рациональный выбор в лечении больных сахарным диабетом 2 типа uMEDp
Сахарный диабет (СД) является распространенным заболеванием, которое признано экспертами ВОЗ неинфекционной эпидемией. В настоящее время в мире насчитывается более 250 миллионов больных диабетом. По прогнозам ученых при сохранении существующих темпов роста заболеваемости количество больных CД через 10-15 лет может достичь 330 млн. Предполагается, что фактическая распространенность заболевания в 2-3 раза превышает зарегистрированную. Необходимо отметить, что около 90% больных диабетом составляют пациенты с СД 2 типа (4, 7, 9).
Рисунок 1. Инсулинорезистентность и дисфункция β-клеток – фундаментальные звенья патогенеза сахарного диабета 2 типа
Рисунок 2. Алгоритм лечебной тактики при СД 2 типа (АДА/EASD, 2009)
Рисунок 3. Механизм действия препаратов сульфонилмочевины на β-клетку
Рисунок 5. Экстрапанкреатические эффекты глимепирида (Амарила): уменьшение инсулинорезистентности
Лечение сахарного диабета может быть успешным лишь при комплексном подходе и должно включать обучение больного, психологическую помощь, рациональное питание и повышение физической активности (изменение образа жизни), применение сахароснижающих препаратов, коррекцию факторов сердечно-сосудистого риска (дислипидемии, артериальной гипертензии, ожирения) и осуществление регулярного самоконтроля показателей гликемии, артериального давления и липидного спектра крови.
К числу важнейших нерешенных проблем современной клинической диабетологии относят низкую эффективность сахароснижающей терапии в реальной клинической практике.
В настоящее время известно, что в основе развития СД 2 типа лежат несколько основных дефектов: снижение чувствительности инсулинозависимых тканей к действию инсулина (инсулинорезистентность), повышение продукции глюкозы печенью и нарушение глюкозозависимой секреции инсулина. Понятие «инсулинорезистентность» определяется как состояние, при котором требуется повышенное количество инсулина для нормального функционирования инсулинозависимых тканей. Поэтому развивающаяся в ответ на инсулинорезистентность гиперинсулинемия в определенной степени является адаптивным процессом, направленным на поддержание нормогликемии (6, 8). Однако в дальнейшем возникает секреторная недостаточность, снижение массы β-клеток и нарастающая инсулинопения. Таким образом, развитию СД 2 типа предшествует довольно длительный период (около 10 лет), когда нарушения углеводного обмена могут быть выявлены только при углубленном исследовании и проявляются инсулинорезистентностью и адаптивной гиперинсулинемией. При этом уровни глюкозы натощак и после еды остаются в пределах нормы. По мере развития и прогрессирования инсулинопении сначала возникают нарушения толерантности к глюкозе, которые в большинстве случаев остаются недиагностированными, а затем, при более значительном снижении секреции инсулина, развивается гипергликемия, что позволяет установить диагноз СД (рисунок 1).
Установлено, что в момент постановки диагноза СД 2 типа масса β-клеток уже снижена примерно на 50% преимущественно за счет повышения активности апоптоза, преобладающего над процессами неогенеза и репликации. Следовательно, значительное снижение секреции инсулина на момент диагностики СД 2 типа у больных обусловлено как нарушением функции, так и снижением массы панкреатических β-клеток.
В основе секреции инсулина лежит механизм закрытия АТФ-зависимых калиевых каналов (КАТФ-каналов) сарколеммы β-клетки в ответ на поступление глюкозы в клетку, что ведет к ее деполяризации и открытию потенциалзависимых кальциевых каналов, через которые в клетку устремляются ионы кальция (рисунок 3). Повышение внутриклеточной концентрации кальция вызывает процесс высвобождения инсулина путем дегрануляции β-клеток, степень которой может быть различной, что определяет возможность значительной вариабельности скорости секреции инсулина. Это является важным механизмом регуляции функционирования β-клеток, который позволяет восстанавливать запас инсулина после воздействия гипергликемии.
При СД 2 типа длительно существующая гипергликемия приводит к десенситизации β-клеток, которая возникает не только в ответ на поступление глюкозы в клетку, но и к действию других секретогенов, а также нарушению восстановления функционального резерва β-клеток. В результате в панкреатических островках исчезают зрелые (наполненные инсулином) клетки, готовые к секреции. На фоне хронической гипергликемии механизм секреции инсулина β-клетками может нарушиться необратимо.
Кроме того, в последние годы установлено, что инсулинорезистентность сама по себе может способствовать снижению секреции инсулина, так как β-клетки имеют рецепторы к инсулину, при снижении чувствительности которых нарушается аутокринная регуляция синтеза и соответственно секреция инсулина (20).
Исходя из особенностей естественного развития заболевания больным СД 2 типа патогенетически оправдано раннее назначение препаратов, улучшающих чувствительность тканей к инсулину, а также стимулирующих его секрецию. Согласно существующему алгоритму лечения больных СД 2 типа (рисунок 2), первым этапом лечения является модификация образа жизни с одновременным назначением метформина – препарата, влияющего прежде всего на механизмы центральной (повышенная продукция глюкозы печенью) и периферической (сниженная утилизация глюкозы мышцами и жировой тканью) инсулинорезистентности (4, 21). Как препарат первого выбора, метформин характеризуется высокой сахароснижающей активностью, значительной доказательной базой, безопасностью, невысокой стоимостью, положительными эффектами на массу тела и липидный профиль. Вместе с тем метформин не оказывает влияние на другой важнейший патогенетический дефект у больных СД 2 типа – нарушение секреции инсулина, в связи с чем в большинстве случаев монотерапия метформином не обеспечивает достижение целей гликемического контроля (15). Кроме того, по данным обзора S. Bolen et al. (2007), у 2 – 63% больных СД 2 типа метформин вызывает побочные эффекты со стороны ЖКТ (11), что ограничивает его клиническое использование. К другим группам сахароснижающих препаратов 1-го ряда относятся производные сульфонилмочевины, основным механизмом действия которых является стимуляция секреции инсулина, а также базальный инсулин (1, 3, 21).
Согласно существующему алгоритму лечения больных СД 2 типа (рисунок 2), первым этапом лечения является модификация образа жизни с одновременным назначением метформина – препарата, влияющего прежде всего на механизмы центральной (повышенная продукция глюкозы печенью) и периферической (сниженная утилизация глюкозы мышцами и жировой тканью) инсулинорезистентности (4, 21). Как препарат первого выбора, метформин характеризуется высокой сахароснижающей активностью, значительной доказательной базой, безопасностью, невысокой стоимостью, положительными эффектами на массу тела и липидный профиль. Вместе с тем метформин не оказывает влияние на другой важнейший патогенетический дефект у больных СД 2 типа – нарушение секреции инсулина, в связи с чем в большинстве случаев монотерапия метформином не обеспечивает достижение целей гликемического контроля (15). Кроме того, по данным обзора S. Bolen et al. (2007), у 2 – 63% больных СД 2 типа метформин вызывает побочные эффекты со стороны ЖКТ (11), что ограничивает его клиническое использование. К другим группам сахароснижающих препаратов 1-го ряда относятся производные сульфонилмочевины, основным механизмом действия которых является стимуляция секреции инсулина, а также базальный инсулин (1, 3, 21).
К преимуществам ПСМ относят высокую сахароснижающую активность (снижение уровня HbA1 в среднем cоставляет 1-2% при монотерапии), хорошую доказательную базу, подтверждающую их эффективность и безопасность, а также низкую стоимость, определяющую доступность препарата. К основным недостаткам ПСМ относят их способность вызывать гипогликемии и прибавку массы тела (3, 9, 21).
В настоящее время ПСМ рекомендуется использовать в качестве дополнительного сахароснижающего препарата при отсутствии адекватного контроля гликемии на фоне модификации образа жизни и монотерапии метформином. Кроме того, ПСМ могут назначаться и в качестве инициирующего сахароснижающего препарата при плохой переносимости метформина или наличии противопоказаний к его назначению (3, 7).
ПСМ, применяемые в клинической практике с середины прошлого столетия, имеют единый механизм действия, но различаются по сахароснижающей активности, продолжительности действия, путям выведения и рецепторной селективности, поэтому принципиально важным для клинической практики является вопрос обоснованного выбора препарата для больных СД 2 типа.
КАТФ-каналы состоят из 2 субъединиц: внутренней стенки канала (Kir6.2) и субъединицы рецептора SUR и обнаруживаются помимо β- клетки в различных тканях: поджелудочной железе, кардиомиоцитах, гладкомышечных клетках сосудов, головном мозге. В настоящее время установлено, что существуют разные изоформы рецептора к сульфонилмочевине: SUR-1 – в β-клетках поджелудочной железы; SUR-2A – в кардиомиоцитах; SUR-2B – в гладкомышечных клетках сосудов (16, 19).
После открытия КАТФ-каналов кардиомиоцитов в 1983 г. длительное время считалось, что сохранение сарколеммных КАТФ-каналов кардиомиоцитов открытыми при ишемии миокарда ограничивает, по описанному выше универсальному механизму, вход ионов кальция в клетку и снижает их доступность для внутриклеточного сокращения миофибрилл кардиомиоцитов, что приводит к уменьшению нагрузки на сердце и снижению потребности миокарда в кислороде. Описанный процесс, являющийся подготовкой к более выраженной ишемии, благодаря которому может значительно уменьшаться зона повреждения миокарда, получил название феномена ишемического прекондиционирования миокарда (2, 17).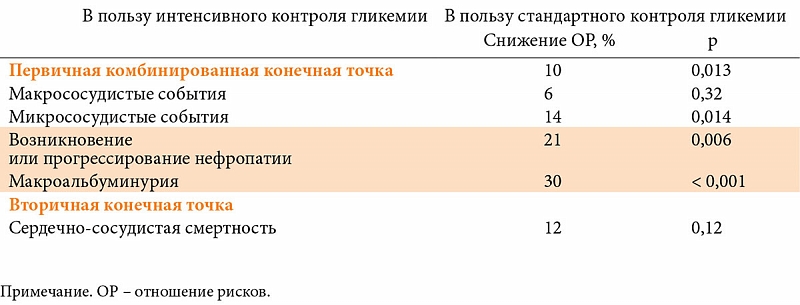
Согласно ранним гипотезам, закрытие КАТФ-каналов кардиомиоцитов под влиянием неселективных ПСМ (глибенкламид, гликлазид, глимепирид, глипизид) служило основной причиной повышенного риска развития неблагоприятных сердечно-сосудистых событий у больных СД 2 типа, получающих сахароснижающую терапию. Вместе с тем эти представления противоречили результатам клинических исследований, которые продемонстрировали, что глимепирид и глибенкламид, относящиеся к неселективным ПСМ, обладали противоположными эффектами на миокард у больных СД 2 типа и ишемической болезнью сердца (ИБС).
Так, при сравнении эффектов глимепирида и глибенкламида на ишемическое прекондиционирование миокарда с помощью двойного слепого плацебо-контролируемого исследования у 45 пациентов с СД 2 типа и ИБС было показано, что у пациентов, получивших глимепирид, отмечалось уменьшение величины средней и максимальной депрессии сегмента SТ во время баллонной окклюзии на 34 и 33% соответственно, а также удлинение времени до появления болей при повторных баллонных окклюзиях по сравнению с пациентами, которым был введен глибенкламид (17).
Кроме того, перевод больных СД 2 типа с глибенкламида на 4 недельную монотерапию глимепиридом сопровождался достоверным возрастанием времени выполнения физической нагрузки до возникновения диагностически значимой депрессии сегмента ST, пикового значения ЧСС и величины двойного произведения, а также поглощения кислорода во время проведения стресс-теста. Полученные данные позволили заключить, что глимепирид повышает ишемический порог, который характеризует способность миокарда противостоять угрозе развития ишемии миокарда в условиях возрастающей потребности в кислороде. Важно отметить, что результаты исследования не могли объясняться влиянием метаболических факторов, так как существенных различий между двумя группами обследованных больных по показателям углеводного и липидного обмена не отмечалось (2).
Указанные противоречия разрешились при более глубоком изучении механизмов влияния ПСМ на развитие ишемического прекондиционирования миокарда. Оказалось, что адаптация миокарда к ишемическому воздействию является сложным и многокомпонентным процессом с участием большого числа внутриклеточных посредников и сигнальных молекул. Была обнаружена важная роль митохондриальных КАТФ-каналов в процессе подготовки миокарда к ишемии, которые под влиянием внутриклеточных протеинкиназ (тирозинкиназы, митогенактивированной протеинкиназы и особенно протеинкиназы С) сохраняются открытыми, обеспечивая защиту митохондрий и сохранение их функций по эффективному транспорту энергии между митохондриальными и миофибриллярными АТФ-азами во время периода реперфузии, способствуя уменьшению или полному исчезновению ишемии миокарда.
Оказалось, что адаптация миокарда к ишемическому воздействию является сложным и многокомпонентным процессом с участием большого числа внутриклеточных посредников и сигнальных молекул. Была обнаружена важная роль митохондриальных КАТФ-каналов в процессе подготовки миокарда к ишемии, которые под влиянием внутриклеточных протеинкиназ (тирозинкиназы, митогенактивированной протеинкиназы и особенно протеинкиназы С) сохраняются открытыми, обеспечивая защиту митохондрий и сохранение их функций по эффективному транспорту энергии между митохондриальными и миофибриллярными АТФ-азами во время периода реперфузии, способствуя уменьшению или полному исчезновению ишемии миокарда.
Современные данные о ведущей роли митохондриальных КАТФ-каналов в адаптации миокарда к ишемии позволили полностью пересмотреть концепцию клинической значимости фактора селективности современных ПСМ и объяснить различия между глимепиридом и глибенкламидом по влиянию на сердечно-сосудистую систему, установленные в некоторых клинических исследованиях.
Как указывалось выше, глимепирид и глибенкламид относятся к неселективным ПСМ, так как способны связываться как с рецепторами сарколеммальных КАТФ-каналов β-клеток, так и с рецепторами сарколеммальных КАТФ-каналов кардиомиоцитов. Вместе с тем глимепирид, в отличие от глибенкламида, не блокирует функцию митохондриальных КАТФ-каналов и не оказывает негативного влияния на процессы прекондиционирования миокарда (рисунок 5), что позволяет более широко и безопасно использовать этот препарат у пациентов СД 2 типа с высоким риском сердечно-сосудистых осложнений (2).
Это особенно актуально, если учесть, что большинство пациентов с СД 2 типа имеют сочетанную патологию, такую как гипертоническая болезнь, ИБС, а также указания на перенесенный в прошлом инфаркт миокарда (6). Кроме того, данные многочисленных исследований о ведущей роли сердечно-сосудистых осложнений в структуре летальности больных СД 2 типа (13, 22, 26) служат дополнительным аргументом в пользу приоритетного выбора среди ПСМ глимепирида как препарата, не обладающего негативным влиянием на механизмы патофизиологической кардиопротекции.
Результаты крупных рандомизированных исследований показали, что тяжелые гипогликемические состояния у пациентов СД 2 типа с сопутствующей кардиальной патологией являются независимым фактором риска повышенной смертности этой категории больных (13).
Ряд сравнительных исследований продемонстрировал более низкий риск гипогликемий при использовании глимепирида по сравнению глибенкламидом. Так, по данным A. Holstein и соавт. (2001) 4-летнее проспективное наблюдение более чем 30000 больных СД 2 типа показало, что на фоне лечения глимепиридом тяжелые гипогликемии наблюдались в 6,5 раз реже, чем при лечении глибенкламидом (0,86/1000 пациентов в год против 5,6/1000 пациентов в год соответственно) (14).
Важным отличием глимепирида от других ПСМ 2-й генерации является его способность обеспечивать у больных СД 2 типа «управляемую гликемию», основанную на более физиологичном характере стимуляции секреции инсулина при применении данного препарата (3). Так, несмотря на сходство сахароснижающего эффекта глимепирида и глибенкламида уровень инсулина в периоды между приемами пищи при применении глимепирида оказался значительно ниже. Исследования in vitro показали (рисунок 4), что глимепирид взаимодействует с низкомолекулярной субъединицей СМ-рецептора (SURx), имеющей меньшую молекулярную массу (65 кДа), а глибенкламид и другие ПСМ второго поколения – с субъединицей SUR1, имеющей большую молекулярную массу (140 кДа) (17). Установлено, что это обеспечивает в 2,5-3 раза более высокую скорость связывания и определяет раннее начало сахароснижающего эффекта, а также в 8-9 раз более высокую скорость диссоциации глимепирида со специфическим рецептором на мембране β-клетки, что приводит к более быстрому прекращению действия данного препарата по сравнению с аналогичными показателями для глибенкламида.
Перечисленные особенности молекулярного взаимодействия глимепирида с рецепторами SURx свидетельствуют о таком существенном преимуществе терапии глимепиридом по сравнению с другими ПСМ, как повышенная безопасность в отношении низкого риска развития гипогликемий, что находит подтверждение в реальной клинической практике (23). Согласно алгоритму ведения пациентов СД 2 типа (ADA/EASD, 2008), в связи с повышенным риском развития гипогликемий на фоне лечения глибенкламидом и хлорпропамидом при выборе ПСМ предпочтение следует отдавать более современным ПСМ: глимепириду и пролонгированным формам гликлазида и глипизида (21).
Согласно алгоритму ведения пациентов СД 2 типа (ADA/EASD, 2008), в связи с повышенным риском развития гипогликемий на фоне лечения глибенкламидом и хлорпропамидом при выборе ПСМ предпочтение следует отдавать более современным ПСМ: глимепириду и пролонгированным формам гликлазида и глипизида (21).
К другим положительным свойствам глимепирида, повышающим эффективность его влияния на углеводный обмен, относятся экстрапанкреатические эффекты, которые характеризуются улучшением чувствительности тканей к инсулину за счет увеличения количества и активности транспортеров глюкозы в адипоцитах (рисунок 5) (18, 19). В исследовании «Эффективность глимепирида и его влияние на инсулинорезистентность, адипоцитокины и атеросклероз» K. Koshiba и соавт. (2006) показал, что у больных СД 2 типа через 28 недель лечения глимепиридом, по сравнению с группой пациентов, получавших глибенкламид, существенно снизились показатели HOMA-IR, содержание в крови ФНО-α, интерлейкина-6, С-реактивного протеина, определяемого высокочувствительным методом, а также параметры, характеризующие «жесткость» сосудистой стенки. Полученные результаты позволили авторам сделать вывод о снижении под влиянием глимепирида инсулинорезистентности и активности проатерогенных факторов (18).
Экскреция глимепирида осуществляется двумя путями: 58% препарата в виде неактивных метаболитов выводится через почки, а 35% – через желудочно-кишечный тракт, что значительно снижает риск кумуляции препарата с последующим развитием гипогликемических состояний. Это позволяет использовать глимепирид у пациентов с патологией почек даже на начальных стадиях хронической почечной недостаточности.
Известно, что у пациентов, получающих ПСМ, отмечается увеличение массы тела, что относится к нежелательным эффектам терапии, так как увеличивает имеющуюся инсулинорезистентность. Популяционное исследование эффективности и переносимости глимепирида в ежедневной клинической практике, проведенное с участием более 22000 пациентов СД 2 типа в Германии, показало, что терапия глимепиридом способствовала снижению массы тела, особенно у людей с ожирением, что объясняется отсутствием значительной гиперинсулинемии на фоне приема этого препарата (24). Нейтральность в отношении влияния на вес у пациентов СД 2 типа была подтверждена при проведении мета-анализа многочисленных клинических исследований с применением глимепирида (12).
Нейтральность в отношении влияния на вес у пациентов СД 2 типа была подтверждена при проведении мета-анализа многочисленных клинических исследований с применением глимепирида (12).
Важным качеством современного сахароснижающего препарата, которое существенно повышает приверженность пациентов с СД 2 типа к лечению, является удобство применения. Очевидно, что форма выпуска глимепирида (таблетки по 1, 2, 3, 4 мг), однократный прием препарата с рекомендуемой начальной дозой 1 мг в сутки, а также простая схема титрации (увеличение дозы на 1 мг в сутки каждую 1-2 недели до достижения целевых значений гликемии) являются предпосылками успешного применения глимепирида широким кругом больных СД 2 типа.
Заключение
Препараты сульфонилмочевины, согласно национальным и международным рекомендациям, по-прежнему остаются лекарственными препаратами 1-й линии у пациентов СД 2 типа, несмотря на развитие новых направлений в фармакотерапии этого заболевания. Учитывая существующие различия ПСМ по сахароснижающей активности, продолжительности действия, путям выведения и рецепторной селективности, большое практическое значение приобретает рациональный выбор препарата, что может существенно повысить эффективность и снизить риски лечения больных СД 2 типа.
Глимепирид (препарат Амарил®) является современным ПСМ третьей генерации, который обладает сочетанием таких качеств, как высокая сахароснижающая активность, низкий риск гипогликемий, отсутствие кардиотоксичности и нефротоксичности, нейтральность в отношении массы тела, имеет простую схему титрации и удобен для приема, что определяет обоснованность его применения у большинства больных СД 2 типа.
эффективное лечение сахарного диабета типа 2 uMEDp
В настоящее время возможности контроля гипергликемии стремительно расширяются. Как следствие, появляется возможность выбора наиболее оптимального препарата и рациональной схемы сахароснижающей терапии для конкретного больного. В статье рассмотрены механизмы действия, эффективность и безопасность одного из представителей класса препаратов сульфонилмочевины – Диабетона МВ как в составе моно-, так и комбинированной терапии. Представлены данные о его антиатерогенном действии.
В статье рассмотрены механизмы действия, эффективность и безопасность одного из представителей класса препаратов сульфонилмочевины – Диабетона МВ как в составе моно-, так и комбинированной терапии. Представлены данные о его антиатерогенном действии.
Рис. 1. Гипергликемия инициирует механизмы повреждения сосудов
Таблица 1. Пациенты с СД типа 2, достигшие целевых значений HbA1c на момент завершения исследования ADVANCE, %
Таблица 2. Сравнительная характеристика исследований UKPDS и ADVANCE
Рис. 2. Профиль безопасности разных ПСМ по сравнению с ситаглиптином
Рис. 3. Снижение частоты развития и прогрессирования микрососудистых осложнений в результате достижения целевого уровня HbA1c
Cтремительное распространение сахарного диабета (СД) типа 2 наносит значительный медико-социальный и экономический урон [1, 2]. По данным регистра, в России в 2015 г. число больных СД составило 4,04 млн (типа 1 – 340 тыс., типа 2 – 3,7 млн) [3]. С учетом скрытого течения СД типа 2 истинная его распространенность гораздо выше – в три–четыре раза.
СД типа 2 – многофакторное заболевание. Его ассоциируют с многочисленными метаболическими нарушениями. Кроме того, СД типа 2 относится к факторам высокого риска ухудшения сердечно-сосудистого прогноза, что приводит к смерти в 60–75% случаев [1, 4, 5].
Основной причиной микрососудистых осложнений является хроническая гипергликемия (рис. 1) [6–8]. Макрососудистые осложнения, как правило, ассоциированы и с другими весомыми факторами, такими как ожирение, инсулинорезистентность, артериальная гипертензия, дислипидемия, альбуминурия. В сочетании с гипергликемией они значительно ухудшают сердечно-сосудистый прогноз и требуют своевременного вмешательства [9–11]..gif)
В настоящее время собрана большая доказательная база в отношении эффективности многофакторного подхода к снижению риска развития сердечно-сосудистых заболеваний и смерти у больных СД [4, 12]. Результаты крупных рандомизированных плацебоконтролируемых исследований и метаанализов послужили платформой для разработки современных алгоритмов ведения таких пациентов. Особое внимание в них уделяется профилактике развития и прогрессирования осложнений заболевания: достижению целевого уровня гликемии, липидов, контроля артериального давления и массы тела [3, 13].
Учитывая преждевременную инвалидизацию и высокую смертность среди пациентов с СД типа 2 из-за сосудистых осложнений, частоту которых можно существенно сократить за счет достижения гликемии, близкой к нормальному уровню, чрезвычайно важным считается эффективный контроль последней [14–16]. Он достигается назначением препаратов, влияющих на основные патогенетические механизмы данного нарушения [3, 17, 18].
Существующие рекомендации по ведению пациентов с СД типа 2 уже не дают жестких указаний о применении тех или иных классов сахароснижающих препаратов как на старте лечения, так и в случае его интенсификации [3, 13]. Перед клиницистами встает вопрос выбора оптимальной схемы лечения для каждого конкретного пациента, препарата и времени перехода на следующий этап терапии, если контроль гликемии на предшествующем этапе оказался неудовлетворительным. При этом учитываются особенности течения заболевания, исходное состояние углеводного обмена, ответ на медикаментозную терапию.
Риск развития патологии сердца и сосудов также повышает гипогликемия – пусковой фактор активации системы контринсулярной защиты [19, 20]. В этой связи при выборе сахароснижающего препарата следует помнить, что возраст, патология почек и печени увеличивают риск ее развития [18, 19].
Сегодня трудно представить сахароснижающую терапию без препаратов сульфонилмочевины (ПСМ), широкое клиническое применение которых началось еще в 50-х гг. прошлого столетия.
прошлого столетия.
ПСМ относятся к группе секретагогов. Данные препараты стимулируют секрецию инсулина бета-клетками поджелудочной железы, особенно в присутствии глюкозы [17]. Наличие в островках Лангерганса достаточного количества функционально активных бета-клеток служит основой для проявления их фармакологического эффекта.
Изучение ПСМ показало, что, несмотря на общий механизм действия, каждый из представителей этого класса имеет фармакокинетические, фармакодинамические особенности и дополнительные эффекты, которые необходимо принимать во внимание.
ПСМ отличает выраженный сахароснижающий эффект (уровень гликированного гемоглобина (HbA1c) уменьшается примерно на 1,5–2%). Наиболее частым побочным действием является гипогликемия [21]. Следует отметить, что гипогликемию может вызвать любой ПСМ, хотя и с разной долей вероятности.
При выборе того или иного ПСМ необходимо основываться на оценке соотношения эффективности и безопасности, путей метаболизма и выведения и доступности его для пациента [17]. Каждый представитель данного класса препаратов может быть более или менее предпочтительным в определенной клинической ситуации [22–25].
Одним из наиболее эффективных ПСМ является гликлазид МВ (Диабетон МВ). Исследование ADVANCE доказало возможность длительного и безопасного применения Диабетона МВ для лечения СД типа 2 и предупреждения его осложнений [26]. Важно отметить, что в рамках исследования изучалось влияние на риск развития сердечно-сосудистых осложнений у больных СД типа 2 не только интенсивных режимов сахароснижающей терапии, но и гипотензивной (периндоприл с индапамидом в фиксированной комбинации – Нолипрел). В работе участвовало 11 140 больных СД типа 2 из разных стран мира, в том числе из России. Это были пациенты с длительным течением заболевания (в среднем более 8 лет), имеющие факторы высокого сердечно-сосудистого риска. Участников рандомизировали в группы стандартного (НbА1с = 7,5–8%) и интенсивного контроля гликемии (НbА1с
Важно и то, что режим интенсивного контроля гликемии способствовал достижению целевых значений HbA1c у гораздо большего числа пациентов (табл. 1).
1).
Результаты ADVANCE продемонстрировали, что ПСМ могут снижать сердечно-сосудистый риск у больных СД типа 2 [17, 27]. Стратегия достижения гликемического контроля, предложенная в исследовании ADVANCE и основанная на применении Диабетона МВ, ассоциировалась с очень низкой частотой эпизодов гипогликемии. Безусловно, гипогликемии затрудняют достижение контроля гликемии, способствуют клинической инертности. Повторяющиеся гликемии снижают возможность их своевременного распознавания и соответственно принятия необходимых мер [5, 20].
Поскольку СД типа 2 – прогрессирующее заболевание, доза гликлазида МВ титровалась до достижения необходимого эффекта. В итоге 70% больных получали по 120 мг препарата в сутки [26]. Эти данные свидетельствуют о важности увеличения дозы Диабетона МВ для проявления полного спектра эффективности препарата. В то же время число гипогликемий было в четыре раза меньше, чем в исследовании UKPDS (несмотря на более низкий уровень HbA1c, достигнутый пациентами группы интенсивного контроля в исследовании ADVANCE). Следует отметить, что в исследование UKPDS были включены пациенты с впервые диагностированным СД типа 2 без диабетических осложнений, в то время как участники исследования ADVANCE имели длительный стаж заболевания, различные сосудистые осложнения и, как следствие, высокий риск развития сердечно-сосудистых заболеваний (табл. 2) [16, 26].
Считается, что инкретиновая терапия характеризуется низким риском гипогликемий. Результаты сравнительных исследований показывают, что частота гипогликемических эпизодов была меньше на фоне приема гликлазида МВ, чем на фоне приема других ПСМ (глибенкламида, глимепирида), и такой же, как при применении ингибитора дипептидилпептидазы 4 (ДПП-4) – ситаглиптина (рис. 2) [28, 29].
Оптимальная переносимость и безопасность гликлазида МВ во многом объясняется высокой обратимостью его связывания с рецептором на поверхности бета-клетки (субъединицами аденозинтрифосфат-зависимых калиевых каналов). При низкой обратимости связывания ПСМ с рецептором (например, у глибенкламида) отмечается пролонгированная эндогенная секреция инсулина, которая может обусловливать высокий риск развития гипогликемии, увеличение массы тела, снижение функциональной активности бета-клеток [17, 21].
При низкой обратимости связывания ПСМ с рецептором (например, у глибенкламида) отмечается пролонгированная эндогенная секреция инсулина, которая может обусловливать высокий риск развития гипогликемии, увеличение массы тела, снижение функциональной активности бета-клеток [17, 21].
Исследование ADVANCE продемонстрировало, что длительное применение Диабетона МВ улучшает отдаленные исходы СД типа 2 [26]. В частности, риск развития микро- и макрососудистых осложнений снизился на 10% (р
Благодаря полученным результатам спектр показаний к применению Диабетона МВ расширился. Диабетон MВ стал первым и единственным сахароснижающим препаратом, для которого зарегистрировано показание: «предупреждение осложнений СД типа 2: уменьшение риска развития макро- и микрососудистых осложнений, в частности новых случаев или прогрессирования нефропатии у пациентов».
Необходимо также отметить ренопротективный эффект Диабетона МВ. Так, в группе интенсивного контроля гликемии (Диабетона МВ) регрессия нефропатии как минимум на одну стадию отмечалась у 62% пациентов [26].
Установлено, что Диабетон МВ воздействует на патогенетические механизмы сосудистых осложнений [6, 11, 30]. В химической структуре гликлазида МВ присутствует азобициклооктановая группа. Это объясняет его антиоксидантный и вазопротекторный эффекты, не зависящие от сахароснижающего эффекта [23, 24]. Препарат уменьшает выраженность оксидативного стресса и агрегацию тромбоцитов. В терапевтических концентрациях Диабетон МВ увеличивает время между воздействием прооксидантов на липопротеины низкой плотности и началом окисления, то есть препятствует окислению последних. Необходимо подчеркнуть, что описанный эффект не воссоздается другими ПСМ.
Сказанное свидетельствует об антиатерогенном действии препарата, что очень важно для больных СД типа 2 с сердечно-сосудистыми заболеваниями, перенесших сердечно-сосудистое событие, а также с факторами риска развития таковых.
Поскольку пациенты с СД типа 2 должны принимать сахароснижающие препараты пожизненно, не менее важен их долгосрочный профиль безопасности и эффективность. Результаты наблюдательной фазы ADVANCE-ON свидетельствуют, что интенсивный контроль гликемии (основа – Диабетон МВ) в долгосрочной перспективе не снижает и не увеличивает частоту смертей от любых причин, а также не влияет на макрососудистые осложнения. Однако эти данные отличаются от данных долгосрочного наблюдения в исследовании UKPDS. Возможная причина – критерии отбора участников. В частности, пациенты в UKPDS были значительно моложе и имели небольшой стаж диабета по сравнению с пациентами в ADVANCE (табл. 2).
В наблюдательной фазе ADVANCE-ON были получены доказательства значительного сокращения случаев развития терминальной стадии хронической болезни почек в долгосрочной перспективе в результате интенсивного контроля гликемии.
Интерес представляют также результаты наблюдательной программы по оценке эффективности и безопасности терапии Диабетоном МВ – DIAMOND [31]. В нее было включено 394 пациента с неэффективным контролем СД типа 2 на фоне диеты или терапии одним пероральным сахароснижающим препаратом (метформином, глитазоном, ингибитором ДПП-4, акарбозой, глинидом или ПСМ (кроме Диабетона МВ)). Пациенты переводились на Диабетон МВ с продолжением или отменой предшествующей терапии (если ранее пациент принимал препарат из группы секретагогов). В последнем случае Диабетон МВ назначался в дозе, эквивалентной дозе ранее принимаемого препарата (например, две таблетки Манинила 3,5 мг равны двум таблеткам Диабетона МВ, Амарил 1 и 2 мг – 30 и 60 мг Диабетона МВ соответственно). Средний возраст пациентов составил 59,0 ± 9,2 года, уровень HbA1c – 8,4 ± 0,9%, гликемии натощак – 9,0 ± 1,9 ммоль/л. Через шесть месяцев лечения Диабетоном МВ в монотерапии и комбинации с другими препаратами у 30 и 70% пациентов соответственно целевого уровня HbA1c
Таким образом, СД типа 2 в настоящее время является серьезной проблемой. Несмотря на прилагаемые усилия, многие пациенты не достигают целевых показателей гликемии. Один из возможных путей решения – индивидуализация лечения. Диабетон МВ может рассматриваться не только как эффективный и безопасный сахароснижающий препарат, но и как средство профилактики диабетических осложнений, что обеспечивает его востребованность в клинической практике.
Несмотря на прилагаемые усилия, многие пациенты не достигают целевых показателей гликемии. Один из возможных путей решения – индивидуализация лечения. Диабетон МВ может рассматриваться не только как эффективный и безопасный сахароснижающий препарат, но и как средство профилактики диабетических осложнений, что обеспечивает его востребованность в клинической практике.
Препараты сульфонилмочевины в современной стратегии лечения сахарного диабета 2 тип | Недосугова
Рост распространенности сахарного диабета 2 типа (СД2) на земном шаре приобрел характер «неинфекционной эпидемии», и по прогнозам экспертов ВОЗ количество больных с СД2 должно достичь к 2025 г. 380 млн человек [1]. Прогрессирование при СД макроваскулярных и микроваскулярных осложнений выводит его на 3-е место по причинам летальности после сердечно-сосудистой и онкологической патологий. Смертность от сердечно-сосудистых заболеваний больных СД2 в 3 раза выше, чем у населения в целом [2]. При этом в 80% случаев причиной смерти является атеросклеротическое поражение коронарных, церебральных и периферических сосудов [3]. В целом от заболеваний, обусловленных атеросклерозом, умирают больше больных диабетом, чем от всех других причин, вместе взятых [4]. Причиной такого выраженного поражения сосудистого русла в настоящее время считают гипергликемию. Метаанализ 20 различных исследований, включавших 95783 пациентов, наблюдаемых в течение 12 лет, позволил сделать вывод о том, что глюкоза является таким же фактором риска для развития атеросклероза и острой сердечно-сосудистой летальности, как и уровень общего холестерина и артериального давления [5].
Ставшие классикой результаты исследования UKPDS (United Kingdom Prospective Diabetes Study) [6] и Kumamoto [7], показавшие роль гликемического контроля в снижении риска прогрессирования диабетических сосудистых осложнений, подтвержденные серией недавних крупных рандомизированных исследований, таких как ADOPT (The Adult Diabetes Outcome Progression Trial) [8], ADVANCE (Action in Diabetes and Vascular Disease –Preterax and Diamicron Modified Control Evaluation) [9], PROACTIVE (PROspective piogltAzone Clinical Trial In macroVascular Events) [10], в комбинации с недавно опубликованными результатами длительного (10-летнего) пост-наблюдения за пациентами, участвовавшими в DCCT/EDIC (The Diabetes Control and Complication Trial//Epidemiology of Diabetes Interventions and Complications ) [11], UKPDS [12] и Steno-2 study [13], послужили основанием для создания международного консенсуса по лечению СД2, провозгласившего достижение уровня HbA1c<6,5% как конечную цель в лечении СД2.
Современные рекомендации более агрессивного подхода к достижению целевого уровня гликемического контроля были, тем не менее, пересмотрены в связи с увеличением риска острой сердечно-сосудистой летальности при попытке добиться целевого уровня HbA1c<6,5% при проведении исследований RECORD (Rosiglitazone Evaluated for Cardiovascular Outcomes in Oral Agent Combination Therapy for Type 2 Diabetes) [14], ACCORD (Action to Control Cardiovascular Risk in Diabetes) [15], VADT (The Veteran Affairs Diabetes Trial) [16]. Согласно последним рекомендациям консенсуса Американской диабетологической ассоциации (ADA) и Европейской ассоциации по изучению диабета (EASD), целевой уровень HbA1c, определенный на основании практического и ожидаемого снижения частоты развития осложнений, «в общем» составляет <7% [17]. Для каждого «конкретного пациента» содержание HbA1c должно быть «как можно ближе к нормальному (<6%) без значимых гипогликемических состояний». По мнению авторов консенсуса по гликемическому контролю [17], уровень HbA1c≥7% должен служить сигналом к началу или изменению терапии, целью которой должно стать снижение его до уровня здоровых людей или хотя бы до <7%. Естественно, что на практике нелегко достичь этой цели у большинства пациентов, поэтому необходимо взвешивать потенциальный риск и пользу любого более интенсивного метода лечения для каждого больного, поскольку стремление к достижению глюкозы плазмы крови натощак <6,0 ммоль/л чревато риском развития гипогликемических состояний, а, следовательно, и риском острых сердечно-сосудистых катастроф.
СД2 характеризуется двумя основными патогенетическими дефектами: снижением чувствительности к инсулину (или инсулинорезистентностью) и неадекватной секрецией инсулина для преодоления барьера инсулинорезистентности. Инсулинорезистентность зачастую предшествует развитию СД в течение многих лет и является генетически обусловленной, хотя и усугубляется такими внешними факторами, как ожирение, снижение физической активности, беременность и избыток контринсулярных гормонов. Изначально существующая инсулинорезистентность компенсируется за счет гиперинсулинемии, что поддерживает нормальную толерантность к углеводам. Нарушение толерантности к углеводам наблюдается при возрастании инсулинорезистентности или при снижении компенсаторных возможностей инсулиновой секреции, либо при прогрессировании обоих дефектов [18, 19]. По современным представлениям, СД2 манифестирует в ситуации, когда секреторные возможности β-клеток оказываются несостоятельными для преодоления барьера инсулинорезистентности. Основная роль в этой несостоятельности инсулярного аппарата отводится генетическим нарушениям [19], однако немаловажную роль в снижении секреторных резервов инсулярного аппарата играет так называемый «феномен глюкозотоксичности», за счет которого развивается апоптоз и гибель β-клеток. По статистическим данным, к моменту манифестации заболевания у пациентов функционирует только 50% от начального количества β-клеток, что подтверждает теорию постепенного прогрессирования нарушений углеводного обмена: от нормогликемии в условиях инсулинорезистентности и гиперинсулинемии до манифестации СД через последовательные стадии нарушения гликемии натощак и нарушенную толерантность к глюкозе [20].
Изначально существующая инсулинорезистентность компенсируется за счет гиперинсулинемии, что поддерживает нормальную толерантность к углеводам. Нарушение толерантности к углеводам наблюдается при возрастании инсулинорезистентности или при снижении компенсаторных возможностей инсулиновой секреции, либо при прогрессировании обоих дефектов [18, 19]. По современным представлениям, СД2 манифестирует в ситуации, когда секреторные возможности β-клеток оказываются несостоятельными для преодоления барьера инсулинорезистентности. Основная роль в этой несостоятельности инсулярного аппарата отводится генетическим нарушениям [19], однако немаловажную роль в снижении секреторных резервов инсулярного аппарата играет так называемый «феномен глюкозотоксичности», за счет которого развивается апоптоз и гибель β-клеток. По статистическим данным, к моменту манифестации заболевания у пациентов функционирует только 50% от начального количества β-клеток, что подтверждает теорию постепенного прогрессирования нарушений углеводного обмена: от нормогликемии в условиях инсулинорезистентности и гиперинсулинемии до манифестации СД через последовательные стадии нарушения гликемии натощак и нарушенную толерантность к глюкозе [20].
Исходя из вышеизложенного, напрашивается вполне логичный вывод о том, что основным стратегическим направлением в лечении СД2 должно быть воздействие на инсулинорезистентность как главное патогенетическое звено в развитии заболевания. Снижая инсулинорезистентность, мы уменьшаем нагрузку на инсулярный аппарат, сохраняя тем самым его секреторные возможности и снимая негативное влияние гиперинсулинемии на повышение аппетита, прибавку веса, состояние сердечно-сосудистой системы. Наиболее простой способ повышения чувствительности к инсулину – снижение веса за счет изменения образа жизни и характера питания, что, к сожалению, позволяет достичь целевого уровня гликемии менее чем у 30% пациентов с впервые выявленным СД2 [21]. В таких ситуациях необходимы средства, воздействующие на основное патогенетическое звено синдрома – инсулинорезистентность.
Наиболее доступным и эффективным средством на сегодняшний день является метформин, основным механизмом действия которого является снижение инсулинорезистентности за счет повышения активности тирозинкиназы инсулинового рецептора в периферических тканях. В результате улучшается утилизация и окисление глюкозы в периферических тканях [22, 23], подавляется липолиз и окисление свободных жирных кислот как альтернативного энергетического субстрата [23, 24]. Именно с повышением чувствительности к инсулину печеночной ткани связывают снижение глюконеогенеза и гликогенолиза [25, 26].
Как указывалось выше, у большинства людей с СД2 мероприятия по изменению образа жизни не обеспечивают достижения целевых параметров углеводного обмена либо из-за недостаточного снижения веса, его повторного набора, либо из-за прогрессирования заболевания, или вследствие сочетания этих и ряда других факторов. Поэтому рекомендуется начинать терапию метформином, наряду с изменением образа жизни, сразу после установления диагноза. При отсутствии специфических противопоказаний метформин рекомендуется назначать в первую очередь благодаря его влиянию на гликемию, отсутствию прибавки в весе и гипогликемических состояний, обычно хорошей переносимости с низкой частотой побочных эффектов, высокому уровню приверженности и относительно низкой стоимости. Доза метформина должна быть постепенно (в течение 1–2 месяцев) увеличена до максимально эффективной и переносимой. Вместе с тем, даже максимальные дозы метформина далеко не всегда позволяют добиться целевого уровня гликемии и снижения уровня HbA1c<7,0% в течение первых 2–3 месяцев лечения, как рекомендуется авторами международного консенсуса ADA/EASD [17]. При сохранении выраженной гипергликемии следует решить вопрос о добавлении других сахароснижающих препаратов. Четкого консенсуса в отношении второго препарата, добавляемого к метформину, пока не существует, и выбор делается между инсулином, препаратом сульфонилмочевины или тиазолидиндионами (рис. 1). В связи с появлением новых препаратов и выявлением новых побочных эффектов авторы консенсуса [17] предлагают в первую очередь использовать сульфонилмочевину либо инсулин как наиболее хорошо изученные препараты, в качестве дополнительной терапии при неэффективности монотерапии метформином и изменении образа жизни.
1). В связи с появлением новых препаратов и выявлением новых побочных эффектов авторы консенсуса [17] предлагают в первую очередь использовать сульфонилмочевину либо инсулин как наиболее хорошо изученные препараты, в качестве дополнительной терапии при неэффективности монотерапии метформином и изменении образа жизни.
В определенных клинических ситуациях может применяться терапия препаратами второго ряда, которые, во-первых, менее изучены, а во-вторых, значительно дороже. В частности, когда риск гипогликемии особенно опасен (например, у пациентов, занимающихся тяжелым физическим трудом), целесообразно дополнительное назначение препаратов класса тиазолидиндионов (ТЗД) – пиоглитазона (Актос) и агонистов глюкагоноподобного пептида-1 (ГПП-1: эксенатид, лираглютид). В случаях, когда одна из основных целей лечения – снижение веса, а уровень HbA1c<8,0%, предпочтительно назначение эксенатида (Баеты).
Однако клиницисты-эндокринологи зачастую сталкиваются с проблемой невозможности добиться целевого уровня гликемии в течение 2–3 месяцев лечения. Обусловлено это тем, что исходный уровень HbA1c у пациентов может колебаться от 6,5% до 10% и выше, что, безусловно, осложняет возможности быстрого и эффективного достижения цели.
В связи с этим Американской ассоциацией клинических эндокринологов (AACE) предложен дифференцированный подход к назначению и коррекции сахароснижающей терапии в зависимости от исходного уровня HbA1c [28]. Действительно, если исходный уровень HbA1c не превышает 7,5%, вполне реально достижение целевого уровня <6,5% с помощью монотерапии метформином, пиоглитазоном, ингибиторами дипептидилпептидазы-4 (ДПП4) или альфа-глюкозидаз, как это представлено на рис. 2. Двойная комбинация при неэффективности монотерапии предполагает добавление препаратов, так или иначе стимулирующих секрецию инсулина, либо за счет непосредственного воздействия на β-клетку (препараты сульфонилмочевины (СМ), глиниды и аналоги глюкагоноподобного пептида-1 (ГПП-1), либо опосредованно, за счет блокады расщепления нативного ГПП-1 ингибиторами фермента ДПП4. В любом случае такая комбинация воздействует на оба патогенетических звена развития СД2: инсулинорезистентность и неадекватную секрецию инсулина, в результате чего обеспечивается адекватный контроль как гликемии натощак, так и после еды, приводя к быстрому достижению цели.
В любом случае такая комбинация воздействует на оба патогенетических звена развития СД2: инсулинорезистентность и неадекватную секрецию инсулина, в результате чего обеспечивается адекватный контроль как гликемии натощак, так и после еды, приводя к быстрому достижению цели.
Если модификация образа жизни, метформин и второй препарат не привели к достижению целевых параметров контроля углеводного обмена, следующий этап заключается в начале или интенсифицировании инсулинотерапии (рис. 2). Если уровень HbA1c близок к целевому (<7,5%), можно добавить третий пероральный сахароснижающий препарат. Тем не менее, такой подход более дорогостоящий и не всегда оказывается эффективным по сравнению с переходом на инсулинотерапию или ее интенсификацией [29].
Тактика ведения пациентов с уровнем HbA1c от 7,6% до 9%
Подавляющее большинство пациентов с СД2 имеют на момент диагностики заболевания уровень HbA1c>7,6%. На сегодняшний день не существует таких препаратов, которые были бы способны обеспечить достижение целевого уровня контроля при монотерапии в течение 2–3 месяцев. Именно поэтому авторы алгоритма предлагают изначально использовать комбинированную «двойную» терапию для достижения быстрого и эффективного контроля гликемии (см. рис. 3).
Такой подход основан на данных многочисленных исследований, показавших, что одновременное назначение препаратов с различными точками приложения действия обеспечивает более значимое снижение HbA1c не только за более короткие сроки, но и в значительно меньших дозировках, нежели начальная монотерапия метформином с последующим присоединением второго препарата [30, 31, 32]. Метформин является основой всех возможных комбинаций, из которых наиболее безопасной является комбинация метформина с инкретиновыми миметиками, за счет отсутствия риска гипогликемических состояний и прибавки в весе, а самой эффективной – комбинация метформина с препаратами СМ, поскольку эти препараты наиболее значимо снижают уровень HbA1c, а их комбинация обеспечивает не только хороший контроль гликемии, но и показателей липидного спектра крови [33].
В случае неэффективности «двойной» терапии рекомендуется добавить третий препарат, опять-таки исходя из принципов эффективности и безопасности: метформин и в этой ситуации является основой терапии, при этом наиболее безопасной, с точки зрения риска развития гипогликемических состояний, является добавление к комбинации метформина с инкретиновыми миметиками тиазолидиндионов, а наиболее эффективной – присоединение препаратов СМ к комбинации метформина с инкретиновыми миметиками.
Таким образом, пациентам, имеющим уровень HbA1c, близкий к 7,5%, целесообразнее назначать комбинацию метформина с ТЗД и инкретиновыми миметиками, тогда как пациентам с более высоким уровнем HbA1c логичнее применять комбинацию метформина с препаратами СМ и инкретиновыми миметиками. Следующим этапом достижения целевого уровня гликемии при неэффективности «тройной» комбинации является назначение инсулинотерапии, сначала в фоновом, а затем и фоново-болюсном режиме, при переходе к которому необходимо отменить препараты, так или иначе стимулирующие секрецию инсулина.
Тактика ведения пациентов при уровне HbA1c>9%
В клинической практике нередки ситуации, при которых уже при диагностике СД2 у пациентов имеется значительная гипергликемия и уровень HbA1c превышает 9%, однако отсутствует клиническая симптоматика заболевания, что свидетельствует о достаточной секреторной активности инсулярного аппарата. Тактикой выбора в этой ситуации, по предложению авторов алгоритма, может быть не интенсивная инсулинотерапия, которая абсолютно показана при HbA1c>10% и выраженной клинической симптоматике, а изначальная «тройная» терапия. Наиболее эффективной при этом считается комбинация метформина с СМ и инкретиновыми миметиками, наиболее безопасной с точки зрения риска гипогликемии – комбинация метформина с инкретиновыми миметиками и ТЗД (см. рис. 4).
Вместе с тем, как указывалось выше, интенсификация сахароснижающей терапии лимитируется риском развития гипогликемических состояний, прибавки веса и, как результат, повышением летальности от острых сосудистых катастроф. Эпизоды гипогликемии выявлялись в 3 раза чаще в группе интенсивного лечения по сравнению со стандартной терапией при проведении исследования AСCORD и в 2 раза чаще в исследовании VADT [15, 16], что сопровождалось повышением случаев сердечно-сосудистых событий в последующие 3 месяца после тяжелой гипогликемии в группе интенсивного лечения у пожилых людей в исследовании VADT.
Интенсивное лечение в этих исследованиях сопровождалось также и увеличением веса в среднем на 10 кг у 28% пациентов за время участия в исследовании AСCORD [15] и на 8,2 кг в исследовании VADT [16]. Нарастание веса, как известно, ассоциировано с повышением уровня глюкозы, артериального давления, дислипидемией, сердечно-сосудистой патологией и повышением летальности. При СД нарастание веса сопровождается ухудшением гликемического контроля и увеличением сердечно-сосудистого риска [34–36].
И, наконец, даже в спланированных, контролируемых исследованиях не удавалось достичь поставленной цели гликемического контроля. Так, например, целью исследований AСCORD и VADT было достижение уровня HbA1c<6,0%. Однако средний уровень HbA1c, достигнутый в исследовании VADT, составил 6,9%, а в исследовании AСCORD – 6,4% [15, 16].
Таким образом, современная стратегия сахароснижающей терапии предполагает применение таких комбинаций сахароснижающих препаратов, которые были бы наиболее эффективны в отношении коррекции углеводного обмена, без риска развития гипогликемических состояний, увеличения веса и негативного влияния на сердечно-сосудистую систему. В представленном выше алгоритме ААСЕ подчеркивается, что даже используя современные препараты, такие как аналоги ГПП-1 и ингибиторы ДПП-4 в комбинации с метформином, мы либо жертвуем эффективностью, применяя ингибиторы ДПП-4, либо безопасностью – при использовании аналогов ГПП-1. Именно поэтому применение СМ в комплексной терапии СД2 прочно сохраняет свои позиции в любом алгоритме лечения. Безусловно, клиницист-эндокринолог должен четко представлять, кому и когда следует назначать препараты этой группы, в зависимости от исходного уровня HbA1c, поставленной цели достижения компенсации, возраста пациента и наличия у него сопутствующей сердечно-сосудистой патологии. Наиболее актуальным остается вопрос выбора конкретного препарата группы СМ при необходимости их назначения. В этой ситуации целесообразно исходить из таких характеристик препарата, как его сахароснижающая активность, длительность действия, частота и выраженность гипогликемических состояний, безопасность в отношении воздействия на сердечно-сосудистую систему и увеличение веса.
Панкреатический эффект действия Амарила
В этом отношении Амарил – препарат СМ, наиболее полно отвечающий всем перечисленным требованиям. Хорошо известно, что препараты СМ могут оказывать сахароснижающий эффект только при сохраненной способности инсулярного аппарата к секреции гормона. препараты СМ оказывают стимулирующий эффект на секрецию инсулина за счет связывания со специфическими рецепторами плазматической мембраны β-клетки, которые интегрированы в структуру АТФ-зависимых К+-каналов плазматических мембран [37]. Роль КАТФ-каналов в процессе регуляции инсулиновой секреции является ключевой. При поступлении в β-клетку глюкозы и при ее окислении повышается концентрация АТФ, что сопровождается закрытием КАТФ‑каналов, изменением мембранного потенциала. Деполяризация мембраны сопровождается открытием вольтаж-зависимых Са++-каналов и вхождением ионов Са++ в клетку. В результате повышается концентрация внутриклеточного Са++, являющегося сократительным микроэлементом, благодаря чему происходит сокращение внутриклеточных миофибрилл и стимулируется секреция инсулина путем экзоцитоза. При взаимодействии СМ с рецепторами β-клетки происходит закрытие КАТФ-каналов и инициируется вся цепь вышеописанных событий, заканчивающаяся секрецией синтезированного ранее и накопленного в β-клетке инсулина. Благодаря тому, что СМ повышает чувствительность β-клеток к глюкозозависимому инсулинотропному полипептиду (ГИП), стимуляция секреции инсулина происходит в соответствии с уровнем глюкозы, вследствие чего восстанавливается нормальная кривая инсулиновой секреции и, в частности, 1 фаза, необходимая для снижения посталиментарной гликемии.
Результаты современных исследований по изучению регуляции секреции инсулина [37] представляют КАТФ-канал как композицию двух типов субъединиц – порообразующей субъединицы Kir6.x. и регуляторной субъединицы, способной связывать СМ, и потому названной рецептором СМ – SUR. Эти субъединицы стереохимически объединены в соотношении 4:4, образуя октаометрический комплекс из 4 пороформирующих субъединиц (Kir 6.2) и 4 регуляторных SUR субъединиц (см. рис. 5).
Описано 2 гена, кодирующих порообразующую субъединицу Kir6.1 и Kir6.2, равно как и 2 гена, кодирующих SUR 1 и SUR 2. Электрофизиологические исследования показали, что различные комбинации Kir.X и SUR присутствуют в разных тканях. Kir 6.2 экспрессируются в β-клетках, сердце, мозге и скелетной мускулатуре, а Kir 6.1 формируют пору КАТФ‑канала в гладкой мускулатуре, хотя существуют данные, что в гладкой мускулатуре могут присутствовать и Kir 6.2, и Kir 6.1 субъединицы, формируя пору КАТФ-канала с различными свойствами. SUR 1 образуют регулирующую субъединиицу в β-клетках и в отвечающих на глюкозу нейронах гипоталамуса, SUR 2A – в сердечной и скелетной мускулатуре, SUR 2B – в гладкой мускулатуре. Порообразующая Kir 6.2-субъединица состоит из 2 трансмембранных доменов, связанных между собой, а регулирующая SUR субъединица – из 17 трансмембранных доменов, объединенных в три группы, и 2 внутриклеточных нуклеотид-связывающих доменов (рис 5). Поскольку до сих пор не найдено АТФ‑связывающих участков на Kir 6.2.-субъединице, считается, что именно SUR субъединица и, в частности, ее нуклеотид-связывающие домены ответственны за метаболическую регуляцию КАТФ-канала. Благодаря связыванию аденозина с нуклеотид-связывающим доменом SUR при повышении концентрации АТФ в клетке происходит инактивация КАТФ‑канала и пора закрывается, что обусловливает деполяризацию мембраны, и напротив, при снижении концентрации АТФ происходит открытие КАТФ-канала и реполяризация мембраны.
Как показали исследования последних лет, SUR1 субъединица КАТФ-канала β-клетки связывает с высокой константой сродства СМ, однако эта константа различна для разных препаратов. Самой слабой константой обладает препарат 1 генерации – толбутамид, самой высокой – глибенкламид, по-видимому, этим фактом и объясняются различия в сахароснижающей активности препаратов, поскольку, чем выше сродство препарата к рецептору, тем длительнее его ингибирующее влияние на КАТФ-канал и тем сильнее будет стимулироваться секреция инсулина за счет поступления в β-клетки ионов Са++.
В этом отношении Амарил продемонстрировал уникальные свойства. С одной стороны, препарат обладает достаточно высокой константой сродства к SUR, которая, тем не менее, в 3–4 раза ниже таковой для глибенкламида, с другой стороны – для Амарила характерно самое высокое соотношение констант диссоциации и ассоциации с SUR (Koff/Kon), превышающее таковое для глибенкламида в 3–4 раза [38]. Константа ассоциации (Kon) с SUR – в 2,5–3 раза, а константа диссоциации (Koff) в 8–9 раз выше для Амарила, чем для глибенкламида, что и обусловливает более быстрый и короткий стимулирующий эффект препарата на секрецию инсулина. Благодаря таким кинетическим характеристикам, на фоне применения Амарила значительно реже и слабее выявляются гипогликемические состояния, чем при использовании других препаратов СМ. В четырехлетнем популяционном проспективном исследовании было продемонстрировано, что у пациентов с СД2 (30 768 пациентов, обращавшихся за медицинской помощью в стационар с симптомами тяжелой гипогликемии) терапия Амарилом в 6,5 раз реже приводила к развитию тяжелых гипогликемий, чем терапия глибенкламидом – 0,86 и 5,6 эпизодов соответственно на 1000 пациентов в год [39].
При изучении кинетических характеристик Амарила исследовательская группа G. Müller [38] выявила, что Амарил взаимодействует с особой субъединицей SUR (SUR X) на β-клетке, с молекулярной массой 65 kDa, тогда как СМ 1-й и 2-й генерации связываются с субъединицей SUR (SUR1) на β-клетке с молекулярной массой 140 kDa. При этом было выяснено, что избыток немеченого глибенкламида или толбутамида в инкубационной среде практически полностью подавляет связывание [3Н]-Амарила с SUR X-65 kDa, и наоборот, немеченый Амарил снижает связывание [3Н]-глибенкламида с SUR1‑140 kDa в дозозависимом соотношении. Таким образом, было доказано кооперативное взаимодействие SUR1 и SUR X и показана возможность связывания СМ как с SUR1 так и SUR X, с соответственно разной аффинностью.
Экстрапанкреатические эффекты действия Амарила
Несмотря на более низкую константу сродства к SUR β-клетки и более короткое стимулирующее секрецию инсулина действие за счет высокого отношения Koff/Kon (см. выше), по сравнению с глибенкламидом, клинические исследования показывают высокую сахароснижающую эффективность Амарила, поскольку дозы, необходимые для идентичного снижения гликемии у людей, на 50–70% ниже дозировок глибенкламида [40]. Это противоречит стандартному представлению, что сахароснижающая активность СМ напрямую связана с ее способностью стимулировать секрецию инсулина в соответствии со степенью сродства к SUR β-клетки. С момента начала применения препаратов СМ не стихают дискуссии относительно способности препаратов этой группы оказывать внепанкреатический эффект, независимый от стимуляции секреции инсулина. Подтверждением этого являются многочисленные наблюдения о снижении инсулинемии при длительном применении СМ без ухудшения гликемического контроля [41]. Инсулиноподобные эффекты и повышение чувствительности к инсулину на фоне СМ были продемонстрированы во многих исследованиях [42–47], однако молекулярные механизмы этих эффектов остаются малоизученными. Оценивая экстрапанкреатический эффект различных препаратов СМ по отношению «выброс инсулина/скорость снижения гликемии», G. Müller с соавт. показали, что Амарил обладает наиболее выраженным инсулиноподобным действием, поскольку отношение инсулин/гликемия составило для глимепирида 0,03, для гликлазида 0,07, для глипизида 0,11 и для глибенкламида 0,16 [38]. Показано, что СМ повышает активность ключевых ферментов липогенеза и гликогенеза, при этом данный эффект почти в 2 раза выше у Амарила, чем у глибенкламида (в 3,5 и 1,9 раз соответственно) [42]. Это может быть объяснено выявлением SUR1 на плазматической мембране адипоцитов и миоцитов in vitro. Вместе с тем, если исходить из предположения, что молекулярные основы периферического действия Амарила такие же, как и на мембране β-клетки, то Амарил должен демонстрировать меньший экстрапанкреатический эффект, по сравнению с глибенкламидом. Однако как показывают многочисленные исследования, Амарил имеет большую активность в отношении транспорта глюкозы в клетку и ее утилизации [38].
Инсулин оказывает свой биологический эффект за счет активации тирозинкиназы инсулинового рецептора, которая запускает цепочку последовательного фосфорилирования белков инсулин-рецепторного субстрата (ИРС-1 и ИРС-2), приводя к активации ключевого фермента в передаче инсулинового сигнала – фосфатидил-инозитол-3-киназы (PI-3К). PI-3K катализирует образование фосфоинозитол-3-фосфата, действующего как вторичны
Роль препаратов сульфонилмочевины в лечении сахарного диабета 2-го типа Текст научной статьи по специальности «Фундаментальная медицина»
Л.А. ШАРОНОВА, к.м.н., А.Ф. ВЕРБОВОЙ, д.м.н., профессор, О.В. КОСАРЕВА, к.м.н. Самарский государственный медицинский университет Минздрава России
РОЛЬ ПРЕПАРАТОВ СУЛЬФОНИЛМОЧЕВИНЫ
В ЛЕЧЕНИИ САХАРНОГО ДИАБЕТА 2-ГО ТИПА
Сахарный диабет 2-го типа (СД2) — одно из самых распространенных заболеваний во всем мире, составляет около 85-90% от общего количества больных диабетом. Более 80% этих пациентов имеют избыточный вес или ожирение и ведут малоподвижный образ жизни. Если раньше СД2 считали «заболеванием пожилых», то в настоящее время половина пациентов, страдающих этим заболеванием, люди трудоспособного возраста. Снижение их трудоспособности, а также затраты на профилактику и лечение поздних осложнений СД представляют собой значимую проблему системы здравоохранения и общества в целом. В то же время терапия СД2 с применением эффективных лекарственных средств, удобных в использовании и с минимальным количеством побочных реакций, может ощутимо снизить затраты на лечение.
Ключевые слова:
сахарный диабет 2-го типа лечение
сульфонилмочевина глимепирид
Основой лечения любого пациента с сахарным диабетом, несомненно, является изменение образа жизни — рациональное питание и повышение физической активности. Согласно клиническим рекомендациям, стратификация лечебной тактики в настоящий момент рассматривается в зависимости от исходного уровня НЬА1с, выявленного у пациента с СД2 при постановке диагноза. Интенсификация сахароснижающей терапии выполняется при отсутствии достижения индивидуальных целей НЬА1с не позднее чем через полгода [1].
В патогенезе СД2 играют роль два основных механизма — инсулинорезистентность (снижение чувствительности к инсулину) и неадекватная секреция инсулина. Как правило, инсулинорезистентность длительное время предшествует развитию СД2 и компенсируется за счет гиперинсулинемии, что позволяет поддерживать нормальный уровень гликемии. В дальнейшем компенсаторные возможности секреторной активности р-клеток оказываются несостоятельными для преодоления барьера инсулинорезистентности и происходит манифестация СД2. В результате прогрессирования глюкозотоксичности и апоптоза к моменту манифестации заболевания у пациентов функционирует только около половины р-клеток поджелудочной железы [2].
При лечении СД2 в первую очередь необходимо снизить инсулинорезистентность. Наиболее простым способом повышения чувствительности к инсулину является снижение массы тела, однако нужно отметить, что у большинства пациентов с СД2 изменение образа жизни не позволяет достичь целевых параметров углеводного обмена [3]. В такой ситуации при исходном уровне НЬА1с
6 МЕДИЦИНСКИЙ СОВЕТ • №03, 2016
6,5-7,5% начинают лечение с монотерапии средствами с минимальным риском гипогликемий — препаратами первого ряда (метформин, иДПП-4, аГПП-1).
Наиболее доступным и эффективным средством, снижающим инсулинорезистентность, на сегодняшний день является метформин. Основным механизмом действия метформина является снижение инсулинорезистентности за счет повышения активности тирозинкиназы инсулино-вого рецептора в периферических тканях. Вместе с тем даже максимальные дозы метформина далеко не всегда позволяют добиться целевого уровня НЬА1с [4].
При неэффективности монотерапии, а также при исходном уровне НЬА1с 7,6-9,0% терапию осуществляют комбинацией двух сахароснижающих препаратов, воздействующих на разные механизмы патогенеза СД2. Наиболее рациональными комбинациями являются сочетания метформина и препаратов, стимулирующих секрецию инсулина: ингибиторов дипептидилпептидазы-4 (иДПП-4), агонистов рецептора глюкагоноподобного пеп-тида-1 (аГПП-1), препараты сульфонилмочевины (ПСМ) или глинидов, а также комбинация метформина и ингибиторов альфа-гликозидазы и натрий-глюкозного котран-спортера 2-го типа (56И2), которая имеет эффект независимо от наличия инсулина в крови.
Несомненно, наиболее частой комбинацией в лечении СД2 является сочетание метформина и препаратов производных сульфонилмочевины. Снижение уровня гликемии под влиянием ПСМ осуществляется за счет стимуляции секреции инсулина, комбинация с метформином воздействует на оба патогенетических звена развития СД2: инсулинорезистентность и неадекватную секрецию инсулина, в результате чего обеспечивается адекватный контроль гликемии как натощак, так и после еды (пост-прандиальной гликемии).
В настоящее время в клинической практике широко используются препараты сульфонилмочевины второго (глибенкламид, гликлазид, глипизид) и третьего (глимепирид) поколений. При выборе препарата акцентируют
внимание на таких его характеристиках, как сахаросни-жающая активность, длительность действия препарата, способность вызывать гипогликемические состояния и увеличение массы тела, а также безопасность препарата.
Механизм действия ПСМ максимально реализуется только при сохраненной функции инсулярного аппарата поджелудочной железы и обусловлен связыванием со специфическими рецепторами плазматической мембраны р-клетки, которые интегрированы в структуру АТФ-зависимых К+-каналов плазматических мембран — рецепторами СМ — SUR. Это приводит к закрытию АТФ-зависимых К+-каналов и запускает изменение мембранного потенциала клетки, открываются Са++-каналы и ионы кальция поступают в клетку, происходит сокращение внутриклеточных миофибрилл и стимуляция секреции инсулина путем экзоцитоза. ПСМ отличаются различной аффинностью к рецептору АТФ-зависимых К+-каналов. Чем выше сродство препарата к рецептору, тем длительнее его ингибирующее влияние на АТФ-зависимый К+-канал и стимуляция секреции инсулина за счет поступления в Р-клетки ионов Са++. Этот эффект наиболее выражен у глибенкламида. ПСМ повышают чувствительность р-клеток к глюкозозависимому инсулинотропному полипептиду (ГИП), и стимуляция секреции инсулина происходит глю-козозависимо, в результате восстанавливается первая фаза секреции инсулина и снижается постпрандиальная гиперликемия [2]. У 5-20% больных СД2 встречается вторичная резистентность к ПСМ, связанная со снижением остаточной секреции инсулина [6].
Необходимо отметить, что в отличие от других ПСМ, которые связываются на клеточной мембране р-клетки с рецептором, молекулярная масса которого составляет 140 кДа, препарат третьей генерации глимепирид связывается с субъединицей этого рецептора массой 65 кДа. Он делает это в 2,5-3 раза быстрее, в результате чего для глимепирида характерно быстрое начало действия. Глимепирид в 8-9 раз быстрее, чем другие ПСМ, высвобождается и диссоциирует с рецепторным аппаратом Р-клетки, т. е. имеет самое высокое соотношение констант диссоциации и ассоциации с SUR, что обусловливает менее выраженное повышение уровня инсулина и, соответственно, более редкие гипогликемические реакции. Глимепирид улучшает контроль гликемии за счет восстановления первой фазы и улучшения второй фазы секреции инсулина [7].
При применении ПСМ как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами наиболее частым нежелательным эффектом становится развитие гипогликемического состояния [8]. В отличие от большинства гипогликемий на фоне введения инсулина связанные с ПСМ гипогликемические состояния имеют некоторые особенности. Для них характерна большая продолжительность и склонность к рецидивам в течение 3 суток даже после коррекции уровня гликемии. Это связано с более длительным периодом полувыведения ПСМ [9]. Однако следует отметить, что тяжелые эпизоды гипогликемии на фоне приема ПСМ относительно редки. В большей зоне риска находятся пожилые пациенты, пациенты, при-
нимающие глибенкламид, соблюдающие пост, а также пациенты со сниженной СКФ. Действительно, глибенкла-мид обладает выраженным сахароснижающим эффектом, но риск гипогликемии достоверно возрастает лишь при приеме его немикронизированных форм (в сравнении с другими секретагогами), в то время как микронизирован-ный глибенкламид не вызывает существенного увеличения частоты гипогликемических состояний [10]. Некоторые авторы отмечают, что у лиц пожилого возраста, особенно при стенозирующем атеросклерозе сосудов сердца и головного мозга, гипогликемия начинается постепенно, без яркой вегетативной симптоматики, и может сопровождаться очаговыми неврологическими знаками, имитируя нарушение мозгового кровообращения [9].
Высокий риск развития гипогликемии отмечается и у больных, соблюдающих пост на фоне лечения ПСМ [11]. В этом случае более безопасными, с учетом сравнительно меньшего риска развития гипогликемического состояния, являются ПСМ второй и третьей генерации. Необходимо учитывать также, что некоторые лекарства, в т. ч. Р-адреноблокаторы, ингибиторы АПФ, тетрациклины и др., усиливают глюкозоснижающее действие ПСМ.
Гипогликемический эффект ПСМ усиливается на фоне снижения СКФ из-за аккумуляции активных метаболитов. В связи с этим при развитии почечной патологии (включая ХБП 4 ст.) возможно применение ряда препаратов этой группы, но только в редуцированной дозе и при условии адекватного контроля гликемии [12]. У больных с нарушением функции почек глимепирид не кумулирует-ся, он полностью метаболизируется в печени и выводится из организма двумя путями: почками — 58% и через ЖКТ — 35%. [2].
В патогенезе СД2 играют роль два основных механизма — инсулинорезистентность (снижение чувствительности к инсулину) и неадекватная секреция инсулина
Гипогликемическая эффективность глимепирида противоречит стандартному представлению, что сахароснижа-ющая активность СМ напрямую связана со степенью сродства к SUR р-клетки. Несмотря на более низкую константу сродства к SUR р-клетки и более короткое стимулирующее секрецию инсулина действие, глимепирид показал высокую сахароснижающую эффективность при значительно меньшей дозировке, необходимой для идентичного снижения гликемии, чем глибенкламид. Это показывает, что эффективность сахароснижающего действия глимепирида обусловлена не только его прямым панкреатическим эффектом, но в большей степени его выраженной внепан-креатической активностью. Все ПСМ обладают в той или иной степени выраженности внепанкреатическим эффектом, независимым от стимуляции секреции инсулина, -повышением чувствительности тканей к инсулину и инсу-линомиметическим (инсулиноподобным) эффектом, что обусловлено наличием АТФ-зависимых К+-каналов, содержащих SUR, в различных тканях. Обладая достаточно высо-
кой константой сродства к SUR и в то же время самым высоким соотношением констант диссоциации и ассоциации с SUR, глимепирид имеет наиболее выраженное инсу-линоподобное действие. Глимепирид повышает активность основных ферментов липо- и гликогенеза, при этом данный эффект выше, чем у глибенкламида, имеет большую активность в отношении транспорта глюкозы в клетку и ее утилизации. Препарат снижает инсулинорезистентность, способствуя повышению продукции адипонектина и снижению уровня фактора некроза опухолей — TNF-a, а также в небольшой степени может повышать чувствительность к инсулину как агонист PPAR-y [2].
Одним из эффектов при длительном применении ПСМ является увеличение массы тела, что может быть обусловлено стимуляцией секреции инсулина ß-клетками и определенным антагонизмом с лептином на нейроны гипоталамуса. В отличие от других ПСМ глимепирид не влияет на прибавку массы тела и даже способствует его снижению за счет не только более короткого и меньшего выброса инсулина из ß-клеток, но и меньшего антагонизма с лептином [2].
Гипогликемические состояния являются важным предиктором смерти при СД2, они способствуют увеличению как общей, так и сердечно-сосудистой смертности [13]. По данным Флорентийского исследования (Florense Registry, 2006), годовая смертность больных с СД2, получающих комбинированную терапию, значительно и достоверно различается в зависимости от назначенного ПСМ. В этом исследовании самая высокая смертность была отмечена у лиц, получавших метформин и глибен-кламид, в то время как она была в 4 раза меньше при комбинации метформина и гликлазида и в 20 раз — при комбинации метформина с глимепиридом [9]. Однако в таких исследованиях, как UKPDS и ADVANCE, предположение о том, что препараты ПСМ могут повышать сердечно-сосудистую смертность, не подтвердилось [8].
ПСМ, содержащие бензамидную группировку, кроме ß-клеток, могут также связываться с АТФ-зависимыми К+-каналами клеток сердечно сосудистой системы. В результате это приводит к их закрытию и ингибирова-нию кардиопротективных механизмов ишемического
прекондиционирования, повышая риск неблагоприятных кардиоваскулярных событий. В структуре глимепирида отсутствует бензамидная группировка, и ни в экспериментах in vitro, ни в опытах in vivo не было выявлено его отрицательного влияния на коронарный кровоток и сосудистый тонус. Кроме того, появились данные и о кардио-протективном действии глимепирида — снижении у пациентов, получавших препарат, таких маркеров кардиова-скулярного риска, как IL-6, CRP, TNF-a, о повышении продукции NO эндотелием. Глимепирид способствует нормализации содержания липидов, снижает содержание малонового альдегида в крови, что ведет к значительному снижению перекисного окисления липидов [2, 14]. Все ПСМ способны опосредованно улучшать агрегацию тромбоцитов за счет улучшения метаболического контроля.
Необходимость приема пациентами большого количества препаратов для лечения СД2 и его осложнений, а также часто имеющейся сопутствующей патологии значительно снижает у них комплаентность. Глимепирид имеет длительность действия до 24 ч и способен стимулировать секрецию инсулина и эффективно обеспечивать контроль постпрандиальной гликемии вне зависимости от кратности приема. Это позволяет применять препарат 1 раз в сутки, обеспечивая у пациентов более высокую приверженность к лечению. Этому способствует и то, что от пациента не требуется соблюдение периода ожидания (30-45 мин перед приемом пищи), а четыре разные дозировки (1, 2, 3 и 4 мг) позволяют подобрать максимально эффективную дозу для каждого пациента.
Все перечисленное свидетельствует о несомненном преимуществе единственного ПСМ третьей генерации -глимепирида (Амарил). Благодаря особенностям его механизма действия, позволяющему при минимальной стимуляции ß-клетки получать максимальный сахаросни-жающий эффект, безопасности в плане гипогликемиче-ских состояний и кардиоваскулярных рисков, а также благодаря выраженной внепанкреатической активности и способности влиять на снижение веса у пациентов с избыточной массой тела, глимепирид может стать препаратом выбора в лечении больных СД2.
ЛИТЕРАТУРА
1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой
(7-й выпуск). Сахарный диабет, 18. 1S: 1-112.
2. Недосугова Л.В. Препараты сульфонилмочевины в современной стратегии лечения сахарного диабета 2 типа. Сахарный диабет, 2011, 2: 99-109.
3. Андрианова О.Л., Мирсаева ГХ., Низамутдинова P.C., Ибрагимова Л.А., Салахов Э.М., Кокина Н.В., Гусева П.С. Роль комплексного подхода в повышении эффективности лечения ожирения. Эндокринология: новости, мнения, обучение, 2014, 2(7): 34-36.
4. Nathan D.M. Medical Management of Hyperglycemia in lType 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. Diabetes Care, 2009, 32: 1-11.
5. Вербовой А.Ф., Барабанова Н.А. Фармако-эпидемиологический анализ терапии сахарно-
го диабета 2-го типа в амбулаторной практике. Проблемы эндокринологии, 2009, 55, 4: 3-6.
6. Аметов А.С., Солуянова Т.Н. Основные подходы в лечении сахарного диабета 2 типа пероральными сахароснижающими препаратами. Медицинский совет, 2011, 1-2: 45-50.
7. Романцова Т.И., Максимова Н.В. Оптимизация таблетированной сахароснижающей терапии с использованием глимепирида при сахарном диабете 2 типа. Сахарный диабет, 2010. 1: 50-54.
8. Макеева Е.И., Оскола Е.В., Шубина А.Т., Карпов ЮА. Эффективность и безопасность перораль-ных сахароснижающих препаратов у больных сахарным диабетом 2-го типа и сердечнососудистыми заболеваниями. Альманах клинической медицины, 2014, 32: 80-88.
9. Верткин А.Л., Магомедова А.Ю., Казарцева С.С., Алексеева А.С., Ястребова О.С.. Клиническое и прогностическое значение гипогликемии у больных сахарным диабетом 2 типа. РМЖ, 2012, 13: 651-653
10. Сапожникова И.Е. Клинико-экономический анализ эффективности и безопасности сахароснижающей терапии у пациентов с сахарным диабетом. 2-го типа. Вятский медицинский вестник, 2015, 1: 22-27.
11. Аметов А., Камынина Л. Управление сахарным диабетом типа 2 в период религиозного поста. Врач, 2014, 7: 28-31.
12. Шамхалова М.Ш., Ярек-Мартынова И.Я., Трубицына Н.П., Шестакова М.В. Особенности сахароснижающей терапии у больных сахарным диабетом и хронической болезнью почек. Сахарный диабет, 2013, 3: 97-102.
13. Асфандиярова Н.С. Смертность при сахарном диабете 2 типа. Сахарный диабет, 2015, 18(4): 12-21.
14. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Новые аспекты действия глимепирида у больных сахарным диабетом 2-го типа. Международный эндокринологический журнал. 2010, 2(26).
S МЕДИЦИНСКИЙ СОВЕТ • №03, 2G16
Инсулин и препараты сульфонилмочевины, назначаемые в качестве препаратов второй линии для лечения сахарного диабета 2 типа, ассоциируются с бóльшим риском сердечно-сосудистых осложнений по сравнению с более новыми сахароснижающими препаратами
В качестве препарата первой линии при лечении сахарного диабета 2 типа рекомендуется использовать метформин. Выбор препарата второй линии может повлиять на риск развития сердечно-сосудистых осложнений.
В журнале JAMA Network Open опубликованы результаты крупного когортного исследования (N=132737), посвященного оценке риска развития сердечно-сосудистых осложнений у пациентов в реальной клинической практике, получающих разные сахароснижающие препараты в качестве терапии второй линии. Препаратом первой линии в большинстве случаев был метформин. В качестве препарата второй линии в 47.6% случаев назначались препараты сульфонилмочевины, 21.8% — ингибиторы DPP-4, 12.2% — базальный инсулин, 8.6% — агонисты глюкагоноподобного пептида — 1, 5.6% — тиазолидиндионы, 4.3% — ингибиторы натрийзависимого переносчика глюкозы типа 2.
В качестве препаратов сравнения были выбраны тиазолидиндионы, поскольку ранее было показано, что они обладают нейтральным эффектом на риск сердечно-сосудистых осложнений.
В исследование включались пациенты с 2011 по 2016гг. За время наблюдения во всей когорте пациентов было зарегистрировано 3480 событий, удовлетворяющих критериям комбинированной конечной точки (развитие ИБС, инсульта, атеросклеротической болезни периферических артерий, госпитализации в связи с декомпенсацией НК).
В сравнении с тиазолидиндионами, частота сердечно-сосудистых осложнений была достоверно выше у пациентов, получающих препараты сульфонилмочевины (ОШ 1.36; 95% ДИ 1.23-1.49) и базальный инсулин (ОШ 2.03; 95% ДИ 1.81-2.27). Возможными общими механизмами неблагоприятного влияния этих препаратов является развитие гиперинсулинемии, нарастание массы тела, эпизоды гипогликемии.
Остальные препараты (в том числе, ингибиторы ГПП-1 и ингибиторы натрийзависимого переносчика глюкозы типа 2) не продемонстрировали протективного эффекта в отношении ССО при сравнении с тиазолидиндионами. Напомним, что прямого сравнения между новыми классами сахароснижающих препаратов с точки зрения развития ССО в рамках рандомизированных клинических исследований не проводилось.
По материалам:
O’Brien MJ, Karam SL, Wallia A, et al. Association of Second-line Antidiabetic Medications With Cardiovascular Events Among Insured Adults With Type 2 Diabetes. JAMA Netw Open. 2018;1(8):e186125. doi:10.1001/jamanetworkopen.2018.6125
Источник
Текст: к.м.н. Шахматова О.О.
Применение сульфонилмочевинных препаратов второй генерации и место глюренорма в терапии инсулиннезависимого сахарного диабета | Балаболкин
История открытия сахаропонижающего действия сульфаниламидов связана с именем М. Loubatieres, который в 1941 г. описал гипоглике- мизирующее действие сульфаниламидов при лечении больных, страдающих пневмонией. В последующие годы (1942-1946) в этой лаборатории было подробно изучено сахаропонижающее действие сульфаниламида глипротиазола, или препарата 2254 RP (p-aminobentenesulfamido-isopro- pyl-thiodiazole).
Было установлено, что гипогликемизирующее действие гликопротиазола проявляется лишь у животных с интактной поджелудочной железой. Такой эффект отсутствовал у депанкреатэктоми- рованных животных. Это и позволило авторам считать, что указанный препарат оказывает специфическое “бета-цитотропное” влияние. Однако, несмотря на это, сульфаниламиды из-за выраженного бактериостатического эффекр для лечения больных сахарным диабетом не применялись.
В 1956 г. были опубликованы клинические и экспериментальные данные о сахаропонижающем эффекте производного сульфаниламидного препарата толбутамида (l-butyl-3-paratolyl-sul- fonylurea), относящегося к группе сулфонилмо- чевинных препаратов. Почти одновременно были опубликованы данные о сахаропонижающем эффекте и других препаратов сульфонил- мочевины.
Можно без преувеличения сказать, что 1956- 1957 гг. являются “эрой пероральной сахаропонижающей терапии” для больных сахарным диабетом II типа (инсулиннезависимый диабет). Ее можно сравнить с “эрой (1921-1922) инсулиноте- рапии” для больных сахарным диабетом I типа.
В 1969 -1972 гг. обстоятельно описаны сахаропонижающие препараты, которые эффективны в дозах, в 20-100 раз меньших по сравнению с толбутамидом, и которые в дальнейшем получили название сульфонилмочевинных препаратов второй генерации [2] (табл. 1).
Сульфонилмочевинные препараты оказывают центральное и периферическое действие. Центральное действие препаратов проявляется стимуляцией секреции и высвобождением инсулина
Характеристика сульфонилмочевинных сахаропонижающих препаратов
Препарат, год внедрения в практику | Синоним | Суточная доза- | Период полураспада (биологический), ч | Длительность гипогликемического действия, ч | Экскреция с мочой, % |
Бутамид. 1956 | Толбутамид Д-860 | Препараты первой генерации (в г) 0,5-2,0 4-5 | 6-12 | 100 | |
Бухарбаи, 1957 | Карбутамид BZ-55 | 0,5-1,5 | 4-5 | 6-12 | 100 |
Хлорпропамид, 1957 | Диабинез | 0,125-0,75 | 36 | до 60 | 90-100 |
Толазамнд, 1962 | Толиназ | 0,1-1,0 | 7 | 12-14 | 85 |
Ацетогексамид, 1962 | Димелор | 0,25-1,5 | 6-8 | 12-14 | 60 |
Глимидин, 1964 | Гликодиазин | 0,5-2,0 | 4 | 6-10 | 65 |
Препараты второй генерации (в мг)
Глибенкламид. 1969 | Манилил | 1,25-20 | 3-5 | 10 (до 24) | 50-55 |
Глипизид, 1971 | Даонил Эуглюкон Глибурид Минидиаб | 1,25-40 | 2-4 | 12-14 (до 24) | 68 |
Гликвидон. 1970 | Глюреиорм | 30-120 | 4-6 | 5-7 (до 12) | 5 |
Гликазид. 1972 | Днабетон | 80-240 | 4-6 | 8-12 | 60-72 |
Глиборнурид. 1970 | Диамикрон Предиан Глутрил | 12-75 | 8 | 18-12 (до 14) | 65-75 |
Глизоксепид, 1971 | — | 2-16 | 2-4 | 8-14 (до 24) | 60-70 |
из р-клеток островков поджелудочной железы. Механизмы стимулирующего влияния глюкозы и сульфонилмочевинных препаратов на секрецию инсулина близки, если не идентичны. Первоначально сульфонилмочевинные препараты связываются с рецепторами р-клеток, и такое взаимодействие стимулирует К+-активизирующую АТФазу, под влиянием которой происходит закрытие АТФ-зависимых калиевых каналов. Это приводит к изменению уровня внутриклеточного калия с последующей деполяризацией мембраны. Деполяризация мембраны в свою очередь вызывает открытие вольтажзависимых Са2+-ка- налов и увеличение вхождения ионов кальция с повышением уровня цитозольного кальция. Последний и является триггером высвобождения инсулина из р-клетки.
Показано, что сульфонилмочевинные препараты стимулируют 1-ю фазу секреции инсулина, активизируют аденилатциклазу, ингибируют фосфодиэстеразу или вызывают длительную деполяризацию мембраны р-клетки.
Периферический эффект сахаропонижающего действия препаратов сульфонилмочевины опосредуется через влияние на рецепторы к инсулину |2|. Четко показано, что сульфонилмочевинные препараты приводят к увеличению количества рецепторов на клетках-мишенях (гепатоциты, мышечная и жировая ткань, лимфоциты и другие клетки). Известно, что у больных сахарным диабетом 11 типа выявляется снижение как количества рецепторов, так и их аффинности. Увеличение количества рецепторов на мембране клеток-мишеней при этом происходит не за счет их синтеза de novo, а за счет улучшения возврата рецептора на мембрану из цитозоля, куда они транслоцируются в виде инсулин-рецепторного комплекса после взаимодействия инсулина с соответствующим рецептором.
Одним из сульфонилмочевинных препаратов второй генерации является гликвидон (глюре- норм) [3]. Указанный препарат имеет одно преимущество, отличающее его от других сульфонилмочевинных препаратов. Около 95% препарата выводится из организма с желчью через желудочно-кишечный тракт, и лишь 5% экстрагируется почками. Поэтому он является препаратом выбора в лечении больных сахарным диабетом с нефропатией с учетом того, что препарат метаболизируется в печени и элиминируется через желчные протоки в кишечник. Возникает, естественно, вопрос о возможности его влияния на функцию печени больных, длительно получающих лечение глюренормом.
Материалы и методы
Целью настоящего исследования было изучение влияния глюренорма на функциональное состояние печени у больных сахарным диабетом, страдающих заболеваниями печени и желчео-выводящих путей. Под нашим наблюдением находилось 20 больных сахарным диабетом II типа (4 мужчины и 16 женщин), которые в течение года получали в качестве сахаропонижающей терапии глюреиорм. В исследование включали больных с верифицированным нарушением функционального состояния печени и желчео-выводящих путей. До начала исследования и ежеквартально больным проводилось биохимическое исследование с определением основных показателей функционального состояния печени, включая определение активности трансаминаз, щелочной фосфатазы, у- глутаминитраспептидазы. содержания билирубина, общего холестерина, триглицеридов, протромбинового индекса. Показатели углеводного обмена, гемодинамики, колебания массы тела контролировались ежемесячно. Общеклинические исследования, включавшие анализ крови мочи, определение содержания креатинина и мочевины, гликированного гемоглобина НЬА1с и иммунореактивного инсулина (ПРИ), проводились ежеквартально.
Средний возраст наблюдавшихся больных составил 67 ± ± 2,5 года (от 38 лет до 71 года), средняя масса тела — 78.8 ± + 4.45 кг (от 55 до 121 кг). Длительность сахарного диабета до назначения глюренорма составила 46,37 ± 13,76 мес (от 2 до 186 мес). Больные поступали в клинику в состоянии декомпенсации либо субкомпенсации сахарного диабета. После верификации сопутствующей терапии больные переводились на лечение глюренормом. В течение 1-го месяца терапии проводился подбор дозы препарата на основании клинической симптоматики (динамика массы тела, жажда, полиурия) и показателей углеводного обмена (гликемия базальная и пос- тпрацциальная), контролировавшихся еженедельно. Отмечено
повышение дозы препарата от 60 до 180 мг/сут в течение этого периода (среднесуточная доза 120 мг).
Из 20 обследованных больных 2 женщины страдали хроническим гепатитом, 3 больных (2 мужчин, 1 женщина) — портальным циррозом печени (в 2 случаях — алкогольным), 6 больных (2 мужчин, 4 женщины) перенесли холецистэктомию по поводу желчнокаменной болезни. 4 женщины страдали желчнокаменной болезнью (диагноз верифицирован при ультразвуковом исследовании либо при холецистогра- фни), 5 женщин — хроническим холециститом с дискинезией желчных путей. Явления жирового гепатоза отмечались практически у всех больных (верифицировано при сцинтиграфии). Все больные получали стандартную диетотерапию калорийностью 1800 ккал/сут.
Результаты и их обсуждение
На ([тоне проводимого лечения у 4 больных достигнуть компенсации углеводного обмена не удалось, несмотря на максимальные дозы препарата. У этих больных развились симптомы декомпенсации сахарного диабета, сопровождающиеся жаждой, полиурией, кетонурией, потерей массы тела, в связи с чем прием глюренорма был прекращен и больные были переведены на лечение другими сульфонилмочевинными препаратами второго поколения — глипизидом или глибенкламидом. Одна больная вследствие развития метаболического ацидоза была переведена на инсулинотерапию. До назначения глюренорма 2 больных не получали никакой сахаропонижающей терапии (длительность диабета 2-3 мес), 1 больная получала инсулинотерапию с явлениями ее хронической передозировки, 3 больных в течение полугода принимали акарбозу, остальные 14 — препараты сульфонилмочевины первой (3 больных) и второй (11 больных) генерации.
Для оценки гипогликемизирующего эффекта глюренорма использовали критерии: отлично — при базальной гликемии до 7,4 ммоль/л, аглюко- зурии и содержании НЬА1с < 8%, хорошо — при базальной гликемии до 8,3 ммоль/л, глюкозурии менее 10 г/л и содержании НЬА1с < 8,6%, плохо — при базальной гликемии более 8,3 ммоль/л, глюкозурии более 10 г/л и Содержании НЬА1с > 8,6%.
Как видно из табл. 2, отличная компенсация была достигнута у 30% больных, которые до перевода на глюреиорм получали акарбозу либо находились на диетотерапии. Среднесуточная доза глюренорма составила у них 60 мг/сут (от 45 до 120 мг). Хорошая компенсация была достигнута у 45% больных, страдавших сахарным диабетом средней степени тяжести. Среднесуточная доза глюренорма составила у них 90 мг (от 60 до 180 мг/сут). При этом в 3 случаях глюреиорм комбинировался с бигуанидами (группа буформина) в суточной дозе 0,25-0,75 г. Одна больная с активным циррозом печени в течение года находилась на комбинированной терапии: глюреиорм + фоновая инсулинотерапия в суточной дозе 22 ЕД (менее
Оценка эффективности глюренорма (по X. Шамбах и соавт. [IJ)
Оценка | Число больных | НЬА!с. % (М ± т) |
Отлично | 6 | 7.59 + 0.32 |
Хорошо | 9 | 8.17 ± 0.24 |
Плохо | 5 | 11,96 ± 1,85 |
0,5 ЕД на 1 кг массы в сутки). Без комбинации с инсулином эффективной компенсации углеводного обмена достичь не удавалось, и у больной развивалось состояние метаболического ацидоза. Плохой была компенсация у 25% больных. При этом у 4 больных было прервано лечение глюренормом, больная в течение года продолжала прием глюренорма в суточной дозе 150 мг в комбинации с 0,75 г/сут буформина. Показатели углеводного обмена. НЬА1С, ПРИ в сыворотке крови на фоне лечения глюренормом приведены в табл. 3.
Таким образом, сравнивая сахаропонижающий эффект глюренорма с другими препаратами сульфонилмочевины, следует отметить его меньшую эффективность в сравнении с другими препаратами второго поколения, такими, как глипи- зид и глибенкламид, поскольку для достижения компенсации сахарного диабета требуются большие дозы препарата. Отличный эффект был получен только у больных, нс принимавших ранее других препаратов сульфонилмочевины.
Оценка функционального состояния печени, проводившаяся ежеквартально в течение года наблюдения. не выявила отрицательной динамики ни со стороны клинической симптоматики, ни со стороны биохимических показателей (табл. 4).
У 1 больного с активным циррозом печени на фоне проводимой терапии выявлена положительная динамика биохимических показателей (снижение активности трансаминаз плазмы, содержания билирубина, щелочной фосфатазы). У 2 больных с алкогольным циррозом не отмечено положительной динамики со стороны биохимических показателей, что может быть обусловлено продолжавшимся злоупотреблением алкоголя.
Только у 1 больного зафиксированы нечеткие гипогликемические состояния (потливость, дрожь, саливация, тахикардия), возникающие между приемами пищи. Гликемического контроля в эти моменты не проводилось, однако больной отмечал улучшение состояния после приема пищи. Четких указаний на причинную связь с приемом глюренорма не было.
Аллергическая реакция на прием глюренорма, проявлявшаяся кратковременно в интервале между приемом препарата и завтраком в виде легкой гиперемии и зуда кожи лица, отмечена лишь у 1 больного. Дополнительного назначения антигистаминной терапии не требовалось.
Таблица 3
Показатели углеводного обмена, НЬА1с, ПРИ в сыворотке крови на фоне лечения глюренормом
Время обследования | Гликемия, ммоль/л | ИРИ, мкЕД/мл | НЬА10, % | ||
базальная | постпрандиальная | базальный | 1 постпрандиальный | ||
До лечения Через 12 мес лечения | 8,05 + 0,33 6,54 ± 0,32 | 10.24 ± 0.048 7,49 ± 0,37 | 86.5 ± 17,1 70.5 ± 15,2 | 148.8 + 27.8 86,0 ± 16,7 | 11,01 ± 0.59 8,06 ± 0,1 |
Таблица 4
Влияние терапии глюренормом на функциональное состояние печени
Биохимические показатели
До терапии
Через 12 мес терапии
Общий холестерин, ммоль/л | 6,14 | ± | 0,15 | 6,46 | + | 0,07 |
Триглицериды, ммоль/л | 1,51 | + | 0,15 | 1,45 | + | 0,12 |
АЛТ, ед. | 41.94 | + | 10,61 | 41,58 | + | 13,71 |
ACT, ед. | 48,44 | ± | 13,71 | 35,86 | + | 6,57 |
у-ГТФ. ммоль/л | ■ 61,93 | + | 14,51 | 72,68 | + | 15.08 |
Щелочная фосфатаза, ммоль/л | 247.15 | + | 16.19 | 242,55 | ± | 17,35 |
Билирубин, ммоль/л | 27,62 | + | 10,34 | 20,79 | ± | 4,66 |
Протромбиновый индекс. % | 87,25 | ± | 1,92 | 86,56 | + | 2,07 |
П р и м е ч а н и е . р > 0,05 для всех показателей.
Таким образом, препарат сульфонилмочевины второй генерации глюреиорм может быть использован как сахаропонижающее средство у больных сахарным диабетом II типа, страдающих заболеваниями печени и желчевыводящих путей, поскольку повреждающего влияния на функциональное состояние этих органов не выявлено. Невысокий гипогликемизирующий эффект препарата компенсируется возможностью увеличения дозы препарата до 120-180 мг/сут (4-6 таблеток) без каких-либо побочных явлений со стороны функционального состояния печени.
В течение 1 года и более при приеме глюренорма нс отмечалось ни клинических, ни лабораторных признаков ухудшения функции печени у обследованных, а у некоторых имелось даже умеренное улучшение показателей функции печени.
В ы в о д ы
- Длительное применение глюренорма в лечении больных сахарным диабетом II типа в сочетании с заболеваниями печени и желчевыводящих путей не сопровождалось ухудшением показателей функционального состояния печени.
- Глюреиорм может быть использован в качестве сахаропонижающего средства для лечения больных, страдающих инсулиннезависимым сахарным диабетом в сочетании с заболеваниями печени и желчевыводящих путей.
Роль препаратов сульфонилмочевины в лечении сахарного диабета 2-го типа | Шаронова
1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой (7-й выпуск). Сахарный диабет, 18. 1S: 1-112.
2. Недосугова Л.В. Препараты сульфонилмочевины в современной стратегии лечения сахарного диабета 2 типа. Сахарный диабет, 2011, 2: 99-109.
3. Андрианова О.Л., Мирсаева ГХ., Низамутдинова Р.С., Ибрагимова Л.А., Салахов Э.М., Кокина Н.В., Гусева П.С. Роль комплексного подхода в повышении эффективности лечения ожирения. Эндокринология: новости, мнения, обучение, 2014, 2(7): 34-36.
4. Nathan D.M. Medical Management of Hyperglycemia in 1Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. Diabetes Care, 2009, 32: 1-11.
5. Вербовой А.Ф., Барабанова Н.А. Фармако-эпидемиологический анализ терапии сахарного диабета 2-го типа в амбулаторной практике. Проблемы эндокринологии, 2009, 55, 4: 3-6.
6. Аметов А.С., Солуянова Т.Н. Основные подходы в лечении сахарного диабета 2 типа пероральными сахароснижающими препаратами. Медицинский cовет, 2011, 1-2: 45-50.
7. Романцова Т.И., Максимова Н.В. Оптимизация таблетированной сахароснижающей терапии с использованием глимепирида при сахарном диабете 2 типа. Сахарный диабет, 2010. 1: 50-54.
8. Макеева Е.И., Оскола Е.В., Шубина А.Т., Карпов ЮА. Эффективность и безопасность пероральных сахароснижающих препаратов у больных сахарным диабетом 2-го типа и сердечносо-судистыми заболеваниями. Альманах клинической медицины, 2014, 32: 80-88.
9. Верткин А.Л., Магомедова А.Ю., Казарцева С.С., Алексеева А.С., Ястребова О.С. Клиническое и прогностическое значение гипогликемии у больных сахарным диабетом 2 типа. РМЖ, 2012, 13: 651-653
10. Сапожникова И.Е. Клинико-экономический анализ эффективности и безопасности сахароснижающей терапии у пациентов с сахарным диабетом. 2-го типа. Вятский медицинский вестник, 2015, 1: 22-27.
11. Аметов А., Камынина Л. Управление сахарным диабетом типа 2 в период религиозного поста. Врач, 2014, 7: 28-31.
12. Шамхалова М.Ш., Ярек-Мартынова И.Я., Трубицына Н.П., Шестакова М.В. Особенности сахароснижающей терапии у больных сахарным диабетом и хронической болезнью почек. Сахарный диабет, 2013, 3: 97-102.
13. Асфандиярова Н.С. Смертность при сахарном диабете 2 типа. Сахарный диабет, 2015, 18(4): 12-21.
14. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Новые аспекты действия глимепирида у больных сахарным диабетом 2-го типа. Международный эндокринологический журнал, 2010, 2(26).
15. Algorithms of specialized medical care to patients with diabetes. Edited by I.I. Dedov, M.V. Shectakova (Vol.7). Sakharniy Diabet, 18. 1S: 1-112.
16. Nedosugova L.V. Sulfonylureas in current treatment strategies for type 2 diabetes. Sakharniy Diabet, 2011, 2: 99-109.
17. Andrianova O.L., Mirsaeva G.H., Nizamutdinova R.S., Ibragimova L.A., Salakov E.M., Kokina N.V., Guseva P.S. The role of the integrated approach in improving the effectiveness of treatment of obesity. Endokrinologiya: Novosti, Mneniya, Obuchenie, 2014, 2(7): 34-36.
18. Verbovoy A.F., Barabanova N.A. Pharmacoepidemiological analysis of diabetes type 2 therapy in outpatient practice. Problemy Endocrinologii, 2009, 55, 4: 3-6.
19. Ametov A.S., Soluyanova T.N. Key approaches to the treatment of type 2 diabetes with oral hypoglycemic agents. Meditsinskiy Sovet, 2011, 1-2: 45-50.
20. Romantsova T.I., Maximova N.V. Optimization of glucose-lowering therapy with glimepiride tablets for type 2 diabetes. Sakharniy Diabet, 2010. 1: 50-54.
21. Makeyeva E.I., Oskola E.V., Shubina A.T., Karpov Y.A. Efficacy and safety of oral hypoglycemic agents in patients with type 2 diabetes and cardiovascular disease. Almanakh Klinicheskoy Meditsiny, 2014, 32: 80-88.
22. Vertkin A.L., Magomedova A.Y., Kazartseva S.S., Alekseeva A.S., Yastrebova O.S. Clinical and prognostic significance of hypoglycemia in patients with type 2 diabetes. RMZ, 2012, 13: 651-653
23. Sapozhnikova I.E. Clinical and economic analysis of the efficacy and safety of glucoselowering therapy in patients with diabetes mellitus type 2. Vyatskiy Meditsinskiy Vestnik, 2015, 1: 22-27.
24. Ametov A., Kamynina L. Managing type 2 diabetes during religious fasting. Vrach, 2014, 7: 28-31.
25. Shamkhalova M.Sh., Yarek-Martynova I.Y., Trubitsyna N.P., Shestakova M.V. The specific glucose-lowering therapy in patients with diabetes and chronic kidney disease.
26. Sakharniy Diabet, 2013, 3: 97-102.
27. Asfandiyarova N.S. Mortality rate for patients with diabetes type 2. Sakharniy Diabet, 2015, 18(4): 12-21.
28. Balabolkin M.I., Klebanova E.M., Kreminskaya V.M. New aspects of the effect of glimepiride in patients with type 2 diabetes. Mezhdunarodniy Endokrinologicheskiy Zhurnal, 2010, 2(26).
препаратов сульфонилмочевины в качестве альтернативы для лечения сахарного диабета: где мы сейчас находимся?
Сульфонилмочевины (СУ) являются отличительной чертой лечения сахарного диабета 2 типа (СД2) и остаются основным фармакологическим подходом на протяжении многих десятилетий. Толбутамид и остальные SU первого поколения были созданы в Германии в 1950-х годах, тогда как агенты второго поколения, такие как глибурид и глипизид, были выпущены в США в 1984 году [1]. Глимепирид, SU третьего поколения, стал доступен в США в 1995 г. [2].В 1997 г. SUs были наиболее назначаемым классом пероральных противодиабетических средств, что соответствовало более 60% всех посещений врача [3].
SU характеризуются как агенты, усиливающие секрецию инсулина, поскольку они стимулируют β-клетки поджелудочной железы к секреции инсулина. Они связываются с SUR1, субъединицей калиевого АТФ-зависимого канала на плазматической мембране β-клеток. Связывание SU приводит к закрытию канала и последующей деполяризации мембраны, что вызывает открытие потенциал-зависимых кальциевых каналов L-типа.Приток кальция, который происходит, приводит к увеличению внутриклеточного кальция, который запускает экзоцитоз гранул инсулина [4].
Поскольку SU используются более 60 лет, клиницисты по всему миру имеют большой опыт работы с ними. Известно, что SU довольно эффективны в контроле гликемии со значительным снижением HbA1c. Метаанализ, сравнивавший эффективность пероральных противодиабетических препаратов, показал снижение HbA1c на 1.25% принимали СУ по сравнению с плацебо и отметили, что СУ имели наибольший эффект по сравнению с остальными противодиабетическими средствами [5]. Другие исследования сообщают о еще большем сокращении, достигающем 1,6% [6]. Однако, согласно другому исследованию, SU, по-видимому, имеют почти такой же эффект на HbA1c, что и ингибиторы тиазолиндионов (TZD) и дипептидилпептидазы-4 (DPP4) [7]. Согласно исследованиям UKPDS и ADVANCE, лечение SU продемонстрировало снижение микрососудистых, но не макрососудистых осложнений [8,9].
Накопление данных из различных исследований показывает, что SU улучшают исходы у пациентов с ишемическим инсультом, уменьшая геморрагическую трансформацию и снимая отек мозга. Согласно ретроспективному исследованию, применение СУ у пациентов с диабетом, перенесших инсульт, приводит к уменьшению внутримозгового кровоизлияния и перигематомного отека при одновременном снижении стационарной смертности [10].
Следует отметить, что суточные препараты значительно дешевле, чем любые другие противодиабетические средства.В действительности, когда все больше и больше людей страдают от СД2, а медицинские расходы являются серьезной проблемой, разумно попытаться включить недорогие лекарства в повседневную практику [11].
Однако, несмотря на заметную эффективность и низкую стоимость, SU имеют более низкий приоритет в алгоритме лечения, и их использование постоянно сокращается, составляя лишь около 20% посещений для лечения диабета в 2012 году [3]. Это снижение частично связано с тем, что новые препараты утверждаются и используются в повседневной практике.В систематическом обзоре, опубликованном в марте 2019 года, сравнивается экономическая эффективность SU и новых противодиабетических препаратов, и делается вывод о том, что агонисты рецепторов GLP-1, ингибиторы DPP-4 и ингибиторы SGLT2 являются более экономически эффективными вариантами комбинированной терапии с метформином, чем SU и TZD. и базальный инсулин [12].
Кроме того, в последние несколько лет известно, что SU имеют ряд недостатков, которые необходимо учитывать. Гипогликемия, вызванная SU, является одним из важнейших клинических проявлений и является следствием их способности вызывать секрецию инсулина даже при низкой концентрации глюкозы в крови [13].Он был описан у 20-40% пациентов, получавших SU, в то время как тяжелая гипогликемия встречается у 1-7% пациентов [14]. В недавнем ретроспективном исследовании, проведенном в Греции, распространенность гипогликемии, вызванной SUs, и ее последствий оказалась еще выше, у 41,6% пациентов, в то время как 9,1% сообщили о тяжелых или очень тяжелых эпизодах гипогликемии [15]. Частота гипогликемии колеблется в зависимости от конкретного агента сульфонилмочевины (SU), возраста, продолжительности диабета и сопутствующей патологии.Использование препаратов длительного действия, таких как хлорпропамид и глибурид, более склонно вызывать гипогликемию [16] и не должно рассматриваться как подходящий вариант для пожилых пациентов [17]. Глибурид вызывает в два раза больше эпизодов гипогликемии, чем другие SU [18].
Что касается остальных пероральных противодиабетических средств, SU явно повышают риск эпизодов гипогликемии. По сравнению с метформином в качестве монотерапии, они имеют более чем в 4 раза более высокий риск, а при добавлении к метформину они имеют в 6 раз более высокий риск по сравнению с другими агентами [18,19].Эпизодов тяжелой гипогликемии может быть меньше, чем эпизодов, возникающих из-за инсулина [20,21], однако они, вероятно, будут более продолжительными и связаны с большей смертностью [16]. В нескольких исследованиях сообщается, что SU виноваты только в эпизодах легкой гипогликемии, а не в тяжелых, которые требуют медицинского вмешательства [6]. Это может быть правдой, однако как тяжелая, так и легкая гипогликемия коррелируют с более низким качеством жизни и значительными долгосрочными последствиями [15,22].
Увеличение веса — еще один частый побочный эффект лечения SU.Пациенты обычно набирают 1–4 кг в течение 1 года, вероятно, из-за анаболического эффекта повышения уровня инсулина [14]. Помимо SU, инсулин и TZD также связаны с увеличением веса в отличие от новых противодиабетических средств, таких как агонисты глюкагоноподобного пептида 1 (GLP-1) и ингибиторы DPP-4, которые, по-видимому, способствуют снижению веса [19,23].
Хорошо известно, что потеря веса улучшает гликемический контроль, приводит к использованию меньшего количества лекарств и помогает управлять остальными факторами риска сердечно-сосудистых заболеваний.Его следует поощрять всем пациентам с СД 2 типа, первоначально путем изменения образа жизни. Однако некоторые авторы считают прибавку в весе из-за SU только умеренной и варьирующейся в зависимости от используемого агента, и полагают, что ее можно довольно легко контролировать [16].
Еще одним недостатком использования SU является тот факт, что они не оказывают длительного эффекта на снижение уровня глюкозы [20]. Эта неспособность поддерживать устойчивый гликемический контроль, вероятно, является следствием потери функции β-клеток поджелудочной железы.Исследование ADOPT, которое было многоцентровым двойным слепым клиническим исследованием, было разработано для оценки и сравнения гликемического контроля у пациентов с СД2, получающих монотерапию TZD, метформином и SU. Согласно исследованию, несмотря на тот факт, что SU оказал наибольшее влияние на снижение HbA1c в течение первых 6 месяцев, наблюдалась прогрессирующая потеря гликемического контроля. Через 4 года только 26% в группе, получавшей SU, имели HbA1c менее 7%. Уровень функции β-клеток также снизился после первых 6 месяцев, с наибольшей годовой скоростью снижения в группе SU [24].Утрата функции β-клеток имеет решающее значение при СД2, поскольку ускоряет необходимость дополнительного лечения и, в конечном итоге, инсулина. Это обычная тактика — попытка сохранить как можно больше функции β-клеток, чтобы продлить этот период. Кроме того, исследование ADOPT показало, что ингибиторы SU и DPP-4 показали самую короткую стойкость, которая варьировалась от 3,3 до 4,4 лет, в то время как препараты класса переносчиков глюкозы натрия-2 и тиазолиндионов показали прогнозируемое время до нейтральности A1c от 6 до 8 лет. .Таким образом, продолжительность лечения SU является важным фактором, который следует знать при принятии решения о лечении [25].
Связано ли использование SU с повышенным риском сердечно-сосудистых заболеваний или нет, является одним из наиболее спорных вопросов, касающихся этого конкретного класса пероральных противодиабетических средств. Дебаты начались в 1970-х, когда Университетская группа по диабету сообщила о повышенном риске сердечно-сосудистых заболеваний и смертности при использовании СУ первого поколения, толбутамида [26].С тех пор в основном обсервационные исследования связывают SU с более высоким риском по сравнению с остальными пероральными антидиабетическими препаратами по сравнению с монотерапией или в комбинации с метформином. Совсем недавно исследование TOSCAT показало, что SUs могут быть связаны с повышенным риском сердечной недостаточности [27].
Проблема сердечно-сосудистого риска, связанного с SU, подтверждена описанием конкретного механизма. Как уже упоминалось, SU связываются с калиевыми АТФ-зависимыми каналами.Помимо β-клеток поджелудочной железы, эти каналы также расположены в нескольких других тканях, включая гладкие и скелетные мышцы и нейроны. В частности, в миокарде калиевые каналы участвуют в очень интересном механизме, называемом «ишемическое прекондиционирование». По сути, это процесс сдержанной, временной и нефатальной ишемии, который защищает миокард от летальной ишемии, делая его более устойчивым. Связываясь с калиевыми каналами миокарда, SU вызывают закрытие каналов и впоследствии препятствуют ишемическому прекондиционированию.Эта особенность SU может потенциально увеличить риск сердечно-сосудистых заболеваний у пациентов с диабетом [28-30]. Однако существующие рандомизированные клинические испытания не смогли прояснить проблему и реально оценить долгосрочные исходы безопасности [31]. Такие исследования, как ADVANCE и ACCORD, не сообщали о росте сердечно-сосудистой смертности у пациентов, получавших SU, а недавние метаанализы продолжают давать противоположные результаты [32].
В связи с этими неблагоприятными исходами авторы высказывают разные мнения.Некоторые убеждены, что имеющихся данных достаточно, чтобы вызвать серьезные опасения по поводу безопасности SU [18], в то время как другие продолжают считать, что нет четких доказательств связи SU с сердечно-сосудистыми заболеваниями и смертностью [6]. Даже рекомендации Американской диабетической ассоциации, опубликованные в 2019 году, кажутся противоречивыми. С одной стороны, SU характеризуются как «нейтральные» в отношении сердечно-сосудистого риска. Однако есть специальное предупреждение FDA, которое указывает на более высокий риск сердечно-сосудистой смертности, основанное на исследованиях более старого СУ первого поколения, толбутамида.Согласно ADA, у пациентов с СД2 и атеросклеротическим сердечно-сосудистым заболеванием препарат, который следует добавлять к метформину, должен иметь доказанную защиту сердечно-сосудистой системы. В настоящее время такими агентами являются специфические ингибиторы транспортеров натрия глюкозы 2 (SGLT2) (эмпаглифлозин и канаглифлозин), а также один агонист рецептора GLP-1 (лираглутид) [33].
В заключение, SUs по-прежнему являются допустимым выбором для пациентов с СД2. Они недороги и обладают большой начальной эффективностью в контроле гликемии.Однако несколько побочных эффектов вызвали споры и подняли ряд серьезных вопросов относительно их долгосрочной безопасности. Эпизоды гипогликемии и увеличение веса, даже если они незначительные, ухудшают гликемический контроль и ухудшают качество жизни пациентов. Прогрессирующая недостаточность β-клеток поджелудочной железы увеличивает потребность в дополнительных противодиабетических средствах и, в конечном итоге, в инсулине. Что касается сердечно-сосудистой безопасности, имеющиеся данные вызывают беспокойство, и для решения этого вопроса необходимы дополнительные исследования.SUs по-прежнему можно назначать пациентам с СД2, которые недостаточно контролируются метформином в качестве монотерапии или проявляют побочные эффекты или противопоказания к другим противодиабетическим препаратам. Предпочтительно, SUs следует назначать пациентам молодого или среднего возраста без сопутствующих заболеваний, на которые может оказать неблагоприятное воздействие лечение SU, и в течение короткого времени. Если речь идет о пожилых пациентах, клиницисты должны учитывать все аспекты и выбирать SU короткого действия с более низким риском эпизодов гипогликемии.В целом, учитывая тот факт, что существуют более новые противодиабетические средства с сопоставимой эффективностью и более безопасным профилем, разумно выбрать другое лечение, кроме SU, если нет серьезных проблем с расходами или здоровьем
- White JR Jr (2014) Краткая история разработки лекарств от диабета. Diabetes Spectr 27: 82-86. [Crossref]
- Quianzon CC, Cheikh IE (2012) История текущих неинсулиновых лекарств от сахарного диабета. J Community Hosp Intern Med Perspect 2. [Crossref]
- Turner LW, Nartey D, Stafford RS, Singh S, Alexander GC (2014) Амбулаторное лечение диабета 2 типа в США, 1997-2012. Уход за диабетом 37: 985-992. [Crossref]
- Seino S, Sugawara K, Yokoi N, Takahashi H (2017) Стимуляторы передачи сигналов β-клеток и секреции инсулина: путь к улучшенной терапии диабета. Диабет, ожирение, метаболизм 1: 22-29. [Crossref]
- Sherifali D, Nerenberg K, Pullenayegum E, Cheng J, Gerstein H (2010) Влияние пероральных противодиабетических средств на уровни A1C: систематический обзор и метаанализ. Уход за диабетом 33: 1859-1864. [Crossref]
- Abrahamson M (2014) Должны ли сульфонилмочевины оставаться приемлемым дополнением к терапии метформином у пациентов с диабетом 2 типа? Да, они продолжают нам хорошо служить! Уход за диабетом 38: 166-169. [Crossref]
- Морган С., Пул С., Эванс М., Барнетт А., Дженкинс-Джонс С. (2012) Что дальше после метформина? Ретроспективная оценка результатов терапии сахароснижающей терапией второй линии у людей с диабетом 2 типа. J Clin Endocrinol Metab 97: 4605-4612. [Crossref]
- Группа перспективного исследования диабета Великобритании (UKPDS) (1998) Интенсивный контроль уровня глюкозы в крови с помощью сульфонилмочевины или инсулина по сравнению с традиционным лечением и риск осложнений у пациентов с диабетом 2 типа (UKPDS 33). Ланцет 352: 837-853.
- Patel A, MacMahon S, Chalmers J и др .; ADVANCE Collaborative Group (2008) Интенсивный контроль уровня глюкозы в крови и сосудистые исходы у пациентов с диабетом 2 типа.N Engl J Med 358: 2560-2572
- Irvine H, Male S, Robertson J (2019) Уменьшение объемов внутримозгового кровоизлияния и перигематомного отека у диабетиков на сульфонилмочевинах. Инсульт 50: 995-998. [Crossref]
- Klarenbach S, Cameron C, Singh S, Ur E (2011) Экономическая эффективность антигипергликемической терапии второй линии у пациентов с сахарным диабетом 2 типа, недостаточно контролируемых метформином. Can Med Assoc Jour 183: E1213-E1220.
- Hong D, Si L, Jiang M, Shao H, Ming W и др. (2019) Экономическая эффективность ингибиторов натрий-глюкозного котранспортера-2 (SGLT2), агонистов рецепторов глюкагоноподобного пептида-1 (GLP-1) и ингибиторов дипептидилпептидазы-4 (DPP-4): систематический обзор. Pharmaco Economics 11. [Crossref]
- Henquin JC (2017) Непонимание и разногласия по поводу секретирующих инсулин свойств противодиабетических препаратов сульфонилмочевины. Biochimie 143: 3-9.[Crossref]
- Tahrani A, Barnett A, Bailey C (2016) Фармакология и терапевтические последствия современных лекарств от сахарного диабета 2 типа. Натр. Эндокринол 12: 566-592.
- Pagkalos E, Thanopoulou A, Sampanis C, Bousboulas S, Melidonis A, et al. (2017) Реальная эффективность и модели лечения диабета 2 типа в Греции. Exp Clin Endocrinol Diab 126: 53-60. [Crossref]
- Del Prato S, Pulizzi N (2006) Место сульфонилмочевины в терапии сахарного диабета 2 типа. Метаболизм 55: S20-27. [Crossref]
- Longo M, Bellastella G, Maiorino MI, Meier JJ, Esposito K и др. (2019) Диабет и старение: от целей лечения к фармакологической терапии. Фронт-эндокринол (Лозанна) 10:45. [Crossref]
- Genuth S (2014) Должны ли сульфонилмочевины оставаться приемлемым дополнением первой линии к терапии метформином у пациентов с диабетом 2 типа? Нет, пора двигаться дальше! Уход за диабетом 38: 170-175.
- Беннетт В.Л., Марутур Н.М., Сингх С., Сигал Дж. Б., Уилсон Л. М. и др. (2011) Сравнительная эффективность и безопасность лекарств от диабета 2 типа: обновленная информация, включая новые лекарства и комбинации из 2 лекарств. Ann Intern Med 154: 602-613. [Crossref]
- Дэвис М., Д’Алессио Д., Фрадкин Дж., Кернан В., Матье С. и др. (2018) Управление гипергликемией при диабете 2 типа, 2018. Консенсусный отчет Американской диабетической ассоциации (ADA) и Европейской ассоциации по изучению диабета (EASD). Diabetologia 41: 2669-2701. [Crossref]
- Данкли А., Фицпатрик С., Грей Л., Вахид Г., Хеллер С. и др. (2019) Частота и тяжесть гипогликемии при диабете 2 типа в зависимости от схемы лечения: многоцентровое 12-месячное проспективное обсервационное исследование в Великобритании. Diab Obes Metabol 6. [Crossref]
- Farahani P (2017) Разница в риске нетяжелой гипогликемии между сульфонилмочевиной и ингибиторами натрий-глюкозного котранспортера-2 (Sglt2-I) в качестве дополнения к метформину в рандомизированных контролируемых исследованиях. J Popul Therap Clin Pharmacol 24.
- Farah D, Leme G, Eliaschewitz F, Fonseca M (2019) Сравнение профиля безопасности и переносимости ингибиторов дипептидилпептидазы-4 и сульфонилмочевины у пациентов с диабетом: систематический обзор и метаанализ. Diab Res Clin Pract 149: 47-63. [Crossref]
- Kahn SE, Haffner SM, Heise MA, Herman WH, Holman RR и др. (2006) Гликемическая стойкость монотерапии розиглитазоном, метформином или глибуридом. N Engl J Med 355: 2427-2443. [Crossref]
- Cherukuri L, Smith MS, Tayek JA (2018) Долговечность пероральных диабетических препаратов: время до исходного уровня A1c и обзор распространенных пероральных препаратов, используемых поставщиком первичной медико-санитарной помощи. Эндокринол, метаболизм диабета J 2. [Crossref]
- Meinert C, Knatterud G, Prout T, Klimt C (1970) Изучение эффектов гипогликемических средств на сосудистые осложнения у пациентов с диабетом во взрослом возрасте.II. Результаты смертности. Диабет 19: 789-830. [Crossref]
- Packer M (2018) Не обращают ли врачи внимания на риск сердечной недостаточности у пациентов с диабетом, получающих сульфонилмочевину? Уроки испытания TOSCA.IT. Eur J Heart Fail 20: 49-51. [Crossref]
- Riddle M (2003) Сульфонилмочевины различаются по действию на ишемическое прекондиционирование — пора ли отказаться от глибурида? J Clin Endocrinol Metabol 88: 528-530.[Crossref]
- Lazdunski M (1996) Эффекты ионных каналов противодиабетических препаратов сульфонилмочевины. Horm Metab Res 28: 488-495. [Crossref]
- Stokfisz K, Ledakowicz-Polak A, Zagorski M, Zielinska M (2017) Предварительное кондиционирование ишемии — текущие знания и потенциальные возможности применения в будущем после 30 лет опыта. Adv Med Sci 62: 307-316. [Crossref]
- Powell W, Christiansen C, Miller D (2018) Мета-анализ терапии сульфонилмочевиной на долгосрочный риск смертности и сердечно-сосудистых событий по сравнению с другими пероральными глюкозоснижающими методами. Diab Ther 9: 1431-1440. [Crossref]
- Ferrannini E, DeFronzo RA (2015) Влияние глюкозоснижающих препаратов на сердечно-сосудистые заболевания при диабете 2 типа. Eur Heart J 36: 2288-2296. [Crossref]
- Американская диабетическая ассоциация (2019) 9. Фармакологические подходы к лечению гликемии: Стандарты медицинской помощи при диабете-2019. Уход за диабетом 42: S90-S102. [Crossref]
Sulfonylureas Артикул
[1]
8.Фармакологические подходы к лечению гликемии: {i} Стандарты медицинской помощи при диабете-2018 {/ i}. Уход за диабетом. 2018 Янв; [PubMed PMID: 29222379]
[2]
Gross JL, Kramer CK, Leitão CB, Hawkins N, Viana LV, Schaan BD, Pinto LC, Rodrigues TC, Azevedo MJ, Влияние антигипергликемических средств, добавленных к метформину и сульфонилмочевине, на гликемический контроль и увеличение веса при диабете 2 типа: a сетевой мета-анализ.Анналы внутренней медицины. 2011 17 мая; [PubMed PMID: 21576535]
[3]
Kalra S, Bahendeka S, Sahay R, Ghosh S, Md F, Orabi A, Ramaiya K, Al Shammari S, Shrestha D, Shaikh K, Abhayaratna S., Shrestha PK, Mahalingam A, Askheta M, A Rahim AA, Eliana F , Shrestha HK, Chaudhary S, Ngugi N, Mbanya JC, Aye TT, Latt TS, Akanov ZA, Syed AR, Tandon N, Unnikrishnan AG, Madhu SV, Jawa A, Chowdhury S, Bajaj S, Das AK, Консенсусные рекомендации по сульфонилмочевине и Комбинации сульфонилмочевины в лечении сахарного диабета 2 типа — Международная целевая группа.Индийский журнал эндокринологии и метаболизма. Январь-февраль 2018 г .; [PubMed PMID: 29535952]
[4]
Леонард С.Е., Билкер В.Б., Брензингер С.М., Хан Х, Флори Дж. Х., Флокхарт Д.А., Ган Дж. Дж., Кардилло С., Хеннесси С. Тяжелая гипогликемия у пользователей сульфонилмочевинных противодиабетических и антигиперлипидемических средств Клиническая фармакология и терапия. 2016 May; [PubMed PMID: 26566262]
[5]
Phung OJ, Scholle JM, Talwar M, Coleman CI, Влияние неинсулиновых противодиабетических препаратов, добавленных к терапии метформином, на гликемический контроль, увеличение веса и гипогликемию при диабете 2 типа.ДЖАМА. 2010 Apr 14; [PubMed PMID: 20388897]
[6]
Sola D, Rossi L, Schianca GP, Maffioli P, Bigliocca M, Mella R, Corlianò F, Fra GP, Bartoli E, Derosa G, сульфонилмочевины и их использование в клинической практике. Архив медицинской науки: AMS. 2015 12 августа; [PubMed PMID: 26322096]
[7]
Спиллер Х.А., Сойер Т.С., Токсикология пероральных противодиабетических препаратов.Американский журнал фармации системы здравоохранения: AJHP: официальный журнал Американского общества фармацевтов систем здравоохранения. 2006 15 мая; [PubMed PMID: 16675650]
[8]
Koster JC, Remedi MS, Dao C, Nichols CG, Чувствительность к АТФ и сульфонилмочевине мутантных АТФ-чувствительных K-каналов при диабете новорожденных: значение для фармакогеномной терапии. Сахарный диабет. 2005 Sep; [PubMed PMID: 16123353]
[9]
Eliasson L, Renström E, Ammälä C, Berggren PO, Bertorello AM, Bokvist K, Chibalin A, Deeney JT, Flatt PR, Gäbel J, Gromada J, Larsson O, Lindström P, Rhodes CJ, Rorsman P, PKC-зависимая стимуляция экзоцитоза сульфонилмочевины в бета-клетках поджелудочной железы.Science (Нью-Йорк, Нью-Йорк). 1996 Feb 9; [PubMed PMID: 8628999]
[10]
Леонард С.Е., Хеннесси С., Хан Х, Сисковик Д.С., Флори Дж. Х., Део Р., Про- и антиаритмические действия сульфонилмочевины: механические и клинические доказательства. Тенденции в эндокринологии и метаболизме: ТЕМ. 2017 Авг; [PubMed PMID: 28545784]
[11]
Прокс П., Рейманн Ф., Грин Н., Гриббл Ф., Эшкрофт Ф. Стимуляция секреции инсулина сульфонилмочевиной.Сахарный диабет. 2002 Dec; [PubMed PMID: 12475777]
[12]
ван Стаа Т., Абенхайм Л., Монетт Дж., Уровень гипогликемии у пользователей сульфонилмочевины. Журнал клинической эпидемиологии. 1997 Jun; [PubMed PMID: 9250272]
[13]
Groop L, Eriksson CJ, Huupponen R, Ylikahri R, Pelkonen R, Роли хлорпропамида, спирта и ацетальдегида в определении промывки хлорпропамид-спирт.Диабетология. 1984 Jan; [PubMed PMID: 6706043]
[14]
Roumie CL, Hung AM, Greevy RA, Grijalva CG, Liu X, Murff HJ, Elasy TA, Griffin MR, Сравнительная эффективность монотерапии сульфонилмочевиной и метформином в отношении сердечно-сосудистых событий при сахарном диабете 2 типа: когортное исследование. Анналы внутренней медицины. 2012 6 ноября; [PubMed PMID: 23128859]
[15]
Залин AM, Хатчинсон CE, Джонг М., Мэтьюз К., Гипонатриемия во время лечения хлорпропамидом и модуретиком (амилорид плюс гидрохлоротиазид).Британский медицинский журнал (под ред. Клинических исследований). 1984 15 сентября; [PubMed PMID: 6434028]
[16]
Американское гериатрическое общество обновило критерии Бирса для потенциально несоответствующего использования лекарств у пожилых людей. Журнал Американского гериатрического общества. 2012 Apr; [PubMed PMID: 22376048]
[17]
Джонсон К.К., Грин Д.Л., Райф Дж. П., Лимон Л., Сульфаниламидная перекрестная реактивность: факт или вымысел? Летопись фармакотерапии.2005 Feb; [PubMed PMID: 15644481]
[18]
Моретти М.Э., Резвани М., Корен Г., Безопасность глибурида при гестационном диабете: метаанализ исходов беременности. Летопись фармакотерапии. 2008 Apr; [PubMed PMID: 18349305]
[19]
Hirst JA, Farmer AJ, Dyar A, Lung TW, Stevens RJ, Оценка влияния сульфонилмочевины на HbA1c при диабете: систематический обзор и метаанализ.Диабетология. 2013 май; [PubMed PMID: 23494446]
[20]
Saudek CD, Derr RL, Kalyani RR, Оценка гликемии при диабете с использованием самоконтроля уровня глюкозы в крови и гемоглобина A1c. ДЖАМА. 2006 Apr 12; [PubMed PMID: 16609091]
[21]
Догерти П.П., Кляйн-Шварц В., Роль октреотида в лечении гипогликемии, вызванной сульфонилмочевиной.Журнал медицинской токсикологии: официальный журнал Американского колледжа медицинской токсикологии. 2010 июн; [PubMed PMID: 20352540]
The Фармакологическое ведение пациентов с типом II Сахарный диабет в эпоху новых оральных препаратов и Аналоги инсулина Джон Р. Уайт младший, PharmD Опционы, исполненные в лечение гипергликемии, вторичной по отношению к диабету II типа в США мало что изменилось за 45 лет, пока несколько месяцев назад.Сульфонилмочевины, инсулин и комбинации сульфонилмочевины / инсулина использовались с конец 1950-х гг. 1 Бигуанид фенформин был некоторое время использовался в этой стране, но был удален из рынок из-за его связи с лактоацидозом. 2 Таким образом, недавние одобрения ингибитора α-глюкозидазы акарбоза, метформин бигуанида и аналог инсулина lispro резко увеличил количество доступных опций практикующим врачам, работающим с диабетом II типа.Другой препарат, троглитазон, показал себя многообещающим. предварительные испытания. В этой статье кратко рассматривается использование из вышеперечисленных препаратов (кроме троглитазона) и предлагает предложенный алгоритм фармакологического лечение диабета типа II с учетом этих возможностей. сульфонилмочевины Механизм действия. Сульфонилмочевины действуют как на поджелудочную, так и на внепанкреатическую эффекты, но полезны только для пациентов с жизнеспособными -клетки. 4,5 Сульфонилмочевины напрямую стимулируют высвобождение инсулина in vitro. 4 In vivo, сульфонилмочевины сенсибилизируют клетки к глюкозе, увеличивая секреция инсулина косвенно. Таким образом, под влиянием сульфонилмочевины, больше инсулина секретируется на всю глюкозу уровней, чем было бы секретно в отсутствие сульфонилмочевина. 4 Другой потенциальный панкреатический эффекты включают ингибирование высвобождения глюкагона. Сульфонилмочевины также могут влиять на уровень глюкозы несколькими способами. внепанкреатические механизмы, такие как повышение инсулина сродство связывания рецептора, увеличение инсулина эффект пострецепторного действия и снижение печеночной экстракция инсулина. Относительная клиническая важность каждый из этих механизмов действия все еще является предметом исследования и дискуссии. 4 Эффективность. Ответ на сульфонилмочевину можно прогнозировать по нескольким факторам. включая возраст, вес, продолжительность заболевания, предшествующие лечение инсулином и глюкозой крови натощак (ВБР) уровни. 6-8 Пациенты с большей вероятностью ответят имеют недавний диагноз (<5 лет),> 40 лет в возрасте 110–160% от идеальной массы тела, имеют FBG <200 мг / дл, никогда не требовался инсулин и не нуждался <40 единиц инсулина в день.Если эти критерии При соблюдении этих требований частота основных отказов может составлять всего 15%. 7 Вторичная частота отказов сульфонилмочевины была оценивается в 10% в год, 4 , хотя в во многих популяциях частота отказов может быть намного выше. У ответившего пациента можно ожидать снижения уровня глюкозы в плазме натощак (ГПН) ~ 50–60 мг / дл и снижение уровня HbA 1c на 1-2%. 9 Новый глимепирид сульфонилмочевины, по-видимому, имеет аналогичный последствия.Среднее снижение HbA1c на 2% наблюдалось в пациенты, получавшие 8 мг глимепирида в день. 10 Исследования с глимепиридом также продемонстрировали Снижение уровня ГПН на 46–77,5 мг / дл при сравнении к плацебо. 11,12 Монотерапевтические эффекты глимепирида аналогичны другим сульфонилмочевины. Побочные эффекты и противопоказания. Гипогликемия и вес усиление — это основные побочные эффекты сульфонилмочевины.В частота гипогликемии варьируется, но одно исследование выявили 20% вероятность гипогликемии каждые 6 месяцев в пациенты, получавшие сульфонилмочевину. 4 Масса усиление обычное дело с этой терапией. Одно исследование, оценивающее Эффекты глибурида сообщили о среднем увеличении веса 2,8 0,7 кг, в то время как другое исследование, оценивающее эффекты толбутамида сообщили о среднем увеличении веса на 1,8 кг. 13,14 Дополнительная, менее распространенная сторона эффекты включают дерматологические реакции, гематологические реакции и желудочно-кишечные расстройства. 4 Были отмечены дисульфирамоподобные реакции и гипонатриемия. сообщалось с хлорпропамидом. 4 Поскольку все сульфонилмочевины
подвергаются печеночному метаболизму, их следует употреблять
осторожно пациентам с нарушением функции печени. 4 Активный метаболит ацетогексамида, гидроксигексамид,
почечно очищается.Кроме того, 20% хлорпропамида
выводится в неизмененном виде с мочой. Следовательно, этогексамид
и хлорпропамид не следует применять пациентам с
нарушение функции почек. Кроме того, толазамид и глибурид имеют
частично активные метаболиты, которые накапливаются у пациентов
с клиренсом <30 мл / мин. Глипизид и
толбутамид предпочтительнее у пациентов с умеренной и средней степенью
тяжелое нарушение функции почек. 4 Акарбоза Механизм действия. Акарбоза конкурентно ингибирует ферменты α-глюкозидазы в кисть каймы тонкой кишки.15 Дополнительно, акарбоза подавляет а-амилазу поджелудочной железы, 16 которая является отвечает за гидролиз сложных крахмалов до олигосахариды в просвете тонкой кишки. В Ферменты α-глюкозидазы отвечают за гидролиз олигосахаридов, трисахаридов и дисахаридов в кисть каймы тонкой кишки и включают мальтаза, изомальтаза, глюкоамилаза и сахароза. Ингибирование этих ферментных систем эффективно снижает скорость переваривания сложных углеводов и последующее всасывание глюкозы, снижение постпрандиального глюкозные экскурсии у больных сахарным диабетом. Эффективность. Одно монотерапевтическое исследование, оценивающее эффекты монотерапия акарбозой у 212 пациентов с ожирением II типа диабет сообщил о снижении HbA 1c из 0,59%, снижение ГПН на 16 мг / дл и на 50 мг / дл снижение постпрандиального уровня глюкозы в плазме. 17 В другом исследовании сообщалось о снижении HbA 1c из 0,54%, среднее снижение ГПН на 20 мг / дл и 51%. Снижение мг / дл глюкозы через 1 час после приема пищи концентрации. 14 Акарбоза также эффективна при Комбинация с метформином, сульфонилмочевиной и инсулином. 18 Чиассон и соавторы сообщили, что добавление акарбоза на терапию инсулином, метформином или сульфонилмочевиной привело к дополнительному снижению гликозилированного уровень гемоглобина примерно 0,4%, 0,8% и 0,5% соответственно. Побочные эффекты и противопоказания.Общие побочные эффекты акарбозы — это дозозависимые желудочно-кишечные жалобы, которые часто может быть ослаблен продолжительным введением медикамент. Эти побочные эффекты включают метеоризм, диарея и боль в животе, которые произошли в США. исследования фазы III с частотой 77%, 33% и 21%, соответственно. 16 При повышенном уровне печеночных ферментов сообщалось о более высоких дозах, повышенном уровне сыворотки уровни трансаминаз были не чаще, чем наблюдались с плацебо при дозах 100 мг т.я бы. или меньше были использовал. 2 Монотерапия акарбозой — это противопоказан пациентам с диабетом I типа или пациенты с диабетическим кетоацидозом в анамнезе. 16 Акарбозу также следует избегать у пациентов с воспалительное заболевание кишечника, язва толстой кишки или непроходимость кишечника. Относительные противопоказания включают хронические кишечные расстройства пищеварения или абсорбция и медицинские условия, которые могут ухудшиться при повышенном кишечном газообразовании. 16 Наконец, пациентам следует избегать терапии акарбозой. с уровнем креатинина сыворотки> 2,0 мг / дл, поскольку исследования показали увеличение концентрации акарбозы в плазме концентрации при почечной дисфункции и длительные Исследования в этой популяции не проводились. 16 Метформин Механизм действия . Метформин является пероральным противогликемическим средством, а не гипогликемическое средство. Его механизм действия отличается от сульфонилмочевины в том, что он не увеличивает секреция инсулина, не связана с гипогликемией, и не приводит к увеличению веса. Первичные сайты метформина действия — печень и мышечная ткань. Это понижает уровень глюкозы в крови (ГК) за счет повышения инсулино-стимулированного транспорт глюкозы в скелетных мышцах. Диапазон наблюдаемое увеличение поглощения глюкозы колеблется от 10–40%, в зависимости от оцениваемой популяции. 20 Метформин также снижает выработку глюкозы в печени по типу Больные сахарным диабетом II типа. Первоначально этот эффект считался опосредовано снижением гликогенолиза. 21 Однако более недавнее исследование показало, что это может быть вторичный по отношению к снижению глюконеогенеза. 22 Эффективность. В рандомизированном параллельном двойном слепом исследовании 289 человек. пациенты с диабетом 2 типа с умеренным ожирением, метформин снижение уровня глюкозы натощак в среднем на 58 мг / дл и HbA1c в среднем 1,8% по сравнению с диетой плюс плацебо. 23 Помимо воздействия на глюкозу, терапия метформином также был связан со снижением уровня триглицеридов концентрации (16%), липопротеины низкой плотности (ЛПНП) холестерин (8%) и общий холестерин (5%), и связано с увеличением липопротеинов высокой плотности (ЛПВП) холестерин (2%). 23 Также пациенты получавшие метформин потеряли в среднем 0,6 кг массы тела. 23 Во второй руке того же в исследовании комбинация метформин-глибурид сравнивалась с монотерапия глибуридом и монотерапия метформином в 632 г. пациенты с диабетом II типа с ожирением, у которых был ранее плохо контролируемый (ГПН> 140 мг / дл) глибурид. 23 Метформин-глибуридная терапия снижает уровень ГПН на 77 мг / дл и HbA 1c на 1,9% при по сравнению с монотерапией глибуридом. Пациенты, чьи сахарный диабет ранее плохо контролировался глибуридом монотерапия метформином не контролировалась монотерапия. Метформин-глибуридная терапия также была связано со снижением уровня триглицеридов концентрации (9,2%), холестерина ЛПНП (6%) и общего холестерин (4.6%) и повышение холестерина ЛПВП (5,4%). Другое испытание продемонстрировало, что Монотерапия метформином ассоциировалась с легким весом уменьшение (-0,8 0,5 кг). Глибурид был связан с значительное (P = 0,001) увеличение веса (+2,8 0,7 кг). Метформин-глибурид ассоциировался с меньшим весом прибавка (+0,7 0,4 кг). 13 Благодаря своей способности уменьшать Уровни ГК без увеличения веса и его благотворно влияет на липиды плазмы, метформин — разумный выбор при ожирении или дислипидемии II типа больным сахарным диабетом, не имеющим противопоказаний. Побочные эффекты и противопоказания. Пациенты, пролеченные метформин имел на 30% больше сообщений о вздутии живота, тошнота, спазмы, чувство полноты и диарея чем пациенты, получавшие плацебо. 24 Эти побочные эффекты обычно самоограничивающиеся, временные и можно смягчить, начав с низкой дозы и медленно титровать, а также принимать лекарства с едой.Дополнительные, менее распространенные побочные эффекты включают: металлический привкус и снижение уровня витамина B12. Лактоацидоз может возникнуть при приеме метформин, но встречается крайне редко (0,03 случая на 1000 пациенто-лет) и встречалась преимущественно у пациентов при значительном нарушении функции почек. 24 Метформин противопоказан пациенты с нарушением функции почек (креатинин сыворотки> 1.5 мг / дл у мужчин или> 1,4 мг / дл у женщин), поскольку метформин выводится почками и может накапливаться в пациенты с нарушением функции почек. Потому что ацидоз — это иногда ассоциируется с нарушением функции печени, метформин противопоказан пациентам с клиническими или лабораторные доказательства нарушения функции печени. Это также противопоказан пациентам с острым или хроническим молочным ацидоз, алкоголизм или пьянство в анамнезе.Наконец, прием метформина следует временно прекратить. пациенты с острыми состояниями, предрасполагающими их к острым почечная недостаточность или ацидоз, например сердечно-сосудистый коллапс, острый инфаркт миокарда, обострение застойной сердечной недостаточности, применение йодсодержащего контраста СМИ или серьезная хирургическая процедура. 24 Инсулин и Лиспро Механизм действия. Эффективность . Пациенты со средней степенью тяжести сахарный диабет II типа (т.е., FPG = 140–200 мг / дл) будет обычно показывают достаточный ответ на один или два суточная доза инсулина в пределах 0,3–0,4 Ед / кг / сут. 31 Самое подходящее время для разовая ежедневная инъекция все еще обсуждается. Одно исследование предположил, что прием перед сном превосходит утром при использовании инсулина средней продолжительности действия, а другой предположил, что 21:00 разумное время для однократной суточной дозы инсулина при использовании в сочетание с сульфонилмочевинами. 32,33 В В предыдущем исследовании сообщалось об улучшении гликемического контроля и более позднее исследование показало меньшую прибавку в весе перед сном или вечерние дозы инсулина по сравнению с утренним инсулином. Пациенты с тяжелым типом II сахарный диабет (FPG> 200 мг / дл) или пациенты, не отвечающие на лечение к этим схемам может потребоваться «Круглосуточный» инсулин.31 Обычно это требует добавления инсулина короткого действия перед питание с общей суточной дозой инсулина от 0.5–1,2 Ед / кг / день. Однако у инсулинорезистентных Пациентам могут потребоваться дозы> 1,5 Ед / кг / день. Аналог инсулина лиспро эффективно улучшает метаболические нарушения при типе II больные сахарным диабетом. 27,34-36 Крупнейшее исследование на сегодняшний день обследовано 722 пациента за 6-месячный переходный период. дизайн. 34 Гликемический контроль оценивался с помощью уровень глюкозы натощак и после приема пищи, глюкоза после приема пищи экскурсии и HbA1c.Заболеваемость гипогликемией составила также измерил. Уровни ВБР были ниже для lispro (LP) пациенты, получавшие лечение, по сравнению с человеческим инсулином Пациенты, получавшие (HI) (LP: 192 мг / дл; HI: 183 мг / дл; P = 0,002). Пациенты, получавшие LP, имели нижнюю 1- и 2-часовую постпрандиальные концентрации глюкозы в крови (1 час: 238 мг / дл для LP, 250 мг / дл для HI, P <0,001; 2 часа: 218 мг / дл для LP, 237 мг / дл для HI, P <0,001) и значительно ниже 1-часовой и 2-часовой экскурсии по глюкозе (1 час: 46.7 мг / дл для LP, 67,4 мг / дл, для HI, P <0,001; 2-часовой: 25,2 мг / дл для LP, 53,5 мг / дл для HI, P <0,001), чем HI-леченные пациенты. Нет существенной разницы в частота гипогликемии между двумя группами лечения была отмечены (LP: 2,67 событий / 30 дней; HI: 2,79 событий / 30 дней; P = 0,310). Исследование пришло к выводу, что лечение LP привело к улучшению постпрандиальных экскурсий по ГК и ГК в пациенты с сахарным диабетом II типа. Lispro также эффективен в сочетание с сульфонилмочевинами. 37 По сравнению к терапии сульфонилмочевиной комбинированная терапия привела к снижение ГПН (154 против 193 мг / дл, P <0,0001), Уровень глюкозы в плазме через 2 часа после приема пищи (251 против 331 мг / дл, P <0,0001) и HbA1c (7,2 против 9%, P <0,0001). Тело вес был выше в группе комбинированной терапии (209 по сравнению с 202 фунтами, P = 0.0001).
Наконец, еще один исследование, оценивающее влияние лиспро на глюкозу толерантность у пациентов с сахарным диабетом II типа пришли к выводу, что лиспро восстановил ранний подъем инсулина в плазме, улучшил толерантность к глюкозе, вызывающая быстрое и преходящее печеночное ингибирование выработки глюкозы и снижение поздно гиперинсулинизация. 27 Побочные эффекты и противопоказания. Несколько возможных побочных эффектов, включая гипогликемию, прибавку в весе и потенциальную при ускоренном макрососудистом заболевании следует рассматривается при использовании инсулина и лизпро при типе II больные сахарным диабетом. Тяжелая гипогликемия, при основная проблема у пациентов с сахарным диабетом II типа, вероятно встречается с меньшей частотой, чем наблюдается в пациенты с сахарным диабетом I типа. 29 Дополнительно, контррегуляторный ответ на гипогликемию при типе II у больных сахарным диабетом притупляется в меньшей степени, чем у пациенты с сахарным диабетом I типа. Годовые показатели гипогликемии и тяжелая гипогликемия (требующая помощи другое лицо) у пациентов, принимающих инсулин, в течение 3-летнего наблюдение за проспективным исследованием диабета в Великобритании (UKPDS) были 33,4 и 1.4% соответственно. 38 Годовой частота гипогликемии и тяжелой гипогликемии у Субъектов, получавших глибурид, в этом испытании составляли 27,8 и 1,3% соответственно. В другом исследовании сообщалось о частота любой гипогликемии у пациентов, получавших комбинация сульфонилмочевины / метформина до 40%, комбинация ультраленте / сульфонилмочевины — 33%, а ультраленте / обычная инсулин должен быть 47%. 39 Однако, в отличие от Исследование по контролю диабета и его осложнений (DCCT) и UKPDS, ни один из случаев гипогликемии в этом исследовании выводил из строя. Исследование Виньяти с участием 722 пациентов получавших лиспро или обычный человеческий инсулин, не сообщалось достоверная разница в количестве гипогликемических событий (LP: 2,67 события / 30 дней; HI 2.79 событий / 30 дней; P = 0,310) между двумя приготовлениями. 34 Однако другое исследование 269 пациентов, ранее не получавших инсулин. получавших лиспро или обычный человеческий инсулин, сообщалось о более низкая частота гипогликемии у лиц с высоким риском гипогликемия (HbA 1c <1 стандартного отклонения ниже среднего значения группы и оценка страха> среднего значения группы) при использовании lispro (LP: 0.37; HI: 2,75). 28 Инсулинотерапия также была связано с увеличением веса. Исследования диабета II типа пациенты, получавшие инсулин в течение 6–12 месяцев, имеют сообщили о средней прибавке в весе до 6 кг. 29 Эпидемиологические исследования демонстрируя корреляцию между гиперинсулинемией (пациенты с диабетом и без него, леченные и не обработанные экзогенным инсулином) и риск макрососудистые заболевания 29 — еще одно серьезное забота о клиницистах.Однако никаких проспективных исследований на сегодняшний день продемонстрировали, что экзогенный инсулин ускоряет макрососудистые заболевания. Недавний американец Заявление о консенсусе Ассоциации диабета заключено, «Введение экзогенного инсулина не имеет прямые побочные эффекты на сердечно-сосудистые события и могут даже благоприятно влияют на профиль сердечно-сосудистого риска, если улучшенный гликемический контроль и липидный профиль выдержанный.” 40 Алгоритм лечения Этот алгоритм предназначен только для в качестве основы для обсуждения и дебатов относительно поэтапный подход к фармакологическому лечению типа II диабет и подчеркнуть некоторые ключевые области, нуждающиеся в дальнейшие исследования. Противопоказания и меры предосторожности есть не показаны в алгоритме, но должны учитываться читатель.Например, пациенту с ожирением с сывороткой креатинин 2,4 мг / дл на этапе 2 не должен лечиться метформином, как предполагает алгоритм. Наконец, этот алгоритм применим не ко всем типам II. диабет и не покрывает все непредвиденные обстоятельства. Цели терапии и точка, в которой предлагается действие, была определена Американской диабетической ассоциации и показаны в Таблице 1. Пациент с новым диагнозом быть изначально ранжировано на основе поста или после приема пищи глюкоза плазмы. 42 Ранее диагностированный пациенты, которые в настоящее время достигли целевого уровня гликемии, будут продолжают свою текущую терапию, пока те, кто не на своем цель будет ранжирована в алгоритме и перемещена в следующий шаг.
Шаг 1: оценочные и нефармакологические подходы. Этот шаг должен включать соответствующее лечебное питание. терапия 43 и физические упражнения, 44 а также формальное диабетическое образование, включая обучение по самостоятельному регулированию уровня глюкозы в крови и развитию гликемические цели для конкретного пациента. Шаг 1 должен быть продолжил на всех остальных этапах терапии.Формальный обучение диабету должно проводиться периодически, чтобы гарантировать постоянное понимание пациентами и сохранять они в курсе новых разработок. Шаг 2: устный монотерапия. Пероральная терапия должна быть рекомендуется пациентам с ГПН 200–300 мг / дл или те, кого недостаточно контролировали на Шаге 1 в одиночку, если пациент не страдает кетозом или серьезно симптоматический.На данном этапе возникает вопрос: «Является ли пациент страдает ожирением? »поможет определить наиболее соответствующий пероральный агент. У тучных пациентов с ГПН < 160 мг / дл, акарбоза может быть подходящей. Можно ожидать снижение ГПН на ~ 20 мг / дл без вредных метаболические побочные эффекты или увеличение веса. 7,14,17,18 Такое снижение ГПН привело бы пациента в разумный контроль. Для пациентов с ожирением и ГПН> 160 мг / дл, метформин может быть препаратом выбора, если нет противопоказания есть.Можно ожидать среднего снижение ГПН на ~ 60 мг / дл без вредных метаболические эффекты или увеличение веса, наблюдаемое с сульфонилмочевина или инсулинотерапия. 23 В UKPDS, метформин оказался столь же эффективным, как и сульфонилмочевина или инсулин для снижения гликемических индексов при значительном снижении эндогенного инсулина плазмы концентрации, не вызывая увеличения веса при сравнении к инсулину или СУ. 38 На основе доступных доказательств, можно было ожидать, что значительная часть те, у кого FPG < 200 мг / дл и меньше доля тех, у кого ГПН 200–300 мг / дл, достичь разумного контроля с помощью этой терапии. При диабете II типа без ожирения пациенты, прием акарбозы или сульфонилмочевины приемлемы выбор. Шаг 3: комбинация оральная терапия .Для пациентов с ожирением, которые потерпели неудачу монотерапия акарбозой, комбинация метформин / акарбоза май привести гликемические параметры в допустимый диапазон без неблагоприятных влияющие на другие метаболические параметры или вызывающие вес прирост. 18 Пациенты с ожирением, не достигшие Целевые гликемические показатели при терапии метформином могут быть назначен на комбинированную терапию сульфонилмочевиной / метформином. Эта комбинация обычно приводит к значительному снижению в гликемических индексах с ослаблением эффектов увеличение веса и гиперинсулинемия, обычно связанные с монотерапия сульфонилмочевиной. 23 Для пациентов, которые находятся в пределах 20 мг / дл от их целевого значения ГПН с метформином монотерапия, добавление акарбозы, а не сульфонилмочевины. Для пациентов, не страдающих ожирением, которые потерпели неудачу акарбозной терапии добавление сульфонилмочевины может быть считается. Еще одно соображение в этом случае было бы для прекращения приема акарбозы и начала приема сульфонилмочевины монотерапия. Сульфонилмочевины могут быть предпочтительнее метформина. из-за их способности увеличивать секрецию инсулина в это население, которое может быть относительно инсулинопеническим.Для пациентов без ожирения, принимающих сульфонилмочевину монотерапия, можно рассмотреть возможность добавления метформина или акарбоза в зависимости от гликемического индекса пациента характеристики. Одна альтернатива не включена в этот алгоритм предназначен для лечения пациентов с тройным пероральным комбинированная терапия. К сожалению, тройной оральный терапия не оценивалась ни в одном крупном рандомизированном проспективные испытания. Пациенты, которые не отвечают адекватно любому из описанных комбинированных методов лечения здесь следует перейти к шагу 4. Шаг 4: комбинация пероральный агент / инсулинотерапия . Для каждого из схемы Шага 4, обсуждаемые ниже, два варианта инсулина предлагаются. Во-первых, один вечер или перед сном уколы НПХ или ленте. Эта форма инсулинотерапии у пациентов с сахарным диабетом II типа широко применяется и изучал, хотя в прошлом инсулин / сульфонилмочевина получил наибольшее внимание. Второй вариант инсулина — инициировать t.i.d. дозирование лиспро с однократным пероральным агент. Недавнее исследование, оценивающее влияние Комбинация лизпро / сульфонилмочевины пришла к выводу, что комбинированная терапия привела к статистически значимому снижение ГПН (154 против 193 мг / дл, P <0,001), Глюкоза через 2 часа после приема пищи (251 против 331 мг / дл, P < 0,001) и HbA1c (7,2 против 9%, P <0.001) когда по сравнению с монотерапией сульфонилмочевиной. 37 Это форма инсулинотерапии предложит хороший постпрандиальный гликемический контроль без проблем доза инсулина / время приема пищи, встречающиеся у обычных людей инсулин. Для пациентов с ожирением и неадекватный ответ на терапию метформином / акарбозой, прекращение приема акарбозы и добавление инсулина — следующее шаг. (Хотя кто-то может выбрать и продолжать акарбозу, нет тройные исследования лекарственных препаратов еще не завершены, и дополнительный расход трех препаратов не может быть оправдан.) В одно исследование 50 пациентов с диабетом II типа с ожирением, метформин / инсулинотерапия привела к значительному снижению профиль глюкозы в плазме (35%), гликозилированный гемоглобин (17%), дозы инсулина (25%) и инсулин плазмы натощак концентрации (30%), чем при монотерапии инсулином. 27 Кроме того, комбинированная терапия привела к статистически более низкий уровень общего холестерина, триглицеридов и артериальное кровяное давление и более высокий уровень ЛПВП, чем наблюдалось при монотерапии инсулином. Для пациентов, не страдающих ожирением, без адекватный ответ на акарбозу / сульфонилмочевину, акарбозу будет прекращено и начато введение инсулина. В ненастоящем пациенты, получавшие метформин / сульфонилмочевину, метформин будет прекращено и добавлен инсулин. Пациенты, которые не отвечают адекватно комбинированной терапии пероральным агентом / инсулином следует перейти к Шагу 5. Шаг 5: инсулин терапия. Пять наиболее часто встречающихся инсулинов схемы указаны под рубрикой Шаг 5. Эти схемы были составлены с использованием нескольких ключевых ссылок и в значительной степени широко используются в клинических упражняться. 25,29,31-33,42 Предложение в этом алгоритме что лиспро можно использовать вместо обычного человеческого инсулина отклоняется от предложенных ранее подходов к поэтапному уходу. Частично это связано с тем, что lispro не был доступен до августа 1996 года.Lispro улучшен фармакокинетический профиль и простота использования вкупе с его недавнее одобрение FDA для использования при диабете типа II делает его разумный вариант — использовать вместо обычного человеческого инсулина. Сводка Недавнее знакомство с Рынок США двух новых пероральных агентов и одного нового инсулина резко увеличил количество вариантов доступны для медицинских работников, ведущих лечение типа II больные сахарным диабетом.К сожалению, консенсуса нет относительно того, как следует вести пациентов с диабетом II типа с фармакологической точки зрения. Пока нет лечения алгоритм предлагает непредвиденные обстоятельства для всех возможностей и никогда не должны заменять здравое клиническое суждение, такое алгоритмы действительно предлагают основу, на основе которой решения могут быть сделано. Надеюсь, текущие и будущие испытания будут лучше обозначить наиболее подходящий фармакологический путь при ведении больных сахарным диабетом II типа. Список литературы 1 Lebovitz HE, Pasmantier R: Комбинированная терапия инсулином и сульфонилмочевиной. Диабет Care 13: 667-75, 1990. 2 Бейли CJ: Бигуаниды и NIDDM. Уход за диабетом 15: 755-72, 1992. 3 Кеннеди Д.Л., Пайпер JM, Baum C: Тенденции использования пероральных гипогликемических средств, 1964-1986 гг.Уход за диабетом 11: 558-62, 1988. 4 Герих JE: Устный гипогликемические средства. N Engl J Med 321: 1232-45, 1989. 5 Skillman TG, Фельдман JM: Фармакология сульфонилмочевины. Am J Med 70: 361, 1981. 6 Leahy JL, Cooper H, Deal DA, Weir GC: хроническая гипергликемия связана с при нарушении влияния глюкозы на секрецию инсулина: а исследование нормальных крыс с использованием хронической глюкозы in vivo настои.J Clin Invest 77: 908-15, 1986. 7 Lebovitz H: Клинический полезность пероральных гипогликемических средств при лечении пациенты с инсулинозависимым сахарным диабетом. Являюсь J Med 75 (Дополнение 5B): 94-99, 1983. 8 Джексон Дж. Э., Бресслер R: Клиническая фармакология гипогликемии сульфонилмочевины. агенты. Наркотики 22: 211-45, 295-320, 1981. 9 Lebovitz H: Новый пероральная терапия для лечения диабета: альфа-глюкозидаза торможение акарбозой.Клинический диабет 13: 99-102, 1995. 10 Амарил в упаковке вставлять. Hoechst Marion Roussel Pharmaceuticals, Сомервилль, штат Нью-Джерси. 11 HOE 490 8 / USA / 202 / DM — Исследования глимепирида, Hoechst Marion Roussel Pharmaceuticals, Сомервилль, штат Нью-Джерси. 12 HOE 490 8 / USA / 201 / DM — Исследования глимепирида, Hoechst Marion Roussel Pharmaceuticals, Сомервилль, штат Нью-Джерси. 13 Герман Л.С., Schersten B, Bitzen P, Kjellstrom T, Lindgarde F, Меландер А: Терапевтическое сравнение метформина и сульфонилмочевина, отдельно и в различных комбинациях. Диабет Care 17: 1100-09, 1994. 14 Coniff RF, Shapior JA, Seaton TB, Bray G: многоцентровое, плацебо-контролируемое испытание по сравнению акарбозы (BAY g5421) с плацебо, толбутамид и толбутамид-плюс-акарбоза в инсулиннезависимый сахарный диабет. Am J Med 98: 443-51, 1995. 15 Сантеусанио Ф, Compagnucci P: оценка риска и пользы акарбозы в лечение инсулинозависимого диабета mellitus. Безопасность лекарств 11: 432-44, 1994. 16 Упаковка PrecosTM вставка, Bayer Pharmaceuticals, Вест-Хейвен, Коннектикут. 17 Coniff RF, г. Шапиро JA, Seaton TB: долгосрочная эффективность и безопасность акарбозы при лечении пациентов с ожирением с инсулиннезависимый сахарный диабет. Arch Intern Мед 154: 2442-48, 1994. 18 Chiasson J-L, Josse Р.Г., Хант Д.А., Палмэсон К., Роджер Н.В., Росс С.А., Райан Э.А., Тан MH, Wolever TMS: эффективность акарбозы в лечение пациентов с инсулинозависимым диабетом mellitus. Ann Intern Med 121: 928-35, 1994. 19 Бейли С: Бигуаниды и NIDDM. Уход за диабетом 15: 755-72, 1992 г. 20 Бейли CJ: Метформин, обновление. General Pharmacol 24: 1299-1309, 1993. 21 ДеФронцо РА, Barzilai N, Simonson DC: Механизм действия метформина в тучные и худые субъекты NIDDM. J Clin Endocrinol Metab 73: 1294-1301, 1993. .22 Stumvall M, Нурджан N, Perriello G, Dailey G, Gerich J: метаболические эффекты метформин при инсулиннезависимом сахарном диабете. N Engl J Med 333: 550-54, 1995. 23 ДеФронцо РА, Гудман А.М. и группа по изучению многоцентрового метформина: Эффективность метформина у пациентов с NIDDM. N Английский J Med 333: 541-49, 1995. 24 Упаковка глюкофага вставка, Bristol-Meyers Squibb, Princeton, NJ. 25 Галлоуэй JA: Лечение NIDDM агонистами или заменителями инсулина. Диабет Care 13: 1209-39, 1990. 26 Траутманн М, Брунель Р., Койвисто В., Вигмати Л., Андерсон Дж.: Снижение постпрандиального повышения глюкозы инсулином лиспро не зависит от глюкозы перед едой. Диабет 45 (Дополнение 2): 121A, 1996. 27 Bruttomesso D, Пианта А, Валерио А, Тадиотто Ф, Лаваньини Т, Дель Прато S: Лизпро инсулина быстрого действия улучшает толерантность к глюкозе. NIDDM путем ингибирования продукции глюкозы в печени. Диабет 45 (Дополнение 2): 140A, 1996. 28 Бастырь Е.Дж., Коцанос J, Vignati L, Cox D: Лизпро инсулина (LP) снижает частота гипогликемии у лиц с сахарным диабетом II типа при высокий риск гипогликемии. Диабет 45 (Доп. 2): 56А, 1996. 29 Genuth S: инсулин использовать в NIDDM. Уход за диабетом 13: 1240-64, 1990. 30 Гульяно Д, Quatraro A, Consoli G, Minei A, Ceriello A, DeRosa N, D’Onofrio F: метформин для лечения ожирения, принимающий инсулин пациенты с диабетом: улучшение гликемического контроля и снижение метаболических факторов риска. Eur J Clin Pharmacol 44: 107-12, 1993. 31 Skyler J: Инсулин лечение. В терапии сахарного диабета и родственных ему заболеваний Расстройства, 2-е издание. Lebovitz H, Ed. Александрия, Вирджиния, Американский Ассоциация диабета , 1994. 32 Seigler DE, Olsson GM, Skyler J: Изофановый инсулин утром в сравнении с инсулином перед сном в сахарный диабет 2 типа (инсулинозависимый). Диабетик Med 8: 826-333, 1992. 33 Yki-Jarvinen H, Kauppila M, Kujansuu E: Сравнение схем инсулина в пациенты с инсулинозависимым сахарным диабетом. N Engl J Med 327: 1426-33, 1992. 34 Vignati L, Brunell RL: Лечение 722 пациентов с сахарным диабетом II типа с инсулин лиспро в 6-месячном перекрестном исследовании. Диабет 44 (Дополнение 1): 229A, 1995. 35 Howey DC, Bowsher Р.Р., Брунель Р.Л., Роу Х.М., Санта П.Ф., Даунинг-Шелтон Дж., Вудворт-младший: человеческий инсулин LysPro: эффект инъекции время на постпрандиальную гликемию. Clin Pharmacol Ther 58: 459-69, 1995. 36 Кроули М., Александр W, Cassar DJ, Hitman G, Джеймс JM, Кессон CM, О’Хара П., Монсон Дж. П., Шоу К. М., Уэльс Дж., Барнетт А. М.: Инсулин лиспро улучшает постпрандиальный контроль уровня глюкозы в крови при типе 1 и диабет 2 типа без увеличения частоты гипогликемия. Диабетическая медицина 12 (Доп. 2): S33 (P26), 1995. 37 Фейнглос М.Н., пер. JD, Thacker CH, English JS: Pre-food insulin lispro улучшает контроль глюкозы у пациентов со вторичным сульфонилмочевинная недостаточность. Диабет 45 (Приложение 2): 286А, 1996. 38 Соединенное Королевство Проспективное исследование диабета (UKPDS) 13: Относительная эффективность случайно выбранной диеты, сульфонилмочевины, инсулина или метформин у пациентов с впервые выявленным инсулинозависимый диабет наблюдался в течение трех лет. Британский Med J 310: 83-88, 1995. 39 Холман Р.Р., Стимсон Дж. Тернер Р.К. Недостаточность сульфонилмочевины при диабете 2 типа: лечение добавками базального инсулина. Diabetic Med 4: 457-62, 1987. 40 Американский диабет Ассоциация: Заявление о консенсусе: Фармакологические лечение гипергликемии при NIDDM. Уход за диабетом 19 (Дополнение 1): S54-61, 1996. 41 Американский диабет Ассоциация: Изложение позиции: Стандарты медицинских уход за больными сахарным диабетом. Диабет Уход 19 (Дополнение 1): S8-15, 1996. 42 Mazze RS, Etzwiler Д., Строк Е., Петерсон К., Макклейв С. Р. II, Месарош Дж. Ф., Leigh C, Owens LW, Peterson A, Kummer M: Стадийный диабет управление. Уход за диабетом 17 (Приложение 1): 56-66, 1994 г. 43 Американский диабет Ассоциация: Заявление о позиции: Nutritional рекомендации и принципы для людей с диабетом mellitus. Уход за диабетом 19 (Приложение 1): S16-19, 1996. 44 Американский диабет Ассоциация: Изложение позиции: Сахарный диабет и упражнение. Уход за диабетом 19 (Приложение 1): S30, 1996. Джон Р.Уайт, младший, PharmD, является доцентом фармацевтической практики и директор Вашингтонского государственного университета / Sacred Heart Отделение наркологических исследований в Медицинском центре в Спокане, штат Вашингтон, Примечание о раскрытии информации: Доктор Уайт получил гонорары за выступления. от и / или выступал в качестве консультанта Eli Lilly и Company, Bristol Myers Squibb, Bayer и Lifescan, которые все производители продуктов для лечения сахарный диабет. | |||
Современные препараты сульфонилмочевины наносят ответный удар — исследуя свободу гибкости
В последние десятилетия были введены различные классы пероральных противодиабетических препаратов (OAD). Первоначальный подход с использованием смирительной рубашки с использованием традиционных сульфонилмочевины и бигуанидов уступил место более гибкому (и запутанному) выбору лекарств. Сульфонилмочевина, пиоглитазон, ингибиторы дипептидилпептидазы-4 (DPP-4), ингибиторы натрий-глюкозного ко-транспортера-2 (SGLT2), бромокриптин и колесевалам — все они борются за место под солнцем, снижающим уровень глюкозы.Хотя такой выбор приветствуется, он также вызывает споры и путаницу.
Sulfonylureas — звезды под атакой
Доступность новых классов препаратов привела к дебатам относительно полезности и жизнеспособности сульфонилмочевины в качестве терапевтического варианта. Несведущее мнение рассматривает сульфонилмочевины как однородную группу препаратов с высоким риском гипогликемии и сердечно-сосудистых осложнений. Хотя это может быть справедливо для более старых производных сульфонилмочевины, таких как толбутамид и хлорпропамид, эти аргументы не верны для современных сульфонилмочевины.1–3
Доказано, что современные препараты сульфонилмочевины эффективны, безопасны и хорошо переносятся в различных клинических ситуациях. Было документально подтверждено, что модифицированное высвобождение гликлазида (MR) улучшает сердечно-сосудистые исходы, обеспечивает благоприятное гликемическое наследие и увеличивает продолжительность жизни. Надежные доказательства, полученные в результате таких исследований, как «Действие при диабете и сосудистых заболеваниях: оценка с контролируемым высвобождением Preterax и Diamicron Modified Release (ADVANCE)», 4 испытания ADVANCE-ON5 и Steno-2, 6 позволяют нам решить проблему дезинформации, с которой сталкиваются современные препараты сульфонилмочевины.
Путаница относительно выбора второго OAD, однако, все еще сохраняется. Американская диабетическая ассоциация (ADA) перечисляет четыре альтернативы инсулину для пациентов с диабетом 2 типа и недостаточностью метформина. Это сульфонилмочевина, пиоглитазон, ингибиторы DPP-4 и ингибиторы SGLT2. Однако в нем не содержится рекомендаций относительно того, как выбрать конкретный класс.7 ADA и Американская ассоциация клинических эндокринологов8 группируют все препараты сульфонилмочевины в один класс, не принимая во внимание их различия.Такой упрощенный выбор основы не позволяет подчеркнуть преимущества современных сульфонилмочевины.
Концепция гибкости
Путаницу вокруг сульфонилмочевины можно развеять, обсудив концепцию гибкости в отношении OAD. Это происходит от прилагательного «гибкость», что означает способность материала, графика или личности сгибаться, адаптироваться или уступать.9 Гибкость режима или препарата инсулина определяется как способность вводить инъекции в разное время с изменяемой инъекцией. — временные промежутки между приемами пищи, частота и количество доз, определяемые совместным принятием решений.Это должно требовать минимального мониторинга уровня глюкозы и консультации медицинского работника без ущерба для безопасности, эффективности и переносимости10
Рубрика гибкости применительно к схемам и препаратам инсулина включает в себя различные области. К ним относятся возможность изменять время введения, интервалы между инъекциями и едой, место введения, количество доз и дозировку единиц. Это также включает необходимость придерживаться строгого режима питания и физической активности, рекомендуемую частоту самоконтроля уровня глюкозы в крови (SMBG) и необходимость проведения других исследований / сопутствующих методов лечения.В лечении диабета слово «гибкость» может использоваться для определения целей лечения, режимов лечения и конкретных лекарств в различных дозах, частотах дозирования, в удобное время приема, с различной частотой SMBG и контролем медицинского работника в широкий спектр пациентов независимо от состояния их здоровья.
Гликлазид с модифицированным высвобождением — гибкий препарат
Эта редакционная статья посвящена гликлазиду MR, современной сульфонилмочевине, как примеру гибкости.
Гибкость дозировки и мониторинг глюкозы
Гликлазид MR выпускается в таблетках с насечками по 30 мг и 60 мг, в диапазоне доз от 15 до 120 мг.11 На некоторых рынках используется комбинация фиксированных доз (FDC) гликлазида MR и метформина (60 + 500 и 60 + 1000 мг) доступен. Комбинированные препараты, содержащие сульфонилмочевину, снижают стоимость, обеспечивают удобство и улучшают приверженность пациента лечению; Следовательно, должны быть доступны КПФД с различной концентрацией сульфонилмочевины + метформин, в то время как можно рассмотреть возможность применения сульфонилмочевины + других препаратов.12 Эти таблетки с насечками обеспечивают большую гибкость при подборе дозы и удобство для пациентов.
Хотя начальная доза обычно зависит от тяжести гипергликемии и ожидаемого риска гипогликемии, титрование дозы основывается на результатах SMBG. Современные препараты сульфонилмочевины позволяют гибко определять частоту SMBG. В то время как людям с нестабильным контролем рекомендуется один раз в неделю SMBG, люди, получающие стабильные дозы, с хорошим контролем могут снизить частоту SMBG до одного раза в две недели.11
Титрование дозы
Иногда пациент может предвидеть или подозревать гипогликемию, не проводя измерения уровня глюкозы.13 В таких случаях рекомендации рекомендуют пациенту самостоятельно снизить дозу. Таблетки гликлазида MR с маркировкой способствуют расширению прав и возможностей пациента, так как дозу можно легко уменьшить вдвое. Бывают случаи, когда пациент не уверен в своем аппетите или пищеварении. Такие проблемы возникают не только при заболеваниях с симптомами желудочно-кишечного тракта, но и при напряженном образе жизни.Время приема пищи, количество и состав могут меняться изо дня в день у одного и того же человека. Поскольку его можно принимать во время еды, и его не нужно употреблять за 30 минут до еды; гликлазид MR — гибкий вариант 14
Пост и пир
Гибкость OAD распространяется на запланированные религиозные посты, такие как Рамадан.11 Исследования показали, что гликлазид MR можно безопасно использовать во время Рамадана без повышенного риска гипогликемии.15 Это преимущество еще более выражено у людей, которые практикуют прерывистый пост для религиозных или религиозных целей. другие цели.Лица, принимающие сульфонилмочевину один раз в день, должны принимать свои лекарства во время ифтара (вечернего приема пищи), в то время как те, кто принимает сульфонилмочевину два раза в день, могут перенести утреннюю дозу на ифтар, а половину вечерней дозы на сухур (утренний прием пищи).
Пациенты, которые придерживаются гибкого режима питания, могут использовать гибкие современные препараты сульфонилмочевины для лечения своего диабета. Консенсус не одобряет практики, позволяющей пациентам самостоятельно титровать дозу в сторону увеличения. Однако у избранных пациентов, которые хорошо осведомлены о диабете и имеют хорошую мотивацию, самотитрование может использоваться для поддержания эугликемии в ситуациях, когда ожидается или подозревается гипергликемия, например, когда вы обедаете вне дома.Гликлазид MR не связан с побочными эффектами, такими как промывание хлорпропамидом и спиртом16
Гликлазид с модифицированным высвобождением в комбинации с другими пероральными противодиабетическими препаратами
Большинству пациентов с диабетом 2 типа требуется комбинированная терапия для лечения их состояния. Сульфонилмочевины гибки в том смысле, что их можно комбинировать со всеми классами пероральных препаратов, кроме глинидов. Их также можно рационально комбинировать со схемами базального, базального и предварительно смешанного инсулина.По данным Международной рабочей группы, современные препараты сульфонилмочевины могут быть продолжены с соответствующей осторожностью при назначении базального инсулина12. Их можно продолжать в приеме антиподовой пищи, если предварительно приготовленный инсулин вводится один раз в день. Сульфонилмочевина короткого действия или глиниды могут быть продолжены или добавлены к третьему приему пищи с соответствующим контролем уровня глюкозы, если предварительная смесь инсулина вводится два раза в день12
Гликлазид с модифицированным высвобождением для разных возрастных групп и национальных границ
Еще одним аспектом гибкости гликлазида MR является его полезность и безопасность в широком спектре клинических состояний.Его можно назначать пожилым пациентам, так как он связан с низким риском гипогликемии. Хотя данные об использовании гликлазида MR у детей ограничены, тенденция к росту диабета 2 типа у подростков может стимулировать исследования в этой области. Глибенкламид может использоваться для гликемического контроля неонатального диабета (мутации гена KCNJ11, ABCC8) и диабета зрелого возраста у молодых 3 (MODY 3), 11 и гликлазид MR может быть изучен в качестве альтернативы этому.
Гликлазид MR одинаково эффективен во всех географических регионах мира.17 Следовательно, он демонстрирует гибкость в использовании и за рубежом.
Здоровье сердечно-сосудистой системы и почек
Сердечно-сосудистые заболевания (ССЗ) являются наиболее серьезным осложнением диабета 18, и гликлазид MR демонстрирует свою гибкость, демонстрируя пользу и безопасность у людей с сердечно-сосудистыми заболеваниями.3 У этой гибкости есть два аспекта: во-первых, гликлазид MR безопасен для использования у пациентов. при сердечно-сосудистых заболеваниях, в отличие от глибенкламида, он не вызывает ишемического прекондиционирования.11 Он не связан с риском увеличения инсульта или ампутации пальцев стопы, 2 и поэтому может использоваться у пациентов с цереброваскулярным заболеванием или заболеванием периферических артерий или с риском их развития. .Нет сообщений о связи гликлазида MR с сердечной недостаточностью.
Gliclazide MR достаточно гибок, чтобы использоваться во всем кардиофенотипическом спектре; во-вторых, доказано, что гликлазид MR улучшает сердечно-сосудистые исходы и оставляет положительное гликемическое наследие. Об этом свидетельствуют испытания ADVANCE и ADVANCE ON4,5
.Подобная гибкость отмечается в области почек, где обнаружено, что ранний интенсивный гликемический контроль с помощью гликлазида MR полезен, особенно с точки зрения снижения риска терминальной стадии почечной недостаточности.5 Его использование связано с традиционными преимуществами, как показано в исследовании ADVANCE ON.5,17 Более того, при хроническом заболевании почек 1–4 стадии не требуется коррекции дозы, но следует проявлять осторожность при использовании гликлазида MR у пациентов на диализе. .19 Это означает, что препарат может применяться во всех рено-фенотипических слоях. Эта гибкость сочетается со способностью улучшать здоровье клубочков и снижать альбуминурию.20
Сводка
Gliclazide MR не только эффективен, безопасен и хорошо переносится, 21,22 он также гибок.Применение такой современной сульфонилмочевины для разных возрастных групп, клинических проявлений и национальных границ уникально. Эта многогранная гибкость, подробно описанная в таблице 1, должна распространяться на гибкость лечения диабета на протяжении будущих десятилетий. Мощная доказательная база и опыт преимуществ, которыми подкреплен гликлазид MR, гарантируют, что он останется препаратом выбора при неконтролируемом диабете 2 типа и в будущем.
(PDF) Современный документ Сульфонилмочевины и их использование в клинической практике
Сульфонилмочевины и их использование в клинической практике
Arch Med Sci 4, август / 2015 847
15.Blumenthal SA. Усиление печеночного действия сулина IN-
хлорпропамидом. Diabetes 1977; 26: 485-9.
16. Шорр Р.И., Рэй В.А., Догерти-младший, Грион М.Р. Индивидуальный
сульфонилмочевины и серьезная гипогликемия у пожилых людей.
J Am Geriatr Soc 1996; 44: 751-5.
17. Lebovitz HE, Feinglos MN. Препараты сульфонилмочевины: механизм противодиабетического действия и терапевтическая ценность.
Уход за диабетом 1978; 1: 189-98.
18.Стенман С., Меландер А., Groop PH, Groop LC. Каковы преимущества
от увеличения дозы сульфонилмочевины? Ann
Intern Med 1993; 118: 169-72.
19. Йонссон А., Ридберг Т., Экберг Дж., Халленгрен Б., Мелан-
дер А. Медленное выведение глибурида у пациентов с NIDDM.
Diabetes Care 1994; 17: 142-5.
20. Ридберг Т., Йонссон А., Рёдер М., Меландер А. Гипоглиц-
активность метаболитов глибурида (глибенкламида) у
человек.Diabetes Care 1994; 17: 1026-30.
21. Винклер Г., Жеро Л. Фармакогенетика секрета инсулина —
агог противодиабетических средств. Orv Hetil 2011; 152: 1651-60.
22. Hermann LS, Scherstén B, Bitzén PO, Kjellström T., Lind-
gärde F, Melander A. Терапевтическое сравнение мет-
формина и сульфонилмочевины, отдельно и в различных комбинациях
стран. Двойное слепое контролируемое исследование. Diabetes Care
1994; 17: 1100-9.
23. Тесье Д., Доусон К., Тетро Дж. П., Браво Дж., Менейи Г.С.
Глибенкламид по сравнению с гликлазидом при сахарном диабете 2 типа. Diabet Med 1994; 11: 974-80.
24. Holstein A, Plaschke A, Egberts EH. Более низкая частота
тяжелой гипогликемии у пациентов с сахарным диабетом 2 типа
, получавших глимепирид, по сравнению с глибенкламидом. Диабет
Metab Res Rev 2001; 17: 467-73.
25. Гангджи А.С., Цукерман Т., Герштейн Х.С., Голдсмит С.Н.,
Класс CM. Систематический обзор и метаанализ
гипогликемии и сердечно-сосудистых событий: сравнение
глибурида с другими стимуляторами секреции и с инсулином.
Уход за диабетом 2007; 30: 389-94.
26. Шорр Р.И., Рэй В.А., Догерти-младший, Грион М.Р. Заболеваемость
и факторы риска серьезной гипогликемии у сыновей старшего возраста, принимающих инсулин или сульфонилмочевину. Arch Intern Med
1997; 157: 1681-6.
27. Бресслер П., ДеФронцо Р.А. Наркотики и сахарный диабет. Диабет
Ред. 1994; 2: 53-84.
28. Шорр Р.И., Рэй В.А., Догерти-младший, Грион М.Р. Заболеваемость
и факторы риска серьезной гипогликемии у сыновей старшего возраста, принимающих инсулин или сульфонилмочевину.Arch Intern Med
1997; 157: 1681-6.
29. Ли Й.Х., Ли Б.В., Чун С.В., Ча Б.С., Ли Х.С. Прогнозные
характеристики пациентов, достигших гликемического контроля
с инсулином после неэффективности сульфонилмочевины. Int J Clin Pract
2011; 65: 1076-84.
30. Derosa G, Limas CP, Macías PC, Estrella A, Maffi oli P.
Диетический и нутрицевтический подход к диабету 2 типа.
Arch Med Sci 2014; 10: 336-44.
31. Groop L, Eriksson CJ, Huupponen R, Ylikahri R, Pelko-
nen R.Роли хлорпропамида, спирта и ацетальдегида в определении потока хлорпропамида-спирта.
Диабетология 1984; 26: 34-8.
32. Кадоваки Т., Хагура Р., Кадзинума Х., Кузуя Н., Йошида С.
Гипонатриемия, вызванная хлорпропамидом: частота и факторы риска
. Уход за диабетом 1983; 6: 468-71.
33. Рао А.Д., Кухадия Н., Рейнольдс К., Фонсека В.А. Связана ли комбинация
сульфонилмочевины и метформина с повышенным риском сердечно-сосудистых заболеваний или
со смертностью от всех причин? A метаанализ наблюдательных
исследований.Уход за диабетом 2008; 31: 1672-8.
34. Морган С.Л., Пул С.Д., Эванс М., Барнетт А.Х., Дженкинс —
Джонс С., Карри С.Дж.. Что дальше после метформина? Aretro-
предполагаемая оценка результатов терапии, снижающей глю-
второй линии, у людей с диабетом 2 типа.
J Clin Endocrinol Metab 2012; 97: 4605-12.
35. Kasznicki J, Drzewoski J. Сердечная недостаточность у больных диабетом
населения — патофизиология, диагностика и лечение-
мент.Arch Med Sci 2014; 10: 546-56.
36. Изучение влияния гипогликемических агентов на сосудистые осложнения у пациентов с диабетом взрослого возраста.
VI. Дополнительный отчет о нефатальных событиях у пациентов
, получавших толбутамид. Диабет 1976; 25: 1129-53.
37. Гарратт К.Н., Брэди П.А., Хассинджер Н.Л., Гриль Д.Е., Терзич А.,
Холмс Д.Р. Сульфонилмочевины увеличивают раннюю смертность у пациентов с сахарным диабетом после прямой
ангиопластики по поводу острого инфаркта миокарда.J Am Coll
Cardiol 1999; 33: 119-24.
38. Мальмберг К. Проспективное рандомизированное исследование интенсивной терапии инсулином
на долгосрочную выживаемость после острого
инфаркта миокарда у пациентов с сахарным диабетом.
Исследовательская группа DIGAMI (Сахарный диабет, инфузия глюкозы инсулина в
Острый инфаркт миокарда). BMJ 1997;
314: 1512-5.
39. Simpson SH, Majumdar SR, Tsuyuki RT, Eurich DT,
Johnson JA.Зависимость «доза-реакция» между препаратами на основе сульфо-
на основе нейлмочевины и смертностью при диабете 2 типа mel-
лит: а популяционное когортное исследование. CMAJ 2006;
174: 169-74.
40. Abdelmoneim AS, Hasenbank SE, Seubert JM, Brocks DR,
Light PE, Simpson SH. Вариации в тканевой селективности
среди стимуляторов секреции инсулина: систематический обзор.
Диабет, ожирение, метаболизм 2012; 14: 130-8.
41. Терао Ю., Аяори М., Огура М. и др.Влияние lurea агентов сульфоний-
на обратный транспорт холестерина in vitro
и vivo. Diab Vasc Dis Res 2011; 18: 513-30.
42. Биллман Г.Е. Сарколемма сердца, АТФ-чувствительный калиевый канал po-
как новая мишень для антиаритмической терапии
. Pharmacol Ther 2008; 120: 54-70.
43. Мики Т., Лисс Б., Минами К. и др. АТФ-чувствительные K + каналы
в гипоталамусе необходимы для поддержания
гомеостаза глюкозы.Nat Neurosci 2001; 4: 507-12.
44. Целлер М., Данчин Н., Саймон Д. и др .; Французский регистр
исследователей острого элевации ST и миокарда без элевации ST.
. Влияние типа предварительной госпитализации
препаратов сульфонилмочевины на смертность и сердечно-сосудистые исходы
у больных сахарным диабетом с острым инфарктом миокарда.
J Clin Endocrinol Metab 2010; 95: 4993-5002.
45. Шрамм Т.К., Гисласон Г.Х., Вааг А. и др. Смертность и
сердечно-сосудистых рисков, связанных с различными стимуляторами секреции инсулина
по сравнению с метформином при диабете 2 типа
betes, с или без предшествующего инфаркта миокарда:
общенациональное исследование.Eur Heart J 2011; 32: 1900-8.
46. Группа сотрудничества ADVANCE, Патель А., МакМахон С.,
Чалмерс Дж. И др. Интенсивный контроль уровня глюкозы в крови и
сосудистых исходов у пациентов с сахарным диабетом 2 типа.
N Engl J Med 2008; 358: 2560-72.
47. Bowker SL, Majumdar SR, Veugelers P, Johnson JA. In-
увеличил смертность от рака среди пациентов с диабетом типа
2, которые принимают сульфонилмочевину или инсулин. Диабет
Уход 2006; 29: 254-8.
48. Монами М., Бальзи Д., Ламанна С. и др. Все ли сульфонилмочевины
иодинаковы? Когортное исследование сердечно-сосудистой и канцерогенной смертности
. Diabetes Metab Res Rev 2007; 23:
479-84.
49. Герич Дж., Раскин П., Жан-Луи Л., Пуркаястха Д., Ба-
рон Массачусетс. PRESERVE-beta: двухлетняя эффективность и безопасность
начальной комбинированной терапии с натеглинидом или глибу-
райд плюс метформин. Уход за диабетом 2005; 28: 2093-9.
| Определение (NCI) | Сульфонилмочевина второго поколения длительного действия с высокой степенью связывания с белками и антигипергликемической активностью. Глибурид, также называемый глибенкламидом, с большей вероятностью вызывает эпизоды гипогликемии из-за его более длительного периода полувыведения и возможного замещения другими препаратами с высокой степенью связывания белка. Этот агент метаболизируется до двух неактивных метаболитов, которые выводятся с желчью и мочой.Этот агент проявляет агонистическую активность гамма-рецептора, активируемого пролифератором пероксисом (PPARgamma). |
| Определение (MSH) | Противодиабетическое производное сульфонилмочевины с действием, аналогичным хлорпропамиду. |
| Определение (CSP) | N-4-бета (2-метокси-5-хлорбензамидо) этилбензосульфонил-N’-циклогексилмочевина; гипогликемические препараты, применяемые против инсулиннезависимого сахарного диабета; считается, что он действует за счет увеличения экспрессии рецепторов инсулина в тканях-мишенях. |
| Концепции | Фармакологическое вещество ( T121 ) , Органические химические вещества ( T109 ) |
| MSH | D005905 |
| SnomedCT | 384978002, 80870001, 387466004 |
| LNC | LP14720-4, MTHU001812 |
| Английский | Глибенкламид, глибенкламид, бензамид, 5-хлор-N- (2- (4 — ((((циклогексиламино) карбонил) амино) сульфонил) фенил) этил) -2-метокси-, глибурид, Глибурид, Гибурид, Глибурид (вещество) , глибурид (лекарство), глибурид, глибурид [химическое вещество / ингредиент], глибенкламид, глибурид, глибенкламид, глибензцикламид, глибурид (продукт), глибенкламид (вещество), глибурид |
| шведский | Глибурид |
| Чешский | глибенкламид |
| финский | Глибуриди |
| Немецкий | Глибурид, глибенкламид, глибенциламид |
| Русский | ГЛИБУРИД, ГЛИБЕНКЛАМИД, ГЛИБЕНКЛАМИД, ГЛИБУРИД |
| Хорватский | ГЛИБУРИД |
| Польский | Евкламин, Глибурид, Глибенкламид |
| Японский | グ リ ベ ン ク ラ ミ ド, グ リ ブ リ ド |
| Испанский | глибурида (сустансия), глибенкламида (продукто), глибенкламида (сустансия), глибенкламида, глибензцикламида, глибурида, глибенкламида, глибурида |
| Французский | Глибенкламид |
| Итальянский | Глибурид |
| Португальский | Глибенкламида, Глибурето |
Сульфонилмочевины как препараты второго ряда при диабете 2 типа и риске сердечно-сосудистых и гипогликемических событий: популяционное когортное исследование
- Антониос Дурос, научный сотрудник123,
- Софи Делл’Аниелло, статистик1,
- Ориана Хой Юн эндокринолог14,
- Кристиан Б. Филион, доцент 125,
- Лоран Азулай, доцент 126,
- Сами Суисса, профессор 125
- 1 Центр клинической эпидемиологии Института леди Дэвис, Еврейская больница общего профиля, 3755 Кот-Сент- Catherine, H-461 Montréal, QC h4T 1E2, Canada
- 2 Департамент эпидемиологии, биостатистики и гигиены труда, Университет Макгилла, Монреаль, Канада
- 3 Институт клинической фармакологии , Charité-Universitätsmedizin Berlin, корпоративный член Freie Universität Berlin, Humboldt -Universität zu Berlin и Берлинский институт здравоохранения, Берлин, Германия
- 4 Отделение эндокринологии, Еврейская больница общего профиля, Монреаль, Квебек, Канада
- 5 Отдел клинической эпидемиологии, Отделение медицины, Университет Макгилла, Монреаль, Квебек, Канада
- 6 Джеральд Бронфман Отделение онкологии, Университет Макгилла, Монреаль, Квебек, Канада
- Для корреспонденции: S Suissa samy.suissa {at} mcgill.ca
Abstract
Цель Оценить, связано ли добавление сульфонилмочевины или переход на нее с повышенным риском инфаркта миокарда, ишемического инсульта, сердечно-сосудистой смерти, смертности от всех причин и тяжелой гипогликемии по сравнению с оставшиеся на монотерапии метформином у пациентов с сахарным диабетом 2 типа.
Дизайн Популяционное когортное исследование.
Настройка Общие врачи, предоставляющие данные в UK Clinical Practice Research Datalink.
Участники Пациенты с сахарным диабетом 2 типа, начавшие монотерапию метформином в период с 1998 по 2013 год.
Основные критерии оценки результатов Используя преобладающий дизайн когорты новых пользователей, мы сопоставили 1: 1 пациентов, которые добавляли сульфонилмочевину или переходили на нее, с теми, кто продолжал монотерапию метформином по шкале предрасположенности высокого измерения, гемоглобину A1c и количеству ранее выписанных рецептов метформина. Две группы сравнивались с использованием моделей пропорциональных рисков Кокса для оценки скорректированных соотношений рисков и 95% доверительных интервалов для результатов исследования.
Результаты Среди 77 138 инициаторов метформина 25 699 добавили или перешли на сульфонилмочевину в течение периода исследования. В течение среднего периода наблюдения 1,1 года сульфонилмочевины были связаны с повышенным риском инфаркта миокарда (уровень заболеваемости 7,8 против 6,2 на 1000 человеко-лет, отношение рисков 1,26, 95% доверительный интервал от 1,01 до 1,56), все они вызывают смертность ( 27,3 против 21,5, 1,28, от 1,15 до 1,44) и тяжелой гипогликемии (5,5 против 0,7, 7,60, 4.64–12,44) по сравнению с продолжающейся монотерапией метформином. Наблюдалась тенденция к увеличению риска ишемического инсульта (6,7 против 5,5, 1,24, от 0,99 до 1,56) и смерти от сердечно-сосудистых заболеваний (9,4 против 8,1, 1,18, 0,98 до 1,43). По сравнению с добавлением сульфонилмочевины переход на сульфонилмочевину был связан с повышенным риском инфаркта миокарда (отношение рисков 1,51, 95% доверительный интервал, 1,03–2,24) и смертности от всех причин (1,23, 1,00–1,50). Не наблюдалось различий в отношении ишемического инсульта, смерти от сердечно-сосудистых заболеваний или тяжелой гипогликемии.
Выводы Сульфонилмочевины в качестве препаратов второго ряда связаны с повышенным риском инфаркта миокарда, все они вызывают летальность и тяжелую гипогликемию по сравнению с продолжением монотерапии метформином. Продолжение приема метформина при введении сульфонилмочевины кажется более безопасным, чем переход на другой.
Введение
Сульфонилмочевины — это пероральные противодиабетические препараты, рекомендуемые в качестве терапии второй линии у пациентов с диабетом 2 типа.1 Несмотря на недавнее одобрение нескольких новых препаратов, сульфонилмочевины остаются наиболее часто назначаемыми противодиабетическими препаратами после неудачного лечения метформином.2 Безопасность сульфонилмочевины в отношении неблагоприятных сердечно-сосудистых и гипогликемических явлений была тщательно изучена.34 Однако исследования, в которых особое внимание уделялось безопасности сердечно-сосудистых заболеваний и гипогликемии в качестве лекарственного средства второго ряда у пациентов с плохо контролируемым диабетом, нуждающихся в добавлении других препаратов или переходе на них. , редки и ограничены.
Рандомизированные контролируемые испытания, оценивающие сульфонилмочевину в качестве препаратов второго ряда, были недостаточны для оценки сердечно-сосудистых осложнений диабета или тяжелой гипогликемии, которые могут способствовать развитию неблагоприятных сердечно-сосудистых событий.56 В клинической практике в большинстве обсервационных исследований, оценивающих эти исходы, сульфонилмочевина сравнивалась с другими противодиабетическими препаратами второго ряда, такими как ингибиторы дипептидилпептидазы-4 или инсулин.789 Таким образом, специфический риск дополнительного лечения сульфонилмочевиной по сравнению с продолжением монотерапии метформином исследовался редко. , и несколько соответствующих наблюдательных исследований имели ограничения метода, такие как систематическая ошибка отбора, 1011 ошибочная классификация воздействия 12 и остаточное искажение.1012
Метформин связан со сниженным риском сердечно-сосудистых событий и низкой частотой гипогликемии.13 Дополнительное лечение сульфонилмочевиной, потенциально кардиотоксическим классом с высоким риском гипогликемических событий, 314 может перевешивать преимущества метформина. Таким образом, целью нашего популяционного исследования было оценить, связано ли использование сульфонилмочевины второй линии после метформина с повышенным риском инфаркта миокарда, ишемического инсульта, сердечно-сосудистой смерти, смертности от всех причин и тяжелой гипогликемии у пациентов с типом 2. сахарный диабет по сравнению с продолжением монотерапии метформином.
Методы
Источники данных
Мы использовали канал данных исследований клинической практики Великобритании (CPRD), связанный с базами данных больничной статистики (HES) и Управления национальной статистики (ONS). CPRD — это большая база данных первичной медико-санитарной помощи, которая содержит медицинские записи более чем 14 миллионов человек, зарегистрированных в более чем 680 врачебных кабинетах15. Диагнозы и процедуры регистрируются с использованием классификации кода чтения. Лекарства, прописанные врачами общей практики, кодируются на основе словаря Управления по рецепту и ценообразованию Великобритании.CPRD содержит информацию об антропометрических переменных, таких как индекс массы тела, и переменных образа жизни, таких как курение и употребление алкоголя. Данные CPRD были ранее проверены и продемонстрировали высокое качество.16 HES содержит всю информацию о госпитализации и госпитализации, включая первичные и вторичные диагнозы (закодированные с использованием МКБ-10 (Международная классификация болезней, 10-й пересмотр) и больничные процедуры. (закодировано с использованием классификации вмешательств и процедур Управления переписей и обследований населения, 4-я версия (OPCS-4)).База данных ONS содержит электронные свидетельства о смерти всех жителей Великобритании и включает основную причину смерти (закодированную с использованием МКБ-9 и МКБ-10). Данные HES и ONS могут быть связаны с CPRD с 1 апреля 1997 г. и ограничены общей практикой в Англии, которая согласилась на схему связи (в настоящее время составляет 75% всех практик в Англии) .16
Базовая когорта
о методах сообщалось ранее.17 Мы сначала сформировали базовую когорту пациентов, впервые получавших метформин в качестве монотерапии диабета 2 типа в период с 1 апреля 1998 г. по 31 марта 2013 г., с последующим наблюдением до 31 марта 2014 г.Вход в базовую когорту определялся датой первого назначения метформина. Мы исключили всех пациентов в возрасте до 40 лет, пациентов с историей болезни менее одного года в CPRD до включения в когорту и женщин с диагнозом синдрома поликистозных яичников в любое время до включения в когорту. Мы также исключили пациентов, которым были назначены какие-либо противодиабетические препараты в любое время до включения в базовую когорту. В группу были включены пациенты с сердечно-сосудистыми заболеваниями в анамнезе.
Когорта исследования
Когорта исследования была сформирована путем выявления всех субъектов из базовой когорты инициаторов метформина, которые впоследствии добавили или перешли на сульфонилмочевину в качестве лечения второй линии.Пациенты, которые добавляли другие противодиабетические препараты или переходили на них, подвергались цензуре. Для каждого пациента, добавлявшего сульфонилмочевину или переходившего на него, мы определили подходящего референтного пациента, который также был инициатором метформина, но продолжал принимать метформин, используя преобладающий дизайн с новым пользователем18. инициаторы метформина в базовой когорте, которые получили рецепт на метформин в течение трех месяцев с даты, когда пациенты, подвергшиеся воздействию, добавили сульфонилмочевину или перешли на нее, и которые получили такое же количество рецептов метформина в течение времени в базовой когорте, что и пациенты, подвергшиеся воздействию (см. рисунок 1, дополнительные материалы).Таким образом, количество назначений метформина между входом в базовую когорту (начало монотерапии) и входом в исследуемую когорту (добавление или переход на сульфонилмочевину или согласованное продолжение) по своей природе было совпадающей ковариатой. Более того, подвергшиеся воздействию и контрольные субъекты соответствовали уровню гемоглобина A1c (≤7%, 7,1-8%,> 8% или неизвестно) при входе в когорту исследования. Наконец, подвергшиеся воздействию и контрольные субъекты были сопоставлены по высокоразмерной шкале предрасположенности.19 Метод многомерной оценки предрасположенности эмпирически отбирает ковариаты на основе их распространенности и вероятности искажения.Для каждого члена каждого сопоставленного набора мы определили всю доступную информацию из семи измерений данных (пять измерений из CPRD: рецепты на лекарства, процедуры, диагнозы, история болезни и административная информация; два измерения формируют HES: диагнозы и процедуры) в один год до даты согласованного набора. Затем мы применили условную логистическую регрессию для оценки склонности к получению препарата сульфонилмочевины, тем самым учитывая 500 наиболее вероятных искажающих факторов.Пациенты с неперекрывающимися многомерными оценками склонности были исключены из когорты. Процедура многомерной оценки склонности повторялась для каждого результата, так как этот метод вычисляет член смещения, который учитывает связь с конкретным результатом. Пациенты с подобранным метформином могли добавить или переключиться на сульфонилмочевину позже во время наблюдения. В этом случае наблюдение за группой монотерапии метформином было подвергнуто цензуре в момент добавления или перехода на сульфонилмочевину. Затем пациент был включен в список пользователей сульфонилмочевины, и с этого момента его можно было сопоставить с пациентом, принимающим метформин.
Пациенты, отвечающие критериям включения в исследование, наблюдались до самого раннего из следующих событий: прекращение лечения, наступление одного из результатов исследования, окончание регистрации в общей врачебной практике или конец периода исследования (31 марта 2014 г.). Прекращение лечения определялось либо отсутствием нового рецепта к концу 60-дневного периода (30-дневный срок назначения плюс 30-дневный льготный период), либо добавлением или переходом на другой антидиабетический препарат, не содержащий сульфонилмочевины.Для инициаторов метформина, добавляющих или переключающихся на сульфонилмочевину, разрешалось дальнейшее переключение в пределах класса сульфонилмочевины.
Результаты исследования
Мы рассмотрели пять исходов: госпитализация по поводу инфаркта миокарда, госпитализация по поводу ишемического инсульта, сердечно-сосудистая смерть, смертность от всех причин и тяжелая гипогликемия. Госпитализация по поводу инфаркта миокарда (коды МКБ-9 410.x, коды МКБ-10 I21.x) и ишемического инсульта (коды МКБ-9 433.x, 434.x или 436.x; коды МКБ-10 I63.x или I64.x) были идентифицированы с использованием HES и ONS. Диагностические коды для определения инфаркта миокарда при ГЭК показали высокую достоверность (> 90%) .20 Достоверность диагнозов инсульта в административных данных также высока (> 80%) .21 Сердечно-сосудистая смерть (коды МКБ-9 390. x-398.x, 401.x-405.x, 410.x-417.x, 420.x-429.x (кроме 427.5), 430.x-438.x или 440.x-447.x ; Коды МКБ-10 I00.x-I77.x (кроме I46.9)) был идентифицирован в ONS, и смертность от всех причин была идентифицирована из всех трех баз данных, с датой смерти, определяемой самой ранней записью смерти в любой базе данных. .У ГЭК была выявлена тяжелая гипогликемия (коды МКБ-10 E16.0, E16.1, E16.2).
Статистический анализ
Мы использовали описательную статистику, чтобы обобщить характеристики пациентов в сопоставленных группах. Потенциальные дисбалансы после сопоставления между ковариатами оценивались с использованием стандартизованных средних различий. Частота каждого исхода рассчитывалась на основе распределения Пуассона и выражалась как количество событий на 1000 человеко-лет. Кроме того, мы построили модель регрессии пропорциональных рисков Кокса для каждого результата, которая оценила отношение рисков и 95% доверительные интервалы для сульфонилмочевины по сравнению с метформином.Чтобы максимизировать сопоставимость между двумя группами, модели инфаркта миокарда, ишемического инсульта, смерти от сердечно-сосудистых заболеваний и тяжелой гипогликемии были дополнительно скорректированы с учетом возраста, пола, децилей шкалы многомерной предрасположенности и истории соответствующего исхода за год до когорты. запись (или, в случае смерти от сердечно-сосудистых заболеваний, инфаркт миокарда или ишемический инсульт в анамнезе). Модель смертности от всех причин была дополнительно скорректирована с учетом возраста, пола и децилей многомерной оценки склонности.
Вторичные анализы
Мы провели три вторичных анализа. Во-первых, мы оценили риск исходов исследования отдельно для добавления сульфонилмочевины к метформину и перехода на сульфонилмочевину с метформина. Для этого анализа мы использовали определение воздействия, зависящее от времени, с подкатегорией времени употребления сульфонилмочевины у человека, что привело к трем взаимоисключающим категориям: текущее использование только метформина (справочная информация), текущее использование только сульфонилмочевины и сопутствующее текущее использование метформина и сульфонилмочевины. .Таким образом, один и тот же пациент может отнести время человека к разным категориям воздействия. Во-вторых, для оценки зависимости «продолжительность-ответ» между добавлением сульфонилмочевины или переходом на нее и риском каждого результата исследования, употребление наркотиков было дополнительно разделено на категории в соответствии с тремя заранее заданными продолжительностью (≤3 месяцев, 3,1–12 месяцев,> 12 месяцев). В-третьих, учитывая фармакологическую гетерогенность, наблюдаемую среди различных сульфонилмочевины, риск каждого результата исследования оценивался отдельно для двух групп сульфонилмочевины, классифицированных по продолжительности действия и специфичности поджелудочной железы.Первая группа включала неспецифические для поджелудочной железы препараты длительного действия (например, глибурид и глимепирид). Вторая группа включала препараты короткого действия, специфичные для поджелудочной железы (например, гликлазид, глипизид и толбутамид). 1722232425 Этот анализ был основан на добавлении или замене первой сульфонилмочевины. Во время наблюдения разрешалось переключение между препаратами сульфонилмочевины той же группы.
Анализ чувствительности
Мы провели четыре анализа чувствительности, чтобы оценить надежность наших результатов. Во-первых, чтобы оценить возможную ошибочную классификацию воздействия, мы повторили анализ, используя 60-дневный льготный период между неперекрывающимися последовательными назначениями.Во-вторых, анализы на инфаркт миокарда, ишемический инсульт, сердечно-сосудистую смерть и тяжелую гипогликемию были повторены после исключения пациентов с историей исхода (или, в случае сердечно-сосудистой смерти, историей инфаркта миокарда или ишемического инсульта) за год до запись в когорте. В-третьих, чтобы оценить потенциальное влияние остаточного искажения, мы повторили первичный анализ после дополнительной поправки на ковариаты со стандартизованной разницей средних> 5%. Наконец, чтобы оценить потенциальное влияние неизмеренного искажения, мы провели апостериорный анализ чувствительности, используя подход, предложенный Дингом и Вандервилом (описанный в дополнительном материале eMethods 1).26
Анализ отрицательного контроля
Для дальнейшей оценки достоверности наших результатов мы провели дополнительный анализ с использованием результата отрицательного контроля.27 Мы сравнили инициаторов метформина, которые добавляли сульфонилмочевину или перешли на нее, с инициаторами метформина, которые продолжали монотерапию метформином, в отношении риска диабетической ретинопатии (идентифицированной с помощью кодов считывания из CPRD и кодов ICD-10 из HES), поскольку для этого исхода не сообщалось о различиях в эффектах метформина и сульфонилмочевины.28 Для этого анализа мы дополнительно исключили всех пациентов с ретинопатией в анамнезе, чтобы оценить случайное заболевание.
Дополнительный анализ
В дополнительном анализе мы сравнили непосредственных пациентов, которые добавляли сульфонилмочевину к метформину, с пациентами, которые переходили на сульфонилмочевину с метформина. Для этого анализа мы определили добавление сульфонилмочевины как рецепт метформина в первый месяц после первого рецепта сульфонилмочевины. Переход на препараты сульфонилмочевины был обусловлен отсутствием назначения метформина в тот же период.Затем мы выполнили многовариантную логистическую регрессию для оценки вероятности (оценка склонности) перехода на сульфонилмочевину по сравнению с добавлением сульфонилмочевины в зависимости от всех ковариат, перечисленных в рукописи. Затем мы вырезали пациентов с неперекрывающимися распределениями оценок предрасположенности. За оставшимися пациентами наблюдали в течение одного месяца после первоначального назначения сульфонилмочевины, пока они не добавили или не переключились на неметформин, несульфонилмочевинные противодиабетические препараты или не испытали один из результатов исследования, в зависимости от того, что произошло раньше.Пациенты, добавляющие сульфонилмочевину, подвергались дополнительной цензуре при прекращении приема метформина или сульфонилмочевины, а пациенты, переходящие на сульфонилмочевину, подвергались дополнительной цензуре в случае повторного начала приема метформина или прекращения приема сульфонилмочевины. Отношение рисков исходов исследования оценивалось с использованием модели пропорциональных рисков Кокса, скорректированной с учетом возраста, пола, истории исходов за год до включения в когорту (или, в случае смерти от сердечно-сосудистых заболеваний, инфаркта миокарда или ишемического инсульта в анамнезе). децили оценки предрасположенности, а также для ковариат со стандартизованной разницей средних> 5%.Все анализы проводились с использованием SAS версии 9.4 (Институт SAS, Кэри, Северная Каролина) и R (Фонд R для статистических вычислений, Вена, Австрия).
Вовлеченность пациентов
Ни один из пациентов не участвовал в постановке вопроса исследования или оценке результатов, а также не участвовал в разработке планов дизайна или проведения исследования. Пациентов не просили дать совет относительно интерпретации или записи результатов. Нет планов по распространению результатов исследования среди участников исследования или соответствующего сообщества пациентов.
Результаты
На рис. 1 показано, что базовая когорта включала 77 138 пациентов, впервые выписавших метформин в период с 1 апреля 1998 г. по 31 марта 2013 г. В общей сложности 25 699 пациентов добавили или перешли на препараты сульфонилмочевины во время наблюдения. Для анализа смертности от всех причин 2107 (8%) этих пациентов были исключены из когорты из-за неперекрывающегося многомерного распределения оценок предрасположенности или отсутствия подходящих соответствий. Рисунок 1 показывает, что когорта исследования для этого результата составила 23 592 пациента, которые добавили сульфонилмочевину или перешли на нее, и 23 592 соответствующих пациента, которые остались на монотерапии метформином.Размер когорт исследования по другим четырем исходам был аналогичным.
Рис. 1Блок-схема, показывающая базовую и исследуемую когорты. HES = Статистика по эпизодам в больнице; ONS = Управление национальной статистики; CPRD = Clinical Practice Research Datalink.
Средний период наблюдения составил 1,1 (стандартное отклонение 1,4) года, в общей сложности 244 150 пациенто-лет. За время наблюдения было зарегистрировано 337 инфарктов миокарда (частота 6,9 на 1000 пациенто-лет, 95% доверительный интервал от 6,2 до 7,7), 299 ишемических инсультов (6.1, 5,5–6,9), 429 случаев смерти от сердечно-сосудистых заболеваний (8,7, 7,9–9,6), 1190 случаев смерти от любой причины (24,4, 23,0–25,8) и 150 тяжелых гипогликемических событий (3,1, 2,6–3,6). Наиболее частыми причинами смерти были рак (31%), сердечно-сосудистые заболевания (31%) и респираторные заболевания (10%). В таблице 1 показаны исходные характеристики согласованных когорт для анализа смертности от всех причин. Соответствующие таблицы для других исходов (инфаркт миокарда, ишемический инсульт, смерть от сердечно-сосудистых заболеваний и тяжелая гипогликемия) были практически идентичными (см. Таблицы 1-4, дополнительные материалы).После сопоставления высокой степени склонности пациенты, которые добавляли сульфонилмочевину или переходили на нее, имели исходный профиль, аналогичный тем, которые продолжали принимать монотерапию метформином.
Таблица 1Характеристики пользователей сульфонилмочевины в качестве терапии второй линии и метформина в качестве терапии первой линии у пациентов с диабетом 2 типа (все они являются причиной смерти в когорте исследования). * Значения представлены числами (в процентах), если не указано иное
Таблица 2 и электронные рисунки 2 -6 (дополнительные материалы) показывают результаты по пяти исходам.По сравнению с использованием монотерапии метформином добавление сульфонилмочевины или переход на нее было связано с повышенным риском инфаркта миокарда (7,8 против 6,2 на 1000 человеко-лет, отношение рисков 1,26, 95% доверительный интервал от 1,01 до 1,56), все они вызывают смертность ( 27,3 против 21,5, 1,28, от 1,15 до 1,44) и тяжелой гипогликемии (5,5 против 0,7, 7,60, от 4,64 до 12,44). Также наблюдалась тенденция к увеличению риска ишемического инсульта (6,7 против 5,5, 1,24, 0,99 к 1.56) и смерти от сердечно-сосудистых заболеваний (9,4 против 8,1, 1,18, 0,98 до 1,43).
Таблица 2Необработанные и скорректированные отношения рисков для связи между использованием сульфонилмочевины в качестве лечения второй линии и риском результатов исследования
Отдельное сравнение добавления и перехода на сульфонилмочевину показало, что увеличение риска было вызвано переключением и не добавление для инфаркта миокарда, сердечно-сосудистой смерти и всех причин смерти, но не для ишемического инсульта или тяжелой гипогликемии (см. таблицу 5, дополнительные материалы).Анализ, основанный на разной продолжительности использования, дал более высокие балльные оценки для всех пяти результатов при более короткой продолжительности использования, особенно для категории ≤3 месяцев (см. Электронные таблицы 6-10, дополнительные материалы). Классификация сульфонилмочевины на основе важных фармакологических свойств дала аналогичные точечные оценки для двух групп сульфонилмочевины (см. Таблицу 11, дополнительные материалы).
Рисунок 2 показывает, что результаты первичного анализа остались согласованными в анализах чувствительности (см. Полную информацию в электронных таблицах 12-14, дополнительные материалы).Для инфаркта миокарда продление льготного периода до 60 дней привело к снижению отношения рисков, что привело к статистически недостоверной ассоциации (отношение рисков 1,12, 95% доверительный интервал от 0,94 до 1,32). Основываясь на ретроспективном анализе, результаты первичного анализа инфаркта миокарда, смертности от всех причин и тяжелой гипогликемии вряд ли будут результатом неизмеримого искажающего фактора при наиболее вероятных ассоциациях воздействие-вмешивающийся фактор и сопутствующий фактор-результат (см. Таблицы 15 -17, доп. Материалы).Наконец, мы не наблюдали различий в риске среди пациентов, принимающих сульфонилмочевину и метформин, относительно исхода отрицательного контроля диабетической ретинопатии (частота встречаемости 41,4 против 40,4 на 1000 человеко-лет, отношение рисков 1,02, 95% доверительный интервал от 0,92 до 1,14).
Рис. 2Лесной график, обобщающий первичный анализ и все анализы чувствительности
В таблице 3 показаны результаты прямого сравнения между пациентами, добавляющими сульфонилмочевину, и пациентами, переходящими на сульфонилмочевину (исходные характеристики для пяти исходов представлены в таблицах 18 -22, доп. Материалы).По сравнению с добавлением сульфонилмочевины переход на сульфонилмочевину был связан с повышенным риском инфаркта миокарда (отношение рисков 1,51, 95% доверительный интервал от 1,03 до 2,24) и пограничным повышенным риском смертности от всех причин (1,23, 1,00 до 1,50). Не наблюдалось различий в риске ишемического инсульта (0,88, 0,58 до 1,33), смерти от сердечно-сосудистых заболеваний (1,22, 0,87 до 1,71) или тяжелой гипогликемии (1,06, 0,65 до 1,71).
Таблица 3Необработанные и скорректированные отношения рисков для связи между переключением на добавление сульфонилмочевины и риском результатов исследования
Обсуждение
В нашем исследовании оценивался сердечно-сосудистый и гипогликемический риск, связанный с использованием сульфонилмочевины в качестве препаратов второго ряда.Среди инициаторов метформина добавление или переход на сульфонилмочевину было связано с повышенным риском инфаркта миокарда, всех причин смертности и тяжелой гипогликемии по сравнению с пациентами, которые продолжали принимать метформин. Более того, наблюдалась тенденция к увеличению риска ишемического инсульта и смерти от сердечно-сосудистых заболеваний. Важно отметить, что наблюдаемые ассоциации с инфарктом миокарда и смертностью от всех причин были вызваны переходом на сульфонилмочевину, а не добавлением сульфонилмочевины. Результаты первичного анализа оставались согласованными в анализах чувствительности, а также после классификации сульфонилмочевины в двух разных группах на основе важных фармакологических свойств.
Сравнение с другими исследованиями
Многочисленные обсервационные исследования оценивали безопасность сульфонилмочевины в качестве препаратов первого ряда. с более высоким риском неблагоприятных сердечно-сосудистых и гипогликемических событий. В большинстве исследований, оценивающих безопасность сульфонилмочевины как препаратов второго ряда, в качестве препаратов сравнения использовались другие препараты второго-третьего ряда.789 Таким образом, нельзя сделать никаких выводов о риске добавления или перехода на сульфонилмочевину, которые были связаны с повышенным риском сердечно-сосудистых и гипогликемических событий, 314 по сравнению с продолжением монотерапии метформином, препаратом с потенциальными кардиозащитными свойствами и низким риск гипогликемии.13 Более того, среди немногих исследований, оценивающих последний риск, несколько содержали ограничения метода, такие как систематическая ошибка выбора из-за включения распространенных пользователей, 1011 неправильная классификация воздействия 12 и искажение.1012 Для нашего исследования мы использовали недавно разработанный преобладающий дизайн для новых пользователей.18 Для имитации рандомизированного контролируемого исследования этот дизайн идентифицирует (при посещении врача, которое привело к добавлению метформина к пациенту или его переходу на сульфонилмочевину) сопоставимого пациента с та же история использования метформина и других характеристик, но кто во время этого визита продолжал принимать метформин. Таким образом, мы могли бы конкретно затронуть вопрос о том, как дополнительное лечение сульфонилмочевиной работает у пациентов, у которых монотерапия метформином оказалась неэффективной.
Это первое обсервационное исследование по оценке риска инфаркта миокарда, связанного с применением сульфонилмочевины в качестве терапии второй линии. Несколько потенциальных механизмов могут объяснить увеличение риска по сравнению с пациентами, продолжающими монотерапию метформином. Во-первых, сульфонилмочевины связаны с увеличением веса, что является важным фактором риска инфаркта миокарда.25 Во-вторых, гипогликемия вовлечена в развитие аритмий и сердечной ишемии, 29 поэтому гипогликемическая склонность сульфонилмочевины может способствовать увеличению риска инфаркта миокарда. .Более высокие оценки, наблюдаемые для более короткой продолжительности использования, свидетельствуют о вовлечении краткосрочных механизмов, таких как аритмия, и против долгосрочных механизмов, таких как увеличение веса. Более того, аналогичные оценки, полученные для двух групп сульфонилмочевины, классифицированных по специфичности поджелудочной железы, показывают, что это фармакодинамическое свойство не обязательно приводит к улучшению клинических результатов.17 Наконец, отсутствие повышенного риска инфаркта миокарда, связанного с добавлением сульфонилмочевины к метформину ( т.е. в случае продолжения приема метформина) намекает на установленный положительный эффект бигуанида в этом отношении.13 Интересно, что недавно было показано, что метформин положительно влияет на сердечно-сосудистые эффекты нового класса противодиабетических препаратов, ингибиторов дипептидилпептидазы-4.30
Наши результаты по смертности от всех причин подтверждают предыдущее исследование, показывающее повышенный риск, связанный с использованием только сульфонилмочевины. , но не при одновременном применении сульфонилмочевины и метформина, по сравнению с использованием только метформина.31 Опять же, отсутствие повышенного риска, связанного с добавлением сульфонилмочевины к метформину, может отражать положительные эффекты бигуанида.13 Более того, наши более высокие балльные оценки для более короткой продолжительности использования показывают, что краткосрочные механизмы, такие как аритмия или судороги и падения, потенциально вызванные тяжелой гипогликемией, могут быть вовлечены в повышенный риск смерти.
Наши результаты по тяжелой гипогликемии согласуются с недавно опубликованным обсервационным исследованием, показывающим повышенный риск для сульфонилмочевины второй линии.11 Подобные оценки, полученные нами для двух групп сульфонилмочевины, классифицированных по продолжительности действия, свидетельствуют против эффекта этого фармакокинетического свойства. о риске тяжелой гипогликемии на фоне лечения второй линии.Это контрастирует с нашими недавними выводами о безопасности сульфонилмочевины в качестве препаратов первого ряда 17 и подчеркивает важность тяжести диабета как возможного модификатора воздействия на риск нежелательных явлений.
Сильные и слабые стороны нашего исследования
У нашего исследования есть несколько сильных сторон. Во-первых, популяционный дизайн, включение пациентов с предыдущими событиями и несколько критериев исключения делают его результаты очень обобщаемыми. Во-вторых, большой размер выборки позволил рассчитать точные оценки даже для редких исходов, таких как тяжелая гипогликемия.В-третьих, наш отдельный анализ поджелудочно-специфических, короткодействующих и неспецифических для поджелудочной железы сульфонилмочевины длительного действия может объяснить высокую фармакологическую гетерогенность, наблюдаемую в этом классе препаратов.25
Наше исследование также имеет некоторые ограничения. Во-первых, из-за своей наблюдательной природы существует вероятность остаточного смешения. Однако мы сделали все возможное, чтобы свести к минимуму эту потенциальную погрешность, сопоставив многомерный показатель склонности, количество ранее выписанных рецептов метформина и уровень гемоглобина A1c.Более того, мы не наблюдали разницы в риске в отношении результата нашего отрицательного контроля, диабетической ретинопатии. Во-вторых, из-за относительно короткой продолжительности наблюдения мы не смогли оценить различия долгосрочного риска между двумя группами. Однако продолжительность наблюдения отражает реальное использование сульфонилмочевины второго ряда.7 В-третьих, поскольку применение метформина противопоказано пациентам с тяжелым заболеванием почек и декомпенсированной сердечной недостаточностью, 32 мы не можем исключить, что такие состояния приводят к прекращению приема метформина и переходу на сульфонилмочевины также могут быть причиной наблюдаемого повышенного риска.Наконец, в наших анализах не учитывалась доза препарата. Таким образом, повышенный риск, наблюдаемый у пациентов, переходящих на сульфонилмочевину, по сравнению с пациентами, добавляющими сульфонилмочевину, также может быть результатом потенциально более высоких доз сульфонилмочевины в первой группе.
Выводы
Наше исследование показало повышенный риск инфаркта миокарда, смертность от всех причин и тяжелую гипогликемию, связанные с применением сульфонилмочевины второй линии по сравнению с продолжением монотерапии метформином.Связь с инфарктом миокарда и смертностью от всех причин была обусловлена переходом на препараты сульфонилмочевины, а не добавлением сульфонилмочевины. Таким образом, в соответствии с текущими рекомендациями по лечению диабета 2 типа1, продолжение приема метформина при введении сульфонилмочевины безопаснее, чем переход на другой.
Что уже известно по этой теме
Сульфонилмочевины широко используются пероральные противодиабетические препараты второго ряда
Предыдущие исследования оценивали их сердечно-сосудистую и гипогликемическую безопасность как препараты первого ряда или в сравнении с другими противодиабетическими препаратами второго ряда
Что добавляет это исследование
Сульфонилмочевины в качестве препаратов второй линии связаны с повышенным риском инфаркта миокарда, смертностью от всех причин и тяжелой гипогликемией по сравнению с продолжением монотерапии метформином
Продолжение приема метформина при введении сульфонилмочевины является безопаснее, чем переключение
Сноски
Соавторы: AD, SD, OHYY, KBF, LA и SS внесли свой вклад в концепцию и дизайн исследования, проанализировали и интерпретировали данные и критически отредактировали рукопись.А.Д. подготовил рукопись. AD, SD и SS провели статистический анализ. SS получил данные, получил финансирование и руководил исследованием. СС является гарантом.
Финансирование: AD является получателем исследовательской стипендии Немецкого исследовательского фонда (Deutsche Forschungsgemeinschaft). KBF имеет награду Chercheur Boursier от Fonds de recherche du Québec-Santé (FRQS). Лос-Анджелес является обладателем награды Chercheur Boursier от FRQS и лауреата премии Уильяма Доусона.SS является лауреатом премии профессора Джеймса МакГилла.
Конкурирующие интересы: Все авторы заполнили единую форму раскрытия информации ICMJE на www.icmje.org/coi_disclosure.pdf и заявляют: это исследование частично финансировалось за счет грантов Канадского института исследований в области здравоохранения, Канадского фонда инноваций. , и Boehringer Ingelheim. Boehringer Ingelheim была предоставлена возможность прокомментировать рукопись, но они не принимали непосредственного участия в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; или подготовка, рецензирование или утверждение рукописи.SS получал гранты на исследования и участвовал в заседаниях консультативного совета или в качестве спикера на конференциях компаний AstraZeneca, Bayer, Boehringer Ingelheim, Bristol Myers Squibb, Merck и Novartis. О других потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось.
Этическое одобрение: Протокол исследования был одобрен Независимым научным консультативным комитетом CPRD (протокол 14_019AMn) и Советом по этике исследований Еврейской больницы общего профиля, Монреаль, Канада.
Обмен данными: Дополнительные данные недоступны.
Прозрачность: Гарант рукописи (SS) подтверждает, что рукопись является честным, точным и прозрачным отчетом об исследовании, о котором сообщается; что ни один важный аспект исследования не был упущен; и что любые расхождения с запланированными (и, если необходимо, зарегистрированными) расхождениями были объяснены.
Это статья в открытом доступе, распространяемая в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0) лицензия, которая позволяет другим распространять, ремикшировать, адаптировать, развивать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно процитирована и использование не является коммерческим.

