Лечение синегнойной палочки — все способы лечения
Терапевты Москвы — последние отзывы
Я доволен доктором. Квалифицированный, вежливый и коммуникабельный специалист. Он мне рассказал все, что было нужно. Врач также выписал мне необходимое лекарство.
Юрий, 24 июня 2021
Мне в целом понравилось.
Мария, 19 июня 2021
Очень душевный врач, которому можно всё доверить и рассказать. Она меня проконсультировала и ранее, когда я обращалась с проблемой доктор мне помогла.
Ольга, 27 апреля 2021
Доктор все сделала. Она меня проконсультировала, как надо все объяснила, назначила анализы и дала установки, рекомендации и инструкции по обследованию, чтобы потом назначить лечение. То что примерно ожидал то и есть. Профессиональный и логичный врач. Он понимал,что люди не миллионеры. Лишних, избыточных процедур не назначал. Никаких заявлений не последовало, которые могли бы вызвать дополнительные вопросы. У неё довольно позитивный, положительный настрой. Сама по себе врач внимательный. Даже на те параметры, на которые человек не жалуется, врач все равно перестраховывается и все проверяет. Даже соблюдаться меры профилактики. На данный момент этот специалист меня ведет, поэтому я обращусь повторно. У меня нет нареканий к этому человеку. Цены в клинике не лояльные. Аппаратура отличная и кабинеты все рядом. Сдать анализ крови можно сдать в соседнем кабинете, без очередей, не то что в государственных поликлиниках. Отношение персонала хорошее. Никаких токсичных людей. Кофе предлагают. Было бы странно ожидать чего то иного за деньги.
Она меня проконсультировала, как надо все объяснила, назначила анализы и дала установки, рекомендации и инструкции по обследованию, чтобы потом назначить лечение. То что примерно ожидал то и есть. Профессиональный и логичный врач. Он понимал,что люди не миллионеры. Лишних, избыточных процедур не назначал. Никаких заявлений не последовало, которые могли бы вызвать дополнительные вопросы. У неё довольно позитивный, положительный настрой. Сама по себе врач внимательный. Даже на те параметры, на которые человек не жалуется, врач все равно перестраховывается и все проверяет. Даже соблюдаться меры профилактики. На данный момент этот специалист меня ведет, поэтому я обращусь повторно. У меня нет нареканий к этому человеку. Цены в клинике не лояльные. Аппаратура отличная и кабинеты все рядом. Сдать анализ крови можно сдать в соседнем кабинете, без очередей, не то что в государственных поликлиниках. Отношение персонала хорошее. Никаких токсичных людей. Кофе предлагают. Было бы странно ожидать чего то иного за деньги.
На модерации, 25 июня 2021
Отличный и внимательный врач. Она мне так понравилась! Доктор все просмотрела у пациентки, осмотрела ее, рассказала и сделала. Врач также хорошо расшифровала КТ, направила на анализы и рассказала, что надо сделать. Я давно не встречала таких специалистов, которые так тщательно делают осмотр пациентов. Я взяла врача на заметку и пошла бы к ней повторно.Лилия, 25 июня 2021
Светлана Ивановна — это тот человек, который сначала меня записал, а потом отказал в приёме из-за беременности.
Мария, 24 июня 2021
Я беременна, у меня 7 месяцев, и в клинике, в которой я записывалась отказывались меня принимать. Я не знаю, по какой причине. Но врач мало того, что меня встретил, прописал полностью терапию, послушал и прочее, так он ещё сам полностью коммуницировал с гинекологом, прописал, что нельзя. Очень хороший доктор работает! Объясняет абсолютно доступно. И что самое главное — не боится беременных! Потому что все остальные врачи перекрещиваются, а здесь он уверен в своей компетенции. Мне кажется даже в какой-то момент, он составит конкуренцию всем. Я очень довольна! Случайно узнала о нём.
Я не знаю, по какой причине. Но врач мало того, что меня встретил, прописал полностью терапию, послушал и прочее, так он ещё сам полностью коммуницировал с гинекологом, прописал, что нельзя. Очень хороший доктор работает! Объясняет абсолютно доступно. И что самое главное — не боится беременных! Потому что все остальные врачи перекрещиваются, а здесь он уверен в своей компетенции. Мне кажется даже в какой-то момент, он составит конкуренцию всем. Я очень довольна! Случайно узнала о нём.
Марина, 24 июня 2021
Я в восторге от внимания и заботы специалиста! Доктор меня выслушала, обследовала и посмотрела предыдущие результаты анализов. Врач также назначила мне дополнительные анализы. Я снова приду по результатам дополнительных анализов. Я ее буду рекомендовать своим друзьям.
Врач также назначила мне дополнительные анализы. Я снова приду по результатам дополнительных анализов. Я ее буду рекомендовать своим друзьям.
Светлана, 24 июня 2021
Я была на приеме с мамой. Все было очень хорошо. Очень внимательный врач. Пациентка в возрасте и поэтому мы беспокоились о затяжном кашле. Она все послушала, направила на рентген и дала рекомендации. Бабуля осталась довольна!
Баирта, 24 июня 2021
Врач очень внимательная, проводит полный осмотр и собирает анамнез не только по тому, что вас беспокоит.
Екатерина, 24 июня 2021
Показать 10 отзывов из 12813Синегнойная палочка . Азбука антибиотикотерапии. Видаль справочник лекарственных препаратов
Автор: врач-клинический фармаколог Трубачева Е.С.
Знакомьтесь с героиней нашего сегодняшнего повествования – синегнойной палочкой или Pseudomonas aeruginosa (P.aeruginosa).
И, воспользовавшись ситуацией, мы поговорим о микробиологической безопасности лечебных учреждений, ведь именно этот возбудитель до сих является одним из лидеров внутрибольничных инфекций, особенно в условиях реанимационных, хирургических, онкологических и ожоговых отделений, и, казалось бы, эта проблема не решаемая.
Те, кого интересуют исключительно вопросы лечения, а по сути, заметания проблемы под ковер, так как одними антибиотиками синегнойку не удалось победить никому, могут перейти сразу к статье «Антисинегнойные препараты».
Микробиологические аспекты
Pseudomonas aeruginosa – это аэробная грамотрицательная палочка, с одним или двумя полярно расположенными жгутиками, которая может расти и размножаться и в анаэробных условиях.
Это один из немногих возбудителей, который угадывается в прямом смысле носом – инфицированная рана издает совершенно неповторимое амбрэ, которое не перепутаешь ни с чем, если услышал хотя бы один раз. Причем больной обнаруживается в прямом смысле по запаху от двери не то, что палаты, а от входа в лечебное отделение. Для тех, кто пока ни разу не сталкивался, – он слышится как запах сладкой карамели с аммиаком, вызывающий отчетливые рвотные позывы (хотя последнее строго индивидуально).
Дикая почвенная синегнойка, являющаяся родоначальницей всех внутрибольничных форм, будет выглядеть следующим образом. Как вы можете видеть, убить ее можно абсолютно всем с применением обычных терапевтических дозировок. (картинка 1)
В природе синегнойная палочка обитает в почве и воде, при этом она непривередлива в плане питательных веществ (в дистиллированной воде растет и размножается до 2,5 месяцев, хотя и снижает свою активность в десять раз). Поэтому идеальной средой ее обитания будет та локализация в организме, где темно, тепло и сыро, а именно – раны, нижние дыхательные пути, мочевыводящие пути и все те полости, в которые можно установить катетеры. Конечно, самостоятельно палочка туда не заползет, у нее нет ножек, зато мы – медицинский персонал, не соблюдая правила обработки рук и имея единственного больного в отделении, к концу смены обсеменим всех, особенно если в ординаторских и сестринских используются общие, а не одноразовые бумажные, полотенца.
Конечно, самостоятельно палочка туда не заползет, у нее нет ножек, зато мы – медицинский персонал, не соблюдая правила обработки рук и имея единственного больного в отделении, к концу смены обсеменим всех, особенно если в ординаторских и сестринских используются общие, а не одноразовые бумажные, полотенца.
P.aeruginosa очень любит, когда вокруг нее тепло (30 – 370С), темно и сыро. Соответственно, самое чистое время года с точки зрения риска принести дикую уличную палочку в стационар – это зима. И если зимой в вашем на 100% чистом стационаре с внутренним микробиологическим контролем вдруг пациент, простите, завонял – ищите любителя-огородника с рассадой на подоконнике. Достаточно такому садоводу-огороднику один раз по приходу на работу не отмыть правильно руки и пойти на перевязку – больной с синегнойной (или ацинетобактерной, а то и вообще микст) инфекцией на ровном месте будет обеспечен. А если все остальные так же правильно не помыли руки или вытерлись общим полотенцем – чистый стационар очень быстро станет стационаром с синегнойкой.
Синегнойная палочка является активным пленкообразователем. В этом процессе участвует вырабатываемая микробом внеклеточная слизь, покрывающая саму клетку тонким слоем. Процесс пленкообразования условного возбудителя наглядно показан на данном видео. Как мы обсуждали ранее, микробы – это не статичные существа, которые всю жизнь питаются и размножаются, они способны вести достаточно бурную социальную жизнь, и синегнойная биопленка тому наглядный пример, поэтому о ней стоит поговорить поподробнее. Когда палочка прикрепляется к поверхности, она тут же образует монослой из микроколоний, покрытых экзополисахаридом. Затем бактерии образуют множество пилей, которыми скрепляются в том числе и друг с другом и вся структура образует полисахаридную матрицу. Когда биопленка созреет (это занимает в среднем неделю), то она становится эластичной и упругой, напоминая резину или силиконовую стельку, и точно так же обеспечивает защиту включенных в нее микроорганизмов от воздействий антибиотиков, антисептиков, дезенфектантов и иммунных клеток организма хозяина. При этом внутри самой биопленки бактерии активно обмениваются факторами вирулентности и антибиотикорезистентности и отшнуровывающиеся в последующем от пленки новые палочки будут обладать всем набором факторов защиты, характерным для материнской биопленки. Так выглядит один из способов получения вооруженной до зубов внутрибольничной микрофлоры, которая убивает пациентов и которую фактически невозможно убить в пациентах в виду как недоступности для действующих агентов (биопленка), так и в виду наличия механизмов антибиотикорезистентности, вплоть до металло-бета-лактамаз, разрушающих все до одного существующих антибиотика и большое число антисептиков и дезенфектантов.
При этом внутри самой биопленки бактерии активно обмениваются факторами вирулентности и антибиотикорезистентности и отшнуровывающиеся в последующем от пленки новые палочки будут обладать всем набором факторов защиты, характерным для материнской биопленки. Так выглядит один из способов получения вооруженной до зубов внутрибольничной микрофлоры, которая убивает пациентов и которую фактически невозможно убить в пациентах в виду как недоступности для действующих агентов (биопленка), так и в виду наличия механизмов антибиотикорезистентности, вплоть до металло-бета-лактамаз, разрушающих все до одного существующих антибиотика и большое число антисептиков и дезенфектантов.
Почему же P.aeruginosa так полюбила больницы? Да потому что здесь, в отличие от дикой среды обитания, для нее созданы идеальные условия, как в плане климата и питательных веществ, так и в плане окружения – зверю практически не требуется бороться за свое выживание с другой микрофлорой, фактически всегда за счет своих свойств синегнойка получает селективное преимущество перед другими возбудителями, которых успешно травят антисептиками, антибиотиками, заключительной дезинфекцией и УФ-излучением, оставляя сегодняшней героине расчищенную от конкурентов территорию.
Где же в стационаре создаются условия для размножения и распространения инфекции? Для этого необходимо знать следующие свойства P.aeruginosa:
- Способность сохраняться в дезинфицирующих растворах, таких как фурациллин (его она вообще ест на завтрак, обед и ужин), хлоргесидин, глутаральдегид и фенол – то есть все то, что чаще всего используется для промывания ран или хранения инструментов, и если технология приготовления нарушена или раствор изначально был нестерильным, получаем инфицирование синегнойкой непосредственно в рану
- Исходя из вышесказанного – бульон из синегнойки будет пузыриться в мыльнице с кусковым мылом. Поэтому только жидкое мыло в дозаторах станет препятствием для дополнительного очага обитания этой зверюшки
- Синегнойная палочка умеет защищаться от УФ-лучей, вырабатывая пигмент мелатонин. Поэтому все наши кварцевания помещений для нее просто повод покрыться дополнительным «загаром»
- В дистиллированной воде она способна жить и размножаться 2,5 месяца, и если она в нее проникла, то все аппараты с использованием такой воды будут источниками синегнойной инфекции
Таким образом, исходя из вышесказанного, любимыми местами обитания в стационарах являются все то, что создает оптимальную для обитания теплую и влажную среду, а именно:
- краны, раковины, кафель и стыки между ними у раковин и моек, сан.
 узлы, тряпочные общие полотенца ординаторских и сестринских
узлы, тряпочные общие полотенца ординаторских и сестринских - медицинское оборудование, создающее теплую и влажную среду (аппараты ИВЛ, наркозные аппараты, аппараты для проведения диализа, испарители всех типов)
- кондиционеры открытого типа, хотя и за сплит-системами необходим постоянный уход и дезинфекция
- посуда для сдачи анализов
- руки мед. персонала
- общие, а не одноразовые полотенца
То есть любимыми отделениями для обитания в стационаре будут ожоговые и хирургические (практически все, а не только гнойная хирургия и травматология), отделения реанимации и интенсивной терапии и хирургический блок. Особняком стоят пульмонологические отделения с пациентами с муковисцидозом и онкологические стационары. При этом синегнойка может оказаться совершенно в любом отделении, переехав туда на руках медицинского персонала и разбежавшись по больным уже через тамошнее общее полотенце. Поэтому первый и главный шаг на пути борьбы с распространением синегнойной инфекции – это наши руки, точнее, правильная их обработка. После КАЖДОГО пациента. И не протирание полотенчиком на обходе, а полноценное мытье, после которого хотя бы самому себе можно сказать, что уж ты-то точно сделал все, что было возможно.
После КАЖДОГО пациента. И не протирание полотенчиком на обходе, а полноценное мытье, после которого хотя бы самому себе можно сказать, что уж ты-то точно сделал все, что было возможно.
Клинические аспекты
Какие пациенты более всего чувствительны к P.aeruginosa и когда вообще ждать именно ее:
- Пациенты с обширной политравмой в теплый сезон привезенные с мест ДТП, покрытые мокрой грязью (вода+почва = дикая синегнойка в ранах с вероятностью более 80%)
- Пациенты с муковисцидозом, у которых данный микроб является хроническим колонизатором нижних дыхательных путей. Таких пациентов необходимо выявить с целью недопустимости обсеменения тех, кто P.aeruginosa пока не имеет (отдельные палаты, отдельный инструментарий, в том числе диагностический, с последующей правильной обработкой)
- Больные с обширными ожогами
- Пациенты с иммунодефицитами различной этиологии
- Пациенты с сахарным диабетом и диабетической стопой
- Онкологические пациенты с нейтропениями и без оных
- Пациенты на ИВЛ
- Пациенты с внутрибольничными случаями инфицирования в стационарах, обсемененных синегнойной палочкой
- Пациенты, получающие массированную антибактериальную терапию по любому иному поводу – в этих ситуациях и при отсутствии должного внимания к чистоте рук, по принципу «свято место пусто не бывает», тихо сидящая колония синегнойки может приобрести селективное преимущество и организовать новый виток генерализованной инфекции, но уже новым возбудителем, то есть собой
- Оперирующие врачи.
 Тут хотелось бы остановиться чуть подробнее – несколько лет назад было поветрие в нескольких регионах, когда в офтальмологические клиники начали обращаться врачи (в основном гинекологи и патологоанатомы) с синегнойным поражением роговицы. Из анамнеза – неудачно потерли глаз во время манипуляций. Как результат, экстренное обращение в ночное время в приемные покои офтальмологических клиник с острейшей болью и язвой на роговице. Про глаза надо запомнить следующее – при любом подозрении необходимо немедленно обращаться к коллегам. Лечение будет стоить копейки, а без оного синегнойка убивает глаз менее чем за сутки, и дальше только энуклеация с последующим протезированием и шансом потери работы. А лучше всего не тереть глаза и использовать защитные очки при любых, а уж тем более подозрительных, манипуляциях
Тут хотелось бы остановиться чуть подробнее – несколько лет назад было поветрие в нескольких регионах, когда в офтальмологические клиники начали обращаться врачи (в основном гинекологи и патологоанатомы) с синегнойным поражением роговицы. Из анамнеза – неудачно потерли глаз во время манипуляций. Как результат, экстренное обращение в ночное время в приемные покои офтальмологических клиник с острейшей болью и язвой на роговице. Про глаза надо запомнить следующее – при любом подозрении необходимо немедленно обращаться к коллегам. Лечение будет стоить копейки, а без оного синегнойка убивает глаз менее чем за сутки, и дальше только энуклеация с последующим протезированием и шансом потери работы. А лучше всего не тереть глаза и использовать защитные очки при любых, а уж тем более подозрительных, манипуляциях
Какую патологию чаще всего вызывает (а лучше сказать, осложняет) P.aeruginosa
- Пневмонии (нозокомиальные и у пациентов с ВИЧ) и легочные абсцессы
- Пиелонефриты, чаще всего после эндоскопических или оперативных вмешательств или обструктивные, вызванные инородным телом
- Бактериальные эндокардиты и сепсис (кто первичен, кто вторичен – разбираться каждый раз индивидуально)
- Поражения кожи: гангренозная эритема при нейтропениях, целлюлиты, фолликулиты, абсцессы, гангренозные стоматиты
- Наружные отиты (любят наши и не наши люди почесать уши не только ватными палочками, но еще скрепками и гвоздиками, поднятыми с горизонтальных поверхностей, подозрительно похожих на полы), хронические средние отиты.

- Синуситы (у больных с ВИЧ)
- Послеоперционные абсцессы головного мозга и менингиты
- Кератиты и эндофтальмиты
- Остеомиелиты
- Раневые послеоперационные инфекции
То есть почти любая область поражения и это говорит нам о крайней необходимости микробиологической диагностики, так как почти точно такой же набор может вызвать нозокомиальный золотистый стафилококк или ацинетобактер.
Эпидемиологические аспекты
Как уже выше было неоднократно сказано – P.aeruginosa умеет поражать практически все, до чего сможет добраться, а уж убивать, да в своих нозокомиальных формах, когда из биопленок вылупились и распространились супермутанты, тем более. Вопрос в том, что делать, ведь ситуация кажется безнадежной. Но это не так.
Вылечить больных мы, конечно, можем, но только в том случае, если перед нами дикая и непуганая P.aeruginosa с улицы. Если случилось так, что в вашем стационаре она живет годами и смогла инфицировать пациента (а сама она не может, ее надо донести на чьих-то медицинских руках или до пациента, или до аппарата, который используется у этого пациента), то тут фармакология почти бессильна, так как внутрибольничные палочки умеют разрушать все до одного антибиотика, имеющегося на рынке, а новых уже лет 10 не было, и неизвестно когда будут, если вообще будут. Поэтому единственным барьером встает эпидемиологический надзор. Причем синегнойку, в отличие от фекальной микрофлоры, из стационара выбить можно полностью, так как в норме она не является элементом нормальной микрофлоры человека, как та же кишечная палочка, клебсиелла или энтерококки, то есть в людях в норме она не живет.
Поэтому единственным барьером встает эпидемиологический надзор. Причем синегнойку, в отличие от фекальной микрофлоры, из стационара выбить можно полностью, так как в норме она не является элементом нормальной микрофлоры человека, как та же кишечная палочка, клебсиелла или энтерококки, то есть в людях в норме она не живет.
Почему в этой статье нет антибиотикограмм устойчивых форм? Ответ до банальности прост – автор долгое время проработала в стационаре, свободном от синегнойки. Это достижимо, и от P.aeruginosa можно освободится даже в самом запущенном случае, что не будет стоить колоссальных денег, при том, что в перспективе высвобождаются действительно серьезные средства, которые ежегодно тратятся на тушение пожара антибиотиками, что в случае внутрибольничных инфекций равноценно тушению бензином. Для достижения полного антисинегнойного эффекта необходимо:
- Правильно мыть руки после каждого пациента
- Менять перчатки после каждого пациента (вместе с мытьем рук)
- Прекратить практику использования общих полотенец и полотенец на обходе
- Ввести тотальный микробиологический мониторинг
- Если есть эпидемиолог, с него требовать доступ к антисептикам и дезенфектантам нескольких видов, а также постоянное наличие одноразовых расходных материалов (это его вопрос, как он будет с начальством договариваться, но все одноразовое обязано быть одноразовым и в достаточных количествах – так как отодрать синегнойную пленку обычными методами, как вы видели, фактически нереально)
- В идеале всю группу антисинегнойных препаратов необходимо вывести из общебольничного оборота и назначать только специально обученным клиническим фармакологом.
 Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
Простая манипуляция в виде правильного мытья рук позволяет на 99,9% снизить риск внутрибольничного заражения синегнойной инфекцией. Остальное сделают мероприятия в рамках Федеральных клинических рекомендаций Минздрава «Эпидемиология и профилактика синегнойной инфекции», по которым должна работать эпидемиологическая служба.
Хотелось бы отдельно напомнить, что P.aeruginosa, точнее, пациент с оной, может быть и на приеме в поликлинике – у отоларинголога, поковырявшись гвоздиком в ухе, у офтальмолога, у гинеколога, травматолога и, конечно, у хирурга. На мысль о возбудителе натолкнут непередаваемый аромат, издаваемый раной, высокая скорость развития гнойно-воспалительного процесса («Доктор, еще вчера ничего не было») и анамнез в виде контакта раны с предметом, покрытым почвой, или нанесения раны подобным предметом. И после подобного пациента необходимо вспомнить о всех правилах асептики и антисептики, чтобы следующий пациент не оказался безвинно инфицированным.
И после подобного пациента необходимо вспомнить о всех правилах асептики и антисептики, чтобы следующий пациент не оказался безвинно инфицированным.
В заключении хотелось бы отметить еще раз – данная статья не про то, как победить синегнойку голыми руками антибиотиками. Этого еще пока никому не удавалось, так как проблема не в одном больном с диким возбудителем. От антибиотиков в этом деле зависит процента два в лучшем случае (приблизительно столько диких форм к вам может прийти за год). Проблема носит глубокий системный характер, и без усилий по освобождению всего стационара от P.aeruginosa, использование только и исключительно антибиотиков на каждый случай, особенно внутрибольничного инфицирования, будет сизифовым трудом с соответствующим печальным результатом.
Поделиться с друзьями
Пожалуйста, заполните поля e-mail адресов и убедитесь в их правильности
Различные пути введения антибиотиков для эрадикации Pseudomonas aeruginosa у пациентов с муковисцидозом
Вопрос обзора
Как наилучшим образом использовать антибиотики для устранения легочной инфекции, вызванной микробом под названием Pseudomonas aeruginosa (синегнойная палочка), у людей, страдающих муковисцидозом?
Актуальность
Муковисцидоз — это наследственное заболевание, при котором воздушные пути часто бывают заблокированы слизью. Муковисцидоз ассоциирован с инфекциями органов грудной клетки, которые могут привести к прогрессирующей дыхательной недостаточности и смерти. Бактерия, которая называется синегнойной палочкой — Pseudomonas aeruginosa — является частой причиной такой инфекции, и она с трудом поддаёся лечению при развитии инфекционного процесса.
Муковисцидоз ассоциирован с инфекциями органов грудной клетки, которые могут привести к прогрессирующей дыхательной недостаточности и смерти. Бактерия, которая называется синегнойной палочкой — Pseudomonas aeruginosa — является частой причиной такой инфекции, и она с трудом поддаёся лечению при развитии инфекционного процесса.
Мы хотели сравнить различные комбинации ингаляционных, пероральных и внутривенных антибиотиков для устранения синегнойной палочки — Pseudomonas aeruginosa — у людей с муковисцидозом, чтобы выяснить, какой метод лечения лучше всего работает и является более экономически эффективным.
Дата поиска
Доказательства актуальны на 10 октября 2016 года.
Характеристика исследований
Мы включили семь испытаний с участием 744 человек с муковисцидозом обоих полов, любого возраста как с легкой, так и с более тяжелой формой поражения легких. Испытания продолжались от 28 дней до 27 месяцев. Мы не могли объединить многие результаты, поскольку в испытаниях использовали различные методы лечения. В двух исследованиях сравнивали тобрамицин с плацебо (лечение пустшкой). В трех исследованиях использовали комбинацию перорального ципрофлоксацина и ингаляционного (вдыхаемого) колистина в экспериментальной группе, но использовали разные препараты сравнения: в одном испытании сравнивали эту комбинацию с отсутствием лечения, в другом — с вдыхаемым тобрамицином и в третьем испытании сравнивали комбинацию с пероральным ципрофлоксацином и вдыхаемым тобрамицином. В другом испытании изучили ингаляционный тобрамицин и сравнили лечение длительностью 28 дней с лечением, продолжавшимся 56 дней. В последнем испытании сравнили регулярные циклы ингаляционного (вдыхаемого) тобрамицина (плюс пероральный ципрофлоксацин или плацебо) с лечением ингаляционным тобрамицином (плюс пероральный ципрофлоксацин или плацебо), используемым на основе результатов культур, выращиваемых в лаборатории.
В двух исследованиях сравнивали тобрамицин с плацебо (лечение пустшкой). В трех исследованиях использовали комбинацию перорального ципрофлоксацина и ингаляционного (вдыхаемого) колистина в экспериментальной группе, но использовали разные препараты сравнения: в одном испытании сравнивали эту комбинацию с отсутствием лечения, в другом — с вдыхаемым тобрамицином и в третьем испытании сравнивали комбинацию с пероральным ципрофлоксацином и вдыхаемым тобрамицином. В другом испытании изучили ингаляционный тобрамицин и сравнили лечение длительностью 28 дней с лечением, продолжавшимся 56 дней. В последнем испытании сравнили регулярные циклы ингаляционного (вдыхаемого) тобрамицина (плюс пероральный ципрофлоксацин или плацебо) с лечением ингаляционным тобрамицином (плюс пероральный ципрофлоксацин или плацебо), используемым на основе результатов культур, выращиваемых в лаборатории.
Основные результаты
По результатам двух небольших испытаний (38 добровольцев) лечение ранней инфекции в течение 2 месяцев ингаляционными антибиотиками имело превосходство над отсутствием лечения и устранило Pseudomonas aeruginosa у большинства пациентов. В одном из этих испытаний сообщалось о результатах, полученных в течение более длительного периода, и было предположено, что эффект от лечения может длиться до 12 месяцев. Еще одно небольшое исследование (26 человек), которое длилось два года, показало, что лечение ранней инфекции комбинацией ингаляционных и пероральных антибиотиков лучше, чем отсутствие лечения для устранения Pseudomonas aeruginosa. В испытании, в котором сравнили лечение в течение 28 дней распыленным через небулайзер раствором тобрамицина для ингаляции (88 человек) с лечением в течение 56 дней, было показано, что оба режима лечения были одинаково переносимы и успешны в отношении устранения синегнойной палочки — Pseudomonas aeruginosa. Четыре прямых сравнения пероральных или ингаляционных антибиотиков (или их комбинаций), в одном из которых сообщалось о 223 лицах, не нашли разницы между различными комбинациями антибиотиков. В недавнем испытании с участием 306 детей (в возрасте до 12 лет) сравнили регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо) с лечением только тогда, когда было показано, что ребенок был инфицирован синегнойной палочкой.
В одном из этих испытаний сообщалось о результатах, полученных в течение более длительного периода, и было предположено, что эффект от лечения может длиться до 12 месяцев. Еще одно небольшое исследование (26 человек), которое длилось два года, показало, что лечение ранней инфекции комбинацией ингаляционных и пероральных антибиотиков лучше, чем отсутствие лечения для устранения Pseudomonas aeruginosa. В испытании, в котором сравнили лечение в течение 28 дней распыленным через небулайзер раствором тобрамицина для ингаляции (88 человек) с лечением в течение 56 дней, было показано, что оба режима лечения были одинаково переносимы и успешны в отношении устранения синегнойной палочки — Pseudomonas aeruginosa. Четыре прямых сравнения пероральных или ингаляционных антибиотиков (или их комбинаций), в одном из которых сообщалось о 223 лицах, не нашли разницы между различными комбинациями антибиотиков. В недавнем испытании с участием 306 детей (в возрасте до 12 лет) сравнили регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо) с лечением только тогда, когда было показано, что ребенок был инфицирован синегнойной палочкой. В этом испытании было показано, что, когда детям давали регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо), у меньшего числа детей обнаруживался рост Pseudomonas aeruginosa (синегнойной палочки) из мокроты. В этом испытании сделали поправку на возраст и не показали никакой разницы по числу эпизодов роста Pseudomonas aeruginosa из образцов между группами, и не было разницы в продолжительности времени, до момента, когда у детей были следующие эпизоды инфекции органов грудной клетки.
В этом испытании было показано, что, когда детям давали регулярные циклы ингаляционного тобрамицина (либо с пероральным ципрофлоксацином, либо с плацебо), у меньшего числа детей обнаруживался рост Pseudomonas aeruginosa (синегнойной палочки) из мокроты. В этом испытании сделали поправку на возраст и не показали никакой разницы по числу эпизодов роста Pseudomonas aeruginosa из образцов между группами, и не было разницы в продолжительности времени, до момента, когда у детей были следующие эпизоды инфекции органов грудной клетки.
Качество доказательств
Некоторые из исследований были проведены до 20 лет назад, и их результаты могут быть не применимы сегодня. Некоторые испытания были небольшими. Все испытания имели довольно короткий период наблюдения. Таким образом, мы не смогли показать, приводит ли лечение людей с муковисцидозом к улучшению их самочувствия или продлению их жизни. С учетом видов лечения, используемых в большинстве испытаний, добровольцам было легко угадать, какое лечение они получали, что могло повлиять на некоторые результаты. Два исследования были поддержаны представителями фармацевтической индустрии. Дальнейшие исследования по-прежнему необходимы, чтобы увидеть, улучшает ли самочувствие и качество жизни у людей с муковисцидозом полное устранение бактерий, и чтобы установить, какие комбинации антибиотиков обеспечивают лучший способ устранения синегнойной палочки — Pseudomonas aeruginosa.
Два исследования были поддержаны представителями фармацевтической индустрии. Дальнейшие исследования по-прежнему необходимы, чтобы увидеть, улучшает ли самочувствие и качество жизни у людей с муковисцидозом полное устранение бактерий, и чтобы установить, какие комбинации антибиотиков обеспечивают лучший способ устранения синегнойной палочки — Pseudomonas aeruginosa.
В целом качество доказательств было от умеренного до очень низкого, а это означает, что дальнейшие исследования могут изменить оценку размера эффекта лечения. Будущие, более крупные испытания (с большей мощностью) могут показать, что одно лечения является более эффективным в эрадикации (уничтожении) синегнойной палочки — Pseudomonas aeruginosa, чем другое.
Зеленый чай оказался эффективен против супербактерий
Зеленый чай может спасти мир от массового заражения синегнойной палочкой. Стало известно, что содержащийся в нем антиоксидант эпигаллокатехин (EGCG) восстанавливает эффективность антибиотика азтреонама, который используется для борьбы с бактериями Pseudomonas aeruginosa – синегнойными палочками.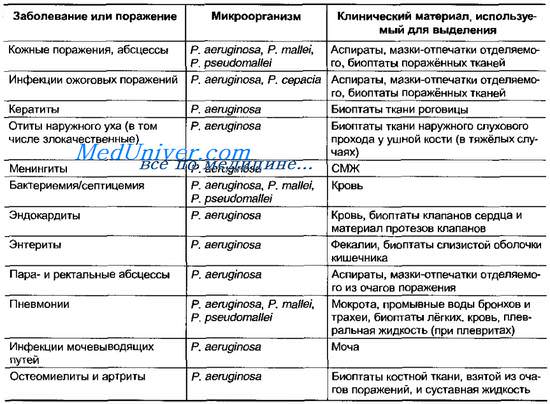
Эти микроорганизмы умеют быстро вырабатывать устойчивость к антибиотикам, даже так называемым антибиотикам последней линии. Для лечения используются комбинации средств, но и они могут быть неэффективными. Синегнойная палочка названа глобальной угрозой: она вызывает множество заболеваний дыхательных путей и кровеносной системы, а их лечение затруднено из-за высокой устойчивости возбудителя к лекарствам. Ведущий автор исследования, специалист Университета Суррея доктор Джонатан Беттс считает эту устойчивость «критической угрозой здоровью человека».
Еще один автор исследования — специалист Университета Суррея Роберто ла Раджоне — сообщил, что, сочетая натуральный зеленый чай с известным антибактериальным препаратом азеотренамом, можно устранить глобальную угрозу.
Азеотренам воздействует на небольшое число видов микроорганизмов и считается «заурядным» препаратом, который явно не тянет на кандидата на войну с супербактериями. Однако зеленый чай дарит этому антибиотику суперсилу.
Исследователи выяснили, как антиоксидант эпигаллокатехин (EGCG), содержащийся в зеленом чае, воздействует на бактерию. Также было исследовано воздействие азтреонама. Затем эти препараты испытали в тандеме, и выяснилось, что эта комбинация значительно усиливает уничтожение синегнойной палочки. Исследования проводились in vitro, то есть вне живого организма. Затем были проведены тесты на клетках человеческой кожи, которые показали, что сочетание антиоксиданта и антибиотика нетоксичны. Также проводились тесты in vivo — на личинках моли. Результаты были сходными: те личинки, в которые вводилась комбинация двух средств, были более устойчивы к заражению, чем те, которые получали только антибиотик или только EGCG.
Ученые считают, что антиоксидант EGCG способствует увеличению поглощения азтреонама бактериями за счет увеличения их проницаемости. Кроме того, он воздействует на биохимический путь, обуславливающий восприимчивость к антибактериальным препаратам.
Исследователи предположили, что данная схема будет работать и с другими антибиотиками. Это будет проверено в ближайших экспериментах.
Это будет проверено в ближайших экспериментах.
Исследование было проведено Университетом Суррея в сотрудничестве с Общественным здравоохранением Англии, Немецким центром исследований инфекций и Кельнским университетом.
СТРАТЕГИЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ, ВЫЗВАННЫХ ВЫСОКОРЕЗИСТЕНТНЫМИ (XDR) ШТАММАМИ СИНЕГНОЙНОЙ ПАЛОЧКИ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ | Григорьевская
1. Григорьевская З.В. Актуальность проблемы госпитальных инфекций в онкологической клинике // Вестник РОНЦ им. Н.Н. Блохина РАМН. 2013. Т. 24, № 3–4. С. 46–49.
2. Григорьевская З.В., Дьякова С.А. Формирование и распространение резистентных микроорганизмов в клиниках – всемирная проблема // Антимикробная терапия внутрибольничных инфекций / Под ред. Н.В. Дмитриевой, И.Н. Петуховой. М.: АБВ-пресс, 2014. 326 с.
3. Давыдов М.И., Дмитриева Н.В. Инфекции в онкологии. М.: Практическая медицина, 2009. 472 с.
Давыдов М.И., Дмитриева Н.В. Инфекции в онкологии. М.: Практическая медицина, 2009. 472 с.
4. Сидоренко С.В. Клиническое значение Pseudomonas aeruginisa // Клиническая фармакология и терапия. 2003. № 2. С. 1–7.
5. Cидоренко С.В., Резван С.П., Еремина Л.В., Поликарпова С.В., Карбак В.И., Меньшикова Е.Д., Тишков В.И., Черкашин Е.А., Белобородов В.Б. Этиология тяжелых госпитальных инфекций в отделениях реанимации и антибиотикорезистентность среди их возбудителей // Антибиотики и химиотерапия. 2005. № 2–3 (50). С. 33–41.
6. Antimicrobial resistance surveillance in Europe 2011. URL: http://www.ecdc.europa.eu (26.01.2015).
7. Antonicelli F., Festa R., Idone F., Di Muzio F., Maviglia R.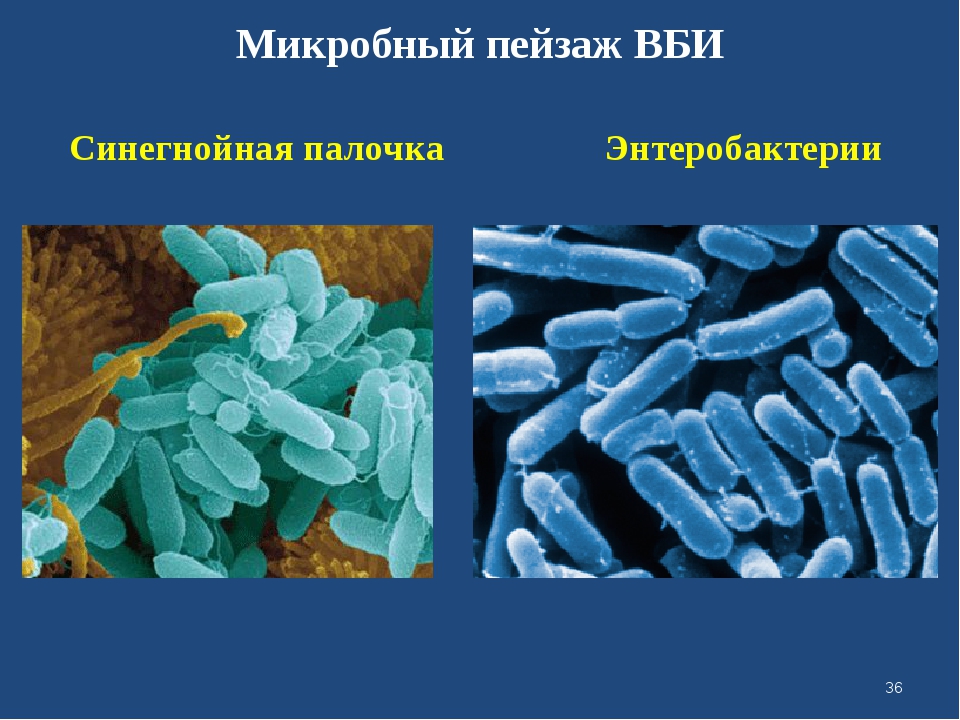 , Antonelli M. Ventilator-associated pneumonia caused by Pseudomonas aeruginosa and respiratory colonization by Candida spp // Critical Care. 2010. № 14 (Suppl. 1). P. 8.
, Antonelli M. Ventilator-associated pneumonia caused by Pseudomonas aeruginosa and respiratory colonization by Candida spp // Critical Care. 2010. № 14 (Suppl. 1). P. 8.
8. Hakki M., Limaye A.P., Kim H.W., Kirby K.A., Corey L., Boeckh M. Invasive Pseudomonas aeruginosa infections: High rate of recurrence and mortality after hematopoietic cell transplantation // Bone Marrow Transplantation. 2007. № 39. P. 687–693.
9. Lambert P.A. Mechanisms of antibiotic resistance in Pseudomonas aeruginosa // J. Royal Society of Medicine. 2002. № 95 (Suppl. 41). P. 22–26.
10. Tang K., Zhuo H., Guglielmo J. Multidrug-Resistant Pseudomonas aeruginosa Ventilator-Associated Pneumonia: The Role of Endotracheal Aspirate Survellance Cultures // Annals of Pharmacotherapy. 2009. № 43 (1). P. 28–35.
№ 43 (1). P. 28–35.
Синегнойная палочка (Pseudomonas aeruginosa). Пути заражения синегнойной палочкой. Вызываемые заболевания. Лечение — БИОФОН
1 июня, 2004 Алексей КозловСинегнойная палочка (Pseudomonas aeruginosa) — это возбудитель инфекций мочевыводящих путей, характеризуется значительной природной устойчивостью к большинству антимикробных препаратов, применяемых в клиниках, что обусловливает появление тяжелых осложнений после инфицирования мочеполовой системы.
Пути передачи
Основные пути распространения синегнойной инфекции это в первую очередь больные с синегнойной инфекцией а также руки обслуживающего персонала. А также заражённые предметы обихода, растворы, кремы для рук, полотенца для лица, гениталий, помазок для бритья и т. п.
Редкие пути распространение инфекции это инструменты, приборы и аппаратура, которые подвергались дезинфекции, оказавшейся неэффективной.
Синегнойная палочка поражает в основном лиц с ослабленным иммунитетом: госпитализированных больных с сопутствующими заболеваниями, лиц пожилого возраст и детей. Попадая в организм через катетеры, инструменты или растворы для орошения мочеиспускательного канала либо влагалища, синегнойные палочки вызывают инфекции мочеполовой системы.
Предрасполагающими факторами для развития инфекции являются мочекаменная болезнь, врожденные пороки развития половых органов, постоянные или часто повторяющиеся катетеризации, удаление предстательной железы. Характерно заражение в больничной обстановке, например, в урологических отделениях. Синегнойные палочки занимают одно из первых мест среди возбудителей инфекций, развивающихся в пересаженной почке.
Вызываемые заболевания
Синегнойная известна микробиологам как патоген растений, однако способна вызывать заболевания и у людей.
Инфекция наиболее часто возникает на месте порезов (в том числе операционных швов) и ожогов. Pseudomonas aeruginosa может вызвать:
инфекцию мочевыводящих путей (заносится, например, при введении катетеров),
инфекцию глаз (как результат травмы или оперативного вмешательства),
инфекцию кожи и мягких тканей (раневые инфекции, дерматит, пиодермия).
Часто Pseudomonas aeruginosa обнаруживают при обследовании детей, страдающих отитом — воспалением среднего уха.
К другим серьезным инфекциям, вызываемым синегнойной палочкой можно отнести пневмонию, эндокардит (заражение клапанов сердца), инфекции центральной нервной системы (менингит и абсцесс мозга), костно-мышечного аппарата (в т.ч. суставов) и желудочно-кишечного тракта. К сожалению, локальная инфекция очень часто перерастает в подчас общее заражение организма, связанное с проникновением бактерий в кровь.
Симптомы и течение болезни
Синегнойная инфекция мочевыводящих путей, как правило, протекает хронически, длится месяцами, а иногда и годами, нарушая функцию почек. Часто инфекция протекает бессимптомно и выявляется при бактериоскопическом исследовании мочи лихорадящих больных, нуждающихся в частой и постоянной катетеризации мочевого пузыря.
Лечение
В лечебной программе обязательно должны быть предусмотрены препараты, нормализующие микрофлору кишечника, например противомикробный аппарат серии «Биофон«, который не только лечит это заболевание, но и эффективно оздоравливает весь организм.
Сегодня при кажущейся широте выбора для борьбы с послеоперационными инфекциями из полутора сотен известных антибиотиков реально могут использоваться не больше десяти. Несмотря на новые открытия в области антимикробной химиотерапии в последние несколько десятков лет, результаты лечения инфекционных заболеваний остались на уровне 1990-х годов, а в некоторых случаях ситуация даже ухудшилась. Связано это с растущей угрозой антибиотикорезистентности. А по данным российского государственного научного центра по антибиотикам, каждому 3-му больному, инфицированному синегнойной палочкой, медицина помочь уже не в силах. Существующие антибиотики не справляются с этим микроорганизмом.Одна из причин этого — активное использование антибактериальных препаратов в сельском хозяйстве, безрецептурный отпуск антибиотиков гражданам, применение при различных инфекциях одного и того же особо популярного антибактериального средства.
Группой российских ученых изобретен метод изменения активности микроорганизмов. На основе этого метода разработаны приборы серии «Биофон«, позволяющие эффективно бороться с различными микробами. Аппарат воздействует только на болезнетворные микроорганизмы, находящиеся в организме человека или животного, позволяя избавиться от заболеваний, которые трудно вылечиваются с помощью антибиотиков и др. средств медицины. Полное освобождение организма от патогенных (болезнетворных) микроорганизмов при соблюдении методики лечения наступает в 98% случаев. Высокая эффективность подтверждается клиническими испытаниями, которые проводились последние 10 лет более чем в 50 медицинских учреждениях России: в городских, областных, республиканских клинических больницах; родильных домах, госпиталях, научно-исследовательских и медицинских институтах.
На основе этого метода разработаны приборы серии «Биофон«, позволяющие эффективно бороться с различными микробами. Аппарат воздействует только на болезнетворные микроорганизмы, находящиеся в организме человека или животного, позволяя избавиться от заболеваний, которые трудно вылечиваются с помощью антибиотиков и др. средств медицины. Полное освобождение организма от патогенных (болезнетворных) микроорганизмов при соблюдении методики лечения наступает в 98% случаев. Высокая эффективность подтверждается клиническими испытаниями, которые проводились последние 10 лет более чем в 50 медицинских учреждениях России: в городских, областных, республиканских клинических больницах; родильных домах, госпиталях, научно-исследовательских и медицинских институтах.
ИННОВАЦИОННЫЙ АНТИБИОТИК ЗЕРБАКСА® (ЦЕФТОЛОЗАН/ТАЗОБАКТАМ) СТАЛ ДОСТУПЕН РОССИЙСКИМ ПАЦИЕНТАМ С ОСЛОЖНЕННЫМИ ИНФЕКЦИЯМИ
16.04.2019 — Компания MSD сообщает о выводе на российский рынок инновационного антибактериального препарата Зербаксы® (цефтолозан/тазобактам). Теперь он доступен для лечения взрослых пациентов с интраабдоминальными инфекциями, а также инфекциями мочевыводящий путей, включая пиелонефрит. Новый препарат обладает высокой активностью в отношении грамотрицательных микроорганизмов, включая полирезистентную синегнойную палочку (Pseudomonas aeruginosa). Согласно классификации Всемирной организации здравоохранения (ВОЗ),P. aeruginosaявляется одним из самых приоритетных патогенов, входит в тройку наиболее устойчивых к антибиотикам возбудителей инфекционных заболеваний, в отношении которых существует острая потребность в новых средствах лечения.В России проблема разработки и вывода антибиотиков, способных успешно бороться с инфекциями, вызванными полирезистентными микроорганизмами, активно обсуждается на государственном уровне.
Теперь он доступен для лечения взрослых пациентов с интраабдоминальными инфекциями, а также инфекциями мочевыводящий путей, включая пиелонефрит. Новый препарат обладает высокой активностью в отношении грамотрицательных микроорганизмов, включая полирезистентную синегнойную палочку (Pseudomonas aeruginosa). Согласно классификации Всемирной организации здравоохранения (ВОЗ),P. aeruginosaявляется одним из самых приоритетных патогенов, входит в тройку наиболее устойчивых к антибиотикам возбудителей инфекционных заболеваний, в отношении которых существует острая потребность в новых средствах лечения.В России проблема разработки и вывода антибиотиков, способных успешно бороться с инфекциями, вызванными полирезистентными микроорганизмами, активно обсуждается на государственном уровне.
Роман Сергеевич Козлов, член-корреспондент РАН, д.м.н., профессор, главный внештатный специалист по клинической микробиологии и антимикробной резистентности Министерства здравоохранения Российской Федерации, руководитель сотрудничающего центра ВОЗ по укреплению потенциала в сфере надзора и исследований антимикробной резистентности:
«Синегнойная палочка вызывает инфекции различной локализации, особенно при наличии факторов риска, например, ран, сахарного диабета, муковисцидоза, ХОБЛ. Среди основных микробных возбудителей нозокомиальных инфекций в России синегнойная палочка занимает второе место (17,6%) по частоте встречаемости после К. pneumoniae (23,1%). Эта динамика сохраняется в течение последних 20 лет. В ближайшие годы в России ожидается еще больший рост устойчивости к антибактериальным препаратам со стороны синегнойной палочки в связи с появление мее нового клона с геном антибиотикорезистентности «высокого риска» – СС654. По данным исследований, новый антибиотик цефтолозан/тазобактам может обеспечить существенную клиническую эффективность в борьбе с полирезистентными внутрибольничными инфекциями»
Среди основных микробных возбудителей нозокомиальных инфекций в России синегнойная палочка занимает второе место (17,6%) по частоте встречаемости после К. pneumoniae (23,1%). Эта динамика сохраняется в течение последних 20 лет. В ближайшие годы в России ожидается еще больший рост устойчивости к антибактериальным препаратам со стороны синегнойной палочки в связи с появление мее нового клона с геном антибиотикорезистентности «высокого риска» – СС654. По данным исследований, новый антибиотик цефтолозан/тазобактам может обеспечить существенную клиническую эффективность в борьбе с полирезистентными внутрибольничными инфекциями»
Сергей Владимирович Яковлев, д.м.н., профессор кафедры госпитальной терапии № 2 Первого МГМУ им. И.М. Сеченова, президент межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов»:
«Цена, которую мы платим за антибиотикорезистентность бактерий, огромна. Количество умирающих ежегодно по причине внутрибольничных инфекций, вызванных полирезистентными бактериями,и в том числе синегнойной палочкой, составляет в странах ЕС –33 тыс. пациентов, в США – 23 тыс. и порядка 25 тыс. в России. По прогнозам ВОЗ, к 2050 году в мире ежегодно будут умирать от неизлечимых инфекций 10 млн человек. В России распространенность нозокомиальных инфекций крайне высока в отделениях реанимации и интенсивной терапии (ОРИТ)–26%, а также в неврологических отделениях–14%. Летальность от нозокомиальных инфекций составляет 13% в структуре общей смертности в стационарах. До сих пор наиболее часто назначаемыми препаратами первой линии терапии тяжелых внутрибольничных инфекций оставались антибиотики из группы карбапенемов.Но приобретенная антибиотикорезистентность к карбапенемам встречается все чаще и уже превышает уровень 75%. Комбинация цефтолозан/тазобактамявляется потенциально наиболее эффективной в отношении полирезистентных внутрибольничных патогенов, прежде всего, синегнойной палочки, включая и новые клоны «высокого риска»
пациентов, в США – 23 тыс. и порядка 25 тыс. в России. По прогнозам ВОЗ, к 2050 году в мире ежегодно будут умирать от неизлечимых инфекций 10 млн человек. В России распространенность нозокомиальных инфекций крайне высока в отделениях реанимации и интенсивной терапии (ОРИТ)–26%, а также в неврологических отделениях–14%. Летальность от нозокомиальных инфекций составляет 13% в структуре общей смертности в стационарах. До сих пор наиболее часто назначаемыми препаратами первой линии терапии тяжелых внутрибольничных инфекций оставались антибиотики из группы карбапенемов.Но приобретенная антибиотикорезистентность к карбапенемам встречается все чаще и уже превышает уровень 75%. Комбинация цефтолозан/тазобактамявляется потенциально наиболее эффективной в отношении полирезистентных внутрибольничных патогенов, прежде всего, синегнойной палочки, включая и новые клоны «высокого риска»
Екатерина Михайловна Лукьянова, медицинский директор MSD в России:
«Больше века MSD вносит весомый вклад в борьбу с заболеваниями во всем мире. Сегодня в арсенале российских врачей появилось дополнительное и долгожданное оружие против жизнеугрожающих инфекций, вызванных грамотрицательными возбудителями. Надеемся, что применение инновационного антибиотика в широкой клинической практике в России позволит сохранить жизни многих российских пациентов»
Сегодня в арсенале российских врачей появилось дополнительное и долгожданное оружие против жизнеугрожающих инфекций, вызванных грамотрицательными возбудителями. Надеемся, что применение инновационного антибиотика в широкой клинической практике в России позволит сохранить жизни многих российских пациентов»
О компании MSD
На протяжении более 125 лет MSD является одной из ведущих международных компаний в области здравоохранения. MSD – это фирменное наименование компании Merck & Co. Inc., штаб-квартира которой находится в Кенилворте, штат Нью-Джерси, США.
Мы создаем, разрабатываем и производим инновационные рецептурные лекарственные препараты, включая биологические лекарственные средства и вакцины, которые помогают сохранять и улучшать здоровье людей. В портфеле MSD представлены лекарственные препараты для профилактики и лечения онкологических заболеваний, сахарного диабета, гепатита C, ВИЧ-инфекций, аутоиммунных воспалительных и респираторных заболеваний, болезней системы кровообращения и других нозологий.
Мы реализуем и поддерживаем программы и партнерские проекты, которые способствуют повышению качества медицинской помощи.
В России компания MSD работает с 1991 года, концентрируя внимание на обеспечении доступности инновационных лекарств и вакцин, партнерстве с локальными производителями и ведущими медицинскими учреждениями, а также поддержке медицинского образования. Мы применяем богатый международный опыт, чтобы внести вклад в развитие здравоохранения и фармацевтической промышленности России.
Подробную информацию о компании вы можете найти на сайте www.msd.ru
Контакты для СМИ:
Лилия Закирова |[email protected]| Тел.: +7 915 0320584
ООО «МСД Фармасьютикалс»
Москва, ул. Тимура Фрунзе 11, к 1. (БЦ Демидов)
Тел.: +7 495 916 71 00
Факс: +7 495 916 70 94
www.msd.ru
Перед назначением любого препарата, упомянутого в данном материале, пожалуйста, ознакомьтесь с полной инструкцией по применению, предоставленной компанией-производителем.
Компания MSD не рекомендует применять препараты компании способами, отличными от описанных в инструкции по применению.
Pseudomonas aeruginosa Инфекции Лекарства: антибиотики
Уильямс Е.П., Кэмерон К. Инфекция, вызванная Bacillus Pyocyaneus, является причиной детской смертности. Папский представитель в области общественного здравоохранения . 1894. 20: 355-60. [Медлайн].
Мацумото Т., Вайт С.Р., Мозли Р.В., Хоули Р.Дж., Лаки Г.Р. Боевая хирургия в зоне связи. I. Военная рана и бактериология (предварительное сообщение). Мил Мед . 1969 Сентябрь 134 (9): 655-65. [Медлайн].
Villavicencio RT.История синего гноя. J Am Coll Surg . 1998 августа 187 (2): 212-6. [Медлайн].
Поллак M. Pseudomonas Aeruginosa. Манделл Г.Л., Беннетт Дж. Э., Долин Р., ред. Принципы и практика инфекционных болезней . 5-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2000. 2310-27.
Манделл Г.Л., Беннетт Дж. Э., Долин Р., ред. Принципы и практика инфекционных болезней . 5-е изд. Нью-Йорк, Нью-Йорк: Черчилль Ливингстон; 2000. 2310-27.
CDC. Угрозы устойчивости к антибиотикам в Соединенных Штатах, 2013. Центры по контролю и профилактике заболеваний. Доступно по адресу http://www.cdc.gov/drugresistance/pdf/ar-threats-2013-508.pdf.
Учебник бактериологии. Интернет-учебник бактериологии Тодара . [Полный текст].
Illgner U, Uekoetter A, Runge S, Wetz HH. Инфекция Pseudomonas aeruginosa при артропатии стопы Шарко. Лодыжка стопы Int . 2013 Февраль 34 (2): 234-7. [Медлайн].
Национальная система надзора за внутрибольничными инфекциями (NNIS). Отчет Национальной системы эпиднадзора за внутрибольничными инфекциями (NNIS), сводка данных с января 1992 г. по июнь 2004 г., выпущенный в октябре 2004 г.Центры по контролю и профилактике заболеваний. Доступно на http://www.cdc.gov/nhsn/pdfs/datastat/nnis_2004.pdf.
по июнь 2004 г., выпущенный в октябре 2004 г.Центры по контролю и профилактике заболеваний. Доступно на http://www.cdc.gov/nhsn/pdfs/datastat/nnis_2004.pdf.
Ратьен Ф., Мунк А., Хо П., Аньялози Г. Лечение ранней инфекции Pseudomonas aeruginosa у пациентов с муковисцидозом: испытание ELITE. Грудь . 2010 апр. 65 (4): 286-91. [Медлайн].
Aloush V, Navon-Venezia S, Seigman-Igra Y, Cabili S, Carmeli Y. Pseudomonas aeruginosa с множественной лекарственной устойчивостью: факторы риска и клиническое воздействие. Противомикробные агенты Chemother . 2006 Январь 50 (1): 43-8. [Медлайн].
Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Монотерапия бета-лактамом по сравнению с комбинированной терапией бета-лактам-аминогликозидами при сепсисе у иммунокомпетентных пациентов: систематический обзор и метаанализ рандомизированных исследований. BMJ . 2004 20 марта. 328 (7441): 668. [Медлайн].
BMJ . 2004 20 марта. 328 (7441): 668. [Медлайн].
Битсори М., Мараки С., Кукураки С., Галанакис Э. Инфекция мочевыводящих путей у детей: Pseudomonas aeruginosa: факторы риска и исходы. Дж Урол . 2012 Январь 187 (1): 260-4. [Медлайн].
Идальго Дж. А., Винлуан С. М., Энтони Н. Цефтазидим / авибактам: новый ингибитор цефалоспоринов / небета-лактамных бета-лактамаз для лечения осложненных инфекций мочевыводящих путей и интраабдоминальных инфекций. Лекарство Des Devel Ther . 2016 26 июля. 10: 2379-86. [Медлайн].
Торрес А., Ранг D, Мелник Д., Рекеда Л., Чен Х, Риккобене Т. и др. Рандомизированное испытание цефтазидима-авибактама в сравнении с меропенемом для лечения бактериальной пневмонии, приобретенной в больнице и связанной с аппаратом искусственной вентиляции легких (REPROVE): анализы в соответствии с конечными точками, указанными FDA США. Открытый форум Infect Dis . 2019 6 (4) апреля: ofz149. [Медлайн].
Открытый форум Infect Dis . 2019 6 (4) апреля: ofz149. [Медлайн].
Allergan объявляет об одобрении FDA препарата Avycaz (цефтазидим и авибактам) для детей. [Полный текст].
Жанель Г.Г., Чунг П., Адам Х., Зеленицкий С., Денисуик А., Швейцер Ф. и др. Цефтолозан / тазобактам: новая комбинация ингибиторов цефалоспоринов / β-лактамаз, обладающая активностью против грамотрицательных бацилл с множественной лекарственной устойчивостью. Наркотики . 2014 Январь 74 (1): 31-51.[Медлайн].
Джанкола С.Е., Махони М.В., Биас Т.Э., Хирш Е.Б. Критическая оценка цефтолозан-тазобактама при осложненных инфекциях мочевыводящих путей и внутрибрюшных инфекциях. Ther Clin Risk Manag . 2016 19 мая. 12: 787-97. [Медлайн].
Kmeid JG, Youssef MM, Kanafani ZA, Kanj SS. Комбинированная терапия грамотрицательных бактерий: какие есть доказательства ?. Expert Rev Anti Infect Ther . 2013 декабря 11 (12): 1355-62. [Медлайн].
Комбинированная терапия грамотрицательных бактерий: какие есть доказательства ?. Expert Rev Anti Infect Ther . 2013 декабря 11 (12): 1355-62. [Медлайн].
Asuphon O, Montakantikul P, Houngsaitong J, Kiratisin P, Sonthisombat P. Оптимизация внутривенного дозирования фосфомицина в комбинации с карбапенемами для лечения инфекций Pseudomonas aeruginosa у пациентов в критическом состоянии на основе моделирования фармакокинетики / фармакодинамики (PK / PD). Int J Заразить Dis . 2016 Сентябрь 50: 23–9. [Медлайн].
Lingscheid T, Tobudic S, Poeppl W., Mitteregger D, Burgmann H. Активность дорипенема плюс фосфомицин in vitro против лекарственно-устойчивых клинических изолятов крови. Фармакология . 2013. 91 (3-4): 214-8. [Медлайн].
Linden PK, Kusne S, Coley K, Fontes P, Kramer DJ, Paterson D. Использование парентерального колистина для лечения серьезной инфекции, вызванной устойчивой к антимикробным препаратам синегнойной палочкой. Clin Infect Dis . 1 декабря 2003 г. 37 (11): e154-60. [Медлайн].
Использование парентерального колистина для лечения серьезной инфекции, вызванной устойчивой к антимикробным препаратам синегнойной палочкой. Clin Infect Dis . 1 декабря 2003 г. 37 (11): e154-60. [Медлайн].
Sabuda DM, Laupland K, Pitout J, Dalton B, Rabin H, Louie T. и др. Использование колистина для лечения синегнойной палочки с множественной лекарственной устойчивостью. Может ли заразить Dis Med Microbiol . 2008 19 ноября (6): 413-8. [Медлайн].
Левин А.С., Бароне А.А., Пенсу Дж., Сантос М.В., Мариньо И.С., Арруда Е.А. и др. Внутривенный колистин как терапия внутрибольничных инфекций, вызванных множественной лекарственной устойчивостью Pseudomonas aeruginosa и Acinetobacter baumannii. Clin Infect Dis . 1999 Май. 28 (5): 1008-11. [Медлайн].
Abuqaddom AI, Darwish RM, Muti H. Влияние некоторых факторов состава, используемых в офтальмологических препаратах, на активность тиомерсала против Pseudomonas aeruginosa и Staphylococcus aureus. J Appl Microbiol . 2003. 95 (2): 250-5. [Медлайн].
Влияние некоторых факторов состава, используемых в офтальмологических препаратах, на активность тиомерсала против Pseudomonas aeruginosa и Staphylococcus aureus. J Appl Microbiol . 2003. 95 (2): 250-5. [Медлайн].
Bliziotis IA, Samonis G, Vardakas KZ, Chrysanthopoulou S, Falagas ME. Эффект комбинированной терапии аминогликозидами и бета-лактамом по сравнению с монотерапией бета-лактамом на возникновение устойчивости к противомикробным препаратам: метаанализ рандомизированных контролируемых исследований. Clin Infect Dis . 2005 г. 15 июля. 41 (2): 149-58. [Медлайн].
Chamot E, Boffi El Amari E, Rohner P, Van Delden C.Эффективность комбинированной антимикробной терапии бактериемии Pseudomonas aeruginosa. Противомикробные агенты Chemother . 2003 Сентябрь 47 (9): 2756-64. [Медлайн].
Крауч Брюер С. , Вундеринк Р.Г., Джонс С.Б., Липер К.В. мл. Пневмония, связанная с искусственной вентиляцией легких, вызванная синегнойной палочкой. Сундук . 1996 апр. 109 (4): 1019-29. [Медлайн].
, Вундеринк Р.Г., Джонс С.Б., Липер К.В. мл. Пневмония, связанная с искусственной вентиляцией легких, вызванная синегнойной палочкой. Сундук . 1996 апр. 109 (4): 1019-29. [Медлайн].
Cunha BA. Клиническая значимость пенициллинрезистентного Streptococcus pneumoniae. Заражение семином респира .2002 Сентябрь 17 (3): 204-14. [Медлайн].
Cunha BA. Новые возможности использования старых антибиотиков: нитрофурантоин, амикацин, колистин, полимиксин B, доксициклин и миноциклин. Med Clin North Am . 2006 ноябрь 90 (6): 1089-107. [Медлайн].
Cunha BA. Пневмония, связанная с искусственной вентиляцией легких: при правильном выборе оптимальна монотерапия. Crit Care . 2006. 10 (2): 141. [Медлайн].
Cunha BA. Множественная лекарственная устойчивость (МЛУ) Klebsiella, Acinetobacter и Pseudomonas aeruginosa. Антибиотики для клиницистов . 2006. 10: 354-355.
Антибиотики для клиницистов . 2006. 10: 354-355.
Cunha BA. Pseudomonas aeruginosa: резистентность и терапия. Заражение семином респира . 2002. 17: 231-239. [Медлайн].
Эдельштейн М.В., Склеенова Е.Н., Шевченко О.В., Д’суза Ю.В., Тапальский Д.В., Азизов И.С. и др. Распространение высокорезистентного VIM-2-положительного ST235 Pseudomonas aeruginosa в Беларуси, Казахстане и России: продольное эпидемиологическое и клиническое исследование. Ланцет Infect Dis . 2013 г. 8 июля [Medline].
Эджворт Д.Д., Тричер Д.Ф., Эйкин С.Дж. 25-летнее исследование внутрибольничной бактериемии в отделении интенсивной терапии для взрослых. Crit Care Med . 1999, 27 августа (8): 1421-8. [Медлайн].
Fiorillo L, Zucker M, Sawyer D, Lin AN. Синдром псевдомонадных горячих ног. N Engl J Med . 2001, 2 августа. 345 (5): 335-8. [Медлайн].
Синдром псевдомонадных горячих ног. N Engl J Med . 2001, 2 августа. 345 (5): 335-8. [Медлайн].
Garcia-Lechuz JM, Cuevas O, Castellares C, Perez-Fernandez C, Cercenado E, Bouza E.Streptococcus pneumoniae, инфекции кожи и мягких тканей: характеристика возбудителей и клиническое заболевание. евро J Clin Microbiol Infect Dis . 2007 Апрель 26 (4): 247-53. Epub. [Медлайн].
Гэвин П.Дж., Сусено М.Т., Кук Ф.В., Петерсон Л.Р., Томсон Р.Б. мл. Левосторонний эндокардит, вызванный синегнойной палочкой: успешное лечение меропенемом и тобрамицином. Диагностика микробиологических инфекций . 2003 Октябрь 47 (2): 427-30. [Медлайн].
Heal CF, Buettner PG, Cruickshank R, Graham D, Browning S, Pendergast J, et al.Уменьшает ли однократное нанесение местного хлорамфеникола на зашитые раны высокого риска частоту раневой инфекции после незначительной операции? Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование.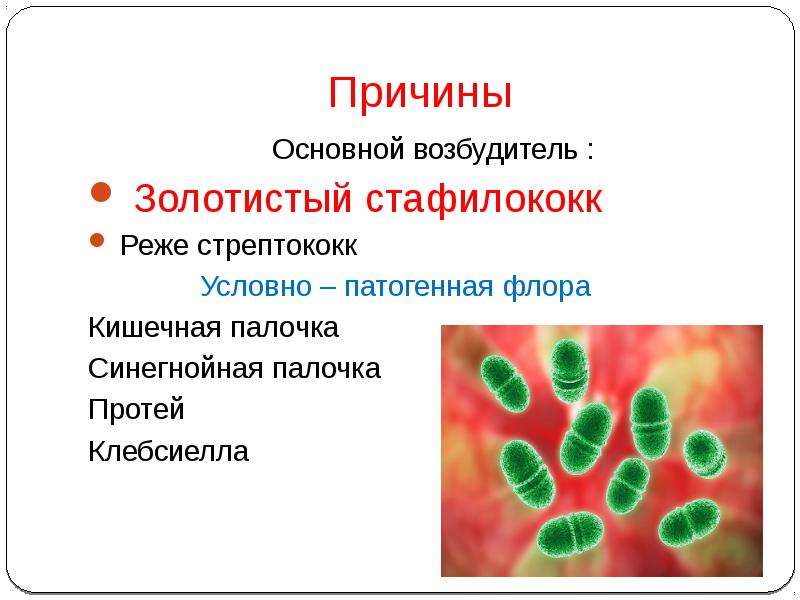 BMJ . 2009 15 января. 338: a2812. [Медлайн]. [Полный текст].
BMJ . 2009 15 января. 338: a2812. [Медлайн]. [Полный текст].
Хобан DJ, Жанель Г.Г. Клинические последствия устойчивости к макролидам при внебольничных инфекциях дыхательных путей. Expert Rev Anti Infect Ther . 2006 декабрь 4 (6): 973-80. [Медлайн].
Ибрагим Э. Х., Уорд С., Шерман Г, Коллеф М. Х.Сравнительный анализ пациентов с ранней и поздней нозокомиальной пневмонией в отделениях интенсивной терапии. Сундук . 2000 Май. 117 (5): 1434-42. [Медлайн].
Янечко Л. Исследование обнаруживает быстрое распространение широко лекарственной устойчивости P. aeruginosa. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/808645. Доступ: 4 августа 2013 г.
Karlowsky JA, Draghi DC, Jones ME, Thornsberry C, Friedland IR, et al. Эпиднадзор за чувствительностью к противомикробным препаратам среди клинических изолятов Pseudomonas aeruginosa и Acinetobacter baumannii от госпитализированных пациентов в США, с 1998 по 2001 год. Противомикробные агенты Chemother . 2003 май. 47 (5): 1681-8. [Медлайн].
Эпиднадзор за чувствительностью к противомикробным препаратам среди клинических изолятов Pseudomonas aeruginosa и Acinetobacter baumannii от госпитализированных пациентов в США, с 1998 по 2001 год. Противомикробные агенты Chemother . 2003 май. 47 (5): 1681-8. [Медлайн].
Клибанов О.М., Рааш Р.Х., Рублейн Ю. Сравнение однократной и комбинированной антибиотикотерапии при грамотрицательных инфекциях. Энн Фармакотер . 2004 Февраль 38 (2): 332-7. [Медлайн].
Micek ST, Lloyd AE, Ritchie DJ, Reichley RM, Fraser VJ, Kollef MH. Инфекция кровотока, вызванная Pseudomonas aeruginosa: важность надлежащего начального противомикробного лечения. Противомикробные агенты Chemother .2005 апр. 49 (4): 1306-11. [Медлайн].
Muramatsu H, Horii T, Morita M, Hashimoto H, Kanno T., Maekawa M. Влияние основных аминокислот на чувствительность к карбапенемам в клинических изолятах Pseudomonas aeruginosa. Int J Med Microbiol . 2003 Июнь 293 (2-3): 191-7. [Медлайн].
Int J Med Microbiol . 2003 Июнь 293 (2-3): 191-7. [Медлайн].
Пол М., Силбигер И., Грозинский С., Соарес-Вайзер К., Лейбовичи Л. Монотерапия бета-лактамным антибиотиком по сравнению с комбинированной терапией бета-лактам-аминогликозидными антибиотиками при сепсисе. Кокрановская база данных Syst Rev . 2006. (1): CD003344. [Медлайн].
Quittner AL, Modi AC, Wainwright C, Otto K, Kirihara J, Montgomery AB. Определение минимальных клинически значимых различий по шкале респираторных симптомов, пересмотренной в опроснике по муковисцидозу, в двух популяциях пациентов с муковисцидозом и хронической инфекцией дыхательных путей, вызванной Pseudomonas aeruginosa. Сундук . 2009 июнь 135 (6): 1610-8. [Медлайн]. [Полный текст].
Retsch-Bogart GZ, Quittner AL, Gibson RL, Oermann CM, McCoy KS, Montgomery AB, et al. Эффективность и безопасность ингаляционного азтреонам лизина для лечения псевдомонад дыхательных путей при муковисцидозе. Сундук . 2009 Май. 135 (5): 1223-32. [Медлайн]. [Полный текст].
Эффективность и безопасность ингаляционного азтреонам лизина для лечения псевдомонад дыхательных путей при муковисцидозе. Сундук . 2009 Май. 135 (5): 1223-32. [Медлайн]. [Полный текст].
Schoni MH. Макролидная антибактериальная терапия у больных муковисцидозом. Swiss Med Wkly . 31 мая 2003 г., 133 (21-22): 297-301. [Медлайн].
Шорр А.Ф. Обзор исследований влияния грамотрицательной бактериальной устойчивости на исходы в отделении интенсивной терапии. Crit Care Med . 2009 Апрель, 37 (4): 1463-9. [Медлайн].
van Delden C. Инфекции кровотока, вызванные Pseudomonas aeruginosa: как их лечить ?. Int J Антимикробные агенты . 2007 30 ноября Приложение 1: S71-5. [Медлайн].
Веезенмейер Дж. Л., Хаузер А. Р., Лиссабон Т. , Релло Дж. Вирулентность и терапия синегнойной палочки: эволюция трансляционных стратегий. Crit Care Med . 2009 Май. 37 (5): 1777-86. [Медлайн]. [Полный текст].
, Релло Дж. Вирулентность и терапия синегнойной палочки: эволюция трансляционных стратегий. Crit Care Med . 2009 Май. 37 (5): 1777-86. [Медлайн]. [Полный текст].
Вонберг Р.П., Гастмайер П. Изоляция пациентов с инфекционным муковисцидозом: результаты систематического обзора. Инфекционный контроль Hosp Epidemiol . 2005 26 апреля (4): 401-9. [Медлайн].
Ван С., Квок М., Макнамара Дж. К., Кунья Б.А. Колистин для лечения грамотрицательных бациллярных инфекций с множественной лекарственной устойчивостью (МЛУ). Антибиотики для клиницистов . 2007. 11: 389-396.
Беннет, Джон. Грамотрицательные бациллы. Принципы инфекционных болезней Манделла, Дугласа и Беннета . Восьмой.
Инфекция, вызванная синегнойной палочкой, и ее лечение
Хронический кашель, обструкция дыхательных путей и инфекции, которые приходят и уходят и вызывают повреждение бронхов и бронхиол, характерны для бронхоэктазов, что делает людей с этим заболеванием восприимчивыми к серьезным инфекциям, вызываемым бактериальными патогенами и грибковыми микробами.
Среди наиболее распространенных бактериальных патогенов, выделяемых при бронхоэктазах, — Haemophilus influenzae, бактерии, которые могут вызывать различные проблемы, от ушных инфекций и бронхита до пневмонии, и Pseudomonas aeruginosa, , которые могут вызывать различные респираторные инфекции, включая пневмонию, и тяжелые системные инфекции.Известно, что около одной трети пациентов с бронхоэктазами страдают хронической инфекцией, вызванной P. aeruginosa .
P. aeruginosa — это грамотрицательные бактерии, что означает, что они устойчивы ко многим лекарствам и становятся все более устойчивыми к доступным антибиотикам. Обнаруженный во влажных местах, таких как почва и вода, это условно-патогенный микроорганизм, использующий ослабленную иммунную защиту, а у людей — бронхоэктатическую болезнь или муковисцидоз — чрезмерное накопление слизи и плохую функцию легких.Бактерия имеет тенденцию сохраняться в бронхоэктатических дыхательных путях из-за ее способности продуцировать факторы вирулентности и модулировать иммунную защиту посредством передачи сигналов кворума и образования биопленок.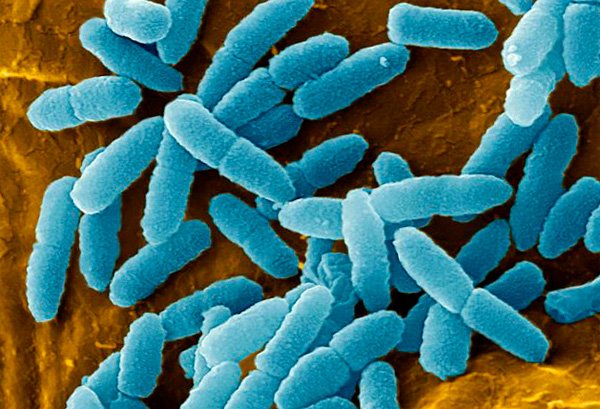
Известно, что люди с бронхоэктатической болезнью и инфекцией P. aeruginosa имеют более низкое качество жизни, чем люди с другими бактериальными инфекциями, и подвержены риску ускоренного ухудшения функции легких и более частых обострений или обострений. Лечение может быть затруднено из-за растущей устойчивости возбудителя к антибиотикам.
Лечение
Pseudomonas aeruginosa инфекций легких Чрезмерное употребление антибиотиков является основной причиной устойчивости Pseudomonas aeruginosa , и Британское торакальное общество опубликовало передовые практические рекомендации по лечению инфекций, вызванных P. aeruginosa , у людей с бронхоэктазами без МВ. Согласно этим рекомендациям, пероральный ципрофлоксацин является предпочтительным средством лечения первой инфекции, а людям, которые действительно реагируют, следует рассмотреть вопрос о внутривенном лечении.Резистентные штаммы этих бактерий, вероятно, требуют комбинированного лечения антибиотиками, включая ципрофлоксацин, и комбинации рекомендуются для пациентов с бронхоэктазами, которым «потребуется много последующих курсов антибиотиков для снижения развития лекарственной устойчивости».
Распыленный колистин также является потенциальным средством лечения этой инфекции.
Американское торакальное общество также рекомендует комбинированное лечение антибиотиками, которое включает аминогликозиды, тикарциллин, цефтазидим, цефепим, азтреонам, ципрофлоксацин и левофлоксацин, с выбором, основанным на таких соображениях, как тяжесть инфекции, основные факторы риска и другие (сопутствующие заболевания). ) болезни у больного.Задержки в лечении инфекций P. aeruginosa связаны с серьезными последствиями, включая более высокий риск смерти, даже у стабильных пациентов.
Ретроспективное исследование изучило устойчивость к антибиотикам у 168 человек с пневмонией, вызванной P. aeruginosa, , и обнаружило, что бактерии наименее устойчивы к лечению колистином, хотя эти бактерии обладают высокой адаптивностью.
Bronchiectasis News Today — это исключительно новостной и информационный веб-сайт об этом заболевании.Он не предоставляет медицинские консультации, диагностику или лечение. Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
Этот контент не предназначен для замены профессиональных медицинских консультаций, диагностики или лечения. Всегда обращайтесь за советом к своему врачу или другому квалифицированному поставщику медицинских услуг по любым вопросам, которые могут у вас возникнуть относительно состояния здоровья. Никогда не пренебрегайте профессиональным медицинским советом и не откладывайте его обращение из-за того, что вы прочитали на этом веб-сайте.
Факторы риска и симптомы, связанные с бактериями
Что такое инфекции, вызванные псевдомонадой?
Инфекции Pseudomonas — это инфекции, вызываемые разновидностью бактерий Pseudomonas, которые обычно встречаются в почве, воде и растениях.Тип, который обычно вызывает инфекции у людей, называется Pseudomonas aeruginosa . У некоторых здоровых людей его штаммы даже растут на коже во влажных частях тела, например, в подмышках или в области гениталий.
Если у вас хорошее здоровье, вы можете заразиться псевдомонадой и не заболеть. У других людей появляется только легкая кожная сыпь или инфекция ушей или глаз. Но если вы заболели или ваша иммунная система уже ослаблена, псевдомонады могут вызвать серьезную инфекцию.В некоторых случаях это может быть опасно для жизни.
У других людей появляется только легкая кожная сыпь или инфекция ушей или глаз. Но если вы заболели или ваша иммунная система уже ослаблена, псевдомонады могут вызвать серьезную инфекцию.В некоторых случаях это может быть опасно для жизни.
Причины и факторы риска заражения Pseudomonas
Вы можете заразиться псевдомонадой разными способами. Он может расти на фруктах и овощах, поэтому вы можете заболеть от употребления зараженной пищи. Он также хорошо себя чувствует во влажных помещениях, таких как бассейны, гидромассажные ванны, ванные комнаты, кухни и раковины.
Самые тяжелые инфекции происходят в больницах. Псевдомонады могут легко расти в увлажнителях и типах медицинского оборудования — например, катетерах, — которые не очищены должным образом.Если медицинские работники плохо моют руки, они также могут передать бактерии от инфицированного пациента вам.
Ваш риск заражения псевдомонадой также повышается, если вы:
Принимаете лекарства, подавляющие вашу иммунную систему, например, те, которые лечат рак
Симптомы инфекции Pseudomonas
Симптомы зависят от того, где находится инфекция. Псевдомонады могут заразить любую часть вашего тела, например кровь, легкие, желудок, мочевыводящие пути или сухожилия. Также могут инфицироваться пролежни, раны и ожоги.
Псевдомонады могут заразить любую часть вашего тела, например кровь, легкие, желудок, мочевыводящие пути или сухожилия. Также могут инфицироваться пролежни, раны и ожоги.
Места возникновения инфекции и их признаки могут включать:
- Уши: боль и выделения
- Кожа: сыпь, которая может включать прыщи, заполненные гноем
- Глаза: боль, покраснение , отек
- Кости или суставы: боль и припухлость в суставах; боль в шее или спине, продолжающаяся несколько недель
- Раны: зеленый гной или выделения с фруктовым запахом
- Пищеварительный тракт: головная боль, диарея
- Легкие: пневмония; сильный кашель и заложенность носа
- Мочевыводящие пути: Инфекции мочевыводящих путей
Лихорадка также часто является признаком тяжелой инфекции псевдомонад.
Диагностика инфекции, вызванной псевдомонадой
Если ваш врач подозревает псевдомонаду, он возьмет образец вашей крови или другой биологической жидкости и отправит его в лабораторию для анализа. Результаты также могут помочь им решить, какие типы антибиотиков лучше всего подойдут для лечения инфекции.
Результаты также могут помочь им решить, какие типы антибиотиков лучше всего подойдут для лечения инфекции.
Лечение инфекции Pseudomonas
Если у вас легкая форма псевдомонад, ваш врач может назначить курс антибиотиков. В зависимости от того, где находится ваша инфекция, это лекарство может быть в форме крема, глазных или ушных капель или таблеток, которые вы принимаете внутрь.
При тяжелой инфекции может потребоваться несколько недель приема антибиотиков, которые вам будут вводить через капельницу. Все бактерии pseudomonas немного отличаются друг от друга, а штаммы постоянно меняются, поэтому эти типы инфекций трудно поддаются лечению. Часто вам может потребоваться принимать более одного вида антибиотиков.
Профилактика псевдомонадной инфекции
Вы можете снизить риск заболевания, стараясь избегать контакта с этим типом бактерий. Попробуйте эти простые советы, чтобы держать эти неприятные микробы в страхе:
Часто мойте руки.
 Это лучший способ избежать заражения псевдомонадой. Если вы находитесь в больнице, убедитесь, что врачи и медсестры всегда моют руки, прежде чем прикасаться к вам.
Это лучший способ избежать заражения псевдомонадой. Если вы находитесь в больнице, убедитесь, что врачи и медсестры всегда моют руки, прежде чем прикасаться к вам.Ополосните фрукты и овощи перед едой. Даже зелень салата следует хорошо промыть.
Мойте бутылки с водой. Стерилизовать кипятком перед каждым использованием.
Избегайте нечистых бассейнов и гидромассажных ванн. Pseudomonas будет процветать в них, если их не чистить часто, а уровень хлора и pH не контролируется.
Задайте вопросы о вашем медицинском обслуживании. Поговорите со своим врачом, если вы беспокоитесь о заражении. Спросите, какое медицинское оборудование вы используете — нужно ли оно и как часто его чистят.
Позаботьтесь о своем здоровье.
 Если ваш врач прописал вам лекарство для контроля состояния здоровья, принимайте его точно так, как предписано. Не пропускайте дозу. После операции внимательно следите за признаками инфекции. Если у вас поднялась температура, появилась боль, покраснение или выделения на месте операции, немедленно обратитесь к врачу.
Если ваш врач прописал вам лекарство для контроля состояния здоровья, принимайте его точно так, как предписано. Не пропускайте дозу. После операции внимательно следите за признаками инфекции. Если у вас поднялась температура, появилась боль, покраснение или выделения на месте операции, немедленно обратитесь к врачу.
Перспективы инфекции Pseudomonas
В большинстве случаев антибиотики могут избавить от инфекции, но важно следовать указаниям врача и сосредоточиться на профилактике. Если один курс антибиотиков не избавляет полностью от бактерий, вызывающих вашу инфекцию, возможно, вам придется принимать их достаточно регулярно, чтобы держать инфекцию под контролем.
Псевдомонадная инфекция | Michigan Medicine
Обзор темы
Что такое псевдомонадная инфекция?
Инфекция pseudomonas вызывается очень распространенным типом бактерий, который называется Pseudomonas aeruginosa (скажем, «soo-duh-MOH-nuss ay-roo-jee-NOH-suh»).
Здоровые люди часто носят эти бактерии, не зная об этом и не испытывая никаких проблем. Иногда эти микробы вызывают незначительные проблемы, такие как ухо пловца и сыпь в горячей ванне. Но у слабых или больных людей эти микробы могут вызвать очень серьезные — даже смертельные — инфекции в любой части тела.
Инфекции трудно поддаются лечению, потому что бактерии могут противостоять многим типам антибиотиков — лекарствам, которые обычно используются для уничтожения бактерий.
Кто заразился?
Люди в больнице могут заразиться этой инфекцией.В больницах бактерии могут распространяться через медицинское оборудование, чистящие растворы и другое оборудование. Они могут распространяться даже через пищу. Когда они распространяются на пациентов, ослабленных в результате болезни, операции или лечения, они могут вызвать очень серьезные инфекции. Например, псевдомонады — одна из основных причин пневмонии у пациентов, находящихся на дыхательных аппаратах.
Жертвы ожогов и люди с колотыми ранами могут получить опасные псевдомонадные инфекции крови, костей или мочевыводящих путей. Бактерии также могут попасть в организм через внутривенные иглы или катетеры.
Бактерии также могут попасть в организм через внутривенные иглы или катетеры.
Эти бактерии любят влажную среду, такую как горячие ванны и бассейны, где они могут вызвать кожную сыпь или уши пловца.
Люди, которые носят контактные линзы, могут получить серьезные глазные инфекции, если бактерии попадут в их растворы для контактных линз. Это может произойти, если вы не соблюдаете стерильность контактных линз и оборудования.
Каковы симптомы?
Симптомы зависят от того, где находится инфекция.Если он в ране, то внутри или вокруг нее может быть сине-зеленый гной. Если у вас есть ухо пловца, у вас болит ухо. Если инфекция вызывает пневмонию, у вас может появиться кашель. Когда инфекция поражает другие части тела, у вас может подниматься температура и вы чувствуете усталость. Но все инфекции, вызываемые псевдомонадой, могут вызвать серьезное заболевание, если они распространяются через кровоток (сепсис). Серьезная инфекция может вызывать симптомы высокой температуры, озноба, спутанности сознания и шока.
Как лечится инфекция?
Антибиотики — основное лечение.Обычно используются два разных вида. Подобрать подходящий антибиотик может быть сложно, потому что бактерии устойчивы ко многим из этих лекарств.
В некоторых случаях для удаления инфицированной ткани используется хирургическое вмешательство.
Если ваш врач прописывает антибиотики, обязательно принимайте все лекарства, даже если вы сразу почувствуете себя лучше. Если вы не примете все лекарства, вы не сможете убить все бактерии. Независимо от того, какое лечение вы проводите, важно позвонить своему врачу, если состояние вашей инфекции не улучшится должным образом.
Как можно предотвратить заражение или распространение этой инфекции?
По мере роста числа устойчивых к антибиотикам бактерий больницы уделяют повышенное внимание контролю над инфекциями. Это включает частое мытье рук и изоляцию инфицированных пациентов.
Вот еще несколько шагов, которые вы можете предпринять, чтобы защитить себя:
- Соблюдайте правила гигиены.

- Держите руки в чистоте, часто и хорошо мойте их. Мытье рук — лучший способ избежать распространения микробов.Вы можете использовать мыло и чистую проточную воду или дезинфицирующее средство для рук на спиртовой основе.
- Держите порезы и царапины в чистоте и закрывайте повязкой. Избегайте контакта с чужими ранами или повязками.
- Не передавайте личные вещи, такие как полотенца или бритвы.
- Будьте осторожны с антибиотиками.
- Знайте, что антибиотики могут помочь , когда инфекция вызвана бактериями. Но они не могут вылечить инфекции, вызванные вирусом.Всегда спрашивайте своего врача, являются ли антибиотики лучшим лечением.
- Всегда принимайте все свои антибиотики в соответствии с предписаниями. Использование только части лекарства может вызвать развитие устойчивых к антибиотикам бактерий.
- Не экономьте на антибиотиках.
 И не используйте те, которые были прописаны кому-то другому.
И не используйте те, которые были прописаны кому-то другому.
- Если вы находитесь в больнице, напомните врачам и медсестрам мыть руки перед тем, как они дотронутся до вас.
Если у вас инфекция pseudomonas, вы можете предотвратить распространение бактерий.
- Закройте рану чистой сухой повязкой. Следуйте инструкциям врача по уходу за раной.
- Держите руки в чистоте. Вы, ваша семья и другие люди, с которыми вы находитесь в тесном контакте, должны часто мыть руки, особенно после смены повязки или прикосновения к ране.
- Не используйте вместе полотенца, мочалки, бритвы, одежду или другие предметы, которые могли соприкасаться с вашей раной или повязкой.Вымойте простыни, полотенца и одежду теплой водой с моющим средством и, если возможно, высушите их в горячей сушилке.
- Поддерживайте чистоту окружающей среды, протирая дезинфицирующим средством все поверхности, к которым вы часто прикасаетесь (например, столешницы, дверные ручки и выключатели).

Инфекции, вызванные Pseudomonas: причины, симптомы и лечение
Инфекции, вызываемые Pseudomonas , — это болезни, вызываемые бактериями Pseudomonas . У многих людей инфекция Pseudomonas вызывает только легкие симптомы.
Однако, если человек находится в больнице или имеет ослабленную иммунную систему, угроза становится очень серьезной. В этих ситуациях инфекция Pseudomonas может быть опасной для жизни.
Хорошая новость в том, что эти инфекции поддаются лечению, особенно при ранней диагностике.
В этой статье мы рассмотрим причины, факторы риска и симптомы инфекций Pseudomonas , а также способы их предотвращения и лечения.
Pseudomonas — распространенный род бактерий, которые при определенных обстоятельствах могут вызывать инфекции в организме.
Существует много различных типов бактерий Pseudomonas . Только несколько типов могут вызвать инфекцию.
Бактерии Pseudomonas обычно живут и размножаются в воде, почве и сырых местах. Чем теплее и влажнее, тем лучше условия для размножения бактерий.
Чем теплее и влажнее, тем лучше условия для размножения бактерий.
Люди, которые находятся в больнице для операции или лечения серьезного заболевания, наиболее уязвимы для этого вида инфекции.
Разрез после хирургической операции или открытая рана могут увеличить риск инфицирования.Бактерии также могут проникать в пролежни или пролежни.
Люди с ослабленной иммунной системой также подвержены более серьезным инфекциям Pseudomonas .
Легче Инфекции, вызванные Pseudomonas , могут возникать у здоровых людей. К ним относятся ушные инфекции и кожная сыпь, особенно после контакта с водой.
Бактерии Pseudomonas вызывают хорошо известные состояния, такие как сыпь в горячей ванне, красная и зудящая кожная сыпь в результате загрязненной воды и уха пловца.
Помимо людей, которые находятся в больнице, имеют ослабленную иммунную систему или и то, и другое, существуют особые группы, которые более уязвимы к инфекциям Pseudomonas .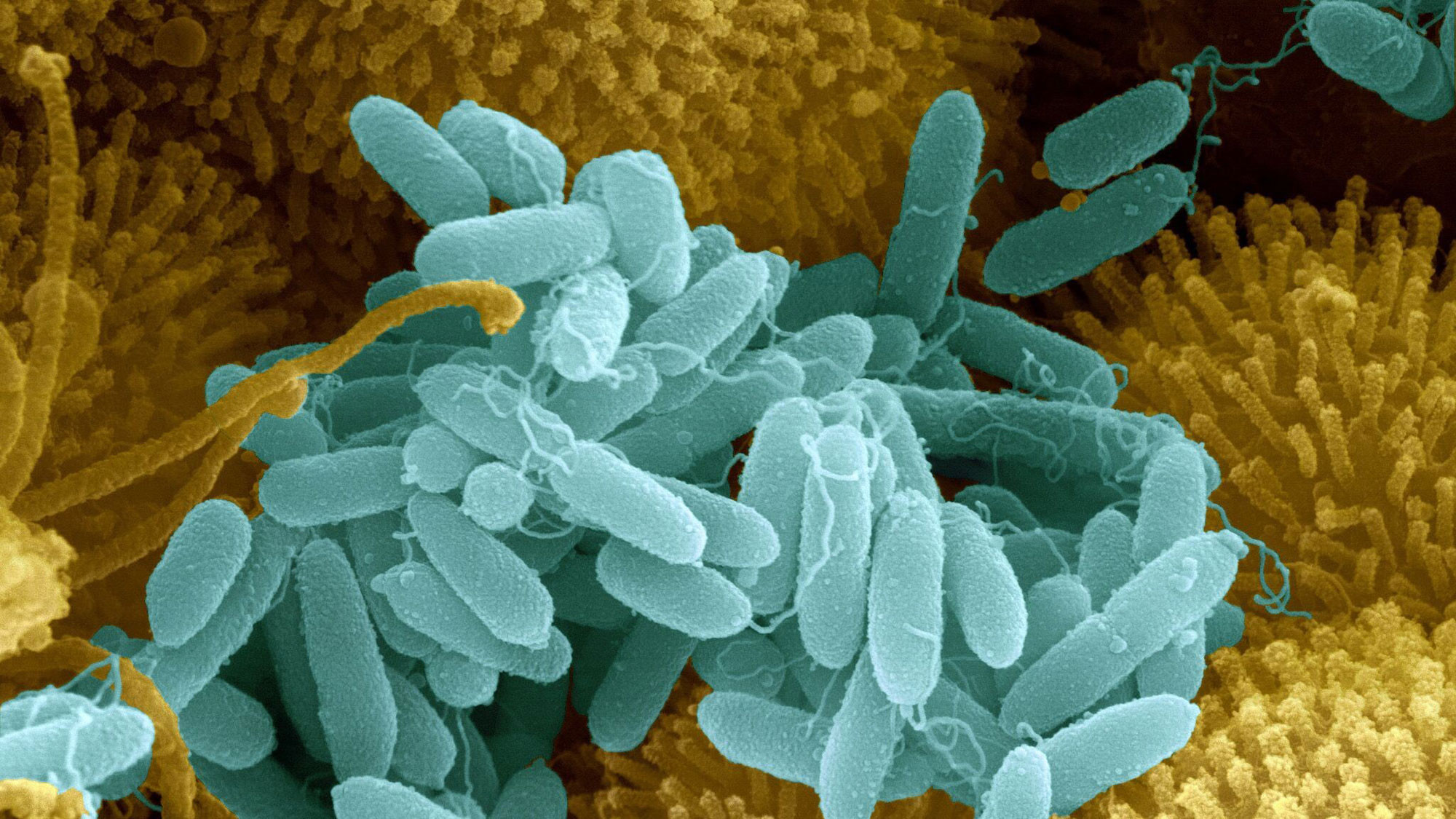
В эти группы входят люди, которые:
- имеют тяжелые ожоги
- перенесли операцию или инвазивную процедуру
- используют дыхательный аппарат или катетер
- проходят химиотерапию
- страдают диабетом
- имеют муковисцидоз
- имеют ВИЧ , которые могут повредить иммунную систему
- имеют любое другое заболевание, которое ставит под угрозу иммунную систему
Симптомы инфекций Pseudomonas различаются в зависимости от тяжести и локализации инфекции.
Области тела, на которые с наибольшей вероятностью повлияет инфекция, — это уши, кожа, легкие, мягкие ткани и кровь.
Инфекция Pseudomonas , которая достигает кровотока, имеет тенденцию быть более серьезной.
Общие симптомы инфекции включают:
- Уши : боль, зуд и жидкие выделения.
- Кожа : Сыпь, которая может состоять из гнойных прыщиков.
- Глаза : Боль и покраснение.
- В легких : пневмония, кашель и заложенность.
- Мягкие ткани : Выделение зеленого гноя и сладкий фруктовый запах.
- В крови : Боль и скованность в суставах, лихорадка, озноб и усталость.
- Другие возможные симптомы : головная боль, диарея или инфекция мочевыводящих путей.
Чтобы помочь диагностировать инфекцию Pseudomonas , врач может спросить о любых недавних действиях, которые могут иметь значение, например о плавании или использовании гидромассажной ванны.Они также проведут медицинский осмотр.
Врач может взять образец крови или жидкости из пораженного участка, чтобы подтвердить диагноз.
Поскольку существуют различные типы бактерий Pseudomonas , лабораторные анализы также могут потребоваться для определения наилучшего курса лечения.
Антибиотики — лучший вариант для лечения Pseudomonas или других бактериальных инфекций.
Некоторые инфекции Pseudomonas требуют агрессивного подхода с применением сильнодействующих лекарств.Чем раньше начинается лечение, тем эффективнее оно останавливает инфекцию.
Это особенно актуально для больниц. Бактерии в больницах регулярно подвергаются воздействию антибиотиков и со временем развивают устойчивость к ним. Это затрудняет их лечение.
Как только врачи узнают, какой тип бактерий Pseudomonas вызывает инфекцию и устойчив ли этот штамм к каким-либо лекарствам, они могут комбинировать лекарства, чтобы сделать лечение более эффективным.
Большинство незначительных инфекций Pseudomonas проходят без лечения или после минимального лечения.
Если симптомы легкие или отсутствуют, лечить инфекцию нет необходимости.
В случае уха пловца может помочь полоскание уха уксусом. Врач также может назначить антибиотик под названием полимиксин.
Врачи обычно лечат инфекции мочевыводящих путей пероральными антибиотиками, такими как левофлоксацин или ципрофлоксацин.
Глазные инфекции, вызываемые бактериями Pseudomonas , относительно редки.Когда они возникают, врачи могут лечить их каплями с антибиотиками.
В тяжелых случаях врачи могут использовать особую процедуру для введения антибиотиков прямо в глаз.
Поделиться на Pinterest Поддержание чистоты в гидромассажных ваннах и бассейнах может предотвратить развитие инфекций.Во многих случаях инфекций Pseudomonas можно предотвратить. Бактерии живут и размножаются во влажных местах. Чем более грязными и влажными становятся эти места, тем больше там живут и размножаются бактерии.
Таким образом, будь то отделение интенсивной терапии или местный бассейн, чистота жизненно важна.
Всем врачам и медсестрам необходимо соблюдать правила гигиены рук. Другой персонал больницы будет содержать оборудование в чистоте и следить за тем, чтобы в палатах пациентов не было микробов.
Люди, находящиеся в больнице, и их семьи должны соблюдать инструкции по частому мытью рук.
Людям с инфекциями, в том числе с простудой, следует избегать посещения пациентов в больнице.
Очень важно регулярно менять повязки и следить за ранними признаками инфекции.
За пределами больниц люди должны с осторожностью использовать бассейны или гидромассажные ванны, которые выглядят грязными или находятся в плохом состоянии.
Люди должны всегда принимать душ после купания и стирать купальники и полотенца в горячей воде.
Бактерии Pseudomonas в целом безвредны. Когда они вызывают инфекцию, у здоровых людей она обычно протекает в легкой форме.
Однако инфекция Pseudomonas может быть тяжелой у людей с ослабленной иммунной системой.Всем, кто подвержен риску осложнений, необходимо как можно скорее обратиться к врачу.
Псевдомонадная инфекция | Британский фонд легких
Псевдомонады — это тип бактерий, вызывающих инфекции легких. В основном он поражает людей, у которых уже есть заболевание легких или проблемы с иммунной системой. Он не реагирует на часто используемые антибиотики, а это означает, что инфекции трудно поддаются лечению.
Если у вас есть заболевание легких и повторяющиеся инфекции дыхательных путей или инфекции дыхательных путей, которые не проходят при обычном лечении, попросите своего лечащего врача пройти тест, чтобы определить, есть ли у вас Pseudomonas в мокроте.
Если у вас муковисцидоз или бронхоэктатическая болезнь, важно сразу же начать эффективное лечение антибиотиками, чтобы предотвратить длительное течение болезни.
На этой странице ответим:
Что такое псевдомонады?
Псевдомонады — распространенный тип бактерий, обычно обнаруживаемый в почве и воде. Он редко вызывает проблемы у людей со здоровыми легкими.
Pseudomonas трудно поддается лечению, поскольку он устойчив к широко используемым антибиотикам, таким как пенициллин, доксициклин и эритромицин.Если у вас Pseudomonas, вам может потребоваться прием других антибиотиков.
Иногда антибиотики не могут удалить Pseudomonas из легких. Когда это произойдет, вам может потребоваться длительное пероральное или ингаляционное лечение антибиотиками, чтобы поддерживать низкий уровень бактерий.
Какие инфекции вызывает Pseudomonas?
Бактерии Pseudomonas могут вызывать различные инфекции, не ограничиваясь инфекциями легких, в том числе:
- пневмония
- Инфекции мочевыводящих путей
- раневые инфекции
- сепсис
- Инфекция желудочно-кишечной системы
Иногда люди без существующих заболеваний легких переносят Pseudomonas в легких, не вызывая инфекции.Это означает, что лечение не всегда необходимо.
Кто подвержен риску заражения Pseudomonas?
Люди с большей вероятностью заразиться инфекцией Pseudomonas включают людей с долгосрочными заболеваниями, такими как:
Он также может вызвать инфекцию у людей с проблемами иммунной системы.
Беременные женщины подвергаются большему риску заражения инфекцией Pseudomonas. Это связано с гормональными изменениями, влияющими на их иммунную систему.
Как диагностируется инфекция Pseudomonas?
Из ваших легких будет взят образец для проверки наличия Pseudomonas.Обычно это делается через образец мокроты.
Но иногда у вас может быть бронхоскопия, когда узкая трубка вводится через ваш нос или рот в легкие, пока вы находитесь под седативным действием.
Как лечится инфекция, вызванная Pseudomonas?
Если у вас инфекция Pseudomonas, ее обычно можно эффективно лечить антибиотиками. Но иногда инфекцию бывает сложно вылечить полностью.
Это связано с тем, что многие стандартные антибиотики не действуют на Pseudomonas.Единственный эффективный вид таблеток — это ципрофлоксацин. Другие антибиотики из той же группы, названия которых заканчиваются на -флоксацин, также эффективны. Этот вид антибиотика может иногда вызывать проблемы с сухожилиями — если вы начинаете ощущать боль в пятке во время его приема, прекратите прием лекарства и немедленно сообщите об этом своему врачу.
Важно закончить курс антибиотиков
Это потому, что:
- Ваша инфекция становится все труднее лечить, поскольку бактерии Pseudomonas могут стать устойчивыми к антибиотикам, которые вы принимали
- Возможно, вам потребуется принять больше лекарств
- Вам могут понадобиться инъекции, а также таблетки
Если ваша инфекция устойчива к этому антибиотику или вы не можете принимать его из-за побочных эффектов, вам может потребоваться внутривенное введение антибиотиков, и для этого может потребоваться госпитализация.
Если у вас длительная инфекция Pseudomonas, которая сохраняется, несмотря на прием антибиотиков, возможно, вам придется принимать антибиотики регулярно. Это необходимо для поддержания низкого уровня инфекции и предотвращения обострения симптомов. Обычно это назначает консультант, и у вас будут регулярные обзоры. Это могут быть таблетки или ингаляционные антибиотики, принимаемые через ингаляторы или небулайзер.
Псевдомонады растут в слизи, поэтому чистота дыхательных путей затрудняет рост бактерий.Спросите своего лечащего врача о посещении физиотерапевта, который может порекомендовать методы очистки дыхательных путей.
Как я могу избежать заражения Pseudomonas?
Главное, что вы можете сделать, — это соблюдать правила гигиены:
- Регулярно мойте руки водой с мылом
- всегда кашлять в салфетку
- очистить загрязненные поверхности с помощью очистителя на основе отбеливателя
- Стирать загрязненную одежду и простыни отдельно при максимально возможной температуре.
Кроме того, если вы курите, важно бросить курить, так как курение повреждает иммунную защиту ваших легких.
Загрузите нашу информацию о Pseudomonas (PDF, 130 КБ)Обновленная информация о лечении пневмонии, вызванной синегнойной палочкой | Журнал антимикробной химиотерапии
Абстрактные
Pseudomonas aeruginosa является важной причиной внутрибольничной пневмонии, связанной с высоким уровнем заболеваемости и смертности. Эта бактерия проявляет множество факторов, которые придают устойчивость к широкому спектру противомикробных агентов.Эмпирическая антибиотикотерапия часто оказывается неадекватной, поскольку в культурах из исходных образцов вырастают штаммы, устойчивые к исходным антибиотикам. Данные эпиднадзора, госпитальная антибиотикограмма и индивидуализация схем лечения на основе предшествующего применения антибиотиков могут снизить риск неадекватной терапии. Использование комбинированной терапии при пневмонии, вызванной P. aeruginosa , давно отстаивается, но потенциальное повышение ценности комбинированной терапии по сравнению с монотерапией остается спорным. Дорипенем и биапенем — новые карбапенемы, обладающие превосходной активностью против P.aeruginosa ; однако им не хватает активности против штаммов, которые выражают устойчивость к доступным в настоящее время карбапенемам. Полимиксины остаются наиболее эффективными агентами против P. aeruginosa с множественной лекарственной устойчивостью. Штаммы, устойчивые к панантибиотикам, встречаются редко, но их частота растет. Комбинации антибиотиков, которые дают некоторую степень восприимчивости in vitro , являются выходом, хотя эффективность этих схем еще не установлена в клинических исследованиях.Экспериментальные полипептиды могут предоставить новый терапевтический подход. Среди них антитело против PcrV иммуноглобулина G, которое блокирует опосредованную системой секреции типа III вирулентность P. aeruginosa , недавно вступило в фазу I / II клинических испытаний.
Введение
Pseudomonas aeruginosa — это грамотрицательная неферментирующая палочка, принадлежащая к семейству Pseudomonadaceae. Впервые он был выделен из зеленого гноя в 1882 году. Более половины всех клинических изолятов продуцируют сине-зеленый пигмент пиоцианин.Он имеет минимальные потребности в питании, что способствует его широкой экологической адаптации и распространению. Большой геном P. aeruginosa обеспечивает огромную гибкость и метаболическую способность процветать в окружающей среде, неблагоприятной для большинства других организмов. 1 Полное секвенирование P. aeruginosa (PA01) дикого типа на рубеже веков дало много полезной информации, касающейся не только его патогенности, но и потенциала устойчивости. 1 Помимо активации медиатора посредством высвобождения эндотоксина, P. aeruginosa обладает набором экзотоксинов и ферментных продуктов, предназначенных для обхода защиты хозяина. 2 Он также имеет ряд хромосомных и плазмидных факторов устойчивости к антибиотикам, что делает лечение антибиотиками трудным и потенциально безуспешным.
По данным Центров США по контролю и профилактике заболеваний и Национальной системы надзора за нозокомиальными инфекциями, P.aeruginosa — вторая по частоте причина внутрибольничной пневмонии (17%), третья по частоте причина инфекции мочевыводящих путей (7%), четвертая по частоте причина инфекции места хирургического вмешательства (8%), седьмой по частоте выделяемый патоген. из кровотока (2%) и пятый по распространенности изолят (9%) во всех местах. 3 Что еще более важно, это наиболее распространенный грамотрицательный патоген с множественной лекарственной устойчивостью (МЛУ), вызывающий пневмонию 4 у госпитализированных пациентов.
За последнее десятилетие существенное внимание было уделено разработке средств борьбы с грамположительными кокками, в то время как разработка противомикробных препаратов для лечения инфекций, вызванных грамотрицательными бациллами, значительно отстала. Поскольку количество новых противомикробных препаратов иссякает, лечение P. aeruginosa по-прежнему основывается на теоретических преимуществах комбинированной терапии и возрождении старых лекарств, от которых ранее отказались из-за серьезной токсичности. 5
Цель этого обзора — обсудить современный подход к антимикробной терапии P.aeruginosa pneumonia и представить новые терапевтические методы, находящиеся в стадии разработки.
Тактика лечения
P. aeruginosa пневмонияПодбор антибиотиков
Набор традиционных антибиотиков с антипсевдомональной активностью включает аминогликозиды, тикарциллин, уреидопенициллины, цефтазидим, цефепим, азтреонам, карбапенемы (за исключением эртапенема), ципрофлоксацин и левофлоксацин. Вопрос о том, какое из этих средств является предпочтительным противомикробным средством при лечении P.aeruginosa pneumonia сложно ответить из-за отсутствия сравнительных рандомизированных двойных слепых исследований, показывающих значительные различия в эффективности. Текущие рекомендации Американского общества инфекционных болезней (IDSA) и Американского торакального общества (ATS) по ведению внебольничной пневмонии и пневмонии, приобретенной в больнице 6,7 , рекомендуют терапевтический выбор, основанный на тяжести инфекции, осведомленности лежащие в основе факторы риска и коморбидные заболевания, распознавание эпидемиологии и фенотипов резистентности в индивидуальных условиях, а также знание фармакокинетико-фармакодинамических параметров.Однако некоторые антибиотики более склонны к развитию резистентности во время терапии, что потенциально может привести к неэффективности лечения. В трех контролируемых исследованиях, сравнивающих имипенем с цефтазидимом, ципрофлоксацином или пиперациллином / тазобактамом, чаще сообщалось о возникновении устойчивости к имипенему. 8–10 Скорректированный коэффициент риска развития устойчивости к имипенему у штаммов P. aeruginosa составил 2,8 по сравнению с 0,7 для цефтазидима, 0,8 для ципрофлоксацина и 1,7 для пиперациллина. 11
Столкнувшись с этой неопределенностью, за последние несколько лет были приняты общие принципы, основанные в основном на мнениях экспертов. При подозрении на пневмонию, вызванную P. aeruginosa , следует начать агрессивный подход к поиску патогенов, желательно до начала первой дозы противомикробной терапии. Использование одинаковых схем лечения антибиотиками для всех пациентов с подозрением на аналогичную инфекцию больше не считается логичным подходом. Повышенный уровень резистентности, ведущий к неадекватной эмпирической терапии, вполне может привести к неблагоприятным исходам для пациентов. 12 Однако начало приема антибиотиков не обязательно должно предшествовать забору пробы из дыхательных путей. Задержка с лечением связана с повышенной смертностью, даже если пациент считается клинически стабильным. 13 Было предложено четыре метода для повышения адекватности покрытия антимикробными препаратами против P. aeruginosa . Во-первых, изучение данных национального эпиднадзора позволяет оценить степень устойчивости к антипсевдомонадным агентам. Хотя надежность этих отчетов может быть сомнительной из-за межлабораторных различий, общая тенденция восприимчивости к патогенам может указывать на географический кластер устойчивых штаммов к определенному классу антибиотиков.Это может оказаться полезным для клиницистов при назначении эмпирического покрытия предполагаемой пневмонии P. aeruginosa у пациентов, переведенных из других учреждений. Во-вторых, знание профиля восприимчивости недавно выделенных патогенов может предсказать не только возбудители, но и характер устойчивости P. aeruginosa , если он был определен как возбудитель. Например, у пациентов, находящихся на ИВЛ, колонизация устойчивым к антибиотикам P.aeruginosa предрасполагает пациента к последующему инфицированию этими же высоковирулентными микроорганизмами. 14 Два недавних исследования показали, что рутинные количественные посевы эндотрахеальных аспиратов, проводимые один или два раза в неделю у всех пациентов на ИВЛ, могут помочь повысить адекватность эмпирической антибиотикотерапии при ИВЛ-ассоциированной пневмонии (ВАП). 15,16 В-третьих, наличие факторов риска MDR P. aeruginosa и предшествующее воздействие антибиотиков может определять степень охвата широким спектром.Во вторичном анализе большого многоцентрового исследования с подозрением на ВАП, 17 независимых фактора риска для изоляции МЛУ P. aeruginosa включали количество дней (≥48 ч) в больнице до поступления в отделение интенсивной терапии (ОИТ) и длительное пребывание в отделении интенсивной терапии. Эти результаты согласуются с более ранней работой Trouillet et al. , 18 , которые обнаружили, что предшествующая длительность ИВЛ связана с повышенным уровнем инфицирования MDR P.aeruginosa . Сопоставимые исследования 18,19 определили воздействие предшествующей антимикробной терапии как важный фактор для лекарственно-устойчивого P. aeruginosa . В отличие от предыдущих отчетов, в которых обычно обнаруживается, что только один или два класса антибиотиков могут быть прогностическими для MDR P. aeruginosa , 20–22 , все антипсевдомонадные агенты могут быть связаны с MDR P. aeruginosa . 23 Однако продолжительность предшествующего воздействия антибиотиков, связанная с MDR P.aeruginosa может варьировать среди антипсевдомонадных классов. Самая короткая продолжительность предшествующего воздействия антибиотиков, связанная с MDR P. aeruginosa , наблюдалась для карбапенемов и фторхинолонов; наибольшая продолжительность была отмечена для цефепима и пиперациллина / тазобактама. В-четвертых, доступ к местным антибиотикам может быть полезен для оценки уровня местной восприимчивости у P. aeruginosa и для мониторинга тенденций устойчивости во времени. 24 Основываясь на рекомендациях ATS / IDSA по использованию комбинированной терапии в случаях нозокомиальной пневмонии, один центр разработал местную «комбинированную» антибиотикограмму для достижения оптимального охвата P.aeruginosa . 25 Хотя этот новый метод комбинированной антибиотикограммы позволил провести умеренную тонкую настройку эмпирических схем противомикробного лечения, выбор противомикробных препаратов существенно не отличался от тех, которые основывались на стандартной антибиотикограмме. Следует отметить, что, хотя антибиотики предоставляют данные о чувствительности и помогают отслеживать тенденции резистентности во времени, они не раскрывают дополнительной информации о сроках введения изолята в связи с поступлением пациента в больницу.
Монотерапия в сравнении с комбинированным охватом
Потенциальное клиническое значение комбинированной терапии по сравнению с монотерапией в отношении P. aeruginosa пневмонии было спорным вопросом в течение многих лет. Считается, что использование комбинированной терапии минимизирует возникновение резистентности 26 и увеличивает вероятность терапевтического успеха за счет синергии противомикробных препаратов. 27 Современное исследование in vitro показало, что левофлоксацин и имипенем могут быть эффективной комбинацией для предотвращения появления резистентности во время лечения P.aeruginosa инфекций. 28 Теория, лежащая в основе использования этой комбинации, заключается в том, что молекулярные механизмы, ответственные за развитие устойчивости P. aeruginosa к фторхинолонам и имипенему во время терапии, не перекрываются. Мутационное снижение экспрессии OprD в наружной мембране P. aeruginosa может приводить к развитию устойчивости к имипенему в процессе терапии, но этот механизм не влияет на восприимчивость к фторхинолонам.Аналогичным образом, мутационные изменения в мишенях фторхинолонов или мутации, ведущие к повышенной экспрессии оттокных насосов с несколькими лекарственными средствами, могут привести к возникновению устойчивости к фторхинолонам во время терапии, но не влияют напрямую на восприимчивость к имипенему. Единственным потенциальным исключением, связанным с комбинацией левофлоксацин / имипенем, является двойная устойчивость к фторхинолонам и имипенему, которая развивается, когда мутанты сверхэкспрессируют эффлюксный насос mexEF — oprN . 29 Хотя этот оттокный насос не влияет напрямую на активность имипенема, мутационное увеличение экспрессии этого насоса связано с одновременным снижением транскрипционной и трансляционной экспрессии oprD , что приводит к двойной устойчивости к обоим препаратам.Хотя это теоретически правдоподобно, профилактика этого типа устойчивости к антибиотикам с помощью комбинированной терапии еще не подтверждена в клинических испытаниях.
Клиническая применимость комбинированной терапии при пневмонии, вызванной P. aeruginosa , в конечном итоге основана на снижении вероятности несоответствующего лечения. В ретроспективном многоцентровом обсервационном исследовании испанских больниц, которое включало 183 эпизода мономикробной ВАП P. aeruginosa , использование двух эмпирических антипсевдомональных антибиотиков привело к меньшей микробиологической неудаче и повышению выживаемости. 30 Однако использование монотерапии в окончательной схеме не повлияло на смертность, продолжительность пребывания, развитие резистентности или появление рецидивов. Напротив, недавний метаанализ 11 испытаний, из которых 13,8% были инфицированы видами Pseudomonas , сравнивал монотерапию с комбинированной терапией при клиническом подозрении на ВАП. 31 Никаких различий в смертности между сравниваемыми схемами не наблюдалось. Показатели смертности и неэффективности лечения при монотерапии по сравнению с комбинированной терапией также были сходными.Исследование было ограничено низким процентом эпизодов ВАП, вызванных МЛУ или трудноизлечимыми организмами в исследованиях. Поскольку можно было ожидать, что эти пациенты получат наибольшую пользу от эмпирической комбинированной терапии, неудивительно, что эмпирическая комбинированная терапия не показала преимущества монотерапии. Heyland и соавторы 32 впоследствии провели многоцентровое рандомизированное исследование для сравнения эффекта комбинированной терапии с эффектом монотерапии антибиотиками широкого спектра действия на 28-дневную смертность при начальном лечении тяжелобольных пациентов с подозрением на позднее начало заболевания. ВАП.В целом монотерапия была связана с аналогичными результатами по сравнению с комбинированной терапией, но в подгруппе пациентов, у которых была инфекция из-за видов Pseudomonas , видов Acinetobacter и грамотрицательных бактерий с МЛУ при включении, адекватность исходных антибиотиков (84,2%) против 18,8%, P <0,001), а микробиологическая эрадикация инфекционных организмов (64,1% против 29,4%, P = 0,05) была выше в группе комбинированной терапии, чем в группе монотерапии.Также сообщалось о более короткой продолжительности вентиляции и пребывания в отделении интенсивной терапии, а также о более низкой смертности в отделениях интенсивной терапии и больницах. Несмотря на отсутствие различий в клинических исходах, этот анализ подгруппы не смог продемонстрировать статистическую значимость. При отсутствии убедительных доказательств обратного следует начинать комбинированную стратегию двух активных антипсевдомонадных агентов, когда местные паттерны резистентности и индивидуальные факторы риска пациента предполагают возможность пневмонии P. aeruginosa .
Продолжительность лечения
Оптимальная продолжительность противомикробной терапии P. aeruginosa пневмонии остается неопределенной. При неосложненной ВАП, диагностированной при бронхоскопии, короткий курс терапии (8 дней против 15 дней) был столь же эффективен, как и традиционная длительная терапия. 33 В 8-дневной группе количество дней без антибиотиков к 28-му дню увеличилось, а изоляция устойчивых патогенов при диагностировании рецидива снизилась.Смертность в 8-дневной группе составила 18,8% по сравнению с 17,2% в 15-дневной группе, абсолютная разница 1,6% (90% доверительный интервал –3,7% –6,9%). Теоретически такой подход снижает экологическую нагрузку и уменьшает побочные эффекты без ущерба для результата. Однако подгруппа пациентов с неферментирующими грамотрицательными бактериями (включая P. aeruginosa ) имела более высокий уровень рецидивов легочной инфекции при 8-дневном режиме лечения. Одна из возможных причин отсроченного искоренения P.aeruginosa из альвеолярного пространства может быть связано с наличием системы секреции типа III, которая нарушает функции нейтрофилов. 34 Можно рассмотреть более длительную терапию ВАП, вызванной неферментирующими грамотрицательными бациллами, 35 , но остается неизвестным, будет ли продолжительная терапия антибиотиками способствовать улучшению исходов или уменьшению рецидивов. Альтернативный подход заключался бы в реализации стратегии наблюдения в сочетании с ранним бронхоскопическим вмешательством после прекращения короткого курса антибактериальной терапии. 33 Необходимы дальнейшие исследования для подтверждения безопасности и эффективности этих подходов.
Антипсевдомонадная терапия
Полимиксины
Отсутствие разрабатываемых новых классов антибиотиков для грамотрицательных бактерий с МЛУ привело к возрождению старых антибиотиков в качестве последнего средства лечения пневмонии, вызванной MDR P. aeruginosa . 36 Полимиксины представляют собой циклические положительно заряженные пептидные антибиотики, происходящие от различных видов Paenibacillus ( Bacillus ) polymyxa .Из пяти первоначально описанных полимиксинов (полимиксинов A – E) два [полимиксин B и полимиксин E (колистин)] использовались в клинических условиях. Механизм действия этих соединений включает эффект, подобный детергенту, который нарушает целостность мембраны и приводит к утечке внутриклеточных компонентов. 37 Благодаря этому отличительному свойству они защищены от перекрестной устойчивости с другими антипсевдомонадными агентами и защищены от быстрого выбора устойчивости. 38
Большая часть повторного введения полимиксинов в последнее десятилетие была сосредоточена на колистине.Колистин все чаще используется в качестве лечебного средства 39 отдельно или в сочетании с одним или несколькими антибактериальными средствами для лечения пневмонии с штаммами МЛУ. 40–48 В отсутствие терапевтических альтернатив эффективность внутривенного колистина для лечения серьезных инфекций, вызванных MDR P. aeruginosa , перевешивает риск нефротоксичности и нейротоксичности. Недавние исследования с использованием колистина для внутривенного введения показали уровень нефротоксичности от 8% до 36%. 49 Риск нефротоксичности связан с исходной функцией почек и длительными курсами (> 4 недель) колистина. Для сравнения, у 7–29% реципиентов колистина развивается нейротоксичность в виде оральных и периоральных парестезий, нарушений зрения и полинейропатии, с редкими случаями дыхательной недостаточности или респираторного апноэ. 41,50
Синергия in vitro между колистином и рифампицином привела к использованию комбинированной терапии у нескольких пациентов с пневмонией, вызванной MDR P.aeruginosa инфекция. 47,51 Однако данные ограниченных клинических исследований показывают, что эта комбинированная терапия не превосходила монотерапию колистином. 46,52,53 Другие противомикробные препараты также использовались в комбинации с колистином, включая имипенем, меропенем, азтреонам, пиперациллин, цефтазидим и ципрофлоксацин, но ни один из этих режимов не показал улучшения результатов в клинических исследованиях. 53
Спорадические случаи 54,55 инфекций, вызванных устойчивостью к колистину P.aeruginosa . Устойчивость к колистину подтверждена также у продуцирующих металло-β-лактамазы P. aeruginosa . 56 В одном отчете клиническое излечение этих инфекций наблюдалось у двух из трех пациентов с подозрением на пневмонию с помощью комбинации колистиновых и β-лактамных антибиотиков. 57 Продолжительное воздействие колистина (> 2 недель) было предпосылкой для развития устойчивости у этих конкретных штаммов. Механизм включает измененный PmrAB, активируемый сенсорной фосфокиназой, с сопутствующим селективным подавлением соответствующего дезактиватора фосфатазы PmrB.Это приводит к конститутивной активации регулона PmrA, который стимулирует синтез аминоарабинозы. 58 Другие предложенные механизмы включают сверхэкспрессию OprH, вызванную мутацией или в результате адаптации к среде с дефицитом Mg 2+ . 59
По сравнению с колистином, существует очень ограниченный клинический опыт применения полимиксина B в лечении пневмонии P. aeruginosa . Насколько нам известно, четыре исследования изучали использование внутривенного полимиксина B для лечения инфекций нижних дыхательных путей, вызванных MDR P.aeruginosa . Фуртадо и его сотрудники 60 ретроспективно проанализировали 74 пациента с пневмонией MDR P. aeruginosa , получавших полимиксин B путем непрерывной инфузии в течение 24 часов. Сопутствующая антибактериальная терапия назначена 28 пациентам (37,8%). Имипенем был наиболее распространенным средством, применяемым в комбинации. Продолжительность терапии полимиксином B составляла от 5 до 38 дней. Хотя у 35 пациентов (47,3%) к концу лечения симптомы и признаки исчезли полностью или частично, внутрибольничная летальность повысилась до 74.3%. Два других исследования 61,62 изучали внутривенное использование полимиксина B в подгруппе пациентов с инфекциями, вызванными продуцирующей металло-β-лактамазой P. aeruginosa . У 22 пациентов была внутрибольничная пневмония, в том числе 10 пациентов с ВАП. Несмотря на адекватную терапию, 30-дневная летальность превысила 50%. Ранее Sobieszczyk и его коллеги 63 провели ретроспективный анализ 25 пациентов с пневмонией в критическом состоянии, получивших 29 курсов полимиксина B в сочетании с другим противомикробным препаратом.Шесть из этих курсов проводились в аэрозольной форме. P. aeruginosa был выделен в 41% случаев. Средняя продолжительность терапии полимиксином B составляла 19 дней (от 2 до 57 дней). Сорок один процент достиг микробиологической очистки. Смертность в конце лечения составила 21%, а общая смертность при выписке — 48%. Нефротоксичность наблюдалась у трех пациентов (10%) и не привела к отмене терапии.
Принимая во внимание предварительные данные наблюдательных исследований, которые подтверждают не меньшую эффективность внутривенных полимиксинов, терапию следует ограничить штаммами с МЛУ в течение ≤ 2 недель при оптимизации фармакокинетики и фармакодинамики.Деэскалация должна проводиться во всех случаях, когда результаты посева позволяют заменить другой антибиотик. Между тем, необходимы будущие рандомизированные контролируемые исследования для оценки эффективности монотерапии колистином или комбинированной терапии в лечении пневмонии, вызванной MDR P. aeruginosa .
Новые антипсевдомонадные антибиотики
Дорипенем
Дорипенем — новый карбапенем с сильной in vitro активностью против различных аэробных и анаэробных грамположительных и грамотрицательных бактерий. 64,65 Он стабилен в отношении многих β-лактамаз, за исключением металло-β-лактамаз класса B, и, как меропенем, имеет некоторую стабильность в отношении почечной дегидропептидазы I. Он связывается с пенициллин-связывающими белками, вызывая клеточную стенку повреждение и бактериальная гибель. Коррекция дозы через почки требуется, так как препарат выводится почками. In vitro Антибактериальная активность против P. aeruginosa дикого типа в 2–4 раза сильнее, чем меропенем и имипенем. 66–69 В исследовании, сравнивающем активность in vitro дорипенема с другими антипсевдомонадными антибиотиками (имипенем, левофлоксацин, пиперациллин, цефтазидим, азтреонам, тобрамицин и цефепим), МПК всех препаратов сравнения по сравнению с дорипенемом была ниже. с.aeruginosa . 67 На основании данных MIC 50 и MIC 90 , дорипенем оказался наиболее сильнодействующим карбапенемом. Дорипенем имел МИК 90 с 2 и 16 мг / л для чувствительных и устойчивых к цефтазидиму изолятов, соответственно, по сравнению с меропенемом (8 и 32 мг / л соответственно) и имипенемом (16 и 32 мг / л соответственно). . 70 Кроме того, склонность к отбору устойчивых мутантов P. aeruginosa in vitro была ниже для дорипенема, чем для других карбепенемов. 71
Недавно были опубликованы два клинических исследования, оценивающих эффективность дорипенема при внутрибольничной пневмонии. В первом рандомизированном открытом исследовании фазы III 72 из 531 пациента сравнивали дорипенем с имипенемом. Пациенты были рандомизированы для получения одной из трех схем лечения: 500 мг дорипенема каждые 8 часов через 4 часа внутривенной инфузии, 500 мг имипенема каждые 6 часов через 30 минут инфузии или 1000 мг имипенема каждые 8 часов через 60 минут внутривенной инфузии в течение 7-14 дней. .Пациенты, которым назначен имипенем, получали либо 500 мг каждые 6 часов, либо 1000 мг каждые 8 часов в зависимости от практики учреждения. Эти две схемы приема имипенема считались фармакодинамически эквивалентными. Статистически значимой разницы в клиническом излечении между двумя группами не было (68,3% для дорипенема и 64,8% для имипенема). При анализе подгрупп P. aeruginosa было выделено у 28 пациентов в группе дорипенема и у 25 пациентов в группе имипенема. МИК была <8 мг / л для всех изолятов на исходном уровне и 18% в целом (исходные и последующие культуры) в группе дорипенема по сравнению с 13.2% на исходном уровне и 64% в целом (исходные и последующие культуры) в группе имипенема ( P <0,01). Также наблюдалась статистически незначимая тенденция к более высокому уровню клинического излечения при применении дорипенема [16/20 (80%)] по сравнению с имипенемом [6/14 (42,9%)]. Во втором рандомизированном проспективном открытом исследовании фазы III 73 448 пациентов с нозокомиальной пневмонией или ранним началом ВАП (<5 дней) сравнивали дорипенем с пиперациллином / тазобактамом. Пациенты были рандомизированы для получения либо 500 мг дорипенема внутривенно каждые 8 часов в виде 1-часовой инфузии, либо 4.5 г пиперациллина / тазобактама внутривенно каждые 6 ч в виде 30-минутной инфузии. Пониженная терапия пероральным левофлоксацином была разрешена через ≥72 ч. В целом показатели микробиологического и клинического излечения в популяции, поддающейся клинической оценке, составили 84,5% и 81,3% для дорипенема и 80,7% и 79,8% для пиперациллина / тазобактама ( P = NS) соответственно. Показатели благоприятных микробиологических исходов в отношении P. aeruginosa были выше в группе дорипенема, чем в группе пиперациллин / тазобактам, но разница не была статистически значимой.В результате более высокая доза дорипенема (1 г вводится в течение 4 часов каждые 8 часов) сравнивается с имипенемом / циластатином (1 г внутривенно каждые 8 часов) в рандомизированном двойном слепом многоцентровом исследовании с участием пациентов с ВАП, исходя из предположения, что эта доза обеспечит более длительную продолжительность уровня свободного лекарственного средства выше МПК, чем ранее используемая доза 500 мг для большинства организмов, вызывающих ВАП, включая более устойчивые виды P. aeruginosa и Acinetobacter .
Биапенем
Биапенем — это парентеральное антибактериальное средство на основе карбапенема, которое было запущено в Японии в 2002 году и в настоящее время проходит фазу II испытаний в США. Он обладает широким спектром антибактериальной активности in vitro против грамотрицательных (включая штаммы, продуцирующие β-лактамазы и P. aeruginosa ), грамположительных и анаэробных бактерий. Биапенем показывает хороший постантибиотический эффект, аналогичный имипенему, и обладает высокой бактерицидной активностью в отношении штаммов, образующих биопленку Pseudomonas , , 74, и нескольких мутантов системы оттока. 75 Средний период полувыведения из плазмы составляет ~ 1 час, а рекомендуемая доза составляет 300 мг, вводимых в виде внутривенной инфузии два раза в день. 76 Дозировка должна быть скорректирована при наличии почечной недостаточности.
Хотя активность in vitro биапенема против P. aeruginosa , как правило, аналогична активности имипенема в большинстве исследований, два исследования показали, что биапенем был более активен, чем имипенем. 77,78 Например, из 67 клинических изолятов P.aeruginosa 98% были восприимчивы к биапенему при концентрациях ≤8 мг / л, по сравнению с 84% чувствительны к имипенему (при концентрациях ≤8 мг / л). В клинических испытаниях 300 мг биапенема два раза в день продемонстрировали клиническую и бактериологическую эффективность, аналогичную эффективности 500 мг имипенема / циластатина два раза в день (каждый раз в течение 14 дней) у взрослых пациентов с различными типами бактериологически задокументированных инфекций нижних дыхательных путей, включая инфекции нижних дыхательных путей. с P. aeruginosa . 79,80 Показатели клинической эффективности в группах биапенема и имипенема / циластатина составили 94.8% (73/77 пациентов) и 92,8% (64/69) соответственно. Бактериальная эрадикация была достигнута у 90,9% (20/22) реципиентов биапенема и 93,1% (27/29) реципиентов имипенема / циластатина.
Томопенем
Томопенем (CS-023) представляет собой новый 1-β-метилкарбапенем, который обладает очень широким спектром активности против грамположительных и грамотрицательных бактерий, включая P. aeruginosa , метициллин-устойчивый Staphylococcus aureus и пенициллин- устойчивый Streptococcus pneumoniae.In vitro и . Исследования in vivo на мышах 81,82 показали, что томопенем проявляет повышенную активность против P. aeruginosa . Считается, что его мощная активность широкого спектра связана с его сильным сродством к пенициллин-связывающим белкам 2 и 3. Подобно другим новым карбапенемам, томопенем демонстрирует очень низкую тенденцию к спонтанному возникновению устойчивости. 83
На мышиной модели хронической инфекции дыхательных путей, вызванной P. aeruginosa , томопенем значительно снизил количество жизнеспособных бактерий по сравнению с контролем. 84 Что более многообещающе, так это то, что томопенем оставался активным против лабораторных мутантов P. aeruginosa , характеризующихся избыточной продукцией хромосомно-кодируемой β-лактамазы AmpC, дефицитом OprD и избыточной продукцией многокомпонентных эффлюксных насосов MexAB – OprM и MexCD – OprJ. 85 До сих пор все данные получены из исследований in vitro , и до сих пор не было начато никаких клинических испытаний.
Цефтобипрол
Цефтобипрол представляет собой цефалоспорин пятого поколения, обладающий свойствами, аналогичными свойствам томопенема, по его сильному сродству к пенициллин-связывающим белкам.Цефтобипрол медокарил представляет собой водорастворимое пролекарство, которое быстро (за секунды) превращается в активное лекарственное средство, диацетил и диоксид углерода эстеразами плазмы. Незначительное количество цефтобипрола превращается в метаболит с открытым кольцом путем гидролиза. 86
Антипсевдомональная активность цефтобипрола аналогична активности цефепима, демонстрируя идентичные МИК 50 и МИК 90 в исследованиях in vitro . 87 В исследовании, посвященном оценке 741 изолята P.aeruginosa , 72% изолятов ингибировались цефтобипролом ≤4 мг / л, по сравнению с 68% и 73% изолятов, которые ингибировались цефепимом и цефтазидимом ≤4 мг / л, соответственно. 88
Цефтобипрол завершил одно исследование фазы III по лечению внутрибольничной пневмонии (HAP), включая подгруппу пациентов с VAP. 89 Участники были рандомизированы для получения 500 мг цефтобипрола внутривенно каждые 8 часов в виде 2-часовой инфузии или цефтазидима плюс линезолид в течение 7–14 дней.У 70 пациентов было пневмонии P. aeruginosa . В целом, 69% пациентов, прошедших клиническую оценку (CE), были излечены цефтобипролом по сравнению с 72% пациентов, получавших комбинированную терапию. Исследование соответствовало критериям не меньшей эффективности как в популяции CE, так и в популяции, собирающейся лечиться. В популяции пациентов с ХЭ, за исключением ВАП, частота клинического излечения составила 77% для цефтобипрола и 76% для комбинированной терапии. Однако показатели излечения в подгруппе пациентов с ВАП были ниже у пациентов, получавших цефтобипрол, и не могло быть установлено не меньшей эффективности. 89 Интересно, что разница в уровне микробиологической эрадикации между группами лечения, которые отдавали предпочтение группе цефтазидим / линезолид, не была связана с P. aeruginosa .
Ситафлоксацин
Ситафлоксацин имеет активность, сравнимую с активностью ципрофлоксацина, в отношении штаммов дикого типа P. aeruginosa , но показывает более низкие значения МИК для мутантов gyrA или parC из-за лучшего сродства к мутантным мишеням. 90 Фототоксичность — главный недостаток всех 8-хлорпроизводных класса фторхинолонов. Рандомизированное открытое многоцентровое исследование фазы II продемонстрировало, что ситафлоксацин (400 мг один раз в день) был так же безопасен и хорошо переносился, как имипенем (500 мг три раза в день) для лечения пневмонии, включая два случая P A. aeruginosa пневмония, по одному в каждой группе. 91
Антибиотики в аэрозольной форме
Антибиотики в аэрозольной форме использовались для лечения и профилактики пневмонии, в основном у пациентов с хроническими псевдомонадными инфекциями, обнаруживаемыми при муковисцидозе. 92 Однако недостаточно данных в поддержку использования аэрозольных антибиотиков для лечения HAP и VAP, вызванных P. aeruginosa , у пациентов с неуковным фиброзом. Рекомендации ATS / IDSA по лечению HAP и VAP рекомендуют использовать аэрозольные антибиотики только у отдельных пациентов, которые не реагируют на системные антибиотики. 7 Недавно было завершено исследование фазы II (AMIK-04-02) аэрозольного BAY 41-6551, доставляемого через запатентованную Pulmonary Drug Delivery System ™ интубированным и искусственно вентилируемым пациентам с VAP или HAP. 93 Подходящие пациенты были рандомизированы в соотношении 1: 1 для получения либо аэрозольного препарата BAY 41-6551 (400 или 800 мг), либо плацебо каждые 12 часов в течение 7–14 дней. Шестьдесят девять пациентов были включены в это многоцентровое многонациональное исследование, при этом 67 пациентов получили по крайней мере одну дозу исследуемого лекарства. Доставка амикацина в форме аэрозоля (Amikacin Inhale; Nektar, CA, USA) позволила достичь высоких концентраций аминогликозида амикацина в жидкости, выстилающей эпителиальную поверхность нижних дыхательных путей, в том числе в легочной области легких, при сохранении безопасных концентраций в сыворотке.О серьезных событиях не сообщалось. Основываясь на результатах этого испытания, для фазы III испытания, которое в настоящее время проводится (проводится компаниями Bayer Healthcare и Nektar Therapeutics), была выбрана доза 400 мг каждые 12 часов.
Параллельно с этим мало данных об использовании аэрозольного колистина у пациентов без муковисцидоза. Несмотря на отсутствие рандомизированных контролируемых испытаний, эффективность ингаляционного колистина при пневмонии, вызванной MDR P. aeruginosa , была высказана в недавних исследованиях.Pereira et al. 94 описали клинические особенности и исходы у 19 пациентов, получавших ингаляционный полимиксин B. У четырнадцати из них была внутрибольничная пневмония (у 11 была ВАП), и они одновременно лечились внутривенным полимиксином B. P. aeruginosa был этиологическим агентом у 11 из них. эти 14 пациентов. Девять (64%) из 14 пациентов умерли во время госпитализации, хотя 13 (93%) из них первоначально были описаны как имеющие положительный ответ. Интересно, что у большинства пациентов, отобранных для этого исследования, ранее не применялась внутривенная терапия полимиксином B.В аналогичном исследовании 60 пациентов в критическом состоянии, инфицированных грамотрицательными бактериями с множественной лекарственной устойчивостью, получали 2,2 ± 0,7 миллиона МЕ колистина в аэрозольной форме для лечения ВАП. 95 P. aeruginosa был зарегистрирован у 12 пациентов. Бактериологический и клинический ответ наблюдался у 50/60 (83,3%) пациентов с общей смертностью 25%. Никаких побочных эффектов, связанных с вдыханием колистина, зарегистрировано не было. Недавно Falagas et al. 96 рассмотрены опубликованные данные о монотерапии пневмонией с использованием аэрозольных антибиотиков в 63 случаях. изолятов P. aeruginosa составили 16% всех патогенов. Колистин (49%), пенициллин (37%) и аминогликозиды (17%) были антимикробными препаратами, вводимыми через дыхательные пути. Одновременно системные противомикробные препараты были назначены 33% (21/63) пациентов. Клиническое излечение и бактериологическая эрадикация в вышеупомянутых образцах наблюдались у 86% (54/63) и 85% (33/39) пациентов, соответственно. Для 31 пациента, по которому были доступны данные, смертность от всех причин и соответствующая смертность составили 36% (11/31) и 10% (3/31), соответственно.В другом метаанализе пяти рандомизированных контролируемых исследований 176 пациентов с нозокомиальной пневмонией (включая пневмонии P. aeruginosa ) Иоанниду и его коллеги 97 сравнили введение противомикробных препаратов через дыхательные пути (с или без одновременного применения системных антибиотиков). с контрольной обработкой. Тобрамицин использовался в трех исследованиях, сизомицин в одном и гентамицин в другом. Одновременное использование системного антибиотика было разрешено в четырех исследованиях. Более высокий успех лечения наблюдался у пациентов с нозокомиальной пневмонией, получавших лечение антибиотиками респираторным путем (путем ингаляции или эндотрахиальной инстилляции).Однако ни уровень смертности, ни частота резистентности статистически не различались.
В настоящее время исследуются новые препараты для ингаляционной терапии ципрофлоксацина и азтреонама. Ингаляционный липосомальный препарат ципрофлоксацина был недавно одобрен FDA США для лечения бронхоэктазов. Разработанный для продления кратковременного действия ципрофлоксацина и локализации его активности в легких, аэрозольный состав предназначен для обеспечения достаточного воздействия на легкие для лечения этих инфекций.В настоящее время планируется исследование фазы III для оценки его эффективности у пациентов с ВАП. Аналогичным образом, ингаляционный состав лизината азтреонама был протестирован в клинических испытаниях фазы III на пациентах с муковисцидозом, которые колонизированы легочными бактериями P. aeruginosa . Предварительные данные показали значительное снижение количества колониеобразующих единиц P. aeruginosa на по сравнению с плацебо. 98 Препарат в настоящее время находится на рассмотрении FDA США.
Хотя имеющиеся данные, по-видимому, предполагают, что аэрозольная антимикробная терапия для P.aeruginosa пневмонию не следует исключать a priori , отсутствие крупных рандомизированных контролируемых исследований продолжает вызывать озабоченность по поводу его эффективности и возможного появления резистентности.
Новые антибактериальные средства
Повышение устойчивости к антибиотикам и появление штаммов МЛУ привели к разработке экспериментальных новых антибактериальных агентов помимо антибиотиков. В то время как антибиотики нацелены на рост бактерий, попытка ослабить бактерии путем вмешательства в высвобождение факторов вирулентности является многообещающей альтернативой для борьбы с растущей заболеваемостью бактериями с множественной лекарственной устойчивостью.Многие из этих агентов представляют собой антитела, которые связываются с белками или рецепторами, расположенными в организме бактерии, и поэтому инактивируют одну из систем вирулентности, ответственных за ее патогенез. Хотя обсуждение всех потенциальных терапевтических мишеней выходит за рамки данной статьи, три моноклональных антитела проходят клинические испытания, причем одно из них предназначено для пациентов с искусственной вентиляцией легких.
Ингибирование системы секреции типа III
Система секреции типа III (TTSS) является одним из механизмов вирулентности, связанных с тяжелым заболеванием и повышенной смертностью у пациентов с VAP, вызванным P.aeruginosa . 99,100 TTSS представляет собой комплекс бактериальных структур, которые обеспечивают грамотрицательные бактерии мощным механизмом вирулентности, позволяя им вводить бактериальные эффекторные белки непосредственно в цитоплазму клетки-хозяина, что позволяет бактериям вызывать изменения в иммунной системе клетки и повреждение эпителиальных клеток. 101–103 Система состоит из трех отдельных белковых комплексов: самого аппарата секреции, аппарата транслокации или нацеливания (белок PcrV), а также секретируемых токсинов (эффекторных белков) и их родственных шаперонов. 104 Вирулентность TTSS наблюдалась не только на животных моделях, но и у пациентов с VAP P. aeruginosa , у которых TTSS-позитивный фенотип было трудно искоренить в легочной ткани даже после соответствующей обработки антибиотиками. 34
В модели инфекции легких мышей иммунизация белком PcrV обеспечивала защиту от летальной инфекции легких, повреждения легких и клеточной токсичности. 105,106 Антитела к PcrV также ингибировали транслокацию токсинов III типа.Более того, вакцинация против PcrV увеличивала выживаемость зараженных мышей и уменьшала воспаление и повреждение легких. 107 Эти многообещающие результаты проложили путь к фазе I / II испытания на людях с использованием моноклональных антител против PcrV. Фрагмент антитела, конъюгированный с полиэтиленгликолем (ПЭГ), в настоящее время находится в стадии клинической разработки для лечения инфекций легких P. aeruginosa при муковисцидозе и у пациентов с механической вентиляцией легких. 108 Этот кандидат в лекарство обладает новыми свойствами, которые решают потенциальные проблемы с антибактериальными средствами на основе антител.Активность Fab-фрагмента считается ключевой в снижении чувствительности к протеазам Pseudomonas , которые разрушают антитела IgG, в то время как пегилирование продлевает период полужизни in vivo и дополнительно снижает восприимчивость к протеолитической инактивации. Способность Fab-фрагмента инактивировать TTSS приводит к предотвращению инъекции токсина в клетки и предотвращает прямое уничтожение макрофагов TTSS, которое происходит даже в отсутствие токсинов. 109
Выводы
П.aeruginosa пневмония часто является тяжелым и опасным для жизни заболеванием. Управление этой инфекцией представляет собой сложную терапевтическую задачу для врачей интенсивной терапии, поскольку растущий уровень устойчивости этих микроорганизмов к большинству классов противомикробных агентов часто приводит к клинической неудаче. Выбор адекватных антибиотиков имеет решающее значение для увеличения выживаемости. Новое поколение антибиотиков не дает существенных преимуществ по сравнению с традиционным арсеналом противомикробных средств.Для пациентов, инфицированных штаммами МЛУ, существует очень мало клинических вариантов. Колистин стал жизнеспособной альтернативой для инфицированных этими штаммами. Вопрос о том, дает ли комбинированная терапия с колистином преимущество перед монотерапией, требует будущих рандомизированных исследований. Учитывая ограниченный набор новых классов противомикробных агентов, изучение бактериального генома открыло возможность выявления новых мишеней; тем не менее, большинство этих агентов все еще находятся на стадии предварительных исследований и только что вышли на клиническую арену в рамках фаз I / II испытаний.
Заявления о прозрачности
AES получила исследовательские гранты от компаний Pfizer и Wyeth Pharmaceuticals. AA: не объявлять.
Список литературы
1« и др.Полная последовательность генома Pseudomonas aeruginosa PAO1, условно-патогенного микроорганизма
,Nature
,2000
, vol.406
(стр.959
—64
) 2« и др.Взаимодействие патоген-хозяин у Pseudomonas aeruginosa pneumonia
,Am J Respir Crit Care Med
,2005
, vol.171
(стр.1209
—23
) 4.Восприимчивость к лекарственно-устойчивому Pseudomonas aeruginosa в отделениях интенсивной терапии: результаты европейской группы исследования MYSTIC
,Clin Microbiol Infect
,2003
, vol.9
(стр.980
—3
) 5.Варианты лечения бактерий с множественной лекарственной устойчивостью
,Expert Rev Anti Infect Ther
,2006
, vol.4
(стр.601
—18
) 6« и др.Общество по инфекционным болезням Америки / Американское торакальное общество согласованное руководство по ведению внебольничной пневмонии у взрослых
,Clin Infect Dis
,2007
, vol.44
Дополнение 2
(стр.S27
—72
) 7Американское торакальное общество и Общество инфекционных заболеваний Америки
Рекомендации по ведению взрослых с больничной пневмонией, пневмонией, связанной с аппаратом искусственной вентиляции легких и связанной с оказанием медицинской помощи
,Am J Respir Crit Care Med
,2005
, vol.171
(стр.388
—416
) 8,,.Монотерапия при серьезных внутрибольничных инфекциях: клиническое испытание цефтазидима по сравнению с имипенемом / циластатином. Европейская исследовательская группа
,J Antimicrob Chemother
,1993
, т.31
(стр.927
—37
) 9« и др.Проспективное рандомизированное сравнение имипенема-циластатина и пиперациллина-тазобактама при внутрибольничной пневмонии или перитоните
,Противомикробные препараты Chemother
,1998
, vol.42
(стр.2966
—72
) 10« и др.Лечение тяжелой пневмонии у госпитализированных пациентов: результаты многоцентрового рандомизированного двойного слепого исследования по сравнению внутривенного ципрофлоксацина с имипенем-циластатином
,Противомикробные агенты Chemother
,1994
, vol.38
(стр.547
—57
) 11« и др.Появление устойчивых к антибиотикам Pseudomonas aeruginosa : сравнение рисков, связанных с различными антипсевдомонадными агентами
,Противомикробные агенты Chemother
,1999
, vol.43
(стр.1379
—82
) 12« и др.Влияние целесообразности начальной антибиотикотерапии на исход ИВЛ-ассоциированной пневмонии
,Intensive Care Med
,2001
, vol.27
(стр.355
—62
) 13« и др.Неадекватное противомикробное лечение инфекций: фактор риска госпитальной смертности тяжелобольных
,Chest
,1999
, vol.115
(стр.462
—74
) 14« и др.Внутрибольничная пневмония у взрослых: диагностика, оценка степени тяжести, начальная антимикробная терапия и профилактические стратегии: согласованное заявление
,Am J Respir Crit Care Med
,1996
, vol.153
(стр.1711
—25
) 15« и др.Раннее лечение антибиотиками при подтвержденной БАЛ-ассоциированной пневмонии: роль обычных эндотрахеальных аспиратных культур
,Chest
,2005
, vol.127
(стр.589
—97
) 16« и др.Предыдущий эндотрахеальный аспират позволяет направлять начальное лечение вентилятор-ассоциированной пневмонии
,Intensive Care Med
,2009
, vol.35
(стр.101
—7
) 17« и др.Пневмония, связанная с ИВЛ, вызванная микроорганизмами с множественной лекарственной устойчивостью или Pseudomonas aeruginosa : распространенность, заболеваемость, факторы риска и исходы
,J Crit Care
,2008
, vol.23
(стр.18
—26
) 18,,, et al.Пневмония, связанная с вентилятором, вызванная потенциально лекарственно-устойчивыми бактериями
,Am J Respir Crit Care Med
,1998
, vol.157
(стр.531
—9
) 19« и др.Идентификация пациентов с Pseudomonas aeruginosa инфекциями дыхательных путей с наибольшим риском инфицирования устойчивыми к карбапенемам изолятами
,Infect Control Hosp Epidemiol
,2007
, vol.28
(стр.959
—65
) 20« и др.Устойчивый к фторхинолонам Pseudomonas aeruginosa : оценка факторов риска и клинического воздействия
,Am J Med
,2006
, vol.119
(стр.526.e19
—25
) 21« и др.Важность рассмотрения множественной лекарственной устойчивости и отказа от допущения об устойчивости к отдельным лекарствам в исследованиях случай-контроль
,Infect Control Hosp Epidemiol
,2006
, vol.27
(стр.670
—4
) 22,.Факторы риска для изоляции Acinetobacter baumannii и Pseudomonas aeruginosa с множественной лекарственной устойчивостью: систематический обзор литературы
,J Hosp Infect
,2006
, vol.64
(стр.7
—15
) 23« и др.Инструмент клинического прогнозирования для выявления пациентов с Pseudomonas aeruginosa инфекциями дыхательных путей с наибольшим риском множественной лекарственной устойчивости
,Противомикробные агенты Chemother
,2007
, vol.51
(стр.417
—22
) 24« и др.Новые рекомендации NCCLS, разработка и клиническое применение
,Hosp Pharm
,2004
, vol.39
(стр.542
—53
) 25« и др.Определение оптимальных комбинаций для эмпирической двойной антимикробной терапии инфекции Pseudomonas aeruginosa : потенциальная роль комбинированной антибиотикограммы
,Инфекционный контроль Hosp Epidemiol
,2006
, vol.27
(стр.413
—5
) 26« и др.Антибактериальная терапия Pseudomonas aeruginosa бактериемия: корреляция результатов в проспективном исследовании 200 пациентов
,Am J Med
,1989
, vol.87
(стр.540
—6
) 27,.Синергетические комбинации антибиотиков при грамотрицательных бациллярных инфекциях
,Rev Infect Dis
,1982
, vol.4
(стр.294
—301
) 28,.Комбинация левофлоксацина и имипенема предотвращает появление устойчивости среди клинических изолятов Pseudomonas aeruginosa
,Clin Infect Dis
,2005
, vol.40
(стр.S105
—14
) 29« и др.Характеристика MexE – MexF – OprN, положительно регулируемой системы оттока нескольких лекарственных препаратов Pseudomonas aeruginosa
,Mol Microbiol
,1997
, vol.23
(стр.345
—54
) 30« и др.Оптимальная терапия для лечения Pseudomonas aeruginosa вентилятор-ассоциированной пневмонии: наблюдательное многоцентровое исследование, сравнивающее монотерапию с комбинированной антибиотикотерапией
,Crit Care Med
,2007
, vol.35
(стр.1888
—95
) 31« и др.Эмпирическая антибактериальная терапия при подозрении на респираторно-ассоциированную пневмонию: систематический обзор и метаанализ рандомизированных исследований
,Crit Care Med
,2008
, vol.36
(стр.108
—17
) 32« и др.Рандомизированное исследование комбинированной и монотерапии для эмпирического лечения подозреваемой ИВЛ-пневмонии
,Crit Care Med
,2008
, vol.36
(стр.737
—44
) 33« и др.Сравнение 8-дневной и 15-дневной антибиотикотерапии по поводу вентилятор-ассоциированной пневмонии у взрослых: рандомизированное исследование
,JAMA
,2003
, vol.290
(стр.2588
—98
) 34« и др.Стойкая инфекция Pseudomonas aeruginosa при ИВЛ-ассоциированной пневмонии
,Am J Respir Crit Care Med
,2008
, vol.178
(стр.513
—9
) 35,.Оптимизация продолжительности антибактериальной терапии респираторно-ассоциированной пневмонии
,Eur Respir Rev
,2007
, vol.16
(стр.40
—4
) 36,,.Сульфат полимиксина B и колистин: старые антибиотики для появляющихся мультирезистентных грамотрицательных бактерий
,Ann Pharmacother
,1999
, vol.33
(стр.960
—7
) 37,,.Полимиксины: фармакология, фармакокинетика, фармакодинамика и клиническое применение
,Infect Dis Clin North Am
,2003
, vol.17
(стр.545
—62
) 38,,.Современная оценка методов тестирования чувствительности к противомикробным препаратам для полимиксина B и колистина: обзор доступных критериев интерпретации и руководств по контролю качества
,J Clin Microbiol
,2001
, vol.39
(стр.183
—90
) 39.Потребность в новых антибиотиках
,Clin Microbiol Infect
,2004
, vol.10
Дополнение 4
(стр.1
—9
) 40,,, et al.Внутривенный колистин для лечения внутрибольничных инфекций, вызванных множественной лекарственной устойчивостью Pseudomonas aeruginosa и Acinetobacter baumannii
,Clin Infect Dis
,1999
, vol.28
(стр.1008
—11
) 41« и др.Использование парентерального колистина для лечения серьезной инфекции, вызванной устойчивостью к противомикробным препаратам Pseudomonas aeruginosa
,Clin Infect Dis
,2003
, vol.37
(стр.l54
—60
) 42« и др.Внутривенный колистин в лечении сепсиса от мультирезистентных грамотрицательных бацилл у тяжелобольных
,Crit Care
,2003
, vol.7
(стр.R78
—83
) 43« и др.Эффективность и нефротоксичность внутривенного колистина для лечения пациентов с инфекциями, вызванными грамотрицательными бактериями, чувствительными только к полимиксину (POS)
,Eur J Clin Microbiol Infect Dis
,2006
, vol.25
(стр.596
—9
) 44« и др.Комбинированная терапия с внутривенным колистином для лечения инфекций, вызванных множественной лекарственной устойчивостью грамотрицательных бактерий у пациентов без муковисцидоза
,Противомикробные агенты Chemother
,2005
, vol.49
(стр.3136
—46
) 45« и др.Эффективность и нефротоксичность монотерапии колистином по сравнению с комбинированной терапией колистин-меропенем для грамотрицательных бактериальных инфекций с множественной лекарственной устойчивостью
,Scand J Infect Dis
,2006
, vol.38
(стр.807
—10
) 46« и др.Вентиляционная пневмония, вызванная только чувствительными к колистину микроорганизмами
,Eur Respir J
,2007
, vol.30
(стр.307
—13
) 47« и др.Эффективность и безопасность колистина (натрий-колистиметата) для лечения инфекций, вызванных множественной лекарственной устойчивостью Pseudomonas aeruginosa и Acinetobacter baumannii в больнице Сирирадж, Бангкок, Таиланд
,Int J Infect Dis
,2007
,2007
,11
(стр.402
—6
) 48« и др.Внутривенный натрий сульфометат колистина для терапии инфекций, вызванных множественной лекарственной устойчивостью грамотрицательных бактерий
,J Infect
,2008
, vol.56
(стр.185
—90
) 49« и др.Нефротоксичность колистина для внутривенного введения: проспективная оценка
,Int J Antimicrob Agents
,2005
, vol.26
(стр.504
—7
) 50.Апноэ с внутримышечной терапией колистином
,JAMA
,1964
, vol.190
(стр.421
—4
) 51« и др.Микробиологическая активность и клиническая эффективность комбинации колистина и рифампицина при множественной лекарственной устойчивости Pseudomonas aeruginosa инфекциях
,J Chemother
,2004
, vol.16
(стр.282
—7
) 52« и др.Безопасность и эффективность колистина по сравнению с имипенемом при лечении вентилятор-ассоциированной пневмонии: исследование случай-контроль
,Intensive Care Med
,2007
, vol.33
(стр.1162
—7
) 53,,.Сравнение монотерапии колистином и комбинированной терапии: данные микробиологических исследований, исследований на животных и клинических исследований
,Clin Microbiol Infect
,2008
, vol.14
(стр.816
—27
) 54« и др.Токсичность после длительного (более четырех недель) введения колистина внутривенно
,BMC Infect Dis
,2005
, vol.5
стр.1
55« и др.Эпидемиологическое исследование инфекций, вызванных устойчивостью к карбапенемам Pseudomonas aeruginosa в Калгари: важность штаммов, продуцирующих металло-β-лактамазу (MBL),
,J Infect Dis
,2005
, vol.192
(стр.1606
—12
) 56« и др.Длительное употребление карбапенемов и колистина предрасполагает к респираторно-ассоциированной пневмонии, вызванной устойчивостью к лекарствам Pseudomonas aeruginosa
,Intensive Care Med
,2007
, vol.33
(стр.1524
—32
) 57« и др.Исход инфекций, вызванных устойчивыми к пандлекарствами (PDR) грамотрицательными бактериями
,BMC Infect Dis
,2005
, vol.5
стр.24
58,,.PmrAB, двухкомпонентная регуляторная система Pseudomonas aeruginosa , которая модулирует устойчивость к катионным антимикробным пептидам и добавлению аминоарабинозы к липиду A
,J Bacteriol
,2004
, vol.186
(стр.575
—9
) 59,.Белок h2 внешней мембраны Pseudomonas aeruginosa : участие в адаптивной и мутационной устойчивости к этилендиаминтетраацетату, полимиксину B и гентамицину
,J Bacteriol
,1980
, vol.143
(стр.872
—8
) 60« и др.Внутривенный полимиксин В для лечения внутрибольничной пневмонии, вызванной множественной лекарственной устойчивостью Pseudomonas aeruginosa
,Int J Antimicrob Agents
,2007
, vol.30
(стр.315
—9
) 61« и др.Влияние продукции металло-β-лактамаз на смертность при внутрибольничных инфекциях Pseudomonas aeruginosa
,J Antimicrob Chemother
,2006
, vol.58
(стр.387
—92
) 62« и др.Переоценка Pseudomonas aeruginosa смертности от госпитальной пневмонии в эпоху множественной лекарственной устойчивости, опосредованной металло-β-лактамазой: проспективное обсервационное исследование
,Crit Care
,2006
, vol.10
стр.R114
63« и др.Комбинированная терапия с полимиксином B для лечения грамотрицательных инфекций дыхательных путей с множественной лекарственной устойчивостью
,J Antimicrob Chemother
,2004
, vol.54
(стр.566
—9
) 64. ,Тестирование чувствительности дорипенема к 815 грамположительным и грамотрицательным клиническим изолятам (DORI-M-004)
,2003
Herndon, VA, USA
65,,, et al.Наблюдение за активностью дорипенема в отношении клинических изолятов, собранных во всем мире (2003 г.) (DORI-M-2008)
Тезисы сорок пятого ежегодного собрания Американского общества инфекционистов
2007 г.
Сан-Диего, Калифорния
Чикаго, Иллинойс , США
Американское общество инфекционных болезней
стр.159
66,.In vitro активность дорипенема против изолятов Pseudomonas aeruginosa и Burkholderia cepacia как от пациентов с муковисцидозом, так и от пациентов без муковисцидоза
,Противомикробные агенты Chemother
,, том 2006
.50
(стр.819
—21
) 67« и др.Дорипенем (S-4661), новый карбапенем: сравнительная активность против современных патогенов, включая бактерицидное действие и предварительная оценка in vitro методов
,J Antimicrob Chemother
,2004
, vol.54
(стр.144
—54
) 68,,, et al.In vitro активности дорипенема и шести препаратов сравнения против 423 аэробных и анаэробных бактериальных изолятов из инфицированных ран диабетической стопы
,Противомикробные агенты Chemother
,2008
, vol.52
(стр.761
—6
) 69« и др.Исследование устойчивости Pseudomonas aeruginosa от британских пациентов с муковисцидозом к шести обычно назначаемым противомикробным препаратам
,Thorax
,2003
, vol.58
(стр.794
—6
) 70« и др.In vitro активность дорипенема, карбапенема для лечения сложных инфекций, вызываемых грамотрицательными бактериями, в отношении недавних клинических изолятов из США
,Antimicrob Agents Chemother
,2008
, vol.52
(стр.4388
—99
) 71« и др.Эффективность карбапенемов для профилактики устойчивых к карбапенемам мутантов Pseudomonas aeruginosa
,J Antibiot
,2006
, vol.59
(стр.220
—8
) 72« и др.Эффективность и безопасность внутривенной инфузии дорипенема по сравнению с имипенемом при вентилятор-ассоциированной пневмонии: многоцентровое рандомизированное исследование
,Crit Care Med
,2008
, vol.36
(стр.1089
—96
) 73« и др.Эффективность и безопасность дорипенема по сравнению с пиперациллином / тазобактамом при нозокомиальной пневмонии: рандомизированное открытое многоцентровое исследование
,Curr Med Res Opin
,2008
, vol.24
(стр.2113
—26
) 74,,.Сравнение активности биапенема in vitro с другими противомикробными средствами против клинических изолятов Pseudomonas aeruginosa
,Chemother Jpn
,2002
, vol.50
(стр.1
—10
) 75« и др.Бактерицидная активность биапенема в отношении различных мутантов системы оттока Pseudomonas aeruginosa
,Jpn J Antibiot
,2002
, vol.55
(стр.67
—76
) 76Meiji
,Omegacin® (Biapenem) Информация по назначению
,2002
Kanagawa
Meiji
77,.Активность биапенема in-vitro против 964 клинических изолятов аэробных бактерий
,J Antimicrob Chemother
,1995
, vol.35
(стр.681
—6
) 78« и др.In vitro активность биапенема против недавних грамотрицательных и грамположительных клинических изолятов
,Chemotherapy
,1997
, vol.43
(стр.393
—3
) 79« и др.Сравнительное исследование биапенема и имипенема / циластатина при инфекциях нижних дыхательных путей
,Jpn J Chemother
,2000
, vol.48
(стр.45
—67
) 80« и др.Сравнительное исследование биапенема и имипенема / циластатина при бактериальной пневмонии
,Jpn J Chemother
,1995
, vol.43
(стр.41
—62
) 81« и др.In vitro и in vivo антибактериальная активность CS-023 (RO4
- 3), нового парентерального карбапенема,
Противомикробные агенты Chemother
,2005
, vol.49
(стр.3239
—50
) 82,.CS-023 (R-115685), новый карбапенем с повышенной активностью in vitro против оксациллин-резистентных стафилококков и Pseudomonas aeruginosa
,J Antimicrob Chemother
,2004
, vol.54
(стр.557
—62
) 83« и др.Влияние нарушения функции почек на фармакокинетику томопенема (RO4
- 3 / CS-023), нового карбапенема,
Противомикробные агенты Chemother
,2008
, vol.52
(стр.2360
—6
) 84« и др.In vivo эффективность и фармакокинетика томопенема (CS-023), нового карбапенема, против Pseudomonas aeruginosa в модели хронической инфекции дыхательных путей мышей
,J Antimicrob Chemother
,2008
, vol.62
(стр.1326
—31
) 85« и др.Сильная активность in vitro томопенема (CS-023) против метициллин-резистентных Staphylococcus aureus и Pseudomonas aeruginosa
,Противомикробные агенты Chemother
,2008
, vol.52
(стр.2849
—54
) 86,.Фармакокинетика и фармакодинамика цефтобипрола, цефалоспорина широкого спектра действия против MRSA
,Clin Pharmacokinet
,2008
, vol.47
(стр.21
—33
) 87,,, et al.Взаимодействие цефтобипрола с β-лактамазами молекулярных классов от A до D
,Антимикробные агенты Chemother
,2007
, vol.51
(стр.3089
—95
) 88.Клинический профиль цефтобипрола, нового β-лактамного антибиотика
,Clin Microbiol Infect
,2007
, vol.13
Дополнение 2
(стр.25
—9
) 89,,, et al.и BAP00248 / 307 Study Group
Цефтобипрол в сравнении с цефтазидимом в сочетании с линезолидом для лечения пациентов с нозокомиальной пневмонией
Сорок восьмая ежегодная международная конференция по антимикробным препаратам и химиотерапии (ICAAC) и Ассоциация инфекционных заболеваний США (IDSA) -шестое ежегодное собрание
2008
Вашингтон, округ Колумбия
Вашингтон, округ Колумбия, США
Американское общество микробиологии
стр.444
90« и др.Вклад C-8 заместителя DU-6859a, нового сильнодействующего фторхинолона, в его активность против мутантов ДНК-гиразы Pseudomonas aeruginosa
,Antimicrob Agents Chemother
,1995
, vol.39
(стр.1467
—71
) 91« и др.Открытое рандомизированное многоцентровое исследование, сравнивающее безопасность и эффективность ситафлоксацина и имипенема / циластатина при внутривенном лечении госпитализированных пациентов с пневмонией
,Int J Antimicrob Agents
,2001
, vol.17
(стр.177
—88
) 92« и др.Двойное слепое исследование эндотрахеального тобрамицина в лечении грамотрицательной бактериальной пневмонии. Группа исследования эндотрахеального тобрамицина
,Противомикробные агенты Chemother
,1990
, vol.34
(стр.269
—72
) 93« и др.Доказательства высокого отложения амикацина в легких у пациентов с механической вентиляцией легких (MVP) с пневмонией и здоровых субъектов (HS), получавших дозу NKTR-061
Американское торакальное общество, Международная конференция
2008
Toronto
New York, NY, USA
Американское торакальное общество
94,,.Спасительное лечение пневмонии и начальное лечение трахеобронхита, вызванного мультирезистентными грамотрицательными бациллами, с помощью ингаляционного полимиксина B
,Diagn Microbiol Infect Dis
,2007
, vol.58
(стр.235
—40
) 95« и др.Колистин в аэрозольной форме в качестве дополнительного лечения респираторно-ассоциированной пневмонии, вызванной грамотрицательными бактериями с множественной лекарственной устойчивостью: проспективное исследование
,Respir Med
,2008
, vol.102
(стр.407
—12
) 96« и др.Введение антибиотиков через дыхательные пути в качестве монотерапии пневмонии
,Expert Rev Anti Infect Ther
,2008
, vol.6
(стр.447
—52
) 97,,.Введение противомикробных препаратов через дыхательные пути для лечения пациентов с нозокомиальной пневмонией: метаанализ
,J Antimicrob Chemother
,2007
, vol.60
(стр.1216
—26
) 98« и др.Азтреонам лизин при хронических заболеваниях дыхательных путей Pseudomonas aeruginosa при муковисцидозе
,Am J Respir Crit Care Med
,2008
, vol.178
(стр.921
—8
) 99,,, et al.Секреция белка III типа связана с плохими клиническими исходами у пациентов с вентиляторно-ассоциированной пневмонией, вызванной Pseudomonas aeruginosa
,Crit Care Med
,2002
, vol.30
(стр.521
—8
) 100« и др.Повышенные концентрации ингибитора активатора плазминогена-1 в жидкостях бронхоальвеолярного лаважа связаны с повышенной смертностью в группе пациентов с синегнойной палочкой
,Anesthesiology
,2007
, vol.106
(стр.252
—61
) 101,,.Модуляция эпителиальных функций легких с помощью Pseudomonas aeruginosa
,Trends Microbiol
,2005
, vol.13
(стр.389
—97
) 102« и др.Секреции экзопродуктов штаммов Pseudomonas aeruginosa влияют на тяжесть повреждения альвеолярного эпителия
,Am J Physiol
,1994
, vol.267
(стр.L551
—6
) 103« и др.In vitro клеточная токсичность предсказывает вирулентность Pseudomonas aeruginosa при легочных инфекциях
,Infect Immun
,1998
, vol.66
(стр.3242
—9
) 104.Системы секреции белков типа III у бактериальных патогенов животных и растений
,Microbiol Mol Biol
,1998
, vol.62
(стр.379
—433
) 105« и др.Терапевтическое введение анти-PcrV F (ab ‘) 2 при сепсисе, связанном с Pseudomonas aeruginosa
,J Immunol
,2001
, vol.167
(стр.5880
—6
) 106« и др.Активная и пассивная иммунизация антигеном Pseudomonas V защищает от интоксикации III типа и повреждения легких
,Nat Med
,1999
, vol.5
(стр.392
—8
) 107,,, et al.Влияние антител против PcrV на хронические дыхательные пути мыши Модель инфекции Pseudomonas aeruginosa
,Eur Respir J
,2007
, vol.29
(стр.965
—8
) 108KaloBios
,Новое моноклональное антитело, которое может безопасно избежать и преодолеть лекарственную устойчивость
109,,, et al.Изоляты муковисцидоза Pseudomonas aeruginosa вызывают быстрый, зависимый от секреции типа III, но независимый от ExoU, онкоз макрофагов и полиморфно-ядерных нейтрофилов
,Infect Immun
,2000
, vol.68
(стр.2916
—24
)© Автор 2009. Опубликовано Oxford University Press от имени Британского общества антимикробной химиотерапии. Все права защищены. Для получения разрешений, пожалуйста, пишите на электронную почту: журналы[email protected]
.

 узлы, тряпочные общие полотенца ординаторских и сестринских
узлы, тряпочные общие полотенца ординаторских и сестринских Тут хотелось бы остановиться чуть подробнее – несколько лет назад было поветрие в нескольких регионах, когда в офтальмологические клиники начали обращаться врачи (в основном гинекологи и патологоанатомы) с синегнойным поражением роговицы. Из анамнеза – неудачно потерли глаз во время манипуляций. Как результат, экстренное обращение в ночное время в приемные покои офтальмологических клиник с острейшей болью и язвой на роговице. Про глаза надо запомнить следующее – при любом подозрении необходимо немедленно обращаться к коллегам. Лечение будет стоить копейки, а без оного синегнойка убивает глаз менее чем за сутки, и дальше только энуклеация с последующим протезированием и шансом потери работы. А лучше всего не тереть глаза и использовать защитные очки при любых, а уж тем более подозрительных, манипуляциях
Тут хотелось бы остановиться чуть подробнее – несколько лет назад было поветрие в нескольких регионах, когда в офтальмологические клиники начали обращаться врачи (в основном гинекологи и патологоанатомы) с синегнойным поражением роговицы. Из анамнеза – неудачно потерли глаз во время манипуляций. Как результат, экстренное обращение в ночное время в приемные покои офтальмологических клиник с острейшей болью и язвой на роговице. Про глаза надо запомнить следующее – при любом подозрении необходимо немедленно обращаться к коллегам. Лечение будет стоить копейки, а без оного синегнойка убивает глаз менее чем за сутки, и дальше только энуклеация с последующим протезированием и шансом потери работы. А лучше всего не тереть глаза и использовать защитные очки при любых, а уж тем более подозрительных, манипуляциях
 Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa
Таким образом, удастся снизить антимикробную нагрузку на внутрибольничную флору, уменьшить ее селективность и снизить вероятность селекции нозокомиальных штаммов самой P.aeruginosa Это лучший способ избежать заражения псевдомонадой. Если вы находитесь в больнице, убедитесь, что врачи и медсестры всегда моют руки, прежде чем прикасаться к вам.
Это лучший способ избежать заражения псевдомонадой. Если вы находитесь в больнице, убедитесь, что врачи и медсестры всегда моют руки, прежде чем прикасаться к вам. Если ваш врач прописал вам лекарство для контроля состояния здоровья, принимайте его точно так, как предписано. Не пропускайте дозу. После операции внимательно следите за признаками инфекции. Если у вас поднялась температура, появилась боль, покраснение или выделения на месте операции, немедленно обратитесь к врачу.
Если ваш врач прописал вам лекарство для контроля состояния здоровья, принимайте его точно так, как предписано. Не пропускайте дозу. После операции внимательно следите за признаками инфекции. Если у вас поднялась температура, появилась боль, покраснение или выделения на месте операции, немедленно обратитесь к врачу.
 И не используйте те, которые были прописаны кому-то другому.
И не используйте те, которые были прописаны кому-то другому.