Физическое развитие детей, рожденных с задержкой внутриутробного развития uMEDp
Эксперты Всемирной организации здравоохранения определяют показатели физического развития как один из основополагающих критериев комплексной оценки состояния здоровья ребенка.Цель данной работы – определить физическое развитие детей, рожденных с задержкой внутриутробного развития (ЗВУР).
Материал и методы. Использованы форма № 112/у «История развития ребенка», данные обменной карты новорожденного, антропометрические данные, полученные при профилактических осмотрах детей до года в установленные сроки. Были сформированы две группы. Первую (основную, исследовательскую) составили 185 детей с ЗВУР, вторую (группу сравнения) – 185 детей, которые при рождении имели среднестатистические показатели длины и массы тела.
Результаты. У детей с ЗВУР средние темпы набора массы тела в месяц превышали 1000 г. К шести месяцам жизни показатели физического развития большинства детей с ЗВУР (62%) были ниже, выше или соответствовали средним значениям.

Заключение. Дети с ЗВУР имели высокие темпы ежемесячной прибавки массы тела, и к году жизни у большинства из них (74%) показатели физического развития соответствовали среднестатистическим.
Рис. 1. Физическое развитие в возрасте шести месяцев у детей с ЗВУР (исследовательская группа) и средними антропометрическими показателями при рождении (контрольная группа)
Рис. 2. Физическое развитие в возрасте шести месяцев у детей с ЗВУР в зависимости от степени ЗВУР при рождении
Рис. 3. Физическое развитие в возрасте 12 месяцев у детей с ЗВУР (основная группа) и средними антропометрическими показателями при рождении (группа сравнения)
Рис. 4. Физическое развитие детей в возрасте 12 месяцев в зависимости от степени ЗВУР при рождении Рис. 5. Показатели соответствия массы тела росту в обеих группах в зависимости от возраста
5. Показатели соответствия массы тела росту в обеих группах в зависимости от возраста
Введение
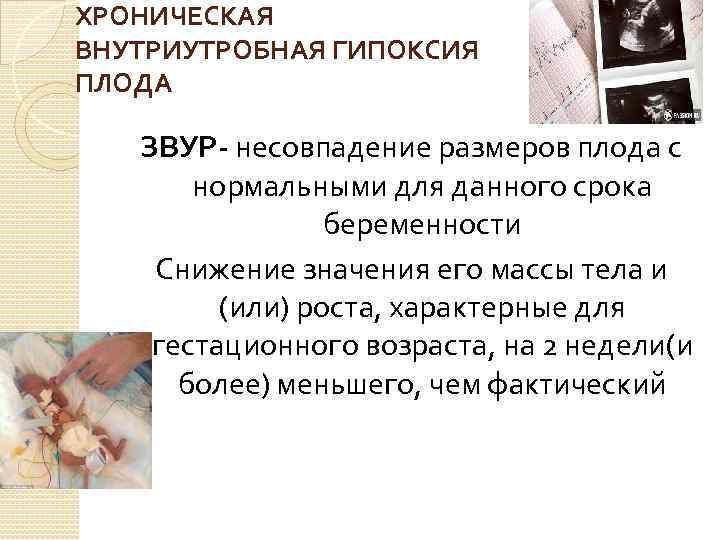
Задержка внутриутробного развития (ЗВУР) – состояние, характеризующееся отставанием в массе или росте плода более чем на два стандартных отклонения и/или ниже среднего значения для данного гестационного возраста либо отклонением показателей массы тела при рождении
На протяжении всей жизни ЗВУР может являться причиной тяжелых заболеваний, требующих как социальных, так и экономических затрат на реабилитацию.
У детей, родившихся с ЗВУР, высок риск развития неонатальных осложнений. К таковым относятся гипотермия, гипогликемия, гипокальциемия, полицитемия, желтуха, некротический энтероколит, тромбоцитопения и почечная недостаточность [1]. Тяжелые формы бронхолегочной дисплазии чаще формируются у маловесных детей [2].
Исследования показали, что у детей с ЗВУР часто имеют место неонатальные инфекционные заболевания, в том числе сепсис [3]. У 2/3 детей с низкими показателями массы тела при рождении наблюдаются признаки энтеральной недостаточности. Более чем у половины отмечается панкреатическая недостаточность, у четверти – билиарная [4].
У 2/3 детей с низкими показателями массы тела при рождении наблюдаются признаки энтеральной недостаточности. Более чем у половины отмечается панкреатическая недостаточность, у четверти – билиарная [4].
Нарушение формирования нормальной микробиоты кишечника у детей с ЗВУР обусловлено высокой частотой кесарева сечения, поздним прикладыванием к груди, пребыванием ребенка в палате интенсивной терапии или отделении реанимации, искусственным вскармливанием. Формируется порочный круг: нутритивная недостаточность приводит к развитию дисбиоза кишечника, который в свою очередь способствует нарушению усвоения питательных компонентов [5].
У каждого пятого ребенка с ЗВУР регистрируются нарушения фосфорно-кальциевого обмена, в частности гипокальциемия. Снижение содержания кальция в крови приводит к повышению уровня паратиреоидного гормона, снижению уровня кальцитонина. Как следствие – нарушаются метаболизм и ремоделирование костной ткани. Ситуация усугубляется нутритивной недостаточностью [6].
Ряд авторов отмечают, что у детей с ЗВУР имеют место и другие нарушения. Так, в младшем возрасте высока частота кишечных инфекций. Пораженная центральная нервная система (ЦНС) восстанавливается медленно. Поражения ЦНС регистрируются практически у каждого пятого маловесного ребенка. Минимальная мозговая дисфункция, двигательные нарушения, когнитивные расстройства в два раза чаще диагностируются у детей с ЗВУР. Это приводит к низкой успеваемости и сложностям в освоении основной программы в школе (32% детей с ЗВУР) [7, 8]. У 2/3 маловесных детей формируются необратимые изменения со стороны бронхолегочной системы [2].
Актуальной остается связь между ростом при рождении и дальнейшими темпами и показателями физического развития. По данным литературы, уровень физического развития детей с ЗВУР впоследствии соответствует низкорослости или отмечается задержка физического развития в первые месяцы и годы жизни [9–11]. Показатели дальнейшего физического развития зависят от варианта и степени тяжести ЗВУР [12, 13]. Низкие антропометрические показатели у части детей с ЗВУР являются главной проблемой физического развития [14–17].
Низкие антропометрические показатели у части детей с ЗВУР являются главной проблемой физического развития [14–17].
Цель
исследования – определить темпы и показатели физического развития детей, рожденных с ЗВУР, на первом году жизни.Материал и методы
Участники исследования были разделены на две группы. В основную (исследовательскую) группу вошли 185 детей с ЗВУР при рождении, в группу сравнения – 185 детей со среднестатистическими антропометрическими данными при рождении. Критерием включения в исследование служило наличие добровольного информированного согласия родителей на проведение антропометрии в установленные сроки.
Набор материала (карта развития ребенка (форма № 112/у «История развития ребенка»), обменная карта новорожденного) осуществлялся на базе поликлиник г. Краснодара. До года антропометрию проводили ежемесячно. Рост измеряли на горизонтальном ростомере, массу – на электронных поверенных весах. Антропометрические исследования (измерение роста и массы) проведены на основании Национального стандарта Российской Федерации с соблюдением требований к технологии выполнения простых медицинских услуг функционального обследования (ГОСТ Р 52623.1–2008). Полученные данные оценивались с помощью центильных таблиц, что позволило определить показатели физического развития детей.
Антропометрические исследования (измерение роста и массы) проведены на основании Национального стандарта Российской Федерации с соблюдением требований к технологии выполнения простых медицинских услуг функционального обследования (ГОСТ Р 52623.1–2008). Полученные данные оценивались с помощью центильных таблиц, что позволило определить показатели физического развития детей.
Период наблюдения составил 12 месяцев. Проводились ежемесячные антропометрические исследования, промежуточные точки – шесть и 12 месяцев жизни. Достоверность различий показателей оценивали с помощью непараметрических критериев Манна – Уитни и Вилкоксона. Статистическая обработка данных проводилась с использованием пакета компьютерных программ StatSoft Statistica v. 10.
Результаты и их обсуждение
Степень ЗВУР при рождении оценивали на основании антропометрических показателей:
- 1-я степень – снижение массы тела на два и более стандартных отклонения (ниже 10-го центиля) при нормальной или умеренно сниженной длине тела;
- 2-я степень – снижение массы тела и длины на два-три стандартных отклонения, что соответствовало 10–3-му центилю;
- 3-я степень – значительное снижение всех параметров физического развития на три и более стандартного отклонения (ниже 3-го центиля).

В исследовательской группе большинство детей (72%) при рождении имели ЗВУР 3-й степени, 1-я степень зафиксирована у 14%, 2-я степень – также у 14% детей.
В шесть месяцев жизни проведены антропометрические измерения. На их основании определены такие параметры, как набор массы и длины тела за указанный промежуток времени, оценены показатели физического развития. В основной (исследовательской) группе средние значения прибавки массы тела за шесть месяцев жизни составили 3900 г, что практически соответствовало среднестатистическим показателям набора массы тела за обозначенный период у детей грудного возраста (долженствующая прибавка массы тела – 4300 г). Средняя ежемесячная прибавка массы тела у детей с ЗВУР составила около 650 г, что незначительно ниже среднестатистического показателя. В группе сравнения набор массы тела за полгода составил 3800 г, средняя ежемесячная прибавка массы – 630 г.
У детей с ЗВУР 1-й степени за шесть месяцев жизни средняя прибавка массы тела составила 2700 г, у детей с ЗВУР 2-й степени – 4400 г, 3-й степени – 4730 г. Отмечалась тенденция более высоких темпов набора массы тела при ЗВУР 2-й и 3-й степени.
Отмечалась тенденция более высоких темпов набора массы тела при ЗВУР 2-й и 3-й степени.
Средний темп набора длины тела за шесть месяцев жизни у детей с ЗВУР составил 17,7 см, в то время как среднестатистический показатель прибавки указанного параметра – 16,5 см. В группе сравнения средний темп увеличения роста составил всего 13 см. Отмечалась тенденция к более высоким темпам роста в зависимости от степени тяжести ЗВУР. Так, при ЗВУР 1-й степени набор роста за шесть месяцев жизни достиг 13 см, 2-й степени – 19 см, 3-й степени – 21,2 см.
Физическое развитие оценивали исходя из антропометрических данных. В группе сравнения 49% детей, рожденных с ЗВУР, в возрасте шести месяцев имели среднестатистические показатели физического развития. Физическое развитие ниже среднего отмечалось у 13% детей, низкое – у 13%, очень низкое – у 25% детей. В контрольной группе показатели физического развития распределились следующим образом: среднее – 54%, выше среднего – 21%, ниже среднего – 4%, низкое – 8%, очень низкое – 13%. На рисунке 1 отображены показатели физического развития в возрасте шести месяцев в группе детей, рожденных с ЗВУР, и детей с нормальными антропометрическими данными при рождении. Как видим, основная часть детей обеих групп в возрасте шести месяцев имела среднестатистические показатели физического развития. Низкие показатели встречались практически с равной частотой. Достоверных различий по указанным показателям не зарегистрировано (р > 0,05). Однако очень низкое физическое развитие в группе детей с ЗВУР регистрировалось практически в два раза чаще, чем в группе сравнения (р
На рисунке 1 отображены показатели физического развития в возрасте шести месяцев в группе детей, рожденных с ЗВУР, и детей с нормальными антропометрическими данными при рождении. Как видим, основная часть детей обеих групп в возрасте шести месяцев имела среднестатистические показатели физического развития. Низкие показатели встречались практически с равной частотой. Достоверных различий по указанным показателям не зарегистрировано (р > 0,05). Однако очень низкое физическое развитие в группе детей с ЗВУР регистрировалось практически в два раза чаще, чем в группе сравнения (р
Анализ показателей физического развития у детей, рожденных с ЗВУР, в зависимости от степени ЗВУР показал, что все дети с ЗВУР 1-й степени имели очень низкий уровень физического развития. При 2-й степени у 86% детей отмечался средний уровень, у 14% – ниже среднего. При 3-й степени у 60% детей зарегистрирован средний уровень, у 20% – низкий, у 20% – очень низкий. На рисунке 2 показан уровень физического развития в возрасте шести месяцев жизни в зависимости от степени ЗВУР при рождении. Как видим, большая часть детей с ЗВУР 2-й и 3-й степени к шести месяцам имела средний уровень физического развития. В то же время дети с ЗВУР 1-й степени не достигли среднестатистических показателей физического развития к указанному возрасту.
Как видим, большая часть детей с ЗВУР 2-й и 3-й степени к шести месяцам имела средний уровень физического развития. В то же время дети с ЗВУР 1-й степени не достигли среднестатистических показателей физического развития к указанному возрасту.
Анализ антропометрических данных показал, что средняя прибавка массы тела за первый год жизни у детей с ЗВУР составила 7180 г (среднестатистический показатель – 7150 г). При этом дети с ЗВУР 1-й степени за 12 месяцев прибавили 7410 г, дети с ЗВУР 2-й степени – 7200 г, 3-й степени – 6940 г. В группе сравнения средние темпы набора массы тела за год составили 5770 г.
За первый год жизни у детей с ЗВУР в среднем рост увеличился на 26 см, у детей из группы сравнения – на 21,5 см (среднестатистический показатель – 25 см). Отмечалась тенденция к более высоким темпам набора длины тела при 3-й и 2-й степени ЗВУР при рождении. Так, при ЗВУР 1-й степени средние темпы набора длины тела за первый год жизни составили 23 см, при ЗВУР 2-й степени – 27 см, 3-й степени – 28,4 см.
Показатели физического развития годовалых детей с ЗВУР в 49% случаев соответствовали среднему значению, в 25% случаев превышали его, в 15% соответствовали очень высокому, в 11% – очень низкому. В группе сравнения средний уровень физического развития отмечался у 62% детей, выше среднего – у 13%, высокий – у 8%, ниже среднего – у 4%, низкий – у 13%. На рисунке 3 наглядно отражены показатели физического развития в двух группах. К 12 месяцам жизни уровень физического развития в обеих группах соответствовал среднему значению. Достоверных различий по указанному показателю не установлено (р > 0,05). У детей с ЗВУР при рождении, напротив, отмечалась тенденция к увеличению показателей физического развития. Однако более чем у 10% детей с ЗВУР к году жизни сохранялся очень низкий уровень физического развития.
При ЗВУР 1-й степени 83% детей имели средний уровень физического развития, 17% – выше среднего. При ЗВУР 2-й степени все дети имели средний уровень. При 3-й степени у 42% детей зарегистрирован средний уровень, у 40% – ниже среднего, у 18% – очень низкий. На рисунке 4 представлены показатели физического развития в 12 месяцев жизни в зависимости от степени ЗВУР при рождении. У большой части детей с ЗВУР при рождении физическое развитие к году соответствовало среднему уровню независимо от степени ЗВУР при рождении. Практически у каждого пятого ребенка с 1-й и 3-й степенью ЗВУР при рождении к 12 месяцам жизни показатели физического развития оставались очень низкими.
При 3-й степени у 42% детей зарегистрирован средний уровень, у 40% – ниже среднего, у 18% – очень низкий. На рисунке 4 представлены показатели физического развития в 12 месяцев жизни в зависимости от степени ЗВУР при рождении. У большой части детей с ЗВУР при рождении физическое развитие к году соответствовало среднему уровню независимо от степени ЗВУР при рождении. Практически у каждого пятого ребенка с 1-й и 3-й степенью ЗВУР при рождении к 12 месяцам жизни показатели физического развития оставались очень низкими.
Гармоничное физическое развитие (соответствие массы тела росту ребенка) зафиксировано у 43% детей с ЗВУР в возрасте шести месяцев, дисгармоничное (дефицит массы тела) – у 57% детей. В группе сравнения данные показатели составили 76 и 24% соответственно. Причем дисгармоничное развитие в большей степени (67% случаев) обусловлено дефицитом массы тела, в меньшей (33%) – избытком массы тела. В возрасте 12 месяцев у детей с ЗВУР гармоничное физическое развитие зарегистрировано в 86% случаев, дисгармоничное – в 14%, в группе сравнения – в 88 и 12% случаев. Дисгармоничное развитие было связано с дефицитом массы тела (рис. 5).
Дисгармоничное развитие было связано с дефицитом массы тела (рис. 5).
Дисгармоничное физическое развитие за счет дефицита массы тела достоверно чаще (р 0,05).
Заключение
В исследовании наблюдались высокие темпы росто-весовых показателей в группе детей с ЗВУР. При этом значения коррелировали со степенью тяжести ЗВУР при рождении. К 12-месячному возрасту большая часть детей с ЗВУР при рождении достигла среднестатистических показателей физического развития.
Задержка внутриутробного развития плода/малый для гестационного возраста плод: диагностические критерии и алгоритм ведения
HEALTH OF WOMAN. 2019.7(143): 25–30; doi 10.15574/HW.2019.143.25
С.И. Жук1, Н.В. Пехнё2, Е.А. Ночвина3
1Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
2Киевский городской родильный дом № 2
3Центр матери и ребенка, м. Винница
В статье представлены данные об информативности инструментальных методов исследования в ведении пациенток со ЗВУРП/МГВП, в частности, допплерометрического обследования кровотока маточно-плацентарно-плодного комплекса вместе с кардиотокографическим исследованием по методу Доуза–Редмана. Проанализировано диагностическую ценность показателей кровотока в пупочной артерии, средней мозговой артерии и венозном протоке в зависимости от термина беременности.
Так, наблюдение за плодом со ЗВУР, диагностированной в ранние термины беременности – до 32 нед, должно включать допплерометрию венозного протока, так как высокорезистентный кровоток в нем (ИП >95%) характеризует начальные изменения состояния плода, тогда как нулевой или реверсный кровоток в данном сосуде свидетельствует о наличии ацидоза и риске гибели плода.
Критичным в ведении беременности с поздним типом ЗВУР является появление аномального кровотока в средней мозговой артерии (СМА). При этом снижение резистентности в СМА (ИП <5%) при ЗВУР, диагностированной на поздних терминах, увеличивает риск неблагоприятных перинатальных последствий и потребность в проведении кесарева сечения, а снижение цереброплацентарного соотношения ухудшает перинатальные последствия. КТГ при ЗВУР необходимо проводить в рамках дородового сопровождения с целью контроля за состоянием плода в сочетании с допплерометрией маточно-плацентарно-плодного комплекса.
Разработанный и внедренный научно обоснованный алгоритм ведения беременности позволяет провести контроль за ходом гестационного периода, прогнозирование патологического состояния плода со своевременным рассмотрением вопроса о досрочном родоразрешении. Широкое внедрение данного алгоритма позволит существенно уменьшить перинатальную заболеваемость и смертность и улучшить качество оказания акушерской помощи.
Ключевые слова: задержка внутриутробного развития плода, малый для гестационного возраста плод, антенатальный мониторинг плода.
СПИСОК ЛИТЕРАТУРЫ
1. Бушуева Э.В. Факторы риска рождения детей с задержкой внутриутробного развития // Саратовский научно-медицинский журнал. 2010; 6 (3): 528-530.
2. Демидов В.Н., Розенфельд Б.Е., Сигизбаева И.К. Значение одновременного использования автоматизированной кардиотокографии и ультразвуковой допплерометрии для оценки состояния плода во время беременности // SonoAce-Ultrasound.2001;9:73-80.
3. Черемисин А.Е. Современное представление о СЗРП (обзор литературы) // Информационный архив.2009; 3 (4):126-129.
4. Хурасева А.Б. Современный взгляд на проблему синдрома задержки внутриутробного развития плода (обзор литературы) // Гинекология. 2007; 9 (5): 40-45.
5. Boers K.E. Disproportionate Intrauterine Growth Intervention Trial At Term: DIGITAT. BMC Pregnancy Childbirth. 2007; 7: 12. https://doi.org/10.1186/1471-2393-7-12; PMid:17623077 PMCid:PMC1933438
6. Figueras, F., Gardosi J. Intrauterine growth restriction: new concepts in antenatal surveillance, diagnosis, and management. Gynecol.2011; 204(4): 288-300. https://doi.org/10.1016/j.ajog.2010.08.055; PMid:21215383
7. Morsing E. Cognitive function after intrauterine growth restriction and very preterm birth. Pediatrics. 2011; 127(4): 874-882. https://doi.org/10.1542/peds.2010-1821; PMid:21382944
8. Nancy K. Grote. A Meta-analysis of Depression During Pregnancy and the Risk of Preterm Birth, Low Birth Weight, and Intrauterine Growth Restriction. Arch. Gen. Psychiatry.2010;м 67(10): 10121024. https://doi.org/10.1001/archgenpsychiatry.2010.111; PMid:20921117 PMCid:PMC3025772
9. Ross, Michael G. Adult Sequelae of Intrauterine Growth Restriction. Semin. Perinatol. 2008; 32(3): 213-218. https://doi.org/10.1053/j.semperi.2007.11.005; PMid:18482624 PMCid:PMC2527863
Перинатальные и отдаленные исходы у детей с синдромом задержки роста плода
В. Е. Радзинский, А. А. Оразмурадов, Е. А. Девятова
Кафедра акушерства и гинекологии с курсом перинатологии Российского Университета Дружбы Народов
ул. Миклухо – Маклая, 8, Медицинский факультет, 117198, Москва, Россия
Т. В. Златовратская, Н. М. Старцева
ГБУЗ «Городская клиническая больница № 29 им. Н.Э. Баумана» ДЗМ
Госпитальная площадь, д. 2, 111020 Москва, Россия
Актуальность: в статье представлен широкий обзор литературы по проблеме хронической плацентарной недостаточности (ПН), и освещены взгляды, сложившихся на рубеже XX–XXI веков. ПН остается одной из наиболее актуальных проблем современного акушерства и перинатологии, так как перинатальная заболеваемость и смертность в большой мере определяются степенью тяжести ПН, а малый вес при рождении – фактор риска повышенной заболеваемости на протяжении всей последующей жизни ребенка и формирует перинатальную заболеваемость и смертность.
Перинатальные поражения центральной нервной системы приводят к возникновению неврологических осложнений различной степени тяжести, что существенно ухудшает качество жизни таких детей.
При изучении отдаленных исходов у детей с синдромом задержки роста плода (ЗРП) в анамнезе обращает на себя внимание не только большой удельный вес неврологических осложнений, но и высокая частота болезней органов дыхания и болезней крови.
Хроническая ПН остаётся ключевой проблемой акушерства, неонатологии, патологии анте- и перинатального периодов, поскольку функциональная недостаточность плаценты приводит к угрозе прерывания беременности, гипоксии, отставанию роста и развития плода, либо к его гибели ( Савельева Г. М., 1991; Бунин А. Т., 1993; Башмакова Н. В. и др., 1996; Макаров И. О., 1998; Радзинский В. Е., Милованов А. П. и др., 2004). Плацентарная недостаточность – это клинический синдром, отражающий патологическое состояние материнской (маточно – плацентарной) и плодной (плацентарно – плодной) частей плаценты, приводящее к замедлению развития и роста плода (Савельева Г. М. и др., 1991). Милованов А. П., (1999) предложил определение ПН: это клинико – морфологический симптомокомплекс, возникающий как результат сочетанной реакции плода и плаценты на различные нарушения состояния материнского организма. Клинически обоснована терминология и классификация ПН предложенная Радзинским В. Е. (1983, 2001): это поликаузальный синдром, возникающий как результат сочетанной реакции плода и плаценты на различные изменения в материнском организме, характеризующийся нарушением молекулярных, клеточных, тканевых и органных адаптационно – гомеостатических реакций фетоплацентарной системы и реализующийся в компенсированной, субкомпенсированной и декомпенсированной формах. Частота плацентарной недостаточности составляет 17 – 26%, не имеет тенденции к снижению и обусловливает до 47% перинатальных потерь (Колгушкина Т. Н., 2004). По данным Барашнева Ю. И. и др. (1997), частота ее колеблется от 3 – 4 % до 45 %, перинатальная заболеваемость достигает 700 %о, а смертность 24,2 – 177,4%о. По данным других исследователей, ПН составляет более 20% в структуре причин перинатальной смертности (Мурашко Л.Е., Бадоева Ф.С., Асымбекова Г.У., Павлович С.В., 1997).
К основным звеньям многогранного патогенеза ПН относят нарушения маточно – плацентарного и плодово – плацентарного кровотока, метаболизма, синтетической функции и состояния клеточных мембран плаценты, изменения иммунного статуса плода. Патология маточно – плацентарного кровообращения в свою очередь характеризуется тремя важнейшими моментами: нарушением притока крови в межворсинчатое пространство, затруднением оттока из него и локальными изменениями реологических и коагуляционных свойств крови.
Функциональная недостаточность плаценты оказывает прямое отрицательное воздействие на развитие плода и новорожденного, что проявляется характерной клинической симптоматикой, в частности синдромом ЗРП, который занимает важное место в структуре перинатальной смертности и оказывает отрицательное влияние на последующее развитие ребенка. (Борзова Н. Ю., Гагаева Ю. В. и др., 2004). Синдром ЗРП – одно из наиболее часто встречающихся состояний новорожденного (Афанасьева Н. В., Игнатко И. В., 2003). В акушерской практике, по данным Медведева Н. В., Юдиной Е. В. (1998), данная патология встречается в 5 – 31 % случаев.
Учитывая важность своевременной профилактики и диагностики ПН, необходима адекватная оценка степени риска ее развития. По данным Сидельниковой В. М. (2002), хроническая ПН наблюдается у каждой третьей женщины из группы высокого перинатального риска. Легко оцениваемым фактором риска является возраст матери до 18 и старше 35 лет. По данным Стрижакова А. Н. (2003), у 26 – 30 % беременных в возрасте до 20 лет выявляются признаки ПН, что создает угрозу развития ЗРП у данной группы беременных. При наличии экстрагенитальной патологии риск развития ПН составляет 24 – 45%. Важная роль в формировании ПН отведена заболеваниям сердечно – сосудистой и эндокринной систем, а болезни почек составляют до 9,5% среди факторов риска ее развития. Среди эндокринных заболеваний особого внимания заслуживает сахарный диабет. Популяционная частота сахарного диабета у беременных составляет 0,2 – 3,0%, однако среди беременных с ПН он встречается в 2 – 3 раза чаще. При этом частота гипотрофии плода составляет 35,5%, а отставание в росте плода, по данным ряда исследователей, отмечается уже в начале II триместра гестации.
В последние годы все больше внимания уделяется изучению внутриутробного инфицирования как этиологического фактора развития ПН. Так, при хронических неспецифических заболеваниях легких отмечается увеличение процента рождения детей с низкими весо – ростовыми показателями. При этом у 30,8% детей выявляются признаки внутриутробной инфекции. У беременных с ПН на фоне генитальных инфекций в 1,6 раза чаще наблюдается ЗРП, при этом в 2 раза чаще возникает ее симметричная форма.
Среди осложнений беременности, наиболее часто приводящих к развитию ПН, первое место занимает гестоз. При наличии ПН на фоне гестоза, частота ЗРП составляет 22,7 – 44%. Частота клинических проявлений ПН прямо пропорциональна тяжести гестоза и составляет при легкой, среднетяжелой и тяжелой степени 16, 22 и 62% для ЗРП соответственно (Федорова М. В. и др., 1997).
Существенную роль в патогенезе плацентарной недостаточности играет неполноценное питание беременных, прежде всего недостаток белков, жиров, витаминов. При отсутствии рациональной диеты частота ЗРП может достигать 16,2%.
Из данных акушерского анамнеза статистически достоверную связь с развитием плацентарной недостаточности имеют перенесенные ранее самопроизвольные аборты, антенатальная гибель плода и рождение детей с низкой массой тела.
Ранняя диагностика ПН и профилактическое лечение беременных групп высокого риска по развитию синдрома ЗРП позволяет предупредить декомпенсированные формы маточно – плацентарной дисфункции и прогнозировать благополучный исход беременности с высокой степенью вероятности (Афанасьева Н. В., Стрижаков А. П., 2004).
Выявление синдрома ЗРП и определение его формы является основной задачей эхографии при диагностике хронической ПН. ЗРП диагностируется при выявлении параметров фетометрии ниже 10 – го перцентиля или более чем на 2 стандартных отклонения ниже среднего значения для данного гестационного возраста. Некоторые исследователи допускают прогнозирование развития ЗРП по отклонению фетометрических показателей ниже 25 – го перцентиля (Федорова и др., 2001). Однако в этом случае вероятность подтверждения прогноза составляет только 70%.
При ультразвуковой (УЗИ) диагностике ЗРП, говоря о I степени тяжести, наблюдается отставание фетометрических параметров до 2 недель (34,2%), при II степени – в пределах 2 – 4 недель (56,6%), при III степени – более 4 недель (9,2%) от должных значений для данного гестационного срока. Клинически принято выделять симметричную, ассиметричную и смешанную формы данного синдрома. Ассиметричная форма встречается чаще симметричной, но развивается обычно позднее (в 30 – 34 недели гестации). Смешанная форма синдрома ЗРП характеризуется непропорциональным отставанием всех фетометрических показателей при наиболее выраженном отставании размеров живота и считается наиболее неблагоприятной. При обнаружении несоответствия одного или нескольких показателей показано произведение расширенной фетометрии. В то же время отставание фетометрических параметров не всегда позволяет уверенно диагностировать ЗРП. До настоящего времени остаются недостаточно разработанными вопросы тактики ведения беременных с симметричным отставанием размеров плода от срока гестации при отсутствии остальных проявлений ПН, поскольку имеются данные о том, что в этих случаях (генетически детерминированная малая масса, плод «small for date») перинатальные исходы не отличаются от таковых в популяции.
Экстрагенитальные заболевания матери в сочетании с акушерской патологией, реализуясь посредством различных патогенетических механизмов, приводят к единому результату – прогрессирующей ЗРП (Радзинский В. Е., Милованов А. П. и др.,2004). Многолетние наблюдения за развитием детей, родившихся у пациенток с диагностированной ПН, позволили сделать вывод, что акушерская патология обусловливает значительное увеличение перинатальной заболеваемости и является субстратом для возникновения многочисленных патологических изменений в организме ребенка, которые в течение первых лет жизни становятся основной причиной нарушения его физического, умственного развития и повышенной заболеваемости.
По данным Л. О. Бадаляна и др. (1983), более 60% всех заболеваний центральной нервной системы детского возраста связано с перинатальной гипоксией плода. Многие авторы (Paneth N., Stark R., 1983; Seidman D.S., Paz G., 1991 и др.) отмечают, что более половины энцефалопатий обусловлено не острой гипоксией при родах, а длительной, хронической гипоксией плода и новорожденного, нередко связанной с внутриутробной инфекцией. Дети, перенесшие острую гипоксию в родах, чаще имеют совершенно нормальное развитие в дальнейшем (Самсыгина Г.А. и др., 1995).
По данным А. Н. Стрижова и др. (1995), при декомпенсированной форме ПН перинатальная смертность достигает 50%, а заболеваемость новорожденных 100%. ЗРП формирует перинатальную заболеваемость и смертность, а также является фактором риска повышения заболеваемости на протяжении предстоящей жизни. Кроме того, у детей, родившихся маловесными, сокращается средняя продолжительность предстоящей жизни, в сравнении с детьми, не имевшими дефицита веса при рождении (Lithell., 1999). Частота ЗРП по данным многих авторов колеблется от 3% до 22% у доношенных, от 18 до 24% у недоношенных, и не имеет тенденции к снижению (Белоусова В. Б., 1988, Ахмадеева Н. Э. и др., 1989; Радзинский В. Е. и др., 1990).
В структуре перинатальной смертности 23% – 25% занимает ЗРП и связанные с этой патологией осложнения. У 32,5% детей, родившихся с гипотрофией, в возрасте одного года сохраняются отклонения в физическом развитии.
Перинатальные поражения центральной нервной системы занимают одно из важнейших мест в структуре перинатальной заболеваемости по частоте и значимости и составляют 60 – 80% всех заболеваний нервной системы детского возраста ( Студеникин М. Я., Халлман Н., 1984; Яцык Г. В., 1989; Бадалян Л. О., 1989, Барашнев Ю. И., 1993). Перинатальные повреждения головного мозга характеризуются многофакторным генезом, но гипоксия является центральным патогенетическим фактором, приводящим к различным структурным и функциональным повреждениям и порокам развития центральной нервной системы. Характер церебральных изменений зависит от гестационного возраста в период развития патологии, времени действия гипоксии и её интенсивности (Студеникин М.Я. и др., 1993).
Серьёзные неврологические осложнения: такие как детский церебральный паралич, ретинопатиия недоношенных, глухота, грубая задержка темпов психомоторного развития, приводят к неполноценному развитию и снижению качества жизни у таких детей. Неврологические осложнения наиболее распространены у недоношенных детей. Частота неврологических нарушений легкой степени у этих детей составляет 10% – 45 %, тяжелой степени 7% – 9 % (Савельева Г. М., Федорова М. В., Клименко П. А., Сичинава Л. Г., 1991).
Снижение уровня смертности в последние годы сопровождается повышением процента инвалидизации (Cano A., Fons F., Brines J., 2001). Ведущее место среди причин детской инвалидности занимают болезни нервной системы, врождённая и наследственная патология, состояния перинатального периода (Емельянова А. С. 1999).
При снижении летальности новорожденных с массой тела при рождении 1500 г и менее до 49—57%, число выживших детей достигает 43—51%. Однако из выживших детей здоровыми оказываются не более 10—25%. Причем количество детей с тяжелыми психоневрологическими расстройствами может достигать 12—19% (Michelsson K., Lindahl E., Parre M.,1984; Lloyd B. W., 1984; Vohr B.R., Coll C., 1985).
Риск развития психоневрологических расстройств разной степени тяжести у новорожденных с очень низкой массой тела при рождении в 3 раза выше, чем у детей с нормальной массой тела при рождении. Для новорожденных с экстремально низкой массой тела (ЭНМТ) при рождении 1000 г и менее перинатальная смертность может достигать 64—85%, а число выживших детей — не более 15—36%. У выживших детей тяжелые инвалидизирующие расстройства могут превышать 28%, а менее грубые психоневрологические нарушения до 44%. Причем, из выживших детей здоровые составляют не более 8—15% ( HirataT., Epcar J.R., Walsh A.,1983; Fleischman A.R.,1986). При сравнении перинатальных исходов в группах новорожденных с ЭНМТ, 1001 – 1500, 1501 – 2000 и 2001 – 2500 гр. Шалина Р. И. и др., 1999, пришли к заключению, что абдоминальное родоразрешение не позволяет полностью избежать развития мозговых дисфункций, но тем не менее способствует уменьшению числа детей с умеренно выраженными и тяжелыми нарушениями центральной нервной системы.
Изучение отдаленного катамнеза у детей группы высокого инфекционного риска от матерей с внутриутробным инфицированием также представляет большой интерес, поскольку имеются сведения, что у таких детей отмечаются симптомы поражения центральной нервной системы: отставание в психомоторном развитии, прогрессирующие нарушения зрения и слуха (Веденеева Г. Н. и др., 1997; Тареева Т.Г. и др., 1999; Hess D.,1993; Couvreus J. Et al., 1996).
По данным Волгиной С. Я. (2000), в структуре заболеваемости недоношенных детей с ЗРП, в различные периоды жизни выявлялись свои особенности. Доминирующее положение занимают болезни органов дыхания. У детей раннего возраста второе и третье места занимали болезни нервной системы и крови. К 7 годам жизни у значительного количества детей, родившихся с признаками ЗРП, сохраняются изменения неврологического статуса. Развитие этой патологии соотносится со степенью отставания фетометрических показателей и выраженностью признаков внутриутробного страдания плода.
Вывод: состояние здоровья маловесных детей в перинатальном и отдаленном периоде не позволяет приуменьшить значимость проблемы плацентарной недостаточности в настоящее время, а лишь еще раз указывает на необходимость ее детального изучения, своевременной профилактики и лечения.
Список литературы:
- Афанасьева Н. В., Игнатко И. В. Особенности неврологического и психологического статуса детей первых лет жизни, рожденных с синдромом задержки роста плода // Вопросы гинекологии, акушерства и перинатологии М., 2003. — Т. 2. – №4. – сс.15-19.
- Афанасьева Н. В., Стрижаков А. Н. Исходы беременности и родов при фетоплацентарной недостаточности различной степени тяжести // Вопросы гинекологии, акушерства и перинатологии. М., 2004. — Т. 3. — № 2. — сс. 7-13.
- Бадалян Л. О., Журба Л.Г. Детский церебральный паралич. Киев, 1983. — 326С.
- Барашнев Ю.И. Перинатальная неврология. Москва, 2001. — сс.439-448.
- Барашнев Ю. И., Бубнова Н. И., Сорокина З. Х. и др. Перинатальная патология головного мозга: предел безопасности, ближайший и отдаленный прогноз // Рос. вестн. перинатол. педиатр., 1998. — сс.4, 6-12.
- Емельянова А. С. Выживаемость и развитие маловесных детей. Дисс.канд….мед. наук. Воронеж, 1999. – 129С.
- Колгушкина Т. Н. Клиническая перинатология. Минск., 2004. — 272С.
- Медведев Н. В., Юдина Е. В. Задержка внутриутробного развития плода // Российская ассоциация врачей ультразвуковой диагностики в перинатологии и гинекологии. М.,1998. – 208С.
- Радзинский В. Е. Особенности развития плацентарной недостаточности при акушерской и экстрагенитальной патологии. Автореф. дис. …докт. мед. наук. -Л.,1985. — 40С.
- Радзинский В. Е., Милованов А. П. и др. Экстраэмбриональные и околоплодные структуры при нормальной и осложненной беременности. М., 2004. — 393С.
- Савельева Г. М., Федорова М. В., Клименко П. А. и др. Плацентарная недостаточность. М., 1991. — 276 с.
- Сичинава Л. Г. Перинатальные гипоксические поражения центральной нервной системы плода и новорожденного. Автореф.дисс. …докт. мед. наук. М., 1993.
- Стрижаков А.Н., Михайленко Е.Т., Бунин А.Т. и др. Задержка развития плода. Киев.: Здоров’ья, 1988. – 183С.
- Цхай В. Б. Перинатальные аспекты хронической фетоплацентарной недостаточности при внутриутробном инфицировании. Автореф. дисс. …докт. мед. наук. Томск, 2000. — 40С.
- Cano A., Fons F., Brines J. The effects on offspring of premature parturition // Hum Reprod Update, 2001. — Sep-Oct. — 7(5): pр.487-494.
- Fleischman A.R. The immediate impact of the birth of a low birth weight infant on the family. Zero Three, 1986. — pр. 1-15.
- HirataT., Epcar J.R., Walsh A. Survival and outcome of infants 501 to750 gm. A six-year experience // J Pediatr, 1983. — рp.102, 741-745.
- Lloyd B. W. Outcome of very low-birth weight babies from Wolverhampton // Lancet, 1984. — Vol. 2. — ph. 739-744.
- Michelsson K., Lindahl E., Parre M. Nine-year follow-up of infants weighing 1500 g or less at birth // Acta Paediatr Scan, 1984. — рp. 73, 835-838.
- Vohr B.R., Coll C. Neurodevelopment and scool performаnce of very low birth-weight infants: A seven-year longitudinal study // Pediatr, 1985. — pp. 76, 345-349.
Вся информация носит ознакомительный характер. Если у вас возникли проблемы со здоровьем, то необходима консультация специалиста.
Читайте также
возможные причины, методы диагностики, терапия, последствия
Приблизительно каждой десятой женщине в положении врач ставит диагноз «задержка внутриутробного развития плода» (ЗВУР). Специалист определяет наличие отклонений, характеризующихся несоответствием размеров малыша нормативным показателям на той или иной неделе развития. Насколько в действительности опасна данная патология и чем она грозит ребенку, важно знать каждой маме, ведь от такого явления абсолютно никто не застрахован.
Что такое ЗВУР?
Задержка внутриутробного развития плода, как правило, диагностируется на основании ультразвукового исследования. Патологию определяют в том случае, если вес малыша меньше нормативных показателей, характерных для этого периода развития. В медицинской практике используются специально разработанные таблицы, в которых указана масса плода в соответствии с его гестационным возрастом, то есть временем с момента оплодотворения. Этот показатель обычно определяется в неделях. Иначе говоря, существуют определенные нормы для каждого срока беременности. Основная единица измерения в таких таблицах — процентиль. Если плод меньше 10 процентилей по этой таблице, врач подтверждает наличие патологии.
Задержка внутриутробного развития плода: причины
Иногда при диагнозе ЗВУР родителям не стоит беспокоиться. Бывает так, что малыш рождается небольших размеров, так как его папа и мама не отличаются большим ростом. Данная физиологическая особенность не влияет на активность ребенка, его умственное и физическое развитие. Во время беременности и после рождения такой малыш не нуждается в узконаправленной терапии.
Во всех остальных ситуациях следует с особым вниманием отнестись к диагнозу. Такое состояние может повлечь за собой отклонения в развитии ребенка или даже смерть плода. ЗВУР может свидетельствовать о том, что малыш в утробе плохо питается. Это значит, что он не получает в достаточных объемах питательные вещества и кислород. Дефицит питания обычно объясняется следующими причинами:
- Неправильный хромосомный набор.
- Вредные привычки матери (курение, употребление алкогольных напитков и наркотических веществ).
- Патогенные заболевания (гипертония, анемия, недуги сердечно-сосудистой системы).
- Неправильное расположение и последующее формирование плаценты.
Кроме того, врачи называют целый ряд иных причин, которые также могут спровоцировать синдром задержки внутриутробного развития плода:
- Многоплодная беременность.
- Применение лекарственных препаратов без предварительного назначения врача.
- Роды после 42 недели.
- Нерациональное питание. Многие женщины не хотят поправиться в течение беременности, поэтому изнуряют себя диетами. Этим они провоцируют истощение организма, которое и приводит к развитию патологии.
- Заболевания инфекционной природы (токсоплазмоз, краснуха, сифилис).
Клиническая картина
Какими симптомами сопровождается задержка внутриутробного развития плода? Признаки патологии проявляются чаще всего на ранних сроках (приблизительно 24-26 неделя). Определить их самостоятельно женщина не в состоянии, это может сделать исключительно врач. Синдром ЗВУР диагностируется при несоответствии нормам следующих показателей:
- Размер головы и бедренной кости малыша.
- Окружность живота на определенном уровне, высота дна матки.
- Объем околоплодных вод.
- Нарушение функционирования плаценты (меняются ее структура и размеры).
- ЧСС плода.
- Скорость кровотока в плаценте и пуповине.
В некоторых случаях патология достаточно быстро развивается и прогрессирует без особых нарушений, то есть протекает бессимптомно.
Степени тяжести
- I степень. Задержка внутриутробного развития плода 1 степени считается относительно легкой, так как отставание в развитии от антропометрических данных, соответствующих определенному сроку беременности, составляет всего две недели. Своевременно назначенная терапия может оказаться эффективной и свести к минимуму вероятность появления негативных последствий для малыша.
- II степень. Задержка в развитии составляет примерно 3-4 недели, требуется серьезное лечение.
- III степень. Считается самой тяжелой формой по причине отставания параметров плода на один месяц и более. Такое состояние обычно сопровождается так называемыми органическими изменениями. Задержка внутриутробного развития плода 3 степени нередко заканчивается летальным исходом.
Асимметричная форма патологии
В данном случае наблюдается значительное снижение массы плода при нормальном его росте. У ребенка диагностируется отставание в формировании мягких тканей груди и живота, неправильное развитие туловища. Возможен неравномерный рост систем внутренних органов. В случае отсутствия адекватной терапии начинается постепенное уменьшение размеров головы и отставание в развитии мозга, что практически всегда влечет за собой гибель плода. Асимметричный вариант синдрома ЗВУР возникает преимущественно в третьем триместре на фоне общей плацентарной недостаточности.
Симметричная форма патологии
При симметричной форме наблюдается равномерное уменьшение массы, размеров органов и роста плода. Такая патология чаще всего развивается на начальных этапах беременности вследствие заболеваний плода (инфицирование, хромосомные аномалии). Симметричная задержка внутриутробного развития плода повышает вероятность рождения ребенка с неполноценно сформированной ЦНС.
Диагностические мероприятия
При подозрении на данную патологию женщине рекомендуется пройти полное диагностическое обследование. В первую очередь врач собирает анамнез пациентки, уточняет перенесенные ранее гинекологические заболевания, особенности течения предыдущей беременности. Затем проводится физикальное обследование с обязательным измерением окружности живота, дна матки, роста и веса женщины.
Дополнительно может потребоваться ультразвуковое исследование, допплерометрия (оценка кровотока в артериях и венах) и кардиотокография (непрерывная запись ЧСС плода, его активности и непосредственно маточных сокращений). На основании результатов проведенных тестов специалист может подтвердить диагноз или опровергнуть его.
Какое требуется лечение
Для определения последующей тактики ведения беременности после подтверждения диагноза «задержка внутриутробного развития плода» следует принимать во внимание причины патологии, форму и степень заболевания. Основные принципы терапии должны быть сфокусированы на улучшении кровотока в системе «матка-плацента-плод». Все терапевтические мероприятия осуществляются в стационарных условиях. В первую очередь женщине необходимо обеспечить покой, рациональное питание и полноценный продолжительный сон. Важным элементом терапии считается контроль за текущим состоянием плода. Для этих целей используется ультразвуковое исследование каждые 7-14 дней, кардиотокография и допплерометрия кровотока.
Медикаментозное лечение включает прием ангиопротекторов для защиты сосудов, токолитиков против мышечного напряжения матки («Папаверин», «Но-шпа»), общеукрепляющих средств. Кроме того, всем женщинам без исключения назначают препараты, уменьшающие нервно-психическое возбуждение (настойка пустырника, валерианы) и улучшающие кровоток в плаценте («Актовегин», «Курантил»).
В зависимости от степени тяжести патологии результаты лечения могут варьироваться. Задержка внутриутробного развития плода 1 степени обычно отлично поддается терапии, вероятность появления в дальнейшем негативных последствий сводится к минимуму. При более серьезных патологиях необходим иной подход к лечению, при этом его результаты достаточно сложно спрогнозировать.
Прерывание беременности
Досрочное родоразрешение, невзирая на срок беременности, рекомендуется в следующих случаях:
- Отсутствие роста показателей плода на протяжении 14 дней.
- Заметное ухудшение состояния малыша внутри утробы (к примеру, замедление кровотока в сосудах).
Беременность сохраняют максимально до 37 недели в том случае, если благодаря медикаментозной терапии наблюдается улучшение показателей, когда не приходится говорить о диагнозе «задержка внутриутробного развития плода».
Последствия и возможные осложнения
Малыши с такой патологией после появления на свет могут иметь отклонения различной степени тяжести, их последующая совместимость с обычной жизнью во многом будет зависеть от родителей.
Первые последствия появляются уже при родоразрешении (гипоксия, нарушения неврологической природы). Задержка внутриутробного развития плода тормозит созревание ЦНС и ее функций, которая влияет на все системы. У таких детей обычно ослаблены защитные силы организма, в более зрелом возрасте существует повышенная вероятность появления недугов сердечно-сосудистой системы.
У малышей до пяти лет часто диагностируется медленный набор веса, психомоторное отставание в развитии, неправильное формирование систем внутренних органов, гипервозбудимость. В подростковом возрасте высокий риск заболевания диабетом. Такие дети обычно склонны к полноте, у них появляются проблемы с артериальным давлением. Это вовсе не означает, что их ежедневное существование будет сводиться к приему лекарственных препаратов и жизни в больницах. Им попросту потребуется чуть больше внимания уделять собственному питанию и ежедневным физическим нагрузкам.
Некоторые дети, у которых была диагностирована задержка внутриутробного развития плода 2 степени и проведено соответствующее лечение, не отличаются от своих сверстников. Они ведут привычный образ жизни, занимаются спортом, общаются с друзьями и получают образование.
Как можно предотвратить ЗВУР
Лучшая профилактика этой патологии — планирование предстоящей беременности. Приблизительно за полгода будущие родители должны пройти комплексное обследование и пролечить все имеющиеся хронические заболевания. Отказ от пагубных привычек, правильный образ жизни, рациональное питание и ежедневные дозированные физические нагрузки — лучший вариант предотвращения ЗВУР.
Посещение женской консультации на регулярной основе после постановки на учет играет важную роль при диагнозе «задержка внутриутробного развития плода». Лечение своевременно обнаруженной патологии позволяет минимизировать риск негативных последствий.
У беременной женщин должен быть грамотно выстроен режим работы и сна. Правильный и полноценный отдых подразумевает под собой 10 часов сна ночью и 2 часа в дневное время. Такой режим позволяет улучшить кровообращение и транспортировку питательных веществ между матерью и ребенком.
Ежедневные прогулки на свежем воздухе, дозированные физические нагрузки не только улучшают общее самочувствие беременной, но и нормализуют состояние плода внутри утробы.
Заключение
Не стоит оставлять без внимания такую патологию, как задержка внутриутробного развития плода, последствия которой могут быть самыми печальными. С другой стороны, родители не должны воспринимать этот диагноз как приговор. Если он поставлен своевременно, будущая роженица примет все необходимые меры по устранению его причины и станет следовать всем рекомендациям врача, прогноз может быть благоприятным. На свете нет таких преград, которые невозможно преодолеть. Важно помнить, что счастье материнства ни с чем не сравнимо!
«Маловесная» проблема с «увесистыми» последствиями
Фото носит иллюстративный характер. Из открытых источников.
Задержка роста плода — осложнение беременности, при котором плод по характеристикам массы и длины отстает от усредненных норм. Маловесным принято считать новорожденного весом 2 500 г, ростом 47 см. Однако это справедливо только при появлении на свет в 37 недель. С увеличением гестационного срока должна расти и масса тела ребенка, достигая к 40 неделям 2 600–2 650 г.
Не факт! Но фактор риска
В период внутриутробного развития плод реализует генетически запрограммированный потенциал роста, который является величиной изменчивой и подверженной влиянию ряда факторов. Наиболее значимые три группы причин задержки роста плода (ЗРП) — материнские, плацентарные и плодовые. При этом плацентарные (инфаркты плаценты, плацентарный мозаицизм, низкая плацентация) и значительная доля материнских (возраст, раса, антропометрические данные и др.) факторов являются немодифицируемыми, и диапазон терапевтического воздействия в этом случае достаточно узок.
До настоящего времени остается не до конца проясненным вклад каждого фактора риска в формирование гипотрофии плода.
Различают два варианта ЗРП: гипопластический (симметричный) и гипотрофический (ассиметричный). Первый тип дебютирует очень рано — во втором триместре беременности — и проявляется одновременным снижением как длины, так и массы тела плода. При втором, более позднем, варианте, отставание преимущественно массы тела обнаруживается в третьем триместре, ближе к доношенному сроку.
Вопрос в масштабе
Частота патологии различается в зависимости от региона. В Беларуси, как и в других европейских странах, ЗРП осложняет до 7–14 % беременностей (см. рис. внизу). Учитывая гипердиагностику, гипотрофия новорожденных в республике отмечается примерно в 3,5–4 % от общего числа рождений.
Кажущаяся редкость патологии — лишь вершина айсберга, впечатляют отдаленные последствия для здоровья детей, родившихся маловесными. Суть проблемы не столько в малых размерах новорожденного, сколько в сопутствующем нарушении тонких механизмов регуляции функций органов и систем такого ребенка. Наличие задержки роста плода определяет высокую неонатальную заболеваемость — в 8 раз выше, чем у новорожденных с нормальной массой тела. Часто встречаются осложнения со стороны ЦНС, а в недалеком будущем таких детей весьма вероятно поджидают артериальная гипертензия, метаболический синдром, заболевания эндокринной системы.
Диагностическая дилемма
Оценивать параметры «внутриутробного пациента» удобнее с помощью УЗИ. В доультразвуковую эпоху акушерам приходилось проявлять недюжинную интуицию и клиническое мышление, чтобы, замеряя высоту дна матки и окружность живота сантиметровой лентой, заподозрить наличие этого грозного осложнения беременности. Однако и с повсеместным внедрением УЗД проблема своевременной диагностики ЗРП не была решена. Систематический обзор в отчете Cochrane 2000 года показал, что рутинное проведение фетометрии после 24 недель у беременных в группе низкого риска не улучшает перинатальные исходы. Наше исследование выявило, что чувствительность простой фетометрии (включало только измерение окружности живота, бипариетального размера головки и длины бедра плода) для диагностики гипотрофии на амбулаторном и стационарном этапах составляет 31,8 % и 38,6 % соответственно. А это говорит о том, что только чуть более трети всех случаев ЗРП были выявлены при использовании указанной методики в качестве рутинной. Прогностическая ценность положительного заключения для амбулаторного этапа оказания помощи беременным равнялась 53,8 %, стационарного — 58,6 %, а значит эффективность описываемой методики можно сравнить с подбрасыванием монетки.
Не оправдывает себя и применение различных биохимических и иммунологических маркеров — интерлейкинов, С-реактивного белка, мочевой кислоты и других. Изолированное их применение с прогностической целью выявило низкие показатели чувствительности и специфичности и в настоящее время остается прерогативой сугубо научных изысканий.
Одним из решений проблемы своевременной диагностики и наблюдения беременных с гипотрофией плода может стать применение разработанного нами дифференцированного подхода к тактике ведения беременности и родоразрешению (Инструкция по применению № 033-0515, утвержденная Минздравом 18.07.2015, доступна для скачивания по ссылке.
Данный подход подразумевает учет факторов риска формирования патологии и регламентирует кратность и объем диагностических мероприятий при подозрении на наличие гипотрофии плода.
Егор Ковалев, врач-акушер-гинеколог, ассистент кафедры акушерства и гинекологии ВГМУ, кандидат мед. наук.
Источник: medvestnik.by
Пороки развития
\n- \n
- развития и укрепления систем регистрации и эпиднадзора; \n
- накопления опыта и создания потенциала; \n
- укрепления научных исследований и научных работ в области этиологии, диагностики и профилактики; \n
- укрепления международного сотрудничества. \n
Определение
\n\nВрожденные пороки развития именуются также врожденными пороками, врожденными нарушениями или врожденными деформациями. Врожденные пороки развития можно определить как структурные или функциональные отклонения от нормы (например, метаболические расстройства), которые проявляются в период внутриутробного развития и могут быть выявлены до рождения, во время рождения или на более поздних этапах жизни.
\nПричины и факторы риска
\n\nПримерно 50% всех пороков развития нельзя связать с какой-либо конкретной причиной, однако некоторые причины или факторы риска известны.
\nСоциально-экономические факторы
\n\nНесмотря на то, что низкий доход может оказаться косвенной детерминантой, пороки развития чаще проявляются в семьях и странах с недостаточными ресурсами. Согласно подсчетам, примерно 94% тяжелых пороков развития наблюдаются в странах со средним и низким уровнем дохода, где женщины зачастую не имеют доступа к достаточному количеству и достаточно хорошей пище и могут подвергаться воздействию какого-либо агента или фактора, например, инфекции или алкоголь, который провоцирует или усиливает отклонения от нормы в предродовом развитии. Более того, материнство в зрелом возрасте повышает риск хромосомных аномалий, включая синдром Дауна, в то время как материнство в молодом возрасте повышает риск некоторых врожденных пороков развития.
\nГенетические факторы
\n\nКровосмешение (кровное родство) повышает распространенность редких генетических врожденных пороков и почти удваивает риск неонатальной и детской смертности, умственной отсталости и тяжелых врожденных пороков у детей, рожденных парами, являющимися двоюродными родственниками. У некоторых этнических групп, например у евреев-ашкенази и у финнов, наблюдается сравнительно высокая распространенность редких генетических мутаций, приводящих к повышенному риску пороков развития.\n
\nИнфекции
\n\nПрисутствие у матерей таких инфекций, как сифилис или корь, является распространенной причиной врожденных пороков в странах с низким и средним уровнем дохода.
\nПитание матери
\n\nДефицит йода, солей фолиевой кислоты, ожирение или такие состояния, как сахарный диабет, связаны с некоторыми пороками развития. Например, дефицит фолиевой кислоты повышает риск рождения ребенка с дефектом нервной трубки. Кроме того, повышенное потребление витамина А может повлиять на нормальное развитие эмбриона или плода.
\nЭкологические факторы
\n\nВоздействие на материнский организм некоторых пестицидов и других химических веществ, а также некоторых лекарственных средств, алкоголя, табака, психоактивных веществ или радиоактивного излучения во время беременности может повышать риск развития у плода или новорожденного ребенка врожденных пороков. Работа или проживание вблизи или непосредственно в месте расположения мусорных свалок, металлургических предприятий или шахт также может быть фактором риска, особенно при воздействии на организм матери других экологических факторов риска или при недостаточности питания.
\nПрофилактика
\n\nПрофилактические медико-санитарные меры, принимаемые в период подготовки к беременности и в период зачатия, а также дородовое медицинское обслуживание снижают частоту появления некоторых врожденных пороков развития. Первичная профилактика пороков развития включает следующие меры:
\n- \n
- Улучшение питания женщин на протяжении репродуктивного периода посредством обеспечения надлежащего потребления витаминов и минералов, в особенности фолиевой кислоты, в результате ежедневного перорального приема пищевых добавок или обогащения основных продуктов питания, таких как пшеничная или кукурузная мука. \n
- Наблюдение за тем, чтобы беременная женщина не употребляла или употребляла в ограниченном количестве вредные для здоровья продукты, в особенности, алкоголь. \n
- Предупреждение диабета в период подготовки к беременности и во время беременности при помощи консультирования, борьбы с излишним весом, правильного питания и, в необходимых случаях, введения инсулина. \n
- Предупреждение во время беременности воздействия содержащихся в окружающей среде опасных веществ (например, тяжелых металлов, пестицидов, некоторых лекарственных препаратов). \n
- Контроль за тем, чтобы любое воздействие на организм беременной женщины лекарственных средств или облучения в медицинских целях (например, рентгеновскими лучами) было оправданным и было основано на тщательном анализе рисков и пользы для здоровья. \n
- Расширение охвата вакцинацией женщин и детей, особенно против вируса краснухи. Эту болезнь можно предотвратить путем вакцинации детей. Вакцина против краснухи может также вводиться по меньшей мере за один месяц до наступления беременности женщинам, не получившим вакцины или не переболевшим краснухой в детстве. \n
- Расширение охвата вакцинацией женщин и детей, особенно против вируса краснухи. Эту болезнь можно предотвратить путем вакцинации детей. Вакцина против краснухи может также вводиться женщинам, не имеющим иммунитета против этой болезни, по меньшей мере, за один месяц до наступления беременности. \n
- Расширение масштабов и усиление учебной работы с медработниками и другими сотрудниками, причастными к укреплению профилактики пороков развития. \n
Выявление
\n\nМедицинская помощь до зачатия (в предзачаточный период) и около времени зачатия (в околозачаточный период) включает основные меры по охране репродуктивного здоровья, а также медицинский генетический скрининг и консультирование. Скрининг можно проводить в течение трех периодов, перечисленных ниже.
\n- \n
- Скрининг в период подготовки к беременности предназначен для выявления людей, подверженных риску появления определенных нарушений здоровья или риску передачи каких-либо нарушений здоровья своим детям. Скрининг включает изучение медицинской истории семьи и скрининг на выявление переносчика инфекции. Скрининг особенно важен в странах, где широко распространены кровосмесительные браки. \n
- Скрининг в предзачаточный период: особенности материнского организма могут повышать риск, и результаты скрининга следует использовать для предоставления надлежащей медицинской помощи в зависимости от риска. В этот период можно проводить скрининг матерей молодого и зрелого возраста, а также скрининг на употребление алкоголя, табака и других психоактивных веществ. Для выявления синдрома Дауна в течение первого триместра беременности и тяжелых пороков развития плода в течение второго триместра можно использовать ультразвуковые методы исследования. Проведение дополнительных тестов и амниоцентеза помогает выявлять дефекты формирования нервной трубки и хромосомные нарушения в течение первого и второго триместров беременности. \n
- Скрининг новорожденных предусматривает проведение клинического обследования, а также скрининга на гематологические, метаболические и гормональные нарушения. Проверка на глухоту и пороки сердца, а также своевременное выявление врожденных пороков может способствовать лечению, направленному на спасение жизни, и предотвратить прогрессирование порока, который может привести к какой-либо форме физической или умственной инвалидности или к инвалидности, связанной со зрением или слухом. В некоторых странах все новорожденные дети перед выпиской из родильного отделения проходят скрининг на выявление патологий щитовидной железы и надпочечников. \n
Лечение и медицинская помощь
\n\nВ странах с надлежащими службами здравоохранения структурные врожденные пороки можно корректировать при помощи педиатрической хирургии и обеспечивать своевременное лечение детей с функциональными проблемами, такими как талассемия (наследуемое по рециссивному типу заболевание крови), серповидно-клеточные нарушения и врожденный гипотиреоз.
\nДеятельность ВОЗ
\n\nВ 2010 году Всемирная ассамблея здравоохранения опубликовала доклад о врожденных пороках. В докладе излагаются основные компоненты создания национальных программ по профилактике и медицинской помощи в случае врожденных пороков, осуществляемых до и после рождения. В докладе также рекомендованы первоочередные действия для международного сообщества по оказанию помощи в создании и укреплении таких национальных программ.
\n\nГлобальная стратегия охраны здоровья женщин и детей, объявленная в сентябре 2010 года Организацией Объединенных Наций в сотрудничестве с руководящими деятелями правительств и другими организациями, такими как ВОЗ и ЮНИСЕФ, играет решающую роль в осуществлении результативных и эффективных с экономической точки зрения действий по укреплению здоровья новорожденных и детей.\n
\n\nВОЗ работает также с Национальным центром по врожденным порокам и проблемам развития, входящим в состав Центров США по борьбе с болезнями и профилактике болезней (ЦББ), и другими партнерами по выработке глобальной политики, направленной на обогащение пищевых продуктов солями фолиевой кислоты на уровне стран. Кроме того, ВОЗ работает с партнерами над предоставлением необходимого технического опыта для проведения эпиднадзора в отношении дефектов нервной трубки, мониторинга усилий по обогащению пищевых продуктов солями фолиевой кислоты и по укреплению лабораторного потенциала для оценки рисков в отношении врожденных пороков, предупреждаемых с помощью солей фолиевой кислоты.
\n\nМеждународный справочно-информационный центр по эпиднадзору и исследованиям в области врожденных пороков является добровольной некоммерческой международной организацией, состоящей в официальных отношениях с ВОЗ. Эта организация собирает данные эпиднадзора в отношении врожденных пороков и программ исследований, проводимых во всем мире, с тем чтобы изучать и предупреждать врожденные пороки, а также смягчать их последствия.
\n\nДепартаменты ВОЗ по репродуктивному здоровью и научным исследованиям и по питанию для здоровья и развития в сотрудничестве с Международным справочно-информационным центром по эпиднадзору и исследованиям в области врожденных пороков и Национальным центром CDC по врожденным порокам и проблемам развития организуют ежегодные семинары по эпиднадзору и предупреждению врожденных пороков и преждевременных родов. Департамент ВОЗ по ВИЧ/СПИДу сотрудничает с этими партнерами в целях усиления эпиднадзора за пороками развития среди женщин, получающих антиретровирусные препараты во время беременности, в качестве неотъемлемой части мониторинга и оценки национальных программ по борьбе с ВИЧ.
\n\nАльянс ГАВИ, в число партнеров которого входит ВОЗ, оказывает помощь развивающимся странам в активизации борьбы и ликвидации краснухи и синдрома врожденной краснухи путем иммунизации.
\n\nВОЗ разрабатывает нормативные инструменты, в том числе руководящие принципы и глобальный план действий по укреплению служб медицинской помощи и реабилитации в поддержку осуществления Конвенции о правах инвалидов. Аналогичным образом ВОЗ оказывает помощь странам в деле включения служб медицинской помощи и реабилитации в общую систему первичной медико-санитарной помощи, поддерживает разработку программ реабилитации на уровне отдельных сообществ и способствует укреплению специализированных центров реабилитации, а также их связей с центрами реабилитации на уровне отдельных сообществ.
\nКонвенция ООН о правах инвалидов
\n\nДепартамент ВОЗ по общественному здравоохранению и окружающей среде ведет работу по целому ряду направлений деятельности и разрабатывает меры вмешательства для решения вопросов, связанных с экологическими и социальными детерминантами развития детей. В их число входят: свойственная только детям уязвимость к загрязнению воздуха внутри и вне помещений, загрязнению воды, отсутствию элементарной гигиены, токсичным соединениям, тяжелым металлам, компонентам отходов и радиационному излучению; смешанное воздействие факторов, связанных с социальной средой, профессиональной деятельностью и питанием, а также условия проживания детей (дом, школа).
\n«,»datePublished»:»2020-12-01T22:52:00.0000000+00:00″,»image»:»https://www.who.int/images/default-source/imported/preterm-birth-mother-jpg.jpg?sfvrsn=c5c1adf1_0″,»publisher»:{«@type»:»Organization»,»name»:»World Health Organization: WHO»,»logo»:{«@type»:»ImageObject»,»url»:»https://www.who.int/Images/SchemaOrg/schemaOrgLogo.jpg»,»width»:250,»height»:60}},»dateModified»:»2020-12-01T22:52:00.0000000+00:00″,»mainEntityOfPage»:»https://www.who.int/ru/news-room/fact-sheets/detail/congenital-anomalies»,»@context»:»http://schema.org»,»@type»:»Article»};
Скрининг преэклампсии на 35–37-й неделе беременности
В III триместре в ходе скрининга роста и состояния плода можно с точностью в 85% выявить женщин группы риска, у которых может развиться поздняя преэклампсия, после 37-й недели беременности.
Выявление в III триместре в ходе скрининга роста и состояния плода женщин, входящих в группу риска поздней преэклампсии, важно, поскольку интенсивный мониторинг матери и ребенка позволяет своевременно выявить признаки заболевания и сопровождающую его задержку внутриутробного развития плода. При угрозе преждевременных родов это дает возможность провести своевременное подготовительное лечение легких плода и выбрать правильное время родов, предотвратив таким образом тяжелые осложнения.
- Группа высокого риска. В эту группу входят женщины, для которых по результатам скрининга риск преэклампсии до 42-й недели был выше 1:100. В группу входит 20% участниц исследования, из них у 90% преэклампсия развивается до 40-й недели беременности. Этих женщин регулярно обследует врач, измеряя артериальное давление и проводя анализ мочи на обнаружение белка на 36–39-й неделях беременности. Тем женщинам, у которых на 36-й неделе беременности отмечалась задержка развития плода или у которых развилось высокое кровяное давление, регулярно проводится ультразвуковое обследование и оценка роста и состояния плода.
- Группа среднего риска. В эту группу риска входят женщины, для которых по результатам скрининга риск преэклампсии до 42-й недели составлял от 1:100 до 1:200. В группу вместе с женщинами высокой группы риска входит менее 60% участниц исследования, и среди них почти все женщины, у которых преэклампсия развивается после 40-й недели беременности. Им, чтобы правильно спланировать время родов, рекомендуется провести переоценку риска на 40-й неделе беременности.
- Группа низкого риска. В эту группу входят женщины, для которых по результатам скрининга риск преэклампсии до 42-й недели беременности был ниже 1:200. В группу входит 40% участниц исследования, и эти женщины получают уверенность, что в 99,9% случаев у них до родов не разовьется преэклампсии и они смогут спокойно дождаться спонтанных родов.
Читать дальше:
Последствия для младенцев с ограничением внутриутробного развития
Ограничение внутриутробного развития — это состояние, при котором плод не достигает своего потенциала роста и связано с перинатальной подвижностью и смертностью. Ограничение внутриутробного развития вызвано плацентарной недостаточностью, которая определяет сердечно-сосудистые нарушения у плода. Это состояние, кроме того, должно побуждать к интенсивному антенатальному наблюдению за плодом, а также к последующему наблюдению за младенцами с задержкой внутриутробного развития, поскольку следует учитывать краткосрочные и долгосрочные последствия.
1. Введение
Плоды с нарушением внутриутробного развития в результате плацентарной недостаточности подвержены повышенному риску неблагоприятных краткосрочных и долгосрочных исходов [1]. Фактически, ограничение внутриутробного развития плода (ЗВУР) является основной причиной перинатальной смертности и заболеваемости и связано с рядом проблем со здоровьем на протяжении всей жизни. Текущее перинатальное ведение плода с ЗВУР направлено в первую очередь на определение оптимального времени родов с последующим интенсивным неонатальным вмешательством для достижения оптимальных темпов роста во избежание неблагоприятных перинатальных осложнений [2].
ЗВУР можно рассматривать как неспособность плода, пережившего недостаточное питание, достичь своего генетического потенциала роста [3]. Это в основном сосудистое заболевание, которое состоит из нарушения роста плода и многососудистых проявлений сердечно-сосудистой системы плода [1]. Циркуляционная реакция плода на плацентарную недостаточность включает перераспределение артериального кровообращения с преимущественным распределением сердечного выброса в сторону левого желудочка, который в основном поддерживает адекватное снабжение кислородом как головного мозга, так и очага.При дальнейшем ухудшении состояния плода сердечная дисфункция приводит к аномальным профилям скорости венозного кровотока, включая обратный поток в венозном протоке во время сокращения предсердий и пульсацию предсердий в пупочной вене.
Более того, сердечная функция плода отличается по ЗВУР по сравнению с АГА плодов, поскольку плацентарная недостаточность влияет на очаг плода. Фактически, у IUGR плодов наблюдается измененная сердечная функция как в систолической, так и в диастолической фазе, что определяет более раннее и более выраженное правое, чем левое, и диастолическое, чем систолическое ухудшение сердечной функции плода [4].
Плоды классифицируются как ЗВУР, если расчетная масса плода (EFW) ниже 10-го перцентиля и индекс пульсации пупочной артерии (PI)> 2 SD.
2. Краткосрочный результат
Ограничение внутриутробного развития имеет огромное значение в акушерской практике. Современная система классификации мертворожденных, ReCoDe, показала, что ЗВУР является наиболее частым фактором, выявляемым у мертворожденных младенцев. Кроме того, это имеет серьезные последствия для выживших младенцев. ЗВУР связано с повышенным риском преждевременных родов; повышенная заболеваемость недоношенными новорожденными, включая некротический энтероколит; низкий балл по шкале Апгар; гипоксическое повреждение головного мозга и его отдаленные последствия; необходимость респираторной поддержки и хронические заболевания легких; ретинопатия недоношенных; отделение длительной неонатальной интенсивной терапии (ОИТН) и смертность [3].Кроме того, ряд причин ЗВУР связан с повышенным риском ЗВУР и внутриутробной смерти (ВМС) при последующей беременности матери [5].
Перинатолог играет фундаментальную роль в диагностике наличия и причины ЗВУР во время беременности, чтобы избежать серьезных последствий, посредством ультразвуковой оценки предполагаемой массы плода и допплеровского исследования кровообращения плода. В частности, это, по-видимому, связь между продолжительностью внутриутробного дефицита и перинатальным исходом.
3. Гипотеза Баркера и фетальное программирование болезни взрослых
Низкая масса тела при рождении, вызванная преждевременными родами и / или задержкой внутриутробного развития, недавно была связана с повышением частоты сердечно-сосудистых заболеваний и инсулинозависимого диабета у взрослых. жизнь [6–10].
Гипотеза «происхождения болезни у взрослых», часто называемая «гипотезой Баркера», предполагает, что эти заболевания возникают в результате адаптации плода, когда он недоедает.Эти адаптации могут быть сердечно-сосудистыми, метаболическими или эндокринными, и они могут навсегда изменить структуру и функции организма, увеличивая факторы риска ишемической болезни сердца, такие как гипертония, сахарный диабет 2 типа, инсулинорезистентность и гиперлипидемия [11–14]. . Эта гипотеза первоначально была основана на наблюдении Баркера и его коллег, что регионы Англии с самыми высокими показателями младенческой смертности в начале 20-го века также имели самые высокие показатели смертности от ишемической болезни сердца десятилетия спустя.Поскольку наиболее часто регистрируемой причиной младенческой смерти в начале 20-го века была низкая масса тела при рождении, эти наблюдения привели к гипотезе о том, что младенцы с низкой массой тела, пережившие младенчество и детство, могут подвергаться повышенному риску ишемической болезни сердца в более позднем возрасте. [15].
Как сообщили Баркер и его коллеги в нескольких эпидемиологических и антропологических исследованиях, в жизни плода ткани и органы проходят так называемые «критические» периоды развития. Это может совпадать с периодами быстрого деления клеток.Хотя на рост плода влияют его гены, несколько исследований показывают, что он обычно ограничивается внутриутробной средой, в частности питательными веществами и кислородом, получаемыми от матери. Влияние, связанное с ростом плода и плаценты, оказывает важное влияние на риск ишемической болезни сердца и инсульта. Таким образом, эта теория, сфокусированная на внутриутробной жизни, предлагает новую отправную точку для исследований сердечно-сосудистых заболеваний. Согласно гипотезе бережливого фенотипа, недостаточное питание плода может сопровождаться программированием, которое включает регулировку кровообращения и инсулинорезистентность в печени и мышечной ткани для сохранения мозга [6–10, 16].
Кроме того, послеродовое избыточное питание после ограничения внутриутробного развития может быть патогенетическим для развития ожирения и диабета 2 типа, тогда как повышенная смертность от сердечно-сосудистых заболеваний может быть связана с быстрым догоняющим ростом в постнатальном периоде в раннем младенчестве [17]. Были рассмотрены многие сообщения о взаимосвязи между размером тела при рождении и неблагоприятным метаболизмом глюкозы и инсулина. В частности, задержка роста плода связана с повышенной инсулинорезистентностью, более высокими концентрациями инсулина натощак и увеличением частоты диабета 2 типа.Было показано, что окружность живота новорожденных позволяет прогнозировать уровни холестерина и фибриногена в плазме у взрослых в более зрелом возрасте, которые являются факторами риска сердечно-сосудистых заболеваний.
Связь между IUGR и повышенным артериальным давлением в детстве и взрослой жизни была широко продемонстрирована во всем мире. В 1996 году обзор, основанный на 34 исследованиях с участием более 66 000 человек всех возрастов, выявил отрицательную взаимосвязь между массой тела при рождении и систолическим артериальным давлением в детстве и во взрослом возрасте.Эта взаимосвязь не зависела от размера тела во время измерения артериального давления, и ее величина имела тенденцию к увеличению с возрастом [18, 19].
Аналогичный обзор 2001 г., основанный на 27 независимых обсервационных исследованиях, также показал, что средняя разница систолического артериального давления составляет -1,7 мм рт. Ст. На килограмм прироста массы тела при рождении. Обзор также документально подтвердил устойчивую отрицательную связь между массой тела при рождении и диастолическим артериальным давлением. Помимо низкой массы тела при рождении, у людей с ЗВУР были выявлены 3 других ранних фактора, которые считаются важными факторами риска развития высокого кровяного давления во взрослой жизни.Во-первых, предполагается, что ускоренный послеродовой рост веса и длины тела увеличивает риск развития гипертонии и диабета 2 типа в более позднем возрасте. Во-вторых, было постулировано, что измененная активность ангиотензина является важным фактором, лежащим в основе гипотезы «эмбриональное происхождение болезней взрослых». Также предполагается, что гипоксия увеличивает активность симпатических нервов и продукцию катехоламинов, а также пролиферацию юкстагломерулярных клеток (и, следовательно, клеток, продуцирующих ренин) в качестве факторов патогенеза [20, 21].В последующем исследовании, недавно опубликованном Cosmi et al. демонстрирует, что измерения систолического артериального давления у 2-летних детей, рожденных с внутриутробным ограничением, значительно выше по сравнению с соответствующими показателями для детей того же возраста гестационного возраста [22].
С исторической точки зрения очевидно, что гипотеза Баркера получила значительную поддержку из-за ее последствий для общественного здравоохранения. Однако следует учитывать, что многие факторы, влияющие на кровяное давление во взрослой жизни, помимо веса при рождении, могут влиять на него.Кроме того, результаты могут быть объяснены большей генетической неоднородностью включенных в исследование лиц. Однако, как заявили Глюкман и Хансон, «больше невозможно игнорировать фазу развития жизни» [23], и последующие исследования в раннем детстве помогут медицинскому сообществу и общественному здравоохранению в разработке вмешательств, чтобы гарантировать наилучшее качество развития плода. развитие [19].
4. Эндотелиальная дисфункция
Эндотелий контролирует сосудистый тонус, коагуляцию и воспалительные реакции.Эндотелиальная дисфункция — это раннее проявление атеросклероза, предшествующее структурным изменениям сосудистой стенки. Считается, что атеросклероз начинается в детстве и развивается незаметно до появления таких клинических событий, как инфаркт миокарда или инсульт [24].
Как и в случае основных факторов риска сердечно-сосудистых заболеваний, нарушение роста в утробе матери связано с функциональными (эндотелиальная дисфункция) и структурными (увеличение толщины стенки) изменениями артериальных сосудов, соответствующими раннему атеросклерозу.Нарушение роста плода у младенцев связано с повышенным симпатическим тонусом и концентрацией липидов, а также снижением концентрации инсулиноподобного фактора роста-1, что может способствовать утолщению артериальной стенки. Однако эти результаты трудно интерпретировать из-за возможного смешения постнатальных влияний или взаимодействия с ними, поэтому эта гипотеза требует дальнейшего уточнения. Teeninga et al. продемонстрированы атероматозные изменения аорты у детей. Гистопатологические изменения были зарегистрированы в раннем детстве, и было установлено, что первые атеросклеротические поражения фактически начинают развиваться в брюшной аорте [25].В настоящее время многие исследования продемонстрировали утолщение атеросклеротических стенок артерий у детей с факторами риска сердечно-сосудистых заболеваний с помощью ультразвуковой визуализации для оценки неинвазивных ранних сосудистых изменений.
В 2005 году Скилтон и его коллеги добавили новую интересную информацию к гипотезе Баркера. Они сравнили толщину интима-медиа (AIMT) стенки аорты у новорожденных с низкой массой тела при рождении с нормальным контролем. У новорожденных, рожденных с ЗВРП, показатель AIMT был значительно выше, чем в контроле.На основании этих результатов ультразвуковое измерение толщины интима-медиа брюшной аорты у детей было описано как возможный, точный и чувствительный маркер риска атеросклероза, и, поскольку не было никаких противоречий с детства и взрослых воздействий, они предоставили четкие указания на вклад плода в более поздние сердечно-сосудистые заболевания [26]. Также Koklu et al. в 2007 г. оценили потенциальное использование aIMT в исследовании новорожденных из группы высокого риска, сделав вывод, что измерение aIMT у новорожденных с IUGR может помочь в раннем выявлении бессимптомной сосудистой дисфункции [27–29].Недавно Cosmi et al. впервые изучали aIMT у плодов, а затем у тех же младенцев после среднего периода наблюдения 18 месяцев. Это исследование показало, что измерения aIMT у IUGR плодов были обратно пропорциональны расчетной массе плода, показывая, что низкая масса тела при рождении и доплеровские аномалии могут быть связаны с измененной сосудистой структурой, вызывающей возможное повреждение эндотелия, что согласуется с выводом о том, что атеросклероз начинает развиваться первым в зародыше. интима аорты. Эти различия присутствовали также во время наблюдения [30].
Аналогичным образом, толщина интима-медиа сонной артерии была больше у детей с низкой массой тела при рождении. В недавнем исследовании Crispi et al. подтверждает наличие увеличенной толщины стенки сонной артерии у детей с ЗВУР и то, что эти изменения сохраняются в детстве. Увеличение толщины артериальной стенки может быть результатом ремоделирования сосудов, связанного с метаболическим программированием во внутриутробной ограниченной жизни [31]. Они также подчеркнули, что у детей с ЗВУР наблюдаются изменения в морфологии сердца, субклиническая продольная дисфункция сердца и гипертензия, которые линейно увеличиваются с тяжестью ограничения роста и не зависят от гестационного возраста при родах, липидного профиля или индекса массы тела.
Важность раннего выявления и вмешательства в педиатрические факторы риска сердечно-сосудистых заболеваний в настоящее время широко признана, и это может открыть новые возможности для мониторинга и вмешательства у новорожденных и детей, страдающих задержкой внутриутробного развития.
5. Плодовое программирование и почечные последствия
Согласно программированию плода, почки также чрезвычайно чувствительны к задержке внутриутробного развития и часто оказываются маленькими по сравнению с массой тела [32].Несколько исследований на животных и людях описали уменьшение количества нефронов после ЗВУР. Это приводит к врожденному уменьшению площади поверхности клубочковой фильтрации, в то время как почечный кровоток в клубочках увеличивается в попытке поддерживать нормальную общую скорость клубочковой фильтрации. Согласно гипотезе гиперфильтрации, объясненной Бреннером и соавторами [33–35], это приводит к гломерулярной гипертензии и гипертрофии, которые вызывают системную гипертензию и повышенную реабсорбцию натрия и повреждение клубочков, приводящее к альбуминурии и гломерулоклерозу.Кроме того, преждевременные роды подразумевают более короткий период активного нефрогенеза, как описано Rodríguez et al., Что приводит к нарушению развития почек [36]. Следовательно, ЗВУР может привести к нарушению функции почек. Почка с уменьшенным числом нефронов имеет меньший почечный резерв для адаптации к излишкам диеты или для компенсации повреждения почек. Путь, ведущий от маленькой почки к гипертензии, может включать ренин-ангиотензиновую систему, которая изменяется на ранней стадии первичной гипертензии. Повышенная активность ренин-ангиотензиновой системы может быть компенсаторным механизмом в уменьшенном количестве нефронов для поддержания нормальной фильтрации [37].Эти механизмы хорошо описаны в экспериментальных исследованиях с участием самцов крыс IUGR, у которых в возрасте 22 недель было более высокое кровяное давление и меньше клубочков [38]. За последние пять лет появилось больше клинических данных о развитии функции почек у младенцев с ЗВУР. Кейзер-Вин и его коллеги в 2005 году определили положительную связь массы тела при рождении и скорости клубочковой фильтрации (СКФ). Исследователи также обнаружили отрицательную связь между массой тела при рождении и креатинином сыворотки, что позволяет предположить, что у лиц с ЗВУР повышен риск развития гипертонии и прогрессирующей почечной недостаточности [39].Эта работа внесла значительный вклад в понимание механизма, связанного с прогрессированием сердечно-сосудистых заболеваний и внутриутробной задержкой развития плода. В отличие от Rakow et al. обнаружили, что скорость клубочковой фильтрации и структура белка в моче были одинаковыми у детей 12-летнего возраста с ЗВУР и контрольной группы, но объем почек был меньше в первой группе [40]. Метаанализ, опубликованный Teeninga et al. в 2008 г., включавший 201 пациента (25 SGA, 176 AGA), показал, что низкая масса тела при рождении оказывает сильное влияние на скорость клубочковой фильтрации и протеинурию, что связано с более высокой вероятностью развития ряда осложнений, включая гипертензию [41].Недавнее последующее исследование показало, что 5-летние дети, рожденные с ЗВУР, показали более высокое кровяное давление, повышенную альбуминурию, более низкий GRF и другую скорость экскреции натрия с мочой по сравнению с контрольной группой. Эти наблюдения подтверждают утверждение о том, что внешнее повреждение почек не является предпосылкой для инициирования и сохранения почечного повреждения и что определенных обстоятельств, обусловленных пренатальным характером, внутренних недостатков функционирующей почечной массы может быть достаточно, чтобы способствовать ухудшению функции почек, происходящему с возрастом.
6. Младенческое нейроразвитие
Ограничение внутриутробного развития играет важную роль как в краткосрочном, так и в долгосрочном исходе и отражается в высокой частоте дисфункции мозга и нарушений развития нервной системы, а также в соматической недостаточности роста. Эти клинические последствия не могли быть очевидны до более позднего периода детского развития и могли включать в себя плохую успеваемость, проблемы с памятью, зрительно-моторными и языковыми проблемами, а также проблемы с управляющими функциями. Несколько лонгитюдных исследований рассматривали вопрос о корреляции между когнитивным развитием и соматическим ростом при ЗВУР, используя другой вопросник, касающийся аспектов чтения, письма, орфографии и математики.Повышенный риск когнитивных нарушений был продемонстрирован у детей с небольшой окружностью головы [42]. Шенкин и др. обнаружили, что масса тела при рождении в значительной степени связана с IQ в возрасте 11 лет [43]. Согласно другим исследованиям, у детей с ЗВУР невербальный и вербальный IQ ниже, чем у детей контрольной группы [44]. По данным Национального совместного перинатального проекта (1959–1976), показатели IQ 2719 детей с ЗВУР, протестированных в возрасте 7 лет, были на 6 баллов ниже, чем у детей с AGA. Зрительно-моторное развитие также было ниже в группе ЗВУР.Помимо нейросенсорных нарушений, серьезную озабоченность вызывают также поведенческие последствия. Поведенческие проблемы, которые могут проявиться только в школьном возрасте, могут иметь большое влияние на успеваемость в школе и социальную компетентность и отрицательно влиять на качество жизни [45]. О трудностях в обучении и поведенческих проблемах чаще сообщают у недоношенных новорожденных с ЗВУР по сравнению с АГА [46].
Лечение этих младенцев спорно. У них повышенная перинатальная смертность и заболеваемость, включая поведенческие проблемы, незначительную задержку развития, слабое нейросенсорное развитие и спастический церебральный паралич.Определение этих важных долгосрочных отношений требует исследования патологического механизма. Недавние расширенные исследования магнитно-резонансной томографии показали, что ЗВУР связана со структурными различиями, которые можно выявить в очень раннем возрасте, такими как уменьшение серого вещества коры головного мозга, объема гиппокампа и индекса сулькации. Эти макроструктурные изменения были связаны с микроструктурными и метаболическими изменениями [47]. Как пояснил Башат и др. [48], IUGR-плод «обеспечивает» сохранение головы при росте во внутриматочной среде с низким содержанием питательных веществ и имеет нейроадаптивную модификацию, направленную на сохранение снабжения мозга кислородом при хронической гипоксии.Клинически этот процесс идентифицируется по пониженному индексу допплеровской пульсации (ИП) в средней мозговой артерии (СМА) [49]. При рассмотрении нескольких параметров, таких как гестационный возраст и масса тела при рождении, обратная конечная диастолическая скорость в пупочной артерии (UA-REDV) определяется как важный фактор развития нервной системы. Подобный эффект не может быть продемонстрирован для аномальных результатов венозного допплера. Сохранение мозга и результаты допплерографии артерий головного мозга являются объектами исследования в качестве предикторов неблагоприятного неврологического исхода, но эти взаимосвязи не получили должной оценки [45, 50].Эти данные имеют важное значение для прогноза и лечения плодов и детей с задержкой внутриутробного развития, за которыми следует внимательно наблюдать, чтобы выявить лиц из группы риска [42].
7. Выводы
Важность ЗВУР в понимании неблагоприятного исхода беременности имеет значение не только для клиницистов, но и для службы общественного здравоохранения. В течение последнего десятилетия знания о краткосрочных и долгосрочных последствиях нарушения роста плода росли очень быстрыми темпами и включали множество клинических аспектов.В настоящее время очень важно не только разработать эффективные методы профилактики и диагностики ЗВУР, выявления плодов из группы риска и скрининга задержки роста плода среди беременностей с низким риском, но и разработать программы последующего наблюдения и адекватного лечения для контроля за беременностью. расстройства, которые могут следовать за этими условиями. Выбор правильного времени для родов — лучший способ избежать неблагоприятного перинатального исхода; действительно, правильное послеродовое вскармливание и рост ребенка могут иметь важное значение для долгосрочного результата.
Границы | От редакции: Причины и последствия ограничения внутриутробного развития
Истоки здоровья и болезни могут быть запрограммированы во время внутриутробного развития, вызванного неблагоприятной внутриутробной средой, известной как «программирование плода». Ограничение внутриутробного или внутриутробного роста плода (IUGR / FGR) описывает патологическое состояние, при котором плод не может развиваться до своего биологического потенциала, в первую очередь из-за плохой функции плаценты. В свою очередь, известно, что FGR приводит к краткосрочным и долгосрочным последствиям, таким как сердечно-сосудистые, почечные, иммунологические и неврологические заболевания, которые сильно влияют на людей и общество.Отсутствуют адекватные диагностические подходы и терапевтические вмешательства. Таким образом, вскрытие клеточных и молекулярных механизмов, вызывающих плацентарную дисфункцию, субоптимальное развитие органов плода / потомства и нарушение генетического / эпигенетического программирования у потомства, является серьезной проблемой, необходимой для изучения возможных вмешательств. Определение индивидуальных причин FGR позволит лучше диагностировать и выявить возможных трансляционных кандидатов для вмешательства с целью улучшения здоровья потомства FGR.
Целью настоящего сборника «Причины и последствия задержки внутриутробного развития (ЗВУР)» было объединить множество причин задержки роста плода и описать последствия предрасположенности к различным заболеваниям в более позднем возрасте. 21 публикация, как обзоры, так и оригинальные исследовательские работы, включает фундаментальные научные и клинические исследования, посвященные плацентарному происхождению ограничения роста, трудностям, связанным с диагностикой in utero , возможным механизмам, инициирующим неблагоприятную материнскую среду, а также последствиям программирования плода. для здоровья новорожденных и на всю жизнь, а также обсуждение возможных вмешательств.
При составлении этой коллекции исследований мы еще больше осознали, насколько разнообразна эта проблема, и что мы остаемся далеки от выявления общих молекулярных механизмов или установления простой концепции происхождения здоровья и болезней. После короткого обсуждения с Салавати и др., Одним из авторов, приглашенные редакторы этого сборника хотели бы сместить термин «задержка / ограничение внутриутробного развития» (ЗВУР) в сторону термина «ограничение роста плода» (FGR).Как исследователи в этой области, мы согласились с тем, что термин FGR более уместно указывает на то, что риску подвергается человек, а не окружающая среда. Кроме того, мы хотели бы поощрять отход от взаимозаменяемого использования терминов малый для гестационного возраста (SGA) и FGR — в прошлые годы оба термина описывали расчетный вес плода / вес при рождении <10-го центиля, но SGA не следует использовать как синоним FGR. Наиболее важно то, что разница между SGA и FGR относится к тому факту, что FGR-плоды патологически ограничены в росте и демонстрируют сокращение траектории роста при нарушении функции плаценты.SGA описывает плод, который является маленьким, но с нормальной траекторией роста и нормальной допплеровской велосиметрией пупочной артерии, которая указывает на то, что плод с SGA растет в основном маленьким в соответствии с его генетически детерминированными размерами. Напротив, FGR-плоды не достигают своего генетически детерминированного потенциального размера из-за патологического прерывания нормального роста, чаще всего в результате плацентарной недостаточности. Таким образом, SGA определяет статистическое отклонение только размера, но не патологического состояния. Более того, в будущих исследованиях было бы целесообразно рассмотреть подразделение FGR с ранним началом (<32 недель) и FGR с поздним началом (≥32 недель), потому что два разных временных интервала, вероятно, связаны с разными причинами дисфункции плаценты и безусловно, приведет к различным последствиям для ребенка с ограниченным ростом.
Помимо генетических дефектов или внутриутробных инфекций, FGR в первую очередь связывают с дисфункциональной плацентой. Уроки, полученные от мутантных мышей, демонстрируют, что дефектные структуры плаценты явно связаны с FGR. Обзор Woods et al. обобщает исследования распространенных типов дефектов плаценты у установленных мутантов мышей, которые помогают нам лучше понять паттерн экспрессии плацентарных генов, влияющий на неудачи в плацентарной системе человека. Кроме того, экспрессия генов, ответственных за развитие различных структур плаценты, часто модулируется эпигенетическими механизмами.
Выявление нарушения развития плаценты — еще одна проблема; Salavati et al. показывают, что скрининг дефектного развития плаценты у человека с помощью морфометрии может служить для выявления FGR на ранних стадиях для лучшего клинического ведения.
Дисфункция плаценты и снижение передачи питательных веществ к плоду является основным медиатором замедления роста плода, однако плацента может компенсировать и, таким образом, поддерживать здоровье развивающегося плода. Используя мышиные мутанты, дефектные по IGF2, Hayward et al.продемонстрировали, что плацента способна компенсировать транспорт кальция за счет уменьшения белков, связывающих кальций, белка, связанного с паратиреоидным гормоном, и увеличения киназы, регулируемой сывороткой / глюкокортикоидами. Другой компенсирующий механизм описан Schmidt et al. с использованием модели крыс FGR, которых кормили низкобелковой диетой во время беременности, было выявлено, что у потомства значительно снижен уровень местного кортикостерона, что, вероятно, является механизмом для поддержания развития мозга. Механизмы эндогенной компенсации редко изучаются в рамках исследований ЛГР, но могут помочь определить новые варианты лечения в будущем.Плацентарная инфекция во время беременности также является основной причиной FGR, и обзор Seitz et al. описывает молекулярные механизмы заражения Plasmodium falciparum — все еще важной проблемой и причиной ЛГР в тропических / субтропических регионах — через определенный поверхностный антиген. Расшифровка таких стратегий заражения может дать толчок к разумным вариантам лечения.
Преэклампсия, вызываемая беременностью, является первичным осложнением, связанным с FGR и повышением уровня антиангиогенной растворимой fms-подобной тирозинкиназы 1 (sFlt-1) плаценты.Vogtmann et al. представляет модель мыши со сверхэкспрессией hs-Flt-1, которая свидетельствует о том, что sFlt-1 отвечает за развитие FGR из-за снижения плацентарной эффективности с изменениями в сосудистой сети матери / плода.
В нескольких исследованиях подчеркивалось, что влияние ЛГР на мать часто игнорируется. Многоцентровое исследование Feenstra et al. выявили, что недостаточность перфузии материнских сосудов способствует развитию FGR на поздних сроках беременности. Материнская васкуляризация в фето-материнской единице у людей и мышей включает вазодилатацию матки и ремоделирование сосудов при инвазии трофобластов с помощью иммунных клеток.Используя специфическую делецию рецептора прогестерона в дендритной клетке мыши, Thiele et al. показали, что нарушение перекрестной связи между прогестероном и дендритными клетками приводит к снижению иммунных клеток, защищающих беременность, что приводит к плохой плацентации и FGR. Эти данные подтверждаются исследованиями беременных женщин, проведенными Dunk et al., Где дефектная опосредованная прогестероном плохая децидуализация связана с повышенным профилем зрелых дендритов и неудачей маточно-сосудистого ремоделирования при FGR.
Этот обзор открывает дискуссию о функциональных связях между пороком развития плаценты и сердечно-сосудистыми заболеваниями, а также заболеваниями головного мозга у взрослых. Здесь необходимо упомянуть, что не только у младенцев с FGR может развиться сердечно-сосудистое заболевание в более позднем возрасте, но существуют долгосрочные сердечно-сосудистые последствия для матерей, у которых развивается преэклампсия во время беременности, тема, которая очень интересна, но не освещена в нашей коллекции. .
Langmia et al.обобщить влияние продолжительного неблагоприятного материнского окружения, такого как диабетическая беременность, а также недоедание и гипоксические состояния на генетические / эпигенетические модификации плаценты, которые, в свою очередь, вносят вклад в FGR в сочетании с программированием сердечно-сосудистой системы у грызунов и людей. Malhotra et al. обратить внимание на последствия ограничения роста для новорожденного после рождения и объединить обзор литературы, чтобы показать, что FGR связан с респираторными, сердечно-сосудистыми и неврологическими заболеваниями после рождения, которые могут потребовать дополнительного лечения в неонатальной интенсивной терапии.Наличие и тяжесть неонатального и долгосрочного респираторного, сердечно-сосудистого и неврологического дефицита отражают раннее или позднее начало FGR, степень ограничения роста, степень адаптации сердечно-сосудистой системы плода и срок беременности при рождении. Патология новорожденных подтверждена Villamor-Martinez et al. которые показывают, что у детей с FGR, но не с SGA, сохраняется открытый артериальный проток после рождения, что еще раз подчеркивает важность различения между SGA и FGR в клинических исследованиях.Легочные последствия FGR исследованы Allison et al. в FGR и правильно выращенных недоношенных ягнятах, а также с потенциальными терапевтическими эффектами раннего вмешательства со стволовыми клетками пуповинной крови.
Акушерское лечение может улучшить догоняющий рост детей с ЛГР, а также улучшить нервное развитие и поведенческие результаты (van Wyk et al.). Когда ограничение роста вызвано диетой с ограничением калорий во время беременности крыс, вмешательство лактоферрина улучшает FGR и оказывает нейрозащитный эффект, как показано van de Looij et al.Клинические исследования последствий для здоровья потомства должны тщательно различать детей только с FGR, с FGR и преждевременными родами и младенцев, определенных как дети с SGA. В этом контексте Morsing et al. может продемонстрировать, что уменьшение объемов мозга, определяемое МРТ, обычно рассматриваемое как следствие FGR, более вероятно из-за преждевременных родов.
Многие исследования посвящены последствиям неблагоприятной материнской среды для развития мозга у детей с ограниченным ростом.Многие из тех материнских оскорблений, которые резюмировали Бод и Беркейн, включают нарушение регуляции стероидных гормонов и факторов роста, которые опосредуют плацентарный обмен между плодами и матерью для роста плода и развития нервной системы. Более долгосрочные неврологические последствия плацентарной недостаточности и FGR становятся все более понятными, особенно по мере того, как используются стандартизированные определения FGR и SGA вместе со стандартными инструментами оценки (Vollmer и Edmonds). Hartkopf et al. исследовали происхождение измененной функции нервного развития у потомства FGR и обнаружили, что реакции плода показывают ранние признаки измененного развития мозга, в то время как в 2-летнем возрасте у детей, рожденных с FGR, была обнаружена задержка развития нервной системы.Действительно, в обзоре Фоллмера и Эдмондса описывается, что дети школьного возраста, рожденные с ограниченным ростом, с большей вероятностью будут демонстрировать когнитивный, поведенческий дефицит и / или дефицит внимания, и это особенно верно, когда FGR и преждевременные роды являются сопутствующими заболеваниями.
Обзор Fleiss et al. резюмирует исследования и клинические усилия по выявлению известных патогенных механизмов, которые способствуют ЛГР и, в частности, нарушениям нервного развития, и подчеркивает пробелы в знаниях, которые требуют устранения.Совершенно разумно, что они требуют более согласованной исследовательской направленности и глобального взаимодействия по этой сложной теме. Yawno et al. изучили онтогенез мозжечкового (неправильного) развития в последнем триместре FGR плодов овцы и показали, что измененный рост мозжечка очевиден антенатально, а продолжающийся in utero компромисс ведет к прогрессивному ухудшению развития мозжечка. Вместе эти доклинические и клинические исследования предоставляют убедительные доказательства того, что изменение развития мозга начинается с в утробе с из-за компромисса с плацентой, и поэтому ранняя диагностика и раннее вмешательство для улучшения неврологической функции у потомства с FGR являются ключевыми областями исследований.
Заключение
Сборник статей, представленный в этом специальном выпуске, направлен на описание различных причин и многих последствий для ребенка, развившегося в неблагоприятной внутриутробной среде, когда плацентарная недостаточность приводит к задержке роста плода. Мы описали материнские оскорбления или компромисс во время беременности, которые могут серьезно повлиять на рост плода и благополучие потомства, включая болезни беременности, расстройства пищевого поведения, инфекции / воспаления и гормональный дисбаланс.Однако очевидно, что ограничение роста плода в первую очередь вызвано дисфункцией плаценты, что приводит к хронической гипоксии и гипогликемии плода. Именно эти последствия плацентарной недостаточности приводят к замедлению роста плода в целом и неоптимальному развитию органов. FGR ассоциируется с бременем хронических заболеваний на протяжении всей жизни, включая метаболические, респираторные, сердечно-сосудистые и неврологические нарушения, которые сильно влияют на людей и общество. В настоящее время по-прежнему отсутствуют адекватные диагностические подходы, а также терапевтические вмешательства.Многочисленные исследования на животных, а также клинические испытания показывают, насколько сложно и сложно определить четкий фенотип и, как следствие, реализовать соответствующую стратегию ведения во время беременности, в период, который имеет высокие этические ограничения в лечении. Таким образом, в этой теме мы описали, что FGR тесно связан с измененными неонатальными и отдаленными исходами, и исследования для улучшения результатов должны основываться на улучшенном понимании патофизиологических механизмов, которые изменяют развитие и рост органов.Здесь наши авторы-участники предлагают более совершенные совместные исследовательские сети, которые будут продолжать работать над стандартизованной диагностикой и оценкой результатов, а также будут продолжать исследования, чтобы улучшить наше понимание сложных изменений, которые происходят из-за плацентарной недостаточности, с тем чтобы внедрить улучшенное клиническое ведение и лечение для уменьшения бремя ЛГР.
Авторские взносы
Все авторы участвовали в качестве редакторов этой темы исследования, а также написали и отредактировали эту редакционную статью.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Развитие мозга, интеллект и когнитивные результаты у детей, рожденных маленькими для гестационного возраста — FullText — Исследование гормонов в педиатрии 2010, Vol. 73, № 1
Аннотация
Ограничение внутриутробного развития (IUGR) может привести к тому, что младенцы родятся маленькими для гестационного возраста (SGA).SGA ассоциируется с повышенной неонатальной заболеваемостью и смертностью, а также с низким ростом, сердечно-сосудистыми заболеваниями, инсулинорезистентностью, сахарным диабетом 2 типа, дислипидемией и терминальной стадией почечной недостаточности во взрослом возрасте. Кроме того, у детей с SGA снижен уровень интеллекта и познания, хотя эффекты в основном незаметны. Общий результат каждого ребенка — результат сложного взаимодействия внутриутробных и внематочных факторов. Исследования на животных и людях показывают структурные изменения в мозге людей с IUGR / SGA.Присутствие рецепторов гормона роста (GH) в головном мозге означает, что мозг также является мишенью для GH. Экзогенный гормон роста теоретически может воздействовать на мозг. Примером этого является влияние гормона роста на познание у взрослых с дефицитом гормона роста. У детей с SGA данные о влиянии экзогенного гормона роста на интеллект и когнитивные способности скудны и противоречивы.
© 2010 S. Karger AG, Базель
Введение
Ограничение внутриутробного развития (ЗВУР) может привести к тому, что младенцы родятся маленькими для гестационного возраста (SGA) [1].SGA ассоциируется с повышенной неонатальной заболеваемостью и смертностью. Также в более старшем возрасте эти дети часто меньше детей, рожденных в соответствии с гестационным возрастом (AGA) [1]. Кроме того, дети с SGA подвержены риску сердечно-сосудистых заболеваний, инсулинорезистентности, сахарного диабета 2 типа, дислипидемии и терминальной стадии почечной недостаточности во взрослом возрасте [1]. Помимо отрицательного влияния на эти физические и метаболические параметры, у детей с SGA было описано снижение уровня интеллекта и познания.Однако природа и серьезность этих интеллектуальных и когнитивных уязвимостей сильно различаются между исследуемыми популяциями [2].
Интеллект включает набор способностей понимать, изучать и применять знания и может быть выражен в виде коэффициента интеллекта (IQ). Познание — это аспект поведения, связанный с обработкой знаний, который можно выделить в следующих когнитивных областях: речь и язык, зрительно-пространственные и зрительно-конструктивные навыки, моторика, обучение и память, внимание и исполнительные функции, такие как планирование, решение проблем и самоконтроль. [3].
И интеллект, и познание определяются генетическим разнообразием и вариациями в до- и постнатальной среде. Интеллект и познание можно рассматривать как функции мозга [3]. Учитывая наблюдаемое снижение интеллектуальных и когнитивных способностей детей с SGA, можно ожидать, что архитектура мозга и функционирование мозга различаются у детей с SGA и AGA.
Интерес к этой теме возрос после одобрения терапии гормоном роста (GH) для лечения детей с SGA [4].Влияние терапии гормоном роста на рост тщательно задокументировано [1]. Интересно, что одна группа описала влияние гормона роста на интеллект и когнитивные способности у детей с SGA [5], тогда как другая группа не обнаружила какого-либо значительного влияния гормона роста на интеллект [6].
В этом обзоре мы обобщаем данные литературы по развитию мозга после ЗВУР у животных и людей. Кроме того, мы рассмотрели и проанализировали исследования интеллекта и познания у детей с SGA. Наконец, мы обсуждаем влияние экзогенного гормона роста на мозг, интеллект и познание.
Определения
ЗВУР определяется как процесс снижения скорости роста плода, приводящий к неспособности плода реализовать свой потенциал роста. Это пренатальный диагноз, основанный на серийных ультразвуковых измерениях во время беременности [7]. К сожалению, для большинства беременностей несколько ультразвуковых измерений недоступны. SGA определяется как масса тела при рождении и / или длина тела ниже заранее определенного порогового значения [7]. Таким образом, группа детей с SGA будет включать не только детей, рожденных маленькими из-за IUGR, но и детей с конституциональным возрастом.Когда, например, за границу отсечения берется 5-й процентиль, примерно 20% детей, которых называют SGA, не будут ограничены в росте, а будут иметь малые конституциональные размеры [8]. Для изучения эффектов ЗВУР в большинстве исследований используется заранее установленный предел отсечения, хотя с методологической точки зрения предпочтительнее использовать серийные ультразвуковые исследования [7].
Развитие мозга после IUGR
Исследования на животных
Поскольку очень сложно получить образцы для гистопатологического исследования мозга человека IUGR, большая часть знаний о центральной нервной системе в IUGR была получена из исследований на животных.Различные методы индукции хронической ЗВРП использовались у различных видов животных (в основном крыс, овец и морских свинок) для изучения воздействия ЗВРП на мозг в середине или на поздних сроках беременности. Часто используемые методы — перевязка маточной артерии, эмболизация или недостаточность питания [9]. Кора головного мозга, гиппокамп и мозжечок являются наиболее изученными областями.
У животных с ЗВУР снижены общая масса тела и масса мозга. Однако вес мозга снижается в меньшей степени, что указывает на относительную щадимость мозга [10].При исследовании объем гиппокампа и мозжечка уменьшился по сравнению с контролем [11,12,13]. Гистопатологические исследования демонстрируют уменьшение толщины коры и уменьшенное количество нейронов у животных с ЗВУР [11,12,14,15,16]. Миграция нейронов в кору может быть отложена [17], а рост дендритов и аксонов замедлен [12,18,19]. Кроме того, была очевидна отсроченная и уменьшенная миелинизация [12,18,20,21]. Есть много факторов, которые влияют на распределение и тяжесть повреждения мозга, обнаруженного у животных с ЗВУР.Время, продолжительность и тяжесть ограничения роста по отношению к графику развития мозга в нескольких областях мозга определяют степень повреждения мозга у каждого вида [22]. Таким образом, эксперименты на животных с ЗВУР демонстрируют, что ЗВУР приводит к различным результатам аномального развития мозга плода.
Исследования на людях
Посмертных исследований человеческого мозга детей с SGA очень мало [23]. В небольшой группе доношенных новорожденных с SGA без документально подтвержденной ЗВУР было обнаружено снижение массы мозга и количества клеток в головном мозге по сравнению с контрольной группой с нормальной массой тела при рождении того же возраста [23].Кроме того, у младенцев с SGA было снижено общее количество и концентрация липидов миелина. С помощью магнитно-резонансной томографии можно изучать анатомию мозга человека in vivo. Визуальные исследования в сочетании с ультразвуковыми измерениями плодов во время беременности показывают, что, несмотря на сохранение мозга, ЗВУР приводит к уменьшению объема мозга [24]. Несколько исследований на недоношенных младенцах с задокументированным ЗВУР и у детей, рожденных с ЗГС, показали уменьшение общего объема головного мозга, наиболее выраженное в сером веществе коры головного мозга [25,26,27].Степень уменьшения объема хорошо коррелировала как с окружностью головы, так и с функциональным результатом в срок, особенно вниманием [26]. В отличие от объема головного мозга, корковая извилина и образование борозды страдают меньше [25].
К сожалению, продольных магнитно-резонансных исследований развития мозга у детей с SGA с момента рождения не проводилось. У подростков, рожденных с SGA в срок с догоняющим послеродовым ростом, была обнаружена тенденция к меньшему объему коры головного мозга по сравнению с контрольными подростками, но эта разница не была значимой [28,29].Исследования с участием детей SGA без догоняющего роста недоступны.
Таким образом, исследования как на животных, так и на людях демонстрируют стойкое недоразвитие мозга у животных и детей, рожденных с SGA.
Интеллект и познание у детей, рожденных SGA
Мы рассмотрели исследования, посвященные изучению интеллекта и познания у детей, рожденных SGA. Мы включили исследования, в которых представлены результаты, полученные на основе тестов интеллекта и когнитивных способностей, выполненных самими детьми. Были исключены исследования, основанные на анкетах родителей или учителей.Другим критерием включения была контрольная группа, состоящая из детей, рожденных AGA, с аналогичным гестационным возрастом. Были включены как можно более ранние исследования, начиная с 1972 года по февраль 2009 года.
Поскольку недоношенность является независимым фактором риска ухудшения интеллекта и когнитивных функций [30,31,32], исследования были сгруппированы в соответствии с гестационным возрастом на доношенных детей или детей. недоношенные дети (таблица 1) [31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52 , 53,54,55,56,57].
Таблица 1
Интеллект и когнитивные способности у детей, рожденных с SGA, по сравнению с детьми, рожденными AGA (сопоставленными по гестационному возрасту)
Дети, рожденные в сроке
Для исследований, включенных в таблицу 1, пороговое значение массы тела при рождении для определения SGA широко варьировалось , начиная с уровня ниже 2.От 3-го процентиля до 15-го процентиля. Размер группы также существенно различается. В большинстве исследований IQ оценивался только один раз, но в некоторых исследованиях детей тестировали повторно с промежутком в несколько лет.
Из таблицы 1 ясно, что в большинстве исследований IQ у детей с SGA значительно ниже, чем у детей контрольной группы AGA. Однако эта разница никогда не превышала 1 стандартное отклонение (15 баллов IQ). В исследованиях у детей с более тяжелым поражением SGA был самый низкий IQ. Разница в показателях IQ между детьми SGA и AGA была положительно связана с пороговым значением массы тела при рождении.В целом, исследования с более строгими критериями для определения SGA сообщили о более значительных различиях в показателях IQ между детьми с SGA и контрольной группой AGA, но эту связь следует интерпретировать с осторожностью, поскольку использовалось много разных наборов тестов с разными психометрическими свойствами.
Для различных когнитивных областей доступно значительно меньше данных. При тестировании дети с SGA показали худшие результаты в различных когнитивных областях по сравнению с их нормальными сверстниками. Учитывая широко распространенные когнитивные уязвимости в различных исследованиях, можно ожидать, что при систематическом тестировании дети с SGA будут хуже работать в различных когнитивных областях.Это подтверждается тем фактом, что дети SGA хуже успевают в школе и испытывают больше трудностей в обучении [31,51,55].
Дети, рожденные недоношенными
Как и следовало ожидать, у детей, родившихся недоношенными, IQ как в группах AGA, так и в группах SGA был ниже, чем у доношенных детей. Тем не менее, большинство исследований обнаружили значительно более низкий IQ у недоношенных детей, рожденных с SGA, по сравнению с недоношенными детьми, рожденными AGA.
Концептуальная модель интеллекта и познания у детей, рожденных SGA
Рождение SGA подвергает ребенка риску нарушения интеллекта и познания, но, как указывалось ранее, общий результат каждого человека является результатом сложного взаимодействия между несколькими факторов, как показано на рисунке 1.Некоторые из этих факторов действуют независимо, в то время как другие связаны с рождением SGA, то есть перинатальной заболеваемостью и более низким социально-экономическим статусом [31,32,41,46,51,52].
Рис. 1
Концептуальная модель интеллекта и познания у детей, рожденных SGA. Адаптировано из Noeker [2] с разрешения.
Внутриутробные факторы, определяющие рост и ограничение роста, можно разделить на факторы плода, матери и плаценты [58]. Серьезность ограничения роста [40], пренатальный характер роста головы [31,43,49] и перинатальные осложнения, включая недоношенность [31,33,52], являются ключевыми факторами в определении исхода ребенка с SGA при рождении.
После рождения, догоняющий рост тела и головы в послеродовой период может происходить по разным схемам. Хороший догоняющий рост связан с лучшими результатами в более старшем возрасте в отношении IQ и когнитивных функций [31,49,55]. Остальные факторы, определяющие конечный результат у детей с SGA, — это психосоциальные и генетические факторы. Наиболее важными факторами являются домашняя и школьная среда, социально-экономический статус и интеллект родителей [33,41,44].
GH и мозг
Распределение рецепторов GH
Из исследований на животных известно, что рецепторы GH (GHR), а также рецепторы инсулиноподобного фактора роста (IGF) -I обнаружены во всех типах клеток мозга. .Их больше всего в головном мозге плода и подростка, а затем с возрастом они уменьшаются [59]. Распределение GHR в неонатальном мозге человека в значительной степени неизвестно. Было опубликовано только одно исследование с использованием мозга плода человека, которое демонстрирует существование GHR на нейронах коры головного мозга [60]. Исследования на взрослых людях демонстрируют присутствие GHR и рецепторов IGF-I в различных областях человеческого мозга, но в основном они сконцентрированы в сосудистом сплетении, гипофизе, гиппокампе, скорлупе и гипоталамусе [61].
Происхождение продукции GH
В то время как локальная продукция GH в головном мозге (нервном GH) животных четко продемонстрирована, местная продукция GH в человеческом мозге менее очевидна [62]. Хотя гематоэнцефалический барьер обычно считался непроницаемым для периферического (или гипофизарного) GH, исследования на животных и людях показали, что периферический GH может проходить гематоэнцефалический барьер [61, 63, 64]. Во время беременности человеческий плацентарный GH, также называемый Gh3 или GH-V, секретируется плацентой и постепенно замещает материнский гипофизарный GH [65].
Действие GH в мозге
Присутствие GHR в развивающемся головном мозге предполагает роль GH в нервном развитии и нервной функции. Используя системы клеточных культур, было обнаружено, что GH индуцирует нейрональную и глиальную пролиферацию и дифференцировку [61,66]. У GH-дефицитных мышей микроцефальный мозг гипомиелинизирован, с задержкой роста нейронов и плохим синаптогенезом. GH, вводимый на критических стадиях развития мозга, увеличивает размер мозга у GH-дефицитных мышей [61,67].Исследования на животных также демонстрируют, что GH оказывает нейропротекторное действие после гипоксически-ишемического повреждения [68,69].
Считается, что некоторые, но не все эффекты GH опосредуются через IGF-I [59,66,70]. Исследования на животных показывают важную роль IGF-I в росте и развитии мозга с продемонстрированным влиянием на пролиферацию и дифференцировку нейронов и глиальных клеток и синаптогенез [70,71,72,73,74]. У мышей с нокаутом IGF-I размер мозга уменьшился, тогда как у мышей с трансгенной сверхэкспрессией IGF-I размер мозга увеличился [75,76].Кроме того, IGF-I способствует выживанию клеток за счет антиапоптотического действия [77]. Клинические исследования у пациентов с дефицитом IGF-I из-за генетического дефекта гена IGF-I выявляют микроцефалию и психомоторную отсталость, и была описана связь между уровнями IGF-I и интеллектом в детстве [78,79].
В заключение, GH и IGF-1 обладают множеством общих эффектов в мозге. Специфические эффекты GH и эффекты GH, опосредованные IGF-1, в головном мозге еще предстоит определить.
GH-терапия и развитие мозга, интеллекта и познания у людей
Присутствие GHR в областях мозга, которые, как считается, участвуют в нейрокогнитивном функционировании, указывает на то, что замещение GH у различных групп пациентов может положительно влиять на развитие мозга и, следовательно, на интеллект и познание.
Влияние терапии гормоном роста на интеллект и когнитивные способности изучалось как у детей, так и у взрослых. Влияние терапии гормоном роста на интеллект и когнитивные способности изучалось у детей с дефицитом гормона роста, идиопатическим низким ростом и синдромами Прадера-Вилли и Тернера.У этих групп пациентов не было описано явных положительных эффектов терапии гормоном роста на IQ и когнитивные способности, хотя количество исследований очень ограничено [80,81]. У взрослых с дефицитом гормона роста IQ в пределах нормы. Несколько исследований показывают, что дефицит гормона роста может привести к незначительным, но клинически значимым когнитивным нарушениям. Наиболее изучены память, скорость обработки данных и внимание [82]. В отличие от отсутствия эффекта экзогенного гормона роста у детей, терапия гормона роста благотворно влияет на познавательные способности у взрослых [82].
Терапия GH у детей, рожденных SGA
Есть 2 группы детей SGA, в которых оценивалось влияние терапии GH на интеллект и когнитивные способности [5,6,83,84].
В Нидерландах дети, рожденные с SGA без догоняющего роста, были обследованы после 2 и 8 лет лечения GH [5,83,84]. У 53 детей, получавших лечение, был обнаружен положительный эффект лечения гормоном роста на работоспособность и общий IQ, а также на внимание. После 8 лет лечения GH оценочные показатели IQ детей с SGA увеличились на 5–10 пунктов и были в том же диапазоне, что и у нормальной популяции.Кроме того, исследователи обнаружили связь между изменением окружности головы и улучшением оценочных показателей IQ во время лечения GH. Эти результаты противоречат результатам, полученным в когорте детей с SGA из Бельгии. В рандомизированном контролируемом исследовании после 2 лет лечения не наблюдалось положительного влияния лечения гормоном роста на показатели IQ [6]. Замечательным открытием в этом исследовании было увеличение IQ примерно на 8 баллов у нелеченных детей с SGA. Группа лечения, состоящая из 17 детей, не показала увеличения показателей IQ, несмотря на явное влияние терапии гормоном роста на окружность головы.
Есть несколько методологических проблем, которые необходимо учитывать при интерпретации этих оценок IQ. Во-первых, в голландском исследовании сообщалось об оценке IQ, основанной на 2 из 12 подшкал пересмотренной шкалы интеллекта Векслера для детей. Во-вторых, на изменения показателей IQ по прошествии 8 лет мог повлиять эффект Флинна, т. Е. Увеличение IQ от поколения к поколению. Эту проблему можно решить, используя соответствующую контрольную группу. В-третьих, изменения в инструментах тестирования (от детей дошкольного возраста до школьников) могли повлиять на показатели IQ в бельгийском исследовании, поскольку они были неравномерно распределены между леченными и нелеченными группами.
Таким образом, нет убедительных доказательств того, что лечение GH у детей с SGA влияет на IQ.
Экзогенный GH в моделях IUGR на животных
К сожалению, исследования на животных влияния экзогенного GH на развитие мозга и познание в моделях IUGR отсутствуют. Экзогенный GH улучшает процессы обучения у крыс, но этот тип экспериментов не проводился на животных IUGR [85,86].
Выводы
ЗВУР приводит к аномальному и задержанному развитию мозга.SGA ассоциируется со сниженным уровнем интеллекта и различными когнитивными проблемами, хотя эффекты в основном незаметны. Общий результат каждого ребенка — результат сложного взаимодействия внутриутробных и внематочных факторов. Присутствие GHR в головном мозге означает, что мозг также является мишенью для GH. Экзогенный гормон роста теоретически может воздействовать на мозг. Примером этого является влияние лечения гормоном роста на когнитивные функции у взрослых пациентов с дефицитом гормона роста. Данные о влиянии экзогенного гормона роста на интеллект и познавательные способности у детей с SGA скудны и противоречивы.Следовательно, для решения этой проблемы необходимы тщательные последующие исследования у детей с SGA, получавших GH.
Благодарности
Мы благодарим г-жу И. Рифаген, Университетскую библиотеку, Университетский медицинский центр VU, за ее библиографическую помощь. Мы благодарим г-жу М. Боерсма за внимательное чтение рукописи. Работа финансировалась образовательным грантом компании Pfizer BV, Нидерланды.
Список литературы
- Saenger P, Czernichow P, Hughes I, Reiter EO: Маленький для гестационного возраста: низкий рост и выше.Endocr Rev 2007; 28: 219–251.
- Noeker M: Нейрокогнитивное развитие у детей с задержкой внутриутробного развития и рожденных маленькими для гестационного возраста: патологические, конституциональные и терапевтические пути. Horm Res 2005; 64 (приложение 3): 83–88.
- Kinsbourne M, Graf WD: Расстройства умственного развития; в Menkes JH, Sarnat HB (ред.): Детская неврология.Филадельфия, Липпинкотт Уильямс и Уилкинс, 2000, стр. 1155–1211.
- Ли PA, Чернаусек SD, Hokken-Koelega AC, Czernichow P; Международный консультативный совет по малому для гестационного возраста: Заявление конференции по выработке консенсуса Международного консультативного совета по малому для гестационного возраста: ведение маленьких детей, рожденных малыми для гестационного возраста, 24 апреля — 1 октября 2001 г.Педиатрия 2003; 111: 1253–1261.
- Ван Паререн YK, Duivenvoorden HJ, Slijper FS, Koot HM, Hokken-Koelega AC: Интеллект и психосоциальное функционирование во время долгосрочной терапии гормоном роста у детей, рожденных маленькими для гестационного возраста. J Clin Endocrinol Metab 2004; 89: 5295–5302.
- Lagrou K, Vanderfaeillie J, Froidcoeur C, Thomas M, Massa G, Tenoutasse S, Craen M, Lebrethon MC, Beckers D, Francois I, Rooman R, Thiry-Counson G, Beaufort de C, De SJ: Эффект от 2 лет применения терапия высокими дозами гормона роста для когнитивного и психосоциального развития маленьких детей, рожденных маленькими для гестационного возраста.Eur J Endocrinol 2007; 156: 195–201.
- Бертино Э., Милани С., Фабрис С., Де СМ: Антропометрические карты новорожденных: что они собой представляют, а что нет. Arch Dis Child Fetal Neonatal Ed 2007; 92: F7 – F10.
- Мамель Н., Коше В., Кларис О: Определение ограничения роста плода в соответствии с конституционным потенциалом роста.Биология новорожденных, 2001; 80: 277–285.
- Вугуин П.М.: Животные модели для гестационного возраста и эмбриональное программирование болезней у взрослых. Horm Res 2007; 68: 113–123.
- Моррисон Дж. Л.: Овцы модели ограничения внутриутробного развития: адаптация плода и последствия.Clin Exp Pharmacol Physiol 2008; 35: 730–743.
- Листер Дж. П., Блатт Дж. Дж., ДеБассио В. А., Кемпер Т. Л., Тонкисс Дж., Галлер Дж. Р., Розен Д. Л.: Влияние пренатальной белковой недостаточности на количество нейронов в основных клеточных слоях формирования гиппокампа взрослых крыс. Гиппокамп 2005; 15: 393–403.
- Mallard C, Loeliger M, Copolov D, Rees S: Уменьшение количества нейронов в гиппокампе и мозжечке у послеродовых морских свинок после внутриутробного ограничения роста. Неврология 2000; 100: 327–333.
- Mallard EC, Rehn A, Rees S, Tolcos M, Copolov D: Вентрикуломегалия и уменьшение объема гиппокампа после внутриутробного ограничения роста: последствия для этиологии шизофрении.Schizophr Res 1999; 40: 11–21.
- Хаякава М., Мимура С., Сасаки Дж., Ватанабе К.: Невропатологические изменения в головном мозге крысы ЗВУР, вызванные синтетическим тромбоксаном А2. Early Hum Dev 1999; 55: 125–136.
- Рис С., Бокинг А.Д., Хардинг Р.: Структура мозга эмбриональной овцы при экспериментальной задержке роста.Дж. Дев Физиол 1988; 10: 211–225.
- Ташима Л., Наката М., Анно К., Сугино Н., Като Х: Пренатальное влияние задержки внутриутробного развития, вызванной ишемией-гипоксией, на развитие мозга и поведенческую активность у крыс. Биология новорожденных 2001; 80: 81–87.
- Сасаки Дж., Фуками Э., Мимура С., Хаякава М., Китох Дж., Ватанабе К.: аномальная миграция мозговых нейронов в крысиной модели задержки внутриутробного развития, вызванной синтетическим тромбоксаном А (2).Early Hum Dev 2000; 58: 91–99.
- Mallard EC, Rees S, Stringer M, Cock ML, Harding R: Влияние хронической плацентарной недостаточности на развитие мозга у эмбрионов овец. Pediatr Res 1998; 43: 262–270.
- Dieni S, Rees S: морфология дендритов изменяется в нейронах гиппокампа после пренатального компромисса.Журнал Neurobiol 2003; 55: 41–52.
- Nitsos I, Rees S: Влияние задержки внутриутробного развития на развитие нейроглии у плода морских свинок. Иммуногистохимическое и ультраструктурное исследование. Int J Dev Neurosci 1990; 8: 233–244.
- Сизоненко С.В., Боррадори-Толса С., Баутай Д.М., Лодыгенски Г., Лазейрас Ф., Хуппи П. Влияние ограничения внутриутробного роста и глюкокортикоидов на развитие мозга: выводы с использованием расширенной магнитно-резонансной томографии.Mol Cell Endocrinol 2006; 254–255: 163–171.
- Morgane PJ, Mokler DJ, Galler JR: Влияние пренатальной белковой недостаточности на формирование гиппокампа. Neurosci Biobehav Rev 2002; 26: 471–483.
- Чейз HP, Велч Н.Н., Дабьер С.С., Васан Н.С., Баттерфилд Л.Дж.: Изменения в биохимии человеческого мозга после задержки внутриутробного развития.Педиатрия 1972; 50: 403–411.
- Дункан К.Р., Исса Б., Мур Р., Бейкер П.Н., Джонсон И.Р., Гоуленд П.А.: Сравнение измерений органов плода с помощью эхопланарной магнитно-резонансной томографии и ультразвука. BJOG 2005; 112: 43–49.
- Dubois J, Benders M, Borradori-Tolsa C, Cachia A, Lazeyras F, Ha-Vinh LR, Sizonenko SV, Warfield SK, Mangin JF, Huppi PS: Первичная кортикальная складка у новорожденного человека: ранний маркер более позднего функционального развития.Мозг 2008; 131: 2028–2041.
- Толса CB, Zimine S, Warfield SK, Freschi M, Sancho RA, Lazeyras F, Hanquinet S, Pfizenmaier M, Huppi PS: Раннее изменение структурного и функционального развития мозга у недоношенных детей, рожденных с задержкой внутриутробного развития. Pediatr Res 2004; 56: 132–138.
- Toft PB, Leth H, Ring PB, Peitersen B, Lou HC, Henriksen O: Объемный анализ мозга нормального младенца и задержка внутриутробного развития. Early Hum Dev 1995; 43: 15–29.
- Мартинуссен М., Фишл Б., Ларссон Г.Б., Скранес Дж., Кульсенг С., Вангберг Т.Р., Вик Т., Брубакк А.М., Харальдсет О., Дейл А.М.: Толщина коры головного мозга у 15-летних подростков с низкой массой тела при рождении, измеренная с помощью автоматизированного МРТ. на основе метода.Мозг 2005; 128: 2588–2596.
- Skranes JS, Martinussen M, Smevik O, Myhr G, Indredavik M, Vik T, Brubakk AM: Результаты МРТ головного мозга у детей с очень низкой массой тела при рождении и детей, не достигших гестационного возраста в возрасте 15 лет. Педиатр Радиол 2005; 35: 758–765.
- Янни М, Марлоу Н: Педиатрические последствия ограничения роста плода.Semin Fetal Neonatal Med 2004; 9: 411–418.
- Лундгрен Е.М., Кнаттингиус С., Йонссон Б., Тувемо Т.: Интеллектуальные и психологические показатели у мужчин, рожденных маленькими для гестационного возраста, с догоняющим ростом и без него. Педиатр Res 2001; 50: 91–96.
- Gutbrod T, Wolke D, Soehne B, Ohrt B, Riegel K: Влияние гестации и веса при рождении на рост и развитие детей с очень низкой массой тела при рождении для гестационного возраста: сравнение сопоставимых групп.Arch Dis Child Fetal Neonatal Ed 2000; 82: F208 – F214.
- Вествуд М., Крамер М.С., Мунц Д., Ловетт Дж. М., Уоттерс Г. В.: Рост и развитие доношенных неасфиксированных новорожденных малого для гестационного возраста: наблюдение в подростковом возрасте. Педиатрия 1983; 71: 376–382.
- Viggedal G, Lundalv E, Carlsson G, Kjellmer I: Нейропсихологическое наблюдение в молодом возрасте доношенных детей, рожденных маленькими для гестационного возраста.Med Sci Monit 2004; 10: CR8 – CR16.
- Фитцхардинг П.М., Стивен Э.М.: Маленький для свидания младенец. II. Неврологические и интеллектуальные последствия. Педиатрия 1972; 50: 50–57.
- Паз I, Гейл Р., Лаор А., Данон Ю.Л., Стивенсон Д.К., Сейдман Д.С.: Когнитивный результат доношенных маленьких детей гестационного возраста в позднем подростковом возрасте.Obstet Gynecol 1995; 85: 452–456.
- Паз I, Лаор А., Гейл Р., Харлап С., Стивенсон Д. К., Зейдман Д. С. Доношенные младенцы с задержкой роста плода не подвергаются повышенному риску низких показателей интеллекта в возрасте 17 лет. Журнал Педиатр 2001; 138: 87–91.
- Strauss RS, Dietz WH: Рост и развитие доношенных детей, рожденных с низкой массой тела при рождении: влияние генетических факторов и факторов окружающей среды.J Pediatr 1998; 133: 67–72.
- Strauss RS: Функциональный результат для взрослых детей, родившихся с малым для гестационного возраста: 26-летнее наблюдение британской когорты родившихся в 1970 году. JAMA 2000; 283: 625–632.
- О’Кифф М.Дж., О’Каллаган М., Уильямс Г.М., Наджман Дж. М., Бор В. Проблемы с обучением, когнитивными функциями и вниманием у подростков, рожденных малыми для гестационного возраста.Педиатрия 2003; 112: 301–307.
- Теодор Р.Ф., Томпсон Дж. М., Уолди К. Э., Бекрофт Д. М., Робинсон Е., Уайлд К. Дж., Кларк П. М., Митчелл Е. А.: Детерминанты когнитивных способностей в 7 лет: продольное исследование методом случай-контроль детей, родившихся в срок до срока беременности. Eur J Pediatr 2009; 168: 1217–1224.
- Kulseng S, Jennekens-Schinkel A, Naess P, Romundstad P, Indredavik M, Vik T, Brubakk AM: Подростки с очень низким весом при рождении и доношенные малые для гестационного возраста подростки: внимание еще раз. Acta Paediatr 2006; 95: 224–230.
- Харви Д., Принц Дж., Бантон Дж., Паркинсон С., Кэмпбелл С.: Способности детей, которые были маленькими для гестационного возраста.Педиатрия 1982; 69: 296–300.
- Sommerfelt K, Andersson HW, Sonnander K, Ahlsten G, Ellertsen B, Markestad T, Jacobsen G, Hoffman HJ, Bakketeig L: когнитивное развитие доношенных детей для детей гестационного возраста в возрасте пяти лет. Arch Dis Child 2000; 83: 25–30.
- Зоммерфельт К., Зоннандер К., Скранес Дж., Андерссон Х.В., Альстен Дж., Эллертсен Б., Маркестад Т., Якобсен Дж., Хоффман Х. Дж., Баккетейг Л.С.: Нейропсихологические и двигательные функции у дошкольников с малым сроком беременности.Pediatr Neurol 2002; 26: 186–191.
- McCarton CM, Wallace IF, Divon M, Vaughan HG Jr: Когнитивное и неврологическое развитие недоношенных, маленьких для гестационного возраста ребенка до 6 лет: сравнение по весу при рождении и гестационному возрасту. Педиатрия 1996; 98: 1167–1178.
- Фельдман Р., Эйдельман А.И.: Организация состояния новорожденного, нейроматурация, взаимодействие матери и ребенка и когнитивное развитие у недоношенных детей с малым для гестационного возраста.Педиатрия 2006; 118: e869 – e878.
- Сунг И.К., Вор Б., О В.: Результат роста и нервного развития младенцев с очень низкой массой тела при рождении с задержкой внутриутробного развития: сравнение с контрольными субъектами, сопоставимыми по весу при рождении и гестационному возрасту. J Pediatr 1993; 123: 618–624.
- Фриск В., Амзель Р., Уайт Х.Э .: Важность моделей роста головы в прогнозировании когнитивных способностей и навыков грамотности у детей, не достигших гестационного возраста.Dev Neuropsychol 2002; 22: 565–593.
- Tideman E, Marsal K, Ley D: Познавательная функция у молодых людей после ограничения внутриутробного развития с аномальным кровотоком в аорте плода. Ультразвуковой акушерский гинеколь 2007; 29: 614–618.
- Холло О., Раутава П., Корхонен Т., Хелениус Х., Керо П., Силланпаа М.: Академическая успеваемость детей с малым для гестационного возраста возрастом 10 лет.Arch Pediatr Adolesc Med 2002; 156: 179–187.
- Фаттал-Валевски А., Лейтнер Ю., Кутай М., Тал-Позенер Э, Томер А., Либерман Д., Яффа А., Мани А., Харел С. Исходы нервного развития у детей с задержкой внутриутробного развития: последующее наблюдение в течение 3 лет. J Child Neurol 1999; 14: 724–727.
- Leitner Y, Fattal-Valevski A, Geva R, Eshel R, Toledano-Alhadef H, Rotstein M, Bassan H, Radianu B, Bitchonsky O, Jaffa AJ, Harel S: Исходы нервного развития детей с задержкой внутриутробного развития: продольный, 10 -летнее проспективное исследование. J Child Neurol 2007; 22: 580–587.
- Гева Р., Эшел Р., Лейтнер Ю., Фаттал-Валевски А., Харел С. Функции памяти у детей, рожденных с асимметричным ограничением внутриутробного развития. Brain Res 2006; 1117: 186–194.
- Гева Р., Эшел Р., Лейтнер Ю., Валевски А.Ф., Харел С.: Нейропсихологический результат у детей с задержкой внутриутробного развития: 9-летнее проспективное исследование.Педиатрия 2006; 118: 91–100.
- Geva R, Eshel R, Leitner Y, Fattal-Valevski A, Harel S: Кратковременная вербальная память у детей: долгосрочные эффекты ограничения внутриутробного развития, зависящие от модальности. J Детская психическая психиатрия 2008; 49: 1321–1330.
- Silva PA, McGee R, Williams S: продольное исследование интеллекта и поведения недоношенных и маленьких детей гестационного возраста.Дж. Дев Бехав Педиатр 1984; 5: 1–5.
- Брайан С.М., Хиндмарш ПК: Нормальный и ненормальный рост плода. Horm Res 2006; 65 (приложение 3): 19–27.
- Lobie PE, Zhu T, Graichen R, Goh EL: Гормон роста, инсулиноподобный фактор роста I и ЦНС: локализация, функция и механизм действия.Гормоны роста IGF Res 2000; 10 (приложение B): S51 – S56.
- Hill DJ, Riley SC, Bassett NS, Waters MJ: Локализация рецептора гормона роста, идентифицированная иммуноцитохимическим методом, в тканях плода человека во втором триместре и в плаценте на протяжении всей беременности. J Clin Endocrinol Metab 1992; 75: 646–650.
- Харви С., Халл К.: Гормон роста нервной системы: обновленная информация. J Mol Neurosci 2003; 20: 1–14.
- Harvey S, Lavelin I, Pines M: Действие гормона роста (GH) в головном мозге: нейронная экспрессия гена GH-ответа.J Mol Neurosci 2002; 18: 89–95.
- Johansson JO, Larson G, Andersson M, Elmgren A, Hynsjo L, Lindahl A, Lundberg PA, Isaksson OG, Lindstedt S, Bengtsson BA: Лечение взрослых с дефицитом гормона роста рекомбинантным гормоном роста человека увеличивает концентрацию гормона роста в спинномозговая жидкость и влияет на нейротрансмиттеры.Нейроэндокринология 1995; 61: 57–66.
- Pan W, Yu Y, Cain CM, Nyberg F, Couraud PO, Kastin AJ: Проникновение гормона роста через гематоэнцефалический барьер. Эндокринология 2005; 146: 4898–4904.
- Mirlesse V, Frankenne F, Alsat E, Ponsel M, Hennen G, Evain-Brion D: Уровни плацентарного гормона роста при нормальной беременности и при беременности с задержкой внутриутробного развития.Pediatr Res 1993; 34: 439–442.
- Ajo R, Cacicedo L, Navarro C, Sanchez-Franco F: Действие гормона роста на пролиферацию и дифференцировку корковых клеток головного мозга от плодных крыс. Эндокринология 2003; 144: 1086–1097.
- Ногучи Т: Влияние гормона роста на развитие мозга: морфологические исследования.Horm Res 1996; 45: 5–17.
- Scheepens A, Sirimanne ES, Breier BH, Clark RG, Gluckman PD, Williams CE: Гормон роста как фактор спасения нейронов во время восстановления после повреждения ЦНС. Неврология 2001; 104: 677–687.
- Shin DH, Lee E, Kim JW, Kwon BS, Jung MK, Jee YH, Kim J, Bae SR, Chang YP: Защитный эффект гормона роста на апоптоз нейронов после гипоксии-ишемии в мозге новорожденных крыс.Neurosci Lett 2004; 354: 64–68.
- Руссо В.К., Глюкман П.Д., Фельдман Э.Л., Вертер Г.А.: Система инсулиноподобных факторов роста и ее плейотропные функции в мозге. Endocr Rev 2005; 26: 916–943.
- Arsenijevic Y, Weiss S: Инсулиноподобный фактор роста-I — это фактор дифференциации для нейрональных предшественников постмитотических стволовых клеток ЦНС: действия, отличные от действий нейротрофического фактора головного мозга.J. Neurosci 1998; 18: 2118–2128.
- Arsenijevic Y, Weiss S, Schneider B, Aebischer P: Инсулиноподобный фактор роста-I необходим для пролиферации нервных стволовых клеток и демонстрирует различные действия эпидермального фактора роста и фактора роста фибробластов-2. J. Neurosci 2001; 21: 7194-7202.
- Д’Эрколе А.Дж., Йе П., О’Куски Дж. Р.: Мутантные мышиные модели действия инсулиноподобного фактора роста в центральной нервной системе. Нейропептиды 2002; 36: 209–220.
- Ye P, Li L, Richards RG, DiAugustine RP, D’Ercole AJ: Миелинизация изменена у мышей с нулевым мутантом по инсулиноподобному фактору роста I.J Neurosci 2002; 22: 6041–6051.
- Beck KD, Powell-Braxton L, Widmer HR, Valverde J, Hefti F: нарушение гена Igf1 приводит к уменьшению размера мозга, гипомиелинизации ЦНС и потере гранул гиппокампа и нейронов, содержащих парвальбумин стриатума. Нейрон 1995; 14: 717–730.
- Carson MJ, Behringer RR, Brinster RL, McMorris FA: инсулиноподобный фактор роста I увеличивает рост мозга и миелинизацию центральной нервной системы у трансгенных мышей.Нейрон 1993; 10: 729–740.
- Ходж Р.Д., Д’Эрколе А.Дж., О’Куски Дж. Р.: Инсулиноподобный фактор роста-I (IGF-I) ингибирует апоптоз нейронов в развивающейся коре головного мозга in vivo. Int J Dev Neurosci 2007; 25: 233–241.
- Ганнелл Д., Миллер Л.Л., Роджерс И., Холли Дж. М.: Связь инсулиноподобного фактора роста I и белка-3, связывающего инсулиноподобный фактор роста, с коэффициентом интеллекта среди детей в возрасте 8–9 лет в продольном исследовании Avon. Родители и дети.Педиатрия 2005; 116: e681 – e686.
- Валенкамп MJ, Wit JM: мутации одного гена, вызывающие SGA. Лучшая практика Res Clin Endocrinol Metab 2008; 22: 433–446.
- Росс JL: Влияние гормона роста на когнитивные функции.Horm Res 2005; 64 (приложение 3): 89–94.
- Myers SE, Whitman BY, Carrel AL, Moerchen V, Bekx MT, Allen DB: Два года терапии гормоном роста у маленьких детей с синдромом Прадера-Вилли: преимущества для физического и нервного развития. Am J Med Genet A 2007; 143: 443–448.
- Фаллети М.Г., Маруфф П., Берман П., Харрис А.: Влияние дефицита гормона роста (GH) и замещения GH на когнитивные функции у взрослых: метаанализ текущей литературы.Психонейроэндокринология 2006; 31: 681–691.
- Ван дер Рейден-Лейкман IE: Проблемы роста? Психологическая оценка детей с низким ростом после задержки внутриутробного развития, до и после двухлетнего лечения гормоном роста. Тезис. Роттердам, Университет Эразма, 1996.
- Van der Reijden-Lakeman IE, Sonneville de LM, Swaab-Barneveld HJ, Slijper FM, Verhulst FC: Оценка внимания до и после 2 лет лечения гормоном роста у детей с задержкой внутриутробного развития. J Clin Exp Neuropsychol 1997; 19: 101–118.
- Schneider-Rivas S, Paredes-Carbajal C, Mascher D, Angoa-Perez M, Jaramillo-Gonzalez E, Borgonio-Perez G, Rivas-Arancibia S: Влияние тестостерона и гормона роста на долгосрочное удержание и исчезновение пассивного избегания ответ у молодых и старых крыс.Int J Neurosci 2007; 117: 1443–1456.
- Ле Гревес М., Чжоу К., Берг М., Ле Гревес П., Фоленхаг К., Мейерсон Б., Ниберг Ф .: Замена гормона роста у гипофизэктомированных крыс влияет на пространственные характеристики и уровни в гиппокампе субъединицы рецептора NMDA и уровни транскрипта гена PSD-95.Exp Brain Res 2006; 173: 267–273.
Автор Контакты
H.M.A. de Bie
Кафедра педиатрии, Медицинский центр Университета VU
PO Box 7057
NL – 1007 MB Амстердам (Нидерланды)
Тел. +31 6 1637 7656, факс +31 20 444 2919, электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 27 мая 2009 г.
Принято: 18 августа 2009 г.
Опубликовано в Интернете: 15 января 2010 г.
Дата выпуска: январь 2010 г.
Количество страниц для печати: 9
Количество рисунков: 1
Количество столов: 1
ISSN: 1663-2818 (печатный)
eISSN: 1663-2826 (онлайн)
Для дополнительной информации: https: // www.karger.com/HRP
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Ограничение внутриутробного развития (ЗВУР) (для родителей)
Что такое ограничение внутриутробного развития (ЗВУР)?
Ограничение внутриутробного развития или ЗВУР — это когда ребенок в утробе матери (плод) не растет так, как ожидалось.Ребенок не такой большой, как можно было бы ожидать на стадии беременности матери. Это время известно как «гестационный возраст» будущего ребенка.
Два типа ЗВУР:
- симметричный ЗВУР: все части тела ребенка одинаково малы по размеру
- асимметричный ЗВУР: голова и мозг ребенка имеют ожидаемый размер, но остальная часть тела ребенка маленькая
Что вызывает ЗВУР?
Часто ЗВУР происходит из-за того, что плод не получает достаточного количества питательных веществ и питания.Это может произойти, если есть проблема с:
- плацента, ткань, доставляющая питательные вещества и кислород развивающемуся ребенку
- кровоток в пуповине, которая соединяет ребенка с плацентой
Ограничение внутриутробного развития может произойти и у беременной женщины:
Как диагностируется ЗВУР?
Перед рождением ребенка врачи проверяют его рост, измеряя живот матери от верхушки лобковой кости до верхушки матки.Это называется высотой дна матки .
Они также могут сделать пренатальное УЗИ , именно так часто диагностируется ЗВУР. Техник покрывает живот женщины гелем, а затем перемещает по нему зонд (инструмент, похожий на палочку). Высокочастотные звуковые волны создают изображения ребенка на экране компьютера. Эти фотографии помогают врачам оценить размер и вес ребенка. Эти оценки не точны, но они помогают поставщикам медицинских услуг отслеживать рост ребенка и определять, есть ли проблемы.Ультразвук также может помочь найти другие проблемы, такие как проблемы с плацентой или низкий уровень околоплодных вод (жидкости, окружающей плод). Врачи также будут использовать ультразвук, чтобы проверить кровоток к плаценте и через пуповину.
Если они думают, что у ребенка ЗВУР, врачи также могут провести такие тесты, как:
- Мониторинг плода для отслеживания частоты сердечных сокращений и движений ребенка
- обследование матери на наличие инфекций, которые могут повлиять на ребенка
- амниоцентез для выявления генетических причин ЗВУР (а иногда и для того, чтобы помочь им увидеть, насколько зрелые легкие ребенка)
Как лечится ЗВУР?
Лечение задержки внутриутробного развития зависит от того, на каком сроке беременность и как обстоят дела у ребенка.Врачи будут внимательно наблюдать за ребенком с ЗВУР во время дородовых посещений. Они будут делать УЗИ, следить за ростом и следить за другими проблемами.
Если у матери ребенка есть заболевание, врачи помогут ей справиться с этим. Это может включать в себя обеспечение того, чтобы она придерживалась здоровой и питательной диеты и набрала правильный вес во время беременности. Некоторые женщины могут перейти в постельный режим, чтобы попытаться улучшить приток крови к ребенку.
Иногда врачи рекомендуют рано вызывать роды.Они могут сделать это, если кажется, что ребенок перестал расти, или если есть проблемы с плацентой или кровотоком в пуповине.
Женщине может быть сделано кесарево сечение (кесарево сечение), если стресс от вагинальных родов считается слишком рискованным для ребенка.
Какие проблемы могут возникнуть?
Младенцы с ЗВУР более подвержены риску некоторых проблем со здоровьем. Рано родившимся или очень маленьким при рождении с большей вероятностью придется оставаться в больнице в течение более длительного времени.Им также может потребоваться особая помощь в отделении интенсивной терапии новорожденных (ОИТН).
Другие проблемы, которые могут быть связаны с ограничением внутриутробного развития, включают:
- проблемы с дыханием и кормлением
- Проблемы с поддержанием постоянной температуры тела
- аномальное количество клеток крови
- низкий уровень сахара в крови (гипогликемия)
- проблемы борьбы с инфекциями
- неврологические проблемы
Долгосрочное воздействие ЗВУР на ребенка может зависеть от состояния, вызвавшего проблему.
Что делать, если у моего ребенка ЗВУР?
Если у вашего ребенка может быть IUGR, следуйте советам врача и посещайте все дородовые визиты и анализы. Это поможет вашему врачу увидеть, как ваш ребенок развивается и растет.
Позаботьтесь о себе:
Когнитивные и поведенческие последствия ограничения внутриутробного развития Дети школьного возраста
Резюме
КОНТЕКСТ: Дети, у которых возникла задержка внутриутробного развития (ЗВР), могут подвергаться повышенному риску неблагоприятных исходов неврологического развития в течение школьного возраста.
ЦЕЛЬ: Оценить влияние ЗВУР на познание и поведение детей школьного возраста.
ИСТОЧНИКИ ДАННЫХ: Medline, Embase и PsycINFO искали статьи на английском языке, опубликованные после 1980 г. оценивается после пятого дня рождения.
ИЗВЛЕЧЕНИЕ ДАННЫХ: Когнитивные данные из 15 исследований и поведенческие данные из 6 исследований были отобраны в общей сложности из 1559 случаев и 1630 контрольных.Были извлечены когнитивные баллы и поведенческие результаты.
РЕЗУЛЬТАТЫ: Контрольная группа имела значительно более высокие когнитивные показатели, чем дети с IUGR (стандартизованная разница средних [SMD] –0,38, 95% доверительный интервал [CI] –0,51 до –0,25, P <0,00001). Показатели IQ в группе ЗВУР существенно не коррелировали со средней массой тела при рождении и гестационным возрастом ( P > 0,05). В исследование поведенческих исходов было включено пять испытаний, показатели поведения значительно различались между группами с и без ЗВУР (SMD 0.31, 95% ДИ от 0,13 до 0,48, P = 0,001). Частота синдрома дефицита внимания / гиперактивности (СДВГ) существенно не различалась между двумя группами ( P = 0,11).
ОГРАНИЧЕНИЯ: Количество исследований, оценивающих поведенческие симптомы и исходы СДВГ, невелико.
ВЫВОДЫ: Полученные данные показывают, что ЗВУР связана с более низкими когнитивными показателями у детей школьного возраста. Однако необходимы дальнейшие крупномасштабные испытания, чтобы оценить влияние ЗВУР на исход поведенческого расстройства и СДВГ.
ОБЗОР, ПРИГЛАШЕННЫЙ СОВЕТАМИ: Задержка внутриутробного развития: значение для наук о животных1 | Journal of Animal Science
Задержка внутриутробного развития (ЗВУР), определяемая как нарушение роста и развития эмбриона / плода млекопитающих или его органов во время беременности, является серьезной проблемой в домашнем животноводстве. Ограничение роста плода снижает выживаемость новорожденных, оказывает постоянное задерживающее воздействие на послеродовой рост и эффективность использования кормов / кормов у потомства, отрицательно влияет на состав всего тела и качество мяса, а также ухудшает здоровье и спортивные результаты в долгосрочной перспективе.Знание основных механизмов имеет важное значение для предотвращения ЗВУР и имеет решающее значение для повышения эффективности животноводства и здоровья животных. Рост плода в матке — сложное биологическое событие, на которое влияют генетические, эпигенетические факторы и факторы окружающей среды, а также зрелость матери. Эти факторы влияют на размер и функциональную способность плаценты, маточно-плацентарный кровоток, перенос питательных веществ и кислорода от матери к плоду, доступность питательных веществ для концептуальных клеток, эндокринную среду и метаболические пути.Изменения в питании плода и эндокринном статусе могут привести к адаптациям развития, которые навсегда изменят структуру, физиологию, метаболизм и постнатальный рост потомства. Нарушение плацентарного синтеза оксида азота (основного вазодилататора и ангиогенного фактора) и полиаминов (ключевых регуляторов синтеза ДНК и белка) может дать единое объяснение этиологии ЗВРП в ответ на недостаточное питание и избыточное питание матери. Появляется все больше доказательств того, что статус питания матери может изменять эпигенетическое состояние (стабильные изменения экспрессии генов через метилирование ДНК и модификации гистонов) генома плода.Это может обеспечить молекулярный механизм роли питания матери в программировании плода и геномном импринтинге. Инновационные междисциплинарные исследования в области питания, репродуктивной физиологии и сосудистой биологии будут играть важную роль в разработке следующего поколения сбалансированных по питательным веществам диет для беременных и разработке новых инструментов для управления животноводством, которые повысят эффективность животноводства и улучшат здоровье животных. существование.
MAGIC Foundation
ВведениеОграничение внутриутробного развития (ЗВУР) определяет плод, у которого в какой-то момент беременности наблюдалось снижение скорости роста.Этот медленный рост плода обычно идентифицируется in utero с помощью серии ультразвуковых измерений, которые отслеживаются с течением времени. Многие факторы могут повлиять на рост эмбриона, а затем и плода. Таким образом, существует множество потенциальных причин этого ограничения гестационного роста, которые могут включать экологические, материнские, плацентарные и / или внутриутробные проблемы.
Поскольку IUGR — это диагноз, основанный на росте во время пренатального периода, гестационный возраст является важным определяющим фактором.Гестационный возраст — это количество времени, в течение которого плод провел в утробе матери , а обычная средняя беременность длится 40 недель, начиная с первого дня последней менструации матери. Чтобы определить, родился ли новорожденный меньше нормального, необходимо учитывать гестационный возраст. Существуют разные стандарты, используемые для сравнения новорожденного с другими новорожденными, но в каждом из них те новорожденные, чей вес при рождении и / или длина тела находятся между 3-м и 97-м процентилями (с поправкой на гестационный возраст), называются «подходящими для гестационного возраста», т.е. масса и / или длина тела при рождении выше 97-го процентиля называются «большими для гестационного возраста», а те, чья масса и / или длина при рождении ниже 3-го процентиля, называются «малыми для гестационного возраста» (SGA).
Новорожденный может родиться с SGA, но не иметь признаков ЗВУР, если с самого начала беременности он остается маленьким. И наоборот, крупный новорожденный на ранних сроках беременности, который затем переживает период ЗВУР, может не родиться с SGA, если его или ее результирующий размер при рождении все еще превышает 3-й процентиль (приблизительно -2SDS на диаграмме ниже). В целом, однако, большинство плодов, которым поставлен диагноз ЗВУР, также рождаются с ЗВР, но не все дети, рожденные с ЗВР, имели ЗВР.
Хорошая новость заключается в том, что у большинства детей с ЗВУР / СГА наблюдается немедленный догоняющий рост после рождения, при этом подавляющее большинство достигает полного догоняющего роста к 2 годам. Фактически, если необходимо наверстывать упущенное, оно обычно происходит быстро в течение первых 3–6 месяцев после рождения и обычно завершается до достижения 2-летнего возраста. У недоношенных детей с IUGR / SGA может потребоваться больше времени, чтобы наверстать упущенное. Тем не менее, исследования показали, что около 10% детей с ЗВУР / СГА не успевают за темпами роста и остаются маленькими в зрелом возрасте, и эти дети также могут столкнуться с дополнительными долгосрочными рисками для здоровья из-за ограничения внутриутробного развития.
Частые вопросы, которые могут задать родители«Как врачи могут определить физическую разницу между маленьким ребенком из-за недоношенности и ребенком, перенесшим ЗВУР, если нет данных ультразвукового исследования?»
Используются два критерия: физический (например, текстура и толщина кожи, складки на ступнях, плотность мочки ушей и внешний вид гениталий) и неврологический (например, поза или тип сгибания рук и ног. ).
«Почему важно определить, маленький ли новорожденный из-за недоношенности или из-за ЗВУР?
Причина в том, что потенциальные медицинские трудности после родов могут быть разными. У некоторых недоношенных новорожденных вообще нет проблем, тогда как у некоторых могут быть незрелые легкие, вызывающие респираторный дистресс-синдром, «желтую» желтуху из-за незрелости функции печени и апноэ, то есть нарушение дыхания, вызванное незрелой нервной системой.Младенцы, рожденные IUGR / SGA, имеют повышенный риск аспирации мекония и густой крови (полицитемия). Многие из краткосрочных проблем у младенцев с ЗВР / СГА аналогичны тем, которые наблюдаются у недоношенных новорожденных, включая гипогликемию и гипокальциемию. Обе группы новорожденных также необходимо внимательно наблюдать на предмет признаков недостатка кислорода, инфекции и низкой температуры (последняя проблема у младенцев с ЗВУР / СГА возникает из-за уменьшения жировой ткани, которая обычно помогает поддерживать температуру тела младенца). Долгосрочные проблемы со здоровьем у младенцев, перенесших IUGR / SGA, включают возможное раннее половое созревание, сердечно-сосудистые заболевания, гипертонию, ожирение и метаболический синдром / диабет 2 типа (T2DM).
«Когда следует проконсультироваться с детским эндокринологом (врачом, специализирующимся на нарушениях роста) по поводу ребенка или ребенка с ЗВУР / SGA?»
Подходящее время для обращения к детскому эндокринологу — это когда ваш ребенок еще младенец (в возрасте одного года или меньше) и не догоняет нижнюю часть нормального диапазона роста для его / ее возраста (например, младше 3-го возраста). до 5-го процентиля на диаграмме роста и / или веса). В редких случаях, если у этого младенца или ребенка очень высокие родители (75-й процентиль или выше), все равно следует обращаться к детскому эндокринологу, даже если рост ребенка / ребенка остается на уровне 5-го процентиля или около него.Когда ваш ребенок подрастет, врач может порекомендовать конкретную лекарственную терапию, чтобы попытаться ускорить рост вашего ребенка.
Причины ограничения внутриутробного роста (IUGR) / Small for Gestational Age (SGA)IUGR / SGA могут быть вызваны одним или несколькими факторами из трех основных категорий — материнскими, внутриутробными и факторами и факторами окружающей среды.
Материнские факторы могут включать:
- маленький размер матери
- статус питания матери во время беременности
- нарушение кровоснабжения плаценты
- аномальная форма или размер матки матери
- заболевания или состояния матери, влияющие на ее кровеносные сосуды , такие как высокое кровяное давление, токсемия или эклампсия, периодические кровотечения во время беременности и сахарный диабет
- любое хроническое или продолжительное заболевание матери, например, болезни клеток крови (например,г., серповидноклеточная анемия)
Влияния и факторы плода могут включать:
- хромосомные аномалии или эпигенетические ошибки, приводящие к любому количеству синдромов, которые, как известно, вызывают малый размер новорожденного
- различные пороки развития плода, в том числе пороки сердца
Факторы окружающей среды (снаружи и внутри матки) могут включать:
- дефекты, связанные с плацентой и пуповиной, приводящие к снижению кислорода и / или питательных веществ для плода
- жизнь на большой высоте
- курение матери или употребление наркотиков
- голод населения
- многоплодие при одной беременности
- материнская инфекция, которая проникает через плаценту к плоду
Выявление IUGR пренатально и / или SGA при рождении) имеет решающее значение, потому что правильное ведение может улучшить прогноз.В период новорожденности врачи могут провести диагностические исследования, чтобы попытаться определить причину IUGR / SGA. Они также могут попытаться подтвердить точность гестационного возраста новорожденного. Если срок родов плода был перенесен на более поздний срок во время беременности из-за меньшего, чем ожидалось, размера, и мать уверена либо в своем последнем менструальном цикле, либо в дате зачатия, то дату родов и срок беременности следует скорректировать на основании это первый расчет. [Это приводит к тому, что новорожденный рождается ближе к доношенному сроку, чем скорректированный срок родов, и часто приводит к тому, что новорожденному ставится диагноз «малоподвижный для гестационного возраста».]
В конечном счете, одними из наиболее важных аспектов IUGR / SGA являются интеллектуальные или другие результаты нервного развития, включая потенциальные нарушения обучаемости. Они в значительной степени отражают первопричину ЗВУР / ГЗВ и подчеркивают важность попытки выяснить причину (ы), чтобы разработать соответствующий план терапии для конкретного ребенка. Младенцы IUGR / SGA, которые также родились недоношенными, подвергаются большему риску медицинских проблем, чем доношенные дети IUGR / SGA.Но все дети, которые перенесли ЗВРП и / или родились с SGA, подвергаются повышенному риску определенных проблем со здоровьем во взрослом возрасте, связанных с метаболическим синдромом, включая диабет 2 типа. А для тех, кто также не может догнать рост, особенно важно, чтобы ребенка направили к детскому эндокринологу, имеющему опыт лечения нарушения роста (и уникального увеличения костного возраста) у детей с ЗВУР / СГА.
Пожалуйста, обратитесь к информации на веб-сайте MAGIC о детях, рожденных малыми для гестационного возраста, для получения более полной информации.
Важные шаги для родителей1) Профилактика, когда это возможно (например, отказ от курения во время беременности).
2) При подозрении на ЗВУР убедитесь, что беременность находится под наблюдением акушера или врача, специализирующегося на беременностях с высоким риском. Следует регулярно проводить УЗИ, чтобы контролировать ограничение роста и оценивать любые другие проблемы во время беременности.
3) После выявления и подтверждения ЗВУР необходимо провести соответствующее лечение матери и плода (а позже и новорожденного).Исследования для определения причины очень важны.
4) Родители, врачи и медицинские работники должны объединить усилия, чтобы обеспечить наилучший результат для отдельного младенца.
5) Если младенец IUGR / SGA не догоняет по длине и остается либо ниже 3-го процентиля, либо более чем на 2 стандартных отклонения ниже, чем должен быть ребенок для его / ее родителей (приблизительно 50 баллов процентиля), ребенок должен обратиться к детскому эндокринологу, знакомому с лечением детей с ЗВУР / СГА.Эндокринолог также должен быть знаком с уникальным улучшением костного возраста этих детей.
6) Наконец, необходимо оценивать и контролировать психосоциальное и моторное развитие ребенка. Во всех штатах есть службы оценки развития и вмешательства для детей младше 3 лет. Эти программы основаны на потребностях ребенка, а не на доходе родителей. Для детей старше 3 лет ответственность за предоставление этих услуг ложится на школьный округ. Воспользуйтесь этим; вмешательство может иметь огромное значение для вашего ребенка!
Автор:
Дженнифер Салем, М.А.,
Фонд MAGIC Foundation
RSS / SGA Фонд исследований и образования
И
Митчелл Э. Геффнер, MD
Профессор педиатрии
Школа медицины Кека при USC
Заведующий Центром эндокринологии, диабета и метаболизма
Детская больница Лос-Анджелеса (CHLA)
Рон Беркл, председатель Центра эндокринологии, диабета и метаболизма
Ресурсы
»Загрузите версию брошюры IUGR
для печати»Загрузите версию для печати брошюры« Стоматологические проблемы, связанные с дефицитом гормона роста »
»Загрузите версию для печати Психосоциального воздействия низкого роста на детей и подростков
»Загрузите версию для печати брошюры« Часто задаваемые вопросы при начале терапии гормоном роста »
»Щелкните здесь, чтобы узнать о преимуществах участника или присоединиться к The MAGIC Foundation
»« ЛАЙК »Страница MAGIC Foundation в Facebook
»Хотели бы вы поговорить с кем-нибудь о ЗВУР? В этом случае позвоните в The MAGIC Foundation по телефону 800-3MAGIC3 или (630) 836-8200 или напишите нам по электронной почте
Чтобы получить помощь за пределами Северной Америки, посетите нашу Международную коалицию, чтобы узнать о ресурсах в вашей стране
.