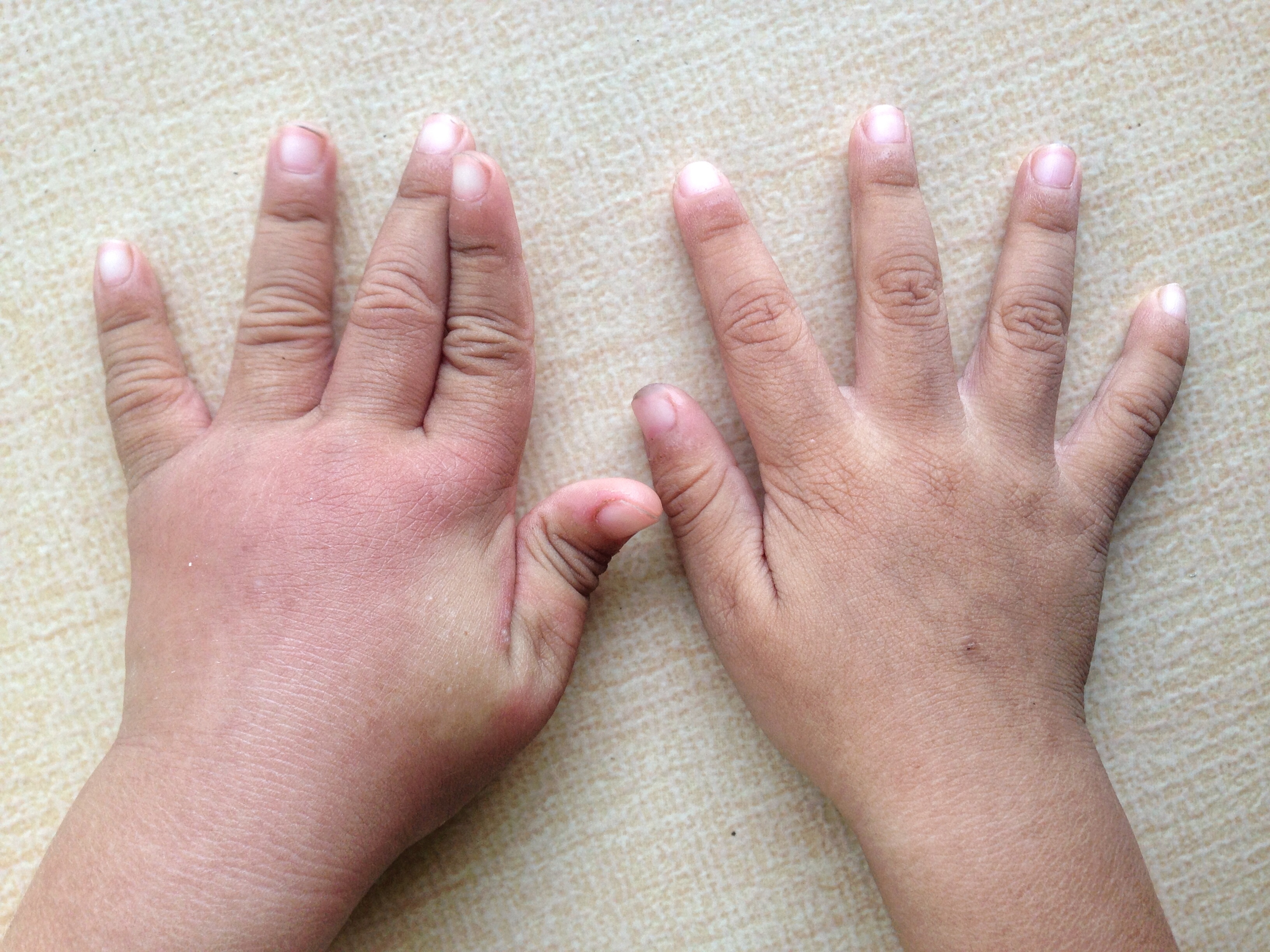
Артрит при воспалительных заболеваниях кишечника
Артрит, или воспаление суставов, является наиболее распространенным осложнением неспецифического язвенного колита (НЯК) и болезни Крона. Двадцать пять процентов людей с неспецифическим язвенным колитом страдают от него, причем он часто встречается у молодых пациентов. Кроме боли в суставах, артрит также вызывает отек и тугоподвижность (скованность в суставе).
При неспецифическом язвенном колите артрит может проявиться в двух различных формах:
Периферический артрит обычно затрагивает крупные суставы рук и ног, в том числе локти, запястья, колени и лодыжки. Боль может «мигрировать», от одного сустава к другому и длиться от нескольких дней до нескольких недель. Чем интенсивнее воспалительный процесс в толстой кишке, тем более выражен артрит. На сегодняшний день, не существует никаких специальных тестов для подтверждения НЯК — ассоциированного артрита. Поставить этот диагноз можно лишь, исключив другие причины болей в суставах.
Спондилоартрит (артрит межпозвоночных суставов) вызывает боль и скованность в нижней части позвоночника и крестцово — подвздошных суставах. У молодых людей эти симптомы могут появиться гораздо раньше кишечных проявлений. В отличие от периферического артрита, спондилоартрит может привести к значительному ухудшению функции позвоночника, так как уменьшается объём движения в межпозвоночных суставах. Спондилит обычно появляется в возрасте около 40 лет.
Лечение артрита при воспалительных заболеваниях кишечника.
В большинстве случаев, симптомы периферического артрита уменьшаются при исчезновении воспаления в толстой кишке. После курса таких препаратов как преднизолон или сульфасалазин, боль в суставах обычно исчезает. Применение Инфликсимаба (Ремикейда ®) для лечения НЯК также эффективно уменьшает воспаление и отек суставов. В отличие от периферического артрита, к сожалению, при спондилоартрите нет такой четкой взаимосвязи между исчезновением признаков воспаления в кишечнике и исчезновением суставных симптомов.
Публикации в СМИ
Спондилоартропатии, серонегативные по РФ, — группа воспалительных заболеваний соединительной ткани, предположительно инфекционного происхождения, развивающаяся у генетически предрасположенных лиц и отличающаяся наличием в клинической картине поражений позвоночника, крестцово-подвздошных и периферических суставов. К серонегативным спондилоартропатиям относят анкилозирующий спондилоартрит, псориатический артрит, реактивный артрит, энтеропатический артриты и недифференцированную спондилоартропатию.
Этиология • Урогенитальные инфекции •• Хламидиоз •• Уреаплазмоз •• Желудочно-кишечные инфекции •• Дизентерия •• Сальмонеллёз •• Иерсиниоз •• Кампилобактериоз •• Инфицирование клебсиеллами •• В ряде случаев этиологический фактор выявить не возможно • Генетические аспекты •• Носительство Аг HLA B27 у 60–90% пациентов
Классификация
• Анкилозирующий спондилит — см. Спондилит анкилозирующий.
• Реактивный артрит (см. Артрит реактивный).
• Псориатический артрит (см. Артрит псориатический).
• Энтеропатические артриты развиваются на фоне болезни Крона, неспецифического язвенного колита, болезни Уиппла, глютеновой энтеропатии, после операций на тонком кишечнике с выполнением анастомозов •• Периферический артрит (артралгии, мигрирующий артрит, асимметричный олигоартрит) развивается у 10–20% больных и коррелирует с активностью воспаления в кишечнике •• Сакроилеит и спондилит обычно протекают бессимптомно, с активностью кишечного воспаления не коррелируют.
• Недифференцированный спондилоартрит чаще развивается у мальчиков в возрасте 7–16 лет и дебютирует SEA-синдромом (S — серонегативность по РФ, E — энтезопатия, A — артропатия; точнее — асимметричный олигоартрит нижних конечностей). В 80% ювенильного спондилоартрита выявляют Аг HLA B27. Это состояние, соответствующее критериям серонегативных спондилоартропатий, при котором не удаётся выявить урогенитальной инфекции, воспалительных заболеваний кишечника, или псориаза. В дальнейшем в большинстве случаев развивается анкилозирующий спондилоартрит.
Классификационные критерии
• Боли в спине воспалительного характера (соответствуют по крайней мере 4 перечисленным признакам) •• начало в возрасте до 45 лет •• постепенное развитие •• улучшение состояния после физических упражнений •• сочетание с утренней скованностью •• длительность не менее 3 мес.
• Синовит (асимметричный артрит с преимущественным поражением нижних конечностей (в момент наблюдения или в анамнезе).
• Семейный анамнез (наличие у родственников первой или второй степени родства одного из следующих признаков •• анкилозирующего спондилита •• псориаза •• острого увеита •• реактивного артрита •• воспалительного заболевания кишечника.
• Псориаз (наличие псориаза, диагностированного врачом, в момент наблюдения или в анамнезе).
• Воспалительные заболевания кишечника (болезнь Крона или неспецифический язвенный колит, диагностированные врачом и подтверждённые колоноскопией или рентгенологическим методом, в момент обследования или в анамнезе).
• Альтернирующие боли в крестце (в момент наблюдения или в анамнезе).
• Энтезопатии (спонтанные боли или болезненность при исследовании мест прикрепления ахиллова сухожилия или подошвенной фасции).
• Острая диарея (эпизоды диареи в течение 1 мес до развития артрита).
• Уретрит (негонококковый уретрит или цервицит в течение 1 мес до развития артрита).
• Сакроилеит (двусторонний 2–4-й степеней или односторонний 3–4-й степеней, в соответствии со следующей рентгенологической оценкой: 0 — норма, 1 — возможный, 2 — минимальный, 3 — умеренный, 4 — анкилоз.
Диагноз спондилоартропатии может быть поставлен при наличии первого или второго критерия в сочетании, по крайней мере, с одним из остальных (чувствительность 87%, специфичность 87%).
Лечение
• НПВС применяют на ночь с целью уменьшения ночных болей и утренней скованности •• Индометацин 75 мг/сут •• Диклофенак 75–100 мг/сут •• Мелоксикам 15–22,5 мг/сут.
• ГК •• внутрь сустава •• ретробульбарно при остром увеите •• внутрь очень редко •• пульс-терапия метилпреднизолоном при высокой активности болезни, резистентном периферическом артрите, увеите.
• Иммунодепрессивная терапия показана в ранний период заболевания, при периферическом артрите и высокой воспалительной активности заболевания •• Сульфасалазин 2–3 г/сут особенно показан при энтеропатических спондилоартропатиях. Снижает частоту рецидивов увеита •• Азатиоприн 1–2 мг/кг/сут •• Метотрексат 7,5–15 мг/нед.
МКБ-10 • M45 Анкилозирующий спондилит • M46 Другие воспалительные спондилопатии • M48 Другие спондилопатии • M49* Спондилопатии при болезнях, классифицированных в других рубриках.
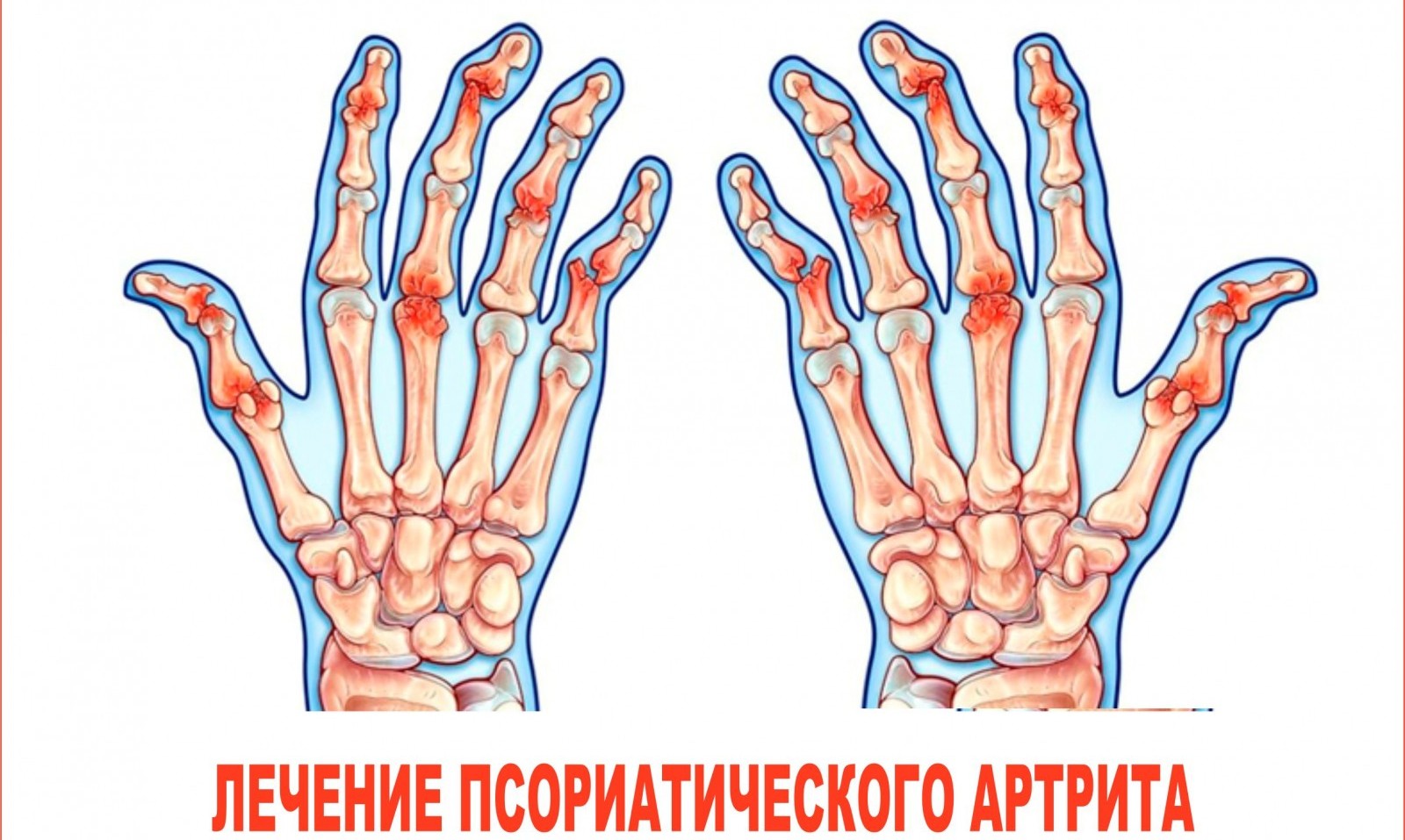
Псориатический артрит.
Псориатический артрит.
Здоровые суставы — это роскошь, значение которой трудно оценить тому, кто никогда не испытывал боли при ходьбе и не ощущал затруднения при попытке поднять руку или ногу, развернуться или присесть. Между тем миллионы людей по всему свету ежегодно обращаются за помощью к врачам-ревматологам с подобными жалобами.
Псориатический артрит — хроническое воспалительной заболевание суставов, позвоночника ассоциированное с псориазом.
Его считают вторым по частоте воспалительным заболеваниям суставов после РА, диагностируют его у 7-39% больных псориазом.
Псориатический артрит развивается в возрасте 25-55 лет. Мужчины и женщины болеют одинаково часто, исключение составляет псориатический спондилоартрит, который в 2 раза чаще наблюдается у мужчин.

Причина развития псориатического артрита – неизвестна, пусковый механизмом может служить:
- Травма
- Инфекции
- Психоэмоциональны напряжения
Симптомы:
- Боль в суставах;
- Утренняя скованность
- Припухлость суставов
Клиника:
- Псориаз кожи и/или ногтей;
- Периферический артрит;
- Поражение позвоночника;
- Поражение крестцово- подвздошных сочленений;
- Энтезит
Боли в суставах наблюдается, причем как мелких, так и крупных. Боли наиболее выражены в ночные и утренние часы.
Диагностика:
- Общий анализ крови, С- реактивный белок, ревматоидный фактор,
- Рентгенографическое обследование: кистей, стоп, позвоночника, таза:
- МРТ крестцово-подвздошных сочленений
Лечение:
- Противовоспалительные препараты.

- Внутрисуставные инъекции
- Подбор базисной противовоспалительной терапии
Какими бы не были причины заболевания суставов, важно вовремя обратить на них внимание и получить консультацию и лечение в ревматологическом отделении Железнодорожной клинической больнице г. Иркутск в целях охраны здоровья и профессионального долголетия!
Информация по тел.:
(3952) 638-800, 638-802
Мы открыты для всех
Аксиальный спондилоартрит — Новая Больница
Если сравнить частоту ревматических заболеваний у мужчин и женщин, то гендерное неравенство станет очевидно: женщин большинство. Но есть одно заболевание, которое значительно чаще встречается у мужчин.
 А при развитии у женщин оно будет протекать значительно легче.С чем же так «повезло» мужчинам? Это анкилозирующий спондилит или болезнь Бехтерева — хроническое воспалительное заболевание из группы спондилоартритов с поражением крестцово-подвздошных суставов и/или позвоночника и потенциальным исходом в анкилоз («сращение»).
А при развитии у женщин оно будет протекать значительно легче.С чем же так «повезло» мужчинам? Это анкилозирующий спондилит или болезнь Бехтерева — хроническое воспалительное заболевание из группы спондилоартритов с поражением крестцово-подвздошных суставов и/или позвоночника и потенциальным исходом в анкилоз («сращение»).Прежде чем пойти дальше скажем пару слов об этих самых спондилоартритах, так как здесь есть заблуждения!
Самое главное, спондилоартрит НЕ РАВНО болезни Бехтерева! Спондилоартриты – это группа воспалительных заболеваний, для которых характерно поражение позвоночника и/или суставов. Они объединены по механизмам их развития и похожим клиническим проявлениям. Делится эта группы на две подгруппы – аксиальный и периферический спондилоартрит. Разница в том, что при первом поражается только крестцово-подвздошные суставы и/или позвоночник, а при втором – может поражать также суставы верхних и нижних конечностей.

Кроме того, подгруппа аксиального спондилоартрита делится на анкилозирующий спондилит (это и есть болезнь Бехтерева) и не рентгенологический аксиальный спондилоартрит. Разница между ними – наличие /отсутствие поражения крестцово-подвздошных суставов на рентгенографии. Рентгенологические изменения происходят очень медленно, иногда для появления признаков «сращения» должно пройти 7-8 лет, поэтому до сих пор идут горячие споры о том, являются ли эти две формы стадиями одного процесса, или разными заболеваниями из одной группы.
Для лучшего понимания ниже будем говорить о группе аксиального спондилоартрита (АС).
Причины заболевания Точная причина заболевания неизвестна. Спондилоартриты в отличие от ревматоидного артрита, относятся в большей степени не к аутоиммунным, а к гипервоспалительным заболеваниям. Они редко вызывают системные воспалительные реакции, а поражают определённые органы и ткани – суставы, кожу, кишечник, глаза.
Один из ключевых факторов развития АС — наличие антигена HLA-B27. Несмотря на 40-летнюю историю его изучения, роль антигена остаётся не до конца ясной. По одной теории, запускающим воспаление процессом могут явиться микробы, у которых часть генов настолько схожа с генами пациента – носителя HLA B-27, что организм человека «путает» их и начинает работать против своих.
Несмотря на 40-летнюю историю его изучения, роль антигена остаётся не до конца ясной. По одной теории, запускающим воспаление процессом могут явиться микробы, у которых часть генов настолько схожа с генами пациента – носителя HLA B-27, что организм человека «путает» их и начинает работать против своих.
Однако, когда заболевание уже проявило себя, не ищите эти таинственные микробы – скорее всего организм уже давно избавился от них, а воспаление будет продолжаться.
Другая теория основана на возможности аномального строения HLA-B27, который сам активирует развёрнутый иммунный ответ. Любой фактор (травма, инфекция) могут оказаться фактором – «триггером» — для активации «неправильной работы» этого антигена. Как бы то ни было, но у 95% пациентов с АС может быть обнаружен этот пресловутый HLA B-27.
А далее разворачивается каскад реакций: последовательно активируются Т-лимфоциты – клетки иммунной системы и увеличивается образование белковых молекул, «медиаторов воспаления» (цитокинов). Они и приводят к изменениям, характерным для всей группы спондилоартритов и АС в частности. В отличие от ревматоидного артрита, где главный механизм разрушения сустава — образование эрозий – «изъеденность» — хряща и разрушение кости, при АС процесс воспаления заканчивается костной пролиферацией – образованием новой «избыточной» костной ткани. В результате – анкилоз (сращение) суставов и оссификация (окостенение) связок позвоночника с исходом в неподвижность.
Они и приводят к изменениям, характерным для всей группы спондилоартритов и АС в частности. В отличие от ревматоидного артрита, где главный механизм разрушения сустава — образование эрозий – «изъеденность» — хряща и разрушение кости, при АС процесс воспаления заканчивается костной пролиферацией – образованием новой «избыточной» костной ткани. В результате – анкилоз (сращение) суставов и оссификация (окостенение) связок позвоночника с исходом в неподвижность.
Мужчины страдают чаще, дебют приходится на возраст младше 45 лет. Возможно развитие АС в детском возрасте с переходом во взрослое состояние, который обычно протекает достаточно тяжело.
Симптомы Наиболее типичный симптом заболевания — боль в нижней части спины (в области крестца и по бокам от него) воспалительного характера, т.е. возникающая ранним утром или после неподвижного положения.
Боль может быть неявной, по типу дискомфорта или ощущения тяжести, часто сопровождается утренней скованностью (тугоподвижностью), может отдавать в ягодицы, но очень часто боль вынуждает просыпаться пациента в 4-5 часов утра.
Симптомы обычно прогрессируют очень медленно (годами и даже – десятилетиями), и пациенты часто наблюдаются с диагнозом «остеохондроз». Насторожить врача или пациента должен непреходящий характер болей, молодой возраст (до 45 лет) и отсутствие улучшения после отдыха.
Следующим после поражения крестцово-подвздошных суставов, АС затрагивает позвонки. Обычно процесс идет «снизу вверх», но реже может быть и иной порядок. При этом сначала наблюдаются воспалительные изменения в телах позвонков, а затем развиваются межпозвонковые «костные мостики» — синдесмофиты.Вместе с кальцифицикацией связок позвоночника это создает на рентгенограмме характерную картину «бамбуковой палки», а при внешнем осмотре врач наблюдает «позу просителя»: позвоночные изгибы сглажены, голова пациента наклонена вперёд, боковые движения в позвоночнике возможны только при повороте всего туловища.
Такого пациента врачу-ревматологу видно «издалека», но, к сожалению, в этой стадии возможности терапии крайне ограничены. Поэтому современные диагностические критерии направлены на возможно более раннюю диагностику АС.
Поэтому современные диагностические критерии направлены на возможно более раннюю диагностику АС.
«Классическим» инструментальным исследованием является рентгенография таза, на которой выявляется двусторонний сакроилиит – воспаление крестцово-подвздошных суставов. Но симптомы на рентгенографии появляются не ранее, чем через 4-5 лет, поэтому для ранней диагностики, как залоге эффективного лечения, применяется метод МРТ. В случае, если сакроилииит выявляется на МРТ, а на рентгенографии его нет, он называется нерентгенологический. Основной признак сакроилиита – отек костного мозга в зоне, прилежащей к крестцово-подвздошным суставам.
Лабораторный критерий АС — антиген HLA-B27. Помните, что в отличие от МРТ, это не признак заболевания, а маркёр ПРЕДРАСПОЛОЖЕННОСТИ к нему. Наличие HLA B-27 – это не приговор! В целом в популяции HLA B-27 может быть обнаружен у 8-15% населения, а какие-либо проявления, ассоциированные с данным геном, будут только у каждого двадцатого его носителя.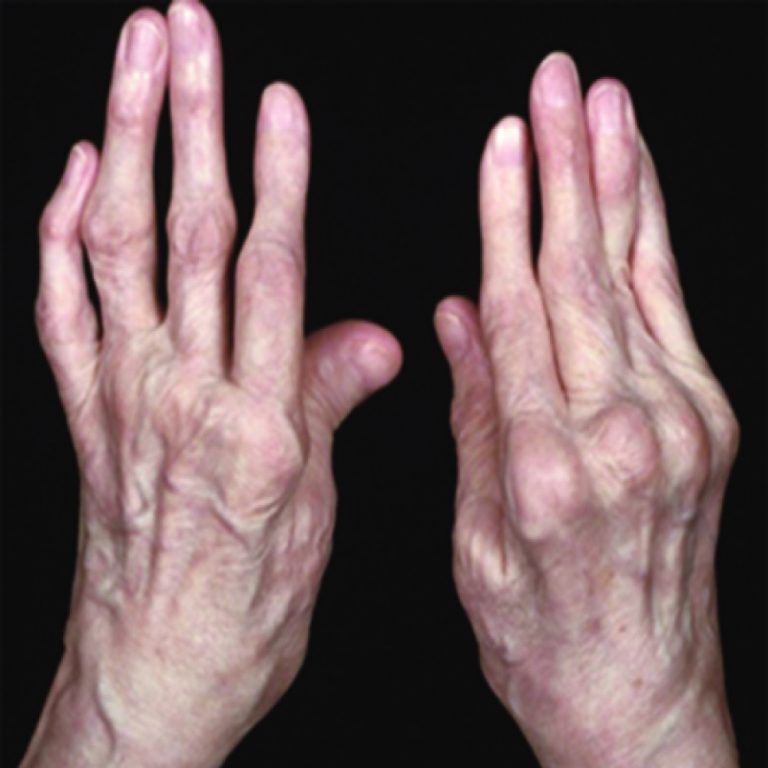
Другие традиционные воспалительные изменения – повышение СОЭ и С-реактивного белка можно наблюдать только у 30% пациентов с АС, поэтому нормальные показатели этих анализов не исключают и не подтверждают наличие заболевания.
К сожалению, наличие HLA B-27 может ассоциироваться не только с АС, но и с поражением других органов. Классической памяткой для ревматолога является «опорно-двигательный аппарат – кожа – глаза — кишечник». И как у кого из пациентов сложится эта мозаика – неизвестно. А поскольку этот ген наследуемый, то у одного члена семьи возможны кожные проявления, а у другого, например, сочетание — АС и поражения кишечника.
Помимо поражения позвоночника патология опорно-двигательного аппарата, связанная с HLA B-27, может проявляться так называемыми «энтезитами» — воспалениями в области прикрепления сухожилия в кости. Любимой локализацией в этом случае является боль в области пятки (сбоку или со стороны стопы) в месте прикрепления пяточной связки или Ахиллова сухожилия.
Еще одним проявлением со стороны опорно-двигательного аппарата может быть дактилит (в переводе-«воспаление пальца»), хотя воспаляются только сухожилия, но не суставы. При этом палец приобретает вид сосиски. Непосредственно воспаление суставов – артриты: чаще асимметричные с большим вовлечением нижних конечностей, также являются тем симптомом, который сориентирует врача на поиск HLA B-27. Кстати, если «мозаика» у конкретного пациента сложится так, что будут воспалены только периферические суставы без вовлечения позвоночника, то заболевание приобретет название «периферический спондилоартрит».
Иногда проявлением заболевания становится передний увеит – воспаление передней камеры глаза. Симптомы: выраженная боль и покраснение глаза, слезотечение, нарушение зрения (помутнение), светобоязнь. Сочетанием с АС может быть поражение кишечника, сопровождающееся болями в животе, послабленным или жидким стулом, в котором могут быть примеси слизи или крови. При колоноскопии может быть диагностирована болезнь Крона или язвенный колит. Еще одним органом-мишенью для HLA B-27 может стать кожа, поэтому врач непременно спросит про наличие псориаза.
Еще одним органом-мишенью для HLA B-27 может стать кожа, поэтому врач непременно спросит про наличие псориаза.
Таким образом, сочетание жалоб и анамнеза пациента, проведение специфических тестов, анализ инструментальных и лабораторных данных позволяет врачу поставить диагноз АС и начать терапию.
Лечение Пациенту необходимо получить от врача максимум информации и строго следовать клиническим рекомендациям. Несмотря на то, что список групп препаратов, влияющих на течение заболевания невелик, вполне возможно избежать анкилоза позвоночника и развития внесуставных осложнений со стороны других органов и систем. Очень важная роль отводится ежедневной гимнастике, которая показана абсолютно всем вне зависимости от активности заболевания и развития анкилоза. Её цель – замедление прогрессирование, профилактика и лечение деформаций, улучшение общего самочувствия. Основные упражнения – растяжение позвоночника и укрепление околопозвоночных мышц.
Если оценивать арсенал препаратов, доказанных в отношении АС (Внимание! Сейчас мы говорим только про позвоночник), то существует два основных класса лекарств.
В первую очередь, это нестероидные противовоспалительные препараты (НПВП). Они должны быть назначены пациенту сразу после установления диагноза, независимо от стадии заболевания, должны приниматься длительно и без перерывов, и способны не просто уменьшать боль, но и замедлять прогрессирование АС.
Иначе говоря, срастание позвонков между собой происходит в четыре раза медленнее по сравнению с теми пациентами, кто использовал НПВП только «по требованию». Подбор НПВП осуществляется лечащим врачом с учётом многих факторов, в том числе сопутствующих заболеваний пациента, особенностей назначения препарата и его возможных побочных эффектов.
Генно-инженерная терапия – это блокаторы ФНО-α (инфликсимаб, голимумаб, адалимумаб, цертолизумаба пэгол, этанерцепт) и антитела к интерлейкину-17 (секукинумаб, нетакимаб). Эффективны на любой стадии развития АС (но на ранней больше, чем на поздней) и для снижения активности, и для профилактики деформаций. Как правило, назначаются в том случае, если эффект от НПВП недостаточный. С учетом наличия нескольких препаратов из группы генно-инженерной терапии у врача появляются возможности «переключать» пациента на другой лекарственный препарат в случае неэффективности первого.
С учетом наличия нескольких препаратов из группы генно-инженерной терапии у врача появляются возможности «переключать» пациента на другой лекарственный препарат в случае неэффективности первого.
В том случае, если возникают внесуставные поражения глаз, кишечника или кожи, то арсенал врача в плане эффективной терапии расширяется еще больше.
Тяжелые осложнения возникают либо при позднем обращении пациента, либо при игнорировании им рекомендованного лечения.
В наше время терапия позволяет избежать быстрого и выраженного прогрессирования анкилозирующего спондилита и сделать классическую «позу просителя» достоянием истории
Стоимость консультаций ревматологов Способы оплаты: оплата наличными средствами; оплата пластиковыми банковскими картами МИР, VISA, MastercardWorldwide
Classification, clinical presentation, diagnosis, treatment
Научно-практическая ревматология. 2018;56(1):60–69 68
Программа непрерывного последипломного образования врачей
19. Love TJ, Zhu Y, Zhang Y, et al. Obesity and the risk of psoriatic
Love TJ, Zhu Y, Zhang Y, et al. Obesity and the risk of psoriatic
arthritis: a population-based study. Ann Rheum Dis.
2012;71:1273-7. doi: 10.1136/annrheumdis-2012-201299
20. Коротаева ТВ. Псориатический артрит: клиника,
диагностика, патогенез, лечение, маркеры
кардиоваскулярного риска. Москва: НПО «Медиа-Графика»;
2013. 309 с. [Korotaeva TV. Psoriaticheskii artrit: klinika, diagnos-
tika, patogenez, lechenie, markery kardiovaskulyarnogo riska
[Psoriatic arthritis: clinic, diagnosis, pathogenesis, treatment,
markers of cardiovascular risk]. Moscow: NPO «Media-Grafika»;
2013. 309 p.]. ISBN 978-5-905541-02-5.
21. Khan M, Schentag C, Gladman DD. Clinical and radiological
changes during psoriatic arthritis disease progression. J Rheumatol.
2003;30:1022-6.
22. Gladman DD, Ziouzina O, Thavaneswaran A, Chandran V.
Dactylitis in psoriatic arthritis: prevalence and response to therapy
in the biologic era. J Rheumatol. 2013;40:1357-9.
J Rheumatol. 2013;40:1357-9.
doi: 10.3899/jrheum.130163
23. Brockbank JE, Stein M, Schentag CT, Gladman DD. Dactylitis in
psoriatic arthritis: a marker for disease severity? Ann Rheum Dis.
2005;64:188-90. doi: 10.1136/ard.2003.018184
24. Kehl AS, Corr M, Weisman MH. Review: enthesitis: new insights
into pathogenesis, diagnostic modalities, and treatment. Arthritis
Rheum. 2016;68:312-22. doi: 10.1002/art.39458
25. Stoll ML, Zurakowski D, Nigrovic LE, et al. Patients with juvenile
psoriatic arthritis comprise two distinct populations. Arthritis
Rheum. 2006;54:3564-72. doi: 10.1002/art.22173
26. Colbert RA. Classification of juvenile spondyloarthritis: enthesitis-
related arthritis and beyond. Nat Rev Rheumatol. 2010;6:477-85.
doi: 10.1038/nrrheum.2010.103
27. Gladman DD, Antoni C, Mease P, et al. Psoriatic arthritis: epi-
demiology, clinical features, course, and outcome. Ann Rheum Dis.
2005;64 Suppl 2:14-7.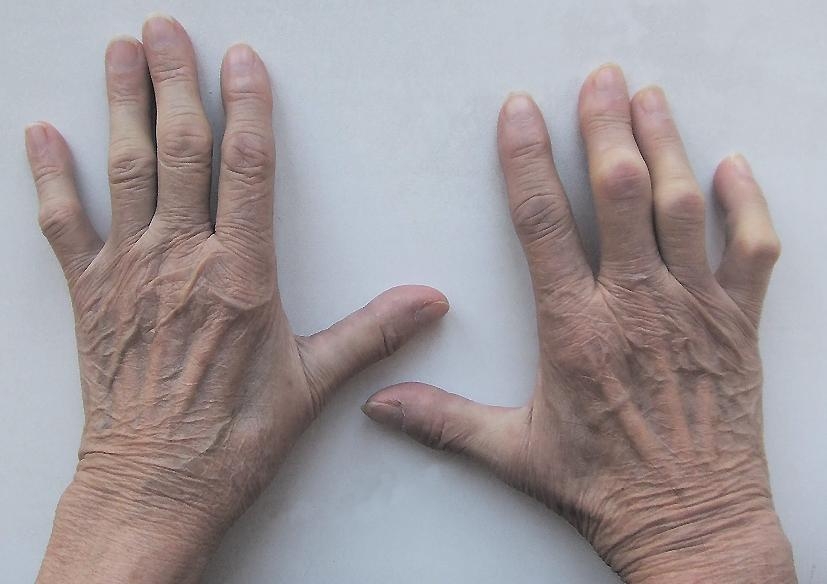 doi: 10.1136/ard.2004.032482
doi: 10.1136/ard.2004.032482
28. Chandran V, Barrett J, Schentag NC, et al. Axial Psoriatic
Arthritis: update on a longterm prospective study. J Rheumatol.
2009;36;2744-50. doi: 10.3899/jrheum.090412
29. Sieper J, van der Heijde D, Landewe R, et al. New criteria for
inflammatory back pain in patients with chronic back pain: a real
patient exercise by experts from the Assessment of
SpondyloArthritis International Society (ASAS). Ann Rheum Dis.
2009;68:784-8. doi: 10.1136/ard.2008.101501
30. Kane D, Pathare S. Early psoriatic arthritis. Rheum Dis Clin North
Am. 2005;31(4):641-57. doi: 10.1016/j.rdc.2005.07.009
31. Qureshi AA, Husni ME, Mody E. Psoriatic arthritis and psoriasis:
need for a multidisciplinary approach. Semin Cutan Med Surg.
2005;24:46-51. doi: 10.1016/j.sder.2005.01.006
32. Prey S, Paul C, Bronsard V, et al. Assessment of risk of psoriatic
arthritis in patients with plaque psoriasis: a systematic review of
the literature. J Eur Acad Dermatol Venereol. 2010;24 Suppl 2:31-5.
J Eur Acad Dermatol Venereol. 2010;24 Suppl 2:31-5.
doi: 10.1111/j.1468-3083.2009.03565.x
33. Gottlieb A, Korman N, Gordon K, et al. Guidelines of care for
the management of psoriasis and psoriatic arthritis: Section 2.
Psoriatic arthritis: overview and guidelines of care for treatment
with an emphasis on the biologics. J Am Acad Dermatol.
2008;58:851-64. doi: 10.1016/j.jaad.2008.02.040
34. Mease PJ. Assessing the impact of psoriatic arthritis on patient
function and quality of life: lessons learned from other rheumato-
logic conditions. Semin Arthritis Rheum. 2009;38:320-35.
doi: 10.1016/j.semarthrit.2008.01.003
35. Raychaudhuri SK, Chatterjee S, Nguyen C, et al. Increased preva-
lence of the metabolic syndrome in patients with psoriatic arthritis.
Metab Syndr Relat Disord. 2010;8:331-4.
doi: 10.1089/met.2009.0124
36. Li W-Q, Han J-L, Chan TA. Psoriasis and psoriatic arthritis and
increased risk of incedent Crohn’s disease in US women. Ann
Ann
Rheum Dis. 2013 Jul;72(7):1200-5. doi: 10.1136/annrheumdis-
2012-202143
37. Ogdie A, Schwartzman S, Husni ME. Recognizing and managing
comorbidities in psoriatic arthritis. Curr Opin Rheumatol.
2015;27:118-26. doi: 10.1097/BOR.0000000000000152
38. Gossec L, Smolen J, Gaujoux-Viala C, et al. European League
Against Rheumatism recommendations for the management of
psoriatic arthritis with pharmacological therapies. Ann Rheum Dis.
2012;71(1):4-12. doi: 10.1136/annrheumdis-2011-200350
39. Mease PJ. Assessment tools in psoriatic arthritis. J Rheumatol.
2008;35:1426-30.
40. Gladman DD, Inman RD, Cook RJ, et al. International spondy-
loarthritis interobserver reliability exercise – the INSPIRE study:
II. Assessment of peripheral joints, enthesitis, and dactylitis.
J Rheumatol. 2007;34:1740-5.
41. Nell-Duxneuner VP, Stamm TA, Machold KP, et al. Evaluation of
the appropriateness of composite disease activity measures for
assessment of psoriatic arthritis. Ann Rheum Dis. 2010;69:546-9.
Ann Rheum Dis. 2010;69:546-9.
doi: 10.1136/ard.2009.117945
42. Smolen JS, Breedveld FC, Schiff MH, et al. A simplified disease
activity index for rheumatoid arthritis for use in clinical practice.
Rheumatology. 2003;42(2):244-57.
doi: 10.1093/rheumatology/keg072
43. Ritchlin CT, Kavanaugh A, Gladman DD, et al. Treatment rec-
ommendations for psoriatic arthritis. Ann Rheum Dis.
2009;68:1387-94. doi: 10.1136/ard.2008.094946
44. Mumtaz A, Gallagher P, Kirby B, et al. Development of a prelimi-
nary composite disease activity index in psoriatic arthritis. Ann
Rheum Dis. 2010;70:272-7. doi: 10.1136/ard.2010.129379
45. Helliwell PS, Fitzgerald O, Fransen J, et al. The development of
candidate composite disease activity and responder indices for
psoriatic arthritis (GRACE project). Ann Rheum Dis. 2013;72:986-
91. doi: 10.1136/annrheumdis-2012-201341
46. Saber TP, Ng CT, Renard G, et al. Remission in psoriatic arthritis:
is it possible and how can it be predicted? Arthritis Res Ther.
2010;12(3):94-8. doi: 10.1186/ar3021
47. Coates LC, Helliwell PS. Validation of minimal disease activity
criteria for psoriatic arthritis using interventional trial data.
Arthritis Care Res (Hoboken). 2010;62:965-9.
doi: 10.1002/acr.20155
48. Kavanaugh AF, Ritchlin CT. Systematic review of treatments for
psoriatic arthritis: an evidence based approach and basis for treat-
ment guidelines. J Rheumatol. 2006;33:1417-21.
49. Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research
and Assessment of Psoriasis and Psoriatic Arthritis 2015 treatment
recommendations for psoriatic arthritis. Arthritis Rheum.
2016;68:1060-71. doi: 10.1002/art.39573
50. Gossec L, Smolen JS, Ramiro S, et al. European League Against
Rheumatism (EULAR) recommendations for the management of
psoriatic arthritis with pharmacological therapies: 2015 update.
Ann Rheum Dis. 2016;75:499-510. doi: 10.1136/annrheumdis-
2015-208337
51. Nash P, Clegg DO. Psoriatic arthritis therapy: NSAIDs and tradi-
Nash P, Clegg DO. Psoriatic arthritis therapy: NSAIDs and tradi-
tional DMARDs. Ann Rheum Dis. 2005;64 Suppl 2:ii74-ii77.
doi: 10.1136/ard.2004.030783
52. Kingsley GH, Kowalczyk A, Taylor H, et al. A randomized place-
bo-controlled trial of methotrexate in psoriatic arthritis.
Rheumatology (Oxford). 2012;51:1368-77. doi: 10.1093/rheumatol-
ogy/kes001
53. Kaltwasser JP, Nash P, Gladman D, et al. Efficacy and safety of
leflunomide in the treatment of psoriatic arthritis and psoriasis:
a multinational, double-blind, randomized, placebo-controlled
clinical trial. Arthritis Rheum. 2004;50:1939-50.
doi: 10.1002/art.20253
54. Mease PJ. Biologic therapy for psoriatic arthritis. Rheum Dis Clin
North Am. 2015;41:723-38. doi: 10.1016/j.rdc.2015.07.010
55. Weitz JE, Ritchlin CT. Ustekinumab: targeting the IL-17 pathway
to improve outcomes in psoriatic arthritis. Expert Opin Biol Ther.
2014;14:515-26. doi: 10.1517/14712598.2014.890587
doi: 10.1517/14712598.2014.890587
56. McInnes IB, Sieper J, Braun J, et al. Efficacy and safety of secuk-
inumab, a fully human anti-interleukin-17A monoclonal antibody,
in patients with moderate-to-severe psoriatic arthritis: a 24-week,
randomised, double-blind, placebo-controlled, phase II proof-of-
concept trial. Ann Rheum Dis. 2014;73:349-56.
doi: 10.1136/annrheumdis-2012-202646
Артриты инфекционной этиологии у собак
Уважаемые Владельцы! Если Вы наблюдали у Вашего питомца следующие клинические признаки:
- хромота;
- припухание суставов;
- скованность движений;
- болезненность при вставании;
- отказ от привычного подвижного образа жизни
Вам необходимо провести комплексное обследование собаки для выявления или исключения заболеваний инфекционной этиологии.
Важно знать, что без точного диагноза нельзя грамотно назначить лечение. Помните, что многие инфекционные заболевания являются общими для человека и животного. Своевременно вылечив своего Друга, Вы обезопасите себя и Ваших близких от опасных болезней.
Своевременно вылечив своего Друга, Вы обезопасите себя и Ваших близких от опасных болезней.
Лаборатория нашей клиники располагает уникальной возможностью провести диагностику ряда заболеваний:
- Болезнь Лайма
- Микоплазмоз
- Хламидиоз
- Моноцитарный эрлихиоз
Для проведения анализов необходимо сдать кровь. Сроки изготовления анализов от 3 часов до 7 дней. Диагностические наборы на эрлихиоз позволяют получить результаты уже через 1 час.
Если анализ окажется положительным хотя бы по одному из перечисленных заболеваний, Вы можете получить консультацию по дальнейшему обследованию и лечению животного. Помните, что инфекционные заболевания могут протекать сочетано, поэтому обследование необходимо проводить комплексное!
Болезнь Лайма – инфекционное трансмиссивное природноочаговое заболевание, вызываемое бактериями рода Borrelia: B.burgdorferi, B.garinii, B.afzelii. Borrelia burgdorferi s.l. На территории России болезнь Лайма переносят клещи рода Ixodes. Болезнь Лайма проявляется артритами, нефритами, реже патологиями сердечно-сосудистой и нервной систем у животных и людей. Болезнь Лайма хроническое заболевание. Инкубационный период (от момента укуса клеща до развития клинических признаков) составляет от 2-5 месяцев до нескольких лет. Поражения суставов при БЛ разнообразны – от умеренных артралгий до хронического деструктивного артрита. Артралгии и миалгии, скованность в суставах и позвоночнике характерны для этого заболевания. Наиболее часто поражаются крупные суставы: плечевой, локтевой, коленный, запястный и скакательный суставы.
Болезнь Лайма проявляется артритами, нефритами, реже патологиями сердечно-сосудистой и нервной систем у животных и людей. Болезнь Лайма хроническое заболевание. Инкубационный период (от момента укуса клеща до развития клинических признаков) составляет от 2-5 месяцев до нескольких лет. Поражения суставов при БЛ разнообразны – от умеренных артралгий до хронического деструктивного артрита. Артралгии и миалгии, скованность в суставах и позвоночнике характерны для этого заболевания. Наиболее часто поражаются крупные суставы: плечевой, локтевой, коленный, запястный и скакательный суставы.
Бруцеллез – зооантропонозная инфекция (общая для человека и животных). У собак это заболевание могут вызвать несколько возбудителей: Br.melitensis, Br.abortus, Br.suis, Br.canis, Br.rangiferi, но наиболее патогенной является Br.canis. В литературе описаны случаи передачи инфекции от собаки человеку. Основными путями заражения собак служат половой (при вязке, а также после щенения или аборта) и алиментарный. Кроме того, бруцеллы могут проникать в организм через поврежденную кожу и слизистые оболочки. Возбудители распространяются по лимфатической и кровеносной системам и оседают в лимфатических узлах, селезенке, печени, костном мозге, половых органах, суставах. Бруцеллы живут внутри клеток ретикуло-эндотелиальной системы (макрофагах), в результате внутриклеточной гибели бруцелл высвобождаются токсины, которые вызывают различные симптомы болезни. Бруцеллез проявляется артритами (чаще полиартритами) и патологиями половой системы: аборты, мертворождаемость, слабая жизнеспособность щенков, пропустование, эпидидимиты, простатиты, орхиты. Собака может заболеть в любом возрасте. Инкубационный период от нескольких недель до нескольких лет.
Кроме того, бруцеллы могут проникать в организм через поврежденную кожу и слизистые оболочки. Возбудители распространяются по лимфатической и кровеносной системам и оседают в лимфатических узлах, селезенке, печени, костном мозге, половых органах, суставах. Бруцеллы живут внутри клеток ретикуло-эндотелиальной системы (макрофагах), в результате внутриклеточной гибели бруцелл высвобождаются токсины, которые вызывают различные симптомы болезни. Бруцеллез проявляется артритами (чаще полиартритами) и патологиями половой системы: аборты, мертворождаемость, слабая жизнеспособность щенков, пропустование, эпидидимиты, простатиты, орхиты. Собака может заболеть в любом возрасте. Инкубационный период от нескольких недель до нескольких лет.
Микоплазмоз – инфекционное заболевание бактериальной этиологии. У собак заболевание вызывают несколько видов микроорганизмов: M.bovigenitalium, M.canis, M.maculosum, M.spumans, M.haemocanis. Микоплазмы распространены повсеместно. Источником микоплазмозной инфекции служат инфицированные животные.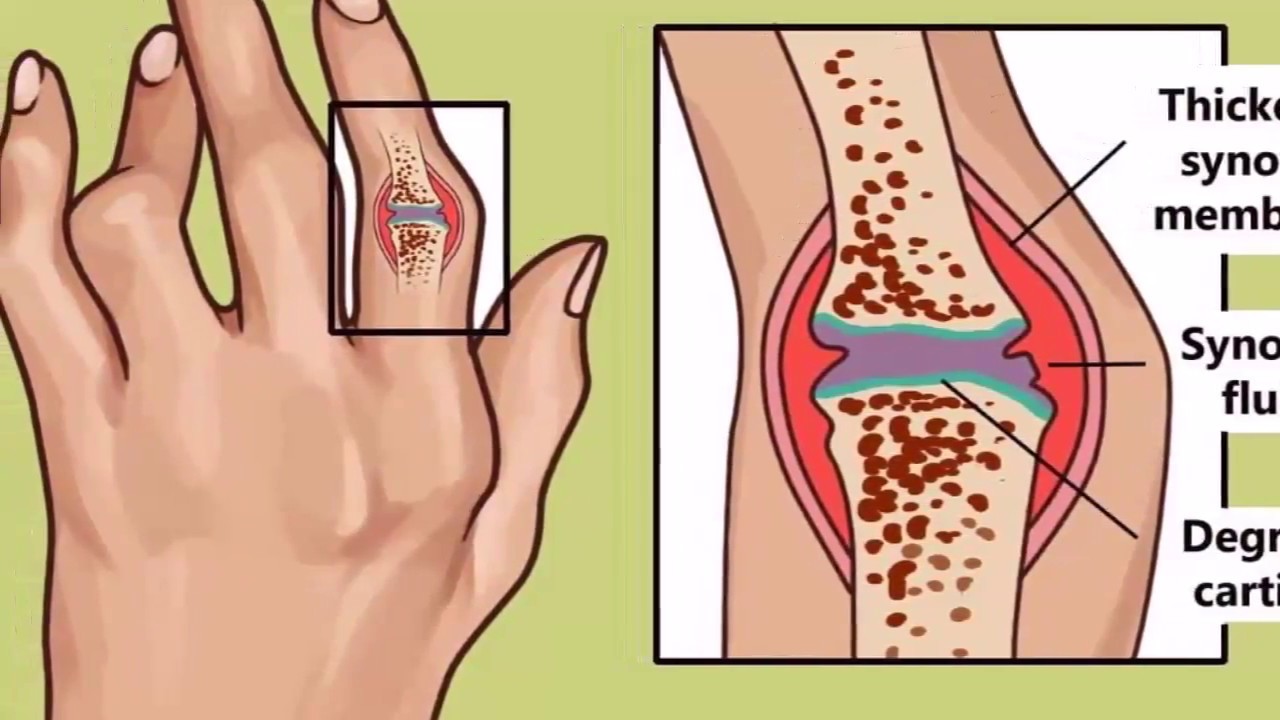 Заражение происходит половым и аэрозольным путями, возможно алиментарное заражение. Микоплазмы могут размножаться внутри клеток хозяина (собаки), поэтому инфекция часто протекает в латентной (скрытой) форме. При определенных условиях (снижении иммунитета на фоне другого заболевания, в период щенности, при воздействии стресс-фактора, плохом кормлении и т.д.) она способна обостряться, сопровождаясь развитием различных клинических признаков: полиартриты, заболевания органов воспроизводства: баланопостит, орхит, эпидидимит, простатит, бесплодие, вагинит, пиометра, аборты, бесплодие и др.; нефриты; пневмония и бронхит; заболевания сердца. Заболеванию животные подвержены в любом возрасте.
Заражение происходит половым и аэрозольным путями, возможно алиментарное заражение. Микоплазмы могут размножаться внутри клеток хозяина (собаки), поэтому инфекция часто протекает в латентной (скрытой) форме. При определенных условиях (снижении иммунитета на фоне другого заболевания, в период щенности, при воздействии стресс-фактора, плохом кормлении и т.д.) она способна обостряться, сопровождаясь развитием различных клинических признаков: полиартриты, заболевания органов воспроизводства: баланопостит, орхит, эпидидимит, простатит, бесплодие, вагинит, пиометра, аборты, бесплодие и др.; нефриты; пневмония и бронхит; заболевания сердца. Заболеванию животные подвержены в любом возрасте.
Моноцитарный эрлихиоз – инфекционное, трансмиссивное природноочаговое заболевание, вызываемое микроорганизмами Ehrlichiacanis. E.canis в моноците периферический крови собаки. Переносчиками заболевания являются клещи Riphicephalussanguinus, которые распространены на юге России, а в этом году клещи этого рода были впервые зарегистрированы в Москве, а также впервые в Москве был поставлен диагноз моноцитарный эрлихиоз собаке, никогда не выезжавшей за пределы города.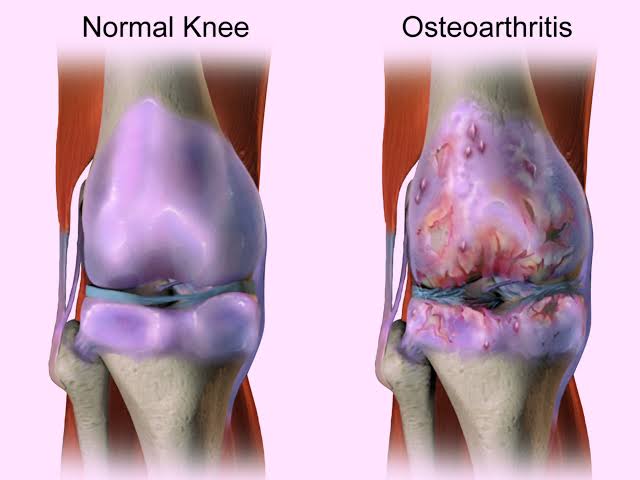 Инкубационный период заболевания составляет от 7 до 20 дней. Как правило, острая форма сопровождается лихорадкой, анорексией, увеличением лимфатических узлов. Позднее развиваются широкий спектр клинических проявлений: полиартриты, анемии, коагулопатии (нарушение системы свертывания крови), гепатиты, сплениты. Нередко заболевание сопровождается летальным исходом. В некоторых случаях заболевание может протекать бессимптомно (от нескольких месяцев до нескольких лет).
Инкубационный период заболевания составляет от 7 до 20 дней. Как правило, острая форма сопровождается лихорадкой, анорексией, увеличением лимфатических узлов. Позднее развиваются широкий спектр клинических проявлений: полиартриты, анемии, коагулопатии (нарушение системы свертывания крови), гепатиты, сплениты. Нередко заболевание сопровождается летальным исходом. В некоторых случаях заболевание может протекать бессимптомно (от нескольких месяцев до нескольких лет).
Хламидиоз – инфекционное заболевание людей, млекопитающих и птиц. У собак инфекцию вызывают микроорганизмы: Chlamydiaabortus, C.psittaci, C.pecorum. Заражение собак Chlamydiaabortus происходит чаще всего половым путем, а также внутриутробно. Другими возбудителями собаки чаще всего заражаются аэрозольным путем. Хламидии являются внутриклеточными паразитами. По мере размножения в клетках хозяина бактерии выходят наружу, инфицируя соседние клетки, при этом инфицированная клетка не получает серьезных повреждений и сохраняет жизнеспособность. Именно благодаря способности длительно персистировать в тканях хламидиозные инфекции протекают у большей части собак бессимптомно. Лишь в спорадических случаях у инфицированных животных после неопределенного по продолжительности инкубационного периода развиваются клинические признаки. Наиболее часто хламидиоз протекает в генитальной форме, проявляющейся простатитами у кобелей, бесплодием, абортами, рождением мертвых и нежизнеспособных щенков у сук. Хламидиоз может сопровождаться полиартритами, бронхопневмонией, энтеритом, заболеваниями глаз.
Именно благодаря способности длительно персистировать в тканях хламидиозные инфекции протекают у большей части собак бессимптомно. Лишь в спорадических случаях у инфицированных животных после неопределенного по продолжительности инкубационного периода развиваются клинические признаки. Наиболее часто хламидиоз протекает в генитальной форме, проявляющейся простатитами у кобелей, бесплодием, абортами, рождением мертвых и нежизнеспособных щенков у сук. Хламидиоз может сопровождаться полиартритами, бронхопневмонией, энтеритом, заболеваниями глаз.
Ревматологические проявления при воспалительном заболевании кишечника
Энн Гастроэнтерол. 2011; 24 (3): 173–180.
Параскеви В. Вулгари
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Янины, Янина, Греция
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Иоаннины, Иоаннина, Греция
Для корреспонденции: Параскеви В. Вулгари, доктор медицины, доцент кафедры ревматологии, клиника ревматологии, кафедра внутренней медицины, медицинский факультет, Университет Янины, 45110, Янина, Греция; тел: +302651007503; факс: +302651007054; электронная почта: rg.iou.cc@ragluovp
Вулгари, доктор медицины, доцент кафедры ревматологии, клиника ревматологии, кафедра внутренней медицины, медицинский факультет, Университет Янины, 45110, Янина, Греция; тел: +302651007503; факс: +302651007054; электронная почта: rg.iou.cc@ragluovpПоступило 15.04.2011; Принято 3 июня 2011 г.
Авторские права: © Греческое общество гастроэнтерологовЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Ревматологические проявления воспалительного заболевания кишечника (ВЗК) являются частыми и включают периферический артрит, поражение оси и периферический энтезит.Также могут возникать вторичный остеопороз и гипертрофическая остеоартропатия. Осложнения ВЗК (например, септический артрит) следует отличать от стерильного воспаления. Побочные эффекты лечения кортикостероидами, такие как остеонекроз, также могут влиять на суставы. Осевое поражение варьируется от боли в пояснице до истинного анкилозирующего спондилита. Человеческий лейкоцитарный антиген B27 связан с аксиальным поражением ВЗК. Периферический артрит подразделяется на два типа. Тип I — это малосуставной асимметричный обычно неразрушающий артрит, поражающий крупные суставы и обычно связанный с активным заболеванием кишечника.Тип II — это полиартрит, поражающий мелкие суставы, и имеет тенденцию протекать независимо от заболевания кишечника. Лечение суставных симптомов при ВЗК включает сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды. Антитела против фактора некроза опухоли эффективны при лечении резистентной или осложненной болезни Крона, а также периферического артрита и аксиального поражения.
Побочные эффекты лечения кортикостероидами, такие как остеонекроз, также могут влиять на суставы. Осевое поражение варьируется от боли в пояснице до истинного анкилозирующего спондилита. Человеческий лейкоцитарный антиген B27 связан с аксиальным поражением ВЗК. Периферический артрит подразделяется на два типа. Тип I — это малосуставной асимметричный обычно неразрушающий артрит, поражающий крупные суставы и обычно связанный с активным заболеванием кишечника.Тип II — это полиартрит, поражающий мелкие суставы, и имеет тенденцию протекать независимо от заболевания кишечника. Лечение суставных симптомов при ВЗК включает сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды. Антитела против фактора некроза опухоли эффективны при лечении резистентной или осложненной болезни Крона, а также периферического артрита и аксиального поражения.
Ключевые слова: периферический артрит, сакроилеит, энтезит, осевое поражение
Введение
Идиопатические воспалительные заболевания кишечника (ВЗК), болезнь Крона (БК) и язвенный колит (ЯК) являются системными заболеваниями, которые могут осложняться внекишечными заболеваниями. проявления у 40% пациентов, в зависимости от исследуемой популяции и используемых определений [1-3].Ревматологические проявления ВЗК являются частыми и включают периферический артрит, поражение оси, периферический энтезит, вторичный остеопороз и вторичную гипертрофическую остеоартропатию (HOA) (). Осложнения ВЗК также могут вызывать боль в суставах, и их следует отличать от стерильного воспаления. Бактериальная инфекция крестцово-подвздошных или периферических суставов может возникнуть из-за свищей или бактериемии. Побочные эффекты лечения ВЗК могут также влиять на суставы, такие как остеонекроз из-за использования кортикостероидов.ВЗК может быть связана с рецидивирующим полихондритом и кожным васкулитом. Связь между кишечником и артритом была постулирована в 1929 году Баргеном, который признал артрит осложнением ЯК [4]. Хенч в 1935 году описал периферический артрит у пациентов с ВЗК и наблюдал тенденцию артрита к обострению при обострении колита и к исчезновению с ремиссией кишечных симптомов [5].
проявления у 40% пациентов, в зависимости от исследуемой популяции и используемых определений [1-3].Ревматологические проявления ВЗК являются частыми и включают периферический артрит, поражение оси, периферический энтезит, вторичный остеопороз и вторичную гипертрофическую остеоартропатию (HOA) (). Осложнения ВЗК также могут вызывать боль в суставах, и их следует отличать от стерильного воспаления. Бактериальная инфекция крестцово-подвздошных или периферических суставов может возникнуть из-за свищей или бактериемии. Побочные эффекты лечения ВЗК могут также влиять на суставы, такие как остеонекроз из-за использования кортикостероидов.ВЗК может быть связана с рецидивирующим полихондритом и кожным васкулитом. Связь между кишечником и артритом была постулирована в 1929 году Баргеном, который признал артрит осложнением ЯК [4]. Хенч в 1935 году описал периферический артрит у пациентов с ВЗК и наблюдал тенденцию артрита к обострению при обострении колита и к исчезновению с ремиссией кишечных симптомов [5]. Введение Райтом и Моллом концепции спондилоартропатий (SpA) привело к дальнейшему изучению взаимосвязи между артритом и воспалением кишечника [6].ВЗК относится к SpA, имея общие черты с другими членами этого семейства расстройств, такие как асимметричный паттерн поражения периферических суставов, возникновение сакроилеита (SI) и спондилита, периферическая энтезопатия, отсутствие ревматоидного фактора, связь с человеческим заболеванием. лейкоцитарный антиген (HLA) B27, а также внесуставные особенности, включая увеит, кардит, поражения кожи и слизистых оболочек.
Введение Райтом и Моллом концепции спондилоартропатий (SpA) привело к дальнейшему изучению взаимосвязи между артритом и воспалением кишечника [6].ВЗК относится к SpA, имея общие черты с другими членами этого семейства расстройств, такие как асимметричный паттерн поражения периферических суставов, возникновение сакроилеита (SI) и спондилита, периферическая энтезопатия, отсутствие ревматоидного фактора, связь с человеческим заболеванием. лейкоцитарный антиген (HLA) B27, а также внесуставные особенности, включая увеит, кардит, поражения кожи и слизистых оболочек.
Таблица 1
Ревматологические проявления при ВЗК
Эпидемиологические особенности и генетические маркеры ревматологических проявлений при ВЗК
Распространенность ЯК колеблется от 50 до 100 на 100 000 населения.Заболевание чаще встречается у белых. Распространенность CD увеличилась за последние несколько десятилетий примерно до 75 на 100 000 населения. Ранние эпидемиологические исследования ассоциированных с ВЗК артропатий в 1960-х, 70-х и 80-х годах включали пациентов с классическим анкилозирующим спондилитом (AS) или SI вместе с периферическим артритом [7-15]. По данным этих исследований, АС присутствовал у 2-16% пациентов, в основном при БК. Бессимптомный и симптоматический СИ был обнаружен у 12-20% пациентов, а периферический артрит — у 11-20%.Связь с HLA-B27 колебалась от 3,9 до 18,9%. Исследования популяций ВЗК с использованием критериев Европейской группы исследования спондилоартропатии [16] или диагностических критериев Амора для спондилоартропатии [17] показали различные результаты [18–32]. В частности, AS варьировала от 1 до 45,1%, SI от 1,9 до 45,7%, периферический артрит от 2,8 до 30,6% и энтезопатия от 5,4 до 50% пациентов. В большинстве этих исследований сообщалось об аналогичных результатах при БК и ЯК при периферическом и осевом поражении. Кроме того, большинство исследований согласились с тем, что язвенный проктит редко осложняется воспалением суставов и что воспалительное заболевание суставов чаще встречается у пациентов с БК с колитом или с более обширным заболеванием кишечника по сравнению с пациентами с поражением подвздошной кишки.Кроме того, у некоторых пациентов развивается одно или несколько проявлений СпА (например, энтезит и / или дактилит) без выполнения критериев классификации.
По данным этих исследований, АС присутствовал у 2-16% пациентов, в основном при БК. Бессимптомный и симптоматический СИ был обнаружен у 12-20% пациентов, а периферический артрит — у 11-20%.Связь с HLA-B27 колебалась от 3,9 до 18,9%. Исследования популяций ВЗК с использованием критериев Европейской группы исследования спондилоартропатии [16] или диагностических критериев Амора для спондилоартропатии [17] показали различные результаты [18–32]. В частности, AS варьировала от 1 до 45,1%, SI от 1,9 до 45,7%, периферический артрит от 2,8 до 30,6% и энтезопатия от 5,4 до 50% пациентов. В большинстве этих исследований сообщалось об аналогичных результатах при БК и ЯК при периферическом и осевом поражении. Кроме того, большинство исследований согласились с тем, что язвенный проктит редко осложняется воспалением суставов и что воспалительное заболевание суставов чаще встречается у пациентов с БК с колитом или с более обширным заболеванием кишечника по сравнению с пациентами с поражением подвздошной кишки.Кроме того, у некоторых пациентов развивается одно или несколько проявлений СпА (например, энтезит и / или дактилит) без выполнения критериев классификации.
Артрит или аксиальные симптомы могут предшествовать желудочно-кишечным симптомам на длительные периоды времени, и пациентов можно рассматривать как недифференцированную спондилоартопатию до тех пор, пока не проявит себя ВЗК. Исследование Mielants и Veys предоставило доказательства того, что пациенты с недифференцированным SpA и даже AS могут иметь субклиническое воспаление кишечника, которое играет важную роль в запуске и сохранении воспаления суставов [33].В последующем 20-летнем исследовании пациентов с ВЗК были выявлены особенности опорно-двигательного аппарата у 30% [34]. HLA-B27-положительные пациенты с CD имеют высокую вероятность прогрессирования до откровенного АС. И наоборот, частота истинного IBD (UC или CD) при AS составляет менее 4%. Однако, если учесть возникновение субклинического воспаления кишечника, распространенность поражения кишечника в группе пациентов со СпА возрастает до 60% [35].
Другие исследования, направленные на выяснение частоты симптоматического или бессимптомного SI.Steer et al. Обнаружили при компьютерной томографии (КТ) признаки СИ у 31/134 пациентов с БК [36]. В другом исследовании, проведенном с участием 50 пациентов с БК с симптомами боли в спине, 28% соответствовали модифицированным Нью-Йоркским критериям СА при рентгенологическом исследовании [37]. С другой стороны, бессимптомный СИ может присутствовать у 10–50% пациентов с ВЗК [38]. В сравнительном исследовании с использованием обычного рентгена и КТ результаты, совместимые с СИ, были обнаружены у 29% пациентов с БК, и только у 3% были симптомы [39]. Магнитно-резонансная томография (МРТ) — наиболее чувствительный метод выявления СИ у пациентов с ВЗК.В литературе также есть исследования, описывающие скелетно-мышечные симптомы у пациентов с ВЗК, без использования точных диагностических критериев для СпА, связанной с ВЗК. Таким образом, сообщалось о расовых различиях в распространенности внекишечных, в том числе ревматологических, проявлений. Большое исследование показало, что у афроамериканцев с ВЗК чаще развиваются увеит и инфаркт миокарда [40]. Другое исследование описало повышенную заболеваемость артритом и увеитом у афроамериканских пациентов с CD [41], хотя в литературе приводятся другие результаты [42].Кроме того, исследователи из Испании сообщили о внекишечных проявлениях почти у половины (46%) из 157 пациентов с БК, в то время как у 22% были обнаружены ревматологические симптомы, которые чаще наблюдались у пациентов с заболеванием, ограниченным толстой кишкой [43]. Исследование, проведенное в Украине, показало, что 29,8% из 319 пациентов с ЯК имели суставные проявления. Артрит коррелировал с обширными формами ЯК и чаще встречался у пациентов с левосторонним ЯК и панколитом. Артралгия была превалирующим симптомом у пациентов с дистальным ЯК [44].Совместное вовлечение в ЯК колеблется от 20 до 35% в других исследованиях [45-47]. Исследование, проведенное в Японии, показало, что 10,3% пациентов с БК страдают артритом и 1,5% — спондилитом [48]. В греческой когорте пациентов с БК 30% страдали артритом / артралгиями [49]. Другое исследование, проведенное в Канаде, сообщило о 4% распространенности АС у госпитализированных пациентов с ВЗК, при этом пациенты мужского пола с БК поражались чаще, чем пациенты мужского пола с ЯК [50]. Однако в бразильском исследовании распространенность составила 14,4% без разницы между БК и ЯК [51].Наконец, исследование, проведенное в Кувейте, сообщило об артрите у 8,9% пациентов с ЯК, в то время как общая распространенность ревматологических жалоб составила 31% [52].
Такие расовые различия в распространенности ревматологических проявлений могут быть объяснены как иммунологическими, так и генетическими факторами. Периферический артрит, возникающий при ВЗК, не связан с HLA-B27. SI и особенно спондилит, однако, связаны с HLA-B27 [40% и 60% соответственно], но в меньшей степени, чем при неосложненном AS [90%].CD был связан с мутацией в гене NOD2 [CARD15] на хромосоме 16 [53]. Это представляет интерес для патогенеза CD, поскольку NOD2 играет важную роль в врожденном иммунитете к патогенам и косвенно участвует в микробных триггерах IBD. На сегодняшний день исследования не обнаружили значимой связи между CARD15 и SpA. Однако мутации CARD15 могут чаще обнаруживаться среди пациентов с БК, осложненной СИ [54], хотя это не было подтверждено в более поздних исследованиях [55].
Клинические особенности ревматологических проявлений ВЗК
Артрит
Суставные осложнения являются наиболее частыми внекишечными проявлениями [56].Артрит чаще встречается у пациентов с заболеванием толстой кишки и у пациентов с такими осложнениями, как абсцессы, псевдомембранозный полипоз, перианальное заболевание, массивное кровотечение, а также у пациентов с узловатой эритемой, стоматитом, увеитом и гангренозной пиодермией. Кроме того, пациенты с БК и поражением толстой кишки имеют более высокий риск развития синовита, чем пациенты с изолированным заболеванием тонкой кишки. В равной степени страдают мужчины и женщины. Периферический артрит подразделяется на два типа [57].Тип I — это малосуставной артрит, обычно поражающий менее пяти крупных (несущих нагрузку) суставов. Обычно это связано с активным заболеванием кишечника и имеет асимметричный характер; моноартрит не редкость. Поражаются крупные и мелкие суставы, преимущественно нижних конечностей (колени, голеностопные и плюснево-фаланговые суставы). Артрит бедер и плеч встречается реже и, как правило, ассоциируется со спондилитом и инфарктом миокарда. Артрит возникает на ранней стадии заболевания кишечника. Обычно оно мигрирующее и преходящее, но рецидивирующее, хотя и не приводит к деформациям суставов [58, 59].У пяти процентов пациентов с ВЗК развивается артропатия I типа. Симптомы со стороны суставов могут возникать до начала заболевания кишечника, особенно при БК. Это также может отсутствовать, хотя образцы илеоколоноскопической биопсии, взятые из терминального отдела подвздошной кишки, выявляют легкие или тяжелые воспалительные поражения, указывающие на наличие субклинической БК у этих пациентов [60]. Время первого приступа артрита, по-видимому, не зависит от продолжительности колита при ЯК. Кроме того, обострение кишечной симптоматики, главным образом при ЯК, часто сопровождается рецидивом периферического артрита.Сообщалось, что хирургическое удаление толстой кишки при ЯК оказывает лечебное действие на симптомы периферических суставов [60].
Периферический артрит I типа связан с аллелем класса II HLA-DRB1 * O103 [56]. Этот аллель обнаруживается у 35% пациентов с артритом типа I по сравнению с 3% в контрольной группе. Если обследовать пациентов с рецидивирующим артритом, эта связь обнаруживается у 65% [2].
Тип II — полиартрит, поражающий в основном мелкие суставы. Это редко предшествует диагностике ВЗК.Обычно он протекает независимо от заболевания кишечника. Пястно-фаланговые суставы часто поражаются, и дифференциация периферического артрита II типа и ревматоидного артрита важна и требует корреляции рентгенологических и иммунологических исследований. Примерно половина пациентов с ВЗК страдает мигрирующим артритом. Активный синовит может сохраняться в течение нескольких месяцев и может повторяться неоднократно. Эпизоды обострений и ремиссий могут продолжаться годами. Переход в хроническое состояние может происходить вместе с рентгенологическими эрозивными поражениями [61].Артропатия II типа поражает 3–4% пациентов с ВЗК. Периферический артрит II типа связан с HLA-B44 * у 62% пациентов по сравнению с 30% в контрольной группе [56]. Это также связано с увеитом, но не с другими внекишечными проявлениями.
Спондилит и SI
Спектр аксиального поражения варьируется от воспалительной боли в пояснице с рентгенологическими признаками SI или без них до бессимптомных SI и истинного AS, характеризующихся классическими клиническими (боль, скованность позвоночника) и рентгенологическими признаками [квадрат, синдесмофиты , бамбуковый корешок].Распространенность аксиального вовлечения у пациентов с ВЗК составляет от 5 до 12% [62], но эти проценты могут быть выше из-за наличия скрытого аксиального вовлечения [63], особенно в SI. Соотношение мужских и ревматологических проявлений у женщин с ВЗК составляет 3: 1, что сопоставимо с СА. Осевое поражение может предшествовать заболеванию кишечника на много лет. Основные жалобы — воспалительные боли в пояснице, боли в ягодицах и груди. Воспалительная боль в спине коварна в начале, обычно в возрасте до 45 лет, часто бывает односторонней и прерывистой в начале, более интенсивной в покое, связана с утренней скованностью, но облегчается при движении, усиливается при кашле или чихании и сопровождается утомляемостью.Боль сохраняется не менее 3 месяцев. Диагноз воспалительной боли в спине подтверждается, когда наступает улучшение после упражнений, пробуждения из-за боли и наличия чередующейся боли в ягодицах [64]. Боль в грудной клетке возникает в результате энтезита реберно-позвоночного, реберно-реберного, реберно-реберного суставов. Он усиливается при кашле и глубоком вдохе и ограничивает респираторное расширение эпизодами переменной продолжительности. Дактилит можно увидеть при АС. Он характеризуется воспалительным отеком одного или нескольких пальцев [колбасных пальцев] или пальцев ног, вызванного теносиновитом сухожилий сгибателей.Ограничение подвижности шейного отдела позвоночника — признак прогрессирования заболевания до генерализованного анкилоза. При воспалительной боли в спине рентгенологическая оценка крестцово-подвздошных суставов позволяет поставить диагноз SI [65]. В отсутствие рентгенологических данных оценка МРТ может привести к диагностике и, таким образом, к эффективному раннему лечению аксиального спондилоартрита [66]. Признаки отека кости при использовании методов T1 post-gadolinium и STIR (восстановление с инверсией короткого тау-белка) являются признаком активного воспаления в крестцово-подвздошных суставах и / или позвоночнике.Осевые и позвоночные симптомы не зависят от обострения воспаления кишечника. Точно так же хирургическое лечение ЯК или БК не влияет на связанный с ним спондилит. Следовательно, было высказано предположение, что периферический артрит является проявлением ВЗК, тогда как спондилит является ассоциированным заболеванием.
Энтезопатия
Энтезопатия — это патологическое изменение в энтезе (месте прикрепления сухожилия или связки к кости). Рентгенологически это проявляется окостенением энтезов.При ВЗК энтезопатии могут возникать на пятке (прикрепление ахиллова сухожилия или подошвенной фасции) или в колене (прикрепление сухожилия надколенника). Воспаление при энтезе может вызвать эрозивные поражения, которые могут привести к образованию шпор.
Остеопороз
Остеопороз — это тихое состояние, характеризующееся уменьшением костной массы и изменениями микроархитектуры, ведущими к повышенной хрупкости костей и склонности к переломам. Остеопороз является осложнением лечения кортикостероидами при ВЗК.
HOA
HOA — синдром, характеризующийся чрезмерным разрастанием кожи и костей в дистальных отделах конечностей. Его наиболее характерной особенностью является выпуклая деформация кончиков пальцев, обычно известная как булавовидная деформация. На поздних стадиях становится очевидным периостальное разрастание трубчатых костей и синовиальный выпот. UC и CD — две причины вторичной HOA. У пациентов с ВЗК развитие клубочков обычно является плохим прогностическим признаком.
Диагностика ревматологических проявлений ВЗК
Не существует патогномоничных находок, подтверждающих клиническое подозрение на артрит, вызванный ВЗК.Диагноз можно заподозрить в надлежащих клинических условиях. Результаты лабораторных исследований определяются активностью ВЗК. Анемия часто встречается при энтеропатическом СпА, что отражает как анемию, вызванную хроническим заболеванием, так и железодефицитную анемию из-за кровопотери со стороны желудочно-кишечного тракта. Лейкоцитоз, выраженный тромбоцитоз с количеством тромбоцитов выше 700 000 / мм 3 — не редкость. Скорость оседания эритроцитов и С-реактивный белок, а также другие реагенты острой фазы повышены. Ревматоидный фактор и антинуклеарные антитела у большинства пациентов отсутствуют.Синовиальная жидкость не характерна: можно обнаружить легкие или выраженные воспалительные изменения с лейкоцитами в диапазоне от 1500 до 50 000 / мм 3 . Уровень глюкозы не снижается. Микробиологические культуры отрицательны [63]. Биопсия синовиальной мембраны выявляет неспецифические аномалии, включая пролиферацию клеток синовиальной оболочки, повышенную васкуляризацию и инфильтрацию мононуклеарных клеток [67]. В случаях моноартрита или олигоартрита важно исключить септический артрит, выполняя совместную аспирацию, поскольку его проявления могут быть нетипичными у пациентов с ВЗК, получающих противовоспалительное или иммунодепрессивное лечение.
Рентгенологические данные
Рентгенограммы позвоночника и таза могут показать типичные результаты AS и SI. Последнее обычно двустороннее, хотя сообщалось о более высокой частоте асимметричного анкилоза SI и скулового сустава [68]. Поражение периферических суставов обычно не сопровождается рентгенологическими изменениями, но описаны эрозивные поражения в основном плюсневых суставов. Эти поражения показывают некоторые отличия от ревматоидных поражений, например, отсутствие остеопороза и наличие пролиферации соседних костей.Редко при БК может наблюдаться деструктивный гранулематозный синовит. Энтезопатии рентгенологически не отличаются от таковых, наблюдаемых при других СпА.
Дифференциальный диагноз
У пациентов с кишечными проявлениями и артритом диагноз ВЗК исключает другие заболевания со схожими симптомами: реактивный артрит (ранее — синдром Рейтера), болезнь Уиппла, болезнь Адамантиадеса-Бехчета, кишечное шунтирование, чувствительную к глютену энтеропатию и паразитарные инфекции. Первоначально необходимо распознать клинические признаки SpA и дифференцировать их от таковых при ревматоидном артрите и других заболеваниях соединительной ткани.IBD включается в дифференциальную диагностику SpA, даже если кишечные симптомы легкие. Наличие спондилита у пациента с отрицательным результатом HLA-B27 увеличивает риск ВЗК. Дифференциальный диагноз боли в суставах у пациента с ВЗК широк. Это включает в себя HOA [67], септический артрит (обычные или условно-патогенные инфекции), остеонекроз, особенно у пациентов, получавших глюкокортикоиды, и испытывающих боль, несоразмерную степени ограничения пассивного диапазона движений пораженного сустава.Узловатая эритема может быть трудно отличить от артрита, когда поражения возникают в околосуставной области. Невозможность аспирации синовиальной жидкости из опухшего и болезненного сустава является ключом к диагнозу.
Патогенез скелетно-мышечных проявлений ВЗК
HLA-B27 является основным фактором риска AS и SpA, связанных с IBD. У трансгенных крыс HLA-B27 развивается SpA. HLA-B27 присутствует у> 90% пациентов с AS, в то время как только от 5 до 15% населения в целом являются HLA-B27-положительными.Среди молекул HLA класса B, которые определяют антигенсвязывающую щель, HLA-B27 имеет уникальный B-карман, который, вероятно, влияет на репертуар пептидов. Подтипы HLA-B27 (их более 30) частично различаются только отдельными аминокислотами. Только несколько подтипов HLA-B27 (например, HLA-B * 2705, HLA-B * 2702 или HLA-B * 2704 и HLA-B * 2707) связаны с AS. Существует 4 основных теории патогенеза спондилоартритов, связанных с HLA-B27 (). Первая — это гипотеза артритогенного пептида. Согласно этому HLA-B27 связывает уникальный набор антигенных пептидов, бактериальных или собственных, и эти пептиды презентируются Т-клеткам CD8 + , вызывая ограниченный HLA-B27 цитотоксический Т-клеточный ответ.Вторая теория — это самоассоциация молекулы HLA-B27. Уникальным свойством HLA-B27 является то, что его тяжелая цепь может образовывать гомодимеры in vitro , которые зависят от связывания дисульфида через их остатки цистеина-67 в альфа-1 домене. Эти гомодимеры возникают в результате неправильной укладки B27 в эндоплазматическом ретикулуме. Накопление неправильно свернутого белка может привести к провоспалительной реакции внутриклеточного стресса. Альтернативно, гомодимеры B27 могут мигрировать на поверхность клетки, где они либо сами становятся антигенными, либо представляют пептид другим воспалительным клеткам.Третья теория относится к изменению внутриклеточного обращения с микробами из-за HLA-B27. Молекула HLA-B27 приводит к менее эффективному уничтожению микробов, таких как сальмонелла, в сочетании с повышенным уровнем выработки цитокинов. Четвертая гипотеза представляет признание HLA-B27 как аутоантигена. Сам HLA-B27 может распознаваться CD4 + Т-клетками, когда он представлен гетеродимерами HLA класса II (DR, DQ, DP) в качестве аутоантигена. Это также было частью гипотезы молекулярной мимикрии, которая подтверждает, что гомология пептидов из молекулы HLA-B27 имеет поразительную гомологию последовательностей с таковой из бактериальных источников [67].Однако генетические эффекты, не связанные с основным комплексом гистосовместимости, по-видимому, также оказывают значительное влияние на тяжесть заболевания [68–70].
Таблица 2
Основные теории о патогенезе SpA, связанного с HLA-B27
Связь между аксиальным поражением и HLAB27 у пациентов с ВЗК менее убедительна, потому что только 40-60% пациентов с CD и AS имеют положительную реакцию на HLA- B27. Измененная проницаемость кишечника может быть ключевым фактором в развитии SpA [71]. Кроме того, периферический артрит 1-го типа связан с HLA-DRB1 * 0103, B * 35 и B * 27 [72], тогда как при артропатии 2-го типа не наблюдались ассоциации с HLA-B27 или DR-4.Эти данные показывают, что артропатии 1-го и 2-го типов являются иммуногенетически разными и что тип 1 больше похож на таковой при осевом SpA. Помимо генетической предрасположенности, в патогенезе периферического артрита важную роль играют бактериальные антигены. Ряд бактериальных агентов, включая адгезивную, инвазивную E. coli и анаэробные палочки бактероидов и фузобактерий, вовлечены в этиопатогенез CD. Несколько исследований были сосредоточены на важной «оси кишечник-синовиальная оболочка» [73,74].Кроме того, у пациентов с БК была продемонстрирована перекрестная реактивность между кишечными бактериями и хрящами [75].
Роль CARD15 в процессе презентации кишечных бактерий антигенпрезентирующими клетками остается неясной. Белок CARD15 экспрессируется моноцитами, гранулоцитами, дендритными клетками и эпителиальными клетками. In vitro этот белок индуцирует активацию пути κB ядерного фактора (NF) после распознавания муррамилдипептида и может помочь защитить стенку кишечника.Генетическая мутация CARD15 может привести к нарушению обращения с бактериальными продуктами и, следовательно, к неадекватной элиминации. Производство цитокинов антигенпрезентирующими клетками играет решающую роль в управлении адаптивными иммунными ответами. Кроме того, взаимодействие между микроорганизмами и толл-подобными рецепторами (TLRS) на эпителиальных клетках слизистой оболочки, моноцитах, макрофагах и дендритных клетках индуцирует секрецию различных медиаторов, таких как цитокины, такие как фактор некроза опухоли (TNF) альфа и интерлейкин 6, путем активации NF-κB и запускает активацию лимфоцитов.Эффекторным Т-клеткам необходимо мигрировать с индуктивных сайтов на эффекторные. Активированные в кишечнике Т-клетки могут проникать в синовиальную оболочку либо через присутствие родственных антигенов в обоих участках, либо за счет хоминга лимфоцитов, инициированных молекулами адгезии [76,77]. Обнаружение идентичных разрастаний Т-клеток в слизистой оболочке толстой кишки, синовиальной оболочке. Ревматологические проявления при ВЗК и крови подтверждают эту гипотезу [78]. Таким образом, TLR находятся на перекрестке врожденного и адаптивного иммунитета, где микробная инвазия транслируется с неспецифических воспалительных реакций на антиген-специфические.
Лечение скелетно-мышечных проявлений ВЗК
Целями терапии скелетно-мышечных проявлений ВЗК являются уменьшение воспаления и предотвращение инвалидности или деформации. Отдых и физиотерапия используются как немедикаментозное лечение. У пациентов с истинным АС большое значение имеет физиотерапия для поддержания подвижности позвоночника и предотвращения деформаций позвоночника с последующим нарушением дыхания и инвалидностью. Следует отдавать предпочтение дыхательным упражнениям, упражнениям для позвоночника и плаванию.Нестероидные противовоспалительные препараты (НПВП) обычно назначают для контроля периферического артрита, болей в спине и скованности. Необходимо соблюдать осторожность, поскольку эти препараты могут обострить ВЗК, особенно ЯК [79, 80]. Побочные эффекты, связанные с НПВП, также могут имитировать вспышку ВЗК и усложнять лечение. Опыт применения селективных ингибиторов циклооксигеназы — 2 (Цокс-2) (таких как целекоксиб и рофекоксиб, последний больше не доступен) у пациентов с ВЗК ограничен. Известно, что активность Цокс-2 способствует разрастанию эпителия и заживлению ран.Теоретически ингибирование Цокс-2 могло иметь пагубные последствия у пациентов с ВЗК [81]. С другой стороны, селективные ингибиторы Цокс-2 уменьшают тяжесть экспериментального колита [82]. В плацебо-контролируемом исследовании использование целекоксиба у пациентов с ВЗК в течение двух недель не показало существенной разницы в частоте рецидивов ВЗК [83]. Другое исследование включало 45 пациентов с ВЗК с артралгиями, получавших рофекоксиб (12,5 мг / день) от трех дней до трех месяцев [84]. Об облегчении артралгии сообщили 71% пациентов (полное облегчение у 18% и частичное облегчение у 53%).Однако 20% пациентов с ВЗК — 9 пациентов — по сравнению с 3% контрольной группы (пациенты с диспезией) прекратили терапию из-за желудочно-кишечных симптомов, которые исчезли после прекращения лечения. Частота прекращения лечения была аналогичной для пациентов с CD или UC. Селективные агенты Цокс-2 могут лучше переноситься в краткосрочной перспективе, но отмена рофекоксиба и вальдекоксиба из-за сердечно-сосудистой токсичности вызывает опасения по поводу их общей пользы.
Несмотря на опасения по поводу способности НПВП и селективных агентов Цокс-2 вызывать обострение воспаления кишечника, ревматологи успешно использовали вышеуказанные препараты у пациентов с ВЗК.Однако, если симптомы или признаки ВЗК развиваются или ухудшаются во время использования НПВП или селективного лечения Цокс-2, целесообразно временно или навсегда прекратить их использование. Из доступных НПВП индометацин и напроксен использовались чаще, но противовоспалительные дозы любого НПВП или селективного агента Цокс-2 могут быть эффективными. Поскольку периферический артрит ВЗК обычно неразрушающий, терапия в первую очередь направлена на облегчение симптомов. НПВП или селективные агенты Цокс-2 уменьшают боль в спине и ригидность при АС, хотя на рентгенограммах может наблюдаться костный анкилоз.
Сульфасалазин, азатиоприн, 6-меркаптопурин, метотрексат и глюкокортикоиды могут быть полезны при воспалении как кишечника, так и суставов. Внутрисуставные инъекции глюкокортикоидов могут использоваться при обострениях периферического артрита. Сульфасалазин эффективен при лечении периферического, но не осевого артрита у пациентов с ВЗК. Начальная доза составляет 500 мг два раза в день с увеличением суточной дозы каждые две недели до исчезновения симптомов артрита или до достижения дозы 1000 мг три раза в день.Перед оценкой эффективности рекомендуется поддерживать максимальную дозу до 12 недель.
Азатиоприн и 6-меркаптопурин, применяемые при ВЗК, также могут оказывать благотворное влияние на заболевания суставов. Однако аминосалицилаты (например, месаламин), полезные для контроля воспаления кишечника, по-видимому, не оказывают прямого противовоспалительного действия на синовиальную оболочку [85].
Исследования, посвященные эффективности метотрексата при периферическом артрите ВЗК, отсутствуют. Многие ревматологи применяют метотрексат у пациентов с ВЗК и периферическим артритом, и метотрексат может быть предпочтительнее азатиоприна, но это эмпирический подход, не подкрепленный данными испытаний [56].Метотрексат при пероральном введении адекватно всасывается даже у пациентов с активной ВЗК. Подкожное введение препарата может уменьшить побочные эффекты со стороны желудочно-кишечного тракта.
Будесонид, глюкокортикоид с первым прохождением печеночного метаболизма и меньшим количеством системных побочных эффектов в результате, использовался при обострениях CD, но на сегодняшний день нет исследований, посвященных влиянию этого стероида на энтеропатический артрит.
Агенты против TNF оказали большое влияние на терапевтический подход к ВЗК и связанных с ним скелетно-мышечных проявлениях.Моноклональные антитела против TNF (инфликсимаб, адалимумаб) эффективны при ВЗК, особенно при БК, и они полезны для пациентов с осевым поражением и периферическим артритом [86–88]. Этанерцепт может контролировать артрит, связанный с CD, но не влияет на заболевание кишечника [89]. Пациенты с ВЗК и истинным AS, у которых наблюдается неадекватный ответ на обычное лечение, являются кандидатами на лечение анти-TNFα. Инфликсимаб, адалимумаб, этанерцепт и голимумаб (человеческие моноклональные антитела, 50 мг один раз в месяц подкожно) можно использовать у пациентов с АС, хотя голимумаб не был одобрен для лечения БК.
Цертолизумаб пегол представляет собой пегилированное гуманизированное антитело, Fab-фрагмент моноклонального антитела TNFα. Цертолизумаб связывается и избирательно нейтрализует активность человеческого TNFα. Поскольку это не полное антитело (без области Fc), оно не индуцирует активацию комплемента, антитело-зависимую клеточную цитотоксичность или апоптоз. Пегилирование цертолизумаба позволяет замедлить выведение и, следовательно, увеличить период полувыведения. Цертолизумаб пегол получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2008 году для лечения и поддержания ответа у взрослых с умеренной и тяжелой БК, у которых не было адекватного ответа на традиционную терапию.Препарат также одобрен в Швейцарии, но не был одобрен Европейским агентством по лекарственным средствам и поэтому не широко доступен в Европе. Рекомендуемая доза для индукции составляет 400 мг подкожно на 0, 2 и 4 неделе, а затем каждые четыре недели для поддержания ответа.
Исследования, оценивающие эффективность инфликсимаба, адалимумаба и цертолизумаба, в целом показали аналогичные результаты, но ни одно исследование не сравнивало их напрямую. Предварительные данные свидетельствуют о том, что цертолизумаб пегол может быть эффективным у пациентов, которые ответили на инфликсимаб и потеряли ответ или стали нетерпимыми к нему [90–92].Безопасность и меры предосторожности аналогичны всем агентам против TNFα. Все пациенты должны пройти кожную пробу на туберкулез до начала терапии анти-TNFα и должны быть обследованы на наличие скрытой инфекции.
Выводы
Ревматологические проявления ВЗК встречаются часто и могут присутствовать у одной трети пациентов.
Осевое поражение варьируется от воспалительной боли в пояснице до SI или истинного AS, хотя также могут возникать энтезопатии.
HLA-B27 связан с аксиальным поражением ВЗК.
Роль HLA-B27 в патогенезе осевого заболевания или АС при ВЗК подтверждается различными теориями.
Периферический артрит подразделяется на два типа. Тип I — это малосуставной, асимметричный обычно неразрушающий артрит, поражающий крупные суставы, и обычно он связан с активным заболеванием кишечника. Тип II — это полиартрит, поражающий мелкие суставы и, как правило, протекает независимо от течения заболевания кишечника.
Сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды используются для лечения ВЗК и суставных симптомов.
Антитела против TNFα эффективны у пациентов с резистентной или осложненной БК, а также при осевом и периферическом артрите.
Биография
•
Университет Янины, Янина, Греция
Сноски
Конфликт интересов: Нет
Ссылки
1. Рикарт Э., Паначчоне Р., Лофтус Э.В., мл. И др. Аутоиммунные расстройства и внекишечные проявления при семейных и спорадических воспалительных заболеваниях кишечника первой степени: исследование случай-контроль.Воспаление кишечника. 2004. 10: 207–214. [PubMed] [Google Scholar] 2. Гринштейн AJ, Яновиц HD, Sachar DB. Внекишечные осложнения болезни Крона и язвенного колита: исследование 700 пациентов. Медицина (Балтимор) 1976; 55: 401–412. [PubMed] [Google Scholar] 3. Бернштейн К.Н., Вайда А., Бланшар Дж. Ф. Объединение других хронических воспалительных заболеваний в воспалительное заболевание кишечника: популяционное исследование. Гастроэнтерология. 2005. 129: 827–836. [PubMed] [Google Scholar] 4. Bargen JA. Осложнения и последствия хронического язвенного колита.Ann Intern Med. 1929; 3: 335. [Google Scholar] 5. Хенч П.С. Острый и хронический артрит. В: Whipple GH, редактор. Бланк хирургии Нельсона I. Нью-Йорк: Томас Нельсон Сонс; 1935. с. 104. [Google Scholar] 6. Райт В. Серонегативный полиартрит: единое понятие. Ревматоидный артрит. 1978; 21: 619–633. [PubMed] [Google Scholar] 7. Ачесон, редактор. Связь между язвенным колитом, регионарным энтеритом и анкилозирующим спондилитом. Q J Med. 1960; 29: 489–499. [PubMed] [Google Scholar] 12. Ранкин Г.Б., Уоттс HD, Мельник С.С., Келли М.Л., Jr Национальное совместное исследование болезни Крона: внекишечные проявления и перианальные осложнения. Гастроэнтерология. 1979; 77: 914–920. [PubMed] [Google Scholar] 13. Münch H, Purrmann J, Reis HE, et al. Клинические особенности воспалительных проявлений суставов и позвоночника при болезни Крона. Гепатогастроэнтерология. 1986; 33: 123–127. [PubMed] [Google Scholar] 14. Деккер-Сейс Б.Дж., Меувиссен С.Г., Ван Ден Берг-Лунен Е.М., Де Хаас В.Х., Агенант Д., Титгат Г.Н. Анкилозирующий спондилит и воспалительное заболевание кишечника.II. Распространенность периферического артрита, сакроилеита и анкилозирующего спондилита у пациентов, страдающих воспалительным заболеванием кишечника. Ann Rheum Dis. 1978; 37: 33–35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Salvarani C, Fries W. Клинические особенности и эпидемиология спондилоартритов, связанных с воспалительным заболеванием кишечника. Мир Дж. Гастроэнтерол. 2009. 15: 2449–2455. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Дугадос М., ван дер Линден С., Юлин Р. и др. Предварительные критерии Европейской исследовательской группы по спондилоартропатии для классификации спондилоартропатии.Ревматоидный артрит. 1991; 34: 1218–1227. [PubMed] [Google Scholar] 17. Амор Б. [Очень ранняя диагностика фаз хондролиза при артрозе] Rev Rhum Mal Osteoartic. 1990; 57: 253–254. [PubMed] [Google Scholar] 18. Скарпа Р., дель Пуэнте А., Д’Ариенцо А. и др. Артрит язвенного колита: клинико-генетические аспекты. J Rheumatol. 1992; 19: 373–377. [PubMed] [Google Scholar] 19. Протцер У., Духманн Р., Хёлер Т. и др. [Энтеропатический спондилоартрит при хронических воспалительных заболеваниях кишечника: распространенность, характер проявления и ассоциация HLA] Мед Клин (Мюнхен) 1996; 91: 330–335.[PubMed] [Google Scholar] 20. Велосо Ф. Т., Карвалью Дж., Магро Ф. Системные проявления воспалительного заболевания кишечника, связанные с иммунитетом. Проспективное исследование 792 пациентов. J Clin Gastroenterol. 1996; 23: 29–34. [PubMed] [Google Scholar] 22. de Vlam K, Mielants H, Cuvelier C, De Keyser F, Veys EM, De Vos M. Спондилоартропатия недооценена при воспалительном заболевании кишечника: распространенность и ассоциация HLA. J Rheumatol. 2000. 27: 2860–2865. [PubMed] [Google Scholar] 23. Queiro R, Maiz O, Intxausti J, et al.Субклинический сакроилеит при воспалительном заболевании кишечника: клиническое и последующее исследование. Clin Rheumatol. 2000. 19: 445–449. [PubMed] [Google Scholar] 24. Christodoulou DK, Katsanos KH, Kitsanou M, Stergiopoulou C, Hatzis J, Tsianos EV. Частота внекишечных проявлений у пациентов с воспалительным заболеванием кишечника в Северо-Западной Греции и обзор литературы. Dig Liver Dis. 2002; 34: 781–786. [PubMed] [Google Scholar] 25. Palm Ø, Moum B, Jahnsen J, Gran JT. Распространенность и частота периферического артрита у пациентов с воспалительным заболеванием кишечника, проспективное популяционное исследование (исследование IBSEN) Rheumatology (Oxford) 2001; 40: 1256–1261.[PubMed] [Google Scholar] 26. Мендоса Дж. Л., Лана Р., Таксонера С., Альба С., Искьердо С., Диас-Рубио М. [Внекишечные проявления воспалительного заболевания кишечника: различия между болезнью Крона и язвенным колитом] Med Clin (Barc) 2005; 125: 297–300. [PubMed] [Google Scholar] 27. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 28. Родригес В.Е., Костас П.Дж., Васкес М. и др.Распространенность спондилоартропатии у пуэрториканских пациентов с воспалительным заболеванием кишечника. Ethn Dis. 2008. 18 (2 доп. 2): 225–229. [PubMed] [Google Scholar] 29. Lanna CC, Ferrari Mde L, Rocha SL, Nascimento E, de Carvalho MA, da Cunha AS. Поперечное исследование 130 бразильских пациентов с болезнью Крона и язвенным колитом: анализ суставных и офтальмологических проявлений. Clin Rheumatol. 2008. 27: 503–509. [PubMed] [Google Scholar] 30. Орчард Т.Р., Вордсворт Б.П., Джуэлл Д.П. Периферические артропатии при воспалительных заболеваниях кишечника: их суставное распределение и естественное течение.Кишечник. 1998. 42: 387–391. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Salvarani C, Vlachonikolis IG, van der Heijde DM, et al. Скелетно-мышечные проявления в популяции пациентов с воспалительными заболеваниями кишечника. Сканд Дж Гастроэнтерол. 2001; 36: 1307–1313. [PubMed] [Google Scholar] 32. Türkçapar N, Ozyüncü N, Idilman R, Ensari A, Soylu K, Ozden A. Макроамилаземия у пациента с селективным дефицитом IgA и антифосфолипидными антителами. Turk J Gastroenterol. 2006. 17: 140–143. [PubMed] [Google Scholar] 33.Mielants H, Veys EM, Cuvelier C, De Vos M, Botelberghe L. Артрит и воспаление кишечника, связанные с HLA-B27. Часть 2. Илеоколоноскопия и гистология кишечника у пациентов с HLA-B27 артритом. J Rheumatol. 1985; 12: 294–298. [PubMed] [Google Scholar] 34. Veloso FT, Fraga J, Saleiro СП. Макроглобулинемия и заболевание тонкого кишечника. Отчет о болезни с обзором литературы. J Clin Gastroenterol. 1988. 10: 546–550. [PubMed] [Google Scholar] 35. Миеланц Х., Вейс Э.М. Кишечник при спондилоартропатиях.J Rheumatol. 1990; 17: 7–10. [PubMed] [Google Scholar] 36. Стир С., Джонс Х., Хибберт Дж. И др. Боль в пояснице, сакроилеит и связь с HLA-B27 при болезни Крона. J Rheumatol. 2003. 30: 518–522. [PubMed] [Google Scholar] 37. Podswiadek M, Punzi L, Stramare R, et al. Распространенность рентгенологического сакроилеита у пациентов с воспалительным заболеванием кишечника с воспалительной болью в пояснице. Ревматизм. 2004. 56: 110–113. [PubMed] [Google Scholar] 38. Миелантс Х. Размышления о связи между кишечной проницаемостью и воспалительными заболеваниями суставов.Clin Exp Rheumatol. 1990; 8: 523–524. [PubMed] [Google Scholar] 39. Скотт В.В., мл., Фишман Е.К., Кульман Дж. Э. и др. Компьютерная томография крестцово-подвздошных суставов при болезни Крона. Радиологическая / клиническая корреляция. Skeletal Radiol. 1990; 19: 207–210. [PubMed] [Google Scholar] 40. Нгуен Г.К., Торрес Э.А., Регейро М. и др. Характеристики воспалительного заболевания кишечника у афроамериканцев, выходцев из Латинской Америки и белых неиспаноязычных: характеристика большой когорты в Северной Америке. Am J Gastroenterol. 2006; 101: 1012–1023.[PubMed] [Google Scholar] 41. Басу Д., Лопес И., Кулкарни А., Селлин Дж. Х. Влияние расы и этнической принадлежности на воспалительные заболевания кишечника. Am J Gastroenterol. 2005; 100: 2254–2261. [PubMed] [Google Scholar] 42. Махид С.С., Малхолл А.М., Голсон Р.Д., Эйхенбергер М.Р., Галандюк С. Воспалительное заболевание кишечника и афроамериканцы: систематический обзор. Воспаление кишечника. 2008; 14: 960–967. [PubMed] [Google Scholar] 43. Репизо А, Алькантара М., Муньос-Росас С. и др. Внекишечные проявления болезни Крона: распространенность и сопутствующие факторы.Rev Esp Enferm Dig. 2006; 98: 510–517. [PubMed] [Google Scholar] 44. Дорофеев А.Е., Василенко И.В., Рассохина О.А. Совместные внекишечные проявления при язвенном колите. Dig Dis. 2009. 27: 502–510. [PubMed] [Google Scholar] 45. Де Вос М. Обзорная статья: поражение суставов воспалительным заболеванием кишечника. Алимент Pharmacol Ther. 2004; 20: 36–42. [PubMed] [Google Scholar] 46. Ротфус К.С., Штанге Э.Ф., Херрлингер К.Р. Внекишечные проявления и осложнения при воспалительных заболеваниях кишечника. Мир Дж. Гастроэнтерол.2006; 12: 4819–4831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Данезе С., Семераро С., Папа А. и др. Внекишечные проявления при воспалительном заболевании кишечника. Мир Дж. Гастроэнтерол. 2005; 11: 7227–7236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Маэда К., Окада М., Яо Т. и др. Кишечные и внекишечные осложнения болезни Крона: предикторы и совокупная вероятность осложнений. J Gastroenterol. 1994; 29: 577–582. [PubMed] [Google Scholar] 49. Триантафиллидис Дж. К., Эммануилидис А., Манусос О., Николакис Д., Кожевинас М.Клинические модели болезни Крона в Греции: последующее исследование 155 случаев. Пищеварение. 2000. 61: 121–128. [PubMed] [Google Scholar] 50. Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. Распространенность внекишечных заболеваний при воспалительном заболевании кишечника: популяционное исследование. Am J Gastroenterol. 2001; 96: 1116–1122. [PubMed] [Google Scholar] 51. Соуза М.Х., Тронкон Л.Е., Родригес С.М. и др. Тенденции возникновения (1980–1999 годы) и клинических особенностей болезни Крона и язвенного колита в университетской больнице на юго-востоке Бразилии.Арк Гастроэнтерол. 2002; 39: 98–105. [PubMed] [Google Scholar] 52. Аль-Шамали М.А., Калауи М., Патти И., Хасан Ф., Хаджа А., Аль-Накиб Язвенный колит в Кувейте: обзор 90 случаев. Пищеварение. 2003. 67: 218–224. [PubMed] [Google Scholar] 53. Эконому М., Филис Дж., Циану З. и др. Эволюция заболеваемости болезнью Крона в северо-западной Греции не связана с изменением вариантов NOD2 / CARD15. Мир Дж. Гастроэнтерол. 2007. 13: 5116–5120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Peeters H, Vander Cruyssen B, Laukens D, et al.Радиологический сакроилеит, признак спондилита, связан с полиморфизмом гена CARD15 у пациентов с болезнью Крона. Ann Rheum Dis. 2004; 63: 1131–1134. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 56. Уильямс Х., Уокер Д., Орчард ТР. Внекишечные проявления воспалительного заболевания кишечника.Curr Gastroenterol Rep. 2008; 10: 597–605. [PubMed] [Google Scholar] 57. Трэвис С.П., Штанге Э.Ф., Леманн М. и др. Европейский консенсус, основанный на фактических данных, по диагностике и лечению болезни Крона: текущее лечение. Кишечник. 2006; 55 (Приложение 1): i16 – i35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Вордсворт П. Артрит и воспалительное заболевание кишечника. Curr Rheumatol Rep. 2000; 2: 87–88. [PubMed] [Google Scholar] 59. Фомберштейн Б., Йерра Н., Пичумони К.С. Ревматологические осложнения желудочно-кишечных расстройств. Am J Gastroenterol.1996. 91: 1090–1103. [PubMed] [Google Scholar] 60. Клиппель Дж. Х., Дьеп, Р. А.. 2-е издание. Мосби: Лондон; 1998. Ревматология; С. 6.24.1–6.24.3. [Google Scholar] 61. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 62. Moll JM. Воспалительное заболевание кишечника. Clin Rheum Dis. 1985; 11: 87–111. [PubMed] [Google Scholar] 63. Leirisalo-Repo M, Turunen U, Stenman S, Helenius P, Seppälä K. Высокая частота тихих воспалительных заболеваний кишечника при спондилоартропатии.Ревматоидный артрит. 1994; 37: 23–31. [PubMed] [Google Scholar] 64. Rudwaleit M, Metter A, Listing J, Sieper J, Braun J. Воспалительная боль в спине при анкилозирующем спондилите: переоценка истории болезни для применения в качестве критериев классификации и диагностики. Ревматоидный артрит. 2006. 54: 569–578. [PubMed] [Google Scholar] 65. Беннетт PH. Wood PHN популяционные исследования ревматических заболеваний Амстердам. Excerpta Medical Fountation. 1968: 456–457. [Google Scholar] 66. Браун Дж., Сипер Дж. Ранняя диагностика спондилоартрита.Nat Clin Pract Rheumatol. 2006; 2: 536–545. [PubMed] [Google Scholar] 67. Клиппель Дж. Х., Стоун Дж. Х., Кроффорд Л. Дж., Уайт РН. 13-е издание. Нью-Йорк: Спрингер; 2008. Букварь по ревматическим заболеваниям; С. 204–205. [Google Scholar] 68. Хамерсма Дж., Кардон Л. Р., Брэдбери Л. и др. Определена ли тяжесть болезни при анкилозирующем спондилите генетически? Ревматоидный артрит. 2001; 44: 1396–1400. [PubMed] [Google Scholar] 69. Браун М.А. Генетика анкилозирующего спондилита, не связанная с комплексом мажорной гистосовместимости. Лучшая практика Res Clin Rheumatol.2006. 20: 611–621. [PubMed] [Google Scholar] 70. Браун М.А., Брофи С., Брэдбери Л. и др. Выявление основных локусов, контролирующих клинические проявления анкилозирующего спондилита. Ревматоидный артрит. 2003. 48: 2234–2239. [PubMed] [Google Scholar] 71. Fornaciari G, Salvarani C, Beltrami M, Macchioni P, Stockbrügger RW, Russel MG. Скелетно-мышечные проявления при воспалительном заболевании кишечника. Можно J Гастроэнтерол. 2001; 15: 399–403. [PubMed] [Google Scholar] 72. Орчард Т.Р., Тиягараджа С., Валлийский К.И., Вордсворт Б.П., Хилл Гастон Д.С., Джуэлл Д.П.Клинический фенотип связан с генотипом HLA при периферических артропатиях воспалительного заболевания кишечника. Гастроэнтерология. 2000. 118: 274–278. [PubMed] [Google Scholar] 73. Кувелье CA, Quatacker J, Mielants H, De Vos M, Veys E, Roels HJ. М-клетки повреждаются и их количество увеличивается в воспаленной слизистой оболочке подвздошной кишки человека. Гистопатология. 1994; 24: 417–426. [PubMed] [Google Scholar] 74. Salmi M, Andrew DP, Butcher EC, Jalkanen S. Двойная связывающая способность иммунобластов слизистой оболочки со слизистой оболочкой и синовиальным эндотелием у людей: анализ молекулярных механизмов.J Exp Med. 1995. 181: 137–149. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Ван ден Брук MF, Ван де Путте LB, Ван ден Берг WB. Болезнь Крона, связанная с артритом: возможная роль перекрестной реактивности между кишечными бактериями и хрящом в патогенезе артрита. Ревматоидный артрит. 1988; 31: 1077–1079. [PubMed] [Google Scholar] 76. Эльваут Д., Де Кейзер Ф., Ван ден Бош Ф. и др. Обогащение Т-лимфоцитов, несущих интегрины бета7, в воспаленной синовиальной ткани пациентов с ранней спондилоартропатией по сравнению с ревматоидным артритом.J Rheumatol. 1998; 25: 1932–1937. [PubMed] [Google Scholar] 77. Салми М., Ялканен С. Субпопуляции лейкоцитов человека из воспаленного кишечника связываются с сосудистой сетью суставов с использованием различных наборов молекул адгезии. J Immunol. 2001; 166: 4650–4657. [PubMed] [Google Scholar] 78. May E, Märker-Hermann E, Wittig BM, Zeitz M, Meyer zum Büschenfelde KH, Duchmann R. Идентичные разрастания Т-клеток в слизистой оболочке толстой кишки и синовиальной оболочке пациента с энтерогенной спондилоартропатией. Гастроэнтерология. 2000; 119: 1745–1755. [PubMed] [Google Scholar] 79.Кауфман Х. Л., Фишер А. Х., Кэрролл М., Беккер Дж. М.. Язвы толстой кишки, связанные с приемом нестероидных противовоспалительных препаратов. Отчет о трех случаях. Dis Colon Rectum. 1996; 39: 705–710. [PubMed] [Google Scholar] 80. Кауфманн Х.Дж., Таубин Х.Л. Нестероидные противовоспалительные препараты активируют вялое воспалительное заболевание кишечника. Ann Intern Med. 1987; 107: 513–516. [PubMed] [Google Scholar] 81. О’Брайен Дж. Нестероидные противовоспалительные препараты у пациентов с воспалительным заболеванием кишечника. Am J Gastroenterol. 2000; 95: 1859–1861.[PubMed] [Google Scholar] 82. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 83. Сандборн В.Дж., Стенсон В.Ф., Брынсков Дж. И др. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin Gastroenterol Hepatol. 2006; 4: 203–211. [PubMed] [Google Scholar] 84. Biancone L, Tosti C, Geremia A и др. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое исследование.Алимент Pharmacol Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 85. Де Кейзер Ф., Ван Дамм Н., Де Вос М., Миелантс Х., Вейс Э.М. Возможности иммунной модуляции при спондилоартропатиях с особым упором на воспаление кишечника. Inflamm Res. 2000; 49: 47–54. [PubMed] [Google Scholar] 86. Ван ден Бош Ф., Круитхоф Э., Де Вос М., Де Кейзер Ф., Миелантс Х. Болезнь Крона, связанная со спондилоартропатией: влияние блокады ФНО-альфа инфликсимабом на суставные симптомы. Ланцет. 2000; 356: 1821–1822.[PubMed] [Google Scholar] 87. Дженерини С., Джакомелли Р., Феди Р. и др. Инфликсимаб при спондилоартропатии, связанной с болезнью Крона: открытое исследование эффективности индукции и поддержания ремиссии скелетно-мышечных и кишечных проявлений. Ann Rheum Dis. 2004. 63: 1664–1669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 88. Риспо А., Скарпа Р., Ди Джироламо Э. и др. Инфликсимаб в лечении внекишечных проявлений болезни Крона. Scand J Rheumatol. 2005; 34: 387–391. [PubMed] [Google Scholar] 89.Марцо-Ортега Х, МакГонагл Д., О’Коннор П., Эмери П. Эффективность этанерцепта для лечения спондилоартрита, связанного с Кроном, но не колита. Ann Rheum Dis. 2003. 62: 74–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Ханауэр С.Б., Панес Дж., Полковник Дж. Ф., Блумфилд Р., Шрайбер С., Сандборн В. Дж.. Клинические испытания: влияние предшествующей терапии инфликсимабом на клинический ответ на поддерживающую терапию цертолизумабом пеголом при болезни Крона. Алимент Pharmacol Ther. 2010. 32: 384–393. [PubMed] [Google Scholar] 91.Сандборн В.Дж., Абреу М.Т., Д’Хаенс Дж. И др. Цертолизумаб пегол у пациентов с болезнью Крона от умеренной до тяжелой степени и вторичной неэффективностью инфликсимаба. Clin Gastroenterol Hepatol. 2010. 8: 688–695. [PubMed] [Google Scholar] 92. Аллез М., Вермейр С., Моззиконачи Н. и др. Эффективность и безопасность третьего моноклонального антитела против TNF при болезни Крона после неэффективности двух других антител против TNF. Алимент Pharmacol Ther. 2010; 31: 92–101. [PubMed] [Google Scholar]Ревматологические проявления при воспалительном заболевании кишечника
Энн Гастроэнтерол.2011; 24 (3): 173–180.
Параскеви В. Вулгари
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Янины, Янина, Греция
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Иоаннины, Иоаннина, Греция
Для корреспонденции: Параскеви В. Вулгари, доктор медицины, доцент кафедры ревматологии, клиника ревматологии, кафедра внутренней медицины, медицинский факультет, Университет Янины, 45110, Янина, Греция; тел: +302651007503; факс: +302651007054; электронная почта: rg.iou.cc@ragluovpПоступило 15.04.2011; Принято 3 июня 2011 г.
Авторские права: © Греческое общество гастроэнтерологовЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Ревматологические проявления воспалительного заболевания кишечника (ВЗК) являются частыми и включают периферический артрит, поражение оси и периферический энтезит.Также могут возникать вторичный остеопороз и гипертрофическая остеоартропатия. Осложнения ВЗК (например, септический артрит) следует отличать от стерильного воспаления. Побочные эффекты лечения кортикостероидами, такие как остеонекроз, также могут влиять на суставы. Осевое поражение варьируется от боли в пояснице до истинного анкилозирующего спондилита. Человеческий лейкоцитарный антиген B27 связан с аксиальным поражением ВЗК. Периферический артрит подразделяется на два типа. Тип I — это малосуставной асимметричный обычно неразрушающий артрит, поражающий крупные суставы и обычно связанный с активным заболеванием кишечника.Тип II — это полиартрит, поражающий мелкие суставы, и имеет тенденцию протекать независимо от заболевания кишечника. Лечение суставных симптомов при ВЗК включает сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды. Антитела против фактора некроза опухоли эффективны при лечении резистентной или осложненной болезни Крона, а также периферического артрита и аксиального поражения.
Ключевые слова: периферический артрит, сакроилеит, энтезит, осевое поражение
Введение
Идиопатические воспалительные заболевания кишечника (ВЗК), болезнь Крона (БК) и язвенный колит (ЯК) являются системными заболеваниями, которые могут осложняться внекишечными заболеваниями. проявления у 40% пациентов, в зависимости от исследуемой популяции и используемых определений [1-3].Ревматологические проявления ВЗК являются частыми и включают периферический артрит, поражение оси, периферический энтезит, вторичный остеопороз и вторичную гипертрофическую остеоартропатию (HOA) (). Осложнения ВЗК также могут вызывать боль в суставах, и их следует отличать от стерильного воспаления. Бактериальная инфекция крестцово-подвздошных или периферических суставов может возникнуть из-за свищей или бактериемии. Побочные эффекты лечения ВЗК могут также влиять на суставы, такие как остеонекроз из-за использования кортикостероидов.ВЗК может быть связана с рецидивирующим полихондритом и кожным васкулитом. Связь между кишечником и артритом была постулирована в 1929 году Баргеном, который признал артрит осложнением ЯК [4]. Хенч в 1935 году описал периферический артрит у пациентов с ВЗК и наблюдал тенденцию артрита к обострению при обострении колита и к исчезновению с ремиссией кишечных симптомов [5]. Введение Райтом и Моллом концепции спондилоартропатий (SpA) привело к дальнейшему изучению взаимосвязи между артритом и воспалением кишечника [6].ВЗК относится к SpA, имея общие черты с другими членами этого семейства расстройств, такие как асимметричный паттерн поражения периферических суставов, возникновение сакроилеита (SI) и спондилита, периферическая энтезопатия, отсутствие ревматоидного фактора, связь с человеческим заболеванием. лейкоцитарный антиген (HLA) B27, а также внесуставные особенности, включая увеит, кардит, поражения кожи и слизистых оболочек.
Таблица 1
Ревматологические проявления при ВЗК
Эпидемиологические особенности и генетические маркеры ревматологических проявлений при ВЗК
Распространенность ЯК колеблется от 50 до 100 на 100 000 населения.Заболевание чаще встречается у белых. Распространенность CD увеличилась за последние несколько десятилетий примерно до 75 на 100 000 населения. Ранние эпидемиологические исследования ассоциированных с ВЗК артропатий в 1960-х, 70-х и 80-х годах включали пациентов с классическим анкилозирующим спондилитом (AS) или SI вместе с периферическим артритом [7-15]. По данным этих исследований, АС присутствовал у 2-16% пациентов, в основном при БК. Бессимптомный и симптоматический СИ был обнаружен у 12-20% пациентов, а периферический артрит — у 11-20%.Связь с HLA-B27 колебалась от 3,9 до 18,9%. Исследования популяций ВЗК с использованием критериев Европейской группы исследования спондилоартропатии [16] или диагностических критериев Амора для спондилоартропатии [17] показали различные результаты [18–32]. В частности, AS варьировала от 1 до 45,1%, SI от 1,9 до 45,7%, периферический артрит от 2,8 до 30,6% и энтезопатия от 5,4 до 50% пациентов. В большинстве этих исследований сообщалось об аналогичных результатах при БК и ЯК при периферическом и осевом поражении. Кроме того, большинство исследований согласились с тем, что язвенный проктит редко осложняется воспалением суставов и что воспалительное заболевание суставов чаще встречается у пациентов с БК с колитом или с более обширным заболеванием кишечника по сравнению с пациентами с поражением подвздошной кишки.Кроме того, у некоторых пациентов развивается одно или несколько проявлений СпА (например, энтезит и / или дактилит) без выполнения критериев классификации.
Артрит или аксиальные симптомы могут предшествовать желудочно-кишечным симптомам на длительные периоды времени, и пациентов можно рассматривать как недифференцированную спондилоартопатию до тех пор, пока не проявит себя ВЗК. Исследование Mielants и Veys предоставило доказательства того, что пациенты с недифференцированным SpA и даже AS могут иметь субклиническое воспаление кишечника, которое играет важную роль в запуске и сохранении воспаления суставов [33].В последующем 20-летнем исследовании пациентов с ВЗК были выявлены особенности опорно-двигательного аппарата у 30% [34]. HLA-B27-положительные пациенты с CD имеют высокую вероятность прогрессирования до откровенного АС. И наоборот, частота истинного IBD (UC или CD) при AS составляет менее 4%. Однако, если учесть возникновение субклинического воспаления кишечника, распространенность поражения кишечника в группе пациентов со СпА возрастает до 60% [35].
Другие исследования, направленные на выяснение частоты симптоматического или бессимптомного SI.Steer et al. Обнаружили при компьютерной томографии (КТ) признаки СИ у 31/134 пациентов с БК [36]. В другом исследовании, проведенном с участием 50 пациентов с БК с симптомами боли в спине, 28% соответствовали модифицированным Нью-Йоркским критериям СА при рентгенологическом исследовании [37]. С другой стороны, бессимптомный СИ может присутствовать у 10–50% пациентов с ВЗК [38]. В сравнительном исследовании с использованием обычного рентгена и КТ результаты, совместимые с СИ, были обнаружены у 29% пациентов с БК, и только у 3% были симптомы [39]. Магнитно-резонансная томография (МРТ) — наиболее чувствительный метод выявления СИ у пациентов с ВЗК.В литературе также есть исследования, описывающие скелетно-мышечные симптомы у пациентов с ВЗК, без использования точных диагностических критериев для СпА, связанной с ВЗК. Таким образом, сообщалось о расовых различиях в распространенности внекишечных, в том числе ревматологических, проявлений. Большое исследование показало, что у афроамериканцев с ВЗК чаще развиваются увеит и инфаркт миокарда [40]. Другое исследование описало повышенную заболеваемость артритом и увеитом у афроамериканских пациентов с CD [41], хотя в литературе приводятся другие результаты [42].Кроме того, исследователи из Испании сообщили о внекишечных проявлениях почти у половины (46%) из 157 пациентов с БК, в то время как у 22% были обнаружены ревматологические симптомы, которые чаще наблюдались у пациентов с заболеванием, ограниченным толстой кишкой [43]. Исследование, проведенное в Украине, показало, что 29,8% из 319 пациентов с ЯК имели суставные проявления. Артрит коррелировал с обширными формами ЯК и чаще встречался у пациентов с левосторонним ЯК и панколитом. Артралгия была превалирующим симптомом у пациентов с дистальным ЯК [44].Совместное вовлечение в ЯК колеблется от 20 до 35% в других исследованиях [45-47]. Исследование, проведенное в Японии, показало, что 10,3% пациентов с БК страдают артритом и 1,5% — спондилитом [48]. В греческой когорте пациентов с БК 30% страдали артритом / артралгиями [49]. Другое исследование, проведенное в Канаде, сообщило о 4% распространенности АС у госпитализированных пациентов с ВЗК, при этом пациенты мужского пола с БК поражались чаще, чем пациенты мужского пола с ЯК [50]. Однако в бразильском исследовании распространенность составила 14,4% без разницы между БК и ЯК [51].Наконец, исследование, проведенное в Кувейте, сообщило об артрите у 8,9% пациентов с ЯК, в то время как общая распространенность ревматологических жалоб составила 31% [52].
Такие расовые различия в распространенности ревматологических проявлений могут быть объяснены как иммунологическими, так и генетическими факторами. Периферический артрит, возникающий при ВЗК, не связан с HLA-B27. SI и особенно спондилит, однако, связаны с HLA-B27 [40% и 60% соответственно], но в меньшей степени, чем при неосложненном AS [90%].CD был связан с мутацией в гене NOD2 [CARD15] на хромосоме 16 [53]. Это представляет интерес для патогенеза CD, поскольку NOD2 играет важную роль в врожденном иммунитете к патогенам и косвенно участвует в микробных триггерах IBD. На сегодняшний день исследования не обнаружили значимой связи между CARD15 и SpA. Однако мутации CARD15 могут чаще обнаруживаться среди пациентов с БК, осложненной СИ [54], хотя это не было подтверждено в более поздних исследованиях [55].
Клинические особенности ревматологических проявлений ВЗК
Артрит
Суставные осложнения являются наиболее частыми внекишечными проявлениями [56].Артрит чаще встречается у пациентов с заболеванием толстой кишки и у пациентов с такими осложнениями, как абсцессы, псевдомембранозный полипоз, перианальное заболевание, массивное кровотечение, а также у пациентов с узловатой эритемой, стоматитом, увеитом и гангренозной пиодермией. Кроме того, пациенты с БК и поражением толстой кишки имеют более высокий риск развития синовита, чем пациенты с изолированным заболеванием тонкой кишки. В равной степени страдают мужчины и женщины. Периферический артрит подразделяется на два типа [57].Тип I — это малосуставной артрит, обычно поражающий менее пяти крупных (несущих нагрузку) суставов. Обычно это связано с активным заболеванием кишечника и имеет асимметричный характер; моноартрит не редкость. Поражаются крупные и мелкие суставы, преимущественно нижних конечностей (колени, голеностопные и плюснево-фаланговые суставы). Артрит бедер и плеч встречается реже и, как правило, ассоциируется со спондилитом и инфарктом миокарда. Артрит возникает на ранней стадии заболевания кишечника. Обычно оно мигрирующее и преходящее, но рецидивирующее, хотя и не приводит к деформациям суставов [58, 59].У пяти процентов пациентов с ВЗК развивается артропатия I типа. Симптомы со стороны суставов могут возникать до начала заболевания кишечника, особенно при БК. Это также может отсутствовать, хотя образцы илеоколоноскопической биопсии, взятые из терминального отдела подвздошной кишки, выявляют легкие или тяжелые воспалительные поражения, указывающие на наличие субклинической БК у этих пациентов [60]. Время первого приступа артрита, по-видимому, не зависит от продолжительности колита при ЯК. Кроме того, обострение кишечной симптоматики, главным образом при ЯК, часто сопровождается рецидивом периферического артрита.Сообщалось, что хирургическое удаление толстой кишки при ЯК оказывает лечебное действие на симптомы периферических суставов [60].
Периферический артрит I типа связан с аллелем класса II HLA-DRB1 * O103 [56]. Этот аллель обнаруживается у 35% пациентов с артритом типа I по сравнению с 3% в контрольной группе. Если обследовать пациентов с рецидивирующим артритом, эта связь обнаруживается у 65% [2].
Тип II — полиартрит, поражающий в основном мелкие суставы. Это редко предшествует диагностике ВЗК.Обычно он протекает независимо от заболевания кишечника. Пястно-фаланговые суставы часто поражаются, и дифференциация периферического артрита II типа и ревматоидного артрита важна и требует корреляции рентгенологических и иммунологических исследований. Примерно половина пациентов с ВЗК страдает мигрирующим артритом. Активный синовит может сохраняться в течение нескольких месяцев и может повторяться неоднократно. Эпизоды обострений и ремиссий могут продолжаться годами. Переход в хроническое состояние может происходить вместе с рентгенологическими эрозивными поражениями [61].Артропатия II типа поражает 3–4% пациентов с ВЗК. Периферический артрит II типа связан с HLA-B44 * у 62% пациентов по сравнению с 30% в контрольной группе [56]. Это также связано с увеитом, но не с другими внекишечными проявлениями.
Спондилит и SI
Спектр аксиального поражения варьируется от воспалительной боли в пояснице с рентгенологическими признаками SI или без них до бессимптомных SI и истинного AS, характеризующихся классическими клиническими (боль, скованность позвоночника) и рентгенологическими признаками [квадрат, синдесмофиты , бамбуковый корешок].Распространенность аксиального вовлечения у пациентов с ВЗК составляет от 5 до 12% [62], но эти проценты могут быть выше из-за наличия скрытого аксиального вовлечения [63], особенно в SI. Соотношение мужских и ревматологических проявлений у женщин с ВЗК составляет 3: 1, что сопоставимо с СА. Осевое поражение может предшествовать заболеванию кишечника на много лет. Основные жалобы — воспалительные боли в пояснице, боли в ягодицах и груди. Воспалительная боль в спине коварна в начале, обычно в возрасте до 45 лет, часто бывает односторонней и прерывистой в начале, более интенсивной в покое, связана с утренней скованностью, но облегчается при движении, усиливается при кашле или чихании и сопровождается утомляемостью.Боль сохраняется не менее 3 месяцев. Диагноз воспалительной боли в спине подтверждается, когда наступает улучшение после упражнений, пробуждения из-за боли и наличия чередующейся боли в ягодицах [64]. Боль в грудной клетке возникает в результате энтезита реберно-позвоночного, реберно-реберного, реберно-реберного суставов. Он усиливается при кашле и глубоком вдохе и ограничивает респираторное расширение эпизодами переменной продолжительности. Дактилит можно увидеть при АС. Он характеризуется воспалительным отеком одного или нескольких пальцев [колбасных пальцев] или пальцев ног, вызванного теносиновитом сухожилий сгибателей.Ограничение подвижности шейного отдела позвоночника — признак прогрессирования заболевания до генерализованного анкилоза. При воспалительной боли в спине рентгенологическая оценка крестцово-подвздошных суставов позволяет поставить диагноз SI [65]. В отсутствие рентгенологических данных оценка МРТ может привести к диагностике и, таким образом, к эффективному раннему лечению аксиального спондилоартрита [66]. Признаки отека кости при использовании методов T1 post-gadolinium и STIR (восстановление с инверсией короткого тау-белка) являются признаком активного воспаления в крестцово-подвздошных суставах и / или позвоночнике.Осевые и позвоночные симптомы не зависят от обострения воспаления кишечника. Точно так же хирургическое лечение ЯК или БК не влияет на связанный с ним спондилит. Следовательно, было высказано предположение, что периферический артрит является проявлением ВЗК, тогда как спондилит является ассоциированным заболеванием.
Энтезопатия
Энтезопатия — это патологическое изменение в энтезе (месте прикрепления сухожилия или связки к кости). Рентгенологически это проявляется окостенением энтезов.При ВЗК энтезопатии могут возникать на пятке (прикрепление ахиллова сухожилия или подошвенной фасции) или в колене (прикрепление сухожилия надколенника). Воспаление при энтезе может вызвать эрозивные поражения, которые могут привести к образованию шпор.
Остеопороз
Остеопороз — это тихое состояние, характеризующееся уменьшением костной массы и изменениями микроархитектуры, ведущими к повышенной хрупкости костей и склонности к переломам. Остеопороз является осложнением лечения кортикостероидами при ВЗК.
HOA
HOA — синдром, характеризующийся чрезмерным разрастанием кожи и костей в дистальных отделах конечностей. Его наиболее характерной особенностью является выпуклая деформация кончиков пальцев, обычно известная как булавовидная деформация. На поздних стадиях становится очевидным периостальное разрастание трубчатых костей и синовиальный выпот. UC и CD — две причины вторичной HOA. У пациентов с ВЗК развитие клубочков обычно является плохим прогностическим признаком.
Диагностика ревматологических проявлений ВЗК
Не существует патогномоничных находок, подтверждающих клиническое подозрение на артрит, вызванный ВЗК.Диагноз можно заподозрить в надлежащих клинических условиях. Результаты лабораторных исследований определяются активностью ВЗК. Анемия часто встречается при энтеропатическом СпА, что отражает как анемию, вызванную хроническим заболеванием, так и железодефицитную анемию из-за кровопотери со стороны желудочно-кишечного тракта. Лейкоцитоз, выраженный тромбоцитоз с количеством тромбоцитов выше 700 000 / мм 3 — не редкость. Скорость оседания эритроцитов и С-реактивный белок, а также другие реагенты острой фазы повышены. Ревматоидный фактор и антинуклеарные антитела у большинства пациентов отсутствуют.Синовиальная жидкость не характерна: можно обнаружить легкие или выраженные воспалительные изменения с лейкоцитами в диапазоне от 1500 до 50 000 / мм 3 . Уровень глюкозы не снижается. Микробиологические культуры отрицательны [63]. Биопсия синовиальной мембраны выявляет неспецифические аномалии, включая пролиферацию клеток синовиальной оболочки, повышенную васкуляризацию и инфильтрацию мононуклеарных клеток [67]. В случаях моноартрита или олигоартрита важно исключить септический артрит, выполняя совместную аспирацию, поскольку его проявления могут быть нетипичными у пациентов с ВЗК, получающих противовоспалительное или иммунодепрессивное лечение.
Рентгенологические данные
Рентгенограммы позвоночника и таза могут показать типичные результаты AS и SI. Последнее обычно двустороннее, хотя сообщалось о более высокой частоте асимметричного анкилоза SI и скулового сустава [68]. Поражение периферических суставов обычно не сопровождается рентгенологическими изменениями, но описаны эрозивные поражения в основном плюсневых суставов. Эти поражения показывают некоторые отличия от ревматоидных поражений, например, отсутствие остеопороза и наличие пролиферации соседних костей.Редко при БК может наблюдаться деструктивный гранулематозный синовит. Энтезопатии рентгенологически не отличаются от таковых, наблюдаемых при других СпА.
Дифференциальный диагноз
У пациентов с кишечными проявлениями и артритом диагноз ВЗК исключает другие заболевания со схожими симптомами: реактивный артрит (ранее — синдром Рейтера), болезнь Уиппла, болезнь Адамантиадеса-Бехчета, кишечное шунтирование, чувствительную к глютену энтеропатию и паразитарные инфекции. Первоначально необходимо распознать клинические признаки SpA и дифференцировать их от таковых при ревматоидном артрите и других заболеваниях соединительной ткани.IBD включается в дифференциальную диагностику SpA, даже если кишечные симптомы легкие. Наличие спондилита у пациента с отрицательным результатом HLA-B27 увеличивает риск ВЗК. Дифференциальный диагноз боли в суставах у пациента с ВЗК широк. Это включает в себя HOA [67], септический артрит (обычные или условно-патогенные инфекции), остеонекроз, особенно у пациентов, получавших глюкокортикоиды, и испытывающих боль, несоразмерную степени ограничения пассивного диапазона движений пораженного сустава.Узловатая эритема может быть трудно отличить от артрита, когда поражения возникают в околосуставной области. Невозможность аспирации синовиальной жидкости из опухшего и болезненного сустава является ключом к диагнозу.
Патогенез скелетно-мышечных проявлений ВЗК
HLA-B27 является основным фактором риска AS и SpA, связанных с IBD. У трансгенных крыс HLA-B27 развивается SpA. HLA-B27 присутствует у> 90% пациентов с AS, в то время как только от 5 до 15% населения в целом являются HLA-B27-положительными.Среди молекул HLA класса B, которые определяют антигенсвязывающую щель, HLA-B27 имеет уникальный B-карман, который, вероятно, влияет на репертуар пептидов. Подтипы HLA-B27 (их более 30) частично различаются только отдельными аминокислотами. Только несколько подтипов HLA-B27 (например, HLA-B * 2705, HLA-B * 2702 или HLA-B * 2704 и HLA-B * 2707) связаны с AS. Существует 4 основных теории патогенеза спондилоартритов, связанных с HLA-B27 (). Первая — это гипотеза артритогенного пептида. Согласно этому HLA-B27 связывает уникальный набор антигенных пептидов, бактериальных или собственных, и эти пептиды презентируются Т-клеткам CD8 + , вызывая ограниченный HLA-B27 цитотоксический Т-клеточный ответ.Вторая теория — это самоассоциация молекулы HLA-B27. Уникальным свойством HLA-B27 является то, что его тяжелая цепь может образовывать гомодимеры in vitro , которые зависят от связывания дисульфида через их остатки цистеина-67 в альфа-1 домене. Эти гомодимеры возникают в результате неправильной укладки B27 в эндоплазматическом ретикулуме. Накопление неправильно свернутого белка может привести к провоспалительной реакции внутриклеточного стресса. Альтернативно, гомодимеры B27 могут мигрировать на поверхность клетки, где они либо сами становятся антигенными, либо представляют пептид другим воспалительным клеткам.Третья теория относится к изменению внутриклеточного обращения с микробами из-за HLA-B27. Молекула HLA-B27 приводит к менее эффективному уничтожению микробов, таких как сальмонелла, в сочетании с повышенным уровнем выработки цитокинов. Четвертая гипотеза представляет признание HLA-B27 как аутоантигена. Сам HLA-B27 может распознаваться CD4 + Т-клетками, когда он представлен гетеродимерами HLA класса II (DR, DQ, DP) в качестве аутоантигена. Это также было частью гипотезы молекулярной мимикрии, которая подтверждает, что гомология пептидов из молекулы HLA-B27 имеет поразительную гомологию последовательностей с таковой из бактериальных источников [67].Однако генетические эффекты, не связанные с основным комплексом гистосовместимости, по-видимому, также оказывают значительное влияние на тяжесть заболевания [68–70].
Таблица 2
Основные теории о патогенезе SpA, связанного с HLA-B27
Связь между аксиальным поражением и HLAB27 у пациентов с ВЗК менее убедительна, потому что только 40-60% пациентов с CD и AS имеют положительную реакцию на HLA- B27. Измененная проницаемость кишечника может быть ключевым фактором в развитии SpA [71]. Кроме того, периферический артрит 1-го типа связан с HLA-DRB1 * 0103, B * 35 и B * 27 [72], тогда как при артропатии 2-го типа не наблюдались ассоциации с HLA-B27 или DR-4.Эти данные показывают, что артропатии 1-го и 2-го типов являются иммуногенетически разными и что тип 1 больше похож на таковой при осевом SpA. Помимо генетической предрасположенности, в патогенезе периферического артрита важную роль играют бактериальные антигены. Ряд бактериальных агентов, включая адгезивную, инвазивную E. coli и анаэробные палочки бактероидов и фузобактерий, вовлечены в этиопатогенез CD. Несколько исследований были сосредоточены на важной «оси кишечник-синовиальная оболочка» [73,74].Кроме того, у пациентов с БК была продемонстрирована перекрестная реактивность между кишечными бактериями и хрящами [75].
Роль CARD15 в процессе презентации кишечных бактерий антигенпрезентирующими клетками остается неясной. Белок CARD15 экспрессируется моноцитами, гранулоцитами, дендритными клетками и эпителиальными клетками. In vitro этот белок индуцирует активацию пути κB ядерного фактора (NF) после распознавания муррамилдипептида и может помочь защитить стенку кишечника.Генетическая мутация CARD15 может привести к нарушению обращения с бактериальными продуктами и, следовательно, к неадекватной элиминации. Производство цитокинов антигенпрезентирующими клетками играет решающую роль в управлении адаптивными иммунными ответами. Кроме того, взаимодействие между микроорганизмами и толл-подобными рецепторами (TLRS) на эпителиальных клетках слизистой оболочки, моноцитах, макрофагах и дендритных клетках индуцирует секрецию различных медиаторов, таких как цитокины, такие как фактор некроза опухоли (TNF) альфа и интерлейкин 6, путем активации NF-κB и запускает активацию лимфоцитов.Эффекторным Т-клеткам необходимо мигрировать с индуктивных сайтов на эффекторные. Активированные в кишечнике Т-клетки могут проникать в синовиальную оболочку либо через присутствие родственных антигенов в обоих участках, либо за счет хоминга лимфоцитов, инициированных молекулами адгезии [76,77]. Обнаружение идентичных разрастаний Т-клеток в слизистой оболочке толстой кишки, синовиальной оболочке. Ревматологические проявления при ВЗК и крови подтверждают эту гипотезу [78]. Таким образом, TLR находятся на перекрестке врожденного и адаптивного иммунитета, где микробная инвазия транслируется с неспецифических воспалительных реакций на антиген-специфические.
Лечение скелетно-мышечных проявлений ВЗК
Целями терапии скелетно-мышечных проявлений ВЗК являются уменьшение воспаления и предотвращение инвалидности или деформации. Отдых и физиотерапия используются как немедикаментозное лечение. У пациентов с истинным АС большое значение имеет физиотерапия для поддержания подвижности позвоночника и предотвращения деформаций позвоночника с последующим нарушением дыхания и инвалидностью. Следует отдавать предпочтение дыхательным упражнениям, упражнениям для позвоночника и плаванию.Нестероидные противовоспалительные препараты (НПВП) обычно назначают для контроля периферического артрита, болей в спине и скованности. Необходимо соблюдать осторожность, поскольку эти препараты могут обострить ВЗК, особенно ЯК [79, 80]. Побочные эффекты, связанные с НПВП, также могут имитировать вспышку ВЗК и усложнять лечение. Опыт применения селективных ингибиторов циклооксигеназы — 2 (Цокс-2) (таких как целекоксиб и рофекоксиб, последний больше не доступен) у пациентов с ВЗК ограничен. Известно, что активность Цокс-2 способствует разрастанию эпителия и заживлению ран.Теоретически ингибирование Цокс-2 могло иметь пагубные последствия у пациентов с ВЗК [81]. С другой стороны, селективные ингибиторы Цокс-2 уменьшают тяжесть экспериментального колита [82]. В плацебо-контролируемом исследовании использование целекоксиба у пациентов с ВЗК в течение двух недель не показало существенной разницы в частоте рецидивов ВЗК [83]. Другое исследование включало 45 пациентов с ВЗК с артралгиями, получавших рофекоксиб (12,5 мг / день) от трех дней до трех месяцев [84]. Об облегчении артралгии сообщили 71% пациентов (полное облегчение у 18% и частичное облегчение у 53%).Однако 20% пациентов с ВЗК — 9 пациентов — по сравнению с 3% контрольной группы (пациенты с диспезией) прекратили терапию из-за желудочно-кишечных симптомов, которые исчезли после прекращения лечения. Частота прекращения лечения была аналогичной для пациентов с CD или UC. Селективные агенты Цокс-2 могут лучше переноситься в краткосрочной перспективе, но отмена рофекоксиба и вальдекоксиба из-за сердечно-сосудистой токсичности вызывает опасения по поводу их общей пользы.
Несмотря на опасения по поводу способности НПВП и селективных агентов Цокс-2 вызывать обострение воспаления кишечника, ревматологи успешно использовали вышеуказанные препараты у пациентов с ВЗК.Однако, если симптомы или признаки ВЗК развиваются или ухудшаются во время использования НПВП или селективного лечения Цокс-2, целесообразно временно или навсегда прекратить их использование. Из доступных НПВП индометацин и напроксен использовались чаще, но противовоспалительные дозы любого НПВП или селективного агента Цокс-2 могут быть эффективными. Поскольку периферический артрит ВЗК обычно неразрушающий, терапия в первую очередь направлена на облегчение симптомов. НПВП или селективные агенты Цокс-2 уменьшают боль в спине и ригидность при АС, хотя на рентгенограммах может наблюдаться костный анкилоз.
Сульфасалазин, азатиоприн, 6-меркаптопурин, метотрексат и глюкокортикоиды могут быть полезны при воспалении как кишечника, так и суставов. Внутрисуставные инъекции глюкокортикоидов могут использоваться при обострениях периферического артрита. Сульфасалазин эффективен при лечении периферического, но не осевого артрита у пациентов с ВЗК. Начальная доза составляет 500 мг два раза в день с увеличением суточной дозы каждые две недели до исчезновения симптомов артрита или до достижения дозы 1000 мг три раза в день.Перед оценкой эффективности рекомендуется поддерживать максимальную дозу до 12 недель.
Азатиоприн и 6-меркаптопурин, применяемые при ВЗК, также могут оказывать благотворное влияние на заболевания суставов. Однако аминосалицилаты (например, месаламин), полезные для контроля воспаления кишечника, по-видимому, не оказывают прямого противовоспалительного действия на синовиальную оболочку [85].
Исследования, посвященные эффективности метотрексата при периферическом артрите ВЗК, отсутствуют. Многие ревматологи применяют метотрексат у пациентов с ВЗК и периферическим артритом, и метотрексат может быть предпочтительнее азатиоприна, но это эмпирический подход, не подкрепленный данными испытаний [56].Метотрексат при пероральном введении адекватно всасывается даже у пациентов с активной ВЗК. Подкожное введение препарата может уменьшить побочные эффекты со стороны желудочно-кишечного тракта.
Будесонид, глюкокортикоид с первым прохождением печеночного метаболизма и меньшим количеством системных побочных эффектов в результате, использовался при обострениях CD, но на сегодняшний день нет исследований, посвященных влиянию этого стероида на энтеропатический артрит.
Агенты против TNF оказали большое влияние на терапевтический подход к ВЗК и связанных с ним скелетно-мышечных проявлениях.Моноклональные антитела против TNF (инфликсимаб, адалимумаб) эффективны при ВЗК, особенно при БК, и они полезны для пациентов с осевым поражением и периферическим артритом [86–88]. Этанерцепт может контролировать артрит, связанный с CD, но не влияет на заболевание кишечника [89]. Пациенты с ВЗК и истинным AS, у которых наблюдается неадекватный ответ на обычное лечение, являются кандидатами на лечение анти-TNFα. Инфликсимаб, адалимумаб, этанерцепт и голимумаб (человеческие моноклональные антитела, 50 мг один раз в месяц подкожно) можно использовать у пациентов с АС, хотя голимумаб не был одобрен для лечения БК.
Цертолизумаб пегол представляет собой пегилированное гуманизированное антитело, Fab-фрагмент моноклонального антитела TNFα. Цертолизумаб связывается и избирательно нейтрализует активность человеческого TNFα. Поскольку это не полное антитело (без области Fc), оно не индуцирует активацию комплемента, антитело-зависимую клеточную цитотоксичность или апоптоз. Пегилирование цертолизумаба позволяет замедлить выведение и, следовательно, увеличить период полувыведения. Цертолизумаб пегол получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2008 году для лечения и поддержания ответа у взрослых с умеренной и тяжелой БК, у которых не было адекватного ответа на традиционную терапию.Препарат также одобрен в Швейцарии, но не был одобрен Европейским агентством по лекарственным средствам и поэтому не широко доступен в Европе. Рекомендуемая доза для индукции составляет 400 мг подкожно на 0, 2 и 4 неделе, а затем каждые четыре недели для поддержания ответа.
Исследования, оценивающие эффективность инфликсимаба, адалимумаба и цертолизумаба, в целом показали аналогичные результаты, но ни одно исследование не сравнивало их напрямую. Предварительные данные свидетельствуют о том, что цертолизумаб пегол может быть эффективным у пациентов, которые ответили на инфликсимаб и потеряли ответ или стали нетерпимыми к нему [90–92].Безопасность и меры предосторожности аналогичны всем агентам против TNFα. Все пациенты должны пройти кожную пробу на туберкулез до начала терапии анти-TNFα и должны быть обследованы на наличие скрытой инфекции.
Выводы
Ревматологические проявления ВЗК встречаются часто и могут присутствовать у одной трети пациентов.
Осевое поражение варьируется от воспалительной боли в пояснице до SI или истинного AS, хотя также могут возникать энтезопатии.
HLA-B27 связан с аксиальным поражением ВЗК.
Роль HLA-B27 в патогенезе осевого заболевания или АС при ВЗК подтверждается различными теориями.
Периферический артрит подразделяется на два типа. Тип I — это малосуставной, асимметричный обычно неразрушающий артрит, поражающий крупные суставы, и обычно он связан с активным заболеванием кишечника. Тип II — это полиартрит, поражающий мелкие суставы и, как правило, протекает независимо от течения заболевания кишечника.
Сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды используются для лечения ВЗК и суставных симптомов.
Антитела против TNFα эффективны у пациентов с резистентной или осложненной БК, а также при осевом и периферическом артрите.
Биография
•
Университет Янины, Янина, Греция
Сноски
Конфликт интересов: Нет
Ссылки
1. Рикарт Э., Паначчоне Р., Лофтус Э.В., мл. И др. Аутоиммунные расстройства и внекишечные проявления при семейных и спорадических воспалительных заболеваниях кишечника первой степени: исследование случай-контроль.Воспаление кишечника. 2004. 10: 207–214. [PubMed] [Google Scholar] 2. Гринштейн AJ, Яновиц HD, Sachar DB. Внекишечные осложнения болезни Крона и язвенного колита: исследование 700 пациентов. Медицина (Балтимор) 1976; 55: 401–412. [PubMed] [Google Scholar] 3. Бернштейн К.Н., Вайда А., Бланшар Дж. Ф. Объединение других хронических воспалительных заболеваний в воспалительное заболевание кишечника: популяционное исследование. Гастроэнтерология. 2005. 129: 827–836. [PubMed] [Google Scholar] 4. Bargen JA. Осложнения и последствия хронического язвенного колита.Ann Intern Med. 1929; 3: 335. [Google Scholar] 5. Хенч П.С. Острый и хронический артрит. В: Whipple GH, редактор. Бланк хирургии Нельсона I. Нью-Йорк: Томас Нельсон Сонс; 1935. с. 104. [Google Scholar] 6. Райт В. Серонегативный полиартрит: единое понятие. Ревматоидный артрит. 1978; 21: 619–633. [PubMed] [Google Scholar] 7. Ачесон, редактор. Связь между язвенным колитом, регионарным энтеритом и анкилозирующим спондилитом. Q J Med. 1960; 29: 489–499. [PubMed] [Google Scholar] 12. Ранкин Г.Б., Уоттс HD, Мельник С.С., Келли М.Л., Jr Национальное совместное исследование болезни Крона: внекишечные проявления и перианальные осложнения. Гастроэнтерология. 1979; 77: 914–920. [PubMed] [Google Scholar] 13. Münch H, Purrmann J, Reis HE, et al. Клинические особенности воспалительных проявлений суставов и позвоночника при болезни Крона. Гепатогастроэнтерология. 1986; 33: 123–127. [PubMed] [Google Scholar] 14. Деккер-Сейс Б.Дж., Меувиссен С.Г., Ван Ден Берг-Лунен Е.М., Де Хаас В.Х., Агенант Д., Титгат Г.Н. Анкилозирующий спондилит и воспалительное заболевание кишечника.II. Распространенность периферического артрита, сакроилеита и анкилозирующего спондилита у пациентов, страдающих воспалительным заболеванием кишечника. Ann Rheum Dis. 1978; 37: 33–35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Salvarani C, Fries W. Клинические особенности и эпидемиология спондилоартритов, связанных с воспалительным заболеванием кишечника. Мир Дж. Гастроэнтерол. 2009. 15: 2449–2455. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Дугадос М., ван дер Линден С., Юлин Р. и др. Предварительные критерии Европейской исследовательской группы по спондилоартропатии для классификации спондилоартропатии.Ревматоидный артрит. 1991; 34: 1218–1227. [PubMed] [Google Scholar] 17. Амор Б. [Очень ранняя диагностика фаз хондролиза при артрозе] Rev Rhum Mal Osteoartic. 1990; 57: 253–254. [PubMed] [Google Scholar] 18. Скарпа Р., дель Пуэнте А., Д’Ариенцо А. и др. Артрит язвенного колита: клинико-генетические аспекты. J Rheumatol. 1992; 19: 373–377. [PubMed] [Google Scholar] 19. Протцер У., Духманн Р., Хёлер Т. и др. [Энтеропатический спондилоартрит при хронических воспалительных заболеваниях кишечника: распространенность, характер проявления и ассоциация HLA] Мед Клин (Мюнхен) 1996; 91: 330–335.[PubMed] [Google Scholar] 20. Велосо Ф. Т., Карвалью Дж., Магро Ф. Системные проявления воспалительного заболевания кишечника, связанные с иммунитетом. Проспективное исследование 792 пациентов. J Clin Gastroenterol. 1996; 23: 29–34. [PubMed] [Google Scholar] 22. de Vlam K, Mielants H, Cuvelier C, De Keyser F, Veys EM, De Vos M. Спондилоартропатия недооценена при воспалительном заболевании кишечника: распространенность и ассоциация HLA. J Rheumatol. 2000. 27: 2860–2865. [PubMed] [Google Scholar] 23. Queiro R, Maiz O, Intxausti J, et al.Субклинический сакроилеит при воспалительном заболевании кишечника: клиническое и последующее исследование. Clin Rheumatol. 2000. 19: 445–449. [PubMed] [Google Scholar] 24. Christodoulou DK, Katsanos KH, Kitsanou M, Stergiopoulou C, Hatzis J, Tsianos EV. Частота внекишечных проявлений у пациентов с воспалительным заболеванием кишечника в Северо-Западной Греции и обзор литературы. Dig Liver Dis. 2002; 34: 781–786. [PubMed] [Google Scholar] 25. Palm Ø, Moum B, Jahnsen J, Gran JT. Распространенность и частота периферического артрита у пациентов с воспалительным заболеванием кишечника, проспективное популяционное исследование (исследование IBSEN) Rheumatology (Oxford) 2001; 40: 1256–1261.[PubMed] [Google Scholar] 26. Мендоса Дж. Л., Лана Р., Таксонера С., Альба С., Искьердо С., Диас-Рубио М. [Внекишечные проявления воспалительного заболевания кишечника: различия между болезнью Крона и язвенным колитом] Med Clin (Barc) 2005; 125: 297–300. [PubMed] [Google Scholar] 27. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 28. Родригес В.Е., Костас П.Дж., Васкес М. и др.Распространенность спондилоартропатии у пуэрториканских пациентов с воспалительным заболеванием кишечника. Ethn Dis. 2008. 18 (2 доп. 2): 225–229. [PubMed] [Google Scholar] 29. Lanna CC, Ferrari Mde L, Rocha SL, Nascimento E, de Carvalho MA, da Cunha AS. Поперечное исследование 130 бразильских пациентов с болезнью Крона и язвенным колитом: анализ суставных и офтальмологических проявлений. Clin Rheumatol. 2008. 27: 503–509. [PubMed] [Google Scholar] 30. Орчард Т.Р., Вордсворт Б.П., Джуэлл Д.П. Периферические артропатии при воспалительных заболеваниях кишечника: их суставное распределение и естественное течение.Кишечник. 1998. 42: 387–391. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Salvarani C, Vlachonikolis IG, van der Heijde DM, et al. Скелетно-мышечные проявления в популяции пациентов с воспалительными заболеваниями кишечника. Сканд Дж Гастроэнтерол. 2001; 36: 1307–1313. [PubMed] [Google Scholar] 32. Türkçapar N, Ozyüncü N, Idilman R, Ensari A, Soylu K, Ozden A. Макроамилаземия у пациента с селективным дефицитом IgA и антифосфолипидными антителами. Turk J Gastroenterol. 2006. 17: 140–143. [PubMed] [Google Scholar] 33.Mielants H, Veys EM, Cuvelier C, De Vos M, Botelberghe L. Артрит и воспаление кишечника, связанные с HLA-B27. Часть 2. Илеоколоноскопия и гистология кишечника у пациентов с HLA-B27 артритом. J Rheumatol. 1985; 12: 294–298. [PubMed] [Google Scholar] 34. Veloso FT, Fraga J, Saleiro СП. Макроглобулинемия и заболевание тонкого кишечника. Отчет о болезни с обзором литературы. J Clin Gastroenterol. 1988. 10: 546–550. [PubMed] [Google Scholar] 35. Миеланц Х., Вейс Э.М. Кишечник при спондилоартропатиях.J Rheumatol. 1990; 17: 7–10. [PubMed] [Google Scholar] 36. Стир С., Джонс Х., Хибберт Дж. И др. Боль в пояснице, сакроилеит и связь с HLA-B27 при болезни Крона. J Rheumatol. 2003. 30: 518–522. [PubMed] [Google Scholar] 37. Podswiadek M, Punzi L, Stramare R, et al. Распространенность рентгенологического сакроилеита у пациентов с воспалительным заболеванием кишечника с воспалительной болью в пояснице. Ревматизм. 2004. 56: 110–113. [PubMed] [Google Scholar] 38. Миелантс Х. Размышления о связи между кишечной проницаемостью и воспалительными заболеваниями суставов.Clin Exp Rheumatol. 1990; 8: 523–524. [PubMed] [Google Scholar] 39. Скотт В.В., мл., Фишман Е.К., Кульман Дж. Э. и др. Компьютерная томография крестцово-подвздошных суставов при болезни Крона. Радиологическая / клиническая корреляция. Skeletal Radiol. 1990; 19: 207–210. [PubMed] [Google Scholar] 40. Нгуен Г.К., Торрес Э.А., Регейро М. и др. Характеристики воспалительного заболевания кишечника у афроамериканцев, выходцев из Латинской Америки и белых неиспаноязычных: характеристика большой когорты в Северной Америке. Am J Gastroenterol. 2006; 101: 1012–1023.[PubMed] [Google Scholar] 41. Басу Д., Лопес И., Кулкарни А., Селлин Дж. Х. Влияние расы и этнической принадлежности на воспалительные заболевания кишечника. Am J Gastroenterol. 2005; 100: 2254–2261. [PubMed] [Google Scholar] 42. Махид С.С., Малхолл А.М., Голсон Р.Д., Эйхенбергер М.Р., Галандюк С. Воспалительное заболевание кишечника и афроамериканцы: систематический обзор. Воспаление кишечника. 2008; 14: 960–967. [PubMed] [Google Scholar] 43. Репизо А, Алькантара М., Муньос-Росас С. и др. Внекишечные проявления болезни Крона: распространенность и сопутствующие факторы.Rev Esp Enferm Dig. 2006; 98: 510–517. [PubMed] [Google Scholar] 44. Дорофеев А.Е., Василенко И.В., Рассохина О.А. Совместные внекишечные проявления при язвенном колите. Dig Dis. 2009. 27: 502–510. [PubMed] [Google Scholar] 45. Де Вос М. Обзорная статья: поражение суставов воспалительным заболеванием кишечника. Алимент Pharmacol Ther. 2004; 20: 36–42. [PubMed] [Google Scholar] 46. Ротфус К.С., Штанге Э.Ф., Херрлингер К.Р. Внекишечные проявления и осложнения при воспалительных заболеваниях кишечника. Мир Дж. Гастроэнтерол.2006; 12: 4819–4831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Данезе С., Семераро С., Папа А. и др. Внекишечные проявления при воспалительном заболевании кишечника. Мир Дж. Гастроэнтерол. 2005; 11: 7227–7236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Маэда К., Окада М., Яо Т. и др. Кишечные и внекишечные осложнения болезни Крона: предикторы и совокупная вероятность осложнений. J Gastroenterol. 1994; 29: 577–582. [PubMed] [Google Scholar] 49. Триантафиллидис Дж. К., Эммануилидис А., Манусос О., Николакис Д., Кожевинас М.Клинические модели болезни Крона в Греции: последующее исследование 155 случаев. Пищеварение. 2000. 61: 121–128. [PubMed] [Google Scholar] 50. Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. Распространенность внекишечных заболеваний при воспалительном заболевании кишечника: популяционное исследование. Am J Gastroenterol. 2001; 96: 1116–1122. [PubMed] [Google Scholar] 51. Соуза М.Х., Тронкон Л.Е., Родригес С.М. и др. Тенденции возникновения (1980–1999 годы) и клинических особенностей болезни Крона и язвенного колита в университетской больнице на юго-востоке Бразилии.Арк Гастроэнтерол. 2002; 39: 98–105. [PubMed] [Google Scholar] 52. Аль-Шамали М.А., Калауи М., Патти И., Хасан Ф., Хаджа А., Аль-Накиб Язвенный колит в Кувейте: обзор 90 случаев. Пищеварение. 2003. 67: 218–224. [PubMed] [Google Scholar] 53. Эконому М., Филис Дж., Циану З. и др. Эволюция заболеваемости болезнью Крона в северо-западной Греции не связана с изменением вариантов NOD2 / CARD15. Мир Дж. Гастроэнтерол. 2007. 13: 5116–5120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Peeters H, Vander Cruyssen B, Laukens D, et al.Радиологический сакроилеит, признак спондилита, связан с полиморфизмом гена CARD15 у пациентов с болезнью Крона. Ann Rheum Dis. 2004; 63: 1131–1134. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 56. Уильямс Х., Уокер Д., Орчард ТР. Внекишечные проявления воспалительного заболевания кишечника.Curr Gastroenterol Rep. 2008; 10: 597–605. [PubMed] [Google Scholar] 57. Трэвис С.П., Штанге Э.Ф., Леманн М. и др. Европейский консенсус, основанный на фактических данных, по диагностике и лечению болезни Крона: текущее лечение. Кишечник. 2006; 55 (Приложение 1): i16 – i35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Вордсворт П. Артрит и воспалительное заболевание кишечника. Curr Rheumatol Rep. 2000; 2: 87–88. [PubMed] [Google Scholar] 59. Фомберштейн Б., Йерра Н., Пичумони К.С. Ревматологические осложнения желудочно-кишечных расстройств. Am J Gastroenterol.1996. 91: 1090–1103. [PubMed] [Google Scholar] 60. Клиппель Дж. Х., Дьеп, Р. А.. 2-е издание. Мосби: Лондон; 1998. Ревматология; С. 6.24.1–6.24.3. [Google Scholar] 61. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 62. Moll JM. Воспалительное заболевание кишечника. Clin Rheum Dis. 1985; 11: 87–111. [PubMed] [Google Scholar] 63. Leirisalo-Repo M, Turunen U, Stenman S, Helenius P, Seppälä K. Высокая частота тихих воспалительных заболеваний кишечника при спондилоартропатии.Ревматоидный артрит. 1994; 37: 23–31. [PubMed] [Google Scholar] 64. Rudwaleit M, Metter A, Listing J, Sieper J, Braun J. Воспалительная боль в спине при анкилозирующем спондилите: переоценка истории болезни для применения в качестве критериев классификации и диагностики. Ревматоидный артрит. 2006. 54: 569–578. [PubMed] [Google Scholar] 65. Беннетт PH. Wood PHN популяционные исследования ревматических заболеваний Амстердам. Excerpta Medical Fountation. 1968: 456–457. [Google Scholar] 66. Браун Дж., Сипер Дж. Ранняя диагностика спондилоартрита.Nat Clin Pract Rheumatol. 2006; 2: 536–545. [PubMed] [Google Scholar] 67. Клиппель Дж. Х., Стоун Дж. Х., Кроффорд Л. Дж., Уайт РН. 13-е издание. Нью-Йорк: Спрингер; 2008. Букварь по ревматическим заболеваниям; С. 204–205. [Google Scholar] 68. Хамерсма Дж., Кардон Л. Р., Брэдбери Л. и др. Определена ли тяжесть болезни при анкилозирующем спондилите генетически? Ревматоидный артрит. 2001; 44: 1396–1400. [PubMed] [Google Scholar] 69. Браун М.А. Генетика анкилозирующего спондилита, не связанная с комплексом мажорной гистосовместимости. Лучшая практика Res Clin Rheumatol.2006. 20: 611–621. [PubMed] [Google Scholar] 70. Браун М.А., Брофи С., Брэдбери Л. и др. Выявление основных локусов, контролирующих клинические проявления анкилозирующего спондилита. Ревматоидный артрит. 2003. 48: 2234–2239. [PubMed] [Google Scholar] 71. Fornaciari G, Salvarani C, Beltrami M, Macchioni P, Stockbrügger RW, Russel MG. Скелетно-мышечные проявления при воспалительном заболевании кишечника. Можно J Гастроэнтерол. 2001; 15: 399–403. [PubMed] [Google Scholar] 72. Орчард Т.Р., Тиягараджа С., Валлийский К.И., Вордсворт Б.П., Хилл Гастон Д.С., Джуэлл Д.П.Клинический фенотип связан с генотипом HLA при периферических артропатиях воспалительного заболевания кишечника. Гастроэнтерология. 2000. 118: 274–278. [PubMed] [Google Scholar] 73. Кувелье CA, Quatacker J, Mielants H, De Vos M, Veys E, Roels HJ. М-клетки повреждаются и их количество увеличивается в воспаленной слизистой оболочке подвздошной кишки человека. Гистопатология. 1994; 24: 417–426. [PubMed] [Google Scholar] 74. Salmi M, Andrew DP, Butcher EC, Jalkanen S. Двойная связывающая способность иммунобластов слизистой оболочки со слизистой оболочкой и синовиальным эндотелием у людей: анализ молекулярных механизмов.J Exp Med. 1995. 181: 137–149. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Ван ден Брук MF, Ван де Путте LB, Ван ден Берг WB. Болезнь Крона, связанная с артритом: возможная роль перекрестной реактивности между кишечными бактериями и хрящом в патогенезе артрита. Ревматоидный артрит. 1988; 31: 1077–1079. [PubMed] [Google Scholar] 76. Эльваут Д., Де Кейзер Ф., Ван ден Бош Ф. и др. Обогащение Т-лимфоцитов, несущих интегрины бета7, в воспаленной синовиальной ткани пациентов с ранней спондилоартропатией по сравнению с ревматоидным артритом.J Rheumatol. 1998; 25: 1932–1937. [PubMed] [Google Scholar] 77. Салми М., Ялканен С. Субпопуляции лейкоцитов человека из воспаленного кишечника связываются с сосудистой сетью суставов с использованием различных наборов молекул адгезии. J Immunol. 2001; 166: 4650–4657. [PubMed] [Google Scholar] 78. May E, Märker-Hermann E, Wittig BM, Zeitz M, Meyer zum Büschenfelde KH, Duchmann R. Идентичные разрастания Т-клеток в слизистой оболочке толстой кишки и синовиальной оболочке пациента с энтерогенной спондилоартропатией. Гастроэнтерология. 2000; 119: 1745–1755. [PubMed] [Google Scholar] 79.Кауфман Х. Л., Фишер А. Х., Кэрролл М., Беккер Дж. М.. Язвы толстой кишки, связанные с приемом нестероидных противовоспалительных препаратов. Отчет о трех случаях. Dis Colon Rectum. 1996; 39: 705–710. [PubMed] [Google Scholar] 80. Кауфманн Х.Дж., Таубин Х.Л. Нестероидные противовоспалительные препараты активируют вялое воспалительное заболевание кишечника. Ann Intern Med. 1987; 107: 513–516. [PubMed] [Google Scholar] 81. О’Брайен Дж. Нестероидные противовоспалительные препараты у пациентов с воспалительным заболеванием кишечника. Am J Gastroenterol. 2000; 95: 1859–1861.[PubMed] [Google Scholar] 82. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 83. Сандборн В.Дж., Стенсон В.Ф., Брынсков Дж. И др. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin Gastroenterol Hepatol. 2006; 4: 203–211. [PubMed] [Google Scholar] 84. Biancone L, Tosti C, Geremia A и др. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое исследование.Алимент Pharmacol Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 85. Де Кейзер Ф., Ван Дамм Н., Де Вос М., Миелантс Х., Вейс Э.М. Возможности иммунной модуляции при спондилоартропатиях с особым упором на воспаление кишечника. Inflamm Res. 2000; 49: 47–54. [PubMed] [Google Scholar] 86. Ван ден Бош Ф., Круитхоф Э., Де Вос М., Де Кейзер Ф., Миелантс Х. Болезнь Крона, связанная со спондилоартропатией: влияние блокады ФНО-альфа инфликсимабом на суставные симптомы. Ланцет. 2000; 356: 1821–1822.[PubMed] [Google Scholar] 87. Дженерини С., Джакомелли Р., Феди Р. и др. Инфликсимаб при спондилоартропатии, связанной с болезнью Крона: открытое исследование эффективности индукции и поддержания ремиссии скелетно-мышечных и кишечных проявлений. Ann Rheum Dis. 2004. 63: 1664–1669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 88. Риспо А., Скарпа Р., Ди Джироламо Э. и др. Инфликсимаб в лечении внекишечных проявлений болезни Крона. Scand J Rheumatol. 2005; 34: 387–391. [PubMed] [Google Scholar] 89.Марцо-Ортега Х, МакГонагл Д., О’Коннор П., Эмери П. Эффективность этанерцепта для лечения спондилоартрита, связанного с Кроном, но не колита. Ann Rheum Dis. 2003. 62: 74–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Ханауэр С.Б., Панес Дж., Полковник Дж. Ф., Блумфилд Р., Шрайбер С., Сандборн В. Дж.. Клинические испытания: влияние предшествующей терапии инфликсимабом на клинический ответ на поддерживающую терапию цертолизумабом пеголом при болезни Крона. Алимент Pharmacol Ther. 2010. 32: 384–393. [PubMed] [Google Scholar] 91.Сандборн В.Дж., Абреу М.Т., Д’Хаенс Дж. И др. Цертолизумаб пегол у пациентов с болезнью Крона от умеренной до тяжелой степени и вторичной неэффективностью инфликсимаба. Clin Gastroenterol Hepatol. 2010. 8: 688–695. [PubMed] [Google Scholar] 92. Аллез М., Вермейр С., Моззиконачи Н. и др. Эффективность и безопасность третьего моноклонального антитела против TNF при болезни Крона после неэффективности двух других антител против TNF. Алимент Pharmacol Ther. 2010; 31: 92–101. [PubMed] [Google Scholar]Ревматологические проявления при воспалительном заболевании кишечника
Энн Гастроэнтерол.2011; 24 (3): 173–180.
Параскеви В. Вулгари
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Янины, Янина, Греция
Ревматологическая клиника, Отделение внутренней медицины, Медицинский факультет, Университет Иоаннины, Иоаннина, Греция
Для корреспонденции: Параскеви В. Вулгари, доктор медицины, доцент кафедры ревматологии, клиника ревматологии, кафедра внутренней медицины, медицинский факультет, Университет Янины, 45110, Янина, Греция; тел: +302651007503; факс: +302651007054; электронная почта: rg.iou.cc@ragluovpПоступило 15.04.2011; Принято 3 июня 2011 г.
Авторские права: © Греческое общество гастроэнтерологовЭто статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution-Noncommercial-Share Alike 3.0 Unported, что разрешает неограниченное использование, распространение и воспроизведение на любом носителе. при условии правильного цитирования оригинала.
Эта статья цитируется в других статьях в PMC.Abstract
Ревматологические проявления воспалительного заболевания кишечника (ВЗК) являются частыми и включают периферический артрит, поражение оси и периферический энтезит.Также могут возникать вторичный остеопороз и гипертрофическая остеоартропатия. Осложнения ВЗК (например, септический артрит) следует отличать от стерильного воспаления. Побочные эффекты лечения кортикостероидами, такие как остеонекроз, также могут влиять на суставы. Осевое поражение варьируется от боли в пояснице до истинного анкилозирующего спондилита. Человеческий лейкоцитарный антиген B27 связан с аксиальным поражением ВЗК. Периферический артрит подразделяется на два типа. Тип I — это малосуставной асимметричный обычно неразрушающий артрит, поражающий крупные суставы и обычно связанный с активным заболеванием кишечника.Тип II — это полиартрит, поражающий мелкие суставы, и имеет тенденцию протекать независимо от заболевания кишечника. Лечение суставных симптомов при ВЗК включает сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды. Антитела против фактора некроза опухоли эффективны при лечении резистентной или осложненной болезни Крона, а также периферического артрита и аксиального поражения.
Ключевые слова: периферический артрит, сакроилеит, энтезит, осевое поражение
Введение
Идиопатические воспалительные заболевания кишечника (ВЗК), болезнь Крона (БК) и язвенный колит (ЯК) являются системными заболеваниями, которые могут осложняться внекишечными заболеваниями. проявления у 40% пациентов, в зависимости от исследуемой популяции и используемых определений [1-3].Ревматологические проявления ВЗК являются частыми и включают периферический артрит, поражение оси, периферический энтезит, вторичный остеопороз и вторичную гипертрофическую остеоартропатию (HOA) (). Осложнения ВЗК также могут вызывать боль в суставах, и их следует отличать от стерильного воспаления. Бактериальная инфекция крестцово-подвздошных или периферических суставов может возникнуть из-за свищей или бактериемии. Побочные эффекты лечения ВЗК могут также влиять на суставы, такие как остеонекроз из-за использования кортикостероидов.ВЗК может быть связана с рецидивирующим полихондритом и кожным васкулитом. Связь между кишечником и артритом была постулирована в 1929 году Баргеном, который признал артрит осложнением ЯК [4]. Хенч в 1935 году описал периферический артрит у пациентов с ВЗК и наблюдал тенденцию артрита к обострению при обострении колита и к исчезновению с ремиссией кишечных симптомов [5]. Введение Райтом и Моллом концепции спондилоартропатий (SpA) привело к дальнейшему изучению взаимосвязи между артритом и воспалением кишечника [6].ВЗК относится к SpA, имея общие черты с другими членами этого семейства расстройств, такие как асимметричный паттерн поражения периферических суставов, возникновение сакроилеита (SI) и спондилита, периферическая энтезопатия, отсутствие ревматоидного фактора, связь с человеческим заболеванием. лейкоцитарный антиген (HLA) B27, а также внесуставные особенности, включая увеит, кардит, поражения кожи и слизистых оболочек.
Таблица 1
Ревматологические проявления при ВЗК
Эпидемиологические особенности и генетические маркеры ревматологических проявлений при ВЗК
Распространенность ЯК колеблется от 50 до 100 на 100 000 населения.Заболевание чаще встречается у белых. Распространенность CD увеличилась за последние несколько десятилетий примерно до 75 на 100 000 населения. Ранние эпидемиологические исследования ассоциированных с ВЗК артропатий в 1960-х, 70-х и 80-х годах включали пациентов с классическим анкилозирующим спондилитом (AS) или SI вместе с периферическим артритом [7-15]. По данным этих исследований, АС присутствовал у 2-16% пациентов, в основном при БК. Бессимптомный и симптоматический СИ был обнаружен у 12-20% пациентов, а периферический артрит — у 11-20%.Связь с HLA-B27 колебалась от 3,9 до 18,9%. Исследования популяций ВЗК с использованием критериев Европейской группы исследования спондилоартропатии [16] или диагностических критериев Амора для спондилоартропатии [17] показали различные результаты [18–32]. В частности, AS варьировала от 1 до 45,1%, SI от 1,9 до 45,7%, периферический артрит от 2,8 до 30,6% и энтезопатия от 5,4 до 50% пациентов. В большинстве этих исследований сообщалось об аналогичных результатах при БК и ЯК при периферическом и осевом поражении. Кроме того, большинство исследований согласились с тем, что язвенный проктит редко осложняется воспалением суставов и что воспалительное заболевание суставов чаще встречается у пациентов с БК с колитом или с более обширным заболеванием кишечника по сравнению с пациентами с поражением подвздошной кишки.Кроме того, у некоторых пациентов развивается одно или несколько проявлений СпА (например, энтезит и / или дактилит) без выполнения критериев классификации.
Артрит или аксиальные симптомы могут предшествовать желудочно-кишечным симптомам на длительные периоды времени, и пациентов можно рассматривать как недифференцированную спондилоартопатию до тех пор, пока не проявит себя ВЗК. Исследование Mielants и Veys предоставило доказательства того, что пациенты с недифференцированным SpA и даже AS могут иметь субклиническое воспаление кишечника, которое играет важную роль в запуске и сохранении воспаления суставов [33].В последующем 20-летнем исследовании пациентов с ВЗК были выявлены особенности опорно-двигательного аппарата у 30% [34]. HLA-B27-положительные пациенты с CD имеют высокую вероятность прогрессирования до откровенного АС. И наоборот, частота истинного IBD (UC или CD) при AS составляет менее 4%. Однако, если учесть возникновение субклинического воспаления кишечника, распространенность поражения кишечника в группе пациентов со СпА возрастает до 60% [35].
Другие исследования, направленные на выяснение частоты симптоматического или бессимптомного SI.Steer et al. Обнаружили при компьютерной томографии (КТ) признаки СИ у 31/134 пациентов с БК [36]. В другом исследовании, проведенном с участием 50 пациентов с БК с симптомами боли в спине, 28% соответствовали модифицированным Нью-Йоркским критериям СА при рентгенологическом исследовании [37]. С другой стороны, бессимптомный СИ может присутствовать у 10–50% пациентов с ВЗК [38]. В сравнительном исследовании с использованием обычного рентгена и КТ результаты, совместимые с СИ, были обнаружены у 29% пациентов с БК, и только у 3% были симптомы [39]. Магнитно-резонансная томография (МРТ) — наиболее чувствительный метод выявления СИ у пациентов с ВЗК.В литературе также есть исследования, описывающие скелетно-мышечные симптомы у пациентов с ВЗК, без использования точных диагностических критериев для СпА, связанной с ВЗК. Таким образом, сообщалось о расовых различиях в распространенности внекишечных, в том числе ревматологических, проявлений. Большое исследование показало, что у афроамериканцев с ВЗК чаще развиваются увеит и инфаркт миокарда [40]. Другое исследование описало повышенную заболеваемость артритом и увеитом у афроамериканских пациентов с CD [41], хотя в литературе приводятся другие результаты [42].Кроме того, исследователи из Испании сообщили о внекишечных проявлениях почти у половины (46%) из 157 пациентов с БК, в то время как у 22% были обнаружены ревматологические симптомы, которые чаще наблюдались у пациентов с заболеванием, ограниченным толстой кишкой [43]. Исследование, проведенное в Украине, показало, что 29,8% из 319 пациентов с ЯК имели суставные проявления. Артрит коррелировал с обширными формами ЯК и чаще встречался у пациентов с левосторонним ЯК и панколитом. Артралгия была превалирующим симптомом у пациентов с дистальным ЯК [44].Совместное вовлечение в ЯК колеблется от 20 до 35% в других исследованиях [45-47]. Исследование, проведенное в Японии, показало, что 10,3% пациентов с БК страдают артритом и 1,5% — спондилитом [48]. В греческой когорте пациентов с БК 30% страдали артритом / артралгиями [49]. Другое исследование, проведенное в Канаде, сообщило о 4% распространенности АС у госпитализированных пациентов с ВЗК, при этом пациенты мужского пола с БК поражались чаще, чем пациенты мужского пола с ЯК [50]. Однако в бразильском исследовании распространенность составила 14,4% без разницы между БК и ЯК [51].Наконец, исследование, проведенное в Кувейте, сообщило об артрите у 8,9% пациентов с ЯК, в то время как общая распространенность ревматологических жалоб составила 31% [52].
Такие расовые различия в распространенности ревматологических проявлений могут быть объяснены как иммунологическими, так и генетическими факторами. Периферический артрит, возникающий при ВЗК, не связан с HLA-B27. SI и особенно спондилит, однако, связаны с HLA-B27 [40% и 60% соответственно], но в меньшей степени, чем при неосложненном AS [90%].CD был связан с мутацией в гене NOD2 [CARD15] на хромосоме 16 [53]. Это представляет интерес для патогенеза CD, поскольку NOD2 играет важную роль в врожденном иммунитете к патогенам и косвенно участвует в микробных триггерах IBD. На сегодняшний день исследования не обнаружили значимой связи между CARD15 и SpA. Однако мутации CARD15 могут чаще обнаруживаться среди пациентов с БК, осложненной СИ [54], хотя это не было подтверждено в более поздних исследованиях [55].
Клинические особенности ревматологических проявлений ВЗК
Артрит
Суставные осложнения являются наиболее частыми внекишечными проявлениями [56].Артрит чаще встречается у пациентов с заболеванием толстой кишки и у пациентов с такими осложнениями, как абсцессы, псевдомембранозный полипоз, перианальное заболевание, массивное кровотечение, а также у пациентов с узловатой эритемой, стоматитом, увеитом и гангренозной пиодермией. Кроме того, пациенты с БК и поражением толстой кишки имеют более высокий риск развития синовита, чем пациенты с изолированным заболеванием тонкой кишки. В равной степени страдают мужчины и женщины. Периферический артрит подразделяется на два типа [57].Тип I — это малосуставной артрит, обычно поражающий менее пяти крупных (несущих нагрузку) суставов. Обычно это связано с активным заболеванием кишечника и имеет асимметричный характер; моноартрит не редкость. Поражаются крупные и мелкие суставы, преимущественно нижних конечностей (колени, голеностопные и плюснево-фаланговые суставы). Артрит бедер и плеч встречается реже и, как правило, ассоциируется со спондилитом и инфарктом миокарда. Артрит возникает на ранней стадии заболевания кишечника. Обычно оно мигрирующее и преходящее, но рецидивирующее, хотя и не приводит к деформациям суставов [58, 59].У пяти процентов пациентов с ВЗК развивается артропатия I типа. Симптомы со стороны суставов могут возникать до начала заболевания кишечника, особенно при БК. Это также может отсутствовать, хотя образцы илеоколоноскопической биопсии, взятые из терминального отдела подвздошной кишки, выявляют легкие или тяжелые воспалительные поражения, указывающие на наличие субклинической БК у этих пациентов [60]. Время первого приступа артрита, по-видимому, не зависит от продолжительности колита при ЯК. Кроме того, обострение кишечной симптоматики, главным образом при ЯК, часто сопровождается рецидивом периферического артрита.Сообщалось, что хирургическое удаление толстой кишки при ЯК оказывает лечебное действие на симптомы периферических суставов [60].
Периферический артрит I типа связан с аллелем класса II HLA-DRB1 * O103 [56]. Этот аллель обнаруживается у 35% пациентов с артритом типа I по сравнению с 3% в контрольной группе. Если обследовать пациентов с рецидивирующим артритом, эта связь обнаруживается у 65% [2].
Тип II — полиартрит, поражающий в основном мелкие суставы. Это редко предшествует диагностике ВЗК.Обычно он протекает независимо от заболевания кишечника. Пястно-фаланговые суставы часто поражаются, и дифференциация периферического артрита II типа и ревматоидного артрита важна и требует корреляции рентгенологических и иммунологических исследований. Примерно половина пациентов с ВЗК страдает мигрирующим артритом. Активный синовит может сохраняться в течение нескольких месяцев и может повторяться неоднократно. Эпизоды обострений и ремиссий могут продолжаться годами. Переход в хроническое состояние может происходить вместе с рентгенологическими эрозивными поражениями [61].Артропатия II типа поражает 3–4% пациентов с ВЗК. Периферический артрит II типа связан с HLA-B44 * у 62% пациентов по сравнению с 30% в контрольной группе [56]. Это также связано с увеитом, но не с другими внекишечными проявлениями.
Спондилит и SI
Спектр аксиального поражения варьируется от воспалительной боли в пояснице с рентгенологическими признаками SI или без них до бессимптомных SI и истинного AS, характеризующихся классическими клиническими (боль, скованность позвоночника) и рентгенологическими признаками [квадрат, синдесмофиты , бамбуковый корешок].Распространенность аксиального вовлечения у пациентов с ВЗК составляет от 5 до 12% [62], но эти проценты могут быть выше из-за наличия скрытого аксиального вовлечения [63], особенно в SI. Соотношение мужских и ревматологических проявлений у женщин с ВЗК составляет 3: 1, что сопоставимо с СА. Осевое поражение может предшествовать заболеванию кишечника на много лет. Основные жалобы — воспалительные боли в пояснице, боли в ягодицах и груди. Воспалительная боль в спине коварна в начале, обычно в возрасте до 45 лет, часто бывает односторонней и прерывистой в начале, более интенсивной в покое, связана с утренней скованностью, но облегчается при движении, усиливается при кашле или чихании и сопровождается утомляемостью.Боль сохраняется не менее 3 месяцев. Диагноз воспалительной боли в спине подтверждается, когда наступает улучшение после упражнений, пробуждения из-за боли и наличия чередующейся боли в ягодицах [64]. Боль в грудной клетке возникает в результате энтезита реберно-позвоночного, реберно-реберного, реберно-реберного суставов. Он усиливается при кашле и глубоком вдохе и ограничивает респираторное расширение эпизодами переменной продолжительности. Дактилит можно увидеть при АС. Он характеризуется воспалительным отеком одного или нескольких пальцев [колбасных пальцев] или пальцев ног, вызванного теносиновитом сухожилий сгибателей.Ограничение подвижности шейного отдела позвоночника — признак прогрессирования заболевания до генерализованного анкилоза. При воспалительной боли в спине рентгенологическая оценка крестцово-подвздошных суставов позволяет поставить диагноз SI [65]. В отсутствие рентгенологических данных оценка МРТ может привести к диагностике и, таким образом, к эффективному раннему лечению аксиального спондилоартрита [66]. Признаки отека кости при использовании методов T1 post-gadolinium и STIR (восстановление с инверсией короткого тау-белка) являются признаком активного воспаления в крестцово-подвздошных суставах и / или позвоночнике.Осевые и позвоночные симптомы не зависят от обострения воспаления кишечника. Точно так же хирургическое лечение ЯК или БК не влияет на связанный с ним спондилит. Следовательно, было высказано предположение, что периферический артрит является проявлением ВЗК, тогда как спондилит является ассоциированным заболеванием.
Энтезопатия
Энтезопатия — это патологическое изменение в энтезе (месте прикрепления сухожилия или связки к кости). Рентгенологически это проявляется окостенением энтезов.При ВЗК энтезопатии могут возникать на пятке (прикрепление ахиллова сухожилия или подошвенной фасции) или в колене (прикрепление сухожилия надколенника). Воспаление при энтезе может вызвать эрозивные поражения, которые могут привести к образованию шпор.
Остеопороз
Остеопороз — это тихое состояние, характеризующееся уменьшением костной массы и изменениями микроархитектуры, ведущими к повышенной хрупкости костей и склонности к переломам. Остеопороз является осложнением лечения кортикостероидами при ВЗК.
HOA
HOA — синдром, характеризующийся чрезмерным разрастанием кожи и костей в дистальных отделах конечностей. Его наиболее характерной особенностью является выпуклая деформация кончиков пальцев, обычно известная как булавовидная деформация. На поздних стадиях становится очевидным периостальное разрастание трубчатых костей и синовиальный выпот. UC и CD — две причины вторичной HOA. У пациентов с ВЗК развитие клубочков обычно является плохим прогностическим признаком.
Диагностика ревматологических проявлений ВЗК
Не существует патогномоничных находок, подтверждающих клиническое подозрение на артрит, вызванный ВЗК.Диагноз можно заподозрить в надлежащих клинических условиях. Результаты лабораторных исследований определяются активностью ВЗК. Анемия часто встречается при энтеропатическом СпА, что отражает как анемию, вызванную хроническим заболеванием, так и железодефицитную анемию из-за кровопотери со стороны желудочно-кишечного тракта. Лейкоцитоз, выраженный тромбоцитоз с количеством тромбоцитов выше 700 000 / мм 3 — не редкость. Скорость оседания эритроцитов и С-реактивный белок, а также другие реагенты острой фазы повышены. Ревматоидный фактор и антинуклеарные антитела у большинства пациентов отсутствуют.Синовиальная жидкость не характерна: можно обнаружить легкие или выраженные воспалительные изменения с лейкоцитами в диапазоне от 1500 до 50 000 / мм 3 . Уровень глюкозы не снижается. Микробиологические культуры отрицательны [63]. Биопсия синовиальной мембраны выявляет неспецифические аномалии, включая пролиферацию клеток синовиальной оболочки, повышенную васкуляризацию и инфильтрацию мононуклеарных клеток [67]. В случаях моноартрита или олигоартрита важно исключить септический артрит, выполняя совместную аспирацию, поскольку его проявления могут быть нетипичными у пациентов с ВЗК, получающих противовоспалительное или иммунодепрессивное лечение.
Рентгенологические данные
Рентгенограммы позвоночника и таза могут показать типичные результаты AS и SI. Последнее обычно двустороннее, хотя сообщалось о более высокой частоте асимметричного анкилоза SI и скулового сустава [68]. Поражение периферических суставов обычно не сопровождается рентгенологическими изменениями, но описаны эрозивные поражения в основном плюсневых суставов. Эти поражения показывают некоторые отличия от ревматоидных поражений, например, отсутствие остеопороза и наличие пролиферации соседних костей.Редко при БК может наблюдаться деструктивный гранулематозный синовит. Энтезопатии рентгенологически не отличаются от таковых, наблюдаемых при других СпА.
Дифференциальный диагноз
У пациентов с кишечными проявлениями и артритом диагноз ВЗК исключает другие заболевания со схожими симптомами: реактивный артрит (ранее — синдром Рейтера), болезнь Уиппла, болезнь Адамантиадеса-Бехчета, кишечное шунтирование, чувствительную к глютену энтеропатию и паразитарные инфекции. Первоначально необходимо распознать клинические признаки SpA и дифференцировать их от таковых при ревматоидном артрите и других заболеваниях соединительной ткани.IBD включается в дифференциальную диагностику SpA, даже если кишечные симптомы легкие. Наличие спондилита у пациента с отрицательным результатом HLA-B27 увеличивает риск ВЗК. Дифференциальный диагноз боли в суставах у пациента с ВЗК широк. Это включает в себя HOA [67], септический артрит (обычные или условно-патогенные инфекции), остеонекроз, особенно у пациентов, получавших глюкокортикоиды, и испытывающих боль, несоразмерную степени ограничения пассивного диапазона движений пораженного сустава.Узловатая эритема может быть трудно отличить от артрита, когда поражения возникают в околосуставной области. Невозможность аспирации синовиальной жидкости из опухшего и болезненного сустава является ключом к диагнозу.
Патогенез скелетно-мышечных проявлений ВЗК
HLA-B27 является основным фактором риска AS и SpA, связанных с IBD. У трансгенных крыс HLA-B27 развивается SpA. HLA-B27 присутствует у> 90% пациентов с AS, в то время как только от 5 до 15% населения в целом являются HLA-B27-положительными.Среди молекул HLA класса B, которые определяют антигенсвязывающую щель, HLA-B27 имеет уникальный B-карман, который, вероятно, влияет на репертуар пептидов. Подтипы HLA-B27 (их более 30) частично различаются только отдельными аминокислотами. Только несколько подтипов HLA-B27 (например, HLA-B * 2705, HLA-B * 2702 или HLA-B * 2704 и HLA-B * 2707) связаны с AS. Существует 4 основных теории патогенеза спондилоартритов, связанных с HLA-B27 (). Первая — это гипотеза артритогенного пептида. Согласно этому HLA-B27 связывает уникальный набор антигенных пептидов, бактериальных или собственных, и эти пептиды презентируются Т-клеткам CD8 + , вызывая ограниченный HLA-B27 цитотоксический Т-клеточный ответ.Вторая теория — это самоассоциация молекулы HLA-B27. Уникальным свойством HLA-B27 является то, что его тяжелая цепь может образовывать гомодимеры in vitro , которые зависят от связывания дисульфида через их остатки цистеина-67 в альфа-1 домене. Эти гомодимеры возникают в результате неправильной укладки B27 в эндоплазматическом ретикулуме. Накопление неправильно свернутого белка может привести к провоспалительной реакции внутриклеточного стресса. Альтернативно, гомодимеры B27 могут мигрировать на поверхность клетки, где они либо сами становятся антигенными, либо представляют пептид другим воспалительным клеткам.Третья теория относится к изменению внутриклеточного обращения с микробами из-за HLA-B27. Молекула HLA-B27 приводит к менее эффективному уничтожению микробов, таких как сальмонелла, в сочетании с повышенным уровнем выработки цитокинов. Четвертая гипотеза представляет признание HLA-B27 как аутоантигена. Сам HLA-B27 может распознаваться CD4 + Т-клетками, когда он представлен гетеродимерами HLA класса II (DR, DQ, DP) в качестве аутоантигена. Это также было частью гипотезы молекулярной мимикрии, которая подтверждает, что гомология пептидов из молекулы HLA-B27 имеет поразительную гомологию последовательностей с таковой из бактериальных источников [67].Однако генетические эффекты, не связанные с основным комплексом гистосовместимости, по-видимому, также оказывают значительное влияние на тяжесть заболевания [68–70].
Таблица 2
Основные теории о патогенезе SpA, связанного с HLA-B27
Связь между аксиальным поражением и HLAB27 у пациентов с ВЗК менее убедительна, потому что только 40-60% пациентов с CD и AS имеют положительную реакцию на HLA- B27. Измененная проницаемость кишечника может быть ключевым фактором в развитии SpA [71]. Кроме того, периферический артрит 1-го типа связан с HLA-DRB1 * 0103, B * 35 и B * 27 [72], тогда как при артропатии 2-го типа не наблюдались ассоциации с HLA-B27 или DR-4.Эти данные показывают, что артропатии 1-го и 2-го типов являются иммуногенетически разными и что тип 1 больше похож на таковой при осевом SpA. Помимо генетической предрасположенности, в патогенезе периферического артрита важную роль играют бактериальные антигены. Ряд бактериальных агентов, включая адгезивную, инвазивную E. coli и анаэробные палочки бактероидов и фузобактерий, вовлечены в этиопатогенез CD. Несколько исследований были сосредоточены на важной «оси кишечник-синовиальная оболочка» [73,74].Кроме того, у пациентов с БК была продемонстрирована перекрестная реактивность между кишечными бактериями и хрящами [75].
Роль CARD15 в процессе презентации кишечных бактерий антигенпрезентирующими клетками остается неясной. Белок CARD15 экспрессируется моноцитами, гранулоцитами, дендритными клетками и эпителиальными клетками. In vitro этот белок индуцирует активацию пути κB ядерного фактора (NF) после распознавания муррамилдипептида и может помочь защитить стенку кишечника.Генетическая мутация CARD15 может привести к нарушению обращения с бактериальными продуктами и, следовательно, к неадекватной элиминации. Производство цитокинов антигенпрезентирующими клетками играет решающую роль в управлении адаптивными иммунными ответами. Кроме того, взаимодействие между микроорганизмами и толл-подобными рецепторами (TLRS) на эпителиальных клетках слизистой оболочки, моноцитах, макрофагах и дендритных клетках индуцирует секрецию различных медиаторов, таких как цитокины, такие как фактор некроза опухоли (TNF) альфа и интерлейкин 6, путем активации NF-κB и запускает активацию лимфоцитов.Эффекторным Т-клеткам необходимо мигрировать с индуктивных сайтов на эффекторные. Активированные в кишечнике Т-клетки могут проникать в синовиальную оболочку либо через присутствие родственных антигенов в обоих участках, либо за счет хоминга лимфоцитов, инициированных молекулами адгезии [76,77]. Обнаружение идентичных разрастаний Т-клеток в слизистой оболочке толстой кишки, синовиальной оболочке. Ревматологические проявления при ВЗК и крови подтверждают эту гипотезу [78]. Таким образом, TLR находятся на перекрестке врожденного и адаптивного иммунитета, где микробная инвазия транслируется с неспецифических воспалительных реакций на антиген-специфические.
Лечение скелетно-мышечных проявлений ВЗК
Целями терапии скелетно-мышечных проявлений ВЗК являются уменьшение воспаления и предотвращение инвалидности или деформации. Отдых и физиотерапия используются как немедикаментозное лечение. У пациентов с истинным АС большое значение имеет физиотерапия для поддержания подвижности позвоночника и предотвращения деформаций позвоночника с последующим нарушением дыхания и инвалидностью. Следует отдавать предпочтение дыхательным упражнениям, упражнениям для позвоночника и плаванию.Нестероидные противовоспалительные препараты (НПВП) обычно назначают для контроля периферического артрита, болей в спине и скованности. Необходимо соблюдать осторожность, поскольку эти препараты могут обострить ВЗК, особенно ЯК [79, 80]. Побочные эффекты, связанные с НПВП, также могут имитировать вспышку ВЗК и усложнять лечение. Опыт применения селективных ингибиторов циклооксигеназы — 2 (Цокс-2) (таких как целекоксиб и рофекоксиб, последний больше не доступен) у пациентов с ВЗК ограничен. Известно, что активность Цокс-2 способствует разрастанию эпителия и заживлению ран.Теоретически ингибирование Цокс-2 могло иметь пагубные последствия у пациентов с ВЗК [81]. С другой стороны, селективные ингибиторы Цокс-2 уменьшают тяжесть экспериментального колита [82]. В плацебо-контролируемом исследовании использование целекоксиба у пациентов с ВЗК в течение двух недель не показало существенной разницы в частоте рецидивов ВЗК [83]. Другое исследование включало 45 пациентов с ВЗК с артралгиями, получавших рофекоксиб (12,5 мг / день) от трех дней до трех месяцев [84]. Об облегчении артралгии сообщили 71% пациентов (полное облегчение у 18% и частичное облегчение у 53%).Однако 20% пациентов с ВЗК — 9 пациентов — по сравнению с 3% контрольной группы (пациенты с диспезией) прекратили терапию из-за желудочно-кишечных симптомов, которые исчезли после прекращения лечения. Частота прекращения лечения была аналогичной для пациентов с CD или UC. Селективные агенты Цокс-2 могут лучше переноситься в краткосрочной перспективе, но отмена рофекоксиба и вальдекоксиба из-за сердечно-сосудистой токсичности вызывает опасения по поводу их общей пользы.
Несмотря на опасения по поводу способности НПВП и селективных агентов Цокс-2 вызывать обострение воспаления кишечника, ревматологи успешно использовали вышеуказанные препараты у пациентов с ВЗК.Однако, если симптомы или признаки ВЗК развиваются или ухудшаются во время использования НПВП или селективного лечения Цокс-2, целесообразно временно или навсегда прекратить их использование. Из доступных НПВП индометацин и напроксен использовались чаще, но противовоспалительные дозы любого НПВП или селективного агента Цокс-2 могут быть эффективными. Поскольку периферический артрит ВЗК обычно неразрушающий, терапия в первую очередь направлена на облегчение симптомов. НПВП или селективные агенты Цокс-2 уменьшают боль в спине и ригидность при АС, хотя на рентгенограммах может наблюдаться костный анкилоз.
Сульфасалазин, азатиоприн, 6-меркаптопурин, метотрексат и глюкокортикоиды могут быть полезны при воспалении как кишечника, так и суставов. Внутрисуставные инъекции глюкокортикоидов могут использоваться при обострениях периферического артрита. Сульфасалазин эффективен при лечении периферического, но не осевого артрита у пациентов с ВЗК. Начальная доза составляет 500 мг два раза в день с увеличением суточной дозы каждые две недели до исчезновения симптомов артрита или до достижения дозы 1000 мг три раза в день.Перед оценкой эффективности рекомендуется поддерживать максимальную дозу до 12 недель.
Азатиоприн и 6-меркаптопурин, применяемые при ВЗК, также могут оказывать благотворное влияние на заболевания суставов. Однако аминосалицилаты (например, месаламин), полезные для контроля воспаления кишечника, по-видимому, не оказывают прямого противовоспалительного действия на синовиальную оболочку [85].
Исследования, посвященные эффективности метотрексата при периферическом артрите ВЗК, отсутствуют. Многие ревматологи применяют метотрексат у пациентов с ВЗК и периферическим артритом, и метотрексат может быть предпочтительнее азатиоприна, но это эмпирический подход, не подкрепленный данными испытаний [56].Метотрексат при пероральном введении адекватно всасывается даже у пациентов с активной ВЗК. Подкожное введение препарата может уменьшить побочные эффекты со стороны желудочно-кишечного тракта.
Будесонид, глюкокортикоид с первым прохождением печеночного метаболизма и меньшим количеством системных побочных эффектов в результате, использовался при обострениях CD, но на сегодняшний день нет исследований, посвященных влиянию этого стероида на энтеропатический артрит.
Агенты против TNF оказали большое влияние на терапевтический подход к ВЗК и связанных с ним скелетно-мышечных проявлениях.Моноклональные антитела против TNF (инфликсимаб, адалимумаб) эффективны при ВЗК, особенно при БК, и они полезны для пациентов с осевым поражением и периферическим артритом [86–88]. Этанерцепт может контролировать артрит, связанный с CD, но не влияет на заболевание кишечника [89]. Пациенты с ВЗК и истинным AS, у которых наблюдается неадекватный ответ на обычное лечение, являются кандидатами на лечение анти-TNFα. Инфликсимаб, адалимумаб, этанерцепт и голимумаб (человеческие моноклональные антитела, 50 мг один раз в месяц подкожно) можно использовать у пациентов с АС, хотя голимумаб не был одобрен для лечения БК.
Цертолизумаб пегол представляет собой пегилированное гуманизированное антитело, Fab-фрагмент моноклонального антитела TNFα. Цертолизумаб связывается и избирательно нейтрализует активность человеческого TNFα. Поскольку это не полное антитело (без области Fc), оно не индуцирует активацию комплемента, антитело-зависимую клеточную цитотоксичность или апоптоз. Пегилирование цертолизумаба позволяет замедлить выведение и, следовательно, увеличить период полувыведения. Цертолизумаб пегол получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2008 году для лечения и поддержания ответа у взрослых с умеренной и тяжелой БК, у которых не было адекватного ответа на традиционную терапию.Препарат также одобрен в Швейцарии, но не был одобрен Европейским агентством по лекарственным средствам и поэтому не широко доступен в Европе. Рекомендуемая доза для индукции составляет 400 мг подкожно на 0, 2 и 4 неделе, а затем каждые четыре недели для поддержания ответа.
Исследования, оценивающие эффективность инфликсимаба, адалимумаба и цертолизумаба, в целом показали аналогичные результаты, но ни одно исследование не сравнивало их напрямую. Предварительные данные свидетельствуют о том, что цертолизумаб пегол может быть эффективным у пациентов, которые ответили на инфликсимаб и потеряли ответ или стали нетерпимыми к нему [90–92].Безопасность и меры предосторожности аналогичны всем агентам против TNFα. Все пациенты должны пройти кожную пробу на туберкулез до начала терапии анти-TNFα и должны быть обследованы на наличие скрытой инфекции.
Выводы
Ревматологические проявления ВЗК встречаются часто и могут присутствовать у одной трети пациентов.
Осевое поражение варьируется от воспалительной боли в пояснице до SI или истинного AS, хотя также могут возникать энтезопатии.
HLA-B27 связан с аксиальным поражением ВЗК.
Роль HLA-B27 в патогенезе осевого заболевания или АС при ВЗК подтверждается различными теориями.
Периферический артрит подразделяется на два типа. Тип I — это малосуставной, асимметричный обычно неразрушающий артрит, поражающий крупные суставы, и обычно он связан с активным заболеванием кишечника. Тип II — это полиартрит, поражающий мелкие суставы и, как правило, протекает независимо от течения заболевания кишечника.
Сульфасалазин, азатиоприн, метотрексат и глюкокортикоиды используются для лечения ВЗК и суставных симптомов.
Антитела против TNFα эффективны у пациентов с резистентной или осложненной БК, а также при осевом и периферическом артрите.
Биография
•
Университет Янины, Янина, Греция
Сноски
Конфликт интересов: Нет
Ссылки
1. Рикарт Э., Паначчоне Р., Лофтус Э.В., мл. И др. Аутоиммунные расстройства и внекишечные проявления при семейных и спорадических воспалительных заболеваниях кишечника первой степени: исследование случай-контроль.Воспаление кишечника. 2004. 10: 207–214. [PubMed] [Google Scholar] 2. Гринштейн AJ, Яновиц HD, Sachar DB. Внекишечные осложнения болезни Крона и язвенного колита: исследование 700 пациентов. Медицина (Балтимор) 1976; 55: 401–412. [PubMed] [Google Scholar] 3. Бернштейн К.Н., Вайда А., Бланшар Дж. Ф. Объединение других хронических воспалительных заболеваний в воспалительное заболевание кишечника: популяционное исследование. Гастроэнтерология. 2005. 129: 827–836. [PubMed] [Google Scholar] 4. Bargen JA. Осложнения и последствия хронического язвенного колита.Ann Intern Med. 1929; 3: 335. [Google Scholar] 5. Хенч П.С. Острый и хронический артрит. В: Whipple GH, редактор. Бланк хирургии Нельсона I. Нью-Йорк: Томас Нельсон Сонс; 1935. с. 104. [Google Scholar] 6. Райт В. Серонегативный полиартрит: единое понятие. Ревматоидный артрит. 1978; 21: 619–633. [PubMed] [Google Scholar] 7. Ачесон, редактор. Связь между язвенным колитом, регионарным энтеритом и анкилозирующим спондилитом. Q J Med. 1960; 29: 489–499. [PubMed] [Google Scholar] 12. Ранкин Г.Б., Уоттс HD, Мельник С.С., Келли М.Л., Jr Национальное совместное исследование болезни Крона: внекишечные проявления и перианальные осложнения. Гастроэнтерология. 1979; 77: 914–920. [PubMed] [Google Scholar] 13. Münch H, Purrmann J, Reis HE, et al. Клинические особенности воспалительных проявлений суставов и позвоночника при болезни Крона. Гепатогастроэнтерология. 1986; 33: 123–127. [PubMed] [Google Scholar] 14. Деккер-Сейс Б.Дж., Меувиссен С.Г., Ван Ден Берг-Лунен Е.М., Де Хаас В.Х., Агенант Д., Титгат Г.Н. Анкилозирующий спондилит и воспалительное заболевание кишечника.II. Распространенность периферического артрита, сакроилеита и анкилозирующего спондилита у пациентов, страдающих воспалительным заболеванием кишечника. Ann Rheum Dis. 1978; 37: 33–35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Salvarani C, Fries W. Клинические особенности и эпидемиология спондилоартритов, связанных с воспалительным заболеванием кишечника. Мир Дж. Гастроэнтерол. 2009. 15: 2449–2455. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Дугадос М., ван дер Линден С., Юлин Р. и др. Предварительные критерии Европейской исследовательской группы по спондилоартропатии для классификации спондилоартропатии.Ревматоидный артрит. 1991; 34: 1218–1227. [PubMed] [Google Scholar] 17. Амор Б. [Очень ранняя диагностика фаз хондролиза при артрозе] Rev Rhum Mal Osteoartic. 1990; 57: 253–254. [PubMed] [Google Scholar] 18. Скарпа Р., дель Пуэнте А., Д’Ариенцо А. и др. Артрит язвенного колита: клинико-генетические аспекты. J Rheumatol. 1992; 19: 373–377. [PubMed] [Google Scholar] 19. Протцер У., Духманн Р., Хёлер Т. и др. [Энтеропатический спондилоартрит при хронических воспалительных заболеваниях кишечника: распространенность, характер проявления и ассоциация HLA] Мед Клин (Мюнхен) 1996; 91: 330–335.[PubMed] [Google Scholar] 20. Велосо Ф. Т., Карвалью Дж., Магро Ф. Системные проявления воспалительного заболевания кишечника, связанные с иммунитетом. Проспективное исследование 792 пациентов. J Clin Gastroenterol. 1996; 23: 29–34. [PubMed] [Google Scholar] 22. de Vlam K, Mielants H, Cuvelier C, De Keyser F, Veys EM, De Vos M. Спондилоартропатия недооценена при воспалительном заболевании кишечника: распространенность и ассоциация HLA. J Rheumatol. 2000. 27: 2860–2865. [PubMed] [Google Scholar] 23. Queiro R, Maiz O, Intxausti J, et al.Субклинический сакроилеит при воспалительном заболевании кишечника: клиническое и последующее исследование. Clin Rheumatol. 2000. 19: 445–449. [PubMed] [Google Scholar] 24. Christodoulou DK, Katsanos KH, Kitsanou M, Stergiopoulou C, Hatzis J, Tsianos EV. Частота внекишечных проявлений у пациентов с воспалительным заболеванием кишечника в Северо-Западной Греции и обзор литературы. Dig Liver Dis. 2002; 34: 781–786. [PubMed] [Google Scholar] 25. Palm Ø, Moum B, Jahnsen J, Gran JT. Распространенность и частота периферического артрита у пациентов с воспалительным заболеванием кишечника, проспективное популяционное исследование (исследование IBSEN) Rheumatology (Oxford) 2001; 40: 1256–1261.[PubMed] [Google Scholar] 26. Мендоса Дж. Л., Лана Р., Таксонера С., Альба С., Искьердо С., Диас-Рубио М. [Внекишечные проявления воспалительного заболевания кишечника: различия между болезнью Крона и язвенным колитом] Med Clin (Barc) 2005; 125: 297–300. [PubMed] [Google Scholar] 27. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 28. Родригес В.Е., Костас П.Дж., Васкес М. и др.Распространенность спондилоартропатии у пуэрториканских пациентов с воспалительным заболеванием кишечника. Ethn Dis. 2008. 18 (2 доп. 2): 225–229. [PubMed] [Google Scholar] 29. Lanna CC, Ferrari Mde L, Rocha SL, Nascimento E, de Carvalho MA, da Cunha AS. Поперечное исследование 130 бразильских пациентов с болезнью Крона и язвенным колитом: анализ суставных и офтальмологических проявлений. Clin Rheumatol. 2008. 27: 503–509. [PubMed] [Google Scholar] 30. Орчард Т.Р., Вордсворт Б.П., Джуэлл Д.П. Периферические артропатии при воспалительных заболеваниях кишечника: их суставное распределение и естественное течение.Кишечник. 1998. 42: 387–391. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Salvarani C, Vlachonikolis IG, van der Heijde DM, et al. Скелетно-мышечные проявления в популяции пациентов с воспалительными заболеваниями кишечника. Сканд Дж Гастроэнтерол. 2001; 36: 1307–1313. [PubMed] [Google Scholar] 32. Türkçapar N, Ozyüncü N, Idilman R, Ensari A, Soylu K, Ozden A. Макроамилаземия у пациента с селективным дефицитом IgA и антифосфолипидными антителами. Turk J Gastroenterol. 2006. 17: 140–143. [PubMed] [Google Scholar] 33.Mielants H, Veys EM, Cuvelier C, De Vos M, Botelberghe L. Артрит и воспаление кишечника, связанные с HLA-B27. Часть 2. Илеоколоноскопия и гистология кишечника у пациентов с HLA-B27 артритом. J Rheumatol. 1985; 12: 294–298. [PubMed] [Google Scholar] 34. Veloso FT, Fraga J, Saleiro СП. Макроглобулинемия и заболевание тонкого кишечника. Отчет о болезни с обзором литературы. J Clin Gastroenterol. 1988. 10: 546–550. [PubMed] [Google Scholar] 35. Миеланц Х., Вейс Э.М. Кишечник при спондилоартропатиях.J Rheumatol. 1990; 17: 7–10. [PubMed] [Google Scholar] 36. Стир С., Джонс Х., Хибберт Дж. И др. Боль в пояснице, сакроилеит и связь с HLA-B27 при болезни Крона. J Rheumatol. 2003. 30: 518–522. [PubMed] [Google Scholar] 37. Podswiadek M, Punzi L, Stramare R, et al. Распространенность рентгенологического сакроилеита у пациентов с воспалительным заболеванием кишечника с воспалительной болью в пояснице. Ревматизм. 2004. 56: 110–113. [PubMed] [Google Scholar] 38. Миелантс Х. Размышления о связи между кишечной проницаемостью и воспалительными заболеваниями суставов.Clin Exp Rheumatol. 1990; 8: 523–524. [PubMed] [Google Scholar] 39. Скотт В.В., мл., Фишман Е.К., Кульман Дж. Э. и др. Компьютерная томография крестцово-подвздошных суставов при болезни Крона. Радиологическая / клиническая корреляция. Skeletal Radiol. 1990; 19: 207–210. [PubMed] [Google Scholar] 40. Нгуен Г.К., Торрес Э.А., Регейро М. и др. Характеристики воспалительного заболевания кишечника у афроамериканцев, выходцев из Латинской Америки и белых неиспаноязычных: характеристика большой когорты в Северной Америке. Am J Gastroenterol. 2006; 101: 1012–1023.[PubMed] [Google Scholar] 41. Басу Д., Лопес И., Кулкарни А., Селлин Дж. Х. Влияние расы и этнической принадлежности на воспалительные заболевания кишечника. Am J Gastroenterol. 2005; 100: 2254–2261. [PubMed] [Google Scholar] 42. Махид С.С., Малхолл А.М., Голсон Р.Д., Эйхенбергер М.Р., Галандюк С. Воспалительное заболевание кишечника и афроамериканцы: систематический обзор. Воспаление кишечника. 2008; 14: 960–967. [PubMed] [Google Scholar] 43. Репизо А, Алькантара М., Муньос-Росас С. и др. Внекишечные проявления болезни Крона: распространенность и сопутствующие факторы.Rev Esp Enferm Dig. 2006; 98: 510–517. [PubMed] [Google Scholar] 44. Дорофеев А.Е., Василенко И.В., Рассохина О.А. Совместные внекишечные проявления при язвенном колите. Dig Dis. 2009. 27: 502–510. [PubMed] [Google Scholar] 45. Де Вос М. Обзорная статья: поражение суставов воспалительным заболеванием кишечника. Алимент Pharmacol Ther. 2004; 20: 36–42. [PubMed] [Google Scholar] 46. Ротфус К.С., Штанге Э.Ф., Херрлингер К.Р. Внекишечные проявления и осложнения при воспалительных заболеваниях кишечника. Мир Дж. Гастроэнтерол.2006; 12: 4819–4831. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Данезе С., Семераро С., Папа А. и др. Внекишечные проявления при воспалительном заболевании кишечника. Мир Дж. Гастроэнтерол. 2005; 11: 7227–7236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Маэда К., Окада М., Яо Т. и др. Кишечные и внекишечные осложнения болезни Крона: предикторы и совокупная вероятность осложнений. J Gastroenterol. 1994; 29: 577–582. [PubMed] [Google Scholar] 49. Триантафиллидис Дж. К., Эммануилидис А., Манусос О., Николакис Д., Кожевинас М.Клинические модели болезни Крона в Греции: последующее исследование 155 случаев. Пищеварение. 2000. 61: 121–128. [PubMed] [Google Scholar] 50. Bernstein CN, Blanchard JF, Rawsthorne P, Yu N. Распространенность внекишечных заболеваний при воспалительном заболевании кишечника: популяционное исследование. Am J Gastroenterol. 2001; 96: 1116–1122. [PubMed] [Google Scholar] 51. Соуза М.Х., Тронкон Л.Е., Родригес С.М. и др. Тенденции возникновения (1980–1999 годы) и клинических особенностей болезни Крона и язвенного колита в университетской больнице на юго-востоке Бразилии.Арк Гастроэнтерол. 2002; 39: 98–105. [PubMed] [Google Scholar] 52. Аль-Шамали М.А., Калауи М., Патти И., Хасан Ф., Хаджа А., Аль-Накиб Язвенный колит в Кувейте: обзор 90 случаев. Пищеварение. 2003. 67: 218–224. [PubMed] [Google Scholar] 53. Эконому М., Филис Дж., Циану З. и др. Эволюция заболеваемости болезнью Крона в северо-западной Греции не связана с изменением вариантов NOD2 / CARD15. Мир Дж. Гастроэнтерол. 2007. 13: 5116–5120. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Peeters H, Vander Cruyssen B, Laukens D, et al.Радиологический сакроилеит, признак спондилита, связан с полиморфизмом гена CARD15 у пациентов с болезнью Крона. Ann Rheum Dis. 2004; 63: 1131–1134. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Пеэтерс Х., Вандер Круиссен Б., Миелантс Х. и др. Клинические и генетические факторы, связанные с сакроилеитом при болезни Крона. J Gastroenterol Hepatol. 2008. 23: 132–137. [PubMed] [Google Scholar] 56. Уильямс Х., Уокер Д., Орчард ТР. Внекишечные проявления воспалительного заболевания кишечника.Curr Gastroenterol Rep. 2008; 10: 597–605. [PubMed] [Google Scholar] 57. Трэвис С.П., Штанге Э.Ф., Леманн М. и др. Европейский консенсус, основанный на фактических данных, по диагностике и лечению болезни Крона: текущее лечение. Кишечник. 2006; 55 (Приложение 1): i16 – i35. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Вордсворт П. Артрит и воспалительное заболевание кишечника. Curr Rheumatol Rep. 2000; 2: 87–88. [PubMed] [Google Scholar] 59. Фомберштейн Б., Йерра Н., Пичумони К.С. Ревматологические осложнения желудочно-кишечных расстройств. Am J Gastroenterol.1996. 91: 1090–1103. [PubMed] [Google Scholar] 60. Клиппель Дж. Х., Дьеп, Р. А.. 2-е издание. Мосби: Лондон; 1998. Ревматология; С. 6.24.1–6.24.3. [Google Scholar] 61. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 62. Moll JM. Воспалительное заболевание кишечника. Clin Rheum Dis. 1985; 11: 87–111. [PubMed] [Google Scholar] 63. Leirisalo-Repo M, Turunen U, Stenman S, Helenius P, Seppälä K. Высокая частота тихих воспалительных заболеваний кишечника при спондилоартропатии.Ревматоидный артрит. 1994; 37: 23–31. [PubMed] [Google Scholar] 64. Rudwaleit M, Metter A, Listing J, Sieper J, Braun J. Воспалительная боль в спине при анкилозирующем спондилите: переоценка истории болезни для применения в качестве критериев классификации и диагностики. Ревматоидный артрит. 2006. 54: 569–578. [PubMed] [Google Scholar] 65. Беннетт PH. Wood PHN популяционные исследования ревматических заболеваний Амстердам. Excerpta Medical Fountation. 1968: 456–457. [Google Scholar] 66. Браун Дж., Сипер Дж. Ранняя диагностика спондилоартрита.Nat Clin Pract Rheumatol. 2006; 2: 536–545. [PubMed] [Google Scholar] 67. Клиппель Дж. Х., Стоун Дж. Х., Кроффорд Л. Дж., Уайт РН. 13-е издание. Нью-Йорк: Спрингер; 2008. Букварь по ревматическим заболеваниям; С. 204–205. [Google Scholar] 68. Хамерсма Дж., Кардон Л. Р., Брэдбери Л. и др. Определена ли тяжесть болезни при анкилозирующем спондилите генетически? Ревматоидный артрит. 2001; 44: 1396–1400. [PubMed] [Google Scholar] 69. Браун М.А. Генетика анкилозирующего спондилита, не связанная с комплексом мажорной гистосовместимости. Лучшая практика Res Clin Rheumatol.2006. 20: 611–621. [PubMed] [Google Scholar] 70. Браун М.А., Брофи С., Брэдбери Л. и др. Выявление основных локусов, контролирующих клинические проявления анкилозирующего спондилита. Ревматоидный артрит. 2003. 48: 2234–2239. [PubMed] [Google Scholar] 71. Fornaciari G, Salvarani C, Beltrami M, Macchioni P, Stockbrügger RW, Russel MG. Скелетно-мышечные проявления при воспалительном заболевании кишечника. Можно J Гастроэнтерол. 2001; 15: 399–403. [PubMed] [Google Scholar] 72. Орчард Т.Р., Тиягараджа С., Валлийский К.И., Вордсворт Б.П., Хилл Гастон Д.С., Джуэлл Д.П.Клинический фенотип связан с генотипом HLA при периферических артропатиях воспалительного заболевания кишечника. Гастроэнтерология. 2000. 118: 274–278. [PubMed] [Google Scholar] 73. Кувелье CA, Quatacker J, Mielants H, De Vos M, Veys E, Roels HJ. М-клетки повреждаются и их количество увеличивается в воспаленной слизистой оболочке подвздошной кишки человека. Гистопатология. 1994; 24: 417–426. [PubMed] [Google Scholar] 74. Salmi M, Andrew DP, Butcher EC, Jalkanen S. Двойная связывающая способность иммунобластов слизистой оболочки со слизистой оболочкой и синовиальным эндотелием у людей: анализ молекулярных механизмов.J Exp Med. 1995. 181: 137–149. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Ван ден Брук MF, Ван де Путте LB, Ван ден Берг WB. Болезнь Крона, связанная с артритом: возможная роль перекрестной реактивности между кишечными бактериями и хрящом в патогенезе артрита. Ревматоидный артрит. 1988; 31: 1077–1079. [PubMed] [Google Scholar] 76. Эльваут Д., Де Кейзер Ф., Ван ден Бош Ф. и др. Обогащение Т-лимфоцитов, несущих интегрины бета7, в воспаленной синовиальной ткани пациентов с ранней спондилоартропатией по сравнению с ревматоидным артритом.J Rheumatol. 1998; 25: 1932–1937. [PubMed] [Google Scholar] 77. Салми М., Ялканен С. Субпопуляции лейкоцитов человека из воспаленного кишечника связываются с сосудистой сетью суставов с использованием различных наборов молекул адгезии. J Immunol. 2001; 166: 4650–4657. [PubMed] [Google Scholar] 78. May E, Märker-Hermann E, Wittig BM, Zeitz M, Meyer zum Büschenfelde KH, Duchmann R. Идентичные разрастания Т-клеток в слизистой оболочке толстой кишки и синовиальной оболочке пациента с энтерогенной спондилоартропатией. Гастроэнтерология. 2000; 119: 1745–1755. [PubMed] [Google Scholar] 79.Кауфман Х. Л., Фишер А. Х., Кэрролл М., Беккер Дж. М.. Язвы толстой кишки, связанные с приемом нестероидных противовоспалительных препаратов. Отчет о трех случаях. Dis Colon Rectum. 1996; 39: 705–710. [PubMed] [Google Scholar] 80. Кауфманн Х.Дж., Таубин Х.Л. Нестероидные противовоспалительные препараты активируют вялое воспалительное заболевание кишечника. Ann Intern Med. 1987; 107: 513–516. [PubMed] [Google Scholar] 81. О’Брайен Дж. Нестероидные противовоспалительные препараты у пациентов с воспалительным заболеванием кишечника. Am J Gastroenterol. 2000; 95: 1859–1861.[PubMed] [Google Scholar] 82. Смейл С., Натт Р.С., Орчард Т.Р., Рассел А.С., Бьярнасон И. Воспалительное заболевание кишечника и спондилоартропатия. Ревматоидный артрит. 2001; 44: 2728–2736. [PubMed] [Google Scholar] 83. Сандборн В.Дж., Стенсон В.Ф., Брынсков Дж. И др. Безопасность целекоксиба у пациентов с язвенным колитом в стадии ремиссии: рандомизированное плацебо-контролируемое пилотное исследование. Clin Gastroenterol Hepatol. 2006; 4: 203–211. [PubMed] [Google Scholar] 84. Biancone L, Tosti C, Geremia A и др. Рофекоксиб и ранний рецидив воспалительного заболевания кишечника: открытое исследование.Алимент Pharmacol Ther. 2004. 19: 755–764. [PubMed] [Google Scholar] 85. Де Кейзер Ф., Ван Дамм Н., Де Вос М., Миелантс Х., Вейс Э.М. Возможности иммунной модуляции при спондилоартропатиях с особым упором на воспаление кишечника. Inflamm Res. 2000; 49: 47–54. [PubMed] [Google Scholar] 86. Ван ден Бош Ф., Круитхоф Э., Де Вос М., Де Кейзер Ф., Миелантс Х. Болезнь Крона, связанная со спондилоартропатией: влияние блокады ФНО-альфа инфликсимабом на суставные симптомы. Ланцет. 2000; 356: 1821–1822.[PubMed] [Google Scholar] 87. Дженерини С., Джакомелли Р., Феди Р. и др. Инфликсимаб при спондилоартропатии, связанной с болезнью Крона: открытое исследование эффективности индукции и поддержания ремиссии скелетно-мышечных и кишечных проявлений. Ann Rheum Dis. 2004. 63: 1664–1669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 88. Риспо А., Скарпа Р., Ди Джироламо Э. и др. Инфликсимаб в лечении внекишечных проявлений болезни Крона. Scand J Rheumatol. 2005; 34: 387–391. [PubMed] [Google Scholar] 89.Марцо-Ортега Х, МакГонагл Д., О’Коннор П., Эмери П. Эффективность этанерцепта для лечения спондилоартрита, связанного с Кроном, но не колита. Ann Rheum Dis. 2003. 62: 74–76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 90. Ханауэр С.Б., Панес Дж., Полковник Дж. Ф., Блумфилд Р., Шрайбер С., Сандборн В. Дж.. Клинические испытания: влияние предшествующей терапии инфликсимабом на клинический ответ на поддерживающую терапию цертолизумабом пеголом при болезни Крона. Алимент Pharmacol Ther. 2010. 32: 384–393. [PubMed] [Google Scholar] 91.Сандборн В.Дж., Абреу М.Т., Д’Хаенс Дж. И др. Цертолизумаб пегол у пациентов с болезнью Крона от умеренной до тяжелой степени и вторичной неэффективностью инфликсимаба. Clin Gastroenterol Hepatol. 2010. 8: 688–695. [PubMed] [Google Scholar] 92. Аллез М., Вермейр С., Моззиконачи Н. и др. Эффективность и безопасность третьего моноклонального антитела против TNF при болезни Крона после неэффективности двух других антител против TNF. Алимент Pharmacol Ther. 2010; 31: 92–101. [PubMed] [Google Scholar]Лечение артрита у пациентов с воспалительным заболеванием кишечника
G&H Как часто артрит возникает у пациентов с воспалительным заболеванием кишечника?
TRO Есть 2 типа проблем с суставами, которые могут возникнуть у пациентов с воспалительным заболеванием кишечника (ВЗК): артрит, то есть воспаление, и артралгия, то есть боль без воспаления.Артралгия чаще встречается у пациентов с ВЗК и встречается у 40-50% пациентов, что аналогично показателю среди населения в целом; артрит встречается примерно у 15-20% пациентов с болезнью Крона (БК) и примерно у 10% пациентов с язвенным колитом (ЯК) на некоторых стадиях их течения.
G&H Какие типы артритов наиболее распространены у пациентов с ВЗК?
TRO Приблизительно 60–70% артритов, наблюдаемых у пациентов с ВЗК, — это периферический артрит, при котором поражаются большие суставы, и этот артрит обычно является олигоартритом, что означает поражение менее 5 суставов.Наиболее часто поражаются колени, лодыжки, запястья, локти и бедра. Меньшая часть пациентов с ВЗК страдает симметричным полиартритом, симптомы которого аналогичны ревматоидному артриту; у этих пациентов может развиться воспаление любых суставов, но обычно поражаются мелкие суставы рук. Наконец, у 1-6% всех пациентов с ВЗК развивается анкилозирующий спондилит, который представляет собой прогрессирующую воспалительную артропатию, поражающую крестцово-подвздошные суставы и позвоночник. У этих пациентов со временем развивается постепенное сращение позвоночника.В то время как артрит крупных суставов почти всегда связан с активной ВЗК, анкилозирующий спондилит и полиартрит мелких суставов могут обостряться независимо от ВЗК пациента.
G&H Чем отличается артрит у пациентов с ВЗК от артрита в общей популяции?
TRO Артрит, который возникает у пациентов с ВЗК, очень отличается от ревматоидного артрита. Пациенты с ревматоидным артритом страдают эрозивной и деформирующей артропатией, которая постепенно разрушает суставы, и некоторым из этих пациентов требуется операция по замене суставов.Напротив, артрит, связанный с ВЗК, не является эрозивным или деформирующим и не должен вызывать долговременного повреждения суставов. Как правило, пациенты с ВЗК с периферическим артритом обращаются с острыми, горячими, опухшими суставами и с артритом крупных суставов, пациенты часто жалуются на боль и припухлость, которые переходят от сустава к суставу. По сравнению с артритом крупных суставов периферический полиартрит имеет тенденцию быть более стойким, длится 1-2 года и постоянно поражает одни и те же суставы.
В некоторых случаях клиницисты могут ошибочно принять артрит крупных суставов за реактивный артрит, который является типом артрита, который может развиваться в ответ на инфекции, например, инфекции Shigella или Yersinia в кишечнике или хламидийные инфекции мочеполовая система.В этих случаях диагноз иногда может быть довольно запутанным, поскольку реактивный артрит в контексте кишечной инфекции может очень сильно имитировать артрит, который возникает у пациентов с ВЗК. У пациентов, у которых известно о ВЗК, проявление диареи и артрита может быть связано с реактивным артритом, вторичным по отношению к инфекции кишечника, или это может быть обострение ВЗК, связанное с артритом. Для пациентов, у которых неизвестно наличие ВЗК, это клиническое проявление может быть первым признаком ВЗК, поскольку проблемы с суставами являются первым симптомом заболевания у некоторых пациентов с ВЗК.
G&H Как тип ВЗК влияет на развитие артрита?
TRO Паттерны артрита фактически одинаковы при БК и ЯК; однако, похоже, что артрит при БК чаще встречается, чем при ЯК. Пациенты с CD, поражающим толстую кишку, вероятно, больше всего страдают артритом. Некоторые данные свидетельствуют о том, что наиболее важными областями кишечника с точки зрения развития артрита являются правая часть толстой кишки и нижняя часть тонкой кишки, но эта связь окончательно не продемонстрирована.
G&H Какой механизм лежит в основе развития артрита у пациентов с ВЗК?
TRO Развитие артрита у этих пациентов определенно связано с генетическим компонентом, который, вероятно, делает пациентов восприимчивыми к микробиоте просвета, которая может вызвать артрит. Артрит, связанный с ВЗК, классифицируется как серонегативная спондилоартропатия; все состояния в этой группе включают развитие артрита без присутствия аутоантител, и все эти состояния связаны с повышенным риском развития анкилозирующего спондилита.Известно, что анкилозирующий спондилит тесно связан с HLA-B27 , который является частным вариантом гена HLA , который контролирует иммунный ответ, а периферический артрит у пациентов с ВЗК также связан с HLA-B27 , хотя менее сильно; эта общая ассоциация, вероятно, объясняет рост заболеваемости анкилозирующим спондилитом среди пациентов с серонегативной спондилоартропатией. Однако периферический артрит у пациентов с ВЗК имеет еще более сильную связь с редким аллелем HLA , называемым HLA-DR103 .Этот аллель присутствует примерно у 35% пациентов с артритом крупных суставов и до 65% пациентов, у которых наблюдается более 1 эпизода артрита крупных суставов. Для сравнения, этот аллель встречается только у 1–3% населения в целом. Как эта генетическая ассоциация приводит к развитию артрита у пациентов с ВЗК, в значительной степени является предположением. Моя гипотеза заключается в том, что эпизодические приступы артрита вызываются сочетанием протекающего воспаленного кишечника, которое обнаруживается при ВЗК, плюс генетическая предрасположенность к определенным бактериям, с которыми могут столкнуться пациенты.Эта восприимчивость определяется генами HLA (и, возможно, другими генами), унаследованными пациентами, и позволяет развиваться неконтролируемому воспалительному ответу, особенно нацеленному на суставы.
Интересно, что анкилозирующий спондилит очень сильно связан с HLA-B27 в целом (более 90% пациентов с идиопатическим анкилозирующим спондилитом обладают этим аллелем), но эта связь на самом деле намного слабее среди пациентов с ВЗК (50-80% ).Моя интерпретация этого открытия заключается в том, что генетическая ассоциация между HLA-B27, и анкилозирующим спондилитом менее важна для пациентов с ВЗК из-за восприимчивости окружающей среды, обусловленной воспалением кишечника. Таким образом, если пациенты имеют генетическую предрасположенность ( HLA-B27 ), которая делает их предрасположенными к анкилозирующему спондилиту, то вероятность развития этого состояния у них составляет 1-10%. Если у них воспаление кишечника, которое делает кишечник очень проницаемым, тогда их иммунная система подвергается воздействию многих антигенов, с которыми они иначе не столкнулись бы, и ВЗК может вызвать анкилозирующий спондилит в отсутствие HLA-B27 .Если пациенты имеют комбинацию HLA-B27, и дырявого кишечника, то их шансы на развитие аксиального артрита очень высоки: в небольшом исследовании, проведенном мной и моими соавторами, магнитно-резонансная томография показала аномалии в крестцово-подвздошных суставах в каждом из них. одинокий человек, у которого были как HLA-B27, , так и диагноз CD. Таким образом, развитие артрита, вероятно, является результатом как генетической предрасположенности, так и воздействия просветных бактерий, но прямых механистических доказательств, подтверждающих эту гипотезу, пока нет.
G&H Какие методы лечения ВЗК с наибольшей вероятностью принесут пользу в плане уменьшения симптомов артрита у пациентов?
TRO Методы лечения, которые врачи обычно используют для лечения анкилозирующего спондилита, совпадают с терапией ВЗК; в частности, препараты против фактора некроза опухолей (TNF), такие как инфликсимаб (Remicade, Janssen Biotech), адалимумаб (Humira, Abbott) и цертолизумаб пегол (Cimzia, UCB), эффективны для обоих состояний.Стероиды не особенно эффективны для лечения анкилозирующего спондилита, а иммуномодуляторы не помогают при осевом заболевании, хотя могут помочь при лечении периферического артрита.
Некоторые данные предполагают, что сульфасалазин может быть лучшим противовоспалительным препаратом, чем месаламин, при периферическом артрите, связанном с ВЗК, но это преимущество не было окончательно доказано. Стероиды, очевидно, обладают противовоспалительным действием на периферические суставы и могут быть довольно эффективными, но эти препараты имеют существенные долгосрочные побочные эффекты, поэтому количество стероидов, назначаемых пациентам с ВЗК, должно быть минимальным.Опять же, препараты против TNF-α очень эффективны для пациентов, у которых есть вызывающий беспокойство и стойкий воспалительный артрит, связанный с ВЗК.
G&H Какие дополнительные методы лечения могут быть добавлены для лечения артрита у пациентов с ВЗК?
TRO В общем, врачи должны стараться использовать противовоспалительные препараты, которые могут лечить проблемы с суставами, а также приносить пользу кишечнику. Артрит крупных суставов обычно проходит после того, как заболевание кишечника находится под контролем, поэтому врачам редко приходится добавлять лекарства помимо тех, которые используются для лечения основного заболевания кишечника.Для пациентов с более стойким артритом, например полиартритом мелких суставов, может оказаться эффективным добавление иммунодепрессанта, такого как метотрексат или, возможно, азатиоприн. У некоторых пациентов с активным заболеванием кишечника заболевание суставов может быть фактором, который заставляет клинициста начать биологическую терапию.
G&H Какие препараты противопоказаны этой группе населения?
TRO Нестероидные противовоспалительные препараты (НПВП) являются основной группой препаратов, которых следует избегать у пациентов с ВЗК.Имеющиеся данные свидетельствуют о том, что эти препараты могут вызывать обострения основной ВЗК, поэтому я бы не рекомендовал использовать НПВП для лечения артрита, если ВЗК у пациента активна. Если у пациента хроническая ВЗК и боли в суставах очень беспокоят, врачи могут с осторожностью попробовать НПВП; в этой ситуации клиницистам необходимо информировать пациентов о риске поражения кишечника при приеме препарата.
G&H Сколько исследований доступно в отношении лечения артрита у пациентов с ВЗК?
TRO Небольшая серия случаев терапии анти-TNF α при артропатиях, связанных с воспалительным заболеванием кишечника, была опубликована в журнале The Lancet в 2000 г., который продемонстрировал у 4 пациентов, что суставные проявления эффективно лечились блокадой TNF α, и В статье, опубликованной в журнале Alimentary Pharmacology & Therapeutics в 2003 г., рассматривались ингибиторы циклооксигеназы-2 (ЦОГ-2) как средство лечения артрита, связанного с ВЗК.Это последнее исследование с использованием рофекоксиба показало, что этот препарат был достаточно безопасным, но только у 41% пациентов был клинический ответ на препарат с точки зрения их артрита. Однако более позднее исследование антагонистов ЦОГ-2 в целом у пациентов с ВЗК показало, что эти препараты были связаны с высоким риском рецидива ВЗК — в дополнение к проблемам безопасности, которые более широко поднимаются этим классом лекарств. Несколько лет назад я и мои соавторы провели генетические исследования в Оксфорде, в ходе которых мы рассмотрели возможные механизмы артрита у пациентов с ВЗК, и в 2009 году мы опубликовали исследование в журнале Alimentary Pharmacology & Therapeutics , в котором мы оценивали риск анкилозирующего спондилита среди пациенты с CD.
Помимо этих небольших исследований, очень мало исследований было сосредоточено на лечении ВЗК и артрита, отчасти потому, что набор пациентов для таких исследований затруднен: хотя 10-20% пациентов разовьются артритом на какой-то стадии в течение их болезни. , этот артрит носит эпизодический характер, поэтому собрать достаточное количество пациентов для исследования на самом деле довольно сложно. Кроме того, поскольку артрит, который возникает у пациентов с ВЗК, не является эрозивным или деформирующим, он не имеет серьезных долгосрочных последствий, которые можно было бы изучить.
G&H Какие дальнейшие исследования необходимы в отношении лечения артрита у пациентов с ВЗК?
TRO Возможно, наиболее насущной необходимостью являются дальнейшие исследования того, как развивается анкилозирующий спондилит у пациентов с ВЗК. Хотя периферический артрит может быть очень неприятным, только очень небольшая часть пациентов страдает периферическим артритом, который является стойким и изнуряющим в течение длительных периодов времени; Напротив, анкилозирующий спондилит — это пожизненное прогрессирующее заболевание, которое может быть весьма изнурительным.Я думаю, что понимание взаимосвязи между воспалением кишечника и развитием анкилозирующего спондилита будет ключом к этому исследованию; Таким образом, большое значение будут иметь исследования проницаемости кишечника, воспаления и бактерий в просвете, чтобы увидеть, как эти факторы могут вызвать анкилозирующий спондилит. Кроме того, исследования уже показали, что аллель HLA-DR103 является сильной генетической детерминантой артрита у пациентов с ВЗК, поэтому логичным шагом было бы выяснить, что вызывает артрит у пациентов, у которых есть этот аллель.
Периферические артропатии при воспалительном заболевании кишечника: их суставное распределение и естественное течение
Опорно-двигательные осложнения хорошо известны как при язвенном колите, так и при болезни Крона. Они включают периферический и осевой синдромы и обычно считаются частью более широкой группы серонегативных спондилоартропатий, 1-3 , включая идиопатический анкилозирующий спондилит, реактивный артрит и псориатический артрит.
Идиопатический анкилозирующий спондилит характеризуется поражением осевого скелета анкилозом, но также может иметь место поражение периферических суставов.Это связано с наличием HLA-B27 более чем в 90% случаев.4 Анкилозирующий спондилит также может осложнять воспалительное заболевание кишечника (ВЗК), но здесь сила связи HLA-B27, как сообщается, меньше (50–70% случаев) .5-7 Изолированный сакроилеит (который может протекать бессимптомно) также был описан при ВЗК, но у этих пациентов не выявлено связи с B27.
Периферические артропатии, связанные с ВЗК, встречаются у 5–20% пациентов8–11, и было описано несколько паттернов поражения суставов, от паучуставной артропатии большого сустава до симметричной полиартропатии маленького сустава.Пропорция каждого исследования различается между исследованиями.8-10 Они являются серонегативными, неэрозивными и обычно не деформирующими, но их клиническое течение и долгосрочные исходы плохо охарактеризованы. , 12 Кроме того, не было показано никакой связи между периферическими артропатиями и HLA-B27 при IBD6. , 13 , 14 несмотря на очевидное сходство между артропатией крупных суставов и пост-дизентерийным реактивным артритом (при котором 70% пациентов являются HLA-B27-положительными) 15.
Оксфорд, Великобритания, является крупным вторичным и третичным центром по лечению ВЗК и имеет большое количество пациентов.В этом исследовании мы идентифицировали всех пациентов с симптомами периферических суставов при отсутствии аксиальной болезни, которые посещают клинику Оксфордского ВЗК. Мы изучили естественную историю заболевания периферических суставов и связи с другими внекишечными проявлениями и заболеванием кишечника в зависимости от характера поражения суставов. Мы проанализировали долгосрочную историю поражения периферических суставов при ВЗК.
Методы
Были проанализированы истории болезни всех пациентов, посещающих клинику ВЗК в Оксфорде, и предоставлена информация об общем характере заболевания кишечника (диагноз, возраст на момент постановки диагноза, степень заболевания, хирургическое вмешательство), внекишечных проявлениях (узловатая эритема, увеит). , гангренозная пиодермия), наличие псориаза и артропатии было абстрагировано.Регистрировали характер поражения суставов, наличие отека или выпота суставов, продолжительность симптомов, количество эпизодов и наличие боли в пояснице. Также были отмечены сопутствующие заболевания суставов, такие как серопозитивный ревматоидный артрит, псориатический артрит, остеоартрит и подагра. Кроме того, все пациенты, посещавшие клинику ВЗК, ответили на прямой вопросник, который проводился во время плановых контрольных посещений в амбулаторной клинике, чтобы подтвердить данные регистрационной записи .
Пациенты с известным анкилозирующим спондилитом (критерии Нью-Йорка), 16 сакроилеитом или симптомами, указывающими на воспалительную боль в спине, были исключены из анализа периферических артропатий, как и пациенты с сопутствующим заболеванием суставов, которое могло объяснить их симптомы.Остальные пациенты с симптомами периферических суставов были классифицированы в соответствии с количеством суставов, пораженных одновременно, и наличием отека или выпота:
- (1)
- артропатия 1 типа (малосуставная) включала пациентов с менее чем пятью суставами. связаны с признаками отека суставов или излияний;
- (2)
- Тип 2 (полиартикулярная) артропатия включала пациентов с поражением пяти или более суставов с признаками отека или выпота суставов.
Определения полусуставных и полиартикулярных были выбраны в соответствии со стандартными ревматологическими определениями. Пациенты с нечетко выраженными суставными симптомами или симптомами без объективных доказательств отека или выпота суставов были классифицированы как страдающие артралгией и не подвергались дальнейшему анализу.
Затем сравнивали естественное течение, суставное распределение и возникновение других осложнений, чтобы проверить гипотезу о том, что артропатии типа 1 и типа 2 различаются по времени и что частота других внекишечных особенностей различается между пациентами с артропатией и без нее.Достоверность различий между группами проверялась с помощью таблиц сопряженности 2 × 2 и критерия χ 2 с поправкой Йейтса.
Результаты
Таблицы 1 и 2 показывают общие характеристики популяции ВЗК. Только у трех пациентов с язвенным колитом и у одного с болезнью Крона был диагностирован псориаз. Сопутствующее заболевание суставов присутствовало у 83 пациентов с язвенным колитом и у 21 с болезнью Крона и включало остеоартрит, серопозитивный ревматоидный артрит, подагру, проблемы с поясничным диском и травмы.Ревматоидный фактор был проверен у 82% пациентов с артропатией 2 типа и во всех случаях был отрицательным. В обеих группах периферической артропатии ни у одного пациента не было деструктивных костных поражений, и клиническое течение не было совместимо ни с ревматоидными, ни с кристаллическими артропатиями, и ни один из пациентов не нуждался в замене суставов. В таблице 3 показана распространенность заболеваний суставов, связанных с ВЗК. Данные о воспалительной боли в спине и анкилозирующем спондилите включены для полноты картины, но не анализировались в контексте периферических артропатий.У женщин была значительно выше вероятность развития артропатии как 1-го (p = 0,009), так и 2-го типа (p = 2,3 × 10 −5 ). Анкилозирующий спондилит встречался у 0,9% пациентов с язвенным колитом и у 1,2% пациентов с болезнью Крона, 50% из которых имели поражение периферических суставов. Средняя продолжительность наблюдения за пациентами с периферической артропатией (10,1 года при язвенном колите и 10,3 года при болезни Крона) была аналогична таковой в популяции в целом (10,7 года при язвенном колите и 10 лет при язвенном колите).2 года при болезни Крона).
Таблица 1Общая характеристика популяции воспалительного заболевания кишечника
Таблица 2Степень заболеваемости язвенным колитом и болезнью Крона
Таблица 3Осложнения суставов при воспалительном заболевании кишечника
В небольшом количестве случаев артропатия предшествовала диагнозу ВЗК или присутствовал во время постановки диагноза. При артропатии 1 типа пять (14%) из 35 пациентов с язвенным колитом и три (10%) из 29 пациентов с болезнью Крона имели острую самоограничивающуюся артропатию за 10–36 месяцев до постановки диагноза.Еще у шести (17%) из 35 пациентов с язвенным колитом и у четырех (14%) из 29 пациентов с болезнью Крона он присутствовал на момент постановки диагноза. Артропатия 2 типа редко проявлялась до постановки диагноза язвенного колита (n = 1) или во время постановки диагноза (n = 1). У двух (10%) из 20 пациентов с болезнью Крона артропатия развивалась до постановки диагноза, а еще у пяти (25%) она присутствовала на момент постановки диагноза. Таким образом, у большинства пациентов развивались суставные осложнения после того, как был поставлен диагноз ВЗК, и в целом вероятность развития суставных осложнений не увеличивалась с увеличением продолжительности наблюдения.
На рисунке 1 показано распределение периферических артропатий. Артропатия 1 типа была асимметричной у 80% пациентов с язвенным колитом и у 76% пациентов с болезнью Крона. Напротив, артропатия 2 типа была симметричной у 83% пациентов с язвенным колитом и 79% пациентов с болезнью Крона — значительная разница для обоих заболеваний с p = 5,9 × 10 −6 при язвенном колите и p = 0,0006 при язвенном колите. Болезнь Крона. Наиболее часто при артропатии типа 1 поражалось колено как при язвенном колите, так и при болезни Крона; очень редко поражались мелкие суставы рук.При артропатии 2 типа чаще всего поражались пястно-фаланговые суставы (МПС), но также поражалось большое количество других суставов.
Рисунок 1Распределение суставов периферических артропатий при воспалительном заболевании кишечника. ЯК, язвенный колит; CD — болезнь Крона; MCP — пястно-фаланговый сустав; PIP, проксимальный межфаланговый сустав; ДИП, дистальный межфаланговый сустав; MTP, плюснефаланговый сустав.
В таблице 4 показано естественное течение периферических артропатий.Тип 1 значительно чаще связан с рецидивом ВЗК, чем тип 2 как для язвенного колита, так и для болезни Крона. Точно так же тип 1 встречается значительно чаще в виде острых, самоограничивающихся эпизодов, чем тип 2 при язвенном колите (83% против 13%, p = 2,6 × 10 -8 ) и болезни Крона (79% против 11%). , p = 1,2 × 10 −7 ). Эти эпизоды всегда длились менее 10 недель и приводили к исчезновению суставных симптомов. Однако количество эпизодов было выше при болезни Крона: у четырех пациентов с болезнью Крона было более трех эпизодов, тогда как ни у одного из пациентов с язвенным колитом не было более трех.Артропатия 2 типа обычно имела более стойкие симптомы, длящиеся в среднем три года как при язвенном колите, так и при болезни Крона.
Таблица 4Естественная история периферических артропатий 1 и 2 типов
Распределение поражения кишечника при язвенном колите было одинаковым у пациентов с артропатией и без нее. При болезни Крона наблюдалась тенденция к большему поражению толстой кишки артропатией 1 типа, но это не было статистически значимым.
Заболевание суставов требовало лечения в подавляющем большинстве случаев (97% типа 1 и 95% типа 2).Двадцати процентам пациентов с обоими типами артропатии требовалось только простое обезболивание. Однако 40% пациентов с артропатией 1-го типа и 55% с артропатией 2-го типа нуждались в лечении нестероидными противовоспалительными препаратами (НПВП), а в трех случаях артропатии 1-го типа это предшествовало появлению кишечных симптомов. Значительная часть пациентов также получала лечение глюкокортикоидами (27% с типом 1 и 25% с типом 2). Сульфасалазин широко использовался при спондилоартропатиях, но, поскольку большинство пациентов уже принимали его при ВЗК, его эффекты, модифицирующие симптомы, было невозможно проанализировать при артропатии ВЗК.
Обнаружена значимая связь между артропатией 1 типа и узловатой эритемой и увеитом при язвенном колите или болезни Крона, а также связь только между типом 2 и увеитом (таблица 5). Наблюдалась тенденция к увеличению количества операций у пациентов с артропатией и язвенным колитом, что было значимым для типа 1, если в исследование были включены пациенты, у которых развилась артропатия после операции на подвздошной кишке (p = 0,013). Напротив, пациенты с болезнью Крона и артропатией 1 типа значительно реже нуждались в хирургическом вмешательстве (p = 0.0004). Мы чувствовали, что это может отражать разницу в распространении заболевания в кишечнике между пациентами с заболеваниями суставов и без них. Однако не было значительных различий в степени заболевания язвенным колитом или болезнью Крона между пациентами с артропатией и без нее.
Таблица 5Связь с другими признаками заболевания
Обсуждение
Это исследование показывает, что периферическая артропатия является относительно частым осложнением ВЗК, которое часто требует модификации лечения и часто использования противовоспалительных препаратов, которые сами могут влиять на заболевание кишечника. .Это также предполагает, что с клинической точки зрения разумно подразделить энтеропатическую периферическую артропатию, связанную с ВЗК, в соответствии с критериями, указанными в рамке.
Классификация энтеропатической периферической артропатии
Тип 1 (малосуставной)
Менее 5 суставов
Острые, самоограничивающиеся приступы (<10 недель)
Часто совпадают с рецидивами ВБК
Сильно связан с внекишечными проявлениями ВЗК
Тип 2 (полиартикулярный)
Пять или более суставов
Симптомы обычно сохраняются от месяцев до лет
Проходит курс, не зависящий от ВЗК
Связано с увеитом, но не с другими внекишечными проявлениями
Клинически артропатия 1 типа схожа с постдизентерийным реактивным артритом, у большинства пациентов наблюдается самоограничивающееся заболевание, но примерно у 20% возникают постоянные проблемы.17 Артропатия обычно связана с острым рецидивом ВЗК и поддается лечению стероидами и НПВП. В некоторых случаях лечение НПВП начиналось до острого рецидива, что повышает вероятность того, что в небольшом количестве случаев прием НПВП мог быть причиной последующего рецидива. Артропатия 1 типа также тесно связана с другими внекишечными проявлениями, такими как узловатая эритема и увеит.
Естественное течение и клинические ассоциации артропатии 2 типа различаются, особенно если игнорировать пациентов с острым, самоограничивающимся заболеванием суставов (на них приходится два из четырех случаев увеита и один из случаев узловатой эритемы при язвенной болезни). колит, и все они поражены крупным суставом).Точно так же при болезни Крона на эту группу приходился один из случаев увеита. Это говорит о том, что либо они были неправильно классифицированы из-за наличия болезненных суставов, которые не были опухшими и, следовательно, не были частью артропатии (то есть сосуществования артрита 1 типа и артралгии), либо что между ними может быть определенное совпадение. синдромы. В подтверждение этой второй возможности у одного пациента, у которого изначально была типичная артропатия 1 типа, впоследствии развилась значительная полиартропатия с отеком суставов.
Хотя оба типа артропатии обычно проявляются после постановки диагноза ВЗК, 31% артропатий типа 1 при язвенном колите и 24% при болезни Крона проявляются за три года до момента постановки диагноза. Недавние исследования показали, что у 6% пациентов с серонегативной спондилоартропатией разовьется ВЗК, но что у пациентов с нормальной гистологией кишечника на момент артропатии ВЗК не развивается. , 19 Таким образом, может показаться хорошей клинической практикой получение пробы ректальной биопсии у всех пациентов с острым «реактивным» артритом, особенно если он связан с диареей, и следует продолжить исследование кишечника, если нарушение кишечника не проходит.Артропатия 2 типа предшествовала диагностике болезни Крона у двух пациентов, но диагноз был поставлен в течение шести месяцев в рамках общего клинического обследования.
Предыдущие исследования периферической артропатии при ВЗК не показали какой-либо связи с обладанием HLA-B27,6 , 7 , 13 , 14 но их количество было небольшим, и все случаи заболевания периферических суставов рассматривались как единое целое, тогда как наше исследование предполагает, что эти две артропатии следует рассматривать отдельно. В контексте других серонегативных артритов сходство между артропатией 1 типа в этом исследовании и реактивным артритом позволяет предположить, что связь с HLA-B27 вероятна.В отличие от этого, артропатия 2-го типа кажется отдельной сущностью.
Мы считаем, что причиной ВЗК, вероятно, является взаимодействие между генетической предрасположенностью и факторами окружающей среды.20 Также вероятно, что существует генетическая гетерогенность внутри заболевания, которая определяет его фенотипические характеристики, 20 , 21хотя определение точных фенотипических связей было трудным. Это исследование демонстрирует существование двух различных форм периферической артропатии при ВЗК, которые можно разделить с помощью простой классификации.Использование этой системы может помочь предсказать клиническое течение заболевания суставов и может быть использовано в качестве основы для дальнейших исследований его этиологии.
Благодарности
Доктор Орчард получил грант от Национальной ассоциации по болезни Крона и колита (NACC).
Периферический артрит может возникнуть в любой момент во время новой аксиальной SpA
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Среди пациентов с недавно начавшимся аксиальным спондилоартритом 36% сообщили о развитии периферического артрита в любое время в течение всего периода болезни, причем эти пациенты демонстрируют большее бремя болезни, чем пациенты без периферического артрита, согласно недавним результатам в Arthritis Research & Therapy .
«Артрит и энтезит являются наиболее частыми периферическими признаками axSpA и могут быть обнаружены преимущественно в нижних конечностях», — написали Клементина Лопес-Медина, доктор медицинских наук, из больницы Кочин, Париж, и ее коллеги. «Распространенность периферического артрита хорошо описана у пациентов с [анкилозирующим спондилитом] с процентным соотношением от 22 до 30%. Однако распространенность этого проявления во всей группе axSpA варьируется между разными когортами. …Большинство этих данных относятся только к базовым визитам, и очень немногие исследования оценивают время появления этой клинической особенности во время последующего наблюдения ».
Чтобы охарактеризовать распространенность и частоту периферического артрита в течение 5 лет наблюдения после недавно начавшегося axSpA, а также изучить факторы, связанные с их развитием, и измерить их влияние на лечение и результаты, Лопес-Медина и его коллеги проанализировали данные Когорта Devenir des Spondylarthropathies Indifferenciées Récentes (DESIR).По словам исследователей, когорта DESIR включает 708 пациентов в возрасте от 18 до 50 лет с ранней воспалительной болью в спине, набранных из 25 центров по всей Франции. Пациенты, ранее принимавшие биопрепараты, были исключены.
Согласно недавним данным, 36% пациентов с недавно начавшимся аксиальным спондилоартритом сообщили о развитии периферического артрита в любое время в течение их болезни.
Источник: Adobe
Посещений этих пациентов было запланировано каждые 6 месяцев в течение первых 2 лет, а затем ежегодно.
Исследователи сосредоточили свое внимание на первых 5 годах наблюдения в когорте DESIR. Для каждого визита они рассчитывали распространенность и частоту периферического артрита и использовали многомерный анализ для анализа исходных факторов, связанных с артритом. Кроме того, они сравнили употребление наркотиков, результаты, сообщаемые пациентами, и использование отпусков по болезни между людьми с периферическим артритом и без него.
По данным López-Medina и его коллег, 36% из 708 включенных пациентов продемонстрировали по крайней мере один случай артрита, в том числе 151, у которых было заболевание до посещения включения, и 104, у которых оно развилось в течение периода последующего наблюдения.Исследователи пишут, что это соответствует уровню заболеваемости 3,7 случая на 100 человеко-лет.
Исследователи также обнаружили, что пациенты с периферическим артритом чаще были в возрасте 33 лет и старше (OR = 1,6; 95% ДИ, 1,12–2,27), некурящими (OR = 1,58; 95% ДИ, 1,1–2,27) и HLAB27- отрицательный (OR = 1,47; 95% ДИ 1,04–2,08). У них также более вероятно, что у них был хотя бы один случай дактилита (OR = 8,5; 95% ДИ, 4,96–14,6) и энтезита (OR = 2; 95% ДИ, 1,41–2,84).
Кроме того, пациенты с периферическим артритом продемонстрировали значительно большее использование ингибиторов ФНО, обычных синтетических БПВП и кортикостероидов во время последующего наблюдения по сравнению с пациентами без них. Они также получили более высокие баллы по индексам BASDAI и BASFI, продемонстрировали более низкое качество жизни и сообщили, что у них больше нет рабочих дней.
«В этом исследовании мы заметили, что периферический артрит может появиться в любой момент во время болезни и связан с высоким бременем болезни (ухудшение качества жизни и появление дней отпуска по болезни)», — написали Лопес-Медина и его коллеги.«Это открытие является причиной, по которой ревматологи должны систематически проверять этот клинический признак во время наблюдения за этими пациентами. Необходимы другие исследования, чтобы подтвердить или опровергнуть эти результаты и лучше понять лежащий в основе патологический процесс ». — Джейсон Ладей
Раскрытие информации : Исследователи не сообщают о раскрытии соответствующей финансовой информации.
Перспектива
Вернуться к началуАлан Л.Эпштейн, MD
Когда мы думаем об осевом спондилоартрите, мы склонны сосредотачиваться на спинальных проявлениях, их естественном течении и реакции на лечение. Следует помнить, что периферический артрит и энтезит также могут быть важными клиническими признаками у пациентов с преимущественно осевым спондилоартритом.
Периферический артрит можно увидеть у 22-30% пациентов с анкилозирующим спондилитом и у 15-20% пациентов с недавно начавшимся аксиальным спондилоартритом на исходном уровне.В когортах пациентов с установленным аксиальным спондилоартритом периферический артрит может наблюдаться у 35-40% пациентов на исходном уровне, демонстрируя повышенную распространенность с течением времени.
У нас очень мало клинической информации о развитии периферического артрита у пациентов с аксиальным спондилоартритом и ответе периферического артрита на лечение. В исследовании Lopez-Medina и его коллег исследователи обнаружили, что 21% пациентов имели признаки периферического артрита на исходном уровне и еще у 19% развился периферический артрит в течение пяти лет наблюдения.У 20% пациентов с периферическим артритом он предшествовал аксиальным симптомам, тогда как у 66% пациентов периферические симптомы следовали за аксиальными.
Периферический артрит может возникнуть в любое время у пациента с преимущественно осевым спондилоартритом и связан с тяжелым бременем болезни. Поэтому клиницисту важно внимательно следить за этой клинической особенностью. Нам все еще нужна дополнительная информация о реакции периферического артрита на лечение.
Алан Л.Эпштейн, MD
Клинический профессор медицины
Медицинский факультет Перельмана
Пенсильванский университет
Член Комитета по медицинской политике
United Rheumatology
Раскрытие информации: Эпштейн не сообщает о раскрытии соответствующей финансовой информации.
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписывайся Нам не удалось обработать ваш запрос. Пожалуйста, попробуйте позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
Распространенность и частота периферического артрита у пациентов с воспалительными заболеваниями кишечника —человек, проспективное популяционное исследование (исследование IBSEN) | Ревматология
«> Материалы и методы
Продолжительность заболевания (мес.) (Средняя) Симптомы 85 84 85 73 74 73 Локализация и распространение заболевания Проктит 100 (28%) Левосторонний колит 122 (35%) Обширный колит 131 (37%) Верхний 9041 (2) желудочно-кишечный тракт Илеит 41 (24%) Колит 62 (37%) Илеоколит
| UC ( n = 353) | CD ( n = 168) | Всего ( n = 521) | Мужчины | 176/177 | 79/89 | 255/266 | |||
| Возраст (лет) [средний (диапазон)] | 46 (15–86) | 39 (16–8 1) | 43 (15–86) | ||||||
| Продолжительность заболевания (мес.) (Средняя) | |||||||||
| Симптомы | 85 | 84 | 85 | 85 | Диагноз | 74 | 73 | ||
| Локализация и распространение заболевания | |||||||||
| Проктит | 100 (28%) | 909 39 | 909 39 Левая сторона | ||||||
| Обширный колит | 131 (37%) | ||||||||
| Верхний желудочно-кишечный тракт | 3 (2%) | 3 (2%) | |||||||
| Колит | 6 2 (37%) | ||||||||
| Илеоколит | 62 (37%) | ||||||||
Характеристики пациентов с ЯК и БК, клинически исследованных
| ЯК ( n = 353) | CD ( n = 168) | Всего ( n = 521) | ||||||||
| Мужчины / женщины | 176/177 | 79/89 | 255/266 | |||||||
| Возраст (лет) [средний (диапазон)] | 46 (15–86) | 39 (16–81 ) | 43 (15–86) | |||||||
| Длительность заболевания (мес.) (Средняя) | ||||||||||
| Симптомы | 85 | 84 | 85 | диагноз | 74 | 73 | ||||
| Локализация и распространение заболевания | ||||||||||
| Проктит | 100 (28%) | Левосторонний колит | 122 (35%) | |||||||
| Обширный колит | 131 (37%) | |||||||||
| Верхний отдел желудочно-кишечного тракта 41 909 909 909 909 909 909 909 909 909 909 | ||||||||||
| Илеит | 41 (24%) | |||||||||
| Колит | 62 (37%) | |||||||||
| 909 909 | ||||||||||
| UC ( n = 353) | CD ( n = 168) | Всего ( n = 521) | ||||
| женщины 176/177 | 79/89 | 255/266 | ||||
| Возраст (лет) [средний (диапазон)] | 46 (15–86) | 39 (16–81) | 43 (15–86) | |||
| Длительность заболевания (мес.) (Средняя) | ||||||
| Симптомы | 85 | 84 | 85 | 73 | ||
| Локализация и распространение болезни | ||||||
| Проктит | 100 (28%) | |||||
| Левая сторона | ||||||
| Обширный колит | 131 (37%) | |||||
| Верхний желудочно-кишечный тракт | 3 (2%) | |||||
| Колит | 62 (37%) | |||||
| Илеоколит | 62 (37%) | |||||
Диагностические критерии и классификация кишечных заболеваний
Применялись единые методы и диагностические критерии.Первоначальная классификация ЯК и БК требовала наличия симптомов, соответствующих ВЗК в течение более 4 недель, за исключением инфекций и других острых или хронических не ВЗК.
Диагноз ЯК был основан на наличии по крайней мере трех из следующих критериев: (1) диарея и / или кровь / гной в стуле в анамнезе; (2) макроскопический вид при эндоскопии с продолжающимся воспалением слизистой оболочки, поражающим прямую кишку вместе с частью или всей толстой кишкой; (3) микроскопические особенности биопсии, совместимые с ЯК; (4) отсутствие подозрений на БК при рентгенографии тонкой кишки, илеоскопии или биопсии [6].
Диагноз CD был основан на установленных критериях [10], а именно: (1) типичные клинические признаки, включая боль в животе, диарею и потерю веса; (2) макроскопический вид при операции или эндоскопии; сегментарные, прерывистые и / или пятнистые поражения с поражением прямой кишки или без, дискретные или афтозные язвы, трещинные и проникающие поражения, булыжник или стриктуры; (3) рентгенологические свидетельства стеноза тонкой кишки, сегментарного колита или свищей; (4) гистологические доказательства трансмурального воспаления или эпителиальных гранулем с гигантскими клетками.Для постановки диагноза БК требовались два или более из этих критериев.
Степень и локализация заболевания толстой кишки были основаны на эндоскопических данных с характерными гистологическими признаками воспаления. Проктит определяли как изменения слизистой оболочки прямой кишки на расстоянии до 15 см от заднего прохода, левосторонний колит до изгиба селезенки и, наконец, воспаление за пределами изгиба селезенки было классифицировано как обширный колит. Когда степень заболевания изменилась во время наблюдения, была зафиксирована максимальная степень поражения кишечника.Больные БК классифицированы по Венской классификации [11].
Диагностические критерии артрита и других внекишечных заболеваний
Артрит определялся как минимум как один анамнестический или текущий эпизод боли, отека и повышения температуры кожи в одном или нескольких суставах. Отдельно регистрировались ПА, диагностированные при клиническом осмотре, и заболевание периферических суставов, диагностированное в анамнезе. Рентген выполняли, когда клинические данные указывали на эрозивный артрит.Диагнозы ревматоидного артрита, псориатического артрита, анкилозирующего спондилита, реактивного артрита и подагры основывались как на настоящих, так и на прошлых клинических данных и соответствовали стандартным диагностическим критериям [12]. ПА считалась связанной с ВЗК, когда были исключены другие причины заболевания суставов. Дактилит был диагностирован, когда присутствовали типичные признаки сосиски пальцев рук или ног из-за воспаления. Энтезопатия диагностировалась при наличии признаков воспаления в месте прикрепления сухожилия к кости без предшествующей инфекции или травмы.
Узловатая эритема диагностировалась при наблюдении болезненных синюшно-красных узелков (в основном на разгибательной стороне конечностей) и гангренозной пиодермии, когда типичные хронические язвы с подорванными некротическими синеватыми краями сохранялись в течение нескольких недель или дольше. Увеит зафиксирован при диагностировании у офтальмолога. Диагноз склерозирующего холангита был основан на типичных данных эндоскопической ретроградной холангиографии.
Этика
Исследование было одобрено Региональным этическим комитетом и Норвежским регистром данных.Конфиденциальность как личности пациента, так и записей сохранялась с использованием руководящих принципов, предложенных Национальным департаментом здравоохранения.
Статистика
Для статистического анализа использовались точный критерийФишера и критерий χ 2 , а значение P менее 0,05 считалось значимым.
Результаты
Результаты клинического осмотра и прямого собеседования
Возникновение PA
PA был обнаружен у 18 из 521 пациента (3.5%) клинически обследованы. Кроме того, 66 пациентов имели ПА в соответствии с историей болезни, что свидетельствует о совокупном возникновении ПА у 84 пациентов (UC = 51, CD = 33) (16%). Однако ПА была связана с другими ревматическими заболеваниями в 22 случаях (ревматоидный артрит у пяти пациентов, анкилозирующий спондилит у семи пациентов, реактивный артрит у трех пациентов, псориатический артрит у трех пациентов, синдром SAPHO у одного пациента и подагра у трех пациентов). Эти пациенты (13 ЯК, 9 БК) были исключены из дальнейшего анализа.Следовательно, было обнаружено 62 пациента с ПА, связанными с ВЗК (ПАИБК), что указывает на совокупную частоту ПАИБК в 12%. У четырех пациентов (0,8%), у двоих с ЯК и у двоих с БК, при обследовании был выявлен артрит. При диагнозе ВЗК 6 годами ранее 38 пациентов (4,5%) имели ПАВБК по данным гастроэнтерологов, текущему состоянию или истории болезни. Возраст начала заболевания и частота встречаемости указаны в Таблице 2.
Таблица 2.Возникновение ПАИБД, связанное с ЯК и БК [ n (%)]
| UC | CD | Всего | |||||
| Возникновение41 | 90924 (14) | 62 (12) | |||||
| Возраст (средний) в начале | 40 (14–70) | 34 (9–67) | 38 (9–70) | ||||
| из ВЗК (диапазон) | |||||||
| Начало артрита | |||||||
| Возраст (средний) в начале | 42 (17–71) | 39 (10–71) | |||||
| артрита (диапазон) | |||||||
| Предварительное начало ВЗК | 7 (2) | 4 (2) | 11 (2)|||||
| Пост-начало ВЗК | 909 39 30 (8)18 (11) | 48 (9) | |||||
| Нет информации | 1 (0.3) | 2 (1,2) | 3 (0,6) | ||||
| Артрит присутствует в | 2 (0,6) | 2 (1) | 4 (0,8) | ||||
| расследование | |||||||
| UC | CD | Всего | |||||
| Возникновение | 38 (11) | 24 (14) 909 909 39 среднее) в начале | 40 (14–70) | 34 (9–67) | 38 (9–70) | ||
| ВЗК (диапазон) | |||||||
| Начало артрита | |||||||
| Возраст (средний) в начале | 42 (17–71) | 35 (10–68) | 39 (10–71) | ||||
| артрита (диапазон) | |||||||
| Предварительное начало ВЗК | 7 (2) | 4 (2) | 11 (2) | ||||
| Пост-начало ВЗК | 30 (8) | 11) | 48 (9) | ||||
| Нет информации | 1 (0.3) | 2 (1,2) | 3 (0,6) | ||||
| Артрит присутствует в | 2 (0,6) | 2 (1) | 4 (0,8) | ||||
| расследование | |||||||
Возникновение ПАИБД, связанное с ЯК и БК [ n (%)]
| UC | CD | Всего | 909 (11) | 24 (14) | 62 (12) | |||
| Возраст (средний) в начале | 40 (14–70) | 34 (9–67) | 38 (9–70) | |||||
| ВЗК (диапазон) | ||||||||
| Начало артрита | ||||||||
| Возраст (средний) в начале 9041 17– | 429 (средний) –68) | 39 (10–71) | ||||||
| артрита (диапазон) | ||||||||
| Предварительное начало ВЗК | 7 (2) | 4 (2) | 11 (2)||||||
| Пост-начало ВЗК | 30 (8) | 18 (11) | 48 (9) | |||||
| Нет информации | 1 (0.3) | 2 (1,2) | 3 (0,6) | |||||
| Артрит присутствует в | 2 (0,6) | 2 (1) | 4 (0,8) | |||||
| расследование | ||||||||
| UC | CD | Всего | |||||
| Возникновение | 38 (11) | 24 (14) 909 909 39 среднее) в начале | 40 (14–70) | 34 (9–67) | 38 (9–70) | ||
| ВЗК (диапазон) | |||||||
| Начало артрита | |||||||
| Возраст (средний) в начале | 42 (17–71) | 35 (10–68) | 39 (10–71) | ||||
| артрита (диапазон) | |||||||
| Предварительное начало ВЗК | 7 (2) | 4 (2) | 11 (2) | ||||
| Пост-начало ВЗК | 30 (8) | 11) | 48 (9) | ||||
| Нет информации | 1 (0.3) | 2 (1,2) | 3 (0,6) | ||||
| Артрит присутствует в | 2 (0,6) | 2 (1) | 4 (0,8) | ||||
| расследование | |||||||
Характеристики ПАИБД
У пациентов с PAIBD артрит развился до начала IBD у 11 пациентов (18%) и после начала заболевания кишечника у 48 пациентов (77%) (Таблица 2).В 5% случаев не было достоверной информации, позволяющей правильно установить начало артрита. У трех пациентов с PAIBD (5%) артрит развился в пяти или более суставах. Колени были поражены в 34 случаях (55%), голеностопы — в 22 случаях (35%), суставы пальцев рук и ног — в 11 случаях (18%). Симметричный артрит имел место у 22 пациентов (35%), из которых пальцы рук и ног были поражены только в трех случаях.
Продолжительность артрита составила менее 4 недель у 34 пациентов (55%).У 13 пациентов (21%) артрит длился 6 месяцев и более, а в трех случаях информация о продолжительности артрита отсутствовала. Разницы в продолжительности PAIBD между UC и CD не наблюдалось (данные не показаны). В подгруппе пациентов с продолжающимся PAIBD при обследовании все имели рецидивирующий артрит колен или голеностопных суставов длительностью менее 4 недель.
Рентгенологические исследования периферических суставов выполнены шести пациентам. За исключением двух случаев сопутствующего остеоартроза (в коленных суставах), никаких признаков разрушения или эрозий обнаружено не было.
Тесты на ревматоидные факторы в сыворотке крови были выполнены у 61 пациента (98%) и у всех были отрицательными.
Связь с кишечными и внекишечными проявлениями
Распределение воспаления желудочно-кишечного тракта было сходным у пациентов с артритом и без него как при ЯК, так и при БК. PAIBD была связана с внекишечными проявлениями, как показано в таблице 3. Дактилит и узловатая эритема встречались значительно чаще у пациентов с PAIBD по сравнению с пациентами без воспалительного заболевания суставов (таблица 3).
Таблица 3.Экстракишечные проявления и системное лечение [ n (%)] у пациентов с PAIBD и без (пациенты с другими воспалительными ревматическими заболеваниями исключены)
| UC ( n = 340) | CD ( n = 159) | IBD ( n = 499) | ||||||||||
| PAIBD PAIBD− ( n = 302) | PAIBD + ( n = 24) | PAIBD− ( n = 135) | PAIBD + ( n = 62) | PAIBD− ( n = 435) | ||||||||
| Внекишечные проявления | ||||||||||||
| Дактилит | 5 (13) | ) | 6 (25) | 3 (2) | 11 (18) | 7 (2) * | ||||||
| Энтезопатия | 5 (13) | 12 (4) | 1 (4) | 5 (4) | 6 (10) | 17 (4) | ||||||
| Увеитис | 3 (8) | 4 (1) | 1 (4) | 4 (3) | 4 ( 6) | 8 (2) | ||||||
| Узловатая эритема | 3 (8) | 1 (0.3) * | 4 (17) | 4 (3) | 7 (11) | 5 (1) * | ||||||
| Гангренозная пиодермия | 1 (3) | 2 (0,7) | 1 ( 4) | 0 (0) | 2 (3) | 2 (0,5) | ||||||
| Склерозирующий холангит | 0 (0) | 1 (0,3) | 1 (4) | 4 (3) | 1 (2) | 5 (1) | ||||||
| Текущее систематическое лечение | ||||||||||||
| Кортикостероиды 3 939 9041 909 909 909 909 909 5 (21) | 21 (16) | 8 (13) | 34 (8) | |||||||||
| Сульфасалазин | 6 (16) | 67 (22) | 5 (21) | 12 (9 ) | 11 (18) | 79 (18) | ||||||
| 5-аминосалициловая кислота | 9093 9 8 (21)68 (23) | 8 (33) | 55 (41) | 16 (26) | 123 (28) | |||||||
| Хирургический a | 4 (11) | 15 (5) | 8 (33) | 40 (30) | 12 (19) | 55 (13) | ||||||
| UC ( n = 340) | CD ( n = 159) | IBD ( n = 499) | ||||||||||
PAIBDIB + ( n88 = 389)n = 302) | PAIBD + ( n = 24) | PAIBD− ( n = 135) | PAIBD + ( n = 62) | PAIBD− ( n = 435) | ||||||||
| Внекишечные проявления | ||||||||||||
| Дактилит | 5 (13) | 4 (1) | 6 (25) | 3 (2) | 11 (18) | 7 (2) 909 * | ||||||
| Энтезопатия | 5 (13) | 12 (4) | 1 (4) | 5 (4) | 6 (10) | 17 (4) | ||||||
| Увейтис | 3 (8) | 4 (1) | 1 (4) | 4 (3) | 4 (6) | 8 (2) | ||||||
| Узловатая эритема | 3 (8) | 1 (0.3) * | 4 (17) | 4 (3) | 7 (11) | 5 (1) * | ||||||
| Гангренозная пиодермия | 1 (3) | 2 (0,7) | 1 ( 4) | 0 (0) | 2 (3) | 2 (0,5) | ||||||
| Склерозирующий холангит | 0 (0) | 1 (0,3) | 1 (4) | 4 (3) | 1 (2) | 5 (1) | ||||||
| Текущее систематическое лечение | ||||||||||||
| Кортикостероиды 3 939 9041 909 909 909 909 909 5 (21) | 21 (16) | 8 (13) | 34 (8) | |||||||||
| Сульфасалазин | 6 (16) | 67 (22) | 5 (21) | 12 (9 ) | 11 (18) | 79 (18) | ||||||
| 5-аминосалициловая кислота | 9093 9 8 (21)68 (23) | 8 (33) | 55 (41) | 16 (26) | 123 (28) | |||||||
| Хирургический a | 4 (11) | 15 (5) | 8 (33) | 40 (30) | 12 (19) | 55 (13) | ||||||
Внекишечные проявления и системное лечение [ n (%)] у пациентов с и без PAIBD (пациенты с другими воспалительными ревматическими заболеваниями исключены)
| UC ( n = 340) | CD ( n = 159) | IBD ( n = 499) | ||||||||||
PAIBDIB + ( n88 = 389)n = 302) | PAIBD + ( n = 24) | PAIBD− ( n = 135) | PAIBD + ( n = 62) | PAIBD− ( n = 435) | ||||||||
| Внекишечные проявления | ||||||||||||
| Дактилит | 5 (13) | 39 4 (1)6 (25) | 3 (2) | 11 (18) | 7 (2) * | |||||||
| Энтезопатия | 5 (13) | 12 (4) | 1 (4) | 5 (4) | 6 (10) | 17 (4) | ||||||
| Увеитис | 3 (8) | 4 (1) | 1 (4) | 4 (3) | 4 (6) | 8 (2) | ||||||
| Узловатая эритема | 3 (8) | 1 (0.3) * | 4 (17) | 4 (3) | 7 (11) | 5 (1) * | ||||||
| Гангренозная пиодермия | 1 (3) | 2 (0,7) | 1 ( 4) | 0 (0) | 2 (3) | 2 (0,5) | ||||||
| Склерозирующий холангит | 0 (0) | 1 (0,3) | 1 (4) | 4 (3) | 1 (2) | 5 (1) | ||||||
| Текущее систематическое лечение | ||||||||||||
| Кортикостероиды 3 939 9041 909 909 909 909 909 5 (21) | 21 (16) | 8 (13) | 34 (8) | |||||||||
| Сульфасалазин | 6 (16) | 67 (22) | 5 (21) | 12 (9 ) | 11 (18) | 79 (18) | ||||||
| 5-аминосалициловая кислота | 9093 9 8 (21)68 (23) | 8 (33) | 55 (41) | 16 (26) | 123 (28) | |||||||
| Хирургический a | 4 (11) | 15 (5) | 8 (33) | 40 (30) | 12 (19) | 55 (13) | ||||||
| UC ( n = 340) | CD ( n = 159) | IBD ( n = 499) | ||||||||||
PAIBDIB + ( n88 = 389)n = 302) | PAIBD + ( n = 24) | PAIBD− ( n = 135) | PAIBD + ( n = 62) | PAIBD− ( n = 435) | ||||||||
| Внекишечные проявления | ||||||||||||
| Дактилит | 5 (13) | 4 (1) | 6 (25) | 3 (2) | 11 (18) | 7 (2) 909 * | ||||||
| Энтезопатия | 5 (13) | 12 (4) | 1 (4) | 5 (4) | 6 (10) | 17 (4) | ||||||
| Увейтис | 3 (8) | 4 (1) | 1 (4) | 4 (3) | 4 (6) | 8 (2) | ||||||
| Узловатая эритема | 3 (8) | 1 (0.3) * | 4 (17) | 4 (3) | 7 (11) | 5 (1) * | ||||||
| Гангренозная пиодермия | 1 (3) | 2 (0,7) | 1 ( 4) | 0 (0) | 2 (3) | 2 (0,5) | ||||||
| Склерозирующий холангит | 0 (0) | 1 (0,3) | 1 (4) | 4 (3) | 1 (2) | 5 (1) | ||||||
| Текущее систематическое лечение | ||||||||||||
| Кортикостероиды 3 939 9041 909 909 909 909 909 5 (21) | 21 (16) | 8 (13) | 34 (8) | |||||||||
| Сульфасалазин | 6 (16) | 67 (22) | 5 (21) | 12 (9 ) | 11 (18) | 79 (18) | ||||||
| 5-аминосалициловая кислота | 9093 9 8 (21)68 (23) | 8 (33) | 55 (41) | 16 (26) | 123 (28) | |||||||
| Хирургический a | 4 (11) | 15 (5) | 8 (33) | 40 (30) | 12 (19) | 55 (13) | ||||||
Текущее системное лечение
Использование 5-аминосалициловой кислоты, сульфасалазина и кортикостероидов было одинаковым у пациентов с PAIBD и без него (таблица 3).
Выводы основаны исключительно на больничных картах, телефонных интервью и анкетах, отправленных по почте
В 133 случаях (32 пациента с CD и 101 с UC), которые не были клинически обследованы на предмет возможного заболевания суставов, были пересмотрены больничные карты. PA была зарегистрирована у 10 пациентов (8%), из которых один пациент (UC) страдал ревматоидным артритом, один (UC) — анкилозирующим спондилитом, а два пациента (UC и CD) — подагрой. Таким образом, в шести случаях (5%) ПА была связана с ВЗК.У всех пациентов развился артрит после начала ВЗК. У пяти пациентов были поражены колени, и у одного был артрит локтевого сустава. Внекишечных проявлений, кроме артрита, не зарегистрировано.
Обсуждение
В настоящем исследовании совокупная встречаемость PAIBD составила 12%. Из 62 пациентов с PAIBD настоящее воспалительное заболевание суставов было обнаружено при обследовании только у четырех пациентов (балльная распространенность 0,8%), тогда как в 58 случаях возникновение PAIBD было основано исключительно на отчетах пациентов.Заболевание суставов, ассоциированное с ВЗК, обычно преходящее, обычно длится всего несколько недель и поддается лечению основного кишечного заболевания [2, 13]. Поразительная разница между точечной распространенностью и наблюдаемой кумулятивной встречаемостью, таким образом, может быть объяснена природой PAIBD, особенно короткой продолжительностью таких проявлений. Кроме того, на результаты могли повлиять различия в достоверности истории болезни пациента и клинического обследования ревматологом.
Кумулятивная встречаемость 12%, обнаруженная в настоящем исследовании, указывает на то, что PAIBD влияет на значительную часть пациентов с IBD. Однако эта частота явно ниже, чем в двух предыдущих исследованиях (16,2 и 23%) [3, 4]. Расхождения в результатах можно объяснить методологическими различиями, поскольку последние исследования были основаны на пациентах, посещающих специализированные центры и университетские клиники, в отличие от настоящего популяционного исследования. Согласно предвзятости Берксона [14], госпитализированные пациенты, как правило, обнаруживают более высокую степень связи между двумя расстройствами, чем наблюдаемая в общей популяции.Кроме того, пациенты, посещающие университетские клиники или другие справочные центры, могут иметь более тяжелые и сложные случаи, что может увеличить предполагаемую частоту PAIBD. Такая взаимосвязь подтверждается нашими данными о повышении частоты узловатой эритемы у пациентов с PAIBD по сравнению с пациентами без PAIBD (таблица 3). Таким образом, различия между различными исследованиями, оценивающими частоту возникновения PAIBD, скорее всего, связаны с разным дизайном исследований.
В соответствии с предыдущими исследованиями [3, 15], была обнаружена тенденция к более высокой частоте PAIBD у пациентов с CD (14%) по сравнению с пациентами с UC (11%).Однако в нашем исследовании разница не достигла статистической значимости, что можно объяснить довольно низким количеством включенных пациентов.
Из-за частого отсутствия информации об артрите расчеты PAIBD, основанные на обзоре больничных записей, могут привести к заниженным оценкам. Примечательно, что в настоящем исследовании была обнаружена более низкая совокупная встречаемость PAIBD на уровне 5%, когда результаты были основаны на больничных записях пациентов, потерянных для последующего наблюдения. В большом обзоре Orchard et al. [15] на основании историй болезни была обнаружена сопоставимая частота PAIBD в 6%. Таким образом, истинная распространенность и частота PAIBD предпочтительно должны основываться на продольных опросах всей популяции пациентов с IBD, а в идеале — на множественных и последовательных клинических обследованиях суставов.
В данной когорте пациентов предыдущая оценка гастроэнтерологов показала, что PAIBD на момент постановки диагноза IBD возникла у 4,5% пациентов. Хотя эти данные не были подтверждены ревматологами, они могут указывать на увеличение кумулятивной встречаемости PAIBD с 4.От 5% при диагнозе ВЗК до 12% через 6 лет. Велосо и др. [3] обнаружил, что совокупная вероятность наличия хотя бы одного внекишечного проявления ВЗК увеличилась с 12 до 30% в течение 20-летнего периода наблюдения. Таким образом, продолжительность ВЗК, по-видимому, имеет большое значение при оценке совокупной заболеваемости ПАВЗ, и ее следует учитывать при сравнении результатов различных исследований.
Распределение воспаления желудочно-кишечного тракта было сходным у пациентов с ПАИБК и без него как при ЯК, так и при БК.Предыдущие исследования показали противоречивые результаты, поскольку ранние исследования показали связь между частотой развития ПА и степенью воспаления кишечника при ЯК [16]. Однако эти данные не были подтверждены последующими исследованиями [3, 15]. У пациентов с CD поражение толстой кишки, по-видимому, указывает на повышенный риск PAIBD [3, 4, 17]. Та же тенденция наблюдалась в настоящем исследовании, что, возможно, указывает на то, что вовлечение дистальной части толстой кишки играет решающую роль в развитии PAIBD.
Распределение и характеристики поражения периферических суставов в нашем исследовании были аналогичны тем, которые были обнаружены в предыдущих исследованиях [13]. Недавно было высказано предположение, что PAIBD можно разделить на два типа: тип 1 (малосуставной) и тип 2 (полиартикулярный), различающиеся количеством пораженных суставов, распределением суставов, естественным течением и ассоциациями болезней [15, 18]. Однако у наших пациентов с PAIBD у немногих было полиартикулярное поражение, и только у небольшого числа из них продолжительность артрита превышала 1-2 месяца.Таким образом, ни один пациент не соответствовал предложенному определению артропатии 2 типа. Большинство пациентов с PAIBD можно отнести к артропатии 1 типа, и их поражение суставов было аналогично описанному в предыдущих исследованиях [2]. Однако интересные выводы, сделанные Orchard et al. [15] не были подтверждены в нашем исследовании. Поскольку их исследование было основано на пациентах, посещающих специализированный центр, разные дизайны исследований могут объяснить разные результаты, но необходимы дальнейшие исследования для оценки распространенности артрита типа 1 и типа 2 в разных популяциях пациентов с ВЗК.
Следует обсудить некоторые методологические вопросы нашего исследования. Во-первых, подавляющее большинство случаев PAIBD было выявлено на основании истории болезни. Несмотря на прямые интервью с пациентом ревматологом, мы не можем исключить возможность того, что информация о прошлых эпизодах артрита в некоторых случаях могла быть неправильно истолкована. Хотя пациенты, сообщившие о PAIBD, обычно предоставляли подробное описание совместных проявлений, мы не можем полностью исключить некоторое завышение частоты PAIBD.Во-вторых, совокупное количество случаев PAIBD, обнаруженное в настоящем исследовании, не следует сравнивать с пациентами с длительным IBD из-за короткой продолжительности заболевания. Для расчета пожизненных рисков PAIBD требуются дальнейшие исследования, желательно те, которые разработаны в виде проспективных популяционных обследований.
В заключение, в этой популяционной когорте пациентов с ВЗК с длительностью заболевания 6 лет ПАИБК встречались у значительного числа пациентов с ВЗК. Однако точечная распространенность PAIBD была очень низкой, вероятно, из-за природы артрита, которая показывала кратковременное, самоограничивающееся, неразрушающее течение.В некоторых случаях ПАИБК была начальным симптомом ВЗК, в то время как корреляция между распространением желудочно-кишечного заболевания и ПАИБК отсутствовала. Дальнейшее наблюдение за данной популяцией пациентов предоставит информацию о частоте и характеристиках воспалительного заболевания суставов, развивающегося при длительном течении ВЗК, а также о влиянии PAIBD на конечный результат.
Авторы хотели бы поблагодарить следующих членов исследовательской группы гастроэнтерологов IBSEN в Норвегии за гастроэнтерологические исследования и советы: Йостейна Сауара (TSS Skien), Идара Лигрена (Университетская больница Уллевол, Осло), Эрлинга Адланда (Университетская больница Акер, Осло). ), Том Шульц (ASA Arendal), Ньял Стрей (больница Диаконхьемметс, Осло), Эрик Оберт, Пер Сандвей, Магне Хенриксен, Пер Толос (больница Эстфолд, Мосс, Фредрикстад и Халден), Кьелл Хебнес (Медицинский центр Волват, Осло) , Ø.Кьеллевольд (больница Нутодден и Рьюкан), Пер Диркорн (больница Крагеро), Мортен Ватн и Олав Фауса (Национальная больница, Осло), Томм Бернклев (Сандефьорд). Исследование было поддержано Исследовательским советом Норвегии, Норвежской женской ассоциацией общественного здравоохранения, Норвежской ассоциацией ревматизма, Lions Clubs International Norway, Astra Norway AS, Nycomed Pharma AS, Исследовательским фондом больниц Østfold.
Список литературы
1De Vos M, De KF, Mielants H, Cuvelier C, Veys E.Обзорная статья: заболевания костей и суставов при воспалительном заболевании кишечника.
Алимент Фармакол Тер
1998
;12
:397
–404.2Gran JT, Husby G. Совместные проявления при желудочно-кишечных заболеваниях. 1. Патофизиологические аспекты, язвенный колит и болезнь Крона.
Dig Dis
1992
;10
:274
–94,3Велозо Ф. Т., Карвалью Дж., Магро Ф. Системные проявления воспалительного заболевания кишечника, связанные с иммунитетом.Проспективное исследование 792 пациентов.
J Clin Gastroenterol
1996
;23
:29
–34,4Greenstein AJ, Janowitz HD, Sachar DB. Внекишечные осложнения болезни Крона и язвенного колита: исследование 700 пациентов.
Медицина
1976
;55
:401
–12,5Кильдебо С., Нордгаард К., Аронсен О., Брекан Р., Бурхол П.Г., Йорде Р. Заболеваемость язвенным колитом в Северной Норвегии с 1983 по 1986 год.Общество гастроэнтерологов Северной Норвегии.
Сканд Дж Гастроэнтерол
1990
;25
:890
–6,6Moum B, Vatn MH, Ekbom A et al. Заболеваемость язвенным колитом и неопределенным колитом в четырех округах юго-восточной Норвегии, 1990–93 гг. Проспективное популяционное исследование. Группа гастроэнтерологов по изучению воспаления кишечника Юго-Восточной Норвегии (IBSEN).
Сканд Дж Гастроэнтерол
1996
;31
:362
–6.7Moum B, Vatn MH, Ekbom A et al. Заболеваемость болезнью Крона в четырех округах на юго-востоке Норвегии, 1990–93 гг. Проспективное популяционное исследование. Группа гастроэнтерологов по изучению воспаления кишечника Юго-Восточной Норвегии (IBSEN).
Сканд Дж Гастроэнтерол
1996
;31
:355
–61,8Moum B, Ekbom A, Vatn MH et al. Воспалительное заболевание кишечника: переоценка диагноза в проспективном популяционном исследовании на юго-востоке Норвегии.
Кишечник
1997
;40
:328
–32,9Jahnsen J, Moum B, Schulz T et al. Воспалительное заболевание кишечника, течение заболевания и статус через 5 лет после постановки диагноза (исследование IBSEN).
Гастроэнтерология
2000
;118
:A1005
.10Binder V, Both H, Hansen PK, Hendriksen C, Kreiner S, Torp-Pedersen K. Заболеваемость и распространенность язвенного колита и болезни Крона в графстве Копенгаген, 1962-1978 гг.
Гастроэнтерология
1982
;83
:563
–8,11Gasche C, Scholmerich J, Brynskov J et al. Простая классификация болезни Крона: доклад Рабочей группы Всемирного конгресса гастроэнтерологов, Вена, 1998.
Воспаление кишечника Dis
2000
;6
:8
–15.12Gabriel SE. Классификация ревматических заболеваний. В: Klippel JH, Dieppe P, eds. Ревматология, Vol. 1, 2 изд.Лондон:
Мосби,
1998
:3
.1
–4,13Шорр-Лесник Б., Брандт Л.Дж. Избранные ревматологические и дерматологические проявления воспалительного заболевания кишечника.
Am J Gastroenterol
1988
;83
:216
–23,14Berkson J. Ограничения применения четырехкратного табличного анализа к больничным данным.
Биометр Бык
1946
;2
:47
–53,15Орчард, TR, Вордсворт Б.П., Джуэлл Д.П.Периферические артропатии при воспалительных заболеваниях кишечника: их суставное распределение и естественное течение.
Кишечник
1998
;42
:387
–91,16Райт В., Уоткинсон Г. Артрит язвенного колита.
Br Med J
1965
;2
:670
–5,17Рэнкин Г.Б., Уоттс Х.Д., Мельник С.С., Келли М.Л. Национальное совместное исследование болезни Крона: внекишечные проявления и перианальные осложнения.
Гастроэнтерология
1979
;77
:914
–20.18Orchard TR, Thiyagaraja S, Welsh KI, Wordsworth BP, Hill GJ, Jewell DP. Клинический фенотип связан с генотипом HLA при периферических артропатиях воспалительного заболевания кишечника.