Полипы эндометрия
Полипы эндометрия.
Полипы эндометрия-это заболевание при котором в полости матки происходит патологическое разрастание базального слоя эндометрия.Полипы эндометрия обнаруживаются у 0.5-5 % гинекологических больных в возрасте 35-50 лет.
Полип состоит из клеток эпителия.В его строении различают тело и ножку.Полипы эндометрия классифицируют по формам.В основе классификации лежит структура строения полипа.Основные формы полипов:
Железистые. В состав входит железистый и стромальный компонент, железистый преобладает.Такие полипы распространены у женщин репродуктивного возраста.
Железисто-фиброзные.В строении: небольшое количество желез, соединительная ткань, у основания плотная фиброзная ткань.Могут выявляться у всех возрастных категорий.
Фиброзные.Состоят из соединительной ткани с единичными железами.Чаще диагносцируются у женщин пожилого возраста.
Аденоматозные и полипы с очаговым аденоматозом
 Состоят из железистой ткани с пролиферацией эпителия.Такие полипы могут иметь в своей структуре атипичные клетки,поэтому их называют предраковыми полипами. Эти полипы имеют особую опасность для женского здоровья .
Состоят из железистой ткани с пролиферацией эпителия.Такие полипы могут иметь в своей структуре атипичные клетки,поэтому их называют предраковыми полипами. Эти полипы имеют особую опасность для женского здоровья .Что влияет на возникновение полипов эндометрия?
На гиперпластическое разрастание эндометрия , в результате которого образуются полипы, могут влиять разнообразные факторы.Перечислим основные из них.
1.Оперативные вмешательства на органах малого таза во время которых было выскабливание полости матки с диагностическими и лечебными целями.Сюда можно отнести выкидыши, аборты, роды осложненные неполным отделением плаценты.Причины возникновения полипов после хирургических вмешательств –создаются благоприятные условия для инфицирования эндометрия и возникновения хронического воспалительного процесса в слизистой матки.
2.Снижение общего иммунитета.
3.Гормональный дисбаланс-чрезмерная выработка эстрогена и низкий уровень прогестерона.
4.Хронические инфекции органов малого таза воспалительного характера.
5.Нарушение психоэмоционального статуса ( длительные депрессии,сильные стрессовые ситуации).
6.Длительное ношение внутриматочного контрацептива.
7.Нарушения эндокринного характера (дисфункция щитовидной железы).
8.Ряд эктрагенитальных заболеваний: гипертоническая болезнь. Ожирение, сахарный диабет.
9.Наследственная предрасположенность к опухолевидным образованиям.
По каким симптомам можно определить заболевании?
Многие гинекологи отмечают, что при небольших размерах полипов ( до 1 см.), женщины могут не иметь жалоб.Довольньно часто такие полипы обнаруживаются при проведении УЗИ полости матки.Как правило первые жалобы появляются при увеличении размеров полипа.В репродуктивном возрасте беспокоит нарушение менструального цикла(обильные или продолжительные менструации). В период отсутствия менструаций у женщин могут появляться кровянистые или мажущие выделения из половых путей, которые бывают однократными или повторяющимися.
Данные симптомы имеют сходство с рядом других гинекологических заболеваний,Поэтому очень важно поставить правильный диагноз для того чтобы подобрать соответствующее лечение. Симптомы полипов эндометрия похожи на симптомы следующих заболеваний-эндометриоз ,миома матки, угроза выкидыша в первом триместре беременности.
Как видите . полипы эндометрия очень важно отличать от других гинекологических заболеваний.Современные методы диагностики дают такую возможность.
УЗИ органов малого таза- при исследовании выявляется расширение полости матки .Полипы видны как образования однородной структуры с четким контуром часто повышенной эхогенности.
Гистероскопия считается наиболее точным и информативным методом .Позволяет оценить форму, размеры,расположение полипа, а также оценить стенки матки, дно и трубные углы.Одновременно с диагностикой можно провести удаление полипа.
Гистологический анализ соскоба эндометрия-подтверждает наличие полипа,его структуру, форму.
Как удаляют полипы.
При гистероскопии специальными инструментами производят удаление полипов в полости матки, затем выполняется выскабливание полости матки и цервикального канала
При гистерорезектоскопии специальной электропетлёй удаляется полип и его ножки .Это необходимо для профилактики рецидивов. Полученный материал из полости матки и цервикального канала отправляется на гистологическое исследование.Выполняется контрольное УЗИ органов малого таза ч\з 3-4 дня после операции.
У большинства пациенток восстановительный период после операции проходит довольно спокойно.В течении 10 дней после выскабливания могут беспокоить кровянистые выделения различной интенсивности, чаще умеренные. Для профилактики воспалительных осложнений назначается антибактериальная терапия . Первые 3 недели после операции рекомендуется избегать половых контактов,физической нагрузки, переохлаждения.
Для профилактики воспалительных осложнений назначается антибактериальная терапия . Первые 3 недели после операции рекомендуется избегать половых контактов,физической нагрузки, переохлаждения.
Следующий этап лечения определяется возрастом пациентки, структурой полипа, есть ли у нее нарушение менструального цикла.
Если полип фиброзный и нарушений менструального цикла нет, достаточно гистероскопии , удаление полипа, выскабливание полости матки и цервикального канала.При железистой и железисто-фиброзной форме полипа и с нарушением менструального цикла, пациентке возможно рекомендуют гормональное лечение. При аденоматозных полипах и полипах с очаговым аденоматозом пациенткам после консультации онколога рекомендуется хирургическое лечение.Женщинам от 45 лет-удаление матки. Если у пациенки выявлены обменно-эндокринные нарушения, а также есть факторы риска онкологической настороженности, выполняется удаление матки с придатками.
Прфилактика полипов эндометрия предполагает своевременное лечение гиперплазии эндометрия и ограничение повреждающих локальных воздействий на матку.
Современные аспекты профилактики и лечения гиперпластических процессов эндометрия в перименопаузе
Современные аспекты профилактики и лечения гиперпластических процессов эндометрия в перименопаузе
Профессор, д.м.н. И.Б. Манухин, профессор, д.м.н. А.Л. Тихомиров,
С.М. Шаркова, А.А. Кочарян
Гиперпластические процессы эндометрия являются распространённой гинекологической патологией, частота которой существенно увеличивается к периоду возрастных гормональных перестроек в перименопаузальном возрасте. Имея неодинаковую степень развития, гиперпластические процессы нередко становятся благоприятным фоном для возникновения предрака, а затем и рака эндометрия, что в течении многих десятилетий представляет важную медико — социальную проблему.
В настоящее время всё более актуальной становится проблема сохранения здоровья женщины перименопаузального возраста, что связано с увеличением средней продолжительности жизни, возрастающей доли женщин старшей возрастной группы среди населения.
Ещё 50 — 60 лет назад только 28% женщин доживали до возраста менопаузы и лишь 5% из них достигали возраста 75 лет. В настоящее время 95% женщин достигает периода перименопаузы, а 55% из них достигает 75 летнего возраста [3 7 12].
Современная демографическая ситуация в стране и мире такова, что 90% женщин проводят в постменопаузальном периоде треть своей жизни. К 2007 году 12% населения мира составляют лица старше 65 лет [3 7 12].
Термин перименопауза — означает период жизни женщины от первого нарушения регулярности менструального цикла до наступления аменореи.
Этот период характеризуется появлением биологических, клинических и эндокринных признаков прекращения менструаций. Паталогические маточные кровотечения среди женщин перименопаузального возраста составляют от 2 до 5% от всех гинекологических больных и являются достаточно распространенным симптомом, который наблюдается при различных патологических процессах эндометрия:
— гиперпластические процессы эндометрия,
— миома матки, аденомиоз,
— гормонально-активные опухоли яичников и их различное сочетание [4 9,10,].
У большинства женщин период перименопаузы (климактерический период) приходится на возраст 45 -50 лет. Кровотечения в этом возрасте именуются климактерическими, что подчеркивает их связь с возрастными изменениями в репродуктивной системе.
Особая роль в гормональной перестройке отведена гипоталямусу, с началом перименопаузы появляется лабильность менструального цикла, нарушение фазности менструаций, что обусловливает нарушение длинной обратной связи как на уровне гипофиза, так и гипоталямуса. Наиболее стабильная корреляция между ФСГ и ЛГ установленная в репродуктивном периоде, в перименопаузе отсутствует.
Со стороны функции яичников в период перименопаузы происходит снижение эстрогенов и прогестерона [4 .9, 10, 11, 13, 14].
Ряд авторов сообщает об отсутствии достоверных статистических различий содержания в крови пролактина, тестостерона и эстрадиола у здоровых женщин, как в репродуктивном периоде, так и в период перименопаузы [7 .12].
Продукция половых стероидных гормонов у женщин тесно связана с ростом фолликулов и гаметогенезом.
Гонадотропная функция гипофиза при физиологическом течении периода перименопаузы является разнонаправленной: уровень ФСГ и ЛГ повышается, а уровень пролактина снижается, что можно рассматривать как универсальную реакцию на резкое снижение функции яичников. При сравнении уровня содержания в крови гормонов: на 7 — 9 день цикла у женщин в перименопаузе ЛГ в три раза, а ФСГ в девять раз выше уровня содержания в крови здоровых женщин репродуктивного возраста, в соответствующие дни менструального цикла [13,14, 15].
Эстрадиол, обнаруживаемый в крови у женщин в перименопаузе, является в основном продуктом экстрагландулярного превращения андрогенов в эстрогены, что имеет важное значение для поддержания нормального гомеостаза.
Ароматизирующие фементные системы, способные превращать андростендион и тестостерон в эстрадиол, обнаруживаются главным образом в жировой ткани.
Ароматизация андростендиона происходит в стромальных и сосудистых клетках жировой клетчатки, а сами жировые клетки (адипоциты) активно захватывают его из плазмы и являются депо половых гормонов [4.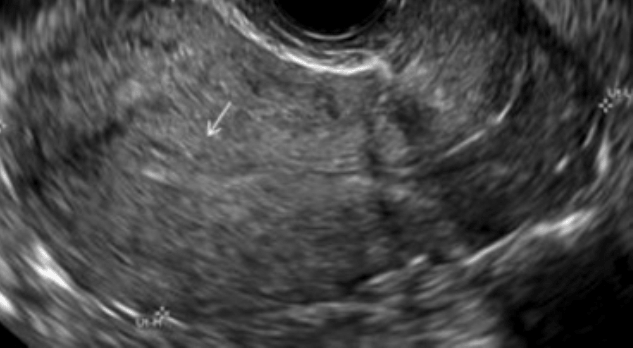 9,10].
9,10].
Гиперпластические процессы, развивающиеся у женщин в период перименопаузы, имеют неодинаковую степень развития, иногда приобретают характер предракового заболевания.
Согласно классификации ВОЗ (Женева 1984 г .), выделяют три основных вида гиперпластических процессов в эндометрии:
— эндометриальные полипы;
— эндометриальная гиперплазия;
— атиптческая гиперплазия эндометрия.
В отечественных материалах обычно используется морфологическая классификация Б.И.Железнова ( 1973 г .), которая выделяет:
— железистую гиперплазию эндометрия;
— железисто — кистозную гиперплазию эндометрия;
— атиптческую гиперплазию эндометрия (диффузные аденоматозные изменения, очаговый аденоматоз и аденоматозные полипы).
Каждое из этих заболеваний может стать причиной кровянистых выделений у женщин в период перименопаузы.
Частота озлокачествления гиперпластических процессов эндометрия колеблется в достаточно широких пределах (0,25 — 50%) и определяется морфологическими особенностями заболевания, длительностью его рецидивирования, а также возрастом пациентки [1.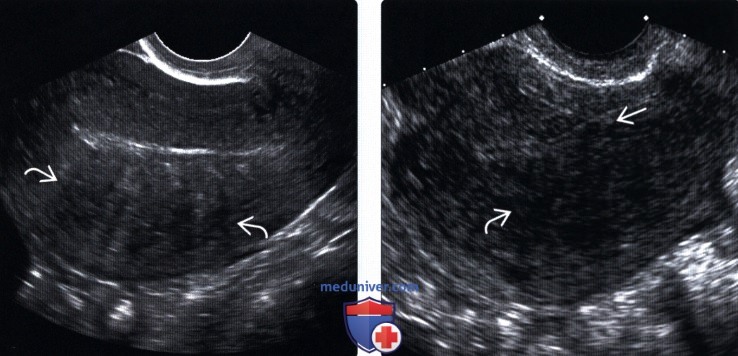 4,8].
4,8].
В литературе данная проблема широко обсуждалась, детально освещены вопросы этиологии и патогенеза, диагностики и лечения гиперпластических процессов Несмотря на появление новых направлений в ведении больных с гиперпластическими процессами эндометрия в различных современных периодах , вопросы лечения данной патологии остаются одними из наиболее актуальных вопросов гинекологии, и ещё далеки от окончательного решения. Это обусловлено прежде всего сложным и неоднородным пато- и морфогенезом заболевания и индивидуальной чувствительностью организма к различным лечебным воздействиям [1. 4,].
Остается недостаточно изученной зависимость различных морфологических форм гиперпластических процессов эндометрия от нейро — эндокринных нарушений организма, таких, как позднее наступление менопаузы, клинический и субклинический сахарный диабет, ожирение, бесплодие, гипертоническая болезнь [8].
Разработка морфологических критериев индивидуальной чувствительности доброкачественных гиперпластических процессов и предрака эндометрия имеет важное практическое значение для оптимизации способа лечения, определения показаний к гормонотерапии, а следовательно и повышения эффективности профилактики развития и лечения предрака, рака эндометрия [1. 4,].
4,].
Практически все авторы едины в мнении, что изменение гормональных взаимоотношений играет роль в развитии пролиферативных процессов в эндометрии. Эндометрий, как «ткань мишень», испытывающий на себе влияние половых гормонов, чрезвычайно чувствителен к действию эстрогенов, оказывающих эффект на его структуру и функцию.
Эстрогены — основной фактор, вызывающий пролиферацию эндометрия, которая при отсутствии достаточного влияния прогестерона, прогрессирует в железистую и атиптческую гиперплазию.
К нарушению взаимоотношений между прогестероном и эстрогенами и к возникновению относительной гиперэстрогенемии приводит – ановуляция.
В перименопаузе в крови повышается уровень ФСГ и ЛГ, что оказывает стимулирующее действие на функцию яичников, которые отвечают повышенной продукцией эстрогенов, не компенсированных действием прогестерона. Следствием этого является нередкое сочетание гиперпластических процессов эндометрия с миомой матки и эндометриозом у женщин указанной возрастной группы [4.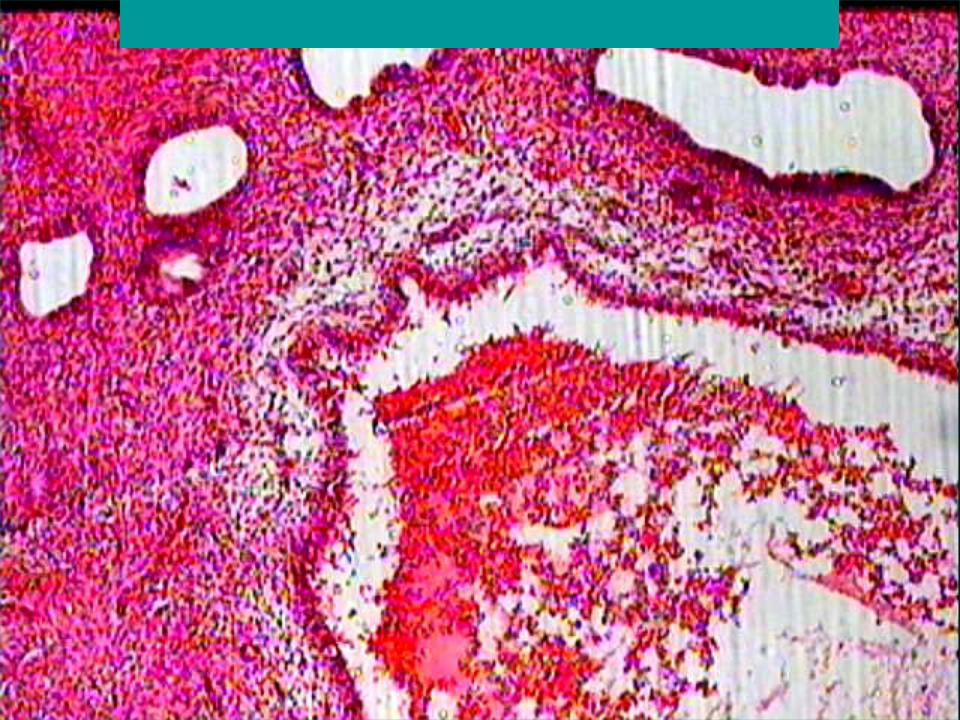 7. 8. 13].
7. 8. 13].
Доказано, что характер пролиферации эндометрия, обусловлен не только уровнем содержания в крови и соотношением гормонов, но и способностью эндометрия к их связыванию, — то есть количеством и качеством специфических рецепторов.
Можно полагать, что генетически обусловленный дефицит рецепторов прогестерона и рецепторов эстрадиола, либо нарушение этой рецепторной системы под влиянием различных патогенетических факторов являются одной из причин неэффективности гормонального лечения.
Между тем, в настоящее время не существует методик, позволяющих в клинических условиях осуществлять полноценную коррекцию нарушений рецепторного аппарата эндометрия. В клинической практике широко исследуется изучение фоновых и предраковых состояний эндометрия [3.7.12.].
Известно, что длительная пролиферация клеток эндометрия независимо от причины вызвавшую пролиферацию, облегчает реализацию онкогенного фактора [1.].
За последние 20 лет в России заболеваемость раком эндометрия (тела матки) выросла в два раза [7].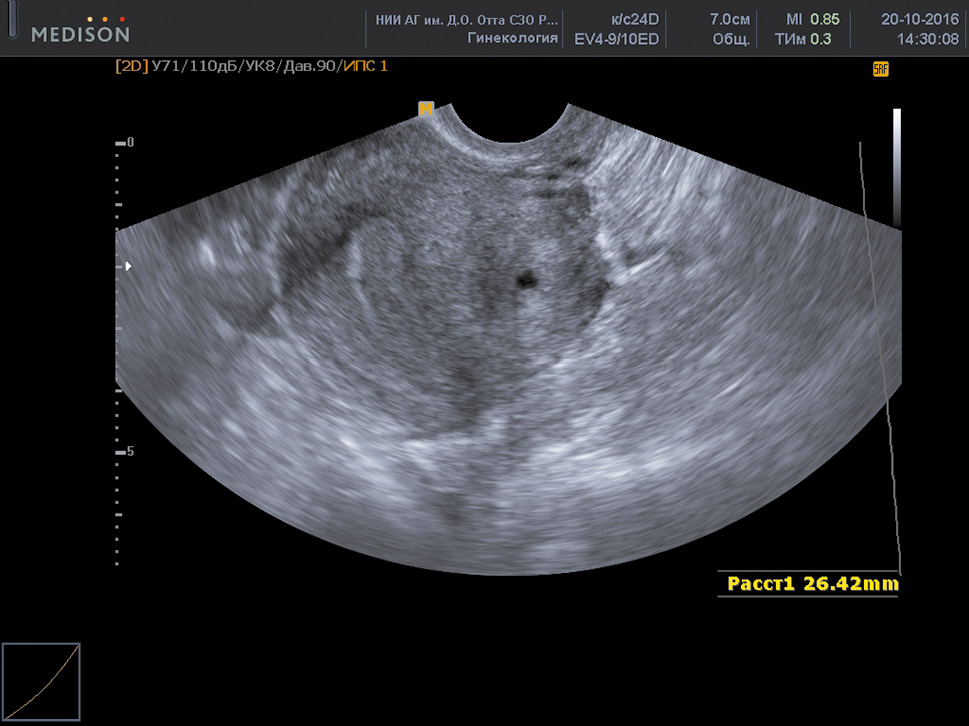
Это связано не только с увеличением средней продолжительности жизни, но и с нарастанием в популяции обменно — эндокринных заболеваний, таких как ановуляция, бесплодие, ожирение, гипертоническая болезнь, сахарный диабет [4].
Рост заболеваний раком тела матки требует не только усовершенствования методов лечения больных, но и в первую очередь усовершенствование возможной профилактики и лечения патологических заболеваний эндометрия на этапе его доброкачественных изменений.
Риск малигнизации в случае железисто — кистозной гиперплазии эндометрия (ЖГЭ) и полипов эндометрия составляет 1 — 2%, что позволяет отнести их скорее к фоновым заболеваниям нежеле к предраковым. В то же время у 55,9% больных раком эндометрия в перименопаузе обнаруживались полипы и железистая гиперплазия эндометрия [1.].
На основании только морфологических исследований невозможно составить прогноз риска развития ракового процесса, должен быть оценен фон, на котором возник пролиферативный процесс в эндометрии, то есть нейро — эндокринно — обменные нарушения в организме женщин, их возраст, гинекологический анамнез, клиническое течение, рецидивирование гиперплазии [1.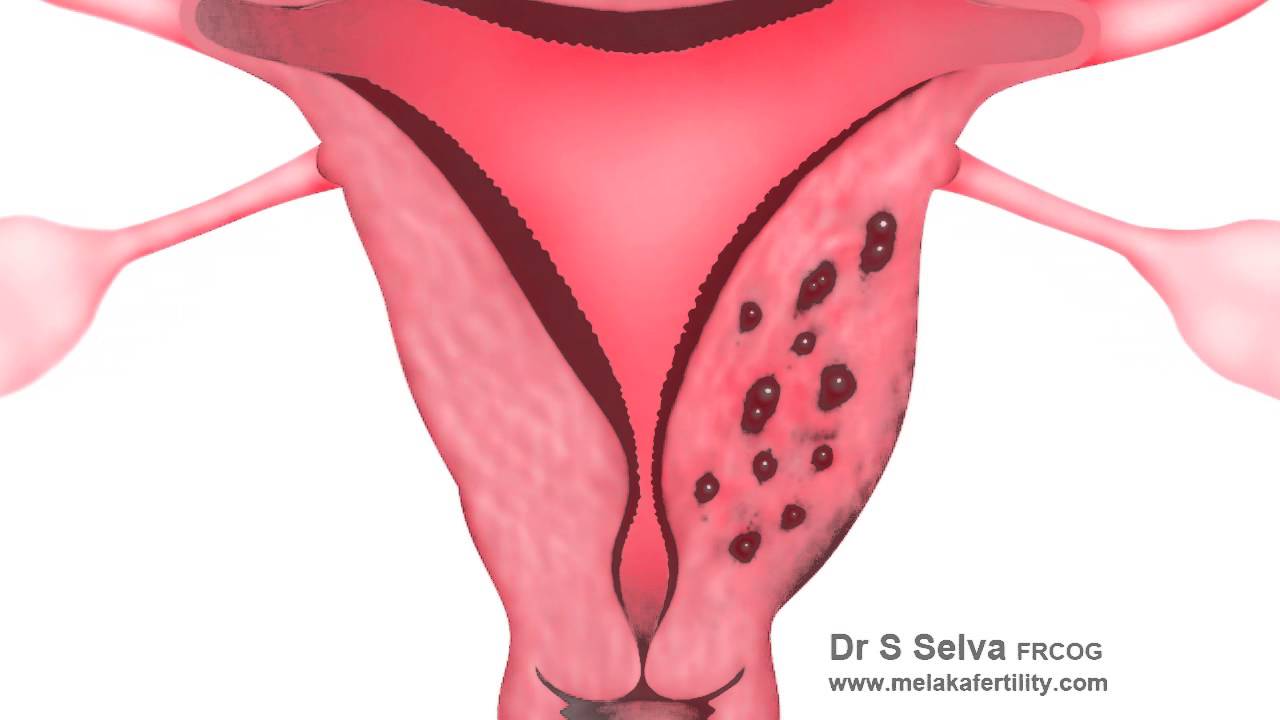 ].
].
Рецидивирующая гиперплазия эндометрия у женщин перименопаузального возраста, развивающаяся часто на фоне ожирения и гипертонической болезни, может быть отнесена к предраку.
В связи с известной зависимостью физиологической трансформации эндометрия от состояния гормональной регуляции, назначение гормональных препаратов для профилактики и лечения гиперпластических процессов эндометрия (ГПЭ) в перименопаузальном периоде считается патогенетически обоснованным.
В настоящее время здоровье, качество жизни и общий жизненный прогноз у женщин в период климактерия определяется прежде всего адекватностью и современностью лечебно — профилактических мероприятий, среди которых гормональная терапия играет большую роль [7].
Однако при отрицательном отношении пациенток к приёму гормональных препаратов в период климактерия, не стоит забывать и о возможности применении препаратов содержащих в своем составе фитогормоны и фитоэстрогены с целью возможной профилактики развития многих заболеваний развивающихся в этом возрастном периоде.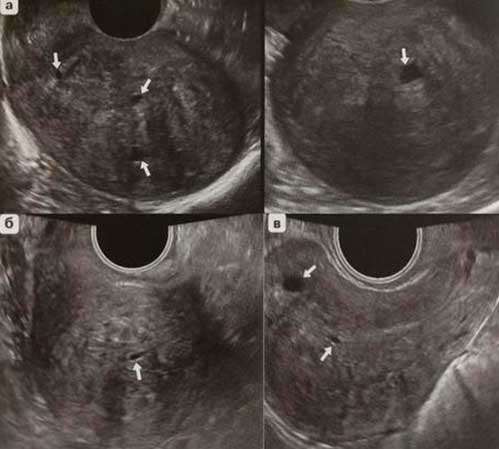 «Данные препараты устраняют также раннюю вазомоторную и психоэмоциональную симптоматику, метаболические нарушения, явления остеопороза, сердечно — сосудистых заболеваний и других заболеваний, развивающихся в климактерии.» [7]
«Данные препараты устраняют также раннюю вазомоторную и психоэмоциональную симптоматику, метаболические нарушения, явления остеопороза, сердечно — сосудистых заболеваний и других заболеваний, развивающихся в климактерии.» [7]
Лечебная тактика при гиперпластических процессах зависит от патоморфологической характеристики эндометрия, возраста, этиологии и патогенеза заболевания, сопутствующей генитальной и экстрагенитальной патологии.
Основным методом лечения гиперпластических процессов эндометрия в период перименопаузы, после оценки патоморфологического исследования, сопутствующей гинекологической и соматической патологии, является гормонотерапия с оказанием антиэстрогенного влияния на слизистую оболочку полости матки, с использованием препаратов, обладающих прогестероновой активностью — синтетические прогестины, «чистые» гестагены. Применяют их укороченными курсами, общей продолжительностью лечения 6 месяцев .
Назначению гормональных препаратов предшествует гистологическое исследование эндометрия, полученного в результате РДВ.
Использование в терапии препаратов прогестероноподобного действия (дюфастон, ЛРС «Мирена», норколут, прогестерон 1% и др.) обосновывается биологическими эффектами прогестерона.
Прогестерон предотвращает эстрогениндуцированное клеточное деление, и тем самым создает условия, при которых пролифирирующий эндометрий превращается в секреторный. Сущность биологического действия прогестерона проявляется в антиэстрогенном эффекте, который осуществляется двумя механизмами:
1 — уменьшение количества цитозольных рецепторов эстрадиола путем ингибирования их синтеза;
2 — прогестерон индуцирует 17в — гидроксистероиддегидрогеназу, которая превращает эстрадиол в менее активный эстрон.
Следует заметить, что реализация действия прогестерона и прогестероноподобных веществ на местном уровне возможна лишь при наличии достаточного количества рецепторов прогестерона. Гормональное лечение гиперпластических процессов эндометрия, проявляющихся маточными кровотечениями, проводится с целью достижения нескольких эффектов, которые связаны между собой:
1) остановка кровотечения;
2) прекращение патологической пролиферации эндометрия;
3) нормализация взаимоотношений в гипоталямо — гипофизарно — яичниковой системе.
Для достижения стойкого клинического эффекта лечение синтетическими прогестинами рекомендуется продолжать 6 — 12 месяцев [11.12].
Влияние гормонов на клетки реализуется посредством взаимодействия со специфическими рецепторами. Количество рецепторов зависит от концентрации соответствующего гормона и от количества стероидов других классов [9.10.].
Эстрогены стимулируют пролиферацию клеток эндометрия, развитие секреторного аппарата клеток и синтез рецепторов к эстрогенам и прогестерону [15].
В тканях мишенях эстрогены увеличивают концентрацию собственных рецепторов и цитоплазматических рецепторов к прогестерону и андрогенам. Прогестерон блокирует этот механизм, снижая, таким образом, количество рецепторов к эстрогенам.
Кроме этого, прогестерон ускоряет оборот ранее синтезированных рецепторов.
Рецептор прогестерона состоит из А и В субъединиц, в соотношении 1:1. Прогестерон обладает высоким сродством к своему рецептору. Эстрадиол, кортизол и тестостерон имеют незначительное сродство к прогестероновым рецепторам. Прогестерон не имеет сродства к рецепторам эстрогенов, но некоторые прогестины и их метаболиты взаимодействуют с эстрагеновыми рецепторами [15].
Прогестерон не имеет сродства к рецепторам эстрогенов, но некоторые прогестины и их метаболиты взаимодействуют с эстрагеновыми рецепторами [15].
Эдометрий способен к стероидогенезу, вырабатывая на местном уровне эстрадиол и сульфат эстрона, пролактин, простагландины, андрогены, маркерные протеины. Кроме того он вырабатывает факторы роста — эпидермальный фактор роста, инсулиноподобный фактор роста (ИПФР) — 1 и 2, трансформирующие факторы роста 1-а и 1-в и их рецепторы [13, 16].
ИПФР — 1 и ИПФР — 2 структурно относятся к инсулину. Считается, что ИПФР, действуя через аутокринные и паракринные механизмы вызывает пролиферацию и дифференцировку клеток. В крови ИПФР находится в связи с белком — переносчиком, известно 6 белковых переносчиков (ИПФРСП). Наибольший интерес представляет ИПФРСП — 1, который синтезируется и секретируется в эндометрии во вторую фазу менструального цикла и прогестерон индуцирует его синтез.
Морфологические изменения эндометрия в секреторной фазе характеризуются отёком стромы, атрофией желез, децидуализацией стромы вплоть до полной атрофии функционального слоя и отсутствие митозов [16]. Наблюдается инфильтрация тканей лимфоцитами, плазматическими клетками и макрофагами, иногда возникает некроз стромы. Выявлены выраженные изменения со стороны сосудов эндометрия, заключающиеся в утолщении стенок артериол, тромбозе капилляров и уменьшении количества спиралевидных артерий.
Наблюдается инфильтрация тканей лимфоцитами, плазматическими клетками и макрофагами, иногда возникает некроз стромы. Выявлены выраженные изменения со стороны сосудов эндометрия, заключающиеся в утолщении стенок артериол, тромбозе капилляров и уменьшении количества спиралевидных артерий.
Так, например, в результате проведенных исследований, посвященных влиянию левоноргестрела (производного 19 — нортестостерона), входящего в ЛРС, было выявлено значительное снижение эстрогеновых и прогестероновых рецепторов эндометрия [13, 14, 15].
Кроме того, в 1998г. Н.О.С ritchley и соавт. опубликовали исследования по изучению содержания прогестероновых и эстрогеновых рецепторов, А и В субъединиц и простагландин — дегидрогеназы в эндометрии на фоне применения ЛРС.
Полученные данные свидетельствуют о значительном снижении количества эстрогеновых, а также А и В субъединиц прогестероновых рецепторов.
При этом наблюдается более выраженная супрессия В субъединицы рецепторов к прогестерону. Кроме того, совместно с ингибированием прогестероновых рецепторов было выявлено значительное снижение уровня простагландин — дегидрогеназы. А также выявлено подавление синтеза, индуцированных эстрогенами и прогестероном ростовых факторов [15].
Кроме того, совместно с ингибированием прогестероновых рецепторов было выявлено значительное снижение уровня простагландин — дегидрогеназы. А также выявлено подавление синтеза, индуцированных эстрогенами и прогестероном ростовых факторов [15].
В противоположность этому зарегистрировано стимулирующее действие левоноргестрела, входящего в ЛРС на образование циклооксигеназы — 2, рецепторов к пролактину и белка, связывающего ИПФР — 1 и ИПФРСП – 1 [15].
Гестагеновому влиянию на ИПФР(1,2) и ИПФРСП — 1 посвящены многочислен-ные исследования, наибольший интерес из которых представляет работа Rutanen .
В ряде исследований были получены результаты, свидетельствующие о супресорном действии левоноргестрела на ИПФР- 1, одновременно с ингибирующим действием на ИПФРСП — 1 и ИПФР — 2.
Значимость данных исследований была обусловлена определяющей ролью ИПФР — как медиатора эстрогенового влияния на эндометрий. Кроме того, ИПФРСП — 1 является маркером прогестинового влияния на эндометрий, которое выражается в дециадулизации стромы и подавлении роста эндометрия.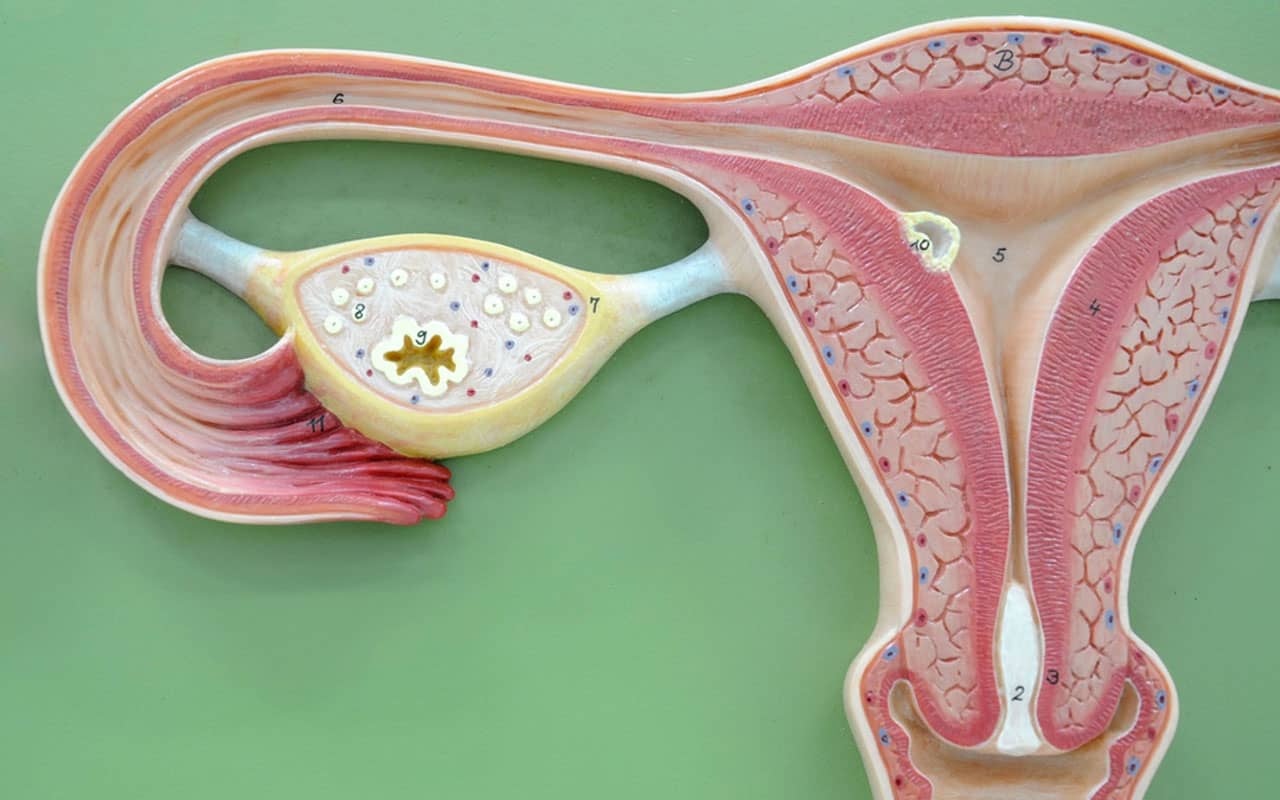
Таким образом, ингибирование ИПФР — 1, по всей вероятности является одним из возможных молекулярных механизмов антипролиферативного действия левоноргестрела, входящего в состав ЛРС, на гиперплазированный эндометрий у женщин в период перименопаузы [14, 15].
Для оказания антиэстрогенного влияния на эндометрий, применяют также эстроген-гестагенные препараты (нон-овлон, ановлар и др.). К их применению существуют относительные противопоказания: хронический холецистит или панкреатит, тромбофлебиты, варикозное расширение вен и др. [4., 13].
Помимо гестагенов, эстраген-гестагенных препаратов, в настоящее время, для лечения гиперпластических процессов эндометрия у больных в период климактерия применяют антигонадотропины — даназол — производные 17а — этилтестостерона по 400-600 мг. ежедневно, гестринон или неместран — производные 19 — норстероидов по 2,5мг. 2 раза в неделю в непрерывном режиме в течении 6 месяцев. Эти препараты обладают выраженным антигонадотропным эффектом, способствуют подавлению функции яичников и, как следствие, вызывают гипоплазию и атрофию эндометрия, что наиболее актуально в позднем периоде климактерия [10. ].
].
Сохраняется значимость включения гестагенов, норстероидов для лечения гиперпластических процессов в перименопаузальном возрасте, вследствие их эффективности и безопасности при кратковременных курсах лечения. При этом в каждом конкретном случае только врач, ориентируясь на индивидуальный статус пациентки, обязан четко определить целевые указания, которые должны быть решены при назначении конкретных гормональных препаратов, динамично отслеживая эффективность и безопасность гормонотерапии, в том числе гибко корректируя возникающие проблемы. (А.Н.Караченцев, Г.А.Мельниченко, 2003г.).
Из вышеизложенного следует, что выбор метода профилактики и лечения патологических процессов эндометрия осуществляется с учетом клинико — анамнестических данных, сопутствующей соматической патологии, наличия противопоказаний для проведения традиционной гормонотерапиии, нередко отрицательное отношение пациенток к приему гормональных препаратов, а также органосохраняющее направление в современной медицине, обусловливает необходимость разработки новых подходов к профилактике развития и лечения гиперпластических процессов эндометрия.
Безоперационное лечение атипической гиперплазии эндометрия за 1 сеанс фотодинамической терапии
Афанасьев Максим Станиславович.
Д.м.н., профессор Сеченовского университета, онколог, хирург, онкогинеколог, гинеколог-иммунолог, эксперт по лечению атипической гиперплазии и рака матки, а также предраковых и опухолевых заболеваний шейки матки.
Атипическая гиперплазия эпителия – это диагноз, который в онкогинекологии однозначно классифицируется как предраковое заболевание с высокой степенью канцерогенности – способностью перерождаться в рак.
Женщин репродуктивного возраста врачи стараются лечить. Проводят тяжелую гормональную терапию или хирургическую процедуру – лазерную абляцию эндометрия. Оба эти метода имеют достаточно серьезные последствия.
На фоне приема гормонов женщина погружается в состояние, свойственное менопаузе, и испытывают такие осложнения, как набор лишнего веса, усталость, снижение либидо и повышенный риск тромбоэмболии (1, 2).
Частым же осложнением абляции является развитие так называемого синдрома Джозефа Ашермана, когда в процессе заживления полость матки срастается.
К сожалению, атипичная гиперплазия матки – это очень серьезное заболевание, которое тяжело поддается лечению. Абляция и гормонотерапия гиперплазии эндометрия с очагами атипии эффективны лишь в определенном проценте случаев.
При неэффективности гормонотерапии и абляции, медицина сегодня может предложить фактически единственный способ избежать озлокачествления процесса и сохранить жизнь. Этот способ – удаление матки. Зачастую показания требуют удаления матки вместе с придатками – то есть, вместе с маточными трубами и яичниками. Поэтому отсутствие эффекта на фоне гормонального лечения или абляции всегда заканчивается одинаково – радикальной рекомендацией избавиться от матки.
Я уже более 10 лет узко занимаюсь проблемой лечения предраковых заболеваний шейки матки и матки и имею основания утверждать, что даже комплексная атипическая гиперплазия поддается успешному лечению и не требует операции.Новый высокотехнологичный метод фотодинамической терапии (ФДТ), который я использую в своей практике, за 1-2 сеанса обеспечивает выздоровление более чем в 80% случаев.
Безоперационный метод ФДТ позволяет сохранить матку, а вместе с ней сохранить женское здоровье, возможность зачать и самостоятельно родить.
Перед тем, как продолжить наш разговор об атипической гиперплазии, давайте определимся, что скрывается за этим термином и какова природа заболевания. Это позволит понять, почему классические методы мало эффективны против атипии и оценить все преимущества ФДТ.
Что такое гиперплазия маткиИзнутри матку выстилает слизистый слой – эндометрий. Эндометрий не однороден. Он состоит из:
1. маточных желез и
2. стромы – служебной ткани, которая поддерживает железы и обеспечивает их питание.
В норме строма и железы занимают примерно равный объем, 1:1.
| Структура здорового эндометрия матки и эндометрия при аденоматозе. |
Каждый месяц к моменту овуляции матка готовится принять в себя яйцеклетку, и толщина эндометрия увеличивается. После выхода яйцеклетки из яичника железы эндометрия активируются и начинают вырабатывать слизь (секрет), создавая благоприятную среду для оплодотворения. Когда оплодотворения не происходит, эндометрий отслаивается и выходит вместе с кровью.
Если по каким-то причинам эндометрий не отторгается во время менструации (например, в этом цикле у женщины не было овуляции), он продолжает разрастаться. Это состояние и называется гиперплазией эндометрия.
Классификация гиперплазии эндометрияГиперплазия эндометрия подразделяется на:
1. простую гиперплазию эндометрия,
2. атипическую гиперплазию эндометрия.
Если толщина эндометрия увеличивается локально, на отдельных участках, такое состояние называется очаговой гиперплазией. Если повсеместно по всей полости матки – диффузной.
Но так как далеко не все гинекологи и морфологи взяли на вооружение новую классификацию, в статье я буду использовать все существующие названия этого диагноза.
Что такое простая гиперплазия эндометрияЭто начальная стадия гиперплазии, которая характеризуется утолщением эндометрия и незначительным неравномерным расположением маточных желез, некоторые из которых превращаются в кисты – закупоренные железы, расширенные изнутри собственным секретом. Соотношение маточных желез и стромы примерно соответствует здоровому – 1:1.
К простым формам гиперплазии сегодня относят следующие диагнозы:
- железистая гиперплазия эндометрия,
- кистозная гиперплазия эндометрия,
- железисто-кистозная гиперплазия эндометрия.
Сочетание нескольких из указанных видов ранее относили и трактуются коллегами как сложная гиперплазия.
Гиперплазия проявляется кровотечениями или мажущими кровянистыми выделениями в период между менструациями. При УЗИ выявляется неоднородная эхоструктура эндометрия.
В силу стрессов – смены часового пояса, недосыпания, отсутствия овуляции (ановуляторный цикл) и нервного перенапряжения, – простая железистая гиперплазия может проявиться в самом обычном цикле даже у самой здоровой женщины. Поэтому можно говорить, что признаки простой гиперплазии наблюдаются в течение жизни у 90% женщин.
Это состояние достаточно легко поддаётся коррекции гестагенными препаратами, а также Дюфастоном, Норколутом, Утрожестаном и др. Молодым пациенткам для лечения часто назначают комбинированные оральные контрацептивы – Джесс, Жанин и другие.
Простая гиперплазия эндометрия не является предраковым состоянием и не требует специального противоопухолевого лечения.
Что такое атипичная гиперплазия эндометрия матки, или аденоматозная гиперплазия эндометрия (код N85.1 в МКБ-10 – международная классификация болезней 10 пересмотра)Аденоматоз эндометрия, или атипическая гиперплазия матки – стадия развития гиперплазии, которая характеризуется появлением атипичных клеток. Слово «атипичные» означает почти то же самое, что «нетипичные»: эти клетки не похожи на нормальные.
Все наши клетки имеют четкую форму, располагаются слоями и выполняют определенную функцию. Но по каким-то причинам (ученые не пришли к единому мнению о причинах развития атипии в эндометрии матки), они изменяют свою форму, размер и перестают выполнять заложенную природой функцию.
Появление атипических клеток – очень серьезный звонок! Эта стадия развития гиперплазии в медицине относится к предраковым заболеваниям матки.
Атипичные клетки продолжают делиться и накапливать повреждения. Если процесс не остановить, атипичная форма гиперплазии приводит к появлению злокачественных клеток и переходит в рак матки.
Между доброкачественной и злокачественной клеткой есть стадия, когда клетка теряет типичные свойства и приобретает атипичные. Такие клетки имеют некоторые свойства раковых, но полноценным раком еще не являются.
Атипичная гиперплазия эндометрия в медицинской практике носит сразу несколько названий – сложная или комплексная гиперплазия с атипией клеток, аденоматозная гиперплазия эндометрия, атипичная железистая гиперплазии эндометрия, очаговый аденоматоз эндометрия, сложная гиперплазия с атипией, железистая гиперплазии эндометрия с атипией, кистозно-аденоматозная гиперплазия, очаговая гиперплазия с атипией клеток и атипическая железистая гиперплазия эндометрия. Некоторые из них устарели, но используются до сих пор.
И какой бы диагноз из этого списка вам не поставили, при появлении атипии все эти состояния трактуются как предраковые и лечатся одинаково.
Название «аденоматозная» эта форма гиперплазии получила не случайно. Аденома – это доброкачественная опухоль, образованная из клеток железистого эпителия, в нашем случае – из эпителия маточных желез.
Как проявляется сложная атипическая гиперплазия эндометрияСложная гиперплазия эндометрия с атипией клеток сопровождается разрастанием желез слизистой оболочки матки. Большое количество маточных желез на ограниченном участке располагаются очень плотно друг к другу и деформируются. Соотношение железистой ткани и стромы смещается к пропорции 2:1. Общая структура эндометрия значительно нарушается.
Многие железы закупориваются, переполняются собственным секретом, образуют кисты и аденомы.
Сложная атипическая гиперплазия эндометрия является истинным предраком тела матки. По данным литературы, частота перерождения атипической гиперплазии в рак составляет порядка 30%.
Атипическая гиперплазия эндометрия может переходить в рак – в этом ее основная опасностьК сожалению, не только может, но и переходит – атипическая гиперплазия эндометрия имеет высокий риск озлокачествления.
Данные статистики сильно отличаются, но в общем и целом от 23 до 81%*** случаев атипической гиперплазии приводят к раку матки.
С одной стороны, такой разброс в цифрах объясняется разным периодом наблюдения за больными с атипической гиперплазией (при длительном наблюдении цифра приближается к 100%).
С другой стороны, даже квалифицированный специалист-патоморфолог, который рассматривает клетки под микроскопом и определяет степень их злокачественности, испытывает сложности при постановке диагноза.
Мы не будем вдаваться в тонкости работы патоморфолога, но, поверьте, крайне сложно однозначно дифференцировать предраковое и начальное раковое состояние эндометрия. И одни видят атипию там, где другие уже видят рак.
Атипичная гиперплазия эндометрия матки – это рак?Атипичная гиперплазия не являются раком в истинном смысле слова:
- нет опухолевого роста,
- отсутствует прорастание атипичных клеток за пределы базальной мембраны,
- нет переноса большого количества атипичных клеток в кровяное русло (так называемого «прорастания» опухоли),
- клетки не приобрели способность к метастазированию.
То есть, атипичные клетки уже приобрели свойства раковых – они разного размера и с увеличенными ядрами, но еще не преодолели сопротивление организма.
Еще раз повторюсь, что вопрос атипических процессов в матке совсем непростой. Постановка диагноза по материалу биопсии или после выскабливания крайне затруднительна. Поэтому при подозрении на диагноз «атипическая гиперплазия эндометрия матки» пересмотр стекол почти всегда сопровождается новым заключением патоморфолога.
Точная диагностика характера очагов аденоматоза возможна только после удаления матки, когда специалист получает возможность прицельно исследовать структуру эндометрия на всю его глубину. То есть, провести не цитологическое исследование (исследование клеток), а гистологическое исследование (исследование тканей), которое позволяет получить более точный результат.
Между тем по литературным данным диагностика тканей матки после гистерэктомии выявляет рак эндометрия у каждой третьей и даже у каждой второй (54%) больной***!
Как раньше проводили лечение атипичной гиперплазия эндометрияРаньше после постановки диагноза «очаговая атипическая гиперплазия эндометрия» гинекологи не могли порадовать своих пациенток наличием эффективного нехирургического метода лечения и благоприятным прогнозом на выздоровление.
Как я уже говорил, стандартный международный подход лечения аденоматоза матки у молодых женщин предусматривает приём тяжелых гормональных препаратов, таких как Депо Провера и его аналоги. Этот метод еще называется «гормональным кюретажем». Такое гормональное лечение направлено на усиление секреции – отторжение гиперплазированного эндометрия.
При отсутствии эффекта лечение аденоматозной гиперплазии эндометрия проводят хирургически – методом абляции (выпаривания) эндометрия при помощи лазера с его последующим кюретированием (выскабливанием). Кюретаж эндометрия выполняют не более трех раз, поскольку этот метод лечения имеет высокие риски развития синехий – осложнения, в результате которого внутренние стенки матки часто в процессе заживления срастаются.
Женщинам репродуктивного возраста, планирующим иметь детей, после проведения выскабливания назначается гормональное лечение прогестероном.
При этом важно понимать, что при железистой гиперплазии с атипией гормональное лечение позволяет уменьшить толщину эндометрия, но слабо при этом влияет на атипию, и атипические клетки продолжают свое деление. То есть, прогестероновая терапия не является профилактикой рака.
В случае неэффективности всех перечисленных методов, женщине выполняют удаление матки.
Здесь приведу слова своего коллеги – профессора, который цитировал мне тактику ведения пациенток, принятую на Западе: «Долгосрочное наблюдение после лечения должно проводиться каждые 6-12 месяцев до тех пор, пока не будет выполнена гистерэктомия».Да, в последние годы европейская медицина при малейшем появлении атипии часто направляет пациентку на удаление матки, исключая таким образом риск перерождения атипии в рак.
«Гистерэктомия», или удаление матки, – такова современная международная тактика ведения пациенток по поводу гиперплазии с атипией клеток, принятая в Европе и Америке. И хотя в отношении не рожавших женщин западная медицина тоже назначает горомонотерапию, финальный исход в виде гистерэктомии считается неизбежным как для рожавших, так и для не рожавших женщин любого возраста.
Для женщин после 45 — 50 лет – в возрасте, близком к менопаузе или в постменопаузе, особенно при наличии аденоматозных полипов, медицина не предлагает никаких альтернативных вариантов, кроме радикального удаления матки с придатками.
Такая тактика спасает жизнь, но приводит к развитию крайне серьезных осложнений.
Последствия удаления маткиПо этому поводу я написал разъясняющую статью, к каким последствиям приводит удаление матки для женщины.
В первую очередь это касается другого качества жизни после операции. Как говорится, природой лишних органов не задумано. И понятно, что при утрате органа, даже по медицинским показаниям, утрачивается и функция этого органа. Но это только часть проблемы. Крайне отрицательное воздействию после операции испытывают и соседние органы.
После удаления матки серьезно страдает мочевыделительная система, нарушается работа толстой кишки, развивается высокое артериальное давление, серьезно повышаются риски инфарктов и инсультов.
Женщинам же репродуктивного возраста, ведущих активную половую жизнь, приходится адаптироваться не только к изменению ощущений во время секса, но и к изменившемуся размеру влагалища.
Стремясь найти эффективное лечение без удаления органа, я разработал протокол лечения атипической гиперплазии эндометрия методом фотодинамической терапии.
Как проходит процедура фотодинамической терапии- После тщательного обследования пациентке внутривенно вводится препарат фотосенсибилизатор «Фоторан» или «Фотодиназин» и его аналоги. Это вещество избирательно накапливается в старых, атипичных, поврежденных и воспаленных клетках слизистой матки и почти не накапливается в здоровых.
- Через 2,5 – 3 часа по протоколу, разработанному совместно с центром лазерной медицины Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова (научный руководитель центра д.м.н., проф. Петрищев Н.Н., научный сотрудник Гришачёва Т.Г.), по особой, отработанной нами методике, внутриматочным балонным световодом проводится облучение полости матки.
| Одноразовый внутриматочный световой баллон для фотодинамической терапии. |
- Такой световод позволяет равномерно распределить свет лазерного луча и получать полноценный лечебный эффект.
- В своей практике я использую только одноразовые внутриматочные световые баллоны. Использование каждый раз нового баллона гарантирует его исправное свечение с заданной мощностью, что критически важно для достижения нужного фотодинамического эффекта и защищает от риска заражения инфекциями.
- Для достижения адекватного фотодинамического эффекта протокол лечения для каждой пациентки я разрабатываю индивидуально.
- Под воздействием лазерного излучения красного спектра фотосенсибилизатор вступает в фотохимическую реакцию с кислородом с образованием так называемого активного синглетного кислорода – мощного окислителя, который повреждает мембраны атипичных клеток и вызывает их гибель.
- Синглетный кислород также является агрессивной средой для бактериальной и вирусной инфекции и уничтожает ее. Это позволяет в рамках одной процедуры проводить лечение сопутствующих воспалительных заболеваний матки, таких как эндометрит.
- Так как каждая атипическая клетка аккумулирует в себе фотосенсибилизатор, ФДТ устраняет все участки аденоматоза. Из здоровых клеток фотосенсибилизатор выводится через 1-1,5 часа после введения, и в процессе лечения они не повреждаются.
Именно такое избирательное воздействие обеспечивает полноценное удаление атипичных клеток и гиперплазированного эндометрия и выздоровление после процедуры.
- После ФДТ организм запускает природные механизмы утилизации поврежденных атипичных клеток и продуктов их распада.
- Заживление после ФДТ проходит с формированием здорового и полноценного эндометрия матки.
Спустя 6–7 недель после сеанса фотодинамической терапии слизистая заживает без рубцов. Формируется здоровый эпителий матки.
В течение полугода все пациентки проходят 3-кратный контроль, который включает:
- УЗИ влагалищным датчиком,
- проведение скарификационной биопсии эндометрия матки с исследованием методом жидкостной цитологии.
В дальнейшем нужно будет посещать гинеколога один раз в пол года для профилактических осмотров.
Пациентка, 34 года, г. Москва, диагноз «атипическая гиперплазия эндометрия»Почему лечение аденоматоза эндометрия нужно проводить методом ФДТОбратилась с поставленным диагнозом зимой этого года. С Января 2015 года перестали приходить самостоятельно менструации. По назначению гинекологов принимала гестагенные препараты (Дюфастон) в непрерывном режиме.
Здесь следует отметить характерные для атипической (сложной) гиперплазии эндометрия жалобы – отсутствие самостоятельных менструаций, признак патологии эндометрия. В мае 2016 года при проведении раздельно выскабливания матки и гистероскопии диагноз снова подтвердился. Гистологическое заключение после пересмотра в лаборатории института онкологии им. Блохина № 24730: в готовых препаратах и препаратах, приготовленных с блока в соскобе кусочки эндометриального полипа с картиной простой железистой гиперплазии без атипии и сложной атипической гиперплазии. Показано проведение специального противоопухолевого лечения в объёме гистерэктомии, гормонотерапии. Была консультирована в том же онкоцентре им. Блохина, от предложенной гормонотерапии решила воздержаться в пользу проведения сеанса фотодинамической терапии.
В октябре 2016 года проведена фотодинамическая терапия матки. Послеоперационный период без осложнений. Пайпель биопсия эндометрия от 03.02.2017 года, гистологическое заключение № 171005746: «вероятнее всего определяется фрагмент железистого полипа эндометрия гиперпластического типа с очаговым фиброзом стромы, фокусами лимфоцитарной инфильтрации».
С целью профилактики рецидива атипической гиперплазии в апреле 2017 года пациентке проведён второй сеанс ФДТ матки, перед которым проведено раздельное выскабливание матки, гистологическое заключение № 171020496: «очаговая простая железистая гиперплазия эндометрия без атипии с кисточкой трансформацией желёз».
Пациентка вылечена. Клинический признак выздоровления: с декабря 2016 года у пациентки восстановился цикл, стали приходить менструации.
На сегодняшний день пациентка здорова и планирует беременность.
Я не могу гарантировать, что ФДТ способна вылечить атипическую гиперплазию эндометрия на 100%, так как причина этого заболевания – в основе своей – комплексная (гормональная).
Но моя многолетняя практика и независимые международные исследования очень обнадеживают. После ФДТ наблюдается очевидное торможение гиперпластических процессов в слизистой матки: гиперплазия прекращает свое развитие и не рецидивирует на протяжении длительного времени.
1. Фотодинамическая терапия прицельно устраняет атипические клетки и, как следствие, избавляет от риска развития рака матки.
После правильно выполненной фотодинамической терапии с возникновением адекватных фотохимических реакций, можно говорить о том, что в зоне лечения атипичных клеток не остается. Это означает, что рецидиву взяться попросту неоткуда.
2. Фотодинамическая терапия сохраняет матку – орган, который важен не только для рождения детей, но и для нормального функционирования всего женского организма – от кишечника до сосудов.
3. Процедура не затрагивает глубокие слои матки, позволяет сохранить целостность матки и все функции здорового органа. Такая матка впоследствии позволяет зачать, выносить и родить.
При этом акушеры и гинекологи в своей практике наблюдают интересный факт – беременность и период лактации благотворно влияют на гормональный фон женщины и служат отличной профилактикой: после родов гиперплазия эндометрия развивается крайне редко.
4. Исследования** эффективности ФДТ показывают удивительную способность процедуры тормозить избыточное разрастание эпителия матки.
На протяжении 6 месяцев наблюдений после одного сеанса ФДТ гиперплазии не была обнаружена у 82 % пациентов, и еще у 7% регрессировала после повторного сеанса ФДТ.*
Это обнадеживает и дает запас времени всем планирующим беременность.
Из пяти моих пациенток с пролеченной атипической гиперплазией четыре уже прошли контроль и здоровы. Одна еще находится под наблюдением в ожидании контроля.
5. ФДТ исключает сращение внутренних стенок матки – распространенное осложнение после хирургической абляции.
Через призму своего многолетнего опыта применения ФДТ в лечении атипичной гиперплазии эндометрия могу уверенно говорить об успешной реализации первой заповеди врача – не навреди.Хуже не будет, а высокая – более 80 процентов – вероятность излечения – хорошее основание, чтобы устранить очаг атипической гиперплазии методом ФДТ. Принять решение об удалении матки всегда успеете.
Таким образом, из всех орагносохраняющих методов лечения гиперплазии эндометрия с атипией фотодинамическая терапия является самым результативным.
Результаты лечения пациентки 39 лет, МоскваЗарубежный опыт лечения гиперплазии матки методом ФДТ подтверждает его высокую эффективностьВторая пациентка 39 лет также из Москвы. Характер ее жалоб – повод обращения к врачу, совершенно не специфичный, можно сказать для больного гинекологического профиля. Боли внизу живота и в области креста, отдающие в ногу. При обследовании проведено УЗИ органов малого таза, заключение: от декабря 2016 года: «эхопризнаки полипа эндометрия, аденомиоза».
Следует отметить второй признак , который позволяет заподозрить атипическую гиперплазию эндометрия – данные ультразвукового исследования органов малого таза (УЗИ), а именно наличие полипов в матке или неоднородной ткани в полости матки.
В феврале 2017 года проведено раздельное выскабливание матки под контролем гистероскопии. Гистологическое заключение № 5618-57: «железисто-фиброзный полип эндометрия с очагами сложной железистой гиперплазии и цитолоической атипией с участком строящихся желез по типу аденокарциномы».
И здесь я не опечатался. Потому что это рак. Первый пересмотр стеклопрепаратов в институте им. Блохина диагноз подтвердил. А третий морфолог в ГКБ № 62 и пересмотр другого классного специалиста в том же институте им. Блохина (это был четвёртый морфолог, давший своё заключение), гистологическое заключение № 8203: «очаги атипической гиперплазии эндометрия с фокусами плоскоклеточной метаплазии, развившиеся в железисто-фиброзных полипах на фоне очаговой типичной гиперплазии эндометрия. Достоверных признаков злокачественного опухолевого роста в пределах присланного материала не найдено».
Перед обращением ко мне за консультацией рекомендую гистологические блоки и стеклопрепараты отвезти на пересмотр в институт им. Блохина на м. Каширская. Атипическая гиперплазия эндометрия является истинным предраком или, можно сказать, раком 0 стадии. И разные морфологи могут трактовать это по-своему.
Часто сложно провести чёткую линию, чтобы разграничить тяжёлый предрак от начальной формы рака, и это не обязательно характеризует квалификацию морфолога.В марте 2017 года проведена фотодинамическая терапия матки. Послеоперационный период без осложнений. В среду проведена операция, в воскресение пациентка с дискомфортными ощущениями в животе улетела в отпуск в Европу. Очередная менструация пришла в срок. Через 1 месяц после операции в конце апреля проведена пайпель биопсия эндометрия, гистологическое заключение № 171028350: «эндометрий средней стадии пролиферации. Хронический эндоцервицит с плоскоклеточной метаплазией. Морфологом описаны артефакты здорового состояния слизистой матки и шейки».
Пациентка здорова, через 2 месяца после контрольного осмотра будем планировать беременность.
Основанием для усовершенствования моей методики проведения ФДТ стала работа врачей из Южной Кореи (3), которые пролечили несколько пациенток с высокодифференцированной аденокарциномой эндометрия матки и получили показательный результат.
Выше мы уже говорили о сложностях разграничения тяжёлой атипической гиперплазии эндометрия (дисплазии) и высокодифференцированной аденокарциномы эндометрия. Поэтому данные корейских коллег можно рассматривать в качестве релевантных и для случаев атипической гиперплазии.
Лечение проходила группа пациенток репродуктивного возраста 24-35 лет. У 10 из 16 пациенток удалось добиться выздоровления после одного сеанса ФДТ. Еще у двух пациенток удалось добиться выздоровления после второго и третьего сеанса ФДТ соответственно.
Таким образом, доля положительного ответа на лечение методом ФДТ составила 75% (12/16).
Из 7 пациенток, которые попытались забеременеть после лечения, у четырех пациенток (57%) прошло семь успешных беременностей, которые привели к рождению 6 живых младенцев.
Стоит также отметить, что после успешного лечения методом ФДТ на протяжении 78 месяцев наблюдения не было отмечено рецидива болезни ни у одной из пациенток. Также не было отмечено серьезных побочных эффектов, связанных с фотодинамической терапией.
Вероятность полного излечения от атипической гиперплазии составляет минимум 75% уже после одного сеанса ФДТ.
Почему направление ФДТ в медицине не развивается?Идея и опыт применения фотодинамической терапии в лечении атипической гиперплазии эндометрия и рака тела матки не нова. Работы по фотодинамической терапии проводилась еще на кафедре акушерства и гинекологии II Медицинского университета им. Н.И. Пирогова.
1. Метод технологически сложный и объединяет в себе три направления науки: медицину, биологию и физику. Ни одну из этих составляющих нельзя считать второстепенной.
Как следствие, практикующий ФДТ специалист должен исповедовать мультидисциплинарный подход и быть специалистом в разных областях знаний. Не у каждого врача это получается.
2. Врачи мало знают про этот метод или не знают совсем, хотя он уже входит в федеральный стандарт оказания медицинской помощи по акушерству и гинекологии при патологии шейки матки при CIN – смотрите Приказ Минздрава России от 01.11.2012 N 572н (ред. от 11.06.2015) «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» (Зарегистрировано в Минюсте России 02.04.2013 N 27960).
3. Сейчас не производят катетеры по форме матки. Что касается лечения матки, технология усложняется тем, что матка – полый мышечный орган треугольной формы. Около 5 лет назад в России и в Швейцарии производили баллонные катетеры по форме матки, но в последнее время их выпуск остановлен.
На сегодняшний день мной совместно с доктором физических наук, профессором Лощёновым В.Б. (ЗАО БИОСПЕК) инициирована разработка и сертифицированное производство внутриматочного баллонного световода нового поколения.
Показания к проведению фотодинамической терапии предрака матки- простая рецидивирующая гиперплазия при отсутствии эффекта после приёма гестагенных препаратов,
- сложная гиперплазия эндометрия как на фоне гормонального лечения, так и в монотерапии – как единственный метод лечения гиперплазии.
- рецидив гиперплазии эндометрия после отсутствия эффекта от проведённого гормонального лечения и 2-3 процедур раздельного диагностического выскабливания матки.
- рецидив атипической гиперплазии эндометрия после проведённого гормонального лечения или лазерной абляции эндометрия.
- высокодифференцированная аденокарцинома эндометрия в репродуктивном периоде,
- пожилой возраст с сопутствующими заболеваниями сердца и других органов,
- отказ по объективным причинам от стандартного хирургического и химиолучевого метода лечения.
Чтобы получить консультацию, показана ли вам фотодинамическая терапия, и рассчитать цену процедуры, высылайте вашу историю болезни и анализы на e-mail doctor.afanasyev@mail.ru. Или звоните по телефону 8 (800) 555-77-26 в Москве.
Прием ведет Афанасьев Максим Станиславович, акушер-гинеколог, онкогинеколог, онколог, иммунолог, доктор медицинских наук, профессор и член ученого совета Первого МГМУ им. И.М. Сеченова МЗ РФ, эксперт по лечению атипической гиперплазии матки.
Прием проводится в двух клиниках в Москве, а также в Санкт-Петербурге, Махачкале, Курске, Ставрополе, Барнауле, Самаре, Набережных Челнах, Салавате, Челябинске, Сургуте и других регионах России. Уточнить дату, место приема в вашем городе и записаться на консультацию вы можете у администратора по телефону +7 (495) 204-18-93.
После лечения я поддерживаю обратную связь со всеми пациентками и решаю все возникающие вопросы. Гепатит и положительный ВИЧ статус не является противопоказаниями для лечения методом ФДТ.
Использованные материалы:
1. Ramirez PT, Frumovitz M, Bodurka DC, et al. Hormonal therapy for the management of grade 1 endometrial adenocarcinoma: a literature review. Gynecol Oncol. 2004;95:133-138.
2. Banno K, Kisu I, Yanokura M, et al. Progestin therapy for endometrial cancer: the potential of fourth-generation progestin [review]. Int J Oncol. 2012;40:1755-1762.
3. Сохранение фертильности путем фотодинамической терапии у молодых пациенток с ранней стадией карциномы эндометрия. Долгосрочное исследование, основанное на последующем наблюдении пациенток. Авторы: Мин Чул Чой, Санг Геун Джунг, Хьюн Парк, Юн Хьюн Чо, Чан Ли, Сеунг Джо Ким.
4. ** Пасман Н. М., Никонов С. Д., Антонюк И. В. и др. Гистероскопическая фотодинамическая терапия больных с хроническим эндометритом и гиперплазией эндометрия / Вестник НГУ. Серия: Биология, клиническая медицина. 2011. Т. 9. Вып. 2. С. 7-13. — ISSN 1818-7943.
5. *** Новикова Е.Г., Чулкова О.В., Пронин С.М. Лечение атипической гиперплазии эндометриия / Практическая онкология. 2004. Т. 4, № 1. С. 52-59.
Аденомиоз матки — цена операции, хирургическое лечение аденомиоза матки в Москве
Выделяют три формы аденомиоза:
- Очаговый — характеризуется прорастанием эндометриоидных клеток в подслизистый и мышечный слои матки, при этом клетки скапливаются, образуя очаги.
- Узловой — характеризуется проникновением железистого эпителия в миометрий с образованием множественных узелков, состоящих из соединительной ткани и железистого компонента, по внешнему виду они напоминают миоматозные узлы.
- Диффузный — характеризуется равномерным врастанием эндометриоидных клеток по всей поверхности слизистой оболочки матки, иногда с формированием «карманов» — участков скопления эндометриоидных клеток проникающих в толщу миометрия на разную глубину.
Причины аденомиоза
Медицине до сих пор неизвестны точные причины аденомиоза матки. Однако установлены предрасполагающие факторы — дисбаланс половых гормонов, а также нарушение последовательности слоев стенки матки. Эндометрий отделен от миометрия базальной мембраной, в случае повреждения этой структуры, рост эндометрия становится бесконтрольным и в неправильном направлении.
Факторы, способствующие возникновению данной патологии:
- Аборт.
- Выскабливание.
- Кесарево сечение и другие хирургические манипуляции на матке.
- Осложнения во время родов (травма, разрыв, воспаление).
- Генетическая предрасположенность.
- Нарушения гормонального фона и обмена веществ (прием оральных контрацептивов без назначения врача, нерегулярная половая жизнь).
- Установка внутриматочной спирали.
- Инфекционно-воспалительные заболевания мочеполовой системы.
- Сниженный иммунитет.
- Нервное перенапряжение.
- Тяжелый физический труд.
- Вредные привычки.
Стадии аденомиоза матки
Стадии аденомиоза матки зависят от распространенности поражения и глубины прорастания эндометрия в стенку матки.
Выделяют 4 стадии:
- Эндометрий прорастает в подслизистый слой на 2-4 мм
- Эндометрий прорастает в миометрий до 50% его толщины
- Эндометрий прорастает толщу миометрия более чем на 50%
- Эндометрий прорастает за пределы мышечного слоя с вовлечением париетальной брюшины малого таза и других органов.
Клинические симптомы аденомиоза
Симптомы аденомиоза матки зависят от стадии заболевания, возраста пациентки, а также общего состояния организма. Основным и главным признаком аденомиоза — являются обильные и болезненные менструации более 8 дней со сгустками крови. Также к симптомам аденомиоза относятся:
- Болезненность во время полового акта.
- Нарушения менструального цикла.
- Кровянистые выделения в промежутке между менструациями.
- Боли внизу живота.
- Вздутие живота (характерно для четвертой стадии).
Диагностика аденомиоза должна быть своевременной и комплексной, так как в начальной стадии заболевание может протекать бессимптомно. Заподозрить болезнь поможет гинекологический осмотр с помощью зеркал, сбор анамнеза и кольпоскопия. При аденомиозе матка увеличивается примерно до 5-6 недели беременности и приобретает шарообразную форму.
Для постановки точного диагноза и его стадии, что необходимо для подбора максимально эффективной терапии, могут понадобиться:
Лабораторные исследования:
- клинический и биохимический анализ крови;
- гинекологический мазок на флору и цитологию;
- анализ крови на гормоны.
Инструментальные исследования:
- УЗИ органов малого таза;
- гистероскопия с биопсией или полным выскабливанием эндометрия с последующим гистологическим исследованием;
- МРТ матки — в случаях, когда не удается установить стадию заболевания с помощью УЗИ.
В клиниках «Мать и дитя» вы можете пройти полный комплекс обследований, необходимый для диагностики данной патологии. Современное оборудование позволяет выявить заболевание даже на ранних стадиях, когда клинические симптомы отсутствуют. Опытные специалисты помогут установить причину заболевания и подобрать наиболее подходящую терапию.
Лечение аденомиоза матки
В ГК «Мать и дитя» схема лечения аденомиоза матки назначается специалистом в индивидуальном порядке. Сначала устанавливается стадия заболевания, учитываются фоновые заболевания, общее состояние организма, возраст, наследственный анамнез. В зависимости от этих факторов, лечение аденомиоза матки может быть консервативным или хирургическим.
Консервативное лечение показано только на ранних стадиях заболевания, также оно может сопровождать хирургическую терапию. Лечение медикаментами направлено на стабилизацию гормонального фона, улучшение иммунной системы пациентки, а также на купирование неприятных симптомов.
Лекарства подбираются индивидуально, учитывая уровни гормонов в крови и другие факторы. Лечение может занять от нескольких месяце до нескольнких лет и требует регулярного наблюдения врачом. Нормализация менструального цикла наступает, в среднем, через 4-6 недель от начала курса.
Хирургическое лечение показано на более поздних стадиях заболевания и считается приемлемым при узловых или очаговых формах аденомиоза. Такой вид лечения направлен на удаление участков патологических тканей и узлов, восстановление нормального анатомического строения стенки матки, ее формы, а также удаление чрезмерно разросшегося слизистого слоя матки, который может вызывать кровотечения.
В клиниках «Мать и дитя» хирургическое лечение проводится несколькими способами.
- Гистероскопия — один из методов диагностики и лечения аденомиоза матки, относится к малоинвазивным хирургическим манипуляциям и показывает хорошие результаты как ранней диагностики патологии, так и её лечения. Процедура проводится под внутривенной анестезией и через 2-3 часа по окончании, пациентка может быть выписана домой.
- Эмболизация маточных артерий (ЭМА) — данный метод широко используется как при миоме матки, так и при аденомиозе. Кровоток, снабжающий патологические узлы приостанавливается и очаги склерозируются. Процедура проводится под местным наркозом и занимает от 10 минут до 2-х часов в зависимости от количества узлов.
- Гистерэктомия — радикальный метод, применяемый в крайних случаях, когда заболевание прогрессирует, несмотря на проводимую терапию и есть вероятность распространения патологии на соседние органы и ткани. Данный метод направлен на удаление матки под общим наркозом, период восстановления после такой операции достаточно длительный.
Аденомиоз матки — не приговор и не повод отказаться от желанной беременности. Это заболевание успешно поддается лечению. В клиниках «Мать и дитя» специалисты помогут индивидуально подобрать схему лечения, максимально направленную на сохранение репродуктивной функции.
Снизить риск заболеваемости и предупредить патологию очень просто. Необходимо ежегодно проходить профилактический гинекологический осмотр. У большинства женщин аденомиоз матки протекает бессимптомно на ранних этапах, когда достаточно скорректировать гормональный фон, не прибегая к помощи хирурга.
Лучшее лечение — это профилактика, поэтому поспешите записаться на прием к гинекологу.
Видео версия:
«У вас в матке аденомиоз» – такое заключение довольно часто приходится слышать женщинам (особенно после 27-30 лет) во время УЗИ или после осмотра на кресле. Очень редко пациенткам подробно объясняют, что из себя представляет это заболевания.
Давайте разбираться.
Аденомиоз иногда называют «внутренним эндометриозом» приравнивая это заболевание к разновидности эндометриоза. Большинство исследователей считают, что хоть эти заболевания и похожи – всё же это два разных патологических состояния.
Что такое аденомиоз?
Напомню, полость матки выстлана слизистой оболочкой, которая называется эндометрием. Эндометрий растет в течение менструального цикла, готовясь принять оплодотворенную яйцеклетку. Если беременность не происходит – поверхностный слой (его еще называют «функциональным») отторгается, что сопровождается кровотечением (этот процесс называется менструацией). В полости матки остается ростковый слой эндометрия, из которого в следующем менструальном цикле вновь начинает расти эндометрий.
Эндометрий отделен от мышечного слоя матки специальной тонкой прослойкой ткани, которая разделяет эти слои. В норме эндометрий может расти только в сторону полости матки, просто утолщаясь во время менструального цикла. При аденомиозе происходит следующее: в разных местах эндометрий прорастает разделительную ткань (между эндометрием и мышцей) и начинает внедряться в мышечную стенку матки.
Важно! Эндометрий прорастает в стенку матки не на всем протяжении, а только местами. Для наглядности приведу пример. Вы посадили рассаду в картонную коробку, и если вы её долго не пересаживали в землю, то отдельные корни прорастают через коробку. Вот так в виде отдельных «корней», внедряющихся в мышечную стенку матки, прорастает эндометрий.
В ответ на появление ткани эндометрия в мышце матки, она начинает реагировать на вторжение. Это проявляется реактивным утолщением отдельных пучков мышечной ткани вокруг вторгшегося эндометрия. Мышца как бы пытается ограничить дальнейшее распространение этого процесса врастания.
Так как мышца увеличивается в размере, то соответственно и матка при аденомиозе начинает увеличиваться в размере, приобретает шаровидную форму.
Какие формы аденомиоза бывают?
В ряде случаев внедрившаяся ткань эндометрия образует очаги своего скопления в толще мышцы, тогда говорят, что это «аденомиоз – очаговая форма». Если происходит просто внедрение эндометрия в стенку матки без образования очагов – говорят о «диффузной форме» аденомиоза. Иногда бывает сочетание диффузной и узловой форм аденомиоза.
Бывает, что эндометрий, внедрившийся в стенку матки, образует узлы очень похожие на узлы миомы матки. Если миома матки, как правило, представлена мышечными и соединительнотканными компонентами, то в узлах аденомиоза преобладает железистый компонент и соединительная ткань. Такую форму аденомиоза называют «узловой».
Аденомиоз и миома матки
Бывает очень трудно при УЗИ отличить узел миомы матки от узловой формы аденомиоза. Кроме этого, считается, что ткань эндометрия может внедряться в уже существующие миоматозные узлы. Довольно часто можно видеть сочетание аденомиоза и миомы матки.К примеру, на фоне диффузного аденомиоза имеются узлы миомы матки.
Очень важно в результате диагностики поставить правильный диагноз и четко определиться с тем, что именно присутствует в матке – миома матки или аденомиоз – узловая форма. Лечение миомы матки и аденомиоза фактически одинаковое, но эффективность отличается, а это будет влиять на прогноз лечения.
Из-за чего образуется аденомиоз?
Точная причина образования аденомиоза до сих пор не известна. Предполагается, что все факторы, которые нарушают барьер между эндометрием и мышечным слоем матки, могут приводить к развитию аденомиоза.
Что конкретно:
- Выскабливания и аборты
- Кесарево сечение
- Удаление узлов миомы матки (особенно со вскрытием полости матки)
- Роды
- Воспаления матки (эндометриты)
- Другие операции на матке
В тоже время, но очень редко, аденомиоз обнаруживается в женщин, никогда не переносивших описанных выше вмешательств и заболеваний, а также у молодых девушек-подростков, у которых только недавно начались месячные.
В этих редких случаях предполагается две причины.
Первая причина связана с возникновением нарушений во время внутриутробного развития девочки, и эндометрий без каких-либо внешних факторов внедряется в стенку матки.
Вторая причина связана с тем, что у молодых девушек может плохо открываться канал шейки матки во время менструации. Мышечные сокращения матки во время менструации при наличии спазма шейки матки создают очень высокое давление внутри матки, что может оказывать травматическое воздействие на эндометрий, а именно на барьер, разделяющий эндометрий и мышечный слой матки. В результате этого может происходить внедрение эндометрия в стенку матки.
Кроме этого, именно такой механизм может играть роль в развитии эндометриоза, так как при затруднении оттока менструальных выделений из матки под воздействием высокого давления, эти выделения через трубы в большом количестве попадают в брюшную полость, где происходит имплантация фрагментов эндометрия на брюшине.
Как проявляется аденомиоз?
Более чем у половины женщин аденомиоз протекает бессимптомно. К наиболее характерным симптомам аденомиоза относятся болезненные и обильные менструации, часто со сгустками, с длительным периодом коричневатых мажущих выделений, боли во время половой жизни и иногда межменструальные кровянистые выделения. Боли при аденомиозе часто достаточно сильные, спастические, режущие, иногда могут быть «кинжальными». Такие боли плохо снимаются приёмом обычных обезболивающих препаратов. Интенсивность болевых ощущений во время менструации может нарастать с возрастом.
Диагностика аденомиоза
Чаще всего диагноз «аденомиоз» ставят на консультации гинеколога во время УЗИ. Врач видит «увеличенную в размере матку, неоднородную структуру миометрия (еще пишут «неоднородная эхогенность») отсутствие четкой границы между эндометрием и миометрием, «зазубренность» в области этой границы, наличие очагов в миометрии. Хорошая продукция покупал тут.
Врач может описать резкое утолщение одной из стенок матки по сравнению с другой. Это наиболее частые УЗИ описания аденомиоза, которые вы можете прочитать в своем заключении. Во время осмотра на кресле врач может сказать, что матка увеличена в размере, очень важное слово «матка круглая».
Диагноз «аденомиоз» часто ставят во время гистероскопии. Во время этой процедуры видят, так называемые «ходы» – это красные точки в эндометрии, которые соответствуют именно тем местам, где произошло внедрение эндометрия в стенку матки.
Реже для подтверждения диагноза используют МРТ. Этот метод наиболее показан в тех случаях, когда с помощью УЗИ не удается достоверно различить узловую форму аденомиоза и миому матки. Это важно при планировании тактики лечения.
Важно! Так как аденомиоз более чем у половины женщин протекает бессимптомно и большинство женщин проживают свою жизнь, так и не зная, что у них был аденомиоз (аденомиоз, как и миома матки и эндометриоз регрессируют после менопаузы) – не стоит сразу же переживать, если во время осмотра вам ставят этот диагноз.
Это довольно частая ситуация – вы приходите на плановой осмотр или с жалобами на выделения из влагалища – вам заодно делают УЗИ и ставят диагноз «аденомиоз», при том,что у вас нет симптомов, характерных для этого заболевания. Врач обязан описать те изменения, которые он увидел, но это не означает, что вам надо срочно начинать лечиться.
Аденомиоз это очень распространенное «состояние» матки, которое может никак себя не проявлять всю жизнь и самостоятельно регрессировать после менопаузы. Вы можете никогда не столкнуть с симптомами этого заболевания.
Аденомиозу в большинстве случаев характерно стабильное бессимптомное течение, без прогрессирования заболевания, если для этого не создаются дополнительные факторы в виде абортов и выскабливаний.
У большинства женщин аденомиоз существует как «фон» и не требует серьезного лечения, только профилактических мероприятий, которые я опишу ниже.
Аденомиоз как серьезная проблема встречается реже, как правило, в этой ситуации он сразу же проявляет себя симптомами и имеет прогрессивное течение. Такой «аденомиоз» требует лечения.
Лечение аденомиоза
Аденомиоз невозможно вылечить полностью, если конечно не брать в расчет удаление матки. Это заболевание самостоятельно регрессирует после наступления менопаузы. До этого момента мы можем добиться небольшой регрессии аденомиоза и предотвращать дальнейшее развитие заболевания.
Для лечения аденомиоза используют фактически те же подходы, как и к лечению миомы матки.
Так как аденомиоз регрессирует после менопаузы – используют препараты агонистов ГнРГ (бусерелин-депо, золадекс, люкрин и.т.д.). Эти препараты создают обратимое состояние менопаузы, что приводит к регрессии аденомиоза и устранению симптомов заболевания. Важно помнить, что после окончания курса лечения и восстановления менструальной функции аденомиоз быстро рецидивирует в подавляющем большинстве случаев, поэтому после основного курса терапии следует обязательно переходит или на гормональные контрацептивы или устанавливать спираль «Мирена».
Это позволит стабилизировать результаты, достигнутые основным курсом лечения.
Эмболизация маточных артерий имеет неоднозначный эффект на аденомиоз. Есть публикации, в которых наличие аденомиоза даже называется причиной неэффективности ЭМА, проводимой с целью лечения миомы матки. Но есть и публикации описывающие высокую эффективность ЭМА в отношении аденомиоза. Мы делали ЭМА при наличии аденомиоза и имели хорошие результаты. Я отмечал, что если ткань аденомиоза хорошо кровоснабжается, то ЭМА была эффективна, а в том случае, если кровоток в зоне аденомиоза был скудный – эффекта не было.
К хирургическим методам относят удаление ткани аденомиоза с сохранением матки и радикальное решение проблемы – ампутация матки. К хирургическим методам лечения стоит прибегать только в крайних случаях, когда ничего уже не помогает.
Хорошо нивелирует симптомы аденомиоза внутриматочная спирать «Мирена». Она устанавливается на 5 лет. На фоне этой спирали менструации становятся скудными или исчезают полностью, могут исчезнуть боли.
Гормональные контрацептивы могут обеспечить профилактику аденомиоза, а также остановить его прогрессирование на ранних этапах заболевания. Для достижения наибольшего эффекта контрацептивы лучше всего принимать по пролонгированной схеме – 63+7 – то есть три пачки подряд без перерыва и только после этого 7-ми дневный перерыв, потом опять 63 дня приема препарата.
Аденомиоз и бесплодие
Согласно данным западных авторов нет доказанной связи между аденомиозом и бесплодием, то есть предполагается, что изолированно аденомиоз не влияет на возможность забеременеть. Однако, аденомиоз довольно часто сочетается с другими патологическими состояниями, к примеру с эндометриозом или миомой матки, которые могут повлиять на фертильность женщины.
Подводим итог:
- Аденомиоз –это довольно распространенное заболевание, частота которого достигает 60-70%
- При аденомиозе эндометрий внедряется в мышечную стенку матки, приводя к реактивному утолщению мышечных волокон вокруг внедрившейся ткани. При этом происходит увеличение размеров матки.
- Чаще всего аденомиоз диагностируется у женщин после 30 лет
- Предполагается, что к развитию аденомиоза приводят различные медицинские манипуляции с маткой – выскабливания, аборты, кесарево сечение, роды, операции на матке, воспалительный процесс.
- Более чем у половины женщин аденомиоз протекает бессимптомно
- Наиболее частым симптомами аденомиоза являются обильные, болезненные и длительные менструации со сгустками и боли при половой жизни
- Аденомиоз чаще всего диагностируется при УЗИ и гистероскопии
- Аденомиоз часто сочетается с миомой матки, при узловой форме аденомиоза его трудно отличить от миоматозного узла
- Лечение аденомиоза сводится к созданию обратимой менопаузы с последующим стабилизационным этапом в виде приема гормональных контрацептивов или установкой внутриматочной гормональной системы «Мирена»
- Эмболизация маточных артерий в ряде случае эффективный метод лечения аденомиоза
- Аденомиоз скорее всего самостоятельно не приводит к бесплодию.
УЗИ диагностика гиперплазии эндометрия в Киеве | Цены 2020
Гиперплазия эндометрия – это незлокачественный процесс, представляющий собой чрезмерное разрастание тканей слизистой оболочки матки, увеличение числа ее клеток, который выявляется при помощи УЗИ-диагностики в Киеве. Разрастание эндометрия матки происходит в здоровом организме женщины каждый месяц, его провоцирует производство гормона эстрогена. Это необходимо для того, чтобы в случае оплодотворения яйцеклетки ей было проще переместиться в матку. Если же зачатия в течение очередного менструального цикла не происходит, то выполняется отторжения эндометрия, провоцирующее менструальные кровотечения.
Говорить о гиперплазии слизистой оболочки матки можно тогда, когда она разрослась в пять раз или более. Из-за такого большого количества клеток естественный процесс отторжения ненужного эндометрия дает сбой, и репродуктивная система женщины уже не справляется с поддержанием здорового, правильного его объема. Кроме того, гиперплазия эндометрия может развиваться и в менопаузе, из-за гормональных скачков в организме.
ОТДЕЛЕНИЕ УЗИ В КИЕВЕ
Какой бывает гиперплазия эндометрия?
Достаточно часто у пациенток возникают вопросы в духе: «Гиперплазия эндометрия – это рак или нет?». Как уже было отмечено выше, разросшийся эндометрий относится к доброкачественным новообразованиям. Выделяют несколько типов такой патологии в зависимости от ее толщины:
- Железистая гиперплазия эндометрия. Она диагностируется, когда толщина эндометрия составляет порядка 1,5 см, и связана с увеличением количества клеток железистой ткани. Также этому сопутствует увеличение просвета между железами.
- Аденоматоз, или атипичная гиперплазия. О ней говорят, когда толщина слизистой оболочки матки составляет до 3 см. Структурные изменения в таком случае уже связаны именно с тканями эндометрия.
- Железисто-кистозная или кистозная разновидность заболевания. Она наблюдается в тех случаях, когда в матке образуются кисты.
- Очаговая гиперплазия эндометрия. При ней толщина новообразований может достигать 6 см. Они располагаются не по всей поверхности, а очагами, в форме полипов.
ЗАПИСАТЬСЯ НА КОНСУЛЬТАЦИЮ ПРОФИЛЬНОГО СПЕЦИАЛИСТА
Что делать при гиперплазии эндометрия?
Гиперплазия эндометрия и эндометриоз – достаточно распространенная проблема среди пациенток (в среднем, от нее страдает каждая десятая женщина). Хотя сам по себе разросшийся эндометрий относится к разряду доброкачественного новообразования, при отсутствии диагностики и эффективного лечения некоторые формы патологии (очаговая и атипичная гиперплазия) могут переродиться в раковые опухоли.
Основные симптомы, по которым можно заподозрить наличие у себя гиперплазии слизистой оболочки матки, следующие:
- Частые сбои в менструальном цикле.
- Чрезмерно обильные кровотечения во время месячных (по сравнению с обычными).
- Чрезмерная болезненность критических дней (по сравнению с обычной).
- Кровотечения в период между месячными.
- Болезненные ощущения, появляющиеся после полового акта.
- Ощущение, как будто в нижней части живота присутствует инородное тело шарообразной формы.
Даже один-два из перечисленных выше симптомов уже являются достаточной причиной для обращения к врачу.
ГИНЕКОЛОГИЯ PROFMEDICAL
УЗИ в Киеве при гиперплазии эндометрия
Для диагностики этого заболевания в нашем медицинском центре выполняется трансвагинальное УЗИ с использованием современной аппаратуры. Ранее с этими целями достаточно часто использовалась биопсия, но она могла дать отрицательный результат при наличии очаговой гиперплазии. Трансвагинальное УЗИ, в отличие от нее, позволяет диагностировать все формы патологии.
Для выполнения такой процедуры используется небольшой датчик, который вводится во влагалище. В связи с особенностями функционирования женской репродуктивной системы, оптимальным временем для диагностики подобным способом считается период с 4-го по 7-ой день цикла.
По итогам процедуры назначается лечение, наиболее подходящее в конкретной ситуации. Оно может быть направлено на торможение процесса разрастания эндометрия и быть консервативным. Либо доктор может назначить операцию по удалению разросшейся слизистой оболочки (гистероскопия или гистерорезектоскопия). В наиболее тяжелых случаях предписывается гистерэктомия (полное удаление) матки и ее придатков.
ЦЕНЫ НА ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ
УЗИ диагностика гиперплазии эндометрия в Киеве: цены 2020-2021
Основные меры по профилактике гиперплазии эндометрия – это бережное отношение к состоянию своей репродуктивной системы и своевременное обращение к врачу при появлении подозрений на наличие каких-либо заболеваний и патологий. Наш центр УЗИ в Киеве предоставляет возможность современной диагностики гиперплазии эндометрия, благодаря которой заболевания точно не будет запущено, а наши доктора смогут назначить вам оптимально подходящее лечение.
- Стоимость узи — диагностики гиперплазии эндометрия в Киеве — 400 грн. (актуальные цены 2020 — 2021)
Как показывают отзывы и фото на форумах, при своевременной диагностике это заболевание практически не сказывается на ритме жизни женщины. Узнать стоимость услуги в нашей клинике вы можете в разделе «Прайс».
Аденомиоз | Симптомы, осложнения, диагностика и лечение
Аденомиоз возникает, когда ткань эндометрия, которая обычно вытягивает матку, врастает в мышечную стенку матки. Вытесненная ткань эндометрия продолжает действовать, как обычно, вызывая утолщение, разрушение и кровотечение во время каждого менструального цикла. Результатом может стать увеличенная матка и болезненные, тяжелые периоды.
Причина аденомиоза остается неизвестной, но болезнь обычно исчезает после менопаузы. Для женщин, которые испытывают серьезный дискомфорт от аденомиоза, некоторые методы лечения могут помочь, но единственным наиболее надежным и эффективным лекарством на сегодняшний день является гистерэктомия.
Симптомы
Иногда аденомиоз происходит спокойно, не вызывая никаких признаков или симптомов, или только легкие неудобства. В других случаях аденомиоз может вызывать:
- Тяжелое или длительное менструальное кровотечение
- Тяжелые судороги или острые, ножевидные боли в области таза во время менструации (дисменорея)
- Менструальные судороги, которые сохраняются в течение всего вашего периода и ухудшаются по мере взросления
- Боль во время полового акта
- Сгустки крови, которые проходят в течение вашего периода
Ваша матка может стать больше. Хотя вы, возможно, не знаете, увеличена ли ваша матка, вы можете заметить, что нижняя часть вашего живота кажется большой или слишком чувствительна.
Причина аденомиоза неизвестна. Экспертные теории о возможной причине включают:
- Инвазивный рост ткани. Некоторые эксперты считают, что аденомиоз является результатом прямого вторжения клеток эндометрия из подкладки матки в мышцу, которая образует стенки матки. Разрезы матки, сделанные во время операции, такие как кесарево сечение (С-разрез), могут способствовать прямому вторжению клеток эндометрия в стенку матки.
- Происхождение развития. Другие эксперты полагают, что аденомиоз возникает внутри мышцы матки из ткани эндометрия, осажденной там, когда матка сначала образуется у плода.
- Воспаление матки связано с родами. Другая теория предполагает связь между аденомиозом и родами. Воспаление слизистой оболочки матки в послеродовом периоде может привести к нарушению нормальной границы клеток, которые выстилают матку. Хирургические процедуры на матке могут иметь аналогичный эффект.
- Происхождение стволовых клеток. Недавняя теория предполагает, что стволовые клетки костного мозга могут вторгаться в мышцу матки, вызывая аденомиоз.
Независимо от того, как развивается аденомиоз, его рост зависит от циркулирующего эстрогена в организме женщины. Когда производство эстрогенов уменьшается при менопаузе, аденомиоз в конечном итоге уходит.
Факторы риска аденомиоза включают:
- Перед маточной операцией, такой как удаление С-секции или удаление фибромы
- Роды
- Переходный возраст
Большинство случаев аденомиоза, которые зависят от эстрогена, встречаются у женщин в возрасте от 40 до 50 лет. Аденомиоз у женщин среднего возраста может относиться к более длительному воздействию эстрогена по сравнению с более молодыми женщинами. До недавнего времени аденомиоз чаще всего диагностировался только тогда, когда у женщины была гистерэктомия. Современные исследования показывают, что это состояние может быть общим, но часто необнаруженным, у молодых женщин.
Осложнения
Если у вас часто бывает продолжительное, сильное кровотечение во время менструального цикла, может произойти хроническая анемия. Анемия вызывает усталость и другие проблемы со здоровьем. Если вы подозреваете, что у вас может быть анемия, обратитесь к врачу.
Хотя подобное состояние и не является вредным, боль и чрезмерное кровотечение, связанное с аденомиозом, могут нарушить ваш образ жизни. Возможно, вы избегаете действий, которые вам нравились в прошлом, потому что не знаете, когда и где можете начаться кровотечение.
Болезненные менструальные циклы могут заставить вас пропустить работу или школу и могут создать конфликт в отношениях. Периодическая боль может привести к депрессии, раздражительности, беспокойству, гневу и чувству беспомощности. Вот почему важно обратиться к врачу, если вы подозреваете, что у вас может быть аденомиоз.
Диагностика
Врач может подозревать аденомиоз на основе:
- Признаки и симптомы
- Тазовый осмотр, который показывает увеличенную чувствительную матку
- Ультразвуковая визуализация матки
- Магнитно-резонансная томография (МРТ) матки
В некоторых случаях врач может взять образец ткани матки для тестирования (биопсия эндометрия), чтобы убедиться, что аномальное маточное кровотечение не связано с каким-либо другим серьезным заболеванием. Но биопсия эндометрия не поможет врачу подтвердить диагноз аденомиоза. Единственный способ быть уверенным в аденомиозе — это осмотреть матку после операции, чтобы удалить ее (гистерэктомия).
Другие заболевания матки могут вызывать признаки и симптомы, сходные с аденомиозом, что затрудняет диагностику аденомиоза. Такие состояния включают в себя фиброзные опухоли (лейомиомы), маточные клетки, растущие за пределами матки (эндометриоз), и рост в маточной оболочке (полипы эндометрия). Ваш врач может заключить, что у вас есть аденомиоз только после определения нет ли других возможных причин для ваших признаков и симптомов.
Лечение
Аденомиоз обычно уходит после менопаузы, поэтому лечение может зависеть от того, насколько вы близки к этому этапу жизни.
Варианты лечения аденомиоза включают:
- Противовоспалительные препараты. Если вы приближаетесь к менопаузе, врач может выписать противовоспалительные препараты, такие как ибупрофен (Advil, Motrin IB, другие), чтобы контролировать боль. Начав прием противовоспалительное лекарства за два-три дня до начала вашего цикла и продолжая принимать его во время цикла, вы можете уменьшить менструальный кровоток и помочь облегчить боль.
- Гормональные препараты. Комбинированные противозачаточные таблетки для эстроген-прогестина или вагинальные кольца могут уменьшить сильное кровотечение и боль, связанные с аденомиозом.
- Гистерэктомии. Если боль тяжелая, а до менопаузы ещедовольно далеко, врач может предложить операцию по удалению матки (гистерэктомия). Удаление яичников не требуется для контроля аденомиоза.
Мой подход к интерпретации биопсии эндометрия и выскабливания
J Clin Pathol. 2006 Aug; 59 (8): 801–812.
WG McCluggage , Отделение патологии, Royal Group of Hospitals Trust, Grosvenor Road, Белфаст, Северная Ирландия
Для корреспонденции: Dr WG McCluggage
Department of Pathology, Royal Group of Hospitals Trust, Grosvenor Road, Belfast BT12 6BL, Северная Ирландия; glenn.mccluggage@bll.n‐i.nhs.uk
Abstract
Большая часть рабочей нагрузки во многих гистопатологических лабораториях приходится на биопсию эндометрия, либо образцы кюретажа, либо образцы биопсии амбулаторных пациентов. Все более широкое использование пипелле и других методов биопсии, не требующих общей анестезии, привело к увеличению количества образцов со скудной тканью, что привело к проблемам с оценкой адекватности и интерпретацией артефактических изменений, некоторые из которых чаще встречаются при амбулаторной биопсии.В этом обзоре обсуждаются критерии адекватности и общие артефакты при биопсии эндометрия, а также интерпретация биопсии эндометрия в целом, с упором на области, вызывающие проблемы у патологов. Для критической оценки биопсии эндометрия патологу необходим адекватный клинический анамнез, включая сведения о возрасте, менструальном анамнезе и статусе менопаузы, а также информацию об использовании экзогенных гормонов и тамоксифена. Такие темы, как эндометрит, полипы эндометрия, изменения, вызываемые гормонами и тамоксифеном в эндометрии, метаплазии и гиперплазии эндометрия, атипичная полиповидная аденомиома, аденофиброма, аденосаркома, гистологические типы карциномы эндометрия и классификация карцином эндометрия с учетом биологических областей карциномы эндометрия. образцы, а не образцы гистерэктомии.При необходимости обсуждается ценность вспомогательных методов, особенно иммуногистохимии.
Во многих гистопатологических лабораториях образцы эндометрия составляют основную часть рабочей нагрузки. Большинство образцов берутся из-за аномального маточного кровотечения или других связанных с ним симптомов, и ожидается, что патолог исключит рак эндометрия или предраковое поражение. В некоторых случаях определяется доброкачественная причина аномального маточного кровотечения, например, эндометрит или полип эндометрия.В этом обзоре я обрисую свой подход к интерпретации образцов биопсии эндометрия, уделяя особое внимание областям, которые, по моему опыту, создают трудности для патологов. Биоптаты эндометрия в настоящее время редко берутся для датирования эндометрия и оценки того, произошла ли овуляция, поскольку измерения различных гормонов в сыворотке дают эквивалентную или более подробную информацию. В этом обзоре датирование эндометрия обсуждаться не будет, поскольку недавно это было подробно рассмотрено. 1 Точно так же чистые мезенхимальные поражения, доброкачественные или злокачественные, могут быть идентифицированы при биопсии эндометрия, и они не будут обсуждаться далее.
Клинический анамнез
При оценке биоптата эндометрия важен адекватный клинический анамнез, включая возраст пациента и причину биопсии. Следует указать статус менопаузы, а также дату начала последней менструации и продолжительность менструального цикла у женщин в пременопаузе.Во многих случаях кровотечения в постменопаузе пациент находится не в постменопаузе, а в перименопаузе с длительным интервалом между менструациями. Это приводит к тому, что клиницист и пациентка предполагают, что женщина находится в постменопаузе. Перед биопсией многие женщины с аномальным маточным кровотечением уже принимают экзогенные гормоны, особенно гестагенные соединения, для остановки кровотечения, и эта информация не всегда передается патологу. Другие женщины могут принимать заместительную гормональную терапию или противозачаточные средства.Эти гормональные соединения могут изменять морфологический вид эндометрия, и знание того, что эти и другие соответствующие препараты, такие как тамоксифен, принимаются, имеет первостепенное значение для патолога.
Критерии адекватности образцов биопсии эндометрия
Ранее образцы биопсии эндометрия в основном получали путем дилатации и кюретажа, проводимых под общей анестезией. Большинство образцов эндометрия в настоящее время берутся амбулаторно с помощью пипеля или других методов, в результате чего многие образцы биопсии содержат скудную ткань эндометрия или даже не содержат ее.Парадоксально, но для оценки образцов поверхностной биопсии эндометрия со скудной тканью часто требуется больше времени, чем для неповрежденных образцов биопсии с заметным количеством ткани. Перед патологом стоит принять решение о том, адекватен ли образец биопсии. Недавнее исследование показало, что среди патологоанатомов-гинекологов существуют значительные разногласия по поводу того, что считать адекватным биоптатом эндометрия. 2 Было показано, что у женщин в постменопаузе с атрофическим эндометрием и отсутствием очаговых поражений при ультразвуковом сканировании наличие скудной ткани эндометрия в биопсиях, полученных в амбулаторных условиях, является нормой, и вероятность пропустить соответствующую патологию очень мала. 3 Кроме того, классификация образца биопсии как неадекватного может иметь медицинские юридические и клинические последствия. Например, некоторые врачи обычно проводят повторную биопсию, когда образец эндометрия классифицируется как неадекватный. Моя политика в отношении отчетов об образцах эндометрия заключается в том, что образец биопсии (из амбулаторной клиники или выскабливания) классифицируется как неадекватный только при отсутствии ткани эндометрия. Если есть какая-либо ткань эндометрия, независимо от того, насколько она мала, я не считаю этот образец неадекватным.Вместо этого я использую термин «не поддающийся оценке» для тех биопсий, в которых присутствует минимальная ткань эндометрия, и утверждаю, что, несмотря на отсутствие гиперплазии, злокачественных новообразований или каких-либо других специфических диагностических поражений, ткань не может быть оценена. Присутствие даже минимального количества ткани эндометрия является предположительным доказательством проникновения в полость эндометрия, хотя теоретически железы эндометриального типа со стромой или без нее могут быть получены из метаплазии тубоэндометрия или эндометриоза в шейке матки.Подчеркивается, что образцы биопсии со скудной тканью, которые обычно включают только поверхностные полоски желез эндометрия (рис. 1), должны быть тщательно исследованы при высоком увеличении для выявления митотической активности (аномальной у женщин в истинном постменопаузе) и атипии. Если присутствует неповрежденная ткань, включающая железы и строму, то ее можно типизировать, хотя с комментарием, что для исследования доступен только ограниченный объем ткани.
Рис. 1 Типичный образец биопсии эндометрия, взятый у амбулаторного пациента, скудный и состоит только из поверхностных полосок желез эндометрия с псевдопапиллярной архитектурой.
Рисунок 2 — это предлагаемый алгоритм оценки адекватности биоптата эндометрия. Интерпретация релевантности не поддающегося оценке образца или скудного образца остается за клиницистом. Как уже говорилось, это норма при атрофическом эндометрии и отсутствии очагового поражения на УЗИ, но не повод для повторной биопсии. Однако при утолщении эндометрия, очаговом поражении или сильном клиническом подозрении на серьезную патологию скудный образец может указывать на необходимость повторной биопсии.Как правило, это должно включать формальное выскабливание, а не амбулаторную биопсию.
Рисунок 2 Алгоритм оценки адекватности биоптата эндометрия.
Диагностический алгоритм для исследования биопсий эндометрия
Ткани, полученные не из эндометрия, обычно представлены в биоптатах эндометрия. Их следует идентифицировать, оценивать и указывать в отчете о патологии. Ткань шейки матки, железистый или плоский эпителий шейки матки со стромой или без нее, может присутствовать и должна быть исследована для исключения серьезной патологии.Наличие жировой ткани или даже слизистой оболочки кишечника может указывать на перфорацию матки, о чем следует сообщить врачу. В случае перфорации матки мезотелиальные клетки или воспалительные клетки могут смешиваться с жировой тканью. Это может отражать наличие лежащих в основе тазовых или перитонеальных аномалий, которые привели к реактивной мезотелиальной пролиферации, которая «зафиксировала» матку и сделала перфорацию более вероятной. Жировая ткань в образце биопсии эндометрия в редких случаях может быть получена из липолейомиомы или липомы матки.Другие ткани, которые могут присутствовать в образце биопсии эндометрия, включают гладкие мышцы миометрия и ткань нижнего сегмента матки или перешейка. Ткань нижнего сегмента матки морфологически можно спутать с полипом эндометрия, поскольку строма имеет волокнистый вид, а железы часто малочисленны. Однако отсутствие толстостенных стромальных кровеносных сосудов и характерная примесь муцинозного эндоцервикального эпителия (обычно присутствующего на поверхности) и мерцательного эпителия трубного типа (обычно в более глубоких железах) должны, однако, указывать на происхождение из нижнего сегмента матки.
После оценки ткани, не полученной из эндометрия, необходимо исследовать имеющуюся ткань эндометрия (если таковая имеется). Полезно дать некоторое представление о количестве представленной ткани эндометрия, и критерии адекватности уже обсуждались. Далее следует типировать эндометрий с учетом возраста пациентки, даты начала последней менструации и любого гормонального лечения. Морфологические особенности циклического и атрофического эндометрия не будут подробно описаны, но несколько основных моментов упомянуты в следующих предложениях.Следует проявлять осторожность при диагностике пролиферативного эндометрия при отсутствии митозов, хотя их может быть немного. Стромальные и железистые митозы обычно обнаруживаются при пролиферативном эндометрии. Атрофический эндометрий, который может быть или не быть признаком постменопаузального состояния (атрофия также характерна для некоторых гормональных агентов), можно спутать с пролиферативным эндометрием, поскольку железы обычно имеют трубчатый вид и может наблюдаться явное расслоение ядер. .Еще одна путаница заключается в том, что не все области эндометрия с одинаковой скоростью реагируют на эндогенные или экзогенные гормоны — например, некоторые области могут проявлять пролиферативные особенности, а другие — раннюю секреторную активность. Сложность возникает, когда эндометрий от женщины в действительно постменопаузальном периоде (как указывалось ранее, некоторые женщины с кровотечением в постменопаузе не являются действительно постменопаузальными, а скорее находятся в перименопаузе с нерегулярными циклами) проявляет пролиферативную активность без признаков гиперплазии.Мой подход состоит в том, чтобы заявить в отчете, что существует продолжающаяся пролиферативная активность, предполагающая продолжающуюся эстрогенную стимуляцию, хотя признаков гиперплазии или злокачественных новообразований нет. Пролиферативная активность эндометрия может возникать при выпадении матки и полипах эндометрия у женщин в постменопаузе.
Артефакты в образцах биопсии эндометрия
В образцах биопсии эндометрия наблюдается несколько общих артефактов, которым в литературе уделяется мало внимания.Некоторые из них могут быть неверно истолкованы как гиперплазия эндометрия или даже как карцинома, если не признаны артефактами. Телескопирование относится к железам внутри желез (рис. 3) и часто встречается. Артефактное скопление и сжатие желез может привести к рассмотрению сложной гиперплазии эндометрия (рис. 4). Благодаря этому артефакту железы сливаются вместе, и часто происходит разрыв ткани вокруг желез, что является ключом к его природе. Артефактом, который особенно характерен для биоптатов, взятых у амбулаторных пациентов, но не только для них, является наличие поверхностных полос эндометрия с псевдопапиллярной архитектурой (рис. 1).Это может привести к рассмотрению широкого спектра папиллярных поражений, доброкачественных и злокачественных, которые возникают в эндометрии. Такие поверхностные полоски сосочкового эндометрия, которые обычно атрофичны, следует исследовать под большим увеличением для выявления пролиферативной активности и ядерной атипии. Раздавленные железы и строма эндометрия могут быть чрезвычайно клеточными и вызывать беспокойство. Как и в случае с другими тканями, раздробленные участки не следует рассматривать изолированно.
Рис. 3 Выдувание или появление железы внутри железы, частый артефакт в образцах биопсии эндометрия.
Рисунок 4 Артефакты компрессии с отливкой сальников. Виден разрыв тканей вокруг желез.
Эндометрит
Эндометрит может вызывать симптомы аномального маточного кровотечения, и патолог всегда должен исключить это. Лимфоциты, включая естественные клетки-киллеры и лимфоидные агрегаты, являются нормальным компонентом эндометрия, а полиморфы характерны для предменструальной и менструальной фаз. Наличие плазматических клеток широко считается наиболее полезным критерием для диагностики эндометрита, хотя они часто смешиваются с другими воспалительными клетками, как острыми, так и хроническими, и могут быть второстепенным компонентом инфильтрата воспалительных клеток. 4 , 5 , 6 При эндометрите инфильтрат воспалительных клеток может быть очаговым, и плазматические клетки, расположенные непосредственно под поверхностными железами, обычно легче всего идентифицировать. Могут существовать и другие морфологические особенности, которые предупреждают патолога о возможном эндометрите. К ним относятся эндометрий, который демонстрирует нарушение созревания — например, очаговые области, которые находятся вне цикла с другими областями, отек стромы и, что характерно, веретено-клеточное изменение стромы, особенно вокруг желез (рис. 5).Определенная степень архитектурной сложности и цитологическая атипия также могут быть замечены, если инфильтрат воспалительных клеток отмечен, что может привести к гипердиагностике гиперплазии или карциномы. Могут возникнуть проблемы с распознаванием плазматических клеток, особенно на гистологических срезах, которые не являются оптимальными. Стромальные клетки эндометрия могут иметь вид плазмоцитоидов с эксцентрическими ядрами, и патолог должен быть уверен в наличии классических плазматических клеток. Подчеркивается, что при отсутствии других морфологических признаков эндометрита, описанных ранее, исчерпывающий поиск плазматических клеток не оправдан.Случайные стромальные плазматические клетки могут быть идентифицированы в нормальном эндометрии, и в этих обстоятельствах не следует ставить диагноз эндометрита. Плазматические клетки могут присутствовать в строме полипов эндометрия, а также могут быть связаны со злокачественными новообразованиями эндометрия. Описан вариант эндометрита, называемый «очаговым некротизирующим эндометритом», который характеризуется инфильтратом воспалительных клеток, включающим лимфоциты, нейтрофилы и гистиоциты без плазматических клеток. 7 Гранулематозный эндометрит повышает вероятность саркоидоза, туберкулеза и других гранулематозных заболеваний.
Рис. 5 Эндометрит с плазматическими клетками в строме и внешним видом веретенообразных клеток.
Дополнительные исследования могут помочь в диагностике эндометрита, хотя, как правило, в них нет необходимости. Для идентификации плазматических клеток можно использовать гистохимическое окрашивание пиронином метилового зеленого, а также иммуногистохимический анализ или гибридизацию in situ для легких цепей κ и λ. 8 Маркеры плазматических клеток VS38 (CD38) и синдекан (CD138) также использовались для идентификации плазматических клеток, 9 , 10 , 11 , хотя, по моему опыту, железистые и стромальные клетки эндометрия диффузно положительны с VS38 ( рис. 6), что делает невозможным идентификацию плазматических клеток.Напротив, синдекан более полезен, так как большинство стромальных клеток отрицательны, хотя железы эндометрия положительны (рис. 7). Антитела против В- и Т-лимфоидных клеток также могут иметь значение. 12 , 13 , 14 , 15 , 16 В нормальном эндометрии большинство лимфоцитов представляют собой Т-клетки и естественные клетки-киллеры (гранулированные лимфоциты). 12 , 13 , 14 , 15 , 16 B-лимфоидные клетки встречаются редко, составляя менее 1% всех лейкоцитов эндометрия, 12 , 13 , 14 , 15 , 16 и обнаруживаются в основном в лимфоидных агрегатах в слое базальных клеток, а также в разбросанных отдельных клетках более поверхностно.Недавнее исследование показало, что в случаях эндометрита количество Т-лимфоцитов и естественных клеток-киллеров не отличалось от контроля. 12 Значительно увеличенное количество В-клеток, однако, было идентифицировано в случаях эндометрита, и они наблюдались в необычных местах, таких как под поверхностным эпителием, внутриэпителиально и внутри просвета железы. Это может иметь значение при диагностике эндометрита на небольших биоптатах, в которых предпочтительно отбирается поверхностный эндометрий.
Рис. 6 Иммуногистохимическое окрашивание на VS38 с положительными железами эндометрия и стромой, что затрудняет идентификацию плазматических клеток.
Рис. 7 Иммуногистохимическое окрашивание синдекана, которое окрашивает плазматические клетки и помогает в подтверждении эндометрита. Железы эндометрия положительные, а строма отрицательная.
Полипы эндометрия
Полипы — частая причина аномальных кровотечений у женщин в пременопаузе и постменопаузе.Патологический диагноз обычно прост, если гинеколог знает о наличии полипа, сообщил эту информацию патологу и удалил полип в неповрежденном виде. Гинеколог может полагать, что полип присутствует, но гистологическое исследование показывает циклический эндометрий, часто секреторный по типу, что отражает тот факт, что обильный секреторный эндометрий может иметь полиповидный вид. Часто гинеколог не подозревает о наличии полипа. В таких случаях фрагменты полипа часто смешиваются с фрагментами неполиповидного эндометрия, что затрудняет диагностику, поскольку признаки могут быть незаметными.Когда биопсия проводится по поводу аномального маточного кровотечения, патолог всегда должен учитывать возможность полипа. При обследовании с малым увеличением первым признаком наличия полипа часто является примесь фрагментов нормального циклического эндометрия и фрагментов, которые морфологически различаются. 17 Строма обычно более фиброзная, чем окружающий эндометрий, хотя это не всегда. Другие морфологические особенности, обычно обнаруживаемые при полипах, включают скопления толстостенных стромальных кровеносных сосудов, железистую архитектурную аномалию (часто в виде расширенных желез необычной формы и очаговой скученности) и различные эпителиальные метаплазии.Железы внутри полипа часто проявляют пролиферативную активность, даже если окружающий эндометрий этого не делает. Следует упомянуть следующие моменты полипов эндометрия:
Пролиферативная активность полипов эндометрия характерна даже для женщин в постменопаузе. Это не имеет отношения к делу, хотя я обычно включаю комментарий на этот счет в отчет о патологии. В таких обстоятельствах полезно, если присутствует и неполиповидный эндометрий, и необходимо указать, проявляет ли он также пролиферативную активность.Если не представлен полиповидный эндометрий, я комментирую, заявляя, что пролиферативная активность может происходить и ограничиваться полипами эндометрия у женщин в постменопаузе, но этот неполиповидный эндометрий не представлен.
Диагноз простой гиперплазии не следует ставить в случае полипа эндометрия, поскольку структура желез, напоминающая простую гиперплазию, является нормальным признаком полипа. Очаговая умеренная скученность желез не редкость и, на мой взгляд, не требует диагноза сложной гиперплазии эндометрия.Однако при значительной скученности желез следует диагностировать сложную гиперплазию. Это может быть ограничено полипом или также включать неполиповидный эндометрий. Как обсуждалось ранее, должны быть описаны гистологические особенности любого представленного неполиповидного эндометрия, и, если такового нет, это следует упомянуть, и в отчете должно быть указано, что сложная гиперплазия может быть ограничена полипом или также включать неполиповидный эндометрий. эндометрий. В таких условиях гинекологу, вероятно, следует провести повторную биопсию эндометрия.Если в полипе эндометрия присутствует атипичная гиперплазия, необходимо сообщить об этом и тщательно обследовать окружающий неполиповидный эндометрий; это часто требует повторной биопсии.
Карциномы, так называемые «полипы рака», могут возникать в полипах эндометрия. Очевидно, что если рак обнаружен в полипе эндометрия, удаленном с помощью биопсии, без полной оценки окружающего эндометрия невозможно установить, возник ли рак в полипе или вторично поражен.Рак полипа может быть эндометриоидным по типу, но серозные пролиферации, серозная карцинома или ее предшественник интраэпителиальная карцинома эндометрия (EIC) имеют особую склонность возникать или быть связаны с другими доброкачественными полипами эндометрия. 18 , 19 Полипы эндометрия следует тщательно исследовать на предмет наличия небольших очагов серозной карциномы или EIC. Это обсуждается более подробно позже.
Полипы эндометрия особенно часто встречаются при приеме тамоксифена.Это также обсуждается позже.
Другие доброкачественные поражения эндометрия
Полезно иметь контрольный список доброкачественных образований, отличных от перечисленных ранее, включая гранулемы, узелки в области плаценты и различные формы эпителиальных и стромальных метаплазий. Эти метаплазии не будут подробно обсуждаться, так как они были недавно пересмотрены. 20 Ниже приведены несколько важных моментов, касающихся метаплазий эпителия эндометрия:
Эпителиальные метаплазии, особенно плоскоклеточные или муцинозные по типу, могут сосуществовать с гиперплазией или карциномой.В случае гиперпластической метаплазии эпителия следует искать и исключать гиперпластический или злокачественный процесс. Это может быть проблематично при плоской плоской метаплазии ороговевшего или морулярного типа (рис. 8). Оценка архитектуры и цитологии желез может быть затруднена, поскольку плоскоклеточные элементы могут быть настолько обширными, что лежащий под ними железистый компонент почти полностью уничтожен. Такие яркие примеры плоскоклеточной метаплазии, которая может возникать в сочетании с обструкцией, так называемым ихтиозом матки, также могут привести к рассмотрению высокодифференцированной плоскоклеточной карциномы.Действительно, при хронической обструкции плоскоклеточный рак эндометрия может развиться из плоской плоской метаплазии.
Рисунок 8 Плоскоклеточная метаплазия флоры в пределах эндометрия. Оценка основной железистой архитектуры проблематична.
Ресничные клетки часто встречаются в нормальном циклическом эндометрии. 21 Я бы зарезервировал диагноз мерцательной метаплазии для случаев, характеризующихся обширной ресничкой и когда клетки имеют обильную эозинофильную цитоплазму, что приводит к внешнему виду, подобному эпителию нормальной фаллопиевой трубы.Ресничные клетки в нижнем сегменте матки нормальны и не должны интерпретироваться как мерцательная метаплазия.
Папиллярная синцитиальная метаплазия, хотя и называется метаплазией, на самом деле является репаративной реакцией, возникающей после разрушения. 22 (рис. 9). Вялый цвет может указывать на серозную карциному или EIC. В этом случае следует обратить внимание на фоновый эндометрий, который при папиллярно-синцитиальной метаплазии обычно имеет признаки разрушения.В проблемных случаях может иметь значение иммуногистохимия p53 (обсуждается ниже).
Рисунок 9 Флоридная папиллярно-синцитиальная метаплазия. Это может привести к рассмотрению серозной карциномы или интраэпителиальной карциномы эндометрия.
Многие эпителиальные метаплазии эндометрия возникают без очевидной причины. Однако эпителиальные метаплазии особенно часто наблюдаются при полипах эндометрия и в сочетании с гормональными препаратами. 21
При витой муцинозной метаплазии исключение хорошо дифференцированной муцинозной аденокарциномы может быть чрезвычайно трудным, если не невозможным, при биопсии эндометрия, поскольку некоторые муцинозные аденокарциномы эндометрия являются цитологически слабыми, даже те, которые демонстрируют инфильтрацию миометрия. .Муцинозные пролиферации эндометрия, которые выявляются при биопсии, можно подразделить на категории в зависимости от степени архитектурной сложности, которые соответствуют возрастающему риску наличия муцинозной аденокарциномы при последующей гистерэктомии. 23
Доброкачественные папиллярные пролиферации (не строго метаплазии) с фиброваскулярными сердцевинами наблюдаются редко, особенно на поверхности полипов эндометрия (рис. 10). 24 Эти сосочковые пролиферации могут иметь сложную архитектуру и часто связаны с эпителиальными метаплазиями.Это благоприятное распространение, и в этой ситуации наличие архитектурной сложности не означает гиперпластического процесса.
Рисунок 10 Доброкачественная папиллярная пролиферация на поверхности полипа эндометрия.
При некоторых эпителиальных метаплазиях — например, светлоклеточной метаплазии, папиллярно-синцитиальной метаплазии и доброкачественной папиллярной пролиферации — дифференциальный диагноз может быть между метапластическим процессом и раком эндометрия 2 типа или EIC.В таких случаях может иметь значение иммуногистохимический анализ, поскольку при раке EIC и типа 2 обычно наблюдается диффузное интенсивное ядерное окрашивание p53, тогда как рецептор эстрогена обычно отрицательный или слабо положительный. Напротив, большинство метапластических процессов являются положительными по рецепторам эстрогена и демонстрируют слабый гетерогенный паттерн окрашивания р53. 25 Однако существует много исключений, причем некоторые светлоклеточные карциномы, в частности, являются р53-отрицательными или слабо положительными.
Поверхность некоторых карцином эндометрия муцинозного или эндометриоидного типа имеет вид, который может очень имитировать шейную микрогландулярную гиперплазию (рис. 11) или различные формы метаплазии, такие как муцинозная метаплазия или папиллярно-синцитиальная метаплазия. 26 Образцы этих поверхностных участков особенно часто могут быть взяты при биопсии и могут создавать проблемы при диагностике.
Рис. 11 Биопсия с поверхности эндометриоидной аденокарциномы, признаки которой напоминают микрогландулярную гиперплазию шейки матки.
Влияние гормонов на эндометрий
Гормоны по-разному влияют на эндометрий, поэтому важно, чтобы врач предоставил патологу подробную информацию о любом гормональном лечении.Такая информация предоставляется не всегда. При любом необычном, нециклическом появлении эндометрия патолог должен учитывать экзогенные гормоны. Некоторые гормональные препараты, особенно те, которые содержат и эстроген, и прогестоген (большинство современных схем заместительной гормональной терапии), обычно приводят к слабому или плохо развитому секреторному эндометрию, 27 , 28 , тогда как с другими препаратами эндометрий атрофичен. Соединения, содержащие только прогестоген, приводят к характерному морфологическому виду с атрофическими или слабыми железами секреторного типа, расположенными в расширенной строме, которая демонстрирует разную степень псевдодецидуализации.Эта псевдодецидуализация часто наиболее заметна непосредственно под поверхностными железами и обычно сопровождается инфильтратом воспалительных клеток, в основном состоящих из естественных клеток-киллеров. Подобные проявления происходят с спиралью Мирена, внутриматочной спиралью, содержащей гестаген, которая широко используется. 29 Это часто вызывает полиповидную поверхность и другие морфологические признаки, включая реактивную атипию поверхностных желез, эпителиальные метаплазии, отложение стромального гемосидерина, кальцификацию, некроз и изменение стромального миксоида. 29
Влияние тамоксифена на эндометрий
Тамоксифен широко используется в качестве адъювантной терапии при лечении рака груди. В настоящее время изучается возможность использования тамоксифена в качестве профилактического средства у пациентов с семейным анамнезом рака груди. Воздействие тамоксифена на эндометрий было предметом нескольких обзоров. 30 , 31 , 32 , 33 Хотя эффективность тамоксифена при раке груди обусловлена его антиэстрогенными свойствами, тамоксифен может оказывать пролиферативное действие на эндометрий, приводя к поражениям, описанным ниже в этой статье. статья.Образцы эндометрия у женщин, принимающих тамоксифен, как правило, скудны, поскольку тамоксифен может привести к фиброзу стромы эндометрия, что затрудняет оценку с помощью биопсии. Фиброз может привести к кистозному расширению желез эндометрия на обструктивной основе, что можно увидеть при гистероскопии.
Наиболее частыми поражениями эндометрия, наблюдаемыми при приеме тамоксифена, являются доброкачественные полипы, которые могут быть одиночными или множественными. 34 , 35 , 36 В некоторых случаях весь эндометрий имеет полиповидный вид, и может быть трудно различить отдельные полипы.Полипы эндометрия, ассоциированные с тамоксифеном, не имеют патогномоничных гистологических особенностей, хотя они часто больше, чем спорадические полипы, и с большей вероятностью демонстрируют эпителиальные метаплазии, оленьи роговые железы и стромальную конденсацию вокруг желез, напоминающую слой камбия. 34 , 35 , 36 В некоторых случаях эта стромальная конденсация может привести к рассмотрению аденосаркомы низкой степени злокачественности. Полипы, ассоциированные с тамоксифеном, следует тщательно отбирать и тщательно исследовать под микроскопом, поскольку могут возникать небольшие карциномы как эндометриоидного, так и неэндометриоидного типа.Действительно, как обсуждалось ранее, серозная карцинома и EIC имеют специфическую тенденцию возникать в полипах эндометрия, спорадически или связанных с тамоксифеном. 18 , 19
Тамоксифен может привести к полному спектру гиперплазии эндометрия и к развитию рака эндометрия, как эндометриоидного, так и неэндометриоидного. Поскольку у женщин с раком груди больше шансов заболеть раком эндометрия из-за общих факторов риска, таких как высокий социально-экономический статус, низкий паритет или гиперэстрогенные состояния, трудно установить, существует ли истинная связь между тамоксифеном и развитием рака эндометрия.Однако большинство эпидемиологических исследований предполагают, что тамоксифен связан с повышенным риском развития рака эндометрия, который в два-три раза выше, чем у пациентов с раком груди, которые не принимают тамоксифен. 33 , 37 , 38 Очевидно, что риск увеличивается с увеличением продолжительности и дозировки тамоксифена. Поскольку считается, что эффекты тамоксифена на эндометрий обусловлены эстрогенной активностью, ожидается, что большинство видов рака эндометрия должны иметь эндометриоидный тип, поскольку эти новообразования являются положительными по рецепторам гормонов.Это, однако, спорно, поскольку некоторые исследования предполагают, что рак 2 типа, такой как серозная карцинома, пропорционально чаще встречается в сочетании с тамоксифеном. 39 , 40 Действительно, было высказано предположение, что карциносаркомы (на самом деле, метапластические карциномы, часто связанные с эпителиальным компонентом карциномы 2 типа 41 , 42 ) особенно вероятно связаны с тамоксифеном, 43 , 44 , 45 и аденосаркомы также были зарегистрированы. 46 Другие исследования, однако, показали, что большинство связанных с тамоксифеном новообразований эндометрия относятся к эндометриоидным аденокарциномам низкой степени злокачественности. 37 , 47 , 48
Гиперплазия эндометрия
По моему опыту, различные аспекты, связанные с гиперплазией эндометрия, обычно создают проблемы для патологоанатомов. В следующих разделах я обсуждаю некоторые из этих проблемных областей.
Возможная доброкачественная имитация гиперплазии эндометрия
Артефакты
Кистозная атрофия
Эндотрий нижнего сегмента матки
Эндотриум
932
Эндометриум 9325932
932932
папиллярные пролиферации
Эндометрит
Полипы эндометрия
Исключение доброкачественных миметиков
Перед диагностикой гиперплазии эндометрия важно исключить многие доброкачественные мимики.Потенциальные доброкачественные имитаторы гиперплазии эндометрия перечислены во вставке 1. Большинство из них демонстрируют увеличение нормального отношения железы к строме, что является определяющим признаком сложной гиперплазии эндометрия и присутствует в большинстве случаев атипичной гиперплазии (сложной атипичной гиперплазии). . Одним из наиболее распространенных поражений, которые ошибочно принимают за гиперплазию, является полип эндометрия, особенно когда он удаляется по частям, и когда гинеколог не знает о наличии полипа и предположение об этом не передается патологу.Обсуждались морфологические особенности полипов эндометрия, а также несколько других потенциальных доброкачественных имитаторов гиперплазии эндометрия. Секреторный эндометрий (и эндометрий с эффектом Ариаса-Стеллы) часто показывает увеличение соотношения железы к строме и может быть ошибочно диагностирован как гиперплазия эндометрия, особенно когда субядерная вакуоляция не очевидна. В целом секреторная активность при гиперплазии эндометрия встречается редко, хотя это действительно происходит, особенно когда гормональное лечение уже начато.Кистозная атрофия отличается от простой гиперплазии атрофическим видом желез, в том числе отсутствием пролиферативной активности. Как правило, перед диагностикой гиперплазии эндометрия следует определять митотическую активность.
Классификация гиперплазии эндометрия
Гиперплазии эндометрия следует классифицировать в соответствии со схемой Всемирной организации здравоохранения (ВОЗ) 1994 года. 49 Следует избегать более старых терминов, таких как кистозная гиперплазия и аденоматозная гиперплазия.Термин дисплазия не следует использовать в отношении эндометрия. Классификация ВОЗ 1994 года была основана на основополагающем исследовании гиперплазии эндометрия, 50 и делит гиперплазию на простые и сложные формы в зависимости от архитектуры железы. При простой гиперплазии нормальное соотношение железы и стромы в значительной степени сохраняется, хотя может быть небольшое увеличение. При сложной гиперплазии наблюдается увеличение соотношения железы к строме. Простые и сложные гиперплазии далее делятся на атипичные и неатипичные категории на основе наличия или отсутствия ядерной атипии.Оценка ядерной атипии чрезвычайно субъективна, что приводит к заметным различиям между наблюдателями, даже среди патологов-гинекологов, в классификации гиперплазии эндометрия. 51 , 52 , 53 Согласно классификации ВОЗ 1994 г. выделяются четыре категории гиперплазии эндометрия: простая неатипичная, сложная неатипичная, простая атипичная и сложная атипичная. На практике атипия обычно возникает в эндометрии со сложной архитектурой, и простая атипичная гиперплазия редко диагностируется, хотя это и происходит редко.В результате многие патологи используют три категории гиперплазии эндометрия — простую, сложную и атипичную. Все эти категории имеют повышенный риск развития аденокарциномы эндометрия эндометриоидного типа, хотя он чрезвычайно низок при простых и сложных гиперплазиях эндометрия (приблизительно 1% и 3% соответственно), 50 которые обычно являются самоограничивающимися поражениями, которые регрессируют. ; хотя после диагностики поражений обычно назначают гормональное лечение. Риск развития эндометриоидной аденокарциномы после диагноза атипичной гиперплазии трудно определить, поскольку после диагностики атипичной гиперплазии эндометрия ее лечат либо гормонально, либо, как правило, хирургическим путем.Однако при атипичной гиперплазии существует значительный риск трансформации в эндометриоидную аденокарциному, вероятно, порядка 25-40%. 50 Кроме того, эндометриоидная аденокарцинома может уже присутствовать и не взята биопсией. По моему опыту, многие случаи с диагнозом атипичная гиперплазия эндометрия представляют собой хорошо дифференцированную эндометриоидную аденокарциному.
Морфологические особенности гиперплазии эндометрия
При простой гиперплазии нормальное соотношение железы и стромы сохраняется или незначительно увеличивается.Эндометрий проявляет пролиферативную активность с кистозно расширенными железами неправильных размеров и форм. Некоторые железы могут иметь «выпуклости», «складки» и «почкование». Ядерной атипии не наблюдается, ядра имеют овальную форму и сохраняют свою ориентацию по отношению к подлежащей базальной мембране. Основной проблемой является различие между простой гиперплазией эндометрия и нарушенным пролиферативным эндометрием, термин, широко используемый, хотя гистологические особенности недостаточно хорошо изучены. Морфологические особенности этих участков совпадают, и различие плохо воспроизводится.В моей практике мне необходимо увидеть большое количество расширенных желез для диагностики простой гиперплазии, тогда как, если присутствуют только редкие расширенные железы, я диагностирую это как нарушение пролиферативного эндометрия, особенно если пациент находится в перименопаузе. Нарушение пролиферативного эндометрия часто встречается в перименопаузе из-за ановуляторных циклов. В любом случае лечение простой гиперплазии эндометрия и нарушенного пролиферативного эндометрия обычно идентично в форме прогестагенных соединений.Кроме того, существует континуум между нарушенным пролиферативным эндометрием и простой гиперплазией. По сути, оба эти состояния являются доброкачественными, связанными с длительной эстрогенной стимуляцией, с небольшим риском трансформации в аденокарциному эндометриоидного типа.
При сложной гиперплазии наблюдается увеличение соотношения железы к строме со скученностью желез. Железы часто плотно упакованы, хотя между отдельными железами обычно остается некоторая строма. Железы проявляют пролиферативную активность и, по определению, ядерной атипии нет.Простая гиперплазия обычно является генерализованным состоянием, тогда как большинство, но не все, случаев сложной гиперплазии являются очаговыми, часто возникающими на фоне простой гиперплазии.
При атипичной гиперплазии, по определению, имеется ядерная атипия. Оценка ядерной атипии является одной из наиболее субъективных и проблемных областей в гинекологической патологии, но эта оценка имеет решающее значение для лечения гиперплазии эндометрия, поскольку хирургическое вмешательство обычно проводится при атипичной гиперплазии, тогда как гормональное лечение является обычным для неатипичной гиперплазии, хотя и много исключений.Ядерная атипия может быть незаметной, и при ее оценке полезно сравнить цитологию атипичных желез с цитологией остаточных нормальных желез эндометрия (рис. 12). При атипичной гиперплазии ядерные изменения часто сопровождаются цитоплазматическими изменениями, так что клетки имеют более обильную, часто эозинофильную цитоплазму. Цитоплазматические изменения, включая усиление цитоплазматической эозинофилии, также могут наблюдаться при различных метаплазиях эндометрия, таких как мерцательная метаплазия. Ядерные особенности при атипичной гиперплазии, которые, как указывалось ранее, часто тонкие, включают ядерную стратификацию, потерю полярности, ядерное округление и присутствие ядрышек.Фактически, скорее, чем явная ядерная атипия, часто характерны различные ядерные особенности аномальных и нормальных желез. Это отражено в широко разрекламированной альтернативной терминологии, предложенной Mutter и соавторами (обсуждается далее в этом обзоре) для классификации предшественников аденокарциномы эндометриоидного типа. 54 В этой классификации используется термин «интраэпителиальная неоплазия эндометрия» (ЭИН), и вместо истинной ядерной атипии оценивается цитологическое разграничение нормальных и аномальных участков.Следует подчеркнуть, что термин EIN относится к предшествующему поражению эндометриоидной аденокарциномы и отличается от EIC, предшественника серозной аденокарциномы, который подробно обсуждается позже в этом обзоре.
Рисунок 12 Атипичная гиперплазия эндометрия, при которой ядерные и цитоплазматические различия присутствуют между атипичными железами и остаточными нормальными железами эндометрия.
Различие между атипичной гиперплазией и эндометриоидной аденокарциномой 1 степени
В небольшом образце биопсии может быть трудно или даже невозможно отличить атипичную гиперплазию в верхнем конце спектра от эндометриоидной аденокарциномы 1 степени.Это неудивительно, поскольку эти два поражения являются частью спектра без четко определенных границ. Как отражение этого континуума, при биопсии эндометрия допустимо поставить диагноз «по крайней мере атипичная гиперплазия, не может исключить эндометриоидную аденокарциному 1 степени». Было высказано предположение, что в образцах биопсии эти два поражения следует объединять под обозначением эндометриоидная неоплазия. 53 Обычно лечение атипичной гиперплазии и эндометриоидной аденокарциномы 1 степени идентично, включая гистерэктомию.У молодой женщины, например, с синдромом поликистозных яичников с атипичной гиперплазией или эндометриоидной аденокарциномой 1 степени и желающей сохранить фертильность, после МРТ может быть предпринято консервативное лечение в виде прогестагенных соединений, чтобы исключить миоинвазивное заболевание. 55 , 56 Если такое лечение проводится, то следует проводить регулярную биопсию эндометрия, например, с интервалом в 3 месяца. В этих обстоятельствах наступили успешные беременности, хотя существует высокий риск последующего рецидива гиперплазии или карциномы. 55 , 56 С другой стороны, желательно различать атипичную гиперплазию и эндометриоидную аденокарциному 1 степени, поскольку многие клиницисты неохотно проводят консервативное лечение аденокарциномы 1 степени. Более того, если диагноз аденокарциномы поставлен на основании биопсии эндометрия, пациенту с большей вероятностью будет проведена полная стадия хирургического вмешательства, включая промывание брюшины, и он может быть включен в клинические испытания.
Несколько признаков помогают отличить атипичную гиперплазию от эндометриоидной аденокарциномы 1 степени.Десмопластический стромальный ответ является убедительным подтверждающим доказательством аденокарциномы, 57 , 58 , но он выявляется только в небольшом количестве биопсий карциномы эндометрия. Прочная архитектура желез спина к спине с полным исключением стромы указывает на аденокарциному, так как при большинстве атипичных гиперплазий между железами остается небольшая строма. Перемычка между соседними железами, приводящая к решетчатому рисунку, а также наличие люминального некроза с полиморфной инфильтрацией, предполагает аденокарциному.Сосочковый узор на поверхности, лабиринтные извилистые железы и твердые не чешуйчатые участки также указывают на аденокарциному. Однако, как указывалось ранее, атипичная гиперплазия и эндометриоидная аденокарцинома 1 степени являются частью спектра без резких границ.
Предлагаемая альтернативная терминология для классификации предшественников эндометриоидной аденокарциномы
Терминология EIN широко отстаивалась Mutter и соавторами. 54 , 59 , 60 , 61 , 62 Недавний обзор в этом журнале суммировал аргументы, и я лишь кратко их рассмотрю. 54 Классификация EIN основана на интеграции морфологических, молекулярно-генетических, морфометрических и прогностических данных. Вкратце, для постановки диагноза EIN должны быть выполнены пять критериев:
Площадь желез, превышающая площадь стромы (объемный процент стромы <55%)
Цитология, различающаяся между архитектурно переполненным фокусом и фоном, то есть цитологическое разграничение
Максимальный линейный размер поражения более 1 мм
Исключение доброкачественных имитаторов
Исключение карциномы.
Подчеркивается, что, хотя критерии были получены с помощью морфометрии и молекулярных исследований, EIN диагностируется при стандартном морфологическом исследовании. 59
Сторонники схемы EIN рассматривают большинство, но не все случаи, которые могут быть диагностированы как простая или сложная неатипичная гиперплазия с помощью системы ВОЗ в качестве реакции эндометрия на избыток эстрогена, и они не используют термин гиперплазия.
Противники системы EIN указывают, что внедрение этой системы потребует переподготовки патологоанатомов и клиницистов, которых смущает еще одна классификация гиперплазии эндометрия.Поскольку ядерная атипия сама по себе не является предпосылкой для диагностики EIN, некоторые случаи, которые можно было бы классифицировать как сложную неатипичную гиперплазию с использованием схемы ВОЗ, можно отнести к категории EIN. Я считаю, что мы должны продолжать использовать классификацию ВОЗ 1994 г. до тех пор, пока не появятся новые данные о воспроизводимости, практических возможностях и прогностических последствиях системы EIN.
Атипичная полиповидная аденомиома
В отношении атипичной полиповидной аденомиомы (APA) будет сделано лишь несколько комментариев, сосредоточенных на тех вопросах, которые могут иметь отношение к образцам биопсии эндометрия.АПА обычно возникает у молодых женщин и чаще всего поражает нижний сегмент матки. 63 , 64 Хотя APA представляет собой полиповидное поражение, его можно удалять по частям. Гистологически сложные в архитектурном отношении железы расположены в обильной строме, которая обычно демонстрирует гладкомышечную дифференцировку (рис.13), хотя в некоторых случаях гладкомышечные функции не очевидны, строма имеет более фиброзный вид, а термин атипичная полиповидная аденомиофиброма имеет был использован. Сопутствующая цитологическая атипия обычно бывает легкой или умеренной.Плоская метаплазия в виде морул, иногда с центральным некрозом, часто бывает заметной. Основным альтернативным диагностическим критерием при биопсии эндометрия, вероятно, будет эндометриоидная аденокарцинома, показывающая инфильтрацию миометрия. Однако при APA строма гладких мышц обычно более клеточная и дезорганизованная, чем нормальный миометрий. Кроме того, в образце биопсии эндометриоидной аденокарциномы было бы крайне необычно увидеть только миоинвазивное заболевание в отсутствие свободных фрагментов опухоли.
Рисунок 13 Атипичная полиповидная аденомиома, состоящая из желез сложной архитектуры, демонстрирующая плоскоклеточную метаплазию с окружающей миоматозной стромой.
Аденофиброма и аденосаркома
Аденофиброма с доброкачественным стромальным компонентом и аденосаркома со злокачественным компонентом представляют собой две смешанные эпителиальные и мезенхимальные (смешанные мюллеровы) опухоли матки. 65 В обоих эпителиальный элемент доброкачественный. Карциносаркомы (злокачественные эпителиальные и мезенхимальные компоненты) обсуждаться не будут, поскольку они были недавно рассмотрены. 41 , 42 Аденофиброма и аденосаркома — редкие новообразования, которые редко выявляются в биоптатах эндометрия, но аденосаркома встречается гораздо чаще. Некоторые авторитеты не признают аденофиброму, но предпочитают рассматривать все поражения в спектре аденофиброма – аденосаркома как аденосаркомы, хотя некоторые из них имеют низкосортный злокачественный стромальный компонент. Лечение аденофибромы и аденосаркомы идентично, включая гистерэктомию. В большинстве случаев это излечивает, если только саркоматозный компонент не имеет высокой степени или нет саркоматозного разрастания или инфильтрации миометрия.В небольшом проценте случаев без этих признаков есть рецидивы влагалища после гистерэктомии. Аденофиброма и аденосаркома представляют собой полиповидные поражения, аденосаркома иногда формирует множественные полипы и редко может быть идентифицирована при биопсии эндометрия. Поскольку злокачественный стромальный компонент при аденосаркоме иногда бывает малозаметным и низкой степени злокачественности, аденосаркома может проявляться в виде рецидивирующих полипов эндометрия, при этом правильный диагноз ставится только после исследования нескольких биопсий. В зависимости от того, какие участки были взяты при биопсии, аденосаркома также может быть первоначально диагностирована как чисто мезенхимальное поражение.Морфологически аденосаркома обычно состоит из листовидных сосочковых выступов, архитектура которых напоминает филлодисную опухоль груди. Эпителиальный элемент, выстилающий сосочковые выступы, доброкачественный и может быть просто кубовидным или столбчатым, муцинозным, реснитчатым или даже плоскоклеточным. Одним из наиболее полезных ключей к диагностике аденосаркомы является повышенная клеточность стромы вокруг эпителиальных элементов, в результате чего образуется слой камбия (рис. 14). В этих областях стромальные клетки часто слегка атипичны, и именно здесь обычно идентифицируются митотические фигуры, хотя они могут быть редкими и могут варьироваться по количеству от области к области.Согласно недавней классификации опухолей груди и женских половых органов ВОЗ, 66 для диагностики аденосаркомы необходимо митотическое число ≥1 HPF. На практике, однако, при митотическом числе меньше этого и при наличии характерной листовой архитектуры и слоя камбия многие диагностируют аденосаркому, а не аденофиброму. Я согласен с этой точкой зрения и повторяю, что гистерэктомия является методом выбора при аденофиброме, так как поражение должно быть полностью осмотрено, чтобы исключить наличие областей, диагностирующих аденосаркому.В редких случаях в стромальном компоненте аденосаркомы могут присутствовать очаги, подобные половому шнуру, аналогично тем, которые наблюдаются при стромальных саркомах эндометрия. 67 Также могут присутствовать гетерологичные элементы.
Рис. 14 Аденосаркома с повышенной клеточностью стромы и митотической активностью под эпителием, в результате чего образуется слой камбия.
Карцинома эндометрия
Будут рассмотрены вопросы, относящиеся только к диагностике карциномы эндометрия на биоптатах.В 1983 году Бохман 68 впервые предположил, что существует два основных варианта рака эндометрия — а именно тип 1 (прототипом которого является эндометриоидная карцинома) и тип 2 (прототипом которого является серозная карцинома). Крайне важно, чтобы рак эндометрия был как типизирован, так и, при необходимости, классифицирован на биопсии эндометрия (термин аденокарцинома эндометрия не подходит, поскольку аденокарциномы эндометрия могут иметь несколько различных морфологических подтипов). Это особенно верно в странах с хорошо развитой гинекологической онкологической службой, таких как Великобритания, где существуют разные схемы направления к специалистам при раке 1 и 2 типа.Например, многие эндометриоидные аденокарциномы (степень 1 и степень 2) лечатся в онкологическом отделении, тогда как рак 2 типа, включая серозную и светлоклеточную карциному, обычно лечится в онкологическом центре. При раке 2 типа может проводиться более обширная хирургическая стадия, например оментэктомия и лимфаденэктомия. Точно так же во многих регионах лечение эндометриоидных карцином 3 степени проводится в онкологических гинекологических центрах. Спорный вопрос о том, следует ли классифицировать серозную карциному (и другие карциномы типа 2, такие как светлоклеточные), и большинство придерживается мнения, что это по определению опухоли 3 степени.Я считаю, что это полезно указать в отчете о патологии, особенно если вы имеете дело с гинекологами общего профиля, которые обычно не занимаются лечением гинекологических новообразований. Все эндометриоидные карциномы (и другие карциномы типа 1, такие как муцинозная карцинома) должны классифицироваться с использованием пересмотренной системы классификации Международной федерации гинекологии и акушерства 1988 года. 69 В этой системе, чтобы архитектурная опухоль 1 или 2 степени была повышена до новообразования 2 или 3 степени соответственно, должны присутствовать ядра высокой (3 степени) степени. 69 , 70 Ядра 3 степени определяются как увеличенные и плеоморфные, с аномальным грубо слипшимся хроматином и крупными неправильными ядрышками. 69 При оценке соотношения твердых и нетвердых элементов плоскоклеточные очаги не следует принимать во внимание. Определить, являются ли твердые участки плоскоклеточным или не плоскоклеточным, часто бывает сложно, так как плоскоклеточные очаги могут иметь различные паттерны, включая морфологию светлоклеточных и веретенообразных клеток. 71
Сообщения на дом
При оценке биоптата эндометрия важен адекватный клинический анамнез, включая детали, касающиеся использования экзогенных гормонов.
У женщин в постменопаузе с атрофическим эндометрием и отсутствием очагового поражения на ультразвуковом сканировании наличие скудной ткани эндометрия при амбулаторной биопсии является нормой.
Когда биопсия эндометрия проводится по поводу аномального маточного кровотечения, патолог всегда должен учитывать возможность полипа.
Серозные пролиферации, будь то серозная карцинома или интраэпителиальная карцинома эндометрия, имеют тенденцию возникать в полипах эндометрия.
Все виды рака эндометрия должны быть типизированы и, при необходимости, классифицированы, даже для небольших биоптатов.
Иногда бывает сложно отличить эндометриоид от серозной карциномы. Эндометриоидная карцинома с папиллярным типом роста может быть ошибочно диагностирована как серозная карцинома, и, наоборот, серозная карцинома с железистой структурой роста и небольшим или отсутствующим папиллярным образованием может быть ошибочно принята за эндометриоидную карциному.Диагноз папиллярной аденокарциномы не следует ставить без уточнения морфологического типа. Архитектурно хорошо дифференцированные эндометриоидные карциномы обычно имеют ядра низкой степени злокачественности; а в архитектурно хорошо дифференцированном новообразовании с ядрами 3 степени и без папиллярного образования следует рассматривать железистый вариант серозной карциномы (рис. 15). При различении эндометриоида и серозной карциномы может иметь значение иммуногистохимический анализ. 72 Эндометриоидные аденокарциномы, особенно 1 или 2 степени, обычно являются положительными по рецепторам эстрогена и отрицательными по р53.И наоборот, серозные карциномы обычно проявляют диффузную ядерную реактивность р53 и являются отрицательными по рецепторам эстрогена. 73 , 74 , 75 Однако существует много исключений: случайные серозные карциномы являются р53-отрицательными, а значительная часть проявляет положительную реакцию на рецепторы эстрогена, хотя часто и очаговые. Напротив, некоторые эндометриоидные аденокарциномы являются p53-положительными, хотя новообразования 1-й и 2-й степени лишь в редких случаях проявляют диффузную сильную ядерную реактивность, характерную для серозной карциномы.Смешанные эндометриоидные и серозные карциномы не редкость. Окрашивание рецептором эстрогена и p53 также может иметь значение для выявления небольших очагов EIC в полиповидном или неполиповидном эндометрии (рис. 16) или для предположения диагноза серозной неоплазии, когда в образце биопсии эндометрия присутствуют только небольшие фрагменты ткани. . 72
Рис. 15 Железистый вариант серозной карциномы без папиллярного образования. Железы выстланы заметно атипичными ядрами, характерными для серозных новообразований.
Рисунок 16 Внутриэпителиальная карцинома эндометрия с диффузной интенсивной положительной реакцией на р53. Остаточные атрофические железы отрицательны.
Как упоминалось ранее, серозная карцинома и ее предполагаемое предшествующее поражение EIC (также называемое карциномой эндометрия in situ или поверхностной серозной карциномой) имеют выраженную склонность возникать или быть связаны с другими доброкачественными полипами эндометрия. 18 , 19 , 76 , 77 Я использую термин «предполагаемое предшествующее поражение», поскольку возможно, что EIC определяется как замена остаточных атрофических желез клетками с явно атипичными ядрами, характерными для серозная неоплазия без инвазии в строму эндометрия, миометрия или сосудов, 76 , 78 , 79 фактически представляет собой образец роста серозной карциномы, а не предшествующее поражение.Полипы эндометрия, особенно большие и встречающиеся у пожилых пациентов, следует тщательно исследовать на предмет небольших серозных разрастаний.
Часто встречающаяся проблема при карциноме эндометрия заключается в определении природы светлых клеток. Это может указывать на чистую светлоклеточную карциному или компонент светлоклеточной карциномы, вариант рака эндометрия 2 типа, обычно с заметно атипичными ядрами, иногда с шиповатым рисунком. Однако редко встречающиеся светлоклеточные карциномы имеют относительно мягкие ядра.Отрицательное окрашивание на рецептор эстрогена и диффузная реактивность p53 благоприятствуют светлоклеточной карциноме, хотя значительная часть светлоклеточных карцином не демонстрирует этот иммунофенотип. 80 Светлые клетки не редкость при эндометриоидных аденокарциномах. Это может представлять собой неспецифическое изменение в светлых клетках, секреторный вариант эндометриоидной карциномы или плоскоклеточные светлоклеточные области (рис. 17). 71 Очищение цитоплазмы при эндометриоидной аденокарциноме также может быть результатом предшествующего лечения гестагенами.
Рис. 17 Эндометриоидная аденокарцинома эндометрия со светлоклеточными плоскоклеточными участками.
Аббревиатуры
APA — атипичная полипоидная аденомиома
EIC — интраэпителиальная карцинома эндометрия
EIN — интраэпителиальная неоплазия эндометрия
ВОЗ — Всемирная организация здравоохранения
Сноски
Заявлено о состязании.
Ссылки
1. Крам С. П., Хорнштейн М. Д., Нуччи М. Р. Хертиг и другие: систематический и практический подход к биопсии эндометрия.Адв. Анат Патол 200310301–318. [PubMed] [Google Scholar] 2. Филлипс В., Макклагэдж В. Г. Результаты анкетирования относительно критериев адекватности биопсии эндометрия. Дж. Клин Патол 200558417–419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Бакур С. Х., Хан К. С., Гупта Дж. К. Контролируемый анализ факторов, связанных с недостаточным количеством образца при амбулаторной биопсии эндометрия. BJOG 20001071312–1314. [PubMed] [Google Scholar]4. Бакли Ч., Фокс Х. Воспаление эндометрия. В Buckley CH, Fox H, eds.Биопсия патологии эндометрия. Лондон: Чепмен и Холл, 200291–111.
5. Мазур М. Т., Курман Р. Дж. Эндометрит. В: Мазур М.Т., Курман Р.Дж., ред. Диагностика биопсии эндометрия и выскабливания. Берлин: Springer, 2005 147–162.
6. Заино Р. Дж. Эндометрит. В кн .: Заино Р.Ж., под ред. Интерпретация биопсий и кюретаций эндометрия. Филадельфия: Липпенкотт-Рэйвен, 1996, 174–180.
7. Беннет Э., Ратхор С., Ратиган Р. М. Фокальный некротический эндометрит: клинико-патологическое исследование 15 случаев.Int J Gynecol Pathol 1990–225. [PubMed] [Google Scholar] 8. Euscher E, Nuovo G J. Обнаружение клеток, экспрессирующих каппа и ламда, в эндометрии путем гибридизации in-situ. Int J Gynecol Pathol 200221383–390. [PubMed] [Google Scholar] 9. Леунг А. С. Й., Виньюват С., Леонг Ф. Дж. В. М. и др. Анти-CD38 и антитела VS38 для обнаружения плазматических клеток при диагностике хронического эндометрита. Appl Immunohistochem 19975189–193. [Google Scholar] 10. Bayer-Garner I B, Korourian S. Клетки плазмы при хроническом эндометрите легко идентифицируются при окрашивании синдеканом-1.Мод Pathol 200114877–879. [PubMed] [Google Scholar] 11. Байер-Гарнер И. Б., Никелл Дж. А. Рутинный иммуногистохимический анализ синдекана-1 помогает в диагностике хронического эндометрита. Arch Pathol Lab Med 20041281000–1003. [PubMed] [Google Scholar] 12. Дисеп Б., Иннес Б. А., Кокран Н. Р. и др. Иммуногистохимическая характеристика лейкоцитов эндометрия при эндометрите. Гистопатология 200445625–632. [PubMed] [Google Scholar] 14. Клитцерис Л. Д., Балмер Дж. Н., Уоррен А. и др. Лимфоидная ткань эндометрия в синхронизированной биопсии эндометрия: морфометрические и иммуногистохимические аспекты.Am J Obstet Gynaecol 196667–6674. [PubMed] [Google Scholar] 15. Маршалл Р. Дж., Джонс Д. Б. Иммуногистохимическое исследование лимфоидной ткани в эндометрии человека. Int J Gynecol Pathol 19887225–235. [PubMed] [Google Scholar] 16. Камат Б. Р., Исаксон П. Иммуногистохимическое распределение субпопуляций лейкоцитов в эндометрии человека. Am J Pathol 198612766–73. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Kim K R, Peng R, Ro J Y.
и др. Диагностически полезная гистопатологическая особенность полипа эндометрия: длинная ось эндометриальных желез расположена параллельно поверхностному эпителию.Am J Surg Pathol 2004281057–1062. [PubMed] [Google Scholar] 18. McCluggage W G, Sumathi V P, McManus D. T. Серозная карцинома матки и интраэпителиальная карцинома эндометрия, возникающая при полипах эндометрия: сообщение о 5 случаях, в том числе 2 связанных с терапией тамоксифеном. Хум Патол (200334939–943). [PubMed] [Google Scholar] 19. Сильва Э. Г., Дженкинс Р. Серозная карцинома в полипах эндометрия. Мод Pathol 190–128. [PubMed] [Google Scholar]20. McCluggage W G. Метаплазии женских половых путей.В: Lowe D, Underwood J, ред. Последние достижения в гистопатологии. Vol. 20. Лондон, Великобритания: Royal Society of Medicine Press Ltd, 2003
21. Хендриксон М. Р., Кемпсон Р. Л. Метаплазии эпителия эндометрия: пролиферации, часто ошибочно диагностируемые как аденокарцинома. Отчет о 89 случаях и предлагаемая классификация. Am J Surg Pathol 19804525–542. [PubMed] [Google Scholar] 22. Заман С.С., Мазур М.Т. Папиллярно-синцитиальное изменение эндометрия: неспецифическое изменение, связанное с активным разрушением. Am J Clin Pathol 199399741–745.[PubMed] [Google Scholar] 23. Нуччи М. Р., Прасад С. Дж., Крам С. П. и др. Муцинозные эпителиальные пролиферации эндометрия: морфологический спектр изменений с различным клиническим значением. Мод Pathol 19949. Скалли Р. Э., Поулсон Х., Собин Л. Х. Международная гистологическая классификация и типирование опухолей женских половых путей. Берлин: Springer, 1994
50. Курман Р. Дж., Камински П. Ф., Норрис Х. Дж. Поведение при гиперплазии эндометрия. Долгосрочное исследование «нелеченой» гиперплазии у 170 пациентов. Рак 198556403–412. [PubMed] [Google Scholar] 51. Сков Б.Г., Брохольм Х., Энгель У. и др. Сравнение воспроизводимости классификаций ВОЗ 1975 и 1994 годов гиперплазии эндометрия.Int J Gynecol Pathol 19971633–37. [PubMed] [Google Scholar] 52. Кендалл Б.С., Роннетт Б.М., Исаксон С. и др. Воспроизводимость диагностики гиперплазии эндометрия, атипичной гиперплазии и хорошо дифференцированной карциномы. Am J Surg Pathol 1998221012–1019. [PubMed] [Google Scholar] 53. Бержерон С., Ногалес Ф. Ф., Массероли М. и др. Многоцентровое европейское исследование, в котором проверяется воспроизводимость классификации гиперплазии эндометрия ВОЗ с предложением упрощенной рабочей классификации образцов для биопсии и выскабливания.Am J Surg Pathol 19902–1108. [PubMed] [Google Scholar] 55. Монц Ф. Дж., Бристоу Р. Э., Бовичелли А. и др. Внутриутробное лечение прогестероном раннего рака эндометрия. Am J Obstet Gynecol 2002186651–657. [PubMed] [Google Scholar] 56. Рэндалл Т. К., Курман Р. Дж. Лечение прогестином атипичной гиперплазии и хорошо дифференцированной карциномы эндометрия у женщин в возрасте до 40 лет. Obstet Gynecol 1997
–440. [PubMed] [Google Scholar] 57. Курман Р. Дж., Норрис Х. Дж. Оценка критериев отличия атипичной гиперплазии эндометрия от хорошо дифференцированной карциномы.Рак 1982152547–2559. [PubMed] [Google Scholar] 58. Курман Р. Дж., Норрис Х. Дж. Инвазия в строму эндометрия в диагностике хорошо дифференцированной карциномы. Am J Surg Pathol 19848719–720. [PubMed] [Google Scholar] 59. Хехт Дж. Л., Инс Т. А., Баак Дж. П. и др. Прогнозирование рака эндометрия с помощью субъективной диагностики интраэпителиальной неоплазии эндометрия. Мод Pathol 200518324–330. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Муттер Дж. Л., Совместная группа по эндометрию. Интраэпителиальная неоплазия эндометрия (ЭИН): внесет ли она порядок в хаос? Гинеколь Онкол 200076287–290.[PubMed] [Google Scholar] 61. Муттер Г. Л., Баак Дж. П. А., Крам П. С. и др. Диагностика предрака эндометрия с помощью гистопатологии, клонального анализа и компьютерной морфометрии. J Pathol 20001–469. [PubMed] [Google Scholar] 63. Мазур М. Т. Атипичные полиповидные аденомиомы эндометрия. Am J Surg Pathol 19815473–482. [PubMed] [Google Scholar] 64. Янг Р. Х., Трегер Т., Скалли Р. Э. Атипичная полиповидная аденомиома матки. Отчет о 27 случаях. Am J Clin Pathol 198686139–145. [PubMed] [Google Scholar] 65.Zaloudek C J, Norris H J. Аденофиброма и аденосаркома матки: клинико-патологическое исследование 35 случаев. Рак 198148354–366. [PubMed] [Google Scholar]66. McCluggage WG, Haller U, Kurman R.J. и др. Опухоли тела матки. Смешанные эпителиальные и мезенхимальные опухоли. В: Тавассоли Ф.А., Девили П., ред. Классификация опухолей Всемирной организации здравоохранения. Патология и генетика опухолей груди и женских половых органов. Лион: IARC Press, 2003245–249.
67.Клемент П. Б., Скалли Р. Э. Муллеровские аденосаркомы матки с элементами, напоминающими половой шнур: клинико-патологический анализ восьми случаев. Am J Clin Pathol 1989–672. [PubMed] [Google Scholar] 68. Бохман Ю.В. Два патогенетических типа рака эндометрия. Гинеколь Онкол 19831510–17. [PubMed] [Google Scholar] 69. Зайно Р. Дж., Курман Р. Дж., Диана К. Л. и др. Полезность пересмотренной Международной федерации гинекологии и акушерства гистологической классификации аденокарциномы эндометрия с использованием определенной ядерной системы классификации: исследование группы гинекологической онкологии.Рак 19957581–86. [PubMed] [Google Scholar] 70. Алкуши А., Абдул-Рахман З. Х., Лим П. и др. Описание новой системы классификации рака эндометрия и сравнение с существующими системами классификации. Am J Surg Pathol 200529295–304. [PubMed] [Google Scholar] 71. Клемент П. Б., Янг Р. Х. Эндометриоидная карцинома тела матки: обзор ее патологии с акцентом на последние достижения и проблемные аспекты. Адвокат Анат Патол 20029145–184. [PubMed] [Google Scholar] 72. Макклагедж В. Г.Критическая оценка значения иммуногистохимии в диагностике новообразований яичников. Адвокат Анат Патол 200411162–171. [PubMed] [Google Scholar] 73. Алкуши А., Лим П., Колдман А. и др. Интерпретация иммунореактивности р53 при карциноме эндометрия: установление биологически значимого порогового уровня. Int J Gynecol Pathol 200423129–137. [PubMed] [Google Scholar] 74. Лакс С. Ф., Кендалл Б., Таширо Х. и др. Частота мутаций p53, K-ras и микросателлитная нестабильность в эндометриоидной и серозной карциноме матки: свидетельство различных молекулярно-генетических путей.Рак 200088814–824. [PubMed] [Google Scholar] 75. Zheng W, Cuo P, Zheng M. et al. сверхэкспрессия p53 и персистенция bcl-2 при карциноме эндометрия: сравнение папиллярных серозных и эндометриоидных подтипов. Gynecol Oncol 199661167–174. [PubMed] [Google Scholar] 76. Уиллер Д. Т., Белл К. А., Курман Р. Дж. и др. Минимальная серозная карцинома матки: диагностика и клинико-патологическая корреляция. Am J Surg Pathol 200024797–806. [PubMed] [Google Scholar] 77. Хуэй П., Келли М., О’Мэлли Д. М. и др. Минимальная серозная карцинома матки: клинико-патологическое исследование 40 случаев. Мод Pathol 20051875–82. [PubMed] [Google Scholar] 78. Амброс Р. А., Шерман М. Е., Зан С. М. и др. Внутриэпителиальная карцинома эндометрия: характерное поражение, специфически связанное с опухолями, демонстрирующими серозную дифференцировку. Хум Патол 1995261260–1267. [PubMed] [Google Scholar] 79. Spiegl G W. Карцинома эндометрия in situ у женщин в постменопаузе. Am J Surg Pathol 199519417–432. [PubMed] [Google Scholar] 80.Lax S. F, Pizer E. S., Ronnett B. M. et al. Светлоклеточная карцинома эндометрия характеризуется отличительным профилем экспрессии p53, Ki-67, рецепторов эстрогена и прогестерона. Хум Патол 199829551–558. [PubMed] [Google Scholar]проблем в дифференциальной диагностике гиперплазии и карциномы эндометрия
Шерман М.Е. Теории канцерогенеза эндометрия: мультидисциплинарный подход. Mod Pathol 2000; 13 : 295–308.
CAS Статья Google ученый
Фокс Х.Гиперплазия эндометрия. Obstet Gynecol Annu 1984; 13 : 197–209.
CAS PubMed Google ученый
Сильверберг С.Г., Курман Р.Дж. Опухоли тела матки и гестационная трофобластическая болезнь. Атлас опухолевой патологии. 3-я серия. Волосник 3 . Вашингтон, округ Колумбия: Институт патологии вооруженных сил; 1992. стр. 13–14.
Google ученый
Fenoglio CM, Crum CP, Ferenczy A.Гиперплазия и карцинома эндометрия. Полезны ли ультраструктурные, биохимические и иммуноцитохимические исследования для их различения? Pathol Res Pract 1982; 174 : 257–284.
CAS Статья Google ученый
Bergeron C, Ferenczy A, Toft DO, Shyamala G. Иммуноцитохимическое исследование рецепторов прогестерона в гиперпластических и опухолевых тканях эндометрия. Cancer Res 1988; 48 : 6132–6136.
CAS PubMed Google ученый
Duggan BD, Felix JC, Muderspach LI, Tsao JL, Shibata DK. Ранняя мутационная активация онкогена c-Ki-ras при карциноме эндометрия. Cancer Res 1994; 54 : 1604–1607.
CAS PubMed Google ученый
Эстеллер М., Гарсия А., Мартинес-Палонес Дж. М., Ксеркавинс Дж., Ревентос Дж. Обнаружение клональности и генетических изменений при биопсии эндометрия трубопровода и ее аналоге из хирургического образца. Lab Invest 1997; 76 : 109–116.
CAS PubMed Google ученый
Иоффе OB, Papadimitriou JC, Drachenberg CB. Корреляция индексов пролиферации, апоптоза и экспрессии родственных онкогенов (bcl-2 и c-erbB-2) и p53 в пролиферативном, гиперпластическом и злокачественном эндометрии. Хум Патол 1998; 29 : 1150–1159.
CAS Статья Google ученый
Левин Р.Л., Каргил CB, Блейз М.С., ван Рис Б., Курман Р.Дж., Элленсон Л.Х.Мутации PTEN и микросателлитная нестабильность при сложной атипичной гиперплазии, предшествующем поражению эндометриоидной карциномы матки. Cancer Res 1998; 58 : 3524–3528.
Google ученый
Максвелл Г.Л., Райзингер Дж. И., Гамбс С., Шоу Х., Бентли Р.С., Барретт Дж. К., и др. . Мутация гена-супрессора опухолей PTEN при гиперплазии эндометрия. Cancer Res 1998; 58 : 2500–2503.
CAS PubMed Google ученый
Mutter GL, Boynton KA, Faquin WC, Ruiz RE, Jovanovic AS. Картирование аллелотипов нестабильных микросателлитов устанавливает прямую преемственность между предраками эндометрия и раком. Cancer Res 1996; 56 : 4483–4486.
CAS PubMed Google ученый
Mutter GL, Chaponot ML, Fletcher JA.Анализ полимеразной цепной реакции для неслучайной инактивации Х-хромосомы выявляет моноклональные и предраковые опухоли эндометрия. Am J Pathol 1995; 146 : 501–508.
CAS PubMed PubMed Central Google ученый
Ниикура Х, Сасано Х, Кага К., Сато С., Ядзима А. Экспрессия белков семейства эпидермального фактора роста и рецептора эпидермального фактора роста в эндометрии человека. Hum Pathol 1996; 27 : 282–289.
CAS Статья Google ученый
Palazzo JP, Mercer WE, Kovatich AJ, McHugh M. Иммуногистохимическая локализация p21 WAF1 / CIP1 в нормальной, гиперпластической и опухолевой тканях матки. Hum Pathol 1997; 27 : 60–66.
Артикул Google ученый
Расти Дж., Мюррей Р., Лу Л., Кубилис П., Бенруби Дж., Масуд С.Экспрессия онкогена HER-2 / neu в нормальном, гиперпластическом и злокачественном эндометрии. Ann Clin Lab Sci 1998; 28 : 138–143.
CAS PubMed Google ученый
Schwartz AM, Silverberg SG, Fu YS, Nozawa S, Huang S, Tsukasaki K, et al . Использование моноклональных антител MSN-1 и B72.3 в прогнозировании естественного течения гиперплазии эндометрия. Int J Gynecol Pathol 1993; 12 : 253–258.
CAS Статья Google ученый
Шройер К.Р., Стивенс Дж. К., Сильверберг С.Г., Маркхэм Н., Шройер А.Л., Уилсон М.Л., и др. . Экспрессия теломеразы в нормальном эндометрии, гиперплазии эндометрия и аденокарциноме эндометрия. Int J Gynecol Pathol 1999; 16 : 219–224.
Google ученый
Ван Д.П., Кониси И., Кошияма М., Мандай М., Нанбу И., Исикава Ю., и др. .Экспрессия белка c-erbB-2 и рецептора роста эпидермиса в карциномах эндометрия. Корреляция с клинико-патологическим статусом и статусом рецепторов половых стероидов. Cancer 1993; 72 : 2628–2637.
CAS Статья Google ученый
Винклер Б., Альварес С., Ричарт Р.М., Крам С.П. Подводные камни в диагностике гиперплазии эндометрия. Obstet Gynecol 1984; 64 : 185–193.
CAS PubMed Google ученый
Кендалл Б.С., Роннетт Б.М., Исаксон С., Чо К.Р., Хедрик Л., Динер-Вест М., и др. .Воспроизводимость диагностики гиперплазии эндометрия, атипичной гиперплазии и высокодифференцированной карциномы. Am J Surg Pathol 1998; 22 : 1012–1019.
CAS Статья Google ученый
Сков Б.Г., Брохольм Х., Энгель У., Францманн МБ, Нильсен А.Л., Лауритцен А.Ф., и др. . Сравнение воспроизводимости классификаций ВОЗ 1975 и 1994 годов гиперплазии эндометрия. Int J Gynecol Pathol 1997; 16 : 33–37.
CAS Статья Google ученый
Заино Р.Дж. Интерпретация результатов биопсии эндометрия и выскабливания . Филадельфия, Пенсильвания: Липпинкотт-Рэйвен; 1996. стр. 209–212.
Google ученый
Longacre TA, Chung MH, Rouse RV, Hendrickson MR. Атипичные полиповидные аденомиофибромы (атипичные полиповидные аденомиомы) матки. Клинико-патологическое исследование 55 случаев. Am J Surg Pathol 1996; 20 : 1–20.
CAS Статья Google ученый
Шерман М.Э., Сильверберг С.Г. Успехи в патологии эндометрия. Clin Lab Med 1995; 15 : 517–543.
CAS Статья Google ученый
Сильверберг С.Г. Гиперплазия и рак эндометрия. Semin Diagn Pathol 1988; 5 : 135–153.
CAS PubMed Google ученый
Hendrickson MR, Ross JC, Kempson RL. К разработке морфологических критериев высокодифференцированной аденокарциномы эндометрия. Am J Surg Pathol 1983; 7 : 819–838.
CAS Статья Google ученый
Курман Р.Дж., Норрис Х.Дж. Оценка критериев отличия атипичной гиперплазии эндометрия от хорошо дифференцированной карциномы. Cancer 1982; 49 : 2547–2559.
CAS Статья Google ученый
Tavassoli F, Kraus FT. Поражения эндометрия в матке иссечены по поводу атипичной гиперплазии эндометрия. Am J Clin Pathol 1978; 70 : 770–779.
CAS Статья Google ученый
Longacre TA, Chung MH, Jensen DN, Hendrickson MR.Предлагаемые критерии диагностики высокодифференцированного рака эндометрия. Диагностический тест на миоинвазию. Am J Surg Pathol 1995; 19 : 371–406.
CAS Статья Google ученый
Сильверберг С.Г., де Джорджи Л.С. Гистопатологический анализ предоперационной лучевой терапии при раке эндометрия. Am J Obstet Gynecol 1974; 119 : 698–704.
CAS Статья Google ученый
Хантер Дж. Э., Триц Д. Е., Хауэлл М. Г., Деприст П. Д., Галлион Н. Х., Эндрюс С. Дж., и др. .Прогностические и терапевтические последствия цитологической атипии у пациентов с гиперплазией эндометрия. Gynecol Oncol 1994; 55 : 64–71.
Артикул Google ученый
Жак С.М., Куреши Ф., Мункара А., Лоуренс В.Д. Межведомственный обзор хирургической патологии в гинекологической онкологии: рак эндометрия в образцах гистерэктомии. Int J Gynecol Pathol 1998; 17 : 42–45.
CAS Статья Google ученый
Сильвер С.А., Шерман М.Э. Морфологическая и иммунофенотипическая характеристика пенистых клеток при поражениях эндометрия. Int J Gynecol Pathol 1998; 17 : 140–145.
CAS Статья Google ученый
Давань МП, Сильверберг С.Г. Пенистые клетки при карциноме эндометрия: клинико-патологическое исследование. Gynecol Oncol 1982; 13 : 67–75.
CAS Статья Google ученый
Copenhaver EH. Атипичная гиперплазия эндометрия. Obstet Gynecol 1959; 13 : 264–268.
CAS PubMed Google ученый
Hertig AT, Sommers SC, Bengloff H. Генез рака эндометрия. I. Изучение предыдущих биопсий. Cancer 1949; 2 : 946–956.
CAS Статья Google ученый
Telinde RW, Jones HW Jr, Galvin GA. Каковы самые ранние изменения эндометрия, позволяющие поставить диагноз рака эндометрия? Am J Obstet Gynecol 1953; 66 : 953–969.
CAS Статья Google ученый
Ферениз А, Гельфанд М.Биологическое значение цитологической атипии при гиперплазии эндометрия, леченной прогестогенами. Am J Obstet Gynecol 1989; 160 : 126–131.
Артикул Google ученый
Курман Р.Дж., Камински П.Ф., Норрис Х.Дж. Поведение гиперплазии эндометрия: долгосрочное исследование «нелеченой» гиперплазии у 170 пациентов. Cancer 1985; 56 : 403–412.
CAS Статья Google ученый
Baak J, Wisse-Brekelmans E, Fleege J, van der Putten H, Bezemer P.Оценка риска рака эндометрия при гиперплазии по морфологическим и морфометрическим признакам. Pathol Res Pract 1992; 188 : 856–859.
CAS Статья Google ученый
Хуанг С.Дж., Ампаро Э.Г., Фу Ю.С. Гиперплазия эндометрия: гистологическая классификация и поведение. Surg Pathol 1988; 1 : 215–229.
Google ученый
Шерман А.И., Браун С.Предшественники рака эндометрия. Am J Obstet Gynecol 1979; 135 : 947–956.
CAS Статья Google ученый
Бойд Дж. Молекулярная биология в клинико-патологической оценке подтипов карциномы эндометрия. Gynecol Oncol 1996; 61 : 163–165.
CAS Статья Google ученый
Шерман М.Е., Бур М.Е., Курман Р.Дж.p53 при раке эндометрия и его предполагаемых предшественниках: данные о различных путях туморогенеза. Хум Патол 1995; 26 : 1268–1274.
CAS Статья Google ученый
Шерман М.Э., Осетр С., Бринтон Л.А., Потишман Н., Курман Р.Дж., Берман М.Л., и др. . Факторы риска и уровни гормонов у пациентов с серозной и эндометриоидной карциномой матки. Mod Pathol 1997; 10 : 963–968.
CAS PubMed Google ученый
Sivridis E, Fox H, Buckley CH. Карцинома эндометрия: два или три образования? Int J Gynecol Cancer 1998; 8 : 183–188.
Артикул Google ученый
Сослоу Р.А., Шен ПУ, Чунг М.Х., Исаксон К. Отличительные профили иммуногистохимической экспрессии p53 и mdm2 предполагают разные патогенетические пути при низкодифференцированной карциноме эндометрия. Int J Gynecol Pathol 1998; 17 : 129–134.
CAS Статья Google ученый
Тобон Х., Уоткинс Дж. Секреторная аденокарцинома эндометрия. Int J Gynecol Pathol 1985; 4 : 328–335.
CAS Статья Google ученый
Хендриксон М.Р., Кемпсон Р.Л. Ресничный рак: вариант рака эндометрия: отчет о 10 случаях. Int J Gynecol Pathol 1983; 2 : 1–12.
CAS Статья Google ученый
Максем Я. Ресничная аденокарцинома эндометрия, диагностированная с помощью щеточной цитологии эндометрия и подтвержденная гистерэктомией: отчет о клиническом случае, подробно описывающий высокоэффективный метод сбора и обработки цитологического исследования. Диагностика Цитопатол 1997; 16 : 78–82.
CAS Статья Google ученый
Новак Е.Р., Наллей ВБ.Аденоакантома матки. Obstet Gynecol 1957; 9 : 396–402.
CAS PubMed Google ученый
Нг А.Б., Рейган Дж. В., Стораасли Дж. П., Венц В. Б.. Смешанный аденосквамозный рак эндометрия. Am J Clin Pathol 1973; 59 : 765–781.
CAS Статья Google ученый
Сильверберг С.Г. Значение плоскоклеточных элементов при раке эндометрия: обзор. Prog Surg Pathol 1982; 4 : 115–136.
Google ученый
Заино Р.Дж., Курман Р., Гербольд Д., Глиедман Дж., Банди Б.Н., Воет Р., и др. . Значение плоскоклеточной дифференцировки при раке эндометрия: данные исследования группы гинекологической онкологии. Cancer 1991; 68 : 2293–2302.
CAS Статья Google ученый
Эстеллер М., Гарсия А., Мартинес-Палонес Дж. М., Ксеркавинс Дж., Ревентос Дж.Клинико-патологические особенности и генетические изменения при эндометриоидной карциноме матки с виллогландулярной дифференцировкой. Am J Clin Pathol 1999; 111 : 336–342.
CAS Статья Google ученый
Kallakury VSB, Ambros RA, Hayner-Buchan AM, Sheehan CE, Malfetano JH, Ross JS. Белки, связанные с пролиферацией клеток, при карциномах эндометрия, включая папиллярные серозные и эндометриоидные подтипы. Int J Gynecol Pathol 1998; 17 : 320–326.
CAS Статья Google ученый
Zaino RJ, Kurman RJ, Brunetto VL, Morrow CP, Bentley RC, Cappellari JO, и др. . Виллогландулярная аденокарцинома эндометрия. Клинико-патологическое исследование 61 случая: исследование группы гинекологической онкологии. Am J Surg Pathol 1998; 22 : 1379–1385.
CAS Статья Google ученый
Maggino T, Romagnolo C, Landoni F, Sartori E, Zola P, Gadducci A.Анализ подходов к лечению рака эндометрия в Северной Америке: исследование CTF. Gynecol Oncol 1998; 68 : 274–279.
CAS Статья Google ученый
Шерман М.Э., Биттерман П., Розеншейн Н.Б., Дельгадо Г., Курман Р.Дж. Серозная карцинома матки. Морфологически разнообразное новообразование с объединяющими клинико-патологическими признаками. Am J Surg Pathol 1992; 16 : 600–610.
CAS Статья Google ученый
Заино Р.Дж., Курман Р.Дж., Диана К.Л., Морроу С.П. Полезность пересмотренной Международной федерации гинекологии и акушерства гистологической классификации аденокарциномы эндометрия с использованием определенной ядерной системы классификации: исследование группы гинекологической онкологии. Cancer 1995; 75 : 81–86.
CAS Статья Google ученый
Хатисуга Т., Каварабаяси Т., Ивасака Т., Сугимори Х., Камура Т., Цунэёси М.Прогностическая ценность полуколичественной ядерной классификации при карциномах эндометрия. Gynecol Oncol 1997; 65 : 115–120.
CAS Статья Google ученый
Тейлор Р.Р., Зеллер Дж., Либерман Р.В., О’Коннор Д.М. Анализ двух и трех степеней рака эндометрия. Gynecol Oncol 1999; 74 : 3–6.
CAS Статья Google ученый
Creasman W, Odincino F, Maisonneuve P, Benefet J, Shepherd J, et al .Карцинома тела матки: Годовой отчет о результатах лечения гинекологического рака. J Epidemiol Biostat 1998; 3 : 46–47.
Google ученый
Морроу С.П., Банди Б.Н., Курман Р.Дж., Кризман В.Т., Хеллер П., Хомсли HD, и др. . Взаимосвязь между хирургически-патологическими факторами риска и исходом при I и II клинической стадии рака эндометрия: исследование группы гинекологической онкологии. Gynecol Oncol 1991; 40 : 55–65.
CAS Статья Google ученый
Джонс HW. Важность классификации рака эндометрия. Gynecol Oncol 1999; 74 : 1-2.
Артикул Google ученый
Мальвия В.К., Деппе Дж., Мэлоун Дж. М. мл., Сундаресон А.С., Лоуренс В.Д. Надежность исследования замороженных срезов в выявлении плохих прогностических показателей при аденокарциноме эндометрия I стадии. Gynecol Oncol 1989; 34 : 299–304.
CAS Статья Google ученый
Атад Дж., Вейл С., Бен-Дэвид Й., Халлак М., Кляйн О., Лурье М., и др. . Интраоперационное исследование глубины инвазии миометрия на замороженных срезах у больных карциномой эндометрия. Int J Gynecol Cancer 1994; 4 : 352–355.
Артикул Google ученый
Сейдман Дж. Д., Керульф К. Х.Патологические результаты исследования здоровья женщин Мэриленда: практические модели диагностики аденомиоза. Int J Gynecol Pathol 1996; 15 : 217–221.
CAS Статья Google ученый
Mittal KR, Barwick KW. Аденокарцинома эндометрия, сопровождающаяся аденомиозом без истинной инвазии миометрия, характеризуется частой предшествующей терапией эстрогенами, низкими гистологическими оценками и отличным прогнозом. Gynecol Oncol 1993; 49 : 197–201.
CAS Статья Google ученый
Longacre TA, Hendrickson MR. Диффузно инфильтративная аденокарцинома эндометрия: злокачественная аденома миоинвазии. Am J Surg Pathol 1999; 23 : 69–78.
CAS Статья Google ученый
Роббой SJ, Bentley RC, Krigman H, Silverberg SG, Norris HJ, Zaino RJ.Синоптические отчеты в гинекологической патологии. Int J Gynecol Pathol 1994; 13 : 161–174.
CAS Статья Google ученый
Сильверберг SG. Протокол исследования образцов от пациентов с карциномами эндометрия: основа для чек-листов. Онкологический комитет, Колледж американских патологов. Arch Pathol Lab Med 1999; 123 : 28–32.
CAS PubMed Google ученый
Гиперплазия эндометрия — обзор
Гиперплазия эндометрия
Гиперплазия эндометрия — это разрастание желез с увеличенным соотношением желез к строме по сравнению с нормальным пролиферативным эндометрием.Изменение может быть очаговым, пятнистым или диффузным и может варьироваться по степени тяжести от области к области. Большинство примеров гиперплазии эндометрия являются результатом длительного или постоянного воздействия эстрогена без сопротивления. У женщин моложе 40 лет с сопутствующей хронической ановуляцией, гирсутизмом, ожирением или бесплодием часто присутствует поликистоз яичников (синдром Штейна-Левенталя) (см. Главу 39). Считается, что женщины, у которых отсутствуют более явные проявления поликистоза яичников, но страдают ожирением, превращают андростендион в эстрон в периферических жировых тканях.Пожилые женщины в перименопаузальном или постменопаузальном возрасте, у которых развивается гиперплазия эндометрия, часто делают это в ответ на безальтернативную заместительную терапию эстрогенами. Пациенты с гиперплазией эндометрия обычно обращаются с патологическим маточным кровотечением, хотя случайные случаи выявляются во время обследования на бесплодие.
Споры вокруг патологической классификации и естественного течения гиперплазии эндометрия. Гиперплазия эндометрия представляет собой гетерогенную группу аномально пролиферирующих желез и стромы, хотя большинство схем гистопатологической классификации подчеркивают патологические паттерны желез.Более того, гистопатологическая интерпретация гиперплазии эндометрия значительно различается между наблюдателями (и даже внутри наблюдателя). 51 Это происходит потому, что все схемы классификации полагаются на искусственные и произвольные точки останова в очевидном континууме прогрессивно аномальной цитологической и архитектурной атипичности. Тем не менее, классификация имеет клиническое применение для прогнозирования прогрессирования карциномы.
Наиболее широко используемая система классификации гиперплазии эндометрия — это система Международного общества патологов-гинекологов (ISGP) под эгидой ВОЗ. 27 Хотя ее воспроизводимость была несколько неудовлетворительной, 51 эта классификационная система получила всемирное одобрение (Таблица 37-1). В этой системе гиперплазия эндометрия делится на две основные категории — гиперплазия эндометрия и атипичная гиперплазия эндометрия, которые различаются наличием или отсутствием цитологической атипии желез. Обе категории подразделяются на простые и сложные (аденоматозные) в зависимости от архитектурных особенностей желез. Относительная редкость простой гиперплазии с атипией привела к предположению, что количество категорий можно сократить до трех: простая гиперплазия, сложная гиперплазия и атипическая гиперплазия.
Для оценки цитологической атипии необходимо оценить цитоплазматические и ядерные особенности; первое важно прежде всего из-за запутанных эпителиальных изменений эндометрия (метаплазий), 49 , наложенные цитоплазматические изменения которых могут сделать гиперпластическое поражение более атипичным, даже приближающимся или имитирующим аденокарциному. Наихудшими нарушителями в этом отношении являются эозинофильная и цилиарная метаплазии, цитологические особенности которых могут частично совпадать. Однако ядерные особенности являются наиболее надежным показателем цитологической атипии.Соседние нормальные или негиперпластические железы могут обеспечить удобный «внутренний ядерный контроль».
Следующие гистопатологические описания суммируют архитектурные и цитологические характеристики каждой из категорий в системе классификации ISGP / ВОЗ. Простая гиперплазия характеризуется трубчатыми железами с различной степенью кистозного расширения со случайным несложным почкованием и от легкой до умеренной скученности желез (рис. 37-9A). Более старый термин кистозная гиперплазия эквивалентен категории простой гиперплазии.Напротив, сложная гиперплазия проявляется скученными, разветвленными железами с заметными папиллярными складками (аденоматозное изменение) и повышенным соотношением железы к строме (см. Рис. 37-9B и C). Цитологические признаки неатипичной гиперплазии эндометрия включают псевдостратифицированные железистые клетки с однородными, удлиненными и поляризованными ядрами. Неатипичная гиперплазия обычно имеет повышенную клеточную стратификацию и митотическую активность по сравнению с нормальными пролиферативными железами.
Атипичная гиперплазия распознается путем изучения цитологических особенностей железистого эпителия.Атипичные ядерные изменения включают потерю осевой полярности, необычные округлые или неправильные контуры ядра, выступающие ядрышки и «комковатый» хроматин (см. Рис. 37-9D). Атипия может быть очаговой, что требует широкого отбора проб. Архитектура сложной атипичной гиперплазии обычно проявляет большую сложность и скученность по сравнению со сложной неатипичной гиперплазией. При сложной атипичной гиперплазии может быть сопутствующая неэндометриоидная дифференцировка, такая как плоскоклеточные морулы. Оценка цитологической атипии может быть проблематичной, учитывая различия в цитологических характеристиках циклического эндометрия, а также цитологические изменения в регенеративных или метапластических процессах; атипию лучше всего оценивать относительно соседних не задействованных желез эндометрия.
Образец биопсии эндометрия в случаях гиперплазии эндометрия обычно состоит из большого количества ткани, которую следует полностью сдать для микроскопического исследования, чтобы убедиться в идентификации наиболее атипичного компонента поражения. Пациентов с гистологическим диагнозом гиперплазии эндометрия можно лечить прогестагенными агентами; в таких случаях эндометрий может сохранять некоторую степень железистой архитектурной аномалии с прогестационным эффектом, проявляющимся в выстилающем эпителии и строме.Однако цитологическая атипия может сохраняться даже после гормональной терапии, а некоторые области гиперпластического эндометрия могут практически не реагировать на лечение. Важно, чтобы история гиперплазии эндометрия, подвергшаяся лечению, была предоставлена во время микроскопической оценки, чтобы правильно оценить эффект прогестагенного агента. Изучение исходного (необработанного) материала биопсии эндометрия и последующих образцов биопсии, полученных в ходе лечения, может помочь в интерпретации изменений, вызванных лекарством, и оценке его эффективности.
В нескольких исследованиях изучались эпидемиологические последствия гиперплазии эндометрия и ее связь с последующим развитием аденокарциномы эндометрия. Наличие эпителиальной атипии при гиперплазии эндометрия является важнейшим фактором риска развития аденокарциномы эндометрия. В одном исследовании только у 1,6% пациентов с простой гиперплазией и сложной гиперплазией без атипии развилась аденокарцинома эндометрия по сравнению с 22% пациентов с атипичной гиперплазией. 52 Аденокарцинома эндометрия, связанная с гиперплазией эндометрия, обычно является эндометриоидным типом низкой степени злокачественности. 52
Предполагаемая плохая воспроизводимость классификации ISGP / ВОЗ, 53 , а также новые молекулярные и морфометрические исследования, побудили предложить альтернативную, упрощенную систему для идентификации предраковых поражений. С этой целью Mutter 54,55 предложил концепцию интраэпителиальной неоплазии эндометрия (EIN).В основе EIN лежит появление моноклональной популяции железистых клеток с архитектурными и цитологическими особенностями, отличными от таковых у соседних неопухолевых желез. В исследованиях результатов утверждается, что EIN связан с более высоким риском прогрессирования карциномы эндометрия по сравнению с атипичной гиперплазией эндометрия. 56 При биопсии эндометрия, в которой определяется EIN, сообщается о 25% вероятности выявления рака при последующей гистерэктомии. 57
Диагностика EIN включает оценку архитектуры железы, цитологические особенности и размер поражения, а также исключение доброкачественных имитаций и рака. 58 Все эти критерии должны быть выполнены для диагностики EIN. Во-первых, чтобы соответствовать архитектурному критерию, площадь железы должна быть больше площади стромы. Более конкретно, процент ткани, занятой стромой (процент объема стромы), должен быть менее 55%. Большинство поражений EIN состоят приблизительно на 40% из стромы, тогда как поражения без EIN состоят приблизительно из 75% стромы. Следует избегать участков с большими доминирующими кистами. Во-вторых, цитология исследуемой области должна отличаться от фона или быть явно ненормальной (рис.37-10). Доказательства цитологической атипии включают изменение размера и контура ядра, слипшийся или гранулярный хроматин, изменение соотношения ядер и цитоплазмы, а также изменение цитоплазматической дифференцировки. Абсолютного уровня цитологической атипии, необходимого для диагностики ЭИН, не существует; попытки определить такой стандарт затруднены нормальными вариациями циклического эндометрия и регенеративными или метапластическими изменениями. Скорее, пораженная область должна четко цитологически отличаться от фона не вовлеченного железистого эпителия.В-третьих, максимальный линейный размер поражения должен быть больше 1 мм. Результаты исследований показали, что для демонстрации повышенного риска рака требуется минимальный размер поражения 1 мм, скорее всего, из-за того, что более мелкие поражения обычно не имеют достаточного количества желез, чтобы точно измерить архитектурные и цитологические особенности. 57,59,60 Требование к размеру должно быть выполнено для одного фрагмента ткани, а не для нескольких фрагментов. Наконец, следует исключить другие процессы.Доброкачественная имитация EIN включает реактивные изменения, артефактические изменения, стойкий эффект эстрогена, средний и поздний секреторный эндометрий и полипы эндометрия. Карциному эндометрия можно отличить от EIN по распознаванию «лабиринтных» просветов, области твердого эпителия, решетчатой архитектуры, спина к спине желез без промежуточной стромы и инвазии миометрия.
В связи с принципиально разными критериями точное сопоставление категорий системы ISGP / ВОЗ и EIN невозможно.Подсчитано, что 79% атипичных гиперплазий эндометрия трансформируются в EIN, и примерно 33% диагнозов EIN связаны с категориями неатипичной гиперплазии. 61 Хотя концепция EIN интригует, она требует дополнительной проверки и клинического признания, чтобы заслужить замену существующей системы классификации ISGP / ВОЗ.
Гиперплазия эндометрия: причины, симптомы и лечение
Обзор
Что такое гиперплазия эндометрия?
Гиперплазия эндометрия — это состояние женской репродуктивной системы.Выстилка матки (эндометрий) становится необычно толстой из-за слишком большого количества клеток (гиперплазия). Это не рак, но у некоторых женщин он повышает риск развития рака эндометрия, разновидности рака матки.
Насколько распространена гиперплазия эндометрия?
Гиперплазия эндометрия встречается редко. Им страдают примерно 133 из 100 000 женщин.
У кого может быть гиперплазия эндометрия?
Женщины в перименопаузе или менопаузе более подвержены гиперплазии эндометрия.Редко встречается у женщин моложе 35 лет. К другим факторам риска относятся:
Какие бывают типы гиперплазии эндометрия?
Врачи классифицируют гиперплазию эндометрия на основании видов клеточных изменений в слизистой оболочке эндометрия. Типы гиперплазии эндометрия включают:
- Простая гиперплазия эндометрия (без атипии): Этот тип гиперплазии эндометрия имеет нормальные на вид клетки, которые вряд ли станут злокачественными. Это состояние может улучшиться без лечения.В некоторых случаях помогает гормональная терапия.
- Простая или сложная атипичная гиперплазия эндометрия: Это предраковое состояние вызывает чрезмерный рост аномальных клеток. Без лечения увеличивается риск рака эндометрия или матки.
Симптомы и причины
Что вызывает гиперплазию эндометрия?
Женщины, у которых развивается гиперплазия эндометрия, производят слишком много эстрогена и недостаточно прогестерона. Эти женские гормоны играют важную роль при менструации и беременности.Во время овуляции эстроген утолщает эндометрий, а прогестерон подготавливает матку к беременности. Если не происходит зачатия, снижается уровень прогестерона. Капля прогестерона заставляет матку терять слизистую оболочку во время менструального цикла.
Женщины с гиперплазией эндометрия вырабатывают мало прогестерона, если вообще вырабатывают его. В результате матка не теряет слизистую оболочку эндометрия. Вместо этого подкладка продолжает расти и утолщаться.
Кроме того, ожирение способствует повышению уровня эстрогена.Жировая ткань (жировые отложения в брюшной полости и теле) может преобразовывать гормоны, вырабатывающие жир, в эстроген. Вот как ожирение способствует повышенному уровню циркулирующего эстрогена и увеличивает риск гиперплазии эндометрия.
Каковы симптомы гиперплазии эндометрия?
У женщин с гиперплазией эндометрия могут наблюдаться:
Диагностика и тесты
Как диагностируется гиперплазия эндометрия?
Многие состояния могут вызвать аномальное кровотечение.Чтобы определить, что вызывает симптомы, ваш лечащий врач может назначить один или несколько из следующих тестов:
- Ультразвук: Трансвагинальное ультразвуковое исследование использует звуковые волны для получения изображений матки. По изображениям видно, толстая ли подкладка.
- Биопсия: При биопсии эндометрия берут образцы ткани из слизистой оболочки матки. Патологи изучают клетки, чтобы подтвердить или исключить рак.
- Гистероскопия: Ваш врач использует тонкий инструмент с подсветкой, называемый гистероскопом, чтобы исследовать шейку матки и заглянуть внутрь матки.Ваш врач может выполнить эту процедуру вместе с дилатацией и выскабливанием (D&C) или биопсией. Наиболее выгодно сочетать это с визуально направленным расширением и выскабливанием эндометрия. С помощью гистероскопии ваш врач может увидеть аномалии в полости эндометрия и провести прицельную (направленную) биопсию любых подозрительных участков.
Ведение и лечение
Каковы осложнения гиперплазии эндометрия?
Все типы гиперплазии могут вызвать аномальное и сильное кровотечение, которое может вызвать анемию.Анемия развивается, когда в вашем организме не хватает эритроцитов, богатых железом.
При отсутствии лечения атипичная гиперплазия эндометрия может перейти в злокачественную опухоль. Рак эндометрия или матки развивается примерно у 8% женщин с нелеченой простой атипичной гиперплазией эндометрия. Около 30% женщин со сложной атипичной гиперплазией эндометрия, не получающих лечения, заболевают раком.
Как лечить или лечить гиперплазию эндометрия?
Если у вас повышенный риск рака из-за атипичной гиперплазии эндометрия, ваш лечащий врач может порекомендовать гистерэктомию для удаления матки.После гистерэктомии нельзя забеременеть. Многие люди видят улучшение симптомов при менее инвазивном лечении прогестином. Прогестин бывает разных форм:
Профилактика
Как предотвратить гиперплазию эндометрия?
Некоторые шаги могут снизить ваши шансы на развитие гиперплазии эндометрия:
- Используйте прогестерон вместе с эстрогеном после менопаузы (если вы принимаете гормональную терапию).
- Примите противозачаточные таблетки.
- Бросить курить.
- Поддерживайте здоровый вес.
Перспективы / Прогноз
Каков прогноз (перспективы) для людей с гиперплазией эндометрия?
Гиперплазия эндометрия хорошо поддается лечению прогестином. Атипичная гиперплазия эндометрия может привести к раку эндометрия или матки. Ваш лечащий врач может порекомендовать более частое прямое (гистероскопическое) обследование или гистерэктомию, чтобы снизить риск рака.
Жить с
Когда мне позвонить врачу?
Вы должны позвонить своему врачу, если у вас возникли проблемы:
Какие вопросы я должен задать своему врачу?
Если у вас гиперплазия эндометрия, вы можете спросить своего врача:
- Почему у меня гиперплазия эндометрия?
- Какой у меня тип гиперплазии эндометрия?
- Подвержен ли я повышенному риску рака эндометрия или матки? Если да, то как я могу снизить этот риск?
- Если у меня избыточный вес, могу ли меня направить к консультанту по контролю веса?
- Как лучше всего лечить мой тип гиперплазии эндометрия?
- Каковы риски лечения и побочные эффекты?
- Есть ли у членов моей семьи риск развития гиперплазии эндометрия? Если да, то что они могут сделать, чтобы снизить этот риск?
- Какой вид последующего ухода мне понадобится после лечения?
- Стоит ли обращать внимание на признаки осложнений?
Записка из клиники Кливленда
Гиперплазия эндометрия — это состояние, вызывающее аномальное маточное кровотечение.Эти симптомы могут вызывать дискомфорт и мешать работе. Многие женщины находят облегчение после лечения прогестиновыми гормонами. Женщины с атипичной гиперплазией эндометрия имеют более высокий риск развития рака матки. Гистерэктомия купирует симптомы и снижает риск рака. Поговорите со своим врачом о наиболее подходящем для вас лечении.
Гиперплазия и неоплазия эндометрия: определение, диагностика и принципы лечения
ВВЕДЕНИЕ
По определению, аденокарцинома эндометрия — это инвазивное заболевание, поражающее либо строму эндометрия, либо лежащий в основе миометрий внематочных тканей.Большинство карцином эндометрия поддерживают дифференцировку эндометриоидов; они также могут содержать участки муцинозной или чешуйчатой дифференцировки. Другие неэндометриоидные подтипы, наблюдаемые в повседневной практике, включают светлоклеточную карциному, папиллярную серозную карциному и другие редкие варианты. Согласно гистологической системе классификации Группы гинекологической онкологии США, 1 степень 1, хорошо дифференцированная карцинома, состоит из новообразования с менее чем 5% солидного рака; степень 2, умеренно дифференцированная карцинома, содержит 6–50% солидного рака; и степень 3, низкодифференцированная карцинома, содержит более 50% солидной опухоли.
Оценка опухоли имеет большее независимое прогностическое значение для эндометриоидной аденокарциномы эндометрия и родственных ей типов (т. Е. Эндометриальной, секреторной, муцинозной, плоскоклеточной), чем для папиллярных серозных и светлоклеточных аденокарцином. Папиллярный серозный и светлоклеточный рак не показывает зависимых от степени изменений агрессивности, наблюдаемых при эндометриоидных опухолях; напротив, как группа они неизменно агрессивны. Разделение аденокарцином эндометрия на клинико-патологические классы эндометриоидного и неэндометриоидного типов сопровождается также различиями в эпидемиологических факторах риска и предшествующих поражениях. 2 , 3 Тип I, или эндометриоидные, аденокарциномы эндометрия чаще встречаются у женщин, принимающих экзогенный эстроген, и им часто предшествуют предшествующие поражения, которые являются предметом данного обсуждения.
Традиционно предполагалось, что эндометриоидной аденокарциноме эндометрия предшествует гиперплазия эндометрия (ГЭ). 4 EH ранее считался континуумом морфологических изменений, часто начинающихся с простого разрастания желез / стромы (простая гиперплазия) и заканчивающихся сложными, в высшей степени атипичными гистологическими и цитологическими пролиферациями, которые по-разному называются атипичной аденоматозной гиперплазией, дисплазией или карциномой в situ .Цифра, наиболее часто приводимая в литературе для прогрессирования атипичной аденоматозной гиперплазии в карциномы, составляла 30% через 10 лет. 4
Эта модель гиперплазии, согласно определению Всемирной организации здравоохранения (ВОЗ), была разработана в первую очередь патологами как морфологическая классификация на четыре класса гиперплазии, состоящих из сложной или простой архитектуры, сочетающейся по-разному с наличием или отсутствием цитологической атипии. . Они не полностью соответствуют четырем отличительным биологическим категориям, и не существует сопоставимого количества клинических вмешательств, индивидуально сопоставленных с каждым подтипом гиперплазии.Сокращение количества категорий до трех было предложено путем объединения всех групп атипичной гиперплазии (АГ) в одну диагностическую категорию (атипичная гиперплазия эндометрия), которая содержит самый высокий риск рака эндометрия. 5 Оценка наличия или отсутствия цитологической атипии патологами заведомо ненадежна и стала основным ограничением этого подхода. 6 В исследовании группы гинекологической онкологии только 38% сообществ с диагнозом атипичная гиперплазия эндометрия были подтверждены как атипичная гиперплазия после центрального обзора группой гинекологических патологов. 7 Еще одним осложнением этого сокращения диагностических групп из-за одной только цитологической атипии является уменьшение акцента на архитектурных особенностях, которые по-прежнему имеют значение при разделении подгрупп высокого и низкого риска.
Новые данные, появившиеся за последнее десятилетие, изменили основные предположения, на которых строится диагностика предрака эндометрия. 8 Предположение о постепенной эволюции гистологических структур эндометрия в группах с гиперплазией неверно.Эндокринно-индуцированные изменения эндометрия, такие как те, которые вызываются не имеющими сопротивления эстрогенами, действительно производят эффект широкого поля, который постепенно изменяет гистологический паттерн в зависимости от времени и дозы. Это можно описать как динамически изменяющийся гистотип, который на ранней стадии имеет вид неупорядоченного пролиферативного эндометрия, а с последующим ремоделированием предполагает переменную плотность железы, которую мы предпочитаем обозначать как последовательность доброкачественной гиперплазии эндометрия. Однако добросовестные предраковые поражения носят совершенно иной характер.Предраковые поражения эндометрия возникают очагово в результате клонального разрастания генетически мутировавших желез, которые имеют различный цитологический и архитектурный паттерн по сравнению с фоном. 9 Их морфология отличается от морфологии самого фонового эндометрия и может быть распознана только по комбинации недавно определенных гистологических признаков, которые определяют сущность интраэпителиальной неоплазии эндометрия (EIN). 10 Это более полно описано в следующем разделе.
EIN не является синонимом карциномы, но указывает на поражение, которое может регрессировать, сохраняться или прогрессировать до инвазии. Примерно у одной трети женщин с диагнозом ЭИН в течение первого года будет диагностирована сопутствующая карцинома, а долгосрочный риск рака в 45 раз выше, чем доброкачественная гиперплазия эндометрия. 11 , 12
Морфологически измененное соотношение между железами и стромой отличает карциному от EIN. Даже если миоинвазия присутствует у пациента, миоинвазия редко проявляется при выскабливании эндометрия или биопсии, при которой редко удается получить образец подлежащего миометрия.По этой причине различие между ЭИН и аденокарциномой обычно следует проводить на изолированных образцах эндометрия, лишенных миометрия. Внутри самого эндометриального компартмента исследование качества и характера стромы в области поражения железы не является надежным показателем того, была ли инвазия стромы. Поражения EIN состоят из совокупностей отдельных желез, которые могут иметь несколько точек ветвления, но не имеют сложных складчатых листов, которые образуют лабиринт взаимосвязанных просветов или виллогландулярную архитектуру в некоторых карциномах.Архитектурный рисунок желез является индикатором измененного взаимодействия между железами и стромой. Функциональные изменения, которые соответствуют злокачественному поведению in vivo , включают потерю роста, зависимого от закрепления. Гистологический эквивалент этой особенности — рост эпителиальных клеток без необходимости контакта с базальной мембраной. Это очевидно гистологически по участкам твердого эпителиального роста без образования просветов или по решетчатому рисунку множественных просветов железы в пределах одной железы.Наличие миоинвазии или любого из описанных выше паттернов (сплошной, решетчатой, виллогландулярной, лабиринтной) является диагностическим признаком аденокарциномы. 13
ПОСЛЕДОВАТЕЛЬНОСТЬ ДОБРОЧНОЙ ГИПЕРПЛАЗИИ ЭНДОМЕТРИА И EIN
Основная цель диагностики и лечения эндометрия — различать первичные гормональные нарушения, имеющие вторичный эндометриальный эффект (последовательность доброкачественной гиперплазии эндометрия), и внутренне аномальные неопластические железы эндометрия, склонные к злокачественной трансформации (EIN).Безальтернативный эстроген вызывает изменения в эндометрии, включая образование кист, беспорядочно разбросанную трубную метаплазию и ремоделирование желез. Напротив, EIN представляет собой клональную пролиферацию аномальных желез эндометрия, которая возникает в точке в пространстве и распространяется периферически, в конечном итоге затрагивая весь эндометриальный компартмент примерно у четверти женщин на момент первоначальной диагностики EIN. Диагностические, номенклатурные и терапевтические различия между этими процессами проецируются в схему диагностики EIN, которая описана ниже.Это призвано заменить, а не дополнить старую классификацию, основанную на стандартах ВОЗ по гиперплазии 1994 года. Применение новых диагностических критериев, которые не были частью описаний ВОЗ 1994 г., препятствует абсолютному соответствию между старой и новой системами. Ниже мы рассматриваем расширенную базу данных для пересмотренных критериев и резюмируем стратегии диагностической реализации.
Рис. 1. Топография гормональных и опухолевых заболеваний эндометрия. Распространенные по всему полю эндометриальные эффекты беспрепятственных эстрогенов при доброкачественной гиперплазии эндометрия случайным образом разбросаны по компартменту эндометрия и включают кисты и локально изменяющуюся плотность желез.Поражения EIN возникают в результате локальной пролиферации генетически мутировавших желез, которые характеризуются измененной цитологией и площадью железы, превышающей площадь стромы. Аденокарцинома имеет аналогичное клональное происхождение (часто в пределах уже существующего поражения EIN), но с твердой, решетчатой или лабиринтной архитектурой. Со временем поражения EIN и аденокарциномы могут расширяться, занимая весь компартмент эндометрия, и, таким образом, больше не сохраняют свой прежний локализационный характер.
Предраковые заболевания эндометрия сначала были идентифицированы как предраковые поражения в силу их временной и пространственной связи с раком в больших группах пациентов.Из всех женщин с атипичной ГГ 25% страдают аденокарциномой при гистерэктомии. 14 Хотя эти стратегии в целом были успешными в определении широких классов морфологических поражений, наиболее вероятно связанных с раком, клинические результаты очень нечувствительны к выявлению предраковых состояний. Низкая эффективность прогрессирования от предрака к раку предсказывает, что большинство предраковых поражений никогда не будут иметь злокачественной конечной точки. Дальнейшие трудности в стандартизации диагностики предраков эндометрия возникают из-за плохой воспроизводимости патологами гистопатологических критериев, используемых для классификации поражений. 15 Эта ситуация подтолкнула к разработке новых диагностических стратегий, применимых к пораженным тканям отдельных пациентов, которые способны точно различать биологические предраковые и непредраковые состояния. Даже если бы такой лабораторный подход был непрактичным для повседневного использования, он стал бы мощным инструментом для критической оценки и уточнения современных методов гистологической диагностики.
Рис. 2. Взгляд патолога на многоступенчатый канцерогенез.Инициирование канцерогенеза сопровождается клональной экспансией мутировавшей клетки, которая впоследствии подвергается дополнительной мутации с образованием новых субклонов со злокачественным поведением. Клональная экспансия мутировавших клеток на каждом этапе — это то, что создает достаточную нагрузку на аномальные железы, чтобы ее мог увидеть патолог.
Моноклональный рост и мутация генов-супрессоров опухоли — это измеримые признаки предраковой фазы онкогенеза эндометрия, которые можно напрямую установить в парафиновых тканях и сопоставить с гистологией в каждом конкретном случае.Идея о том, что предраковые клетки эндометрия являются моноклональными продуктами пролиферации одной трансформированной клетки, основана на многоступенчатой модели онкогенеза 16 , в которой прогрессирование управляется последовательно приобретенными мутациями, проявляющимися в изменении морфологии и возрастающей агрессивности. Хотя на начальных стадиях может не быть инвазивного фенотипа, предполагается, что предраковые поражения обладают достаточным преимуществом в росте по сравнению с исходными тканями, поскольку они разрастаются моноклонально. В настоящее время было показано, что это расширение имеет место для предполагаемых предраков эндометрия с использованием различных молекулярно-генетических методологий на основе полимеразной цепной реакции, применяемых к ДНК, выделенной из целевых областей парафиновых срезов: неслучайная инактивация Х-хромосомы, 17 клональное размножение измененных микросателлитов в микросателлитно-нестабильных тканях, 18 и клональное размножение приобретенных мутаций генов-супрессоров опухолей, таких как K- ras 18 и PTEN . 19 Моноклональный рост, по-видимому, является одним из семенных качеств предраковых тканей на различных участках, включая слизистую оболочку полости рта, шейку матки, кожу, желудок и вульву.
Ранние стадии канцерогенеза характеризуются преимуществами постепенного роста, которые обязательно незначительны по сравнению с нормальными тканями и чрезвычайно чувствительны к изменениям окружающей среды. Гормонально-опосредованный отбор 20 латентно трансформированных клонов является одним из механизмов, который может связывать генетические и эндокринные события в генезе этого заболевания.Этот отбор может происходить за счет изменений скорости пролиферации предраковых клонов или ремоделирования прилегающих нормальных тканей. В случае предраковых заболеваний, ограниченных функционалом, стойкость усиливается за счет отсутствия регулярного выделения (ановуляции). Выделение также является ключевой частью прогестиновой терапии предраковых состояний, потому что пациенты, которым перед кровотечением отмены делают биопсию, часто имеют стойкие поражения, хотя и с измененной цитологией. По этой причине повторную биопсию для подтверждения предраковой аблации постпрогестина лучше всего выполнять после кровотечения отмены, чтобы в полной мере реализовать преимущества выделения и избежать мешающего воздействия прогестинов на интерпретацию гистопатологии.
Множественные маркерные системы (инактивация X, новые микросателлиты), используемые вместе, обладают примерно 80% чувствительностью при обнаружении моноклональных предраковых состояний из парафиновых срезов, что является значительным улучшением по сравнению с 25% чувствительностью обнаружения предрака, реализуемой при использовании клинического стандарта прогрессирования до карциномы. В случаях, когда действительно имеется ассоциированная карцинома, сохранение приобретенных генетических изменений между совпадающими предраковыми и злокачественными тканями обеспечивает высокоспецифичную основу для вывода об эволюции от первого ко второму.Детальная реконструкция клонов, включая иерархическое упорядочение шагов от предрака к раку, была выполнена в тех случаях, когда репертуар информативных генетических маркеров достаточно богат. 18 Высокая стоимость и техническая сложность делают молекулярно-генетический лабораторный стандарт диагностики предрака вне досягаемости рутинной диагностики.
Рис. 3. Легкое действие эстрогена. Нарушенный пролиферативный эндометрий имеет разбросанные кистозно расширенные железы, но в целом их низкая плотность.Беспорядочно расположенные железы могут иметь трубную метаплазию, а фибриновые тромбы могут вызывать микроинфаркты с симптоматическим кровотечением.
Рис. 4. Умеренный эффект эстрогена. Доброкачественная гиперплазия эндометрия. При дополнительной продолжительности воздействия эстрогена ремоделирование и расширение железы может привести к более высокой плотности железы в целом. Хотя это тот же основной процесс, что и менее серьезное нарушение пролиферативного эндометрия, это пример доброкачественной гиперплазии эндометрия.Скученные железы не претерпели согласованных цитологических изменений.
Рис. 5. A. Локализованное поражение EIN. Плотный кластер цитологически измененных желез включает поражение EIN на этом ориентированном участке. Остаточные нормальные железы видны на правой стороне эндометрия.
Рис. 5. B. Деталь локализованного поражения EIN, показанного на рисунке 5A. Обратите внимание на изменение цитологии опухолевых желез (слева) и фонового эндометрия (справа).
Рис. 6. Аденокарцинома эндометрия, эндометриоидного типа, хорошо дифференцированная. В отличие от поражения EIN, описанного выше, железы больше не видны по отдельности, а расположены в виде складчатых виллогландулярных листов.
Рис. 7. Ребристые железы при хорошо дифференцированной карциноме эндометрия.
Тщательное гистопатологическое исследование генотипически установленных предраков эндометрия объясняет предшествующие проблемы в диагностике и дает конкретные указания по улучшению. 21 Тесная корреляция между гистопатологией и генотипом возможна путем выделения ДНК из очерченных областей парафинового среза, который также доступен в виде серийно срезов окрашенных слайдов. Эпителиальная дифференцировка моноклональных предраков обычно эндометриоидна, но могут присутствовать очаги плоскоклеточной, муцинозной и трубной дифференцировки. Изменения гормональной среды, например введение прогестерона, могут снизить степень цитологической атипии. Хотя большинство генетических предраков диагностируется как атипичная ГГ, плохая воспроизводимость этого диагноза ставит под угрозу последовательное ведение и повышает вероятность того, что существующие диагностические критерии неадекватны.Особым пробелом в диагностике предрака было отсутствие информативных архитектурных критериев. Компьютеризированный морфометрический анализ моноклональных предраков эндометрия, 21 с использованием алгоритмов, которые ранее были показаны для прогнозирования соответствующих клинических исходов одновременной 22 или будущей 23 аденокарциномы эндометрия, вышел из этого тупика. Когда цитологически измененные железы эндометрия становятся настолько переполненными, что составляют более половины срезанной поверхности, они предсказывают моноклональность с чувствительностью и специфичностью, по крайней мере, равной клинической оценке опытных гинекологических патологов узкой специализации. 21 Абсолютный вид цитологии EIN сильно варьируется между отдельными примерами, и не все имеют вид округлых ядер с выступающими ядрышками, что является классическим определением атипии в этой ткани. Однако согласованно то, что переполненные железы поражения EIN всегда имеют измененную цитологию по сравнению с фоновым эндометрием у одного и того же пациента. Относительный внутренний, а не абсолютный фиксированный стандарт для распознавания измененной цитологии является общим признаком предракового заболевания эндометрия и ЭИН.Размер является важным фактором при оценке локализованного поражения, такого как возникающий EIN. Порог клинической значимости — это когда скученный очаг (области с площадью железы, превышающей площадь стромы) цитологически измененных желез достигает максимального размера более 1 мм в пределах одного фрагмента. Более мелкие поражения не обязательно связаны с повышенным риском рака и не должны диагностироваться как EIN.
Внедрение пересмотренных диагностических критериев — сложный процесс, который нельзя полностью описать здесь.Подробные методы рутинной гистопатологической диагностики EIN доступны в нескольких специализированных текстах по гинекологической патологии 24 25 и на сайте www.endometrium.org.
Термин внутриэпителиальная неоплазия эндометрия точно описывает предраковые состояния эндометрия, поскольку моноклональное происхождение от одной трансформированной клетки является патогномоничным признаком всех новообразований. Превосходная производительность компьютеризированного морфометрического анализа при классификации всех генетически 21 и клинически 23 определенных предраков в одну группу подтверждает возможность использования рутинных срезов тканей, окрашенных гематоксилином и эозином, для определения единственной категории предраков.Компьютеризированный морфометрический анализ недоступен для большинства практик, но практикующие патологи могут имитировать его работу 26 , применяя диагностические критерии, указанные в таблице 1.
Таблица 1. Функциональная классификация эффекта эстрогена, предраковых и злокачественных заболеваний эндометрия 27
0019000000000000000000 918 918 918918 918 918 2 918
918Изменения в масштабах всего поляНоменклатура | Критерии | Функциональная категория | Менеджмент | |||||||
| 82Нерегулярные железы с кистами | Эффект эстрогена | Гормональная терапия | ||||||||
| и | ||||||||||
и | ||||||||||
3. Отсутствие цитологических изменений | ||||||||||
| и | ||||||||||
Внутриэпителиальная неоплазия эндометрия (EIN) | 1. Цитологические изменения | Предраковые заболевания | Предраковые заболевания | 9000 918 918 9000 918 918 918 918 9000 918 918 918 9000 918 918 918 918 9000 918 918 918 918 918 9000 918 918 918 918 9000 918 918 918 918 918 | ||||||
2. Железа превышает площадь стромы | ||||||||||
| и | .Размер> 1 мм в одном фрагменте | |||||||||
| и | ||||||||||
| 4. Исключение миметиков | ||||||||||
| 5. Исключение карциномы | ||||||||||
Аденокарцинома | 1. Миоинвазия | Рак | или радиотерапия | или радиотерапия | ||||||
2.Сплошной эпителий | ||||||||||
или | ||||||||||
3. Лабиринтоподобные железы | ||||||||||
| 4. Архитектура Cribriform |
Классификация заболеваний эндометрия на основе биологии поражения направлена на то, чтобы объединить все предраковые образования в одну группу (EIN) и в отличие от взаимоисключающих субъектов, относящихся к разному ведению. параметры.Введение уточненных диагностических критериев предрака, таких как процентный объем стромы (VPS) 22 , 28 (эта функция срезов ткани, занятой стромой), может улучшить гистопатологическое разрешение между доброкачественными ановуляторными (BEH) и предраковыми (EIN) ) болезнь.
В настоящее время проводится несколько крупных исследований клинических исходов, в которых излагаются клинические исходы пациентов с диагнозом ЭИН. Высокий уровень сопутствующей скрытой карциномы у женщин с диагнозом ЭИН при биопсии.В большом исследовании GOG, в котором 153 женщинам с EIN была проведена гистерэктомия, у 36% (56) была обнаружена карцинома. 29 Это согласуется с ретроспективным обзором патологии 11 , в котором у 39% женщин с диагнозом ЭИН развилась аденокарцинома в течение первого года. В дополнение к этой высокой частоте сопутствующей аденокарциномы, которая не очевидна при первичной биопсии, содержащей EIN, существует 45-кратное увеличение риска развития карциномы после первого года. 11
Рис.8. Раковые исходы EIN. В общей сложности 674 пациента с различными формами гиперплазии эндометрия были переклассифицированы как EIN (красный) или доброкачественная гиперплазия эндометрия (синий) и наблюдались в среднем более 5 лет. Кривая показывает долю каждой группы, у которой не было рака в течение периода наблюдения. Обратите внимание на очень низкую заболеваемость раком (2/446 случаев) в группе доброкачественной гиперплазии по сравнению с таковой в группе EIN (65/228). Хотя многие виды рака возникли вскоре после постановки диагноза EIN и, таким образом, могут быть истолкованы как сопутствующие, прогрессирование до карциномы продолжалось в течение нескольких лет после этого.(Изменено из Baak et al. Cancer 2005; 103 (11): 2304.)
Относительно низкий риск доброкачественной гиперплазии эндометрия по сравнению с EIN очевиден в исследовании более 600 женщин с различными «гиперплазиями эндометрия». которые были разделены на EIN и доброкачественные (обычно эффект эстрогена или последовательность доброкачественной гиперплазии эндометрия). Результаты, показанные на рисунке, указывают на очень высокую отрицательную прогностическую ценность отсутствия исходов рака у женщин с доброкачественной гиперплазией эндометрия.
Клиническое ведение ЭИН аналогично тому, что ранее применялось при диагностике атипичной гиперплазии эндометрия. В США это обычно гистерэктомия. Существует клиническая потребность в нехирургических альтернативных методах лечения женщин, которые хотят сохранить фертильность или не подходят для хирургических вмешательств, но данных о клинических исследованиях по этому вопросу мало. Терапия высокими дозами прогестина может успешно устранить некоторые поражения EIN, но из-за высокой одновременной частоты рака и непредсказуемого ответа она должна сопровождаться тщательным клиническим наблюдением.
НАСЕЛЕНИЕ ПОД РИСКОМ
Большинство пациентов (75%) с раком эндометрия имеют постменопаузальное кровотечение; однако только 10% женщин с кровотечением в постменопаузе имеют карциному эндометрия. 28 Остальные женщины с кровотечением в постменопаузе имеют атрофический или неактивный эндометрий или доброкачественные состояния эндометрия, такие как полипы. Клиническая прогностическая модель, предложенная Фельдманом и его коллегами 30 (т. Е. Возраст 70 лет и старше, диабет, нерожание и состояние в постменопаузе), недостаточно предсказуема, чтобы различать женщин с перименопаузальным или постменопаузальным кровотечением при низком и высоком риске карциномы эндометрия. . 31 Традиционные индикаторы риска, связанные с EIN / карциномой, показаны в Таблице 2. Большинство индикаторов связаны с эстрогенами либо из эндогенных, либо из экзогенных источников. У женщин с этими факторами риска относительный риск развития карциномы составляет 1,2–35. 32 Опыт также показывает, что значительная часть пациентов не имеет этих показателей риска, но у них развивается карцинома эндометрия. В этих случаях заболевание либо не связано с гормонами, либо гиперэстрогенизм метаболически не проявляется.Согласно обзору литературы, 74% пациентов с аденокарциномой эндометрия не страдали ожирением, 58% не были первородящими, 22% пережили менопаузу в возрасте до 49 лет и 43–89% не подвергались заместительной гормональной терапии (ЗГТ). 33 Похоже, что единственный постоянный показатель риска карциномы эндометрия — это возраст. У женщин в возрасте 65 лет и старше рак эндометрия обычно агрессивен и имеет высокий уровень смертности (75%) по сравнению с этим (15%) в более молодой возрастной группе с гормональным раком. 34
Таблица 2. Индикаторы риска рака эндометрия и его предшественников
Возраст ≥60 лет
Ожирение (с типом жировой ткани в верхней части тела) *
Заместительная терапия только эстрогенами
Предыдущий рак груди
Терапия тамоксифеном для груди рак
Хроническая болезнь печени
Бесплодие
Низкая четность
Хроническая ановуляция (поликистоз яичников, эстроген-секретирующая строма яичников или опухоли)
* С диабетом и гипертонией или без них.
СКРИНИНГ И ДИАГНОСТИКА
В случае рака эндометрия текущий консенсус среди экспертов в области периодических медицинских осмотров состоит в том, чтобы не рекомендовать скрининг на рак эндометрия и его предшественников, поскольку нет научных доказательств в поддержку таких обследований в период менопаузы и женщины в постменопаузе. 35 Аргументы против скрининга на рак эндометрия следующие:
- Несмотря на то, что карцинома эндометрия является обычным явлением, показатели заболеваемости низкие, сравнительно менее значимые по количеству, чем рак груди, рак толстой кишки, рак легких, лейкемия, лимфома, рак головного мозга, карцинома поджелудочной железы и карцинома яичников.
- Исходя из частоты рака эндометрия у бессимптомных женщин, потребуется около 1000 процедур для выявления единственного случая карциномы или ее предшественника, атипичной гиперплазии (АГ). 36 , 37
- Методы, доступные для диагностики заболеваний эндометрия у бессимптомных женщин, страдают от ошибок в интерпретации или инструментарии. Одна из них — сложность интерпретации относительно недорогого цитологического материала; 38 другое заключается в том, что методы аспирации офисной биопсии относительно дороги и от неудобных до болезненных, а количество тканей, недостаточных для диагностики, может составлять 25%.
- Контролируемых рандомизированных исследований для оценки эффективности скрининга рака эндометрия не проводилось. Даже у женщин из группы высокого риска в менопаузе скрининг выявляет только 50% всех случаев рака эндометрия. 39
- У большинства пациентов заболевание в конечном итоге становится симптоматическим (т. Е. С аномальным маточным кровотечением, но на момент хирургической диагностики и лечения заболевание имеет раннюю клиническую стадию). Это утверждение подтверждается превосходной 5-летней выживаемостью пациентов с карциномой эндометрия I стадии (т.е., 80–91%). 40 Клинико-патологические и эпидемиологические данные показывают, что около 80% карцином эндометрия медленно растут с благоприятным течением, 34 и более раннее лечение бессимптомных карцином не будет более эффективным, чем лечение, проводимое при появлении симптомов.
- Пожилых людей трудно записать в программы скрининга, и процент отсева относительно высок. Это особенно верно, если для оценки эндометрия используются болезненные методы.
- Заболеваемость карциномой эндометрия и ее предшественниками низкая у женщин в возрасте до 50 лет и у женщин, получающих ЗГТ комбинированного типа (эстроген / прогестины). 32
Скрининг рака эндометрия или его предшественника, EIN, у бессимптомных женщин в постменопаузе в настоящее время не рекомендуется из-за низкой заболеваемости раком эндометрия в этой группе женщин, оцениваемой в 1,7 случая на 1000 женщин в год. и низкая распространенность — порядка 1 на 1000 женщин. 36 В исследовании «Вмешательство эстроген / прогестин в постменопаузе» (PEPI) ни у одного пациента не развился карцинома эндометрия при ежедневной заместительной терапии только эстрогенами в дозе 0,625 мг в течение 36 месяцев по сравнению с 1% женщин, у которых развился рак эндометрия. плацебо. 41 Средний возраст женщин с ЭИН составляет 52 года, что примерно на 8 лет раньше, чем средний возраст 60 лет для эндометриоидной аденокарциномы эндометрия в той же популяции пациентов. 42 Интервал прогрессирования от EIN до аденокарциномы можно более точно оценить у отдельных пациентов, которые проходят длительное наблюдение после постановки диагноза EIN.После исключения пациентов с сопутствующей аденокарциномой (определяемой как рак, обнаруженный в течение первого года наблюдения), средний интервал до диагностики аденокарциномы составляет 4 года. 11
Кого следует обследовать?
Женщинам, принимающим эстрогены без противодействия, необходимо брать образцы эндометрия один раз в 2 года (относительный риск увеличивается только после 2 лет применения эстрогенов), особенно если гиперстимуляция эндометрия была документально подтверждена ранее и не лечилась кратковременным введением прогестинов.Кроме того, если информированный человек из группы высокого риска запрашивает оценку эндометрия до или во время ЗГТ или в любое время во время ее периодических медицинских осмотров, ее не следует лишать офисной процедуры расследования, чтобы исключить патологию эндометрия. Оценка эндометрия также должна проводиться у женщин с высоким риском карциномы эндометрия, таких как женщины с синдромом Линча II в анамнезе. 43
Термин «диагноз », в отличие от скрининга , относится к применению теста к женщинам с симптомами (чаще всего патологическими кровянистыми выделениями или кровотечениями), которые предположительно связаны с карциномой эндометрия или его предшественниками.В исследовании рассматривалась оптимальная стратегия оценки для пациентов с первым периодом постменопаузального кровотечения с различным риском карциномы эндометрия и АГ. 44 Среди четырех вариантов — офисная биопсия эндометрия, дилатация и выскабливание (D&C), гистерэктомия и только наблюдение (если кровотечение не повторяется) — офисная биопсия с использованием техники Vabra была наиболее экономически эффективным начальным средством, стоившим менее 41 000 долларов США за штуку. год жизни, сохраненный для пациентов с 10% -ным риском развития рака эндометрия или АГ.Однако для пациентов с 5% -ным риском стоимость биопсии эндометрия увеличилась до 66 000 долларов США в год дополнительной сохраненной жизни для 60-летних пациентов. Ни D&C, ни гистерэктомия не были столь же рентабельны, как офисная биопсия, как процедура первоначальной диагностической оценки у пациентов с любым риском карциномы / АГ и аномального маточного кровотечения. Основываясь на этой модели анализа решений, возраст пациента и риск карциномы эндометрия / АГ кажутся важными детерминантами для использования данного метода оценки эндометрия.
Методы скрининга и диагностики
В настоящее время существует семь методов оценки эндометрия: цитология шейки матки / влагалища, цитология эндометрия, биопсия эндометрия, трансвагинальное ультразвуковое исследование (TVUS), магнитно-резонансная томография, гистероскопия и D&C.
ЦЕРВИКАЛЬНАЯ / ВАГИНАЛЬНАЯ ЦИТОЛОГИЯ
Основными недостатками этого метода являются то, что он выявляет в основном запущенную карциному эндометрия и имеет высокий уровень ложноотрицательных результатов (80%) у пациентов с бессимптомным раком эндометрия в постменопаузе.В одном исследовании отношение шансов карциномы эндометрия у женщин в постменопаузе с симптомами было в три раза больше в присутствии гистиоцитов с фагоцитозом острых воспалительных и красных кровяных телец по сравнению с контрольной группой. 45 Гистиоциты сами по себе не смогли предсказать ни карциному эндометрия, ни гиперплазию. Клетки эндометрия в мазках из шейки матки имели четырехкратное отношение шансов для ГЭ. Цитологическое исследование влагалища может выявить рецидив рака у женщин, леченных от рака эндометрия. Поскольку риск рецидива карциномы эндометрия (11-17%) и осложнений дополнительной лучевой терапии (70%) наиболее высок в течение первых 3 послеоперационных лет, а также потому, что у большинства пациентов рецидив является симптоматическим и лишь немногие выживают после рецидива заболевания, ежегодное наблюдение достаточно обследования, включающего цитологическое исследование влагалища. 40
Принято считать, что наилучший результат достигается при тестировании непосредственно на слизистой оболочке эндометрия. 38 На рынке имеется множество пробоотборников клеток эндометрия. Большинство из них получают образцы клеток путем чистки или аспирации поверхностной слизистой оболочки эндометрия (Таблица 3). Все пробоотборники клеток эндометрия использовались в экспериментальных условиях; результаты по частоте обнаружения не отражают уровень обнаружения в целом. Тем не менее, если цитологическая атипия является единственным признаком, который следует искать, цитологический анализ эндометрия может с высокой точностью отличить карциному от нормальной или гиперплазии без цитологической атипии (рис.9). В одном исследовании цитология эндометрия с использованием пластиковых щеток дала 79% чувствительности, 95,4% специфичности и 80,5% отрицательной прогностической ценности. 46 Если мазок содержит нормальные клетки эндометрия, у пациентки может быть нормальная или гиперпластическая слизистая оболочка матки. Часто гиперплазия без цитологической атипии неотличима от нормального пролиферативного эндометрия. Однако, поскольку эта форма гиперплазии не является предшественником карциномы, пациентов с такими симптомами, как маточное кровотечение, можно лечить консервативно.Большинству цитологических лабораторий не хватает опыта, чтобы отличить цитологическую атипию, связанную с неоплазией, от атипии, связанной с дегенерацией или восстановлением. В результате количество ложноположительных результатов может быть слишком высоким, чтобы оправдать рутинное использование цитологии при заболеваниях эндометрия. Кроме того, скрининг мазка эндометрия занимает много времени, а его интерпретация затруднена из-за сложности морфологии клеток эндометрия. Многие имитаторы карциномы приводят к ложноположительным результатам. 37 , 38
Таблица 3.Точность цитологических методов эндометрия для обнаружения новообразований *
Метод | Диагностическая точность † (%) | 16a † |
Чистка щеткой (Endo-Pap, Gynecyte, Endocyte, Endoscan) | 91–100 | 4–10 |
Образец аспирации (Isaacs Cell) | 96–100 | 10–12 |
* Подтверждено гистологически.
† Включая рак и атипичную гиперплазию.
† У женщин в постменопаузе.
Фиг.9 . Цитология эндометрия, полученная путем аспирации эндометрия. A. Гиперпластические клетки эндометрия с регулярной цитологической структурой неотличимы от нормальных клеток эндометрия пролиферативной фазы цикла. B. Атипичные клетки эндометрия с плеоморфными, гиперхроматическими ядрами и макронуклеолами.Этот пациент с ожирением не имел симптомов и имел хорошо дифференцированную инвазивную аденокарциному на стадии 1A по классификации FIGO.
ГИСТОЛОГИЧЕСКИЕ МЕТОДЫ
В настоящее время забор гистологических образцов является лучшим методом диагностики бессимптомной или симптоматической (патологическое маточное кровотечение) неоплазии эндометрия. Пластиковые одноразовые или металлические устройства многоразового использования, использующие чистку щеткой, аспирационную биопсию, аспирационный кюретаж или инсультную биопсию, использовались с такой же высокой диагностической точностью (Таблица 4). 38 Недостатки гистологических методов заключаются в их относительно высокой стоимости и степени дискомфорта.Последнее приводит к низким показателям соответствия повторным испытаниям. Обычное выскабливание слишком дорого, но не на 100% надежно с точки зрения диагностической точности. 47 Согласно текущему опыту, включая наш собственный, эндометриальные устройства, которые кажутся наиболее рентабельными и вызывают наименьший дискомфорт для пациентов, — это аспираторы эндометрия. 38 В случаях, когда ткань не получается с помощью одного из аспираторов аспирационного типа с низким вакуумом, особенно у пожилых женщин в постменопаузе, эндометрий которых чаще всего атрофирован, используют аспираторы с мощной вакуумной силой всасывания (например, у пожилых женщин в постменопаузе с атрофическим эндометрием).г., аспиратор Vabra; Тис-у-ловушка; или четырехтактная кюретка для биопсии с острым лезвием) обеспечивают диагностические ткани.
Таблица 4. Точность гистологических методов эндометрия для диагностики новообразований
918918 918 918 918 918 918 918 918 918 918 918 Конец
| Метод | Диагностическая точность * (%) | Тканевая недостаточность |
| Аспирация | ||
| Пипелле | 95–98 | 9 |
| Эндоэлемент | 95–98 | 11 |
| Пробоотборник клеток Isaacs | 95–98 | 30 |
| Pistolette | 95–98 | 13 |
| 100 | 36 | |
| Биопсия 918 00 | ||
| Кеворкян | 97 | 10 |
| Прочие |
* Включая карциному и интраэпителиальную опухоль эндометрия.
† У женщин в постменопаузе.
Хотя некоторые врачи успешно использовали щетки для эндометрия, такие как Gynecyte (Looper Surgical, Inc; европейская версия Endocyte), для цитологического исследования эндометрия, большинство из них предпочитают брать образцы эндометрия для гистологии. Наиболее часто используемым инструментом является трубка эндометрия (Sepal, Бостон, Массачусетс) (рис.10 и 11) и, при необходимости, кюретка Кеворкяна (EuroMed, Redmond, WA) (см. Рис. женщины с симптомами риска рака эндометрия и его предшественников. 38 Примерно у 10% женщин в постменопаузе полость эндометрия трудно или невозможно проникнуть из-за тяжелого стеноза внешнего / внутреннего зева или из-за спазма внутреннего зева. В этих случаях назначение пациента на последовательную циклическую терапию конъюгированными эстрогенами (Премарин) (0,625 мг в течение 25 дней) и медроксипрогестероном (Провера) (5 мг в течение 11–12 дней) в течение 3 месяцев подряд часто приводит к адекватному расширению наружного / внутренний зев для проникновения в полость эндометрия.Другой альтернативой является выполнение ТВУЗИ и оценка толщины эндометрия (см. Трансвагинальное УЗИ ниже). Наконец, тракция матки с помощью эндоцервикального зажима Эммета или кожного (радужного) крючка (см. Рис. 10) значительно помогает при входе в полость эндометрия в офисе. Если используется аспиратор для эндометрия типа Pipelle, важно перемещать и вращать канюлю под действием всасывающей силы отрицательного воздействия в полости эндометрия как минимум шесть раз, чтобы взять образец самой большой площади поверхности эндометрия.При сравнении Pipelle с аспиратором Vabra процент слизистой оболочки поверхности эндометрия, взятой с помощью Pipelle, составил 4,2% по сравнению с 42% с аспиратором Vabra и 60% с D&C под общей анестезией. 48 Разница в процентах отобранной площади, вероятно, связана со сравнительно большей силой всасывания у Vabra, чем у Pipelle.
Рис. 10. Аспираторы эндометрия и кюретка. Pipelle, Z-sampler (BEI / Zinnanti, Chatsworth, CA), Uterobrush (Medscand USA, Голливуд, Флорида), Endocell и кюретка Кеворкяна без корзин (вверху).Emmet tenaculum и крючок для радужки (Cooper Surgical, Shelton, CT) для тракции матки (внизу).
Рис. 11. Endometrial Pipelle. Гибкая полипропиленовая аспирационная канюля с внешней оболочкой длиной 24 см, шириной 3 мм и мелкокалибровым поршнем (вверху). Подробный вид 2,5-мм дистального бокового порта, через который аспирируется образец (внизу).
Отбор образцов для гистологии: пошаговое руководство
- Дважды исследуйте матку, чтобы определить ее положение.
- Очистите шейку матки и влагалище уксусной кислотой или другим асептическим раствором.
- Вставьте зажим Эммета или крючок радужки (см. Рис. 10) во внешнюю треть эндоцервикального канала и осторожно потяните, чтобы добиться тракции матки.
- Вставьте эндометриальный аспиратор в эндоцервикальный канал (см. Рис. 10 и 11). Когда аспиратор находится на уровне нижнего сегмента матки, нажмите и поверните его, чтобы облегчить проникновение в полость эндометрия.
- Когда он находится на дне, быстро и полностью втяните поршень обратно в канюлю, чтобы создать высокий градиент отрицательного давления.
- Переместите канюлю назад и вперед 6–12 раз в полости эндометрия и одновременно поверните ее.
- Удалите канюлю с отведенным назад поршнем (сохранение всасывания) из полости эндометрия. Опустошите материал на бумаге для линз, протолкнув поршень вперед, и поместите его в фиксатор ткани с 10% забуференным формалином.
Если получено мало ткани или совсем нет ткани, процедуру можно повторить один раз. Если ткань по-прежнему не получена, забор эндометрия можно выполнить с помощью либо Vabra, либо других мощных аспираторов, либо металлической кюретки (см.рис.10). Если по-прежнему нет ткани и матка мала, можно предположить атрофию эндометрия или наличие фиброзных полипов на ножке. Если у пациента есть симптомы, может быть проведена трансвагинальная сонография или гистероскопия.
В настоящее время стадия рака эндометрия хирургическая (гистерэктомия, двусторонняя сальпингоофорэктомия и биопсия тазового узла) 49 и включает гистологическую оценку инвазии слизистой оболочки шейки матки (стадия Международной федерации гинекологии и акушерства [FIGO] IIA) по сравнению со стромой (стадия IIB по FIGO) в образце гистерэктомии.В результате больше не требуется предоперационная оценка эндоцервикального канала. Исключением из правил является более молодая женщина в пременопаузе, у которой фракционный анализ матки может определить, есть ли у пациентки эндоцервикальная или первичная опухоль эндометрия. 50 , 51
ТРАНСВАГИНАЛЬНАЯ УЛЬТРАЗОНОГРАФИЯ
TVUS позволяет визуализировать эндометрий на мониторе, когда датчик с частотой 5 МГц помещается напротив свода влагалища. Толщина эндометрия может быть измерена с высокой точностью, поскольку соединение эндометриомиометрия имеет отчетливый ореол (рис.12). TVUS очень чувствителен, но также имеет высокий уровень ложноположительных результатов (низкая специфичность) для выявления рака эндометрия. Исследования показали, что специфичность может быть улучшена без ущерба для показателей чувствительности, если пороговые значения были основаны на продолжительности времени после менопаузы. 46 Когда толщина эндометрия составляет 4 мм для женщин менее 5 лет после менопаузы и 3 мм для женщин более 5 лет после менопаузы, TVUS имеет чувствительность 97,4%, специфичность 75,7% и отрицательную прогностическую ценность 99,7%.Что касается TVUS, точки отсечки для минимальной толщины варьировались от страны к стране. Однако существует консенсус, что средняя двойная толщина эндометрия в случаях гиперплазии / карциномы эндометрия значительно больше, чем у пациентов без таких поражений. В США рекомендуемый нижний предел обнаружения рака эндометрия составляет 4 или 5 мм, а при 3 мм биопсия эндометрия не требуется. 50 , 51
Рис.12. Трансвагинальное УЗИ матки. Обратите внимание на атрофическую слизистую оболочку эндометрия (стрелка).
МАГНИТНО-РЕЗОНАНСНАЯ ВИДЕО диагностика рака эндометрия и его предшественников. 52 Его роль в первичной диагностике рака эндометрия и его предшественников еще предстоит определить.
ГИСТЕРОСКОПИЯ
Значение гистероскопии в диагностике и направленной биопсии различных внутриполостных или эндометриальных поражений у женщин с постменопаузальным кровотечением широко подтверждено документами. Если при аспирационном выскабливании получается недостаточное количество ткани или если у пациента продолжается аномальное кровотечение, часто рекомендуется формальный D&C, несмотря на то, что его превосходство над офисными процедурами в диагностике рака не установлено. 47
Абсолютных показаний к гистероскопии не установлено.Однако при наличии возможности гистероскопия показана любой женщине с аномальным маточным кровотечением, у которой есть подозрение на внутриутробную аномалию (рис. 13). Другие показания включают повторяющиеся выкидыши, бесплодие, вызванное патологией эндометрия, удаление ретинированной внутриматочной спирали и подозрение на подслизистую лейомиому перед абдоминальной миомэктомией. Гистероскопия противопоказана при наличии активной инфекции и внутриутробной беременности. Активное кровотечение является относительным противопоказанием к офисной гистероскопии только потому, что кровь мешает зрению, если углекислый газ используется в качестве расширяющей среды.У пациентов с серьезными проблемами со здоровьем целесообразно проводить гистероскопию в амбулаторных условиях, где доступны все возможности для наблюдения и реанимации.
Рис. 13. Гистероскоп с источником света (слева) и инсуффлятором (справа).
РАСШИРЕНИЕ И ВЫКЛЮЧЕНИЕ
D&C было заменено офисной биопсией эндометрия с использованием гибких аспирационных устройств. Последнее более рентабельно, чем D&C, и диагностическая ценность у женщин с симптомами и бессимптомными аналогична D&C с показателями чувствительности и специфичности 90% и 95%. 38 Стеноз шейки матки препятствует успешному забору эндометрия примерно в 10% случаев.
ЛОЖНО-ОТРИЦАТЕЛЬНАЯ ГИСТОЛОГИЯ
Даже прямой забор эндометрия для гистологии может не выявить аденокарциному. В нескольких исследованиях D&C под общей анестезией пропустила 10% карцином эндометрия. 38 , 47 Это неудивительно, поскольку, как было сказано ранее, только 60% средней площади поверхности отбирается с помощью D&C по сравнению с 40% для кюретажа Vabra и 4% для биопсии эндометрия с помощью аспиратора для эндометрия Pipelle. 48 Другие обнаружили четырех из 86 (4,6%) женщин с постменопаузальным кровотечением и карциномой эндометрия, у которых был либо отрицательный результат биопсии эндометрия, либо D&C в течение 2 лет до постановки диагноза рака. 53 В другом исследовании, проведенном в Австралии, 54 частота ложноотрицательных результатов биопсии эндометрия очаговых аденокарцином эндометрия составила 47%.
ЛЕЧЕНИЕ ДОБРОЧНОЙ ЭНДОМЕТРИАЛЬНОЙ ГИПЕРПЛАЗИИ И EIN
Лечение зависит от того, является ли основное заболевание преимущественно гормональным (доброкачественная гиперплазия эндометрия) или внутренним предраковым заболеванием (EIN).Выбор хирургической или гормональной терапии зависит от гистопатологического диагноза, репродуктивного статуса женщины, получает ли пациентка заместительную терапию только эстрогенами и ее общее состояние здоровья. В целом, EIN управляется с использованием алгоритмов, которые были ранее разработаны для лечения атипичной гиперплазии эндометрия и доброкачественной гиперплазии эндометрия с использованием алгоритмов, ранее использовавшихся для неатипичных гиперплазий. Высокий риск рака, связанный с диагнозом EIN, включая 36% случаев скрытой карциномы, из которых одна треть является миоинвазивной, необходимо тщательно учитывать при выборе подходящей терапии. 55 Хотя некоторые случаи EIN / ранней внутрислизистой аденокарциномы реагируют на экзогенные гестагены, индукторы овуляции или и то, и другое, в большинстве случаев поражения имеют тенденцию повторяться в течение от нескольких месяцев до нескольких лет после рождения новорожденного. Медицинская гормональная терапия также назначается женщинам, у которых общее состояние здоровья не подходит для хирургического вмешательства.
Доброкачественная гиперплазия эндометрия хорошо поддается лечению медроксипрогестерона ацетатом (MPA), 10 мг перорально, или микронизированным прогестероном, 300 мг перорально, один раз в день в течение 14 дней в месяц в течение 3 месяцев.Такие циклические режимы приводят к кровотечению отмены; образец биопсии берется по окончании прогестиновой терапии через 3–4 месяца. Пациенты с полным ответом должны получать циклическую терапию прогестероном или, при необходимости, комбинированную циклическую или непрерывную ЗГТ. Если получен частичный ответ, можно провести еще одно трехмесячное испытание с МПА, 10 мг перорально четыре раза в день или мегестрола ацетатом, 80 мг, в течение 3 месяцев. Неответчикам и пациентам с трудноизлечимым прорывным кровотечением может быть проведена трансабдоминальная гистерэктомия.Прогестиновая терапия для женщин в пременопаузе с EIN требует больших доз MPA, 100 мг перорально в день; мегестрола ацетат, 160 мг; или 1 г / неделя МПА внутримышечно в течение 12 недель. В последние годы еще одним средством лечения гиперплазии эндометрия с атипией или без нее стало использование внутриматочной спирали (ВМС), такой как внутриматочная система, высвобождающая LNG- (левоноргестрел) (Mirena®, Bayer Healthcare Pharmaceuticals, Inc., Уэйн, Нью-Джерси, США). . Несколько исследований показали полный ответ (обращение гиперплазии эндометрия на эндометрий прогестационного типа) в диапазоне от 25 до более 90%.В целом ЭГ лучше (90–100%), чем ЭИН (67–88%), на внутриутробный СПГ. 56 , 57 , 58 В дополнение к мощному прогестационному эффекту Мирены на эндометрий значительно сокращаются нежелательные явления (побочные эффекты), которые обычно возникают у пациентов, принимающих пероральную прогестагенотерапию. Это связано с тем, что системная абсорбция СПГ значительно снижена по сравнению с пероральной прогестагенной терапией. 56 , 57 , 58 , 59 Образец биопсии должен показать эндометрий прогестационного типа с выраженной децидуализацией стромы.Рекомендуется тщательное последующее наблюдение, включая повторную биопсию с интервалами примерно в 6 месяцев до тех пор, пока у нескольких пациентов не исчезнет заболевание, для обеспечения полной абляции. Индукция овуляции должна сопровождаться гестагенной терапией.
Операция (например, трансабдоминальная гистерэктомия) с двусторонней сальпингоофорэктомией или без нее рекомендуется женщинам со стойкой доброкачественной гиперплазией эндометрия, но имеющей симптомы (патологическое маточное кровотечение), и женщинам пострепродуктивной возрастной группы с ЭИН.Хирургическое вмешательство оправдано в этой группе, учитывая частоту прогрессирования инвазии в 25–35% и неэффективность прогестагенной терапии в 80% случаев. 60 Женщины, у которых развивается доброкачественная гиперплазия эндометрия во время заместительной терапии только эстрогенами, могут получить пользу от добавления прогестинов в их схему заместительной терапии. Редкий пациент (1%), у которого развивается доброкачественная гиперплазия эндометрия во время комбинированной циклической или непрерывной ЗГТ 41 , может быть полезен либо более высокие дозы комбинированной ЗГТ, либо просто переход на заместительную терапию только прогестином в течение 3 месяцев, чтобы попытаться вернуть гиперпластический эндометрий. в норму.
Было показано, что продолжительность введения прогестина имеет решающее значение для подавления митотической активности эндометрия; это важно, потому что контроль роста эндометрия в первую очередь связан с контролем митотической активности эпителия. Подавление митотической активности эндометрия отмечается через 11 дней лечения прогестином. 61 Гормональные препараты, наиболее часто используемые для лечения оцененной гиперплазии с атипией или без нее, представлены в таблице 5.
Таблица 5.Схемы лечения по типу гормона, дозировке и продолжительности *
Гормональные препараты plasignEIN
мг перорально × 14 дней / месяц
СПГ-ВМСГистология эндометрия | |||
Гормональные препараты | |||
Медроксипрогестерона ацетат | 10 мг перорально × 14 дней в месяц | 100 мг перорально или 1000 мг / неделя внутримышечно | |
300 мг / день PO | |||
мегестрола ацетат | 80 мг перорально × 14 дней / месяц | 160 мг / день PO | 19 |
| 20 мкг / день x от 6 месяцев до 2 лет | |||
Внутримышечно внутримышечно; ПО, перорально; СПГ, левоноргестрел.
* Все схемы даны на 3 месяца.
СПОРНЫЕ ВОПРОСЫ
Следует ли женщинам, которым будет назначен комбинированный вариант ЗГТ, пройти обследование эндометрия, и если да, следует ли использовать биопсию эндометрия или ТВУЗИ? В пользу оценки эндометрия у этих женщин могут быть два фактора, предпочтительно путем получения гистологического материала. Появляется все больше свидетельств обнаружения ранее существовавшей карциномы эндометрия у женщин, получающих комбинированную циклическую или комбинированную непрерывную ЗГТ. 62 , 63 , 64 , 65 Важно избежать юридических обязательств при назначении ЗГТ пациенту с ранее существовавшей карциномой эндометрия. Хотя в большинстве этих случаев карцинома эндометрия является ранней стадией FIGO IA / B, хорошо дифференцированной стадией FIGO I с отличным прогнозом, некоторые из них представляют собой запущенные карциномы с плохими прогностическими факторами. Кроме того, у некоторых пациентов симптомы отсутствуют, и, по крайней мере теоретически, возможно, что более раннее выявление может привести к большей выживаемости, чем более поздняя диагностика заболевания.
Скрининг патологии эндометрия с помощью TVUS был предложен женщинам, получающим длительную терапию тамоксифеном. 66 Другие предупреждают, что ТВУЗИ эндометрия может иметь высокий уровень ложноположительных результатов, поскольку тамоксифен оказывает эхогенное и сонопрозрачное действие на строму и миометрий эндометрия, маскируясь под гиперплазию или карциному. 67 Ультрасонографические исследования не обнаружили доказательств увеличения распространенности патологии эндометрия в серии из 108 женщин, получавших тамоксифен, которым была сделана биопсия. 68 Различные изменения эндометрия у пациентов с карциномой молочной железы в постменопаузе, получающих лечение тамоксифеном, включают полипы эндометрия аденоматозного типа, гиперплазию, карциному и саркому. 69
ПРОГЕСТЕРОНОВЫЙ ТЕСТ
Исторически Падвик и его коллеги 70 внедрили тест на прогестерон в клиническую практику в Европе, особенно в Соединенном Королевстве, до такой степени, что кровотечение на 11-й день введения прогестина или после него было считается гарантией эффективной защиты эндометрия.Однако это исследование было основано только на 96 женщинах. В более недавнем исследовании 413 женщин в постменопаузе, получавших комбинированную ЗГТ с использованием прогестинов в течение 10 дней, не было корреляции между гистологией эндометрия, включая гиперплазию, и временем начала кровотечения. 71 По нашему 25-летнему опыту практики и клинических исследований, хотя многие женщины с эстрогенизированным эндометрием, включая гиперплазию, могут испытывать кровотечение отмены, у других нет. 72
ВЫВОДЫ
Инвазивной карциноме эндометрия предшествует EIN, который по генетическим маркерам является моноклональным и морфологически идентифицируется по значительным цитологическим изменениям относительно фонового эндометрия того же пациента в области желез, в которой площадь железы превышает площадь стромы. площадь.Доброкачественная гиперплазия эндометрия не является предшественником карциномы, а скорее является реакцией эндометрия на ненормальную гормональную среду беспрепятственного действия эстрогенов.
Несмотря на то, что карцинома эндометрия и ее предшественники имеют большое значение из-за своей заболеваемости, смертность от карциномы низка. В результате массовый скрининг бессимптомной карциномы эндометрия и ее предшественников нерентабелен и не рекомендуется. Тем не менее, если скрининг на рак эндометрия желателен в частной практике, его следует сосредоточить на женщинах в возрасте 55 лет и старше и женщинах с высокими показателями риска карциномы.
Цитологический забор эндометрия напрямую ограничен сообществами, в которых доступна цитологическая экспертиза. Наиболее часто используемый метод оценки эндометрия — гистология; для снижения стоимости его следует проводить в офисе, а используемое устройство должно иметь вакуумную силу всасывания, быть одноразовым и иметь низкую стоимость. TVUS представляется потенциально полезной альтернативой гистологии для скрининга и диагностики карциномы и гиперплазии эндометрия. Гистероскопия является методом выбора для пациентов, у которых офисная биопсия и ТВУЗИ не позволили поставить точный диагноз.Пациенты с ГГ без цитологической атипии и пациенты с атипией, желающие забеременеть, должны проходить прогестагенную терапию. Пациентам с атипией или трудноизлечимым маточным кровотечением без атипии может быть полезна гистероскопия.
Гиперплазия стромы эндометрия: недооцененное состояние
Гиперплазия стромы эндометрия — это плохо распознаваемое поражение, не имеющее широкого признания, при этом большинство, если не все, таких случаев, описанных в литературе, как узелки стромы эндометрия или саркомы стромы эндометрия низкой степени злокачественности.В этой статье мы описываем три примера «гиперплазии стромы эндометрия», которые имеют замечательное морфологическое сходство с нормально пролиферирующей стромой эндометрия и стромальными новообразованиями эндометрия, но которые также обладают небольшими, но достаточными различиями, чтобы оправдать их таксономическое разделение.
1. Введение
Гиперпластический процесс в эндометрии по большей части диффузный, вовлекает как железы, так и строму (простая гиперплазия), реже является очаговым или мультифокальным и поражает исключительно железы эндометрия (сложная гиперплазия и обычно атипичная гиперплазия) [1].О гиперплазии эндометрия, состоящей исключительно из стромальных клеток, сообщалось в литературе только в исключительных случаях [2], в основном потому, что эти поражения не распознаются как патологические образования, отличные от стромального узла эндометрия и стромальной саркомы эндометрия низкой степени злокачественности. Мы сообщаем здесь о трех таких случаях гиперплазии эндометрия стромы и раскрываем ее тонкие, но уникальные особенности, для которых эта форма гиперплазии заслуживает отдельного рассмотрения.
2. Случай 1
71-летняя женщина была направлена для оценки толстого эндометрия, обнаруженного при обычном ультразвуковом обследовании в рамках ее ежегодного осмотра.В анамнезе у пациента была левая колэктомия по поводу аденокарциномы слепой кишки 3 года назад и полипэктомия по поводу тубуловиллярной аденомы толстой кишки 2 года назад. Несколько лет страдала артериальной гипертонией. Гормональной терапии в анамнезе не было. У пациентки было два нормальных родоразрешения и два искусственных аборта. При гистероскопической биопсии был получен фрагмент ткани размером 0,5 см 2 вместе с небольшим полипом эндометрия 0,7 см при максимальном диаметре.
При гистологическом исследовании более крупный фрагмент был сформирован, почти полностью, из листов мелких однородных клеток с яйцевидными или веретеновидными ядрами, со скудной цитоплазмой и нечеткими границами клеток (рис. 1 (а)).Обнаружено замечательное сходство со стромальными клетками нормального эндометрия позднего пролиферативного типа. Полип эндометрия содержал небольшую область диаметром 0,2 см, которая однородно состояла из плотной стромы эндометрия того же типа, что и на фрагменте эндометрия (рис. 1 (b)). Оба образца не имели цитологической атипии, митотической активности или инвазии лимфатических сосудов. Биопсия была описана как «поражение стромы эндометрия« гиперплазия стромы »стромальный узелок эндометрия.«После этого у пациента нет никаких симптомов, и последующее ультразвуковое исследование показало нормальную толщину эндометрия и миометрия. Через год после лечения пациент жив-здоров. Ввиду нормального ультразвукового исследования, отсутствия каких-либо симптомов и после просмотра слайдов, о которых сообщалось ранее, мы расценили этот случай как гиперплазию стромы эндометрия.
3. Случай 2
47-летняя женщина была направлена на гинекологическую консультацию семейным врачом в связи с 30-месячным анамнезом аномального вагинального кровотечения.У нее было двое детей, оба родились путем кесарева сечения. При физикальном обследовании выявлены множественные лейомиомы матки. В анамнезе она сделала левую овариэктомию по поводу муцинозной цистаденомы 5 лет назад. Гормональная терапия не получала. Выполнены тотальная абдоминальная гистерэктомия и правая сальпингоофорэктомия.
Образец гистерэктомии содержал множественные типичные лейомиомы. Был распространен аденомиоз. Шейка матки в норме. В эндометрии обнажился плотный клеточный полип 0.6 см в диаметре, полностью состоит из маленьких веретеновидных клеток с небольшой цитоплазмой и нечеткими границами клеток (рис. 1 (c)). На всем протяжении поражения видны толстостенные сосуды артериолярного типа. Сходное морфологическое поражение с сосудами аналогичного типа было замечено в эндометрии на площади 0,8 см, расширяясь в окружающий миометрий с гладкой сдвигающейся границей (рис. 1 (d)). Ни в одном из двух поражений не было цитологической атипии, митотической активности или инвазии лимфатических сосудов.Был диагностирован гиперплазия стромы эндометрия. В правом яичнике обнаружена муцинозная цистаденома. Пациентка остается здоровой в течение трех лет после удаления матки.
4. Случай 3
75-летняя женщина обратилась с жалобой на сильное аномальное вагинальное кровотечение в течение недели. У нее было две нормальные роды. Пациентка страдала ожирением, гипертонией, имела эндометрий толщиной 10 мм с двумя небольшими полипами, выступающими в полость эндометрия. В настоящее время она принимает тироксин от гипотиреоза; она не получала гормональную терапию.Диагностический и терапевтический выскабливание выявили четыре фрагмента эндометрия, полностью состоящие из небольших регулярных стромальных клеток с яйцевидными или веретеновидными ядрами и плохо выраженной цитоплазмой, напоминающей нормальную позднюю пролиферативную строму. Не было клеточного плеоморфизма, митотической активности или инвазии лимфо-сосудистых каналов. Клетки были расположены в виде листов, в которых присутствовало множество сосудов типа артериолярных клеток (рис. 1 (е)). Из двух полученных полипов один содержал железы пролиферативного типа в фиброзной строме; другой был образован исключительно из стромальных клеток с характеристиками, аналогичными описанным в эндометрии.Биопсия была описана как «поражение стромы эндометрия« стромальная гиперплазия »стромальный узелок эндометрия». Последующее ультразвуковое исследование было нормальным. Пациент был жив и здоров в 14 месяцев. На основании клинических и гистологических особенностей, сонографических изображений и информации о последующем наблюдении этот случай был расценен как гиперплазия стромы эндометрия.
Иммуногистохимия была проведена во всех случаях и выявила диффузную положительность для ER (рис. 1 (f)), PR, виментина и bcl-2 и фокальную положительность для CD10.Они были отрицательными для α -актина гладких мышц, кальретинина.
5. Обсуждение
В настоящее время есть дополнительные доказательства того, что пролиферация клеток в эндометрии может принимать форму чистой стромальной гиперплазии — редкий, но специфический паттерн роста, который отличается от других форм пролиферативной активности на этом участке. Это неудивительно для динамической ткани, так как эндометрий, имеющий два основных структурных компонента, железы эндометрия и специализированную строму эндометрия, каждая из которых, по отдельности или в любой комбинации, обладает потенциалом для интенсивного разрастания и роста в ответ на соответствующие гормональные раздражители.В этом отношении было признано, что продолжительная эстрогенная стимуляция эндометрия без сопротивления может привести к гиперпластическому росту, который включает оба компонента эндометрия, то есть железы и строму (простая гиперплазия), или может, реже, вызывают форму гиперплазии с пролиферацией, ограниченной железами эндометрия (сложная гиперплазия, атипичная гиперплазия) [1]; были идентифицированы аналогичные пролиферации, ограниченные стромой эндометрия, но этот образец роста традиционно считался неизменно неопластическим, либо доброкачественным (стромальный узел эндометрия), либо злокачественным (стромальная саркома эндометрия низкой степени, недифференцированная саркома) — точка зрения, которая не является отражают выводы настоящего отчета и, по всей видимости, нуждаются в пересмотре.
Мнение о том, что пролиферация стромальных клеток в эндометрии по определению является неопластической, было впервые оспорено Stewart et al. [2], когда они столкнулись с серией из двух биопсий эндометрия и последующей гистерэктомией у молодой женщины с меноррагией. Две биопсии показали нормальный образец пролиферации эндометрия с примесью небольших тканевых фрагментов плотной стромы эндометрия. Возможность того, что это доброкачественные стромальные опухоли, учитывалась в биопсийном материале, но исключалась в образце гистерэктомии, где по причинам, которые будут обсуждены позже, был поставлен диагноз фокальной гиперплазии стромы эндометрия.Это единственный полностью задокументированный случай гиперплазии стромы эндометрия в литературе, и к этому мы добавили три настоящих случая. Еще о трех случаях сообщили Vanni et al. [3], исследуя транслокации в полипах эндометрия, но их отчет был кратким и неполным.
Немногочисленные примеры гиперплазии стромы эндометрия, зарегистрированные до сих пор, представляют собой лишь приблизительную оценку ее истинной частоты и для многих случаев не были зарегистрированы, в то время как другие оставались нераспознанными и регистрировались как стромальные узелки эндометрия или стромальные саркомы эндометрия низкой степени, это во многом объясняется тем, что диагностическая метка гиперплазии стромы не установлена.Тем не менее, эти примеры иллюстрируют тот факт, что «чистые» пролиферации стромальных клеток эндометрия сами по себе не обязательно неопластические, но некоторые могут принимать форму гиперплазии стромы. Тем не менее, распознавание этой формы гиперплазии эндометрия и ее отделение от опухолей стромы эндометрия может вызвать трудности, особенно в материале для выскабливания, гиперпластические поражения стромы гистологически очень похожи, почти идентичны тем, которые являются действительно неопластическими, и есть только тонкие морфологические различия и молекулярные транслокации, которые делают различие возможным.Фактически, анализ наших случаев показал, что несколько признаков имеют диагностическую ценность в этом отношении.
Таким образом, согласно Stewart et al. По мнению [2], гиперплазия стромы эндометрия — это полностью внутриэндометриальные поражения, возможно, распространяющиеся в миометрий с толкающим, а не инфильтрирующим краем. Стромальные клетки, образующие очаги поражения, хотя и очень похожи на клетки стромы нормальной пролиферативной фазы, лишены митозов или проявляются лишь изредка; они окрашивают положительно на CD10 и виментин, экспрессируют рецепторы эстрогена (ER) и прогестерона (PR), но отрицательны на актин и десмин.Размер поражений менее 1 см, и действительно, не было зарегистрировано ни одного случая, в котором гиперпластический элемент имел бы диаметр более 0,8 см. Кроме того, гиперплазии стромы имеют тенденцию образовывать небольшие полипы или развиваться в уже существовавшем полипе, который в образцах кюретажа может создавать впечатление мультифокального поражения, как описано другими [2]. Такие полипы эндометрия с преобладанием стромальной гиперплазии характеризуются транслокацией t (6; 14) (p21; q24) [3].
Напротив, новообразования типа стромальных узелков обычно большие, до 20 см в диаметре, со средним размером 5-6 см в диаметре, хотя они могут достигать 0,8 см [4]. Эти поражения могут быть внутриэндометриальными или полностью интрамуральными и, за очень немногими исключениями, одиночными. Многие из них полиповидны и расширяют полость матки. Опухоли обычно хорошо ограничены и расширяются, но, хотя они часто «выступают» на 3 мм в окружающие ткани, не имеют четких доказательств инвазии.Однако дальнейшее распространение в миометрий, то есть более чем на 3 мм, и / или явное свидетельство инфильтрации сосудов указывает на то, что опухоль представляет собой саркому стромы эндометрия. Стромальные узелки компактны, с клетками, которые напоминают клетки нормально пролиферирующей стромы эндометрия, но могут проявлять некоторую ядерную атипию и редкую митотическую активность: <3 митозов на 10 мощных полей (HPF), но иногда может достигать 15 митозов на 10 HPF. Распространенной цитогенетической аномалией является t (7; 17) (p15q21) , что приводит к слиянию гена JAZF1-JJAZ1 [5, 6].
Опухолевые клетки стромальных сарком эндометрия низкой степени злокачественности все еще напоминают нормальные стромальные клетки эндометрия, но могут проявлять митотическую активность (от <3 митозов до> 10 митозов на 10 HPF) и, возможно, области ядерного плеоморфизма. Однако отличительной особенностью этой опухоли является глубокая инвазия миометрия, обычно сопровождающаяся инвазией сосудистых каналов и редко метастазами. Опухоли, как и стромальные узелки, обнаруживают гибридный ген JAZF1 / JJAZ1 , вызванный транслокацией t (7; 17) (p15; q21) [5, 6].Недифференцированные саркомы эндометрия — это откровенно инвазивные опухоли с кровотечением, некрозом и, возможно, метастазами; они могут проявлять большую степень плеоморфизма и митотической активности (от ≥10 митозов до ≥20 митозов на 10 HPF), но не имеют характерных молекулярных аберраций [5, 6].
Клинические особенности пациентов с гиперплазией стромы эндометрия во многом такие же, как и у женщин с новообразованиями стромальных клеток, наиболее частой жалобой является аномальное маточное кровотечение.Точно так же гиперпластическое состояние встречается в широком возрастном диапазоне, от до 1940-х годов до возраста старше 75 лет, в среднем 58 лет. После хирургического удаления матки и яичников часто встречались аденомиоз / эндометриоз и лейомиома матки, и, за исключением Stewart’s et al. В этом случае была высокая частота сосуществующих полипов эндометрия. Эти патологические особенности никоим образом не являются специфическими или характерными для этой конкретной формы гиперплазии, но, по-видимому, подразумевают, что преобладает эстрогенная среда.
Из этого обсуждения очевидно, что чистые пролиферации стромальных клеток в эндометрии не обязательно являются неопластическими, поскольку несколько описанных примеров, по-видимому, являются подлинно гиперпластическими по природе. Предполагается, что если поражение стромы имеет небольшой размер, локализацию внутри эндометрия и мультифокальное распределение, и если оно имеет тенденцию к образованию полипов или возникает в уже существующем полипе и не имеет сосудистой инвазии, то его можно рассматривать как гиперплазия стромы эндометрия.Специфический молекулярно-генетический тест, который может подтвердить диагноз в проблемных случаях, — это t (6; 14) (p21; q24) . Несмотря на короткое время наблюдения, считается, что любое гиперпластическое поражение без цитологической атипии и, если на то пошло, гиперплазия стромы эндометрия, вероятно, имеет благоприятный прогноз и, следовательно, заслуживает таксономического разделения.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Рак матки: стадии и степени
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете, как врачи описывают рост или распространение рака.Это называется этапом и степенью. Используйте меню для просмотра других страниц.
Стадия — это способ описания того, где находится рак, если или где он распространился, и влияет ли он на другие части тела.
Врачи используют диагностические тесты, чтобы определить стадию рака, и им может потребоваться информация, основанная на образцах тканей после операции. Из-за этого определение стадии может быть неполным, пока не будут завершены все анализы и не будет проведена операция по удалению опухоли (см. Типы лечения).Знание стадии помогает врачу решить, какой вид лечения лучше всего, и может помочь предсказать прогноз женщины, который является шансом на выздоровление. Существуют разные описания стадий для разных типов рака. Для рака матки используется система стадирования, разработанная Международной федерацией акушерства и гинекологии (FIGO).
Стадии по FIGO при аденокарциноме матки
Этап представляет собой общий способ описания рака, позволяя врачам совместно спланировать лучшее лечение.Врачи определяют стадию рака эндометрия с помощью системы FIGO.
Стадия I: Рак обнаруживается только в матке или матке и не распространился на другие части тела.
Стадия II: Опухоль распространилась из матки на строму шейки матки, но не на другие части тела.
Стадия III: Рак распространился за пределы матки, но по-прежнему поражает только область малого таза.
Стадия IIIA: Рак распространился на серозную оболочку матки и / или ткань маточных труб и яичников, но не на другие части тела.
Стадия IIIB: Опухоль распространилась на влагалище или рядом с маткой.
Стадия IIIC1: Рак распространился на регионарные тазовые лимфатические узлы. Лимфатические узлы — это маленькие бобовидные органы, которые помогают бороться с инфекцией.
Стадия IIIC2: Рак распространился на парааортальные лимфатические узлы с или без распространения на регионарные тазовые лимфатические узлы.
Стадия IV: Рак метастазировал в прямую кишку, мочевой пузырь и / или отдаленные органы.
Стадия IVA: Рак распространился на слизистую прямой кишки или мочевого пузыря.
Стадия IVB: Рак распространился на лимфатические узлы в области паха и / или распространился на отдаленные органы, такие как кости или легкие.
Марка (G)
Врачи также описывают этот тип рака по его степени (G). Оценка описывает, насколько раковые клетки похожи на здоровые при просмотре под микроскопом.
Врач сравнивает злокачественную ткань со здоровой тканью. Здоровая ткань обычно содержит много разных типов клеток, сгруппированных вместе. Если рак похож на здоровую ткань и имеет разные группы клеток, его называют «дифференцированной» или «низкосортной опухолью». Если злокачественная ткань сильно отличается от здоровой ткани, ее называют «низкодифференцированной» или «высокодифференцированной опухолью». Степень рака может помочь врачу предсказать, как быстро он будет распространяться.В целом, чем медленнее распространение, тем лучше прогноз.
Буква «G» используется для определения степени рака матки.
GX: Оценка не может быть оценена.
G1: Клетки хорошо дифференцированы.
G2: Клетки умеренно дифференцированные.
G3: Клетки слабо дифференцированы.
Рецидив рака матки
Рецидивирующий рак — это рак, который вернулся после лечения.Рак матки может вернуться в матку, таз, лимфатические узлы брюшной полости или другую часть тела. Если есть рецидив, это, как правило, происходит в течение 3 лет с момента постановки первоначального диагноза, но иногда могут возникать и более поздние рецидивы.

