Лечение диспластического меланоцитарного невуса в Москве. Цены. Отзывы. Фото. Удаление невуса Кларка лазером.
Ультразвуковое диагностическое сканирование – хорошо известная и отработанная методика, которая в настоящее время составляет более 1/3 объема всех диагностических процедур в медицинской практике. Современные приборы уже достаточно просты в применении и доступны для многих клиник.
Однако в дерматологии эти исследования ранее не применялись, что было связано с трудностью технического решения данной задачи. В обычных приборах датчики имеют частоту 3-10 МГц, при которой было невозможно получить изображение структур эпидермиса, дермы и гиподермы.
Немецкая компания TPM создала уникальные приборы с частотой датчиков 20-100 МГц. Такая методика называется цифровой ультразвуковой визуализацией высокого разрешения с возможностью изучения наиболее поверхностных слоев кожи.
По материалам исследований, проведенным при помощи аппарата DUB TPM (список прилагается отдельно), опубликовано множество статей и 2 монографии.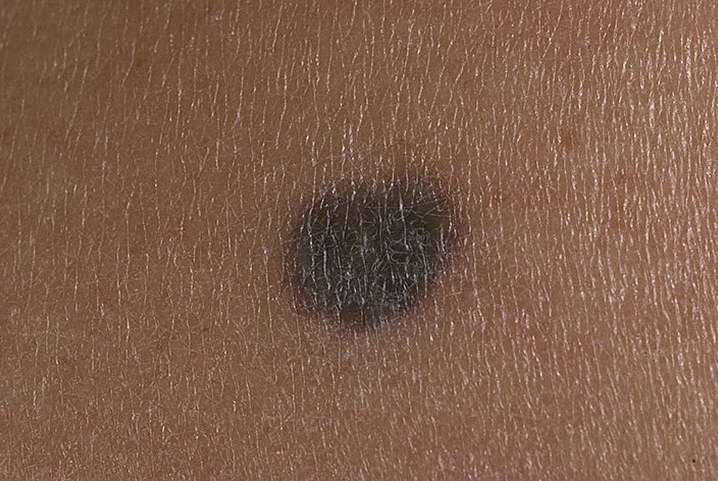
До настоящего времени основным методом изучения морфологии кожи было гистологическое и патоморфологическое исследование. Эта методика довольно трудоемкая и затратная, кроме того, исследуется биоптат, уже обработанный различными химическими реагентами.
Ультразвуковая диагностика кожи заполняет пробел, который существовал ранее между наружными методами исследований и гистологией, так как этот неинвазивный метод позволяет изучать кожу in vivo.
Значение ультразвукового сканирования для диагностики кожи трудно переоценить. Этот метод обладает целым рядом неоспоримых преимуществ – неинвазивность, безболезненность, безопасность и высокая точность измерений. Все исследования проводятся без повреждения тканей и могут повторяться на одном и том же участке кожи многократно.
Новый инструмент, позволяет увидеть срез кожи и подкожно-жировой клетчатки до мышечной фасции. Мы можем исследовать кожу в различные интервалы времени, документируя все особенности. Данные оцифровываются и помещаются в базу данных.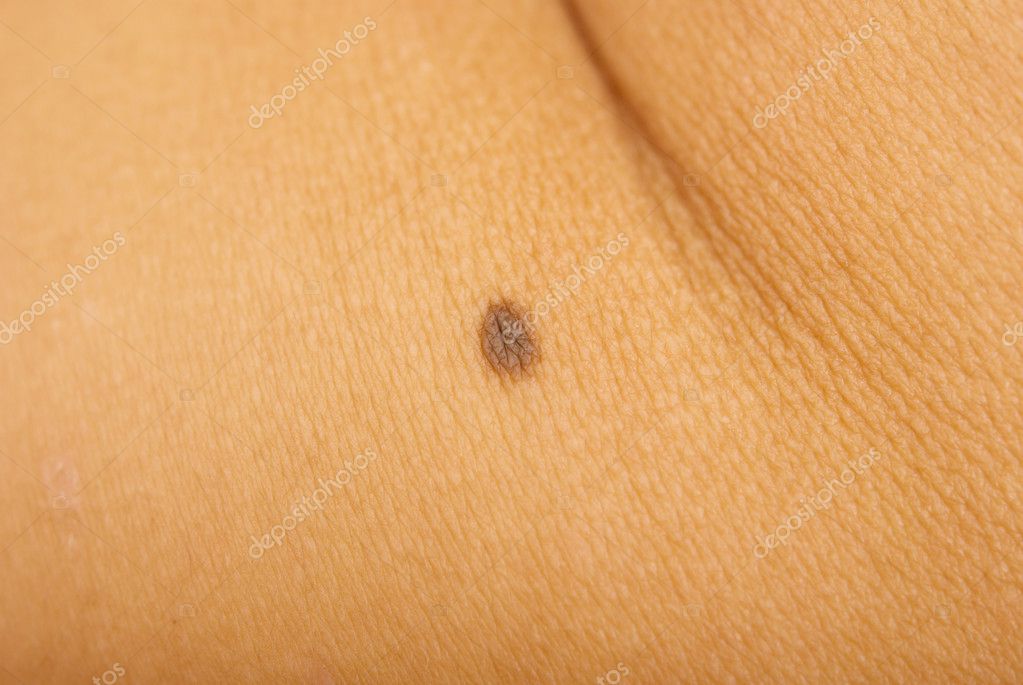 Легко проводится сравнительный анализ снимков полученных в динамике, изображения сохраняются на любых цифровых носителях и данные передаются в общедоступных форматах через сеть Internet.
Легко проводится сравнительный анализ снимков полученных в динамике, изображения сохраняются на любых цифровых носителях и данные передаются в общедоступных форматах через сеть Internet.
Ультразвуковое исследование кожи должно стать «золотым стандартом» в диагностике кожи, как в акушерстве, гинекологии и кардиологии.
Отличительные особенности системы DUB
- TPM впервые разработала и освоила серийный выпуск УЗ для кожи, а также установила стандарты ультразвукового исследования кожи во всем мире.
- Только аппараты DUB оснащаются датчиками с максимально высокой частотой до 100 МГц и разрешением до 8-10 мкм.
- Режимы сканирования A,B,C.
- Трехмерное сканирование.
- Кинопетля без ограничения длительности съемки.
- Оцифровка сигнала, следовательно, изображение более детальное и четкое.
- Цифровая обработка данных.
- Просмотр нескольких изображений полученных в разное время.
- Инновационные алгоритмы обработки изображений.

- Сохранение необработанных данных.
- Расширенный пакет программного обеспечения.
- Применение открытой системы с водой позволяет получать на 10-20% информации больше, чем использование системы с пленкой.
- В данный момент прибор не имеет аналогов во всем мире.
Возможности прибора:
- 1) Изучение состояния, структуры и размеров всех слоев кожи и кожных образований.
- 2) Углубленная диагностика морфологических и функциональных изменений при острых и хронических заболеваниях кожи, в том числе при рубцовых изменениях и липодистрофиях.
- 3) Оценка динамики состояния кожи в норме и патологии.
- 4) Облегчение диагностики малых высыпаний на коже.
- 5) Своевременная ранняя диагностика, так как с помощью ультразвукового сканирования можно не только выявить характерные признаки кожных проявлений на самых ранних стадиях, но и провести доклиническую диагностику, профилактику или своевременное лечение.
- 6) Диагностика состояний кожи в случае каких-либо трудно определяемых невооруженным глазом проявлений.

- 7) Визуализация, определение размеров, объема и глубины инвазии, а также оценка новообразований кожи и метастазов в кожу, выбор методов лечения, установка параметров и контроль эффективности.
- 8) Предоперационное измерение глубины распространения и объема опухолей при проведении хирургических вмешательств, в том числе и электрохирургии, криохирургии, лазерной или лучевой терапии.
- 9) Исследование возрастных изменений кожи.
- 10) Определение глубины, интенсивности и длительности лечебного воздействия, выбор метода.
- 11) Оценка эффективности и контроль терапевтических, физиотерапевтических и хирургических методов лечения, в том числе и косметологических процедур (например, таких как мезотерапия, пилинги, пластические операции, удаление татуировок, аппаратные процедуры и т.п.).
- 12) Предварительная диагностика и оценка результатов введения филлеров, препаратов гиалуроновой кислоты, коллагена, синтетических или полусинтетических гелей и т.д.
- 13) Ранняя диагностика остеопороза.

- 14) Исследование эластичности кожи.
- 15) Исследование слизистых оболочек.
Преимущества использования этого метода:
- 1) Неинвазивная методика визуализации внутренних структур кожи in vivo, которая позволяет получать важную информацию, недоступную при других методах исследования.
- 2) Метод незаменим для оценки динамики состояния кожи в дерматологии, косметологии и дермато-онкологии. Позволяет проводить наблюдение за состоянием кожных проявлений и использовать данные при первичной диагностике, профилактике и лечении большинства заболеваний кожи.
- 3) Возможность сохранения данных в памяти компьютера и на любых электронных носителях, распечатка фотографий для историй болезни, пересылка по internet для консультаций с коллегами.
- 4) Объективная оценка динамики состояния кожи пациента – важный юридический аспект в разрешении конфликтных ситуаций.
- 5) Наглядная визуализация состояния внутренних структур кожи и ее рельефа – сильный психологический фактор при разъяснении пациентам необходимости проведения лечебных мероприятий.

- 6) При помощи DUB легко доказывать эффективность лечения в доступной для клиента форме. Это мощный маркетинговый инструмент для привлечения новых клиентов.
- 7) Наличие этого метода повышает рейтинг учреждения и свидетельствует о высокой оснащенности и использовании передовых технологий.
- 8) В дополнение к гистологической картине, повышает точность патоморфологического диагноза.
- 9) Проведение научных и образовательных программ.
- 10) Проведение консилиумов и консультационно-диагностических мероприятий.
Новым аспектом использования данного метода для производителей является проведение оценки воздействия на кожу различной продукции, в том числе косметических, лекарственных препаратов, приборов.
МЕЛАНОМА
Мелано́ма — злокачественная опухоль, развивающаяся из меланоцитов — пигментных клеток, продуцирующих меланины. Наряду с плоскоклеточным и базальноклеточным раком кожи относится к злокачественным опухолям кожи. Преимущественно локализуется в коже, реже — сетчатке глаза, слизистых оболочках (полость рта, влагалище, прямая кишка). Одна из наиболее опасных злокачественных опухолей человека, часто рецидивирующая и метастазирующая лимфогенным и гематогенным путём почти во все органы.
Преимущественно локализуется в коже, реже — сетчатке глаза, слизистых оболочках (полость рта, влагалище, прямая кишка). Одна из наиболее опасных злокачественных опухолей человека, часто рецидивирующая и метастазирующая лимфогенным и гематогенным путём почти во все органы.
Факторы риска и причины
- Ультрафиолетовое излучение: естественное (солнечное) и из искусственных источников (оборудование для загара). Является ведущим фактором риска.
- Фенотип — белая кожа, светлые (голубые) глаза, светлые волосы и розовые веснушки.
- Наличие в анамнезе солнечных ожогов. При этом даже те из них (ожоги), которые были получены в детском, подростковом и юношеском возрасте могут сыграть роковую роль в развитии опухоли в последующие годы.
- Меланоформный невус (синонимы: диспластический меланоцитарный невус, синдром атипического невуса). Относится к доброкачественным новообразованиям кожи.
- Наследственность — семейный анамнез меланомы. В 1987—1989 года первый локус восприимчивости к семейной кожной меланоме (CMM1) был картирован в 36-м бэнде 1-й хромосомы человека (1p36), однако в 1994 году уверенность в связи локуса 1p36 с семейной меланомой поставлена под сомнение.
 В настоящее время повышенный риск заболеваемости меланомой связывают с нарушением функции супрессоров опухолевого роста, одним из которых является CDKN2A, локус хромосомы 9р21, кодирующий белки p16 и p14ARF и второй — ген CDK4 (cyclin-dependent kinase 4) с локализацией в хромосоме 12q14.
В настоящее время повышенный риск заболеваемости меланомой связывают с нарушением функции супрессоров опухолевого роста, одним из которых является CDKN2A, локус хромосомы 9р21, кодирующий белки p16 и p14ARF и второй — ген CDK4 (cyclin-dependent kinase 4) с локализацией в хромосоме 12q14. - Невусы — По данным НИИ онкологии им. проф. Н. Н. Петрова, среди больных с установленным фоном для развития меланомы были названы следующие типы невусов: сложный (45 %), пограничный (34 %), интрадермальный (16 %), голубой невус (3,2 %). При этом 70 % невусов были расценены как врожденные, а 30 % — как приобретенные.
- Фактор множественности невусов (более 50) увеличивает риск развития меланомы.
- Пигментная ксеродерма.
- Уже ранее перенесённая меланома.
- Возраст старше 50 лет.
Фототипы кожи человека (По Фитцпатрику)
Основная статья: Шкала Фитцпатрика
Относительный риск развития меланомы связан с фототипом кожи. При этом наиболее подвержены к развитию опухоли лица с I и II фототипом и наименее с V и VI, что однако не исключает у них полностью вероятность болезни.
При этом наиболее подвержены к развитию опухоли лица с I и II фототипом и наименее с V и VI, что однако не исключает у них полностью вероятность болезни.
Реакция на облучение | |
I | солнечный ожог всегда возникает после кратковременного (30 мин.) пребывания на солнце; загар никогда не приобретается |
II | солнечные ожоги возникают легко; загар возможен, хотя и с трудом |
III | возможны незначительные ожоги; развивается хороший ровный загар |
IV | никогда не бывает солнечных ожогов; легко возникает загар |
V | смуглая от природы кожа |
VI | чёрная кожа выходцев с Африканского континента |
Варианты
Меланома кожи
Клинические формы:
- Поверхностно-распространяющаяся меланома, 70 % случаев: как правило развивается у женщин, характеризуется горизонтальным ростом и в общем имеет благоприятный прогноз
- Узловая меланома (нодулярная), 15 %: чаще у мужчин, характеризуется ростом в толщу кожи, считается самым неблагоприятным в плане прогноза типом
- Акролентигинозная меланома (лат.
 Acral Lentigo Maligna) 10 %: известна и как подногтевая меланома. Растёт также на кончиках пальцев, ладонях. Встречается чаще всего у темнокожих лиц.
Acral Lentigo Maligna) 10 %: известна и как подногтевая меланома. Растёт также на кончиках пальцев, ладонях. Встречается чаще всего у темнокожих лиц. - Лентигинозная меланома, (лат. Lentigo Maligna, злокачественная веснушка Хатчинсона, меланоз Дюбрейля) 5 %: развивается на фоне пигментного пятна (родинки), как правило на лице, главным образом у женщин. Характеризуется горизонтальным, медленным ростом и имеет наиболее благоприятный прогноз.
- Ахроматическая меланома (беспигментная) очень редко.
Другие меланомы
Меланома сетчатки глаза
Меланома сетчатки глаза
Лентигинозная меланома слизистых оболочек — 1 % от общего числа меланом. Встречается в полости носа, рта, перианальной и вульвовагинальной областях. Характеризуется выраженной, неравномерной пигментацией.
Малигнизированная меланома мягких тканей (англ. malignant melanoma of soft parts или clear cell sarcoma) — растёт на связках и апоневрозах. Встречается во всех возрастных группах, в том числе у детей и подростков.
malignant melanoma of soft parts или clear cell sarcoma) — растёт на связках и апоневрозах. Встречается во всех возрастных группах, в том числе у детей и подростков.
Подозрение на меланому
В большинстве случаев невозможно определить макроскопически тип невуса (родинки). Важно, однако, вовремя заметить изменения которые могут характеризовать озлокачествление. Такими изменениями могут быть:
- Чувство зуда в области невуса
- Выпадение волос с его поверхности
- Изменение цвета
- Изъязвление
- Увеличение размера
- Изменение очертаний родинки.
- Исчезновение исчерченности кожи в области невуса
- Кровотечение с его поверхности
- Узлообразование
Диагноз
- Дерматоскопия — самая ранняя диагностика меланомы. Проводится как с помощью простой лупы, так и с помощью дерматоскопа (эпилюминисцентного микроскопа) делающего прозрачным роговой слой эпидермиса.
 При этом можно с высокой вероятностью определить, является ли невус опасным или нет на основании системы ABCDE, предложенную Friedman в 1985 году.
При этом можно с высокой вероятностью определить, является ли невус опасным или нет на основании системы ABCDE, предложенную Friedman в 1985 году.
A — asymmetry, асимметричность родинки
B — border irregularity, неровный край
C
D — diameter, диаметр родинки более 6 миллиметров
E — evolving, изменчивость родинки
На сегодняшний день разработанные компьютерные системы микродермоскопии повышают уровень ранней диагностики меланомы с 60 % до 90 %, но часто только в экспериментальных условиях.
- Окончательный диагноз меланомы может быть установлен только после гистологического исследования, проведённого после тотального удаления невуса (опухоли) с достаточным захватом здоровых тканей. Предоперационная биопсия с помощью иглы или частичного удаления противопоказана, во избежание распространения меланомы. Определяется глубина прорастания (Clark, Breslow) и митотический индекс.

- ЛДГ — лактатдегидрогеназа, помогает установить наличие метастазов в печени.
- Компьютерная томография, магнитно-ядерный резонанс и сцинтиграфия (радиоизотопное исследование) c изотопом фосфора применяется для обнаружения метастазов в лимфоузлах и других органах.
Метастазирование
Меланома характеризуется бурным и ранним метастазированием. Чаще всего метастазами поражаются регионарные лимфатические узлы. Гематогенные метастазы могут возникнуть в любом органе, но чаще всего поражаются легкие, печень, кости и головной мозг. При наличии отдаленных метастазов прогноз крайне неблагоприятен.
Лечение
При подозрении на наличие меланомы следует незамедлительно обратиться к дерматологу. В случае необходимости пациента направляют к врачу-онкологу.
Начальная меланома (без регионарных и отдаленных метастазов)
Основной метод лечения начальной меланомы — хирургическое удаление. Как для первичной опухоли, так и для лечения рецидивов выполняется футлярно-фасциальное иссечение опухоли.
Местнораспространенная меланома, метастазирующая
Основными методами лечения метастазирующей меланомы являются полихимиотерапия, иммунотерапия и лучевая терапия, которые применяются, как правило, в комбинации.
- Иммунотерапия
- Лучевая терапия
- Регионарная и системная химиотерапия
- Профилактика
Профилактика меланомы сводится к ограничению пребывания на солнце. Людям из группы риска рекомендуют пользоваться солнцезащитными средствами с коэффициентом защиты не ниже 15, носить шляпу и светлую закрытую одежду.
Некоторые типы меланом имеют четкую наследственную предрасположенность, поэтому если у кого-то из ваших родственников когда-либо была диагностирована меланома, следует регулярно проходить обследование у дерматолога.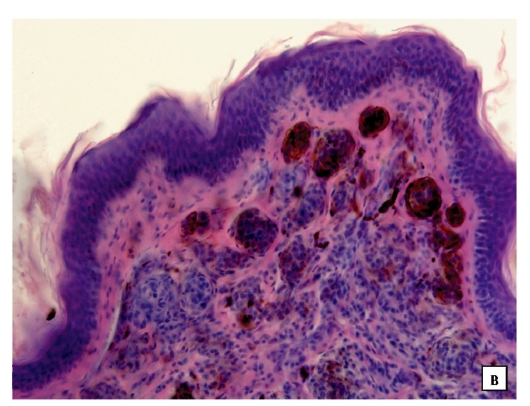
Врач-хирург Ханто Е.С.
Клинический случай прогрессирующего диспластического невуса с переходом в меланому
Романова О.А., Артемьева Н.Г., Солохина М.Г.
ЗАО «Центральная поликлиника Литфонда», Москва, Россия
Опубликовано: Журнал «Клиническая дерматология и венерология», 2018, 17(2): 34-37.
Приведено наблюдение крупного диспластического невуса с переходом в меланому in situ. Подчеркнуты трудности при морфологическом установлении диагноза меланомы in situ.
Ключевые слова: прогрессирующий диспластический невус, меланома in situ.
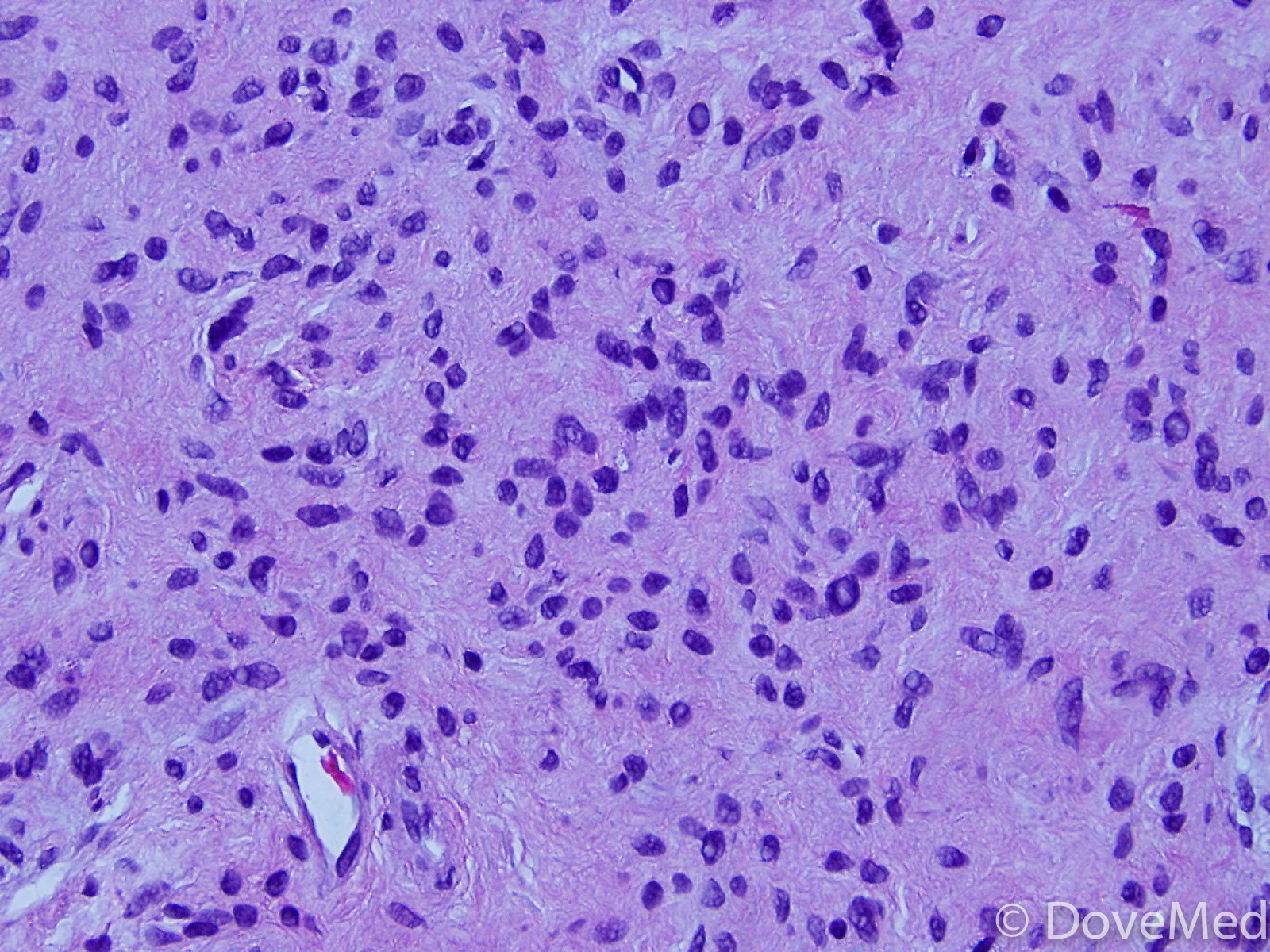
Диспластические невусы в настоящее время привлекают внимание исследователей в связи с их возможной трансформацией в меланому. Диспластические невусы могут быть множественными и единичными, наследственными и спорадическими. В 1978 году Кларк с соавторами впервые описали множественные наследственные невусы, являющиеся предшественниками меланомы, и обозначили эту ситуацию как «В-К моль синдром» [1]. Гистологически эти образования, которые в дальнейшем стали называться диспластическими невусами, представляли собой атипическую меланоцитарную гиперплазию, лимфоидную инфильтрацию, нежную фиброплазию и новообразованные кровеносные сосуды. В 1980 году Элдер с соавторами описали подобные невусы у больных ненаследственной меланомой и показали, что диспластический невусный синдром, как и наследственный «В-К-моль синдром», является фактором риска развития меланомы кожи [2]. При гистологическом исследовании диспластических невусов авторы обнаружили 2 типа нарушения роста внутриэпидермальных меланоцитов, наиболее частый тип – лентигинозная меланоцитарная дисплазия (ЛМД) – наблюдался во всех диспластических образованиях и напоминал изменения, происходящие в lentigo simplex. Второй тип нарушения роста – эпителиоидно-клеточная меланоцитарная дисплазия – был найден в 2 образованиях в дополнение к лентигинозной меланоцитарной дисплазии и напоминал классическую поверхностно-распространяющуюся меланому. В 1982 году профессор МНИОИ им. П.А. Герцена З.В. Гольберт [3] впервые выделила 3 степени развития лентигинозной меланоцитарной дисплазии (ЛМД). При 1 степени отмечалось увеличение числа меланоцитов в базальном слое эпидермиса и некоторая их атипия. При 2 степени имелись более выраженная пролиферация меланоцитов, местами полностью замещающих базальный ряд кератиноцитов, и нарастание признаков их анаплазии. 3 степень ЛМД, при которой имеется тенденция к врастанию меланоцитов в вышерасположенные слои эпидермиса и вглубь, в сосочковый слой дермы, приближается к картине меланомы
Возможное развитие меланомы на фоне невуса отмечали многие авторы. Н.Н. Трапезников в своей монографии 1976 года приводит данные зарубежных авторов, которые в 1971-1973 годах отмечали в пограничных невусах скопления патологически измененных меланоцитов [4]. Н.Н. Трапезников с соавторами также полагали, что пограничные невусы могут озлокачествляться, в связи с чем требуют наблюдения. Однако авторы отнесли к признакам озлокачествления невуса такие симптомы, как мокнутье, кровоточивость. Эти признаки характерны не для невуса, а для уже развившейся меланомы в фазе горизонтального роста. Авторы явно недооценили открытие Кларком в 1969 году поверхностно-распространяющейся меланомы, которая проходит длительную фазу горизонтального роста под маской невуса [5]. Экзофитный рост образования, который авторы считают признаком озлокачествления невуса и связывают его с травмой, свидетельствует о переходе уже развившейся меланомы из горизонтальной фазы роста в вертикальную [5]. Основным фактором прогноза меланомы в настоящее время считается толщина опухоли, определяемая в миллиметрах при гистологическом исследовании. Хороший прогноз относится к опухолям толщиной 1 мм и менее. Такая опухоль называется «тонкой меланомой» и клинически выглядят как гладкое пигментное пятно или слегка возвышающееся пигментное образование. Экзофитный рост свидетельствует о том, что толщина опухоли увеличивается и обозначает плохой прогноз.
Диспластические невусы могут быть малыми – до 0,3 см, средними – 0,4-0,8 см и крупными – 0,9-1,5 см, они представляют собой пигментные пятна или слегка возвышающиеся образования рыжеватого или коричневого цвета. В отличие от обычных (пограничных) невусов, которые обнаруживаются у детей, диспластические невусы появляются в подростковом возрасте и в дальнейшей жизни до глубокой старости. Наши наблюдения показали, что диспластические невусы могут быть как лентигинозными, так и смешанными, но во внутридермальные они не превращаются и не фиброзируются, как это происходит с пограничными невусами у детей. Диспластические невусы являются доброкачественными образованиями, они длительно существуют без каких-либо изменений или регрессируют, однако в отдельных случаях могут прогрессировать с переходом в меланому. О прогрессировании диспластического невуса (дисплазия 2-3 степени) могут свидетельствовать неправильная форма, волнистые или фестончатые края, неоднородная окраска коричневых или черных тонов [6-8]. Диспластические невусы с дисплазией 1 степени клинически имеют правильную форму, равномерную окраску, ровные края. Однако основным признаком прогрессирующего диспластического невуса, как показали наши наблюдения, является изменение размеров, окраски или конфигурации невуса за последние 6-12 месяцев или 1-10 лет. Быстрый (в течение 6-12 месяцев) рост невуса, появившегося на здоровой коже после наступления полового созревания, является важным признаком прогрессирования, поэтому подобные невусы необходимо подвергать эксцизионной биопсии даже при отсутствии других клинических признаков. Должно настораживать появление синюшных или розоватых тонов в окраске невуса, которое может свидетельствовать о переходе невуса в меланому.
Клинически отличить прогрессирующий диспластический невус от меланомы in situ не представляется возможным, так как озлокачествление происходит на клеточном уровне. Диагноз устанавливается только при гистологическом исследовании, при этом требуется высокая квалификация патоморфолога.
В Центральной поликлинике Литфонда мы в амбулаторных условиях с 2009 года производим иссечение (эксцизионную биопсию) диспластических невусов в целях профилактики меланомы [6-8]. Эксцизионной биопсии подлежат малые и средние диспластические невусы с признаками прогрессирования. Пациентов с крупными прогрессирующими диспластическими невусами мы направляем в онкологический стационар, так как в этих случаях нельзя исключить поверхностно-распространяющуюся меланому в фазе горизонтального роста. При гистологическом исследовании этих образований, удаленных в онкологических стационарах, обнаруживалась меланома, однако в двух случаях был установлен диагноз – пигментный невус. Приводим эти наблюдения.
Пациентка К., 63 лет, обратилась в Центральную поликлинику Литфонда 06.11.15 по поводу пигментного пятна в области спины, которое заметила 5 лет назад, в последние 6 месяцев отмечает зуд в области пятна. При осмотре: в левой лопаточной области имеется пигментное пятно 2,0×1,8 см, неправильной формы, неоднородной окраски коричневых и темно-коричневых тонов, с участками синюшно-розового цвета у верхнего наружного края. Пятно имеет неровные, «фестончатые» края (рис. 1, 2). Подмышечные лимфатические узлы не увеличены. Пациентка направлена к онкологу по месту жительств с подозрением на меланому. В Онкологическом диспансере №4 произведен соскоб образования для цитологического исследования, получены клетки меланомы. Больная направлена в Городскую клиническую больницу №5 для хирургического лечения. Осмотр в стационаре: на коже левой лопаточной области имеется образование 2,0×2,0 см, черно-коричневого цвета, с неровной поверхностью и неровными фестончатыми краями, без экзофитного компонента, с небольшой корочкой.
Рисунок 1. Прогрессирующий диспластический невус с переходом в меланому у женщины 63 лет.
Рисунок 2. Прогрессирующий диспластический невус с переходом в меланому у женщины 63 лет (крупный план).
25.11.15 произведено иссечение образования, отступя от видимых границ 2,0 см. Гистологическое исследование №82986: в зоне пятна, в центре кожного лоскута картина эпителиоидной меланоцитарной дисплазии атипического характера, в одном из участков крайне подозрительная по переходу в меланому (?). Пациентка выписана из стационара с диагнозом «Пигментный невус кожи левой лопаточной области». Гистологический препарат был консультирован в МНИОИ им. П.А. Герцена к.м.н. Ягубовой Э.А., заключение: эпителиоидно-клеточная пигментная неизъязвленная лентиго-меланома in situ на фоне смешанного диспластического невуса, с умеренной лимфоидно-плазмоклеточной инфильтрацией в основе. Удалено в пределах здоровых тканей.
В приведенном наблюдении у больной имелась яркая клиническая картина прогрессирующего диспластического невуса: неправильная форма, неровные «фестончатые» края, неоднородная окраска, возникновение пятна на здоровой коже 5 лет назад и дальнейший его рост. В связи с наличием участков розовато-синюшной окраски была заподозрена меланома кожи. При соскобе образования в Онкологическом диспансере №4, вероятно, именно на участке розовато-синюшной окраски были выявлены клетки меланомы. Однако следует отметить, что мы встречали меланому in situ при наличии пигментного пятна с относительно равномерной окраской. Несмотря на выявленную при гистологическом исследовании внутриэпидермальную дисплазию меланоцитов, патоморфологом стационара не было дано заключение о наличии диспластического невуса, хотя для клинициста важно получить такую информацию. Меланоцитарная дисплазия 2-3 степени свидетельствует о высоком риске развития меланомы у данного больного. Следует отметить, что в последнее время некоторые зарубежные авторы также стали выделять 3 степени дисплазии меланоцитов: легкую, умеренную и тяжелую.
Данное наблюдение показало, что диагноз «меланома in situ» вызывает затруднения у отечественных патоморфологов. Этим можно объяснить тот факт, что меланома in situ в РФ диагностируется крайне редко, в то время как в США и Австралии – очень часто. По данным John W. Kelly [9], в Австралии за период с 1996 по 2000 год было выявлено 5117 меланом, при этом меланома in situ установлена в 1711 случаях (33,4%). В 2007 году в США было зарегистрировано 59940 случаев инвазивной меланомы и 48290 случаев меланомы in situ [10].
Приводим еще одно наблюдение, где при наличии типичной картины прогрессирующего диспластического невуса диагноз морфологически подтвержден не был.
Больной П., 50 лет, обратился к онкологу в Центральную поликлинику Литфонда 03.04.15 по поводу пигментного образования кожи спины, которое заметил 3 года назад. При осмотре: в левой лопаточной области имеется пятно черного цвета 1,2×0,9 см, неправильной формы, с неровными краями, в центре – небольшое возвышение 0,2 см светло-коричневого цвета (рис. 3). Пациент был направлен в Онкологическую больницу №40 с подозрением на меланому. 13.04.15 произведено широкое иссечение образования. Гистологическое исследование – пограничный пигментный невус.
Рисунок 3. Прогрессирующий диспластический невус у мужчины 50 лет.
Учитывая клиническую картину, характерную для прогрессирующего диспластического невуса, мы, несмотря на отсутствие морфологического подтверждения, сообщили больному, что у него высокий риск развития меланомы. Через 1,5 года, 30.12.16. пациент сам обратился к онкологу в Центральную поликлинику Литфонда с жалобами на появление 1,5 месяца назад пигментного пятна на туловище. При осмотре – на спине слева, по задне-подмышечной линии имеется пятно 0,4×0,3 см, темно-коричневого, почти черного цвета. В Центральной поликлинике Литфонда 17.01.17 произведена эксцизионная биопсия образования, отступя от границ 0,5 см. Гистологическое исследование, проведенное в МНИОИ им. П.А. Герцена (Ягубова Э.А.), выявило смешанный пигментный невус с тяжелой (3 степени) меланоцитарной ленигинозной дисплазией, удаленный в пределах здоровых тканей. В основе – выраженная лимфоидно-плазмоклеточная инфильтрация.
Приведенные наблюдения показывают, что для своевременного выявления прогрессирующих диспластичеких невусов и меланомы in situ необходимо повышать квалификацию отечественных патоморфологов. Считаем целесообразным организовать курсы повышения квалификации патоморфологов на базе МНИОИ им П.А. Герцена, это будет способствовать своевременному выявлению меланомы in situ и снижению смертности от этой опасной опухоли кожи.
Литература
- Clark WH, Reimer RR, Greene M, Ainsworth AM, Mastrangelo MJ. Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. The B-K mole Syndrom. Archives of Dermatology, 1978; 114(5): 732-739.
- Elder DE, Leonardi J, Goldman J, Goldman SC, Greene MH, Clark WH. Displastic nevus syndrome. A pfenotypic assotiation of sporadic cutaneous melanoma. Cancer. 1980; 46(8): 1787-1794.
- Гольберт З.В., Червонная Л.В., Клепиков В.А., Романова О.А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы. Архив патологии. 1982; 12: 36-41.
- Трапезников Н.Н., Рабен А.С., Яворский В.В., Титинер Г.Б. Пигментные невусы и новообразования кожи. М., 1976.
- Clark WH, From L, Bernardino EA, Mihm MC. The histogenesis and biologic behavior of primary human malignant melanoma of skin. Cancer Research. 1969; 29: 705-726.
- Романова О.А., Артемьева Н.Г. Хирургическая профилактика меланомы кожи. Онкохирургия. 2013; 5(3): 12-18.
- Романова О.А., Артемьева Н.Г., Ягубова Э.А., Марычева И.М, Рудакова В.Н., Вещевайлов А.А. Тактика ведения пациента с диспластическим невусом. Клиническая дерматология и венерология. 2015; 14(2): 92-97.
- Романова О.А., Артемьева Н.Г., Ягубова Э.А., Марычева И.М., Рудакова В.Н., Вещевайлов А.А. Принципы эксцизионной биопсии диспластического невуса в амбулаторных условиях. Онкология. Журнал имени П.А. Герцена. 2016; 5(1): 36-41.
- Kelly J. The management of early skin cancer in the 1990s. Austr Fam Fhysician. 1990; 19: 1714-1729.
- Усатине Р.П., Смит М.А., Мэйо Э.Д. и др. Дерматология. Атлас-справочник практикующего врача. Пер. с англ. М., 2012; 324-335.
Рекомендации для пациентов с диспластическими невусами.
Рекомендации для пациентов с диспластическими невусами.
Что такое диспластический невус?
Диспластический невус – это особый тип обычных пигментных родинок, внешне от них отличающийся. Некоторые врачи могут использовать слово «атипичный невус», говоря о невусе диспластическом. По размеру диспластический невус может быть больше обычной родинки, а его цвет, поверхность, границы могут различаться. Обычно размер диспластического невуса превышает 5 мм, эти невусы могут быть неоднородно окрашены в разные цвета, от розового до темно-коричневого. Поверхность диспластических невусов может быть гладкой, слегка чешуйчатой или по типу гальки, а края таких невусов обычно неровные, размытые в структуре окружающей кожи.
Диспластический невус может располагаться на любом участке тела, но, как правило, он возникает в тех местах, которые подвергались воздействию солнца, например, на коже спины. Но это не обязательное правило: диспластические невусы бывают и в тех местах, которые не облучались солнцем – на коже волосистой части головы, молочных желез, ниже пояса. У некоторых людей всего пара таких невусов, а у некоторых их количество больше десяти. У людей, у которых есть диспластические невусы, как правило, и количество других родинок больше обычного.
Может ли диспластический невус переродиться в меланому?
Да. Но большинство диспластических невусов в меланому не перерождаются, оставаясь стабильными долгое время. Исследования показывают, что риск меланомы десятикратно увеличивается для тех людей, у которых больше пяти диспластических невусов в сравнении с теми людьми, у которых их нет, и чем больше диспластических невусов у человека, тем больше риск развития меланомы в течение жизни.
Что делать людям, у которых есть диспластические невусы?
Всем людям необходимо защищать свою кожу от солнца, избегать соляриев и не загорать на солнце, но для тех людей, у которых есть диспластические невусы, особенно важно – избежать загара и солнечных ожогов.
Кроме того, многие врачи рекомендуют своим пациентам самостоятельно проверять свои родинки один раз в месяц. Человек должен сказать своему врачу, если он видит в одном из своих диспластических невусов следующие изменения:
— изменения цвета невуса
— увеличение или уменьшение его размера
— какие-либо изменения формы, текстуры или высоты невуса
— если кожа на поверхности невуса становится сухой или чешуйчатой
— невус уплотнился и стал ощутимым
— появился зуд в области невуса
— невус кровоточит или из него сочится какая-то жидкость
Еще одна вещь, которая нужна людям с диспластическими невусами – это периодические осмотры врача. Иногда люди (или врачи) делают фотографии своих родинок, чтобы со временем можно было увидеть изменения, в этих родинках произошедшие. Тем, у кого больше пяти диспластических невусов, врачи могут проводить осмотры один или два раза в год, вследствие умеренно повышенного риска меланомы у этих пациентов. А для тех пациентов, у которых в семейной истории отмечены случаи меланомы у родственников, такие осмотры могут быть рекомендованы чаще – каждые три-шесть месяцев.
Нужно ли удалять диспластические или обычные невусы, чтобы предотвратить развитие меланомы?
Нет. Обычно диспластические, равно как и обычные родинки, не нужно удалять. Одной из причин отсутствия такой необходимости является то, что диспластические невусы очень редко трансформируются в меланому. Другая причина заключается в том, что удаление даже всех родинок не способно снизить риск развития меланомы, поскольку меланома может развиваться на неизмененной коже. Поэтому обычно врачи удаляют те невусы, в которых появляются изменения в течение времени (см.выше), либо новые пигментные образования.
Источник.
Перевод И.Е. Синельникова.
ВИДЫ РОДИНОК И ПРИНЦИПЫ ИХ САМОДИАГНОСТИКИ
Кожа — это орган человека, который выполняет множество функций, в том числе защитную роль и ряд биологических функций. Кожей покрыто все тело человека, и в зависимости от роста и веса, ее площадь составляет от 1,5 до 2 м2, а вес от 4 до 6 % от массы человека.
Родинка или меланоцитарный невус – кожное новообразование, заполненное клетками (меланоцитами), способными образовывать пигмент меланин. Меланоциты, расположенные в нижнем пласту эпидермиса, могут вырабатывать пигмент меланин, точно такой же вырабатывается при загаре. Создание меланина происходит под влиянием естественных (солнечных) или искусственных ультрафиолетовых лучей (лучи, используемые в соляриях).
Виды родинок:
Наиболее распространенные невусы — это скопление пигментных клеток.
Пигментные родинки возникают из-за переизбытка в клетках меланина. Они развиваются в течение 5— 10 лет, хотя известны случаи появления в более позднем возрасте. Внешне невусы выглядят как пятна или образования повышенной плотности различной величины, формы, цвета. Консистенция не отличается от здоровой кожи или незначительно уплотнена.
Бородавчатыми невусами называют выпуклые родинки бурого или коричневого цвета, напоминающими внешне цветную капусту.
Сосудистые родинки появляются из-за активного размножения клеток — внутренней поверхности стенок сосудов. Они проявляются в виде изменения сосудистой структуры кожи.
Родимые пятна отличаются от других кожных образований тем, что появляются сразу при рождении.
Невусы бывают разного цвета — серые, коричневые, голубые, черные.
Ряд родинок возвышаются над поверхностью тела. Они могут крепиться к коже с помощью длинной ножки или образовываться на основании из папилломы. Нередко на их поверхности прорастают волосы.
Первичная самодиагностика родинки – ответственность каждого человека перед собой и своими близкими!
Чтобы вовремя распознать опасную родинку самостоятельно, нужно запомнить алгоритм первичной диагностики, который называется АККОРД. Это слово-аббревиатура, в которой каждая буква имеет свое значение – признак перерождения родинки:
А – асимметрия. Края родинки не одинаковые;
К – край. Он становится неровным, волнообразным;
К – кровоточивость. Из родинки без получения травмы вдруг начинает идти кровь;
О – окрас. Изменения цвета (появление крапинок более темного или более светлого цвета), обесцвечивание могут свидетельствовать о начале патологического процесса;
Р – размер. Разрастание родинки является тревожным сигналом;
Д – динамика. Изменения внешнего вида, появление корочек, изменение текстуры должны заставить обратиться к врачу.
Самостоятельную диагностику родинки по данной системе специалисты рекомендуют проводить до 10 раз в год. В основном изменения в состоянии и росте родинок могут происходить летом, когда воздействие солнечных лучей наиболее активно и после него. При обнаружении любых изменений по одному из параметров, необходимо незамедлительно обращаться к участковому терапевту или онкологу.
Как правильно самостоятельно обследовать кожу
Мы подготовили для вас следующие рекомендации, чтобы сделать самостоятельный осмотр более быстрым и удобным. Лучше всего проводить осмотр после принятия душа или ванны. Вам понадобится 2 зеркала — в полный рост и небольшое, желательно с длинной ручкой. Такая комбинация зеркал позволит тщательно рассмотреть все участки тела. Также для осмотра головы понадобится расческа-гребень или фен — они позволят обнажить участи кожи под волосяным покровом. Осмотр обязательно нужно производить в хорошо освещенном помещении. При необходимости использовать небольшой фонарик.
Лазерное удаление сосудистых звездочек по доступной цене в Долгопрудном
РОДИНКИ (ПИГМЕНТНЫЕ ИЛИ МЕЛАНОЦИТАРНЫЕ НЕВУСЫ)
Родинки (пигментные или меланоцитарные невусы) это доброкачественные опухоли кожи, состоящие из невусных клеток и меланоцитов. Распространены они повсеместно и встречаются одинаково часто у мужчин и женщин. 1-2% невусов являются врожденными (то есть появляются с рождения и в первые 2 года жизни). Более 90% невусов появляются до 30 лет. Приобретенные после 30 лет невусы, возникающие на защищенных от воздействия солнца участках тела, должны считаться подозрительными (риск озлокачествления) и наблюдаться.Если пациент обратился в клинику с целью лазерного удаление родинки (невуса), на консультации врач дерматоонколог проводит дерматоскопическое исследование родинки. Дерматоскопия — это метод нетравматичной микроскопии кожи, позволяющий увидеть внутрикожные изменения эпидермиса и дермы, не прибегая к биопсии кожи. Коротко говоря, дерматокопия позволяет «заглянуть» под роговой слой эпидермиса и рассмотреть кожное образование более детально. Что позволяет принять решение о возможности лазерного удаления родинки. Зачастую различные по своей сути образования внешне выглядят одинаково, при осмотре же в дерматоскоп врач выявляет важные особенности и определяет свою дальнейшую тактику.
Дерматоскопическое исследование позволяет выявлять на ранних стадиях злокачественные опухоли кожи и диспластические невусы (потенциально опасные в плане озлокачествления). После осмотра с помощью дерматоскопа врач может дать рекомендации: динамическое наблюдение; лазерное удаление родинки; удаление родинки у хирурга с захватом окружающих тканей с последующим гистологическим исследованием; или рекомендовать обратиться к онкологу.Лазерное удаление родинок с косметическими целями допустимо только в том случае, если доброкачественность родинки не вызывает сомнений. В остальных случаях иссечение родинок производится с захватом 1,5-2 мм окружающей ткани с последующим обязательным гистологическим исследованием материала. Такое удаление возможно произвести только хирургическим путем. Преимуществом лазерного удаления родинок на лице является минимальное рубцевание, в отличие от других методов удаления.
Лазерное удаление родинок цена
В связи с внешним сходством невусов (родинок) с некоторыми формами злокачественной меланомы, удаление невусов производится строго после дерматоскопии
| Услуга | Время | Цена |
|---|---|---|
| Консультация врача дерматолога-косметолога, дерматоонколога (дерматоскопия одного кожного новообразования и рекомендации при обращении с целью удаления) | 20 мин | 1100р |
| Дерматоскопия дополнительных кожных новообразований (цена за один элемент) | 10 мин | 400р |
| Прием врача дерматоонколога первичный при множественных невусах (родинках): осмотр всего тела, консультация, дерматоскопия невусов. | 45 мин | 3500р |
| Прием врача дерматоонколога повторный: осмотр после удаления новообразования, дерматоскопия (при необходимости), консультация. | 10 мин | 600р |
Удаление новообразований на коже лица, шеи, туловища, конечностей (кроме ладоней и стоп) | ||
| Лазерное удаление кожного новообразования до 1 мм | 200р | |
| Лазерное удаление кожного новообразования до 5 мм | 800р | |
| Лазерное удаление кожного новообразования 10 мм | 1800р | |
Удаление новообразований на коже век, волосистой части головы, интимных областей | ||
| Лазерное удаление кожного новообразования до 1 мм | 500р | |
| Лазерное удаление кожного новообразования до 5 мм | 1000р | |
| Лазерное удаление кожного новообразования до 10 мм | 2500р | |
Обезболивание | ||
| Артикаин | 500р | |
Гистологическое исследование удалённого новообразования (исследование проводит лаборатория Бион) | ||
| Гистологическое исследование удалённого новообразования (одно новообразование) | 1 неделя | 2200р |
Записаться на прием или получить консультацию можно по телефону или через мессенджеры.
Родинки (невусы) могут визуально изменяться со временем. Существующие невусы могут увеличиваться в размерах, приобретать более сильную окраску в подростковом возрасте и во время беременности. Воздействие солнца и солярия доказано являются стимулом для роста невусных клеток. У большинства взрослых имеется от 12 до 20 родинок. Большее количество может быть семейной особенностью.
Приобретенные невусы вначале появляются в виде плоских, круглых и равномерно окрашенных папул. Невусы могут быть лишь немного темнее окружающей кожи и слегка приподнятыми в центре.
Прежде всего, за состоянием родинок нужно наблюдать самостоятельно. Если вы отметили какие-либо видимые изменения или чувствуете дискомфорт в области родинки, обратитесь к онкологу.
Поводом для обращения к онкологу являются следующие замеченные пациентом признаки:
- Появление невуса после 30 лет, особенно на защищённых от воздействия солнца участках кожи.
- Появление асимметрии, «фестончатости» очертаний, изменение форм (неправильная форма: напоминающая географическую карту, с «заливами» и «полуостровами»).
- Заметное увеличение или уменьшение размера невуса, а также необычно быстрый рост.
- Появление зуда и жжения.
- Шелушение поверхности невуса с образованием сухих корочек.
- Изменение окраски невуса (неравномерный цвет: беспорядочное смешение различных оттенков красного, серого, синего с вкраплениями коричневого или чёрного цвета).
- Исчезновение кожного рисунка на поверхности невуса.
- Появление блестящей, глянцевой поверхности невуса.
- Появление дополнительных узелков на поверхности невуса или рядом с ним.
- Изъязвление поверхности невуса.
- Появление венчика покраснения вокруг невуса.
- Мокнутие поверхности невуса.
- Кровоточивость (спонтанная или при минимальной травматизации).
Невус, не имеющий вышеперечисленных признаков, желательно удалять в случае, если он располагается в заведомо травмируемых местах (пряжка ремня, бюстгалтер, волосистая часть головы, воротниковая, паховая и поясничная области) или подвергается частой инсоляции (воздействию солнечных лучей). Так как частая травматизация и воздействие ультрафиолета могут способствовать озлокачествлению.
Приходя к специалисту на процедуру необходимо понимать, что на месте удаленного образования в любом случае остаются рубчики. Удаленные невусы иногда могут рецидивировать.
В завершение хочется сказать — до сих пор вопрос тщательного изучения невусов остается открытым. До конца не ясны точные причины и механизмы их появления и развития, рецидивирования и озлокачествления. Каждая невусная клетка обладает «клональностью»- способностью давать прогрессирующий рост под воздействием различных факторов. Решение об удаление невуса в косметических целях должно быть взвешенным и обдуманным.
Материал подготовлен: врач дерматолог-косметолог, дерматоонколог Ратникова С.В.
Почему Вам следует обратиться к нам:
- Врачи дерматоонкологи клиники Code Beauty Medicine обязательно проводят дерматоскопию перед лазерным удалением родинок.
- В клинике косметологии Code Beauty Medicine имеется единственный в Долгопрудном эрбиевый лазер для удаления кожных новообразований.
- Удаление родинок эрбиевым лазером практически безболезненно и часто не требует анестезии.
- Лазерное удаление родинок оставляет минимальный рубчик, в сравнении с другими методами удаления, такими, как удаление электрокоагулятором или радиоволновым методом.
- Удаление родинок эрбиевым лазером позволяет сохранить неповрежденный материал для дальнейшего гистологического исследования.
Поделиться:
С вами работают:
Не знаете, какую процедуру выбрать?
Пройдите онлайн-тестирование и получите индивидуальный план косметологических процедур!
Родинки. Невусы — израильская онкологическая клиника ЛИСОД в Киеве, Украине
У многих людей на коже возникает накопление пигмента, называемое родинками. Чаще всего эти образования – доброкачественные. Но если они вдруг начинают менять размер, форму или цвет, то к этому явлению нужно отнестись очень серьезно, т.к. такие изменения могут быть опасны. Чтобы исключить рак, необходимо родинки удалить и провести гистологическое исследование. Если обнаружатся злокачественные родинки, то очень велика их возможность перерождения в меланому, рак кожи.
Виды родинок
Изменения кожи на небольшом участке – это родимые пятна или родинки. Они бывают несосудистые (на коже возникает темная или светлая пигментация, а также стебельчатые или бородавчатые возвышения) и сосудистые (ангиомы). У родинок нет выраженной локализации. Их можно обнаружить у только родившегося ребенка, и они могут появляться на протяжении всей жизни.
Гемангиомы (сосудистые родинки) имеют пурпурный или розовый цвет, их края бывают неровными, их размер может быть самым разным. Если на них надавить, они светлеют. Каппилярные родинки – плоские, находятся на поверхности кожи. Родинки кавернозные – узловатые, находятся в толще кожи, имеют бугристую поверхность. Бурые или серые бляшки различной формы с твердой и неровной поверхностью – это бородавчатые родинки. Темные бляшки, размер которых занимает от 1 см до больших участков на коже, – это родинки пигментные. У пигментно-волосатых родинок поверхность неровная, ее покрывают волосы.
Если на сетчатке глаз, на коже или слизистых оболочках возникают новообразования или пятна, – это невусы. Их можно обнаружить у человека в любом возрасте. Они могут возникнуть у женщин во время беременности. На их появление влияет солнечное излучение. Большинство таких новообразований приобретаются людьми в течение жизни. Поэтому термин «родимые пятна» не очень точен.
Почему родинки перерождаются? Почему возникают злокачественные родинки?
Родинки превращаются в злокачественные родинки, если присутствует раздражающий фактор. Особенно опасны большие дозы ультрафиолетового излучения, при которых в кожных клетках происходят необратимые изменения. Определить точно, какая доза опасна, невозможно, т.к. это индивидуально для каждого человека. Нужно знать, что следует избегать пребывания на солнце в течение длительного времени. Ожоги, которые можно получить, загорая, влияют на иммунитет кожи – возникают различные новообразования, злокачественные родинки. Очень осторожно к загару должны относиться беременные женщины. Во время беременности в организме происходят гормональные изменения, которые могут повлечь за собой перемены в состоянии кожи.
Если травмировать родинку, это может стать причиной возникновения опухоли. Если Вы случайно родинку повредили, обратитесь к онкологу обязательно – именно к врачу-онкологу, а не к терапевту.
Кто относится к группам риска?
Или позвоните:
0-800-500-110 — бесплатно по Украине;
+38 044 277-8-277 — ежедневно с 8.00 до 20.00
Врач оценивает форму и цвет родинок, анализирует их природу и потенциальную опасность.
- Люди, у которых на теле много родинок, и их диаметр больше 5 мм.
- Будущие мамы.
- Люди со светлой кожей и светлыми волосами.
- Люди, у которых очень много веснушек.
- Люди, у которых есть пигментные пятна.
Что такое меланоцитарная дисплазия?
Необходимо знать, что в начальной форме меланома излечивается. На ранней стадии диагноз называется меланоцитарная дисплазия и, несмотря на зловещее звучание, это заболевание успешно лечится. Главное, быть настороже и, заметив изменения, обязательно записаться на прием к врачу-онкологу.
Симптомы превращения родинок в злокачественные родинки
- Язвы или трещины на поверхности родинки.
- Потеря волос с области пятна или родинки.
- Неприятные ощущения, жжение в том месте, где находится родинка.
- Появление некроза, пятен, узлов рядом с родинкой.
- Размер родинки или пигментного пятна увеличивается.
- Изменяется (расплывается) граница пятна или родинки.
- Воспаление, краснота вокруг родинки.
- Родинка или пигментное пятно окрашены неравномерно.
- Образование кольца из черных узлов, которые сливаются вместе.
При обнаружении перечисленных выше признаков необходимо срочно получить консультацию онколога.
Как с родинкой поступать?
В целях профилактики родинки не удаляются, т.к. встречаются у людей часто, а развитие меланомы – явление редкое. Но, если замечены «рваные» края родинки, воспаление, зуд, боль, кровоточивость, увеличение размера родинки, нужно проконсультироваться с онкологом.
Меланома – очень коварное заболевание. Злокачественная опухоль развивается на коже медленно, иногда – десятки лет. Метастазы прорастают в мозг, в сердце, в легкие, в глаза. Заболеваемость во всем мире растет. 4% всех злокачественных новообразований составляет сегодня меланома.
Как лечатся подозрительные родинки?
Прежде всего – это хирургическое лечение: удаление родинки в пределах здоровых тканей. Затем проводится гистологическое исследование родинки. Еще раз подчеркиваем, что необходимо внимательно отнестись к любому изменению родинки – увеличению размера, изменению формы, окраски, появлению новых пятен.
Можно ли предупредить появление меланомы? Профилактика.
Ни в коем случае не находитесь на солнце с 11 до 16 часов. В это время ультрафиолетовые лучи очень опасны. Не поможет ни тент, ни шляпа, ни накидка – песок отражает солнечные лучи, их пропускают облака, мокрый купальный костюм. Искупавшись, примите обязательно душ, переоденьтесь в сухую одежду.
Помните, что водяные капли и кристаллическая морская соль на солнце превращаются в линзы, которые концентрируют лучи. При малейшем подозрении посетите специалиста.
Записаться на прием к дерматологу можно, позвонив в Информационный центр LISOD: 0-800-500-110 – бесплатная линия для звонящих со стационарных телефонов по Украине, 38 (044) 520-94-00 – ежедневно с 09:00 до 20:00
Родинка, атипичный (атипичный невус) у взрослых: состояние, методы лечения и фотографии — обзор
52760 34 Информация для Взрослые подпись идет сюда …Изображения невуса, нетипичные
Обзор
Атипичные родинки (атипичные невусы) или диспластические родинки (диспластические невусы) вызываются скоплением цветообразующих (вырабатывающих пигмент) клеток кожи (меланоцитов), в которых клетки растут ненормальным образом.Атипичные родинки могут возникать как новые поражения или как изменение существующей родинки. Поражения могут быть одиночными или множественными. При синдроме атипичного невуса можно увидеть сотни атипичных родинок. Люди с атипичными родинками могут подвергаться повышенному риску развития рака кожи (меланомы), причем риск увеличивается с увеличением количества атипичных родинок.
Кто в опасности?
- Атипичные родинки могут возникать в любом возрасте и у всех этнических групп.
- Атипичные родинки часто встречаются в семьях.
- Люди с атипичными родинками могут иметь в семейном анамнезе меланому.
Признаки и симптомы
- Атипичные родинки могут появиться на коже в любом месте. Поражения могут различаться по размеру и / или цвету.
- Они могут быть больше ластика карандаша (6 мм) и могут иметь различный цвет в пределах поражения от розового до красновато-коричневого и до темно-коричневого.
- Атипичные родинки могут быть более темно-коричневыми в центре или по краям (периферии).
- У людей с синдромом атипичного невуса могут быть сотни родинок разного размера и цвета.
Рекомендации по уходу за собой
- Защитные меры, такие как предотвращение воздействия солнечных лучей на кожу в часы пиковой нагрузки (с 10:00 до 15:00), ношение защитной одежды и нанесение солнцезащитного крема с высоким SPF, необходимы для снижения воздействия вредного ультрафиолетового (УФ) света.
- Ежемесячный самообследование кожи помогает обнаружить новые поражения или изменения в существующих поражениях.
- Убедитесь, что ваши атипичные родинки не являются признаком рака кожи (меланомы).Вспомните ABCDE очагов меланомы:
A — Асимметрия: одна половина поражения не отражает другую половину.
B — Граница: Границы неправильные или нечеткие (нечеткие).
C — Цвет: внутри родинки можно отметить более одного цвета.
D — Диаметр: Размер более 6 мм (примерно размер ластика карандаша) может быть проблемой.
E — Развитие: заметные изменения в поражении с течением времени являются подозрительными признаками рака кожи.
Когда обращаться за медицинской помощью
- Возникновение новой родинки (пигментного невуса) у взрослого человека необычно; при появлении нового пигментного поражения обратитесь к врачу для оценки.
- Людей с множественными родинками и необычными (атипичными) родинками следует осматривать дерматолога каждые 4–12 месяцев в зависимости от их прошлого и семейного анамнеза.
- Может быть трудно отличить атипичную родинку от нормальной, поэтому обратитесь за медицинской помощью, если вы не уверены в природе родинки или заметили изменения в родинке.
- Ваш врач может порекомендовать вам пройти биопсию или хирургическое удаление (иссечение) родинок необычного вида, чтобы выяснить, есть ли у вас атипичные родинки или меланома.
Процедуры, которые может назначить ваш врач
- Биопсия или хирургическое удаление (иссечение) могут быть выполнены, чтобы родинка могла быть исследована специалистом (патологом) для установления фактического диагноза.
- Как отмечалось ранее, люди с множественными и атипичными родинками должны регулярно посещаться дерматологом.Фотография всего тела или фотографии отдельных родинок могут быть полезны для отслеживания этих людей.
Надежных ссылок
MedlinePlus: РодинкиКлиническая информация и дифференциальный диагноз невуса, атипичныйСписок литературы
Болонья, Жан Л., изд. Дерматология , стр 17, 1770. Нью-Йорк: Мосби, 2003.
Фотография всего тела | Nevus Outreach
В июле 2010 года мы привлекли компанию Canfield Scientific к компании Derma-Trak Imaging Systems, которая, вероятно, является наиболее уважаемым поставщиком услуг фотографии всего тела (TBP) в стране, чтобы они приехали на нашу конференцию в Техас и сделали эту услугу доступной для всех присутствующих. .TBP — это назначенная врачом процедура, которую дерматологи используют, чтобы следить за внешним видом кожных покровов. В случае больших невусов, которые, как предполагается, следует «отслеживать на предмет изменений», фотография в настоящее время считается лучшим способом определить, изменилось ли пигментное поражение.
Зачем нужен TBP?
Мы сочли это важным по двум причинам. Во-первых, в нашем хранилище не было коллекции подходящих изображений людей с невусами, достойных медицинских исследований, но мы думали, что должны; нам вполне может понадобиться такой ресурс для будущих исследований невусов.Во-вторых, общеизвестно, что за эту процедуру сложно получить страховку, за которую нужно заплатить. Врачи назначают его, так как это важно для людей, страдающих большими невусами, но если страховка не покрывает его, пациенты, скорее всего, этого не сделают.
Учитывая нашу потребность в ресурсах исследовательского уровня и потребность пациентов в избавлении от страховых кошмаров, мы сочли целесообразным сделать эту услугу доступной для всех, кто приезжает на нашу конференцию, в обмен на то, что они позволят нам включить их изображения в наши хранилище данных.
Успех!
Перед конференцией 2010 года мы поставили перед собой цель сфотографировать 10 пациентов. Когда осела пыль, мы сфотографировали 68 пациентов! Мы были настолько воодушевлены поддержкой всех этих пациентов, что продолжали предлагать эту услугу на наших встречах в 2012 и 2014 годах. На момент написания этой статьи мы сфотографировали более 100 пациентов, причем некоторых из них несколько раз за несколько лет. .
The Science
Самое первое научное применение, в которое мы поместили фотографии, было получено на организованном Nevus Outreach Международном экспертном совещании 2011 года по большим врожденным меланоцитарным невусам и нейрокожному меланоцитозу в Тюбингене, Германия.Команда врачей во главе с доктором Свеном Кренгелем хотела разработать новую систему для более организованного и систематического описания врожденных невусов.
Наша команда опубликовала эту новую систему классификации после использования фотографий многих наших пациентов в качестве тестовых примеров. Возникает вопрос, можем ли мы повысить уровень согласованности описаний, когда два разных врача смотрят на одного и того же пациента? После подтверждения того, что эта цель будет достигнута с помощью новой системы классификации, она была снова опубликована.
Следующие шаги
Теперь, когда у нас есть такой большой пул фотографий, все из которых были сделаны с использованием одного и того же оборудования в одинаковых условиях, следующим шагом будет поиск способов использования фотографий для улучшения ухода за пациентами. поражены врожденными меланоцитарными невусами. Представьте себе, например, как можно было бы улучшить диагностику, если бы мы могли анализировать данные, полученные путем анализа этих цифровых фотографий с высоким разрешением. Если мы можем измерить, например, площадь поверхности тела, которую покрывает невус, и подсчитать количество спутников с гораздо большей точностью, чем мы делаем в настоящее время, или степень роста волос, или метрику текстуры или цвета, мы можем быть умеет более правильно прогнозировать факторы риска меланомы и нейрокожного меланоцитоза.
От имени всех сотрудников Nevus Outreach мы хотим поблагодарить всех пациентов, принявших участие в проекте, и призываем всех людей, страдающих врожденными невусами, участвовать в будущих возможностях фотографии всего тела.
Проект Total Body Photography на конференции Nevus Outreach 2010 имел беспрецедентный успех. Мы надеялись сфотографировать 10 пациентов, но в итоге получилось 68! Чтобы обработать так много, потребовалось немного больше времени, но с помощью наших усердных работников мы разослали результаты всем участникам.С тех пор мы предлагали эту услугу на конференциях 2012 и 2014 годов, и на сегодняшний день мы сфотографировали более 100 пациентов.
Воспроизводимое количество невусов с использованием трехмерной фотографии всего тела и сверточных нейронных сетей — FullText — Дерматология
Абстрактные
Справочная информация: Количество невусов на человеке является самым сильным фактором риска меланомы; однако подсчет родинок сильно различается из-за отсутствия последовательной методологии и отсутствия согласия между экспертами.Было показано, что машинное обучение является ценным инструментом для классификации изображений в дерматологии. Цели: Проверить, возможен ли автоматизированный воспроизводимый подсчет родинок с помощью комбинации сверточных нейронных сетей (CNN) и трехмерной (3D) визуализации всего тела. Методы: Полные изображения тела из исследования невусов в общей популяции использовались для обучения (82 субъекта, 57 742 поражения) и тестирования (10 субъектов; 4868 поражений) наборов данных для разработки CNN.Старший дерматолог назвал поражения как невусы или нет («не невусы») в качестве золотого стандарта. Производительность CNN оценивалась с использованием чувствительности, специфичности и каппа Коэна и оценивалась на уровне поражения и на уровне человека. Результаты: Анализ уровня поражения, сравнивающий автоматизированный подсчет с золотым стандартом, показал чувствительность и специфичность 79% (76–83%) и 91% (90–92%), соответственно, для поражений ≥2 мм, и 84% (75–91%) и 91% (88–94%) для поражений ≥5 мм.Каппа Коэна составляла 0,56 (0,53–0,59), что указывает на умеренное согласие для невусов ≥2 мм и существенное согласие (0,72, 0,63–0,80) для невусов ≥5 мм. Для 10 человек в тестовой выборке согласие на уровне человека оценивалось по категориям с 70% совпадением между автоматическим подсчетом и подсчетом по золотому стандарту. Согласие было ниже у пациентов с многочисленными себорейными кератозами. Заключение: Автоматический подсчет родинок с разумным согласием с таковыми опытного клинициста возможен благодаря комбинации трехмерной фотографии всего тела и CNN.Такой алгоритм может обеспечить более быстрый и воспроизводимый метод по сравнению с традиционным индивидуальным подсчетом родинок всего тела.
© 2021 Автор (ы) Опубликовано S. Karger AG, Базель
Введение
Медицинская визуализация становится все более распространенным средством диагностики и мониторинга заболеваний. Он особенно подходит для дерматологии, учитывая визуальный характер кожных заболеваний. Поскольку диагностика часто основывается на субъективной оценке практикующих врачей, добавление последовательных изображений может значительно помочь в отслеживании эволюции или прогрессирования поражения.Меланома — одно из таких состояний кожи, которое может значительно выиграть от точного и объективного мониторинга кожи, так как долгосрочный прогноз в значительной степени зависит от раннего обнаружения [1].
Самым сильным известным фактором риска меланомы является количество меланоцитарных невусов [2, 3]. Однако подсчет невусов очень субъективен, и нет единого мнения о стандартной методологии подсчета. Зарегистрированное количество невусов различается в зависимости от места исследования тела, размера подсчитываемых невусов (> 2 мм,> 3 мм,> 5 мм) и того, кто их считает (практикующие врачи, обученные исследователи, самоотчет) [4, 5].Следовательно, объективно зарегистрированные результаты визуализации могут быть полезны для выявления людей с высоким риском меланомы; Следовательно, необходим стандартизированный, объективный и повторяемый алгоритм подсчета родинок.
Традиционно для наблюдения за всеми невусами на всей поверхности кожи человека использовалась двухмерная фотография всего тела. Это требует времени и ресурсов и требует от фотографа в среднем 24 снимков объектов в разных позах [6]. Было показано, что использование 2D-визуализации всего тела снижает количество биопсий и повышает точность диагностики у людей с высоким риском меланомы [7].Внедрение трехмерной (3D) фотографии всего тела позволяет одновременно делать 92 изображения, которые затем превращаются в трехмерный аватар [8]. Однако валидность и клиническое применение трехмерной фотографии всего тела для идентификации поражения еще не были продемонстрированы.
Учитывая большой объем данных, собранных с помощью трехмерной визуализации всего тела, автоматические методы обнаружения и классификации поражений очень помогут клиницистам и исследователям. Была предпринята попытка автоматического подсчета родинок с использованием относительно несложных изображений пигментных поражений на спине детей [9]; однако более сложная задача по различению невусов среди различных типов пигментных поражений на фотостаренной коже взрослых не решалась.Недавние исследования показали, что сверточные нейронные сети (CNN) в большинстве случаев способны классифицировать дерматоскопические изображения пигментных поражений с большей точностью по сравнению с группой экспертов-людей [10], с потенциалом взаимодействия человека и компьютера, чтобы обеспечить дальнейшее развитие. улучшения [11]. Целью этого исследования было измерить надежность глубокой нейронной сети, чтобы помочь в идентификации невусов по трехмерной фотографии всего тела экосистемы поражения кожи, и обеспечить подсчет невусов всего тела, чтобы помочь в стратификации риска меланомы [2 , 3].
Методы
Краткое описание методов показано на рис. 1.
Рис. 1.
Рабочий процесс от визуализации до автоматического подсчета родинок.
Разработка алгоритма подсчета невусов
Наборы обучающих и тестовых данных были случайным образом выбраны из трехмерных аватаров субъектов исследования «Не забывай о своих родинках» [12], популяционного когортного исследования в Квинсленде, Австралия. Субъекты получали с помощью VECTRA®WB360 (Canfield Scientific Inc., Парсиппани, Нью-Джерси, США), который одновременно делает 92 изображения, объединяя их в трехмерный аватар [8].Демографические факторы были собраны с использованием стандартных вопросников с клиническими характеристиками, собранными научными сотрудниками, как описано ранее [12].
Для обучения CNN обычно рекомендуется предоставлять не менее 5000 помеченных изображений для каждой категории [13]. Тренировочная выборка из трехмерных аватаров 82 случайно выбранных субъектов состояла из 57 742 автоматически обнаруженных изображений поражения ≥2 мм в диаметре (рис. 1). Количество поражений на одного пациента варьировалось от 59 до 4 125 (в среднем 539).Возраст исследуемой популяции варьировался от 23 до 69 (медиана 55) лет, 52 (62%) составляли мужчины. У всех испытуемых были типы кожи по Фитцпатрику I – IV. Семь субъектов (9%) сообщили о меланоме в личном анамнезе. Все поражения были помечены на экране как невусы ( n = 5,106, 10%) или не-невусы ( n = 52 636, 90%) старшим дерматологом с большим опытом использования системы VECTRA. Независимый тестовый набор изображений от дополнительных 10 субъектов был помечен на экране независимо тремя опытными врачами с консенсусом, рассчитанным как согласие ≥2 клиницистов.Кроме того, невусы вручную определялись в клинике старшим дерматологом с помощью дерматоскопа — это считалось золотым стандартом для набора тестов. Чтобы сопоставить подсчет в клинике с автоматическим подсчетом общего трехмерного изображения тела, повреждения под нижним бельем, на коже черепа или подошвах ног не учитывались. Между показом на экране и маркировкой в клинике требовался минимум 1 месяц. Для большей повторяемости для классификации учитывались только поражения ≥2 мм.
Сверточная нейронная сеть
Тайловое изображение с поправкой в перспективе каждого поражения было создано путем перепроецирования исходных 2D-изображений поражений с использованием калиброванной информации трехмерной геометрии трехмерного аватара.Это создавало вид поражения, как если бы оно было сфотографировано перпендикулярно поверхности кожи. Затем был сконструирован двухклассовый классификатор CNN, который принимал одно мозаичное изображение поражения и выводил вероятность того, что поражение принадлежало классам «Naevus» и «Non-Naevus». Три из 82 обучаемых субъектов были случайным образом выбраны для формирования набора для проверки гиперпараметров CNN. Таким образом, набор для проверки состоял из 1023 изображений поражений (1,8%), включая 248 невусов. Из-за несбалансированности классов в наборе данных изображения в классе «Naevus» были воспроизведены 8 раз для облегчения обучения.Полные данные обучения были дополнительно расширены за счет случайных поворотов, переворотов, регулировки интенсивности, контраста и цвета для уменьшения переобучения. CNN была построена как три блока из двух сверточных слоев, объединяющего слоя и активации выпрямленного линейного блока, за которыми следовали два полностью связанных слоя. Веса сети были инициализированы из предварительно обученной сети анализа повреждений. Обучение происходило с использованием фреймворка глубокого обучения Caffe [14] на двух графических процессорах Nvidia 1080Ti с использованием оптимизатора среднеквадратичного распространения за 500 эпох (итераций всего набора данных) с планировщиком скорости обучения с сигмовидным распадом.
Статистический анализ
Эффективность алгоритма и врачей сравнивали как на уровне поражения, так и на уровне человека. Идентификации на экране 3 опытных клиницистов по 10 испытуемым сравнивались с идентификациями, полученными с помощью автоматизированного алгоритма VECTRA, описанного выше. Каппа Коэна [15], специфичность, чувствительность и общее согласие были рассчитаны с использованием клинической классификации, используемой в качестве золотого стандарта. На уровне человека общее количество ≥5 мм сравнивалось с использованием Предела согласия Бланда-Альтмана.Кроме того, подсчеты (≥2 мм) были разделены на «немного» (<20), «некоторые» (20–50), «много» (> 50) и сравнивались между собой методами подсчета.
Результаты
Набор тестовых данных
Тестовый набор включал 10 субъектов (5 мужчин, 5 женщин), случайно выбранных из общей когорты исследования, со средним возрастом 57 (37–67) лет. Все испытуемые были европейского происхождения, большинство со светлым врожденным цветом кожи ( n = 8, 80%) и голубыми / зелеными глазами ( n = 9, 90%). Пятьдесят процентов ( n = 5) сообщили о кератиноцитарном раке в анамнезе, а 3 (30%) сообщили о меланоме в анамнезе (все in situ) (доп.Таблица 1; для всех онлайн-дополнений. материалы см. www.karger.com/ doi / 10.1159 / 000517218).
Анализ уровня поражения в тестовой выборке
Из 4868 поражений ≥2 мм, проанализированных у 10 субъектов, невусы, выявленные в клинике, составляли 11% ( n = 520) всех поражений ≥2 мм и 21% ( n = 83) из 388 очагов ≥5 мм, а остальные — другие доброкачественные поражения (например, солнечный лентиго, себорейный кератоз, ангиомы).
Идентификация невуса на экране в сравнении с золотым стандартом в клинике
Общее согласие для идентификации на экране по сравнению с золотым стандартом идентификации в клинике врачом 1 (который выполнил экранный золотой стандарт для обучающей выборки) составило 90%.Каппа Коэна составила 0,45 (0,41–0,49), что указывает на умеренное согласие, с чувствительностью 50% (45–54%) и специфичностью 94% (93–95%). Снижение чувствительности и повышение специфичности наблюдались как у врача 1, так и у клиницистов (таблица 1) по поводу определения невусов ≥5 мм. Сопоставимое согласие было замечено между консенсусом трех врачей на экране и подсчетами в клинике (Таблица 1).
Таблица 1.
Точечные оценки и 95% доверительные интервалы для автоматической классификации родинок по сравнению с золотым стандартом подсчета родинок в клинике в тестовой выборке (N = 10; n = 4868) Классификация
Чувствительность и специфичность автоматизированной CNN для поражений ≥2 мм составила 79% (76–83%) и 91% (90–92%), соответственно (Таблица 1).Для поражений ≥5 мм автоматизированный алгоритм показал немного более высокую чувствительность — 84% (75–91%) и аналогичную специфичность — 91% (88–94%). Сравнение CNN с клинической оценкой дерматолога дало каппа Коэна 0,56 (0,53–0,59), что указывает на умеренное согласие для невусов ≥2 мм и существенное согласие (0,72, 0,63–0,80) для невусов ≥5 мм.
Анализ на уровне человека
Корреляция между автоматическим и клиническим подсчетом невуса общего тела
Была замечена отличная корреляция между подсчетом AI и тегами на экране врача для обучения (87%, рис.2a), а также между подсчетами AI и набором тестовых данных золотого стандарта (97%, рис. 2b). Однако средняя разница между автоматическим подсчетом и подсчетом в клинике составила 11, с межквартильным диапазоном 4–19 для обучения и 6–44 для тестовой выборки. Когда подсчет родинок был преобразован в категории (несколько, несколько, много), алгоритм и согласие в клинике составили 70% (таблица 2). В двух (20%) случаях несоответствия эксперт-дерматолог оценил количество родинок в несколько (<20), а алгоритм - в некоторые (20–50) категорий.В третьем случае дерматолог оценил количество как небольшое, а AI оценил его как большое количество (> 50). Было отмечено, что у двух субъектов, у которых количество родинок не соответствовало наибольшему расхождению между алгоритмом и дерматологом, было много себорейных кератозов; это явление также было замечено в обучающем наборе данных (рис. 3). Когда два пациента с множеством себорейных кератозов были исключены, пределы согласия Бланда-Альтмана показали, что 95% автоматизированных подсчетов ≥5 мм находились в пределах ± 5 от клинических показателей золотого стандарта (79% подсчетов находились в пределах ± 3). .
Таблица 2.
Общее количество родинок на теле (≥2 мм) на основе консенсуса на экране между 3 клиницистами, врач 1 подсчет на экране и в клинике (золотой стандарт), подсчет AI и категория самоотчета
Рис. 2.
Корреляция между автоматическим подсчетом и подсчетом на экране для набора обучающих данных ( a ), а также между автоматическим и клиническим золотым стандартом для набора тестовых данных ( b ).
Рис. 3.
Изображения спины с аннотациями общего подсчета родинок тела по золотому стандарту клиники (Clin) и автоматизированному подсчету искусственного интеллекта (AI).У субъектов с массами g и i было много себорейного кератоза на теле, и AI варьировался пропорционально больше всего.
Обсуждение
В этом исследовании мы разработали и протестировали алгоритм автоматического подсчета родинок всего тела на основе трехмерной фотографии всего тела на основе 57 742 автоматически обнаруженных кожных повреждений ≥2 мм у 82 участников исследования. Помимо того, что это первый алгоритм, применяемый к таким данным, он обеспечивает экономящий время объективный метод стандартизации подсчета невусов.Общая точность идентификации отдельных невусов была высокой, при этом автоматизированный подсчет невусов показывал разумное соответствие с золотым стандартом подсчетов дерматологов в клинике.
Меры межэкспертной надежности подсчета общего количества невусов на теле редко приводятся в литературе, вероятно, из-за того, что получение подсчетов невусов на множестве одних и тех же людей несколько раз несколькими наблюдателями занимает много времени. Воспроизводимость общего количества невусов чаще отмечается у детей, у которых невусы легче идентифицировать, чем у взрослых, из-за снижения уровней фотоповреждений и почти полного отсутствия других доброкачественных образований у молодежи, которые являются общими для старения, таких как солнечный лентиго и т. Д. себорейный кератоз [16].В исследованиях, в которых сообщается о межэкспертной надежности, это часто указывается как корреляция, которая, как правило, высока (например, naevi ≥2 мм: r = 0,88 [17], r = 0,95 [18]), но корреляция не точно отражает согласие [19]. Из-за низкого уровня согласия между подсчетами невусов, подсчеты часто классифицируются, а согласие измеряется с помощью Каппа Коэна (). У взрослых межэкспертная надежность подсчета родинок ≥2 мм на левой руке между обученными интервьюерами и дерматологом была низкой (четыре категории: 0, 1–4, 5–10, 11+, = 0.19) или умеренного (= 0,51) между двумя дерматологами [20]. Согласие между экспертами двух врачей-дерматологов по количеству невусов любого размера было существенным (четыре категории: 1–10, 11–500, 51–100,> 100; = 0,66). Аналогичные результаты были получены при самостоятельной классификации невусов (любого размера) по сравнению с дерматологом (пять категорий: 0, 1–9, 10–39, 40–100,> 100, = 0,14) и для невусов ≥2. мм (5 категорий: ≤5, 6–15, 16–30, 31–50, 51+, = 0,19 [21]), улучшается до = 0,32 с двумя категориями (<50, ≥50) [22].Для общего количества невусов ≥5 мм 79% самооценок и подсчетов врача согласовывались в пределах ± 3 единиц [5]. Это похоже на соглашение, наблюдаемое между автоматизированным подсчетом, полученным CNN, и золотым стандартом в клинике.
Автоматическая категоризация биологической экосистемы невусов и других доброкачественных поражений кожи имеет потенциальную ценность для лучшего понимания развития меланомы и рака кератиноцитов. Однако независимо от того, является ли конкретное поражение доброкачественным невусом или доброкачественным новообразованием другого типа (например,g., солнечное лентиго или себорейный кератоз) представляет в основном академический интерес; В реальных клинических условиях практикующего врача обычно интересует только то, является ли поражение подозрительным на злокачественность. Следовательно, клиническая полезность этого алгоритма — различение доброкачественного невуса и другого типа доброкачественного поражения («non-naevus») — заключается в его способности обеспечивать мгновенный и точный подсчет невуса, который можно использовать для объективной классификации риска меланомы у человека. .
Ведутся споры о том, как лучше всего представить подсчет невусов, и категориальный подсчет был предложен как более универсальный [23].Были предложены различные пороговые значения [24], но консенсуса не было достигнуто. Некоторые исследования показали, что увеличение даже одного невуса увеличивает риск меланомы у человека [25]. Значительные различия в моделях риска и недостаточная воспроизводимость методов подсчета родинок могут, таким образом, привести к неправильной классификации риска меланомы [26].
Несмотря на то, что наш подход является многообещающим, существуют ограничения, которые необходимо улучшить в будущей работе. Это включает идентификацию невусов для тренировочного набора на экране, а не лично; тем не менее, золотым стандартом для набора тестов был принят старший дерматолог в клинике.В то время как набор тестов был небольшим с точки зрения субъектов ( n = 10), соответствующее количество тестовых поражений было большим ( n = 4868). Однако это означало, что мы не смогли оценить, работает ли алгоритм по-разному для разных характеристик объекта, таких как уровень фотоповреждения или пола. Например, в нашем тестовом наборе алгоритм перевыпустил счет у всех 5 мужчин, но это могло быть просто случайностью. Также необходимо доработать этот алгоритм для более темных типов кожи, не включенных в исследуемую популяцию.Алгоритм плохо работал у людей с множеством себорейных кератозов, но таких людей можно легко идентифицировать в клинике и пометить для ручного подсчета. В качестве альтернативы, алгоритм классификации, обученный определять как невусы, так и себорейный кератоз, может решить эту проблему. Еще одно ограничение заключается в том, что даже для опытных дерматологов иногда невозможно различить доброкачественные невусы и доброкачественные «не невусы» диаметром от 2 до 5 мм на сильно поврежденной светом коже, и поэтому даже сама клиническая оценка золотого стандарта не может быть полностью надежным.
В заключение, стандартизированная, объективная и повторяемая методика подсчета родинок, особенно с учетом размера родинок, необходима для точной оценки количества родинок как фактора риска меланомы. Трехмерная фотография всего тела в сочетании с автоматизированным алгоритмом, таким как тот, который представлен в этом исследовании, может дать дополнительное представление о биологической экосистеме невусов и других доброкачественных поражений кожи и имеет потенциальную ценность для лучшего понимания движущих сил развития меланомы и рака кератиноцитов.
Ключевое сообщение
Автоматизированное воспроизводимое количество родинок можно рассчитать путем применения машинного обучения к трехмерным изображениям всего тела.
Выражение признательности
Авторы хотели бы поблагодарить участников исследования, научных сотрудников Кейтлин Нуфер, Шанталь Рутжес, Кейтлин Хоршам, Сайру Санджиду и Монтану О’Хара за их помощь в управлении данными, а также Группу клинических исследований Центра дерматологических исследований за сбор данных. изображения.
Заявление об этике
Это исследование было одобрено Комитетом по этике исследований на людях больницы принцессы Александры (HREC / 09 / QPAH, 7 февраля 2009 г.) и Университета Квинсленда (UQ200
Заявление о конфликте интересов
H.P.S. является акционером e-derm consult GmbH и MoleMap от Dermatologies Pty Ltd. Он регулярно предоставляет теледерматологические отчеты для обеих компаний. H.P.S. также консультирует Canfield Scientific Inc., Revenio Research Oy и является консультантом First Derm TM .
Источники финансирования
Эта работа была поддержана Национальным советом по здравоохранению и медицинским исследованиям — схема центра передового опыта (номер гранта: APP1099021).H.P.S. также финансируется Фондом будущих медицинских исследований — стипендиатом программы клинических исследователей нового поколения (APP1137127).
Вклад авторов
B.B.S. имел полный доступ к данным и берет на себя ответственность за целостность данных и точность анализа данных. B.D., H.P.S., M.J., UK, E.P .: концепция и дизайн исследования. B.D. разработал алгоритм ИИ. H.P.S., S.W.M., R.H.W., Великобритания: сбор данных. B.B.S., B.D .: анализ и интерпретация данных.B.B.S., U.K., A.C.G., H.P.S .: составление рукописи. B.B.S .: статистический анализ. A.C.G., H.P.S .: учебный надзор.
Ссылки
- Грин AC, Olsen CM, Hunter DJ. Учебник эпидемиологии рака. Оксфорд: издательство Оксфордского университета; 2018 г.
- Usher-Smith JA, Emery J, Kassianos AP, Walter FM.Модели прогнозирования риска для меланомы: систематический обзор. Биомаркеры эпидемиологии рака Пред. 2014. 23 (8): 1450–63.
- Olsen CM, Pandeya N, Thompson BS, Dusingize JC, Webb PM, Green AC, et al. Стратификация риска меланомы: модели, полученные и проверенные в специально созданной предполагаемой когорте.J Natl Cancer Inst. 2018; 110: 1075–83.
- Галлахер Р.П., Маклин Д.И. Эпидемиология приобретенных меланоцитарных невусов. Краткий обзор. Dermatol Clin. 1995. 13 (3): 595–603.
- Лоусон Д.Д., Мур Д.Х. 2-й, Шнайдер Д.С., Сейджбиэль Р.В.Невус считается фактором риска меланомы: сравнение самостоятельного подсчета с подсчетом врачом. J Am Acad Dermatol. 1994; 31 (3 Pt 1): 438–44.
- Денгел Л.Т., Петрони Г.Р., судья Дж., Чен Д., Актон С.Т., Шроен А.Т. и др. Фотосъемка всего тела для скрининга рака кожи. Int J Dermatol.2015; 54 (11): 1250–4.
- Чыонг А., Страззулла Л., Марч Дж., Буше К.М., Нельсон К.С., Ким С.К. и др. Уменьшение количества биопсий невуса у пациентов под наблюдением с помощью фотографии всего тела. J Am Acad Dermatol. 2016; 75 (1): 135 – e5.
- Райнер Дж. Э., Лайно А. М., Нуфер К. Л., Адамс Л., Рафаэль А. П., Мензис С. В. и др.Клиническая перспектива трехмерной фотографии всего тела для раннего выявления и скрининга меланомы. Фронт Мед (Лозанна). 2018; 5: 152.
- Ли Т.К., Аткинс М.С., Кинг М.А., Лау С., Маклин Д.И. Автоматический подсчет родинок по задним изображениям. IEEE Trans Biomed Eng. 2005; 52 (11): 1966–9.
- Tschandl P, Codella N, Akay BN, Argenziano G, Braun RP, Cabo H и др.Сравнение точности человеческих читателей с алгоритмами машинного обучения для классификации пигментных поражений кожи: открытое международное диагностическое исследование на базе Интернета. Ланцет Онкол. 2019; 20 (7): 938–47.
- Tschandl P, Rinner C, Apalla Z, Argenziano G, Codella N, Halpern A и др.Сотрудничество человека и компьютера для распознавания рака кожи. Nat Med. 2020; 26 (8): 1229–34.
- Ко У, Джанда М., Эйткен Дж. Ф., Даффи Д. Л., Мензис С., Штурм Р. А. и др. Не забывайте об исследовании своих родинок: протокол проспективного когортного исследования меланоцитарных невусов. BMJ Open. 2018; 8 (9): e025857.
- Goodfellow I, Bengio Y, Courville A, Bengio Y.Глубокое обучение. Кембридж: MIT Press; 2016 г.
- Джиа Ю., Шелхамер Э., Донахью Дж., Караев С., Лонг Дж., Гиршик Р. и др. и другие. Caffe: сверточная архитектура для быстрого встраивания функций. Материалы 22-й Международной конференции ACM по мультимедиа; 2014. с. 675–678.
- Ландис-младший, Кох Г.Г.Измерение согласия наблюдателя для категориальных данных. Биометрия. 1977; 33 (1): 159–74.
- Йитман Дж. М., Килкенни М., Маркс Р. Распространенность себорейных кератозов среди населения Австралии: влияет ли воздействие солнечного света на их частоту? Br J Dermatol. 1997. 137 (3): 411–4.
- Грулич А.Е., Батай В., Свердлов А.Дж., Ньютон-Бишоп Дж. А., Кузик Дж., Херси П. и др. Naevi и пигментные характеристики как факторы риска меланомы в популяции высокого риска: исследование случай-контроль в Новом Южном Уэльсе, Австралия. Int J Cancer. 1996. 67 (4): 485–91.
- Батай V, Snieder H, МакГрегор AJ, Sasieni P, Spector TD.Генетика факторов риска меланомы: исследование невусов и веснушек у взрослых близнецов. J Natl Cancer Inst. 2000. 92 (6): 457–63.
- Бланд Дж. М., Альтман Д. Г.. Статистические методы оценки соответствия между двумя методами клинического измерения. Ланцет. 1986; 1 (8476): 307–10.
- Байлз Дж. Э., Хеннрикус Д., Сансон-Фишер Р., Херси П.Надежность невуса важна для выявления людей с высоким риском злокачественной меланомы. Br J Dermatol. 1994. 130 (1): 51–6.
- Buettner PG, Garbe C. Соглашение между самооценкой меланоцитарных невусов пациентами и дерматологическим обследованием. Am J Epidemiol. 2000. 151 (1): 72–7.
- Карли П., Де Джорджи В., Нардини П., Манноне Ф., Палли Д., Джаннотти Б. Частота обнаружения меланомы и соответствие между самостоятельным осмотром кожи и клинической оценкой у пациентов, посещающих клинику пигментных поражений в Италии. Br J Dermatol. 2002. 146 (2): 261–6.
- Морз К.Дж., Олсен С.М., Перри С.Л., Джекман Л.М., Раньери Б.А., О’Брайен С.М. и др.Хорошая воспроизводимость повторных тестов для инструмента для выявления факторов риска меланомы, о которых сообщают сами. J Clin Epidemiol. 2012. 65 (12): 1329–36.
- Риберо С., Зугна Д., Оселла-Абате С., Гласс Д., Натан П., Спектор Т. и др. Прогнозирование высокого количества невусов у здорового населения Великобритании для оценки риска меланомы.Br J Dermatol. 2016; 174 (2): 312–8.
- Гандини С., Сера Ф., Каттаруцца М.С., Паскини П., Абени Д., Бойл П. и др. Мета-анализ факторов риска меланомы кожи: I. Общие и атипичные невусы. Eur J Cancer. 2005. 41 (1): 28–44.
- Betz-Stablein B, Koh U, Plasmeijer EI, Janda M, Aitken JF, Soyer HP и др.Самостоятельная оценка плотности невуса может привести к неправильной классификации риска меланомы. Br J Dermatol. 2020; 182 (6): 1488–90.
Автор Контакты
Бриджид Бец-Стэблин, [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Поступила: 10 ноября 2020 г.
Дата принятия: 7 марта 2021 г.
Опубликована онлайн: 8 июля 2021 г.
Количество страниц для печати: 8
Количество рисунков: 3
Количество столов: 2
ISSN: 1018-8665 (печатный)
eISSN: 1421-9832 (онлайн)
Для дополнительной информации: https: // www.karger.com/DRM
Лицензия открытого доступа / Дозировка лекарства / Отказ от ответственности
Эта статья находится под международной лицензией Creative Commons Attribution-NonCommercial 4.0 (CC BY-NC). Для использования и распространения в коммерческих целях требуется письменное разрешение. Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новое и / или редко применяемое лекарство. Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
случаев новых и измененных невусов и меланом, обнаруженных с помощью исходных изображений и дерматоскопии у пациентов с высоким риском меланомы | Дерматология | JAMA дерматология
Цель Определить частоту появления новых, измененных и регрессивных невусов и меланом в когорте пациентов с высоким риском меланомы с использованием базовой фотографии всего тела и дерматоскопии.
Дизайн Когортное исследование пациентов с высоким риском меланомы, которым была сделана исходная фотография кожи в период с 1 января 1992 г. по 31 декабря 1997 г. и которые имели как минимум 1 контрольный визит к 31 декабря 1998 г.
Настройка Кабинеты частной практики 1 дерматолога в сочетании с многопрофильной клиникой меланомы на базе государственной больницы в Виктории, Австралия.
Пациенты Всего 309 пациентов, которые имели по крайней мере 1 из следующих факторов риска меланомы: личный анамнез, семейный анамнез, 100 или более невусов или 4 или более диспластических невусов.
Основные показатели результатов Количество новых, измененных и регрессирующих невусов и меланом, обнаруженных и удаленных в течение периода исследования.
Результаты Частота появления новых, измененных и регрессивных невусов уменьшалась с возрастом ( P <0,001), тогда как частота возникновения меланом увеличивалась ( P = 0,05). Количество диспластических невусов на исходном уровне положительно ассоциировалось с частотой измененных невусов ( P <.001) и меланомы ( P = 0,03). Использование исходной фотографии и дерматоскопии было связано с низкими показателями биопсии и ранним обнаружением меланом. Развитие меланомы в сочетании с ранее существовавшим невусом не коррелировало напрямую с изменением ранее существовавшего поражения, отслеживаемого с помощью базовой фотографии.
Выводы Невусы динамичны, и лишь небольшой процент всех новых и измененных меланоцитарных поражений — это меланомы. Пациенты моложе 50 лет имели более низкую частоту меланом и более высокую частоту новых, измененных и регрессивных невусов по сравнению с пациентами старше 50 лет.Новое или измененное пигментное поражение с большей вероятностью будет меланомой у пациентов старше 50 лет.
Наблюдение за кожей хорошо описано как эффективный метод раннего выявления меланомы. 1 -5 Важным подспорьем в этом процессе скрининга является базовая фотография кожи. Сообщается, что это эффективный метод обнаружения изменений, указывающих на меланому, и средство минимизации ненужных операций. 1 , 3 , 5 , 6
При фотографическом наблюдении за кожей сообщалось о высокой заболеваемости меланомой и раннем обнаружении меланомы у пациентов из группы высокого риска. 1 , 3 , 5 , 7 При наблюдении за такими пациентами выявляется много новых и измененных пигментных поражений. Не все эти поражения указывают на меланому, и, наряду с дерматоскопией, многие из них можно лечить с помощью повторной визуализации и дальнейшего наблюдения. Это исследование направлено на определение доли новых и измененных очагов, которые являются меланомами, а также частоты возникновения меланом и новых, измененных и регрессивных невусов.
Мы набирали пациентов в частных кабинетах 1 дерматолога (J.W.K.) совместно с Victorian Melanoma Service, государственной мультидисциплинарной консультационной службой по лечению меланомы кожи (J.W.K., J.P.B. и J.P.D.). В период с 1 января 1992 г. по 31 декабря 1997 г. пациенты 16 лет и старше, поступившие в консультационные кабинеты для полного кожного обследования, оценивались на соответствие критериям. Базовая фотография поверхности кожи предлагалась, если у пациента имелся хотя бы 1 из следующих факторов риска меланомы: 4 или более клинически диспластических невусов, 8 , 9 100 или более меланоцитарных невусов, 8 , 9 личных история меланомы, 10 , 11 или семейная история меланомы. 12 , 13
В исследование были включены все 309 пациентов (168 женщин и 141 мужчина), у которых были исходные фотографии и которые посетили по крайней мере один повторный визит к 31 декабря 1998 года. Пациенты были разделены по возрасту на момент фотографирования: моложе 30 лет, от 30 до 39 лет, от 40 до 49 лет и от 50 лет и старше. При входе в исследование пациентам сообщали о высоком риске развития меланомы, рекомендовалось трехмесячное самообследование, обсуждались клинические особенности ранней меланомы и описывались соответствующие меры защиты от солнца.
Пациенты имели набор из 14 базовых фотографий кожи, каждый вид определялся легко расположенными анатомическими ориентирами (рис. 1). Кожа головы, тыльная поверхность рук, ладони, подошвы и гениталии обычно не фотографировались. Использовалась 35-мм однообъективная зеркальная фотокамера (Nikon FM2; Nikon Corporation, Токио, Япония), оснащенная 105-миллиметровым макромодельным объективом, способным фокусироваться с увеличением 1: 2 или более. Пациент располагался перед серым фоном, а две электронные студийные вспышки (1200 Вт-секунды), каждая из которых рассеивалась с помощью больших софтбоксов, были расположены под углом 45 ° к пациенту.Это смягчило любые грубые тени. Цветные слайды были проявлены из пленки Fujichrome 100 (Fujifilm, Токио, Япония) и спроектированы с помощью проектора Kodak Ektagraphic Projector (Kodak, Рочестер, Нью-Йорк).
Исходным уровнем была дата первоначальной фотографии кожи пациента. При первом осмотре пациента количество диспластических невусов регистрировалось в диапазоне от 0 до 10, от 11 до 20, от 21 и более. Кроме того, общее количество меланоцитарных невусов оценивалось и регистрировалось в пределах от 100 и менее до более 100.
Невус считался диспластическим, если он имел как клинические 14 , так и дерматоскопические 15 признаки, соответствующие диагнозу. Клинически диспластический невус имел макулярный компонент и демонстрировал по крайней мере 3 из следующих 5 клинических признаков: нечеткую границу, нерегулярно распределенную пигментацию, фоновую эритему, максимальный диаметр более 5 мм и нерегулярную границу. 14
Наблюдение за пациентами было запланировано с интервалами в 3, 6 или 12 месяцев.При каждом посещении дерматологом-исследователем (J.W.K.) проводился общий кожный осмотр тела, и все меланоцитарные невусы сравнивались с исходными фотографиями. Используя эти изображения, при каждом посещении регистрировали количество новых, измененных и полностью регрессированных невусов. Не делалось различий между обычными невусами и диспластическими невусами, а также между невусами, обнаруженными в разных анатомических участках, при регистрации частоты появления новых, измененных и регрессивных невусов.
Специфические изменения были классифицированы в соответствии с макроскопическими клиническими изменениями цвета, размера (диаметра) и формы, которые были очевидны при сравнении с исходными фотографиями крупных участков тела (рис. 2).Незначительных изменений клинически незначительной величины не зафиксировано. Новый невус появился после исходного уровня (рис. 3). Невус считался регрессивным, если он полностью исчез.
Биоптаты не были получены для всех измененных и новых пигментных поражений. Если меланома не могла быть уверенно исключена клиническим обследованием и дерматоскопией, выполнялась эксцизионная биопсия. Регистрировались все новые и измененные не удаленные пигментные поражения. Пигментные поражения, удаленные по косметическим причинам, которые клинически не свидетельствовали о меланоме, не учитывались.
Все меланомы, диагностированные при последующем наблюдении, были зарегистрированы как новые или измененные очаги по сравнению с исходными фотографиями. Все меланомы были обследованы одним дерматопатологом (J.P.D.). Тип опухоли был классифицирован в соответствии с McGovern et al. , 16, , как поверхностная распространяющаяся меланома, узловая меланома или меланома лентиго maligna, а уровни инвазии регистрировались от I до V в соответствии с Clark et al. 17 Также были зарегистрированы гистологические доказательства ассоциированного невуса и толщины меланом.
Показатели заболеваемости были рассчитаны для меланом, новых невусов, изменившихся невусов и регрессивных невусов. Продолжительность наблюдения рассчитывалась от даты фотографирования до даты последнего контрольного посещения. В расчеты были включены все соответствующие поражения, независимо от того, сколько у каждого пациента было во время последующего наблюдения. Мы рассчитали общую частоту и частоту отдельно по базовому возрасту (<30, 30-39, 40-49 и ≥50 лет), полу, количеству диспластических невусов на исходном уровне (<4, 4-10, 11-20 и ≥21) и общее количество невусов (<100 и ≥100).Отрицательная биномиальная регрессия использовалась для оценки соотношений частот, доверительных интервалов и значений P для каждой из этих переменных.
Уровень заболеваемости меланомой среди пациентов сравнивался с частотой среди всех жителей Виктории путем расчета стандартизированного коэффициента заболеваемости с поправкой на календарный год, пол и возраст в 5-летних группах. В этот анализ были включены все in situ и инвазивные меланомы в популяции Виктории с 1992 по 1998 год и у пациентов (данные предоставлены Регистром рака штата Виктория 26 июля 2002 года). 18 Доверительный интервал складного ножа был построен для учета множественных меланом на одного пациента. Все анализы были выполнены с помощью статистического программного обеспечения Stata, версия 7 (Stata Corporation, College Station, Tex).
В таблице 1 указано количество пациентов, которые соответствовали каждому из критериев отбора. Средний возраст на исходном уровне составлял 38 лет (возрастной диапазон от 16 до 74 лет). Среднее количество последующих визитов после фотографии составило 3 (диапазон от 1 до 18).Средняя продолжительность наблюдения составила 34 месяца (от 2 до 79 месяцев).
Всего обнаружено 311 измененных невусов. У 71 невуса не было данных о типе обнаруженного изменения. Из тех невусов с задокументированными изменениями наиболее частыми изменениями были размер (67%), цвет (15%), а также размер и цвет (14%). Изменения формы (2%) и все 3 изменения вместе (2%) не были обычными. Были иссечены 53 (17%) измененных невуса (таблица 2).Из них почти половина были диспластическими невусами и 14 (26%) были меланомами.
Частота измененных невусов составила 329 на 1000 человеко-лет (Таблица 3). Частота снижалась с увеличением возраста и была более чем в 2 раза выше для пациентов моложе 30 лет. Заболеваемость также была выше у пациентов с большим количеством диспластических невусов на исходном уровне, но не показала связи с полом пациента или количеством общих невусов на исходном уровне (таблица 3).
Обнаружено двести шестьдесят два новых пигментных очага (таблица 4).Из них биопсии были выполнены у 18 (7%), выявлено 4 меланомы (таблица 2). Частота появления новых пигментных поражений составила 277 на 1000 человеко-лет (Таблица 4). Частота появления новых невусов была самой высокой у пациентов младше 30 лет на исходном уровне. Частота не была связана с полом пациента или количеством диспластических невусов на исходном уровне, но была самой высокой, хотя и незначительно, у пациентов с наибольшим количеством общих невусов на исходном уровне.
Полностью регрессивные невусы
Восемьдесят шесть невусов полностью регрессировали (таблица 5).Частота исчезновения пигментных невусов составила 91 на 1000 человеко-лет (Таблица 5). Частота снижалась с увеличением возраста и была выше у мужчин, но не показала устойчивой связи с количеством диспластических невусов на исходном уровне и без связи с количеством общих невусов на исходном уровне (Таблица 5).
Восемнадцать меланом были обнаружены у 16 пациентов (таблица 6). При контрольных визитах было обнаружено семнадцать меланом; 4 были новыми очагами и 14 — измененными.Одна меланома была обнаружена пациентом между визитами (таблица 6). Две меланомы были обнаружены в течение 6 месяцев после исходной фотографии как изменения как в размере, так и в цвете. За период исследования было диагностировано 15 поверхностных меланом, 2 меланомы лентиго и 1 узловая меланома. Среднее время диагностики меланомы у каждого пациента после фотографии составляло 26 месяцев (диапазон от 5 до 72 месяцев).
Присутствие ассоциированного невуса гистопатологически мало связано с историей болезни пигментного поражения.Из 4 меланом, представленных как новые поражения, 2 имели гистологические доказательства ассоциированного невуса по сравнению с 8 из 14 меланом в измененных поражениях (Таблица 6). Только 1 из 6 меланом in situ среди измененных поражений имела гистологические доказательства ассоциированного невуса (Таблица 6).
Если предположить, что ни одно из поражений, не подвергшихся биопсии, не было меланомой, то 1 (0,4%) из 252 новых очагов, выявленных у пациентов моложе 50 лет при фотографировании, были меланомой по сравнению с 3 (30%) из 10 выявленных новых очагов. у пожилых пациентов.Аналогичным образом, 9 (3%) из 288 измененных поражений у пациентов моложе 50 лет были меланомами по сравнению с 5 (22%) из 23 измененных поражений у пожилых пациентов. Общее соотношение доброкачественных и злокачественных результатов биопсии составило 2,8. Он составлял 4,5 у пациентов моложе 50 лет и 0,75 у пациентов старшего возраста.
Большинство (77%) обнаруженных меланом относились к уровню I или II по Кларку. Для инвазивных меланом 80% имели толщину не более 0,75 мм; средняя толщина составила 0,39 мм. Одна обнаруженная меланома была узловой меланомой IV и 2 уровня Кларка.45 мм толщиной, с ассоциированным невусом. Эта меланома была обнаружена пациентом как изменяющееся образование при самообследовании между посещениями. По сравнению с фотографиями, эта меланома увеличилась в размерах за 6 месяцев между контрольными визитами.
Общая заболеваемость меланомой составила 19 на 1000 человеко-лет (таблица 7), что в 34 раза (95% доверительный интервал, 21-54) раза выше, чем в викторианском населении того же возраста и пола. Частота была самой высокой у пациентов 50 лет и старше.Пациенты с большим количеством диспластических невусов имели более высокую заболеваемость меланомой, но не было положительной связи с количеством общих невусов на исходном уровне.
Наше исследование подтверждает, что невусы — это динамические поражения. 19 -23 У этих пациентов из группы высокого риска повышенная частота меланомы была обнаружена во всех возрастных группах. У пациентов моложе 50 лет, и особенно у пациентов моложе 30 лет, было обнаружено больше новых, измененных и регрессированных невусов и меньше обнаруженных меланом.Напротив, у пациентов старше 50 лет было обнаружено больше меланом и было меньше новых невусов или изменений или регресса существующих невусов. Следовательно, новый или измененный невус у пожилого пациента с гораздо большей вероятностью будет меланомой, чем у более молодого пациента. У пациентов моложе 50 лет менее 1% всех новых поражений были меланомами, тогда как у пациентов старше 50 лет меланомами были 30%. Аналогичным образом, из всех измененных поражений, обнаруженных у пациентов моложе 50 лет, 3% были меланомами, тогда как у пациентов старше 50 лет 22% были меланомами.
Два предыдущих исследования подтверждают наблюдение, что невусы становятся более стабильными у пациентов с возрастом. Halpern et al., , 20, , сообщили, что у 33% пациентов новые диспластические невусы появлялись на спине в течение среднего периода наблюдения в 89 месяцев, при этом самая высокая частота встречалась у пациентов моложе 30 лет (76%), которая затем уменьшалась с течением времени. возрастной возраст. Гистологически Lund и Stobbe 22 продемонстрировали, что с возрастом невусы становятся менее активными и более зрелыми, так что происходит меньше изменений и меньше регрессии.
Примерно у одной трети наших пациентов ежегодно меняются невусы. Эта скорость изменения намного меньше, чем обнаруженная Halpern et al., 20 , при этом 51% всех оцененных невусов в среднем за 89 месяцев наблюдения показали клинические признаки изменения. Это различие, вероятно, объясняется разными пороговыми значениями для обнаружения изменений в каждом исследовании. Мы зарегистрировали только общие клинические изменения в невусах, определенные с использованием исходных фотографий больших областей тела. Halpern et al, 20 , с другой стороны, исследовали невусы с помощью макрофотографии и зафиксировали незначительные изменения.
Во многих перекрестных исследованиях 21 , 24 -27 сообщается, что общее количество невусов уменьшается с возрастом. Обычно это связывают с регрессом невусов с возрастом. 19 -21 Однако в нашем исследовании скорость регрессии невусов была меньше, чем скорость появления новых невусов во всех возрастных группах, что позволяет предположить, что уменьшение количества невусов с возрастом может быть когортным эффектом, возможно, отражающим разные закономерности пребывания на солнце в детстве.Недавних исследований количества невусов по возрасту в течение взрослой жизни не проводилось, и возможно, что текущие данные не покажут (поперечного) снижения с возрастом. Также возможно, что наши короткие сроки исследования могли быть недостаточными, чтобы продемонстрировать ожидаемое снижение количества невусов с возрастом. Кроме того, у пациентов в нашем исследовании было большое количество невусов и диспластических невусов, и у таких пациентов естественное течение невусов может отличаться от такового в общей популяции.
Заболеваемость меланомой была в 34 раза выше, чем среди населения в целом. Этому, возможно, способствовала предвзятость эпиднадзора, и аналогичные показатели были продемонстрированы в других исследованиях групп высокого риска. 1 , 5
Количество диспластических невусов было положительно связано с заболеваемостью меланомой, что подтверждает широко описанную 1 , 8 , 9,28 роль диспластических невусов как основного фактора риска меланомы и ранее существовавшую взаимосвязь между дозой и реакцией. наблюдается между количеством диспластических невусов и заболеваемостью меланомой. 1 Как ни странно, мы не обнаружили связи между общим количеством распространенных невусов и уровнем меланомы. Однако широкие диапазоны, используемые для регистрации количества невусов, могли замаскировать эту ожидаемую взаимосвязь.
Существует консенсус, что только новые и измененные невусы, которые клинически указывают на меланому, требуют удаления. Используя дерматоскопию, Kittler et al. 29 обнаружили 516 изменений в невусах, из которых только 75 были удалены. Halpern et al., , 20, удалили только 48 из 593 измененных невусов.Только 17% всех измененных и 7% всех новых невусов, обнаруженных у наших пациентов, были удалены. Из этих биоптатов 26% измененных и 22% новых поражений были меланомами.
В нашем исследовании соотношение доброкачественных и злокачественных новообразований в биоптатах было почти 3: 1. Это соотношение можно сравнить с предыдущим исследованием 1 , проведенным в той же частной практике, в котором соотношение доброкачественных и злокачественных новообразований составляло 9: 1. Наше более низкое соотношение в этом более недавнем исследовании можно объяснить тем фактом, что мы использовали дерматоскопию в дополнение к фотографии.Сочетание фотографии, демонстрирующей стабильность многих невусов, которые в противном случае могли бы быть иссечены, и дерматоскопии, помогающей исключить меланому во многих новых и измененных невусах, значительно сократило количество иссечений, необходимых нашим пациентам. В целом также сообщалось о соотношении доброкачественных и злокачественных новообразований 12: 1 для дерматологов и 30: 1 для врачей общей практики. 30
Когда цены на консультации и биопсию соответствуют действующим тарифам программы Medicare (ноябрь 2003 г.) правительства Австралии и разрешено 125 австралийских долларов за комплект фотографий, стоимость диагностики каждой меланомы в этом исследовании составила 4840 австралийских долларов.Однако, если бы соотношение доброкачественных и злокачественных новообразований составляло 12: 1, как ранее сообщалось для дерматологов, 30 , то общее количество биопсий увеличилось бы до 234, а стоимость диагностики каждой меланомы возросла бы до 6323 австралийских долларов. . Таким образом, значительная экономия может быть достигнута только за счет снижения частоты биопсии за счет использования комбинации базовой фотографии и дерматоскопии.
В нашем исследовании 44% меланом находились на месте, а 80% инвазивных меланом были меньше нуля.Толщина 75 мм. Тридцать пять процентов меланом в Виктории за 1995 год находились на месте. Средняя толщина инвазивных меланом, обнаруженных в этом исследовании, составила 0,39 мм по сравнению с 0,60 мм для всех инвазивных меланом в Виктории, диагностированных между 1992 и 1998 годами у лиц моложе 72 лет. Наблюдение сыграло важную роль в обнаружении в этом исследовании: 17 из 18 меланом были обнаружены путем сравнения с исходными фотографиями.
В литературе нет единого мнения о доле меланом, которые возникают из-за ранее существовавших доброкачественных невусов.По крайней мере, две трети пациентов заявляют, что их меланомы возникли в результате ненормального роста существующей родинки. 31 Friedman et al. 32 сообщили, что у 70% пациентов с гистологическими признаками меланомы, ассоциированной с невусом, в анамнезе ранее существовало поражение. Ранние гистологические исследования сообщили о ассоциированном доброкачественном невусе в 53% меланом, 33 , тогда как более поздние исследования показали, что эта связь ниже, порядка 20-30%. 32 , 34 -36 В нашем исследовании 44% меланом не имели гистологических признаков ассоциированного невуса, тогда как в нашем предыдущем исследовании 1 этот показатель составлял 65%.Таким образом, согласно гистологическим исследованиям, большинство меланом, по-видимому, возникают de novo, однако клинические истории предполагают, что меланомы возникают из ранее существовавших невусов.
В нашем исследовании клиническое впечатление от меланомы de novo по сравнению с меланомой, возникшей из ранее существовавшего невуса, основанное на сравнении с исходными фотографиями, не всегда подтверждалось гистологическими данными. Мы ожидали, что меланомы, которые проявляются изменением ранее существовавшего пигментного поражения, покажут гистологические доказательства ассоциированного невуса, тогда как меланомы, которые появились как новые поражения на нормальной коже, не будут.Хотя при инвазивной меланоме возможно, что признаки ранее существовавшего невуса были уничтожены меланомой, маловероятно, что меланома уровня I заменит ранее существовавший невус.
Пять из 6 меланом in situ, которые представляли собой изменение ранее существовавшего поражения, не были связаны с невусом. Эти меланоцитарные поражения присутствовали при первой консультации и первоначально казались доброкачественными при клиническом и дерматоскопическом обследовании. Во время наблюдения эти поражения претерпели подозрительные изменения, и была проведена эксцизионная биопсия.Вполне вероятно, что эти пигментные поражения изначально были меланомами in situ и были клинически стабильными или медленно растущими. Кроме того, 2 из 4 меланом, которые отсутствовали на исходных фотографиях и развились как новые поражения во время наблюдения, показали гистологические доказательства ассоциированного невуса. Для этих поражений меланома и невус могли развиваться одновременно в течение интервала между контрольными визитами.
Это исследование показывает, что невусы продолжают меняться и появляться на протяжении всей жизни, по крайней мере, у пациентов из группы высокого риска.Использование базовой фотографии всего тела и дерматоскопии для мониторинга пигментных поражений значительно снижает обычно высокие показатели биопсии, необходимые для оценки пациентов с высоким риском, и обеспечивает значительную экономию на стоимости биопсии и связанных с ними заболеваний. Кроме того, меланомы обнаруживаются раньше, чем можно было бы ожидать, что снижает вероятность смертности от меланомы.
Очевидно, что лишь небольшая часть новых и измененных очагов может быть меланомой.Это важно для врачей при установке пороговых значений для выполнения биопсии. Новые и измененные поражения с гораздо большей вероятностью будут меланомой у пациентов старше 50 лет.
Для корреспонденции: John W. Kelly, MDBS, Victorian Melanoma Service, The Alfred, Commercial Road, Prahran, Victoria 3181, Australia ([email protected]).
Принята к публикации: 7 декабря 2004 г.
Заявление об ограничении ответственности: Авторы имели полный доступ ко всем данным в исследовании и несли ответственность за целостность данных и точность анализа данных.
Предыдущие презентации: Это исследование было частично представлено на 29-м ежегодном научном собрании Австралийского клинического онкологического общества; 26 ноября 2002 г .; Сидней, Австралия; и 83-е ежегодное собрание Британской ассоциации дерматологов; 3 июля 2003 г .; Брайтон, Англия.
Дополнительная информация: Это исследование было удостоено награды Schering-Plough Research Award (доктор Банки) для стажеров Австралазийского колледжа дерматологов.
Благодарность: Мы благодарим Аманду П. Хенхэм, BApp-Sci (Photog), за создание изображений поверхности кожи и фотографирование всех пациентов в этом исследовании.
Раскрытие финансовой информации: Нет.
1. Келли JWYeatman JMRegalia CMason GHenham AP Высокая частота меланомы, обнаруженная у пациентов с множественными диспластическими невусами при фотографическом наблюдении Med J Aust 1997; 167191-194PubMedGoogle Scholar2.Масри GDClark WH JrGuerry D IVHalpern AThompson JElder DE Скрининг и наблюдение за пациентами с высоким риском злокачественной меланомы приводят к выявлению более раннего заболевания J Am Acad Dermatol 1990; 221042-1048PubMedGoogle ScholarCrossref 3.Mackie RMMcHenry PHole D Ускоренное выявление кожной злокачественной меланомы с помощью проспективного наблюдения в группах высокого риска Lancet 1993; 3411618-1620PubMedGoogle ScholarCrossref 4.Shriner Д.Л. Вагнер RFGlowczwski JR Photography для ранней диагностики злокачественной меланомы у пациентов с атипичными родинками Cutis 1992; 50358-362PubMedGoogle Scholar5.Rivers JKKopf AWVinokur AF и другие. Клиническая характеристика злокачественных меланом, развивающихся у лиц с диспластическими невусами Рак 1990; 651232-1236PubMedGoogle ScholarCrossref 6.Kopf AWRivers JKSlue WRigel Д.С.Фридман Фотографии RJ полезны для обнаружения злокачественных меланом у пациентов с диспластическими невусами J Am Acad Dermatol 1988; 191132–1134Google ScholarCrossref 7.Tiersten А.Д.Грин CMKopf AW и другие. Проспективное наблюдение за злокачественной меланомой у пациентов с синдромом атипичных родинок (диспластических родинок) J Dermatol Surg Oncol 1991; 1744-48PubMedGoogle ScholarCrossref 8.Holly EAKelly JWShpall SNChiu SH Количество меланоцитарных невусов как основной фактор риска злокачественной меланомы J Am Acad Dermatol 1987; 17459-468PubMedGoogle ScholarCrossref 9.Bataille VBishop JASasieni п и другие.Риск кожной меланомы в зависимости от количества, типов и локализации невусов: исследование случай-контроль Br J Cancer 1996; 731605-1611PubMedGoogle ScholarCrossref 10. REVaisman IMastrangelo MJLustbader E Множественные первичные злокачественные новообразования у пациентов с меланомой кожи Рак 1977; 401974-1981 PubMedGoogle ScholarCrossref 12.Holman CDJArmstrong BK Пигментные черты, этническое происхождение, доброкачественные невусы и факторы риска в семейном анамнезе кожной злокачественной меланомы J Natl Cancer Inst 1984; 72257-266PubMedGoogle Scholar13.Форд DBliss JMSwerdlow AJ и другие. Риск кожной меланомы, связанный с семейным анамнезом заболевания Int J Cancer 1995; 62377-381PubMedGoogle ScholarCrossref 14.Kelly JWCrutcher WASagebiel RW Клинический диагноз диспластических меланоцитарных невусов: клинико-патологическая корреляция J Am Acad Dermatol 1986; 141044-1052PubMedGoogle ScholarCrossref 15.Salopek ТГКопф AWStefanato CMVossaert К. Сильверман MYadav S Дифференциация атипичных родинок (диспластических невусов) от ранних меланом с помощью дерматоскопии Dermatol Clin 2001; 19337-345PubMedGoogle ScholarCrossref 16.Макговерн VJCochran AJVan Der Esch EPL Little JHMacLennan R Классификация злокачественной меланомы, ее гистологическое описание и регистрация: пересмотр Сиднейской классификации 1972 г. Патология 1986; 1812-21 PubMedGoogle ScholarCrossref 17. Кларк WH Младший LBernardino EAMihm MC Гистогенез и биологическое поведение первичных злокачественных меланом кожи человека Cancer Res 1969; 29705-726PubMedGoogle Scholar18.Джайлз GWhitfield KThursfield VStaples M Рак в Виктории 1995 Мельбурн, Австралия Совет по борьбе с раком штата Виктория 1998; Canstat 27
19 Барнс LMNordlund JJ Естественная история диспластических невусов: история болезни, иллюстрирующая их эволюцию Arch Dermatol 1987; 1231059-1061PubMedGoogle ScholarCrossref 20.Halpern ACGuerry D IVПожилой DETrock BSynnestvedt MHumphreys T Естественная история диспластических невусов J Am Acad Dermatol 1993; 2951-57PubMedGoogle ScholarCrossref 22.Лунд HZStobbe GD Естественная история пигментного невуса: факторы возраста и анатомического расположения Am J Pathol 1949; 251117-1155PubMedGoogle Scholar23.Kelly JWRivers JKMacLennan RHarrison SLewis AETate BJ Солнечный свет: основной фактор риска, связанный с развитием меланоцитарных невусов у австралийских школьников J Am Acad Dermatol 1994; 3040-48PubMedGoogle ScholarCrossref 24.Nordlund Дж. Дж. Кирквуд JForget BM и другие.Демографическое исследование клинически атипичных (диспластических) невусов у пациентов с меланомой и субъектов сравнения Cancer Res 1985; 451855-1861PubMedGoogle Scholar25.Grulich AEBataille VSwerdlow AJ и другие. Naevi и пигментные характеристики как факторы риска меланомы в популяции высокого риска: исследование случай-контроль в Новом Южном Уэльсе, Австралия Int J Cancer 1996; 67485-491PubMedGoogle ScholarCrossref 26.Cooke KRSpears GFSSkegg DCG Частота родинок в определенной популяции J Epidemiol Community Health 1985; 3948-52 PubMedGoogle ScholarCrossref 27.Николс Е.М. Развитие и устранение пигментных родинок, а также анатомическое распределение первичной злокачественной меланомы Рак 1973; 32191-195PubMedGoogle ScholarCrossref 28. Tucker MAHalpern AHolly EA и другие. Клинически признанные диспластические невусы: центральный фактор риска меланомы кожи JAMA 1997; 2771439-1444PubMedGoogle ScholarCrossref 29.Kittler HPehamberger HWolff KBinder M Последующее наблюдение за меланоцитарными кожными поражениями с помощью цифровой эпилюминесцентной микроскопии: паттерны модификаций, наблюдаемые при ранней меланоме, атипичных невусах и общих невусах J Am Acad Dermatol 2000; 43467-476PubMedGoogle ScholarCrossref 30.Метки RJolley DMcCormack Соревич А.П. Кто удаляет пигментные поражения кожи? исследование соотношения меланомы и других доброкачественных пигментных опухолей, удаленных разными категориями врачей в Австралии в 1989 и 1994 годах J Am Acad Dermatol 1997; 36721-726PubMedGoogle ScholarCrossref 31.Scott JPJolly KDMacKinnon MJClarke AM Меланома в Отаго и Саутленде N Z Med J 1980; 92422-424PubMedGoogle Scholar32.Фридман RJRigel DSKopf AW и другие. Благоприятный прогноз для злокачественной меланомы, связанной с приобретенными меланоцитарными невусами Arch Dermatol 1983; 119455-462PubMedGoogle ScholarCrossref 34.Marks РДоревич APMason G Все ли меланомы происходят от «родинок»? исследование гистологической ассоциации между меланоцитарными невусами и меланомой Australas J Dermatol 1990; 3177-80PubMedGoogle ScholarCrossref 35.Stolz WSchmoeckel CLandthaler MBraun-Falco O Ассоциация ранней злокачественной меланомы с невоцитарными невусами Рак 1989; 63550-555PubMedGoogle ScholarCrossref 36.Бевона CGoggins WQuinn TFullerton JTsao H Меланомы кожи, связанные с невусами Arch Dermatol 2003; 1391620-1624PubMedGoogle ScholarCrossrefАтипичные меланоцитарные невусы генитального типа с обсуждением реципрокных паренхимно-стромальных взаимодействий в биологии новообразований
Меланоцитарные поражения половых органов, особенно вульвы, могут представлять большие трудности при гистологической интерпретации.Гистологический диагноз злокачественной меланомы был поставлен более чем в одной трети из 56 меланоцитарных поражений области гениталий, представленных после консультации с авторами. Средний возраст пациентов с этими поражениями составлял 25 лет. Эта статья представляет собой клинико-патологическое исследование этих поражений и позволяет отличить их от злокачественной меланомы. Строма поражений области гениталий отличалась от стромы, наблюдаемой в диспластических невусах и меланоме. Различия в стромальной форме при различных поражениях полезны в диагностике и имеют глубокое биологическое значение.Подробно описывается строма в описанных очагах поражения и в некоторых очагах меланоцитарной неоплазии, и обсуждается ее биологическое значение. В этом сравнительном исследовании используются три набора случаев для определения клинико-патологической природы и биологии генитальных невусов. 56 случаев, представленных в консультации, составляют основную серию нашей работы (Лабораторная серия кожной патологии Кларка). Их сравнивают с серией случаев от Группы пигментных поражений Пенсильванского университета и Патологической службы, Inc., а также с серией случаев от Отделения генетической эпидемиологии Национального института рака.Две серии, использованные для сравнительного исследования, содержат примерно такое же количество случаев диспластических невусов и злокачественной меланомы, как и атипичных меланоцитарных невусов генитального типа в первичной серии. Общее количество случаев было изучено путем сравнения их атрибутов в реляционной базе данных. Клинические данные первичной серии были получены с помощью анкеты, заполненной участниками. В 56 случаях были представлены две отличительные патологические картины. Один из них называется атипичными меланоцитарными невусами генитального типа (AMNGT), тогда как диспластические невусы (DN) формируют вторую из двух патологических картин.Всего было 36 АМНГТ и 14 ДН. Остальные шесть случаев были обычными невусами без атипии или плохо выраженной меланоцитарной гиперплазии. Поражения AMNGT обычно локализуются на вульве, но они видны на промежности и, реже, на лобковой кости и в подмышечной впадине. Поражения, похожие на AMNGT, редко наблюдаются на мужских гениталиях. Структуры стромы были отличительными и связаны со специфическими меланоцитарными поражениями. Неклассифицированный (неклассифицированный) или неспецифический паттерн стромы был связан с AMNGT; паттерн регрессии с дифференцировкой (дифф-регресс) доминировал в строме общих дермальных невусов; концентрическая эозинофильная фиброплазия (cef) и пластинчатая фиброплазия (lf) присутствовали в диспластических невусах; фиброплазия с бляшечным лимфоцитарным инфильтратом (fl) и диффузная эозинофильная фиброплазия (def) были отмечены при меланоме в радиальной фазе роста; и фиброплазия с ангиогенезом (fa) или отсутствие доказательств паренхиматозных стромальных реципрокных взаимодействий (nopsi), отмеченных толстыми или глубоко инвазивными меланомами в вертикальной фазе роста.Предлагаются рекомендации по лечению поражений.
Выводы: Один из видов атипичной пролиферации меланоцитов в области гениталий формирует отличительную клинико-патологическую единицу, которую можно отличить от меланомы и диспластических невусов, AMNGT. Такие поражения чаще встречаются на малых половых губах или слизистой оболочке клиторальной области, чем на больших половых губах.Другой распространенной атипичной меланоцитарной пролиферацией в этой области является диспластический невус, который гораздо чаще встречается на больших половых губах, чем на малых половых губах. Взаимные взаимодействия между паренхимой и стромой обсуждаются как гомеостатические процессы, постоянно функционирующая матрица, поддерживающая форму и функцию ткани, органа и организма. Прогрессирующая дезорганизация этого шаблона при неоплазии проиллюстрирована и считается кардинальным элементом биологии неоплазии.
Эруптивный невус шпица, яркий пример доброкачественного метастазирования
Считается, что слияния киназ, которые инициируют невусы шпица, являются результатом неправильной репарации разрывов двухцепочечной ДНК в интронах двух отдельных генов, один из которых кодирует киназу, а другой — ее слияние. партнер, которые объединяются в один или несколько химерных генов. Партнеры по слиянию могут находиться рядом друг с другом на одной и той же хромосоме или на отдельных хромосомах. Поскольку разрывы происходят на длинных участках некодирующей ДНК, содержащей интроны каждого из партнеров по слиянию, возможно множество различных перестроек между двумя генами, которые могут сформировать ген слияния, который после транскрипции производит точно такую же функциональную молекулу матричной РНК. и сращивание.Таким образом, вероятность обнаружения одного и того же слияния в трех отдельно инициированных опухолях пациента бесконечно мала, и результаты показывают, что опухоли произошли от одной клетки, которая приобрела слияние TPM3 — ROS1 .
Несколько способов распространения могут объяснить распространение поражений у нашего пациента. Учитывая, что первый невус появился на левой ягодице, а последующие невусы следовали за ним (т. Е. Формировали агминированные невусы шпица), первоначальное трансформирующее событие могло произойти в меланоцитах или клетках-предшественниках меланоцитов в этой области.Двум ранее зарегистрированным случаям прорезывания невусов Шпица также предшествовали агминированные невусы Шпица до более широкого распространения 10,14 . В нашем случае, как и в других ранее описанных случаях 9,15,16 , невусы сначала появились на нижних конечностях и ягодицах, а затем затронули туловище и верхние конечности. Другое соображение заключается в том, что, возможно, местное распространение сначала произошло из-за миграции вдоль сосудисто-нервных пучков или через лимфатические сосуды 17 . Пери- или интраневральная инвазия происходит у невусов шпица, а способность невусов шпица распространяться по лимфатическим сосудам подтверждается обнаружением лимфатической инвазии более чем в 10% случаев 18 .Способность доброкачественных меланоцитарных опухолей проходить через лимфатическую сосудистую сеть может объяснить высокую частоту метастазирования атипичных опухолей Шпица в сторожевые лимфатические узлы, что резко контрастирует с чрезвычайно низкой частотой метастатического распространения в отдаленные участки у этих пациентов 19 .
Тот факт, что в дальнейшем поражения возникли по всему покрову с симметричным распределением, предполагает, что в какой-то момент диссеминация стала гематогенной. В нашем случае, как и в других ранее описанных случаях 9,15,16 , невусы сначала появились на нижних конечностях и ягодицах, а затем затронули туловище и верхние конечности.Факторы, которые могли бы объяснить первоначальное появление диссеминированных невусов в нижней части тела, неизвестны, но могут быть связаны с повышенной экстравазацией опухолевых клеток в зависимых областях.
Примечательно, что поражения были клинически мономорфными и затрагивали поверхностную кожу. Хотя невозможно узнать, обнаруживаются ли аналогичные небольшие новообразования и в тканях за пределами кожи, стереотипная картина колонизации кожи предполагает, что трофические факторы, обеспечиваемые поверхностной кожей, способствуют перемещению и пролиферации трансформированных меланоцитов, необходимых для образования клинически видимых поражений.Трансформированные клетки, которые достигают кожи посредством лимфоваскулярного или гематогенного распространения, должны будут активно мигрировать вверх через кожу и пересекать зону базальной мембраны, чтобы осесть в эпидермисе, тем самым воспроизводя врожденно запрограммированный путь предшественников меланоцитов во время эмбрионального развития. В то время как оборот нормальных меланоцитов в эпидермисе взрослого человека, а также динамика и расположение соответствующих популяций стволовых клеток недостаточно изучены, популяция стволовых клеток была идентифицирована в дерме, которая может давать начало эпидермальным меланоцитам 20,21 .Вполне возможно, что эруптивные невусы шпица происходят из такой стволовой клетки в результате специфических онкогенных изменений, таких как слияние киназ, что приводит к частично трансформированной клеточной популяции с повышенной скоростью пролиферации, которая может поддерживать типичный паттерн самонаведения исходной клетки даже после уносится через сосудистую систему.
Таким образом, молекулярные открытия дают удивительное представление о патогенезе эруптивного невуса шпица. Они представляют собой яркий пример доброкачественного метастаза, при котором доброкачественное новообразование широко распространяется по всему телу.Это наблюдение дополняет клинические наблюдения, которые ставят под сомнение господствующую догму о том, что метастатическое распространение — это свойство, которое приобретается на поздних этапах эволюции первичных новообразований и является определяющим свойством злокачественного новообразования. Вместо этого результаты показывают, что новообразования определенных линий, таких как меланоциты, могут широко распространяться даже на ранних стадиях, даже если они не являются злокачественными. Явление доброкачественной опухоли, приводящей к образованию метастатических отложений, было названо доброкачественным метастазом и не ограничивается меланоцитарной неоплазией — другие примеры включают доброкачественные лейомиомы матки 22 , плеоморфные аденомы 23 , фиброзные гистиоцитомы 24 , аденомиоэпитомы 25 и менингиома 26 .Концепция доброкачественных метастазов важна для клинического лечения. Присутствие опухолевых клеток вдали от первичного очага новообразования часто интерпретируется как достаточное доказательство того, что новообразование является злокачественным, даже если первичная опухоль не обладает однозначными признаками злокачественности. Это может привести к ненужному лечению, стигматизации и заболеваемости.
Доброкачественные меланоцитарные невусы — обзор
Локальные вариации
Доброкачественные меланоцитарные невусы в определенных анатомических областях могут иметь необычные гистопатологические особенности. 254 Самыми известными из них являются невусы вульвы и акральной области. Невусы в других участках, таких как ухо, грудь, кожа головы и места изгиба, могут иметь схожие черты. 255 Невусы на дистальном отделе нижней конечности (голеностопного сустава) — это последняя группа атипичных невусов, которые необходимо очертить. 256
У некоторых вульвальных невусов у женщин в пременопаузе наблюдаются атипичные гистологические особенности, характеризующиеся увеличением узловых гнезд меланоцитов, с изменчивостью размера, формы и положения гнезд. 257–259 Часто наблюдается пагетоидное распространение меланоцитов. 260 Эти атипичные образования были названы атипичными меланоцитарными невусами генитального типа . 261,262 В одном исследовании шести случаев рецидивов не было зарегистрировано при долгосрочном наблюдении. 261 В дополнение к уже упомянутым особенностям, это исследование прокомментировало заметную соединительную активность, созревание дермы и отсутствие ядерной атипии или митозов в дерме. 261 В недавнем исследовании 56 случаев только одно поражение имело рецидив при последующем наблюдении, но через 11 лет после его повторного удаления рецидивов этого поражения не наблюдалось. 263 Невусы у беременных также могут проявлять некоторую «активацию» с увеличением базальных меланоцитов и повышением митотической активности в этих клетках. 264 Изменения обычно мягкие и никогда не бывают достаточными, чтобы вызвать диагностическую путаницу. 264
Невусы ушной области также могут иметь нетипичные черты. Как указывалось в последнем издании этой книги, автор получил, для второго мнения, слайды гистологии многих атипичных невусов, удаленных из ушей подростков мужского пола.Эти атипичные невусы также могут возникать у женщин. Они часто показывают плохое очертание, латеральное расширение соединительного компонента за пределы дермального компонента и удлинение ребер с перемычкой между ними. 265 Пагетоидное распространение и цитологическая атипия также могут присутствовать. 266 Митозы и апоптотические невомеланоциты встречаются редко. Во многих случаях наблюдается легкий лимфоцитарный инфильтрат. 266
Невусы из груди также имеют нетипичные черты как у мужчин, так и у женщин. 267 Иногда обнаруживаются легкое пагетоидное распространение, меланоцитарная атипия и дермальная фиброплазия. 262,267
Изгибные невусы могут иметь гнездовой и дисгезивный узор с некоторыми вариациями в размере и расположении гнезда. 268
Конъюнктивальные невусы — еще один пример невусов на определенных участках, которые могут иметь тревожные особенности. 262,269 Как упоминалось в главе 2 (стр. 31), автор всегда соглашался с данным ему более 35 лет назад советом о том, что можно безопасно «снизить» атипию, которая часто наблюдается при невусах конъюнктивы.Невусы конъюнктивы необходимо отличать от меланоза конъюнктивы, при котором наблюдается повышенная пигментация или небольшое увеличение нормальных меланоцитов. 270 Также может присутствовать атипия этих меланоцитов. Этот предмет был рассмотрен в 2007 году. 270
Меланоцитарные поражения ладоней и подошв также могут вызывать диагностические трудности. 271 Это, по-видимому, частично связано с наличием отметин на коже (дерматоглифики) на этих участках. 272–274 Если срезы разрезать перпендикулярно, а не параллельно дерматоглифику, симметрия и очертание будут видны чаще. 272 McCalmont et al. Обратили внимание на сложность диагностики акральных невусов, показывающих некоторое распространение пагетоидов. Они придумали термин «МАНИАК» (меланоцитарные акральные невусы с внутриэпидермальным подъемом клеток) для обозначения таких поражений. 275 Это пример пагетоидного меланоцитоза, процесса, наблюдаемого во многих невусах на определенных участках. 250 Дермоскопические особенности акральных невусов могут быть разными и могут измениться при краткосрочном наблюдении. 276–278 Изменения, по-видимому, отражают уникальные анатомические и гистопатологические характеристики акральной кожи. 279–281 Заостренные невусы подошвы чрезвычайно редки. 282 Также поступали сообщения об эруптивных невусах. 283 Подногтевые невусы иногда включают в эту категорию атипичных невусов ладоней и подошв. 284 Трансэпидермальное удаление четко очерченных гнезд клеток невуса иногда наблюдается в доброкачественных невусах, но пагетоидную инфильтрацию эпидермиса отдельными атипичными клетками или небольшими группами атипичных клеток с бледной цитоплазмой следует рассматривать с подозрением. 260 285 286 Лимфоцитарный инфильтрат в дерме является подозрительным, но не диагностическим признаком меланомы. 285 Существует уникальный вариант невуса на подошвенной коже — акральный лентигинозный невус. 287 Внешний вид этого поражения имеет некоторое сходство с диспластическим (атипичным) невусом, хотя в них отсутствует цитологическая атипия и ламеллярная фиброплазия. 287
Невусы на коже черепа подростков могут иметь нетипичные черты, но, по-видимому, после полного иссечения они, очевидно, ведут себя доброжелательно. 288 Около 10% невусов, удаленных с этого участка в одном учреждении, показали нетипичные особенности. 288 Там были большие гнезда причудливой формы, беспорядочно разбросанные вдоль зоны сочленения. Было поражение фолликулов. Отмечались пагетоидное распространение и умеренная цитологическая атипия. В соединительных гнездах было несколько «дискогезивных меланоцитов». 288
Невусы на дистальном отделе нижней конечности (голеностопного сустава) могут иметь архитектурную атипию от умеренной до тяжелой, но цитологическую атипию от легкой до умеренной. 256 Таким образом, они имеют общие черты с акральными невусами, диспластическими невусами и меланомой in situ. 256 Средний возраст пациентов в исследовании составлял 47 лет. Их лечили простым иссечением. Рецидивов не было. Авторы признали, что эти поражения могут быть ранними диспластическими невусами. Они также заявили, что, хотя они могут быть сгруппированы с другими акральными невусами, их отличительные особенности заслуживают отдельного рассмотрения. 256
Еще одна особая группа невусов — это матрица ногтя , невусов. 289 Большинство из них имеют соединительный тип, но при соединении обычно происходит небольшое созревание клеток дермы. Распределение меланоцитов в базальном слое может быть несимметричным. Пагетоидное распространение меланоцитов ограничено супрабазальным слоем. Клинически поражения представляют собой продольную меланонихию. 289
Разделенные или «целующиеся» невусы представляют собой сложные или внутрикожные невусы, обычно обнаруживаемые на веках, но они также могут возникать на половом члене и вульве. 290 Считается, что они развиваются во время эмбриогенеза в результате разделения изначально соединенных структур.






 В настоящее время повышенный риск заболеваемости меланомой связывают с нарушением функции супрессоров опухолевого роста, одним из которых является CDKN2A, локус хромосомы 9р21, кодирующий белки p16 и p14ARF и второй — ген CDK4 (cyclin-dependent kinase 4) с локализацией в хромосоме 12q14.
В настоящее время повышенный риск заболеваемости меланомой связывают с нарушением функции супрессоров опухолевого роста, одним из которых является CDKN2A, локус хромосомы 9р21, кодирующий белки p16 и p14ARF и второй — ген CDK4 (cyclin-dependent kinase 4) с локализацией в хромосоме 12q14. Acral Lentigo Maligna) 10 %: известна и как подногтевая меланома. Растёт также на кончиках пальцев, ладонях. Встречается чаще всего у темнокожих лиц.
Acral Lentigo Maligna) 10 %: известна и как подногтевая меланома. Растёт также на кончиках пальцев, ладонях. Встречается чаще всего у темнокожих лиц.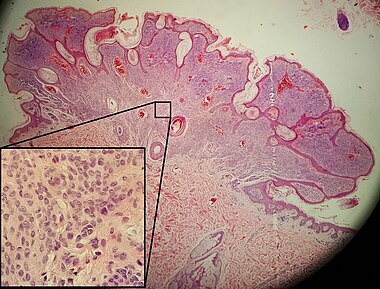 При этом можно с высокой вероятностью определить, является ли невус опасным или нет на основании системы ABCDE, предложенную Friedman в 1985 году.
При этом можно с высокой вероятностью определить, является ли невус опасным или нет на основании системы ABCDE, предложенную Friedman в 1985 году.