4-4 СОСУДИСТЫЙ ТОНУС
4.4. СОСУДИСТЫЙ ТОНУС
Сосудистый тонус — длительное напряжение сосудистой стенки, которое обеспечивает оптимальную емкость сосудистого русла, а также создает дополнительное сопротивление кровотоку.
2 вида сосудистого тонуса:
1. Базальный (миогенный)
2. Неврогенный
Базальный тонус:
Если денервировать сосуд и устранить источники гуморальных воздействий, можно выявить базальный тонус сосудов.
Различают:
а) электрогенный компонент — обусловлен спонтанной электрической активностью миоцитов сосудистой стенки. Наибольшая автоматия — у прекапиллярных сфинктеров и артериол.

Показано, что автоматия гладкомышечных клеток усиливается под влиянием их растяжения. Возрастает также и их механическая (сократительная) активность (т.е. наблюдается положительная обратная связь: между величиной АД и сосудистым тонусом).
Местная гуморальная регуляция
1. Сосудорасширяющие:
а). Неспецифические метаболиты — непрерывно образуются в тканях и в месте образования они всегда препятствуют сужению сосудов, а так же вызывают их расширение./метаболическая регуляция/.
К ним относятся- СО2, угольная кислота, Н
+, молочная кислота, закисление /накопление кислых продуктов/, снижение напряжения О2., увеличение осмотического давления вследствие накопления низкомолекулярных продуктов, оксид азота/NO/( продукт инкреции эндотелия сосудов).
б). БАВ/при действии в месте выделения/ — образуются специализированными клетками. которые входят в состав сосудистого окружения.
1. Сосудорасширяющие БАВ/в месте выделения/ — ацетилхолин, гистамин, брадикинин, некоторые простагландины, простациклин, секретируемый эндотелием, может опосредовать свой эффект через оксид азота.
2.Сосудосуживающие БАВ/при действии в месте вылеления/-
образуются
специализированными клетками. которые
входят в состав сосу дистого окружения-
катехоламины, серотонин, некоторые
простагландины, эндотелин 1 -пептид,
21-на аминокислота, продукт инкреции
эндотелия сосудов, а так же тромбоксан
А
Неврогенный тонус
Неврогенный
тонус обусловлен деятельностью сосудодвигательного
центра (СДЦ)
в продолговатом мозге, на дне IV желудочка
(В.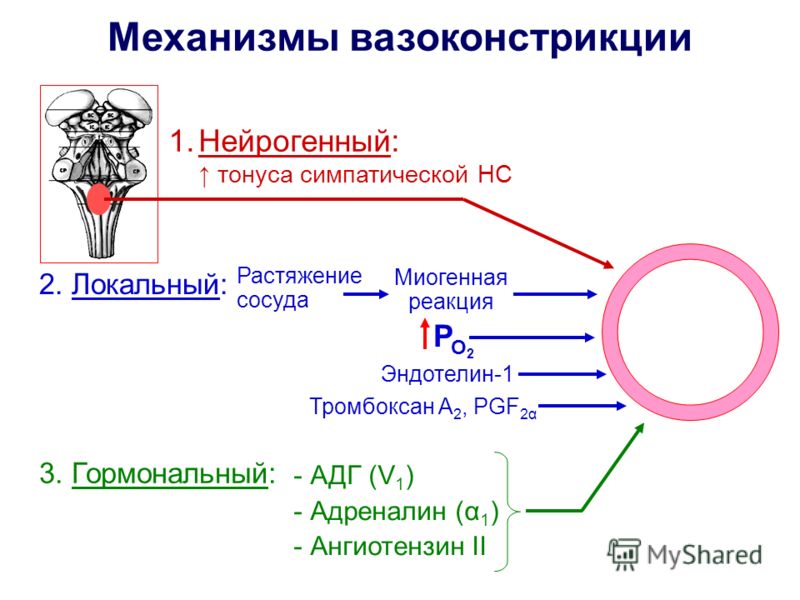 Ф. Овсянников, 1871 г., открыт методом
перерезки ствола мозга на различных
уровнях), представлен
двумя отделами (прессорный
и депрессорный).
Ф. Овсянников, 1871 г., открыт методом
перерезки ствола мозга на различных
уровнях), представлен
двумя отделами (прессорный
и депрессорный).
Прессорный отдел находится в постоянном тонусе и через центры симпатической нервной системы посылает импульсы к сосудистой стенке.
Депрессорный отдел вызывает расширение сосудов, понижая тонус прессорного отдела
.Классический опыт Клода Бернара
(Перерезка симпатического нерва ведет к покраснению уха кролика вследствие расширения денервированных сосудов.
Раздражение нерва — побеление уха вследствие спазма сосудов).
Причины, влияющие на тонус сосудодвигательного центра:
1. Импульсы от рефлексогенных зон:
а)
сосудистые (баро- и хеморецепторы,)-
вызывают рефлексы ,так называемые
собственные сосудистые рефлексы.
Раздражение барорецепторов понижают сосудистый тонус.
Раздражение хеморецепторов вызывает повышение сосудистого тонуса. Неспецифические метаболиты попав в кровоток вызывают сужение кровеносных сосудов, оказывая на них рефлекторное действие через хеморецепторы сосудистых рефлексогенных зон. Ряд специфических метаболитов- адреналин кинины и др. действуя рефлекторно с хеморецепторов сосудистых рефлексогенных зон вызывает повышение сосудистого тонуса.
б) внесосудистые /кожа, брюшина/ (болевые рецепторы, холодовые рецепторы, рецепторы натяжения)-вызывают рефлексы, так называемые сопряженные сосудистые рефлексы. В вызывают увеличение сосудистого тонуса.
2.Кортикальные влияния.
Условные рефлексы(предстартовое повышение АД у спортсменов).
Большинство
сосудов имеет только симпатическую иннервацию. Эффект симпатических влияний
на тонус сосудов зависит от того какой
вид адренорецепторов/альфа- или
бета-адренорецепторы/ приобладает в
данной сосудистой структуре.
Некоторые сосуды (органов малого таза, слюнных желез) иннервируются и через парасимпатическую нервную систему. Возбуждение парасимпатики вызывает активное увеличения просвета сосудов/снижение сосудистого тонуса/.
Роль БАВ в регуляции сосудистого тонуса
На ряду с нервными влияниями важную роль в регуляции сосудистого тонуса играют различные БАВ, обладающие дистантным, сосудодвигательным действием: гормоны ( вазопрессин, адреналин), парагормоны(серотонин, брадикинин, ангиотензин, гистамин, опиатные пептиды/эндорфины и энкефалины. В основном эти БАВ обладают прямым действием, так как большинство гладкой мускулатуры сосудов имеет специфические рецепторы к этим БАВ. Одни БАВ вызывают повышение сосудистого тонуса, другие уменьшают его. /См лекция гормоны и парагормоны/
Сосудистый тонус и его компоненты.

Наличие сосудистого тонуса определяют 2 основных механизма – нейрогенный и миогенный.
Миогенный тонус возникает, когда некоторые гладкомышечные клетки сосудов начинают спонтанно генерировать нервный импульс. Возникающее возбуждение
распространяется на другие клетки, и
происходит сокращение. Тонус поддерживается
за счёт базального механизма. Разные
сосуды обладают разным базальным
тонусом: максимальный тонус наблюдаются
в коронарных сосудах, скелетных мышцах,
почках, а минимальный – в коже и слизистой
оболочке. Его значение заключается в
том, что сосуды с высоким базальным
тонусом на сильное раздражение отвечают
расслаблением, а с низким – сокращением.
Возникающее возбуждение
распространяется на другие клетки, и
происходит сокращение. Тонус поддерживается
за счёт базального механизма. Разные
сосуды обладают разным базальным
тонусом: максимальный тонус наблюдаются
в коронарных сосудах, скелетных мышцах,
почках, а минимальный – в коже и слизистой
оболочке. Его значение заключается в
том, что сосуды с высоким базальным
тонусом на сильное раздражение отвечают
расслаблением, а с низким – сокращением.Нервный механизм возникает в гладкомышечных клетках сосудов под влиянием импульсов из ЦНС. За счёт этого происходит ещё большее увеличение базального тонуса. Такой суммарный тонус – тонус покоя, с частотой импульсов 1 – 3 в секунду.
Кроме того, на сосудистый тонус оказывают влияние гуморальные механизмы, которые осуществляются за счёт веществ местного и системного действия.Эти механизмы и предстоит рассмотреть при изучении регуляции сосудистого тонуса.
Происхождение сосудистого тонуса
Нейрогенный
компонент сосудистого тонуса определяется
исключительно тонической активностью
симпатических адренергических
вазоконстрикторных нервных волокон
(симпатические и парасимпатические
холинергические вазодилататорные
волокна тонической активностью не
обладают).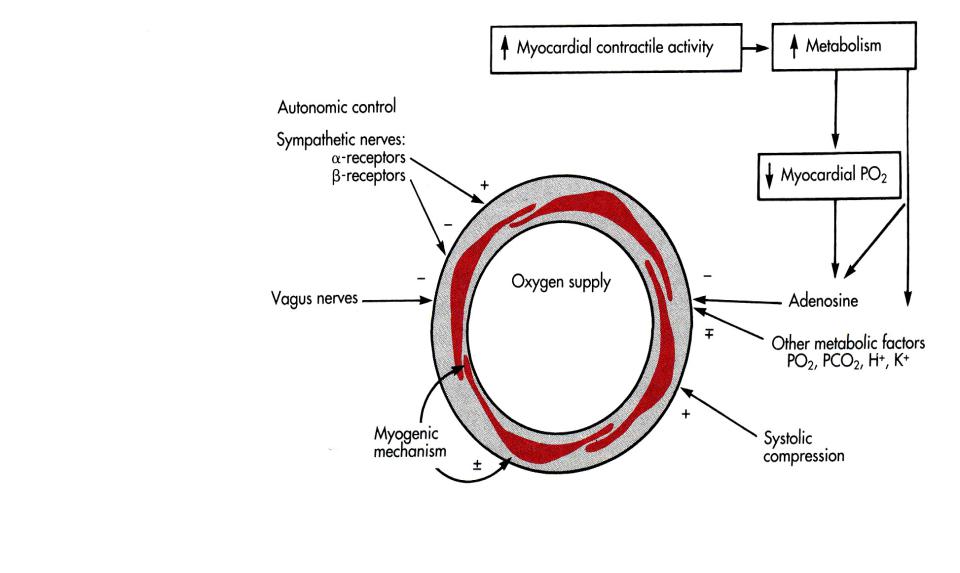 Считается установленным, что
в условиях физиологического покоя
тоническая симпатическая вазоконстрикторная
импульсация не превышает 1 – 2 имп/с
.Однако электрофизиологические
исследования показывают, что эфферентная
симпатическая импульсация в покое имеет
нерегулярный характер , с непериодическим
чередованием отдельных импульсов и
пачек импульсов, с разным расстоянием
между импульсами, с разным числом
импульсов в пачках и по частоте,
следовательно, может значительно
превышать 1 – 2 имп/с.
Считается установленным, что
в условиях физиологического покоя
тоническая симпатическая вазоконстрикторная
импульсация не превышает 1 – 2 имп/с
.Однако электрофизиологические
исследования показывают, что эфферентная
симпатическая импульсация в покое имеет
нерегулярный характер , с непериодическим
чередованием отдельных импульсов и
пачек импульсов, с разным расстоянием
между импульсами, с разным числом
импульсов в пачках и по частоте,
следовательно, может значительно
превышать 1 – 2 имп/с.
Нейрогенный
механизм сосудистого тонуса выявлен
во многих участках сосудистого русла,
причём величина его в разных органах
существенно различается. Это связано,
очевидно, не столько с различиями
эфферентной симпатической посылки к
разным органам, сколько с органными
особенностями плотности симпатической
иннервации сосудов, плотности распределения
в них и чувствительности адренорецепторов.
Децентрализация приводит к умеренной
вазодилатации в скелетных мышцах
(нестойкой) , в кишечнике (устойчивой),
в коже (наиболее стойкой), слабая
вазодилатация наблюдается в печени,
миокарде, непостоянно выявляется в
мозге и почке.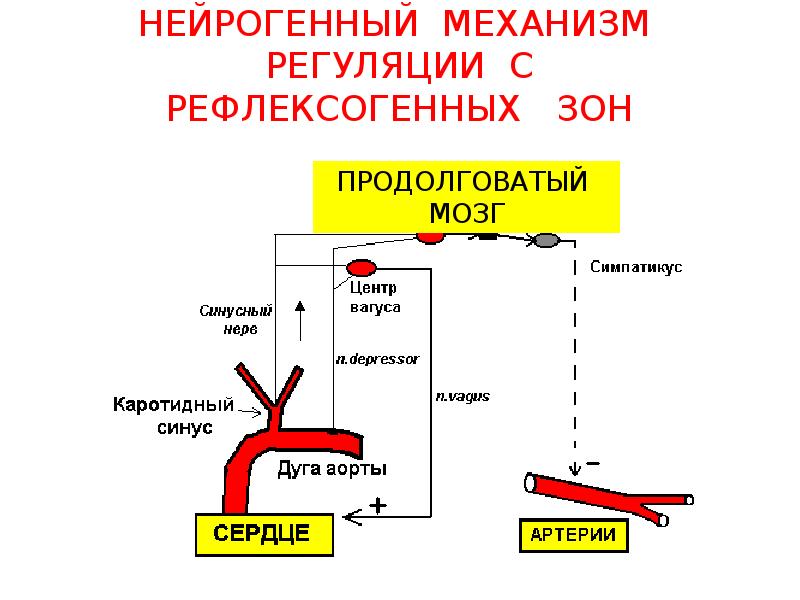
Нейрогенный
компонент не является решающим фактором
формирования сосудистого тонуса; даже
в органах с высокой плотностью иннервации
он определяет, очевидно, не более 15 –
20 % суммарного тонуса сосудов. После
выключения всех нервных и гуморальных
влияний (в основном циркулирующих в
крови катехоламинов) в сосудах сохраняется
так называемый основной или базальный
тонус (именуемый так же «периферическим»
или «миогенным»). Он сохраняется так же
при выключении реагирования сосудов
на изменения внутрисосудистого давления.
Кроме того, внутрисосудистое давление
не является постоянно действующим
раздражителем. Например, в децентрализованных
скелетных мышцах многие артериолы
полностью закрыты (что отражает их
высокий тонус), хотя давление крови в
них практически равно нулю. Следовательно,
миогенная реакция сосудов на растяжение
(феномен Остроумова — Бейлисса) не
является главенствующим фактором,
ответственным за формирование базального
тонуса. Считается, что в основе базального
тонуса лежит автоматия сосудистых
гладких мышц, т.
Базальный тонус неодинаков в сосудах разных органов и имеет разное функциональное значение. Он высок в артериолах и значительно ниже в венозных сосудах. Хорошо выражен базальный тонус в сосудах скелетных мышц, слюнных желёз, кишечника, печени, сердца, менее выражен в сосудах мозга, сравнительно низок в сосудах почки и жировой ткани и практически отсутствует в артериовенозных анастомозах кожи. Миогенный (базальный) тонус сосудов и представляет собой ту основу, на которой реализуется влияние различных местных факторов регуляции – механических, метаболических, гормональных, что и обеспечивает осуществление важных процессов ауторегуляции кровотока и функциональной гиперемии.
Регуляция тонуса сосудов, понятие о базальном и нейрогенном тонусе.
 Функциональная система поддержания АД на оптимальном уровне.
Функциональная система поддержания АД на оптимальном уровне.Под тонусом сосудов понимают непрерывно поддерживаемую определённую степень сократительной активности сосудистых гладких мышц, которая не сопровождается развитием утомления и определяет противодействие растягивающему сосуд давлению крови. Таким образом, тонус сосудов формируется исключительно деятельностью их гладких мышц. Усиление тонуса сопровождается увеличением сопротивления потоку крови, ослабление – уменьшением сопротивления. На сопротивление сосудов, помимо их тонуса, оказывают влияние многие факторы: вязкость крови (а, следовательно, температура, гематокрит ,содержание белков, скорость кровотока, деформируемость эритроцитов), экстраваскулярная компрессия, состояние коллагеново — эластинового каркаса и др.
Наличие сосудистого тонуса определяют 2 основных механизма – нейрогенный и миогенный.
Миогенный тонус возникает, когда некоторые гладкомышечные клетки сосудов начинают спонтанно генерировать нервный импульс. Возникающее возбуждение распространяется на другие клетки, и происходит сокращение. Тонус поддерживается за счёт базального механизма. Разные сосуды обладают разным базальным тонусом: максимальный тонус наблюдаются в коронарных сосудах, скелетных мышцах, почках, а минимальный – в коже и слизистой оболочке. Его значение заключается в том, что сосуды с высоким базальным тонусом на сильное раздражение отвечают расслаблением, а с низким – сокращением.
Возникающее возбуждение распространяется на другие клетки, и происходит сокращение. Тонус поддерживается за счёт базального механизма. Разные сосуды обладают разным базальным тонусом: максимальный тонус наблюдаются в коронарных сосудах, скелетных мышцах, почках, а минимальный – в коже и слизистой оболочке. Его значение заключается в том, что сосуды с высоким базальным тонусом на сильное раздражение отвечают расслаблением, а с низким – сокращением.
Нервный механизм возникает в гладкомышечных клетках сосудов под влиянием импульсов из ЦНС. За счёт этого происходит ещё большее увеличение базального тонуса. Такой суммарный тонус – тонус покоя, с частотой импульсов 1 – 3 в секунду.
Кроме того, на сосудистый тонус оказывают влияние гуморальные механизмы, которые осуществляются за счёт веществ местного и системного действия.
Эти механизмы и предстоит рассмотреть при изучении регуляции сосудистого тонуса.
Происхождение сосудистого тонуса
Нейрогенный компонент сосудистого тонуса определяется исключительно тонической активностью симпатических адренергических вазоконстрикторных нервных волокон (симпатические и парасимпатические холинергические вазодилататорные волокна тонической активностью не обладают). Считается установленным, что в условиях физиологического покоя тоническая симпатическая вазоконстрикторная импульсация не превышает 1 – 2 имп/с .Однако электрофизиологические исследования показывают, что эфферентная симпатическая импульсация в покое имеет нерегулярный характер , с непериодическим чередованием отдельных импульсов и пачек импульсов, с разным расстоянием между импульсами, с разным числом импульсов в пачках и по частоте, следовательно, может значительно превышать 1 – 2 имп/с.
Считается установленным, что в условиях физиологического покоя тоническая симпатическая вазоконстрикторная импульсация не превышает 1 – 2 имп/с .Однако электрофизиологические исследования показывают, что эфферентная симпатическая импульсация в покое имеет нерегулярный характер , с непериодическим чередованием отдельных импульсов и пачек импульсов, с разным расстоянием между импульсами, с разным числом импульсов в пачках и по частоте, следовательно, может значительно превышать 1 – 2 имп/с.
Нейрогенный механизм сосудистого тонуса выявлен во многих участках сосудистого русла, причём величина его в разных органах существенно различается. Это связано, очевидно, не столько с различиями эфферентной симпатической посылки к разным органам, сколько с органными особенностями плотности симпатической иннервации сосудов, плотности распределения в них и чувствительности адренорецепторов. Децентрализация приводит к умеренной вазодилатации в скелетных мышцах (нестойкой) , в кишечнике (устойчивой), в коже (наиболее стойкой), слабая вазодилатация наблюдается в печени, миокарде, непостоянно выявляется в мозге и почке.
Нейрогенный компонент не является решающим фактором формирования сосудистого тонуса; даже в органах с высокой плотностью иннервации он определяет, очевидно, не более 15 – 20 % суммарного тонуса сосудов. После выключения всех нервных и гуморальных влияний (в основном циркулирующих в крови катехоламинов) в сосудах сохраняется так называемый основной или базальный тонус (именуемый так же «периферическим» или «миогенным»). Он сохраняется так же при выключении реагирования сосудов на изменения внутрисосудистого давления. Кроме того, внутрисосудистое давление не является постоянно действующим раздражителем. Например, в децентрализованных скелетных мышцах многие артериолы полностью закрыты (что отражает их высокий тонус), хотя давление крови в них практически равно нулю. Следовательно, миогенная реакция сосудов на растяжение (феномен Остроумова — Бейлисса) не является главенствующим фактором, ответственным за формирование базального тонуса. Считается, что в основе базального тонуса лежит автоматия сосудистых гладких мышц, т. е. присущая им способность развивать и поддерживать сократительную активность за счёт внутренних биохимических и регуляторных процессов. Таким образом, по своему происхождению базальный тонус сосудов является миогенным.
е. присущая им способность развивать и поддерживать сократительную активность за счёт внутренних биохимических и регуляторных процессов. Таким образом, по своему происхождению базальный тонус сосудов является миогенным.
Базальный тонус неодинаков в сосудах разных органов и имеет разное функциональное значение. Он высок в артериолах и значительно ниже в венозных сосудах. Хорошо выражен базальный тонус в сосудах скелетных мышц, слюнных желёз, кишечника, печени, сердца, менее выражен в сосудах мозга, сравнительно низок в сосудах почки и жировой ткани и практически отсутствует в артериовенозных анастомозах кожи. Миогенный (базальный) тонус сосудов и представляет собой ту основу, на которой реализуется влияние различных местных факторов регуляции – механических, метаболических, гормональных, что и обеспечивает осуществление важных процессов ауторегуляции кровотока и функциональной гиперемии.
От величины просвета сосудов, от их тонуса и количества выбрасываемой в них сердцем крови зависит кровоснабжение органов. Поэтому при рассмотрении регуляции функции сосудов прежде всего должна идти речь о механизмах поддержания сосудистого тонуса и о взаимодействии сердца и сосудов.
Поэтому при рассмотрении регуляции функции сосудов прежде всего должна идти речь о механизмах поддержания сосудистого тонуса и о взаимодействии сердца и сосудов.
Нейрогенный мочевой пузырь — Патология мочеполовой системы
-
Остаточный объем мочи
-
Креатинин сыворотки крови
-
Обычно цистография, цистоскопия и цистометрия с уродинамическими пробами
Предварительный диагноз устанавливается на основании клинической картины. Обычно измеряется остаточный объем мочи после мочеиспускания, УЗИ почек проводится для выявления гидронефроза, а уровень сывороточного креатинина измеряется для оценки функции почек.
Дальнейшие исследования обычно не проводятся у пациентов, неспособных к самокатетеризации или пользованию уборной (например, серьезно обездвиженные пожилые пациенты или перенесшие инсульт).
Пациентам в некритическом состоянии с гидронефрозом или нефропатией обычно рекомендуется проведение цистографии, цистоскопии и цистометрии для определения дальнейшей тактики лечения.
-
Цистографию применяют для оценки вместимости мочевого пузыря и выявления уретрального рефлюкса.
-
Цистоскопия используется для оценки продолжительности и тяжести задержки мочи (с помощью выявления степени образования трабекул), а также для выявления обструкции выходного отверстия мочевого пузыря.
-
С помощью цистометрии можно оценить объем мочевого пузыря и давление в нем; если проводить исследование в восстановительную фазу после повреждения спинного мозга, то оно может помочь в оценке функциональных возможностей детрузора и определении перспектив реабилитации ( Обследование).
Уродинамические исследования скорости потока мочи при помощи электромиографии сфинктера могут продемонстрировать скоординированность расслабления сфинктера и сокращения мочевого пузыря.
Оценка регуляции сосудистого тонуса у больных билиарнозависимым панкреатитом Текст научной статьи по специальности «Клиническая медицина»
УДК 616.37-002.1-07: 616.13/14-009.16
ОЦЕНКА РЕГУЛЯЦИИ СОСУДИСТОГО ТОНУСА У БОЛЬНЫХ БИЛИАРНОЗАВИСИМЫМ ПАНКРЕАТИТОМ ©
А. И. Ершова1*, А. В. Попов1, С. Ю. Подтаев2, И. А. Мизева2, Е. Р. Ганеева1, И. Л. Гуляева1
1 Пермская государственная медицинская академия им. ак. Е. А. Вагнера,
2 Институт механики сплошных сред УрО РАН, г. Пермь, Россия
ESTIMATION OF VASCULAR TONUS REGULATION IN PATIENTS WITH BILIARY-DEPENDENT PANCREATITIS
A. I. Ershova1*, A. V. Popov1, S. Yu. Podtaev2,I. A. Mizeva2, E. R. Ganeeva1,I. L. Gulyaeva1
R. Ganeeva1,I. L. Gulyaeva1
1 Perm State Academy of Medicine named after Academician E. A. Wagner,
2 Institute of Continuum Mechanics, UD of RAS, Perm, Russian Federation
Цель. Изучить состояние системной и регионарной микроциркуляции у пациентов с билиарно-зависимым панкреатитом.
Материалы и методы. Обследовано 12 больных билиарнозависимым панкреатитом. Кроме стандартных методов обследования выполняли реогепатографию и прецизионную термометрию. Результаты. У практически здоровых амплитуды колебаний кожной температуры в ответ на холо-довую нагрузку достоверно снижаются, а после ее окончания в течение трех минут восстанавливаются до начальных значений. Колебания кожной температуры в эндотелиальном диапазоне частот при билиарном панкреатите снижаются во время холодовой пробы и в дальнейшем не изменяются. В нейрогенном и миогенном диапазонах частот колебания кожной температуры снижаются во время прессорного теста и восстанавливаются до исходных значений только к 10-й минуте после пробы. Эндотелиальная и нейрогенная дизрегуляция тонуса сосудов ассоциирована с нарушениями регионарного кровообращения и служит одним из факторов риска развития панкреатогенной печеночной и почечной дисфункции. Нарушение эндотелиальной системы вазорегуляции неразрывно связано с гемореологическими изменениями крови.
В нейрогенном и миогенном диапазонах частот колебания кожной температуры снижаются во время прессорного теста и восстанавливаются до исходных значений только к 10-й минуте после пробы. Эндотелиальная и нейрогенная дизрегуляция тонуса сосудов ассоциирована с нарушениями регионарного кровообращения и служит одним из факторов риска развития панкреатогенной печеночной и почечной дисфункции. Нарушение эндотелиальной системы вазорегуляции неразрывно связано с гемореологическими изменениями крови.
Выводы. Развитие билиарнозависимого панкреатита сопровождается эндотелиальной дисфункцией и снижением активности нейрогенного и миогенного механизмов регуляции сосудистого тонуса. Ключевые слова. Билиарнозависимый панкреатит, прецизионная термометрия, реогепатография, эндотелиальная дисфункция, нейрогенная и миогенная дизрегуляция.
Aim. To study the state of systemic and regional microcirculation in patients with biliary-dependent pancreatitis. Materials and methods. 12 patients with biliary-dependent pancreatitis were examined. Besides the standard methods of examination, rheohepatography and precision thermometry was performed. Results. In practically healthy persons, skin temperature amplitudes are reliable decreased in response to cold stress, but after its termination they restore till the initial values during three minutes. In biliary pancreatitis, skin temperature fluctuations in endothelial frequency range fall during the cold test and do not
Materials and methods. 12 patients with biliary-dependent pancreatitis were examined. Besides the standard methods of examination, rheohepatography and precision thermometry was performed. Results. In practically healthy persons, skin temperature amplitudes are reliable decreased in response to cold stress, but after its termination they restore till the initial values during three minutes. In biliary pancreatitis, skin temperature fluctuations in endothelial frequency range fall during the cold test and do not
©
Ершова А. И., Попов А. В., Подтаев С. Ю., Мизева И. А., Ганеева Е. Р., Гуляева И. Л., 2013 e-mail: [email protected] тел. 8 (342) 239-29-30
[Ершова А. И. («контактное лицо) — аспирант кафедры госпитальной хирургии; Попов А. В. — доцент кафедры госпитальной хирургии; Подтаев С. Ю. — старший научный сотрудник лаборатории физической гидродинамики; Мизева И. А. — младший научный сотрудник лаборатории физической гидродинамики; Ганеева Е. Р. — старший преподаватель кафедры патологической физиологии; Гуляева И. Л. — заведующая кафедрой патологической физиологии].
А. — младший научный сотрудник лаборатории физической гидродинамики; Ганеева Е. Р. — старший преподаватель кафедры патологической физиологии; Гуляева И. Л. — заведующая кафедрой патологической физиологии].
change later on. In neurogenic and myogenic frequency ranges, skin temperature fluctuations decrease during the pressor test and restore to the initial values by the 10th minute after the test. Endothelial and neurogenic disregulation of vascular tonus is associated with disturbances of regional circulation and serves as one of risk factors for development of pancreatogenic hepatic and renal dysfunction. Disturbance of endothelial vasoregulation system is closely connected with hemorheological changes in blood. Conclusion. Development of biliary-dependent pancreatitis is accompanied by endothelial dysfunction and decrease in activity of neurogenic and myogenic mechanisms of vascular tonus regulation. Key words. Biliary-dependent pancreatitis, precision thermometry, rheohepatography, endothelial dysfunction, neurogenic and myogenic dysregulation.
Введение
Развитие панкреатита в 30% случаев связывают с холедохолитиазом или употреблением алкоголя. Не менее редкой причиной заболевания является гиперлипидемия, особенно гипертриглицеридемия. Действие липазы на триглицериды приводит к повреждению сосудов и ишемии в микроциркуля-торном русле поджелудочной железы [5]. Исследования показали, что тяжесть течения панкреатита непосредственно связана с функциональным состоянием эндотелия [6].
Дисфункция эндотелия проявляется дисбалансом, с одной стороны, между продукцией вазодилатирующих, ангиопротектив-ных, антипролиферативных факторов (N0, простациклин, тканевой активатор плазми-ногена, С-тип натрийуретического пептида, эндотелиального гиперполяризующего фактора) и вазоконстриктивных, протромботи-ческих, пролиферативных факторов (эндо-телин, супероксиданион, тромбоксан А2, ингибитор тканевого активатора плазминоге-на) — с другой стороны [7]. При этом механизм их окончательной реализации у больных би-лиарнозависимым панкреатитом неясен.
При этом механизм их окончательной реализации у больных би-лиарнозависимым панкреатитом неясен.
Для оценки состояния механизмов регуляции и выявления адаптационных резервов системы микроциркуляции применяют лазерную допплеровскую флоуметрию или исследование сосудистого тонуса с помощью прецизионной термометрии [8]. Использование вейвлет-анализа колебаний кожной температуры позволяет выделить диапазоны час-
тот, отвечающие за миогенный, нейрогенный и эндотелиальный механизмы регуляции тонуса сосудов [3].
Нарушения функции микроциркуля-торного русла являются одним из универсальных механизмов патогенеза многих заболеваний и ассоциированы с изменениями кровообращения в печени. По данным рео-гепатографии показано, что билиарнозави-симый панкреатит сопровождается инверсией портоартериального кровообращения [4]. При этом практически отсутствует структурированный анализ изменений микроциркуляции на органном и системном уровнях.
Цель работы — изучить состояние системной и регионарной микроциркуляции у пациентов с билиарнозависимым панкреатитом.
Материалы и методы
ИССЛЕДОВАНИЯ
Под нашим наблюдением находились 12 пациенток с билиарнозависимым панкреатитом, средний возраст — 43,7±6,9 г. При обследовании больных учитывали общий анализ крови и мочи, биохимический анализ крови, данные коагулограммы, результаты ультразвукового обследования и компьютерной томографии органов панкреатобилиар-ной зоны. Контрольную группу составили 24 практически здоровых добровольца.
Гемодинамика печени оценивалась с помощью диагностического комплекса «Полире-окардиограф-01 Пермь» и оригинального тет-раполярного метода наложения электродов.
Определялся индекс объема жидкости печеночных синусоидов (ИО, л/м2) и печеночный индекс (ПИ, л/мин/м2).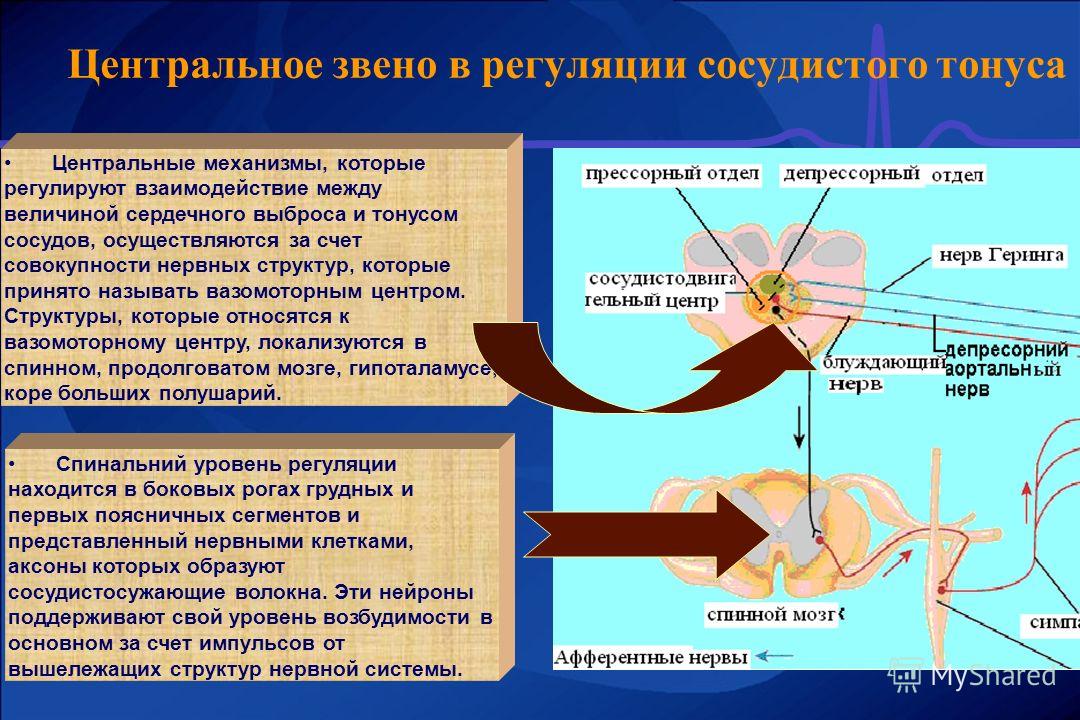 Индекс артериально-синусоидальной перфузии (ИАПС, ед.) рассчитывался по формуле: ИАПС=ПИ/ИО [4].
Индекс артериально-синусоидальной перфузии (ИАПС, ед.) рассчитывался по формуле: ИАПС=ПИ/ИО [4].
Тонус сосудов изучался с помощью прибора «Термодат» (НПП «Системы контроля», г. Пермь, Россия, сертификат RU.C 32.001 .А № 18321). Исследование включало в себя регистрацию температурного сигнала в покое (в течение 10 минут), далее в течение 3 минут проведения холодовой пробы и на протяжении 10 минут после нее. Результаты регистрации сигнала были обработаны с помощью вейвлет-анализа [8].
Для выявления значимых различий в рассматриваемых группах использовались стандартные методы непараметрической статистики — критерии Вальда-Вольфовитца (Wald-Wolfowitz Runs Test), Манна-Уитни (Mann-Whitney U-Test) и Колмогорова -Смирнова (Kolmogorov-Smirnov Test). Достоверность различий (p) между средними параметрами прецизионной термометрии оценивали с использованием непараметрических критериев Вилкоксона (Wilcoxon Matched Pairs Test) и знакового (Sign-test). Различие показателей считали значимым при p<0,05. Корреляционный анализ проводили с использованием ранговых методов и метода Спирмена (Spearmen).
Различие показателей считали значимым при p<0,05. Корреляционный анализ проводили с использованием ранговых методов и метода Спирмена (Spearmen).
Результаты и их обсуждение
У практически здоровых лиц амплитуды колебаний кожной температуры во всех диапазонах частот в ответ на холодовую нагрузку достоверно снижались. После окончания функциональной пробы в течение трех минут амплитуда колебаний восстанавливалась до начальных значений и не изменялась в дальнейшем.
У больных билиарнозависимым панкреатитом колебания кожной температуры
в диапазоне частот, отвечающем за эндоте-лиальный механизм регуляции сосудистого тонуса, также достоверно снижались (р=0,017). Однако после прекращения холо-довой нагрузки изменения амплитуд колебаний были недостоверны и не достигали исходных значений даже в течение 10 минут после теста (рисунок, а).
В нейрогенном диапазоне частот амплитуды колебаний кожной температуры у больных билиарнозависимым панкреатитом так же, как и у здоровых лиц, достоверно снижались в ответ на холодовую пробу (р=0,017). После прекращения нагрузки амплитуды колебаний увеличивались медленно и достигали стартовых значений только к концу исследования (рисунок, б).
Изменения миогенного механизма регуляции сосудистого тонуса у больных били-арнозависимым панкреатитом оказались подобны. Так же, как и в нейрогенном диапазоне, амплитуды колебаний кожной температуры снижались во время холодового прессорного теста (р=0,027) и медленно восстанавливались после прекращения нагрузки (рисунок, в).
Таким образом, билиарнозависимый панкреатит характеризуется эндотелиальной дисфункцией и снижением активности ней-рогенного и миогенного механизмов регуляции сосудистого тонуса.
Известно, что эндотелиальная дисфункция сопровождается нарушениями свертывающей системы крови [1]. Изменения коагу-ляционных свойств крови — один из основных факторов в патогенезе острого панкреатита [2]. По нашим данным, повышение уровня фибриногена (£$=0,85) и активированного протромбинового времени (£$=0,82) было тесно связано с выраженностью нарушений эндотелиального механизма вазорегуляции. Подтверждением взаимосвязи гемореологиче-ских нарушений крови и эндотелиальной дисфункции при билиарном панкреатите слу-
Диаграмма размаха ( 4у*7с) Медиана; Ящик: 25%-75%; Отрезки: Размах без выбр.
В1 В2 ВЗ В4 6
Диаграмма размаха ( 4у*7с) Медиана; Ящик: 25%-75%; Отрезки: Размах без выбр.
С1 С2 СЗ С4
□ Медиана
□ 25%-75%
~Г Размах без выбр.
* Крайние точки
А1 А2 АЗ А4
а
Диаграмма размаха (4у*7с) Медиана; Ящик: 25%-75%; Отрезки: Размах без выбр.
L= l—i J □
о Медиана
□ 25%-75%
«Г Размах без выбр.
о Выбросы
* Крайние точки
—
□
!
1 □
□ Медиана □ 25%-75%
; Размах без выбр.
о Выбросы
Рис. Изменения амплитуд колебаний кожной температуры у больных билиарнозависимым панкреатитом: а — в эндотелиальном диапазоне; б — в нейрогенном диапазоне; в — в миогенном диапазоне (А1 — амплитуда колебаний кожной температуры в покое, А2 — во время холодовой пробы, А3 — в течение 3 минут после пробы, А4 — в течение последующих 7 минут)
жила выявленная корреляция между уровнем гемоглобина и степенью снижения амплитуды колебаний кожной температуры в эндотелиальном диапазоне частот в ответ на холодовую нагрузку (Rs=-0,85).
Синдром цитолиза, нередко выявляемый у больных билиарнозависимым панкреатитом, в наших исследованиях был связан со степенью угнетения активности эндотелия микроциркуляторного русла (Rs=0,92). Не вызывает сомнений, что нарушения системной микроциркуляции связаны с изменениями внутрипеченочно-го кровообращения. Мы подтвердили известную взаимосвязь между эндотелиаль-ной дисфункцией и уровнем артериали-зации печеночного кровотока (Rs=0,82). Кроме того, обнаружена взаимосвязь между органной и системной микроциркуляцией на уровне нейрогенного механизма регуляции сосудистого тонуса. Это нашло отражение в прямой корреляции реактивных изменений колебаний кожной температуры на прессорный тест в нейроген-ном диапазоне частот с уровнем притока артериальной крови к печени (Rs=0,92) и степенью артериализации синусоид (Rs=0,82).
Мы подтвердили известную взаимосвязь между эндотелиаль-ной дисфункцией и уровнем артериали-зации печеночного кровотока (Rs=0,82). Кроме того, обнаружена взаимосвязь между органной и системной микроциркуляцией на уровне нейрогенного механизма регуляции сосудистого тонуса. Это нашло отражение в прямой корреляции реактивных изменений колебаний кожной температуры на прессорный тест в нейроген-ном диапазоне частот с уровнем притока артериальной крови к печени (Rs=0,92) и степенью артериализации синусоид (Rs=0,82).
Ассоциированная с микроциркулятор-ными нарушениями панкреатогенная почечная дисфункция проявляла себя корреляцией элементов мочевого осадка (количество кристаллов солей и плоского эпителия) с выраженностью нарушений нейрогенной системы вазорегуляции (Rs=0,82). Подтверждением известной взаимосвязи эндотели-альной дисфункции с развитием тубуляр-но-интерстициального нефроза у больных панкреатитом служила установленная взаимосвязь между уровнем креатинина и степенью восстановления амплитуд колебаний кожной температуры в эндотелиальном диапазоне частот после холодовой нагрузки (Rs—0,94).
Выводы
1. Развитие билиарнозависимого панкреатита сопровождается эндотелиальной дисфункцией и снижением активности ней-рогенного и миогенного механизмов регуляции сосудистого тонуса.
2. Эндотелиальная и нейрогенная диз-регуляция тонуса сосудов ассоциирована с нарушениями регионарного кровообращения и служит одним из факторов риска развития панкреатогенной печеночной и почечной дисфункции.
3. Нарушение эндотелиальной системы вазорегуляции неразрывно связано с гемо-реологическими изменениями крови.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Лазерная допплеровская флоуметрия микроциркуляции крови: руководство для врачей / под ред. А. И. Крупаткина, В. В. Сидорова. М.: Медицина 2005; 125.
2. Нестеренко Ю. А., Лаптев В. В., Михаилу -сов С В. Диагностика и лечение деструктивного панкреатита. М.: БИНОМ-Пресс 2004; 304.
3. Попов А В, Подтаев С. Ю, Фрик П. Г, Ершова А И., Жукова Е. А Исследования низко-
амплитудных колебаний кожной температуры при проведении непрямой холодовой пробы. Регионарное кровообращение и микроциркуляция 2011; 1: 89-94.
4. Попов А В, Ранкевич Н А, Ершова А. И., Жукова Е. А, Шилов М. В. Возможности реоге-патографии в оценке изменений микроциркуляции печени у больных желчнокаменной болезнью. Пермский мед. журн. 2009; 3: 102-108.
5. Хендерсон Д. М. Патофизиология органов пищеварения М.: БИНОМ 1997; 230.
6. Chen Z. H., Liu Z. H, Yu C, Ji D. X, Li L S. Endothelial dysfunction in patients with severe acute pancreatitis: improved by continuous blood purification therapy. Int. J. Artif. Organs 2007; 30: 393-400.
X, Li L S. Endothelial dysfunction in patients with severe acute pancreatitis: improved by continuous blood purification therapy. Int. J. Artif. Organs 2007; 30: 393-400.
7. Elhadd T. A, Abdu T. A, Oxtoby J. Biochemical and biophysical markers of endothelial dysfunction in adults with hypopituitarism and severe GH deficiency. J. of Clin. Endocrinol. Metab. 2001; 86: 4223-4232.
8. Podtaev S, Morozov M, Frick P. Wavelet-based correlations of skin temperature and blood flow oscillations. Cardiovasc. Eng. 2008; 8: 185-189.
Материал поступил в редакцию 07.07.2013
Синдром мышечной дистонии у детей первого года жизни
Cиндром мышечной дистонии является одним из самых частых диагнозов, которые ставят неврологи, а так же педиатры в нашей стране.
Давайте сначала разберемся, что такое мышечный тонус и каковы могут быть причины его повышения?
Итак, под мышечным тонусом понимают сопротивление мышцы, возникающее при ее пассивном растяжении во время движения в суставе. В регуляции тонуса мышц принимает участие ряд структур спинного и головного мозга. Для формирования патологического тонуса мышц, особенно повышенного (“гипертонуса”), необходима веская причина, связанная с поражением, нарушением структуры головного и/или спинного мозга. Например, такими причинами могут быть тяжелая гипоксия в родах (оценка по шкале Апгар <5 баллов), травма, энцефалит, порок развития ГМ и/или СМ, а так же ряд редких генетических заболеваний. Таким образом, при отсутствии вышеописанных серьезных причин, наличие у ребенка отклонений мышечного тонуса от нормы маловероятно.
В регуляции тонуса мышц принимает участие ряд структур спинного и головного мозга. Для формирования патологического тонуса мышц, особенно повышенного (“гипертонуса”), необходима веская причина, связанная с поражением, нарушением структуры головного и/или спинного мозга. Например, такими причинами могут быть тяжелая гипоксия в родах (оценка по шкале Апгар <5 баллов), травма, энцефалит, порок развития ГМ и/или СМ, а так же ряд редких генетических заболеваний. Таким образом, при отсутствии вышеописанных серьезных причин, наличие у ребенка отклонений мышечного тонуса от нормы маловероятно.
Разберем несколько наиболее часто встречающихся клинических ситуаций, когда заключение “Синдром мышечной дистонии” звучит страшно, но является лишь случаем гипердиагностики.
У детей от рождения до 3-3,5 месяцев в норме повышен тонус мышц, которые сгибают конечности. Это проявляется своеобразной позой, когда у ребенка преимущественно ноги и руки находятся в согнутом положении. Подобные проявления являются нормой и не требуют лечения и массажа.

Опора ребенка на мыски стоп и/или вытягивание мысков при вертикализации в возрасте 5-7 месяцев как изолированный симптом встречается в рамках нормы. Это связано с этапами становления двигательной функции и не является признаком патологии, особенно столь серьезной, как детский церебральный паралич (ДЦП).
Термин «дистония» обозначает нарушение механизма взаиморегуляции тонуса различных мышц между собой. Когда эта взаимосогласованная регуляция нарушается, именно это и называют дистонией. Дело в том, что на первом году жизни, особенно в 1-е месяцы, дети в норме очень дистоничны, так как становление взаимодействия и регуляции тонуса различных групп мышц будут происходить до 2-х лет, и наиболее активно в первые 14 месяцев. Мы нередко можем видеть определенную односторонность: движения конечностями одной половины тела могут быть более активными, тонус немного выше. Это характерно для детей до 6-ти месяцев. По мере развития головного мозга и проводящих нервных путей, а так же становления двигательных навыков формируется симметрия движений.
 Курсы массажа с элементами ЛФК влияют на данный процесс только опосредованно в качестве упражнения, тренировки навыка. Если вы будете сами обучать своего ребенка как сидеть, ползать, вставать и т.д., результат будет таким же, а зачастую — намного лучше, потому что контакт и степень доверия родителям намного лучше, чем массажисту, чужому человеку.
Курсы массажа с элементами ЛФК влияют на данный процесс только опосредованно в качестве упражнения, тренировки навыка. Если вы будете сами обучать своего ребенка как сидеть, ползать, вставать и т.д., результат будет таким же, а зачастую — намного лучше, потому что контакт и степень доверия родителям намного лучше, чем массажисту, чужому человеку.
В данной статье мы отразили наиболее распространенные клинические ситуации. Конечно, все не так однозначно. Поэтому при подозрении на нарушения в развитии ребенка необходимо проконсультироваться у квалифицированного детского невролога.
Тактика ведения пациентов с нейрогенным мочевым пузырем
Автор: Андреева Е. А., ветеринарный врач-терапевт. Ветеринарная клиника неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург, 2017 год.
Сокращения: ВДН – верхний двигательный нейрон, НДН – нижний двигательный нейрон.
Проблема нейрогенного мочевого пузыря довольно актуальна у неврологических пациентов. У многих животных с нарушением иннервации мочевого пузыря, даже успешно перенесших хирургическое вмешательство, развивается бактериальный уроцистит, способный впоследствии привести к развитию пиелонефрита, уросепсиса и гибели животного.
У многих животных с нарушением иннервации мочевого пузыря, даже успешно перенесших хирургическое вмешательство, развивается бактериальный уроцистит, способный впоследствии привести к развитию пиелонефрита, уросепсиса и гибели животного.
Нейрогенный мочевой пузырь – это группа заболеваний, при которых нарушается иннервация мочевого пузыря. Результатом может быть нарушение фазы опорожнения мочевого пузыря, подтекание мочи, функциональная обструкция мочевого пузыря, реже – нарушение фазы накопления мочи, нарушение взаимодействия мышц детрузора и наружного сфинктера уретры (диссинергия).
Наиболее часто встречаются поражения мочевого пузыря по типу верхнего и нижнего двигательного нейрона.
Для того чтобы разобраться в причинах подобных нарушений, необходимо вспомнить механизм иннервации мочевого пузыря. За иннервацию мочевого пузыря отвечают три нерва: подчревный, тазовый и срамной. Ядра подчревного нерва располагаются в сегментах L1–L4 спинного мозга, ядра тазового и срамного нервов располагаются в сегментах S1–S3 спинного мозга. Центр мочеиспускания находится в стволе мозга. При этом верхним двигательным нейроном для мочевого пузыря является центр мочеиспускания в стволе мозга, а нижним – ядра тазового и срамного нервов в сегментах спинного мозга S1–S3.
Центр мочеиспускания находится в стволе мозга. При этом верхним двигательным нейроном для мочевого пузыря является центр мочеиспускания в стволе мозга, а нижним – ядра тазового и срамного нервов в сегментах спинного мозга S1–S3.
В фазу наполнения мочевого пузыря ветви подчревного нерва обеспечивают расслабление детрузора и одновременно смыкание внутреннего гладкомышечного сфинктера мочевого пузыря (рис. 1). При достижении порога растяжимости от рецепторов в мочевом пузыре через тазовый нерв поступают чувствительные импульсы в центр мочеиспускания (ствол мозга). Из ствола мозга в ответ выходят импульсы, активирующие ядра тазового нерва и блокирующие ядра подчревного и срамного нервов. Результатом активации тазового нерва является сокращение детрузора и опорожнение мочевого пузыря (рис. 2). По мере опорожнения мочевого пузыря поступление импульсов от рецепторов растяжения в ствол мозга прекращается, и мочевой пузырь снова переходит в фазу накопления мочи.
При повреждении проводящих путей на любом участке краниальнее сегмента S1 нарушается проведение двигательных импульсов от центра мочеиспускания к ядрам НДН.
В таком случае развивается нейрогенный мочевой пузырь по типу ВДН. При этом детрузор постоянно находится в расслабленном состоянии (стадия накопления мочи), а поперечно-полосатый сфинктер мочевого пузыря всегда находится в тонусе. У такого пациента мануальное отведение мочи может представлять сложность или быть вовсе невозможным. Моча может подтекать при переполнении пузыря, но в небольшом объеме.
При поражении спинного мозга или нервов конского хвоста каудальнее сегмента спинного мозга L7 развивается нейрогенный мочевой пузырь по типу НДН. При этом детрузор находится в стадии наполнения, а поперечно-полосатый сфинктер пузыря – в расслабленном состоянии. У такого пациента моча легко отводится мануально, но полного опорожнения пузыря при этом не наступает. Моча у таких пациентов при переполнении пузыря подтекает часто и большими объемами, особенно в моменты напряжения брюшной стенки.
Для диагностики нарушения иннервации мочевого пузыря проводится неврологический осмотр.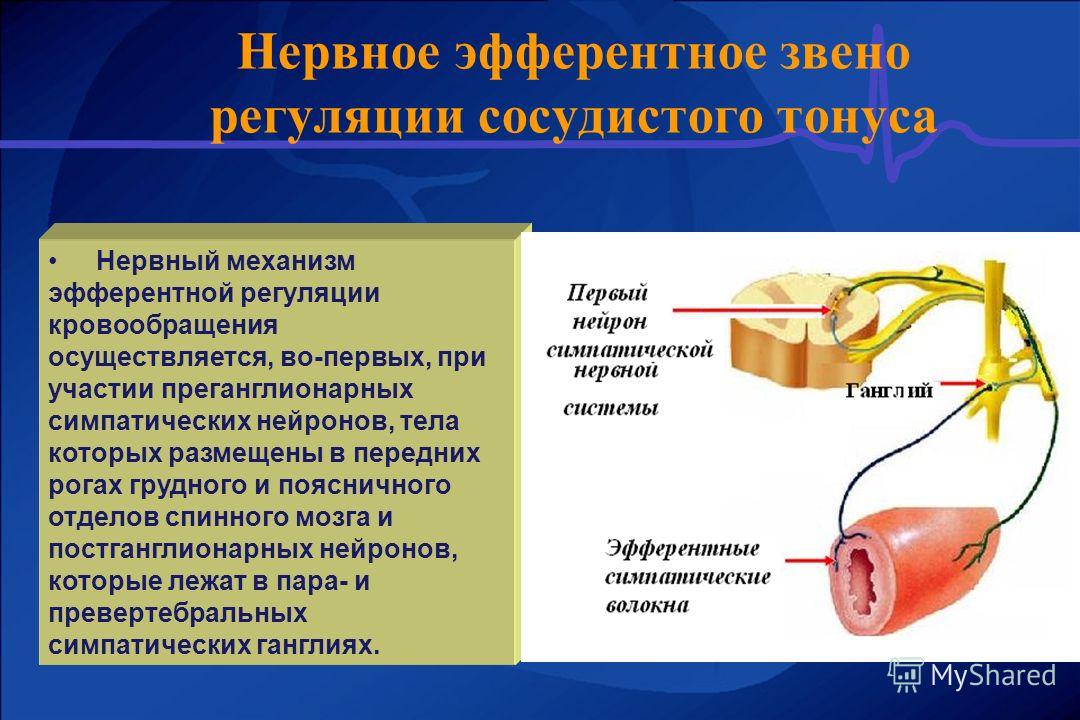 При повреждении ВДН характер неврологических нарушений будет зависеть от зоны поражения. Нарушения могут включать в себя парез или паралич грудных и/или тазовых конечностей, проприоцептивный дефицит. При повреждении НДН может наблюдаться вялый паралич тазовых конечностей (отсутствие рефлексов). Поражение седалищного нерва приводит к атаксии тазовых конечностей, снижению рефлекса подтягивания. Поражение срамного нерва приводит к отсутствию анального и промежностного рефлексов.
При повреждении ВДН характер неврологических нарушений будет зависеть от зоны поражения. Нарушения могут включать в себя парез или паралич грудных и/или тазовых конечностей, проприоцептивный дефицит. При повреждении НДН может наблюдаться вялый паралич тазовых конечностей (отсутствие рефлексов). Поражение седалищного нерва приводит к атаксии тазовых конечностей, снижению рефлекса подтягивания. Поражение срамного нерва приводит к отсутствию анального и промежностного рефлексов.
Дифференциальная диагностика
Необходимо помнить, что нарушению мочеиспускания могут способствовать многие состояния не неврологического характера.
При подтекании мочи у кастрированных сук необходимо исключать USMI (недостаточность уретрального сфинктера, связанная с недостатком половых гормонов), инфекции мочевыводящих путей. Молодых животных нужно исследовать на наличие эктопии мочеточников.
При невозможности опорожнения мочевого пузыря необходимо исключить наличие механических преград на пути оттока мочи (уролиты, гиперплазия простаты, стриктуры, воспаление). Это можно сделать посредством постановки уретрального катетера или проведения контрастной уретрографии. Следует помнить, что атония мочевого пузыря может развиваться при его длительном переполнении (частичная обструкция уретры, длительная ОЗМ).
Это можно сделать посредством постановки уретрального катетера или проведения контрастной уретрографии. Следует помнить, что атония мочевого пузыря может развиваться при его длительном переполнении (частичная обструкция уретры, длительная ОЗМ).
Ведение пациентов с нейрогенным мочевым пузырем
Тактика ведения таких пациентов будет зависеть от локализации поражения в нервной системе, предполагаемой продолжительности нарушения иннервации (временная или постоянная) и от полноты нарушения иннервации (полная или частичная).
Две основные проблемы, с которыми мы сталкивается у подобных пациентов, – это развитие инфекции мочевыводящих путей и нарушение оттока мочи из почек, что может привести к их повреждению (рис. 3).
Развитие инфекции у пациентов с нейрогенным мочевым пузырем обусловливается нарушением его защитных механизмов. В частности, задержка мочи в мочевом пузыре и отсутствие полного и своевременного его опорожнения способствуют накоплению бактерий в мочевом пузыре и уретре, а повреждение защитного гликозаминогликанового слоя и эпителия мочевого пузыря из-за перерастяжения стенок и повышенного давления мочи внутри пузыря – размножению бактерий на поверхности эпителия и внутри стенок органа.
Основные правила, которые нужно соблюдать при работе с такими пациентами, – это как можно более частое и полное опорожнение мочевого пузыря и максимальная стерильность. Катетеризации уретры по возможности нужно избегать из-за риска развития инфекции.
Животное удачно восстановилось после травмы ВДН, однако множественные катетеризации мочевого пузыря без соблюдения правил асептики в период восстановления иннервации мочевого пузыря и отсутствие последующего мониторинга привели к тотальному поражению мочевыводящего тракта и гибели животного в результате острой почечной недостаточности и уросепсиса. (Фотографии любезно предоставлены Ганкиной Юлией – ветеринарным врачом-патологом Ветеринарной клиники неврологии, травматологии и интенсивной терапии Санкт-Петербурга).
Пациенты с временной атонией мочевого пузыря
1. Необходимо осуществлять ежедневное отведение мочи. Существуют следующие методы отведения мочи:
- Мануальный.
 Осуществляется путем надавливания на мочевой пузырь через брюшную стенку. Отведение должно осуществляться 2–4 раза в сутки (чем чаще, тем лучше) до минимально возможного остаточного объема мочи. Мануальное отведение всегда является наиболее предпочтительным из-за низкого риска развития инфекции. Однако пациентам с повреждением ВДН, которым невозможно произвести отведение мочи мануально, необходимо устанавливать уретральный катетер.
Осуществляется путем надавливания на мочевой пузырь через брюшную стенку. Отведение должно осуществляться 2–4 раза в сутки (чем чаще, тем лучше) до минимально возможного остаточного объема мочи. Мануальное отведение всегда является наиболее предпочтительным из-за низкого риска развития инфекции. Однако пациентам с повреждением ВДН, которым невозможно произвести отведение мочи мануально, необходимо устанавливать уретральный катетер.
Плюсы метода: не происходит проникновения в мочевой пузырь инородных предметов (уретральный катетер), которые могут являться источником инфекции, возможность осуществления манипуляции в домашних условиях.
Недостатки метода: не происходит полного опорожнения мочевого пузыря, во время манипуляции может потребоваться значительная физическая сила (особенно у крупных собак).
- Уретральная катетеризация. Процедура должна проводиться в максимально стерильных условиях, для каждой катетеризации должен использоваться НОВЫЙ стерильный уретральный катетер.
 Необходимо выбирать наиболее мягкий катетер (Нелатона, Фолея).
Необходимо выбирать наиболее мягкий катетер (Нелатона, Фолея).
Плюсы метода: полное опорожнение мочевого пузыря.
Недостатки метода: высокий риск развития инфекции мочевыводящей системы, травматизация стенок уретры при каждой катетеризации (риск появления участков сужения по ходу уретры), необходимость транспортировки животного в клинику для проведения манипуляции (при невозможности ее осуществления в домашних условиях).
Если катетер устанавливается на длительный срок, к нему обязательно должна быть присоединена стерильная система для сбора мочи. После извлечения катетера у всех пациентов необходимо брать мочу на бакпосев методом цистоцентеза.
— Медикаментозная терапия. Для стимуляции опорожнения мочевого пузыря могут использоваться следующие группы препаратов:
-
ингибиторы холинэстеразы (прозерин, калимин) могут стимулировать сокращение детрузора (хотя их эффективность сомнительна).

-
альфа-адреноблокаторы (теразозин) обеспечивают снижение тонуса гладкой мускулатуры в области треугольника мочевого пузыря и проксимального отдела уретры, облегчая отток мочи.
-
препараты, снижающие тонус наружного поперечно-полосатого сфинктера уретры (диазепам).
2. Антибиотикотерапия: антибиотики, назначенные после проведения операции, применяются до извлечения уретрального катетера. Если антибактериальная терапия не требуется, то до момента извлечения уретрального катетера применение антибиотиков не рекомендуется (за исключением случаев уже подтвержденной инфекции мочевыводящих путей).
После извлечения уретрального катетера и спустя 5–7 дней после прекращения антибиотикотерапии (если таковая проводилась) берется бакпосев мочи методом цистоцентеза. По его результатам при необходимости назначается курс антибактериальной терапии для купирования инфекции. Если нет возможности осуществить бактериологическое исследование мочи, антибиотиками выбора будут амоксициллин + клавулановая кислота, хлорамфеникол, нитрофурантоин, фторхинолоны. При этом фторхинолоны являются антибиотиками резерва. Продолжительность курса будет зависеть от степени поражения мочевыводящих путей (затронут только мочевой пузырь или совместно с ним поражены почки, тяжесть воспалительного процесса, воспаление локальное или системное). В ситуации, когда поражен только мочевой пузырь и при этом не нарушены его защитные механизмы (сохранена целостность слизистой оболочки, опорожнение мочи происходит в полном объеме и т.д.), продолжительность антибиотикотерапии будет составлять в среднем 14 дней. При поражении почек, нарушении защитных механизмов мочевого пузыря или наличии уросепсиса антибиотики назначаются сроком от 1 месяца. Дальнейшая продолжительность курса зависит от результатов контрольных осмотров и анализов.
Если нет возможности осуществить бактериологическое исследование мочи, антибиотиками выбора будут амоксициллин + клавулановая кислота, хлорамфеникол, нитрофурантоин, фторхинолоны. При этом фторхинолоны являются антибиотиками резерва. Продолжительность курса будет зависеть от степени поражения мочевыводящих путей (затронут только мочевой пузырь или совместно с ним поражены почки, тяжесть воспалительного процесса, воспаление локальное или системное). В ситуации, когда поражен только мочевой пузырь и при этом не нарушены его защитные механизмы (сохранена целостность слизистой оболочки, опорожнение мочи происходит в полном объеме и т.д.), продолжительность антибиотикотерапии будет составлять в среднем 14 дней. При поражении почек, нарушении защитных механизмов мочевого пузыря или наличии уросепсиса антибиотики назначаются сроком от 1 месяца. Дальнейшая продолжительность курса зависит от результатов контрольных осмотров и анализов.
3. Увеличение объема образующейся мочи позволит снизить концентрацию в моче бактерий и веществ, раздражающих стенку мочевого пузыря, и увеличить частоту мочеиспусканий для механического вымывания бактерий из мочевыводящих путей. Наиболее оптимальный способ увеличения объема мочи – стимуляция потребления животным большего количества жидкости посредством увеличения количества мисок в доме, применения влажных или размоченных сухих кормов, улучшения вкусовых качеств воды. Существуют промышленные рационы, стимулирующие жажду. В крайнем случае можно прибегать к назначению диуретиков (при отсутствии противопоказаний, например поражения почек).
Наиболее оптимальный способ увеличения объема мочи – стимуляция потребления животным большего количества жидкости посредством увеличения количества мисок в доме, применения влажных или размоченных сухих кормов, улучшения вкусовых качеств воды. Существуют промышленные рационы, стимулирующие жажду. В крайнем случае можно прибегать к назначению диуретиков (при отсутствии противопоказаний, например поражения почек).
4. Закисление мочи. Применение закисляющих мочу препаратов оправдано при сдвиге рН мочи в щелочную сторону (7,0 и выше). Закисление мочи в этом случае позволяет повысить ее бактерицидные свойства. Показатель рН мочи должен находиться в диапазоне 6,5–5,5. Если кислотность мочи падает ниже 5,5, закисляющую терапию необходимо прекратить или снизить дозу препарата. Для закисления мочи могут применяться препараты на основе клюквы, метионин, а также специальные закисляющие диеты.
Пациенты с постоянной атонией мочевого пузыря
Пациенты с хронической формой нейрогенного мочевого пузыря имеют высокие риски развития инфекции мочевыводящих путей ввиду постоянной задержки мочи и перерастяжения стенок мочевого пузыря.
В связи с этим таким пациентам крайне не рекомендуется устанавливать уретральные катетеры – мочу необходимо отводить мануально не менее двух раз в сутки.
Профилактические осмотры проводятся раз в 1–3 месяца для контроля ультразвуковой картины мочевого пузыря и почек, а также для проведения общего анализа мочи. Бакпосев мочи берется 1 раз в 3–6 месяцев, в зависимости от результатов контрольных осмотров и ОАМ (общего анализа мочи). При наличии инфекции курс антибиотикотерапии у таких пациентов будет продолжаться не менее 1 месяца и зависеть от частоты, степени и метода опорожнения мочевого пузыря (иногда они вынуждены получать антибиотики постоянно).
Список литературы:
-
Bartges J., Polzin D. J. Nephrology and Urology of Small Animals, 2011.
-
Carwardine D. R., Rose J. H., Harcourt-Brown T. R., Granger N.
 Effectiveness of manual bladder expression in paraplegic dogs. Am J Vet Res, 2017.
Effectiveness of manual bladder expression in paraplegic dogs. Am J Vet Res, 2017.
-
Chow D. J., Dibatola S. P., Schenck P. Canine and feline nephrology and urology, 2011.
-
Gregory F. Grauer. Canine Urinary Tract Infections, Clinician’s Brief, 2012.
-
Julie K. Byron. Micturition Disorders. Vet Clin North Am Small Anim Pract, 2015.
-
Katrina R. Viviano. Top urinary tract and prostate antibiotics, Clinician’s Brief, 2017.
-
Michael D. Lorenz, Joan Coates, Marc Kent. Handbook of Veterinary Neurology, 2011.
-
Nicola Ackerman. Managing Indwelling Urinary Catheters, Clinician’s Brief, 2016.
-
Stefano Romagnoli. Diagnosing Canine Urinary Incontinence, Clinician’s Brief, 2009.

Вклад центральной нервной системы в нейрогенный тонус гладких мышц
- A. C. Mannard
- C. Polosa
Abstract
Большая часть гладких мышц получает тонизирующий возбуждающий импульс, исходящий от ЦНС в виде непрерывного возбуждения симпатические преганглионарные нейроны (СПН). Механизм генерации и другие особенности цепочек спайков, испускаемых одиночными SPN во время их тонического возбуждения, были исследованы с помощью внеклеточных микроэлектродов на кошках.Эксперименты проводились на анестезированных нембуталом (нейроаксиально интактных, NI или высокошейный спинной NS) или неанестезированных (высокий мостовой децеребрат, D) кошках — торакотомизированных, парализованных и искусственно вентилируемых. С помощью анализа временных рядов (гистограмма межспайковых интервалов, IH и автокоррелограмма, ACG) систематизированы закономерности статистически стационарного фонового воспламенения. Эти паттерны в сочетании с реакциями нейронов на антидромные стимулы были использованы для гипотезы о стохастических процессах, ответственных за инициирование спайков.
Эти паттерны в сочетании с реакциями нейронов на антидромные стимулы были использованы для гипотезы о стохастических процессах, ответственных за инициирование спайков.
Ключевые слова
Схема срабатывания шиповой цепи Межспайковый интервал Модальный интервал Срабатывание тоникаЭти ключевые слова были добавлены машиной, а не авторами. Этот процесс является экспериментальным, и ключевые слова могут обновляться по мере улучшения алгоритма обучения.
При поддержке гранта Канадского совета медицинских исследований.
Это предварительный просмотр содержимого подписки,
войдите в, чтобы проверить доступ.
Информация об авторских правах
© Springer-Verlag Berlin · Heidelberg 1972
Авторы и аффилированные лица
- A.К. Маннард
- К. Полоса
- 1.Факультет физиологииУниверситет МакГиллаМонреальКанада
Контроль сосудов | Торакальный ключ
Поскольку метаболические потребности организма постоянно меняются, сердечно-сосудистая система должна постоянно корректировать диаметр своих сосудов. Цели этих сосудистых изменений: (1) эффективное распределение сердечного выброса между тканями с различными текущими потребностями (работа артериол) и (2) регулирование распределения объема крови и сердечного наполнения (работа вен).В этой главе мы обсуждаем наше текущее понимание того, как все это достигается.
СОСУДИСТАЯ ГЛАДКАЯ МЫШЦА
Хотя долгосрочная адаптация диаметров сосудов может зависеть от ремоделирования как активных (т. Е. Гладких мышц), так и пассивных (т. Е. Структурных, соединительных тканей) компонентов сосудистой стенки, коротких — Сроки корректировки диаметра сосудов производятся путем регулирования сократительной активности гладкомышечных клеток сосудов. Эти сократительные клетки присутствуют в стенках всех сосудов, кроме капилляров.Задача гладкой мускулатуры сосудов уникальна, потому что для поддержания определенного диаметра сосуда перед лицом непрерывного растягивающего давления крови внутри него гладкая мускулатура сосудов должна иметь возможность выдерживать активное напряжение в течение продолжительных периодов времени.
Есть много функциональных характеристик, которые отличают гладкие мышцы от скелетных или сердечных мышц. Например, по сравнению с этими другими типами мышц, гладкомышечные клетки
1. сокращаются и расслабляются намного медленнее;
2. может изменять свою сократительную активность в результате либо потенциалов действия, либо изменений мембранного потенциала покоя;
3. могут изменять свою сократительную активность при отсутствии каких-либо изменений мембранного потенциала;
4. может поддерживать напряжение в течение длительных периодов времени при низких затратах энергии; и
5. можно активировать путем растяжения.
Гладкомышечные клетки сосудов представляют собой небольшие (приблизительно 5 мкм × 50 мкм) веретеновидные клетки, обычно расположенные по окружности или под небольшими углами спирали в стенках мышечных кровеносных сосудов.Во многих, но не во всех сосудах соседние гладкомышечные клетки электрически связаны щелевыми соединениями, аналогичными тем, которые обнаруживаются в миокарде.
Сократительные процессы
Как и в случае с другими типами мышц, развитие и укорочение гладкой мускулатуры считаются результатом поперечного взаимодействия между толстыми и тонкими сократительными нитями, состоящими из миозина и актина, соответственно. Однако в гладких мышцах эти нити не расположены в регулярных повторяющихся саркомерных единицах.Как следствие, в «гладких» мышечных клетках отсутствуют микроскопически видимые полосы, характерные для клеток скелетных и сердечных мышц. Нити актина в гладких мышцах намного длиннее, чем в поперечно-полосатых мышцах. Многие из этих актиновых филаментов прикрепляются к внутренней поверхности клетки в структурах, называемых плотными полосами . Внутри клетки актиновые филаменты не прикрепляются к Z линиям, а скорее прикрепляются к маленьким поперечным структурам, называемым плотными телами , которые сами привязаны к поверхностной мембране с помощью кабельных промежуточных филаментов .Миозиновые филаменты вкраплены между актиновыми филаментами гладких мышц, но более случайным образом, чем регулярное переплетение поперечно-полосатых мышц. В поперечно-полосатых мышцах сократительные нити неизменно выровнены с длинной осью клетки, тогда как в гладких мышцах многие сократительные нити проходят наклонно или даже поперек длинной оси клетки. Несмотря на отсутствие организованных саркомеров, изменение длины гладкой мускулатуры влияет на ее способность активно развивать напряжение.То есть гладкая мышца демонстрирует «соотношение длины и напряжения», аналогичное тому, которое наблюдается в поперечно-полосатой мышце (см. Рис. 2-8). Как и в поперечно-полосатых мышцах, сила перекрестного взаимодействия между миозиновыми и актиновыми филаментами в гладких мышцах контролируется в первую очередь изменениями внутриклеточного уровня свободного Ca 2+ , который колеблется от примерно 10 -8 M в расслабленном состоянии. мышца до 10 -5 М при максимальном сокращении. Однако последовательность шагов, связывающих повышенную концентрацию свободного Ca 2+ с взаимодействием сократительных нитей, отличается в гладких мышцах, чем в поперечно-полосатых мышцах.В гладких мышцах:
1. Внутриклеточный свободный Ca 2+ сначала образует комплекс с кальций-связывающим белком , кальмодулином .
2. Комплекс Ca 2+ –кальмодулин затем активирует фосфорилирующий фермент, называемый киназой легкой цепи миозина (киназа MLC).
3. Этот фермент обеспечивает фосфорилирование аденозинтрифосфатом (АТФ) белка легкой цепи, который является частью головки поперечного мостика миозина (MLC).
4. Фосфорилирование MLC обеспечивает образование поперечных мостиков и цикл, во время которого энергия АТФ используется для развития напряжения и укорочения.
Гладкая мускулатура также уникальна тем, что после развития напряжения его можно поддерживать с очень низкими энергетическими затратами, то есть без необходимости постоянно расщеплять АТФ при езде по мосту. Ответственные механизмы все еще несколько неясны, но предположительно связаны с очень медленными циклическими или даже нециклирующими перекрестными мостами.Это часто упоминается как состояние фиксации , и может включать дефосфорилирование легкой цепи прикрепленных поперечных мостиков.
С помощью механизмов, которые еще не полностью изучены, очевидно, что сократительная активность гладких мышц сосудов регулируется не только изменениями внутриклеточных уровней свободного Ca 2+ , но также изменениями в чувствительности Ca 2+ сократительная техника. Таким образом, сократительное состояние гладких мышц сосудов может иногда изменяться при отсутствии изменений внутриклеточных уровней свободного Ca 2+ .Частично эта явно изменяющаяся чувствительность активации сократительного аппарата гладких мышц к Ca 2+ может быть связана с переменной активностью другого фермента, миозинфосфатазы , который облегчает некоторую реакцию, в которой в качестве реагента участвует фосфорилированный MLC. Например, факторы, повышающие внутриклеточные концентрации циклических нуклеотидов, часто приводят к расслаблению гладких мышц сосудов. Таким образом, состояние фосфорилирования MLC net (и, следовательно, предположительно сократительная сила) зависит от определенного баланса между эффектами Ca 2+ -зависимого фермента MLC-киназы и Ca 2+ -независимой фермент MLC фосфатаза. 1
Мембранные потенциалы
Гладкомышечные клетки имеют мембранные потенциалы покоя в диапазоне от –40 до –65 мВ и, следовательно, обычно менее отрицательны, чем в поперечно-полосатых мышцах. Как и во всех клетках, мембранный потенциал покоя гладких мышц в значительной степени определяется проницаемостью клетки для калия. Многие типы каналов K + были идентифицированы в гладких мышцах. Канал, который, по-видимому, в основном отвечает за определение мембранного потенциала покоя, называется каналом внутреннего выпрямляющего типа K + .Есть также АТФ-зависимых K + каналов, которые закрываются, когда клеточные уровни АТФ в норме, но открываются, если уровни АТФ падают. Было высказано предположение, что такие каналы играют важную роль в согласовании кровотока в органе с метаболическим состоянием ткани.
Гладкомышечные клетки обычно имеют потенциал действия только в определенных сосудах. Когда они действительно возникают, потенциалы действия гладких мышц инициируются в первую очередь входящим внутрь током Ca 2+ и развиваются медленно, как сердечные потенциалы действия «медленного типа» (см. Рисунки 2–2C и D).Как и в сердце, этот направленный внутрь (деполяризующий) ток Ca 2+ протекает через управляемый напряжением канал (VOC) для Ca 2+ ; этот тип каналов является одним из нескольких типов кальциевых каналов, присутствующих в гладких мышцах. Фаза реполяризации потенциала действия происходит главным образом за счет потока ионов калия наружу через задержанных K + каналов и кальций-активированных каналов K + .
Многие типы ионных каналов в дополнение к упомянутым были идентифицированы в гладких мышцах сосудов, но в большинстве случаев их точная роль в сердечно-сосудистой функции остается неясной.Например, по всей видимости, существуют неселективные, чувствительные к растяжению катионные каналы, которые могут участвовать в реакции гладких мышц на растяжение. Читатель должен, однако, отметить, что многие важные ионные каналы в гладких мышцах сосудов также важны в сердечной мышце (см. Таблицу 2–1).
Электромеханическое и фармакомеханическое связывание
В гладких мышцах изменения внутриклеточных уровней свободного Ca 2+ могут происходить как с , так и с без изменений мембранного потенциала.Соответствующие процессы называются электромеханическим соединением , и фармакомеханическим соединением , , соответственно, и показаны на рис. 7–1.
Рисунок 7–1 . Общие механизмы активации гладких мышц сосудов. VOC, управляемый напряжением канал Ca 2+ ; ROC, управляемый рецептором канал Ca 2+ ; R — рецептор, специфичный к агонисту; G, GTP-связывающий белок; PIP 2 , фосфатидилинозитолбифосфат; IP 3 , инозитолтрифосфат; ДАГ, диацилглицерин.
Электромеханическое соединение, показанное в левой половине рисунка 7–1, происходит потому, что мембрана гладкой мускулатуры содержит ЛОС для кальция (те же ЛОС, которые участвуют в генерации потенциала действия). Деполяризация мембраны увеличивает вероятность открытого состояния этих каналов и, таким образом, приводит к сокращению гладкомышечных клеток и сужению сосудов. И наоборот, гиперполяризация мембраны приводит к расслаблению гладких мышц и расширению сосудов. Поскольку ЛОС для Ca 2+ частично активируются низким мембранным потенциалом покоя гладких мышц сосудов, изменения в потенциале покоя могут изменить скорость притока кальция в покое и, следовательно, базальное сократительное состояние.
При фармакомеханическом связывании химические агенты (например, высвобождаемые нейротрансмиттеры) могут вызывать сокращение гладких мышц без необходимости изменения мембранного потенциала. Как показано на правой стороне рисунка 7-1, комбинация сосудосуживающего агониста (такого как норэпинефрин) со специфическим мембраносвязанным рецептором (таким как α 1 -адренергический рецептор) инициирует события, которые вызывают внутриклеточный свободный Ca 2+ уровней для повышения по двум причинам. Во-первых, активированный рецептор может открывать каналы на поверхности мембраны, управляемые рецептором, для Ca 2+ , что обеспечивает приток Ca 2+ из внеклеточной жидкости.Во-вторых, активированный рецептор может индуцировать образование внутриклеточного «второго мессенджера», трифосфата инозитола (IP 3 ), который открывает определенные каналы, высвобождающие Ca 2+ из внутриклеточных хранилищ саркоплазматического ретикулума. В обоих процессах активированный рецептор сначала стимулирует специфические гуанозинтрифосфат-связывающие белки (GTP-связывающие белки или G-белки ). Такие G-белки, связанные с рецепторами, по-видимому, представляют собой общий первый шаг, через который действует большинство мембранных рецепторов, инициируя свой конкретный каскад событий, которые в конечном итоге приводят к специфическим клеточным ответам.
Читатель должен , а не сделать вывод из рисунка 7–1, что все вазоактивные химические агенты (химические агенты, вызывающие сосудистые эффекты) оказывают свое действие на гладкие мышцы без изменения мембранного потенциала. Фактически, большинство вазоактивных химических агентов действительно вызывают изменения мембранного потенциала, потому что их рецепторы могут быть связаны с помощью G-белков или других средств с ионными каналами многих видов.
На рис. 7–1 не показаны процессы, которые удаляют Ca 2+ из цитоплазмы гладких мышц сосудов, хотя они также важны для определения уровней свободного цитозольного Ca 2+ .Как и в сердечных клетках (см. Рис. 2-7), гладкомышечные клетки активно перекачивают кальций в саркоплазматический ретикулум и наружу через сарколемму. Кальций также переносится из клетки в обмен на натрий.
Механизмы релаксации
Гиперполяризация клеточной мембраны — один из механизмов, вызывающих расслабление гладких мышц и расширение сосудов. Кроме того, однако, существует по крайней мере два общих механизма, с помощью которых определенные химические сосудорасширяющие агенты могут вызывать расслабление гладких мышц фармакомеханическими средствами.На рис. 7-1 специфический рецептор химического вазоконстриктора показан связанным специфическим G-белком с фосфолипазой C. Аналогичным образом другие специфические рецепторы могут быть связаны другими специфическими G-белками с другими ферментами, которые производят вторичные мессенджеры. чем IP 3 . Примером может служить β 2 -адренергический рецептор 2 , который присутствует в артериолах скелетных мышц и печени. β 2 -Рецепторы не иннервируются, но иногда могут быть активированы аномально повышенными уровнями циркулирующего эпинефрина .Рецептор β 2 связан определенным белком G (G s ) с аденилатциклазой. Аденилатциклаза катализирует превращение АТФ в циклический аденозинмонофосфат (цАМФ). Повышенные внутриклеточные уровни цАМФ вызывают активацию протеинкиназы А, фосфорилирующего фермента, который, в свою очередь, вызывает фосфорилирование белков на многих участках. Общий результат — стимуляция оттока Ca 2+ , гиперполяризация мембраны и снижение чувствительности сократительного механизма к Ca 2+ — все из которых действуют синергетически, вызывая вазодилатацию.Помимо адреналина, гистамин и вазоактивный кишечный пептид являются другими вазодилататорами, которые действуют через путь цАМФ.
В дополнение к цАМФ, циклический гуанозинмонофосфат (цГМФ) является важным внутриклеточным вторичным посредником, который вызывает расслабление гладких мышц сосудов. Оксид азота является важным сосудорасширяющим веществом, которое действует через путь цГМФ. Оксид азота может вырабатываться эндотелиальными клетками, а также нитратами, клинически важным классом сосудорасширяющих препаратов.Оксид азота является газообразным веществом и легко диффундирует в гладкомышечные клетки, где активирует фермент гуанилилциклазу, который, в свою очередь, вызывает образование цГМФ.
КОНТРОЛЬ ТОНУСА АРТЕРИОЛЯ
Сосудистый тонус — это термин, обычно используемый для характеристики общего сократительного состояния сосуда или сосудистой области. «Сосудистый тонус» области можно рассматривать как показатель «уровня активации» отдельных гладкомышечных клеток в этой области.Как описано в главе 6, кровоток через любой орган в значительной степени определяется его сосудистым сопротивлением, которое в первую очередь зависит от диаметра его артериол. Следовательно, кровоток в органе контролируется факторами, которые влияют на тонус гладких мышц артериол.
Basal Tone
Артериолы остаются в состоянии частичного сужения даже после снятия всех внешних воздействий на них; следовательно, они, как говорят, имеют степень базового тона (иногда называемого внутренним тоном ).Понимание механизма неполное, но базальный артериолярный тонус может быть отражением того факта, что гладкомышечные клетки по своей природе активно сопротивляются растяжению, поскольку они постоянно находятся в артериолах под давлением. Другая гипотеза состоит в том, что базальный тонус артериол является результатом тонизирующего производства местных сосудосуживающих веществ эндотелиальными клетками, выстилающими их внутреннюю поверхность. В любом случае, этот базовый тон устанавливает исходный уровень частичного сужения артериол, от которого внешние воздействия на артериолы проявляют свои расширяющие или сужающие эффекты.Эти влияния можно разделить на три категории: местные влияния, невральные влияния и гормональные влияния.
Местное влияние на артериолы
M ЭТАБОЛИЧЕСКИЕ I ВЛИЯНИЯ
Артериолы, которые контролируют кровоток через данный орган, лежат внутри самой ткани органа. Таким образом, артериолы и гладкие мышцы в их стенках подвергаются воздействию химического состава интерстициальной жидкости органа, который они обслуживают.Интерстициальные концентрации многих веществ отражают баланс между метаболической активностью ткани и ее кровоснабжением. Например, интерстициальный уровень кислорода падает, когда клетки ткани используют кислород быстрее, чем он доставляется в ткань кровотоком. И наоборот, интерстициальный уровень кислорода повышается всякий раз, когда избыток кислорода доставляется к ткани из крови. Почти во всех сосудистых руслах воздействие низкого содержания кислорода снижает тонус артериол и вызывает расширение сосудов, тогда как высокие уровни кислорода вызывают сужение сосудов артериол. 3 Таким образом, существует механизм локальной обратной связи, который автоматически воздействует на артериолы, регулируя кровоток в ткани в соответствии с ее метаболическими потребностями. Когда кровоток и доставка кислорода падают ниже потребности ткани в кислороде, уровень кислорода вокруг артериол падает, артериолы расширяются, и кровоток через орган соответственно увеличивается.
Многие вещества помимо кислорода присутствуют в тканях и могут влиять на тонус гладких мышц сосудов.Когда скорость метаболизма скелетных мышц увеличивается с помощью упражнений, уровень кислорода в тканях снижается, но уровень углекислого газа, H + и K + увеличивается. Осмолярность мышечной ткани также увеличивается во время упражнений. Все эти химические изменения вызывают расширение артериол. Кроме того, при повышенной метаболической активности или кислородном голодании клетки многих тканей могут выделять аденозина , который является чрезвычайно сильным сосудорасширяющим агентом.
В настоящее время неизвестно, какие из этих (и, возможно, других) метаболически связанных химических изменений в тканях являются наиболее важными для местного метаболического контроля кровотока.Кажется вероятным, что тонус артериол зависит от сочетанного действия многих факторов.
Для концептуальных целей на рис. 7–2 обобщено текущее понимание местного метаболического контроля. Сосудорасширяющие факторы проникают в интерстициальное пространство из клеток ткани со скоростью, пропорциональной тканевому метаболизму. Эти сосудорасширяющие факторы удаляются из ткани со скоростью, пропорциональной кровотоку. Когда метаболизм в тканях происходит со скоростью, для которой кровоток недостаточен, концентрации интерстициального вазодилататорного фактора автоматически повышаются и вызывают расширение артериол.Это, конечно, вызывает усиление кровотока. Процесс продолжается до тех пор, пока кровоток не увеличится в достаточной степени, чтобы соответствовать скорости метаболизма в тканях и предотвратить дальнейшее накопление сосудорасширяющих факторов. Эта же система также работает, чтобы уменьшить кровоток, когда он выше, чем требуется метаболической активностью ткани, потому что эта ситуация вызывает снижение интерстициальной концентрации метаболических вазодилататорных факторов.
Рисунок 7–2 . Гипотеза местного метаболического вазодилататора.
Локальные метаболические механизмы представляют собой, безусловно, наиболее важные средства местного контроля кровотока . С помощью этих механизмов отдельные органы могут регулировать свой собственный поток в соответствии со своими конкретными метаболическими потребностями.
Как указано ниже, было выявлено несколько других типов местного воздействия на кровеносные сосуды. Однако многие из них представляют собой механизмы тонкой настройки, и многие из них важны только в определенных, обычно патологических, ситуациях.
L OCAL I NFLUENCES FROM E NDOTHELIAL C ELLS
Эндотелиальные клетки покрывают всю внутреннюю поверхность сердечно-сосудистой системы. Большое количество исследований показали, что кровеносные сосуды по-разному реагируют на определенные сосудистые воздействия, когда их эндотелиальная выстилка отсутствует. Ацетилхолин, например, вызывает расширение неповрежденных сосудов, но вызывает сужение сосудов, лишенных эндотелиальной выстилки.Этот и аналогичные результаты привели к осознанию того, что эндотелиальные клетки могут активно участвовать в контроле диаметра артериол, производя местные химические вещества, которые влияют на тонус окружающих гладкомышечных клеток. В случае сосудорасширяющего эффекта инфузии ацетилхолина через неповрежденные сосуды сосудорасширяющее действие, производимое эндотелиальными клетками, было идентифицировано как оксид азота. Оксид азота вырабатывается внутри эндотелиальных клеток из аминокислоты L -аргинин под действием фермента синтазы оксида азота.Синтаза оксида азота активируется повышением внутриклеточного уровня Ca 2+ . Оксид азота — это небольшая жирорастворимая молекула, которая после образования легко диффундирует в соседние гладкомышечные клетки, где вызывает расслабление, стимулируя выработку цГМФ, как упоминалось ранее.
Ацетилхолин и несколько других агентов (включая брадикинин, вазоактивный кишечный пептид и вещество P) стимулируют выработку оксида азота эндотелиальными клетками, поскольку их рецепторы на эндотелиальных клетках связаны с управляемыми рецепторами каналами Ca 2+ .Вероятно, что более важно с физиологической точки зрения, связанные с потоком напряжения сдвига на эндотелиальных клетках стимулируют их продукцию оксида азота, предположительно потому, что активируются чувствительные к растяжению каналы для Ca 2+ . Такое производство оксида азота эндотелиальными клетками, связанное с кровотоком, может объяснить, почему, например, упражнения и усиление кровотока через мышцы голени могут вызывать расширение кровоснабжающей бедренной артерии в точках, расположенных далеко выше по потоку от самой тренирующейся мышцы.
Агенты, которые блокируют выработку оксида азота, ингибируя синтазу оксида азота, вызывают значительное повышение сосудистого сопротивления большинства органов. По этой причине считается, что эндотелиальные клетки обычно всегда производят некоторое количество оксида азота, который играет важную роль, наряду с другими факторами, в снижении нормального тонуса артериол в состоянии покоя по всему телу.
Было также показано, что эндотелиальные клетки продуцируют несколько других вазоактивных агентов местного действия, включая вазодилататоры «эндотелиальный гиперполяризующий фактор», простациклин и вазоконстриктор эндотелин .В частности, эндотелин является предметом интенсивных текущих исследований. Он обладает наибольшим сосудосуживающим действием из всех известных веществ и, по-видимому, также обладает множеством других биологических эффектов. Многие недавние данные свидетельствуют о том, что эндотелин может играть важную роль в таком важном общем процессе, как обработка соли в организме и регулирование артериального давления.
Одна общая нерешенная проблема с концепцией, что тонус артериол (и, следовательно, местный кровоток питательных веществ) регулируется факторами, производимыми артериолярными эндотелиальными клетками, заключается в том, как эти клетки могут знать, каковы метаболические потребности нижестоящих тканей.Это связано с тем, что эндотелиальные клетки, выстилающие артериолы, подвергаются воздействию артериальной крови, состав которой постоянен независимо от скорости потока или того, что происходит ниже по течению. Одна из гипотез состоит в том, что между эндотелиальными клетками сосудов существует какая-то система связи. Таким образом, эндотелиальные клетки в капиллярах или венулах могут передавать восходящую информацию о том, действительно ли кровоток адекватен.
O THER L OCAL C HEMICAL I NFLUENCES
В дополнение к местному метаболическому влиянию на тонус сосудов, были идентифицированы многие специфические местные химические вещества, которые имеют эффекты и, следовательно, могут быть важны в местной сосудистой регуляции в определенных случаях.Однако в большинстве случаев точная информация об относительной важности этих веществ в регуляции сердечно-сосудистой системы отсутствует.
Простагландины и тромбоксан представляют собой группу из нескольких химически родственных продуктов циклооксигеназного пути метаболизма арахидоновой кислоты. Некоторые простагландины являются сильнодействующими вазодилататорами, тогда как другие — сильнодействующими вазоконстрикторами. Несмотря на вазоактивную активность простагландинов и тот факт, что большинство тканей (включая эндотелиальные клетки и клетки гладких мышц сосудов) способны синтезировать простагландины, не было убедительно продемонстрировано, что простагландины играют решающую роль в контроле сосудов нормальных .Однако ясно, что вазодилатирующие простагландины участвуют в воспалительных реакциях. Следовательно, ингибиторы синтеза простагландинов, такие как аспирин, являются эффективными противовоспалительными препаратами. Простагландины, продуцируемые тромбоцитами и эндотелиальными клетками, играют важную роль в гемостатических (остановка кровотока, остановка кровотечения) вазоконстрикторных и агрегационных реакциях тромбоцитов на повреждение сосудов. Следовательно, аспирин часто назначают для снижения тенденции к свертыванию крови, особенно у пациентов с потенциальными ограничениями коронарного кровотока.Метаболиты арахидоновой кислоты, продуцируемые системой липоксигеназы (например, лейкотриенов ), также обладают вазоактивными свойствами и могут влиять на кровоток и проницаемость сосудов во время воспалительных процессов.
Гистамин синтезируется и хранится в высоких концентрациях в секреторных гранулах тучных клеток тканей и циркулирующих базофилах. При высвобождении гистамин вызывает расширение артериолярных сосудов (через путь цАМФ) и увеличивает проницаемость сосудов, что приводит к образованию отека и локальному набуханию тканей.Гистамин увеличивает проницаемость сосудов, вызывая разделения между эндотелиальными клетками, выстилающими сосудистую систему. Высвобождение гистамина классически связано с реакциями антиген-антитело при различных аллергических и иммунных ответах. Многие лекарства и физические или химические воздействия, которые повреждают ткани, также вызывают высвобождение гистамина. Гистамин может стимулировать чувствительные нервные окончания, вызывая зуд и болевые ощущения. Несмотря на очевидную важность во многих патологических ситуациях, кажется маловероятным, что гистамин участвует в нормальной регуляции сердечно-сосудистой системы.
Брадикинин — это небольшой полипептид, который примерно в десять раз превышает сосудорасширяющую способность гистамина на молярной основе. Он также увеличивает проницаемость капилляров, открывая стыки между эндотелиальными клетками. Брадикинин образуется из определенных субстратов глобулина плазмы под действием фермента калликреин и затем быстро распадается на неактивные фрагменты различными тканевыми киназами. Считается, что, как и гистамин, брадикинин участвует в ответных реакциях сосудов, связанных с повреждением тканей и иммунными реакциями.Он также стимулирует ноцицептивные нервы и, таким образом, может участвовать в боли, связанной с повреждением тканей.
T RANSMURAL P ДАВЛЕНИЕ
Пассивные эластичные механические свойства артерий и вен и то, как изменения трансмурального давления влияют на их диаметр, обсуждаются в главе 6. Влияние трансмурального давления на диаметр артериол более сложное. потому что артериолы реагируют как пассивно, и активно, так и на изменения трансмурального давления.Например, внезапное повышение внутреннего давления внутри артериолы вызывает (1) сначала небольшое пассивное механическое растяжение (небольшое, потому что артериолы относительно толстостенные и мускулистые) и (2) затем активное сужение, которое в течение нескольких секунд, может полностью изменить исходное вздутие живота. Внезапное снижение трансмурального давления вызывает по существу противоположную реакцию, то есть немедленное пассивное уменьшение диаметра, за которым вскоре следует снижение активного тонуса, что возвращает диаметр артериол почти к тому, который существовал до изменения давления.Активная фаза такого поведения называется миогенным ответом , потому что, по-видимому, оно возникает внутри самой гладкой мышцы. Механизм миогенного ответа доподлинно неизвестен, но чувствительные к растяжению ионные каналы на гладкомышечных клетках артериолярных сосудов являются вероятными кандидатами на участие.
Все артериолы имеют нормальное давление расширения, на которое они, вероятно, активно реагируют. Следовательно, миогенный механизм, вероятно, является фундаментально важным фактором в определении базального тонуса артериол повсюду.Кроме того, по очевидным причинам и как скоро будет обсуждено, миогенная реакция потенциально участвует в сосудистой реакции на любое сердечно-сосудистое нарушение, которое включает изменение трансмурального давления в артериолах.
F LOW R ESPONSES C ПРИНИМАЕТСЯ L OCAL M ЭХАНИЗМЫ
Активная гиперемия– В органах с сильно изменчивой скоростью метаболизма, таких как скелетные и сердечные мышцы, кровоток внимательно следит за скоростью метаболизма тканей.Например, кровоток в скелетных мышцах увеличивается в течение нескольких секунд после начала тренировки мышц и возвращается к контрольным значениям вскоре после прекращения тренировки. Это явление, проиллюстрированное на рис. 7–3A, известно как упражнение или активная гиперемия (гиперемия , означает высокий поток). Должно быть ясно, как активная гиперемия может быть следствием местной метаболической вазодилататорной обратной связи на гладких мышцах артериол. Как упоминалось ранее, инициированные локальным метаболическим влиянием на мелкие сосуды сопротивления, эндотелиальные механизмы, зависящие от потока, могут способствовать распространению вазодилатации на более крупные сосуды выше по течению, что способствует доставке крови к тренирующейся мышце.
Рисунок 7–3 . Реакции кровотока органов, вызванные местными механизмами: активная и реактивная гиперемии.
Реактивная гиперемия — В этом случае более высокий, чем обычно, кровоток возникает временно после снятия любого ограничения, которое вызвало период более низкого, чем нормальный кровоток, и иногда упоминается как посткклюзионная гиперемия . Это явление проиллюстрировано на Рисунке 7–3B. Например, кровоток через конечность выше нормального в течение периода после снятия жгута с конечности.Как местные метаболические, так и миогенные механизмы могут быть вовлечены в создание реактивной гиперемии. Степень и продолжительность реактивной гиперемии зависят от продолжительности и тяжести окклюзии, а также от скорости метаболизма ткани. Эти данные лучше всего объясняются интерстициальным накоплением метаболических сосудорасширяющих веществ в период ограничения кровотока. Однако неожиданно большое увеличение кровотока может последовать за артериальной окклюзией, продолжающейся всего 1-2 секунды. Лучше всего это можно объяснить миогенной дилатационной реакцией на снижение внутрисосудистого давления и уменьшение растяжения стенок артериол, которое существует в период окклюзии.
Саморегуляция — За исключением случаев активной и реактивной гиперемии, почти все органы стремятся поддерживать постоянный кровоток, несмотря на колебания артериального давления, то есть саморегулируют свой кровоток. Как показано на рис. 7–4A, резкое повышение артериального давления обычно сопровождается первоначальным резким увеличением кровотока в органах, который затем постепенно возвращается к норме, несмотря на устойчивое повышение артериального давления. Начальный рост расхода с повышением давления ожидается из основного уравнения расхода (= Δ P / R ).Последующее возвращение кровотока к нормальному уровню вызвано постепенным повышением активного тонуса артериол и сопротивлением кровотоку. В конце концов, новое устойчивое состояние достигается лишь при небольшом увеличении кровотока, поскольку повышенному давлению движения противодействует более высокое, чем обычно, сопротивление сосудов. Как и в случае феномена реактивной гиперемии, ауторегуляция кровотока может быть вызвана как локальными механизмами метаболической обратной связи, так и миогенными механизмами. Сужение сосудов артериол, ответственное за ауторегуляторную реакцию, показанную на рис. 7-4A, например, может быть частично вызвано (1) «вымыванием» метаболических вазодилататорных факторов из интерстиция чрезмерным начальным кровотоком и (2) миогенным увеличением в тонусе артериол, который стимулируется увеличением силы растяжения, которую увеличение давления оказывает на стенки сосудов.Существует также гипотеза о тканевом давлении ауторегуляции кровотока, для которой предполагается, что резкое повышение артериального давления вызывает транскапиллярную фильтрацию жидкости и, таким образом, приводит к постепенному увеличению объема и давления интерстициальной жидкости. Предположительно увеличение внесосудистого давления вызовет уменьшение диаметра сосуда путем простого сжатия. Этот механизм может быть особенно важен для таких органов, как почки и мозг, объемы которых ограничены внешними структурами.
Рисунок 7–4 . Ауторегуляция органного кровотока.
Хотя это не показано на рис. 7-4A, механизмы ауторегуляции действуют в противоположном направлении в ответ на снижение артериального давления ниже нормального значения. Одним из важных общих последствий местных механизмов ауторегуляции является то, что стабильный кровоток во многих органах имеет тенденцию оставаться около нормального значения в довольно широком диапазоне артериального давления. Это показано на графике на Рисунке 7-4B.Как обсуждается ниже, врожденная способность определенных органов поддерживать адекватный кровоток, несмотря на более низкое, чем обычно, артериальное давление, имеет большое значение в таких ситуациях, как шок от кровопотери.
Нейронные влияния на артериолы
S YMPATHETIC V ASOCONSTRICTOR N ERVES
Эти нервные волокна иннервируют артериолы во всех системных органах и обеспечивают наиболее важные средства рефлексивного контроля сосудистой сети.Симпатические сосудосуживающие нервы являются основой системы контроля общего периферического сопротивления и, таким образом, являются важными участниками глобальных сердечно-сосудистых задач, таких как регулирование артериального кровяного давления.
Симпатические вазоконстрикторные нервы высвобождают норэпинефрин из своих терминальных структур в количествах, обычно пропорциональных частоте их потенциала действия. Норэпинефрин вызывает повышение тонуса артериол после объединения с α 1 -адренергическим рецептором на гладкомышечных клетках.Норэпинефрин, по-видимому, повышает тонус сосудов в основном за счет фармакомеханических средств. Механизм включает связывание G-белка α-адренергических рецепторов с фосфолипазой C и последующее высвобождение Ca 2+ из внутриклеточных хранилищ под действием второго мессенджера IP 3 , как показано на правой стороне рисунка 7–1.
Симпатические вазоконстрикторные нервы обычно имеют постоянную или тонизирующую активность . Эта тонизирующая активность симпатических вазоконстрикторных нервов делает нормальный сократительный тонус артериол значительно выше, чем их базальный тонус.Дополнительный компонент сосудистого тонуса называется нейрогенным тонусом . Когда частота возбуждения симпатических вазоконстрикторных нервов увеличивается выше нормы, артериолы сужаются и вызывают падение кровотока в органах ниже нормы. И наоборот, расширение сосудов и усиление кровотока в органах могут быть вызваны симпатическими вазоконстрикторными нервами, если их нормальный уровень тонической активности снижен. Таким образом, кровоток в органе может быть либо снижен ниже нормы, либо увеличен выше нормы за счет изменения скорости возбуждения симпатических сосудосуживающих волокон.
O THER N EURAL I NFLUENCES
Кровеносные сосуды, как правило, не получают иннервации от парасимпатического отдела вегетативной нервной системы. Однако парасимпатических сосудорасширяющих нервов , которые выделяют ацетилхолина , присутствуют в сосудах мозга и сердца, но их влияние на тонус артериол в этих органах, по-видимому, несущественно. Парасимпатические сосудорасширяющие нервы также присутствуют в сосудах слюнных желез, поджелудочной железы и слизистой оболочки желудка, где они имеют важное влияние на секрецию и моторику.В наружных половых органах они отвечают за расширение притока сосудов, отвечающих за секрецию и эрекцию.
Гормональные воздействия на артериолы
В нормальных условиях краткосрочные гормональные воздействия на кровеносные сосуды обычно считаются незначительными по сравнению с местными метаболическими и нервными воздействиями. Однако следует подчеркнуть, что понимание того, как работает сердечно-сосудистая система во многих ситуациях, является неполным.Таким образом, гормоны, обсуждаемые в следующих разделах, могут играть более важную роль в регуляции сердечно-сосудистой системы, чем это считается сейчас.
C ИЗЛУЧЕНИЕ C АТЕХОЛАМИНЫ
Во время активации симпатической нервной системы надпочечники высвобождают катехоламины эпинефрин и норэпинефрин в кровоток. В нормальных условиях уровни этих агентов в крови, вероятно, недостаточно высоки, чтобы вызвать серьезные сердечно-сосудистые эффекты.Однако циркулирующие катехоламины могут оказывать воздействие на сердечно-сосудистую систему в ситуациях (например, при интенсивных упражнениях или геморрагическом шоке), которые связаны с высокой активностью симпатической нервной системы. В целом, сердечно-сосудистые эффекты высоких уровней циркулирующих катехоламинов параллельны прямым эффектам симпатической активации, которые уже обсуждались; и адреналин, и норадреналин могут активировать сердечные β 1 -адренергические рецепторы для увеличения частоты сердечных сокращений и сократимости миокарда, а также могут активировать сосудистые α-рецепторы, вызывая вазоконстрикцию.Напомним, что в дополнение к α 1 -рецепторам, которые опосредуют вазоконстрикцию, артериолы в некоторых органах также обладают β 2 -адренергическими рецепторами, которые опосредуют вазодилатацию. Поскольку сосудистые β 2 -рецепторы более чувствительны к адреналину, чем сосудистые α 1 -рецепторы, умеренно повышенные уровни циркулирующего адреналина могут вызывать вазодилатацию, тогда как более высокие уровни вызывают опосредованное α 1 -рецептором сужение сосудов. Сосудистые β 2 -рецепторы не иннервируются и поэтому не активируются норадреналином, высвобождаемым симпатическими вазоконстрикторными нервами.Физиологическое значение этих сосудистых β 2 -рецепторов неясно, поскольку высвобождение адреналина надпочечниками происходит в периоды повышенной симпатической активности, когда артериолы одновременно подвергаются прямому нейрогенному сужению сосудов. Опять же, при нормальных обстоятельствах циркулирующие катехоламины не являются важным фактором регуляции сердечно-сосудистой системы.
V АСОПРЕССИН
Этот полипептидный гормон, также известный как антидиуретический гормон (или АДГ), играет важную роль в гомеостазе внеклеточной жидкости и высвобождается в кровоток из задней доли гипофиза в ответ на низкий объем крови. и / или высокая осмолярность внеклеточной жидкости.Вазопрессин действует на собирательные каналы в почках, уменьшая выведение воды почками. Его роль в балансе жидкости в организме оказывает очень важное косвенное влияние на сердечно-сосудистую функцию, что более подробно обсуждается в главе 9. Вазопрессин, однако, также является сильнодействующим вазоконстриктором артериол. Хотя считается, что прямое сужение сосудов из-за аномально высоких уровней вазопрессина существенно не участвует в нормальном сосудистом контроле, оно может быть важным в ответ на определенные нарушения, такие как сильная потеря крови из-за кровотечения.
A NGIOTENSIN II
Ангиотензин II — это циркулирующий полипептид, который регулирует высвобождение альдостерона из коры надпочечников как часть системы контроля баланса натрия в организме. Эта система, более подробно описанная в главе 9, очень важна для регулирования объема крови. Ангиотензин II также является очень сильным сосудосуживающим средством. Хотя его не следует рассматривать как нормальный регулятор тонуса артериол, прямая вазоконстрикция ангиотензином II, по-видимому, является важным компонентом общей сердечно-сосудистой реакции на тяжелую кровопотерю.Также имеются убедительные доказательства того, что прямое сосудистое действие ангиотензина II может быть вовлечено во внутрипочечные механизмы контроля функции почек. Кроме того, ангиотензин II может частично отвечать за патологическое сужение сосудов, которое сопровождает многие формы гипертензии. Опять же, следует подчеркнуть, что знание многих патологических ситуаций, включая гипертонию, является неполным. Эти ситуации могут включать сосудистые влияния, которые еще не распознаются.
КОНТРОЛЬ ВЕНОЗНОГО ТОНА
Прежде чем рассматривать детали контроля венозного тонуса, вспомните, что венулы и вены играют в сердечно-сосудистой системе совершенно иную роль, чем артериолы.Артериолы — это приточные клапаны, которые контролируют скорость потока питательной крови через органы и отдельные области внутри них. Соответственно, на артериолы обычно сильно влияют текущие местные метаболические потребности региона, в котором они проживают, тогда как на вены нет. Однако вены коллективно регулируют распределение доступного объема крови между периферическими и центральными венозными отделами. Напомним, что центральный объем крови (и, следовательно, давление) оказывает заметное влияние на ударный объем и сердечный выброс.Следовательно, при рассмотрении того, что делают периферических вен, следует прежде всего думать о том, какие эффекты будут иметься на центральных, венозном давлении и сердечном выбросе.
Вены содержат гладкие мышцы сосудов, на которые влияют многие факторы, влияющие на гладкие мышцы сосудов артериол. Сужение вен (веноконстрикция) в значительной степени опосредовано деятельностью симпатических нервов, которые их иннервируют. Как и в артериолах, эти симпатические нервы выделяют норэпинефрин, который взаимодействует с α 1 -рецепторами и вызывает повышение венозного тонуса и уменьшение диаметра сосудов.Однако есть несколько функционально важных различий между венами и артериолами. По сравнению с артериолами вены обычно имеют слабый базальный тонус. Таким образом, вены обычно находятся в расширенном состоянии. Одним из важных последствий отсутствия базального венозного тонуса является то, что метаболиты вазодилататоров, которые могут накапливаться в тканях, мало влияют на вены.
Вены из-за своих тонких стенок гораздо более восприимчивы к физическим воздействиям, чем артериолы. Большое влияние внутреннего венозного давления на диаметр вен обсуждалось в главе 6 и проявляется в скоплении крови в венах нижних конечностей, которое происходит во время длительного стояния (как обсуждается далее в главе 10).
Часто внешние силы сжатия являются важным фактором, определяющим венозный объем. Особенно это касается вен скелетных мышц. Во время сокращения внутри ткани скелетных мышц создается очень высокое давление, которое вызывает коллапс венозных сосудов. Поскольку вены и венулы имеют односторонние клапаны, кровь, вытесняемая из вен во время сокращения скелетных мышц, принудительно движется вперед, к правой стороне сердца. Фактически, ритмичные сокращения скелетных мышц могут производить значительную перекачивающую способность, часто называемую насосом скелетных мышц , который помогает возвращать кровь в сердце во время упражнений.
КРАТКОЕ ОПИСАНИЕ ПЕРВИЧНЫХ МЕХАНИЗМОВ КОНТРОЛЯ СОСУДИСТОЙ
Как видно из предыдущего обсуждения, сосуды подвержены широкому спектру влияний, и особые воздействия и / или ситуации часто применяются к конкретным органам. Некоторые общие факторы, однако, доминируют над первичным контролем периферической сосудистой сети, если смотреть с точки зрения общей функции сердечно-сосудистой системы; эти влияния обобщены на Рисунке 7–5. Базальный тонус, местные метаболические сосудорасширяющие факторы и симпатические вазоконстрикторные нервы, действующие через α 1 -рецепторы, являются основными факторами, контролирующими тонус артериол и, следовательно, скорость кровотока через периферические органы.Симпатические вазоконстрикторные нервы, внутреннее давление и внешние силы сжатия являются наиболее важными факторами, влияющими на диаметр вен и, следовательно, на периферически-центральное распределение объема крови.
Рисунок 7–5 . Первичные воздействия на артериолы и вены. NE, норэпинефрин; α, альфа-адренорецептор; P , давление.
Как видно из оставшихся разделов этой главы, многие детали сосудистого контроля варьируются от органа к органу.Однако, что касается контроля кровотока, большинство органов можно расположить где-нибудь в спектре, который варьируется от почти полного доминирования местных метаболических механизмов до почти полного доминирования симпатических вазоконстрикторных нервов.
Поток крови в таких органах, как мозг, сердечная мышца и скелетная мышца, очень сильно контролируется локальным метаболическим контролем, тогда как поток в почках, коже и внутренних органах очень сильно контролируется активностью симпатических нервов. Следовательно, некоторые органы автоматически вынуждены участвовать в общих сердечно-сосудистых рефлекторных реакциях в большей степени, чем другие органы.Общий план, по-видимому, заключается в том, что в случае сердечно-сосудистой недостаточности приток к мозгу и сердцу будет сохранен за счет всего остального, если это будет необходимо.
СОСУДИСТЫЙ КОНТРОЛЬ В КОНКРЕТНЫХ ОРГАНАХ
Общие типы сосудистых влияний, описанные ранее в этой главе, имеют различное относительное значение для разных органов. В следующих разделах мы рассмотрим, чем отличается контроль кровотока в некоторых основных органах. Такие различия, очевидно, влияют на то, что определяет кровоток через конкретный рассматриваемый орган.Но хорошо иметь в виду, что все органы являются частью общей, гидравлически взаимосвязанной сердечно-сосудистой системы. То, что происходит в каком-либо отдельном органе, в конечном итоге имеет разветвления по всей системе. В приведенном ниже обзоре управления потоком в конкретных органах мы пытаемся решить как местные, так и глобальные проблемы, перечисляя важные, а иногда и уникальные факторы, контролирующие поток в основных органах или системах органов.
Коронарный кровоток
1. Основные правая и левая коронарные артерии, обслуживающие ткань сердца, являются первыми сосудами, отходящими от аорты. Таким образом, движущей силой миокардиального кровотока является системное артериальное давление, как и для других системных органов . Большая часть крови, которая протекает через ткань миокарда, возвращается в правое предсердие через большую сердечную вену, называемую коронарным синусом .
2. Коронарный кровоток в основном контролируется местными метаболическими механизмами .Он быстро и точно реагирует на изменения потребления кислорода миокардом. У человека в состоянии покоя миокард извлекает от 70% до 75% кислорода из крови, которая проходит через него. Из-за такой высокой скорости извлечения кровь из коронарного синуса обычно имеет более низкое содержание кислорода, чем кровь в любом другом месте сердечно-сосудистой системы.
3. Поскольку экстракция кислорода миокардом не может значительно увеличиться по сравнению с его высоким значением в состоянии покоя, увеличение потребления миокардом кислорода должно сопровождаться соответствующим увеличением коронарного кровотока .
4. Вопрос о том, какие метаболические вазодилататорные факторы играют доминирующую роль в модуляции тонуса коронарных артериол, в настоящее время не решен. Многие подозревают, что аденозин, высвобождаемый мышечными клетками миокарда в ответ на повышенную скорость метаболизма, может иметь важное местное коронарное метаболическое вазодилататорное воздействие. Независимо от конкретных деталей, потребление кислорода миокардом является наиболее важным влиянием на коронарный кровоток .
5. Большие силы и / или давления создаются в ткани миокарда во время сокращения сердечной мышцы . Такие внутримиокардиальные силы давят на коронарные сосуды снаружи и вызывают их коллапс во время систолы. Из-за этого систолического сжатия и связанного с ним коллапса коронарных сосудов сопротивление коронарных сосудов значительно увеличивается во время систолы. Результатом, по крайней мере для большей части миокарда левого желудочка, является то, что коронарный кровоток во время систолы ниже, чем во время диастолы, даже если системное артериальное давление (то есть давление коронарной перфузии) является самым высоким во время систолы.Это показано на графике кровотока в левой коронарной артерии, показанном на рис. 7–6. Систолическая компрессия оказывает гораздо меньшее влияние на кровоток в миокарде правого желудочка, как видно из графика кровотока в правой коронарной артерии на Рисунке 7-6. Это связано с тем, что пиковое систолическое внутрижелудочковое давление для правого сердца намного ниже, чем для левого сердца, и систолические сжимающие силы в стенке правого желудочка, соответственно, меньше, чем в стенке левого желудочка.
Рисунок 7–6 . Фазовые потоки в левой и правой коронарных артериях в зависимости от давления в аорте и левом желудочке.
6. Систолические сжимающие силы на коронарных сосудах больше в эндокардиальных (внутренних) слоях стенки левого желудочка, чем в эпикардиальных слоях . 4 Таким образом, поток в эндокардиальные слои левого желудочка затруднен больше, чем поток в эпикардиальные слои из-за систолического сжатия. Обычно эндокардиальная область миокарда может восполнить отсутствие кровотока во время систолы за счет высокого кровотока в диастолическом интервале.Однако, когда коронарный кровоток ограничен — например, из-за коронарной болезни и стеноза — эндокардиальные слои левого желудочка часто являются первыми областями сердца, которым трудно поддерживать кровоток, достаточный для их метаболических потребностей. Инфаркт миокарда (участки ткани, погибшие из-за отсутствия кровотока) чаще всего возникают в эндокардиальных слоях левого желудочка.
7. Коронарные артериолы плотно иннервируются симпатическими вазоконстрикторными волокнами, но при повышении активности симпатической нервной системы коронарные артериолы обычно расширяют сосуды, а не сужают сосуды .Это связано с тем, что повышение симпатического тонуса увеличивает потребление кислорода миокардом за счет увеличения частоты сердечных сокращений и сократительной способности. Повышенное местное метаболическое вазодилататорное влияние, по-видимому, перевешивает сопутствующее сосудосуживающее влияние увеличения активности симпатических вазоконстрикторных волокон, которые оканчиваются на коронарных артериолах. Экспериментально было продемонстрировано, что данное повышение активности сердечного симпатического нерва вызывает большее увеличение коронарного кровотока после того, как прямое сосудосуживающее влияние симпатических нервов на коронарные сосуды было устранено с помощью агентов, блокирующих α-рецепторы.Однако симпатические вазоконстрикторные нервы, по-видимому, недостаточно влияют на коронарный кровоток, чтобы повлиять на механические характеристики нормального сердца. Могут ли эти коронарные сосудосуживающие волокна иметь функциональное значение в определенных патологических ситуациях, все еще остается открытым вопросом.
Кровоток в скелетных мышцах
1. Из-за большой массы скелетных мышц кровоток через них является важным фактором общей сердечно-сосудистой гемодинамики .В совокупности скелетные мышцы составляют от 40% до 45% веса тела — больше, чем любой другой отдельный орган тела. Даже в состоянии покоя примерно 15% сердечного выброса поступает в скелетные мышцы, а во время напряженных упражнений скелетные мышцы могут получать более 80% сердечного выброса.
2. Покоящаяся скелетная мышца имеет высокий уровень внутреннего сосудистого тонуса . Из-за этого высокого тонуса гладкой мускулатуры в сосудах сопротивления покоящихся скелетных мышц поток крови на грамм ткани довольно низкий по сравнению с другими органами, такими как почки.Тем не менее, кровоток в скелетных мышцах в состоянии покоя по-прежнему значительно превышает уровень, необходимый для поддержания их метаболических потребностей. Покоящиеся скелетные мышцы обычно извлекают только 25–30% кислорода, поступающего к ним с артериальной кровью. Таким образом, изменения в активности симпатических сосудосуживающих волокон могут уменьшить кровоток в мышцах в состоянии покоя без нарушения метаболических процессов в тканях.
3. Местный метаболический контроль артериолярного тонуса является наиболее важным фактором, влияющим на кровоток через тренировку мышц .Особенно важной характеристикой скелетных мышц является очень широкий диапазон скорости метаболизма. Во время тяжелых упражнений скорость потребления кислорода и его извлечения тканями скелетных мышц может достигать высоких значений, типичных для миокарда. Во многих отношениях факторы, контролирующие кровоток к тренирующимся мышцам, аналогичны факторам, контролирующим коронарный кровоток. Местный метаболический контроль артериолярного тонуса очень силен при тренировке скелетных мышц, и потребление мышцами кислорода является наиболее важным фактором, определяющим их кровоток.Кровоток в скелетных мышцах может увеличиваться в 20 раз во время интенсивных упражнений.
4. Изменения активности симпатической нервной системы могут изменить кровоток в скелетных мышцах, не выполняющих упражнения, . Например, максимальная частота симпатических разрядов может снизить кровоток в мышце в состоянии покоя до менее чем одной четвертой от его нормального значения, и, наоборот, если весь нейрогенный тонус устранен, кровоток в скелетных мышцах может удвоиться. Это небольшое увеличение потока по сравнению с тем, что может происходить в скелетных мышцах, выполняющих упражнения.Тем не менее, из-за большой массы вовлеченной ткани изменения в сосудистом сопротивлении покоящихся скелетных мышц, вызванные изменениями симпатической активности, очень важны в общей рефлекторной регуляции артериального давления.
5. Изменения активности симпатических нервов могут влиять на кровоток в скелетных мышцах . Как будет обсуждаться в главе 10, сердечно-сосудистая реакция на мышечную нагрузку включает в себя общее повышение симпатической активности.Это, конечно же, снижает приток к чувствительным органам, в том числе к мышцам, не занимающимся спортом. При тренировке мышц повышенная активность симпатического вазоконстрикторного нерва не проявляется как явное сужение сосудов, но ограничивает степень метаболической вазодилатации. Одной из важных функций, которую может выполнять этот, казалось бы, контрпродуктивный процесс, является предотвращение чрезмерного снижения общего периферического сопротивления во время упражнений. В самом деле, если бы артериолам в большинстве скелетных мышц тела было позволено одновременно расширяться до их максимальной емкости, общее периферическое сопротивление было бы настолько низким, что сердце не могло бы обеспечить достаточный сердечный выброс для поддержания артериального давления.
6. Ритмические сокращения могут увеличить венозный возврат от тренировки скелетных мышц . Как и в случае сердца, сокращение мышц вызывает большие сжимающие силы в тканях, которые могут разрушить сосуды и затруднить кровоток. Сильные, продолжительные (тетанические) сокращения скелетных мышц могут фактически остановить кровоток в мышцах. Примерно 10% общего объема крови обычно содержится в венах скелетных мышц, и во время ритмических упражнений «насос скелетных мышц» очень эффективен для вытеснения крови из вен скелетных мышц.Клапаны в венах предотвращают обратный ток обратно в мышцы. Кровь, вытесняемая из скелетных мышц в центральный венозный бассейн, является важным фактором гемодинамики при напряженных упражнениях для всего тела.
7. Вены в скелетных мышцах могут сужаться в ответ на усиление симпатической активности . Однако вены в скелетных мышцах довольно редко иннервируются симпатическими вазоконстрикторными волокнами, и довольно небольшой объем крови, который может быть мобилизован из скелетных мышц при активации симпатических нервов, вероятно, не имеет большого значения для общей гемодинамики тела.Это резко контрастирует с большим вытеснением крови из тренирующих мышц механизмом мышечного насоса. (Это обсуждается более подробно при рассмотрении постуральных рефлексов в главе 10.)
Церебральный кровоток
1. Прерывание мозгового кровотока более чем на несколько секунд приводит к потере сознания и повреждению головного мозга. за очень короткий период . Одно из правил общей функции сердечно-сосудистой системы состоит в том, что в всех ситуациях принимаются меры, необходимые для сохранения адекватного кровотока к мозгу.Обычно это достигается за счет очень быстрой рефлекторной коррекции сердечного выброса и общего периферического сопротивления, предназначенных для поддержания постоянного среднего артериального давления (более подробно обсуждается в главах 9 и 10).
2. Церебральный кровоток почти полностью регулируется местными механизмами . Мозг в целом имеет почти постоянную скорость метаболизма, которая в пересчете на грамм почти такая же, как у ткани миокарда. Поток через головной мозг очень сильно саморегулируется и мало зависит от изменений артериального давления, если только оно не падает ниже примерно 60 мм рт.Когда артериальное давление падает ниже 60 мм рт. Ст., Мозговой кровоток пропорционально уменьшается. В настоящее время не решено, вовлечены ли метаболические механизмы или миогенные механизмы или и то, и другое в феномен ауторегуляции мозга.
3. На местные изменения церебрального кровотока могут влиять местные метаболические условия . Предположительно, из-за того, что общая средняя скорость метаболизма мозговой ткани мало меняется, общий мозговой кровоток остается постоянным почти во всех ситуациях.Однако церебральная активность в отдельных частях мозга меняется от ситуации к ситуации. В результате кровоток к дискретным областям не является постоянным, а внимательно следует за локальной нейрональной активностью. Механизмы, ответственные за этот сильный локальный контроль церебрального кровотока, еще не определены, но наиболее вероятно, что в них участвуют H + , K + , кислород и аденозин.
4. Церебральный кровоток снижается, когда артериальная кровь P CO 2 падает ниже нормы .И наоборот, церебральный кровоток увеличивается всякий раз, когда парциальное давление углекислого газа ( P CO 2 ) в артериальной крови поднимается выше нормы. Это нормальное состояние для большинства тканей, но особенно важно, когда это происходит в мозге. Например, головокружение, спутанность сознания и даже обмороки, которые могут возникнуть при гипервентиляции (и «сдутии» CO 2 ), являются прямым результатом сужения сосудов головного мозга. Похоже, что церебральные артериолы реагируют не на изменения P co 2 , а на изменения внеклеточной концентрации H + (т.е. pH), вызванные изменениями в P CO 2 .Церебральные артериолы также расширяют сосуды, когда парциальное давление кислорода ( P O 2 ) в артериальной крови падает значительно ниже нормальных значений. Однако артериальная кровь выше нормы P o 2 , например, вызванная вдыханием чистого кислорода, вызывает небольшое снижение церебрального кровотока.
5. Симпатические и парасимпатические нейронные влияния на церебральный кровоток минимальны . Хотя сосуды головного мозга получают как симпатические вазоконстрикторы, так и парасимпатические сосудорасширяющие волокна, иннервация которых происходит, при нормальных обстоятельствах на церебральный кровоток очень мало влияют изменения активности того и другого.Однако симпатические вазоконстрикторные реакции могут быть важны для защиты сосудов головного мозга от чрезмерного пассивного растяжения после резкого резкого повышения артериального давления.
6. «Гематоэнцефалический барьер» относится к тесно связанным эндотелиальным клеткам сосудов, которые серьезно ограничивают транскапиллярное движение всех полярных и многих других веществ . 5 Из-за этого гематоэнцефалического барьера внеклеточное пространство головного мозга представляет собой особый жидкостный отсек, химический состав которого регулируется отдельно от такового в плазме и общем внеклеточном отсеке тела.Внеклеточный отдел головного мозга включает как интерстициальную жидкость, так и цереброспинальную жидкость (CSF), которая окружает головной и спинной мозг и заполняет желудочки головного мозга. ЦСЖ образуется из плазмы путем селективной секреции (не простой фильтрации) специализированными тканями, сосудистыми сплетениями , расположенными в желудочках мозга. Эти процессы регулируют химический состав CSF. Межклеточная жидкость головного мозга приобретает химический состав спинномозговой жидкости посредством свободного диффузионного обмена.
Гематоэнцефалический барьер служит для защиты церебральных клеток от ионных нарушений в плазме. Кроме того, за счет исключения и / или метаболизма эндотелиальных клеток он предотвращает влияние многих циркулирующих гормонов (и лекарств) на паренхиматозные клетки головного мозга и гладкомышечные клетки сосудов в сосудах головного мозга.
7. Хотя многие органы могут переносить некоторый уровень отека (накопление избыточной внеклеточной жидкости), отек в головном мозге представляет собой кризисную ситуацию .Отек мозга увеличивает внутричерепное давление, которое необходимо незамедлительно снять, чтобы избежать повреждения головного мозга. Специальные механизмы, включающие различные специфические ионные каналы и переносчики, точно регулируют транспорт растворенных веществ и воды через астроциты и эндотелиальный барьер. Эти механизмы способствуют нормальному поддержанию баланса внутриклеточной и внеклеточной жидкости.
Спланхнический кровоток
1. Из-за высокого кровотока с по и большого объема крови в чревном ложе его сосудистый контроль существенно влияет на общую сердечно-сосудистую гемодинамику .Ряд органов брюшной полости, включая желудочно-кишечный тракт, селезенку, поджелудочную железу и печень, совместно снабжается так называемым внутренним кровотоком . Спланхнический кровоток доставляется к этим органам брюшной полости через многие артерии, но в конечном итоге он проходит через печень и возвращается в нижнюю полую вену по печеночным венам. Органы чревной области получают примерно 25% сердечного выброса в состоянии покоя и содержат более 20% объема циркулирующей крови.Таким образом, изменение кровотока или объема крови в этой области имеет чрезвычайно важное влияние на сердечно-сосудистую систему.
2. Симпатическая нервная активность играет важную роль в сосудистом контроле внутреннего кровообращения . В совокупности внутренние органы имеют относительно высокий кровоток и извлекают только 15-20% кислорода, доставленного к ним с артериальной кровью. Артерии и вены всех органов, участвующих в внутреннем кровообращении, обильно иннервируются симпатическими вазоконстрикторными нервами.Максимальная активация симпатических вазоконстрикторных нервов может привести к 80% снижению кровотока в чревной области, а также вызвать большой сдвиг крови от внутренних органов в центральный венозный бассейн. У людей большая часть крови, мобилизуемой из внутреннего кровообращения в периоды активации симпатической нервной системы, происходит из-за сужения вен в печени. У многих других видов селезенка выступает в качестве основного резервуара, из которого мобилизуется кровь за счет симпатического сокращения гладкой мускулатуры, расположенной во внешней капсуле органа.
3. Локальная метаболическая активность, связанная с перистальтикой желудочно-кишечного тракта, секрецией и абсорбцией, связана с местным усилением внутреннего кровотока . Существует большое разнообразие сосудистой структуры и функции отдельных органов и даже областей внутри органов в чревной области. Механизмы сосудистого контроля в определенных областях спланхнической области не совсем понятны, но, вероятно, будут весьма разнообразными. Тем не менее, поскольку большинство внутренних органов участвуют в переваривании и всасывании пищи из желудочно-кишечного тракта, общий внутренний кровоток увеличивается после приема пищи. Парасимпатическая нервная активность участвует во многих из этих функций желудочно-кишечного тракта, поэтому косвенно участвует в увеличении внутреннего кровотока. Обильная пища может вызвать увеличение внутреннего кровотока от 30% до 100%, но отдельные органы в висцеральной области, вероятно, имеют более высокий процент увеличения кровотока в определенные моменты времени, потому что они последовательно участвуют в процессе пищеварения-абсорбции.
Почечный кровоток
1. Почечный кровоток играет важную роль в основной долгосрочной работе почек по регулированию водного баланса организма и, следовательно, объема циркулирующей крови .Однако резкое изменение почечного кровотока также имеет важные краткосрочные гемодинамические последствия. Почки обычно получают примерно 20% сердечного выброса человека в состоянии покоя. Этот поток можно уменьшить практически до нуля при сильной симпатической активации. Таким образом, контроль почечной крови , кровоток, важен для общей сердечно-сосудистой функции. Однако, поскольку почки являются такими маленькими органами, изменения объема почечной крови несущественны для общей сердечно-сосудистой гемодинамики.
2. Почечный кровоток находится под сильным влиянием симпатической нервной стимуляции . Изменения активности симпатической нервной системы могут оказывать заметное влияние на общий почечный кровоток, изменяя нейрогенный тонус почечных резистентных сосудов. Фактически, экстремальные ситуации, связанные с интенсивной и продолжительной активностью симпатического вазоконстриктора (что может сопровождать тяжелую кровопотерю), могут привести к резкому снижению почечного кровотока, необратимому повреждению почек и почечной недостаточности.
3. Местный метаболический механизм может влиять на местный тонус сосудов, но физиологические роли не ясны . Давно известно, что экспериментально выделенные и почки (т.е. почки, лишенные нормального симпатического воздействия) довольно сильно саморегулируют свой кровоток. Механизм, ответственный за это явление, точно не установлен, но гипотезы о миогенном, тканевом и метаболическом давлении были выдвинуты. Настоящий вопрос заключается в том, какую роль играет такой сильный локальный механизм в неповрежденном организме, который, по-видимому, в значительной степени перекрывается рефлекторными механизмами.У интактного человека почечный кровоток непостоянен, но сильно варьируется в зависимости от преобладающего уровня активности симпатического вазоконстрикторного нерва.
Механизмы, ответственные за внутреннюю регуляцию почечного кровотока и функции почек, не установлены. Хотя исследования показывают, что могут быть задействованы простагландины и некоторая внутрипочечная ренин-ангиотензиновая система, весь вопрос о местном сосудистом контроле почек остается довольно неясным. Почечная функция сама по себе имеет первостепенное значение для общей сердечно-сосудистой функции, как описано в главе 9.
Кожный кровоток
1. Физиологическая роль кожного кровотока состоит в том, чтобы помочь регулировать температуру тела . В результате метаболической активности клеток тела выделяется тепло, которое необходимо терять, чтобы температура тела оставалась постоянной. Кожа является основным местом теплообмена тела с внешней средой. Изменения кожного кровотока в ответ на различные метаболические состояния и условия окружающей среды являются основным механизмом, ответственным за температурный гомеостаз.(Другие механизмы, такие как дрожь, потоотделение и одышка, также участвуют в регулировании температуры тела в более экстремальных условиях.)
2. Снижение температуры тела снижает кровоток в коже и наоборот . Кожный кровоток, составляющий примерно 6% сердечного выброса в состоянии покоя, может уменьшаться примерно до одной двадцатой его нормального значения, когда необходимо сохранить тепло (например, в холодной окружающей среде, на стадии развития лихорадки). Напротив, кожный кровоток может увеличиваться в семь раз по сравнению с его нормальным значением, когда необходимо терять тепло (например, в жаркой среде, сопровождающейся высоким уровнем метаболизма, после того, как лихорадка «спадет»).
3. Структурная адаптация кожных сосудов способствует потере тепла или сохранению тепла . Анатомические взаимосвязи между микрососудами в коже узкоспециализированы и чрезвычайно сложны. Обширная система взаимосвязанных вен, называемая венозным сплетением , обычно содержит наибольшую долю объема кожной крови, которая у людей со слегка пигментированной кожей придает коже красноватый оттенок. В значительной степени передача тепла от крови происходит через большую площадь поверхности венозного сплетения.Венозное сплетение богато иннервируется симпатическими вазоконстрикторными нервами. Когда эти волокна активируются, кровь вытесняется из венозного сплетения, и это помогает снизить потерю тепла, а также осветляет цвет кожи. Поскольку кожа является одним из крупнейших органов тела, сужение вен может привести к перемещению значительного количества крови в центральный венозный бассейн.
4. Рефлекторная симпатическая нервная активность оказывает важное, но комплексное влияние на кровоток в коже . Сосуды кожного сопротивления обильно иннервируются симпатическими вазоконстрикторными нервами, и поскольку эти волокна обладают нормальной тонической активностью, кожные сосуды сопротивления обычно имеют высокую степень нейрогенного тонуса.Когда температура тела поднимается выше нормы, кожный кровоток увеличивается за счет рефлекторных механизмов. В определенных областях (например, руках, ушах и носу) вазодилатация, по-видимому, полностью возникает в результате снятия симпатического сосудосуживающего тонуса. В других областях (например, на предплечье, лбу, подбородке, шее и груди) кожная вазодилатация, возникающая при нагревании тела, намного превышает ту, которая возникает при простом удалении симпатического сосудосуживающего тонуса. Эта «активная» вазодилатация тесно связана с возникновением потоотделения в этих областях.Потовые железы в кожной ткани человека, участвующие в терморегуляции, иннервируются холинергическими симпатическими волокнами , которые выделяют ацетилхолин. Активация этих нервов вызывает потоотделение и , сопровождающееся выраженной кожной вазодилатацией. Точный механизм этой связанной с потоотделением кожной вазодилатации остается неясным, потому что она не устраняется агентами, блокирующими сосудистые эффекты ацетилхолина. Долгое время считалось, что это вызвано местным образованием брадикинина, вторичным по отношению к процессу активации потовых желез.Новые данные свидетельствуют о том, что холинэргические симпатические нервы потовых желез могут выделять не только ацетилхолин, но и другие сосудорасширяющие котрансмиттеры. Хотя эти особые симпатические нервы очень важны для регулирования температуры, они не участвуют в нормальном, текущем регулировании сердечно-сосудистой системы.
5. Кожные сосуды реагируют на изменение локальной температуры кожи . Как правило, местное охлаждение приводит к локальному сужению сосудов, а местное нагревание вызывает локальное расширение сосудов.Механизмы этого неизвестны. Если поместить руку в ледяную воду, сначала происходит почти полное прекращение кровотока в руке, сопровождающееся сильной болью. Через несколько минут кровоток в руке начинает увеличиваться, достигая значений, значительно превышающих нормальные значения, температура руки увеличивается, и боль исчезает. Это явление называется холодовой вазодилатацией . При продолжительном погружении в воду циркулирует кровоток в руке каждые несколько минут между периодами практически полного отсутствия кровотока и периодами гиперемии.Механизм холодовой вазодилатации неизвестен, но было высказано предположение, что норэпинефрин может потерять способность сужать сосуды, когда их температура приближается к 0 ° C. Каким бы ни был механизм, вазодилатация, вызванная холодом, по-видимому, защищает открытые ткани от повреждений холодом.
6. Кожные сосуды реагируют на локальное повреждение наблюдаемыми ответами . Повреждение тканей в результате ожогов, ультрафиолетового излучения, холодовых травм, едких химикатов и механических травм вызывает реакции в кровотоке кожи.Классическая реакция, называемая тройным ответом , возникает после энергичного поглаживания кожи тупым предметом. Первым компонентом тройного отклика является красная линия , которая появляется на прямом пути истирания примерно за 15 с. Вскоре после этого появляется неправильная красная вспышка , которая простирается примерно на 2 см по обе стороны от красной линии. Наконец, через минуту или две вдоль линии травмы появляется волдырь . Механизмы, участвующие в тройном ответе, не совсем понятны, но кажется вероятным, что высвобождение гистамина из поврежденных клеток, по крайней мере, частично отвечает за расширение, о чем свидетельствует красная линия, и последующее образование отека волдыря.Красная вспышка, по-видимому, затрагивает нервы в своего рода локальном рефлексе аксона , потому что она может быть вызвана сразу после пересечения кожных нервов, но не после дегенерации периферических частей разрезанных нервов.
Легочный кровоток
1. Легочный кровоток равен сердечному выбросу . За исключением очень кратковременных изменений, скорость кровотока через легкие обязательно равна сердечному выбросу левого желудочка при любых обстоятельствах.Когда сердечный выброс в системный кровоток увеличивается в три раза во время упражнений, например, легочный кровоток также должен увеличиваться в три раза.
2. Сопротивление легочных сосудов составляет примерно одну седьмую от общего системного сосудистого сопротивления . Легочные сосуды действительно оказывают сосудистое сопротивление. Хотя уровень легочного сосудистого сопротивления обычно не влияет на скорость легочного кровотока, это важно, поскольку он является одним из определяющих факторов легочного артериального давления (Δ P = R ).Напомним, что среднее легочное артериальное давление составляет приблизительно 13 мм рт. Ст., Тогда как среднее системное артериальное давление составляет приблизительно 100 мм рт. Причина разницы в легочном и системном артериальном давлении не в том, что правая сторона сердца слабее, чем левая сторона сердца, а скорее в том, что сопротивление легочных сосудов по своей природе намного ниже, чем системное общее периферическое сопротивление. Легочное русло имеет низкое сопротивление, поскольку оно имеет относительно большие сосуды на всем протяжении.
3. Легочные артерии и артериолы менее мускулистые и более эластичные, чем системные артерии и артериолы . Когда давление в легочной артерии увеличивается, легочные артерии и артериолы становятся больше в диаметре. Таким образом, повышение легочного артериального давления снижает легочное сосудистое сопротивление. Это явление важно, поскольку оно ограничивает повышение легочного артериального давления, которое происходит при увеличении сердечного выброса.
4. Легочные артериолы сужаются в ответ на местную альвеолярную гипоксию . Одним из наиболее важных и уникальных активных ответов в легочной сосудистой сети является гипоксическая вазоконстрикция , легочных артериол в ответ на низкий уровень кислорода в альвеолах. ( Примечание : это реакция на гипоксию альвеолярного отростка , а не на низкий уровень кислорода в крови, т. Е. Гипоксемию.) Это прямо противоположно вазодилатации, которая происходит в системных артериолах в ответ на низкий уровень тканей. P О 2 .Механизмы, вызывающие эту необычную реакцию в легочных сосудах, неясны, но, по-видимому, зависят от ощущения кислорода гладкими мышечными клетками легочной артерии. Текущие данные свидетельствуют о том, что местная продукция эндотелина или синтез простагландинов могут быть вовлечены в легочную гипоксическую вазоконстрикцию. Каким бы ни был механизм, гипоксическая вазоконстрикция необходима для эффективного газообмена в легких, поскольку она отводит кровоток от участков легких, которые недостаточно вентилируются. Следовательно, наиболее вентилируемые участки легкого также получают наибольший кровоток.Как следствие гипоксической вазоконстрикции артериол, общая гипоксия (например, возникающая на большой высоте) вызывает повышение легочного сосудистого сопротивления и легочную артериальную гипертензию.
5. Вегетативные нервы не играют большой роли в контроле легочной сосудистой активности . И легочные артерии, и вены получают иннервацию симпатических сосудосуживающих волокон, но рефлекторные воздействия на легочные сосуды, по-видимому, гораздо менее важны, чем физические и местные гипоксические воздействия.Легочные вены служат резервуаром крови для сердечно-сосудистой системы, и симпатическая вазоконстрикция легочных вен может иметь важное значение для мобилизации этой крови в периоды общего сердечно-сосудистого стресса.
6. Низкое капиллярное гидростатическое давление способствует реабсорбции жидкости и предотвращает накопление жидкости в легочных дыхательных путях . Следствием низкого среднего давления в легочной артерии является низкое гидростатическое давление в легочных капиллярах, составляющее примерно 8 мм рт. Ст. (По сравнению с примерно 25 мм рт. Ст. В системных капиллярах).Поскольку онкотическое давление плазмы в капиллярах легких составляет около 25 мм рт. Ст., Как и во всех капиллярах, вполне вероятно, что транскапиллярные силы в легких сильно способствуют постоянной реабсорбции жидкости. Однако это не может быть полной историей, потому что легкие, как и другие ткани, постоянно производят некоторую лимфу, а для выработки лимфатической жидкости требуется некоторая чистая капиллярная фильтрация. Эта фильтрация возможна, несмотря на необычно низкое гидростатическое давление в легочных капиллярах, поскольку легочная интерстициальная жидкость имеет необычно высокую концентрацию белка и, следовательно, онкотическое давление.
ПЕРСПЕКТИВЫ
Как должно быть очевидно из широкого обзора, предпринятого в этой главе, сосудистый контроль действительно является очень сложной проблемой. Наше текущее понимание многих факторов, вовлеченных в этот процесс, в лучшем случае все еще остается «нечетким». Для начинающих мы не понимаем, как работают гладкие мышцы сосудов, а также понимаем, как работают поперечнополосатые мышцы. Если бы этого было недостаточно, на работу гладких мышц, по-видимому, потенциально влияет гораздо больше химических и механических факторов, чем на работу поперечно-полосатой мышцы.Благодаря недавним достижениям в клеточной и молекулярной биологии мы теперь начинаем понимать сложные множественные молекулярные этапы, посредством которых некоторые из этих путей влияют на работу гладкомышечных клеток сосудов. Это, конечно, стало стимулом для фармацевтической промышленности к разработке лекарств, которые могут блокировать (или усиливать) тот или иной путь. Но знание механизма, посредством которого действует определенное влияние, на самом деле ничего не дает для ответа на основные вопросы, с которыми должен столкнуться практикующий врач.Например: несколько влияний просто складываются или они взаимодействуют сложным образом? Существенно ли различается сочетание влияний между органами или даже внутри органа? Есть ли какая-то адаптация к влиянию, так что его влияние со временем уменьшается? Как контролируется кровоток в пересаженных органах? Мы многого не понимаем.
Только золотые участники могут продолжить чтение. Войдите или зарегистрируйтесь, чтобы продолжить Связанные
ICS | Мышечный тонус
Редактор: Jenniffer Voelkl Guevara
Последнее обновление: август 2018 г.
Текущее определение: (1,2)
«Состояние мышцы, обычно определяемое ее напряжением в состоянии покоя, клинически определяется сопротивлением. к пассивному движению.Мышечный тонус состоит из двух компонентов: сократительного компонента, создаваемого низкочастотной активацией небольшого количества двигательных единиц, и вязкоупругого компонента, который не зависит от нервной активности и отражает пассивные физические свойства упругого напряжения мышечного волокна. элементы и осмотическое давление клеток ».
История:
Мышечный тонус также можно назвать жесткостью, которая соответствует изменению сопротивления или силы на единицу изменения длины (Δ сила / Δ смещение ткани) (3)
В нормально иннервируемых скелетных мышцах, тон состоит из активных и пассивных компонентов (4).Мышечная активность, возникающая в результате мышечного сокращения (т. Е. Электрогенного сокращения), обнаруживается среди активных компонентов, вносящих вклад в мышечный тонус; он создается низкочастотной активацией небольшого числа двигательных единиц (2).
Пассивный компонент не зависит от нейронной активности и отражает пассивные физические свойства вязкоупругого напряжения элементов мышечных волокон и осмотического давления клеток (2).
Мышечный тонус оценивается клинически как сопротивление, оказываемое мышцей при приложении к ней давления / деформации или растяжения; оно может изменяться при наличии или отсутствии боли (1)
Пальпация пальцами, ультразвуковая визуализация, манометрия давления, динамометрия и оценка ЭМГ были описаны несколькими авторами как методы оценки тонуса мышц тазового дна; каждый метод может позволять измерять различные аспекты тонуса, такие как активность в состоянии покоя, жесткость или эластичность; однако не существует стандартного метода оценки, который бы охватывал оба компонента мышечного тонуса.(2,5)
Другие термины:
• Гипертонус: общее повышение мышечного тонуса, которое может быть связано либо с повышенной сократительной активностью, либо с пассивной жесткостью в мышце (4), и может присутствовать в полное отсутствие мышечной активности. Стандартизация терминологии по синдромам хронической тазовой боли ICS предложила использовать термин «повышенный тонус», когда имеется ненейрогенная причина. Другие авторы предполагают нейрогенный гипертонус и ненейрогенный гипертонус (1).
• Гипотоничность: общее снижение мышечного тонуса, которое может быть связано либо со снижением сократительной активности, либо с пассивной ригидностью мышцы. Поскольку причина часто неизвестна, рекомендуются термины нейрогенная гипотоничность и ненейрогенная гипотоничность (4), однако Комитет по стандартизации терминологии ICS предлагает использовать термин «пониженный тонус» (1).
• Спазм: электромиографическая (ЭМГ) запись повышенного напряжения с или без укорочения мышцы из-за непроизвольной активности двигательного нерва.Спазм идентифицируется по потенциалам двигательных единиц, которые не могут быть прекращены произвольным расслаблением, и он может быть или не быть болезненным (4), авторы заявляют, что этот термин отличается от контрактуры. (6). Спазм также можно определить как: постоянное сокращение поперечно-полосатой мышцы, которое не может быть высвобождено произвольно. Если схватка болезненна, это обычно называют судорогой. Спазмы возникают с нерегулярными интервалами, с переменной частотой и степенью, и в течение нескольких дней или недель могут привести к контрактуре (1)
• Контрактура: физиологическая контрактура (или окоченение) — это состояние сократительной активности мышц, обычно пальпируемая тугая полоса (также может быть называется триггерной точкой), не сопровождающейся электрической активностью.(4)
Противоречие
Термины спам, гипертонус, гиперактивность и контрактура часто используются взаимозаменяемо, сбивая с толку пациентов и медицинских специалистов, ищущих стратегии лечения. Пациентам с неконтрактильным повышенным тонусом, протестированным с помощью ЭМГ, сказали, что дисфункции PFM нет, и они задаются вопросом, «все ли в моей голове». Эти условия указывают на отдельные и отличные условия. Хотя некоторые подходы к лечению частично совпадают, в каждом случае существуют уникальные методы лечения, которые улучшают эффективность и функциональность.Для медицинских работников важно уточнить эти термины.
К сожалению, эта работа осложняется из-за отсутствия исследований и инструментов. Не существует установленного стандарта для клинической оценки мышечного тонуса, а также нет справочных или нормативных значений. Большинство доступных инструментов измеряют общий тон PFM (т. Е. Суммарный вклад активных и пассивных компонентов). В этой области необходимы дополнительные исследования.
Каталожные номера:
Bø, K., Фроули, Х., Хейлен, Б. Т., Абрамов, Ю., Алмейда, Ф., Бергманс, Б.,… Уэллс, А. (2017). Совместный отчет Международной урогинекологической ассоциации (IUGA) / Международного общества по недержанию мочи (ICS) о терминологии консервативного и нефармакологического лечения дисфункции тазового дна у женщин. Международный журнал урогинекологии и дисфункция тазового дна, стр. 1–27. http://doi.org/10.1007/s00192-016-3140-3
Doggweiler R, Whitmore KE, Meijlink JM, Drake MJ, Frawley H, Nordling J и др.Стандарт терминологии синдромов хронической тазовой боли: отчет рабочей группы по хронической тазовой боли международного общества по воздержанию. Neurourol Urodyn [Интернет]. 2016 26 августа [процитировано 16 октября 2016]; Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27564065
Thibault-Gagnon, S., & Morin, M. (2015). Активные и пассивные компоненты тонуса мышц тазового дна у женщин с спровоцированной вестибулодинией: перспектива на основе обзора литературы.
Саймонс Д.Г. и Менсе С. (1998). Понимание и измерение мышечного тонуса в связи с клинической болью в мышцах. Боль, 75 (1), 1–17. http://doi.org/10.1016/S0304-3959(97)00102-4
Padoa, A., & Rosenbaum, T. (2016). Сверхактивное тазовое дно. Сверхактивное тазовое дно. http://doi.org/10.1007/978-3-319-22150-2
Трэвелл Дж. и Саймонс Д. (2012). Миофасциальные клетки и дисфункция. Руководство по триггерной точке. Верхние конечности (2-е изд.). Уилкинс, Липпинкотт Уильямс и.
Возрастные различия в реакции на силденафил и тамсулозин обусловлены миогенным тонусом гладких мышц предстательной железы человека
Когорта пациентов
Ткань предстательной железы человека была собрана с информированного письменного согласия пациентов и с одобрения Комитета по этике исследований на людях Кабрини (13-14-04-08), Комитет по этике человека Epworth HealthCare (53611) и Комитет по этике исследований человека Университета Монаша (2004/145). Все эксперименты проводились в соответствии с соответствующими инструкциями и правилами.Ткани были собраны у 38 мужчин, перенесших радикальную простатэктомию для лечения рака простаты низкой и средней степени (оценка Глисона ≤ 7). Для минимизации любого возможного влияния опухоли на доброкачественную ткань применялась строгая процедура отбора тканей. Были отобраны только пациенты с одним очагом опухоли, расположенным в PZ, и, во-вторых, использовались только пациенты с очень низким объемом опухоли в процентах от веса простаты (менее 10%). Клинические данные пациента представлены в таблице 1.
После простатэктомии части незлокачественной ткани предстательной железы были вырезаны сертифицированным патологом из переходной (TZ) и периферической (PZ) зоны простаты и помещены в охлажденный физиологический солевой раствор (PSS) для транспортировки в исследовательские учреждения. . Ткань готовили путем микродиссекции на препараты (2 мм × 5 мм) для исследований в ванне для органов или фиксировали в формалине (10%) для гистологического анализа. Ретроспективный доступ к историям болезни пациентов осуществлялся через врачей, больниц и диагностических лабораторий.Клиническая ДГП была диагностирована хирургами до радикальной простатэктомии и определялась на основании степени интравезикального протрузии предстательной железы (IPP) и наличия СНМП. Пациенты, ранее проходившие фармакологическое лечение ДГП, были исключены из когорты.
Исследования в ванне с органами
Записи натяжения были получены для образцов TZ и PZ, как описано ранее 26,27,28 . К ткани прикладывали начальное напряжение 25 мН и оставляли для уравновешивания на 60 минут.«Базальное натяжение» описывает натяжение ткани после периода уравновешивания. Это напряжение не было восстановлено до предварительно определенного исходного уровня, чтобы позволить спонтанным сокращениям возникать. После периода уравновешивания препарат инкубировали с тамсулозином (0,1 нМ), силденафилом (10 мкМ), атропином (1 мкМ) или тетродотоксином (TTX: 1 мкМ), приготовленным в свежем физиологическом солевом растворе (PSS), в течение периода времени. 30 минут (подробные сведения обо всех химикатах и реагентах см. в дополнительных методах).После периода вымывания ткань обрабатывали раствором хлорида калия (20 мМ) для оценки жизнеспособности ткани и надежного индуцирования сильного сокращения во всех жизнеспособных препаратах. После завершения экспериментов препараты взвешивали.
Анализ записей напряжения сосредоточен на трех параметрах: базальном напряжении (внутреннее напряжение в ткани; мН), а также амплитуде и частоте (сила и скорость сокращений; Н / г и мин. −1 , соответственно) как ранее сообщалось 26, 29 .Эти параметры используются в предыдущих исследованиях для определения миогенного тонуса 26,27,28 . Chart Pro ® v 5.5.6 использовали для анализа записей натяжения, при этом указанные параметры измеряли для 5 последовательных ответов и усредняли до и во время инкубации с тамсулозином (0,1 нМ) или силденафилом (10 мкМ).
Иммуногистохимия и пятна на тканях
Срезы депарафинизировали и регидратировали с помощью серии растворов ксилола и этанола. Разделы были размещены в 1.2% H 2 O 2 в течение 30 минут для блокирования эндогенной пероксидазной активности и инкубировали с первичными антителами; PKG-1 (1: 1000, ADI-KAP-PK005-F, Enzo Life Sciences), PDE5A (1: 500, FabGennix) и α-актин гладких мышц (α-SMA) (1: 10 000, Sigma), разведенные в PBS с 0,2% BSA и 0,1% азида натрия в течение 24 часов при 4 ° C. Иммунореактивность визуализировали с помощью набора DAKO EnVision (DAKO, Гамбург, Германия) с последующим применением никель-глюкозооксидазного метода 30 . Извлечение антигена выполняли до инкубации с первичным антителом для срезов, инкубированных с α-SMA и антителом PDE5A, кипячением цитратного буфера (pH 6.0) в микроволновой печи (9 минут при 700 Вт, затем 15 минут при 450 Вт). Отрицательные контроли выполняли, исключая первичное антитело.
Слайды сканировали с использованием сканера Aperio ScanScope, и программное обеспечение Aperio ImageScope использовалось для визуализации и определения стромальных областей ткани, за исключением железистых областей. Алгоритм Aperio Color Deconvolution v9 использовался для количественной оценки процента положительных пикселей, соответствующих сильному окрашиванию коллагена, в то время как алгоритм Positive Pixel Count v9 с параметрами по умолчанию использовался для определения количества клеток α-SMA.Слепые исследования проводились с участием трех (3) наивных зрителей, которым было предложено оценить интенсивность окрашивания, используя следующие критерии; (-) отсутствие окрашивания, (+) слабое окрашивание и (++) высокое окрашивание.
Химические вещества и реагенты
Физиологический солевой раствор (PSS) состоял из 2,5 мМ CaCl 2 , 11 мМ D-глюкозы, 5 мМ KCl, 120 мМ NaCl, 25 мМ NaHCO 3 , 1,2 мМ KH 2 PO 4 , 1,2 мМ MgSO 4 , барботированный газовой смесью 95% O 2 : 5% CO 2 для поддержания pH 7.3-7.4. Силденафил (Sigma, Сент-Луис, Миссури, США) растворяли в диметилсульфоксиде (ДМСО, Sigma, Сент-Луис, Миссури, США) с получением исходного раствора (10 мМ). Тамсулозин (Yamanouchi Pharmaceutical Co. Ltd, Токио, Япония; подарок от профессора Дж. Н. Пеннефатера) растворяли в дистиллированной воде с получением исходного раствора (0,01 мМ). Исходный раствор разбавляли PSS до требуемых концентраций и перед использованием барботировали газовой смесью 95% O 2 : 5% CO 2 .
Статистический анализ
Соответствующие пациенту образцы TZ и PZ сравнивали с использованием парного t-критерия Стьюдента.Непарные t-критерии Стьюдента использовались для сравнения сократительных параметров между группами мужчин в когорте. Лечение с помощью одной фармакотерапии сравнивалось с использованием парного t-критерия Стьюдента с GraphPad Prism версии 6.04 для Windows (GraphPad Software, La Jolla California USA). Тест Extreme Studentized Deviate (ESD) с альфа-уровнем 0,05 использовался для исключения выбросов. Многолинейный регрессионный анализ использовался для корреляции историй болезни с процентной реакцией на фармакотерапевтическое лечение с использованием IBM SPSS Statistics для Windows версии 22.0. Все полосы ошибок на всех графиках представляют собой стандартную ошибку среднего (SEM).
Гипотония — Причины — NHS
Гипотония (снижение мышечного тонуса) — это скорее симптом, чем состояние. Это может быть вызвано рядом основных проблем, которые могут быть неврологическими или неневрологическими.
Неврологические состояния — это состояния, поражающие нервы и нервную систему. Гипотония чаще всего связана с неврологическим контролем мышечного тонуса.
Для нормального функционирования мышцы зависят от сигналов двигательных нервов. Эти сигналы могут быть нарушены на уровне головного и спинного мозга (центральная гипотония) или в результате повреждения нервов между спинным мозгом и мышцами (периферическая гипотония).
Неврологические состояния
Неврологические состояния, которые влияют на центральную нервную систему и могут вызывать центральную гипотонию, включают:
- церебральный паралич — неврологические проблемы, возникающие при рождении, которые влияют на движения и координацию ребенка
- Травма головного и спинного мозга — включая кровотечение в головной мозг
- серьезные инфекции — такие как менингит (инфекция внешней оболочки головного мозга) и энцефалит (инфекция самого мозга)
Неврологические состояния, которые влияют на периферическую нервную систему и могут вызывать периферическую гипотонию, включают:
- мышечная дистрофия — группа генетических состояний, которые постепенно вызывают ослабление мышц, что приводит к увеличению, но изменчивому уровню инвалидности
- myasthenia gravis — заболевание, вызывающее у взрослых слабость и повышенную утомляемость, а не гипотонию; младенцы, рожденные от матерей с миастенией, также могут быть затронуты, и, если так, обычно имеют гипотонию
- Спинальная мышечная атрофия — генетическое заболевание, вызывающее мышечную слабость и прогрессирующую потерю подвижности
- Болезнь Шарко-Мари-Тута — наследственное заболевание, которое влияет на вещество под названием миелин, которое покрывает нервы и помогает передавать сообщения в мозг и из него
Неневрологические проблемы
К неневрологическим проблемам, которые могут вызвать гипотонию у новорожденных и маленьких детей, относятся:
- Синдром Дауна — генетическое заболевание, присутствующее при рождении, которое влияет на нормальное физическое развитие человека и вызывает трудности в обучении
- Синдром Прадера-Вилли — редкий генетический синдром, вызывающий широкий спектр симптомов, включая постоянный голод, ограничение роста и трудности в обучении
- Болезнь Тея-Сакса — редкое и обычно смертельное генетическое заболевание, вызывающее прогрессирующее поражение нервной системы
- врожденный гипотиреоз — при рождении ребенка с недостаточной активностью щитовидной железы; в Великобритании младенцы проходят скрининг и раннее лечение
- Синдром Марфана и Синдром Элерса-Данлоса — наследственные синдромы, которые влияют на соединительные ткани, которые обеспечивают структуру и поддержку других тканей и органов
- Нарушения соединительной ткани — соединительная ткань, такая как коллаген, обеспечивает ткани тела силой и поддержкой и находится в связках и хрящах
- преждевременные роды (до 37 недели беременности) — недоношенные дети иногда имеют гипотонию, потому что их мышцы не полностью развиты к моменту рождения
Гипотония в более старшем возрасте
Гипотония иногда может возникать у детей старшего возраста и взрослых, хотя это встречается реже.
Это может быть вызвано некоторыми из проблем, упомянутых выше, но другие возможные причины включают:
- рассеянный склероз — миелин, покрывающий нервные волокна, повреждается, что мешает их способности передавать электрические сигналы от головного и спинного мозга к остальным частям тела
- Болезнь двигательных нейронов — редкое заболевание, которое постепенно повреждает двигательные нервы и приводит к истощению мышц
Слабость и проблемы с подвижностью и равновесием также являются обычным явлением для этих состояний.
Последняя проверка страницы: 11 июня 2018 г.
Срок следующей проверки: 11 июня 2021 г.
Каковы признаки и симптомы нейрогенного шока от перелома шейного отдела позвоночника?
Канвар Р., Деласобера Б.Э., Хадсон К., Фрохна В.Оценка отделения неотложной помощи и лечение травм шейного отдела позвоночника. Emerg Med Clin North Am . 2015 май. 33 (2): 241-82. [Медлайн].
Guarnieri G, Izzo R, Muto M. Роль экстренной радиологии при травмах позвоночника. руб. Дж Радиол . 2016. 89 (1061): 20150833. [Медлайн].
Winslow JE 3rd, Hensberry R, Bozeman WP, Hill KD, Miller PR. Риск переломов пояснично-грудного отдела увеличился вдвое у пострадавших в результате дорожно-транспортных происшествий с переломами шейного отдела позвоночника. Дж. Травма . 2006 Сентябрь 61 (3): 686-7. [Медлайн].
Duane TM, Dechert T, Wolfe LG, Aboutanos MB, Malhotra AK, Ivatury RR. Клиническое обследование и его надежность при выявлении переломов шейного отдела позвоночника. Дж. Травма . 2007 июн. 62 (6): 1405-8; обсуждение 1408-10. [Медлайн].
Чилверс Г., Джанджуа У., Чоудхари С. Тупая травма шейного отдела позвоночника при политравме у взрослых: частота, характер травм и предикторы значительного повреждения связок на КТ. Клин Радиол . 2017 10 августа [Medline].
Мандади А.Р., Васим М. Травма, позвоночник, травма позвоночника, педиатрия. Июнь 2017 г. [Medline]. [Полный текст].
Pencle F, Месфин Ф.Травмы шейного отдела позвоночника. Июнь 2017 г. [Medline]. [Полный текст].
Asemota AO. Что нового в чрезвычайных ситуациях, травмах и шоке? Решение проблем с переломами шейного отдела позвоночника. J Шок для экстренной травмы . 2017 янв-март. 10 (1): 1. [Медлайн].
Иванчич ПК. Биомеханика перелома одонтоида. Позвоночник (Phila Pa 1976) . 2014 15 ноября. 39 (24): E1403-10. [Медлайн].
Шах К., Тику А., Котари М.К., Нене А. Современные концепции травм шейного отдела позвоночника у детей. Открытый Ортоп J . 2017. 11: 346-352. [Медлайн].
Kill C, Risse J, Wallot P, Seidl P, Steinfeldt T., Wulf H. Видеоларингоскопия с помощью глидескопа снижает подвижность шейного отдела позвоночника у пациентов с незащищенным шейным отделом позвоночника. J Emerg Med . 2013 22 января [Medline].
Азиз М. Использование устройств для интубации с видеоинтубацией при ведении пациентов с травмами. Анестезиол Клин . 2013 31 марта (1): 157-66. [Медлайн].
Юэ Дж. К., Чан А. К., Винклер Е. А., Упадхьяюла П., Ридди В. Дж., Дхалл СС. Обзор и обновление рекомендаций по неотложной помощи при травме шейного отдела спинного мозга (ТСМ) — часть II. Дж. Нейрохирургия . 2015 9 сентября. [Medline].
Даррас К., Эндрюс Г.Т., Маклафлин П.Д., Хоррами-Арани Н., Ростон А., Форстер ВВ и др. Жемчуг для интерпретации компьютерной томографии шейного отдела позвоночника при травмах. Радиол Клин Норт Ам . 2015 июл.53 (4): 657-74, vii. [Медлайн].
Quarrington RD, Jones CF, Tcherveniakov P, Clark JM, Sandler SJI, Lee YC и др. Травматический субаксиальный подвывих и вывих шейной фасетки: эпидемиология, рентгенологические анализы и факторы риска повреждения спинного мозга. Позвоночник J . 21 июля 2017 г. [Medline].
МЕЖДУНАРОДНЫЕ СТАНДАРТЫ НЕВРОЛОГИЧЕСКОЙ КЛАССИФИКАЦИИ ТРАВМЫ СПИННОГО МОЗГА. Американская ассоциация травм позвоночника. Доступно по адресу http: // asia-spinalinjury.org / wp-content / uploads / 2016/02 / International_Stds_Diagram_Worksheet.pdf. 2011; Доступ: 18 августа 2017 г.
Cui LW, Probst MA, Hoffman JR, Mower WR. Чувствительность простой рентгенографии при травмах шейного отдела позвоночника у детей. Emerg Radiol . 20 июня 2016 г. [Medline].
Hoffman JR, Mower WR, Wolfson AB и др. Обоснованность набора клинических критериев для исключения травмы шейного отдела позвоночника у пациентов с тупой травмой. Национальная группа по изучению использования экстренной рентгенографии. N Engl J Med . 2000 13 июля. 343 (2): 94-9. [Медлайн].
Schleicher P, Scholz M, Kandziora F, Badke A, Brakopp FH, Ekkerlein HKF и др. [Субаксиальные травмы шейного отдела позвоночника: рекомендации по лечению Немецкого общества ортопедов и травматологов]. Z Orthop Unfall . 20 июля 2017 г. [Medline].
Берритто Д., Пинто А., Мишлен П., Демондион X, Бадр С. Визуализация травм острой шейной части позвоночника. Радиол костно-мышечной системы Семина .2017 21 июля (3): 184-198. [Медлайн].
Trafton PG. Травмы спинного мозга. Surg Clin North Am . 1982 Февраль 62 (1): 61-72. [Медлайн].
Ху Дж, Ян К.Х., Чжоу С.К., Король А.И. Численное исследование факторов, влияющих на травмы шейного отдела позвоночника при опрокидывании. Позвоночник (Phila Pa 1976) . 2008 г. 1. 33 (23): 2529-35. [Медлайн].
Thompson WL, Stiell IG, Clement CM, Brison RJ. Связь механизма травмы с риском переломов шейного отдела позвоночника. CJEM . 2009 11 (1): 14-22 января. [Медлайн].
Donaldson WF 3rd, Hanks SE, Nassr A, Vogt MT, Lee JY. Травмы шейного отдела позвоночника, связанные с неправильным использованием подушек безопасности при столкновении автомобилей. Позвоночник (Phila Pa 1976) . 2008 15 марта. 33 (6): 631-4. [Медлайн].
Ван МС, Пинтар Ф, Йоганандан Н, Майман Диджей. Продолжающееся бремя переломов позвоночника после автомобильной аварии. J Нейрохирургия позвоночника . 2009 фев.10 (2): 86-92. [Медлайн].
Stein DM, Kufera JA, Ho SM, Ryb GE, Dischinger PC, O’connor JV, et al. Характеристики пассажиров и аварийных ситуаций для пассажиров с травмами шейного отдела позвоночника, полученными в результате дорожно-транспортных происшествий. Дж. Травма . 2011 Февраль 70 (2): 299-309. [Медлайн].
Vanderlan WB, Tew BE, Seguin CY, Mata MM, Yang JJ, Horst HM, et al. Неврологические последствия проникающей травмы шейки матки. Позвоночник (Phila Pa 1976) .2009 15 ноября. 34 (24): 2646-53. [Медлайн].
Beaty N, Slavin J, Diaz C, Zeleznick K, Ibrahimi D, Sansur CA. Травма шейного отдела позвоночника в результате огнестрельных ранений. J Нейрохирургия позвоночника . 2014 Сентябрь 21 (3): 442-9. [Медлайн].
Дэвидсон, JSD, Бердселл, округ Колумбия. Травма шейного отдела позвоночника у пациентов с травмой лицевого скелета. Дж. Травма . 1989. 29: 1276-1278. [Медлайн].
O’Malley KF, Ross SE. Заболеваемость травмами шейного отдела позвоночника у пациентов с черепно-мозговой травмой. Дж. Травма . 1988 28 октября (10): 1476-8. [Медлайн].
Синклер Д., Шварц М., Грусс Дж., Маклеллан Б. Ретроспективный обзор взаимосвязи между переломами лица, травмами головы и травмами шейного отдела позвоночника. J Emerg Med . 1988 март-апрель. 6 (2): 109-12. [Медлайн].
Hills MW, Deane SA. Травмы головы и лица: есть ли повышенный риск травмы шейного отдела позвоночника ?. Дж. Травма . 1993 Apr, 34 (4): 549-53; обсуждение 553-4.[Медлайн].
Леонард Дж. К., Купперманн Н., Олсен С., Бэбкок-Симпелло Л., Браун К., Махаджан П. и др. Факторы, связанные с травмой шейного отдела позвоночника у детей после тупой травмы. Энн Эмерг Мед . 2011 Август 58 (2): 145-55. [Медлайн].
Stiell IG, Clement CM, McKnight RD и др. Канадское правило C-spine в сравнении с критериями низкого риска NEXUS у пациентов с травмой. N Engl J Med . 2003 25 декабря. 349 (26): 2510-8. [Медлайн].[Полный текст].
Бакленд А.Дж., Брессан С., Джоветт Х., Джонсон МБ, Тиг В.Дж. Неоднородность в оценке шейного отдела позвоночника при педиатрической травме: обзор знаний врачей и их применения в педиатрическом центре тяжелой травмы. Emerg Med Australas . 2016 28 июля. [Medline].
Benayoun MD, Allen JW, Lovasik BP, Uriell ML, Spandorfer RM, Holder CA. Использование компьютерной томографии шейного отдела позвоночника при оценке травм при падении с уровня земли. J Хирург для неотложной помощи при травмах . 2016 Август 81 (2): 339-44. [Медлайн].
Mulkens TH, Marchal P, Daineffe S, Salgado R, Bellinck P, te Rijdt B и др. Сравнение мультидетекторной компьютерной томографии со стандартной и низкой дозой при травме шейного отдела позвоночника. AJNR Am J Нейрорадиол . 2007 сентября, 28 (8): 1444-50. [Медлайн].
Nordin M, Carragee EJ, Hogg-Johnson S, Weiner SS, Hurwitz EL, Peloso PM, et al. Оценка боли в шее и связанных с ней расстройств: результаты работы Целевой группы по костям и суставам 2000-2010 гг. По боли в шее и связанных с ней расстройствах. Дж. Манипулятивная физиология Ther . 2009 г., 32 февраля (2 доп.): S117-40. [Медлайн].
Кумар Ю., Хаяси Д. Роль магнитно-резонансной томографии при острой травме позвоночника: обзорный обзор. BMC Musculoskelet Disord . 2016 22 июля. 17: 310. [Медлайн].
Маунг А.А., Джонсон, округ Колумбия, Барре К., Пепонис Т., Месар Т., Велмахос ГК и др. МРТ шейного отдела позвоночника у пациентов с отрицательной КТ: проспективное многоцентровое исследование Исследовательского консорциума Центров травм Новой Англии (ReCONECT). J Хирург для неотложной помощи при травмах . 2017 Февраль 82 (2): 263-269. [Медлайн].
Утц М., Хан С., О’Коннор Д., Мейерс С. Оценка травм шейного отдела позвоночника с помощью MDCT и МРТ. Insights Imaging . 2014 Февраль 5 (1): 67-75. [Медлайн].
Hagedorn JC 2nd, Emery SE, France JC, Daffner SD. Имеет ли значение КТ-ангиография для пациентов с травмами шейного отдела позвоночника ?. J Хирургия костного сустава Am . 2014 г. 4 июня. 96 (11): 951-955. [Медлайн].
Гуд Т., Янг А., Уилсон С.П., Катцен Дж., Вулф Л.Г., Дуэйн TM.Оценка перелома шейного отдела позвоночника у пожилых людей: можно ли доверять нашему физическому обследованию ?. Am Surg . 2014 Февраль 80 (2): 182-4. [Медлайн].
Srinivas BH, Rajesh A, Purohit AK. Факторы, влияющие на исход острой травмы шейного отдела позвоночника: проспективное исследование. Азиатский Дж. Нейросург . 2017 июл-сен. 12 (3): 416-423. [Медлайн].
Национальный статистический центр травм спинного мозга (NSCISC). Повреждение спинного мозга. Факты и цифры: краткий обзор.Бирмингем, штат Алабама: NSCISC; Июль 1996.
Nordin M, Carragee EJ, Hogg-Johnson S, Weiner SS, Hurwitz EL, Peloso PM, et al. Оценка боли в шее и связанных с ней расстройств: результаты работы Целевой группы по костям и суставам 2000-2010 гг. По боли в шее и связанных с ней расстройствах. Позвоночник . 2008 15 февраля. 33 (4 доп.): S101-22. [Медлайн].
Стассен Н.А., Уильямс В.А., Гестринг М.Л. и др. Магнитно-резонансная томография в сочетании со спиральной компьютерной томографией обеспечивает безопасный и эффективный метод очистки шейного отдела позвоночника у пациента с тупой травмой. Дж. Травма . 2006 Январь 60 (1): 171-7. [Медлайн].
Stiell IG, Wells GA, Vandemheen KL, et al. Канадское правило C-spine для рентгенографии у бодрствующих и стабильных пациентов с травмой. ЯМА . 2001, 17 октября. 286 (15): 1841-8. [Медлайн].
Нейрогенный шок Артикул
Введение
Нейрогенный шок — разрушительное последствие повреждения спинного мозга (ТСМ), также известное как вазогенный шок.Повреждение спинного мозга приводит к внезапной потере симпатического тонуса, что приводит к вегетативной нестабильности, проявляющейся в гипотонии, брадиаритмии и нарушении регуляции температуры. Повреждение спинного мозга не следует путать со спинальным шоком, который представляет собой обратимое снижение сенсорной и моторной функции после травмы спинного мозга. Нейрогенный шок связан с травмой шейного и верхнего отдела грудного отдела позвоночника. Нейрогенный шок следует дифференцировать от гиповолемического шока; последнее часто связано с тахикардией.
Раннее выявление и агрессивное лечение жизненно важны при нейрогенном шоке для предотвращения вторичного повреждения позвоночника. Эта глава представляет собой краткий обзор, который поможет в дальнейшем лечении пациентов, у которых развивается нейрогенный шок. [1] [2] [3]
Этиология
Нейрогенный шок определяется как повреждение спинного мозга с ассоциированной дисрегуляцией вегетативной нервной системы. Это нарушение регуляции происходит из-за потери симпатического тонуса и беспрепятственного парасимпатического ответа.Нейрогенный шок чаще всего является следствием травм спинного мозга. Обзор базы данных о травмах показал, что нейрогенный шок встречается у 19,3% повреждений шейного отдела позвоночника и 7% повреждений грудного отдела позвоночника. К другим причинам нейрогенного шока, которые встречаются гораздо реже, относятся спинальная анестезия, синдром Гийена-Барре, токсины вегетативной нервной системы, поперечный миелит и другие невропатии. Педиатрическая популяция сообщает о нейрогенном шоке у детей с трисомией 21, дисплазией скелета и тонзиллофарингитом.Нейрогенный шок остается диагнозом исключения у травмированного пациента — в Advance Trauma Life Support говорится, что геморрагический шок является более частой причиной гипотензии. Если с этим справиться должным образом, следует рассмотреть возможность нейрогенного шока [4].
Эпидемиология
По оценкам, от 8000 до 10 000 человек ежегодно получают травмы спинного мозга в Соединенных Штатах Америки. Обзор изолированного повреждения спинного мозга, проведенный Сетью аудита и исследований травм, выявил 490 изолированных повреждений спинного мозга.Из этих изолированных повреждений спинного мозга у 64 пациентов развился нейрогенный шок, или 14,2% от всех изолированных повреждений спинного мозга. Однако ретроспективное исследование травматологического центра с высоким уровнем объема 1 показало, что частота нейрогенного шока составила 8,8%. Не существует определенных универсальных гемодинамических параметров для нейрогенного шока. Однако в большинстве исследований используется определение систолического артериального давления менее 100 мм рт. Ст. И частоты сердечных сокращений менее 80 ударов в минуту. Эпидемиологию нейрогенного шока трудно оценить, поскольку до сих пор неизвестно, как геморрагический шок и другие травмы влияют на гемодинамические эффекты травмы спинного мозга.
Патофизиология
Нейрогенный шок — это клиническое состояние, проявляющееся в результате первичного и вторичного повреждения спинного мозга. Гемодинамические изменения наблюдаются при повреждении спинного мозга выше уровня Т6. Нисходящие симпатические тракты чаще всего повреждаются в результате перелома или вывиха позвонков в шейном или верхнем грудном отделе позвоночника. Первичное повреждение спинного мозга происходит в течение нескольких минут после первого повреждения.Первичное повреждение — это прямое повреждение аксонов и нервных мембран в промежуточно-латеральном ядре, латеральной серой материи и переднем корне, которое приводит к нарушению симпатического тонуса. Вторичное повреждение спинного мозга происходит через несколько часов или дней после первоначального повреждения. Вторичное повреждение возникает в результате сосудистого инсульта, электролитных сдвигов и отека, которые приводят к прогрессирующему центральному геморрагическому некрозу серого вещества в месте повреждения. Существует эксайтотоксичность из-за накопления NMDA на клеточном уровне, неправильного гомеостаза электролитов, митохондриального повреждения и реперфузионного повреждения, которые все приводят к контролируемому и неконтролируемому апоптозу.Нейрогенный шок — это комбинация первичных и вторичных повреждений, которые приводят к потере симпатического тонуса и, следовательно, к беспрепятственной парасимпатической реакции, вызванной блуждающим нервом. Следовательно, пациенты страдают от нестабильности артериального давления, частоты сердечных сокращений и регулирования температуры.
История и физика
Нейрогенный шок может быть трудно диагностировать и требует тщательного исследования. Нейрогенный шок чаще всего связан с тупой травмой шейного отдела позвоночника.Выявление травматического повреждения спинного мозга жизненно важно для исследования нейрогенного шока. Медицинские работники должны установить механизм травмы, наличие болезненности позвоночника по средней линии, отвлекающую травму, которая может отвлечь внимание от области позвоночника, потерю сознания, неврологический дефицит или интоксикацию, которая может неверно истолковать экзамен, поскольку они связаны с травмой позвонка. . Хотя нейрогенный шок следует рассматривать только после исключения геморрагического шока у травмированного пациента, наличие перелома или вывиха позвонков вызывает опасения по поводу нейрогенного шока.Брадиаритмия, гипотензия, покраснение кожи — классические признаки нейрогенного шока. Объединенный комитет Американской ассоциации травм позвоночника и Международного общества спинного мозга предложил определение нейрогенного шока как общую дисфункцию вегетативной нервной системы, которая также включает такие симптомы, как ортостатическая гипотензия, вегетативная дисрефлексия и нарушение регуляции температуры. Для диагностики нейрогенного шока нет необходимости в очаговом неврологическом дефиците.
Оценка
До расширенной визуализации нейрогенный шок был связан с повреждением спинного мозга без радиологических отклонений (SCIWORA).С появлением современных методов визуализации, таких как компьютерная томография и МРТ, травмы спинного мозга выявляются более точно. Диагноз нейрогенного шока остается комбинацией рентгенологического исследования, гемодинамического мониторинга и клинического обследования. [3] [5] [6] [7] [8]
Лечение / менеджмент
Первоначальное лечение нейрогенного шока направлено на стабилизацию гемодинамики. В первую очередь следует лечить гипотонию, чтобы предотвратить вторичную травму. Первой линией лечения гипотонии является внутривенная инфузионная терапия.Это необходимо для соответствующей компенсации возникающего вазогенного расширения. Если гипотензия сохраняется, несмотря на эуволемию, вазопрессоры и инотропы являются второй линией. Использование одного агента не рекомендуется. Обычно используется фенилэфрин, поскольку это чистый агонист альфа-1, который вызывает сужение периферических сосудов, чтобы противодействовать потере симпатического тонуса. Однако отсутствие бета-активности приводит к рефлекторной брадикардии, которая усиливает и без того неоспоримый тонус блуждающего нерва. Норэпинефрин обладает как альфа-, так и бета-активностью, помогая как при гипотонии, так и при брадикардии, поэтому является предпочтительным средством.Адреналин упоминается в случаях рефрактерной гипотензии, и он редко требуется. Рекомендуется поддерживать среднее артериальное давление (САД) на уровне от 85 до 90 мм рт. Ст. В течение первых 7 дней для улучшения перфузии спинного мозга. Следует соблюдать осторожность при использовании вазопрессоров, так как могут быть сопутствующие травмы, усугубляемые сужением сосудов. [9] [10] [11] [12]
Лечение брадикардии — атропин и гликопирролат для снижения тонуса блуждающего нерва, особенно перед отсасыванием. Считается, что изопротеренол обладает чистым хронотропным эффектом.Метилксантины, такие как теофиллин и аминофиллин, упоминаются для лечения рефрактерных случаев брадикардии.
Первоначальная иммобилизация шейного отдела позвоночника важна для предотвращения дальнейшего повреждения спинного мозга. Следует использовать воротник Miami J или Philadelphia. Метилпреднизолон и кортикостероиды показали себя многообещающими на животных моделях. Однако это не было продемонстрировано в клинических испытаниях, а стероиды повышают риск таких осложнений, как инфекция, и не рекомендуются многими обществами. В конечном итоге может потребоваться хирургическое вмешательство для декомпрессии травмы позвоночника и уменьшения нейрогенного шока.Сообщалось, что симптомы нейрогенного шока сохраняются от 4 до 5 недель.
Дифференциальная диагностика
- Гиповолемический шок
- Обструктивный шок
- Кардиогенный шок
- Септический шок
Все эти типы шока связаны с тахикардией, тогда как нейрогенный шок связан с брадикардией.
Термин «спинальный шок» означает острую потерю двигательных, сенсорных и рефлекторных функций ниже уровня травмы и может быть связан с нейрогенным шоком.
Прогноз
Общий прогноз зависит от степени повреждения спинного мозга и реакции на лечение. Те, которые связаны с неврологическим дефицитом, обычно имеют плохие результаты.
Осложнения
Осложнения нейрогенного шока могут включать тяжелую, длительную гипотензию, которая требует вазопрессивной терапии и может длиться до 5 недель после травмы.
Сдерживание и обучение пациентов
Нейрогенный шок может привести к летальному исходу, и пациенты, перенесшие травму спинного мозга, должны понимать, что любые признаки тошноты, головокружения или боли в груди после такого происшествия требуют неотложного внимания квалифицированных практикующих врачей.
Улучшение результатов команды здравоохранения
Диагностика и лечение нейрогенного шока — непростая задача.Таким образом, с этим состоянием лучше всего справляется межпрофессиональная команда, в которую входят врач отделения неотложной помощи, невролог, нейрохирург, хирург-ортопед, травматолог и реаниматолог. За такими пациентами обычно наблюдают медсестры отделения интенсивной терапии неврологии. В то время как жидкостная реанимация является начальным лечением, следует осторожно использовать вазопрессоры, поскольку они могут усугубить любое сужение сосудов; это должно быть сделано при участии аптеки.
У большинства этих пациентов есть другие сопутствующие травмы, которые также требуют внимания.Медсестры должны обеспечить пациентам профилактику тромбоза глубоких вен, защиту от пролежней и катетер Фолея. У этих пациентов может развиться ряд осложнений, включая аспирационную пневмонию, стрессовую язву и тромбоз глубоких вен.


 Курсы массажа с элементами ЛФК влияют на данный процесс только опосредованно в качестве упражнения, тренировки навыка. Если вы будете сами обучать своего ребенка как сидеть, ползать, вставать и т.д., результат будет таким же, а зачастую — намного лучше, потому что контакт и степень доверия родителям намного лучше, чем массажисту, чужому человеку.
Курсы массажа с элементами ЛФК влияют на данный процесс только опосредованно в качестве упражнения, тренировки навыка. Если вы будете сами обучать своего ребенка как сидеть, ползать, вставать и т.д., результат будет таким же, а зачастую — намного лучше, потому что контакт и степень доверия родителям намного лучше, чем массажисту, чужому человеку. Осуществляется путем надавливания на мочевой пузырь через брюшную стенку. Отведение должно осуществляться 2–4 раза в сутки (чем чаще, тем лучше) до минимально возможного остаточного объема мочи. Мануальное отведение всегда является наиболее предпочтительным из-за низкого риска развития инфекции. Однако пациентам с повреждением ВДН, которым невозможно произвести отведение мочи мануально, необходимо устанавливать уретральный катетер.
Осуществляется путем надавливания на мочевой пузырь через брюшную стенку. Отведение должно осуществляться 2–4 раза в сутки (чем чаще, тем лучше) до минимально возможного остаточного объема мочи. Мануальное отведение всегда является наиболее предпочтительным из-за низкого риска развития инфекции. Однако пациентам с повреждением ВДН, которым невозможно произвести отведение мочи мануально, необходимо устанавливать уретральный катетер. Необходимо выбирать наиболее мягкий катетер (Нелатона, Фолея).
Необходимо выбирать наиболее мягкий катетер (Нелатона, Фолея).
 Effectiveness of manual bladder expression in paraplegic dogs. Am J Vet Res, 2017.
Effectiveness of manual bladder expression in paraplegic dogs. Am J Vet Res, 2017.
