| A27.30.138 | Молекулярно-генетическое исследование микроделеций в в гене AZF | НИИ Урологии | Кровь | 14 | 3 700,00 ₽ | |||
| A27.05.036.001 | Молекулярно-генетическое исследование мутаций в гене CFTR (муковисцидоз) | НИИ Урологии | Кровь | 7 | 3 800,00 ₽ | |||
| A27.30.107 | Молекулярно-генетическое исследование Анализ длины CAG-повтора в гене AR | НИИ Урологии | Кровь | 7 | 4 200,00 ₽ | |||
| A27.05.053.001 | Молекулярно-генетическое исследование мутаций в гене VHL | НИИ Урологии | Кровь | 14 | 6 500,00 ₽ | |||
| A27.05.052.001 | Молекулярно-генетическое исследование мутаций в гене RET | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 14 | 8 800,00 ₽ | |
A27. 05.040.001 05.040.001 | 29023 | Молекулярно-генетическое исследование мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 7 | 6 000,00 ₽ |
| A27.05.046.001 | Молекулярно-генетическое исследование мутаций в гене CHEK2 | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 7 | 4 500,00 ₽ | |
| A27.30.015.001 | Определение полиморфизма гена UGT1A1 | НИИ Урологии | Кровь | 14 | 4 400,00 ₽ | |||
| A27.30.108 | Молекулярно-генетическое исследование мутаций в гене DPYD | НИИ Урологии | Кровь | 7 | 5 900,00 ₽ | |||
| A27.30.109 | Анализ полиморфизма гена TPMT | НИИ Урологии | Кровь | 7 | 5 800,00 ₽ | |||
A27.30.016. 001 001 | 29013 | Молекулярно-генетическое исследование мутаций в гене EGFR | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 8 500,00 ₽ | |
| A27.30.110 | Молекулярно-генетическое исследование мутаций в генах KRAS, NRAS и BRAF при колоректальном раке | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 12 700,00 ₽ | ||
| A27.30.006.001 | Молекулярно-генетическое исследование мутаций в гене KRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 7 000,00 ₽ | ||
| A27.30.007.001 | Молекулярно-генетическое исследование мутаций в гене NRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 8 000,00 ₽ | ||
| A27.30.009 | 29012 | Молекулярно-генетическое исследование мутации V600 BRAF | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 5 050,00 ₽ | |
A27. 30.008.001 30.008.001 | Молекулярно-генетическое исследование мутаций в гене BRAF | НИИ Урологии | МРНЦ | Блоки (срезы) | 7 | 6 100,00 ₽ | ||
| A27.30.111 | Молекулярно-генетическое исследование мутаций в гене PIK3CA | НИИ Урологии | МРНЦ | Блоки (срезы) | 21 | 7 000,00 ₽ | ||
| A27.30.112 | 29015 | Определение микросателлитной нестабильности (MSI) | НИИ Урологии | МРНЦ | Блоки (срезы) + кровь | 12 | 6 800,00 ₽ | |
| A27.30.112.001 | Определение микросателлитной нестабильности (MSI) по 9 маркерам | НИИ Урологии | Блоки (срезы) + кровь | 14 | 13 500,00 ₽ | |||
| A27.30.113 | Молекулярно-генетическое исследование мутаций в гене TERT | НИИ Урологии | Блоки (срезы) | Моча | 7 | 6 500,00 ₽ | ||
A27.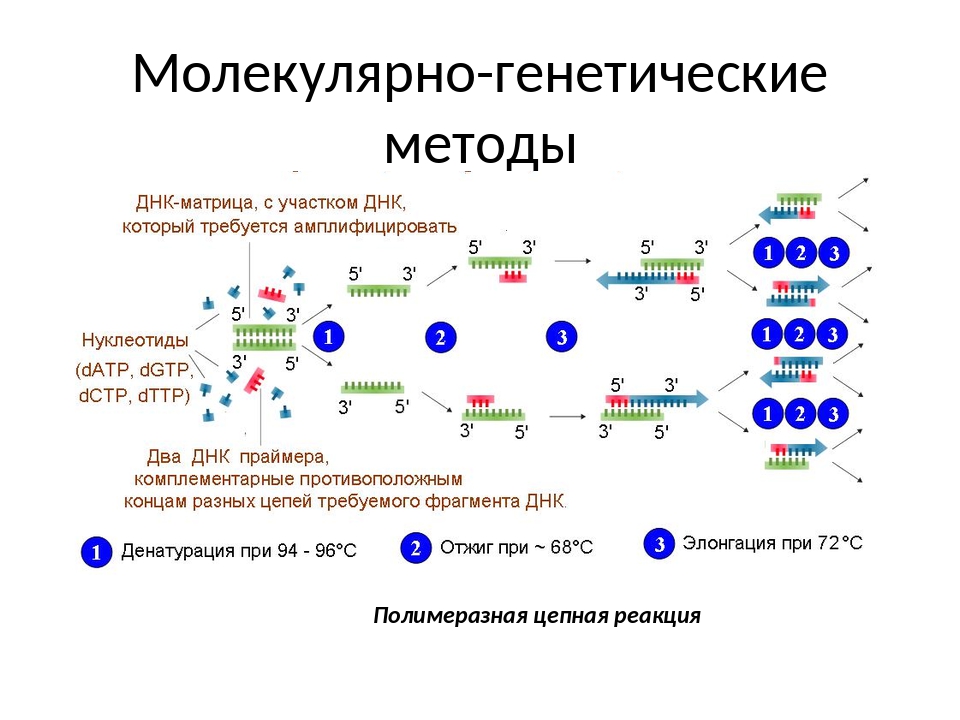 30.114 30.114 | Молекулярно-генетическое исследование мутаций в гене FGFR3 | НИИ Урологии | Блоки (срезы) | Моча | 7 | 8 100,00 ₽ | ||
| A09.28.087 | Исследование уровня антигена рака простаты 3 (PCA3) в моче | НИИ Урологии | Моча | Блоки (срезы) | 14 | 7 400,00 ₽ | ||
| A27.05.048.001 | Молекулярно-генетическое исследование мутаций в гене TP53 | НИИ Урологии | Блоки (срезы) | 14 | 9 100,00 ₽ | |||
| A27.30.115 | Молекулярно-генетическое исследование мутаций в гене GNAS | НИИ Урологии | Блоки (срезы) | 7 | 5 000,00 ₽ | |||
| A27.30.012.001 | Молекулярно-генетическое исследование мутаций в гене c-KIT | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 7 800,00 ₽ | ||
A27. 30.116 30.116 | 29016 | Молекулярно-генетическое исследование мутаций в генах KIT и PDGFRA | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 | 10 600,00 ₽ | |
| A27.30.117 | Молекулярно-генетическое исследование мутаций в гене ERBB2 | НИИ Урологии | Блоки (срезы) | 7 | 5 000,00 ₽ | |||
| A27.30.118 | Молекулярно-генетическое исследование мутаций в гене HRAS | НИИ Урологии | МРНЦ | Блоки (срезы) | 14 | 7 050,00 ₽ | ||
| A27.30.085.001 | Молекулярно-генетическое исследование мутаций в гене CTNNB1 методом секвенирования | НИИ Урологии | Блоки (срезы) | 14 | 4 800,00 ₽ | |||
| A27.30.119 | Молекулярно-генетическое исследование мутаций в гене h4F3A методом секвенирования | НИИ Урологии | Блоки (срезы) | 14 | 4 800,00 ₽ | |||
A27. 30.051.001 30.051.001 | Молекулярно-генетическое исследование мутаций в гене IDh2 | НИИ Урологии | Блоки (срезы) | 14 | 5 000,00 ₽ | |||
| A27.30.120 | Молекулярно-генетическое исследование мутаций в гене WT1 при Синдроме Дениса-Драша | НИИ Урологии | Кровь | 14 | 7 700,00 ₽ | |||
| A27.30.121 | Молекулярно-генетическое исследование мутаций в гене WT1 при Синдроме Фразера | НИИ Урологии | Кровь | 7 | 4 400,00 ₽ | |||
| A27.30.122 | Молекулярно-генетическое исследование мутаций в гене PTPN11 при Синдроме Нунан | НИИ Урологии | Кровь | 14 | 7 000,00 ₽ | |||
| A27.30.123 | Молекулярно-генетическое исследование мутаций в гене TTR при наследственном амилоидозе | НИИ Урологии | Кровь | 14 | 6 500,00 ₽ | |||
A27. 30.124 30.124 | Молекулярно-генетическое исследование мутаций в генах F2, F5 (Предрасположенность к тромбофилии) | НИИ Урологии | Кровь | 7 | 3 300,00 ₽ | |||
| A27.30.125 | Молекулярно-генетическое исследование мутаций в гене FH методом секвенирования | НИИ Урологии | Кровь | 21 | 13 400,00 ₽ | |||
| A27.30.126 | Молекулярно-генетическое исследование мутаций в гене FLCN при Синдроме Берта-Хогга-Дьюба | НИИ Урологии | Кровь | 21 | 13 400,00 ₽ | |||
| A27.30.127 | Молекулярно-генетическое исследование мутаций в гене MET при наследственной папиллярной карциноме 1-го типа | НИИ Урологии | Кровь | 21 | 10 000,00 ₽ | |||
| A27.30.128 | Молекулярно-генетическое исследование мутаций в гене SMARCB1 при Синдроме рабдоидных опухолей | НИИ Урологии | Кровь | 14 | 13 300,00 ₽ | |||
A27. 30.129 30.129 | Молекулярно-генетическое исследование мутаций в гене AGXT при наследственной гипероксалурии I типа | НИИ Урологии | Кровь | 21 | 14 700,00 ₽ | |||
| A27.30.130 | Молекулярно-генетическое исследование аллельного дисбаланса по STR-маркерам при дифференциальной диагностике между хромофобной карциномой и онкоцитомой почки | НИИ Урологии | Блоки (срезы) + кровь | 14 | 22 000,00 ₽ | |||
| A27.05.012 | Молекулярно-генетическое исследование мутации в гене V617F (замена 617-ой аминокислоты с валина на фенилаланин) JAK2 (янус тирозин-киназа второго типа) в крови | МРНЦ | Кровь | 14 | 3 150,00 ₽ | |||
| A27.05.021 | Молекулярно-генетическое исследование маркеров Ph-негативных миелопролиферативных заболеваний (мутации в генах Jak2, MPL и CALR) | МРНЦ | Кровь | 7 | 5 500,00 ₽ | |||
А27. 05.021.001 05.021.001 | Молекулярно-генетическое исследование мутаций в гене кальретикулина (CALR) | МРНЦ | Кровь | 7 | 3 700,00 ₽ | |||
| А27.05.021.002 | Молекулярно-генетическое исследование мутаций в гене рецептора тромбопоэтина (MPL-1) | МРНЦ | Кровь | 7 | 3 700,00 ₽ | |||
| А27.05.041.001 | Типирование генов гистосовместимости человека (HLA) II класса методом амплификации ДНК | МРНЦ | Кровь | 7 | 4 950,00 ₽ | |||
| А27.30.069.001 | Определение экспрессии мРНК BCR-ABLp210 | МРНЦ | Кровь | 10 | 3 900,00 ₽ | |||
| А26.05.011 | Молекулярно-биологическое исследование крови на вирус Эпштейна-Барра (Epstein — Barr virus) | МРНЦ | Кровь | 5 | 560,00 ₽ | |||
A27.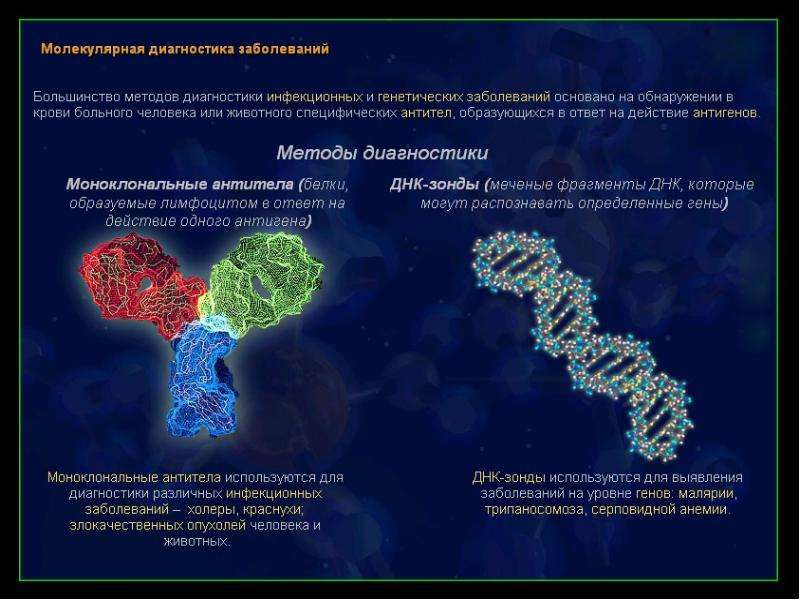 30.131 30.131 | Комплексная Мужкая ПЦР диагностика ИППП (хламидия, микоплазма(Mycoplasma hominis), микоплазма(Mycoplasma genitalium), уреаплазма (Ureaplasma species), гонорея, вирус простого герпеса 1 и 2 типа, цитомегаловирус, трихомонада, возбудитель кандидоза, гарднерелла (Gardnerella vaginalis)) — соскобы | НИИ Урологии | Соскоб | 5 | 3 000,00 ₽ | |||
| A27.30.132 | Комплексная Женская ПЦР диагностика ИППП (хламидия, микоплазма(Mycoplasma hominis), микоплазма(Mycoplasma genitalium), уреаплазма (Ureaplasma species), гонорея, вирус простого герпеса 1 и 2 типа, цитомегаловирус, трихомонада, возбудитель кандидоза, вирус папилломы человека ВКР, гарднерелла (Gardnerella vaginalis)) — соскобы | НИИ Урологии | Соскоб | 5 | 3 500,00 ₽ | |||
| A26.01.024.001 | Определение ДНК вируса простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) в везикулярной жидкости, соскобах с высыпаний методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 400,00 ₽ | ||
A26. 01.024.002 01.024.002 | Определение ДНК вируса простого герпеса 6 типа (Herpes simplex virus type 6) в везикулярной жидкости, соскобах с высыпаний методом ПЦР | НИИ Урологии | Соскоб | 5 | 470,00 ₽ | |||
| A26.08.058.001 | 28211 | Определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 610,00 ₽ | |
| A26.20.009.004 | Определение ДНК и типа вируса папилломы человека (Papilloma virus) высокого канцерогенного риска в отделяемом (соскобе) из цервикального канала методом ПЦР | НИИ Урологии | Соскоб | 5 | 790,00 ₽ | |||
| A26.20.009.010 | 28211 | Определение ДНК вирусов папилломы человека (Papilloma virus) 16 и 18 типов методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
A26. 08.066.002 08.066.002 | 28211 | Определение ДНК хламидии трахоматис (Chlamydia trachomatis) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.028.001 | 28211 | Определение ДНК микоплазмы хоминис (Mycoplasma hominis) в отделяемом слизистых оболочек женских половых органов методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.027.003 | 28211 | Определение ДНК микоплазмы гениталиум (Mycoplasma genitalium) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.20.029.003 | 28211 | Определение ДНК уреаплазм (Ureaplasma spp.) методом ПЦР, качественное исследование | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
| A26.21.023.002 | 28211 | Определение ДНК уреаплазм (Ureaplasma urealyticum, Ureaplasma parvum) методом ПЦР | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
A26. 20.030.002 20.030.002 | 28211 | Определение ДНК гарднереллы вагиналис (Gadnerella vaginalis) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.21.038.001 | 28211 | Определение ДНК гонококка (Neisseria gonorrhoeae) в секрете простаты методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.28.016.001 | 28211 | Определение ДНК трихомонас вагиналис (Trichomonas vaginalis) в моче методом ПЦР, качественное исследование | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.21.044.002 | 28211 | Определение ДНК грибов рода кандида (Candida spp.) методом ПЦР | НИИ Урологии | МРНЦ | Соскоб | 5 | 560,00 ₽ | |
| A26.21.044.003 | Определение ДНК энтеробактерий, стафилококков и стрептококков методом ПЦР | НИИ Урологии | Соскоб | 5 | 1 000,00 ₽ | |||
A26. 05.038.003 05.038.003 | 28211 | Определение ДНК Pseudomonas aeruginosa методом ПЦР | НИИ Урологии | Соскоб | 5 | 560,00 ₽ | ||
| A26.05.038.004 | 28211 | Определение ДНК уропатогенной Escherichia coli методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
| A26.05.038.005 | 28211 | Определение ДНК Klebsiella pneumoniae методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
| A26.05.038.006 | 28211 | Определение ДНК Proteus mirabilis методом ПЦР | НИИ Урологии | Биоматериал | 5 | 560,00 ₽ | ||
| A26.05.038.007 | Определение ДНК метициллин-резистентных стафилококков методом ПЦР | НИИ Урологии | Биоматериал | 5 | 1 200,00 ₽ | |||
A26. 05.038.008 05.038.008 | Определение ДНК антибиотико-резистентных микроорганизмов методом ПЦР | НИИ Урологии | Биоматериал | 5 | 1 400,00 ₽ | |||
| A27.30.134 | Анализ герминальных мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | Кровь | 60 | 39900 | |||
| A27.30.135 | Анализ соматических мутаций в генах BRCA1 и BRCA2 | НИИ Урологии | Блоки (срезы) | 60 | 39900 | |||
| A27.30.136 | Секвенирование по Сэнгеру 1 пцр продукта (без учета выделения ДНК) | НИИ Урологии | МРНЦ | Кровь | Блоки (срезы) | 14 | 3 000,00 ₽ | |
| A27.30.137 | Выделение ДНК из цельной крови | НИИ Урологии | МРНЦ | Кровь | 4 | 1 500,00 ₽ | ||
| A27.30.139 | Выделение ДНК из парафинового блока | НИИ Урологии | МРНЦ | Блоки (срезы) | 4 | 2 000,00 ₽ | ||
| 29014 | Определение мутаций в экзонах 2-4 генов KRAS и NRAS методом Сэнгера (ОМС) См комментарий (для медворка) | НИИ Урологии | МРНЦ | Блоки (срезы) | 10 |
Молекулярно-генетические исследования
directions
Молекулярно-генетические исследования играют огромную роль при изучении организма. Они позволяют выявить нарушения в генах, другими словами – мутацию. Для проведения исследований выделяется ДНК человека. Молекулярно-генетический анализ способен выявить риск возникновения заболевания по генной предрасположенности, что позволяет человеку скорректировать свой образ жизни. При планировании рождения ребёнка молекулярно-генетические исследования смогут показать вероятность наличия у будущего малыша опасных заболеваний. В нашем медицинском центре Вы сможете пройти все необходимые молекулярно-генетические исследования.
Они позволяют выявить нарушения в генах, другими словами – мутацию. Для проведения исследований выделяется ДНК человека. Молекулярно-генетический анализ способен выявить риск возникновения заболевания по генной предрасположенности, что позволяет человеку скорректировать свой образ жизни. При планировании рождения ребёнка молекулярно-генетические исследования смогут показать вероятность наличия у будущего малыша опасных заболеваний. В нашем медицинском центре Вы сможете пройти все необходимые молекулярно-генетические исследования.
Врачи-специалисты
Медицинская сестра
Медицинская сестра эндоскопического кабинетаВрач-терапевт
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Генетические исследования являются целесообразными для людей, планирующих свою жизнь. Кроме всего вышеперечисленного, они будут полезны для людей с отягощённой наследственностью, а так же лицам, которые хотят выявить у себя предрасположенность возникновения рака, болезни Альцгеймера, сахарного диабета.
Наиболее распространённые генные заболевания
Болезнь Кэнэвэн, также известная как спонгиозная младенческая дегенерация. При ней поражаются нервные клетки мозга. Развитие обусловлено дефектом гена, отвечающего за синтез фермента аспартоацилазы. Первые симптомы появляются у детей в возрасте от 3-х до 6-ти месяцев. Они выражаются в виде увеличения головы, задержки развития, проблемного кормления, потери тонуса мышц, судорог. В большинстве случаев дети умирают, не достигнув и десятилетнего возраста.
Болезнь Тея-Сакса вызывается мутацией фермента, участвующего в метаболизме ганглиозидов. Новорождённые нормально развиваются в первые месяцы своей жизни, однако в возрасте полугода возникают отклонения в физическом и психологическом развитии. Ребёнок постепенно теряет способность глотать, зрение и слух, появляются судороги, и наступает паралич. Болезнь заканчивается летальным исходом в возрасте до 4-х лет. Иногда заболевание имеет поздние проявления, когда первые симптомы появляются в 20-30 лет.
Гемофилия – редкое наследственное заболевание, связанное с нарушением коагуляции (процессом свёртывания крови), в результате чего возникают кровоизлияния во внутренние органы, мышцы и суставы. При тяжёлых формах заболевания больные подвергаются инвалидизации. Чаще всего заболевание встречается у мужчин. У больных гемофилией трудно остановить кровотечение, поэтому наибольшую опасность вызывают хирургические операции. На сегодняшний день болезнь является неизлечимой, однако врачи научились её контролировать путём введения недостающего фактора крови.
Дальтонизм – цветовая слепота. Выражается в виде неспособности различать один цвет или несколько. Болезнь может появляться как от рождения и передаваться по генам, а так же быть приобретённой.
Муковисцидоз является одним из наиболее тяжёлых наследственных заболеваний. При нём поражается желудочно-кишечный тракт и бронхо-лёгочная система. Для заболевания характерна высокая смертность в детском возрасте. К общим признакам муковисцидоза можно отнести хронические заболевания органов дыхания, отставание в физическом развитии, хронический бронхит и гайморит, полипы носа. При заболевании назначают симптоматическое лечение.
Нейрофиброматоз выражается в виде появления множественных опухолей на теле. Передаётся по наследству при наличии у родителей генов. Лечится оперативным методом удаления опухолей.
Расщепление позвоночника или незаращение дужки позвонка (Spina bifida) возникает у плода ещё в начале беременности. Часто сочетается с дефектами спинного мозга. Чаще всего рекомендуют прерывать беременность, но в некоторых случаях дефект можно исправить при помощи хирургического вмешательства.
Синдром Дауна наблюдается очень часто, однако благодаря пренатальной диагностике частота рождения таких детей постепенно снижается. Синдром Дауна обнаруживается у плода ещё на ранних сроках беременности, как на УЗИ, так и при биопсии хориона или амниоцентезе. Для синдрома Дауна характерны следующие проявления: плоское лицо, кожные складки на шее, мышечная гипотония, короткие конечности, гиперподвижность суставов, плоская переносица, врождённый порок сердца, отставание в физическом и психическом развитии.
Фенилкетонурия приводит к развитию отсталости в умственном развитии у детей. Носительство мутаций почти никак не проявляется.
Методы проведения молекулярно-генетических исследований
Анализ проводится методом полимеразной цепной реакции. Для исследования необходимо иметь ДНК-материал всего лишь одной клетки организма. Процесс протекает в одной пробирке и состоит из повторных копирований. При помощи ПЦР непосредственно исследуются места предполагаемых мутаций. По результатам анализа Вы можете получить консультацию у врача по поводу того, какие продукты не стоит принимать в пищу или каких ситуаций следует избегать, чтобы не дать толчок возникновению заболевания.
Материалом для проведения тестирования служит венозная кровь, которая была сдана натощак. Клетки человека содержат двойной набор всех генов по каждой точке. В связи с этим можно получить три варианта результатов: отсутствие мутации, мутация в одном парном гене, либо в обоих.
Молекулярно-генетические исследования у беременных
При планировании ребёнка для рождения здорового малыша следует исключить все опасности для его здоровья, а так же передачу генетических заболеваний. Первоначально проводится обследование супругов и создание генетической карты. Помимо этого за основу берутся ещё и данные о наследственной предрасположенности.
1328,1322,815,1269,1318,832
Смерткин Алексей Сергеевич 11.02.2021 19:40medi-center.ru
Хочу выразить благодарность врачу Саранчину Александру за качественный осмотр и рекомендации в лечении. Успехов Вам, Александр и профессионально развития.
Яника Сок 01.02.2021 22:09medi-center.ru
Мне очень понравилось на приеме у доктора. Провела осмотр и УЗИ, это единственный из всех врачей которая увидела на УЗИ спайки!!!Спайки действительно есть!(данные лапароскопии) Во время ультразвукового обследования доктор все объясняла, рассказывала и даже наглядно показывала. Изначально я к ней пришла на ГСГ процедуру доктор провела замечательно, ничего не больно, успокаивала меня (я еще та трусиха)…на основании ГСГ дала свои рекомендации Правильные. Спасибо Вам огромное! Доктор очень вежливая, тактичная и замечательная. Профессионализм Регины Гумеровны на высшем уровне, качеством её работы я осталась полностью довольна. Я и буду советовать доктора к посещению! Прошу премировать доктора!
Здравствуйте. Благодарю за слаженную работу персонал Медицентра. Обратилась с признаками ОРЗ. 1. На ресепнш достаточно подробно описали правила прикрепления и уловия приема при остутствии прикрепления по полису ОМС. 2. Прекрасная работа процедурного кабинета, а также м/брата, который осуществляет забор мазков на дому. 3. Мои терапевты: Половодова Е.А. и Артюх Л.Ю.Спасибо за все! 4. Отличная работа сall-центра и личный кабинет просто СУПЕР! Очень хотелось бы, чтобы отзыв нашел всех, кто упомянут. Спасибо!
Здравствуйте! Выражаю благодарность всем сотрудникам медцентра и лично Поддубной Анастасии Михайловне за работу в такое непростое время, хорошие и результативные рекомендации по лечению. Переболел COVID, благодаря вам иду на поправку!
Хочу выразить большую благодарность клинике на аллее Поликарпова 6к2, всегда вежливые, доброжелательные девушки на ресепшн. Помогли удобно состыковать время приёма врачей. А также отдельно поблагодарить замечательнейшего доктора Гиндрюк Василия Васильевича за профессионализм, заботу и внимание! Наблюдаться у него одно удовольствие!!!
Главной задачей для медицинских учреждений по прежнему остается завоевать доверие людей (пациентов), оказывая медицинскую помощь (услугу) посредством высокой квалифицированности медицинских работников. Я мама троих детей и внучка шестимесячная у нас. Обслуживание поликлиниками по ОМС с каждым годом становится все хуже и хуже (в частности наших окрестностей Мурино, Девяткино, Кузьмолово,Токсово..). В платных медицинских центрах цены конечно разнообразные, но жителям нового Мурино, которые в пожизненной ипотеке платить лишние деньги при имеющимся полисе ОМС как то не серьезно! Обратились впервые за помощью в Медицентр на ул.Охтинская аллея д18 на коммерческой основе, с травмой носа у младшей дочери (4года). Хочу отметить, что лишних денег не взяли, а именно – квалифицированный врач травматолог определил ушиб, а не возможный перелом, тем самым избавил нас от облучения ребенка рентгеном. Позже очень обрадовалась тому, что именно этот центр принимает граждан по ОМС. Написала заявление и принесла необходимый пакет документов на ресепшен. Сотрудники центра с добродушием и пониманием принимали мои документы то на одного ребенка, потом на второго….да еще и не совсем в определенные часы…чего то не хватило….мы все работники государства. Спасибо Ташкиной Марине Сергеевне, Фанченковой Екатерине Викторовне и Петроченко Ольге Александровне – и по сей день встречают с добродушием и всегда стараются подобрать наиболее удобное время для посещения врача, например, для двоих детей сразу. Сдача анализов крови происходит в «волшебно» удобных креслах с массой необходимых вопросов (например: не бывает ли вам плохо от вида крови и т.п.) Благодарна за аккуратность и профессионализм в своем деле Сат Намзыраю Юрьевичу, Леванкову Максиму Владимировичу, Дерешовскому Александру и девушка была (имени не узнала). Проходя дорогу к узким специалистам через терапевта Султанга Валерию Дмитриевну, я не на секунду не усомнилась в ее компетентности , даже не смотря на ее молодой возраст. Индивидуальный подход, умеренная строгость и настаивании на непременном принятии определенных мер в отношении проблемы с моим здоровьем — позволили настроиться на позитив. Возникли сложности с посещением эндокринолога (прием был по другому адресу центра) и гинеколога (плотная запись), а ситуация сложилась экстренная, можно сказать до слез! И вот я в кабинете у заведующего отделением Степановой Натальи Юрьевны! Огромная благодарность и низкий поклон за полезное использование времени с полноценным приемом врача кардиолога в ее лице, необходимых рекомендаций со стороны эндокринологии, да и за простое человеческое общение и понимание!!! Благодаря Наталье Юрьевне я более двух месяцев живу другой жизнью с давлением 110/80, а между прочим более 15 лет страдала от высокого давления 190/140, а разнообразные препараты, которые мне назначали врачи, снижали АД лишь до 140/100 и то на время. Спасибо за прием гинеколога Эскендеровой Гюлюшак Абдулаевне! Никогда бы не подумала в чем проблема, и что ранее назначенный препарат был просто бесполезен. Отдельно хочется поблагодарить Сидоркина Владимира Александровича (ЛОР) – такого тщательного осмотра я ни на себе ни на детях не наблюдала. Пришла с осипшим голосом, который затруднял мою профессиональную деятельность почти два месяца! Педиатр Абакумова Ольга Николаевна оказалась очень чутким, внимательным, тактичным доктором – нужные советы, не были назначены дорогущие и (наверно) лишние лекарства. Мои девочки перенесли заболевание ветряной оспой, не испытывая сильного недомогания и зуда (одной из них 12 лет) и именно Ольга Николаевна приходила к нам по вызову на дом дважды, один врач – доверие детей! Несомненно написала подробно и много, не подумайте что раньше мне попадались одни шарлатаны или я хорохорюсь. В одном месте и такое добродушное отношение практически всего персонала! Очень часто и резко у нас может заболеть и одно…и другое и сразу, а тут еще и дети!!! Моей семье, и я не сомневаюсь, что многим – очень повезло с таким МЕДИЦЕНТРОМ рядом! Такое добросовестное обслуживание надо поискать! ПРИМИТЕ слова Благодарности, отдельное спасибо, низкий поклон и от всей души от моей многочисленной семьи! Вы все несете определенную миссию, здоровье людям и отлично справляетесь с основной задачей — МЫ ВАМ ДОВЕРЯЕМ !!!
что это, методы, особенности, область применения
Расшифровка генома человека стала настоящим прорывом ХХ века: мир узнал о том, как заложенный «код» влияет на каждого из нас. И пусть ученые до сих пор ведут споры вокруг этой темы, мы уже можем оценить результаты многолетних исследований: любому человеку стала доступна молекулярно-генетическая диагностика.
Как узнать свой личный «код» и для чего это нужно? Об этом мы расскажем в данной статье.
Что такое молекулярно-генетическая диагностика
Итак, молекулярно-генетическая диагностика — сравнительно новый метод обследования организма, позволяющий точно и быстро выявить вирусы и инфекции, мутации генов, вызывающих патологию, оценить риски наследственных и иных заболеваний. И это далеко не полный спектр возможностей исследования ДНК.
Важнейшим достоинством молекулярно-генетической диагностики является минимальная степень медицинского вмешательства, поскольку исследование проводят in vitro. Метод успешно применяют даже для диагностики заболеваний у эмбрионов, а также у ослабленных и тяжелобольных пациентов. Самый распространенный материал для исследования — кровь из вены, однако возможно выделение ДНК/РНК из других жидкостей и тканей: слюны, соскоба слизистой рта, выделений из половых органов, околоплодной жидкости, волос, ногтей и т.д.
Молекулярная диагностика — значительный шаг к персонализированной медицине, она позволяет учитывать все особенности конкретного пациента при обследовании и терапии.
Области медицинского применения методов молекулярной диагностики
Итак, исследование ДНК/РНК используется во многих разделах медицины. Давайте рассмотрим задачи и области, в которых активно применяют молекулярную диагностику:
- Выявление существующих патологий. Например, к молекулярной диагностике прибегают в тех случаях, когда инфекционное или вирусное заболевание не может быть определено обычными методами. Она позволяет обнаружить болезнь даже на ранней стадии, когда внешних проявлений нет.
- Исследование аллергических реакций. Молекулярная диагностика успешно применяется для определения аллергии: в отличие от традиционных методов, она более точна и при этом безопасна для пациента, так как отсутствует непосредственный контакт с аллергеном.
- Индивидуальная оценка рисков развития наследственных заболеваний. Молекулярная диагностика помогает выявить у взрослых и детей опасность в будущем подвергнуться различным патологиям. Нужно отметить, что есть болезни, которые вызваны исключительно мутацией гена (моногенные) и те, которые обусловлены в том числе генетическими особенностями (мультифакторные). Информация о первых позволяет, к примеру, оценить риски передачи наследственных заболеваний от родителей к ребенку. Знание о предрасположенности к мультифакторной патологии необходимо еще и для профилактики болезней с помощью изменения образа жизни.
- Перинатальная медицина. Как уже было сказано, молекулярная диагностика способна дать информацию о состоянии здоровья и генетических предрасположенностях человека. Это относится и к эмбрионам: анализ ДНК еще не родившегося ребенка позволяет распознать синдромы Дауна, Эдвардса, Патау, Тернера, Клайнфельтера. Также молекулярная диагностика применяется в области вспомогательных репродуктивных технологий: она позволяет установить генетические причины бесплодия и невынашивания беременности.
- Фармакогенетика. Молекулярная диагностика объясняет, почему на некоторых действуют одни препараты, а на других — иные: все дело в генетических особенностях пациентов. Возможность определения эффективности веществ имеет особое значение при лечении тяжелых заболеваний, например, онкологических.
- Спортивная медицина. Настоящие чудеса исследования ДНК и РНК творят и в области оценки спортивных перспектив. Например, родители малышей могут узнать о том, какой вид занятий принесет ребенку наибольшую пользу для здоровья или позволит достичь спортивных результатов.
На заметку
В США побочные воздействия лекарств входят в пятерку самых распространенных причин госпитализации и смерти, а устранение ПВЛ обходится дороже, чем само лечение. Медики возлагают большие надежды на молекулярную диагностику: индивидуальный подбор препаратов с учетом генетических особенностей каждого (персонализированная терапия) должен решить эту проблему.
Когда проводится генетическое исследование
Итак, обращение к генетическим исследованиям актуально в тех случаях, когда пациент стремится получить сведения о состоянии своего организма. Обычно это необходимо в следующих ситуациях:
- для постановки точного диагноза. Например, очень распространенным является неверное определение аллергена либо несвоевременная диагностика вирусного заболевания. Между тем от этого зависит успешность лечения;
- для профилактики возможных патологий. Если пациенту известно о повышенном риске сердечно-сосудистых заболеваний или рака, он может предпринимать соответствующие меры, например, отказаться от вредных привычек;
- для повышения эффективности лечения. К примеру, онкозаболевания имеют множество вариантов терапии. Выбор тактики лечения «методом проб и ошибок» приводит к потере драгоценного времени и здоровья, а иногда — и к летальному исходу;
Отдельной группой стоит выделить исследования ДНК, которые проводят в связи с планированием или рождением ребенка. Чаще всего родители обращаются в лабораторию, чтобы:
- изучить свою генетическую совместимость, оценить риски наследственных заболеваний потомства;
- исследовать состояние плода, выявить синдромы и опасные патологии;
- диагностировать заболевания (и оценить риски) и аллергические реакции у малыша;
- определить, какие спортивные занятия, какое питание и образ жизни будут наиболее полезны для ребенка, а чего стоит избегать;
- установить отцовство или материнство.
Этапы исследования
Независимо от выбранного метода молекулярно-генетического исследования, оно будет включать в себя следующие этапы:
- взятие биоматериала. Как уже было сказано, чаще для исследования используют кровь пациента. Полученный материал маркируют и транспортируют в лабораторию;
- выделение ДНК/РНК;
- проведение исследований в соответствии с выбранным методом;
- изучение и интерпретацию результатов;
- выдачу заключения.
Методы молекулярно-генетической диагностики
Методы молекулярной цитогенетикиЦитогенетический анализ позволяет выявить наследственные заболевания, психические отклонения, врожденные пороки развития. Суть метода — в изучении хромосом с помощью специальных микроматриц, нанесенных на ДНК-чипы. Для этого из образца крови выделяют лимфоциты, которые затем помещают на 48–72 часа в питательную среду и по истечении этого времени исследуют. Назначают такой анализ нечасто, в основном для изучения причин бесплодия и невынашивания беременности, для уточнения диагноза у детей при подозрении на врожденные заболевания. Анализ очень точен, но достаточно трудоемок и длителен (результат можно получить лишь через 20–30 дней после сдачи).
Достоинство и в то же время недостаток метода — в его специфичности: цитогенетика может выявить лишь небольшое количество патологий (например, аутизм), однако делает это практически без погрешностей.
Молекулярная диагностика методом ПЦРПолимеразная цепная реакция — метод, изобретенный в 1983 году, по сей день самый популярный и фундаментальный в молекулярной диагностике. Характеризуется высочайшей точностью и чувствительностью, а также скоростью проведения исследования. Молекулярная диагностика ДНК/РНК методом ПЦР позволяет выявить такие патологии, как ВИЧ, вирусные гепатиты, инфекции, передающиеся половым путем, туберкулез, боррелиоз, энцефалит и многие другие.
Для анализа выбирают участок ДНК и многократно дублируют его в лаборатории с помощью специальных веществ. Для диагностики подходит большой перечень биоматериалов: кровь, слюна, моча, выделения из половых органов, плевральная и спинномозговая жидкость, ткани плаценты и т.д.
Метод флуоресцентной гибридизации (FISH)В данном молекулярном методе объектом исследования становятся уникальные нуклеотидные соединения отдельно взятой хромосомы или ее участок. Для этого используются меченые флуоресцентными маркерами короткие ДНК-последовательности (зонды), которые позволяют выявить фрагменты с атипичными генами. Биоматериал для анализа может быть любой: кровь, костный мозг, плацента, ткани эмбриона, биопсия и т.д. Важно, чтобы образец был доставлен в лабораторию сразу после его изъятия.
Метод особенно активно используют в онкологии (например, для наблюдения за остаточными злокачественными клетками после химиотерапии), а также в пренатальной диагностике (для определения риска развития у плода врожденных пороков), гематологии. FISH-метод очень чувствителен и точен для выявления поврежденных фрагментов ДНК (погрешность около 0,5%), при этом достаточно быстр: результат придется ждать не более 72-х часов. Однако у него есть и недостатки: FISH еще более специфичен, чем микроматричный цитогенетический анализ, и может служить лишь для подтверждения или опровержения предполагаемого диагноза.
МикрочипированиеЭтот метод похож на предыдущий — здесь так же используются меченные флуоресцентом последовательности ДНК. Однако эти зонды сначала выделяют из проб, полученных от пациента, и затем сравнивают с образцами, нанесенными на микрочипы. ДНК-микрочип представляет собой основание (стеклянное, пластиковое, гелевое), на которое может быть нанесено до нескольких тысяч микротестов длиной от 25 до 1000 нуклеотидов. Полученные после очистки биоматериала пробы (зонды) совмещают с микротестами на чипе и наблюдают за реакцией маркёров. Результаты исследования готовы через 4–6 дней после забора материала.
Для анализа используется любой биоматериал, из которого можно получить образец ДНК/РНК. Используют такой метод в онкологии и кардиологии (в том числе для изучения генетической предрасположенности), он точен и чувствителен, однако в России его применяют редко — в этом его главный минус.
Итак, молекулярная диагностика — неинвазивный и точный метод обследования организма с широким спектром применения в разных областях медицины. Если на Западе исследования ДНК/РНК уже распространены повсеместно, то в России подобную услугу предлагают далеко не все клиники.
Молекулярно-генетические методы в практике современных медико-биологических исследований. Часть I: Теоретические основы ПЦР-диагностики | Волков
1. Zhu H, Zhang H, Xu Y, Laššáková S, Korabečná M, Neužil P. PCR past, present and future. BioTechniques. 2020;69(4):317- 325. https://dx.doi.org/10.2144/btn-2020-0057
2. Kralik P, Ricchi M. A Basic Guide to Real Time PCR in Microbial Diagnostics: Definitions, Parameters, and Everything. Front Microbiol. 2017;8:108. https://dx.doi. org/0.3389/fmicb.2017.00108
3. Волков А.Н., Хабиева С.М., Смирнова Е.Ю., Ларионов А.Ю. Генодиагностика мутаций UGT1A1 в практике современной медицины. Клиническая лабораторная диагностика. 2018;63(3):186-192 https://dx.doi.org/10.18821/0869-2084-2018-63-3-186-192
4. Tong Y, Shen S, Jiang H, Chen Z. Application of digital PCR in detecting human diseases associated gene mutation. Cell Physiol Biochem. 2017;43(4):1718-1730. https://dx.doi. org/10.1159/000484035
5. Волков А.Н., Лошакова Л.Ю. Значение полиморфизма генов человека, участвующих в амелогенезе и формировании микросреды ротовой полости, для развития кариеса зубов. Медицинская генетика. 2011;10(2):12-16
6. Дружинин В.Г., Волков А.Н., Глушков А.Н., Головина Т.А., Минина В.И., Ингель Ф.И., Ларионов А.В., Мейер А.В., Лунина А.А., Толочко Т.А., Ахальцева Л.В., Кривцова Е.К., Юрцева Н.А., Юрченко В.В. Роль полиморфизма генов репарации в оценке чувствительности генома человека к воздействию сверхнормативных концентраций радона. Гигиена и санитария. 2011;5:26-30
7. Cavanaugh SE, Bathrick AS Direct PCR amplification of forensic touch and other challenging DNA samples: A review. Forensic Sci Int Genet. 2018;32:40-49. https://dx.doi. org/10.1016/j.fsigen.2017.10.005
8. Petersen B, Fredrich B, Hoeppner MP, Ellinghaus D, Franke A. Opportunities and challenges of whole-genome and -exome sequencing. BMC Genet. 2017;18(1). https://dx.doi. org/10.1186/s12863-017-0479-5
9. Waller JV, Kaur P, Tucker A, Lin KK, Diaz MJ, Henry TS, Hope M. Diagnostic tools for Coronavirus disease (COVID-19): Comparing CT and RT-PCR viral nucleic acid testing. American Journal of Roentgenology. 2020;215. https:// dx.doi.org/10.2214/AJR.20.23418
10. Long C, Xu H, Shen Q, Zhang X, Fan B, Wang C, Zeng B, Li Z, Li X, Li H. Diagnosis of the Coronavirus disease (COVID-19): rRT-PCR or CT? European Journal of Radiology. 2020;126:108961. https://dx.doi.org/10.1016/j. ejrad.2020.108961
11. Udugama B, Kadhiresan P, Kozlowski HN, Malekjahani A, Osborne M, Li VYC, Chen H, Mubareka S, Gubbay JB, Chan WCW. Diagnosing COVID-19: The disease and tools for detection. ACS Nano. 2020;14(4):3822-3835. https://dx.doi. org/10.1021/acsnano.0c02624
12. Ghatak S, Muthukumaran RB, Nachimuthu SK. A simple method of genomic DNA extraction from human samples for PCR-RFLP analysis. J Biomol Tech. 2013;24:224-231. https:// dx.doi.org/10.7171/jbt.13-2404-001
13. Hue NT, Chan NDH, Phong PT, Linh NTT, Giang NDT. Extraction of human genomic DNA from dried blood spots and hair roots. Int J Biosci Biochem Bioinforma. 2012;2(1):21-26. 14. Khare P, Raj V, Chandra S, Agarwal S. Quantitative and qualitative assessment of DNA extracted from saliva for its use in forensic identification. J Forensic Dent Sci. 2014;6(2):81- 85.
14. Волков А.Н. Фиксированные лимфоциты человека как источник ДНК для ПЦР-диагностики. Клиническая лабораторная диагностика. 2016;61(12):819-821 https:// dx.doi.org/10.18821/0869-2084-2016-61-12-819–821
15. Green MR, Sambrook J. Isolation and quantification of DNA. Cold Spring Harb Protoc; 2018. https://dx.doi.org/10.1101/ pdb.top093336
16. Katevatis C, Fan A, Klapperich CM. Low concentration DNA extraction and recovery using a silica solid phase. PLoS ONE. 2017;12(5):e0176848. https://dx.doi.org/10.1371/journal. pone.0176848
17. Alberts B, Johnson A, Lewis J, Morgan D, Raff M, Roberts K, Walter P. Molecular biology of the cell. 6th ed. New YorkLondon: Garland Science Publishing; 2015.
18. Pierce BA. Genetics: A conceptual approach. New York: WH Freeman and Company; 2012.
19. Браун Т.А. Геномы. М.–Ижевск: Институт компьютерных исследований; 2011.
20. Кребс Дж., Голдштейн Э, Килпатрик С. Гены по Льюину. М.: Лаборатория знаний; 2017
21. Li D, Zhang J, Li J. Primer design for quantitative realtime PCR for the emerging Coronavirus SARS-CoV-2. Theranostics. 2020;10(16):7150-7162. https://dx.doi. org/10.7150/thno.47649.
22. Potapov V, Ong JL. Examining sources of error in PCR by single-molecule sequencing. PLoS One. 2017;12(1):e0169774. https://dx.doi.org/10.1371/journal.pone.0169774
23. Chen S, Zheng X, Cao H, Jiang L, Liu F, Sun X. A simple and efficient method for extraction of Taq DNA polymerase. Electronic Journal of Biotechnology. 2015;18:355-358. https:// dx.doi.org/10.1016/j.ejbt.2015.08.001
24. Green MR, Sambrook J. Analysis of DNA by agarose gel electrophoresis. Cold Spring Harb Protoc; 2019(1). https:// dx.doi.org/10.1101/pdb.top100388
Молекулярно-генетические методы для исследования микробиома кишечника | Кардымон
1. Ding T., Schloss P.D. Dynamics and associations of microbial community types across the human body. Nature 2014; 509(7500):357-60.
2. David L.A., Maurice C.F., Carmody R.N., Gootenberg D.B., Button J.E., Wolfe B.E., Ling A.V., Devlin A.S., Varma Y., Fischbach M.A., Biddinger S.B., Dutton R.J., Turnbaugh P.J. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014; 505(7484):559-63. doi: 10.1038/nature12820.
3. Quince C., Ijaz U.Z., Loman N., Eren A.M., Saulnier D., Russell J., Haig S.J., Calus S.T., Quick J., Barclay A., Bertz M., Blaut M., Hansen R., McGrogan P., Russell R.K., Edwards C.A., Gerasimidis K. Extensive modulation of the fecal metagenome in children with Crohn’s disease during exclusive enteral nutrition. Am J Gastroenterol 2015; 110(12):1718-29.
4. Song H., Yoo Y., Hwang J., Na Y.C., Kim H.S. Faecalibacterium prausnitzii subspecies-level dysbiosis in the human gut microbiome underlying atopic dermatitis. J Allergy Clin Immunol 2016; 137(3):852-60.
5. Labbé A., Ganopolsky J.G., Martoni C.J., Prakash S., Jones M.L. Bacterial bile metabolising gene abundance in Crohn’s, ulcerative colitis and type 2 diabetes metagenomes. PLoS One 2014; 9(12): e115175.
6. Sankar S.A., Lagier J.C., Pontarotti P., Raoult D., Fournier P.E. Syst Appl Microbiol 2015; 38(4):276-86.
7. Takami H., Taniguchi T., Moriya Y., Kuwahara T., Kanehisa M., Goto S. Evaluation method for the potential functionome harbored in the genome and metagenome. BMC Genomics 2012; 13:699.
8. Louis S., Tappu R.M., Damms-Machado A., Huson D.H., Bischoff S.C. Characterization of the gut microbial community of obese patients following a weight-loss intervention using whole metagenome shotgun sequencing. PLoS One 2016; 11(2): e0149564.
9. Wang W.L., Xu S.Y., Ren Z.G., Tao L., Jiang J.W., Zheng S.S. Application of metagenomics in the human gut microbiome. World J Gastroenterol 2015; 21(3):803-14.
10. Dantas G., Sommer M.O., Degnan P.H., Goodman A.L. Experimental approaches for defining functional roles of microbes in the human gut. Annu Rev Microbiol 2013; 67:459-75.
11. Lagier J.C., Armougom F., Million M., Hugon P., Pagnier I., Robert C., Bittar F., Fournous G.,
Молекулярно-генетический анализ SARS-CoV-2 бессимтомных пациентов Ростовской области | Перевезенцев
Аннотация
Цель: провести молекулярно-генетическую диагностику SARS-CoV-2 у бессимптомных индивидуумов Ростовской области.
Материал и методы: было обследовано 22037 индивидуумов, которые на момент сдачи материала не имели клинически выраженных симптомов респираторного заболевания COVID-19. Молекулрно-генетическая диагностика SARS-CoV-2 проводилась методами RT-PCR и изотерической амплификации с ручным и автоматическим выделением вирусной РНК.
Результаты: положительный результат был выявлен у 297 индивидуумов, подтверждён результат региональным референсным центром у 149 человек (0.68 %). Среди общей выборки было обследовано 3090 «контактных» пациентов (положительный результат — в 78 случаях (2.52 %)), 8109 медицинских работников (положительный результат – в 23 случаях (0.28 %)) и 3098 «контактных» медработников (положительный результат — в 24 случаях (0.77 %)).
Выводы: применение молекулярно-генетического тестирования SARS-CoV-2 для выявления асимптомных случаев имеет серьёзные ограничения, поэтому для данной диагностической задачи необходима разработка альтернативных методов лабораторной диагностики, основанной на особенностях этиопатогенеза новой коронавирусной инфекции.
Введение
Коронавирусы (СoV) (Coronoviridae) — это семейство вирусов, содержащих в качестве генетического материала одноцепочечную (+) РНК, со специфическими гликопротеидными шипами (спайками) вокруг вирусного капсида, которые при электронном микрокопировании похожи на солнечную корону [1]. Семейство коронавирусов делится на несколько подсемейств, включающих четыре рода (от альфа- до дельта-), которые потенциально патогенны для различных видов млекопитающих, включая человека [2]. За последние 20 лет кроме ранее известных четырёх видов коронавирусов у человека, входящих в структуру сезонных ОРВИ, были описаны новые более патогенные виды данного семейства: SARS-CoV (подрод Sarbecovirus), описанный в 2002 г., который в 2002-2003 гг. стал причиной вспышки атипичной пневмонии (тяжелый острый респираторный синдром — ТОРС, SARS) в Китае; MERS-CoV (подрод Merbecovirus), который 2012 г. вызвал вспышку ближневосточного респираторного синдрома в Саудовской Аравии и в 2015 г. — в Южной Корее (MERS), и новый коронавирус SARSCoV-2 (как и вирус атипичной пневмонии, относящийся к подроду Sarbecovirus), который вызвал вспышку болезни, названной COVID19, в китайской провинции Ухань, перешедшей в настоящее время в глобальную пандемию1. Достаточно высокая степень передачи нового коронавируса (среднее медианное значение индекса репродукции — 2.2, разброс — 3.3-5.47), его способность, в отличие от вируса SARS-CoV, передаваться от человек к человеку и потенциальная тяжесть последствий заболевания СOVID-19, вызываемого данным вирусом, превратили его в главнейшую медицинскую проблему 2020 г. [1][3].
Изучение факторов патогенности коронавируса SARSCoV-2 показало, что в клетки человека он проникает через рецепторы к ангиотензин-превращающему ферменту 2-го типа (ACE2), который достаточно широко представлен в различных тканях: он экспрессируется в легких на уровне альвеол, кишечнике, гонадах, почках и т.д. [4]. Поэтому потенциально при новой коронавирусной инфекции могут поражаться не только дыхательные пути, но и другие ткани и органы [1][4][5]. С диагностической точки зрения, вирус может обнаруживаться не только в биоматериале из дыхательных путей (назофарингеальные соскобы, БАЛ, мокрота), но и в других биологических жидкостях (фекалии, моча, кровь) [1][4][6][7]. Теоретически он может обнаруживаться в моче и в семенной жидкости у мужчин [1].
В настоящее время специфическими методами диагностики новой коронавирусной инфекции SARS-CoV-2 являются молекулярно-генетические методы, в частности, в качестве референсного используется метод ПЦР в реальном времени с обратной транскрипцией вирусной РНК [8]. Базисным тестовым набором для ПЦР диагностики новой коронавирусной инфекции является рекомендованная ВОЗ тест-система, в котором используются праймеры к генам SARS-CoV РНК зависимой РНК полимеразы (RdRP) и капсидного белка (E), то есть данная тест-систем основана на детекции специфической РНК последовательности двух компонентов вируса [9]. Это связано с тем, что диагностические ПЦР-тест-системы, основанные на выявлении специфической последовательности только одного компонента SARS-CoV-2 (E-гена), хоть и являются более чувствительными, чем основанные на выявлении RdRp, но при использовании такого набора может быть затруднена интерпретация результата из-за высокой зависимости качества ПЦР от сторонних факторов2. Также для ПЦР диагностики в реальном времени новой коронавирусной инфекции могут применяться тест-системы, которые содержат праймеры к двум локусам вирусного нуклеокапсида (N1 и N2) и гену человеческой РНКазы P [8].
Из-за достаточно стремительного распространения нового коронавируса по миру особое значение приобретает максимально широкий охват данным молекулярно-генетическим тестированием населения различных стран для эффективного проведения противоэпидемических мероприятий и быстрое проведение тестирования [8]. Метод ПЦР в реальном времени является достаточно долгим и ограничен применением только в стационарной, хорошо оборудованной лаборатории. Поэтому для ускорения молекулярно-генетической диагностики SARS-CoV-2 был предложен другой метод, основанный на петлевой изотермическиой амплификации с обратной транскрипцией вирусной РНК (метод LAMP) [10]. В нем для детекции вирусной РНК используются 6 праймеров к генам orf1ab, S и N. Преимуществом данного метода является высокая скорость получения результата (до 30 мин.) и достаточно высокая чувствительность (80 копий/мл). Более высокая чувствительность метода LAMP может быть критически важна для выявления бессимптомных носителей SARS-CoV-2, а также пациентов в инкубационном периоде3. В настоящее время показано, что бессимптомные носители новой коронавируснойинфекции являются важнейшими участниками эпидемического процесса [11]. Некоторые исследования показывают, что вирусная нагрузка и вирусовыделение у полностью бессимптомных носителей новой коронавирусной инфекции сходно с больными COVID19, у которых есть симптомы заболевания [12]. Поэтому крайне важно оперативно выявлять таких индивидуумов методами молекулярной генетики [11][13].
Цель исследования — провести оценку выявляемости короновирусной инфекции SARS-CoV-2 у бессимптомных индивидуумов Ростовской области молекулярно-генетическими методами ПЦР в реальном времени и изотермической амплификации.
Материалы и методы
В ПЦР-отделе лаборатории клинической патоморфологии и молекулярно-биологических исследований ГАУ РО Областной консультативно-диагностический центр было протестировано на SARS-CoV-2 22037 индивидуумов, которые на момент сдачи материала не имели клинически выраженных симптомов респираторного заболевания COVID-19. Среди общей выборки было обследовано 3090 человек, контактировавших с больными COVID-19 (группа «контактных»), 8109 медицинских работников и 3098 «контактных» медработников. В качестве биоматериала использовались назальный и фарингеальный соскобы, зонды с которыми помещались в пробирку типа Eppendorf с транспортной средой для увеличения вирусной нагрузки. Молекулярно-генетическое качественное исследование проводилось методом ПЦР в реальном времени с обратной транскрипцией в одной пробирке с использованием тест-систем «РеалБест РНК SARS-CoV-2» (ООО «Вектор бест», Новосибирск) (заявленная чувствительность — 1000 копий/мл) с использованием автоматического выделения вирусной ДНК на платформе KingFisher Flex (Thermo Fisher Scientific) набором «РеалБест УниМаг», тест-системы для выявления РНК коронавирусов SARS-CoV-2 и подобных SARS-CoV (ООО «ДНК-технология», Москва) c ручным выделением вирусной РНК (заявленная аналитическая чувствительность — 500 копий/мл, используются праймеры к специфической последовательности генов E и N РНК SARSCoV-2), а также методом изотермической амплификации с использованием тест-системы Изотерм SARS-CoV-2 РНК Скрин (ООО «Дженериум», резидент Сколково, Владимирская обл.) (заявленная аналитическая чувствительность — 1000 копий/мл). Критерии положительного результата анализа для каждой из тест-систем представлены в табл. 1. При анализе использовался один положительный и один отрицательный контрольный образец. 95 % образцов было проанализировано двумя указанными выше тест-системами, основанными на RT-PCR. Положительные образцы отправлялись для подтверждения результата в референсную лабораторию регионального ФГБУЗ. Полученные результаты анализировались в программе Statictica 6.0.
Таблица / Table 1
Критерии положительного результата молекулярно-генетических тест-систем, использованных для специфической лабораторной диагностики инфекции SARS-CoV-2
Criteria for positive results of molecular genetic test systems, used for specific laboratory diagnostics of infection SARS-CoV-2
Результаты
В табл. 2 представлены обобщенные результаты молекулярно-генетического тестирования бессимптомных индивидуумов на новую коронавирусную инфекцию с выделением ряда подгрупп тестируемых.
В табл. 3 представлен сравнительный анализ положительных и подтверждённых референсным ФБУЗ результатов молекулярно-генетического анализа на COVID-19, выполненных на платформе двух различных тест-систем, основанных на методе ПЦР в реальном времени с обратной транскрипцией вирусной РНК.
Таблица / Table 2
Сводная таблица результатов молекулярно-генетического тестирования бессимптомных пациентов на инфекцию SARS-CoV-2
Summary table of molecular genetic testing asymptomatic patientsfor SARS-C0V-2 infection
Группа пациентов (% от общего числа) | Общее кол-во | Кол-во положительных результатов | Кол-во потверж- дённых референсным ФГБУЗ | Доля положити- тельного результатов (%) | Доля ложноположительного результатов (%) |
Всего (100 %) | 22037 | 297 | 149 | 0,68 | 49,8 |
«Контактные» (14 %) | 3090 | 172 | 78 | 2,52 | 54,7 |
Медицинские работники (36,8 %) | 8109 | 38 | 23 | 0,28 | 39,4 |
«Контактные» медицинские работники (14 %) | 3098 | 38 | 24 | 0,77 | 36,8 |
Таблица / Table 3
Сравнение положительных и подтвержденных рефересным ФБУЗ результатов молекулярно-генетического тестирования на SARS-C.V-2, выполненных на платформе двух тест-систем методом RT-PCR Comparison ofpositive and verified by reference centre molecular genetics results of SARS-CoV-2, made on the platform of two test systems by RT-PCR method
Тест-система | Количество положительных результатов | Количество подтверждённых ФБУЗ результатов | % подтверждённых результатов от общего кол-ва тестов | % ложноположительных результатов |
SARS-CoV-2 / SARS-CoV («ДНК-технология») (ручное выделение) | 126 | 68 (до 18.05) | 0,31 | 46,0 |
«РеалБест РНК SARS-CoV-2» (автоматическое выделение) | 171 | 81 (до 18.05) | 0,37 | 52,6 |
Обсуждение
Согласно результатам данного исследования, в общей когорте бессимптомных индивидуумов количество выявленных случаев инфекции SARS-CoV-2 составляет всего 0.68 %. Среди общей популяции на порядок выше величина инфицирования среди лиц, которые находились в контакте с заболевшими COVID-19 (2,52 %). Среди медицинских работников уровень инфицируемости составляет 0,28 %, что ниже средних значений, но среди медиков, которые контактируют с больными и инфицированными новой коронавирусной инфекцией, уровень выявленных случаев SARSCoV-2 несколько выше (0,77 %), чем среднее значение.
Таким образом, в выборке лиц, не имеющих симптомов новой коронавирусной инфекции, в том числе и из групп риска, наблюдается достаточно низкое значение положительных результатов молекулярно-генетической диагностики на SARS-CoV-2. Причин этому может быть несколько. Первой из них является действительное отсутствие инфицирования у таких лиц. Видно, что в группе «контактных» индивидуумов выявляемость вируса на порядок выше,чем общей группе, что подтверждает нахождение такихлюдей в группе риска. Но даже в этой подгруппе процент положительных результатов не такой высокий, как можнобыло прогнозировать. Известно, что лабораторного коронавирусной инфекции должны применяться только длярешения определённых диагностических задач [9]. Такжеважным является специфичность и чувствительность тест-системы. Если принять за репликации SARS-CoV-2 в зависимости от стадии заболевания и тяжести его протекания ПЦР-тесты с низкой чувствительностью подойдут для тестирования симптоматических пациентов, но у асимптомных индивидуумов могут дать ложноотрицательный результат. Как показано выше, нижняя граница чувствительности использованы диагностических тест-систем составляет 500 копий/мл, что может быть недостаточным для выявления бессимптомных носителей, у которых может быть уровень репликации вируса [9][10]. Ряд авторов указывает на то, что для эффективного скрининга носителей SARS-CoV-2 или для выявления лиц в инкубационном периоде существующие молекулярно-генетические тест-достаточно невысокую диагностическую значимость [9]. И если для выявления вирусной инфекции у пациентов с симптомами COVID-19 метод RT-PCR является референсным и весьма эффективным, то для выявления асимптомного инфицирования его возможности сильно ограничены. Следует отметить, что и иммунологические методы лабораторной бессимптомного носительства новой коронавирусной инфекции также мало подходят для решения данной диагностической задачи, так как основная цель таких тестов — эпидемиологическое наблюдение и индивидуального и коллективного иммунитета к SARS-CoV-2 [9][14].
Что касательно высокого процента ложно-положительны результатов, которые показаны в настоящем исследовании, то одним из объяснений этого может быть ложное срабатыванием молекулярно-генетических тест-систем на другие виды сезонных коронавирусов, которые уже давно циркулируют в человеческой популяции. В настоящее время четкие причины высокого процента результатов такого рода выявить сложно, учитывая то, что в коммерческих тест-системах дизайн использованных праймеров в открытой печати не публикуется.
Заключение
Несмотря на активное развитие в настоящее время методов специфической лабораторной диагностики новой коронавирусной инфекции остаётся немало сложностей для выявления бессимтомных носителей SARS-CoV-2. До конца не изучена стадийность репликации и вирусовыделения SARS-CoV-2 при бессимптомном носительстве, что также усложняет точное выявление новой коронавирусной инфекции. Поэтому на данный момент необходима разработка тестов для выявления бессимптомных SARS-CoV, которые базировались бы не только свойствах этиологического агента, но и на особенностях патогенеза данной инфекции, что должно повысить их чувствительность, специфичность и диагностическую значимость. Примером таких тестов может служить созданная американским учеными лабораторная диагностическая тест-система, основанная на технологии генетического редактирования CRISPR-Cas 12 [15]. Разработка таких тестов может сыграть решающую роль в выявлении асимптомных носителей заболевания и позволит уточнить особенности его этиопатогенеза и в конечном итоге взять под полный контроль развитие эпидемического процесса [16].
Финансирование. За счёт ГАУ РО Областной консультативно-диагностический центр.
Financing. At the cost Regional consulting and diagnostic center, Rostov-on-Don.
Конфликт интересов. Авторы заявляют об отсутствииконфликта интересов.
Conflict of interest. Authors declares no conflict of interest.
1. Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, Turriziani O, et al. Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. // J Endocrinol Invest. – 2020. – V.23. – P.1–4. https://doi.org/10.1007/s40618-020-01261-1
2. Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA. Insights into the Recent 2019 Novel Coronavirus (SARSCoV-2) in Light of Past Human Coronavirus Outbreaks. // Pathogens. – 2020. – V.9(3). – P.186. https://doi.org/10.3390/pathogens9030186
3. Cascella M, Rajnik M, Cuomo A, Dulebohn SC, Di Napoli R. Features, Evaluation, and Treatment of Coronavirus (COVID-19) [Updated 2020 Aug 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK554776/
4. Chen Y, Guo Y, Pan Y, Zhao ZJ. Structure analysis of the receptor binding of 2019-nCoV. // Biochemical and Biophysical Research Communications. – 2020. – V.525, Is.1. – P. 135-140. https://doi.org/10.1016/j.bbrc.2020.02.071.
5. Corman VM, Landt O, Kaiser M, Molenkamp R, Meijer A, Chu DK, et al. Detection of 2019 novel coronavirus (2019- nCoV) by real-time RT-PCR. // Euro Surveill. – 2020. – V.25(3). -2000045. https://doi.org/10.2807/1560-7917.ES.2020.25.3.2000045.
6. Xie C, Jiang L, Huang G, Pu H, Gong B, Lin H, et al. Comparison of different samples for 2019 novel coronavirus detection by nucleic acid amplification tests. // Int J Infect Dis. – 2020. – V.93. – P.264-267. https://doi.org/10.1016/j.ijid.2020.02.050.
7. Peng X, Xu X, Li Y, Cheng L, Zhou X, Ren B. Transmission routes of 2019-nCoV and controls in dental practice. // International Journal of Oral Science. – 2020. – V.12(1). https://doi.org/10.1038/s41368-020-0075-9
8. Cheng MP, Papenburg J, Desjardins M, Kanjilal S, Quach C, Libman M, et al. Diagnostic Testing for Severe Acute Respiratory Syndrome–Related Coronavirus-2. A Narrative Review. // Ann Intern Med. – 2020. – V. 172(11). – P. 726-734. https://doi.org/10.7326/M20-1301.
9. Wang W, Xu Y, Gao R, Lu R, Han K, et al. Detection of SARSCoV-2 in Different Types of Clinical Specimens. // JAMA. – 2020. – V. 323(18). – P.1843–4. https://doi.org/10.1001/jama.2020.3786.
10. Huang WE, Lim B, Hsu C, Xiong D, Wu W, Yu Y, et al. RTLAMP for rapid diagnosis of coronavirus SARS‐CoV‐2. // Microbial Biotechnology. – 2020. – V.13(4). – P. 950-961. https://doi.org/10.1111/1751-7915.13586
11. Lai CC, Liu YH, Wang CY, Wang YH, Hsueh SC, et al. Asymptomatic carrier state, acute respiratory disease, and pneumonia due to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): Facts and myths. // J Microbiol Immunol Infect. – 2020. – V.53(3). – P.404-412. https://doi.org/10.1016/j.jmii.2020.02.012
12. Zou L, Ruan F, Huang M, Liang L, Huang H, et al. SARSCoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N // Engl J Med. – 2020. – V. 382(12). – P.1177- 1179. https://doi.org/10.1056/NEJMc2001737.
13. Lippi G, Sanchis-Gomar F, Henry BM. Coronavirus disease 2019 (COVID-19): the portrait of a perfect storm. // Annals of Translational Medicine. – 2020. – V.8(7). – P.497–497. https://doi.org/10.21037/atm.2020.03.157
14. Guo L, Ren L, Yang S, Xiao M, Chang D, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). // Clin Infect Dis. – 2020. – V. 71(15). – P. 778- 785. https://doi.org/10.1093/cid/ciaa310.
15. Broughton JP, Deng X, Yu G, Fasching CL, Servellita V, Singh J, et al. CRISPR-Cas12-based detection of SARS-CoV-2. // Nat Biotechnol. – 2020. – V. 38(7). – P. 870-874. https://doi.org/10.1038/s41587-020-0513-4.
16. Бурцев Д.В., Аванян Н.Л., Кипайкин В.А., Скрипец Н.В. О системе эпидемиологической безопасности в областном консультативно-диагностическом центре. // Инфекция и иммунитет. — 2017. — № S. — С. 113. eLIBRARY ID: 35379622
Молекулярно-генетические исследования в Санкт-Петербурге
Молекулярная генетика — это раздел генетики, предметом изучения которого являются молекулярные основы наследственности, т.е. структура и функции ДНК, РНК и белков.
К настоящему времени методы молекулярной генетики активно применяются не только в научных лабораториях, но и в медицинских центрах по всему миру, позволяя успешно диагностировать многие виды наследственных и приобретённых, в том числе онкологических заболеваний.
Лаборатория молекулярно-генетических исследований Клиники высоких медицинских технологий им. Н. И. Пирогова СПбГУ специализируется на анализе операционного и биопсийного материала у пациентов с немелкоклеточным раком лёгкого, колоректальным раком, меланомой, раком простаты и другими типами онкологических заболеваний.
Оптимизация работы лаборатории позволяет осуществлять молекулярно-генетические исследования из биопсийного и операционного материала в течение 48-72 часов с момента регистрации материала, что положительным образом отражается на эффективности диагностического процесса с учётом возможных дальнейших исследований.
В лаборатории стандартизировано определение статуса соматических мутаций следующих протоонкогенов:
- EGFR
- KRAS
- NRAS
- Экспрессия PCA3
Возможности и преимущества работы лаборатории с биопсийным и операционным материалом
- Работа с регионами.
- Среднее время проведения анализа — 48-72 часа с момента регистрации материала в лаборатории.
- Проведение всех этапов молекулярно-генетического анализа (от выделения ДНК до определения статуса мутаций) в одной лаборатории.
- Использование электронной системы регистрации операционного и биопсийного материала.
- Возможность длительного хранения выделенной ДНК при -80°С.
Важно!
- Для проведения анализа необходимо 5-10 срезов с парафинового блока, толщиной до 10 мкм, с площадью тканевого фрагмента — 250 мм2
- Анализируемый образец должен содержать не менее 50% опухолевых клеток.
- Низкое качество предшествующей гистологической проводки существенно влияет на информативность результатов.
- Необходимо наличие сопроводительной медицинской документации с морфологической верификацией диагноза.
Клиника сертифицирована по системе менеджмента качества ISO 9001 — 2015 (ISO 9001:2015) на все виды оказываемых услуг и каждый год проходит процедуру подтверждения соответствия услуг установленным требованиям независимыми организациями. Наличие такого добровольного сертификата во многих странах является знаком качества оказываемых услуг для потребителя, дополнительной гарантией надежности и профессиональной компетентности не только на национальном, но и на международном уровне.
Молекулярная диагностика — обзор
Введение
Молекулярная диагностика — это раздел лабораторной медицины или клинической патологии, который использует методы молекулярной биологии для диагностики заболевания, прогнозирования течения заболевания, выбора методов лечения и мониторинга эффективности терапии. Молекулярная диагностика связана практически со всеми клиническими специальностями и является жизненно важным дополнением к нескольким областям клинической и лабораторной медицины, но в основном она связана с инфекционными заболеваниями, онкологией и генетикой.Предметом этой главы является молекулярная генетика, которая занимается анализом нуклеиновых кислот человека в их отношении к болезням.
С момента завершения первого рабочего проекта последовательности человеческого генома в 2000 году и завершения уточненной последовательности в 2003 году прогресс в молекулярной генетике был быстрым и не показывает никаких признаков ослабления. В конце 1990-х было клинически доступно относительно небольшое количество генетических тестов, тогда как сегодня доступно более 5000 тестов. Кроме того, молекулярно-генетическое тестирование оказалось достаточно полезным и надежным, чтобы его можно было расширить до популяционного скрининга.Молекулярное тестирование служит окончательным подтверждающим тестом для нескольких заболеваний, включенных в расширенные программы скрининга новорожденных, и в 2003 году Американский колледж медицинской генетики и Американский конгресс акушеров и гинекологов рекомендовали популяционный скрининг носителей кистозной болезни. фиброз с использованием молекулярного тестирования будет внедрен в Соединенных Штатах.
Молекулярная генетика как дисциплина и как клиническая лабораторная служба существует не на пустом месте.Скорее, это тесно связано с молекулярной и клеточной биологией и центральной парадигмой молекулярной биологии, согласно которой гены кодируют белки. Таким образом, понимание генезиса нарушения функции белка может быть достигнуто посредством анализа генов. Такое исследование, в частности, влечет за собой оценку того, как последовательность ДНК гена сравнивается с его последовательностью дикого типа или нормальной последовательностью. В конечном итоге нарушения функции белков, связанные с мутациями генов, приводят к дисфункции органов и болезненным состояниям. В этой главе будут рассмотрены основы молекулярной генетики и она разделена на пять разделов, в которых рассматриваются концепции, присущие молекулярной генетике.Первый раздел посвящен молекулярной структуре ДНК, транскрипции ДНК и трансляции белков. Второй раздел посвящен молекулярной патологии, репликации ДНК и механизмам восстановления ДНК. В третьем разделе представлен базовый обзор генетики передачи. Четвертый раздел подчеркивает взаимосвязь между генами, белками и фенотипом и включает обоснование молекулярно-генетического тестирования. В последнем разделе рассматривается аллельная гетерогенность и соответствующий выбор аналитической методологии.
Молекулярная диагностика | OHSU
Генетический тест включает анализ ДНК, РНК, хромосом, белков или других метаболитов для выявления изменений, связанных с наследственным заболеванием. Есть несколько различных типов генетического тестирования:
- Прямое тестирование включает прямую проверку кода ДНК или РНК гена
- При тестировании сцепления анализируются генетические маркеры, унаследованные с геном, вызывающим болезнь
- Биохимическое тестирование изучает конкретные метаболиты из таких образцов, как кровь или моча, которые могут указать, правильно ли функционирует определенный ген
- Цитогенетическое тестирование включает исследование хромосом клетки с помощью ряда различных методов.
Хотя генетическое тестирование имеет некоторые общие черты с другими типами лабораторных исследований, во многих отношениях оно уникально.Результаты генетического тестирования обычно относятся к индивидууму, проходящему тестирование, и к другим членам семьи. И наоборот, иногда может потребоваться тестирование других членов семьи, чтобы уточнить результат тестирования человека. На ранних этапах открытия генов семьям может быть доступно исследовательское генетическое тестирование. Это тестирование проводится с целью лучшего понимания генетического состояния или гена или для разработки клинического теста. Клинические тесты — это тесты, в ходе которых исследуются образцы, а результаты сообщаются лечащему врачу или пациенту с целью диагностики, профилактики или лечения.В США клинические лаборатории должны соответствовать федеральным стандартам контроля качества и квалификации в соответствии с Поправкой о совершенствовании клинических лабораторий 1988 г. (CLIA).
Спрос на генетическое тестирование со стороны генетиков, врачей первичного звена и неспециалистов будет продолжать расти по мере открытия новых генов и появления новых тестов. Для исследователей, изучающих редкие заболевания, идентификация гена, вызывающего заболевание, может привести к новым трудностям, включая определение лаборатории, одобренной CLIA, заинтересованной в переносе теста в клинические условия, информирование направляющих врачей и затронутых семей о доступности нового теста. и подтверждение результатов молекулярных исследований в клинической лаборатории.Лаборатория биохимической генетики OHSU, лаборатория цитогенетики и Диагностический центр Молеклуар проводят генетические тесты на многочисленные заболевания. Центр молекулярной диагностики, возглавляемый доктором Сью Ричардс, специализируется на разработке и проведении тестирования на редкие генетические нарушения.
Технические стандарты и рекомендации: Молекулярно-генетическое тестирование на сверхредкие заболевания
ПРИЛОЖЕНИЕ: Образцы лабораторных отчетов для тестирования на сверхредкие заболевания
ОБРАЗЕЦ 1: Полное секвенирование генов с отрицательными результатами и гетерозиготными положениями:
Тест: Анализ последовательности Ген XXXПоказания для тестирования: Предполагаемый диагноз синдрома ________
Метод: 20 кодирующих экзонов и фланкирующие интронные области гена были амплифицированы с помощью ПЦР и секвенированы в двух направлениях.Эталонной последовательностью мРНК является NM_xxxxxxxx, с кодоном 1, соответствующим стартовому ATG, и нуклеотидом 1, соответствующим A.
Результат: Мутации гена XXX не обнаружено.
Подробности: Было отмечено несколько гетерозиготных положений, согласующихся с обнаружением двух нормальных аллелей. В кодоне 255 присутствовали как ТАТ, так и ТАС. Это известный полиморфизм, не имеющий очевидного клинического значения, поскольку обе последовательности кодируют тирозин. В кодоне 871 присутствовали как CCA (пролин, P), так и CGA (аргинин, R).Сообщается, что P871R является нормальным вариантом, не связанным с заболеванием (Author et al., 1999). Гетерозиготность также наблюдалась в некодирующей позиции, c.428-15 (IVS3-15), которая не оказывает видимого эффекта. Наличие этих гетерозиготных положений подтверждает наличие двух аллелей и исключает возможность полной делеции одного аллеля.
Интерпретация: В гене этого пациента не было обнаружено мутации, связанной с синдромом ______. Этот результат не исключает диагноза этого синдрома.Мутации в _________ обнаруживаются у 60% пациентов с синдромом _______ и положительным семейным анамнезом и в 35% единичных случаев (Author et al., 2000). Интерпретация основана на современном понимании генетики синдрома ________.
Ограничения: Были исследованы только кодирующие области гена XXX и последовательности непосредственно фланкирующих интронов. Изменения в промоторной области, дальше в интроны или в других некодирующих областях гена не будут обнаружены.Чувствительность секвенирования ДНК составляет более 99% для обнаружения изменений нуклеотидных оснований, небольших делеций и вставок в анализируемых областях. Мутации в генах, отличных от XXX, не будут идентифицированы. Множественные делеции экзонов, множественные вставки экзонов и полная делеция одного аллеля не могут быть идентифицированы с помощью этих методов. Другие типы редких генетических вариаций могут помешать этому анализу.
Артикул:
ОБРАЗЕЦ 2: Полное секвенирование гена с отрицательными результатами и отсутствием гетерозиготных позиций:
Тест: Анализ последовательности гена XXXПоказания для тестирования: Предполагаемый диагноз ________ синдрома
Метод: 12 кодирующих экзонов и фланкирующие интронные области гена XXX амплифицировали с помощью ПЦР и секвенировали в двух направлениях.Эталонной последовательностью мРНК является NM_xxxxxxxx, с кодоном 1, соответствующим стартовому ATG, и нуклеотидом 1, соответствующим A.
Результат: Мутации гена XXX не обнаружено.
Детали: Гетерозиготных позиций не обнаружено. Если присутствует, гетерозиготные нормальные полиморфные положения служат для исключения грубых делеций генов. Известно, что делеции встречаются при синдроме _______ более чем в 10% случаев. Кроме того, последовательность этого пациента включала явно гомозиготный G в положении c.428-34 (ИВС3-34). Это отличие от прототипа T, которое мы не наблюдали более чем в 100 контрольных последовательностях и последовательностях пациентов. Присутствие G в IVS3-34 не считается причинной мутацией, но его можно рассматривать как дополнительное показание для делеционного тестирования, поскольку редкое изменение последовательности вряд ли окажется гомозиготным, если родители пациента не являются кровными родственниками.
Интерпретация: В гене XXX этого пациента не было обнаружено мутации, связанной с синдромом ______.Этот результат не исключает диагноза этого синдрома. Мутации последовательности в XXX обнаруживаются у 60% пациентов с синдромом _______ и положительным семейным анамнезом и в 35% единичных случаев (Author et al., 2000). Тестирование родителей пациента на IVS3-34 может быть выполнено, чтобы уточнить наличие делеции у этого пациента. В качестве альтернативы можно также рассмотреть вопрос о делеционном анализе этого гена, если он доступен. Эта интерпретация основана на современном понимании генетики синдрома ________.
Ограничения: Были исследованы только кодирующие области гена XXX и последовательности непосредственно фланкирующих интронов. Изменения в промоторной области, дальше в интроны или в других некодирующих областях гена не будут обнаружены. Чувствительность секвенирования ДНК составляет 99% для обнаружения изменений нуклеотидных оснований, небольших делеций и вставок в анализируемых областях. Мутации в генах, отличных от XXX, не будут идентифицированы. Множественные делеции экзонов, множественные вставки экзонов и полная делеция одного аллеля не могут быть идентифицированы с помощью этих методов.Другие типы редких генетических вариаций могут помешать этому анализу.
Артикул:
ОБРАЗЕЦ 3: Сканирование и секвенирование генов с положительными результатами:
Тест: Анализ мутаций гена XXXПоказания для тестирования: Предполагаемый диагноз синдрома ________
Метод: 20 кодирующих экзонов и фланкирующий интроник области гена XXX амплифицировали с помощью ПЦР и проверяли на мутации с использованием денатурирующей высокоэффективной жидкостной хроматографии (dHPLC).Ампликоны, показывающие вариации, секвенировали в двух направлениях. Эталонной последовательностью мРНК является NM_xxxxxxxx, с кодоном 1, соответствующим стартовому ATG, и нуклеотидом 1, соответствующим A.
Результат: Положительный результат для двух мутаций: S320P и p.L1061fsX4.
Подробности: S320P (серин на пролин в аминокислоте 320) вызывается у этого пациента заменой T на C в положении нуклеотида c.958. Насколько нам известно, об этой мутации не сообщалось у других пациентов с синдромом __________, но она вызывает неконсервативную аминокислотную замену в критическом домене, в положении, где серин инвариантен у всех позвоночных.S320P не был зарегистрирован как нормальная вариация и не наблюдался в нашем анализе более 50 нормальных аллелей. Таким образом, S320P, вероятно, является мутацией, вызывающей синдром ________, хотя функциональные исследования не проводились, чтобы окончательно это доказать. p.L1061fsX4 описывает мутацию сдвига рамки считывания в кодоне 1061 лейцина (L), вызванную делецией нормального T в положении c.3183. Сдвиг рамки приводит к преждевременному завершению 4-х кодонов ниже по течению. Ранее сообщалось о p.L1061fsX4 у пациентов с синдромом _______ (Автор и др., 1995).
Интерпретация: Предполагается, что S320P и p.L1061fsX4 являются причиной синдрома ________ у этого пациента. Обнаружение двух мутаций в гене XXX подтверждает диагноз и предоставляет конкретную информацию о мутациях, которую можно использовать для тестирования на носительство и пренатальной диагностики в этом семействе. При этом аутосомно-рецессивном заболевании предполагается, что каждый из родителей этого пациента несет одну мутацию, хотя возможны новые мутации. Эта интерпретация основана на нашем нынешнем понимании генетики синдрома ______.
Ограничения: Предполагается, что две обнаруженные мутации находятся на противоположных хромосомах, но это не может быть доказано секвенированием. Это предположение должно быть подтверждено тестированием родителей этого пациента перед любым дополнительным тестированием в этой семье.
Артикул:
ОБРАЗЕЦ 4: Полное секвенирование гена с результатами неизвестной значимости:
Тест: Анализ последовательности гена XXXПоказания для тестирования: Предполагаемый диагноз синдрома ________
Метод: 5 кодирующих экзонов и фланкирование интронные области гена XXX амплифицировали с помощью ПЦР и секвенировали в двух направлениях.Эталонной последовательностью мРНК является NM_xxxxxxxx, с кодоном 1, соответствующим стартовому ATG, и нуклеотидом 1, соответствующим A.
Результат: Идентифицирован вариант неизвестной значимости: c.978 C к T (S326S). Других отличий от прототипной нормальной последовательности не наблюдалось.
Подробности: Этот пациент является гетерозиготным по замене C на T в нуклеотиде c.978, что приводит к AGT вместо AGC в кодоне 326. Обе последовательности кодируют серин (S). Это изменение последовательности, по-видимому, ранее не описывалось у пациентов с синдромом _______, а также не было описано как известный полиморфизм (доброкачественное изменение последовательности) в гене XXX.Поскольку аминокислота не изменяется и ложный сайт сплайсинга, по-видимому, не вводится, возможно, что это изменение непатогенное, но функциональные исследования не проводились, чтобы окончательно доказать это.
Интерпретация: Не было обнаружено явных патогенных мутаций, но сообщается о неубедительных результатах. Более 80% пациентов с классическим синдромом ______ имеют очевидные мутации патогенной последовательности в гене XXX. Тестирование родителей пациента на c.Изменение 978C> T, наряду с тщательным физическим обследованием на предмет легких признаков синдрома ________, может помочь определить патогенную природу этой находки.
Ограничения: Были исследованы только кодирующие области гена XXX и последовательности непосредственно фланкирующих интронов. Изменения в промоторной области, дальше в интроны или в других некодирующих областях гена не будут обнаружены. Чувствительность секвенирования ДНК составляет более 99% для обнаружения изменений нуклеотидных оснований, небольших делеций и вставок в анализируемых областях.Мутации в генах, отличных от XXX, не будут идентифицированы. Множественные делеции экзонов, множественные вставки экзонов и полная делеция одного аллеля не могут быть идентифицированы с помощью этих методов. Другие типы редких генетических вариаций могут помешать этому анализу, но полное отсутствие одной копии гена XXX исключается наблюдением гетерозиготности в одном или нескольких положениях.
Артикул:
ОБРАЗЕЦ 5: Пользовательское тестирование на известную мутацию с положительными результатами:
Тест: Пользовательский анализ на мутацию G403R в экзоне 8 гена XXXПоказания для тестирования: Семейный анамнез с синдромом ___________.Сообщалось, что мутация G403R была обнаружена в этой семье в исследовательской лаборатории доктора _____________, который направил этого пациента к нам для клинического тестирования.
Метод: Были предоставлены результаты исследований, показывающие, что член этого семейства имеет мутацию GGC в CGC в кодоне 403 (глицин в аргинин) гена XXX, с использованием эталонной последовательности мРНК NM_xxxxxxxx и присвоением кодона 1 стартовому ATG с включение расщепленного сигнального пептида. Замена нуклеотида G на C соответствует положению c.1207 в мРНК. Экзон 8 амплифицировали с помощью ПЦР и секвенировали в двух направлениях. Анализ проводился на отдельном образце крови пациента, отправленном непосредственно в нашу лабораторию. (В случае, если отдельный образец крови от пораженного пробанда недоступен: образец ДНК был предоставлен исследователем в качестве положительного контроля, хотя независимый новый образец положительного контроля не был доступен).
Результат: У этого пациента обнаружена мутация G403R в гетерозиготном состоянии.
Подробности: Тестирование образца крови пациента (или: образец ДНК положительного контроля, предоставленный исследователем) позволил нам продемонстрировать, что разработанный нами метод тестирования может обнаружить указанную мутацию G403R. Обнаружение этой мутации у пациента подтверждает находку исследовательской лаборатории в этой семье.
Интерпретация: У этой пациентки есть мутация G403R, о которой ранее сообщалось, что она есть в ее семье. В литературе сообщается, что эта мутация является вредной (цитируется) и, таким образом, интерпретируется как мутация, вызывающая заболевание.Этому человеку рекомендуется генетическое консультирование.
Ограничения: Была исследована только область, непосредственно окружающая кодон 403 гена XXX. Изменения в другом месте в гене или в других генах не были бы обнаружены. (В случае, если отдельный образец крови от пораженного пробанда недоступен: поскольку отдельный образец пациента не может быть исследован, нельзя исключать наличие смешивания образцов в исследовательской лаборатории.)
Артикул:
ОБРАЗЕЦ 6: Пользовательское тестирование на известную мутацию без подтверждения:
Тест: Пользовательский анализ на мутацию R100X в экзоне 4 гена XXXПоказания для тестирования: Семейный анамнез с синдромом ___________.Сообщалось, что мутация R100X была обнаружена у этого пациента в исследовательской лаборатории доктора _____________, который направил семью к нам для клинического тестирования. Этот пациент проходит тестирование в качестве положительного контроля.
Метод: Были предоставлены результаты исследования, показывающие, что этот пациент имеет мутацию AGA в TGA в кодоне 100 (аргинин для остановки) гена XXX, с использованием эталонной последовательности мРНК NM_xxxxxxxx и присвоения кодона 1 инициатору ATG. Изменение нуклеотида A на T соответствует положению c.298 в мРНК. Экзон 4 амплифицировали с помощью ПЦР и секвенировали в двух направлениях.
Результат: Невозможно подтвердить наличие какой-либо мутации в кодоне R100.
Подробности: Была видна только нормальная последовательность экзона 4. Никаких гетерозиготных положений не было обнаружено где-либо еще в экзоне или фланкирующей интронной последовательности; такие позиции, если они есть, подтвердили бы, что два аллеля были амплифицированы. Тот же результат был получен с использованием альтернативного набора праймеров.
Интерпретация: Этот пациент демонстрирует противоречивые результаты между нашей лабораторией и исследовательской лабораторией.Редкие генетические варианты могут мешать этому типу анализа, особенно в сайтах связывания праймеров, поэтому были использованы два разных набора праймеров. Ни один из наборов не обнаружил описанной мутации. Пока это несоответствие не будет устранено, этот тест не будет доступен для дополнительных членов этой семьи.
Ограничения: Был исследован только экзон 4 гена XXX. Изменения в другом месте в гене или в других генах не были бы обнаружены.
Артикул:
методов генетического тестирования | Лабораторные тесты онлайн
Рем, Х.Л. (2013 апрель). Секвенирование, ориентированное на заболевание: краеугольный камень клиники. Природа Обзоры Генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3786217/. По состоянию на октябрь 2018 г.
Кацанис, С. Х. и Кацанис Н. (июнь 2013 г.). Молекулярно-генетическое тестирование и будущее клинической геномики. Национальный обзор генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4461364/. По состоянию на октябрь 2017 г. Behjati, S. and Tarpey P.S. (2013 декабрь). Что такое секвенирование следующего поколения? Архив болезней детства.Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3841808/. По состоянию на октябрь 2018 г.
Шен Т. и др. (17 июня 2015 г.). Клинические применения секвенирования следующего поколения при раке: от панелей до экзомов и геномов. Границы генетики. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4469892/. По состоянию на октябрь 2018 г.
Мойнихан Т. (30 июня 2015 г.). Профилирование экспрессии генов при раке груди: что это такое? Клиника Майо. Доступно в Интернете по адресу https: // www.mayoclinic.org/diseases-conditions/breast-cancer/expert-answers/gene-expression-profiling/faq-20058144. По состоянию на октябрь 2018 г.
(27 августа 2015 г.). Технология микрочипов ДНК. Национальный институт исследования генома человека. Доступно в Интернете по адресу https://www.genome.gov/10000533/dna-microarray-technology/. По состоянию на октябрь 2018 г.
(обновлено 18 декабря 2015 г.). Секвенирование ДНК. Национальный институт исследования генома человека. Доступно в Интернете по адресу https://www.genome.gov/10001177/dna-sequencing-fact-sheet/.По состоянию на октябрь 2018 г.
Беновиц, С. (29 марта 2016 г.). Новое исследование бросает вызов золотому стандарту проверки результатов секвенирования ДНК. Национальный институт исследования генома человека. Доступно в Интернете по адресу https://www.genome.gov/27564480/2016-news-feature-new-study-challenges-gold-standard-for-validating-dna-sequencing-results/. По состоянию на октябрь 2018 г.
Hamilton, A. et al. (2016 10 мая). Соответствие между секвенированием всего экзома и клиническим секвенированием по Сэнгеру: значение для ухода за пациентами.Молекулярная генетика и геномная медицина. Доступно в Интернете по адресу http://onlinelibrary.wiley.com/doi/10.1002/mgg3.223/full. По состоянию на октябрь 2018 г.
Sabour L., et al. (2017 апрель). Клинические применения секвенирования нового поколения в диагностике рака. Патология и онкологические исследования. Доступно на сайте https://link.springer.com/article/10.1007/s12253-016-0124-z. По состоянию на октябрь 2018 г.
(© 2017). Что такое диагностическое тестирование? Гены в жизни. Доступно в Интернете по адресу http: //www.genesinlife.org / testing-services / testing-генетические-условия / диагностическое-тестирование. По состоянию на октябрь 2018 г.
(© 2017). Что такое генотипирование и профили экспрессии? Генотипирование и Институт медицинских исследований Кориелла. Доступно в Интернете по адресу https://www.coriell.org/research-services/genotyping-microarray/what-is-genotyping-and-expression-profiling. По состоянию на октябрь 2018 г.
(27 августа 2015 г.) Национальный исследовательский институт генома человека, ДНК-микрочип. Доступно на сайте https://www.genome.gov/10000533/dna-microarray-technology/ По состоянию на октябрь 2018 г.
Молекулярные методы, применяемые в клинической лаборатории: перспективы и подводные камни | Возбудители и болезни
Аннотация
Роль молекулярного обнаружения, идентификации и типирования или снятия отпечатков пальцев микроорганизмов постепенно перешла от академического мира к рутинной диагностической лаборатории. За последнее десятилетие молекулярные методы все шире используются для улучшения чувствительности, специфичности и времени оборачиваемости в клинической лаборатории.Молекулярные методы также использовались для идентификации новых и некультивируемых агентов. В настоящее время коммерчески доступны многие высокопроизводительные молекулярные тесты, что сказывается на инфраструктуре многих диагностических лабораторий. В этой статье мы даем общий взгляд на использование молекулярных методов (перспективы и недостатки) на основе нашего клинического опыта и опыта в области общественного здравоохранения, в частности, в связи с Borrelia burgdorferi , трансмиссивным патогеном, Treponema pallidum . , вновь появляющийся глобальный патоген, передаваемый половым путем, и вирус Западного Нила, недавно признанный вирус в Северной Америке.
Введение
Возникновение и повторное появление нескольких инфекционных заболеваний, которые могут потенциально повлиять на общественное здоровье во всем мире, стало темой, вызывающей интерес в клинических исследованиях. На возникновение новых инфекционных заболеваний влияет множество сложных факторов. Некоторые из этих факторов включают: генетические вариации в организме хозяина и патогена, изменения в поведении общества и популяционную динамику, а также давление окружающей среды как на людей, так и на животных.Ситуация усложняется тем, что доступность международных поездок также позволила инфекционным агентам распространяться по всему миру с невиданной ранее в истории человечества скоростью. Именно эта сложность делает быстрое выявление новых, а также признанных болезнетворных патогенов неотложной задачей в секторе общественного здравоохранения. Чтобы лечить людей из группы риска, ограничивать передачу болезней, улучшать наблюдение за здоровьем и отслеживать патогенные воздействия на окружающую среду, поставщики медицинских услуг и лаборатории должны быть готовы быстро распознавать новые и необычные события и необычные микробные агенты, а также необъяснимые человеческие и болезни животных (Peruski et al., 2003).
Молекулярные методы могут дополнять традиционные методы на основе культивирования, антигенов и антител для обнаружения, идентификации и эпидемиологического анализа инфекционных микроорганизмов (Zaidi et al. , 2003). К недостаткам традиционных методов относятся их неспособность различать новые патогены, происходящие от общего предка, неэффективность по времени при обеспечении только удовлетворительных результатов, а также низкая чувствительность и специфичность результатов тестов. Молекулярные методы в настоящее время становятся важными инструментами во всех лабораториях для рутинного обнаружения и снятия отпечатков пальцев, а также для помощи в надзоре за общественным здоровьем, что потенциально может позволить быстрое внедрение методов инфекционного контроля и вмешательства.
Несмотря на преимущества и популярность методов молекулярной диагностики и снятия отпечатков пальцев, необходимо решить серьезные проблемы, прежде чем эти методы можно будет внедрить в клинико-диагностической лаборатории. Несмотря на то, что существует ряд доступных молекулярных методов, большинство меню лабораторных тестов клинической диагностики ограничено ПЦР или родственными анализами обнаружения. Расширенные меню тестов, которые неизбежно появятся в большем количестве диагностических лабораторий, включают ПЦР в реальном времени (ОТ-ПЦР) и секвенирование ДНК.Поскольку у молекулярных методов также есть свои подводные камни, клинические микробиологи, врачи-инфекционисты и эпидемиологи должны научиться понимать использование и ограничения молекулярных методов.
Перспективы
Быстрые, высокочувствительные, специфические тесты, легко стандартизируемые
Одним из самых мощных методов молекулярной диагностики, используемых в клинических лабораториях, является амплификация генов с помощью ПЦР. Праймеры для ПЦР предназначены для гибридизации с конкретными последовательностями РНК, ДНК или кДНК в гене.Это позволяет точно идентифицировать возбудителя болезни с пределом обнаружения, который варьируется от 1 до 100 копий целевого ампликона в клинических образцах, что намного превосходит аналогичный иммунологический анализ (Zaidi et al. , 2003). Эту точность можно дополнительно повысить с помощью ОТ-ПЦР для обнаружения, поскольку для идентификации ампликона можно использовать селективные зонды, нацеленные на определенные генетические последовательности или анализ кривой плавления. Пример метода ПЦР, демонстрирующий повышенную чувствительность по сравнению с обычным методом, приведен в таблице 1 для обнаружения T.pallidum , возбудитель сифилиса. Образцы были взяты у пациентов, осматривавшихся в клинике болезней, передающихся половым путем, Центра по контролю за заболеваниями Британской Колумбии (BCCDC), Ванкувер, Британская Колумбия. Из 106 протестированных образцов генитальной язвы (GUD) 28 (26%) были положительными при ПЦР, но отрицательными при микроскопии темного поля (DF), и только 1 (0,94%) образец был положительным при микроскопии DF и отрицательным при ПЦР. Эти результаты не были неожиданными, поскольку микроскопия DF может быть особенно сложной, если флуоресценция слабая или если в образце присутствует небольшое количество спирохет.Обратное верно для ПЦР, которая может обнаруживать небольшое количество организмов и точно дифференцировать организмы. Этот пример показывает, насколько молекулярные методы могут снизить количество ложноотрицательных тестов (Morshed et al. , 2001).
Таблица 1Сравнение стандартной темнопольной микроскопии и ПЦР для обнаружения T. pallidum в образцах генитальной язвы с использованием праймеров, обнаруженных pol Область A
| Микроскопия темного поля на сифилис: положительный результат | Микроскопия темного поля на сифилис: отрицательная | |
| Положительная ПЦР | 26 | 28 |
| Отрицательная ПЦР | 1 | 51 |
Сравнение результатов традиционной темнопольной микроскопии обнаружение Т.pallidum в образцах язвы половых органов с использованием праймеров обнаружил pol A область
Снижение времени оборачиваемости с помощью методологии молекулярного тестирования — еще одно преимущество молекулярного тестирования перед традиционным тестированием на основе культур.Автоматизация экстракции нуклеиновых кислот в сочетании с ОТ-ПЦР приводит к быстрой и точной платформе, с помощью которой присутствие ДНК может быть подтверждено немедленно (LightCycler и TaqMan). Кроме того, он позволяет проводить крупномасштабный скрининг организмов на наличие патогенов всего за несколько часов, в отличие от методов на основе геля, которые требуют ручного труда квалифицированных специалистов. В целом молекулярные методы позволяют повысить надежность и эффективность за счет автоматизации. Пример, показанный на рис. 1, представляет собой молекулярный метод обнаружения РНК вируса Западного Нила (WNV) у комаров.Эта программа наблюдения за общественным здоровьем включает в себя крупномасштабный отбор проб насекомых, и потребность в эффективности и точности очень высока. Эффективность и точность этого метода не может быть сравнена ни с одним обычным методом (Shi et al. , 2001). Результаты могут быть получены менее чем за 4 часа за счет использования автоматического экстрактора генетического материала и системы одноэтапной ПЦР с обратной транскрипцией в реальном времени в 96-луночном формате (Lanciotti et al. , 2000). Этот рисунок также иллюстрирует использование внутреннего положительного контроля (IPC) для мониторинга экстракции, а также процедуры RT-PCR, которая обеспечивает более конкретный и точный тест (Eisler et al., 2004). Хорошо продуманные мультиплексные праймеры и зонды с IPC гарантируют качество теста. Кроме того, закрытая система снижает вероятность перекрестного заражения. Рисунок 1 Крупномасштабный эпиднадзор за комарами вирусом Западного Нила в формате автоматической экстракции и 96-луночного планшета в режиме реального времени амплификация и обнаружение ПЦР с обратной транскрипцией (неопубликованные данные). Рисунок 1 Крупномасштабный эпиднадзор за комарами вируса Западного Нила с автоматической экстракцией и 96-луночным планшетом в режиме реального времени амплификацией и обнаружением ПЦР с обратной транскрипцией (неопубликованные данные). Инструменты для выявления новых, некультивируемых или медленнорастущих патогеновДля образцов, содержащих неидентифицированные патогены, разумной стратегией будет скрининг большой панели возможных возбудителей с помощью молекулярных тестов, таких как универсальные праймеры для ПЦР и секвенирования ДНК. Этот метод приводит к сужению объема тестирования с тестами амплификации нуклеиновых кислот, поскольку некоторые организмы могут иметь похожие гены и последовательности. Секвенирование гена 16S рРНК широко используется для идентификации клинических изолятов с неоднозначными биохимическими профилями и для бактерий, которые нельзя культивировать (Rolph et al., 2001). Большая база данных Ribosomal Database Project (RDP) для большинства эубактерий доступна для выравнивания и идентификации последовательностей. Норовирус, ранее известный как вирус Norwalk, нельзя культивировать in vitro и его можно было идентифицировать только с помощью электронной микроскопии (ЭМ) до разработки метода ПЦР. Этот молекулярный тест не только позволяет лаборатории, не оснащенной ЭМ, проводить тест, но и значительно увеличивает чувствительность обнаружения. Исследование норовируса, проведенное в BCCDC Laboratory Services, показало, что EM выявляет только 17% всех ПЦР-положительных образцов (McNabb et al., 2002). Сифилис — еще один пример того, как ПЦР помогает в диагностике. Treponema pallidum нельзя культивировать на бесклеточных лабораторных средах, поэтому ПЦР является хорошей альтернативой в диагностике первичного и вторичного сифилиса, а ампликон из ПЦР может быть дополнительно протестирован путем секвенирования ДНК для получения подтверждающих результатов (Liu et al. , 2001). Для медленно растущих бактерий, таких как Mycobacterium tuberculosis , методы молекулярной амплификации оказались ценными не только для сокращения времени цикла идентификации (TAT) при идентификации, но и для исключения необходимости проведения процедуры живого культивирования (Rene и другие., 1998). При проведении прямых тестов с неизвестными или высоко заразными агентами всегда существует неотъемлемый риск для здоровья персонала лаборатории. Молекулярные методы значительно снижают этот риск для здоровья сотрудников лаборатории, поскольку большинство образцов становятся неинфекционными во время процесса лизиса и нагревания экстракции нуклеиновой кислоты. Это выгодно не только из-за снижения уровня воздействия на лаборантов во время манипуляций с образцами, но и из-за ограниченного числа сотрудников, подготовленных для работы в помещениях для защиты биологических объектов.Таким образом, появляется больше лабораторий для обнаружения потенциально опасных новых патогенов. Инструменты эпидемиологическиеИдентификация на основе последовательностей и типирование штаммов, наряду с разработкой зондов для генетических маркеров, позволяет проводить детальный фингерпринт штаммов. Анализ отпечатков пальцев ДНК можно использовать для изучения родства штаммов, а также групповой гетерогенности для конкретного организма. Таким образом, анализ может оказать значительное влияние на ведение пациентов и контроль заболеваний за счет раннего выявления кластеров болезней или вспышек.Такое молекулярное типирование добавило новое измерение к изучению эпидемиологии инфекционных заболеваний за счет распознавания непредвиденной передачи и определения вероятных мест или способов передачи, а также количественной оценки степени передачи (Oiu et al. , 1992; Эстебан и др. , 1996; Харпаз и др. , 1996; Крайден и др. , 1998; Харрингтон и Бишай, 2004; Крайден, 2005). На рисунке 2 показан путь информации и процедура тестирования, используемые для отслеживания и обнаружения B.burgdorferi , возбудитель болезни Лайма, из образцов окружающей среды, таких как клещи и мыши. На этой схеме используются как молекулярные, так и серологические методы. Культуры, положительные на спирохеты в среде BSK II, подтверждены как B. burgdorferi с помощью ПЦР, иммунофлуоресценции (IFA) и вестерн-блоттинга (WB), однако тесты ПЦР в этом случае дают большинство подтверждающих результатов (Morshed et al. др. , 2006). На рис. 2а показана предварительная ПЦР, проведенная для обнаружения гена, обнаруженного у большинства видов Borrelia , rrf-rrl .Если получен положительный результат, подтверждение выполняется с использованием гена ospA в качестве мишени, что сужает результат до возбудителя B. burgdorferi , как показано на рис. 2b. Последний тест — секвенировать положительные образцы ospA и идентифицировать последовательность с помощью основного локального поискового инструмента (blast) веб-сайта Национального центра биотехнологической информации (NCBI). Затем эту идентификацию можно сопоставить с последовательностями других видов Borrelia и поместить на филогенные деревья для определения их родства (рис.2в). Передачу сифилиса также можно отслеживать с помощью молекулярных методов, таких как полиморфизм длины рестрикционного фрагмента с помощью ПЦР (ПЦР-ПДРФ). На рисунке 3b показаны результаты генотипирования ПЦР-ПДРФ в генах tpr T. pallidum . RFLP использует рестрикционные ферменты для разрезания ампликона на фрагменты, которые разделяются при гель-электрофорезе. Это позволяет напрямую сравнивать отдельные образцы полос для изолята с образцами контроля (Pillay et al. , 1998) Рисунок 2 Тестирование на болезнь Лайма: (a) ПЦР, определяющая виды Borrelia, (b) ПЦР, определенная для B.Burgdorferi, (c) кластерный анализ последовательностей. ГИС, Географическая информационная система (неопубликованные данные). Рисунок 2 Тестирование болезни Лайма: (а) ПЦР, определяющая виды Borrelia, (b) ПЦР, определенная для B. Burgdorferi, (c) кластерный анализ последовательностей. ГИС, Географическая информационная система (неопубликованные данные). Рисунок 3 Использование ПЦР для диагностики, генотипирования и определения устойчивости к азитромицину T. pallidum. (а) ПЦР на основе гена polA.(б) ПЦР-ПДРФ генов tpr. (c) PCRRFLP для обнаружения мутации в гене 23S рРНК (неопубликованные данные). Рисунок 3 Использование ПЦР для диагностики, генотипирования и определения устойчивости к азитромицину T. pallidum. (а) ПЦР на основе гена polA. (б) ПЦР-ПДРФ генов tpr. (c) PCRRFLP для обнаружения мутации в гене 23S рРНК (неопубликованные данные). Мониторинг леченияТрадиционное лечение инфекционных заболеваний может нуждаться в пересмотре, поскольку обнаружение потенциальных патогенов в режиме, близком к реальному времени, позволило быстро прогнозировать профили лекарственной устойчивости, факторы вирулентности микробов и факторы хозяина.Это позволило более быстрыми темпами внедрять терапевтические меры и меры контроля в области общественного здравоохранения. Несколько изолятов инфекционного агента, полученные от одного и того же человека, могут представлять или не представлять один и тот же штамм. Множественные штаммы могут указывать на повторное заражение новым штаммом, неудачу терапии или наличие случайного заражения. Определение каждой ситуации может быть затруднено традиционными культуральными или биохимическими методами. ПЦР и секвенирование ДНК для дифференциации и определения этих штаммов могут быть полезны при ответе на клинические вопросы или вопросы общественного здравоохранения в таких ситуациях. Молекулярные анализы также можно использовать для контроля эффективности терапии. Вирусная нагрузка вируса иммунодефицита (например, ВИЧ) является важным показателем для врачей, использующих план лечения для ВИЧ-инфицированных (Nkoghe et al. , 2004). Анализы генотипирования также использовались для лечения заболеваний. Например, пациенты с генотипами вируса гепатита С (HCV), отличными от типа 1, лучше реагируют на терапию интерфероном (Lee et al. , 2002a, b). Оптимальная продолжительность лечения варьируется в зависимости от генотипа ВГС, выявленного в диагностической лаборатории.Этот молекулярный подход также может быть полезен при принятии решения о том, следует ли использовать монотерапию или комбинированную терапию (Richter, 2002). Молекулярное тестирование также может широко использоваться для выявления микробной лекарственной устойчивости. Обнаружение генов устойчивости у M. tuberculosis , например, имеет потенциал для клинического применения в ближайшем будущем. Этот подход также использовался при лечении инфекций Treponema (Lukehart et al. , 2004). На рисунке 3c показано обнаружение резистентного к азитромицину T.pallidum с использованием анализа ПЦР-ПДРФ путем обнаружения известной мутации в последовательности гена 23S рРНК. Подводные камниОтбор, отгрузка и хранениеВажно охарактеризовать образец, так как это определит наилучший тип образца и время, когда должен быть произведен оптимальный сбор. Время сбора образцов, условия обращения, температура хранения и транспортировка в лабораторию являются важными параметрами. Например, титр вируса Западного Нила в 10 раз ниже за 24-часовой период при 28 ° C по сравнению с 4 ° C (Mayo & Beckwith, 2002).Поэтому очень важно следить за тем, чтобы образцы собирались должным образом и содержались при надлежащей температуре после сбора. Хранение нуклеиновых кислот после экстракции также важно. Следует отметить, что оптимальные температуры хранения ДНК и РНК не совпадают. ДНК необходимо хранить при температуре 4 ° C или –20 ° C. Однако в идеале РНК следует хранить при -80 ° C, но часто -20 ° C является приемлемым для кратковременного хранения (Halfon et al. , 1996). Ложноположительные и ложноотрицательные результатыМолекулярные диагностические тесты, как и любые другие лабораторные анализы, могут давать ложноположительные и ложноотрицательные результаты.В диагностической лаборатории должен использоваться строгий контроль качества для выявления этих ложных результатов. Даже очень небольшое количество амплифицированного генетического продукта может загрязнить лабораторные реактивы и оборудование (Zaidi et al. , 2003) и вызвать серьезные последствия для обеспечения качества в лаборатории в любой момент во время процедуры тестирования (Nowak et al. , 1996; Нойман и др. , 1998; Зангеллини и др. , 1999; Нистерс и др. , 2000). Хорошие асептические методы, правильное обращение с инфекционными материалами и тщательная уборка рабочих зон — все это необходимо для предотвращения заражения.Автоматизированное оборудование может еще больше снизить вероятность загрязнения (Krajden, 2005). Некоторые лаборатории также предпочитают включать урацил в продукты амплификации, а затем предварительно переваривать реакционные смеси с урацил-N-гликозилазой; это помогает снизить вероятность заражения (Neumaier et al. , 1998). Неспецифическая генетическая амплификация может происходить из других источников, помимо прямого заражения. Они могут поступать из окружающей среды (например, нормальная флора из образца стула) или из гена хозяина (кровь и ткань пациента).Некоторые из этих амплификаций могут иметь ампликон аналогичного размера при гель-электрофорезе или могут иметь одинаковую температуру плавления при анализе кривой плавления. Если не будет проведен подтверждающий анализ, это может привести к ложноположительному результату. Хороший экспериментальный дизайн, такой как выбор праймеров с более высокими температурами отжига и поиск в Genbank для определения специфичности праймеров, помогает снизить вероятность неспецифической амплификации. Другие подходы к решению этой проблемы включают использование техники «горячего старта» или «приземления», гибридизацию зондов, ПДРФ или вложенную ПЦР. На рисунке 4 показано, как неспецифическое связывание или перекрестное загрязнение может привести к ложноположительному результату. Фотография геля показывает, что образец может содержать рассматриваемый инфекционный агент, как показано слабой полосой (в кружке), которая соответствует полосе того же размера, что и положительный контроль. Ампликон был секвенирован и подвергнут бластному поиску, чтобы определить его наилучшее соответствие в базе данных NCBI. Конечным результатом было совпадение с геном ДНК человека. Следовательно, стандартные рабочие процедуры молекулярных методов должны быть установлены, чтобы включать строгие процедуры обеспечения качества и подтверждающие тесты. Рисунок 4 Ампликон из спинномозговой жидкости пациента в анализе Borrelia PCR имеет такой же размер, как и положительный контроль при гель-электрофорезе. После сравнения секвенирования ДНК подтверждено, что это неспецифическая амплификация ДНК человека. Рисунок 4 Ампликон из спинномозговой жидкости пациента в анализе Borrelia PCR имеет такой же размер, как и положительный контроль при гель-электрофорезе. После сравнения секвенирования ДНК подтверждено, что это неспецифическая амплификация ДНК человека. Ложноотрицательные результаты теста может быть трудно обнаружить, поскольку они могут быть результатом вставок или делеций в геноме организма (Papin et al. , 2004), смешанных инфекций, неправильного времени для сбора образцов или неправильного обращения с ними. образцы или ингибирование материала в образце. Вставка или удаление в геноме организма могут быть подтверждены только методами секвенирования. Эти мутации останутся незамеченными в основной реакции ПЦР, которая может просто показать ампликон другого размера по сравнению с положительным контролем.Для подтверждения результатов ПЦР необходимо провести дополнительные анализы. Образец, содержащий смешанную инфекцию, может давать несколько полос в реакции ПЦР или только одну полосу, отражающую доминирующую инфекцию. Амплификация различных организмов может быть результатом того, что праймеры, используемые в реакции ПЦР, недостаточно специфичны для рассматриваемого организма. Как и при любом лабораторном диагностическом тесте, необходимо учитывать время сбора образцов. Некоторые организмы имеют длительный инкубационный период внутри хозяина; поэтому может пройти от нескольких недель до месяцев, прежде чем будет обнаружен этиологический агент.В таком случае, если образцы взяты у человека слишком рано, диагностическое тестирование будет бесполезным. Ингибирующие вещества в образце также могут вызывать проблемы. Такие вещества, как гепаринизированная кровь, триглицериды, гемоглобин, некоторые терапевтические препараты или экстракционные реагенты, могут вызывать ложноотрицательные результаты; продукт ПЦР не обнаружен (Холодный и др. , 1991; Эльбейк и др. , 2004), хотя инфекционный агент действительно присутствует. В некоторых случаях это можно исправить, разбавив образец.Разбавление образца приведет к разбавлению ингибирующего вещества и позволит продолжить амплификацию. Лучший способ обнаружить ингибиторы — использовать внутренние положительные контроли с тестируемыми образцами. Этот контроль будет подвергаться той же процедуре экстракции, амплификации и обнаружения, что и образец, чтобы гарантировать, что лабораторные процедуры выполняются правильно, и он помогает в определении ингибирования. Трудности при валидации тестирования сиротТесты на сиротство — это тесты, проводимые на патогены, но не во многих лабораториях.В общем, они не получили широкого подтверждения. Некоторые примеры включают тесты на болезнь Лайма, бартонеллу, лихорадку Ку и вирус Ханта. Поскольку немногие диагностические лаборатории проводят тестирование на эти патогены, может быть очень трудно получить положительный контроль и образцы, достаточные для подтверждения этих анализов. Поэтому в некоторых случаях необходимо использовать искусственные или искусственные средства контроля. Примером этого является использование Armored RNA для тестирования WNV (Eisler et al. , 2004). Альтернативой отсутствию положительных контролей является обмен подтвержденными положительными образцами между лабораториями.В любом случае проверка этих материалов по-прежнему вызывает проблемы, поскольку многие из них не являются количественными (точные концентрации контролируемого вещества неизвестны). Проверка квалификации и управление качествомПроцессы молекулярной диагностики должны быть разработаны таким образом, чтобы гарантировать соблюдение процедурных элементов; тесты должны быть проверены на соответствие принятым стандартным методам, чтобы гарантировать эквивалентность результатов. Необходимо внимательно следить за соотношением сигнал / шум и тщательно анализировать пределы обнаружения.Лаборатории должны участвовать в программах проверки квалификации (внешнее обеспечение качества) для оценки выполнения тестов и точности интерпретации (Krajden et al. , 1999; Lefrere et al. , 2004). Проверка квалификации по обычным методам обычно включает тестовые образцы, разработанные в другой лаборатории, в которые добавлены известные количества рассматриваемого инфекционного агента. Испытуемая лаборатория обязана обнаруживать, количественно определять и сообщать о возбудителе.Это сложная задача для молекулярных методов, потому что часто не существует единственного способа обнаружения определенного организма. Многие молекулярные лаборатории разрабатывают свои собственные методы тестирования конкретного организма или дополнительно адаптируют опубликованные методы для повышения чувствительности или специфичности теста. Это приводит к межлабораторным вариациям молекулярных методов и, таким образом, затрудняет проверку путем сравнения со стандартными методами. Требуется строгий контроль качества (QC), прежде чем многие молекулярные методы будут признаны приемлемыми для использования при обнаружении инфекционных агентов.Обеспечение качества (ОК) в системах менеджмента качества (СМК) также является важным аспектом общей точности клинических результатов. Валидация тестов от сбора образцов до представления результатов должна проводиться, чтобы лаборатории могли поставить точный диагноз. Стабильность и целостность любого образца должны поддерживаться во время обработки и транспортировки, поскольку такие факторы, как время хранения, время транспортировки и антикоагулянты, будут влиять на целостность (Холодный и др., 1995; Ginocchio et al. , 1997; Grant et al. , 2000; Ли и др. , 2002а, б). Важным вопросом качества является не только целостность образца, но и условия экстракции и сохраняющаяся целостность других тестовых реагентов. Такие реагенты, как готовые мастер-миксы для ПЦР, праймеры и зонды, необходимо постоянно контролировать, чтобы гарантировать сохранение их состава и концентраций. Наконец, оборудование, используемое во время извлечения, обнаружения и анализа образцов, необходимо протестировать как часть системы обеспечения качества.Например, пипетки необходимо постоянно калибровать, чтобы гарантировать точные объемы пипеток. Температуру термоциклера необходимо регулярно проверять, чтобы обеспечить точные условия цикла. Система обеспечения качества в любой лаборатории будет зависеть от того, получил ли тест одобрение регулирующих органов, используется ли он для научных или исследовательских исследований, или является ли это адаптированной процедурой из теста производителя. От того, как часто будет проводиться тестирование, также будет зависеть требуемый контроль качества (Krajden, 2005). Информационные технологииВажно понимать характер и охват используемой базы данных. Неполная или «загрязненная» база данных может привести к проблемам, особенно связанным с взломом или набором данных с помощью кластерного анализа. База данных NCBI — хороший источник генетической информации о многих различных организмах; однако во многих случаях необходимо проверять непроверенные или несвязанные последовательности. С другой стороны, количество доступных данных о последовательностях напрямую связано с уровнем чувствительности анализа при идентификации неизвестных агентов.Иногда эти данные требуются для разработки молекулярного диагностического теста. Без других лабораторий или исследовательских групп, желающих сотрудничать, получение точной информации может стать проблемой информатики. Многие молекулярные анализы и их результаты в настоящее время не интегрированы в лабораторные информационные системы (ЛИС). Они по-прежнему зависят от ручного анализа, который не стандартизирован и иногда более субъективен. Интерпретация результатов может варьироваться от лаборатории к лаборатории.Даже если некоторые из них интегрированы в LIS, выбор алгоритмов и аналитических методов, включая параметры и пороговые значения, по-прежнему остается проблемой, особенно при работе с пограничными образцами. Однако в этой области ожидаются многие разработки, поскольку преимущества для пациентов, а также расширение возможностей для анализа микробного генома очевидны. СтоимостьОдним из недостатков использования молекулярных методов является повышенная стоимость по сравнению с традиционными методами.Затраты на установку могут быть значительными, поскольку для уменьшения загрязнения обычно требуются специально спроектированные помещения и специальное оборудование. Требуемая аппаратура, например, термоциклеры, секвенаторы или машины реального времени, также дороги. Стоимость также варьируется в зависимости от типа используемого молекулярного метода. После завершения первоначальной настройки требуется финансирование для поддержания оптимальной работы анализов с улучшенным контролем качества. Базовые праймеры недороги, но зонды и специально разработанные праймеры, необходимые для повышения чувствительности и специфичности, увеличивают стоимость.Таким образом, общие затраты зависят от типа выполняемых анализов, но в целом этот вопрос представляет собой проблему. Существуют способы снижения затрат (например, объединение образцов) для скрининга образцов, но необходимы стратегии для решения проблемы финансирования. ВыводыНесмотря на то, что использование молекулярных методов сопряжено с большим количеством проблем, их можно решить. Использование этих методов для предоставления точной и своевременной информации медицинским работникам явно выгодно.Ожидается, что использование молекулярных методов будет постоянно расширяться, особенно в диагностической микробиологии и в лабораториях общественного здравоохранения геометрически. В ближайшее десятилетие это будет растущая отрасль. Использование молекулярных методов, отдельно или в сочетании с обычными методами, имеет большой потенциал для улучшения нашего успеха в продолжающейся войне с распространением и появлением инфекционных заболеваний во всем мире. БлагодарностиМы хотели бы поблагодарить Аллана Пиллэя из Центров по контролю и профилактике заболеваний в Атланте; Амелию Тринидад, лабораторную службу, Центр контроля заболеваний Британской Колумбии, и доктору Шону Бирну, Министерство сельского хозяйства, продовольствия и рыболовства Британской Колумбии, за то, что они нашли время, чтобы просмотреть нашу рукопись. Список литературы( 2004 )Использование внутреннего положительного контроля в мультиплексной ПЦР с обратной транскрипцией для обнаружения РНК вируса Западного Нила в пулах комаров .J Clin Microbiol 42 :841 —843 .и другие. . ( 2004 )Многоцентровая оценка рабочих характеристик Bayer VERSANT HCV RNA 3.0 анализ (бДНК) .J Clin Microbiol 42 :563 —569 .( 1996 )Передача вируса гепатита С кардиохирургом .N Engl J Med 334 :555 —560 .( 1997 )Влияние условий сбора, обработки и хранения образцов на стабильность уровней РНК вируса иммунодефицита человека типа 1 в плазме .J Clin Microbiol 35 :2886 —2893 .( 2000 )Влияние обработки и хранения крови на стабильность РНК вируса гепатита С: значение для тестирования NAT в практике переливания крови .Vox Sang 78 :137 —142 .( 1996 )Влияние различных условий обращения и хранения на количественное определение РНК вируса гепатита С .J Hepatol 25 :307 —311 .и другие. . ( 1996 )Передача вируса гепатита В нескольким пациентам от хирурга без доказательств недостаточного инфекционного контроля .N Engl J Med 334 :549 —554 .( 2004 )Молекулярная эпидемиология и инфекционные болезни .Эпидемиология инфекционных заболеваний: теория и практика (, ред.)Jones & Bartlett Publishers International ,Mississauga, ON .( 1991 )Ингибирование амплификации гена вируса иммунодефицита человека гепарином .J Clin Microbiol 29 :676 —679 .( 1995 )Сравнительная стабильность количественной РНК вируса иммунодефицита человека в плазме из образцов, собранных в пробирки VACUTAINER CPT, VACUTAINER PPT и стандартные пробирки VACUTAINER .J Clin Microbiol 33 :1562 —1566 .( 2005 )Преодоление разрыва между аналитической и клинической проверкой .Nucleic Acid Testing for Human Disease (, ed)Taylor & Francis ,Boca Raton, FL .( 1998 )Оценка стабильности ДНК вируса гепатита В в сыворотке с помощью анализа разветвленной ДНК Chiron quantiplex .J Clin Microbiol 36 :382 —386 .( 1999 )Влияние нескольких циклов замораживания-оттаивания на количественное определение ДНК вируса гепатита В и РНК вируса гепатита С, измеренное с помощью технологии разветвленной ДНК .J Clin Microbiol 37 :1683 —1686 .и другие. . ( 2000 )Быстрое обнаружение вируса Западного Нила в клинических образцах человека, собранных в полях комарах и образцах птиц с помощью анализа ПЦР с обратной транскриптазой Taqman. J Clin Microbiol 38 :4066 —4071 .( 2002a )Стабилизированные вирусные нуклеиновые кислоты в плазме как альтернативный способ доставки NAT .Переливание крови 42 :409 —413 .и другие. . ( 2002b )Факторы прогноза и ранняя предсказуемость устойчивого вирусного ответа на пегинтерферон альфа-2a (40KD) .J Hepatol 37 :500 —506 .и другие. . ( 2004 )Опыт французских лабораторий по обнаружению, генотипированию и количественному определению РНК вируса гепатита С — сыворотка .J Clin Microbiol 42 :2027 —2030 .( 2001 )Новые тесты на сифилис: рациональная разработка метода ПЦР для обнаружения Treponema pallidum в клинических образцах с использованием уникальных участков гена ДНК-полимеразы I. .J Clin Microbiol 39 :1941 —1946 .и другие. . ( 2004 )Устойчивость к макролидам у Treponema pallidum в США и Ирландии .N Engl J Med 351 :154 —158 .( 2002 )Инактивация вируса Западного Нила во время серологического тестирования и транспортировки .J Clin Microbiol 40 :3044 —3046 .( 2002 )Двухлетнее наблюдение за вспышками норволк-подобного вирусного гастроэнтерита в Британской Колумбии .CACMID ,Галифакс, Новая Шотландия ,Ноябрь ,2002 .( 2001 ) Тестирование на основе полимеразной цепной реакции ( pol A Gene) более чувствительно, чем микроскопия темного поля (DFM), для обнаружения Treponema pallidum Genital Ulcer Disease (GUD).Международный конгресс инфекций, передаваемых половым путем .2001 24–27 июня .Берлин, Германия .( 2006 )Распространение и характеристика изолятов Borrelia burgdorferi из Ixodes scapularis и присутствие у млекопитающих-хозяев в Онтарио, Канада .J Med Entomol 43 :762 —773 .( 1998 )Основы оценки качества методов молекулярной амплификации в клинической диагностике.Международная федерация клинической химии Комитет научного отдела по методам молекулярной биологии .Clin Chem 44 :12 —26 .( 1998 )Вирусная динамика гепатита С in vivo и противовирусная эффективность терапии интерфероном-альфа .Наука 282 :103 —107 .( 2000 )Многоцентровое исследование, посвященное оценке метода амплификации сигнала digene hybird capture II для обнаружения ДНК вируса гепатита B в образцах сыворотки и тестирования стандартов EUROHEP .J Clin Microbiol 38 :2150 —2155 .( 2004 )Выявление факторов, влияющих на реакцию на антиретровирусное лечение .Med Mal Infect 34 :37 —41 .( 1996 )Динамика вирусной инфекции гепатита B .Proc Natl Acad Sci USA 93 :4398 —4402 .и другие. . ( 1992 )Молекулярная эпидемиология передачи ВИЧ в стоматологической практике .Наука 256 :1165 —1171 .( 2004 )SYBR Green Количественный анализ ПЦР в реальном времени для обнаружения вируса Западного Нила позволяет обойти ложноотрицательные результаты из-за изменчивости штамма .J Clin Microbiol 42 :1511 —1518 .( 2003 )Быстрый диагностический тест в эпоху геномной биологии: обнаружение и идентификация инфекционных заболеваний и агентов биологического оружия .BioTechniques 35 :840 —846 .( 1998 )Молекулярное подтипирование Treponema pallidum подвидов pallidum .Sex Transm Dis 25 :408 —414 .( 1998 )Время возврата (TAT) для обнаружения Mycobacterium tuberculosis : влияние Bactec 460 и методов полимеразной цепной реакции .Abstr Intersci Conf Антимикробные агенты Chemother Intersci Conf Антимикробные агенты Chemother. 1998 24–27 сентября ;38 :163 ().( 2002 )Лабораторные анализы для диагностики и лечения вирусной инфекции гепатита С .J Clin Microbiol 40 :4407 —4412 .( 2001 )Молекулярная идентификация микроорганизмов от эндодонтических инфекций .J Clin Microbiol 39 :3282 —3289 .и другие. . ( 2001 )Высокопроизводительное обнаружение РНК вируса Западного Нила .J Clin Microbiol 39 :1264 —1271 .( 2003 )Роль молекулярной биологии и технологии нуклеиновых кислот в изучении инфекции человека и эпидемиологии .Arch Pathol Lab Med 127 :1098 —1105 .( 1999 )Бессимптомная первичная цитомегаловирусная инфекция: вирусологические и иммунологические особенности .J Инфекция Dis 180 :702 —707 .Заметки автора© 2007 Федерация европейских микробиологических обществ (PDF) Диагностические методы в молекулярной биологии — ОбзорMedRead J Fam Med — Том 1, выпуск 2 — 2020 — Страница — 07 Отправьте рукопись | www.med-read.org Издательская группа MedRead Очуко Оракпогенор Уолтер П. Выделение, клонирование и секвенирование ДНК. Молекулярная биология клетки.4-е издание. Нью-Йорк: Garland Science. 2002. 3. Аманн Р., Фукс Б. М. Идентификация отдельных клеток в микробных сообществах с помощью улучшенных флуоресцентных методов гибридизации in situ. Nature Reviews Микробиология. 2008; 6: 339-348. 4. Андорно Р. Право не знать: подход, основанный на автономии . Журнал медицинской этики. 2004; 30: 435-439. 5. Эпплтон Э., Тао Дж., Пикша Т., Денсмор Д.Интерактивные алгоритмы сборки для молекулярного клонирования. Природа Методы. 2014; 11: 657-662. 6. Атанасовская Б., Божиновский Г., Чакалова Л., Кочева С., Каранульски О., Пласеска-Караньская Д. Молекулярная Диагностика β-лалассемии. Балканский журнал Медицинская генетика. 2012; 15: 61-65. 7. Бахманн Б., Люк В., Хансманн Г. Улучшение секвенирования ПЦР-амплифицированной ДНК с помощью детергентов.Исследования нуклеиновых кислот. 1990; 18: 1309. 8. Басс Дж. Дж., Уилкинсон Д. Д., Ранкин Д., Филипс Б. Э., Шевчик, штат Нью-Джерси, Смит К. и др. al. Обзор технических аспектов для применения Вестерн-блоттинга в физиологических исследованиях. Скандинавский журнал Медицина и наука в спорте. 2017; 27: 4-25. 9. Басс Дж. Дж., Уилкинсон Д. Д., Рэнкин Д., Филлипс Б. Э., Шевчик Нью-Джерси, Смит К., Атертон П. Дж.. Обзор технических аспектов для приложений вестерн-блоттинга для физиологических исследований.Скандинавский журнал «Медицина и наука в спорте», 2016 г .; 27 (1): 4-25. 10. Bastida JM, Palma-Barqueros V, Lozano ML, Benito R, Vicente V, Hernández-Rivas JM, et. al. Современный подход к молекулярной диагностике наследственных нарушений кровотечения . Журнал молекулярной и генетической медицины . 2018; 12: 322-324. 11. Belloni E, Bonnomi E, Lahortiga I, Odero MD, Di Fiore PP, Pelicci PG.Спектральное кариотипирование (НЕБО). Ecancer Медицинская наука. 2010; 4: 181. 12. Бернаскони Б., Карамитополу-Диамантис Е., Торнилло Л., Лугли А., Ди Визио Д., Дирнхофер С. и др. др. Хромосомная нестабильность в слизистой оболочке желудка — ассоциированных лимфом лимфоидной ткани: флуоресцентное исследование in situ гибридизации с использованием тканевого микрочипа . Патология человека. 2008; 39: 536-542. 13. Бравин Дж., Кендалл Б.Судьи отменяют действие Джина Патентов. Получено Wall Street Journal. 2013. 14. Бреннан Д. Д., О’Коннор Д. П., Рекшепадж Э., Понтен Ф., Галлахер В. М.. Протеомика на основе антител: Fast- молекулярная диагностика в онкологии. Природа Отзывы Рак. 2010; 10: 605-617. 15. Брыксин А., Мацумура И. Расширение перекрытия Клонирование ПЦР: простой и надежный способ создания рекомбинантных плазмид.Биотехники. 2010; 48: 463-465. 16. Burkardt HJ. Пандемия h2N1 2009 («свиньи u»): Диагностические и другие проблемы. Экспертная оценка Молекулярная диагностика. 2011; 11: 35-40. 17. Бернс Дж. Р., Зейферт А., Фертиг Н., Ховорка С. Биометрический канал на основе ДНК для контролируемого лигандом транспорта заряженных молекулярных грузов через биологическую мембрану . Природа Нанотехнологии.2016; 11: 152-156. 18. Канберк С., Лонгатто-Филхо А., Шмитт Ф. Молекулярная диагностика инфекционных заболеваний с использованием цитологических образцов. Диагностическая цитопатология. 2016; 44: 156- 164. 19. Cariani A, Piano A, Consolandi C, Severgnini M, Castiglioni B, Caredda G, et. al. Обнаружение и характеристика патогенных вибрионов в оболочке с помощью подхода Ligation Detection Reaction-Universal Array .Международный журнал пищевой микробиологии 2012; 153 (3): 474-482. 20. Castaldo G, Nardiello P, Bellitti F, Santamaria R, Rocino A, Coppola A, et. al. Гемофилия B: от молекулярной диагностики до генной терапии. Клиническая Химия и лабораторная медицина. 2003; 41: 445- 451. 21. Choo SY. e HLA System: Genetics, Immunology, Clinical Testing, and Clinical Implications.Йонсей. Медицинский журнал. 2007; 48: 11-23. 22. Чу Й, Кори ДР. Секвенирование РНК: выбор платформы, план эксперимента и интерпретация данных. Nucleic Кислотная терапия. 2012; 22: 271-274. 23. Кларк Д.П., Паздерник, штат Нью-Джерси. Молекулярная биология, Academic Press-Cell, 2013; 928pp., ISBN 978-0-1237-8594-7. 24. Кон Д. В., Элтинг Дж. Дж., Фрик М., Элде Р. Селективная локализация секреторного белка паращитовидной железы-I / хромогранина мозгового вещества надпочечников семейства белков в большом разнообразии эндокринных клеток крысы. Эндокринология. 1984; 114: 1963–1974. 25. Дэвисон Дж. Генетические инструменты для псевдомонад, ризобий, и других грамотрицательных бактерий. Биотехники. 2002; 32: 386-401. 26. Дербишир К.М., Грей Т.А. Распределительный конъюгальный перенос : новые взгляды на горизонтальный перенос генов и генетический обмен у микобактерий. Микробиология Болезни и молекулярная диагностика: на шаг ближе к точной медицинеКан Ю.В., Ли К.Ю., Фурбетта М., Ангиус А., Цао А. Полиморфизм последовательности ДНК в области гена бета-глобина. Применение для пренатальной диагностики талассемии бета 0 на Сардинии. N Engl J Med. 1980. 302 (4): 185–8. CAS PubMed Статья Google Scholar Persselin JE, Stevens RH. Антитела против Fab у человека. Преобладание минорных подклассов иммуноглобулинов G при ревматоидном артрите. J Clin Invest. 1985. 76 (2): 723–30. CAS PubMed PubMed Central Статья Google Scholar Poste G. Молекулярная диагностика: новый мощный компонент цепочки создания стоимости в здравоохранении. Эксперт Rev Mol Diagn. 2001; 1 (1): 1–5. CAS PubMed Статья Google Scholar Маллис КБ, Фалуна Ф. Специфический синтез ДНК in vitro с помощью цепной реакции, катализируемой полимеразой.Методы Энзимол. 1987; 155: 335–50. CAS PubMed Статья Google Scholar Сайки Р.К., Гельфанд Д.Х., Стоффель С., Шарф С.Дж., Хигучи Р., Хорн Г.Т. и др. Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы. Наука. 1988. 239 (4839): 487–91. CAS PubMed Статья Google Scholar Сайки Р.К., Шарф С., Фалуна Ф., Маллис К.Б., Хорн Г.Т., Эрлих Х.А. и др.Ферментативная амплификация геномных последовательностей бета-глобина и анализ сайтов рестрикции для диагностики серповидноклеточной анемии. Наука. 1985. 230 (4732): 1350–4. CAS PubMed Статья Google Scholar Сайки РК, Бугаван Т.Л., Хорн ГТ, Маллис КБ, Эрлих HA. Анализ ферментативно амплифицированной ДНК бета-глобина и HLA-DQ альфа с аллель-специфическими олигонуклеотидными зондами. Природа. 1986. 324 (6093): 163–6. CAS PubMed Статья Google Scholar Хигучи Р., Фоклер С., Доллингер Г., Уотсон Р. Анализ кинетической ПЦР: мониторинг реакций амплификации ДНК в реальном времени. Biotechnol Nat Publ Co., 1993; 11 (9): 1026–30. CAS Статья Google Scholar Машал Р.Д., Кунц Дж., Склар Дж. Обнаружение мутаций путем расщепления гетеродуплексов ДНК резольвазами бактериофагов. Нат Жене. 1995. 9 (2): 177–83. CAS PubMed Статья Google Scholar Saleeba JA, Ramus SJ, Cotton RG. Полное обнаружение мутации с использованием немеченого химического расщепления. Hum Mutat. 1992; 1 (1): 63–9. CAS PubMed Статья Google Scholar Ландегрен Ю., Кайзер Р., Сандерс Дж., Худ Л. Метод обнаружения генов, опосредованных лигазой. Наука. 1988. 241 (4869): 1077–80. CAS PubMed Статья Google Scholar Orita M, Iwahana H, Kanazawa H, Hayashi K, Sekiya T. Обнаружение полиморфизмов ДНК человека с помощью гель-электрофореза как однонитевых конформационных полиморфизмов. Proc Natl Acad Sci USA. 1989. 86 (8): 2766–70. CAS PubMed PubMed Central Статья Google Scholar Сайки Р.К., Уолш П.С., Левенсон С.Х., Эрлих А.А. Генетический анализ амплифицированной ДНК с иммобилизованными последовательностями олигонуклеотидных зондов. Proc Natl Acad Sci USA.1989. 86 (16): 6230–4. CAS PubMed PubMed Central Статья Google Scholar Чан К., Вонг М.С., Чан Т.К., Чан В. Набор талассемии для Юго-Восточной Азии. Br J Haematol. 2004. 124 (2): 232–9. CAS PubMed Статья Google Scholar Fan J-B, Gunderson KL, Bibikova M, Yeakley JM, Chen J, Wickham Garcia E, et al. Универсальные бусины Illumina.Методы Энзимол. 2006; 410: 57–73. CAS PubMed Статья Google Scholar Сосновски Р.Г., Ту Э, Батлер В.Ф., О’Коннелл Дж. П., Хеллер М.Дж. Быстрое определение мутаций несоответствия одного основания в гибридах ДНК с помощью прямого контроля электрического поля. Proc Natl Acad Sci USA. 1997. 94 (4): 1119–23. CAS PubMed PubMed Central Статья Google Scholar Ронаги М., Улен М., Нирен П. Метод секвенирования на основе пирофосфата в реальном времени. Наука. 1998. 281 (5375): 363–5. CAS PubMed Статья Google Scholar Rohde A, Hammerl JA, Appel B, Dieckmann R, Al Dahouk S. РЫБА на бактерии в пищевых продуктах: многообещающий инструмент для надежного обнаружения патогенных бактерий? Food Microbiol. 2015; 46: 395–407. CAS PubMed Статья Google Scholar Cui C, Shu W, Li P. Флуоресцентная гибридизация in situ: генетическая диагностика и исследования на основе клеток. Front Cell Dev Biol. 2016; 4: 89. PubMed PubMed Central Статья Google Scholar Шах Дж., Велтман Х., Нарцисо П., Мерфи К., Порури А., Балига С. и др. Двухцветная флуоресцентная гибридизация in situ (FISH) для обнаружения комплексов Mycobacterium tuberculosis и Mycobacterium avium и родственных патогенов в культурах.PLoS ONE. 2017; 12 (4): e0174989. PubMed PubMed Central Статья CAS Google Scholar Nolte FS. Влияние тестирования на вирусную нагрузку на лечение пациентов. Arch Pathol Lab Med. 1999. 123 (11): 1011–4. CAS PubMed Google Scholar Вудс ГЛ. Молекулярные методы обнаружения микобактерий. Arch Pathol Lab Med. 2001. 125 (1): 122–6. CAS PubMed Google Scholar Nübel U, Schmidt PM, Reiss E, Bier F, Beyer W., Naumann D. Олигонуклеотидный микрочип для идентификации Bacillus anthracis на основе межгенных транскрибированных спейсеров в рибосомной ДНК. FEMS Microbiol Lett. 2004. 240 (2): 215–23. PubMed Статья CAS Google Scholar Хуанг А., Ли Дж-В, Шен З-К, Ван Х-З, Джин М. Высокопроизводительная идентификация клинических патогенных грибов путем гибридизации с олигонуклеотидным микрочипом.J Clin Microbiol. 2006. 44 (9): 3299–305. CAS PubMed PubMed Central Статья Google Scholar Spiess B, Seifarth W., Hummel M, Frank O, Fabarius A, Zheng C, et al. Обнаружение и идентификация грибковых патогенов на основе микрочипов ДНК в клинических образцах от пациентов с нейтропенией. J Clin Microbiol. 2007. 45 (11): 3743–53. CAS PubMed PubMed Central Статья Google Scholar You Y, Fu C, Zeng X, Fang D, Yan X, Sun B и др. Новый микрочип ДНК для быстрой диагностики энтеропатогенных бактерий в образцах стула пациентов с диареей. J Microbiol Methods. 2008. 75 (3): 566–71. CAS PubMed Статья Google Scholar Султанкулова К.Т., Кожабергенов Н.С., Строчков В.М., Бурашев Ю.Д., Шораева К.А., Червякова О.В. и др. Новый олигонуклеотидный микрочип для быстрой диагностики вирусных заболеваний птиц.Вирол Дж. 2017; 14 (1): 69. PubMed PubMed Central Статья Google Scholar Морита А. Клиническая и лабораторная диагностика инфекций центральной нервной системы. Мозговой нерв Shinkei Kenkyu No Shinpo. 2015; 67 (7): 777–85. PubMed Google Scholar Долан Томас Дж., Хэтчер С.П., Саттерфилд Д.А., Теодор М.Дж., Бах М.К., Линскотт К.Б. и др. ПЦР в реальном времени на основе sodC для обнаружения Neisseria meningitidis.PLoS ONE. 2011; 6 (5): e19361. PubMed PubMed Central Статья CAS Google Scholar Hoffman T, Rock K, Mugizi DR, Muradrasoli S, Lindahl-Rajala E, Erume J, et al. Молекулярное обнаружение и характеристика видов Brucella в сыром неофициально продаваемом молоке из Уганды. Infect Ecol Epidemiol. 2016; 6: 32442. PubMed Статья Google Scholar Zarrinfar H, Mirhendi H, Fata A, Khodadadi H, Kordbacheh P. Обнаружение Aspergillus flavus и A. fumigatus в образцах бронхоальвеолярного лаважа трансплантатов гемопоэтических стволовых клеток и гематозных цепных злокачественных новообразованиях у пациентов с полициклическими заболеваниями в реальном времени ПЦР и микологические анализы. Jundishapur J Microbiol. 2015; 8 (1): e13744. PubMed Google Scholar Jiang L, Ren H, Zhou H, Qin T, Chen Y.Одновременное обнаружение девяти основных бактериальных респираторных патогенов с помощью технологии Luminex xTAG ® . Int J Environ Res Public Health. 2017; 14 (3): 223. PubMed Central Статья Google Scholar Брэнсон Б.М. Будущее тестирования на ВИЧ. J Acquir Immune Defic Syndr 1999. 2010; 55 (Приложение 2): S102–5. Артикул Google Scholar Фибиг Э. У., Райт Д. Д., Равал Б. Д., Гаррет П. Е., Шумахер Р. Т., Педдада Л. и др.Динамика ВИЧ-виремии и сероконверсии антител у доноров плазмы: значение для диагностики и определения стадии первичной ВИЧ-инфекции. AIDS Lond Engl. 2003. 17 (13): 1871–189. Артикул Google Scholar Джакетти К., Линнен Дж. М., Колк Д. П., Доктер Дж., Джиллот-Тейлор К., Парк М. и др. Высокочувствительный мультиплексный анализ для обнаружения РНК вируса иммунодефицита человека 1 типа и вируса гепатита С. J Clin Microbiol. 2002. 40 (7): 2408–19. CAS PubMed PubMed Central Статья Google Scholar Rouet F, Montcho C, Rouzioux C, Leroy V, Msellati P, Kottan JB, et al. Ранняя диагностика детской инфекции ВИЧ-1 среди африканских детей, находящихся на грудном вскармливании, с использованием количественного анализа РНК ВИЧ в плазме. AIDS Lond Engl. 2001. 15 (14): 1849–56. CAS Статья Google Scholar Ford N, Nachega JB, Engel ME, Mills EJ.Антиретровирусная терапия под прямым наблюдением: систематический обзор и метаанализ рандомизированных клинических исследований. Lancet Lond Engl. 2009. 374 (9707): 2064–71. Артикул Google Scholar Wang Z, Trillo-Pazos G, Kim S.Y, Canki M, Morgello S, Sharer LR, et al. Влияние вируса иммунодефицита человека 1 типа на экспрессию и функцию гена астроцитов: потенциальная роль в нейропатогенезе. J Neurovirol. 2004; 10 (Дополнение 1): 25–32. PubMed Статья Google Scholar Гири М.С., Небожин М, Шове Л., Монтанер Л.Дж. Данные микрочипов о модуляции генов ВИЧ-1 в иммунных клетках: 2000–2006 гг. J Leukoc Biol. 2006. 80 (5): 1031–43. CAS PubMed Статья Google Scholar Лю Д. Молекулярные подходы к идентификации патогенных и непатогенных листерий. Microbiol Insights. 2013; 6: 59–69. CAS PubMed PubMed Central Статья Google Scholar Boughner LA, Singh P. Экология микробов: где мы сейчас? Postdoc J J Postdr Res Postdr Aff. 2016; 4 (11): 3–17. Google Scholar Салдарриага В., Тассоне Ф., Гонсалес-Тешима Л.Ю., Фореро-Фореро СП, Аяла-Сапата С., Хагерман Р. Синдром ломкой Х-хромосомы. Коломб Медика Кали Коломб. 2014. 45 (4): 190–8. Google Scholar Amancio AP, de Melo CAO, de Vieira AM, Minasi LB, de Silva DME, da Silva CC, et al.Молекулярный анализ пациентов с подозрением на синдром ломкой Х-хромосомы. Genet Mol Res GMR. 2015; 14 (4): 14660–9. CAS PubMed Статья Google Scholar Тассон Ф. Передовые технологии молекулярной диагностики синдрома ломкой Х-хромосомы. Эксперт Rev Mol Diagn. 2015; 15 (11): 1465–73. PubMed PubMed Central Статья CAS Google Scholar Maher ER. Болезнь фон Хиппеля – Линдау. Curr Mol Med. 2004. 4 (8): 833–42. CAS PubMed Статья Google Scholar Crossey PA, Eng C, Ginalska-Malinowska M, Lennard TW, Wheeler DC, Ponder BA, et al. Молекулярно-генетическая диагностика болезни фон Гиппеля – Линдау при семейной феохромоцитоме. J Med Genet. 1995. 32 (11): 885–6. CAS PubMed PubMed Central Статья Google Scholar Hasani-Ranjbar S, Amoli MM, Ebrahim-Habibi A, Haghpanah V, Hejazi M, Soltani A, et al. Скрининг мутаций гена VHL в семье со злокачественной двусторонней феохромоцитомой: от изолированной семейной феохромоцитомы до болезни фон Хиппеля – Линдау. Fam Cancer. 2009. 8 (4): 465–71. CAS PubMed Статья Google Scholar Эльборн Ж.С. Муковисцидоз. Lancet Lond Engl. 2016; 388 (10059): 2519–31. CAS Статья Google Scholar Fanen P, Wohlhuter-Haddad A, Hinzpeter A. Генетика муковисцидоза: классификации мутаций CFTR в отношении методов лечения МВ на основе генотипа. Int J Biochem Cell Biol. 2014; 52: 94–102. CAS PubMed Статья Google Scholar Чанг Э. Х., Забнер Дж. Прецизионная геномная медицина при муковисцидозе. Clin Transl Sci. 2015; 8 (5): 606–10. PubMed PubMed Central Статья Google Scholar Langfelder-Schwind E, Karczeski B, Strecker MN, Redman J, Sugarman EA, Zaleski C, et al. Практические рекомендации по молекулярному тестированию статуса носителя муковисцидоза: рекомендации Национального общества консультантов по генетике. Дженет Коунс. 2014; 23 (1): 5–15. PubMed Статья Google Scholar Фьюз Н. Генетические основы глаукомы. Tohoku J Exp Med. 2010. 221 (1): 1–10. CAS PubMed Статья Google Scholar Чен Й, Цзян Д., Ю Л, Кац Б., Чжан К., Ван Б. и др. Мутации CYP1B1 и MYOC у 116 китайских пациентов с первичной врожденной глаукомой. Arch Ophthalmol Chic Ill 1960. 2008; 126 (10): 1443–7. CAS Статья Google Scholar Дюфье Дж. Л., Розет Дж. М., Каплан Дж., Рош О. От врожденной глаукомы до хронической открытоугольной глаукомы в зрелом возрасте: клинический и генетический континуум. Bull Acad Natl Med. 2013; 197 (1): 133–9 (обсуждение 140–141) . PubMed Google Scholar Ratnapriya R, Chew EY. Клинический обзор возрастной дегенерации желтого пятна и обновление генетики. Clin Genet. 2013. 84 (2): 160–6. CAS PubMed PubMed Central Статья Google Scholar Велес-Монтойя Р., Оливер СКН, Олсон Дж. Л., Файн С.Л., Кирос-Меркадо Х., Мандава Н. Современные знания и тенденции возрастной дегенерации желтого пятна: генетика, эпидемиология и профилактика.Сетчатка. 2014. 34 (3): 423–41. CAS PubMed Статья Google Scholar Daiger SP, Sullivan LS, Bowne SJ. Гены и мутации, вызывающие пигментный ретинит. Clin Genet. 2013. 84 (2): 132–41. CAS PubMed Статья Google Scholar Йунг К.Ю., Баум Л., Чан В.М., Лам Д.С., Квок А.К., Панг С.П. Молекулярная диагностика пигментного ретинита.Clin Chim Acta Int J Clin Chem. 2001. 313 (1-2): 209-15. CAS Статья Google Scholar Pang CP, Lam DSC. Дифференциальная встречаемость мутаций, вызывающих заболевания глаз, у населения Китая. Hum Mutat. 2002. 19 (3): 189–208. CAS PubMed Статья Google Scholar Коллинз С.Дж., Лоусон В.А., магистр КЛ. Трансмиссивные губчатые энцефалопатии.Lancet Lond Engl. 2004. 363 (9402): 51–61. CAS Статья Google Scholar Канселотти Э., Махал С.П., Сомервилль Р., Диак А., Браун Д., Пиккардо П. и др. Посттрансляционные изменения PrP изменяют свойства штамма трансмиссивной губчатой энцефалопатии. EMBO J. 2013; 32 (5): 756–69. CAS PubMed PubMed Central Статья Google Scholar Бикс М. Вариант болезни Крейтцфельда-Якоба (vCJD): эпидемиология и профилактика вторичной передачи от человека человеку. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2010. 53 (6): 597–605. CAS PubMed Статья Google Scholar Wadsworth JD, Joiner S, Hill AF, Campbell TA, Desbruslais M, Luthert PJ, et al. Распределение в тканях протеазоустойчивого прионного белка при варианте болезни Крейтцфельдта – Якоба с использованием высокочувствительного иммуноблоттинга.Lancet Lond Engl. 2001. 358 (9277): 171–80. CAS Статья Google Scholar Зануссо Г., Поло А., Фаринаццо А., Нонно Р., Кардоне Ф., Ди Бари М. и др. Новая конформация прионного белка и гликотип при болезни Крейтцфельдта – Якоба. Arch Neurol. 2007. 64 (4): 595–9. PubMed Статья Google Scholar Kramer ML, Bartz JC. Быстрое и высокопроизводительное обнаружение PrPSc с помощью 96-луночного иммуноанализа.Прион. 2009. 3 (1): 44–8. CAS PubMed PubMed Central Статья Google Scholar Будет РГ. Вариант болезни Крейтцфельдта – Якоба. J Neurol Neurosurg Psychiatry. 2002. 72 (3): 285–6. CAS PubMed PubMed Central Статья Google Scholar Сальвадорес Н., Шахнаваз М., Скарпини Е., Тальявини Ф., Сото С. Обнаружение неправильно свернутых олигомеров Aβ для чувствительной биохимической диагностики болезни Альцгеймера.Cell Rep.2014; 7 (1): 261–8. CAS PubMed Статья Google Scholar Zhang B, Gaiteri C, Bodea L-G, Wang Z, McElwee J, Podtelezhnikov AA, et al. Интегрированный системный подход позволяет выявлять генетические узлы и сети при болезни Альцгеймера с поздним началом. Клетка. 2013. 153 (3): 707–20. CAS PubMed PubMed Central Статья Google Scholar Марон Б.Дж., Марон М.С. Гипертрофическая кардиомиопатия. Lancet Lond Engl. 2013. 381 (9862): 242–55. Артикул Google Scholar Zou Y, Wang J, Liu X, Wang Y, Chen Y, Sun K и др. Множественные генные мутации, а не тип мутации, являются модификатором гипертрофии левого желудочка у пациентов с гипертрофической кардиомиопатией. Mol Biol Rep., 2013; 40 (6): 3969–76. CAS PubMed Статья Google Scholar Fujita E, Nakanishi T, Nishizawa T., Hagiwara N, Matsuoka R. Мутации в гене сердечного тропонина T показывают различные прогнозы у японских пациентов с гипертрофической кардиомиопатией. Сердечные сосуды. 2013. 28 (6): 785–94. PubMed PubMed Central Статья Google Scholar Tester DJ, Ackerman MJ. Генетика синдрома удлиненного интервала QT. Метод DeBakey Cardiovasc J. 2014; 10 (1): 29–33. Артикул Google Scholar Радке Р.М., Баумгартнер Х. Диагностика и лечение синдрома Марфана: обновленная информация. Heart Br Card Soc. 2014; 100 (17): 1382–91. Google Scholar Зейер К.А., Рейнхардт Д.П. Сконструированные мутации фибриллина-1, приводящие к синдрому Марфана, действуют на белковом, клеточном и организменном уровнях. Mutat Res, Rev Mutat Res. 2015; 765: 7–18. CAS Статья Google Scholar Афтимос П.Г., Бартелеми П., Авада А. Молекулярная биология в медицинской онкологии: диагностика, прогноз и точная медицина. Discov Med. 2014. 17 (92): 81–91. PubMed Google Scholar Харви П., Басуита А., Эндерсби Д., Кертис Б., Яковиду А., Уокер М. Систематический обзор диагностической точности специфического антигена простаты. BMC Urol. 2009; 10 (9): 14. Артикул CAS Google Scholar Двиведи С., Гоэль А., Хаттри С., Мандхани А., Шарма П., Мисра С. и др. Генетическая изменчивость промоторов IL-18 (про) и IL-10 (против) воспалительного гена влияет на восприимчивость и их уровни в сыворотке крови: исследовательское исследование пациентов с раком простаты в популяциях Северной Индии. Цитокин. 2015; 74 (1): 117–22. CAS PubMed Статья Google Scholar Ma Y, Li Y, Cui H, Liang X, Tang Z, Li X и др.Переоценка интервальной операции по удалению объёма при запущенном эпителиальном раке яичников. Чжунхуа Фу Чан Кэ За Чжи. 2012. 47 (5): 355–60. PubMed Google Scholar Уиллард С.С., Кочекпур С. Регуляторы экспрессии генов как биомаркеры рака простаты. Am J Cancer Res. 2012. 2 (6): 620–57. CAS PubMed PubMed Central Google Scholar Росс-Адамс Х., Болл С., Лоуренсон К., Халим С., Рассел Р., Уэллс С. и др.Варианты HNF1B связаны с метилированием промотора и регулируют генные сети, активируемые при раке простаты и яичников. Oncotarget. 2016; 7 (46): 74734–46. PubMed PubMed Central Google Scholar Tomlins SA, Aubin SMJ, Siddiqui J, Lonigro RJ, Sefton-Miller L, Miick S, et al. TMPRSS2 в моче: расшифровка слияния ERG стратифицирует риск рака простаты у мужчин с повышенным уровнем ПСА в сыворотке. Sci Transl Med. 2011; 3 (94): 94ra72. CAS PubMed PubMed Central Статья Google Scholar Srivastava A, Goldberger H, Afzal Z, Suy S, Collins SP, Kumar D. Обнаружение циркулирующих микроРНК при раке простаты. Методы Мол Биол Клифтон, штат Нью-Джерси. 2015; 1238: 523–38. Артикул Google Scholar Dwivedi S, Goel A, Mandhani A, Khattri S, Sharma P, Misra S, et al. Функциональная генетическая изменчивость промоторов про (ИЛ-18) и анти- (ИЛ-10) воспалительного процесса влияет на экспрессию их мРНК и выживаемость у пациентов с карциномой простаты: последующее пятилетнее исследование.Простата. 2015; 75 (15): 1737–46. CAS PubMed Статья Google Scholar Митчелл П.С., Паркин Р.К., Крох Е.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Е.Л. и др. Циркулирующие микроРНК как стабильные маркеры крови для обнаружения рака. Proc Natl Acad Sci USA. 2008. 105 (30): 10513–8. CAS PubMed PubMed Central Статья Google Scholar Дрейк Р.Р., Кислингер Т. Протеомика экзосом рака простаты. Эксперт Rev Proteomics. 2014; 11 (2): 167–77. CAS PubMed Статья Google Scholar Dwivedi S, Goel A, Natu SM, Mandhani A, Khattri S, Pant KK. Диагностическое и прогностическое значение простатоспецифического антигена и сывороточного интерлейкина 18 и 10 у пациентов с местнораспространенным раком простаты: проспективное исследование. Азиатский Pac J Cancer Предыдущий APJCP.2011; 12 (7): 1843–8. PubMed Google Scholar Двиведи С., Шукла К.К., Гупта Г., Шарма П. Неинвазивный биомаркер рака простаты: новый подход. Индийский J Clin Biochem IJCB. 2013. 28 (2): 107–9. PubMed Статья Google Scholar Dwivedi S, Goel A, Khattri S, Mandhani A, Sharma P, Pant KK. Воздействие табака различными способами может изменять провоспалительные (IL-12) и противовоспалительные (IL-10) уровни и влиять на выживаемость пациентов с карциномой простаты: исследовательское исследование среди населения Северной Индии.Biomed Res Int. 2014; 2014: 158530. PubMed PubMed Central Статья CAS Google Scholar Dwivedi S, Singh S, Goel A, Khattri S, Mandhani A, Sharma P, et al. Генетические варианты про- (IL-18) и анти- (IL-10) воспалительных промоторов (внутренние факторы) при воздействии табака (внешние факторы) могут влиять на восприимчивость и тяжесть карциномы простаты: проспективное исследование. Азиатский Pac J Cancer Предыдущий APJCP. 2015; 16 (8): 3173–81. PubMed Статья Google Scholar Dwivedi S, Goel A, Mandhani A, Khattri S, Pant KK. Воздействие табака может усилить воспаление у пациентов с карциномой простаты: исследовательское исследование среди населения Северной Индии. Toxicol Int. 2012. 19 (3): 310–8. PubMed PubMed Central Статья CAS Google Scholar Dwivedi S, Goel A, Khattri S, Sharma P, Pant KK.Обострение воспаления от бездымного табака по сравнению с курительным табаком. Индийский J Clin Biochem IJCB. 2015; 30 (1): 117–9. PubMed Статья Google Scholar Каттан М.В., Истхэм Дж. Алгоритмы рецидива простат-специфического антигена после лечения локализованного рака простаты. Clin рака простаты. 2003. 1 (4): 221–6. PubMed Статья Google Scholar Кришнамурти У, Сильверман Дж. Ф. HER2 при раке груди: обзор и обновление. Adv Anat Pathol. 2014; 21 (2): 100–7. CAS PubMed Статья Google Scholar Zhao L, Zhu S, Gao Y, Wang Y. Соотношение экспрессии двух генов в качестве предиктора рака груди, полученного тамоксифеном: данные метаанализа. Tumor Biol. 2014; 35 (4): 3113–7. CAS PubMed Статья Google Scholar Rajput AB, Hu N, Varma S, Chen C-H, Ding K, Park PC и др. Иммуногистохимическая оценка экспрессии центромерного белка-A (CENPA) при инвазивном раке молочной железы человека. Раки. 2011. 3 (4): 4212–27. CAS PubMed PubMed Central Статья Google Scholar Buyse M, Loi S, van’t Veer L, Viale G, Delorenzi M, Glas AM и др. Подтверждение и клиническая полезность прогностической сигнатуры из 70 генов для женщин с раком молочной железы без лимфоузлов.J Natl Cancer Inst. 2006. 98 (17): 1183–92. CAS PubMed Статья Google Scholar Кип М., Монтебан Х., Стейтен Л. Долгосрочная экономическая эффективность Oncotype DX ® по сравнению с текущей клинической практикой с точки зрения затрат в Нидерландах. J Comp Eff Res. 2015; 4 (5): 433–45. PubMed Статья Google Scholar Иорио М.В., Феррачин М., Лю С.Г., Веронезе А., Спиццо Р., Саббиони С. и др.Нарушение регуляции экспрессии генов микроРНК при раке груди человека. Cancer Res. 2005. 65 (16): 7065–70. CAS PubMed Статья Google Scholar Wang W, Luo Y. МикроРНК при раке груди: онкогены и опухолевые супрессоры с клиническим потенциалом. J Zhejiang Univ Sci B. 2015; 16 (1): 18–31. CAS PubMed PubMed Central Статья Google Scholar Хенсинг Т., Чавла А., Батра Р., Салгия Р. Персонализированное лечение рака легких: молекулярные пути, таргетная терапия и геномная характеристика. Adv Exp Med Biol. 2014; 799: 85–117. CAS PubMed Статья Google Scholar Сеть исследований атласа генома рака. Комплексный геномный анализ рака яичников. Природа. 2011. 474 (7353): 609–15. Артикул CAS Google Scholar Clamon GH, Bossler AD, Abu Hejleh T., Furqan M. Мутации зародышевой линии, предрасполагающие к немелкоклеточному раку легких. Fam Cancer. 2015; 14 (3): 463–9. CAS PubMed Статья Google Scholar Black RC, Хуршид Х. НМРЛ: обновленная информация о мутациях-драйверах, их роли в патогенезе и клиническом значении. RI Med J. 2015; 98 (10): 25–8. Google Scholar Gomes CC, Fonseca-Silva T, Galvão CF, Friedman E, De Marco L, Gomez RS. Молекулярная гетерогенность лейкоплакии полости рта между и внутри очагов поражения. Oral Oncol. 2015; 51 (2): 178–81. CAS PubMed Статья Google Scholar Rosin MP, Poh CF, Guillard M, Williams PM, Zhang L, MacaUlay C. Визуализация и другие появляющиеся технологии как факторы изменений в профилактике рака полости рта. Ann N Y Acad Sci. 2007; 1098: 167–83. CAS PubMed Статья Google Scholar Томсон П.Дж., Хамада О. Рак в полости рта: использование «полевой биопсии картирования» в клиническом ведении. Oral Oncol. 2007. 43 (1): 20–6. CAS PubMed Статья Google Scholar Rosas SL, Koch W, da Costa Carvalho MG, Wu L, Califano J, Westra W, et al. Паттерны гиперметилирования промотора p16, O6-метилгуанин-ДНК-метилтрансферазы и ассоциированной со смертью протеинкиназы в опухолях и слюне пациентов с раком головы и шеи.Cancer Res. 2001. 61 (3): 939–42. CAS PubMed Google Scholar Канифоль М.П., Лам В.Л., Пох С., Ле Н.Д., Ли Р.Дж., Цзэн Т. и др. 3p14 и 9p21 Loss — простой инструмент для прогнозирования второго злокачественного новообразования полости рта на ранее леченных участках рака полости рта. Cancer Res. 2002; 62: 6447–50. CAS PubMed Google Scholar Zimmermann BG, Wong DT. Мишени мРНК слюны для диагностики рака.Oral Oncol. 2008. 44 (5): 425–9. CAS PubMed Статья Google Scholar Ahmed MU, Saaem I, Wu PC, Brown AS. Персонализированная диагностика и биосенсоры: обзор биологии и технологий, необходимых для персонализированной медицины. Crit Rev Biotechnol. 2014. 34 (2): 180–96. PubMed Статья CAS Google Scholar Regierer B, Zazzu V, Sudbrak R, Kühn A, Lehrach H.Будущее медицины: модели в предиктивной диагностике и персонализированной медицине. Adv Biochem Eng Biotechnol. 2013; 133: 15–33. PubMed Google Scholar Двиведи С., Ядав С.С., Сингх М.К., Шукла С., Хаттри С., Пант К.К. Фармакогеномика вирусных болезней. В: Барх Д., Дхаван Д., Гангули Н., редакторы. Омикс для персонализированной медицины. Нью-Дели: Спрингер; 2013. с. 637–76. Глава Google Scholar Двиведи С., Гоэль А., Садашив, Верма А., Шукла С., Шарма П. и др. Молекулярная диагностика метастазирующего рака молочной железы на основе жидкостной биопсии. В: Барх Д., редактор. Omics подходит для лечения рака груди. Нью-Дели: Спрингер; 2014. с. 425–59. Шарма П., Двиведи С. Перспективы молекулярной биотехнологии в диагностике: шаг к точной медицине. Индийский J Clin Biochem IJCB. 2017; 32 (2): 121–3. PubMed Статья Google Scholar Сингх Б.П., Двиведи С., Дхакад У., Мурти Р.С., Чуби В.К., Гоэль А. и др. Состояние и взаимосвязь цинка, меди, железа, кальция и селена при раке простаты. Индийский J Clin Biochem IJCB. 2016; 31 (1): 50–6. CAS PubMed Статья Google Scholar Dwivedi S, Shukla S, Goel A, Sharma P, Khattri S, Pant KK. Нутригеномика при раке груди. В: Барх Д., редактор. Omics подходит для лечения рака груди. Нью-Дели: Спрингер; 2014 г.п. 127–51. Google Scholar Dwivedi S, Khattri S, Pant KK. Последние достижения в молекулярной диагностике микробных заболеваний. В: Тивари С.П., Шарма Р., Сингх Р.К., редакторы. Последние достижения микробиологии, т. 1. Нью-Йорк: Нова; 2013. с. 133–54. Google Scholar |

