Лейшмании (Leischmania)
ЛЕЙШМАНИИ
Leischmania donovani – возбудитель общего (висцерального) лейшманиоза, Leischmania tropica – кожного лейшманиоза, а Leischmania brasiliensis – кожно-слизистого лейшманиоза.
Лейшманиозы – трансмиссивные природно-очаговые заболевания. Висцеральный лейшманиоз распространен в странах Средиземноморья, Средней и Южной Азии, Африки и Южной Америки. Кожный лейшманиоз встречается в странах Южной Европы, Северной и Западной Африки, Ближнего Востока, Центральной и Южной Азии. Основной очаг кожнослизистого лейшманиоза находится в Южной и Центральной Америке.
Морфологические особенности (рис. 8): есть 2 формы – промастигота (имеет жгутик, отходящий от кинетопласта и размеры до 10-20 мкм) и амастигота (безжгутиковая округлая или овальная форма, размер – 3-5 мкм). Все возбудители лейшманиоза морфологически сходны, но имеют биохимические и антигенные различия.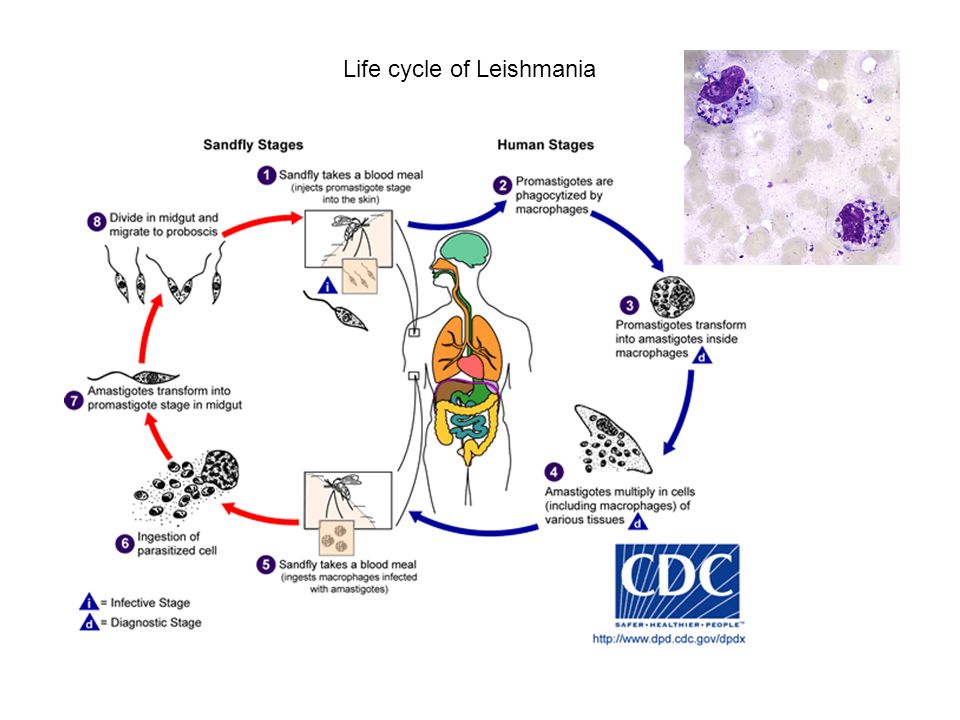
Рис. 8. Морфология возбудителей лейшманиозов и их переносчика. А – схема,
Б – жгутиковая форма (7х40), В – безжгутиковая форма внутри макрофага (7х40), Г – москит
Жизненный цикл (рис.9): специфическими переносчиками лейшманий являются москиты р. Phlebotomus, у которых паразиты размножаются в пищеварительном тракте и накапливаются в хоботке. В организме переносчика образуется жгутиковая стадия – промастигота. Заражение человека происходит при укусах москитом (трансмиссивный путь). В организме человека и других позвоночных (рептилии,
млекопитающие) лейшмании теряют жгутик, превращаются в амастиготы, переходят к внутриклеточному паразитированию и интенсивно размножаются.
Природными резервуарами L. donovani могут быть шакалы, собаки, грызуны, L. tropica – грызуны, L. braziliensis – грызуны, обезьяны, ленивцы.
Рис. 9. Жизненный цикл возбудителей лейшманиозов
ВИСЦЕРАЛЬНЫЙ ЛЕЙШМАНИОЗ (черная болезнь, лихорадка дум-дум, кала-азар, детский лейшманиоз)
Эти заболевания вызывают L.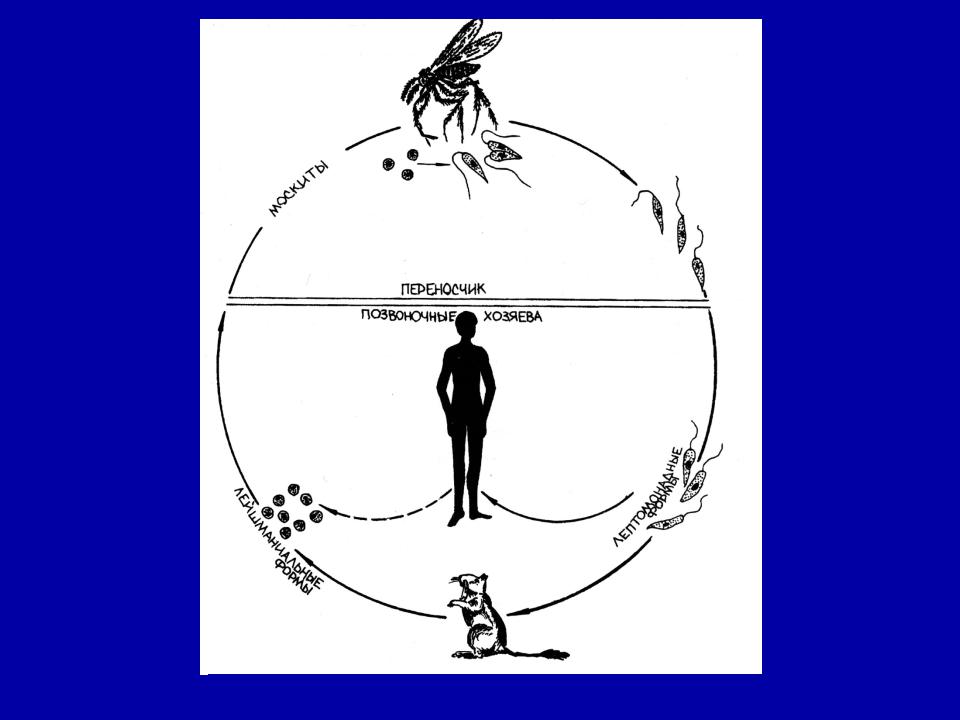 donovani и L. infantum.
donovani и L. infantum.
Патогенное действие:
Механическое (разрушение клеток печени, селезенки, лимфатических узлов, красного костного мозга).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Инкубационный период длится от нескольких недель до 6-8 месяцев. Характерные симптомы: лихорадка неправильного типа, слабость, головная боль, интоксикация, истощение, пигментация кожи, сыпь, увеличение печени и селезенки, анемия. Болеют висцеральным лейшманиозом чаще дети. Перенесенные лейшманиозы дают стойкий
иммунитет.
Лабораторная диагностика: обнаружение лейшманий в пунктатах костного мозга (грудина), лимфатических узлов, иногда печени или селезенки.
Применяются иммунологические методы исследований (определение антител в сыворотке крови больных).
КОЖНЫЙ ЛЕЙШМАНИОЗ (пендинка, восточная язва)
Это заболевание вызывают 2 вида лейшманий: L. tropica major и L.tropica minor.
Патогенное действие:
Механическое (разрушение клеток кожи).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Характерные симптомы: небольшие эритематозные бугорки, которые появляются на коже через 2-6 недель после укуса москита. Позже формируется возвышающееся над кожей уплотнение, в центре которого образуется язва с приподнятыми краями (лейшманиома).
Весь процесс от первых проявлений до заживления язвы занимает от 3-4-х месяцев до 2-х лет. После заживления язв остаются обезображивающие рубцы.
Лабораторная диагностика: обнаружение лейшманий в мазках из содержимого язв.
КОЖНО-СЛИЗИСТЫЙ ЛЕЙШМАНИОЗ (эспундия)
Это заболевание вызывают L. brasiliensis, L.mexicana и L.peruviana.
Инкубационный период от 2-3-х недель до 1-3-х месяцев.
Патогенное действие:
Механическое (разрушение клеток кожи и слизистых оболочек и даже хрящей).
Токсико-аллергическое (отравление организма продуктами жизнедеятельности).
Характерные симптомы: язвы, увеличивающиеся в размерах и постепенно разрушающие все мягкие ткани.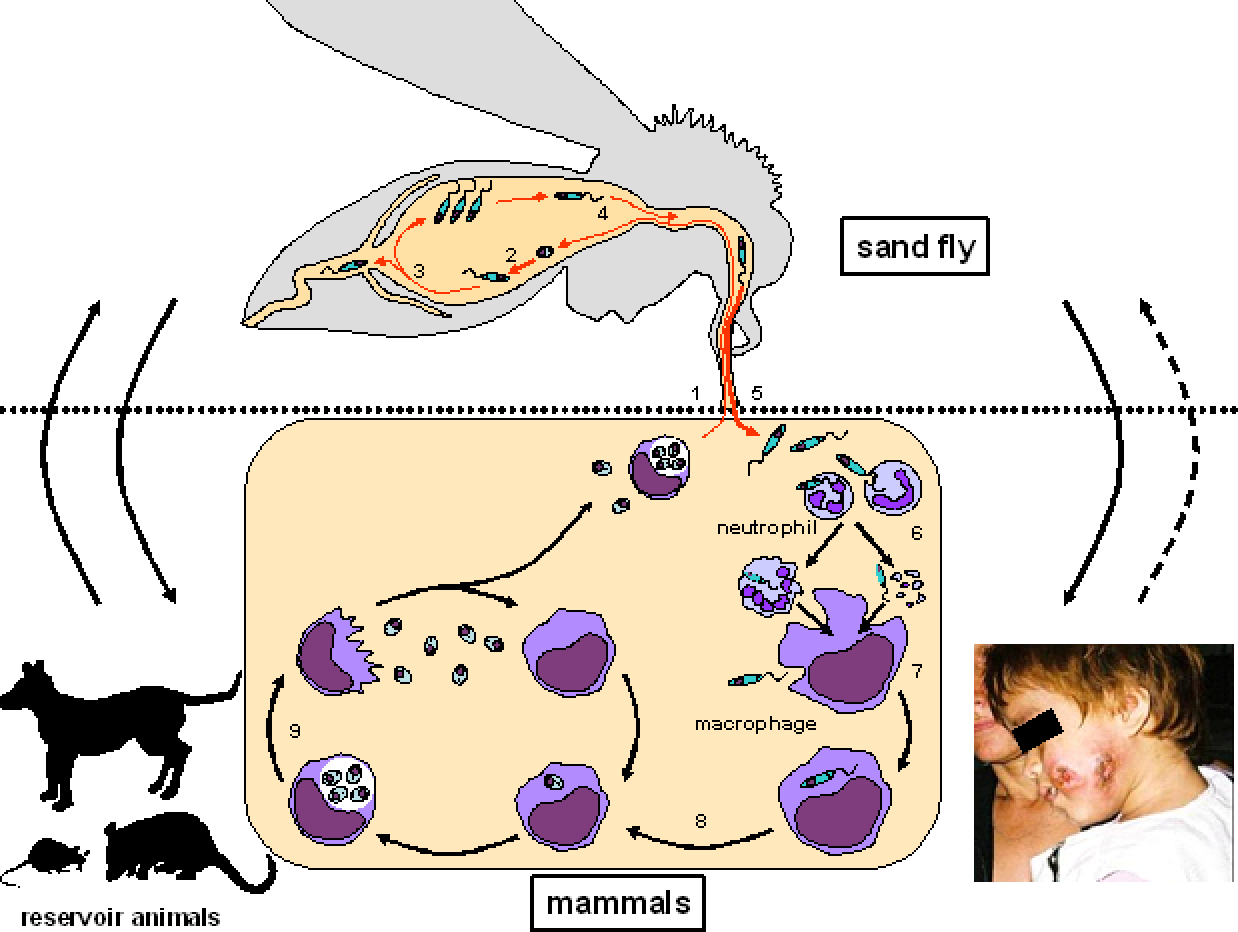 Разрастание тканей носа, губ,
Разрастание тканей носа, губ,
глотки, гортани.
Болезнь трудно поддается лечению и часто заканчивается смертью в результате осложнений.
Лабораторная диагностика: обнаружение лейшманий в мазках из содержимого язв.
Профилактика лейшманиозов: индивидуальная защита от укусов москитов (реппеленты, противомоскитные сетки) и прививки ослабленными штаммами лейшманий, выявление и лечение больных, уничтожение москитов, уничтожение животных, которые являются резервуарами возбудителей заболеваний, санитарно-просветительная работа.
Лейшманиоз — Инфекционные болезни — Справочник MSD Профессиональная версия
Лечение кожного лейшманиоза может быть местным или системным в зависимости от повреждения и возбудителя.
В том случае, если поражения небольшие и спустя некоторое время самостоятельно проходят, а также если они не вызваны представителями рода Leishmania, ассоциированными с лейшманиозом слизистых оболочек, возможно тщательное наблюдение, а не лечение.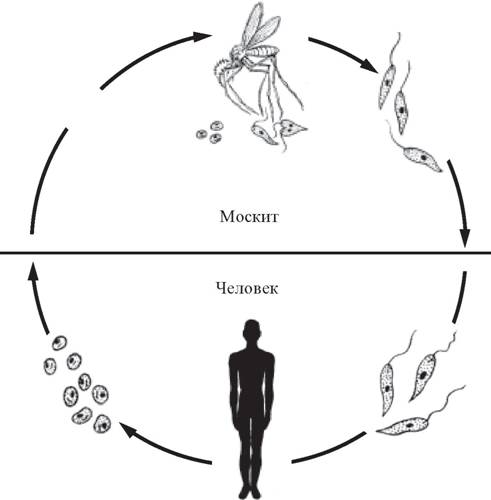
Местное лечение подходит для небольших, неосложненных повреждений. Инъекции стибоглюконата натрия в пораженный участок использовались в течение многих лет для лечения простого кожного лейшманиоза в Европе и Азии; такое лечение в настоящее время недоступно в США и РФ. Другие варианты местного лечения включают тепловую терапию, которая требует специальных условий для выполнения, и криотерапию; обе могут быть болезненным и применяются только для лечения небольших поражений. В дополнение, местные препараты с паромомицином используются за пределами США в виде мази, содержащей 15% паромомицина и 12% метил бензэтония хлорида в мягком белом парафине.
Системная терапия используется у пациентов, у которых наблюдается:
-
Заражение L. braziliensis или родственными организмами, ассоциированными с лейшманиозом слизистых оболочек
-
Сложные случаи кожного лейшманиоза с множественными обширными, распространёнными по всему телу или уродующими высыпаниями
-
В США варианты системного лечения включают липид-ассоциированную формулу амфотерицина В, милтефозин и дезоксихолат амфотерицина В. Стибоглюконат натрия или меглумина антимонат могут быть использованы в случаях, когда заражение инфекцией произошло в районах, где резистентность к сурьме не распространена. В схемах лечения висцерального лейшманиоза обычно назначают липосомальный амфотерицин B и амфотерицин B с дезоксихолатом.
Стибоглюконат натрия или меглумина антимонат могут быть использованы в случаях, когда заражение инфекцией произошло в районах, где резистентность к сурьме не распространена. В схемах лечения висцерального лейшманиоза обычно назначают липосомальный амфотерицин B и амфотерицин B с дезоксихолатом.
Милтефозин, который имеет преимущество при пероральном введении, может быть эффективным при кожном лейшманиозе, особенно в случаях, когда возбудителем является Leishmania braziliensis, Leishmania guyanensis и Leishmania panamensis. Милтефозин дозируется по массе тела: пациентам от 30 до 44 кг – 50 мг перорально два раза в день в течение 28 дней; ≥ 45 кг – 50 мг перорально 3 раза в день в течение 28 дней. Побочные явления включают тошноту, рвоту, преходящее повышение аминотрансфераз и головокружение. Милтефозин противопоказан во время беременности. Женщинам детородного возраста, которые принимают этот препарат, необходимо использовать эффективные противозачаточные средства или другие методы контрацепции.
Препараты пятивалентной сурьмы (натрия стибоглюконат или меглумина антимонат) могут использоваться только в том случае, если предполагается инфицирование чувствительными представителями рода Leishmania. Стибоглюконат натрия доступен в Центрах по контролю и профилактике заболеваний (ЦКЗ), (звоните в Службу лекарств ЦКЗ по номеру 404 639-3670). Меглумина антимониат (соединение пятивалентной сурьмы) используется в Латинской Америке. Дозы обоих препаратов основаны на их содержании пятивалентной сурьмы – 20 мг/кг внутривенно (медленное вливание) или внутримышечно 1 раз/день в течение 20 дней. Побочные эффекты включают тошноту, рвоту, недомогание, повышение амилазы и/или ферментов печени, а также кардиотоксичность (аритмии, миокардиальная депрессия, сердечная недостаточность, изменения кардиограммы, остановка сердца). Уровень побочных явлений увеличивается с возрастом. Препарат прекращают давать, если у пациентов обнаруживается кардиотоксичность.
Альтернативой является использование азолов (например, флуконазол, итраконазол). Флуконазол 200 мг перорально 1 раз/день в течение 6 недель обычно не дает эффекта, что иногда приводит к использованию более высоких суточных доз.
Флуконазол 200 мг перорально 1 раз/день в течение 6 недель обычно не дает эффекта, что иногда приводит к использованию более высоких суточных доз.
Диффузный кожный лейшманиоз является относительно стойким к лечению.
Лейшмании (род Leishmania)
|
|||
Leishmania major — Leishmania major
Leishmania основным является одним видов паразитов , обнаруженных в роду Leishmania , и связано с заболеванием зоонозных кожный лейшманиоз (также известный как кожный лейшманиоз , Багдад фурункул , Bay больное , кнопка Biskra , Chiclero язва , Дели фурункул , Кандагар боль , Лахоре боль , Восточная болячка , Пиан Буа и Ута ).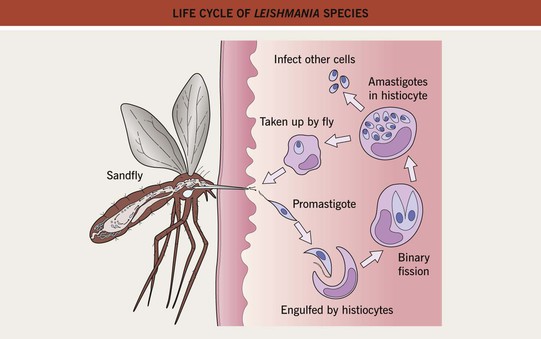 Л. основным является внутриклеточным патогеном , который инфицирует макрофаги и дендритные клетки на систему иммунной . Хотя виды Leishmania встречаются на всех континентах, кроме Антарктиды , Leishmania major встречается только в Восточном полушарии , особенно в Северной Африке , на Ближнем Востоке , в Северо-Западном Китае и Северо-Западной Индии .
Л. основным является внутриклеточным патогеном , который инфицирует макрофаги и дендритные клетки на систему иммунной . Хотя виды Leishmania встречаются на всех континентах, кроме Антарктиды , Leishmania major встречается только в Восточном полушарии , особенно в Северной Африке , на Ближнем Востоке , в Северо-Западном Китае и Северо-Западной Индии .
Жизненный цикл
Как трипаносоматида , L. major начинает свой жизненный цикл в форме промастигот в средней кишке основного переносчика — самок песчаных мух ( Phlebotomus spp. ). Попадая в кишечник песчаной мухи, паразиты превращаются из флагелированных амастигот в
Жизненный цикл Leishmania major жгутиковые промастиготы в течение 1–2 недель, пока они полностью не разовьются, после чего они попадают в хоботок . После кусает млекопитающим хозяина , promastigotes выбрасываются в кровоток , где они поглощаются макрофагами . После поглощения промастиготы дифференцируются в амастиготы . Амастиготы имеют овальную или круглую форму и диаметр 2-3 мкм . Кроме того, они содержат большое эксцентрично расположенное ядро вместе с кинетопластом (который содержит внеклеточную ДНК ). Оснащенное выжить кислую среду внутри фагосом из макрофагов , в amastigotes воспроизвести в процессе бинарного деления . В этот момент амастиготы высвобождаются по всему телу и могут быть съедены самками песчаных мух , завершая цикл. L. major имеет половой цикл, включая мейотический процесс. Спаривание происходит только в векторе песчаной мухи.
После поглощения промастиготы дифференцируются в амастиготы . Амастиготы имеют овальную или круглую форму и диаметр 2-3 мкм . Кроме того, они содержат большое эксцентрично расположенное ядро вместе с кинетопластом (который содержит внеклеточную ДНК ). Оснащенное выжить кислую среду внутри фагосом из макрофагов , в amastigotes воспроизвести в процессе бинарного деления . В этот момент амастиготы высвобождаются по всему телу и могут быть съедены самками песчаных мух , завершая цикл. L. major имеет половой цикл, включая мейотический процесс. Спаривание происходит только в векторе песчаной мухи.
Инфекционное заболевание
Попадая в кровоток млекопитающих , L. major встречает очаг инфекции — макрофаг . Благодаря двум поверхностным молекулам , протеазе gp63 и липофосфогликану , промастиготы способны связываться с несколькими рецепторами макрофагов . Присоединению промастигот к макрофагам способствует ряд рецепторов , включая рецепторы комплемента CR1 и CR3 , а также рецептор конечных продуктов гликозилирования .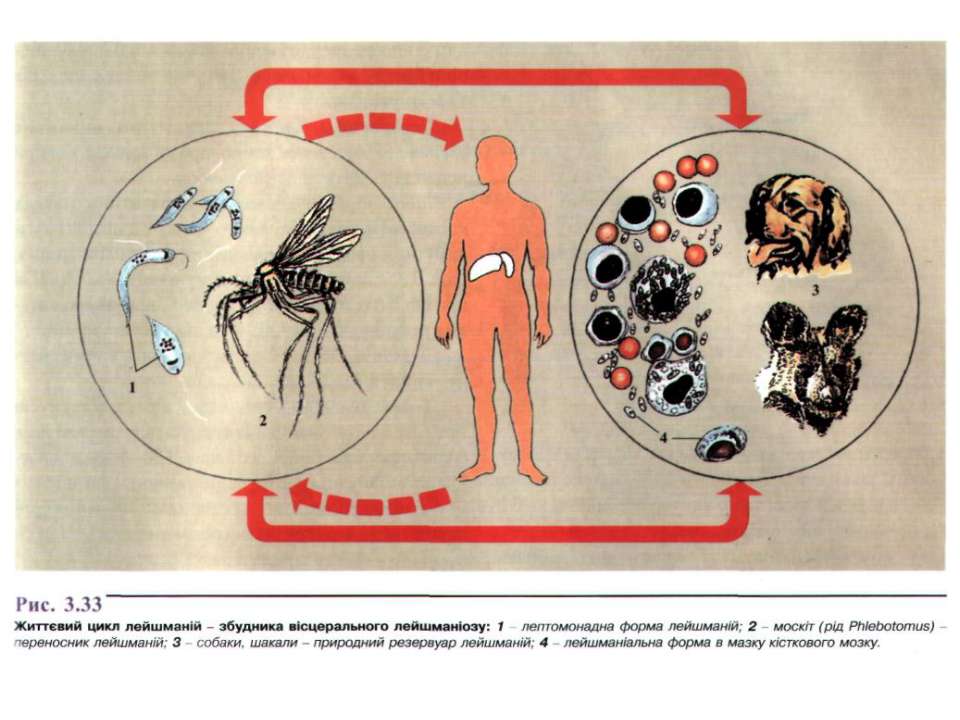 Активация комплементов происходит далеко от клеточной мембраны , и встраивание комплекса атаки мембраны не происходит. Это действие позволяет паразиту избежать лизирования и оставаться в макрофагах хозяина .
Активация комплементов происходит далеко от клеточной мембраны , и встраивание комплекса атаки мембраны не происходит. Это действие позволяет паразиту избежать лизирования и оставаться в макрофагах хозяина .
Эпидемиология
Кожный лейшманиоз в Северной Африке; Основные зараженные зоны Leishmania отмечены синим цветом. Уровень заболеваемости в кожный лейшманиоз оценивается между 1-1,5 млн случаев в год. Однако передача инфекции нечасто происходит внутриутробно , во время переливания крови или при межличностном контакте. Таким образом, основная форма передачи — через вектор песчаной мухи . Песчаные мухи не летают на большие расстояния и, как правило, завершают свой жизненный цикл в районах диаметром менее 1 км. Кроме того, из-за склонности москитов искать убежище в норах мелких грызунов , где L. major является эндемиком , мелкие млекопитающие, такие как песчанки и птицы, служат основными резервуарами .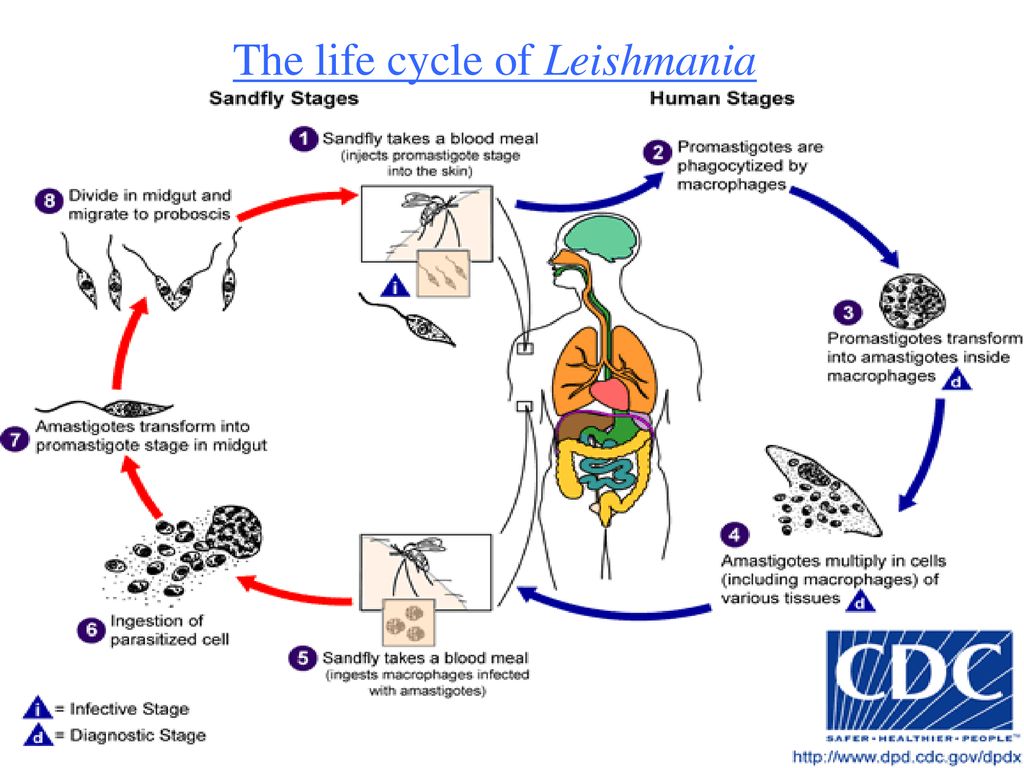 Были зарегистрированы случаи заражения собак кожным лейшманиозом в Египте и Саудовской Аравии . Это редко , однако, и собака не являются важными хозявами для Л. мажора .
Были зарегистрированы случаи заражения собак кожным лейшманиозом в Египте и Саудовской Аравии . Это редко , однако, и собака не являются важными хозявами для Л. мажора .
L. major и его двоюродный брат L. tropica признаны вызывающими большинство случаев кожного лейшманиоза на Ближнем Востоке , в Северной Африке и в некоторых районах Китая и Индии (как упоминалось выше). В период с 2002 по 2004 год было зарегистрировано более 700 случаев заболевания среди военнослужащих Соединенных Штатов, проходящих службу в Ираке .
Клинические проявления
Кожная лейшманиозная боль После заражения у пациентов обычно появляются поражения на месте укуса песчаной мухи . Инфекция является острой , и , как правило , имеет продолжительность около 3-6 месяцев. По мере того как все больше и больше фагоцитирующих клеток поглощают промастиготы , вызывая образование амастигот , на коже образуются узелки .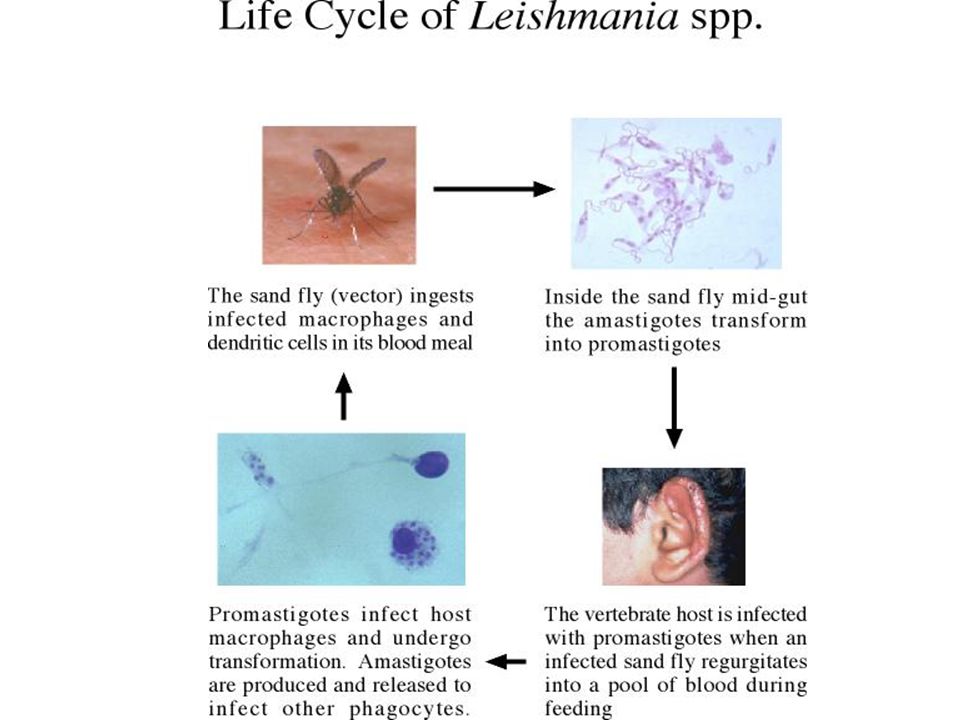 Затем эти узелки изъязвляются , хотя из-за различных характеристик поражений видоспецифическая идентификация патогена невозможна. Как правило, поражения выглядят влажными, имеют приподнятые внешние границы, гранулирующую основу, покрывающий слой белого гнойного экссудата и описываются как « похожие на пиццу ». Биопсия этих поражений обычно выявляет ряд находок, включая многочисленные макрофаги, содержащие внутриклеточные амастиготы, а также лимфоциты с наблюдаемым образованием гранулем и небольшим количеством паразитов .
Затем эти узелки изъязвляются , хотя из-за различных характеристик поражений видоспецифическая идентификация патогена невозможна. Как правило, поражения выглядят влажными, имеют приподнятые внешние границы, гранулирующую основу, покрывающий слой белого гнойного экссудата и описываются как « похожие на пиццу ». Биопсия этих поражений обычно выявляет ряд находок, включая многочисленные макрофаги, содержащие внутриклеточные амастиготы, а также лимфоциты с наблюдаемым образованием гранулем и небольшим количеством паразитов .
Диагностика
L. основной следует рассматривать в дифференциальной диагностике с хроническим поражением людей , которые проводят время в районах , где это эндемик . Однако другие патогены могут вызывать аналогичные поражения, и поэтому также следует учитывать паракокцидиодомикоз, гистоплазмоз , споротрихоз , лобомикоз , волчанку обыкновенную , Mycobacterium ulcerans , сифилис , кожный саркоидоз и лепру .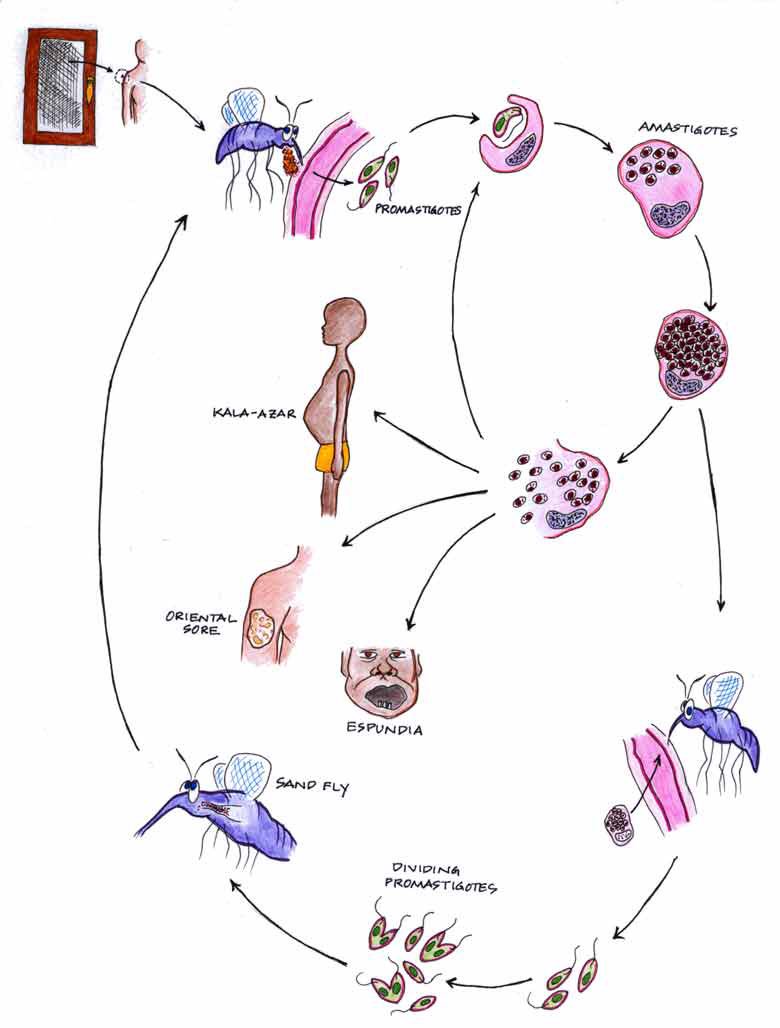
Наиболее распространенные способы диагностики лейшманиоза — выявление амастигот в препарате прикосновения, окрашенном по Райту-Гимзе, или путем выделения паразитов в культурах.
лечение
Потому что хозяин иммунная система имеет тенденцию к Resolve инфекции через 3-6 месяцев, лечение поражений обычно фокусируется на ограничение ткани повреждения и некроза . Ряд различных методов лечения дали результаты различной эффективности при лечении кожного лейшманиоза, вызванного L. major .
Профилактика
Распространение лейшманиоза можно предотвратить, прервав жизненный цикл песчаной мухи или удалив или обработав резервуары патогенов . Избегание укусов песчаных мух — эффективное средство предотвращения болезней для краткосрочных посетителей территорий, где L. major является эндемичным . Это может быть достигнуто за счет использования ДЭТА, содержащего репеллент от насекомых, нанесения инсектицидов на одежду и постельное белье, а также за счет использования москитных сеток для покрытия кроватей. Песчаные мухи обычно кусаются между закатом и рассветом , поэтому в это время следует принимать профилактические меры.
Песчаные мухи обычно кусаются между закатом и рассветом , поэтому в это время следует принимать профилактические меры.
Хотя вакцины , которая могла бы предотвратить кожный лейшманиоз , еще не существует, предполагается, что она будет разработана в ближайшем будущем. У пациентов, вылечившихся от инфекции L. major, вырабатывается высокий уровень иммунитета к патогену . В России и Израиле солдатам «иммунизировали» против L. major путем инъекции живых промастигот в ягодицы ; однако эта форма лечения была прекращена в Израиле из-за периодического образования крупных или медленно заживающих повреждений .
Рекомендации
| Викискладе есть медиафайлы по теме Leishmania major . |
Определение антител к лейшмании (Leischmania) в крови , цены в Нижнем Новгороде
В данном анализе определяются суммарные антитела классов IgM и IgG к Leishmania infantum.
Определение специфических антител используется в качестве дополнительного метода диагностики висцерального лейшманиоза с методом изучения тканей под микроскопом. Достоверный прирост антител в 4 раза и более при повторном исследовании с интервалом в 10-14 дней подтверждает диагноз заболевания.
Общая информация об исследовании
Лейшманиозы — протозойные, трансмиссивные заболевания, возбудителем которых является лейшмания, относящаяся к семейству Trypanosmatidae. Передается инфекция через укус женской особи песчаной мухи (род Phlebotomus).
Существуют три основных типа лейшманиозов:
- кожный — возбудитель L. major;
- кожно-слизистый — возбудитель L. Brasiliensis;
- висцеральный — вызывает L. infantum.
Для висцеральной формы характерно то, что лейшмании диссеминируют и интенсивно размножаются в ретикулоэндотелии паренхиматозных органов (селезенке, печени, костном мозге). Заболевание характеризуется хроническим течением, волнообразной лихорадкой, гепатоспленомегалией, панцитопенией.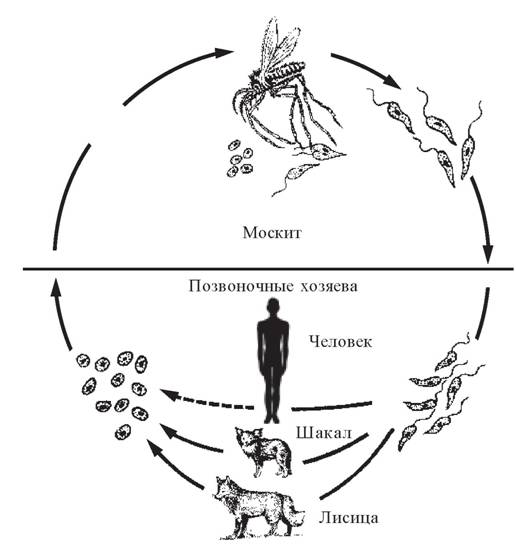 Географическая локализация Leishmania infantum — бассейн Средиземного моря, Ближний и Средний Восток, Центральная и Южная Америка.
Географическая локализация Leishmania infantum — бассейн Средиземного моря, Ближний и Средний Восток, Центральная и Южная Америка.
В жизненном цикле лейшманий выделяют позвоночных хозяев — человек, собаки, волки, шакалы и беспозвоночный хозяин и специфический переносчик — москит рода Phlebotomus. Питаясь от больных животных и людей, москиты всасывают паразитов с кровью. В желудке москитов в течение первых суток образуются жгутиковые формы. На 6-8-е сутки лейшмании концентрируются в глотке москита, образуя блок, при укусе происходит заражение позвоночного хозяина. Пути заражения: трансплацентарный, гемотрансфузионный и перкутанный.
При ВИЧ висцеральный лейшманиоз все чаще встречается как оппортунистическая инфекция. Большинство таких случаев зарегистрировано в Южной Европе, висцеральным лейшманиозом там страдают уже не только дети младшего возраста. У ВИЧ-инфицированных даже слабовирулентные штаммы лейшманий могут вызвать поражение внутренних органов.
Микробиологическая диагностика достаточно сложна и основана на исследовании биоптатов костного мозга, печени, селезенки и лимфатических узлов. В связи с этим иммунологические методы занимают лидирующие позиции в диагностике лейшманиоза.
В связи с этим иммунологические методы занимают лидирующие позиции в диагностике лейшманиоза.
Показания к назначению данного исследования
- Диагностика лейшманиоза.
- Дифференциальная диагностика с другими патологиями: малярией, тифопаратифозными заболеваниями, туберкулезом, сепсисом, абсцессом печени, лимфогранулематозом, гистоплазмозом, бронхопневмонией.
- Лихорадка неясного генеза, особенно у лиц, в анамнезе которых пребывание в эндемичных районах (Южная Европа, Северная Африка, Ближний Восток, Средняя Азия и Северо-Западный Китай).
- ВИЧ-инфицирование.
Литература:
- Бронштейн А.М., Токмалаев А.К. Паразитарные болезни человека. Протозоозы и гельминтозы. — М.: «Российский университет дружбы народов», 2002.
- Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. — М.: ООО «Медицинское информационное агентство», 2009. С. 683-685.
- Методические указания МУК 4.
 2.3145-13 «Лабораторная диагностика гельминтозов и протозоозов» (утверждены от 26 ноября 2013 года).
2.3145-13 «Лабораторная диагностика гельминтозов и протозоозов» (утверждены от 26 ноября 2013 года).
Лейшманиозы
Лейшманиозы — группа протозойных трансмиссивных болезней человека и животных, которые характеризуются поражением внутренних органов (висцеральный лейшманиоз) или кожи и слизистых оболочек (кожный лейшманиоз), переносчиками которых являются москиты.
Исторические сведения. История изучения лейшманиозов началась с 1898 г., когда ташкентский врач П. Ф. Боровский открыл и описал возбудителя, обнаружив лейшмании в мазках из грануляций пендинской язвы, получивших название L. tropica. Однако задолго до открытия возбудителя кожный лейшманиоз был известен и регистрировался под разными названиями: багдадская, ашхабадская язва, мургабская болезнь, кокандка и др.
В 1900 — 1904 гг. W. В. Leishman и С. Donovan в селезенке больных кала-азаром обнаружили возбудителя висцерального лейшманиоза — L. donovavi.
Изучению лейшманиозов были посвящены научные исследования отечественных ученых — Е. И. Марциновского, В. Л. Якимова, Н. И. Ходукина, П. А. Петрищевой, А. В. Долматова, Н. А. Демина, Ш. Д. Мошковского, В. П. Сергиева и А. Я. Лысенко и многих других.
И. Марциновского, В. Л. Якимова, Н. И. Ходукина, П. А. Петрищевой, А. В. Долматова, Н. А. Демина, Ш. Д. Мошковского, В. П. Сергиева и А. Я. Лысенко и многих других.
Различные формы лейшманиоза регистрируются более чем в 80 странах мира, где насчитывается 40 — 60 млн больных.
Этиология. Возбудителями лейшманиозов являются простейшие, которые относятся к типу Sarcomastigophora, отряду Ki-netoplastida, семейству Trypanosomatidae, роду Leishmania. В настоящее время известно около 20 видов и подвидов лейшманий.
Для лейшманий характерен сложный жизненный цикл, проходящий при участии двух хозяев. Одним из них является позвоночное животное — собака, лисица, бурундук — и человек, вторым хозяином являются москиты — флеботомусы.
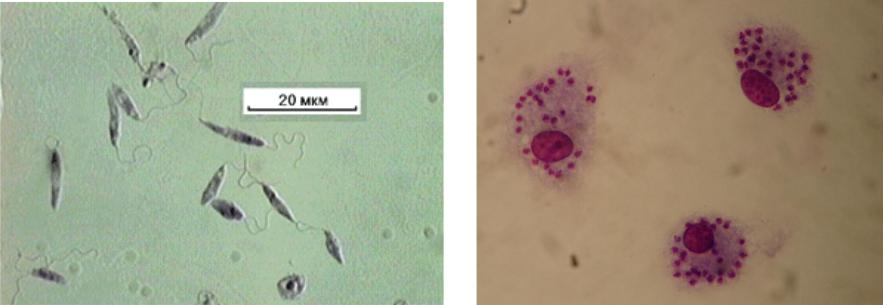
В организме человека и позвоночных животных лейшманий развиваются внутриклеточно в виде амастиготной (безжгутиковой), лейшманиальной или тканевой формы в свободных макрофагах или ретикулогистиоцитарных клетках. Амастиготы представляют собой мелкие округлой или овальной формы клетки размером 1-3×2-6 мкм с расположенным внутри овальным ядром и хорошо видимым палочковидной формы кинетопластом. По Романовскому — Гимзе цитоплазма окрашивается в голубой цвет, ядро (0,7 х 0,8 мкм) — в красно-фиолетовый, кинетопласт — в темно-красный, рубиновый. Лейшманиальная форма размножается путем простого деления.
По Романовскому — Гимзе цитоплазма окрашивается в голубой цвет, ядро (0,7 х 0,8 мкм) — в красно-фиолетовый, кинетопласт — в темно-красный, рубиновый. Лейшманиальная форма размножается путем простого деления.
В просвете кишечника заразившегося москита-переносчика эти безжгутиковые формы превращаются в подвижные жгутиковые — промастиготы, лептомонадные формы.
Аептомонадная подвижная стадия развития паразита имеет веретенообразную вытянутую форму размерами 4 — 6 × 10 — 12 мкм и жгут, отходящий от кинетопласта — орган движения паразита.
Лейшманий могут быть выращены на питательной среде NNN, содержащей дефибринированную кровь, на хорион-аллантоисной оболочке развивающегося куриного эмбриона, а также в культуре клеток в виде амастигот. На питательной среде через 3-4 дня при 23°С образуются мелкие прозрачные колонии, состоящие из промастигот.
Лейшманиозы — трансмиссивные паразитозы. Переносчиками возбудителей являются москиты — флеботомусы, обитающие в жарких и теплых поясах земли. В мире известно до 600 видов москитов, наиболее разнообразны они в Африке, но обитают также в Средней Азии, Казахстане, Закавказье, в Крыму, на юге Украины и в Молдавии.
В мире известно до 600 видов москитов, наиболее разнообразны они в Африке, но обитают также в Средней Азии, Казахстане, Закавказье, в Крыму, на юге Украины и в Молдавии.
Москиты — мелкие двукрылые насекомые, активные в сумерках, ночью.
Заражаются самки москитов при поглощении крови человека или животных, больных лейшманиозом. Амастиготы, попавшие в желудок переносчика, превращаются в жгутиковые формы, которые размножаются и скапливаются в его глотке. Москит становится заразным на 5 — 8 сутки.
В последние годы ситуация по лейшманиозам осложнилась в связи с распространением ВИЧ-инфекции. Известно, что возбудитель висцерального лейшманиоза способен персистировать в организме клинически здорового человека в течение нескольких лет. У инфицированого может возникнуть рецидив болезни при снижении иммунного статуса. Случаи висцерального лейшманиоза зарегистрированы у лиц, которые были в очагах лейшманиоза, после их заражения вирусом иммунодефицита.
Различают кожный и висцеральный лейшманиозы и несколько их разновидностей.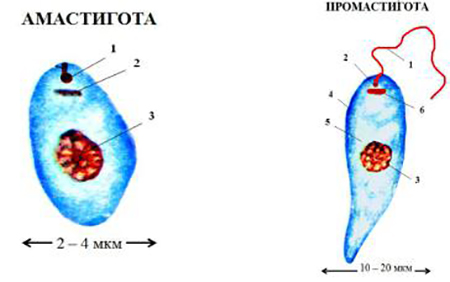 Патогенез и клинические проявления инфекции имеют существенные отличия, но в морфологии возбудителей разница невелика. Однако существуют значительные штаммовые особенности, как-то: вирулентность возбудителя, тканевой тропизм, биология, чувствительность к химиопрепара-там и др.
Патогенез и клинические проявления инфекции имеют существенные отличия, но в морфологии возбудителей разница невелика. Однако существуют значительные штаммовые особенности, как-то: вирулентность возбудителя, тканевой тропизм, биология, чувствительность к химиопрепара-там и др.
Различают следующие наиболее частые клинико-эпидемиологические варианты лейшманиозов: висцеральные лейшманиозы — индийский, средиземноморско-среднеазиатский, восточно-африканский Старого Света и южноамериканский висцеральный лейшманиоз Нового Света; кожные лейшманиозы — суданский и эфиопский Старого Света, мексиканский, бразильский и др. Нового Света.
Висцеральные лейшманиозы характеризуются хроническим течением, волнообразной лихорадкой, спленомегалией, гепатомегалией, прогрессирующей анемией, лейкопенией, тромбоцитопенией, кахексией.
Индийский висцеральный лейшманиоз (Синонимы: кала-азар, черная болезнь, лихорадка дум-дум)
Этиология. Возбудитель Leishmania donovani.
Эпидемиология. Источник инфекции — больной человек, т.е. индийский висцеральный лейшманиоз — антропоноз. Переносчики — москиты вида Phlebotomus argentipes, самки которых питаются кровью человека, нападая на него в сумеречное и ночное время. Развитие лейшманий в моските заканчивается за 6 — 8 суток. Человек заражается при укусе переносчика. Описаны случаи заражения при гемотрансфузиях. Восприимчивы к заболеванию люди всех возрастов, но чаще болеют в возрасте 10 — 30 лет, проживающие в сельской местности, особенно в низменных районах с большим количеством осадков.
Регистрируется в Индии, Пакистане, Бангладеш, Непале.
Для этой формы лейшманиоза характерно периодическое возникновение эпидемических вспышек.
Патогенез обусловлен поражением клеток РЭС селезенки, печени, костного мозга, лимфатических узлов. Продукты метаболизма и гибели лейшманий являются причиной интоксикации. В пораженных органах развиваются воспалительные, дистрофические и некротические изменения. Получены доказательства, что в патогенезе висцерального лейшманиоза важное место занимают иммунопатологические процессы.
Получены доказательства, что в патогенезе висцерального лейшманиоза важное место занимают иммунопатологические процессы.
Клиника.
В течении висцерального лейшманиоза различают три периода: начальный, спленомегалический, кахектический.
Инкубационный период продолжается от 15 — 20 дней до 10 — 12 месяцев.
Начальный период проявляется первичным аффектом, когда через несколько дней или недель после заражения на коже образуется уплотненный бледно-розовый узелок, который в дальнейшем рассасывается.
После инкубационного периода развиваются общие явления в виде слабости, адинамии, бледности кожных покровов, увеличения селезенки, ухудшения аппетита. Период разгара болезни начинается с кардинального симптома болезни — лихорадки. Температурная кривая обычно носит волнообразный характер. Длительность лихорадочных волн и ремиссий колеблется от нескольких дней до нескольких месяцев. Постоянными признаками при этой форме висцерального лейшманиоза являются увеличение и уплотнение печени и селезенки, но лимфоузлы при этом не увеличены.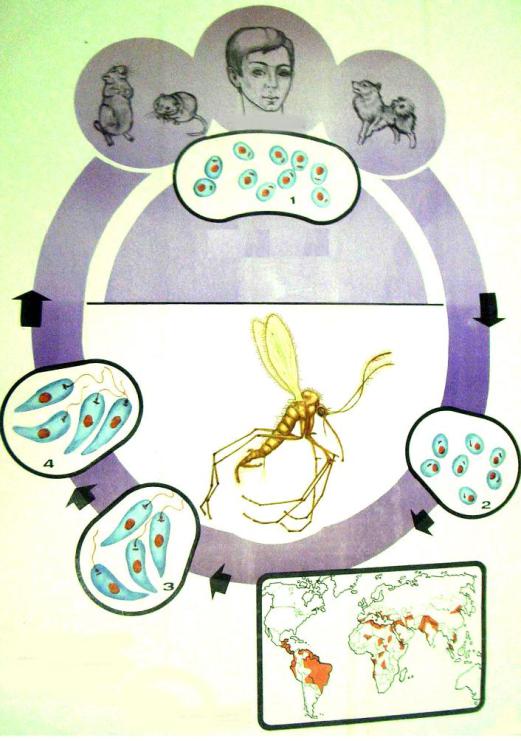 Кожные покровы постепенно приобретают темный, почти черный цвет («черная болезнь»), что связано с поражением надпочечников. Волосы теряют блеск, становятся сухими и ломкими.
Кожные покровы постепенно приобретают темный, почти черный цвет («черная болезнь»), что связано с поражением надпочечников. Волосы теряют блеск, становятся сухими и ломкими.
Поражается костный мозг, нарастает анемия. Может произойти некроз миндалин, слизистых оболочек рта, десен (нома). Нередко развивается геморрагический синдром с кровоизли яниями в кожу, слизистые оболочки, кровотечениями из носа, желудочно-кишечного тракта. Нарастают симптомы сердечной недостаточности.
Для заболевания характерны кожные лейшманоиды — узелковые или пятнистые высыпания, появляющиеся через 1-2 года после эффективной терапии, которые содержат годами сохраняющиеся лейшманий. Такие больные становятся источником инфекции для москитов.
В гемограмме определяется выраженная гипохромная анемия, лейкопения и гранулоцитопения, относительный лимфоцитоз, часто анэозинофилия, тромбоцитопения. СОЭ резко повышена.
В терминальном периоде нарастает кахексия. Часто присоединяются вторичные инфекции. Прогноз неблагоприятен, на фоне кахексии наступает смерть.
Прогноз неблагоприятен, на фоне кахексии наступает смерть.
Диагностика. В зоне эндемичного распространения лейшманиоза клинический диагноз нетруден. Для его подтверждения исследуют мазок костного мозга, получаемый при пункции грудины, крыла тазовой или болыиеберцовой кости, окрашенный по Романовскому — Гимзе.
Достаточно информативно серологическое обследование с помощью НРИФ или РЭМА.
В неэндемичных зонах очень важен эпидемиологический анамнез (пребывание в очагах, нападение москитов). Дифференциальный диагноз проводят с малярией и системными заболеваниями, сопровождающимися спленомегалией.
Средиземноморско-среднеазиатский висцеральный лейшманиоз (Синонимы: детский лейшманиоз, детский кала-азар)
Этиология. Возбудитель L.donovani infantum.
Эпидемиология. Средиземноморско-среднеазиатский лейшманиоз — зоонозное заболевание.
Различают три типа очагов:
1. природные очаги, в которых возбудитель циркулирует среди диких животных (шакалы, лисицы, суслики и др.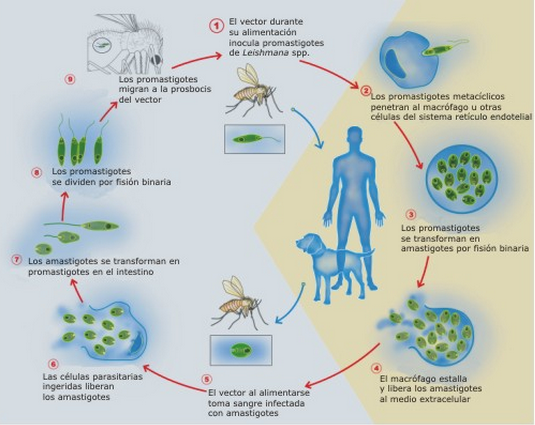 грызуны), являющихся источником инвазии;
грызуны), являющихся источником инвазии;
2. сельские очаги, в которых возбудитель циркулирует у собак -главных источников инвазии, а также у диких животных;
3. городские (синантропные) очаги, в которых основным источником инвазии служат собаки и синантропные крысы.
Переносчики — различные виды москитов — флеботомусы.
Болеют в основном дети в возрасте от 1 года до 5 лет, а также взрослые — приезжие из неэндемичных районов.
Заболеваемость носит спорадический характер; в городах возможны вспышки. Сезон заражения — лето, а сезон заболеваемости — осень этого года или весна следующего.
Очаги регистрируются в странах Средиземноморья, Китая, Ближнего Востока, Латинской Америки.
Спорадические случаи регистрируются в Средней Азии и Закавказье: Туркменистан, юг Казахстана, Грузия, Армения, Азербайджан.
Патогенез. Существенно не отличается от патогенеза при индийском лейшманиозе.
Клиника. Инкубационный период — от 20 дней до 3 — 5 месяцев. В месте укуса детей 1-1,5 лет, реже у старших и взрослых, возникает первичный аффект в виде бледно-розовой папулы, иногда на ее поверхности видна небольшая чешуйка. Важно знать, что еще до появления выраженных признаков болезни в соскобе кожи папулы, как правило, обнаруживаются лейшмании. В дальнейшем развитии болезни лейшмании находят значительно реже.
В месте укуса детей 1-1,5 лет, реже у старших и взрослых, возникает первичный аффект в виде бледно-розовой папулы, иногда на ее поверхности видна небольшая чешуйка. Важно знать, что еще до появления выраженных признаков болезни в соскобе кожи папулы, как правило, обнаруживаются лейшмании. В дальнейшем развитии болезни лейшмании находят значительно реже.
Клиническая картина принципиально не отличается от клиники индийского лейшманиоза и характеризуется симптомами системного ретикулоэндотелиоза. Существенные особенности — отсутствие кожного лейшманоида и вовлечение в патологический процесс лимфатических узлов с развитием проявлений периферического лимфаденита, реже мезаденита. В отличие от индийского лейшманиоза при этой форме кожные покровы не темнеют, а, напротив, бледнеют, становятся «фарфоровыми», восковидного, землистого оттенка.
Заболевание может проявляться в острой, подострой и затяжной формах.
Острая форма, чаще у младших детей, характеризуется бурным течением и может закончиться смертью. Затяжная форма — самая частая и благоприятная, встречается у старших детей и взрослых.
Затяжная форма — самая частая и благоприятная, встречается у старших детей и взрослых.
Прогноз у детей младшего возраста и при развитии осложнений может быть неблагоприятным.
Диагноз. В периферической крови лейшмании обнаруживают крайне редко.
Восточно-африканский висцеральный лейшманиоз
Этиология. Возбудитель — L. archibaldi.
Эпидемиология. Источники инфекции — человек и дикие млекопитающие из отрядов грызунов и хищников. Переносчики — москиты из рода Phlebotomus: Ph. orientalis, Ph. martini.
Чаще болеют молодые люди из сельских местностей и кочевых племен.
Заболеваемость носит в основном спорадический характер, но бывают и крупные эпидемические вспышки. Регистрируется в Судане, Кении, Сомали, Эфиопии, Уганде, Чаде.
Патогенез. Сходен с другими формами висцерального лейшманиоза.
Клиническая картина. Особенности по сравнению с другими формами висцерального лейшманиоза:
1. более частое разви тие на месте укуса москита папулы (до 0,5 см в диаметре) и даже язвы;
более частое разви тие на месте укуса москита папулы (до 0,5 см в диаметре) и даже язвы;
2. нередкое развитие кожного лейшманоида после клинического выздоровления;
3. тенденция к рецидивам болезни.
Кожные лейшманиозы
Кожные лейшманиозы — трансмиссивные протозоозы тропического и субтропического климата, характеризующиеся ограниченными поражениями кожи с последующим изъязвлением и рубцеванием.
Различают кожные лейшманиозы Старого Света (антропонозный, зоонозный, суданский) и Нового Света (бразильский, мексиканский, гвианский, перуанский и др.).
Кожные лейшманиозы старого света
Антропонозный кожный лейшманиоз (Синонимы: поздно изъязвляющийся, городской тип, ашхабадка, годовик)
Этиология. Возбудитель Leishmania tropica.
Эпидемиология. Источником инфекции является больной человек и, возможно, собака. Переносчики — самки москитов Phlebotomus sergenti. Развитие возбудителя в моските продолжается 6-8 дней. Голодный москит может сосать кровь на нескольких людях и на разных местах кожи.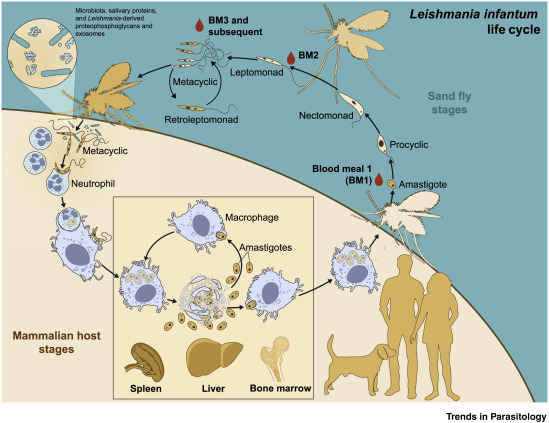 Таким образом один инвазированный москит может заразить нескольких людей. Антропонозный кожный лейшманиоз встречается преимущественно в городах, поселках городского типа. Восприимчивость людей всеобщая. После перенесенного заболевания остается пожизненный иммунитет, реинфекции редки.
Таким образом один инвазированный москит может заразить нескольких людей. Антропонозный кожный лейшманиоз встречается преимущественно в городах, поселках городского типа. Восприимчивость людей всеобщая. После перенесенного заболевания остается пожизненный иммунитет, реинфекции редки.
Регистрируется в странах Ближнего Востока, Западной и Северной Африки, широко — в Западной части Индии. Раньше встречался в городах и поселка республик Средней Азии и Закавказья под названием «ашхабадка», «годовик». В настоящее время практически ликвидирован и там.
Патогенез. В месте укуса москита лейшмании размножаются, вызывают продуктивное воспаление и формирование гранулемы — лейшманиомы.
Отсюда лейшмании могут рассеиваться лимфогенно, что приводит к образованию новых бугорков обсеменения, развитию лимфангитов, лимфаденитов. Общая реакция организма выражена слабо.
Клиника. Инкубационный период продолжается от 2 — 8 месяцев до 1,5 лет и более.
Клиническая классификация:
— первичная лейшманиома:
стадия бугорка;
стадия изъязвления;
стадия рубцевания;
— последовательная лейшманиома;
— диффузно-инфильтрирующая лейшманиома;
— туберкулоидный кожный лейшманиоз.
На месте внедрения лейшмании в кожу появляется первичная гладкая папула розового цвета диаметром 2-3 мм. Через 3-6 месяцев она достигает 1-2 см. В центре бугорка появляется чешуйка, затем корка, которая постепенно утолщается и через 6-10 месяцев отпадает. Остается неглубокая язва с гнойным налетом на дне. В подкожную жировую клетчатку язва не проникает. Увеличение размеров язвы происходит вследствие распада плотного краевого инфильтрата, и к 8 — 12 месяцу болезни она может достигнуть 4 — 6 см в диаметре. Скудное отделяемое язвы серозного или серозно-гнойного характера.
Спустя несколько месяцев происходит рубцевание. На месте язвы образуется вначале розовый, затем бледный, атрофичный «штампованный» рубец. От появления бугорка до формирования рубца проходит в среднем 1 год (отсюда название «годовик»), реже 2 года и более. В случае присоединения вторичной инфекции течение осложняется и удлиняется. Язвы чаще безболезнены, локализуются на лице и верхних конечностях, число 1 — 3, редко 8 — 10.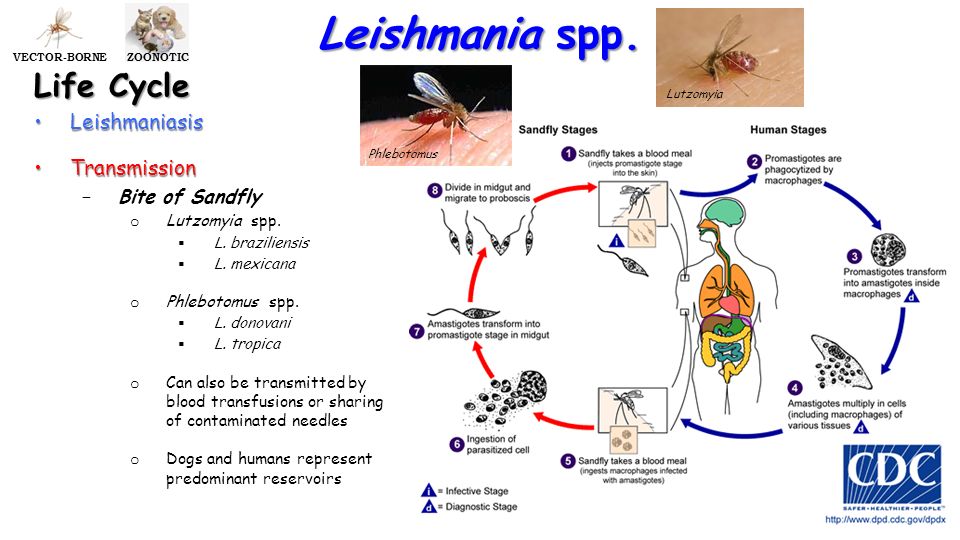
Вторая клиническая форма представлена развитием последовательных лейшманиом, ранних и поздних.
Ранние лейшманиомы развиваются параллельно первичным лейшманиомам, поздние протекают абортивно и не изъявляются на фоне формирующегося иммунитета.
У старых и ослабленных больных в результате лимфогенного распространения лейшмании развиваются диффузно-инфильтративные лейшманиомы без наклонности к изъязвлению. Через 5-7 месяцев инфильтрат начинает рассасываться и постепенно исчезает.
У некоторых больных (обычно у детей и юношей) развивается туберкулоидный кожный лейшманиоз. Вокруг рубцов появляются мелкие (1-3 мм в диаметре) множественные бугорки, не склонные к изъязвлению, но они могут увеличиваться и сливаться. Процесс длительный — до 5 — 20 лет и заканчивается он образованием рубца.
Прогноз. Для жизни благоприятный, но остаются косметические дефекты, обезображивающие рубцы.
Диагностика. В основе — клинико-эпидемиологические данные. Диагноз подтверждается обнаружением лейшманий в материале, полученном из бугорков со дна язв и краевого инфильтрата, избегая возможного кровотечения.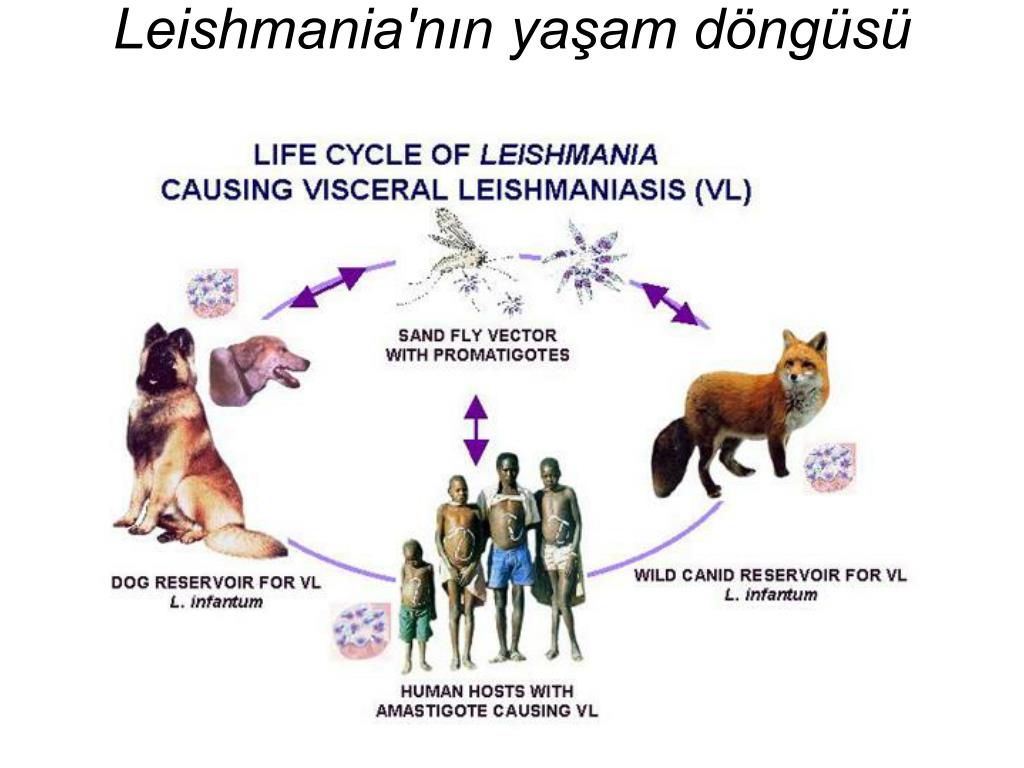 Для этого инфильтрированные участки кожи после обработки спиртом сдавливают пальцами, делают надрез и берут соскоб. Возможно использование биопробы на белых мышах или хомяках, а также получение культуры лейшманий.
Для этого инфильтрированные участки кожи после обработки спиртом сдавливают пальцами, делают надрез и берут соскоб. Возможно использование биопробы на белых мышах или хомяках, а также получение культуры лейшманий.
Зоонозный кожный лейшманиоз. (Синонимы: остро некротизирующийся, пустынно-сельский, влажный кожный лейшманиоз, пендинская язва)
Этиология. Возбудитель — L. major.
Эпидемиология. Основным резервуаром возбудителя является большая песчанка, краснохвостая и др. Переносчики — главным образом Ph. pappatasi, которые становятся заразными через 6-8 дней после кровососания на грызунах. Человек заражается через укус москита. Поэтому регистрируется летняя сезонность заболевания. Встречается в сельской местности. Восприимчивость всеобщая. Чаще болеют дети и приезжие, т. к. местное население после перенесенного заболевания приобретает стойкий иммунитет. Повторные заболевания крайне редки.
Зоонозный кожный лейшманиоз распространен в странах Северной и Западной Африки, Азии (Индия, Пакистан, Иран, Саудовская Аравия, Йемен и др. ). Встречается в Туркменистане и Узбекистане.
). Встречается в Туркменистане и Узбекистане.
Патогенез. Близок патогенезу антропонозного кожного лейшманиоза, но процесс изъязвления и рубцевания первичной лейшманиомы происходит ускоренными темпами.
Клиника. Инкубационный период короче, в среднем 10 — 20 дней. Различают те же клинические варианты, что и при антропонозном кожном лейшманиозе. Однако с самого начала образующаяся лейшманиома имеет большие размеры, иногда напоминает фурункул с воспалительной реакцией вокруг, но малоболезненный. Спустя 1-2 недели начинается центральный некроз лейшманиомы, образуются язвы размерами до 10 — 15 см и более с подрытыми краями, обильным серозно-гнойным, часто сукровичным экссудатом, болезненные при пальпации. Вокруг первичной лейшманиомы формируются множественные мелкие узелки — «бугорки обсеменения», которые превращаются в язвочки и сливаются, образуют язвенные поля. Число лейшманиом может быть различным (обычно 5 — 10), описаны случаи — более 100.
Лейшманиомы чаще локализуются на открытых частях тела — лице, руках, ногах. Рубцевание язвы начинается уже через 2-4, реже 5-6 месяцев, и завершается не позднее 6-7 месяцев.
Рубцевание язвы начинается уже через 2-4, реже 5-6 месяцев, и завершается не позднее 6-7 месяцев.
Часто возникают узловатые безболезненные лимфангиты, лимфадениты, которые в свою очередь могут изъязвляться и рубцеваться.
Изредка возникает туберкулоидный лейшманиоз кожи, длящийся годами. Описана лепроматоидная форма.
Диагностика, прогноз и лечение аналогичны таковым при антропонозном кожном лейшманиозе.
Суданский кожный леишманиоз. (Синонимы: египетский кожный леишманиоз, нодулярный кожный леишманиоз).
Этиология: Возбудитель — L. nilotica.
Эпидемиология изучена недостаточно. Распространен в Египте, Судане, Кении, Сомали, Чаде, Ливии, Уганде.
Патогенез, клиника. Инкубационный период не установлен. Начальные стадии болезни сходны с зоонозым кожным лейшманиозом. Особенность — лейшманиомы превращаются в келоидоподобные узлы, которые могут существовать долгое время.
Диагностика, лечение аналогичны другими типам кожного лейшманиоза.
Кожные лейшманиозы нового света
Возбудителями кожного лейшманиоза Нового Света являются комплекс L. mexicana (5 подвидов), комплекс L. braziliensis (3 подвида), и L. peruviana.
mexicana (5 подвидов), комплекс L. braziliensis (3 подвида), и L. peruviana.
Переносчики — москиты, многие виды которых нападают на людей в дневные часы, когда они занимаются сельскохозяйственным трудом. В городах болезнь встречается редко. Заражение происходит в большинстве случаев в сезон дождей. Восприимчивость всеобщая.
Патогенез при этих формах лейшманиоза сходен с таковым при кожном лейшманиозе Старого Света. Отличия — более глубокое поражение кожи (вплоть до гиподермы и подслизистого слоя), а также довольно частое поражение слизистых оболочек носа, рта, глотки, гортани, реже половых органов. Особенность — иммунитет нестойкий и ненапряженный.
Мексиканский кожный лейшманиоз
Возбудитель — L. mexicana mexicana.
Инкубационный период от 2 — 3 недель до 1 — 3 месяцев. Образующаяся язва (язва чиклеров) в большинстве случаев единична, безболезненна, часто локализуется на ушной раковине, вызывая ее деструкцию. Чаще язва заживает спонтанно в течение нескольких месяцев.
Резервуар и источник инфекции — различные виды диких крыс и мышей, обитающие в густых, влажных, низменных тропических лесах.
Заболевание встречается в Северной части Центральной Америки (Мексика, Гватемала. Гондурас).
Перуанский кожный лейшманиоз
Возбудитель — L. peruviana.
Отличается доброкачественным течением.
Язвы — одна, реже несколько — безболезненны, заживают даже без лечения через 4-12 месяцев. Слизистые оболочки поражаются редко. Болеют главным образом дети. Они являются главным резервуаром и источником инфекции. Другим резервуаром возбудителя являются собаки.
Встречается в сухих и горных районах, склонах Анд, в Перу и Аргентине, в Боливии.
Гвианский кожный лейшманиоз
Возбудитель — L. braziliensis gujanensis. Заболевание проходит под названием «лесной пион», «лесная фрамбезия». Иногда поражаются слизистые оболочки, но сравнительно доброкачественно, в виде «сухих» язв без осложнений. Спонтанное выздоровление наступает в течение 9 месяцев.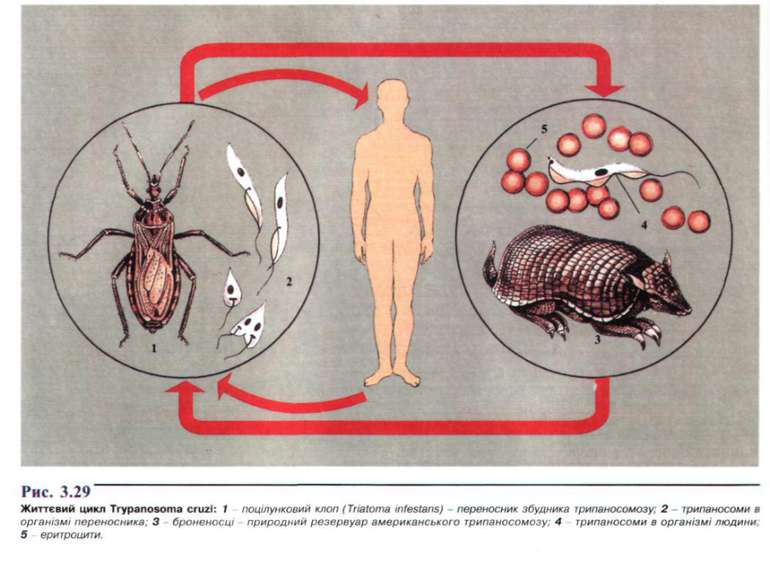 Редко, в результате лимфогенного распространения образуются также доброкачественные новые язвы.
Редко, в результате лимфогенного распространения образуются также доброкачественные новые язвы.
Резервуар инфекции — щетинистые крысы лесов северных районов Южной Америки (Гайана, Суринам, Панама).
Панамский кожный лейшманиоз
Возбудитель — L. braziliensis panamensis.
Это наиболее тяжелая и распространенная форма кожного лейшманиоза Нового Света.
Язвы с влажной, мокнущей поверхностью часто инфицируются, болезненны. Возможна лимфогенная диссеминация. Спонтанного заживления язв не бывает.
Распространен в большинстве стран Центральной Америки. Резервуар и источник инфекции — обезьяны, ленивцы, цепкохвостый медведь, коати, хлопковые крысы.
Кожно-слизистый лейшманиоз нового света
Возбудитель — L. braziliensis braziliensis.
Эта форма кожного лейшманиоза протекает наиболее тяжело. Язвы обычно бывают крупнее и болезненнее. Самозаживление наблюдается редко. Особенно тяжело заболевание протекает при поражении слизистых оболочек, что наблюдается в 90% случаев. Язвы могут возникать через несколько лет после заживления кожных язв (эспундия).
Язвы могут возникать через несколько лет после заживления кожных язв (эспундия).
Язвенное разрушение слизистых оболочек мягкого неба, глотки, носа («нос тапира»), гортани, трахеи способствует вторичному инфицированию и усугублению процесса. Иногда остаются обезображивающие лицо рубцы, происходит разрушение носовой перегородки, голосовых связок.
Прогноз может быть неблагоприятным
Диагностика и лечение такие же, как при кожном лейшманиозе Старого Света.
Регистрируется в западных и северных районах Южной Америки, Бразилии, странах Центральной Америки.
Резервуар возбудителя — лесные крысы и мыши.
Профилактика лейшманиозов
Комплекс профилактических мероприятий включает меры, направленные на источник инфекции, на механизм передачи — переносчика и меры личной профилактики.
Меры по отношению к источнику инфекции: при антропонозном типе лейшманиозов необходимо раннее выявление больных и их лечение в условиях, предупреждающих нападения переносчика (засетчивание окон, использование репеллентов), при кожных поражениях — наложение повязок, наклеек.
Диагностика завозных тропических болезней, в том числе лейшманиозов, бывает нелегкой. Помогает знание эпиданамнеза, установление факта пребывания больного в жарких странах, времени, сроков и характера профессионального труда, условий нападения переносчиков и др. Эти сведения помогут выбрать дополнительные клинические и лабораторные методы обследования.
При зоонозном типе инфекции производится уничтожение грызунов (обработка нор ядовитыми газами, ловушки и др.). Необходимо также проводить уничтожение бродячих собак и ветеринарное наблюдение за служебными и домашними собаками.
Важная мера профилактики — уничтожение москитов и предохранение от их укусов.
Общесанитарные меры (уборка помещений, удаление мусора), уничтожение кустарников вокруг населенного пункта ликвидируют возможные места выплода москитов. После механической очистки все подозрительные места подлежат химической обработке инсектицидами.
Для индивидуальной и групповой защиты от москитов используют различные отпугивающие средства — репелленты. В тропиках необходимы засетчивание окон и дверей, пологи над постелью, пропитанные репеллентами, края которых должны быть заправлены под матрас. Кондиционеры, электрические фумигаторы с инсектицидной таблеткой обеспечивают защиту. Для защиты от укусов насекомых в вечернее время следует носить длинные брюки и носки, одежду с длинными рукавами.
В тропиках необходимы засетчивание окон и дверей, пологи над постелью, пропитанные репеллентами, края которых должны быть заправлены под матрас. Кондиционеры, электрические фумигаторы с инсектицидной таблеткой обеспечивают защиту. Для защиты от укусов насекомых в вечернее время следует носить длинные брюки и носки, одежду с длинными рукавами.
Имеются рекомендации по использованию химиопрофилактики (хлоридином или тиндурином 1 раз в неделю по возрастным дозировкам при кратковременном пребывании в тропиках.
Что такое Лейшманиоз? Симптомы, диагностика, лечение, профилактика
09.12.2020
Мы продолжаем рассказывать о простейших, которые могут вызывать у человека самые разнообразные заболевания. Казалось бы — одноклеточный организм! Но все не так просто, как нам хотелось бы.
Одним из таких заболеваний является лейшманиоз — звучит жутко, но из названия понятно, что вызывается он простейшими рода Leishmania.
Лейшманиозы распространены по всему миру — инфекция у человека вызывается 20 видами Leishmania!
В зависимости от географии, они делятся на лейшманиозы Нового и Старого Света. В зависимости же от клинических проявлений — при поражении только кожи, кожи и слизистых оболочек или внутренних органов — они подразделяются на кожную, кожно-слизистую и висцеральную форму болезни соответственно.
Возбудителями кожного лейшманиоза являются L.L. major, L.L. tropica (Центральная и Юго-восточная Азия, средний Восток, Африка), L.L. aethiopica (Эфиопия, Кения, Уганда), L.L. mexicana, L.V. braziliensis (Центральная и Южная Америка, Мексика, Перу и Аргентина), L.V. guyanensis (Панама, Коста-Рика, Эквадор, Перу, Венесуэла). Последние 4 группы из них способны вызвать диффузные кожные лейшманиозы и кожно-слизистые формы заболевания. Висцеральные формы лейшманиоза чаще всего вызывают L.L. infantum, L.L. donovani (Средиземноморье, Северная Африка, Ближний Восток, Центральная и Юго-Западная Азия, Балканы, Китай, Индия, Китай, Пакистан, Центральная и Южная Америка).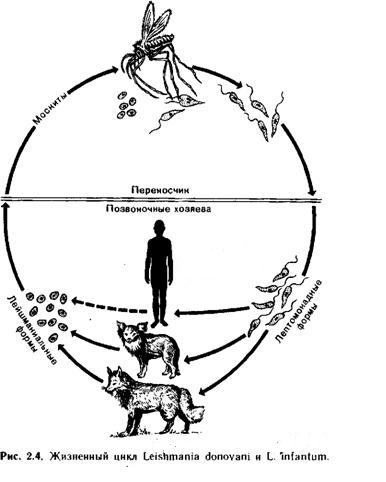
Лейшманиозы — группа трансмиссивных заболеваний, это значит, что они передаются через укусы насекомых, в частности при укусах москитов видов Phlebotomus, Lutzomyia в зависимости опять же от географии. Источником инфекции и резервуаром являются человек и различные виды животных грызуны, собаки и другие — это также зависит от видов лейшманий и географического положения.
После укуса москита лейшмании могут либо оставаться в пределах кожи ограниченно или диффузно, либо распространяться на слизистые оболочки — в основном носа, ротоглотки, либо через лимфатическую систему разноситься к другим органам и тканям организма — проникать в селезенку, костный мозг, печень, кишечник и др. Висцеральный лейшманиоз является наиболее тяжелой формой заболевания. Форма и тяжесть заболевания зависят не только от вида лейшмании, но и от иммунной защиты организма, поэтому тяжелее болеют дети раннего возраста, а для пациентов с ВИЧ-инфекцией лейшманиоз рассматривается как оппортунистическое заболевание.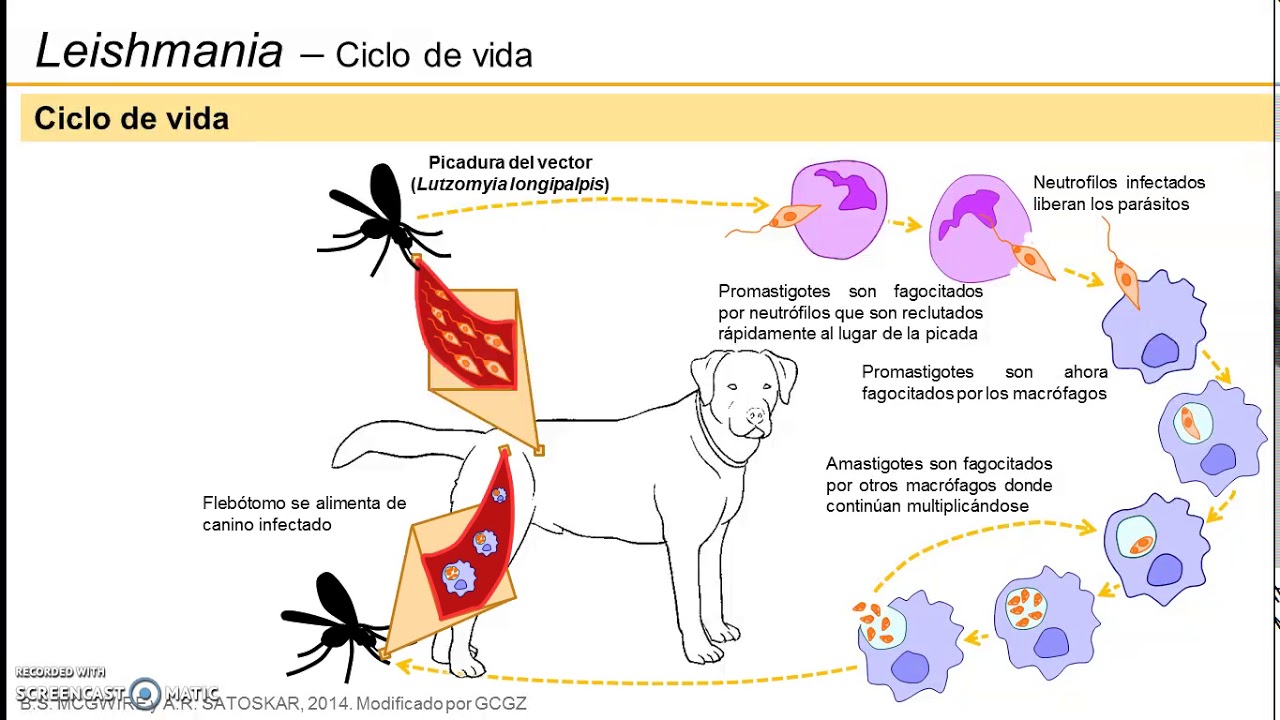
Кожный лейшманиоз.
Поражение кожи развивается на месте укуса москита через несколько недель или даже месяцев. Множественные поражения кожи могут быть результатом неоднократных укусов. Изначально это папула, которая медленно увеличивается, в центре образуется язвочка и развивается приподнятая эритематозная граница, где сконцентрированы внутриклеточные паразиты. Язвочки чаще всего безболезненны, но присоединение вторичной бактериальной флоры может привести к прогрессированию заболевания и нагноению. Изъязвления обычно заживают спонтанно через несколько месяцев, но могут сохраняться в течение многих лет.
Диффузный кожный лейшманиоз.
Диффузная форма кожного лейшманиоза развивается редко, в основном лейшманиями Нового Света. Характеризуется распространенным утолщением кожи в форме бляшек, папул или множественных узелковых образований, особенно на лице и наружней повержности конечностей, напоминая поражения при лепре.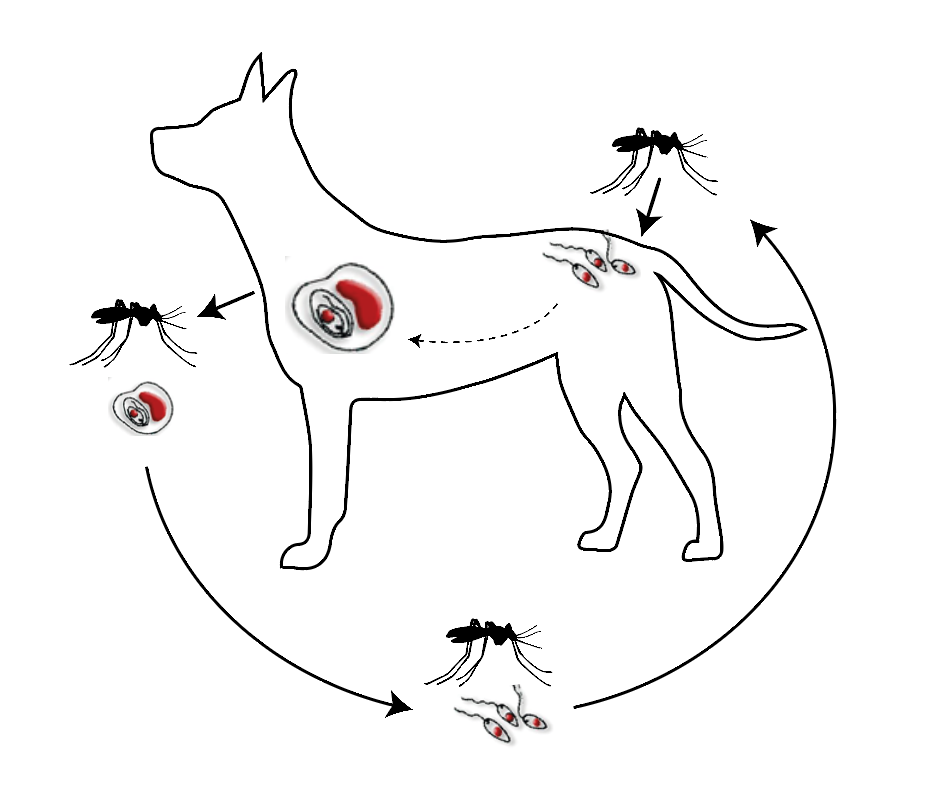 Изъязвления и поражение слизистых оболочек чаще отсутствуют, но болезнь не проходит спонтанно и отличается склонностью к рецидивам после лечения.
Изъязвления и поражение слизистых оболочек чаще отсутствуют, но болезнь не проходит спонтанно и отличается склонностью к рецидивам после лечения.
Кожно-слизистый лейшманиоз.
Начинается с первичной кожной язвочки, как и другие формы кожного лейшманиоза. Это поражение кожи проходит спонтанно. Метастатическое распространение процесса на слизистые оболочки носа, ротоглотки могут произойти как на ранней стадии болезни, так и спустя многие годы. Патогенетически при данном процессе происходит разрушение мягких тканей и хрящей, отек носа и губ. Как правило, у пациентов появляются заложенность носа, выделения и боль. Но болевой синдром может отсутствовать. Со временем развиваются массивные поражения носа, неба или лица, обезображивающие больного. Опасно присоединение вторичной бактериальной инфекции. Летальные исходы у таких пациентов наступают из-за бактериальных осложнений и истощения.
Висцеральный лейшманиоз.
Клинические проявления могут развиться остро (например при иммунодефицитных состояниях), но могут начать проявляться через многие месяцы. Некоренные жители могут заразиться при посещение эндемичных районов — в таком случае инкубационные=й период может длиться до 2 лет.
Некоренные жители могут заразиться при посещение эндемичных районов — в таком случае инкубационные=й период может длиться до 2 лет.
Характерны волнообразная лихорадка с ознобом, чаще всего два пика температуры в течение суток, гепатоспленомегалия, лимфаденопатия, истощение, отеки. Лабораторно выявляются панцитопения, гипоальбуминемия, гипергаммаглобулинемия, нарушение свертываемости крови. Поражения кожи встречаются редко. Нередко присоединяется вторичная бактериальная инфекция. При несвоевременном неадекватном лечении или его отсутствии в течение нескольких месяцев-лет наступает летальный исход.
У пациентов, у которых нет клинических проявлений (например жители эндемичных районов), либо наступает самоизлечение, либо у оставшихся в живых после успешного лечения, наблюдается резистентность к дальнейшим заражениям — формируется стойкий иммунитет. Однако возможно возникновение рецидива болезни через многие годы.
В Индии висцеральный лейшманиоз называют “кала-азар” или “черная болезнь”, так как из-за поражения надпочечников часто отмечается потемнение кожи лица, рук, живота, стоп. Примерно у 10% таких больных через несколько месяцев и до двух лет возникает посткалаазарный кожный лейшманиоз — поражение характеризуется плоскими или узловыми повреждениями кожи, в которых содержится множество паразитов — эти поражения считаются резервуаром, они способствуют распространению инфекции в этих областях.
Примерно у 10% таких больных через несколько месяцев и до двух лет возникает посткалаазарный кожный лейшманиоз — поражение характеризуется плоскими или узловыми повреждениями кожи, в которых содержится множество паразитов — эти поражения считаются резервуаром, они способствуют распространению инфекции в этих областях.
При подозрении на лейшманиоз любой формы для подтверждения диагноза могут быть использованы следующие методы диагностики:
-
Микроскопия и ПЦР-исследование пунктатов органов и тканей, соскоба с пораженной области кожи
-
ПЦР-исследование крови может быть информативным при лейшманиозе у пациентов с ВИЧ-инфекцией
-
Серологическое исследование (ИФА IgG) применяется при подозрении на висцеральный лейшманиоз, но стоит помнить, что возможно получение как ложноотрицательных результатов (например, при ВИЧ-инфекции, при раннем и пожилом возрастах), так и ложноположительных (СКФ, лейкоз, сифилис, и др.
 ). При этом серологические исследования не проводятся для определения эффективности проводимого лечения — это связано с длительным обнаружением IgG в крови после излечения.
). При этом серологические исследования не проводятся для определения эффективности проводимого лечения — это связано с длительным обнаружением IgG в крови после излечения.
-
Также может быть информативным культуральное исследование пунктатов — посев на специальные среды.
Лечение лейшманиоза является сложным, что в некоторой степени обусловлено возрастающей резистентностью микроорганизмов к применяемым препаратам. Выбор препаратов зависит от следующих факторов:
-
Клинический синдром
-
Подтвержденный диагноз лейшманиоза
-
Географический регион (место заражения)
-
Вероятная восприимчивость микроорганизма к лечению
-
Иммунный статус хозяина (иммунодефицитные состояния)
Подходы к лечению кожного и висцерального лейшманиоза сильно отличаются. При кожном лейшманиозе имеет большое значение клиническая тяжесть инфекции, например при кожном ограниченном лейшманиозе без риска возникновения проявления со стороны слизистых оболочек может применяться только местная терапия, в то время как при кожно-слизистом или диффузном кожном лейшманиозах необходима системная терапия. В случае висцерального лейшманиоза кала-азар при отсутствии лечения летальность составляет до 90%, здесь не стоит вопрос о необходимости терапии, выбор препаратов основан на доступности и сведениях о резистентности. А при развитии лейшманиоза на фоне прогрессирующей ВИЧ-инфекции требуется не только системная терапия противопаразитарными препаратами, но и скорейшее начало антиретровирусной терапии, без которой клинический эффект от проводимой терапии будет недостаточен.
При кожном лейшманиозе имеет большое значение клиническая тяжесть инфекции, например при кожном ограниченном лейшманиозе без риска возникновения проявления со стороны слизистых оболочек может применяться только местная терапия, в то время как при кожно-слизистом или диффузном кожном лейшманиозах необходима системная терапия. В случае висцерального лейшманиоза кала-азар при отсутствии лечения летальность составляет до 90%, здесь не стоит вопрос о необходимости терапии, выбор препаратов основан на доступности и сведениях о резистентности. А при развитии лейшманиоза на фоне прогрессирующей ВИЧ-инфекции требуется не только системная терапия противопаразитарными препаратами, но и скорейшее начало антиретровирусной терапии, без которой клинический эффект от проводимой терапии будет недостаточен.
Почему важно знать о лейшманиозе?
География путешествий человека расширяется, но для того, чтобы увеличить риск заражения лейшманиозом, не обязательно лететь в южную Африку.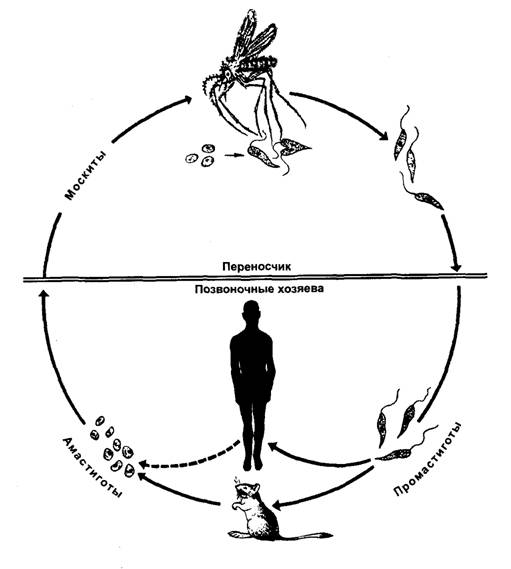 Риск заражения лейшманиозом остается при посещении стран ближнего зарубежья: Азербайджана, Армении, Грузии, Кыргызстана, Таджикистана, Узбекистана в пик активности переносчиков возбудителя. В России регистрируются только завозные случаи лейшманиоза. Инкубационный период развития заболевания у туристов может достигать нескольких лет, поэтому очень важны сведения о посещении и длительности пребывания на тех или иных эндемичных территориях, а также указания на взаимодействия с москитами и другими вредными насекомыми :)
Риск заражения лейшманиозом остается при посещении стран ближнего зарубежья: Азербайджана, Армении, Грузии, Кыргызстана, Таджикистана, Узбекистана в пик активности переносчиков возбудителя. В России регистрируются только завозные случаи лейшманиоза. Инкубационный период развития заболевания у туристов может достигать нескольких лет, поэтому очень важны сведения о посещении и длительности пребывания на тех или иных эндемичных территориях, а также указания на взаимодействия с москитами и другими вредными насекомыми :)
Специфической профилактики не разработано, поэтому путешественникам в эндемичных областях на открытые участки кожи следует использовать средства от насекомых, содержащие диэтилтолуамид, пропитывать одежду репеллентами. Также могут быть эффективны противомоскитные сетки, сетки на кроватях, особенно если пропитать их перметрином или пиретрумом.
Услуги, упомянутые в статье*:
-
Микроскопическое исследование соскобов с кожи, папул и краев язв на лейшмании (А26.
 01.01.s01)
01.01.s01)
-
Микроскопическое исследование пунктатов органов кроветворения на лейшмании (А26.05.014)
-
Определение антител класса G к возбудителю лейшманиоза в крофи методом ИФА
-
Определение ДНК лейшманий в крови методом ПЦР (А26.06.053.s01)
*Назначение и интерпретация результатов анализов должны проводиться только лечащим врачом
Автор: врач-инфекционист Университетской клиники H-Clinic Анастасия Александровна Коновалова.
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич.
Возврат к списку
Каков жизненный цикл Leishmania по отношению к лейшманиозу?
Автор
Craig G Stark, MD
Craig G Stark, MD является членом следующих медицинских обществ: Американского колледжа врачей — Американского общества внутренней медицины, Международного общества медицины путешествий, Phi Beta Kappa, Королевского колледжа врачей и Хирурги Глазго, Общество летных хирургов армии США
Раскрытие информации: нечего раскрывать.
Соавтор (ы)
Кондживарам Видьяшанкар, MD, MRCP Педиатрический врач, Королевский госпиталь Дамфриса и Галлоуэя, Шотландия
Кондживарам Видьяшанкар, доктор медицины, MRCP является членом следующих медицинских обществ: Международного общества по СПИДу, Королевского педиатрического колледжа и Индийская академия педиатрии, Европейское общество детских инфекционных болезней
Раскрытие информации: нечего раскрывать.
Главный редактор
Пранатхарти Харан Чандрасекар, бакалавр медицины и медицины Профессор, заведующий отделением инфекционных заболеваний, факультет внутренней медицины, Медицинский факультет Государственного университета Уэйна
Пранатхарти Харан Чандрасекар, бакалавр медицины и медицины, является членом следующих медицинских обществ: Американский колледж врачей , Американское общество микробиологии, Международное принимающее общество с ослабленным иммунитетом, Общество инфекционных болезней Америки
Раскрытие: Ничего не говорится.
Благодарности
Ручир Агравал, MD Заведующий отделением аллергии и иммунологии, Клиника Авроры Шебойган
Ручир Агравал, доктор медицины, является членом следующих медицинских обществ: Американской академии аллергии, астмы и иммунологии, Американской академии педиатрии, Американского колледжа аллергии, астмы и иммунологии и Американской медицинской ассоциации
.Раскрытие: Ничего не раскрывать.
Пранатхарти Харан Чандрасекар, MBBS, доктор медицины Профессор кафедры внутренней медицины, директор стипендии по инфекционным заболеваниям, больница Харпер, медицинский факультет государственного университета Уэйна
Pranatharthi Haran Chandrasekar, MBBS, MD является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционных болезней Америки
webmd.com»> Раскрытие: Ничего не раскрывать.Дирк М. Элстон, доктор медицины Директор, Академия дерматопатологии Акермана, Нью-Йорк
Дирк М. Элстон, доктор медицины, является членом следующих медицинских обществ: Американская академия дерматологии
Раскрытие: Ничего не раскрывать.
Джон Халперн, DO, FACEP Доцент кафедры семейной медицины, Колледж остеопатической медицины Юго-Восточного университета Нова; Медицинский директор, Институт карьеры здравоохранения; Медицинский директор отделения неотложной помощи, Больница Палмс Вест
Джон Халперн, DO, FACEP является членом следующих медицинских обществ: Американский колледж врачей скорой помощи
Раскрытие: Ничего не раскрывать.
Эдмонд А. Хукер II, доктор медицины, доктор медицинских наук, FAAEM Доцент, Департамент управления службами здравоохранения, Университет Ксавьера, Цинциннати, Огайо; Доцент кафедры неотложной медицины Медицинского колледжа Университета Цинциннати
Эдмонд А. Хукер II, MD, DrPH, FAAEM является членом следующих медицинских обществ: Американской академии экстренной медицины, Американской ассоциации общественного здравоохранения, Общества академической неотложной медицины и Южной медицинской ассоциации
Раскрытие: Ничего не раскрывать.
Renee Y Hsia, MD, MSc Клинический инструктор, Отделение неотложной медицины, Калифорнийский университет в Медицинской школе Сан-Франциско; Лечащий врач отделения неотложной медицины больницы общего профиля Сан-Франциско
webmd.com»> Раскрытие: Ничего не раскрывать.Джули Р. Кеннер, доктор медицины, доктор философии Частная практика, Центр дерматологии Кеннера
Джули Р. Кеннер, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии дерматологии и Американского общества дерматологической хирургии
Раскрытие: Ничего не раскрывать.
Томас М. Керкеринг, доктор медицины Заведующий отделением инфекционных болезней Медицинской школы штата Вирджиния Tech Carilion
Томас М. Керкеринг, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американская ассоциация общественного здравоохранения, Американское общество микробиологии, Американское общество тропической медицины и гигиены, Американское общество инфекционных заболеваний, Медицинское общество Вирджинии и Медицинское общество дикой природы
webmd.com»> Раскрытие: Ничего не раскрывать.Абдул-Гани Кибби, доктор медицины Профессор и заведующий кафедрой дерматологии Медицинского центра Американского университета в Бейруте, Ливан
Раскрытие: Ничего не раскрывать.
Дженнифер Дж. Ли Доктор медицины, доцент, отделение дерматологии, медицинский факультет, Медицинский центр Университета Вандербильта
Дженнифер Дж. Ли является членом следующих медицинских обществ: Американская академия дерматологии
Раскрытие: Ничего не раскрывать.
Lester F Libow, MD Дерматопатолог, Южно-Техасская дерматопатологическая лаборатория
Лестер Ф. Либоу, доктор медицины, является членом следующих медицинских обществ: Американской академии дерматологии, Американского общества дерматопатологов и Техасской медицинской ассоциации
.
Раскрытие: Ничего не раскрывать.
Гэри Дж. Ноэль, доктор медицины Профессор кафедры педиатрии Медицинского колледжа Вейл Корнелл; Лечащий педиатр пресвитерианской больницы Нью-Йорка
Гэри Дж. Ноэль, доктор медицины, является членом следующих медицинских обществ: Общество педиатрических инфекционных болезней
Раскрытие: Ничего не раскрывать.
Уильям Г. Стеббинс, доктор медицины Доцент кафедры дерматологии, Университет Вандербильта
Уильям Г. Стеббинс, доктор медицины, является членом следующих медицинских обществ: Американской академии дерматологии, Американского общества дерматологической хирургии и Фонда дерматологии
com»> Раскрытие: Ничего не раскрывать.Russell W. Steele, MD Руководитель отделения детских инфекционных болезней Детского оздоровительного центра Охснера; Клинический профессор кафедры педиатрии медицинского факультета Тулейнского университета
Рассел Стил, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологов, Американского общества инфекционных болезней, Медицинского общества штата Луизиана, Общества педиатрических инфекционных болезней, Общество педиатрических исследований и Южная медицинская ассоциация
Раскрытие: Ничего не раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
webmd.com»> Раскрытие информации: Medscape Salary EmploymentДжетер (Джей) Притчард Тейлор III, MD Специалист по соблюдению нормативных требований, лечащий врач, отделение неотложной медицины, отделение неотложной медицины, Palmetto Health Richland, Школа медицины Университета Южной Каролины; Медицинский директор отделения неотложной медицины, Palmetto Health Baptist
Джетер (Джей) Притчард Тейлор III, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американской медицинской ассоциации и Общества академической неотложной медицины
Раскрытие: Ничего не раскрывать.
N Ewen Wang, MD Консультант, Отделение хирургии, Отделение неотложной медицины, Госпиталь Стэнфордского университета
webmd.com»> Раскрытие: Ничего не раскрывать.Питер Вейна, доктор медицины, доктор философии Полковник армии США; Заместитель командира / заместитель директора, медицинский директор лаборатории диагностики лейшмании, Армейский научно-исследовательский институт Уолтера Рида,
Питер Дж. Вейна, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества тропической медицины и гигиены, Ассоциации военных хирургов США и Международного общества туристической медицины
Раскрытие: Ничего не раскрывать.
Майкл Дж. Уэллс, доктор медицины Доцент кафедры дерматологии, Центр медицинских наук Техасского технологического университета, Медицинская школа Пола Л. Фостера
webmd.com»> Майкл Дж. Уэллс, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии дерматологии, Американской медицинской ассоциации и Техасской медицинской ассоциацииРаскрытие: Ничего не раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не раскрывать.
Благодарности
Мнения или утверждения, содержащиеся в данном документе, являются частной точкой зрения авторов и не должны рассматриваться как официальные или отражающие точку зрения Министерства армии или Министерства обороны.
Распознавание и лечение кожного лейшманиоза
1. Дедет Дж. П., Пратлонг Ф. Лейшманиоз. В: Manson P, Cook GC, Zumla A, eds. Тропические болезни Мэнсона. 21-е изд. Лондон: Сондерс, 2003: 1339–64 ….
Дедет Дж. П., Пратлонг Ф. Лейшманиоз. В: Manson P, Cook GC, Zumla A, eds. Тропические болезни Мэнсона. 21-е изд. Лондон: Сондерс, 2003: 1339–64 ….
2.Herwaldt BL. Лейшманиоз. Ланцет . 1999; 354: 1191–9.
3. Cope SE, Шульц Г.В., Ричардс А.Л., Savage HM, Смит GC, Митчелл CJ, и другие. Оценка членистоногих-переносчиков инфекционных заболеваний в районах дислокации войск США в Персидском заливе. Am J Trop Med Hyg . 1996; 54: 49–53.
4. Hyams KC, Хэнсон К., Wignall FS, Эскамилла Дж., Олдфилд ЕС 3d.Влияние инфекционных заболеваний на здоровье войск США, дислоцированных в Персидском заливе во время операций Desert Shield и Desert Storm. Clin Infect Dis . 1995; 20: 1497–504.
5. McNeil DG Jr. Воспаленная область: лекарство; По словам Армии, сотни американских солдат заражены паразитами, переносимыми москитами. New York Times 6 декабря 2003 г .: А, 8.
New York Times 6 декабря 2003 г .: А, 8.
6. Центры по контролю и профилактике заболеваний (CDC). . Кожный лейшманиоз у военнослужащих США — Юго-Западная / Центральная Азия, 2002–2003 гг. MMWR Morb Mortal Wkly Rep . 2003. 52: 1009–12.
7. Переулок РП. Флеботоминовые москиты. В: Manson P, Cook GC, Zumla A, eds. Тропические болезни Мэнсона. 21-е изд. Лондон: Сондерс, 2003: 1733–41.
8. Информационный бюллетень ВОЗ. Лейшманиоз и коинфекция лейшмании / ВИЧ. По состоянию на 16 октября 2003 г., по адресу: http://www.who.int/inf-fs/en/fact116.html.
9. Magill AJ. Лейшманиоз. В: Hunter GW, Strickland GT, ред. Hunter’s Тропическая медицина и новые инфекционные болезни.8-е изд. Филадельфия: Сондерс, 2000: 665–87.
10. Аронсон, NE,
Wortmann GW,
Джонсон СК,
Джексон Дж. Э.,
Гассер Р.А. младший,
Мэджилл Эй Джей,
и другие.
Безопасность и эффективность внутривенного введения стибоглюконата натрия в лечении лейшманиоза: недавний военный опыт США. Clin Infect Dis .
1998. 27: 1457–64.
Clin Infect Dis .
1998. 27: 1457–64.
11. Мартинес С, Marr JJ. Аллопуринол в лечении американского кожного лейшманиоза. N Engl J Med . 1992; 326: 741–4.
12. Велес I, Агудело С, Хендрикс Э, Пуэрта Дж, Грогль М, Модаббер Ф, и другие. Неэффективность аллопуринола в качестве монотерапии колумбийского кожного лейшманиоза. Рандомизированное контролируемое исследование. Энн Интерн Мед. . 1997. 126: 232–6.
13. Эсфандиарпур I, Алави А. Оценка эффективности аллопуринола и антимониата меглумина (глюкантайм) при лечении кожного лейшманиоза. Инт Дж Дерматол . 2002; 41: 521–4.
14. Льянос-Куэтас А,
Эчеваррия J,
Круз М,
Ла Роса А,
Кампос П.,
Кампос М,
и другие.
Эффективность стибоглюконата натрия отдельно и в комбинации с аллопуринолом для лечения кожно-слизистого лейшманиоза. Clin Infect Dis .
1997; 25: 677–84.
Clin Infect Dis .
1997; 25: 677–84.
15. Навин Т.Р., Арана Б.А., Арана ИП, де Мерида AM, Castillo AL, Pozuelos JL.Плацебо-контролируемое клиническое испытание антимоната меглумина (глюкантайм) в сравнении с локализованным контролируемым нагревом при лечении кожного лейшманиоза в Гватемале. Am J Trop Med Hyg . 1990; 42: 43–50.
16. Веласко-Кастрехон О, Уолтон BC, Ривас-Санчес Б, Гарсия М.Ф., Лазаро Г.Дж., и другие. Лечение кожного лейшманиоза локализованным полем тока (радиочастотой) в Табаско, Мексика. Am J Trop Med Hyg .1997; 57: 309–12.
17. Гурей М.С.,
Татли Н,
Озбилге Н,
Эрель О,
Сейрек А,
Коцигит А,
и другие.
Эффективность криотерапии и пентостама внутри очага поражения при лечении кожного лейшманиоза. J Egypt Soc Parasitol .
2000. 30: 169–76.
18. Альраджи А.А., Ибрагим Э.А., Де Вол ЭБ, Хайрат М, Фарис Р.М., Магуайр JH. Флуконазол для лечения кожного лейшманиоза, вызванного Leishmania major. N Engl J Med . 2002; 346: 891–5.
19. Дэвис ЧР, Кэй П, Croft SL, Сундар С. Лейшманиоз: новые подходы к борьбе с болезнями. BMJ . 2003. 326: 377–82.
20. Шарифи I, ФеКри АР, Афлатонский MR, Хамесипур А, Надим А, Мусави М.Р., и другие. Рандомизированное испытание вакцины однократной дозы убитого Leishmania major плюс БЦЖ против антропонозного кожного лейшманиоза в Баме, Иран. Ланцет . 1998. 351: 1540–3.
21. Крегер А,
Авила Е.В.,
Морисон Л.
Шторы, пропитанные инсектицидом, для борьбы с передачей кожного лейшманиоза внутри страны в Венесуэле: кластерное рандомизированное исследование. BMJ . 2002; 325: 810–3.
2002; 325: 810–3.
Лейшманиоз: клинические синдромы и лечение | QJM: Международный медицинский журнал
Абстрактные
Лейшманиоз — это глобальный термин для обозначения кожных и висцеральных антропонозов и зоонозов, вызываемых трансмиссивными паразитами из рода Leishmania .От этих болезней ежегодно страдают не менее 2 миллионов человек, из которых более 350 миллионов подвергаются риску в 98 странах мира. Это болезни, в основном вызываемые бедными, что затрудняет их профилактику, диагностику и лечение. Терапия лейшманиоза варьируется от местного лечения кожных поражений до системной, часто токсической, терапии диссеминированных кожных, кожно-слизистых и смертельных висцеральных заболеваний. Этот обзор представляет собой краткое изложение клинических синдромов, вызванных Leishmania , и схем лечения, используемых в настоящее время для различных форм лейшманиоза.
Введение
Простейшие из рода Leishmania представляют собой разнообразную группу паразитов, которые передаются от млекопитающих-хозяев кровососущими москитами. Leishmania поочередно заражает самок москитов, которые сосут кровь для обеспечения питательной ценности откладывания яиц, а также различных видов млекопитающих, включая человека. Различные животные служат естественными резервуарами и включают как домашних, так и диких собак, грызунов, лисиц, шакалов, волков, енотов и даманов, ленивцев, трубкозубов, опоссумов и грызунов, таких как крысы и мыши.Считается, что люди представляют собой главный резервуар в Индии. Заражение человека патогенными видами лейшманиоза вызывает различные хронические инфекции кожи и внутренних органов и присутствует как в Старом (в регионах Дальнего и Среднего Востока, Центральной Западной и Восточной Европы и Африки), так и в Новом (в регионах Центральной и Южной Америки). ) Миры и в основном встречаются в бедных сельских районах. В целом, во всем мире существует более 20 видов Leishmania , и подтип болезни связан с видами, вызывающими заражение Leishmania , и взаимодействием генетического фона и иммунного статуса хозяина.
Leishmania поочередно заражает самок москитов, которые сосут кровь для обеспечения питательной ценности откладывания яиц, а также различных видов млекопитающих, включая человека. Различные животные служат естественными резервуарами и включают как домашних, так и диких собак, грызунов, лисиц, шакалов, волков, енотов и даманов, ленивцев, трубкозубов, опоссумов и грызунов, таких как крысы и мыши.Считается, что люди представляют собой главный резервуар в Индии. Заражение человека патогенными видами лейшманиоза вызывает различные хронические инфекции кожи и внутренних органов и присутствует как в Старом (в регионах Дальнего и Среднего Востока, Центральной Западной и Восточной Европы и Африки), так и в Новом (в регионах Центральной и Южной Америки). ) Миры и в основном встречаются в бедных сельских районах. В целом, во всем мире существует более 20 видов Leishmania , и подтип болезни связан с видами, вызывающими заражение Leishmania , и взаимодействием генетического фона и иммунного статуса хозяина. По оценкам, ежегодно во всем мире заболеваемость составляет 2 миллиона случаев в 98 странах, а еще 350 миллионов подвержены риску заражения. 1
По оценкам, ежегодно во всем мире заболеваемость составляет 2 миллиона случаев в 98 странах, а еще 350 миллионов подвержены риску заражения. 1
Leishmania имеет две основные стадии жизненного цикла: подвижный флагеллированный промастигот, который присутствует в векторе москитов, и внутриклеточный немагеллированный амастигот, который присутствует в клетках-хозяевах млекопитающих (рис. 1). Leishmania — паразиты профессиональных фагоцитов (макрофагов и дендритных клеток), которые инициируют инфекцию через рецептор-опосредованное связывание инфекционных промастиготов, доставленных в ткань хозяина во время кормления инфицированных москитов. 2 Паразиты, содержащиеся в паразитофорных вакуолях, сливаются с лизосомами с образованием фаголизосом, в которых промастиготы трансформируются и реплицируются в амастиготы. 3 В конце концов, нагрузка паразитов увеличивается, физически разрушая инфицированные макрофаги хозяина, доставляя внеклеточные амастиготы в окружающие ткани, где они поглощаются неинфицированными макрофагами. Паразиты и инфицированные макрофаги могут метастазировать в кожу и внутренние органы. Контроль над инфекцией — это сложное взаимодействие факторов врожденного и адаптивного иммунитета, которые не до конца изучены. 4 , 5
Паразиты и инфицированные макрофаги могут метастазировать в кожу и внутренние органы. Контроль над инфекцией — это сложное взаимодействие факторов врожденного и адаптивного иммунитета, которые не до конца изучены. 4 , 5
Рисунок 1.
Жизненный цикл Leishmania и клинические синдромы. ( A ) Схематическое изображение жизненного цикла Leishmania . ( B ) Окрашенный по Гимзе препарат промастигот L. donovani , ( C ) окрашенный по Гимзе препарат сенсорного поражения кожного поражения, показывающий присутствие внутриклеточных паразитов внутри макрофагов, ( D ) поражение CL на руке, ( E ) кожно-слизистые поражения (MCL) рта и носа, ( F ) лицевые поражения в случае PKDL, ( G ) возникающие поражения внутри старого рубца CL в LR и ( H ) поражения на всем протяжении в DCL.Авторские права на изображения: Панели: A, получены от NIAID; B, www.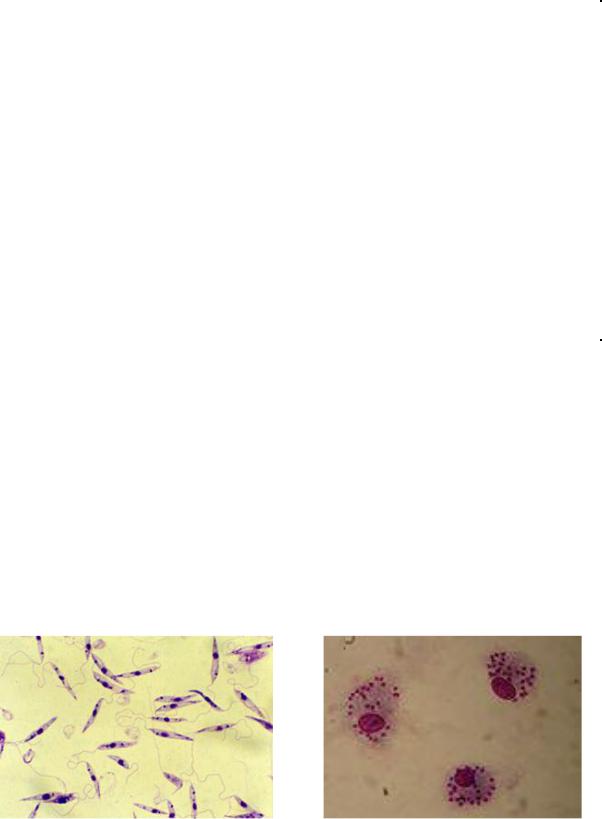 lookfordiagnosis.com; C, Центры по контролю заболеваний, www.CDC.gov; D, www.Dermnet.com; E, www.Drugline.org; F, www.WHO.int, G, www.globalskinatlas.com и H, Медицинские книги в Интернете, www.cixip.com.
lookfordiagnosis.com; C, Центры по контролю заболеваний, www.CDC.gov; D, www.Dermnet.com; E, www.Drugline.org; F, www.WHO.int, G, www.globalskinatlas.com и H, Медицинские книги в Интернете, www.cixip.com.
Рисунок 1.
Жизненный цикл Leishmania и клинические синдромы. ( A ) Схематическое изображение жизненного цикла Leishmania . ( B ) Окрашенный по Гимзе препарат промастигот L. donovani , ( C ) окрашенный по Гимзе препарат сенсорного поражения кожного поражения, показывающий присутствие внутриклеточных паразитов внутри макрофагов, ( D ) поражение CL на руке, ( E ) кожно-слизистые поражения (MCL) рта и носа, ( F ) лицевые поражения в случае PKDL, ( G ) возникающие поражения внутри старого рубца CL в LR и ( H ) поражения на всем протяжении в DCL.Авторские права на изображения: Панели: A, получены от NIAID; B, www.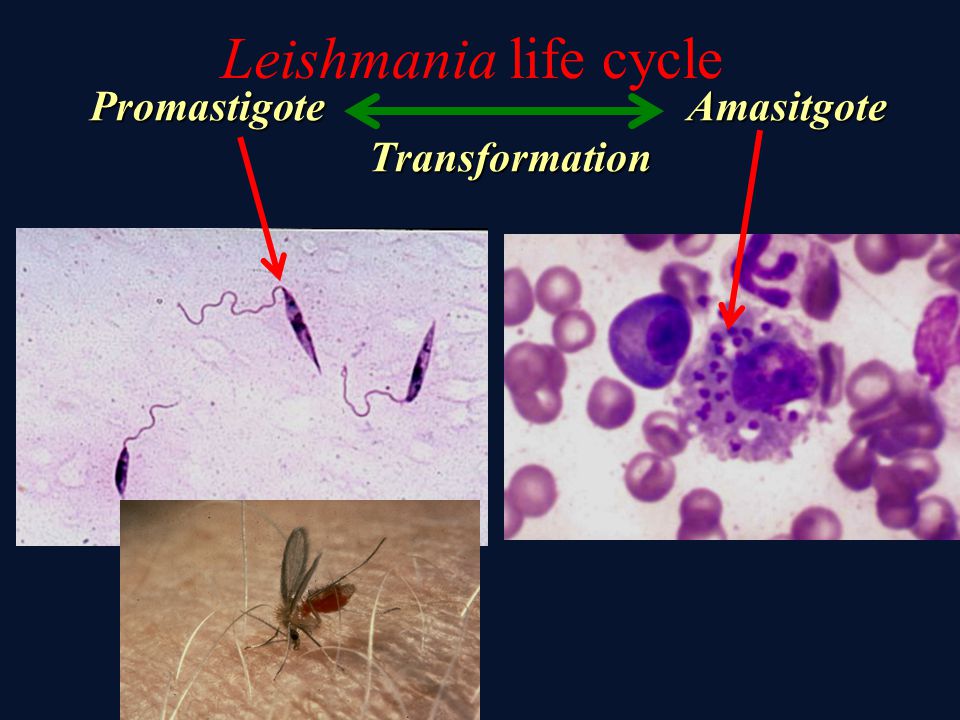 lookfordiagnosis.com; C, Центры по контролю заболеваний, www.CDC.gov; D, www.Dermnet.com; E, www.Drugline.org; F, www.WHO.int, G, www.globalskinatlas.com и H, Медицинские книги в Интернете, www.cixip.com.
lookfordiagnosis.com; C, Центры по контролю заболеваний, www.CDC.gov; D, www.Dermnet.com; E, www.Drugline.org; F, www.WHO.int, G, www.globalskinatlas.com и H, Медицинские книги в Интернете, www.cixip.com.
Клинические синдромы
Лейшманиозная болезнь вызывает три основных синдрома у человека и несколько менее распространенных клинических проявлений (рис. 1). Результат каждого определяется видом заражающего паразита и генетической восприимчивостью хозяина.
Кожные заболевания
Кожный лейшманиоз (КЛ) является наименее тяжелой формой болезни и вызывается несколькими видами, такими как Leishmania major и Leishmania tropica в Старом Свете и Leishmania mexicana , Leishmania amazonensis , Leishmania70ania Leishmania panamensis и Leishmania braziliensis в различных регионах Центральной и Южной Америки. 6 Простое кожное заболевание проявляется в виде единичных язвенных или узловых поражений в месте контакта с насекомыми или рядом с ним.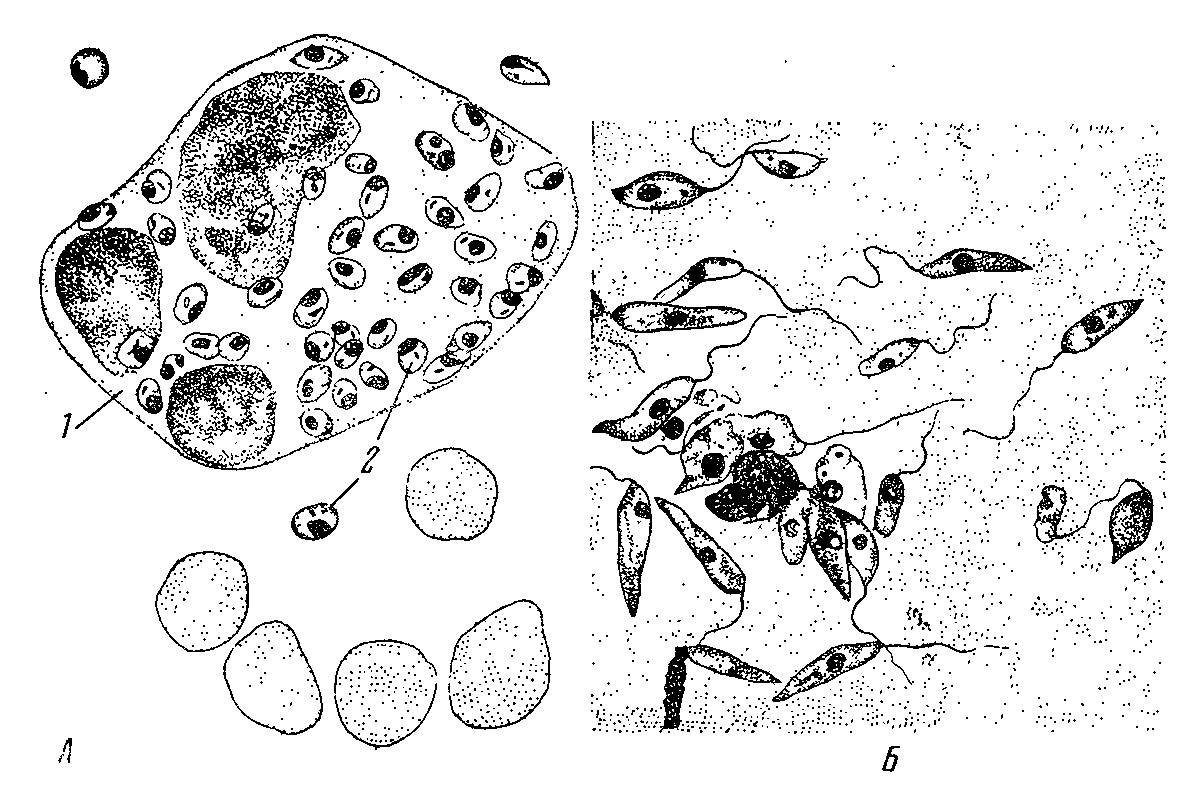 Обычно они обнаруживаются на открытых участках тела, таких как лицо, предплечья и голени, и развиваются в течение недель или месяцев. При диффузном кожном заболевании, например, вызванном L. amazonensis , узелковые поражения различного размера часто прорезываются в различных местах, удаленных от места воздействия насекомых. Простые кожные поражения чаще всего самоизлечиваются, но в некоторых случаях, например, вызванных L. panamensis и L. braziliensis , могут прогрессировать с поражением кожно-слизистой ткани.Лечение кожных повреждений часто можно ускорить. 7
Обычно они обнаруживаются на открытых участках тела, таких как лицо, предплечья и голени, и развиваются в течение недель или месяцев. При диффузном кожном заболевании, например, вызванном L. amazonensis , узелковые поражения различного размера часто прорезываются в различных местах, удаленных от места воздействия насекомых. Простые кожные поражения чаще всего самоизлечиваются, но в некоторых случаях, например, вызванных L. panamensis и L. braziliensis , могут прогрессировать с поражением кожно-слизистой ткани.Лечение кожных повреждений часто можно ускорить. 7
Кожно-слизистые заболевания
Кожно-слизистый лейшманиоз (MCL) вызывается L. braziliensis , который может быть вызван распространением или паразитарным метастазированием местного кожного заболевания в кожно-слизистую ткань. MCL может проявляться через несколько месяцев или лет после разрешения первичных поражений. Часто это ужасно обезображивающая инфекция, возникающая в результате хронического местного разрушения тканей носа, рта, ротовой полости, носоглотки и век, и может прогрессировать, нарушая дыхательную функцию и затрудняя питание. Лежащий в основе патогенез, приводящий к MCL, недостаточно изучен и, вероятно, является результатом сложного взаимодействия факторов хозяина и паразита. 8 Заболевание часто невосприимчиво к химиотерапии, и пациенты обычно умирают от вторичных суперинфекций и недоедания. MCL обнаруживается в странах Южной Америки, при этом большинство заболеваний обнаруживается в Бразилии, Перу и Боливии, но также в меньшей степени обнаруживается в Колумбии, Эквадоре, Парагвае и Венесуэле. В Эквадоре большинство случаев заболевания обнаруживается в низменностях Амазонки, реже — в межандских и тихоокеанских прибрежных регионах. 9
Лежащий в основе патогенез, приводящий к MCL, недостаточно изучен и, вероятно, является результатом сложного взаимодействия факторов хозяина и паразита. 8 Заболевание часто невосприимчиво к химиотерапии, и пациенты обычно умирают от вторичных суперинфекций и недоедания. MCL обнаруживается в странах Южной Америки, при этом большинство заболеваний обнаруживается в Бразилии, Перу и Боливии, но также в меньшей степени обнаруживается в Колумбии, Эквадоре, Парагвае и Венесуэле. В Эквадоре большинство случаев заболевания обнаруживается в низменностях Амазонки, реже — в межандских и тихоокеанских прибрежных регионах. 9
Болезнь внутренних органов
Висцеральный лейшманиоз (ВЛ, также известный как кала-азар) возникает в результате инфицирования фагоцитов в ретикулоэндотелиальной системе из-за метастазирования паразитов и инфицированных паразитами макрофагов из начального очага кожной инфекции. В Старом свете ВЛ вызывается Leishmania donovani (в регионах Индии, Пакистана, Китая и Африки) и Leishmania infantum (в Средиземноморском регионе). В Новом Свете ВЛ также вызывается L. infantum (также известной как Leishmania chagasi или L. infantum chagasi ), которая встречается в основном в Бразилии. На Ближнем Востоке сообщалось о висцеральных заболеваниях, вызываемых висцеротропными штаммами L. tropica , 10 , которые классически считались возбудителем ХЛ. Распространение паразитов в макрофагах в печени, селезенке и костном мозге пациентов с ВЛ приводит к прогрессирующей гепатоспленомегалии и подавлению костного мозга.Без лечения у пациентов развиваются панцитопения и иммуносупрессия, и они подвержены суперинфекции другими микробами. Без терапии пациенты с ВЛ в конечном итоге умирают от болезни. Лица, коинфицированные ВИЧ, особенно подвержены развитию атипичных проявлений и повышенной тяжести ВН, а развитие ВН у пациентов с ВИЧ является заболеванием, определяющим СПИД. 11 Вероятно, это происходит из-за эффектов нарушения регуляции обоих агентов на иммунную систему хозяина.
В Новом Свете ВЛ также вызывается L. infantum (также известной как Leishmania chagasi или L. infantum chagasi ), которая встречается в основном в Бразилии. На Ближнем Востоке сообщалось о висцеральных заболеваниях, вызываемых висцеротропными штаммами L. tropica , 10 , которые классически считались возбудителем ХЛ. Распространение паразитов в макрофагах в печени, селезенке и костном мозге пациентов с ВЛ приводит к прогрессирующей гепатоспленомегалии и подавлению костного мозга.Без лечения у пациентов развиваются панцитопения и иммуносупрессия, и они подвержены суперинфекции другими микробами. Без терапии пациенты с ВЛ в конечном итоге умирают от болезни. Лица, коинфицированные ВИЧ, особенно подвержены развитию атипичных проявлений и повышенной тяжести ВН, а развитие ВН у пациентов с ВИЧ является заболеванием, определяющим СПИД. 11 Вероятно, это происходит из-за эффектов нарушения регуляции обоих агентов на иммунную систему хозяина. 12
12
Рецидив лейшманиоза
Это характеризуется рецидивом кожного заболевания на участках ранее заживших поражений ХЛ. 13 Это может произойти через десятилетия после исчезновения первичных поражений и часто формируется в пределах края предыдущего рубца. 14 Поражения при рецидивирующем лейшманиозе (LR) напоминают поражения при дискоидной волчанке или волчаночном лейшманиозе и часто требуют лечения двойной терапией.
Кожный лейшманиоз после кала-азара
В подгруппе пациентов, успешно пролеченных по поводу ВЛ, у которых в течение нескольких месяцев или лет не наблюдается симптомов заболевания, развивается молниеносное и прогрессирующее размножение паразитов в коже, которое приводит к диффузным макулярным, макулопапулезным или узловатым поражениям.Посткала-азарный кожный лейшманиоз (PKDL) встречается в основном в Индии и Судане у пациентов, инфицированных L. donovani . 15 В Судане PDKL может возникать у 50% пациентов и возникает раньше (в течение 6 месяцев), чем у пациентов в Индии, где заболеваемость составляет 5–10% в течение 2–3 лет после устранения VL. Патогенез PKDL до конца не изучен, но, по-видимому, связан с агрессивным иммунным ответом хозяина, управляемым интерфероном γ, который генерируется против сохранившихся кожных паразитов.Биопсия поражений показывает, что макрофаги сильно нагружены амастиготами, которые генотипически идентичны паразитам, образующим возбуждающую ВН. Развитие PKDL, наблюдаемое у ВИЧ / СПИДа, получающих ВААРТ, может быть проявлением синдрома восстановления иммунитета. 16
donovani . 15 В Судане PDKL может возникать у 50% пациентов и возникает раньше (в течение 6 месяцев), чем у пациентов в Индии, где заболеваемость составляет 5–10% в течение 2–3 лет после устранения VL. Патогенез PKDL до конца не изучен, но, по-видимому, связан с агрессивным иммунным ответом хозяина, управляемым интерфероном γ, который генерируется против сохранившихся кожных паразитов.Биопсия поражений показывает, что макрофаги сильно нагружены амастиготами, которые генотипически идентичны паразитам, образующим возбуждающую ВН. Развитие PKDL, наблюдаемое у ВИЧ / СПИДа, получающих ВААРТ, может быть проявлением синдрома восстановления иммунитета. 16
Лечение
Существует ряд методов лечения различных форм лейшманиоза, и предпочтения в отношении лечения первой и второй линии варьируются в зависимости от типа заболевания и часто определяются региональной практикой.Пятивалентная сурьма на протяжении десятилетий считалась основой терапии лейшманиоза, однако этот агент обладает множественной токсичностью и становится все более неэффективным из-за развития резистентности паразитов.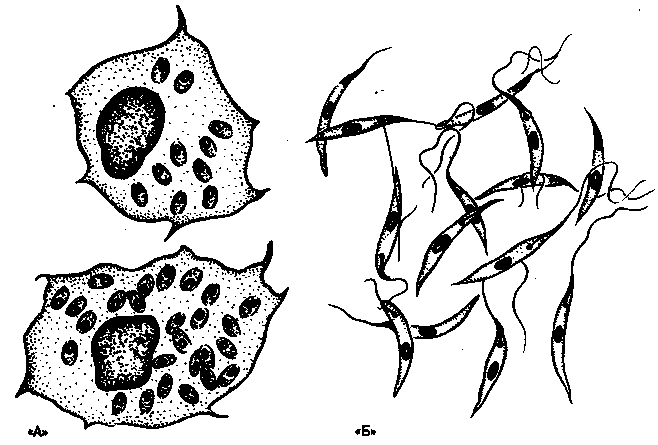 Другие альтернативные агенты используются в различных клинических ситуациях и зависят от доступности и эффективности в разных регионах. Ниже приводится общее описание препаратов, используемых в настоящее время в клинической практике. 1 См. Сводку в таблице 1.
Другие альтернативные агенты используются в различных клинических ситуациях и зависят от доступности и эффективности в разных регионах. Ниже приводится общее описание препаратов, используемых в настоящее время в клинической практике. 1 См. Сводку в таблице 1.
Лейшманиозные болезни, паразиты и схемы лечения по регионам
| Виды . | Болезнь . | Географическое положение a . | Лечение b . | |
|---|---|---|---|---|
| Старый Свет | ||||
| L. major | CL | Ближний Восток, Африка | Местный: t-paro, il-Sb, il-Sb + CT, HT, CT | |
| Системное: грипп, s-Sb, s-Sb + ptxf | ||||
| L. tropica и L.Infantum | CL | Ближний Восток, Средиземноморье, Африка | Местное: t-paro, il-Sb, il-Sb + CT, HT, CT Системное: s-Sb, s-Sb + Allo | |
| LR | ||||
L. aethiopica aethiopica | CL | Африка | s-SB + im-paro | |
| L. donovani | VL, Дальний Восток L-AmB + Mil, L-AmB + im-paro, Mil + im-paro, AmB, Mil, im-paro, s-Sb | |||
| Африка | s-Sb + im-paro, s- Sb, L-AmB, AmB, Mil | |||
| PKDL | Дальний Восток | AmB, Mil | ||
| PKDL | Африканский | L-AmB, s-Sb | ||
| L.Infantum | VL | Средиземноморье, Восточная Европа, Дальний Восток | L-AmB, AmB, s-Sb | |
| New World | ||||
| L. infantum / chagasi | VL | VL | Америка | L-AmB, AmB, s-Sb |
| L. mexicana | CL | Северная, Центральная и Южная Америка | Местное: t-paro, HT, il-Sb Системное: Ket, Mil | |
| Л.amazonensis | CL, DCL | Южная Америка | Местное: t-paro, HT, il-Sb Системное: s-Sb | |
L.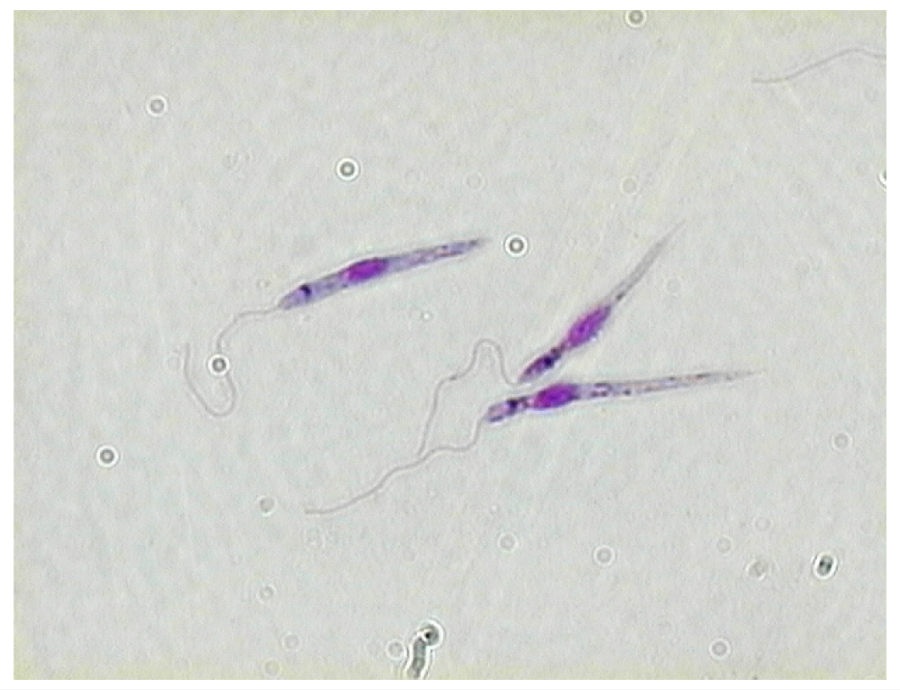 panamensis panamensis | CL | Центральная и Южная Америка | : t-paro, HT, il-Sb Системные: Pent, s-Sb, Mil||
| L. brazilienensis | CL, MCL | Центральная и Южная Америка | Местное: t-paro, HT, il -Sb Системный: AmB, L-AmB, s-Sb | |
| L.guyanensis | CL | Южная Америка | Местный: t-paro, HT, il-Sb Системный: Pent, s-Sb, Mil | |
| Leishmania peruviana и Leishmania venezuelensis | АмерикаМестный: t-paro, HT, il-Sb Системный: s-Sb | |||
| Все виды | Рецидив CL, DCL или MCL | AmB, L-AmB, s-Sb + t-imi или иммунотерапия | ||
| Виды . | Болезнь . | Географическое положение a . | Лечение b . | |
|---|---|---|---|---|
| Старый Свет | ||||
L.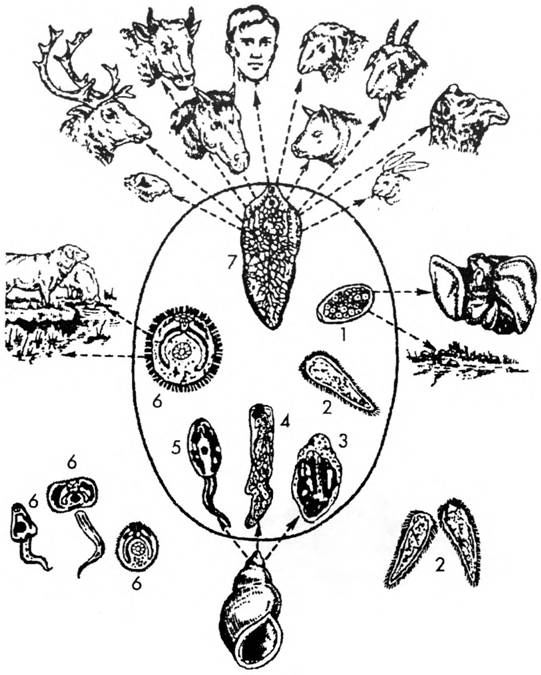 major major | CL | Ближний Восток, Африка | Местный: t-paro, il-Sb, il-Sb + CT, HT, CT | |
| Системное: грипп, s-Sb, s-Sb + ptxf | ||||
| L. tropica и L.Infantum | CL | Ближний Восток, Средиземноморье, Африка | Местное: t-paro, il-Sb, il-Sb + CT, HT, CT Системное: s-Sb, s-Sb + Allo | |
| LR | ||||
| L. aethiopica | CL | Африка | s-SB + im-paro | |
| L. donovani | VL, Дальний Восток L-AmB + Mil, L-AmB + im-paro, Mil + im-paro, AmB, Mil, im-paro, s-Sb | |||
| Африка | s-Sb + im-paro, s- Sb, L-AmB, AmB, Mil | |||
| PKDL | Дальний Восток | AmB, Mil | ||
| PKDL | Африканский | L-AmB, s-Sb | ||
L. Infantum Infantum | VL | Средиземноморье, Восточная Европа, Дальний Восток | L-AmB, AmB, s-Sb | |
| New World | ||||
| L. infantum / chagasi | VL | VL | Америка | L-AmB, AmB, s-Sb |
| L. mexicana | CL | Северная, Центральная и Южная Америка | Местное: t-paro, HT, il-Sb Системное: Ket, Mil | |
| Л.amazonensis | CL, DCL | Южная Америка | Местное: t-paro, HT, il-Sb Системное: s-Sb | |
| L. panamensis | CL | Центральная и Южная Америка | : t-paro, HT, il-Sb Системные: Pent, s-Sb, Mil||
| L. brazilienensis | CL, MCL | Центральная и Южная Америка | Местное: t-paro, HT, il -Sb Системный: AmB, L-AmB, s-Sb | |
| L.guyanensis | CL | Южная Америка | Местный: t-paro, HT, il-Sb Системный: Pent, s-Sb, Mil | |
| Leishmania peruviana и Leishmania venezuelensis | АмерикаМестный: t-paro, HT, il-Sb Системный: s-Sb | |||
| Все виды | Рецидив CL, DCL или MCL | AmB, L-AmB, s-Sb + t-imi или иммунотерапия | ||
Лейшманиозные болезни, паразиты и схемы лечения по регионам
Виды
.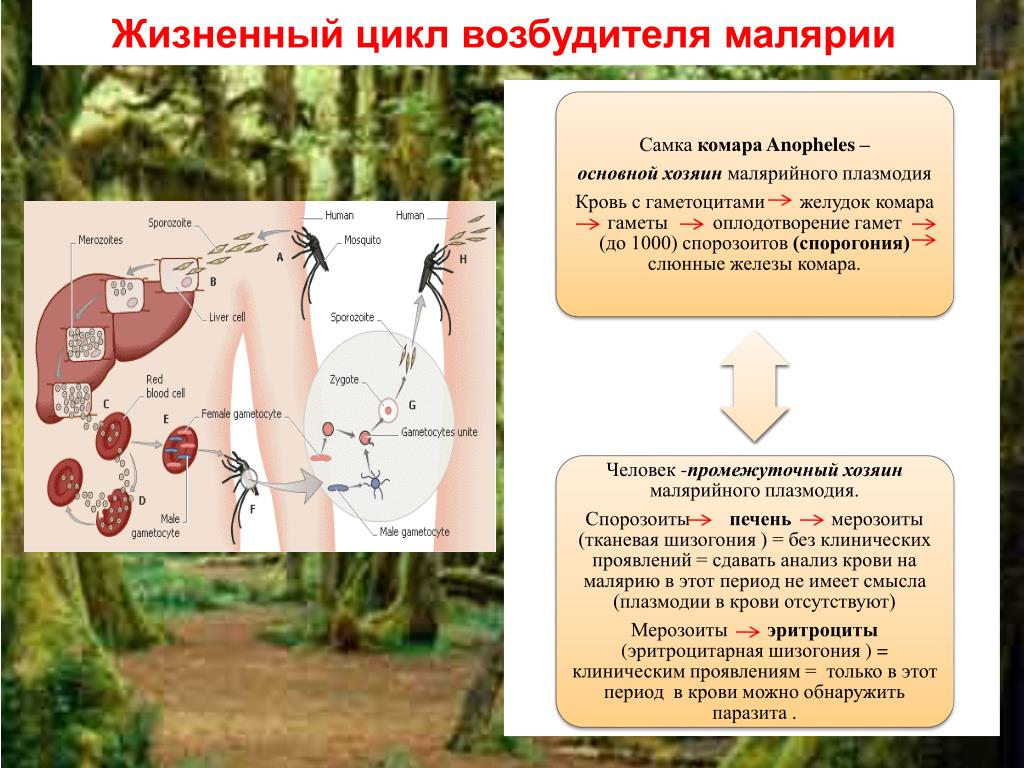 | Болезнь . | Географическое положение a . | Лечение b . | |
|---|---|---|---|---|
| Старый Свет | ||||
| L. major | CL | Ближний Восток, Африка | Местный: t-paro, il-Sb, il-Sb + CT, HT, CT | |
| Системное: грипп, s-Sb, s-Sb + ptxf | ||||
| L. tropica и L.Infantum | CL | Ближний Восток, Средиземноморье, Африка | Местное: t-paro, il-Sb, il-Sb + CT, HT, CT Системное: s-Sb, s-Sb + Allo | |
| LR | ||||
| L. aethiopica | CL | Африка | s-SB + im-paro | |
| L. donovani | VL, Дальний Восток L-AmB + Mil, L-AmB + im-paro, Mil + im-paro, AmB, Mil, im-paro, s-Sb | |||
| Африка | s-Sb + im-paro, s- Sb, L-AmB, AmB, Mil | |||
| PKDL | Дальний Восток | AmB, Mil | ||
| PKDL | Африканский | L-AmB, s-Sb | ||
L. Infantum Infantum | VL | Средиземноморье, Восточная Европа, Дальний Восток | L-AmB, AmB, s-Sb | |
| New World | ||||
| L. infantum / chagasi | VL | VL | Америка | L-AmB, AmB, s-Sb |
| L. mexicana | CL | Северная, Центральная и Южная Америка | Местное: t-paro, HT, il-Sb Системное: Ket, Mil | |
| Л.amazonensis | CL, DCL | Южная Америка | Местное: t-paro, HT, il-Sb Системное: s-Sb | |
| L. panamensis | CL | Центральная и Южная Америка | : t-paro, HT, il-Sb Системные: Pent, s-Sb, Mil||
| L. brazilienensis | CL, MCL | Центральная и Южная Америка | Местное: t-paro, HT, il -Sb Системный: AmB, L-AmB, s-Sb | |
| L.guyanensis | CL | Южная Америка | Местный: t-paro, HT, il-Sb Системный: Pent, s-Sb, Mil | |
| Leishmania peruviana и Leishmania venezuelensis | АмерикаМестный: t-paro, HT, il-Sb Системный: s-Sb | |||
| Все виды | Рецидив CL, DCL или MCL | AmB, L-AmB, s-Sb + t-imi или иммунотерапия | ||
Виды
. | Болезнь . | Географическое положение a . | Лечение b . | |
|---|---|---|---|---|
| Старый Свет | ||||
| L. major | CL | Ближний Восток, Африка | Местный: t-paro, il-Sb, il-Sb + CT, HT, CT | |
| Системное: грипп, s-Sb, s-Sb + ptxf | ||||
| L. tropica и L.Infantum | CL | Ближний Восток, Средиземноморье, Африка | Местное: t-paro, il-Sb, il-Sb + CT, HT, CT Системное: s-Sb, s-Sb + Allo | |
| LR | ||||
| L. aethiopica | CL | Африка | s-SB + im-paro | |
| L. donovani | VL, Дальний Восток L-AmB + Mil, L-AmB + im-paro, Mil + im-paro, AmB, Mil, im-paro, s-Sb | |||
| Африка | s-Sb + im-paro, s- Sb, L-AmB, AmB, Mil | |||
| PKDL | Дальний Восток | AmB, Mil | ||
| PKDL | Африканский | L-AmB, s-Sb | ||
L. Infantum Infantum | VL | Средиземноморье, Восточная Европа, Дальний Восток | L-AmB, AmB, s-Sb | |
| New World | ||||
| L. infantum / chagasi | VL | VL | Америка | L-AmB, AmB, s-Sb |
| L. mexicana | CL | Северная, Центральная и Южная Америка | Местное: t-paro, HT, il-Sb Системное: Ket, Mil | |
| Л.amazonensis | CL, DCL | Южная Америка | Местное: t-paro, HT, il-Sb Системное: s-Sb | |
| L. panamensis | CL | Центральная и Южная Америка | : t-paro, HT, il-Sb Системные: Pent, s-Sb, Mil||
| L. brazilienensis | CL, MCL | Центральная и Южная Америка | Местное: t-paro, HT, il -Sb Системный: AmB, L-AmB, s-Sb | |
| L.guyanensis | CL | Южная Америка | Местный: t-paro, HT, il-Sb Системный: Pent, s-Sb, Mil | |
| Leishmania peruviana и Leishmania venezuelensis | АмерикаМестный: t-paro, HT, il-Sb Системный: s-Sb | |||
| Все виды | Рецидив CL, DCL или MCL | AmB, L-AmB, s-Sb + t-imi или иммунотерапия | ||
Пятивалентная сурьма
Средством выбора для большинства форм лейшманиоза является системное использование пятивалентной сурьмы (Sb), которая присутствует в меглюминовой антимонате (торговое название «глюкантим» или «глюкантим») или стибоглюконате натрия (торговое название «пентостам»). Точный механизм действия Sb при лейшманиозе не совсем понятен, но, вероятно, он является многофакторным, действуя непосредственно на молекулярные процессы паразита, а также влияя на паразитицидную активность макрофагов. 17 Для системного применения эти соединения можно вводить внутривенно (в / в) или внутримышечно (в / м), а также для лечения ХЛ внутри очага поражения (илл.). Для VL и LR 20 мг Sb / кг массы тела в день вводят ежедневно в течение 28–30 дней и используют в качестве средства первой линии до 60 дней при PKDL в Восточной Африке.При использовании в качестве системной терапии для CL продолжительность лечения короче, от 10 до 20 дней, а при использовании для MCL продолжительность терапии увеличивается до 30 дней. Системная терапия используется в некоторых случаях в сочетании с другими агентами, включая восточноафриканскую ВЛ, где она сочетается с паромомицином (15 мг / кг / день в / м), чтобы сократить общий курс терапии до 17 дней, а также при ХЛ и диффузной кожной лейшманиоз (DCL), вызываемый Leishmania aethiopica .
Точный механизм действия Sb при лейшманиозе не совсем понятен, но, вероятно, он является многофакторным, действуя непосредственно на молекулярные процессы паразита, а также влияя на паразитицидную активность макрофагов. 17 Для системного применения эти соединения можно вводить внутривенно (в / в) или внутримышечно (в / м), а также для лечения ХЛ внутри очага поражения (илл.). Для VL и LR 20 мг Sb / кг массы тела в день вводят ежедневно в течение 28–30 дней и используют в качестве средства первой линии до 60 дней при PKDL в Восточной Африке.При использовании в качестве системной терапии для CL продолжительность лечения короче, от 10 до 20 дней, а при использовании для MCL продолжительность терапии увеличивается до 30 дней. Системная терапия используется в некоторых случаях в сочетании с другими агентами, включая восточноафриканскую ВЛ, где она сочетается с паромомицином (15 мг / кг / день в / м), чтобы сократить общий курс терапии до 17 дней, а также при ХЛ и диффузной кожной лейшманиоз (DCL), вызываемый Leishmania aethiopica .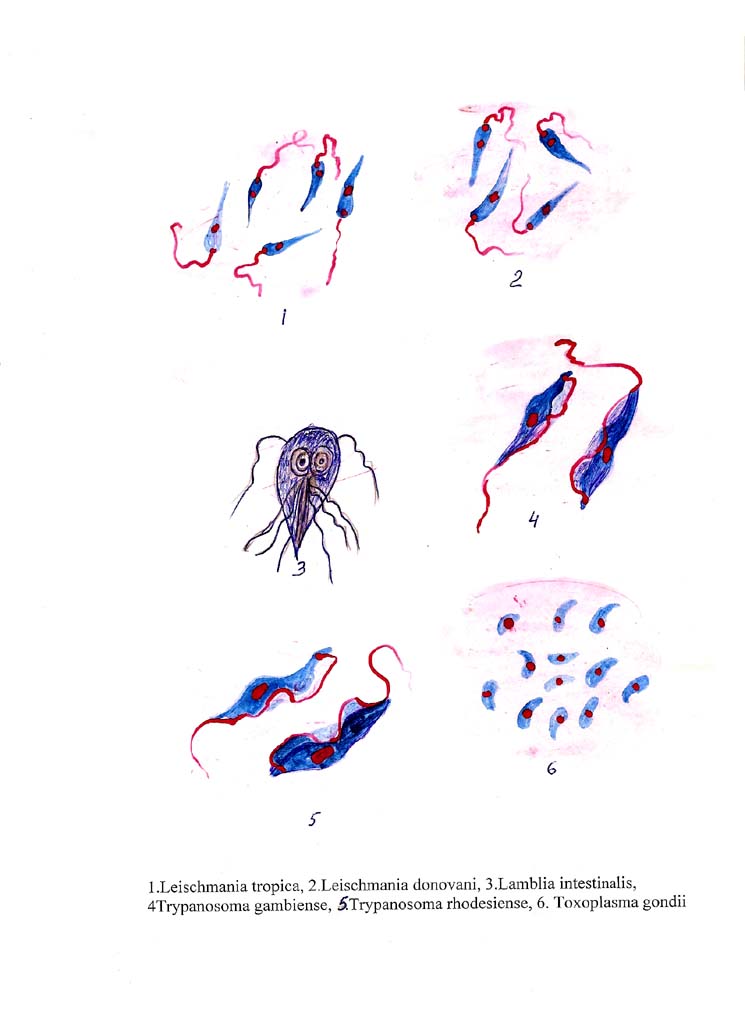 Он использовался вместе с пентоксифиллином, ингибитором TNF-α (400 мг перорально / день), для лечения ХЛ, вызванной L.major и MCL, где было показано, что он более эффективен, чем одна сурьма, в отношении полного излечения и сокращения времени до излечения. 18 Аллопуринол (20 мг перорально / кг / день в течение 30 дней) также использовался в качестве вспомогательного средства к системной сурьме при CL и LR, вызванных L. tropica . 19 При использовании системной сурьмяной терапии часто встречаются побочные эффекты, наиболее серьезными из которых являются кардиотоксичность (аритмии, удлинение интервала QT и внезапная смерть), но возникают и многие другие (повышение уровня ферментов печени и поджелудочной железы, панцитопения и электролитные нарушения), требующие осторожности. наблюдение за пациентами во время курса терапии.
Он использовался вместе с пентоксифиллином, ингибитором TNF-α (400 мг перорально / день), для лечения ХЛ, вызванной L.major и MCL, где было показано, что он более эффективен, чем одна сурьма, в отношении полного излечения и сокращения времени до излечения. 18 Аллопуринол (20 мг перорально / кг / день в течение 30 дней) также использовался в качестве вспомогательного средства к системной сурьме при CL и LR, вызванных L. tropica . 19 При использовании системной сурьмяной терапии часто встречаются побочные эффекты, наиболее серьезными из которых являются кардиотоксичность (аритмии, удлинение интервала QT и внезапная смерть), но возникают и многие другие (повышение уровня ферментов печени и поджелудочной железы, панцитопения и электролитные нарушения), требующие осторожности. наблюдение за пациентами во время курса терапии.
Амфотерицин B
Полиеновый амфотерицин В является эффективным антилейшманиальным средством, которое действует путем связывания с мембранным эргостеролом, вызывая нестабильность мембран. Дезоксихолат и инкапсулированные в липосомы составы амфотерицина B (торговое название «AmBisome») применялись в клинических условиях при лейшманиозе. 20 Дезоксихолат амфотерицина B используется внутривенно в дозе 0,75–1 мг / кг / день в течение 15–20 доз при ВН, вызванной L. donovani , или до 30 дней при ВН, вызванной L.Младенец . PKDL вводят ежедневно или через день в течение периода до 4 месяцев терапии. Для CL, вызванного L. braziliensis , продолжительность терапии составляет 25-30 дней, а для MCL — до 45 дней. Липосомальный амфотерицин B обычно используется в дозе 2,5–5 мг / кг / день, и этот препарат сокращает общую продолжительность терапии наполовину по сравнению с нелипосомальной формой. Однократная доза липосомального амфотерицина B в дозе 10 мг / кг при ВН, вызванной L. donovani , или 5 мг / кг в сочетании с милтефозином в течение 10 дней или паромомицином, эффективны при лечении (см. ниже). 21 Общие побочные эффекты амфотерицина B — это почечная недостаточность и электролитные нарушения, которые в меньшей степени проявляются в липосомной форме, однако этот препарат более дорогостоящий, что ограничивает его широкое использование.
Дезоксихолат и инкапсулированные в липосомы составы амфотерицина B (торговое название «AmBisome») применялись в клинических условиях при лейшманиозе. 20 Дезоксихолат амфотерицина B используется внутривенно в дозе 0,75–1 мг / кг / день в течение 15–20 доз при ВН, вызванной L. donovani , или до 30 дней при ВН, вызванной L.Младенец . PKDL вводят ежедневно или через день в течение периода до 4 месяцев терапии. Для CL, вызванного L. braziliensis , продолжительность терапии составляет 25-30 дней, а для MCL — до 45 дней. Липосомальный амфотерицин B обычно используется в дозе 2,5–5 мг / кг / день, и этот препарат сокращает общую продолжительность терапии наполовину по сравнению с нелипосомальной формой. Однократная доза липосомального амфотерицина B в дозе 10 мг / кг при ВН, вызванной L. donovani , или 5 мг / кг в сочетании с милтефозином в течение 10 дней или паромомицином, эффективны при лечении (см. ниже). 21 Общие побочные эффекты амфотерицина B — это почечная недостаточность и электролитные нарушения, которые в меньшей степени проявляются в липосомной форме, однако этот препарат более дорогостоящий, что ограничивает его широкое использование.
Паромомицин
Паромомицин — это аминогликозидный антибиотик, который блокирует синтез белка за счет связывания с 16S рибосомной РНК. При лейшманиозе он используется внутримышечно для системного применения (в дозе 15 мг / кг) отдельно до 21 дня в индийской VL или в комбинации с липосомальным амфотерицином B для индийской или восточноафриканской VL. 21 Паромомицин можно использовать местно при ХЛ Нового и Старого Света в виде 15% мази вместе с 12% метилбензотонийхлоридом ежедневно в течение 20 дней 22 , 23 и недавно было показано местное применение паромомицина с гентамицином и без него. быть эффективным в ускорении разрешения поражений, вызванных L. major . 24 Местная терапия не указывается в случаях MCL. Побочные эффекты системного применения паромомицина аналогичны другим аминогликозидам, таким как ототоксичность, вестибулярная нестабильность и нефротоксичность.
Пентамидин
Точные антимикробные механизмы пентамидина (торговые названия «Пентакринат» и «Пентам») неизвестны, но препарат нарушает биосинтез макромолекул, таких как ДНК, РНК, фосфолипиды и белки. Он использовался (в / в дозы через день в течение 3-5 дней с 4 мг / кг массы тела) для лечения южноамериканской ХЛ, вызванной L. guyanensis и L. panamensis , и есть некоторые данные чтобы показать, что он также эффективен при CL в Старом Свете, вызванном L.tropica и L. major , а также кожные поражения L. infantum . 25 Сообщалось о большом количестве побочных реакций при использовании пентамидина, наиболее заметными из которых являются гипогликемия и / или обострение диабета, аномалии ферментов печени, эффекты костного мозга, такие как лейкопения и анемия, нефротоксичность и кардиотоксичность, такие как аритмии и сердечная недостаточность и т. Д. гипотония. Пациенты, принимающие этот препарат, требуют тщательного наблюдения.
Милтефозин
Первоначально исследованный в качестве противоопухолевого средства, алкилфосфохолин милтефозин (торговые наименования «Импавидо» и «Милтекс») является единственным пероральным средством, используемым для лечения ВЛ в Индии и Восточной Африке как у детей, так и у взрослых, где доза постепенно зависит от веса ( возраст ≤12 лет в 2 года.5 мг / кг ежедневно; для лиц старше 12 лет и веса <25 кг доза составляет 50 мг / кг; для пациентов с массой тела 25–50 кг дозировка составляет 100 мг / кг, а для пациентов с массой тела> 50 кг — 150 мг / кг в течение 28 дней). 26 , 27 Милтефозин также использовался в комбинации с паромомицином для индийской ВЛ (см. Выше). 21 Недавно было показано, что милтефозин эффективен при PKDL, и продолжительность терапии увеличилась до 12 недель. 28 В Новом Свете CL, вызванный L.mexicana , L. guyanensis и L. panamensis милтефозин может быть эффективен в дозе 2,5 мг / кг в течение 28 дней 29 , но не приносит пользы при кожной инфекции L. braziliensis . Однако боливийский MCL реагирует на терапию милтефозином в течение 4–6 недель с коэффициентом излечения до 75%. 30–32 Этот препарат очень хорошо переносится, и основными побочными эффектами являются неспецифическая тошнота и рвота. Это средство тератогенное и противопоказано при беременности.
Имиквимод
Имиквимод (торговое название «Алдара» или «Циклара») представляет собой имидазолхинолон для местного применения, который вызывает активацию макрофагов за счет продукции провоспалительных цитокинов, таких как IL-2, IFN-γ и TNF-α. Его можно использовать в сочетании с пятивалентной сурьмой при рецидиве New World CL 33 , 34 и может быть эффективным в случаях, не поддающихся сурьме. 35 Имиквимод не доказал свою эффективность в случаях L.tropica 36 , но недавний отчет предлагает ответ в случае CL в Старом Свете, вызванной L. chagasi . 37 Этот агент обычно хорошо переносится с основным побочным эффектом — раздражением в месте нанесения.
Азолы
Хотя азолы (ингибиторы синтеза эргостерола) обладают in vitro, паразитистатической активностью против различных видов лейшманиев, они не показали такой же эффективности, как другие агенты для клинического использования.Пероральный кетоконазол (торговое название «Низорал») (600 мг перорально ежедневно в течение 28-30 дней) и флуконазол (торговое название «Дифлюкан») (ежедневная доза 200 мг перорально в течение 6 недель) ускоряют заживление поражений ХЛ, вызванных L. mexicana 38 и L. major , 23 , 39 соответственно. Пациентам, длительно принимающим азол, требуются обычные анализы крови для выявления нарушений функции печени.
Криотерапия
Нанесение жидкого азота непосредственно на очаги поражения ХЛ от одного до нескольких раз, до пяти раз каждые 3–7 дней использовалось при ХЛ Старого Света, вызванной L.tropica , L. aethiopica и L. infantum или в комбинации с сурьмой внутри очага поражения для L. major . 40–42
Тепловая терапия
Нагревание поражений до 50 ° C в течение 30 секунд до трех раз может использоваться для ускорения разрешения поражений ХЛ Старого и Нового Света и сравнимо с внутриповрежденной или системной терапией сурьмой. 43 , 44 Это лечение также оказалось эффективным против ХЛ у ВИЧ-инфицированных пациентов, которые не реагируют на терапию сурьмой. 45
Иммунотерапия
Вакцины, состоящие из убитых нагреванием Leishmania плюс БЦЖ или определенных рекомбинантных антигенов вместе с гранулоцитарно-макрофагальным колониестимулирующим фактором, использовались у небольшого числа пациентов с рефрактерными MCL или DCL. 46–50
Выводы
Болезни, вызываемые внутриклеточными простейшими паразитами Leishmania , представляют собой серьезную глобальную проблему здравоохранения и классифицируются ВОЗ по тропической болезни, которой не уделяется должного внимания.Около 10% населения мира подвержено риску заражения лейшманиозом. По оценкам, во всем мире насчитывается 12 миллионов активных случаев лейшманиоза, из которых ежегодно регистрируется около 2 миллионов новых случаев. Среди паразитарных инфекций это заболевание является причиной наибольшего количества лет жизни с поправкой на инвалидность (показатель бремени здоровья) после малярии. В настоящее время доступно несколько методов лечения лейшманиоза, включая системные препараты сурьмы, липосомальный амфотерицин B и милтефозин.Однако эти химиотерапевтические вмешательства токсичны и плохо соблюдаются пациентами, поскольку многие из них требуют ежедневного системного (в / в или в / м) введения в течение периодов от 3 до 5 недель. Кроме того, во всем мире быстро растет количество устойчивых к лекарственным средствам штаммов, и эти методы лечения не вызывают бесплодия, поскольку не устраняют стойких паразитов из организма-хозяина. Следовательно, существует постоянная потребность в новых методах лечения лейшманиоза, которые были бы безопасными, эффективными для долгосрочного лечения и которые было бы легче применять.
Финансирование
Эта работа была поддержана грантом NIH No. RC4 AI 092624 к A.R.S.
Конфликт интересов: Не объявлен.
Список литературы
1Комитет экспертов
,Контроль лейшманиозов. Серия технических отчетов ВОЗ 949
,2010
Женева, Швейцария
Всемирная организация здравоохранения
(стр.1
—186
) 2,.Рецептор-опосредованный фагоцитоз Leishmania : влияние на внутриклеточную выживаемость
,Trends Parasitol
,2012
, vol.28
(стр.335
—44
) 3,.Размножение паразита человека ( Leishmania donovani ) в фаголизосомах макрофагов хомяка in vitro
,Science
,1976
, vol.193
(стр.678
—80
) 4,,.Врожденный иммунный ответ против Leishmania паразитов
,Immunobiology
,2008
, vol.213
(стр.377
—87
) 5,,,.Модель микробной вирулентности Leishmania : актуальность размножения паразитов и патоантигенность
,Acta Trop
,2003
, vol.85
(стр.375
—90
) 6,.Кожный и слизисто-кожный лейшманиоз
,Infect Dis Clin North Am
,2012
, vol.26
(стр.293
—307
) 7,.Кожный и слизисто-кожный лейшманиоз
,Dermatol Ther
,2009
, vol.22
(стр.491
—502
) 8,.Иммунобиология инфекции Leishmania braziliensis
,Front Immunol
,2012
, vol.3
стр.145
9,,.Эпидемиология лейшманиоза в Эквадоре: текущий уровень знаний — обзор
,Mem Inst Oswaldo Cruz
,2004
, vol.99
(стр.663
—72
) 10Центры по контролю за заболеваниями
Висцеротропный лейшманиоз у лиц, вернувшихся после операции «Буря в пустыне» — 1990–1991
,MMWR Morb Mortal Wkly Rep
, 9000 vol2 .41
(стр.131
—4
) 11,,,,.Конкордантная ВИЧ-инфекция и висцеральный лейшманиоз в Эфиопии: влияние антиретровирусной терапии и других факторов на исход
,Clin Infect Dis
,2008
, vol.46
(стр.1702
—9
) 12,.Иммунология коинфекции Leishmania / ВИЧ
,Immunol Res
,2013
, vol.56
(стр.163
—71
) 13,,,,.Leishmaniasis recidiva cutis в кожном лейшманиозе Нового Света
,Int J Dermatol
,1998
, vol.37
(стр.846
—9
) 14,,,,, и др.Рецидив рецидива лейшманиоза через 43 года: клиническое и иммунологическое заключение после успешного лечения
,Clin Infect Dis
,2001
, vol.33
(стр.1076
—9
) 15,,,,.Дермальный лейшманиоз после кала-азара
,Lancet Infect Dis
,2003
, vol.3
(стр.87
—98
) 16,,,,, и др.Дермальный лейшманиоз после кала-азара как воспалительный синдром восстановления иммунитета у пациента с синдромом приобретенного иммунодефицита
,Br J Dermatol
,2007
, vol.157
(стр.1032
—6
) 17,,,.Молекулярные основы лечения сурьмой при лейшманиозе
,J Med Chem
,2009
, vol.52
(стр.2603
—12
) 18,,,,, и др.Успешное лечение рефрактерного лейшманиоза слизистых оболочек пентоксифиллином и сурьмой
,Am J Trop Med Hyg
,2001
, vol.65
(стр.87
—9
) 19,.Лечение рецидивирующего кожного лейшманиоза комбинацией аллопуринола и меглумина антимониата: клиническое и гистологическое исследование
,Int J Dermatol
,2007
, vol.46
(стр.848
—52
) 20,.Сравнение эффективности и фармакологии препаратов амфотерицина B, используемых для лечения лейшманиоза
,Curr Opin Infect Dis
,2005
, vol.18
(стр.527
—30
) 21,,,,, и др.Сравнение краткосрочного комбинированного лечения со стандартной терапией висцерального лейшманиоза в Индии: открытое рандомизированное контролируемое исследование не меньшей эффективности
,Lancet
,2011
, vol.377
(стр.477
—86
) 22,,,.Рандомизированное контролируемое двойное слепое исследование местного лечения кожного лейшманиоза мазью паромомицин плюс метилбензетония хлорид в Гватемале
,Am J Trop Med Hyg
,2001
, vol.65
(стр.466
—70
) 23,,,.Вмешательства при кожном лейшманиозе Старого Света
,Кокрановская база данных Syst Rev
,2008
, vol.4
стр.CD005067
24,,,,, и др.Паромомицин для местного применения с гентамицином или без него при кожном лейшманиозе
,N Engl J Med
,2013
, vol.368
(стр.524
—32
) 25,,,,, и др.Лечение кожного лейшманиоза Старого Света пентамидинизетионатом. Открытое исследование 11 пациентов
,Дерматология
,2000
, т.200
(стр.120
—3
) 26,,,,, и др.Милтефозин, пероральное средство для лечения индийского висцерального лейшманиоза
,N Engl J Med
,1999
, vol.341
(стр.1795
—800
) 27,,,,.Милтефозин для перорального применения для лечения индийского висцерального лейшманиоза
,Trans R Soc Trop Med Hyg
,2006
, vol.100
Доп. 1
(стр.S26
—33
) 28,,,,, и др.Милтефозин для перорального применения при дермальном лейшманиозе в Индии после кала-азара: рандомизированное исследование
,Trop Med Int Health
,2013
, vol.18
(стр.96
—100
) 29,,,,, и др.Милтефозин от кожного лейшманиоза нового мира
,Clin Infect Dis
,2004
, vol.38
(стр.1266
—72
) 30,,,,, и др.Эффективность пролонгированного (шесть недель) лечения лейшманиозом слизистых оболочек милтефозином в Боливии
,Am J Trop Med Hyg
,2009
, vol.81
(стр.387
—9
) 31,,,,, и др.Эффективность милтефозина при боливийском кожном лейшманиозе
,Am J Trop Med Hyg
,2008
, vol.78
(стр.210
—1
) 32,,,,, и др.Лечение лейшманиоза слизистой оболочки Боливии милтефозином
,Clin Infect Dis
,2007
, vol.44
(стр.350
—6
) 33,,,,.Рандомизированное двойное слепое клиническое испытание местного имиквимода 5% с парентеральным введением сурьмы меглумина в лечении кожного лейшманиоза в Перу
,Clin Infect Dis
,2005
, vol.40
(стр.1395
—403
) 34,,,,, и др.Роль имиквимода и парентерального антимоната меглумина в начальном лечении кожного лейшманиоза
,Clin Infect Dis
,2007
, vol.44
(стр.1549
—54
) 35,,,,, и др.Успешное лечение лекарственно-устойчивого кожного лейшманиоза у людей с помощью имиквимода, иммуномодулятора
,Clin Infect Dis
,2001
, vol.33
(стр.1847
—51
) 36,,,,, и др.Имиквимод в сочетании с меглуминовым антимониатом при кожном лейшманиозе: рандомизированное слепое контролируемое испытание с привлечением экспертов
,Arch Dermatol
,2006
, vol.142
(стр.1575
—9
) 37,,,,, и др.Старый свет Leishmania infantum Кожный лейшманиоз, не реагирующий на липосомальный амфотерицин B, леченный местным имиквимодом
,Pediatr Infect Dis J
,2012
, vol.31
(стр.97
—100
) 38,,,,,.Вмешательства при американском кожном и кожно-слизистом лейшманиозе
,Кокрановская база данных Syst Rev
,2009
, vol.2
стр.CD004834
39,,,,,.Флуконазол для лечения кожного лейшманиоза, вызванного Leishmania major
,N Engl J Med
,2002
, vol.346
(стр.891
—5
) 40,,,,, и др.Ответ на лечение кожного лейшманиоза, вызванного Leishmania aethiopica , на криотерапию и генерический стибоглюконат натрия от пациентов из Силти, Эфиопия
,Trans R Soc Trop Med Hyg
,2012
, vol.106
(стр.496
—503
) 41,,,,.Эффективность лечения одним только антимониатом меглумина внутри очага поражения по сравнению с криотерапией в сочетании с антимониатом меглумина или стибоглюконатом натрия внутри очага поражения при лечении кожного лейшманиоза
,Ann Trop Med Parasitol
,2003
, vol.97
(стр.493
—8
) 42,,,.Сравнительное исследование эффективности комбинированной криотерапии и антимониата меглумина внутри очага поражения (Glucantime) по сравнению с криотерапией и только антимониатом меглумина внутри очага поражения (Glucantime) для лечения кожного лейшманиоза
,Int J Dermatol
,2004
, vol.43
(стр.281
—3
) 43,,,,, и др.Долгосрочная эффективность однократной радиочастотной тепловой терапии по сравнению с сурьмой внутри очага поражения при кожном лейшманиозе в Индии
,Br J Dermatol
,2013
, vol.168
(стр.1114
—9
) 44,,,,, и др.Эффективность термотерапии для лечения кожного лейшманиоза, вызванного Leishmania tropica в Кабуле, Афганистан: рандомизированное контролируемое исследование
,Clin Infect Dis
,2005
, vol.40
(стр.1148
—55
) 45,,,,, и др.Жар, восточная язва и ВИЧ
,Ланцет
,2011
, т.377
стр.610
46,,,,, и др.Иммунологические корреляты излечения первого пациента с кожным лейшманиозом в Америке, получившего иммунотерапию в Аргентине. История болезни
,Invest Clin
,2011
, vol.52
(стр.365
—75
) 47,,,,, и др.Иммунотерапия американского кожного лейшманиоза в Венесуэле в период 1990-99 гг.
,Trans R Soc Trop Med Hyg
,2003
, vol.97
(стр.469
—72
) 48,,,,, и др.Терапия венесуэльских пациентов с тяжелыми кожно-слизистыми или ранними поражениями диффузного кожного лейшманиоза вакциной, содержащей пастеризованные промастиготы Leishmania и палочки Кальметта-Герена: предварительный отчет
,Mem Inst Oswaldo Cruz
,2004
, vol.99
(стр.57
—62
) 49,,,,, и др.Успешное использование вакцины с определенным антигеном / адъювантом GM-CSF для лечения лейшманиоза слизистых оболочек, резистентного к сурьме: клинический случай
,Braz J Infect Dis
,2001
, vol.5
(стр.223
—32
) 50,,,,, и др.Иммунотерапия лекарственно-рефрактерного лейшманиоза слизистых оболочек
,J Infect Dis
,2006
, vol.194
(стр.1151
—9
)© Автор, 2013. Опубликовано Oxford University Press от имени Ассоциации врачей. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
(PDF) Жизненный цикл кожного лейшманиоза в Ларестане, южный Иран
142 кожный лейшманиоз
Иранский журнал клинических инфекционных заболеваний, 2006 г .; 1 (3): 137-143
9.Всемирная организация здоровья. Лейшманиоз.
Отчет комитета экспертов ВОЗ. Технический отчет
Серия № 793, Женева: 1984; ВОЗ.
10. Ягоби-Эршади М.Р., Ханафи-Бойд А.А., Ахаван
А.А. и др. Эпидемиологическое исследование в новом очаге
кожного лейшманиоза, вызванного Leishmania major, в
городе Ардестан, Центральный Иран. Acta Trop 2001; 79: 115-
21.
11. Надим А., Фагих М. Эпидемиология
кожного лейшаниоза в провинции Исфахан, Иран.
Резервуар, болезнь человека. Trans R Soc Trop
Med Hyg 1968; 61: 534-42.
12. Надим А., Сейед-Рашти М.А., Месхали А.
Эпидемиология кожного лейшманиоза в Туркамане
Сахра, Иран. J. Trop Med Hyg 1968; 71: 238-39.
13. Джавадиан Э., Дехестани М., Надим А. и др.
Подтверждение наличия Tatera indica (Rodentia: Gerbillidae)
как основного резервуара зоонозного кожного
лейшманиоза на западе Ирана.Иранский J Public
Health 1998; 27 (1-2): 55-60.
14. Сейеди-Рашти М.А., Надим А. Эпидемиология
кожного лейшманиоза в Иране. Б. Хорасанский район, часть
I: водохранилища. De la Soc Pathol Ex 1967; 60: 510-18.
15. Сейеди-Рашти М.А., Салехзаде А. Новый очаг
зоонозного кожного лейшманиоза недалеко от Тегерана, Иран.
Bulletin de la Societe Francaise de Paresitologie
1990; 8 (2): 145 (Реферат).
16.Сейеди-Рашти М.А., Надим А. Кожный
лейшманиоз в Белушистане, Иран. Резюме XI
Международного конгресса по тропической медицине и
Малярия. Калгари, Канада, 1984; 124.
17. Надим А., Месхали А., Джавадиан Э. Кожный
лейшманиоз в Южном Иране. In Ecologies des
lershamaniosis (Colloques Internationaux No. 239),
1977; p: .215-18. Париж: Национальный исследовательский центр
Scientifique.
18. Раси Й, Джалали М., Джавадиан Э., Мотазедиан М.
Подтверждение наличия Meriones libycus (Rodentia;
Gerbillidae) как основного резервуара зоонозов
кожного лейшманиоза в Арсанджане, провинция Фарс,
,
Иран (1999-2000). Иранский журнал общественного здравоохранения2001; 30 (3-4): 143-44.
19. Фарс Бюджетно-плановая организация.
Пресса для управления и планирования. 2000; с .: 20-30 (В
персидский).
20. Лахер младший Т. Э., Марес М. А., Алхо С. Дж. Структура
сообщества мелких млекопитающих в центральной части Бразилии
Саванна. В: Редфорд KH, Eisenberg JF, редакторы.
Достижения в неотропической маммологии. Sandhill
Cranepress Inc., Гейнсвилл, США, 1989 г .; стр. 37-62.
21. Эйзенберг Дж. Ф., Редфорд К. Млекопитающие
Неотропов. Центральные Неотропы: Эквадор, Перу,
Боливия, Бразилия, Vol. 3. University of Chicago Press,
1999, Чикаго, США.
22. Смарт Дж., Джордан К., Уиттик Р.Дж. Насекомые медицинского значения
. 4-е издание. Adlen Press, Oxfords,
1965; стр: 286-88.
23. Теудор О., Месхали А. О флеботомине
Иран. Журнал Med Entomol 1964; 2: 285-300.
24. Льюис DJ. Таксономический обзор рода
Phlebotomus (Diptera: Psychodidae), Bull Br Mus Nat
Hist (Ent) 1982; 45 (2): 121-209.
25. Эдриссиан Г., Зовейн З., Надим А. Простая методика
для подготовки мазков из уха
Rhombomys opimus для выявления лейшмианской инфекции
.Trans R Soc Trop Med Hyg 1982; 76: 706-7.
26. Эванс Д.А. Справочник по изоляции, характеристике
и криоконсервации Leishmania. Женева: United
Программа развития Объединенных Наций Всемирный банк / мир
Организация здравоохранения. 1989 г .; ВОЗ.
27. Арансай А.М., Скулика Э., Целентис Ю. Обнаружение
и идентификация ДНК Leishmania в естественных
инфицированных москитах с помощью семенной ПЦР на миникольце
кинетопластической ДНК.Appl Environ Microbiol
2000; 66: 1933-8.
28. Джавадиан Э. Резервуар кожного лейшманиоза
в Иране. Тезисы XII Международного
Конгресса по тропической медицине и малярии.
Аместердам, Нидерланды, 1988 г .; с. 52.
29. Yaghoobi-Ershadi MR, Javadian E, Tahvidare-
Bidruni GH. Изоляция Leishmania major из
Phlebotomus (Paraphlebotomus) caucasicus в Исфахане
, провинция Исламская Республика Иран.Trans R Soc Trop
Med Hyg 1994; 88: 518-19.
30. Yaghoobi-Ershadi MR, Javadian E, Tahvidare-
Bidruni GH. Leishmania major MON 26, выделенная из
естественно инфицированных Phlebotomus papatasi (Diptera:
Psychodidae) в провинции Исфахан, Иран. Acta Trop
1995; 59: 279-82.
31. Ягоби-Эршади М.Р., Ахаван А.А., Мохабали М.
Meriones libycus и Rhombomys opimus (Rodentia:
Gerbillidae) являются основными резервуарными хозяевами в новом очаге
зоонозного кожного лейшманиоза в Иране.Trans R
Soc Trop Med Hyg 1996; 90: 503-504.
32. Парвизи П., Маурисио И., Арансай А.М. и др. Первое обнаружение
Leishmania major у перидоместных
Phlebotomus papatasi из провинции Исфахан, Иран:
сравнение вложенной ПЦР ядерной ИТС рибосомной ДНК
и полувложенной ПЦР ДНК миникольца кинетопласта
. Acta Trop 2005; 93: 75-83.
Жизненный цикл видов Leishmania. Москиты вводят заразно…
Контекст 1
… при оральной передаче из-за насекомоядной природы этих животных (188, 217, 218). Собаки и кошки тоже насекомоядны. Среди людей эпидемии из-за передачи через зараженные фрукты и овощи из эндемичных регионов вызвали повышенную озабоченность по поводу передачи через пищу. В некоторых сообщениях предполагалось, что оральная передача является основным путем распространения T. cruzi между животными и переносчиками и основной причиной острых заболеваний человека в Амазонии (219).Клиническая форма пероральной CD имеет клиническую картину, аналогичную острой CD, с некоторыми отличиями. Пероральное воздействие приводит к острому фебрильному синдрому через 3–22 дня после контакта с миалгией, холангиогепатитом и гастритом с носовыми кровотечениями, гематемезисом и, возможно, шоком (219). В период с 1980 по 2001 год в Бразилии произошло 28 небольших семейных вспышек из-за загрязнения сока, воды или пищи триатомами, их фекалиями или секретами из анальных желез инфицированных млекопитающих (219, 220).Соки асаи и сахарного тростника были причастны к вспышкам из-за характера приготовления сока и измельчения в сок трехатомных насекомых (220). Одна из самых недавних и крупных вспышек орального заражения CD произошла в школьном сообществе Венесуэлы (221). Во время этой вспышки было зарегистрировано 103 подтвержденных случая, из которых 75% имели симптомы, из которых 20,3% потребовали госпитализации (221). Эта вспышка была в значительной степени связана с потреблением сока гуавы, который был приготовлен накануне вечером и оставлен охлаждаться в открытом контейнере на улице (221).Оральная передача CD, которая, возможно, является преобладающим средством заражения домашних животных, подчеркивает важность содержания домашних животных в помещении, когда это возможно, безопасность пищевых продуктов и общие гигиенические правила, а также поддержание контроля качества и бдительности во время приготовления пищи, особенно сока. Профилактика БК в значительной степени зависит от борьбы с переносчиками инфекции, проверки кровоснабжения и донорских органов, а также стандартных методов обеспечения безопасности пищевых продуктов. Практика борьбы с переносчиками инфекции во многих странах Южной Америки привела к значительному снижению показателей серопозитивности среди людей (222, 223).В этих регионах резервуары млекопитающих, как правило, остались, и число бессимптомных серопозитивных людей среднего возраста и старше остается высоким. Таким образом, CD, вероятно, продолжит представлять угрозу для кровоснабжения и риск врожденной инфекции. Надзор за донорами крови в сочетании со скрининговыми вопросами о БК для доноров крови, вероятно, снизил количество острых случаев БК, связанных с переливанием крови. Для беременных женщин, уже инфицированных T. cruzi, не существует действенной профилактики врожденной передачи инфекции из-за возможных побочных эффектов текущей токсической терапии на плод (224).Для женщин в целом профилактика врожденной передачи инфекции в будущем зависит от распознавания и лечения до зачатия (224). Постоянные усилия по борьбе с CD значительно снизили бремя этого зооноза за последние два десятилетия. Однако, учитывая глобальный характер иммиграции, широкий спектр компетентных переносчиков и резервуаров, а также бессимптомный характер болезни, болезнь Шагаса в обозримом будущем будет оставаться проблемой мирового общественного здравоохранения. Лейшманиоз — это трансмиссивное заболевание, вызываемое видами Leishmania семейства Kinetoplastidae.Заражение Leishmania spp. может привести к целому ряду клинических заболеваний, зависящих от вида-инфекции. Висцеральный лейшманиоз (ВЛ) вызывается Leishmania infantum в Северной и Южной Америке и в бассейне Средиземного моря и L. donovani в Индии, странах Африки к югу от Сахары и в Азии. Иногда случаи ВЛ возникают от видов, вызывающих кожные заболевания, и случаются у военнослужащих США из-за инфекции L. tropica (225). ВЛ возникает в результате паразитарной инфекции фагоцитарных клеток во вторичных лимфатических органах (селезенке и лимфатических узлах), печени и костном мозге.Кожный лейшманиоз (КЛ) (таблица 2) возникает в результате инфекции эпидермальной ткани после инокуляции промастиготом. У восприимчивых хозяев и лиц с ослабленным иммунитетом диссеминированный кожный или диффузный кожный лейшманиоз может возникать как редкое, но тяжелое проявление CL. Третья форма заболевания, кожно-слизистый лейшманиоз (MCL), возникает из-за небольшого процента случаев кожного заболевания, у которых болезнь исчезла за несколько месяцев или лет до начала MCL. MCL часто начинается с поражения слизистой оболочки носа, включая генерализованное воспаление и изъязвление.Изъязвления и некроз этих участков могут быть серьезными, приводя к обезображиванию и, иногда, к смерти. Механизмы образования кожно-слизистых поражений плохо изучены, но вирус РНК Leishmania (LRV1) был связан с тяжелыми кожно-слизистыми поражениями через TLR3-зависимую воспалительную реакцию (296). Жизненные циклы Leishmania spp. относительно просты и включают в себя млекопитающего-хозяина и векторную стадию (рис. 10). Переносчиками лейшмании служат москиты-флеботомины из рода Lutzomyia в Америке и Phlebotomus в других эндемичных регионах.Москита вводит инфекционные промастиготы восприимчивому млекопитающему во время кормления. Промастиготы (рис. 11А) быстро фагоцитируются резидентными фагоцитами, трансформируются в амастиготы на тканевой стадии и делятся простым делением в паразитофорной вакуоли. В зависимости от факторов хозяина и паразита паразит инфицирует дальнейшие фагоцитарные клетки либо в месте кожной инфекции, либо во вторичных лимфоидных органах, что в конечном итоге приводит к паразитемии. Москиты инфицируются при питании хозяином либо с активным поражением кожи в CL, либо с паразитемией в VL.Паразиты превращаются в промастиготы в средней кишке москитов и размножаются до большого количества через 4–14 дней. Эти промастиготы мигрируют в слюнные железы, превращаются в инфекционные метациклические промастиготы и ожидают начала кормления. Leishmania spp. обладают уникальными механизмами вирулентности, поддерживая персистентность в фагоцитах хозяина для установления долгосрочной хронической инфекции. После того, как москита укусит хозяина, хемоаттрактанты слюны способствуют притоку нейтрофилов и макрофагов к месту питания (297).Паразиты подавляют закисление фагосом, позволяя им выживать в нейтрофилах, но не было показано, что они превращаются в амастиготы или пролиферируют в нейтрофилах (298). Во время апоптоза нейтрофилов выжившие паразиты фагоцитируются резидентными и инфильтрирующими макрофагами. Дендритные клетки также инфицируются, становятся зрелыми и мигрируют в лимфатический узел. L. amazonensis специфически ингибирует созревание дендритных клеток за счет усиления активации внеклеточной сигнально-регулируемой киназы (ERK) из фагосомы, что приводит к снижению продукции интерлейкина 12, ключевого провоспалительного медиатора (299).Фагоцитоз Leishmania опосредуется рецепторами комплемента 1 и 3 и рецепторами скавенджеров маннозы, что указывает как на зависимые от опсонизации, так и на независимые механизмы инвазии (300). Поглощение приводит к реорганизации F-актина и замедленному слиянию фаголизосом (300, 301). Leishmania spp. устойчивы к подкислению как амастиготы и сохраняются в LAMP1- и Rab7-положительных вакуолях, ассоциированных с поздними эндосомами (302). Амастиготы реплицируются внутри фаголизосомы до возможного лизиса клетки-хозяина.Способность паразита направлять перенос фагосом и задерживать слияние фаголизосом зависит от поверхностных липофосфогликанов с разными боковыми цепями (302–304). Leishmania spp. также способны приобретать питательные вещества, необходимые для выживания, посредством экспрессии LIT-1 для приобретения Fe 2 ϩ, необходимого для роста и выживания (305). Иммунный ответ на все виды Leishmania как внутриклеточного патогена зависит от своевременного и соответствующего ответа Т-хелпера 1, включая продукцию IL-12 дендритными клетками и макрофагами, эффективную презентацию MHC-II и последующую продукцию IFN-β популяциями Т-клеток. .Изъятие инфекции Leishmania с помощью врожденной иммунной системы зависит в первую очередь от внутриклеточного уничтожения с помощью супероксида и оксида азота в фаголизосомах инфицированных макрофагов, что усиливается стимуляцией IFN-β от NK-клеток на ранних стадиях инфекции и Т-клеток на более поздних стадиях. Механизмы иммунитета к различным видам Leishmania и специфические механизмы уклонения, используемые видами Leishmania, выходят за рамки этого обзора и подробно обсуждались в других работах (306, 307).В 98 странах и 3 территориях лейшмания является эндемическим заболеванием, при этом большинство случаев заболевания происходит в развивающихся странах (308). Распространение компетентных видов-переносчиков и лейшманиоза расширилось за последнее десятилетие, возможно, из-за все более благоприятной среды обитания переносчиков из-за изменений климата (309). Это приводит примерно к 200 000–400 000 случаев ВЛ и от 700 000 до 1,2 миллиона случаев КЛ ежегодно и примерно от 20 000 до 40 000 случаев смерти (308). Более 90% случаев ВЛ происходит в Индии, Бангладеш, Судане, Южном Судане, Эфиопии и Бразилии (308).Считается, что среди 15 видов Leishmania, вызывающих болезни, 13 имеют некоторую степень зоонозной передачи, а в случае L. infantum собаки являются основным резервуаром, в значительной степени ответственным за переход от лесного цикла к домашнему (9 , 269). Кратко обсуждаются клинические формы лейшманиоза, в первую очередь исходя из степени передачи зоонозов от домашних животных. Кожный лейшманиоз. CL вызывается рядом Leishmania spp. с широким распространением и множеством видов-резервуаров, специфичных для конкретного местоположения (Таблица 2).В Старом Свете основной причиной ХЛ является Leishmania major. Резервуары L. major различаются в зависимости от местоположения, но включают в себя множество видов грызунов. Плотность резервуаров и переносчиков инфекции в значительной степени коррелирует с сезонностью инфекции. …
NORD (Национальная организация по редким заболеваниям)
Лейшманиоз может поражать людей по-разному. У некоторых действительно тихая инфекция, и у них не развиваются никакие признаки или симптомы. У других заболевание развивается от легкой до средней степени тяжести, но у некоторых развивается тяжелая инфекция, которая может привести к необратимым повреждениям и потенциально опасным для жизни осложнениям.
КОЖАНЫЙ ЛЕЙШМАНИАЗ
Это наиболее распространенная форма лейшманиоза. Симптомы могут проявиться в течение недель или месяцев после укуса инфицированной песчаной мухи. У пораженных людей может появиться одна или несколько язв (кожных поражений), особенно на открытых частях тела, таких как лицо, уши, руки и ноги. Поражения образуются на месте укуса. Поражения могут быть папулами (бугорками) или узелками (твердые, выступающие бугорки), бляшками (распространенными, выступающими высыпаниями) или язвами (открытыми, эродированными участками, такими как кратеры).Поражения кожи могут изменяться в размере, становиться меньше, но часто увеличиваются и не заживают. Язвы могут быть влажными и вытекать жидкость (например, гной) или могут быть сухими и покрытыми коркой и обычно безболезненны. У людей могут развиваться поражения, ограниченные одной областью тела, которые могут медленно зажить самостоятельно в течение 6-18 месяцев. Однако при поражениях обычно остаются заметные шрамы. Иногда у людей также наблюдаются опухшие прилегающие лимфатические узлы (лимфаденопатия).
Диффузный кожный лейшманиоз
Эта очень редкая форма характеризуется начальным поражением кожи, которое распространяется и поражает кожу нескольких различных участков тела.Люди часто имеют плохо функционирующую иммунную систему, что делает их уязвимыми к широко распространенному поражению кожи, предрасполагает к плохой реакции на лечение и позволяет инфекции длиться бесконечно долго. У больных может быть несколько бляшек, язв и узелков по всему телу. Диффузный кожный лейшманиоз прогрессирует медленно, но является хроническим заболеванием, которое обычно рецидивирует после лечения, даже если лечение изначально было эффективным.
Leishmaniasis Recidivans
Этот термин используется для определения рецидива поражения кожи через годы после заживления первоначального поражения.Рецидивирующий лейшманиоз часто развивается на лице, особенно на щеке, с новой язвой или папулой, образующейся над рубцом старого поражения или рядом с ним. Иногда это поражение может медленно увеличиваться в размерах.
МУКОЗНЫЙ ЛЕЙШМАНИЗ
Паразиты могут распространяться от начального поражения кожи через кровоток к другим удаленным участкам, таким как слизистые оболочки носа, рта и горла. У людей с лейшманиозом слизистых оболочек обычно наблюдается поражение кожи, которое заживает само по себе или после лечения, но часто спустя несколько лет, а иногда и десятилетий, развивается поражение слизистой оболочки.Стойкая заложенность носа или кровотечение из носа могут быть первыми признаками заболевания. Со временем может возникнуть воспаление и частичное или полное разрушение слизистых оболочек рта, носа и горла. При отсутствии лечения лейшманиоз слизистых оболочек может вызвать обезображивающие повреждения и рубцевание носа и рта. Это повреждение может привести к заложенности носа и кровотечению. Осложнения трудно поддаются лечению, и они постепенно ухудшаются. Лейшманиоз слизистых оболочек может развиться у людей, которые не получали лечения или изначально не получали должного лечения от кожного лейшманиоза.К известным факторам риска развития заболеваний слизистых оболочек относятся: инфицирование определенными видами паразитов, которые часто встречаются в Южной Америке; множественные, большие, продолжительные поражения кожи на голове или шее; подавленная иммунная система; или инфекция, приобретенная в Боливии.
ВИСЦЕРАЛЬНЫЙ ЛЕЙШМАНИАЗ
Эта форма лейшманиоза, обычно наиболее тяжелая клинически, также развивается, если некоторые виды паразитов покидают кожу, попадают в кровоток и достигают внутренних органов, включая селезенку, печень и костный мозг.Клинические данные варьируются от бессимптомной инфекции до легкой болезни, которая проходит сама по себе, до тяжелой, опасной для жизни инфекции. Если симптомы развиваются, а полномасштабное заболевание остается без лечения, висцеральный лейшманиоз обычно заканчивается летальным исходом.
У больных могут развиваться повторяющиеся приступы продолжительной лихорадки, слабости, непреднамеренной потери веса или даже серьезного истощения организма (кахексия), значительного увеличения селезенки и печени и панцитопении (низкие уровни трех основных типов клеток крови (красный клетки крови, лейкоциты и тромбоциты)).Низкий уровень красных кровяных телец называется анемией и может вызывать усталость, бледность кожи (бледность), одышку, головокружение, головокружение и учащенное или нерегулярное сердцебиение. Больные часто становятся хуже в течение недель или месяцев.
Висцеральный лейшманиоз в Индии еще называют кала-азар. Кала-азар в переводе с хинди означает «черную лихорадку» и обычно относится к тяжелым хроническим случаям заболевания. Для висцерального лейшманиоза можно использовать множество дополнительных названий, включая лихорадку Дум-дум, лихорадку Бурдвана, болезнь Сиркари и болезнь Сахиба.
Кожный лейшманиоз после кала-азара
Эта форма инфекции встречается у людей, которые болеют или переболели висцеральным лейшманиозом. Наиболее распространен в Африке и Индии. В Африке (например, Судан) болезнь присутствует или отмечается вскоре после диагностики и лечения висцерального лейшманиоза. У людей может появиться сыпь на лице, ягодицах, руках и ногах. Эти поражения заживают сами по себе со временем или после лечения висцеральной инфекции.
В Индии дермальный лейшманиоз после кала-азара развивается через несколько лет после лечения висцерального лейшманиоза.У людей часто появляются множественные плоские обесцвеченные участки кожи (пятна). Со временем эти поражения превращаются в бляшки или узелки на лице и туловище. В Индии эта форма требует интенсивного лечения.
Коинфекция лейшманиоз-ВИЧ
Некоторые люди инфицированы как вирусом иммунодефицита человека (ВИЧ), так и лейшманиозом. У этих людей больше шансов на развитие тяжелых, опасных для жизни осложнений и смерти. У них могут развиться осложнения, которые обычно не наблюдаются у здоровых людей с лейшманиозом, включая поражение желудочно-кишечного тракта и других атипичных участков.Из-за иммунодефицита, связанного с ВИЧ, лечение может быть неэффективным, а частота рецидивов высока даже после явно эффективного лечения.
Leishmania braziliensis — обзор
Кожный лейшманиоз
Цели лечения кожного лейшманиоза — ограничить повреждение тканей, а в случае заражения L. braziliensis или родственными видами Leishmania (Viannia) — предотвратить более позднее развитие заболевания слизистых оболочек. Люди с косметически несущественными кожными поражениями могут наблюдаться выжидательно при условии, что инфекция не вызвана L.braziliensis или другие Leishmania (Viannia) видов. Следует лечить пациентов с поражением лица, крупными поражениями, диффузным кожным лейшманиозом, диссеминированным кожным лейшманиозом или инфицированными видами Leishmania (Viannia) , которые могут вызывать лейшманиоз слизистых оболочек.
Пятивалентные препараты сурьмы часто используются для лечения кожного лейшманиоза, но видов Leishmania различаются по своей чувствительности. Обычно Sb v 20 мг / кг / день назначается в течение 20–28 дней. 183 Были использованы более короткие курсы и более низкие дозы, но они могут предрасполагать к развитию устойчивости к сурьме. Даже после успешной химиотерапии поражения обычно заживают медленно в течение нескольких недель. Показатели излечения L. braziliensis у жителей Бразилии и Колумбии находились в диапазоне 60–70%, но в войсках США, инфицированных L. panamensis в Панаме, они превышали 95%. В случае L. major 60% пациентов, получавших плацебо, вылечились в течение 20 недель после обращения за медицинской помощью в одном исследовании, а 74% пациентов, получавших пятивалентную сурьму, вылечились в течение 30 дней.
Для лечения кожного лейшманиоза использовался ряд других препаратов и подходов. Противогрибковые средства имидазола, кетоконазол, итраконазол и флуконазол эффективно использовались в некоторых, но не во всех исследованиях. Leishmania видов различаются по восприимчивости. Например, сообщалось, что кетоконазол 400–600 мг / день в течение 4–8 недель эффективен примерно у 70% людей с инфекциями L. major и L. mexicana , но менее эффективен против L.tropica, L. aethiopica и L. braziliensis . 197 Флуконазол (200 мг в день в течение 6 недель) превосходил плацебо у людей с кожным лейшманиозом из-за L. major в Саудовской Аравии. 198 В конце периода лечения 60% реципиентов плацебо выздоровели по сравнению с 90% группы, получавшей флуконазол. Однако частота излечения была аналогичной в контрольной группе, получавшей плацебо, и в группе путешественников, инфицированных флуконазолом L. major , в последующей серии. 199
Милтефозин перспективен для лечения кожного лейшманиоза. В исследовании, проведенном в Колумбии, милтефозин 200 50–100 мг / день в течение 21 дня привел к излечению у 66% реципиентов; более высокие дозы 133–150 мг / день вылечили 94%, но 40% реципиентов испытали укачивание. Рвота и диарея наблюдались в 2% дней лечения. Дальнейшие испытания милтефозина проводятся в Латинской Америке. В одном раннем исследовании сообщалось об эффективности аллопуринола, но впоследствии его использование было поставлено под сомнение. 201 Сообщается, что другие препараты обладают антилейшманиозной активностью, на основании относительно небольших исследований, которые не проводились в контролируемой слепой форме. Учитывая, что при кожном лейшманиозе происходит самопроизвольное заживление, сформулировать рекомендации на их основе невозможно.
Другой подход — местная и местная терапия. Применение 15% паромомицина и 12% метилбензетония успешно применялось у людей с кожным лейшманиозом в Израиле, на Ближнем Востоке и в Латинской Америке. 202 Внутриочаговые инъекции сурьмы также использовались для лечения кожного лейшманиоза Старого Света. Обычно 0,5–2,0 мл (100 мг / мл) вводят со всех сторон поражения, пока оно не побледнеет. Когда 10 таких инъекций делали пациентам из Египта через день, 85% из них были вылечены через 3 месяца наблюдения.
Другие подходы, включая иммунотерапию, местное тепло и криотерапию, были изучены и имеют своих сторонников. Криотерапия используется при небольших поражениях.Иммунотерапия комбинацией промастиготных антигенов Leishmania и живой бациллы Кальметта – Герена (БЦЖ) эффективно использовалась в Венесуэле и Бразилии, но время до клинического ответа относительно велико.



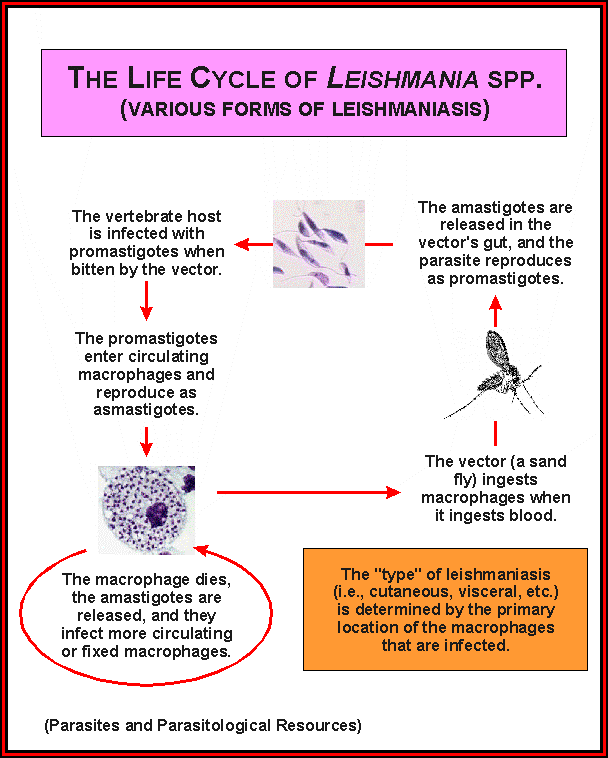 Паразиты имеют округлую форму (2-5мкм),
без жгутиков.
Паразиты имеют округлую форму (2-5мкм),
без жгутиков. aethiopica
aethiopica braziliensis сomplex
braziliensis сomplex 2.3145-13 «Лабораторная диагностика гельминтозов и протозоозов» (утверждены от 26 ноября 2013 года).
2.3145-13 «Лабораторная диагностика гельминтозов и протозоозов» (утверждены от 26 ноября 2013 года).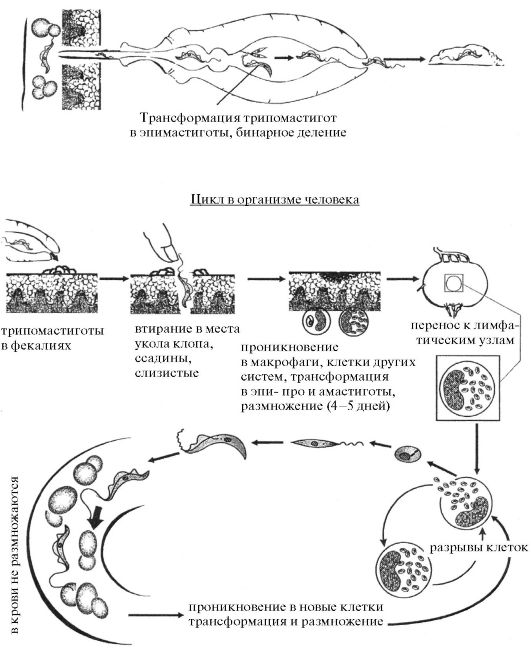 ). При этом серологические исследования не проводятся для определения эффективности проводимого лечения — это связано с длительным обнаружением IgG в крови после излечения.
). При этом серологические исследования не проводятся для определения эффективности проводимого лечения — это связано с длительным обнаружением IgG в крови после излечения.
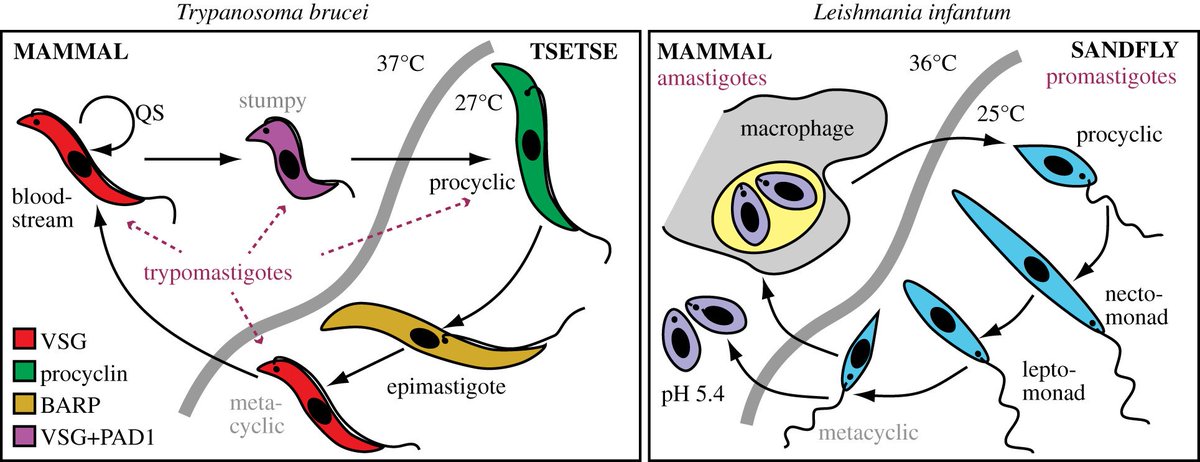 01.01.s01)
01.01.s01)