Лейшмании
Виды лейшманий.
Для человека патогенны несколько видов лейшманий. Leishmania tropica (впервые обнаружены в 1897 г. русским врачом и ученым П. Ф. Боровским), вызывает антропонозный (городской) кожный лейшманиоз; Leishmania major — возбудитель зоонозного (пустынного) кожного лейшманиозa; Leishmania braziliensis — встречается в Южной Америке и вызывает кожно-слизистый (американский) лейшманиоз; Zeishmania donovani — вызывает висцеральный, или внутренний, лейшманиоз (индийский кала-азар), возбудителя этого вида впервые обнаружили в селезенке больных людей Лейшман и Донован (1900—1903), в честь которых он и получил название; Leishmania infantum — возбудитель висцерального (средиземноморского) лейшманиоза.
Строение лейшманий.
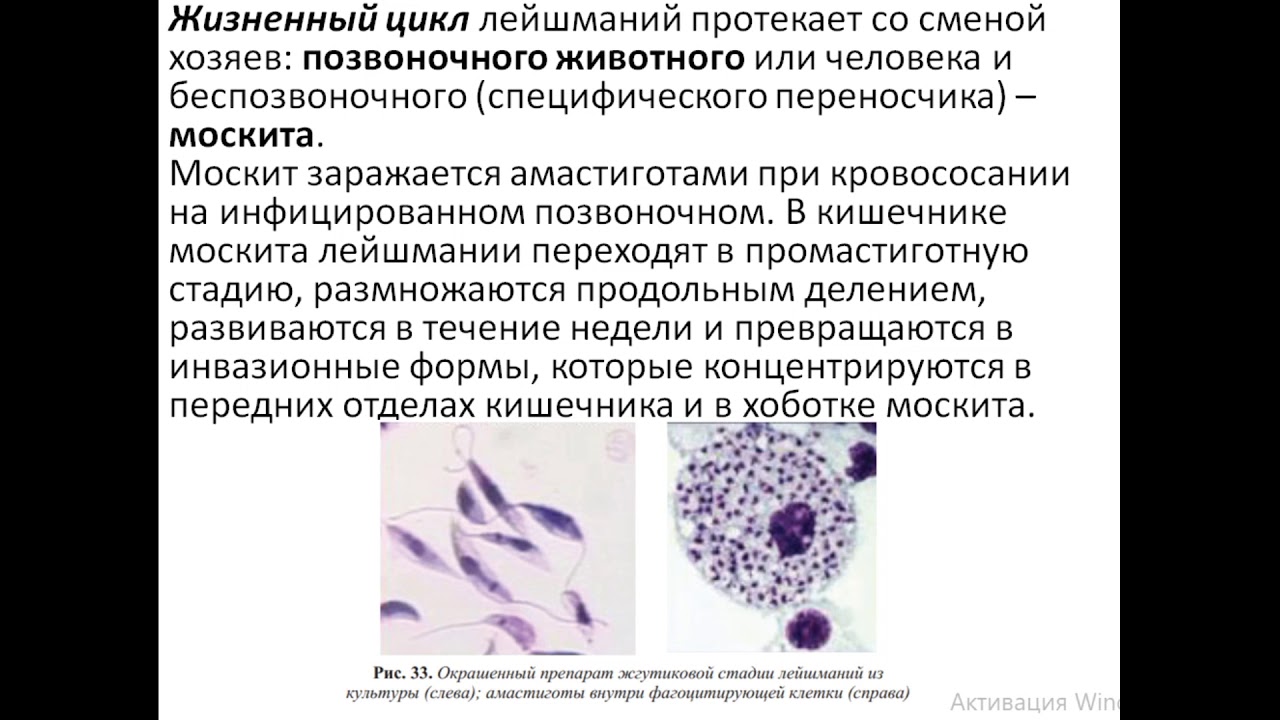
Лейшмании проходят две стадии развития: безжгутиковую и жгутиковую. Безжгутиковая форма овальная, длиной 2—6 мкм. Ядро округлое, занимает до 1/3 клетки. Рядом с ним находится кинетопласт, имеющий вид короткой палочки.
Встречаются в теле позвоночного хозяина (человек, собака, грызуны), паразитируют внутриклеточно в макрофагах, клетках костного мозга, селезенки, печени. В одной пораженной клетке может содержаться до нескольких десятков лейшманий. Размножаются простым делением.
Жгутиковая форма подвижная, жгутик длиной 15—20 мкм. Тело удлиненное веретенообразное, длиной до 10-20 мкм. Деление продольное. Развиваются в теле безпозвоночного хозяина— переносчика (москита) и в культуре на питательных средах.
Жизненный цикл.
Лейшманиозы входят в группу трансмиссивных инфекций, переносчиками служат мелкие кровососущие насекомые — москиты. Москиты заражаются при кровососании на больных людях или животных. В первые же сутки заглоченные безжгутиковые паразиты превращаются в подвижные жгутиковые формы, начинают размножаться и спустя 6—8 дней скапливаются в глотке москита.
При укусе человека или животного зараженным москитом подвижные лейшмании из его глотки проникают в ранку и затем внедряются в клетки кожи или внутренних органов в зависимости от вида лейшманий. Здесь происходит их превращение в безжгутиковые формы.
Источники инфекции при лейшманиозах многообразны: при индийском висцеральном лейшманиозе (кала-азаре) — больные люди; при средиземноморском висцеральном лейшманиозе — шакалы, лисы, дикобразы, собаки (роль последних доказали советские ученые Н.И. Ходукин и М.С. Софиев).
У собаки, пораженной висцеральным лейшманиозом развиваются истощение, язвы на голове и коже тела, шелушение кожи, особенно вокруг глаз. У молодых собак заболевание может протекать остро и даже приводить к гибели, у взрослых животных течение болезни нередко более стертое или бессимптомное (носительство).
При кожном лейшманиозе источником инфекции являются или больные люди, или дикие грызуны — большая и краснохвостая песчанки, обитатели пустынь (при зоонозной форме, «пендинской язве», что в 1937- 1940 гг.
 доказал Н. И. Латышев).
доказал Н. И. Латышев).Зоонозный кожный лейшманиоз встречается в Туркмении и Узбекистане, на юге Казахстана.
Клиническая картина.
Висцеральным (средиземноморским) лейшманиозом чаще заболевают дети. После инкубационного периода длительностью от нескольких недель до нескольких месяцев у заболевшего повышается температура тела, появляются вялость, адинамия, бледность, исчезает аппетит. Увеличиваются селезенка и печень, вследствие чего заметно выступает живот. Развиваются анемия и истощение больного.
При кожном лейшманиозе после инкубационного периода (1—2 мес) в местах укусов москитов появляются небольшие бугорки буровато-красноватого цвета, средней плотности, обычно малоболезненные. Бугорки постепенно увеличиваются и затем изъязвляются через 3—6 нед при антропонозной форме и через 1—3 нед при зоонозной. Возникают язвы с отеком окружающей ткани, воспалением и увеличением лимфатических узлов.
Процесс тянется несколько месяцев, при антропонозной форме — больше года, заканчиваясь выздоровлением. На месте язв остаются рубцы. После перенесенного заболевания формируется стойкий иммунитет.
Диагноз.
Окончательный диагноз висцерального лейшманиоза ставят на основании обнаружения лейшманий при микроскопии мазков костного мозга, окрашенных по Романовскому, с иммерсионным объективом. Для получения костного мозга пункцию грудины, гребешка подвздошной кости или верхней части большеберцовой кости производит врач.
При кожном лейшманиозе материал получают поскабливанием скальпелем нераспавшихся бугорков или инфильтрата по краю язв до появления серозно-кровянистой жидкости. Из соскоба готовят мазки, красят по Романовскому и исследуют с иммерсионным объективом.
Лейшмании легко обнаруживаются на начальных стадиях изъязвления. В гнойном отделяемом язвы могут быть обнаружены лишь деформированные и разрушающиеся лейшмании, что затрудняет постановку диагноза.
 На стадии заживления лейшмании обнаруживаются редко.
На стадии заживления лейшмании обнаруживаются редко.В ряде случаев применяют посев материала из кожных поражений или костного мозга на питательную среду которая готовится на агаре с добавлением дефибринированной крови кролика. В положительном случае на 2-10-й день в культуре появляются жгутиковые формы лейшманий.
Профилактика.
При висцеральном лейшманиозе — подворные обходы для раннего выявления больных, уничтожение безнадзорных собак и осмотры ветеринарными работниками собак ценных пород. При зоонозном кожном лейшманиозе — истребление диких грызунов в окрестностях поселков, профилактические прививки.
С целью предупреждения заболеваемости всеми видами лейшманиозов проводят уничтожение москитов, ликвидацию мест выплода, обработку мест пребывания ядохимикатами, а также принимают меры по предохранению людей от укусов москитов (пологи, репелленты).
Класс жгутиковые: лейшмании, трихомонады, лямблии, трипаносомы реферат по биологии
САМАРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ Курсовая работа Тема: «Класс жгутиковые: лейшмании, трихомонады , лямблии, трипаносомы. » Исполнитель: студентка I курса факультета сверхнормативного образования Баринова Ю.Ю. Проверил: Аршина С.Г. Сызрань 2000 год План I. Общая характеристика простейших. II. Класс жгутиков. III. Лейшмании: 1. Виды 2. Строение 3. Цикл развития 4. Источники инфекции 5. Клиника 6. Диагностика 7. Профилактика IV. Трипаносомы: 1. Строение 2. Жизненный цикл 3. Клиника 4. Диагностика V. Лямблии: 1. Строение 2. Цикл развития 3. Клиника 4. Диагностика VI. Трихомонады: 1. Виды 2. Строение 3. Клиника 4. Диагностика теле позвоночного хозяина (человек, собаки, грызуны), паразитируют внутриклеточно в макрофагах, клетках костного мозга, селезенки, печени. В одной пораженной клетке может содержаться до нескольких десятков лейшманий. Размножаются простым делением. Жгутиковая форма подвижная, имеет жгутик длиной 15—20 мкм. Форма тела удлиненная, веретенообразная, длиной до 10—20 мкм. Деление продольное. Развивается в теле беспозвоночного хозяина — переносчика (москита). В культуре на питательных средах также развиваются жгутиковые формы лейшманий.
» Исполнитель: студентка I курса факультета сверхнормативного образования Баринова Ю.Ю. Проверил: Аршина С.Г. Сызрань 2000 год План I. Общая характеристика простейших. II. Класс жгутиков. III. Лейшмании: 1. Виды 2. Строение 3. Цикл развития 4. Источники инфекции 5. Клиника 6. Диагностика 7. Профилактика IV. Трипаносомы: 1. Строение 2. Жизненный цикл 3. Клиника 4. Диагностика V. Лямблии: 1. Строение 2. Цикл развития 3. Клиника 4. Диагностика VI. Трихомонады: 1. Виды 2. Строение 3. Клиника 4. Диагностика теле позвоночного хозяина (человек, собаки, грызуны), паразитируют внутриклеточно в макрофагах, клетках костного мозга, селезенки, печени. В одной пораженной клетке может содержаться до нескольких десятков лейшманий. Размножаются простым делением. Жгутиковая форма подвижная, имеет жгутик длиной 15—20 мкм. Форма тела удлиненная, веретенообразная, длиной до 10—20 мкм. Деление продольное. Развивается в теле беспозвоночного хозяина — переносчика (москита). В культуре на питательных средах также развиваются жгутиковые формы лейшманий. Цикл развития. Паразитируя в организме человека и некоторых животных, могут находиться в крови и коже. Москиты, мелкие насекомые, насосавшись крови больных людей или животных, заражаются лейшманиями. Впервые же сутки заглоченные безжгутиковые паразиты превращаются в подвижные жгутиковые формы, начинают размножаться и спустя 6—8 дней скапливаются в глотке москита. При укусе человека зараженным москитом подвижные формы лейшманий из его глотки проникают в ранку и затем внедряются в клетки кожи или внутренних органов в зависимости от вида лейшманий. Здесь происходит их превращение в безжгутиковые формы. . Рис № 2 Собака, пораженная висцеральным лейшманиозом. Источники инфекции. На возможную роль собак как источника инфекции при средиземноморском висцеральном лейшманиозе впервые указал французский ученый Ш. Николь, а подтвердили это советские ученые Н. И. Ходукин и М. С. Софиев. Кроме собак, источником инфекции могут быть и некоторые дикие животные (шакалы, дикообразы, лисицы). При индийском лейшманиозе (кала-азаре) источником инфекции являются больные люди.
Цикл развития. Паразитируя в организме человека и некоторых животных, могут находиться в крови и коже. Москиты, мелкие насекомые, насосавшись крови больных людей или животных, заражаются лейшманиями. Впервые же сутки заглоченные безжгутиковые паразиты превращаются в подвижные жгутиковые формы, начинают размножаться и спустя 6—8 дней скапливаются в глотке москита. При укусе человека зараженным москитом подвижные формы лейшманий из его глотки проникают в ранку и затем внедряются в клетки кожи или внутренних органов в зависимости от вида лейшманий. Здесь происходит их превращение в безжгутиковые формы. . Рис № 2 Собака, пораженная висцеральным лейшманиозом. Источники инфекции. На возможную роль собак как источника инфекции при средиземноморском висцеральном лейшманиозе впервые указал французский ученый Ш. Николь, а подтвердили это советские ученые Н. И. Ходукин и М. С. Софиев. Кроме собак, источником инфекции могут быть и некоторые дикие животные (шакалы, дикообразы, лисицы). При индийском лейшманиозе (кала-азаре) источником инфекции являются больные люди. У собаки, пораженной висцеральным лейшманиозом (рис. 2), развивается истощение, появляются язвы на голове и коже тела, шелушение кожи, особенно вокруг глаз. При этом важно учитывать, что если у молодых собак заболевание может протекать остро и даже приводить их к гибели, то у взрослых животных течение болезни нередко более стертое или даже бессимптомное (носительство). В СНГ висцеральный лейшманиоз встречается спорадически в Средней Азии, на юге Казахстана и в Закавказье. При кожном лейшманиозе источником инфекции являются больные люди или, как это впервые показал в 1937—1940 гг. Н. И. Латышев, дикие грызуны (при зоонозной форме, “пендинской язве”). Основными хранителями лейшманий являются большая песчанка (рис. 3) и краснохвостая песчанка. Зоонозный кожный лейшманиоз встречается во многих оазисах южной части Туркмении и Узбекистане. Передача этого лейшманиоза иногда идет столь интенсивно, что местные жители переболевают им еще в дошкольном возрасте. Жизненные циклы лейшманий представлены на рис.
У собаки, пораженной висцеральным лейшманиозом (рис. 2), развивается истощение, появляются язвы на голове и коже тела, шелушение кожи, особенно вокруг глаз. При этом важно учитывать, что если у молодых собак заболевание может протекать остро и даже приводить их к гибели, то у взрослых животных течение болезни нередко более стертое или даже бессимптомное (носительство). В СНГ висцеральный лейшманиоз встречается спорадически в Средней Азии, на юге Казахстана и в Закавказье. При кожном лейшманиозе источником инфекции являются больные люди или, как это впервые показал в 1937—1940 гг. Н. И. Латышев, дикие грызуны (при зоонозной форме, “пендинской язве”). Основными хранителями лейшманий являются большая песчанка (рис. 3) и краснохвостая песчанка. Зоонозный кожный лейшманиоз встречается во многих оазисах южной части Туркмении и Узбекистане. Передача этого лейшманиоза иногда идет столь интенсивно, что местные жители переболевают им еще в дошкольном возрасте. Жизненные циклы лейшманий представлены на рис. 4 и 5 Рис. № 3. Большая песчанка. Рис № 4 Жизненный цикл Leishmania donovani Рис № 5 Жизненный цикл Leishmania tropika Клиника. Висцеральным лейшманиозом чаще заболевают дети. После инкубационного периода длительностью от нескольких недель до нескольких месяцев у заболевшего повышается температура тела, в разгаре болезни достигающая 39— 40°С, появляется вялость, адинамия, бледность, исчезает аппетит, увеличивается, иногда резко, селезенка и печень, вследствие чего заметно выступает живот (рис. № 6) Рис № 6 Ребенок, больной висцеральным лейшманиозом. Развиваются анемия и истощение больного. Заболевание тянется несколько месяцев и при отсутствии лечения обычно заканчивается смертью, непосредственной причиной которой часто являются такие осложнения, как пневмония, диспепсия. При заражении человека возбудителем кожного лейшманиоза после инкубационного периода от 1— 2 нед до нескольких месяцев (при зоонозном типе 0 0 1 Fэтот пери од обычно короткий) в местах укусов москитов появляются небольшие бугорки.
4 и 5 Рис. № 3. Большая песчанка. Рис № 4 Жизненный цикл Leishmania donovani Рис № 5 Жизненный цикл Leishmania tropika Клиника. Висцеральным лейшманиозом чаще заболевают дети. После инкубационного периода длительностью от нескольких недель до нескольких месяцев у заболевшего повышается температура тела, в разгаре болезни достигающая 39— 40°С, появляется вялость, адинамия, бледность, исчезает аппетит, увеличивается, иногда резко, селезенка и печень, вследствие чего заметно выступает живот (рис. № 6) Рис № 6 Ребенок, больной висцеральным лейшманиозом. Развиваются анемия и истощение больного. Заболевание тянется несколько месяцев и при отсутствии лечения обычно заканчивается смертью, непосредственной причиной которой часто являются такие осложнения, как пневмония, диспепсия. При заражении человека возбудителем кожного лейшманиоза после инкубационного периода от 1— 2 нед до нескольких месяцев (при зоонозном типе 0 0 1 Fэтот пери од обычно короткий) в местах укусов москитов появляются небольшие бугорки. Они буровато-красноватого цвета, средней плотности, обычно малоболезненные. Бугорки постепенно увеличиваются и затем изъязвляются — через 3— 6 нед при антропонозной форме и через 1—3 нед при зоонозной. 0 0 1 FВозникают язвы с отеком окружающей ткани, вос палением и увеличением лимфатических узлов. Процесс тянется несколько месяцев (при антропонозной форме—больше года), заканчиваясь выздоровлением. На месте язв остаются рубцы. После перенесенного 0 0 1 Fзаболе вания формируется стойкий иммунитет. Диагностика. При постановке клинического диагноза указанные выше основные симптомы заболевания являются опорными. Следует учитывать эпидемиологические данные (проживание в неблагополучных по лейшманиозу местах и т.д.). Окончательный и достоверный диагноз висцерального лейшманиоза ставится на основании обнаружения возбудителя. Исследование пунктата костного мозга С целью обнаружения возбудителя висцерального лейшманиоза, а в ряде случаев и других простейших исследуют костный мозг. Костный мозг получают, пунктируя гребень подвздошной, головку большеберцовой кости или грудину.
Они буровато-красноватого цвета, средней плотности, обычно малоболезненные. Бугорки постепенно увеличиваются и затем изъязвляются — через 3— 6 нед при антропонозной форме и через 1—3 нед при зоонозной. 0 0 1 FВозникают язвы с отеком окружающей ткани, вос палением и увеличением лимфатических узлов. Процесс тянется несколько месяцев (при антропонозной форме—больше года), заканчиваясь выздоровлением. На месте язв остаются рубцы. После перенесенного 0 0 1 Fзаболе вания формируется стойкий иммунитет. Диагностика. При постановке клинического диагноза указанные выше основные симптомы заболевания являются опорными. Следует учитывать эпидемиологические данные (проживание в неблагополучных по лейшманиозу местах и т.д.). Окончательный и достоверный диагноз висцерального лейшманиоза ставится на основании обнаружения возбудителя. Исследование пунктата костного мозга С целью обнаружения возбудителя висцерального лейшманиоза, а в ряде случаев и других простейших исследуют костный мозг. Костный мозг получают, пунктируя гребень подвздошной, головку большеберцовой кости или грудину. Во всех случаях пункция является ответственной процедурой и производится только врачом. Полученный при пункции костный мозг помещают на предметное стекло и, осторожно размазывая тонким слоем с помощью шлифованного стекла, готовят 0 0 1 Fмазок. При значи тельной примеси крови в пунктате на стекле находят маленькие белые комочки и готовят из них мазки. Фиксация мазка. Мазок сушат на воздухе, фиксируют 30 мин в абсолютном этиловом спирте или 5 мин в метаноле (метиловом спирте), снова высушивают на воздухе. Фиксированные мазки можно хранить до окраски несколько дней. Окраска мазка. Стекла укладывают мазками кверху на стеклянные палочки в фотокювете. На всю поверхность мазка наливают разведенную в фосфатном буфере (рН 6,9—7,1) краску Романовского на 30—50 мин. Продолжительность окраски зависит от температуры помещения — в теплом она меньше, в холодном — больше. После окраски препарат ополаскивают дистиллированной водой (или кипяченой) и высушивают. Исследуют под иммерсией. Оценка результатов.
Во всех случаях пункция является ответственной процедурой и производится только врачом. Полученный при пункции костный мозг помещают на предметное стекло и, осторожно размазывая тонким слоем с помощью шлифованного стекла, готовят 0 0 1 Fмазок. При значи тельной примеси крови в пунктате на стекле находят маленькие белые комочки и готовят из них мазки. Фиксация мазка. Мазок сушат на воздухе, фиксируют 30 мин в абсолютном этиловом спирте или 5 мин в метаноле (метиловом спирте), снова высушивают на воздухе. Фиксированные мазки можно хранить до окраски несколько дней. Окраска мазка. Стекла укладывают мазками кверху на стеклянные палочки в фотокювете. На всю поверхность мазка наливают разведенную в фосфатном буфере (рН 6,9—7,1) краску Романовского на 30—50 мин. Продолжительность окраски зависит от температуры помещения — в теплом она меньше, в холодном — больше. После окраски препарат ополаскивают дистиллированной водой (или кипяченой) и высушивают. Исследуют под иммерсией. Оценка результатов. В разгаре болезни лейшмании могут обнаруживаться легко. В ранней стадии и в период лечения требуется более длительный просмотр мазка — не менее 40 мин. В препаратах лейшманий могут находиться группами или поодиночке, как внутриклеточно, так и вне клеток в связи с разрушением их во время приготовления мазка. При кожном лейшманиозе исследуют мазки из не распавшихся бугорков или из инфильтратов вблизи язв. Пункция кожных поражений и лимфатических узлов. При некоторых болезнях протозойной этиологии, например, кожном лейшманиозе, исследуют материал из кожных поражений, а в ряде случаев исследуют пунктат лимфатических узлов (лейшманиоз, трипаносомоз, токсоплазмоз). При кожном лейшманиозе мазки готовят из не распавшихся бугорков и язв. Кожу в области бугорка протирают спиртом, двумя пальцами слегка сдавливают и иглой или кончиком скальпеля делают прокол или поверхностный надрез. Из выступившей серозно-кровянистой жидкости готовят на предметном стекле мазок. При наличии язв материал брать непосредственно из них не рекомендуется, так как наличие микрофлоры и остатков разрушенных клеток затрудняет поиски лейшманий.
В разгаре болезни лейшмании могут обнаруживаться легко. В ранней стадии и в период лечения требуется более длительный просмотр мазка — не менее 40 мин. В препаратах лейшманий могут находиться группами или поодиночке, как внутриклеточно, так и вне клеток в связи с разрушением их во время приготовления мазка. При кожном лейшманиозе исследуют мазки из не распавшихся бугорков или из инфильтратов вблизи язв. Пункция кожных поражений и лимфатических узлов. При некоторых болезнях протозойной этиологии, например, кожном лейшманиозе, исследуют материал из кожных поражений, а в ряде случаев исследуют пунктат лимфатических узлов (лейшманиоз, трипаносомоз, токсоплазмоз). При кожном лейшманиозе мазки готовят из не распавшихся бугорков и язв. Кожу в области бугорка протирают спиртом, двумя пальцами слегка сдавливают и иглой или кончиком скальпеля делают прокол или поверхностный надрез. Из выступившей серозно-кровянистой жидкости готовят на предметном стекле мазок. При наличии язв материал брать непосредственно из них не рекомендуется, так как наличие микрофлоры и остатков разрушенных клеток затрудняет поиски лейшманий. Поэтому после предварительной обработки кожи спиртом область вокруг язвы сжимают двумя пальцами и в зоне инфильтрата по краю язвы делают прокол иглой или поверхностный разрез скальпелем. Для приготовления мазков используют каплю серозно-кровянистой жидкости или полученный при поскабливании скальпелем по краю разреза материал. Мазки сушат на воздухе, фиксируют смесью Никифорова и красят по Романовскому. Оценка результатов. В препарате должны быть хорошо различимы клетки инфильтрата — макрофаги, эндотелиальные, плазматические, лимфоидные клетки, фибробласты и небольшая примесь клеток периферической крови. Наличие в препарате эпителиальных клеток, бесструктурных глыбок, окрашивающихся в равномерно сиреневый цвет, означает, что соскоб был взят поверхностно и должен быть повторен. В мазке не должно быть слишком много крови, а также гноя и бактерий. трипаносом здесь значительно меньше, поэтому требуется просматривать большое число препаратов. В хронической стадии паразиты в крови встречаются очень редко, поэтому исследование периферической крови бывает малоэффективным.
Поэтому после предварительной обработки кожи спиртом область вокруг язвы сжимают двумя пальцами и в зоне инфильтрата по краю язвы делают прокол иглой или поверхностный разрез скальпелем. Для приготовления мазков используют каплю серозно-кровянистой жидкости или полученный при поскабливании скальпелем по краю разреза материал. Мазки сушат на воздухе, фиксируют смесью Никифорова и красят по Романовскому. Оценка результатов. В препарате должны быть хорошо различимы клетки инфильтрата — макрофаги, эндотелиальные, плазматические, лимфоидные клетки, фибробласты и небольшая примесь клеток периферической крови. Наличие в препарате эпителиальных клеток, бесструктурных глыбок, окрашивающихся в равномерно сиреневый цвет, означает, что соскоб был взят поверхностно и должен быть повторен. В мазке не должно быть слишком много крови, а также гноя и бактерий. трипаносом здесь значительно меньше, поэтому требуется просматривать большое число препаратов. В хронической стадии паразиты в крови встречаются очень редко, поэтому исследование периферической крови бывает малоэффективным.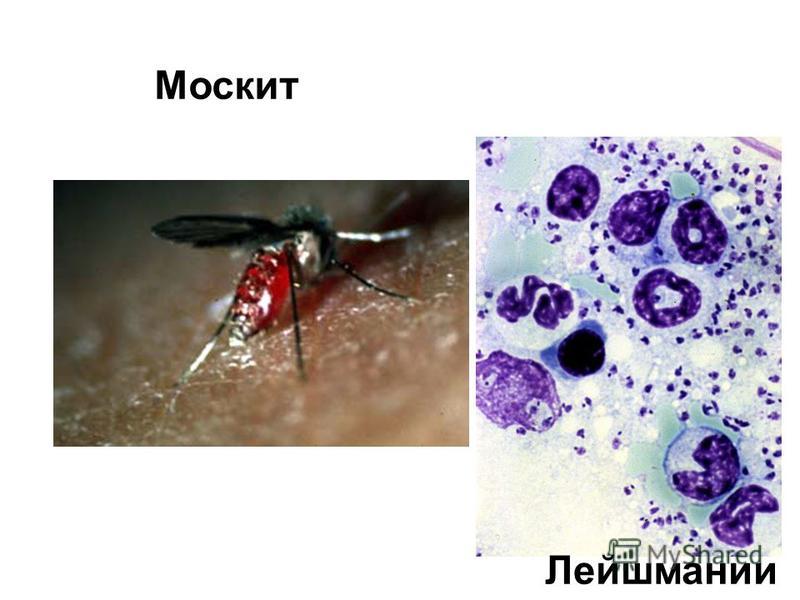 В таких случаях рекомендуется заражение белых мышей или морских свинок, а также посевы на питательные среды. С целью диагностики используют серологические реакции: связывания комплемента, агглютинации, флюоресцирующих антител. Лямблии Строение. Лямблия (Lamblia intestinalis) впервые была описана русским ученым Д. Ф. Лямблем (1859), в честь которого она и получила свое название. Лямблия существует в виде вегетативной формы (трофозоит) и цисты (рис. 10). Вегетативная форма активная, подвижная, грушевидная, передний конец тела закруглен, задний заострен. Длина 9—18 мкм. В передней части тела находится присасывательный диск в виде углубления. Имеет 2 ядра, 4 пары жгутиков. Жгутики, проходя частично в цитоплазме, образуют два хорошо видимых при окраске продольных пучка. Рис № 10 Лямблии 0 0 1 FПри наблюдении в живом состоянии движение очень ха рактерное, паразит все время переворачивается боком за счет вращательного движения вокруг продольной оси. В препарате при комнатной температуре лямблии быстро 0 0 1 Fпогибают.
В таких случаях рекомендуется заражение белых мышей или морских свинок, а также посевы на питательные среды. С целью диагностики используют серологические реакции: связывания комплемента, агглютинации, флюоресцирующих антител. Лямблии Строение. Лямблия (Lamblia intestinalis) впервые была описана русским ученым Д. Ф. Лямблем (1859), в честь которого она и получила свое название. Лямблия существует в виде вегетативной формы (трофозоит) и цисты (рис. 10). Вегетативная форма активная, подвижная, грушевидная, передний конец тела закруглен, задний заострен. Длина 9—18 мкм. В передней части тела находится присасывательный диск в виде углубления. Имеет 2 ядра, 4 пары жгутиков. Жгутики, проходя частично в цитоплазме, образуют два хорошо видимых при окраске продольных пучка. Рис № 10 Лямблии 0 0 1 FПри наблюдении в живом состоянии движение очень ха рактерное, паразит все время переворачивается боком за счет вращательного движения вокруг продольной оси. В препарате при комнатной температуре лямблии быстро 0 0 1 Fпогибают.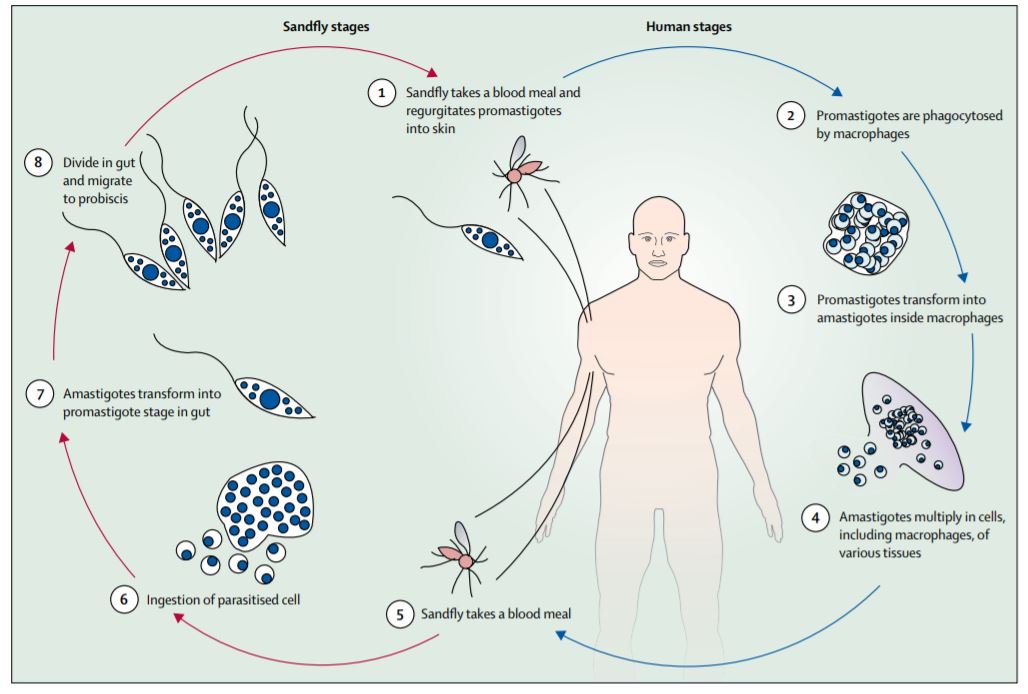 Пищу всасывают всей поверхностью. Размно жаются продольным делением. Цисты — это неподвижные неактивные формы паразита. Длина 10—14 мкм. 0 0 1 FФорма овальная. Оболочка сравнитель но толстая, хорошо очерчена, часто в значительной своей части как бы отслоена от тела самой цисты. Этот признак помогает отличать цисты лямблий от других сходных образований. В растворе Люголя окрашиваются в желтовато-коричневатый цвет. Окрашивание позволяет видеть в зрелой цисте 4 ядра. Цикл развития. Обитают в верхнем отделе тонкого кишечника. С помощью присасывательного диска прикрепляются к ворсинкам. В желчном пузыре лямблий не живут, так как желчь на них действует губительно. Частое обнаружение их при дуоденальном зондировании объясняется тем, что лямблий попадают в содержимое двенадцатиперстной кишки с ее стенок. Обычно вегетативные формы с испражнениями не выделяются, однако при поносах их можно обнаружить в свежевыделенных жидких фекалиях. Лямблий, попадая в нижние отделы кишечника, где условия для них неблагоприятные, превращаются в цисты, которые и выделяются обычно с испражнениями.
Пищу всасывают всей поверхностью. Размно жаются продольным делением. Цисты — это неподвижные неактивные формы паразита. Длина 10—14 мкм. 0 0 1 FФорма овальная. Оболочка сравнитель но толстая, хорошо очерчена, часто в значительной своей части как бы отслоена от тела самой цисты. Этот признак помогает отличать цисты лямблий от других сходных образований. В растворе Люголя окрашиваются в желтовато-коричневатый цвет. Окрашивание позволяет видеть в зрелой цисте 4 ядра. Цикл развития. Обитают в верхнем отделе тонкого кишечника. С помощью присасывательного диска прикрепляются к ворсинкам. В желчном пузыре лямблий не живут, так как желчь на них действует губительно. Частое обнаружение их при дуоденальном зондировании объясняется тем, что лямблий попадают в содержимое двенадцатиперстной кишки с ее стенок. Обычно вегетативные формы с испражнениями не выделяются, однако при поносах их можно обнаружить в свежевыделенных жидких фекалиях. Лямблий, попадая в нижние отделы кишечника, где условия для них неблагоприятные, превращаются в цисты, которые и выделяются обычно с испражнениями. 0 0 1 FЦисты хорошо сохраняются во внешней среде, в зависи мости от влажности и окружающей температуры — до месяца; при высушивании погибают очень быстро. Заражение может произойти через загрязненные руки, игрушки, пищу и воду. Цисты, попадая в кишечник, превращаются там в вегетативные формы. Одна циста образует две вегетативные формы. Клиника. Лямблии распространены очень широко, особенно часто они встречаются у детей. По мнению некоторых ученых, лямблии, особенно при большом их числе, 0 0 1 Fмо гут вызывать механическое раздражение слизистой оболочки кишечника, в 0 0 1 Fопределенной степени затруднять всасыва ние жиров и жирорастворимых витаминов. При этом могут возникать нерезкие боли в животе, расстройство стула, снижение аппетита, иногда боли в правом подреберье (лямблиоз). В некоторых случаях лямблии могут ухудшить течение других заболеваний кишечника и желчных путей. Ряд ученых считают лямблии непатогенными. Таким образом, вопрос о патогенности лямблии в настоящее время окончательно не решен.
0 0 1 FЦисты хорошо сохраняются во внешней среде, в зависи мости от влажности и окружающей температуры — до месяца; при высушивании погибают очень быстро. Заражение может произойти через загрязненные руки, игрушки, пищу и воду. Цисты, попадая в кишечник, превращаются там в вегетативные формы. Одна циста образует две вегетативные формы. Клиника. Лямблии распространены очень широко, особенно часто они встречаются у детей. По мнению некоторых ученых, лямблии, особенно при большом их числе, 0 0 1 Fмо гут вызывать механическое раздражение слизистой оболочки кишечника, в 0 0 1 Fопределенной степени затруднять всасыва ние жиров и жирорастворимых витаминов. При этом могут возникать нерезкие боли в животе, расстройство стула, снижение аппетита, иногда боли в правом подреберье (лямблиоз). В некоторых случаях лямблии могут ухудшить течение других заболеваний кишечника и желчных путей. Ряд ученых считают лямблии непатогенными. Таким образом, вопрос о патогенности лямблии в настоящее время окончательно не решен.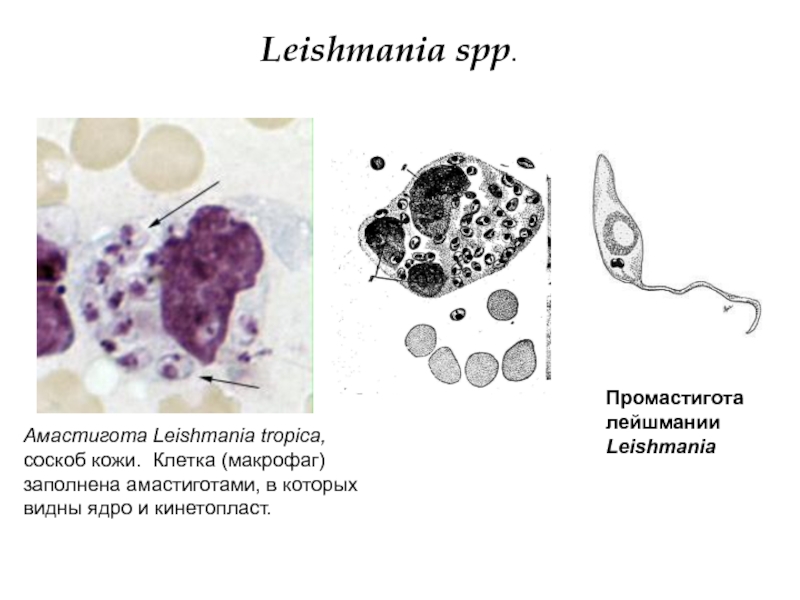 Диагностика. Обнаружить лямблии у зараженного человека обычно сравнительно легко. . Исследование желчи. Желчь и содержимое двенадцатиперстной кишки, полученные при дуоденальном зондировании, осматривают и выбирают комочки слизи на предметное стекло и микроскопируют. Кроме того, материал центрифугируют, 0 0 1 Fпросмат ривают под микроскопом осадок. Этим методом можно обнаружить вегетативные стадии лямблий. В свежевыделенном материале, полученном при дуоденальном зондировании, можно обнаружить подвижные вегетативные формы. Исследование испражнений/ Сбор материала. Фекалии исследуют с целью обнаружения простейших кишечника. Движение простейших — одно из самых характерных и отличительных свойств, которое позволяет поставить правильный диагноз. Поэтому основное правило, которое необходимо неукоснительно выполнять — это подвергать исследованию только свежий материал. Промежуток времени от момента выделения до исследования не должен превышать 30 мин., т. е. в лабораторию должны доставляться фекалии в теплом виде.
Диагностика. Обнаружить лямблии у зараженного человека обычно сравнительно легко. . Исследование желчи. Желчь и содержимое двенадцатиперстной кишки, полученные при дуоденальном зондировании, осматривают и выбирают комочки слизи на предметное стекло и микроскопируют. Кроме того, материал центрифугируют, 0 0 1 Fпросмат ривают под микроскопом осадок. Этим методом можно обнаружить вегетативные стадии лямблий. В свежевыделенном материале, полученном при дуоденальном зондировании, можно обнаружить подвижные вегетативные формы. Исследование испражнений/ Сбор материала. Фекалии исследуют с целью обнаружения простейших кишечника. Движение простейших — одно из самых характерных и отличительных свойств, которое позволяет поставить правильный диагноз. Поэтому основное правило, которое необходимо неукоснительно выполнять — это подвергать исследованию только свежий материал. Промежуток времени от момента выделения до исследования не должен превышать 30 мин., т. е. в лабораторию должны доставляться фекалии в теплом виде.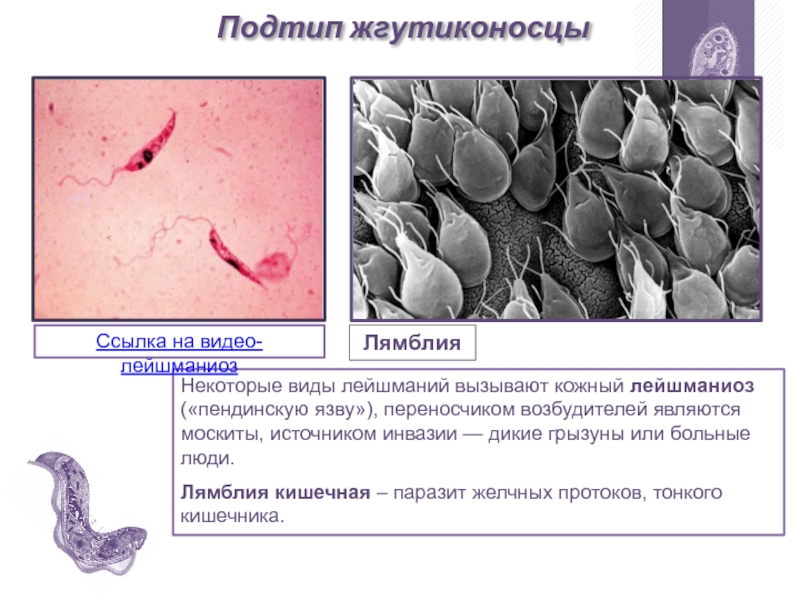 Под термином “теплые фекалии” надо 0 0 1 Fпони мать фекалии, не остывшие после выделения их из организма, но отнюдь не подогретые искусственно. Исследование оформленных испражнений допускается в течение 2 ч после выделения. Исследуемый материал собирают в чистую сухую посуду. Наиболее подходящими для этой цели являются картонные парафинированные стаканчики, которые после одноразового использования сжигают. Если фекалии собирают в стеклянную или фарфоровую посуду, то перед употреблением ее стерилизуют кипячением. Вегетативные формы простейших весьма чувствительны к химическим веществам, и если в посуде, куда собирают : фекалии, остаются следы дезинфицирующих веществ, простейшие быстро погибают и распознавание их 0 0 1 Fстано вится трудным, а иногда и невозможным. Доставленный в лабораторию материал прежде всего подвергают макроскопическому осмотру. При этом отмечают консистенцию кала, наличие слизи и крови. Если в лабораторию доставлено одновременно несколько проб 0 0 1 Fфе калий, в первую очередь подлежат исследованию неоформленные фекалии с патологическими примесями/ Сохранять пробу до исследования надо при обычной температуре в вытяжном шкафу.
Под термином “теплые фекалии” надо 0 0 1 Fпони мать фекалии, не остывшие после выделения их из организма, но отнюдь не подогретые искусственно. Исследование оформленных испражнений допускается в течение 2 ч после выделения. Исследуемый материал собирают в чистую сухую посуду. Наиболее подходящими для этой цели являются картонные парафинированные стаканчики, которые после одноразового использования сжигают. Если фекалии собирают в стеклянную или фарфоровую посуду, то перед употреблением ее стерилизуют кипячением. Вегетативные формы простейших весьма чувствительны к химическим веществам, и если в посуде, куда собирают : фекалии, остаются следы дезинфицирующих веществ, простейшие быстро погибают и распознавание их 0 0 1 Fстано вится трудным, а иногда и невозможным. Доставленный в лабораторию материал прежде всего подвергают макроскопическому осмотру. При этом отмечают консистенцию кала, наличие слизи и крови. Если в лабораторию доставлено одновременно несколько проб 0 0 1 Fфе калий, в первую очередь подлежат исследованию неоформленные фекалии с патологическими примесями/ Сохранять пробу до исследования надо при обычной температуре в вытяжном шкафу.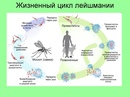 Помещать в термостат не следует, так как при повышенной температуре быстрее происходит размножение бактерий, больше образуется продуктов метаболизма, что приводит к быстрой дегенерации простейших. При каждом анализе испражнений с целью обнаружения простейших кишечника обязательным является исследование нативного препарата и мазка, окрашенного раствором Люголя. Нативный мазок. Жидкие кровянисто-слизистые испражнения без видимой примеси фекальных масс могут быть исследованы без добавления изотонического 0 0 1 Fраствора хло рида натрия. Деревянной палочкой каплю испражнений переносят на предметное стекло и накрывают покровным стеклом. Пользоваться стеклянными палочками не рекомендуется, так как ими невозможно набирать 0 0 1 Fслизистые ко мочки, в которых находятся простейшие. Правильно приготовленный препарат должен быть опрятным, покровное стекло должно плотно прилегать к предметному с равномерным распределением жидкости между стеклами без ее выступания за пределы покровного стекла. Мазок должен быть умеренной толщины.
Помещать в термостат не следует, так как при повышенной температуре быстрее происходит размножение бактерий, больше образуется продуктов метаболизма, что приводит к быстрой дегенерации простейших. При каждом анализе испражнений с целью обнаружения простейших кишечника обязательным является исследование нативного препарата и мазка, окрашенного раствором Люголя. Нативный мазок. Жидкие кровянисто-слизистые испражнения без видимой примеси фекальных масс могут быть исследованы без добавления изотонического 0 0 1 Fраствора хло рида натрия. Деревянной палочкой каплю испражнений переносят на предметное стекло и накрывают покровным стеклом. Пользоваться стеклянными палочками не рекомендуется, так как ими невозможно набирать 0 0 1 Fслизистые ко мочки, в которых находятся простейшие. Правильно приготовленный препарат должен быть опрятным, покровное стекло должно плотно прилегать к предметному с равномерным распределением жидкости между стеклами без ее выступания за пределы покровного стекла. Мазок должен быть умеренной толщины. Густой мазок малопрозрачен и его трудно микроскопировать, если же взято слишком мало фекалий, то мазок получится разведенным и простейших можно не обнаружить. Через правильно приготовленный мазок должен быть виден печатный текст. Микроскопическое исследование свежего мазка нужно проводить, обязательно соблюдая следующие правила: 1) освещение препарата не должно быть ярким. Правильное освещение 0 0 1 Fдостигается соответствующим положением кон денсора, который опускают тем больше, чем сильнее источник света. Используют также светофильтр; 2) 0 01 F препарат про сматривают сначала под малым увеличением микроскопа (X 10), а потом с сухой системой большого увеличения; 3) передвигать препарат надо с таким расчетом, чтобы не пропустить какие-либо участки мазка или не попасть повторно на уже просмотренное место. При правильном освещении даже под малым увеличением можно увидеть вегетативные стадии и цисты лямблий. После ориентировочного просмотра под малым увеличением обязательно применяют большое увеличение (х10, х40).
Густой мазок малопрозрачен и его трудно микроскопировать, если же взято слишком мало фекалий, то мазок получится разведенным и простейших можно не обнаружить. Через правильно приготовленный мазок должен быть виден печатный текст. Микроскопическое исследование свежего мазка нужно проводить, обязательно соблюдая следующие правила: 1) освещение препарата не должно быть ярким. Правильное освещение 0 0 1 Fдостигается соответствующим положением кон денсора, который опускают тем больше, чем сильнее источник света. Используют также светофильтр; 2) 0 01 F препарат про сматривают сначала под малым увеличением микроскопа (X 10), а потом с сухой системой большого увеличения; 3) передвигать препарат надо с таким расчетом, чтобы не пропустить какие-либо участки мазка или не попасть повторно на уже просмотренное место. При правильном освещении даже под малым увеличением можно увидеть вегетативные стадии и цисты лямблий. После ориентировочного просмотра под малым увеличением обязательно применяют большое увеличение (х10, х40).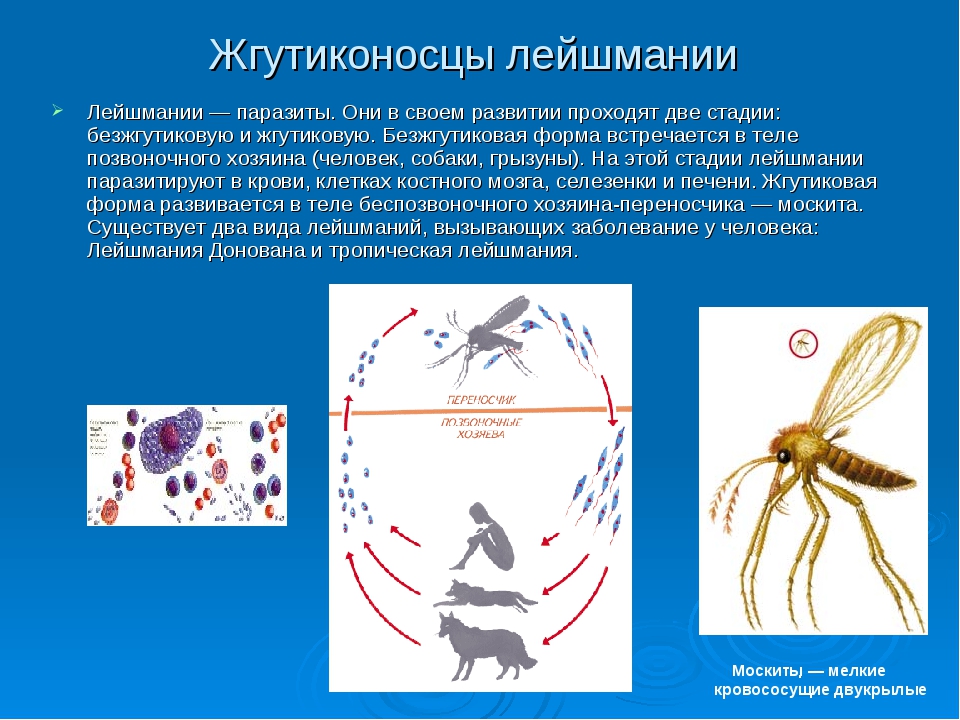 Циста в нативном мазке отличается от вегетативной стадии постоянной формой благодаря оболочке. Строение цист в нативном препарате плохо заметно, невидны Исследование выделений мочеполовых путей. При воспалительных заболеваниях мочеполовых путей обязательно исследование на наличие влагалищных трихомонад. Патологические выделения у женщин берут для исследования с помощью влагалищных зеркал и тампона со слизистой оболочки влагалища или из его заднего свода, а при обилии выделений — с наружных половых органов или с пальца резиновой перчатки после осмотра больной врачом. Из уретры получают материал с помощью специальной ложечки, которую вводят до сфинктера. У мужчин до мочеиспускания из уретры выдавливают каплю выделений. Для исследования мочевого пузыря мочу получают катетером и микроскопируют осадок после ее центрифугирования. Во всех случаях 1—-2 капли выделений необходимо сразу же поместить в каплю изотонического раствора хлорида натрия на предметном стекле, накрыть покровным стеклом и исследовать при среднем увеличении (Х40, х10) с сухой системой.
Циста в нативном мазке отличается от вегетативной стадии постоянной формой благодаря оболочке. Строение цист в нативном препарате плохо заметно, невидны Исследование выделений мочеполовых путей. При воспалительных заболеваниях мочеполовых путей обязательно исследование на наличие влагалищных трихомонад. Патологические выделения у женщин берут для исследования с помощью влагалищных зеркал и тампона со слизистой оболочки влагалища или из его заднего свода, а при обилии выделений — с наружных половых органов или с пальца резиновой перчатки после осмотра больной врачом. Из уретры получают материал с помощью специальной ложечки, которую вводят до сфинктера. У мужчин до мочеиспускания из уретры выдавливают каплю выделений. Для исследования мочевого пузыря мочу получают катетером и микроскопируют осадок после ее центрифугирования. Во всех случаях 1—-2 капли выделений необходимо сразу же поместить в каплю изотонического раствора хлорида натрия на предметном стекле, накрыть покровным стеклом и исследовать при среднем увеличении (Х40, х10) с сухой системой. В препарате, приготовленном указанным способом, вследствие быстрого высыхания подвижность трихомонад вскоре прекращается. Поэтому рекомендуют готовить препарат по типу “висячей капли”. В получающейся при этом влажной камере, где благодаря вазелиновой прокладке создается герметичность и замедляется высыхание препарата, подвижность трихомонад может наблюдаться иногда в течение часа. Это дает возможность готовить препараты в процедурном кабинете и направлять их в лабораторию (в холодное время года препараты надо доставлять в утепленном биксе). В нативном препарате трихомонады легко отличаются от лейкоцитов и других клеток по движению, а также по наличию жгутов и ундулирующей мембраны. Более четко трихомонады видны при исследовании в темном поле или при фазово- контрастной микроскопии. В несвежем или подсохшем мазке трихомонады быстро прекращают свое движение, и в таком случае их определение становится практически невозможным. Для диагностики трихомонадного поражения из исследуемого материала в процедурном кабинете готовят мазки и направляют в лабораторию, где их после подсушивания фиксируют и красят по Романовскому.
В препарате, приготовленном указанным способом, вследствие быстрого высыхания подвижность трихомонад вскоре прекращается. Поэтому рекомендуют готовить препарат по типу “висячей капли”. В получающейся при этом влажной камере, где благодаря вазелиновой прокладке создается герметичность и замедляется высыхание препарата, подвижность трихомонад может наблюдаться иногда в течение часа. Это дает возможность готовить препараты в процедурном кабинете и направлять их в лабораторию (в холодное время года препараты надо доставлять в утепленном биксе). В нативном препарате трихомонады легко отличаются от лейкоцитов и других клеток по движению, а также по наличию жгутов и ундулирующей мембраны. Более четко трихомонады видны при исследовании в темном поле или при фазово- контрастной микроскопии. В несвежем или подсохшем мазке трихомонады быстро прекращают свое движение, и в таком случае их определение становится практически невозможным. Для диагностики трихомонадного поражения из исследуемого материала в процедурном кабинете готовят мазки и направляют в лабораторию, где их после подсушивания фиксируют и красят по Романовскому. В окрашенных препаратах достаточно четко выявляются особенности морфологии трихомонад, что наряду с неограниченным временем исследования (в противоположность нативному мазку, где сроки доставки и микроскопии 0 0 1 Fогра ничены временем сохранения подвижности трихомонад) делает этот метод достаточно удобным для практических условий. Окраска по Романовскому дает лучшие результаты в модификации Н. А. Цагикян (1954). Для этого фиксированный тонкий мазок красят 40 мин краской следующего состава: воды дистиллированной 100 мл, 1% раствора карбоната натрия 15 капель и краски Романовского 4 мл. По указанной модификации более четко красятся жгутики, трихомонады становятся хорошо различимыми. Ядра окрашиваются в фиолетово-рубиновый или фиолетовый цвет, цитоплазма—в голубой, жгутики и некоторые другие структурные образования — в розово— красный. Повышению эффекта лабораторного исследования способствует просмотр нативных и окрашенных препаратов. Список используемой литературы. 1. Генис Д.Е. Медицинская паразитология, М.
В окрашенных препаратах достаточно четко выявляются особенности морфологии трихомонад, что наряду с неограниченным временем исследования (в противоположность нативному мазку, где сроки доставки и микроскопии 0 0 1 Fогра ничены временем сохранения подвижности трихомонад) делает этот метод достаточно удобным для практических условий. Окраска по Романовскому дает лучшие результаты в модификации Н. А. Цагикян (1954). Для этого фиксированный тонкий мазок красят 40 мин краской следующего состава: воды дистиллированной 100 мл, 1% раствора карбоната натрия 15 капель и краски Романовского 4 мл. По указанной модификации более четко красятся жгутики, трихомонады становятся хорошо различимыми. Ядра окрашиваются в фиолетово-рубиновый или фиолетовый цвет, цитоплазма—в голубой, жгутики и некоторые другие структурные образования — в розово— красный. Повышению эффекта лабораторного исследования способствует просмотр нативных и окрашенных препаратов. Список используемой литературы. 1. Генис Д.Е. Медицинская паразитология, М.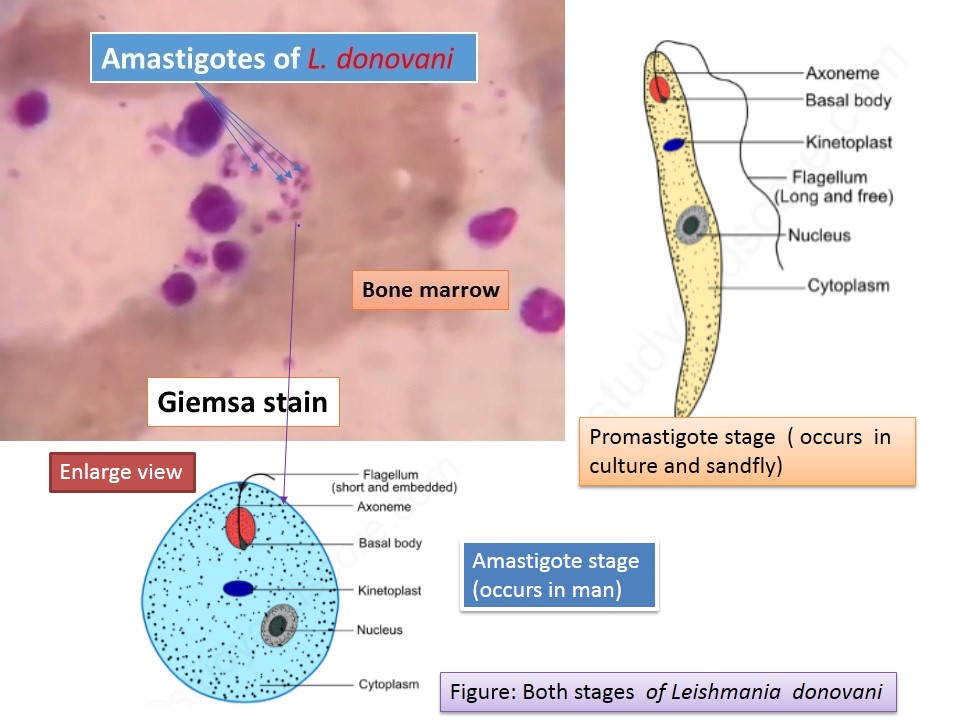 «Медицина», 1985 г 2. Воробьев А.А. Микробиология и иммунология, М. «Медицина», 1999 г. 3. Коротеев А.И. Медицинская микробиология, иммунология и вирусология, С-П., 1998 г. 4. Золотницкий В.С. Руководство к практическим занятиям по эпидемиологии и паразитологии, М. «Медицина», 1975 г. 5. Слюсарев А.А. Биология с общей генетикой, М. «Медицина», 1978 г. 6. Чернес Ф.К. Микробиология, М. «Медицина», 1987 г. 7. Ярыгин В.Н. Биология, М. «Медицина», 1980 г.
«Медицина», 1985 г 2. Воробьев А.А. Микробиология и иммунология, М. «Медицина», 1999 г. 3. Коротеев А.И. Медицинская микробиология, иммунология и вирусология, С-П., 1998 г. 4. Золотницкий В.С. Руководство к практическим занятиям по эпидемиологии и паразитологии, М. «Медицина», 1975 г. 5. Слюсарев А.А. Биология с общей генетикой, М. «Медицина», 1978 г. 6. Чернес Ф.К. Микробиология, М. «Медицина», 1987 г. 7. Ярыгин В.Н. Биология, М. «Медицина», 1980 г.
причины, симптомы, диагностика и лечение
Лейшманиоз представляет собой протозойную инфекцию с трансмиссивным механизмом распространения, характеризующуюся поражением кожных покровов или внутренних органов внутриклеточными паразитами – лейшманиями. Лейшманиозы подразделяют на висциральные, протекающие с поражением легких, печени, селезенки, сердца, и кожные, проявляющиеся трансформирующимися в очаги изъязвления папулами. Диагностика лейшманиоза осуществляется путем выявления лейшманий в крови пациента (при висцеральной форме) или в отделяемом кожных элементов (при кожной форме).
Общие сведения
Лейшманиоз представляет собой протозойную инфекцию с трансмиссивным механизмом распространения, характеризующуюся поражением кожных покровов или внутренних органов внутриклеточными паразитами – лейшманиями.
Характеристика возбудителя
Лейшманиоз вызываются семнадцатью из более чем двадцати видов простейших паразитов рода Leishmania. Лейшмании развиваются внутри клеток хозяина (преимущественно в макрофагах и элементах ретикулоэндотелиальной системы). В течение своего жизненного цикла им необходимо сменить двух хозяев. В организме позвоночных животных лейшмании находятся в безжгутиковой форме, развиваясь в жгутиковую форму в теле членистоногого. Лейшмании отличаются резистентностью к антибиотикам, и чувствительны к препаратам пятивалентной сурьмы.
Подавляющее большинство лейшманиозов – зоонозы (резервуаром и источником инфекции являются животные), только два вида – антропонозы. Виды животных, участвующих в распространении лейшманиоза, довольно ограничены, поэтому инфекция является природно-очаговой, распространяется в пределах обитания соответствующей фауны: грызунов песчаниковых видов, псовых (лисы, собаки, шакалы), а также переносчиков – москитов. Преимущественно очаги лейшманиоза располагаются в странах Африки и Южной Америки. Большинство из них — развивающиеся, среди 69 стран, где распространен лейшманиоз, 13 являются беднейшими странами мира.
Виды животных, участвующих в распространении лейшманиоза, довольно ограничены, поэтому инфекция является природно-очаговой, распространяется в пределах обитания соответствующей фауны: грызунов песчаниковых видов, псовых (лисы, собаки, шакалы), а также переносчиков – москитов. Преимущественно очаги лейшманиоза располагаются в странах Африки и Южной Америки. Большинство из них — развивающиеся, среди 69 стран, где распространен лейшманиоз, 13 являются беднейшими странами мира.
Человек является источником инфекции в случае поражения кожной формой лейшмании, при этом москиты получают возбудителя с отделяемым кожных язв. Висцеральная лейшмания в подавляющем большинстве случаев является зоонозной, москиты заражаются от больных животных. Заразность москитов отсчитывается с пятого дня попадания лейшманий в желудок насекомого и сохраняется пожизненно. Человек и животные контагиозны в течение всего срока пребывания возбудителя в организме.
Лейшманиоз передается исключительно с помощью трансмиссивного механизма, переносчики – москиты, получают инфекцию, питаясь кровью больных животных, и переносят здоровым особям и людям. Человек обладает высокой восприимчивостью к инфекции, после перенесения кожного лейшманиоза сохраняется продолжительный стойкий иммунитет, висцеральная форма такового не формирует.
Человек обладает высокой восприимчивостью к инфекции, после перенесения кожного лейшманиоза сохраняется продолжительный стойкий иммунитет, висцеральная форма такового не формирует.
Патогенез
Возбудитель проникает в толщу кожи человека при укусе москита, формируя в области входных ворот лейшманиозную гранулему. Впоследствии, при висцеральной форме инфекции гранулема рассасывается, а при кожной — прогрессирует в язву. Лейшмании разносятся по организму с током лимфы, поражая регионарные лимфатические узлы. Вдоль лимфатического сосуда паразиты могут формировать лейшманиомы – ряд последовательно располагающихся специфических язв.
В Южной Америке отмечаются формы лейшмании, протекающие с поражением слизистых оболочек ротовой полости, носоглотки и верхних дыхательных путей с грубой деформацией глубоких тканей и развитием полипозных образований. Висцеральная форма лейшманиоза развивается в результате рассеивания возбудителя по организму и попадания в печень, селезенку, костный мозг.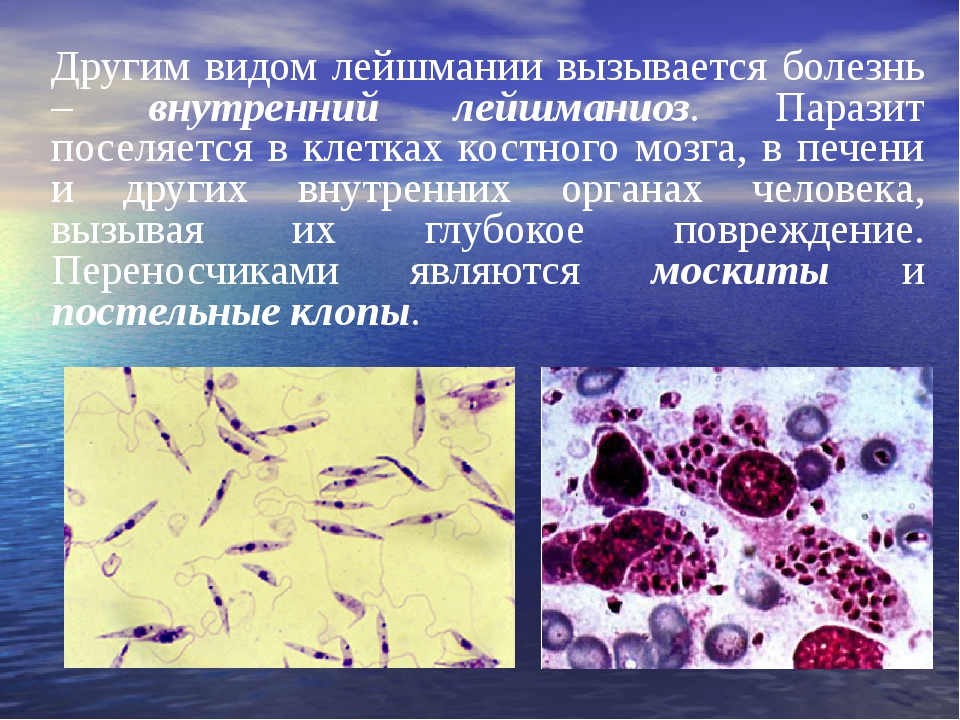 Реже – в кишечную стенку, легкие, почки и надпочечники.
Реже – в кишечную стенку, легкие, почки и надпочечники.
Возникающий иммунный ответ подавляет инфекцию, при этом заболевание протекает латентно, либо с маловыраженной симптоматикой. При иммунодефиците, сниженных защитных свойствах лейшманиоз прогрессирует, протекает с выраженной клиникой интоксикационного синдрома, лихорадкой. Размножение паразитов в печени способствуют замещению гепатоцитов фиброзной тканью, в селезенке отмечают атрофию пульпы с участками инфарктов и некротизации. Вследствие поражения костного мозга развивается анемия. В целом висцеральный лейшманиоз, прогрессируя, вызывает общую кахексию.
Классификация
Лейшманиозы подразделяются на висцеральные и кожные формы, каждая форма, в свою очередь, разделяется на антропонозы и зоонозы (в зависимости от резервуара инфекции). Висцеральные зоонозные лейшманиозы: детский кала-азар (средиземноморско-среднеазиатский), лихорадка дум-дум (распространена в восточной Африке), носоглоточный лейшманиоз (кожно-слизистый, лейшманиоз Нового Света).
Индийский кала-азар является висцеральным антропонозом. Кожные формы лейшманиоза представлены болезнью Боровского (городской антропонозный тип и сельский зооноз), пендинской, ашхабадской язвами, багдадским фурункулом, эфиопским кожным лейшманиозом.
Симптомы лейшманиоза
Висцеральный средиземноморско-азиатский лейшманиоз
Инкубационный период этой формы лейшманиоза составляет от 20 дней до нескольких (3-5) месяцев. Иногда (довольно редко) затягивается до года. У детей раннего возраста в этот период может отмечаться первичная папула в месте внедрения возбудителя (у взрослых встречается в редких случаях). Инфекция протекает в острой, подострой и хронической формах. Острая форма обычно отмечается у детей, характеризуется бурным течением и без должной медицинской помощи заканчивается летально.
Чаще всего встречается подострая форма заболевания. В начальном периоде отмечается постепенное нарастание общей слабости, разбитости, повышенной утомляемости.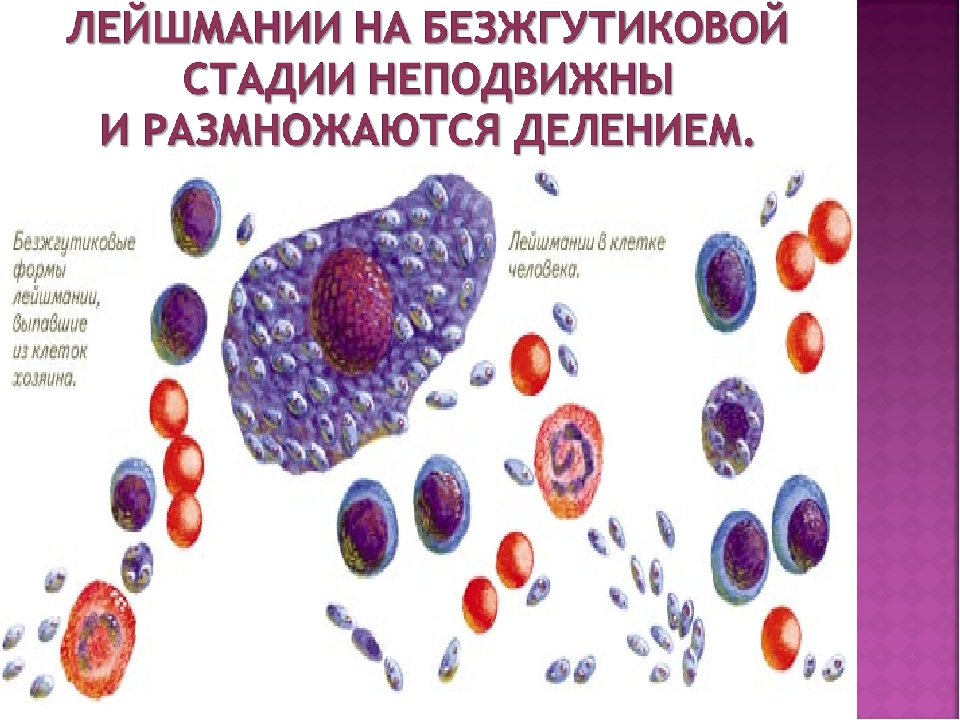 Отмечается снижение аппетита, побледнение кожи. В этом периоде при пальпации можно выявить некоторое увеличение размеров селезенки. Температура тела может подниматься до субфебрильных цифр.
Отмечается снижение аппетита, побледнение кожи. В этом периоде при пальпации можно выявить некоторое увеличение размеров селезенки. Температура тела может подниматься до субфебрильных цифр.
Подъем температуры до высоких значений говорит о вступлении заболевания в период разгара. Лихорадка имеет неправильный или волнообразный характер, продолжается в течение нескольких дней. Приступы лихорадки могут сменяться периодами нормализации температуры или снижения до субфебрильных значений. Такое течение обычно продолжается 2-3 месяца. Лимфатические узлы увеличены, отмечается гепато- и, в особенности, спленомегалия. Печень и селезенка при пальпации умеренно болезненны. При развитии бронхоаденита отмечается кашель. При такой форме нередко присоединяется вторичная инфекция дыхательной системы и развивается пневмония.
С прогрессированием заболевания отмечается усугубление тяжести состояния больного, развивается кахексия, анемия, геморрагический синдром.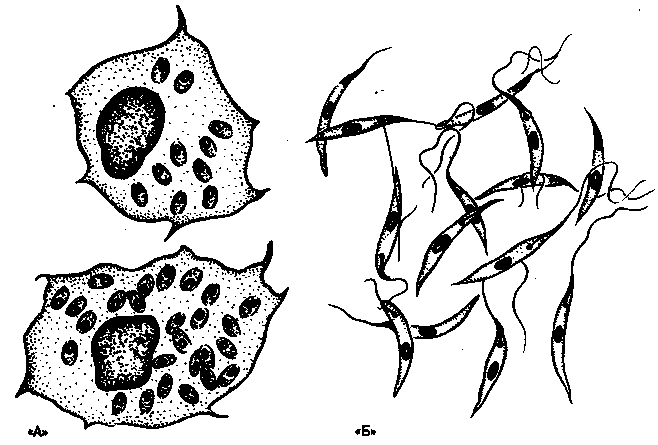 На слизистых оболочках ротовой полости возникают некротизированные участки. Ввиду значительного увеличения селезенки происходит смещение сердца вправо, тоны его глухие, ритм сокращений ускорен. Отмечается склонность к падению периферического артериального давления. С прогрессированием инфекции формируется сердечная недостаточность. В терминальном периоде больные кахексичны, кожные покровы бледные и истонченные, отмечаются отеки, выражена анемия.
На слизистых оболочках ротовой полости возникают некротизированные участки. Ввиду значительного увеличения селезенки происходит смещение сердца вправо, тоны его глухие, ритм сокращений ускорен. Отмечается склонность к падению периферического артериального давления. С прогрессированием инфекции формируется сердечная недостаточность. В терминальном периоде больные кахексичны, кожные покровы бледные и истонченные, отмечаются отеки, выражена анемия.
Хронический лейшманиоз протекает латентно, либо с незначительной симптоматикой. Антропонозный висцеральный лейшманиоз может сопровождаться (в 10% случаев) появлением на коже лейшманоидов – мелких папиллом, узелков или пятен (иногда просто участки со сниженной пигментацией), содержащих возбудителя. Лейшманоиды могут существовать годами и десятилетиями.
Кожный зоонозный лейшманиоз (болезнь Боровского)
Распространен в тропическом и субтропическом климате. Инкубационный период его составляет 10-20 дней, может сокращаться до недели и удлиняться до полутора месяцев. В области внедрения возбудителя при этой форме инфекции обычно формируется первичная лейшманиома, первоначально имеющая вид розовой гладкой папулы около 2-3 см в диаметре, в дальнейшем прогрессирующей в безболезненный или малоболезненный при надавливании фурункул. Спустя 1-2 недели в лейшманиоме формируется некротический очаг, и вскоре образуется безболезненное изъязвление с подрытыми краями, окруженное валиком инфильтрированной кожи с обильным отделяемым серозно-гнойного или геморрагического характера.
В области внедрения возбудителя при этой форме инфекции обычно формируется первичная лейшманиома, первоначально имеющая вид розовой гладкой папулы около 2-3 см в диаметре, в дальнейшем прогрессирующей в безболезненный или малоболезненный при надавливании фурункул. Спустя 1-2 недели в лейшманиоме формируется некротический очаг, и вскоре образуется безболезненное изъязвление с подрытыми краями, окруженное валиком инфильтрированной кожи с обильным отделяемым серозно-гнойного или геморрагического характера.
Вокруг первичной лейшманиомы развиваются вторичные «бугорки обсеменения», прогрессирующие в новые язвы и сливающиеся в единое изъязвленное поле (последовательная лейшманиома). Обычно лейшманиомы появляются на открытых участках кожных покровов, их количество может колебаться от единичной язвы до десятков. Нередко лейшманиомы сопровождаются увеличением регионарных лимфоузлов и лимфангитом (обычно безболезненным). Спустя 2-6 месяцев язвы заживают, оставляя рубцы. В целом заболевание, как правило, длиться около полугода.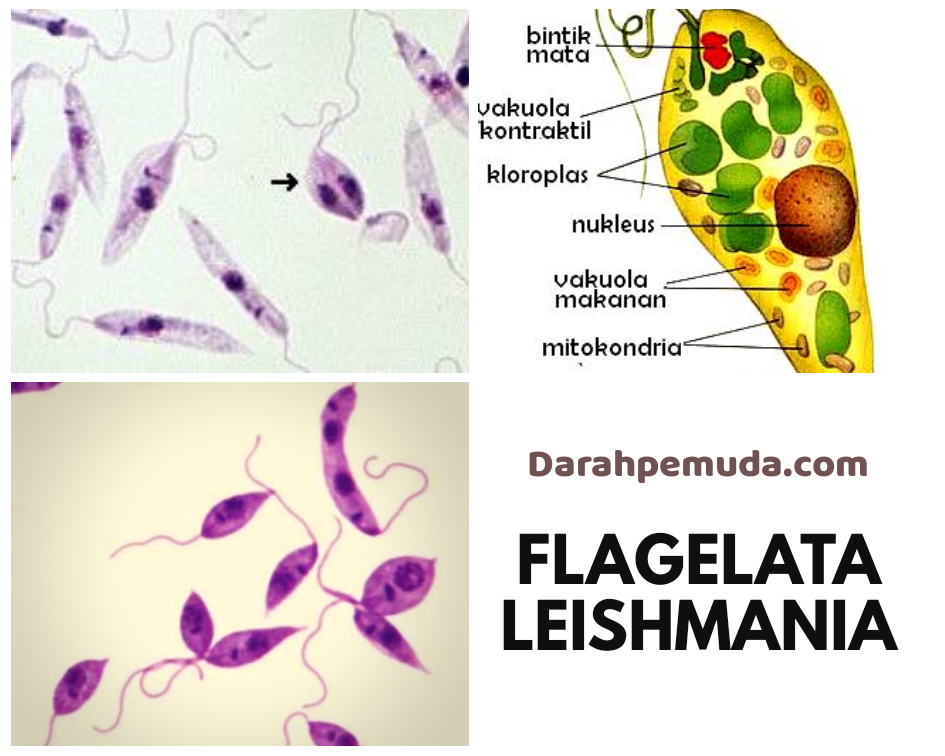
Диффузно-инфильтрирующий лейшманиоз
Отличается значительной распространенной инфильтрацией кожи. Со временем инфильтрат регрессирует, не оставляя последствий. В исключительных случаях отмечаются мелкие язвы, заживающие без заметных рубцов. Такая форма лейшманиоза достаточно редка, обычно отмечается у пожилых лиц.
Туберкулоидный кожный лейшманиоз
Наблюдается в основном у детей и молодых людей. При этой форме вокруг послеязвенных рубцов или на них появляются мелкие бугорки, могущие увеличиваться в размерах и сливаться друг с другом. Изъязвляются такие бугорки редко. Язвы при этой форме инфекции оставляют значительные рубцы.
Антропонозная форма кожного лейшманиоза
Характеризуется продолжительным инкубационным периодом, который может достигать нескольких месяцев и лет, а также медленным развитием и умеренной интенсивностью кожных поражений.
Осложнения лейшманиоза
Диагностика лейшманиоза
Общий анализ крови при лейшманиозе показывает признаки гипохромной анемии, нейтропении и анэозинофилии при относительном лимфоцитозе, а также пониженную концентрацию тромбоцитов. СОЭ повышена. Биохимический анализ крови может показать гипергаммаглобулинемию. Выделение возбудителя кожного лейшманиоза возможно из бугорков и язв, при висцеральном — лейшмании обнаруживаются в посеве крови на стерильность. При необходимости для выделения возбудителя производят биопсию лимфоузлов, селезенки, печени.
СОЭ повышена. Биохимический анализ крови может показать гипергаммаглобулинемию. Выделение возбудителя кожного лейшманиоза возможно из бугорков и язв, при висцеральном — лейшмании обнаруживаются в посеве крови на стерильность. При необходимости для выделения возбудителя производят биопсию лимфоузлов, селезенки, печени.
В качестве специфической диагностики осуществляют микроскопическое исследование, бакпосев на питательной среде NNN, биопробы на лабораторных животных. Серологическая диагностика лейшманиоза проводится с применением РСК, ИФА, РНИФ, РЛА. В периоде реконвалесценции отмечается позитивная реакция Монтенегро (кожная проба с лейшманином). Производится при эпидемиологических исследованиях.
Лечение лейшманиоза
Этиологическое лечение лейшманиоза заключается в применении препаратов пятивалентной сурьмы. При висцеральной форме их назначают внутривенно с нарастанием дозировки на 7-10 дней. В случае недостаточной эффективности терапию дополняют амфотерицином В, вводимым с 5% раствором глюкозы внутривенно медленно.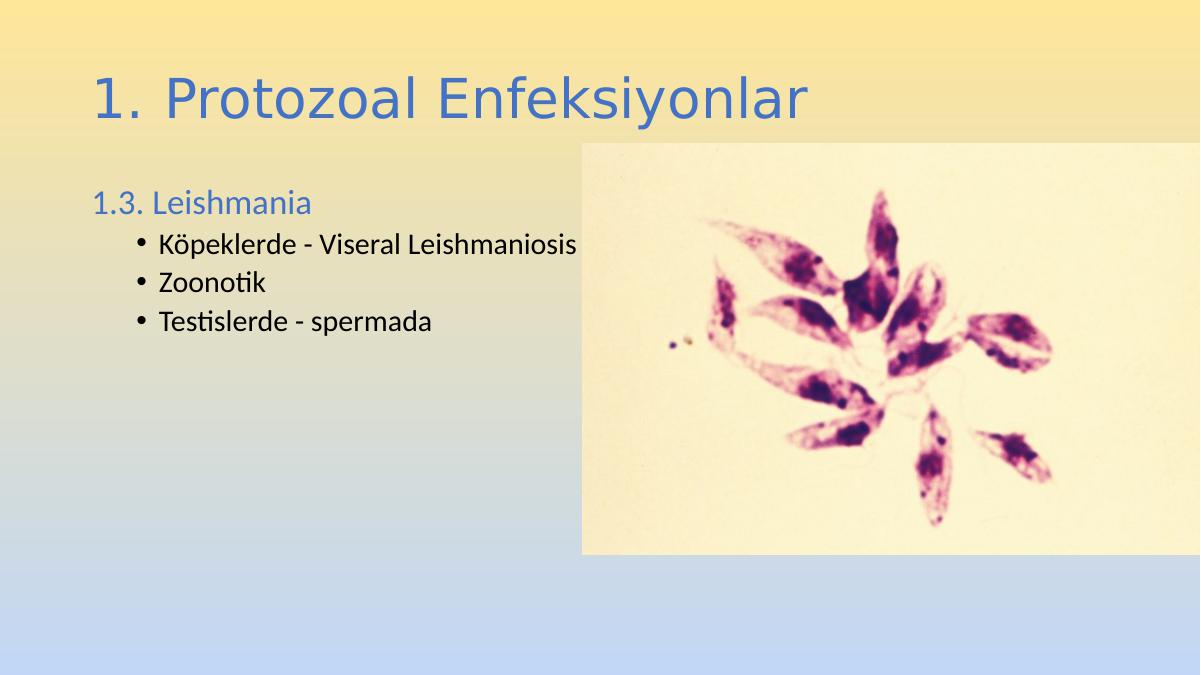 На ранних стадиях кожного лейшманиоза бугорки обкалывают мономицином, сульфатом берберина или уротропином, а также назначают эти препараты в виде мазей и примочек.
На ранних стадиях кожного лейшманиоза бугорки обкалывают мономицином, сульфатом берберина или уротропином, а также назначают эти препараты в виде мазей и примочек.
Сформировавшиеся язвы являются показанием к назначению мирамистина внутримышечно. Для ускорения заживления язв эффективна лазерная терапия. Препаратами резерва при лейшманиозе являются амфотерицин В и пентамидин, их назначают в случаях рецидивирования инфекции и при резистентности лейшманий к традиционным средствам. Для повышения эффективности терапии можно добавить человеческий рекомбинантный гаммаинтерферон. В некоторых случаях бывает необходимо хирургическое удаление селезенки.
Прогноз и профилактика лейшманиоза
При легко протекающем лейшманиозе возможно самостоятельное выздоровление. Благоприятен прогноз при своевременном выявлении и должных медицинских мерах. Тяжелые формы, инфицирование лиц с ослабленными защитными свойствами, отсутствие лечения значительно ухудшают прогноз. Кожные проявления лейшманиоза оставляют косметические дефекты.
Кожные проявления лейшманиоза оставляют косметические дефекты.
Профилактика лейшманиоза включает меры по благоустройству населенных пунктов, ликвидацию мест расселения москитов (свалок и пустырей, затопленных подвальных помещений), дезинсекцию жилых помещений. Индивидуальная профилактика заключается в использовании репеллентов, других средств защиты от укусов москитов. При обнаружении больного производят химиопрофилактику пириметамином в коллективе. Специфическая иммунная профилактика (вакцинация) производится лицам, планирующим посещение эпидемически опасных районов, а также неимунному населению очагов инфекции.
Лейшмании (род Leishmania)
|
|||
Общая характеристика класса Жгутиковые. Лейшмании. Систематическое положение, морфология, цикл развития, обоснование лабораторной диагностики, пути заражения, профилактика
Flagellata
представители характеризуются присутствием жгутиков в течение всего вегетативного периода их жизни.— Большинство Ж. имеет удлиненное тело, обычно заостренное с одной стороны. По большей части они имеют постоянную форму; лишь немногие метаболичны, т. е. способны к незначительному изменению формы тела. Некоторые имеют ундулирующую мембрану – своеобразную органеллу передвижения.
Паразиты – Трипаносомы, Лейшмании, Лямблии, Трихомонады
Тип Protozoa — простейшие
Класс Flagellata -Жгутиковые
Отряд Protomonadina -одножгутиковые
Род Leishmania — Лейшмания
Вид Leishmania Tropica – лейшмания тропика
Подвид Leishmania Tropica Minor
Подвид Leishmania Tropica Maior
Подвид Leishmania Brasiliensis – лейшмания бразильензис
Вид Leishmania Donovani – лейшмания доновани
Leischmaniadonovani – возбудитель общего (висцерального) лейшманиоза, Leischmania tropica – кожного лейшманиоза, а Leischmania brasiliensis – кожно-слизистого лейшманиоза. Лейшманиозы – трансмиссивные природно – очаговые заболевания. Висцеральный лейшманиоз распространен в странах Средиземноморья, Средней и Южной Азии, Африки и Южной Америки. Кожный лейшманиоз встречается в странах Южной Европы, Северной и Западной Африки, Ближнего Востока, Центральной и Южной Азии. Основной очаг кожно- слизистого лейшманиоза находится в Южной и Центральной Америке. Морфологические особенности: есть 2 формы – промастигота ( имеет жгутик , отходящий от кинетопласта и размеры до 10-20 мкм) и амастигота ( безжгутиковая округлая или овальная форма, размер – 3-5мкм ). Все возбудители лейшманиоза морфологически сходны, но имеют биохимические и антигенные различия.
Лейшманиозы – трансмиссивные природно – очаговые заболевания. Висцеральный лейшманиоз распространен в странах Средиземноморья, Средней и Южной Азии, Африки и Южной Америки. Кожный лейшманиоз встречается в странах Южной Европы, Северной и Западной Африки, Ближнего Востока, Центральной и Южной Азии. Основной очаг кожно- слизистого лейшманиоза находится в Южной и Центральной Америке. Морфологические особенности: есть 2 формы – промастигота ( имеет жгутик , отходящий от кинетопласта и размеры до 10-20 мкм) и амастигота ( безжгутиковая округлая или овальная форма, размер – 3-5мкм ). Все возбудители лейшманиоза морфологически сходны, но имеют биохимические и антигенные различия.
Жизненный цикл: специфическими переносчиками лейшманий являются москиты р . Phlebotomus, у которых паразиты размножаются в пищеварительном тракте и накапливаются в хоботке. В организме переносчика образуется жгутиковая стадия – промастигота. Заражение человека происходит при укусах москитом(трансмиссивный путь).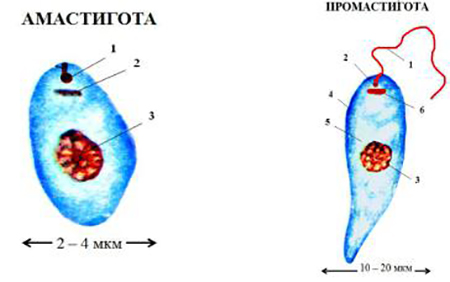
В организме человека и других позвоночных (рептилии, млекопитающие) лейшмании теряют жгутик , превращаются в амастиготы, переходят к внутриклеточному паразитированию и интенсивно размножаются. Природными резервуарами L. donovani могут быть шакалы, собаки, грызуны , L. tropica – грызуны , L. braziliensis – грызуны, обезьяны, ленивцы.
ВИСЦЕРАЛЬНЫЙ ЛЕЙШМАНИОЗ(черная болезнь, лихорадка дум- дум,
кала-азар, детский лейшманиоз) Эти заболевания вызывают L. donovani и L. infantum.
Лабораторная диагностика : обнаружение лейшманий в пунктатах костного мозга( грудина), лимфатических узлов, иногда печени или селезенки. Применяются иммунологические методы исследований (определение антител в сыворотке крови больных).
КОЖНЫЙ ЛЕЙШМАНИОЗ( пендинка, восточная язва) Это заболевание вызывают 2 вида лейшманий: L. tropica major и L.tropica minor.
Лабораторная диагностика: обнаружение лейшманий в мазках из
содержимого язв.
КОЖНО-СЛИЗИСТЫЙ ЛЕЙШМАНИОЗ (эспундия)
Это заболевание вызывают L. brasiliensis, L.mexicana и L.peruviana.
brasiliensis, L.mexicana и L.peruviana.
Лабораторная диагностика: обнаружение лейшманий в мазках из содержимого язв.
Профилактика лейшманиозов: индивидуальная защита от укусов москитов (реппеленты, противомоскитные сетки) и прививки ослабленными штаммами лейшманий, выявление и лечение больных, уничтожение москитов, уничтожение животных, которые являются резервуарами возбудителей заболеваний, санитарно-просветительная работа.
Общая характеристика класса Жгутиковые. Трихомонады. Систематическое положение, морфология, цикл развития, обоснование лабораторной диагностики, пути заражения, профилактика.
Flagellata
представители характеризуются присутствием жгутиков в течение всего вегетативного периода их жизни.— Большинство Ж. имеет удлиненное тело, обычно заостренное с одной стороны. По большей части они имеют постоянную форму; лишь немногие метаболичны, т. е. способны к незначительному изменению формы тела. Некоторые имеют ундулирующую мембрану – своеобразную органеллу передвижения.
Паразиты – Трипаносомы, Лейшмании, Лямблии, Трихомонады
Тип Protozoa — простейшие
Класс Flagellata -Жгутиковые
Отряд Polymastigina многожгутиковые
Род Trichomonas — Трихомонада
Вид Trichomonas Hominis – кишечная трихомонада
Вид Trichomonas Vaginalis – влагалищная трихомонада
НЕ ОБРАЗУЮТ ЦИСТ!
3. Лейшмании (Leishmaniae) . Общая биология: конспект лекций
Лейшмании (Leishmania) – это простейшие класса жгутиковые. Являются возбудителями лейшманиозов – трансмиссивных заболеваний с природной очаговостью.
Заболевания у человека вызывают несколько видов этого паразита: L. tropica – возбудитель кожного лейшманиоза, L. do-novani – возбудитель висцерального лейшманиоза, L. brasilien-sis – возбудитель бразильского лейшманиоза, L. mexicana – возбудитель центрально Американской формы заболевания. Все они имеют морфологическое сходство и одинаковые циклы развития.
Существуют в двух формах: жгутиковой (лептомонадной, иначе промастигота) и безжгутиковой (лейшманиальной, иначе амастигота).
Лейшманиальная форма очень мелкая (3–5 мкм), округлая. Жгутика не имеет. Обитает в клетках ретикулоэндотелиальной системы человека и некоторых животных (грызунов, собак). Жгутиковая форма удлинена (до 25 мкм), на переднем конце имеет жгутик. Находится в пищеварительном тракте переносчиков (мелких москитов рода Phlebotomus). Эти формы могут также образовываться в искусственных культурах. Природный резервуар – грызуны, дикие и домашние хищники.
Лейшмании широко распространены в странах с тропическим и субтропическим климатом, на всех континентах, где есть москиты.
При кожном лейшманиозе очаги поражения находятся в коже. Это наиболее распространенная форма. Заболевание протекает относительно благоприятно. Вызывается L. tropica, L. mexicana и некоторыми биоварами L. brasiliensis. После укуса москита на открытых частях тела образуются округлые, долго незаживающие язвы. После заживления остаются рубцы. Иммунитет пожизненный. Некоторые формы L. brasiliensis могут мигрировать по лимфатическим сосудам, вызывая образование язв далеко от места укуса.
Слизисто-кожная форма вызывается подвидом L. brasiliensis brasiliensis. Лейшмании проникают из кожи по кровеносным сосудам в слизистую носоглотки, гортани, мягкого неба, половых органов, вызывают деструктивные изменения в слизистых.
Диагностика
Берут отделяемое из кожной или слизистой язвы и готовят мазки для последующей микроскопии.
Висцеральная форма заболевания вызывается L. donovani. Инкубационный период длительный, болезнь начинается через несколько месяцев или лет после заражения. Болеют чаще дети до 12 лет. Заболевание протекает как системная инфекция. Паразиты размножаются в тканевых макрофагах и моноцитах крови. Очень велика интоксикация. Нарушена функция печени, кроветворения. При отсутствии лечения болезнь заканчивается летально.
Диагностика
Получают пунктат красного костного мозга (при пункции грудины) или лимфатических узлов с последующим приготовлением мазка или отпечатка для микроскопии. В окрашенных препаратах находят лейшманиальную форму паразита как вне-, так и внутриклеточной локализации.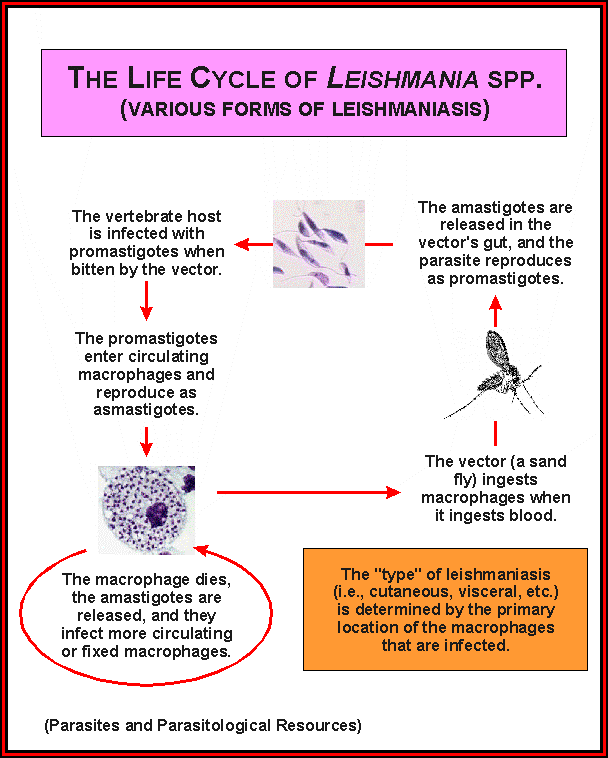 В сомнительных случаях производят посев материала на питательные среды, где лейшманиальная форма превращается в жгутиковую, активно движется и обнаруживается при обычном микроскопировании. Используются биологические пробы (например, заражение лабораторных животных).
В сомнительных случаях производят посев материала на питательные среды, где лейшманиальная форма превращается в жгутиковую, активно движется и обнаруживается при обычном микроскопировании. Используются биологические пробы (например, заражение лабораторных животных).
Профилактика
Борьба с переносчиками (москитами), уничтожение природных резервуаров, профилактические прививки.
3. Жгутиконосцы — возбудители заболеваний человека
К животным жгутиконосцам относят многих возбудителей заболеваний человека.
Трипаносома — возбудитель сонной болезни, паразитирует в крови человека.
Рис. \(1\). Трипаносома
На переднем конце клетки начинается жгутик, который продолжается вдоль всей клетки, соединяясь с ней тонкой волнообразной перепонкой.
Переносчик трипаносом — муха цеце.
 Заболевание распространено в Африке. При укусе больного человека в кишечник мухи попадают трипаносомы и начинают там размножаться. После этого они попадают в слюнные железы насекомого. Если такое насекомое кусает здорового человека, то трипаносомы попадают в его кровеносную систему и вызывают сонную болезнь. Сонная болезнь характеризуется нервными и психическими расстройствами, сонливостью и истощением организма. Это приводит к смерти человека.
Заболевание распространено в Африке. При укусе больного человека в кишечник мухи попадают трипаносомы и начинают там размножаться. После этого они попадают в слюнные железы насекомого. Если такое насекомое кусает здорового человека, то трипаносомы попадают в его кровеносную систему и вызывают сонную болезнь. Сонная болезнь характеризуется нервными и психическими расстройствами, сонливостью и истощением организма. Это приводит к смерти человека.
Рис. \(2\). Жизненный цикл трипаносом
Лейшмании — жгутиковые простейшие, паразиты человека, вызывающие заболевание — лейшманиоз.
Рис. \(3\). Лейшмании
Заболевание распространяется москитами.
При укусе больного человека в пищеварительную систему самки москита попадают лейшмании, которые начинают там размножаться. После этого они попадают в слюнные железы москита. При укусе здорового человека лейшмании попадают в его рану. Заболевание проявляется возникновением язв на коже, иногда поражением внутренних органов.
Рис. \(4\). Жизненный цикл лейшманий
В теле москита лейшмании имеют длинный жгутик, веретеноподобную форму.
А в теле человека у них короткий жгутик, круглая форма, они неподвижны.
Лямблии — жгутиковые простейшие, паразитирующие в кишечнике человека.
Рис. \(5\). Строение лямблии
Лямблии попадают в организм человека с употреблением заражённой воды и пищи. В кишечнике человека питаются переваренной пищей. В окружающую среду попадают с фекалиями. Находясь в теле человека, лямблии вырабатывают токсины, которые нарушают работу внутренних органов.
Трихомонады — жгутиковые простейшие, паразитирующие в кишечнике человека. Вызывают кишечный трихомониаз. Питаются трихомонады бактериями, живущими в кишечнике человека, и вызывают диарею. Заражение происходит путём употребления заражённых трихомонадами пищи и воды.
Рис. \(6\). Трихомонады
Источники:
Рис. 2. Жизненный цикл трипаносом © ЯКласс
2. Жизненный цикл трипаносом © ЯКласс
Рис. 4. Жизненный цикл лейшманий © ЯКласс
от описаний учебников к биологическому пониманию
Open Biol. 2017 сен; 7 (9): 170165.
Джек Сантер
1 Департамент биологических и медицинских наук, Университет Оксфорд Брукс, кампус Хедингтон, Оксфорд, OX3 0BP, Великобритания
Кит Гулл
2 Школа патологии сэра Уильяма Данна , Оксфордский университет, Oxford OX1 3RE, UK
1 Департамент биологических и медицинских наук, Oxford Brookes University, Headington Campus, Oxford OX3 0BP, UK
2 Школа патологии сэра Уильяма Данна, Оксфордский университет, Oxford OX1 3RE, UK
Поступило 5 июля 2017 г .; Принята в печать 4 августа 2017 г.
Опубликовано Королевским обществом в соответствии с условиями лицензии Creative Commons Attribution License http://creativecommons.org/licenses/by/4.0/, которая разрешает неограниченное использование при условии указания автора и источника ссылки на эту статью. другие статьи в PMC.
другие статьи в PMC.Abstract
Форма и форма простейших паразитов неразрывно связаны с их патогенностью. Эволюционное давление, связанное с установлением и поддержанием инфекции и передачей переносчику или хозяину, сформировало морфологию паразита.Однако не существует «единого для всех» морфологического решения этих различных факторов давления, и паразиты демонстрируют ряд различных морфологий, отражающих разнообразие их сложных жизненных циклов. В этом обзоре мы сосредоточимся на форме и форме Leishmania spp., Группы очень успешных простейших паразитов, вызывающих ряд заболеваний, от самовосстанавливающегося кожного лейшманиоза до висцерального лейшманиоза, который при отсутствии лечения приводит к летальному исходу.
Ключевые слова: морфология , Leishmania , патогенность, паразит
1.Форма и форма
Leishmania Подобно многим простейшим паразитам, Leishmania имеют дигенетический жизненный цикл с участием как млекопитающего-хозяина, так и насекомого-переносчика.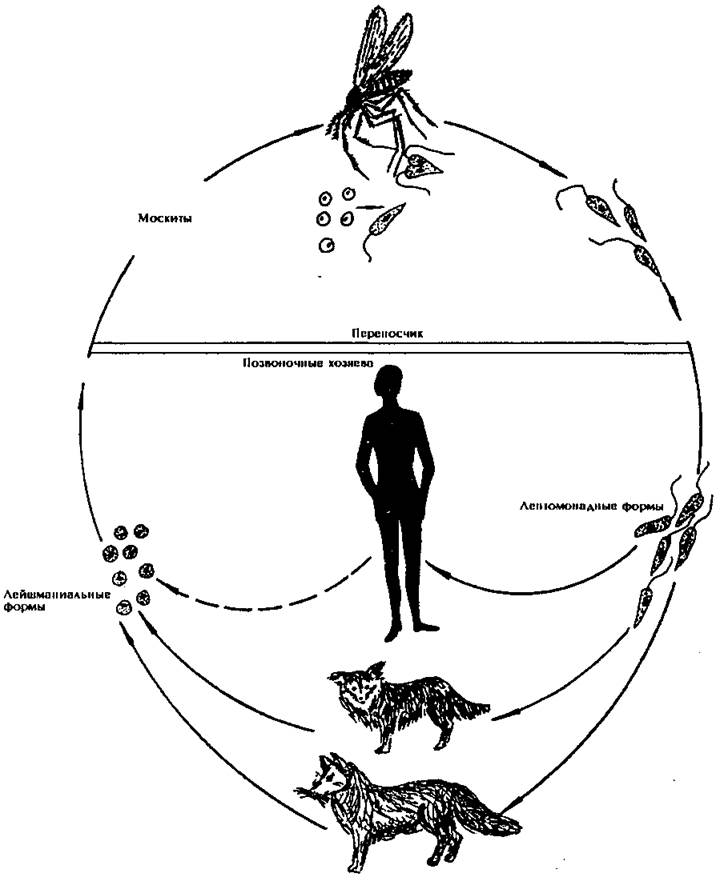 Leishmania паразиты демонстрируют множество различных морфологий клеток и ряд типов клеток (форм развития), которые адаптированы либо к хозяину, либо к вектору. Как видно на примере других паразитов, таких как Plasmodium и трипаносомы, некоторые из этих форм развития являются пролиферативными, тогда как другие находятся в состоянии покоя и предварительно адаптированы для передачи следующему хозяину [1–4].Большая часть интерпретации клеточной формы и функции у видов Leishmania происходит из более изученной базовой клеточной биологии трипаносом. Хотя это естественная передача знаний, необходимо сохранять бдительность в отношении того факта, что между двумя системами патогенов могут существовать нераспознанные различия даже в их базовой биологии.
Leishmania паразиты демонстрируют множество различных морфологий клеток и ряд типов клеток (форм развития), которые адаптированы либо к хозяину, либо к вектору. Как видно на примере других паразитов, таких как Plasmodium и трипаносомы, некоторые из этих форм развития являются пролиферативными, тогда как другие находятся в состоянии покоя и предварительно адаптированы для передачи следующему хозяину [1–4].Большая часть интерпретации клеточной формы и функции у видов Leishmania происходит из более изученной базовой клеточной биологии трипаносом. Хотя это естественная передача знаний, необходимо сохранять бдительность в отношении того факта, что между двумя системами патогенов могут существовать нераспознанные различия даже в их базовой биологии.
Leishmania имеет две основные различные морфологии клеток, примером которых является морфология промастигот у песчаных мух и морфология амастигот у млекопитающего-хозяина ( a ).Однако основная клеточная архитектура сохраняется между двумя формами клеток Leishmania и определяется поперечносшитыми микротрубочками субпелликулярного корсета. Этот массив сохраняется на протяжении всего клеточного цикла, поэтому деление клеток зависит от вставки и удлинения микротрубочек в существующий массив. Внутри клетки находятся ядро и набор однокопийных органелл, таких как митохондрия и аппарат Гольджи. Перед ядром находится кинетопласт, масса конкатенированной митохондриальной ДНК, которая непосредственно связана с базальным телом, от которого отходит жгутик [5–8].В основании жгутика находится впячивание клеточной мембраны, образующее вазоподобную структуру, называемую жгутиковым карманом, которая важна для этих паразитов, так как это единственное место эндоцитоза и экзоцитоза и, следовательно, является критически важным интерфейсом между паразитом и среда его хозяина [9].
Схема морфологии промастигот и амастигот и жизненного цикла Leishmania с выделенными различными типами клеток. ( a ) Морфология промастигот и амастигот выровнена вдоль задней передней оси с ключевыми структурами в указанных клетках.( b ) Рисунок современного понимания жизненного цикла Leishmania с выделенными критическими событиями и различными типами клеток. Песчаная муха принимает пищу из крови инфицированного млекопитающего-хозяина и проглатывает макрофаг, содержащий лейшманий и амастигот. Попав в среднюю кишку песчаной мухи, амастиготы дифференцируются в проциклические промастиготы. Затем проциклические промастиготы становятся промастиготами нектомонад, которые покидают перитрофический матрикс и затем прикрепляются к микроворсинкам в средней кишке, прежде чем перейти в грудную среднюю кишку и стомодальный клапан, где они дифференцируются в промастиготы лептомонад.Здесь промастиготы лептомонад дифференцируются либо на промастиготы гаптомонад, которые прикрепляются к стомодеальному клапану, либо на метациклические промастиготы, которые представляют собой инфекционную форму млекопитающих, которые передаются, когда песчанка в следующий раз принимает пищу с кровью. Стадии пролиферации обозначены круговой стрелкой.
По сути, клетка Leishmania сконструирована из ряда модульных единиц, таких как жгутик, единица базального тельца – митохондриального кинетопласта и единица Гольджи – шейка кармана жгутика [8].Эти модульные единицы затем позиционируются относительно друг друга, чтобы вызвать различные наблюдаемые морфологии клеток [10,11]. Ключом к определению динамической формы и формы этого паразита, следовательно, является понимание морфогенеза этих различных индивидуальных модульных единиц и их положения относительно друг друга.
Клеточная морфология паразитов Leishmania очень точно определяется формой клетки, длиной жгутика, положением кинетопласта / ядра и ультраструктурными особенностями, и поэтому традиционно используется для определения наблюдаемых форм клеток.Однако в некоторых случаях эти морфологические описания клеточных форм вошли в литературу как определяющие конкретные типы клеток в жизненном цикле. Однако в настоящее время существует несколько молекулярных маркеров, помогающих более точно определять формы жизненного цикла, и поэтому существует потребность в осторожности и осторожности при определении типов клеток исключительно на основе морфологии клеток.
2. Определение разнообразия: разные виды, разные заболевания, разные клетки в переносчике и хозяине
Различные виды Leishmania паразиты вызывают болезни у людей, при этом разные виды часто группируются вместе в зависимости от того, возникли ли они в старом мире или новый мир () [12] и от характера патологии (кожный, кожно-слизистый или висцеральный лейшманиоз) [12,13].Важно помнить, что это болезнь не только человека, и что Leishmania заразит других млекопитающих, создавая зоонозный резервуар, который имеет серьезные последствия для борьбы с болезнями [14]. Переносчик песчаной мухи добавляет еще один уровень сложности: существует множество видов, способных переносить паразит Leishmania ; однако часто существуют особые отношения, при которых некоторые виды песчаных мух способны передавать только один или ограниченное количество из видов Leishmania () [15].
Таблица 1.
Переносчик, болезнь и происхождение ряда различных видов Leishmania . По материалам Бейтса [12].
| вид | переносчик песчаной мухи | болезнь | старый или новый мир | ||||||
|---|---|---|---|---|---|---|---|---|---|
| L. major | Phlebotomus duboscqi 1 Phlebotomus papat кожный | старый мир | |||||||
| L.mexicana | Lutzomyia olmeca olmeca | кожный | новый мир | ||||||
| L. braziliensis | Lutzomyia wellcomei Lutzomyia olmeca 9011 9011 9011 Lutzomyia complexus 6 901 901 L. donovani | Phlebotomus argentipes | Phlebotomus orientalis Phlebotomus martini висцеральный | старый мир | L.infantum | Phlebotomus ariasi | Phlebotomus perniciosus Lutzomyia longipalpis висцеральный | новый и старый мир | |
Несмотря на все эти морфологические уровни сложности и сложность Leman демонстрирует замечательную сохранность формы в процессе своего жизненного цикла. Клетки с морфологией амастигот или промастигот выглядят кардинально по-разному, но они сохраняют ту же базовую клеточную структуру с кинетопластом впереди ядра и жгутиком, отходящим от базального тела ( a ) [5,6].Морфология амастиготы представлена более мелким и более сферическим телом клетки с коротким неподвижным жгутиком, который едва выходит из жгутикового кармана и потенциально больше ориентирован на сенсорные функции [16,17]. Напротив, морфология промастигот определяется удлиненным яйцевидным клеточным телом с длинным подвижным жгутиком, выходящим из жгутикового кармана, который обеспечивает движущую силу, вероятно, ответственную за облегчение прохождения через пищеварительный тракт песчаных мух [18].
3.Переход от промастиготы к амастиготе
Когда песчанка, инфицированная Leishmania , принимает кровяную муку, метациклические промастиготы откладываются в месте укуса ( b ). Повреждение, вызванное песчаной мухой, приводит к рекрутированию макрофагов в место укуса, и это клетки, которые Leishmania заражает и которые остаются в организме хозяина, позволяя им сохраняться в организме хозяина [19–21]; однако существует минимальное количество доказательств, показывающих, где происходит взаимодействие между Leishmania и макрофагами в организме хозяина.Метациклические промастиготы — очень подвижные клетки, и Leishmania способны мигрировать через коллагеновый матрикс [22]. Следовательно, возможно, что фагоцитоз Leishmania может происходить в местах, удаленных от места укуса. Более того, возможно, спектр заболеваний, вызываемых Leishmania от кожного до висцерального, отражается в способности паразита вторгаться в хозяина за пределами места укуса либо напрямую, либо через движение инфицированных макрофагов.
В литературе есть противоречивые сообщения о полярности взаимодействия и поглощения между Leishmania и макрофагом, причем некоторые предполагают, что это происходит сначала через жгутик, а другие показывают, что это происходит преимущественно через тело клетки или с обоих концов [ 23–25].Учитывая движение жгутика вперед, проявляемое этими метациклическими промастиготами, кончик жгутика, вероятно, будет первой частью клетки, которая взаимодействует с макрофагом. У близкородственного паразита Trypanosoma brucei кончик жгутика имеет ряд белков, включая рецепторы, которые локализуются исключительно в этой области [26,27]. Следовательно, существует вероятность того, что дифференцированный мембранный домен на кончике жгутика будет подготовлен к столкновению с макрофагом, что будет инициировать серию сигнальных событий, ведущих к успешному захвату и дифференцировке паразита.Однако в какой бы ориентации ни был охвачен Leishmania , паразит в конечном итоге будет указывать жгутиком на периферию макрофага [24,25]. Продолжающееся движение жгутика внутри макрофага приводит к повреждению плазматической мембраны и нарушению целостности, что способствует лизосомному экзоцитозу, потенциально изменяя состав паразитофорной вакуоли, тем самым увеличивая шансы паразита успешно заразить макрофаг [25].
Оказавшись внутри макрофага, промастигот дифференцируется от подвижной формы промастигота, которая имеет длинный жгутик и удлиненную форму клеток, до формы амастиготы, которая имеет короткий жгутик с небольшим выпуклым кончиком, выходящим за пределы теперь более сферического тела клетки. .Это резкое изменение формы клеток и приводит к минимальному соотношению поверхности клетки к объему, следовательно, к уменьшению площади, на которой клетка подвергается воздействию суровых условий паразитофорной вакуоли, а также к вероятному изменению формата использования жгутика [28–30]. ].
Наиболее яркое различие между формами амастигот и промастигот — изменение жгутика с длинного подвижного жгутика с аксонемой 9 + 2 на короткий неподвижный жгутик с расположением аксонем 9 + 0 (9v) [17].Wheeler et al. [17] подробно изучили этот специфический аспект процесса дифференцировки и показали, что это изменение в структуре жгутика включает в себя либо (i) разборку существующего длинного жгутика и удаление его центральной пары, а следовательно, его сжатие до короткого 9v аксонема, или (ii) сборка короткого нового жгутика, лишенного центральной пары и демонстрирующего аксонему 9v. Последний механизм интересен тем, что пробазальное тельце, которое собрало аксонему 9v, собрало бы аксонему 9 + 2, если бы эта клетка оставалась в культуре промастигот, показывая способность пробазального тельца переключаться между конструкциями любого типа. аксонема.
Учитывая, что есть примеры организмов, которые способны полностью терять и преобразовывать свой жгутик в течение своего жизненного цикла, продолжающееся присутствие жгутика у амастигот предполагает, что он выполняет важную функцию для паразита в макрофаге [30–32] . Наиболее часто постулируемая функция этого жгутика — сенсорная роль, потому что аксонемная архитектура 9v структурно подобна той, которая обнаруживается в первичных ресничках млекопитающих, а кончик жгутика амастиготы Leishmania часто находится в тесном контакте с мембраной паразитофорной вакуоли. [16,33].Паразит Leishmania через свой жгутик потенциально может определять «здоровье» своего макрофага-хозяина, оценивая ключевые метаболиты, такие как, например, аденозиновые нуклеотиды. Если макрофаг «здоров», паразит может делиться, но если макрофаг «нездоров», паразит может решить не делиться, поскольку макрофаг может вот-вот умереть и лизироваться, тем самым высвобождая паразита в новую среду. Поэтому, вероятно, существуют определенные контрольные точки, которые будут применяться в клеточном цикле Leishmania на границах от G1 до G0 / S.Более того, высвобождение паразита вряд ли будет «пассивным» процессом, а скорее будет осуществляться самим паразитом. Это область интереса и важности, в которой специфическая клеточная биология возможного высвобождения паразита, связанного с клеточным циклом, не была изучена.
Помимо резкого изменения структуры жгутика во время дифференцировки в форму амастиготы, также наблюдается большая реструктуризация кармана жгутика и области шеи, связанная с изменениями локализации белков зоны прикрепления жгутика [7].Неожиданным следствием этой перестройки является закрытие шейки жгутикового кармана так, что нет наблюдаемого промежутка между жгутиком и мембраной шейки жгутикового кармана [7]. Догма для жгутикового кармана у этого и родственных ему паразитов состоит в том, что это единственный участок экзоцитоза и эндоцитоза в клетке и, следовательно, главный интерфейс между паразитом и его хозяевами. Однако, если карман для жгутика закрыт на шее, как это повлияет на этот важный интерфейс? Является ли это закрытие динамичным и больше похоже на операцию клапана? Снижает ли ограниченный доступ к карману жгутика способность паразита поглощать макромолекулы из окружающей среды? Скорость роста аксенических амастигот, измеренная с помощью мечения тяжелой водой, была намного медленнее, чем у промастигот [34], и, кроме того, амастиготы имеют гораздо меньший объем клеток, чем промастиготы, что приводит к одновременной меньшей метаболической нагрузке.Взятые вместе, низкая скорость роста и меньшая метаболическая нагрузка могут отражать сниженную скорость поглощения макромолекул клеткой. Однако медленный рост может быть результатом эволюционного давления, направленного на то, чтобы не подавлять иммунную систему хозяина, тем самым позволяя хозяину выжить дольше, а паразиту — дольше размножаться и, таким образом, увеличивая вероятность передачи паразита песчаной мухе.
Закрывание шейки жгутикового кармана также вероятно является следствием защиты потенциально уязвимого домена клетки от окружающей среды внутри паразитофорной вакуоли, которая является кислой и полной протеаз [28,29].Уменьшение доступа к карману жгутика из-за уменьшения пространства между шейкой и мембранами жгутика в амастиготах является вероятным объяснением того, что литические липопротеины высокой плотности, содержащие трипанолитический фактор, не могут лизировать амастиготы в кислой паразитофорной вакуоли, но могут чтобы убить метациклические промастиготы, у которых есть более доступный карман жгутика [35]. Будет интересно сравнить морфологию жгутикового кармана амастиготы Leishmania с морфологией внутриклеточной амастиготы близкородственного организма Trypanosoma cruzi , поскольку этот паразит убегает из паразитофорной вакуоли и размножается в совершенно ином окружении — цитоплазме. клетки-хозяина [36].
Существует два различных типа паразитофорных вакуолей, которые развиваются в инфицированных макрофагах, которые коррелируют с видами Leishmania . Заражение некоторыми видами, такими как L. amazonensis , приводит к образованию больших многокомпонентных паразитофорных вакуолей (вакуоли типа II), которые содержат несколько амастигот, тогда как другие виды, такие как Leishmania major , образуют маленькие, плотно прилегающие, одноразовые паразитофорные вакуоли ( вакуоли типа I), которые окружают одиночного паразита амастиготу [37,38].Сопутствующие инфекции с L. amazonensis и L. major в одном макрофаге показали, что слияние двух типов паразитофорных вакуолей, больших, содержащих амастигот L. amazonensis , или малых, содержащих амастиготу L. major , составляет L. не произошло. Это говорит о том, что паразитофорная вакуоль модифицируется в соответствии с конкретными потребностями каждого вида, что препятствует успешному слиянию разных типов паразитофорных вакуолей [37].
Интересно, что несмотря на различия, наблюдаемые в типах паразитофорных вакуолей, клеточная организация и расположение амастигот разных видов хорошо сохраняются [39].Однако есть некоторые наблюдаемые различия между амастиготами разных видов: амастигот L. mexicana примерно на 50% больше по среднему диаметру, чем амастиготы L. braziliensis и L. donovani [40]. Эта разница в размерах может иметь последствия для патологии, вызванной различными видами Leishmania , но нет простой связи между этими или другими признаками и типом патологии. Действительно, в качестве другого примера можно привести ультраструктурные исследования амастигот L.tropica и L. donovani выявили отчетливую заднюю инвагинацию, названную «чашечкой» или «задней инвагинацией» [41,42]. Авторы предположили, что это может быть альтернативный сайт экзо / эндоцитоза в этих клетках. Насколько нам известно, эта структура не была обнаружена ни у одного другого вида амастигот Leishmania . Поскольку L. tropica вызывает кожный лейшманиоз, а L. donovani вызывает висцеральный лейшманиоз, эта морфологическая адаптация опять же не связана с патологией заболевания.Таким образом, в целом, хотя различия между промастиготами и амастиготами, вероятно, очень важны для взаимоотношений хозяин / переносчик, общее сходство в морфологии амастигот между разными видами предполагает, что не существует простой связи между морфологией и патологией заболевания. Вместо этого либо более тонкие особенности, либо обладание и экспрессия различных потенциальных факторов вирулентности, продуцируемых разными видами, таких как белок A2, могут иметь большее значение для спектра заболеваний [43,44].
Распределенная популяция макрофагов, инфицированных Leishmania , недавно наблюдалась Doehl et al. [45]. Эта распределенная циркулирующая популяция инфицированных макрофагов поможет обеспечить эффективную передачу паразитов Leishmania от хозяина к песчаной мухе, поскольку селезеночная инфекция недоступна для москитов, а москиты вряд ли будут кусать исключительно на месте фактического поражения. локализованная кожная инфекция. Более того, эти инфицированные макрофаги могут содержать потенциально другую форму амастиготы Leishmania , которая предназначена для выживания в средней кишке песчаной мухи, когда попадает в нее с кровяной мукой, что отражает трансмиссивность метациклических клеток промастиготного типа у песчаных мух или коренастых мух. форма африканских трипаносом [12,30,46].
4. Переход от амастиготы к промастиготе
После проглатывания песчаной мухой и высвобождения из макрофага амастигота начинает дифференцироваться в подвижную форму промастиготы. Точные признаки дифференциации еще не установлены, но, вероятно, это комбинация изменения температуры и pH, схожая с другими паразитами, и, как видно на примере Leishmania , поскольку он отличается от промастиготы до амастиготы в паразитофорной вакуоли [47]. ]. Однако может также требоваться наличие определенного химического триггера, чтобы гарантировать, что дифференциация происходит только в векторе, а не в хозяине; например, для дифференциации Plasmodium требуется ксантуреновая кислота, предшественник пигмента москитного глаза [48].Сама по себе температура вряд ли может быть единственным триггером для дифференциации, поскольку макрофаг будет испытывать различные температуры при циркуляции по телу, но он может действовать, повышая чувствительность амастиготы к другим сигналам дифференциации, как это было обнаружено с T. brucei [ 49].
Дифференциация in vitro из амастигот L. amazonensis в промастиготы детально изучена с помощью микроскопии [50]. Первым видимым шагом в этом процессе является удлинение подвижного жгутика, которое происходит до деления клетки, а после этого первого деления клетки обе дочерние клетки имеют подвижный жгутик [50].Таким образом, при созревании пробазальное тельце в родительской клетке было способно собрать 9 + 2 подвижную аксонему, однако, если бы эта же клетка осталась в макрофаге, то же пробазальное тельце собрало бы аксонему 9v, что снова демонстрирует мультипотентность пробазального тела у Leishmania [17]. Эти результаты дополняют результаты Wheeler et al. [17] и показывают, что пробазальные тельца способны собирать либо 9 + 2, либо 9v аксонемы независимо от того, какой тип аксонемы продуцировало материнское базальное тельце [17,50].
Во время дифференцировки в форму промастигота форма клетки также начинает изменяться от сферической амастиготы до более вытянутой овоидной формы. Вместе с изменениями, которые происходят с общей формой тела клетки, изменяется организация зоны прикрепления жгутика и жгутикового кармана. В частности, шейная область жгутикового кармана становится более открытой, отражая обращение процесса, происходящего во время дифференцировки в форму амастиготы [7]. Это открытие шеи может облегчить доступ к карману жгутика, позволяя поглощать крупные макромолекулы, а также потенциально влияя на подвижность паразита.
5. Роль жгутика
Leishmania в песчаной мухеЖгутик играет несколько потенциальных ролей, позволяя паразитам Leishmania успешно устанавливать и поддерживать инфекцию у песчаной мухи. У жгутика песчаной мухи есть три потенциальные ключевые функции, которые мы обсудим в следующих разделах:
(i) подвижность, чтобы покинуть перитрофический матрикс и мигрировать в переднюю кишку,
(ii) прикрепление к микроворсочкам средней кишки и стомодальному клапану и
(iii) потенциальные сенсорные функции.
5.1. Подвижность
Проглатывание кровяной муки песчаной мухой вызывает многочисленные изменения у песчаной мухи, включая создание перитрофического матрикса из хитина и гликопротеинов, который покрывает кровяную муку, отделяя ее от эпителия средней кишки. Примерно через 4 дня оставшаяся непереваренная кровяная мука и окружающий перитрофический матрикс испражняются песчаной мухой [51,52]. Следовательно, промастиготы Leishmania должны покинуть перитрофический матрикс до того, как произойдет дефекация.Более того, для успешной передачи млекопитающему-хозяину паразиты Leishmania должны колонизировать область стомодального клапана песчаной мухи и таким образом мигрировать из средней кишки в ротовой аппарат; активная подвижность жгутиков предположительно способствует обоим этим процессам.
5.2. Приложение
Потеря целостности перитрофического матрикса позволяет паразитам Leishmania покинуть эндотрофическое пространство [53]; эти клетки затем прикрепляются к эпителию средней кишки, вставляя свои жгутики между микроворсинками, что помогает предотвратить изгнание паразитов из песчаной мухи во время дефекации.Это прикрепление не сопровождается какими-либо наблюдаемыми морфологическими изменениями в клетке Leishmania [54]. Данные свидетельствуют о том, что прикрепление опосредуется посредством специфических взаимодействий гликопротеин-лектин, обеспечивая потенциальный механизм, с помощью которого определяется специфичность вектор-паразит. Компонент поверхностного покрытия липофосфогликан (LPG) считался решающим для этого взаимодействия, поскольку клетки L. major , дефицитные в синтезе LPG, не могли прикрепиться к москитам Phlebotomus papatasi и P.duboscqi [55,56]. Однако недавняя работа показала, что этот мутант L. major способен успешно инфицировать другие виды песчаных мух, такие как P. arabicus , P. argentipes , P. perniciosus и Lutzomyia longipalpis , и более того. мутант L. mexicana , неспособный синтезировать LPG, также способен полностью развиваться в пределах Lutzomyia longipalpis [56–58]. Очевидно, что LPG важен для взаимодействия между примерно видами Leishmania и видами песчаных мух, но он не является универсальным детерминантом этих взаимодействий.
Второе место прикрепления Leishmania у песчаной мухи находится в стомодеальном клапане, где наблюдается особый тип клеток, называемый гаптомонадой, прикрепленный к кутикуле клапана гемидесмосомными структурами, которые обнаруживаются на увеличенном кончике ствола. относительно короткий жгутик [54]. Эти гемидесмосомные структуры напоминают те, которые наблюдаются для прикрепленных эпимастиготных форм трипаносом, и вполне вероятно, что прикрепление к насекомому-переносчику через такие структуры будет универсальной особенностью кинетопластид [59,60].В настоящее время биохимическая идентичность этих структур остается загадочной, но, учитывая их важность для многих видов кинетопластид, открытие молекулярных компонентов будет представлять большой интерес [60]. Сильное прикрепление предположительно останавливает передачу типа клеток Leishmania haptomonad млекопитающим-хозяину, когда песочные мухи питаются, и, следовательно, может играть роль в поддержании долгосрочной инфекции у песчаных мух и / или асимметричных делениях [61].
5.3. Сенсорная
После выхода из перитрофического матрикса паразиты затем мигрируют вперед через песчаных мух и колонизируют среднюю кишку грудной клетки.Успешная колонизация и передача Leishmania зависят от того, что песчанка принимает сахарную муку после еды с кровью, и это заманчивая гипотеза, что Leishmania способны перемещаться по градиенту сахара вдоль кишечника, чтобы обеспечить колонизацию песка. муха передней кишки. Молекулярные компоненты, необходимые для хемотаксиса, присутствуют в Leishmania с углеводными рецепторами, обнаруженными на поверхности клетки, и жгутиком, способным выполнять различные структуры биений, которые позволяют клетке двигаться вперед и переориентировать себя.Более того, эксперименты in vitro и показали, что Leishmania способны реагировать на изменение концентрации сахара [62–64].
описывает публикации, в которых морфология и / или подвижность были изменены путем мутационного анализа у видов Leishmania [18,65–78]. Ясно, что некоторые морфологические мутанты будут иметь катастрофические эффекты на деление клеток и как таковые не очень полезны для оценки связи с патогенностью и развитием. Сравнение с работой т.brucei показывает, что тонкие нокдауны RNAi (доступные сейчас как технология в L. braziliensis ) могут обеспечивать драматические изменения в архитектуре клетки [11,79,80]. Один из уроков из этого состоит в том, что тонкие различия в экспрессии, а не отсутствие или присутствие в геномах могут влиять на вирулентность или патологию. Текущие улучшения как обратной, так и прямой генетики в Leishmania будут очень полезны в этой области [81–84]. Выше мы обрисовали в общих чертах три функции жгутика Leishmania у песчаной мухи, но каковы фактические доказательства того, что жгутик необходим у песчаных мух? Исходя из этого, мы можем видеть, что существует много мутантов, у которых функция / длина жгутика Leishmania была нарушена, например, из-за сверхэкспрессии KIN13-2 или потери PFR2, но очень мало исследований инфицировали москитов этими насекомыми. мутанты [18,65,72].
Таблица 2.
Сводка морфологических и / или подвижных мутантов у Leishmania .
| белок | ген ID | фенотип | сохраняется у видов Leishmania на TriTrypDBv33 | развитие у москитов | патогенность в макрофагах | патогенность в макрофагах | LmjF.16.1425 / 1427/1430 | Нокаут-клетки PFR-2 имели измененное биение жгутика с пониженной скоростью плавания | да | не выполнено | не выполнено | не выполнено | [65] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PFR | LmjF.29.1750 / 1760/1770 | и клетки с нокаутом PFR1, и клетки с двойным нокаутом PFR1 / 2 имели измененный ритм жгутика с пониженной скоростью плавания | да | не выполнено | не выполнено | не выполнено | [66] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ARL-3A | LdBPK_2.1 | Клетки, избыточно экспрессирующие конститутивно «активную» форму ARL-3A, были неподвижны с короткими жгутиками, а длина жгутика была обратно пропорциональна экспрессии мутантного белка | да | неспособны развиваться в песке мухи | нет изменений в инфективности макрофагов | не выполнено | [18,67] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MKK | LmxM.08_29.2320 | MKK-нокаутные клетки имели подвижные жгутики, которые были значительно короче и не имели парафлагеллярного стержня, а также имели более короткие тела клеток | да | не выполнено | не выполнено | не выполнено | [68] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MPK9 | LmxM.19.0180 | Нокаутные клетки MPK9 имели более длинные жгутики, тогда как сверхэкспрессия привела к субпопуляции с короткими / отсутствующими жгутиками | да | не выполнено | не выполнено | не выполнено | 9010 9010DHC2.2 | LmxM.27.1750 | Нокаутные клетки DHC2.2 были неподвижны и имели округлое тело клетки. Жгутик не выходил за пределы тела клетки и не имел парафлагеллярного стержня и других аксонемных структур | да | не выполнено | не выполнено | не выполнено | [70] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MPK3 | LmxM.10113 | Клетки с нокаутом MPK3 имели более короткие жгутики с короткими клеточными теламида | не выполнено | не выполнено | не выполнено | [71] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| KIN13-2 | LmjF.13.0130 | Нокаут-клетки KIN13-2 имели более длинные жгутики, тогда как сверхэкспрессия приводила к более коротким жгутикам | да | не выполнено | не выполнено | не выполнено | [72] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ADF / cofilin | Клетки с нокаутом ADF / кофилин (актин-деполимеризующий фактор) были неподвижны с более короткими жгутиками и нарушенным паттерном биений. Ячейки также были короче и шире | да | не выполнено | не выполнено | не выполнено | [73] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| катанин | LmjF13.0960 | клетки, сверхэкспрессирующие катанин-подобный гомолог, имели более короткие жгутики | да | не выполнено | не выполнено | не выполнено | [74] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMP1 | уменьшение SMP1 по длине жгутика и дефектам подвижности | да | не выполнено | не выполнено | не выполнено | [75] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DC2 | LdBPK_323050.1 | DC2 нокаут-клетки с более короткой ультратонкой структурой жгутиков снижение моторики.Более того, тела клеток были короче и округлее. | да | не выполнено | небольшое увеличение инфективности макрофагов | не выполнено | [76] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ингибитор серинпептидазы 1 (ISP1) | LmjF.15.0300 | ISP1 / 2 нокаут клеток имели более длинные жгутики и были менее подвижны, чем клетки с двойным нокаутом ISP2 / 3. Более того, тройной нокаут имел большее количество клеток с морфологией гаптомонад, нектомонад и лептомонад.Также было изменение формы переднего конца этих клеток. L. amazonesis приводил к клеткам, которые были неспособны собрать жгутик полной длины и имели нарушенную подвижность [67]. Когда эти клетки использовались для заражения москитов, эти мутанты не могли заразить инфекцию, вероятно, из-за их дефектной подвижности [18].Более того, длина жгутика также может играть роль: более короткий жгутик будет менее эффективным при интеркалировании между микроворсинками в средней кишке, обеспечивая меньшую площадь поверхности для взаимодействия, уменьшая силу связывания и увеличивая вероятность изгнание во время дефекации. Однако недавно мутант L. braziliensis был выделен из поражения пациента, который не смог собрать полноразмерный жгутик при выращивании в условиях культивирования промастигот in vitro [85].Жгутик в мутантных клетках только что вышел из жгутикового кармана, и неожиданно эти мутанты успешно заразили песчаных мух, хотя инфекции были проанализированы только в течение 4 дней после кормления, так что способность этого мутанта поддерживать инфекцию в течение длительного времени неизвестно. Точная роль (и) жгутика Leishmania в составе песчаной мухи еще не выяснена полностью, поэтому было бы полезно проанализировать потенциал ряда мутантов жгутика Leishmania для установления и поддержания инфекции у песчаные мухи.6. Переходы промастиготВ дополнение к всеобъемлющей морфологии промастигот и амастигот в переносчике песчаных мух и млекопитающих-хозяевах, соответственно, обнаружены вариации морфологий промастигот, такие как проциклические и метациклические промастиготы у песчаных мух. Сообщаемая форма этих разных форм может быть экстремальной, и это привело к тому, что они были определены как разные типы клеток (формы развития), а не просто разные переходные морфологии.В настоящее время существует четыре основных типа клеток, идентифицированных у песчаной мухи на основании длины / ширины тела клетки и жгутика [86] ( a ):
Развитие Leishmania в пищеварительном тракте песчаных мух. ( a ) Иллюстрации основных морфологий промастигот, наблюдаемых у песчаных мух во время заражения Leishmania . ( b ) Leishmania Число клеток на одну песчаную муху во время типичного заражения песчаной мухой в течение 10 дней. ( c ) Плотность клеток из ( b ) была заново нанесена на график и рассчитано время удвоения для ранней и поздней стадий заражения.( d ) Анализ пропорций различных типов клеток, наблюдаемых во время заражения песчаной мухой. ( a ), ( b ) и ( d ) воспроизводятся с разрешения Rogers et al. [86]. ( e ) Схема клеточного цикла Leishmania с соответствующими типами клеток, показанными выше. ( f ) Корреляция длины жгутика и длины тела клетки из трех независимых культур L. mexicana in vitro , проанализированных при разной плотности клеток.Затем данные были классифицированы по различным морфологиям промастигот [86]. ( г ) Доля клеток с различной морфологией промастигот в зависимости от хода клеточного цикла. Прогресс клеточного цикла клеток, используемых в анализе для ( f ), был рассчитан на основе длины их клеток и содержания ДНК, а затем объединен с классификацией морфологии промастигот из ( f ) [87,88]. Пунктирными линиями обозначены переходы между стадиями клеточного цикла (C, цитокинез).( e ) и ( f ) воспроизводятся с разрешения Уиллера [89]. Считается, что эти четыре типа клеток представляют собой последовательность развития со специфическими отношениями предшественник-продукт между ними ( b ). Вкратце, проциклический промастигот встречается в кровяной муке; Промастигот нектомонад наблюдается по мере того, как перитрофический матрикс разрушается и движется к передней кишке, где он становится промастиготом лептомонад, прежде чем дифференцироваться либо в инфекционный метациклический, либо в промастиготный гаптомонад [86, 90].В дополнение к этим четырем основным формам, прикрепленная гаптомонадная промастигота и парамастигота также наблюдаются у песчаных мух, но с гораздо меньшей частотой [86]. Все эти формы имеют одинаковую базовую архитектуру промастиготных клеток с кинетопластом (митохондриальной ДНК) перед ядром и жгутиком, отходящим от переднего конца клетки с неглубоким жгутиковым карманом, за исключением парамастигота, в котором кинетопласт располагается следующим. к ядру. Число и время появления различных типов промастиготных клеток у москитов было изучено Rogers et al. [86] ( a — d ). В своей экспериментальной системе они подсчитали, что каждая песчаная муха могла проглотить приблизительно 3200 амастигот в 1,6-мкл муки с кровью. После приема внутрь было начальное снижение количества паразитов в течение первого дня примерно до 2500, а затем популяция выросла в течение следующих 5 дней и достигла пика примерно до 35000 паразитов на муху, что означает, что произошло примерно четыре удвоения популяции паразитов ( б ). Первоначально рост клеток был относительно быстрым, время удвоения составляло приблизительно 18 часов в период от 1 до 3 дней после заражения.Затем скорость роста замедлилась, и время удвоения упало примерно до 54 часов с 3 по 6 день ( c ). После 6-го дня произошло быстрое уменьшение количества присутствующих паразитов, и к 10-му дню осталось всего несколько тысяч. Причины резкого падения количества паразитов неизвестны, но это может быть связано с истощением запасов питательных веществ или иммунный ответ песчаной мухи. Каждый день после заражения Rogers et al. проанализировал различные типы промастиготных клеток, присутствующих в песчаной мухе, и показал, что рост и деление Leishmania кажется первоначально относительно синхронным, поскольку наблюдаются четкие последовательные пики различных типов промастиготных клеток ( d ) [86].В течение первых 2 дней заражения, помимо значительного увеличения общей численности паразитов, наблюдалось быстрое снижение доли амастигот с одновременным увеличением доли проциклических промастигот. Взятые вместе, это означает, что дифференцировка амастиготы в проциклический промастигот включает как прямую клеточную дифференцировку, так и дифференцировку, направленную на деление, соответствующую дифференцировке in vitro и [50]. После пика проциклических промастигот следует пик промастигот нектомонад, за которыми следуют промастиготы лептомонад, которые затем падают пропорционально тому, как покоящиеся метациклические промастиготы начинают доминировать над инфекцией. Другими последовательно наблюдаемыми типами клеток Leishmania у песчаной мухи являются прикрепленная гаптомонадная промастигота и парамастигота. Когда эти формы были определены количественно, парамастиготы наблюдались редко и составляли не более 2% наблюдаемых клеток [86]. Существует вероятность того, что это может быть продукт аберрантного деления, когда кинетопласт оказался рядом с ядром. Положение в цикле развития прикрепленной промастиготы гаптомонад, которая наблюдается в небольших количествах и встречается на более поздних стадиях инфекции, неясно, поскольку она потенциально происходит от промастиготы лептомонад ( b ) [86].Этот тип клеток редко встречается при делении, что предполагает, что прикрепление к кутикуле может быть обратимым, и клетка может стохастически прикрепляться и отделяться или что она очень медленно делится. Синхронность появления различных типов промастиготных клеток, идентифицированная Rogers et al. в песчаной мухе интригует, поскольку in vitro, синхронизированные культуры клеток быстро теряют свою синхронность, но здесь она сохраняется примерно в течение четырех удвоений клеток ( d ).Возможно, что синхронность клеточного деления устанавливается вступлением в процесс пролиферации, когда амастиготы начинают дифференцироваться и делиться, но, возможно, есть и другие элементы, такие как условия окружающей среды. Быстрое распространение паразитов Leishmania в песчаной мухе оказывает большое влияние на уровень питательных веществ. Может ли изменение питательных веществ создать синхронизацию наблюдаемых различных типов клеток? Это будет напоминать диауксический рост, наблюдаемый у бактерий, где, если присутствуют и глюкоза, и галактоза, бактерии предпочтительно метаболизируют глюкозу.Когда он истощается, они переключаются на лактозу, но это переключение сопровождается паузой в росте клеток, поскольку метаболизм клетки перепрограммируется [91,92]. Недавние транскриптомные данные из Inbar et al. [93] показывают, что наблюдается падение уровня мРНК генов, связанных с метаболизмом глюкозы, с увеличением уровня мРНК генов переносчиков аминокислот, когда паразит переключается с проциклического промастигота на промастиготный тип клеток нектомонад. 7. Жизненный цикл и клеточный циклДополнительное осложнение к анализу различных типов клеток промастигот связано с недавней работой по морфологическим изменениям, наблюдаемым во время клеточного цикла промастигот, культивируемых in vitro [87,94].Это продемонстрировало, что по мере прохождения промастигота по клеточному циклу длина его клетки увеличивается вдвое, а затем вдвое. Кроме того, в отличие от многих других организмов, две дочерние клетки, продуцируемые делением клеток промастигот Leishmania , отличаются. Одна дочерняя унаследует старый и, следовательно, более длинный жгутик, а другая унаследует новый и, следовательно, более короткий жгутик, поэтому деление промастиготных клеток может генерировать две дочерние клетки с резко различающейся длиной жгутика ( e ).Если морфологическое определение типов проциклических, нектомонадных и лептомонадных промастиготных клеток, как определено Rogers et al. применяется к клеткам, наблюдаемым в культуре, обнаруживаются все три типа клеток ( f , g ) [86,89].
Это подчеркивает проблемы использования морфологических параметров для определения типов клеток, поскольку две дочерние клетки в делении промастигот in vitro можно по-разному классифицировать как клетки проциклического или лептомонадного типа. Поэтому он также подчеркивает необходимость независимых клеточных маркеров для разных типов клеток жизненного цикла. Возможно, что на долю клеток, образующихся после деления с морфологией, которая определяет их как проциклические или лептомонадные клетки, влияет время, в течение которого родительская клетка проводит в G2, поскольку это время, в течение которого происходит удлинение как старых, так и новых жгутиков встречается ( e ).Например, если клетка достаточно долго проводит в G2, то последующее деление будет генерировать два типа клеток лептомонад ( e ). Таким образом, посредством манипуляции с длиной G2 можно предположить, что в растущей популяции из промастигот Leishmania и могут доминировать типы клеток лептомонад, как это видно на примере песчаных мух. Более того, тип клеток нектомонад был определен как неделящаяся стадия, поскольку никогда не наблюдалось наличия двух кинетопластов или двух ядер [90].Интересно, что промастиготные клетки, наблюдаемые в культуре с морфологией, которая определяла бы их как промастигот нектомонад, находятся преимущественно в S-фазе и поэтому будут иметь только один кинетопласт и ядро ( g ) [89]. Развитие жизненного цикла рассматривается как улица с односторонним движением, и поэтому, когда паразит проходит каждый шаг, он обязуется дифференцироваться в следующую стадию жизненного цикла, не имея возможности вернуться к предыдущей стадии. Это означает, что между паразитами на разных этапах жизненного цикла будут существенные различия, включая изменения в метаболизме, экспрессии белков на клеточной поверхности, а также в форме клеток.Однако с последними следует быть осторожными, поскольку эти характеристики могут изменяться по другим причинам, таким как положение клеточного цикла и состояние метаболизма. Поэтому лучше всего определять, стал ли паразит клеткой другого типа, на основе молекулярных маркеров. Недавний транскриптомный анализ клеток Leishmania у песчаной мухи должен помочь прояснить текущую ситуацию [93]. 8. ОбсуждениеУ простейших паразитов есть отличительные фазы популяционной пролиферации и дифференцировки, связанные с различными типами пролиферативных клеток и типами клеток передачи.В свою очередь, это связано с перемещением между различными экологическими нишами в жизненном цикле паразита. Общей особенностью стадий передачи является то, что они больше не являются размножающимися, необратимо дифференцируются и могут снова размножаться только после того, как они успешно переместятся на следующий участок окружающей среды в своем жизненном цикле. Например, в Plasmodium мерозоит — это тип пролиферативных клеток в эритроците, а гаметоцит — это тип клеток, который вызывает инфекцию у комара.Поскольку дифференциация в форму передачи необратима, этот процесс должен строго регулироваться и, следовательно, будет зависеть от среды хозяина паразита [1]. Следовательно, паразитам необходимо внимательно следить за своей средой, чтобы они могли реагировать наиболее подходящим образом, что могло бы быть либо продолжением распространения, либо переключением на программу дифференциации для подготовки к передаче. Кроме того, точка принятия решения для дифференцировки должна быть интегрирована в клеточный цикл и согласована с ним.Это подразумевает, что существует контрольная точка, основанная на клеточном цикле, в которой клетка должна решить либо делиться, либо дифференцироваться в следующую стадию развития, и это решение будет основано на интеграции внутренних и внешних сигналов паразита [1]. Для того, чтобы произошла инцистация Giardia , клетки должны пройти цикл репликации ДНК до того, как может произойти дифференцировка, предполагая, что для этого организма точка принятия решения находится во время G2 [95]. В настоящее время идентификация этих сигналов развития является областью активных исследований, поскольку нарушение этого процесса имеет большой терапевтический потенциал, вызывая преждевременную дифференцировку или полностью блокируя процесс [46]. Эукариотические паразиты развили поразительное множество различных морфологий, которые, вероятно, будут адаптированы к различным экологическим нишам. Кинетопластидные паразиты представляют собой идеальный набор организмов для изучения и, следовательно, понимания роли формы и формы клеток в обеспечении передачи между хозяином и переносчиком, а также в установлении и поддержании инфекции. Близкородственные паразиты Leishmania spp., T. brucei и T. cruzi адаптировались к разным нишам в организме хозяина, имеют другой вектор и другой набор морфологий, по которым они дифференцируются в течение своих жизненных циклов. .Высококачественные геномы доступны для всех трех видов, и сравнительная геномика определила наборы генов, которые уникальны для каждого из этих организмов или являются общими только для двух из них; они, вероятно, вовлечены в определенные процессы, такие как адаптация к внутриклеточному или внеклеточному образу жизни хозяина [96–98]. Интересное наблюдение, выявленное при сравнении Leishmania с T. brucei , заключается в том, что разные формы развития T.brucei , наблюдаемые у мухи цеце, образуются в результате асимметричных делений, в результате которых образуются две разные дочерние клетки, резко отличающиеся по размеру или имеющие различное расположение ядер кинетопластов [99,100]. Однако во время разработки Leishmania у песчаной мухи не было зарегистрировано никаких асимметричных делений. Были ли они упущены, или различные формы, наблюдаемые у песчаной мухи, потенциально генерируются с помощью другого механизма? Во время клеточного цикла клетка Leishmania подвергнется удвоению, а затем уменьшению вдвое своей длины [87], демонстрируя, что индивидуальная клетка Leishmania имеет иную пластичность по форме и форме, чем трипаносома.Следовательно, различные формы Leishmania , наблюдаемые у песчаной мухи, могут быть вызваны модуляцией формы отдельной клетки, тогда как изменения, которые происходят в форме трипаносомных клеток у мухи цеце, могут зависеть от асимметричного деления для образования клеток различной формы. . Понимание биологии, лежащей в основе способности паразитов Leishmania разрушать своих хозяев, представляет большой интерес и является медицинской необходимостью. У паразита есть определенные типы клеток и морфология, которые четко связаны с нишами патогенов, но нам необходимо интерпретировать их в контексте современной клеточной биологии.Теперь есть возможность вернуться к описанию формы, формы и типов клеток в учебниках, используя новые инструменты и методы. Иногда нам не хватает строгих доказательств, подтверждающих общепринятые выводы. Отсутствие доказательств не является доказательством отсутствия. Молекулярная паразитология переходит от описания этих паразитов в учебнике паразитологии двадцатого века к современному пониманию клеточной биологии двадцать первого века клеточных механизмов, которые позволяют им выживать и процветать. БлагодарностиАвторы благодарят бывших и настоящих сотрудников лаборатории Gull за плодотворные обсуждения. Авторы благодарят Ричарда Уиллера за помощь с карикатурами и за критическое прочтение рукописи. Доступность данныхВ этой статье нет дополнительных данных. Авторские работыJ.S. и К. задумал рецензию, написал рукопись и утвердил окончательную версию. Конкурирующие интересыАвторы заявляют, что у них нет конкурирующих интересов. ФинансированиеWellcome Trust поддерживает работу в лаборатории Gull (WT066839MA, 104627 / Z / 14 / Z, 108445 / Z / 15 / Z). Ссылки3. Шапиро С.З., Наессенс Дж., Лизеганг Б., Молоо СК, Магонду Дж. 1984 г. Анализ проточной цитометрии синтеза ДНК в течение жизненного цикла африканских трипаносом. Acta Trop. 41, 313–323. [PubMed] [Google Scholar] 9. Lacomble S, Vaughan S, Gadelha C, Morphew MK, Shaw MK, McIntosh JR, Gull K. 2009 г. Трехмерная клеточная архитектура жгутикового кармана и ассоциированного цитоскелета в трипаносомах, выявленная с помощью электронной томографии.J. Cell Sci. 122, 1081–1090. (doi: 10.1242 / jcs.045740) [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Cuvillier A, Miranda JC, Ambit A, Barral A, Merlin G. 2003 г. Абортивное инфицирование насекомых-векторов Lutzomyia longipalpis афлагеллированными паразитами LdARL-3A-Q70 L, сверхэкспрессирующими Leishmania amazonensis . Клетка. Microbiol. 5, 717–728. (DOI: 10.1046 / j.1462-5822.2003.00316.x) [PubMed] [Google Scholar] 22. Петрополис ДБ, Родригес ДжКФ, Виана Н.Б., Понтес Б., Перейра КФА, Сильва-Филью.2014 г. Leishmania amazonensis промастигот в 3D-культуре коллагена I: in vitro, физиологическая среда для изучения взаимодействия внеклеточного матрикса и клетки-хозяина. PeerJ 2, e317 (doi: 10.7717 / peerj.317) [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Rittig MG, Schröppel K, Seack KH, Sander U, N’Diaye EN, Maridonneau-Parini I, Solbach W., Bogdan C. 1998 г. Спиральный фагоцитоз трипаносоматид и грибковых клеток. Заразить. Иммун. 66, 4331–4339. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24.Courret N, Fréhel C, Gouhier N, Pouchelet M, Prina E, Roux P, Antoine JC. 2002 г. Биогенез Leishmania — порода паразитофорных вакуолей после фагоцитоза метациклических промастигот или стадий амастигот паразитов. J. Cell Sci. 115, 2303–2316. [PubMed] [Google Scholar] 25. Forestier C-L, Machu C, Loussert C, Pescher P, Späth GF. 2011 г. Визуализация динамики взаимодействия клетки-хозяина — Leishmania вовлекает подвижность паразита, рекрутирование лизосом и повреждение клетки-хозяина в инфекционный процесс.Клеточный микроб-хозяин 9, 319–330. (DOI: 10.1016 / j.chom.2011.03.011) [PubMed] [Google Scholar] 28. Антуан Дж. К., Прина Э, Жуан С., Бонгран П. 1990 г. Паразитофорные вакуоли инфицированных макрофагов Leishmania amazonensis поддерживают кислый pH. Заразить. Иммун. 58, 779–787. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Гулл К. 2009 г. Точка зрения паразита: идеи и вопросы клеточной биологии взаимодействий паразит-фагоцит Trypanosoma и Leishmania .Во взаимодействиях фагоцитов и патогенов (ред. Рассел Д., Гордон С.), стр. 453–462. Вашингтон, округ Колумбия: ASM Press. [Google Scholar] 31. Глин М., Гулл К. 1990 г. Ретракция жгутика и деполимеризация аксонемы во время трансформации жгутиконосцев в амебы у Physarum . Протоплазма 158, 130–141. (DOI: 10.1007 / BF01323125) [Google Scholar] 36. Карадонна К.Л., Берли Б.А. 2011 г. Глава 2 — Механизмы инвазии клеток-хозяев Trypanosoma cruzi . В «Успехах в паразитологии» (ред. Вайс Л. М., Тановиц Х. Б.), стр.33–61. Нью-Йорк, штат Нью-Йорк: Academic Press. [PubMed] [Google Scholar] 39. Кастро Р., Скотт К., Джордан Т., Эванс Б., Крейг Дж., Питерс Э.Л., Свиер К. 2006 г. Ультраструктура паразитофорной вакуоли, образованная Leishmania major . J. Parasitol. 92, 1162–1170. (DOI: 10.1645 / GE-841R.1) [PubMed] [Google Scholar] 43. Zhang W-W, Mendez S, Ghosh A, Myler P, Ivens A, Clos J, Sacks DL, Matlashewski G. 2003 г. Сравнение локуса гена A2 в Leishmania donovani и Leishmania major и его контроль над кожной инфекцией.J. Biol. Chem. 278, 35 508–35 515. (doi: 10.1074 / jbc.M305030200) [PubMed] [Google Scholar] 47. Би А., Калли Ф.Дж., Алкхалиф И.С., Бодман-Смит КБ, Рейнс Дж. Г., Бейтс ПА. 2001 г. Трансформация метациклических промастигот Leishmania mexicana в амастиготоподобные формы за счет связывания С-реактивного белка человека. Паразитология 122, 521–529. (DOI: 10.1017 / S0031182001007612) [PubMed] [Google Scholar] 48. Биллкер О., Линдо В., Панико М., Этьен А. Э., Пакстон Т., Делл А., Роджерс М., Синден Р. Э., Моррис Х. Р..1998 г. Идентификация ксантуреновой кислоты как предполагаемого индуктора развития малярии у комаров. Природа 392, 289–292. (DOI: 10.1038 / 32667) [PubMed] [Google Scholar] 52. Гемечу Т. 1974 г. Морфология и тонкая структура средней кишки и перитрофической мембраны взрослой самки, Phlebotomus longipes, Parrot and Martin (Diptera: Psychodidae). Аня. Троп. Med. Паразитол. 68, 111–124. (DOI: 10.1080 / 00034983.1974.11686930) [PubMed] [Google Scholar] 54. Киллик-Кендрик Р., Молинье Д.Х., Эшфорд Р.В.1974 г. Leishmania у москитов-флеботомид. I. Изменения жгутика, связанные с прикреплением к средней кишке и пищеводному клапану москиты. Proc. R. Soc. Лондон. B 187, 409–419. (DOI: 10.1098 / rspb.1974.0085) [PubMed] [Google Scholar] 59. Тетли Л., Викерман К. 1985 г. Дифференциация Trypanosoma brucei : соединения клеток-хозяев и паразитов и их устойчивость во время приобретения вариабельной антигенной оболочки. J. Cell Sci. 74, 1–19. [PubMed] [Google Scholar] 61.Хендри К.А., Викерман К. 1988 г. Потребность в прикреплении эпимастигот во время деления и метациклогенеза у Trypanosoma congolense . Паразитол. Res. 74, 403–408. (DOI: 10.1007 / BF00535138) [PubMed] [Google Scholar] 62. Баррос В.К., Оливейра Дж.С., Мело Миннесота, Гонтижу Н.Ф. 2006 г. Leishmania amazonensis : хемотаксические и осмотаксические реакции в промастиготах и их вероятная роль в развитии флеботоминового кишечника. Exp. Паразитол. 112, 152–157. (DOI: 10.1016 / j.exppara.2005.10.005) [PubMed] [Google Scholar] 65. Сантрих С., Мур Л., Шервин Т., Бастин П., Брокоу К., Чайка К., ЛеБовиц Дж. Х. 1997 г. Функция подвижности парафлагеллярного стержня паразитов Leishmania , выявленная нокаутом гена PFR-2. Мол. Biochem. Паразитол. 90, 95–109. (DOI: 10.1016 / S0166-6851 (97) 00149-7) [PubMed] [Google Scholar] 66. Мага Дж. А., Шервин Т., Фрэнсис С., Чайка К., ЛеБовиц Дж. Х. 1999 г. Генетическое вскрытие парафлагеллярного стержня Leishmania , уникальной структуры цитоскелета жгутика.J. Cell Sci. 112, 2753–2763. [PubMed] [Google Scholar] 67. Cuvillier A, Redon F, Antoine JC, Chardin P, DeVos T, Merlin G. 2000 г. LdARL-3A, белок, специфичный для промастигот Leishmania , подобный фактору рибозилирования АДФ, необходим для целостности жгутика. J. Cell Sci. 113, 2065–2074. [PubMed] [Google Scholar] 72. Blaineau C, Tessier M, Dubessay P, Tasse L, Crobu L, Pagès M, Bastien P. 2007 г. Новый кинезин, деполимеризующий микротрубочки, участвует в контроле длины жгутика эукариот.Curr. Биол. 17, 778–782. (DOI: 10.1016 / j.cub.2007.03.048) [PubMed] [Google Scholar] 75. Талл Д., Надерер Т., Спурк Т., Мертенс HDT, Хенг Дж., Макфадден Г.И., Гули П.Р., МакКонвилл М.Дж. 2010 г. Мембранный белок SMP-1 необходим для нормальной функции жгутика у Leishmania . J. Cell Sci. 123, 544–554. (doi: 10.1242 / jcs.059097) [PubMed] [Google Scholar] 79. Сантер Дж. Д., Бенц С., Андре Дж., Уиппл С., Маккин П. Г., Чайка К., Джинджер М. Л., Люкеш Дж. 2015 г. Модуляция белков зоны прикрепления жгутика и регуляция формы клеток в переходах жизненного цикла Trypanosoma brucei .J. Cell Sci. 128, 3117–3130. (doi: 10.1242 / jcs.171645) [Бесплатная статья PMC] [PubMed] [Google Scholar] 86. Роджерс М.Э., Шанс М.Л., Бейтс, Пенсильвания. 2002 г. Роль секреторного геля промастигот в происхождении и передаче инфекционной стадии Leishmania mexicana москитами Lutzomyia longipalpis . Паразитология 124, 495–507. (DOI: 10.1017 / S0031182002001439) [PubMed] [Google Scholar] 91. Монод Дж. 1941 г. Recherches sur la Croissance des Bactériennes. Париж, Франция: Германн.[Google Scholar] 99. Ротюро Б, Субота I, Бюиссон Дж., Бастин П. 2012 г. Новое асимметричное деление способствует непрерывному образованию инфекционных трипаносом у мухи цеце. Dev. Camb. Англ. 139, 1842–1850. (doi: 10.1242 / dev.072611) [PubMed] [Google Scholar] 100. Шарма Р., Павлин Л., Глуенц Э., Чайка К., Гибсон В., Кэррингтон М. 2008 г. Асимметричное деление клеток как путь к сокращению длины клеток и изменению морфологии клеток в трипаносомах. Протист 159, 137–151. (DOI: 10.1016 / j.protis.2007.07.004) [PubMed] [Google Scholar]от описаний учебников к биологическому пониманиюOpen Biol. 2017 сен; 7 (9): 170165. Джек Сантер1 Департамент биологических и медицинских наук, Университет Оксфорд Брукс, кампус Хедингтон, Оксфорд, OX3 0BP, Великобритания Кит Гулл2 Школа патологии сэра Уильяма Данна , Оксфордский университет, Oxford OX1 3RE, UK 1 Департамент биологических и медицинских наук, Oxford Brookes University, Headington Campus, Oxford OX3 0BP, UK 2 Школа патологии сэра Уильяма Данна, Оксфордский университет, Oxford OX1 3RE, UK Поступило 5 июля 2017 г .; Принята в печать 4 августа 2017 г. Опубликовано Королевским обществом в соответствии с условиями лицензии Creative Commons Attribution License http://creativecommons.org/licenses/by/4.0/, которая разрешает неограниченное использование при условии указания автора и источника ссылки на эту статью. другие статьи в PMC.AbstractФорма и форма простейших паразитов неразрывно связаны с их патогенностью. Эволюционное давление, связанное с установлением и поддержанием инфекции и передачей переносчику или хозяину, сформировало морфологию паразита.Однако не существует «единого для всех» морфологического решения этих различных факторов давления, и паразиты демонстрируют ряд различных морфологий, отражающих разнообразие их сложных жизненных циклов. В этом обзоре мы сосредоточимся на форме и форме Leishmania spp., Группы очень успешных простейших паразитов, вызывающих ряд заболеваний, от самовосстанавливающегося кожного лейшманиоза до висцерального лейшманиоза, который при отсутствии лечения приводит к летальному исходу. Ключевые слова: морфология , Leishmania , патогенность, паразит 1.Форма и формаLeishmaniaПодобно многим простейшим паразитам, Leishmania имеют дигенетический жизненный цикл с участием как млекопитающего-хозяина, так и насекомого-переносчика. Leishmania паразиты демонстрируют множество различных морфологий клеток и ряд типов клеток (форм развития), которые адаптированы либо к хозяину, либо к вектору. Как видно на примере других паразитов, таких как Plasmodium и трипаносомы, некоторые из этих форм развития являются пролиферативными, тогда как другие находятся в состоянии покоя и предварительно адаптированы для передачи следующему хозяину [1–4].Большая часть интерпретации клеточной формы и функции у видов Leishmania происходит из более изученной базовой клеточной биологии трипаносом. Хотя это естественная передача знаний, необходимо сохранять бдительность в отношении того факта, что между двумя системами патогенов могут существовать нераспознанные различия даже в их базовой биологии. Leishmania имеет две основные различные морфологии клеток, примером которых является морфология промастигот у песчаных мух и морфология амастигот у млекопитающего-хозяина ( a ).Однако основная клеточная архитектура сохраняется между двумя формами клеток Leishmania и определяется поперечносшитыми микротрубочками субпелликулярного корсета. Этот массив сохраняется на протяжении всего клеточного цикла, поэтому деление клеток зависит от вставки и удлинения микротрубочек в существующий массив. Внутри клетки находятся ядро и набор однокопийных органелл, таких как митохондрия и аппарат Гольджи. Перед ядром находится кинетопласт, масса конкатенированной митохондриальной ДНК, которая непосредственно связана с базальным телом, от которого отходит жгутик [5–8].В основании жгутика находится впячивание клеточной мембраны, образующее вазоподобную структуру, называемую жгутиковым карманом, которая важна для этих паразитов, так как это единственное место эндоцитоза и экзоцитоза и, следовательно, является критически важным интерфейсом между паразитом и среда его хозяина [9]. Схема морфологии промастигот и амастигот и жизненного цикла Leishmania с выделенными различными типами клеток. ( a ) Морфология промастигот и амастигот выровнена вдоль задней передней оси с ключевыми структурами в указанных клетках.( b ) Рисунок современного понимания жизненного цикла Leishmania с выделенными критическими событиями и различными типами клеток. Песчаная муха принимает пищу из крови инфицированного млекопитающего-хозяина и проглатывает макрофаг, содержащий лейшманий и амастигот. Попав в среднюю кишку песчаной мухи, амастиготы дифференцируются в проциклические промастиготы. Затем проциклические промастиготы становятся промастиготами нектомонад, которые покидают перитрофический матрикс и затем прикрепляются к микроворсинкам в средней кишке, прежде чем перейти в грудную среднюю кишку и стомодальный клапан, где они дифференцируются в промастиготы лептомонад.Здесь промастиготы лептомонад дифференцируются либо на промастиготы гаптомонад, которые прикрепляются к стомодеальному клапану, либо на метациклические промастиготы, которые представляют собой инфекционную форму млекопитающих, которые передаются, когда песчанка в следующий раз принимает пищу с кровью. Стадии пролиферации обозначены круговой стрелкой. По сути, клетка Leishmania сконструирована из ряда модульных единиц, таких как жгутик, единица базального тельца – митохондриального кинетопласта и единица Гольджи – шейка кармана жгутика [8].Эти модульные единицы затем позиционируются относительно друг друга, чтобы вызвать различные наблюдаемые морфологии клеток [10,11]. Ключом к определению динамической формы и формы этого паразита, следовательно, является понимание морфогенеза этих различных индивидуальных модульных единиц и их положения относительно друг друга. Клеточная морфология паразитов Leishmania очень точно определяется формой клетки, длиной жгутика, положением кинетопласта / ядра и ультраструктурными особенностями, и поэтому традиционно используется для определения наблюдаемых форм клеток.Однако в некоторых случаях эти морфологические описания клеточных форм вошли в литературу как определяющие конкретные типы клеток в жизненном цикле. Однако в настоящее время существует несколько молекулярных маркеров, помогающих более точно определять формы жизненного цикла, и поэтому существует потребность в осторожности и осторожности при определении типов клеток исключительно на основе морфологии клеток. 2. Определение разнообразия: разные виды, разные заболевания, разные клетки в переносчике и хозяинеРазличные виды Leishmania паразиты вызывают болезни у людей, при этом разные виды часто группируются вместе в зависимости от того, возникли ли они в старом мире или новый мир () [12] и от характера патологии (кожный, кожно-слизистый или висцеральный лейшманиоз) [12,13].Важно помнить, что это болезнь не только человека, и что Leishmania заразит других млекопитающих, создавая зоонозный резервуар, который имеет серьезные последствия для борьбы с болезнями [14]. Переносчик песчаной мухи добавляет еще один уровень сложности: существует множество видов, способных переносить паразит Leishmania ; однако часто существуют особые отношения, при которых некоторые виды песчаных мух способны передавать только один или ограниченное количество из видов Leishmania () [15]. Таблица 1.Переносчик, болезнь и происхождение ряда различных видов Leishmania . По материалам Бейтса [12].
Несмотря на все эти морфологические уровни сложности и сложность Leman демонстрирует замечательную сохранность формы в процессе своего жизненного цикла. Клетки с морфологией амастигот или промастигот выглядят кардинально по-разному, но они сохраняют ту же базовую клеточную структуру с кинетопластом впереди ядра и жгутиком, отходящим от базального тела ( a ) [5,6].Морфология амастиготы представлена более мелким и более сферическим телом клетки с коротким неподвижным жгутиком, который едва выходит из жгутикового кармана и потенциально больше ориентирован на сенсорные функции [16,17]. Напротив, морфология промастигот определяется удлиненным яйцевидным клеточным телом с длинным подвижным жгутиком, выходящим из жгутикового кармана, который обеспечивает движущую силу, вероятно, ответственную за облегчение прохождения через пищеварительный тракт песчаных мух [18]. 3.Переход от промастиготы к амастиготеКогда песчанка, инфицированная Leishmania , принимает кровяную муку, метациклические промастиготы откладываются в месте укуса ( b ). Повреждение, вызванное песчаной мухой, приводит к рекрутированию макрофагов в место укуса, и это клетки, которые Leishmania заражает и которые остаются в организме хозяина, позволяя им сохраняться в организме хозяина [19–21]; однако существует минимальное количество доказательств, показывающих, где происходит взаимодействие между Leishmania и макрофагами в организме хозяина.Метациклические промастиготы — очень подвижные клетки, и Leishmania способны мигрировать через коллагеновый матрикс [22]. Следовательно, возможно, что фагоцитоз Leishmania может происходить в местах, удаленных от места укуса. Более того, возможно, спектр заболеваний, вызываемых Leishmania от кожного до висцерального, отражается в способности паразита вторгаться в хозяина за пределами места укуса либо напрямую, либо через движение инфицированных макрофагов. В литературе есть противоречивые сообщения о полярности взаимодействия и поглощения между Leishmania и макрофагом, причем некоторые предполагают, что это происходит сначала через жгутик, а другие показывают, что это происходит преимущественно через тело клетки или с обоих концов [ 23–25].Учитывая движение жгутика вперед, проявляемое этими метациклическими промастиготами, кончик жгутика, вероятно, будет первой частью клетки, которая взаимодействует с макрофагом. У близкородственного паразита Trypanosoma brucei кончик жгутика имеет ряд белков, включая рецепторы, которые локализуются исключительно в этой области [26,27]. Следовательно, существует вероятность того, что дифференцированный мембранный домен на кончике жгутика будет подготовлен к столкновению с макрофагом, что будет инициировать серию сигнальных событий, ведущих к успешному захвату и дифференцировке паразита.Однако в какой бы ориентации ни был охвачен Leishmania , паразит в конечном итоге будет указывать жгутиком на периферию макрофага [24,25]. Продолжающееся движение жгутика внутри макрофага приводит к повреждению плазматической мембраны и нарушению целостности, что способствует лизосомному экзоцитозу, потенциально изменяя состав паразитофорной вакуоли, тем самым увеличивая шансы паразита успешно заразить макрофаг [25]. Оказавшись внутри макрофага, промастигот дифференцируется от подвижной формы промастигота, которая имеет длинный жгутик и удлиненную форму клеток, до формы амастиготы, которая имеет короткий жгутик с небольшим выпуклым кончиком, выходящим за пределы теперь более сферического тела клетки. .Это резкое изменение формы клеток и приводит к минимальному соотношению поверхности клетки к объему, следовательно, к уменьшению площади, на которой клетка подвергается воздействию суровых условий паразитофорной вакуоли, а также к вероятному изменению формата использования жгутика [28–30]. ]. Наиболее яркое различие между формами амастигот и промастигот — изменение жгутика с длинного подвижного жгутика с аксонемой 9 + 2 на короткий неподвижный жгутик с расположением аксонем 9 + 0 (9v) [17].Wheeler et al. [17] подробно изучили этот специфический аспект процесса дифференцировки и показали, что это изменение в структуре жгутика включает в себя либо (i) разборку существующего длинного жгутика и удаление его центральной пары, а следовательно, его сжатие до короткого 9v аксонема, или (ii) сборка короткого нового жгутика, лишенного центральной пары и демонстрирующего аксонему 9v. Последний механизм интересен тем, что пробазальное тельце, которое собрало аксонему 9v, собрало бы аксонему 9 + 2, если бы эта клетка оставалась в культуре промастигот, показывая способность пробазального тельца переключаться между конструкциями любого типа. аксонема. Учитывая, что есть примеры организмов, которые способны полностью терять и преобразовывать свой жгутик в течение своего жизненного цикла, продолжающееся присутствие жгутика у амастигот предполагает, что он выполняет важную функцию для паразита в макрофаге [30–32] . Наиболее часто постулируемая функция этого жгутика — сенсорная роль, потому что аксонемная архитектура 9v структурно подобна той, которая обнаруживается в первичных ресничках млекопитающих, а кончик жгутика амастиготы Leishmania часто находится в тесном контакте с мембраной паразитофорной вакуоли. [16,33].Паразит Leishmania через свой жгутик потенциально может определять «здоровье» своего макрофага-хозяина, оценивая ключевые метаболиты, такие как, например, аденозиновые нуклеотиды. Если макрофаг «здоров», паразит может делиться, но если макрофаг «нездоров», паразит может решить не делиться, поскольку макрофаг может вот-вот умереть и лизироваться, тем самым высвобождая паразита в новую среду. Поэтому, вероятно, существуют определенные контрольные точки, которые будут применяться в клеточном цикле Leishmania на границах от G1 до G0 / S.Более того, высвобождение паразита вряд ли будет «пассивным» процессом, а скорее будет осуществляться самим паразитом. Это область интереса и важности, в которой специфическая клеточная биология возможного высвобождения паразита, связанного с клеточным циклом, не была изучена. Помимо резкого изменения структуры жгутика во время дифференцировки в форму амастиготы, также наблюдается большая реструктуризация кармана жгутика и области шеи, связанная с изменениями локализации белков зоны прикрепления жгутика [7].Неожиданным следствием этой перестройки является закрытие шейки жгутикового кармана так, что нет наблюдаемого промежутка между жгутиком и мембраной шейки жгутикового кармана [7]. Догма для жгутикового кармана у этого и родственных ему паразитов состоит в том, что это единственный участок экзоцитоза и эндоцитоза в клетке и, следовательно, главный интерфейс между паразитом и его хозяевами. Однако, если карман для жгутика закрыт на шее, как это повлияет на этот важный интерфейс? Является ли это закрытие динамичным и больше похоже на операцию клапана? Снижает ли ограниченный доступ к карману жгутика способность паразита поглощать макромолекулы из окружающей среды? Скорость роста аксенических амастигот, измеренная с помощью мечения тяжелой водой, была намного медленнее, чем у промастигот [34], и, кроме того, амастиготы имеют гораздо меньший объем клеток, чем промастиготы, что приводит к одновременной меньшей метаболической нагрузке.Взятые вместе, низкая скорость роста и меньшая метаболическая нагрузка могут отражать сниженную скорость поглощения макромолекул клеткой. Однако медленный рост может быть результатом эволюционного давления, направленного на то, чтобы не подавлять иммунную систему хозяина, тем самым позволяя хозяину выжить дольше, а паразиту — дольше размножаться и, таким образом, увеличивая вероятность передачи паразита песчаной мухе. Закрывание шейки жгутикового кармана также вероятно является следствием защиты потенциально уязвимого домена клетки от окружающей среды внутри паразитофорной вакуоли, которая является кислой и полной протеаз [28,29].Уменьшение доступа к карману жгутика из-за уменьшения пространства между шейкой и мембранами жгутика в амастиготах является вероятным объяснением того, что литические липопротеины высокой плотности, содержащие трипанолитический фактор, не могут лизировать амастиготы в кислой паразитофорной вакуоли, но могут чтобы убить метациклические промастиготы, у которых есть более доступный карман жгутика [35]. Будет интересно сравнить морфологию жгутикового кармана амастиготы Leishmania с морфологией внутриклеточной амастиготы близкородственного организма Trypanosoma cruzi , поскольку этот паразит убегает из паразитофорной вакуоли и размножается в совершенно ином окружении — цитоплазме. клетки-хозяина [36]. Существует два различных типа паразитофорных вакуолей, которые развиваются в инфицированных макрофагах, которые коррелируют с видами Leishmania . Заражение некоторыми видами, такими как L. amazonensis , приводит к образованию больших многокомпонентных паразитофорных вакуолей (вакуоли типа II), которые содержат несколько амастигот, тогда как другие виды, такие как Leishmania major , образуют маленькие, плотно прилегающие, одноразовые паразитофорные вакуоли ( вакуоли типа I), которые окружают одиночного паразита амастиготу [37,38].Сопутствующие инфекции с L. amazonensis и L. major в одном макрофаге показали, что слияние двух типов паразитофорных вакуолей, больших, содержащих амастигот L. amazonensis , или малых, содержащих амастиготу L. major , составляет L. не произошло. Это говорит о том, что паразитофорная вакуоль модифицируется в соответствии с конкретными потребностями каждого вида, что препятствует успешному слиянию разных типов паразитофорных вакуолей [37]. Интересно, что несмотря на различия, наблюдаемые в типах паразитофорных вакуолей, клеточная организация и расположение амастигот разных видов хорошо сохраняются [39].Однако есть некоторые наблюдаемые различия между амастиготами разных видов: амастигот L. mexicana примерно на 50% больше по среднему диаметру, чем амастиготы L. braziliensis и L. donovani [40]. Эта разница в размерах может иметь последствия для патологии, вызванной различными видами Leishmania , но нет простой связи между этими или другими признаками и типом патологии. Действительно, в качестве другого примера можно привести ультраструктурные исследования амастигот L.tropica и L. donovani выявили отчетливую заднюю инвагинацию, названную «чашечкой» или «задней инвагинацией» [41,42]. Авторы предположили, что это может быть альтернативный сайт экзо / эндоцитоза в этих клетках. Насколько нам известно, эта структура не была обнаружена ни у одного другого вида амастигот Leishmania . Поскольку L. tropica вызывает кожный лейшманиоз, а L. donovani вызывает висцеральный лейшманиоз, эта морфологическая адаптация опять же не связана с патологией заболевания.Таким образом, в целом, хотя различия между промастиготами и амастиготами, вероятно, очень важны для взаимоотношений хозяин / переносчик, общее сходство в морфологии амастигот между разными видами предполагает, что не существует простой связи между морфологией и патологией заболевания. Вместо этого либо более тонкие особенности, либо обладание и экспрессия различных потенциальных факторов вирулентности, продуцируемых разными видами, таких как белок A2, могут иметь большее значение для спектра заболеваний [43,44]. Распределенная популяция макрофагов, инфицированных Leishmania , недавно наблюдалась Doehl et al. [45]. Эта распределенная циркулирующая популяция инфицированных макрофагов поможет обеспечить эффективную передачу паразитов Leishmania от хозяина к песчаной мухе, поскольку селезеночная инфекция недоступна для москитов, а москиты вряд ли будут кусать исключительно на месте фактического поражения. локализованная кожная инфекция. Более того, эти инфицированные макрофаги могут содержать потенциально другую форму амастиготы Leishmania , которая предназначена для выживания в средней кишке песчаной мухи, когда попадает в нее с кровяной мукой, что отражает трансмиссивность метациклических клеток промастиготного типа у песчаных мух или коренастых мух. форма африканских трипаносом [12,30,46]. 4. Переход от амастиготы к промастиготеПосле проглатывания песчаной мухой и высвобождения из макрофага амастигота начинает дифференцироваться в подвижную форму промастиготы. Точные признаки дифференциации еще не установлены, но, вероятно, это комбинация изменения температуры и pH, схожая с другими паразитами, и, как видно на примере Leishmania , поскольку он отличается от промастиготы до амастиготы в паразитофорной вакуоли [47]. ]. Однако может также требоваться наличие определенного химического триггера, чтобы гарантировать, что дифференциация происходит только в векторе, а не в хозяине; например, для дифференциации Plasmodium требуется ксантуреновая кислота, предшественник пигмента москитного глаза [48].Сама по себе температура вряд ли может быть единственным триггером для дифференциации, поскольку макрофаг будет испытывать различные температуры при циркуляции по телу, но он может действовать, повышая чувствительность амастиготы к другим сигналам дифференциации, как это было обнаружено с T. brucei [ 49]. Дифференциация in vitro из амастигот L. amazonensis в промастиготы детально изучена с помощью микроскопии [50]. Первым видимым шагом в этом процессе является удлинение подвижного жгутика, которое происходит до деления клетки, а после этого первого деления клетки обе дочерние клетки имеют подвижный жгутик [50].Таким образом, при созревании пробазальное тельце в родительской клетке было способно собрать 9 + 2 подвижную аксонему, однако, если бы эта же клетка осталась в макрофаге, то же пробазальное тельце собрало бы аксонему 9v, что снова демонстрирует мультипотентность пробазального тела у Leishmania [17]. Эти результаты дополняют результаты Wheeler et al. [17] и показывают, что пробазальные тельца способны собирать либо 9 + 2, либо 9v аксонемы независимо от того, какой тип аксонемы продуцировало материнское базальное тельце [17,50]. Во время дифференцировки в форму промастигота форма клетки также начинает изменяться от сферической амастиготы до более вытянутой овоидной формы. Вместе с изменениями, которые происходят с общей формой тела клетки, изменяется организация зоны прикрепления жгутика и жгутикового кармана. В частности, шейная область жгутикового кармана становится более открытой, отражая обращение процесса, происходящего во время дифференцировки в форму амастиготы [7]. Это открытие шеи может облегчить доступ к карману жгутика, позволяя поглощать крупные макромолекулы, а также потенциально влияя на подвижность паразита. 5. Роль жгутикаLeishmania в песчаной мухеЖгутик играет несколько потенциальных ролей, позволяя паразитам Leishmania успешно устанавливать и поддерживать инфекцию у песчаной мухи. У жгутика песчаной мухи есть три потенциальные ключевые функции, которые мы обсудим в следующих разделах:
5.1. ПодвижностьПроглатывание кровяной муки песчаной мухой вызывает многочисленные изменения у песчаной мухи, включая создание перитрофического матрикса из хитина и гликопротеинов, который покрывает кровяную муку, отделяя ее от эпителия средней кишки. Примерно через 4 дня оставшаяся непереваренная кровяная мука и окружающий перитрофический матрикс испражняются песчаной мухой [51,52]. Следовательно, промастиготы Leishmania должны покинуть перитрофический матрикс до того, как произойдет дефекация.Более того, для успешной передачи млекопитающему-хозяину паразиты Leishmania должны колонизировать область стомодального клапана песчаной мухи и таким образом мигрировать из средней кишки в ротовой аппарат; активная подвижность жгутиков предположительно способствует обоим этим процессам. 5.2. ПриложениеПотеря целостности перитрофического матрикса позволяет паразитам Leishmania покинуть эндотрофическое пространство [53]; эти клетки затем прикрепляются к эпителию средней кишки, вставляя свои жгутики между микроворсинками, что помогает предотвратить изгнание паразитов из песчаной мухи во время дефекации.Это прикрепление не сопровождается какими-либо наблюдаемыми морфологическими изменениями в клетке Leishmania [54]. Данные свидетельствуют о том, что прикрепление опосредуется посредством специфических взаимодействий гликопротеин-лектин, обеспечивая потенциальный механизм, с помощью которого определяется специфичность вектор-паразит. Компонент поверхностного покрытия липофосфогликан (LPG) считался решающим для этого взаимодействия, поскольку клетки L. major , дефицитные в синтезе LPG, не могли прикрепиться к москитам Phlebotomus papatasi и P.duboscqi [55,56]. Однако недавняя работа показала, что этот мутант L. major способен успешно инфицировать другие виды песчаных мух, такие как P. arabicus , P. argentipes , P. perniciosus и Lutzomyia longipalpis , и более того. мутант L. mexicana , неспособный синтезировать LPG, также способен полностью развиваться в пределах Lutzomyia longipalpis [56–58]. Очевидно, что LPG важен для взаимодействия между примерно видами Leishmania и видами песчаных мух, но он не является универсальным детерминантом этих взаимодействий. Второе место прикрепления Leishmania у песчаной мухи находится в стомодеальном клапане, где наблюдается особый тип клеток, называемый гаптомонадой, прикрепленный к кутикуле клапана гемидесмосомными структурами, которые обнаруживаются на увеличенном кончике ствола. относительно короткий жгутик [54]. Эти гемидесмосомные структуры напоминают те, которые наблюдаются для прикрепленных эпимастиготных форм трипаносом, и вполне вероятно, что прикрепление к насекомому-переносчику через такие структуры будет универсальной особенностью кинетопластид [59,60].В настоящее время биохимическая идентичность этих структур остается загадочной, но, учитывая их важность для многих видов кинетопластид, открытие молекулярных компонентов будет представлять большой интерес [60]. Сильное прикрепление предположительно останавливает передачу типа клеток Leishmania haptomonad млекопитающим-хозяину, когда песочные мухи питаются, и, следовательно, может играть роль в поддержании долгосрочной инфекции у песчаных мух и / или асимметричных делениях [61]. 5.3. СенсорнаяПосле выхода из перитрофического матрикса паразиты затем мигрируют вперед через песчаных мух и колонизируют среднюю кишку грудной клетки.Успешная колонизация и передача Leishmania зависят от того, что песчанка принимает сахарную муку после еды с кровью, и это заманчивая гипотеза, что Leishmania способны перемещаться по градиенту сахара вдоль кишечника, чтобы обеспечить колонизацию песка. муха передней кишки. Молекулярные компоненты, необходимые для хемотаксиса, присутствуют в Leishmania с углеводными рецепторами, обнаруженными на поверхности клетки, и жгутиком, способным выполнять различные структуры биений, которые позволяют клетке двигаться вперед и переориентировать себя.Более того, эксперименты in vitro и показали, что Leishmania способны реагировать на изменение концентрации сахара [62–64]. описывает публикации, в которых морфология и / или подвижность были изменены путем мутационного анализа у видов Leishmania [18,65–78]. Ясно, что некоторые морфологические мутанты будут иметь катастрофические эффекты на деление клеток и как таковые не очень полезны для оценки связи с патогенностью и развитием. Сравнение с работой т.brucei показывает, что тонкие нокдауны RNAi (доступные сейчас как технология в L. braziliensis ) могут обеспечивать драматические изменения в архитектуре клетки [11,79,80]. Один из уроков из этого состоит в том, что тонкие различия в экспрессии, а не отсутствие или присутствие в геномах могут влиять на вирулентность или патологию. Текущие улучшения как обратной, так и прямой генетики в Leishmania будут очень полезны в этой области [81–84]. Выше мы обрисовали в общих чертах три функции жгутика Leishmania у песчаной мухи, но каковы фактические доказательства того, что жгутик необходим у песчаных мух? Исходя из этого, мы можем видеть, что существует много мутантов, у которых функция / длина жгутика Leishmania была нарушена, например, из-за сверхэкспрессии KIN13-2 или потери PFR2, но очень мало исследований инфицировали москитов этими насекомыми. мутанты [18,65,72]. Таблица 2.Сводка морфологических и / или подвижных мутантов у Leishmania .
|




 tropica
tropica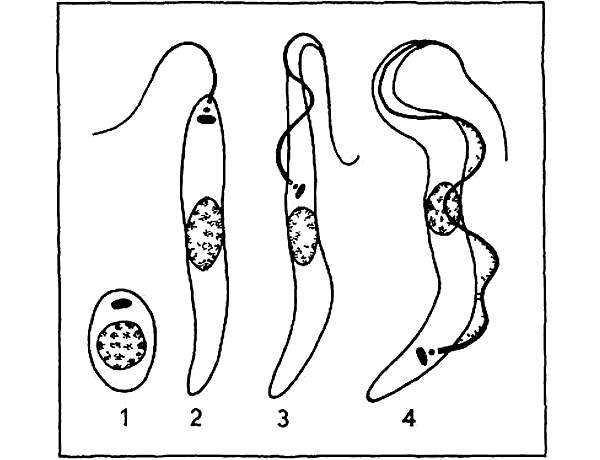 Восток,Китай
Восток,Китай склоны Перуанских
Анд
склоны Перуанских
Анд