Через сколько после приема лекарств можно пить алкоголь? | Здоровая жизнь | Здоровье
В инструкции к некоторым лекарственным средствам указывается о запрете употребления алкоголя во время терапии. Например, спиртное должно быть абсолютно исключено при приеме антибиотиков, психотропных лекарств, ряда противомикробных и противопротозойных препаратов — производных нитрофурана, фторхинолона и пр.
Совместимы ли лекарства и алкоголь?
По словам провизора Ирины Булыгиной, алкоголь не желательно употреблять ни с какими лекарственными средствами, даже если об этом не написано в инструкции. «И лекарства, и алкоголь всасываются в кровь. Поэтому алкоголь может нейтрализовать действие лекарственного средства или наоборот — усилить. То есть реакция будет не та, на которую рассчитывает человек. Например, принял препарат от гипертонии, через какое-то время выпил спиртное — сосуды сузились, эффекта не будет. Давление поднимется еще выше», — объясняет эксперт.
Поэтому нужно внимательно следить за тем, чтобы лекарственное средство успело сработать и полностью вывелось из организма, прежде чем употреблять спиртные напитки. Если же не соблюсти этот срок и принять алкоголь раньше, пациент может не получить нужный эффект от лечебной терапии. Кроме того, по словам Булыгиной, в два раза большую нагрузку получат органы, выполняющие функцию выведения лекарств и алкоголя — почки и печень.
Через какое время после лекарств можно пить алкоголь?
«Если принимаете лекарство, в этот день точно алкоголь пить не следует», — говорит Булыгина. Как отмечает эксперт, это правило касается всех лекарственных препаратов. В некоторых случаях период выведения лекарственного средства может занять больше суток.
Если прием лекарства был не однократным, пациент пропил курс, то перерыв перед употреблением алкоголя может быть больше. «Курсовое лечение имеет накопительный эффект, поэтому перед приемом спиртного необходимо учесть срок выведения препарата.
Смотрите также:
Эссенциале форте Н
Как правильно принимать Эссенциале® форте Н?
Рекомендован следующий курс приема — по 2 капсулы 3 раза в день. Лекарство следует принимать во время еды, запивая достаточным количеством воды.
Препарат может применяться у взрослых и у детей с 12 лет при условии, если масса тела > 43 кг.1 А вот беременные женщины могут применять Эссенциале® форте Н только в случае назначения и под наблюдением врача. Применение лекарства в период грудного вскармливании не рекомендуется.1
Что входит в состав Эссенциале® форте Н?
Чаще всего медикаменты состоят из двух частей — действующего и вспомогательных веществ.
Действующее вещество Эссенциале® форте Н — это фосфолипиды растительного происхождения (так называемые эссенциальные фосфолипиды), изученные в более 200 исследованиях2. Концентрация действующего вещества в составе препарата очень высокая — 76% эссенциальных фосфолипидов.1 Чтобы помочь при жировом гепатозе, они должны быть доставлены к клеткам печени — гепатоцитам. Эссенциальные фосфолипиды встраиваются в мембраны клеток 1,3 Это помогает восстанавливать мембраны поврежденных гепатоцитов, способствуя их регенерации, и благотворно влияя на функцию печени и обмен веществ. В дополнение к этому эссенциальные фосфолипиды оказывают противовоспалительное4, антиоксидантное4,5 и другие действия.
Одним из преимуществ Эссенциале® форте Н является благоприятный профиль безопасности.
Сколько капсул в день нужно принимать?
При хроническом гепатите и жировой болезни печени рекомендуется в дозе 1800 мг/сутки.4 В одной капсуле содержится 300 мг эссенциальных фосфолипидов. Таким образом, в сутки необходимо принимать шесть капсул Эссенциале® форте Н.
В соответствии с инструкцией препарата, суточную дозу необходимо разделить на три приёма по две капсулы, запивая достаточным количеством воды.1 Для достижения ожидаемого терапевтического действия важно соблюдать рекомендованный режим терапии.
Как принимать Эссенциале® форте Н — до еды или после?
В ряде случаев, еда может влиять на эффективность получаемой лекарственной терапии. В некоторых случаях лекарство рекомендуют принимать после еды, до неё или во время принятия пищи.
Прием Эссенциале® форте Н рекомендован во время еды. При этом лучше запивать капсулы достаточным количеством воды.1
При этом лучше запивать капсулы достаточным количеством воды.1
Сколько длится курс лечения?
Эссенциале® форте Н относится к группе гепатопротекторов — лекарств, которые способствуют улучшению функции и структуры печени, в случае нарушений в работе этого крайне важного органа. Из-за вредных воздействий, повышенной нагрузки или по другим причинам, клетки печени могут повреждаться. В этом случае им становится сложнее справляться со своей работой, а приём эссенциальных фосфолипидов способствует их восстановлению и правильному обмену веществ, что было подтверждено рядом исследований.2 Ограничений по продолжительности приема Эссенциале® форте Н не выявлено, однако рекомендуется проконсультироваться со специалистом, чтобы выбрать оптимальный курс и длительность приема.
Совместим ли этот препарат с другими?
Когда мы принимаем несколько препаратов, у нас может возникнуть вопрос о совместимости лекарственных средств. Эссенциальные фосфолипиды могут применяться в комплексной терапии неалкогольной жировой болезни печени.4 Стеатоз печени может сопровождаться сахарным диабетом, дислипидемией, артериальной гипертонией и другими сердечно-сосудистыми и метаболическими нарушениями.6 В этой связи можно отметить, что прием эссенциальных фосфолипидов может сочетаться с препаратами, снижающими уровень сахара и холестерина в крови.
Эссенциальные фосфолипиды могут применяться в комплексной терапии неалкогольной жировой болезни печени.4 Стеатоз печени может сопровождаться сахарным диабетом, дислипидемией, артериальной гипертонией и другими сердечно-сосудистыми и метаболическими нарушениями.6 В этой связи можно отметить, что прием эссенциальных фосфолипидов может сочетаться с препаратами, снижающими уровень сахара и холестерина в крови.
В то же время в случае одновременного приема Эссенциале® форте Н с антикоагулянтами (препаратами, влияющими на свертываемость крови), может понадобиться коррекция их дозы.1
С какого возраста можно использовать Эссенциале® форте Н?
Препарат должен применяться по показаниям. Прием Эссенциале® Форте Н возможен у взрослых и детей с 12 лет,
Можно ли использовать лекарство во время беременности или грудного вскармливания?
Применение любых лекарственных средств у беременных женщин и кормящих мам связано с возможным риском воздействия на плод или младенца. Эссенциале® форте Н у беременных женщин стоит использовать только в случае назначения врачом и под его строгим наблюдением. В то же время препарат не применяется при кормлении грудью в связи с недостаточной доказательной базой.1
Среди показаний к использованию препарата есть токсикоз беременности.1 Однако, любые вмешательства при этом состоянии должны проводиться только по решению специалиста и под профессиональным медицинским контролем.
инструкция по применению, аналоги, состав, показания
Доза зависит от типа, локализации и тяжести инфекции, чувствительности возбудителя, от возраста пациента и состояния функций его печени и почек.
Дозы, указанные в таблицах, приведенных ниже, являются рекомендованными дозами для применения при этих показаниях. В особенно тяжелых случаях следует рассматривать целесообразность назначения самых высоких доз из указанных диапазонов.
В особенно тяжелых случаях следует рассматривать целесообразность назначения самых высоких доз из указанных диапазонов.
Взрослые и дети старше 12 лет (масса тела >50 кг)
|
Доза1 |
Кратность применения2 |
Показания |
|
1-2 г |
1 раз в сутки |
Не госпитальные пневмонии. Обострение хронических обструктивных болезней легких. Интраабдоминальные инфекции. Осложненные инфекции мочевыводящих путей (в том числе пиелонефрит). |
|
2 г |
1 раз в сутки |
Внутрибольничные пневмонии. Инфекции костей и суставов |
|
2-4 г |
1 раз в сутки |
Пациентам с нейтропенией и лихорадкой, вызванной бактериальной инфекцией. Бактериальный эндокардит. Бактериальный менингит. |
[1]При установленной бактериемии рассматриваются наиболее высокие дозы из приведенного диапазона.
[1]При назначении препарата в дозе более чем 2 г в сутки рассматривается возможность применения препарата 2 раза в день.
Показания для взрослых и детей старше 12 лет (>50 кг), которые требуют специального режима введения препарата:
Острый средний отит: как правило, достаточно однократного внутримышечного введения препарата в дозе 1-2 г. Ограниченные данные свидетельствуют о том, что в тяжелых случаях или при отсутствии эффекта от предшествующей терапии, может быть эффективно внутримышечное введение цефтриаксона в дозе 1-2 г в сутки в течение 3 дней.
Предоперационная профилактика хирургических инфекций: однократное введение перед операцией в дозе 2 г.
Гонорея: однократное введение в дозе 0,5 г.
Сифилис: рекомендованные дозы 0,5 г или 1 г один раз в день увеличивают до 2 г один раз в день при нейросифилисе, продолжительность лечения 10-14 дней. Рекомендации по дозировке при сифилисе, в том числе при нейросифилисе, основаны на ограниченных данных. Необходимо принимать во внимание национальные и местные руководства.
Диссеминированный Лайм-боррелиоз (ранняя и поздняя стадия): применять в дозе 2 г один раз в сутки в течение 14-21 дня. Рекомендуемая продолжительность лечения варьирует.
Необходимо принимать во внимание национальные и местные руководства.
Применение у детей
Новорожденные, младенцы и дети от 15 дней до 12 лет (
|
Доза* |
Кратность применения** |
Показания |
|
50-80 мг/кг массы тела |
1 раз в сутки |
Интраабдоминальная инфекция. Негоспитальная пневмония. Госпитальная пневмония |
|
50-100 мг/кг массы тела (максимальная доза — 4 г) |
1 раз в сутки |
Осложненные инфекции кожи и мочевыводящих путей. Инфекции костей и суставов. Пациентам с нейтропенией с лихорадкой, вызванной бактериальной инфекцией. |
|
80-100 мг/кг массы тела (максимальная доза — 4 г) |
1 раз в сутки |
Бактериальный менингит |
|
100 мг/кг массы тела (максимальная доза — 4 г) |
1 раз в сутки |
Бактериальный эндокардит |
*При установленной бактериемии рассматриваются наиболее высокие дозы из приведенного диапазона.
**При назначении препарата в дозе более чем 2 г в сутки рассматривается возможность применения препарата 2 раза в день.
Показания для новорожденных, младенцев и детей от 15 дней до 12 лет (
Острый средний отит: как правило, достаточно однократного внутримышечного введения лекарственного средства в дозе 50 мг/кг массы тела.
Ограниченные данные свидетельствуют о том, что в тяжелых случаях или при отсутствии эффекта от предшествующей терапии, может быть эффективно внутримышечное введение цефтриаксона в дозе 50 мг/кг в сутки в течение 3 дней.
Предоперационная профилактика хирургических инфекций: однократное введение перед операцией в дозе 50-80 мг/кг массы тела.
Сифилис: рекомендованные дозы 75-100 мг/кг массы тела один раз в сутки, продолжительность лечения 10-14 дней. Рекомендации о дозировке при сифилисе, в том числе при нейросифилисе, основаны на ограниченных данных. Необходимо принимать во внимание национальные и местные руководства.
Необходимо принимать во внимание национальные и местные руководства.
Диссеминированный Лайм-боррелиоз (ранняя(П) и поздняя (III) стадия): применять в дозе 50-80 мг/кг массы тела один раз в сутки на протяжении 14-21 дня. Рекомендуемая продолжительность лечения варьирует. Необходимо принимать во внимание национальные и местные руководства.
Новорожденные в возрасте 0-14 дней
Цефтриаксон противопоказан недоношенным новорожденным в возрасте до 41 недели (гестационный возраст + хронологический возраст).
|
Доза* |
Кратность применения** |
Показания |
|
25-50 мг/кг массы тела |
1 раз в сутки |
Интраабдоминальные инфекции. Осложненные инфекции мочевыводящих путей (включая пиелонефрит). Негоспитальные пневмонии. Госпитальные пневмонии. Инфекции костей и суставов. Пациентам с нейтропенией и лихорадкой, вызванной бактериальной инфекцией. |
|
50 мг/кг массы тела |
1 раз в сутки |
Бактериальный менингит. Бактериальный эндокардит. |
*При установленной бактериемии рассматриваются наиболее высокие дозы из приведенного диапазона. Не превышать максимальную суточную дозу 50 мг/кг массы тела.
Показания для новорожденных в возрасте 0-14 дней, которые требуют специального режима введения препарата:
Острый средний отит
Как правило, достаточно однократного внутримышечного введения лекарственного средства в дозе 50 мг/кг массы тела.
Предоперационная профилактика хирургических инъекций
Однократное введение перед операцией в дозе 20-50 мг/кг массы тела.
Сифилис
Рекомендованная доза 50 мг/кг массы тела один раз в сутки, продолжительность лечения 10-14 дней. Рекомендации по дозировке при сифилисе, в том числе при нейросифилисе, основаны на ограниченных данных. Необходимо принимать во внимание национальные и местные руководства.
Продолжительность терапии
Продолжительность терапии зависит от течения заболевания. Применение цефтриаксона следует продолжать в течение 48-72 часов после нормализации температуры тела пациента или подтверждения эрадикации возбудителя.
Применение у лиц пожилого возраста
При условии нормального функционирование почек и печени коррекция дозы для пациентов пожилого возраста не требуется.
Применение у пациентов с нарушением функции печени
Имеющиеся данные не указывают на необходимость коррекции дозы цефтриаксона при легком или умеренном нарушении функции печени при условии нормальной функции почек.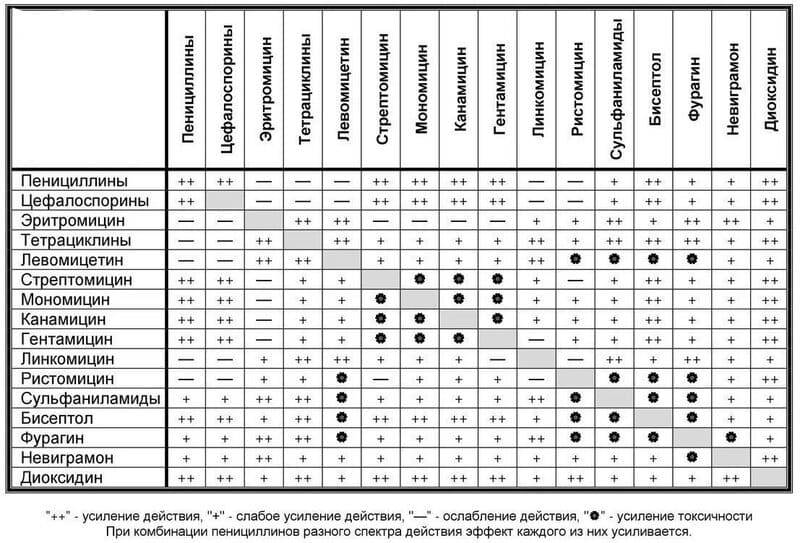 Исследования по применению препарата у пациентов с тяжелой печеночной недостаточностью не проводились.
Исследования по применению препарата у пациентов с тяжелой печеночной недостаточностью не проводились.
Применение у пациентов с нарушением функции почек
Имеющиеся данные не указывают на необходимость коррекции дозы цефтриаксона у пациентов с нарушениями функции почек при условии, что функция печени не нарушена. В случаях претерминальной почечной недостаточности (клиренс креатинина
Применение у пациентов с тяжелой печеночной и почечной недостаточностью
При применении цефтриаксона у пациентов с тяжелой почечной и печеночной недостаточностью необходим клинический контроль за безопасностью и эффективностью препарата.
Способ применения
Цефтриаксон следует применять в виде внутривенной инфузии в течение не менее 30 мин (предпочтительный путь), внутривенно струйно медленно в течение 5 мин или внутримышечно (глубокие инъекции).
Внутривенное струйное введение следует осуществлять в течение 5 мин предпочтительно в большие вены.
Внутривенные дозы 50 мг/кг или более у младенцев и детей до 12 лет следует вводить путем инфузии. У новорожденных продолжительность инфузии должна составлять более 60 минут, чтобы уменьшить потенциальный риск билирубиновой энцефалопатии.
Внутримышечное введение следует осуществлять в крупные мышцы, в одну мышцу вводить не более 1 г.
Цефтриаксон следует вводить внутримышечно в случаях, когда ввести препарат внутривенно нет возможности или внутримышечный путь введения является предпочтительным для пациента. Для доз, превышающих 2 г, следует использовать внутривенный способ введения.
Лидокаин запрещается использовать в качестве растворителя детям до 15 лет.
При использовании лидокаина в качестве растворителя внутривенное введение полученного раствора противопоказано. Перед введением такого раствора внутримышечно следует исключить у пациента противопоказания к применению лидокаина (см. инструкцию по применении лидокаина), а также учитывать аллергические реакции на лидокаин в анамнезе.
инструкцию по применении лидокаина), а также учитывать аллергические реакции на лидокаин в анамнезе.
При использовании лидокаина в качестве растворителя у лиц старше 15 лет рекомендуется провести внутрикожную аллергическую пробу на лидокаин.
Цефтриаксон противопоказан новорожденным при необходимости введения препаратов кальция или кальцийсодержащих растворов из-за риска образования преципитатов цефтриаксон-кальция в легких и почках.
Из-за риска образования осадка для растворения цефтриаксона не следует использовать кальцийсодержащие препараты (раствор Рингера, раствор Хартмана).
Также возникновение преципитатов кальциевых солей цефтриаксона может происходить при смешивании препарата с растворами, содержащими кальций, в одной инфузионной системе для внутривенного введения. Поэтому не следует смешивать или одновременно применять цефтриаксон и растворы, содержащие кальций.
Для предоперационной профилактики хирургических инфекций цефтриаксон следует вводить за 30-90 минут до операции.
Приготовления растворов
Для внутримышечной инъекции 1 г растворяют в 3,5 мл 1% раствора лидокаина; инъекцию делают глубоко в ягодичную мышцу. Рекомендуется вводить не более 1 г в одну ягодицу.
Концентрация для внутривенных инъекций: 100 мг/мл. Для внутривенной инъекции растворяют 1 г цефтриаксона в 10 мл воды для инъекций. Концентрация для внутривенных инфузии: 50 мг/мл. Для приготовления раствора для инфузии следует растворить 2 г цефтриаксона в 40 мл одного из следующих инфузионных растворов, свободных от ионов кальция: 0,9% раствор хлорида натрия, раствор хлорида натрия 0,45% + раствор глюкозы 2,5%, раствор глюкозы 5% или 10%, раствор декстрана 6% в растворе глюкозы 5%, 6-10% гидроксиэтилированный крахмал. Учитывая возможную несовместимость, растворы, содержащие цефтриаксон, нельзя смешивать с растворами, содержащими другие антибиотики, как при приготовлении, так и при введении.
Совместимы ли цефтриаксон и алкоголь?
Цефтриаксон — это лекарственный препарат, который просто так, без показаний, ни один здравомыслящий врач не назначит и ни один человек не начнет его принимать без особых на то показаний. Поэтому если человеку выписали этот антибиотик, значит, со здоровьем у него не все гладко. Тем более, что он сильнодействующий и при заболеваниях легкого характера врачи отдаю предпочтение препаратам послабее.
Поэтому если человеку выписали этот антибиотик, значит, со здоровьем у него не все гладко. Тем более, что он сильнодействующий и при заболеваниях легкого характера врачи отдаю предпочтение препаратам послабее.
Содержание
Цефтриаксон — антибиотик широкого спектра действия
Цефтриаксон относится к группе цефалоспоринов и является одним из самых эффективных ее представителей. Он высокоактивный к разным микроорганизмам, поэтому эффективен при разных заболеваниях. С помощью Цефтриаксона лечат такие заболевания как сепсис, пневмония, менингит, заболевания органов брюшной полости — инфекции желчевыводящих путей и желчного пузыря, перитонит, инфекции желудочно-кишечного тракта, различные инфекции мягких тканей, кожи, костей и суставов.
Инфекции органов малого таза, мочевыводящих путей и почек, заболевания ЛОР-органов инфекционного характера, раневые инфекции — все это также показания к приему Цефтриаксона.
Как и все остальные антибиотики, Цефтриаксон не только приносит выздоровление, но и вред всему организму. Особенно негативному влиянию поддаются печень и почки.
Особенно негативному влиянию поддаются печень и почки.
Именно поэтому вопрос «Цефтриаксон и алколголь?» имеет однозначный ответ: категорическое «Нет!». Ведь двойной удар для организма может оказаться слишком сильным, он его попросту может не выдержать.
Хотя это — не единственная причина, которая «не разрешает» сочетать данный антибиотик с алкоголем. Снижение эффективности препарата и возможность развития побочных реакций — вот чего стоит бояться при таком сочетании.
Цефтриаксон и алкоголь — совместимы ли они?
Ответ на этот вопрос приведен выше. Стоит перечислить проявления побочных реакций:
- Аллергические реакции — кожный зуд, крапивница, отек Квинке, эритема, сывороточная болезнь, лихорадка, эозинофилия, анафилактический шок, бронхоспазм, абдоминальная боль.
- Со стороны нервной системы: сильная головная боль и головокружение.
- Местные реакции — боль на месте введения препарата.
- Со стороны мочевыводящей системы — уменьшение суточного количества мочи.

- Со стороны органов кроветворения: лейкопения, анемия, гранулоцитопения, базофилия, тромбоцитоз, удлинение протромбинового времени.
- Со стороны пищеварительной системы: нарушения вкуса, тошнота, диарея, рвота, метеоризм, стоматит, глоссит, дисбактериоз.
- Другое — носовые кровотечения, развитие грибковых инфекций.
Кроме этого, существует так называемая дисульфирамподобная реакция, которая развивается при сочетании алкоголя с цефалоспоринами. Ее можно сравнить с таким состоянием, как употребление спиртных напитков человеком, который от него «закодировался»: возникает внезапная сильная тошнота и резкая неудержимая сильная рвота, тахикардия и одышка, лицо становится ярко-красным, а артериальное давление резко понижается, в животе — резкие сильные боли и спазмы.
Такие реакции возможны даже после употребления нескольких глотков вина или слабоалкогольного напитка.
Так как лекарственные препараты могут вступать в химические реакции с алкоголем (и никогда неизвестно, как именно организм отреагирует), медицина вообще запрещает смешивать эти два элемента.
Возможные последствия можно только предполагать, но стоит ли подвергать такому риску собственное здоровье?
Скептики, а другими словами — любители выпить, находят разные аргументы, «подтверждающие», что при приеме антибиотиков не стоит объявлять «сухой закон» и отказывать себе в алкоголе. Например, существует такая прибаутка: миф о несовместимости антибиотиков и алкоголя придумали американцы в военные времена. Тогда солдатам давали пенициллин, а из-за нехватки лекарств, их мочу также использовали в лечебных целях — в ней содержалось достаточное количество препарата. Солдаты же баловали себя пивом, которое, как известно, разбавляет мочу, и, соответственно, концентрация пенициллина уменьшалась. Именно поэтому и придумали «страшилку» о возможных осложнениях.
Конечно, можно твердить, что это — правда. Но все-таки стоит задуматься о собственном здоровье: врачи верят в здравый смысл и именно поэтому категорически запрещают при приеме Цефтриаксона употреблять спиртные напитки. К тому же не рекомендуется выпивать и в первые дни (и даже недели) после отмены данного препарата. Почему? Организму необходимо время, чтобы полностью очиститься от продуктов распада и набраться сил, чтобы снова вступить в борьбу против очередного яда, то есть — алкоголя.
К тому же не рекомендуется выпивать и в первые дни (и даже недели) после отмены данного препарата. Почему? Организму необходимо время, чтобы полностью очиститься от продуктов распада и набраться сил, чтобы снова вступить в борьбу против очередного яда, то есть — алкоголя.
потенциальная роль в модуляции уровней глутамата xCT и GLT1 у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправляйте корреспонденцию: доктору Юсефу Сари, Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Толедо, Огайо 43614 [email protected] Тел: 419-383 -1507 (Office) Окончательная отредактированная версия этой статьи издателем доступна в J Mol Neurosci. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс. Данные свидетельствуют о том, что различные эффекты, включающие изменения глутаматергической нейротрансмиссии, возникают после длительного употребления этанола.В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов P крыс. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первой внутрибрюшинной инъекции цефтриаксона) по 14-й день, , через 10 дней после последней инъекции .Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя.
Данные свидетельствуют о том, что различные эффекты, включающие изменения глутаматергической нейротрансмиссии, возникают после длительного употребления этанола.В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов P крыс. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первой внутрибрюшинной инъекции цефтриаксона) по 14-й день, , через 10 дней после последней инъекции .Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках модели — хронического потребления . Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга.Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
. Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках модели — хронического потребления . Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга.Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011, Sari et al., 2011, Bahi et al. , 2012 ), как было показано, взаимодействуют с глутаматергической системой в различных областях мозга.
, 2012 ), как было показано, взаимодействуют с глутаматергической системой в различных областях мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al.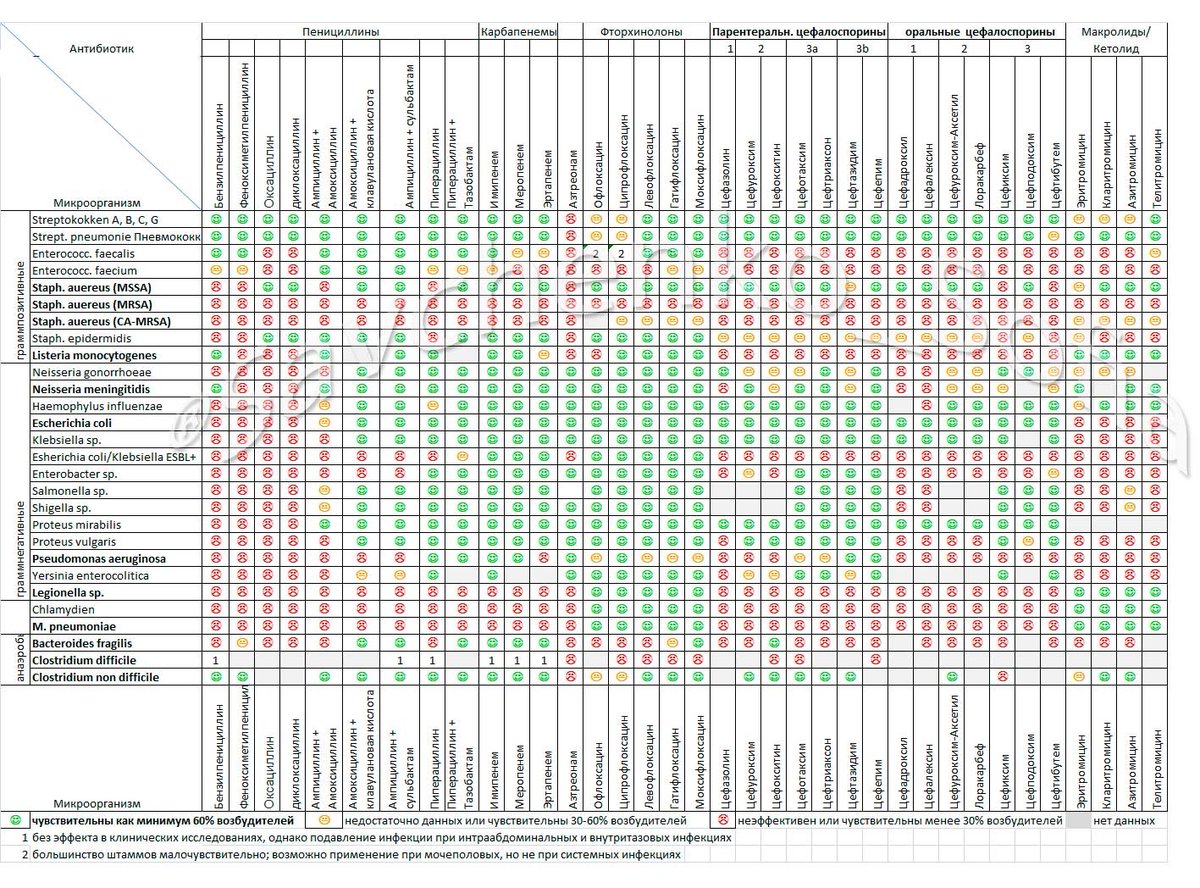 , 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
, 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c — , которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркозависимости (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al. , 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, таким образом, восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
, 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, таким образом, восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола. P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета Индианы (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, и средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по институциональному уходу за животными и их использованию Университета Толедо, Health Science Campus, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылок. Мы выбрали лечение животных в течение 5 дней на основании предыдущих и недавних исследований из нашей лаборатории и других, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, веса тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарствами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14-й день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем ингаляции и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченные пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группами, получавшими цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± SEM. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± SEM. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± SEM.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± SEM. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± SEM. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов крыс P.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейромедиаторов, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую связаны с развитием поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Дин З.М., Энглман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис, штат Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверит Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего участка в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Кау К.С., Мадаяг А., Манч Дж. Р., Грир, доктор медицины, Абдулхамид О., Бейкер Д.А. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамат-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое ингибирование метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в субрегионах прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Цефтриаксон-индуцированная повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Zarrindast MR, Meshkani J, Rezayof A, Beigzadeh R., Rostami P. Никотиновые ацетилхолиновые рецепторы дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
потенциальная роль xCT и GLT1 в модуляции уровня глутамата у самцов крыс P
J Mol Neurosci. Авторская рукопись; доступно в PMC 2015 1 сентября 2015 г.
Опубликован в окончательной редакции как:
PMCID: PMC4127185
NIHMSID: NIHMS567451
P.S.S. Рао
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
Юсеф Сари
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
1 Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Толедо, Огайо.
* Отправить корреспонденцию: Доктору Юсефу Сари Университет Толедо, Колледж фармации и фармацевтических наук, Департамент фармакологии, Медицинский научный кампус, 3000 Арлингтон-авеню, HEB282G Toledo, OH 43614 [email protected] Тел: 419-383-1507 (офис) Окончательная отредактированная версия этой статьи издателем доступна на сайте J Mol Neurosci. См. другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Было высказано предположение, что изменения глутаматергической нейротрансмиссии влияют на многие аспекты нейропластичности, связанные с алкогольной / наркотической зависимостью. Ранее мы показали, что цефтриаксон, β-лактамный антибиотик, который, как известно, активирует переносчик глутамата 1 (GLT1), снижает потребление этанола после пяти недель употребления этанола по свободному выбору у самцов предпочитающих алкоголь (P) крыс.Данные свидетельствуют о том, что различные эффекты, включающие изменения глутаматергической нейротрансмиссии, возникают после длительного употребления этанола. В этом исследовании мы проверили, сохраняется ли эффективность введения цефтриаксона после 14 недель свободного доступа к 15% и 30% этанолу у самцов P крыс. После 14 недель потребления этанола самцам крыс P вводили цефтриаксон (100 мг / кг, внутрибрюшинно) или физиологический раствор в течение пяти дней. Мы обнаружили, что лечение цефтриаксоном привело к значительному снижению потребления этанола, начиная со 2-го дня (48 часов после первого i.п. инъекции цефтриаксона) до 14-го дня, , 10 дней после последней инъекции . Вестерн-блот-анализ образцов головного мозга животных, умерщвленных через 24 часа после обработки последней дозой цефтриаксона, выявил значительную повышающую регуляцию уровней цистин / глутаматного обменника (xCT) и уровней GLT1 в префронтальной коре, прилежащем ядре и миндалине по сравнению с группой, получавшей солевой раствор носителя. . Эти результаты продемонстрировали эффективность цефтриаксона в снижении потребления этанола в рамках модели — хронического потребления .Частично это может быть связано с повышением уровня как xCT, так и GLT1 в областях вознаграждения мозга. Таким образом, препарат обладает потенциальным терапевтическим действием при лечении алкогольной зависимости.
Ключевые слова: глутамат, крысы, предпочитающие алкоголь, хроническое воздействие этанола, xCT, GLT1
Введение
Глутаматергическая система была предложена в качестве одной из систем нейротрансмиттеров, ответственных за развитие злоупотребления наркотиками. Среди наркотиков, вызывающих злоупотребление, обладают усиливающими / вознаграждающими свойствами кокаина (Sari et al., 2009, Li et al., 2010, Moussawi et al., 2011, Lu et al., 2012), героин (Bossert et al., 2012) и этанол (Obara et al., 2009, Cannady et al., 2011 , Sari et al., 2011, Bahi et al., 2012), как было показано, взаимодействуют с глутаматергической системой в различных областях вознаграждения мозга.
Употребление алкоголя может привести к заметному изменению уровней внеклеточного глутамата в центральных областях мозга, отвечающих за вознаграждение [См. Обзор исх. (Рао и Сари, 2012)]. Повышение уровней внеклеточного глутамата в областях вознаграждения мозга наблюдалось после введения этанола (Dahchour et al., 2000, Капасова, Шумлински, 2008, Динг и др., 2012). С другой стороны, во время отмены этанола наблюдались повышенные уровни внеклеточного глутамата в прилежащем ядре (NAc) (Dahchour et al., 1998). Примечательно, что уровни внеклеточного глутамата регулируются несколькими переносчиками глутамата, распределенными в нейронах и глии (Gegelashvili and Schousboe, 1997, Seal and Amara, 1999, Anderson and Swanson, 2000). Среди этих переносчиков, переносчик глутамата 1 (GLT1), его человеческий гомолог является переносчиком возбуждающих аминокислот 2 (EAAT2), как предполагается, регулирует удаление большей части внеклеточного глутамата (Ginsberg et al., 1995, Ротштейн и др., 1995, Данболт, 2001, Митани и Танака, 2003). Недавно мы сообщили, что потребление этанола в течение пяти недель вызывает снижение уровня GLT1 в NAc (Sari and Sreemantula, 2012). Точно так же уровень GLT1 снижался в NAc после самостоятельного введения кокаина (Knackstedt et al., 2010). Подавление экспрессии GLT1 было обращено лечением цефтриаксоном, β-лактамным антибиотиком, который, как известно, повышает уровень GLT1 (Rothstein et al., 2005), в NAc и префронтальной коре (PFC) на животных моделях воздействия кокаина и этанола (Sari et al. ., 2009, Knackstedt et al., 2010, Sari et al., 2011).
Исследования продемонстрировали роль системы x c — , которая представляет собой цистин / глутаматный обменник (xCT), в нескольких моделях наркозависимости (Baker et al., 2003, Knackstedt et al., 2010, Moussawi и др., 2011). Воздействие кокаина, например, приводит к снижению активности системы x c — , в то время как активность системы увеличивается x c — предотвращает восстановление (Baker et al., 2003, Madayag et al., 2007). Сходным образом, самовведение никотина крысам снижает экспрессию каталитической субъединицы цистин-глутаматного обменника, xCT, в NAc и VTA (Knackstedt et al., 2010). Было показано, что после самостоятельного введения кокаина крысам цефтриаксон усиливает экспрессию xCT в NAc и восстанавливает активность системы x c —, таким образом, восстанавливая гомеостаз глутамата (Knackstedt et al., 2010, Trantham-Davidson et al., 2012).
Недавние исследования нашей лаборатории с использованием пятинедельной модели потребления этанола свободного выбора выявили связь ослабления потребления этанола и активации GLT1 с цефтриаксоном или нейроиммунофилином GPI-1046 в NAc и PFC (Sari et al., 2011, Sari and Sreemantula, 2012). В настоящем исследовании мы стремились определить эффективность лечения цефтриаксоном в отношении потребления этанола у крыс P после 14 недель потребления этанола, что считается парадигмой хронического воздействия этанола.P-крысы были выбраны в качестве подходящей животной модели для настоящего исследования и предыдущих исследований в нашей лаборатории из-за их предпочтения свободному выбору этанола (Murphy et al., 2002, Bell et al., 2006). Важно отметить, что длительное воздействие этанола вызывало изменения глутаматергической системы и других систем нейромедиаторов, включая дофаминергическую и холинергическую системы (Syvalahti et al., 1988, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). Мы исследовали эффективность цефтриаксона при приеме этанола во время лечения и после лечения, которое длилось 10 дней после последнего внутрибрюшинного введения. инъекция препарата. Важно отметить, что we также исследовали уровни xCT, и GLT1 в PFC, NAc и миндалине (AMG) в группе, получавшей цефтриаксон, по сравнению с группой, получавшей физиологический раствор, через 24 часа после последней инъекции .
Материалы и методы
Животные
Самцы крыс P были получены из племенных колоний Медицинской школы Университета Индианы (Индианаполис, Индиана).После привыкания к виварию в помещении для лабораторных животных в Университете Толедо, животных содержали по одному в пластиковые клетки с подстилкой из древесной стружки при контролируемой температуре (21 ° C) и влажности (50%) виварии, поддерживаемом в течение 12/12 часов. цикл свет / темнота. В начале эксперимента всем животным было не менее 90 дней, и средний вес составлял 417 ± 5 г (среднее значение ± стандартная ошибка среднего). Крысы имели доступ к пище и воде ad lib на протяжении всего исследования. Протоколы, использованные в этом исследовании, были одобрены Комитетом по институциональному уходу за животными и их использованию Университета Толедо, Health Science Campus, Толедо, Огайо.Эти протоколы были разработаны на основе руководящих принципов, изложенных Комитетом по уходу и использованию институциональных животных Национального института здравоохранения и Руководства по уходу и использованию лабораторных животных (Институт ресурсов лабораторных животных, Комиссия по наукам о жизни, 1996 г. ). Животные были разделены на две группы во время обработки физиологическим раствором-носителем или лекарственным средством: 1) группа, обработанная физиологическим раствором-носителем (n = 6) и 2) группа, обработанная цефтриаксоном (100 мг / кг, внутрибрюшинно) (n = 10). Цефтриаксон вводили в виде раствора в физиологическом растворе.Обе группы животных имели доступ к этанолу (15% и 30%) по выбору, воде и пище.
Потребление этанола
Все крысы P имели свободный доступ к двум концентрациям этанола, 15% и 30% в дистиллированной воде на протяжении всего исследования. Животным давали свободный выбор этанола, воды и корма в течение 14 недель подряд. Это устоявшаяся модель употребления этанола, состоящая из нескольких вариантов этанола (15% и 30%), которая, как известно, увеличивает потребление этанола у крыс P (Rodd-Henricks et al., 2001, Сари и др., 2006). Начиная с 11 недели потребление этанола, потребление воды и вес тела всех животных измеряли три раза в неделю (понедельник, среда и пятница). После завершения 14 недель доступа этанола животных случайным образом делили на группы, получавшие физиологический раствор и цефтриаксон. Цефтриаксон вводили один раз в день в течение пяти дней около полудня во время взвешивания бутылок. Мы выбрали лечение животных в течение 5 дней на основании предыдущих и недавних исследований из нашей лаборатории и других, демонстрирующих, что этот период эффективен для повышения уровня GLT1 (Rothstein et al., 2005, Миллер и др., 2008, Сари и др., 2009, Сари и др., 2011). Исходное значение для трех параметров, веса тела, потребления воды и потребления этанола, было основано на среднем значении данных за последние две недели до введения физиологического раствора или лечения лекарствами (недели 13 и 14). Измерения этанола производили с точностью до ближайших 10 – грамма путем вычитания веса бутылки из ее предыдущего веса. Важно отметить, что животные с исходным уровнем потребления этанола менее 4 г / день не были включены в это исследование, и впоследствии они были умерщвлены.После воздействия этанола произвольного выбора в течение 14 недель каждое животное внутрибрюшинно. вводили физиологический раствор или цефтриаксон (100 мг / кг) в течение 5 дней подряд. После i.p. После инъекций крыс ежедневно контролировали на предмет потребления этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции препарата (день 6). для определения уровней xCT и GLT1 в , NAc, PFC и AMG в этот момент времени.
Извлечение ткани головного мозга
Через десять дней после последней инъекции, 14-й день, оставшиеся животные были умерщвлены путем воздействия CO 2 путем ингаляции и затем обезглавлены. Мозг немедленно удаляли и хранили при -70 ° C. Области мозга (NAc, PFC и AMG) выделяли и стереотаксически микроперфорировали стереотаксически с использованием криостата, поддерживаемого при -20 ° C. Координаты участка экстракции были в соответствии с Атласом Паксиноса и Ватсона мозга крысы.Затем области мозга хранили замороженными при -70 ° C до анализа вестерн-блоттингом (Paxinos and Watson, 2007).
Вестерн-блот-анализ
Вестерн-блот-анализ был проведен на образцах ткани мозга для определения уровня экспрессии GLT1 с использованием ранее описанной процедуры (Sari et al., 2009, Sari et al., 2010, Sari et al., 2011 ). Вкратце, области мозга (NAc, AMG и PFC) гомогенизировали в буфере для лизиса и определяли количество общих белков (Bio-Rad, Hercules, Калифорния, США).После экстракции белки в равных количествах из обеих групп (группы, обработанные физиологическим раствором, носителем и цефтриаксоном) загружали в 10-20% глициновый гель (Invitrogen). После завершения белки были электрофоретически перенесены из геля на PVDF-мембрану. Затем мембрану блокировали 3% молоком в трис-буферном солевом растворе Tween 20 при комнатной температуре. Затем к блокирующему буферу добавляли анти-GLT1 морской свинки (Millipore; разведение 1: 5000) или кроличье антитело против xCT (Novus; разведение 1: 1000) и инкубировали мембрану в течение ночи при 4 ° C.В этом исследовании использовали меченные пероксидазой хрена вторичные антитела против морских свинок или против кроликов в разведении 1: 5000. Пленку Kodak BioMax MR использовали для захвата хемилюминесцентного сигнала от HRP. Дальнейшее проявление пленки производилось на аппарате SRX-101A. Антитело GAPDH использовали в качестве маркера загрузки. Иммуноблоты были оцифрованы с использованием системы MCID, и данные были представлены как соотношение GLT-1 / GAPDH и xCT / GAPDH.
Статистический анализ
Мы использовали общие линейные модели (GLM) с повторными измерениями для статистического анализа (SPSS) данных, связанных с потреблением этанола, потреблением воды и массой тела крысы.Кроме того, чтобы наблюдать дневной эффект лечения, данные были повторно проанализированы с использованием однофакторного дисперсионного анализа (SPSS). Данные о соотношении GLT1 / GAPDH и xCT / GAPDH были статистически проанализированы с использованием независимого t-критерия для сравнения между группами, получавшими физиологический раствор (день 14) и группами, получавшими цефтриаксон (день 6). Все статистические тесты были основаны на уровне значимости p <0,05.
Результаты
Влияние цефтриаксона на потребление этанола
Влияние лечения цефтриаксоном на потребление этанола отслеживали в течение 14 дней.представляет собой среднее потребление этанола крысами P (г / кг / день), которым вводили цефтриаксон (100 мг / кг) или физиологический раствор. Исходное значение представляет собой среднее потребление этанола за две недели, предшествующие первой инъекции. Анализ повторных измерений GLM, сравнивающий потребление этанола между двумя группами, выявил значительный основной эффект дня [F (1,14) = 10,81, p <0,05)] и значительный день X Эффект взаимодействия лечения [F (1,14) ) = 4,11, p <0,05)]. Однофакторный дисперсионный анализ показал, что снижение потребления этанола, вызванное лечением цефтриаксоном, было статистически значимым (p <0.05) со 2-го по 14-й день.
Ежедневное потребление этанола крысами P после обработки физиологическим раствором-носителем (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднее потребление этанола во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднее потребление этанола в течение двухнедельного периода, предшествующего лечению. На основании повторных измерений GLM было обнаружено, что лечение цефтриаксоном привело к значительному снижению потребления этанола по сравнению с контрольной группой, получавшей физиологический раствор.Данные выражены как среднее ± SEM. (*: p <0,05)
Влияние цефтриаксона на потребление воды
представляет собой среднее потребление воды двумя группами крыс P в ходе исследования. Было обнаружено, что после обработки цефтриаксоном крысы P потребляли значительно большее количество воды по сравнению с животными, получавшими физиологический раствор. Наблюдался значительный основной эффект Дня [F (1,14) = 8,5, p <0,05)] наряду со значительным эффектом взаимодействия Дня X с лечением [F (1,14) = 6.4, р <0,05)]. Результаты однофакторного дисперсионного анализа показали, что значительно более высокое потребление воды продолжалось с 3-го по 12-й день.
Ежедневное потребление воды самцами крыс P, получавших солевой раствор (n = 6) или цефтриаксон (100 мг / кг, n = 6). ). График представляет среднесуточное потребление воды в обеих группах. Исходное значение отражает среднее потребление воды в течение двухнедельного периода, предшествующего лечению. Статистический анализ (повторные измерения GLM) показал, что группа, получавшая цефтриаксон, потребляла большее количество воды в день по сравнению с группой, получавшей солевой раствор.Данные выражены как среднее ± SEM. (*: p <0,05)
Влияние цефтриаксона на массу тела крыс P
На протяжении всего исследования отслеживали массу тела крыс P (). Анализ повторных измерений GLM, сравнивающий массу тела животных между двумя группами, выявил значительный основной эффект дня [F (1,14) = 2,85, p <0,05)] наряду со значительным эффектом взаимодействия дня X с лечением [F (1, 14) = 12,6, р <0,05)]. Однако односторонний дисперсионный анализ не выявил каких-либо значительных различий в массе тела между двумя группами ни во время лечения, ни в конце исследования (p> 0.05).
Суточная масса тела самцов крыс P после обработки физиологическим раствором (n = 6) или цефтриаксоном (100 мг / кг, n = 6). График представляет среднюю массу тела во время лечения (дни 1-5) и после лечения (дни 6-14). Исходное значение отражает среднюю массу тела в течение двухнедельного периода, предшествующего лечению. Однофакторный дисперсионный анализ не выявил какой-либо значимой разницы (p> 0,05) в массе тела между группами, получавшими физиологический раствор, носитель и цефтриаксон, во время лечения или в конце исследования.Данные выражены как среднее ± SEM.
Влияние цефтриаксона на экспрессию xCT и GLT1
Мы исследовали влияние цефтриаксона на уровни GLT1 и xCT на 6-й день у PFC, NAc и AMG по сравнению с крысами, получавшими физиологический раствор. и (верхняя панель) показаны иммуноблоты для GLT1 и xCT вместе с маркером нагрузки в группах, получавших физиологический раствор и цефтриаксон, для трех областей мозга. Статистический анализ с использованием t-критерия Стьюдента показал значительную разницу в экспрессии GLT1 и xCT между группой, получавшей цефтриаксон, и группой, получавшей физиологический раствор (и, нижняя панель).Среднее процентное повышение уровня GLT1 после лечения цефтриаксоном в NAc (p = 0,0004), PFC (p = 0,019) и AMG (p = 0,016) составило 51%, 59% и 52% соответственно по сравнению с контрольная группа. Кроме того, было обнаружено, что экспрессия xCT повышается на 36%, 19% и 44% в NAc (p = 0,031), PFC (p = 0,012) и AMG (p = 0,029), соответственно.
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) по сравнению с группой, получавшей физиологический раствор, на экспрессию GLT1 в префронтальной коре (PFC), прилежащем ядре (NAc) и миндалины (AMG) по сравнению с контрольными животными, получавшими физиологический раствор (день 14).(A) Иммуноблоттинг для GLT1 и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении GLT1 / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± SEM. (* p <0,05; *** p <0,001)
Влияние лечения цефтриаксоном (CEF, 100 мг / кг, n = 4) (, 24 часа после лечения, ) на экспрессию xCT в префронтальной коре (PFC ), прилежащем ядре (NAc) и миндалине (AMG) по сравнению с контрольной группой, получавшей физиологический раствор (день 14).(A) Иммуноблоттинг для xCT и GAPDH в качестве маркера контроля нагрузки для соответствующих областей мозга. (B) Количественный анализ иммуноблотов выявил значительную разницу в соотношении xCT / GAPDH во всех областях мозга в группе, получавшей цефтриаксон, по сравнению с животными, получавшими физиологический раствор (100%). Данные выражены как среднее ± SEM. (* p <0,05)
Обсуждение
В этом исследовании мы сообщаем, что после 14 недель хронического приема этанола лечение цефтриаксоном (100 мг / кг) способствовало снижению суточного потребления этанола у самцов крыс P.Эффективность лечения сохранялась до 10 дней после последнего внутрибрюшинного введения. инъекция цефтриаксона. В то же время цефтриаксон не вызывал каких-либо изменений массы тела обработанных животных по сравнению с контрольной группой (солевой раствор). Однако было обнаружено, что животные, получавшие цефтриаксон, потребляли значительно большее количество воды после обработки. Как было обнаружено в недавнем исследовании, в котором использовалась парадигма употребления этанола в течение пяти недель (Sari et al., 2011), увеличение потребления воды может быть компенсирующим механизмом для сокращения потребления этанола.Наряду с длительным эффектом снижения потребления этанола, лечение цефтриаксоном привело к статистически значимому повышению уровней xCT и GLT1 в PFC, NAc и AMG через 24 часа после последней инъекции по сравнению с группой, получавшей физиологический раствор. Важно отметить, что изменения на уровнях xCT и GLT1 наблюдались в мезокортиколимбической цепи вознаграждения дофамина, такой как NAc и PFC и связанная с ней область мозга (AMG) расширенной миндалины.
Усиление лекарственного средства связано с различными областями вознаграждения мозга, в частности с PFC (Goldstein and Volkow, 2002), NAc (Childress et al., 1999, Obara et al., 2009) и AMG (Zarrindast et al., 2010, Sinclair et al., 2012, Christian et al., 2013). Хотя хорошо известно, что дофамин является одним из основных нейромедиаторов, ответственных за развитие наркотической зависимости и (Anderson and Swanson, 2000, Ito et al., 2004), исследования, сосредоточенные на этих центрах вознаграждения мозга, ясно продемонстрировали и лежащая в основе взаимосвязь между глутаматергической передачей и злоупотреблением этанолом (Carrara-Nascimento et al., 2011, Gass et al., 2011, Мишра и др., 2012). Исследования, направленные на изучение основных причин нарушения гомеостаза глутамата вокруг центров вознаграждения мозга, выявили , что изменяют s в экспрессии двух ключевых белков, экспрессируемых на глиальных клетках, xCT (Baker et al., 2003, Knackstedt et al. , 2010) и GLT1 (Rothstein et al., 2005, Sari et al., 2009, Sari et al., 2011, Sari and Sreemantula, 2012), связаны со злоупотреблением наркотиками.
Снижение активности / экспрессии xCT было показано на нескольких моделях злоупотребления наркотиками.Исследования связывают злоупотребление кокаином с снижением уровня xCT на в NAc и, в свою очередь, снижением уровня xCT , как было показано, способствует поведению, связанному с поиском наркотиков (Baker et al., 2003, Kau et al., 2008). Было показано, что xCT может регулировать уровни несинаптических уровней глутамата, которые стимулируют ингибирующий пресинаптический рецептор mGluR 2/3 (Moran et al., 2005). Мы предполагаем, что повышенные уровни xCT в областях мозга после лечения цефтриаксоном будут модулировать возбуждающую глутаматергическую передачу и, таким образом, снизить потребление этанола .
Кроме того, регулирование уровней внеклеточного глутамата посредством изменений в экспрессии GLT1 ранее было продемонстрировано как эффективная стратегия лечения алкогольной зависимости (Sari et al., 2011, Sari and Sreemantula, 2012). В пятинедельной схеме лечение цефтриаксоном или GPI-1046 вызывало заметное изменение экспрессии GLT1 как в NAc, так и в PFC. Обратите внимание, что мы недавно обнаружили, что потребление этанола в течение пяти недель приводит к снижению уровня GLT1 в NAc (Sari and Sreemantula, 2012).Подавлению уровня GLT1 в NAc противодействовало лечение GPI-1046, которое, как известно, усиливает экспрессию GLT1 (Ganel et al., 2006, Sari and Sreemantula, 2012).
Длительное воздействие этанола вызывает изменения активности различных нейротрансмиттеров, включая глутаматергической системы (Syvalahti et al., 1988, Weiss et al., 1993, Weiss et al., 1996, Engleman et al., 2002, Thielen et al., 2004, Sari et al., 2006, Zhou et al., 2006, Szumlinski et al., 2008). В этом исследовании мы проверили, может ли цефтриаксон быть полезным для , восстанавливая гомеостаз глутамата посредством регуляции экспрессии xCT и GLT1 после хронического воздействия этанола. Таким образом, для определения эффективности цефтриаксона была использована парадигма 14-недельного хронического употребления этанола. Очевидно, цефтриаксон был эффективен в снижении потребления этанола в этой парадигме хронического потребления этанола в году. Мы предполагаем, что повышенные уровни xCT и GLT1 в PFC, NAc и AMG при лечении цефтриаксоном могут восстанавливать гомеостаз внеклеточного глутамата , что приводит к и ослаблению потребления этанола.Пониженные уровни xCT и GLT1 напрямую связаны с развитием поведения, подобного зависимости (Reissner and Kalivas, 2010). Следовательно, увеличивает s в уровнях xCT и GLT1 может непосредственно подразумевать снижение внеклеточных уровней глутамата, что, следовательно, приводит к уменьшению потребления этанола. Эти наблюдения, кроме того, подтверждают фармакологический механизм действия на опосредованное цефтриаксоном снижение поведения при употреблении этанола при употреблении алкоголя .Дальнейшие исследования, сфокусированные на молекулярных механизмах, участвующих в повышении уровня GLT1 и xCT после лечения цефтриаксоном, предоставят информацию о новых молекулярных мишенях для лечения алкогольной зависимости. Кроме того, дозозависимые эффекты цефтриаксона на уровни GT1 и xCT заслуживают исследования для оценки эффективности этого препарата.
Здесь мы делаем вывод, что даже после обширного (14-недельного) воздействия этанола цефтриаксон ослабляет потребление этанола у крыс P.Повышение уровня xCT и GLT1 в NAc, PFC и AMG после введения цефтриаксона, по-видимому, частично связано с этими сокращениями потребления этанола (). Эти данные подтверждают эффективность и длительное действие цефтриаксона на потребление этанола , которое может быть частично опосредовано активацией двух важных глиальных белков, таких как xCT и GLT1. Таким образом, цефтриаксон можно рассматривать как потенциальный препарат для лечения алкогольной зависимости.
Благодарности
Эта работа была поддержана премией № R01AA019458 (Y.S.) от Национальных институтов по злоупотреблению алкоголем и алкоголизму. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения Национального института злоупотребления алкоголем и алкоголизмом или Национального института здравоохранения.
Сноски
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов.
Ссылки
- Anderson CM, Swanson RA.Транспорт глутамата астроцитов: обзор свойств, регуляции и физиологических функций. Глия. 2000; 32: 1–14. [PubMed] [Google Scholar]
- Bahi A, Fizia K, Dietz M, Gasparini F, Flor PJ. Фармакологическая модуляция mGluR7 с помощью AMN082 и MMPIP оказывает специфическое влияние на потребление и предпочтение алкоголя у крыс. Биология зависимости. 2012; 17: 235–247. [PubMed] [Google Scholar]
- Бейкер Д.А., МакФарланд К., Лейк-РВ, Шен Х., Тан XC, Тода С., Каливас П.В. Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина.Nat Neurosci. 2003; 6: 743–749. [PubMed] [Google Scholar]
- Белл Р.Л., Родд З.А., Люменг Л., Мерфи Дж. М., Макбрайд В. Дж.. Предпочитающие алкоголь модели чрезмерного употребления алкоголя на крысах и животных. Биология зависимости. 2006. 11: 270–288. [PubMed] [Google Scholar]
- Bossert JM, Stern AL, Theberge FR, Marchant NJ, Wang HL, Morales M, Shaham Y. Роль проекций из вентральной медиальной префронтальной коры на прилежащее ядро в вызванном контекстом возобновлении поиска героина . Журнал неврологии: официальный журнал Общества неврологии.2012; 32: 4982–4991. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Cannady R, Grondin JJ, Fisher KR, Hodge CW, Besheer J. Активация метаботропных глутаматных рецепторов группы II подавляет дискриминационные стимулирующие эффекты алкоголя за счет избирательной активности в миндалине. Neuropsychopharmacol. 2011; 36: 2328–2338. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Carrara-Nascimento PF, Griffin WC, 3rd, Pastrello DM, Olive MF, Camarini R. Изменения внеклеточных уровней глутамата в прилежащем ядре после индуцированной этанолом поведенческой сенсибилизации у подростковые и взрослые мыши.Алкоголь. 2011; 45: 451–460. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Чайлдресс А.Р., Мозли П.П., МакЭлгин В., Фицджеральд Дж., Райвич М., О’Брайен С.П. Лимбическая активация во время тяги к кокаину, вызванной сигналом. Американский журнал психиатрии. 1999; 156: 11–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christian DT, Alexander NJ, Diaz MR, McCool BA. Таламические глутаматергические афференты в базолатеральную миндалину крысы демонстрируют повышенную пресинаптическую функцию глутамата после отказа от хронического прерывистого приема этанола.Нейрофармакология. 2013; 65: 134–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dahchour A, De Witte P, Bolo N, Nedelec JF, Muzet M, Durbin P, Macher JP. Центральные эффекты акампросата: часть 1. Акампросат блокирует увеличение глутамата в микродиализате прилежащего ядра у крыс, лишенных этанола. Psychiatry Res. 1998. 82: 107–114. [PubMed] [Google Scholar]
- Дахур А., Хоффман А., Дейтрих Р., де Витте П. Влияние этанола на уровни внеклеточных аминокислот у крыс с высоким и низким содержанием алкоголя: исследование микродиализа.Алкоголь Алкоголь. 2000; 35: 548–553. [PubMed] [Google Scholar]
- Danbolt NC. Поглощение глутамата. Prog Neurobiol. 2001; 65: 1–105. [PubMed] [Google Scholar]
- Дин З.М., Энглман Э.А., Родд З.А., Макбрайд В.Дж. Этанол увеличивает нейротрансмиссию глутамата в задней вентральной тегментальной области самок крыс линии Вистар. Алкоголизм, клинические и экспериментальные исследования. 2012; 36: 633–640. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Энглман Э.А., Тилен Р.Дж., О’Брайен К.Э., Хилл Т.Э., Люменг Л., Ли Т.К., Макбрайд В.Дж., Мерфи Дж.М.Хроническое употребление этанола и длительные или повторяющиеся депривации снижают передачу дофамина (DA) в прилежащем ядре (ACB). Soc Neurosci. 2002 Abs 28 309.1. [Google Scholar]
- Ганель Р., Хо Т., Марагакис, штат Нью-Джерси, Джексон М., Штайнер Дж. П., Ротштейн Дж. Д.. Селективная регуляция глиального Na + -зависимого переносчика глутамата GLT1 с помощью нейроиммунофилинового лиганда приводит к нейрозащите. Нейробиология болезни. 2006. 21: 556–567. [PubMed] [Google Scholar]
- Gass JT, Sinclair CM, Cleva RM, Widholm JJ, Olive MF.Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Биология зависимости. 2011; 16: 215–228. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гегелашвили Г., Шоусбо А. Транспортеры глутамата с высоким сродством: регуляция экспрессии и активности. Mol Pharmacol. 1997; 52: 6–15. [PubMed] [Google Scholar]
- Ginsberg SD, Martin LJ, Rothstein JD. Региональная деафферентация подавляет подтипы белков-переносчиков глутамата.J Neurochem. 1995; 65: 2800–2803. [PubMed] [Google Scholar]
- Goldstein RZ, Volkow ND. Наркомания и ее нейробиологическая основа: нейровизуализационные доказательства поражения лобной коры. Американский журнал психиатрии. 2002; 159: 1642–1652. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ито Р., Роббинс Т.В., Эверит Б.Дж. Дифференциальный контроль над поиском кокаина ядром и оболочкой прилежащего ядра. Nat Neurosci. 2004. 7: 389–397. [PubMed] [Google Scholar]
- Капасова З., Шумлински К.К.Различия штаммов в нейрохимической пластичности, вызванной алкоголем: роль глутамата прилежащего участка в потреблении алкоголя. Алкоголизм, клинические и экспериментальные исследования. 2008. 32: 617–631. [PubMed] [Google Scholar]
- Кау К.С., Мадаяг А., Манч Дж. Р., Грир, доктор медицины, Абдулхамид О., Бейкер Д.А. Снижение функции цистин-глутаматного антипортера в прилежащем ядре способствует поиску наркотиков, вызванному кокаином. Неврология. 2008; 155: 530–537. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Knackstedt LA, Melendez RI, Kalivas PW.Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив кокаина. Биологическая психиатрия. 2010. 67: 81–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Li X, Li J, Gardner EL, Xi ZX. Активация mGluR7 ингибирует индуцированное кокаином восстановление поведения, связанного с поиском наркотиков, с помощью механизма глутамат-mGluR2 / 3 ядра прилежащего ядра у крыс. Журнал нейрохимии. 2010. 114: 1368–1380. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lu L, Xue Y, Steketee JD, Rebec GV, Sun W.Регулирование индуцированного кокаином восстановления метаботропными глутаматными рецепторами группы II в вентральной тегментальной области. Психофармакология. 2012; 220: 75–85. [PubMed] [Google Scholar]
- Madayag A, Lobner D, Kau KS, Mantsch JR, Abdulhameed O, Hearing M, Grier MD, Baker DA. Повторное введение N-ацетилцистеина изменяет зависимые от пластичности эффекты кокаина. Журнал неврологии: официальный журнал Общества неврологии. 2007. 27: 13968–13976. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Miller BR, Dorner JL, Shou M, Sari Y, Barton SJ, Sengelaub DR, Kennedy RT, Rebec GV.Повышающая регуляция экспрессии GLT1 увеличивает поглощение глутамата и ослабляет фенотип болезни Хантингтона у мышей R6 / 2. Неврология. 2008. 153: 329–337. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Mishra D, Zhang X, Chergui K. Этанол нарушает механизмы индукции долговременной потенциации в прилежащем ядре мыши. Alcohol Clin Exp Res. 2012; 36: 2117–2125. [PubMed] [Google Scholar]
- Митани А., Танака К. Функциональные изменения глиального транспортера глутамата GLT-1 во время ишемии: исследование in vivo СА1 гиппокампа нормальных мышей и мутантных мышей, лишенных GLT-1.J Neurosci. 2003; 23: 7176–7182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Моран М.М., МакФарланд К., Мелендес Р.И., Каливас П.В., Симанс Дж. Обмен цистина / глутамата регулирует пресинаптическое ингибирование метаботропного рецептора глутамата передачи возбуждения и уязвимость к поиску кокаина. J Neurosci. 2005. 25: 6389–6393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Moussawi K, Zhou W, Shen H, Reichel CM, See RE, Carr DB, Kalivas PW. Обращение кокаина-индуцированного синаптического потенцирования обеспечивает длительную защиту от рецидива.Труды Национальной академии наук Соединенных Штатов Америки. 2011; 108: 385–390. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Мерфи Дж. М., Стюарт Р. Б., Белл Р. Л., Бадиа-Элдер Н. Э., Карр Л. Г., Макбрайд В. Дж., Люмен Л., Ли Т. К.. Фенотипическая и генотипическая характеристика линий крыс из Университета Индианы, селективно селектированных в пользу высокого и низкого предпочтения алкоголя. Behav Genet. 2002. 32: 363–388. [PubMed] [Google Scholar]
- Obara I., Bell RL, Goulding SP, Reyes CM, Larson LA, Ary AW, Truitt WA, Szumlinski KK.Дифференциальные эффекты хронического потребления этанола и его отмены на экспрессию гомера / глутаматного рецептора в субрегионах прилежащей кости и миндалины крыс P. Alcohol Clin Exp Res. 2009; 33: 1924–1934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Paxinos G, Watson C. Мозг крысы в стереотаксических координатах. Шестое издание Academic Press; Нью-Йорк: 2007. [Google Scholar]
- Рао П.С., Сари Ю. Транспортер глутамата 1: цель для лечения алкогольной зависимости. Современная лекарственная химия.2012; 19: 5148–5156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рейсснер К.Дж., Каливас П.В. Использование гомеостаза глутамата в качестве мишени для лечения аддиктивных расстройств. Поведенческая фармакология. 2010; 21: 514–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Родд-Хенрикс З.А., Белл Р.Л., Кук К.А., Мерфи Дж.М., Макбрайд В.Дж., Люменг Л., Ли Т.К. Влияние одновременного доступа к нескольким концентрациям этанола и повторяющихся деприваций на потребление алкоголя крысами, предпочитающими алкоголь. Alcohol Clin Exp Res.2001; 25: 1140–1150. [PubMed] [Google Scholar]
- Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta П, Фишер ПБ. Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Природа. 2005; 433: 73–77. [PubMed] [Google Scholar]
- Ротштейн Дж. Д., Ван Каммен М., Леви А. И., Мартин Л. Дж., Кункл Р. У. Избирательная потеря глиального транспортера глутамата GLT-1 при боковом амиотрофическом склерозе.Анналы неврологии. 1995. 38: 73–84. [PubMed] [Google Scholar]
- Сари Ю., Белл Р.Л., Чжоу ФК. Влияние хронического алкоголя и повторяющихся деприваций на уровни дофаминовых рецепторов D1 и D2 в расширенной миндалине у инбредных крыс, предпочитающих алкоголь. Alcohol Clin Exp Res. 2006; 30: 46–56. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Prieto AL, Barton SJ, Miller BR, Rebec GV. Цефтриаксон-индуцированная повышающая регуляция кортикального и полосатого тела GLT1 в модели R6 / 2 болезни Хантингтона.J Biomed Sci. 2010; 17: 62. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL. Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь. 2011; 46: 239–246. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Smith KD, Ali PK, Rebec GV. Повышающая регуляция GLT1 ослабляет вызванное сигналом возобновление кокаинового поведения у крыс. J Neurosci. 2009; 29: 9239–9243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sari Y, Sreemantula SN.Нейроиммунофилин GPI-1046 снижает потребление этанола частично за счет активации GLT1 у предпочитающих алкоголь крыс. Неврология. 2012; 227: 327–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Seal RP, Amara SG. Возбуждающие переносчики аминокислот: семья в постоянном движении. Ежегодный обзор фармакологии и токсикологии. 1999; 39: 431–456. [PubMed] [Google Scholar]
- Sinclair CM, Cleva RM, Hood LE, Olive MF, Gass JT. Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола.Pharmacol Biochem Behav. 2012; 101: 329–335. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сивалахти Е.К., Хиетала Дж., Ройтта М., Гронроос Дж. Снижение количества дофаминовых и мускариновых рецепторов в мозге крыс после хронического употребления алкоголя. Pharmacol Toxicol. 1988. 62: 210–212. [PubMed] [Google Scholar]
- Шумлински К.К., Ари А.В., Ломинац К.Д., Клугманн М., Киппин Т.Э. Сверхэкспрессия Accumbens Homer2 способствует нейропластичности, вызванной алкоголем, у мышей C57BL / 6J. Neuropsychopharmacol. 2008. 33: 1365–1378.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Thielen RJ, Engleman EA, Rodd ZA, Murphy JM, Lumeng L, Li TK, McBride WJ. Употребление этанола и его депривация изменяют дофаминергическую и серотонинергическую функции в прилежащем ядре крыс, предпочитающих алкоголь. Журнал фармакологии и экспериментальной терапии. 2004. 309: 216–225. [PubMed] [Google Scholar]
- Trantham-Davidson H, LaLumiere RT, Reissner KJ, Kalivas PW, Knackstedt LA. Цефтриаксон нормализует синаптическую передачу прилежащего ядра, транспорт и экспорт глутамата после тренировки по самостоятельному введению кокаина и вымирания.Журнал неврологии: официальный журнал Общества неврологии. 2012; 32: 12406–12410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weiss F, Lorang MT, Bloom FE, Koob GF. Самостоятельный прием алкоголя внутрь стимулирует высвобождение дофамина в прилежащем ядре крысы: генетические и мотивационные детерминанты. J Pharmacol Exp Ther. 1993; 267: 250–258. [PubMed] [Google Scholar]
- Вайс Ф., Парсонс Л. Х., Шультейс Дж., Хиития П., Лоранг М. Т., Блум Ф. Е., Куб Г. Ф. Самостоятельное введение этанола восстанавливает связанный с отменой дефицит дофамина в прилежащей области и высвобождение 5-гидрокситриптамина у зависимых крыс.Журнал неврологии: официальный журнал Общества неврологии. 1996; 16: 3474–3485. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Zarrindast MR, Meshkani J, Rezayof A, Beigzadeh R., Rostami P. Никотиновые ацетилхолиновые рецепторы дорсального гиппокампа и базолатеральной миндалины участвуют в обусловленном этанолом предпочтении места. Неврология. 2010. 168: 505–513. [PubMed] [Google Scholar]
- Zhou FC, Sahr RN, Sari Y, Behbahani K. Синаптические терминалы глутамата и дофамина в расширенной миндалине после 14-недельного хронического употребления алкоголя у инбредных крыс, предпочитающих алкоголь.Алкоголь. 2006; 39: 39–49. [PubMed] [Google Scholar]
Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс
Цели: Изменения глутаматергической передачи влияют на многие аспекты нейропластичности, связанные с этанолом и наркозависимостью. Например, поведению, связанному с поиском этанола и наркотиков, способствует усиленная передача глутамата в ключевых областях двигательной цепи.Мы предположили, что, поскольку транспортер глутамата 1 (GLT1) отвечает за удаление большей части внеклеточного глутамата, повышающая регуляция или активация GLT1 будет снижать потребление этанола.
Методы: Крысам, предпочитающим алкоголь (Р), давали круглосуточный одновременный доступ к 15 и 30% этанолу, воде и пище в течение 7 недель. В течение недели 6 крысы P получали цефтриаксон в дозе 25, 50, 100 или 200 мг / кг (CEF, i.p.), β-лактамный антибиотик, повышающий экспрессию GLT1, или физиологический раствор в течение пяти дней подряд. Потребление воды, потребление этанола и массу тела измеряли ежедневно в течение 15 дней, начиная с 1-го дня инъекций. Мы также проверили влияние CEF (100 и 200 мг / кг, внутрибрюшинно) на ежедневное потребление сахарозы (10%) в качестве контроля мотивированного поведенческого употребления алкоголя.
Полученные результаты: Статистический анализ выявил значительное снижение ежедневного потребления этанола, но не сахарозы, после лечения CEF.В период после лечения наблюдалось восстановление потребления этанола через несколько дней. Дозозависимое увеличение потребления воды проявлялось одновременно с вызванным CEF снижением потребления этанола. Тем не менее, CEF не влиял на массу тела. Исследование подгруппы крыс, получавших этанол, получавших CEF, на третий день после лечения CEF выявило увеличение уровней экспрессии GTL1 в префронтальной коре и прилежащем ядре.
Выводы: Эти результаты показывают, что CEF эффективно снижает потребление этанола, возможно, за счет активации GLT1, и может быть потенциальным терапевтическим препаратом для лечения алкогольной зависимости.
Препарат «Цефтриаксон» и алкоголь: совместимость
Антибактериальные препараты играют важную роль в современной медицине. Средства помогают избавиться от болезней, которые раньше считались смертельными. Самыми эффективными препаратами считаются инъекции. К таким относится «Цефтриаксон».
Можно ли употреблять алкоголь во время лечения? Этот вопрос часто возникает у пациентов. Особенно обидно, когда нос в отпуске, а человек «сидит» на антибиотиках.Сегодняшняя статья поможет вам разобраться в волнующем вопросе.
Описание препарата и способ его применения
«Цефтриаксон» — цефалоспоринантибиотик третьего поколения. Препарат в виде порошка для приготовления раствора. Препарат применяют парентерально. В одной ампуле содержится 0,5, 1 и 2 грамма цефтриаксона в виде денатритической соли. Препарат эффективен против многих грамположительных и грамотрицательных микроорганизмов. Препарат обладает устойчивостью к пенициллиназе и цефалоспориназе.Это ферменты, которые выделяют бактерии для собственной защиты от лекарств. Этот факт лишний раз доказывает эффективность препарата.
Лекарство вводят внутримышечно или внутривенно. Предварительно порошок смешивают с новокаином, реже — лидокаином. Продолжительность лечения от 5 дней до 2 недель. Многое зависит от типа заболевания и его степени тяжести. Препарат применяют в индивидуальной дозировке в зависимости от возраста пациента. Детям назначают с рождения.
«Цефтриаксон» и спирт: разрешает ли производитель?
Можно ли лечиться описанным лекарством и пить одновременно? Чтобы узнать ответ на этот вопрос, необходимо сначала обратиться к инструкции.В аннотации черным по белому написано, что препарат «Цефтриаксон» и алкоголь несовместимы. Но многие не учитывают этот факт. Ведь существует распространенный миф о запрете употребления алкоголя при применении антибиотиков. Стоит ли верить?
Велосипед о запрете алкоголя во время курса антибиотиков
Скептики, которые любят пропустить пару стаканов, говорят, что «цефтриаксон» и алкоголь можно сочетать. При этом они подтверждают свои слова следующей информацией.
Во время войны солдаты переносили пенициллин. Лечили такие заболевания, как сифилис и некоторые патологии мочеполовой системы. Во время терапии необходимо было воздерживаться от половых контактов. Также алкоголь провоцировал частые сношения пьяных воинов с распутными девушками. Лечение было бесполезным. С тех пор возник миф о том, что нельзя одновременно употреблять антибиотики и алкоголь.
Действительно, от одновременного применения пенициллина и алкоголя вреда будет не так уж и много.Лекарство просто не подействует. Но в этой статье речь идет о препарате «Цефтриаксон». Он не относится к группе пенициллинов. Поэтому этот миф тоже нельзя отнести к этому лекарству.
Заболевание и употребление алкоголя
Запрещается одновременное применение инъекций «Цефтриаксона» и алкоголя по следующей причине. Лекарство относится к сильнодействующим антибиотикам. Он способен уничтожить даже устойчивые бактерии. Он не зря назначается.Лекарство показано при серьезных заболеваниях:
- сепсис и менингит;
- бронхит и пневмония;
- перитонит и инфекции желудочно-кишечного тракта;
- инфекционные процессы на коже, суставах и костях;
- бактериальная патология ЛОР-органов;
- болезни мочеполовой сферы; ,
- состояние после операции и тд.
Во всех этих ситуациях использование этанола не только нецелесообразно, но и достаточно рискованно.Если вы действительно хотите вылечиться, то вам нужно следовать назначению врача, а не искать оправдания, разрешающее одновременное применение «Цефтриаксона» и этанола.
«Цефтриаксон» и алкоголь: совместимость и реальные последствия
Многие потребители сообщают, что неоднократно употребляли алкоголь во время лечения. С ними ничего страшного не случилось. Врачи также говорят, что пациенты просто увлеклись. Вероятно, последствия такого сочетания еще дадут о себе знать в будущем.Чем чревато сочетание антибиотика и алкогольных напитков? Почему нельзя употреблять алкоголь после «Цефтриаксона»?
Препарат несовместим с алкоголем по причине повышенной частоты побочных реакций. При правильном применении лекарство переносится хорошо и редко имеет негативные последствия. Но во время терапии большая нагрузка на печень. Если одновременно пить, то токсический эффект усилится в разы. Это приводит к гепатиту и изменениям органов, которые невозможно устранить.После сочетания препарата «Цефтриаксон» даже с слабоалкогольными напитками могут возникнуть:
- колит, диарея, метеоризм;
- тошнота и неукротимая рвота;
- помутнение зрения, обморок;
- крапивница, шок, отек Квинке.
Согласно статистике и клиническим исследованиям, препарат вызывает дисульфирамоподобные реакции. Это означает, что при одновременном употреблении алкоголя с антибиотиком наступает сильное опьянение. Прием больших доз может привести к летальному исходу.Кроме того, средство может спровоцировать кандидоз. Алкоголь только способствует его прогрессированию.
Когда это возможно?
Если вы принимаете препарат Цефтриаксон, через сколько времени можно принимать алкоголь? Выпивать стакан алкоголя разрешается только после полного выведения действующего вещества из организма. У взрослых пациентов он составляет 1-2 дня. При заболеваниях почек или мочевыделительной системы срок увеличивается.
Если вам назначили лечение, но вы накануне употребляли алкоголь — как быть? Использовать антибиотик можно только после полного выведения этанола из кровеносной системы.В зависимости от крепости напитка и его количества этот период может варьироваться от нескольких дней до 2-3 дней.
Мнения и рекомендации
Какие отзывы о сочетании алкоголя с лекарством «Цефтриаксон»? О том, что некоторым пьющим удается сочетать эти вещества, вы уже знаете. Но не всегда такие ситуации заканчиваются благополучно. Минимум, что вы можете получить, — это неэффективность препарата. Ваши силы и деньги будут потрачены зря.
Врачи утверждают, что этот антибиотик не предназначен для длительного применения.Он назначается не более чем на две недели. Часто рекомендуется пятидневное применение. Не так уж много времени, чтобы уметь воздерживаться от алкоголя. Согласитесь, здоровье важнее одного веселого вечера. Проведите терапию так, как должно быть. Не занимайтесь любительской деятельностью. По окончании лечения дождитесь полного выведения препарата из организма. Только после этого можно употреблять алкоголь. Врачи не рекомендуют злоупотреблять горячими напитками, знайте меру.
Обобщить
Из статьи вы узнали об эффективных антибиотиках цефалоспоринового ряда.Препарат не применяется для лечения алкогольной зависимости. Тем не менее комбинация препарата с этанолом вызывает дисульфирамоидоподобные эффекты. Поинтересуйтесь у врача, после какого количества алкоголя можно пить после «Цефтриаксона» и не нарушать сроки. Быть здоровым!
p >>| Раствор для инъекций, порошок | Внутримышечно; Парентерально | 1 г / 3,5 мл | ||||
| Порошок для инъекций для раствора | Внутримышечно; Парентерально | 500 MG / 2ML | ||||
| Порошок для инъекций для раствора | Внутривенно; Парентерально | 1 G / 10ML | ||||
| Порошок для раствора | 2 G | |||||
| Инъекция порошка для раствора | Парентерально | 0.5 г | ||||
| Порошок для инъекций для раствора | Внутривенно; Парентерально | 1000 мг / 10 мл | ||||
| Порошок для инъекций для раствора | Внутримышечно | 1 г / 3,5 мл | ||||
| Порошок для инъекций для раствора | Внутримышечный | 52 | ||||
| Порошок для инъекций для раствора | Внутривенный | 0.5 гр. | ||||
| Порошок для инъекций для раствора | Внутримышечно; Внутривенный | |||||
| Раствор для инъекций, порошок | Внутримышечный; Внутривенно | 1000 мг | ||||
| Порошок для инъекций для суспензии | Парентеральный | 1 г | ||||
| Порошок для инъекций, лиофилизированный, для раствора | Внутримышечно; Внутривенно | 1 г | ||||
| Порошок для инъекций для раствора | Внутривенный | 1 г | ||||
| Порошок для инъекций для раствора | Внутримышечно; Внутривенно | 1 г | ||||
| Порошок для инъекций для раствора | Внутримышечный | 1 г / 1 | ||||
| Порошок для инъекций для раствора | Внутримышечный | 250 мг / 1 | Порошок для инъекций , для раствора | Внутримышечно; Внутривенно | 1 г / 10 мл | |
| Порошок для инъекций для раствора | Внутримышечно; Внутривенно | 2 г / 1 | ||||
| Порошок для инъекций для раствора | Внутримышечно; Внутривенно | 250 мг / 1 | ||||
| Порошок для инъекций для раствора | Внутривенно | 1 г / 1 | ||||
| Порошок для инъекций для раствора | Внутривенный | |||||
| Внутривенно | 10 г / 100 мл | |||||
| Инъекция, порошок, для раствора | Внутривенно | 100 мг / 1 мл | ||||
| Инъекции, порошок, для раствора | 100846Внутривенно / 1 | |||||
| Порошок для инъекций, для раствора | Внутривенно | 2 г / 1 | ||||
| Порошок для инъекций, лиофилизированный, для раствора | Внутривенный | Порошок 100 мг / 1 мл | 52 | |||
| Внутримышечный; Внутривенно | 1 г / 1 | |||||
| Порошок для раствора | Внутримышечно; Внутривенно | 2 г / 1 | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 250 мг / 1 | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 500 мг / 1 | ||||
| Порошок для инъекций для раствора | Внутримышечно; Парентерально | 250 MG / 2ML | ||||
| Порошок для инъекций для раствора | Внутривенно; Парентерально | 500 мг / 5 мл | ||||
| Порошок для инъекций для раствора | Парентеральный | 1 г / 10 мл | ||||
| Порошок для раствора | Парентеральный порошок | 2 г | Внутримышечно | |||
| Порошок для инъекций для раствора | Внутримышечно; Парентерально | 250 MG | ||||
| Порошок для инъекций для раствора | Внутримышечно; Парентерально | 500 MG | ||||
| Порошок для раствора | Внутривенно | 100 г / пакет | ||||
| Порошок для инъекций, для раствора | Внутримышечный | 250 MG / 2ML | раствор | Внутримышечно | 500 мг / 2 мл | |
| Инъекция, порошок, для раствора | Внутривенно | 1 г / 10 мл | ||||
| Раствор | Внутривенно | 100047 908 46 | Внутривенно | 2000 мг / 50 мл | ||
| Раствор для инъекций, порошок | Внутримышечно; Внутривенно | 1 г / 1 | ||||
| Порошок для инъекций для раствора | Внутримышечно; Внутривенно | 500 мг / 1 | ||||
| Раствор для инъекций | Внутривенный | 500 мг / 1 | ||||
| Порошок для раствора | Внутримышечно; Внутривенное | 0.25 г / флакон | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 10 г / флакон | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 1 г / флакон | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 2 г / флакон | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 250 мг / флакон | ||||
| Порошок для раствора | Внутримышечно; Внутривенно | 500 мг / флакон | ||||
| Порошок для раствора | Внутривенно | 10 г / флакон | ||||
| Порошок для инъекций, для раствора | ||||||
| Порошок для инъекций Для инъекций для инъекций | ||||||
| Порошок для раствора | ||||||
| Раствор для инъекций | Внутримышечно | |||||
| Раствор | Внутривенно | |||||
| Внутривенно | ||||||
| внутривенный порошок | Порошок для инъекций для раствора | Внутримышечно | 500 мг | |||
| Набор | Внутримышечно; Внутривенный | |||||
| Раствор для инъекций | Внутривенный | |||||
| Для инъекций | Внутримышечно; Внутривенное | |||||
| Инъекционное | ||||||
| Инъекционное | Внутримышечное | 250 мг | ||||
| Инъекционное | Внутримышечное | |||||
| Внутримышечный; Парентерально | 1 MG / 3.5 мл | |||||
| Порошок для инъекций для раствора | Внутривенный | |||||
| Порошок для инъекций для раствора | Внутримышечно; Парентерально | 1 G | ||||
| Порошок для инъекций для раствора | Внутривенно; Парентерально | 250 мг / 5 мл | ||||
| Порошок для инъекций для раствора | Парентеральный | 500 мг | ||||
| Раствор для инъекций | Внутривенно | 1 г / 50 мл раствор | 2 г / 50 мл | |||
| Порошок, для раствора | Внутривенно | 1 г / флакон | ||||
| Раствор для инъекций | Внутримышечно | |||||
| Внутривенно | Внутримышечных Внутривенный||||||
| Раствор для инъекций, порошок | Внутримышечно; Внутривенный | |||||
| Раствор для инъекций, порошок | Внутривенный; Парентерально | 1 G | ||||
| Порошок | ||||||
| Порошок для инъекций для раствора | 250 мг / 1 флакон | |||||
| Инъекционный порошок для раствора | 1500 мг Порошок | 500 мг / 1 флакон | ||||
| Порошок | 250 мг / 1 флакон | |||||
| Порошок |
Цефтриаксон Внутривенное введение2000 Предупреждения при приеме, побочные эффекты 9 Взаимодействия может возникнуть покраснение или боль в месте инъекции.Если какой-либо из этих эффектов сохраняется или ухудшается, немедленно сообщите об этом своему врачу или фармацевту.
Помните, что ваш врач прописал это лекарство, потому что он или она посчитали, что польза для вас больше, чем риск побочных эффектов. Многие люди, принимающие это лекарство, не имеют серьезных побочных эффектов.
Немедленно сообщите своему врачу, если у вас есть какие-либо серьезные побочные эффекты, в том числе: легкие синяки / кровотечения, необычная усталость, симптомы заболевания желчного пузыря (такие как боль в животе / животе, тошнота, рвота), признаки проблем с почками (например, изменение в количестве мочи), розовая / кровянистая / темная моча, болезненное / частое мочеиспускание, боль в спине / боку, пожелтение глаз / кожи, неконтролируемые движения, психические изменения / изменения настроения (например, спутанность сознания), судороги.
Этот препарат в редких случаях может вызывать тяжелые кишечные заболевания (диарею, связанную с Clostridium difficile) из-за резистентных бактерий. Это состояние может возникнуть во время лечения или через несколько недель или месяцев после прекращения лечения. Немедленно сообщите своему врачу, если у вас возникнут: непрекращающаяся диарея, боль / спазмы в животе или животе, кровь / слизь в стуле.
Не принимайте лекарства от диареи или опиоиды, если у вас есть какие-либо из этих симптомов, потому что эти продукты могут усугубить их.
Использование этого лекарства в течение длительных или повторяющихся периодов может привести к молочнице полости рта или новой инфекции дрожжей. Обратитесь к врачу, если вы заметили белые пятна во рту, изменение выделений из влагалища или другие новые симптомы.
Если цефтриаксон смешать с лекарством, вызывающим онемение (например, лидокаином) перед инъекцией в мышцу, это может редко вызвать серьезные проблемы с кровью (метгемоглобинемия). Немедленно обратитесь за медицинской помощью, если у вас есть очень серьезные побочные эффекты, в том числе: бледная / серая / синяя кожа, учащенное сердцебиение, одышка.
Очень серьезные аллергические реакции на этот препарат возникают редко. Однако немедленно обратитесь за медицинской помощью, если вы заметили какие-либо симптомы серьезной аллергической реакции, в том числе: сыпь, зуд / отек (особенно лица / языка / горла), сильное головокружение, затрудненное дыхание.
Это не полный список возможных побочных эффектов. Если вы заметили другие эффекты, не перечисленные выше, обратитесь к врачу или фармацевту.
В США —
Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов.Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088 или на сайте www.fda.gov/medwatch.
В Канаде — Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов. Вы можете сообщить о побочных эффектах в Министерство здравоохранения Канады по телефону 1-866-234-2345.
Цефтриаксон (роцефин): несовместим с растворами, содержащими кальций
Дата статьи: октябрь 2009 г.
Цефтриаксон (роцефин) представляет собой цефалоспориновый антибиотик широкого спектра действия, который используется для лечения инфекций, которые известны или могут быть вызваны одним или несколькими чувствительными микроорганизмами, а также при необходимости парентеральной терапии.Цефтриаксон можно вводить путем глубокой внутримышечной инъекции, медленной внутривенной инъекции или медленной внутривенной инфузии после восстановления раствора.
Цефтриаксон и осаждение кальция
Ранее мы напоминали медицинским работникам, что цефтриаксон не следует смешивать или одновременно вводить с растворами, содержащими кальций, такими как растворы Хартмана или Рингера, из-за риска выпадения осадка. См. Наше предыдущее обновление о безопасности лекарств.
Мы также сообщили, что цефтриаксон противопоказан новорожденным, которым требуется лечение кальцием из-за риска осаждения цефтриаксон-кальциевой соли.
Обзор имеющихся данных
Обзор имеющихся данных показывает, что новорожденные (в возрасте до 28 дней) подвергаются большему риску преципитации кальций-цефтриаксон, чем пациенты старшего возраста, особенно если они недоношены или имеют нарушенное связывание билирубина.
Риск выпадения в осадок кальций-цефтриаксона у взрослых, вероятно, будет низким; однако в качестве меры предосторожности не следует вводить цефтриаксон и кальций одновременно внутривенно. Однако они могут вводиться последовательно пациентам в возрасте 28 дней и старше, если инфузионная линия промывается или промывается между растворами, или инфузии вводятся через разные инфузионные линии в разных местах.
Некоторые растворы для общего парентерального питания (ППН) содержат такие же уровни кальция, что и физиологические растворы, такие как растворы Рингера или Хартмана, и могут представлять такую же степень риска.
Совет для медицинских работников показывает, что:
- цефтриаксон противопоказан:
- недоношенные новорожденные до скорректированного возраста до 41 недели (недели беременности + недели жизни)
- доношенных новорожденных в возрасте до 28 дней, которые:
- необходимо лечение растворами, содержащими кальций (включая растворы ПП), из-за риска осаждения цефтриаксон-кальциевой соли
- страдает желтухой, гипоальбуминемией или ацидозом, поскольку это состояния, при которых связывание билирубина может быть нарушено
- одновременная инфузия: всем пациентам цефтриаксон нельзя смешивать с содержащими кальций растворами для внутривенного введения и нельзя вводить одновременно с растворами, содержащими кальций, даже через разные инфузионные линии.
- последовательная инфузия: кальций и цефтриаксон можно вводить последовательно пациентам в возрасте 28 дней и старше при условии, что либо инфузионная линия промывается или промывается между растворами, либо инфузии вводятся через разные инфузионные линии в разных местах
- у пациентов, которым требуется постоянное питание растворами ПП, содержащими кальций, медицинские работники могут рассмотреть возможность использования альтернативных антибактериальных препаратов, которые не несут аналогичный риск выпадения осадка.Если нет альтернативы введению цефтриаксона с растворами ППП, то введение может быть одновременным при условии, что они вводятся через разные инфузионные линии в разных местах
Цитирование статьи: Обновление безопасности лекарств, октябрь 2009 г., том 3, выпуск 3: 2.
Опубликовано 11 декабря 2014 г.
.

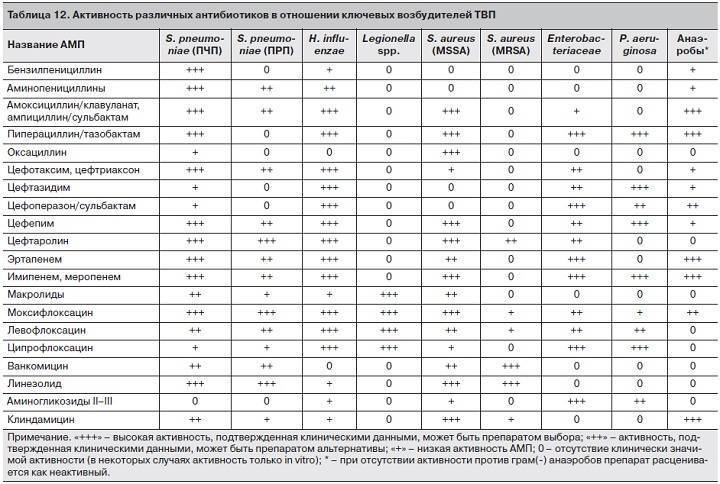 Осложненные инфекции кожи и мягких тканей
Осложненные инфекции кожи и мягких тканей
 Осложненные инфекции мочевыводящих путей (включая пиелонефрит).
Осложненные инфекции мочевыводящих путей (включая пиелонефрит).
 Осложненные инфекции кожи и мягких тканей.
Осложненные инфекции кожи и мягких тканей.

 Возможные последствия можно только предполагать, но стоит ли подвергать такому риску собственное здоровье?
Возможные последствия можно только предполагать, но стоит ли подвергать такому риску собственное здоровье?