Дуодено-гастральный рефлюкс
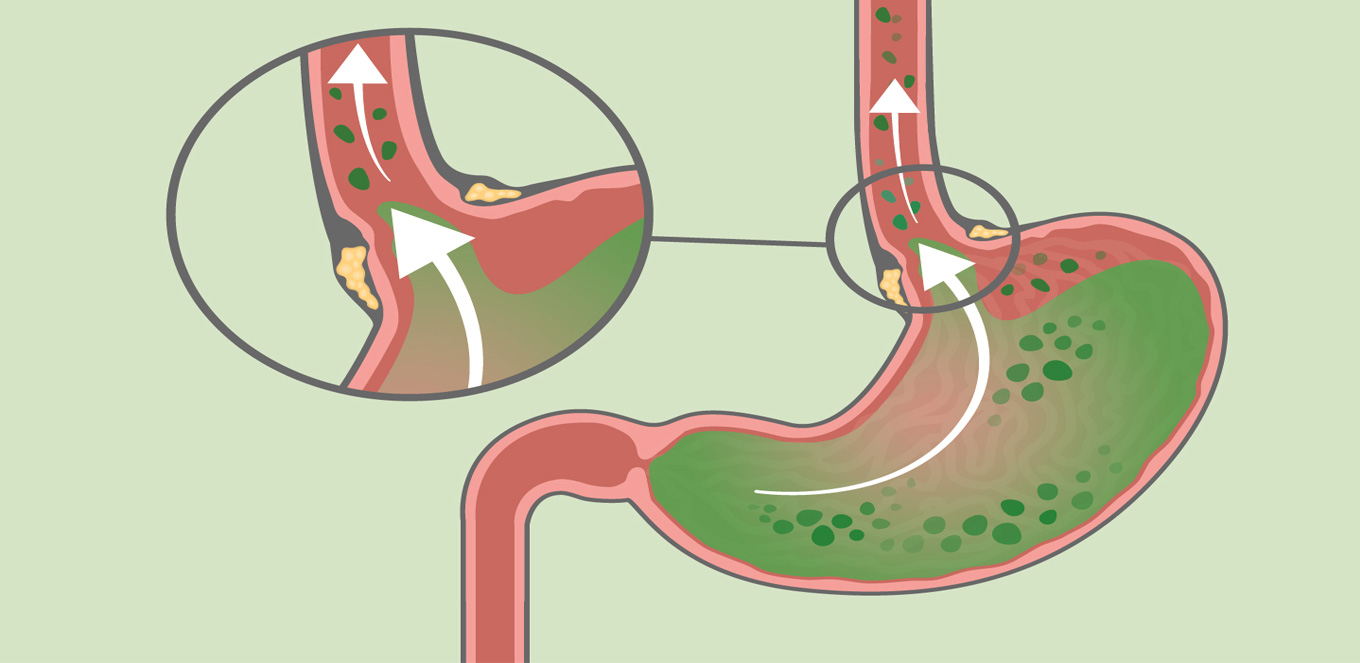
Что такое дуодено-гастральный рефлюкс?Собственно, это заброс содержимого 12 перстной кишки в желудок. И происходит такая ситуация, когда по каким-то причинам в 12-перстной кишке нарушается проходимость. В этом случае давление в кишке повышается, и привратник (сфинктер, в норме препятствующий попаданию кишечного содержимого в желудок) начинает это самое содержимое в желудок пропускать. То есть в желудок попадают желчь, агрессивные ферменты поджелудочной железы и собственно содержимое 12 перстной кишки, сильно отличающееся по кислотности от содержимого желудка. Чаще всего рефлюкс является проявлением различных заболеваний желудочно-кишечного тракта, к примеру: хронического гастрита, язвы двенадцатиперстной кишки или желудка, гастроэзофагеальной рефлюксной болезни, но может встречаться и самостоятельно.
Проявляется это заболевание собственно болями разной интенсивности в эпигастрии (верхних отделах живота), изжогой после приема пищи, тошнотой, отрыжкой воздуха, вздутием и распиранием в животе, горький привкус во рту
Почему же так происходит, какие факторы способствуют развитию рефлюкса?
Курение (воздействие никотина на собственно никотиновые рецепторы в итоге снижает тонус гладкой мускулатуры привратника, что приводит к забросу содержимого кишки в желудок.
Прием лекарственных препаратов. Действующих на гладкую мускулатуру
Глистная инвазия
Дисбактериоз
Аномалии развития кишечника
Грыжа диафрагмы
Беременность
Несбалансированное питание (нерегулярно и всухомятку)
Употребление в большом количестве острой и жирной пищи.
Нарушение функций поджелудочной железы (недостаточность, панкреатит, сахарный диабет)
Лечить дуодено-гастральный рефлюкс необходимо, так как с течением времени и прогрессированием заболевание может переродиться в злокачественное. И лечение должно быть комплексное. Кроме медикаментозной терапии назначенной специалистом, необходимо пересмотреть свои пищевые и жизненные привычки. Отказаться от кофеина, курения и алкоголя, сбросить вес, отказаться от желчегонных препаратов, аспирина. Обязательно соблюдение щадящей диеты стол No5 по Певзнеру (смотрите нашу публикацию от 15 января 2020года). Ну и главное- собственно за терапией НЕОБХОДИМО обратиться к специалисту.
Ну а к гастроэнтерологу Вы можете записаться совершенно самостоятельно на удобное для Вас время на нашем сайте или по телефону 22-22-03
Будьте здоровы и любимы!
Дуоденогастральный рефлюкс — это.
 .. Что такое Дуоденогастральный рефлюкс? Суточная рН-грамма тела желудка с дуоденогастральными рефлюксами (направленные вверх пики в правой части графика)
.. Что такое Дуоденогастральный рефлюкс? Суточная рН-грамма тела желудка с дуоденогастральными рефлюксами (направленные вверх пики в правой части графика)Дуоде́ногастра́льный рефлю́кс (ДГР) — заброс содержимого двенадцатиперстной кишки в желудок.
Причиной ДГР является недостаточность замыкательной функции привратника, хронический дуоденит и повышенное давление в двенадцатиперстной кишке (ДПК).[1]
ДГР ведёт к поражению слизистой оболочки желудка, преимущественно примыкающему к ДПК антрального отдела желудка, жёлчными кислотами, их солями, панкреатическими ферментами, лизолецитином и другими компонентами дуоденального содержимого.
В отношении ДГР у здоровых людей у гастроэнтерологов существуют несколько отличающиеся мнения, которые выражаются в формулировках. Так одни считают. что дуоденогастральный рефлюкс встречается у здоровых людей[2], других пишут более определённо: ДГР постоянно присутствует у здоровых людей, занимает около 40 % времени суток и усиливается ночью. [3]
[3]
Длительное существование ДГР приводит к возникновению так называемого гастрита типа С (химико-токсического).[1]
Клинически себя проявляют только выраженные, длительно существующие рефлюксы. У пациентов появляется желтый налет на языке, боли в животе без чёткой локализации, диспепсия (отрыжка, изжога). При появлении этих признаков стоит выполнить комплексное обследование: УЗИ органов брюшной полости, ЭГДС, комплексную суточную рН-метрию (исследование кислотности) нижней трети пищевода, кардиального отдела и тела желудка, электрогастроэнтерографию. Особенно важно исследование уровня кислотности, так как этот метод позволяет наиболее достоверно установить наличие или отсутствие дуоденогастрального рефлюкса и степень его выраженности. [1]
Лекарственная терапия
Лечение ДГР направлено на нормализацию моторики и связывание жёлчных кислот. Так как жёлчные кислоты и лизолецитин оказывают повреждающее действие только в присутствии кислоты, то, при наличии тех или иных клинических проявлений, могут назначены ингибиторы протонного насоса. Для уменьшения забросов в желудок содержимого ДПК назначают блокаторы дофаминовых D
Для уменьшения забросов в желудок содержимого ДПК назначают блокаторы дофаминовых D
Источники
Примечания
| Рефлюксы | |
|---|---|
| ЖКТ | Гастроэзофагеальный рефлюкс • Дуоденогастральный рефлюкс • Фаринголарингеальный рефлюкс |
| Жёлчные протоки, печень, поджелудочная железа | Дуоденобилиарный рефлюкс • Холедохопанкреатический рефлюкс • Билиопанкреатический рефлюкс • Панкретобилиарный рефлюкс |
| Выделительная система | Пузырно-мочеточниковый рефлюкс • Пузырно-мочеточниково-лоханочный рефлюкс • Лоханочно-почечный рефлюкс |
| Женская репродуктивная система | Маточно-венозный рефлюкс • Рефлюкс менструальной крови |
Дуоденогастральный рефлюкс как причина развития рефлюкс-гастрита Текст научной статьи по специальности «Клиническая медицина»
infants]: avtoref.
23. Doyle, L.W. Respiratory function at age in extremely lou birthweight / very preterm children in Victoria in 1991—1992 / L.W. Doyle // Pediatr. Pulmonol. — 2006. — № 118. — P.108—113.
24. Bronchopulmonary dysplasia in very low birth weight subjects and lung function in late adolescence / L.W. Doyle, B. Faber, C. Calanan [et al.] // Pediatric. — 2006. — № 118. — P. 108—113.
25. Ellison-Loschmann, L. Socioeconomic status, asthma and chronic bronchitis in a large community-based stady / L. Ellison-Loschmann, J. Sunyer, E. Plana // Eur. Respir. J. — 2007. — Vol. 29. — P.897—905.
26. Van Gent, R. Poor perception of dyspnea in children with undiagnosed asthma / R. van Gent., L.E.M. van Essen-Zandvliet // Eur. Respir. J. — 2007. — Vol.
28. Emphysema in yang adult survivors of moderate-to-severe bronchopulmonary dysplasia / P.M. Wong, A.N. Lees, N. French [et al.] // Eur. RespirY J. — 2008. — № 32. — P.321—328.
29. Alekseevskih, Yu.G. Strukturno-funkcional’nye osobennosti krupnyh i melkih bronhov i razlichiya voznikayuschih v nih vospalitel’nyh reakcii [Structural and functional features of the large and small bronchi and differences arising in these inflammatory reactions] / Yu.G. Alekseevskih, I.K. Esipova // Arhiv patologii. — 1994. — № 4. — S.6—9.
30. E p i d e m i o l o g i c h e s k i e p o d h o d y k i z u c h e n i y u rasprostranennosti recidiviruyuschih i hronicheskih bronholegochnyh zabolevanii u detei na primere Sankt-Peterburga: metod. rekomendacii [Epidemiological approaches to the study of the prevalence of recurrent and chronic bronchopulmonary diseases in children by the example of St.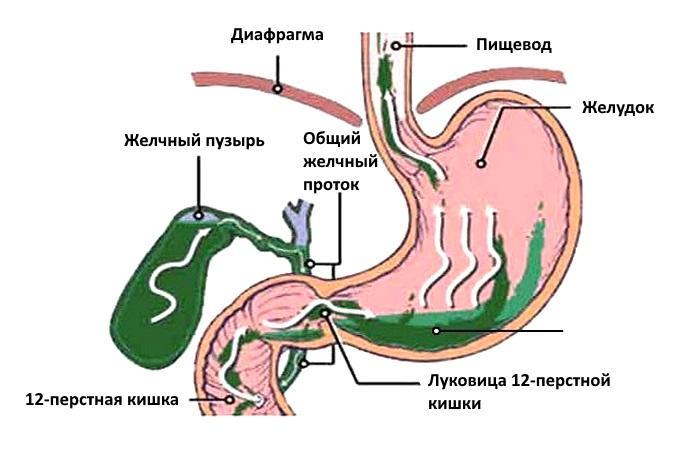
31. Zaiceva, O.V. Bronhoobstruktivnyi sindrom [Bronchial obstruction] / O.V. Zaiceva // Infekciya respiratornogo trakta u detei rannego vozrasta [In Respiratory tract infections in infants] / pod red. G.A. Samsyginoi. — M., 2006. — C.279.
32. Goloborod’ko, M.M. Rasprostranennost’ i faktory riska formirovaniya boleznei melkih bronhov u detei na primere g. Sankt-Peterburga i Leningradskoi oblasti [Prevalence and risk factors for the formation of small airways disease in children by the example of St. Petersburg and Leningrad region]: dis. … kand. med. nauk / Goloborod’ko Mariya Mihailovna — SPb., 2009. — 15 s.
33. Gosudarstvennyi doklad o sostoyanii zdorov’ya naseleniya Rossiiskoi Federacii v 2005 g. [State report on the health status of the population of the Russian Federation in 2005] // Zdravoohranenie Rossiiskoi Federacii [Health of the Russian Federation]. — 2007. — № 5. — C.3—34.
— 2007. — № 5. — C.3—34.
34. 2010 Child Asthma Data: Prevalence Tables [electronic resource] // Centers for Disease Control and Prevention. — 2010. —URL: http: www.cdc.gov/asthma/brfss/2010/child/ lifetime/tablek/htm
35. Truncova, E.S. Rasprostranennost’ hronicheskih i recidiviruyuschih nespecificheskih zabolevanii legkih v Yuzhnom regione strany (g. Astrahan’) [The prevalence of chronic and recurrent nonspecific pulmonary diseases in the Southern region of the country (Astrakhan)]: avtoref. dis. … kand. med. nauk / Truncova Evgeniya Semenovna. — SPb., 2005. — C.7—16.
36. Gaiduk, I.M. Respiratornaya allergiya u detei: epidemiologiya, sovremennyi podhod k terapii i profilaktike [Respiratory allergies in children: epidemiology, modern approach to therapy and prevention]: avtoref. dis. … d-ra med. nauk / Gaiduk Irina Mihailovna. — SPb., 2013. — 35 s.
— SPb., 2013. — 35 s.
37. Zabolevaemost’ detskogo naseleniya Rossii v 2011 g.: stat. materialy / Ministerstvo zdravoohraneniya i social’nogo razvitiya [The incidence of child population in Russia in 2011 statistics.The Ministry of Health Social Development]. — M., 2012. — ch. 5. — 144 s.
© Ш.З. Галиев, Н.Б. Амиров, 2015 УДК 616.33-002-02(048.8)
ДУОДЕНОГАСТРАЛЬНЫЙ РЕФЛЮКС КАК ПРИЧИНА РАЗВИТИЯ РЕФЛЮКС-ГАСТРИТА
ШАМИЛЬ ЗУЛЬФАРОВИЧ ГАПИЕВ, аспирант кафедры общей врачебной практики ГБОУ ВПО «Казанский государственный медицинский университет» Минздрава России, Казань, Россия, тел. 8-927-421-03-08, e-mail: [email protected]
НАИЛЬ БАГАУВИЧ АМИРОВ, докт. мед. наук, профессор кафедры общей врачебной практики ГБОУ ВПО «Казанский государственный медицинский университет» Минздрава России, Казань, Россия, тел. 8-905-313-01-11
8-905-313-01-11
Реферат. Цель исследования — проанализировать проблему дуоденогастрального рефлюкса (ДГР) у различных категорий больных, выявить последствия, к которым приводит наличие данной патологии. Материал и методы. В предложенном обзоре литературы приводятся взгляды на патофизиологические механизмы ДГР и развитие рефлюкс-гастрита (РГ). Проводится анализ работ, указывающих на взаимосвязь ДГР и развития предраковых изменений слизистой оболочки желудка (СОЖ). Приводятся данные исследований, в которых имеются несовпадающие друг с другом результаты воздействия желчного рефлюкса на Н. pylori. Результаты и их обсуждение. В клинической картине нет симптомов, специфичных для ДГР, поэтому диагностика строится главным образом на инструментальных методах исследования. Заключение. В лечении ДГР и рефлюкс-гастрита на сегодняшний день применяются различные группы препаратов, эффективность которых исследована в разной степени, а
50
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
2
общепринятые схемы лечения данной патологии отсутствуют. Приведена обоснованность назначения урсоде-зоксихолиевой кислоты (УДХК) при ДГР
Ключевые слова: дуоденогастральный рефлюкс, рефлюкс-гастрит, кишечная метаплазия, урсодезоксихолиевая кислота.
DUODENOGASTRiO REFLUX AS A CAUSE OF REFLUX-GASTRiTiS
SHAMIL Z. GALIEV. graduate student of Department of general practice of SBEIHPE «Kazan State Medical University»,
Kazan, Russia, tel. 8-927-421-03-08, e-mail: [email protected]
NAIL B. AMIROV, D.Med.Sci., Professor of Department of general practice of SBEI HPE «Kazan State Medical University», Kazan, Russia, tel. 8-905-313-01-11
Abstract. Aim. The purpose of the study is to look into the problem of duodenogastric reflux (DGR) among different categories of patients. And also to identify consequences of the disease. Material and methods. The literature review shows different existing positions on pathophysiological mechanisms of the DGR and development of reflux gastritis. The main attention is paid on of the articles pointing on the link between DGR and the development of precancerous changes in the gastric mucosa. Comparison of different surveys on how biliary reflux affects H. Pylori displays controversy in their data. Results. Mainly it’s because the clinical picture of DGR has no specific symptoms, so generally the diagnosis is based on instrumental methods of research. Conclusion. It is known than different groups of drugs are used in the treatment of the DGR and reflux gastritis. Nevertheless their efficiency has not been studied uniformly. And the generally accepted regimen for this illness seems has not been found yet.
Aim. The purpose of the study is to look into the problem of duodenogastric reflux (DGR) among different categories of patients. And also to identify consequences of the disease. Material and methods. The literature review shows different existing positions on pathophysiological mechanisms of the DGR and development of reflux gastritis. The main attention is paid on of the articles pointing on the link between DGR and the development of precancerous changes in the gastric mucosa. Comparison of different surveys on how biliary reflux affects H. Pylori displays controversy in their data. Results. Mainly it’s because the clinical picture of DGR has no specific symptoms, so generally the diagnosis is based on instrumental methods of research. Conclusion. It is known than different groups of drugs are used in the treatment of the DGR and reflux gastritis. Nevertheless their efficiency has not been studied uniformly. And the generally accepted regimen for this illness seems has not been found yet. It is shown the validity of UDCA prescription for DGR treatment.
It is shown the validity of UDCA prescription for DGR treatment.
Key words: duodenal reflux, reflux gastritis, intestinal metaplasia, UDCA.
Патофизиологические аспекты дуодено-гастрального рефлюкса. Дуоденальное содержимое является частым спутником и составной частью желудочного сока. Оно выявляется у 20—25% обследуемых [1], а у больных, страдающих патологией верхних отделов желудочно-кишечного тракта (ЖКТ), ретроградный заброс дуоденального содержимого через пилорический сфинктер становится постоянным явлением и обнаруживается в 45—100% случаев [2]. Одни авторы рассматривают его как защитную реакцию организма в ответ на поступление в двенадцатиперстную кишку желудочного сока с высокой кислотно-пептической активностью, подчеркивают его важную роль в регуляции желудочной секреции [8, 9, 32]. Другие исследователи отводят рефлюксу дуоденального содержимого в желудок роль патологического агента в развитии заболеваний желудка и двенадцатиперстной кишки [3].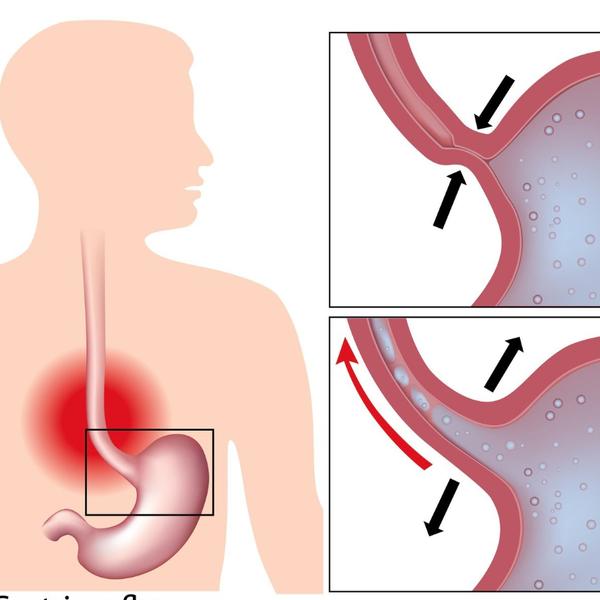
В ходе измерений концентрации желчных кислот в желудке с помощью фиброоптической спектрофотометрии (Bilitec, 2000) было показано, что желчь в желудке у здоровых пациентов присутствует 37% от времени записи: 28% в дневное время и 47% в ночное [38]. H. Sjovall (2011), исследуя особенности работы мигрирующего моторного комплекса в зоне антрального отдела желудка и двенадцатиперстной кишки, выделяет наличие рефлюкса в содержимом двенадцатиперстной кишки, в котором отсутствует желчь, но содержатся бикарбонат и секреторный IgA. Такому рефлюксу автор отводит большую физиологическую роль в регулировании кислотности антродуоденальной зоны [32].
Основываясь на данных суточной интрагаст-ральной рН-метрии, В.С. Волков и соавт. (2010) делают вывод, что дуоденогастральный рефлюкс (ДГР) постоянно присутствует у здоровых людей, занимает около 40% времени суток и усиливается ночью. Общее число ДГР у здоровых людей составляет в среднем 60—68 раз, в то время как у
больных язвенной болезнью (ЯБ) двенадцатиперстной кишки — 27—32 раза. Обнаружено также, что у больных ЯБ двенадцатиперстной кишки средняя продолжительность рефлюкса вдвое меньше, чем у здоровых людей, для них характерно отсутствие его ночной активации и ограничение преимущественно антральным отделом [8]. Исследуя ДГР у больных хроническим гастродуоденитом, И.Ю. Колесникова и соавт. (2012) придают ему роль антиязвенного протектора. У таких больных повышенная кислотность в теле желудка сочетается с нормально функционирующим ДГР, что способствует компенсации антрального ощелачивания. В то же время у больных ЯБ двенадцатиперстной кишки по сравнению со здоровыми людьми значительно повышена кислотность в теле желудке и его антральном отделе, меньше частота и продолжительность ДГР, отсутствуют его нормальные циркадные колебания. По мнению авторов, роль ДГР в патогенезе таких кислотозависимых заболеваний, как хронический гастрит и ЯБ двенадцатиперстной кишки, до конца не изучена и является предметом дальнейших исследований [9].
Обнаружено также, что у больных ЯБ двенадцатиперстной кишки средняя продолжительность рефлюкса вдвое меньше, чем у здоровых людей, для них характерно отсутствие его ночной активации и ограничение преимущественно антральным отделом [8]. Исследуя ДГР у больных хроническим гастродуоденитом, И.Ю. Колесникова и соавт. (2012) придают ему роль антиязвенного протектора. У таких больных повышенная кислотность в теле желудка сочетается с нормально функционирующим ДГР, что способствует компенсации антрального ощелачивания. В то же время у больных ЯБ двенадцатиперстной кишки по сравнению со здоровыми людьми значительно повышена кислотность в теле желудке и его антральном отделе, меньше частота и продолжительность ДГР, отсутствуют его нормальные циркадные колебания. По мнению авторов, роль ДГР в патогенезе таких кислотозависимых заболеваний, как хронический гастрит и ЯБ двенадцатиперстной кишки, до конца не изучена и является предметом дальнейших исследований [9].
Патогенез рефлюкс-гастрита. Рефлюкс-гастрит (РГ) (щелочной рефлюкс-гастрит) рассматривается как своеобразная форма заболевания, связанная с забросом содержимого двенадцатиперстной кишки в желудок, что оказывает повреждающее действие вследствие постоянной травматизации слизистой оболочки желудка компонентами рефлюксата.
Рефлюкс-гастрит (РГ) (щелочной рефлюкс-гастрит) рассматривается как своеобразная форма заболевания, связанная с забросом содержимого двенадцатиперстной кишки в желудок, что оказывает повреждающее действие вследствие постоянной травматизации слизистой оболочки желудка компонентами рефлюксата.
В настоящее время определены следующие механизмы развития желчного рефлюкса, приводящего к патологическим изменениям слизистой оболочки желудка:
• несостоятельность сфинктерного аппарата: дуоденальное содержимое может свободно достигать желудка и пищевода через пилорический и нижний пищеводный сфинктеры;
• антродуоденальная дисмоторика — нарушение координации между антральным, пилорическим отделами желудка и двенадцатиперстной кишкой,
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
2
ОБЗОРЫ
51
которые управляют направлением тока дуоденального содержимого;
• ликвидация естественного антирефлюксного барьера (после частичной гастрэктомии и других оперативных вмешательств) [5].
В развитии ДГР наряду с антиперистальтическим механизмом участвует фактор повышения давления в двенадцатиперстной кишке и следующее за ним развитие хронической дуоденальной непроходимости (ХДН) [14]. В течении синдрома ХДН различают компенсированную, субкомпен-сированную и декомпенсированную стадии. При компенсированной (или латентной) стадии ХДН еще сохраняется замыкательная функция привратника. При субкомпенсированной стадии ХДН нарастает гипертензия в двенадцатиперстной кишке, появляются антиперистальтические сокращения, возникает застой желчи и секрета поджелудочной железы. Двенадцатиперстная кишка постепенно расширяется, истощается ее нервно-мышечный аппарат, что приводит к расслаблению привратникового жома и забросу дуоденального содержимого в желудок, развивается ДГР. Желудок расширяется, а в результате повреждения его слизистой оболочки желчными кислотами и лизолецитином формируется рефлюкс-гастрит (РГ). В стадии декомпенсации ХДН гипертензия и усиленная перистальтика двенадцатиперстной кишки сменяются гипотонией и атонией, значительной ее дилатацией, что приводит к развитию порочного круга: содержимое двенадцатиперстной кишки свободно перемещается через зияющий привратник в желудок и обратно. Длительный стаз в двенадцатиперстной кишке приводит к инфицированию содержимого и обусловливает развитие уже хронического дуоденита с прогрессирующей атрофией слизистой оболочки, появлением в ней эрозий и изъязвлений.
Двенадцатиперстная кишка постепенно расширяется, истощается ее нервно-мышечный аппарат, что приводит к расслаблению привратникового жома и забросу дуоденального содержимого в желудок, развивается ДГР. Желудок расширяется, а в результате повреждения его слизистой оболочки желчными кислотами и лизолецитином формируется рефлюкс-гастрит (РГ). В стадии декомпенсации ХДН гипертензия и усиленная перистальтика двенадцатиперстной кишки сменяются гипотонией и атонией, значительной ее дилатацией, что приводит к развитию порочного круга: содержимое двенадцатиперстной кишки свободно перемещается через зияющий привратник в желудок и обратно. Длительный стаз в двенадцатиперстной кишке приводит к инфицированию содержимого и обусловливает развитие уже хронического дуоденита с прогрессирующей атрофией слизистой оболочки, появлением в ней эрозий и изъязвлений.
Среди компонентов рефлюксата наиболее хорошо изучен механизм повреждающего действия желчных кислот, им, по-видимому, принадлежит основная роль в патогенезе повреждения пищевода и желудка при дуоденогастроэзофагеальном рефлюксе (ДГЭР). Желчные кислоты, содержащиеся в рефлюксате, обладают детергентными свойствами и способствуют солюбилизации липидов мембран поверхностного эпителия. Такой эффект зависит от концентрации, уровня конъюгации и гидроксили-рования желчных кислот и, что очень важно, от рН желудочного содержимого. При низких значениях последнего слизистую оболочку повреждают только тауриновые конъюгаты, другие конъюгаты в таких условиях преципитируют. Напротив, при высоких значениях рН, что особенно характерно для культи резецированного желудка, неконъюгированные и дигидроксильные желчные кислоты обладают значительно большими повреждающими свойствами, чем конъюгированные и тригидроксильные [5].
Желчные кислоты, содержащиеся в рефлюксате, обладают детергентными свойствами и способствуют солюбилизации липидов мембран поверхностного эпителия. Такой эффект зависит от концентрации, уровня конъюгации и гидроксили-рования желчных кислот и, что очень важно, от рН желудочного содержимого. При низких значениях последнего слизистую оболочку повреждают только тауриновые конъюгаты, другие конъюгаты в таких условиях преципитируют. Напротив, при высоких значениях рН, что особенно характерно для культи резецированного желудка, неконъюгированные и дигидроксильные желчные кислоты обладают значительно большими повреждающими свойствами, чем конъюгированные и тригидроксильные [5].
Компоненты дуоденального содержимого, повреждающие слизистую оболочку пищевода и желудка, представлены не только желчными кислотами, но и лизолецитином, и трипсином. Установлено, что конъюгированные желчные кислоты (в первую очередь, тауриновые конъюгаты) и лизолецитин об-
ладают более выраженным повреждающим эффектом на слизистую пищевода и желудка при кислом рН, что определяет их синергизм с соляной кислотой в патогенезе эзофагита и рефлюкс-гастрита. Неконъюгированные желчные кислоты и трипсин более токсичны при нейтральном и слабощелочном рН, т.е. их повреждающее действие в присутствии ДГЭР усиливается на фоне медикаментозного подавления кислого рефлюкса. Токсичность неконъюгированных желчных кислот обусловлена преимущественно их ионизированными формами, которые легче проникают через слизистую оболочку пищевода. Приведенные данные могут объяснять факт отсутствия адекватного клинического ответа на монотерапию антисекреторными препаратами у 15—20% больных воспалительными заболеваниями слизистой пищевода и желудка [12].
Неконъюгированные желчные кислоты и трипсин более токсичны при нейтральном и слабощелочном рН, т.е. их повреждающее действие в присутствии ДГЭР усиливается на фоне медикаментозного подавления кислого рефлюкса. Токсичность неконъюгированных желчных кислот обусловлена преимущественно их ионизированными формами, которые легче проникают через слизистую оболочку пищевода. Приведенные данные могут объяснять факт отсутствия адекватного клинического ответа на монотерапию антисекреторными препаратами у 15—20% больных воспалительными заболеваниями слизистой пищевода и желудка [12].
Результатом постоянного повреждения слизистой оболочки желудка кишечным содержимым являются дистрофические и некробиотические изменения желудочного эпителия. Морфологические изменения при этом стереотипны: фовеолярная гиперплазия, отек и пролиферация гладкомышечных клеток в собственной пластинке на фоне умеренного воспаления. Фовеолярную гиперплазию определяют как экспансию слизистых клеток. При РГ она охватывает исключительно поверхностный эпителий и этим отличается от гастрита типа В (хеликобактерного), для которого характерна гиперплазия не только поверхностного, но и ямочного эпителия слизистой оболочки желудка. Эпителий становится резко уплощенным базофильным, насыщенным РНК и почти не содержащим слизи. В клетках эпителия отмечаются грубая вакуолизация цитоплазмы, пик-ноз ядер, некробиоз и некроз, который считается началом образования эрозий. Со временем нарастают атрофические изменения, сопровождающиеся прогрессированием пролиферативных процессов и развитием дисплазии различной степени выраженности, что увеличивает риск малигнизации [6].
При РГ она охватывает исключительно поверхностный эпителий и этим отличается от гастрита типа В (хеликобактерного), для которого характерна гиперплазия не только поверхностного, но и ямочного эпителия слизистой оболочки желудка. Эпителий становится резко уплощенным базофильным, насыщенным РНК и почти не содержащим слизи. В клетках эпителия отмечаются грубая вакуолизация цитоплазмы, пик-ноз ядер, некробиоз и некроз, который считается началом образования эрозий. Со временем нарастают атрофические изменения, сопровождающиеся прогрессированием пролиферативных процессов и развитием дисплазии различной степени выраженности, что увеличивает риск малигнизации [6].
Информативность морфологической диагностики изменений слизистой оболочки желудка при ДГР очень высока. По причине стереотипности изменений слизистой оболочки желудка появилась возможность разработать индекс ДГР, основанный на гистологических данных. Данный индекс был введен G.M. Sobala и соавт. в 1993 г. на основании данных биопсии антрального отдела желудка или дистального отдела культи желудка. Индекс выводится на основе наличия и тяжести некоторых гистологических параметров: отек в собственной пластинке слизистой оболочки желудка (обозначенный как E в формуле ниже), кишечная метаплазия (IM), хроническое воспаление (CI в приведенной ниже формуле) и колонизация Helicobactor pylori (.H.p.) в желудке. Каждому гистологическому параметру патологоанатом присваивает оценку от 0 до 3, что соответствует уровням: отсутствие параметра, легкая, умеренная или высокая степень наличия соответственно. Формула определения индекса билиарного рефлюкса (сокращенно BRI) была выведена на основе ступенчатого логистического регрессионного анализа:
в 1993 г. на основании данных биопсии антрального отдела желудка или дистального отдела культи желудка. Индекс выводится на основе наличия и тяжести некоторых гистологических параметров: отек в собственной пластинке слизистой оболочки желудка (обозначенный как E в формуле ниже), кишечная метаплазия (IM), хроническое воспаление (CI в приведенной ниже формуле) и колонизация Helicobactor pylori (.H.p.) в желудке. Каждому гистологическому параметру патологоанатом присваивает оценку от 0 до 3, что соответствует уровням: отсутствие параметра, легкая, умеренная или высокая степень наличия соответственно. Формула определения индекса билиарного рефлюкса (сокращенно BRI) была выведена на основе ступенчатого логистического регрессионного анализа:
52
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
BRI = (7 x Е) + (3 x IM) + (4 x CI) — (6 x Н. р.).
р.).
По данным Sobala и соавт., BRI выше 14 указывает на ДГР (что соответствует уровню желчных кислот более 1 ммоль/л, т.е. выше уровня верхнего предела физиологической нормы) с 70% чувствительности и 85% специфичности. Основываясь на этих данных, а также на том, что другие методы диагностики ДГР не обладают на сегодняшний день высокой точностью, данный индекс используется рядом авторов в качестве диагностического критерия в клинических исследованиях [40, 45 и др.].
Вторичный билиарный рефлюкс-гастрит. Наверное, самой многочисленной группой пациентов, у которых развивается вторичный рефлюкс-гастрит (РГ), являются пациенты, перенесшие холецистэктомию (ХЭ). Все больше данных появляется о том, что ХЭ, которая является золотым стандартом лечения желчнокаменной болезни (ЖКБ), связана с высоким риском развития различной патологии слизистой оболочки желудка. У пациентов после ХЭ с удлинением времени после операции увеличивается риск развития РГ [26], кишечной метаплазии и даже рака желудка [33]. Предыдущие исследования [35] показали, что от 51 до 89% пациентов после ХЭ имеют патологический ДГР, имеется значительная корреляция между уровнем внутрижелудочных желчных кислот и тяжестью ДГР. G. Aprea и соавт. (2012) исследовали пациентов после проведенной ХЭ на протяжении 6 мес послеоперационного периода. Обнаружилось, что у 58% таких пациентов возникает РГ, для диагностики которого использовался гистологический BRI. Причем клиническая симптоматика в послеоперационном периоде не соответствует гистологическим данным: в то время как BRI был положительный у 58% пациентов после ХЭ, клинические симптомы в виде диспепсии были обнаружены только у 41,9% из них. При этом уровень инфицированности Н. pylory у таких пациентов оставался неизменным как до, так и после операции, несмотря на высокий уровень показателей ДГР [45].
Предыдущие исследования [35] показали, что от 51 до 89% пациентов после ХЭ имеют патологический ДГР, имеется значительная корреляция между уровнем внутрижелудочных желчных кислот и тяжестью ДГР. G. Aprea и соавт. (2012) исследовали пациентов после проведенной ХЭ на протяжении 6 мес послеоперационного периода. Обнаружилось, что у 58% таких пациентов возникает РГ, для диагностики которого использовался гистологический BRI. Причем клиническая симптоматика в послеоперационном периоде не соответствует гистологическим данным: в то время как BRI был положительный у 58% пациентов после ХЭ, клинические симптомы в виде диспепсии были обнаружены только у 41,9% из них. При этом уровень инфицированности Н. pylory у таких пациентов оставался неизменным как до, так и после операции, несмотря на высокий уровень показателей ДГР [45].
Другой вид операций, при котором высок процент изменений слизистой оболочки желудка по причине желчного рефлюкса, — это резекции желудка или операции на тонкой кишке [24, 30]. S. Kuran и соавт. (2008) изучали пациентов, которым проводились различные манипуляции на желчевыводящих путях, такие как эндоскопическая папиллосфинктеротомия, эндоскопическое стентирование или холедоходуоде-ностомия при патологиях, не связанных со злокачественными новообразованиями. Оказалось, что все указанные выше процедуры связаны с повышенным риском развития ДГР. Наиболее высокий процент ДГР возникает у больных после холедоходуодено-стомии. При этом, если у пациентов, которые не были прооперированы, ДГР в основном оказывает влияние на антральный отдел желудка, то у пациентов, перенесших перечисленные выше операции на желчных путях, в том числе и после ХЭ, ДГР воздействует как на антральный отдел, так и на тело желудка [46]. Таким образом, по мере проведения новых исследований появляется все больше данных
S. Kuran и соавт. (2008) изучали пациентов, которым проводились различные манипуляции на желчевыводящих путях, такие как эндоскопическая папиллосфинктеротомия, эндоскопическое стентирование или холедоходуоде-ностомия при патологиях, не связанных со злокачественными новообразованиями. Оказалось, что все указанные выше процедуры связаны с повышенным риском развития ДГР. Наиболее высокий процент ДГР возникает у больных после холедоходуодено-стомии. При этом, если у пациентов, которые не были прооперированы, ДГР в основном оказывает влияние на антральный отдел желудка, то у пациентов, перенесших перечисленные выше операции на желчных путях, в том числе и после ХЭ, ДГР воздействует как на антральный отдел, так и на тело желудка [46]. Таким образом, по мере проведения новых исследований появляется все больше данных
о возникновении послеоперационных осложнений, причиной которых выступает ДГР.
Дуоденогастральный рефлюкс и предраковые изменения слизистой оболочки желудка. В
В
связи с тем общим положением, что хроническое воспаление является предрасполагающим фактором в развитии рака, а также с доказанным фактом, что в желудке воспаление, вызванное Helicobacter pylori, связано с развитием рака желудка, возникает вопрос о взаимосвязи гастрита, вызванного ДГР, с канцерогенезом. До настоящего времени нет прямых доказательств, что ДГР является причиной развития рака желудка. В «скандинавском исследовании» изучалась взаимосвязь ДГР и рака желудка у пациентов после ХЭ. Для того чтобы изучить вопрос, является ли длительное неинфекционное воспаление, каковым является ДГР, предиктором канцерогенеза, K. Fall и соавт. (2007) провели масштабное исследование большой когорты населения после проведенной ХЭ. Как известно, после такой операции с высокой частотой возникают ДГР и реактивный гастрит. Были исследованы данные 251 672 пациентов Шведского национального регистра госпитализированных больных, которые перенесли ХЭ с 1970 по 1997 г. При этом все случаи заболевания раком желудка были выявлены через взаимосвязь со Шведским регистром заболеваемости раком. В качестве сравнения использовались показатели заболеваемости раком среди всего населения Швеции. Для обеих групп были высчитаны стандартизированные коэффициенты заболеваемости. В результате было выявлено, что у больных после ХЭ на 11% возрастает риск возникновения рака дистального отдела желудка. Причем такая взаимосвязь была найдена только у мужчин и в течение 10 лет после операции. У женщин не было выявлено изменения риска заболеваемости, кроме того, у мужчин со сроком операции более 10 лет такая связь также не наблюдалась. Тот факт, что взаимосвязь изменялась в зависимости от пола и затрагивала сравнительно короткий период, а с течением времени ослабевала, то, по мнению авторов, она ослабляет причинноследственную связь между ХЭ и раком желудка на протяжении долгого периода времени [35].
При этом все случаи заболевания раком желудка были выявлены через взаимосвязь со Шведским регистром заболеваемости раком. В качестве сравнения использовались показатели заболеваемости раком среди всего населения Швеции. Для обеих групп были высчитаны стандартизированные коэффициенты заболеваемости. В результате было выявлено, что у больных после ХЭ на 11% возрастает риск возникновения рака дистального отдела желудка. Причем такая взаимосвязь была найдена только у мужчин и в течение 10 лет после операции. У женщин не было выявлено изменения риска заболеваемости, кроме того, у мужчин со сроком операции более 10 лет такая связь также не наблюдалась. Тот факт, что взаимосвязь изменялась в зависимости от пола и затрагивала сравнительно короткий период, а с течением времени ослабевала, то, по мнению авторов, она ослабляет причинноследственную связь между ХЭ и раком желудка на протяжении долгого периода времени [35].
В ряде исследований изучались патогенетические механизмы воздействия билиарного рефлюкса на слизистую оболочку желудка и определялось, может ли ДГР быть фактором канцерогенеза. Так как при ДГР наблюдается усиление пролиферации слизистых клеток, это увеличивает вероятность возникновения опухолевого клона эпителиальных клеток. Такие клоны возникают, в частности, в тех случаях, когда хронические повреждения эпителия связаны с рефлюксом желчи [36].
Так как при ДГР наблюдается усиление пролиферации слизистых клеток, это увеличивает вероятность возникновения опухолевого клона эпителиальных клеток. Такие клоны возникают, в частности, в тех случаях, когда хронические повреждения эпителия связаны с рефлюксом желчи [36].
В ряде других исследований изучались факторы, которые способствуют развитию кишечной метаплазии слизистой оболочки желудка, так как кишечная метаплазия также может быть фактором канцерогенеза. Ранее уже было показано, что такая метаплазия связана с хроническим воспалением, вызванным или желудочно-пищеводным рефлюксом, или гастроэзофагеальной рефлюксной болезнью (ГЭРБ), или хеликобактерной инфекцией.
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ОБЗОРЫ
53
Другим этиологическим фактором является рефлюкс желчи. Было показано, что рефлюкс желчи является независимым фактором риска в развитии кишечной метаплазии как на уровне кардиального отдела слизистой оболочки желудка [41], так и в других отделах желудка. Причем такие изменения слизистой оболочки желудка наблюдались, по некоторым данным, уже на протяжении 6 мес после операции [47], в то время как другие исследователи [45] считают такой срок слишком коротким для развития метаплазии на фоне патологического ДГР и РГ
Было показано, что рефлюкс желчи является независимым фактором риска в развитии кишечной метаплазии как на уровне кардиального отдела слизистой оболочки желудка [41], так и в других отделах желудка. Причем такие изменения слизистой оболочки желудка наблюдались, по некоторым данным, уже на протяжении 6 мес после операции [47], в то время как другие исследователи [45] считают такой срок слишком коротким для развития метаплазии на фоне патологического ДГР и РГ
В большом исследовании T Matsuhisa и соавт. (2013) было обнаружено наличие взаимосвязи между риском возникновения атрофического гастрита и кишечной метаплазии и рефлюксом желчных кислот в желудок, а также наличие хеликобактерной инфекции. В исследовании приняло участие 2 283 пациента с наличием желчных кислот в содержимом желудка натощак. Пациенты были разделены на группы по уровню концентрации желчных кислот. При этом оказалось, что риск развития атрофического гастрита не связан с наличием ДГР ни у Н. pylori-позитивных, ни у Н. pylori-негативных пациентов. В то время как риск развития кишечной метаплазии связан с наличием повышенных концентраций желчных кислот в желудке у Н. pylori-негативных пациентов [42]. В исследованиях последних лет было обнаружено, что воздействие желчных кислот на слизистую оболочку желудка, в частности хеноде-зоксихолевой кислоты (ХДК), имеет свой, не связанный с H. pylori, механизм действия. В эксперименте in vitro на культуре клеток было показано, что ХДК приводит к кишечной метаплазии клеток слизистой оболочки желудка путем экспрессии генов Cdx2 и MUC2, вызывающих подобные изменения. Причем эффект воздействия ХДК на экспрессию этих генов был дозозависимым [43]. Такие же данные были получены in vivo при исследовании воздействия желчных кислот на слизистую оболочку желудка у пациентов, инфицированных H. pylori. Несмотря на то что при воздействии желчных кислот уровень воспалительных изменений слизистой оболочки желудка, вызванных H. pylori, снижался, на фоне ДГР развивались атрофия и кишечная метаплазия и повышался риск возникновения рака желудка [44].
pylori-позитивных, ни у Н. pylori-негативных пациентов. В то время как риск развития кишечной метаплазии связан с наличием повышенных концентраций желчных кислот в желудке у Н. pylori-негативных пациентов [42]. В исследованиях последних лет было обнаружено, что воздействие желчных кислот на слизистую оболочку желудка, в частности хеноде-зоксихолевой кислоты (ХДК), имеет свой, не связанный с H. pylori, механизм действия. В эксперименте in vitro на культуре клеток было показано, что ХДК приводит к кишечной метаплазии клеток слизистой оболочки желудка путем экспрессии генов Cdx2 и MUC2, вызывающих подобные изменения. Причем эффект воздействия ХДК на экспрессию этих генов был дозозависимым [43]. Такие же данные были получены in vivo при исследовании воздействия желчных кислот на слизистую оболочку желудка у пациентов, инфицированных H. pylori. Несмотря на то что при воздействии желчных кислот уровень воспалительных изменений слизистой оболочки желудка, вызванных H. pylori, снижался, на фоне ДГР развивались атрофия и кишечная метаплазия и повышался риск возникновения рака желудка [44].
H. pylori и дуоденогастральный рефлюкс в патогенезе гастрита. Вопрос о взаимодействии таких патогенных факторов, как H. pylori и желчи в развитии рефлюкс-гастрита, ставится уже давно. Известны данные об ингибирующем воздействии желчных кислот на H. pylori, это было продемонстрировано в работе M.L. Hanninen (1991), где под действием хенодезоксихолевой и дезоксихолевой кислот (основных компонентов желчи) происходило разрушение этого микроорганизма in vitro [25]. Однако в клинических исследованиях имеются различные данные по этому вопросу.
У пациентов после ХЭ исследования различных авторов показали разные результаты по уровню обсемененности H. pylori слизистой оболочки желудка. Имеются исследования, в которых количественные показатели обсемененности H. pylori снижались в послеоперационном периоде [47].
В других исследованиях обсемененность H. pylori не изменялась [33] или даже увеличивалась [26] и в послеоперационном периоде. Во многих случаях авторы отмечают синергизм этих двух патогенных факторов в возникновении патологических изменений в слизистой оболочке желудка у пациентов после ХЭ.
pylori не изменялась [33] или даже увеличивалась [26] и в послеоперационном периоде. Во многих случаях авторы отмечают синергизм этих двух патогенных факторов в возникновении патологических изменений в слизистой оболочке желудка у пациентов после ХЭ.
При исследовании пациентов, перенесших резекцию желудка или прооперированных на кишечнике, также нет однозначных данных по влиянию Н. pylori на течение рефлюкс-гастрита. Исследования, проведенные у таких больных, выявили, что частота гастрита культи, вызванного Н. pylori возрастает после резекции желудка и снижается после операций на желчевыводящих путях [30]. У тех больных, у которых операция выполнена таким способом, который защищает культю желудка от желчного рефлюкса (резекция желудка по Бильрот-2), были более высокие показатели обсемененности H. pylori и более низкие показатели воспаления слизистой оболочки желудка, по данным эндоскопического исследования. И, наоборот, у больных, которым была проведена резекция желудка по Бильрот-1, показатели воспаления слизистой оболочки желудка были выше, а уровень обсемененности H.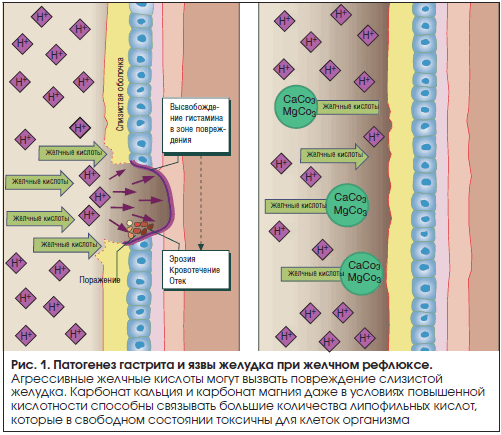 pylori — ниже [24].
pylori — ниже [24].
В более позднем исследовании X.B. Li и соавт. (2008) показатели хронического воспаления, его активность, атрофия и кишечная метаплазия слизистой оболочки желудка у пациентов после резекции дистальной части желудка на фоне присутствия H. pylori были значительно более высокими, чем у H. pylori-негативных пациентов. На основании этих данных авторы делают вывод о том, что и ДГР, и инфицированность H. pylori утяжеляют течение гастрита [31].
В исследованиях пациентов с первичным билиарным рефлюксом было также отмечено взаимное влияния рефлюкса и H. pylori на состояние слизистой оболочки желудка. При оценке влияния билиарного рефлюкса на выраженность повреждений слизистой оболочки желудка у пациентов с диспепсией и хроническим гастритом было выявлено, что как степень изменений слизистой оболочки, так и колонизация инфекцией H. pylori коррелировали с длительностью билиарного рефлюкса [22]. В другом исследовании было найдено, что у пациентов с хроническим каль-кулезным холециститом, инфицированных H. pylori, желчный рефлюкс встречается достоверно чаще, чем у здоровых лиц и у неинфицированных больных [27]. В одном из ранних исследований, посвященных этой проблеме, при исследовании пациентов с билиарным рефлюксом было обнаружено, что это не только два независимых фактора в развитии гастрита. При наличии инфицированности H. pylori количество рефлюксов в желудок возрастает [34]. Однако в последующих исследованиях не было найдено подтверждения такой взаимосвязи.
Можно предположить комплексный механизм воздействия ДГР и H. pylori на слизистую оболочку желудка. Так, абсорбция рефлюктанта желчи на поверхности слизистой оболочки желудка оказывает прямой повреждающий эффект, а также усиливает
54
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
действие пепсина и соляной кислоты; повреждение слизистой оболочки желудка в свою очередь способствует колонизации Н. pylori от антрального отдела до тела желудка. В отсутствие инфицирования Н. pylori вследствие забросов щелочного содержимого из ДПК и изменения рН возможна бактериальная контаминация микрофлорой нижележащих отделов пищеварительного тракта, что также приводит к более выраженному повреждению слизистой оболочки желудка.
Клиническая картина. В «чистом» виде ДГР встречается редко, в большинстве случаев он диагностируется на фоне других заболеваний ЖКТ, прежде всего гастродуоденальной патологии, что накладывает отпечаток на клиническую симптоматику рефлюкса, в значительной степени маскируя ее. Клинические проявления ДГР характеризуются преобладанием диспептических симптомов — отрыжкой воздухом или кислым, тошнотой, изжогой, рвотой желчью, горечью во рту, часто не проходящей или усиливающейся на фоне приема ингибиторов протонной помпы (ИПП).
Боли в животе носят периодический характер, чаще схваткообразный, иногда провоцируются физической нагрузкой, стрессовыми ситуациями. В отличие от «классического» кислого рефлюкса, проявляющегося изжогой, регургитацией и дисфагией, ассоциация ДГР с соответствующей симптоматикой выражена слабее, однако чаще, чем при кислом рефлюксе, выявляются симптомы диспепсии. Пациенты могут предъявлять жалобы на боль в эпига-стрии, усиливающуюся после приема пищи, иногда достигающую значительной интенсивности [15].
Чаще всего указанные выше симптомы возникают как следствие развившегося на фоне ДГР гастрита. Несостоятельность сфинктерного аппарата, антродуоденальная дискоординация (нарушение координации между антральным, пилорическим отделами желудка и двенадцатиперстной кишки), а также резекции части желудка, приводящая к ликвидации естественного антирефлюксного барьера, являются причиной формирования желчного рефлюкса и служат важными факторами анамнеза, выявление которых может привести к правильной постановке диагноза [11].
В связи с тем, что нет клинических симптомов, специфичных для ДГР, его диагностика в большей степени проводится на основании инструментальных методов исследования.
Диагностика дуоденогастрального рефлюкса. Наиболее распространенным на сегодняшний день методом диагностики, при котором устанавливается диагноз ДГР, является эндоскопическая эзофагогастродуоденоскопия. Среди изменений, определяемых при ЭГДС, наблюдаются наличие очаговой гиперемии, отек слизистой оболочки желудка, окрашивание содержимого желудка в желтый цвет. Привратник, из которого в желудок порционно поступает желчь, зияет [4, 5]. Наиболее распространенными эндоскопическими изменениями при ДГР являются: эритема слизистой оболочки желудка, наличие желчи в желудке, утолщение складок желудка, эрозии, атрофия слизистой оболочки желудка, пе-
техии, кишечная метаплазия и полипы желудка [29]. Причем, по данным авторов, после операций на желудке, таких как резекция желудка, пилоропластика и наложение желудочно-кишечного анастомоза при возникновении рефлюкс-гастрита, наиболее часто возникали такие изменения слизистой оболочки желудка, как острое воспаление, наличие хеликобак-терной инфекции, образование желудочных полипов и пептических язв. В то время как у пациентов после операций на желчевыводящих путях, таких как ХЭ или наложение холедоходуоденального анастомоза, более частыми были изменения в виде отека и дисплазии слизистой оболочки желудка.
рН-метрия как кратковременная, так и суточная позволяет оценить профиль внутрижелудочной рН и высоту рефлюкса. Более достоверным методом является суточная рН-метрия. При этом определяется рН в теле желудка и антральном отделе. За ДГР принимается «зазубренное» ощелачивание или быстрое повышение рН в антральном отделе выше 4,0, не связанное с приемом пищи или поступлением слюны [17].
В связи с тем, что указанные выше методы диагностики ДГР являются недостаточно точными, они часто дополняются другими методами. Среди них можно отметить аспирацию содержимого желудка, выполняемую совместно с ФЭГДС или рН-метрией, которые позволяют провести биохимический анализ находящихся в желудке желчных кислот и определить их концентрацию [4].
При ультразвуковой диагностике (эхография с водной нагрузкой) в случае заброса щелочного содержимого двенадцатиперстной кишки в кислую среду желудка, т.е. при ДГР, на эхограммах периодически, соответственно забросу в желудок дуоденального содержимого, регистрируется ретроградное движение пузырьков газа (эхогенных участков) и жидкости от привратника к телу желудка [18, 19].
При рентгеноскопии желудка характерным признаком ДГР является регургитация бария из двенадцатиперстной кишки в желудок.
Из методов диагностики билиарного рефлюкса наиболее точной, по мнению ряда авторов [28, 47, 56], является фиброоптическая спектрофотометрия (Bilitec, 2000), основанная на определении абсорбционного спектра билирубина. В отличие от диагностики аппаратом Bilitec, изолированное мони-торирование рН внутри пищевода или желудка признано неудовлетворительным, так как нет возможности с точностью определить, когда заканчивается постпрандиальный период. Кроме того, по мнению ряда авторов, фиброоптическая спектрофотометрия является наиболее удобным диагностическим методом для пациента. Однако более поздние исследования показали, что если для измерения концентрации желчи в пищеводе фиброоптическая спектрофотометрия является достаточно точной методикой, то для измерений уровня билирубина в желудке методика не так точна. K.H. Fuchs и соавт. (1999) [37] при исследовании пищевода и желудка с помощью Biliteс и рН-мониторинга обнаружили несоответствие этих двух методов в регистрации ДГР. Так, в щелочной среде регистрируется повышение
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ОБЗОРЫ
55
уровня билирубина более часто при постоянном рН (43%), а увеличение рН — при неизменном уровне билирубина (37%). Другие авторы показали, что данные по концентрации билирубина, измеренные с помощью Bilitec, не совсем точны в кислой среде желудка [38, 39].
Радионуклидная билиарная сцинтиграфия с HIDA меченым радиоизотопом технеция применяется в условиях стационара, однако до настоящего времени имеет ряд преимуществ перед другими методами, так как является неинвазивным и физиологическим методом определения ДГР Исследования, проведенные в последние годы, показали наличие корреляции между тяжестью гистологических изменений на слизистой оболочке желудка и наличием ДГР на сцинтиграфии. Будучи физиологической методикой с хорошей воспроизводимостью результатов, гепатобилиарная сцинтиграфия подходит для рутинного клинического применения в диагностике ДГР [47]. Для косвенного определения уровня ДГР широко используется индекс, основанный на гистологических изменениях слизистой оболочки желудка, о котором говорилось выше.
Лечение. Лечение ДГР и РГ представляет сложную задачу и включает назначение прокинетиков, антацидов, препаратов урсодезоксихолевой кислоты (УДХК), ингибиторов протонной помпы (ИПП), сорбентов и цитопротекторов.
Терапия ДГР направлена на нейтрализацию раздражающего действия компонентов дуоденального содержимого на слизистую оболочку желудка и пищевода (в случае УДХК, сорбентов и цитопротекторов), на нормализацию пропульсивной способности ЖКТ (прокинетики). Терапия, подавляющая кислотопродукцию, может быть эффективна в снижении повреждающего действия соляной кислоты и желчи. Подавление кислотопродукции с применением ИПП эффективно снижает как кислотный, так и желчный рефлюкс [49]. Возможный механизм, который задействован в подавлении желчного рефлюкса, связан с тем, что ИПП увеличивают длительность III фазы активности антрального отдела желудка и двенадцатиперстной кишки в межпищеварительный период. Удлинение данной фазы, названной мигрирующим моторным комплексом, может приводить к ускорению продвижения содержимого желудка по антруму и двенадцатиперстной кишки, что, в свою очередь, должно уменьшить число ДГР и объем как кислотного, так и желчного заброса в желудок. Данный факт был обнаружен L. Vinter-Jensen и соавт. (1989) при исследовании воздействия омепразола на мигрирующий моторный комплекс у здоровых добровольцев [51].
Помимо рабепразола у больных РГ применяется антацид местного действия — гидротальцит. Достоинством этого антацида является его специфическая слоисто-сетчатая структура, которая создает механизм для оптимального рН-контроля, создаваемого препаратом. Механизм действия данной структуры состоит в том, что когда гидротальцит взаимодействует с кислотой, активны только поверхностные слои таблетки, включающие в себя окись алюминиевого и магниевого гидратата. Как только показатель
рН становится больше 5, реакция останавливается. Оставшиеся слои решетки, представленные прослойками воды и анионов углекислой кислоты, сохраняются до тех пор, пока секреция кислоты вновь не возрастет. Далее включается в действие следующий слой гидротальцита. Благодаря этому препарат не только быстро избавляет от изжоги, боли, тяжести в желудке, но и дольше, чем другие антациды, удерживает рН на уровне 3, не нарушая при этом процесса пищеварения [21]. Помимо поддержания рН у гидротальцита имеется также свойство адсорбента, благодаря чему адсорбируются желчь и лизолецитин. В исследовании H. Chen и соавт. (2010) при применении рабепразола или гидротальцита в монотерапии уровень купирования симптомов при ДГР был недостаточен. Исследование показало, что при применении комбинированной терапии (рабепразол плюс гидротальцит) снижались все показатели ДГР, которые исследовались авторами: диспептическая симптоматика, эндоскопические и гистологические данные ДГР, количество желчных рефлюксов, количество желчных рефлюксов длительностью более 5 мин и процент времени, в течение которого обнаруживался билирубин в содержимом желудка. Таким образом, комбинированная терапия рабепразолом плюс гидротальцитом наиболее эффективна по сравнению с группой пациентов без терапии и по сравнению с монотерапией каждым препаратом у больных ДГР [50].
К препаратам, которые применяются для восстановления ЖКТ и устранения ДГР, относятся антагонисты дофаминовых рецепторов (метокло-прамид, домперидон), агонисты 5-НТ4 серотонино-вых рецепторов (мосаприд, тегасерод), препараты комбинированного действия: антагонисты периферических дофаминовых D2-рецепторов и блокаторы ацетилхолинэстеразы (итоприда гидрохлорид), агонисты мотилиновых рецепторов (эритромицин), агонисты опиоидных периферических рецепторов (тримебутина малеат), неселективные блокаторы синтеза NO и др.2-антагонист) связаны с блокадой дофаминовых рецепторов. Антагонисты дофаминовых рецепторов повышают тонус нижнего пищеводного сфинктера, усиливают сократительную способность желудка и препятствуют его релаксации, ускоряют эвакуацию из желудка и улучшают антродуоденальную координацию, способствуя тем самым устранению ДГР. Из препаратов этой группы чаще применяется домпери-дон в связи с тем, что метоклопрамид проникает через гематоэнцефалический барьер и может вызывать большое количество побочных эффектов: мышечный гипертонус, гиперкинезы, сонливость, беспокойство, депрессию, а также эндокринные нарушения (гиперпролактинемия, галакторея).
56
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
Препарат комбинированного действия итоприда гидрохлорид является одновременно антагонистом дофаминовых рецепторов и блокатором ацетилхолинэстеразы. Он усиливает пропульсивную моторику желудка и ускоряет его опорожнение, оказывает противорвотный эффект в результате взаимодействия с D2-рецепторами триггерной зоны (эффективность препарата 57—81%). Антагонист периферических опиоидных рецепторов тримебу-тина малеат является универсальным регулятором моторики, оказывает спазмолитическое (антагонист NMDA-рецепторов) или прокинетическое действие в зависимости от исходного состояния моторики ЖКТ (эффективность 83%). Тримебутин оказывает стимулирующее влияние на III фазу активности антрального отдела желудка и двенадцатиперстной кишки в межпищеварительный период, что приводит к улучшению пропульсивной перистальтики ЖКТ и доказанному уменьшению ДГР [15].
Кроме прокинетиков при наличии билиарного рефлюкса применяются, как было показано выше, антациды и цитопротекторы, сорбенты для нейтрализации соляной кислоты и адсорбции желчных кислот и лизолецитина, а также с целью повышения устойчивости слизистой оболочки желудка к действию повреждающих агрессивных факторов.
Основанием для применения УДХК при гастрите и эзофагите, обусловленных ДГР, служит ее цитопротекторный эффект. УДХК способствует переходу желчных кислот, содержащихся в забрасываемом содержимом, в водорастворимую форму, что уменьшает агрессивные свойства рефлюксата. Вытеснение пула гидрофобных желчных кислот и предотвращение индуцированного ими апоптоза эпителиоцитов ведут к редукции клинической симптоматики и эндоскопических признаков повреждения слизистой оболочки желудка и слизистой пищевода.
Эффективность УДХК в лечении желчного рефлюкс-гастрита была показана в экспериментальных научных исследованиях.
Т. Kawamura и соавт. (1989) вызывали у экспериментальных крыс стрессовое повреждение желудка. Предварительное назначение УДХК защищало желудок экспериментального животного от ульцерации, при этом уровень каталазы в сыворотке крови и ткани желудка был существенно ниже, чем у животных из группы контроля. Кроме того, УДХК в данном эксперименте продемонстрировала антиоксидантный эффект [55]. В 2008 г. группой ученых были опубликованы результаты эксперимента по применению УДХК у мышей, инфицированных H. pylori. Мыши с H. pylori-позитивным гастритом были разделены на две группы: 1-я получала УДХК, а 2-я — плацебо. Результаты эксперимента показали уменьшение колонизации H. pylori на слизистой оболочке желудка. Это повлияло на степень выраженности гастрита, которая оценивалась по активности миелопероксидазы, свидетельствующей о наличии полиморфно-ядерных лейкоцитов в ткани желудка. Данный показатель определялся на 4, 6 и 8-й нед приема УДХК, при этом отмечалось его снижение на 60, 40 и 37,5% соответственно. В
этом же исследовании было показано, что УДХК при гастрите снижает уровень малатдегидрогеназы и кислородных радикалов, что может предотвратить апоптоз при H. pylori-позитивном гастрите. Таким образом, на экспериментальной модели была показана эффективность применения УДХК не только при поражениях, вызванных ДГР, но и при гастритах, причиной которых является H. pylori [54]. Это важный аспект применения УДХК в силу того, что, как было отмечено выше, в патогенезе рефлюксгастритов желчные кислоты и H. pylori обладают синергизмом в повреждающем воздействии на слизистую оболочку желудка и пищевода.
A.B. Stefaniwsky и соавт. (1985) применяли УДХК у больных после операций на желудке в дозе 1000 мг/сут в течение месяца. У больных присутствовали эпигастральная боль, тошнота и рвота желчью. В плацебоконтролируемом исследовании оценивалось влияние УДХК на клиническую симптоматику и гистологические показатели слизистой оболочки желудка. В результате лечения с помощью УДХК значительно уменьшились интенсивность и частота болей, почти исчезли тошнота и рвота. За период терапии доля УДХК в желчи, полученной из желудочного содержимого, выросла до 50% от общего количества желчных кислот [52].
Эффективность лечения РГ с помощью УДХК, подтвержденная эндоскопическим исследованием, была отмечена и у больных после ХЭ. M. Ozkaya и соавт. (2002) исследовали воздействие УДХК на уровень эпидермального фактора роста в слизистой оболочке желудка. Данный индуктор пролиферации эпителиальных клеток слизистой оболочки желудка секретируется в ответ на повреждение слизистой, а также является фактором защиты и заживления слизистой оболочки желудка у больных с билиарным РГ после проведенной ХЭ. В исследовании участвовал 31 пациент с ДГР и различными степенями гастрита. После 6-недельного курса лечения УДХК у 29% пациентов наблюдалось полное исчезновение эндоскопических симптомов заболевания, а у остальных пациентов излечение было частичным. Однако уровень эпидермального фактора роста значительно снижался у всех пациентов на фоне лечения УДХК. Низкий уровень высвобождения фактора роста эпидермиса можно объяснить заживлением слизистой оболочки желудка после курса лечения. Однако авторы считают, что необходимы дальнейшие исследования для того, чтобы выяснить, имеет ли УДХК прямое влияние на эпидермальный фактор роста или эта взаимосвязь опосредованная [53].
Таким образом, ДГР как патологический рефлюкс осложняет течение многих функциональных и органических заболеваний ЖКТ, является одним из факторов, способствующих канцерогенезу в слизистой оболочке желудка, а его клинические проявления не позволяют своевременно диагностировать ДГР и предотвратить его последствия. Одновременно с этим методы диагностики и лечения ДГР нуждаются в дальнейшей доработке и нахождении оптимальных и общепринятых схем и алгоритмов.
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ОБЗОРЫ
57
ЛИТЕРАТУРА
1. Пиманов, С.И. Гастрит, эзофагит и язвенная болезнь / С.И. Пиманов. — Н. Новгород: Изд-во НГМА. — 2000. — 380 с.
2. Михаськив, И.Н. Роль рефлюкса дуоденального содержимого в генезе рака культи желудка после резекции желудка / И.Н. Михаськив // Хирургия. — 1980. — № 2. — С.44—51.
3. Вахрушев, Я.М. Комплексное изучение патогенетических механизмов эрозивного поражения желудка и двенадцатиперстной кишки / Я.М. Вахрушев, Е.В. Никишина // Pocсийский гастроэнтерологический журнал. — 1998. — № 3. — С.22—29.
4. Санников, О.Р Оптимизация диагностики дуодено-гастрального рефлюкса после холецистэктомии: авто-реф. дис. … канд. мед. наук / О.Р Санников. — Пермь, 2007. — 22 с.
5. Бабак, О.Я. Желчный рефлюкс: современные взгляды на патогенез и лечение / О.Я. Бабак // Сучасна гастроэнтеролога. — 2003. — № 1(11). — С.28—30.
6. Аруин, Л.И. Морфологическая диагностика болезней желудка и кишечника / Л.И. Аруин, Л.Л. Капуллер,
В.А. Исаков. — М.: Триада-Х, 1998. — 496 с.
7. Гончарик, И.И. Клиническая гастроэнтерология / И.И. Гончарик. — Минск: Интерпрессервис, 2002. — 334 с.
8. Волков, В.С. Дуоденогастральный рефлюкс и язвенная болезнь двенадцатиперстной кишки — расставим точки над «i» / В.С. Волков, И.Ю. Колесникова // Верхневолжский медицинский журнал. — 2010. — Т. 8, № 1. — С.26—29.
9. Колесникова, И.Ю. Почему не возникает язва двенадцатиперстной кишки у больных хроническим гастродуоденитом? / И.Ю. Колесникова, В.С. Волков,
Е.К. Лукашева // Российские медицинские вести. — 2012. — Т XVII., № 3. — С.69—72.
10. Колесникова, И.Ю. Особенности дуоденогастрального рефлюкса при язвенной болезни двенадцатиперстной кишки и его динамика после эрадикации Helicobacter pylori / И.Ю. Колесникова, В.С. Волков, Л.А. Любская // Экспериментальная и клиническая гастроэнтерология. — 2011. — № 5. — С.16—19.
11. Панько, С.В. Значение суточного рН-мониторирования в диагностике рефлюксной патологии желудочнокишечного тракта / С.В. Панько, Г.А. Журбенко, А.С. Карпицкий [и др.] // Биологические ритмы: материалы Междунар. науч.-практ. конф. 11—12 окт. 2012 г. — Брест, 2012. — С.147—149.
12. Осипенко, М.Ф. Подходы к диагностике и терапии гастрита, ассоциированного с рефлюксом желчи / М.Ф. Осипенко, М.А. Ливзан // Лечащий врач. — 2012. — № 2. — С.50—53.
13. Буеверов, А.О. Дуоденогастроэзофагеальный рефлюкс как причина рефлюкс-эзофагита / А.О. Буеверов, Т.Л. Лапина // Фарматека. — 2006. — № 1. — С.1—5.
14. Звягинцева, Т.Д. Хроническая дуоденальная непроходимость и принципы консервативной терапии / Т.Д. Звягинцева, И.И. Шаргород // Новости медицины и фармации. Гастроэнтерология (тематический номер). — 2011. — № 367 (газета). — URL: http://www. mif-ua.com (дата обращения 26.10.2014).
15. Звягинцева, ТД. Дуоденогастральный рефлюкс в практике врача-гастроэнтеролога: очевидные опасности и скрытая угроза / Т.Д. Звягинцева, А.И. Чернобай // Здоровье Украины. — 2012. — № 3. — С.11.
16. Юрченко, И.Н. Дуоденогастральный рефлюкс при гастроэзофагеальной рефлюксной болезни / И.Н. Юрченко, Н.А. Каширина, Н.А. Власова // Материалы XVII Российской гастронедели // РЖГГК. — 2011. — № 5, прил. 38. — C.19.
17. Селезнева, Э.Я. Внутрижелудочная рН-метрия в оценке секреторных и моторных нарушений желудка /
Э.Я. Селезнева // Российский гастроэнтерологический журнал. — 1998. — № 4 — С.69—72.
18. Гибадулина, И.О. Возможности ультразвуковой оценки функциональных результатов хирургической коррекции дуоденогастрального рефлюкса / И.О. Гибадулина,
Н.В. Гибадулин // SonoAce-Ultrasound. — 2011. — № 22 (мед. журнал). — URL: http://www.medison.ru/si/
19. Руководство по ультразвуковой диагностике заболеваний пищевода, желудка и двенадцатиперстной кишки / под ред. ГК. Жерлова, С.А. Соколова. — Новосибирск: Наука, 2005. — 208 с.
20. Белоусов, С.С. Гастроэзофагеальная рефлюксная болезнь и дуоденогастральный рефлюкс / С.С. Белоусов,
C. В. Муратов, А.М. Ахмад. — Н. Новгород: Изд-во Нижегородской гос. мед. академии, 2005. — 120 с.
21. Лапченко, Е.С. Состояние слизистой оболочки желудка у больных с дуоденогастральным рефлюксом / Е.С. Лапченко, Т.М. Преображенская, Е.В. Галаева, И.Д. Лоранская // Экспериментальная и клиническая гастроэнтерология. — 2010. — № 9. — С.25—29.
22. Ивашкин, В.Т. Место антацидов в современной терапии язвенной болезни / В.Т. Ивашкин, Е.К. Баранская,
O. С. Шифрин, Е.Ю. Юрьева // Русский медицинский журнал. Болезни органов пищеварения. — 2002. — Т 4, № 2. — URL: http://www.rmj.ru/
23. Chen, S.L. Effects of bile reflux on gastric mucosal lesions in patients with dyspepsia or chronic gastritis / S.L. Chen,
J.Z. Mo, Z.J. Cao [et al.] // World J. Gastroenterol. — 2005. — Vol. 11, № 18. — P.2834—2847.
24. Abe, H. Influence of bile reflux and Helicobacter pylori infection on gastritis in the remnant gastric mucosa after distal gastrectomy / H. Abe, K. Murakami, S. Satoh [et al.] // J. Gastroenterol. — 2005. — Vol. 40, № 6. —
P. 563—569.
25. Hanninen, M.L. Sensitivity of Helicobacter pylori to different bile salts / M.L. Hanninen // Eur. J. Clin. Microbiol. Infect. Dis. — 1991. — Vol. 10. — P.515—518.
26. Caldwell, M.T.P. Helicobacter pylori infection increases following cholecystectomy / M.T.P. Caldwell, M. McDermott, S. Jazrawi [et al.] // Ir. J. Med. Sci. — 1995. — Vol. 164. — P52—55.
27. Chen, D.F. H. pylori exist in the gallbladder mucosa of patients with chronic cholecystitis / D.F. Chen, L. Hu, P Yi,
D. C. Fang [et al.] // World J. Gastroenterol. — 2007. — Vol. 13, № 10. — P1608—1611.
28. Bechi, P. Are there alternative methods for measuring «bile» reflux? / P Bechi, F. Pucciani, F. Baldini [et al.] // Dig. Dis. Sci. — 1993. — Vol. 38, № 7. — P1297—1306.
29. Lin, J.K. A study of diagnosis of primary biliary reflux gastritis / J.K. Lin, PJ. Hu, C.J. Li [et al.] // Zhonghua Nei Ke Za Zhi. — 2003. — Vol. 42, № 2. — P.81—83.
30. Vere, C.C. Endoscopical and histological features in bile reflux gastritis / C.C. Vere, S. Cazacu, V. Comanescu [et al.] // Rom. J. Morphol. Embryol. — 2005. — Vol. 46, № 4. — P269—274.
31. Li, X.B. Role of bile reflux and Helicobacter pylori infection on inflammation of gastric remnant after distal gastrectomy / X.B. Li, H. Lu, H.M. Chen [et al.] // J. Dig. Dis. — 2008. — Vol. 9, № 4 — P.208—212.
32. Sjovall, H. Meaningful or redundant complexity — mechanisms behind cyclic changes in gastroduodenal pH in the fasting state / H. Sjovall // Acta Physiol (Oxf). — 2011. — Vol. 201, № 1. — P127—131.
33. Zullo, A. Gastric Pathology in Cholecystectomy Patients: Role of Helicobacter pylori and Bile Reflux / A. Zullo, V. Rinaldi, C. Hassan [et al.] // Journal of Clinical Gastroenterology. — 1998. — Vol. 27, № 4. — P335— 338.
58
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
34. Ladas, S.D. Helicobacter pylori may induce bile reflux: link between H. pylori and bile induced injury to gastric epithelium / S.D. Ladas, J. Katsogridakis, H. Malamou [et al.] // Gut. — 1996. — Vol. 38, № 1. — P. 15—18.
35. Fall, K. Risk for Gastric Cancer After Cholecystectomy / K. Fall, W. Ye, O. Nyren // The American Journal of Gastroenterology. — 2007. — Vol. 102, № 6. — P.1180— 1184.
36. Mac Dowall, J.E. Cell proliferation in type C gastritis affecting the intact stomach / J.E. Mac Dowall, P. Willis,
R. Prescott [et al.] // Clin. Pathol. — 2000. — Vol. 53. — P.784—787.
37. Fuchs, K.H. The role of 24-hr gastric pH-monitoring in the interpretation of 24-hr gastric bile monitoring for duodenogastric reflux / K.H. Fuchs, M. Fein, J. Maroske [et al.] // Hepatogastroenterology. — 1999. — Vol. 46, № 25. — P.60—65.
38. Tibbling, G.L. Gastric bile monitoring: an in vivo and in vitro study of Bilitec reliability / G.L. Tibbling, L. Blackadder, T. Franzen, E. Kullman // Scand. J. Gastroenterol. — 2002. — Vol. 37, № 11. — P.1334—1337.
39. Bechi, P. Technical aspects and clinical indications of 24-hour intragastric bile monitoring / P. Bechi, F. Cianchi // Hepatogastroenterology. — 1999. — Vol. 46, № 25. — P.54—59.
40. Sobala, G.M. Bile reflux and intestinal metaplasia in gastric mucosa / G.M. Sobala, H.J. O’Connor, E.P. Dewar [et al.] // J. Clin. Pathol. — 1993. — Vol. 46. — P.235—240.
41. Dixon M.F. Bile reflux gastritis and intestinal metaplasia at the cardia / M.F. Dixon, N.P. Mapstone, P.M. Neville [et al.] // Gut. — 2002. — Vol. 51. — P.351—355.
42. Matsuhisa, T. Relation between bile acid reflux into the stomach and the risk of atrophic gastritis and intestinal metaplasia: a multicenter study of 2283 cases / T. Matsuhisa, T. Arakawa, T. Watanabe [et al.] // Dig. Endosc. — 2013. — Vol. 25, № 5. — P.519—525.
43. Xu, Y. Bile Acids Induce Cdx2 Expression Through the Farnesoid X Receptor in Gastric Epithelial Cells / Y Xu, T. Watanabe, T. Tanigawa [et al.] // J. Clin. Biochem. Nutr. — 2010. — Vol. 46, № 1. — P.81—86.
44. Tatsugami, M. Bile acid promotes intestinal metaplasia and gastric carcinogenesis. / M. Tatsugami, M. Ito, S. Tanaka [et al.] // Cancer Epidemiol Biomarkers Prev. — 2012. — Vol. 21, № 11. — P.2101—2107.
45. Aprea, G. Morpho-functional gastric pre-and post-operative changes in elderly patients undergoing laparoscopic cholecystectomy for gallstone related disease / G. Aprea, A. Canfora, A. Ferronetti [et al.] // BMC Surg. — 2012. — Vol. 12, № 1. — P.5.
46. Kuran, S. Bile reflux index after therapeutic biliary procedures / S. Kuran, E. Parlak, G. Aydog [et al.] // BMC Gastroenterol. — 2008. — Vol. 8. — P.4.
47. Atak, I. The effect of laparoscopic cholecystectomy on the development of alkaline reflux gastritis and intestinal metaplasia / I. Atak, K. Ozdil, M. Yucel [et al.] // Hepatogastroenterology. — 2012. — Vol. 59, № 113. — P.59—61.
48. Chen, T.-F. Comparative evaluation of intragastric bile acids and hepatobiliary scintigraphy in the diagnosis of duodenogastric reflux / T.-F. Chen, P.K. Yadav, R.-J. Wu [et al.] //World J. Gastroenterol. — 2013. — Vol. 19, № 14. — P.2187—2196.
49. Menges, M. Increased acid and bile reflux in Barrett’s oesophagus compared to reflux oesophagitis, and effect of proton pump inhibitor therapy / M. Menges, M. Muller,
M. Zeitz // Am. J. Gastroenterol. — 2001. — Vol. 96. — P.331—337.
50. Chen, H. Rabeprazole combined with hydrotalcite is effective for patients with bile reflux gastritis after
cholecystectomy / H. Chen, X. Li, Z. Ge [et al.] // Can. J. Gastroenterol. — 2010. — Vol. 24, № 3. — P.197—201.
51. Vinter-Jensen, L. A double-blind placebo-controlled trial of omeprazole on characteristics of the migrating motor complex in healthy volunteers / L. Vinter-Jensen,
K. Kraglund, S.A. Pedersen // Aliment. Pharmacol. Ther. — 1989. — Vol. 3, № 6. — P.615—620.
52. Stefaniwsky, A.B. Ursodeoxycholic acid treatment of bile reflux gastritis. / A.B. Stefaniwsky, G.S. Tint, J. Speck [et al.] // Gastroenterology. — 1985. — Vol. 89, № 5. — P.1000—1004.
53. Ozkaya, M. The effect of ursodeoxycholic acid treatment on epidermal growth factor in patients with bile reflux gastritis / M. Ozkaya, A. Erten, I. Sahin [et al.] // Turk. J. Gastroenterol. — 2002. — Vol. 13, № 4. — P.198—202.
54. Thao, T.D. Antibacterial and anti-atrophic effects of a highly soluble, acid stable UDCA formula in Helicobacter pylori-induced gastritis / T.D. Thao, H.C. Ryu, S.H. Yoo [et al.] // Biochem. Pharmacol. — 2008. — Vol. 75, № 11. — P.2135—2146.
55. Kawamura, T. Effect of ursodeoxycholic acid on water immersion restraint stress ulcer of rats / T. Kawamura,
F. Koizumi, A. Ishimori // Nihon Shokakibyo Gakkai Zasshi. — 1989. — Vol. 86, № 10. — P.2373—2378.
56. Kawiorski, W. Current diagnosis of gastroduodenal reflux and biliary gastritis / W. Kawiorski, R.M. Herman, J. Legut-ko // Przegl. Lek. — 2001. — Vol. 58, № 2. — P.90—94.
REFERENCES
1. Pimanov, S.I. Gastrit, ezofagit i yazvennaya bolezn’ [Gastritis, esophagitis and peptic ulcer] / S.I. Pimanov. —
N. Novgorod: Izd-vo NGMA. — 2000. — 380 s.
2. Mihas’kiv, I.N. Rol’ reflyuksa duodenal’nogo soderzhimogo v geneze raka kul’ti zheludka posle rezekcii zheludka [The role of reflux of duodenal contents in the genesis of cancer of the gastric stump after gastrectomy] / I.N. Mihas’kiv // Hirurgiya [Surgery]. — 1980. — № 2. — S.44—51.
3. Vahrushev, Ya.M. Kompleksnoe izuchenie patogene-ticheskih mehanizmov erozivnogo porazheniya zheludka i dvenadcatiperstnoi kishki [Comprehensive study of pathogenetic mechanisms of erosive lesions of the stomach and duodenum] / Ya.M. Vahrushev, E.V. Nikishina // Pocsiiskii gastroenterologicheskii zhurnal [Russian Journal of Gastroenterology]. — 1998. — № 3. —
S.22—29.
4. Sannikov, O.R. Optimizaciya diagnostiki duodeno-gastral’nogo reflyuksa posle holecistektomii [Optimizing the diagnosis of duodenal reflux after cholecystectomy]: avtoref. dis. … kand. med. nauk / O.R. Sannikov. — Perm’, 2007. — 22 s.
5. Babak, O.Ya. Zhelchnyi reflyuks: sovremennye vzglyady na patogenez i lechenie [Bile reflux: current views on the pathogenesis and treatment] / O.Ya. Babak // Suchasna gastroenterologiya [Modern Gastroenterology]. — 2003. — № 1(11). — S.28—30.
6. Aruin, L.I. Morfologicheskaya diagnostika boleznei zheludka i kishechnika [Morphological diagnosis of diseases of the stomach and intestines] / L.I. Aruin,
L. L. Kapuller, V.A. Isakov. — M.: Triada-H, 1998. — 496 s.
7. Goncharik, I.I. Klinicheskaya gastroenterologiya [Clinical Gastroenterology] / I.I. Goncharik. — Minsk: Interpresservis, 2002. — 334 s.
8. Volkov, V.S. Duodenogastral’nyi reflyuks i yazvennaya bolezn’ dvenadcatiperstnoi kishki — rasstavim tochki nad «i» [Duodenal reflux and duodenal ulcer — dot the «i»] / V.S. Volkov, I.Yu. Kolesnikova // Verhnevolzhskii medicinskii zhurnal [Verhnevolzhskiy Medical Journal]. —
2010. — T 8, № 1. — S.26—29.
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ОБЗОРЫ
59
9. Kolesnikova, I.Yu. Pochemu ne voznikaet yazva dvenadcatiperstnoi kishki u bol’nyh hronicheskim gastroduodenitom? [Why is not there a duodenal ulcer in patients with chronic gastroduodenitis?] / I.Yu. Kolesnikova, V.S. Volkov, E.K. Lukasheva // Rossiiskie medicinskie vesti [Russian Medical News]. — 2012. — T. XVII., № 3. —
S. 69—72.
10. Kolesnikova, I.Yu. Osobennosti duodenogastral’nogo reflyuksa pri yazvennoi bolezni dvenadcatiperstnoi kishki i ego dinamika posle eradikacii Helicobacter pylori [Features of duodenogastric reflux with duodenal ulcer and its dynamics after Helicobacter pylori eradication] / I.Yu. Kolesnikova, V.S. Volkov, L.A. Lyubskaya // Eksperimental’naya i klinicheskaya gastroenterologiya [Experimental and Clinical Gastroenterology ]. — 2011. — № 5. — S.16—19.
11. Pan’ko, S.V. Znachenie sutochnogo rN-monitorirovaniya v diagnostike reflyuksnoi patologii zheludochno-kishechnogo trakta [Meaning of daily pH monitoring in diagnosing reflux diseases of the gastrointestinal tract] / S.V. Pan’ko,
G.A. Zhurbenko, A.S. Karpickii [i dr.] // Biologicheskie ritmy: materialy Mezhdunar. nauch.-prakt. konf. 11—12 okt. 2012 g. [Biological rhythms: Materials intern. scientific and practical. conference]. — Brest, 2012. — S.147—149.
12. Osipenko, M.F. Podhody k diagnostike i terapii gastrita, associirovannogo s reflyuksom zhelchi [Approaches to diagnosis and treatment of gastritis associated with bile reflux] / M.F. Osipenko, M.A. Livzan // Lechaschii vrach [Treating physician]. — 2012. — № 2. — S.50—53.
13. Bueverov, A.O. Duodenogastroezofageal’nyi reflyuks kak prichina reflyuks-ezofagita [Duodenogastroesophageal reflux as a reason of reflux oesophagitis] / A.O. Bueverov,
T. L. Lapina // Farmateka. — 2006. — № 1. — S.1—5.
14. Zvyaginceva, T.D. Hronicheskaya duodenal’naya neprohodimost’ i principy konservativnoi terapii [Chronic duodenal obstruction and principles of conservative therapy] / T.D. Zvyaginceva, I.I. Shargorod // Novosti mediciny i farmacii. Gastroenterologiya (tematicheskii nomer) [News of medicine and pharmacy. Gastroenterology]. — 2011. — № 367 (gazeta). — URL: http://www.mif-ua.com (data obrascheniya 26.10.2014).
15. Zvyaginceva, T.D. Duodenogastral’nyi reflyuks v praktike vracha-gastroenterologa: ochevidnye opasnosti i skrytaya ugroza [Duodenogastric reflux in practice of Gastroenterologist: obvious dangers and hidden threat] / T.D. Zvyaginceva, A.I. Chernobai // Zdorov’e Ukrainy. — 2012. — № 3. — S.11.
16. Yurchenko, I.N. Duodenogastral’nyi reflyuks pri gastroezofageal’noi reflyuksnoi bolezni [Duodenogastric reflux with gastroesophageal reflux disease] /
I.N. Yurchenko, N.A. Kashirina, N.A. Vlasova // Materialy XVII Rossiiskoi gastronedeli [Materials XVII Russian gastro week] // RZHGGK. — 2011. — № 5, pril. 38. — C.19.
17. Selezneva, E.Ya. Vnutrizheludochnaya rN-metriya v ocenke sekretornyh i motornyh narushenii zheludka [Intragastric pH-metry in the evaluation of secretory and motor disorders of the stomach] / E.Ya. Selezneva // Rossiiskii gastroenterologicheskii zhurnal [Russian Journal of Gastroenterology]. — 1998. — № 4 — S.69—72.
18. Gibadulina, I.O. Vozmozhnosti ul’trazvukovoi ocenki funkcional’nyh rezul’tatov hirurgicheskoi korrekcii duodenogastral’nogo reflyuksa [Ultrasound evaluation of the functional capabilities of the results of surgical correction of duodenogastric reflux] / I.O. Gibadulina, N.V. Gibadulin // SonoAce-Ultrasound. — 2011. — № 22 (med. zhurnal). — URL: http://www.medison.ru/si/
19. Rukovodstvo po ul’trazvukovoi diagnostike zabolevanii pischevoda, zheludka i dvenadcatiperstnoi kishki [Guide to the ultrasound diagnosis of diseases of the esophagus,
stomach and duodenum] / pod red. G.K. Zherlova, S.A. Sokolova. — Novosibirsk: Nauka, 2005. — 208 s.
20. Belousov, S.S. Gastroezofageal’naya reflyuksnaya bolezn’ i duodenogastral’nyi reflyuks [Gastroesophageal reflux disease and duodenogastric reflux] / S.S. Belousov, S.V. Muratov, A.M. Ahmad. — N. Novgorod: Izd-vo Nizhegorodskoi gos. med. akademii, 2005. — 120 s.
21. Lapchenko, E.S. Sostoyanie slizistoi obolochki zheludka u bol’nyh s duodenogastral’nym reflyuksom [Condition of the gastric mucosa in patients with duodeno-gastric reflux] / E.S. Lapchenko, T.M. Preobrazhenskaya,
E.V. Galaeva, I.D. Loranskaya // Eksperimental’naya i klinicheskaya gastroenterologiya [Experimental and Clinical Gastroenterology]. — 2010. — № 9. — S.25— 29.
22. Ivashkin, V.T. Mesto antacidov v sovremennoi terapii yazvennoi bolezni [The place of antacids in modern therapy of peptic ulcer] / V.T. Ivashkin, E.K. Baranskaya,
O. S. Shifrin, E.Yu. Yur’eva // Russkii medicinskii zhurnal. Bolezni organov pischevareniya [Russian Medical Journal. Diseases of the digestive]. — 2002. — T. 4, № 2. — URL: http://www.rmj.ru/
23. Chen, S.L. Effects of bile reflux on gastric mucosal lesions in patients with dyspepsia or chronic gastritis / S.L. Chen,
J.Z. Mo, Z.J. Cao [et al.] // World J. Gastroenterol. — 2005. — Vol. 11, № 18. — P.2834—2847.
24. Abe, H. Influence of bile reflux and Helicobacter pylori infection on gastritis in the remnant gastric mucosa after distal gastrectomy / H. Abe, K. Murakami, S. Satoh [et al.] // J. Gastroenterol. — 2005. — Vol. 40, № 6. —
P. 563—569.
25. Hanninen, M.L. Sensitivity of Helicobacter pylori to different bile salts / M.L. Hanninen // Eur. J. Clin. Microbiol. Infect. Dis. — 1991. — Vol. 10. — P.515—518.
26. Caldwell, M.T.P Helicobacter pylori infection increases following cholecystectomy / M.T.P. Caldwell, M. McDermott, S. Jazrawi [et al.] // Ir. J. Med. Sci. — 1995. — Vol. 164. — P.52—55.
27. Chen, D.F. H. pylori exist in the gallbladder mucosa of patients with chronic cholecystitis / D.F. Chen, L. Hu, P. Yi, D.C. Fang [et al.] // World J. Gastroenterol. — 2007. — Vol. 13, № 10. — P.1608—1611.
28. Bechi, P. Are there alternative methods for measuring «bile» reflux? / P. Bechi, F. Pucciani, F. Baldini [et al.] // Dig. Dis. Sci. — 1993. — Vol. 38, № 7. — P.1297—1306.
29. Lin, J.K. A study of diagnosis of primary biliary reflux gastritis / J.K. Lin, P.J. Hu, C.J. Li [et al.] // Zhonghua Nei Ke Za Zhi. — 2003. — Vol. 42, № 2. — P.81—83.
30. Vere, C.C. Endoscopical and histological features in bile reflux gastritis / C.C. Vere, S. Cazacu, V. Comanescu [et al.] // Rom. J. Morphol. Embryol. — 2005. — Vol. 46, № 4. — P.269—274.
31. Li, X.B. Role of bile reflux and Helicobacter pylori infection on inflammation of gastric remnant after distal gastrectomy / X.B. Li, H. Lu, H.M. Chen [et al.] // J. Dig. Dis. — 2008. — Vol. 9, № 4 — P.208—212.
32. Sjovall, H. Meaningful or redundant complexity — mechanisms behind cyclic changes in gastroduodenal pH in the fasting state / H. Sjovall // Acta Physiol (Oxf). —
2011. — Vol. 201, № 1. — P.127—131.
33. Zullo, A. Gastric Pathology in Cholecystectomy Patients: Role of Helicobacter pylori and Bile Reflux / A. Zullo, V. Rinaldi, C. Hassan [et al.] // Journal of Clinical Gastroenterology. — 1998. — Vol. 27, № 4. — P.335— 338.
34. Ladas, S.D. Helicobacter pylori may induce bile reflux: link between H. pylori and bile induced injury to gastric epithelium / S.D. Ladas, J. Katsogridakis, H. Malamou [et al.] // Gut. — 1996. — Vol. 38, № 1. — P.15—18.
61
ОБЗОРЫ
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОМ МЕДИЦИНЫ 2015 Том 8, вып. 2
35. Fall, K. Risk for Gastric Cancer After Cholecystectomy / K. Fall, W. Ye, O. Nyren // The American Journal of Gastroenterology. — 2007. — Vol. 102, № 6. — P.1180— 1184.
36. Mac Dowall, J.E. Cell proliferation in type C gastritis affecting the intact stomach / J.E. Mac Dowall, P. Willis,
R. Prescott [et al.] // Clin. Pathol. — 2000. — Vol. 53. — P.784—787.
37. Fuchs, K.H. The role of 24-hr gastric pH-monitoring in the interpretation of 24-hr gastric bile monitoring for duodenogastric reflux / K.H. Fuchs, M. Fein, J. Maroske [et al.] // Hepatogastroenterology. — 1999. — Vol. 46, № 25. — P.60—65.
38. Tibbling, G.L. Gastric bile monitoring: an in vivo and in vitro study of Bilitec reliability / G.L. Tibbling, L. Blackadder, T. Franzen, E. Kullman // Scand. J. Gastroenterol. — 2002. — Vol. 37, № 11. — P.1334—1337.
39. Bechi, P. Technical aspects and clinical indications of 24-hour intragastric bile monitoring / P. Bechi, F. Cianchi // Hepatogastroenterology. — 1999. — Vol. 46, № 25. — P.54—59.
40. Sobala, G.M. Bile reflux and intestinal metaplasia in gastric mucosa / G.M. Sobala, H.J. O’Connor, E.P. Dewar [et al.] // J. Clin. Pathol. — 1993. — Vol. 46. — P.235—240.
41. Dixon M.F. Bile reflux gastritis and intestinal metaplasia at the cardia / M.F. Dixon, N.P. Mapstone, P.M. Neville [et al.] // Gut. — 2002. — Vol. 51. — P.351—355.
42. Matsuhisa, T. Relation between bile acid reflux into the stomach and the risk of atrophic gastritis and intestinal metaplasia: a multicenter study of 2283 cases / T. Matsuhisa, T. Arakawa, T. Watanabe [et al.] // Dig. Endosc. — 2013. — Vol. 25, № 5. — P.519—525.
43. Xu, Y. Bile Acids Induce Cdx2 Expression Through the Farnesoid X Receptor in Gastric Epithelial Cells / Y Xu, T. Watanabe, T. Tanigawa [et al.] // J. Clin. Biochem. Nutr. — 2010. — Vol. 46, № 1. — P.81—86.
44. Tatsugami, M. Bile acid promotes intestinal metaplasia and gastric carcinogenesis. / M. Tatsugami, M. Ito,
S. Tanaka [et al.] // Cancer Epidemiol Biomarkers Prev. —
2012. — Vol. 21, № 11. — P.2101—2107.
45. Aprea, G. Morpho-functional gastric pre-and postoperative changes in elderly patients undergoing laparoscopic cholecystectomy for gallstone related disease / G. Aprea, A. Canfora, A. Ferronetti [et al.] // BMC Surg. — 2012. — Vol. 12, № 1. — P.5.
46. Kuran, S. Bile reflux index after therapeutic biliary procedures / S. Kuran, E. Parlak, G. Aydog [et al.] // BMC Gastroenterol. — 2008. — Vol. 8. — P.4.
47. Atak, I. The effect of laparoscopic cholecystectomy on the development of alkaline reflux gastritis and intestinal metaplasia / I. Atak, K. Ozdil, M. Yucel [et al.] // Hepatogastroenterology. — 2012. — Vol. 59, № 113. — P.59—61.
48. Chen, T.-F. Comparative evaluation of intragastric bile acids and hepatobiliary scintigraphy in the diagnosis of duodenogastric reflux / T.-F. Chen, P.K. Yadav, R.-J. Wu [et al.] //World J. Gastroenterol. — 2013. — Vol. 19, № 14. — P.2187—2196.
49. Menges, M. Increased acid and bile reflux in Barrett’s oesophagus compared to reflux oesophagitis, and effect of proton pump inhibitor therapy / M. Menges, M. Muller,
M. Zeitz // Am. J. Gastroenterol. — 2001. — Vol. 96. — P.331—337.
50. Chen, H. Rabeprazole combined with hydrotalcite is effective for patients with bile reflux gastritis after cholecystectomy / H. Chen, X. Li, Z. Ge [et al.] // Can.
J. Gastroenterol. — 2010. — Vol. 24, № 3. — P.197— 201.
51. Vinter-Jensen, L. A double-blind placebo-controlled trial of omeprazole on characteristics of the migrating motor complex in healthy volunteers / L. Vinter-Jensen,
K. Kraglund, S.A. Pedersen // Aliment. Pharmacol. Ther. — 1989. — Vol. 3, № 6. — P.615—620.
52. Stefaniwsky, A.B. Ursodeoxycholic acid treatment of bile reflux gastritis. / A.B. Stefaniwsky, G.S. Tint, J. Speck [et al.] // Gastroenterology. — 1985. — Vol. 89, № 5. — P.1000—1004.
53. Ozkaya, M. The effect of ursodeoxycholic acid treatment on epidermal growth factor in patients with bile reflux gastritis / M. Ozkaya, A. Erten, I. Sahin [et al.] // Turk. J. Gastroenterol. — 2002. — Vol. 13, № 4. — P.198—202.
54. Thao, T.D. Antibacterial and anti-atrophic effects of a highly soluble, acid stable UDCA formula in Helicobacter pylori-induced gastritis / T.D. Thao, H.C. Ryu, S.H. Yoo [et al.] // Biochem. Pharmacol. — 2008. — Vol. 75, № 11. — P.2135—2146.
55. Kawamura, T. Effect of ursodeoxycholic acid on water immersion restraint stress ulcer of rats / T. Kawamura, F. Koizumi, A. Ishimori // Nihon Shokakibyo Gakkai Zasshi. — 1989. — Vol. 86, № 10. — P.2373— 2378.
56. Kawiorski, W. Current diagnosis of gastroduodenal reflux and biliary gastritis / W. Kawiorski, R.M. Herman, J. Legutko // Przegl. Lek. — 2001. — Vol. 58, № 2. — P.90—94.
© В.Д. Менделевич, 2015 УДК 613.84(048.8)
ПОЛЬЗА И ВРЕД ЭЛЕКТРОННЫХ СИГАРЕТ СКВОЗЬ ПРИЗМУ
разных терапевтических методологий
ВЛАДИМИР ДАВЫДОВИЧ МЕНДЕЛЕВИЧ, докт. мед. наук, профессор, зав. кафедрой медицинской и общей психологии ГБОУ ВПО «Казанский государственный медицинский университет» Минздрава России,
Казань, Россия, тел. +7-843-238-60-74, e-mail: [email protected]
Реферат. Цель исследования. В статье приводится аналитический обзор современных исследований по оценке пользы и вреда использования электронных сигарет (ЭС) при никотиновой зависимости. Материал и методы. Изучены результаты исследования нескольких десятков работ, выполненных в дизайне доказательных исследований. Результаты и их обсуждение. Делается вывод о том, что оценка эффективности зависит от того, какой терапевтической парадигмы придерживается исследователь — стратегии «нулевой толерантности» или «снижения вреда». В первом случае позитивное влияние оценивается исключительно на основании полного отказа от курения (как обычных, так и электронных сигарет), во втором — используются критерии уменьшения вредных последствий курения. Обращается внимание на то, что медики имеют отношения с реальными пациентами, значительная часть которых не желает бросать курить и будет продолжать курить, несмотря на очевидные риски
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ОБЗОРЫ
61
Дуодено-гастральный рефлюкс: причины, лечение, прогноз
Почему возникают проблемы?Дуодено-гастральный рефлюкс может развиваться по причине:
- анатомических особенностей двенадцатиперстной кишки;
- хронического нарушения дуоденальной проходимости на фоне рубцовых изменений связочного аппарата, спаек в зоне тонкого кишечника;
- хирургического удаления привратника;
- функциональной несостоятельности пилорического сфинктера;
- расстройства моторики ЖКТ, в частности, нарушения координации между желудком и двенадцатиперстной кишкой.
Все это приводит к тому, что пищевой комок или желчь поступает из тонкого кишечника в желудок, откуда может забрасываться и в вышерасположенные отделы – пищевод, глотку. Кислоты, входящие в состав желчи, повреждают слизистую оболочку желудка и пищевода. Это сопровождается развитием гастрита и эзофагита. Очень часто у пациентов с дуодено-гастральным рефлюксом диагностируются:
- функциональная диспепсия;
- рефлюкс-гастрит;
- гастрит с пониженной кислотностью;
- язвенная болезнь желудка;
- пищевод Баррета.
Хроническое повреждение слизистой запускает процесс ее метаплазии, то есть перерождения. На поврежденных участках образуются нетипичные для этой зоны клетки. В тяжелых случаях это приводит к развитию плоскоклеточного рака пищевода.
Повреждение слизистой глотки может сопровождаться катаральным фарингитом и пароксизмальным ларингоспазмом. Нередки также жалобы пациентов на боли в области грудной клетки (проекции сердца), кашель, поражение органов дыхания. Их появление может быть вызвано раздражением ветвей блуждающего нерва.
Каким должно быть лечение?Лечение дуодено-гастрального рефлюкса начинается с консервативных мероприятий: диеты и медикаментозной терапии. В том случае, если эти меры не позволяют достичь желаемого результата, симптоматика сохраняется, а болезнь прогрессирует, выполняется хирургическое вмешательство. Основная цель операции – укрепить пилорический сфинктер, то есть создать механическое препятствие для заброса дуоденального содержимого в желудок, и устранить имеющиеся препятствия для продвижения пищевого комка и желчи.
В настоящее время ведущие хирурги страны – в частности, Константин Пучков – проводят хирургическое лечение этой патологии методом лапароскопии. После такой операции на брюшной стенке пациента остается несколько незаметных рубцов, а восстановительный период протекает очень быстро.
В первый день после операции они начинают пить, на второй принимают жидкую пищу. Уже на вторые-третьи сутки большинство пациентов выписывается из стационара. К работе они могут приступить уже через две-три недели после операции. В течение полугода им рекомендуется соблюдение мягкой диеты, в дальнейшем пациент возвращается к привычному рациону и не нуждается в приеме лекарственных средств.
Примечательно, что сегодня в рамках одного хирургического вмешательства можно провести хирургическое лечение нескольких заболеваний. Такой подход позволяет полностью наладить работу желудочно-кишечного тракта с минимальными временными затратами и ущербом для здоровья пациента.
Дуоденогастральный рефлюкс. Симптомы проявления и терапия
Дуоденогастральный рефлюкс – это явление, при котором часть содержимого двенадцатиперстной кишки забрасывается в желудок. Как правило, дуоденогастральный рефлюкс сопровождает такие заболевания желудочно-кишечного тракта, как гастроэзофагеальная рефлюксная болезнь, хронические гастриты, язвенные болезни двенадцатиперстной кишки и желудка.
Дуоденогастральный рефлюкс. Возможные последствия
Протоки печени, а также поджелудочной железы выходят в двенадцатиперстную кишку, по этой причине ее секрет содержит большое количество желчи и соков поджелудочной железы. Когда же данные жидкости вбрасываются в желудок, его слизистая не в состоянии нейтрализовать ферменты желчи и поджелудочной, начинается воспаление и существует вероятность серьезного ожога слизистой желудка. Результатом этого может стать такое заболевание, как рефлюкс-гастрит (другое название – химический гастрит типа С).
Дуоденогастральный рефлюкс. Симптомы
Симптомы, сопутствующие дуоденогастральному рефлюксу, не всегда бывают явно выраженными. Иногда это явление может протекать абсолютно бессимптомно, а обнаруживают его во время проведения электрогастродуоденоскопического исследования.
Обычно дуоденогастральный рефлюкс сопровождается такими симптомами, как отрыжка, горечь или сухость во рту, отсутствие аппетита, тошнота и слабость после еды.
Дуоденогастральный рефлюкс. Лечение
Чтобы определиться с методикой лечения, необходимо обнаружить первоначальную, истинную причину его возникновения, пройти ряд обследований, чтобы выявить наличие язвенной болезни, гастрита, дуоденита. Лечение рефлюкса, как правило, начинается с терапии вызвавших его заболеваний. Зачастую в случае устранения основного заболевания исчезает и дуоденогастральный рефлюкс.
Тем не менее нередки случаи, когда решение этой проблемы вызывает значительные трудности, в особенности, если первопричина появления рефлюкса заключается в хирургическом вмешательстве в область желудочно-кишечного тракта,
В этом случае врач должен назначить препараты, нейтрализующие воздействие желчи на желудок и его слизистую, а также медикаменты, способствующие ускоренному опорожнению пищевода и желудка, повышению тонуса пищеводного сфинктера. Для этого назначаются лекарства-прокинетики, такие как метоклопрамид, домперидон, на беспрерывный непродолжительный срок, обычно до 3 недель. Один из отрицательных моментов такого лечения – возможное возобновление симптомов рефлюкса после отмены приема препаратов.
Курс лечения рефлюкса должен включать также применение ингибиторов помпы протонной, особенно при заболеваниях, для которых характерен повышенный уровень кислотности. Эта группа препаратов помогает нейтрализовать агрессивное действие соляной кислоты на слизистую желудка. Стоит отдать предпочтение препаратам последнего поколения, таким как пантопразол. Они обладают очень небольшим числом побочных эффектов и разрешены к применению даже беременными женщинами.
Еще одной группой средств, применяющихся при дуоденогастральном рефлюксе, являются антациды. Они связывают желчь химическим образом, но при этом не отражаются на уровне соляной кислоты. И к тому же антациды защищают слизистую желудка, усиливая тем самым терапевтический эффект. Данные лекарственные средства выпускаются в виде суспензий или гелей.
На сегодняшний день для лечения рефлюкса часто используются препараты урсодезоксихолевой кислоты. С их помощью желчные кислоты переходят в водорастворимые формы. Это уменьшает негативное действие желчи на слизистые оболочки. Обычно прием препарата назначают два раза в день.
В целом, для лечения дуоденогастрального рефлюкса требуется курс, длящийся не менее чем два месяца. Полноценный эффект от лечения может быть достигнут только при достаточно длительном приеме препаратов.
Дуодено-гастральный рефлюкс
Состояние, при котором в желудок вбрасывается содержимое двенадцатиперстной кишки. Чаще всего, это симптом других патологий желудочно-кишечного тракта, а не самостоятельная болезнь. Пациента беспокоят болевые и диспепсические синдромы, которые проявляются неопределенными диффузными абдоминальными болями, жжением за грудной, отрыжкой, тошнотой, рвотой, желтым налетом на языке. Для установления и подтверждения диагноза врач анализирует симптомы, изучает историю болезни, проводит физикальный осмотр и назначает дополнительные обследования. Как правило, выполняют эзофагогастродуоденоскопию, круглосуточную внутрижелудочную рН-метрию, андродуоденальная манометрию, исследование желудочного сока, а также ультразвуковое исследование. Лечение включает коррекцию рациона питания, селективные прокинетики, ингибиторы желчных кислот, блокаторы протонной помпы, антациды, а также препараты которые нормализуют моторику первых сегментов желудочно-кишечного тракта. Кроме того, пациенту необходимо отказаться от пагубных привычек: курения, употребления спиртных напитков.
Причины дуодено-гастрального рефлюксаЗаболевание может развиваться на фоне хронического гастрита, язвенной болезни, онкологического процесса в желудке, нарушения тонуса сфинктера между двенадцатиперстной кишкой и поджелудочной железой, резекции желчного пузыря, ушивания дуоденальной язвы, дискоординации моторики желудка и начальных сегментов тонкой кишки, а также дисмоторного расстройства органов желудочно-кишечного тракта.
Симптомы дуодено-гастрального рефлюксаСостояние само по себе может быть симптом многих других болезней пищеварительной системы, а потому не имеет специфической симптоматики. Как правило, недуг выражается болевыми ощущениями спастического характера в животе, не имеющими определенной локализации, которые возникают после приема пищи. Также пациента беспокоят вздутие живота, чувство жжения за грудиной, срыгивание частицами пищи и кислотой, отрыжка, рвота с желчью. Больные отмечают горечь в ротовой полости и налет желтоватого оттенка на спинке языка. При длительном течении возможно развитие серьезных осложнений в пищеводе и желудке. Повышенное давление в желудке провоцирует гастроэзофагеальную рефлюксную болезнь. Со временем под воздействием желчных кислот и панкреатических ферментов поражается слизистая оболочка пищевода, клетки желудка меняются и становятся похожими на клетки кишечника, что способствует возникновению злокачественного опухолевого процесса в пищеводе – аденокарциномы. Если заболевание вовремя не диагностируется и не лечится, на фоне постоянного заброса желчных кислот в полость желудка и химического повреждения слизистых оболочек, повышается вероятность развития токсико-химического гастрита.
Диагностика дуодено-гастрального рефлюксаБолезнь диагностируется гастроэнтерологом и эндоскопистом. Для установления и подтверждения диагноза врач анализирует симптомы, изучает историю болезни, проводит физикальный осмотр и назначает дополнительные обследования. С помощью эзофагогастродуоденоскопии определяются кислоты желчи в желудке. Также врачи круглосуточно проверяют показатели кислотности желудочных ферментов выполняя внутрижелудочную рН-метрию. Желудочный сок также исследуют, чтобы выявить в нем пищеварительные ферменты поджелудочной и желчные кислоты. Дополнительно могут выполнять ультразвуковое исследование и андродуоденальную манометрию.
Заболевание отличают от гастрита, эрозивного гастрита, дуоденита, язвенной болезни желудка, острого холецистита, панкреатита, холангита и желчнокаменной болезни.
Лечение дуодено-гастрального рефлюксаНа время обследования больного могут размещать в гастроэнтерологическом отделении стационара. Медикаментозная терапия включает селективные прокинетики, ингибиторы желчных кислот, блокаторы протонной помпы, антациды, а также препараты которые нормализуют моторику первых сегментов желудочно-кишечного тракта. Также специалисты корректируют рацион питания больного, рекомендуют снизить вес (при ожирении) и отказаться от пагубных привычек (табакокурение, употребление спиртных напитков или наркотических веществ). Больному запрещают самостоятельно принимать нестероидные противовоспалительные средства, желчегонные препараты и другие медикаменты.
Профилактика дуодено-гастрального рефлюксаСпецифические меры профилактики не разработаны. Необходимо придерживаться принципов правильного питания, вести здоровый образ жизни, а также исключить курение и алкогольные напитки.
Болезни пищевода
К наиболее часто встречающимся заболеваниям пищевода относится гастроэзофагеальная рефлюксная болезнь (ГЭРБ). Основными проявлениями ГЭРБ являются изжога, отрыжка воздухом или съеденной пищей, тошнота, рвота, неприятный кислый или горький привкус во рту по утрам, нарушение глотания. Иногда пациенты предъявляют жалобы на жгучие боли, дискомфорт в подложечной области или за нижней третью грудины, которые в ряде случаев бывает трудно отличить от проявлений серьезных сердечно-сосудистых заболеваний. Перечисленные симптомы чаще появляются после еды, связаны с изменением положения тела и возникают при наклоне вперед, в положении лежа. Также больных могут беспокоить такие внепищеводные проявления (маски заболевания), как боли и ощущение кома в горле, охриплость голоса, кашель, разрушение зубной эмали, избыточное слюнотечение.
По современным представлениям основным механизмом развития ГЭРБ считается нарушение двигательной активности пищевода и желудка. Между желудком и пищеводом существует нижний пищеводный сфинктер, состоящий из круговых мышечных волокон, у здорового человека этот клапан плотно смыкается, не позволяя содержимому желудка попасть обратно в пищевод. У пациентов с ГЭРБ отмечается уменьшение тонуса нижнего пищеводного сфинктера и ослабление способности пищевода быстро эвакуировать обратно в желудок попавшее в него содержимое. В результате этого кислое содержимое желудка попадает в пищевод (гастроэзофагеальный рефлюкс), способствуя развитию воспаления слизистой оболочки пищевода. В случае длительного контакта при отсутствии адекватного лечения на месте воспаления развиваются эрозии и язвы, приводящие в ряде случаев к рубцовым изменениям или кровотечениям, которые могут потребовать хирургического вмешательства. Повышается риск возникновения предракового изменения строения слизистой оболочки – пищевод Баррета. Желчные кислоты, ферменты, бикарбонаты, входящие в состав содержимого двенадцатиперстной кишки, также оказывают сильное повреждающее воздействие на слизистую пищевода. При забросе этих веществ в желудок (дуоденогастральный рефлюкс) может наблюдаться их обратное продвижение в пищевод.
Основными причинами нарушений моторики пищевода и желудка являются диетические погрешности (переедание, острая и жирная пища, алкоголь, кофе, шоколад, газированные напитки), грыжа пищеводного отверстия диафрагмы, прием лекарственных препаратов (нестероидные противовоспалительные средства, блокаторы кальциевых каналов, нитраты, психотропные средства, прогестерон, эуфиллин и др.), ожирение, неврозы, курение, ношение тугих поясов, беременность.
Кроме моторных нарушений причинами развития воспаления пищевода могут быть инфекционные заболевания (грипп, герпес, дифтерия и др.), кандидоз (при иммунодефиците), травмы, ожоги.
Дуодено-желудочно-пищеводный рефлюкс — что такое патологический? Сравнение пациентов с пищеводом Барретта и добровольцев того же возраста
Abstract
Введение
Целью исследования был анализ данных мониторинга pH и желчи у пациентов с пищеводом Барретта и в контрольной группе, сопоставимой по возрасту и полу.
Субъекты и методы
Двадцать четыре последовательных пациента Барретта (8 женщин, 16 мужчин, средний возраст 57 лет), 21 пациент с эзофагитом (10 женщин, 11 мужчин, средний возраст 58 лет) и 19 здоровых пациентов контрольной группы (8 женщин). , 11 мужчин, средний возраст 51 год).Только пациентам проводилась эндоскопия с биопсией. Все группы были исследованы с помощью манометрии, 24-часового pH желудка и пищевода и одновременного мониторинга желчи в соответствии со стандартизованным протоколом. Абсорбция билирубина> 0,25 была определена как вредный желчный рефлюкс. Метод характеристики оператора приемника (ROC) был применен для определения оптимального порогового значения уровней патологического билирубина.
Результаты
Из пациентов Барретта 79% имели патологический кислый желудочный рефлюкс (pH <4> 5% от общего времени измерения).Однако у 32% здоровых людей из контрольной группы также был кислотный рефлюкс ( p <0,05) без каких-либо симптомов. Медиана рефлюкса желчи из пищевода составила 7,8% (нижний квартиль (LQ) - верхний квартиль (UQ) = 1,6–17,8%) у пациентов с болезнью Барретта, у пациентов с эзофагитом - 3,5% (LQ – UQ = 0,1–13,5) и контраст с 0% (LQ – UQ = 0–1,0%) в контроле, p = 0,001. ROC-анализ показал оптимальное значение деления для пациентов с рефлюксом желчи более 1% в течение 24 часов (чувствительность 75%, специфичность 84%).
Заключение
Оптимальный порог для различения нормального и патологического рефлюкса желчи в пищевод составляет 1% (24-часовой мониторинг желчи с поглощением> 0.25).
Ключевые слова: Референтное значение bilitec, Рефлюкс желчи, Кислотный рефлюкс, слизистая оболочка Барретта, пищевод, спектрофотометрия
Введение
Заболеваемость аденокарциномой пищевода и кардии желудка в западных промышленно развитых странах быстро выросла1. Помимо злоупотребления никотином и алкоголем, факторы питания, высокий индекс массы тела, кислый желудочный рефлюкс и пищевод Барретта считаются критическими факторами канцерогенеза.2–4. Недавние исследования показали, что наличие билиарного рефлюкса в сочетании с кислым желудочным рефлюксом повреждает слизистой пищевода и вызывает осложнения гастроэзофагеальной рефлюксной болезни (ГЭРБ), e.g., развитие слизистой оболочки Барретта (BM) .5,6 Дуодено-желудочный рефлюкс в пищевод (DGER), в частности, по-видимому, важен для патогенеза пищевода Барретта (7). пациенты с тяжелым эзофагитом и пищеводом Барретта.8 Восемьдесят процентов пациентов с пищеводом Барретта, принимающих ингибиторы протонной помпы, демонстрируют нормальный профиль pH пищевода, но 60% демонстрируют ненормальное воздействие желчи через пищевод по данным Bilitec 2000.9
В прошлом прямое и продолжительное количественное определение двенадцатиперстно-пищеводного рефлюкса было труднодостижимым. Теперь концентрацию билирубина можно напрямую измерить спектрофотометрией на основе удельного поглощения на длине волны 453 нм. Билиарный рефлюкс можно измерить с помощью амбулаторного фиброоптического зонда, проходящего через нос (Bilitec 2000), который регистрирует всасывание желчи. Уже опубликован ряд работ по обнажению пищевода10–13 и желудка24–16 с использованием этой техники.Однако в этих исследованиях возраст контрольной группы составлял от 25 до 35 лет. В клинической практике пациенты со слизистой Барретта обычно старше. Кроме того, авторы каждого исследования использовали различные контрольные значения для измерения билиарного рефлюкса в пищеводе, что затрудняло сравнение измеренных значений.
Целью настоящего исследования был анализ данных мониторинга pH и желчи в группе здоровых лиц из контрольной группы, соответствующих возрасту и полу, и пациентов с пищеводом Барретта.
Субъекты и методы
Субъекты
Отбор контролей проводился в соответствии со строгим протоколом. В исследование были включены здоровые добровольцы, лечившиеся с 1999 по 2000 год, в возрасте от 40 до 60 лет. Никто из контрольных не принимал препараты, подавляющие кислоту или перистальтику кишечника, не имел в анамнезе заболеваний верхних отделов желудочно-кишечного тракта, не подвергался хирургическим вмешательствам на верхних отделах брюшной полости или обширным операциям на брюшной полости, а также не подвергался терапевтическим эндоскопическим процедурам верхних отделов желудочно-кишечного тракта.Диагностическая эндоскопия и проглатывание бария не проводились, но желчнокаменная болезнь была исключена на УЗИ.
С 1999 по 2002 год в исследование были включены 24 пациента с гистологически подтвержденной слизистой оболочкой Барретта. Для дополнительного сравнения мы включили группу пациентов с эзофагитом (стадия I – III по Савари и Миллеру) без пищевода Барретта, которым перед плановой лапароскопической фундопликацией были выполнены те же диагностические процедуры. В течение вышеупомянутого периода для этого исследования был доступен 21 пациент в возрасте старше 40 лет.Критериями исключения были хирургия пищевода, желудка или желчевыводящих путей в анамнезе, лучевая терапия брюшной или грудной клетки в анамнезе или наличие язвенной болезни, активное желудочно-кишечное кровотечение, варикозное расширение вен пищевода или дна, хроническое заболевание пищевода или верхних отделов тонкой кишки или опухолевые заболевания. Все препараты, потенциально влияющие на перистальтику желудочно-кишечного тракта и секрецию, были отменены по крайней мере за 1 неделю до исследования.
Эндоскопия верхних отделов желудочно-кишечного тракта
Всем пациентам была выполнена классическая эндоскопия верхних отделов желудочно-кишечного тракта.Если была необходима седация, обычно применяли внутривенное введение пропофола (до 200 мг) или изредка применяли мидазолам (до 5 мг). Во время эндоскопии было отмечено наличие и степень эзофагита, пищевода Барретта и грыжи пищеводного отверстия диафрагмы. Биопсии были взяты со слизистой оболочки Барретта.
Амбулаторный мониторинг pH пищевода / желудка и желчи
Все группы прошли манометрию пищевода и 24-часовой мониторинг pH и одновременный мониторинг желчи с использованием стандартизованного протокола.Амбулаторный мониторинг pH проводился с использованием трансназально введенного сурьмяного pH-электрода с отдельным кожным электродом сравнения (Synetics Medical, Стокгольм, Швеция). Данные сохранялись на портативном цифровом записывающем устройстве (Digitrapper MkIII, Synectics Medical Stockholm, Швеция). Перед каждым исследованием зонд pH калибровали в буферных растворах с pH 7 и 1. Эпизод кислотного рефлюкса определялся как снижение pH пищевода до менее 4 в течение более 10 с.
Для количественной оценки дуодено-пищеводного рефлюкса использовался амбулаторный фиброоптический спектрофотометр, переданный через нос (Bilitec 2000, Synectics, Швеция).Система состоит из миниатюрного зонда диаметром 1,5 мм, который передает световые сигналы в пищевод и обратно через пластиковую волоконно-оптическую связку. Перед каждым исследованием зонд калибровали в воде. В соответствии с текущей литературой, абсорбция билирубина> 0,25 использовалась в качестве эталона для вредного билиарного рефлюкса.14
Зонды желчи и pH были скреплены лентой и переданы трансназально в пищевод и желудок, как подробно описано в другом месте.17 Верхняя часть кончики зондов были расположены на 5 см выше верхней границы нижнего сфинктера пищевода, как определено манометрией пищевода.Дистальный pH-электрод и оптоволоконный датчик помещали на дно желудка, на 10 см дистальнее нижнего сфинктера пищевода (рис.). Контрольной группы и пациентов просили следовать строгому протоколу трехразового питания без жидкости между приемами пищи. Лежачие фазы записи разрешались только ночью. Пациентов просили вести дневник, фиксируя точный характер приема пищи, фазы измерения в положении лежа на спине и стоя, а также ощущения изжоги и срыгивания.
Расположение датчиков pH и билирубина в желудке и пищеводе.(UES = верхний сфинктер пищевода; LES = нижний сфинктер пищевода).
Одновременный мониторинг желчных протоков и pH проводился с применением бесцветной «белой диеты» (WD), включая жидкую и твердую пищу с максимальной абсорбцией желчи in vitro 0,25 [шкала абсорбции от 0 (обычная вода) до 1 (общая экран)]. Еда включала воду, молоко, тосты, картофель, курицу, сухое печенье и рыбу.
Сбор и интерпретация данных
После завершения измерений зонды у пациентов извлекались, и данные сохранялись через интерфейс на IBM-совместимом компьютере, оснащенном программным обеспечением Polygram® (Medtronic).Для анализа использовались данные каждой секунды 24-часовых измерений. Чтобы оценить наличие желудочного или пищеводного билиарного рефлюкса, был рассчитан процент времени, когда абсорбция была больше 0,25 для следующих периодов: всего в положении лежа на спине, в вертикальном положении и после приема пищи. Постпрандиальный период определялся как 2 ч после окончания приема пищи. Процент времени с pH пищевода ниже 4 и медианным pH желудка и процент времени с pH желудка, равным 1, 2, 3–7 и> 7, также был рассчитан для вышеуказанных периодов.Средняя продолжительность амбулаторного мониторингового исследования pH и Bilitec составляла 22 часа 40 минут у пациентов и 23 часа 44 минуты в контрольной группе.
Статистический анализ
Для анализа результатов использовалась программа SPSS (версия 11.0, Чикаго, Иллинойс). Для графического представления использовали программу MedCalc для Windows (версия 9.0, MedCalc Software, Бельгия). Были установлены медианы, значения межквартильного размаха (IQR или 25–75 перцентиль). Непараметрические тесты (анализ Манна – Уитни и Краскела – Уоллиса) использовались для оценки взаимосвязи между переменными.Для представления некоторых данных использовались графики Box и Whisker. На этих графиках прямоугольник представляет IQR, а усы — самые высокие и самые низкие значения. Также нанесены выбросы, определенные как более чем в 1,5 раза превышающие IQR от 75-го центиля. Экстремальные значения были определены как более чем трехкратный IQR от 75-го центиля.
Кривая характеристики оператора приемника (ROC) использовалась для определения порогового значения для оптимальной чувствительности и специфичности согласно Цвейгу и Кэмпбеллу18. Площадь под кривой (AUC) использовалась как измерение диагностической эффективности теста.Результаты представлены в виде точек с доверительным интервалом 95% (95% ДИ) и графически для представления всех данных. В качестве положительной группы мы использовали пациентов со слизистой оболочкой Барретта, а отрицательную тестовую группу определяли здоровыми добровольцами. Предполагалось непараметрическое распределение площади под кривой.
Предположения для расчета требуемого размера выборки были альфа = 0,05, бета = 0,80, и что тест действителен для ежедневного использования только в том случае, если менее 20% здоровых контролей и не менее 80% пациентов имеют положительный результат теста. полученные результаты.Расчетный размер выборки для каждой группы составил 20.
Этика
Протокол исследования был одобрен этическим комитетом Кельнского университета. Каждый субъект дал письменное информированное согласие.
Результаты
В исследование были включены 24 пациента с пищеводом Барретта (средний возраст: 58 лет), 21 пациент с эзофагитом (средний возраст: 57 лет) и 19 здоровых людей контрольной группы со средним возрастом 51 год. У пациентов с БМ выявлен эзофагит 0 степени (4 случая), I степени (12 случаев) и II степени (8 случаев).В контрольной группе пациентов с эзофагитом было девять случаев с I степенью, восемь случаев со II степенью и три случая с III степенью. Демографические данные пациентов и добровольцев представлены в таблице (данные одного добровольца не были использованы из-за технических проблем).
Таблица 1
Демографические данные пациентов с слизистой оболочкой Барретта или эзофагитом и здоровых добровольцев
| Параметры | Пациенты с пищеводом Барретта ( n = 24) | Пациенты с эзофагитом ( n = 21) | Контроли ( n = 19) | Значение Пат.с Barrett vs Controls |
|---|---|---|---|---|
| Возраст (средний) | 57 лет | 58 лет | 51 год | — |
| Мин. 39–62 года | ||||
| Пол м: ж | 16: 8 | 11:10 | 11: 8 | нс |
| ИМТ (медиана) мин – макс | 27,0 кг / м 2 (18,6–33,1) | 26.9 кг / м 2 (17,9–31,5) | 24,1 кг / м 2 (19,62–27,34) | p = 0,003 |
| Курильщики (%) | n = 5 (20,8 ) | n = 4 (19,0) | n = 6 (31,6) | нс |
| Без спирта% | n = 3 (12,5) | n = 5 (23,8) | n = 5 (26,3) | n.s. |
Кислый желудочный рефлюкс (AGR)
Пациенты с пищеводом Барретта, 19 из 24 (79%) и 20 из 21 контрольных пациентов с эзофагитом (95%) имели патологические AGR [pH <4 в> 5% от общего числа измерения времени (TMT)], но также у 6 из 19 здоровых контролей (32%) наблюдались патологические AGR без каких-либо симптомов ( p = 0.002). Во время TMT средний AGR составил 10,6% для пациентов Barrett и 3,2% для контрольной группы ( p <0,01). В частности, измерения длительного кислотного рефлюкса (LAR), определяемого как pH рефлюкса <4, длящегося более 5 минут, показали значительные различия между пациентами и контрольной группой. Патологический AGR был обнаружен у пациентов в период измерения натощак как в положении лежа на спине, так и в вертикальном положении. Напротив, патологические AGR у здоровых людей наблюдались только в вертикальном положении (таблица).
Таблица 2
Медиана кислотного желудочного рефлюкса в пищевод у пациентов с BM или с эзофагитом и в здоровой контрольной группе
| Параметры | Пациенты с пищеводом Барретта ( n = 24) [медиана (LQ-UQ )] | Пациенты с эзофагитом ( n = 21) [медиана (LQ-UQ)] | Контрольная группа ( n = 19) [медиана (LQ-UQ)] | Значение Пат.с Barrett vs Controls |
|---|---|---|---|---|
| Процент от общего времени измерения pH <4 (%) | 10,6 (6,2–38,3) | 19,9 (1,6–71,7) | 3,2 (0,9–5,5) | p = 0,01 |
| Процент времени измерения в вертикальном положении pH <4 (%) | 11,7 (6,03–6,4) | 18,9 (8,7–60,8) | 2,4 (0,9–6,1) | p <0,05 |
| Процент времени измерения в положении лежа на спине pH <4 (%) | 10.9 (0,4–27,1) | 6,3 (0,0–13,3) | 0,3 (0,0–4,2) | p = 0,004 |
24-часовой мониторинг внутрижелудочного pH и желчи
Мониторинг pH желудка не показал значимых различия между пациентами и контрольной группой для всех периодов измерения (таблица). Воздействие желудочного билирубина, указывающее на билиарный рефлюкс, было значительно более частым у пациентов, чем в контрольной группе, в течение всех периодов измерения (таблица). Воздействие желчных протоков в положении лежа на спине обычно происходило в ранние утренние часы во время сна, что выражалось в увеличении абсорбции в течение 2–3 часов с быстрым возвращением к исходным значениям примерно в то время, когда субъект возвращался в вертикальное положение.За тот же период времени мониторинг pH желудка показал повышение уровня pH до более чем 2 (рис.).
Таблица 3
Результаты 24-часового внутрижелудочного мониторинга pH и желчи у пациентов с пищеводом Барретта и здоровой контрольной группы
| Параметры | Пациенты ( n = 24) [медиана (LQ – UQ)] | Контроли ( n = 19) [Медиана (LQ – UQ)] | Значимость |
|---|---|---|---|
| Медиана внутрижелудочного pH во время TMT | 1.3 (1,0–1,4) | 1,4 (1,1–1,7) | н.с. |
| Процент воздействия билирубина (%) TMT | 7,8 (1,6–17,8) | 0,0 (0,0–1,0) | p = 0,001 |
| Процент воздействия билирубина (%) в прямом эфире | 6,9 (0,1–12,9) | 0,0 (0,0–1,3) | p <0,01 |
| Процент воздействия билирубина (%) во время пребывания на спине | 2,0 (0,0–28,6) | 0.0 (0,0–0,0) | p = 0,001 |
24-часовой внутрижелудочный мониторинг pH и желчи у пациента с пищеводом Барретта, демонстрирующего дуоденогастральный рефлюкс ранним утром. а. Bilitec®-мониторинг, б. pH-мониторинг.
Воздействие билирубина на пищевод
По результатам TMT медиана билиарного рефлюкса пищевода составила 7,8% для пациентов с пищеводом Барретта (LQ – UQ = 1,6–17,8%) и 3,5 (LQ – UQ = 0,1–13,5) для контроля пациентов, в отличие от 0% для контроля (LQ – UQ = 0–1.0%), р = 0,001). На рисунке показано, что мониторинг желчи пищевода у пациентов с пищеводом Барретта и здоровых людей в контрольной группе варьировался в течение всего периода измерения и периода лежа на спине.
Результаты мониторинга желчи в пищеводе у 24 пациентов с пищеводом Барретта, 21 пациента с эзофагитом и 19 здоровых людей из контрольной группы а) общий период измерения (тест Краскела-Уоллиса = 0,01) б) период лежа на спине (тест Краскала-Уоллиса p = 0,01) .
Рабочая кривая приемника, отображающая процент истинных положительных результатов (пациенты с пищеводом Барретта, идентифицированные по воздействию билирубина) в зависимости от частоты ложных срабатываний (здоровые контроли с высоким уровнем воздействия билирубина), показана на рис.. При площади под кривой 0,78 (95% ДИ = 0,56–0,89) ROC-анализ мониторинга желчевыводящих путей показал оптимальное значение для пациентов при 1% TMT [чувствительность 75% (95% ДИ = 53–90%). , Специфичность 84% (95% ДИ = 60–96%)]. Следовательно, пороговое значение для различения нормального и патологического билиарного рефлюкса с использованием 24-часового мониторинга желчевыводящих путей в пищеводе (порог поглощения> 0,25) должно быть зафиксировано на уровне 1% от TMT.
ROC-кривая с 95% доверительным интервалом для патологического мониторинга желчи у пациентов с пищеводом Барретта по сравнению со здоровыми контрольными пациентами, соответствующими возрасту и полу.
пациентов Барретта, 18 из 24 (75%), 15 из 21 контрольного пациента с эзофагитом (71%) и 3 из 19 контрольных (16%) показали билирийный рефлюкс в пищевод более 1,1% TMT ( p <0,001). Используя это пороговое значение, ни у одного из контрольных пациентов, у 10 из контрольных пациентов (48%) и у 11 из 24 пациентов с болезнью Барретта (46%) не было патологического воздействия билирубина во время сна.
Обсуждение
Результаты нашего исследования подтверждают, что пациенты с пищеводом Барретта имеют значительно более частый дуоденогастральный рефлюкс в пищевод, чем здоровые люди из контрольной группы того же возраста и пола.Кроме того, этот рефлюкс, измеряемый воздействием кислоты и билирубина, дольше остается в пищеводе, особенно во время сна.
Роль кислотного и некислотного рефлюкса в пищевод как причинного фактора симптомов и поражений слизистой оболочки рассматривалась в ряде исследований. Не только продолжительность, но, возможно, и состав рефлюкса, играет важную роль в развитии таких поражений.13 Круглосуточный внутрижелудочный мониторинг желчи предоставил клиницисту однозначные доказательства чрезмерного дуоденогастрального рефлюкса (DGR) у 41% пациентов. с эндоскопическим эзофагитом, симптомами гастроэзофагеального рефлюкса (ГЭР) и желудочными симптомами, указывающими на ДГР.19 Рефлюкс двенадцатиперстной кишки в желудок, особенно после приема пищи, является физиологическим явлением; 20 однако билиарный рефлюкс вносит значительный вклад в поражение слизистой оболочки всего желудка 21
В нашем исследовании контрольная группа пациентов с различными степенями тяжести. При эзофагите не было выявлено значительных различий в показателях кислотного или желчного рефлюкса в желудок или пищевод по сравнению с пациентами Барретта. Это может быть вызвано отбором пациентов с эзофагитом, которые были кандидатами на фундопликацию, но обе группы пациентов значительно различались по сравнению со здоровым контролем.Поэтому наши результаты имеют большое клиническое значение, особенно для предоперационной диагностики.
Marshall et al. сравнивали здоровую контрольную группу с пациентами с различными степенями рефлюкс-эзофагита и пищевода Барретта в отношении измерения желчи в желудке.22 В этом исследовании средний возраст контрольных пациентов составлял 25 лет, а пациентов групп I, II , а III — 42, 50 и 60 лет соответственно. Билитек-зонд располагался на 10 см ниже нижнего сфинктера пищевода (LES).Порог поглощения билирубина составлял 0,14, и хотя не было обнаружено различий между группами по ТМТ, воздействие билирубина желудка было выше в положении лежа на спине, чем в вертикальном положении. В текущем исследовании контрольная группа была старше, чем в исследовании Маршалла. Больше дуодено-желудочного рефлюкса было зарегистрировано как у исследуемых, так и у контрольных пациентов во все периоды измерения. Эти результаты могут быть связаны с улучшением условий исследования.
Мы использовали пищеводный порог поглощения билирубина 0,25.Fein et al. [14] в исследовании in vitro абсорбции различных белых блюд показали, что наименьшее влияние пищи во время мониторинга желчи было измерено при абсорбции> 0,25.
Tack et al. сообщили о влиянии консистенции еды на результаты измерений Bilitec у здоровых субъектов.23 Они сравнили две группы молодых людей из контрольной группы. Испытуемые принимали либо только жидкую пищу, не поглощающую свет той же длины волны, что и билирубин, либо твердую пищу, избегая диет, которые влияют на поглощение билирубина.Авторы обнаружили существенные различия между двумя группами, используя порог поглощения билирубина> 0,14 со средним процентным соотношением (межквартильный размах) над TMT 10,9% (6,7–19,3) для твердой пищи и 0,3% (0,0–2,8) для жидкой пищи. Основные артефакты приема пищи присутствовали у субъектов, получавших твердую пищу из двух блюд (10%) и без жидкости. В нашем исследовании мы обнаружили такой артефакт приема пищи у одного пациента и одного контроля, но значения поглощения билирубина были ниже 0,25 и, следовательно, не соответствовали нашим результатам.
Гастроэзофагеальный рефлюкс нередко содержит секреции желчи, двенадцатиперстной кишки и поджелудочной железы. Использование спектрофотометрического зонда Bilitec продемонстрировало более высокую распространенность аномального воздействия билирубина пищевода у пациентов с метаплазией Барретта по сравнению с пациентами с эрозивным повреждением или без признаков эзофагита (6,8,10,13). добровольцы включены в контрольную группу. Однако другие исследования показали повышенную распространенность гастроэзофагеального рефлюкса с возрастом.24 По этим причинам мы изучали здоровых людей из контрольной группы по возрасту и полу и пациентов с пищеводом Барретта или с эзофагитом. Мы обнаружили патологическую кислотность и желчный рефлюкс пищевода у одной трети контрольной. Возможно, это может быть вызвано артефактами или нарушением протокола волонтерами. Но в предыдущем опубликованном исследовании мы смогли показать, что у более молодых здоровых людей не было такого патологического рефлюкса17. Возможно, эти явления вызваны расслаблением, которое чаще встречается у пожилых людей.Напротив, почти все пациенты с пищеводом Барретта (87%) и все пациенты с эзофагитом (100%) показали патологический кислотный рефлюкс и / или желчный рефлюкс, измеренные с помощью комбинированного мониторинга pH и желчи. В частности, рефлюкс желчи в пищевод во время сна был обнаружен только у пациентов с BM или с эзофагитом.
В нашем исследовании мы измерили внутрижелудочный pH и рефлюкс желчи из двенадцатиперстной кишки в желудок (DGR). Медиана внутрижелудочного pH была одинаковой в обеих группах.Но пациенты с пищеводом Барретта имели значительно более длительный дуоденогастральный рефлюкс в течение 24-часового периода измерения, чем контрольная группа. Ночью было продемонстрировано больше ДГР, чем днем, в обеих группах исследуемых пациентов и в контрольной здоровой группе. Согласно ранее опубликованным исследованиям, это может быть связано со щелочным сдвигом pH. Точный механизм, с помощью которого происходит ночной DGR, и роль, которую играет поза, остаются неясными.
Bowrey et al. не смогли установить ни гастроэзофагеальный, ни дуоденогастральный рефлюкс как преобладающую причину воспаления в слизистой оболочке сердца желудка с использованием устройства Bilitec 2000.16 Это понятно, поскольку количество рефлюкса в желудок (DGR) не обязательно коррелирует с DGER в пищевод. В этом исследовании авторы продемонстрировали больше DGR у женщин в период лежа на спине, в то время как у мужчин было больше DGER. При этом корреляции между уровнями желчи в желудке и пищеводе не было. Однако контрольная группа была намного моложе пациентов. Мы обнаружили значительные различия в измерениях желчи желудка и пищевода между пациентами с BM и контрольной группой.В отличие от Bowrey et al., Мы наблюдали больше DGER у женщин в период лежа на спине и больше DGR у пациентов-мужчин.
Напротив, Banki сообщил об аналогичном воздействии на пищевод рефлюксной кислоты и билирубина у женщин и мужчин со слизистой оболочкой Барретта.28 Pfaffenbach et al. пищевода (SSBE) и пациентов с гастроэзофагеальной рефлюксной болезнью (GERD). Субъекты прошли манометрию пищевода и одновременный 24-часовой мониторинг pH и желчи (Bilitec 2000) со значением абсорбции> 0.2 на 10,9% от общего периода. GER не отличался между группами. Однако DGER различалась у пациентов с LSBE (14,7%), SSBE (2,1%) и GERD (2,1%).
Таким образом, анализ эталонных значений показателей кислотности пищевода и рефлюкса желчи в группе здоровых, сопоставимых по возрасту и полу контролей по сравнению с пациентами с BM привел к следующим выводам:
Хотя около 30% здоровых контролей показали кислотный рефлюкс при мониторинге pH, пациенты с BM имели значительно более высокий кислотный рефлюкс в течение всех измеренных периодов.
У здоровых людей не было значимого дуодено-желудочно-пищеводного рефлюкса, измеренного по абсорбции билирубина. Особенно в период лежа на спине не было рефлюкса желчи.
Оптимальный порог патологического рефлюкса желчи составляет 1,1% (мониторинг желчи с оптической плотностью 0,25).
Управление рефлюксом желчи
G&H Что такое рефлюкс желчи и насколько распространено это состояние?
DS Когда материал, продуцируемый поджелудочной железой и печенью, попадает в двенадцатиперстную кишку, он смешивается с двенадцатиперстной жидкостью; вместе двенадцатиперстная кишка, секреция печени, содержимое желчного пузыря и секреция поджелудочной железы образуют в двенадцатиперстной кишке раствор, содержащий желчь, а также многие другие компоненты.Когда этот раствор попадает в желудок, а затем в пищевод, у пациента возникает так называемый желчный рефлюкс. Однако более подходящим названием для этого состояния является дуоденальный гастроэзофагеальный рефлюкс, поскольку оно более точно описывает компоненты материала.
Рефлюкс желчи у здоровых людей встречается очень редко. Это состояние более тяжелое у пациентов с гастроэзофагеальной рефлюксной болезнью, особенно у пациентов с тяжелым эзофагитом и / или пищеводом Барретта.
G&H Чем отличается желчный рефлюкс от кислотного рефлюкса?
DS Невозможно отличить желчный рефлюкс от кислотного рефлюкса по признакам и симптомам. Как упоминалось выше, жидкость, вырабатываемая поджелудочной железой и печенью, концентрируется в желчном пузыре, попадает в двенадцатиперстную кишку, а затем попадает в желудок из-за дуоденального желудочного рефлюкса, физиологического состояния, которое возникает в постпрандиальном периоде.В норме всегда есть определенное количество дуоденопанкреатического секрета, который попадает в желудок. В желудке этот раствор смешивается с желудочным содержимым, которое в большинстве случаев является кислотой. Этот материал обычно не должен попадать в пищевод, но у пациентов с гастроэзофагеальной рефлюксной болезнью закисленное желудочно-дуоденальное содержимое рефлюксируется в пищевод. Поэтому сложно отличить кислотный рефлюкс от желчного рефлюкса.
G&H Почему у некоторых людей бывает только кислотный рефлюкс, а у других — комбинация кислотного и желчного рефлюкса?
DS Не совсем понятно, почему у некоторых людей бывает только кислотный рефлюкс, а у других — кислотный и желчный рефлюкс.Одна из возможностей состоит в том, что у людей с рефлюксом желчи чаще бывает дуоденогастральный рефлюкс. Альтернативное объяснение состоит в том, что в более проксимальной части желудка, в так называемом кислотно-желчном кармане, происходит ненормальное скопление подкисленной желчной жидкости желудка. Это может быть резервуар и источник дуоденогастроэзофагеального рефлюкса.
G&H Есть ли какие-либо состояния, кроме кислотного рефлюкса, с которыми можно спутать желчный рефлюкс?
DS В течение многих лет считалось, что желчный рефлюкс был синонимом некислотного рефлюкса, и до сих пор многие люди считают, что эти два состояния одинаковы.Некислотный рефлюкс — это тип рефлюкса, который можно распознать только с помощью импедансного мониторинга pH. Некислотный рефлюкс может содержать или не содержать желчь. В целом желчь чаще связана с кислым желудочным соком, чем с некислотным компонентом желудочного содержимого.
G&H Как обычно диагностируется рефлюкс желчи?
DS Первый и наиболее очевидный метод диагностики заключается в обнаружении желчи и последующем ее измерении.Если содержимое пищевода аспирируется во время рефлюкса, можно использовать биохимический анализ для определения присутствия желчи в жидкости, которая рефлюксируется в пищевод. Желчь не должна попадать в пищевод; наличие желчи свидетельствует о наличии рефлюкса желчи.
Однако этот метод диагностики не очень практичен. Альтернативный метод, система мониторинга Bilitec, был разработан много лет назад для выявления изменений цвета рефлюксата в пищеводе.Поскольку желчь имеет определенный цветовой диапазон, это фото-колориметрическое устройство позволяет врачу определить, есть ли желчь в рефлюксате, и если да, то сколько и как долго она находилась в пищеводе.
G&H Каковы наиболее распространенные варианты лечения пациентов с рефлюксом желчи?
DS Лечение желчного рефлюкса такое же, как и лечение кислотного рефлюкса. В общем, все, что может уменьшить кислотный рефлюкс, может уменьшить рефлюкс желчи.Примеры включают изменение образа жизни, снижение веса и отказ от еды непосредственно перед сном или положения лежа на спине сразу после еды. Кроме того, было обнаружено, что курение является фактором развития кислотного рефлюкса. Таким образом, все эти факторы следует относить и к рефлюксу желчи.
Аналогичным образом, лекарства, которые уменьшают секрецию кислоты желудочного сока (например, ингибиторы протонной помпы) или уменьшают содержимое или объем желудка, могут быть использованы для лечения кислого рефлюкса желчи.Поскольку прокинетические препараты увеличивают моторику желудка и ускоряют опорожнение желудка, они также могут уменьшить рефлюкс желчи. Другие препараты, уменьшающие расслабление нижнего сфинктера пищевода, такие как баклофен, также уменьшают желчный рефлюкс, особенно у пациентов, невосприимчивых к терапии ингибиторами протонной помпы. Наконец, так же, как антирефлюксная хирургия может уменьшить кислотный рефлюкс, она также может уменьшить рефлюкс желчи.
В настоящее время в клинической практике нет лекарств, которые можно было бы использовать специально для снижения желчи.
G&H Поскольку лечение желчного рефлюкса такое же, как и лечение кислотного рефлюкса, почему важно определить, содержит ли рефлюкс желчь?
DS Было показано, что пациенты с большим рефлюксом желчи имеют более тяжелое повреждение слизистой оболочки пищевода, поэтому существует четкая корреляция между количеством желчного рефлюкса и тяжестью дистального воспаления пищевода. Фактически, пациенты с наиболее тяжелой степенью гастроэзофагеального воспаления, пищеводом Барретта, — это пациенты с наибольшим рефлюксом желчи.Таким образом, важность рефлюкса желчи в первую очередь связана с серьезностью повреждения слизистой оболочки пищевода, развитием слизистой оболочки Барретта и, возможно, риском рака. Известно, что чем больше у пациента рефлюкса желчи, тем выше риск развития пищевода Барретта; Исследования как in vivo, так и in vitro показали связь между желчью, которая контактирует со слизистой оболочкой пищевода, и изменениями в слизистой оболочке, совместимыми с пищеводом Барретта.
Однако пациентам с рефлюксом желчи нет необходимости проходить специальное наблюдение или принимать какие-либо профилактические меры (кроме лечения гастроэзофагеальной рефлюксной болезни), если у них уже нет пищевода Барретта.Даже в этом случае эндоскопическое наблюдение является спорным, если на слизистой оболочке Барретта нет признаков дисплазии.
G&H Каковы следующие шаги исследований в этой области?
DS В этой области есть 3 основных направления исследований. Один из них связан с воздействием желчных кислот и солей желчных кислот на слизистую оболочку пищевода и развитием пищевода Барретта и рака. Второе направление исследований касается роли рефлюкса желчи при экстраэзофагеальных синдромах, связанных с рефлюксом (например, развитие респираторных расстройств, связанных с рефлюксом).Есть некоторые свидетельства того, что наличие желчи при аспирации рефлюкса в дыхательные пути может иметь очень важное значение в развитии респираторных заболеваний. Это маркер аспирации, а также очень важный воспалительный компонент, который может вызвать воспаление. Это верно для пациентов с рефлюксом, перенесших трансплантацию легких, и пациентов с муковисцидозом. Таким образом, появление желчи в респираторном секрете не только считается маркером, но также может быть патогенным при респираторном заболевании.Третье направление исследований касается роли желчи в патогенезе неэрозивной рефлюксной болезни и ее симптомов. Известно, что пациенты со стойкими симптомами, такими как изжога или срыгивание, могут иметь рефлюксат, содержащий желчную кислоту, несмотря на терапию ингибиторами протонной помпы (поскольку ингибиторы протонной помпы не уменьшают присутствие желчной кислоты). Желчные кислоты могут влиять на слизистую пищевода у пациентов с неэрозивной рефлюксной болезнью и могут быть связаны с сохранением симптомов у этих пациентов.
Симптомы, диагностика и лечение гастроэзофагеальной рефлюксной болезни
Обзор
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — это расстройство пищеварения, которое возникает, когда кислый желудочный сок или пища и жидкости возвращаются из желудка в пищевод. ГЭРБ поражает людей всех возрастов — от младенцев до пожилых людей.
Люди, страдающие астмой, подвержены более высокому риску развития ГЭРБ. Обострения астмы могут вызвать расслабление нижнего сфинктера пищевода, что позволяет содержимому желудка стекать обратно или рефлюксно в пищевод.Некоторые лекарства от астмы (особенно теофиллин) могут ухудшить симптомы рефлюкса.
С другой стороны, кислотный рефлюкс может усугубить симптомы астмы, раздражая дыхательные пути и легкие. Это, в свою очередь, может привести к все более серьезной астме. Кроме того, это раздражение может вызвать аллергические реакции и сделать дыхательные пути более чувствительными к условиям окружающей среды, таким как дым или холодный воздух.
Симптомы и диагностика
Симптомы
У всех был гастроэзофагеальный рефлюкс.Это случается, когда вы отрыгиваете, чувствуете кислый привкус во рту или изжогу. Однако, если эти симптомы мешают вашей повседневной жизни, пора обратиться к врачу.
Другие симптомы, которые возникают реже, но могут указывать на то, что у вас может быть ГЭРБ:
• Кислотная отрыжка (повторное употребление пищи после еды)
• Затруднение или боль при глотании
• Внезапное выделение слюны
• Хроническая ангина
• Ларингит или охриплость голоса
• Воспаление десен
• Полости
• Неприятный запах изо рта
• Рецидивирующий или хронический кашель
• Боль в груди (немедленно обратитесь за медицинской помощью)
Диагностика
Для диагностики ГЭРБ можно использовать несколько тестов, в том числе:
• Рентген верхнего отдела пищеварительной системы
• Эндоскопия (исследует пищевод изнутри)
• Амбулаторный кислотный (pH) тест (контролирует количество кислоты в пищеводе)
• Тест на импеданс пищевода (измерение движения веществ в пищеводе)
Лечение и менеджмент
Если у вас и ГЭРБ, и астма, лечение ГЭРБ поможет контролировать симптомы астмы.
Исследования показали, что у людей с астмой и ГЭРБ наблюдалось уменьшение симптомов астмы (и использование лекарств от астмы) после лечения рефлюксной болезни.
Изменения образа жизни для лечения ГЭРБ включают:
• Поднимите изголовье кровати на 6-8 дюймов
• Похудеть на
человека
• Бросьте курить
• Снизить потребление алкоголя
• Ограничивайте размер еды и избегайте обильных ужинов
• Не ложитесь в течение двух-трех часов после еды
• Уменьшите потребление кофеина
• Избегайте теофиллина (по возможности)
Ваш врач может также порекомендовать лекарства для лечения рефлюкса или облегчения симптомов.Антациды и блокаторы h3, отпускаемые без рецепта, могут помочь уменьшить действие желудочного сока. Ингибиторы протонной помпы блокируют выработку кислоты и также могут быть эффективными.
В тяжелых случаях и при непереносимости лекарств может быть рекомендовано хирургическое вмешательство.
Узнайте больше об астме.
Будьте в курсе последней информации и общайтесь с другими. Присоединяйтесь к нам в Facebook и Twitter.
Патофизиология гастроэзофагеальной рефлюксной болезни: подвижность желудочно-кишечного тракта онлайн
Нормальная физиология
Дистальный отдел пищевода проходит через диафрагмальный перерыв, который обычно формируется правой ножкой диафрагмы.В результате диафрагма может функционировать как «внешний сфинктер», сжимая желудочно-пищеводный переход; это сжатие увеличивает давление LES на 10–100 мм рт. ст. при каждом вдохе, в зависимости от интенсивности вдоха. 107, 108 Повышение внутрибрюшного давления также увеличивает давление LES, частично за счет сокращения диафрагмы. 109 Нижняя часть диафрагмы расслабляется при глотании и TLESR, а также при отрыжке и рвоте.Расслабление бедренной части во время TLESR увеличивает вероятность гастроэзофагеального рефлюкса, особенно при низком давлении LES.
При наличии грыжи пищеводного отверстия диафрагмы диафрагмальный сфинктер удален от гастроэзофагеального перехода и, следовательно, теряет свою способность действовать как антирефлюксный механизм.
Френоэзофагеальная связка
Диафрагмально-пищеводная связка — это отдельная структура, которая прикрепляет желудочно-пищеводный переход к диафрагме.Он растягивается при грыже пищеводного отверстия диафрагмы (рис. 6) (рис. 7). Его отношение к ГЭРБ было предметом споров на протяжении многих лет. 110, 111, 112 Тем не менее, его структура и расположение являются хорошими аргументами для будущих исследований, чтобы изучить его функциональную роль и природу антирефлюксной хирургии, которая будет учитывать эту роль. 57
«Связка» имеет два слоя: тонкий слой, исходящий от эндоторакальной фасции, и более толстое периферическое продолжение поперечной (эндоабдоминальной) фасции.Перед попаданием в стенку пищевода формируются два листка. Более тонкий нижний лист проходит каудально и прикрепляется к стенке пищевода чуть выше угла His, тогда как верхний более толстый лист проходит краниально, чтобы слиться с адвентицией пищевода над диафрагмой. Связка состоит из большого количества коллагеновых и эластичных волокон и нескольких вкраплений гладких мышечных клеток. Верхний лист прочно прикреплен к пищеводу с помощью коллагеновых расширений, которые проникают до уровня подслизистой основы, тогда как нижний лист сливается только с адвентицией.С возрастом листья становятся несколько истонченными, нижний — в большей степени, и этот лист может исчезнуть.
Структура и прикрепление связки обеспечивают логическую основу для ее потенциальной функции. Его эластичные свойства и прочное прикрепление, в первую очередь, будут служить для ограничения смещения пищевода в грудную клетку и втягивания его обратно в исходное положение, минимизируя при этом окружное вытяжение в области LES. Ослабление связки с возрастом может способствовать развитию грыжи пищеводного отверстия диафрагмы.
Грыжа пищеводного отверстия диафрагмы
Некоторые замечания о грыже пищеводного отверстия диафрагмы и ее связи с ГЭРБ сделаны выше. Вкратце, (1) рефлюкс облегчается наличием грыжи пищеводного отверстия диафрагмы, причем рефлюкс увеличивается по мере увеличения размера грыжи. 92, 95, 113, 114, 115, 116 (2) Давление НПС снижено, а податливость НПС и площадь поперечного сечения увеличиваются у пациентов с ГЭРБ, и наиболее эффективны у пациентов с грыжей пищеводного отверстия диафрагмы.106, 117 (3) Комбинация сфинктера низкого давления и грыжи пищеводного отверстия диафрагмы наиболее часто встречается у пациентов с тяжелым эзофагитом и его осложнениями, хотя наличие грыжи пищеводного отверстия диафрагмы само по себе также сигнализирует о наличии повышенного рефлюкса и др. тяжелый эзофагит. 115, 118 (4) Пищеводный клиренс кислоты снижается при наличии грыжи пищеводного отверстия диафрагмы. 119, 120
Механизмы, посредством которых грыжа пищеводного отверстия диафрагмы связана со снижением давления НПС, уменьшением кислотного клиренса и повышенным рефлюксом, многочисленны и не полностью изучены: (1) Низкое давление НПС частично является результатом удаления наружный диафрагмальный сфинктер, 106 и, кроме того, от воспалительного воздействия на внутренние мышцы сфинктера и их иннервацию (см. ниже).(2) Хотя физиологическая причина увеличения доли TLESR, связанных с рефлюксом у пациентов с ГЭРБ, неизвестна, механизм может быть связан с наличием грыжи пищеводного отверстия диафрагмы. 92, 95 Частота и количество явлений общей полости TLESR уменьшаются после антирефлюксной репарации фундопликации, возможно, из-за изменения афферентных механизмов фундального и блуждающего нерва, которые индуцируют TLESR. 121, 122, 123 (3) Грыжа действует как резервуар, диафрагма задерживает в ней кислоту, обеспечивая повторный рефлюкс кислоты и, возможно, повышенную склонность к воспалению кардии (кардит). 124, 125 (5) Растяжение нижнего плеча диафрагмально-пищеводной связки потенциально может привести к периферической тракции нижнего предсердия, особенно у молодых пациентов, до того, как с возрастом произойдет дегенерация связки. 57
Механизмы защиты слизистой оболочки и воспаление
При гастроэзофагеальном рефлюксе большая продолжительность воздействия на пищевод pH <4 приводит к увеличению тяжести эзофагита и его осложнений (рис. 7). 5, 48 Как LES-механизмы, вызывающие избыточный кислотный рефлюкс, так и нарушения моторики пищевода, которые приводят к длительному воздействию кислоты на слизистую оболочку, влияют на продолжительность воздействия.
Воспаление: LES и моторика пищевода
Как отмечалось выше, некоторые заболевания, такие как склеродермия, могут привести к ГЭРБ через повреждение нервного контроля и мышц, что приводит к гипомоторности LES и тела пищевода. Чаще наличие воспаления слизистой оболочки и стенки пищевода связано со снижением давления LES и моторики пищевода, что может повлиять на кислотную нагрузку на слизистую оболочку за счет увеличения рефлюкса и замедленного клиренса пищевода. 126 В организме часто наблюдается снижение амплитуды первичных и вторичных перистальтических волн и нарушение перистальтики. Также могут возникать нерегулярные схватки. 20, 118, 126, 127, 128, 129, 130 Возникает порочный круг (рисунок 2). Как низкое давление LES, так и нарушение моторики пищевода более распространены и выражены у пациентов с более тяжелым эзофагитом, но из-за порочного круга неясно, какая телега, а какая лошадь.
Тем не менее, накапливаются доказательства того, что воспаление влияет на нервы и мышцы, изменяя LES и моторику тела пищевода. По-видимому, задействованы как снижение холинергических возбуждающих, так и усиление нитрергических и других тормозных механизмов. Эта комбинация приведет к пониженной подвижности. В исследованиях участвовали только круговые мышцы, но не праща.
Уменьшение холинергического возбуждения может иметь блуждающий компонент. 131 Эксперименты на животных и исследования ткани LES человека демонстрируют снижение местного холинергического возбуждения, 132, 133, 134 и значительные изменения в запасах кальция 135 и во внутриклеточных путях, которые опосредуют тонус и возбуждение. сокращение сцепления в ответ на ацетилхолин (ACh). 136 В частности, задействованы простаноиды. Медиаторы воспаления, такие как интерлейкин-1B (IL-1B), и увеличение количества активных форм кислорода (например, H 2 O 2 ) связаны с увеличением простагландина E 2 (PGE 2 ) и изоформы PGE. 2 . Простагландин E 2 расслабляет LES, тогда как изоформа PGE 2 блокирует сокращение, опосредованное простагландином F 2a (PGF 2a ). 137 Простагландин E 2a вместе с тромбоксаном A 2 / B 2 важны для поддержания тонуса LES, а блокада активности PGE 2a дополнительно снижает тонус LES. 138 Недавние исследования также показывают, что воспаление индуцирует выработку IL-6 в слизистой оболочке и что IL-6, но не (IL-1B), приводит к увеличению H 2 O 2 в мышцах. 139 H 2 O 2 , по-видимому, является основным виновником увеличения фактора активации тромбоцитов (PAF) и PGE 2 , оба из которых могут снижать как высвобождение ACh 140 , так и LES. мышечный тонус. 141 Более ранние исследования показали, что ингибирование синтеза простагландинов с помощью индометацина предотвращает или корректирует связанную с эзофагитом гипотензию LES, предположительно за счет снижения PGE 2 . 142 Пищеводный IL-8 также увеличивается при рефлюкс-эзофагите и, по-видимому, усиливает транспортировку нейтрофилов. 143
В дополнение к простаноидным эффектам воспаление связано с повышенным содержанием NO в тканях пищевода 134, 144 и свидетельством повышенной активности ингибирующей нитрергической иннервации. 132, 134 Эти изменения также приводят к низкому давлению LES и снижению подвижности тела пищевода.
Интересно, что инфузия кислоты вызывает укорочение пищевода 145 в ответ на медиаторы воспаления, 146 и NO сокращает продольные гладкие мышцы пищевода. 147 Эти ответы на кислоту и вызванное кислотой воспаление были предложены как потенциальные факторы, способствующие развитию грыжи пищеводного отверстия диафрагмы.
Сенсорные механизмы и симптомы
Хотя кислотные или воспалительные медиаторы считаются предполагаемыми инициаторами пищеводных симптомов, механизмы, посредством которых они получают доступ к сенсорным путям и впоследствии вызывают симптомы либо напрямую, либо через другие события, такие как ненормальное сокращение мышц, остаются предметом изучения. споры, предположения и исследования. 49, 148, 149 В этой области остается ряд вопросов: (1) Почему пациенты испытывают изжогу при отсутствии аномального воздействия кислоты или эзофагита (НЭРБ)? 150, 151 (2) Почему у некоторых пациентов с тяжелым эзофагитом и такими осложнениями, как пищевод Барретта, изжога отсутствует или небольшая? 152 (3) Является ли висцеральная гиперчувствительность периферической и / или центральной, гипералгезией или аллодинией? 152, 153, 154, 155, 156 (4) Возникают ли такие ощущения, как изжога, из-за аномальных сокращений, таких как длительные сокращения пищевода круговых или продольных мышц и / или растяжения, 156, 157, 158 и важен ли проксимальный рефлюкс? 2, 4 (5) Является ли дисфункция слизистой оболочки, которая вызывает аномальное сопротивление ткани, объяснением некоторых или всех противоречий? 148 (6) Имеют ли значение возраст и пол пациентов? 159, 160, 161 (7) В какой степени НЭРБ является «функциональным» расстройством пищевода? 162
Другие факторы
Опорожнение желудка .Опорожнение желудка, определенное недавно с помощью стандартизированной методики, подтверждает, что задержка опорожнения часто встречается у пациентов с ГЭРБ и присутствует у 26% пациентов на основании задержки через 4 часа. 163 Есть убедительные причины полагать, что задержка опорожнения может привести к ГЭРБ, включая увеличение содержимого желудка, которое может увеличить частоту TLESR и секреции желудочной кислоты. 164 Однако существует мало доказательств, подтверждающих этот вывод, поскольку у большинства пациентов нет задержки опорожнения желудка, и эта задержка, вероятно, является лишь усиливающим кофактором у меньшинства пациентов.Фактически, у некоторых пациентов с симптомами передней кишки задержка опорожнения желудка может быть связана со снижением постпрандиального рефлюкса. 165 Точно так же у детей нет определенной взаимосвязи между задержкой опорожнения желудка и ГЭРБ, если нет других аномалий, таких как мальротация желудка. 166, 167
Слюна и нейтрализация кислоты . Нейтрализация кислоты проглоченной слюной служит для «очистки» оставшейся кислоты после того, как болюс опорожняется из пищевода, и происходит поэтапно при каждом перистальтическом сокращении, вызванном глотанием. 168 Секреция кислоты увеличивается как у здоровых субъектов, так и у пациентов с рефлюкс-эзофагитом, 169 увеличение связано в первую очередь с появлением изжоги. 170 Нет никаких доказательств того, что нарушение слюноотделения или кислотонейтрализующей способности способствует развитию ГЭРБ у обычного пациента. При заболеваниях, связанных с комплексом сухого кишечника, симптомы рефлюкса не усиливаются, 171 , хотя у некоторых таких пациентов снижение слюноотделения может быть связано с повреждением пищевода. 172
Спящий режим . Хотя частота эпизодов рефлюкса снижается во время сна, 75, 173 многие физиологические изменения, которые происходят во время сна, способствуют развитию ГЭРБ. 89, 90 Эти изменения включают (1) повышенную секрецию кислоты, которая также может рассматриваться как «ночной прорыв» у пациентов с ГЭРБ, получающих терапию протонной помпой 174, 175, 176 ; (2) заметное уменьшение кислотного клиренса с усилением проксимальной миграции из-за потери гравитационных эффектов в положении лежа на спине, 177, 178 снижение частоты глотания и, следовательно, первичной перистальтики, 179, 180 снижение слюны производство, 181 снижение восприятия изжоги 89 ; и (3) изменения медленноволновой электрической активности желудка 182 , которые могут предрасполагать к уменьшению опорожнения желудка. 183 Другие факторы, такие как апноэ во сне и его связь с ожирением, также связаны с ГЭРБ. 89, 184 Механизм этой взаимосвязи неясен и может быть связан с изменениями внутригрудного давления, связанными с апноэ, или с факторами, связанными с ожирением, такими как повышенное внутрибрюшное давление и грыжа пищеводного отверстия диафрагмы. 185, 186
Ожирение . Связь ожирения с ГЭРБ противоречива. Было обнаружено, что ожирение является фактором риска ГЭРБ, 187 , а потеря веса может быть связана с улучшением симптомов ГЭРБ или 188 , а может и не быть 189 .Другое исследование не обнаружило связи ожирения с симптомами ГЭРБ. 190 Любые отношения могут в значительной степени определяться наличием грыжи пищеводного отверстия диафрагмы у пациентов с ожирением. 186
Генетика . Существует множество доказательств того, что существует наследственная тенденция к развитию ГЭРБ. 191, 192, 193 Доказательства получены в основном из эпидемиологических и семейных исследований 194, 195, 196, 197 и исследований близнецов. 198, 199 Многие проблемы остаются нерешенными, и это является стимулом для продолжения исследований: (1) ГЭРБ у детей и взрослых имеет как сходные, так и разные клинические особенности, которые повлияют на генетические исследования. 200 (2) Может существовать предопределенная генетическая предрасположенность к развитию различных фенотипов ГЭРБ (НЭРБ, эрозивный эзофагит и пищевод Барретта). 192 Этот вопрос особенно важен для связи ГЭРБ с аденокарциномой пищевода. 197, 201 (3) Некоторая генетическая предрасположенность к развитию ГЭРБ, вероятно, связана с такими факторами риска, как ожирение и грыжа пищеводного отверстия диафрагмы. 202, 203 (4) Хромосомные детерминанты демонстрируют множество идентифицируемых взаимосвязей из-за множества факторов, вовлеченных в патогенез ГЭРБ. Например, картирование гена на хромосоме 13q14 было обнаружено у некоторых пациентов 204 , но не у других. 205
Рефлюкс дуоденального содержимого вызывает канцерогенез пищевода
Обзорная статьяХолецистэктомия и дуоденогастральный рефлюкс: рефлюкс Содержимое двенадцатиперстной кишки вызывает канцерогенез пищевода
Наоки Хашимото *
Отделение хирургии, Университет Киндай, Япония
* Автор, ответственный за переписку: Наоки Хашимото, Департамент Хирургия, Университет Киндай, 589-8511 377-2 Оно- Хигаси Осака Саяма Осака, Япония
Опубликован: 18 января 2018 г.
Цитируйте эту статью как : Hashimoto N.Холецистэктомия и
Дуоденогастральный рефлюкс: рефлюкс
Содержание двенадцатиперстной кишки вызывает пищевод
Канцерогенез. Clin Surg. 2018; 3:
1867.
Аннотация
Холецистэктомия — очень распространенная операция. Пациенты, перенесшие холецистэктомию, имеют повышенное
рефлюкс желчи и панкреатического сока из двенадцатиперстной кишки в желудок и более высокая частота
дуоденогастральный рефлюкс (ДГР). Существует повышенная вероятность попадания сока двенадцатиперстной кишки в пищевод.
Рефлюкс дуоденального содержимого может вызвать повреждение слизистой оболочки и способствовать онкогенезу.Следовательно,
мы сделали модель рефлюкса крысы, на которой была создана эзофаго-дуоденостомия с тотальной гастрэктомией.
для разрешения хронического заброса дуоденального содержимого в пищевод. Север макроскопический,
микроскопические и молекулярные изменения наблюдались почти в 100% случаев после 40 недель.
хронического дуодено-пищеводного рефлюкса. Было обнаружено, что сок двенадцатиперстной кишки (особенно желчная кислота)
вызвать рак пищевода в нашей животной модели. Следовательно, холецистэктомия связана с
умеренно повышенный риск рака пищевода, возможно, из-за токсического действия рефлюксного сока двенадцатиперстной кишки
(особенно желчная кислота) на слизистой оболочке пищевода.Нам необходимо полностью понимать DGR, чтобы адекватно
консультировать пациентов о последствиях холецистэктомии.
Ключевые слова: холецистэктомия; Дуоденогастральный рефлюкс; Эзофаго-дуоденостомия; Пищевода
рак; Желчные кислоты
Введение
Холецистэктомия — наиболее частая плановая хирургическая операция на брюшной полости, и большинство пациентов после этого совершенно здоровы. Иногда у пациентов появляются симптомы тошноты и боли, но эти обычно со временем оседают. В некоторых случаях тревожным последствием является дискинезия желчевыводящих путей.К счастью, для у большинства с осложненной патологией желчевыводящих путей это нечастый исход. Это особенно важно понимать физиопатологию, которая может возникнуть в результате холецистэктомии при бессимптомном течении пациенты. Целью данной работы является изучение того, увеличивает ли холецистэктомия DGR и рефлюкс дуоденальное содержимое вызывает канцерогенез пищевода, судя по моим экспериментальным данным и литературным данным.
Влияние холецистэктомии на микросреду пищевода и желчи
Механизм функции желчного пузыря очень сложен и требует многих гуморальных и нервных контролирует.В межпищеварительный период желчный пузырь расслаблен, сфинктер Одди закрыт. и желчный пузырь наполняется желчью. Желчь накапливается в желчном пузыре между приемами пищи и выводится в двенадцатиперстной кишке сокращением желчного пузыря в ответ на стимулированную едой секрецию CCK из двенадцатиперстная кишка. CCK высвобождается в ответ на небольшие пептиды и жирные кислоты в двенадцатиперстной кишке. Это вызывает сокращение желчного пузыря и расслабление сфинктера Одди. Когда желчный пузырь удаляется, место для хранения между приемами пищи разрушается, и желчь непрерывно поступает в двенадцатиперстная кишка, способствующая ретроградному рефлюксу в желудок, ведущему к дуодено-желудочному рефлюксу.Потеря функций желчного резервуара приводит к ненормальной ситуации, когда желчь попадает в двенадцатиперстную кишку в непрерывный, а не прерывистый режим, и связан с приемом пищи. Большой объем желчи после холецистэктомии может перегрузить очищающую способность проксимального отдела двенадцатиперстной кишки и, следовательно, вызывают дуоденогастральный рефлюкс через привратник. Появляется все больше свидетельств важности дуоденогастральный рефлюкс, который усиливается после холецистэктомии. Есть свидетельства того, что вовлекает дуоденогастральный пищеводный рефлюкс в патогенез пищевода Барретта и рака [1,2].Уолш и др. [3] ранее показали, что холецистэктомия связана с увеличением заболеваемость ГЭРБ. Фридман и др. [4] предположили связь между холецистэктомией и повышенный риск аденокарциномы пищевода, возможно, из-за токсического действия рефлюксных желчь на слизистой оболочке пищевода. Необходимы дальнейшие исследования связи между рефлюксом желчи и канцерогенез пищевода.
Оценка DGR
Объективное физиологическое измерение DGR затруднено и до недавнего времени большинство методов, используемых для измерения DGR, имели требуется интубация, которая помимо того, что является инвазивной техникой сам по себе может способствовать DGR и приводить к ложным результатам.
Сцинтиграфия
Гепатобилиарная сцинтиграфия проводилась с использованием 3-4 мкКи из 99 мкм
Tc-HIDA. Техника сцинтиграфической оценки была
подробно описано ранее [5]. Снимки передней брюшной полости
были сняты гамма-камерой, каждое изображение размером 500 тыс.
принимается с 5-минутными интервалами в течение 60 минут. Интерпретация изображения и
Тяжесть DGR оценивалась и оценивалась в соответствии со следующими
шкала; о, рефлюкса нет; 1, заброс только в антральный отдел; 2, умеренный рефлюкс
в тело; 3 — выраженный отток в организм и средства; и 4, рефлюкс
в пищевод.
Мы исследовали с помощью сцинтиграфии только холецистэктомию.
группа. Легкая ДГР 1 степени наблюдалась у 2 (22%) из 9 пациентов.
[6]. Сцинтиграфическая документация DGR технически проста, проста
и физиологичен, поскольку он неинвазивен. Но надежность и точность
сцинтиграфии было оспорено. Самая частая проблема была
перекрытие тонкой кишки и желудка встречается у 36% пациентов,
что не исправимо. Другие проблемы включали перекрытие левого
доли печени и желудка, движения пациента и прерывистые
характер рефлюкса желчи.
Гистологическое определение рефлюкса желчи
ЭРХПГ выполняли с помощью дуоденоскопа TJF-240 (Olympus, Япония), а эндоскопия верхних отделов желудочно-кишечного тракта выполнялась с помощью Эзофагогастродуоденоскоп QX10 (Olympus, Япония). В течение Во время процедуры были взяты 2 биопсии из антрального отдела желудка и 2 биопсии. из корпуса. Патологоанатом (ГА), не имеющий отношения к пациенту клинические результаты оценивали каждый образец ткани желудка в соответствии с вышеупомянутая система индекса рефлюкса желчи (BRI), разработанная Собалой, и другие.[7] В этой системе индекс выводится на основе присутствия / выраженность некоторых гистологических показателей: отек в пластинке propria, кишечная метаплазия (IM), хроническое воспаление (CI) и Колонизация Hp в желудке. Для каждого образца патологоанатом присвоена оценка от 0 до 3 (что означает отсутствие, легкая, умеренная, или отмечены соответственно) для каждого гистологического параметра. Индекс значение затем вычислялось по формуле, полученной из пошагового логистический регрессионный анализ. BRI = (7 × E) + (3 × IM) + (4 × CI) — (6 × Hp).Согласно Sobala, et al. [7], BRI выше 14 означает DGR с 70% чувствительность и 85% специфичность.
Амбулаторный мониторинг билирубина
В 1993 г. Бечи и др. [8] утвердили систему для амбулаторного обнаружения. рефлюкса желчи с помощью волоконно-оптической спектрофотометрической системы (BillitecR2000, Synectics и Стокгольм, Швеция). Система состояла из волокна оптический зонд диаметром 5 мм с открытой канавкой диаметром 2 мм какие две длины волны света излучаются и отбираются образцы материала билирубин обнаруживается между зеркалом и оптоволоконным наконечником на конец зонда по поглощению света на 453 нм, где билирубин имеет пик поглощения.Данные собираются в портативном регистраторе данных и позже. проанализированы на компьютере. Этот метод позволяет амбулаторно обнаружить желчи в пищеводе почти так же, как определение pH. Тем не менее есть некоторые ограничения. Некоторые цветные продукты могут помешать измерениям и мелкие кусочки пищи могут попасть застрял между зеркалом и концом световода. На низком pH ниже 3,5 билирубин образует диммеры с разными оптическими свойствами вызывая занижение концентрации билирубина не менее 30 процентов [8].Устройство BillitecR — лучший способ мониторинга уровни билирубина в пищеводе, однако интерпретация желудочного билирубин более сложен, и BillitecR не так точен в этом параметр.
Влияние DGR на канцерогенез пищевода в Rat Model
Хроническая гастроэзофагеальная рефлюксная болезнь (ГЭРБ) несет повышенный риск развития повреждения слизистой оболочки пищевода, столбчатая метаплазия, дисплазия и аденокарцинома пищевод. Эти изменения вызваны тем, что рефлюксный сок достигает слизистая оболочка пищевода желудка, обычно содержащая желчь компоненты.Эксперименты на крысах показали, что дуоденальное содержимое вызвать рак пищевода без воздействия канцерогенов, тогда как содержимое желудка — нет. Чтобы смоделировать эффект потенциального канцерогенный рефлюкс сока есть соответствующие хирургические методы (сквозная эзофаго-дуоденостомия), обеспечивающая подходящую модель для рефлюкс-индуцированных патологий пищевода без необходимости для дополнительного введения канцерогенов. Основное назначение Экспериментальное исследование было направлено на изучение частоты возникновения ГЭРБ, вызванной злокачественное образование из-за дуодено-пищеводного анастомоза.
Животные и дизайн экспериментального Хирургия
Для моего экспериментального исследования ГЭРБ 30 крыс-самцов линии Вистар (в среднем вес от 250 г до 300 г). Продольная лапаротомия по средней линии была выполнена сквозная эзофаго-дуоденостомия с тотальная гастрэктомия (EDA) была произведена атравматическим рассасывающимся прерывистые швы для соединения двенадцатиперстной кишки с пищеводом. Этот процедура допускает хронический заброс дуоденального содержимого в пищевод через место анастомоза. Крыс приносили в жертву 40 недель после операции под общим наркозом и брюшной полости и грудной клетки были вскрыты.Пищевод и двенадцатиперстная кишка удалены. в непрерывном, продольно открытом виде и выкладываемом на пробковую пластину для макроскопическое исследование.
Гистопатологические изменения
Все животные, подвергшиеся хирургическому вмешательству, показали признаки хронической ГЭРБ,
включая гиперплазию базальных клеток, акантоз и гиперкератоз. В
рассечение образца пищевода показало типичные признаки ГЭРБ
как утолщенная стена и отмеченные неправильные складки с типичным булыжником
внешний вид, простирающийся от середины пищевода до анастомоза
эзофаго-дуоденостомии.Внешний вид гортани и
двенадцатиперстная кишка в норме. В многослойном плоском эпителии
в средней части пищевода присутствовали типичные рефлюкс-ассоциированные симптомы.
В нижней части пищевода обнаружены изъязвленные плоскоклеточные клетки.
карцинома с инвазивными очагами кератинового жемчуга. Прилегающий плоскоклеточный
эпителий был диспластическим, от легкой дисплазии до карциномы
in situ, где базальный слой уже был заменен пропуском
метаплазия столбчатой слизистой оболочки. На стыке чешуек и столбиков,
микроскопическая аденокарцинома, поражающая подслизистую область, была
идентифицированы.Столбчатый эпителий (CLE) развивается в дистальном
часть пищевода. CLE наблюдалась у 40% на 40-й неделе.
Тяжелая дисплазия произошла в 100% случаев плоскоклеточной карциномы (SCC).
наблюдалась в 40% случаев, а аденокарцинома (ADC) наблюдалась в
30% на 40 неделе. Иммунореактивность COX2 в основном наблюдалась в инфильтрирующих клетках и фибробластах в строме. Рак пищевода
встречается в 2 основных гистопатологических формах, ADC, которая развивается из
предшественник, воспалительное метапластическое поражение, пищевод Барретта
и SCC, который развивается из нормальной слизистой оболочки через классический
последовательность гиперплазия-дисплазия-карцинома.По сравнению с АЦП,
SCC реже является воспалительным, за исключением пациентов из областей в
мир, где этот тип рака встречается очень часто, например
например Северный Иран. Было несколько эпителиальных клеток SCC.
и ADC, который сильно экспрессировал белок COX2 [9]. P53 дикого типа
накопление белка наблюдалось как положительное ядерное окрашивание в
ADC, тогда как в SCC он был отрицательным. Бенуа и др. [10] предложили, чтобы
хроническое воспаление может представлять собой физиопатологический контекст
в котором фактор транскрипции NF-каппа B может взаимодействовать с
активировать COX2.(c) Канцерогенный потенциал рефлюкса дуоденального сока.
на слизистой оболочке пищевода.
У людей большая часть EAC возникает в пищеводе Барретта, где
столбчато-клеточная метаплазия заменяет нативный плоскоклеточный эпителий
выстилает дистальный отдел пищевода. Важно отметить, что двенадцатиперстная кишка
сок, то есть желчь, вызывает окислительный стресс в эпителии пищевода,
тем самым приводя к хроническому воспалению, а затем к метаплазии. В нашем
Модель на крысах [9], общая желчная кислота в просвете пищевода была значительно выше.
увеличилось в модели EDA по сравнению с крысами с ложной операцией.Желчь
соли могут быть нацелены на несколько потенциально взаимосвязанных путей, что приводит к
к нарушению слизистого барьера и может изменить функцию клеток
с которыми они, вероятно, свяжутся. Понимание природы
вызванные регургитацией поражения слизистой оболочки предполагают использование подходящих
экспериментальные модели. В наших экспериментах строго макроскопические,
микроскопические и молекулярные изменения наблюдались почти в
100% случаев после 40-й недели хронической двенадцатиперстно-пищеводной
рефлюкс. Мы подтвердили, что сок двенадцатиперстной кишки без экзогенного
Введение канцерогена, несомненно, может способствовать эпителиальному
гиперпролиферация и канцерогенез пищевода.В Мива
исследование на крысах, у которых дуоденоэзофагеальный рефлюкс был вызван
создание эзофагодуоденального анастомоза было индукцией
рака пищевода, который не был обнаружен, если дуоденальный сок был
отводится дальше по кишечнику [11].
Желчные кислоты
Воздействие желчных кислот на эпителий пищевода инициирует серию реакций, включая повышенную проницаемость клеток и расширенные межклеточные пространства, повреждение и восстановление клеток, воспаление и активация провоспалительных факторов транскрипции и генов [12].И все эти реакции предрасполагают пищевод к дисплазии и рак [13]. Ширвани и др. [14]. предположил, что желчные кислоты стимулируют Экспрессия COX2, связанная с хроническим воспалением рост эпителиальных клеток пищевода Барретта и рак. В Исследование in vitro, проведенное Дженкинсом, показало, что воздействие на слизистую пищевода физиологический уровень желчных кислот активирует NF-KB, который активирует СОХ2 [15,16]. Бенуа и др. [10] | предположил, что хроническое воспаление (рефлюкс дуоденального содержимого) может представлять собой физиопатологическое контекст, в котором фактор транскрипции NF-каппа B может взаимодействовать для активации COX2.
Заключение
Учитывая повышенную вероятность дуоденально-желудочного рефлюкса и гастроэзофагеальный рефлюкс после холецистэктомии наблюдается повышенная шанс попадания дуоденального сока в пищевод. Дуоденальный сок (особенно желчная кислота), как было обнаружено, вызывает рак пищевода. в нашей модели на животных. Следовательно, холецистэктомия связана с умеренно повышенный риск рака пищевода, возможно, из-за токсическое действие рефлюксного сока двенадцатиперстной кишки (особенно желчной кислоты) на слизистая пищевода.Следовательно, нам необходимо полностью понимать DGR, чтобы адекватно проконсультировать пациентов о последствиях холецистэктомии.
Список литературы
- Souza RF, Krishnan K, Spechler SJ. Азбука создания метаплазии Барретта. Am J Physiol Gastrointest Liver Physiol. 2008: 295 (2): G211-8.
- Gutschow CA, Bludau M, Vallbohmer D, Schröder W, Bollschweiler E, Hölscher AH. НЭРБ, ГЭРБ и пищевод Барретта: пересмотр роли кислотного и некислотного рефлюкса с комбинированным мониторингом сопротивления pH.Dig Dis Sci. 2008; 53 (12): 3076-81.
- McDonnell CO, Bailey I, Stumpf T, Walsh TN, Johnson CD. Влияние холецистэктомии на холецистокинин плазмы. Am J Gastroenterol. 2002; 97 (9): 2189-92.
- Freedman J, Ye W, Naslund E, Lagergren J. Связь между холецистэктомией и аденокарциномой пищевода. Гастроэнтерология. 2001; 121 (3): 548-53.
- Xynos E, Vassilakis JS, Fountos A, George Pechlivanides, Nikolaus Karkavitsas. Энтерогастральный рефлюкс после различных видов противоязвенных операций на желудке: количественное определение сцинтиграфией 99mTc-HIDA.Гастроэнтерология. 1991: 101: 991-8.
- Hashimoto N, Yasuda T., Inayama M, Ho H, Shinkai M, Kawanishi K и др. Дуоденогастральный рефлюкс после холедоходуоденоанастомоза: оценка сцинтиграфией с технецием-99m. Гепатогастроэнтерология. 2007; 54: 796-8.
- Sobala GM, O’Connor HJ, Dewar EP, King RF, Axon AT, Dixon MF. Желчный рефлюкс и кишечная метаплазия в слизистой оболочке желудка. J Clin Pathol. 1993; 46 (3): 235-40.
- Vaezi MF, Lacamera R, Richter JE. Валидационные исследования системы амбулаторного мониторинга дуоденогастрального рефлюкса Bilitec 2000.Am J Physiol. 1994: 267 (6): G1050-7.
- Хашимото Н. Экспрессия COX2 и p53 при раке пищевода у крыс, вызванном рефлюксом дуоденального содержимого. ISRN Гастроэнтерология. 2012; 2012: 914824.
- Бенуа В., де Мораес Е., Дар Н.А., Тараншон Е., Бурс В., Отфёй А. и др. Для транскрипционной активации циклооксигеназы-2 опухолевым супрессором p53 требуется ядерный фактор-каппа B. Онкоген. 2006: 25: 5708-18.
- Мива К., Сахара Х, Сегава М., Шиничи К., Такахиро С., Ицуо М. и др. Рефлюкс дуоденального или гастродуоденального содержимого вызывает у крыс карциному пищевода.Int J Cancer. 1996; 67: 269-74.
- Tobey NA, Hosseini S, Argote CM, Dobrucali AM, Awayda MS, Orlando RC. Расширенные межклеточные пространства и проницаемость шунта в эпителии пищевода, неэрозивно поврежденном кислотой. Am J Gastroenterology. 2004; 99: 13-22.
- Барлоу WJ, Орландо RC. Патогенез изжоги при неэрозивной рефлюксной болезни: объединяющая гипотеза. Гастроэнтерология. 2005; 128 (3): 771-8.
- Ширвани В.Н., Уату-Ласкар Р., Каур Б.С., Омари МБ, Триадафилопулос Г. Экспрессия циклооксигеназы 2 в пищеводе Барретта и аденокарциноме: Ex vivo индукция солями желчных кислот и воздействием кислоты.Гастроэнтерология. 2000; 118 (3): 487-96.
- Райе Б., Гелинас С. Аберрантные гены rel / nfkb и активность при раке человека. Онкоген. 1999; 18 (49): 6938-47.
- Hinz M, Löser P, Mathas S, Krappmann D, Dörken B, Scheidereit C. Конститутивная NF-каппа B поддерживает высокую экспрессию характерной генной сети, включая CD 40, CD86 и набор антиапоптотических генов в Hodgkin / Reed -Клетки Штейнберга. Кровь. 2001; 97: 2798-807.
Схема классификации симптоматического энтерогастрального рефлюкса с использованием аугментации цинкалидом при гепатобилиарной сцинтиграфии
Реферат
Энтерогастральный рефлюкс (EGR) — это рефлюкс двенадцатиперстного содержимого в желудок.Гепатобилиарная сцинтиграфия обеспечивает физиологическую оценку желчевыводящей системы и использовалась для проверки гипотезы о том, что наличие и время рециркуляции выхлопных газов могут быть связаны с инфузией синкалида, заменителя эндогенного холецистокинина. Методы: Ретроспективно проанализировано сто пятьдесят семь исследований гепатобилиарной сцинтиграфии. Данные включали частоту EGR в первоначальных отчетах, частоту после замаскированных вторых считываний и время начала EGR по отношению к инфузии синкалида. Затем случаи рециркуляции выхлопных газов были классифицированы в соответствии с дебютом на изображениях до, после или одновременно с пресинкалидной и постинкалидной визуализацией. Результаты: Время начала EGR через 19–24 минуты после начала 15-минутной инфузии холина значительно отличалось от нормы ( p <0,0001). Первоначально О EGR сообщалось в 14 из 157 случаев (8,9%), но было обнаружено в 38 из 157 случаев при скрытом повторном чтении (24,2%), что соответствует показателю несоответствия 15,3%. Заключение: Временная ассоциация начала EGR с инфузией холина может идентифицировать пациентов с EGR, имитирующим хронический холецистит или дискинезию желчевыводящих путей. Таким образом, новая схема классификации была разработана в качестве основы для будущих исследований, использующих начало рециркуляции выхлопных газов в связи с пре-, пост- или одновременно пресинкалидной и постинкалидной визуализацией в качестве гипотетического биомаркера клинически значимого рециркуляционного рака.
Энтерогастральный рефлюкс (EGR) — это рефлюкс желчи и других пищеварительных жидкостей из двенадцатиперстной кишки в желудок. EGR — распространенное, но недостаточно диагностируемое заболевание, которое оказывает вредное воздействие на слизистую оболочку желудка, способствует колонизации Helicobacter pylori и действует синергетически с H. pylori , вызывая хронический гастрит и кишечную метаплазию (1,2). Дуоденогастроэзофагеальный рефлюкс, при котором рефлюкс распространяется из двенадцатиперстной кишки в пищевод, связан с рефрактерной гастроэзофагеальной рефлюксной болезнью и способствует развитию пищевода Барретта и аденокарциномы пищевода (3–5).Факторы риска EGR включают операцию на желудке и холецистэктомию (2,6).
EGR может быть причиной боли в животе, связанной с другой распространенной этиологией, включая холецистит (7). Варианты диагностики EGR включают сканирование гепатобилиарной сцинтиграфии, эндоскопию желудочно-кишечного тракта, прямой забор желудочного аспирата и автоматические измерения абсорбции билирубина (1,3,8,9). Многочисленные исследования показывают, что сканирование гепатобилиарной сцинтиграфии может быть лучше других методов для обнаружения EGR (10,11).Однако обзор литературы выявил недостаток исследований взаимосвязи между EGR и введением синкалида, суррогата эндогенного холецистокинина. Синкалид вызывает сокращение желчного пузыря и расслабление сфинктера Одди, тем самым облегчая выведение желчных кислот в кишечник. Измененный физиологический ответ на холецистокинин и, следовательно, также на эндогенный холецистокинин, может потенциально вызывать или усиливать рециркуляцию выхлопных газов.
Мы выполнили 12-месячный ретроспективный обзор всех сканирований гепатобилиарной сцинтиграфии, чтобы оценить корреляцию между наличием и временем EGR по отношению к синкалиду.Мы предположили, что холецистокинин, как аналог эндогенного холецистокинина, может вызывать или усугублять EGR и, следовательно, воспроизводить EGR после еды. После того, как была обнаружена взаимосвязь между EGR и инфузией синкалида, была разработана новая схема классификации EGR, основанная на наличии EGR на пре- и пост-инкалидной гепатобилиарной сцинтиграфии, в качестве гипотетического визуализирующего биомаркера для симптоматической EGR.
МАТЕРИАЛЫ И МЕТОДЫ
Утверждение Институционального наблюдательного совета было получено до ретроспективного обзора отчетов всех 157 гепатобилиарных сцинтиграфических исследований, проведенных у взрослых в нашем учреждении с 1 января 2012 года по 31 декабря 2012 года, и требования получения информированного согласия было отказано.
Популяция пациентов
Критерии включения включали всех пациентов 18 лет и старше, которые были направлены на амбулаторную гепатобилиарную сцинтиграфию для оценки подозрения на хронический холецистит или дискинезию желчевыводящих путей. Критерии исключения: несовершеннолетние, пациенты, госпитализированные, или пациенты, у которых был диагностирован острый холецистит.
Показатели результата
Первичные критерии оценки включали наличие или отсутствие EGR в первоначальных отчетах о гепатобилиарной сцинтиграфии и при последующем замаскированном обзоре.Также оценивалось время начала EGR в минутах до или после инфузии холина, если применимо. Вторичные критерии оценки включали взаимосвязь EGR с возрастом и полом пациента, мегабеккерелями (mCi) введенного радиоактивного индикатора и фракцией выброса желчного пузыря (GBEF), если проводилось.
Для достижения результатов все исследования были переоценены независимо двумя сертифицированными радиологами, прошедшими стажировку в области ядерной медицины, а также первыми читателями, на предмет наличия и продолжительности рециркуляции выхлопных газов, а также времени введения пре- или постинкалида.Случаи разногласий по поводу наличия EGR были затем рассмотрены обоими врачами вместе, и было принято консенсусное решение о наличии и продолжительности EGR. Для того чтобы консенсус в отношении EGR был положительным, оба считывателя должны иметь субъективный уровень достоверности более 95% для наличия EGR. Читатели были замаскированы для первоначальных отчетов о изображениях во время просмотра.
Идентификация EGR оценивалась с использованием 3 критериев, все из которых должны были присутствовать для положительного сканирования.Эти критерии включали локализацию активности радиоактивных индикаторов в левом верхнем квадранте, форму активности с ожидаемой конфигурацией желудка и активность, которая казалась отличной от тонкой или толстой кишки (т. Е. Неэнтерическая активность).
При просмотре читатели также задокументировали время начала EGR в виде пресинкалида, постинкалида или как пресинкалида, так и постинкалида в соответствии с началом EGR в течение каждого соответствующего периода визуализации. Продолжительность EGR в минутах для каждого периода времени также была занесена в таблицу.
Разработка классификационной схемы
После замаскированного обзора каждый случай EGR был классифицирован в соответствии с новой схемой классификации, разработанной авторами в качестве гипотетического биомаркера и основы для будущих исследований клинически симптоматической EGR (таблица 1). Класс A применяется к случаям, в которых рециркуляция выхлопных газов происходит только во время преинкалидной визуализации или рециркуляционная эмиссия происходит во время как преинкалидной, так и постинкалидной визуализации, при этом постинкалидная рециркуляция выхлопных газов демонстрирует равную или меньшую интенсивность по сравнению с пресинкалидной рециркуляцией (т.е. активность в желудке не увеличивается после инфузии холина) (рис. 1). Класс B применяется к случаям рециркуляции выхлопных газов, которые возникают исключительно во время постинкалидной визуализации (рис. 2). Класс C применяется к случаям рециркуляции выхлопных газов во время как пресинкалидной, так и постинкалидной визуализации, когда интенсивность рециркуляции выхлопных газов увеличивалась в течение постинкалидного периода (т.е. активность в желудке возрастала после инфузии холина) (рис. 3). Каждый случай EGR был подклассифицирован как переходный или постоянный, что означает, что EGR был переходным и разрешался до завершения каждого соответствующего периода визуализации, или EGR сохранялся на протяжении оставшейся части каждого соответствующего периода визуализации (до или после инкалида).
ТАБЛИЦА 1Схема классификации для EGR
РИСУНОК 1.Женщина 20 лет с постоянными болями в животе. Все изображения представлены в 5-минутных временных рамках. Пример EGR класса A: EGR присутствует на изображениях до инкалида, без увеличения интенсивности EGR на изображениях после инкалида. Изображения пресинкалида (A) показывают начало EGR через 40 мин (маленькая открытая стрелка), которое сохраняется на протяжении оставшейся части изображения пресинкалида (большая открытая стрелка). Постинкалидные изображения (B) показывают, что EGR сохраняется на протяжении всего постинкалидного изображения (черные стрелки), без увеличения интенсивности по сравнению с пресинкалидным EGR (A).Постинкалидная визуализация начинается одновременно с началом инфузии холина.
РИСУНОК 2.Мужчина 60 лет с хронической болью в правом подреберье. Все изображения представлены в 5-минутных временных рамках. Пример EGR класса B: EGR присутствует только на постинкалидных изображениях. Изображения пресинкалида не показывают EGR (A). Постсинкалидные изображения (B) показывают начало рециркуляции выхлопных газов через 20 мин, которое сохраняется в течение оставшегося периода визуализации (черные стрелки). Постинкалидная визуализация начинается одновременно с началом инфузии холина.Визуализация пресинкалида была прекращена раньше, чем через 50 минут, поскольку пациент ушел в туалет.
РИСУНОК 3.Женщина 77 лет с болью в правом подреберье. Все изображения представлены в 5-минутных временных рамках. Пример EGR класса C: EGR присутствует на изображениях до и после инкалида, с увеличением интенсивности EGR во время постинкалидного периода. Изображения пресинкалида (A) демонстрируют EGR, которая окончательно видна через 50 минут (черная стрелка). Постинкалидные изображения (B) показывают остаточную активность в желудке по данным пресинкалидной визуализации с последующим заметным увеличением активности через 18–24 мин после начала инфузии синкалида, что соответствует дополнительной рециркуляции рециркуляции (черная стрелка).Таким образом, этому пациенту была проведена инфузия EGR до и после введения цинкалида, и он был сгруппирован в класс C. Постинкалидная визуализация начинается одновременно с началом инфузии синкалида. Кривая GBEF не показана для лучшего отображения изображений до и после инкалида.
Техника визуализации
Перед визуализацией все пациенты голодали не менее 6 часов. Технические параметры сканирования гепатобилиарной сцинтиграфии включали переднюю планарную визуализацию, представленную в виде 1-, 3- или 5-минутных кадров, в зависимости от используемой системы камеры (Axis [Philips] или Transcam [ADAC]) после инъекции в среднем 192.4 МБк (5,2 мКи [диапазон, 148–222 МБк и 4,0–6,0 мКи]) 99m Tc-меброфенина. GBEF оценивали с помощью 15-минутной инфузии с использованием инъекционного насоса холина (0,01 мкг / кг) (Bracco Diagnostics, Inc.), после чего следовали дополнительные 15 минут визуализации. В зависимости от системы камеры 30-минутная визуализация во время и после инфузии холина также была представлена в виде 1-, 3- или 5-минутных кадров. Чтобы воспроизвести среду первоначальной интерпретации изображений, все изображения были просмотрены в их исходном формате без дополнительной обработки.
Статистические методы
Тест χ 2 использовался для оценки различий между полом и наличием EGR. Непарные тесты t были использованы для оценки различий между EGR в зависимости от возраста пациента, концентрации введенного радиоактивного индикатора и GBEF. Тест z использовали для расчета перекоса начала EGR после введения синкалида. Тест ANOVA использовался для оценки времени начала активности кишечника или желчного пузыря для случаев с и без EGR.Значимость была рассчитана как значение P , меньшее или равное 0,05.
РЕЗУЛЬТАТЫ
Ретроспективный обзор исходных клинических отчетов выявил зарегистрированный диагноз EGR в 14 из 157 случаев, что соответствует 8,9% зарегистрированной заболеваемости EGR в нашей популяции. Скрытый обзор клинических изображений выявил 40 случаев EGR, диагностированных читателем 1, и 35 случаев EGR, диагностированных читателем 2. Консенсус между читателями выявил 38 случаев EGR, соответствующих частоте EGR 24% (38/157 случаев).Только 1 случай рециркуляции отработавших газов, диагностированный в первоначальном отчете, был отменен при рассмотрении. Остальные 13 случаев рециркуляции выхлопных газов, диагностированных в первоначальных отчетах, были подтверждены.
Тест z для асимметрии начала EGR в течение 5-минутных интервалов после введения синкалида показал, что время начала через 19–24 мин после введения синкалида значительно отличалось от статистически нормального распределения по Гауссу ( P <0,0001) (Рис.4). Этот результат постинкалида заметно отличался от результатов пресинкалида.Тест z асимметрии времени начала рециркуляции выхлопных газов при визуализации до инкалида не выявил значительных отклонений от нормального гауссовского распределения.
РИСУНОК 4.Время начала EGR после инфузии холина. График гистограммы и анализ перекоса демонстрируют, что только время начала EGR через 19–24 мин после введения холина значительно отличалось от нормы ( P <0,0001).
ГБЭВ было оценено в 117 из 157 случаев, 43 из которых были аномальными (фракция выброса <35%).После инъекции 99m Tc-меброфенина активность кишечника сначала наблюдалась в среднем через 28 минут для случаев без рециркуляции и через 34 минуты для случаев с рециркуляцией выхлопных газов ( P = 0,875). Активность желчного пузыря наблюдалась в среднем через 28 и 26 минут для случаев с и без EGR, соответственно. Тест ANOVA не выявил статистически значимых различий для начала активности кишечника или желчного пузыря для случаев с и без EGR ( P = 0,875) и не выявил значимого взаимодействия между этими переменными ( P = 0.099).
Средний возраст пациентов составлял 50,4 года (от 18 до 90 лет). Женщины составили 68,2% включенных пациентов (107/157 пациентов). Тест χ 2 не продемонстрировал статистически значимых различий между полами, при этом EGR присутствует у 26% женщин и 20% мужчин (χ 2 = 0,707, P = 0,401). Непарные тесты t не показали статистически значимых различий для EGR в зависимости от возраста пациента ( P = 0,724), активности введенного радиоактивного индикатора ( P = 0.788) и GBEF ( P = 0,996). Не было существенной разницы между EGR до или после инъекции в зависимости от возраста ( P = 0,632), инъекционной активности ( P = 0,517) или GBEF ( P = 0,851) (Таблица 2).
ТАБЛИЦА 2Определение значимости наличия и отсутствия EGR в зависимости от возраста, пола пациента, МБк (мКи) введенной активности и GBEF
Было невозможно классифицировать 4 из 38 случаев EGR, поскольку синкалид не был данные во время этих экзаменов; Таким образом, в нашу схему можно отнести 34 случая (таблица 1).EGR класса A был выявлен у 6 из 34 пациентов, 5 из которых были стойкими, а 1 — преходящими. EGR класса B была идентифицирована у 21 из 34 пациентов, с устойчивой картиной в 20 случаях и переходной картиной в единственном случае. EGR класса C была идентифицирована у 7 из 34 пациентов, с постоянной картиной в 3 случаях и переходной картиной в 4 случаях.
ОБСУЖДЕНИЕ
Частое начало EGR в интервале 19–24 мин после начала инфузии синкалида было статистически значимым ( P <0.0001). Это распознавание наиболее вероятного момента возникновения EGR может повысить чувствительность радиолога к обнаружению EGR. Это открытие также подразумевает, что инфузия холина во время гепатобилиарной сцинтиграфии или во время эндоскопии может повысить чувствительность обнаружения рециркуляции выхлопных газов. Действительно, 62% случаев EGR в нашем исследовании были выявлены только на постинкалидных изображениях. Поскольку инфузия холецистокинина действует как суррогат эндогенного высвобождения холецистокинина, вызванного приемом пищи, связь EGR с холецистом в прандиальный и постпрандиальный периоды может улучшить понимание патофизиологии EGR, предполагая, что холецистокинин играет важную роль.Необходимы дальнейшие исследования клинической значимости этого открытия.
Новая схема классификации может идентифицировать случаи рециркуляции выхлопных газов, которые, скорее всего, имитируют хронический холецистит или дискинезию желчевыводящих путей. Эта идентификация важна, потому что холецистэктомия является известным фактором риска ухудшения EGR (2,6). Согласно нашей модели, пациенты с EGR класса A будут иметь клинические симптомы, не связанные с приемом пищи, и вряд ли будут иметь EGR, имитирующую боль в желчном пузыре. Пациенты с EGR класса B будут иметь клинические симптомы преимущественно во время еды или в постпрандиальном состоянии, что имитирует случаи хронического холецистита или дискинезии желчевыводящих путей.Пациенты с EGR класса C, у которых EGR ухудшается в постпрандиальном периоде, могут иметь комбинацию симптомов, не связанных с приемом пищи, которые ухудшаются в постпрандиальном состоянии, а также могут имитировать патологию желчного пузыря. Пациенты, отнесенные к подклассу с постоянным рециркуляционным выхлопом, ожидают в целом более тяжелой и более продолжительной боли, а пациенты с подклассом преходящего рециркуляционного рака могут иметь более легкие симптомы и периодическую боль. В нашем исследовании 82% пациентов с EGR имели либо класс B, либо класс C.Схема классификации предлагает основу для будущих исследований других биомаркеров визуализации и клинических или эндоскопических корреляций.
По крайней мере, две возможности объясняют начало рециркуляции выхлопных газов в интервале 19–24 мин после начала инфузии синкалида. Во-первых, появление постинкалида EGR может зависеть от времени от начала инфузии холина, тем самым происходя примерно через 20 минут после начала 15-минутной инфузии холина. Альтернативное объяснение заключается в том, что начало рециркуляции отработавших газов связано с истощением синкалида, период полураспада которого равен 2.5 мин (12). Эти 4–9 минут (2–4 периода полураспада) после инфузии холина будут подходящими временными рамками для прекращения действия синкалида. Холецистокинин и холецист стимулируют перистальтику кишечника с одновременным сокращением привратника (12,13). Гипотетический физиологический механизм EGR состоит в том, что влияние на сокращение привратника является неполным или более коротким, чем усиление перистальтики тонкой кишки, что вызывает рефлюкс в желудок. Общая доза и скорость введения холина также могут быть важными переменными.Кроме того, в отличие от 15-минутной внутривенной инфузии холецистокинина, высвобождение эндогенного холецистокинина может длиться до нескольких часов после еды (12). Более длительная продолжительность высвобождения эндогенного холецистокинина может увеличить вероятность рециркуляции выхлопных газов, если сокращение привратника недостаточно, учитывая более длительную продолжительность потока желчи через открытый сфинктер Одди.
В дополнение к уже обсужденным ограничениям, неизвестно, перенесли ли пациенты в исследовании предшествующие операции на желудочно-кишечном тракте или принимали такие лекарства, как сукралфат или ингибиторы протонной помпы, которые предлагаются для лечения EGR (6).В будущих исследованиях следует сопоставить историю болезни и результаты эндоскопии с предлагаемой системой классификации.
Мы обнаружили расхождение в 15,1% между частотой рециркуляции выхлопных газов, первоначально зарегистрированной в нашей клинической практике (8,9%), и частотой, обнаруженной при последующем замаскированном обзоре с направленным диагностическим вниманием (24%). Наша пересмотренная частота EGR приближается к показателям в рецензируемой литературе и составляет от 26% до 58% (7,14). В нашем учреждении данные о EGR занижены, и это может быть репрезентативным и для других практик.Если да, то это занижение указывает на возможность дальнейшего обучения врача.
ЗАКЛЮЧЕНИЕ
Маскированный обзор 157 последовательных сканирований гепатобилиарной системы из рутинной клинической практики в нашем учреждении показал, что время начала EGR оказалось статистически значимым через 19–24 мин после начала 15-минутной инфузии синкалида. Следовательно, обнаружение EGR может быть усилено введением синкалида и наиболее надежно идентифицировано в этом временном окне. Новая схема классификации, основанная на времени EGR по отношению к инфузии холина, может оказаться полезной для будущих исследований для прогнозирования клинических симптомов, связанных с EGR, и выявления случаев EGR, которые имитируют холецистит или дискинезию желчевыводящих путей.
РАСКРЫТИЕ ИНФОРМАЦИИ
О потенциальных конфликтах интересов не сообщалось.
- Принята к публикации 4 апреля 2014 г.
- Принята к публикации 23 июня 2014 г.
Индекс желчного рефлюкса после лечебных билиарных процедур | BMC Gastroenterology
Малагелада Дж. Р., Филипс С. П., Шортер Р. Г., Хиггинс Дж. А., Магрина С., ван Херден Дж. А., Адсон М. А.: Послеоперационный рефлюкс-гастрит: патофизиология и отдаленные результаты после переброса по Ру.Ann Int Med. 1985, 103: 173-183.
Артикул Google ученый
Куперман AM: Послеоперационный щелочной рефлюкс-гастрит. Surg Clin North Am. 1976, 56 (6): 1445-59.
CAS PubMed Google ученый
Stein HJ, Kauer WKH, Feussner H, Siewert JR: Желчные кислоты как компоненты дуоденогастрального рефлюкса: обнаружение, связь с билирубином, механизм повреждения и клиническое значение.Гепатогастроэнтерология. 1999, 46: 66-73.
CAS PubMed Google ученый
Коек Г.Х., Вос Р., Сифрим Д., Куомо Р., Янссенс Дж., Тэк Дж .: Механизмы, лежащие в основе дуодено-желудочного рефлюкса у человека. Нейрогастроэнтерол Мотил. 2005, 17: 191-199. 10.1111 / j.1365-2982.2004.00633.x.
CAS Статья PubMed Google ученый
Собала Г.М., О’Коннор Х.Дж., Дьюар Е.П., Кинг Р.Ф., Аксон А.Т., Диксон М.Ф .: Желчный рефлюкс и кишечная метаплазия в слизистой оболочке желудка.J Clin Pathol. 1993, 46: 235-240. 10.1136 / jcp.46.3.235.
CAS Статья PubMed PubMed Central Google ученый
Mackie C, Hulks G, Cuschieri A: Энтерогастральный рефлюкс и желудочный клиренс рефлюкса у здоровых субъектов и у пациентов с рвотой желчью или без нее после операции по поводу язвенной болезни. Ann Surg. 1986, 204: 537-542. 10.1097 / 00000658-198611000-00005.
CAS Статья PubMed PubMed Central Google ученый
King PM, Pryde A, Heading RC: Транспилорическое движение жидкости и антродуоденальная моторика у пациентов с гастроэзофагеальным рефлюксом. Кишечник. 1987, 28: 545-548. 10.1136 / gut.28.5.545.
CAS Статья PubMed PubMed Central Google ученый
Schindlbeck NE, Heinrich C, Stellaard F, Paumgartner G, Müller-Lissner SA: У здоровых людей желчный рефлюкс не меньше, чем у пациентов с язвой желудка. Кишечник. 1987, 28: 1577-83. 10.1136 / гут.28.12.1577.
CAS Статья PubMed PubMed Central Google ученый
Fiorucci S, Distrutti E, Di Matteo F, Brunori P, Santucci L, Mallozzi E, Bigazzi U, Morelli A: Циркадные вариации желудочной кислоты и секреции пепсина и внутрижелудочной желчной кислоты у пациентов с рефлюкс-эзофагитом и здоровый контроль. Am J Gastroenterol. 1995, 90: 270-276.
CAS PubMed Google ученый
Offerhaus GJ, Rieu PN, Jansen JB, Joosten HJ, Lamers CB: проспективное сравнительное исследование влияния послеоперационного рефлюкса желчи на гистологию слизистой оболочки желудка и инфекцию Campylobacter pylori. Кишечник. 1989, 30: 1552-1557. 10.1136 / гут.30.11.1552.
CAS Статья PubMed PubMed Central Google ученый
Ричи У .: Щелочной рефлюкс-гастрит: критическая переоценка. Кишечник. 1984, 25: 975-987. 10.1136 / гут.25.9.975.
CAS Статья PubMed PubMed Central Google ученый
Muller-Lissner SA, Schindlbeck NE, Heinrich C: Рефлюкс желчных солей после холецистэктомии. Scand J Gastroenterol Suppl. 1987, 139: 20-24. 10.3109 / 003655287070.
CAS Статья PubMed Google ученый
Brown TH, Walton G, Cheadle WG, Larson GM: Щелочной сдвиг рН желудка после холецистэктомии.Am J Surg. 1989, 157: 58-65. 10.1016 / 0002-9610 (89)
-0.CAS Статья PubMed Google ученый
Brough WA, Taylor TV, Torrance HB: Хирургические факторы, влияющие на дуоденогастральный рефлюкс. Br J Surg. 1984, 71: 770-773. 10.1002 / bjs.1800711011.
CAS Статья PubMed Google ученый
Калима Т., Шоберг Дж .: Рефлюкс желчи после холецистэктомии.Scand J Gastroenterol Suppl. 1981, 67: 153-156.
CAS PubMed Google ученый
Бирн Дж. П., Аттвуд SEA: Дуоденогастральный рефлюкс и рак. Гепатогастроэнтерология. 1999, 46: 74-85.
CAS PubMed Google ученый
Dixon MF, Neville PM, Mapstone NP, Moayyedi P, Axon AT: Желчный рефлюкс-гастрит и пищевод Барретта: дополнительные доказательства роли дуоденогастроэзофагеального рефлюкса ?.Кишечник. 2001, 49: 359-363. 10.1136 / gut.49.3.359.
CAS Статья PubMed PubMed Central Google ученый
Диксон М.Ф., Мапстон Н.П., Невилл П.М., Моайеди П., Аксон А.Т.: Желчный рефлюкс-гастрит и кишечная метаплазия в кардии. Кишечник. 2002, 51: 351-355. 10.1136 / gut.51.3.351.
CAS Статья PubMed PubMed Central Google ученый
Mason RC: Дуоденогастральный рефлюкс при раке желудка крысы. Br J Surg. 1986, 73: 801-803. 10.1002 / bjs.1800731014.
CAS Статья PubMed Google ученый
Мива К., Хаттори Т., Миядзаки И.: Дуоденогастральный рефлюкс и канцерогенез передней кишки. Рак. 1995, 75: 1426-1432. 10.1002 / 1097-0142 (19950315) 75: 6+ <1426 :: AID-CNCR2820751506> 3.0.CO; 2- #.
CAS Статья PubMed Google ученый
Мива К., Сегава М., Такано Ю., Мацумото Х., Сахара Х, Яги М., Миядзаки И., Хаттори Т.: Введение карциномы пищевода и предсердия у крыс путем рефлюкса двенадцатиперстной кишки. Br J Рак. 1994, 70: 185-189.
CAS Статья PubMed PubMed Central Google ученый
Чемпион G, Рихтер Дж. Э., Ваези М. Ф., Сингх С., Александр Р. Дуоденогастроэзофагеальный рефлюкс: связь с pH и важность в пищеводе Барретта.Гастроэнтерол. 1994, 108 (3): 747-754.
Артикул Google ученый
Ваези М.Ф., Рихтер Дж. Э .: Синергизм кислотного и дуоденогастроэзофагеального рефлюкса в осложненном пищеводе Барретта. Операция. 1995, 117: 699-704. 10.1016 / S0039-6060 (95) 80015-8.
CAS Статья PubMed Google ученый
Fountos A, Chrysos E, Tsiaoussis J, Karkavitsas N, Zoras OJ, Katsamouris A, Xynos E: Дуоденогастральный рефлюкс после билиарной хирургии: сцинтиграфическая количественная оценка и улучшение с помощью эритромицина.ANZ J Surg. 2003, 73: 400-3. 10.1046 / j.1445-2197.2003.t01-1-02654.x.
Артикул PubMed Google ученый
Tritapepe R, Piro D, Damilano I: Долгосрочные эффекты в билио-пищеварительных шунтах. Итал Дж. Гастроэнтерол. 1993, 25: 425-428.
CAS PubMed Google ученый
Ди Вита Г., Сирагуса Г., Асаро М., Коста Р., Салерно В., Ди Пейс Г.: Br-IDA в оценке папилло-сфинктеротомии и холедоходуоденостомии.Минерва Чир. 1991, 46: 175-178.
CAS PubMed Google ученый
Stein HJ, Smyrk TC, Demeester TR, Rouse J, Hinder RA: Клиническая ценность эндоскопии и гистологии в диагностике дуоденогастральной рефлюксной болезни. Операция. 1992, 112: 796-804.
CAS PubMed Google ученый
Тибблинг Гран, Л. Блэкэддер, Э. Куллман: Мониторинг желчи желудка: исследование надежности Bilitec in vivo и in vitro.Сканд Дж Гастроэнтерол. 2002, 37: 1334-1337. 10.1080 / 003655202761020632.
CAS Статья PubMed Google ученый
Бечи П., Чианки Ф .: Технические аспекты и клинические показания 24-часового мониторинга внутрижелудочной желчи. Гепатогастоэнтерология. 1999, 46: 54-59.
CAS Google ученый
Fuchs K-H, Fein M, Maroske J, Heimbucher J, Freys SM: Роль 24-часового мониторинга pH желудка в интерпретации 24-часового мониторинга желчи желудка при дуоденогастральном рефлюксе.Гепатогастроэнтерология. 1999, 46: 60-65.
CAS PubMed Google ученый
Bollschweiler E, Wolfgarten E, Putz B, Gutschow C, Holscher AH: Рефлюкс желчи в желудок и пищевод для добровольцев старше 40 лет. Пищеварение. 2005, 71: 65-71. 10.1159 / 000084521.
Артикул PubMed Google ученый

