Антибиотики без побочек. Как правильно принимать эти лекарства?
Продукты, которые есть нельзя!Чтобы антибиотики не принесли вреда здоровью, на время лечения придётся отказаться от некоторых продуктов, в первую очередь от алкоголя. Ведь алкоголь, по сути, – это яд для наших клеток. Да, в небольшом количестве он образуется и у нас в организме, в кишечнике при расщеплении бактериями растительной пищи. И с малыми дозами этого вещества здоровый человек справиться может. Но на фоне заболевания, когда на организм воздействуют не только вирусы и бактерии, но и антибиотики, приём алкоголя – удар по системе детоксикации. Такого она попросту может не выдержать, и тогда проблем с печенью не избежать.
Ещё один напиток, с которым придётся на время попрощаться, – молоко. Кальций, содержащийся в молочных продуктах, вступает в реакцию с компонентами антибактериальных препаратов, тем самым дезактивируя их. В результате лекарства попросту не будут работать. К тому же молоко снижает количество полезных бактерий, а на фоне дисбиоза (нарушения баланса между полезной и условно-патогенной микрофлорой) ухудшается способность переваривать лактозу – молочный сахар. Поэтому в сочетании с молоком антибиотики могут привести к брожению в кишечнике и вздутию живота.
Поэтому в сочетании с молоком антибиотики могут привести к брожению в кишечнике и вздутию живота.
Также на фоне приёма лекарств стоит максимально уменьшить количество углеводистой пищи, особенно простых углеводов. Как мы уже говорили, они могут спровоцировать рост условно-патогенной микрофлоры.
Откажитесь от острого, жареного, перчёного – такая пища раздражает слизистую желудка, которая из-за антибиотиков и так не в лучшем состоянии. Жиров тоже должно быть по минимуму – жирная пища перегружает печень.
Питание на фоне приёма антибиотиков должно включать продукты, которые защищают слизистую желудочно-кишечного тракта, а также поддерживают дружественную нам микрофлору. Это прежде всего овощи, в которых много клетчатки (именно пищевые волокна служат пищей для полезной микрофлоры). Это могут быть сельдерей, кабачки, баклажаны, зелень. Можно включить в меню немного фруктов – слишком большое их количество не рекомендуется из-за довольно высокого содержания сахара. Но и овощи, и фрукты нужно термически обрабатывать (отваривать, тушить, запекать) – ферментированная клетчатка быстрее и легче усвоится бактериями.
Не забывайте и про крепкие мясные бульоны – они помогают защитить и восстановить слизистую кишечника. Неслучайно они так часто используются в лечебном питании.
Эффективное восстановление микрофлоры кишечника препаратом Стимбифид Плюс
При развитии инфекционно-воспалительного процесса, к препаратам первой линии относят антибиотики, которые оказывают не только терапевтический эффект, но и способствуют развитию дисбактериоза кишечника. Когда микрофлора после антибиотиков нарушена, на первый план выходят такие симптомы, как диарея, избыточное газообразование в просвете кишечника (метеоризм), тошнота, расстройства стула в виде запоров или диареи, кожная сыпь, нарушение процесса всасывания веществ, поступающих с пищей. Дисбактериоз, спровоцированный приемом антибиотиков, требует своевременного и правильного лечения. Как восстановить микрофлору кишечника после антибиотиков, будет подробно рассмотрено ниже.
Причины дисбактериоза при приеме антибиотиков
Чувствительность микрофлоры к антибиотикам не избирательна. Даже современные препараты, обладающие антибактериальной активностью, не способны воздействовать только на отдельные патогенные микроорганизмы. Лекарственные медикаменты, которые используются для лечения инфекционных заболеваний, уничтожают не только болезнетворные микроорганизмы, но и положительную микрофлору кишечника. Результатом такого процесса становится дисбактериоз. Для того чтобы избежать негативных последствий антибиотикотерапии, необходимо воспользоваться дополнительными методами поддержания баланса нормальной микробиоты кишечника.
Симптомы дисбактериоза
Распознать дисбаланс кишечной микрофлоры, связанный с приемом антибактериальных средств, можно по таким характерным клиническим признакам:
- Расстройства стула, которые выражаются в виде запоров, чередующихся с диареей.
- Избыточное газообразование в кишечнике (метеоризм).

- Болевые ощущения, которые локализуются в околопупочной области.
- Боль в животе, усиливающаяся после приема пищи.
- Слабость и общее недомогание.
- Снижение аппетита.
- Ухудшение состояния кожных покровов, появление сыпи.
- Увеличение показателей температуры тела в пределах 37,1-37,4 градусов.
Наиболее распространенным последствием приёма антибиотиков, является дисбактериоз кишечника, который приводит не только к ухудшению общего состояния, но и к развитию тяжелых осложнений.
Диагностика
Определить наличие дисбактериоза, спровоцированного приемом антибактериальных лекарственных средств, можно по характерным клиническим признакам. К специфическим методам диагностики этого патологического состояния, относят бактериальный посев кала и лабораторный анализ на дисбактериоз. Для того чтобы определить дисбактериоз тонкого кишечника, выполняется исследование аспирата или соскоба из тощей кишки.
Лечение
Людям, столкнувшимся с кишечным дисбиозом на фоне антибиотикотерапии, показан диетический стол № 4 по Певзнеру, который помогает нормализовать моторно-эвакуаторную функцию толстого кишечника и снизить интенсивность бродильных, а также гнилостных процессов в просвете ЖКТ. В ежедневный рацион включают продукты, богаты растительными волокнами, а также кисломолочную продукцию, которая содержит бифидум и лактобактерии.
Коррекция состава микрофлоры проводится с использованием антибактериальных средств, которые не всасываются в системный кровоток (Рифаксимин). Также, широко применяются кишечные антисептики (Нифуроксазид). Для восстановления баланса кишечной микробиоты, используются такие группы препаратов:
- Пробиотики (препараты, содержащие культуры полезных кишечных микроорганизмов).
- Пребиотики (вещества, стимулирующие рост и размножение нормальной кишечной микрофлоры).

- Синбиотики (комплексные препараты, содержащие как полезные микроорганизмы, так и питательный субстрат для них).
Новейшим и наиболее эффективным способом восстановления микрофлоры после приема антибиотиков, является приём метапребиотиков, которые содержат питательную среду для кишечной микрофлоры (фруктополисахариды и фруктоолигосахариды), а также лактат кальция, стимулирующий процесс размножения и рост полезных бактерий в кишечнике. Для подтверждения эффективности метапребиотиков в борьбе с дисбактериозом, был проведён сравнительный эксперимент, в ходе которого был использован метапребиотик Стимбифид Плюс и другие препараты, используемые для восстановления микрофлоры после антибиотиков. Максимальная результативность была доказана в отношении метапребиотика Стимбифид Плюс, который за короткий промежуток времени помогал восстановить необходимое количество собственных бифидобактерий, обитающих в просвете ЖКТ.
- Для восстановления кишечника после антибиотиков может быть использован одновременно с антибак..териальными средствами с первого дня их приема.
- Помогает эффективно восстановить собственную микрофлору кишечника человека.
- Не вызывает побочные реакции.
- Одинаково эффективен и безопасен для людей любого возраста.
- Благоприятно влияет на состояние желудочно-кишечного тракта на всей его протяженности.
- Снижает интенсивность воспалительного процесса, который может развиваться при дисбактериозе.
- Помогает ускорить процесс естественного восстановления эпителия слизистой оболочки желудочно-кишечного тракта.
Если говорить о том, что пить с антибиотиками для восстановления микрофлоры, то метапребиотик Стимбифид Плюс является лучшим выбором
Прогноз и профилактика
При своевременно начатом лечении, прогноз относительно выздоровления при кишечном дисбактериозе на фоне антибиотикотерапии, является благоприятным. Снизить вероятность развития данного состояния помогает соблюдение точной дозировки и кратности приема антибактериальных средств, которые были назначены лечащим врачом. Для восстановления кишечника после антибиотиков, рекомендовано принимать антибактериальное средство в комбинации с Стимбифид Плюс, который эффективен не только с лечебной, но и с профилактической целью. Комбинированное использование двух препаратов не повлияет на эффективность каждого из них.
Снизить вероятность развития данного состояния помогает соблюдение точной дозировки и кратности приема антибактериальных средств, которые были назначены лечащим врачом. Для восстановления кишечника после антибиотиков, рекомендовано принимать антибактериальное средство в комбинации с Стимбифид Плюс, который эффективен не только с лечебной, но и с профилактической целью. Комбинированное использование двух препаратов не повлияет на эффективность каждого из них.
/ Доктор Стимбифид
Поделиться в соцсетях:
аптечные средства и рецепты народной медицины от дисбактериоза, рекомендации по улучшению иммунитета
Антибиотики при длительном приеме разрушают микрофлору кишечника. Даже при однократном приеме нарушается правильный баланс. За один полный курс погибает около 50% микроорганизмов.
Восстановить микрофлору кишечника после антибиотиков очень сложно, поэтому принимать бифидобактерии нужно с начала антибактериальной терапии и не менее 1-2 недели по ее окончании.
Сведения о микрофлоре
Микрофлорой называют ряд бактерий, участвующих в обеспечении жизнедеятельности организма. Большая часть полезной флоры заселяет кишечник, оставшаяся треть распределяется на кожные покровы и органы мочеполовой системы.
- обеспечение защиты от вирусных и бактериальных инфекций;
- очистка от токсических выделений;
- контроль водно-электролитного процесса, газообразования;
- продукция гормонов, витаминов;
- регулировка усвоения полезных веществ.
Влияние антибактериальных средств на баланс микрофлоры
Кишечник насыщен бифидо и лактобактериями. Они нужны организму, отвечают за правильную работу органа. К условно-патогенной среде относят энтерококки, кишечную палочку, дрожжеподобные грибы. При нормальном балансе они не представляют угрозы для человека.
Антибактериальные препараты нарушают эту гармонию и приводят к уничтожению как вредных, так и полезных бактерий.
Наиболее опасны средства из макролидного, хинолинового, клиндамицинового, цефалоспоринового, амино пенициллинового ряда. Менее выраженное действие имеет Эритромицин.
При приеме антибиотиков разрушается флора кишечника. При отсутствии лечения это приводит к снижению иммунитета, нарушению в работе ЖКТ, ухудшению выработки витаминов, гормонов, не полному всасыванию полезных веществ.
Симптомы повреждения микрофлоры
- Появлении диареи.
- Вздутии.
- Повышенной утомляемости.
- Головных болях.
- Апатии.
- Депрессии.
- Неприятных ощущениях. Боль в животе обычно локализуется в нижней его части.
- Ломкости волос, ногтей, из-за плохой усвояемости витаминов.
Нормализация баланса микрофлоры у детей
Основными симптомами дисбактериоза у детей является боль и тяжесть в животе после приема лекарства. Это связано с тем, что из-за недостатка ферментов пища плохо переваривается и не полностью усваивается.
Это связано с тем, что из-за недостатка ферментов пища плохо переваривается и не полностью усваивается.
Остатки начинают гнить и провоцируют метеоризм, вздутие. Далее появляется диарея, обезвоживание. Может наблюдаться неприятный запах изо рта, гнилостный “аромат” испражнений, остатки непереваренной пищи в кале, слабость, сонливость.
- стоматит;
- молочница у девочек;
- аллергия на непереваренный белок;
- ослабление иммунитета;
- авитаминоз.
У малышей до года кишечник стерилен. Заселение бифидобактерий и иной флоры начинается при родах и продолжается при кормлении грудью. Тем не менее у грудничков риск дисбактериоза значительно выше, так как полное формирование оканчивается около года.
Проявляется болезнь обычно сильным плачем, срыгиванием, диареей, потерей веса, нарушением аппетита. При лечении детей следует неукоснительно соблюдать рекомендации врача. Но обычно достаточно материнского молока и введения кисломолочных продуктов после достижения 6 месяцев.
Классификация препаратов
Средства, восстанавливающие микрофлору, бывают в виде таблеток, капсул, готовых суспензий, порошков для разведения, капель.
- Пребиотики. Эти лекарства являются лишь основой “роста” новой флоры. Они не подлежат перевариванию. К этой группе относят галактозу, олигосахариды, лактулозу, инулин, изомеры фруктозы. Пребиотики встречаются в кукурузе, луке, цикории, чесноке, пшенице. Из медицинских средств выделяют Дюфалак, Лактусан, Нормазе.
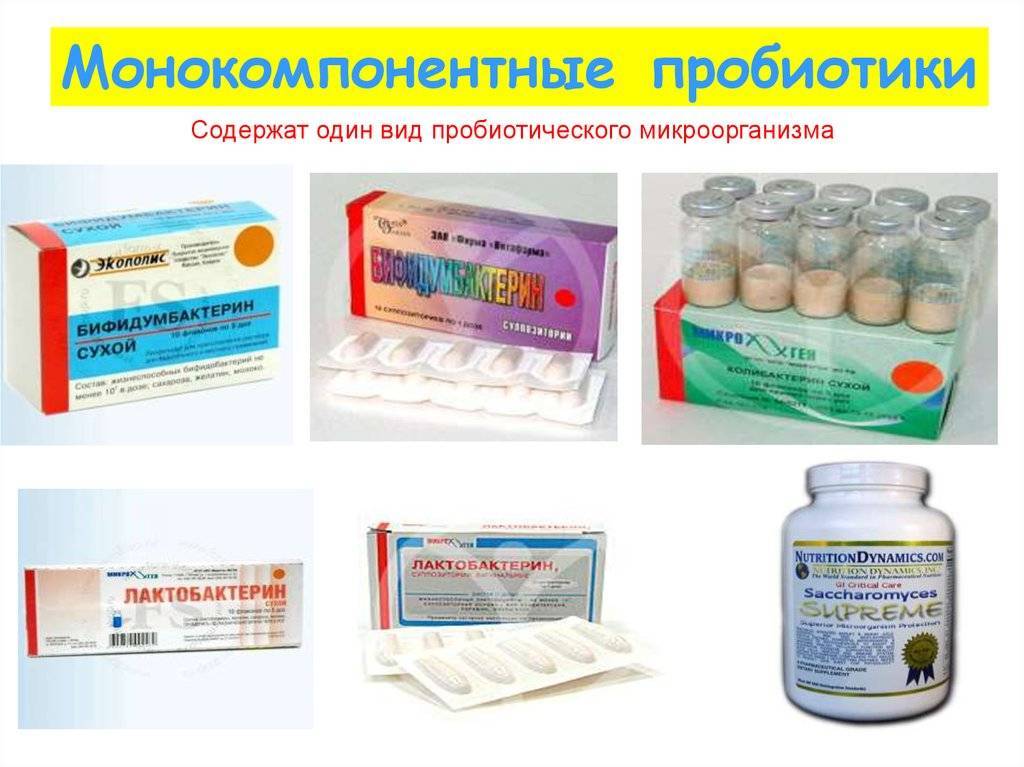
- Пробиотики. Это комплексные средства с содержанием живых полезных бактерий. Они помогают побороть патогенную флору и нормализовать баланс. Известны такие лекарственные пробиотики, как Бифидумбактерин, Лактобактерин.
- Симбиотики. Имеют ряд бактерий, в составе пробиотические и пребиотические свойства. Сюда относят Бификол, Бифиформ. Некоторые медикаменты имеют комбинированный состав вместе с пребиотиками, например, Бифидо-бак, Ламинолакт.

- Иммуномодуляторы. Возобновляют защитные функции организма. Это настойка лимонника, эхинацеи, элеутерококка, экстракт прополиса.
Медикаменты для флоры, применяемые после антибиотиков
Лекарства, поддерживающие микрофлору, делятся на типы, основываясь на назначение и свойства. Из пробиотиков большая часть содержащихся бактерий не достигает места назначения, поэтому их лучше вводить с применением зонда или клизмы.
- Линекс. При нарушении микрофлоры обеспечивает организм бифидо и лактобактериями. Препарат поликомпонентный, поддерживает деятельность существующей полезной среды, сохраняя ее и заселяя новыми микроорганизмами. Выпускается в капсулах. У взрослых прием препарата производится в целом виде, детям разрешено раскрывать капсулу и растворять порошок в соке или воде. Запрещен медикамент при непереносимости лактозы.
- Бифидумбактерин. Бывает в порошке и капсулах. Недорогой и эффективный препарат комбинированного типа, назначают, когда окончен прием антибиотиков.

- РиоФлора. Укрепляет иммунитет, повышает уровень иммуноглобулинов А, поддерживает флору, предотвращает дисбактериоз.
Пребиотики помогают побороть патогенный микроорганизм еще в процессе приема антибактериальных средств.
- Хилак Форте. Угнетает патогенную среду, нормализует работоспособность кишечника. Форма выпуска – капли. Лекарство помогает справиться с запором, диареей, вздутием, метеоризмом, уменьшает тошноту. Детям препарат разводят в воде или соке.
- Дюфалак и Нормазе. Действующее вещество – лактулоза. Расщепление этого компонента происходит лишь в нижних частях пищеварительного тракта. Процесс приводит к понижению кислотности и размножению полезных бактерий.
- Бифиформ. В состав входят бифидобактерии, энтерококки. Бывает лекарство в виде капсул или порошкообразной формы.
- Биовестин. Комбинированный препарат. Жидкая эмульсия помогает наладить пищеварение, переваривание и всасывание полезных веществ, улучшает иммунитет, участвует в синтезе веществ.

- Бифидобак. БАД с рядом микроорганизмов. Помогает вырабатывать витамины, участвует в обменных процессах, стимулирует иммунитет. Производится в капсулах.
- Мультидофилус. Стимулирует работу кишечника. Содержит лактобациллы и бифидобактерии.
- Аципол. Капсулы устойчивы к кислотности желудка. Внутри содержатся ацидофильные лактобациллы и штаммы кефирного грибка. Средство избавляет от пищевой аллергии, инфекций, устраняет расстройство. Если принимать на фоне антибиотиков, то можно предотвратить молочницу.
Эффективны и препараты на основе спорообразующих бактерий. Это объясняется тем, что кислота желудка на них никак не влияет.
Среди таких препаратов:
- Споробактерин;
- Биоспорин.
Препараты для профилактики сохранения микрофлоры до приема антибиотиков
Чтобы защитить микрофлору и не позволить ее разрушить при употреблении антибактериальных средств, рекомендуется начать пить вспомогательные препараты сразу или заранее.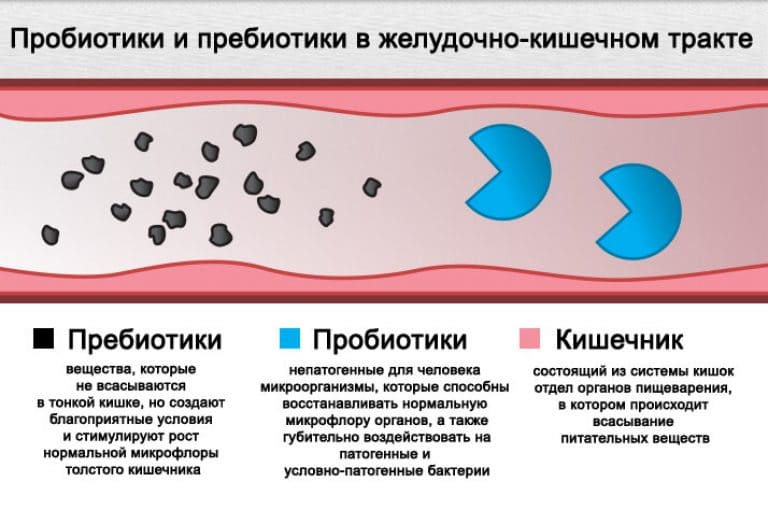 Курс лечения включает пребиотики, витамины, энтеросорбенты.
Курс лечения включает пребиотики, витамины, энтеросорбенты.
Энтеросорбенты борются с интоксикацией. Наиболее популярны: Смекта, Энтеросгель, Полисорб.
Витаминные комплексы помогают предотвратить снижение иммунитета, ухудшение усвояемости полезных веществ, авитаминоз.
Пробиотики следует принимать после антибиотиков, они не эффективны для профилактических мер. Диета для микрофлоры
Чтобы нормализовать микрофлору, помимо приема препаратов, необходимо еще правильно питаться. Нельзя переедать, кушать следует часто, но маленькими порциями. Разгрузочные дни можно проводить на яблочной или кефирной диете.
Соблюдение питьевого режима — не менее важный этап, в сутки следует потреблять около 2 литров жидкости. Объем соли необходимо сократить. Продукты нужно отваривать или готовить на пару.
Стоит отказаться от:
- консерв;
- жирного мяса, бульонов, рыбы;
- мороженого;
- пряностей, копченостей;
- сдобы;
- кондитерских изделий;
- майонеза;
- кетчупа;
- алкоголя;
- кофе;
- перловки, ячки, пшенички;
- белого хлеба;
- бобовых;
- грибов;
- редиса.
Питание можно разнообразить фруктами и овощами богатыми клетчаткой, нежирным мясом, кефиром, ряженкой, йогуртом, гречкой, геркулесом, черносливом, медом.
Растительные препараты
После приема антибиотиков восстановить флору помогают некоторые травы, в частности их настои:
- Календула и зверобой. Для приготовления настойки смешивают зверобой и календулу в равных частях. 1 столовую ложку заливают кипятком и настаивают 15-20 минут. Готовый отвар процеживают и пьют по 50-80 мл незадолго до еды, за 30 минут. Этот напиток имеет бактерицидное действие, подавляет болезнетворные бактерии, стимулирует процесс пищеварения, устраняет интоксикацию.
- Шалфей и подорожник. Чтобы приготовить средство, смешивают подорожник и шалфей в равных пропорциях. Траву заливают кипятком (достаточно будет 1 литра) и варят около 5 минут. Процеживают и остужают, принимают по 50-60 мл трижды в сутки за полчаса до еды. Лекарственное средство имеет вяжущее, регенерирующее, бактерицидное действие.
Народные рецепты
Чтобы ускорить восстановление флоры на фоне приема соответствующих препаратов, можно прибегнуть к домашним методам борьбы с дисбактериозом.
Наиболее популярны:
- Смесь кураги, меда, чернослива. Все ингредиенты соединяют в равных частях и хранят в холодильнике. Принимают по 1 столовой ложке средства.
- Чеснок с простоквашей. На 1 стакан напитка понадобится 2 зубчика чеснока, которые следует тщательно измельчить. Принимают средство перед отходом ко сну.
- Чесночная настойка. 5 головок чеснока измельчают и соединяют смесь с литром оливкового или льняного масла. Настаивают в темном месте трое суток. Настойку пьют по 1 чайной ложке ежедневно натощак.
Чтобы избавиться от вздутия, народные средства предлагают укропную воду. Для этого 2 столовые ложки семян растения заливают 250 мл горячей воды и настаивают в термосе 2 часа. Пьют понемногу каждые 10-15 минут.
Длительность полного восстановления
Продолжительность терапии варьирует от 2 недель до нескольких месяцев. В основном это зависит от вида антибактериального средства, состояния органов ЖКТ пациента, типа болезни и ее тяжести, методов терапии. Намного быстрее выздоровление наступает, если пробиотики вводят сразу на фоне употребления антибиотиков, а не по окончании основной терапии.
Для стабилизации флоры после приема антибиотиков разработана масса средств в форме таблеток, капсул, капель, сиропов.
Симбиотики и пребиотики можно начинать пить раньше или совместно с антибактериальной терапией, что позволяет предотвратить негативные последствия. Пробиотики в этот период неэффективны. Их назначают после основного курса лечения.
Правильно подобрать средство может только врач, опираясь на характер патологии, степень тяжести заболевания, возраст пациента, индивидуальные особенности организма.
Источник: https://vseozhivote.ru/kishechnik/kak-vosstanovit-mikrofloru-kishechnika-posle-antibiotikov.html
Как быстро восстановить микрофлору кишечника народными средствами и продуктами
В кишечнике человека находится множество бактерий: из них 80 % составляют бифидобактерии, остальная часть распределяется между микроорганизмами. В совокупности все они образуют микрофлору кишечника. Бифидобактерии, составляющие самую многочисленную группу кишечной флоры, очень необходимы для эффективной работы кишечного тракта.
Микрофлора кишечника нуждается в восстановлении, если в нем значительно уменьшается количественный состав бифидобактерий, народные средства зачастую очень эффективно справляются с этой задачей.
Роль микрофлоры для здоровья
Нормальная микрофлора кишечника является защитным барьером организма.
Если в кишечнике полный порядок с микроорганизмами, весь организм человека чувствует себя нормально, так как происходит хорошее переваривание пищи, питательные вещества полноценно усваиваются организмом.
Здоровая микрофлора является естественным барьером для патогенных бактерий, вырабатывает слизистые вещества, необходимые для оболочки кишечника, синтезирует витамины группы В и витамин К, тем самым обеспечивает нормальный уровень иммунитета.
Причины дисбактериоза
Если баланс бактерий в кишечном тракте нарушается, значительно уменьшается количество полезных бактерий и нарастает число болезнетворных микроорганизмов, развивается дисбактериоз. Он проявляется дискомфортом в животе. Но он не возникает сам по себе. Нормальная микрофлора нарушается при:
- приеме антибиотиков
- стрессовых ситуациях
- неправильном питании
- хронических заболеваниях
Признаки дисбактериоза, схожи с синдромом раздраженного кишечника:
- вздутие живота
- запор
- вялость
- диарея
Советы по восстановлению микрофлоры кишечника
Важно вовремя обратить внимание на проблему. Одной из причин нарушения флоры кишечника является прием антибиотиков. Поэтому обязательно после их приема следует пропить пробиотики, помогающие восстановить нормальную бактериальную среду кишечника.
Действие антибиотиков заключается в уничтожении и подавлении роста бактерий, вызывающих заболевание. Но вместе с болезнетворными бактериями антибиотики уничтожают и полезные. Количество полезных лакто−, бифидобактерий после курса антибиотиков значительно уменьшается, что позволяет патогенным микроорганизмам занять их место.
Прием препаратов, восстанавливающих микрофлору кишечника, очень важен во время лечения антибиотиками, если возникли предпосылки, и после него.
В аптеках представлен целый ряд этих замечательных препаратов: БифидумБАГ, Экофлор, Биофлор и др.
Если во время лечения антибиотиком возникло нарушение стула, появились признаки нарушения работы кишечника, начинают прием пробиотиков и пребиотиков. Но важно помнить, что эти препараты не принимаются одновременно с антибиотиком. Должно пройти не менее 2 часов после приема препарата, иначе антибиотик разрушит полезное действие пробиотического препарата.
Пробиотики содержат штаммы лакто−, бифидобактерий, необходимых для нормальной работы кишечника, пребиотики − попадая в ЖКТ, создают условия для быстрого роста полезной микрофлоры.
Также очень важно после курса приема антибиотиков включать в рацион питания кисломолочные продукты, содержащие бифидобактерии и лактобактерии. Это могут быть биойогурты, бифидокефир.
Народные средства, восстанавливающие микрофлору кишечника
Применение рецептов народной медицины помогает восстановить нормальный баланс микроорганизмов в кишечнике.
Лечение травами
Лекарственные травы помогают восстановить микрофлору кишечника. Прием настоя из равных частей зверобоя, ромашки, мелисы, семян льна благотворно сказывается на состоянии кишечника.
1 ст.л. сбора залить 0,5л кипятка, настоять 30мин., процедить. Принимать по ½ стакана 2 р. в день перед едой.
- Народное средство от вздутия живота и метеоризма
5 частей эвкалипта, 3 части мяты перечной, 1 часть семян укропа. 1 ст. л. смеси залить 1л кипятка, плотно закрыть, настоять 1 час, процедить. Принимать по 0,5 стакана перед едой в течение 2 недель.
- Настой девясила для улучшения микрофлоры
1ст.л. измельченного корня растения залить 200г чистой холодной воды, оставить на 8 часов (можно на ночь). Утром процедить. Пить по 50г перед едой 2 недели.
Отличным восстанавливающим действием обладает сбор из плодов шиповника, травы зверобоя, листьев крапивы двудомной, мяты перечной, подорожника, травы спорыша, листьев стевии, цветков липы. Смешать в равных количествах перечисленные ингредиенты (плоды шиповника измельчить). 1 ч.л. смеси залить 250г кипятка, закрыть крышкой, настоять 20 мин. Принимать по 0,5 стакана 2 р. в день.
- Отвар из корня кровохлёбки
300г измельченного корня залить 300мл кипятка, на слабом огне проварить 10 мин. Настоять 5 мин., процедить. Пить средство по 2 ст.ложки 4 р. в день в течение месяца.
Продукты для нормализации микрофлоры кишечника
Наряду с народными средствами нормализовать микрофлору кишечника помогут некоторые продукты питания. Продукты питания, пагубно влияющие на болезнетворные бактерии: чеснок, лук, черемша. Ежедневное употребление этих продуктов поможет быстрее привести в норму работу кишечника.
Для усиления их действия используют такие рецепты:
5 средних головок чеснока измельчить, залить 1л льняного или оливкового масла, настаивать 3 дня. Принимать масло по 1ч.л. утром натощак.
- Чеснок или черемша с простоквашей
2 зубчика чеснока или свежую черемшу смешать с 200г простокваши. Пить напиток вечером, незадолго перед сном.
Если нужно быстро восстановить микрофлору кишечника у маленьких детей, то поможет этот очень вкусный и простой рецепт: измельчите чернослив и курагу в блендере и смешайте полученную массу с качественным медом по вкусу. Для маленьких детей доза составляет по 1 чайной ложке утром и вечером, для подростков или взрослых по 1 ст ложке 2 раза в день.
Очень эффективный рецепт восстановления полезной микрофлоры кишечника у взрослых – это безградусная брага. Готовится это народное средство очень просто: в полулитре теплой воды размешайте по 1 столовой ложке сахарного песка и меда, а затем добавьте 2 грамма обычных дрожжей и тоже тщательно перемешайте.
Оставьте посуду в теплом месте побродить 2 часа (больше не нужно, иначе получится хмельная бражка). Всю дозу нужно будет выпить залпом за 1 раз между приемами пищи, т. е. примерно в 10-11 часов и 16-17 часов.
Эффективность этого рецепта высока тем, что вы сразу поселяете в своем кишечнике бродильные микроорганизмы, которые быстро восстанавливают полезную микрофлору.
Оздоровить и восстановить нормальную микрофлору кишечника помогут каши. Особенно хороши жидкие гречневая и геркулесовая каши. Употреблять их надо утром натощак. В каши можно добавлять яблоки, чернослив, курагу. Каши помогают выводу из организма шлаков, токсинов.
Включите в ежедневный рацион питания кисломолочные продукты: кефир, ряженку, кумыс. Утром и вечером выпивайте по стакану полезного напитка и со временем вы забудете о неприятной проблеме.
Профилактика
Причиной нарушения микрофлоры часто являются хронические заболевания. Своевременное выявление и лечение их помогут избежать проблем с кишечным трактом.
Откажитесь от вредных продуктов, диет для похудения. Организм должен ежедневно получать сбалансированное питание. Отказ от некоторых продуктов питания приводит к заболеваниям желудка и кишечника, чреватым нарушением их флоры.
Отличным способом профилактики дисбактериоза и восстановления микрофлоры в кишечнике является включение в рацион питания кисломолочных продуктов, овощей, фруктов, содержащих большое содержание клетчатки.
Важно! Газированные напитки, особенно сладкие, раздражают слизистую пищеварительного тракта, помогая вредным бактериям активно размножаться!
Обращайте внимание на состав продуктов, которые покупаете в магазине. Входящие в их состав усилители вкуса, консерванты, ароматизаторы не приносят пользы микрофлоре кишечника. Старайтесь выбирать продукты, содержащие минимум вредных веществ или вовсе откажитесь от таких.
Соблюдайте режим питания. Ешьте небольшими порциями. Пища не должна быть слишком горячей.
Источник: https://dar-zdorovya.ru/vosstanovlenie-mikrofloryi-kishechnika.html
Как восстановиться после курса антибиотиков
В любое время года можно заболеть. В особенности на стыке осень – зима, и зима – весна. Причиной тому является повышенная сырость и теплая погода. Не жара и не мороз. Чтобы правильно лечиться, важно понимать природу заболевания, правильно поставить диагноз. Если у болезни бактериальная основа, тяжелая форма и хоть немного запущенная стадия, для выздоровления назначаются антибиотики.
Почему антибиотики
Наш организм изначально оснащен системой защиты и способен отражать атаки врагов. Это иммунитет. Но если бактерий, попавших в тело, большое количество, а иммунная система недостаточно сильна, нам требуется помощь извне. Вот тут и нужны антибактериальные препараты. Они запрограммированы убивать те микроорганизмы, которые взломали иммунную защиту.
Вредоносных бактерий огромное число. Не все одинаково уязвимы. Поэтому антибиотики делятся на различные группы, в зависимости от того, какие бактерии они могут обезвредить. Как бы прискорбно это ни звучало, но вместе с вражескими, погибают и наши друзья-микроорганизмы. Те, что заселяют кишечник, кровь, слизистые оболочки. В общем, помощники нашего организма.
В тех случаях, когда диагноз был поставлен верно, назначено подходящее лечение и препараты, и не упущено драгоценное время – организм быстро выходит из критического положения.
Это хорошо также и тем, что восстановление иммунной системы происходит практически безболезненно и микрофлора без посторонней помощи вновь достигает необходимого уровня.
Но что бывает, когда антибактериальная терапия продолжается дольше недели? Когда болезнь беспощадно истощает тело, а антибиотики разрушают практически всю нашу защитную крепость? Человек начинает испытывать другой недуг – дисбактериоз. В таком случае приходится отстраивать все заново, используя для восстановления все, что только возможно.
Как распознать дисбактериоз?
Дисбактериоз – это нарушение соотношения полезной кишечной палочки, бифидо- и лакто-бактерий в организме.
Основные симптомы:
- нарушения стула, с преобладанием диареи;
- болевые ощущения в животе умеренной интенсивности;
- вздутие живота;
- встречается небольшое повышение температуры;
- слабость, быстро наступающая усталость, головные боли;
- депрессивные состояния, беспричинная смена настроения;
- сухость кожи и слизистых, хрупкость ногтей и волос.
Не делайте выводов самостоятельно, не рискуйте, чтобы не ухудшить ситуацию. Если вы обнаружили у себя однин или тем более несколько симптомов, немедленно обратитесь к врачу. Возможно, подтвердится дисбактериоз и придется от него избавляться.
В помощь микрофлоре
Врач с опытом и искренним желанием помочь вам восстановить организм после серьезного заболевания непременно расскажет о возможном вреде от антибиотиков. Прежде всего, доктора рекомендуют некоторые препараты фармацевтики.
Таблетки, порошки, капсулы и суспензии для возобновления полезной микрофлоры и выведения остатков лекарств из организма.
Но на сегодняшний день множество врачей обращают наше внимание на немедикаментозные способы лечения, на рецепты наших прародителей, на целебные силы самой природы.
И все же в первую очередь стоит качественно изменить свой рацион. Придется ограничить или вовсе исключить такие продукты, как алкоголь, соления и овощные салаты, пирожные и конфеты, жареное, острое и жирное. Во время еды не пить воду.
И вообще, чай, кофе и другое питье нужно употреблять с промежутком как минимум в час после приема пищи. Предпочтение следует отдать белковой, мясной еде, но исключительно в тушеном или отварном виде.
Хлеб лучше есть подсушенный и в виде сухариков.
Рецепты для борьбы с дисбактериозом
Чтобы помочь своему организму попробуйте применить некоторые рекомендации.
- На водяной бане 15 минут варить столовую ложку дубовой коры, залитую стаканом кипящей воды. Отставить на 45 минут, процедить и можно принимать по ½ стакана несколько раз в сутки.
- Столовую ложку лапчатки залить стаканом кипятка, 15 минут поварить на медленном огне. После накрыть кастрюлю толстым полотенцем и оставить до утра. Пить по пол стакана 3 раза в день.
- В 500 мл теплой воды растворить по ложке меда и сахара, добавить 2 г дрожжей. Не более чем через полтора часа, чтобы не забродило, весь объем нужно выпить. Через три часа можно поесть. Два-три дня принимать лекарство дважды в сутки.
- Утром натощак выпить стакан домашней теплой сыворотки. Несколько дней и микрофлора восстановится.
- Литр молока вскипятить и разделить на 4 порции. Подойдут маленькие баночки или стаканы. Когда молоко будет уже комнатной температуры, положить в каждую посуду для закваски ломтики черного черствого хлеба. Спустя сутки в получившуюся простоквашу нужно добавить еще сухариков, натертых чесноком. Убрать в холодильник. Лекарство принимать по необходимости несколько дней. Можно периодически готовить такую простоквашу с чесноком просто для удовольствия и профилактики.
- Две ложки смеси подорожника и аира залить кипятком и настоять полчаса. Готовое лекарство принимать на протяжении 10 дней по 50 мл за 30 минут каждый раз перед едой.
- Практически любые кислые ягоды замечательно помогают восстанавливать микрофлору кишечника после антибактериального лечения. Для этого нужно просто ежедневно есть немного шиповника, клюквы, голубики или других подобных ягод.
- Взять поровну ядра грецкого ореха, семечки подсолнуха и тыквы. В ступке или блендером измельчить смесь. В полстакана кипяченой воды всыпать 2 столовые ложки получившегося порошка, перемешать и выпить. Принимать дважды в день. Эффект наступит от 10-дневного курса.
- Стаканом воды залить 200 г измельченных корней кровохлебки. На маленьком огне томить 20 минут. Остудить, процедить и принимать по столовой ложке до 6 раз в сутки на протяжении месяца.
- Небольшого размера тыкву помыть, обсушить и срезать верхушку, как крышку. Аккуратно вынуть все семечки, а внутрь залить натуральный мед до самого верха. Срезанную верхушку приложить обратно и тестом по кругу замазать щель, как бы законопатить тыкву. Поставить в темное и прохладное место на 10 дней. Теперь лекарство готово. Есть его нужно по столовой ложке за час до еды трижды в день.
- На протяжении двух часов настаивать 2 столовые ложки укропного семени в стакане кипятка. Пить понемногу через каждые два часа.
- На завтрак следует есть кашу из овсяных хлопьев или гречневой крупы. Хорошо будет добавить в кашу чернослив. Обед обогащайте вареной свеклой. Два зубка чеснока в день помогут восстановить микрофлору кишечника. Полезно пить компот из сухофруктов или чай с лимоном.
- Приготовить смесь из чернослива, кураги и меда. Измельчить, перемешать и съедать по столовой ложке в день.
- Пол-литра кефира или кислого молока поместить в литровую банку, положить туда же несколько веточек свежего или сухого укропа с петрушкой, по чайной ложке цветков ромашки и зверобоя, два зубчика измельченного чеснока и примерно столько же лука. Кипящей водой долить содержимое банки до верха. Настаивать полчаса, затем процедить и сразу выпить один-два стакана лекарства.
Есть много различных комбинаций лекарственных растений, помогающих восстановиться после антибактериального лечения. Всех компонентов нужно взять в одинаковом количестве, пропустить через мясорубку или кофемолку. Две ложки сбора сложить в термос, запарить литром кипятка и оставить до утра.
Мелкими порциями, по 100 мл, выпить за день весь объем процеженного настоя. Допускается для вкуса положить в чашку немного меда. Проводить лечение травяными настоями придется продолжительное время, используя курсы по 2 месяца с перерывом в две недели. Затем необходимо поменять сбор и продолжить терапию.
Результат уже довольно скоро порадует, но рекомендуется принимать травы на протяжении года. Вот некоторые из таких сборов:
- спорыш, репешок, плоды рябины черноплодной, плоды или соцветия черемухи, дубовая кора, корни осины и аира;
- ольховые шишки, корни осины, бадана и змеиного горца, кора дуба, плоды софоры и трава тысячелистника;
- репешок, тысячелистник, плоды софоры, ольховые шишки, соцветия или плоды черемухи, корень кровохлебки;
- трава грушанки, листья черники, плоды черемухи, корни аира и кора дуба.
Важно
Часто мы относимся к своему здоровью не очень внимательно. К состоянию своей микрофлоры тем более, ведь невооруженным глазом ее не рассмотреть. Однако нормальный баланс микроорганизмов в нашем теле крайне важен.
Это и защита от возбудителей разных болезней, и гарантия правильного пищеварения, и поддержание нашего иммунитета в тонусе.
Может, если все это будет работать без сбоев, нам и вовсе не понадобится лечение при помощи антибиотиков?
Источник: http://fitoresept.ru/kak-vosstanovitsya-posle-kursa-antibiotikov/
Лучшие народные рецепты для восстановление микрофлоры кишечника
Восстановление микрофлоры кишечника народными средствами — очень эффективная процедура, которая вполне может быть проведена в домашних условиях.
И если уничтожить микроорганизмы, живущие в кишечники очень просто, то их восстановление может занять продолжительное время.
Повредить микроорганизмам могут самые разные причины и факторы. Во-первых, уничтожить флору кишечника могут различные врожденные болезни, которые приводят к недостатку (или переизбытку) фермента.
Во-вторых, флора может быть уничтожена вследствие принятия медикаментозных средств (например антибиотиков), а также из-за неправильного питания, различных инфекций и излишка алкогольных напитков.
Кроме того радиация всех видов (включая рентгеновские лучи) могут убивать флору кишечника.
Поэтому восстановление микрофлоры кишечника народными средствами крайне важно, так как от этого зависит здоровье человека. Благо существует огромное количество лекарственных трав, которые помогут решить эту проблему.
Так в частности для того, чтобы быстро восстановить микрофлору кишечника можно сделать сладкую и полезную смесь. Изготавливается такая смесь из меда, кураги и чернослива. Твердые ингредиенты необходимо размельчить с помощью блендера или мясорубки, а после смешать их с медом. Употреблять такую смесь надо по одной столовой ложке в день.
Восстановление микрофлоры кишечника народными средствами можно проводить с помощью классических круп. К примеру, очень помогают каши из геркулеса или гречки, съеденные за завтраком. Не будет лишним добавить к каше качественный чернослив.
Также восстановлению микрофлоры очень хорошо помогает компот из сухофруктов. К обеду добавляйте винегрет или любой другой салат из свеклы.
Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
Конечно же, оптимальным вариантом будет употреблять различные кисломолочные продукты, такие как кефир и творог. Есть их можно без ограничений, так как эти продукты приносят организму исключительно пользу. Достаточно большой эффективностью отличается прием кумыса или ряженки (до двух стаканов в сутки).
Восстановление микрофлоры кишечника народными средствами можно осуществлять с помощью корней кровохлебки. Для этого нужно 200 граммов корня кровохлебки залить стаканом воды и оставить вариться на медленном огне 15-20 минут. Получившийся отвар нужно принимать внутрь пять-шесть раз в день по одной столовой ложке. Подобное лечение нужно проводить как минимум месяц.
Также можно приготовить отличный рецепт из четырех чайных ложек семян укропа. Семена укропа нужно залить стаканом кипятка и оставить настаиваться в течение двух часов. После этого полученный настой следует принимать каждые два часа.
Подорожник с корнем аира – отличный способ восстановить флору кишечника. Как и в предыдущих случаях, 2 ч ложки смеси лекарственных трав заливают кипятком и настаивают полчаса, после чего принимают в течение десяти дней по 50 миллилитров за полчаса перед каждым приемом пищи.
Восстановление микрофлоры кишечника после антибиотиков брагой. Это самый, что ни на есть народный рецепт. В поллитра теплой воды добавляете по 1 ст ложке меда и сахара и примерно 2 г дрожжей. Все тщательно перемешиваете и оставляете бродить на пАру часов в теплое место.
Дольше не стоит, иначе получится хмельная брага. Выпить следует сразу все за раз залпом. Выпивать по времени ровно между приемами пищи. Это получится 2 кружки в день.
Этим средством вы сразу поселяете в кишечник бродильные микроорганизмы, тем самым восстанавливаете его нормальную работу.
Еще запомните — все кислые ягоды, типа клюквы, и плоды шиповника — это очень хорошее лекарство для восстановления микрофлоры кишечника. Ешьте их ежедневно и у вас все будет хорошо.
Уже ни для кого не секрет, что тыквенные семечки хорошо очищают кишечник от паразитов. Усильте их действие таким рецептом: в равных количествах измельчите в блендере тыквенные семечки, семечки от подсолнуха и грецкие орехи. 2 ст ложки получившегося порошка размешиваете в половине стакана кипяченой воды и выпиваете. Курс приема 2 раза в день 10 дней.
Стоит отметить, что восстановление флоры кишечника процедура, которая требует терпения и кропотливой работы. Для полного излечения нужно принимать целебные травы как минимум десять дней и при этом нельзя игнорировать диету.
Источник: https://formulazdorovya.com/631617629171222633/luchshie-narodnye-retsepty-dlya-vosstanovlenie-mikroflory-kishechnika/
Восстановление после антибиотиков: очищение организма, усиление иммунитета
Если человек хотя бы единожды в жизни сталкивался с необходимостью приема антибиотиков, то наверняка знаком и с важностью восстановления после антибиотиков.
Антибиотические средства – это эффективное лекарство в борьбе против вредоносных микроорганизмов, которые вызывают инфекции и воспаления.
Мы принимаем эти препараты по время сезонной простуды, а также при воспалении тканей, после операций, чтобы не допустить осложнений.
Однако ни для кого не секрет, что у антибиотических средств, спасших миллионы жизней, есть и обратная сторона.
Своеобразной платой за их эффективность являются тяжелые токсические эффекты и гибель полезной микрофлоры.
Некоторые из препаратов нового поколения уже частично лишены этих недостатков, однако подавляющее большинство лекарств против бактерий все еще оставляют после себя неприятные последствия.
Врачи, прописывая курс антибактериальных препаратов, всегда подсказывают пациенту, как восстановиться после приема курса антибиотиков.
Иногда в условиях стационара проводится полноценная реабилитация после антибиотиков, если больному с иммунодефицитом пришлось перенести агрессивное лечение.
Но в данной статье речь пойдет скорее о том, как почистить организм после антибиотиков в домашних условиях после бытовой ситуации: к примеру, лечения простуды.
Чем вредят антибиотики
Прежде чем переходить к непосредственно описанию восстановительного курса, следует пояснить, зачем нужно восстановление после антибиотиков. Как уже было упомянуто, после длительного приема антибиотиков вместе с патогенной микрофлорой гибнет и полезная – например, бактерии пищеварения, которые безвредны для человека и помогают переваривать пищу.
В результате этого после применения антибиотиков возникает дисбаланс кишечной микрофлоры (если речь идет про таблетки, а не про антибиотики в ампулах или местные средства). «Вакантное» место погибших бактерий сразу же начинают занимать другие микроорганизмы – либо другие бактерии, либо простейшие грибы, которые начинают врастать в стенки кишечника, нарушая его деятельность.
На организм женщины антибиотики влияют еще сильнее. Например, распространенная проблема представительниц прекрасного пола – появление молочницы после приема антибиотиков. Это происходит из-за того, что антибиотики, даже принимаемые в виде таблеток, способны оказывать системное влияние на организм, действуя не только в кишечнике, но и на слизистых.
Осложнения после лечения антибиотиками могут быть самые разные. Основные, и самые безобидные – это метеоризм, диарея, длительные запоры и другие кишечные расстройства. В тяжелых случаях серьезно страдает печень и развиваются другие токсические эффекты.
Еще раз отметим, что восстановление после приема антибиотиков – это нормальная процедура, которая входит в курс лечения.
Это не значит, что антибиотики – плохое средство и нужно всеми силами избегать их употребления (напротив, это может быть опасно для здоровья), а вот разумно помогать своему организму необходимо.
Заниматься самодеятельностью тоже не нужно – как восстановить организм должен либо подсказывать врач, либо сам пациент должен согласовать с ним свою инициативу.
Так ли необходимо восстановление
Многие сторонники здорового образа жизни и лечения народными средствами настолько фанатично обсуждают очищение организма от токсинов после антибиотиков, будто человек прошел не курс лечения, а был отравлен ядом.
Во-первых, восстановление организма после приема антибиотиков требуется далеко не всем пациентам.
Если человек, к примеру, лечится от простуды или воспалительного процесса, но при этом не имеет никаких тяжелых хронических заболеваний, не является пожилым и не имеет иммунодефицита, то стандартный курс антибиотических средств не сможет ему навредить.
Другое дело, если курс лечения затягивается и становятся очевидными побочные эффекты – появляется диарея или метеоризм, нарушается поступление питательных веществ из кишечника, возможно появление вздутия живота.
Во-вторых, реабилитация после курса лечения антибиотиками необходима не только как восстановление организма после антибиотиков, но, прежде всего, как восстановление организма после болезни.
Бактерии сами по себе наносят гораздо больший ущерб, чем можно нанести лекарствами – антибиотиками, так что вопрос должен быть не столько о том, как восстановиться после антибиотиков, а скорее о том, как восстанавливаться и устранять последствия перенесенной болезни.
Таким образом, после курса антибиотиков нужно пропить препараты для восстановления организма тем людям, которые:
- были ослаблены на момент лечения;
- испытывают побочные действия антибиотиков.
Для остальных пациентов после антибиотиков нужно лишь соблюдать щадящий режим, употребить курс витаминов и хорошо отдыхать.
Как минимизировать негативное действие антибиотиков
Чтобы не думать о том, как восстановить организм после антибиотиков, нужно соблюдать правила их приема, которые помогут сохранить полезные бактерии микрофлоры и здоровье других органов.
Прежде всего следует знать касательно антибиотиков что нужно пить эти препараты только по назначению врача и сдачи анализов. Самые токсичные противомикробные лекарства – препараты широкого спектра действия, гораздо эффективнее в самом начале заболевания выявить возбудителя, сделав посев флоры, и принимать препарат избирательного действия.
Без назначения врача пить антибиотические лекарства нельзя ни в коем случае, т.к. это ведет не только к интоксикации организма, но и к тому, что бактерии привыкают к препарату и у них появляется устойчивость к его воздействию. Это уже опасно не только для конкретного человека, но и для всех, кто с ним контактирует.
Второе золотое правило – нужно принимать антибиотические средства строго в той дозировке и длительности, что была предписана врачом. Меньшая доза и срок могут привести к тому, что бактерии приобретут устойчивость и выживут, поэтому необходимо пропить курс целиком, даже если пациенту кажется, что он уже здоров.
Диета во время и после курса лечения – важная часть сохранения микрофлоры. После антибиотиков для восстановления работы печени и кишечника хорошо употреблять в пищу кисломолочные продукты, каши (особенно овсяную), хлеб с содержанием муки грубого помола и добавлением отрубей, фрукты и овощи, много зелени, орехи.
Для устранения таких симптомов, как метеоризм, диарея, запоры, выпивайте в день несколько стаканов кефира, или хотя бы один стакан на ночь. Для тех людей, которые не переносят вкус кефира, есть альтернатива – ряженка, закваска, питьевые йогурты с более мягким вкусом.
Очищение после антибиотиков
Первый этап восстановления после завершения лечения антибиотическими средствами – детоксикация. На этом этапе из организма нужно вывести все шлаки и токсины, а также остаточные следы препарата. Как очистить организм после приема антибиотиков? Для этого существует несколько основных приемов, которые можно как комбинировать, так и выбрать один понравившийся.
Главный помощник в детоксикации – активированный уголь. Есть и другие препараты для выведения токсинов, но они нужны скорее для случаев отравления.
Лучше и дешевле для реабилитации в домашних условиях, чем активированный уголь, не справится ни одно другое лекарство. Принцип действия угля состоит в абсорбции шлаков, связывании токсичных веществ до безвредных комплексов и выведении их из организма.
Это средство можно пить после антибиотиков и детям, и взрослым – активированный уголь абсолютно безвреден.
Итак, чем почистить организм мы выяснили, но сколько надо лечиться углем? И какое лекарство может его заменить? Тут все индивидуально.
Средний срок детоксикации активированным углем составляет около 3 дней, при склонности к запорам лучше ограничиться 1 днем и повторять прием угля после нормализации стула.
Заменить черный уголь можно белым активированным углем или любым абсорбирующим препаратом, соблюдая рекомендованную для него дозировку.
Другой вариант – выпивать каждое утро натощак стакан теплой кипяченой воды.
Это правило можно совмещать с приемом активированного угля и можно применять не только в качестве восстановления после лечения. Такую привычку можно взять на вооружение хоть на каждый день.
Однако людям с больными почками следует отнестись к этому правилу с осторожностью и сначала проконсультироваться у лечащего врача.
В обычной жизни мы не замечаем, что пьем недостаточно чистой воды, заменяя ее соками, кофе, другими жидкостями.
Отмечено, что тело тех людей, которые регулярно пьют 1,5 – 2 л воды в сутки, более гармонично распределяет жировую ткань и накапливает меньше токсинов. Обязательно пейте чистую воду по утрам, и до полутора литров в течение дня.
Такой режим помогает устранить кишечное расстройство, метеоризм, проблемы со стулом. Восстанавливаются функции кишечника.
Усиление иммунитета после антибиотиков
Мы выяснили, как очистить организм после антибиотиков. Следующий шаг – восстанавливаем нормальный иммунитет и повышаем выносливость организма.
Можно пить после приема антибиотиков специальные препараты, содержащие антиоксиданты, а можно попить натуральные средства, которые воздействуют точно так же.
Итак, что нужно употреблять после антибиотиков как восстановить организм? Для этого нужно добавить на свой стол сухофрукты (особенно чернослив и курагу), орехи (фундук и миндаль являются природными средствами для улучшения иммунитета), зелень (особенно петрушку), натуральный какао.
Для многих пациентов важен вопрос – что пить во время курса восстановления, кроме кефира и воды? Количество употребляемой жидкости можно дополнить натуральными отварами трав – например, отваром листьев крапивы.
Можно употреблять и другие травы – например, желудочно-кишечный сбор, листья липы и другие. Нежелательно употреблять кофе и крепкий чай, т.к. они могут утомлять ослабленный организм и быстро обезвоживают его.
С нормализацией перистальтики желудка в рацион можно вводить больше белковых продуктов – нежирное мясо и рыбу, яйца. Нежелательно на первых этапах выздоровления перегружать организм тяжелой, обильно приправленной и жареной пищей. Отдавайте предпочтение мясу птицы и рыбе, приготовленным на пару или отваренным. Не стоит увлекаться и употреблением сладостей и сдобы.
Что пропить для дополнительного усиления организма, должен решать врач. Иногда случается так, что даже безобидные на первый взгляд мультивитаминные комплексы могут навредить здоровью, т.к. на фоне дисбаланса в организме они действуют неадекватно. Так что после принятия курса антибиотиков, наравне с тем, как лечить болезнь, врач должен подсказывать, какие меры принимать для его реабилитации.
Специальные добавки
Несмотря на то, что употребление специальных препаратов вроде «Хилак Форте» или «Панкреатин» выглядит очевидным в вопросе восстановления после курса лечения, это не совсем верное решение.
Во-первых, это дорогие препараты, без которых человек вполне может обойтись, прибегнув к правилам здорового питания и банально введя в свой рацион кисломолочные продукты.
Во-вторых, препараты для печени не являются профилактическими и предназначены для лечения нарушений этого органа, здоровым людям незачем их принимать. Наконец, в-третьих, эффективность различных про- и эубиотиков до сих пор не доказана клинически.
Решение о том, принимать ли ему тот или иной препарат для восстановления микрофлоры или функций печени, должен принимать врач. В праве пациента остается воспользоваться доступными ему средствами информации для выяснения эффективности того или иного назначенного препарата.
Здоровый образ жизни
Несмотря на банальность этого пункта, соблюдение правил здорового образа жизни непосредственно сказывается на вреде антибиотиков. Во-первых, умеренная физическая нагрузка до приема курса препарата снижает риск возникновения побочных эффектов, т.к. организм при регулярных занятиях физической культурой становится более выносливым и менее подверженным токсическому влиянию.
Во-вторых, лечебная гимнастика после (не во время!) болезни способствует скорейшему восстановлению перистальтики кишечника, снабжению тканей кислородом, а значит и детоксикации организма.
Следующий пункт – это правильное питание и отсутствие вредных привычек. Это одни из важнейших факторов, которые влияют на здоровье печени.
Именно на печень приходится главный удар антибиотиков, и из-за слабости печени возникает большинство токсических эффектов.
Гепатоциты (клетки печени) имеют свойство восстанавливать свои функции, и гораздо быстрее этот процесс происходит у тех людей, которые следят за своим здоровьем.
Еще один важный момент, о котором многие забывают, когда речь заходит о здоровом образе жизни.
Своевременная диагностика и выполнение врачебных предписаний – это те условия, при которых лечение протекает максимально быстро, эффективно и без мучительных последствий для пациента.
Поэтому ни в коем случае не занимайтесь самодиагностикой, самолечением и не принимайте антибиотики без предписаний врача.
Заключение
Подведем итоги тем правилам, которые помогут сохранить здоровье кишечника и получить минимальные побочные эффекты при приеме антибиотиков.
- Следить за здоровьем нужно постоянно. Чем здоровее человек до приема антибиотиков – тем меньше вероятность того, что они дадут токсический эффект, и тем быстрее пациент оправится от болезни.
- Доверяйте медицине. Обращаться к врачам за помощью нужно своевременно, пить лекарства только по назначению врача, а в период восстановления соблюдать врачебные предписания.
- Не всем нужны препараты для восстановления после антибиотиков. Этот пункт близок к предыдущему – доверяйте рекомендациям врача, интересуйтесь у них состоянием своего организма и необходимостью дополнительных мероприятий.
- Пейте больше жидкости и очищайте организм от шлаков. Наш организм – это самовосстанавливающаяся система, которая в состоянии исправить практически любые возникающие в ней сбои. Нужно только немного ей помочь и вывести токсичные вещества.
- Употребляйте в пищу продукты, которые улучшают работу кишечника и содержат антиоксиданты. В период восстановления после болезни не нагружайте организм тяжелой и вредной пищей.
- Не лечите то, что не болит. Не поддавайтесь на рекламные уловки покупать препарат для улучшения работы печени, если врачи не выявили нарушений ее работы. Стандартный курс антибиотиков во время работы не способен разрушить клетки печени.
И, наконец, будьте здоровы и счастливы!
Источник: https://proantibiotik.ru/vzroslym/vosstanovlenie-posle-antibiotikov
Максилак инструкция по применению: показания, противопоказания, побочное действие – описание Maxilac Капсулы (40649)
Максилак® — первый синбиотик, зарегистрированный в РФ, каждая капсула которого содержит 9 культур полезных бактерий в необходимой для кишечника человека концентрации — 4.5 миллиарда КОЕ.
Входящие в состав синбиотика Максилак®бифидобактерии подавляют рост широкого спектра патогенных и гнилостных микроорганизмов, восстанавливают равновесие кишечной микрофлоры, нормализуют пищеварительную и защитную функции кишечника, активизируют обменные процессы, повышают сопротивляемость организма простудным и инфекционным заболеваниям.
Лактобактерии, которые также входят в состав синбиотика Максилак®, участвуют в регуляции обмена веществ, помогают организму в борьбе с пищевой аллергией, стимулируют сократительную функцию кишечника, укрепляют иммунитет и восстанавливают защитные функции организма. Молочная кислота, синтезируемая лактобактериями, активизирует усвоение витамина D, железа и кальция.
Фруктоолигосахариды (пребиотик в составе продукта Максилак®) стимулируют быстрое размножение полезных микроорганизмов, что тормозит развитие болезнетворных бактерий, уменьшают загрязнение кишечника токсинами и улучшают его работу, стимулируют перистальтику, очищают от шлаков, служат в целях профилактики запоров и диареи, способствуют нормализации функции ЖКТ.
Особая защита SFERA (Surrounded Freeze Release Armour [СФЕРА — всесторонняя защита путем заморозки и замедленного высвобождения]) способствует сохранности полезных бактерий в составе синбиотика Максилак®. Запатентованная технология DuPont обеспечивает высокую активность и жизнеспособность полезных бактерий в течение длительного времени, в т.ч. при повышенных температурах и различной степени влажности. Инновационная капсула DRcaps™, в свою очередь, нейтрализует негативное воздействие кислого содержимого желудка, солей желчных кислот и пищеварительных ферментов. Двойная защита помогает компонентам синбиотика Максилак® без потерь преодолеть желудок, адаптироваться и прижиться в просвете кишечника, сохранив высокую биологическую активность, что положительно сказывается на восстановлении микрофлоры ЖКТ.
Максилак® не содержит казеина, глютена и консервантов, поэтому безопасен для людей с аллергией на продукты этой группы.
Максилак® можно принимать лицам с непереносимостью лактозы.
Для производства капсулы Максилак® не используется желатин животного происхождения (вегетарианская капсула).
Депздрав предостерегает от использования антибиотиков при ОРВИ
С приходом осени учащаются случаи заболевания ОРВИ или, проще говоря, простудой. И часто заболевшие начинают заниматься самолечением, назначать себе те или иные препараты. Многие начинают пить антибиотики, рассчитывая на их силу в борьбе с болезнью. Главный специалист по первичной медицинской помощи взрослому населению Департамента здравоохранения Москвы Андрей Тяжельников предостерег, что делать этого категорически нельзя, потому что от такого лечения может быть больше вреда, чем пользы.
«Для начала стоит разобраться, что же из себя представляют антибиотики и для чего они выпускаются. Лекарства группы антибиотиков применяются при заболеваниях, вызванных микробами. Так, первые полученные препараты этого класса разрушали клеточные стенки микробов, другие лекарства нарушают синтез белка у микроба, то есть не лишая его возможности деления и передвижения по организму», – рассказал Андрей Тяжельников.
Вирусы отличаются от бактерий. Они могут жить и размножаться только в чужих клетках. Вирусы не имеют клеточных стенок, на которые могут влиять антибиотики. Именно поэтому прием антибиотиков на фоне вирусного заболевания лишен всякого смысла. Исключение составляют случаи, когда вслед за ОРВИ начинают активно размножаться болезнетворные бактерии. Такое явление называется суперинфекцией.
Могут ли навредить антибиотики, если принимать их без назначения врача? Разумеется, да. Антибиотики обладают серьезными побочными эффектами, среди которых угнетение функции печени и почек, аллергические реакции, снижение иммунитета. Антибиотики вызывают дисбаланс микрофлоры желудка и слизистых оболочек в организме. Кроме этого, неоправданный прием этих лекарств ведет к развитию заболеваний, устойчивых к ним. И уже не редки случай, когда антибиотики становятся бессильны к болезням, против которых они и были созданы.
Андрей Тяжельников напомнил, что при возникновении симптомов заболевания нужно сразу обращаться к врачу, который назначит необходимое лечение.
Некоторые люди путаются в определениях гриппа и ОРВИ, однако это не совсем верно. ОРВИ – общее название любой респираторной вирусной инфекции, а грипп только один из этих представителей. И если большинство ОРВИ протекают относительно легко, то грипп может приводить к крайне опасным осложнениям.
Самым эффективным способом защиты от гриппа является своевременная вакцинация. Сделать бесплатную прививку против гриппа можно как во всех поликлиниках, так и в мобильных пунктах рядом со станциями метро, МЦК, ж/д станцией Крюково, в некоторых павильонах «Здоровая Москва», в двух флагманских центрах госуслуг «Мои документы».
Привиться в мобильных пунктах могут все совершеннолетние граждане России. С собой нужно взять только паспорт. Перед вакцинацией каждого обязательно осматривает врач-терапевт или инфекционист. После прививки выдают сертификат. Вся процедура занимает 10–15 минут.
Антибиотики при COVID-19: простой путь навредить себе и приблизить времена, когда антибиотики не будут работать | Громадское телевидение
«Пациенты часто просят, чтобы я назначил им какую-то “волшебную пилюлю”, которая вылечит их от коронавирусной инфекции. А когда отказываю, начинают показывать статьи в СМИ, написанніе так называемыми “специалистами” — о том, чем надо лечиться. Или рассказывают истории родственников и знакомых, которые якобы выздоровели благодаря тем или иным чудодейственным лекарствам», — рассказывает Ирина Суворкина, кандидат медицинских наук, пульмонолог клиники «Обериг».
Очень часто на роль «волшебной таблетки» претендуют антибиотики. В представлении пациентов это лекарства, которые помогают чуть ли не от всего: насморка, боли, сбивают температуру и так далее.
В то же время назначение антибиотиков заключается в том, чтобы убивать бактерий, которые являются причиной той или иной болезни. На вирусы антибиотики не действуют вообще, поэтому вылечить с их помощью COVID-19 просто невозможно. Так же, как нет никакого смысла лечить ими грипп, корь, ветряную оспу, вирусные гепатиты или любые другие вирусные заболевания.
Пневмонии бывают разные
Отчасти пациентов вводит в заблуждение диагноз «пневмония», которая часто возникает как осложнение COVID-19. Если говорить об обычной пневмонии, то ее не только можно, но и нужно лечить антибиотиками, ведь ее вызывают пневмококки и некоторые другие бактерии. Но есть пневмонии, которые называются атипичными, поскольку их вызывают другие возбудители — например, вирус гриппа или SARS-CoV-2 и другие микроорганизмы.
Подавляющее большинство пациентов не знает, как такие пневмонии отличить от «обычных», как они развиваются и как их нужно лечить. Но следует признать, что далеко не все врачи хорошо умеют это делать.
«Пациенты часто сами себе назначают компьютерную томографию. В начале болезни они видят, что поражено 10% легких, и поэтому назначают себе антибиотики. А через несколько недель КТ показывает, что поражено уже 25% легких. “Значит, нужны еще антибиотики”, — полагает пациент и продолжает заниматься самолечением», — рассказывает Ирина Суворкина.
По ее словам, у таких пациентов после приема двух или трех видов антибиотиков, которые не могли помочь, часто диагностируют медикаментозные гепатиты. То есть, к тем проблемам, которые уже были, добавляется еще одна.
fullscreenЖенщина покупает лекарства в аптеке, Киев, Украина
Фото:EPA/SERGEY DOLZHENKO
Когда при COVID-19 антибиотики нужны
Но есть ситуации, когда больному COVID-19 действительно необходимо назначить антибиотики. Это делают в тех случаях, когда к вирусной инфекции присоединяется бактериальная.
«Ее можно заподозрить, когда у больного появляется вторая волна лихорадки, выделяется гнойная мокрота при кашле, меняются показатели крови и при других симптомах, которые должен знать врач», — рассказывает Ирина Суворкина.
Но такие случаи встречаются довольно редко. По данным американских и британских исследователей, сопутствующая бактериальная инфекция бывает у 3-5% больных COVID-19. Но, несмотря на это, более 70% пациентов с коронавирусной инфекцией в США лечились антибиотиками. Следовательно, эта проблема касается не только Украины.
Пить антибиотики «для профилактики» при COVID-19 также нет никакого смысла. Они могут навредить нормальной микрофлоре, и это никак не предотвратит возможные осложнения, зато может стать причиной других, отнюдь не менее тяжелых.
Антибиотики на волне популярности
Проблема неправильного применения антибиотиков существовала задолго до пандемии коронавируса. Но сейчас она приобрела особые масштабы.
Министр здравоохранения Максим Степанов недавно заявил, что потребление антибиотиков в этом году возросло в 3,5 раза по сравнению с аналогичным периодом прошлого года. По данным сайта apteka.ua, продажи азитромицина и цефтриаксона (антибиотиков, применяемых, в том числе, для лечения пневмонии) стремительно выросли осенью, что совпадает со значительным ростом заболеваемости COVID-19.
Похожие тенденции, как мы уже видели, есть в других, в том числе развитых странах. Проблема не только в самолечении, но и в том, что врачи часто просто не знают, как лечить новую болезнь и по своему усмотрению назначают различные лекарства, в том числе и антибиотики.
читайте также
fullscreenЖенщина в госпитале для больных COVID-19 в Кыргызстане
Фото:EPA/IGOR KOVALENKO
Это делает их сильнее
Но неправильное использование антибиотиков имеет гораздо худшие последствия, чем медикаментозные гепатиты и другие осложнения. Речь идет об антибиотикорезистентности. Говоря простыми словами, среди хорошо известных нам бактерий возникают штаммы (разновидности), нечувствительные к антибиотикам, которыми их успешно лечили раньше. Иногда это означает, что на них не действуют никакие из известных антибиотиков.
Уже сейчас каждый год от болезней, вызванных устойчивыми к антибиотикам бактериями, в мире умирают не менее 700 тысяч человек. Речь идет не о каких-то экзотических диагнозах, а о хорошо знакомых туберкулезе, инфекциях, передающихся половым путем, о той же пневмонии и тому подобном.
По прогнозам, к 2050 году из-за устойчивых к антибиотикам бактерий ежегодно в мире будут умирать 10 миллионов человек. ВОЗ считает проблему устойчивости к противомикробным препаратам (к которым относятся и антибиотики) одной из десяти глобальных угроз здоровью.
Наши ложные представления
Несколько лет назад по заказу ВОЗ в нескольких странах провели исследование, чтобы выяснить, насколько хорошо люди понимают, что такое резистентность к антибиотикам.
64% участников исследования считают, что антибиотиками можно лечить простуду и грипп (хотя это вирусные болезни).
Почти треть людей считает, что если после нескольких дней приема антибиотиков самочувствие улучшилось, то лечение следует прекратить. Но именно таким образом мы «отбираем» устойчивые бактерии, которые наименее уязвимы к действию антибиотиков.
А еще две трети респондентов считают, что людям, которые правильно принимают антибиотики, проблема антибиотикорезистентности не угрожает.
Но это опасное заблуждение. Дело в том, что резистентность — это не то, что возникает в организме какого-то человека, а то, что характеризует бактерий. Если такие бактерии возникли в организме одного человека, то ими может заразиться другой, который не нарушал никаких предписаний врача.
Иными словами, принимать или не принимать антибиотики и как их принимать — отнюдь не «личное дело каждого». Если не изменить нашу практику применения антибиотиков, то мир вернется на сто лет назад — в тот период, когда люди умирали от обычных пневмоний и других заболеваний, вызванных бактериями.
читайте также
fullscreenДва человека в защитных масках и щитках около диагностического центра в Буэнос-Айресе, Аргентина
Фото:AP/Juan Ignacio Roncoroni
Наука нас спасет, но не скоро
Можно ли как-то избежать такой перспективы?
В только что упомянутом исследовании выяснилось, что 64% участников считают, что медики решат проблему устойчивых к антибиотикам бактерий еще до того, как она станет слишком серьезной.
Правда в том, что человечеству действительно требуются новые антибиотики, без которых победить резистентных бактерий не удастся. Но, по данным ВОЗ, среди антибиотиков, которые сегодня разрабатывают фармацевтические компании, очень мало действительно инновационных. Большинство из них мало отличаются от тех, что уже есть на рынке.
Правда, на стадии доклинических испытаний находятся препараты, на которые возлагают большие надежды. Но даже в лучшем случае первые из них будут доступны для пациентов примерно через 10 лет. Это значит, что ученые и врачи сами эту проблему не решат.
Как каждый может сдержать появление резистентных бактерий
Очень многое зависит от того, насколько ответственно каждый из нас относится к применению антибиотиков.
В частности, ВОЗ рекомендует соблюдать следующие правила:
- принимать антибиотики только в том случае, если их назначил квалифицированный врач;
- никогда не требовать у врача антибиотики, если он говорит, что на этот раз они не нужны;
- всегда следовать рекомендациями врача по применению антибиотиков; в частности, это означает, что курс лечения должен длиться не меньше и не больше, чем назначил врач;
- нельзя передавать свои антибиотики для использования другим людям, которым они не прописаны врачом.
Есть и другие важные правила, которые не касаются приема антибиотиков, но помогают избежать возникновения резистентных бактерий. Они направлены на то, чтобы уберечься от бактериальных инфекций — таким образом, чтобы потребность в антибиотиках даже не возникала. Эти рекомендации включают регулярное мытье рук, безопасный секс, а также своевременную вакцинацию, которая позволяет предупредить заболевания, в том числе и бактериальные.
читайте также
Линекс® экспертный подход к решению любых ситуаций для восстановления баланса микрофлоры
Москва. 30 июля 2015 г. Компания «Сандоз» расширяет линейку препаратов Линекс® — лидера безрецептурного портфеля компании и пробиотика №1 в России.*
Пробиотики являются одной из наиболее динамично развивающихся категорий на мировом фармацевтическом рынке. Связано это с тем, что характер питания населения развитых стран изменился: в рационе большинства современных горожан преобладают продукты, подвергшиеся рафинированию, термической обработке или замораживанию, генной модификации для улучшения вкусовых качеств и продления срока годности. Поэтому пробиотики – препараты, позволяющие поддерживать в норме состояние микрофлоры и здоровье желудочно-кишечного тракта – все чаще используются как в лечебных, так и в профилактических целях. Мировой рынок производства пробиотиков растет ежегодно на 7%. По данным Euromonitor, к 2017 году он составит 33,5 млрд евро1.
Линекс® хорошо известен российским врачам и потребителям благодаря высочайшему качеству и широкой линейке препаратов, в которой каждый сможет найти для себя оптимальный вариант пробиотика. В июле 2015 году, помимо всеми любимого Линекс® и Линекс для детей®, линейка пополнилась новинкой — Линекс® Форте. Новинка содержит комплекс из 2-х наиболее изученных бактерий BB-12 и LA-5 в высокой концентрации,что позволяет принимать от одной капсулы в день. что особенно удобно для проведения курсов лечения.Входящие в состав препарата пробиотические штаммы подавляют рост патогенных бактерий и оказывают благотворное влияние на состав кишечной микробиоты (микрофлоры).
Нормальная микрофлора снижая активность болезнетворных микроорганизмов, подавляет патогенные, гнилостные и газообразующие бактерии. Кроме того представители кишечной микробиоты принимают участие в жировом и пигментном обмене, стимулируют иммунную систему, принимают активное участие в переваривании пищи. Микробиоценоз желудочно-кишечного тракта – а это приблизительно 100 триллионов микроорганизмов (от 1013 до 1014) весом около 1,5 кг у взрослого человека – в значительной степени определяет состояние здоровья человека, являясь, по существу, органом, ответственным за ряд ключевых метаболических процессов в организме1-3. Но существует множество факторов, оказывающих негативное влияние на микробиоту кишечника и приводящих к дисбалансу. Это особенности питания, заболевания органов пищеварения, кишечные инфекции, применение антибактериальных препаратов4. Для коррекции состояния кишечной микробиоты при различных патологических состояниях: дисбиозах, диареях различного происхождения, Clostridium difficile ассоциированных инфекциях и др. – используются препараты-пробиотики.
По словам директора по корпоративным связям компании «Сандоз» Юрия Головатчика, новинка станет значимым подспорьем в лечении ряда болезней:
«В состав пробиотика Линекс® Форте в суточной дозировке входят 2 хорошо изученные бактерии, являющие представителями нормальной микрофлоры кишечника — лакто- и бифидобактерии. Бактерии, содержащиеся в капсулах Линекс® Форте, нормализуют и поддерживают физиологический баланс кишечной микрофлоры во всех отделах кишечника. Линекс® Форте показан для профилактики и лечения дисбактериоза кишечника, симптомами которого могут быть диарея, запоры, нарушение пищеварения, тошнота, метеоризм, отрыжка и кожные аллергические реакции».
Д.м.н., профессор, заведующая кафедрой пропедевтики детских болезней Педиатрического факультета Первого Московского государственного медицинского университета (Первого МГМУ) им. И.М. Сеченова, Светлана Ильинична Эрдес отметила: «Кишечник не напрасно называют «вторым мозгом» человека. Наше здоровое состояние во многом зависит от микрофлоры кишечника, основы основ слаженной работы организма. Именно поэтому пробиотики препараты, дающие возможность поддерживать в норме бактериальный состав кишечника – так важны в жизни современного человека. Погрешности в питании, стресс, прием антибиотиков и множество других факторов могут привести к нарушению состава кишечной микробиоты. Широкая линейки Линекс® позволяет подобрать каждому пациенту подходящий для него робиотик в любой ситуации нарушения микрофлоры!
О компании «Сандоз»
Компания «Сандоз», дженериковое подразделение группы компаний «Новартис», является лидером в отрасли воспроизведенных лекарственных средств и постоянно стремится к повышению уровня доступности высококачественной медицинской помощи для пациентов. «Сандоз» располагает штатом свыше 26 000 сотрудников по всему миру. Компания поставляет широкий спектр доступных по цене лекарственных препаратов пациентам в разных странах мира.
Достигнув объема продаж в 9,6 млрд. долларов США в 2014 г. и обладая портфелем лекарственных средств, состоящим из более чем 1100 химических соединений, компания «Сандоз» занимает лидирующую позицию в мире как в области биоаналогов, так и на рынке противоинфекционных и офтальмологических дженериков, а также дженериков применяемых в трансплантологии. Кроме того, компания «Сандоз» является одним из мировых лидеров на рынке дженериков в таких ключевых терапевтических областях как: инъекционные и дерматологические препараты, препараты для лечения заболеваний дыхательной, центральной нервной, сердечно-сосудистой и пищеварительной систем, метаболических нарушений и болевых синдромов.
Компания «Сандоз» разрабатывает, производит и продает лекарственные средства, а также фармацевтические и биотехнологические активные субстанции действующих веществ. Около половины портфеля препаратов «Сандоз» состоит из различных категорий лекарственных средств, более сложных в разработке и производстве, чем стандартные дженерики.
Начиная с 2003 года, когда компания консолидировала различные направления производства дженериков под брендом «Сандоз», мы наблюдаем высокий естественный рост бизнеса за счет увеличения продаж. В дополнение к этому, рост обусловлен рядом целевых приобретений, которые компания «Сандоз» осуществила в различных регионах и направлениях бизнеса, в том числе «Гексал» (Германия), «Эбеве Фарма» (Австрия) и «Фуджера Фармасьютикалс» (США).
Компания «Сандоз» представлена в Twitter. Подписывайтесь на новости компании по ссылке http://twitter.com/Sandoz_Global.
**По продажам в упаковках по данным ООО “АЙ ЭМ ЭС Хэлс”, январь-декабрь 2014
Amann R, Fuchs BM. Nat Rev Microbiol 2008; 6:339.
Zhao L. Nature Review. Microbiology, Sept 2013; 11:639-47
O’Hara AM&Shanahan F. Best Practice / Research Clinical Gastroenterology 2014; 28:585-97
Приказ N 231 от 9 июня 2003 г. Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника»
Как восстановить флору кишечника и очистить кишечник после приема антибиотиков
Вот что вам нужно знать, чтобы восстановить здоровье кишечника, помочь своей естественной флоре и выбрать пищевые добавки для здоровья кишечника после антибиотиков.
Стать самым здоровым человеком может показаться непреодолимой задачей, особенно потому, что наши тела могут быть невероятно загадочными и сложными. Но многие люди не знают, что существуют простые, конкретные, изученные способы улучшить свое здоровье, и большинство из них связано с кишечником.
Это потому, что ваше тело полагается на полезные бактерии, которые регулируют пищеварительную систему, поддерживают иммунитет, производство серотонина и многое другое. Вместо того, чтобы выяснять, как избавиться от вредных кишечных бактерий, вы обнаружите, что восстановление кишечной флоры и устранение полезных бактерий важнее.
Содержание
В этой статье наших друзей из Jetson Probiotics исследуются преимущества пробиотиков для смягчения воздействия антибиотиков и другие способы поддержания здоровья кишечника, заботясь о кишечном микробиоме.
☝️ ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ ☝Эта статья предназначена только для информационных целей. Он не предназначен для использования в качестве замены профессиональных медицинских рекомендаций, диагностики или лечения.
Что такое микробиом кишечника?
Зачем кишечнику нужны бактерии (Тед Эд)Микробиом кишечника живет в толстом кишечнике и является домом для самых разнообразных бактерий во всем организме. Это потому, что, в отличие от любой другой части тела, ваш пищеварительный тракт представляет собой открытую экосистему, которая больше подвержена влиянию внешней среды, чем любая другая часть тела.
Что это значит? Что ж, микробиом кишечника может быть сформирован такими вещами, как пол, возраст, географические и социально-экономические условия, диета и состояние здоровья. Это также означает, что микробиом кишечника каждого человека будет разным и на него будут влиять разные факторы.
Хорошие бактерии и здоровье кишечника
Но нам десятилетиями говорили, что все бактерии — зло, поэтому, если вы задаетесь вопросом: «Полезна ли для вас флора?» прямо сейчас, значит, вы не одиноки. Не волнуйтесь, это широко распространенное мнение — миф.Фактически, теперь мы знаем, что бактерии в подавляющем большинстве безвредны, некоторые из них полезны, а лишь некоторые из них вредны.
Чтобы ваш кишечник оставался счастливым и вы были здоровы, это зависит от микробного разнообразия. По сути, должно быть много разных типов микробов, живущих вместе. Когда этого не происходит, это приводит к дисбактериозу, при котором недостаточно разнообразия, и некоторые бактерии могут бесконтрольно расти.
Когда происходит дисбаланс между хорошими и плохими бактериями, микробиом может стать несчастливым, что имеет последствия для пищеварения, воспаления, слизистой оболочки кишечника и даже настроения и здоровья мозга.
Кишечные бактерии и здоровье иммунной системы
Что наиболее важно, захват вредных бактерий может резко повлиять на иммунитет и оставить место для развития инфекций, болезней и хронических заболеваний. Кишечник — это первая линия связи между внешней средой и иммунной системой. Эти двое работают вместе, чтобы взаимно регулировать реакцию нашего организма на вредные патогены.
Но когда иммунная система и кишечник работают вместе, все работает гладко. Это стимулирует рост полезных бактерий, что улучшает иммунитет и работу кишечника.Он вызывает более сильную реакцию на болезнетворные микроорганизмы, в то же время делая организм более устойчивым к естественным кишечным бактериям.
Как антибиотики вредят здоровью кишечника?
Восстановление здоровья кишечника начинается с понимания бактерий в вашем желудочно-кишечном тракте.Антибиотики прописываются почти половине населения Великобритании каждый год от обычных заболеваний и в больницах для лечения и предотвращения серьезных инфекций. Вот наиболее распространенные применения антибиотиков:
| ушные инфекции | Инфекции носовых пазух |
| инфекции грудной клетки | Инфекции горла |
| Инфекции мочевыводящих путей, мочевого пузыря и почек | Кожные и раневые инфекции |
| пневмония |
К сожалению, антибиотики не останавливаются на вредных бактериях и не лечат вирусные инфекции, которые часто почти невозможно отличить от бактериальных.Вместо этого антибиотики убивают и хорошие бактерии, а это плохо, потому что хорошие бактерии часто помогают вашему организму бороться с инфекцией.
Многие люди также испытывают легкие или тяжелые побочные эффекты антибиотиков, особенно если их иммунное здоровье уже нарушено, например, пациенты в больницах. Более того, антибиотики могут оставлять место для чрезвычайно вредных бактерий, таких как кишечная палочка , C.diff и сальмонелла, — инфекции, которые могут быть настолько серьезными, что потребуется госпитализация.
Общие побочные эффекты антибиотиков
- понос
- дрожжевые инфекции
- газ
- рвота
- тошнота
- запор
Несмотря на то, что антибиотики очень эффективны при лечении бактериальных инфекций, важно принять необходимые меры предосторожности, чтобы поддержать микробиом кишечника, потому что сохранение хороших бактерий так же важно, как и уничтожение плохих.
Как лучше всего восстановить здоровье кишечника?
Диета, богатая пребиотическими растительными продуктами, питает микробиом кишечника.Ни для кого не секрет, что здоровье кишечника не является обязательным условием для достижения общего состояния здоровья. Поддерживать уровень полезных бактерий в микробиоме кишечника можно разными способами, включая диету и использование пробиотиков.
Все начинается с диеты. Хорошие бактерии насыщаются клетчаткой и питательными веществами в растительной пище — это пребиотики — и они превращают эти вещества в питательные вещества, которые питают слизистую оболочку кишечника и поддерживают баланс кишечного биома.
С другой стороны, пробиотические добавки содержат миллиарды бактерий из одного или нескольких штаммов бактерий, которые в определенных, изученных дозах приносят пользу вашему здоровью. Вот некоторые из самых известных и хорошо изученных пробиотических бактерий и дрожжей, которые вы найдете в добавках:
| Бифидобактерии | Лактобациллы |
| Лактококк | Сахаромицеты |
☝️ Что сообщает Atlas Biomed: ☝️ Ученые-микробиомы из Atlas подчеркивают, что преимущества пробиотиков могут быть временными для некоторых людей и сохраняться только до тех пор, пока они принимают добавки.
Сколько времени нужно, чтобы снова заселить кишечник полезными бактериями?
На этот вопрос нет простого ответа, потому что он зависит от состояния вашего микробиома, качества вашей диеты, принимаемых вами лекарств, уровня физической активности и многого другого. Однако микробиом кишечника очень легко адаптируется и реагирует на положительный образ жизни.
Итак, если вы придерживаетесь диеты с большим количеством цельных продуктов, богатых клетчаткой (ученые называют это пребиотиками) и добавляете пробиотические продукты или добавки, вы можете ускорить восстановление биома кишечника.Кроме того, регулярные упражнения, особенно кардио, связаны с большим разнообразием кишечника.
Как восстановить здоровую флору кишечника
Пробиотики в целом безопасны, и иногда их даже рекомендуется принимать во время курса антибиотиков, за исключением госпитализированных пациентов и людей с ослабленной иммунной системой. После этого они особенно полезны для восстановления микробиома кишечника.
☝️ СОВЕТ Не существует такой вещи, как диета с чистым кишечником — ваш кишечник очищается естественным образом.Тем не менее, вы можете помочь кишечным бактериям сохранить здоровье с помощью пребиотической диеты, богатой растениями.
Какие пробиотики при побочных эффектах антибиотиков?
Пробиотики борются с воздействием антибиотиков на полезные кишечные бактерииОбычно организму требуется время, чтобы сбалансировать микробиом до здорового, разнообразного уровня бактерий. Фактически, исследования показывают, что восстановление после повреждений, нанесенных антибиотиками, занимает около 6 месяцев. И даже тогда организм может даже не вернуться в то состояние, в котором он находился до антибиотика.
Saccharomyces boulardii , пробиотические дрожжи, особенно хороши для предотвращения и облегчения диареи, связанной с антибиотиками, и диареи путешественников. Это также друг кишечных бактерий, поддерживающий полезные бактерии и предотвращающий воспаления.
Lactobacillus acidophilus , пробиотическая бактерия, наиболее известная тем, что содержится в йогурте, также полезна для кишечника. Исследования показывают, что он помогает лечить и предотвращать инфекции, а также снижает побочные эффекты антибиотиков для пищеварения.
Другие бактерии, которые помогают восстановиться после употребления антибиотиков, включают:
- L. casei
- L. Rhamnosus GG
- L. Plantarum 299v
- B. subtilis
- B. coagulans lactospore
- B. clausii
Каковы долгосрочные последствия нарушения здоровья кишечника?
Ваше тело не только более восприимчиво к инфекциям, ослабленному иммунитету и хроническим воспалениям, но мы также знаем, что несбалансированная микробиота может увеличить риск более поздних хронических заболеваний, таких как болезни сердца, диабет, даже болезни Альцгеймера и Паркинсона.
Микробиом кишечника — это самая разнообразная по бактериальному составу часть вашего тела, и на него влияют то, что вы едите, пьете, уровень вашей активности и лекарства, которые вы принимаете. Это может показаться немного сложным, но для восстановления кишечника не нужно много времени: хорошее питание, регулярные упражнения и некоторая помощь пробиотических бактерий.
Антибиотики при инфекциях мочевыводящих путей у пожилых людей
Когда они вам нужны, а когда нет
Антибиотики — это лекарства, которые убивают бактерии.Врачи часто используют антибиотики для лечения инфекций мочевыводящих путей (ИМП). Основные симптомы ИМП:
- Чувство жжения при мочеиспускании.
- Сильные позывы к частому мочеиспусканию.
Однако многие пожилые люди получают лечение от ИМП, даже если у них нет этих симптомов. Это может принести больше вреда, чем пользы. Вот почему:
Антибиотики обычно не помогают при отсутствии симптомов ИМП.
У пожилых людей часто содержатся бактерии в моче.Это не означает, что у них ИМП. Но врачи могут обнаружить бактерии в обычном тесте и в любом случае назначить антибиотики.
Этим пациентам антибиотик не помогает.
- Не предотвращает ИМП.
- Не помогает контролировать мочевой пузырь.
- Не помогает проблемы с памятью или балансом.
Большинству пожилых людей не следует проходить обследование или лечить ИМП, если у них нет симптомов ИМП. А если у вас есть ИМП и вы лечитесь, вам обычно не требуется еще один тест, чтобы узнать, вылечились ли вы.Вам следует пройти обследование или пройти курс лечения только в том случае, если симптомы ИМП вернутся.
Антибиотики имеют побочные эффекты.
Антибиотики могут иметь побочные эффекты, такие как лихорадка, сыпь, диарея, тошнота, рвота, головная боль, разрывы сухожилий и повреждение нервов.
Антибиотики могут вызвать проблемы в будущем.
Антибиотики могут убить «дружественные» микробы в организме. Это может привести к вагинальной дрожжевой инфекции. Это также может привести к другим инфекциям, тяжелой диарее, госпитализации и даже смерти.
Кроме того, антибиотики могут способствовать росту «устойчивых к лекарствам» бактерий. Эти бактерии труднее убить. Они вызывают болезни, которые труднее вылечить и которые обходятся дороже. Вашему врачу, возможно, придется попробовать несколько антибиотиков. Это увеличивает риск осложнений. Устойчивые бактерии также могут передаваться другим людям.
Антибиотики — пустая трата денег.
Антибиотики, отпускаемые по рецепту, могут стоить от 15 до 100 долларов. Если вы заразились устойчивыми бактериями, вам может потребоваться больше посещений врача и лекарства, которые стоят дороже.
Когда пожилым людям следует принимать антибиотики при ИМП?
Если у вас симптомы ИМП, могут помочь антибиотики.
- Наиболее частыми симптомами ИМП являются болезненное чувство жжения при мочеиспускании и частое сильное желание «пойти».
- Другие симптомы ИМП у пожилых людей могут включать жар, озноб или спутанность сознания. Наряду с этими симптомами обычно наблюдается боль на одной стороне спины ниже ребер или дискомфорт в нижней части живота. Может измениться внешний вид или запах мочи.
Некоторые виды хирургических вмешательств могут вызвать кровотечение в мочевыводящих путях — например, операция на предстательной железе и некоторые процедуры по удалению камней в почках или опухоли мочевого пузыря. Если вы собираетесь сделать эту операцию, вам может потребоваться тестирование и лечение бактерий в моче.
Этот отчет предназначен для вас при разговоре со своим врачом. Это не заменяет медицинские консультации и лечение. Вы используете этот отчет на свой страх и риск. © 2017 Consumer Reports.Разработано в сотрудничестве с Американским гериатрическим обществом.
10/2013
Антибиотиков изменяют микробиом кишечника и здоровье хозяина
Кредит: Юлия Петрова / Alamy Stock Photo
Антибиотики действуют не только на бактерии, вызывающие инфекции, но также влияют на микробиоту, живущую там. Хотя этот побочный эффект давно осознали, достижения в технологиях секвенирования позволили подробно изучить, как антибиотики изменяют микробиом кишечника.
Хотя состав микробиоты кишечника варьируется от человека к человеку, сообщество каждого человека остается относительно стабильным с течением времени (этап 7). В 2008 году Релман и его коллеги изучили трех здоровых людей и показали, что лечение ципрофлоксацином влияет на численность примерно одной трети бактериальных таксонов в образцах фекалий. Эти изменения уменьшили таксономическое богатство, разнообразие и равномерность сообщества. Хотя большинство бактериальных групп восстановилось после лечения, некоторые таксоны не восстановились (даже через шесть месяцев), и уровень восстановления варьировал между людьми.Последующее исследование показало, что второй курс ципрофлоксацина имел аналогичные эффекты. Не было корреляции между величиной сдвига микробиома при первом и втором сеансах лечения у любого человека; каждое лечение было очередным «броском кости».
Из-за тесных связей между резидентной микробиотой и хозяином такое нарушение микробиоты антибиотиками может повлиять на физиологию хозяина и потенциально на его здоровье. Действительно, одно исследование показало, что введение антибиотиков молодым мышам увеличивало ожирение и уровни метаболических гормонов в крови, а трансплантация фекалий от мышей, леченных антибиотиками, мышам, свободным от микробов, передала метаболический фенотип.Помимо воздействия на метаболизм, микробиота кишечника также тесно взаимодействует с иммунной системой хозяина и влияет на нее, и, таким образом, нарушения микробиома могут влиять на развитие нескольких аутоиммунных, воспалительных и аллергических заболеваний.
Лечение мышей антибиотиками с рождения также изменяет экспрессию генов и количество клеток, регулирующих иммунные реакции. Импульсное лечение антибиотиками увеличивало частоту диабета типа 1 у восприимчивых мышей, и относительные уровни противовоспалительных Т-клеток были ниже у этих мышей (до начала заболевания), чем у нелеченных мышей.Лечение новорожденных антибиотиками увеличивало восприимчивость взрослых мышей к псориазу, индуцированному имиквимодом.
Аналогичные наблюдения были сделаны для астмы. У детей, которые подвергаются воздействию антибиотиков в первый год жизни, немного повышается риск развития астмы, и этот риск увеличивается с увеличением количества курсов антибиотиков. Регрессионный анализ детей с астмой показал, что раннее воздействие антибиотиков является фактором риска. Численность родов Faecalibacterium , Lachnospira , Veillonella и Rothia (FLVR) снизилась у детей в возрасте трех месяцев, которые лечились антибиотиками и позже у них развилась астма.В экспериментах по переносу фекалий одного из этих детей добавление FLVR уменьшало тяжесть заболевания на мышиной модели астмы. Изменения в составе сообщества сопровождались изменениями метаболитов, таких как ацетат, короткоцепочечная жирная кислота, которая, как известно, влияет на метаболизм и иммунную функцию хозяина. В другом исследовании воздействие антибиотика ванкомицина в раннем возрасте действительно увеличивало иммуноглобулин Е и снижало уровни регуляторных Т-клеток у мышей.
Исследование, изучающее нарушение микробиоты кишечника антибиотиками и риск развития воспалительного заболевания кишечника, также показало, что передача нарушенной микробиоты кишечника от матери мышей их новорожденным детенышам способствовала и ускоряла развитие воспаления кишечника у потомства.
Определенные меры могут помочь восстановить микробное сообщество кишечника до исходного состояния, если потребуются антибиотики. Например, Элинав и его коллеги недавно обнаружили, что введение определенных пробиотиков затрудняет, а аутологичная фекальная трансплантация помогает восстановить микробиом.
Наблюдение за тем, что микробиом кишечника может быть постоянно нарушен даже при краткосрочном лечении или лечении низкими дозами антибиотиков, и что это изменение может иметь долгосрочные последствия для здоровья, предостерегает от широко распространенного и потенциально ненужного использования антибиотиков, особенно у молодых детям и беременным женщинам, и показывает, что антибиотики не следует считать безвредными.Однако это также вселяет надежды на модуляцию микробиома в качестве терапевтического лечения иммунных состояний.
Дополнительная литература
Willing, C.P. et al. Сдвиг баланса: влияние антибиотиков на мутуализм хозяина и микробиоты. Nat. Rev. Microbiol. 9 , 233–243 (2011).
антибиотиков | Johns Hopkins Medicine
Что такое антибиотики?
Антибиотики — сильнодействующие лекарства, применяемые для лечения определенных болезней.Однако антибиотики не лечат все, а ненужные антибиотики могут даже навредить.
Существует 2 основных типа микробов, вызывающих большинство инфекций. Это вирусы и бактерии.
Вирусы вызывают:
Антибиотики не могут убить вирусы или помочь вам почувствовать себя лучше, когда у вас есть вирус.
Бактерии, вызывающие:
Большинство ушных инфекций
Некоторые инфекции носовых пазух
Стрептококковая ангина
Инфекции мочевыводящих путей
Антибиотики убивают определенные бактерии.
Некоторые вирусы вызывают симптомы, напоминающие бактериальные инфекции, а некоторые бактерии могут вызывать симптомы, напоминающие вирусные инфекции. Ваш лечащий врач может определить, какое у вас заболевание, и порекомендовать правильный тип лечения.
Что такое устойчивые бактерии?
Каждый раз, когда вы принимаете антибиотик, бактерии погибают. Иногда бактерии, вызывающие инфекции, уже устойчивы к назначенным антибиотикам. Бактерии также могут стать устойчивыми во время лечения инфекции.Устойчивые бактерии не реагируют на антибиотики и продолжают вызывать инфекцию. Распространенное заблуждение состоит в том, что организм человека становится устойчивым к определенным лекарствам. Однако именно бактерии, а не люди становятся устойчивыми к лекарствам.
Каждый раз, когда вы принимаете или даете ребенку антибиотик без надобности или ненадлежащим образом, вы увеличиваете вероятность развития устойчивых к лекарствам бактерий. Поэтому крайне важно принимать антибиотики только при необходимости. Из-за этих устойчивых бактерий некоторые болезни, которые раньше легко лечить, теперь практически невозможно вылечить.
Бактерии могут развить устойчивость к определенным лекарствам:
Устойчивость к лекарствам возникает, когда бактерии находят способы выжить при использовании лекарств, предназначенных для их уничтожения или ослабления.
Если микроб становится устойчивым ко многим лекарствам, лечение инфекций может стать трудным или даже невозможным.
Человек с инфекцией, устойчивой к определенному лекарству, может передать эту устойчивую инфекцию другому человеку.Таким образом, трудно поддающееся лечению заболевание может передаваться от человека к человеку.
В некоторых случаях устойчивое к антибиотикам заболевание может привести к серьезной инвалидности или даже смерти.
Устойчивость может возникнуть при частичном лечении бактериальной инфекции. Чтобы предотвратить это, важно закончить прием всех назначенных антибиотиков в соответствии с инструкциями, даже если ваш ребенок чувствует себя лучше.
Когда нужны антибиотики?
Этот сложный вопрос, на который должен ответить ваш лечащий врач, зависит от конкретного диагноза.Например, существует несколько типов ушных инфекций — большинству нужны антибиотики, а некоторым нет. Большинство случаев ангины вызваны вирусами. Один вид, стрептококковое горло, диагностированный в лабораторных условиях, требует антибиотиков.
Общие вирусные инфекции, такие как кашель или простуда, иногда могут усложняться, и может развиться бактериальная инфекция. Однако лечение вирусных инфекций антибиотиками для предотвращения бактериальных инфекций не рекомендуется из-за риска возникновения бактериальной резистентности:
Помните, что антибиотики не действуют против вирусной простуды и гриппа, и что ненужные антибиотики могут быть вредными.
Поговорите со своим лечащим врачом об антибиотиках и узнайте о различиях между вирусами и бактериями, а также о том, когда следует и не следует использовать антибиотики.
Если ваш ребенок получает антибиотик, обязательно давайте его точно в соответствии с предписаниями, чтобы уменьшить развитие резистентных бактерий. Попросите ребенка выпить весь рецепт. Не останавливайтесь, когда симптомы инфекции исчезнут.
Никогда не оставляйте остатки антибиотиков на всякий случай.»Эта практика также может привести к устойчивости к бактериям.
Не делитесь своими антибиотиками с кем-то другим и не принимайте антибиотики, прописанные кому-то другому.
Устойчивость к антибиотикам является проблемой как для детей, так и для взрослых.
Помните, что правильный прием антибиотиков и обеспечение правильной вакцинации вашего ребенка поможет избежать приема более опасных и дорогостоящих лекарств.Поговорите со своим врачом для получения дополнительной информации.
Состав кишечных бактерий почти восстанавливается после приема антибиотиков — ScienceDaily
Триллионы бактерий в кишечнике человека влияют на наше здоровье множеством способов, включая влияние на иммунные функции и обмен веществ. Считается, что богатая и разнообразная микробиота кишечника способствует укреплению здоровья, предоставляя человеку-хозяину множество возможностей для предотвращения хронических заболеваний. Напротив, плохое разнообразие экосистемы кишечника является характерной чертой хронических заболеваний, включая ожирение, диабет, астму и воспалительные заболевания кишечника.
Из-за того, что антибиотики в целом убивают бактерии, было высказано предположение, что повторное использование антибиотиков лишает людей богатой бактериальной среды кишечника и, таким образом, приводит к неблагоприятным последствиям для здоровья.
Международная группа исследователей во главе с Копенгагенским университетом и Центром диабета Стено в Копенгагене сообщает, что когда 3 антибиотика давали молодым здоровым мужчинам в течение 4 дней, это привело к почти полному уничтожению кишечных бактерий с последующим постепенным восстановлением большинства бактерий. видов в течение шести месяцев.
Однако по прошествии шести месяцев участникам исследования по-прежнему не хватало девяти общих полезных бактерий, и несколько новых потенциально нежелательных бактерий колонизировали кишечник. Результаты опубликованы сегодня в журнале « Nature Microbiology ».
«Мы показываем, что кишечное бактериальное сообщество здоровых взрослых людей устойчиво и способно восстанавливаться после кратковременного одновременного воздействия трех разных антибиотиков. Однако наши результаты также предполагают, что воздействие антибиотиков широкого спектра действия может уменьшить разнообразие кишечной бактериальной экосистемы. .Антибиотики могут быть благом для сохранения здоровья человека, но их следует использовать только на основании четких доказательств бактериальной причины инфекции », — объясняет руководитель исследования профессор Олуф Педерсен, Центр фундаментальных метаболических исследований Novo Nordisk.
Отсутствуют ли полезные кишечные микробы в западном мире из-за чрезмерного использования антибиотиков?
Исследование представляет собой четырехдневное вмешательство с использованием трех так называемых «крайних мер» антибиотиков широкого спектра действия у 12 взрослых здоровых мужчин. Метод с коктейлем из трех антибиотиков был разработан, чтобы имитировать реальное лечение в отделениях интенсивной терапии.
Кишечник — это резервуар сотен различных видов бактерий с генами устойчивости к антибиотикам. Это было подтверждено в исследовании, поскольку эти бактериальные гены были инициирующей силой, которая привела к пополнению запасов бактерий в кишечнике.
«В этом случае хорошо, что мы можем регенерировать нашу кишечную микробиоту, которая важна для нашего общего здоровья. Однако проблема связана с потенциально необратимой потерей полезных бактерий после многократного воздействия антибиотиков в течение нашей жизни.Есть свидетельства того, что западное население имеет значительно меньшее разнообразие кишечной микробиоты, чем коренные жители, живущие в определенных частях Африки и Амазонки. Одним из возможных объяснений этого может быть широкое использование антибиотиков при лечении инфекционных заболеваний », — говорит Олуф Педерсен.
История Источник:
Материалы предоставлены Копенгагенским университетом Факультет здравоохранения и медицинских наук . Примечание. Содержимое можно редактировать по стилю и длине.
Нарушение экосистемы кишечника антибиотиками
Yonsei Med J. 2018 1 января; 59 (1): 4–12.
1, 2 и 1, 2Mi Young Yoon
1 Департамент микробиологии и иммунологии, Brain Korea 21 Project for Medical Sciences, Сеул, Корея.
2 Институт иммунологии и иммунологических заболеваний, Медицинский колледж Университета Йонсей, Сеул, Корея.
Сан Сун Юн
1 Отдел микробиологии и иммунологии, Brain Korea 21 Project for Medical Sciences, Сеул, Корея.
2 Институт иммунологии и иммунологических заболеваний, Медицинский колледж Университета Йонсей, Сеул, Корея.
1 Отдел микробиологии и иммунологии, Проект Brain Korea 21 для медицинских наук, Сеул, Корея.
2 Институт иммунологии и иммунологических заболеваний, Медицинский колледж Университета Йонсей, Сеул, Корея.
Автор, ответственный за переписку. Автор, ответственный за переписку: д-р Сан Сон Юн, факультет микробиологии и иммунологии, Медицинский колледж Университета Йонсей, 50-1 Йонсей-ро, Содэмун-гу, Сеул 03722, Корея.Тел .: 82-2-2228-1824, Факс: 82-2-392-7088, ca.shuy@nooy_nusgnas © Авторское право: Медицинский колледж Университета Йонсей, 2018 г. Это статья в открытом доступе, распространяемая в соответствии с условиями Creative Commons Attribution Non- Коммерческая лицензия (http://creativecommons.org/licenses/by-nc/4.0/), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. другие статьи в PMC.Abstract
Микробиота кишечника представляет собой сложную экосистему, состоящую из различных микроорганизмов, которая расширяет генетический репертуар человека и, следовательно, влияет на здоровье и болезни человека.Метаболические процессы и пути передачи сигналов хозяина и кишечных микроорганизмов тесно связаны, и ненормальное развитие каждого процесса приводит к изменениям в кишечной среде. Изменения в микробных сообществах приводят к изменениям функциональных структур на основе метаболитов, продуцируемых в кишечнике, и эти изменения окружающей среды приводят к различным бактериальным инфекциям и хроническим кишечным воспалительным заболеваниям. Здесь мы проиллюстрируем, как антибиотики связаны с повышенным риском заболеваний, связанных с антибиотиками, вызывая изменения кишечной среды, которые способствуют распространению и вирулентности патогенов.Понимание патогенеза, вызываемого антибиотиками, будет решающим ключом к лечению заболеваний, связанных с антибиотиками, путем смягчения изменений в кишечной среде и восстановления ее до исходного состояния.
Ключевые слова: Микробиота, антибиотики, трансплантация фекальной микробиоты (FMT), пробиотики, кишечные патогены
ВВЕДЕНИЕ
Кишечная микробиота играет полезную роль во многих физиологических процессах организма хозяина. Он извлекает энергию и питание из пищи, защищает от энтеропатогенов и поддерживает развитие и поддержание иммунной системы хозяина. 1 , 2 , 3 Биоразнообразие кишечной микробиоты среди индивидуумов означает, что она поддерживает состояние гомеостатического равновесия при снижении ее состава и функций. 4 , 5 Особые взаимоотношения между кишечной микробиотой и хозяином являются результатом длительного сосуществования и эволюции. 5 , 6 , 7 Дисбиоз, нарушение микробного состава из-за различных стрессов, вовлечен в воспалительное заболевание кишечника (ВЗК), рак толстой кишки, ожирение, астму и другие заболевания. 1 , 8 , 9 Первым шагом в лечении этих заболеваний является понимание симбиотических отношений между кишечной микробиотой и ее хозяином. Здесь мы рассматриваем и обрисовываем в общих чертах исследования, которые обнаружили, как антибиотики изменяют микробный состав, как результат физические и химические изменения в организме, и как такие изменения становятся триггером заболевания. Наконец, мы обсуждаем недавний прогресс в подходах, направленных на восстановление нарушенной экосистемы.
СИМБИОЗ И ДИСБИОЗ
Позвоночные животные являются хозяевами плотного микробного сообщества бактерий, вирусов и грибов, а именно микробиоты, в органах, содержащих слизистые оболочки, таких как полость рта и кишечник.У здоровых людей Proteobacteria, Bacteroidetes и Archaebacteria считаются основными таксонами бактерий. 10 Поселяясь в кишечнике, эти разнообразные микроорганизмы образуют сложные экологические сети посредством взаимодействия с другими бактериями для получения питательных веществ, необходимых для их колонизации и размножения. 3 , 4 , 11 , 12 , 13 Взаимодействия между хозяином и микробами и микробно-микробными взаимодействиями устанавливают состояние равновесия микробного состава в кишечном тракте. 6 , 10 , 14 Полная кишечная микробиота поддерживает симбиоз кишечника, подавляя вторжение микроорганизмов извне и регулируя чрезмерное размножение микроорганизмов, которые присутствуют в кишечнике в небольшом количестве. Когда кишечные микробные сообщества разрушаются или становятся неуравновешенными из-за множества причин, таких как антибиотики, химические токсические вещества, патогенные инфекции и резкие изменения в пищевых привычках, иммунные реакции хозяина действуют ненормально, что приводит к ВЗК. 6 , 8 , 15 В частности, чрезмерное дозирование антибиотиков вызывает потерю естественной кишечной микробиоты. Такая потеря увеличивает количество дрожжей, таких как Candida albicans , и бактерий, таких как Proteus , Staphylococcus и Clostridium difficile ( C. difficile ), которые обычно существуют в небольших количествах, что приводит к угнетение пищеварительной функции или возникновение заболеваний кишечника. 8 , 9 , 16 , 17 Подразумевается, что внешние стимулы изначально вызывают нарушения в кишечной среде, которые приводят к одному из четырех состояний: сопротивление, сопротивляемость, избыточность или дисбактериоз — в зависимости от того, преодолевается микробной экосистемой кишечника. 4 , 12 , 14 , 18 , 19 , 20 Когда кишечная микробиота соответствующим образом реагирует на любые колебания и восстанавливается до своего исходного состояния до того, как подвергнуться стрессу из-за воздействия окружающей среды, состояние окружающей среды кишечника считается сопротивлением. 7 Однако в случаях, когда стресс очень силен, происходят изменения в сообществе на уровне родов или видов и потеря функций, и кишечная среда начинает изменяться в следующих трех направлениях: если эффект незначителен, экосистема кишечника переходит в состояние устойчивости с микробным сообществом, аналогичным исходному, путем преобразования в исходное состояние. В состоянии избыточности рост бактерий, отличных от бактерий в исходном состоянии, увеличивается, так что разнообразие бактерий увеличивается, хотя гены не претерпевают функциональных изменений.В этом случае продуцируются белки и метаболиты, аналогичные исходным по функциям. 12 , 18 , 21 Устойчивость, устойчивость и избыточность — это атрибуты, которые проявляются, когда кишечная микробиота сильна и показывает функциональное восстановление. 14 , 15 , 18 Напротив, дисбиоз относится к состоянию, при котором необратимые изменения происходят в кишечной микробиоте с вариациями и функциональными повреждениями на уровне генов или белков, что в конечном итоге приводит к нарушениям ответов и иммунной системы. в кишечных эпителиальных клетках вместе с изменениями кишечных метаболитов.
АНТИБИОТИКИ ИЗМЕНЯЮТ БАЛАНС СООБЩЕСТВА И ФУНКЦИЮ МИКРОБИОТЫ КИШЕЧНИКА
Антибиотики могут быть очень мощным фактором, вызывающим дисбаланс микробиоты кишечника. 22 , 23 , 24 В 1954 году Bohnhoff и др. заметили, что мыши, которым давали стрептомицин, легко заражались сероваром Enteritidis Salmonella enterica и представили концепцию, согласно которой кишечная микробиота может подавлять рост бактерий, вторгающихся в мышей извне за счет устойчивости к колонизации. 25 Прямое взаимодействие кишечной микробиоты с бактериями и конкуренция за кишечные питательные вещества являются прямыми методами подавления колонизации кишечника патогенами. Однако дозирование антибиотиков снижает разнообразие и численность кишечной микробиоты, что приводит к снижению способности конкурентного исключения. 26 , 27 , 28 Косвенно это разрушает структуру сообщества, тем самым нарушая взаимодействия между видами микробов и дополнительные системы метаболических путей питательных веществ, что приводит к широко распространенным колебаниям в кишечной среде.Эти изменения полностью не отменяются даже после нескольких месяцев прекращения приема препарата. 16 , 22 В конце концов, вызванный антибиотиками дисбиоз кишечной микробиоты влияет на развитие и регуляцию иммунной системы и увеличивает риск кишечных заболеваний, таких как ВЗК и инфекционные заболевания, в дополнение к разнообразному иммунитету: связанные расстройства, такие как аллергические или атопические кожные заболевания и диабет 1 типа. 16 , 28 , 29 В эксперименте, в котором мышей лечили антибиотиками в субтерапевтических концентрациях, изменения в составе кишечной микробиоты были связаны с изменениями общей массы тела, содержания жира в организме, плотности костей, продуктивности. короткоцепочечных жирных кислот (SCFA) и метаболизма жирных кислот в печени.Чтобы понять влияние антибиотиков на гомеостаз иммунной системы, нам сначала нужно понять, как антибиотики сильно меняют микробную экосистему кишечника. Антибиотики обычно вводят для уничтожения определенных микроорганизмов; однако, поскольку большинство антибиотиков обладают широким спектром действия, они также влияют на родственные микроорганизмы. Эти эффекты сохраняются в кишечной среде в течение нескольких месяцев после прекращения приема препарата. 19 , 23 , 30 , 31 Влияние антибиотиков на таксономический состав кишечной микробиоты у разных людей различается, а симптомы, такие как уменьшение разнообразия бактерий, снижение гомологии и относительное чрезмерное увеличение определенных видов восстанавливается или сохраняется.Другие симптомы также могут возникать в зависимости от различий в характеристиках людей.
Исследования воздействия антибиотиков сразу после рождения показывают, что численность и разнообразие кишечной микробиоты меняются независимо от типа антибиотика. 32 , 33 Микробиота кишечника недоношенных детей, рожденных до 33 недель, примерно в 10 раз меньше, чем у доношенных детей. Кроме того, воздействие различных антибиотиков сразу после рождения также приводит к заметным различиям в первоначальном формировании микробных сообществ.В частности, численность и разнообразие кишечной микробиоты быстро снижается при воздействии меропенема, цефотаксима и тикарциллин-клавуланата. В отличие от других антибиотиков, прием ванкомицина и гентамицина не сильно меняет разнообразие, но наблюдается увеличение экспрессии генов, связанных с устойчивостью к этим антибиотикам. Активная регуляция таких генов показывает тесную связь с увеличением количества определенных микроорганизмов. В частности, тикарциллин-клавуланат и ампициллин связаны с заметным увеличением количества Klebsiella pneumoniae вместе с увеличением экспрессии генов, связанных с устойчивостью к антибиотикам. 34
Анаэробные бактерии составляют большую часть кишечной микробиоты и играют важную роль в развитии кишечного иммунитета. 15 , 26 , 32 , 33 , 35 Эти организмы производят летучие жирные кислоты, такие как бутират, которые активируют иммунные клетки для поддержания здоровья кишечника. Клиндамицин, антибиотик широкого спектра действия против анаэробных бактерий, выделяется из желчи после приема и накапливается в высоких концентрациях в кале, влияя на состав кишечной микробиоты в течение длительного времени, даже после прекращения приема. 22 Клиндамицин, как известно, оказывает наибольшее влияние на функцию кишечной микробиоты, которая проявляет устойчивость к патогенным бактериям C. difficile . Исследования влияния кларитромицина, метронидазола и омепразола на состав таксонов глоточных и фекальных бактерий показывают, что эти антибиотики могут влиять на 30% или более состава микробиоты, и, хотя микробиота может частично восстанавливаться, эффекты могут сохраняться до не менее 4 лет после заражения. 33 Кроме того, анализ изменений микробиоты до и после лечения пациентов фторхинолоновыми и β-лактамными антибиотиками в течение 1 недели показал, что количество копий 16S рРНК не изменилось или не увеличилось, в то время как изменения в составе микробиоты и сокращение разнообразия не наблюдалось. В частности, наблюдалось увеличение соотношения Bacteroidetes и Firmicutetes, а распределение бактериальных таксонов имело тенденцию к упрощению. 26
Даже ципрофлоксацин, который проявляет относительно низкую активность в отношении анаэробных бактерий, может оказывать сильное влияние на состав кишечной микробиоты. 36 , 37 Ципрофлоксацин назначался в течение 5 дней пациентам, которые ранее не принимали антибиотик, и были проанализированы изменения микробиоты кишечника между 60 днями до и после дозирования, а также между после дозирования и через 6 месяцев после прекращения дозирования. Результаты показали, что разнообразие бактериальных таксонов уменьшилось примерно на треть, а таксономическая численность, разнообразие и однородность кишечной микробиоты снизились. 36 , 38 Результаты другого исследования показали, что разнообразие бактериальных таксонов уже начало уменьшаться на ранних стадиях воздействия антибиотика, и когда различия в ответах между людьми, а также степень и время восстановления микробиота была измерена, наблюдалось повсеместное снижение численности Ruminococcaceae , в дополнение к быстрому разрушению бактериального разнообразия.Хотя некоторые изменения состава сохранялись, даже по прошествии 6 месяцев, большинство композиций демонстрировали тенденцию к почти полному восстановлению через 1 месяц после введения дозы. Было показано, что эти различия связаны с разнообразием кишечной микробиоты на ранней стадии, что указывает на то, что разнообразие бактериальных таксонов кишечной микробиоты играет важную роль в последующем восстановлении разнообразия до состояния избыточности. 5 , 37 Кроме того, повторное воздействие того же количества ципрофлоксацина через 6 месяцев показало аналогичные эффекты на структуру кишечной микробиоты, хотя наблюдалась тенденция к менее эффективному восстановлению. 36
РАСПРОСТРАНЕНИЕ ИНФЕКЦИОННЫХ БАКТЕРИЙ КИШЕЧНИКА
Антибиотики вызывают распространение кишечных патогенных бактерий 22 из-за способности инфекционных бактерий эффективно использовать расстройство, возникающее при разрушении кишечной микробиоты. 10 , 39 Хотя все еще остается много вопросов о причинах увеличения бактериальных инфекций в кишечнике после лечения антибиотиками, наиболее интересные факты, выявленные к настоящему времени, описаны ниже ().
Патогены используют вызванные антибиотиками воспалительные состояния. Патогены используют сахара и неорганические соединения, вырабатываемые кишечной микробиотой, в качестве источников углерода или энергии и выполняют анаэробное дыхание при воспалительных состояниях, вызванных антибиотиками. (A) Когда распространение кишечных микроорганизмов находится в стабильном состоянии, инвазия патогенных бактерий подавляется антимикробными веществами, продуцируемыми кишечными бактериями и клетками-хозяевами, и воспаление контролируется соответствующим образом.(B) При воспалительном состоянии колонизация E. coli и Salmonella увеличивается за счет анаэробного дыхания с использованием ROS и RNS, которые высвобождаются DUOX2 и iNOS в эпителиальных клетках. Сероводород, полученный из сульфатредуцирующих бактерий, таких как Desulfovibrio spp. превращается в тиосульфат во время клеточного дыхания в эпителиальных клетках толстой кишки. АФК, генерируемые нейтрофилами, превращают тиосульфат в тетратионат, который можно использовать в качестве акцептора электронов.Во время этого процесса образующийся тетратионат ускоряет рост S. Typhimurium посредством дыхания тетратионата, которое превращает тетратионат в тиосульфат. E. coli восстанавливает нитраты до нитритов посредством нитратного дыхания. (C) Bacteroides thetaiotaomicron разлагает гликоконъюгаты слизистой оболочки с образованием сиаловой кислоты. EHEC и Salmonella могут использовать сиаловую кислоту в качестве источника углерода. Воспалительные состояния приводят к высвобождению фукозы из гликана хозяина, и высвобожденная фукоза впоследствии потребляется патогенами.Например, известно, что EHEC регулирует экспрессию генов вирулентности, ощущая фукозу. (D) C. difficile , C. rodentium и EHEC используют сукцинат, который продуцируется другими кишечными микроорганизмами. SCFAs выделяются в процессе метаболизма полисахаридов аэробными бактериями, а бутират, пропионат и ацетат преимущественно присутствуют в кишечной среде. Комменсальная бактерия, Bacteroides spp., В основном распределяет сукцинат, который впоследствии в стабильном состоянии потребляется вторичными ферментативными микробами и поэтому редко накапливается в кишечной среде.Однако сукцинат не потребляется при лечении антибиотиками или при воспалительных процессах, что в конечном итоге приводит к его накоплению в просвете кишечника. Сукцинат способствует глюконеогенезу EHEC. Кроме того, усилены колонизация и пролиферация C. rodentium , особенно при экспрессии генов вирулентности LEE. C. difficile может сочетать метаболизм сукцината и превращать его в бутират с ферментацией углеводов, тем самым усиливая его колонизацию и вирулентность.(E) Антибиотики могут вызвать рост энтеробактерий. АФК в высоких концентрациях приводит к размножению E. coli , несущей дополнительную каталазу, которая генерируется генетически путем хромосомной модификации, и в конечном итоге способствует кишечной колонизации Vibrio cholerae , штамма, который является высокочувствительным штаммом к АФК, за счет снижения АФК которые чрезмерно генерируются при воспалительных состояниях. E. coli , Escherichia coli ; АФК, активные формы кислорода; RNS, активные формы азота; iNOS, индуцибельная синтаза оксида азота; EHEC, Enterohemorrhagic Escherichia coli ; С.difficile , Clostridium difficile ; C. rodentium , Citrobacter rodentium ; SCFAs, короткоцепочечные жирные кислоты; LEE, место сглаживания энтероцитов.
Воспалительные реакции хозяев
В кишечной среде обязательные анаэробные бактерии, такие как Bacteroidia и Clostridia , не имеют генов, связанных с аэробным дыханием, и растут за счет ферментации аминокислот или полисахаридов (). Дисбаланс кишечной микробиоты вызывает воспалительные реакции кишечника, и наиболее важным изменением окружающей среды в этом отношении является увеличение количества активных форм азота (RNS) и активных форм кислорода (ROS).У пациентов, страдающих ВЗК, увеличивается экспрессия индуцибельной синтазы оксида азота в кишечном эпителии и увеличивается концентрация оксида азота (NO — ) в просвете толстой кишки. NO — реагирует с супероксидными радикалами (O 2-) с образованием пероксинитрита (ONOO —) с образованием нитрата (NO 3-) или окисляет органические сульфиды и третичные амины до S-оксидов и N- оксиды соответственно. В отличие от обязательных анаэробных бактерий, Enterobacteriaceae способны к анаэробному дыханию, используя нитраты, S-оксиды и N-оксиды в качестве конечных рецепторов переноса электронов. 40 АФК и РНС, продуцируемые иммунной системой хозяина, могут использоваться факультативными анаэробными бактериями, такими как Escherichia coli ( E. coli ) и аэробными бактериями. 41 , 42 E. coli присутствует в небольшом количестве в здоровом кишечнике, но ее уровни имеют тенденцию к значительному увеличению у мышей, получавших стрептомицин (). Мутант E. coli , лишенный moaA, гена, необходимого для биосинтеза кофактора молибдена, который абсолютно необходим для активности нитратредуктаз, S-оксидредуктаз и N-оксидредуктаз, имеет тенденцию демонстрировать снижение кишечной пролиферации. у мышей с воспалением, вызванным декстрансульфатом натрия. 42 Salmonella также подвергается аэробному дыханию с использованием АФК, продуцируемых нейтрофилами и тетратионатом (S 4 O 6 2-), соединением для переноса электрона, образующимся в процессе окисления сероводорода (H 2 ). S), продуцируемые микроорганизмами (). 42 При исследовании патогенеза Vibrio cholerae в условиях окислительного стресса, вызванного различными антибиотиками, после введения стрептомицина наблюдался чрезмерный рост Enterobacteriaceae и Enterococci. 43 Это исследование показало, что изменения в сообществе кишечной микробиоты, вызванные антибиотиком, приводят к увеличению ROS в кишечной среде. Атипичная кишечная палочка , несущая дополнительную каталазу ( katE ), адаптирована к этой среде и чрезмерно размножается, что приводит к временному снижению концентрации АФК, и бактерии холеры могут эффективно использовать такие условия ().
Питательные вещества кишечника
Микроорганизмы производят и потребляют продукты посредством различных метаболических путей, поэтому экосистема состоит из очень сложных сетей. 44 , 45 Archaebacteriae Methanobrevibacter smithii и Bacteroides thethaiotaomicron могут более эффективно внедряться у стерильных крыс вместе, чем по отдельности, благодаря сотрудничеству в метаболизме полисахаридов через путь, который превращает фруктан в ацетат и образующийся формиат. 46 Кроме того, результаты, показывающие, что Bifidobacterium adolescentis , который разлагает макромолекулярные углеводы, способен обеспечивать лактат и ацетат субстратов для бактерий, производящих бутират в кишечнике, демонстрируют способность бактерий использовать друг друга для преодоления условий недостаточного метаболические пути. 47
Сообщалось, что антибиотики изменяют кишечную микробиоту, участвующую в углеводном обмене, тем самым увеличивая кишечную концентрацию углеводов, необходимых для размножения инфекционных бактерий. 48 Большинство кишечных резидентных бактерий и патогенных бактерий могут использовать кишечную сиаловую кислоту (Neu5Ac) в качестве питательного вещества (). Bacteroides thetatiotaomicron ( B. thetatiotaomicron ), одна из репрезентативных комменсальных бактерий, обладает ферментом сиалидазой, способным разрушать гликоконъюгаты, присутствующие в слизистой оболочке, с образованием сиаловой кислоты , но метаболический путь, который потребляет ее, является неполным. 49 Напротив, Salmonella enterica серовар Typhimurium ( S. Typhimurium в дальнейшем) и C. difficile имеют оперон nan , который необходим для использования сиаловой кислоты, но не содержат сиалидазы, которая требуется. для производства сиаловой кислоты из слизистой оболочки кишечника. Когда B. thetatiotaomicron был перенесен на стерильных мышей и степень метаболизма сиаловой кислоты у S. Typhimurium и C. difficile у этих мышей сравнивали с таковой у необработанных мышей, экспрессия nanE увеличивалась. (ген в пути деградации сиаловой кислоты) и оперон fuc1 (кластер генов, метаболизирующих фукозу) наблюдались в S.Typhimurium , пролиферирующий у мышей B. thetatiotaomicron . В случае C. difficile наблюдалось увеличение экспрессии генов nanA и nanE . Кроме того, когда нормальных мышей лечили стрептомицином, производилось относительно больше сиаловой кислоты, и в группе, получавшей антибиотик, было выявлено увеличение экспрессии генов, связанных с метаболизмом сиаловой кислоты. 49 Другое исследование показало, что C.difficile способна размножаться в кишечнике с помощью метаболического пути сукцинат-бутират (). В присутствии B. thetatiotaomicron дополнительно индуцируется путь, по которому C. difficile метаболизирует сукцинат, продукт ферментации B. thetatiotaomicron , в бутират. 50 В средах с избытком полисахарида B. thetatiotaomicron производит сукцинат высокой концентрации, а C. difficile производит бутират.Кроме того, количество сукцината, присутствующего в кишечнике мышей с нормальной бактериальной флорой, увеличивалось после лечения антибиотиками, а мутантные штаммы, лишенные способности использовать сукцинат из-за потери переносчика сукцината, демонстрировали снижение кишечной пролиферации. 50 Фактически, B. thetatiotaomicron — это нормальная кишечная бактериальная флора и полезная бактерия, способная метаболизировать различные углеводы. Следовательно, производство сукцината также происходит в условиях нормальной бактериальной флоры. 51 Однако в этом исследовании уровни SCFAs ацетата и бутирата снизились, в то время как уровень сукцината увеличился в кишечнике, где диарея была вызвана лечением антибиотиками или полиэтиленгликолем, что указывает на повышение уровня сукцината из-за изменений в кишечном глюконеогенезе. вызванные антибиотиками, могут быть одной из различных причин, способствующих пролиферации C. difficile . Использование сукцината также наблюдается в Citrobacter rodentium ( C.rodentium ) (). Известно, что C. rodentium инициирует экспрессию генов патогенных факторов ler, espA, eae, nleAr и stx2, которые являются локусом генов удаления энтероцитов, необходимых для кишечных инфекций, путем распознавания сукцината и регулирования фактора транскрипции Cra. 52
Компоненты респираторной системы транспорта электронов
Воспалительные реакции кишечника помогают S. Typhimurium распространяться в просвет толстой кишки, а миграция в толстую кишку способствует переносу фекалий в полость рта другим высокочувствительным хозяевам. 25 , 53 , 54 S. typhimurium , который вызывает сальмонеллез у людей, как сообщается, амплифицируется у мышей, получавших ванкомицин и стрептомицин. 16 В частности, чрезмерное употребление антибиотиков во время послеоперационного выздоровления может вызвать рецидив бактериальных инфекций и патологических симптомов. Известные патогенные факторы для нетифоидной Salmonella , такие как S. typhimurium , включают систему секреции типа III, связанную с инвазией (T3SS-1), необходимую для проникновения патогена в эпителиальные клетки кишечника, и секрецию второго типа III. система (T3SS-2), необходимая для выживания возбудителя в тканях.Увеличение пролиферации S. Typhimurium в кишечнике объясняется увеличением компонентов транспорта респираторных электронов, генерируемых во время воспалительных реакций хозяина (). Например, S. Typhimurium может образовывать нитрат, субстрат для анаэробного дыхания, используя РНС, один из результатов воспаления. 55 Другие примеры объясняются использованием SCFA (). SCFAs, такие как бутират, ацетат и пропионат, продуцируются анаэробными бактериями, присутствующими в толстом кишечнике, и используются для барьерных функций, таких как секреция IL-8 и выработка слизи эпителиальными клетками кишечника, плотное соединение между клетками кишечника и активация кишечных клеток. 44 , 56 , 57 Они также используются в качестве источника энергии для клеток кишечника. Кроме того, бутират играет роль в регуляции фактора, индуцируемого гипоксией (HIF), фактора транскрипции, который регулирует барьерную функцию, выработку слизи и защищает от патогенов эпителиальных клеток кишечника. 45 , 57 Эпителий толстой кишки относительно гипоксичен, потому что он расположен между просветом кишечника с низким парциальным давлением кислорода и собственной пластинкой с высокой концентрацией кислорода.SCFAs способствуют потреблению O 2 клеток кишечника человека для поддержания анаэробной среды кишечника и стабилизации HIF-1α, субъединицы HIF. После обработки антибиотиками окрашивание чувствительным красителем пимонидазолом O 2- пропадало, и активность HIF-1α снижалась. Кроме того, пероральное введение бутирата приводило к увеличению концентрации HIF-1α и восстановлению барьерного эффекта кишечных клеток в зависимости от концентрации байтрата. 45
Влияние антибиотиков на гипоксический барьер кишечных эпителиальных клеток.(A) В нормальных условиях напряжение кислорода неуклонно снижается от подслизистого слоя кишечника к просвету. Хотя парциальное давление кислорода в базальном слое составляет примерно 100 мм рт. Ст., В просвете оно составляет почти 0 мм рт. При лечении антибиотиками или при воспалительных условиях Clostridia продуцируют бутират, а эпителиальные клетки толстой кишки превращают бутират в двуокись углерода, что приводит к поддержанию гипоксии в просвете. (B) Когда в кишечнике не хватает бутирата, клетки используют глюкозу для клеточного дыхания, а лактат, который выделяется во время процесса, увеличивает оксигенацию в просвете. S. Typhimurium может пролиферировать с использованием цитохрома bd-II оксидазы, кодируемой в cyxB , которая высоко экспрессируется при низких концентрациях кислорода.
Лечение антибиотиками увеличивает производство кислорода в эпителиальных клетках толстой кишки, увеличивая содержание кислорода в просвете кишечника. Ожидается, что уменьшение содержания Clostridia , продуцента бутирата, усилит реакции окисления клеток кишечника и будет способствовать диффузии кислорода в просвет кишечника (2).Кислород — единственный рецептор респираторного транспорта электронов с большим окислительно-восстановительным потенциалом, чем нитрат, и более эффективно используется аэробными или факультативно анаэробными микроорганизмами. Парциальное давление кислорода, составляющее около 100 мм рт. Ст. В базальном слое, становится 20-40 мм рт. Ст. В слое слизи и достигает почти 0 мм рт. Ст. В просвете, что приводит к гипоксии. 58 Следовательно, изменения парциального давления кислорода в кишечнике, вызванные лечением антибиотиками, являются первым препятствием для выживания кишечной микробиоты и могут быть очень важным фактором в индукции инфекционного заболевания.Клетки толстой кишки окисляют бутират с образованием CO 2 , что приводит к гипоксическому (<7,6 мм рт. Ст. Или <1% O 2 ) состоянию. Однако в случае новорожденных мышей, поскольку бутират, являющийся метаболитом кишечной микробиоты, отсутствует, энергия получается путем производства лактата из глюкозы. Этот процесс увеличивает оксигенацию клеток кишечника. 45 Для дыхания с использованием кислорода Salmonella использует цитохром bd оксидазу, продуцируемую cydA , и цитохром bd-II оксидазу, продуцируемую cyxB . Salmonella может размножаться с помощью оксидазы цитохрома bd-II при низком парциальном давлении кислорода (0,8%) (). 54 Кроме того, лечение трибутирином спасало толстую кишку мышей, получавших стрептомицин, от состояния гипоксии и увеличивало концентрацию бутирата в слепой кишке.
ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АНТИБИОТИКАМИ
Самым серьезным заболеванием кишечника, вызываемым антибиотиками, является псевдомембранозное заболевание, которое является типичной диареей, связанной с антибиотиками, вызванной повышением уровня C.difficile . Инфекция C. difficile (CDI) является одной из наиболее распространенных патогенных инфекций и особенно распространена среди пациентов, постоянно принимающих антибиотики. 48 , 59 , 60 ИКД впервые была признана в развитых странах, таких как США и европейские страны, где наблюдается много случаев заболевания. Лечение и рецидивы этого заболевания происходят неоднократно, и, поскольку рецидивирующие случаи не поддаются лечению с помощью общих антибиотиков, эта бактерия классифицируется как возбудитель серьезного заболевания. 59 Контроль и полное лечение C. difficile сложно, потому что его споры могут выжить несколько лет даже в алкоголе. 48 Несмотря на то, что число пациентов с ИКД в зарубежных странах постоянно растет, количество случаев заболевания в Южной Корее по-прежнему невелико, хотя коллективные вспышки считаются возможными.
Были предприняты такие подходы, как разработка антибиотиков с новым активным механизмом, нацеливание на патогенные факторы или использование природных микроорганизмов, таких как пробиотики. 61 , 62 Однако такие разработки или попытки все еще вызывают много споров с точки зрения безопасности или эффективности. В следующем разделе представлены репрезентативные методы лечения без применения антибиотиков, используемые для лечения C. difficile и других заболеваний кишечника.
Трансплантация фекальной микробиоты
Трансплантация фекальной микробиоты (FMT), метод, который включает инъекцию фекальных микроорганизмов здоровых людей, которые с высокой вероятностью имеют структуру кишечной микробиоты, аналогичную микробиоте пациента, для восстановления нормальной бактериальной флоры кишечник, было показано, что он эффективен в различных клинических испытаниях.Трансплантация фекальной микробиоты приводит к восстановлению кишечной среды пациентов с составом кишечной микробиоты донора, в конечном итоге вызывая относительный контроль над C. difficile и тем самым обеспечивая эффективное лечение. 63 , 64 Этот метод очень эффективен и, как сообщается, показывает процент излечения в диапазоне 80-100%, в зависимости от количества применений FMT. Это очень эффективно, поскольку обеспечение здоровой кишечной микробиоты позволяет приобрести способность противостоять вторичной проблеме инфицирования другими патогенами, такими как устойчивые к ванкомицину Enterococcus и устойчивые к карбапенемам Enterobacteriaceae. 48 , 64 , 65 FMT, по-видимому, является важной альтернативой антибиотикам, которые уничтожают важные комменсальные бактерии и обеспечивают устойчивость к колонизации, такую как исключение ниш для патогенов, производство противомикробных препаратов и активация иммунной системы слизистый слой. 64
В недавних исследованиях была предпринята попытка борьбы с инфекциями Salmonella с использованием бактериальной флоры, таксоны и характеристики которой были идентифицированы среди бактерий, выделенных из кишечника. 62 Терапевтическая микробная экосистема (MET-1) — это экологическая система, состоящая из 33 видов микроорганизмов, выделенных из фекалий человека, включая актинобактерии (в основном Bifidobacterium spp.), Bacteroidetes, Firmicutes и Proteobacteria. У мышей, получавших MET-1, наблюдалась потеря массы тела из-за инфекции S. Typhimurium , а также снижение сывороточных цитокинов, ядерное окрашивание NF-κB и инфильтрация нейтрофилов в слепой кишке. Кроме того, в слепой кишке сохранялся ZO-1, белок с плотными контактами, клеточная локализация клаудина-1 снижалась и S.Транслокация Typhimurium в селезенку уменьшилась. Однако не было изменений в колониеобразующих единицах Salmonella в кишечнике. Следовательно, MET-1 должен был регулировать системные инфекции путем поддержания плотного соединения для контроля доступа к системному кровообращению. 62
Несмотря на многочисленные попытки и положительные результаты, все еще остаются вопросы о безопасности FMT. Взаимодействия между патогенными бактериями и микроорганизмами непростые, и соответствующей информации все еще недостаточно.Кроме того, промышленное использование FMT увеличивается, а использование FMT пациентами, у которых не был определен диагноз ИКД, может вызвать другие проблемы, а также существует возможность существования других патогенов в кишечной микробиоте донора. Следовательно, использование FMT требует строгих критериев в отношении оптимизированного состава кишечной микробиоты, основанных на составе и функциях микроорганизмов, которые подходят для лечения заболевания, вызывающего заболевание, возраста реципиента и стадии прогрессирования заболевания. 63 Получение подтвержденной бактериальной флоры путем полного обследования состояния здоровья донора, определения того, является ли какое-либо генетическое заболевание латентным, и подробный анализ состава кишечной микробиоты очень важны. 64
Пробиотики
Пробиотики начали сосредотачиваться в 1908 году, когда Мечников сообщил о взаимосвязи между ферментированной пищей и долголетием, объяснив, что кишечная микробиота развивает иммунную систему слизистых оболочек и может предотвратить вторжение инфекционных бактерий.После этого различные бактериальные таксоны были протестированы в различных экспериментальных условиях, чтобы определить, могут ли пробиотики лечить различные заболевания кишечника, такие как болезнь Крона и язвенный колит, синдром раздраженного кишечника, ИКД, инфекционная диарея и некротический энтероколит. 35 , 61 , 66 , 67 Идея о том, что пробиотики могут улучшить или предотвратить диарею, началась с представления о том, что эти кишечные заболевания были вызваны коллапсом «устойчивости к колонизации» из-за отсутствия нормальных бактериальная флора.Во многих исследованиях пробиотики использовались для лечения заболеваний кишечника путем активации иммунной системы, конкуренции за места поселения в клетках кишечника и выработки бактериоцина. Эти эффекты различаются в зависимости от формы и причин диареи, например, вирусной диареи, диареи, связанной с антибиотиками, или диареи путешественника.
Пробиотики, как известно, очень эффективны для лечения диареи, связанной с антибиотиками, с Saccharomyces boulardii ( S.boulardii ), E. coli Nissle 1917, Lactobacillus и Bifidobacterium в качестве основного объекта исследований. 66 , 68 Положительные эффекты были выявлены в условиях, когда молочнокислые бактерии, такие как Lactobacillus GG (LGG), S. boulardii , E. faecium , Lactobacillus acidophilus ( L. acidophilus ) , и Lactobacillus bulgaris принимали вместе с различными типами антибиотиков. 35 Когда здоровые взрослые были проинструктированы о приеме эритромицина и LGG, наблюдалось сокращение продолжительности симптомов диареи с 8 до 2 дней, а частота сопутствующих симптомов, таких как боль в животе, снизилась с 39% до 23%. В педиатрическом исследовании, проведенном с участием примерно 200 детей, которым вводили антибиотики, назначение LGG снизило частоту диареи с 26% до 8% и сократило период диареи с 5,88 дней до 4,7 дней. 67 Кроме того, л.plantarum 299v, вводимый вместе с пероральными антибиотиками, облегчал симптомы заболеваний, возникших после прекращения использования антибиотиков, а L. rhamnosus предотвращал диарею, вызванную лечением антибиотиками. 68 S. boulardii способен расщеплять C. difficile токсин A и токсин B, высвобождая протеазу 54 кДа. В исследовании, проведенном с участием 138 пациентов больницы, в котором пациенты, которым случайным образом назначался пробиотический штамм, сравнивались с пациентами плацебо, только 2.Было обнаружено, что 9% тех, кто принимал пробиотики, имели токсина C. difficile по сравнению с 7,25% пациентов, получавших плацебо.61 Когда были исследованы все образцы кала, только 46% группы, принимавшей пробиотики, показали C. difficile токсин-положительных реакций по сравнению с 78% в группе плацебо. Кроме того, была продемонстрирована эффективность пробиотиков в качестве адъювантных терапевтических агентов. В исследовании, проведенном с участием 124 взрослых пациентов с заболеванием, ассоциированным с Clostridium difficile, примерно 60% пациентов прописали S.boulardii вместе с антибиотиками облегчили симптомы инфекции. Кроме того, S. boulardii также продемонстрировал относительные эффекты для профилактики вторичных заболеваний у пациентов с риском рецидива ИКД, 61 , 67 , хотя это противоречиво.
Результаты исследований, проведенных на данный момент, показывают, что механизмы, с помощью которых пробиотики могут лечить заболевания, весьма разнообразны, и информация о том, какие механизмы индуцируют отдельные пробиотики, полностью не проверена.Эти механизмы варьируются в зависимости от типов бактериальных таксонов, используемых в качестве пробиотиков, и типа экспериментального заболевания, и известные эффекты в основном включают поддержание взаимодействий между хозяином и микроорганизмами, удаление бактерий, секрецию слизи из бокаловидных клеток, контроль функции эпителиального барьера. кишечных клеток, производство антибактериальных факторов, таких как молочная кислота, перекись водорода и бактериоцин, и активация приобретенной иммунной системы хозяина. 20 , 35 , 67 , 68 Однако различные механизмы, используемые для получения положительных эффектов, затрудняют выбор пробиотиков.По сути, для проверки эффектов необходимо определить, выживут ли пробиотики, а также продуцируемые поверхностные белки и бактериоцин. Кроме того, чтобы использовать пробиотики для лечения различных заболеваний, необходимо точно определить как заболевание, так и механизмы действия пробиотиков. Тщательный выбор полностью изученных и проверенных пробиотиков может обеспечить альтернативную терапию для улучшения здоровья и заменить антибиотики в основных терапевтических целях.
ЗАКЛЮЧЕНИЕ
Диарея, связанная с антибиотиками, возникающая у пациентов, принимающих антибиотики, подчеркивает важность сбалансированной кишечной микробиоты.Воздействие антибиотиков на кишечную микробиоту на самом деле является ключом к пониманию того, какие молекулярные вещества или механизмы каждая инфекционная бактерия может эффективно использовать в изменившейся среде, чтобы расти и вызывать заболевание в среде хозяина. Недавние исследования предоставили информацию о том, как антибиотики могут изменять кишечную среду, как реагируют вредные бактерии и полезные бактерии и как патогенные бактерии используют эту среду. Патогены используют сахара, радикалы и кислород, возникающие в результате нарушения кишечной микробиоты и воспалительной реакции хозяина.Применение FMT и пробиотиков для искоренения желудочно-кишечных заболеваний и энтеропатогенов демонстрирует потенциал для восстановления деградированной экосистемы и защиты от колонизации и распространения энтеропатогенов. Это новое исследование дало нам лучшее понимание и новые направления при рассмотрении будущих подходов к лечению инфекционных заболеваний, связанных с антибиотиками.
БЛАГОДАРНОСТИ
Данное исследование было поддержано грантами Корейского национального исследовательского фонда (NRF), финансируемых правительством Кореи (MSIP), 2017M3A9F3041233, 2017R1A2A2A05019987, 2015M3C9A2054024 и 2017R11200A1A0500.
Сноски
У авторов нет финансового конфликта интересов.
Ссылки
1. Кумар Х., Лунд Р., Лайхо А., Лунделин К., Лей Р.Э., Исолаури Э. и др. Микробиота кишечника как эпигенетический регулятор: пилотное исследование, основанное на анализе метилирования всего генома. MBio. 2014; 5: e02113 – e02114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 2. Ха CW, Лам YY, Холмс AJ. Механические связи между динамикой микробного сообщества кишечника, микробными функциями и метаболическим здоровьем. Мир Дж. Гастроэнтерол.2014; 20: 16498–16517. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Соммер Ф., Андерсон Дж. М., Бхарти Р., Раес Дж., Розенштиль П. Устойчивость кишечной микробиоты влияет на здоровье и болезни. Nat Rev Microbiol. 2017; 15: 630–638. [PubMed] [Google Scholar] 5. Наим С., Ли С. Биоразнообразие повышает надежность экосистемы. Природа. 1997; 390: 507–509. [Google Scholar] 6. Guarner F, Malagelada JR. Флора кишечника в норме и при болезнях. Ланцет. 2003. 361: 512–519. [PubMed] [Google Scholar] 7. Faith JJ, Guruge JL, Charbonneau M, Subramanian S, Seedorf H, Goodman AL, et al.Долгосрочная стабильность микробиоты кишечника человека. Наука. 2013; 341: 1237439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Клементе Дж. К., Урселл Л. К., Парфри Л. В., Найт Р. Влияние микробиоты кишечника на здоровье человека: комплексный взгляд. Клетка. 2012; 148: 1258–1270. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Камада Н., Со Су, Чен Г. Ю., Нуньес Г. Роль кишечной микробиоты в иммунитете и воспалительных заболеваниях. Nat Rev Immunol. 2013; 13: 321–335. [PubMed] [Google Scholar] 10. Камада Н., Чен Г.Й., Инохара Н., Нуньес Г.Контроль болезнетворных микроорганизмов и патобионтов микробиотой кишечника. Nat Immunol. 2013; 14: 685–690. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Тернбо П.Дж., Бэкхед Ф., Фултон Л., Гордон Дж. Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мыши. Клеточный микроб-хозяин. 2008; 3: 213–223. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа.2012; 489: 220–230. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Тамбурини С., Шен Н., Ву ХК, Клементе Дж. Микробиом в раннем возрасте: последствия для здоровья. Nat Med. 2016; 22: 713–722. [PubMed] [Google Scholar] 14. Моя А., Феррер М. Устойчивость кишечной микробиоты, вызванная функциональной избыточностью, подвергается нарушениям. Trends Microbiol. 2016; 24: 402–413. [PubMed] [Google Scholar] 15. Уиллинг Б.П., Рассел С.Л., Финли ББ. Сдвиг баланса: влияние антибиотиков на мутуализм хозяина и микробиоты. Nat Rev Microbiol.2011; 9: 233–243. [PubMed] [Google Scholar] 16. Секиров И., Там Н.М., Йогова М., Робертсон М.Л., Ли Ю., Лупп С. и др. Вызванные антибиотиками нарушения микробиоты кишечника изменяют восприимчивость хозяина к кишечной инфекции. Infect Immun. 2008. 76: 4726–4736. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Potgieter M, Bester J, Kell DB, Pretorius E. Спящий микробиом крови при хронических воспалительных заболеваниях. FEMS Microbiol Rev.2015; 39: 567–591. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Эллисон SD, Мартини JB.Доклад коллоквиума: устойчивость, устойчивость и избыточность в микробных сообществах. Proc Natl Acad Sci U S. A. 2008; 105 (Приложение 1): 11512–11519. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Бекаттини С., Таур Ю., Памер Э.Г. Изменения микробиоты кишечника и заболевания, вызванные антибиотиками. Тенденции Мол Мед. 2016; 22: 458–478. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Comte J, Fauteux L, Del Giorgio PA. Связь между метаболической пластичностью и функциональной избыточностью в сообществах пресноводного бактериопланктона.Front Microbiol. 2013; 4: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Лэнгдон А., Крук Н., Дантас Дж. Влияние антибиотиков на микробиом на протяжении всего процесса разработки и альтернативные подходы к терапевтической модуляции. Genome Med. 2016; 8: 39. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. ДиДжиулио Д.Б., Ромеро Р., Амоган Х.П., Кусанович Дж.П., Бик Э.М., Готч Ф. и др. Распространенность, разнообразие и изобилие микробов в околоплодных водах во время преждевременных родов: молекулярное исследование и исследование на основе культуры.PLoS One. 2008; 3: e3056. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Бонхофф М, Дрейк Б.Л., Миллер С.П. Влияние стрептомицина на восприимчивость кишечного тракта к экспериментальной сальмонеллезной инфекции. Proc Soc Exp Biol Med. 1954. 86: 132–137. [PubMed] [Google Scholar] 26. Панда С., Эль-Хадер I, Каселлас Ф., Лопес Виванкос Дж., Гарсия Корс М., Сантьяго А. и др. Кратковременное действие антибиотиков на микробиоту кишечника человека. PLoS One. 2014; 9: e95476. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Перес-Лопес А., Бенсен Дж., Нуччио С.П., Раффателлу М.Иммунитет слизистых оболочек к болезнетворным кишечным бактериям. Nat Rev Immunol. 2016; 16: 135–148. [PubMed] [Google Scholar] 28. Шуберт AM, Sinani H, Schloss PD. Вызванные антибиотиками изменения микробиоты кишечника мышей и последующие эффекты на устойчивость к колонизации против Clostridium difficile. MBio. 2015; 6: e00974. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Прюдом М., Аттайек Л., Санчес Дж., Мартин Б., Клаверис Дж. П. Стресс антибиотиками вызывает генетическую трансформируемость человеческого патогена Streptococcus pneumoniae.Наука. 2006; 313: 89–92. [PubMed] [Google Scholar] 30. Gipponi M, Sciutto C, Accornero L, Bonassi S, Raso C, Vignolo C и др. Оценка изменений кишечной бактериальной флоры у пациентов, длительно принимающих пероральный прием бакампициллина или амоксициллина: случайное исследование. Химиотерапия. 1985; 4: 214–217. [PubMed] [Google Scholar] 31. Nord CE, Sillerström E, Wahlund E. Влияние тигециклина на нормальную микрофлору ротоглотки и кишечника. Антимикробные агенты Chemother. 2006; 50: 3375–3380. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32.Джернберг С., Лёфмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое влияние приема антибиотиков на микробиоту кишечника человека. ISME J. 2007; 1: 56–66. [PubMed] [Google Scholar] 33. Jakobsson HE, Jernberg C, Andersson AF, Sjölund-Karlsson M, Jansson JK, Engstrand L. Кратковременное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS One. 2010; 5: e9836. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Гибсон М.К., Ван Б., Ахмади С., Бернем К.А., Тарр П.И., Уорнер Б.Б. и др.Динамика развития микробиоты кишечника недоношенных детей и резистома к антибиотикам. Nat Microbiol. 2016; 1: 16024. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. McFarland LV. Использование пробиотиков для коррекции дисбактериоза нормальной микробиоты после болезни или разрушительных событий: систематический обзор. BMJ Open. 2014; 4: e005047 [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Детлефсен Л., Хусе С., Согин М.Л., Релман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, что выявлено глубоким секвенированием 16S рРНК.PLoS Biol. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci U S. A. 2011; 108 (Приложение 1): 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Hill DA, Hoffmann C, Abt MC, Du Y, Kobuley D, Kirn TJ и др. Метагеномные анализы выявляют вызванные антибиотиками временные и пространственные изменения кишечной микробиоты с соответствующими изменениями гомеостаза иммунных клеток.Mucosal Immunol. 2010; 3: 148–158. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Перес-Кобас А.Е., Госальбес М.Дж., Фридрихс А., Кнехт Х., Артачо А., Эйсманн К. и др. Нарушение микробиоты кишечника во время терапии антибиотиками: многомерный подход. Кишечник. 2013; 62: 1591–1601. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Гарретт В.С., Галлини С.А., Яцуненко Т., Мишо М., Дюбуа А., Делани М.Л. и др. Enterobacteriaceae действуют совместно с микробиотой кишечника, вызывая спонтанный и передаваемый от матери колит.Клеточный микроб-хозяин. 2010. 8: 292–300. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Spees AM, Wangdi T., Lopez CA, Kingsbury DD, Xavier MN, Winter SE и др. Воспаление, вызванное стрептомицином, усиливает колонизацию кишечника Escherichia coli за счет нитратного дыхания. MBio. 2013; 4: e00430 – e00413. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Winter SE, Winter MG, Xavier MN, Thiennimitr P, Poon V, Keestra AM и др. Нитрат, полученный из организма хозяина, ускоряет рост кишечной палочки в воспаленном кишечнике. Наука. 2013; 339: 708–711.[Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Yoon MY, Min KB, Lee KM, Yoon Y, Kim Y, Oh YT и др. Один ген комменсального микроба влияет на восприимчивость хозяина к кишечной инфекции. Nat Commun. 2016; 7: 11606. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Ли М., Ван Б., Чжан М., Ранталайнен М., Ван С., Чжоу Х. и др. Симбиотические кишечные микробы модулируют метаболические фенотипы человека. Proc Natl Acad Sci U S. A. 2008; 105: 2117–2122. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Келли CJ, Zheng L, Campbell EL, Saeedi B., Scholz CC, Bayless AJ, et al.Перекрестное взаимодействие между короткоцепочечными жирными кислотами, полученными из микробиоты, и HIF кишечного эпителия усиливает барьерную функцию ткани. Клеточный микроб-хозяин. 2015; 17: 662–671. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Сэмюэл Б.С., Гордон Джи. Гуманизированная модель гнотобиотической мыши мутуализма «хозяин-архей-бактерия». Proc Natl Acad Sci U S. A. 2006; 103: 10011–10016. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Беленгер А., Дункан С.Х., Колдер А.Г., Холтроп Дж., Луис П., Лобли Г.Е. и др. Два пути метаболического перекрестного питания между Bifidobacterium adolescentis и анаэробами, продуцирующими бутират, из кишечника человека.Appl Environ Microbiol. 2006. 72: 3593–3599. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ley RE. Использование микробиоты для уничтожения патогена: сладкоежки Clostridium difficile. Nat Med. 2014; 20: 248–249. [PubMed] [Google Scholar] 49. Нг К.М., Феррейра Дж. А., Хиггинботтом С. К., Линч Дж. Б., Кашьяп П.С., Гопинатх С. и др. Высвобожденные микробиотой сахара хозяина способствуют распространению кишечных патогенов после приема антибиотиков. Природа. 2013; 502: 96–99. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Феррейра Дж. А., Ву К. Дж., Грицковиан А. Дж., Були Д. М., Веймер Британская Колумбия, Зонненбург Дж. Л..Сукцинат, продуцируемый кишечной микробиотой, способствует инфицированию C. difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин. 2014; 16: 770–777. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Curtis MM, Hu Z, Klimko C, Narayanan S, Deberardinis R, Sperandio V. Кишечный комменсальный Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин. 2014. 16: 759–769. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Winter SE, Thiennimitr P, Winter MG, Butler BP, Huseby DL, Crawford RW и др.Воспаление кишечника является акцептором респираторных электронов для сальмонелл. Природа. 2010; 467: 426–429. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Ривера-Чавес Ф., Чжан Л.Ф., Фабер Ф., Лопес К.А., Биндлосс МХ, Олсан Э.Е. и др. Истощение кишечной микробиоты клостридий, продуцирующих бутират, вызывает аэробное распространение сальмонелл в просвете. Клеточный микроб-хозяин. 2016; 19: 443–454. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Лопес CA, Ривера-Чавес F, Byndloss MX, Bäumler AJ. Периплазматическая нитратредуктаза NapABC поддерживает рост в просвете серовара Typhimurium Salmonella enterica во время колита.Infect Immun. 2015; 83: 3470–3478. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Эль Каутари А., Армугом Ф., Гордон Дж. И., Рауль Д., Хенриссат Б. Обилие и разнообразие углеводно-активных ферментов в микробиоте кишечника человека. Nat Rev Microbiol. 2013; 11: 497–504. [PubMed] [Google Scholar] 57. Донохо Д.Р., Гарге Н., Чжан Х, Сан В., О’Коннелл TM, Бангер М.К. и др. Микробиом и бутират регулируют энергетический обмен и аутофагию в толстой кишке млекопитающих. Cell Metab. 2011; 13: 517–526. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58.Эспей МГ. Роль градиентов кислорода в формировании окислительно-восстановительных отношений между кишечником человека и его микробиотой. Free Radic Biol Med. 2013; 55: 130–140. [PubMed] [Google Scholar] 59. Lessa FC, Mu Y, Bamberg WM, Beldavs ZG, Dumyati GK, Dunn JR, et al. Бремя инфекции Clostridium difficile в США. N Engl J Med. 2015; 372: 825–834. [PubMed] [Google Scholar] 60. Келли С.П., Поулакис С., Ламонт Дж. Т.. Колит Clostridium difficile. N Engl J Med. 1994; 330: 257–262. [PubMed] [Google Scholar] 61.Джонстон BC, Ма С.С., Гольденберг Дж. З., Торлунд К., Вандвик П.О., Леб М. и др. Пробиотики для профилактики диареи, связанной с Clostridium difficile: систематический обзор и метаанализ. Ann Intern Med. 2012; 157: 878–888. [PubMed] [Google Scholar] 62. Martz SL, McDonald JA, Sun J, Zhang YG, Gloor GB, Noordhof C и др. Введение определенной микробиоты оказывает защитное действие на мышиной модели инфекции Salmonella. Научный доклад 2015; 5: 16094. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Баккен Дж.С., Бороды Т., Брандт Л.Дж., СП Брилл, Демарко Д.С., Франзос М.А. и др.Лечение инфекции Clostridium difficile с помощью трансплантации фекальной микробиоты. Clin Gastroenterol Hepatol. 2011; 9: 1044–1049. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Бороды Т.Дж., Хоруц А. Трансплантация фекальной микробиоты и новые применения. Нат Рев Гастроэнтерол Гепатол. 2011; 9: 88–96. [PubMed] [Google Scholar] 65. Хассетт DJ, Элкинс Дж. Г., Ма Дж. Ф., Макдермотт Т. Р.. Чувствительность биопленок Pseudomonas aeruginosa к биоцидам: использование перекиси водорода в качестве модельного противомикробного агента для изучения механизмов устойчивости.Методы Энзимол. 1999; 310: 599–608. [PubMed] [Google Scholar] 66. Шульц М. Клиническое использование E. coli Nissle 1917 при воспалительном заболевании кишечника. Воспаление кишечника. 2008; 14: 1012–1018. [PubMed] [Google Scholar] 67. Хемпель С., Ньюберри С.Дж., Махер А.Р., Ван З., Майлз Дж. Н., Шанман Р. и др. Пробиотики для профилактики и лечения диареи, связанной с антибиотиками: систематический обзор и метаанализ. ДЖАМА. 2012; 307: 1959–1969. [PubMed] [Google Scholar] 68. Гаро М.Г., Шерман П.М., Уокер В.А. Пробиотики и микробиота кишечника в здоровье и болезнях кишечника.Нат Рев Гастроэнтерол Гепатол. 2010; 7: 503–514. [Бесплатная статья PMC] [PubMed] [Google Scholar]Диарея, связанная с антибиотиками — симптомы и причины
Обзор
Диарея, связанная с антибиотиками, означает отхождение жидкого водянистого стула три или более раз в день после приема лекарств, используемых для лечения бактериальных инфекций (антибиотиков).
Чаще всего диарея, связанная с приемом антибиотиков, протекает в легкой форме и не требует лечения. Диарея обычно проходит в течение нескольких дней после прекращения приема антибиотика.Более серьезная диарея, связанная с антибиотиками, может потребовать прекращения приема антибиотиков или замены их.
Симптомы
У большинства людей диарея, связанная с приемом антибиотиков, вызывает легкие признаки и симптомы, например:
- Стулья свободные
- Более частые испражнения
Диарея, связанная с антибиотиками, может начаться примерно через неделю после начала приема антибиотика.Однако иногда диарея и другие симптомы появляются только через несколько дней или даже недель после окончания лечения антибиотиками.
Инфекция, вызванная Clostridium difficile
C. difficile — бактерия, продуцирующая токсины, которая может вызывать более серьезную диарею, связанную с антибиотиками. Инфекция C. difficile может вызывать не только жидкий стул и более частое испражнение, но и:
- Боль и спазмы внизу живота
- Субфебрильная температура
- Тошнота
- Потеря аппетита
Когда обращаться к врачу
Немедленно позвоните своему врачу, если у вас есть серьезные признаки и симптомы диареи, связанной с приемом антибиотиков.Эти признаки и симптомы являются общими для ряда состояний, поэтому ваш врач может порекомендовать тесты для определения причины.
Причины
Почему возникает диарея, связанная с приемом антибиотиков, до конца не изучено. Обычно считается, что он развивается, когда антибактериальные препараты (антибиотики) нарушают баланс хороших и вредных бактерий в желудочно-кишечном тракте.
Антибиотики, которые с наибольшей вероятностью вызывают диарею
Почти все антибиотики могут вызывать диарею, связанную с антибиотиками.Чаще всего используются следующие антибиотики:
- Цефалоспорины, такие как цефдинир и цефподоксим
- Пенициллины, такие как амоксициллин и ампициллин
Инфекция C. difficile
Когда антибиотики нарушают баланс бактерий в пищеварительной системе, бактерии C. difficile могут быстро выйти из-под контроля. Бактерии C. difficile создают токсины, которые поражают слизистую оболочку кишечника. Антибиотики, наиболее часто связанные с инфекцией C. difficile, включают фторхинолоны, цефалоспорины, пенициллины и клиндамицин.
Факторы риска
Диарея, связанная с антибиотиками, может возникнуть у любого, кто принимает антибиотики. Но у вас с большей вероятностью разовьется диарея, связанная с приемом антибиотиков, если вы:
- Были в прошлом диареи, связанные с приемом антибиотиков
- Принимали антибиотики в течение длительного времени
- Принимаете более одного антибиотика
Осложнения
Одним из наиболее частых осложнений любого типа диареи является чрезмерная потеря жидкости и электролитов (обезвоживание).Сильное обезвоживание может быть опасным для жизни. Признаки и симптомы включают очень сухость во рту, сильную жажду, слабое мочеиспускание или его отсутствие и слабость.
Профилактика
Чтобы предотвратить диарею, связанную с приемом антибиотиков, попробуйте:
- Принимайте антибиотики только при необходимости. Не принимайте антибиотики, если ваш врач не считает их необходимыми. Антибиотики могут лечить бактериальные инфекции, но не помогают при вирусных инфекциях, таких как простуда и грипп.
- Попросите опекунов вымыть руки. Если вы госпитализированы, попросите всех вымыть руки или использовать дезинфицирующее средство для рук на спиртовой основе, прежде чем прикасаться к вам.
- Сообщите своему врачу, если у вас раньше была диарея, связанная с приемом антибиотиков. Одноразовая диарея, связанная с антибиотиками, увеличивает вероятность того, что антибиотики снова вызовут ту же реакцию. Ваш врач может подобрать для вас другой антибиотик.