Перитонит акушерский после кесарева сечения
Ведущие специалисты в области акушерства и гинекологии
проф. Круглов Сергей Владимирович (слева), Крючкова Оксана Александровна (справа)
Автор проекта: Круглов Сергей Владимирович, профессор, заслуженный врач России, доктор медицинских наук, врач высшей квалификационной категории
Подробнее
Редактор страницы: Крючкова Оксана Александровна – врач-травматолог-ортопед
Подробнее
Сидоренко Юрий Сергеевич
Сидоренко Юрий Сергеевич, Академик РАМН, Профессор, Доктор медицинских наук, Директор РНИОИ, Заведующий гинекологическим отделением РНИОИ, Заслуженный деятель науки РФ, Заслуженный изобретатель России, Лауреат Государственной премии РФ
Подробнее
Рымашевский Александр Николаевич
Рымашевский Александр Николаевич
Профессор, Доктор медицинских наук, Заведующий кафедрой акушерства и гинекологии№1 РостГМУ
Подробнее
Спицкий Александр Юрьевич
Спицкий Александр Юрьевич Кандидат медицинских наук, гинеколог-онколог Врач высшей категории
Подробнее
Коган Ольга Михайловна
Коган Ольга Михайловна Заведующая отделением гинекологии, кандидат медицинских наук, врач-гинеколог высшей квалификационной категории
Подробнее
ОГЛАВЛЕНИЕ КНИГИ
Перитонит акушерский после кесарева сечения имеет несколько клинических форм в зависимости от патогенеза. Он возникает вследствие неполноценности швов на матке, инфицирования брюшной полости во время кесарева сечения, при хориоамнионите у роженицы или на фоне длительно не разрешающегося пареза кишечника. Значительно реже перитонит может развиться при ранении кишечника во время кесарева сечения или при разрыве гнойных образований придатков матки. Так, из 98 больных перитонитом последний возник при ранении кишечника у 2 женщин и вследствие разрыва тубо- овариального образования —у одной.
Он возникает вследствие неполноценности швов на матке, инфицирования брюшной полости во время кесарева сечения, при хориоамнионите у роженицы или на фоне длительно не разрешающегося пареза кишечника. Значительно реже перитонит может развиться при ранении кишечника во время кесарева сечения или при разрыве гнойных образований придатков матки. Так, из 98 больных перитонитом последний возник при ранении кишечника у 2 женщин и вследствие разрыва тубо- овариального образования —у одной.
Мы остановимся на особенностях классификации, этиологии, патогенеза, клиники и лечения перитонита после кесарева сечения.
Клиническое течение перитонита после кесарева сечения зависит от многих факторов, среди которых нужно обратить внимание на следующие. Этиология перитонита бактериальная. Чаще всего ведущая роль принадлежит кишечной палочке, смешанной грамнегативной флоре, реже — стафилококку. При акушерском перитоните в зависимости от стадии может наблюдаться серозный, фибринозный или гнойный экссудат.
По данным В. И. Кулакова и соавт. (1978), при перитоните стафилококки были высеяны
в 19,6% случаев, кишечная палочка — в 20,3%, прочие микроорганизмы — в 4,7%, роста флоры не было в 39,2% случаев. Согласно нашим данным, из 76 больных, у которых определены аэробные возбудители инфекции, грамотрицательная флора выявлена у 48, золотистый стафилококк — у 18; у остальных больных роста микрофлоры не обнаружено. Таким образом, у большинства больных отмечается смешанный характер инфекции. В то же время нельзя не отметить и значительную группу женщин с перитонитом, у которых характер возбудителя установить не удается, что скорей всего связано не с его отсутствием, а с несовершенством методов обнаружения флоры.
Характер экссудата при перитоните после кесарева сечения может быть различным (табл.
Таблица 26 Характер экссудата при перитоните в зависимости от длительности заболевания
Перитонит акушерский после кесарева сечения
Как видно из табл. 26, имеется прямая зависимость между характером экссудата и длительностью перитонита. Наличие гнойного экссудата в брюшной полости всегда совпадает с клиническими признаками расхождения послеоперационного шва на матке. Перитонит после кесарева сечения не имеет тенденции к отграничению и протекает преимущественно в виде диффузного воспаления. По нашим данным, ограниченный перитонит отмечен лишь у 1 % больных, диффузный — у 95 %, тотальный — у 4% больных.
Перитонит после кесарева сечения имеет все признаки послеоперационного воспаления брюшины—• наличие клинических проявлений, отсутствие синдрома «мышечной защиты», боли на начальных этапах заболевания, быстроразвивающаяся интоксикация. На одну из особенностей перитонита после кесарева сечения следует обратить особое внимание, в связи с тем что он не обусловлен деструктивным процессом кишечника.
Перитонит акушерский после кесарева сечения. Клиническое течение и особенности патогенеза перитонита после кесарева сечения во многом обусловлены способом инфицирования брюшины.
В эксперименте и клиническими исследованиями показано, что однократное попадание возбудителя в брюшную полость далеко не всегда вызывает перитонит [Симонян К. С., 1971]. Только снижение устойчивости организма родильницы в сочетании с инфекцией создает предпосылки к его возникновению. G другой стороны, каждую родильницу после кесарева сечения можно рассматривать как иммунологически ослабленную в связи с операционным стрессом, повышенной кровопотерей, процессами нарушения микроциркуляции, частичным депонированием крови и другими неблагоприятными факторами. С этих позиций становится понятной особая роль инфицирования брюшной полости, которое может иметь место при следующих обстоятельствах: а) в процессе операции кесарева сечения у рожениц с хориоамнионитом; б) при расхождении послеоперационного шва на матке; в) вследствие нарушения барьерной функции кишечника при стойком парезе кишечника, нарушении микроциркуляции в сосудах желудка и кишечника.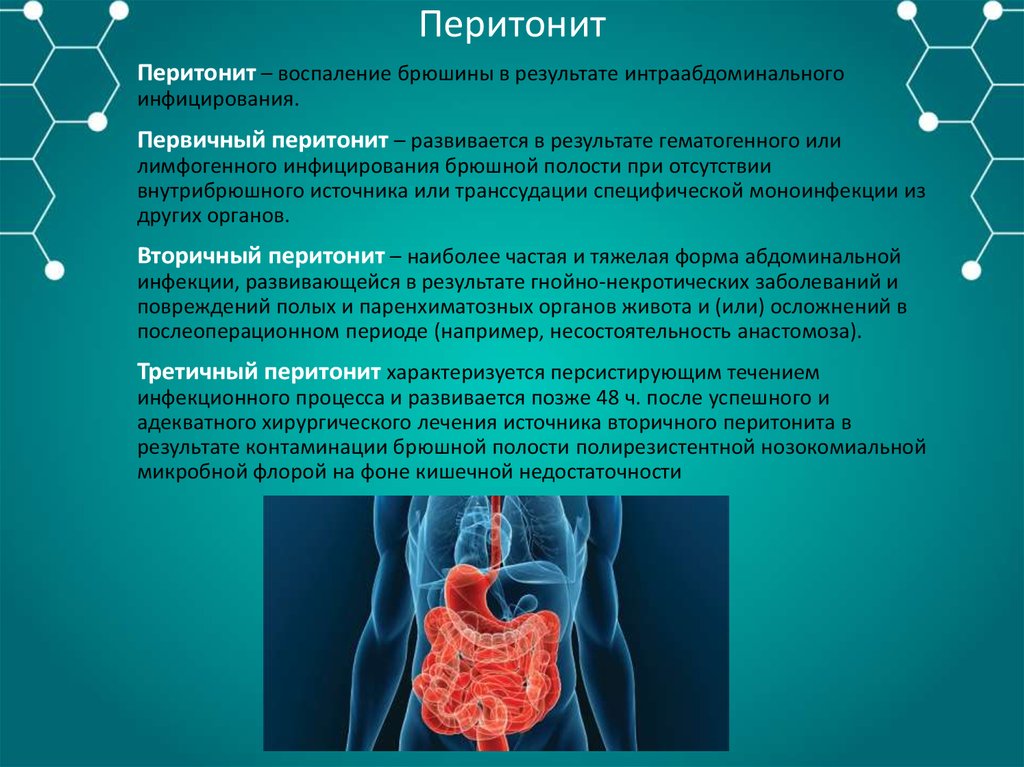
Два первых варианта инфицирования брюшины хорошо известны и принимаются во внимание при трактовке патогенеза перитонита после кесарева сечения. Последний вариант учитывается реже, хотя, по нашему опыту имеет у части больных решающее значение. Профилактика пареза кишечника, лечение динамической кишечной непроходимости при эндометрите после кесарева сечения являются важнейшими этапами лечения, позволяющими у части больных предупредить инфицирование брюшины и послеоперационного шва на матке. Тем самым уменьшается интоксикация и улучшается прогноз.
Перитонит акушерский после кесарева сечения. В зависимости от пути инфицирования можно выделить три варианта или три клинические формы перитонита после кесарева сечения.
Первой формой является ранний перитонит, возникающий вследствие инфицирования брюшины во время операции кесарева сечения, чаще всего произведенной на фоне хориоамнионита. Вторая клиническая форма — перитонит вследствие длительного пареза кишечника у больной с эндометритом после кесарева сечения. К третьей клинической форме относится перитонит, развивающийся в результате послеоперационного расхождения шва на матке. Общая реакция на попадание инфекции во многом зависит от состояния иммунной и эндокринной систем организма. Большая роль в общей реакции зависит от показателей общей и органной гемодинамики, состояния системы микроциркуляции. Согласно современным представлениям, массивная инвазия бактерий и особенно длительно действующие источники инфекции вследствие высвобождения эндотоксинов при гибели микробных клеток приводят к интоксикации.
К третьей клинической форме относится перитонит, развивающийся в результате послеоперационного расхождения шва на матке. Общая реакция на попадание инфекции во многом зависит от состояния иммунной и эндокринной систем организма. Большая роль в общей реакции зависит от показателей общей и органной гемодинамики, состояния системы микроциркуляции. Согласно современным представлениям, массивная инвазия бактерий и особенно длительно действующие источники инфекции вследствие высвобождения эндотоксинов при гибели микробных клеток приводят к интоксикации.
Наступает мобилизация сосудисто-активных субстанций, таких, как катехоламины, глюкокортикоиды, гистамины, кинины. Вследствие выработки вазоактивных веществ возникает расширение капилляров, повышение проницаемости их стенок. Нарушаются процессы микроциркуляции, депонируется часть крови на периферии, нарастает гиповолемия. Картина усугубляется нарушением водно-электролитного баланса вследствие потери больших количеств жидкости и электролитов при атонии кишечника, парезе, динамической (паралитической) непроходимости. Нарушения обратного всасывания воды и экссудация в кишечник значительно усугубляют гиповолемию.
Нарушения обратного всасывания воды и экссудация в кишечник значительно усугубляют гиповолемию.
Нарастающая интоксикация при перитоните может завершиться картиной гиповолемического шока, который правильнее называть септическим или бактериальным.
Выраженное нарушение макро- и микроциркуляции у ряда больных с перитонитом может стать ведущим звеном в развитии клинической картины и основной причиной неблагоприятного исхода. Это заставляет обращать особое внимание на коррекцию водно-электролитного баланса, состояние общей гемодинамики и микроциркуляции. Если удается провести коррекцию гемодинамики, инфекционный процесс протекает значительно легче.
Исследование состояния некоторых нейроэндокринных систем и особенностей обмена гистамина у больных перитонитом после кесарева сечения, проведенные в нашей клинике (М. 3. Асимова), позволили вскрыть ряд закономерностей патогенеза данного заболевания. Установлено, что изменения в системе АКТГ — глюкокортикоиды максимально выражены вскоре после кесарева сечения. Секреция АКТГ повышается в 2!/г раза, суммарное содержание 11-ОКС в крови возрастает за счет резкого увеличения (в 8—9 раз) уровня свободных 11-ОКС. К 10-м суткам после операции полной нормализации в системе АКТГ — глюкокортикоиды не происходит (табл. 27).. У больных перитонитом в острый период заболевания функциональное состояние системы АКТГ—глюкокортикоиды несколько снижено. Таким образом, на фоне операционного стресса происходит активация, а на фоне перитонита — ослабление системы гипофиз—кора надпочечников.
Секреция АКТГ повышается в 2!/г раза, суммарное содержание 11-ОКС в крови возрастает за счет резкого увеличения (в 8—9 раз) уровня свободных 11-ОКС. К 10-м суткам после операции полной нормализации в системе АКТГ — глюкокортикоиды не происходит (табл. 27).. У больных перитонитом в острый период заболевания функциональное состояние системы АКТГ—глюкокортикоиды несколько снижено. Таким образом, на фоне операционного стресса происходит активация, а на фоне перитонита — ослабление системы гипофиз—кора надпочечников.
Что касается изменений в симпатико-адреналовой системе, то они имеют ту же закономерность, что и изменения гипофизарно-надпочечникового звена (табл. 28).
Активация выработки некоторых катехоламинов, в частности свободного норадреналина, адреналина, дофамина происходит после операции кесарева сечения без признаков инфекции.
При перитоните существенных изменений в обмене катехоламинов не выявляется. Противоположная точка зрения высказывается В. И. Кулаковым. и соавт. (1978), считающими, что в остром периоде перитонита и сепсиса выработка глюкокортикоидов и катехоламинов активируется.
и соавт. (1978), считающими, что в остром периоде перитонита и сепсиса выработка глюкокортикоидов и катехоламинов активируется.
Однако данные, полученные в нашей клинике с участием гормональной лаборатории I ММИ им. И. М. Сеченова, свидетельствуют о том, что в острый период заболевания имеет
Таблица 28
Перитонит акушерский после кесарева сечения
место снижение экскреции свободных, связанных и суммарных форм катехоламинов. Уровень свободного адреналина и норадреналина значительно снижен (р<0,01). Также уменьшена экскреция свободного дофамина и ДОФА (р<0,05). В период клинического выздоровления соотношения между различными катехоламинами выравнивались.
Таким образом, полученные данные свидетельствуют о наличии закономерных изменений в гипофизарно-надпочечниковой и симпатико-адреналовой системах. После кесарева сечения функциональное состояние и мозгового, и коркового слоя надпочечников изменяется в сторону активации, наблюдается и увеличение секреции АКТГ. Следовательно, у любой родильницы после кесарева сечения создаются условия для нарушения макро- и микроциркуляции. Этому способствуют и осложнения, присущие кесареву сечению — кровопотеря, попадание околоплодных вод и крови в брюшную полость, резко выраженные гормональные изменения, обусловленные перестройкой эндокринного статуса в послеродовом периоде.
Следовательно, у любой родильницы после кесарева сечения создаются условия для нарушения макро- и микроциркуляции. Этому способствуют и осложнения, присущие кесареву сечению — кровопотеря, попадание околоплодных вод и крови в брюшную полость, резко выраженные гормональные изменения, обусловленные перестройкой эндокринного статуса в послеродовом периоде.
Дополнительный неблагоприятный фактор в виде инфицирования в таких условиях является «пусковым моментом» для развития перитонита.
Для понимания патогенеза перитонита после кесарева сечения особую роль имеет изучение системы гистамин—гистаминаза.
Гистамин как один из медиаторов и вазоактивных веществ известен в качестве причины сосудистых и вегетативных реакций, в ряде случаев резко меняющих физиологическое функционирование органов и систем. Известна роль гистамина в патогенезе септического процесса, особенно при возникновении тяжелых циркуляторных расстройств. По данным Lee (1957) и др., введение гистамина в долях миллиграмма экспериментальным животным сопровождается коллапсом; у человека 0,5— 1 мг гистамина вызывает нарушение микроциркуляции, падение артериального давления. Повторное воздействие эндогенного или экзогенного гистамина обусловливает развитие шока.
Повторное воздействие эндогенного или экзогенного гистамина обусловливает развитие шока.
При перитоните роль гистамина в патогенезе велика, так как бактериальные токсины индуцируют образование его свободной формы, которая ведет к развитию микроциркуляторных нарушений, интоксикации, шока. Гистамин у здоровых женщин содержится в крови в количестве 0,054 ±0,008 мкг/мл. У родильниц после кесарева сечения без признаков инфекции его количество увеличивается незначительно. В остром периоде перитонита содержание гистамина увеличивается в 7—8 раз (0,27 ±0,12 мкг/мл) (рис. 21). Повышение его уровня сопровождается увеличением содержания гистамвназы в крови: в норме оно равно 1,72 ± 0,39 мкг/мл, после кесарева сечения повышается до 2,38 ±1,35 мкг/мл, при перитоните— до 4,48 ± ±1,68 мкг/мл. Однако увеличение содержания гистамина при перитоните превосходит повышение уровня гистаминазы. Уровень свободного адреналина и норадреналина значительно снижен (р<0,01). Также уменьшена экскреция свободного дофамина и ДОФА (р<0,05). В период клинического выздоровления соотношения между различными катехоламинами выравнивались.
В период клинического выздоровления соотношения между различными катехоламинами выравнивались.
Таким образом, полученные данные свидетельствуют о наличии закономерных изменений в гипофизарно-надпочечниковой и симпатико-адреналовой системах.
После кесарева сечения функциональное состояние и мозгового, и коркового слоя надпочечников изменяется в сторону активации, наблюдается и увеличение секреции АКТГ. Следовательно, у любой родильницы после кесарева сечения создаются условия для нарушения макро- и микроциркуляции. Этому способствуют и осложнения, присущие кесареву сечению — кровопотеря, попадание околоплодных вод и крови в брюшную полость, резко выраженные гормональные изменения, обусловленные перестройкой эндокринного статуса в послеродовом периоде. Дополнительный неблагоприятный фактор в виде инфицирования в таких условиях является «пусковым моментом» для развития перитонита.
Для понимания патогенеза перитонита после кесарева сечения особую роль имеет изучение системы гистамин—гистаминаза. Гистамин как один из медиаторов и вазоактивных веществ известен в качестве причины сосудистых и вегетативных реакций, в ряде случаев резко меняющих физиологическое функционирование органов и систем. Известна роль гистамина в патогенезе септического процесса, особенно при возникновении тяжелых циркуляторных расстройств. По данным Lee (1957) и др., введение гистамина в долях миллиграмма экспериментальным животным сопровождается коллапсом; у человека 0,5— 1 мг гистамина вызывает нарушение микроциркуляции, падение артериального давления. Повторное воздействие эндогенного или экзогенного гистамина обусловливает развитие шока.
Гистамин как один из медиаторов и вазоактивных веществ известен в качестве причины сосудистых и вегетативных реакций, в ряде случаев резко меняющих физиологическое функционирование органов и систем. Известна роль гистамина в патогенезе септического процесса, особенно при возникновении тяжелых циркуляторных расстройств. По данным Lee (1957) и др., введение гистамина в долях миллиграмма экспериментальным животным сопровождается коллапсом; у человека 0,5— 1 мг гистамина вызывает нарушение микроциркуляции, падение артериального давления. Повторное воздействие эндогенного или экзогенного гистамина обусловливает развитие шока.
При перитоните роль гистамина в патогенезе велика, так как бактериальные токсины индуцируют образование его свободной формы, которая ведет к развитию микроциркуляторных нарушений, интоксикации, шока.
Гистамин у здоровых женщин содержится в крови в количестве 0,054+0,008 мкг/мл. У родильниц после кесарева сечения без признаков инфекции его количество увеличивается незначительно. В остром периоде перитонита содержание гистамина увеличивается в 7—8 раз (0,27 ±0,12 мкг/мл) (рис. 21). Повышение его уровня сопровождается увеличением содержания гистаминазы в крови: в норме оно равно 1,72+0,39 мкг/мл, после кесарева сечения повышается до 2,38 ± 1,35 мкг/мл, при перитоните — до 4,48 ± + 1,68 мкг/мл. Однако увеличение содержания гистамина при перитоните превосходит повышение уровня гистаминазы. Кро-
В остром периоде перитонита содержание гистамина увеличивается в 7—8 раз (0,27 ±0,12 мкг/мл) (рис. 21). Повышение его уровня сопровождается увеличением содержания гистаминазы в крови: в норме оно равно 1,72+0,39 мкг/мл, после кесарева сечения повышается до 2,38 ± 1,35 мкг/мл, при перитоните — до 4,48 ± + 1,68 мкг/мл. Однако увеличение содержания гистамина при перитоните превосходит повышение уровня гистаминазы. Кро-
Рис. 21. Концентрация гистамина
Перитонит акушерский после кесарева сечения
ме того, при перитоните снижается гистаминопептическая активность крови, что способствует более длительному функционированию гистамина. Если в норме этот индекс равен 24,5 ±2,9, а при кесаревом
сечении составляет 26,17 ± ± 15,70, то при перитоните его величина снижается до 18,8 ± ±4,88 мкг%.
Большую роль в патогенезе перитонита играют нарушения обратного всасывания воды и экссудация в кишечник, значительно усугубляющие гиповолемию. Вследствие развития подсерозных экссудативных процессов и экссудации в перитонеальную полость больная теряет большое количество внеклеточной жидкости (от 3 до 9 л). Интоксикация бактериальными токсинами и продуктами белкового распада увеличивает обезвоживание организма, которое из изотонического может перейти в гипотоническое. Вследствие усиленной экссудации и трансминерализации наступает потеря натрия и калия. Недостаточность калия обусловливает и поддерживает атонию кишечника, парез, динамическую непроходимость. Одновременно нарастает гипопротеинемия вследствие воспалительной экссудации и повышенного катаболического распада белков.
Интоксикация бактериальными токсинами и продуктами белкового распада увеличивает обезвоживание организма, которое из изотонического может перейти в гипотоническое. Вследствие усиленной экссудации и трансминерализации наступает потеря натрия и калия. Недостаточность калия обусловливает и поддерживает атонию кишечника, парез, динамическую непроходимость. Одновременно нарастает гипопротеинемия вследствие воспалительной экссудации и повышенного катаболического распада белков.
Количество поступающей к сердцу венозной крови уменьшается.
Тахикардия только на короткий период выравнивает минутный объем. Ввиду сниженного венозного притока минутный объем быстро падает. Это приводит к гипоксии жизненно важных органов, функция которых нарушается. Наибольшие изменения возникают со стороны сердечной деятельности, функции почек и печени.
Основные факторы патогенеза острого перитонита представлены на схеме 1.
Течение перитонита характеризуется тремя фазами. Первая, начальная, фаза обозначается многими авторами как реактивная. Для данной фазы характерно образование экссудата. Вторая фаза перитонита — токсическая. Для нее характерно подавление защитных механизмов, постепенное развитие нарушений гемодинамики,
Для данной фазы характерно образование экссудата. Вторая фаза перитонита — токсическая. Для нее характерно подавление защитных механизмов, постепенное развитие нарушений гемодинамики,
Схема 1
Перитонит акушерский после кесарева сечения
микроциркуляции, функции почек, печени, нарастающая гипоксия и нарушение тканевого дыхания. Третья фаза (терминальная) сопровождается гиповолемичееким, септическим шоком, нарушением сердечной деятельности. Если в первой фазе перитонита лечение, как правило, бывает эффективным, то во второй и третьей фазах прогноз становится сомнительным или неблагоприятным.
Перитонит после кесарева сечения характеризуется быстро наступающей токсической фазой, реактивная фаза выражена недостаточно. Нет сомнений в необходимости принимать во внимание динамику патологического процесса. Однако нужно иметь в виду, что на фоне интенсивной терапии яркие проявления интоксикации могут от-
сутствовать. Кроме того, в современных условиях относительно часто встречаются «стертые» формы заболевания, протекающие без ярких клинических признаков, но с выраженными изменениями внутренних органов и очага инфекции.
Клиническая картина перитонита после кесарева сечения зависит от ряда факторов. В частности, к ним относятся:
1) перитонит после кесарева сечения по своей сути является послеоперационным; в связи с этим выраженные клинические проявления могут отсутствовать или выражаться в стертой форме;
2) в связи с отсутствием при перитоните после кесарева сечения деструкции кишечника функциональные нарушения со стороны желудка и кишечника наблюдаются только в токсической и терминальной фазах перитонита, что затрудняет диагностику заболевания в реактивной фазе;
3) клиническая картина перитонита после кесарева сечения зависит от варианта инфицирования брюшины: произошло ли оно во время операции на фоне хориоамнионита или длительного безводного промежутка с инфицированием амниона, связано ли с инфицированием швов на матке или в большей степени зависит от нарушения барьерной функции кишечника и повышенной проницаемости кишечной стенки для микробов;
4) клинические проявления перитонита во многом зависят от качества комплексной патогенетической терапии;
5) клиническая картина во многом обусловлена тем фоном, на котором произведена операция, кровопотерей и корригирующей терапией во время операции.
Таким образом, в соответствии с этиологией и патогенезом, предшествующим течением беременности, особенностями оперативного вмешательства, вирулентностью микрофлоры, локализацией и распространением, стадией заболевания и реактивностью организма симптомы перитонита могут быть различными.
Кардинальными симптомами разлитого гнойного перитонита являются боли в животе,
симптом Щеткина—Блюмберга, защитное напряжение мышц живота, рвота, паралитическая непроходимость кишечника (парез). Симптомы, обусловленные интоксикацией, не должны относиться к типичным признакам перитонита; они характеризуют фазу интоксикации и варьируют в зависимости от качества и полноты проводимой терапии. Другими словами, тахикардия, гипотония, сухость слизистых оболочек, нарушения ритма сердца могут поддаваться коррекции и не являются патогномоничными для клинической картины перитонита после кесарева сечения.
Важнейшим признаком последнего является возвратность симптомов после проведенной терапии.
Особого внимания заслуживает перитонит, возникающий на фоне хориоамнионита. Мы считаем уместным еще раз подчеркнуть, что производство кесарева сечения на фоне хориоамнионита — грубая ошибка, являющаяся следствием нарушения правильного прогнозирования родов. К сожалению, подобные ситуации все еще встречаются в клинической практике. Следует помнить, что при хориоамнионите операцию не производят или применяют экстраперитонеальное кесарево сечение.
Клиническая картина перитонита, развивающегося на фоне хориоамнионита
(имевшегося до кесарева сечения), характеризуется ранним началом (на 1—2-е сутки после операции), высокой температурой тела, выраженной тахикардией, парезом кишечника. Защитное напряжение мышц живота отсутствует, симптом Щеткина—Блюмберга и боли в животе не выражены, рвоты не бывает. Перистальтика кишечника в первые 2 дня заболевания определяется, после стимуляции кишечника бывает стул. Описанная картина свойственна не местно протекающему перитониту и реактивному состоянию, а токсической фазе. Раннее начало перитонита позволяет исключить такую причину инфицирования, как расхождение швов на матке.
Среди наблюдавшихся нами больных раннее начало заболевания, возникшего на фоне хориоамнионита, отмечено у 1/з женщин. Гематологические показатели у этих больных характеризовались высоким лейкоцитозом (16,7-103± 1,47• 103 в 1 мкл), повышением числа палочкоядерных лейкоцитов (25±8,4%). Однако у каждой 7-й больной количество лейкоцитов не превышало 9—10-103 в 1 мкл, палочкоядерного сдвига не было.
При динамическом наблюдении в течение 12—24 ч отмечается ухудшение общего состояния, парез кишечника принимает стойкий характер, перестает определяться его перистальтика, становятся неэффективными меры стимуляции кишечника, усиливается жажда, язык становится сухим, нарастает тахикардия. У каждой 5-й больной развивается гипотония и дыхательная недостаточность. Появляется рвота застойными массами, у 10% больных отмечается атония желудка со значительным его расширением. Желудочное содержимое может иметь геморрагический характер, что свидетельствует о глубоком нарушении микроциркуляции в стенке желудка.
При отсутствии адекватной терапии смертельный исход наступает на 5—16-е сутки от бактериального шока или нарастающей сердечно-сосудистой слабости на фоне гиповолемического состояния.
Нетрудно заметить, что клиническая картина быстровозникающего перитонита после кесарева сечения очень напоминает таковую при эндометрите, осложненном парезом кишечника.
Исход перитонита вследствие инфицирования брюшины во время операции кесарева сечения зависит от качества лечения.. При интенсивной, патогенетически обоснованной консервативной терапии возможен благоприятный исход. Однако следует иметь в виду, что консервативная терапия должна проводиться не более чем в течение суток.
За 24 ч интенсивной терапии и «неотступного» наблюдения должно быть получено кардинальное улучшение состояния больной или окончательная уверенность в необходимости хирургического лечения.
Определенные клинические особенности имеет перитонит; развивающийся вследствие паралитической непроходимости кишечника, при попадании инфекции в брюшную полость через кишечную стенку. Начало данной формы перитонита относится к 3—4-му дню после операции. В течение первых 2 дней состояние больной бывает удовлетворительным, температура субфебрильная, имеются умеренная тахикардия, преходящее чувство жажды, стойкий парез кишечника. Болей в животе нет, «мышечная защита» отсутствует, симптом Щеткина—Блюмберга отрицательный. Ведущим симптомом, стойко сохраняющимся, несмотря на проводимое лечение, является парез кишечника, переходящий в паралитическую непроходимость с полным прекращением перистальтики и явлениями «гробовой тишины» в брюшной полости.
С этого времени состояние больной резка ухудшается: появляется выраженная лихорадка, тахикардия,, общее угнетение или эйфория, жидкий стул. В брюшной полости определяется и нарастает экссудат. Из желудка можно извлечь значительное количество застойного содержимого. Данная клиническая картина напоминает таковую при непроходимости кишечника, за исключением начальных часов заболевания, которые при непроходимости кишечника протекают с выраженным болевым синдромом.
При сравнении течения перитонита после кесарева сечения, обусловленного попаданием инфекции в процессе операций, и перитонита,
развивающегося вследствие стойкого пареза, паралитической непроходимости кишечника и инфицирования брюшной полости через неповрежденную кишечную стенку, можно выделить следующие особенности. Клиническое течение но первому типу характеризуется ранним (1—2-е сутки после операции) началом, выраженной интоксикацией, рецидивирующим парезом кишечника. Клиническое течение заболевания по второму типу отличается вначале невыраженной интоксикацией, нарастающим парезом. С 3—4-го дня после операции появляются и быстро нарастают признаки интоксикации, экссудация в брюшную полость, транссудация в кишечник, под серозные покровы органов брюшной полости.
Первый вариант клинической картины (раннее начало) наблюдается у 30% больных, второй —у 15%. Обе клинические формы перитонита имеют и некоторые общие черты. При них нет выраженного болевого синдрома, синдрома «мышечной защиты» и симптома Щеткина—Блюмберга. Постепенное возникновение метеоризма «маскирует» симптомы раздражения брюшины.
Более чем у половины больных (55%) перитонит развивается вследствие неполноценности швов на матке и последующего инфицирования брюшины. Заболевание характеризуется относительно поздним началом (4—9-е сутки после операции). Перитонит развивается исподволь, вначале появляется болезненность матки, чаще справа в области послеоперационного шва, определяются симптом Щеткина—Блюмберга, невыраженное напряжение мышц (мышечная защита). Одновременно возникает парез кишечника, в брюшной полости определяется экссудат. За короткий период (4—12 ч) состояние больной ухудшается, реактивная фаза сменяется фазой интоксикации. При неполноценности хирургического шва на матке клиническая картина перитонита достаточно выражена, на фоне нарастающей интоксикации больную беспокоят боли, имеется парез кишечника, «мышечная защита», симптом Щеткина—Блюмберга, рвота, жидкий стул.
Таким образом, лишь эта форма перитонита приближается к тому представлению, которое сформировалось в акушерской практике относительно острого гнойного перитонита.
Если при первом типе клинической картины возможна интенсивная консервативная терапия, то при втором и третьем типе необходимо комплексное лечение — неотложная операция и интенсивная терапия.
Рассматривая клиническое течение перитонита после кесарева сечения дифференцированно, в зависимости от патогенеза, можно объяснить то многообразие симптомов и те особенности, которыми акушерский перитонит отличается от «хирургического», Диагностика перитонита после кесарева сечения представляет определенные трудности вследствие недостаточно выраженной симптоматики и трудностей психологического характера. Сама по себе постановка диагноза перитонита неизбежно влечет за собой травматическое хирургическое лечение, лишающее женщину возможности в дальнейшем иметь беременности и нарушающее ряд других специфических функций женского организма. В то же время все клиницисты отмечают крайнюю необходимость ранней диагностики и незамедлительного хирургического лечения.
Ранняя диагностика перитонита необходима, вследствие то- то, что в реактивной фазе заболевания лечение всегда эффективно, в то время как в фазе интоксикации прогноз становится сомнительным. Однако следует принимать во внимание то, что правильно проводимая терапия позволяет предупредить и задержать прогрессирование интоксикации. Если же проводится недостаточная терапия и основное внимание уделяется только хирургическому вмешательству, не всегда удается справиться с прогрессированием заболевания.
Наш опыт свидетельствует о том, что «ранний» перитонит может быть вылечен применением консервативных методов.
Перитонит, развивающийся вследствие пареза кишечника, может быть предупрежден при условии правильной терапии в первые дни после операции; однако если перитонит уже возник, то при этой форме промедление с операцией недопустимо. Перитонит, источником которого являются неполноценные швы на матке, возникает несколько позже, протекает достаточно типично и диктует активную хирургическую тактику.
В связи с тем что при перитоните после кесарева сечения патогномоничные симптомы (боль, |«мышечная защита», симптом Щеткина—Блюмберга, рвота, паралитическая непроходимость кишечника) не выражены и у некоторых больных возникают поздно, нужно обращать особое внимание на возвратность симптомов, недостаточную курабельность больных и нарастание признаков интоксикации. Следовательно, при постановке диагноза перитонита после кесарева сечения большое значение имеет оценка динамики патологического состояния на фоне проводимой патогенетически обоснованной терапии. В отличие от хирургического перитонита, при котором основной задачей является удаление источника инфекции, при перитоните после кесарева сечения первоначально допустимо проведение консервативной терапии, при безутешности которой показано хирургическое лечение.
Таким образом, перитонит после кесарева сечения по клинической картине и патогенезу делится на три клинические формы, которые могут переходить одна в другую или развиваться независимо друг от друга.
Ориентировка на особенности клиники значительно облегчает диагностику и позволяет провести правильную в тактическом отношении терапию.
В.ОК. 25.10.2016г.
ОПТ. ОК. 25.10.2016г.
причины, симптомы, диагностика, лечение, профилактика
Представляет собой острое воспалительное поражение брюшины, развивающееся на фоне ее бактериального обсеменения в родах либо послеродовом периоде.
ПричиныАкушерский перитонит представляет собой воспалительное поражение брюшины, возникающее на фоне кесарева сечения либо родов в результате дисбаланса между вирулентностью патогенной флоры и уровня иммунной устойчивости женщины. Возбудителями патологии чаще всего являются грамотрицательные микроорганизмы и неспорообразующие анаэробы. Довольно часто в перитонеальном экссудате у таких больных выявляются грамположительные стафилококки и энтерококки, при этом возбудителями тяжелых форм недуга являются анаэробно-аэробные возбудители.
Вероятность развития послеродового перитонита значительно выше при продолжительном безводном периоде, бактериальной обсемененности влагалища, хорионамнионите, эндометрите, возникшем в послеродовый период, цервиците с хроническим течением, сальпингите, аднексите и длительном парезе кишечника. Специалисты в сфере акушерства и гинекологии выделяют три способа инфицирования брюшины:
инфицирование в родах;
проникновение патогенной флоры через кишечную стенку;
обсеменение брюшной полости патогенными микроорганизмами, спровоцированное расхождением швов.
СимптомыПрактически у половины рожениц наблюдается скрытое течение перитонита. В большинстве случаев в этом случае у рожениц отмечается вздутие живота в период с 1 по 9 день после родов. В реактивной фазе у пациентки наблюдается отсутствие стула, затрудненное или невозможное отхождение газов. Появление локальной болезненности внизу живота, которая в дальнейшем приобретает разлитой характер. Также у таких больных отмечается напряжение мышц в нижней трети живота, появление гноевидных и зловонных лохий, повышения температуры до высоких цифр, тошноты, рвоты, сухости слизистой рта и озноба.
После перехода заболевания в токсическую фазу у пациентки наблюдается возникновение симптомов интоксикации, слабости, головокружений и заторможенности. Происходит уменьшение количества отделяемой мочи, нарастание симптомов метеоризма и нарушения перистальтики кишечника, также учащается дыхание и частота сердечных сокращений. В этот период наблюдается незначительное снижение выраженности болей и мышечного напряжения. При отсутствии корректного лечения заболевание может на 1 либо 3 сутки перейти в терминальную фазу.
ДиагностикаПри подозрении на акушерский перитонит женщине назначают физикальный осмотр, пальпацию живота, перкуссию брюшной полости, аускультацию кишечника, общий анализ крови и мочи, биохимическое исследование крови, микробиологическое исследование крови или перитониального эксудата, ультразвуковое и рентгенографическое исследование брюшной полости.
ЛечениеВыбор терапевтической схемы зависит от типа, стадии и тяжести заболевания. Консервативное лечение эффективно только в реактивной фазе раннего перитонита. На этом этапе пациенту назначают антибиотикотерапию и инфузионно-трансфузионную терапию. При недостаточной эффективности консервативного лечения, прогрессировании симптомов кишечной непроходимости и интоксикации больному проводят хирургическое вмешательство.
ПрофилактикаПоскольку послеродовое воспаление брюшины зачастую становится следствием кесарева сечения, важную роль играет обоснованный выбор в пользу оперативного родоразрешения. Для предупреждения развития патологии всем роженицам в послеродовом периоде показано систематическое измерение температуры и скрининг, позволяющий своевременно выявить признаки интоксикации и симптомы раздражения брюшины.
Клинико-диагностические особенности и современная терапия перитонита и сепсиса после родов и абортов
На правах рукописи СЕЛИВАНОВА Галина Борисовна
УДК (618.5+618.39):(616.381-002+616.94)-07-085
КЛИНИКО-ДИАГНОСТИЧЕСКИЕ ОСОБЕННОСТИ И СОВРЕМЕННАЯ ТЕРАПИЯ ПЕРИТОНИТА И СЕПСИСА ПОСЛЕ РОДОВ И АБОРТОВ 14.00.01 — акушерство н гинекология
АВТОРЕФЕР АТ
диссертации на соискание ученой степени кандидата медицинских наук
Иваново — 1996 г.
Работа выполнена на кафедре акушерства и гинекологии лечебного факультета Московского медицинского стоматологического института имени H.A. Семашко.
Научный руководитель -
Член-корреспондент РАМН, профессор В.Н.Серов
Официальные оппоненты:
Член-корреспондент РАМН, профессор А.Н.Стрижаков Доктор медицинских наук, профессор Л.В. Посисеева
Ведущее учреждение -‘
Московский областной научно-исследовательский институт акушерства и гинекологии.
Защита состоится » 9 » октября 1996 г. в 10 часов на
заседании диссертационного Совета по присуждении ученой степени кандидата медицинских наук ( К 084.33.01) при Ивановской государственной медицинской академии (153452, г.Иваново, ул. Ф.Энгельса, 8).
С диссертацией можно ознакомиться в библиотеке Ивановской государственной медицинской академии.
Автореферат разослан
Ученый секретарь диссертационного совета, кандидат медицинских наук, доцент
В.В.Парешивнлп
АКТУАЛЬНОСТЬ ТЕМЫ
Акушерский перитонит и сепсис, несмотря на успехи современной ме-(ицины, остаются основной причиной материнской смертности (Кулаков 5.И. и соавт., 198S; Рыбалка А.Н., Вдовиченко Ю.П., 1990; Гуртовой Б.Л., 994; Monga M.L. et al, 1993).
Увеличение числа больных с акушерским перитонитом, в значительной iepe, обусловлено возрастанием частоты кесарева сечения, после которого аболевание развивается у 0,47-0,6% и даже 2,0% родильниц, а летальность ;остигает 32,9% (Гуртовой Б.Л. и соавт., 1981; Чиладзе А.З., 1989; Kwast i.Е., 1991). Практически всегда акушерский перитонит возникает именно осле абдоминального родоразрешения и только 1-2% женщин заболевает еритонитом вследствие гнойного воспаления придатков матки или сеп-икопиемии (Серов В.Н. и соавт., 1996).
Примерно те же закономерности прослеживаются и в отношении сеп-иса. Частота его после кесарева сечения в 5-10 раз более высокая, чем осле самопроизвольных родов (Жаров Е.В., 1990; Gibs R S., 1985; Kwast I.E., 1991).
В то же время, увеличение числа поздних абортов по социальным и ме-ицинским показаниям, сохраняющееся на довольно высоком уровне чис-о криминальных вмешательств также являются частыми причинами нойно-септических осложнений, в том числе перитонита и различных орм сепсиса (Гуртовой Б.Л.,1994).
Своевременная диагностика тяжелых инфекционных осложнений, гочнение формы заболеваний, их этиологии, степени и характера нару-[ений иммунологического и водно-электролитного гомеостаза позволяют ифференцировать комплексную интенсивную терапию. Однако, подоб-ые комплексные исследования в акушерстве практически отсутствуют.
Нуждаются в уточнениии характер клинических проявлений хрониосепс; са, эффективность некоторых новых химиотерапевтических и иммуноко; регирующих средств для лечения больных с акушерским перитонитом сепсисом.
ЦЕЛЬ ИССЛЕДОВАНИЯ
На основании углубленного изучения клиники, результатов бактери» логического, иммунологического обследования и данных коллоидн< осмотического состояния усовершенствовать комплексную терапию пер! тонита и сепсиса после родов и абортов.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
1. Выявить особенности клинического течения перитонита и разли1 ных форм сепсиса после родов и абортов в современных условиях.
2. Выяснить этиологию тяжелых гнойно-септических заболеваний акушерских больных.
3. Установить характер изменений иммунологической реактивности неспецифических факторов защиты, а также коллоидно-осмотического сс стояния плазмы крови у больных перитонитом и сепсисом после родов абортов.
4. Усовершенствовать комплексную интенсивную терапию тяжелы форм гнойно-септических заболеваний после родов и абортов.
НАУЧНАЯ НОВИЗНА ИССЛЕДОВАНИЯ:
Впервые на группе больных перитонитом и сепсисом показана рол факультативно-анэробной и анаэробно-аэробной флоры в патогенезе ге нерализованных форм послеродовой инфекции.
Анализ иммунологических показателей у больных сепсисом и перито-итом после родов и абортов показал неоднозначную направленность из-енений иммунитета. У части больных иммунитет снижен, а у части — на оне снижения клеточного иммунитета имеет место активация неспецифи-2ских факторов иммуной системы.
Следовательно, иммунотерапия у больных сепсисом и перитонитом элжна проводиться при лабораторном контроле.
Установлены клинико-лабораторные критерии для специфической и 5щей интенсивной терапии у больных сепсисом и перитонитом после ро-)в и абортов.
ПРАКТИЧЕСКАЯ ЦЕННОСТЬ
1. Для выбора метода лечения акушерского перитонита основную роль •рает возвратность клинической симптоматитики после комплексной ин-нсивной терапии в течение 6-12 часов.
2. Выявленная роль эндогенных возбудителей позволяет сделать вывод > особой значимости индивидуальных одноразовых медицинских пн-рументов и предметов ухода за больными в современных условиях.
Выявленные факторы свидетельствуют — послеродовая инфекция у шьных сепсисом и перитонитом является эндогенной и контагиозностъ льных находится в прямой зависимости от использования одноразовых дицинских систем и предметов ухода за больными.
3. Рекомендован комплекс лечебных мероприятий, направленных на вышение иммунологической реактивности больных за счет введения [мунокоррегирующих и иммуностимулирующих препаратов и нормали-дии метаболических нарушений.
4. Предложена методика введения современных химиотерапевтически средств, позволяющих повысить эффективность лечения больных с пери тонитом и сепсисом после родов и абортов.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В ПРАКТИКУ
Результаты исследования внедрены в лечебную практику акушерски отделений родильных домов при 15, 36 и 68 ГКБ г. Москвы.
Материалы диссертации используются в учебном процессе при подго товке студентов на кафедре акушерства и гинекологии ММСИ.
ОСНОВНЫЕ ПОЛОЖЕНИЯ ДИССЕРТАЦИИ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
Основными факторами, позволяющими проводить эффективную диф ференцированную терапию у больных с перитонитом и сепсисом после ро дов и абортов и значительно снизить материнскую смертность от эти: осложнений, являются выявление этиологии и состояния иммунологиче ского гомеосгаза, а также индивидуальных клинических и лабораторны. изменений коллоидно-осмотического состояния.
Эффективность лечения больных с перитонитом и сепсисом после ро дов и абортов значительно повышается при использовании современны; иммунокоррегирующих, химиотерапевтических средств для общего I местного применения, своевременном хирургическом удаленш «первичного очага» инфекции.
ПУБЛИКАЦИИ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
По теме диссертации опубликованы 2 печатные работы.
ОБЪЕМ И СТРУКТУРА ДИССЕРТАЦИИ
Диссертация написана на русском языке и состоит из введения, 5 глав, выводов и практических рекомендаций, изложенных на 136 страницах машинописного текста. Иллюстрирована 16 таблицами и 6 рисунками. Би-элиографический указатель включает 303 источника, в том числе 148 отечественных и 155 иностранных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Для решения поставленных задач проведен анализ клинического тече-шя тяжелых гнойно-септических заболеваний после родов и абортов у 174 женщин, распределенных на 2 группы: в первую вошли 82 больные с аку-лерским перитонитом, во вторую — 92 с сепсисом.
У части женщин, находившихся в роддоме 36 ГКБ, являющегося кли-шческой базой кафедры акушерства и гинекологии лечебного факультета vIMCM им. Н.А.Семашко, проводились специальные исследования. Ре-;ультаты изучения иммунного гомеостаза и коллоидно-осмотического состояния у больных исследуемых групп сопоставлялись с показателями, порченными при обследовании 10 практически здоровых женщин контрольная группа).
При анализе клинического материала, включающего 174 больных с пе-штонитом и сепсисом после родов и абортов, установлено, что почти у :аждой второй возраст превышал 30 лет (40,4%; 39,2%), в анамнезе у каждой из них выявлялась различная экстрагенитальная патология (95,1%; 6,7%). Нередкими были ранее перенесенные воспалительные гинекологи-еские заболевания (17,1%; 12,0%), а течение беременности, особенно, во торой половине часто осложнялось развитием гестоза (37,8%; 38,7%) или немии (26,8%; 33,3%).
В 1 исследуемой группе из 82 больных у 74 (90,2%) перитонит вознш после кесаревого сечения, у 8 (9,8%) — после самопроизвольных родов. Исход? из возможных вариантов инфицирования брюшины «первичный» перитонит бьи установлен у 23 больных (28,0%), «вторичный» — у 59 (72,0%), в том числе у 3< (43,9%) вследствие «несостоятельности швов» на фоне эндометрита после кесарево го сечения, у 15 (18,3%) — нарушения барьфной функции кишечника на фоне после операционного пареза («перитонит-парез») и у 8 (9,7%) больных — разрыва пиосаль пинкса в раннем послеродовом периоде. По срокам возникновения перитонита обследованные больные распределились следующим образом: на 2-3 сутки — 26 (31,7%), на 4-5- сутки -16 (19,5%) и на 6-10 супси — 40 (48,8%).
При оценке клинического течения акушерского перитонита у обследованные больных (таблица 1) установлено, что характерными для всей группы больных было повышение температуры (37,9 + 0,8 С), тахикардия (102 + 9 ударов в минуту), тахипноэ (более 24 дыхательных движений в минуту). Сознание больных было, как правило, ясным, однако у части из них (18) отмечалась эйфория с недостаточно адекватной реакцией на окружающее, у 24 — некоторая заторможенность. Кроме того, у всех больных была значительной интенсивности боль в животе, носящая у 40 ограниченный (преимущественно в нижних отделах), а у 42 — разлитой характер. Тошнота отмечена у 54 (65,8%), рвота — 43 (52,4%) больных же!один. Ограничение подвижности брюшной стенки при дыхании выявлено у 68 (82,9%) больных, защитное напряжение мышц брюшной стенки, локализованное в нижних отделах — у 41, по всему животу — у 29. Положительный симптом Щегкина-Блюмберга был у 75 больных, причем, у 51 -выраженный место, у 24 -«разлитой». Вздутие кишечника, резкое ослабление и исчезновение перистальтики выявлено у 58 больных. Влагалищное исследование было, как правило, затруднено из-за защитного напряжения мышц передней брюшной стенки, однако выбухание и резкая болезненность заднего свода отмечены у 56 (68,3%) больных, болезненность при попытке смещения матки — у 65 (79,3%).
Таблица 1
Частота клинических симптомов у больных с акушерским перитонитом
Число больных
Клинические симптомы (п=82)
абс. %
Болезненность матки при пальпации 75 91,5
Симптомы интоксикации:
-лихорадка (37,9±0,8С) 82 100,0
-тахикардия (109,0+7,3 уд. в 1 мин.) 82 100,0
-тахипноэ (ЧД>24 в мин.) 82 100,0
-эйфория 18 21,9
-заторможенность 24 29,3
Тошнота 54 65,8
Рвота 43 52,4
Симптомы раздражения брюшины:
-боль в животе: 82 100,0
-ограниченная, в нижних отделах 40 48,8
-разлитая по всему животу 42 51,2
-«мышечная защита»: 70 83,4
-в нижних отделах живота 41 50,0
-по всему животу 29 33,4
-ограничение подвижности брюшной
стенки при дыхании 68 82,9
-положительный симптом Щеткина-Блюмберга: 75 91,5
-«местный»(внизу живота) 51 62,2
—«разлитой» 24 29,3
Парез (паралич) кишечника 58 50,7
На основании клинической оценки состояния больных, подтвержденного впоследствии данными лабораторных исследований, реактивная фаза перитонита была диагностирована у 24 (29,3%), токсическая — у 51 (62,2%), терминальная — у 7 (8,5%).
При оценке клинического течения акушерского сепсиса во 2 исследуемой группе из 92 больных установлено, что у 42 (45,7%) заболевание возникло после абдоминального родоразрешения, у 32 (34,8%) — после самопроизвольных родов.и у 18 (19,6%) — после аборта. Чаще «первичным очагом» являлся эндометрит (68), в том числе, после кесаревого сечения (32), самопроизвольных родов (32) или позднего самопроизвольного аборта (4). У 10 больных генерализация инфекции сопровождала перитонит после абдоминального родоразрешения. Возникновению сепсиса у 14 больных предшествовал криминальный аборт. Установлено, что после родов и абортов возможно возникновение нескольких клинических форм генерализованной гнойно-септической инфекции — септицемия, сетикопиемия, септический шок и хрониосепсис. В таблице 2 суммирована частота отдельных клинических симптомов у больных с акушерским сепсисом.
Септицемия наблюдалась у 56 (60,8%) больных. Клиническая картина в этой группе больных характеризовалась высокой температурой (38,8 ± 0,6 С), только у 6 больных температура была выше 40 С, причем размах температурной кривой у половины больных превышал более одного градуса. Появление ознобов отмечено у 41 больной ( у 18 — периодические, у 23 -ациклические). У всех больных отмечались стойкая, несмотря на колебания температуры, тахикардия (118,0+_9,0 ударов в минуту) и тахипноэ ( число дыханий более 24 в минуту). Часто отмечалось изменение цвета кожи — гиперемия или бледность с желтушным оттенком, иногда акро-цианоз; петехиальные и мелкоточечные высыпания выявлены у 11 больных, а 17 — предъявляли жалобы на костно-мышечные боли. Быстро нарас-
тала интоксикация, следствием чего нередким было нарушение сознания. Причем, во всех наблюдениях вначале возникала резкая заторможенность больных, а затем на этом фоне присоединялся интоксикационный делирий (11). Кроме перечисленных признаков, для ряда больных с септицемией было характерным наличие гипотонии (9), олигурии (12), протеинурии (14), частого жидкого стула (6).
Септикопиемия была установлена у 7 (7,6%) больных и у всех возника-па на 6 — 9 сутки послеродового периода. Клиническая картина характери-ювалась более поздним началом, тяжелыми проявлениями интоксикации, повторными ухудшениями состояния, сменяющими короткие ремиссии. Наряду с интоксикацией, у всех обследованных больных отмечался син-хром полиорганной недостаточности (матка, легкие, печень, почки), при-¡ем явная множественность поражения была весьма характерной.
Септический шок во 2 исследуемой группе наблюдался у 26 (28,3%) Зольных. У 10 он возник на фоне перитонита, у 2 развился на фоне после-юдового эндометрита, 14 больных поступило с клинической картиной оптического шока после криминального вмешательства с целью прерыва-шя беременности. Клиника септического шока была довольно характер-юй и включала во всех наблюдениях лихорадку (более 38,5 С) и озноб, на->ушения кожной чувствительности, тахипноэ, тахикардию (127 +12 уд. в шн.), гипотензию (АД ниже 90 мм рт. ст.). У всех больных отмечены на-|ушения психики: сопор (1), адинамия, вялость психических реакций (4), йфория (2) с делириозными расстройствами и бредом у 1 больной. Увели-ение размеров печени и селезенки выявлено у 21 больной.
Клиническими симптомами, общими для 3 (3,3%) больных с хронио-епсисом в стадии ремиссии, были жалобы на слабость, быструю утомляе-юсть, одышку даже при небольшой физической нагрузке, субфебрильную емпературу.
Таблица 2
Частота клинических симптомов у больных с акушерским сепсисом
Число больных Клинические сиптомы (п=92)
абс. %
Гипертермия 92 100,0
Озноб: 92 100,0
-периодический 18 19,6
-ациклический 74 80,4
Тахикардия 92 100,0
Тахипноэ 92 100,0
Нарушение сознания: 92 100,0
-интоксикационный делирий 13 14,1
-эйфория 3 3,1
-сопор 1 1,1
-заторможенность 68 73,9
Костно-мышечные боли 20 21,7
Изменение цвета кожных покровов:
-иктеричность 23 25,0
-акроцианоз 9 9,9
-петехиальные высыпания 15 16,5
-бледность 92 100,0
Гипотония 41 44,7
Олигурия 38 41,3
Гепатоспленомегалия 21 22,8
Во всех клинических наблюдениях были признаки астенического синдрома :о снижением массы тела, гипотонией, пониженной работоспособностью. Ухудшение состояния сопровождалось повышением температуры тела до 38 — 40 С с гектическими размахами, ознобами, явлениями интоксикации, периодическими болями в нижних отделах живота.
Клиническое наблюдение за больными с перитонитом и сепсисом в процессе комплексной интенсивной терапии состояло в изучении окраски кожных покровов, частоты дыхания и сердечных сокращений, измерении артериального давления, минутного диуреза, акушерского обследования, консультаций смежных специалистов и лабораторных исследований ‘клинический анализ крови и мочи, ЭКГ, биохимическое исследование <рови, определение газов крови, гемостаза и др.). Специальные исследования включали: изучение иммунитета (клеточного, гуморального, неспеци-}шческих факторов защиты), бактериологии, оценку коллоидно-эсмотического состояния плазмы крови. В ряде случаев выполнялись уль-гразвуковые и эндоскопические методы исследования.
При оценке бактериологических исследований у больных с акушерским перитонитом и сепсисом установлено, что в половине случаев акушерский перитонит (рис. 1 А) возникал при участии аэробно-анаэробных ассоциа-дий, у каждой третьей больной — воспалительный процесс вызывала пробная микрофлора, а у 16,7% пациенток — анаэробная микрофора. Среди аэробов, помимо кишечной палочки (25,6%), все еще играющей существенную роль в развитии заболевания, почти в таком же проценте случаев ‘23,2%) были идентифицированы стафиллококки, несколько реже — протей 9,3%) и другие энтеробактерии. Анаэробная микрофлора в экссудате из Зрюшной полости у больных с перитонитом была представлена бактероидами (16,3%) и анаэробными стрептококками (11,7%).
При акушерском сепсисе (рис. 1 Б) у 53,3% больных в гемокультурах также выделялись полимикробные ассоциации аэробов и анаэробов, у 26,7% -только аэрорбные, у 20,0% — исключительно анаэробные микроорганизмы. Среди аэробов характерна высокая частота высеваемости кишечной палочки, идентифицированной в 25,7%. Нередко, в 20,0% наблюдений, выделяли золотистый сгафиллококк, реже протей (11,4% ), клеб-сиеллу (8,6%) и стрептококк (2,9%). Среди анаэробов чаще всего причиной сепсиса были бактероиды (11,4%), анаэробные стрептококки и клостридии
(5,7%). ……….
При изучении иммунного гомеостаза у больных с акушерским перитонитом установлено, что изменения касались всех звеньев иммунитета (рис.М, в то время , как синтез не претерпевал существенных изменений. Однако, оценка индивидуальных показателей выявила, что у 30,3% больных этой группы на фоне значительного угнетения клеточного и гуморального иммунитета наблюдалась активация ряда показателей, относящихся к неспецифическим факторам защиты: увеличивалось абсолютное число нейтрофилов и фагоцитоз, фагоцитарный показатель практически не изменялся, а фагоцитарное число снижалось.
РЕЗУЛЬТАТЫ БАКТЕРИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ ЭКССУДАТА ИЗ БРЮШНОЙ ПОЛОСТИ У БОЛЬНЫХ С АКУШЕРСКИМ ПЕРИТОНИТОМ ( А ) И ГЕМОКУЛЬТУР У
БОЛЬНЫХ С СЕПСИСОМ (Б)
Для иммунологического гомеостаза у больных с акушерским сепсисом (рис. 2 Б) характерен вторичный иммунодефицит по Т- и В-звену. Это подтверждалось резким снижением абсолютного числа лимфоцитов и Ем-РОЛ (В-лимфоцитов), а также числа Т- хелперов при одновременном увеличении содержания Т-супрессоров, в связи с чем иммунорегуляторный индекс уменьшался в значительно большей степени, чем у больных с перитонитом. Число субпопуляций Е-РОЛ (Т-лимфоцитов) также было ниже. Изменения гуморального звена иммунитета характеризовались, помимо значительного уменьшения числа Ем-РОЛ (В-лимфоцитов), снижением уровня сывороточной концентрации Цв, 1яМ, ЦА — до 1,7 + 0,1. Неспецифические факторы защиты у больных с акушерским сепсисом также были подавлены, что проявлялось снижением числа и активности нейтрофилов, уменьшением абсолютного фагоцитарного показателя. Оценивая иммуно-логическй статус у больных сепсисом, установили ряд закономерностей, имеющих принципиальное значение для понимания особенностей клинического течения и возможностей его лечения. Перечисленные нарушения иммунного ответа у больных с сепсисом требовали быстрой и адекватной коррекции, так как картина иммунологических поражений носила более распространенный, по сравнению с перитонитом, характер с наличием комбинированного иммунодефицита.
В результате серийных исследований коллоидно-осмотическокого состояния (КОС) у больных с акушерским перитонитом были получены результаты (рис.—а акушерский сепсис
контрольная группа а-гк акушерский сепсис
ПОКАЗАТЕЛИ КОЛЛОИДНО-ОСМОТИЧЕСКОГО СОСТОЯНИЯ У БОЛЬНЫХ С АКУШЕРСКИМ ПЕРИТОНИТОМ (А) И СЕПСИСОМ (Б) ПО СРАВНЕНИЮ С РЕЗУЛЬТАТАМИ КОНТРОЛЬНОЙ
ГРУППЫ
При анализе концентрации натрия и калия в исследуемой группе больных отмечена тенденция к снижению перечисленных показателей, однако разность значений в обоих случаях статистически не достоверна. Содержание азота мочевины, креатинина в сыворотке крови у больных перитонитом значительно увеличивалось и свидетельствовало о нарушении экскреторной функции почек. Гемоконцентрация, так характерная для больных с перитонитом, подтверждалась оценкой гематокрита. У всех больных средние значения этого параметра значительно превышали соответствующие показатели в контрольной группе. Полученные результаты, в сочетании с установленным снижением содержания гемоглобина, свидетельствовали об анемизации больных с акушерским перитонитом.
При оценке КОС у больных с акушерским сепсисом также были выяв-пены выраженные нарушения белкового обмена, проявившиеся гипопро-геинемией и диспротеинемией, значительным снижением КОД (рис.3 Б). Установлено, что у больных с сепсисом наблюдалось прогрессирующее снижение осмоляльности — гипоосмоляльное состояние, при котором эсмоляльность плазмы достигала 269,0 ± 1,7 (р < 0,001), а дискримент эсмоляльности — 23,4 +2,2 (р < 0,001). При анализе содержания электролитов (натрия и калия) выявлена тенденция к снижению калия (р > 0,5), ги-тонатремия (р < 0,001), установлено значительное увеличение содержания дзота мочевины (р < 0,001) и креатинина (р < 0,001). Показатели гематокрита значительно превышали соответствующие его значения в контрольной группе (р < 0,001), что в сочетании с выраженным снижением содержания гемоглобина до 100,0 ±3,1 г/л (р < 0,001), свидетельствовало ) прогрессирующей гемоконцентрации.
Обобщая результаты проведенных исследований, важно подчеркнуть, ¡то, с одной стороны, перитонит и сепсис являются стадиями одного и то-~о же заболевания, различающимися по тяжести течение процесса, а с дру-
гой стороны, это весьма отличающиеся по многим признакам болезни, имеющие свои специфические клинические и лабораторные показатели, что требует индивидуального подхода к лечению таких больных. .
В исследовании представлены результаты дифференцированной терапии 83 больных с тяжелыми формами гнойно-септических заболеваний, распределенных на 2 лечебные группы. Первую — составили 27 больных с перитонитом после кесаревого сечения; во вторую вошли 56 больных с акушерским сепсисом: 37 с сетицемией, 16 — бактериальным шоком, 3 -хрониосепсисом.
Лечение больных с акушерским перитонитом и сепсисом было индивидуальным и определялось результатами динамического клинического наблюдения, характером и степенью нарушений основных систем гомеоста-за.
Акушерский перитонит у большинства больных (90,2%) развивался медленно, поэтому на первый план выдвигалась консервативная терапия, а не удаление источника инфекции, при безуспешности которой производилось оперативное лечение. Только комплексная терапия была признана правильной, отдавать предпочтение какому-либо методу нет оснований, так как даже хирургическое вмешательство при перитоните малоэффективно без комплексной терапии.
Оперативное лечение выполнялось при неполноценности швов на матке, при перитоните вследствие нарушения барьерной функции кишечника, разрыве пиосальпинксов, то есть, в основном при «вторичном» перитоните. При экстирпации матки с трубами по поводу перитонита после кесаревого сечения, произведенного в нижнем маточном сегменте с поперечным разрезом, операцию выполняли со вскрытием заднего свода влагалища, что исключало технические трудности переднего доступа, связанного с инфильтрацией клетчатки мочевого пузыря. Во время чревосечения
/точняли форму перитонита по характеру экссудата (серозный, фибри-юзный, гнойный) и распространенности поражения брюшины ограниченный, диффузный или тотальный). Одновременно с удалением шфицированной матки обязательно производили качественное дрениро-шние брюшной полости. При ушивании раны передней брюшной стенки тщательно изолировали кишечные петли от лапаротомной раны большим :альником с последующим восстановлением ее отдельными шелковыми нвами с амортизаторами и проточно-аспирационным дренированием.
Особое внимание у больных с акушерским перитонитом уделялось методам устранения пареза кишечника. Восстановление мышечного тонуса сишечной стенки производилось в несколько этапов. На первом — выпол-■ялась декомпрессия желудочно-кишечного тракта (дренирование желудка 1 начального отдела тонкой кишки зондом) и денитрогенизация кишечнп-са. Следующий этап заключался в стимуляции кишечника, которая носила индивидуальный характер. У небольшой части больных она проводилась с томощыо препаратов, усиливающих двигательную активность мышечной ггенки кишечника: 1,0 мл 0,5 — 0,1% раствора прозерина, убретид до 500 1г/сутки, нибуфин 0,033% раствор до 10,0 — 15,0 мл/сутки. У большинства юльных для устранения стойкого пареза кишечника использовали гипер-шрическую оксигенацию, которая значительно улучшала тонус и сокра-ительпую способность кишечной стенки, ускоряла диффузию азота из фосвета кишки, играла роль механического раздражителя стенки кишки.
Опыт работы специализированного по инфекции роддома при 36 ГКБ ‘. Москвы, полученные нами результаты оценки эффективности ком-шексной интенсивной терапии 56 больных с сепсисом показывают, что (тсутствие возможности прогнозирования течения заболевания даже при декватном общем лечении, но в условиях существования первичного нойного очага, заставляют считать ликвидацию последнего при сепсисе
основным лечебным мероприятием. Известно, что иммунная система, которая, в конечном итоге, и определяет устойчивость макроорганизма к инфекции, не может полноценно функционировать при наличии плохо дренируемого очага воспаления. Поэтому, на первом этапе задачей специфических компонентов интенсивной терапии (вакуум-аспирация, выскабливание, надежное дренирование и проточно-аспирационное промывание полости матки растворами антисептиков, управляемая гипотермия матки, противоотечная терапия) являлось снижение микробной агрессии; на втором — ликвидация очага инфекции.
При сепсисе , возникшем у 31 больной на фоне послеродового (27) или постабортного (4) эндометрита, активное воздействие на септический очаг заключалось в местном использовании антисептических и антибактериальных препаратов. Хорошие клинические результаты были получены при наложении аппликаций канамицина с димексидом, длительном промывании (в течение 6-8 часов) полости матки через катетер раствором диокси-дина, содержащим глюкокортикоидные гормоны и антибиотики широкого спектра действия, или свежеприготовленным раствором гипохлорита натрия. Проведенные контрольные бактериологические исследования в процессе местного применения препарата подтвердили его высокую бактерицидную активность в отношении основных возбудителей послеродовой инфекции.
У 6 больных с сепсисом, возникшим на фоне эндометрита после кеса-ревого сечения, единственно правильным являлось радикальное вмешательство — экстирпация матки с маточными трубами. Несмотря на исходную тяжесть состояния больных этой группы, все они успешно перенесли хирургическое вмешательство.
Наиболее сложной являлась проблема ликвидации первичного гнойно-септического очага у 16 больных с септическим шоком, тем более, что у 14
кенщин причиной его развития был криминальный аборт. Тяжесть со-ггояния больных требовала применения наименее травматичного, щадя-дего метода на фоне интенсивной терапии. Этим условиям, в принципе, хгвечает проточно-аспирационное дренирование полости матки. Наш эпыт показывает, что данная методика дает лишь незначительный, крат-современный эффект. Поэтому, наиболее рациональным считали приме-тение данного метода только на этапе подготовки к радикальному хирургическому вмешательству в объеме экстирпации матки с маточными трупами.
Наш небольшой клинический опыт не позволяет подробно останавли-$аться на проблеме ликвидации первичного очага у больных с хрониосеп-:исом, однако хотелось бы отразить некоторые собственные наблюдения. Отсутствие результата от консервативной терапии поступивших к нам в слинику больных можно объяснить лишь одним обстоятельством — не бы-ю санации очага инфекции, и на этом фоне антибактериальная, общеукрепляющая, иммуностимулирующая терапия давала лишь временный •ффект. Поэтому методом выбора явилось оперативное вмешательство в )бьеме экстирпации матки с трубами, что позволило добиться выздоро-«ления больных.
Активная санация первичного очага инфекции или удаление матки у юльпых с акушерским сепсисом сочетались с антибактериальной, нмму-юстимулирующей и инфузионно-трансфузионной терапией, средствами ;етоксикации, гипербарической оксигенацией и др..
На основании данных микробиологических исследований и антибио-‘икограмм наиболее целесообразным являлось применение соответствую-цих доз клафорана и амикацина, цепорина и оксациллина, ампициллина и •ентамицина, левомицетина и линкомицина, что практически перекрывало 1есь спектр обнаруживаемой микрофлоры. При инфильтративных процес-
сах в брюшной полости и малом тазу эффективным оказалось эндолимфа-тическое введение перечисленных антибиотиков. Одновременно с антибиотиками назначались сульфаниламиды (10,0% раствор этазола, бисеп-тола по 10 мл/сутки), инфузии препаратов фторхинолонового ряда (ципролет, ципрофлоксацин), метронидазол. Для профилактики кандидо-микоза и дисбактериоза в схему лечения включали нистатин, леворин, споранокс, эубиотики (мексаза, колибактерин, бифидум бактерии). В течение двух последних лет для лечения больных с акушерским сепсисом в виде монотерапии успешно использовались современные цефалоспорины III поколения — цефметазон, сульперазон, тамицин. По результатам определения чувствительности микрофлоры дисковым методом свыше 90% микроорганизмов были чувствительны к указанным лекарственным средствам. Схема введения была стандартной и включала в себя медленное внутривенное введение 1,0 -2,0 г препарата каждые 12 часов в течение 7 — 10 дней.
В комплексном лечении больных с перитонитом и сепсисом с успехом использовали экстракорпоральные методы детоксикации (гемо- и лимфо-сорбцию, плазмаферез) и комбинации их с физическими методами (УФО, лазерное облучение крови).
Иммунокоррегирующая терапия определялась конкретными изменениями иммунного гомеостаза. В последние годы чаще использовались новые методы, прошедшие широкую клиническую аппробацию в клиниках кафедры, такие, как биогемосорбция путем подключения донорской ксе-носелезенки и ее модификации — инфузии нативного или лиофилизиро-ванного перфузата ксеноселезенки (ИПС.ИЛПС), гемоперфузия через криоконсервированные фрагменты ткани ксеноселезенки (ГКФКС). Преимущества данных методов в лечении больных с акушерским пертонитом и сепсисом заключалось в сочетании детоксикационного и иммуномоду-лирующего действия. Иммуномодулирующий эффект обусловлен действи-
ем биологически активных веществ, вырабатываемых клетками селезенки и поступающих в кровоток при биогемосорбцин с использованием донорской ксеноселезенки, что принципиально отличает этот мегод ог стандартных способов гемосорбцни. По нашему опыту биогемосорбцин с применением донорской ксеноселезенки и ее модификации обладают рядом преимуществ перед другими методами иммунокоррекции: быстрота эффекта, короткий срок иммуномодулирующего действия без опасения активации аутоиммунных процессов ( длительная и нарастающая активация иммунной системы после биогемосорбцин является противопоказанием к повторным сеансам), отсутствие сенсебилизации при повторных перфузи-ях, одновременный антитоксический и иммуномодулируюший эффект.
Инфузионно-трансфузионная терапия у больных с тяжелыми формами гнойно-септических заболеваний также носила индивидуальный характер и определялась конкретными изменениями коллоидно-осмотического состояния. При акушерском перитоните вводили не более 2,0 — 2,5 л жидкости, из которых 1/2 или 2/3 составляли коллоидные растворы (полиглюкин, реополиглюкин, плазма, альбумин, протеин, желатиноль и т.д.), а остальной объем — кристаллоиды (раствор Рингера, лактосол, 10,0% раствор глюкозы, содержащий не менее 4-6 гр калия, инсулин). В качестве гемодилютантов, понижающих концентрацию токсинов в крови и интер-стицни, служили кристаллондные растворы: 5,0 — 10,0% раствор глюкозы и изотонический раствор хлорида натрия в объеме 1000,0 — 1200,0 мл. В комплексе инфузионной терапии больных с сепсисом соотношение между коллоидами и кристаллоидами составляло в первые 6 дней 2:1, в последующие 6 дней 1:1, далее -1:1,5. Для ликвидации острой гипопротеинемин и гипоальбуминемии применяли растворы плазмы, протеина, альбумина. Для повышения коллоидно-онкотического давления использовали полиглюкин, реополиглюкин, гемодез, желатиноль. Из кристаллоидных рас-
творов применяли 10,0% раствор глюкозы с инсулином и калием, лакто-сол, раствор Рингера, 4,0% раствор гидрокарбоната калия. В зависимости от конкретных нарушений концентрации электролитов в эти растворы добавляли расчитанное количество недостающих катионов и анионов.
В состав лечебных мероприятий у всех больных с перитонитом и сепсисом входила по специальным показаниям дигитализация, гепаринотера-пия, антипиретики, антиагреганты (курантил, компламин), ингибиторы ферментов (гордокс), салуретики, витамины, глюкокортикоиды, допамин, налоксон (наркан), парентеральное питание.
Представленная комплексная терапия больных с акушерским перитонитом и сепсисом позволила значительно снизить материнскую смертность от этих осложнений. Из 83 больных с перитонитом и сепсисом умерло 5 женщин, причем 4 из них — от септического шока после криминального аборта, 1 — от прогрессирующей полиорганной недостаточности на фоне сепсиса после кесаревого сечения.
ВЫВОДЫ
1. Акушерский перитонит у 90,2% больных возникает после кесаревого сечения и только в 9,8% случаев является следствием гнойного воспаления придатков матки. Частота «первичного» перитонита составляет 28,0%, «вторичного» — 72,0%, в том числе 43,9% — вследствие «несостоятельности швов» после кесаревого сечения, 18,3% — «перитонита-пареза». 9,7% — разрыва пиосальпинкса в раннем послеродовом периоде.
2. Среди различных клинических форм акушерского сепсиса чаще возникает септицемия (60,8%), реже — септический шок (28,3%), сентикопиемия (7,6%) и хрониосепсис (3,3%). Основой для постановки диагноза должна являться динамика заболевания, выявления «первичного очага», полиорганной недостаточности, а также бактериологическое подтверждение.
3. Этиология акушерского перитонита и сепсиса практически идентичная: в половине случаев эти заболевания возникают при участии аэробно-днаэробных ассоциаций (50,0; 53,3%), несколько реже — только аэробной [33,3; 26,7%) или анаэробной микрофлоры (16,7; 20,0%). Полученные результаты необходимо учитывать при выборе антибактериальных препаратов для лечения данной группы больных.
4. У больных с акушерским перитонитом развитие вторичного клеточного и гуморального иммунодефицита сопровождается активацией неспецифических факторов защиты, что свидетельствует о сохранении защитных возможностей организма. Для больных с сепсисом характерен комплексный вторичный иммунодефицит, проявляющийся резким угнетением не только клеточного и гуморального иммунитета, но и неспецифических факторов защиты.
5. Для иммунокоррегирующей терапии у больных с перитонитом и :епсисом наиболее эффективна биогемосорбция путем подключения донорской ксеноселезенки и ее модификации: инфузия нативного или лио-]жлизированного перфузата ксеноселезенки (И ПС, ИЛ ПС), гемоперфузия нерез криоконсервированные фрагменты ткани ксеноселезенки (ГКФКС). Преимущество данных методов заключается в сочетании детоксикацион-юго и иммуномодулирующего действия.
6. Выраженное гипоонкотическое и гипоосмотнческое состояние плазмы крови у больных с акушерским перитонитом и сепсисом требуют дифференцированного подбора средств коррегирующей инфузионной тера-
1ИИ.
7. Своевременная диагностика и комплексная терапия больных с аку-перским перитонитом и сепсисом, включающая активное воздействие на ‘первичный очаг» (санация, промывание, своевременное удаление и др.), »временные химногерапевтические средства, биогемосорбцию с актива-
цией иммунной системы, управляемую инфузионную терапию и ряд других постоянно пополняющихся методов, позволяют добиться значительного снижения материнской смертности.
8. На основании полученных данных о роли эндогенной инфекции в послеродовом периоде целесообразно, наряду с соблюдением принятого противоэпидемического режима акушерского стационара, особое внимание обращать на использование одноразовых медицинских систем и инструментов, а также предметов ухода за больными.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для своевременной диагностики акушерского перитонита и сепсиса необходима тщательная клиническая оценка и проведение специальных методов исследования (бактериологические, иммунологические, УЗ-обследование, оценка КОС).
2. Для снижения микробной агрессии и повышения защитных сил макроорганизма у больных с акушерским перитонитом и сепсисом показана срочная санация, дренирование или удаление «первичного очага». При подозрении на перитонит после кесаревого сечения показана комплексная интенсивная терапия в течении 6-12 часов, в случае ее неэффективности необходимо удаление очага инфекции и дальнейшая консервативная терапия.
3. Антибактериальная терапия у больных с тяжелыми гнойно-септическими заболеваниями должна проводиться соответствующими дозами клафорана и амикацина, цепорина и оксациллина, ампициллина и гентамицина, левомицетина и линкомицина, что перекрывает весь спектр обнаруживаемой микрофлоры. Для монотерапии препаратами выбора яв-
ляются современные цефалоспорины III поколения — цефметазон, сульпе-разон, тамицин. При инфильтративных процессах в брюшной полости и малом тазу показано эндолимфатнческое введение перечисленных антибиотиков.
4. Для иммунокоррегирующей терапии у больных с перитонитом и сепсисом наиболее эффективна биогемосорбция путем подключения донорской ксеноселезенки и ее модификации: инфузии нативного или лио-филизированного перфузата ксеноселезенки (ИПС, ИЛПС), гемоперфузия через криоконсервированные фрагменты ткани ксеноселезенки ( ГКФКС). Преимущество данных методов, по сравнению с традиционными (гемо- и лимфосорбция, плазмаферез, УФО, лазерное облучение крови), заключается в сочетении детоксикационного и иммуномодулирующего действия. Количество сеансов ЭКПС, ГКФКС, ИПС, ИЛПС, а так же их комбинаций на курс лечения, с интервалами от 2 до 7 суток, определяется сроками достижения стойкого клинического положительного эффекта.
5. Критерием оценки эффективности биогемосорбции у больных с перитонитом и сепсисом является нормгшизация кличества лимфоцитов, Т-лимфоцитов, выравнивание дисбаланса Т-хелперов и Т-супрессоров, увеличение метаболической активности нейтрофилов, снижение уровня циркулирующих иммунных комплексов и повышение синтеза иммуноглобулинов, в первую очередь IgG.
6. При инфузионно-трансфузионной терапии у больных с перитонитом необходимо не более 2,0 — 2,5 л жидкости, из которых 1/2 или 2/3 должны составлять коллоидные растворы (полиглюкин, реополиглюкин, плазма, альбумин, протеин, желатиноль), а остальной объем — кристаллоиды (раствор Рингера, лактосол, 10,0% раствор глюкозы, содержащий не менее 4 — 6 гр калия, инсулин). У больных с сепсисом соотношение между коллоидами и кристаллоидами должно составлять в первые 6 дней 2:1, в по-
следующие 6 дней 1:1, далее 1:1,5. Средний объем вводимой за сутки жид кости в 1-ю неделю составляет до 3200 мл, в течение второй недели — дс 2200 мл, в последующем от 800 до 1600 мл. При развитии септическогс шока соотношение между коллоидами и кристаллоидами должно состав лять 2,5:1.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Интенсивная терапия акушерского перитонита и сепсиса
(в соавт. с В.Н.Серовым, Е.В.Жаровым, О.И.Сусковым, С.Ю.Мешковой)// «Вестник акушера гинеколога».-1996.Nl.-c.3-6.
2. Клинико-бактериологические особенности акушерского перитонита и сепсиса в современных условиях (в соавт. с В.Н.Серовым, Е.В.Жаровым, М.К.Зубаревой)// «Вестник акушера гинеколога».-1996.N2.-с. 19-21.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
45678910
11121314151617
18192021222324
25262728293031
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Мекониевый перитонит — обзор
Результаты рентгенологического исследования
Пренатальный диагноз МВ основывается на ряде неспецифических ультразвуковых данных: многоводие, мекониевый перитонит, внутрибрюшная киста, асцит или расширенный кишечник, заполненный эхогенным материалом. Эти данные приобретают особое значение, когда есть брат или сестра с МВ. Мекониевый перитонит и мекониальная непроходимость кишечника описаны и проиллюстрированы в главе 117.
Эзофагограммы с барием редко используются для поиска варикозного расширения вен у детей, у которых фиброз печени вызвал портальную гипертензию.Варикозное расширение вен может быть случайной находкой на КТ, но его можно выявить и лечить с помощью эндоскопии. Эндоскопия также может быть полезна для оценки пациентов с рефлюксом, поскольку может развиться слизистая оболочка Барретта. Эзофагограммы с барием могут быть полезны пациентам с дисфагией для выявления гастроэзофагеального рефлюкса и его осложнений, таких как эзофагит и стриктура. Портальный венозный кровоток можно оценить с помощью допплерографии при подозрении на портальную гипертензию. 40
Воспаление легких может быть источником активного кровотечения, которое можно спутать с кровотечением из варикозно расширенных вен.Кровоточащие сосуды, которые лечат с помощью методов внутрисосудистой эмболизации или сегментарной резекции легкого, чаще развиваются в правой верхней доле, чем в других сегментах легкого, из-за хронических воспалительных изменений, которые, по-видимому, благоприятствуют этому сегменту. КТ легких используется для оценки степени заболевания даже в периоды, когда у ребенка нет симптомов.
Рентгенограммы брюшной полости у детей с МВ могут выявить кальцификаты брюшины, а у пожилых пациентов — кальцификации поджелудочной железы.У пациентов с портальной гипертензией часто увеличивается селезенка. Инвагинацию трудно отличить от синдрома, эквивалентного меконию илеуса. И то и другое может проявляться болью в животе, пальпируемым образованием брюшной полости и очевидными рентгенограммами непроходимости тонкой кишки. Пациенты с эквивалентом мекониевой непроходимости, вероятно, будут иметь большое количество пузырчатых фекалий, видимых на рентгенограммах брюшной полости (рис. 122-11). Доброкачественный кишечный пневматоз, не связанный с лежащим в основе некрозом или изъязвлением кишечника, может присутствовать у пожилых пациентов, у которых есть другие аномальные скопления воздуха в грудной клетке или брюшной полости, и в некоторых случаях может имитировать эквивалент кишечной непроходимости мекония. 42
Патологии желчевыводящих путей встречаются часто. 28, 29, 43 Несмотря на адекватное голодание, при УЗИ часто бывает небольшой или неотличимый желчный пузырь. Повышается частота образования камней в желчном пузыре и ила. Нарушения оттока желчи были зарегистрированы с помощью гепатобилиарной сцинтиграфии. 44 Корреляция результатов сонографии с биохимическими исследованиями функции печени может позволить раннее выявить пациента, печень которого требует более тщательного наблюдения.Тяжелое заболевание печени можно лечить трансплантацией печени. 41
Пероральные контрастные исследования двенадцатиперстной кишки (см. Главу 116) и тонкой кишки демонстрируют дилатацию, длительное время прохождения и выступающие вальвулы conniventes. Плохое покрытие двенадцатиперстной кишки вызвано ненормальным количеством и качеством слизи. Дефекты пломбирования также могут возникать в результате увеличения лимфатических узлов Бруннера или варикозного расширения вен парадуоденальной области. Загустевшая слизь, пораженная криптами слизистой оболочки, вызывает их увеличение. Если эти эктатические крипты заполняются барием, слизистая оболочка тонкой кишки становится нерегулярной и покрытой шипами.Повреждение слизистой оболочки двенадцатиперстной кишки усугубляется гиперсекрецией желудка, которая недостаточно забуферена субнормальным панкреатическим секретом.
Фиброзирующая колонопатия более полно описана в главе 121. Этот воспалительный процесс связан с высокими уровнями заместительной терапии ферментами поджелудочной железы, возможно, наложенной на иммунологически специфический субстрат популяции МВ. Также считается, что некоторые препараты, заменяющие ферменты поджелудочной железы, с большей вероятностью вызывают это осложнение.
Смертельный диссеминированный туберкулезный перитонит после самопроизвольного аборта: отчет о болезни
Мы описываем редкий случай летального диссеминированного туберкулезного перитонита у молодой женщины с быстро прогрессирующим клиническим течением после самопроизвольного аборта на сроке 20 недель беременности. Клинические и лабораторные данные изначально были без особенностей. Ей была сделана диагностическая лапароскопия, которая выявила многочисленные крошечные имплантаты на брюшине и внутренних органах. Гистопатология показала хронические казеозные гранулемы, а в культуре ткани выросли Mycobacterium tuberculosis.На пятый день противотуберкулезного лечения наступила полиорганная недостаточность — легочная, печеночная и почечная недостаточность. У нее развился рефрактерный метаболический ацидоз с коагулопатией и панцитопенией, и она умерла от острого респираторного дистресс-синдрома и септического шока на двенадцатый день госпитализации.
1. Введение
Туберкулез (ТБ) — серьезная проблема глобального здравоохранения. Всемирная организация здравоохранения объявила туберкулез глобальной чрезвычайной ситуацией в 1994 г. [1]. Хотя это заболевание можно предотвратить и вылечить, ежегодно от восьми до десяти миллионов человек заболевают туберкулезом; ежегодно от этого заболевания умирает не менее двух миллионов человек [2].Заболеваемость составляет 130 на 100000 человек в мире и 22 на 100000 человек в Турции [3]. ТБ вносит значительный вклад в материнскую смертность, при этом заболевание входит в тройку основных причин смерти среди женщин в возрасте 15–45 лет [4]. Осложнения, о которых сообщалось во время беременности, включают более высокий уровень самопроизвольных абортов, малость матки для фиников, субоптимальную прибавку в весе во время беременности, преждевременные роды, низкий вес при рождении и повышенную неонатальную смертность. Поздняя диагностика является независимым фактором, который может увеличить акушерскую заболеваемость примерно в четыре раза, а риск преждевременных родов — в девять раз [5].
Хотя первичным источником туберкулеза являются легкие, одна треть пациентов может иметь внелегочное заболевание [6]. Брюшина — одно из наиболее частых внелегочных очагов заболевания. Распространенный или мягкий ТБ означает все формы прогрессирующего, широко распространенного гематогенного ТБ [7]. Он может быть первичным молниеносным, включая полиорганную системную недостаточность, септический шок и синдром острого респираторного дистресс-синдрома (ОРДС) с острым началом и быстрым клиническим течением, или может быть реактивацией латентного очага, который с большей вероятностью будет подострым и хроническим [7 , 8].Здесь мы сообщаем о редком случае летального диссеминированного туберкулезного перитонита у молодой женщины с быстро прогрессирующим клиническим течением после самопроизвольного аборта на сроке 20 недель.
2. Описание клинического случая
Женщина 25 лет, беременность 3, паритет 1, самопроизвольный аборт 1 и медикаментозный аборт с отсасывающим выскабливанием 1, женщина обратилась в нашу клинику с диффузной болью в животе продолжительностью 2 недели, массивным асцитом и длительная перемежающаяся лихорадка с повышением до 40,0 ° C. Девять дней назад она перенесла самопроизвольный аборт на сроке 20 недель в другой больнице.Она сообщила об отсутствии аппетита, головокружении, потливости и повышенной температуре, сохраняющихся не менее 3 недель. Она отрицала кашель и потерю веса. При физикальном обследовании у нее было вздутие живота, которое предполагало скопление жидкости, диффузную болезненность, особенно в нижней части живота, и незначительную шейку матки с положительным тестом на болезненность при движении. Признаков портальной гипертензии не было. Трансвагинальное УЗИ подтвердило наличие асцита и двустороннего гидросальпинкса (рис. 1). Гемоглобин, тромбоциты, С-реактивный белок и лейкоциты были 7.9 г / дл, 112000 / мм 3 , 21,6 мг / л и 8010 мк / л с низким числом лимфоцитов соответственно. Тест на ВИЧ, серологический анализ на гепатит, посев крови и мочи были отрицательными. Функциональные тесты почек и уровни печеночных трансаминаз были в пределах нормы. Уровень канцерогенного антигена (Ca) -125 в сыворотке был 669 единиц / мл. Рентгенография грудной клетки выявила небольшие плевральные выпоты с обеих сторон. Диагностический парацентез выявил воспаление с преобладанием лимфоцитов и реактивных мезотелиальных клеток.Цитологический анализ на атипичные клетки отрицательный. Под микроскопом кислотоустойчивые бациллы не обнаружены. Результаты полимеразной цепной реакции ТБ (ПЦР) и посева асцитической жидкости были отрицательными. Первоначально пациентка получала внутривенные антибиотики широкого спектра действия, но лечение не улучшило ее клиническое состояние, и в дальнейшем она была госпитализирована в отделение интенсивной терапии. На основании анамнеза и лабораторных исследований были получены снимки компьютерной томографии (КТ) грудной клетки и брюшной полости для дальнейшего изучения этиологии асцита.Эти исследования продемонстрировали двусторонний плевральный выпот, ателектаз, внешний вид матового стекла паренхимы легких, массивный асцит, гепатомегалию, гепатостеатоз и картину перитонеального карциноматоза с образованием сальника без определенной опухолевой массы придатков. Эндоскопия верхних отделов желудочно-кишечного тракта патологии не выявила. Примерно через 7 дней после поступления пациенту была проведена диагностическая лапароскопия, которая выявила массивный асцит, обширные спайки между внутренними органами и многочисленные крошечные узелковые имплантаты на поверхности брюшины, печени, желудка, яичников, кишечника, сальника и брыжейки.Из-за наличия подозрения на злокачественное новообразование лапароскопию преобразовали в исследовательскую лапаротомию. Проведен адгезиолиз. Матка была размером 6–8 недель с узловатой серозной поверхностью. Двусторонние фаллопиевы трубы были сильно раздуты и извивались с неузнаваемыми бахромками. Из подозрительных имплантатов были взяты множественные прицельные биопсии. Образцы тканей фимбрии, брюшины и сальника были отправлены на анализ замороженных срезов, и было обнаружено, что они соответствуют гранулематозному воспалению.Некоторые образцы тканей и асцитическая жидкость отправлены на микробиологическое исследование.
В послеоперационном периоде антимикобактериальная терапия изониазидом, рифампицином, пиразинамидом и этамбутолом была запланирована и начата эмпирически. У нее была гипотензия, и ей требовались вазопрессоры. Ее газы крови и контрольная рентгенография грудной клетки, показавшая диффузные легочные инфильтраты, были совместимы с ОРДС. Пациенту вводили седативные препараты и применяли методы искусственной вентиляции легких с защитой легких. На пятый день противотуберкулезного лечения наступила полиорганная недостаточность — легочная, печеночная и почечная недостаточность.У нее развился рефрактерный метаболический ацидоз с коагулопатией и панцитопенией, и она умерла от ОРДС, септического шока и полиорганной недостаточности на двенадцатый день госпитализации. Окончательное гистопатологическое исследование образцов биопсии показало хронические казеозные гранулемы с центральным некрозом (рис. 2), а в культуре ткани выросли Mycobacterium tuberculosis.
3. Обсуждение
Туберкулезный перитонит — это форма туберкулеза брюшной полости и / или таза, которая может поражать брюшину, желудочно-кишечный тракт, лимфатические узлы или твердые внутренние органы, и составляет около 1-2% от общего числа случаев.Это происходит либо в результате распространения соседнего туберкулезного заболевания, такого как абдоминальный или генитальный очаг, либо в результате гематогенного распространения при первичном туберкулезе легких [9]. ТБ — серьезная диагностическая проблема. Он имеет разнообразные и неспецифические симптомы и результаты лабораторных исследований и может имитировать многие другие инфекционные или злокачественные заболевания [10]. Наиболее частыми симптомами являются лихорадка, потеря веса и вздутие живота, а наиболее частыми признаками — вздутие живота, асцит и образование в брюшной полости. Он был включен в дифференциальную диагностику лихорадки неизвестного происхождения, перитонеального карциноматоза, рака яичников и асцита портальной гипертензии или сердечного происхождения [11].
Поражения легких могут не распознаваться как туберкулез, или инфекции могут не проявляться при рентгенографии грудной клетки. Плевральный выпот может быть единственным рентгенологическим обнаружением у некоторых пациентов [12]. Наиболее частыми результатами сонографии и КТ являются асцит, утолщение внутренних органов (сальниковых, брыжеечных, перитонеальных и кишечных), спаек между внутренними органами и лимфаденопатия [13]. Лапароскопические находки, сообщаемые разными авторами, как правило, представляют собой экссудативный, мутный асцит с множественными беловатыми узелками или бугорками, покрывающими висцеральную и париетальную брюшину, пленчатые обширные спайки и утолщение сальника [14, 15].В нашем случае были очевидны как визуализация, так и оперативные данные.
Повышенный уровень Са-125 в сыворотке крови является неспецифическим маркером рака яичников. Он также может быть повышен при различных гинекологических и негинекологических состояниях, таких как туберкулезный перитонит, эндометриоз, менструация, тазовая инфекция, перитонит, панкреатит, гепатит, нефротический синдром, перикардит и пневмония [16]. Сообщалось о нескольких сериях случаев туберкулезного перитонита, имитирующего рак яичников, с повышенным уровнем Са-125 [17, 18].Однако рак яичников редко встречается в возрасте до 40 лет, но туберкулез брюшины чаще всего встречается у пациентов в возрасте от 20 до 40 лет [18], как сообщается в нашей статье.
Есть разногласия относительно лучшего способа диагностики туберкулезного перитонита. Казеозное гранулематозное воспаление может быть признаком туберкулезного перитонита. Для постановки точного диагноза часто требуется гистологическое исследование. Диагноз также можно подтвердить посевом и ПЦР инфицированных тканей.Однако производительность культивирования Mycobacterium tuberculosis из жидкостей организма низкая, а время обработки культивирования составляет около 6 недель, что может вызвать задержку диагностики и лечения, если у пациента действительно рак яичников [19]. В обзоре 18% случаев диссеминированного туберкулеза были диагностированы посмертно по сравнению с 4,8% среди больных туберкулезом легких [20]. Следовательно, предоперационная оценка биологических жидкостей может не предоставить достаточных доказательств перед любым хирургическим вмешательством. Другие неинвазивные скрининговые тесты, такие как анализ асцитической жидкости, оценка аденозиндезаминазы при асците и визуализация, в лучшем случае могут быть дополнительными диагностическими инструментами [13, 21].
В частности, внелегочные органные проявления туберкулеза могут быть связаны с ошибочным диагнозом и летальным исходом [22]. Распространенный туберкулез может вызывать жизненно важные функциональные нарушения в зависимости от стадии заболевания и органных проявлений. Смертность от диссеминированного туберкулеза составляет примерно 20% [23]. У ОРДС с более тяжелым туберкулезом определенно более высокий уровень смертности. Сообщается, что смертность достигает 100% при наличии сопутствующей панцитопении [24]. Другие факторы, связанные со смертностью, включают несвоевременную диагностику и терапию, а также наличие диссеминированной внутрисосудистой коагулопатии, септического шока и полиорганной недостаточности.Было подсчитано, что 1-2% случаев ОРДС были связаны с диссеминированным туберкулезом [25].
Информация о заболеваемости туберкулезом у беременных недоступна во многих странах из-за множества смешивающих факторов. Однако ожидается, что заболеваемость среди беременных женщин будет такой же высокой, как и среди населения в целом. Влияние туберкулеза на беременность может зависеть от многих факторов, включая тяжесть заболевания, степень протекания беременности на момент постановки диагноза, наличие внелегочного распространения и коинфекции ВИЧ, а также назначенное лечение.Наихудший прогноз отмечается у женщин, у которых диагностирована запущенная стадия заболевания в послеродовом периоде, а также у женщин с коинфекцией ВИЧ [5].
В текущем отчете мы представили редкую фатальную комбинацию диссеминированного туберкулезного перитонита и ОРДС после самопроизвольного аборта. Первоначальные диагностические исследования не смогли определить реальную болезнь, и она резко умерла от болезни на двенадцатый день госпитализации. В этом отчете подчеркивается прогностическое значение беременности для лечения туберкулеза, а также важность ранней диагностики и лечения.Раннее назначение антимикобактериальной химиотерапии и ИВЛ, особенно при наличии ОРДС, имеет решающее значение для оптимизации результата.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Перитонит — Диагностика и лечение
Диагноз
Чтобы диагностировать перитонит, ваш врач обсудит с вами вашу историю болезни и проведет медицинский осмотр.Когда перитонит связан с перитонеальным диализом, ваших признаков и симптомов, особенно мутности диализирующего раствора, может быть достаточно, чтобы врач смог диагностировать это состояние.
В случаях перитонита, при котором инфекция может быть результатом других заболеваний (вторичный перитонит) или когда инфекция возникает из-за скопления жидкости в брюшной полости (спонтанный бактериальный перитонит), ваш врач может порекомендовать следующие тесты для подтверждения диагноз:
- Анализы крови. Образец вашей крови может быть взят и отправлен в лабораторию для проверки на высокое количество лейкоцитов. Также может быть выполнен посев крови, чтобы определить, есть ли в вашей крови бактерии.
- Визуальные тесты. Ваш врач может захотеть использовать рентгеновский снимок, чтобы проверить наличие отверстий или других перфораций в желудочно-кишечном тракте. Также можно использовать ультразвук. В некоторых случаях ваш врач может использовать компьютерную томографию (КТ) вместо рентгеновского снимка.
- Анализ перитонеальной жидкости. Используя тонкую иглу, ваш врач может взять образец жидкости в брюшине (парацентез), особенно если вы проходите перитонеальный диализ или у вас в брюшной полости имеется жидкость из-за заболевания печени. Если у вас перитонит, исследование этой жидкости может показать повышенное количество лейкоцитов, что обычно указывает на инфекцию или воспаление. Посев жидкости также может выявить присутствие бактерий.
Вышеупомянутые тесты могут также потребоваться, если вы получаете перитонеальный диализ и диагноз перитонита не определен после физического осмотра и исследования диализирующего раствора.
Лечение
Спонтанный бактериальный перитонит может быть опасным для жизни. Тебе нужно остаться в больнице. Лечение включает антибиотики и поддерживающую терапию.
Вам также необходимо будет остаться в больнице из-за перитонита, вызванного инфекцией, вызванной другими заболеваниями (вторичный перитонит). Лечение может включать:
- Антибиотики. Скорее всего, вам дадут курс лечения антибиотиками для борьбы с инфекцией и предотвращения ее распространения.Тип и продолжительность антибактериальной терапии будут зависеть от тяжести вашего состояния и типа перитонита. Вам могут назначить антибиотик, который лечит широкий спектр бактерий, пока врачи не получат больше информации о конкретных бактериях, вызывающих вашу инфекцию. Тогда они смогут более точно нацелить ваш антибиотик.
- Хирургия. Хирургическое вмешательство часто требуется для удаления инфицированной ткани, лечения основной причины инфекции и предотвращения распространения инфекции, особенно если перитонит вызван разрывом аппендикса, желудка или толстой кишки.
- Другие виды лечения. В зависимости от ваших признаков и симптомов ваше лечение в больнице, скорее всего, будет включать обезболивающие, жидкости, вводимые через зонд (внутривенные жидкости), кислород и, в некоторых случаях, переливание крови.
Если вы проходите перитонеальный диализ
Если у вас перитонит, ваш врач может порекомендовать вам пройти диализ другим способом в течение нескольких дней, пока ваше тело не излечится от инфекции. Если перитонит сохраняется или рецидивирует, возможно, вам придется полностью прекратить перитонеальный диализ и перейти на другую форму диализа.
Клинические испытания
Изучите исследования клиники Мэйо, в которых тестируются новые методы лечения, вмешательства и тесты как средства предотвращения, обнаружения, лечения или контроля этого состояния.
18 июня 2020 г.
Показать ссылки- Yu ASL, et al., Eds. Перитонеальный диализ. В: Brenner & Rector’s The Kidney. 11-е изд. Эльзевир; 2020. https: //www.clinicalkey.com. По состоянию на 20 марта 2020 г.
- Ferri FF. Перитонит вторичный. В: Клинический советник Ферри 2020. Elsevier; 2020. https://www.clinicalkey.com. По состоянию на 17 марта 2020 г.
- Методы лечения почечной недостаточности: перитонеальный диализ. Национальный информационный центр по почечным и урологическим заболеваниям (NKUDIC). http://kidney.niddk.nih.gov/KUDiseases/pubs/peritoneal/index.aspx. По состоянию на 20 марта 2020 г.
- Runyon BA. Спонтанный бактериальный перитонит у взрослых: лечение и профилактика.https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Острая боль в животе. Руководство Merck Professional Edition. http://www.merckmanuals.com/professional/gastrointestinal_disorders/acute_abdomen_and_surgical_gastroenterology/acute_abdominal_pain.html?qt=&sc=&alt=. По состоянию на 13 марта 2020 г.
- Picco MF (заключение эксперта). Клиника Майо. 24 марта 2015 года.
- Доэрти GM, изд. Брюшная полость. В: Современная диагностика и лечение: хирургия.14-е изд. McGraw-Hill Education; 2015. https://accessmedicine.mhmedical.com. По состоянию на 13 марта 2020 г.
- AskMayoExpert. Спонтанный бактериальный перитонит (взрослый). Клиника Майо; 2019.
- Runyon BA. Спонтанный бактериальный перитонит у взрослых: диагноз. https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Feehally J, et al., Eds. Осложнения перитонеального диализа. В кн .: Комплексная клиническая нефрология. 6-е изд. Эльзевир; 2019. https: // www.Clinicalkey.com. По состоянию на 20 марта 2020 г.
- Salzer, WL. Перитонит, связанный с перитонеальным диализом: проблемы и решения. Международный журнал нефрологии и реноваскулярных заболеваний. 2018; DOI: 10.2147 / IJNRD.S123618.
- Спонтанный бактериальный перитонит (САБ). Руководство Merck Professional Edition. https://www.merckmanuals.com/professional/hepatic-and-biler-disorders/approach-to-the-patient-with-liver-disease/spontaneous-bacterial-peritonitis-sbp. Доступ 13 марта 2020 г.
- Greenberger NJ, et al., Eds. Асцит и спонтанный бактериальный перитонит. В: Современная диагностика и лечение: гастроэнтерология, гепатология и эндоскопия. 3-е изд. McGraw-Hill Education; 2016. https://accessmedicine.mhmedical.com. По состоянию на 17 марта 2020 г.
- Burkart JM. Клинические проявления и диагностика перитонита при перитонеальном диализе. https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Burkart JM. Факторы риска и профилактика перитонита при перитонеальном диализе.https://www.uptodate.com/contents/search. По состоянию на 13 марта 2020 г.
- Li PK и др. Рекомендации ISPD по перитониту: обновленная информация о профилактике и лечении 2016 г. Международный перитонеальный диализ. 2016; DOI: 10.3747 / pdi.2016.00078.
- Раджан Э. (экспертное заключение). Клиника Майо. 1 июня 2020 г.
Связанные
Связанные процедуры
Показать другие связанные процедурыПродукты и услуги
Показать больше продуктов и услуг Mayo ClinicТуберкулез брюшины у беременной женщины из Гаити, США — Том 19, номер 3 — март 2013 — Журнал Emerging Infectious Diseases
Редактору: 29-летняя женщина на сроке гестации 23 недели во время первой беременности обратилась в акушерскую клинику нашей больницы после 6 дней вагинального кровотечения и болей в животе.У нее не было ни лихорадки, ни пота, ни потери веса, ни схваток, ни других симптомов. В остальном она была здорова; она не принимала никаких лекарств, но принимала препараты железа и поливитамины. Она легально иммигрировала в Соединенные Штаты из Гаити 8 месяцев назад и не имела контактов с туберкулезом. При физическом осмотре были обнаружены коричневые выделения из влагалища и закрытая шейка матки. Акушерское ультразвуковое исследование было нормальным, а образцы вагинального мазка были отрицательными на Neisseria gonorrhea и Chlamydia trachomatis .
Рисунок
Рисунок. . . Последовательность Т2-взвешенной магнитно-резонансной томографии брюшной полости беременной женщины из Гаити. Перед маткой показано сальниковое образование средней интенсивности (белая стрелка).
В течение следующих 2 недель у нее усилились вагинальное кровотечение и боль в животе. Ее положили в больницу. Медицинский осмотр выявил вагинальное кровотечение, но в остальном ее состояние не изменилось. Обычные лабораторные исследования были нормальными. Повторное акушерское ультразвуковое исследование показало жизнеспособный плод, асцит и корку эхогенного материала размером 15 × 15 × 3 см перед маткой.Эта аномалия была в верхней части живота, области, не визуализированной на ее предыдущем ультразвуковом исследовании. Магнитно-резонансная томография брюшной полости выявила умеренный асцит и сальник 21 × 14 × 3 см средней интенсивности на последовательностях T1 и T2; лимфаденопатии не было (рисунок). На рентгенограмме грудной клетки был виден крошечный плевральный выпот слева. Обычные результаты кожных проб на ВИЧ и туберкулин были отрицательными 4 месяца назад, а результаты предиммиграционного обследования и рентгенограмма грудной клетки были нормальными.
Тонкоигольная аспирация сальниковой массы не диагностирована.У пациентки продолжались вагинальное кровотечение и боль в животе, шейка матки расширилась. У нее была температура во рту 38,9 ° по Цельсию. Исследовательская лапаротомия показала рыхлое образование сальника с имплантатами в тонкой кишке; на 26 неделе беременности была выполнена частичная оментэктомия. Во время этой процедуры у пациентки родился ребенок мужского пола.
Множественные гранулемы, некоторые из которых содержат кислотоустойчивые бациллы, были идентифицированы при гистологическом исследовании импульса (рисунок в Техническом приложении).Опосредованная транскрипцией амплификация образца дала положительный результат на Mycobacterium tuberculosis рРНК; позже вырастили M. tuberculosis , чувствительных ко всем противотуберкулезным препаратам первого ряда. Мазки и посев мокроты не проводились. Лечение пациента началось с изониазида, рифампицина, этамбутола и пиразинамида; у нее исчезли лихорадка и боли в животе. Ее сын был помещен в отделение реанимации новорожденных и получил антимикобактериальную терапию.Он также выздоровел и был выписан через 135 дней.
Этот случай освещает несколько вопросов, связанных с эпидемиологией и диагностикой туберкулеза. Хотя заболевание легких является наиболее частым проявлением туберкулеза в целом, внелегочный туберкулез составляет значительную и постоянно увеличивающуюся долю случаев в Соединенных Штатах ( 1 ). Беременность связана с большей вероятностью внелегочного заболевания; Согласно недавнему исследованию ( 3 ) внелегочная инфекция составляет 13% всех случаев во всем мире ( 2 ), но 50% случаев приходится на беременность.
Частота туберкулеза брюшины у беременных неизвестна; в литературе было зарегистрировано несколько случаев ( 4 — 7 ), хотя нам известно еще о 3 случаях из Гаити (онлайн-таблица Технического приложения). Тем не менее, случаи, скорее всего, не будут диагностированы или диагностированы на поздних стадиях болезни. Недостаточный диагноз и поздняя диагностика могут быть вызваны неспецифическим характером симптомов, обычно болью в животе и асцитом, которые могут быть связаны с самой беременностью или акушерскими осложнениями.Эти ошибочные объяснения симптомов отражены в этом пациенте, симптомы которого изначально были связаны с отслойкой позвоночника, и у которого не был диагностирован туберкулез до более чем 3 недель после обращения за медицинской помощью. Такие задержки в диагностике типичны для туберкулеза брюшины и связаны с повышенным уровнем смертности ( 8 ). Во многих случаях клинические признаки не позволяют отличить туберкулез брюшины от злокачественного новообразования, что требует более тщательного обследования ( 7 ).
Неспособность диагностировать туберкулез брюшины во время беременности или иным образом также может быть результатом нечувствительности неинвазивных диагностических тестов. Парацентез с кислотостойким окрашиванием выявляет лишь меньшую часть случаев ( 8 ). Чувствительность микобактериальных культур асцитной жидкости варьируется, и результаты посева часто недоступны в течение нескольких недель ( 8 ). Аденозиндезаминаза асцитной жидкости показала себя многообещающим в качестве надежного, минимально инвазивного диагностического теста в странах с ограниченными ресурсами, но оказалась нечувствительной в исследовании Соединенных Штатов ( 9 ).Кроме того, хотя на эффективность туберкулиновой кожной пробы и анализа высвобождения гамма-интерферона беременность не влияет ( 10 ), ни одна из них не может отличить активную инфекцию от латентной. Без диагностических клинических признаков или чувствительных неинвазивных тестов диагноз туберкулеза брюшины может быть подтвержден только с помощью лапароскопии или лапаротомии, как в нашем случае. Такие инвазивные методы и оборудование для тестирования, оборудование и персонал могут быть недоступны в условиях ограниченных ресурсов.
Этот случай также иллюстрирует сохраняющуюся угрозу туберкулеза в странах с любым уровнем дохода. Неясно, где наш пациент заболел туберкулезом; она, скорее всего, заразилась на Гаити, но передача инфекции внутри ее гаитянской общины в Соединенных Штатах или из другого источника также возможна. Тем не менее, как и в ее случае, большинство случаев туберкулеза в Соединенных Штатах происходит у лиц, родившихся за границей. Учитывая легкость и частоту поездок, отсутствие контроля над туберкулезом в любом месте, вероятно, будет иметь более широкие последствия.Где бы они ни работали, клиницисты должны проявлять бдительность в отношении туберкулеза во всех его разнообразных формах.
верхний
Принадлежность к авторам: Принадлежности: Бригам и женская больница, Бостон, Массачусетс, США (К.Л. Ард, Б.Т. Чан, Д.А. Милнер-младший, П.Е. Фармер, С.П. Кениг); Массачусетская больница общего профиля, Бостон (K.L. Ard, B.T. Chan)
Выводы, выводы и мнения, высказанные авторами, пишущими для этого журнала, не обязательно отражают официальную позицию U.S. Министерство здравоохранения и социальных служб, Служба общественного здравоохранения, Центры по контролю и профилактике заболеваний или аффилированные с авторами учреждения. Торговые наименования используются только для идентификации и не подразумевают одобрения какой-либо из вышеперечисленных групп.
Список литературы
| ||||
Серьезные послеродовые инфекции | GLOWM
ВВЕДЕНИЕ
Эндометрит — наиболее распространенная послеродовая инфекция.Заболеваемость послеродовым эндометритом снизилась благодаря широкому применению профилактических антибиотиков. Заболеваемость после кесарева сечения снизилась с 50% до 90% без антибиотикопрофилактики до 15-20% с профилактикой. 1 Тем не менее, инфекция все еще встречается у 10-20% пациентов, получающих профилактику, а также у большого числа женщин, не получающих профилактику, поэтому очевидно, что инфекция все еще имеет место в эту эпоху профилактики. Кроме того, влияние антибиотикопрофилактики на серьезную инфекцию кажется минимальным, отчасти потому, что профилактика, по-видимому, меньше влияет на развитие серьезной инфекции, чем на послеоперационную лихорадку, и отчасти потому, что у большого числа женщин, у которых развивается серьезная инфекция, наблюдается недостаточные факторы риска для профилактики.Многие из наиболее серьезных инфекций возникают из-за необычных организмов, которые чаще вызывают инфекцию случайно, чем из-за наличия предсказуемых факторов риска. В то же время изменения в акушерской практике продолжают увеличивать риск инфицирования пациентов. Кесарево сечение составляет постоянно увеличивающуюся долю родов; Послеродовой эндометрит в 10-20 раз чаще встречается у женщин, родивших путем кесарева сечения, чем у женщин, родивших естественным путем. 2 Кроме того, все большее число женщин проходят инвазивные процедуры до или во время родов.Существует тенденция, особенно среди беременных с выраженной недоношенностью, к более длительным задержкам между разрывом плодных оболочек и родами. Женщинам с тяжелым заболеванием, которое потенциально увеличивает частоту инфекций, например, диабетикам, пациентам с трансплантацией почек и тем, кто проходит длительную стероидную терапию, теперь рекомендуется забеременеть, если раньше они либо не могли забеременеть, либо им не рекомендовали беременность.
С другой стороны, серьезные осложнения, вызванные инфекцией, стали необычными в нашу эпоху.Материнская смертность от инфекций больше не входит в число трех традиционных основных причин материнской смертности. 3 Послеродовой эндометрит обычно адекватно лечится любым из большого числа эффективных и безопасных антибиотиков. Фактически, зависимость от эффективности антибиотиков настолько велика, что подавляющее большинство женщин с лихорадкой лечатся без тщательного медицинского осмотра или без посева. Однако не все женщины с лихорадкой страдают послеродовым эндометритом, и не все инфицированные пациенты адекватно реагируют на терапию антибиотиками.Сегодня практикующие врачи имеют тенденцию почти слепо полагаться на эффективность антибиотиков. В этой главе станет очевидно, что, хотя они и редки, серьезные послеродовые инфекции все же возникают. Необходимо быстро и точно диагностировать серьезную инфекцию. Также станет очевидно, что многие серьезные, потенциально опасные для жизни послеродовые инфекции не поддаются лечению только антибиотиками, и обычно становится необходимым хирургическое вмешательство.
Полезно знать патофизиологию послеродовой инфекции.Влагалище содержит большое количество организмов (от 10 4 до более 10 9 организмов на миллилитр вагинальной жидкости) в непосредственной близости от обычно стерильных верхних половых путей. 4 В то время как большинство этих вагинальных организмов имеют низкую вирулентность, меньшие концентрации организмов с высокой вирулентностью также находятся во влагалище. Небольшое количество женщин даже является носителем большого количества вирулентных организмов. Организмы из влагалища часто попадают в матку во время родов.Колонизация околоплодных вод и частота послеродовых инфекций напрямую связаны с продолжительностью родов и разрывом плодных оболочек. Полость матки имеет две характеристики, которые способствуют возможности инфицирования: большая площадь поверхности, на которой может возникнуть инфекция, и после родов через плаценту большие открытые венозные каналы под плацентой, которые напрямую доступны для бактерий внутри матки. Матка также служит анатомическим барьером, который эффективно предотвращает инфекцию; однако разрывы этого анатомического барьера позволяют установить инфекцию.Инфекции гораздо более распространены, когда анатомический барьер нарушается путем кесарева сечения, установки мочевого катетера, внутривенного введения и анестезиологических блокад, чем когда эти процедуры не выполняются. Организмы, занесенные в обычно стерильные зоны в результате нарушения, часто вызывают инфицирование уязвимых зон.
Полезно разделить послеродовые инфекции на те, которые возникают в раннем послеродовом периоде (<48 часов), и на те, которые возникают в позднем послеродовом периоде (от 3 дней до 6 недель). 5 У пациентов могут развиться инфекции, а иногда и серьезные инфекции, в течение первых 24 часов после родов, и ранние инфекции требуют такого же быстрого и эффективного лечения, как и те, которые возникают позже. У послеродовых фебрильных женщин бактериемия проявляется как в первые 24 часа, так и в последующие несколько дней. 6 Более 90% женщин с лихорадкой 38,5 ° C или выше в первые 24 часа после родов нуждаются в лечении, 7 и старая концепция, согласно которой инфекция не возникает в первые 24 часа после родов, должна быть отвергнута.Фактически, опасная для жизни инфекция может возникнуть в течение нескольких часов после родов. С другой стороны, субфебрильная лихорадка с температурой до 38 ° C в течение первых 24 часов после родов, особенно перемежающаяся лихорадка, обычно не свидетельствует об инфекции и не требует лечения антибиотиками. 7
РАННЯЯ ИНФЕКЦИЯ
Ранняя инфекция чаще всего возникает в результате субклинической инфекции или чрезмерной бактериальной колонизации околоплодных вод и децидуальных матов до родов, причем оба эти явления часто возникают в результате продолжительных родов или разрыва плодных оболочек.Обычно организмы, вызывающие ранние инфекции, способны быстро делиться или вырабатывать токсины. Организмы, токсины или и то, и другое легко получают доступ к сосудистой системе послеродовых пациентов из-за больших открытых венозных каналов в матке или из-за нарушения естественных барьеров.
При развитии симптомов или признаков тяжелой инфекции необходимо тщательное обследование пациента путем сбора анамнеза и физического обследования. Симптомы сильной боли, которые кажутся непропорциональными, чем обычно ожидаемые, могут возникать при тяжелой инфекции.Внезапная боль при потоотделении может указывать на внезапное событие. Наиболее частые симптомы и признаки, связанные с тяжелой инфекцией, перечислены в таблице 1. Необычное беспокойство или дезориентация могут указывать на надвигающийся шок кровообращения. Прострация указывает на серьезное состояние. Необычное повышение температуры, лейкоцитоз, лейкопения, гемоконцентрация, низкий гематокрит или плохой диурез требуют тщательного исследования на предмет серьезной инфекции. Дополнительные необычные проявления указывают на серьезную инфекцию у пациента с сепсисом: септический шок, респираторный дистресс-синдром у взрослых, диссеминированное внутрисосудистое свертывание, легочная эмболия, гемолиз, внезапная анасарка или сердечная недостаточность.Увеличение площади целлюлита при адекватной терапии антибиотиками или некроз тканей также указывает на серьезную инфекцию. Как подчеркивается позже, при появлении этих дополнительных признаков требуется хирургическое удаление инфицированных участков. Мониторинг интенсивной терапии следует проводить так, чтобы можно было точно задокументировать жизненно важные показатели, газы крови и функцию мочи (таблица 2). Могут быть показаны ультразвуковые или визуализирующие исследования. Пациенты с симптомами и признаками серьезной инфекции должны проконсультироваться со специалистом по инфекционным заболеваниям или быть переведены в специализированный центр после стабилизации клинического состояния.
ТАБЛИЦА 1. Общие проявления, указывающие на тяжелую послеродовую инфекцию
Физический осмотр | Лабораторный осмотр | ||||||||||||||||||||||||||||
Дезориентация | Выраженная лейкопения (<1 000) | ||||||||||||||||||||||||||||
Прострация | Гемоконцентрация (гематокрит | 000 4 Низкий <20%) | |||||||||||||||||||||||||||
Необычное повышение температуры (; 39 ° C) | Низкий диурез (<20 мл / ч) | ||||||||||||||||||||||||||||
Сердечная недостаточность | 904 902 ТАБЛИЦА 2.Необычные признаки, которые практически всегда указывают на серьезную инфекцию, которая обычно требует хирургического удаления
ЭНДОМЕТРИТ или ЭНДОМЕТРИТИЧЕСКАЯ ЖИДКОСТЬ ОБОЛОЧКИЭНДОМЕТРИТ ЭНДОМЕТРИТ или ИНФЕКЦИЯ ЭНДОМЕТРИТА ЭНДОМЕТРИТЫ 900 ЭНДОМЕТРИТ или ПЕРИТИЧЕСКАЯ ЖИДКОСТЬ МАТЧИ 900 до доставки. 8 Часто инфекция околоплодных вод не распознается во время родов, особенно если не поднялась температура. Факторы риска, важные для инфицирования околоплодных вод, также важны для раннего послеродового эндометрита и включают события, которые могут привести к загрязнению околоплодных вод (, т.е. , продолжительные роды, длительный разрыв плодных оболочек, многократные обследования шейки матки и более низкий социально-экономический статус). 9 Пациенты из низших социально-экономических групп, вероятно, имеют повышенный уровень вирулентных вагинальных организмов, вызывающих инфекцию верхних мочевых путей. 10 Продолжительные роды и разрыв плодных оболочек способствуют колонизации околоплодных вод организмами, колонизирующими нижние отделы половых путей. Колонизирующие организмы обычно не проникают в эндометрий и не вызывают инфекцию, если пациентки рожают через естественные родовые пути, поскольку в этих случаях загрязненные околоплодные воды стекают во влагалище. Однако во время кесарева сечения бактерии в околоплодных водах больше не остаются в матке, но могут инфицировать брюшную полость, разрезы матки и брюшную рану.Фактически, послеродовой эндометрит (маточно-перитонеальные инфекции) в 10-20 раз чаще встречается у пациенток, родивших путем кесарева сечения, чем у пациенток, родивших естественным путем. 2 Ранний послеродовой эндометрит обычно диагностируется на основании температуры 38,5 ° C или выше в первые 24 часа или 38 ° C или выше в течение 4 часов подряд после первых 24 часов после родов. Ожидается болезненность матки, потому что у большинства пациенток после кесарева сечения будут раны и матки, и брюшной полости.Поскольку степень болезненности матки сильно различается, обнаружение болезненности матки не является точным ориентиром для определения наличия или отсутствия инфекции матки. Некоторые организмы, особенно стрептококки, могут вызывать незначительную болезненность матки или совсем не вызывать ее. При тщательном физикальном обследовании обычно выявляются признаки перитонита с кишечной непроходимостью и болезненностью отскока как в верхнем, так и в нижнем квадрантах живота. Во время медицинского осмотра важно исключить другие источники лихорадки, особенно рану, внутривенную линию или легочную инфекцию. Многие врачи обычно не получают посевы эндометрия, потому что микроорганизмы, вызывающие ранний послеродовой эндометрит, хорошо описаны и до недавнего времени были относительно схожими между больницами. Определенно ненадежные результаты посева возникают при использовании посевов из шейки матки или при получении посевов трансцервикального эндометрия путем проталкивания незащищенного мазка через шейку матки. 11 Вместо этого для получения культуры эндометрия следует использовать защищенные тампоны, поскольку они уменьшают (хотя и не устраняют) цервиковагинальное заражение.Культуры эндометрия или околоплодных вод, взятые во время родов, точно отражают флору эндометрия в течение 24 часов после родов и могут быть заменены трансцервикальной культурой эндометрия в этот период. Тем не менее, у оставшихся пациентов должны быть получены культуры эндометрия для выявления необычных или особо вирулентных организмов. Микроорганизмы, которые обычно выделяются от пациентов с послеродовым эндометритом, описаны в других частях этих томов и здесь подробно не обсуждаются.Культуры обычно восстанавливают широкий спектр факультативных бактерий, включая стрептококки группы B, другие факультативные стрептококки, Gardnerella vaginalis и Escherichia coli , а также широкий спектр анаэробных бактерий, включая виды Bacteroides и Peptostreptococcus . 6 , 12 При посеве крови аналогичные организмы обнаруживаются примерно у 15–25% пациентов с лихорадкой. 6 Бактериемия per se не позволяет прогнозировать тяжесть или течение инфекции, хотя выделение определенных вирулентных организмов может служить предиктором серьезной инфекции.Несмотря на высокую частоту положительных посевов крови, у молодых, в остальном здоровых пациентов септический шок развивается редко. Для успешного лечения послеродового эндометрита использовались самые разные антибиотики. Антибиотик должен быть активен против наиболее распространенных факультативных и анаэробных бактерий. 13 Более 90% пациентов с послеродовым эндометритом легко реагируют на терапию антибиотиками. Если пациенты не реагируют на терапию антибиотиками, необходимо проверить несколько возможностей (таблица 3).Назначение слишком низкой дозы антибиотика является наиболее частой причиной неэффективности лечения. Беременным и послеродовым женщинам требуется увеличение дозы антибиотиков на 40% по сравнению с дозой, необходимой для прекращения беременности. 14 Увеличение на 40% объема крови, внеклеточного объема и скорости клубочковой фильтрации, происходящее во время беременности, сохраняется в ближайшем послеродовом периоде, а концентрации антибиотиков должны быть достаточно высокими для достижения бактериального подавления у послеродовых пациенток.Таким образом, большинство антибиотиков, особенно те, которые выводятся через почки, необходимо вводить в высоких дозах. Например, повышенные дозы, которые следует вводить в послеродовом периоде, составляют от 8 до 12 г / день β-лактамного (пенициллин или цефалоспоринового) антибиотика. Другие причины неэффективности лечения антибиотиками включают инфекцию от резистентных организмов (необычно), инфекцию раны, образование абсцесса и развитие септического тромбофлебита. 13 ТАБЛИЦА 3. Возможности проверки, когда пациенты не реагируют на терапию антибиотиками
ИНФЕКЦИЯ МОЧЕВЫХ ПУТЕЙПримерно 5% пациентов, у которых развиваются немедленные и послеродовые инфекции, имеют стерильную полость эндометрия, но 10 5 организмов на миллилитр посев мочи. 6 У большинства этих пациентов была бессимптомная дородовая бактериурия, которая становится симптоматической после катетеризации мочевого пузыря или родовой травмы. Болезненность реберно-позвоночного угла и другие клинические признаки острого пиелонефрита обычно отсутствуют. Следовательно, по клиническим признакам этих пациентов трудно отличить от пациентов с ранним послеродовым эндометритом. Осадки мочи обычно содержат большое количество лейкоцитов, а посевы мочи положительны на уропатогены.Инфекция мочевыводящих путей обычно легко поддается лечению обычными антибиотиками, используемыми для лечения эндометрита. Тем не мение. Сообщалось о необычных серьезных дородовых осложнениях пиелонефрита с тяжелой респираторной недостаточностью и диссеминированной внутрисосудистой коагулопатией, требующей длительной вспомогательной вентиляции. 15 Врачи должны знать, что подобные тяжелые проявления пиелонефрита могут возникать в раннем послеродовом периоде. НАРУШЕННЫЕ АБСЦЕССЫВнутрибрюшные абсцессы во время беременности встречаются редко.Аппендицит и, реже, абсцесс от сальпингита 16 являются наиболее вероятными источниками внутрибрюшного абсцесса. Относительно бессимптомные абсцессы возникают из-за того, что инфекция внутри абсцессов остается отделенной от сосудистой сети и от соседних органов стенкой абсцесса. Во время беременности матка обычно составляет часть стенки абсцесса. Во время родов маточная часть стенки абсцесса нарушена из-за схлопывания матки, и гной просачивается в брюшную полость.Затем инфекция может распространиться, вызывая явный перитонит, бактериемию или и то, и другое. Разорванный абсцесс может быть трудно распознать, особенно если утечка происходит медленно и нет внезапных изменений брюшины. Своевременное распознавание прорвавшегося абсцесса на основании анамнеза и результатов физикального обследования может предотвратить неконтролируемый и потенциально смертельный сепсис. У пациентки во время беременности могла быть нечеткая боль внизу живота или даже приступ, напоминающий аппендицит. Неожиданный разрыв абсцесса происходит у рожениц, родившихся через естественные родовые пути, потому что абсцесс был бы обнаружен во время кесарева сечения.Возможный разрыв абсцесса легче всего распознать у пациенток, родившихся через естественные родовые пути, без продолжительных родов или разрыва плодных оболочек, у которых в противном случае нельзя было бы ожидать внезапного развития септического шока или признаков сепсиса. Распознавание становится более трудным, когда пациенты распознают факторы риска заражения. Немедленное обследование брюшной полости при покрытии антибиотиками необходимо для контроля сепсиса из-за нарушенного разорванного абсцесса (таблица 4). ТАБЛИЦА 4. Наиболее частая причина серьезной инфекции, возникающей в раннем послеродовом периоде (<48 часов до родов) Послеродовой эндометрит БЫСТРО РАЗВИВАЮЩАЯСЯ ИНФЕКЦИЯ МЯГКИХ ТКАНЕЙБыстро развивающиеся инфекции мягких тканей — это потенциально летальные инфекции подкожной ткани, мышц или миометрия, чаще всего вызываемые клостридиями или стрептококками группы А.Пациенты с этими быстро развивающимися инфекциями обычно имеют анамнез и физическое обследование, аналогичные пациентам с другими причинами послеродовой инфекции. Эти инфекции обычно маскируются под послеродовой эндометрит, и пациенты могут иметь обычные факторы риска инфицирования, включая длительные роды или разрыв плодных оболочек, хотя многие другие не имеют особых факторов риска. Однако две клинические особенности предполагают более серьезную инфекцию: тяжесть клинических проявлений и признаки септического шока.Пациенты с этими инфекциями неизменно проявляют выраженные системные признаки и симптомы, включая сильную боль, непропорциональную обычно ожидаемой, прострацию и, иногда, дезориентацию вначале или позже в ходе инфекции. Температура может быть высокой (40 ° C), лейкоцитоз может быть выраженным (> 30 000), и может наблюдаться гемоконцентрация в виде значительного смещения жидкости из инфицированной области сосудистого компартмента. У этих пациентов часто развиваются признаки особо тяжелой инфекции, включая респираторный дистресс-синдром у взрослых, диссеминированную внутрисосудистую коагулопатию или почечную недостаточность.Часто со временем развиваются признаки септического шока. Относительно высокий (приблизительно 20%) уровень бактериемии наблюдается при послеродовом эндометрите. 6 Однако у немногих в остальном здоровых послеродовых женщин с неосложненным послеродовым эндометритом или неосложненной послеродовой инфекцией развивается септический шок. Даже у молодых пациентов без основного заболевания уровень смертности при возникновении септического шока составляет от 20% до 30%. 17 Пациентам с септическим шоком требуется немедленная реанимация с применением жидкостей, респираторной поддержки, поддержки кровообращения и антибиотиков.Наблюдение за интенсивной терапией становится обязательным. Дифференциальный диагноз включает эмболию околоплодными водами, тромбоэмболию легочной артерии, кардиогенный шок (от лекарств, сердечных заболеваний или расслоения аорты) и диабетический кетоацидоз. Хотя это и необычно, разрыв абсцесса с выделением грамотрицательных анаэробных и аэробных бактерий также необходимо учитывать при возникновении септического шока. Возбудитель болезни и источник инфекции должны быть точно идентифицированы с помощью физикального обследования, диагностических тестов и надлежащим образом полученных культур.Плохие прогностические признаки включают лейкопению, тяжелую диссеминированную внутрисосудистую коагулопатию, высокий уровень лактата и респираторный дистресс-синдром взрослых. Успешный результат обычно зависит от хирургического удаления источника инфекции. Практически любой послеродовой септический шок возникает из-за источника инфекции, который поддается хирургическому дренированию или удалению. Поэтому обязанностью хирурга-акушера является полное исключение возможности хирургического лечения инфекции при появлении признаков тяжелой инфекции.Хирург не должен отказываться от этой ответственности при переводе пациента с шоком к специалисту по интенсивной терапии. Жидкая реанимация часто восстанавливает кровяное давление до нормального уровня, создавая ложное чувство безопасности. Таким образом, если не установлено, что инфекция возникает из легких, почек или сердца или из другого участка за пределами таза, для диагностики и лечения может потребоваться исследование раны, обследование под наркозом, выскабливание или исследовательская лапаротомия. Хирургическое вмешательство должно быть выполнено как можно скорее после восстановления адекватного кровообращения.Хирургическое вмешательство, которое становится необходимым, несмотря на ухудшение функции кровообращения, опасно, но иногда может спасти жизнь, если существует определенный очаг инфекции. Эндотрахеальная интубация с минимальной сбалансированной общей анестезией предпочтительнее регионарной анестезии. Некоторые причины быстро развивающейся инфекции или шока встречаются чаще, чем другие. Среди них мионекроз, вызванный либо Clostridium perfringens , либо другими клостридиями, включая C. sordellii , занимает первое место в списке возможных, особенно если необычная травма ткани возникла в результате сложного введения щипцов или во время кесарева сечения.Другие признаки клостридиальной инфекции включают классические признаки сильной боли, гемолиза, почечной недостаточности и газообразования. Другие организмы-продуценты токсинов, такие как стрептококки группы А, или другие организмы, включая E . coli , может вызывать быстро развивающийся целлюлит без мионекроза. Бактериальные токсины обычно вызывают некроз в области целлюлита, а сочетание некроза тканей и системного выброса токсинов вызывает необычно тяжелые проявления.Некроз может возникать в подкожной клетчатке, поперечно-полосатой мышце или ткани миометрия. У пациентов с некрозом наблюдается прогрессирующая местная инфекция и ранее отмеченные тревожные системные признаки. Источник инфекции может быть особенно трудно обнаружить при физическом обследовании или визуализации, если стрептококки или клостридии группы А вызывают некроз глубоких поперечно-полосатых мышц или мышц матки. Некротический фасциит, вызванный раной брюшной полости или эпизиотомией, является еще одной причиной быстро развивающейся инфекции и шока, которая будет более подробно рассмотрена ниже. Немедленная антибактериальная терапия должна охватывать грамотрицательные факультативные и анаэробные бактерии и, в частности, клостридии. Пациентам с септическим шоком или тяжелыми проявлениями инфекции, описанными выше, первоначально показаны три антибиотика. Для подавления факультативных аэробных бактерий выбирают аминогликозид или цефалоспорин первого поколения. Клиндамицин, имипенем-циластатин или метронидазол назначают для подавления анаэробных бактерий, а пенициллин или ампициллин используют из-за его действия на клостридии и синергического действия с аминогликозидами против энтерококков.Однако нельзя переоценить тот факт, что одной только антибиотикотерапии при этих серьезных инфекциях почти никогда не бывает достаточно для контроля сепсиса, и обычно требуется хирургическое обследование (Таблица 5). Неспособность распознать мионекроз или некротический целлюлит часто оказывается фатальным для пациентов с этими серьезными инфекциями. Сами по себе антибиотики не действуют на некротические ткани. ТАБЛИЦА 5. Терапия для быстро развивающихся инфекций мягких тканей и некротического фасциита Три антибиотика
Амик одного для подавления анаэробных бактерий Клиндамицин инфицированных тканей для исследования с пациентом под общей анестезией, как описано для некротического фасциита.Посев тканей и окраска по Граму необходимы для выявления ответственных организмов. Для выявления некроза может потребоваться замороженный срез ткани. 18 Некротическая ткань должна быть удалена до состояния жизнеспособности. Удаление раны служит для удаления как некротической ткани, так и источника бактериальных токсинов. Пораженная область может быть маленькой в случае раннего некротического целлюлита или обширной, когда инфекция вышла из-под контроля. Клостридиальный мионекроз может поражать мышцы матки или других участков тазовой диафрагмы или крестцовой области. Исследовательская лапаротомия может спасти жизнь пациентам с неконтролируемой бактериемией и неконтролируемым внутрибрюшным сепсисом. Особенно следует рассмотреть возможность лапаротомии, когда очевидный источник инфекции не очевиден. Очевидно, инфицированные или некротические структуры необходимо удалить, а нормальные органы и ткани следует сохранить. Удаление или дренирование абсцесса можно проводить без удаления матки или маточных труб, если эти органы не инфицированы широко. Обширно инфицированная матка обычно бледная, желтая или явно некротическая, часто с обширным тромбозом яичников и придаточных сосудов.Когда эти результаты присутствуют и у пациентов наблюдается все более тяжелая и опасная для жизни диссеминированная коагулопатия или респираторный дистресс, гистерэктомия может спасти жизнь. Матка обычно содержит участки явного некроза или микробъцессов миометрия. Опасная для жизни коагулопатия или респираторный дистресс в результате сепсиса медленно проходит после удаления инфицированной ткани. С другой стороны, в редких случаях асцит и отек кишечника, матки и придатков присутствуют без явно инфицированной ткани.Требуется серьезное клиническое заключение. У нас были эти редкие случаи прогрессирующей опасной для жизни коагулопатии и респираторного дистресса у взрослых при максимальных уровнях кислорода и положительном давлении в конце выдоха, при которых матка содержала только нормальные некротические децидуальные оболочки. Разрешение этих опасных для жизни признаков началось сразу же, хотя и медленно, после гистерэктомии. Вполне вероятно, что в этих редких обстоятельствах сепсис, вызвавший коагулопатию и респираторный дистресс, был успешно вылечен антибиотиками, но нормальный некроз децидуальных оболочек продолжал выделять достаточно тромбопластина или других факторов, чтобы поддерживать порочный круг коагулопатии и респираторного дистресса. НЕКРОТИЗИРУЮЩИЙ ФАСЦИИТНекротический фасциит — это быстро развивающаяся острая инфекция поверхностной фасции (подкожной клетчатки). Поверхностная фасция содержит два слоя подкожной ткани, которые становятся инфицированными: поверхностная фасция Кампера и более глубокая фасция Скарпа. Некротический фасциит обычно начинается с раневой инфекции, которая распространяется бесконтрольно отчасти из-за отсутствия естественных тканевых барьеров. При ране брюшной полости инфекция распространяется сверху, сбоку и снизу по брюшной стенке, а при эпизиотомической ране инфекция распространяется на брюшную стенку, латерально на внутреннюю поверхность бедер или сзади на ягодицы.Что еще более важно, синергетическое действие по крайней мере двух организмов вызывает некроз тканей. Большое разнообразие организмов может сочетаться, чтобы вызвать синергетическую инфекцию, включая негемолитические стрептококки и стафилококки, смешанные аэробные и анаэробные бактерии (включая клостридии), а также гемолитические стрептококки и анаэробы группы B. Комбинированное действие микроорганизмов вызывает обширный некроз подкожной ткани и во многих случаях токсины, которые вызывают серьезные системные эффекты. Некроз предотвращает попадание антибиотиков в инфицированную ткань, и организмы продолжают размножаться и выделять токсин в некротизированных областях.Глубокие фасции и мышечные слои не затрагиваются, если инфекция полностью не вышла из-под контроля или отсутствуют клостридии. Кроме того, кожа изначально не инфицирована. Следовательно, степень некроза часто невозможно оценить по внешнему виду кожи до поздних стадий заболевания, когда появляются буллы или явный некроз кожи. Хотя инфекции были связаны с сахарным диабетом, 19 у большинства послеродовых пациентов с некротическим фасциитом нет предшествующих заболеваний.Обычно дородовой курс и роды проходят несложно. Обширные разрывы после эпизиотомии не связаны с некротическим фасциитом. Смертность колеблется от 20% до 75%; уровень смертности напрямую зависит от своевременности постановки диагноза и хирургической обработки раны. 20 Чаще всего смерть наступает через 4 дня после начала болезни. Типичные клинические признаки включают сильную местную боль и прогрессирующую эритему и отек области, окружающей рану, несмотря на соответствующую терапию антибиотиками.Заражение может произойти в течение нескольких часов после хирургической раны. Это прогрессирование может быть зарегистрировано в течение нескольких часов при чрезвычайно быстром заражении, особенно среди диабетиков. Чаще инфекция прогрессирует в течение нескольких дней. Эритема и деревянистый отек возникают за пределами границ, обычно ожидаемых при простой раневой инфекции, и особенно характерным признаком является прогрессирование. 21 Кроме того, любого пациента с целлюлитом, у которого развивается септический шок, следует считать больным некротическим фасциитом.Пациенты неизменно имеют выраженные системные особенности, включая высокую температуру (которая иногда может быть нормальной), выраженную прострацию, анемию (которая может быть замаскирована гемоконцентрацией, поскольку во внеклеточном пространстве собирается огромное количество жидкости), шок, выраженный лейкоцитоз ( часто 20 000–75 000) и диссеминированная внутрисосудистая коагулопатия. Гипокальциемия — обычное явление, вызванное действием бактериальных липаз, которые расщепляют жир на жирные кислоты, которые, в свою очередь, соединяются с кальцием с образованием мыла. Любому пациенту с подозрением на некротический фасциит необходимо немедленно подтвердить диагноз путем осмотра раны под общим наркозом. Раны не следует открывать у постели больного без адекватной анестезии, потому что характерных признаков инфекции, таких как гной, обычно нет, а ограниченное исследование часто приводит к выводу, что присутствует только минимальная инфекция. При вскрытии раны присутствует жидкий, водянистый, обычно без запаха экссудат, напоминающий «мыльную воду», но гной не обнаруживается.Ткань не имеет явно некротического вида, а скорее выглядит отечной. Некроз подтверждается легким рассечением свободной ткани тупым инструментом. Диагностика замороженных тканей на подозреваемых некротических участках может быть полезна, когда врач не знаком с заболеванием или когда клинические данные нетипичны. 18 Необходимо провести посев ткани и немедленное окрашивание по Граму, чтобы исключить наличие больших грамположительных палочек, указывающих на клостридии. Наличие больших стержней должно подтолкнуть к поиску более глубокой инфекции, включая мионекроз. Терапия этой инфекции очевидна, когда установлен правильный диагноз. Это необычное заболевание обычно не знакомо акушеру. Многие хирурги общего профиля имели опыт лечения этой инфекции, но консультации неопытных врачей, даже специалистов по инфекционным заболеваниям, могут привести к ошибочным рекомендациям. Терапия включает немедленную очистку всей некротической ткани. Некротическая ткань должна быть удалена до того момента, когда возникнет кровотечение. Иногда более жизнеспособную кожу можно сохранить и использовать в качестве кожного трансплантата, поскольку кожа изначально не инфицирована.Даже при надлежащей хирургической обработке раны выживают только 50% пациентов. 20 Однако выживаемость без хирургической обработки раны практически равна нулю. Выживаемость также низкая, если у пациентов развился септический шок или клостридиальная инфекция. Необходимо назначить антибактериальную терапию широкого спектра действия, но следует подчеркнуть, что большинство людей, умирающих от этой инфекции, получали оптимальную антибактериальную терапию с момента постановки диагноза. Часто требуется многократная обработка раны, и пациенту следует удалять ткань под анестезией так часто, как это необходимо, часто с ежедневной обработкой раны, пока инфекция не стабилизируется. ВНУТРИВЕННАЯ ИНФЕКЦИЯЗагрязнение жидкости Загрязнение жидкости внутривенно — это необычная, но летальная инфекция, при которой необычные организмы ( Erwinia sp, Enterobacter cloacae, Pseudomonas stutzeri, Mima sp или колонизируют гереллерию sp) распространяться внутривенно при введении жидкости. 22 Организмы в высоких концентрациях или организмы, вырабатывающие токсины, особенно смертельны. Подсчитано, что большое количество этих инфекций происходит ежегодно, но большинство эпизодов остаются нераспознанными, потому что пациенты, которые получают внутривенные жидкости, часто страдают изнурительными заболеваниями с высоким уровнем смертности.Акушер может легче распознать эту инфекцию, если у здорового пациента развилось быстрое начало сепсиса. Загрязнение внутривенной жидкостью вызывает быстрое начало сепсиса или стойкий грамотрицательный сепсис с гектической лихорадкой, лейкоцитозом, гипотонией, диссеминированным внутрисосудистым свертыванием, респираторным расстройством и часто почечной недостаточностью. Бутылка для внутривенного введения обычно не мутная, и для диагностики требуется высокая степень подозрительности и извлечение одного и того же организма как из крови пациента, так и из внутривенной жидкости.Терапия включает немедленную замену внутривенного шланга и флакона; введение антибиотиков, в том числе аминогликозидов, для защиты от грамотрицательных факультативных бактерий; и обычная реанимационная терапия шока и тяжелого сепсиса. Во многих случаях источник нарушения не может быть идентифицирован, особенно если проявления проявляются поздно или присутствуют у пациента, у которого был другой очевидный источник инфекции. Инфекция катетера Инфекция внутривенного катетера связана с пластиковыми катетерами, которые находятся на месте более 48 часов.Эти инфекции уменьшаются, когда профессионально обученные бригады внутривенных инъекций устанавливают катетеры и ухаживают за ними. Дальнейшие профилактические методы включают использование стальных игл и верхних конечностей, тщательное мытье рук перед установкой лески, надежное закрепление катетера и покрытие места стерильной повязкой. Кровь не следует брать по внутривенным линиям. Однако смена места катетера по крайней мере каждые 48 часов обеспечивает максимальную защиту от этих инфекций. Клинические признаки этой инфекции включают наличие пластикового катетера (обычно на месте более 48 часов) и лихорадку.с болезненностью и покраснением по ходу вены или гноем на месте удаления катетера. Также может присутствовать пальпируемый венозный тяж. Стойкая сепсис, гипотензия или множественная легочная эмболия также должны вызывать подозрение на эту инфекцию. В число вовлеченных микроорганизмов входят видов Staphylococcus aureus (примерно в 50% случаев) и видов Klebsiella, Enterobacter и Serratia . Терапия включает немедленное удаление внутривенного катетера и культивирование катетера.Вращение катетера на пластине с кровью представляет собой простой метод полуколичественного посева. 23 Наличие более 15 колоний на пластинке с кровью коррелирует с инфекцией, тогда как меньшее количество колоний указывает на колонизацию катетера кожной флорой. Необходима соответствующая внутривенная антибиотикотерапия для подавления Staphylococcus aureus через новое место внутривенного введения. При обнаружении внутрипросветного гноя следует рассмотреть возможность хирургического удаления вены, особенно если эмболизация легочной артерии продолжается, несмотря на соответствующую терапию антибиотиками. ПОЗДНЯЯ ИНФЕКЦИЯВ отличие от ранее обсуждавшихся ранних послеродовых инфекций, большинство поздних послеродовых инфекций не связаны с высокой смертностью. Многие поздние инфекции развиваются медленно и коварно. И патогенез, и микробиология поздних послеродовых инфекций отличаются от таковых для ранних послеродовых инфекций. Поздние инфекции часто труднее диагностировать и включают более широкий диапазон возможностей, чем ранние послеродовые инфекции. Клинические особенности часто менее очевидны.Например, у некоторых пациентов не будет лихорадки или лейкоцитоза. Несмотря на часто коварный характер поздних инфекций, они все же могут вызывать серьезные заболевания (Таблица 6). ТАБЛИЦА 6. Наиболее частая причина серьезных инфекций, возникающих в позднем послеродовом периоде (от 3 дней до 6 недель)
ПРОДОЛЖЕНИЕ РАННЕГО ПОСЛЕДНЕГО ЭНДОМЕТРИТА И ИНФЕКЦИИ МЯГКИХ ТКАНЕЙФизическое обследование пациента является ключом к диагностике продолжения ранее перенесенных инфекций.Пациента следует тщательно осмотреть на предмет раневой инфекции и других источников лихорадки за пределами таза. Тщательное медицинское обследование должно включать бимануальное исследование органов малого таза. Если гинекологический осмотр выявил лишь минимальную болезненность и отсутствие образования; оставшееся физическое обследование не выявило другого источника инфекции, а только лихорадку; учащенный пульс, лейкоцитоз, болезненность в животе и кишечная непроходимость исчезли, лихорадка исчезнет в течение 24 часов, а дополнительная или новая антибактериальная терапия не показана.Следует внимательно наблюдать за пациентом. Однако, если лихорадка вместе с какими-либо другими признаками сохраняется или появляется снова, следует использовать следующий контрольный список:
Два антибиотика, как правило, следует вводить, когда пациенты имеют длительную или серьезную инфекцию. 24 Покрытие антибиотиками широкого спектра действия клиндамицином или аминогликозидом подавляет большинство аэробных и анаэробных бактерий. Другими возможными вариантами выбора являются метронидазол и цефалоспорин или другие комбинации антибиотиков. Также можно использовать один имипенем-циластатин. В редких случаях пациенты с ранним послеродовым эндометритом остаются серьезно больными с длительным течением или у них развиваются признаки неконтролируемого сепсиса, такие как стойкая бактериемия или все более тяжелая диссеминированная внутрисосудистая коагулопатия или респираторный дистресс-синдром взрослых.Такая же тщательная клиническая оценка, необходимая для лечения стойкого раннего сепсиса, также необходима для стойкого позднего сепсиса. Пациенты с такими продолжающимися проявлениями инфекции должны быть тщательно обследованы на предмет наличия инфекции, поддающейся хирургическому лечению, или несоответствующей терапии антибиотиками. Как и в случае неконтролируемой ранней инфекции, неконтролируемая поздняя инфекция с этими серьезными проявлениями обычно представляет собой скопление гноя или некротизированной инфицированной ткани, которая требует хирургического удаления. Если нет другого очевидного источника инфекции, например раны или экстрагенитального участка, следует рассмотреть возможность лапаротомии. ОБРАЗОВАНИЕ АБСЦЕССАОбщепризнанные клинические признаки образования абсцесса включают резкие скачки температуры, несмотря на соответствующую антибиотикотерапию, стойкую тахикардию, стойкий лейкоцитоз и очевидное новообразование. Образование может быть трудно ощутить при гинекологическом осмотре на ранних стадиях формирования абсцесса, но хорошо выявленные абсцессы могут быть продемонстрированы либо тазовым осмотром, либо ультразвуком, компьютерной томографией (КТ) или сканированием магнитных изображений (МИ). Абсцессы обычно содержат как аэробные, так и анаэробные бактерии, включая один или несколько видов Bacteroides , обычно B . bivius , B . disiens или B . fragilis . Терапия абсцессов включает введение антибиотиков и возможность хирургического дренирования, если абсцессы большие (более 6 см). В зависимости от клинической ситуации и опыта врача можно выбрать несколько методов хирургического дренирования. Традиционно абсцессы дренировали вагинально, дренировали или удаляли хирургическим путем при лапаротомии. В прошлом также часто выполнялась гистерэктомия или двусторонняя сальпингоофорэктомия.Гистерэктомия обычно не показана, если абсцесс хорошо установлен и инфицирование миометрия матки маловероятно. Согласно недавним исследованиям, более 90% внутрибрюшных абсцессов успешно лечились с помощью чрескожного катетерного дренирования. 25 Опыт с акушерскими и гинекологическими инфекциями показывает, что аналогичные показатели успеха имеют место и при чрескожном дренировании тазовых абсцессов. 26 Во многих случаях катетеры можно установить во время минилапаротомии или под контролем УЗИ, если абсцесс направлен близко к поверхности живота, а кишечник отсутствует между абсцессом и передней брюшной стенкой.Открытая лапароскопия также может использоваться, чтобы избежать кишечника и большой послеродовой матки, а также установить чрескожные катетеры. Абсцесс визуализируется непосредственно через лапароскоп, кишечник отделяется от поверхности абсцесса, и абсцесс подтверждается путем аспирации гноя с помощью чрескожно введенной спинномозговой иглы 18 калибра. Дренажный катетер, помещенный над острым троакаром, можно ввести через кожу в абсцесс под прямым наблюдением. Гной аспирируется через катетер, а стерильная вода используется для орошения полости абсцесса.Важно, чтобы ирригационная жидкость не попадала в полость абсцесса, а, скорее, она должна течь под действием силы тяжести, чтобы предотвратить распространение бактерий в стенке абсцесса в сосудистую систему и вызвать септический шок. Когда дренаж абсцесса очищается, через катетер в абсцесс можно ввести 2 г цефалоспорина широкого спектра действия и зажать катетер на 2 часа. Затем катетер прикрепляют к закрытому мешку дренажной системы и дают ему стечь под действием силы тяжести.Катетер вытягивают, когда дренаж прекращается, обычно через 24-48 часов. В отчетах о небольшом количестве пациентов показатель успеха достиг 90%. 26 Процедуры чрескожного дренирования позволяют дренировать абсцесс без длительной госпитализации или послеоперационного восстановления из-за лапаротомии. Противопоказания включают отсутствие явного источника абсцесса и возможность кишечного источника. Требуется тщательное наблюдение, чтобы гарантировать дальнейшее рассасывание абсцесса.Системное лечение антибиотиками следует продолжать до тех пор, пока инфекция не исчезнет. Если абсцесс не лечится хирургическим путем, лучше продолжать внутривенное введение антибиотиков до тех пор, пока абсцесс не уменьшится до 50% или менее от его первоначального размера. Пациентам с такой степенью разрешения, у которых нет лихорадки, лейкоцитоза или сильной болезненности тазовых органов, можно назначить пероральные антибиотики еще на 10–14 дней. Следует использовать пероральные дозы клиндамицина, метронидазола или аугментина (амоксициллин и клавуланат калия), поскольку они активны в отношении анаэробных бактерий, развивают соответствующий уровень в тканях и проникают в абсцессы.За пациентом следует внимательно следить, чтобы обеспечить полное разрешение. ИНФЕКЦИИ ИЗ РАВ ЖИВОТНЫХПримерно у 5% (диапазон 2–10%) женщин, перенесших кесарево сечение, развивается инфекция ран брюшной полости. 1 , 27 Факторы, увеличивающие скорость инфицирования раны, включают инфекцию околоплодных вод, длительные роды или разрыв плодных оболочек. 27 срочность операции, ожирение, сахарный диабет, предоперационное бритье, использование дренажей и электрокоагуляции. 28 , 29 Некоторые факторы могут быть устранены, включая чрезмерно высокий ток электрокаутеризации и использование дренажей, особенно дренажей Пенроуза, выведенных через абдоминальное иссечение. При необходимости следует установить дренаж закрытым катетером, выведенным из раны через отдельный кожный разрез. Дополнительная мера, предотвращающая инфицирование раны, включает использование отсроченного первичного закрытия всякий раз, когда у пациентов проявляется устоявшаяся инфекция, определяемая либо по сильно гнойному экссудату, либо по амниотической жидкости с неприятным запахом при кесаревом сечении.Уровень инфицирования ран в этих условиях приближается к 25% при немедленном первичном закрытии. 28 Брюшину и фасцию можно закрыть, но подкожную клетчатку и рану следует оставить открытыми. Отсроченное первичное закрытие может быть произведено через 2–4 дня после родов. Инфекция раны обычно вызывает покраснение, болезненность раны и жар. Гной обычно можно выявить с помощью аспирационной иглы 18-го размера или вскрытия раны. Если гноя нет, следует учитывать стрептококковый целлюлит или некротический фасциит.Посев из раны должен быть получен либо из ткани, взятой из глубокой части раны, либо из мазка, взятого из гноя глубоко в ране. Окрашивание образца по Граму необходимо проверить для выявления стрептококков или клостридий. Терапия включает постоянное использование антибиотиков широкого спектра действия до исчезновения целлюлита, на что указывает разрешение прилегающей эритемы, отека и болезненности. Следует вскрыть раневую инфекцию и под анестезией удалить все некротические остатки. В рану накладывают влажную марлю, а затем ее осторожно орошают три раза в день.Сильное расчесывание, соскоб или другие травмы раны только предотвратят дальнейшее заживление раны. 30 Может потребоваться хирургическое удаление новых или некротических остатков с дополнительной обработкой раны. После борьбы с раневой инфекцией ране можно позволить закрыться вторичным намерением, хотя большие открытые чистые раны могут быть вторично закрыты. СИНДРОМ ТОКСИЧЕСКОГО ШОКАКлинические признаки синдрома токсического шока хорошо описаны. Они включают гипотензию (систолическое падение <90 мм рт. Ст. Или ортостатическое падение 15 мм рт. Ст.), Лихорадку (> 38 ° C), диффузную макулярную сыпь, мультисистемное поражение и шелушение кожи, обычно ладоней и подошв, в течение 1-2 недель. после начала заражения. 31 Токсин-продуцент Staphylococcus aureus и, реже, Staphylococcus epidermidis , вызывающие это заболевание. Синдром токсического шока недавно был обнаружен у послеродовых пациентов. 32 Типичные клинические признаки этого синдрома у послеродового пациента должны предупредить врача о диагнозе. Необходимо немедленно начать поиск источника токсина S. aureus . У послеродового пациента может быть трудно обнаружить очаг инфекции.Синдром токсического шока S. aureus может возникать в результате инфекции раны, эндометрия или даже груди. Хотя могут присутствовать признаки типичной раневой инфекции, синдром токсического шока также возникает из ран с минимальной эритемой или даже из изначально нормальных ран, которые развивают проявления инфекции через несколько дней после начала синдрома токсического шока. 33 Таким образом, диагноз зависит от выявления типичных клинических признаков синдрома у пациента с S.aureus инфекция. Терапия синдрома токсического шока включает немедленное удаление источника токсина. Необходимо удалить раневые инфекции и поискать инфекции эндометрия, груди или другие инфекции. Требуется поддерживающая терапия и решающее значение имеет адекватное восполнение объема; Пациент должен находиться под тщательным наблюдением на предмет почечной недостаточности или респираторного дистресс-синдрома у взрослых. Нафциллин, 1 г каждые 4 часа, рекомендуется для предотвращения рецидива инфекции, но ценность антибиотиков в острой фазе синдрома может быть минимальной. ЭПИЗИОТОМИЧЕСКАЯ ИНФЕКЦИЯБольшинство эпизиотомических инфекций представляют собой простые раневые инфекции, которые можно лечить аналогично раневой инфекции брюшной полости. Однако обширный целлюлит от организмов, продуцирующих токсины, и некротический фасциит также могут возникать в ранах после эпизиотомии. Пациенты с серьезными системными проявлениями, септическим шоком или признаками раневой инфекции за пределами области непосредственной эпизиотомии должны быть тщательно обследованы на предмет этих возможностей, особенно некротического фасциита.Некротический фасциит после эпизиотомической раны имеет такие же летальные последствия, как некротический фасциит в других частях тела, и было зарегистрировано несколько смертельных случаев. 21 Серьезную эпизиотомическую инфекцию трудно оценить. Практически все эпизиотомии у первородящих женщин вызывают боль, часто сильную. Отеки, синяки и гематомы после длительного второго периода родов также являются частыми причинами изменения цвета этой области. Большинство инфекций после эпизиотомии легко поддаются простому дренированию и антибактериальной терапии.Тем не менее, серьезную инфекцию при эпизиотомии следует рассматривать при наличии системной токсичности или признаков, выходящих за рамки непосредственной эпизиотомии. 21 Хирургическое лечение клостридиального мионекроза и некротического фасциита такое же, как и при наличии этих инфекций в других областях. НОВАЯ ВОСХОДЯЩАЯ ИНФЕКЦИЯ МАТКИВ отличие от ранних послеродовых инфекций матки, которые обычно связаны с кесаревым сечением, поздние инфекции матки обычно развиваются у пациенток, родивших через естественные родовые пути. 5 Начало инфекции чаще всего происходит через 2 недели (от 3 дней до 6 недель) после родов. Наиболее вероятно, что патогенез поздней инфекции матки включает подъем бактерий по поверхности слизистой оболочки, аналогичный тому, что происходит у небеременных пациенток с воспалительными заболеваниями органов малого таза. У пациентов обычно наблюдаются легкие клинические симптомы с минимальной болью. Обычно у них нет лихорадки и часто наблюдается минимальная болезненность в животе и матке. Chlamydia trachomatis был выделен из шейки матки и эндометрия у половины пациентов. 34 У остальных пациентов обнаружены либо аэробные, либо анаэробные бактерии, либо генитальные микоплазмы. Необходимо получить посев из шейки матки на С . trachomatis и другие культуры, как указано. Терапию следует начинать с антибиотиков, ингибирующих C . trachomatis (эритромицин или, для женщин, не кормящих грудью, тетрациклины). В сочетании с этими антибиотиками может потребоваться назначение других антибиотиков широкого спектра действия, особенно если пациенты серьезно больны или нуждаются в госпитализации.Несмотря на минимальную боль в животе и болезненность матки, важно установить диагноз из-за возможных отдаленных последствий. Недавно была установлена связь между хламидиями и бесплодием. 35 Около половины пациентов, страдающих бесплодием из-за непроходимости маточных труб, никогда не имели подтвержденного эпизода воспалительного заболевания органов малого таза. 35 От одной трети до двух третей пациенток, страдающих бесплодием из-за закупорки маточных труб, ранее были беременны. 35 Обычно от 5% до 10% беременных носят C . trachomatis в шейке матки. Хотя частота поздних послеродовых инфекций после нормальных родов через естественные родовые пути неизвестна, сальпингит встречается примерно у 20% женщин с C. trachomatis после искусственного аборта. 36 Если бы аналогичные показатели инфицирования в послеродовом периоде имели место у женщин с C. trachomatis , возможно, что эти поздние восходящие послеродовые инфекции эндометрита-сальпингита вызывали значительное бесплодие.Поэтому, несмотря на зачастую легкие клинические проявления, кажется важным выявить и лечить эти инфекции. СЕПТИЧЕСКИЙ ТРОМБОФЛЕБИТ (СПТ)Пациенты с СПТ обычно имеют резкую лихорадку неясного происхождения вместе с ознобом и частотой пульса, непропорциональной степени лихорадки. Симптомы со стороны грудной клетки могут возникнуть в случае тромбоэмболии легочной артерии. Сочетание крупных вен таза, повышенной свертываемости крови и повреждения сосудов (в результате инфекции или хирургического вмешательства) у послеродового пациента создает угрозу тромбоза. 37 У женщин, родивших через кесарево сечение, значительно выше частота СПТ, чем у женщин, родивших естественным путем. Септический тромбофлебит органов малого таза встречается в 1–2% послеродовых инфекций органов малого таза. 13 , 24 Существуют два клинически различных синдрома SPT. Самый частый синдром — тромбоз яичниковой вены. У этих пациентов возникают острые боли в животе и лихорадка, обычно через 2–3 дня после родов. Они кажутся больными и обычно имеют пальпируемое правостороннее образование в нижней части живота. 38 Второй синдром септического тромбоза развивается позже и связан с неясным, сильным резким повышением температуры тела, минимальной болью или болезненностью в животе или их отсутствием, а также обычно без образования брюшной полости. 39 Следует отметить, что у большинства пациентов, у которых на фоне терапии антибиотиками развивается стойкая лихорадка, нет СПТ, но чаще наблюдается стойкий эндометрит или, реже, другой источник инфекции. Организмы, которые были связаны с SPT, включают факультативные стрептококки, S. aureus, Escherichia coli , анаэробные стрептококки и Bacteroides sp. Диагноз может быть поставлен у пациентов с типичными клиническими признаками, у которых нет другого очевидного источника лихорадки.КТ и внутривенная пиелограмма могут помочь продемонстрировать тромбоз яичниковой вены. Диагноз может быть подтвержден быстрым разрешением, обычно в течение 24 часов, лихорадки и признаков и симптомов после начала терапии гепарином для поддержания времени свертывания крови или активированного частичного тромбопластина в два-три раза дольше, чем обычно. 40 Антибиотики широкого спектра действия следует продолжать применять для лечения распространенных аэробных и анаэробных бактерий. В обычных случаях гепарин назначают в течение 7-10 дней.Длительная терапия гепарином требуется только в случае эмболии легочной артерии, и в этом случае кумарин назначают в течение 3–6 месяцев. Следует избегать хирургического вмешательства, если диагноз может быть установлен до хирургического обследования. 37 , 41 Иногда требуется хирургическое обследование, чтобы исключить перекрут придатка, дегенерированную лейомиому, тазовый абсцесс или аппендицит, а хирургическое удаление или лигирование иногда может потребоваться для пациентов, которые продолжают принимать легочные эмболы, несмотря на полную гепаринизацию. ИНФЕКЦИИ ПОЛОВОГО И ПАРАЦЕРВИКАЛЬНОГО БЛОКАРАНеобычные инфекции полового и парацервикального блока возникают, когда игла, используемая для блокады нерва, переносит бактерии с поверхности влагалища в забрюшинное пространство. Большое забрюшинное пространство снизу ограничено тазовой диафрагмой, но инфекция может бесконтрольно распространяться вверх по поясничной мышце или латерально по вертлужной мышце в бедро. Инфекция часто продвигается до того, как происходит распознавание.Инфекцию обычно вызывают различные аэробные и анаэробные бактерии. Клинический диагноз может быть поставлен пациентам, перенесшим блокаду половых органов или парацервикальную блокаду. Болезненность бедра — характерный и заметный признак этой инфекции. Пациенты не могут переносить большой вес на ногу пораженного бедра. 42 При физикальном обследовании выявляется болезненность при движении бедра и болезненность тазобедренной капсулы, паравагинальных и поясничных мышц. Иногда компьютерная томография или инфаркт миокарда выявляют абсцесс в этом пространстве. Согласно недавнему опыту, раннее начало антибактериальной терапии широкого спектра действия, которая включает анаэробное покрытие, обычно предотвращает образование серьезных абсцессов. Однако ранние сообщения об инфекциях полового и парацервикального блока включали пациентов, у которых развились большие абсцессы. 42 При больших абсцессах необходимо хирургическое дренирование. 43 Забрюшинная инфекция часто прогрессирует, потому что в этом большом пространстве может скапливаться большой объем (несколько литров) гноя.Эти инфекции потенциально опасны, потому что большие абсцессы разорвались и вызвали параплегию или привели к длительной госпитализации. ИНФЕКЦИЯ МОЛОЧНОЙ ЖЕЛЕЗЫПримерно у 2% кормящих матерей развивается инфекция груди. Стафилококковая колонизация ротовой полости младенца начинается через несколько дней после рождения. 44 Микроорганизмы могут попасть в грудь через трещины или отрицательное давление во время сосания. Легкий застой молока способствует заражению.Существуют две формы инфекции. Первым и наиболее распространенным типом является эндемический мастит, типичным примером которого является целлюлит, при котором часто появляются трещины и возникает лихорадка с симптомами гриппа. 45 У некоторых пациентов симптомы лихорадки или гриппа развиваются еще до болезненности груди. Второй, менее частый эпидемический мастит представляет собой внутрибольничную инфекцию, при которой существует первичная протоковая инфекция и на соске может присутствовать гной, но трещины возникают редко. Золотистый стафилококк и реже S.epidermidis — обычные организмы, выздоравливающие при этих инфекциях. Диагноз основывается на наличии покраснения и болезненности в области груди или колеблющегося образования груди, обычно вместе с лихорадкой. Терапия должна включать прием антибиотика широкого спектра действия, устойчивого к пенициллиназе. Клоксациллин, диклоксациллин или цефалексин в дозе 500 мг перорально каждые 6 часов являются эффективными. Также следует принять местные меры для обеспечения дренажа молока. Продолжение грудного вскармливания помогает предотвратить дальнейший застой грудного молока.Пациенту следует рекомендовать начать грудное вскармливание инфицированной груди, чтобы обеспечить адекватный дренаж. Это может быть сложно при наличии трещин или чрезмерной болезненности. Исключение из продолжающегося грудного вскармливания должно быть сделано, если присутствует абсцесс груди, потому что абсцессы легких новорожденных связаны с наличием абсцессов груди матери. 46 Хотя возможно, что младенец с абсцессами легких заразит мать и вызовет инфекцию груди, альтернативная возможность состоит в том, что большая концентрация бактерий из абсцессов груди может попасть в легкие младенца, вызывая легочные абсцессы.Для обеспечения дренажа при абсцессе груди следует использовать молокоотсос. Часто требуется хирургическое дренирование абсцессов груди. 47 За исключением редких случаев развития синдрома токсического шока, пациенты с инфекцией груди обычно не заболевают серьезно. Псевдомембранный колитПсевдомембранозный колит возникает у пациентов, которые получали или продолжают получать антибиотики. Эта потенциально смертельная инфекция вызывается чрезмерным ростом Clostridium difficile в желудочно-кишечном тракте, связанного с подавлением нормальной кишечной флоры вводимым антибиотиком. 48 Разрастание Clostridium difficile производит достаточный уровень токсина, чтобы вызвать слущивание слизистой оболочки кишечника и клинические проявления. Тяжесть диареи сильно различается: от легкой диареи до тяжелого мегаколона. Необходимо учитывать возможность псевдомембранозного колита, когда у пациента, принимающего антибиотики, развивается стойкая лихорадка вместе с другими проявлениями этой инфекции. Инфекция связана с пахнущей водянистой диареей, иногда с примесью крови, а также с лейкоцитами в кале.Высокая температура, лейкоцитоз, вздутие живота и сильная болезненность живота являются обычными явлениями и предвещают тяжелое заболевание в отличие от доброкачественной диареи, связанной с антибиотиками. 49 Проявления чаще всего развиваются через 4–9 дней после начала приема антибиотиков, но нередки более короткие и более длительные периоды. Лишь небольшая часть пациентов с антибиотико-ассоциированной диареей страдает псевдомембранозным колитом. Более доброкачественная диарея, связанная с приемом антибиотиков, без псевдомембранозного колита, не вызывает лихорадки, кровавой диареи или абдоминальных симптомов.Хотя псевдомембранозный колит первоначально чаще всего отмечался при приеме клиндамицина, с тех пор практически все антибиотики (особенно ампициллин, цефалоспорины и тетрациклины) были связаны с этой инфекцией. Сообщалось даже о псевдомембранозном колите после короткого курса профилактики цефалоспориновыми антибиотиками. Диагноз может быть поставлен путем обнаружения язв слизистой оболочки и псевдомембранозных бляшек при ректороманоскопии и выявления токсина C.difficile в диарейной жидкости.Однако проксимальный цецит при ректороманоскопии не может быть выявлен. Повышенное количество лейкоцитов может быть обнаружено в стуле более чем в 50% случаев. Хотя C. difficile может быть выделен у этих пациентов, он также может быть получен примерно у 5% здоровых пациентов, и выделение этого организма без обнаружения токсина недостаточно специфично для диагностики псевдомембранозного колита. При тяжелом течении болезни также следует искать другие организмы, связанные с диареей ( Salmonella, Shigella, Entamoeba histolytica, Campylobacter и Yersinia ).Токсический мегаколон, перфорация, вторичный сепсис и тяжелое кровотечение связаны с высокой смертностью. Лечение включает прекращение антибактериальной терапии, если возможно, и жидкостную поддержку. Не следует использовать лекарства, замедляющие перистальтику и, следовательно, выведение токсинов, такие как гидрохлорид дифеноксилата с сульфатом атропина (ломотил). Пациентам с серьезными проявлениями можно назначать пероральный ванкомицин 125 мг каждые 6 часов или пероральный метронидазол. Эти антибиотики подавляют C.difficile , и их применение снижает риск рецидивов заболевания. 50 Боль в левом нижнем квадранте: рекомендации Американского колледжа критериев соответствия радиологии1. Ferzoco LB, Раптопулос V, Силен В. Острый дивертикулит. N Engl J Med . 1998; 338 (21): 1521–1526 …. 2. Столлман Н., Раскин Ж.Б. Дивертикулярная болезнь толстой кишки. Ланцет . 2004. 363 (9409): 631–639. 3. Джейн С., Мигер А, Frizelle FA. Плановая хирургия после острого дивертикулита. руб. J Surg . 2005. 92 (2): 133–142. 4. Амброзетти П., Беккер С, Терьер Ф. Дивертикулит толстой кишки: влияние визуализации на хирургическое лечение — проспективное исследование 542 пациентов. евро Радиол . 2002. 12 (5): 1145–1149. 5. Schwesinger WH, Страница CP, Гаскилл HV III, и другие.Оперативное ведение дивертикулярных неотложных состояний: стратегии и результаты. Arch Surg . 2000. 135 (5): 558–562. 6. Американский колледж радиологии. Критерии соответствия ACR: боль в левом нижнем квадранте. http://www.acr.org/SecondaryMainMenuCategories/quality_safety/app_criteria/pdf/ExpertPanelonGastrointestinalImaging/LeftLowerQuadrantPainDoc8.aspx. По состоянию на 24 февраля 2010 г. 7. Рао П.М., Рея JT. Дивертикулит толстой кишки: оценка знака стрелки и воспаленного дивертикула для КТ-диагностики. Радиология . 1998. 209 (3): 775–779. 8. Ротерт Х, Nöldge G, Энке Дж. Рихтер GM, Дюкс М. Значение КТ в диагностике острого дивертикулита [на немецком языке]. Радиолог . 2003. 43 (1): 51–58. 9. Амброзетти П., Дженни А, Беккер С, Терьер ТФ, Морел П. Острый дивертикулит левой толстой кишки — сравнение результатов компьютерной томографии и водорастворимой контрастной клизмы: проспективная оценка 420 пациентов. Диск прямой кишки . 2000. 43 (10): 1363–1367. 10. Cho KC, Morehouse HT, Альтерман Д.Д., Торнхилл Б.А. Сигмовидный дивертикулит: диагностическая роль КТ — сравнение с исследованиями бариевой клизмы. Радиология . 1990. 176 (1): 111–115. 11. Халник DH, Мегибоу AJ, Бальтазар Э.Дж., Найдич Д.П., Босняк М.А. Компьютерная томография в оценке дивертикулита. Радиология . 1984. 152 (2): 491–495. 12. Johnson CD, Бейкер МЭ, Рис RP, Сильверман П., Томпсон WM. Диагностика острого дивертикулита толстой кишки: сравнение бариевой клизмы и КТ. AJR Ам Дж. Рентгенол . 1987. 148 (3): 541–546. 13. Шрайер Д., Скукас Дж, Вайс С. Дивертикулит: оценка с помощью компьютерной томографии и контрастной клизмы. Ам Дж. Гастроэнтерол . 1991. 86 (10): 1466–1471. 14. Хачигиан депутат, Хоникман С, Eisenstat TE, Рубин Р.Ж., Salvati EP.Компьютерная томография в начальном лечении острого левостороннего дивертикулита [опубликованная коррекция опубликована в Dis Colon Rectum. 1993; 36 (2): 193]. Диск прямой кишки . 1992. 35 (12): 1123–1129. 15. Кайзер А.М., Цзян Дж. К., Озеро JP, и другие. Ведение осложненного дивертикулита и роль компьютерной томографии. Ам Дж. Гастроэнтерол . 2005; 100 (4): 910–917. 16. Lohrmann C, Ганем Н, Паш Г, Маковец Ф, Коттер Э, Лангер М.КТ при остром перфорированном дивертикулите сигмовидной кишки. евро J Радиол . 2005. 56 (1): 78–83. 17. Кирхер М.Ф., Рея JT, Кихичак Д, Novelline RA. Частота, чувствительность и специфичность отдельных признаков дивертикулита на тонких спиральных КТ с контрастным материалом толстой кишки: опыт с 312 случаями. AJR Ам Рентгенол . 2002. 178 (6): 1313–1318. 18. Рао П.М., Рея JT, Novelline RA, и другие.Спиральная КТ только с контрастным веществом толстой кишки для диагностики дивертикулита: проспективное обследование 150 пациентов. AJR Ам Дж. Рентгенол . 1998. 170 (6): 1445–1449. 19. Гох В., Халлиган S, Тейлор С.А., Берлинг Д, Бассет П., Бартрам CI. Дифференциация дивертикулита и колоректального рака: количественные измерения перфузии при КТ в сравнении с морфологическими критериями — первоначальный опыт. Радиология . 2007. 242 (2): 456–462. 20. Холл EJ, Бреннер DJ. Риск рака от диагностической радиологии. Бр. Дж. Радиол . 2008. 81 (965): 362–378. 21. Бакли О., Геогеган Т, Маколи Джи, Персо Т, Хоса Ф, Торреджиани WC. Графический обзор: магнитно-резонансная томография дивертикулита толстой кишки. евро Радиол . 2007. 17 (1): 221–227. 22. Heverhagen JT, Zielke A, Ishaque N, Борер Т, Эль-Шейх М, Klose KJ.Острый дивертикулит толстой кишки: визуализация на магнитно-резонансной томографии. Магнитно-резонансная томография . 2001. 19 (10): 1275–1277. 23. Schwerk WB, Шварц С, Ротмунд М. Сонография при остром дивертикулите толстой кишки. Перспективное исследование. Диск прямой кишки . 1992. 35 (11): 1077–1084. 24. Уилсон С.Р., Той А. Значение сонографии в диагностике острого дивертикулита толстой кишки. AJR Ам Дж. Рентгенол .1990. 154 (6): 1199–1202. 25. Лильегрен Г, Чабок А, Уикбом М, Смед К, Нильссон К. |

