когда назначается, эффективность, цены на лучевую терапию при опухоли простаты в Москве
Побочные реакции лучевой терапии при раке простаты
Во время или после облучения рака предстательной железы могут возникать различные побочные эффекты. У большинства пациентов проходит около 3-4 недель до появления выраженного дискомфорта. Нежелательные последствия прекращаются, как правило, после окончания лучевой терапии.
Дискомфорт зависит от дозы облучения и размера лучевого поля – чем целенаправленнее облучение, тем менее вероятны побочные эффекты.
Основные побочные эффекты лечения рака простаты лучевой терапией:
Раздражение кожи в области облучения. Возможно покраснение, зуд или незначительная боль. Более серьезное повреждение кожи встречается редко. Нужно использовать pH-нейтральные средства для личной гигиены и носить свободную одежду.
Воспаление слизистых оболочек в мочевом пузыре и уретре.
 Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.
Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.Воспаление слизистой оболочки в кишечнике. Дефекация может быть временно болезненной, также возможны легкие кровотечения или диарея. Для устранения воспаления назначаются суппозитории кортизона и при необходимости средства от повышенной активности кишечника.
При интенсивно-модулированной лучевой терапии (IMRT) острый дискомфорт после терапии меньше, чем при «классическом» облучении, т. к. мочевой пузырь и кишечник практически не подвергается воздействию лучей.
Возникают также долгосрочные последствия облучения, которые зависят не только от дозы облучения, но и от индивидуальных факторов.
В 50% случаев лечения рака предстательной железы мужчины сталкиваются с эректильной дисфункцией. Эта проблема решается с помощью соответствующих медикаментов, которые должен назначить врач. После обычной чрескожной лучевой терапии уже не все мужчины способны зачать детей. Пациенты, у которых все еще есть желание иметь ребенка, должны сделать клиническую процедуру замораживания спермы до начала лечения. На поддержание фертильности ни в коем случае не следует полагаться, даже после брахитерапии.
Любое радиационное воздействие повышает риск развития злокачественных новообразований. У мужчин с онкологией предстательной железы есть вероятность развития рака прямой кишки и, возможно, других тканей, находящихся в лучевом поле.:max_bytes(150000):strip_icc()/patient-going-for-radiology---cancer-treatment-157681132-d1abbe5705f64f3a8f3016aafe9a7c11.jpg)
Лучевая терапия при раке простаты. Когда применятеся?
Лучевую терапию простаты так же называют радиотерапия простаты. Цель лучевой терапии простаты — уничножение больных (раковых) клеток, путем воздействия на них рентгеновских лучей высокой мощности. При этом стараются сохранить, на сколько это возможно, здоровые ткани.
При лучевой терапии простаты, предстательная железа облучается с разных углов, к сожалению при этом уничтожаются не только больные, но и здоровые клетки. В большинстве случаев затронутые здоровые клетки через некоторое время восстанавливаются, так как основная концентрация лучей направлена не на них.
Цель облучения простаты
Облучение простаты показано нескольким группам пациентов:
- пациентам которым противопоказано хирургическое вмешательсво в силу тех или иных обстоятельств (возраст, проблемы с сердечно-сосудистой системой).
 Облучение проводится без наркоза, ни сердце ни другие органы не испытывают дополнительной нагрузки, поэтому внешнее облучение, как и внутреннее (брахитерапия), показана пациентам находящимся в группе риска.
Облучение проводится без наркоза, ни сердце ни другие органы не испытывают дополнительной нагрузки, поэтому внешнее облучение, как и внутреннее (брахитерапия), показана пациентам находящимся в группе риска. - если раковая опухоль вышла за капсусу предстательной железы и хирург не видит смысла удалять простату (при продвинутых стадиях рака простаты), может быть показано внешнее облучение предстательной железы.
- после проведения простатэктомии, в случае когда у пациента была обнаружена агрессивная опухоль и/или опухоль вышедшая за капсулу простаты и существует большой шанс на рецидив рака, уролог может рекомендовать облучения простатического ложа.
Чем больше было проведено дополнительных обследований, особенно это относится к пациентам из группы риска и пациентам с продвинутой стадией рака простаты, тем лучше лечащий врач сможет разработать тактику лечения конкретного пациента.
Для определения наиболее эффективной тактики лечения, лечащему врачу необходим не только основной диагноз, но и полный анамнез пациента. Например, при лечении рака простаты 3 стадии пациентам в определенных случаях, могут быть показаны различные тактики лечения: простатэктомия или облучение, или простатэктомия с последующей химиотерапией.
Например, при лечении рака простаты 3 стадии пациентам в определенных случаях, могут быть показаны различные тактики лечения: простатэктомия или облучение, или простатэктомия с последующей химиотерапией.
Как проводят лучевую терапию простаты
Полный курс лучевой терапии простаты длиться около 7 недель. В общем проводится от 19 до 39 сессий облучения в зависимости от конкретного случая. Пациент не прибывает в клинике стационарно, ему необходимо ежедневно приходить для сессии облучения, которая длится около 5 минут, в радиологическое отделение клиники.
Применяемый аппарат для внешнего обучения простаты называется линейный ускоритель. Аппарат концентрирует рентгеновские лучи высокой мощности и направляет их на предстательную железу с целью разрушить их и прекратить их деление. Раковые клетки больше подвержены воздействию радиации чем здоровые, тем самым существует возможность сохранить больше здоровых клеток.
Отдел радиологии располагает специальным оборудованием и програмным обеспечением для 3-х мерного моделированя предстательной железы, ее точной локализацмм относительно других органов, размера и формы. Делается это для того, чтобы как можно меньше здоровых тканей организма не было затронуто радиактивными лучами.
Делается это для того, чтобы как можно меньше здоровых тканей организма не было затронуто радиактивными лучами.
Во время облучения пациент находится на специальном столе, вокруг него движется линейный ускоритель и воздействует рентгеновскими лучами на предстательную железу.
Радиотрапия направлена на прекращение роста опухоли, смягчение болевых ощущений у пациентов с продвинутой стадией рака.
Побочные действия лучевой терапии простаты
При выборе медицинского учреждения где будет проводится лучевая терапия необходимо уделить особое внимание опыту специалистов, которые будут проводить терапию. Побочные действия, связанные с некачественным проведением облучения простаты могут принести пациенту большое количество проблем со здоровьем. Возможые пробочные эффекты связаны с нарушением функций или частичного разрушения:
- кишечника
- анального отверстия
- стенку прямой кишки
- уретры (мочеиспускательного канала)
Вышеописанные побочные действия могут быть как временными так и постоянными. Так же после облучения может возникать общая слабость, иногда тошнота.
Так же после облучения может возникать общая слабость, иногда тошнота.
Где проводить лучевую терапию простаты?
Пациент решивший проводить курс лучевой терапии в Германии, должен расчитывать на длительное прибывание в непосредственной близости от клиники. Процедуры облучения проводятся каждый день с перерывами на выходные.
Средний курс облучения содержит 33 сессии. Облучение не подразумевает стационарного пребывания и проводится амбулаторно.
| Программа проведения лучевой терапии простаты в Европейском Центре Простаты включает: |
|---|
| формироваание медицинского досье на русском языке |
| перевод досье на немецкий язык |
| визовая поддержка |
| помощь в организации трансфера и отеля |
| консультация со специалистом радиологом |
| 33 сессии облучения предстательной железы |
| заключительная консультация со специалистом и рекомендации |
| возможность консультации со специалистом клиники на расстоянии после проведения облучения |
лучше лечить или удалять ее?
Назад к списку24 ноября 2016
Существует несколько возможностей лечения рака простаты с одинаково хорошими прогнозами. Поэтому решение каждого пациента сводится к вопросу: «На какие побочные эффекты я бы вероятнее всего согласился?» О разных методах лечения предстательной железы и их последствиях журналу Quora рассказывает доктор Гари Ларсон, медицинский директор Центра протонной терапии, Оклахома, США:
Поэтому решение каждого пациента сводится к вопросу: «На какие побочные эффекты я бы вероятнее всего согласился?» О разных методах лечения предстательной железы и их последствиях журналу Quora рассказывает доктор Гари Ларсон, медицинский директор Центра протонной терапии, Оклахома, США:
— Американская Урологическая Ассоциация периодически проверяет все опубликованные материалы с результатами лечения рака простаты и всегда приходит к одному заключению – в целом нет разницы в вероятности излечения, будь то хирургия или лучевая терапия. Если бы один метод лечения явно превосходил все другие, это упростило бы жизнь. Мы, как врачи, тогда бы выбирали именно его. А так как проценты излечимости одинаковые, мужчинам все же необходимо обдумать все варианты и решить, какое лечение им выбрать (или, скажем так, против какого лечения они бы меньше всего возражали).
Прежде чем продолжить, нужно иметь в виду следующие вещи.
Не все, у кого есть рак простаты, нуждаются в лечении – для многих мужчин будет достаточно активного наблюдения, по крайней мере, в течение короткого периода, а вероятно и всей жизни.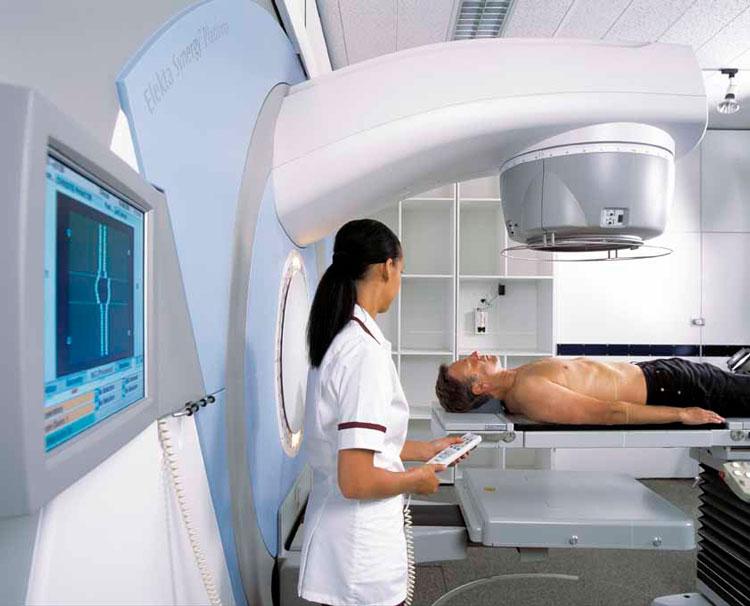
Есть только два метода лечения рака простаты – хирургический и лучевая терапия. Такие вещи как криотерапия, фокусированный ультразвук высокой интенсивности, прогревание микроволновым излучением, лазерная абляция и некоторые другие методы могут быть рекомендованы для рака простаты, повторно появившегося после прохождения основного лечения. Но сами по себе они не могут являться основным лечением.
Андрогенное подавление (гормональная терапия) остановит развитие большинства случаев рака простаты, снизит показатель ПСА практически до нуля и сократит новообразования и метастазы в кости, но его эффект будет только временным – от нескольких месяцев до нескольких лет. Как и методы, указанные выше, это само по себе не радикальное лечение, хотя оно может сочетаться с лучевой терапией для повышения вероятности излечения. Андрогенное подавление имеет набор побочных эффектов, включая усталость, потерю мышечной массы, набор веса, потерю либидо, импотенцию, остеопороз и депрессию.
Урологи любят говорить пациентам: «Если вы пройдете хирургическую операцию, вы всегда сможете после нее получить облучение. Но если вы сначала пролечитесь лучевой терапией, то потом вы не сможете пройти хирургическую операцию». По большей части, это является правдивым утверждением, но данное обобщение упускает некоторые определенные факты.
Во-первых, после лучевой терапии редко возникает необходимость проводить хирургическое вмешательство, так как большинство мужчин, не излечившихся от этой болезни, не имеют рецидивов в простате. Наоборот, при рецидивах после лучевого лечения рака простаты в большинстве случаев обнаруживаются злокачественные опухоли в других органах. Как правило, такие пациенты имели скрытое онкозаболевание помимо простаты, которое нельзя было определить до начала лечения. Скоплениям раковых клеток необходимо разрастись до определенных размеров, чтобы они смогли вызвать повышение показателя ПСА и стали заметными.
Если у пациента после лучевой терапии постоянно отмечается повышенный уровень ПСА, а повторные биопсии железы положительные (между прочим, результаты биопсии являются надежными только спустя два года после лучевой терапии, так как раковые клетки отмирают в течение какого-то времени после лечения), то шансы на рецидив только в железе составляют 50%.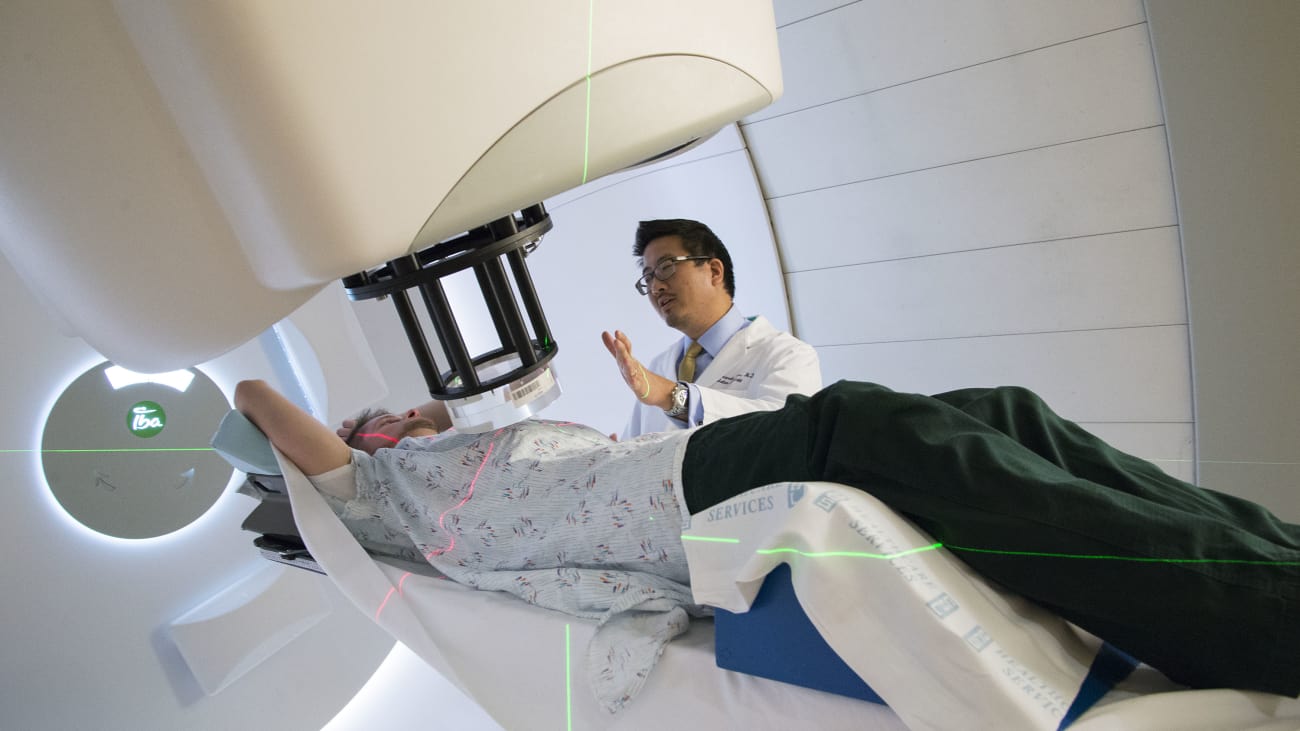
Спасительная в этом случае простатэктомия может быть выполнена после лучевой терапии, хотя это трудная операция из-за интенсивного фиброза вокруг железы и пониженного кровообращения – оба состояния являются результатом перенесенной лучевой терапии. Такие операции лучше всего проводить в крупном урологическом центре, где проводится большое количество подобных вмешательств, вместо того, что доверить эту операцию урологу небольшой клиники. Но даже при высоком мастерстве хирурга существует высокий риск возникновения недержания вследствие простатэктомии, проведенной после лучевой терапии.
Так как риск возникновения рецидива рака только в простате составляет 50 на 50, то и шансы на то, что хирургия приведет к излечению также 50 на 50.
Если первичной была хирургическая операция, то в 20-30% случаев после нее пациент должен пройти лучевую терапию для полного излечения. Послеоперационная лучевая терапия дает 90-процентный шанс ликвидации любого оставшегося рака. Кстати говоря, когда хирурги называют общий процент исцелившихся пациентов, они включают в это число и тех мужчин, которые были вылечены только благодаря послеоперационной лучевой терапии, хотя редко упоминают об этом факте в своих публикациях.
Кстати говоря, когда хирурги называют общий процент исцелившихся пациентов, они включают в это число и тех мужчин, которые были вылечены только благодаря послеоперационной лучевой терапии, хотя редко упоминают об этом факте в своих публикациях.
Рак простаты обычно растет медленно. Термин «ранняя стадия» имеет отношение к тому факту, что он все еще локализован в простате или, как минимум, в ближайшей перипростатической ткани. Ранняя стадия также может быть низкого, среднего или высокого риска по шкале Глиссона. Уровень риска определяется врачом после обследования материала биопсии по уровню ПСА и в некоторой степени по количеству положительных образцов биопсии.
Хирургическое лечение и последствия
В целом есть два метода выполнения простатэктомии. Открытая – когда хирург делает разрез от лобковой кости до пупка, вырезает простату и некоторые лимфоузлы, потом присоединяет шейку мочевого пузыря к оставшейся уретре (так как промежуточной уретры простаты уже нет) и оставляет катетер на месте на несколько недель для того, чтобы все зажило. Второй способ — роботизированная простатэктомия. Это практически та же самая операция, но выполняется через маленькие разрезы с использованием дистанционно управляемых роботизированных манипуляторов и стереоскопической визуализации. В опытных руках диссекция является более точной и сроки пребывания пациента в больнице короче. В публикациях сообщается о потенциально возможном снижении побочных эффектов, таких как инфекция и кровотечение, но трудно сказать что-то определенное об осложнениях в долгосрочной перспективе, таких как импотенция и недержание.
Второй способ — роботизированная простатэктомия. Это практически та же самая операция, но выполняется через маленькие разрезы с использованием дистанционно управляемых роботизированных манипуляторов и стереоскопической визуализации. В опытных руках диссекция является более точной и сроки пребывания пациента в больнице короче. В публикациях сообщается о потенциально возможном снижении побочных эффектов, таких как инфекция и кровотечение, но трудно сказать что-то определенное об осложнениях в долгосрочной перспективе, таких как импотенция и недержание.
Основной побочный эффект, который имеет хирургия и которого нет у лучевой терапии, — это недержание. Большинству мужчин требуется от одного до двух месяцев, чтобы восстановить регуляцию функции мочеиспускания, а около 5% прооперированных никогда не восстанавливают контроль над мочеиспусканием, им приходится использовать памперсы до конца жизни.
Импотенция встречается чаще при хирургии по сравнению с лучевой терапией. Хотя хирургические издания часто сообщают о сохранении потенции на уровне выше 50%, они определяют потенцию как «способность получать эрекцию, достаточную для вагинального проникновения». Поэтому если вы можете заниматься сексом в течение 30 секунд, урологи считают вас способным к половому акту.
Хотя хирургические издания часто сообщают о сохранении потенции на уровне выше 50%, они определяют потенцию как «способность получать эрекцию, достаточную для вагинального проникновения». Поэтому если вы можете заниматься сексом в течение 30 секунд, урологи считают вас способным к половому акту.
Я обследовал первых 150 мужчин, которым я проводил брахитерапию в середине 1990-х и просто задал им такой вопрос: «Вы довольны вашей сексуальной жизнью?» Я оставлял им место на опросном листе для подробного ответа. Более 60% ответили, что они довольны их сексуальной функцией. И ни один из тех, кто сказал, что могут только достичь проникновения, не был доволен.
В нашем Протонном центре всякий раз при последующем приеме мы обследуем каждого мужчину, который прошел у нас лечение, при помощи двух средств оценки качества жизни. Первое из них — это опросный лист «Расширенный индекс рака простаты». А другой — анкета сексуального здоровья для мужчин. В нашей базе данных на данный момент более 2600 пациентов и оценки в баллах у более 70% из них показывают, что они удовлетворены своей сексуальной функцией.
В целом мужчины имеют гораздо лучшую сексуальную функцию и несравненно лучший контроль мочеиспускания (так число случаев недержания практически свелось к нулю – оно почти никогда не встречается при лучевой терапии), если они прошли лечение лучевой терапией, в отличие от хирургии.
Каковы минусы лучевой терапии?
Я коснусь этих моментов, так как они имеют отношение к каждому из различных способов, которыми проводится лучевая терапия.
Для пациентов с низким риском, локализованной болезнью (Глиссон 6 гистология с ПСА менее 10 и менее 4 позитивных образцов биопсии) брахитерапия может использоваться как монотерапия. Пациенты приходят для проведения процедуры разметки, при которой врачи определяют точный контур простаты каждые 5 мм сверху донизу, используя трансректальный ультразвук, а затем в компьютерной программе планирования лечения создают 3-D образ простаты. Рассчитывается оптимальная комбинация радиоактивных зерен, они заранее помещаются в иглы для введения их в железу. В день процедуры пациенту делается общая анестезия и используются от 20 до 40 игл для введения от 60 до 120 зерен в простату при помощи трансректального ультразвукового контроля.
Пациент обычно возвращается домой через несколько часов с катетером, установленным на ночь (так как железа может опухнуть, лучше установить катетер, чем ехать посреди ночи в больницу из-за проблем с мочеиспусканием). Мужчины обычно испытывают довольно серьезные неприятные симптомы, связанные с мочеиспусканием: частота позывов, неспособность терпеть, ночные позывы, сниженный напор струи, — которые проходят через месяц.
Пациенты могут иметь некоторые неприятные ректальные симптомы в течение нескольких недель. Может появиться ректальная язва в течение года или двух после процедуры лечения, если некоторые зерна оказались близко к ректальной стенке. Такая язва всегда заживает со временем, если только гастроэнтеролог не решит провести ее биопсию, заподозрив рак. В этом случае она может никогда не зажить, и пациенту понадобится колостомия.
Если у кого то есть факторы риска, кроме указанных выше, тогда одна только брахитерапия не даст достаточно высоких результатов излечения (вследствие того, что были затронуты перипростатические ткани вне пределов досягаемости радиационных зерен). Понадобится добавить двадцать пять процедур облучения внешней радиации для того, чтобы повысить дозу на перипростатические ткани. Основное преимущество брахитерапии — сокращение времени лечения — будет практически утрачено.
При заболевании от среднего до высокого риска, вероятно, придется выбрать внешнюю лучевую терапию как основной метод лечения, а не брахитерапию плюс сокращенный курс лучевой. Обычно курс лучевой терапии состоит курс из 44 процедур за девять недель.
Побочные эффекты внешней лучевой терапии как основного метода лечения рака простаты
Внешняя лучевая терапия может проводиться высокоэнергетическими рентгеновскими лучами, используя технику лучевой терапии с модулированной интенсивностью, или протонной терапией. Я сравню эти два метода. Кстати, Кибер-нож, томотерапия и другие разнообразные линейные ускорители проводят лечение лучевой терапией с модулированной интенсивностью при помощи рентгеновских лучей (фотонов). Между ними в конечном итоге разницы нет, отличаются только машины, которыми проводят лечение. Возможно, вы также слышали термин лучевая терапия с визуальным контролем, который просто означает, что проводится какое-то сканирование пациента на лечебном столе прямо перед проведением лечения. Это может быть КТ, портальное сканирование, стереоскопические рентгеновские лучи и др. Лучевая терапия с визуальным контролем используется со всеми формами лучевой терапии с модулированной интенсивностью, а также с протонной терапией.
Для обоих методов (протоны или фотоны) планирование лечения начинается с КТ сканирования тонкими слоями, которое интегрировано с высоко детализированной МРТ. КТ необходимо для того, чтобы сообщить компьютеру, планирующему лечение, толщину ткани во всех точках, через которые пройдет луч радиации. МРТ дает лучшую анатомическую картинку для определения контура простаты, семенных желез, мочевого пузыря, прямой кишки и т.д.
После нескольких дней, за которые создаются контуры органов, проводится множество опытов с конфигурацией луча, его модуляцией и т.д., вырабатывается оптимальный план лечения. После этого врач проводит проверку соответствия всем условиям для того, чтобы убедиться, что компьютерные расчеты дадут планируемое распределение дозы в ткани. И, наконец, пациент возвращается для первичного «визуального контроля» и первой из 44 процедур.
Радиолог — онколог встречается с каждым пациентом еженедельно и занимается побочными эффектами, которые могут возникнуть. В ходе лечения лучевой терапией с модулированной интенсивностью фотонами это может быть усталость, иногда до такой степени, что пациентам приходится идти домой и спать пару часов во второй половине дня.
После нескольких недель лечения может появиться ректальное раздражение, которое выражается в симптомах от слабой диареи до боли, кровотечения и постоянного ощущения в необходимости опорожнить кишечник, хотя в стуле может быть ничего, кроме небольшого количества слизи.
Также после нескольких недель лечения могут появиться раздражающие урологические симптомы, такие как частота походов в туалет, неспособность терпеть позывы, медленное опорожнение мочевого пузыря и необходимость несколько раз вставать ночью. Они могут длиться несколько недель после прохождения лечения.
Риски, которые могут возникнуть в будущем, включают развитие рака, вызванного радиацией. Кроме долгосрочного риска появления вторичного рака, большинство побочных эффектов проходят за срок от нескольких месяцев до года после окончания лучевой терапии.
Протонная терапия
При протонной терапии побочные эффекты выглядят иначе. Усталость минимальная или отсутствует вообще. (Я лечил одного заядлого велосипедиста, который проехал на своем велосипеде более тысячи миль за девять недель, во течение которых проходил терапию).
Ректальные симптомы почти не встречаются, так как только очень маленький объем прямой кишки получает радиацию. Урологические раздражающие симптомы могут появиться на такой же срок, как и при лечении рентгеновскими лучами (фотонами), хотя обычно они менее серьезны.
Множественные эпидемиологические исследования показали, что существует только минимальное повышение риска возникновения рака после облучения протонами по сравнению с рентгеновскими лучами. Вероятно из-за меньшего объема ткани, получающего какую-то дозу радиации. Если у мужчин и появляются немногие побочные эффекты, они обычно проходят за несколько недель после окончания облучения протонами.
Каковы сравнительные данные по побочным эффектам протонной терапии против лучевой терапии с модулируемой интенсивностью?
Мы объединили наши данные с различными онкологическими центрами, обследовали приблизительно 1000 пациентов, которые прошли лечение рака простаты протонной терапией, и сравнили их показатели качества жизни с мужчинами из контрольной группы, которые не проходили лечение (потому что у не было рака простаты).
Все мужчины заполняли опросные листы касательно качества их жизни каждые три месяца с начала лечения до, как минимум, одного года после лечения. Результаты показали, что пациенты, которые прошли лечение протонной терапией, имели такие же показатели качества жизни, как и те, у которых даже не было рака простаты.
Рак простаты обычно растет медленно. Не позволяйте никому подгонять вас при принятии решения, которое будет иметь последствия до конца вашей жизни.
Источник: www.medicaldaily.com
Назад к спискуЛЕЧЕНИЕ ЛУЧЕВЫХ ПОВРЕЖДЕНИЙ ОРГАНОВ МАЛОГО ТАЗА ПОСЛЕ ЛУЧЕВОЙ ТЕРАПИИ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | Сычева
1. Пасов В.В., Курпешева А.К. Осложнения и повреждения органов и тканей при лучевой терапии. Основы лучевой диагностики и терапии: национальное руководство. М.: ГЭОТАР-Медиа, 2012. 962–990.
2. Столярова И.В., Винокурова В.Л. Проблемы больных после лечения рака шейки матки. Профилактика и лечение постлучевых осложнений. Практическая онкология. 2002; 3: 220–227.
3. Сычева И.В., Пасов В.В., Курпешева А.К. Консервативные методы лечения местных лучевых повреждений, формировавшихся в результате сочетанной лучевой терапии и брахитерапии рака предстательной железы. Сибирский онкологический журнал. 2012;
4. : 57–60.
5. Сычева И.В., Пасов В.В. Лучевые повреждения органов малого таза после лечения ранних стадий рака предстательной железы (обзор литературы). Радиация и риск. 2014; 23 (4): 99–115.
6. Бардычев М.С., Цыб А.Ф. Местные лучевые повреждения. М.: Медицина, 1985. 230.
7. Бурковская В.А. Радиационные (лучевые) поражения кишечника. Гастроэнтерология Санкт-Петербурга. 2013; 203 (4): 18–24.
8. Гончарик И.И. Радиационный (лучевой) колит и энтерит. Военная медицина. 2010; 4: 119–121.
9. Hong J., Park W., Ehrenpreis E. Review article: current therapeutic options for radiation proctopathy. Aliment Pharmacol Ther. 2001; 15: 1253–1262.
10. Johnston M.J., Robertson G.M., Frizelle F.A. Management of late complications of pelvic radiation in the rectum and anus: a review. Dis Colon Rectum. 2003; 46 (2): 247–259. doi: 10.1097/01.DCR.0000050451.16169.59.
11. Kennedy G.D., Heise C.P. Radiation сolitis and proctitis. Clin Colon Rectal Surg. Feb 2007; 20 (1): 64–72. doi: 10.1055/s-2007-970202.
12. Pasov V., Boyko I., Sycheva I., Kurpesheva A. Radiation injuries with prostate cancer after interstitial radiation therapy with sealed I125 sources and concurrent radiation therapy. Ann Oncol. 2010; 21 (suppl 8): 303.
13. Rustagi T., Mashimo H. Endoscopic management of chronic radiation proctitis. World J Gastroenterol. 2011 Nov 7; 17 (41): 4554–62. doi: 10.3748/wjg.v17.i41.4554.
14. Eddi R., Depasquale J.R. Radiofrequency ablation for the treatment of radiation proctitis: a case report and review of literature. Therap Adv Gastroenterol. 2013 Jan; 6 (1): 69–76. doi: 10.1177/1756283X12456895.
15. Курпешева А.К., Пасов В.В., Терехов О.В., Белая Н.С., Червякова А.Е., Сычева И.В. Применение гемостатических трубок у больных поздними лучевыми геморрагическими ректитами. Материалы ХIII онкологического конгресса. М., 2009. 350–351.
16. Vanneste B.G., Van De Voorde L., de Ridder R.J., Van Limbergen E.J., Lambin P., van Lin E.N. Chronic radiation proctitis: tricks to prevent and treat. Int J Colorectal Dis. 2015 Oct; 30 (10): 1293–303. doi: 10.1007/s00384-015-2289-4.
17. Cotti G., Seid V., Araujo S., Souza A.H. Jr., Kiss Dr., Habr-Gama A. Conservative therapies for hemorrhagic radiation proctitis: a review. Rev Hosp Clin Fac Med Sao Paulo. 2003 Sep-Oct; 58 (5): 284–92.
18. Weiner J.P., Wong A.T., Schwartz D., Martinez M., Aytaman A., Schreiber D. Endoscopic and non-endoscopic approaches for the management of radiation-induced rectal bleeding. World J Gastroenterol. 2016 Aug 21; 22 (31): 6972–86. doi: 10.3748/wjg.v22.i31.6972.
19. Hanson B., MacDonald R., Shaukat A. Endoscopic and medical therapy for chronic radiation proctopathy: a systematic review. Dis Colon Rectum. 2012 Oct; 55 (10): 1081–95. doi: 10.1097/DCR.0b013e3182587aef.
20. Do N.L., Nagle D., Poylin V.Y. Radiation Proctitis: Current Strategies in Management. Gastroenterol Res Pract. 2011; 2011: 917941. doi: 10.1155/2011/917941.
21. Lund J.Å., Kaasa S., Wibe A., Widmark A., Fransson P. Late radiation effects to the rectum and anus after treatment for prostate cancer; validity of the LENT/SOMA score. Acta Oncol. 2013; 52 (4): 727–735. doi: 10.3109/0284186X.2013.747695.
22. Bansal N., Soni A., Kaur P., Chauhan A.K., Kaushal V. Exploring the Management of Radiation Proctitis in Current Clinical Practice. J Clin Diagn Res. 2016 Jun; 10 (6): XE01XE06. doi: 10.7860/JCDR/2016/17524.7906.
23. Wilson S.A., Rex D.K. Endoscopic treatment of chronic radiation proctopathy. Curr Opin Gastroenterol. 2006; 22: 536–549.
24. Shadad A.K., Sullivan F.J., Martin J.D., Egan L.J. Gastrointestinal radiation injury: prevention and treatment. World J. Gastroenterol. 2013 Jan 14; 19 (2): 185–198. doi: 10.3748/wjg.v19.i2.199.
25. Барышев В.В., Попучиев В.В. Статистическая оценка событий в клинических наблюдениях. Обнинск, 2009. 48.
26. Phan J., Swanson D.A., Levy L.B., Kudchadker R.J., Bruno T.L., Frank S.J. Late rectal complications after prostate brachytherapy for localized prostate cancer: incidence and management. Cancer. 2009 May 1; 115 (9): 1827–39. doi: 10.1002/cncr.24223.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ЛУЧЕВАЯ ТЕРАПИЯ ЛОКАЛИЗОВАННОГО РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Чуприк-Малиновская Т.П., Малофеевская Е.В.
Центральная клиническая больница Медицинского центра Управления делами Президента РФ, Москва
В структуре онкологической заболеваемости у мужчин рак предстательной железы продолжает занимать лидирующее место, составляя 13% в экономически развитых странах Европы и США. В России рак предстательной железы составляет 10,9-11,3 случаев на 100 000 населения (1). Учитывая тот факт, что пик заболеваемости приходится на шестое-седьмое десятилетия жизни, а демографическая обстановка характеризуется устойчивой тенденцией к увеличению числа лиц пожилого возраста, эпидемиологический прогноз предсказывает дальнейший рост больных раком предстательной железы. Ожидается, что к 2007 году число больных раком предстательной железы составит 1,6 млн. человек, ежегодный рост заболеваемости — 3,8 %. По данным Канцер-регистра Медицинского центра УДП РФ (2) более чем в два раза возросла заболеваемость раком предстательной железы в 1991-95 годах в сравнении с аналогичным периодом в 80-х годах (с 5% до 12 %).
Лучевая терапия является одним из основных компонентов комплексного лечения больных раком предстательной железы. Впервые лучевая терапия была использована в 1915 году Young H.H. в виде внутриполостного метода радиевыми источниками (12). Дистанционная лучевая терапия применялась с 1930 в качестве паллиативного средства при обструктивном процессе. Методика была описана Hultberg в 1940 году, однако, в связи с активным применением гормональной терапии (1941 г.) несколько утратила свое значение. Совершенствование радиологической аппаратуры, внедрение высокоэнергетического излучения на линейных ускорителях, симуляторов вновь вызвали интерес к лучевой терапии в 50-х годах (3, 4), который сохраняется и по настоящее время наряду со значительным прогрессом в разработке лекарственных средств и совершенствованием хирургической техники (6, 11).
Результаты лучевого лечения 1797 пациентов в Стенфордском Университете показали, что при опухолях, ограниченных размерами предстательной железы, 5-ти, 10-ти и 15-летняя выживаемость составили соответственно 81%, 60% и 35%, а при выходе опухоли за пределы железы — соответственно 61%, 36% и 18% (10). Эффективность лечения безусловно зависит от распространенности процесса, степени вовлечения капсулы железы, лимфатических узлов малого таза, гистологического строения опухоли, степени обструкции уретры, а также интервала между диагностикой и началом лечения. По данным различных авторов частота поражения лимфатических узлов при локализованных формах рака составляет 19-20%, а при местнораспространенных — 56-60% (7,10). Эти обстоятельства обуславливают необходимость тщательного обследования больных для оценки первичной распространенности опухоли. С использованием современных диагностических возможностей (цветная доплеровская ультрасонография, компьютерная и магнитнорезонанcная томография, диагностическая лапароскопия с биопсией лимфатических узлов). Планирование методики лучевой терапии проводят с учетом полученных данных, что определяет объем облучаемых тканей.
1.Дистанционная лучевая терапия.
Основными принципами лучевой терапии являются применение высокоэнергетического излучения на линейных ускорителях энергией 4-6 Мэв с прецизионным облучением подвижным методом (секторная или круговая ротация), либо с использованием «бокс» — методики с 4-х полей, позволяющих уменьшить нагрузку на заднюю стенку прямой кишки. Отдается предпочтение режиму обычного или мультифракционированного облучения разовой дозой 2 Гр с обязательным ежедневным облучением со всех полей до суммарных очаговых доз 70-76 Гр на область предстательной железы и 50 Гр на лимфатические узлы малого таза (1-2 эшелона — группа обтураторных, внутренних и наружных подвздошных лимфатических узлов). При необходимости облучения парааортальных лимфатических узлов, используется статическое облучение с противолежащих фигурных полей до суммарных очаговых доз 50 Гр. Лимфатические узлы не облучают, если доказано отсутствие метастатического их поражения при лапаротомии, у пациентов старшего возраста (более 75 лет), в случае низкого или среднего значения индекса Глиссона (6 и менее).
Частота осложнений при использовании дистанционной лучевой терапии составляет 10-15 %. Наиболее серьезными являются стриктура уретры, наблюдаемая у 3-5 % больных, проктиты — 4,5%. Показано, что совершенствование методики облучения сопровождается уменьшением как частоты, так и степени выраженности осложнений с 5-7% до 2-5%. Потенция сохраняется у 60% больных, а при современных методиках у 86% пациентов (4).
Для уменьшения частоты осложнений особенно важны вопросы обеспечения качества лучевой терапии за счет воспроизводимости условий ежедневного облучения, обеспечения точности укладки, защиты окружающих нормальных тканей, в том числе яичек. Применение методик объемного планирования, создание фигурных полей с помощью мультилифтного коллиматора, ежедневный контроль параметров облучения в реальном пучке излучения — современные возможности совершенствования лучевой терапии.
2. Внутритканевая лучевая терапия.
Наибольший опыт применения внутритканевой лучевой терапии источниками иода-125 имеется в Мемориальном центре онкологии в Слоан-Кеттеринге, где она используется с 1970 г. (9). Результаты наблюдения за больными более 10 лет показали следующее:
— необходим тщательный отбор больных с распространенностью опухоли соответственно В (Т 1,Т 2) или С (Т 3) стадиями;
— исключаются больные с выраженными признаками обструкции уретры, распространением опухоли на латеральные отделы или семенные пузырьки, либо при наличии отдаленных метастазов;
— исключаются больные после ТУР.
Методика внутритканевой терапии заключается в следующем: после выполнения билатеральной лимфаденэктомии в малом тазу под контролем пальца или ультразвукового датчика осуществляется внедрение радиоактивных источников через промежностный доступ. В определенной последовательности производится внедрение от 40 до 70 зерен изотопа йод-125 с периодом полураспада 60 дней. При условии равномерного распределения дозы в объеме на периферии опухоли доза составляет приблизительно 180 Гр, что соответствует 80 Гр наружного облучения. Лечение удовлетворительно переносится больными, 28% из них отмечают неприятные ощущения в виде ректита, цистита. Серьезные осложнения наблюдаются не более, чем у 2% больных, хотя описаны единичные случаи ректоуретральных свищей. Потенция сохраняется у 93% больных. Результаты лечения в значительной степени зависят от распространенности опухоли. 5-ти летняя выживаемость при Т 1 составляет 72% и уменьшается до 30% при локализации опухоли в обеих долях простаты и 25% при вовлечении капсулы. 10-летняя выживаемость при Т 1-2 составляет 54% (9). Очевидно, что методика имеет ограниченное применение в силу определенных показаний к ней, а также сложностей в осуществлении.
3. Комбинация наружного и внутритканевого облучения с помощью имплантации радиоактивных источников.
Методика позволяет нивелировать недостатки двух методов лучевого лечения, увеличивая очаговую дозу на опухоль и снижая лучевую нагрузку на окружающие ткани. На первом этапе выполняется диссекция лимфатических узлов малого таза. В дальнейшем осуществляется внедрение от 6 до 10 радиоактивных гранул золота в область предстательной железы, при этом суммарная очаговая доза составляет 35 Гр. Хотя иглы вводятся сквозь всю железу, упор делается на пальпируемый участок опухоли. С учетом особенностей радиоактивных источников золота, заключающихся в более высокой энергии излучения (относительно иода-125) и слоя половинного ослабления в тканях (до 45 см) возможно применение данных источников даже при резецированной простате, либо при поражении семенных пузырьков или шейки мочевого пузыря. Имплантация источников занимает 5-10 минут, общее время операции 45-75 минут, при этом значительно сокращается время облучения персонала.
Через 14-21 день после имплантации источников (период полураспада составляет 2,7 дня) проводится курс дистанционного облучения с использованием тормозного излучения энергий 6-7 Мэв. При отсутствии метастатических лимфатических узлов подводится суммарная очаговая доза 45 Гр по 2,25 Гр ежедневно 4 раза в неделю в течение 5 недель. При поражении лимфоузлов на область малого таза подводится суммарная доза 50 Гр с использованием противолежащих полей и дополнительно на простату 400 рад. При сопоставлении с режимом обычного облучения суммарная доза на предстательную железу составляет 80-89 Гр.
Частота осложнений при осуществлении данной методики сопоставима с внутритканевым облучением источниками йода. Наиболее значимыми являются проктит (3,8 %), цистит (7,8%), отек бедер (3,8%), отек половых органов (3%). Смертность не превысила 0,5% (причины: легочная эмболия и лучевой энтерит). 67% больных перенесли лечение без осложнений, у 70% сохранилась потенция (8).
Результаты сочетанного лучевого лечения составляют при Т 1-2 — 81% и 50% (5 и 10-летняя выживаемость).
Комбинация наружного и внутритканевого компонентов облучения расширила возможности применения даже при местно-распространенном процессе. При определенных показаниях (задержка мочи, сужение уретры) до начала сочетанного облучения может быть выполнена трансуретральная резекция опухоли, при этом облучения начинается спустя 5-6 недель.
Используется также методика внутритканевого введения источников иридия высокой мощности дозы в предварительно установленные эндостаты в область предстательной железы с применением внутриполостных аппаратов. Общая доза на лимфатические узлы малого таза составляет 50 Гр и 40 Гр локально на предстательную железу. При этом выполняются две укладки по 15 Гр за сеанс. Авторы, имеющие опыт наблюдения за больными более 6 лет, сообщают о безрецидивной 5-летней выживаемости у 86% больных (5).
Таким образом, сопоставление непосредственных и отдаленных результатов лучевого и хирургического лечения, а также частоты осложнений свидетельствуют о равных возможностях двух методов при локализованных формах рака предстательной железы. Существующие ограничения к применению радикальной простатэктомии расширяют применение лучевой терапии. Среди различных методов лучевого воздействия преимущество следует, по-видимому, отдавать наружному способу как наиболее доступному.
В качестве примера, приводим результаты собственных наблюдений за 216 больными локализованным раком предстательной железы (Т 1-2N 0М 0), получавшими лучевое лечение в 1984-1999 гг. (34 из них наблюдались в течение последнего года). Возраст больных колебался от 49 до 89 лет, 43,7% были в возрасте 70-79 лет. Высокодифференцированная аденокарцинома была обнаружена у 83,5% больных, у 7% больных определялись низкодифференцированные формы рака, у 13 больных степень дифференцировки не была определена. Размеры простаты и опухолевого узла, его локализация, связь с капсулой и мочевым пузырем определялись на основании данных ТРУЗИ (в последний год одновременно с ультразвуковой ангиографией), компьютерно-томографического исследования. Оценка распространенности процесса проводилась на основании данных сцинтиграфии скелета, ультрасонографии печени, забрюшинных лимфоузлов, КТ и МРТ органов малого таза, определения уровня ПСА крови в динамике.
Все больные получали дистанционную лучевую терапию на область предстательной железы и парапростатической клетчатки. У 103 (47,3%) облучение сочетали с применением антиандрогенной терапии (флюцином), в некоторых случаях с одновременным назначением аналога гонадотропин-рилизинг гормона золадекса. Назначение антиандрогенной терапии было обусловлено наличием низкодифференцированных форм опухоли, либо значительным повышением уровня ПСА.
Рентгенотопометрическая подготовка проводилась на рентгеновском симуляторе Ксиматрон. На компьютерном томографе на протяжении всего объема мишени выполнялись серии поперечных томограмм (шаг 10 мм), которые затем идентифицировались на фронтальной топограмме. Полученная информация обрабатывалась на планирующей системе Кадплан. На всех срезах проводился выбор необходимого объема облучения и определялись оптимальные параметры. Точная визуализация опухоли, воспроизведение на протяжении всего объема пространственного изображения окружающих нормальных тканей, возможность ежедневного контроля расположения полей облучения с помощью системы рентгеновского изображения в пучке тормозного излучения. В зависимости от топографо-анатомических особенностей нами были использованы три методики подвижного облучения: круговая ротация, секторная ротация в радиусе 240 градусов, двухзонное секторное качание с включением в зону
90% изодозной кривой области простаты и парапростатической клетчатки. Поле на оси ротации 7-8х9-11 см, разовая очаговая доза 2 Гр х 5 раз в неделю, суммарная очаговая доза 68-74 Гр. В ряде случаев применялась методика 4-х польного облучения по системе «бокс» методики с моделированием фигурных боковых полей в соответствии с конфигурацией предстательной железы. Непосредственная лучевая реакция в виде умеренно выраженного цистита отмечена у 28% больных. У одного пациента через 4 года развился язвенный ректит.
Период наблюдения составил от 1 года до 13 лет, 47 больных из общего числа наблюдались более 5 лет, 34 — в течение последнего года. Рецидив первичной опухоли не выявлен ни у одного больного. У 24 больных (12%) развились отдаленные метастазы (в среднем через 40,7 месяцев), преимущественно в кости, печень, парааортальные лимфатические узлы. Живы 176 больных, умерли 40 больных, причем лишь 11 из них (28%) вследствие генерализации процесса. Скорректированная 5-летняя выживаемость для 182 больных, наблюдаемых более 2-х лет, составила 92,5%, 10-летняя — 51,5%.
У 34 пациентов, наблюдаемых в течение последнего года, проведено динамическое наблюдение за степенью резорбции опухоли с помощью доплеровской ультрасонографии и уровнем снижения ПСА непосредственно после окончания лечения и в сроки 3, 6, 12 месяцев. Положительная динамика в виде уменьшения размеров предстательной железы и опухолевого узла, а также нормализация уровня ПСА отмечена у 97% больных через 12 месяцев после окончания лечения. Соответственно в более ранние сроки, непосредственно после окончания лечения (А), через 3 (Б) и 6 (В) месяцев, эти показатели оказались равными: (А) ТРУЗИ 76%, ПСА -56%; (Б) -ТРУЗИ-80%, ПСА-71%, (В)- ТРУЗИ-97%, ПСА-80%. Полученные данные представляют практический интерес, поскольку позволяют объективно проводить оценку эффективности лучевого лечения неинвазивным способом.
Таким образом, приведенные отдаленные результаты свидетельствуют о высокой эффективности лучевой терапии у больных локализованным раком предстательной железы с использованием современной радиологической аппаратуры, которая успешно может конкурировать с хирургическим лечением.
Литературы:
1. Двойрин В.В. Аксель Е.М. Трапезников Н.Н. Заболеваемость злокачественными новообразованиями и смертность от них населения стран СНГ в 1995 году. — М. 1996, 125с.
2. Денисов Л.Е. Николаев А.М. Виноградова Н.Н. Ушакова Т.И. Организация ранней диагностики злокачественных новообразований основных локализаций. — М. 1997. С.122-134.
3. Bagshaw M.A. et al. Linear accelerator supervoltage YII. Carcinoma of the prostate. -Radiology, 1965, 85,121-129.
4. Bagshaw M.A. et al. Radiotherapy of prostatic carcinoma: long- or short-term efficacy. -Urology (Suppl.) 1985, 25, 17.
5. Galalae R. Et al. Outcome following high dose rate (HDR) brachytherapy and external beam radiation for localized prostate cancer. — The European Journal of Cancer. 1999, vol. 35, suppl. 4, 341.
6. Gibbons R.P. et al. Total prostatectomy for localized prostatic cancer. — J. Urol. 1984, 131-137.
7. Gibbons R.P. Localized prostate carcinoma. — Cancer, 1993, 10, v. 72, 2965-72.
8. Guerriero B.S. et al. Combined interstitial and external radiotherapy in the definitive management of carcinoma of the prostate. — Cancer. 1980, 45, 1922-28.
9. Hilaris B.S. et al. Brachytherapy Oncology 1983. Edited by B.S.Hilaris and M.A.Botata. Publ. By Memorial Sloan-Kettering Cancer Center. 1983.
10. Pistemna D.A., Bagshow M.A. Freiha F.S. Extended- field radiation therapy for prostatic adenocarcinoma: status report of a limited prospective trial. — In Johnson D.E. : » Cancer of the genitourinary tract». New-York: Raven Press, 1979, p.229.
11. Walsh P.C. Jewett H.I. Radical surgery for prostatic cancer. -Cancer. 1980, 45, 1906.
12. Young H.H. Technique of radium treatment of cancer of the prostate and seminal vesicles. Surg. Gynecol. Obstet. 1922, 34, 93-98.
Реабилитация онкобольных после лучевой терапии и на фоне
Одним из методов лечения онкологических заболеваний является лучевая терапия. Она направлена на подавление роста опухолей различной локализации. Она может применяться как отдельный метод лечения, так и в комбинации с оперативным или химиотерапевтическим, таргетным, гормональным лечением.
Особенности лучевой терапии
Искусственное ионизирующее излучение используют в радиотерапии, его направляют на клетки рака. При проникновении ионизирующих лучей внутрь клетки происходит разрыв химических связей в биологических молекулах, что приводит к сбою в работе клеточных структур и гибели всей клетки. Внутри клеток рака нет каких-либо участков, которые были бы устойчивы к излучениям, но дозы облучения в зависимости от вида тканей и типа рака различаются.
Особенно чувствительны к облучению клетки, которые часто и быстро делятся. Это позволяет применять радиотерапию в лечении онкологии, так как опухолевые клетки активнее обычных, и делятся чаще, более чувствительны к ионизирующим лучам. Поэтому почти у половины онкобольных одним из методов терапии становится облучение как один из этапов борьбы с раком. Современная медицина позволяет сделать облучение более прицельным, максимально защищая здоровые ткани от ионизирующих лучей. Это помогает снизить общую лучевую нагрузку на тело, из-за чего лечение переносится гораздо лучше. Но полностью оградить свои клетки от облучения невозможно, поэтому после лучевой терапии возможны осложнения и требуется реабилитация.
Последствия лучевой терапии
Процесс лечения не лишен недостатков, при проведении радиотерапии могут возникать общие лучевые реакции и местные изменения в зоне воздействия.
Общие реакции возникают со стороны всего тела как реакция на излучение, так и на процесс распада опухолевых тканей с выделением продуктов метаболизма. Тяжесть реакций зависит от общей дозы и конкретной технологии облучения. Сегодня общие реакции выражены не сильно, они не требуют длительных перерывов в лечении или отмены данного метода терапии. К ним можно отнести:
- слабость и быструю утомляемость;
- головокружения с головной болью;
- тошноту;
- раздражительность.
Эти реакции обычно исчезают самостоятельно в течение примерно 3-4 недель.
Местные реакции разделяются на ранние (возникают в срок до 3 месяцев) и поздние (после этого времени) изменения. Они разнообразны и зависят от конкретной зоны облучения и типа тканей. Со стороны кожи возможны дерматиты, язвы, потеря волосяного покрова. Со стороны слизистых оболочек типичны эрозии, язвочки, сухость, воспаление. Если это брюшная полость, могут возникать проблемы со стулом, спазмы, дискомфорт в животе. Облучение грудной клетки грозит лучевой пневмонией, эзофагитом, перикардитом. Могут также возникать воспалительные процессы в области нервной ткани, остеопороз.
Большинство этих изменений носят временный характер и исчезают при реабилитации после лучевой терапии.
Как восстановиться после лучевой терапии
Для скорейшего устранения последствий облучения необходима разработка курса реабилитации. Это важно для повышения качества жизни пациента, скорейшего возвращения к привычной деятельности, предотвращения вторичных осложнений. Для каждого пациента в «СМ-Клиника» разрабатывается индивидуальная программа реабилитации, которая включает в себя медикаментозную поддержку, физиотерапию, изменение образа жизни, коррекцию питания и режима, психологическую поддержку.
Показания к реабилитации
Среди ключевых показаний к реабилитации:
- проведение лучевой терапии крупных опухолей;
- появление общих реакций на лучевую терапию;
- местные изменения в тканях;
- необходимость скорейшего восстановления перед следующим этапом лечения.
Особенности восстановления после лучевой терапии
Пациенту рекомендуется усиленное, витаминизированное питание, достаточный прием жидкости, регулярное пребывание на свежем воздухе, защита от инфекционных болезней. При возникновении определенных симптомов врач назначает курс медикаментозных препаратов – для коррекции пищеварительных, неврологических, воспалительных явлений. В некоторых случаях необходима стимуляция процесса кроветворения и поддержка иммунных функций.
Врач тщательно следит за изменениями, которые происходят в организме пациента в период реабилитации, проводя коррекцию плана восстановления. Это позволяет своевременно предотвратить осложнения, возникающие в период после облучения раковой опухоли.
Преимущества реабилитации в «СМ-Клиника»
Чтобы снизить вероятность развития осложнений после лучевой терапии, реабилитационные мероприятия начинаются одновременно с курсом лечения. Главным образом реабилитация направлена на снижение последствий со стороны кроветворной, нервной и иммунной системы, а также для предупреждения развития инфекционных и других заболеваний на фоне ослабления организма.
В медицинском центре «СМ-Клиника» проводятся все виды реабилитаций после лучевой терапии:
- Восстановительная. После лечения заболевания на ранней стадии, когда применялась точечная терапия, оставив минимальные последствия.
- Поддерживающая. При лечении более тяжелой стадии рака.
- Паллиативная. Направлена на уменьшение симптомов и борьбу с ростом опухоли.
Программа реабилитации может включать в себя следующее:
- иммуностимулирующие препараты и витамины;
- физиотерапию;
- лекарства и аппаратные методики восстановления функций почек и печени.
Для комфорта пациента в «СМ-Клиника» работает стационарное отделение с круглосуточным дежурством врачей и медицинского персонала. Помимо стационарного лечения, есть возможность прохождения реабилитации в условиях амбулатории или на дому.
«Спасительные» методы лечения рака предстательной железы после радикальной терапии
А.В. Сивков, В. Муравьев, Н.Г. Кешишев, И.А. Шадеркин, О.В. Шкабко
НИИ урологии Минздравсоцразвития, 2Urology Division/Department of Surgery University of Cincinnati College of Medicine
В России отмечается рост заболеваемости раком предстательной железы (РПЖ). Так, в 1998-2008 гг. заболеваемость РПЖ на 100 000 населения возросла с 15,28 до 33,69, т.е. на 120,5%. [1]. Из-за активного внедрения в повседневную практику определения уровня ПСА [2, 3], осведомленности населения, наличии программ раннего выявления рака предстательной железы, увеличивается процент выявления заболеваний в ранней стадии (T1-2) [4, 5]. Этот факт позволяет пациентам предложить радикальные методы лечения рака предстательной железы: радикальная простатэктомия (РПЭ), дистанционная лучевая терапия (ДЛТ), брахитерапия, новые аблятивные технологии (HIFU-терапия, криотерапия, фотодинамическая терапия, лазерная абляция и др.).
Однако каждый из этих методов радикального лечения имеет свой процент рецидивирования рака предстательной железы. На первых этапах диагностики рецидива мы можем говорить лишь только о биохимическом рецидиве рака простаты.
Понятие «биохимический рецидив» отличается при различных методах радикального лечения РПЖ. Согласно международному консенсусу [6, 7], два последовательных повышения уровня ПСА после РПЭ, равных или выше 0,2 нг/мл, свидетельствуют о биохимическом рецидиве заболевания. Некоторые авторы оспаривают эти данные, указывая на другой пороговый уровень 0,4 нг/мл для более точного выделения группы больных с высоким риском клинической прогрессии заболевания [8]. Согласно рекомендациям Европейской ассоциации урологов, повышение уровня ПСА после РПЭ более чем на 0,2 нг/мл свидетельствует о наличии рецидива основного заболевания [9].
До недавнего времени, согласно рекомендации ASTRO 1996 г. [10], определение биохимического рецидива после лучевой терапии подразумевало 3 последовательных повышения уровня ПСА. В 2006 г. конференция по пересмотру консенсуса RTOG-ASTRO дала новое определение биохимического рецидива после лучевого лечения это рост уровня ПСА на 2 нг/мл и выше после достижения минимального уровня маркера [11]. Такого же мнения придерживаются специалисты Европейской ассоциации урологов [9].
Относительно HIFU или криотерапии были использованы различные определения биохимического рецидива [12]. Большинство из них основывалось на повышении уровня ПСА выше 1 нг/мл.
Для выработки дальнейшей тактики лечения биохимического рецидива РПЖ необходимо отдифференцировать местный рецидив заболевания от генерализации процесса.
Местный рецидив или генерализация процесса в течение 10 лет после ДЛТ или РПЭ у больных, получавших лечение второй линии в течение 5 лет после первичного лечения, имеет место у 27-53% и 16-35% соответственно [13-18].
Согласно рекомендациям Европейской ассоциации урологов, критериями отличия местного рецидива от генерализованного после РПЭ является время повышения ПСА после вмешательства, время удвоения ПСА, скорость прироста ПСА, патоморфологическая стадия и показатель по шкале Глисона. Так, при местном рецидиве у 80% больных наблюдается подъем уровня ПСА более чем на 0,2 нг/мл через 3 года, время удвоения ПСА > 11 месяцев, дифференцировка опухоли по шкале Глисона < 6 и стадия < pT3a, pN0, pTx R1.
Критериями системного прогрессирования более чем у 80% больных являются: повышение уровня ПСА менее чем через 1 год после хирургического вмешательства, время удвоения ПСА 4-6 месяцев, дифференцировка опухоли по шкале Глисона 8-10, стадия pT3b, pTx pN1.
По нашему мнению, для подтверждения местного рецидива заболевания показана биопсия в области уретро-везикального анастомоза и участков, подозрительных на местный рецидив РПЖ.
Согласно рекомендациям ASTRO [19], при наличии у больного биохимического рецидива после проведения ДЛТ выполнение биопсии предстательной железы не показано. Тем не менее, при планировании «спасительной» терапии у больных с уровнем ПСА выше минимального значения, достигнутого после проведения ДЛТ, биопсия является обязательным условием [20-22]. При планировании данного метода терапии общепризнанной является выжидательная тактика на протяжении 18 месяцев после проведения ДЛТ, брахитерапии, криодеструкции предстательной железы или HIFU.
Согласно рекомендациям Европейской ассоциации урологов, критериями местного рецидива после лучевой терапии являются: наличие злокачественных клеток при биопсии через 18 месяцев и более после начала лучевой терапии; подъем ПСА более чем на 2 нг/мл от достигнутого уровня; отсутствие метастатического поражения при КТ (МРТ) и остеосцинтиграфии [9].
После верифицикации диагноза встает вопрос о возможных вариантах лечения рецидива РПЖ. Такое лечение называется лечением второй линии, «спасительной» или сальважной терапией РПЖ.
Необходимо различать следующие методы терапии местного рецидива РПЖ: «спасительная» дистанционная лучевая терапия (СДЛТ), «спасительная» радикальная простатэктомия (СРПЭ), «спасительная» высокодозная брахитерапия (СВБТ), «спасительная» HIFUтерапия и «спасительная» криотерапия (СКрТ).
«Спасительная» дистанционная лучевая терапия (СДЛТ)
После РПЭ
Основываясь на многочисленных исследованиях по проведению лучевой терапии у больных с биохимическим рецидивом после РПЭ, следует принимать во внимание множество факторов, которые способствуют определению наиболее рационального метода терапии: динамического наблюдения, ДЛТ или гормонального лечения. Как показывают многочисленные исследования, в том числе и с высоким уровнем доказательности, уровень ПСА на момент диагностики рецидива основного заболевания является важным фактором прогноза отдаленных результатов лучевой терапии [23-31]. В исследованиях [23, 24] также было показано, что при уровне ПСА до начала проведения ДЛТ < 2,5 нг/мл показатели выживаемости составляют 53 и 76%, а при уровне ПСА > 2,5 нг/мл только 8 и 26% соответственно. По данным исследования Format и соавт. [25], безрецидивная выживаемость больных с наличием биохимического рецидива после РПЭ составляет 83% при уровне ПСА < 2,0 нг/мл и только 33% при уровне ПСА > 2,0 нг/мл до начала проведения ДЛТ. По данным другого исследования [26], показатели выживаемости без признаков прогрессирования составляют 58% при уровне ПСА < 1,0 нг/мл и 21% у больных при уровне ПСA > 1,0 нг/мл.
Основываясь на рекомендации ASTRO, доза облучения на ложе предстательной железы у больных с биохимическим рецидивом после РПЭ при уровне ПСА <1,5 нг/мл должна быть не менее 64 Гр [11]. Полученные данные подкреплены результатами других исследований [27-29], показавших существенные различия показателей 5-летней общей и безрецидивной выживаемости у больных, получавших «спасительную» лучевую терапию при выявлении только биохимического или местного рецидива в виде пальпируемых узловых образований после РПЭ.
Результаты крупного рандомизированного исследования SWOG 8974, перед которым стояла цель установить, улучшает ли отдаленные результаты терапии проведение немедленной адъювантной ДЛТ на ложе предстательной железы у больных в группе РПЖ высокого риска, показали, что у пациентов с уровнем ПСA < 0,2 нг/мл безрецидивная выживаемость составляет 77% [28]. У больных с уровнем ПСА 0,2-1,0 нг/мл и > 1 нг/мл показатели 5-летней безрецидивной выживаемости составили соответственно 34 и 0%. Вышеприведенные данные свидетельствуют о том, что адъювантная ДЛТ ложа предстательной железы эффективна даже в группе больных высокого риска, тем не менее терапевтический эффект более значим в подгруппе пациентов с невысоким уровнем ПСА.
В исследовании Stephenson и соавт. [29] произведена оценка прогностических моделей с целью прогнозирования результатов лучевой терапии. Исследуемая группа включала в себя 1603 больных с биохимическим рецидивом после РПЭ, получавших лечение в 17 Североамериканских центрах. Авторы установили статистически значимую взаимосвязь между уровнем ПСА во время проведения облучения и эффективностью проводимой терапии: 6-летняя выживаемость без биохимического рецидивирования составляла 48% в подгруппе больных с уровнем ПСА < 0,5 нг/мл и 40, 28 и 18% в подгруппах с ПСА 0,51-1,0; 1,01-1,5 и > 1,5 нг/мл соответственно.
В исследовании, опубликованном в журнале Urology в 1999 г., Egewa и соавт. [30] представили данные о показателях 5-летней биохимической безрецидивной и общей выживаемости, которые составили 69 и 96% в группе с отсутствием патологии при пальцевом ректальном исследовании, по сравнению с 45 и 78% в подгруппе с пальпируемыми образованиями соответственно. Тем не менее, в связи с отсутствием результатов крупных рандомизированных исследований, а также длительного периода наблюдения влияние данного факта на показатели отдаленной выживаемости больных остается неясным.
После HIFU-терапии
Таблица 1. Осложнения после СРПЭ и РПЭ
| Осложнения | После СРПЭ | После РПЭ |
| Стриктура уретро-везикального анастомоза | 1-26% | 0,2-3% |
| Повреждение прямой кишки | 1-2% | 0% |
| Недержание мочи | 56% | 43% |
| Острая задержка мочеиспускания | 1-10% | 0,2-0,3% |
| Инфекционные осложнения | 2% | 0% |
Pasticier G. в 2008 году описал использование СДЛТ после HIFUтерапии РПЖ. 45-ти пациентам была выполнена СДЛТ, причем у 13-ти пациентов СДЛТ сочеталась с гормональной терапией. Пятилетняя выживаемость без биохимического рецидива в группе пациентов, подвергшихся монотерапии СДЛТ (всего 32 пациента), составила 64% [32].
«Спасительная» РПЭ
После ДЛТ
Пятилетняя выживаемость без прогрессии после СРПЭ составляет 47-65%, тогда как 10-летняя выживаемость 30-43%. Пятилетняя раковоспецифическая выживаемость составляет 90-93%, 10-летняя 70-77%. Стоит отметить, что прогрессия заболевания также зависит от уровня ПСА перед «спасительной» РПЭ. Так, при уровне ПСА < 4, 4-10 и более 10 нг/мл выживаемость без биохимического рецидива составляет 86%, 55% и 37% соответственно [33-35].
Сравнивая результаты СРПЭ и РПЭ через 3 месяца, были выявлены следующие осложнения: стриктура уретро-везикального анастомоза (1-26% при СРПЭ против 0,2-3% при РПЭ), повреждение прямой кишки (1-2% при СРПЭ против 0% при РПЭ), недержание мочи (56% при СРПЭ против 43% при РПЭ), острая задержка мочеиспускания (1 %-10% при СРПЭ против 0,2-0,3% при РПЭ), инфекционные осложнения (абсцесс в области анастомоза 2% при СРПЭ против 0% при РПЭ) [35] (Таблица 1).
После HIFU-терапии, брахитерапии
Liatsikos E. и соавт. в своей работе сообщают о 12 случаях выполнения «спасительной» экстраперитонеоскопической простатэктомии после ДЛТ (6 пациентов), брахитерапии (2 пациента) и HIFU-терапии (4 пациента). Период наблюдения составлял 20 месяцев. Средняя продолжительность операции составила 153 минуты, средний установленный объем кровопотери 238 мл, время нахождения уретрального катетера в послеоперационном периоде 7,2 дней. Авторы отметили отсутствие осложнений во время операции и в послеоперационном периоде. У 10 пациентов сохранялось полное удержание мочи, у 2-х пациентов отмечено недержание мочи. Данных о состоянии эректильной функции и уровне ПСА после вмешательства не сообщается [36].
После криотерапии РПЖ
Grampsas S-А. и соавт. в 1995 году сообщили о 6-ти пациентах, которым была выполнена СРПЭ после криотерапии РПЖ. Авторы отмечают, что через 12 месяцев наблюдения все пациенты были живы, и не отмечено прогрессии заболевания по уровню ПСА [37].
«Спасительная» Высокодозная брахитерапия (СВБТ) после ДЛТ и перманентной брахитерапии
В настоящее время определены показания к выполнению СВБТ. Данный метод лечения можно выполнять пациентам с необструктивным типом мочеиспускания, у которых время удвоения ПСА превышает 6 месяцев, сумма баллов по Глисону < 6, уровень ПСА менее 10 нг/мл и время предполагаемой продолжительности жизни превышает 5 лет [38].
По данным Grado и соавторов анализ 49 пациентов с местным рецидивом после ДЛТ показывал, что трехлетняя выживаемость без биохимического рецидива после выполнения СВБТ составила 48%, пятилетняя 34%. При этом автор обращает внимание на то, что после СВБТ при достижении ПСА менее 0,5 нг/мл выживаемость без биохимического рецидива намного лучше 77% через 3 года и 56% через 5 лет [39].
Lee H.K. в 2008 году опубликовал данные наблюдения 21 пациента, которые подверглись СВБТ по поводу местного рецидива после ДЛТ, и выживаемость без биохимического рецидива после выполнения СВБТ через 3 года составила 94%, через 5 лет 38% [40].
По данным Burri R.J. и соавт., у 37 пациентов (35 пациентов после ДЛТ и 5 пациентов после перманентной брахитерапии), которым была выполнена СВБТ, десятилетняя выживаемость без биохимического рецидива составила 54%, а раковоспецифическая выживаемость составила 96% [41].
Среди осложнений СВБТ острая задержка мочеиспускания встречается в 14% случаев, гематурия в 4%, дизурия в 6%, повреждения прямой кишки в 4%, ректальное кровотечения в 2% случаев [39]. Lee H.K. и соавт. в 2008 году сообщили, что у 29% больных после СВБТ определялись нежелательные явления 1-2 степени, у 5% со стороны желудочно-кишечного тракта 2-й степени [40]. По данным Brian Lee и соавт. [42], частота осложнений со стороны мочеполовой системы 1-2 степени составила 85% и 14% 3-й степени.
«Спасительная» криотерапия (СКрТ)
После ДЛТ
В настоящее время не существует общепризнанных рекомендаций по проведению СКрТ. По мнению Richard J. Babaian с соавт. (2008) идеальными пациентами для СКрТ являются пациенты с клинической стадией заболевания менее T2c, показателем по шкале Глисона < 8, ПСА к моменту СКрТ < 4 и ПСА < 10 при выполнении ДЛТ. Противопоказаниями для выполнения СКрТ являются наличие объема ПЖ более 40 см3 (идеально 20-30 см3), распространение опухоли на семенные пузырьки и ТУР ПЖ в анамнезе. Выполнение СКрТ после ТУР ПЖ может привести к некрозу уретры [43].
Mohamed Ismail в 2007 году провел анализ 100 пациентов, которым была выполнена СКрТ местного рецидива РПЖ после ДЛТ. 20% пациентов до выполнения СКрТ была выполнена лапароскопическая лимфаденоэктомия. Перед выполнением СКрТ антиандрогены принимали 46% больных. 12-месячная выживаемость без биохимического рецидива составила 83%, через 24 месяца 72% и 59% через 36 месяцев. Используя критерии биохимического рецидива, пятилетняя выживаемость без биохимического рецидива для групп больных с низким, средним и высоким риском составила 73%, 45% и 11% соответственно. Уровень ПСА менее 0,1 нг/мл через 3 месяца был достигнут у 50% больных [44].
Таблица 2. Результаты скрт после ДЛТ [44]
| Автор | Количество пациентов | Медина наблюдения (мес.) | Порог оценки биохимического рецидива | Выживаемость без биохимического рецидива (%) | ||
| низкий риск | средний риск | высокий риск | ||||
| de la Taille et al. | 43 | 22 (1-54) | < 0,1 | 66 (все группы риска) | | ||
| Chin et al. | 118 | 19 (3-54) | < 0,5 | Нет данных | Нет данных | 34 | |
| Ghafar et al. | 38 | 21 (3-37) | Nadir + 0,3 | 74 (все группы риска) | ||
| Han et al. | 18 | 12 (нет данных) | < 0,4 | 77 (все группы риска) | ||
| Bahn et al. | 59 | 82 (нет данных) | < 0,5 | 59 (все группы риска) | ||
| Creswell et al. | 20 | 9 (1,5-18) | < 0,5 | 67 (все группы риска) | ||
| Ismail et al. | 100 | 33 (1 2-79) | < 0,5 | 73 | 45 | 11 |
| ASTRO* | 59 (все группы риска) | |||||
| Ng et al. | 187 | 39 (нет данных) | Houston** | 56 | Нет данных | 14 |
| Pisters et al. | 279 | 22 (нет данных) | ASTRO* | 59 (все группы риска) | ||
| Phoenix** | 55 (все группы риска) | |||||
| *ASTRO три последовательные повышения уровня ПСА в динамике **Houston/Phoenix повышение уровня ПСА на 2 нг/мл выше достигнутого уровня | ||||||
По данным Mohamed Ismail (2007 год) недержание мочи после СКрТ встречается у 13% больных, СНМП у 16%, боли в области промежности у 4%, эректильная дисфункция у 86%, уретро-прямокишечные свищи у 1%, острая задержка мочеиспускания у 2% пациентов [44].
В таблице 3 приведены осложнения СКрТ при местном рецидиве после ДЛТ [43].
«Спасительная» криотерапия (СКРТ) после РПЭ
Нами найдена одна статья Siddiqui S.A. от 2007 года, в которой автор описывает 15 случаев выполнения СКрТ после РПЭ. У 6 пациентов (40%) через 20 месяцев отмечено снижение уровня ПСА (группа успешной терапии). 9 пациентов (60%) имели прогрессирование заболевания (группа неудачного лечения), которая была в этом исследовании определена как повышение уровня ПСА более чем 0,1 нг/мл от достигнутого уровня [45].
С 2010 года метод криотерапии при раке предстательной железы стал доступен и в России благодаря оборудованию американской компании «Galil», поставляемому на Российский рынок компанией «Медицинские партнеры».
«Спасительная» HIFU-терапия (HIFU)
После ДЛТ
Критерии идеального пациента для «спасительной» HIFU-терапии совпадают с подобными критериями для СКрТ, но в отличие от СКрТ, выполнение HIFU не противопоказано пациентам с предшествующей ТУРПЖ. Более того, у пациентов, перенесших ТУРПЖ, объем ПЖ уменьшается (чаше всего менее 40 см3), что позволяет, используя фокусное расстояние в 4 см («Sonablate-500») подвергнуть абляции всю ткань ПЖ.
К противопоказаниям к выполнению «спасительной» HIFUтерапии следует отнести наличие кальцинатов с акустической тенью размерами более 1 см в ПЖ, а также наличие патологии со стороны прямой кишки (отсутствие прямой кишки, проктиты, трещины и т.д.).
По данным Murat F.J. и соавт. (2009 г.) анализ 167 пациентов с медианой наблюдения 18,1 месяца демонстрировал уровень отрицательных результатов биопсии предстательной железы в 73% случаев. Под прогрессий заболевания авторы понимают комбинацию критериев Phoenix с положительной биопсией ПЖ. Общая выживаемость через 5 лет составила 84%, выживаемость без прогрессии через 3 года в группе низкого риска составила 53%, среднего 42% , высокого 25% [46].
В таблице 4 представлены данные «спасительной» HIFU-терапии при местном рецидиве РПЖ.
Willam C. Huang среди осложнения после «спасительной» HIFUтерапии выделяет: задержку мочеиспускания в 10-15%, свищи в 0-16%, недержание мочи в 5%, стриктуру уретры и склероз шейки мочевого пузыря в 15% случаев [47].
Таблица 3. Осложнения Скрт после длт [43] (данные адаптировали Mouraviev и polascik)
| Автор | Год | Количество пациентов | Криосистема | эд (%) | Недержание мочи (%) | Свищи (%) | Стриктура уретры (%) | Боли в промежности (%) | ОЗМ (%) |
| Pisters et al. | 1997 | 150 | Accuprobe | 72 | 73 | 1 | Нет данных | Нет данных | 67 |
| Chin et al. | 2001 | 118 | Cryocare | Нет данных | 6,7 | 3,3 | 0 | Нет данных | 8,5 |
| Ghafar et al. | 2001 | 38 | Seednet | Нет данных | 7,9 | 0 | 0 | Нет данных | 4 |
| Han and Bellegrun | 2004 | 29 | Seednet | Нет данных | 9 | 0 | 0 | Нет данных | 3 |
| Katz et al. | 2005 | 157 | Cryocare/Seednet | Нет данных | 9,7 | 0 | 0 | 12,8 | 58/1,9 |
Таблица 4. результаты «спасительной» HIFu-терапии при местном рецидиве РПЖ после длт [47]
| Авторы | Количество пациентов | % негативных биопсий ПЖ | Период наблюдений | Выживаемость без биохимического рецидива | Определение биохимического рецидива |
| Gelet еt al. | 71 | 80 | 14,8 (мес.) | 44% | Комбинация гистологии и ПСА |
| Chaussy еt al. | 29 | 60 | 43,8 (недель) | Нет данных | Нет данных |
| Murat еt al. | 167 | 73 | 17,5 (мес.) | 37% | Надир ПСА + 2 нг/мл |
| Zacharakis еt al. | 32 | Нет данных | 3 (мес.) | 50% | Надир ПСА > 0,2 нг/мл |
| Murat еt al. | 72 | 80 | 39 (мес.) | 41% | Надир ПСА + 2 нг/мл |
| Seo еt al. | 30 | Нет данных | 12 (мес.) | 56,7% | Нет данных |
| Mallik еt al. | 68 | Нет данных | 6 (мес.) | 54,4% | ПСА > 0,5 нг/мл |
Выполнение «спасительной» HIFUтерапии после комбинированного лечения РПЖ методом брахитерапии и ДЛТ увеличивает риск развития осложнений. Так, в своей работе Ahmed H.U. и соавт. сообщают о том, что у трех из пяти пациентов в послеоперационном периоде появились уретро-прямокишечные свищи. Авторы объясняют это нарушением кровоснабжения передней стенки прямой кишки вследствие сочетания двух видов лучевой терапии и УЗ воздействия [48].
После РПЭ
Опубликовано немногочисленное количество случаев применения HIFU-терапии в качестве «спасительной» терапии после РПЭ. В литературе нами найдено лишь две статьи, посвященные лечению местного рецидива после РПЭ методом HIFU [49, 50]. В первой из них описано лечение 4-х пациентов с верифицированным при биопсии рецидивом новообразования в области везикоуретрального анастомоза. Средний предоперационный уровень ПСА составил 0,555 нг/мл (0,318-0,898), а градация по Глисону 5-7. Всем больным под спинальной анестезией были проведены сеансы HIFU на аппарате «Sonablate-500». Операция в среднем занимала 30 мин. Пациенты находились под наблюдением от 7 до 18 мес. Зарегистрировано снижение ПСА в среднем до 0,137 нг/мл (0,1020,290) у всех наблюдавшихся. Достигаемый уровень ПСА в среднем равнялся 0,054 нг/мл (0,008-0,097). Серьезных осложнений отмечено не было [49].
В другой статье также описываются 4 случая гистологически подтвержденного рецидива после РПЭ, причем 3 пациентам была проведена адъювантная дистанционная лучевая терапия. Средний уровень ПСА до операции составлял 4,3 нг/мл, объем очага поражения 4,6 см3. Всем больным в качестве «спасительного лечения» была выполнена HIFUабляция области очага рецидива РПЖ на аппарате «Sonablate-500». Средняя продолжительность операции составила 27 мин. После 2-летнего наблюдения повторная биопсия у всех пациентов показала отсутствие злокачественного роста. Осложнений во время HIFU-терапии и в послеоперационном периоде авторами не зарегистрировано [50].
В журнале «Экспериментальная и клиническая урология» (№ 2, 2010 г.) опубликовано клиническое наблюдение применения метода HIFU при местном рецидиве РПЖ после простатэктомии [51]. Через 6 мес. после операции по данным ТРУЗИ и МРТ зарегистрировано уменьшение в размерах очага рецидива и семенных пузырьков на 61% за счет развития некроза и последующего замещения соединительной тканью. Уровень ПСА в послеоперационном периоде стабилизировался на уровне, не пре вышающем 0,02 нг/мл. По данным урофлоуметрии качество мочеиспускания после HIFU существенно не изменилось, симптомов гиперактивности мочевого пузыря не выявлено. После отмены гормональной терапии аналогами ЛГРГ отмечено повышение баллов по шкале МИЭФ с 5 до 9.
Абляция резидуальных тканей в области семенных пузырьков и основания ложа предстательной железы связана с опасностью термического поражения интрамуральных отделов мочеточников в виду близости их расположения. Планирование HIFUтерапии позволяет четко локализовать зону воздействия и, что особенно важно, регулировать мощность ультразвуковой энергии. Это позволило предотвратить повреждение мочеточников при выполнении HIFU.
Представленный нами случай демонстрирует успешное применение метода HIFU у пациента с морфологически верифицированным рецидивом РПЖ.
Обсуждение и выводы
Существуют различные методы «спасительной» терапии РПЖ, которые зависят от вида выполненного ранее радикального лечения. В таблице 5 представлены сводные данные о возможности выполнения «спасительных» технологий лечения РПЖ.
После местного рецидива после РПЭ возможно выполнение ДЛТ, HIFU-терапии и криотерапии. Сравнивать эти методики пока рано, т.к. период наблюдения после «спасительных» аблятивных методов лечения небольшой. Из них наиболее используемым методом является ДЛТ, эффективность которой достигает 45-69% (5-ти летняя выживаемость без биохимического рецидива).
При местном рецидиве после РПЭ наиболее научно обоснованным является выполнении ДЛТ. На данный момент перспективными методами являются аблятивные технологии (HIFU и криоабляция).
При местном рецидиве после ДЛТ возможно выполнение СРПЭ, высокодозной брахитерапии, криоабляции и HIFU-терапии. Сравнительный анализ этих методик говорит о том, что наиболее эффективным методом является СРПЭ, при которой пятилетняя выживаемость без прогрессии составляет 47-65%. Несмотря на это, неплохие результаты получены после выполнения высокодозной брахитерапии и аблятивных методов лечения. Однако период наблюдения после этих методик составляет 3-5 лет, поэтому сравнивать полученные результаты с СРПЭ невозможно.
При местном рецидиве после ДЛТ научно обоснованным является выполнение СРПЭ. Аблятивные технологии и СВБТ являются перспективными методиками, но требуют изучения отдаленных результатов.
Таблица 5. Варианты лечения местного рецидива РПЖ
| «спасительные» технологии лечения РПЖ | вид радикального лечения РПЖ | ||||
| РПЭ | ДЛТ | Брахитерапия | Криоабляция | HiFu | |
| СРПЭ | Не найдены данные | Возможно | Возможно | Возможно | Возможно |
| СДЛТ | Возможно | Не найдены данные | Не найдены данные | Не найдены данные | Возможно |
| СВДБТ | Не найдены данные | Возможно | Возможно | Не найдены данные | Не найдены данные |
| СКрТ | Возможно | Возможно | Не найдены данные | Повторное лечение | Не найдены данные |
| «Спасительная» HIFU | Возможно | Возможно | Не найдены данные * | Не найдены данные | Повторное лечение |
| * В настоящее время происходит набор материла в НИИ урологии и в других урологических клиниках по всему миру (Северная Америка, Европа, Япония, Китай). | |||||
При местном рецидиве после перманентной брахитерапии возможно выполнение СРПЭ, СВДБТ. В литературе представлены единичные случаи подобного лечения, оценить эффективность которых на данный момент сложно. В НИИ урологии есть опыт выполнения «спасительной» HIFUтерапии с положительными результатами, в настоящее время подобные операции выполняются в ведущих мировых центрах. Однако, публикаций, доступных для статистического анализа, нами не найдено.
При местном рецидиве после перманентной брахитерапии технически возможно выполнении СРПЭ, СВДБТ и «спасительной» HIFU-терапии. Требуется накопление опыта и изучение отдаленных результатов.
При местном рецидиве после криоабляции возможно выполнение СРПЭ и повторное выполнение процедуры. Авторы публикаций не выделяют в отдельную категорию пациентов, подвергшихся повторной процедуре, поэтому анализ ее результативности невозможен. Имеются лишь публикации и о единичных случаях выполнения СРПЭ, по которым сложно оценить эффективность данного метода.
При местном рецидиве после криотерапии технически возможно выполнение СРПЭ и повторное выполнение процедуры. Требуется накопление опыта и изучение отдаленных результатов.
При местном рецидиве РПЖ после HIFU-терапии наиболее часто используется повторное выполнение процедуры. Многие авторы отмечают, что одним из преимуществ выполнения HIFU-терапии является возможность ее повторного произведения. Имеется одна публикация использования СДЛТ с 5-летней безрецидивной выживаемостью равной 64%. Также есть публикация о единичных случаях выполнения СРПЭ после HIFU-терапии.
При местном рецидиве после HIFU-терапии обоснованным является повторное выполнение процедуры.
Ключевые слова: рак предстательной железы, местный рецидив, «спасительные» операции, дистанционная лучевая терапия, HIFU-терапия, криотерапия.
Keywords: prostate cancer, local recurrence, salvage beam therapy, salvage radical prostatectomy, salvage high dose brachytherapy, salvage cryotherapy.
Литература
- Анализ уронефрологической заболеваемости в Российской Федерации по данным официальной статистики / Аполихин О.И., Сивков А.В., Бешлиев Д.А., Солнцева Т.В., Комарова В.А. // Экспериментальная и клиническая урология. №1. 2010
- Пушкарь Д.Ю., Говоров А.В., Бормотин А.В. Простат-специфический антиген и биопсия предстательной железы. М. 2003. 160 с.
- Алексеев. Б. Я., Калпинский А. С. Роль простатоспецифического антигена в диагностике рака предстательной железы // Российский онкологический журнал: научно-практический журнал. 2007. № 6. С. 43-46.
- Итоги Московской программы «Диспансеризация мужского населения по выявлению заболеваний предстательной железы / Максимов А.А., Прохоров А.В., Борисик В.И., Рябой А.В., Евсеев А.В. // Материалы XI Съезда Российского общества урологов. М. 2007. С. 183-184.
- Ранняя диагностика и лечение больных локализованным раком простаты / Журавлев В.Н., Баженов И.В., Зырянов А.В., Коган О.С., Вахлов С.Г., Борзунов И.В., Качмазов А.А., Машковцев А.В. // Материалы XI Съезда Российского общества урологов. М. 2007. С. 153-154.
- Management of prostate-specific antigen relapse in prostate cancer: a European Consensus /Boccon-Gibod L., Djavan W.B., Hammerer P., Hoeltl W., Kattan M.W., PrayerGaletti T., Teillac P., Tunn U.W. // Int J Clin Pract. 2004. Vol. 58, №4. P. 382-390.
- Moul J.W. Prostate specific antigen only progression of prostate cancer // J Urol. 2000. Vol. 163. № 6. P. 1632-1642.
- Defining biochemical recurrence of prostate cancer after radical prostatectomy: a proposal for a standardized definition / Stephenson A.J., Kattan M.W., Eastham J. A., Dotan Z.A., Bianco Jr. F.J., Lilja H., Scardino P.T. // J Clin Oncol. 2006. Vol. 24. № 24. P. 39733978.
- Guidelines on Prostate Cancer / Heidenreich A., Bolla M., Joniau S., Mason M.D., Matveev V., Mottet N., Schmid H-P., van der Kwast T.H., Wiegel T., Zattoni F. 2010.
- American Society for Therapeutic Radiology and Oncology Consensus Panel. Consensus statement: guidelines for PSA following radiation therapy // Int J Radiat Oncol Biol Phys. 1997. Vol. 37. № 5. P. 1035-1041.
- Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix consensus conference. / Roach III M., Hanks G., Thames Jr H., Schelhammer P., Shipley W.U., Sokol G.E., Sandler H. // Int J Radiat Oncol Biol Phys. 2006. Vol. 65. № 4. P. 965-974.
- Aus G. Current status of HIFU and cryotherapy in prostate cancer a review // Eur Urol. 2006. Vol. 50. № 5. P. 927-934.
- Long-term biochemical disease-free and cancerspecific survival following anatomic radical retropubic prostatectomy. The 15-year Johns Hopkins experience / Han M., Partin A.W., Pound C.R., Epstein J.I., Walsh P.C.// Urol Clin North Am. 2001. Vol.28. № 3. P. 555-565.
- Biochemical disease-free survival in men younger than 60 years with prostate cancer treated with external beam radiation / Rosser C.J., Chichakli R., Levy L.B., Kuban D.A., Smith L.G., Pisters L.L. // J Urol. 2002. Vol. 168. № 2. P. 536-541.
- Definitions of biochemical failure that best predict clinical failure in patients with prostate cancer treated with external beam radiation alone: a multi-institutional pooled / Horwitz E.M., Thames H.D., Kuban D.A., Levy L.B., Kupelian P.A., Martinez A.A., Michalski J.M., Pisansky T.M., Sandler H.M., Shipley WU., Zelefsky M.J., Hanks G.E., Zietman A.L. // J Urol. 2005. Vol. 173. № 3. P. 797-802.
- The relationship of ultrasensitive measurements of prostate-specific antigen levels to prostate cancer recurrence after radical prostatectomy / Taylor J. III, Koff S.G., Dauser D.A., McLeod D.G. // BJU Int. 2006. Vol. 98. № 3. P. 540-543.
- Recommendations for Post-Prostatectomy Radiation Therapy in the United States Before and After the Presentation of Randomized Trials. /Hoffman K.E., Nguyen P.L., Chen M.H., Chen R.C., Choueiri T.K., Hu J.C., Kuban D.A., D’Amico A.V. // J Urol. 2010. Vol. 184.
- Management of prostate-specific antigen relapse in prostate cancer: a European Consensus /Boccon-Gibod L., Djavan W.B., hammerer P., Hoeltl W., Kattan M.W., PrayerGaletti T., Teillac P., Tunn U.W. // Int J Clin Pract. 2004. Vol. 58. № 4. P. 382-390.
- Consensus statements on radiation therapy of prostate cancer: guidelines for prostate re-biopsy after radiation and for radiation therapy with rising prostate-specific antigen levels after radical prostatectomy. American Society for Therapeutic Radiology and Oncology Consensus Panel / Cox J.D., Gallagher M.J., Hammond E.H., Kaplan R.S., Schellhammer P.F. // J Clin Oncol. 1999. Vol. 17. № 4. P. 1155-1163.
- Vaidya A., Soloway M.S. Salvage radical prostatectomy for radiorecurrent prostate cancer: morbidity revisited //J Urol. 2000. Vol. 164. № 6. P. 1998-2001.
- Shekarriz B., Upadhyay J., Pontes J.E. Salvage radical prostatectomy // Urol Clin North Am. 2001. Vol. 28. № 3. P. 545-553.
- Eastham J.A., DiBlasio C.J., Scardino P.T. Salvage radical prostatectomy for recurrence of prostate cancer radiation therapy // Curr Urol Rep. 2003. Vol. 4. № 3. P. 211-215.
- The efficacy of postprostatectomy radiotherapy in patients with an isolated elevation of serum prostate-specific antigen /Wu J.J., King S.C., Montana G.S., McKinstry C.A., Anscher M.S. // Int J Radiat Oncol Biol Phys. 1995. Vol. 32. № 2. P. 317-323.
- The use of radiotherapy or patients with isolated elevation of prostate specific antigen following radical prostatectomy / Schild S.E., Buskirk S.J., Wong W.W., Halyard M.Y., Swanson S.K., Novicki D.E., Ferrigni R.G. // J Urol. 1996. Vol. 156. № 5. P. 1725-1729.
- Therapeutic irradiation for patients with an elevated postprostatectomy prostate specific antigen level /Forman J.D., Meetze K., Pontes E., Wood D.P., Shamsa F., Rana T., Porter A.T. // J Urol. 1997. Vol. 158. № 4. P. 1436-1439.
- Radiotherapy after radical prostatectomy: treatment outcomes and failure patterns / Nudell D.M., Grossfeld G.D., Weinberg V.K., Roach M. 3rd, Carroll P.R. // Urology. 1999. Vol. 54. № 6. P. 1049-1057.
- Salvage radiotherapy for men with isolated rising PSA or local palpable recurrence after radical prostatectomy: do outcomes differ? / MacDonald O.K., Schild S.E., Vora S., Andrews P.E., Ferrigni R.G., Novicki V., Swanson S.K., Wong W.W. // Urology. 2004. Vol.64. № 4. P. 760-764.
- Predominant treatrment failure in postprostatectomy patients is local: analysis of patterns of treatment failure in SWOG 8794. / Swanson G.P., Hussey M.A., Tangen C.M., Chin J., Messing E., Canby-Hagino E., Forman J.D., Thompson I.M., Crawford E.D. // J Clin Oncol. 2007. Vol. 25. № 6. P. 222-229.
- Predicting outcome of salvage radiation therapy for recurrent prostate cancer after radical prostatectomy. /Stephenson A.J., Scardino P.T., Kattan M.W., Pisansky T.M., Slawin K.M., Klein E.A., Anscher M.S., Michalski J.M., Sandler H.M., Lin D.W., Forman J.D., Zelefsky M.J., Kestin L.L., Roehrborn C.G., Catton C.N., DeWeese T.L., Liauw S.L., Valicenti R.K., Kuban D.A., Pollack A. // J Clin Oncol. 2007. Vol. 25. № 15. P. 2035-2041.
- Limited suppression of prostate specific antigen after salvage radiotherapy for its isolated elevation after radical prostatectomy. / Egewa S., Matsumoto K., Suyama K., Soh S., Kuwao S., Iwamura M. // Urology. 1999. Vol. 53. № 1. P. 148-155.
- Salvage radiotherapy after high-intensity focused ultrasound for localized prostate cancer: early clinical results / Pasticier G., Chapet O., Badet L., Ardiet J.M., Poissonnier L., Murat F.J., Martin X., Gelet A. // Urology. 2008. Vol. 72. № 6. P. 1305-1309.
- Salvage surgery for radiorecurrent prostate cancer: contemporary outcomes / Ward J.F., Sebo T.J., Blute M.L., Zincke H. // J Urol. 2005. Vol. 173. № 4. P. 1156-1160.
- Long-term oncologic results of salvage radical prostatectomy for locally recurrent prostate cancer after radiotherapy. /. Bianco F.J. Jr., Scardino P.T., Stephenson A.J., Diblasio C.J., Fearn P. A., Eastham J.A. // Int J Radiat Oncol Biol Phys. 2005. Vol. 62. № 2. P. 448453.
- Stephenson A.J., Eastha J.A. Role of salvage radical prostatectomy for recurrent prostate cancer after radiation therapy // J Clin Oncology. 2005. Vol 23. № 3210. P. 8198-8203.
- Impact of prior prostate radiation on complications after radicalpProstatectomy / Gotto G.T., Yuis L.H., Vora K., Eastham J.A., Scardino P.T., Rabbani F. // J Urol. 2010. Vol. 184. № 1. P. 136-142.
- Treatment of patients after failed high intensity focused ultrasound and radiotherapy for localized prostate cancer: salvage laparoscopic extraperitoneal radical prostatectomy / Liatsikos E., Bynens B., Rabenalt R., Kallidonis P., Do M., Stolzenburg J.U. // J Endourol. 2008. Vol. 22. № 10. P. 2295-2298.
- Grampsas S.A., Miller G.J., Crawford E.D. Salvage radical prostatectomy after failed transperineal cryotherapy: histologic findings from prostate whole-mount specimens correlated with intraoperative transrectal ultrasound images // Urology. 1995. Vol. 45. № 6. P. 936-941.
- Beyer D.C. Salvage brachytherapy after external-beam irradiation for prostate cancer // Oncology . 2004. Vol.18. № 2. P. 151-158.
- Salvage brachytherapy for localized prostate cancer after radiotherapy failure / Grado G.L., Collins J.M., Kriegshauser J.S., Balch C.S., Grado M.M., Swanson G.P., Larson T.R., Wilkes M.M., Navickis R.J. // Urology. 1999. Vol. 53. № 1. P. 2-10.
- Lee H.K., Adams M.T., Motta J. Richmond salvage prostate brachytherapy for localized prostate cancer failure after external beam radiation therapy // Brachytherapy. 2008. Vol. 7. № 1. P. 17-21.
- Long-term outcome and toxicity of salvage brachytherapy for local failure after initial radiotherapy for prostate cancer. / Burri R.J., Stone N.N., Unger P., Stock R.G. // Int J Radiat Oncol Biol Phys. 2010. Vol. 77. № 5. P. 1338-1344.
- Feasibility of high-dose-rate brachytherapy salvage for local prostate cancer recurrence after radiotherapy: The University of California-San Francisco experience / Lee B., Shinohara K., Weinberg V., Gottschalk A.R., Pouliot J., Roach M. 3rd, Hsu I.C. // Int J Radiat Oncol Biol Phys. Vol. 7. № 4. P. 1106-1112.
- Best practice statement on cryosurgery for the treatment of localized prostate cancer / Babaian R. J., Donnelly B., Bahn D., Baust J. G, Dineen M., Ellis D., Katz A., Pisters L., Rukstalis D., Shinohara K., Thrasher J. B. // J Urol 2008. Vol. 180. P. 1993-2004.
- Salvage cryotherapy for recurrent prostate cancer after radiation failure: a prospective case series of the first 100 patients / Ismail M, Ahmed S, Kastner C, Davies J. // BJU Int. 2007. Vol. 100. № 4. P. 760-764.
- Langenhuijsen J.F., Broers E.M., Vergunst H. Cryosurgery for Prostate Cancer: an Update on Clinical Results of Modern Cryotechnology // Eur Urol. 2009. Vol. 55. № 1. P. 52-55.
- Mid-term results demonstrate salvage high-intensity focused ultrasound (HIFU) as an effective and acceptably morbid salvage treatment option for locally radiorecurrent prostate cancer / Murat F.J., Poissonnier L., Rabilloud M., Belot A., Bouvier R., Rouviere O., Chapelon J.Y., Gelet A. // Eur Urol. 2009. Vol. 55. № 3. P. 640-647.
- Huang W.C. Minimally ablative therapies for salvage treatment following radiation therapy //Minimally Invasive Ablative Treatment of Prostate Cancer. June 25-26. 2010. New York, NY.
- Rectal fistulae after salvage high-intensity focused ultrasound for recurrent prostate cancer after combined brachytherapy and external beam radiotherapy / Ahmed H.U., Ishaq A., Zacharakis E., Shaw G., Illing R., Allen C., Kirkham A., Emberton M. // BJU Int. 2009. Vol. 103. № 3. P. 321-323.
- Hayashi M., Shinmei S., Asano K. Transrectal high-intensity focused ultrasound for treatment for patients with biochemical failure after radical prostatectomy // Int J Urol. 2007. Vol. 14. № 11. P. 1048-1050.
- Salvage high-intensity focused ultrasound for biopsy-confirmed local recurrence of prostate cancer after radical prostatectomy. / / Murota-Kawano A., Nakano M., Hongo S., Shoji S., Nagata Y., Uchida T. / BJU Int. 2010. Vol. 105. № 12. P. 1642-1645.
- HIFU-терапия местного рецидива рака предстательной железы после простатэктомии / Сивков А.В., Кудрявцев Ю.В., Кешишев Н.Г., Шадеркин И.А., Щербинин С.Н. // Экспериментальная и клиническая урология. 2010. № 2. С. 68-71.
| Прикрепленный файл | Размер |
|---|---|
| Статья в формате PDF | 322.45 кб |
Побочные эффекты лучевой терапии
Лучевая терапия эффективно лечит многие виды рака. Но, как и другие методы лечения рака, он часто вызывает побочные эффекты. Каждый человек испытывает разные побочные эффекты. Побочные эффекты зависят от типа рака, его локализации, дозы лучевой терапии, вашего общего состояния здоровья и других факторов. Важно поговорить со своим лечащим врачом о любых побочных эффектах, которые вы испытываете, чтобы они могли найти способы помочь вам.
Почему лучевая терапия вызывает побочные эффекты?
Высокие дозы лучевой терапии используются для уничтожения раковых клеток.Побочные эффекты возникают в результате повреждения здоровых клеток и тканей вблизи области лечения.
За последние годы в лучевой терапии были достигнуты значительные успехи в исследованиях, которые сделали ее более точной. Это уменьшило побочные эффекты этого лечения по сравнению с методами лучевой терапии, которые использовались в прошлом.
Некоторые люди испытывают незначительные побочные эффекты от лучевой терапии. Или даже нет. Другие люди испытывают более серьезные побочные эффекты.
Реакция на лучевую терапию часто начинается на второй или третьей неделе лечения.Или они могут длиться несколько недель после последнего лечения. Некоторые побочные эффекты могут быть долгосрочными. Поговорите со своей терапевтической бригадой о том, чего ожидать.
Есть ли варианты предотвращения или лечения этих побочных эффектов?
Да. Ваша медицинская бригада может помочь вам предотвратить или облегчить многие побочные эффекты. Предотвращение и лечение побочных эффектов — важная часть общего лечения рака. Это называется паллиативной или поддерживающей терапией.
Перед началом лечения спросите, какие побочные эффекты вероятны от конкретного типа лечения, которое вы получаете, и когда они могут произойти.А во время и после лечения регулярно сообщайте своему лечащему врачу, как вы себя чувствуете.
Каковы общие побочные эффекты лучевой терапии?
Лучевая терапия называется местным лечением. Это означает, что он влияет только на целевую область тела. Например, лучевая терапия кожи головы может вызвать выпадение волос. Но люди, которым лучевая терапия воздействует на другие части тела, обычно не теряют волосы на голове.
Общие физические побочные эффекты лучевой терапии включают:
Скин изменения. Некоторые люди, получающие лучевую терапию, испытывают сухость, зуд, образование волдырей или шелушение. Эти побочные эффекты зависят от того, какая часть тела подверглась лучевой терапии и других факторов. Изменения кожи после лучевой терапии обычно проходят через несколько недель после окончания лечения. Если повреждение кожи становится серьезной проблемой, ваш врач может изменить ваш план лечения. Лосьон может помочь при изменениях кожи, но не забудьте узнать у медсестры или другого медицинского работника, какой крем они рекомендуют и когда его наносить.Также лучше всего защищать пораженную кожу от солнца. Узнайте больше о побочных эффектах, связанных с кожей.
Усталость. Усталость — это термин, используемый для описания ощущения усталости или истощения почти все время. Многие пациенты испытывают утомляемость. Уровень вашей усталости часто зависит от вашего плана лечения. Например, лучевая терапия в сочетании с химиотерапией может привести к повышенной утомляемости. Научитесь справляться с усталостью.
Долгосрочные побочные эффекты. Большинство побочных эффектов проходят после лечения.Но некоторые продолжают, возвращаются или развиваются позже. Это называется долгосрочными или поздними эффектами. Один из возможных поздних эффектов — развитие второго рака. Это новый тип рака, который развивается из-за первоначального лечения рака. Риск этого позднего эффекта невелик. И риск часто меньше, чем польза от лечения первого рака.
Каковы местные побочные эффекты лучевой терапии?
Некоторые побочные эффекты зависят от типа и места воздействия лучевой терапии на теле.
Голова и шея. Лучевая терапия, направленная на голову или шею человека, может вызвать следующие побочные эффекты:
Узнайте больше о здоровье зубов во время лечения рака и о том, как справляться с проблемами питания при лечении головы и шеи.
Сундук. Лучевая терапия, направленная на грудную клетку, может вызвать следующие побочные эффекты:
Затруднения при глотании
Одышка
Болезненность груди или сосков
Жесткость плеча
Кашель, жар и ощущение полноты в груди, известные как лучевой пневмонит.Это происходит между 2 неделями и 6 месяцами после лучевой терапии.
Лучевой фиброз, вызывающий стойкие рубцы легких в результате нелеченого лучевого пневмонита. Онколог-радиолог знает, как снизить риск фиброза.
Желудок и брюшная полость. Лучевая терапия, направленная на живот или живот, может вызвать следующие побочные эффекты:
Потеря аппетита
Тошнота и рвота
Спазмы кишечника
Жидкий стул или диарея
Эти симптомы, скорее всего, исчезнут после лечения.Во время лечения ваш врач может назначить лекарство для лечения этих побочных эффектов. Внесение изменений в свой рацион также может уменьшить симптомы. Может быть полезно поговорить с диетологом-онкологом.
Таз. Лучевая терапия, направленная на таз, может вызвать следующие побочные эффекты:
Жидкий стул или диарея
Ректальное кровотечение
Недержание, когда человек не может контролировать свой мочевой пузырь
Раздражение мочевого пузыря
Сексуальные проблемы у мужчин, такие как эректильная дисфункция, то есть невозможность получить или поддерживать эрекцию
Пониженное количество сперматозоидов и снижение активности сперматозоидов.Это может произойти в результате лучевой терапии яичек (семенников) или предстательной железы. Это может повлиять на вашу способность иметь детей. Узнайте о способах сохранения фертильности у мужчин.
Изменения в менструации, например прекращение менструации
Симптомы менопаузы, такие как вагинальный зуд, жжение, сухость и другие изменения сексуального здоровья женщин
Если оба яичника проходят лучевую терапию, у вас может возникнуть бесплодие.Узнайте о способах сохранения фертильности у женщин.
Что такое отзыв радиации?
Радиационный отзыв — это сыпь, похожая на сильный солнечный ожог. Это редко и происходит, когда определенные виды химиотерапии назначаются во время или вскоре после дистанционной лучевой терапии.
Сыпь появляется на части тела, подвергшейся облучению. Симптомы могут включать покраснение, болезненность, отек, влажные язвы и шелушение кожи.
Обычно эти побочные эффекты начинаются в течение нескольких дней или недель после лучевой терапии.Но они также могут появиться спустя месяцы или годы. Врачи лечат радиационный синдром с помощью лекарств, называемых кортикостероидами. В редких случаях может потребоваться подождать, пока кожа не заживет, прежде чем продолжить химиотерапию.
Как справиться с побочными эффектами лучевой терапии
У всех разный опыт лучевой терапии. Побочные эффекты варьируются от человека к человеку, даже если они получают один и тот же тип лечения. Перед лечением спросите свою медицинскую бригаду, какие физические побочные эффекты возможны и на что обращать внимание.Также могут быть эмоциональные побочные эффекты, поэтому важно обратиться за психологической поддержкой, которая поможет справиться с тревогой или стрессом.
Спросите у своего лечащего врача, как позаботиться о себе в период лечения, включая достаточный отдых, хорошее питание и поддержание водного баланса. Спросите, есть ли какие-либо ограничения на ваш регулярный график тренировок или других физических нагрузок.
И продолжайте разговаривать с командой на протяжении всего лечения. Всегда сообщайте своему лечащему врачу, когда побочные эффекты впервые появляются, усиливаются или продолжаются, несмотря на лечение.Это позволит вашей медицинской бригаде найти способы помочь вам почувствовать себя лучше во время и после лечения.
Вопросы, которые следует задать бригаде здравоохранения
Какие физические побочные эффекты могут быть связаны с моим планом лечения лучевой терапией? Когда они, вероятно, начнутся?
Как можно предотвратить или контролировать эти побочные эффекты?
Как мне позаботиться о пораженной коже во время лечения?
Кому я могу сообщить, когда появляется или усиливается побочный эффект?
Есть ли особые побочные эффекты, о которых я должен немедленно сообщить врачу?
С кем я могу поговорить, если я чувствую беспокойство или расстроен из-за этого лечения?
Если у меня возникают побочные эффекты, влияющие на мое питание, можете ли вы порекомендовать диетолога-онколога?
Как еще я могу позаботиться о себе во время лечения?
Существуют ли какие-либо ограничения на упражнения или другую физическую активность во время этого лечения?
Может ли это лечение повлиять на мою сексуальную жизнь? Если да, то как и как долго?
Может ли это лечение повлиять на мою способность забеременеть или иметь ребенка? Если да, следует ли мне поговорить со специалистом по фертильности до начала лечения рака?
Каковы потенциальные долгосрочные эффекты этого вида лучевой терапии?
Если я беспокоюсь об управлении финансовыми расходами на лечение рака, кто может мне помочь?
Потребуются ли особые меры предосторожности для защиты моей семьи и других людей от радиационного облучения в период моего лечения?
Каким будет мой план последующего лечения после завершения лучевой терапии?
Почему последующее наблюдение важно для устранения побочных эффектов лечения?
Связанные ресурсы
Общие сведения о лучевой терапии
Чего ожидать при лучевой терапии
Страх побочных эффектов, связанных с лечением
Протонная терапия
Дополнительная информация
Национальный институт рака: побочные эффекты лучевой терапии
Чего ожидать при лучевой терапии
Это нормально — чувствовать беспокойство или подавленность, когда вы узнаете, что вам понадобится лучевая терапия.Однако, узнав больше об этом типе лечения рака, вы сможете почувствовать себя более подготовленным и комфортным. Информация в этой статье может помочь вам подготовиться к первому лечению.
Кто входит в мою бригаду лучевой терапии?
Высококвалифицированная медицинская бригада будет работать вместе, чтобы предоставить вам наилучшее лечение. В эту команду могут входить следующие специалисты в области здравоохранения:
Врач-радиолог. Врач этого типа специализируется на проведении лучевой терапии для лечения рака.Онколог-радиолог наблюдает за лучевой терапией. Они работают в тесном сотрудничестве с другими членами команды, чтобы разработать план лечения.
Медсестра отделения радиационной онкологии. Эта медсестра специализируется на уходе за людьми, получающими лучевую терапию. Медсестра отделения радиационной онкологии играет множество ролей, в том числе:
Ответы на вопросы о лечении
Наблюдение за своим здоровьем во время лечения
Помогает справиться с побочными эффектами лечения
Медицинский физик-радиолог. Этот специалист помогает разрабатывать планы лечения. Они эксперты в использовании радиационного оборудования.
Дозиметрист. Дозиметрист помогает вашему онкологу-радиологу рассчитать правильную дозу облучения.
Лучевой терапевт или технолог лучевой терапии. Этот профессионал управляет лечебными аппаратами и проводит запланированные процедуры.
Прочие специалисты в области здравоохранения. Дополнительные члены бригады могут помочь удовлетворить физические, эмоциональные и социальные потребности во время лучевой терапии.В число этих специалистов входят:
Социальные работники
Диетологи или диетологи
Реабилитационные терапевты, такие как физиотерапевты или логопеды
Стоматологи
Узнайте больше о онкологической бригаде.
Что происходит до лечения лучевой терапией?
Каждый план лечения создается для удовлетворения индивидуальных потребностей пациента, но есть несколько общих шагов.Вы можете ожидать этих шагов до начала лечения:
Встреча с вашим онкологом-радиологом. Врач просмотрит вашу медицинскую карту, проведет медицинский осмотр и порекомендует анализы. Вы также узнаете о потенциальных рисках и преимуществах лучевой терапии. Это прекрасное время, чтобы задать любые вопросы или поделиться опасениями, которые могут у вас возникнуть.
Выдача разрешения на лучевую терапию. Если вы решите пройти лучевую терапию, ваша медицинская бригада попросит вас подписать форму «информированного согласия».Под подписью документа подразумевается:
Ваша команда предоставила вам информацию о вариантах лечения.
Вы выбрали лучевую терапию.
Вы даете разрешение медицинским работникам на проведение лечения.
Вы понимаете, что лечение не гарантирует ожидаемых результатов.
Моделирование и планирование лечения. Ваш первый сеанс лучевой терапии — это симуляция.Это означает, что это тренировка без лучевой терапии. Ваша команда будет использовать сканирование изображений, чтобы определить местоположение опухоли. Сюда могут входить:
В зависимости от обрабатываемой области на коже могут появиться небольшие отметины. Это поможет вашей команде направить луч излучения на опухоль.
Вы также можете быть оснащены иммобилизирующим устройством. Это может включать использование:
Лента
Пенные губки
Подголовники
Формы
Гипсовые слепки
Эти предметы помогут вам оставаться в одном и том же положении на протяжении всего лечения.
Для лучевой терапии головы или шеи вам может быть надета термопластическая маска. Это сетчатая маска, которая прикрепляется к лицу и прикрепляется к столу. Он мягко удерживает вашу голову на месте.
Важно, чтобы ваше тело находилось в одном и том же положении во время каждой процедуры. Ваша бригада радиационной онкологии заботится о вашем комфорте. Поговорите с командой, чтобы найти удобное положение, в котором вы можете находиться каждый раз, когда придете на лучевую терапию. Скажите им, если вы испытываете беспокойство, лежа в неподвижном состоянии с иммобилизирующим устройством.Ваш врач может прописать вам лекарство, которое поможет вам расслабиться.
После моделирования на вашем первом сеансе ваша бригада лучевой терапии изучит вашу информацию и разработает план лечения. Компьютерное программное обеспечение помогает команде разработать план.
Что происходит во время лучевой терапии?
То, что происходит во время вашего лечения лучевой терапией, зависит от вида лучевой терапии, которую вы получаете.
Внешняя лучевая терапия
Внешняя лучевая терапия — это облучение от аппарата за пределами тела.Это наиболее распространенное лечение рака с помощью лучевой терапии.
Каждое занятие быстрое, длится около 15 минут. При попадании в тело радиация не причиняет боль, не жалит и не обжигает. Во время процедуры вы будете слышать щелчки или жужжание, а также может ощущаться запах от аппарата. Обычно люди проходят сеансы лечения 5 раз в неделю с понедельника по пятницу. Этот график обычно длится от 3 до 9 недель, в зависимости от вашего личного плана лечения.
Этот вид лучевой терапии направлен только на опухоль.Но это повлияет на некоторые здоровые ткани, окружающие опухоль. Хотя большинство людей не чувствуют боли при проведении каждого сеанса лечения, эффекты лечения постепенно нарастают и могут включать дискомфорт, изменения кожи или другие побочные эффекты, в зависимости от того, на какой части тела проводится лечение. Двухдневный перерыв в лечении каждую неделю дает вашему организму время на восстановление этого повреждения. Некоторые эффекты могут не исчезнуть до завершения периода лечения. Сообщите медицинским работникам, если вы испытываете побочные эффекты.Узнайте больше о побочных эффектах лучевой терапии.
Внутренняя лучевая терапия
Внутренняя лучевая терапия также называется брахитерапией. Это включает как временное, так и постоянное размещение радиоактивных источников на месте опухоли.
Как правило, вам будут проходить повторные сеансы лечения через несколько дней и недель. Эти процедуры могут потребовать кратковременного пребывания в больнице. Вам может потребоваться анестезия, чтобы заблокировать осознание боли, пока радиоактивные источники находятся в теле.Большинство людей не чувствуют дискомфорта во время этого лечения. Но некоторые могут испытывать слабость или тошноту от наркоза.
Вам нужно будет принять меры для защиты других от радиационного облучения. Эти инструкции предоставит ваша бригада лучевой терапии. Необходимость в таких мерах предосторожности отпадает, когда:
Еженедельные отчеты
Во время лечения ваш онколог-радиолог проверит, насколько хорошо оно работает. Обычно это происходит не реже одного раза в неделю. При необходимости они могут скорректировать ваш план лечения.
Личная гигиена
Многие люди во время лучевой терапии испытывают усталость, чувствительность кожи в месте облучения и эмоциональный стресс. Во время лучевой терапии важно отдыхать и заботиться о себе. Рассмотрите следующие способы ухода за собой:
Узнайте больше о копинге во время лечения. И обязательно поговорите со своим лечащим врачом о том, как вы себя чувствуете на протяжении всего периода лечения.
Что происходит после окончания лучевой терапии?
По окончании лечения вам предстоит повторный прием к онкологу-радиологу.Важно продолжить последующее наблюдение, которое включает:
Проверяю на рекавери
Наблюдение за побочными эффектами лечения, которые могут произойти не сразу
По мере заживления вашего тела вам потребуется меньше последующих посещений. Попросите вашего врача записать ваше лечение. Это полезный ресурс при управлении долгосрочным медицинским обслуживанием.
Вопросы, которые следует задать бригаде здравоохранения
Кто составляет мой план лечения лучевой терапией? Как часто будет пересматриваться план?
К каким медицинским работникам я буду встречаться на каждом сеансе лечения?
Не могли бы вы описать, на что будет похожа моя первая сессия или симуляция?
Потребуются ли мне какие-либо анализы или сканирование перед началом лечения?
Будет ли моя кожа отмечена при планировании лечения?
С кем я могу поговорить, если я чувствую беспокойство или расстроен из-за этого лечения?
Сколько времени длится каждый сеанс лечения? Как часто я буду проходить лучевую терапию?
Могу ли я приводить кого-нибудь с собой на каждое занятие?
Существуют ли специальные услуги для пациентов, получающих лучевую терапию, такие как определенные парковочные места или тарифы на парковку?
С кем мне следует поговорить о любых побочных эффектах, которые я испытываю?
Какие лосьоны вы рекомендуете при кожных побочных эффектах? Когда мне его применять?
Как еще я могу позаботиться о себе во время лечения?
Потребуются ли особые меры предосторожности для защиты моей семьи и других людей от радиационного облучения в период моего лечения?
Каков будет мой график последующего наблюдения?
Связанные ресурсы
Общие сведения о лучевой терапии
Побочные эффекты лучевой терапии
Планы ASCO по лечению рака и выживанию
Дополнительная информация
RTA ответов.org: Чего ожидать
Секвенирование химиотерапии и лучевой терапии после консервативных операций по поводу рака груди на ранней стадии
Фон: Пациенты с раком молочной железы на ранней стадии, подверженные значительному риску системных метастазов, все чаще получают терапию, сохраняющую грудь, и адъювантную химиотерапию. Однако оптимальная последовательность химиотерапии и лучевой терапии не ясна.
Методы: Двести сорок четыре пациента с раком груди I или II стадии, которые подвергались значительному риску отдаленных метастазов, были случайным образом распределены для прохождения 12-недельного курса химиотерапии до или после лучевой терапии. Всем была сделана операция по сохранению груди. Средняя продолжительность наблюдения за выжившими пациентами составила 58 месяцев (от 10 до 124).
Полученные результаты: Пятилетние актуарные показатели рецидивов рака в любом месте и отдаленных метастазов в группе, получавшей первую лучевую терапию, и группе, получавшей первую химиотерапию, составили 38 процентов и 31 процент (P = 0.17) и 36 процентов и 25 процентов (P = 0,05) соответственно. Общая выживаемость составила 73% и 81% (P = 0,11) соответственно. Пятилетняя приблизительная частота первых рецидивов в зависимости от места в группах сначала лучевой терапии и первой химиотерапии, соответственно, составляла 5 процентов и 14 процентов для местных рецидивов и 32 процентов и 20 процентов для отдаленных или региональных рецидивов или того и другого. Это различие в характере рецидивов имело пограничную статистическую значимость (P = 0,07).
Выводы: Это исследование предполагает, что для пациентов с высоким риском системных метастазов предпочтительнее провести 12-недельный курс химиотерапии с последующей лучевой терапией, чем лучевую терапию с последующей химиотерапией.
Лучевая терапия немелкоклеточного рака легкого
Лучевая терапия использует высокоэнергетические лучи или частицы для уничтожения раковых клеток.
В зависимости от стадии немелкоклеточного рака легкого (НМРЛ) и других факторов может использоваться лучевая терапия:
- В качестве основного лечения (иногда вместе с химиотерапией), особенно если опухоль легкого не может быть удалена из-за ее размера или местоположения, если человек недостаточно здоров для операции или если человек не хочет операции .
- После операции (отдельно или вместе с химиотерапией), чтобы попытаться убить любые небольшие раковые участки, которые могла быть пропущена операцией.
- Перед операцией (обычно вместе с химиотерапией), чтобы попытаться уменьшить опухоль легкого, чтобы облегчить операцию.
- Для лечения рака, распространившегося на другие области, такие как мозг или кости.
- Для облегчения (облегчения) симптомов распространенного НМРЛ, таких как боль, кровотечение, проблемы с глотанием, кашель или проблемы, вызванные распространением на другие органы, такие как мозг.
Виды лучевой терапии, применяемые при НМРЛ
Для лечения НМРЛ можно использовать различные виды лучевой терапии. Есть 2 основных типа:
- Наружная лучевая терапия
- Брахитерапия (внутренняя лучевая терапия)
Внешняя лучевая терапия
Внешняя лучевая лучевая терапия (ДЛТ) фокусирует излучение извне тела на опухоль. Этот вид лучевой терапии чаще всего используется для лечения НМРЛ или его распространения на другие органы.
Лечение очень похоже на рентген, но доза облучения выше. Сама процедура безболезненна, и каждая процедура длится всего несколько минут. Чаще всего лучевая терапия легких проводится 5 дней в неделю в течение 5-7 недель, но это может варьироваться в зависимости от типа ДЛТ и причины, по которой она проводится.
Было показано, что новые методы EBRT помогают врачам более точно лечить рак легких, снижая при этом радиационное воздействие на близлежащие здоровые ткани.Это включает:
- Стереотаксическая лучевая терапия тела (SBRT) , также известная как стереотаксическая абляционная лучевая терапия (SABR) , чаще всего используется для лечения рака легких на ранней стадии, когда операция невозможна из-за состояния здоровья человека или у людей, которые не хочу операции. Его также можно рассмотреть для опухолей, которые ограниченно распространились на другие части тела, такие как мозг или надпочечники.
Вместо того, чтобы давать небольшую дозу радиации каждый день в течение нескольких недель, SBRT использует очень сфокусированные пучки высокой дозы радиации, вводимые при меньшем количестве (обычно от 1 до 5) процедур.На опухоль под разными углами направлено несколько лучей. Чтобы точно нацелить излучение, вас помещают в специально разработанную раму для каждого сеанса лечения. Это уменьшает подвижность опухоли легкого во время дыхания.
- Трехмерная конформная лучевая терапия (3D-CRT) использует специальные компьютеры для точного определения местоположения опухоли. Затем формируются лучи излучения, которые направляются на опухоль (опухоли) с нескольких направлений, что снижает вероятность повреждения нормальных тканей.
- Лучевая терапия с модуляцией интенсивности (IMRT) — это форма 3D-терапии. Наряду с формированием лучей и направлением их на опухоль под несколькими углами, сила лучей может регулироваться, чтобы ограничить дозу, достигаемую близлежащими нормальными тканями. Этот метод используется чаще всего, если опухоли находятся рядом с важными структурами, такими как спинной мозг.
Вариант IMRT называется объемно-модулированная дуговая терапия (VMAT) . В нем используется машина, которая быстро доставляет излучение, когда она один раз вращается вокруг тела.Это позволяет проводить каждую процедуру всего за несколько минут.
- Стереотаксическая радиохирургия (SRS) на самом деле не операция, а тип стереотаксической лучевой терапии, которая проводится только за один сеанс. Иногда его можно использовать вместо или вместе с хирургическим вмешательством при единичных опухолях, распространившихся на головной мозг. В одной из версий этого лечения аппарат фокусирует около 200 лучей радиации на опухоль под разными углами в течение от нескольких минут до часов. Ваша голова удерживается в том же положении с помощью жесткого каркаса.В другой версии линейный ускоритель (машина, создающая излучение), управляемый компьютером, перемещается вокруг вашей головы, доставляя излучение к опухоли под разными углами. При необходимости эти процедуры можно повторить.
Для более подробного описания этих процедур см. Внешняя лучевая терапия.
Брахитерапия (внутренняя лучевая терапия)
У людей с НМРЛ иногда используется брахитерапия для уменьшения опухолей в дыхательных путях и облегчения симптомов.
Врач помещает небольшой источник радиоактивного материала (часто в виде маленьких гранул) непосредственно в раковый участок или в дыхательные пути рядом с раком. Обычно это делается с помощью бронхоскопа, но это также может быть сделано во время операции. Излучение распространяется только на небольшое расстояние от источника, ограничивая воздействие на окружающие здоровые ткани. Источник излучения обычно удаляется через короткое время. Реже маленькие радиоактивные «семена» остаются на месте навсегда, и радиация ослабевает в течение нескольких недель.
Возможные побочные эффекты лучевой терапии NSCLC
Если вы собираетесь пройти лучевую терапию, важно спросить своего врача о возможных побочных эффектах, чтобы вы знали, чего ожидать. Общие побочные эффекты зависят от того, куда направлено излучение, и могут включать:
- Усталость
- Тошнота и рвота
- Потеря аппетита и похудание
- Кожные изменения в обрабатываемой области, которые могут варьироваться от легкого покраснения до волдырей и шелушения
- Выпадение волос при попадании излучения на тело
Часто они проходят после лечения.Когда лучевая терапия проводится вместе с химиотерапией, побочные эффекты могут быть хуже.
Лучевая терапия грудной клетки может повредить ваши легкие и вызвать кашель, проблемы с дыханием и одышку. Обычно они улучшаются после окончания лечения, хотя иногда они могут не исчезнуть полностью.
Ваш пищевод, расположенный посередине грудной клетки, может подвергнуться воздействию радиации, что может вызвать боль в горле и проблемы с глотанием во время лечения. Это может затруднить употребление чего-либо, кроме мягкой пищи или жидкости, на какое-то время.Это также часто улучшается после завершения лечения.
Лучевая терапия больших участков мозга иногда может вызвать потерю памяти, головные боли или проблемы с мышлением. Обычно эти симптомы незначительны по сравнению с симптомами, вызванными раком, распространившимся на мозг, но они могут повлиять на качество вашей жизни.
Побочные эффекты лучевой терапии
Очень важно помнить, что каждый человек по-разному реагирует на лечение. Любой побочный эффект, который у вас может возникнуть, зависит от типа и локализации рака, дозы облучения и вашего общего состояния здоровья.У некоторых людей мало или совсем нет побочных эффектов, у других их довольно много.
Как долго длятся побочные эффекты?
Помните, что тип побочных эффектов радиации, которые могут возникнуть у вас, зависит от предписанной дозы и режима приема. Большинство побочных эффектов проходят в течение нескольких месяцев после прекращения лечения. Некоторые побочные эффекты могут продолжаться после окончания лечения, поскольку здоровым клеткам требуется время, чтобы оправиться от радиации.
Побочные эффекты могут ограничивать вашу способность делать некоторые вещи.Что вы можете сделать, будет зависеть от того, как вы себя чувствуете. Некоторые пациенты могут ходить на работу или развлекаться во время лучевой терапии. Другие считают, что им нужно больше отдыха, чем обычно, и они не могут этого делать. Если у вас есть неприятные побочные эффекты, влияющие на вашу повседневную деятельность или здоровье, врач может на время прекратить лечение, изменить график или изменить тип лечения, которое вы получаете. Сообщите своей онкологической бригаде о любых побочных эффектах, которые вы замечаете, чтобы они могли помочь вам с ними.
Ранние и поздние эффекты лучевой терапии
- Ранние побочные эффекты возникают во время или вскоре после лечения. Эти побочные эффекты обычно кратковременны, легки и поддаются лечению. Обычно они исчезают в течение нескольких недель после окончания лечения. Наиболее частыми ранними побочными эффектами являются утомляемость (чувство усталости) и изменения кожи. Другие ранние побочные эффекты обычно связаны с обрабатываемой областью, например, выпадение волос и проблемы со ртом, когда лучевая терапия проводится в этой области.
- Поздние побочные эффекты могут развиться через месяцы или даже годы. Они могут возникать в любой нормальной ткани тела, подвергшейся облучению. Риск поздних побочных эффектов зависит от обрабатываемой области, а также от использованной дозы облучения. Тщательное планирование лечения может помочь избежать серьезных долгосрочных побочных эффектов. Всегда лучше поговорить со своим онкологом-радиологом о риске долгосрочных побочных эффектов.
Радиозащитные препараты для уменьшения побочных эффектов
Одним из способов уменьшения побочных эффектов является использование радиозащитных препаратов, но они используются только для определенных типов излучения, воздействующего на определенные части тела.Эти препараты назначают перед лучевой терапией, чтобы защитить определенные нормальные ткани в области лечения. Сегодня наиболее часто используется амифостин. Этот препарат можно использовать у людей с раком головы и шеи, чтобы уменьшить проблемы со ртом, вызванные лучевой терапией.
Не все врачи согласны с тем, как эти препараты следует использовать в лучевой терапии. У этих препаратов также есть свои побочные эффекты, поэтому убедитесь, что вы понимаете, на что обращать внимание.
Общие общие побочные эффекты лучевой терапии
Усталость
Усталость — это чувство усталости физически, умственно и эмоционально.Это очень распространено у людей, больных раком, и часто случается при лучевой терапии. Большинство людей начинают чувствовать усталость после нескольких недель лучевой терапии. Это происходит потому, что лучевая терапия разрушает некоторые здоровые клетки, а также раковые клетки. По мере продолжения лечения усталость обычно усиливается. Стресс из-за болезни и ежедневные поездки на лечение могут усугубить усталость. Снижение утомляемости — важная часть лечения.
Усталость, ощущаемая во время лучевой терапии, отличается от усталости в повседневной жизни, и она может не улучшиться после отдыха.Это может длиться долго и мешать вашим обычным занятиям. Но обычно это проходит со временем после окончания лечения.
Только вы знаете, есть ли у вас усталость и насколько она сильна. Никакие лабораторные анализы или рентген не могут диагностировать или описать ваш уровень усталости. Лучшим показателем утомляемости является ваш собственный отчет перед онкологической бригадой. Вы можете описать свой уровень усталости как нулевой, легкий, умеренный или тяжелый. Или вы можете использовать шкалу от 0 до 10, где 0 означает отсутствие усталости, а 10 означает худшую усталость, которую вы можете себе представить.
В любом случае важно описать свою усталость врачам-онкологам. Обязательно поговорите с ними, если:
- Ваша усталость не проходит, возвращается или усиливается.
- Вы устали больше, чем обычно, во время или после занятия.
- Вы чувствуете усталость, и это не связано с тем, что вы сделали.
- Вы сбиты с толку или не можете сосредоточить свои мысли.
- Вы не можете вставать с постели более 24 часов.
- Ваша усталость мешает вашей общественной жизни или распорядку дня.
Если вам нужно отдохнуть на работе, поговорите со своим работодателем.
Проблемы с кожей
Ваша кожа в зоне лучевой терапии может выглядеть красной, раздраженной, опухшей, покрытой волдырями, солнечными ожогами или загаром. Через несколько недель ваша кожа может стать сухой, шелушащейся, зудящей или шелушиться. Иногда это называют лучевым дерматитом. Важно сообщать вашим специалистам по лечению рака о любых изменениях кожи.Они могут посоветовать способы облегчить дискомфорт, уменьшить дальнейшее раздражение и предотвратить заражение.
Эти проблемы обычно проходят постепенно после окончания лечения. Однако в некоторых случаях обработанная кожа остается более темной и может быть более чувствительной, чем была раньше.
Вы должны бережно относиться к своей коже. Вот несколько способов сделать это:
- Не надевайте тесную, грубую или жесткую одежду поверх зоны обработки. . Сюда входят все тугие или эластичные предметы, сжимающие эту область.Вместо этого носите свободную одежду из мягкой гладкой ткани. Не крахмаливайте одежду.
- Не трите, не трите, не царапайте и не используйте липкую ленту для обработки обработанной кожи. Если ваша кожа должна быть покрыта или перевязана, используйте бумажную ленту или другую ленту для чувствительной кожи. Старайтесь размещать ленту за пределами обрабатываемой области и не кладите ленту каждый раз в одно и то же место.
- Не кладите тепло или холод (например, грелку, лампу или пакет со льдом) на обрабатываемую зону , предварительно не посоветовавшись со своей онкологической бригадой.Даже горячая вода может повредить кожу, поэтому для мытья обработанного участка используйте только теплую воду.
- Защищать обработанный участок от солнца . Ваша кожа может быть очень чувствительной к солнечному свету. Если возможно, перед выходом на улицу накройте обработанную кожу темной одеждой или одеждой, защищающей от ультрафиолета. Спросите у своей бригады по лечению рака, следует ли вам использовать солнцезащитный крем. В таком случае используйте солнцезащитный крем широкого спектра действия с фактором защиты от солнца (SPF) не менее 30. Часто наносите солнцезащитный крем. Продолжайте защищать кожу от солнечного света даже после окончания лучевой терапии.
- Используйте только теплую воду и мягкое мыло. Просто дайте воде стечь по обработанному участку. Не тереть. Также будьте осторожны, чтобы не стереть чернильные пятна, необходимые для лучевой терапии, пока она не будет завершена.
- Проконсультируйтесь со своей бригадой по лечению рака, прежде чем брить обработанный участок. Они могут порекомендовать вам использовать электробритву.
- Спросите своего лечащего врача, прежде чем наносить что-либо на кожу в зоне лечения. Сюда входят порошки, кремы, духи, дезодоранты, масла для тела, мази, лосьоны, средства для удаления волос или домашние средства во время лечения и в течение нескольких недель после него.Многие продукты для кожи могут оставлять на коже налет, который может вызвать раздражение, а некоторые могут даже повлиять на дозу радиации, попадающую в организм.
Выпадение волос
Лучевая терапия может вызвать истончение или выпадение волос в обрабатываемой области. Например, облучение головы может привести к потере некоторых или всех волос на голове (даже бровей и ресниц), но если вы обработаете бедро, вы не потеряете волосы на голове.
Большинство людей обнаруживают, что их волосы снова отрастают после окончания лечения, но с их выпадением бывает трудно справиться.Когда они снова отрастут, ваши волосы могут стать тоньше или иметь другую текстуру, чем были раньше. Если у вас есть какие-либо вопросы или опасения по поводу выпадения волос, обратитесь к врачу-онкологу.
Если вы все же потеряете волосы, ваша кожа головы может стать нежной, и вам, возможно, захочется прикрыть голову. Надевайте шляпу или шарф, чтобы защитить голову, когда вы находитесь на солнце. Если вы предпочитаете парик или шиньон, убедитесь, что подкладка не раздражает кожу головы. Ваш местный офис Американского онкологического общества может помочь вам получить парики или головные уборы.
Низкие показатели крови
В редких случаях лучевая терапия может вызвать изменения в ваших показателях крови. Эти клетки крови помогают вашему организму бороться с инфекцией и предотвращают кровотечение. Если ваши анализы крови показывают низкие показатели крови, ваше лечение может быть прекращено на неделю или около того, чтобы показатели крови вернулись к норме. Этот побочный эффект более вероятен, если вы также получаете химиотерапию.
Специфические побочные эффекты лучевой терапии, поражающие части тела
Если вы получаете лучевую терапию головного мозга
Людям с опухолями головного мозга часто проводят стереотаксическую радиохирургию (облучение одной большой дозой), если рак поражен только в одном или нескольких участках головного мозга.Побочные эффекты зависят от того, куда направлено излучение. Некоторые побочные эффекты могут проявиться быстро, но другие могут проявиться не раньше, чем через 1–2 года после лечения. Поговорите со своим онкологом-радиологом о том, на что обращать внимание и когда звонить врачу.
Если рак поражает многие участки, иногда облучением обрабатывают весь мозг. Побочные эффекты лучевой терапии всего мозга могут быть незаметны в течение нескольких недель после начала лечения.
Облучение головного мозга может вызвать следующие краткосрочные побочные эффекты:
- Головные боли
- Выпадение волос
- Тошнота
- Рвота
- Сильная усталость (утомляемость)
- Потеря слуха
- Изменения кожи и волосистой части головы
- Проблемы с памятью и речью
- Изъятия
Некоторые из этих побочных эффектов могут возникать из-за того, что радиация вызывает опухание мозга.Обычно назначают лекарства, чтобы предотвратить отек мозга, но важно, чтобы ваша бригада по лечению рака знала о головных болях или любых других симптомах. Лечение может повлиять на каждого человека по-разному, и у вас может не быть этих конкретных побочных эффектов.
Облучение мозга также может иметь побочные эффекты, которые проявляются позже — обычно от 6 месяцев до многих лет после окончания лечения. Эти отсроченные эффекты могут включать серьезные проблемы, такие как потеря памяти, симптомы инсульта и плохое функционирование мозга.У вас также может быть повышенный риск возникновения другой опухоли в этой области, хотя это нечасто.
Поговорите со своей командой по лечению рака о том, чего ожидать от вашего конкретного плана лечения.
Если вы получаете лучевую терапию головы или шеи
Люди, получившие радиацию в голову и шею, могут иметь такие побочные эффекты, как:
- Болезненность (или даже открытые язвы) во рту или горле
- Сухость во рту
- Проблемы с глотанием
- Изменения вкуса
- Тошнота
- Болит в ушах
- Кариес зуба
- Отек десен, горла или шеи
- Выпадение волос
- Изменения текстуры кожи
- Жесткость челюсти
Как ухаживать за полостью рта во время лечения
Если вы получили лучевую терапию на голову или шею, вам нужно хорошо заботиться о своих зубах, деснах, рте и горле.Вот несколько советов, которые могут помочь вам справиться с проблемами рта:
- Избегайте острой и грубой пищи, такой как сырые овощи, сухие крекеры и орехи.
- Не ешьте и не пейте очень горячую или очень холодную пищу или напитки.
- Не курите, не жуйте табак и не употребляйте алкоголь — они могут усугубить язвы во рту.
- Держитесь подальше от сладких закусок.
- Попросите свою врачебную бригаду порекомендовать хорошую жидкость для полоскания рта. Спирт в некоторых жидкостях для полоскания рта может сушить и раздражать ткани рта.
- При необходимости полощите рот теплой солью и содовой каждые 1-2 часа. (Используйте 1 чайную ложку соли и 1 чайную ложку пищевой соды на 1 литр воды.)
- Часто пейте прохладные напитки в течение дня.
- Съешьте конфеты без сахара или жевательную резинку, чтобы сохранить влажность во рту.
- Смочите пищу подливкой и соусом, чтобы облегчить ее употребление.
- Спросите у своей онкологической бригады о лекарствах, которые помогают вылечить язвы во рту и уменьшить боль во время еды.
Если этих мер недостаточно, обратитесь за советом к своему лечащему врачу. Сухость во рту может быть проблемой даже после окончания лечения. Если да, поговорите со своей командой о том, что вы можете сделать.
Как ухаживать за зубами во время лечения
Лучевая терапия головы и шеи может повысить вероятность образования кариеса. Это особенно актуально, если в результате лечения у вас возникла сухость во рту.
Перед началом облучения поговорите со своей бригадой по лечению рака о том, следует ли вам пройти полное обследование у стоматолога.Попросите стоматолога поговорить с врачом-радиологом перед началом лечения. Если у вас есть один или несколько проблемных зубов, стоматолог может предложить удалить их перед началом лечения. Радиация (и сухость во рту) могут повредить их до такой степени, что их все равно придется удалять, а это может быть труднее сделать после начала лечения.
Если вы носите зубные протезы, они могут перестать подходить из-за опухших десен. Если на зубных протезах появляются язвы, возможно, вам придется прекратить их носить до тех пор, пока не будет проведена лучевая терапия, чтобы язвы не заразились.
Ваш стоматолог может захотеть увидеть вас во время лучевой терапии, чтобы проверить ваши зубы, поговорить с вами об уходе за полостью рта и зубов и помочь вам справиться с любыми проблемами. Скорее всего, вам скажут:
- Чистите зубы и десны очень мягкой щеткой после еды и хотя бы один раз в день.
- Используйте зубную пасту с фтором, не содержащую абразивов.
- После чистки зубов хорошо прополощите рот прохладной водой или раствором пищевой соды.(Используйте 1 чайную ложку пищевой соды на 1 литр воды.)
- Если вы обычно пользуетесь зубной нитью, спросите своего стоматолога или специалистов по лечению рака, можно ли это во время лечения. Сообщите своей бригаде по лечению рака, если это вызывает кровотечение или другие проблемы.
Если вы получаете лучевую терапию груди
Излучение груди может повлиять на ваше сердце или легкие, а также вызвать другие побочные эффекты.
Краткосрочные побочные эффекты
Облучение груди может вызвать:
- Раздражение, сухость и изменение цвета кожи
- Болезненность груди
- Набухание груди из-за скопления жидкости (лимфедема)
Во избежание раздражения кожи вокруг груди женщинам следует по возможности стараться не носить бюстгальтер.Если это невозможно, наденьте бюстгальтер из мягкого хлопка без косточек.
Если вы чувствуете скованность в плечах, спросите у своего лечащего врача, какие упражнения позволят вашему плечу свободно двигаться.
Болезненность груди, изменение цвета и скопление жидкости (лимфедема), скорее всего, исчезнут через месяц или два после окончания лучевой терапии. Если накопление жидкости по-прежнему остается проблемой, спросите свою команду по лечению рака, какие шаги вы можете предпринять. См. «Лимфедема» для получения дополнительной информации.
Долговременные изменения груди
Лучевая терапия может вызвать долговременные изменения груди.Ваша кожа может быть немного темнее, а поры — крупнее и заметнее. Кожа может быть более или менее чувствительной и ощущаться более толстой и упругой, чем была до лечения. Иногда размер груди меняется — она может стать больше из-за скопления жидкости или меньше из-за рубцовой ткани. Эти побочные эффекты могут длиться долго после лечения.
Примерно через год у вас не должно быть никаких новых изменений. Если вы заметили изменения в размере, форме, внешнем виде или текстуре груди по прошествии этого времени, немедленно сообщите об этом своей бригаде по лечению рака.
Менее частые побочные эффекты в близлежащих областях
Радиация груди может поражать органы грудной клетки, в том числе сердце и легкие, хотя и бывает редко. Сегодня это не так распространено, как в прошлом, потому что современное оборудование для лучевой терапии позволяет врачам лучше фокусировать лучи излучения на области, пораженной раком, с меньшим воздействием на другие области.
Переломы ребер: В редких случаях лучевая терапия может ослабить ребра, что может привести к перелому.Убедитесь, что вы понимаете, на что обращать внимание, и сообщите об этом своей бригаде по лечению рака, если заметите какой-либо из этих побочных эффектов.
Сердечные осложнения: Облучение груди также может повлиять на сердце. Это может вызвать затвердение артерий (что может повысить вероятность сердечного приступа в дальнейшем), повреждение сердечного клапана или нерегулярное сердцебиение.
Поражение легких (лучевой пневмонит): Попадание облучения в грудь иногда может вызвать воспаление легких, которое называется лучевой пневмонит .См. Более подробную информацию в разделе «Если вы получаете лучевую терапию в грудную клетку» ниже.
Повреждение нервов плеча и руки: Радиация груди иногда может повредить некоторые нервы руки. Это называется плечевой плексопатией и может привести к онемению, покалыванию, боли и слабости в плече, руке и кисти.
Побочные эффекты брахитерапии
Если ваше лечение включает брахитерапию (внутренние радиационные имплантаты), вы можете заметить болезненность груди, стянутость, покраснение и синяки.У вас также могут быть те же побочные эффекты, что и при внешнем лучевом лечении. Сообщите своей команде по лечению рака о любых проблемах, которые вы заметили.
Если вы получаете лучевую терапию грудной клетки
Лучевая терапия грудной клетки может вызвать такие побочные эффекты, как:
- Боль в горле
- Проблемы с глотанием
- Потеря аппетита
- Кашель
- Одышка
Радиация также может вызывать другие проблемы с сердцем или легкими.
Осложнения сердца
Попадание радиации в среднюю часть грудной клетки может повысить риск сердечных заболеваний. Этот риск возрастает с увеличением доз облучения и увеличением площади обрабатываемых участков в этой части тела. Радиация также может вызвать затвердение артерий (что может повысить вероятность сердечного приступа в дальнейшем), повреждение сердечного клапана или нерегулярное сердцебиение.
Лучевой пневмонит
Лучевой пневмонит — это воспаление легких, которое может быть вызвано лучевой терапией грудной клетки (или, реже, груди).Это может произойти примерно через 3-6 месяцев после лучевой терапии. Это более вероятно, если у вас есть другие заболевания легких, такие как эмфизема (которая включает постепенное повреждение легочной ткани). Общие симптомы лучевого пневмонита включают:
- Одышка, которая обычно усиливается при физической нагрузке
- Боль в груди, которая часто усиливается при глубоком вдохе
- Кашель
- Мокрота с розовым оттенком
- Субфебрильная температура
- Слабость
Иногда симптомы отсутствуют, и на рентгенограмме грудной клетки обнаруживают лучевую пневмонию.
Симптомы часто проходят сами по себе, но если лечение необходимо, оно основано на попытке уменьшить воспаление. Обычно используются стероиды, такие как преднизон. После лечения большинство людей выздоравливает без каких-либо длительных эффектов. Но если он не исчезнет, это может привести к фиброзу легких (усилению жесткости или рубцеванию легких). Когда это происходит, легкие больше не могут полностью надуваться и всасывать воздух.
Убедитесь, что вы понимаете, на что обращать внимание, и сообщите об этом своей команде по лечению рака, если вы заметите какие-либо из этих побочных эффектов.
Если вы получаете лучевую терапию живота (живота)
Если вы получаете облучение желудка или какой-либо части живота (живота), у вас могут возникнуть такие побочные эффекты, как:
- Тошнота
- Рвота
- Спазмы живота
- Диарея
- Запор
Употребление определенных продуктов или отказ от них может помочь с некоторыми из этих проблем, поэтому планирование диеты является важной частью лучевой терапии желудка или брюшной полости.Спросите свою команду по лечению рака о том, чего вы можете ожидать и какие лекарства вам следует принимать, чтобы облегчить эти проблемы. Проконсультируйтесь со своей онкологической бригадой о любых домашних или безрецептурных лекарствах, которые вы собираетесь использовать.
Эти проблемы должны исчезнуть после окончания лечения.
Управление тошнотой
Некоторые люди испытывают тошноту в течение нескольких часов сразу после лучевой терапии. Если у вас есть эта проблема, постарайтесь не есть в течение нескольких часов до и после лечения.Лучше перенести лечение натощак. Если проблема не исчезнет, спросите свою команду по лечению рака о лекарствах, которые помогут предотвратить и лечить тошноту. Обязательно принимайте лекарство точно так, как вам велено.
Если вы заметили тошноту перед лечением, попробуйте съесть что-нибудь легкое, например тосты или крекеры, и постарайтесь как можно больше расслабиться. См. Раздел «Тошнота и рвота», чтобы получить советы, как помочь при расстройстве желудка, и узнать больше о том, как управлять этими побочными эффектами.
Управление диареей
У многих людей в какой-то момент после начала лучевой терапии живота возникает диарея.Ваша команда по лечению рака может прописать вам лекарства или дать вам особые инструкции по решению этой проблемы. Также могут быть рекомендованы изменения диеты, например:
- Попробуйте придерживаться чистой жидкой диеты (вода, некрепкий чай, яблочный сок, персиковый нектар, прозрачный бульон, фруктовое мороженое и простой желатин), как только начнется диарея или когда вы почувствуете, что она вот-вот начнется.
- Не ешьте продукты с высоким содержанием клетчатки, которые могут вызвать газы или спазмы, например сырые фрукты и овощи, бобы, капусту, цельнозерновой хлеб и крупы, сладости и острую пищу.
- Ешьте часто, небольшими порциями.
- Не пейте молоко и не ешьте молочные продукты, если они раздражают кишечник.
- Когда диарея начнет уменьшаться, попробуйте есть небольшое количество продуктов с низким содержанием клетчатки, таких как рис, бананы, яблочное пюре, йогурт, картофельное пюре, нежирный творог и сухие тосты.
- Убедитесь, что вы получаете достаточно калия (его можно найти в бананах, картофеле, бобах, персиках и многих других продуктах). Это важный минерал, который вы можете потерять из-за диареи.
Если вы проходите лучевую терапию таза
Лучевая терапия таза (например, для лечения рака мочевого пузыря, яичников или простаты) может вызывать такие побочные эффекты, как:
- Проблемы с мочевым пузырем
- Проблемы с фертильностью
- Изменения в вашей сексуальной жизни
У вас могут быть те же проблемы, которые возникают у людей в результате облучения брюшной полости, например тошнота, рвота, диарея или запор.
Проблемы с мочевым пузырем
Облучение таза может вызвать проблемы с мочеиспусканием, в том числе:
- Боль или жжение
- Проблемы с мочеиспусканием
- Кровь в моче
- Частые позывы к мочеиспусканию
Большинство этих проблем со временем проходят, но лучевая терапия также может вызывать долгосрочные побочные эффекты:
- Лучевой цистит. Если радиация повреждает слизистую оболочку мочевого пузыря, лучевой цистит может быть долговременной проблемой, вызывающей кровь в моче или боль при мочеиспускании.
- Недержание мочи. Лучевая терапия некоторых видов рака, таких как рак простаты и мочевого пузыря, может привести к тому, что вы не сможете контролировать свою мочу или у вас будет подтекание или подтекание. Существуют разные типы и степени недержания мочи, но они поддаются лечению. Даже если недержание мочи нельзя вылечить полностью, все равно можно помочь. См. Раздел Недержание мочевого пузыря и кишечника, чтобы узнать больше. Этот побочный эффект чаще всего является проблемой для мужчин, получающих лечение от рака простаты, но некоторая информация может быть полезна и женщинам, страдающим недержанием мочи, связанным с лечением.
- Свищи. В редких случаях радиация может вызвать образование отверстия, называемого свищом , между органами в тазу, например, между влагалищем и мочевым пузырем или между мочевым пузырем и прямой кишкой. Их можно исправить хирургическим путем.
Как это может повлиять на рождаемость
Для женщин: Поговорите со своей бригадой по лечению рака о том, как радиация может повлиять на вашу фертильность (способность иметь ребенка). Лучше сделать это до начала лечения , чтобы вы знали о возможных рисках для вашей фертильности.
В зависимости от дозы облучения у женщин, получающих лучевую терапию в области малого таза, иногда прекращаются менструации и появляются другие симптомы менопаузы. Сообщите об этих симптомах своему онкологическому врачу и спросите их, как облегчить эти побочные эффекты. Иногда менструальные периоды возвращаются после окончания лучевой терапии, а иногда — нет.
См. «Фертильность и женщины с раком», чтобы узнать больше.
Для мужчин: Лучевая терапия области, включающей яички, может уменьшить как количество сперматозоидов, так и их способность функционировать.Если вы хотите стать отцом ребенка в будущем и беспокоитесь о снижении фертильности, поговорите со своей бригадой по лечению рака до начала лечения . Одним из вариантов может быть заблаговременное хранение вашей спермы.
См. «Фертильность и мужчины с раком», чтобы узнать больше.
Как это может повлиять на секс
При некоторых видах лучевой терапии, затрагивающей таз и / или половые органы, мужчины и женщины могут замечать изменения в своей способности получать удовольствие от секса или снижение уровня их желания.
Для женщин: Во время лучевой терапии таза некоторым женщинам запрещают заниматься сексом. Некоторым женщинам секс может показаться болезненным. Лечение также может вызвать зуд, жжение и сухость влагалища. Скорее всего, вы сможете заняться сексом в течение нескольких недель после окончания лечения, но сначала посоветуйтесь с врачом. Некоторые виды лечения могут иметь долгосрочные последствия, например, рубцовая ткань, которая может повлиять на способность влагалища растягиваться во время секса. Опять же, ваша команда по лечению рака может предложить способы помочь, если с вами такое случится.Вы также можете получить дополнительную информацию в разделе «Секс и женщины с раком».
Для мужчин: Радиация может повлиять на нервы, которые позволяют мужчине иметь эрекцию. Если проблемы с эрекцией все же возникают, они обычно постепенные, в течение многих месяцев или лет. Поговорите со своим врачом о вариантах лечения, если это вас беспокоит. Дополнительную информацию можно найти в разделе «Секс и мужчины с раком».
Если вы проходите внутреннюю лучевую терапию с использованием семенных имплантатов, узнайте у своей онкологической бригады о мерах предосторожности во время секса
Подробнее о побочных эффектах
Для получения дополнительной информации о побочных эффектах, упомянутых здесь, и о том, как с ними бороться, см. «Управление побочными эффектами, связанными с раком».
.

 Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.
Пациент ощущает симптомы цистита, так называемого лучевого цистита, редко в моче появляется немного крови. Лечение предусматривает использование обезболивающих средств и спазмолитиков. При присоединении инфекции врач прописывает антибиотики. Если облученная простата сильно набухает, то для мочеиспускания может временно потребоваться катетер.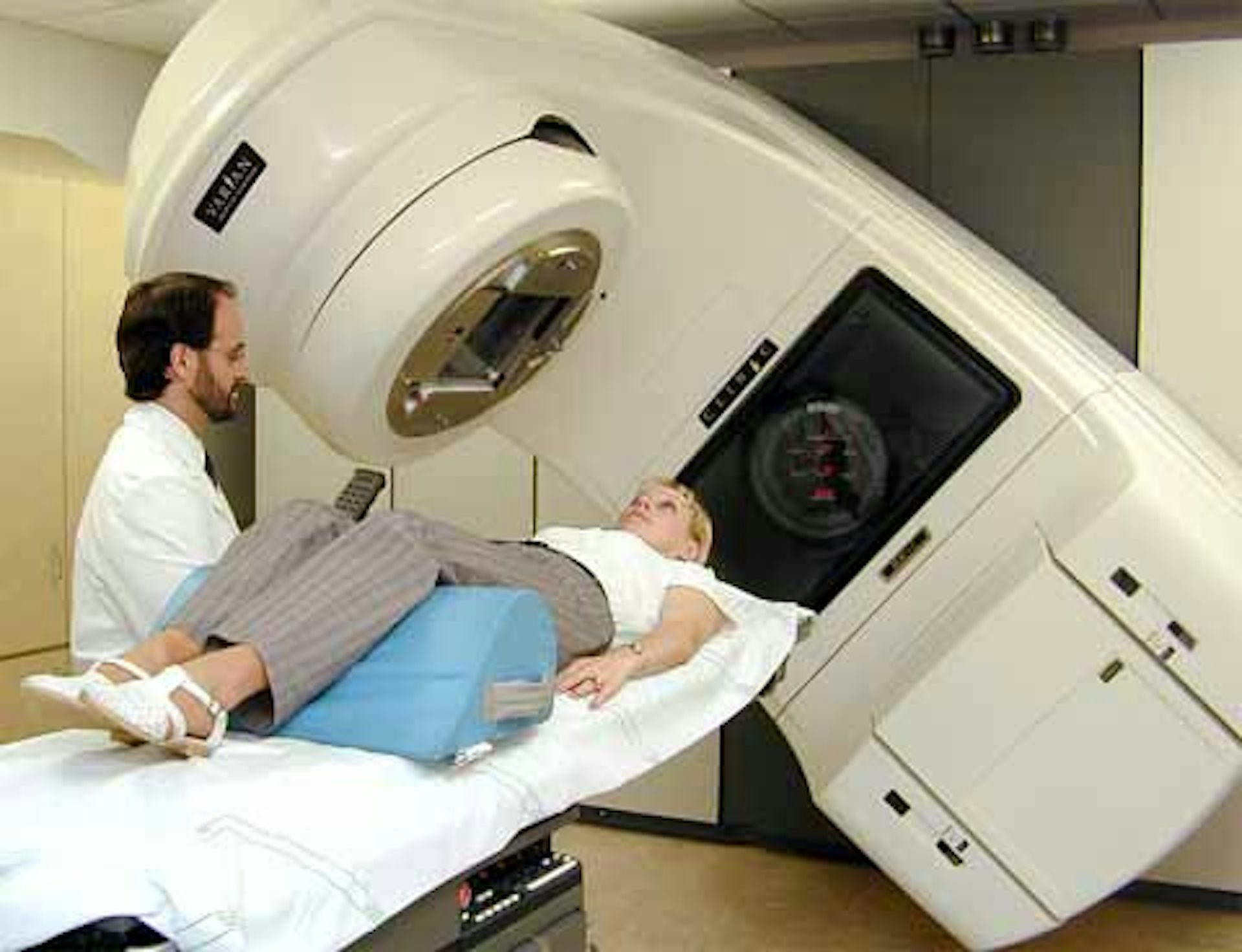 Облучение проводится без наркоза, ни сердце ни другие органы не испытывают дополнительной нагрузки, поэтому внешнее облучение, как и внутреннее (брахитерапия), показана пациентам находящимся в группе риска.
Облучение проводится без наркоза, ни сердце ни другие органы не испытывают дополнительной нагрузки, поэтому внешнее облучение, как и внутреннее (брахитерапия), показана пациентам находящимся в группе риска.