Стафилококковая инфекция
«Стафилококк» — это сокращенное название распространенной бактерии, которая называется «золотистый стафилококк». Бактерии стафилококка часто присутствуют на коже, не вызывая инфекции. Инфекция развивается, если они проникают под кожу. Это вызывает покраснение, болезненную чувствительность, отекание и иногда жидкие выделения.
МРЗС означает «метициллин-резистентный золотистый стафилококк» («Methicillin-Resistant Staph Aureus») В отличие от обычной стафилококковой инфекции, бактерии МРЗС устойчивы к воздействию обычных антибиотиков (antibiotics) и сложнее поддаются лечению. Кроме того, бактерии МРЗС более токсичны, чем обычные бактерии стафилококка. Они могут быстро распространяться в организме и вызывать опасное для жизни заболевание.
МРЗС передается при непосредственном физическом контакте с бактериями. МРЗС также передается через предметы, зараженные человеком, являющимся носителем бактерий, такие как повязки, полотенца, постельное белье или спортивный инвентарь.
При подозрении на инфекцию МРЗС врач может сделать посев выделений из раны (wound culture) для подтверждения диагноза. При наличии абсцесса он может быть дренирован. Вероятно, вам будет назначен один или несколько антибиотиков, которые действуют на МРЗС.
Уход в домашних условиях
Принимайте антибиотики в точном соответствии с назначением. Даже если вы почувствовали себя лучше, не прекращайте принимать их, пока они не закончатся, или до тех пор, пока не получите указание прекратить их прием от своего лечащего врача.
Если вам была назначена мазь с антибиотиком, применяйте ее в соответствии с полученными указаниями.
В течение 5 дней ежедневно мойте все тело (от волосистой части головы до пальцев ног) специальным мылом.
 Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.Раны должны быть закрыты чистыми и сухими повязками. Если повязки загрязнились, их необходимо заменить. Каждый раз, когда вы меняете повязку или касаетесь раны, тщательно мойте руки.
Если у вас наращенные ногти или лак на ногтях, их необходимо снять.
Лечение членов семьи
Если у вас диагностировано возможное заражение инфекцией МЗРМ, ваши близкие, живущие вместе с вами, подвержены более высокому риску наличия бактерий на коже или в носу, даже при отсутствии признаков инфекции. Бактерии необходимо удалить с кожи всех членов семьи одновременно, чтобы они не передавались от одного к другому. Проинструктируйте их, как следует удалить бактерии:
Члены семьи должны использовать специальное мыло, как описано выше.
Если у кого-либо из членов семьи имеется кожная инфекция, ее должен лечить врач. Чтобы вылечить инфекцию МРЗС, мытья не достаточно.

Очистите столешницы и детские игрушки.
Каждый член семьи должен пользоваться только своими предметами личного обихода, такими как зубные щетки или бритвенные станки. При этом пользоваться общими очками, тарелками и столовыми приборами разрешается.
Предотвращение распространения инфекции.
Часто мойте руки простым мылом и теплой водой. Обязательно очищайте зоны под ногтями, между пальцами и запястья. Вытирайте руки одноразовыми полотенцами (например, бумажными). Если нет возможности воспользоваться мылом и водой, можно использовать антисептик для рук на основе спирта. Втирайте антисептик по всей поверхности рук, пальцев и запястий до полного высыхания.
Не пользуйтесь чужими предметами личного обихода, такими как полотенца, бритвенные станки, одежда или униформа. Стирайте постельное белье, полотенца и одежду в горячей воде со стиральным порошком. Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.

Если вы посещаете тренажерный зал, до и после каждого применения протирайте инвентарь антисептиком на основе спирта. Также протирайте все ручки и места, за которые беретесь руками.
Если вы занимаетесь спортом, после каждой тренировки принимайте душ с обычным мылом. Каждый раз после душа используйте чистое полотенце.
Последующее наблюдение
Приходите на контрольные приемы, назначенные вашим врачом, или в соответствии с указаниями, полученными от наших сотрудников. Если был сделан посев выделений из раны, получите результаты в указанное время. Если в ваш курс лечения будут внесены какие-либо изменения, вам о них сообщат.
Если у вас был диагностирован МРЗС, в будущем вам необходимо будет сообщать медицинскому персоналу о том, что вы проходили лечение от этой инфекции.
Когда необходимо обратиться за медицинской помощью
В любом из следующих случаев обратитесь в обслуживающее вас медицинское учреждение:
Усиливающееся покраснение, опухание или боль
Красные полосы в коже вокруг раны
Слабость или головокружение
Появление гноя или выделений из раны
Температура выше 100,4 ºF (38,0 ºС) или в соответствии с указаниями вашего лечащего врача
О стафилококке и стафилококковой инфекции — Министерство здравоохранения ПМР
Стафилококки — это целый род микроорганизмов, на сегодня известно уже 27 видов, при этом 14 видов обнаружены на коже и слизистых оболочках человека. Большинство стафилококков абсолютно безвредны. Из упомянутых 14 видов, чаще всего три способны вызывать болезни: золотистый стафилококк (самый распространенный и вредоносный), эпидермальный стафилококк (также патогенный, но гораздо менее опасный, чем золотистый) и сапрофитный стафилококк – практически безвредный, тем не менее, также способный вызывать заболевания.
Большинство стафилококков абсолютно безвредны. Из упомянутых 14 видов, чаще всего три способны вызывать болезни: золотистый стафилококк (самый распространенный и вредоносный), эпидермальный стафилококк (также патогенный, но гораздо менее опасный, чем золотистый) и сапрофитный стафилококк – практически безвредный, тем не менее, также способный вызывать заболевания.
Практически все связанные со стафилококком медицинские проблемы подразумевают присутствие именно золотистого стафилококка, обладающего удивительной живучестью: не теряет активности при высушивании, 12 часов живет под воздействием прямых солнечных лучей, в течение 30 минут выдерживает температуру в 800 С, не погибает в чистом этиловом спирте, не боится перекиси водорода.
Стафилококки распространены повсеместно, их можно обнаружить практически на любом участке человеческого тела и окружающих предметах. В течение первой недели жизни у 90% новорожденных в полости носа выявляется золотистый стафилококк. В первые два года жизни у 20% детей обнаруживаются золотистые стафилококки в полости носа, а к 4-6 годам они обнаруживаются у 30-50%, у взрослых носительство колеблется в пределах 12-50%.
В первые два года жизни у 20% детей обнаруживаются золотистые стафилококки в полости носа, а к 4-6 годам они обнаруживаются у 30-50%, у взрослых носительство колеблется в пределах 12-50%.
Важно всегда разграничивать такие понятия, как стафилококк и стафилококковая инфекция. Золотистый стафилококк является условно-патогенным микроорганизмом, представителем нормальной человеческой микрофлоры. Термин «условно-патогенный» означает, что стафилококк вызывает заболевание лишь при определенных обстоятельствах. Он может находиться в организме долгое время (хоть всю жизнь), не причиняя человеку вреда и должны создаться определенные условия, чтобы он вызвал болезнь. А именно – ослабление иммунитета. Если иммунная защита человека работает нормально, стафилококк существует в организме, не причиняя «хозяину» никакого беспокойства. Если иммунитет дает сбой, стафилококк может атаковать организм человека, что ведет к появлению самых различных болезней (более ста наименований): от относительно легких кожных гнойничковых инфекций до таких тяжелых процессов как пневмония (воспаление легких), менингит (воспаление оболочек мозга), остеомиелит (поражение костей), сепсис (воспалительный процесс во всех органах человека или «заражение крови»), токсический шок и другие.
Безусловно, стафилококковые инфекции подлежат лечению. Этим занимаются врачи различных специальностей. Лечение стафилококковых болезней — удивительно сложная задача, ибо нет микроба, способного сравниться со стафилококком по способности вырабатывать устойчивость к антибиотикам и другим антибактериальным средствам. Поэтому лечение необходимо назначать только после определения чувствительности к антибактериальным средствам. С этим согласны все специалисты.
Сложнее обстоят дела при здоровом носительстве, когда микроб присутствует в организме человека (например, на слизистой носоглотки), но заболевание не развивается вследствие равновесия факторов агрессии микроба и защитных сил иммунной системы человека. Вместе с тем, носитель может представлять серьезную опасность для окружающих. Особенно опасен такой человек, если он работает в пищевой отрасли (повар, раздатчик готовых блюд), в медицине (медицинская сестра детского отделения, врач хирург или акушер-гинеколог и др.![]()
Вопросы лечения носительства золотистого стафилококка будоражат медицинскую общественность не одно десятилетие. Когда с этой условно-патогенной бактерией нужно бороться, а когда — нет? Что делать с устойчивым штаммом? Чем его лечить?
Носительство без симптомов лечить не нужно! Ничем и никогда. Живите спокойно и забудьте об этом анализе. Если у совершенно здорового ребенка или взрослого вдруг в посеве кала (грудного молока, мазка из носоглотки, зева, влагалища и так далее) высевается золотистый стафилококк, лечить его не имеет никакого смысла.
При носительстве с симптомами нужно быть полностью уверенным, что они имеют отношение к золотистому стафилококку. Только в таком случае, после консультации врача, можно брать рецепт и идти в аптеку.
Обязательному лечению подлежат люди, которые, будучи носителями стафилококка, при исполнении своих профессиональных обязанностей могут вызвать возникновение стафилококковой инфекции у других людей. Список профессий, представители которых подлежат лечению в связи с носительством стафилококка, оговорен специальным директивным документом. Помимо медицинских работников в него входят, например, работники сферы общественного питания. Опасность стафилококконосительства в этой категории состоит еще и в том, что стафилококки могут попасть в приготавливаемую пищу и вызвать массовое заболевание пищевой токсикоинфекцией. Также имеет смысл проходить лечение здоровым носителям стафилококка, проживающим совместно с людьми, которые страдают повторными стафилококковыми инфекциями (например, фурункулезом) или тяжелыми хроническими болезнями.
Помимо медицинских работников в него входят, например, работники сферы общественного питания. Опасность стафилококконосительства в этой категории состоит еще и в том, что стафилококки могут попасть в приготавливаемую пищу и вызвать массовое заболевание пищевой токсикоинфекцией. Также имеет смысл проходить лечение здоровым носителям стафилококка, проживающим совместно с людьми, которые страдают повторными стафилококковыми инфекциями (например, фурункулезом) или тяжелыми хроническими болезнями.
Лечение носительства золотистого стафилококка антибиотиками нецелесообразно. В арсенале специалистов достаточно других средств. Лечение антибиотиками дисбактериоза с высоким содержанием стафилококка вовсе противопоказано, так как это приведет к противоположному результату – более интенсивному размножению стафилококка.
Профилактика стафилококковой инфекции включает в себя: соблюдение правил личной гигиены, отказ от вредных привычек, здоровое питание и полноценный сон. Необходимо избегать общих переохлаждений и перегревов, своевременно обрабатывать антисептиками (йод, зеленка) микротравмы кожи.
Ни в коем случае не отчаивайтесь, если у Вас обнаружен стафилококк. Победить его можно, сделать это будет легче при своевременном обращении к врачу и четком выполнении рекомендаций по лечению и профилактике, впрочем, это правило относится к любому заболеванию. Всегда согласовывайте свои действия с врачом.
Будьте здоровы.
Врач эпидемиолог С. С. Пынзарь
Инфекции, вызываемые стафилококками
Стафилококки хорошо известны как возбудители гнойно-септических инфекций у человека и животных. Наряду с представителями семейства Enterobacteriaceae
 Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Род Staphylococcus включает в себя 35 различных видов. В зависимости от способности продуцировать коагулазу, фермент, вызывающий коагуляцию плазмы крови, они подразделяются на две группы: коагулазопозитивные и коагулазонегативные. Место обитания стафилококков – человек и теплокровных животные, внешняя среда. Локализация у человека – кожа и слизистые оболочки, толстый кишечник. Источником стафилококковых инфекций является больной человек или здоровый носитель. Пути передачи: воздушно-капельный, воздушно-пылевой, контактный, пищевой. Восприимчивость к инфекции зависит от общего состояния организма и возраста. Наиболее восприимчивы дети, особенно новорожденные и грудного возраста. В норме способность стафилококка к инвазии и резистентность хозяина хорошо сбалансированы, поэтому инфекция не развивается, пока не создастся ситуация, когда встречаются высоковирулентный микроорганизм или макроорганизм со сниженной резистентностью.
Наиболее известным представителем коагулазопозитивных стафилококков является S. aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.
aureus (золотистый стафилококк). Он встречается в передних отделах носовых ходов у 20–40% здоровых взрослых людей. Приблизительно у 1/3 населения он постоянно выделяется из носа, у 1/3 отмечается транзиторное носительство и 1/3 свободна от носительства. S.aureus наиболее часто выделяется при гнойной патологии, вызывает целый ряд заболеваний: фолликулиты, фурункулы и карбункулы, гидроадениты, маститы, раневые инфекции, бактериемии и эндокардиты, менингиты, перикардиты, легочные инфекции, остеомиелиты и артриты, гнойные миозиты, пищевые отравления, синдром токсического шока. Упомянутые заболевания обусловливаются факторами патогенности: капсульными полисахаридами, пептидогликанами и тейхоевыми кислотами, протеином А, ферментами, гемолизинами, токсинами (эксфолиативный, энтеротоксины от А до Е, Н и I), суперантигеном, который принадлежит к энтеротоксину (TSST-1), вызывающему токсический шок синдром.
Все остальные коагулазопозитивные стафилококки выделяются в основном от животных и редко от человека, но в отдельных случаях могут вызывать у человека гнойно-воспалительные заболевания.
Среди коагулазонегативных стафилококков наиболее значимы в патологии человека S.epidermidis и S.saprophyticus. Они могут вызывать инфекции мочевыводящих путей, остеомиелиты, бактериемии, инфекции у новорожденных детей в палатах интенсивной терапии, заболевания глаз, кожные инфекции, поражают клапаны сердца, вызывают гнойные воспаления при операции по замене сердечных клапанов на искусственные, при шунтирование органов, использование внутривенных катетеров, катетеров при гемодиализе, а также при ангиопластике.
В настоящее время микроорганизмы рода Staphylococcus играют лидирующую роль среди возбудителей внутрибольничных инфекций. До определенного времени пенициллин был основным препаратом выбора при лечении тяжелых гнойных инфекций вызываемых S.aureus. Затем стали появляться штаммы устойчивые к этому антибиотику. Оказалось, что устойчивость к пенициллину была обусловлена продукцией фермента .-лактамазы разрушающей β-лактамное кольцо в молекуле пенициллина. В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы. В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная.
В настоящее время около 80% изолируемых штаммов S.aureus синтезируют β-лактамазу. Вместо пенициллина в случае выделения пенициллин резистентных штаммов применяют полусинтетические пенициллины устойчивые к β-лактамазе. Но с 80-х годов начинают выделяться штаммы S.aureus устойчивые и к этой группе антибиотиков в частности к оксациллину и метициллину. Устойчивость таких штаммов связана с продукцией пенициллин связывающего белка (PBP 2а), синтез которого в свою очередь связан с приобретением стафилококками хромосомного гена mecA. Штаммы S.aureus, обладающие этим геном проявляют устойчивость ко всем β-лактамным антибиотикам включая цефалоспорины. S.aureus с упомянутым механизмом устойчивости присваивается термин метициллин- резистентные штаммы. В ряде случаев устойчивость к полусинтетическим пенициллинам может быть обусловлена гиперпродукцией β-лактамаз. В этом случае устойчивость к полусинтетическим пенициллинам при определении ее в лабораторных условиях характеризуется как умеренная. Метициллин-резистентные штаммы S.aureus часто проявляют устойчивость к другим антибиотикам в частности к эритромицину и клиндамицину. В связи с их распространением в ряде зарубежных стран в качестве антибиотиков выбора начинают использовать ванкомицин и тейкопланин. Но уже в 1996 году появляются первые сообщения о выделении штаммов S.aureus с умеренной устойчивостью к ванкомицину (MIC=8 мкг/ мл.), а с 2002 г. штаммов с высокой устойчивостью (МIC>32 мкг/мл.). Метициллин резистентные штаммы выявляются также среди S.epidermidis, а ванкомицрезистентные среди S.haemolyticus.
Метициллин-резистентные штаммы S.aureus часто проявляют устойчивость к другим антибиотикам в частности к эритромицину и клиндамицину. В связи с их распространением в ряде зарубежных стран в качестве антибиотиков выбора начинают использовать ванкомицин и тейкопланин. Но уже в 1996 году появляются первые сообщения о выделении штаммов S.aureus с умеренной устойчивостью к ванкомицину (MIC=8 мкг/ мл.), а с 2002 г. штаммов с высокой устойчивостью (МIC>32 мкг/мл.). Метициллин резистентные штаммы выявляются также среди S.epidermidis, а ванкомицрезистентные среди S.haemolyticus.

Показания к обследованию. Признаки гнойно-септической инфекции, обследование медицинского персонала на носительство.
Материал для исследований. Кровь, СМЖ, гной, раневое отделяемое, грудное молоко, мазки из носа; смывы c медицинского оборудования и инвентаря.
Этиологическая лабораторная диагностика включает выделение возбудителя на питательных средах, выявление его ДНК.
Сравнительная характеристика методов лабораторной диагностики, показания к применению различных лабораторных исследований. Техника выделения возбудителя в настоящее время хорошо отработана. Микроорганизмы довольно устойчивы к факторам внешней среды, поэтому если отобранный биологический материал невозможно сразу использовать для исследования, можно воспользоваться специальными контейнерами и траспортными средами. Подробнее техника отбора и транспортировки биологического материала в клинико- диагностическую лабораторию описана в разделе преаналитические этапы исследования. Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
Для выделения возбудителя, как правило, достаточно 3–4 дня. Исключением является выделение стафилококков из крови. В этом случае успех техники во многом будет зависеть от правильного выбора времени для отбора крови и присутствия в крови пациентов антибактериальных препаратов.
 aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.
aureus, S.epidermidis, S.haemolyticus, S.saprophyticus методом ПЦР не позволяет выявить жизнеспособные микроорганизмы, а также определить у них чувствительность к антибиотикам.Особенности интерпретации результатов лабораторных исследований. При исследовании стерильного биологического материала (кровь, СМЖ) клиническое значение имеет обнаружение S.aureus в любых концентрациях. В нестерильном биологическом материале клиническое значение имеют только высокие концентрации S.aureus, означающие его ведущую роль в воспалительном процессе.
Симптомы и лечение золотистого стафилококка у взрослых и детей
Золотистый стафилококк – признаки и лечение. Симптомы золотистого стафилококка в кишечнике у взрослых
Золотистый стафилококк – аэробная бактерия, отличающаяся шарообразной формой и неподвижностью. Может провоцировать развитие разных заболеваний у детей. У взрослых встречается крайне редко. Анализ на золотистый стафилококк поможет выявить его присутствие в окружающей среде – на игрушках и посуде, постельном белье и коже человека, как абсолютно здорового, так и больного.
У взрослых встречается крайне редко. Анализ на золотистый стафилококк поможет выявить его присутствие в окружающей среде – на игрушках и посуде, постельном белье и коже человека, как абсолютно здорового, так и больного.
Классификация инфекции
В медицине выделяют две формы стафилококковой инфекции – генерализованную и очаговую. В первом случае речь идет о сепсисе, когда все системы и органы заражены стафилококком. Сепсис – опасное состояние, которое часто заканчивается летальным исходом даже на фоне оказания квалифицированной медицинской помощи.
Чаще диагностируется очаговая форма стафилококковой инфекции, когда выявляются заболевания кожных покровов, костной ткани, суставов. Отдельно врачи выделяют пищевое отравление токсинами – с характерными симптомами золотистого стафилококка в кишечнике у взрослых.
Стафилококковая инфекция может протекать в легкой, средней и тяжелой степени, острой или хронической форме.
Симптомы стафилококковой инфекции
Аэробную бактерию можно найти на поверхности кожи даже у здорового человека, поэтому удивляться ее наличию не стоит. Инфекция разовьется только в том случае, если «сработают» провоцирующие факторы – сниженный иммунитет, вирусное заболевание, хирургическое вмешательство, травмы, половая инфекция и так далее. Принято считать, что после лабораторного исследования посевов биоматериала, взятого из разных мест организма, можно выявить истинную угрозу наличия стафилококка. Врачи различают несколько степеней присутствия колоний аэробной бактерии. Если колоний обнаружено в пределах 10, а степень равна 6, то это высшая граница нормы. Более высокие показатели будут свидетельствовать о выраженной патологии. Получив результат анализа «золотистый стафилококк на коже 10 в степени 5», беспокоиться не нужно – лечение будет непродолжительным и обязательно с положительным результатом.
Инфекция разовьется только в том случае, если «сработают» провоцирующие факторы – сниженный иммунитет, вирусное заболевание, хирургическое вмешательство, травмы, половая инфекция и так далее. Принято считать, что после лабораторного исследования посевов биоматериала, взятого из разных мест организма, можно выявить истинную угрозу наличия стафилококка. Врачи различают несколько степеней присутствия колоний аэробной бактерии. Если колоний обнаружено в пределах 10, а степень равна 6, то это высшая граница нормы. Более высокие показатели будут свидетельствовать о выраженной патологии. Получив результат анализа «золотистый стафилококк на коже 10 в степени 5», беспокоиться не нужно – лечение будет непродолжительным и обязательно с положительным результатом.
Заболевания, вызванные рассматриваемой аэробной бактерией, не имеют каких-либо отличительных признаков. Если золотистый стафилококк поражает горло, то у человека может развиться ангина, фарингиты и ларингиты, отличающиеся тяжелым течением с высокой температурой тела и сильной слабостью. Заболевания дыхательной группы с частыми рецидивами считаются основным признаком присутствия бактерии в зеве.
Кроме этого, золотистый стафилококк может быть выявлен:
- в костной ткани – инфекция проникает при переломах или тяжелых ранениях;
- в фурункулах, карбункулах и абсцессах – как правило, инфицируется волосяная луковица, и процесс воспаления запускается снова и снова даже на фоне проводимого лечения;
- на коже – у ребенка появляются высыпания, дерматиты.
Нередко выявляется золотистый стафилококк у грудничка в кале. Диагностироваться это может еще в роддоме – инфицирование происходит во время тяжелых родов на фоне сниженного иммунитета у недоношенных детей или младенцев с врожденными патологиями.
Самое тяжелое состояние при инфицировании аэробной бактерией – токсический шок. Он отличается характерными симптомами – резким повышением температуры до критических показателей, тошнотой, острой болью в голове, сыпью на теле, появлением гнойного отделяемого из имеющихся ран. В таком случае никакие исследования не проводятся – только золотистый стафилококк может вызвать данное состояние. Назначается срочная терапия.
Лечение золотистого стафилококка
Антибиотики против золотистого стафилококка не всегда эффективны, поэтому их назначают лишь на начальной стадии развития заболевания. Эффективными будут только антибиотики последнего поколения – цефалоспорины и другие непенициллинового ряда.
Чаще всего врачи применяют комбинированную терапию. Если требуется лечение золотистого стафилококка в горле у ребенка, то будут назначены:
- обработка слизистой антисептическими растворами – хлорфиллиптом;
- иммуностимулирующие препараты;
- антистафилококковый бактериофаг.
Многих интересует, как вылечить золотистый стафилококк в зеве, который вызывает частые ангины, ларингиты, тонзиллиты. Без назначений врача не обойтись – привычные лекарственные препараты не помогают либо дают кратковременный эффект выздоровления. Специалист даст рекомендации по обработке слизистой глотки антисептическими растворами, проведет исследование на восприимчивость бактерии к антибиотикам и сделает медикаментозные назначения.
Чаще всего колонии рассматриваемых бактерий обнаруживаются в носу – они могут годами там находиться и не вызывать никаких заболеваний. Если же ребенок часто простужается, имеет отставание в росте и развитии, то хронических патологий не избежать. Как лечить золотистый стафилококк в носу у детей:
- госпитализировать ребенка в лечебное учреждение;
- проводить ежедневную санацию слизистой носа и глотки, так как имеется большой риск распространения инфекции;
- выполнять назначения врача для снятия тяжелых симптомов.
Независимо от того, какой именно орган поражен стафилококком, обязательно будут назначаться витамины, иммуномодуляторы и пробиотики для восстановления кишечной микрофлоры.
Длительность лечения стафилококковой инфекции – от 7 до 30 дней, что зависит от своевременности диагностирования заболевания и выявления больших колоний бактерии. Если терапия проводится в точном соблюдении назначений лечащего врача, то прогноз по заболеванию благоприятный.
Более подробно о том, как передается золотистый стафилококк и какие симптомы укажут на наличие аэробных бактерий, можно узнать на нашем сайте Добробут.ком.
Опасность золотистого стафилококка и методы его лечения
Лечение золотистого стафилококка
Стафилококки – это широко распространенные в природе микробы, являющиеся обитателями том числе и тела человека. Их относят к условно-патогенной флоре, при обычных условиях никак не влияющей на жизнь и здоровье человека. Но стафилококк имеет особые свойства, он может формировать патогенные штаммы (особенно опасны внутрибольничные, устойчивые к антибиотикам и особо агрессивные). Также, при снижении иммунной защиты организма или попадании в нетипичную для его обитания среду организма, стафилококк может давать инфекционный процесс.
Стафилококк: виды и свойства
Обычно стафилококк обитает на поверхности кожных покровов и слизистых человека, не причиняя ему вреда. У детей раннего возраста, ослабленных больных или при изменении патогенных свойств, стафилококк способен проявлять свои патогенные свойства. В виду того, что штаммов стафилококка очень много, у них выявляется разная степень опасности для организма.
К особо важным в отношении заболеваемости, относят несколько видов стафилококка – гемолитический, эпидермальный, сапрофитный или золотистый стафилококк. Особыми свойствами данных микробов является наличие у них особых ферментов и выделяемых токсинов, которые приводят к повреждению клеток и нарушению обменных процессов организма. стафилококки могут негативно влиять на кожные покровы и слизистые, подкожную клетчатку, провоцируют поражения дыхательной системы и легочной ткани, поражения кишечника и почек, а также генерализованные состояния в виде сепсиса, токсинового шока и поражений головного и спинного мозга. Зачастую стафилококковые инфекции имеют вторичное происхождение, наслаиваясь на основное заболевание и давая гнойные осложнения. Они обладают достаточной устойчивостью к средствам дезинфекции и многим антибиотикам, виду чего ними порой крайне сложно бороться.
Золотистый стафилококк
Этот вид микроба относят к одним из самых распространенных и самым опасным в плане гнойно-септических осложнений. Им могут поражаться люди всех возрастов от младенцев до стариков, часто именно этот вид провоцирует вспышки внутрибольничных инфекций, приобретая особо патогенные свойства. Золотистый стафилококк способен поражать любые органы и ткани тела, провоцировать различные гнойно-воспалительные поражения. Микроб обладает высокой устойчивостью к действию дезинфекции, антисептических препаратов и многих антибиотиков. За счет него провоцируются кожные процессы в виде ячменей, фурункулов, абсцессов и флегмон. Он может давать гнойные поражения костей, абсцессов мозга, поражения сердца и почек, а также пищевые токсикоинфекции.
Стафилококк: лечение
Основу лечения стафилококковой инфекции составляют антибиотики. Однако, в виду того, что многие штаммы обладают устойчивостью к традиционным и широко применимым препаратам, терапия может осложняться из-за ограниченности выбора медикаментов. Если выявлен стафилококк, лечение проводят пор результатам посева и определения чувствительности микроба к антибиотикам. Применимы препараты пенициллинового ряда, защищенные и нового поколения, а также цефалоспорины. В некоторых случаях применимы препараты аминогликозидов и макролидов, либо, при развитии внутрибольничных штаммов – антибиотики резерва.
Дополняет лечение введение анти-стафилококкового иммуноглобулина, гипериммунной плазмы и дотоксикация. При наличии гнойных полостей, необходима их хирургическая обработка с удалением гноя и промыванием растворами антисептиков.
Не смотря на успехи медицины в лечении гнойных инфекций, стафилококк остается актуальной проблемой медицины в виду его особых свойств. На сегодня летальность от данной инфекции все еще очень высока.
18+
Имеются противопоказания. Необходима консультация специалиста.
На правах рекламы
Посев на золотистый стафилококк (Staphylococcus aureus) с определением чувствительности к антибиотикам
Бактериологический посев на золотистый стафилококк на специальных питательных средах позволяет определить количество микроорганизма с последующей постановкой антибиотикограммы диско-диффузионным методом с учетом рекомендаций по чувствительности и резистентности к антибиотикам.
В каких случаях обычно назначают посев на золотистый стафилококк?
Золотистый стафилококк распространен повсеместно и передается от человека к человеку при контакте, через воздух, воду и пищу. Способен вызывать острые и хронические гнойные процессы в различных органах. Часто может заселять слизистые ЛОР органов и ЖКТ, мочеполовой системы вызывая состояние бессимптомного бактерионосительства. Попав в организм человека, вырабатывает токсины, угнетающие работу иммунной, нервной систем и желудочно-кишечного тракта. Может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с вторичными очагами воспаления во внутренних органах и костно-мышечной системе.
Золотистый стафилококк может вызывать пищевые токсические инфекции при употреблении пищевых продуктов обсемененных им и его токсином: кондитерские изделия без термообработки (содержащие яйца и молочные продукты), салаты и мороженное.
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах кала.
В эпидемиологических целях анализ проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицина, образование, питание и торговля. В данном случае посев выполняется из 2 локусов: носа и зева.
Что именно определяется в процессе анализа?
Определяется наличие возбудителя в посеве и его чувствительность к антибиотикам различных групп.
Что означают результаты теста?
«Положительный» результат теста- выявление золотистого стафилококка, свидетельствует об инфекции или о бессимптомном носительстве. В норме результат – «отрицательный», микроорганизм не обнаружен. Анализ поможет врачу педиатру и терапевту в подборе этиотропного антибактериального лечения данной инфекции.
О бычный срок выполнения теста:
до 8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Анализ необходимо сдавать до начала антибактериальной терапии, до применения местных антисептических средств или не ранее, чем через 2 недели после проведенного лечения. Подробнее про условия сдачи можно прочитать в разделе «Подготовка».
Наука: Наука и техника: Lenta.ru
Многие ученые и врачи считают, что человечество вступает в новую эру, когда антибиотики, спасающие множество жизней, перестают быть эффективными против новых штаммов микробов. Ситуация обостряется с каждым годом во многом из-за того, что люди злоупотребляют препаратами и буквально сами взращивают неуязвимые бактерии. Золотистый стафилококк, устойчивый к метициллину, — как раз один из таких смертельно опасных монстров. «Лента.ру» пишет, чем опасны новые штаммы стафилококков, откуда они появились и можно ли их победить.
В 2008 году в педиатрическое отделение при Университете Аристотеля (Греция) поступила десятилетняя девочка с царапиной на локте правой руки. У ребенка в последние три дня держалась высокая температура 40 градусов, и она с трудом могла двигать правой ногой. Врачи диагностировали воспаление правого тазобедренного сустава. Заподозрив бактериальную инфекцию, врачи назначили антибиотик клоксациллин. Тогда они еще не знали, что столкнулись со смертельно опасным противником.
Состояние девочки ухудшалось с каждым часом. Проявились симптомы поражения мозга и серьезные нарушения дыхания из-за проникновения инфекции в легкие. Стало ясно, что клоксациллин не помогает, поэтому было назначено сразу несколько новых антибиотиков. На пятый день рентген показал обширное поражение правой бедренной кости и прилегающей мышечной ткани. Доктора провели дренирование мягких тканей на ноге и выпустили гной, в котором кишели метициллинрезистентные золотистые стафилококки (МРЗС).
Микробные культуры золотистого стафилококка
Фото: Andrei Papkou
Девочка находилась в критическом состоянии целую неделю, после чего ее самочувствие стало улучшаться благодаря интенсивной терапии. Однако инфекция терроризировала организм ребенка в течение нескольких месяцев, бактерии практически «объели» кость. На полное восстановление организма после тяжелой инфекции потребовалось три года. Девочке сильно повезло, потому что благополучный исход составляет лишь небольшой процент подобных случаев.
МРЗС обычно связан с внутрибольничными инфекциями. Иными словами, пациенты в больницах, имеющие раны и ослабленный иммунитет, являются основной группой риска. Золотистый стафилококк способен выживать в почти стерильных условиях и распространяется несмотря на дезинфекцию. Но, к сожалению, МРЗС встречается и за пределами больниц, в этом случае он называется бытовым. Именно его подхватила десятилетняя пациентка через обыкновенную царапину. Стафилококк может и не вызвать инфекции, но если организм по какой-то причине ослаблен, последствия могут быть катастрофическими.
МРЗС является одной из тех самых «пожирающих плоть бактерий», о которых СМИ рассказывают леденящие душу истории. Этот микроб отвечает за треть всех случаев некротизирующего фасциита — тяжелой инфекции, буквально разъедающей мягкие ткани организма. Входными воротами для смертельно опасного микроба может быть порез или ожог, хотя известны случаи, когда фасциит развивался после употребления сырых морепродуктов. Зубные болезни тоже повышают риск инфекции.
Впрочем, некротизирующий фасциит можно предотвратить, если правильно ухаживать за ранами, мыть руки и следить за гигиеной полости рта. При лечении врачи ампутируют пораженные ткани и вводят ударную смесь антибиотиков. Однако даже при правильном и своевременном лечении треть пациентов умирает.
Легкие, пораженные стафилококком
В 2015 году врачи сообщили о крайне необычном случае некротизирующего фасциита, вызванного бытовым стафилококком. Инфекция развивалась молниеносно у пациента с нормальной иммунной системой. Мужчина в возрасте 52 лет поступил в больницу с невыносимой болью в левом бедре и отеком, который держался уже неделю. На коже ноги виднелись гематомы, пузыри, а пораженные участки потеряли чувствительность. Несмотря на агрессивную терапию, хирургическую обработку раны и прием антибиотиков широкого спектра действия больной скончался от сепсиса менее чем через 24 часа после обращения. У мужчины не было никаких травм или предполагаемых контактов с МРЗС, однако он лечился от остеоартроза левого колена периодическими инъекциями стероидов. Последняя инъекция была сделана за три недели до начала симптомов.
МРЗС вызывает не только инфекции мягких тканей. Стафилококк наряду с некротизирующим фасциитом способен провоцировать смертельную некротизирующую пневмонию или внутреннюю гангрену, быстро разрушающую легочные ткани. В большинстве случаев заболевание приводит к летальному исходу, даже несмотря на ударную дозу сильнодействующих антибиотиков, нацеленных против стафилококков. Такая пневмония чаще развивается у детей и молодых взрослых, особенно после вирусной респираторной инфекции, однако поражает и людей старшего возраста.
Ежегодно в США регистрируется почти 300 тысяч госпитализаций, связанных с золотистым стафилококком, при этом почти половина приходится на МРЗС. Бытовой стафилококк отличается от внутрибольничного генетически. В Северной Америке наиболее распространен «суперзаразный» штамм USA300.
Материалы по теме
00:01 — 9 июля 2020
Возвращение мора
На границе с Россией вспышка смертельной бубонной чумы. Чем это грозит россиянам?
00:04 — 15 апреля 2020
Грязный убийца
Как безобидный микроб веками убивал миллионы людей по всему миру
Устойчивость к метициллину придает ген mecA, располагающийся в так называемой стафилококковой кассетной хромосоме (SCC, staphylococcal cassette chromosome), которые у разных штаммов имеют разное строение. Бытовые штаммы имеют меньшую и менее сложную версию SCC, специалисты ее обозначают как SCC mecA типа IVa. Она содержит меньше генов, способствующих устойчивости, чем внутрибольничные виды МРЗС, однако включает уникальные гены вирулентности, то есть способности вызывать заболевания или гибель организма. Таким образом бытовые штаммы легче поддаются лечению, но они убивают быстрее, чем те, что атакуют пациентов больниц и клиник. Гены вирулентности производят токсины, представляющие опасность даже для здоровых людей с нормальным иммунитетом. Один из таких токсинов — лейкоцидин Пантона-Валентайна (PVL) — помогает бактерии бороться с клетками иммунитета. Попадание МРЗС, вырабатывающих PVL, в организм человека часто приводит к инфекции мягких тканей, в том числе некротизирующему фасцииту.
Распространение золотистого стафилококка в Европе
Штамм USA300 прибыл в Северную Америку в первой половине XX века из Европы, где он появился в середине XIX века. Тогда он был менее заразным и не имел многих мутаций, сейчас делающих его смертельно опасным. Роковую роль в создании супермикроба-монстра сыграл заразивший стафилококк вирус — бактериофаг ϕSa2USA, который нес в себе ген, кодирующий PVL. В начале третьего тысячелетия штамм получил широкое распространение в США, а также переселился в Южную Америку, Европу, Африку и Азиатско-Тихоокеанский регион. Считается, что к 2001 году МРЗС колонизировал примерно восемь процентов населения США.
Журналистка Соня Шах в своей книге «Пандемия: Всемирная история смертельных вирусов» так вспоминает свою встречу с бытовым МРЗС, которым заразился ее сын: «Педиатр, обычно шутливая и жизнерадостная, взглянув на колено моего сына, резко посуровела. Назначение она выписала, не дожидаясь результатов анализов: сильный антибиотик клиндамицин, старый добрый и надежный бактрим и в придачу жесткий режим избавления от гноя с помощью горячих компрессов и выдавливания… Каждую каплю требовалось аккуратно подбирать и удалять, чтобы она не просочилась в микротрещины на коже или, что еще хуже, не поселилась на полотенцах, постелях, обивке или свободных поверхностях, где она может ждать своего часа целый год».
Золотистый стафилококк
Ребенок выздоровел, однако, несмотря на все усилия и гигиенические процедуры, семье не удалось полностью избавиться от МРЗС. Рецидив сначала случился у сына, так как стафилококк поселился у него в организме, иногда проявляясь в виде болезненных нарывов, наполненных гноем. Через некоторое время инфекция перешла и на журналистку. Шах пишет, что хроническая инфекция затихла сама собой, несмотря на всю борьбу с коварными микробами. Тем не менее в запущенных случаях иногда единственным способом остановить заражение остается ампутация конечностей.
Пока МРЗС остается восприимчив к ряду антибиотиков, не принадлежащих бета-лактамам. Однако обнаруживаются новые штаммы, которые проявляют устойчивость и к другим лекарствам. Ситуацию осложняет то, что антибиотики применяют повсеместно и часто неправильно, что только провоцирует размножение бактерий, вызывающих трудноизлечимые или вообще неизлечимые инфекции. При этом антибиотики новых классов изобретаются достаточно редко, а эффективных заменителей, к сожалению, пока не существует.
О Staphylococcus aureus — Департамент здравоохранения Миннесоты
Информационный бюллетень Министерства здравоохранения Миннесоты
Пересмотрено в феврале 2010 г.
Загрузите версию этого документа для печати: Staphylococcus aureus Информационный бюллетень (PDF)
Staphylococcus aureus ( S. aureus или «стафилококк») фактов, включая то, как распространяется S. aureus , общие симптомы и осложнения.
S. aureus давно признан одной из наиболее важных бактерий, вызывающих болезни у людей.Это основная причина инфекций кожи и мягких тканей, таких как абсцессы (фурункулы), фурункулы и целлюлит. Хотя большинство стафилококковых инфекций не являются серьезными, S. aureus может вызывать серьезные инфекции, такие как инфекции кровотока, пневмония или инфекции костей и суставов.
На этой странице:
Признаки и симптомы инфекции
Продолжительность болезни
Передача
Осложнения
Дополнительные информационные бюллетени
Признаки и симптомы инфекции
- Большинство инфекций вызывается S.aureus — инфекции кожи и мягких тканей, такие как абсцессы или целлюлит.
Абсцесс
- Инфекционный очаг, образующийся на месте травмы.
- Обычно заполнен гноем.
- Область вокруг абсцесса обычно красная, болезненная и опухшая, а кожа
окружающие абсцесс могут быть теплыми на ощупь.Целлюлит
- Инфекция нижележащих слоев кожи.
- Обычно возникает в результате царапины или пореза на коже, через которую попадают бактерии, хотя при этом не может быть очевидных повреждений.
- Целлюлит может возникнуть в любом месте тела, но чаще всего возникает на ногах или руках.
- Симптомы включают покраснение, отек и боль в месте инфекции.
- S. aureus также может вызывать серьезные инфекции, такие как пневмония (инфекция легких) или бактериемия (инфекция кровотока).
- Симптомы этих инфекций включают затрудненное дыхание, недомогание, лихорадку или озноб.
- Если вы подозреваете, что у вас инфекция S. aureus , обратитесь к своему врачу.
Продолжительность болезни
- Некоторые люди могут быть колонизированы S. aureus и никогда не заразиться.
- Для людей, которые действительно заразились, время от контакта до развития болезни может составлять от дней до лет.
- Многие распространенные кожные инфекции, вызываемые S. aureus , излечиваются без лечения.
- Однако при некоторых кожных инфекциях требуется разрез и дренирование инфицированного участка, а при некоторых инфекциях могут потребоваться антибиотики.
- Большинство кожных инфекций излечиваются в течение нескольких недель.
- Для лечения более серьезных кожных инфекций может потребоваться больше времени, если лечение откладывается или проводится неэффективное лечение.
- Некоторые серьезные инфекции S. aureus (например, пневмония или инфекции кровотока) обычно требуют госпитализации и лечения внутривенными антибиотиками.
Трансмиссия
- S. aureus чаще всего передается другим людям через зараженные руки.
- Кожа и слизистые оболочки обычно являются эффективным барьером против инфекции. Однако, если эти барьеры будут нарушены (например,g., повреждение кожи в результате травмы или повреждение слизистой оболочки в результате вирусной инфекции) S. aureus может получить доступ к подлежащим тканям или кровотоку и вызвать инфекцию.
- Лица с ослабленным иммунитетом или инвазивные медицинские устройства особенно уязвимы для инфекции.
Трансмиссия MRSA:
- Традиционно, метициллин-резистентные инфекции Staphylococcus aureus (MRSA) были связаны с госпитализацией или другими факторами риска, связанными с оказанием медицинской помощи.
- В последние годы врачи и другие поставщики медицинских услуг наблюдали рост числа людей с инфекциями MRSA, у которых отсутствуют традиционные факторы риска, связанные с оказанием медицинской помощи. Похоже, что у этих людей есть инфекции, связанные с сообществом.
Осложнения
- Большинство кожных инфекций проходят без лечения, однако некоторые инфекции требуют разреза и дренирования или лечения антибиотиками, чтобы вылечить инфекцию.
- Кожные инфекции, оставленные без лечения, могут перерасти в более серьезные опасные для жизни инфекции, такие как инфекции костей или крови.
- Некоторые люди повторно заражаются S. aureus .
- Существует вероятность более длительных или более тяжелых инфекций, вызванных устойчивостью к метициллину Staphylococcus aureus (MRSA), если первоначально назначенный антибиотик не способен убить бактерии.
Дополнительные информационные бюллетени
- Материалы для печати
Включает печатные информационные бюллетени по Staph, MRSA, CA-MRSA, HA-MRSA, VISA / VRSA и другим.
Золотистый стафилококк — APIC
Что такое
S. aureus и как он распространяется?Золотистый стафилококк или «стафилококк» — это тип бактерий, обнаруживаемых на коже человека, в носу, подмышках, паху и других областях. Хотя эти микробы не всегда причиняют вред, при определенных обстоятельствах они могут вызвать заболевание. S. aureus является основной причиной инфекций кожи и мягких тканей, таких как абсцессы, фурункулы, фурункулы и целлюлит (красная, опухшая, болезненная, теплая кожа). Микробы S. aureus могут также вызывать более серьезные инфекции, такие как пневмония, инфекции кровотока, эндокардит (инфекция внутренней оболочки камер сердца и сердечных клапанов), а также инфекции костей и суставов.
S. aureus передается при прикосновении к инфицированной крови или биологическим жидкостям, чаще всего через зараженные руки.
Кто заражается
S. aureus ?Любой человек может заразиться инфекцией S. aureus , хотя некоторые группы людей более вероятны, чем другие.Сюда входят люди с такими заболеваниями, как диабет, рак, сосудистые заболевания, экзема, заболевания легких, а также люди, употребляющие инъекционные наркотики. Пациенты, госпитализированные в отделения интенсивной терапии (ОИТ), пациенты, перенесшие определенные виды операций, и пациенты с медицинскими устройствами, вставленными в их тело, такими как центральные линии и катетеры, подвергаются большему риску более серьезного S. aureus инфекция. Люди, которые часто посещают медицинские учреждения, и жители домов престарелых также подвергаются повышенному риску.
Каковы симптомы инфекции
S. aureus ?Инфекции, вызванные S. aureus , обычно проявляются на коже в виде гноя, окруженного красной болезненной кожей или целлюлитом.
Как лечится
S. aureus ?Лечение зависит от типа инфекции, вызванной бактериями. Когда назначаются антибиотики, они выбираются на основании лабораторных исследований бактерий и могут включать более одного вида бактерий.
Бактерии стафилококка очень легко приспосабливаются, и многие разновидности стали устойчивыми к одному или нескольким антибиотикам.Рост числа устойчивых к антибиотикам штаммов стафилококка, часто описываемых как устойчивые к метициллину штаммы S. aureus (MRSA), привел к использованию внутривенных антибиотиков с потенциалом дополнительных побочных эффектов.
Как можно предотвратить заражение
S. aureus ?Чтобы предотвратить заражение стафилококком, соблюдайте правила гигиены рук, держите инфицированные места закрытыми и чистыми и избегайте совместного использования личных вещей, таких как бритвы, полотенца и иглы.
Дополнительные ресурсы
Стафилококковые инфекции: MedlinePlus
Что такое стафилококковые (стафилококковые) инфекции?
Стафилококк (стафилококк) — группа бактерий.Всего более 30 видов. Тип, называемый золотистым стафилококком, вызывает большинство инфекций.
Бактерии стафилококка могут вызывать множество различных типов инфекций, в том числе
- Кожные инфекции, которые являются наиболее распространенными видами стафилококковой инфекции
- Бактериемия, инфекция кровотока. Это может привести к сепсису — очень серьезному иммунному ответу на инфекцию.
- Костные инфекции
- Эндокардит, инфекция внутренней оболочки камер и клапанов сердца
- Пищевое отравление
- Пневмония
- Синдром токсического шока (СТШ), опасное для жизни состояние, вызываемое токсинами определенных видов бактерий
Что вызывает стафилококковые инфекции?
Некоторые люди переносят стафилококковые бактерии на коже или в носу, но они не заражаются инфекцией.Но если они получат порез или рану, бактерии могут проникнуть в организм и вызвать инфекцию.
Бактерии стафилококка могут передаваться от человека к человеку. Они также могут распространяться на такие предметы, как полотенца, одежду, дверные ручки, спортивное снаряжение и пульты дистанционного управления. Если у вас есть стафилококк, и вы не обрабатываете пищу должным образом, когда готовите ее, вы также можете передать стафилококк другим людям.
Кто подвержен риску заражения стафилококком?
Любой человек может заболеть стафилококковой инфекцией, но некоторые люди подвергаются большему риску, включая тех, кто
- Есть хронические заболевания, такие как диабет, рак, сосудистые заболевания, экзема и болезни легких
- Иметь ослабленную иммунную систему, например, из-за ВИЧ / СПИДа, принимать лекарства для предотвращения отторжения органов или химиотерапию
- Перенесли операцию
- Используйте катетер, дыхательную трубку или трубку для кормления
- Находятся на диализе
- Наркотики инъекционные
- Занимайтесь контактными видами спорта, так как вы можете контактировать кожа к коже с другими людьми или пользоваться общим оборудованием
Каковы симптомы стафилококковой инфекции?
Симптомы стафилококковой инфекции зависят от типа инфекции:
- Кожные инфекции могут выглядеть как прыщи или нарывы.Они могут быть красными, опухшими и болезненными. Иногда появляется гной или другой дренаж. Они могут превратиться в импетиго, которое превращается в корку на коже, или в целлюлит, опухшую, красную область кожи, которая кажется горячей.
- Инфекции костей могут вызывать боль, отек, тепло и покраснение в инфицированной области. У вас также может быть озноб и жар.
- Эндокардит вызывает некоторые симптомы гриппа: жар, озноб и утомляемость. Он также вызывает такие симптомы, как учащенное сердцебиение, одышка и скопление жидкости в руках или ногах.
- Пищевое отравление обычно вызывает тошноту и рвоту, диарею и жар. Если вы потеряете слишком много жидкости, вы также можете обезвожиться.
- Симптомы пневмонии включают высокую температуру, озноб и не проходящий кашель. У вас также может быть боль в груди и одышка.
- Синдром токсического шока (СТШ) вызывает высокую температуру, внезапное снижение артериального давления, рвоту, диарею и спутанность сознания. На вашем теле может появиться сыпь, напоминающая солнечные ожоги. СТШ может привести к органной недостаточности.
Как диагностируются стафилококковые инфекции?
Ваш лечащий врач проведет медицинский осмотр и спросит о ваших симптомах. Часто врачи могут определить наличие у вас кожной инфекции стафилококка, посмотрев на нее. Чтобы проверить наличие других типов стафилококковой инфекции, врачи могут провести посев с соскобом кожи, образцом ткани, образцом стула, мазками из горла или носа. В зависимости от типа инфекции могут быть другие тесты, такие как визуализирующие тесты.
Какие методы лечения инфекций стафилококка?
Лечение стафилококковой инфекции — антибиотики.В зависимости от типа инфекции вы можете получить крем, мазь, лекарства (для проглатывания) или внутривенно (внутривенно). Если у вас инфицированная рана, врач может ее осушить. Иногда может потребоваться операция по поводу костных инфекций.
Некоторые стафилококковые инфекции, такие как MRSA (метициллин-устойчивый золотистый стафилококк), устойчивы ко многим антибиотикам. Все еще существуют определенные антибиотики, которые могут лечить эти инфекции.
Можно ли предотвратить заражение стафилококком?
Определенные меры могут помочь предотвратить инфекцию стафилококка:
- Соблюдайте правила гигиены, в том числе часто мойте руки
- Не делитесь полотенцами, простынями или одеждой с больным стафилококком
- Лучше не делиться спортивным снаряжением.Если вам все же нужно поделиться, убедитесь, что он должным образом очищен и высушен, прежде чем использовать.
- Соблюдайте правила безопасности пищевых продуктов, в том числе не готовьте пищу для других, если у вас стафилококк.
- Если у вас есть порез или рана, закройте ее.
Характеристика Staphylococcus aureus от людей и сравнение с изолятами животного происхождения, Северная Дакота, США
Abstract
Различные клоны метициллин-чувствительного (MSSA) и метициллин-устойчивого (MRSA) Staphylococcus aureus были обнаружены у людей, а также у животных и мяса в магазинах.Однако необходима дополнительная информация о генетических характеристиках и сходстве между штаммами. Целью этого исследования было выявить и охарактеризовать Staphylococcus aureus у людей и сравнить их характеристики с изолятами животного происхождения. Всего было взято 550 мазков из носа у здоровых людей и S . Было выделено и идентифицировано aureus . Положительный S . Изоляты aureus были подвергнуты молекулярному типированию и тестированию на чувствительность.Кроме того, 108 изолятов MRSA были выделены у клинических пациентов в штате Северная Дакота и 133 изолятов S . aureus Были включены изолятов от животных и мяса, ранее проанализированных. Носовая коляска S . aureus у здоровых людей составляло 7,6%, и в целом клоны были генетически разнообразны. Ни один из S . aureus штаммов, полученных от здоровых людей, были mecA — или PVL-положительными. В общей сложности 105 (97,2%) изолятов MRSA из клинических случаев содержали ген mecA и 11 (10.2%), выделенные из инфекций кровотока, содержали ген PVL. Самый распространенный профиль сопротивления среди S . aureus от здоровых людей — пенициллин, а от клинических случаев — эритромицин-пенициллин-ципрофлоксацин. Уровень множественной лекарственной устойчивости (МЛУ) у людей составлял 70%. Большая часть S . aureus , несущие гены mecA и PVL, были идентифицированы как ST5 и ST8 и демонстрировали МЛУ. Однако S . Изоляты aureus животного происхождения, использованные для сравнения, показали более низкий уровень МЛУ.Наиболее распространенными профилями устойчивости у изолятов животного происхождения были пенициллин-тетрациклин и пенициллин-тетрациклин-эритромицин у животных и сырого мяса, соответственно. ST5 также был обнаружен у животных и мяса, причем основными клонами были ST9 и ST398. Генетическое сходство между клонами от человека и мяса предполагает риск распространения S . aureus в пищевой цепи.
Образец цитирования: Velasco V, Buyukcangaz E, Sherwood JS, Stepan RM, Koslofsky RJ, Logue CM (2015) Характеристика Staphylococcus aureus от людей и сравнение с изолятами животного происхождения в Северной Дакоте, США.PLoS ONE 10 (10): e0140497. https://doi.org/10.1371/journal.pone.0140497
Редактор: Патрик М. Шливерт, Медицинский колледж Карвер Университета Айовы, США
Поступила: 2 июля 2015 г .; Принята к печати: 25 сентября 2015 г .; Опубликован: 20 октября 2015 г.
Авторские права: © 2015 Velasco et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах документ и вспомогательные информационные файлы к нему.
Финансирование: Эта работа была поддержана деканатом Колледжа сельского хозяйства, продовольственных систем и природных ресурсов Государственного университета Северной Дакоты (Валерия Веласко), деканатом Колледжа ветеринарной медицины Университета штата Айова, Эймс, США. Айова; и Комиссия по научно-исследовательским проектам Университета Улудаг (Проект YDP (V) -2009/4) (Эсра Буюкчангаз). Спонсоры не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
За последние несколько десятилетий у многих видов бактерий выработалась устойчивость к противомикробным препаратам, которые обычно применялись для их лечения [1]. Staphylococcus aureus — один из патогенов, который, как известно, быстро развивает устойчивость к противомикробным препаратам по мере появления новых антибиотиков [2]. Через пару лет после внедрения пенициллина в клиническую медицину появился первый устойчивый к пенициллину S .Было обнаружено aureus . Первый метициллин-устойчивый S . штаммов aureus (MRSA) были идентифицированы из клинических образцов в 1961 г .; через два года после того, как в качестве антибиотика был введен метициллин [3, 4].
Метициллин-устойчивый S . aureus был причастен к инфекциям, связанным с сообществом (CA-MRSA), медицинским (HA-MRSA) и связанным с домашним скотом (LA-MRSA) инфекциями во всем мире. В США носовой лафет S . aureus у людей составляло 29% (78,9 миллиона человек), а MRSA — примерно 1,5% (4,1 миллиона человек) в 2003–2004 годах [5]. В 2005 году было около 478 000 госпитализаций, что соответствует шиллингов . aureus инфекций, примерно 278 000 из них были связаны с MRSA [6]. Кроме того, около 94 000 человек заболели инвазивной инфекцией MRSA, что привело к 19 000 смертельным исходам. Распределение этих инфекций составило примерно 86% HA-MRSA и 14% CA-MRSA [7].Однако клоны HA-MRSA постепенно заменяются штаммами CA-MRSA из-за увеличения резервуара сообщества и увеличения притока в больницу людей, у которых есть CA-MRSA [8, 9].
Животные-производители мяса также были идентифицированы как носители MRSA [10–12]. Более того, было обнаружено, что мясо в розничной торговле также может быть заражено MRSA [13–15]. Эти данные усилили опасения, что пища может служить средством передачи MRSA среди людей [16].
Устойчивость к метициллину в S . aureus в первую очередь опосредуется геном mecA , который кодирует низкоаффинный пенициллин-связывающий белок 2a (PBP2a) [17, 18]. Недавно новый ген гомолог mecA ( mecA LGA251 , переименованный в mecC ) был обнаружен в S . aureus штаммов людей и домашнего скота, которые были фенотипически устойчивы к метициллину, но дали отрицательный результат на ген mecA .Ген mecC демонстрирует примерно 70% гомологию последовательности с геном mecA и расположен на хромосоме стафилококковой кассеты mec типа XI (type-XI SCC mec ) [19–22]. Среди факторов вирулентности ген, кодирующий лейкоцидин Пантона-Валентайна (PVL), был связан с большинством штаммов CA-MRSA [23, 24], которые вызывают тяжелые кожные инфекции и некротическую пневмонию [25].
Различные клоны метициллин-чувствительных S . aureus (MSSA) и MRSA были обнаружены у людей, а также у животных и мяса в магазинах. Обычно клоны, вызывающие инфекции CA-MRSA (USA300 и USA400), отличаются от клонов, вызывающих инфекции HA-MRSA (USA100 и USA200) [26]. Были идентифицированы некоторые типы последовательностей (ST), связанные с HA-MRSA, в том числе: ST5, ST8, ST22, ST36, ST45 и другие [27]. Типы последовательностей ST30 и ST80 были связаны с CA-MRSA [28], а ST398 — с животными [10, 29]. Типы последовательностей ST398 и ST9 были обнаружены как у животных (свиньи), так и у мяса (свинины) с генетическим сходством между S . aureus штаммов из этих разных источников [15]. Однако клональный тип ST398 также был обнаружен у людей [10, 29].
Целью этого исследования было идентифицировать и охарактеризовать Staphylococcus aureus , выделенных от человека, и сравнить молекулярные характеристики и чувствительность к антимикробным препаратам с S . aureus изолятов животных и мяса.
Материалы и методы
Образцы
Всего было получено 550 образцов мазков из носа у студентов, зачисленных на факультет ветеринарных и микробиологических наук Государственного университета Северной Дакоты, которые считались здоровыми людьми.Образцы были получены из чашек, используемых в классе, которые были выброшены в конце исследования, таким образом, ни один из полученных изолятов не был идентифицирован с помощью обратного отслеживания. Выборки были собраны в осеннем семестре 2010 г. ( n = 231) и в весеннем семестре 2011 г. ( n = 319). Кроме того, в общей сложности 108 изолятов MRSA, выделенных из клинических случаев MRSA, пораженных раневыми инфекциями и инфекциями кровотока (сепсис, кость, спинномозговая жидкость [CSF], синовиальная жидкость, субдуральная жидкость, ткань, язва ног и плевральная жидкость) были получены из Департамент здравоохранения Северной Дакоты (Бисмарк, Северная Дакота) летом 2010 года.
Всего 133 S . aureus штаммов, выделенных от животных (свиней, n = 30; овец, n = 26; крупного рогатого скота, n = 2), сырого мяса (свинина, n = 35; курица, n = 25; говядина, n = 9) и мясные деликатесы (ветчина, n = 4; курица, n = 2) были использованы для сравнения молекулярных характеристик и чувствительности к антимикробным препаратам с S . aureus изолятов от человека.Модель S . aureus штаммов животного происхождения были выделены и проанализированы, как описано ранее Buyukcangaz et al . (2013) [15] (Таблицы 1 и 2).
Institutional Review Board (IRB) был запрошен для человеческих изолятов, и исследование было признано освобожденным от NDSU IRB. Утверждение Институционального комитета по уходу и использованию животных (IACUC) было использовано для работы с животными, как описано ранее [15].
Метод культивирования
Носовые мазки были взяты у здоровых людей с помощью стерильного смоченного тампона, вставленного в ноздрю на глубину примерно 1 см и повернутого пять раз.У каждого испытуемого брали пробы из обеих ноздрей с помощью одного и того же тампона. Назальные мазки инокулировали на чашки с маннитоловым агаром (MSA) (Becton, Dickinson and Company [BD], Sparks, MD) и инкубировали при 37 ° C в течение 48 часов. После инкубации были отобраны все колонии, окруженные желтыми зонами на MSA. Колонии с розовыми или красными зонами на MSA были исключены.
Все предполагаемые S . aureus колоний были подтверждены биохимическим тестированием с использованием планшетов Sensititre Gram Positive ID (GPID) (Sensititre ® , TREK Diagnostic Systems Ltd., Кливленд, Огайо) в соответствии с рекомендациями производителя.
Изоляты Staphylococcus aureus от здоровых людей и изоляты MRSA из клинических случаев до использования хранили при -80 ° C в инфузионном бульоне мозг-сердце (BD), содержащем 20% глицерина.
Мультиплексная полимеразная цепная реакция (мПЦР)
Staphylococcus aureus штаммов от здоровых людей и из клинических случаев, хранящихся при -80 ° C, помещали в чашки с триптиказо-соевым агаром (TSA) и инкубировали при 37 ° C в течение 18–24 часов.Экстракцию ДНК проводили путем суспендирования одной колонии в 50 мкл дистиллированной воды, не содержащей ДНКазы / РНКазы (Gibco Invitrogen, Гранд-Айленд, Нью-Йорк, США), нагревания (99 ° C, 10 мин) и центрифугирования (30,000 × g). , 1 мин) для удаления клеточного мусора. Оставшуюся ДНК переносили в новую пробирку и хранили при -20 ° C до использования.
Мультиплексный ПЦР-анализ был использован для обнаружения: 16S рРНК (идентификация S . aureus ), mecA (связанного с устойчивостью к метициллину) и генов, кодирующих PVL (фактор вирулентности) (Таблица 3).Два микролитра ДНК-матрицы (описанной выше) добавляли к 50 мкл конечной реакционной смеси: 1X реакционный буфер Go Taq ® (pH 8,5), 1,25 ед. ДНК-полимеразы Go Taq ® , 200 мкМ dNTP (Promega, Мэдисон, Висконсин, США) и 1 мкМ праймеров (16S рРНК, mecA , LukS / F-PV) (Integrated DNA Technologies, Inc., Coralville, IA, USA). Условия реакций ПЦР регулировали в соответствии с протоколом, описанным Makgotlho et al . (2009) [30] с использованием термоциклера (Eppendorf, Гамбург, Германия).
Таблица 3. Нуклеотидная последовательность праймеров, использованных для обнаружения 16S рРНК, mecA , лейкоцидин Пантона-Валентайна, mecA LGA251 , arcC , aroE , p0007 p0007 g0007k, glpF6 , , tpi и yqiL гены.
https://doi.org/10.1371/journal.pone.0140497.t003
Продукты mPCR (10 мкл) загружали в 1,5% (вес / объем) агарозный гель (Agarose I TM ) с использованием загрузки EzVision One. красителя (Amresco, Solon, Огайо, США) и электрофорез проводили в 1X буфере TAE при 100 об. в течение 1 ч.Маркер молекулярной массы 100-п.н. лестницы (Promega, Мэдисон, Висконсин, США) и отрицательный (дистиллированная вода, не содержащая ДНКазы / РНКазы) и положительный контроль ( S , aureus ATCC 33591; MRSA) были включены в каждый гель. Полосы, соответствующие каждому гену, визуализировали с использованием УФ-сканера Alpha Innotech (FluorChem TM ).
Все клинические изоляты MRSA, которые были отрицательными по гену mecA с помощью анализа mPCR, были подвергнуты обнаружению гена mecC (таблица 3) с помощью ПЦР в соответствии с протоколом, описанным Stegger et al .(2011) [31].
Гель-электрофорез в импульсном поле (PFGE)
Использовался протокол PulseNet с небольшими изменениями [26]. Вкратце S . штаммов aureus выделяли из замороженного материала на чашки с TSA и инкубировали при 37 ° C в течение 18-24 часов. Единственную колонию высевали на вторую чашку TSA и инкубировали при 37 ° C в течение 18-24 часов. Колонии переносили в полистирольные круглодонные пробирки объемом 5 мл, содержащие 2 мл буфера для клеточной суспензии (100 мМ Трис-HCl [pH 8.0], Invitrogen; 100 мМ ЭДТА [pH 8,0], Gibco), доводя концентрации клеток до оптической плотности от 0,9 до 1,1 с помощью спектрофотометра (Smart Spec TM plus, Bio-Rad Laboratories, США) при 610 нм. Следующие шаги (подготовка пробки, лизис, отмывка и рестрикционное переваривание ферментом SmaI ) были выполнены в соответствии с протоколом PulseNet. В качестве ДНК-маркера использовали Salmonella Branderup H9812 [32].
Электрофорез проводили на установке Chef Mapper (Bio-Rad Laboratories) PFGE с начальным временем переключения 5 с, окончательным временем переключения 40 с и общим временем работы 17 ч 45 мин.Гели окрашивали бромидом этидия (1,5 мкг / мл), а затем модели макрорестрикции визуализировали с использованием имидж-сканера UVP (UVP, Upland, CA).
Макрорестрикционные паттерны Staphylococcus aureus. изолятов от людей, животных и мяса были проанализированы с использованием программного обеспечения BioNumerics Fingerprinting (Ver 6.6 Applied Math, Остин, Техас). Индекс сходства был рассчитан с использованием коэффициента Дайса, допуска положения полосы 1% и оптимизации 0,5%. Метод невзвешенных пар с алгоритмом среднего арифметического (UPGMA) был использован для построения дендрограммы, и кластеры были выбраны с использованием порогового значения на уровне 80% генетического сходства [26].
Мультилокусное типирование последовательностей (MLST)
После построения дендрограммы (PFGE), содержащей S . aureus , по крайней мере, один изолят человека из каждого кластера был выбран в качестве представителя группы для анализа MLST. Штаммы S . aureus от животных и мяса были включены для сравнения, а ST были получены из предыдущей работы [15]. Секвенирование продуктов ПЦР MLST выбранных человеческих изолятов проводили в Центре секвенирования ДНК Университета штата Айова (Эймс, Айова).Вкратце S . изолятов aureus наносили на чашки с TSA и инкубировали при 37 ° C в течение 18-24 часов. Экстракцию ДНК из клеток проводили методом кипячения, как описано выше.
Были амплифицированы внутренние фрагменты следующих семи генов домашнего хозяйства: arcC , aroE , glpF , gmk , pta , tpi и yqiL (таблица 3; данные S1) [33]. . Все реакции ПЦР проводили в объемах 50 мкл: 1 мкл ДНК-матрицы, ДНК-полимеразы Taq (Promega) (1.25 ед.), Буфер для 1X ПЦР (Promega), праймеры (0,1 мкМ) (Integrated DNA Technologies, Inc.) и dNTP (200 мкМ) (Promega). Условия ПЦР были скорректированы в соответствии с протоколом, описанным Enright et al . (2000) [33] с использованием термоциклера (Eppendorf). Десять микролитров продуктов ПЦР загружали в 1% агарозные гели в 1X TAE с загрузочным красителем EzVision One и проводили электрофорез при 100 В в 1X TAE в течение 1 часа. Изображения были получены с помощью тепловизора Alpha Innotech.
Очистку ампликона проводили с использованием набора для очистки ПЦР QIAquick ® (Qiagen, Valencia, CA) в соответствии с инструкциями производителя.Очищенные продукты ПЦР секвенировали в ДНК-лаборатории Университета штата Айова (Эймс, Айова) с использованием анализатора ДНК Applied Biosystems 3730xl (Applied Biosystems, Фостер-Сити, Калифорния). Данные последовательностей были импортированы в DNAStar (Lasergene, Madison, WI), обрезаны и выровнены с контрольными последовательностями (с сайта MLST) и опрошены по базе данных MLST (http://saureus.mlst.net/). Типы последовательности выбранных S . изолятов aureus были добавлены к информации о штаммах для анализа в программе BioNumerics.
Тест на чувствительность
Изоляты Staphylococcus aureus были подвергнуты тестированию на чувствительность к противомикробным препаратам с использованием метода микроразведения в бульоне и панелей Национальной системы мониторинга устойчивости к противомикробным препаратам (NARMS) (CMV3AGPF, Sensititre ® , Trek Diagnostics) в соответствии со стандартами производителя и клинической лаборатории. (2012) [34] рекомендации. Противомикробные препараты в панели и их контрольные точки устойчивости были следующими: эритромицин (≥8 мкг / мл), тетрациклин (≥16 мкг / мл), ципрофлоксацин (≥4 мкг / мл), хлорамфеникол (≥32 мкг / мл), пенициллин ( ≥0.25 мкг / мл), ванкомицин (≥16 мкг / мл), нитрофурантоин (≥128 мкг / мл), гентамицин (≥16 мкг / мл), хинупристин / далфопристин (≥4 мкг / мл), линезолид (≥8 мкг / мл). мл), канамицин (≥64 мкг / мл) и даптомицин (чувствительный ≤1 мкг / мл). Множественная лекарственная устойчивость (МЛУ) рассматривалась как устойчивость по крайней мере к трем классам протестированных противомикробных препаратов [35] (данные S4).
Результаты
Результаты для идентификации S . Гены aureus (16S рРНК), mecA и PVL в образцах, полученных от людей, показаны в таблице 4 и данных S2 и данных S3.Распространенность носового носительства S . aureus у здоровых людей составляло 7,6%. Ни один из этих изолятов не содержал генов mecA или PVL. Клинические изоляты были идентифицированы как штаммы MRSA в больнице с использованием стандартных микробиологических процедур. Как и ожидалось, все эти изоляты были подтверждены как S . aureus путем обнаружения гена 16S рРНК с помощью ПЦР-анализа. Среди 108 клинических изолятов MRSA 105 (97,2%) несли ген mecA , а 11 (10.2%) несли ген PVL. Интересно, что анализ ПЦР не обнаружил ген PVL в штаммах MRSA, выделенных из клинических случаев, затронутых раневыми инфекциями.
Генетическое сходство между S . aureus, штаммов, выделенных от человека, и S . aureus штаммов животного происхождения были проанализированы с помощью программного обеспечения BioNumerics. На рис. 1 показана дендрограмма, содержащая шаблоны макроограничения S . aureus и тип последовательности (ST) некоторых изолятов из каждого кластера (данные S1).Тридцать четыре S . aureus ST398 штаммов животного происхождения не были включены в дендрограмму, поскольку их не удалось ограничить. Всего наблюдали пятнадцать кластеров, из которых шесть были гомогенными, содержащими один тип изолята исключительно от здоровых людей (кластер 1 и 2), изоляты MRSA из клинических случаев (кластер 9) или изоляты животного происхождения (кластеры 10, 11). и 15). В целом генетическое разнообразие наблюдалось среди изолятов от здоровых людей, классифицированных в различные кластеры по типам последовательностей: ST5, ST15, ST30, ST34, ST39 и ST45.Генетическое сходство наблюдалось между S . aureus штаммов от человека и мяса: кластер 3 (ST39), кластер 4 (ST1), кластер 7 (ST5) и кластер 12 (ST15). В кластере 9 генетическое сходство между mecA -положительными штаммами и одним штаммом, не несущим ни mecA , ни mecC генов, выделенных из клинических случаев, и было идентифицировано как ST8. Кроме того, два клинических изолята, идентифицированных как MRSA ST5, которые были mecA — и mecC -отрицательными, показали генетическое сходство с mecA -положительным S . aureus Штаммы ST5, выделенные от человека и из свинины (кластер 8).
Рис. 1. Дендрограмма, показывающая генетическое сходство между S . aureus изолятов от человека и животного происхождения.
Шкала указывает уровни сходства с вертикальной линией, обозначающей пороговое значение (уровень сходства 80%), числа представляют коды образцов, за которыми справа следуют тип последовательности (ST) и тип образца. * mecA -положительный S . aureus в свинине. ** mecA — и mecC -отрицательный MRSA из клинических случаев.
https://doi.org/10.1371/journal.pone.0140497.g001
Среди противомикробных препаратов, протестированных с использованием критериев интерпретации CLSI [34], большинство изолятов MRSA из клинических случаев были устойчивы к эритромицину, пенициллину и ципрофлоксацину, а S . Изоляты aureus от здоровых людей проявляли резистентность в основном к пенициллину (таблица 5, данные S4).70% штаммов МЛУ были обнаружены у людей, в первую очередь среди клинических изолятов, которые все были идентифицированы как MRSA. У людей один клинический изолят, идентифицированный как MRSA, был чувствителен ко всем антимикробным агентам. Минимальные ингибирующие концентрации (МПК) резистентного S . Штаммы aureus от человека показаны в таблице 6. Высокие МИК наблюдались у большинства устойчивых к пенициллину S . aureus изолятов от человека (8 -> 16 мкг / мл). Большинство устойчивых к ципрофлоксацину S .Изоляты aureus от человека показали MIC> 4 мкг / мл.
Обсуждение
Presumptive S . aureus изолятов на чашках MSA от здоровых людей были подтверждены биохимическим тестированием (идентификационные планшеты Sensititre) со 100% согласованием с ПЦР (обнаружение гена 16S рРНК) (таблица 4). В этом исследовании частота носительства через нос 7,6% наблюдалась для S . aureus , что значительно ниже, чем распространенность, о которой сообщалось в других исследованиях (29–32%) [5, 36].Однако в этих исследованиях рассматривались значительно больший размер выборки, различные демографические характеристики и разные годы выборки как часть национальной репрезентативной оценки носителей S . золотистый . В данном исследовании S . штаммов aureus были выделены от здоровых людей студенческого возраста и не содержали генов mecA или PVL. В других исследованиях сообщается, что частота носительства MRSA составляет примерно 0,8–1,5% среди населения [5, 36], 0.От 5 до 44% у пациентов [37], 20% у медицинских работников [38] и 30% у людей, живущих и работающих на фермах с MRSA-положительными свиньями или пылью [39]. Напротив, Buyukcangaz et al . (2013) [15] не удалось обнаружить гены mecA и PVL в S . изолятов aureus от мясных животных (таблица 1), которые использовались для сравнения с человеческими изолятами в этом исследовании. Однако низкая распространенность S . aureus , несущий ген mecA , был обнаружен в свинине.
Доля MRSA по отношению ко всем S . aureus Штаммы , вызывающие инфекции, до сих пор неизвестны, что затрудняет точную оценку масштабов инфекций MRSA и разработку соответствующей политики действий в отношении здоровья [7, 40]. В этом исследовании три клинических изолята, идентифицированных как MRSA, были отрицательными по гену mecA с использованием протокола, описанного Makgotlho et al. (2009) [30]. По этой причине наличие нового гомолога mecA ( mecA LGA251 или mecC ) оценивали с использованием протокола, описанного Stegger et al.(2011) [31]. Однако эти штаммы были отрицательными по гену mecC (фрагменты 138 и 718 п.н.), но были положительны при тестировании на фрагмент 356 п.н. с использованием вырожденных праймеров. Следовательно, необходимо провести дальнейшие исследования для определения генетической изменчивости этого варианта mecA . Кроме того, известно, что S имеет пограничную устойчивость к оксациллину. aureus (BORSA) демонстрирует промежуточный уровень устойчивости к оксациллину, который не опосредуется mecA [41, 42].Все mecA — и mecC — отрицательный S . штаммов aureus , идентифицированных как MRSA, были подвергнуты испытанию на чувствительность к оксациллину. Один из этих изолятов обладал промежуточным уровнем устойчивости к оксациллину (2–4 мкг / мл) [34], что можно было рассматривать как BORSA. Различные модификации генов PBP, вызывающие аминокислотные замены в домене транспептидазы, также связаны с пограничной устойчивостью [41].
Фактор вирулентности PVL был обнаружен в этом исследовании у 11 человек.1% изолятов MRSA из клинических случаев, идентифицированных как инфекции кровотока. Изоляты MRSA из случаев, идентифицированных как раневые инфекции, не содержали гена PVL. Токсин PVL представляет собой порообразующий белок, который, по-видимому, связан с повышением тяжести заболевания ( mecA -позитивный S ). aureus штаммов, в первую очередь связанных с инфекциями кровотока [24]. Хотя ген PVL считается стабильным маркером CA-MRSA, некоторые штаммы CA-MRSA оказались PVL-отрицательными [9].
В данном исследовании около S . штаммов aureus , выделенных от людей каждого кластера на дендрограмме (рис. 1), подвергали MLST для определения типа последовательности. В целом, у здоровых людей наблюдались разные клоны, что указывает на наличие генотипически разнообразного S . aureus клонов, циркулирующих в сообществе. Хотя MRSA не был обнаружен у здоровых людей, они могут стать носителями с риском распространения инфекции среди населения [38].Метициллин-устойчивый S . штаммов aureus , выделенных из клинических случаев в этом исследовании, имели более низкое генетическое разнообразие и в основном относились к ST5 и ST8. Ранее и ST5, и ST8 были связаны с инфекциями HA-MRSA [27, 42]. Описание генетических характеристик клонов MRSA, связанных с инвазивными инфекциями человека, могло бы помочь сосредоточить усилия на изучении наиболее распространенных клонов, циркулирующих в больничной среде.
Молекулярные характеристики S . штаммов aureus , выделенных от человека, также сравнивали с изолятами животного происхождения. Генетическое сходство наблюдалось между mecA — и mecC -отрицательными изолятами MRSA из клинических случаев и mecA -положительным S . aureus штаммов, выделенных из клинических случаев и свинины, что предполагает модификации, происходящие в генах PBP в mecA — и mecC -отрицательных штаммах MRSA [41], потенциально приводящих к небольшим изменениям в наблюдаемых макрорестрикционных моделях.
Загрязнение мяса S . aureus штаммов животных и людей могут встречаться во время забоя или переработки. В этом исследовании генетическое сходство между человеческими штаммами и мясом предполагает заражение сырого мяса во время обработки. Кроме того, генетическое сходство между S . aureus Ранее было обнаружено штаммов, выделенных от мясных животных и розничной торговли мясом, что также подтверждает заражение мяса во время забоя [15].В этом исследовании другие S . aureus штаммов, которые ранее были связаны с LA-MRSA и свиноводами, такие как ST398 и ST9 [10, 15, 29], не были обнаружены в S . aureus изолятов от человека. Однако Сун и др. . (2008) [43] обнаружили, что линии животных были тесно связаны с линиями человеческих, что могло быть связано с адаптивным поведением S . aureus [44].
В этом исследовании устойчивость к пенициллину преобладала в S . aureus штаммов, выделенных от здоровых людей, и профили устойчивости Ery-Pen-Cip и Ery-Pen-Cip-Kan были наиболее распространены у изолятов MRSA из клинических случаев (Таблица 5). Сравнение образцов устойчивости к противомикробным препаратам человеческих изолятов с S . aureus изолятов животного происхождения, некоторые отличия не наблюдались (таблица 2). Согласно критериям интерпретации CLSI (2012) [34], большинство S . aureus изолятов животных проявили устойчивость к пенициллину и тетрациклину, а изоляты из розничного мяса — к бывшим антибиотикам и эритромицину.Тетрациклин-устойчивый S . штаммов aureus были выделены от животных и розничного мяса, однако устойчивый к ципрофлоксацину S . штаммов aureus В клинических изолятах обнаружено штаммов. Более высокая ставка MDR . штаммов aureus были получены от людей, а не от животных и мяса, что может быть связано с большим количеством штаммов MRSA из клинических случаев, затронутых острыми инфекциями, которые были включены в это исследование. Было обнаружено, что большинство штаммов MRSA, выделенных из клинических случаев, имеют МЛУ [45].Кроме того, клинические изоляты (обозначенные как MRSA) показали более высокие значения MIC для пенициллина (таблица 6), чем S . aureus штаммов, полученных от животных и мяса [15], что свидетельствует о потенциальном влиянии обработки или воздействия на выбор устойчивых штаммов. В этом исследовании все S . штаммов aureus были чувствительны к линезолиду, который считался хорошей альтернативой для лечения MDR S . aureus [46]. Критерии CLSI (2012) [34] устанавливают чувствительность к даптомицину при МПК ≤1 мкг / мл, поэтому в клинических изолятах МПК 2 и 4 мкг / мл считались нечувствительными изолятами.Интерпретация результатов для гентамицина, канамицина и пенициллина может быть неоднозначной из-за их принятых контрольных точек и ограниченных разведений, доступных на панели NARMS. Например, все S . штаммов aureus , выделенных от людей, продемонстрировали МИК ≤128 мкг / мл для гентамицина, который имеет точку разрыва ≥16 мкг / мл; для канамицина и пенициллина примерно S . Штаммы aureus показали МПК ≤128 мкг / мл и ≤0,25 мкг / мл, соответственно, однако критерии CLSI рекомендуют контрольную точку ≥64 мкг / мл и ≥0.25 мкг / мл в качестве сопротивления. Следовательно, для интерпретации некоторых видов устойчивости может потребоваться дальнейшая оценка с использованием более широкого диапазона разведения противомикробных препаратов, чтобы улучшить интерпретацию результатов тестирования чувствительности для этих антибиотиков.
Заключение
Носовая тележка S . aureus у здоровых людей, по-видимому, является низким, с генотипически разнообразными клонами и mecA — и PVL-отрицательными. Staphylococcus aureus штаммов, несущих гены mecA и PVL, присутствовали в клинических изолятах от пациентов, пострадавших от инвазивных инфекций, и большинство этих изолятов имели ST5 и ST8 и демонстрировали профили МЛУ.Генетическое сходство наблюдалось между S . aureus штаммов, выделенных от людей и сырого мяса, что позволяет предположить, что заражение мяса во время обработки или обработки может представлять риск передачи человеку.
Благодарности
Эта работа была поддержана деканом Колледжа сельского хозяйства, продовольственных систем и природных ресурсов Государственного университета Северной Дакоты (Валерия Веласко), деканатом Колледжа ветеринарной медицины Университета штата Айова, Эймс, Айова; и Комиссия по научно-исследовательским проектам Университета Улудаг (Проект YDP (V) -2009/4) (Эсра Буюкчангаз).
Вклад авторов
Задумал и спроектировал эксперименты: CML VV. Проведены эксперименты: CML VV EB JSS RMS RJK. Проанализированы данные: CML VV EB. Предоставленные реагенты / материалы / инструменты анализа: CML. Написал статью: CML VV EB JSS TMS RJK.
Ссылки
- 1. Шварц MN. Использование противомикробных средств и лекарственная устойчивость. N Engl J Med. 1997; 337: 491–492. pmid: 9250853
- 2. Lowy FD. Устойчивость к противомикробным препаратам: на примере Staphylococcus aureus .J Clin Invest. 2003; 111: 1265–1273. pmid: 12727914
- 3. Джевонс МП. Цельбенин-устойчивые стафилококки. Br Med J. 1961; 1: 124–125.
- 4. de Lencastre H, Oliveira D, Tomasz A. Устойчивый к антибиотикам Staphylococcus aureus : парадигма адаптивной силы. Curr Opin Microbiol. 2007. 10: 428–435. pmid: 174
- 5. Горвиц Р.Дж., Крусзон-Моран Д., Макаллистер С.К., Маккуиллан Дж., Макдугал Л.К., Фошхейм Г.Е. и др. Изменения в распространенности колонизации носа Staphylococcus aureus в США, 2001–2004 гг.J Infect Dis. 2008; 197: 1226–1234. pmid: 18422434
- 6. Кляйн Э., Смит Д.Л., Лаксминараян Р. Госпитализации и смерти, вызванные устойчивым к метициллину Staphylococcus aureus , США, 1999–2005 гг. Emerg Infect Dis. 2007; 13: 1840–1846. pmid: 18258033
- 7. Клевенс Р.М., Моррисон М.А., Надл Дж., Пети С., Гершман К., Рэй С. и др. Инвазивные метициллин-устойчивые инфекции Staphylococcus aureus в США. J Am Med Assoc.2007; 298: 1763–1771.
- 8. D’Agata EMC, Webb GF, Horn MA, Moellering RC Jr., Ruan S. Моделирование проникновения в больницы внебольничных устойчивых к метициллину бактерий Staphylococcus aureus . Clin Infect Dis. 2009. 48: 274–284. pmid: 154
- 9. Ниммо Г.Р., Берг Х., Накос Дж., Уилли Д., Маркиз Дж., Гюйгенс Ф. и др. Замена ассоциированного со здравоохранением MRSA на ассоциированный с сообществом MRSA в Квинсленде: подтверждение генотипированием. J Infect. 2013; 67: 439–447.pmid: 23872210
- 10. ван Белкум А., Меллес Д.К., Петерс Дж.К., ван Леувен В.Б., ван Дуйкерен Э., Хуйсденс С.В. и др. Метициллин-устойчивый и чувствительный к Staphylococcus aureus тип последовательности 398 у свиней и людей. Emerg Infect Dis. 2008. 14: 479–483. pmid: 18325267
- 11. Guardabassi L, O’Donoghue M, Moodley A, Ho J, Boost M. Новая линия метициллин-устойчивого Staphylococcus aureus , Гонконг. Emerg Infect Dis. 2009; 15: 1998–2000.pmid: 19961685
- 12. Persoons D, Van Hoorebeke S, Hermans K, Butaye P, de Kruif A, Haesebrouck F и др. Метициллин-устойчивый Staphylococcus aureus у домашней птицы. Emerg Infect Dis. 2009. 15: 452–453. pmid: 19239762
- 13. де Бур Э., Цварткруис-Науис Дж. Т., Вит Б., Хёйсденс XW, де Нилинг А. Дж., Бош Т. и др. Распространенность метициллин-устойчивого Staphylococcus aureus в мясе. Int J Food Microbiol. 2009. 134: 52–56. pmid: 132
- 14.Pu S, Han F, Ge B. Выделение и характеристика устойчивых к метициллину штаммов Staphylococcus aureus из розничных мясных продуктов Луизианы. Appl Environ Microbiol. 2009. 75: 265–267. pmid: 18978079
- 15. Buyukcangaz E, Velasco V, Sherwood JS, Stepan RM, Koslofsky RJ, Logue CM. Молекулярное типирование золотистого стафилококка и метициллин-устойчивого золотистого стафилококка (MRSA), выделенных из мяса и животных в розничной торговле в Северной Дакоте, США. Foodborne Pathog Dis. 2013; 10: 608–617.pmid: 23638848
- 16. О’Брайен А.М., Хэнсон Б.М., Фарина С.А., Ву Дж.Й., Симмеринг Дж.Э., Вардин С.Е. и др. MRSA в обычных и альтернативных продуктах из свинины в розничной торговле. PLoS One. 2012; 7 (1): e30092. pmid: 22276147
- 17. Хартман Б., Томаш А. Измененные пенициллин-связывающие белки в метициллин-устойчивых штаммах Staphylococcus aureus . Противомикробный. Агенты Chemother. 1981; 19: 726–735. pmid: 7294764
- 18. Ван Де Гринд П., Хервальдт Л.А., Алвис Б., ДеМартино М., Хейльманн К., Доерн Г. и др.Метициллин-резистентный Staphylococcus aureus , Айова, США. Emerg Infect Dis. 2009; 15: 1582–1589. pmid: 19861049
- 19. Гарсиа-Альварес Л., Холден М.Т.Г., Линдси Х., Уэбб С.Р., Браун Д.Ф.Дж., Карран М.Д. и др. Метициллин-устойчивый Staphylococcus aureus с новым гомологом mecA в популяциях людей и крупного рогатого скота в Великобритании и Дании: описательное исследование. Ланцет. 2011; 11: 595–603. pmid: 21641281
- 20. Ито Т., Хирамацу К., Томаш А., де Ленкаср Х., Перретен В., Холден MTG и др.Руководство по сообщению о новых гомологах гена mecA . Противомикробный. Агенты Chemother. 2012; 56: 4997–4999. pmid: 22869575
- 21. Лоран Ф., Шардон Х., Хэнни М, Бес М, Реверди М-Е, Мадек Дж-Й и др. MRSA, несущий mec A, вариантный ген mec C, Франция. Emerg Infect Dis. 2012; 18: 1465–1467. pmid: 22932400
- 22. Петерсен А., Стеггер М., Хельтберг О., Кристенсен Дж., Цойтен А., Кнудсен Л.К. и др. Эпидемиология метициллин-устойчивого Staphylococcus aureus , несущего новый ген mecC в Дании, подтверждает наличие зоонозного резервуара с передачей человеку.Clin Microbiol Infect. 2012; 19: E16 – E22. pmid: 23078039
- 23. Баба Т., Такеучи Ф., Курода М., Юдзава Х., Аоки К., Огучи А. и др. Геном и детерминанты вирулентности внебольничного MRSA с высокой вирулентностью. Ланцет. 2002; 359: 1819–1827.
- 24. Dufour P, Gillet Y, Bes M, Lina G, Vandenesch F, Floret D и др. Внебольничные инфекции, устойчивые к метициллину Staphylococcus aureus во Франции: появление единственного клона, продуцирующего лейкоцидин Пантона-Валентайна.Clin Infect Dis. 2002; 35: 819–824. pmid: 12228818
- 25. Эберт МД, Шет С, Фишман Э. Некротическая пневмония, вызванная внебольничным метициллин-устойчивым золотистым стафилококком: все более частая причина «хаоса в легких». Emerg Radiol. 2009. 16: 159–162. pmid: 18274797
- 26. Макдугал Л.К., Стюард С.Д., Киллгор Г.Е., Чайтрам Дж.М., Макаллистер С.К., Теновер ФК и др. Типирование с помощью гель-электрофореза в импульсном поле изолятов Staphylococcus aureus , устойчивых к оксациллину, из США: создание национальной базы данных.J Clin Microbiol. 2003; 41: 5113–5120. pmid: 14605147
- 27. Деуренберг Р. Х., Винк С., Каленич С., Фридрих А. В., Брюггеман, Калифорния, Стобберинг Э. Молекулярная эволюция метициллин-устойчивого Staphylococcus aureus . Clin Microbiol Infect. 2007. 13: 222–235. pmid: 173
- 28. Стенхем М., Ортквист А., Рингберг Х., Ларссон Л., Олссон-Лильеквист Б., Хеггман С. и др. Импортный метициллин-устойчивый Staphylococcus aureus , Швеция. Emerg Infect Dis.2010. 16: 189–196. pmid: 20113546
- 29. Krziwanek K, Metz-Gercek S, Mittermayer H. Устойчивый к метициллину Staphylococcus aureus ST398 от пациентов-людей, Верхняя Австрия. Emerg Infect Dis. 2009. 15: 766–769. pmid: 19402964
- 30. Макготлхо П.Е., Кок М.М., Хусен А., Лекалакала Р., Омар С., Дав М. и др. Молекулярная идентификация и генотипирование изолятов MRSA. FEMS Immunol Med Microbiol. 2009. 57: 104–115. pmid: 19712080
- 31. Стеггер М., Андерсен П.С., Кернс А., Пишон Б., Холмс М.А., Эдвардс Г. и др.Быстрое обнаружение, дифференциация и типирование метициллин-устойчивого Staphylococcus aureus , несущего либо mecA , либо новый гомолог mecA mecA LGA251. Clin Microbiol Infect. 2011; 18: 385–400.
- 32. Ribot EM, Fair MA, Gautom R, Cameron DN, Hunter SB, Swaminathan B, et al. Стандартизация протоколов гель-электрофореза в импульсном поле для определения подтипов Escherichia coli O157: H7, Salmonella и Shigella для PulseNet.Foodborne Pathog Dis. 2006; 3: 59–67. pmid: 16602980
- 33. Энрайт М.С., Дэй Н.П., Дэвис К.Э., Пикок С.Дж., Спратт Б.Г. Мультилокусное типирование последовательностей для характеристики метициллин-устойчивых и метициллин-чувствительных клонов Staphylococcus aureus . J Clin Microbiol. 2000; 38: 1008–1015. pmid: 10698988
- 34. [CLSI] Институт клинических и лабораторных стандартов. Стандарты производительности для тестирования чувствительности к противомикробным препаратам. 22-е информационное приложение.Документ 2012; M100-S22. CLSI, Уэйн, Пенсильвания.
- 35. Айдын А., Муратоглу К., Судагидан М., Бостан К., Окуклу Б., Харса С. Распространенность и устойчивость к антибиотикам изолятов золотистого стафилококка пищевого происхождения в Турции. Foodborne Pathog Dis. 2011; 8: 63–69. pmid: 21039132
- 36. Майноус А.Г. III, Хьюстон В.Дж., Эверетт К.Дж., Диас В.А. Носительство Staphylococcus aureus и метициллин-резистентного S. aureus через нос в США, 2001–2002 гг. Ann Fam Med. 2006. 4: 132–137. pmid: 16569716
- 37.Tiemersma EW, Bronzwaer SLAM, Lyytikäinen O, Degener JE, Schrijnemakers P, Bruinsma N, et al. Метициллин-устойчивый Staphylococcus aureus в Европе, 1999–2002 гг. Emerg Infect Dis. 2004; 10: 1627–1634. pmid: 15498166
- 38. Кумар П., Шукла И., Варшней С. Носовой скрининг медицинских работников на предмет носительства коагулаза-положительного MRSA и распространенности носовой колонизации Staphylococcus aureus. Biol Med. 2011; 3: 182–186.
- 39. Van Den Broek IVF, Van Cleef BAGL, Haenen A, Broens EM, Van Der Wolf PJ, Van Den Broek JM, et al.Метициллин-устойчивый Staphylococcus aureus у людей, живущих и работающих на свинофермах. Epidemiol Infect. 2009. 137: 700–708. pmid: 18947444
- 40. Moxnes JF, de Blasio BF, Leegaard TM, Fossum Moen AE. Метициллин-устойчивый золотистый стафилококк (MRSA) растет в Норвегии: анализ временных рядов зарегистрированных случаев MRSA и метициллин-чувствительных случаев S. aureus, 1997–2010 гг. PLoS One. 2013; 8 (8): e70499. pmid: 23936442
- 41. Надараджа Дж., Ли MJS, Луи Л., Джейкоб Л., Симор А.Е., Луи М. и др.Идентификация различных клональных комплексов и разнообразных аминокислотных замен в пенициллин-связывающем белке 2 (PBP2), связанных с устойчивостью к бодерлин-оксациллину, в изолятах канадского Staphylococcus aureus. J Med Microbiol. 2006; 55: 1675–1683. pmid: 17108271
- 42. Стефани С., Чанг Д. Р., Линдси Дж. А., Фридрих А. В., Кернс А. М., Вест Х. и др. Метициллин-устойчивый золотистый стафилококк (MRSA): глобальная эпидемиология и гармонизация методов типирования. Int J Antimicrob Agents.2012; 39: 273–282. pmid: 22230333
- 43. Сун JML, Ллойд DH, Линдси Дж. Staphylococcus aureus Специфичность хозяина: сравнительная геномика изолятов человека и животных с помощью мультиштаммового микроматрицы. Microbiol. 2008; 154: 1949–1959.
- 44. Маккарти А. Дж., Линдси Дж. А., Лёффлер А. Все ли устойчивые к метициллину Staphylococcus aureus (MRSA) одинаковы у всех хозяев? Эпидемиологическое и генетическое сравнение MRSA животных и человека. Vet Dermatol. 2012; 23: 267 – e54.pmid: 22823579
- 45. Арора С., Деви П., Арора Ю., Деви Б. Распространенность метициллин-устойчивого золотистого стафилококка (MRSA) в больнице третичного уровня в Северной Индии. Врачи лаборатории J. 2014; 2: 79–81.
- 46. Кишор С., Верма Д., Сиддик М. Сравнение активности линезолида и ванкомицина in vitro против золотистого стафилококка, выделенного из больницы третичного уровня. J Clin Diagn Res. 2014; 8: DC12 – DC15. pmid: 24995175
- 47. МакКлюр Дж. А., Конли Дж. М., Лау В., Эльсайед С., Луи Т., Хатчинс В. и др.Новый метод мультиплексной ПЦР для обнаружения маркера вирулентности стафилококков, генов лейкоцидинов Panton-Valentine и одновременного выделения метициллин-чувствительных стафилококков и резистентных стафилококков. J Clin Microbiol. 2006; 44: 1141–1144. pmid: 16517915
Влияние Staphylococcus aureus USA 300 Колонизация и кожные инфекции на системные иммунные реакции у людей
Резюме
Staphylococcus aureus одновременно является и комменсалом, и патогеном, а USA300 — штаммом, который обычно устойчив к метициллину, но иногда может быть метициллинорезистентным. восприимчив, вызывает инфекции кожи и мягких тканей (SSTI) в масштабах эпидемии среди здоровых людей.Хотя многие люди колонизированы штаммами S. aureus , в том числе некоторые из них USA300, у некоторых из этих колонизированных особей развиваются SSTI. Это наводит на мысль о том, что инфекции могут развиваться у людей с несколько сниженными врожденными и / или адаптивными иммунными ответами на S. aureus либо потому, что предшествующая колонизация S. aureus избирательно подавляла такие ответы, либо из-за более глобального снижения иммунной реактивности. . В этом исследовании мы проанализировали S.aureus и ответы PBMC на врожденные и адаптивные стимулы у 72 пациентов с SSTI и 143 неинфицированных, демографически сопоставимых контрольных. Вопреки сформулированной гипотезе, PBMC от инфицированных пациентов, полученные во время инфицирования, демонстрировали повышенную продукцию врожденных цитокинов при рестимуляции по сравнению с PBMC от контроля, разница, которая исчезла после разрешения инфекции. Примечательно, что PBMC от пациентов, инфицированных задокументированным SSTI USA300, демонстрировали большую продукцию врожденных цитокинов, чем у пациентов, инфицированных задокументированными генотипами, отличными от USA300.Более того, колонизация USA300 у инфицированных пациентов, независимо от их инфекционного штамма, коррелировала с увеличением продукции IL-10, IL-17A и IL-22 по сравнению с пациентами, колонизированными подтипами, отличными от USA300. Таким образом, наши результаты демонстрируют, что инфицированные пациенты, ассоциированные с USA300 либо как инфекционный штамм, либо как колонизирующий штамм, имеют более сильные системные иммунные ответы, чем те, которые связаны с другими подтипами S. aureus .
Введение
Грамположительная бактерия S.aureus — частый комменсал кожи и слизистых оболочек человека, но он также является наиболее часто изолированным бактериальным патогеном человека и важной причиной инфекций кожи и мягких тканей (SSTI) (1). С середины 1990-х годов произошло резкое увеличение заболеваемости SSTIs, S. aureus , среди населения, проживающего в общинах, при отсутствии частого контакта с системой здравоохранения. Это увеличение совпало с идентификацией новых вирулентных типов штаммов S. aureus , которые обычно устойчивы почти ко всем β-лактамным антибиотикам (устойчивый к метициллину S.aureus [MRSA]). Такие штаммы MRSA, ассоциированные с сообществом, можно отличить на молекулярном уровне от штаммов, связанных со здравоохранением, и, по-видимому, они вызывают инфекции у здоровых людей. С 2001 года в США доминирующим штаммом, вызывающим инфекции в сообществе, является USA300 MRSA, хотя также существуют метициллин-чувствительные штаммы S. aureus (MSSA), имеющие многие генетические характеристики USA300 (2, 3).
Часто упоминается, что 20% человеческой популяции постоянно колонизированы S.aureus (4), хотя распространенность, вероятно, выше (5). Помимо пациентов с иммунными генетическими дефектами, которые, как известно, связаны с рецидивирующими инфекциями S. aureus (6), неясно, почему у некоторых, казалось бы, здоровых людей развивается SSTIs, а у других — нет. Одна из возможностей состоит в том, что у людей с немного более низкими иммунными ответами (слева от гауссовского распределения нормальных иммунных ответов) развиваются SSTI. Действительно, полиморфизмы генов цитокинов IL6 , TNF , IL10 , IL17A и IFNG , а также в гене модуляции врожденного иммунитета TLR10 , были связаны с восприимчивостью к сложным SSTI, хотя, как эти полиморфизмы влияют на уровни цитокинов, не решено (7, 8).Альтернативная возможность состоит в том, что колонизация S. aureus может привести к толерантности иммунной системы к Ag S. aureus или микробным продуктам, как таковая, предрасполагая человека к последующим инфекциям любым штаммом S. aureus . Это возможно, поскольку суперантигенные свойства S. aureus могут приводить к делеции или анергии всего семейства Т-клеток Vβ (9), а десенсибилизация рецепторов распознавания образов может происходить в врожденных клетках после воздействия определенных микробных продуктов. (10).
Инфекции, вызванные S. aureus , могут активировать как врожденные, так и адаптивные иммунные клетки. TLR2 клеточной поверхности и цитозольный нуклеотид-связывающий домен олигодимеризации 2 являются основными рецепторами распознавания молекулярных паттернов микробов, которые, как известно, сигнализируют иммунным клеткам во время инфекции S. aureus (11). Активированные врожденные клетки продуцируют воспалительные цитокины, включая IL-6, которые способствуют выработке C-реактивного белка, примитивного опсонина и активатора комплемента (12). Связь между наличием нейтрализующих антител к IL-6 в сыворотке крови, низким С-реактивным белком и рецидивирующими S.aureus (13), что подчеркивает важность этого цитокина в иммунитете против S. aureus . Ответам Т-клеток уделялось меньше внимания, но новые данные подтверждают их роль в защите от инфекций S. aureus . Например, было показано, что Т-клетки, но не Ат, опосредуют защиту от летальности S. aureus после вакцинации мышей (14, 15). Связь между Т-клеточными IL-17 и IL-22 и защита от SSTI, вызываемых S.aureus появился как у грызунов, так и у людей (16–19), и наша группа показала, что клетки Th27 могут обеспечивать частичную защиту, которая ограничивает размер дермонекротических поражений при вторичной кожной инфекции у мышей (20). Примечательно, что у пациентов с мутациями в гене STAT3 , который сигнализирует ниже по течению от IL-6, развиваются рецидивирующие S. aureus инфекции кожи и легких, но не системные инфекции (21–26). Поскольку IL-6 важен для дифференцировки Th27, у этих пациентов отсутствует S.aureus — опосредованная продукция IL-17 Т-клетками. Эти наблюдения предполагают, что снижение системных ответов Th27 может привести к повышенной восприимчивости к местным SSTI. В отношении здоровых людей эти исследования показывают, что оценка системного иммунитета к S. aureus путем анализа PBMC может выявить некоторые причины предрасположенности к локализованным кожным инфекциям.
В этом исследовании мы решили ответить на конкретные вопросы, связанные с восприимчивостью к S.aureus SSTI: 1) Имеют ли люди, у которых развиваются SSTI, более слабые, чем в среднем, иммунные ответы? 2) Приводит ли колонизация S. aureus к ослаблению врожденной или адаптивной реактивности к рестимуляции S. aureus ? 3) Являются ли иммунные ответы на инфекцию USA300 разной степени или качества, чем иммунные ответы на другие генотипы S. aureus , объясняя рост этой специфической инфекции? Чтобы ответить на эти вопросы, мы воспользовались преимуществами продолжающегося многоцентрового клинического исследования, в котором сравнивали различные методы лечения пациентов, поступающих в отделение неотложной помощи (ED), с SSTI при отсутствии сопутствующих заболеваний (27, 28).Кровь собирали у пациентов с кожными инфекциями и у контрольных лиц, поступивших в отделение неотложной помощи по поводу незначительных неинфекционных причин, и сравнивали выработку цитокинов как в сыворотке, так и в стимулированных PBMC. Параллельно с этим культивировали мазки с кожи из трех анатомических участков у пациентов с SSTI (участки, отличные от инфекции) и неинфицированных контролей для выявления колонизации S. aureus . Заражающий изолят S. aureus SSTI также подвергся генотипической характеристике.Наши результаты документируют системный иммунный ответ, который имеет место после SSTI, выявляют более сильные иммунные ответы на штаммы USA300, чем типы штаммов, отличных от USA300, и выступают против системных иммуносупрессивных эффектов за счет колонизации штаммов S. aureus .
Материалы и методы
Пациенты и образцы
В исследование были включены здоровые взрослые пациенты, поступившие в отделение неотложной помощи Медицинского факультета Чикагского университета с кожной инфекцией в период с сентября 2010 года по сентябрь 2012 года.Критерии исключения включали укус человека или животного в месте инфицирования, лихорадку (температура во рту> 38,5 ° C), прием иммунодепрессантов, наличие сопутствующего состояния, такого как диабет или хроническая почечная недостаточность, патологическое ожирение (индекс массы тела> 40 кг / м 2 ), или антибактериальная терапия с антистафилококковой активностью в течение предшествующих 14 дней. Все критерии включения / исключения были такими, как описано ранее (27, 28). Пациенты были рандомизированы для получения триметоприма / сульфаметоксазола или клиндамицина (или плацебо в случае одного абсцесса <5 см в диаметре).Хирургический разрез и дренирование выполняли при наличии абсцесса и культивировании гнойного материала. Кровь брали в день первого посещения инфицированных пациентов (день 0, D0) и на 40 день (D40) после включения в исследование.
Неинфицированными контрольными пациентами были взрослые, обратившиеся в отделение неотложной помощи в течение того же периода времени с незначительными неинфекционными жалобами без сопутствующих заболеваний. В контрольную группу входили люди того же возраста, пола и расы, по самооценке, что и пациенты с SSTI. Кровь брали только после идентификации контрольного пациента (D0).
При включении пациентов с SSTI и контрольной группы было получено информированное согласие. Каждого согласившегося субъекта культивировали в носовой, ротоглоточной и перианальной / паховой областях с использованием отдельных аппликаторов с сухими вискозными наконечниками (CultureSwab, BD Diagnostic Systems). Эти культуры были повторены у инфицированных пациентов при последующем посещении D40. Протокол был одобрен Наблюдательным советом Института Чикагского университета.
Условия культивирования тампонов для колонизации и молекулярная диагностика изолятов колонизации и инфекции
Мазки с культурой были доставлены в исследовательскую лабораторию MRSA Чикагского университета и инкубированы в триптиказо-соевом бульоне с 7% хлоридом натрия в течение ночи при 37 ° C.Затем аликвоту бульона наносили на среду BBL CHROMagar S. aureus (BD Diagnostic Systems) и инкубировали в течение 24 часов при 37 ° C. Одна лиловая колония была взята из чашки и подтверждена как S. aureus с помощью типичной морфологии колонии, положительной каталазы и агглютинации с помощью теста Staphaureux (Remel, Thermo Scientific). изолятов S. aureus хранили при -70 ° C в обезжиренном молоке (Difco) до дальнейшей оценки.
Геномная ДНК была выделена из каждого изолята с использованием набора для крови и тканей Qiagen DNeasy в соответствии с инструкциями производителя и модифицирована путем инкубации с лизостафином в буфере для ресуспендирования (при 37 ° C в течение не менее 30 минут) для облегчения S.aureus лизис (29). Видообразование S. aureus было подтверждено с помощью анализа ПЦР, специфичного для spa (кодирующего белок А). Изоляты S. aureus были охарактеризованы мультилокусным типированием последовательностей (30) для определения генетического фона и типированием элемента SCC mec , мобильного генетического элемента, несущего mecA (31), с присвоением типов с использованием опубликованных руководств ( 32). Обнаружение генов, кодирующих лейкоцидин Пантона – Валентайна (PVL), проводили, как описано (33).Два изолята S. aureus считались неразличимыми, если они разделяли мультилокусное типирование последовательностей и тип SCC mec и были согласованы в отношении наличия или отсутствия генетических детерминант PVL. На основании предыдущего исследования, демонстрирующего, что присутствие обоих генов PVL (luk-S-PV и luk-F-PV) и гена arcA , обнаруженного на ACME, в высокой степени соответствует генетическому фону USA300 MRSA, оцененному с помощью гель-электрофореза в импульсном поле (34), изоляты с этими характеристиками были признаны USA300 MRSA (таблица I).Изоляты USA300, в которых отсутствовали mecA и SCC mec , были названы USA300 MSSA.
Приготовление и выделение сыворотки, PBMC и анализов цитокинов
Сыворотка была приготовлена из ~ 3 мл негепаринизированной крови центрифугированием пробирки при 3000 об / мин в течение 10 минут при комнатной температуре. Сыворотку собирали и аликвоты замораживали при -20 ° C. Уровни цитокинов IL12p70, TNF, IL-1β, IL-6, IL-23, IL-10, IFN-γ, IL-2, IL-17, IL-17F и IL-22 в сыворотке измеряли с помощью мультиплексора. анализ шариков (EMD Millipore, Billerica, MA).
Около 12 мл крови, содержащей антикоагулянт натрий-гепарин, было взято у всех пациентов и неинфицированной контрольной группы. PBMC из цельной крови выделяли после центрифугирования в градиенте фиколла для удаления эритроцитов. Эти свежие PBMC (10 6 клеток / мл / лунку) культивировали в 48-луночных планшетах в конечном объеме 1 мл, нестимулированных или стимулированных mAb против CD3 (OKT3, 5 мкг / мл), агонистом TLR2. Pam 3 CSK 4 (1 мкг / мл) или лизат из обработанного ультразвуком штамма USA300 MRSA 923 (50 мкл / лунка) в течение 24 часов.PBMC из замороженных аликвот от одного здорового донора использовали в каждом планшете в качестве положительного контроля для проверки качества стимуляции. Супернатанты собирали в пробирки Эппендорфа и замораживали в аликвотах при -80 ° C. Концентрация цитокинов TNF, IL-1β, IL-6, IL-23, IL-10, IFN-γ, IL-2, IL-17 и IL-22 определялась с помощью ELISA (R&D System, Миннеаполис, Миннесота). в соответствии с инструкциями производителя или для IL-17A после рестимуляции ультразвуком USA300 MRSA с помощью микрофлюидного ELISA (Siloam Biosciences, Цинциннати, Огайо).
Статистический анализ
Число инфицированных пациентов и неинфицированных контрольных пациентов для включения в исследование было определено путем расчета размера выборки для получения> 80% мощности (с p <0,05) при обнаружении заданной разницы в IL-17. Отношение / IFN-γ между случаями (медиана, 0,25; межквартильный размах, 0,12–0,050) и контролем (медиана, 0,43; межквартильный размах, 0,16–1,02), основанное на распределении продукции цитокинов, наблюдаемом в предварительных результатах. Размер выборки был рассчитан таким образом, что отношение случаев к контролю составляло 1: 2, чтобы увеличить мощность при меньшем количестве случаев.
Статистический анализ цитокинов из PBMC проводили с использованием непараметрического теста Манна – Уитни U и программного обеспечения GraphPadPrism 6.0. Анализ цитокинов сыворотки крови проводили с использованием критерия суммы рангов Вилкоксона или, при необходимости, критерия суммы рангов Вилкоксона для согласованных пар. Для сравнения категориальных данных использовался тест χ 2 или тест Макнемара для парных данных. Значение p <0,05 считалось статистически значимым.
Результаты
Демографические данные пациентов, колонизация и инфекционный статус
В целом было включено 215 взрослых, в том числе 72 пациента с SSTI и 143 человека в контрольной группе (рис.1А, таблица I). Большинство неинфицированных контрольных пациентов поступили в отделение неотложной помощи после незначительных травм (рис. 1B). Всем пациентам был проведен хирургический разрез и дренирование, за исключением случаев негнойного целлюлита. Пациенты были рандомизированы для приема одного из двух антибиотиков, клиндамицина или триметоприма / сульфаметоксазола, у пациентов с множественными или большими поражениями, или для приема этих антибиотиков или плацебо, когда абсцесс был небольшим. Пациенты и контрольная группа имели одинаковое распределение по полу, возрасту и расе (Таблица II).Большинство людей были афроамериканцами, что отражает население, обслуживаемое ED в Чикагском университете, и им было меньше 40 лет. Были получены культуры из носа, ротоглотки и перианальной / паховой области, чтобы установить статус колонизации инфицированных пациентов в D0 и D40 и неинфицированных контролей в D0, и колонизация считалась положительной, если по крайней мере один из участков дал положительный результат. Колонизация была обнаружена в одинаковых пропорциях на всех трех участках тела. Особи были отнесены к неколонизированным ( S.aureus ) или колонизированные штаммами USA300 по сравнению с типами штаммов S. aureus , не относящимися к USA300 . Негенотипированные изоляты были обозначены как нетипированные (рис. 1С). Пятьдесят шесть процентов контрольной группы и 72% пациентов в группе D0 были колонизированы S. aureus , из них 19% контрольной группы и 46% пациентов с SSTI были колонизированы USA300 (рис. 1C). Анализ колонизации у пациентов на D40 выявил снижение распространенности колонизации, которое не было статистически значимым (с использованием теста χ 2 ) после лечения антибиотиками, при этом 50% пациентов были колонизированы S.aureus , из которых 44% были USA300. Среди колонизированных людей 52,6, 51,9 и 39,4% были положительными более чем в одном месте в контрольной группе и инфицированных пациентов в D0 и D40, соответственно. Следует отметить, что некоторые сдвиги в колонизирующих штаммах были очевидны у инфицированных пациентов между D0 и D40 (Таблица III) либо из-за лечения антибиотиками, полученного пациентами, либо из-за того, что сдвиги обычно происходят с течением времени.
РИСУНОК 1.Зачисление, колонизация и статус инфекции. ( A ) Схематическое изображение включения в контрольную группу и пациентов с SSTI.( B ) Распространение основной жалобы по неинфицированным средствам контроля, направляемой в ED. ( C ) У включенных в исследование лиц брали мазки с трех участков тела, и при первом посещении отделения пациентов с SSTI и неинфицированной контрольной группы определяли статус колонизации и генотип штамма S. aureus , когда хотя бы один участок был положительным. (D0), а также на D40 для пациентов с SSTI. ( D ) Пациентам, поступившим с SSTI на D0, по возможности вырезали и дренировали кожные поражения, а полученный материал отправляли в лабораторию для генотипирования.Пациенты, образцы которых выросли в клинической микробиологической лаборатории на S. aureus MRSA или MSSA, но не были генотипированы, помечаются как нетипированные. Пациенты, образцы которых не были получены или посев был отрицательным, помечаются как неизвестные.
Таблица I. Алгоритм классификации штаммов S. aureus Таблица II. Демографические данные пациентов Таблица III. Колонизирующие штаммов S. aureus меняются с течением времениИнфекционный изолят был идентифицирован в лаборатории клинической микробиологии, а затем отправлен в исследовательскую лабораторию MRSA для молекулярного типирования и классификации на типы штаммов USA300 или не USA300.Одиннадцать образцов инфекции были идентифицированы как MRSA и два как MSSA лабораторией клинической микробиологии, но не были типизированы исследовательской лабораторией MRSA и помечены как MRSA-нетипированные или MSSA-нетипированные на рис. 1D. Пациенты с негнойным целлюлитом, которые не могли быть дренированы ( n = 10), отрицательные культуры и образцы, которые не подвергались типированию ( n = 16), были объединены в категорию, названную «неизвестным» для возбудителя инфекции (рис. . 1D). Во всех положительных культурах выявлено S.aureus в качестве возбудителя инфекции, и 27,8% пациентов с SSTI были инфицированы документированным USA300. Интересно, что заражающий штамм S. aureus часто отличался от колонизирующего штамма (Таблица IV), что позволяет предположить, что разные штаммы могут колонизировать, а не инфицировать, или что, типируя только одну колонию из каждого анатомического участка, мы пропустили обнаружение других колонизирующих штаммы, которые могли включать инфекционный штамм.
Таблица IV. Статус колонизации пациентов с SSTI с задокументированными S.aureus инфекцияСтимулированные PBMC от пациентов с SSTI продуцируют больше врожденных, но не адаптивных цитокинов
В остальном здоровые люди, у которых развивается SSTIs , могут быть людьми с немного более низким глобальным иммунным ответом, который может не сдерживать колонизирующие бактерии или возникающие инфекции. Чтобы проверить эту гипотезу, мы сравнили врожденные цитокины, продуцируемые PBMC пациентов с SSTI во время и после инфекции, с неинфицированными контрольными организмами при стимуляции in vitro агонистом TLR2 Pam 3 CysK 4 или ультразвуковым ультразвуком USA300 MRSA для имитации сигналов. вызвано S.aureus . Кроме того, мы измерили адаптивные цитокины, продуцируемые после воздействия анти-CD3 mAb активатора пан-Т-клеток или ультразвуком USA300 MRSA. В отличие от нашей гипотезы, продукция врожденных цитокинов PBMC, полученными от пациентов с SSTI на D0, была фактически увеличена (Il-1β, IL-6 и TNF) по сравнению с таковой у контрольных лиц, оба следуя Pam 3 CysK 4 и стимуляция USA300 (рис. 2А). В большинстве случаев уровни цитокинов были ниже, когда инфекция разрешилась после лечения на D40, но не ниже, чем в контрольных PBMC (рис.2А). Следует отметить, что аналогичное снижение уровня цитокинов между D0 и D40 наблюдалось у инфицированных пациентов, получавших триметоприм / сульфаметоксазол, или пациентов, получавших клиндамицин (дополнительный рисунок 1). Эти результаты подтверждают системные последствия локализованной инфекции на D0, и они предполагают, что SSTI приводит либо к увеличению количества циркулирующих клеток, которые могут реагировать на эти стимулы, либо к увеличению способности каждой клетки продуцировать эти цитокины.
РИСУНОК 2.Больше врожденных цитокинов, продуцируемых стимулированными PBMC от пациентов с SSTI, чем в контрольной группе.( A ) PBMC от неинфицированных контролей (Ctrl) и пациентов, инфицированных SSTI (Pt), стимулировали Pam 3 CysK 4 (Pam3, верхние панели) или ультразвуковыми анализаторами USA300 MRSA (нижние панели) в течение 24 часов. Супернатанты анализировали на IL-1β, IL-6 и TNF с помощью ELISA. ( B ) Уровни цитокинов, индуцированных ультразвуковыми воздействиями USA300 MRSA, сравнивали между PBMC от пациентов с зарегистрированной инфекцией, отличной от USA300, и PBMC от пациентов с зарегистрированной инфекцией USA300. Графики представляют собой среднее значение ± стандартная ошибка среднего.Статистическая значимость рассчитывалась с использованием критерия Манна – Уитни U . * p <0,05, ** p <0,01, *** p <0,001.
Чтобы исследовать, вызывала ли инфекция USA300 отдельные ответы по сравнению с другими типами штаммов S. aureus , мы сравнили продукцию врожденных цитокинов PBMC у пациентов, инфицированных зарегистрированным USA300, по сравнению с пациентами, инфицированными задокументированными не-USA300. Как показано на фиг. 2B, PBMC от пациентов с задокументированной инфекцией USA300 продуцировали больше IL-1β и IL-6 после рестимуляции S.aureus sonicates, что свидетельствует о более устойчивом системном иммунном ответе.
В отличие от различий в продукции врожденных цитокинов, не наблюдалось различий в адаптивных цитокинах (IL-2, IFN-γ, IL-17A, IL-22), обнаруженных после стимуляции, опосредованной ультразвуком анти-CD3– или USA300 MRSA. , либо между пациентами с SSTI и неинфицированным контролем (дополнительный рисунок 2A), либо между пациентами с SSTI, инфицированными USA300 по сравнению с пациентами, не входящими в USA300 (дополнительный рисунок 2B), хотя значительно более высокая продукция IL-10 была обнаружена у USA300-инфицированных по сравнению с не-USA300- инфицированные пациенты на S.aureus рестимуляции (дополнительный рис. 2B).
Взятые вместе, эти результаты опровергают гипотезу о том, что инфицированные пациенты экспрессируют понижающие полиморфизмы, которые снижают их иммунный ответ на штаммов S. aureus , или что инфекция ослабляет иммунные ответы.
Сывороточные цитокины были увеличены у инфицированных пациентов
Повышенная продукция врожденных цитокинов PBMC у инфицированных пациентов по сравнению с неинфицированными контрольными пациентами предполагала, что системный иммунный ответ имел место в ответ на локализованную инфекцию, по крайней мере, у некоторых пациентов.Для дальнейшего изучения возможных системных последствий инфекции концентрация цитокинов в сыворотке была измерена у неинфицированных контрольных пациентов и пациентов с ИМТП. У более высокой доли инфицированных пациентов на D0 обнаруживались цитокины в сыворотке по сравнению с неинфицированными контрольными пациентами (рис. 3A), а у инфицированных пациентов были значительно более высокие уровни в сыворотке TNF, IL-6, IL-10, IL-17F и IL-22 ( Рис. 3Б). К D40 уровни сывороточного IL-6 и IL-17F были значительно снижены по сравнению с D0 (рис. 3B), и аналогично у пациентов, получавших триметоприм / сульфаметоксазол или клиндамицин (дополнительный рис.1 для IL-6 и данные не показаны для IL-17F). Обнаруживаемый уровень циркулирующих цитокинов, вероятно, не был связан с системным распространением инфекции, поскольку критерием включения была температура тела ниже 38,5 ° C. Фактически, все пациенты, кроме четырех, имели температуру тела <37 ° C (дополнительный рисунок 3), а у четырех пациентов с температурой от 37 до 37,9 ° C не было более высоких уровней цитокинов в сыворотке, чем у пациентов с афебрильной болезнью (данные не показано). Следует отметить, что пациенты с ИСМТ, инфицированные документированным USA300, не имели более высоких уровней цитокинов в сыворотке, чем пациенты, инфицированные документально не USA300 (дополнительный рис.4), хотя у исследования было недостаточно возможностей для анализа этого параметра, поскольку не у всех пациентов были измеряемые сывороточные цитокины (рис. 3A).
РИСУНОК 3.Повышенные сывороточные цитокины у пациентов с ИМТП. Сыворотку выделяли у пациентов с SSTI (Pt) и неинфицированных контролей (Ctrl), а уровни цитокинов измеряли с помощью анализа с помощью мультиплексных шариков. ( A ) Процент пациентов с определяемыми уровнями данных цитокинов. Статистическая значимость между неинфицированными и инфицированными D0 рассчитывалась с использованием критерия χ 2 , а между D0 и D40 — с использованием теста Макнемара для парных данных.( B ) Показаны уровни выбранных цитокинов (среднее ± SEM). Статистическая значимость рассчитывалась с использованием двустороннего дисперсионного анализа. * p <0,05, ** p <0,01, *** p <0,001.
Влияние колонизации
S. aureus на иммунные ответыДизайн нашего исследования также позволил нам проверить гипотезу о том, что бессимптомная колонизация у неинфицированных людей может привести к толеризации иммунных клеток, так что иммунные ответы на S. aureus могут стать притупленными, и, таким образом, колонизированные особи могут стать более восприимчивыми к инфекции либо самим колонизирующим штаммом, либо последующим штаммом, которому они могут подвергнуться.Чтобы проверить эту гипотезу, мы сравнили уровни цитокинов, продуцируемых при стимуляции in vitro ультразвуком USA300 MRSA PBMC из неинфицированных контролей, которые либо не были колонизированы во время посещения ED, либо были колонизированы USA300, по сравнению с типами штаммов, отличными от USA300. Ни врожденная, ни адаптивная продукция цитокинов существенно не различались у колонизированных и неколонизированных контрольных индивидуумов (рис. 4), что позволяет предположить, что колонизация не снижает чувствительность врожденного иммунного ответа к S.aureus у этих индивидуумов и что репертуар Т-клеток, способный распознавать Ag или суперантигены S. aureus , все еще присутствует в крови колонизированных хозяев. Колонизация также не влияла на ответы на Pam 3 CysK 4 или рестимуляцию анти-CD3, или продукцию других тестируемых цитокинов (данные не показаны).
РИСУНОК 4.Документированное заселение S. aureus не связано со снижением ответов PBMC у неинфицированных субъектов. PBMC из неинфицированного контроля стимулировали ультразвуком USA300 MRSA в течение 24 часов, и уровни цитокинов в супернатантах измеряли с помощью ELISA.На графиках сравниваются цитокины, продуцируемые неинфицированными контролями, классифицированными как неколонизированные, с цитокинами, классифицированными как колонизированные USA300, и цитокинами, классифицированными как колонизированные генотипами, отличными от USA300 (среднее ± SEM). Различия не были значительными, как определено с помощью теста Манна-Уитни U .
Наконец, мы проверили, влияет ли колонизация типа S. aureus на иммунные ответы у инфицированных пациентов. Неожиданно, независимо от штамма инфекции, PBMC от инфицированных пациентов, которые также были колонизированы USA300 на D0, продуцировали больше IL-17A, IL-22 и IL-10, но не IFN-γ (или IL-2, не показано), после рестимуляции ультразвуком анти-CD3 или USA300 MRSA, чем те, которые были колонизированы штаммами, отличными от USA300, и эти различия исчезли после исчезновения инфекции на D40 (рис.5). IL-17A, IL-22 и IL-10 представляют собой цитокины, которые были связаны с иммунными ответами на S. aureus in vitro (35), что позволяет предположить, что мы можем обнаруживать ответ циркулирующих Т-клеток памяти у инфицированных пациентов, которые колонизирован USA300.
РИСУНОК 5.PBMC от пациентов с SSTI, колонизированных USA300, продуцируют больше цитокинов IL-17, IL-22 и IL-10, чем у пациентов с SSTI, колонизированных не USA300. PBMC от пациентов с SSTI стимулировали в течение 24 часов ультразвуковыми растворами USA300 MRSA (верхние панели) или анти-CD3 (нижние панели), а уровни цитокинов в супернатантах определяли с помощью ELISA.Результаты пациентов с задокументированной колонизацией USA300 сравнивали с результатами пациентов с задокументированной колонизацией штаммом S. aureus , не относящимся к USA300 . Графики показывают среднее значение ± SEM. * p <0,05, ** p <0,01, *** p <0,001, как определено с помощью теста Манна – Уитни U .
Обсуждение
Кожные инфекции представляют собой проблему для общественного здравоохранения. Однако иммунные ответы у пациентов с ИППП недостаточно документированы, и гипотезы, объясняющие, почему некоторые люди подвержены этим инфекциям, не были проверены.В этом исследовании мы генотипировали колонизирующие и инфицирующие штаммов S. aureus пациентов с SSTI, проанализировали их иммунные ответы на постинфекции D0 и D40 и проверили, является ли причина развития SSTI у здоровых людей в том, что они уменьшили общее или S. aureus — специфические иммунные ответы по сравнению с неинфицированным контролем. В отличие от гипотезы, мы обнаружили, что пациенты с SSTI продуцируют более высокие уровни врожденных цитокинов, чем неинфицированные контрольные, как было определено в измерениях сыворотки, а также при рестимуляции PBMC.Примечательно, что кожная инфекция документированным USA300 вызвала большую продукцию врожденных цитокинов PBMC, чем кожная инфекция задокументированным non-USA300. Более того, колонизация USA300 по сравнению с типами штаммов, отличными от USA300, коррелировала с повышенным воспроизводством адаптивных цитокинов к воспоминаниям PBMC пациентов с SSTI во время инфекции, но не после исчезновения инфекции или в неинфицированном контроле. Наши результаты выступают против системной толерантности за счет колонизирующих штаммов или ингибирующих иммунных полиморфизмов как факторов, способствующих развитию SSTI у здоровых людей, и вместо этого демонстрируют обнаруживаемый системный иммунный ответ у пациентов с локализованными неосложненными SSTI с более высокими системными иммунными ответами при обнаружении USA300. либо как патоген в SSTI, либо как комменсал в культурах, полученных для тестирования на колонизацию.
Распространенность колонизации S. aureus , наблюдаемая среди взрослого населения, включенного в это исследование, а именно 56% контрольной группы и 72% пациентов, соответствовала полученной в исходном исследовании, которое включало как взрослых, так и детей (27). , но он был выше, чем обычно указывается в общей популяции, когда отбираются только ноздри (36). Поскольку мы считали пациентов колонизированными, когда S. aureus было выделено из любого из трех участков тела культивирования, и поскольку анализ только мазков из носа дал аналогичные проценты с предыдущими отчетами (27), наши данные предполагают, что S.aureus встречается чаще, чем принято считать, и более широко распространена по всему телу (27). Люди становятся колонизированными с ограниченной микробиотой при рождении, и было показано, что стафилококки являются одними из первых колонизирующих таксонов (37). Демонстрация того, что антитела против S. aureus с переключением изотипов могут быть быстро и все чаще обнаруживаться в детстве при отсутствии явной инфекции (38), подразумевает быстрое общее воздействие и формирование адаптивного иммунитета к колонизации S.aureus или перекрестно реагирующие штаммы. Это также согласуется с недавним отчетом, идентифицирующим высокий уровень памяти Т-клеток до S. aureus у здоровых людей, при этом S. aureus — специфическая частота Т-клеток, оцениваемая между 0,2 и 5,7% репертуара Т-клеток ( 4). Взятые вместе, эти исследования показывают, что здоровые люди на самом деле могут быть иммунологически не наивными по отношению к S. aureus Ag.
Эпидемиологические данные нашего исследования показывают, что колонизация USA300 была более частой у пациентов с SSTI, чем в контрольной группе, и что лечение антибиотиками не помогло устранить S.aureus у многих пациентов, независимо от его генотипа и несмотря на разрешение кожной инфекции в большинстве случаев. Более того, у многих пациентов генотип колонизирующих штаммов изменился с D0 на D40. Это может быть связано с давлением, оказываемым антибиотиками, вводимыми для лечения инфекции, и / или изменениями, которые могут происходить с течением времени даже у здоровых людей, не подвергавшихся преднамеренно противомикробной терапии. В качестве альтернативы, люди часто могут быть колонизированы несколькими генотипами одновременно, так что взятие проб отдельных колоний в два разных момента времени может просто выявить два различных типа штаммов, которые оба присутствовали на протяжении всего периода времени.Действительно, даже при ограниченном подходе к генотипированию только одной бактериальной колонии из каждого из трех участков культивирования, мы ранее обнаружили, что 25% лиц комбинированной взрослой и педиатрической популяции, включенных в родительское исследование, были колонизированы поликлонально (27). В соответствии с концепцией поликолонизации мы также обнаружили, что инфицированные изоляты S. aureus часто генотипически отличались от изолятов, колонизировавших одного и того же человека, что указывает на то, что многие пациенты инфицированы одним штаммом и одновременно колонизируются другим.Присутствует ли инфекционный штамм также как колонизирующий комменсал в другом участке тела у этих пациентов или он присутствовал как колонизирующий комменсал до заражения, еще предстоит определить.
S. aureus был единственным инфекционным агентом, идентифицированным в положительных культурах из поражений SSTI у наших пациентов. Хотя мы не можем исключить, что негнойный целлюлит, который не может быть дренирован, или поражения с отрицательными культурами, были вызваны микробными организмами, отличными от S. aureus , разумно предположить, что подавляющее большинство поражений SSTI вызвано S .aureus . Таким образом, при анализе данных мы сначала сгруппировали всех инфицированных пациентов в единую категорию независимо от результатов посева с их сайта SSTI.
Наши данные показывают увеличение врожденных цитокинов у инфицированных пациентов по сравнению с контрольной группой. Хотя различия в средней продукции цитокинов между группами были небольшими, статистически значимое увеличение уровней врожденных цитокинов у инфицированных пациентов на D0 по сравнению с неинфицированным контролем коррелировало с продолжающейся инфекцией, а значительное снижение на D40 по сравнению с D0 (и отсутствие статистической разницы на D40 с неинфицированным контролем) коррелировали с разрешением инфекции, предполагая, что, даже если они незначительны, эти различия были связаны с функциональным ответом.Хотя неясно, являются ли более высокие уровни цитокинов у пациентов, инфицированных USA300, по сравнению с пациентами, не относящимися к USA300, биологически значимыми, этот более сильный иммунный ответ может быть необходим для устранения инфекции таким вирулентным штаммом или может привести к более серьезным воспалительным симптомам, которые затем привести больше пациентов в отделение неотложной помощи, что, в свою очередь, может объяснить обнаружение этого типа штамма среди культур SSTI в масштабах эпидемии.
Наши результаты также показывают повышенную реакцию воспоминаний у инфицированных пациентов, колонизированных USA300.Вспомните, что ответы Т-клеток памяти на S. aureus находятся в циркулирующих CCR6 + CCR4 + Т-клетках, которые содержат Th27, а также некоторые клетки Th2, а не в CXCR3 + или CCR4 + подмножества, которые обогащены клетками Th2 и Th3 соответственно (35). Дифференциация Т-клеток от здоровых контролей в течение 12 дней in vitro с инактивированными нагреванием импульсными моноцитами S. aureus выявила преимущественно продукцию IL-17, IL-22 и IL-10 (35).Поразительно, но IL-17, IL-22 и IL-10 также были цитокинами, продукция которых в течение 24 часов, как мы обнаружили, значительно увеличивалась в PBMC от пациентов с SSTI, колонизированных USA300, независимо от генотипа инфекционного штамма. Эти цитокины могут вызывать тканезащитные и иммунодепрессивные эффекты, и они задействованы на участках кожи (35). Повышенная способность циркулирующих РВМС продуцировать эти цитокины при воспроизведении in vitro может отражать аддитивный эффекторный ответ / ответ памяти типа Th27 на продолжающуюся инфекцию и колонизацию USA300.Это подтверждается тем фактом, что колонизация USA300 не приводила к усилению ответов Т-клеток в неинфицированном контроле.
Мы также проверили, может ли воздействие на иммунную систему человека бессимптомно колонизирующего S. aureus ослабить иммунный ответ на Ag S. aureus и микробные сигналы, тем самым повышая восприимчивость человека к инфекции. Однако наш анализ неинфицированных контрольных субъектов с обнаруживаемыми, но бессимптомными S.Колонизация aureus не выявила какого-либо снижения способности их PBMC продуцировать врожденные или адаптивные цитокины при рестимуляции S. aureus по сравнению с неколонизированными контролями. Этот результат следует интерпретировать с осторожностью, потому что возможно и, возможно, вероятно, что все люди колонизируются S. aureus временно или постоянно, так что неинфицированные субъекты, которые мы охарактеризовали как неколонизированные, могли на самом деле колонизироваться и уже подавляли их иммунные ответы на S.aureus .
В заключение, наши результаты не подтверждают гипотезу о том, что SSTI возникают у людей с более притупленными системными иммунными ответами по сравнению с людьми, у которых не развиваются инфекции, а скорее, что текущие кожные инфекции USA300 вызывают более сильный врожденный воспалительный ответ, чем неинфекционные. Кожные инфекции USA300, тогда как колонизация USA300 может вызвать более сильную память Th27. Ограничением нашего исследования является то, что анализировались только системные иммунные ответы. Хотя наши данные показывают, что дефектов в глобальных или С. нет.aureus — специфический Т-клеточный иммунитет, остается возможным, что S. aureus -реактивных Т-клеток могут быть нарушены при их миграции в кожу, или что инфекционная среда может напрямую подавлять функцию этих Т-клеток после кожной инфильтрации. Местные иммунные ответы на кожные комменсалы и патогены только начинают изучаться (39) и могут дать дополнительную информацию о восприимчивости к SSTI. Наше исследование также поднимает дополнительные вопросы для последующих исследований, в том числе почему ранее существовавшие Т-клеточные ответы не защищают от инфекции, какую роль эти иммунные ответы играют в избавлении от инфекции и в патологии тканей, и какие генетические черты присутствуют в USA300, но не прочее S.aureus вызывают более сильный иммунный ответ.
Раскрытие информации
У авторов нет финансового конфликта интересов.
Благодарности
Мы благодарим Томаса Гаевского и Криса Монтгомери за полезные обсуждения.
Сноски
Эта работа была поддержана грантом AR059414 Национальных институтов здравоохранения (R.S.D. и M.-L.A.).
Онлайн-версия статьи содержит дополнительные материалы.
Сокращения, использованные в этой статье:
- D0
- день 0
- D40
- день 40
- ED
- отделение неотложной помощи
- MRSA
- метициллин-резистентный 915oc7 Stapureus methicillin-устойчивый 9SA -чувствительный Staphylococcus aureus
- PVL
- Лейкоцидин Пантона – Валентайна
- SSTI
- Инфекция кожи и мягких тканей.
- Поступила 29.03.2016.
- Принято 13 июня 2016 г.
- Авторские права © 2016 Американская ассоциация иммунологов, Inc.
Комменсалы кожи человека увеличивают патогенез Staphylococcus aureus
Isolauri, E., Kirjavainen, PV & Salminen, S. Пробиотики: роль в лечении кишечных инфекций и воспалений? Кишечник 50 , iii54 – iii59 (2002).
PubMed PubMed Central Статья Google Scholar
Грайс, Э. А. и Сегре, Дж. А. Микробиом кожи. Нат. Rev. Microbiol. 9 , 244–253 (2011).
PubMed PubMed Central Статья CAS Google Scholar
Grice, E. A. et al. Топографическое и временное разнообразие микробиома кожи человека. Наука 324 , 1190–1192 (2009).
PubMed PubMed Central Статья CAS Google Scholar
Набер, К. К. Staphylococcus aureus бактериемия: эпидемиология, патофизиология и стратегии лечения. Clin. Заразить. Дис. 48 , S231 – S237 (2009).
Артикул PubMed Google Scholar
Naik, S. et al. Взаимодействие комменсалов с дендритными клетками определяет уникальную защитную иммунную подпись кожи. Природа 520 , 104–108 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Рэмси, М. М., Фрейре, М. О., Габрильска, Р. А., Рамбо, К. П. и Лемон, К. П. Staphylococcus aureus смещается в сторону комменсализма в ответ на видов Corynebacterium . Фронт. Microbiol. 7 , 1230 (2016).
PubMed PubMed Central Статья Google Scholar
Lo, C.-W., Lai, Y.-K., Liu, Y.-T., Gallo, R. L. & Huang, C.-M. Staphylococcus aureus захватывает комменсал кожи, чтобы усилить ее вирулентность: иммунизация, направленная на β-гемолизин и фактор CAMP. J. Invest. Дерматол. 131 , 401–409 (2011).
Артикул CAS PubMed Google Scholar
McVicker, G. et al. Клональная экспансия в динамике инфицирования Staphylococcus aureus свидетельствует об эффекте антибиотикотерапии. PLoS Pathog. 10 , e1003959 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Prajsnar, T. K. et al. Привилегированная ниша внутрифагоцитов ответственна за диссеминированную инфекцию Staphylococcus aureus в модели рыбок данио. Ячейка. Microbiol. 14 , 1600–1619 (2012).
PubMed PubMed Central Статья CAS Google Scholar
Прайснар, Т. К., Канлифф, В. Т., Фостер, С. Дж. И Реншоу, С. А. Новая модель позвоночных, вызывающая инфекцию Staphylococcus aureus , выявляет фагоцит-зависимую устойчивость рыбок данио к патогенам, не являющимся хозяевами. Ячейка. Microbiol. 10 , 2312–2325 (2008).
Артикул CAS PubMed Google Scholar
Horsburgh, M. J., Wiltshire, M. D., Crossley, H., Ingham, E. & Foster, S. J. PheP, предполагаемая аминокислотная пермеаза Staphylococcus aureus , способствует выживанию in vivo и во время голодания. Заражение. Иммун. 72 , 3073–3076 (2004).
PubMed PubMed Central Статья CAS Google Scholar
Bera, A., Biswas, R., Herbert, S. & Götz, F. Присутствие пептидогликан-O-ацетилтрансферазы у различных видов стафилококков коррелирует с резистентностью к лизоциму и патогенностью. Заражение. Иммун. 74 , 4598–4604 (2006).
PubMed PubMed Central Статья CAS Google Scholar
Cheng, A. G. et al. Вклад коагулаз в заболевание Staphylococcus aureus и защитный иммунитет. PLos Pathog. 6 , e1001036 (2010).
PubMed PubMed Central Статья CAS Google Scholar
Grice, E. A. et al. Профиль разнообразия микробиоты кожи человека. Genome Res. 18 , 1043–1050 (2008).
PubMed PubMed Central Статья CAS Google Scholar
Шерерц Р.J. et al. Трехлетний опыт работы с ультразвуковыми культурами сосудистых катетеров в лаборатории клинической микробиологии. J. Clin. Microbiol. 28 , 76–82 (1990).
PubMed PubMed Central CAS Google Scholar
Сорбара М. Т. и Филпотт Д. Дж. Пептидогликан: критический активатор иммунной системы млекопитающих во время инфекции и гомеостаза. Immunol. Ред. 243 , 40–60 (2011).
Артикул CAS PubMed Google Scholar
Уиллер Р., Шевалье Г., Эберл Г. и Гомпертс Бонека И. Биология бактериальных пептидогликанов и их влияние на иммунитет и физиологию хозяина. Ячейка. Microbiol. 16 , 1014–1023 (2014).
Артикул CAS PubMed Google Scholar
Баба Т., Бэ Т., Шнеуинд, О., Такеучи, Ф. и Хирамацу, К. Последовательность генома штамма Newman Staphylococcus aureus и сравнительный анализ геномов стафилококков: полиморфизм и эволюция двух основных островов патогенности. J. Bacteriol. 190 , 300–310 (2008).
PubMed PubMed Central Статья CAS Google Scholar
Surewaard, B.G.J. et al. Идентификация и лечение резервуара Staphylococcus aureus in vivo. J. Exp. Med. 213 , 1141–1151 (2016).
PubMed PubMed Central Статья Google Scholar
Thammavongsa, V., Missiakas, D. M. & Schneewind, O. Staphylococcus aureus разрушает внеклеточные ловушки нейтрофилов, способствуя гибели иммунных клеток. Наука 342 , 863–866 (2013).
PubMed PubMed Central Статья CAS Google Scholar
Wang, R. et al. Идентификация новых цитолитических пептидов в качестве ключевых детерминант вирулентности для ассоциированного с сообществом MRSA. Нат. Med. 13 , 1510–1514 (2007).
Артикул CAS PubMed Google Scholar
Элек, С. Д. и Конен, П. Е. Вирулентность Staphylococcus pyogenes для человека; исследование проблем раневой инфекции. Br. J. Exp. Патол. 38 , 573–586 (1957).
PubMed PubMed Central CAS Google Scholar
Шлейфер К. Х. и Кандлер О. Пептидогликановые типы стенок бактериальных клеток и их таксономическое значение. Бактериол. Ред. 36 , 407–477 (1972).
PubMed PubMed Central CAS Google Scholar
Hashimoto, M. et al. Липопротеин является преобладающим лигандом Toll-подобного рецептора 2 в компонентах клеточной стенки Staphylococcus aureus . Внутр. Иммунол. 18 , 355–362 (2006).
Артикул CAS PubMed Google Scholar
Вердренг М. и Тарковски А. Роль нейтрофилов в экспериментальной сепсисе и септическом артрите, вызванном Staphylococcus aureus . Заражение. Иммун. 65 , 2517–2521 (1997).
PubMed PubMed Central CAS Google Scholar
Ригби К. и ДеЛео Ф. Р. Нейтрофилы в врожденной защите хозяина от инфекций Staphylococcus aureus . Семин. Immunopathol. 34 , 237–259 (2012).
Артикул CAS PubMed Google Scholar
Heyworth, P. G., Cross, A. R. & Curnutte, J. T. Хроническая гранулематозная болезнь. Curr. Opin. Иммунол. 15 , 578–584 (2003).
Артикул CAS PubMed Google Scholar
Zeng, Z. et al. CRIg функционирует как рецептор распознавания образов макрофагов, чтобы напрямую связывать и улавливать переносимые кровью грамположительные бактерии. Клеточный микроб-хозяин 20 , 99–106 (2016).
Артикул CAS PubMed Google Scholar
Clarke, T. B. et al. Распознавание пептидогликана из микробиоты с помощью Nod1 повышает системный врожденный иммунитет. Нат. Med. 16 , 228–231 (2010).
PubMed PubMed Central Статья CAS Google Scholar
Gauguet, S. et al. Кишечная микробиота мышей влияет на устойчивость к пневмонии Staphylococcus aureus . Заражение. Иммун. 83 , 4003–4014 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Stoll, H., Dengjel, J., Nerz, C. & Götz, F. Staphylococcus aureus , дефицитный по липидированию прелипопротеинов, ослаблен в росте и иммунной активации. Заражение. Иммун. 73 , 2411–2423 (2005).
PubMed PubMed Central Статья CAS Google Scholar
Chamaillard, M. et al. Существенная роль NOD1 в распознавании хозяином бактериального пептидогликана, содержащего диаминопимелиновую кислоту. Нат.Иммунол. 4 , 702–707 (2003).
Артикул CAS PubMed Google Scholar
Wolf, A. J. et al. Гексокиназа — это рецептор врожденного иммунитета для обнаружения бактериального пептидогликана. Ячейка 166 , 624–636 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Поллок, Дж.D. et al. Мышиная модель Х-сцепленной хронической гранулематозной болезни, наследственного дефекта продукции супероксида фагоцитами. Нат. Genet. 9 , 202–209 (1995).
Артикул CAS PubMed Google Scholar
Бойл, Дж. П., Паркхаус, Р. и Мони, Т. П. Понимание молекулярных основ сигнального пути NOD2. Open Biol. 4 , 140178 (2014).
PubMed PubMed Central Статья CAS Google Scholar
Филпотт, Д. Дж., Сорбара, М. Т., Робертсон, С. Дж., Кроитору, К., Гирардин, С. Е. Белки NOD: регуляторы воспаления при здоровье и болезни. Нат. Rev. Immunol. 14 , 9–23 (2014).
Артикул CAS PubMed Google Scholar
Коргаонкар, А., Триведи, У., Рамбо, К. П. и Уайтли, М. Эпиднадзор в общинах усиливает вирулентность Pseudomonas aeruginosa во время полимикробной инфекции. Proc. Natl Acad. Sci. США 110 , 1059–1064 (2013).
PubMed PubMed Central Статья Google Scholar
Nieto, C. & Espinosa, M. Конструирование подвижной плазмиды pMV158GFP, производного pMV158, несущего ген, кодирующий зеленый флуоресцентный белок. Плазмида 49 , 281–285 (2003).
Артикул CAS PubMed Google Scholar
Cheng, A. G. et al. Генетические требования для образования абсцесса Staphylococcus aureus и сохранения его в тканях хозяина. FASEB J. 23 , 3393–3404 (2009).
PubMed PubMed Central Статья CAS Google Scholar
Turner, R.D. et al. Архитектура пептидогликана может определять плоскости деления в Staphylococcus aureus . Нат. Commun. 1 , 26 (2010).
Артикул CAS PubMed Google Scholar
Sabroe, I., Williams, T. J., Hébert, C. A. и Collins, P. D. Перекрестная десенсибилизация рецептора нейтрофилов IL-8 человека хемоаттрактантом включает интернализацию рецептора и регуляцию дифференциального подтипа рецептора. J. Immunol. 158 , 1361–1369 (1997).
CAS PubMed Google Scholar
Докрелл, Д. Х., Ли, М., Линч, Д. Х. и Рид, Р. С. Иммуноопосредованный фагоцитоз и уничтожение Streptococcus pneumoniae связаны с прямым и случайным апоптозом макрофагов. J. Infect. Дис. 184 , 713–722 (2001).
Артикул CAS PubMed Google Scholar
Bremell, T. et al. Вспышка спонтанного стафилококкового артрита и остита у мышей. Arthritis Rheum. 33 , 1739–1744 (1990).
Артикул CAS PubMed Google Scholar
Али А. и др. Иммуноглобулин CTLA4, но не терапия противоопухолевым фактором некроза, способствует развитию стафилококкового септического артрита у мышей. J. Infect. Дис. 212 , 1308–1316 (2015).
Артикул CAS PubMed Google Scholar
Kwiecinski, J., Jin, T. & Josefsson, E. Поверхностные белки Staphylococcus aureus играют важную роль в экспериментальной инфекции кожи. APMIS 122 , 1240–1250 (2014).
Артикул CAS PubMed Google Scholar
Wong, C.H.Y., Jenne, C.N., Lee, W.-Y., Léger, C. & Kubes, P. Функциональная иннервация печеночных iNKT-клеток оказывает иммуносупрессивное действие после инсульта. Наука 334 , 101–105 (2011).
Артикул CAS PubMed Google Scholar
Wilson, R. et al. Защита от инфекции легких Streptococcus pneumoniae после колонизации носоглотки требует как гуморального, так и клеточного иммунного ответа. Mucosal Immunol. 8 , 627–639 (2015).
Артикул CAS PubMed Google Scholar
Nusslein-Volhard, C.& Dahm, R. Данио. Практический подход (Oxford Univ. Press, Нью-Йорк, 2002).
Horsburgh, M. J. et al. σ B модулирует экспрессию детерминанты вирулентности и устойчивость к стрессу: характеристика функционального штамма rsbU , полученного из Staphylococcus aureus 8325-4. J. Bacteriol. 184 , 5457–5467 (2002).
PubMed PubMed Central Статья CAS Google Scholar
Mainiero, M. et al. Дифференциальная активация целевого гена двухкомпонентной системой Staphylococcus aureus saeRS . J. Bacteriol. 192 , 613–623 (2010).
Артикул CAS PubMed Google Scholar
Дути, Э. С. и Лоренц, Л. Л. Стафилококковая коагулаза: механизм действия и антигенность. J. Gen. Microbiol. 6 , 95–107 (1952).
CAS PubMed Google Scholar
Pang, Y. Y. et al. agr-зависимые взаимодействия Staphylococcus aureus USA300 с полиморфно-ядерными нейтрофилами человека. J. Врожденный иммунитет. 2 , 546–559 (2010).
PubMed PubMed Central Статья CAS Google Scholar
Surewaard, B.G.J. et al. Инактивация стафилококковых фенолрастворимых модулянов липопротеидными частицами сыворотки крови. PLoS Pathog. 8 , e1002606 (2012).
PubMed PubMed Central Статья CAS Google Scholar
Fey, P. D. et al. Генетический ресурс для быстрого и всестороннего фенотипического скрининга несущественных генов Staphylococcus aureus. мБио 4 , e00537-12 (2013).
PubMed PubMed Central Статья CAS Google Scholar
Modun, B.J., Cockayne, A., Finch, R. & Williams, P. Staphylococcus aureus, и Staphylococcus epidermidis. трансферрин-связывающих белков экспрессируются in vivo во время инфекции. Microbiology 144 , 1005–1012 (1998).
Артикул CAS PubMed Google Scholar
Hasenberg, A. et al. Catchup: модель мыши для отслеживания и модуляции нейтрофильных гранулоцитов на основе изображений. Нат.Методы 12 , 445–452 (2015).
Артикул CAS PubMed Google Scholar
Gomez de Agüero, M. et al. Материнская микробиота способствует раннему постнатальному развитию врожденного иммунитета. Наука 351 , 1296–1302 (2016).
Артикул CAS PubMed Google Scholar
Что такое золотистый стафилококк?
Золотистый стафилококк — это разновидность бактерий.Он окрашивает Gram положительно и представляет собой неподвижные маленькие кокки округлой формы или неподвижные кокки. Он содержится в гроздьях винограда (стафило-). Вот почему это называется стафилококком.
На кого влияет Staphylococcus aureus?Стафилококк входит в пятерку наиболее частых причин инфекций после травм или операций. Ежегодно он поражает около 500 000 пациентов в американских больницах. В медицинской литературе он обозначается аббревиатурой « S. aureus » или «Staph aureus».S. aureus был обнаружен в Абердине, Шотландия, в 1880 году хирургом сэром Александром Огстоном в гное хирургических абсцессов.
Бактериальные клетки бактерий (Staphylococcus aureus), которые являются одним из возбудителей мастита у дойных коров. Его большая капсула защищает организм от атак иммунологической защиты коровы. Увеличение в 50 000 раз. Кредит изображения: arsusda.gov
Staphylococcaceae СемействоЗолотистый стафилококк относится к семейству Staphylococcaceae. Поражает все известные виды млекопитающих, включая человека. Кроме того, благодаря своей способности воздействовать на широкий круг видов, S. aureus может легко передаваться от одного вида к другому. Это включает передачу между людьми и животными.
Передача
золотистого стафилококкаS. aureus может часто встречаться в окружающей среде. S. aureus передается воздушно-капельным путем или аэрозолем. Когда инфицированный человек кашляет или чихает, он выпускает множество мелких капелек слюны, которые остаются взвешенными в воздухе.Они содержат бактерии и могут заразить других.
Другой распространенный метод передачи — прямой контакт с объектами, зараженными бактериями, или укусы инфицированных людей или животных. Примерно 30% здоровых людей переносят S. aureus в носу, задней части глотки и на коже.
Клиническое проявление инфекции
Около трети здоровых людей переносят эти бактерии в носу, глотке и на коже.У нормального здорового и иммунокомпетентного человека S. aureus колонизация кожи, кишечного тракта или носоглотки не приводит к каким-либо симптомам или заболеванию.
Когда S. aureus выделяется из абсцесса, фурункула или другого поражения кожи, это обычно происходит из-за вторичного проникновения в рану, а не из-за первичной причины заболевания. S. aureus аналогичным образом может быть выделен при абсцессах, абсцессах груди или мастите, дерматите или кожных инфекциях и инфекциях половых путей.
S. aureus считается классическим оппортунистом в этом смысле, поскольку он использует сломанную кожу или другие места проникновения, чтобы вызвать инфекцию.
У животных и людей с ослабленным иммунитетом или иммунодефицитом эти бактерии могут быть опасными для жизни. Это может привести к гнойным (абсцедирующим) инфекциям кожи, глаз и половых путей.
Что вызывает
S. aureus ?Из всего разнообразия проявлений S. aureus может вызывать:
- Незначительные кожные инфекции, такие как прыщи, импетиго и т. Д.
- Может вызывать фурункулы (фурункулы), фолликулит целлюлит, карбункулы
- Причина синдрома ожога кожи и абсцессов
- Может привести к легочным инфекциям или пневмонии
- Инфекции головного мозга или менингит
- Инфекции костей или остеомиелит
- Инфекции сердца или эндокардит
- Генерализованные опасные для жизни инфекции крови или синдром токсического шока (СТШ), бактериемия и сепсис
Диагностика
Наличие S.


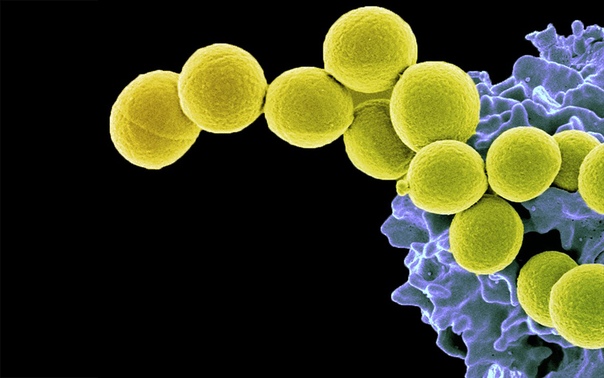 Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
