Цитологическое исследование: лейкоцитарная реакция — выраженная — Вопрос гинекологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 72 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.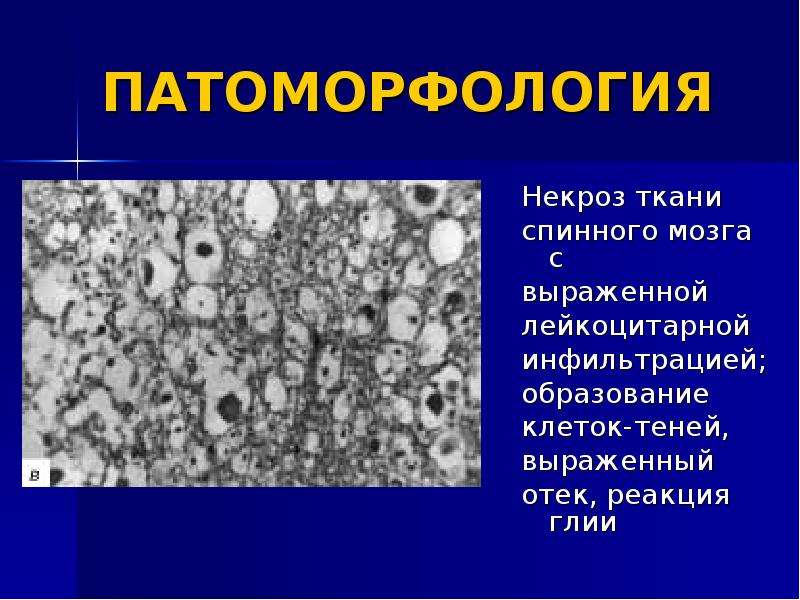
Мы отвечаем на 97.45% вопросов.
Оставайтесь с нами и будьте здоровы!
Патоморфологическая диагностика эрозивно-язвенного рефлюкс-эзофагита по биопсии слизистой оболочки пищевода
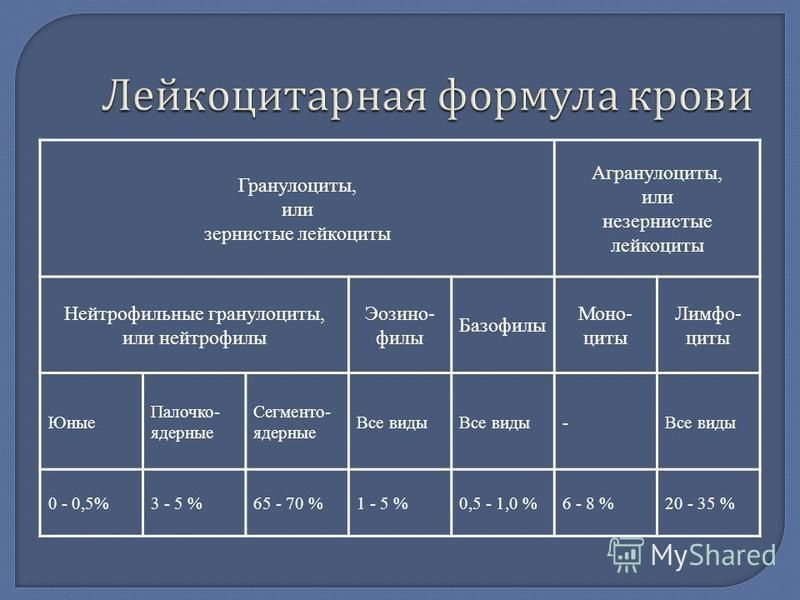
Актуальность проблемы гастроэзофагеальной рефлюксной болезни (ГЭРБ) обусловлена ее высокой распространенностью, которая, по данным ряда авторов, среди взрослого населения достигает 20—40% [1]. Особое место среди форм ГЭРБ занимают эрозивно-язвенные поражения, которые могут осложняться перфорацией, рубцовой стриктурой пищевода, приводить к медиастиниту и являться причиной смерти. Для их характеристики обычно используют эндоскопические классификации, учитывающие распространенность поражений к общей площади дистального отдела пищевода. Сведения о гистологической характеристике и морфогенезе острых язв и эрозий слизистой оболочки пищевода (СОП) остаются неполными [2, 3], в то время как аналогичные изменения в желудке и двенадцатиперстной кишке хорошо изучены и подробно описаны [4—6].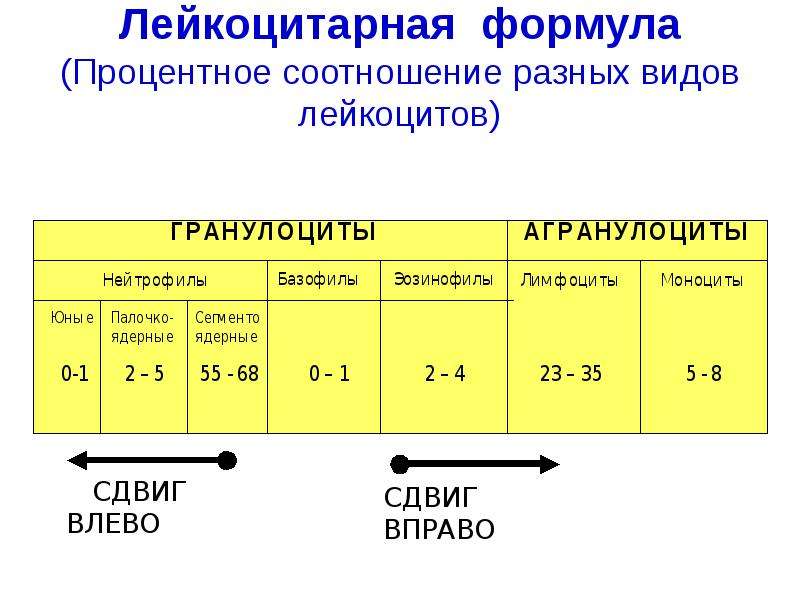 В то же время знание особенностей развития и заживления деструктивных поражений СОП под влиянием содержимого желудка и/или двенадцатиперстной кишки должно способствовать разработке особых методов лечения, с использованием, помимо антисекреторных, противовоспалительных препаратов и цитопротекторов слизистой оболочки, синергистов или антагонистов факторов роста.
В то же время знание особенностей развития и заживления деструктивных поражений СОП под влиянием содержимого желудка и/или двенадцатиперстной кишки должно способствовать разработке особых методов лечения, с использованием, помимо антисекреторных, противовоспалительных препаратов и цитопротекторов слизистой оболочки, синергистов или антагонистов факторов роста.
Цель исследования — изучить морфологическую характеристику и морфогенез эрозивно-язвенных поражений при ГЭРБ.
В работе использовали материал 2220 биоптатов слизистой оболочки дистального отдела пищевода и области сквамозно-цилиндроклеточного соединения (СЦС) у 669 пациентов (у 90 больных проводились повторные исследования в динамике лечения ИПП). Гистологические препараты окрашивали гематоксилином и эозином, по Ван-Гизону, метиленовым синим по Лефлеру, комбинированным методом — алциановым синим и PAS-реакцией.
Пептические эрозии выявлены в 24% наблюдений, язвы — в 17%. Они, как правило, локализовались в области СЦС или зоны, выстланной многослойным плоским эпителием (МПЭ).
Отличительный признак острых пептических поражений — возникновение своеобразного некроза коллагеновых и мышечных волокон, который в литературе часто обозначают термином «фибриноидный» некроз. На самом деле в тех единичных случаях, когда удается увидеть начальные стадии повреждения СОП желудочным соком, типичной картины «фибриноида» не наблюдается.
 Окрашивание: а — PAS-реакция; б—г — гематоксилином и эозином; д, е — PAS-реакция и алциановый синий. ×200. Они могут иметь небольшой размер, занимать лишь поверхностные отделы субэпителиальной зоны или распространяться до наружного слоя стенки пищевода. В некротизированных массах видны расширенные сосуды с гомогенными бесструктурными стенками, в просветах их нередко выявляются тромбы. Эти изменения мы обозначили как стадию некроза.
Окрашивание: а — PAS-реакция; б—г — гематоксилином и эозином; д, е — PAS-реакция и алциановый синий. ×200. Они могут иметь небольшой размер, занимать лишь поверхностные отделы субэпителиальной зоны или распространяться до наружного слоя стенки пищевода. В некротизированных массах видны расширенные сосуды с гомогенными бесструктурными стенками, в просветах их нередко выявляются тромбы. Эти изменения мы обозначили как стадию некроза.Возможны два варианта заживления таких эрозий и язв.
В 27% наблюдений внутри или вокруг очагов некроза отмечалась выраженная лейкоцитарная инфильтрация с расплавлением некротических масс, их секвестрацией и отторжением (II стадия). В области краев или дна дефекта уже ко 2-м суткам можно увидеть новообразование капилляров и формирование грануляционной ткани. В биоптатах редко визуализируются все стадии процесса. Часто рядом с пластами МПЭ или изолированно обнаруживаются лишь очаговые скопления нейтрофилов, фибрина и/или некротических масс, указывающие на наличие острых пептических поражений.
Степень развития грануляционной ткани варьирует от очень мелких очагов в краях до обширных участков, занимающих всю площадь биоптата (рис. 1, б). Новообразованная молодая соединительная ткань представлена многочисленными сосудами капиллярного типа, иногда хорошо различимыми или невидимыми из-за обильной инфильтрации клеточными элементами. На поверхности грануляционной ткани видны скопления фибрина, лейкоцитов, а также микробов (чаще кокков), нити грибов типа Candida. При специальном окрашивании можно выявить характерный вертикальный ход капилляров к поверхности язвы. В глубоких отделах они располагаются параллельно поверхности дефекта и распространяются в мышечные слои. Эндотелий капилляров часто набухший, с крупными гиперхромными ядрами, на обычных препаратах приобретает сходство с опухолевыми клетками. Только использование специального окрашивания для выявления базальных мембран капилляров, а иногда и иммуногистохимических реакций позволяет выявить истинный характер изменений.
С момента повреждения начинается регенерация эпителиоцитов. В МПЭ происходят пролиферация клеток базального слоя (базально-клеточная гиперплазия), удлинение сосочков, что сопровождается значительным утолщением пласта; железистый эпителий в виде пласта смещается на эрозированную поверхность или грануляционную ткань. Нередко в эпителиоцитах желез, непосредственно граничащих с зоной повреждения, появляется смешанная желудочно-кишечная или кишечная слизь, интенсивно окрашивающаяся алциановым синим. Иногда на поверхности грануляционной ткани находятся группы недифференцированных клеток цилиндрического и многослойного плоского эпителия, лежащие изолированно друг от друга (стадия эпителизации;
 Постепенно происходит полное закрытие дефектов сквамозным или цилиндрическим эпителием, которые иногда сосуществуют в виде изолированных островков или наслаиваются друг на друга. Поверхность эпителизированных дефектов ровная или ворсинчатая, с формированием полиповидных структур (рис. 1, г). Постоянно происходит новообразование слизистых оболочек желез. Заживление эрозий и язв занимает 4—8 нед. Таким образом, при эпителизации дефектов в 19% случаев возникает цилиндроклеточная метаплазия (ЦМ) сквамозного эпителия. В 74% наблюдений выявляется ЦМ кардиального типа: столбчатые клетки сходны с покровно-ямочным эпителием слизистой оболочки желудка, содержат в цитоплазме PAS+-слизь (рис. 1, д). В 26% наблюдений ЦМ расценена как кишечная. Во всех случаях она была неполной, сочеталась с ЦМ кардиального типа, имела разную распространенность (от отдельных бокаловидных клеток (БК) до крупных очагов с плоской или ворсинчатой поверхностью), наиболее обширной была в зоне СЦС, в краях глубоких язв (рис.
Постепенно происходит полное закрытие дефектов сквамозным или цилиндрическим эпителием, которые иногда сосуществуют в виде изолированных островков или наслаиваются друг на друга. Поверхность эпителизированных дефектов ровная или ворсинчатая, с формированием полиповидных структур (рис. 1, г). Постоянно происходит новообразование слизистых оболочек желез. Заживление эрозий и язв занимает 4—8 нед. Таким образом, при эпителизации дефектов в 19% случаев возникает цилиндроклеточная метаплазия (ЦМ) сквамозного эпителия. В 74% наблюдений выявляется ЦМ кардиального типа: столбчатые клетки сходны с покровно-ямочным эпителием слизистой оболочки желудка, содержат в цитоплазме PAS+-слизь (рис. 1, д). В 26% наблюдений ЦМ расценена как кишечная. Во всех случаях она была неполной, сочеталась с ЦМ кардиального типа, имела разную распространенность (от отдельных бокаловидных клеток (БК) до крупных очагов с плоской или ворсинчатой поверхностью), наиболее обширной была в зоне СЦС, в краях глубоких язв (рис. 1, е). Помимо БК, в биоптатах обнаруживались и другие клеточные элементы кишечного типа: цилиндрические абсорбирующие с синей каймой, секретирующие с синей цитоплазмой, промежуточные клетки («тонко-толстокишечные», «желудочно-кишечные», «муцинозно-плоскоклеточные»). Количество БК возрастало с увеличением степени активности воспалительного процесса и снижалось при его затухании на фоне антисекреторной и противовоспалительной терапии. Таким образом формировался пищевод Барретта — участок ЦМ слизистой оболочки с кишечными бокаловидными и цилиндрическими клетками.
1, е). Помимо БК, в биоптатах обнаруживались и другие клеточные элементы кишечного типа: цилиндрические абсорбирующие с синей каймой, секретирующие с синей цитоплазмой, промежуточные клетки («тонко-толстокишечные», «желудочно-кишечные», «муцинозно-плоскоклеточные»). Количество БК возрастало с увеличением степени активности воспалительного процесса и снижалось при его затухании на фоне антисекреторной и противовоспалительной терапии. Таким образом формировался пищевод Барретта — участок ЦМ слизистой оболочки с кишечными бокаловидными и цилиндрическими клетками.При хронизации язв в глубоких отделах отмечается фиброзная ткань, содержащая коллагеновые волокна, фибробласты, лимфоидные и макрофагальные инфильтраты. На вертикальном срезе можно различить три слоя: фибринозно-лейкоцитарный (внутренний), грануляционной и фиброзной ткани с выраженной воспалительной инфильтрацией.
Помимо описанного варианта заживления пептических эрозий и язв возможен второй путь — без развития типичной грануляционной ткани, за счет организации некротических масс, который встречался в 15% наблюдений.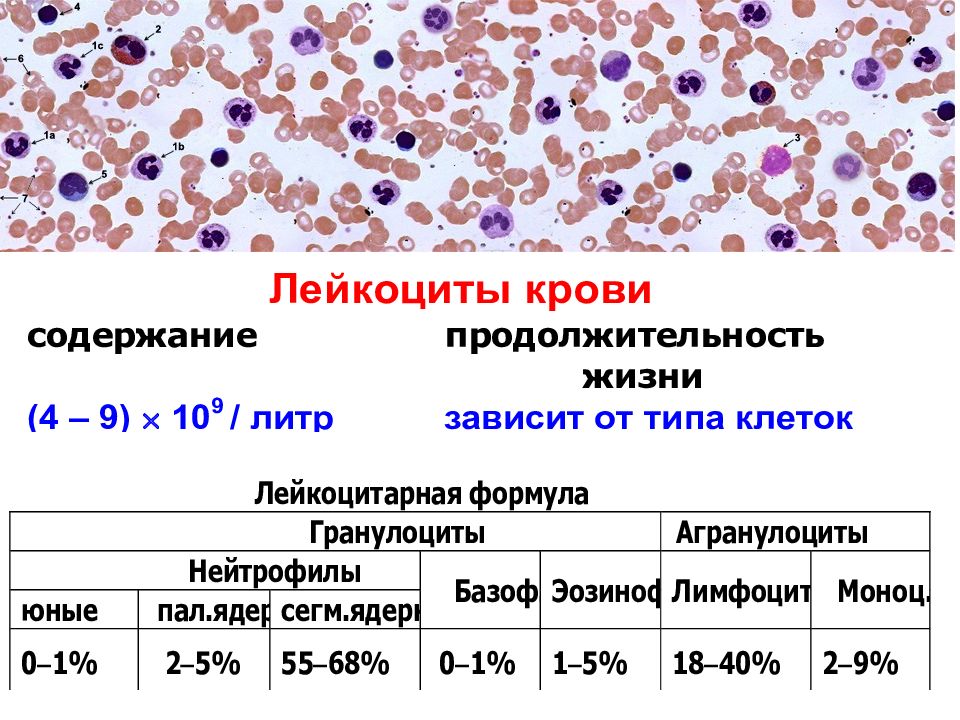

 В их клетках увеличивается количество слизистого секрета, который становится амфифильным или ярко окрашивается алциановым синим, т.е. приобретает признаки кишечной слизи.
В их клетках увеличивается количество слизистого секрета, который становится амфифильным или ярко окрашивается алциановым синим, т.е. приобретает признаки кишечной слизи.Острые поражения на фоне предсуществующей ЦМ МПЭ СОП поверхностны (рис. 2, в). Это свидетельствует о том, что ЦМ является своеобразной приспособительной реакцией организма в ответ на воздействие кислого желудочного или щелочного дуоденального содержимого. Небольшие очаги некроза слизистой оболочки инфильтрируются нейтрофилами и отторгаются. При регенерации железистого эпителия появляются БК (рис. 2, г), усиливается новообразование желез. Многие из них кистозно расширяются. В их эпителиальной выстилке также появляются элементы с кишечной слизью и типичные БК. При каждом обострении число элементов с кишечной слизью увеличивается. Так расширяется зона пищевода Барретта.
Помимо пептических эрозий и язв, могут возникать деструктивные процессы другого происхождения. Так, при желудочной метаплазии слизистой оболочки часть эрозий связана с повреждением эпителия Helicobacter pylori. Такие изменения характеризуются поверхностным расположением, инфильтрацией нейтрофилами при отсутствии зон некроза. По сравнению с пептическими поражениями слабо выражена реактивная гиперплазия слизистых оболочек желез. Возможно участие и других микроорганизмов. Инфицирование микробами и грибами, как правило, сопровождается выраженным гнойным воспалением, новообразованием лимфоидных фолликулов, HPV и HSV — своеобразными изменениями многослойного плоского эпителия.
Такие изменения характеризуются поверхностным расположением, инфильтрацией нейтрофилами при отсутствии зон некроза. По сравнению с пептическими поражениями слабо выражена реактивная гиперплазия слизистых оболочек желез. Возможно участие и других микроорганизмов. Инфицирование микробами и грибами, как правило, сопровождается выраженным гнойным воспалением, новообразованием лимфоидных фолликулов, HPV и HSV — своеобразными изменениями многослойного плоского эпителия.
Конечной стадией репарации при острых эрозивно-язвенных поражениях является ремоделирование слизистой оболочки и подслизистого слоя в виде формирования на поверхности акантом и папиллом, железистых гиперплазиогенных полипов, репликации мышечной ткани t. muscularis mucosae, склероза, гиалиноза, ангиоматоза.
При развитии рубцовых стенозов в биоптатах выявляется резкое утолщение МПЭ с папилломатозом, гиперкератозом, акантозом, выраженным гиалинозом подлежащей соединительной ткани.
Таким образом, по данным биопсий, эрозивно-язвенные поражения СОП были выявлены в 41% наблюдений, несмотря на то, что эндоскопию и забор материала проводили обычно после курса терапии ИПП. Наиболее тяжелые эрозивно-язвенные формы наблюдаются в области СЦС или в зонах МПЭ. Можно выделить 5 типичных стадий их развития — некроз, лейкоцитарную инфильтрацию и отторжение некротических масс, гранулирование, эпителизацию и ремоделирование тканей после рубцевания. Заживление язв — длительный процесс, занимающий не менее 4—8 нед.
Наиболее тяжелые эрозивно-язвенные формы наблюдаются в области СЦС или в зонах МПЭ. Можно выделить 5 типичных стадий их развития — некроз, лейкоцитарную инфильтрацию и отторжение некротических масс, гранулирование, эпителизацию и ремоделирование тканей после рубцевания. Заживление язв — длительный процесс, занимающий не менее 4—8 нед.
Помимо классического варианта нами описан второй возможный путь репарации — инкапсуляция и организация некротических масс, превращение их в очаги гиалиноза. В этих случаях слабо выражены лейкоцитарная и макрофагальная инфильтрация, резко угнетен ангиогенез, вследствие чего не формируется богато васкуляризированная соединительная (грануляционная) ткань. Нарушается реэпителизация, в краях дефектов отмечается активная пролиферация клеток многослойного плоского и железистого эпителия, в окружающих тканях происходит гиперплазия слизистых оболочек желез. Именно на этом фоне часто регистрируется интестинальная метаплазия и создаются условия для формирования предопухолевых состояний.
При предсуществующей ЦМ острые деструктивные поражения СОП поверхностны. В процессе регенерации эпителия происходит кишечная метаплазия покровного и железистого эпителия. Так постепенно формируется пищевод Барретта.
Следовательно, острые эрозии и язвы, возникающие в зонах многослойного плоского и цилиндрического эпителия, представляют собой закономерный этап в цепи изменений, предшествующих развитию пищевода Барретта и способствующих его прогрессированию.
Учитывая частоту пептических поражений СОП, длительность заживления, возникающие грубые морфологические изменения, в комплекс лечебных мероприятий помимо антисекреторной терапии следует, по-видимому, включать противовоспалительные и цитопротекторные препараты.
Все стадии развития пептических эрозий и язв должны найти отражение в гистологических заключениях по биоптатам СОП, и их необходимо учитывать при назначении местного и общего лечения.
Сибирская язва
Сиби́рская я́зва (карбункул злокачественный, антракс) — особо опасная инфекционная болезнь сельскохозяйственных и диких животных всех видов, а также человека. Болезнь протекает молниеносно, сверхостро, остро и подостро (у овец и крупного рогатого скота), остро, подостро и ангинозно (у свиней), преимущественно в карбункулёзной форме — у человека. Встречаются также орофарингеальная и гастроинтестинальная формы[1]. Характеризуется интоксикацией, развитием серозно-геморрагического воспаления кожи, лимфатических узлов и внутренних органов; протекает в кожной или септической форме (также у животных встречаются кишечная и лёгочная формы).
Болезнь протекает молниеносно, сверхостро, остро и подостро (у овец и крупного рогатого скота), остро, подостро и ангинозно (у свиней), преимущественно в карбункулёзной форме — у человека. Встречаются также орофарингеальная и гастроинтестинальная формы[1]. Характеризуется интоксикацией, развитием серозно-геморрагического воспаления кожи, лимфатических узлов и внутренних органов; протекает в кожной или септической форме (также у животных встречаются кишечная и лёгочная формы).
Происхождение названия
Сибирская язва, известная с древнейших времен под названиями «священный огонь», «персидский огонь» и др., неоднократно упоминалась в сочинениях античных и восточных писателей и учёных. Подробное описание клиники этой болезни было сделано французским врачом Мораном в 1766 году. В дореволюционной России в виду преимущественного распространения в Сибири это заболевание получило название «сибирская язва», когда русский врач С. С. Андреевский в 1788 году описал в сочинении «О сибирской язве» крупную эпидемию этой инфекции в западносибирских губерниях, а в опыте самозаражения установил идентичность сибирской язвы животных и человека и доказал возможность её передачи от животных к людям.
Возбудитель
Возбудитель заболевания был почти одновременно описан в 1849—1850 годах сразу тремя исследователями: А. Поллендером, Ф. Брауэллем и К. Давеном. В 1876 году Р. Кох выделил его в чистой культуре. Из всех патогенных для человека бактерий возбудитель сибирской язвы был открыт первым. Общепринятое на сегодняшний день наименование сибирской язвы — антракс, от др.-греч. ἄνθραξ «уголь, карбункул»: такое название было дано по характерному угольно-чёрному цвету сибиреязвенного струпа при кожной форме болезни.Возбудитель сибирской язвы — бацилла Bacillus anthracis. Она представляет собой крупную спорообразующую грамположительную палочку размером 5—10 × 1—1,5 мкм. Бациллы сибирской язвы хорошо растут на мясопептонных средах, содержат капсульный и соматический антигены и способны выделять экзотоксин, представляющий собой белковый комплекс, состоящий из вызывающего отёк (повышение концентрации цАМФ), протективного (взаимодействует с мембранами клеток, опосредует активность других компонентов) и летального (цитотоксический эффект, отёк лёгких) компонентов. Капсула — антифагоцитарная активность.Сибиреязвенная бактерия вне организма при доступе кислорода образует споры, вследствие чего обладает большой устойчивостью к высокой температуре, высушиванию и дезинфицирующим веществам. Споры бактерий сибирской язвы могут сохраняться годами; пастбище, заражённое испражнениями и мочой больных животных, может долгие годы сохранять сибиреязвенные споры. Вегетативные формы сибиреязвенной палочки быстро погибают при кипячении и воздействии обычных дезинфектантов. При автоклавировании споры при температуре 110 °C гибнут лишь через сорок минут. Сухой жар при температуре 140 °C убивает споры через два с половиной — три часа. Прямые солнечные лучи споры сибирской язвы выдерживают в течение десяти — пятнадцати суток. Спороцидным действием обладают также активированные растворы хлорамина, горячего формальдегида, перекиси водорода.
Капсула — антифагоцитарная активность.Сибиреязвенная бактерия вне организма при доступе кислорода образует споры, вследствие чего обладает большой устойчивостью к высокой температуре, высушиванию и дезинфицирующим веществам. Споры бактерий сибирской язвы могут сохраняться годами; пастбище, заражённое испражнениями и мочой больных животных, может долгие годы сохранять сибиреязвенные споры. Вегетативные формы сибиреязвенной палочки быстро погибают при кипячении и воздействии обычных дезинфектантов. При автоклавировании споры при температуре 110 °C гибнут лишь через сорок минут. Сухой жар при температуре 140 °C убивает споры через два с половиной — три часа. Прямые солнечные лучи споры сибирской язвы выдерживают в течение десяти — пятнадцати суток. Спороцидным действием обладают также активированные растворы хлорамина, горячего формальдегида, перекиси водорода.
Эпизоотология
Источником инфекции являются больные сельскохозяйственные животные: крупный рогатый скот, лошади, ослы, овцы, козы, олени, верблюды, у которых болезнь протекает в генерализованной форме. Домашние животные — кошки, собаки — мало восприимчивы.
Домашние животные — кошки, собаки — мало восприимчивы.
Сибирская язва у животных характеризуется следующими особенностями:
- короткий инкубационный период, обычно не превышающий 3—4 дня;
- выраженная клиника в виде тяжёлого лихорадочного состояния, упадка сердечно-сосудистой деятельности, менингеальных явлений, кровавой диареи и рвоты;
- стремительное развитие инфекционного процесса, заканчивающегося гибелью животных в течение, как правило, первых 2—3 суток.
Крупный рогатый скот и лошади: как правило протекает остро и подостро. Характеризуется: (септическая форма) резким повышением температуры, апатией, снижением продуктивности, отеками головы, шеи и подгрудка; (кишечная форма) апатией, отказом от корма, кровавой диареей и рвотой, тимпанией.
Свиньи: (ангинозная форма) встречается только у свиней и протекает бессимптомно; изменения можно обнаружить только при ветеринарно-санитарной экспертизе туш по характерному катарально-геморрагическому воспалению лимфатических узлов.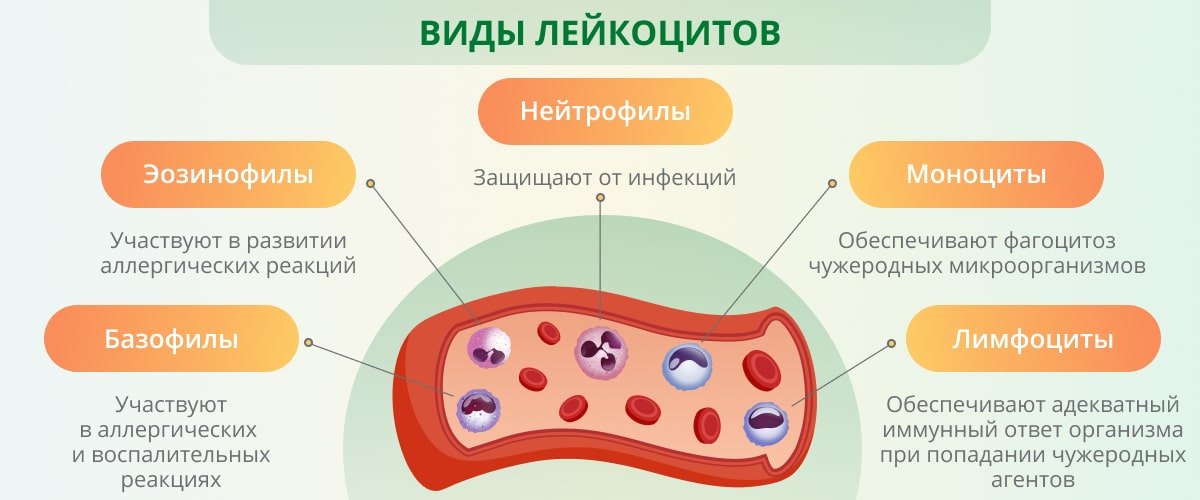 Эпизоотии сибирской язвы территориально привязаны к почвенным очагам — хранилищам возбудителей. Первичные почвенные очаги образуются в результате непосредственного инфицирования почвы выделениями больных животных на пастбищах, в местах стойлового содержания животных, в местах захоронения трупов (скотомогильники) и т. п. Вторичные почвенные очаги возникают путём смыва и заноса спор на новые территории дождевыми, талыми и сточными водами. Заражение может произойти при участии большого числа факторов передачи. К ним относятся выделения из шкуры больных животных, их внутренние органы, мясные и другие пищевые продукты, почва, вода, воздух, предметы внешней среды, обсеменённые сибиреязвенными спорами.Восприимчивость к сибирской язве у человека не зависит от возрастных, половых и других физиологических особенностей организма; она связана с путями заражения и величиной инфицирующей дозы.
Эпизоотии сибирской язвы территориально привязаны к почвенным очагам — хранилищам возбудителей. Первичные почвенные очаги образуются в результате непосредственного инфицирования почвы выделениями больных животных на пастбищах, в местах стойлового содержания животных, в местах захоронения трупов (скотомогильники) и т. п. Вторичные почвенные очаги возникают путём смыва и заноса спор на новые территории дождевыми, талыми и сточными водами. Заражение может произойти при участии большого числа факторов передачи. К ним относятся выделения из шкуры больных животных, их внутренние органы, мясные и другие пищевые продукты, почва, вода, воздух, предметы внешней среды, обсеменённые сибиреязвенными спорами.Восприимчивость к сибирской язве у человека не зависит от возрастных, половых и других физиологических особенностей организма; она связана с путями заражения и величиной инфицирующей дозы.
Патогенез
Воротами инфекции для сибирской язвы обычно является повреждённая кожа. В редких случаях бацилла внедряется через слизистые оболочки дыхательных путей и желудочно-кишечного тракта. На месте внедрения возбудителя в кожу возникает сибиреязвенный карбункул в виде очага серозно-геморрагического воспаления с некрозом, отёком прилегающих тканей и регионарным лимфаденитом. Местный патологический процесс обусловлен действием экзотоксина сибиреязвенной палочки, отдельные компоненты которого вызывают выраженные нарушения микроциркуляции, отёк тканей и коагуляционный некроз. Вне зависимости от входных ворот инфекции первая стадия представляет собой локализованное поражение регионарных лимфатических узлов, вторая стадия — генерализацию процесса. Генерализация инфекции с прорывом возбудителей сибирской язвы в кровь и развитием септической формы происходит при кожной форме сибирской язвы чрезвычайно редко. Сибиреязвенный сепсис обычно развивается при внедрении возбудителя через слизистые оболочки дыхательных путей или желудочно-кишечного тракта. В этих случаях нарушение барьерной функции трахеобронхиальных или мезентериальных лимфатических узлов приводит к генерализации процесса.
В редких случаях бацилла внедряется через слизистые оболочки дыхательных путей и желудочно-кишечного тракта. На месте внедрения возбудителя в кожу возникает сибиреязвенный карбункул в виде очага серозно-геморрагического воспаления с некрозом, отёком прилегающих тканей и регионарным лимфаденитом. Местный патологический процесс обусловлен действием экзотоксина сибиреязвенной палочки, отдельные компоненты которого вызывают выраженные нарушения микроциркуляции, отёк тканей и коагуляционный некроз. Вне зависимости от входных ворот инфекции первая стадия представляет собой локализованное поражение регионарных лимфатических узлов, вторая стадия — генерализацию процесса. Генерализация инфекции с прорывом возбудителей сибирской язвы в кровь и развитием септической формы происходит при кожной форме сибирской язвы чрезвычайно редко. Сибиреязвенный сепсис обычно развивается при внедрении возбудителя через слизистые оболочки дыхательных путей или желудочно-кишечного тракта. В этих случаях нарушение барьерной функции трахеобронхиальных или мезентериальных лимфатических узлов приводит к генерализации процесса. Бактериемия и токсинемия могут явиться причиной развития инфекционно-токсического шока.
Бактериемия и токсинемия могут явиться причиной развития инфекционно-токсического шока.
В основе патогенеза лежит действие экзотоксина возбудителя, который состоит, по крайней мере, из трёх компонентов или факторов:
- первого (I), эдематозного (воспалительного) фактора;
- второго (II), протективного (защитного) фактора;
- третьего (III), летального фактора. Добавление I фактора ко II фактору увеличивает иммуногенные свойства, III фактора — их снижает.
Смесь I и II факторов вызывает увеличение воспалительной реакции и отёка за счёт увеличения проницаемости капилляров. Смесь II и III факторов усиливает действие летального фактора и приводит к гибели морских свинок, крыс и мышей. Смесь трёх факторов сибиреязвенного токсина (I, II, III) оказывает воспалительное (эдематозное) и летальное действие.Морфологической сущностью сибиреязвенного сепсиса является острое серозно-геморрагическое, геморрагическое, реже — фибринозно-геморрагическое воспаление. Лейкоцитарная реакция в очагах воспаления при сепсисе выражена слабо или отсутствует. В органах иммуногенеза (селезёнка, лимфоузлы, вилочковая железа) имеется подавление иммунной защиты организма с замещением лимфоидной ткани макрофагами и наличие примитивной защитной реакции в виде макрофагального незавершенного фагоцитоза возбудителя.
Лейкоцитарная реакция в очагах воспаления при сепсисе выражена слабо или отсутствует. В органах иммуногенеза (селезёнка, лимфоузлы, вилочковая железа) имеется подавление иммунной защиты организма с замещением лимфоидной ткани макрофагами и наличие примитивной защитной реакции в виде макрофагального незавершенного фагоцитоза возбудителя.
Клиническая картина
Продолжительность инкубационного периода колеблется от нескольких часов до дней, чаще всего составляет 2—3 дня. Заболевание может протекать в локализованной (кожной) или генерализованной (легочной и кишечной) форме.
Кожная форма сибирской язвы
Встречается в 98—99 % всех случаев сибирской язвы. Наиболее частой её разновидностью является карбункулёзная форма, реже встречаются эдематозная, буллёзная и эризипелоидная формы заболевания. Поражаются преимущественно открытые части тела; особенно тяжело протекает болезнь при локализации карбункулов на голове, шее, слизистых оболочках рта и носа . Клиника генерализации сибиреязвенной инфекции, вне зависимости от формы — кожной или висцеральной, — при крайнем многообразии проявлений в начальном периоде болезни в терминальной стадии однотипна: она сопровождается выходом в периферическую кровь сибиреязвенных бактерий, концентрация которых достигает сотен тысяч и миллионов бактериальных клеток в 1 мм³ крови, что может рассматриваться как сибиреязвенный сепсис (см.), и представляет собой клинику инфекционно-токсического шока. Это тяжёлые нарушения свертывающей и антисвертывающей систем крови, ацидоз, острая почечная недостаточность, падение температуры тела ниже нормы, сильнейшая интоксикация. Обычно карбункул бывает один, но иногда их количество доходит до 10—20 и более. На месте входных ворот инфекции последовательно развивается пятно, папула, везикула, язва. Безболезненное пятно красновато-синего цвета и диаметром 1—3 мм, имеющее сходство со следом от укуса насекомого, через несколько часов переходит в папулу медно-красного цвета. Нарастает зуд и ощущение жжения.
Клиника генерализации сибиреязвенной инфекции, вне зависимости от формы — кожной или висцеральной, — при крайнем многообразии проявлений в начальном периоде болезни в терминальной стадии однотипна: она сопровождается выходом в периферическую кровь сибиреязвенных бактерий, концентрация которых достигает сотен тысяч и миллионов бактериальных клеток в 1 мм³ крови, что может рассматриваться как сибиреязвенный сепсис (см.), и представляет собой клинику инфекционно-токсического шока. Это тяжёлые нарушения свертывающей и антисвертывающей систем крови, ацидоз, острая почечная недостаточность, падение температуры тела ниже нормы, сильнейшая интоксикация. Обычно карбункул бывает один, но иногда их количество доходит до 10—20 и более. На месте входных ворот инфекции последовательно развивается пятно, папула, везикула, язва. Безболезненное пятно красновато-синего цвета и диаметром 1—3 мм, имеющее сходство со следом от укуса насекомого, через несколько часов переходит в папулу медно-красного цвета. Нарастает зуд и ощущение жжения. Через 12—24 ч. папула превращается в пузырёк диаметром 2—3 мм, заполненный жидкостью, которая темнеет и становится кровянистой. При расчёсывании (иногда и самопроизвольно) пузырёк лопается, и на его месте образуется язва с тёмно-коричневым дном, приподнятыми краями и серозно-геморрагическим отделяемым. Через сутки язва достигает 8—15 мм в диаметре. В результате некроза центральная часть язвы через 1—2 недели превращается в чёрный безболезненный плотный струп, вокруг которого имеется выраженный воспалительный валик красного цвета. Внешне струп напоминает уголёк в пламени, что и послужило поводом для названия этой болезни (Antrax — уголь). Это поражение и получило название карбункула.
Через 12—24 ч. папула превращается в пузырёк диаметром 2—3 мм, заполненный жидкостью, которая темнеет и становится кровянистой. При расчёсывании (иногда и самопроизвольно) пузырёк лопается, и на его месте образуется язва с тёмно-коричневым дном, приподнятыми краями и серозно-геморрагическим отделяемым. Через сутки язва достигает 8—15 мм в диаметре. В результате некроза центральная часть язвы через 1—2 недели превращается в чёрный безболезненный плотный струп, вокруг которого имеется выраженный воспалительный валик красного цвета. Внешне струп напоминает уголёк в пламени, что и послужило поводом для названия этой болезни (Antrax — уголь). Это поражение и получило название карбункула.
Септическая форма сибирской язвы
Септическая форма встречается довольно редко. Заболевание начинается остро с потрясающего озноба и повышения температуры до 39—40 °C. Наблюдаются выраженные тахикардия, одышка, тахипноэ, боли в груди и кашель с выделением пенистой кровянистой мокроты. Определяются признаки пневмонии и плеврального выпота. При развитии инфекционно-токсического шока возникает геморрагический отёк лёгких. В крови и мокроте обнаруживают большое количество сибиреязвенных бактерий. У части больных появляются боли в животе, присоединяются тошнота, кровавая рвота, жидкий кровянистый стул. В последующем развивается парез кишечника, возможен перитонит. Обнаруживаются симптомы менингоэнцефалита. Инфекционно-токсический шок, отёк и набухание головного мозга, желудочно-кишечное кровотечение и перитонит могут явиться причиной летального исхода уже в первые дни заболевания.
Определяются признаки пневмонии и плеврального выпота. При развитии инфекционно-токсического шока возникает геморрагический отёк лёгких. В крови и мокроте обнаруживают большое количество сибиреязвенных бактерий. У части больных появляются боли в животе, присоединяются тошнота, кровавая рвота, жидкий кровянистый стул. В последующем развивается парез кишечника, возможен перитонит. Обнаруживаются симптомы менингоэнцефалита. Инфекционно-токсический шок, отёк и набухание головного мозга, желудочно-кишечное кровотечение и перитонит могут явиться причиной летального исхода уже в первые дни заболевания.
Диагностика
Диагноз ставится на основе клинико-эпидемиологических и лабораторных данных. Лабораторная диагностика включает бактериоскопический и бактериологический методы, а в целях ранней диагностики — иммунофлюоресцентный. Применяют также аллергологическую диагностику сибирской язвы путём внутрикожной пробы с антраксином, дающей положительные результаты после 5-го дня болезни. Материалом для лабораторного исследования являются содержимое везикул и карбункулов, а также мокрота, кровь, испражнения и рвотные массы при септической форме. Сибирскую язву различают с сапом, банальными фурункулами и карбункулами, чумой, туляремией, рожей, пневмониями и сепсисом иной этиологии.
Материалом для лабораторного исследования являются содержимое везикул и карбункулов, а также мокрота, кровь, испражнения и рвотные массы при септической форме. Сибирскую язву различают с сапом, банальными фурункулами и карбункулами, чумой, туляремией, рожей, пневмониями и сепсисом иной этиологии.
Лечение и профилактика
Этиотропную терапию сибирской язвы проводят антибиотиками. Назначают пенициллин. В патогенетической терапии используют коллоидные и кристаллоидные растворы, плазму, альбумин, глюкокортикостероиды. Хирургические вмешательства при кожной форме болезни недопустимы: они могут привести к генерализации инфекции. Профилактические мероприятия осуществляют в тесном контакте с ветеринарной службой. Выявленных больных животных следует изолировать, а их трупы сжигать; инфицированные объекты необходимо обеззараживать. Для дезинфекции шерсти и меховых изделий применяется камерная дезинфекция. Лица, находившиеся в контакте с больными животными или заразным материалом, подлежат активному врачебному наблюдению в течение 2 недель. Важное значение имеет вакцинация людей и животных сухой живой сибиреязвенной вакциной. Первую вакцину изобрёл и испытал французский микробиолог и химик Луи Пастер.
Важное значение имеет вакцинация людей и животных сухой живой сибиреязвенной вакциной. Первую вакцину изобрёл и испытал французский микробиолог и химик Луи Пастер.
Прогноз
Прогноз во многом определяется формой заболевания, в целом является условно неблагоприятным и возможен летальный исход даже при адекватном и своевременном лечении. При отсутствии соответствующего лечения кожной формы летальность составляет 10—20 %. При лёгочной форме заболевания в зависимости от штамма возбудителя летальность может превышать 90—95 %, даже при соответствующем лечении. Кишечная форма — около 50 %. Сибиреязвенный менингит — 90 %.
Эпизоотологическая обстановка
Вспышки сибирской язвы регистрируются в России и по сегодняшний день. Так 23 июля 2016 года появилось извещение ветеринарного надзора о падеже оленей на одном участке тундры в ямальском районе. 3 августа 2016 года появились сообщения об эпидемии сибирской язвы в Ямало-Ненецком АО. Для ликвидации вспышки сибирской язвы привлекались Вооружённые Силы Российской Федерации. 9 ноября 2016 года на севере Волгоградской области, в Нехаевском районе, граничащим с Ростовской и Воронежской областями был установлен случай падежа коровы
9 ноября 2016 года на севере Волгоградской области, в Нехаевском районе, граничащим с Ростовской и Воронежской областями был установлен случай падежа коровы
Лейкемоидная реакция — обзор
Клинические признаки
Клинические признаки и симптомы связаны с замещением клеток костного мозга лейкемическими бластами и инфильтрацией экстрамедуллярных участков. Бледность, усталость, петехии, кровотечение или жар могут быть вызваны панцитопенией. Боль в костях и артралгии, начало хромоты и отказа от ходьбы и даже откровенный артрит — не редкость. Симптомы опорно-двигательного аппарата можно спутать с остеомиелитом или ювенильным ревматоидным артритом, что может отсрочить постановку диагноза.Нечасто поражение центральной нервной системы (ЦНС) может проявляться в виде признаков и симптомов повышенного внутричерепного давления, таких как головные боли и отек диска зрительного нерва; или паралич черепных нервов, ригидность затылочной кости и, в редких случаях, гиперфагия и ожирение, вызванные инфильтрацией гипоталамуса. Явный лейкоз яичек проявляется безболезненным увеличением яичек. Поражение средостения, распространенное при Т-клеточном ОЛЛ, может вызывать одышку и синдром верхней полой вены.
Явный лейкоз яичек проявляется безболезненным увеличением яичек. Поражение средостения, распространенное при Т-клеточном ОЛЛ, может вызывать одышку и синдром верхней полой вены.
Клинические лабораторные исследования часто включают анемию и тромбоцитопению.Примерно у 20% детей количество лейкоцитов> 50 000 / мкл. Важно отметить, что примерно у 40% детей количество лейкоцитов <10 000 / мкл, и лейкозные бласты могут быть или не обнаружены в мазках периферической крови. Поэтому диагноз лейкемии иногда может быть пропущен при рутинном автоматическом анализе крови. Повышенная сывороточная активность лактатдегидрогеназы и концентрации мочевой кислоты и фосфора часто встречаются у пациентов с большим количеством лейкозных клеток.
Диагноз ОЛЛ устанавливается при исследовании костного мозга.Нормальный костный мозг содержит <5% бластов. Для диагностики ОЛЛ необходимо минимум 25% лимфобластов при дифференциальном исследовании аспирата костного мозга. У большинства детей с ОЛЛ имеется гиперклеточный костный мозг с бластами, составляющими 60–100% ядерных клеток.
Традиционно лейкоз ЦНС определяется как наличие по крайней мере пяти лейкоцитов на микролитр спинномозговой жидкости (CSF) и обнаружение лейкемических бластных клеток по наличию паралича черепных нервов или поражению сетчатки при офтальмоскопии. .Хотя явный лейкоз ЦНС относительно редок, субмикроскопическое поражение ЦНС присутствует при диагностике, по крайней мере, у половины пациентов при отсутствии каких-либо неврологических симптомов. Таким образом, терапия, направленная на ЦНС, обычно включается в терапию ОЛЛ.
Дифференциальный диагноз ОЛЛ включает опухолевые и неопухолевые заболевания. Поскольку у детей с ОЛЛ наблюдаются разнообразные неспецифические симптомы, некоторые детские незлокачественные заболевания можно спутать с лейкемией. Поскольку лечение стероидами может маскировать наличие ОЛЛ, необходимо серьезно подумать о диагнозе ОЛЛ до начала лечения стероидами любого детского незлокачественного заболевания.В случае сомнений рекомендуется исследование костного мозга.
Идиопатическая тромбоцитопеническая пурпура (ИТП) — частая причина синяков и петехий у детей. ИТП характеризуется отсутствием каких-либо других гематологических отклонений. Костный мозг следует исследовать при наличии анемии или гепатоспленомегалии.
Инфекционный мононуклеоз может проявляться лихорадкой, недомоганием, аденопатией, спленомегалией, сыпью и лимфоцитозом. Атипичные лимфоциты морфологически могут напоминать лейкозные лимфобласты.В редких случаях может потребоваться проточная цитометрия, чтобы отличить активированные атипичные лимфоциты от незрелых лейкозных лимфобластов.
Лейкемоидные реакции, наблюдаемые при сепсисе, остром гемолизе и других заболеваниях, обычно легко отличить от ОЛЛ с помощью морфологического исследования мазка периферической крови. Поскольку иногда ОЛЛ проявляется панцитопенией, апластическая анемия также входит в список дифференциальной диагностики.
Clinical Pearls
Острый лимфобластный лейкоз (ALL) и ревматоидные заболевания
- •
ALL может имитировать ювенильный идиопатический артрит (ЮИА; Глава 53) и другие нарушения опорно-двигательного аппарата.
- •
Поскольку лейкозные бласты могут отсутствовать в периферической крови, у любого ребенка с ЮИА следует рассмотреть возможность обследования костного мозга, особенно до начала стероидной терапии.
До 10% детей с ОЛЛ сначала проходят обследование в детских ревматологических клиниках. Лихорадку, артралгию, артрит или хромоту, сопровождающуюся анемией, легкой спленомегалией и лимфаденопатией, часто можно спутать с ювенильным идиопатическим артритом (Глава 53) или остеомиелитом.Этих пациентов можно лечить антибиотиками и противовоспалительными средствами в течение от нескольких недель до месяцев, прежде чем будет окончательно поставлен диагноз ОЛЛ. У таких пациентов следует серьезно подумать об исследовании костного мозга.
Поскольку лейкозные лимфобласты при окрашивании гематоксилином и эозином выглядят как маленькие круглые синие клетки, их редко можно спутать с метастатическими мелкоклеточными опухолями у детей, включая нейробластому, рабдомиосаркому и ретинобластому.
Иммунная система (для подростков) — Nemours KidsHealth
Идете ли вы в душе босиком после занятий физкультурой или касаетесь дверной ручки ванной, вы подвергаетесь воздействию микробов.К счастью для большинства из нас, иммунная система постоянно находится на связи, чтобы бороться с ошибками, которые могут вывести нас из строя.
Что такое иммунная система?
Иммунная система — это защита организма от инфекций. Иммунная система (произносится: ih-MYOON) атакует микробы и помогает нам оставаться здоровыми.
Какие части иммунной системы?
Многие клетки и органы работают вместе, чтобы защитить тело. Лейкоциты, также называемые лейкоцитами (произносится: LOO-kuh-sytes), играют важную роль в иммунной системе.
Некоторые типы лейкоцитов, называемые фагоцитами (произносится: FAH-guh-sytes), поглощают вторгшиеся организмы. Другие, называемые лимфоцитами (произносится: LIM-fuh-sytes), помогают организму запоминать захватчиков и уничтожать их.
Одним из типов фагоцитов является нейтрофил (произносится: НОО-тру-фил), который борется с бактериями. Если у кого-то может быть бактериальная инфекция, врачи могут назначить анализ крови, чтобы узнать, вызвало ли оно много нейтрофилов в организме.Другие типы фагоцитов выполняют свою работу, чтобы убедиться, что организм реагирует на захватчиков.
Двумя типами лимфоцитов являются B-лимфоциты и T-лимфоциты . Лимфоциты берут начало в костном мозге и либо остаются там и созревают в В-клетки, либо переходят в вилочковую железу для созревания в Т-клетки. В-лимфоциты похожи на военную разведывательную систему организма — они находят свои цели и посылают средства защиты, чтобы заблокировать их. Т-клетки похожи на солдат — они уничтожают захватчиков, которых обнаруживает система разведки.
Как работает иммунная система?
Когда организм улавливает чужеродные вещества (называемые антигенами), иммунная система распознает антигены и избавляется от них.
В-лимфоциты запускаются, чтобы вырабатывать антитела (также называемые иммуноглобулинами ). Эти белки фиксируются на определенных антигенах. После того, как они вырабатываются, антитела обычно остаются в нашем организме на тот случай, если нам снова придется бороться с тем же микробом. Вот почему тот, кто заболевает какой-либо болезнью, например ветряной оспой, обычно не заболевает ею снова.
Таким же образом иммунизация (вакцина) предотвращает некоторые заболевания. Иммунизация вводит в организм антиген таким образом, чтобы никто не заболел. Но это позволяет организму вырабатывать антитела, которые защитят человека от будущих атак со стороны микробов.
Хотя антитела могут распознавать антиген и фиксироваться на нем, они не могут уничтожить его без посторонней помощи. Это работа Т-клеток . Они разрушают антигены, помеченные антителами или инфицированными или каким-либо образом измененными клетками.(Некоторые Т-клетки на самом деле называются «клетками-киллерами».) Т-клетки также помогают сигнализировать другим клеткам (например, фагоцитам), чтобы они выполняли свою работу.
Антитела также могут:
- нейтрализует токсины (ядовитые или повреждающие вещества), вырабатываемые различными организмами
- активирует группу белков под названием комплемент , которые являются частью иммунной системы. Комплемент помогает убивать бактерии, вирусы или инфицированные клетки.
Эти специализированные клетки и части иммунной системы обеспечивают защиту организма от болезней.Эта защита называется иммунитетом.
У людей есть три типа иммунитета — врожденный, адаптивный и пассивный:
- Врожденный иммунитет: Каждый человек рождается с врожденным (или естественным) иммунитетом, типом общей защиты. Например, кожа действует как барьер, препятствующий проникновению микробов в организм. И иммунная система распознает, когда некоторые захватчики являются чужими и могут быть опасными.
- Адаптивный иммунитет: Адаптивный (или активный) иммунитет развивается на протяжении всей нашей жизни.У нас развивается адаптивный иммунитет, когда мы подвергаемся болезням или когда мы иммунизируемся против них вакцинами.
- Пассивный иммунитет: Пассивный иммунитет «заимствован» из другого источника и длится непродолжительное время. Например, антитела в материнском грудном молоке дают ребенку временный иммунитет к заболеваниям, которым подверглась мать.
Иммунная система нуждается в помощи вакцин. Своевременное получение всех рекомендуемых вакцин поможет вам сохранить максимальное здоровье.Точно так же можно хорошо и часто мыть руки, чтобы избежать заражения, правильно питаться, много спать и заниматься спортом, а также регулярно проходить медицинские осмотры.
границ | Количество лейкоцитов и неблагоприятные клинические исходы у пациентов с острым ишемическим инсультом
Введение
Считается, что воспалительная реакция связана со всеми стадиями ишемического инсульта и приводит к развитию ишемического повреждения и обострению неврологической функции (1–3).Количество лейкоцитов как маркер воспаления, с одной стороны, связано с тяжестью ишемического поражения (4, 5). Установлено, что ранний лейкоцитоз связан с объемом ткани, пораженной инфарктом, у пациентов с острым ишемическим инсультом (6). С другой стороны, предыдущие исследования показали, что количество лейкоцитов является важным независимым предиктором плохих клинических исходов и инвалидности при выписке (5). Это также связано с повышенным риском смерти от всех причин после ишемического инсульта (7). Более того, по сообщениям, повышенное количество лейкоцитов связано с более высоким риском повторного ишемического инсульта (8).
Постишемическая воспалительная реакция — сложный процесс, на который могут влиять многие факторы, такие как возраст, пол и т. Д. Некоторые из этих факторов характеризуются хроническим воспалительным состоянием средней степени тяжести. Эти факторы могут влиять на исходы острого ишемического инсульта через воспалительную реакцию. Например, появляющиеся данные демонстрируют различия в составе циркулирующих и инфильтрирующих лейкоцитов, рекрутированных в ишемический мозг старых самцов мышей после инсульта, по сравнению с молодыми самцами мышей (9).Кроме того, обострение воспалительной реакции на острый ишемический инсульт у старых мышей приводит к более серьезным повреждениям головного мозга и поведенческой дисфункции (10). Недавние исследования показывают, что половые различия в иммунном ответе на ишемический инсульт также могут влиять на результаты (11). Сообщается, что в экспериментальной мышиной модели диабета острые воспалительные реакции нарушаются в головном мозге после инсульта, и это изменение связано с обострением повреждения, вызванного инсультом (12). Более того, эксперимент на животных показывает, что ранее существовавшая гипертензия вызывает большие размеры инсульта, возможно, как следствие значительного увеличения постинсультного воспаления (13).
Тем не менее, те фактор-зависимые роли воспалительного ответа, связанные с повышенным ишемическим повреждением головного мозга, полностью не выяснены. В настоящее время также неясно, могут ли результаты, полученные в экспериментах на животных, быть перенесены на пациентов с ишемическим инсультом. Кроме того, насколько нам известно, в настоящее время существует ограниченное количество исследований, посвященных влиянию воспалительной реакции на исход ишемического инсульта при различных факторах. Итак, мы выбрали количество лейкоцитов в качестве маркера постишемического воспалительного ответа и провели это исследование, чтобы выяснить, различаются ли эффекты количества лейкоцитов на прогноз у пациентов с острым ишемическим инсультом в разных подгруппах факторов.
Методы
Популяция исследования
Мы взяли данные из Китайского национального регистра инсультов II (CSNR II). CSNR II — это общенациональное многоцентровое проспективное регистрационное исследование, запущенное Министерством здравоохранения Китая с целью создания надежной национальной базы данных об инсульте и оценки оказания помощи при инсульте в клинической практике (14). В общей сложности 25 018 пациентов были последовательно набраны из 219 больниц, добровольно участвовавших в CSNR II с июня 2012 г. по январь 2013 г., которые соответствовали следующим критериям: (1) возраст> 18 лет; (2) диагноз в течение 7 дней после индексного события ишемического инсульта, транзиторной ишемической атаки, спонтанного внутримозгового кровоизлияния или субарахноидального кровоизлияния, подтвержденный визуализацией головного мозга; (3) прямая госпитализация из поликлиники или отделения неотложной помощи; и (4) информированное согласие пациента или его законного представителя.Протокол исследования CNSR II был одобрен Центральным экспертным советом больницы Тяньтань в Пекине. Перед участием все пациенты или их представители предоставили письменное информированное согласие.
Среди всех пациентов, включенных в CSNR II, у 19 604 был диагностирован ишемический инсульт. После исключения пациентов с внутрибольничной пневмонией ( n = 1 501), отсутствием доступного количества лейкоцитов ( n = 1315) и потерянных для последующего наблюдения ( n = 2110), 14 678 пациентов были включены в наши исследования. анализ.
Сбор данных
Исходная информация, включая возраст, пол, статус курения и употребления алкоголя, историю болезни и время от появления симптомов до прибытия, систематически собиралась посредством личных интервью во время госпитализации обученными координаторами исследований в каждой участвующей больнице. Баллы по шкале инсульта Национального института здоровья (NIHSS) при поступлении оценивались обученными неврологами, не имеющими отношения к клинической информации пациентов.
Определение количества лейкоцитов
Образцы цельной крови натощак из венепункции были взяты в течение первых 24 часов после помещения в вакуумную пробирку, содержащую ЭДТА, и хранили при комнатной температуре.После этого количество лейкоцитов анализировали автоматическим гематологическим анализатором в течение 1 часа после сбора образцов в каждом исследовательском центре. Все измерения проводились лабораторным персоналом, не знающим клинических ситуаций испытуемых.
Оценка результатов
пациентов, включенных в исследование, были опрошены по телефону через 3 месяца и 1 год после начала инсульта в соответствии с протоколом исследования CSNR II. Конечные события, включая рецидив инсульта, смерть от всех причин и инвалидность, оцененные по модифицированной шкале Рэнкина (mRS), собирались подготовленными координаторами исследования в каждой участвующей больнице, которые следовали стандартным сценариям и не знали исходных характеристик пациентов.Неблагоприятные клинические исходы определялись как повторный инсульт, смерть от всех причин и плохие функциональные исходы (3 ≤ mRS ≤ 5). Рецидивирующий инсульт включал как ишемический, так и геморрагический инсульт в течение периода наблюдения.
Статистический анализ
Мы представили непрерывные переменные в виде медианы с межквартильным размахом и категориальных переменных в виде пропорций. Включенные пациенты были разделены на четыре группы по квартилям количества лейкоцитов. Исходные данные сравнивали по группам, получавшим учетверенное количество лейкоцитов, с использованием точного критерия Фишера для категориальных переменных и теста Краскела – Уоллиса для непрерывных переменных.Мы использовали многомерную логистическую регрессию для исследования связи между количеством лейкоцитов и неблагоприятными клиническими исходами. Чтобы внести поправку на другие потенциально мешающие переменные, был проведен многомерный анализ, включая возраст, пол, артериальную гипертензию, гиперлипидемию, диабет, перенесенный инсульт или транзиторную ишемическую атаку, инфаркт миокарда, фибрилляцию предсердий, употребление алкоголя, курение и оценку NIHSS при поступлении. По кривым рабочей характеристики приемника (ROC) мы определили точность уровней лейкоцитов, которые служат в качестве прогноза.Площадь под кривой (AUC) рассчитывалась как критерий точности теста. При анализе подгрупп мы выбрали возраст, пол, анамнез гипертонии, анамнез диабета, анамнез предыдущего инсульта или транзиторной ишемической атаки и статус курения в качестве факторов подгруппы. Во-первых, мы также использовали многомерную логистическую регрессию для исследования связи количества лейкоцитов с неблагоприятными клиническими исходами в каждой подгруппе и скорректировали с учетом тех же потенциальных смешивающих переменных, указанных выше. Кроме того, мы провели тест на взаимодействие между количеством лейкоцитов и факторами каждой подгруппы. P <0,05 для двусторонней проверки гипотез считалось статистически значимым. Все статистические анализы проводились с помощью программного обеспечения SAS версии 9.4 (SAS Institute Inc., Кэри, Северная Каролина).
Результаты
Базовые характеристики
Всего в наш анализ было включено 14 678 пациентов. В таблице 1 показаны исходные характеристики по сравнению между включенными и исключенными пациентами. Среднее (IQR) количество лейкоцитов составило 6,695 (5,500–8,200) × 10 9 / л.Исходные характеристики включенных пациентов, стратифицированных по квартилям в соответствии с количеством лейкоцитов, показаны в таблице 2. Из всех пациентов средний возраст (IQR) составлял 65,0 лет (56,0–74,0), 5364 (36,54%) составляли женщины, а медиана (IQR) время от появления симптомов до появления симптомов составляло 23 часа (6–56). Диабет, фибрилляция предсердий и артериальная гипертензия чаще встречались у пациентов с более высокими квартилями, а другие истории болезни не различались по квартилям. Медиана баллов по шкале NIHSS при поступлении от самого низкого до самого высокого квартиля составляла 3 (2–6), 3 (2–6), 4 (2–6) и 4 (2–8), соответственно.Таким образом, пациенты из более высоких квартилей чаще страдали тяжелым неврологическим дефицитом. Более того, пациенты из более высоких квартилей чаще курили и употребляли алкоголь. Таким образом, по сравнению с пациентами с более низким количеством лейкоцитов, пациенты из более высоких квартилей с большей вероятностью будут моложе, мужчины, курильщики и пьющие, и у них будет более короткое время от появления симптомов до прибытия, большая доля случаев диабета в анамнезе, предсердий фибрилляция и гипертония, а также более высокая степень тяжести инсульта (таблица 2).
Таблица 1 . Исходные характеристики включенных и исключенных пациентов.
Таблица 2 . Исходные характеристики пациентов, стратифицированные квартилями по количеству лейкоцитов.
Связь количества лейкоцитов с неблагоприятными клиническими исходами
Через 3 месяца наблюдения у 595 (4,08%) пациентов был повторный инсульт, 507 (3,45%) пациентов умерли и 2136 (14,55%) пациентов имели плохие функциональные результаты, а через год наблюдения — 847 ( 6.05%) произошел рецидив инсульта, 1032 (7,03%) пациента закончились смертью и 1859 (12,67%) пациентов имели плохие функциональные исходы. Риск неблагоприятных клинических исходов в квартилях количества лейкоцитов показан в таблице 3. Как через 3 месяца, так и через год наблюдения, по сравнению с самым низким квартилем, взятым в качестве эталона, более высокие квартили были достоверно связаны с повышенным риском неблагоприятных клинических исходов. . Это означало, что пациенты из более высоких квартилей с большей вероятностью имели неблагоприятные клинические исходы.После внесения поправок на возраст, пол, артериальную гипертензию, гиперлипидемию, диабет, перенесенный инсульт или транзиторную ишемическую атаку, инфаркт миокарда, фибрилляцию предсердий, употребление алкоголя, курение и оценку NIHSS при поступлении, связь между квартилями количества лейкоцитов и неблагоприятными клиническими исходами все еще оставалась существенный. Итак, мы посчитали, что количество лейкоцитов у пациентов может влиять на клинические исходы (таблица 3).
Таблица 3 . Риск неблагоприятных клинических исходов стратифицирован квартилями количества лейкоцитов.
В соответствии с кривой ROC в таблице 4 показаны оптимальные значения отсечки уровня количества лейкоцитов, прогнозируемые неблагоприятные клинические исходы, а также чувствительность, специфичность и AUC. Подсчет лейкоцитов имеет умеренную точность для прогнозирования неблагоприятных клинических исходов как через 3 месяца, так и через год наблюдения (таблица 4).
Таблица 4 . Кривая рабочих характеристик приемника для подсчета лейкоцитов при неблагоприятных клинических исходах.
Анализ подгрупп
На основании результатов существующих исследований и исходных характеристик в нашем исследовании мы выбрали возраст, пол, анамнез гипертонии, анамнез диабета, анамнез предыдущего инсульта или транзиторной ишемической атаки и статус курения в качестве факторов подгруппы.Результаты анализа подгрупп о взаимосвязи между квартилями количества лейкоцитов и риском неблагоприятных клинических исходов показаны в таблицах 5, 6. После поправок на возраст, пол, артериальную гипертензию, гиперлипидемию, диабет, перенесенный инсульт или транзиторную ишемическую атаку, инфаркт миокарда, предсердия фибрилляция, употребление алкоголя, курение и оценка NIHSS при поступлении в большинстве подгрупп, квартили количества лейкоцитов были значимо связаны с неблагоприятными клиническими исходами через 3 месяца и год наблюдения.Влияние квартилей количества лейкоцитов на неблагоприятные клинические исходы было одинаковым во всех подгруппах. Однако как через 3 месяца, так и через год наблюдения влияние квартилей количества лейкоцитов на смерть от всех причин оказалось более выраженным среди пациентов, перенесших инсульт или транзиторную ишемическую атаку ( P = 0,0194 для взаимодействие при 3-месячном наблюдении и P ( = 0,0003) для взаимодействия при 1-летнем наблюдении). Более того, через 3 месяца последующего наблюдения по сравнению с пациентами с диабетом у пациентов без диабета в более высоких квартилях с большей вероятностью были плохие функциональные результаты ( P = 0.0056 для взаимодействия). К сожалению, мы не получили аналогичного результата через 1 год наблюдения ( P = 0,0656 для взаимодействия). Таким образом, не было значительной разницы во взаимосвязи между количеством лейкоцитов и неблагоприятными клиническими исходами в большинстве подгрупп, таких как возраст, пол, гипертензия в анамнезе и курение. Между тем, взаимосвязь между количеством лейкоцитов и смертью от всех причин в соответствии с историей предыдущего инсульта или транзиторной ишемической атаки через 3 месяца и через год наблюдения значительно различалась.Взаимосвязь между количеством лейкоцитов и плохими функциональными результатами также значительно различалась у пациентов с диабетом и без него через 3 месяца наблюдения (таблицы 5, 6; рисунки 1, 2).
Таблица 5 . Подгрупповой анализ взаимосвязи между квартилями количества лейкоцитов и риском неблагоприятных клинических исходов через 3 месяца наблюдения.
Таблица 6 . Подгрупповой анализ взаимосвязи между квартилями количества лейкоцитов и риском неблагоприятных клинических исходов через 1 год наблюдения.
Рисунок 1 . Скорректированные отношения шансов по квартилям количества лейкоцитов для смерти от всех причин через 3 месяца и через год наблюдения в соответствии с историей предыдущего инсульта или транзиторной ишемической атаки. ИЛИ — отношение шансов; 95% ДИ, 95% доверительный интервал. Были сделаны поправки на возраст, пол, артериальную гипертензию, гиперлипидемию, диабет, инфаркт миокарда, фибрилляцию предсердий, употребление алкоголя, курение и оценку NIHSS при поступлении.
Рисунок 2 . Скорректированные отношения шансов по квартилям количества лейкоцитов для плохих функциональных исходов через 3 месяца и год наблюдения в соответствии с историей диабета.ИЛИ — отношение шансов; 95% ДИ, 95% доверительный интервал. Были сделаны поправки на возраст, пол, артериальную гипертензию, гиперлипидемию, перенесенный инсульт или преходящую ишемическую атаку, инфаркт миокарда, фибрилляцию предсердий, употребление алкоголя, курение и оценку NIHSS при поступлении.
Обсуждение
В этом анализе исследования CSNR II мы сначала подтвердили, что у пациентов с острым ишемическим инсультом более высокое количество лейкоцитов в течение первых 24 часов после госпитализации было связано с краткосрочными и долгосрочными неблагоприятными клиническими исходами, включая повторный инсульт, все — вызывают смерть и плохие функциональные результаты.Согласно таблице 1, исключенные нами пациенты имели более высокую долю факторов риска ишемического инсульта и более высокую степень тяжести инсульта. Следовательно, у них может быть больше шансов иметь неблагоприятные клинические исходы, и это может повлиять на прогностическую ценность количества лейкоцитов для неблагоприятных клинических исходов в нашем исследовании. Кроме того, мы обнаружили, что, хотя не было значительной разницы во взаимосвязи между количеством лейкоцитов и неблагоприятными клиническими исходами в зависимости от возраста, пола, гипертонии и курения в анамнезе, влияние количества лейкоцитов как на краткосрочные, так и на долгосрочные общие причины смерть была более выражена среди пациентов с предыдущим инсультом или транзиторной ишемической атакой, и аналогичный результат был обнаружен во влиянии количества лейкоцитов только на краткосрочные плохие функциональные исходы у пациентов без диабета.Эти результаты могут свидетельствовать о том, что количество лейкоцитов при поступлении после острых цереброваскулярных событий было полезно для оценки клинических исходов, особенно у пациентов с определенными специфическими характеристиками.
После начала инсульта надпочечники немедленно выделяют гормоны стресса, в частности катехоламины, и запускают устойчивую активацию иммунной системы (2, 3, 15) через лимфоидные органы, напрямую иннервируемые симпатической нервной системой (16, 17). В то же время некротические клетки в ишемической области могут вызывать высвобождение провоспалительных цитокинов, хемокинов и привлечение иммунных клеток в центральную нервную систему (18, 19).В целом, постишемическая ткань мозга проявляется в активации эндотелия, дисфункции барьера, повышенном образовании медиаторов воспаления и привлечении лейкоцитов (20). Среди них вопрос о влиянии рекрутирования лейкоцитов является спорным (18). Эти клетки могут участвовать в восстановлении тканей, но их пагубные последствия более значительны (18). Предыдущие исследования показали, что повышенное количество и активация циркулирующих лейкоцитов могут активно способствовать ишемии органа за счет увеличения адгезии и повреждения эндотелия (21).Лейкоциты могут высвобождать протеазы, медиаторы воспаления и свободные радикалы, которые вызывают протеолитическое и окислительное повреждение эндотелиальных клеток (8). Кроме того, лейкоциты крупнее других клеток крови и могут напрямую закупоривать микрососуды (22). Таким образом, повышенные и активированные лейкоциты участвуют в патофизиологии ишемического повреждения головного мозга через различные механизмы и влияют на его развитие. Таким образом, считается, что лейкоциты способны прогнозировать и влиять на клинические результаты после острого ишемического инсульта (18).
Недавно несколько экспериментов на животных показали определенные характерные различия в постишемических воспалительных реакциях, которые могут способствовать клиническим исходам. У старых мышей, мышей с диабетом и гипертонией после ишемического инсульта наблюдались обостренные воспалительные реакции, которые приводили к более серьезным повреждениям головного мозга и неблагоприятным клиническим исходам. Однако об иммунологических механизмах, лежащих в основе вышеуказанных эффектов, известно немного. Возможное объяснение возрастных различий состоит в том, что старение характеризуется хроническим воспалительным состоянием слабой степени с повышением системных воспалительных цитокинов (10, 23-25).Вкладом в половые различия могут быть различные эндокринные состояния, генетическое кодирование, специфичное для пола, эпигенетический контроль экспрессии генов и специфичные для пола изменения микробиома, метаболизма и коагуляции (11, 26, 27). Что касается эффекта диабета, объяснение заключается в том, что диабет включает хроническое системное воспаление низкой степени, проявляющееся генерацией активных форм кислорода, экспрессией провоспалительных цитокинов и активацией других медиаторов воспаления (28). Обнаружение, связанное с гипертензией, можно объяснить увеличением количества и статусом активации циркулирующих миелоидных лейкоцитов и повышенными уровнями привлекающих лейкоциты хемокинов (13).
Однако мы не получили аналогичных результатов с предыдущими экспериментами на животных. Мы обнаружили, что не было значительной разницы во взаимосвязи между количеством лейкоцитов и неблагоприятными клиническими исходами в зависимости от возраста, пола, гипертонии и курения в анамнезе. Мы думаем, что причины несоответствия результатов анализа пациентов и экспериментов на животных могут быть следующими. Во-первых, воспалительная реакция после острого ишемического инсульта — сложный процесс, и влияние различных факторов на постишемический воспалительный ответ будет более сложным.Механизмы и цели этих факторов остаются неизвестными. Таким образом, выбор только количества лейкоцитов может быть неуместным. Эти факторы могут влиять на воспалительную реакцию не только за счет привлечения, увеличения количества или активации лейкоцитов. Во-вторых, в предыдущих экспериментах на животных в основном использовалась модель острого ишемического инсульта на мышах. Влияние факторов на постишемический воспалительный ответ может быть различным у мышей и пациентов. Таким образом, взаимосвязь между воспалительным ответом и неблагоприятными клиническими исходами в подгруппах также может быть разной у мышей и пациентов.
Более того, мы обнаружили, что соотношение между количеством лейкоцитов и общей смертью значительно различается в зависимости от перенесенного инсульта или транзиторной ишемической атаки в анамнезе. Наиболее правдоподобное объяснение состоит в том, что у пациентов с предыдущим инсультом или транзиторной ишемической атакой могло быть хроническое воспалительное состояние средней степени тяжести в центральной нервной системе, а когда ишемический инсульт повторяется снова, воспалительная реакция может быть значительно усилена и быстро активирована. таким образом влияя на клинические результаты.Хотя считается, что диабет связан с хроническим системным воспалением низкой степени, мы обнаружили связь повышенного количества лейкоцитов с худшими 3-месячными функциональными результатами у пациентов с острым ишемическим инсультом без диабета, и причины этого остаются неизвестными. Возможное объяснение состоит в том, что воспалительная реакция после ишемического инсульта у пациентов с диабетом и без него различна. Возможно, постишемический воспалительный ответ у пациентов с диабетом характеризуется активацией медиатора воспаления и не предполагает значительного увеличения количества лейкоцитов.
Основным преимуществом нашего исследования является большой, многоцентровый, последовательный дизайн включения пациентов и проспективный сбор демографических, клинических и последующих данных. Однако в нашем исследовании все же были некоторые ограничения. Во-первых, неоднородность оборудования в исследовательских центрах может привести к необъективным оценкам результатов, но это может иметь небольшое влияние, потому что оборудование в каждом исследовательском центре находится под строгим контролем качества при повседневном использовании. Во-вторых, в нашем исследовании оценивалось только количество лейкоцитов.Другие воспалительные маркеры могут быть более значимыми в отражении влияния различных факторов на воспалительную реакцию после острого ишемического инсульта. В-третьих, в нашем исследовании не было динамических данных о количестве лейкоцитов и не оценивалось изменение количества лейкоцитов во время госпитализации. Однако динамическое изменение количества лейкоцитов с течением времени может предоставить ценную информацию для понимания основного механизма воспалительного ответа после инсульта и его клинического значения. В-четвертых, средний балл (IQR) по шкале NIHSS при поступлении от общего числа пациентов, включенных в наш анализ, составлял 4 (2–6).Тяжесть ишемического инсульта может быть легкой, и это может ограничивать возможность оценки связи количества лейкоцитов с клиническими исходами у пациентов с более тяжелым ишемическим инсультом. Наконец, остаточная систематическая ошибка может все еще существовать из-за влияния сопутствующих заболеваний или факторов окружающей среды, таких как опухоль, травма и острый токсикоз.
Заключение
Наши результаты показывают, что количество лейкоцитов при поступлении связано с краткосрочными и долгосрочными клиническими исходами у пациентов с острым ишемическим инсультом и может играть роль предиктора клинических исходов, особенно у пациентов с определенными специфическими характеристиками, хотя это требует дальнейшего изучения. исследование, чтобы подтвердить это.
Заявление о доступности данныхВсе наборы данных, созданные для этого исследования, включены в статью / дополнительный материал.
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены Центральным институциональным наблюдательным советом пекинской больницы Тяньтань. Пациенты / участники предоставили письменное информированное согласие на участие в этом исследовании.
Авторские взносы
KQ и YW разработали концепцию этой работы.Статистический анализ был проведен AW, XZ и KQ. KQ подготовил рукопись. YW был гарантом этой бумаги. Все авторы одобрили протокол.
Финансирование
Эта работа была поддержана грантами Национальной программы ключевых исследований и разработок Китая (2017YFC1310901, 2016YFC0
1 и 2016YFC0
2), Пекинского муниципального комитета науки и технологий (D151100002015003), Плана миссии муниципальной администрации больниц Пекина (SML20150502), Министерство науки и технологий Китайской Народной Республики (2011BAI08B02, 2012ZX09303 и 2013BAI09B03) и Пекинский институт болезней мозга (BIBD-PXM2013_014226_07_000084).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Zhao L, Dai Q, Chen X, Li S, Shi R, Yu S, et al. Отношение количества нейтрофилов к лимфоцитам позволяет прогнозировать продолжительность пребывания в стационаре и стоимость больницы для оказания неотложной помощи пациентам с острым ишемическим инсультом. J Stroke Cerebrovas Dis . (2016) 25: 739–44. DOI: 10.1016 / j.jstrokecerebrovasdis.2015.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Макрез Р., Али К., Тутирайс О., Ле Мауфф Б., Дефер Дж., Дирнагл У. и др. Инсульт и иммунная система: от патофизиологии к новым терапевтическим стратегиям. Ланцет Нейрол . (2011) 10: 471–80. DOI: 10.1016 / S1474-4422 (11) 70066-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Валлийский П., Барбер М., Лангхорн П., Рамли А., Лоу Г. Д., Стотт Д. Д..Связь воспалительных и гемостатических биомаркеров с неблагоприятным исходом острого ишемического инсульта. Цереброваск Дис . (2009) 27: 247–53. DOI: 10.1159 / 000196823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Нарди К., Милия П., Эусеби П., Пачарони М., Казо В., Аньелли Г. Лейкоцитоз при поступлении при острой ишемии головного мозга: влияние на ранний исход. J Stroke Cerebrovasc Dis. (2012) 21: 819–24. DOI: 10.1016 / j.jstrokecerebrovasdis.2011.04.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Бак Б. Х., Либескинд Д. С., Савер Дж. Л., Банг О. Ю., Юн С. В., Старкман С. и др. Ранняя нейтрофилия связана с объемом ишемической ткани при остром инсульте. Инсульт. (2008) 39: 355–60. DOI: 10.1161 / STROKEAHA.107.4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Уайтли В., Чонг В.Л., Сенгупта А., Сандеркок П. Маркеры крови для прогноза ишемического инсульта: систематический обзор. Ход . (2009) 40: e380–9. DOI: 10.1161 / STROKEAHA.108.528752
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Грау А.Дж., Бодди А.В., Дукович Д.А., Багл Ф., Личи С., Брандт Т. и др. Подсчет лейкоцитов как независимый предиктор повторных ишемических событий. Ход . (2004) 35: 1147–52. DOI: 10.1161 / 01.STR.0000124122.71702.64
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Ритцель Р. М., Лай Ю. Дж., Крапсер Дж. Д., Патель А. Р., Шреценгост А., Гренье Дж. М. и др.Старение изменяет иммунологический ответ на ишемический инсульт. Acta Neuropathol . (2018) 136: 89–110. DOI: 10.1007 / s00401-018-1859-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Шен Ф., Цзян Л., Хань Ф., Дегос В., Чен С., Су Х. Повышенная воспалительная реакция у старых мышей связана с более серьезным повреждением нейронов в острой стадии ишемического инсульта. Диск старения . (2019) 10: 12–22. DOI: 10.14336 / AD.2018.0205
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Spychala MS, Honarpisheh P, McCullough LD. Половые различия в нейровоспалении и нейропротекции после ишемического инсульта. J Neurosci Res . (2017) 95: 462–71. DOI: 10.1002 / jnr.23962
CrossRef Полный текст | Google Scholar
12. Ким Э., Толхерст А.Т., Чо С. Дерегуляция воспалительной реакции при диабетическом состоянии связана с усилением ишемического повреждения головного мозга. Дж. Нейровоспаление . (2014) 11:83. DOI: 10.1186 / 1742-2094-11-83
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13.Мёллер К., Пёзель С., Кранц А., Шульц И., Шайбе Дж., Дидвишус Н. и др. Артериальная гипертензия усиливает врожденный иммунный ответ после экспериментального инсульта. Front Cell Neurosci. (2015) 9: 461. DOI: 10.3389 / fncel.2015.00461
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Li Z, Wang C, Zhao X, Liu L, Wang C, Li H, et al. Национальные регистры инсульта Китая. Значительный прогресс, но значительные возможности для улучшения лечения инсульта в Китае. Ход .(2016) 47: 2843–9. DOI: 10.1161 / STROKEAHA.116.014143
CrossRef Полный текст | Google Scholar
17. Винклевски П.Дж., Радковски М., Демков У. Перекрестный разговор между воспалительной реакцией, активацией симпатической нервной системы и легочной инфекцией при ишемическом инсульте. J Neuroinflam. (2014) 11: 213. DOI: 10.1186 / s12974-014-0213-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Рухнау Дж., Шульце Дж., Дрессель А., Фогельгесанг А. Тромбоз, нейровоспаление и постинсультная инфекция: многогранная роль нейтрофилов в инсульте. Дж. Иммунол Рес . (2017) 2017: 5140679. DOI: 10.1155 / 2017/5140679
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Worthmann H, Tryc AB, Deb M, Goldbecker A, Ma YT, Tountopoulou A, et al. Связь инфекции и воспаления при остром ишемическом инсульте. Энн Н. И Акад. Наук . (2010) 12076: 116–22. DOI: 10.1111 / j.1749-6632.2010.05738.x
CrossRef Полный текст | Google Scholar
20. Исикава М., Чжан Дж. Х., Нанда А., Грейнджер Д. Н..Воспалительные реакции на ишемию и реперфузию в церебральной микроциркуляции. Front Biosci. (2004) 9: 1339–47. DOI: 10.2741 / 1330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Расули М., Несархейни В., Киасари А.М., Араб С., Шариати Р., Каземи Д. и др. Мультипликативное взаимодействие количества лейкоцитов с некоторыми другими факторами риска повышает прогностическую ценность ишемической болезни сердца. Кардиол Дж . (2011) 18: 246–53.
PubMed Аннотация | Google Scholar
24.Franceschi C, Campisi J. Хроническое воспаление (воспаление) и его потенциальный вклад в возрастные заболевания. J Gerontol A Biol Sci Med Sci. (2014) 69: S4–9. DOI: 10.1093 / erona / glu057
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Влияние децитабина на аллогенные иммунные реакции инфузии донорских лимфоцитов через активацию дендритных клеток | Экспериментальная гематология и онкология
Gooley TA, Chien JW, Pergam SA, et al.Снижение смертности после трансплантации аллогенных гемопоэтических клеток. N Engl J Med. 2010; 363: 2091–101.
CAS PubMed PubMed Central Google ученый
Ли С., Ким Д.В., Чо Б.С. и др. Влияние кинетики минимальной остаточной болезни во время лечения иматинибом на исход трансплантации при остром лимфобластном лейкозе с положительной хромосомой в Филадельфии. Лейкемия. 2012; 26: 2367–74.
CAS PubMed Google ученый
Янг С.А., Ким М., Ким Т.М. и др. Лучший результат трансплантации с предтрансплантационным ответом костного мозга после лечения гипометилированием при МДС высокого риска с избытком бластов. Oncotarget. 2017; 8: 12342–54.
PubMed Google ученый
Цай Х.С., Ли Х, Ван Несте Л. и др. Кратковременные низкие дозы ДНК-деметилирующих агентов оказывают стойкое противоопухолевое действие на гематологические и эпителиальные опухолевые клетки. Раковая клетка. 2012; 21: 430–46.
CAS PubMed PubMed Central Google ученый
Дауркин Х.С., Ерусланов Э., Вьюег Дж. И др. Получение антиген-представляющих клеток из инфильтрированных опухолью миелоидных клеток CD11b с помощью деметилирующего агента ДНК 5-аза-2′-дезоксицитидина. Cancer Immunol Immunother. 2010. 59: 697–706.
CAS PubMed Google ученый
Schmiedel BJ, Arélin V, Gruenebach F, et al. Азацитидин снижает реактивность NK-клеток, в то время как децитабин усиливает реакцию NK-клеток на стимуляцию. Int J Cancer.2011; 128: 2911–22.
CAS PubMed Google ученый
Санчес-Абарка Л.И., Гутьеррес-Косио С., Сантамария С. и др. Иммуномодулирующий эффект 5-азацитидина (5-azaC): потенциальная роль в условиях трансплантации. Кровь. 2010; 115: 107–21.
PubMed Google ученый
Goodyear O, Agathanggelou A, Novitzky-Basso I, et al. Индукция CD8 + Т-клеточного ответа на антиген рака яичка MAGE путем комбинированного лечения азацитидином и вальпроатом натрия у пациентов с острым миелоидным лейкозом и миелодисплазией.Кровь. 2010; 116: 1908–18.
CAS PubMed Google ученый
Fransolet G, Ehx G, Somja J, et al. Азацитидин смягчает экспериментальную склеродермическую хроническую болезнь трансплантат против хозяина. J Hematol Oncol. 2016; 9: 53–64.
PubMed PubMed Central Google ученый
Шмид М., Лабопин М., Наглер А. и др. Инфузия донорских лимфоцитов в лечении первого гематологического рецидива после аллогенной трансплантации стволовых клеток у взрослых с острым миелоидным лейкозом: ретроспективный анализ факторов риска и сравнение с другими стратегиями Рабочей группой EBMT Acute Leukemia.J Clin Oncol. 2007; 25: 4938–45.
CAS PubMed Google ученый
Родди С., Пеггз К.С. Инфузия донорских лимфоцитов после трансплантации аллогенных гемопоэтических стволовых клеток. Экспертное мнение Biol Ther. 2011; 11: 473–87.
PubMed Google ученый
Левин Ю.Е., Браун Т., Пенза С.Л. и др. Проспективное исследование химиотерапии и инфузий донорских лейкоцитов при рецидиве поздних миелоидных злокачественных новообразований после трансплантации аллогенных стволовых клеток.J Clin Oncol. 2002; 20: 405–12.
CAS PubMed Google ученый
Шимони А., Крегер Н., Зандер А.Р. и др. Мезилат иматиниба (STI571) при подготовке к аллогенной трансплантации гемопоэтических стволовых клеток и инфузии донорских лимфоцитов пациентам с острыми лейкозами, положительными в Филадельфии. Лейкемия. 2003. 17: 290–7.
CAS PubMed Google ученый
Левин Б.Л., Бернштейн В.Б., Коннорс М. и др. Влияние костимуляции CD28 на долгосрочную пролиферацию CD4 + Т-клеток в отсутствие экзогенных питающих клеток. J Immunol. 1997; 159: 5921–30.
CAS PubMed Google ученый
Laport GG, Levine BL, Stadtmauer EA, et al. Адоптивный перенос костимулированных Т-клеток индуцирует лимфоцитоз у пациентов с рецидивирующей / рефрактерной неходжкинской лимфомой после трансплантации CD34 + -селектированных гемопоэтических клеток.Кровь. 2003. 102: 2004–13.
CAS PubMed Google ученый
Falkenburg JH, Wafelman AR, Joosten P, et al. Полная ремиссия ускоренной фазы хронического миелоидного лейкоза путем лечения лейкозно-реактивными цитотоксическими Т-лимфоцитами. Кровь. 1999; 94: 1201–8.
CAS PubMed Google ученый
Ким Ю.Дж., Чо С.Г., Ли С. и др. Возможная роль адоптивно перенесенных аллогенных WT1-специфических CD4 + и CD8 + Т-лимфоцитов в устойчивой ремиссии рефрактерного ОМЛ.Пересадка костного мозга. 2010; 45: 597–9.
PubMed Google ученый
Корал С., Сигалотти Л., Гаспаролло А. и др. Длительная повышающая регуляция экспрессии антигенов HLA класса I и костимулирующих молекул на клетках меланомы, обработанных 5-аза-2′-дезоксицитидином (5-AZA-CdR). J Immunother. 1999; 22: 16–24.
CAS PubMed Google ученый
Сигалотти Л., Альтомонте М., Колицци Ф. и др.Лечение злокачественных новообразований кроветворения с помощью 5-аза-2′-дезоксицитидина (децитабина): мультимеханический терапевтический подход? Кровь. 2003. 101: 4644–6.
CAS PubMed Google ученый
Альмштедт М., Благитко-Дорфс Н., Дуке-Афонсо Дж. И др. Агент деметилирования ДНК 5-аза-2′-дезоксицитидин индуцирует экспрессию NY-ESO-1 и других антигенов рака / семенников в клетках миелоидного лейкоза. Leuk Res. 2010; 34: 899–905.
CAS PubMed Google ученый
Атанакович Д., Люткенс Т., Клот Б. и др. Экспрессия антигена рака яичка и ее эпигенетическая модуляция при остром миелоидном лейкозе. Am J Hematol. 2011; 86: 918–22.
CAS PubMed Google ученый
Frikeche J, Clavert A, Delaunay J, et al. Влияние гипометилирующего агента 5-азацитидина на функцию дендритных клеток. Exp Hematol. 2011; 39: 1056–63.
CAS PubMed Google ученый
Duffner UA, Maeda Y, Cooke KR, et al. Одних дендритных клеток-хозяев достаточно для инициирования острой реакции «трансплантат против хозяина». J Immunol. 2004. 172: 7393–8.
CAS PubMed Google ученый
Лим Дж. Ю., Чой М. С., Юн Х. Влияние предтрансплантационного кондиционирования на эффект «трансплантат против лейкемии» у мышей. Exp Hematol. 2011; 39: 1018–29.
CAS PubMed Google ученый
Чой М.С., Лим Дж.Й., Чо Б.С. и др. Роль регуляторных Т-клеток во время ослабления активности трансплантат против лейкемии после инфузии донорских лейкоцитов мышам. Leuk Res. 2011; 35: 1549–56.
CAS PubMed Google ученый
Кук К.Р., Кобзик Л., Мартин Т.Р. и др. Экспериментальная модель синдрома идиопатической пневмонии после трансплантации костного мозга: I. Роль минорных антигенов H и эндотоксина. Кровь. 1996; 88: 3230–9.
CAS PubMed Google ученый
Инаба К., Инаба М., Романи Н. и др. Генерация большого количества дендритных клеток из культур костного мозга мышей с добавлением колониестимулирующего фактора гранулоцитов / макрофагов. J Exp Med. 1992; 176: 1693–702.
CAS PubMed Google ученый
de Lima M, Giralt S, Thall PF, et al. Поддерживающая терапия низкими дозами азацитидина после трансплантации аллогенных гемопоэтических стволовых клеток при рецидивирующем остром миелогенном лейкозе или миелодиспластическом синдроме: исследование по подбору дозы и графика.Рак. 2010. 16: 5420–31.
Google ученый
Хан С., Ким Ю.Дж., Ли Дж. И др. Основанный на модели адаптивный дизайн исследования фазы I посттрансплантационного поддерживающего лечения децитабином при миелодиспластическом синдроме. J Hematol Oncol. 2015; 8: 118–26.
PubMed PubMed Central Google ученый
Platzbecker U, Middeke JM, Sockel K, et al. Измеримая резидуальная терапия азацитидином для предотвращения гематологического рецидива у пациентов с миелодиспластическим синдромом и острым миелоидным лейкозом (RELAZA2): открытое многоцентровое исследование фазы 2.Лачет Онкол. 2018; 19: 1668–79.
CAS Google ученый
Schroeder T, Czibere A, Platzbecker U, et al. Инфузии азацитидина и донорских лимфоцитов в качестве первой спасательной терапии при рецидиве ОМЛ или МДС после трансплантации аллогенных стволовых клеток. Лейкемия. 2013; 27: 1229–35.
CAS PubMed Google ученый
Schroeder T, Rachlis E, Bug G, et al.Лечение острого миелоидного лейкоза или рецидива миелодиспластического синдрома после трансплантации аллогенных стволовых клеток азацитидином и инфузиями донорских лимфоцитов — ретроспективный многоцентровый анализ Немецкой группы совместных исследований трансплантологии. Пересадка костного мозга Biol. 2015; 21: 653–60.
CAS PubMed Google ученый
Platzbecker U, Wermke M, Radke J, et al. Азацитидин для лечения неминуемого рецидива у пациентов с МДС или ОМЛ после аллогенной ТГСК: результаты исследования РЕЛАЗА.Лейкемия. 2012; 26: 38–389.
Google ученый
Cardoso AA, Schultze JL, Boussiotis VA, et al. Клетки пре-B острого лимфобластного лейкоза могут вызывать анергию Т-клеток к аллоантигену. Кровь. 1996; 88: 41–8.
CAS PubMed Google ученый
Редди П., Сан Й., Тубай Т. и др. Ингибирование гистон-деацетилазы модулирует зависимые от индоламин-2,3-диоксигеназы функции DC и регулирует экспериментальную реакцию «трансплантат против хозяина» у мышей.J Clin Invest. 2008. 118: 2562–73.
CAS PubMed PubMed Central Google ученый
Степанек И., Индрова М., Биеблова Ю. и др. Влияние 5-азацитидина и трихостатина А на созревание дендритных клеток. Средства для гомеостаза J Biol Regul. 2011; 25: 517–29.
CAS PubMed Google ученый
Triozzi PL, Aldrich W., Achberger S, et al. Дифференциальные эффекты децитабина в низких дозах на иммунные эффекторные и супрессорные реакции у мышей с меланомой.Cancer Immunol Immunother. 2012; 61: 1441–50.
CAS PubMed Google ученый
Чакраверти Р., Эом Х.С., Сакс Дж. И др. Антигенпрезентирующие клетки МНС класса II + и клетки CD4 необходимы для CD8-опосредованных реакций трансплантат против лейкемии после отсроченных инфузий донорских лейкоцитов. Кровь. 2006; 108: 2106–13.
CAS PubMed PubMed Central Google ученый
Чой Дж., Ричи Дж., Прайор Дж. Л. и др. Введение in vivo гипометилирующих агентов ослабляет болезнь трансплантат против хозяина, не жертвуя реакцией трансплантат против лейкемии. Кровь. 2010; 116: 129–39.
CAS PubMed PubMed Central Google ученый
Goodyear OC, Dennis M, Jilani NY, et al. Азацитидин увеличивает экспансию регуляторных Т-клеток после трансплантации аллогенных стволовых клеток у пациентов с острым миелоидным лейкозом (ОМЛ).Кровь. 2012; 119: 3361–9.
CAS PubMed Google ученый
Шредер Т., Фребель Дж., Кадедду Р.П. и др. Спасательная терапия азацитидином увеличивает регуляторные Т-клетки в периферической крови пациентов с ОМЛ или МДС и ранним рецидивом после трансплантации аллогенных стволовых клеток крови. Лейкемия. 2013; 27: 1910–3.
CAS PubMed Google ученый
Чан МВт, Чанг CB, Тунг Ч. и др.Предварительная обработка низкими дозами 5-аза-2′-дезоксицитидина подавляет экспериментальный аутоиммунный энцефаломиелит за счет индукции регуляторных Т-клеток. Mol Med. 2014; 20: 248–56.
PubMed PubMed Central Google ученый
Лау Дж., Сартор М., Брэдсток К.Ф. и др. Активированные циркулирующие дендритные клетки после трансплантации гемопоэтических стволовых клеток предсказывают острую болезнь трансплантат против хозяина. Трансплантация. 2007; 83: 839–46.
PubMed Google ученый
Johnson BD, Truitt RL. Отсроченная инфузия иммунокомпетентных донорских клеток после трансплантации костного мозга нарушает толерантность трансплантат-хозяин, что обеспечивает стойкую противолейкемическую реактивность без тяжелой реакции трансплантат против хозяина. Кровь. 1995; 85: 3302–12.
CAS PubMed Google ученый
Mackinnon S, Papadopoulos EB, Carabasi MH, et al. Адоптивная иммунотерапия, оценивающая возрастающие дозы донорских лейкоцитов для рецидива хронического миелоидного лейкоза после трансплантации костного мозга: разделение реакции трансплантат против лейкемии от реакции трансплантат против хозяина.Кровь. 1995; 86: 1261–8.
CAS PubMed Google ученый
Филграстим для инъекций: информация о лекарствах MedlinePlus
Продукты для инъекций Филграстима выпускаются в виде раствора (жидкости) во флаконах и предварительно заполненных шприцах для инъекций под кожу или в вену. Обычно его вводят один раз в день, но инъекционные препараты филграстима (Neupogen, Nivestym, Zarxio) можно вводить два раза в день, когда они используются для лечения тяжелой хронической нейтропении. Продолжительность лечения зависит от вашего состояния и от того, насколько хорошо ваше тело реагирует на лекарства.
Если вы используете продукты для инъекций филграстима, чтобы снизить риск заражения, уменьшить время лихорадки или увеличить количество лейкоцитов во время химиотерапии, вы получите свою первую дозу лекарства не позднее чем через 24 часа после приема доза химиотерапии и будет продолжать получать лекарство каждый день в течение 2 недель или до тех пор, пока количество клеток крови не вернется к норме. Если вы используете продукты для инъекций филграстима, чтобы снизить риск инфицирования во время трансплантации костного мозга, вы получите лекарство не менее чем через 24 часа после прохождения химиотерапии и как минимум через 24 часа после инфузии костного мозга.Если вы используете продукты для инъекций филграстима для подготовки крови к лейкаферезу, вы получите первую дозу не менее чем за 4 дня до первого лейкафереза и будете продолжать получать лекарство до последнего лейкафереза. Если вы используете продукты для инъекций филграстима для лечения тяжелой хронической нейтропении, вам может потребоваться использовать это лекарство в течение длительного периода времени. Если вы используете инъекцию филграстима из-за вредного воздействия радиации, ваш врач будет внимательно следить за вами, и продолжительность вашего лечения будет зависеть от того, насколько хорошо ваше тело реагирует на лекарство.Не прекращайте использование продуктов для инъекций филграстима, не посоветовавшись с врачом.
Продукты Filgrastiminjection могут быть даны вам медсестрой или другим поставщиком медицинских услуг, или вам может быть предложено вводить лекарство под кожу дома. Если вы или лицо, осуществляющее уход, будете вводить инъекции филграстима дома, поставщик медицинских услуг покажет вам или вашему опекуну, как вводить лекарство. Убедитесь, что вы понимаете эти указания. Если у вас есть вопросы, обратитесь к своему врачу.Используйте препараты для инъекций филграстима точно так, как указано. Не используйте его больше или меньше и не используйте его чаще, чем предписано вашим доктором.
Не встряхивайте флаконы или шприцы, содержащие раствор филграстима. Перед инъекцией всегда смотрите на продукты для инъекций филграстима. Не используйте, если срок годности истек, или если раствор филграстима имеет частицы или выглядит пенистым, мутным или обесцвеченным.
Используйте каждый шприц или флакон только один раз. Даже если в шприце или флаконе еще остался раствор, не используйте его снова.Выбрасывайте использованные иглы, шприцы и флаконы в контейнер, устойчивый к проколам. Поговорите со своим врачом или фармацевтом о том, как утилизировать устойчивый к проколам контейнер.
Ваш врач может назначить вам низкую дозу продуктов для инъекций филграстима и постепенно увеличивать дозу. Ваш врач может также уменьшить вашу дозу в зависимости от того, как ваше тело реагирует на лекарство.
Если вы используете препараты для инъекций филграстима для лечения тяжелой хронической нейтропении, вы должны знать, что этот препарат будет контролировать ваше состояние, но не вылечит его.Продолжайте использовать инъекционные препараты филграстима, даже если чувствуете себя хорошо. Не прекращайте использование продуктов для инъекций филграстима, не посоветовавшись с врачом.
Попросите вашего фармацевта или врача копию информации производителя для пациента.
Доброкачественные заболевания крови: симптомы и лечение
Область гематологии охватывает широкий спектр заболеваний. Некоторые из этих заболеваний являются доброкачественными, что означает, что они полностью исчезают после терапии или не вызывают симптомов и не влияют на общую продолжительность жизни.Некоторые из них носят хронический характер и сохраняются на протяжении всей жизни, но, опять же, не влияют на продолжительность жизни. Вот некоторые примеры этих доброкачественных заболеваний:
- Анемия, вызванная хроническим заболеванием
- Железодефицитная анемия
- Аутоиммунная гемолитическая анемия, иммуноопосредованное заболевание, вызывающее снижение количества эритроцитов
- Идиопатическая тромбоцитопеническая пурпура (ИТП), иммуноопосредованное заболевание, вызывающее низкое количество тромбоцитов
- Низкие показатели крови (количество лейкоцитов, количество эритроцитов или количество тромбоцитов) из-за лекарственной реакции, например, гепарин-индуцированной тромбоцитопении
- Низкие показатели крови не из-за приема лекарств, а из-за основных заболеваний, например, анемии при хроническом заболевании или низкого количества тромбоцитов, вызванного заболеванием печени
- Талассемия (легкая)
- Гемофилия (легкая форма)
- Болезнь фон Виллебранда
- Сгустки крови (не опасные для жизни)
- Моноклональная гаммопатия неопределенной значимости (MGUS), заболевание плазматических клеток, вызывающее аномальные белки в крови)
Другие нарушения со стороны крови являются более серьезными, поскольку они могут вызывать хронические заболевания или опасны для жизни:
Информация о раке: классификация гематологических заболеваний
Другой способ классифицировать гематологическое заболевание — наследственное или приобретенное.Например, гемофилия, некоторые нарушения свертывания крови, талассемия и серповидно-клеточная анемия являются наследственными состояниями, тогда как большинство других заболеваний, перечисленных выше, являются приобретенными. Унаследованные болезни крови обычно диагностируются в детстве, но если человек поражен легкой степенью, такой диагноз не может быть поставлен, пока он / она не достигнет совершеннолетия. Например, ненормальный лабораторный результат может быть обнаружен во время операции при скрининговых тестах — анемия или нарушение свертывания крови. Их необходимо оценить, чтобы убедиться, что пациент не подвергается повышенному риску для операции.
Какие симптомы?
Симптомы гематологического заболевания зависят от многих факторов. Симптомы зависят от того, какой тип клеток поражен и насколько велико или низко их количество. Это определяется с помощью общего анализа крови («CBC»). При анемии наблюдается низкое количество красных кровяных телец и, следовательно, снижение количества кислорода, поступающего в ткани. Симптомы включают: крайнюю усталость, головокружение, потерю концентрации, шум в ухе, одышку при физической нагрузке и учащенное сердцебиение. У пациентов с нарушением функции сердца анемия может вызвать застойную сердечную недостаточность.Низкое количество тромбоцитов или тромбоцитопения может привести к появлению синяков, красных пятен на нижних конечностях, носовых кровотечений, кровотечений изо рта и десен, а также крови в моче или стуле. Низкое количество лейкоцитов (лейкопения или нейтропения) может вызвать повторные бактериальные инфекции.
Когда конкретный показатель крови снижен незначительно, это может не вызывать никаких симптомов. Однако отклонение от нормы может быть маркером основного заболевания костного мозга или другого заболевания и, следовательно, должно быть исследовано.Например, у пациента с заболеванием печени может быть большая селезенка и низкие показатели крови, особенно тромбоцитопения. Количество тромбоцитов обычно недостаточно низкое, чтобы вызвать серьезное кровотечение, но это должно вызвать расследование относительно того, почему увеличена селезенка, будь то цирроз печени или портальная гипертензия, болезнь Гоше, инфекция или лимфома.
Другие системные заболевания влияют на метаболизм железа, вызывая хронические анемии (известные как анемия хронических заболеваний).Они также могут подавлять деятельность костного мозга, как при системной красной волчанке и других хронических воспалительных состояниях. В этих условиях признаки и симптомы основного заболевания обычно более выражены, чем те, которые связаны с низкими показателями крови.
Унаследованные нарушения гемоглобина, такие как талассемия и серповидноклеточная анемия, вызывают ряд осложнений от легких до тяжелых. При серповидно-клеточной анемии мелкие кровеносные сосуды иногда блокируются деформированными эритроцитами (серповидная форма).У пациентов часто возникают периодические приступы боли, обычно в конечностях и спине, но иногда и в животе. Хотя боль может быть вызвана инфекцией, операцией, погодными изменениями и даже эмоциональным стрессом, мы обычно не знаем, что вызывает конкретный болевой кризис. Независимо от причины серповидно-клеточная боль и другие осложнения выводят из строя и приводят к частой госпитализации.
Подобно тому, как наследственные или приобретенные нарушения могут вызывать чрезмерное кровотечение, другие наследственные и приобретенные дефекты вызывают аномальное или чрезмерное свертывание крови.Система свертывания включает несколько важных естественных ингибиторов свертывания, которые, если они недостаточны или дисфункциональны, приводят к образованию сгустка крови. Если сгусток находится в венах прямо под поверхностью кожи, это называется поверхностным тромбофлебитом. Если это в системе глубоких вен конечностей, диагноз — тромбоз глубоких вен или «ТГВ». Это приводит к болезненному отеку конечности (обычно ноги), связанному с покраснением и повышением температуры кожи.Если сгусток крови не лечить немедленно препаратами, разжижающими кровь, повышается вероятность того, что часть сгустка оторвется и поднимется через правую часть сердца в легкие. Это известно как тромбоэмболия легочной артерии. Симптомы включают внезапную резкую боль в груди, одышку, головокружение, учащенное сердцебиение и кашель (иногда кашель с кровью). Если эмбол массивный, может произойти внезапный сердечно-сосудистый коллапс и смерть.
Наш механизм свертывания крови имеет тенденцию становиться более активным по мере того, как мы становимся старше, увеличивая шансы на ТГВ.Обычно есть какое-то отягчающее событие, которое увеличивает риск тромбоза. Это может включать хирургическое вмешательство, длительную неподвижность (постельный режим, длительные поездки на автомобиле или самолете), курение и эстрогены (оральные контрацептивы, заместительная гормональная терапия). Когда эти факторы отсутствуют или когда у молодого пациента наблюдается необъяснимый ТГВ, подозревается наследственная тенденция к тромбозу (тромбофилия). Это подозрение дополнительно подкрепляется положительным семейным анамнезом тромбов, частыми выкидышами в анамнезе или тромбом, возникающим в необычном месте, например, в кровеносных сосудах брюшной полости, венозных каналах головного мозга или кровеносных сосудах в глазу. .В этих обстоятельствах показано лабораторное обследование, чтобы попытаться идентифицировать дефект в одном или нескольких ингибирующих белках коагуляции.
Как диагностируется?
Гематолог использует медицинский осмотр, историю болезни пациента и лабораторные исследования для оценки гематологических заболеваний. Независимо от того, являются ли показатели крови слишком высокими или слишком низкими, одна из наиболее распространенных диагностических дилемм — это отделение вторичного или «реактивного» явления от первичного гематологического состояния или состояния костного мозга.Для этого часто требуется биопсия костного мозга. Обычно это включает исследование хромосом (цитогенетика) и исследование поверхностных белков или рецепторов на клетках костного мозга (проточная цитометрия). Последний является очень чувствительным тестом для исключения лимфопролиферативного заболевания, такого как хронический лимфолейкоз или лимфома. Другое специализированное тестирование необходимо, чтобы исключить гемолиз или быстрое разрушение или разрушение эритроцитов. Еще требуется дальнейшее тестирование для выявления проблем с органами (почки, печень, легкие, щитовидная железа), заболеваний соединительной ткани (красная волчанка, ревматоидный артрит) и рака, все из которых могут иметь косвенное влияние на костный мозг или кровь. .
Диагностика нарушений свертывания крови может быть относительно простой или сложной задачей. Нередко у пациента наблюдаются симптомы кровотечения, но даже после тщательного обследования никаких отклонений выявить невозможно. Это может расстраивать как пациента, так и врача, особенно при принятии решения о том, безопасно ли продолжать операцию. Тот же сценарий применим к нарушениям чрезмерного свертывания крови, когда у пациентов есть несколько эпизодов тромбоза, но после обширного тестирования не обнаруживается никаких конкретных дефектов.Несмотря на эти трудности, коагуляционная медицина является областью интенсивных исследований, и только за последнее десятилетие был достигнут значительный прогресс.
Какие варианты лечения?
Лечение различается в зависимости от типа заболевания и может включать простое наблюдение, использование стероидов и других иммуномодулирующих методов лечения, переливание крови или поддержку фактора свертывания крови, добавление фактора роста, комплексную химиотерапию и трансплантацию костного мозга. (См. Лейкоз, миелодисплазию, лимфому, трансплантацию костного мозга для получения дополнительной информации.)
Анемия
При хронической анемии лечат основное заболевание (инфекция, артрит, болезнь сердца, легких или почек), часто улучшая течение анемии. Если это невозможно и симптомы у пациента вызывают анемия, может потребоваться переливание эритроцитов. Рекомбинантный человеческий эритропоэтин можно вводить еженедельно или раз в две недели и обычно на неопределенный срок. Эритропоэтины также полезны при других типах анемии, при которых наблюдается недостаточное производство эритроцитов в костном мозге, таких как анемия, вызванная химиотерапией, миелодиспластический синдром и апластическая анемия.Они особенно полезны при анемии, вызванной заболеванием почек, которое вызвано недостаточной выработкой эритропоэтина в некоторых специализированных клетках почек.
Если причиной является недостаточность питания, могут быть назначены пероральные таблетки железа, инъекции витамина B12 или пероральная фолиевая кислота.
Для пациентов с анемией, вызванной аутоантителами против собственных эритроцитов (аутоиммунная гемолитическая анемия), стероиды подавляют иммунную систему и препятствуют разрушению эритроцитов. Пероральный прием преднизона в умеренно высоких дозах обычно помогает замедлить процесс и повысить уровень гемоглобина.Однако прием стероидов нельзя продолжать бесконечно, не вызывая долгосрочных побочных эффектов, таких как остеопороз. Большинство пациентов отвечает, но при рецидиве иногда используются другие агенты, такие как внутривенный иммуноглобулин (ВВИГ), циклофосфамид или циклоспорин. В некоторых случаях может потребоваться удаление селезенки.
Серповидно-клеточная анемия часто трудно поддается лечению. Если основная причина серповидно-клеточного криза (например, инфекция) может быть идентифицирована, своевременное лечение уменьшит тяжесть или продолжительность криза.Для купирования приступа сильной боли требуются сильнодействующие обезболивающие наркотические средства. Переливания часто назначают при тяжелой анемии, которая нарушает нормальную функцию сердца и легких, или когда пациенты собираются в хирургическое вмешательство. Они также используются у детей и взрослых, перенесших инсульт, поскольку было продемонстрировано, что регулярное переливание или обменное переливание крови предотвращает повторение инсульта у пациентов с серповидно-клеточной анемией. К сожалению, хроническое переливание крови приводит к проблемам с перегрузкой железом, что приводит к отложению железа в печени, сердце и других местах, что вызывает проблемы с этими органами.Мы можем использовать десфериоксамин или деферасирокс (Exjade ™), чтобы избежать этих проблем. Другое лекарство, гидроксимочевина, снижает частоту и тяжесть серповидно-клеточных кризов.
Тромбоцитопения (низкое количество тромбоцитов)
В отличие от анемии, не существует агента, который надежно увеличивает количество тромбоцитов в условиях недостаточной продукции тромбоцитов в костном мозге. Однако даже относительно небольшое количество тромбоцитов может не потребовать лечения, поскольку оно не вызывает опасного для жизни кровотечения.У пациентов с заболеваниями костного мозга, которые приводят к очень низкому количеству тромбоцитов, или если тяжелая тромбоцитопения и кровотечение возникают после химиотерапии, необходимо проводить переливание тромбоцитов, чтобы уменьшить риск кровотечения или остановить кровотечение. Поскольку перелитые тромбоциты не задерживаются в кровотоке (в среднем 3-4 дня), а антитела к тромбоцитам могут развиваться при многократном контакте с перелитыми или «чужеродными» клетками, переливание тромбоцитов используется только на короткое время, чтобы увидеть пациента в течение периода самый высокий риск.
У пациентов с аутоантителами против тромбоцитов может развиться тяжелая тромбоцитопения (идиопатическая тромбоцитопеническая пурпура или ИТП). Это требует терапии, чтобы прервать разрушение тромбоцитов или подавить иммунную систему. Первое лечение обычно состоит из стероидов, но другие методы лечения, такие как внутривенное введение иммуноглобулина (ВВИГ), анти-резус-антитела (WinRhoSD) и ритуксимаб (Ритуксан), были успешно использованы. Спленэктомия применяется в отдельных случаях, что приводит к длительным периодам ремиссии заболевания.Разрабатываются новые агенты для ИТП, и мы участвуем в клинических испытаниях новых лекарств.
Другим заболеванием, вызывающим тяжелую тромбоцитопению, является тромботическая тромбоцитопеническая пурпура или ТТП. ТТП — это острое заболевание, поражающее многие системы органов. ТТП вызывает агрегацию тромбоцитов и затрудняет кровоток в мелких артериальных сосудах. Это приводит к неврологической дисфункции и дисфункции почек, а также к типу анемии, называемой микроангиопатической гемолитической анемией. ТТП лечится путем замены собственной плазмы пациента на новую плазму.Плазмаферез обычно доступен только в специализированных центрах, которые имеют современное оборудование и обученный персонал, необходимый для безопасного и быстрого выполнения этой процедуры.
Миелопролиферативные заболевания — истинная полицитемия, эссенциальная тромбоцитемия и первичный миелофиброз
Все миелопролиферативные заболевания приводят к перепроизводству клеток крови. Из-за пагубного воздействия большого количества клеток крови всех типов лечение направлено на снижение их количества.Истинная полицитемия лечится с помощью флеботомии, простого метода, который включает в себя удаление единиц крови через определенные промежутки времени. Это поддерживает количество эритроцитов (гематокрит) в пределах нормы, снижая риск инсульта или сердечного приступа.
При эссенциальной тромбоцитемии и в некоторых случаях истинной полицитемии необходимо снизить высокое количество тромбоцитов, также для предотвращения инсульта, сердечного приступа или опасного для жизни свертывания крови. Оптимальное количество тромбоцитов в этой ситуации неизвестно, в основном потому, что степень активации тромбоцитов и, следовательно, повышенный потенциал свертывания крови, невозможно измерить рутинно.Однако обычно количество 600 000 / л (нормальное: 150 000 — 450 000 / л) используется в качестве порогового значения для начала терапии миелопролиферативных заболеваний. Если у пациента наблюдается опасное для жизни тромботическое событие, количество тромбоцитов может быть очень быстро снижено механическими средствами (тромбоцитферез). В противном случае используются лекарства: гидроксимочевина или анагрелид (Agrylin ™). Оба этих препарата подавляют клетки костного мозга, которые производят тромбоциты (мегакариоциты) и продукцию тромбоцитов, хотя гидроксимочевина оказывает более глобальное влияние на функцию костного мозга.
Нарушения коагуляции (чрезмерное кровотечение или свертывание)
Тяжелые наследственные нарушения свертываемости крови обычно выявляются в детстве, когда родители наблюдают обильное кровотечение легкой степени или без очевидной причины. Если диагноз — гемофилия, терапия направлена на восполнение отсутствующего фактора свертывания крови. При наличии ряда доступных сегодня концентратов фактора VIII и IX, очищенных из плазмы человека или полученных с помощью молекулярных методов (рекомбинантных), это относительно простой процесс.Однако следует принять во внимание несколько предостережений. Во-первых, дозировка должна быть правильно рассчитана и адаптирована к типу кровотечения. Во-вторых, пациентов или их родителей необходимо научить вводить фактор дома, поскольку быстрое введение после кровотечения в сустав или мягкие ткани ограничивает общий объем кровотечения и предотвращает дальнейшее повреждение тканей. В-третьих, у некоторых пациентов вырабатываются ингибиторы (антитела) к введенному продукту фактора. Это значительно усложняет лечение эпизода кровотечения, поскольку антитело действует, чтобы немедленно нейтрализовать активность переливаемого фактора.В таких случаях для лечения кровотечения используются другие типы продуктов фактора, которые обходят блокировку, налагаемую ингибитором. В-четвертых, лечение пациентов с гемофилией должно осуществляться только гематологами и хирургами, хорошо разбирающимися в заболевании и его осложнениях и знакомыми с широким ассортиментом доступных препаратов факторов свертывания крови.
При легких формах гемофилии и при большинстве типов болезни фон Виллебранда заболевание часто не диагностируется до достижения взрослого возраста, когда пациент проходит предоперационную оценку для плановой операции, которая показывает аномальное время свертывания крови.Обычно операция должна быть отложена, а патология должна быть оценена гематологом. Если обнаруживается основная патология, пациенту вводят тестовую дозу DDAVP (десмопрессина), которая вызывает повышение уровня фактора VIII или фактора фон Виллебранда. Если продемонстрировано достаточное увеличение, то это средство можно использовать для поддержки гемостаза во время небольшой хирургической процедуры. В противном случае или если это серьезная операция (кардиохирургия или операция на головном мозге), FVIII или концентраты фактора фон Виллебранда следует вводить непосредственно перед процедурой и продолжать в течение нескольких дней после нее.
Некоторые тромботические заболевания (свертываемость крови) также передаются по наследству, но обычно проявляются не раньше, чем в более зрелом возрасте. Некоторые сгустки крови могут образовываться спонтанно и без очевидной причины, но более распространенным является тип сгустка крови, который развивается после операции или длительных периодов неподвижности. Независимо от того, в какой обстановке, лечение представляет собой антикоагулянтную терапию. После определенных видов хирургических вмешательств, таких как ортопедические процедуры на нижних конечностях или операции на позвоночнике, очень высок риск послеоперационного тромбоза.Многочисленные клинические испытания продемонстрировали пользу профилактической антикоагуляции для снижения частоты тромботических явлений. Используют либо гепарин, либо варфарин, начиная с того момента, как это возможно, после операции и до тех пор, пока пациент не окажется амбулаторным.
Антикоагулянты также используются для лечения уже образовавшегося тромба. Терапия включает внутривенное введение гепарина с последующим пероральным приемом варфарина (кумадина). При неосложненном тромбозе пациент может самостоятельно принимать лекарства дома.Обычно антикоагулянтная терапия продолжается от 3 до 6 месяцев. Пациенты, у которых есть рецидивирующие эпизоды тромбоза, особенно легочной эмболии, или у которых есть лабораторные маркеры тромбофилии, обычно получают более длительные, а иногда и неопределенные периоды лечения.
Область гематологии включает широкий спектр заболеваний крови и костного мозга. Поскольку проблемы в других органах часто влияют на кровь, решение о том, является ли аномалия крови вторичной по отношению к какой-либо другой болезни или первичным заболеванием само по себе, может быть очень сложной и иногда неразрешимой проблемой.Для постановки правильного диагноза и принятия рациональных решений в отношении лечения часто требуются сложные лабораторные тесты коагуляции и гематологии, а также участие других медицинских специалистов.
Текущие фундаментальные научные и клинические исследования в области гематологии улучшили наше понимание патофизиологии крови и болезней свертывания крови и улучшили наши диагностические инструменты. Такие исследования обещают новые терапевтические агенты для лечения наших пациентов, улучшающие их общий исход и качество жизни.
Воспалительный статус влагалища у беременных с нормальной и патогенной микробиотой нижних отделов половых путей
Цель . Оценить воспалительный статус влагалища (VIS) у беременных женщин, будь то симптоматический или бессимптомный, путем количественного определения лейкоцитов по отношению к микробиоте в течение каждого триместра беременности (T). Материалы и методы . Проспективно исследованы тысяча двести сорок восемь вагинальных экссудатов беременных.Всем пациенткам выполнено клинико-кольпоскопическое обследование и микробиологическое исследование влагалищного экссудата. Количественное определение лейкоцитов определяли окрашиванием Мэй-Грюнвальда Гимзы как LNR на поле (400X). Результатов . Статистически значимые различия (SSD) в LNR наблюдались в VIS бессимптомных пациентов (AP) по сравнению с симптоматическими (SP) с нормальной микробиотой: 10-15 для 1-го T, <10, от 20 до 25 и> 25 для 2-й Т и> 25 для 3-го; при кандидозе: <10 для 1-го T, <10, от 15 до 20 и> 25 для 2-го T и <10 и> 25 для 3-го T.У женщин с трихомониазом SSD в LNR наблюдались между SP с LNR ≥ 10 и AP с NLR <10 в целом в трех триместрах. У женщин с BV не наблюдалось SSD в LNR любого AP в отношении SP для трех T. Заключение . На VIS влияет микробиота влагалища и зависит от состояния беременности, а также от срока гестации. Следует отметить выраженное повышение лейкоцитов у бессимптомных пациенток при отсутствии инфекции нижних отделов половых путей в третьем триместре беременности.
1. Введение
Некоторые гормональные изменения происходят во время беременности, которые могут все более предрасполагать к инфекциям нижних половых путей [1–4].
Эти инфекции связаны с большим количеством гинекологических и акушерских осложнений, таких как преждевременные роды [5–13], преждевременный разрыв плодных оболочек [14–16], хориоамнионит [17, 18], послеродовой эндометрит [8], воспалительные заболевания органов малого таза [19, 20], задержка внутриутробного развития [21] и низкая масса тела при рождении [13].
Эти материнские и перинатологические осложнения могут быть частично вызваны местным иммунным ответом как частью патогенного механизма, вызванного инфекцией [22].
Однако важно выяснить, действительно ли гестация влияет на этот иммунологический ответ слизистой оболочки влагалища. В литературе нет сведений о воспалительном статусе влагалища (VIS) во время беременности, выраженном в виде числового диапазона лейкоцитов (LNR) при микроскопическом исследовании.
Целью данной работы было оценить ВИС у беременных женщин, будь то симптоматическое или бессимптомное, путем количественного определения лейкоцитов по отношению к нормальной микробиоте и наличию кандидоза, трихомониаза и бактериального вагиноза (БВ) в течение каждого триместра беременности (T ).
2. Материалы и методы
Тысяча двести сорок восемь вагинальных экссудатов беременных женщин (231, 359 и 658 в первом, втором и третьем Т соответственно), которые были последовательно и проспективно исследованы в клинике Были проанализированы акушерские услуги клиники Hospital de Clínicas Университета Буэнос-Айреса, Аргентина, с 1 июля 2005 г. по 31 декабря 2008 г.Это исследование было одобрено Комитетом по этике больниц. Всем пациенткам выполнено клинико-кольпоскопическое обследование и микробиологическое исследование влагалищного экссудата. Пациенты с симптомами показали зуд и / или увеличение выделений из влагалища, которые были густыми, липкими, гнойными, зловонными, жидкими и / или однородными в зависимости от случая. Микробиологическое исследование влагалищного экссудата включало следующие исследования: (i) мазки по Граму и пролонгированное окрашивание по Май-Грюнвальду-Гимзе, (ii) микроскопическое исследование мокрого мазка с 1 мл физиологического солевого раствора, (iii) микроскопическое исследование мокрого мазка с натрием- формалин ацетат уксусной кислоты (SAF) / метиленовый синий (0.5 мл метиленового синего и 0,5 мл SAF) [23], (iv) определение pH влагалищного экссудата, (v) тест на рыбный запах с 1 мл 10% КОН с задним микроскопическим исследованием мокрого мазка, (vi) жидкая среда культуры ( модифицированная тиогликолатная среда) для обнаружения Trichomonas vaginalis с семидневным периодом инкубации при 37 ° C в атмосфере 5% CO 2 [24], и (vii) культивирование на твердой среде (модифицированный колумбийский агар) на 5% человеческом чашки крови с 48-часовым периодом инкубации при 37 ° C в атмосфере 5% CO 2 .Образец хранился в транспортной среде Стюарта.
Присутствие грамположительных бацилл при окрашивании по Граму и развитие небольших точечных и ά -гемолитических колоний в культуре твердой среды (модифицированный колумбийский агар) в 5% -ных чашках крови человека считалось нормальным. или лактобациллярная микробиота.
Обнаружение кандидоза проводили с помощью микроскопического исследования мокрого мазка с 1 мл 10% КОН, а также методом Сабуро и культуры кровяного агара.
Диагностика бактериального вагиноза (БВ) была проведена с помощью метода Ньюджента путем определения балла ≥7 в окрашивании по Граму [25] и методом Амселя, то есть наличия трех или более следующие критерии [26]: (i) «ключевые клетки» в окраске по Граму, (ii) pH ≥ 4.5, (iii) положительный тест на рыбный запах и (iv) жидкие и однородные выделения из влагалища.
T. vaginalis обнаружение проводили прямым микроскопическим исследованием с физиологическим солевым раствором и СНФ / метиленовым синим, пролонгированным окрашиванием Май-Грюнвальда Гимза и модифицированной тиогликолатной средой, которую ежедневно исследовали влажными мазками для обнаружения подвижных паразитов.
Количественное определение лейкоцитов (без комкования) определяли окрашиванием Мэй-Грюнвальда Гимза и выражали как LNR на поле (400x), наблюдая 10 несмежных микроскопических полей.
2.1. Критерии исключения
Пациенты с цервицитом при кольпоскопическом исследовании не включались в исследование.
2.2. Статистический анализ
Тесты Фишера и хи-квадрат 𝜒2 были выполнены для оценки VIS по отношению к микробиоте, применяя расчет скорректированного остатка (AR) в тех случаях с ≤,05 для определения LNR, которые дали полученные уровни значимости ( Эпи инфо 6.04). LNR с AR ≥ ± 2 считались теми, которые давали полученные уровни значимости.
3. Результаты
Статистически значимые различия, полученные в результате LNR, наблюдались в VIS бессимптомных беременных пациенток с нормальной микробиотой по сравнению с таковыми у пациенток с симптомами: от 10 до 15 в первом триместре, <10, 20, до 25 и> 25 во втором триместре и> 25 в третьем триместре (2: 10,73, 𝑃 : ,03, AR: ± 2,32; 2: 11,11, 𝑃: 0,02, AR: ± 2,32 ± 2,02 y ± 2,50; 𝜒2 : 10.53, 𝑃: .03, AR: ± 3.04, соответственно) (Таблица 1).
У пациентов с кандидозом статистически значимые различия в LNR наблюдались в VIS бессимптомных пациентов по сравнению с симптомными: <10 для первого триместра, <10, от 15 до 20 и> 25 для второго триместр, и <10 и> 25 для третьего триместра (2: 10.40, 𝑃: 0,03, AR: ± 2,63; 2: 17.60, 𝑃: .00, AR: ± 2,65 ± 2,58 y ± 2,14; 2: 14,24, 𝑃: 0,00, AR: ± 3,47 и ± 2,09, соответственно) (таблица 2).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

