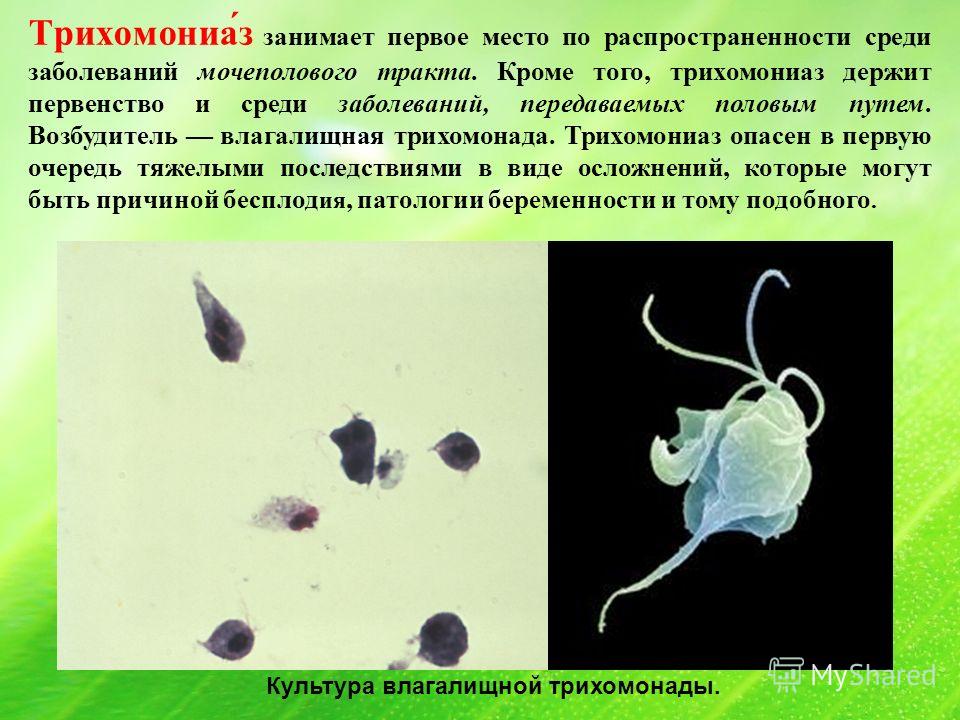
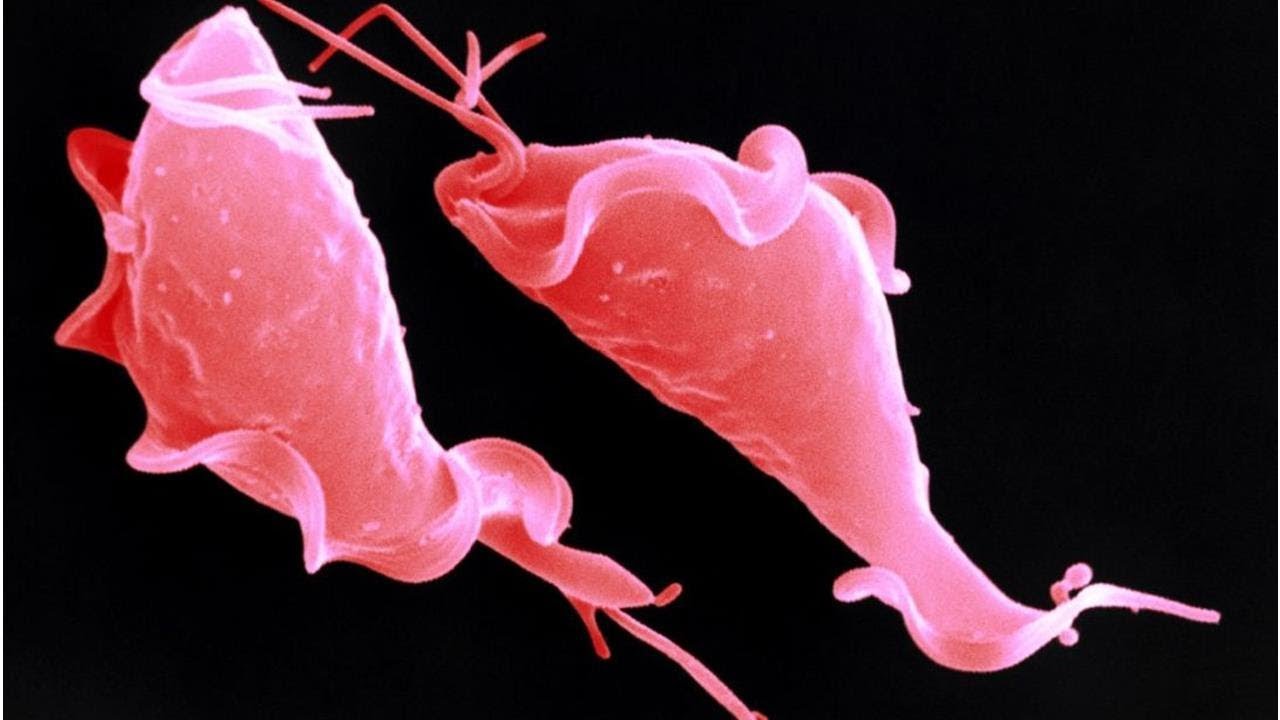
Диагностика трихомониаза — сдать анализ в СЗЦДМ
Трихомониаз (трихомоноз) ― одно из самых распространенных заболевание, передающееся половым путем. В России трихомонадную инфекцию диагностируют у 35% мужчин, обратившихся к урологу, и у 40% женщин-пациенток гинекологических клиник.
Возбудитель инфекции ― влагалищная трихомонада (Trichomonas vaginalis), одноклеточный организм, способный проникать в межклеточные пространства. Вне организма возбудитель быстро погибает высыхая. Для трихомонады губительна температура от +45С, ее легко можно смыть водопроводной водой. Максимальное время жизни 2 — 3 часа во влажной среде, например, в мочалке. Поэтому риск заразиться бытовым путем практически сведен к нулю.
1. Симптоматика у женщин:
-
Характерные обильные выделения из влагалища, пенистые, желтовато-зеленого цвета.

-
Покраснение наружных половых органов, зуд и жжение.
-
Болевые ощущения при мочеиспускании и половом акте.
-
Частое мочеиспускание, ложные позывы.
-
Слизистая оболочка влагалища, а иногда и наружные половые органы покрыты гнойными язвочками, выделяющими секрецию.
Трихомонады поражают влагалище, шейку матки и мочеиспускательный канал. Непроведение своевременного лечения способствует передвижению и размножению других патогенных микроорганизмов в организме женщины. Внутренний слой матки претерпевает патологические изменения, ведущие к неизлечимому бесплодию. Хроническое воспаление мочевого пузыря вызывает цистит.
2. Симптомы трихомониаза у мужчин:
-
Пенистые выделения из мочеиспускательного канала от прозрачных до гнойных.
-
Болевые ощущения, зуд и жжение при мочеиспускании и эякуляции.
-
Отечность отверстия уретры.
-
Ранки и язвочки на половом члене.
-
Редко можно наблюдать небольшие кровяные скопления в моче и сперме.
Если заболевание не лечить воспалительные процессы переходят на другие органы мочеполовой системы. Трихомониаз может привести к простатиту, инфицированный мочеиспускательный канал к уретриту, поражению мочеточников, мочевого пузыря и почек. Снижается качество семенного материала, сперматозоиды теряют активность, что ведет к практически неизлечимому бесплодию. Хроническое инфицирование ослабляет иммунитет, в результате чего начинают размножаться другие патогенные микроорганизмы.
Снижается качество семенного материала, сперматозоиды теряют активность, что ведет к практически неизлечимому бесплодию. Хроническое инфицирование ослабляет иммунитет, в результате чего начинают размножаться другие патогенные микроорганизмы.
Инкубационный период трихомониаза колеблется от нескольких дней до 2 месяцев. Это зависит от иммунитета инфицированного, наличия сопутствующих заболеваний и формы развития трихомониаза. Если он протекает в стертой (скрытой) форме, то первые признаки болезни проявляются спустя несколько недель после заражения.
У женщин болезнь протекает более выражено, чем у мужчин. Симптоматика женского трихомониаза, проявляется быстрее и сильнее, усиливается перед и после менструации. В большинстве случаев мужской трихомониаз существует в форме носительства. В детском возрасте трихомониаз диагностируют редко. Инфицирование может произойти от больной матери при прохождении через родовые пути, при использовании одного полотенца. Симптоматика сходна с симптомами взрослых, у девочек чаще протекает в виде вульвовагинита.
Симптоматика сходна с симптомами взрослых, у девочек чаще протекает в виде вульвовагинита.
-
Острая форма ― первичное заражение с ранним и сильным проявлением симптомов.
-
Подстрая форма ― первичное заражение со смазанной, не явной симптоматикой.
-
Хроническая форма ― возникает при отсутствии лечения, может годами протекать со слабо выраженными симптомами либо чередоваться периодами затишья и рецессии.
-
Трихомонадоносительство ― проявления заболевания отсутствуют, возбудитель выявляется случайно при лабораторных анализах.
Характер и объем выделений напрямую зависит от стадии течения заболевания. При хроническом развитии выделяется небольшое количество слизи. Со временем проявления могут утихнуть, но выздоровление не наступит.
Со временем проявления могут утихнуть, но выздоровление не наступит.
Трихомониаз часто сочетается с другими ИППП: гонорейной инфекцией, хламидиозом, бактериями микоплазмами. Увеличивает риск заражения ВИЧ-инфекцией. Среди осложнений: бесплодие, преждевременные роды, мертворождение. Хроническая форма может привести к простатиту, раку простаты и раку шейки матки. Важно следить за состоянием здоровья, гигиеной, избегать случайных половых контактов без использования контрацепции. Следует своевременно проходить медицинские исследование и лечить выявленные заболевания.
-
Наличие симптоматики, указывающей на заболевание, при воспалении органов мочеполовой системы.
-
Обследование семейной пары при планировании и во время беременности.
-
Перед проведением гинекологической, урологической лапароскопии.

-
Для выявления причины невынашивания беременности у женщин, бесплодия у обоих полов.
-
В профилактических целях после незащищенного полового контакта.
Ранняя диагностика трихомониаза позволит избежать многих негативных последствий в будущем. Из-за инфекции мочеполовые органы воспаляются, что приводит к микроскопическим трещинкам и кровоизлияниям. Нарушается естественный баланс микрофлоры. Через ослабленный защитный барьер могут проникнуть другие инфекции. В очаге поражения увеличивается концентрация иммунных клеток. При проникновении вируса иммунодефицита, именно эти клетки в первую очередь подвергаются атаке вируса. Чем выше уровень концентрации иммунных клеток, тем больше вероятность заражения.
Методы лабораторной диагностики
Существует 3 основных метода диагностирования наличия трихомонады и несколько дополнительных. К основным относятся:
К основным относятся:
-
Микроскопия соскоба из влагалища или уретры;
-
культуральный посев;
-
молекулярно-генетические методы.
Часто дополнительным способом лабораторного диагностирования выступает серологическое исследование. Его не назначают отдельно, только в комплексе. Помимо диагностирования наличия заболевания, он также позволяет узнать, болел ли человек трихомониазом в прошлом.
1. Микроскопия
Биологический материал (соскоб) наносят на предметное стекло под покровным. В первый час изучается «влажный» мазок без окрашивания. При острой стадии болезни уже на этом этапе можно выявить трихомонады. Чувствительность теста составляет 70%. Если с момента забора прошло больше часа, а также при скрытой форме болезни после анализа «влажного» мазка, биоматериал обрабатывают красителем.
Стоит учесть, что в последние десятилетия чаще стали отмечаться случаи выявления атипичных вагинальных трихомонад. Особи могут быть лишены органоидов движения, быть малоактивны, не иметь ундулирующей мембраны, блефаропласта, жгутиков. Это значительно усложнило диагностирование заболевания. Несмотря на это микроскопия продолжает оставаться самым популярным методом в нашей стране. После получения отрицательного результата, рекомендовано, подтвердить его другими анализами.
2. Микробиологическое исследование (культуральный посев)
Биологический материал помещают на питательную среду, поддерживают определенный температурный режим. Выдерживают определенное количество часов и выявляют возбудитель. Метод самый точный, позволяет определить заболевание скрытой формы без симптомов. Чувствительность 95%.
Сюда относятся метод полимеразной цепной реакции (ПЦР), амплификация нуклеиновых кислот (NASBA) и других методики, выявляющие участки ДНК или РНК в биологическом материале. NASBA ― более современный тест, чем ПЦР. Основан на амплификации молекул рибосомальной РНК ― прямой маркер наличия трихомонады. Чувствительность молекулярно-генетических методов около 87 — 95%.
Тест проводится комплексно с другими методами, так как высока вероятность ложноположительного или ложноотрицательного результат. При этом данный анализ способен обнаружить антитела в течение 1 года после перенесенного заболевания.
После получения положительного результата лабораторных исследований, назначается адекватная терапия. В процессе лечения и по окончании курса приема препаратов, необходимо пройти повторные анализы. Это делается для оценки эффективности терапии и для того, чтобы подтвердить полное выздоровление. Это важный этап, поскольку недолеченная инфекция перейдет в хроническую форму. Лечение беременных проводится на любом сроке, поскольку важно предотвратить преждевременного разрыва плодных оболочек, патологий плода, низкой массы и преждевременных родов.
Это делается для оценки эффективности терапии и для того, чтобы подтвердить полное выздоровление. Это важный этап, поскольку недолеченная инфекция перейдет в хроническую форму. Лечение беременных проводится на любом сроке, поскольку важно предотвратить преждевременного разрыва плодных оболочек, патологий плода, низкой массы и преждевременных родов.
Если назначен забор мазка необходимо подготовится к анализу заранее. Для этого соблюдают следующие условия:
-
За 2 — 3 часа не ходить в туалет.
-
За 2 дня прекратить использование вагинальных свечей спринцевания.
-
За 2 дня начать воздержание от половых актов.
-
Накануне не подмываться.

В противном случае можно смыть микрофлору и получить ложный результат. Обследование не проводится во время месячных или накануне, после проведения кольпоскопии или вагинального УЗИ.
Если назначено молекулярно-генетическое исследование, необходимо также сохранить микрофлору: ни мочиться, ни подмываться. Биоматериалом помимо мазка (соскоба) может стать, первая порция утренней мочи или утренняя сперма после небольшого периода воздержания. Материал собирают в стерильную емкость, герметизируют от внешней среды.
Если назначен анализ на антитела, пациенту придется сдавать кровь. Сдают ее натощак в утренние часы. За сутки до забора крови следует оградить себя от эмоционального и физического напряжения. Не курить в течение часа.
Расшифровка результатов
Готовность результата зависит от типа исследования. Микроскопия может быть готова в течении 1 — 2 дня. Результат при исследовании биоматериала может быть положительным или отрицательным.
Микроскопия может быть готова в течении 1 — 2 дня. Результат при исследовании биоматериала может быть положительным или отрицательным.
Анализ на трихомонады различны для мужчин и женщин, отличие кроется в способе оценки. Самый красноречивый биоматериал у женщин ― мазок со слизистой половых органов. При наличии заболевания в нем обнаруживают большое количество живых возбудителей. В большинстве случаев этого достаточно для постановки диагноза. У мужчин трихомониаз часто протекает в скрытой форме, соскоб не всегда дает правдивый результат. Поэтому используют комплексное исследование. Микроскопию мазка из уретры целесообразнее заменить на анализ ПЦР и серологическое исследование.
Часто анализ на трихомонады проводят совместно с тестами на гонококк. Нередко встречаются пациенты, одновременно болеющие гонореей и трихомониазом. В идеале стоит пройти полное обследование на ИППП, включая ВИЧ и сифилис.
Сдать анализы на трихомониаз и другие инфекции можно в лаборатории Северо-Западного центра доказательной медицины. В распоряжении квалифицированных специалистов новейшее диагностическое оборудование, поэтому можно гарантировать:
В распоряжении квалифицированных специалистов новейшее диагностическое оборудование, поэтому можно гарантировать:
-
точность результата;
-
быструю готовность анализов;
-
выполнение всех видов тестов для полного обследования.
Результаты можно получить любым удобным для вас способом: лично, по указанной при регистрации, электронной почте.
Анализы
перейти к анализам
Сдать анализ на трихомониаз, лечение трихомониаза у мужчин и женщин
Урогенитальный трихомониаз (УТ) вызывается жгутиковым простейшим Trichomonas vaginalis, относится к ИППП. Возбудитель имеет тропность к клеткам плоского эпителия влагалища, богатых гликогеном, который служит питательным материалом паразитам. У женщин УТ протекает в форме вагинита, сопровождающимся воспалением с гиперемией, отеком слизистой влагалища, шейки матки, вульвы, пенистыми выделениями. В 40–50% случаев симптоматика и проявления УТ отсутствуют или не выражены. У мужчин УТ проявляется симптомами уретрита, сопровождается слизистыми выделениями, но в большинстве случаев (60–70%) течение инфекции носит торпидный характер. Осложнениями УТ у женщин являются ВЗОМТ (воспалительные заболевания органов малого таза), эндометрит, преждевременные роды, малый вес новорожденных, у мужчин – простатит, эпидимит.
У женщин УТ протекает в форме вагинита, сопровождающимся воспалением с гиперемией, отеком слизистой влагалища, шейки матки, вульвы, пенистыми выделениями. В 40–50% случаев симптоматика и проявления УТ отсутствуют или не выражены. У мужчин УТ проявляется симптомами уретрита, сопровождается слизистыми выделениями, но в большинстве случаев (60–70%) течение инфекции носит торпидный характер. Осложнениями УТ у женщин являются ВЗОМТ (воспалительные заболевания органов малого таза), эндометрит, преждевременные роды, малый вес новорожденных, у мужчин – простатит, эпидимит.
Показания к обследованию. У мужчин: наличие симптомов и клинических проявлений уретрита, эпидидимита или простатита; при физикальном осмотре – наличие выделений из уретры.
У женщин: наличие симптомов воспалительного процесса нижних отделах урогенитального тракта и органов малого таза, боли в низу живота, патологические выделения из влагалища; отечность и признаки воспаления шейки матки; нарушение менструального цикла; болезненность при половых контактах; подготовка к беременности; отягощенный акушерско-гинекологический анамнез: невынашивание беременности, преждевременные роды.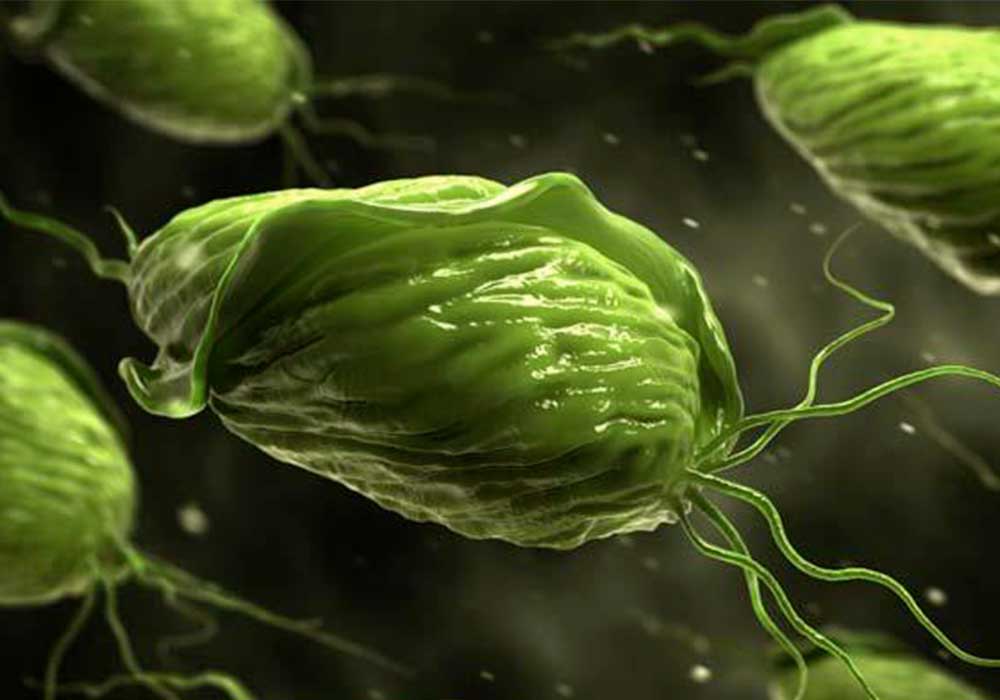
У лиц обоего пола без симптомов и признаков воспалительного процесса урогенитального тракта: наличие перечисленных выше симптомов и признаков у половых партнеров или установленный УТ; многочисленные половые контакты или половые контакты с новым половым партнером без барьерной контрацепции.
Дифференциальная диагностика. Хламидийная, гонококковая инфекция, инфекция, вызванная M.genitalium, урогенитальный кандидоз, бактериальный вагиноз, аэробный вагинит.
Этиологическая диагностика включает визуальное выявление T.vaginalis с использованием микроскопии, культуральные исследования, выявление НК и АГ T.vaginalis, выявление специфических АТ к T.vaginalis.
Материал для исследований
- Мазки/соскобы со слизистой влагалища – микроскопическое выявление трихомонад, культуральные исследования, выявление АГ, ДНК/РНК;
- мазки/соскобы со слизистой уретры мужчин – микроскопическое выявление трихомонад, культуральные исследования, выявление АГ, ДНК, РНК;
- моча (первая порция) у мужчин – выявление ДНК, РНК;
- сыворотка крови – выявление АТ.

Сравнительная характеристика методов лабораторной диагностики. Для визуального выявления влагалищных трихомонад используют световую микроскопию. Применяют как нативные препараты для выявления подвижных жгутиковых простейших, так и фиксированные препараты, окрашенные метиленовым синим, по Граму или по Романовскому-Гимзе. Выявление возбудителя осуществляется на основании типичной морфологии T.vaginalis (размер 10–20 мкм, овальная или грушевидная форма клеток, наличие жгутиков, ундулирующей мембраны, аксостиля). При исследовании нативных препаратов дополнительным признаком является подвижность трихомонад. Методы просты в исполнении и, благодаря крупным размерам возбудителя и выраженным видовым признакам, высоко специфичны. Однако диагностическая чувствительность микроскопического исследования в значительной степени зависит от количества простейших в биологическом материале, поэтому методы эффективны при острых формах УТ – их диагностическая чувствительность достигает 80%.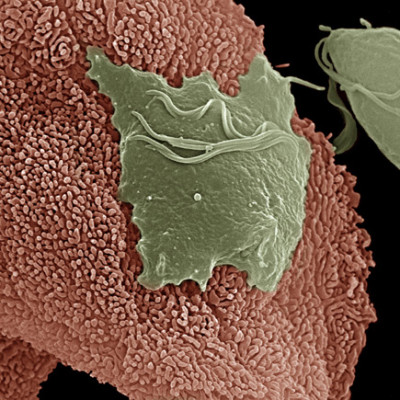 При хронических и бессимптомных формах инфекции и трихомониазе у мужчин диагностическая чувствительность микроскопических исследований составляет 10–30%.
При хронических и бессимптомных формах инфекции и трихомониазе у мужчин диагностическая чувствительность микроскопических исследований составляет 10–30%.
Для выделения культуры T.vaginalis используют жидкие питательные среды. Культивирование проводится в течение 5–7 суток с ежедневной оценкой результатов на основании появления в среде подвижных жгутиковых простейших с характерной морфологией T.vaginallis. Диагностическая чувствительность теста достигает 90–95% у пациентов с клиническими проявлениями инфекции, у бессимптомных пациентов не превышает 60%. На эффективность результатов культуральных исследований влияют условия транспортировки биологического материала, обеспечивающие сохранение жизнеспособности возбудителя.
Для выявления ДНК T.vaginalis в РФ преимущественно используется ПЦР с различными вариантами детекции продуктов реакции и метод выявления РНК на основе NASBA(НАСБА). Диагностическая чувствительность метода ПЦР при диагностике УТ находится в пределах от 90 до 98%, NASBA(НАСБА) достигает 95–98%, специфичность метода ПЦР составляет 96–98%, NASBA(НАСБА) – до 100%.
Методы выявления АГ более трудоемки по сравнению с микроскопическими исследованиями, в РФ отсутствуют серийно выпускаемые наборы реагентов.
Выявление АТ к T.vaginalis не имеют практического значения в установлении наличия инфекции.
Показания к применению различных лабораторных исследований. Микроскопическое исследование проб биоматериала показано в случаях, когда у пациентов имеются симптомы и клинические проявления урогенитальной инфекции в качестве наиболее быстрого метода диагностики. Однако при отсутствии симптомов и клинических проявлений инфекции микроскопические исследования не рекомендуется рассматривать как метод диагностики УТ из-за низкой информативности.
Культуральное исследование рекомендуется проводить в тех случаях, когда необходимо получить чистую культуру микроорганизма. Из-за длительности культивирования применение метода в рутинной диагностической практике ограничено.
В настоящее время выявление ДНК методом ПЦР рассматривают как оптимальный метод скрининга для пациентов обоего пола. Исследование показано и для оценки результатов лечения. При выявлении ДНК методом ПЦР контроль лечения УТ необходимо проводить не ранее 2–3 недель. РНК возбудителя является более ранним маркером ответа на терапию, поэтому с помощью метода NASBA(НАСБА) можно оценивать эффективность лечения через 1–2 недели после окончания курса.
Исследование показано и для оценки результатов лечения. При выявлении ДНК методом ПЦР контроль лечения УТ необходимо проводить не ранее 2–3 недель. РНК возбудителя является более ранним маркером ответа на терапию, поэтому с помощью метода NASBA(НАСБА) можно оценивать эффективность лечения через 1–2 недели после окончания курса.
Особенности интерпретация результатов лабораторных исследований. При обнаружении простейших с типичной морфологией T.vaginalis в ходе микроскопического исследования дополнительных лабораторных исследований не требуется. Положительный результат культурального исследования является наиболее объективным доказательством инфекции, однако в силу зависимости чувствительности методов микроскопии и культурального исследования от количества возбудителя и условий транспортировки биологического материала, отрицательный результат не исключает наличие инфекции.
При обнаружении ДНК T.vaginalis у пациентов с клинической симптоматикой урогенитальной инфекции и наличии факторов, способствующих инфицированию, дополнительного исследования не требуется и диагноз УТ считается установленным.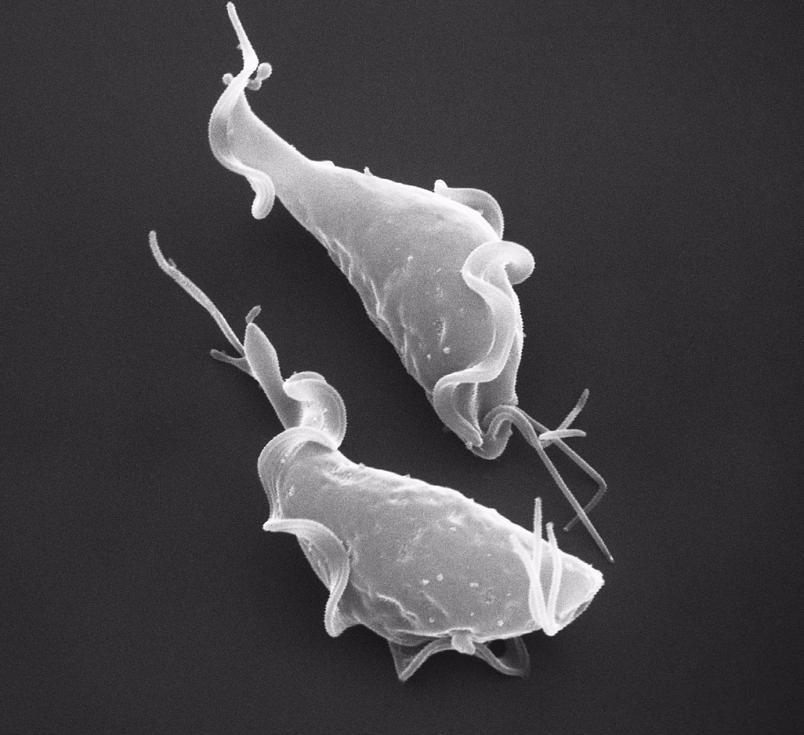 При обнаружении ДНК T.vaginalis, но отсутствии субъективных и объективных признаков инфекции и факторов риска, для подтверждения диагноза рекомендуется провести исследование для выявления РНК T.vaginalis методом NASBA(НАСБА). Наличие РНК и ДНК является объективным лабораторным признаком инфекции.
При обнаружении ДНК T.vaginalis, но отсутствии субъективных и объективных признаков инфекции и факторов риска, для подтверждения диагноза рекомендуется провести исследование для выявления РНК T.vaginalis методом NASBA(НАСБА). Наличие РНК и ДНК является объективным лабораторным признаком инфекции.
Заболевание на двоих
В настоящий период молодежь изменила свое отношение к добрачным сексуальным связям. Основная масса молодых людей не связывают сексуальные отношения с обязательным вступлением в брак и половина из них имеет опыт сексуальных отношений с несколькими половыми партнерами. Эти глубинные перемены в физическом здоровье и социальном поведении сопряжены со значительным риском для репродуктивного и сексуального здоровья, которые проявляются высокой распространенностью инфекций, передающихся половым путем
Болезни, передающиеся половым путем, являются болезнями, которые передаются от одного человека к другому во время или в результате интимной половой близости и являются значимой проблемой репродуктивного здоровья.
Трихомониаз – одно из наиболее распространенных заболеваний, передающихся половым путем. Заболевание широко распространенно, встречается как у женщин, так и у мужчин. Ежегодно 100 млн. женщин во всем мире заражаются этой инфекцией.
У женщин трихомониаз поражает влагалище, мочеиспускательный канал, но воспалительный процесс может распространиться на матку и её придатки, тазовую брюшину, мочевой пузырь, почки.
Возбудитель трихомониаза — влагалищная трихомонада — одноклеточный организм довольно сложного строения. Трихомонада очень подвижна. Жизнеспособность влагалищной трихомонады в мочеполовом аппарате высокая, а во влажной среде вне организма человека (в губках и других предметах) – может сохранить свою жизнеспособность не более 1-2 часов. В водопроводной воде, в естественных водоемах влагалищные трихомонады быстро погибают.
Заражение происходит половым путем от больного трихомониазом или трихомонадоносителя. Последний сам не болеет, но при исследовании его выделений из мочеполовых органов обнаруживаются трихомонады.
Девочки могут заразиться трихомониазом неполовым путем, при пользовании общими с больным человеком вещами: мочалкой, губкой, купальными трусиками и т.д.
Проявления болезни у женщины разнообразны. На 3-11 день после заражения появляются признаки трихомониаза : выделения из половых органов сероватого или желтоватого цвета, возможны также и пенистые выделения, зуд, жжение, болезненность при мочеиспускании.
У женщин трихомониаз может протекать без выраженных признаков болезни. Появляющиеся при этой форме болезни бели мало или совсем не беспокоят больную. Практически больные узнают о своем заболевании, когда являются источником заражения мужчины.
Если вовремя не начать лечение, болезнь переходит в хроническую форму. Она изнуряет больную частыми обострениями. Причиной обострений являются различные факторы, ослабляющие организм: охлаждение, переутомление, перенесенные инфекционные заболевания.
При длительной нелеченной инфекции в организме возникают осложнения в виде воспаления в яичниках и маточных трубах. Хронические воспалительные (трихомониазные) заболевания маточных труб ведут к значительному снижению их просвета, результатом чего может быть внематочная беременность, требующая немедленного хирургического вмешательства. Иногда наблюдаются нарушения менструального цикла. Самым грозным осложнением трихомониаза является бесплодие. Утрата возможности стать матерью – горе для каждой женщины! Но еще тяжелее оказаться виновной в болезни своего ребенка. Возбудитель трихомониаза, у детей, может также поражать мочеиспускательный канал, мочевой пузырь и почки.
Хронические воспалительные (трихомониазные) заболевания маточных труб ведут к значительному снижению их просвета, результатом чего может быть внематочная беременность, требующая немедленного хирургического вмешательства. Иногда наблюдаются нарушения менструального цикла. Самым грозным осложнением трихомониаза является бесплодие. Утрата возможности стать матерью – горе для каждой женщины! Но еще тяжелее оказаться виновной в болезни своего ребенка. Возбудитель трихомониаза, у детей, может также поражать мочеиспускательный канал, мочевой пузырь и почки.
Трихомониаз, не распознанный в течение длительного времени, представляет опасность как для самого заболевшего, так и для здоровых. Больной трихомониазом, не зная о своем заболевании, при несоблюдении правил личной гигиены, не прекращая половую жизнь, является источником заражения и распространения инфекции.
Современная медицина располагает эффективными медикаментозными средствами для лечения трихомониаза. При современных методах лечения трихомониаз излечим. Лечение проводится под контролем врача.
При современных методах лечения трихомониаз излечим. Лечение проводится под контролем врача.
Важным условием эффективного лечения при трихомониазе является одновременное лечение супругов (или половых партнеров) и излеченности.
Больной трихомониазом должен строго соблюдать режим:
- не иметь половых связей;
- не употреблять алкоголь;
- острые, соленые, кислые блюда;
- выполнять все назначения врача;
- соблюдать правила личной гигиены.
Не следует лечиться самостоятельно по совету друзей и знакомых, так как самолечение изменяет клиническую картину, затрудняет диагностику и такое «лечение» приводит к серьезным осложнениям.
При первом же появлении признаков болезни: обильных выделений сероватого или желтоватого цвета, зуде, жжении, болезненности при мочеиспускании, — немедленно обращайтесь к врачу!
Не скрывайте от врача сведения о половых партнерах. Ведь вместе с трихомониазом можно заразиться и венерическими болезнями.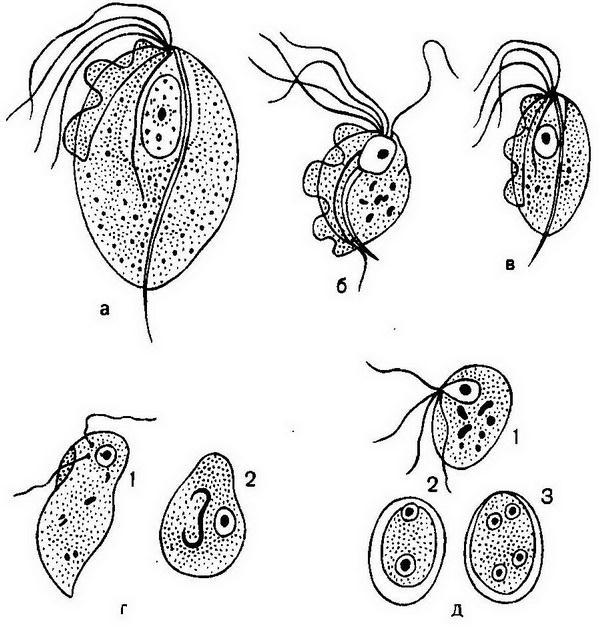 Своевременное обследование источников распространения инфекции предупреждает заболевание и позволяет правильно и своевременно назначить лечение, прекратить распространение заболевания и уберечь других людей от возможного заражения и последствий болезни.
Своевременное обследование источников распространения инфекции предупреждает заболевание и позволяет правильно и своевременно назначить лечение, прекратить распространение заболевания и уберечь других людей от возможного заражения и последствий болезни.
Чтобы предупредить болезнь, следует остерегаться случайных связей. Беспорядочная, распущенная половая жизнь приводит к заражению болезнями, передающимися половым путем.
Подумайте, не слишком ли дорого приходится расплачиваться за легкомыслие, беспечность, моральную нечистоплотность! Страдать не только от болезни, но и от угрызения совести за то, что вы стали причиной несчастья других людей, своих близких.
Врач дерматовенеролог УЗ «Жодинская ЦГБ Лашова Н.В.
Современные стандарты терапии инфекций, передаваемых половым путем
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!
Е.И. БОРОВКОВА, д.м.н., Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России, кафедра акушерства и гинекологии
И.М. Сеченова Минздрава России, кафедра акушерства и гинекологии
Инфекции, передаваемые половым путем (ИППП) — это группа заболеваний, основным путем передачи которых является половой. В настоящее время известно более 20 инфекций, передача которых связана с половым путем [2].
Среди них хламидийная и вирусная инфекции постепенно вытесняют возбудителей классических болезней бактериальной этиологии (сифилис, гонорея) как с точки зрения значимости, так и по частоте встречаемости. Отсутствие специфической картины воспаления, вялое, а зачастую бессимптомное течение осложняют диагностику этих заболеваний, что способствует формированию хронической формы процесса и развитию таких осложнений, как бесплодие, фоновые заболевания шейки матки, внематочная беременность, тазовые боли, невынашивание беременности, внутриутробное инфицирование плода, повышение заболеваемости и смертности новорожденных [1].
Согласно МКБ 10 пересмотра к ИППП относятся следующие возбудители (табл. 1) [1]:
1) [1]:
Согласно рекомендациям ВОЗ препараты, используемые для лечения ИППП, должны быть высоко-эффективны (не менее 95%), иметь доступную цену, хорошую переносимость, возможность однократного применения перорально, возможность применения во время беременности и медленное развитие к ним резистентности у микроорганизмов [1].
Эффективность является важнейшим критерием отбора схем лечения. Схемы с гарантией излечения меньшей, чем 95% должны использоваться с осторожностью, т. к. такое лечение способствует селекции устойчивых штаммов. Применение схем лечения, эффективность которых ниже 85%, недопустимо.
Вторым важнейшим вопросом при лечении ИППП является вопрос безопасности, которая зависит от степени токсичности применяемых средств. При проведении терапии ИППП допустимо использовать основные (препарат выбора) и альтернативные схемы лечения. Препарат выбора обеспечивает наилучшее соотношение между эффективностью и безопасностью лечения. Альтернативные препараты назначают при невозможности использования препаратов первого выбора в связи с индивидуальной непереносимостью, беременностью, лактацией и сопутствующими состояниями и заболеваниями [2].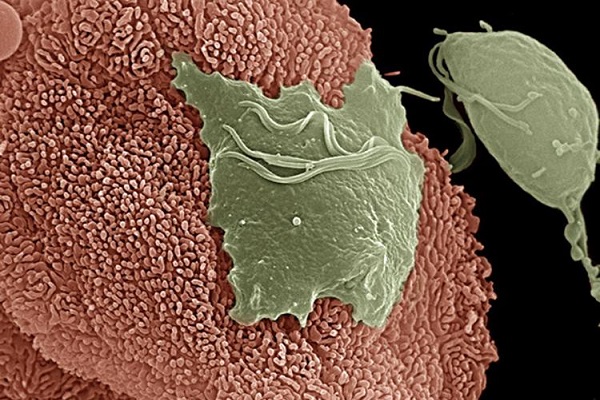
К специфическим видам лечения при ИППП относят превентивное и профилактическое лечение. Превентивное лечение проводят пациенткам, у которых был половой или тесный бытовой контакт с больными ранними формами сифилиса или гонореей, если с момента контакта с больным сифилисом прошло не более 2 мес., а гонореей — не более 14 дней. Превентивное лечение имеет очень важное значение для дальнейшего предотвращения распространения инфекции [2, 9].
Профилактическое лечение проводят детям, родившимся без проявлений сифилиса от нелеченых матерей, при поздно начатом специфическом лечении матери, при отсутствии негативации реакций серологического комплекса к моменту родов или серорезистентности у матери.
В настоящем обзоре мы коснемся только наиболее распространенных и значимых инфекций в практике врача акушера-гинеколога.
Урогенитальный хламидиоз
Частота хламидийной инфекции в популяции достигает 8—15%, ежегодно в мире регистрируется около 90 млн новых случаев заболевания. У пациентов репродуктивного возраста хламидии наиболее часто ассоциируются с трихомонадами (39,5%), гарднереллами (15%), микоплазмами (12%), а в детском и пожилом возрасте — с золотистым стафилококком (21%) и грибами рода Candida (15%) [2].
У пациентов репродуктивного возраста хламидии наиболее часто ассоциируются с трихомонадами (39,5%), гарднереллами (15%), микоплазмами (12%), а в детском и пожилом возрасте — с золотистым стафилококком (21%) и грибами рода Candida (15%) [2].
Источником инфекции при урогенитальном хламидиозе является человек, болеющий острой или хронической формой заболевания с манифестным или бессимптомным течением. Возбудитель урогенитального хламидиоза обитает в эпителии мочеполовых органов, поэтому основным путем передачи инфекции является половой. Распространение в организме происходит каналикулярно (трансцервикально, через маточные трубы), трансплацентарно, лимфогенно, гематогенно, а также при участии сперматозоидов. Для детей описывают антенатальный, интранатальный, контактно-бытовой и половой путь инфицирования.
Этиология. Хламидии — это мелкие грамотрицательные (иногда грамвариабельные) кокковидные бактерии, относящиеся к порядку Chlamydiales, семейству Chlamydiaceae, роду Chlamydia. Хлами-дии являются облигатными внутриклеточными паразитами, обладающими тропизмом к клеткам цилиндрического, а возможно, и переходного эпителия. Уникальность хламидий определяется своеобразным циклом развития в виде последовательного образования элементарных телец (ЭТ) — инфекционная форма, и ретикулярных телец (РТ) — вегетативная форма. ЭТ адаптированы к внеклеточному выживанию, обладают слабой метаболической активностью. Первым этапом инфекционного процесса является адсорбция ЭТ хламидий на клеточной мембране чувствительной клетки. Затем происходит внедрение возбудителя в клетку путем инвагинации участков плазмалеммы и образования фагоцитарных вакуолей. Данный этап продолжается от 7 до 10 ч. Вирулентные ЭТ трансформируются в метаболически активные РТ (тельца Гальберштедтера — Провацека) в течение 6—8 ч [7].
Хлами-дии являются облигатными внутриклеточными паразитами, обладающими тропизмом к клеткам цилиндрического, а возможно, и переходного эпителия. Уникальность хламидий определяется своеобразным циклом развития в виде последовательного образования элементарных телец (ЭТ) — инфекционная форма, и ретикулярных телец (РТ) — вегетативная форма. ЭТ адаптированы к внеклеточному выживанию, обладают слабой метаболической активностью. Первым этапом инфекционного процесса является адсорбция ЭТ хламидий на клеточной мембране чувствительной клетки. Затем происходит внедрение возбудителя в клетку путем инвагинации участков плазмалеммы и образования фагоцитарных вакуолей. Данный этап продолжается от 7 до 10 ч. Вирулентные ЭТ трансформируются в метаболически активные РТ (тельца Гальберштедтера — Провацека) в течение 6—8 ч [7].
Процесс трансформации РТ в ЭТ занимает 36—42 ч, и на данном этапе обнаруживаются переходные формы (промежуточные тельца) хламидий. Заканчивается жизненный цикл хламидий выходом ЭТ из эндосомы и разрушением инфицированной клетки. Через 48—72 ч освободившиеся ЭТ проникают в новые клетки-мишени [6].
Через 48—72 ч освободившиеся ЭТ проникают в новые клетки-мишени [6].
Ключом к пониманию механизмов персистенции инфекции явилось открытие свойства ЭТ хламидий продуцировать антилизосомальные ферменты, препятствующие полноценному фагоцитозу микроорганизма. Хламидии способны трансформироваться в L–формы, что позволяет возбудителю ускользать от ранее образованных иммунной системой специфических антител. Обладая тропизмом к цилиндрическому эпителию, хламидии чаще всего вызывают эндоцервициты. В нормальном многослойном плоском эпителии у взрослых женщин хламидии не способны размножаться, однако у девочек нередко поражается и плоский эпителий влагалища и шейки матки.
Классификация. По топографии выделяют хламидийное поражение нижнего отдела урогени-тального тракта (не осложненный хламидиоз) и восходящую хламидийную инфекцию (осложненный хламидиоз). К поражению нижнего отдела урогенитального тракта относится хламидийный уретрит, парауретрит, бартолинит, кольпит, эндоцервицит. Восходящее распространение инфекции приводит к развитию эндометрита, сальпингита и сальпингоофорита, пельвиоперитонита, перигепатита, периаппендицита (аппендикулярно-генитальный синдром Fitz — Hugh — Curtis) [2].
Восходящее распространение инфекции приводит к развитию эндометрита, сальпингита и сальпингоофорита, пельвиоперитонита, перигепатита, периаппендицита (аппендикулярно-генитальный синдром Fitz — Hugh — Curtis) [2].
По длительности заболевания различают свежий (с давностью заражения до 2 мес.) и хронический (с давностью заражения более 2 мес.) урогенитальный хламидиоз, хотя деление это весьма условно в связи с тем, что момент инфицирования установить, как правило, невозможно.
По стадиям течения в клинике свежего хламидиоза выделяют острую, подострую и торпидную (малосимптомную) стадии, смена которых происходит в процессе взаимодействия микро- и макро-организма.
Клиника урогенитального хламидиоза. В 50—70% случаев урогенитальный хламидиоз протекают мало- или асимптомно. Из микросимптомов для хламидиоза характерны умеренные или обильные влагалищные выделения (40%), зуд в области наружных половых органов (26%), дизурические явления (30%). Учитывая тропность Ch. trachomatis к цилидрическому и переходному эпителию, основные очаги поражения локализуются в уретре, цервикальном канале и прямой кишке [2].
Учитывая тропность Ch. trachomatis к цилидрическому и переходному эпителию, основные очаги поражения локализуются в уретре, цервикальном канале и прямой кишке [2].
Влияние на течение и исход беременности. Среди беременных частота выявления хламидийной инфекции колеблется от 2 до 24% и наиболее высока в группе молодых малообследованных пациенток. Риск внутриутробного инфицирования плода составляет от 10 до 12%. Новорожденные чаще всего инфицируются интранатально, и у 50% из них развивается хламидийный конъюнктивит. Примерно у 10% детей в возрасте 2—3 мес. жизни возможна манифестация хламидийного пневмонита и отита среднего уха.
Диагностика урогенитального хламидиоза. Согласно рекомендациям ВОЗ диагностика урогенитального хламидиоза проводится в следующих случаях [4]:
— новорожденные при наличии диагностированной хламидийной инфекции у матери;
— хронический цистит;
— хронические воспалительные заболевания мочеполовой системы;
— эктопия шейки матки;
— нарушение менструального цикла по типу метроррагий;
— самопроизвольные и искусственные аборты;
— лечебные и диагностические выскабливания слизистых оболочек шейки и тела матки, другие внутриматочные вмешательства;
— использование внутриматочной контрацепции;
— частая смена половых партнеров;
— реактивный артрит;
— хронический конъюнктивит;
— атипичная пневмония;
— лихорадка неясного генеза.
Учитывая, что хламидии обитают внутри клеток цилиндрического эпителия, в качестве материала для исследования используют соскобы (а не выделения) со слизистой оболочки уретры, шеечного канала, прямой кишки, конъюнктивы и др. В настоящее время основным методом диагностики урогенитального хламидиоза является ПЦР. Серологическое исследование необходимо проводить только для верификации венерической лимфогранулемы или для подтверждения хламидийной пневмонии у новорожденных.
Лечение урогенитального хламидиоза.
Из современных препаратов, активных в отношении хламидий, с учетом биологических свойств возбудителя используются тетрациклины, макролиды и фторхинолоны. Согласно клиническим рекомендациям Российского общества дерматовенерологов и косметологов от 2012 г. препаратами первого выбора являются [6, 7]:
• Доксициклина моногидрат 100 мг внутрь 2 раза в день 7 дней или
• Джозамицин 500 мг 3 раза в день 7 дней или
• Азитромицин 1,0 г внутрь однократно
Альтернативная схема
• Левофлоксацин 500 мг внутрь 1 раз в день 7 дней
или офлоксацин 400 мг внутрь 2 раза в день 7 дней
Беременные
• Джозамицин 500 мг 3 раза в день 7 дней
При хламидийной инфекции органов малого таза
• Доксициклина моногидрат 100 мг внутрь 2 раза в день 14—21 день или
• Джозамицин 500 мг 3 раза в день 14—21 день
Альтернативная схема
• Левофлоксацин 500 мг внутрь 1 раз в день 14—21 день или
• Офлоксацин 400 мг внутрь 2 раза в день 14—21 день
Беременные
• Джозамицин 500 мг 3 раза в день 7 дней.
Согласно рекомендациям Центра по контролю за заболеваемостью в США (CDC) и Европейских рекомендаций за 2012 г. препаратами выбора в терапии острого неосложненного хламидиоза являются азитромицин и доксициклин (табл. 2) [3, 7, 10].
Контроль излеченности проводится методом ПЦР через 30 дней.
Заболевание вызывается простейшим Trichomonas vaginalis
В развитых странах заболеваемость составляет 0,1—0,3%. По данным ВОЗ заболеваемость по миру превышает 300 млн человек в год [8].
Классификация. В зависимости от длительности заболевания и интенсивности реакции организма выделяют:
1. Свежий; острый; подострый; торпидный (малосимптомный) трихомониаз.
2. Хронический трихомониаз (торпидное течение и давность заболевания свыше 2 мес. или не установленная длительность заболевания).
3. Трихомонадоносительство (наличие трихомонад в отделяемом из влагалища и отсутствие объективных и субъективных симптомов заболевания).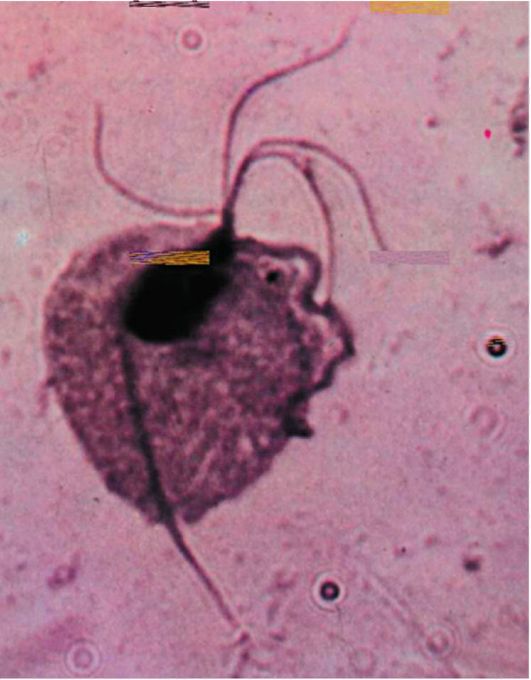
У человека паразитируют 3 вида трихомонад: урогенитальные, ротовые (Trichomonas tenax) и ки-шечные (Trichomonas hominis).
Возбудителем урогенитального трихмониаза является вагинальная трихомонада — Trichomonas vaginalis — подвижный одноклеточный организм, приспособившийся в процессе эволюции к жизни в органах мочеполовой системы человека. Они являются факультативными анаэробами, не имеющими типичной дыхательной цепи (типичных митохондрий). Мочеполовой трихомоноз является многоочаговой инфекцией, передающейся половым путем. У женщин трихомонады поражают большие вестибулярные железы, преддверье влагалища и само влагалище, могут обнаруживаться в полости матки, в маточных трубах. Однако возможно и трихомонадоносительство — от 10 до 50% трихомонадных инфекций протекают бессимптомно [11].
Клиника. При остром трихомониазе воспалительный процесс протекает бурно, с обильными, раздражающими кожу выделениями и сильным зудом наружных половых органов. Беспокоят жжение и болезненность при мочеиспускании. Выделения из половых путей отмечают 50—75%, неприятный запах — 10%, зуд половых органов — 25 — 80% инфицированных пациенток. Часто зуд бывает настолько выраженным, что нарушается сон. Дизурия встречается примерно у 35% пациенток. Жалобы появляются вскоре после начала половой жизни или случайной половой связи. Инкубационный период при трихомониазе равен в среднем 5—15 дням [8].
Выделения из половых путей отмечают 50—75%, неприятный запах — 10%, зуд половых органов — 25 — 80% инфицированных пациенток. Часто зуд бывает настолько выраженным, что нарушается сон. Дизурия встречается примерно у 35% пациенток. Жалобы появляются вскоре после начала половой жизни или случайной половой связи. Инкубационный период при трихомониазе равен в среднем 5—15 дням [8].
При осмотре выявляют воспалительные изменения от умеренной гиперемии свода влагалища и шейки матки до обширных эрозий, петехиальных геморрагий и опрелости в области промежности. Весьма характерным, но не постоянным симптомом является наличие гранулематозных, рыхлых поражений слизистой оболочки шейки матки красного цвета (малиновая шейка матки).
Хронический мочеполовой трихомониаз представляет собой смешанный протозойно-бактериальный процесс, поскольку трихомонада является резервуаром для хламидий, уреаплазм, гонококков, стафилококков и другой флоры. Только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% случаев выявляют смешанные трихомонадные инфекции в различных комбинациях.
Под трихомонадоносительством понимают наличие трихомонад в организме человека при отсутствии клинических признаков заболевания. Частота трихомонадоносительства, по данным разных авторов, составляет от 2 до 41%. Трихомонадная инфекция не приводит к развитию выраженного иммунитета.
Влияние на течение и исход беременности. Трихомониаз увеличивает риск преждевременного излития околоплодных вод и преждевременных родов. Заражение плода возможно только интранатально. Антенатальное инфицирование невозможно в связи с тем, что плацентарный барьер непроницаем для трихомонад. У новорожденных девочек от женщин с острой инфекцией в 5% случаев диагностируется вульвит и вульвовагинит [2].
Диагностика. В качестве диагностических методов используется микроскопия нативного препарата, микроскопия мазка, окрашенного метиленовым синим и ПЦР из влагалища и уретры. Золотым стандартом является культуральное исследование, чувствительность которого достигает 95%.
Обследованию подлежат женщины с ИППП, имевшие половой контакт с больными трихомониазом и пациентки с гнойными выделениями из влагалища [12].
Лечение. Терапию необходимо проводить обоим половым партнерам. На фоне лечения целесо-образно воздерживаться от половых контактов или использовать барьерную контрацепцию (презерватив). По рекомендациям ВОЗ оптимальным является применение препаратов 5-нитроимидазолового ряда (метронидазол или тинидазол). Разработана схема однократного приема высокой дозы препарата, эффективность которой достигает 90%. Однако возможно назначение и альтернативной схемы (метронидазол 500 мг 2 раза в день 5—7 дней или тинидазол 500 мг 2 раза в день 5 дней). Исключительно важным является терапия полового партнера, даже в случае, если трихомониаз у него не подтвержден [8].
Согласно международным рекомендациям препаратами первой линии являются [8]: Метронидазол 500 мг внутрь 2 раза в сутки 7 дней
или орнидазол 500 мг внутрь 2 раза в сутки 5 дней
или тинидазол 500 мг внутрь 2 раза в сутки 5 дней
При осложненном или рецидивирующем трихомониазе:
Метронидазол 500 мг внутрь 3 раза в день 7 дней, или 2,0 г 1 раз в сутки 5 дней, или орнидазол 500 мг 2 раза внутрь 10 дней, или тинидазол 2,0 г внутрь 1 раз 3 дня
Альтернативные схемы: Метронидазол 2,0 г внутрь однократно, или орнидазол 1,5 г внутрь однократно, или тинидазол 2,0 г внутрь однократно
Местная терапия: Метронидазол — вагинальные табл. 500 мг на ночь 6 дней или гель 0,75% 5 дней
500 мг на ночь 6 дней или гель 0,75% 5 дней
Лечение трихомониаза во время беременности
В I триместре смазывают уретру и влагалище 4%-ным водным раствором метиленового синего, борной кислотой, Н2О2, раствором протаргола. Возможно использование тержинана с конца I триместра беременности (по 1 влагалищной таблетке в день 10 дней). Во II триместре проводится местная терапия с применением Тержинана — по 1 свече 10 дней вместе с системной терапией метронидазолом 500 мг 2 раза в сутки 5 дней. В III триместре: таблетированные препараты (метронидазол 500 мг 2 раза в день 5 дней) и местная терапия [10].
Контроль излеченности производится через 14 дней и включает ПЦР, нативный мазок или культуральный метод.
Генитальный герпес
Герпесвирусные инфекции — это группа инфекционных заболеваний, вызываемых представителями семейства герпесвирусов (Herpesviridae), широко распространенных в природе и способных вызывать различные заболевания.
Эпидемиология. Свыше 90% людей инфицировано ВПГ и около 20% из них имеют те или иные клинические проявления инфекции. Обладая нейротропизмом, ВПГ поражает кожу и слизистые оболочки, центральную нервную систему (менингиты, энцефалиты), глаза (конъюнктивиты, кера-титы).
Свыше 90% людей инфицировано ВПГ и около 20% из них имеют те или иные клинические проявления инфекции. Обладая нейротропизмом, ВПГ поражает кожу и слизистые оболочки, центральную нервную систему (менингиты, энцефалиты), глаза (конъюнктивиты, кера-титы).
Этиология. На сегодняшний день открыто более 100 представителей семейства вирусов герпеса, из них 8 типов патогенны для человека. Вирус простого герпеса 1-го и 2-го типа относится к подсемейству α-герпес вирусов и представляет собой двухцепочечный ДНК-вирус [5].
Классификация. Выделяют первичный генитальный герпес и рецидивирующий генитальный герпес. По характеру клинического течения рецидивирующего генитального герпеса выделяют формы манифестную, атипичную, абортивную и субклиническую.
Патогенез. Попадая в организм человека, вирус пожизненно персистирует в нем, периодически вызывая рецидивы различной тяжести. Паравертебральные сенсорные ганглии становятся тем местом, в котором вирусы герпеса (ВПГ и ЦМВ) находятся в латентном состоянии. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом или носителя ВПГ. Заражение может происходить в том случае, если у партнера рецидив болезни. Согласно ре-зультатам серологического исследования, выделяют первичную и рецидивирующую инфекцию [5].
Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом или носителя ВПГ. Заражение может происходить в том случае, если у партнера рецидив болезни. Согласно ре-зультатам серологического исследования, выделяют первичную и рецидивирующую инфекцию [5].
Первичный генитальный герпес. Самая высокая заболеваемость зарегистрирована в возрастной группе 20—29 лет. Чаще всего первичное заражение протекает бессимптомно, с формированием в дальнейшем латентного носительства ВПГ или рецидивирующей формы генитального герпеса. Однако в случаях клинически выраженного дебюта первичный генитальный герпес обычно проявляется после 1—10-дневного инкубационного периода и отличается от последующих рецидивов более тяжелым и продолжительным течением. Он характеризуется образованием на слизистых оболочках половых органов и прилежащих участках кожи сгруппированных везикулезных элементов на эритематозном фоне.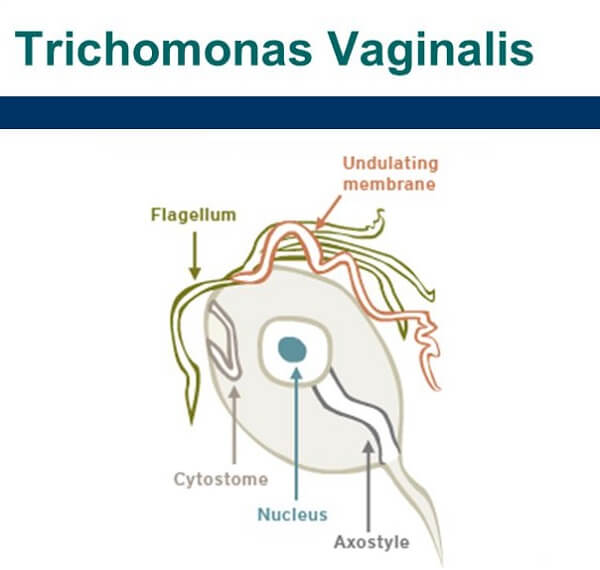 При осмотре вульвы, влагалища и шейки матки обнаруживаются элементы высыпания: везикулы, пустулы, эрозии, эпителизирующиеся под коркой или без нее. Продолжительность острого периода при первичном генитальном герпесе может достигать 3—5 нед.
При осмотре вульвы, влагалища и шейки матки обнаруживаются элементы высыпания: везикулы, пустулы, эрозии, эпителизирующиеся под коркой или без нее. Продолжительность острого периода при первичном генитальном герпесе может достигать 3—5 нед.
Симптоматика разрешается на 2—3-й неделе с момента появления клинических признаков инфекции. Бессимптомное слущивание эпителия, поврежденного вирусом, наблюдается в течение по-следующих 2 нед. [2, 5].
Рецидивирующая инфекция диагностируется у пациенток, имеющих одновременно симптомы генитального герпеса и антитела к реактивированному типу. Рецидивирующий генитальный герпес не является результатом экзогенного инфицирования, а возникает вследствие реактивации эндогенной инфекции, т. е. независимо от полового контакта.
В противоположность первичному генитальному герпесу возникновению рецидивирующего герпеса в генитальной области предшествует продромальная симптоматика, характеризующаяся гиперестезией, невралгической болью и недомоганием. Примерно у 50% больных наблюдаются зуд, боль, дизурия и болезненность лимфатических узлов.
Примерно у 50% больных наблюдаются зуд, боль, дизурия и болезненность лимфатических узлов.
Среди факторов, способствующих рецидивированию ВПГ выделяют снижение иммунологической реактивности, переохлаждение или перегрев организма, интеркуррентные заболевания, стресс и некоторые психические состояния, медицинские манипуляции (аборты, введение ВМК). Заболевание приобретает рецидивирующий характер у 70—85% от общего числа инфицированных пациен-ток. По характеру клинического течения рецидивирующего генитального герпеса выделяют манифестную, атипичную, абортивную и субклиническую формы.
Манифестная форма рецидивирующего генитального герпеса характеризуется типичным развитием герпетических элементов в очаге поражения. Постоянными признаками заболевания являются пузырьки, эрозии, язвочки, экссудация, рецидивирующий характер высыпаний. К атипично протекающему рецидивирующему генитальному герпесу относится отечная и зудящая формы. Очаг поражения может быть представлен глубокими рецидивирующими трещинами слизистой оболочки вульвы. Трещины эпителизируются в течение 4—7 дней. Абортивная форма генитального герпеса чаще развивается у пациентов, получивших ранее противовирусное лечение и вакцинотерапию. Очаг поражения при абортивном течении может проявляться в виде зудящего пятна или папулы, разрешающихся за 1—3 дня. К абортивно протекающим формам генитального герпеса относят эритематозную, папулезную и пруриго-невротическую, при которых отсутствуют везикулезные элементы. Субклиническая форма генитального герпеса характеризуется микросимптоматикой (кратковременное появление на слизистой оболочке наружных гениталий поверхностных трещинок, сопровождающихся незначительным зудом) или полным отсутствием клинических проявлений.
Трещины эпителизируются в течение 4—7 дней. Абортивная форма генитального герпеса чаще развивается у пациентов, получивших ранее противовирусное лечение и вакцинотерапию. Очаг поражения при абортивном течении может проявляться в виде зудящего пятна или папулы, разрешающихся за 1—3 дня. К абортивно протекающим формам генитального герпеса относят эритематозную, папулезную и пруриго-невротическую, при которых отсутствуют везикулезные элементы. Субклиническая форма генитального герпеса характеризуется микросимптоматикой (кратковременное появление на слизистой оболочке наружных гениталий поверхностных трещинок, сопровождающихся незначительным зудом) или полным отсутствием клинических проявлений.
Влияние на течение и исход беременности. При первичном эпизоде генитального герпеса у матери во время беременности риск передачи вируса плоду составляет 50%, при рецидиве — только 4%. Инфицирование плода может произойти антенатально (5%), интранатально (90%) и постнатально (5%). Клинические формы неонатального герпеса представлены локальной формой с поражением кожи и слизистых (кожа, глаза, ротовая полость), локальной формой с поражением ЦНС (энцефалит) с летальностью до 50% и диссеминированной формой (гепатит, энцефалит, пневмония) с летальностью до 90% [2].
Клинические формы неонатального герпеса представлены локальной формой с поражением кожи и слизистых (кожа, глаза, ротовая полость), локальной формой с поражением ЦНС (энцефалит) с летальностью до 50% и диссеминированной формой (гепатит, энцефалит, пневмония) с летальностью до 90% [2].
Диагностика ВПГ. Наряду с типичной клинической картиной заболевания, характеризующейся специфическими высыпаниями, для диагностики герпетической инфекции в настоящее время используются молекулярно-генетическая диагностика (ПЦР) и серологические методы.
Лечение вирусной инфекции. Основой лечения является раннее начало системной терапии противовирусными препаратами (табл. 3).
Лечение во время беременности. Безопасность системной терапии беременных ацикловиром, валацикловиром и фамцикловиром полностью не доказана. Назначение ацикловира беременным во время I триместра не повышает риск возникновения врожденных дефектов по сравнению со средним уровнем в популяции. Результаты применения валацикловира и фамцикловира при бере-менности носят предварительный характер и не могут быть основанием для их регулярного использования. Ацикловир может с осторожностью применяться беременными внутрь в дозах, ука-занных ниже, как во время первичного эпизода, так и при рецидивах герпеса.
Результаты применения валацикловира и фамцикловира при бере-менности носят предварительный характер и не могут быть основанием для их регулярного использования. Ацикловир может с осторожностью применяться беременными внутрь в дозах, ука-занных ниже, как во время первичного эпизода, так и при рецидивах герпеса.
Лечение генитального герпеса у беременных [1, 2, 5]:
• Ацикловир 200 мг внутрь 5 раз в день 5 дней или Ацикловир 400 мг внутрь 3 раза в день 5 дней
• Ежедневная супрессивная терапия ацикловиром 400 мг 3 раза в сутки после 36 нед. для предотвращения рецида заболевания
• Кесарево сечение проводят при первичном эпизоде герпеса за 6 нед. до родов и менее
• Если роды через естественные родовые пути неизбежны — не проводить амниотомии и диагностических инвазивных процедур.
При наличии у беременной симптомов генитального герпеса накануне или у роженицы во время родов показано оперативное родоразрешение путем кесарева сечения. Однако при герпетическом поражении шейки матки и безводном промежутке более 4—6 ч оперативное родоразрешение не предупреждает заражения новорожденного. Применение беременным с рецидивирующим генитальным герпесом супрессивной терапии ацикловиром (0,4 г каждые 12 ч) за 4 нед. до предполагаемого срока родов может предотвратить обострение и, таким образом, позволить родоразрешение через естественные родовые пути.
Однако при герпетическом поражении шейки матки и безводном промежутке более 4—6 ч оперативное родоразрешение не предупреждает заражения новорожденного. Применение беременным с рецидивирующим генитальным герпесом супрессивной терапии ацикловиром (0,4 г каждые 12 ч) за 4 нед. до предполагаемого срока родов может предотвратить обострение и, таким образом, позволить родоразрешение через естественные родовые пути.
Литература
1. Ведение больных с инфекциями, передаваемыми половым путем, и урогенитальными ин-фекциями. Клинические рекомендации Российского общества дерматовенерологов и косметологов. М.: Деловой экспресс, 2012.
2. Макаров И.О., Боровкова Е.И. Бактериальные и вирусные инфекции в акушерстве и гинекологии. М.: МЕДпресс-информ, 2013.
3. 2012 European guideline for the organisation of a consultation for sexually transmitted infections (K.W. Radcliffe, S. Flew, A. Poder, M. Cusini).
4. 2012 IUSTI / WHO European STI Guidelines Editorial Board (Keith Radcliffe, Karen Babayan, Simon Barton, Michel Janier, Jorgen Skov Jensen, Lali Khotenashvili, Marita van de Laar, Willem van der Meijden, Harald Moi, Martino Neumann, Raj Patel, Angela Robinson, Jonathan Ross, Jackie Sherrard, Magnus Unemo).
5. 2012 European guideline for the management of genital herpes (Rajul Patel, Steven Alderson, Anna Geretti, Arvid Nilsen, Elizabeth Foley, Stephan Lautenschlager, John Green, Willem van der Meijden, Mikhail Gomberg, Harald Moi).
6. European guideline for the management of Chlamydia trachomatis infections. Revision date: July 2010. (E. Lanjouw, J.M. Ossewaarde, A. Stary, F. Boag).
7. European Branch of the International Union against Sexually Transmitted Infections (IUSTI Eu-rope) and the European Office of the World Health Organisation (WHO-Europe).
8. Ginocchio C.C., Chapin K., Smith J.S. Prevalence of Trichomonas vaginalis and coinfection with Chlamydia trachomatis and Neisseria gonorrhoeae in the United States as determined by the Aptima Trichomonas vaginalis nucleic acid amplification assay. J Clin Microbiol, 2012, 50: 2601.
9. Sexually transmitted diseases: Overview of issues specific to adolescents (J.D. Fortenberry, A.B. Middleman, S.L. Kaplan, M.M. Torchia).
10. Sexually Transmitted Disease Surveillance, 2011. Centers for Disease Control and Prevention. http://www.cdc.gov/std/stats/
11. Sobel JD, Subramanian C, Foxman B et al. Mixed vaginitis-more than coinfection and with ther-apeutic implications. Curr Infect Dis Rep, 2013, 15: 104.
12. Vijayakumari Malipatil, Shivkumar Madagi, Biplab Bhattacharjee. Sexually transmitted diseases putative drug target database: A comprehensive database of putative drug targets of pathogens identi-fied by comparative genomics. Indian J Pharmacol., 2013, Sep.-Oct., 45 (5): 434-438.
Урогенитальный трихомониаз
Трихомониаз — заболевание мочеполовой системы, вызываемое простейшим одноклеточным паразитом Trichomonas vaginalis. Заболевание передаётся половым путём и, в крайне редких случаях, возможно заражение через контаминированные поверхности. В мире трихомониазом страдает примерно 170 млн. человек [28]. Болезнь не имеет сезонного характера, поражает все слои населения. Несмотря на интенсивное изучение, имеются определённые трудности в диагностике трихомониаза и его лечении.
Инфекционным агентом трихомониаза человека (синонимы – трихомоноз, трихомонадоз) является исключительно Trichomonas vaginalis. По систематике одноклеточное простейшее Trichomonas vaginalis относится к царству высших процистов — Protozoa, классу жгутиковых — Flagella, семейству — Trichomonadidae, роду — Trichomonas. Человек может быть носителем трёх видов трихомонад: Trichomonas tenax (elongata), Trichomonas hominis (abdominalis), Trichomonas vaginalis. В ротовой полости на кариозных зубах обитает Trichomonas tenax. При диспепсических расстройствах, обычно у детей и реже у взрослых, выделяют комменсал толстого кишечника — Trichomonas hominis. Трихомонадой, живущей в урогенитальном тракте, считается исключительно Trichomonas vaginalis. Другие человеческие трихомонады, наблюдаемые при лабораторной диагностике, следует рассматривать как контаминацию во время забора материала. Такие ошибки в диагностике трихомониаза чаще случаются при обследовании детей.
Частота инфицирования трихомониазом клинически здоровых женщин в развитых странах составляет 2-10% и в развивающихся 15-40%. Причём в США ежегодно регистрируют примерно 3 млн новых случаев заболевания женщин (это приблизительно 2,4%). В России в 1996 году на 100 тыс. населения зарегистрировано 339 (0.34%) случаев заболевания трихомониазом.
Подробную характеристику заболеваемости трихомониазом московской популяции в возрастной группе от 14 до 59 лет мужчин и женщин дал М.М.Васильев [4]. Среди больных трихомониазом и смешанной гонорейно-трихомонадной инфекцией подавляющее число пациентов были незамужем/неженаты или разведены (практически 80%). Как правило, возраст больных трихомониазом и смешанной инфекцией женщин колебался в пределах 18-39 лет, мужчин- 15-39 лет. Последние данные подтверждают мировую практику — болезнь охватывает население, ведущее активную половую жизнь. Заболевание протекало с минимальными клиническими проявлениями, поэтому чаще трихомониаз выявлялся при профилактических осмотрах и при привлечении к обследованию половых партнёров. При этом трихомонадное носительство выявлялось у 40-50% больных смешанной урогенитальной инфекцией.
То, что инфекция Trichomonas vaginalis передаётся от лица к лицу, как правило, при половых контактах подтверждается следующими фактами. Во-первых, высокая скорость инфицирования половых путей у мужчин- партнёров больных женщин; во-вторых, быстрая реинфекция у партнёра в случае отсутствия или неэффективного лечения одного из них. Данные статистики указывают на то, что до 40% женщин, посещающих учреждения дерматовенерологического профиля, являются носителями T. vaginalis. Зарубежные данные обследования проституток демонстрируют носительство T. vaginalis до 70%. Возбудитель заболевания крайне редко обнаруживается у женщин в постменопаузальном периоде и у девственниц.
Передача Trichomonas vaginalis не половым путём встречается крайне редко в следующих случаях: использование высококонтаминированных дужки душа (биде), сиденья унитаза и полотенца. Возможность инфицирования женщин паразитом при купании в естественных водоёмах, бассейне и бане при соблюдении правил личной гигиены в настоящее время полностью отвергается вследствие крайне низкой его концентрации в анализируемых образцах воды. Жизнеспособные Trichomonas vaginalis обнаруживаются в моче, сперме и необеззараженной воде спустя несколько часов после выхода из половых путей инфицированного лица, т. к. некоторе время микроорганизм защищён от высыхания и действия солнечного ультрафиолета.
Лечение трихомониаза в СПб в Клинике Нарвская
Трихомониаз — широко распространенное заболевание, относящееся к инфекциям, передающимся половым путем. Возбудителем трихомониаза является простейший микроорганизм — Trichomonas vaginalis. Трудность самостоятельной диагностики заболевания заключается в разнообразии его проявлений. Поэтому любые нарушения со стороны мочеполовой системы должны стать поводом для обследования.
Пройти диагностику можно в клинике «Нарвская» по предварительной записи.
Лечение трихомониаза цена
| Наименование | Цена |
| Комплексное обследование на ИППП женщины (9 ПЦР + мазок на микрофлору+ забор материала) | 2700₽ |
| Комплексное обследование на ИППП женщины (9 ПЦР + мазок на микрофлору+ анализ крови на ВИЧ, гепатиты В и С, сифилис + забор материала) | 3300₽ |
| Комплексное обследование ИППП для мужчин (9 ПЦР + забор материала) | 2400₽ |
| Комплексное обследование на ИППП мужчины (9 ПЦР + анализ крови на ВИЧ, гепатиты В и С, сифилис+ забор материала) | 3100₽ |
| Интимный — 9 тестов по моче (хламидии, гарднерелла, герпес, микоплазма 2 вида, гонорея, трихомонады, уреаплазма 2 вида) | 2100₽ |
| Посев на Trichomonas vaginalis | 500₽ |
| Забор материала | 200₽ |
Все цены Калькулятор анализов Акции Задать вопрос по ИППП
Симптомы
У мужчин на ранних стадиях заболевание протекает практически бессимптомно. У некоторых пациентов наблюдается жжение во время семяизвержения или мочеиспускания, зуд в уретре или незначительные выделения.
У женщин, как правило, трихомониаз появляется в виде следующих симптомов:
- дискомфортные ощущения во время полового акта;
- зуд в области наружных половых органов;
- покраснение больших и малых половых губ;
- отек наружных половых органов;
- появление влагалищных выделений с неприятным запахом.
Пути заражения
Trichomonas vaginalis передается во время полового акта от одного партнера к другому. Наиболее распространенными путями передачи являются:
- влагалище — влагалище;
- половой член — влагалище.
Мужчины могут заражаться только от женщин, а женщины могут инфицироваться и при гомосексуальных контактах. Возбудитель также может передаваться от матери ребенку во время его прохождения по родовому каналу.
Диагностика
К основным диагностическим методам, позволяющим выявить трихомониаз, относятся:
- Забор влагалищных выделений и их микроскопическое исследование с использованием импрегнированного субстрата.
- ИХА с использованием тест-полосок.
- Прямое микроскопическое исследование, где в качестве биологического материала используются вагинальные выделения.
- Посев мазка из уретры или мочи у представителей мужского пола.
Объективное обследование также играет важную роль, так как трихомониаз можно заподозрить у женщин с вагинитом и у мужчин с уретритом. Достоверность этого признака повышается, если ранее пациенты были пролечены от других инфекций, передающихся половым путем.
Лечение
Всем пациентам рекомендуется не пренебрегать систематическими медицинскими осмотрами, которые помогают обнаружить болезнь на раннем этапе. На начальной стадии заболевание трудно выявить, однако излечивание происходит легче и быстрее.
Достижения современной медицины позволяют сохранять фертильность практически у всех пациентов, однако при переходе процесса в хроническую стадию возможно развитие осложнений, связанных с воспалением органов малого таза.
Несколько правил проведения лечения трихомоноза:
- половые партнеры должны проходить лечение одновременно;
- во время лечения рекомендуется отказаться от половых контактов;
- лечение проводится на любой стадии трихомониаза;
- даже при отсутствии признаков инфицирования сексуальный партнер заболевшего должен принимать назначенные препараты.
Препаратом выбора при лечении трихомониаза является метронидазол, в качестве альтернативы могут использоваться производные нитроимидазола. Лечение заболевания является комплексным и включает в себя:
- иммунотерапию;
- физиотерапевтические процедуры;
- массаж уретры.
Около 40% мужчин подвержены развитию осложнений трихомониаза в виде простатита и эпидидимита, поэтому проведение массажа простаты является обязательным.
Профилактика
Для профилактики трихомониаза достаточно соблюдать несколько простых правил:
- Перед началом сексуальных отношений с новым партнером нужно убедиться в том, что он здоров. Для этого достаточно сдать тест на трихомониаз и получить отрицательный результат.
- Сексуальные отношения с постоянным партнером — залог вашего здоровья.
- При случайных половых контактах нужно использовать барьерные контрацептивы, к которым относятся женские и мужские презервативы.
- Систематические профилактические осмотры у дерматовенеролога, гинеколога помогут выявит заболевание на ранних этапах и провести его своевременную терапию.
Наиболее важным моментом является одновременное лечение обоих сексуальных партнеров, если хотя бы у одного из них был диагностирован трихомониаз.
Пройти обследование и лечение трихомониаза вы можете в нашей клинике в СПб. Опытные врачу проведут диагностику и помогут вам восстановить сексуальное здоровье.
Лечение трихомониаза в Москве — лучшие клиники и медцентры: отзывы, врачи, цены
Урогенитальный трихомониаз — инфекция, поражающая мочеполовую систему. Заболевание передается в основном половым путем, крайне редко — при контакте с поверхностью, содержащей возбудителя болезни Trichomonas vaginalis. Болезни подвержены люди обоих полов и разного возраста, поэтому лечение трихомониаза может понадобиться мужчинам, женщинам и детям.
Для трихомониаза характерно большое разнообразие клинических проявлений. Болезнь может проявляться как в острых формах с ярко выраженными симптомами, так и иметь бессимптомное или атипичное течение. Основные симптомы болезни:
- покраснение и отек слизистой оболочки вульвы, влагалища, наружного отверстия уретры;
- жжение, зуд и болезненность, усиливающаяся при мочеиспускании;
- патологические выделения из мочеиспускательного канала;
- пенистые вагинальные выделения желтоватого или зеленоватого цвета;
- болезненные ощущения при половом контакте.
Почему важно своевременно диагностировать и лечить трихомониаз
Несвоевременное лечение трихомониаза приводит к распространению инфекции на органы мочеполовой системы и появлению нескольких очагов болезни. У мужчин трихомониаз осложняется простатитом, баланопоститом, везикулитом, эпидидимитом. Трихомониаз у женщин сопровождается, как правило, вульвитом, кольпитом, экзо- и эндоцервицитом. Если заражение произошло накануне беременности, существует риск развития трихомонадного эндомиометрита и самопроизвольного выкидыша.
Лечение мужчин
В большинстве случаев лечение трихомониаза у мужчин предполагает одновременную терапию патологий соседних органов, в которые проникает возбудитель болезни. Это в первую очередь относится к предстательной железе, семенным пузырькам, придаткам яичек и мочевому пузырю.
Лечение женщин
Лечение трихомониаза у женщин начинают после тщательного диагностического обследования. Материалом для исследований служат образцы, полученные из уретры, наружных половых органов и прямой кишки. Чаще всего трихомонады выявляют в цервикальном канале и уретре. Лечение беременных допустимо на любом сроке вместе с санацией гениталий.
Лучшие частные клиники урологии на портале Meds.ru
Для поиска лучших урологических клиник, в которых проводится лечение трихомониаза в Москве, стоит воспользоваться онлайн-сервисом Meds.ru. В его базе данных содержится информация о врачах и медцентрах, предоставляющих квалифицированные услуги в Москве на основании лицензии. На Meds.ru вы найдете их адрес, график работы, стоимость лечения трихомониаза.
Trichomonas vaginalis: обзор эпидемиологических, клинических и лечебных проблем | BMC Infectious Diseases
Всемирная организация здравоохранения W. Глобальная заболеваемость и распространенность отдельных излечимых инфекций, передаваемых половым путем. 2008. ISBN 978 92 4 150383 9
World Health O. Глобальная распространенность и заболеваемость отдельными излечимыми инфекциями, передаваемыми половым путем: обзоры и оценки. В: WHO / HIV_AIDS. Под редакцией организации WH. Женева; 2001.
Miller WC, Swygard H, Hobbs MM, Ford CA, Handcock MS, Morris M, et al. Распространенность трихомониаза среди молодых людей в США. Sex Transm Dis. 2005. 32 (10): 593–8.
PubMed Google Scholar
Саттон М., Стернберг М., Куманс Э. Х., МакКвиллан Дж., Берман С., Марковиц Л. Распространенность инфекции Trichomonas vaginalis среди женщин репродуктивного возраста в США, 2001–2004 гг. Clin Infect Dis. 2007. 45 (10): 1319–26.
PubMed Google Scholar
Грегсон С., Мейсон П.Р., Гарнетт Г.П., Жуау Т., Ньямукапа Калифорния, Андерсон Р.М. и др. Эпидемия ВИЧ в сельских районах Зимбабве? Результаты опроса населения. Int J ЗППП, СПИД. 2001. 12 (3): 189–96.
CAS PubMed Google Scholar
Клингер Э.В., Капига С.Х., Сэм Н.Э., Абуд С., Чен С.Ю., Баллард Р.К. и др. Общественное исследование факторов риска инфекции Trichomonas vaginalis среди женщин и их партнеров-мужчин в городском округе Моши на севере Танзании.Sex Transm Dis. 2006. 33 (12): 712–8.
PubMed Google Scholar
Mgone CS, Lupiwa T., Yeka W. Высокая распространенность Neisseria gonorrhoeae и множественных заболеваний, передаваемых половым путем, среди сельских женщин в провинции Восточное нагорье Папуа-Новой Гвинеи, обнаруженная с помощью полимеразной цепной реакции. Sex Transm Dis. 2002. 29 (12): 775–9.
PubMed Google Scholar
Wangnapi RA, Soso S, Unger HW, Sawera C, Ome M, Umbers AJ и др. Распространенность и факторы риска инфекции Chlamydia trachomatis, Neisseria gonorrhoeae и Trichomonas vaginalis у беременных женщин в Папуа-Новой Гвинее. Половая трансмиссия. 2015; 91 (3): 194–200.
CAS PubMed Google Scholar
Lan PT, Lundborg CS, Phuc HD, Sihavong A, Unemo M, Chuc NT, et al. Инфекции репродуктивного тракта, включая инфекции, передаваемые половым путем: популяционное исследование женщин репродуктивного возраста в сельском районе Вьетнама.Половая трансмиссия. 2008. 84 (2): 126–32.
CAS PubMed Google Scholar
Depuydt CE, Leuridan E, Van Damme P, Bogers J, Vereecken AJ, Donders GG. Эпидемиология Trichomonas vaginalis и инфекции вируса папилломы человека, обнаруженная с помощью ПЦР в реальном времени во Фландрии. Gynecol Obstet Invest. 2010. 70 (4): 273–80.
PubMed Google Scholar
Хуанг Х.С., Ю СФ, Цай М, Тан Ф, Чжэн XY, Пан CW.Получение моноклональных антител против адгезионного белка 33 Trichomonas vaginalis. Чжунго Цзи Шэн Чун Сюэ Ю Цзи Шэн Чун Бин За Чжи. 2007. 25 (2): 97–100. 105.
PubMed Google Scholar
Джонстон В.Дж., Маби, округ Колумбия. Глобальная эпидемиология и борьба с Trichomonas vaginalis. Curr Opin Infect Dis. 2008. 21 (1): 56–64.
PubMed Google Scholar
Паз-Бейли Г., Моралес-Миранда С., Якобсон Дж. О., Гупта С. К., Сабин К., Мендоза С. и др. Высокие показатели ЗППП и рискованного сексуального поведения среди гарифуна в Гондурасе. J Acquir Immune Defic Syndr. 2009; 51 Приложение 1: S26–34.
PubMed Google Scholar
Миллер В.С., Зенилман Дж. М.. Эпидемиология хламидийной инфекции, гонореи и трихомониаза в США — 2005 г. Заражение Dis Clin North Am. 2005. 19 (2): 281–96.
PubMed Google Scholar
Shafir SC, Sorvillo FJ, Smith L. Текущие проблемы и соображения, касающиеся трихомониаза и вируса иммунодефицита человека у афроамериканцев. Clin Microbiol Rev.2009; 22 (1): 37–45. Оглавление.
PubMed PubMed Central Google Scholar
Фриман А.Х., Кац К.А., Пандори М.В., Раух Л.М., Кон Р.П., Лиска С. и др. Распространенность и корреляты Trichomonas vaginalis среди заключенных оцениваются с помощью высокочувствительного молекулярного анализа.Sex Transm Dis. 2010. 37 (3): 165–8.
PubMed Google Scholar
Ратод С.Д., Крупп К., Клауснер Д.Д., Арун А., Рейнгольд А.Л., Мадхиванан П. Бактериальный вагиноз и риск инфекции Trichomonas vaginalis: продольный анализ. Sex Transm Dis. 2011. 38 (9): 882–6.
PubMed PubMed Central Google Scholar
Харп Д.Ф., Чоудхури И. Трихомониаз: от оценки к исполнению.Eur J Obstet Gynecol Reprod Biol. 2011; 157 (1): 3–9.
PubMed PubMed Central Google Scholar
Карлтон Дж. М., Хирт Р. П., Силва Дж. К., Делчер А. Л., Шатц М., Чжао К. и др. Проект последовательности генома возбудителя, передающегося половым путем, Trichomonas vaginalis. Наука. 2007. 315 (5809): 207–12.
PubMed PubMed Central Google Scholar
Петрин Д., Делгати К., Бхатт Р., Гарбер Г.Клинико-микробиологические аспекты Trichomonas vaginalis. Clin Microbiol Rev.1998; 11 (2): 300-17.
CAS PubMed PubMed Central Google Scholar
Krieger JN. Трихомониаз у мужчин: старые проблемы и новые данные. Sex Transm Dis. 1995. 22 (2): 83–96.
CAS PubMed Google Scholar
Берч Т.А., Рис К.В., Рирдон Л. Диагностика вагинита Trichomonas vaginalis.Am J Obstet Gynecol. 1959; 77 (2): 309–13.
CAS PubMed Google Scholar
Афзан М.Ю., Суреш К. Псевдокистные формы Trichomonas vaginalis при неоплазии шейки матки. Parasitol Res. 2012; 111 (1): 371–81.
CAS PubMed Google Scholar
Перейра-Невес А., Рибейро К.С., Бенчимол М. Псевдокисты у трихомонад — новые открытия. Протист. 2003. 154 (3–4): 313–29.
PubMed Google Scholar
Charles SX. Эпидемиология trichomonas vaginalis (TV) у сельских детей подросткового и юношеского возраста. J Trop Pediatr. 1991; 37 (2): 90.
CAS PubMed Google Scholar
Аду-Саркоди Ю. Передача Trichomonas vaginalis в семье. Genitourin Med. 1995. 71 (3): 199–200.
CAS PubMed PubMed Central Google Scholar
Crucitti T, Jespers V, Mulenga C, Khondowe S, Vandepitte J, Buve A. Несексуальная передача Trichomonas vaginalis у девочек-подростков, посещающих школу в Ндоле, Замбия. PLoS One. 2011; 6 (1): e16310.
CAS PubMed PubMed Central Google Scholar
Гудман Р.П., Фререт Т.С., Кула Т., Геллер А.М., Токингтон М.В., Тан-Фернандес В. и др. Клинические изоляты Trichomonas vaginalis одновременно инфицированы штаммами до четырех видов вируса трихомонады (семейство Totiviridae).J Virol. 2011. 85 (9): 4258–70.
CAS PubMed PubMed Central Google Scholar
Sena AC, Miller WC, Hobbs MM, Schwebke JR, Leone PA, Swygard H, et al. Инфекция Trichomonas vaginalis у половых партнеров-мужчин: значение для диагностики, лечения и профилактики. Clin Infect Dis. 2007. 44 (1): 13–22.
PubMed Google Scholar
Wolner-Hanssen P, Krieger JN, Stevens CE, Kiviat NB, Koutsky L, Critchlow C, et al.Клинические проявления вагинального трихомониаза. ДЖАМА. 1989. 261 (4): 571–6.
CAS PubMed Google Scholar
Мартинес-Гарсия Ф., Регадера Дж., Майер Р., Санчес С., Нисталь М. Инфекции простейших мужских половых путей. J Urol. 1996. 156 (2 Pt 1): 340–9.
CAS PubMed Google Scholar
Аллсуорт Дж. Э., Ратнер Дж. А., Пайпер Дж. Ф. Трихомониаз и другие инфекции, передаваемые половым путем: результаты Национального обследования состояния здоровья и питания 2001–2004 гг.Sex Transm Dis. 2009. 36 (12): 738–44.
PubMed PubMed Central Google Scholar
Сильвер Б.Дж., Гай Р.Дж., Калдор Дж.М., Джамил М.С., Рамболд А.Р. Trichomonas vaginalis как причина перинатальной заболеваемости: систематический обзор и метаанализ. Sex Transm Dis. 2014. 41 (6): 369–76.
PubMed Google Scholar
Манн Дж. Р., Макдермотт С., Барнс Т. Л., Хардин Дж., Бао Х., Чжоу Л.Трихомониаз при беременности и задержка умственного развития у детей. Ann Epidemiol. 2009. 19 (12): 891–9.
PubMed Google Scholar
Schwandt A, Williams C, Beigi RH. Перинатальная передача Trichomonas vaginalis: клинический случай. J Reprod Med. 2008. 53 (1): 59–61.
PubMed Google Scholar
Carter JE, Whithaus KC. Поражение дыхательных путей новорожденных Trichomonas vaginalis: отчет о болезни и обзор литературы.Am J Trop Med Hyg. 2008. 78 (1): 17–9.
PubMed Google Scholar
Темесвари П., Керекес А., Теге А., Сарка К. Демонстрация Trichomonas vaginalis в трахеальном аспирате у младенцев с ранней дыхательной недостаточностью. J Matern Fetal Neonatal Med. 2002. 11 (5): 347–349.
CAS PubMed Google Scholar
Киссинджер П., Адамски А. Трихомониаз и взаимодействие с ВИЧ: обзор.Половая трансмиссия. 2013. 89 (6): 426–33.
PubMed PubMed Central Google Scholar
Сардана С., Содхани П., Агарвал С.С., Сегал А., Рой М., Сингх В. и др. Эпидемиологический анализ инфекции Trichomonas vaginalis в мазках воспаления. Acta Cytol. 1994. 38 (5): 693–7.
CAS PubMed Google Scholar
Guenthner PC, Secor WE, Dezzutti CS.Вызванное Trichomonas vaginalis разрушение монослоя эпителия и репликация вируса иммунодефицита человека типа 1 (ВИЧ-1): последствия для передачи ВИЧ-1 половым путем. Заражение иммунной. 2005. 73 (7): 4155–60.
CAS PubMed PubMed Central Google Scholar
Moodley P, Connolly C, Sturm AW. Взаимосвязь между инфекцией вируса иммунодефицита человека 1 типа, бактериальным вагинозом, трихомониазом и наличием дрожжей.J Infect Dis. 2002; 185 (1): 69–73.
PubMed Google Scholar
van de Wijgert JH, Morrison CS, Brown J, Kwok C, Van Der Pol B, Chipato T, et al. Выявление вклада инфекций репродуктивного тракта в заражение ВИЧ среди африканских женщин. Sex Transm Dis. 2009. 36 (6): 357–64.
PubMed Google Scholar
Сорвилло Ф., Керндт П. Trichomonas vaginalis и усиление передачи ВИЧ-1.Ланцет. 1998. 351 (9097): 213–4.
CAS PubMed Google Scholar
Chesson HW, Blandford JM, Pinkerton SD. Оценки ежегодного числа и стоимости новых случаев заражения ВИЧ среди женщин, вызванных трихомониазом, в США. Sex Transm Dis. 2004. 31 (9): 547–51.
PubMed Google Scholar
McClelland RS. Инфекция Trichomonas vaginalis: можем ли мы позволить себе ничего не делать? J Infect Dis.2008. 197 (4): 487–9.
PubMed PubMed Central Google Scholar
Прайс М.А., Стюарт С.Р., Миллер В.С., Бехетс Ф., Доу У.Х., Мартинсон Ф.Е. и др. Экономическая эффективность лечения мужского трихомониаза для предотвращения передачи ВИЧ у мужчин, обращающихся за помощью в связи с заболеваниями, передаваемыми половым путем, в Малави. J Acquir Immune Defic Syndr. 2006. 43 (2): 202–9.
PubMed Google Scholar
Сорвилло Ф, Смит Л., Керндт П., Эш Л. Trichomonas vaginalis, ВИЧ и афроамериканцы. Emerg Infect Dis. 2001. 7 (6): 927–32.
CAS PubMed PubMed Central Google Scholar
Прайс М.А., Зимба Д., Хоффман И.Ф., Кайдос-Дэниэлс С.К., Миллер В.С., Мартинсон Ф. и др. Добавление лечения трихомониаза к синдромному лечению уретрита в Малави: рандомизированное клиническое испытание. Sex Transm Dis. 2003. 30 (6): 516–22.
CAS PubMed Google Scholar
Ван СС, Макклелланд Р.С., Рейли М., Овербо Дж., Эмери С.Р., Мандалия К. и др. Влияние лечения вагинальных инфекций на распространение вируса иммунодефицита человека типа 1. J. Infect Dis. 2001. 183 (7): 1017–22.
CAS PubMed Google Scholar
Киссинджер П., Амеди А., Кларк Р.А., Дюместр Дж., Тилл К.П., Майерс Л. и др.Лечение Trichomonas vaginalis снижает вагинальное выделение ВИЧ-1. Sex Transm Dis. 2009. 36 (1): 11–6.
PubMed PubMed Central Google Scholar
Boselli F, Chiossi G, Bortolamasi M, Gallinelli A. Распространенность и детерминанты генитального выделения вируса простого герпеса среди женщин, посещающих итальянские клиники кольпоскопии. Eur J Obstet Gynecol Reprod Biol. 2005. 118 (1): 86–90.
PubMed Google Scholar
Gottlieb SL, Douglas Jr JM, Foster M, Schmid DS, Newman DR, Baron AE, et al. Заболеваемость вирусом простого герпеса 2 типа в 5 клиниках по лечению болезней, передаваемых половым путем (ЗППП), и влияние консультирования по снижению риска ВИЧ / ЗППП. J Infect Dis. 2004. 190 (6): 1059–67.
PubMed Google Scholar
Чжан Ц.Ф., Бегг CB. Является ли Trichomonas vaginalis причиной неоплазии шейки матки? Результаты комбинированного анализа 24 исследований.Int J Epidemiol. 1994. 23 (4): 682–90.
CAS PubMed Google Scholar
Виикки М., Пуккала Э., Ниеминен П., Хакама М. Гинекологические инфекции как детерминанты риска последующей неоплазии шейки матки. Acta Oncol. 2000. 39 (1): 71–5.
CAS PubMed Google Scholar
Roeters AM, Boon ME, van Haaften M, Vernooij F, Bontekoe TR, Heintz AP. Воспалительные явления, обнаруженные в мазках из шейки матки и в плоскоклеточных интраэпителиальных поражениях.Diagn Cytopathol. 2010. 38 (2): 85–93.
PubMed Google Scholar
Li CD, Zhang WY, Wu MH, Zhang SW, Zhou BL, Zhu L, et al. Анализ факторов высокого риска, связанных с интраэпителиальной неоплазией шейки матки у замужних женщин в возрасте 25–54 лет в Пекине в 2007–2008 гг. Чжунхуа Фу Чан Кэ За Чжи. 2010. 45 (10): 757–61.
CAS PubMed Google Scholar
Yap EH, Ho TH, Chan YC, Thong TW, Ng GC, Ho LC и др. Сывороточные антитела к Trichomonas vaginalis у больных инвазивным раком шейки матки. Genitourin Med. 1995. 71 (6): 402–4.
CAS PubMed PubMed Central Google Scholar
Sutcliffe S, Alderete JF, Till C, Goodman PJ, Hsing AW, Zenilman JM, et al. Трихомоноз и последующий риск рака простаты в испытании по профилактике рака простаты. Int J Cancer. 2009. 124 (9): 2082–7.
CAS PubMed PubMed Central Google Scholar
Sutcliffe S, Giovannucci E, Alderete JF, Chang TH, Gaydos CA, Zenilman JM, et al. Плазменные антитела против Trichomonas vaginalis и последующий риск рака простаты. Биомаркеры эпидемиологии рака Пред. 2006; 15 (5): 939–45.
CAS PubMed Google Scholar
Kingston MA, Bansal D, Carlin EM.«Срок годности» trichomonas vaginalis. Int J ЗППП, СПИД. 2003. 14 (1): 28–9.
CAS PubMed Google Scholar
Peterman TA, Tian LH, Metcalf CA, Malotte CK, Paul SM, Douglas Jr JM, et al. Стойкие, необнаруженные инфекции Trichomonas vaginalis? Clin Infect Dis. 2009. 48 (2): 259–60.
PubMed Google Scholar
Гацки М., Мена Л., Левисон Дж., Кларк Р.А., Хендерсон Х., Шмидт Н. и др.Лечение партнером, доставленным пациентом, и повторная инфекция Trichomonas vaginalis среди женщин, инфицированных вирусом иммунодефицита человека. Sex Transm Dis. 2010. 37 (8): 502–5.
CAS PubMed PubMed Central Google Scholar
Най М.Б., Швебке Дж. Р., Кузов BA. Сравнение опосредованной транскрипцией амплификации APTIMA Trichomonas vaginalis с мокрой микроскопией, посевом и полимеразной цепной реакцией для диагностики трихомониаза у мужчин и женщин.Am J Obstet Gynecol. 2009; 200 (2): 188. е181-187.
PubMed Google Scholar
Huppert JS, Biro F, Lan D, Mortensen JE, Reed J, Slap GB. Симптомы со стороны мочевыводящих путей у девочек-подростков: ИППП или ИМП? J Здоровье подростков. 2007. 40 (5): 418–24.
PubMed PubMed Central Google Scholar
Андреа С.Б., Чапин К.С. Сравнение анализа транскрипционной амплификации Aptima Trichomonas vaginalis и BD подтверждают VPIII для обнаружения T.vaginalis у женщин с симптомами: параметры эффективности и эпидемиологические последствия. J Clin Microbiol. 2011; 49 (3): 866–9.
PubMed PubMed Central Google Scholar
Ван Дер Поль Б., Крафт С.С., Уильямс Дж. А. Использование адаптации коммерчески доступного ПЦР-анализа, направленного на диагностику хламидиоза и гонореи, для обнаружения Trichomonas vaginalis в образцах урогенитальных органов. J Clin Microbiol. 2006. 44 (2): 366–73.
Google Scholar
Huppert JS, Mortensen JE, Reed JL, Kahn JA, Rich KD, Miller WC, et al. Быстрое тестирование на антиген выгодно отличается от анализа транскрипционной амплификации для выявления Trichomonas vaginalis у молодых женщин. Clin Infect Dis. 2007. 45 (2): 194–8.
CAS PubMed Google Scholar
Ван Дер Поль Б., Уильямс Дж. А., Орр Д. П., Баттейгер Б. Е., Фортенберри Дж. Д.. Распространенность, заболеваемость, естественное течение и ответ на лечение инфекции Trichomonas vaginalis среди женщин-подростков.J Infect Dis. 2005. 192 (12): 2039–44.
Google Scholar
Williams JA, Ofner S, Batteiger BE, Fortenberry JD, Van Der Pol B. Продолжительность ДНК, определяемой полимеразной цепной реакцией, после лечения инфекций Chlamydia trachomatis, Neisseria gonorrhoeae и Trichomonas vaginalis у женщин. Sex Transm Dis. 2014; 41 (3): 215–9.
CAS PubMed Google Scholar
Вендель К.А., Ворковски К.А. Трихомониаз: проблемы надлежащего лечения. Clin Infect Dis. 2007; 44 Приложение 3: S123–129.
PubMed Google Scholar
Cudmore SL, Garber GE. Профилактика или лечение: преимущества вакцины против Trichomonas vaginalis. J заразить общественное здравоохранение. 2010. 3 (2): 47–53.
PubMed Google Scholar
Буртин П., Таддио А., Арибурну О., Эйнарсон Т.Р., Корен Г.Безопасность метронидазола при беременности: метаанализ. Am J Obstet Gynecol. 1995. 172 (2 Pt 1): 525–9.
CAS PubMed Google Scholar
Каро-Патон Т., Карвахаль А., Мартин де Диего I, Мартин-Ариас Л.Х., Альварес Рекехо А., Родригес Пинилья Е. Является ли метронидазол тератогенным? Метаанализ. Br J Clin Pharmacol. 1997. 44 (2): 179–82.
CAS PubMed PubMed Central Google Scholar
Workowski KA, Berman S, Центры по борьбе с болезнями C, Профилактика. Руководство по лечению болезней, передающихся половым путем, 2010. MMWR Recommended Rep. 2010; 59 (RR-12): 1–110.
Google Scholar
Helms DJ, Mosure DJ, Secor WE, Workowski KA. Ведение Trichomonas vaginalis у женщин с подозрением на гиперчувствительность к метронидазолу. Am J Obstet Gynecol. 2008; 198 (4): 370. е371-377.
PubMed Google Scholar
Чен М.Ю., Смит Н.А., Фокс Э.Ф., Бингхэм Дж.С., Барлоу Д. Пессарии с ацетарсолом в лечении резистентной к метронидазолу Trichomonas vaginalis. Int J ЗППП, СПИД. 1999. 10 (4): 277–80.
CAS PubMed Google Scholar
Музны С., Барнс А., Мена Л. Симптоматическая инфекция Trichomonas vaginalis на фоне тяжелой аллергии на нитроимидазол: успешное лечение борной кислотой. Сексуальное здоровье. 2012; 9 (4): 389–91.
PubMed Google Scholar
Goldman LM, Upcroft JA, Workowski K, Rapkin A. Лечение резистентных к метронидазолу Trichomonas vaginalis. Сексуальное здоровье. 2009. 6 (4): 345–7.
PubMed Google Scholar
Nyirjesy P, Gilbert J, Mulcahy LJ. Резистентный трихомониаз: успешное лечение комбинированной терапией. Sex Transm Dis. 2011. 38 (10): 962–3.
PubMed Google Scholar
Дэн М., Собель Дж. Д.Неспособность нитазоксанида вылечить трихомониаз у трех женщин. Sex Transm Dis. 2007. 34 (10): 813–4.
PubMed Google Scholar
Маммен-Тобин А., Уилсон Дж. Д.. Лечение метронидазол-резистентной Trichomonas vaginalis — новый подход. Int J ЗППП, СПИД. 2005. 16 (7): 488–90.
CAS PubMed Google Scholar
Vieira Pde B, Giordani RB, Macedo AJ, Tasca T.Натуральные и синтетические соединения против влагалищной трихомонады: обновленный обзор. Parasitol Res. 2015; 114 (4): 1249–61.
PubMed Google Scholar
Киссинджер П., Хогбен М. Ускоренное лечение партнеров от инфекций, передаваемых половым путем: обновленная информация. Curr Infect Dis Rep. 2011; 13 (2): 188–95.
PubMed Google Scholar
Гацки М., Мартин Д.Х., Левисон Дж., Мена Л., Кларк Р.А., Мерфи М. и др.Влияние бактериального вагиноза на ответ на лечение Trichomonas vaginalis среди ВИЧ-инфицированных женщин. Половая трансмиссия. 2011. 87 (3): 205–8.
PubMed PubMed Central Google Scholar
Адамски А., Кларк Р.А., Мена Л., Хендерсон Н., Левисон Дж., Шмидт Н. и др. Влияние АРТ на лечение Trichomonas vaginalis среди ВИЧ-инфицированных женщин. Clin Infect Dis. 2014. 59 (6): 883–7.
CAS PubMed PubMed Central Google Scholar
Balkus JE, Richardson BA, Mochache V, Chohan V, Chan JD, Masese L, et al. Проспективное когортное исследование, сравнивающее влияние однократной дозы 2 г метронидазола на инфекцию Trichomonas vaginalis у ВИЧ-серопозитивных и ВИЧ-серонегативных женщин. Sex Transm Dis. 2013. 40 (6): 499–505.
CAS PubMed PubMed Central Google Scholar
Lazenby GB, Unal ER, Andrews AL, Simpson K. Анализ экономической эффективности ежегодного скрининга и лечения Trichomonas vaginalis у ВИЧ-инфицированных женщин для предотвращения передачи ВИЧ.Sex Transm Dis. 2014. 41 (6): 353–8.
PubMed Google Scholar
Киссинджер П., Секор В.Е., Лейхлитер Дж.С., Кларк Р.А., Шмидт Н., Куртин Е. и др. Ранние повторные инфекции Trichomonas vaginalis среди ВИЧ-положительных и ВИЧ-отрицательных женщин. Clin Infect Dis. 2008. 46 (7): 994–9.
PubMed Google Scholar
Krashin JW, Koumans EH, Bradshaw-Sydnor AC, Braxton JR, Evan Secor W., Sawyer MK, et al.Распространенность, заболеваемость, факторы риска и устойчивость к антибиотикам Trichomonas vaginalis среди подростков. Sex Transm Dis. 2010. 37 (7): 440–4.
PubMed Google Scholar
Киссинджер П., Шмидт Н., Мохаммед Х., Лейхлитер Дж. С., Гифт Т.Л., Мидорс Б. и др. Лечение партнером, доставленным пациентом, от инфекции Trichomonas vaginalis: рандомизированное контролируемое исследование. Sex Transm Dis. 2006. 33 (7): 445–50.
PubMed Google Scholar
Spence MR, Harwell TS, Davies MC, Smith JL. Минимальная однократная пероральная доза метронидазола для лечения трихомониаза: рандомизированное слепое исследование. Obstet Gynecol. 1997. 89 (5 Pt 1): 699–703.
CAS PubMed Google Scholar
Forna F, Gulmezoglu AM. Вмешательства по лечению трихомониаза у женщин. Кокрановская база данных Syst Rev.2003; 2: CD000218.
PubMed Google Scholar
Csonka GW. Трихомонадный вагинит лечится одной дозой метронидазола. Br J Vener Dis. 1971 г., 47 (6): 456–8.
CAS PubMed PubMed Central Google Scholar
Hager WD, Brown ST, Kraus SJ, Kleris GS, Perkins GJ, Henderson M. Метронидазол от вагинального трихомониаза. Семидневные схемы по сравнению с однократной дозой. ДЖАМА. 1980. 244 (11): 1219–20.
CAS PubMed Google Scholar
Schwebke JR, Barrientes FJ. Распространенность изолятов Trichomonas vaginalis с устойчивостью к метронидазолу и тинидазолу. Антимикробные агенты Chemother. 2006. 50 (12): 4209–10.
CAS PubMed PubMed Central Google Scholar
Перес С., Фернандес-Вердуго А., Перес Ф., Васкес Ф. Распространенность устойчивой к 5-нитроимидазолу трихомонады влагалища в Овьедо, Испания. Sex Transm Dis. 2001. 28 (2): 115–6.
CAS PubMed Google Scholar
Schmid G, Narcisi E, Mosure D, Secor WE, Higgins J, Moreno H. Распространенность метронидазолустойчивой Trichomonas vaginalis в гинекологической клинике. J Reprod Med. 2001. 46 (6): 545–9.
CAS PubMed Google Scholar
Магнус М., Кларк Р., Майерс Л., Фарли Т., Киссинджер П.Дж. Trichomonas vaginalis среди ВИЧ-инфицированных женщин: связаны ли иммунный статус или прием ингибиторов протеазы с последующей положительной реакцией на T. vaginalis? Sex Transm Dis.2003. 30 (11): 839–43.
CAS PubMed Google Scholar
Никколай Л.М., Копицко Дж. Дж., Кэсси А., Петрос Х., Кларк Р.А., Киссинджер П. Заболеваемость и предикторы повторного инфицирования Trichomonas vaginalis у ВИЧ-инфицированных женщин. Sex Transm Dis. 2000. 27 (5): 284–8.
CAS PubMed Google Scholar
Lyng J, Christensen J. Двойное слепое исследование ценности лечения однократной дозой тинидазола для партнеров женщин, больных трихомониазом.Acta Obstet Gynecol Scand. 1981; 60 (2): 199–201.
CAS PubMed Google Scholar
Schwebke JR, Desmond RA. Рандомизированное контролируемое исследование методов уведомления партнера для профилактики трихомониаза у женщин. Sex Transm Dis. 2010. 37 (6): 392–6.
PubMed Google Scholar
Hirt RP, Sherrard J. Происхождение Trichomonas vaginalis, молекулярная патобиология и клинические аспекты.Curr Opin Infect Dis. 2015; 28 (1): 72–9.
CAS PubMed Google Scholar
Мартин Д.Х., Зозая М., Лиллис Р.А., Майерс Л., Нсуами М.Дж., Феррис М.Дж. Уникальная вагинальная микробиота, которая включает неизвестный микоплазмоподобный организм, связана с инфекцией Trichomonas vaginalis. J Infect Dis. 2013. 207 (12): 1922–31.
PubMed PubMed Central Google Scholar
Киссинджер П., Мена Л., Левисон Дж., Кларк Р.А., Гацки М., Хендерсон Х. и др. Рандомизированное исследование лечения: однократная доза метронидазола в сравнении с 7-дневной дозой для лечения вагинальной трихомонады среди ВИЧ-инфицированных женщин. J Acquir Immune Defic Syndr. 2011; 55 (5): 565–71.
Google Scholar
Уоррен Д., Кляйн Р.С., Собел Дж., Кике-младший Б., Браун В., Шуман П. и др. Многоцентровое исследование бактериального вагиноза у женщин, инфицированных вирусом иммунодефицита человека или находящихся в группе риска.Заражение Dis Obstet Gynecol. 2001. 9 (3): 133–41.
CAS PubMed PubMed Central Google Scholar
Plitt SS, Garfein RS, Gaydos CA, Strathdee SA, Sherman SG, Taha TE. Распространенность и корреляты chlamydia trachomatis, neisseria gonorrhoeae, trichomonas vaginalis и бактериального вагиноза среди группы молодых потребителей инъекционных наркотиков в Балтиморе, штат Мэриленд. Sex Transm Dis. 2005. 32 (7): 446–53.
PubMed Google Scholar
Taha TE, Hoover DR, Dallabetta GA, Kumwenda NI, Mtimavalye LA, Yang LP, et al. Бактериальный вагиноз и нарушения микрофлоры влагалища: связь с увеличением заражения ВИЧ. СПИД. 1998. 12 (13): 1699–706.
CAS PubMed Google Scholar
Севанкамбо Н., Грей Р.Х., Вавер М.Дж., Пакстон Л., Макнейм Д., Вабвайр-Манген Ф. и др. ВИЧ-1 инфекция, связанная с аномальной морфологией вагинальной флоры и бактериальным вагинозом.Ланцет. 1997. 350 (9077): 546–50.
CAS PubMed Google Scholar
Томасон Дж. Л., Гелбарт С. М., Собун Дж. Ф., Шулиен МБ, Гамильтон ПР. Сравнение четырех методов обнаружения влагалищной трихомонады. J Clin Microbiol. 1988. 26 (9): 1869–70.
CAS PubMed PubMed Central Google Scholar
Франклин Т.Л., Мониф Г.Р. Trichomonas vaginalis и бактериальный вагиноз.Сосуществование с вагинальными влажными препаратами от беременных. J Reprod Med. 2000. 45 (2): 131–4.
CAS PubMed Google Scholar
Демирезен С., Кая Д., Бексац С. Цитологические находки в мазках Папаниколау на актиномицеподобные организмы. Acta Cytol. 2005. 49 (3): 257–61.
PubMed Google Scholar
Хеллер Д.С., Масляк С., Скурник Дж. Связано ли наличие трихомонад в мазке Папаниколау с увеличением заболеваемости бактериальным вагинозом? J Low Genit Tract Dis.2006. 10 (3): 137–9.
PubMed Google Scholar
Fettweis JM, Serrano MG, Huang B., Brooks JP, Glascock AL, Sheth NU, et al. Возникающая микоплазма, связанная с трихомониазом, вагинальной инфекцией и заболеванием. PLoS One. 2014; 9 (10): e110943.
PubMed PubMed Central Google Scholar
Brotman RM, Bradford LL, Conrad M, Gajer P, Ault K, Peralta L, et al.Связь между Trichomonas vaginalis и составом бактериального сообщества влагалища среди женщин репродуктивного возраста. Sex Transm Dis. 2012. 39 (10): 807–12.
PubMed PubMed Central Google Scholar
Hillier SL, Krohn MA, Nugent RP, Gibbs RS. Характеристики трех паттернов влагалищной флоры, оцененные с помощью окрашивания по Граму среди беременных женщин. Группа изучения вагинальных инфекций и недоношенности. Am J Obstet Gynecol. 1992. 166 (3): 938–44.
CAS PubMed Google Scholar
Trichomonas vaginalis — обзор
Другие паразиты
Trichomonas vaginalis — жгутиковые паразиты, вызывающие вагинит, и есть другие амебы, вызывающие симптомы, похожие на дизентерию. Возможно, на Западе более распространены заражения червями (круглыми и ленточными), вшами, клещами и блохами. Хотя несколько книг по ароматерапии предполагают, что различные эфирные масла обладают глистогонными свойствами (что делает их пригодными для удаления кишечных глистов), данных исследований очень мало.Для лечения желудочно-кишечного тракта эфирные масла нужно принимать внутрь. Паразитов, обитающих на коже или непосредственно под ней, можно эффективно лечить с помощью эфирных масел, применяемых местно. Некоторые из моих студентов во Флориде использовали эфирные масла местно, чтобы убить морских вшей и удалить зуд и эритему, сопровождающие заражения подобного рода. Эфирное масло, которое они использовали, было настоящей лавандой, либо неразбавленным, либо с 5% разбавлением. Эффект был «почти мгновенным».
Лимонная камедь оказалась противопаразитарным средством как от амеб, так и от глистов (Gilbert & Mors 1972; De Blasi & Debrot 1990).Эвкалипт также эффективен против некоторых амеб.
Американский червь (Chenopodium ambrosioides L. var. anthelminticum) давно используется североамериканскими индейцами, которые использовали его для изгнания червей и паразитов из кишечника. (Они принимают траву орально.) Иногда это растение называют иерусалимским дубом. Семена этого растения производят эфирное масло, которое использовалось в течение сотен лет, что кажется достаточно безопасным для детей (Erichsen-Brown, 1979).Грив (1931) обнаружил, что этот сорт Chenopodium является эффективным средством от анкилостомы и аскариды, и он был включен в официальную американскую фармакопею . Однако между травами часто путают Chenopodium ambrosioides L. var. anthelminticum и Chenopodium botrys L., которые содержат гораздо более высокий процент аскаридола и могут привести к летальному исходу.
Лавант из семян червей (Artemisia cina) также имеет долгую историю использования, восходящую к Диоскориду.Считается, что его глистогонное действие вызвано сантонином, который накапливается в цветочных головках. Это эффективное средство против круглых червей и, в меньшей степени, против остриц, но не действует на ленточных червей. Однако побочные эффекты включают нарушения зрения, которые добавляют желтый оттенок всему, что видит пациент. Сантонин не содержится в эфирном масле, но может быть в экстракте CO 2 . Есть три полыни (обыкновенная, морская и римская), которые принадлежат к роду Artemisia, , который также включает эстрагон, который сам считается глистогонным средством (Lawless 1992).Все три травы (Artemisia absinthium, Artemisia maritima, и Artemisia pontica) обладают глистогонными свойствами.
Индийский розовый корень (Spigelia marilandica) — еще одно североамериканское растение, которое использовалось американскими индейцами в качестве глистогонного средства (Lewis & Elvin-Lewis 1977). Тем не менее, Duke (1995) предполагает, что в случае использования его экстракта следует добавить физиологический раствор, потому что трава токсична и имеет эффекты, аналогичные эффектам стрихнина.Он используется гомеопатически при мании и косоглазии.
Чайное дерево и лаванда ( Lavandula latifolia или L. angustifolia ) — распространенные эфирные масла, используемые для лечения вшей, клещей и блох. L. angustifolia также можно безопасно использовать для лечения детей и животных. Грожан (1992) предлагает от вшей герань, шалфей или лаванду. Бархатцы (Tagetes minuta) , как сообщил Лоулесс (1992), обладают глистогонными свойствами. Тиссеранд (1989) предлагает использовать бергамот, ромашку, камфору, эвкалипт, фенхель, иссоп, лаванду, мелиссу или перечную мяту.Валнет (1990) предлагает все это, а также каджупут, тмин, корицу, гвоздику, лимон, ниаули, чабер, эстрагон и тимьян. Для лечения клещей Лоулесс (1992) предлагает сладкий майоран, а от вшей — корицу, эвкалипт (синюю камедь), герань, колючую лаванду, сосну обыкновенную, розмарин или тимьян.
Хотя некоторые из этих эфирных масел трудно получить, а их использование может быть спорным, эфирные масла или экстракты CO 2 , по-видимому, обладают потенциалом в качестве противопаразитарных агентов.В тропиках или в развивающихся странах, где традиционные лекарства дороги и труднодоступны, эфирные масла могут иметь экономический смысл. Однако, хотя представленная здесь информация предполагает, что обсуждаемые эфирные масла могут иметь противопаразитарный эффект, нет никаких гарантий. Необходимы клинические испытания.
Что вызывает трихомониаз?
Трихомониаз представляет собой обычную инфекцию, передающуюся половым путем, которая вызывается жгутиковидным паразитическим возбудителем простейших Trichomonas vaginalis .Симптомы включают воспалительный вагинит у женщин и уретрит у мужчин, хотя нередки бессимптомные случаи.
Тем не менее, это состояние было связано с преждевременными родами и повышенной детской смертностью, а также с облегчением передачи вируса иммунодефицита человека (ВИЧ).
Trichomonas vaginalis был первоначально обнаружен врачом Альфредом Франсуа Донне в 1836 году, который наблюдал подвижные микроорганизмы в гнойных выделениях из влагалища инфицированных женщин, тогда как клиническое заболевание, известное как трихомониаз, было впервые описано в 1916 году Хоне.Однако, несмотря на эти ранние открытия, исследования этого организма не были полностью начаты до 20 века.
Морфология возбудителя
Trichomonas vaginalis — это паразитические простейшие, которые, как и некоторые другие простейшие паразиты, существуют только в виде трофозоитов и не образуют цисты. Этот человеческий патоген может быть разного размера и формы, но всегда несет четыре передних жгутика и один рецидивирующий пятый, прикрепленный к телу паразита волнообразной мембраной.Это приводит к отчетливой дрожащей моторике.
Гиалиновая тонкая стержнеобразная структура, известная как аксостиль, продольно делит это простейшее пополам. Он выступает через заднюю часть паразита, заканчиваясь острым концом. Эта структура очень важна, поскольку считается, что она прикрепляет Trichomonas vaginalis к эпителиальным клеткам влагалища.
У этого паразита также есть гидрогеносомы, представляющие собой электронно-плотные сферические органеллы или гранулы диаметром 0.5 микрометров. Биохимические исследования показали, что эти органеллы функционально очень похожи на митохондрии, поскольку они содержат ферменты цикла трикарбоновых кислот, используемых для синтеза аденозинтрифосфатов.
Рост и жизненный цикл Trichomonas vaginalis
Обработка с помощью сканирующей электронной микроскопии ясно показала, что Trichomonas vaginalis чаще всего имеет яйцевидную форму, от 6 до 28 миллиметров в длину и от 5 до 12 миллиметров в ширину. Оптимальным условием для его роста in vitro является pH от 6.0 и 6,3, хотя для трихомонад может подходить широкий диапазон значений pH.
Этот жгутик размножается за счет продольного бинарного деления, сохраняя при этом ядерную мембрану. Несколько крупных круглых форм Trichomonas vaginalis описаны в культуре делящейся фазы роста — это, прежде всего, формы без жгутиков, формы со жгутиками и делящимся ядром, а также формы со жгутиками и множественными ядрами. Преобладающая школа мысли состоит в том, что эти формы не являются стадиями жизненного цикла; скорее, они возникают при определенных неблагоприятных условиях.
Генетические и клинические тонкости организма
Последовательность генома Trichomonas vaginalis была опубликована в 2007 году, что послужило поводом для проведения других исследований, которые выявили двухтипную популяционную структуру во всемирной выборке затронутых женщин. Недавнее исследование показало, что те, у кого был диагностирован этот паразит, были инфицированы либо типом 1, либо типом 2 Trichomonas почти в равных процентах, в то время как 10 процентов женщин были носителями обоих типов.
Изоляты Trichomonas vaginalis , относящиеся к типу 1, было легче обнаружить с помощью широко используемых диагностических процедур (таких как влажное крепление), и они могут указывать на лиц с симптомами и высокой паразитарной нагрузкой.С другой стороны, те, которые принадлежали к типу 2, требовали более высоких концентраций лекарств для достижения летального воздействия на паразита; следовательно, они могут быть связаны с устойчивостью к антибиотикам.
Интересным фактоидом является вирус с двухцепочечной РНК (обычно называемый вирусом Trichomonas vaginalis ), который обнаруживается в 73 процентах изолятов трихомонад типа 1, но только в 2,5 процентах изолятов трихомонад типа 2. Считается, что присутствие этого вируса может модулировать патогенность паразита, изменяя экспрессию цистеиновых протеиназ и поверхностных молекул.
Изучение «Трича»: ЗППП, о котором вы, вероятно, не слышали Сыграть
Дополнительная литература
Trichomonas vaginalis: наиболее распространенная невирусная инфекция, передаваемая половым путем, привлекает меньше всего внимания со стороны общественного здравоохранения | Клинические инфекционные болезни
Инфекция Trichomonas vaginalis впервые была описана как венерическое заболевание в середине 20 века, за несколько десятилетий до того, как инфекция Chlamydia trachomatis была признана таковой.Подвижные простейшие, вызывающие трихомониаз у женщин, легко увидеть с помощью простой микроскопии. К сожалению, это создает впечатление, что, поскольку эти организмы большие, подвижные и легко различимые, микроскопия влажных препаратов очень чувствительна. При этом игнорируется высокая нагрузка организма, необходимая для взятия проб из влагалища для захвата организмов. Поскольку влажные препараты с положительными результатами получают от женщин с высокими нагрузками на организм, неудивительно, что у большинства этих женщин проявляются симптомы.В результате этого бессимптомные женщины редко проходят тестирование за пределами клиники по лечению инфекций, передаваемых половым путем (ИППП). После разработки тестов амплификации нуклеиновых кислот для ДНК T. vaginalis наше понимание эпидемиологии этого патогена улучшилось и позволяет предположить, что до одной трети инфекций у женщин могут протекать бессимптомно.
Инфекция T. vaginalis является наиболее распространенной невирусной ИППП как в США, так и во всем мире. По оценкам Всемирной организации здравоохранения, его распространенность составляет от 170 до 190 миллионов случаев во всем мире каждый год (оценочная распространенность в США составляет около 8 миллионов случаев в год).Эти оценки основаны на предположении, что чувствительность влажной установки составляет от 60% до 80%. Это говорит о том, что оценки могут быть заниженными, учитывая, что вероятная чувствительность для микроскопии с мокрым креплением, вероятно, ближе к 35–60% [1–5]. Однако, даже если мы примем эти оценки за чистую монету, почему так мало внимания уделяется тому факту, что распространенность инфекции T. vaginalis равна объединенным оценкам распространенности C. trachomatis и Neisseria gonorrhoeae. инфекция?
Относительная доля этих оценок подтверждается данными, полученными из различных популяций [1, 6, 7].В акушерской клинике Среднего Запада, которая регулярно проверяет все три этих ИППП в течение первого триместра беременности, распространенность инфекции C. trachomatis, N. gonorrhoeae и T. vaginalis за период с середины 2004 г. по середину 2006 г. составила 3,0%, 0,9% и 3,9% соответственно (Джеймс А. Уильямс, личное сообщение). Среди 186 женщин, посетивших клиники по лечению ИППП в округе Марион, штат Индиана, распространенность инфекции C. trachomatis, N. gonorrhoeae и T. vaginalis в удобной выборке с середины 1990-х годов составила 15.1%, 9,1% и 22,0% соответственно [2]. В том же исследовании распространенность для удобной выборки посетителей клиник по лечению ИППП мужского пола составила 5,4%, 5,2% и 5,0% соответственно. Хотя распространенность инфекции T. vaginalis среди мужчин была низкой в этом исследовании, распространенность инфекции C. trachomatis и N. gonorrhoeae также была низкой в популяции клиники ИППП. В других исследованиях измерялась распространенность инфекции T. vaginalis у мужчин [8–12] и было обнаружено, что T.vaginalis — распространенный патоген, хотя среди мужчин инфекция встречается реже, чем среди женщин. Мужчины с инфекцией T. vaginalis преимущественно протекают бессимптомно. Такой низкий уровень клинических проявлений у мужчин приводит к снижению внимания к выявлению случаев заболевания, поскольку доступные ограниченные ресурсы направлены на средства, вызывающие уретрит и связанные с ним синдромы.
Учитывая высокую распространенность заболевания по сравнению с другими ИППП в различных группах женщин, почему T.vaginalis не включены в агрессивные программы скрининга и контроля? Один из аргументов заключался в том, что инфекция T. vaginalis , по сути, является помехой для самоустранения. Однако продольный отбор образцов показывает, что без лечения инфекция может сохраняться не менее 3 месяцев [3]. Более того, инфекция T. vaginalis была связана с последствиями для половых путей, включая воспалительные заболевания органов малого таза и неблагоприятные исходы беременности [13–15]. Стоит отметить, что не только распространенность инфекции среди мужчин ниже, чем среди женщин, но и мужчины также редко испытывают последствия невылеченной инфекции.Возможно, это население, для которого это неприятное заболевание и, следовательно, незначительный возбудитель.
Если последствия инфекции T. vaginalis для репродуктивного здоровья женщин недостаточны для того, чтобы требовать усилий по контролю общественного здравоохранения, то, возможно, усиление передачи ВИЧ должно вызвать интерес к этому эндемическому патогену. Хотя роль C. trachomatis как кофактора в заражении ВИЧ неясна, N. gonorrhoeae , если таковая имеется, ассоциирована с повышенным риском заражения ВИЧ как у мужчин, так и у женщин.Однако из этих 3 ИППП, вызывающих выделения, инфекция N. gonorrhoeae является наименее распространенной. Инфекция T. vaginalis также связана с повышенными шансами заражения ВИЧ среди женщин, занимающихся секс-бизнесом [6], и посетителей клиник планирования семьи [16] в Восточной и Южной Африке. Хотя скорректированные OR для заражения ВИЧ-инфекцией у женщин с T. vaginalis ниже, чем OR для женщин, инфицированных N. gonorrhoeae , распространенность в 3 раза выше, потенциально составляя T.vaginalis , более важными ИППП, на которые должны быть нацелены программы борьбы. T. vaginalis также ассоциируется с повышенной вирусной нагрузкой в семенном и цервиковагинальном отделах [17, 18]. Поскольку вирусная нагрузка является самым большим фактором риска передачи ВИЧ в парах с дискордантным инфекционным статусом, это предполагает, что борьба с инфекцией T. vaginalis у мужчин может помочь снизить инфекционность ВИЧ-инфицированных.
Хотя большая часть представленной здесь информации не нова, если рассматривать ее в целом, информация о распространенности и потенциальных последствиях T.vaginalis среди мужчин и женщин требует внимания. Члены области ИППП должны стать сторонниками улучшения доступности ресурсов для T. vaginalis — усилий по борьбе. Это не первый призыв к действию в отношении этого возбудителя; несколько лидеров в области НТИ подняли этот вопрос в другом месте [19–21].
Нам необходимо применить уроки, которые мы извлекли из программы C. trachomatis — программы контроля для эффективного снижения бремени болезней, которые преимущественно затрагивают женщин.Один из наиболее важных вопросов заключается в том, что при контроле за ИППП важны партнеры. В важном исследовании Seña et al. [22] в этом выпуске журнала была проведена обширная оценка партнеров-мужчин T. vaginalis — инфицированных женщин. Актуальность этого типа исследования трижды: (1) демонстрация того, что мужчины подвержены инфекции T. vaginalis , повышает осведомленность практикующих врачей, (2) понимание согласованности в диадах подчеркивает необходимость управления партнерами и (3) понимание клинических проявлений помогает целенаправленно проводить диагностику и лечение.
Предыдущие исследования инфекции C. trachomatis показали, что конкордантность внутри диад [23-25] аналогична показателям, показанным Seña et al. [22] для инфекции T. vaginalis , что делает разумным применение результатов программ борьбы с хламидиозом к проблеме контроля T. vaginalis . Данные из различных источников показали, что сосредоточение внимания только на скрининге и лечении женщин от C. trachomatis не привело к желаемому устойчивому снижению распространенности [26–28].Необработанные партнеры продолжают оставаться источником повторного заражения, с которым необходимо бороться. Вместо того, чтобы сосредоточиться на отслеживании контактов для выявления и лечения инфицированных мужчин, необходимо включить скрининг на T. vaginalis в разрабатываемые программы скрининга бессимптомных мужчин на C. trachomatis и N. gonorrhoeae.
Включение скрининга на T. vaginalis в программы борьбы с ИППП не должно ограничиваться мужчинами; Необходимо усиленное тестирование бессимптомных женщин для выявления тех инфекций, которые могут сохраняться при отсутствии физических признаков, которые могут побудить женщин обратиться за медицинской помощью.Добавление T. vaginalis к существующим и разрабатываемым программам скрининга становится все более осуществимым, потому что в настоящее время доступны как анализы амплификации нуклеиновых кислот, так и анализы амплификации нуклеиновых кислот для использования в обычных условиях. Поскольку инфекция T. vaginalis легко поддается лечению, необходимы дополнительные эпидемиологические исследования (например, исследование, проведенное Сенья и др. [22]) для определения рекомендаций по лечению в условиях, в которых диагностическое тестирование невозможно, особенно для мужчин. Нам необходимо поощрять индустрию диагностики ИППП к продолжению разработки улучшенных тестов, но вряд ли это станет приоритетом в отсутствие национальных мандатов на тестирование.Между тем, тестирование на T. vaginalis любым методом лучше, чем не проводить никаких диагностических исследований и полагаться только на признаки и симптомы. Однако даже простые диагностические тесты и лечение требуют ресурсов, направленных на борьбу с этим патогеном. Без целевого финансирования инфицирование T. vaginalis будет по-прежнему «тихой» ИППП, подвергая миллионы женщин повышенному риску осложнений репродуктивного здоровья и ВИЧ-инфекции.
Благодарности
Возможный конфликт интересов .B.V.D.P .: конфликтов нет.
Список литературы
1,,,,,.Сравнение обычного тестирования с полимеразной цепной реакцией при обнаружении Trichomonas vaginalis у женщин из числа коренного населения, проживающих в отдаленных районах
,Int J STD AIDS
,2005
, vol.16
(стр.811
—5
) 2,,.Использование адаптации коммерчески доступного ПЦР-анализа, направленного на диагностику хламидиоза и гонореи, для обнаружения Trichomonas vaginalis в образцах урогенитальных
,J Clin Microbiol
,2006
, vol.44
(стр.366
—73
) 3,,,,.Распространенность, заболеваемость, естественное течение и реакция на лечение инфекции Trichomonas vaginalis среди женщин-подростков
,J Infect Dis
,2005
, vol.192
(стр.2039
—44
) 4« и др.Улучшенная диагностика инфекции Trichomonas vaginalis с помощью ПЦР с использованием вагинальных мазков и образцов мочи по сравнению с диагностикой с помощью влажной микроскопии, посева и флуоресцентного окрашивания
,J Clin Microbiol
,1999
, vol.37
(стр.4127
—30
) 5,,,.Trichomonas vaginalis в сравнении со стандартными диагностическими и терапевтическими протоколами для выявления и лечения вагинального трихомониаза
,Clin Infect Dis
,2002
, vol.35
(стр.576
—80
) 6« и др.Неязвенные заболевания, передаваемые половым путем, как факторы риска передачи ВИЧ-1 у женщин: результаты когортного исследования
,AIDS
,1993
, vol.7
(стр.95
—102
) 7,,, et al.Рандомизированное общественное испытание интенсивной борьбы с болезнями, передаваемыми половым путем для профилактики СПИДа, Ракаи, Уганда
,AIDS
,1998
, vol.12
(стр.1211
—25
) 8« et al.Trichomonas vaginalis как причина уретрита у малавийских мужчин
,Sex Transm Dis
,1999
, vol.26
(стр.381
—7
) 9,,,,.Сравнительная распространенность инфекции Trichomonas vaginalis среди мужчин, обращающихся в клинику по лечению заболеваний, передающихся половым путем
,Sex Transm Dis
,2000
, vol.27
(стр.236
—40
) 10,,, et al.Разработка и валидация иммуноферментного анализа мочи на основе ПЦР для использования в условиях клинических исследований для выявления Trichomonas vaginalis у женщин
,J Clin Microbiol
,2002
, vol.40
(стр.89
—95
) 11.Трихомониаз у мужчин: старые проблемы и новые данные
,Sex Transm Dis
,1995
, vol.22
(стр.83
—96
) 12,.Высокий уровень Trichomonas vaginalis среди мужчин, посещающих клинику по лечению заболеваний, передающихся половым путем: значение для скрининга и лечения уретрита
,J Infect Dis
,2003
, vol.188
(стр.465
—8
) 13,,, et al.Trichomonas vaginalis , ассоциированная с низкой массой тела при рождении и преждевременными родами. Группа исследования вагинальных инфекций и недоношенных детей
,Sex Transm Dis
,1997
, vol.24
(стр.353
—60
) 14,,,,.Trichomonas vaginalis ассоциируется с воспалительными заболеваниями органов малого таза у женщин, инфицированных вирусом иммунодефицита человека
,Clin Infect Dis
,2002
, vol.34
(стр.519
—22
) 15,.Трихомониаз
,Clin Microbiol Rev
,2004
, т.17
(стр.794
—803
) 16,,,,.Частота и факторы риска трихомониаза среди беременных заключенных в Нью-Йорке
,Sex Transm Dis
,1998
, vol.25
(стр.303
—7
) 17,,, et al.Дополнение лечения трихомониаза к синдромному лечению уретрита в Малави: рандомизированное клиническое исследование
,Sex Transm Dis
,2003
, vol.30
(стр.516
—22
) 18,,, et al.Влияние лечения вагинальных инфекций на распространение вируса иммунодефицита человека 1 типа
,J Infect Dis
,2001
, vol.183
(стр.1017
—22
) 19,.Trichomonas vaginalis: возрождающийся патоген
,Clin Obstet Gynecol
,1993
, vol.36
(стр.137
—44
) 20.Trichomonas vaginalis — больше не является второстепенным ЗППП
,Sex Transm Dis
,1999
, vol.26
(стр.388
—9
) 21.Трихомониаз у подростков: маркер отсутствия ответных мер общественного здравоохранения на эпидемию венерических заболеваний в США
,J Infect Dis
,2005
, vol.192
(стр.2036
—8
) 22,,, et al.Инфекция Trichomonas vaginalis у половых партнеров-мужчин: значение для диагностики, лечения и профилактики
,Clin Infect Dis
,2007
, vol.44
(стр.13
—22
) 23,,, et al.Скрининг мужчин на инфекций Chlamydia trachomatis и Neisseria gonorrhoeae в клиниках ЗППП в трех городах США — Индианаполисе, Новом Орлеане, Сиэтле
,Int J STD AIDS
,2004
, vol.15
(стр.822
—8
) 24,,.Инфекция Chlamydia trachomatis у бессимптомных мужчин
,Am J Prev Med
,2003
, vol.24
(стр.36
—42
) 25.Соответствие Chlamydia trachomatis генитальной инфекции между половыми партнерами в эпоху тестирования нуклеиновых кислот
,Сексуальное здоровье
,2005
, vol.2
(стр.23
—4
) 26,,,,.Эффективность последующего наблюдения и отслеживания контактов женщин с положительным результатом теста на половые пути Chlamydia trachomatis до прерывания беременности
,J Obstet Gynaecol
,2004
, vol.24
(стр.687
—9
) 27,,,,.Неожиданное влияние программы инфекционного контроля Chlamydia trachomatis на восприимчивость к повторному заражению
,J Infect Dis
,2005
, vol.192
(стр.1836
—44
) 28,,,.Расследование предполагаемой вспышки вагинального трихомониаза среди женщин-заключенных
,Sex Transm Dis
,1999
, vol.26
(стр.335
—8
)© 2007 Американского общества инфекционистов
Инфекционные болезни и противомикробные препараты
Trichomonas vaginalis — жгутиковые простейшие организмы, которые обычно вызывает у людей заболевания, передающиеся половым путем. Обнаружен в 1836 г. (12), но только в середине прошлого века (23, 29) было определено, что это патоген для человека, T.vaginalis , как теперь известно, вызывает больше, чем просто уретрит и вагинит.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ
У мужчин T. vaginalis в первую очередь отвечает за уретрит, колонизацию организм, вызывающий дискомфортные воспалительные выделения из уретры (25). Однако могут быть вовлечены и другие участки, помимо уретры (например, семенные везикулы), длительное бессимптомное носительство является обычным и спонтанным разрешение колонизации уретры может произойти примерно у трети инфицированных частные лица (26).Редко инфекция может быть более паренхиматозной. по локализации, как при трихомониазе, срединного шва полового члена (49). Очевидно, что это бессимптомное носительство, которое предрасполагает к продолжающимся половым актам. передачи, поскольку отсутствие симптомов исключает обращение за медицинской помощью забота.
Трихомониаз у женщин в первую очередь рассматривается как воспалительный вагинит, хотя до половины женщин являются носителями этого организма может протекать бессимптомно (42).Характерные клинические данные включают желтые выделения из влагалища, зуд вульвы, эритему вульвы и вагинальная эритема (55). У беременных трихомониаз бывает в значительной степени ассоциируется с желтым, зеленым или кровавым вагинальным или шейным отделом выделения, ненормальный запах после добавления КОН (положительный запах тест »), pH влагалища более 5,0 и рыхлость шейки матки (39). Кроме того, трихомониаз во время беременности был связан с низким уровнем масса тела при рождении и недоношенность (8, 20, 24), а также респираторное заболевание и вагинит у новорожденного, рожденного беременной. колонизирован трихомонадами (9, 33).
Помимо недоношенных и неонатальных инфекций, трихомониаз имеет было показано, что увеличивает внутриутробную передачу цитомегаловируса (17). Кроме того, было обнаружено, что инфекция T. vaginalis увеличивает риск передача вируса иммунодефицита человека (27). Верно, другие виды трихомонад также были замешаны в заболеваниях люди с ослабленным иммунитетом (47). Очевидно, человек трихомониаз был признан в последнее десятилетие двадцатого века. как более серьезное заболевание, чем считалось ранее.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
Хотя Trichomonas vaginalis можно культивировать in vitro в ряде культур СМИ, в первую очередь медиума Даймонда, диагноз обычно ставится микроскопия влажного препарата вагинального секрета или выделений из уретры, поскольку культура дороже и ограничена по времени. Клинические образцы должны быть исследовали, смешанные с 0,9% физиологическим раствором, а также отдельно смешанные с 10% КОН, чтобы различать T.vaginalis , бактериальный вагиноз и вагинальный кандидоз ((5). Trichomonas может проявляться как подвижное простейшее, несколько крупнее полиморфноядерного лейкоцита, с характерные жгутики. В случае возникновения вопросов относительно диагноза или возможного на устойчивость к противомикробным препаратам следует взять посевы для более обширного тестирования.
Клиническое обследование пациента и различные клинические образцы необходимы для надлежащего лечения трихомониаза и других виды вагинитов и уретритов.Пациент, практикующий соблазн «лечить по телефону» обречено на ошибочный диагноз и неэффективная терапия. Телефон оказался неэффективным инструментом для диагностики и лечения этих типов жалоб, в первую очередь вульвовагинит, приводящий к очень плохому соглашению между практикующими врачами. диагнозы и микробиологические и микроскопические данные (1). Пациенты, которые лечат себя от дрожжевой инфекции без рецепта. противогрибковые препараты также неправильно диагностируют себя, примерно в 66% случаев (16).
УСТОЙЧИВОСТЬ IN VITRO И В VIVO
Trichomonas vaginalis не подвержен многим обычным заболеваниям. антибиотики, как и следовало ожидать от простейших (46). Однако препараты семейства нитроимидазолов, которые активны в отношении ряда бактериальных, протозойных и гельминтозных организмов предлагает множество соединений, которые полезны сейчас или являются многообещающими в будущем при лечении человеческих трихомониаз (28).
Механизм действия нитроимидазольных соединений против трихомонад зависит от анаэробного метаболизма организма. Первоначально исходное соединение пассивно диффундирует в клетку. Затем препарат восстанавливается по нитрогруппе за счет анаэробного клеточного метаболизма. в присутствие молекулярного кислорода, это восстановление будет обратным, так как кислород готовый акцептор электронов. Таким образом, чтобы иметь значительное повреждение клеток, анаэробный метаболизм должен быть в силе.Сниженная нитрогруппа наносит урон к ДНК, вызывая разрыв цепи и гибель клеток, нарушение потока электронов и увеличивает градиент невосстановленного препарата, что способствует более пассивному диффузия соединения в клетку (14).
Метронидазол
Стандартный нитроимидазол, применяемый при трихомониазе для много лет был метронидазолом. Чувствительность Trichomonas к метронидазолу может быть определена с помощью аэробных или анаэробных условия.Как правило, присутствие кислорода приводит к более высокому минимальному смертельному исходу. концентрации (MLC), так как присутствие кислорода предотвращает восстановление нитро группа от причинения клеточного повреждения. Фактически, один предполагаемый механизм устойчивость организма к нитроимидазолам — толерантность к кислороду, то есть, позволяя более высокие концентрации кислорода в ячейке, обеспечивая больше электроны опускаются, чтобы предотвратить восстановление исходного препарата (15). Таким образом, одним из показателей клинически значимой резистентности к метронидазолу является повышенный аэробный MLC, или, более конкретно, повышенный аэробный / анаэробный MLC соотношение (31, 35).
Большинство штаммов Trichomonas vaginalis клинически чувствительны к MLC в диапазоне 0,5-32 мкг / мл на основании аэробных условий тестирования (10). 1962 г. у трихомонад была продемонстрирована устойчивость к метронидазолу (43). В США уровень резистентности к метронидазолу T. vaginalis был постоянно менее 5%, при этом большинство изолятов демонстрируют только низкий уровень сопротивление (44).
На основании тестирования in vitro в аэробных условиях , устойчивость Trichomonas к метронидазолу стратифицирована следующим образом (32):
чувствительный MLC <50 мкг / мл
предельное сопротивление MLC = 50 мкг / мл
мягкая устойчивость MLC = 100 мкг / мл
MLC средней устойчивости = 200 мкг / мл
MLC с тяжелой устойчивостью> 200 мкг / мл
Однако есть одно предостережение: эти измеренные MLC, основанные на аэробных тестах in vitro , не указывают на необходимую кровь или ткань. уровни лекарственного средства, необходимые для клинической эффективности, как обычно понимается для обычные бактериальные минимальные ингибирующие концентрации (МПК) при определении дозировки антибиотика.Часто лабораторная устойчивость не коррелирует с клиническая чувствительность к антибиотикам (44). Таким образом, большая часть сведения о дозировке метронидазола были определены эмпирически, накапливается как совокупная мудрость медицинского сообщества, имеющая опыт лечение трихомониаза человека.
Другие препараты
Было показано, что другие соединения нитроимидазола проявляют активность против Trichomonas vaginalis .Тинидазол примерно так же активен, как и чувствительный аэробный MLC < 25 мкг / мл. Штаммы, устойчивые к метронидазолу: в целом устойчив к тинидазолу, с MLC > 50 мкг / мл (36), хотя некоторые устойчивые к метронидазолу штаммы клинически реагируют на тинидазол (22, 48). Орнидазол, нитроимидазол с фармакокинетическими параметрами, подходящими для одного Введение дозы (1,5 г перорально), как было показано, эффективно у человека трихомониаз (18), как и (4.0 г в разделенных дозах из) ниморазол (6). Другие соединения с активностью, подобной метронидазол изучается (13).
Старые препараты имидазола, разработанные для местного применения. формы для таких заболеваний, как кандидоз влагалища, обладают некоторой активностью против trichomonads, хотя MLC несколько выше, чем у метронидазола. Интересно, однако, местное применение таких препаратов, как клотримазол. был использован для увеличения активности системного метронидазола, чтобы достичь синергетической активности в отношении штаммов, устойчивых к метронидазолу (10).
Некоторые альтернативные химические соединения были исследованы на предмет трихомониаз, особенно ввиду наличия устойчивых организмов. В Было показано, что нитрофурановый препарат фуразолидон активен против Trichomonas vaginalis , с MLC в диапазоне 0,8–3,1 мкг / мл, даже в отношении организмов. с МЛК метронидазола и тинидазола более 200 мг / мл (36). Другой препарат, пурпуромицин, нафтаразин-изокумарин соединение, а также некоторые из его полусинтетических производных, как было показано, быть активным (MLC < 25 мкг / мл) in vitro против Trichomonas vaginalis (19).Клиническая эффективность была продемонстрирована с помощью аминоциклитол паромомицин, назначаемый в виде вагинального крема, в случае нитроимидазолустойчивый трихомониаз, хотя побочные эффекты несколько А довольно архаичная терапия мышьяком имеет успешно использовался для лечения резистентного трихомониаза (37, 41). Мышьяки использовались для заражения Trichomonas до появления нитроимидазольные препараты.Таким образом, неудивительно, что мышьяковые пессарии будет эффективным в терапии вагинита из-за высокой устойчивости к нитроимидазолу Trichomonas (54).
Интересно отметить, что не только Trichomonas vaginalis развивает устойчивость к различным противопротозойным соединениям путем становится более толерантным к кислороду, следовательно, менее анаэробным и менее чувствительным к препараты нитроимидазола, но организм, будучи подвижным, может фактически работать вдали от токсичных химикатов. Trichomonas очень сильно проявляет хеморепульсионную активность. вскоре после воздействия различных токсичных веществ, позволяющих организму избежать цидные концентрации препарата (52). Фактически, более токсичный чем соединение, тем более заметен хемотаксис у простейших. Этот объяснил бы невозможность применения препаратов для местного применения (например, клотримазола). вагинальный крем), чтобы вызвать гораздо больше, чем просто облегчение симптомов у пациентов с трихомонадный вагинит.Это также объясняет низкую эффективность, наблюдаемую при местное применение метронидазола сравнивают с системным введением препарата (53).
Работа по вагинальной терапии все еще продолжается, в том числе многообещающий вагинальный пессарий на основе метронидазола / миконазола при множественном вагините организмов (38). Однако малообещающим оказался исследование женщин с задокументированными подвижными трихомонадами, обнаруженными на влажном препарате случайным образом назначается либо однократная пероральная доза метронидазола 2 г, либо один суппозиторий ноноксинола-9 на 150 мг, вводимый интравагинально 3 раза подряд ночи (2).Исследование было прекращено досрочно по причине: низкая эффективность суппозиториев ноноксинола-9. Пациенты, получавшие ноноксинол-9 и отрицательные результаты влажной подготовки при повторном тестировании продемонстрировали Показатель излечения 17,6%, в то время как у всех 16 пациентов, получавших метронидазол, был отрицательный результат. результаты влажной подготовки (степень отверждения 100%). Все женщины с неэффективностью приема ноноксинола-9 у которых после лечения 2 г метронидазола был отрицательный влажный результаты подготовки.
Метронидазол остается препаратом выбора для лечения трихомониаз человека. Это единственный противотрихомональный препарат, доступный в США, хотя другие нитроимидазолы, такие как тинидазол, являются доступен в Канаде и Европе. биодоступность при пероральном приеме, по существу, 100%, и легко распространяется по большей части тела.Основная токсичность метронидазола — его дисульфурамоподобный эффект, заключающийся в тахикардии, приливы, тошнота и рвота при приеме с этанолом. Также метронидазол и дисульфурам, взятые вместе, могут вызвать острый психоз. На более высоком дозы, например, более 2 г / день, используемые при лечении резистентности к нитроимидазолу штаммы T. vaginalis , метронидазол может вызывать желудочно-кишечные расстройства, металлический привкус во рту и периферическая невропатия.Моча также может становятся темными (45).
Несколько Режимы дозирования метронидазола рекомендуются для лечения неосложненный трихомониаз, вызванный чувствительными к метронидазолу микроорганизмами. В текущие рекомендации Центров по контролю за заболеваниями (5) включают:
Более старая, немного другая схема, метронидазол 250 мг перорально трижды в день в течение 7 дней также использовался с эффективностью, аналогичной однократной дозе режим (21).Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрила дозу метронидазола 375 мг дважды в день в течение семи дней лечение, основанное на фармакологической эквивалентности этого препарата и 250 мг трехкратная суточная доза. Однако ни одно клиническое исследование не продемонстрировало эквивалентности. (5). Самая низкая эффективная разовая доза метронидазола имеет Было показано, что однократный пероральный прием 1,5 г (51).
В любом случае пациенты, получающие лечение от трихомониаза, должны: получить инструкции избегать полового акта до тех пор, пока они и их партнеры не будут вылечила (5), хотя такие барьерные методы, как женский Было показано, что презервативы предотвращают передачу инфекции (50).Для предотвращения повторного заражения рекомендуется одновременное лечение партнера (5). Если это будет выполнено, все эти схемы считаются 85-95% эффективный.
Лечение вагинальным гелем метронидазола, пока эффективно при терапия бактериального вагиноза не рекомендуется при трихомониазе (5, 53). терапия, однако. В турецком исследовании изучалась эффективность вагинального пессарии, содержащие метронидазол 500 мг и
миконазол нитрат 100 мг, для лечение кандидоза, бактериального вагиноза и трихомониаза и в смешанные вагинальные инфекции (38).Получено клиническое излечение у 91% из 74 обследованных пациентов с улучшением еще у 7%. Показатели микробиологического излечения трихомониаза составили 97,3%, бактериального — 86,6%. вагиноз и 81% кандидоз. Частота рецидивов составила 2,7, 3,8 и 16,1%, в соответствующих группах. Общая микробиологическая эффективность лечения смешанных инфекции составили 86%, из них 93% — трихомониаз плюс бактериальный вагиноз, и 73% — бактериальный вагиноз плюс кандидозный вагинит.В двух случаях из трех при всех трех условиях микроорганизмы были полностью уничтожены.
Особые соображения
Устойчивость к метронидазолу: следует практикующий подозревает резистентность или толерантность к метронидазолу, есть несколько вариантов дозировки метронидазола, которые можно использовать. CDC рекомендует прием метронидазола в дозе 2 г ежедневно в течение 3-5 дней (5).Одна альтернатива, которая пытается достичь более высоких уровней в крови и тканях, чем пероральное введение — это метронидазол внутривенно в нагрузочной дозе 2 г и один грамм внутривенно каждые шесть часов в течение 24 часов с последующим введением увеличивайте до 2 г устно каждые шесть часов в течение 36 часов. У больного лечили по этому протоколу был достигнут уровень сыворотки 110 мкг / мл, что значительно выше, чем 40 мкг / мл, достигнутые пероральной дозой 2 г (11).Недостатком этой стратегии являются нежелательные симптомы, связанные с высоким уровни препарата в крови (хотя у этого пациента не было обнаружено каких-либо неблагоприятных событие за исключением легкой тошноты).
Другие терапевтические стратегии включают одновременное применение пероральных и вагинальный метронидазол, использование крема имидазола вагинально вместе с пероральным метронидазол или использование других препаратов нитроимидазола (например, тинидазол), хотя ни одна из этих стратегий хорошо изучена, и никакие другие препараты были одобрены в США для лечения трихомониаз.
Одно недавнее исследование в США показало показатель излечения 22 (92%) из 24 случаев. пациенты с рефрактерным трихомониазом, получавшие высокие дозы перорального и вагинальный тинидазол (48). В эту серию вошли 15 кейсов с увеличил in vitro значений MLC метронидазола. Тинидазол, несмотря на высокую использованные дозы, переносились очень хорошо, с небольшими побочными эффектами.
Паромомицин для местного применения оказался умеренно эффективным при пациенты с резистентным трихомониазом, но частые и иногда тяжелые местные вульвовагинальные побочные реакции исключают широкое применение (41, 48).
Метронидазол аллергия: если у пациента с трихомониазом аллергия на метронидазол, CDC не предлагает альтернативная терапия (5). Другие подходящие препараты будут трудно найти, поскольку истинная аллергия на любой из нитроимидазолов вероятно, означает высокую степень перекрестной аллергенности (например, на тинидазол). Тем не менее, была по крайней мере одна попытка снизить чувствительность пациентов с многообещающая аллергия на метронидазол.Женщины лечились с выпускником, увеличение доз в диапазоне микрограммов в течение нескольких часов, с последующим увеличением дозы пероральных таблеток, достигающей кульминации в дозе 2 г. Нет были отмечены побочные эффекты, и пациенты были излечены от заражения (40).
Беременность: С на беременность может отрицательно повлиять трихомониаз, общая тенденция в последние годы лечили трихомониаз во время беременности, когда когда-либо это обнаружено.Теоретический недостаток использования метронидазола во время беременность была угрозой тератогенности, так как метронидазол был Показано, что мутагенное действие на бактериальные экспериментальные системы, а также канцерогенное и онкогенный при введении крысам и мышам в высоких дозах. Однако это еще не было обнаружено, что это проблема у людей (45). Мета-анализ подтверждает, что весь человеческий опыт применения метронидазола во время беременности было относительно гладко (4).
Ранее CDC рекомендовал прекратить прием метронидазола во время первого триместра, чтобы избежать необходимости даже беспокоиться о возможных последствиях для младенец. В текущих рекомендациях это предостережение не упоминается (5). Однако в настоящее время CDC отмечает, что лечение трихомониаза с метронидазол во время беременности показан только для облегчения симптомов, но не для предотвращения неблагоприятного исхода беременности из-за инфекции (5).
Хотя очевидно, что трихомониаз связан с недоношенными доставка (8, 30), недавнее рандомизированное исследование (24) назначило 617 женщин с бессимптомным течением трихомониаз, которые были на сроке беременности от 16 до 23 недель, чтобы получить две дозы 2 г метронидазол (320 женщин) или плацебо (297 женщин) с интервалом 48 часов, с повторное лечение с той же схемой приема двух доз на 24–29 неделе беременности. Трихомониаз разрешился у 249 из 269 женщин, у которых были проведены посевы культур. доступен в группе метронидазола (92.6 процентов) и 92 из 260 женщин с последующие посевы в группе плацебо (35,4 процента). Интересно, роды произошли преждевременно (до 37 недель беременности) у 60 женщин в в группе метронидазола (19,0 процента) и 31 женщина в группе плацебо (10,7 процента). процентов), что в первую очередь связано с увеличением преждевременных родов, в результате от самопроизвольных преждевременных родов. Поэтому лечение беременных с при По крайней мере, бессимптомный трихомониаз не предотвращает преждевременных родов.Рутина обследование и лечение бессимптомных беременных женщин по поводу этого состояния не могут быть рекомендованы исследователями, хотя лечение симптоматическое заболевание по-прежнему будет преследоваться. История еще не закончилась.
ВИЧ-инфекция: пациенты ВИЧ-инфицированным рекомендуются те же схемы лечения, что и ВИЧ-отрицательные (5).
По данным CDC, пациенты, у которых нет симптомов после лечения нет необходимости в дальнейшем наблюдении.Однако, если симптомы не исчезнут или есть другая причина при подозрении на рецидив или повторное заражение рекомендуется повторное обследование и повторное лечение при 7-дневном режиме. Однако практикующий должен опасаться возможность наличия метронидазолустойчивого или толерантного штамма Trichomonas . В Фактически, в таких случаях CDC рекомендует проконсультироваться с экспертом, необходимо провести исследования чувствительности к метронидазолу (5).
Вакцины против трихомониаза у людей отсутствуют. Однако Модель трихомониаза крупного рогатого скота была разработана для изучения механизмов иммунопрофилактика (7). Системная и местная иммунизация иммуноаффинно очищенный антиген очистил половые пути от трихомонад зараженных коров значительно раньше, чем неиммунизированный контроль. Исследователи обнаружили, что преимущественно ответы IgA или преимущественно IgG ответы в маточном и вагинальном секрете были практически одинаковыми защитные и маточные и вагинальные IgA-ответы могут быть вызваны системным прайминг и местное усиление через слизистую оболочку влагалища или носа.В любом В этом случае в слизистой оболочке матки и влагалища образовались лимфоидные агрегаты, которые не присутствовали на слизистой оболочке половых органов неинфицированных и необлученных животных. Исследователи пришли к выводу, что системная иммунизация или системное прайминг местное усиление защищает от трихомониаза крупного рогатого скота через IgG или IgA антитела (соответственно) к основному трихомональному поверхностному антигену, и иммунизация слизистой оболочки половых органов приводит к образованию индуктивных участков для местный ответ IgA.
Трихомониаз — серьезное заболевание человека, от которого страдают более 170 миллионов человек. люди. Важно отметить, что инфицирование Trichomonas vaginalis может увеличить распространение ВИЧ-инфекции (26). Компьютерное моделирование имеет продемонстрировали, что лечение только тех, у кого есть симптомы болезни, минимально влияние на эндемическую распространенность болезней даже при высоком уровне охвата, при выявлении лиц с симптомами и бессимптомно инфекция является наиболее эффективным методом борьбы, но была чувствительна к интервал скрининга (3).Борьба с трихомониазом — это вероятно, успех в развитых странах из-за регулярного доступа к здравоохранения, тогда как трихомониаз остается эндемическим заболеванием во многих развивающихся странах. страны, потому что контроль может быть возможен только менее регулярными симптоматическими лечение. Для успеха в борьба с трихомониазом.
ССЫЛКИ
1.Аллен-Дэвис Дж. Т., Бек A, Паркер Р., Эллис Дж. Л., Полли Д. Оценка вульвовагинальных жалоб: точность телефонной сортировки и диагностики в офисе. Акушерский гинекол 2002 г. Янв; 99: 18-22. [PubMed]
2. Антонелли Н.М., Диль С.Дж., Райт JW. Рандомизированное исследование интравагинального приема ноноксинола 9 по сравнению с пероральным метронидазол в лечении вагинального трихомониаза. Am J Obstet Gynecol 2000 Май; 182: 1008-10. [PubMed]
3.Боуден Ф.Дж., Гарнетт Г.П. Trichomonas vaginalis Эпидемиология: параметризация и анализ модели лечебные вмешательства. Инфекция, передаваемая половым путем, 2000 августа; 76: 248-56. [PubMed]
4. Буртин П., Таддио А, Арибурну О., Эйнарсон Т.Р., Корен Г. Безопасность метронидазола при беременности: A метаанализ. Am J Obstet Gynecol 1995; 172: 525-529. [PubMed]
5. Центры болезней Контроль и профилактика. Руководство по лечению заболеваний, передаваемых половым путем, 1998 г. Болезни.MMWR 1998; 47 (RR-1): 74-75. [PubMed]
6. Chunge CN, Kangethe S, Pamba HO, Owate J. Лечение симптоматического трихомониаза у взрослых женщин пероральные нитроимидазолы. East Afr Med J 1992; 69: 398-401. [PubMed]
7. Корбейл Л. Б., Мансон Л., Campero C, BonDurant RH. Трихомониаз крупного рогатого скота как модель развития вакцины против болезней, передающихся половым путем. Am J Reprod Immunol 2001 Май; 45: 310-9.[PubMed]
8. Cotch MF, Pastorek JG, Наджент Р.П., Хиллиер С.Л., Гиббс Р.С., Мартин Д.Х., Эшенбах Д.А., Эдельман Р., Кэри Дж.С., Реган Дж. А., Крон М. А., Клебанофф М. А., Рао А. В., Роадс Г. Г.. Trichomonas vaginalis ассоциируется с низкой массой тела при рождении и преждевременными родами. Секс трансм дис 1997; 24: 1-8. [PubMed]
9. Данеш И.С., Стивен Дж. М., Горбач Ю. Новорожденные Trichomonas vaginalis инфекция. J Emerg Med 1995; 13: 51-54.[PubMed]
10. Debbia EA, Campora У, Массаро С., Болдрини Э., Скито Г. In vitro активность одного метронидазола и в комбинации с клотримазолом против клинических изолятов Trichomonas Вагиналис . J. Chemother 1996: 8: 96-101. [PubMed]
11. Домбровский М.П., Сокол RJ, Браун WJ, Бронстин Р.А. Внутривенная терапия метронидазолустойчивой Trichomonas vaginalis . Obstet Gynecol 1987; 69: 524-525.[PubMed]
12. Donné MA. Animalcules наблюдает за Purulentes и продукцией секрета des organes genitaux de l’homme et de la femme extrait d’une lettre. Акад Sci (Париж) 1836; 3: 385-386. [PubMed]
13. Дубини Ф, Ривьера Л, Cocuzza C, Беллотти MG. Антибактериальные, антимикотические и трихомонцидные активность нового нитроимидазола (ЕС 11100). J. Chemother 1992; 4: 342-346. [PubMed]
14.Эдвардс Д.И. Нитроимидазольные препараты — механизмы действия и резистентности I. Механизмы действия действие. Журнал Antimicrob Chemother 1993; 34: 9-20. [PubMed]
15. Эдвардс Д.И. Нитроимидазольные препараты — механизмы действия и резистентности II. Механизмы сопротивление. J. Antimicrob Chemother 1993; 34: 204-210. [PubMed]
16. Ferris DG, Nyirjesy П., Собель Дж. Д., Сопер Д., Павлетик А., Литакер М. С.. Противогрибковые препараты, отпускаемые без рецепта. неправильное использование, связанное с диагностированным пациентом вульвовагинальным кандидозом.Акушерство Gynecol 2002 Mar; 99: 419-25. [PubMed]
17. Фаулер КБ, Пасс РФ. Заболевания, передающиеся половым путем, у матерей новорожденных с врожденными цитомегаловирусная инфекция. J. Infect Dis 1991; 164: 259-264. [PubMed]
18. Фугере П., Verschelden G, Caron M. Однократная пероральная доза орнидазола у женщин с вагинальным трихомониаз. Obstet Gynecol 1983; 62: 502-505. [PubMed]
19. Гольдштейн Б.П., Кинг А, Рипамонти Ф., Трани А., Филлипс И. In-vitro активность пурпуромицина и MDL 63 604 против микроорганизмов, вызывающих вагиниты и вагинозы. J Антимикроб Chemother 1995; 36: 1061-1065. [PubMed]
20. Grice AC. Вагинальный инфекция, вызывающая самопроизвольный разрыв плодных оболочек и преждевременные роды. Ауст Н. З. Дж. Обстет Гинеколь 1974; 14: 156-158. [PubMed]
21. Hager WD, Brown ST, Краус С.Дж., Клерис Г.С., Перкинс Г.Дж., Хендерсон М.Метронидазол вагинальный трихомониаз. JAMA 1980; 244: 1219-1220. [PubMed]
22. Хамед К.А., Студемейстер А.Е. Успешный ответ резистентных к метронидазолу трихомонов вагинит к тинидазолу. Отчет о болезни. Sex Transm Dis 1992; 19: 339-340. [PubMed]
23. Hesseltine HC. Wolters SL, Campbell A. Экспериментальный вагинальный трихомониаз человека. J заразить Диск 1942; 71: 127-130. [PubMed]
24.Клебанов М.А., Кэри JC, Hauth JC, Hillier SL, Nugent RP, Thom EA, Ernest JM, Heine RP, Wapner RJ, Форель В., Моавад А., Левено К.Дж., Миодовник М., Сибай Б.М., Ван Дорстен Дж. П., Депутат Домбровски, О’Салливан М.Дж., Варнер М., Лангер О., Макнеллис Д., Робертс Дж. М.; Сеть Национального Института Детского Здоровья и Развития Человека Отделения материнско-фетальной медицины. Неспособность метронидазола предотвратить преждевременные роды роды среди беременных с бессимптомной инфекцией Trichomonas vaginalis .N Engl J Med 2001 16 августа; 345: 487-93. [PubMed]
25. Кригер Дж. Н., Дженни К., Вердон М., Сигель Н., Спрингвотер Р., Кричлоу К. В., Холмс К. К.. Клинический проявления трихомониаза у мужчин. Энн Интерн Мед, 1993; 118: 844-849. [PubMed]
26. Krieger JN, Вердон М., Сигель Н., Холмс К.К. Естественное течение урогенитального трихомониаза у мужчин. J Урол 1993; 149: 1455-1458. [PubMed]
27. Лага М, Манока А, Кивуву М., Малеле Б., Тулиза М., Нзола Н., Гоеман Дж., Бехетс Ф., Баттер В., Алари М., Хейворд В.Л., Райдер Р.В., Пиот П.Неязвенные заболевания, передающиеся половым путем, как факторы риска передачи ВИЧ-1 у женщин: результаты когортного исследования. СПИД 1993; 7: 95-102. [PubMed]
28. Лампа KC, Freeman CD, Клутман Н.Е., Кружевной МК. Фармакокинетика и фармакодинамика нитроимидазольные противомикробные препараты. Clin Pharmacokinet 1999; 36: 353-73. [PubMed]
29. Лэнсли Ф., МакЭнтегарт МГ. Trichomonas vaginalis у мужчин: экспериментальное заражение нескольких добровольцев.Ланцет 1953; 4: 668-671. [PubMed]
30. Слесарь Г., Дафф П. Инфекция, антибиотики и преждевременные роды. Семин Перинатол 2001; 25: 295-309. [PubMed]
31. Лоссик Дж. Г. Мюллер М., Горрелл Т.Э. In vitro лекарственная чувствительность и дозы метронидазола необходим для лечения рефрактерного вагинального трихомониаза. J заразить Дис 1986; 153: 948-955. [PubMed]
32.Лоссик Дж. Химиотерапия резистентного к нитроимидазолу вагинального трихомониаза. Acta Univ Кэрол Биол 1988; 30: 533-545. [PubMed]
33. McLaren LC, Дэвис LE, Хили Г.Р., Джеймс К.Г. Выделение Trichomonas vaginalis из дыхательные пути младенцев с респираторными заболеваниями. Педиатрия 1983; 71: 888-890. [PubMed]
34. Minkoff H, Грюнебаум А.Н., Шварц Р.Х., Фельдман Дж., Каммингс М., Кромблхолм В., Кларк Л., Прингл Дж., Маккормак ВМ.Факторы риска недоношенности и преждевременного разрыва плодных оболочек: Проспективное исследование флоры влагалища при беременности. Am J Obstet Gynecol 1984; 150: 965-972. [PubMed]
35. Мюллер М., Лоссик Дж. Г., Горрелл TE. In vitro Чувствительность Trichomonas vaginalis к метронидазолу и результаты лечения вагинального трихомониаза. Sex Transm Dis1988; 15: 17-24. [PubMed]
36. Нарциси Е.М., Секор МЫ.In vitro действие тинидазола и фуразолидона на метронидазолустойчивые Trichomonas vaginalis . Противомикробные агенты Chemother 1996; 40: 1121-1125. [PubMed]
37. Nyirjesy P, Weitz М.В., Гелон СП, Фекете Т. Паромомицин для устойчивости к нитроимидазолу трихомоноз. Ланцет 1995; 346: 1710. [PubMed]
38. Озюрт Е, Тойкулиева М.Б., Данильянс И.Л., Мортон О., Бактыр Г. Эффективность 7-дневного лечения. с метронидазолом + миконазолом (Neo-Penotran) — пессарием тройного действия для лечение одиночных и смешанных вагинальных инфекций.Int J Gynaecol Obstet 2001 Июл; 74: 35-43. [PubMed]
39. Pastorek JG, Котч MF, Мартин Д.Х., Эшенбах Д.А. Клинические и микробиологические корреляты вагинальный трихомониаз при беременности. Clin Infect Dis 1996; 23: 1075-1080. [PubMed]
40. Перлман М.Д., Яшар C, Ernst S, Solomon W. Протокол возрастающего дозирования для женщин с тяжелым вагинальный трихомониаз и побочные реакции на метронидазол.Am J Obstet Gynecol 1996; 174: 934-936. [PubMed]
41. Poppe WA. Резистентный к нитроимидазолу вагинальный трихомониаз лечится паромомицином. Евро Журнал J Obstet Gynecol Reprod Biol 2001 Май; 96: 119-20. [PubMed]
42. Рейн М.Ф., Мюллер М. Trichomonas vaginalis и трихомониаз. Глава 43 в: Holmes KK, Mårdh P-A, Спарлинг П.Ф., Визнер П.Дж., Кейтс В., Лимон С.М., Штамм В.Е., ред. Сексуально Передающиеся заболевания.2-е изд. Нью-Йорк: McGraw-Hill, Inc., 1990: 481-492. [PubMed]
43. Робинсон СК. Трихомонадный вагинит, резистентный к метронидазолу. Кан Мед Ассо Дж. 1962 г .; 86: 665. [PubMed]
44. Шмид Г., Нарциси Э., Мосуре Д., Секор В.Е., Хиггинс Дж., Морено Х. Распространенность метронидазол-резистентной Trichomonas vaginalis в гинекологической клинике. J Reprod Med 2001; 46: 545-9. [PubMed]
45. Schwebke JR. Метронидазол: применение у акушерских и гинекологических больных.Секс трансм Диск 1995; 22: 370-375. [PubMed]
46. Sears SD, О’Хара J. In vitro Чувствительность Trichomonas vaginalis к 50 антимикробным препаратам агенты. Противомикробные агенты Chemother 1988; 32: 144-146. [PubMed]
47. Сиота Т, Аризоно Н, Morimoto T, Shimatsu A, Nakao K. Trichomonas tenax эмпиема в Пациент с ослабленным иммунитетом и распространенным раком. Паразит 1998; 5: 375-7.[PubMed]
48. Sobel JD, Nyirjesy P, Brown W. Тинидазольная терапия при вагинальной резистентности к метронидазолу трихомониаз. Clin Infect Dis 2001; 33: 1341-6. [PubMed]
49. Soendjojo A, Pindha S. Trichomonas vaginalis Инфекция срединного шва полового члена. Секс Transm Dis 1981; 8: 255-257. [PubMed]
50. Soper DE, Shoupe D, Шангольд Г.А., Шангольд М.М., Гутманн Дж., Мерсер Л.Профилактика вагинального трихомониаз при правильном использовании женского презерватива. Sex Transm Dis 1993; 20: 137-139. [PubMed]
51. Спенс М.Р., Харвелл ТС, Дэвис М.С., Смит Дж. Л. Минимальная разовая доза метронидазола перорально для лечение трихомониаза: рандомизированное слепое исследование. Obstet Gynecol 1997; 89: 699-703. [PubMed]
52. Шугармен Б., Маммам N. Влияние антимикробных препаратов на рост и хемотаксис Trichomona. vaginalis.Противомикробные агенты Chemother 1988; 32: 1323-1326. [PubMed]
53. Tidwell BH, Лашбо В.Б., Лафлин М.Д., Глири Д.Д., Финли Р.В. Двойной слепой плацебо-контролируемое испытание однократной интравагинальной дозы по сравнению с однократной пероральной дозой метронидазол в лечении трихомонадного вагинита. J заразить Дис 1994; 170: 242-246. [PubMed]
54. Уотсон П.Г., Паттман RS. Пессарии мышьяка в успешном устранении метронидазолустойчивый Trichomonas vaginalis .Int J STD AIDS 1996; 7: 296-297. [PubMed]
55. Wolner-Hanssen P, Дригер Дж. Н., Стивенс К. Э., Кивиат Н. Б., Коутски Л., Кричлоу С., ДеРоуэн Т., Хиллиер S, Холмс К.К. Клинические проявления вагинального трихомониаза. JAMA 1989; 261: 571-576. [PubMed]
Устойчивость к лекарствам простейших, передающихся половым путем, Trichomonas vaginalis
Устойчивость простейших к лекарствам является растущей проблемой при относительно небольшом количестве доступных лекарственных альтернатив.Плохо контролируемые режимы лечения и химиопрофилактическое использование противомикробных препаратов привели к неэффективности ценных лекарств, таких как хлорохин, при лечении малярии falciparum 1 . Перекрестная устойчивость к хлорохину и его аналогам в настоящее время встречается практически во всех эндемичных районах. Устойчивость анаэробного простейшего паразита Trichomonas vaginalis , о котором сообщалось еще в 1962 году, также подвержена риску стать устойчивой ко всем рекомендованным терапевтическим средствам 2 .Это самая распространенная инфекция, передаваемая половым путем, и, по оценкам, за один раз инфицировано около миллиарда человек 3, 4 . Семейство препаратов 5-нитроимидазола, в частности метронидазол и тинидазол, является единственным классом препаратов, одобренным для лечения трихомониаза, по оценкам, до 10% инфекций, не поддающихся лечению, в США 4 . Устойчивые организмы космополитичны по распространению и вызывают серьезную озабоченность, поскольку инфекций, вызванных трихомонадой, связаны с вагинальной передачей ВИЧ 5, 6, 7 .
T. vaginalis , обнаруженный Альфредом Донне в 1836 году, представляет собой амитохондриальную микроаэротолерантную жгутик урогенитального тракта человека. Каждый трофозоит имеет 4 передних жгутика и один рекуррентный жгутик, включенный в волнообразную мембрану, которая поддерживается несокращающимся ребром. Тело клетки продольно пронизано тонкой гиалиновой структурой, называемой аксостилем, которая выступает сзади. Ядро заключено в пористую оболочку, типичную для высших эукариот.Были описаны как свободные, подвижные, так и прикрепленные амебоидные формы 8 . Множественные гранулярные органеллы, гидрогеносомы, характерны для T. vaginalis и участвуют в метаболических путях паразита. Происхождение гидрогеносомы остается спорным и считается либо аналогом митохондрий, имеющих общего предка, a-грамотрицательных протеобактерий 9 , либо, альтернативно, прямым производным самого митохондрии 10 . T. vaginalis трофозоитов делятся посредством продольного бинарного деления. Стадия кисты неизвестна. Однако образование псевдоцист было описано в клетках, подвергающихся стрессу окружающей среды 11 .
T. vaginalis встречается на всех континентах и в каждой культуре с наибольшим распространением в Южной и Юго-Восточной Азии, Африке к югу от Сахары и среди малообеспеченных 3 . Примерно 50% инфекций проявляются нетипичными симптомами, начиная от вагинита, цервицита и вульвита у женщин до уретрита, простатита и зуда у мужчин 12, 13 .Неонатальные глазные и респираторные инфекции были также описаны у новорожденных от инфицированных матерей 14, 15 . Хронические инфекции были связаны с преждевременными родами и новорожденными с низкой массой тела, раком шейки матки и увеличением передачи ВИЧ среди наиболее тревожных 16, 17, 18 . Сообщалось о том, что в 1998 г. уровень инфицирования достигал 67% в Монголии 19 , 40-60% в Африке, 40% среди коренных австралийцев старше 40 лет 20 и 46% среди женщин горных районов Папуа-Новой Гвинеи 21, 22 .Трихомониаз имеет самую высокую распространенность и заболеваемость среди всех ИППП, и его искоренение вполне может быть единственным наиболее рентабельным шагом в снижении заболеваемости ВИЧ 23, 24 .
Лечение трихомониазаМетронидазол был первоначально синтезирован и одобрен для лечения трихомониаза в 1959 г. 25 . Рекомендуемые режимы лечения варьируются от однократной пероральной дозы 1,5 или 2 г до разделенных доз по 500 мг два раза в день в течение 7 дней 26, 27 .Хотя метронидазол и тинидазол рекомендуются для лечения трихомониаза, их широкий спектр противомикробных препаратов распространяется на другие анаэробные простейшие, включая Entamoeba histolytica , Giardia duodenalis и Blastocystis hominis и анаэробные бактерии 48 spp 28 . Метронидазол также ценится за свои профилактические свойства в гинекологической и другой хирургии, простоту введения пероральным, местным, интравагинальным или внутривенным путями, небольшое количество побочных эффектов и относительно недорогой 28 .
Энергетический обменT. vaginalis использует ферментативные пути на уровне субстрата для производства АТФ. Гликолиз происходит внутри цитозоля и придерживается классических путей с небольшими изменениями. Пируват, образующийся в результате гликолиза, транспортируется в гидрогеносомы и декарбоксилируется ключевым гидрогеносомальным ферментом пируватом: ферредоксин оксидоредуктазой (PFOR) с образованием ацетил-КоА. Ацетат производится в качестве конечного продукта путем превращения КоА в сукцинат.КоА высвобождается сукцинаттиокиназой, что приводит к выработке АТФ. Ферредоксин (Fd) принимает электроны, генерируемые PFOR. Затем гидрогеназа (HYD) связывает электроны с ионами водорода, образуя молекулярный водород в качестве конечного продукта 4, 29 (рис. 1). Подобные метаболические пути были описаны у древних простейших, G. duodenalis 4, 30, 31 , а также у анаэробной бактерии H. pylori 32 . Однако у этих организмов отсутствует компартментальная организация гидрогеносомы.
Рисунок 1Анаэробный метаболизм Trichomonas vaginalis . Пируват в результате гликолиза попадает в гидрогеносомы, где он декарбоксилируется мембраносвязанным ферментом пируват: ферредоксин оксидоредуктаза (PFOR), который отдает электроны ферредоксину (Fd). В результате декарбоксилирования пирувата образуется ацетат и, в конечном итоге, АТФ. Fd повторно окисляется гидрогеназой (Hyd) с молекулярным водородом в качестве конечного продукта в цепи переноса электронов внутри гидрогеносомы. Пролекарство метронидазол (RNO 2 ) проникает в гидрогеносому посредством пассивной диффузии, где он конкурирует с гидрогеназой за электроны от Fd.Восстановление метронидазола активирует лекарство до его токсичной нитрорадикальной формы. В присутствии кислорода происходит бесполезная рециркуляция, превращающая радикалы обратно в пролекарство. бык окисленный; красный, редуцированный.
Механизмы действия препаратаГидрогеносома не только является метаболическим центром клетки, но и играет решающую роль в активации лекарств 29, 33 . Метронидазол проникает как в клетку, так и в органеллы посредством пассивной диффузии в качестве пролекарства и конкурирует с концевым ферментом гидрогеназой в качестве акцептора электронов от Fd.Активация препарата происходит, когда электрон переносится на все важные нитрогруппы, образуя токсичный нитрорадикал (рис. 1) 4, 29, 34 . У бактерий радикалы вызывают разрыв хромосом и гибель клеток 35 . Однако точная цель в ядросодержащем организме неизвестна, так как белки и транспорт белков, вероятно, являются основными мишенями 29 . Помимо токсичных радикалов, производство молекулярного водорода нарушается в присутствии метронидазола, что приводит к увеличению внутриклеточной перекиси водорода 29, 36 .В аэробных условиях in vitro кислород превращает радикалы обратно в пролекарство. Таким образом, в анализах чувствительности, проводимых в аэробных условиях, ингибирующие концентрации лекарственного средства выше, чем в анаэробных 4, 34, 37 .
Клиническая лекарственная устойчивостьКлинические изоляты, полученные в результате неудачного лечения, обычно проявляют устойчивость к метронидазолу в аэробных условиях, в то время как некоторые также проявляют анаэробную устойчивость.В недавно опубликованной нами системе анализа клинически устойчивый изолят BRIS / 92 / STDL / B7268 (B7268) имеет анаэробную минимальную ингибирующую концентрацию (МИК) 25 мкМ метронидазола, в то время как МИК чувствительных изолятов составляет 3-6 мкМ 34 (Таблица 1). В аэробных условиях B7268 имеет MIC> 200 мкМ (34 мкМ мкг / мл) метронидазола (таблица 2). Сообщалось, что в зависимости от используемой системы анализа аэробные МИК метронидазола для клинически устойчивых изолятов находятся в диапазоне от 25 мкМ мкг / мл до> 200 мкг мкг / мл (Таблица 2).Набор анализов, описанных в литературе, не позволяет проводить прямые сравнения, но значения, включенные в Таблицу 2, дают некоторое представление об уровнях устойчивости, достигаемых несколькими клиническими изолятами, устойчивыми к метронидазолу. Резистентность обычно возникает после нескольких курсов лечения метронидазолом от трихомониаза или другого состояния, и в большинстве случаев симптомы могут быть окончательно устранены с помощью высоких доз тинидазола и / или метронидазола в течение длительного времени, но в некоторых случаях эти высокие дозы, плохо переносимые методы лечения также являются неудачно (вкладка 3).
Таблица 1 MLC для Trichomonas vaginalis в анализах лекарственной чувствительности Таблица 2 Устойчивость к метронидазолу у T. vaginalis , выделенных в случаях неудачного лечения Таблица 3 Истории болезни неудач лечения трихомониаза Устойчивость in vitroАэробная или, так называемая, частичная устойчивость проявляется, когда кислород конкурирует с метронидазолом за электроны, и это объясняется нарушением путей поглощения кислорода, что позволяет увеличить бесполезную рециркуляцию метронидазола по сравнению с чувствительными штаммами 38 (рис. 1).Сообщения об аэробно устойчивых изолятах указывают на то, что они часто чувствительны в анаэробных условиях 38, 39, 40 . Однако B7268, установленный в нашей лаборатории у пациента из Брисбена с рефрактерной инфекцией 41 , демонстрирует как высокую аэробную, так и анаэробную устойчивость к метронидазолу. Анаэробная или полная резистентность селективно развивается in vitro путем непрерывного культивирования трофозоитов в возрастающих концентрациях метронидазола, как мы и другие сделали 42, 43 .Мы разработали несколько анаэробно устойчивых к метронидазолу линий, обычно способных выжить в культуральной среде, содержащей> 400 мкМ метронидазол 43 . Для сравнения, клинически чувствительные к метронидазолу родительские штаммы, от которых были получены линии с высокой устойчивостью, имеют минимальные значения МПК, равные 3 мкМ 34 (Табл. 1). Процесс индукции лекарственной устойчивости у установленного чувствительного родительского штамма в конечном итоге приводит к сингенным родительским и лекарственно-устойчивым линиям, по которым можно определить критические изменения, вовлеченные в механизм лекарственной устойчивости, и легко сравнить их с клиническими изолятами, как мы активно доказывали. 4, 44 .
Механизмы сопротивленияПервоначально мы индуцировали высокие уровни устойчивости у клинически восприимчивого штамма BRIS / 92 / STDL / F1623 (F1623) путем непрерывного культивирования в сублетальных возрастающих концентрациях (в конечном итоге достигающих 1 м M ) метронидазола, 43 . Это подтвердило аналогичные данные Kulda et al. 42 , где 2 штамма, один чувствительный и один аэробно устойчивый, культивировались в возрастающих концентрациях метронидазола в течение почти 2 лет, пока паразиты не смогли выжить в очень высоких концентрациях метронидазола.Поскольку мы показали, что активность PFOR и уровни Fd были снижены у высокорезистентных к метронидазолу паразитов Giardia 30, 45 , мы сравнили уровни транскрипции этих двух белков в наших сингенных линиях устойчивых к метронидазолу и восприимчивых к метронидазолу T. vaginalis паразитов. Радиоактивно меченные зонды, полученные из 764 п.н. 5′-области гена PFOR и продукта 500 п.н. гена Fd, гибридизовали с мРНК из сингенных линий. Нозерн-блоттинг показал, что 4.Полоса 4 т.п.н. мРНК PFOR и мРНК Fd были представлены только в чувствительном штамме 43 . Наши данные 43 , данные Kulda et al 42 и Quon et al 46 , а также данные Land et al 36 , работающие с паразитом крупного рогатого скота, Tritrichomonas fetus 36 , показали, что Уровни мРНК гидрогеносомных белков PFOR, HYD, Fd и малатного фермента (ME) были снижены до 100%, и гидрогеносомная функция в целом была истощена у устойчивых линий.Однако Ланд и др. 36 и Ярослав Кульда (личное сообщение) недавно сообщили, что обедненные гидрогеносомы присутствуют в устойчивых клетках в таком же количестве, что и чувствительные клетки, но они были значительно меньше в устойчивой линии. По нашему опыту, типичный коричневый цвет трофозоитов T. vaginalis (особенно заметен в гранулированных клетках) из-за наличия в гидрогеносомах белков, содержащих кластер Fe-S, не проявляется в высокорезистентных к метронидазолу клетках, что согласуется с понижающей регуляцией гидрогеносомная функция.
Клинически устойчивые к метронидазолу паразиты растут аэробно, в то время как лабораторно индуцированные высокорезистентные линии нет, и поэтому утверждалось, что они не выживут in vivo . Rasoloson et al., , 38, подтвердили, что снижение экспрессии Fd не является механизмом устойчивости у аэробно-устойчивых клинических изолятов, как наблюдалось в лабораторных линиях с высокой устойчивостью к метронидазолу, и пришел к выводу, что механизм аэробной устойчивости включает нарушенные пути поглощения кислорода.
Когда метронидазол удаляется из культуральной среды линий с высокой устойчивостью к метронидазолу, они не сразу возвращаются к чувствительности и даже после нескольких месяцев отсутствия лекарственного средства все еще демонстрируют некоторый уровень устойчивости (Таблица 4). В то время как наши предварительные результаты указывают на отсутствие очевидной разницы между генотипами сингенных линий, чувствительных к метронидазолу и устойчивых к метронидазолу (данные не показаны), очевидно, что такая медленная и неполная реверсия к восприимчивости предполагает генетические перестройки, произошедшие в течение длительного процесса индукции устойчивости.
Таблица 4 Изменение устойчивости после удаления метронидазола из питательной среды Альтернативные механизмы сопротивленияМы продемонстрировали существование двух альтернативных 2-кетокислотных оксидоредуктаз (OR), KOR1 и KOR2, у резистентных к метронидазолу T. vaginalis 43 . KOR1 присутствует как в лекарственно-устойчивых, так и в чувствительных к лекарствам клетках, и его активность была очевидна в экстрактах клеток Triton.Активность KOR2 наблюдалась только в резистентных к метронидазолу клетках. KOR 1 и 2 не отдают электроны Fd, поскольку нет обнаруживаемой мРНК Fd в резистентных к метронидазолу клетках, в которых мы идентифицировали оба альтернативных OR. Среди анаэробов в целом существует множество альтернативных путей получения энергии; например, четыре различных OR, которые предпочтительно используют субстраты кетокислот, альтернативные пирувату, были идентифицированы в Thermococcus litoralis 47 . Анаэробные простейшие, в отличие от высших эукариот, сохранили разнообразие в использовании альтернативных кетокислот для производства энергии, а у T.vaginalis индолепируват является предпочтительным субстратом двух ферментов KOR 43, 48 .
В дополнение к демонстрации того, что уровни Fd были снижены у резистентных к метронидазолу T. vaginalis , Quon et al. 46 идентифицировали точечную мутацию в 5′-фланкирующей области гена Fd, которая, как они предположили, мешает ДНК-связывающим белкам, в результате чего в снижении транскрипции гена Fd. Также работая с геном Fd, но на этот раз в T. fetus , Лэнд и др. 49 смогли показать, что трансформация устойчивых к метронидазолу клеток геном Fd, который экспрессировался in vivo , приводила к частичной реверсии. к чувствительности клеток.
Kulda и его коллеги 29, 50 утверждают, что дефицит PFOR у T. fetus полностью исключает активацию метронидазола, в то время как T. vaginalis обладает дополнительной системой активации лекарств, которая должна быть устранена до достижения полной устойчивости. Этот альтернативный путь вовлекает НАД-зависимый МЭ в окислительное декарбоксилирование малата в гидрогеносомах и последующее восстановление (или активацию метронидазола) через НАДН: ферредоксин оксидоредуктазу и Fd.
Другие изменения метронидазолустойчивой T. vaginalisПодавление гидрогеносомальной функции — не единственное изменение, наблюдаемое в наших линиях с высокой устойчивостью к метронидазолу. Также происходят морфологические изменения. Мы показали, что прилипание к культуральным пробиркам и 96-луночным планшетам резко увеличивается почти до 100% у устойчивых к метронидазолу линий F1623-M1 и BRIS / 92 / STDL / B7708-M1 по сравнению с их чувствительными к метронидазолу родительскими штаммами F1623 и BRIS / 92 / STDL / B7708, придерживающиеся менее 20% (данные не показаны).Нарушение моторики и увеличенное время генерации также характерны для устойчивых линий. Эти изменения только частично исчезли после отмены препарата в течение нескольких месяцев. Обычно изоляты T. vaginalis демонстрируют ряд морфологий от очень подвижных до в основном прикрепленных, и это первый случай, когда сообщается о феномене индуцированных морфологических изменений, связанных с воздействием метронидазола.
Множественная устойчивость к лекарствамP-гликопротеины (Pgp) представляют собой мембраносвязанные АТФ-зависимые оттокные насосы, содержащие две гомологичные половины, каждая из которых демонстрирует АТФ-связывающую кассету, связанную с 6 трансмембранными альфа-спиралями 51 .Сверхэкспрессия Pgps напрямую связана с фенотипом множественной лекарственной устойчивости (MDR), наблюдаемым как в опухолевых клетках млекопитающих, так и у простейших паразитов Entamoeba и Leishmania 51, 52, 53, 54, 55 . Присутствие Pgps было задокументировано, но интенсивно не изучалось на T. vaginalis 56 . T. vaginalis Pgp (Tvpgp1) подобен по последовательности Pgps млекопитающих и присутствует в 2 копиях в геноме. Повышенная экспрессия мРНК Tvpgp1 была продемонстрирована в нескольких устойчивых штаммах до уровней в диапазоне от 2-3 до 20 раз в одном штамме, но число копий гена не увеличивается в устойчивых штаммах, и четыре из 7 исследованных устойчивых штаммов имели только единственная копия гена Tvpgp1 56 .У клинически устойчивых изолятов T. vaginalis не было показано четкого механизма устойчивости, и неясно, играет ли Pgps роль в устойчивости этих изолятов к метронидазолу. Однако транспорт лекарственного средства из клетки — очевидный кандидатный механизм. Ряд липофильных агентов, включая верапамил, блокатор каналов ионов кальция, способны обратить вспять фенотип MDR in vitro 51, 53, 57, 58 , но многие из этих агентов очень токсичны для хозяина; следовательно, был испытан ряд фармакологически относительно инертных поверхностно-активных веществ.Cremophor EL и Solutol HS 15 являются поверхностно-активными веществами на основе эфиров жирных кислот и зарекомендовали себя как модуляторы MDR 57 . Мы провели предварительные эксперименты с клинически устойчивой к метронидазолу линией B7268 и показали, что включение Cremophor EL (0,05–0,2%) или солутола (874 мкМ ) в анализы чувствительности к метронидазолу снижает MIC с 50 мкМ до 12,5. мкМ . Добавление 100-200 мкМ верапамила также снижает чувствительность восстановления МИК примерно до 6 мкМ.Это наводит на мысль о классическом пути МЛУ, действующем в клинически устойчивой к метронидазолу линии, B7268, и мы проводим дальнейшую работу с использованием других клинически устойчивых линий и других модуляторов, чтобы решить вопросы, касающиеся механизмов устойчивости к метронидазолу у клинических изолятов. Интересно, что, когда модуляторы МЛУ включены в анализы с использованием наших лабораторно индуцированных линий T. vaginalis с высокой устойчивостью к метронидазолу, не наблюдается снижения значений МИК метронидазола по сравнению с лечением одним метронидазолом, что предполагает подавление функции гидрогеносом. является основным механизмом лекарственной устойчивости, действующим в этих линиях.Полученные к настоящему времени данные предполагают множественные механизмы, которые должны перекрываться по функциям, в зависимости от уровня устойчивости, достигая высшей точки в очень высокой анаэробной устойчивости, наблюдаемой у лабораторно индуцированных изолятов.
Перекрестная устойчивостьПерекрестная резистентность между производными 5-нитроимидазола широко наблюдалась у изолятов T. vaginalis . В недавнем исследовании Crowell et al. 59 оценивалась чувствительность 104 клинически устойчивых к метронидазолу изолятов к метронидазолу и тинидазолу.MLC тинидазола были такими же, как MLC метронидазола для 38% изолятов и ниже (что указывает на то, что тинидазол более эффективен, чем метронидазол — в разной степени) в 60% изолятов. Это подчеркивает значительный уровень перекрестной резистентности между двумя препаратами 5-нитроимидазола, но также то, что перекрестная резистентность может быть неполной. Ранее было документально подтверждено, что случаи, резистентные к метронидазолу, в конце концов излечиваются тинидазолом, хотя и в очень высоких дозах (табл. 3). Собел и Браун 60 успешно вылечили 22 из 24 случаев резистентных к метронидазолу инфекций с помощью пероральных высоких доз (500 мг q.i.d) и интравагинальный тинидазол (500 мг два раза в день) в течение 14 дней, и Lewis et al. 61 также сообщают об аналогичном успехе. Однако тинидазол недоступен для лечения в некоторых странах и не одобрен для использования в США.
В 2000 г. были зарегистрированы первые три случая резистентности к метронидазолу T. vaginalis из Финляндии, а изоляты также были устойчивы к 5-нитроимидазолу орнидазолу 62 .
Мы исследовали активность 12 новых и 1 ранее протестированного соединения нитроимидазола против как чувствительного к метронидазолу, так и анаэробно устойчивого T.vaginalis 63 . В то время как 7 из 13 препаратов были такими же или более эффективными, чем метронидазол, против восприимчивых паразитов T. vaginalis , анаэробно-резистентные паразиты были перекрестно устойчивы ко всем нитроимидазолам и, как правило, демонстрировали одинаковый уровень устойчивости ко всем лекарствам.
Альтернативные химиотерапевтические средстваНе существует рекомендуемых альтернативных методов лечения инфекций, вызванных T.vaginalis и использование альтернативных противомикробных препаратов было зарегистрировано с разными результатами. Успешное лечение интравагинальным паромомицином было описано у 33-летней пациентки, страдающей рецидивирующим трихомониазом. Однако у пациента наблюдались неблагоприятные побочные эффекты, включая боль в вульве и изъязвление слизистой оболочки, что могло способствовать оппортунистической инфекции, что делало паромомицин непривлекательным в качестве альтернативного терапевтического средства 64 (Табл. 3). Пессарии с мышьяком и клотримазолом также использовались в сложных случаях с некоторым успехом 65, 66 , а комбинация спринцеваний сульфатом цинка и умеренных доз метронидазола, позволяющая избежать неприятных побочных эффектов высоких доз, оказалась успешной у четырех пациентов, страдающих хроническими заболеваниями. трихомониаз 67 (вкладка 3).
Многие соединения были протестированы против T. vaginalis in vitro , и некоторые из них являются многообещающими. Мощный 5-нитротиазолил, нитазоксанид, был разработан с широким спектром противопаразитарного действия и низкой токсичностью. Он активен против различных паразитов, включая Cryptosporidium parvum in vivo 68 , Entamoeba, Giardia и Blastocystis 69 и, по-видимому, так же эффективен против T. vaginalis 70, как метронидазол 71 .Две серии из трех триоксанов и 18 дизамещенных пероксидов были синтезированы и оценены на их трихомонацидную активность, причем лучшее соединение было примерно в пять раз более активным, чем метронидазол 72 . Метионин-гамма-лиаза, фермент, катализирующий одностадийное превращение метионина в альфа-кетобутират, аммиак и метантиол, очень активен во многих анаэробных патогенных микроорганизмах, но не имеет аналогов у млекопитающих. Этот патоген-специфический фермент использовался в качестве лекарственной мишени, и было показано, что субстрат трифторметионин является высокотоксичным in vitro от до T.vaginalis 73 .
Из-за широкого спектра действий бензотиазольных препаратов, включая нейропротекторное, противосудорожное, антиаллергенное, противомикробное и противоопухолевое, Delmas et al. 74 исследовали антитрихомональную активность различных бензотиазолов. Обычно они проявляли низкую токсичность трофозоитов, но два соединения имели ингибирующие концентрации 1,6 и 2,9 мкМ по сравнению с 3,2 мкМ для метронидазола.
Дисульфирам является ингибитором альдегиддегидрогеназы и традиционно используется при лечении алкоголизма.Было показано, что антитрихомональная активность дисульфирама и его метаболита, дитиокарба, более эффективна, чем метронидазол, против как чувствительных, так и устойчивых трихомонад 75 . Сульфимидазол имеет две функциональные группы: одну сульфонамид, а другую 5-нитроимидазол. Поскольку он активен в отношении аэробных и анаэробных бактерий, он был протестирован против 8 штаммов метронидазол-чувствительных и 4 штаммов резистентных к метронидазолу T. vaginalis 76 . Сульфимидазол проявлял активность, аналогичную метронидазолу, против чувствительных штаммов и был более эффективным, чем метронидазол, против устойчивых штаммов (MLC 10 мк мкг / мл и 40-60 мк мкг / мл, соответственно).
% PDF-1.7 % 534 0 объект > эндобдж xref 534 119 0000000016 00000 н. 0000003700 00000 н. 0000003961 00000 н. 0000003988 00000 н. 0000004043 00000 н. 0000004079 00000 п. 0000004561 00000 п. 0000004748 00000 н. 0000004861 00000 н. 0000004974 00000 н. 0000005087 00000 н. 0000005200 00000 н. 0000005313 00000 н. 0000005425 00000 н. 0000005534 00000 п. 0000005647 00000 н. 0000005760 00000 н. 0000005873 00000 н. 0000005986 00000 н. 0000006099 00000 н. 0000006212 00000 н. 0000006324 00000 н. 0000006436 00000 н. 0000006549 00000 н. 0000006662 00000 н. 0000006774 00000 н. 0000006886 00000 н. 0000006999 00000 н. 0000007112 00000 н. 0000007225 00000 н. 0000007338 00000 н. 0000007448 00000 н. 0000007558 00000 н. 0000007714 00000 н. 0000007862 00000 н. 0000007942 00000 п. 0000008021 00000 н. 0000008102 00000 п. 0000008182 00000 п. 0000008262 00000 п. 0000008341 00000 п. 0000008421 00000 н. 0000008500 00000 н. 0000008580 00000 н. 0000008659 00000 н. 0000008738 00000 н. 0000008816 00000 н. 0000008895 00000 н. 0000008973 00000 н. 0000009053 00000 н. 0000009132 00000 н. 0000009210 00000 п. 0000009290 00000 н. 0000009583 00000 н. 0000010220 00000 п. 0000010444 00000 п. 0000010828 00000 п. 0000010987 00000 п. 0000011151 00000 п. 0000011834 00000 п. 0000012337 00000 п. 0000012440 00000 п. 0000016269 00000 п. 0000016620 00000 п. 0000019027 00000 н. 0000019716 00000 п. 0000020220 00000 п. 0000022674 00000 п. 0000024956 00000 п. 0000025378 00000 п. 0000025713 00000 п. 0000028175 00000 п. 0000030717 00000 п. 0000030862 00000 п. 0000031209 00000 п. 0000031799 00000 п. 0000032038 00000 п. 0000032326 00000 п. 0000032628 00000 п. 0000032849 00000 п. 0000035331 00000 п. 0000038017 00000 п. 0000040663 00000 п. 0000041854 00000 п. 0000048879 00000 н. 0000049231 00000 п. 0000051741 00000 п. 0000060582 00000 п. 0000061023 00000 п. 0000065123 00000 п. 0000065179 00000 п. 0000065468 00000 п. 0000065676 00000 п. 0000066013 00000 п. 0000066238 00000 п. 0000067824 00000 п. 0000068088 00000 п. 0000068630 00000 п. 0000068758 00000 п. 0000115433 00000 н. 0000115472 00000 н. 0000116018 00000 н. 0000116154 00000 н. 0000161019 00000 н. 0000161058 00000 н. 0000166074 00000 н. 0000166132 00000 н. 0000166290 00000 н. 0000166408 00000 п. 0000166491 00000 н. 0000166597 00000 н. 0000166725 00000 н. 0000166904 00000 н. 0000167035 00000 н. 0000167216 00000 н. 0000167367 00000 н. 0000167525 00000 н. 0000003527 00000 н. 0000002731 00000 н.