Стволовая клетка — все статьи и новости
Стволовая клетка — это незрелая (недифференцированная) клетка, из которой может развиться большое количество типов клеток многоклеточного организма.
Стволовые клетки способны к самообновлению — делению без дифференцирования и без изменения фенотипа. В таком состоянии они могут делиться неограниченное количество раз. Важное свойство стволовых клеток — их потентность (возможность образовывать определенное количество типов клеток). Так, тотипотентность означает, что данная стволовая клетка может дать начало любой клетке организма, а плюрипотентность — любой, кроме клетки зародышевых оболочек. Возможности мультипотентной клетки сужены до пределов одного зародышевого листка: так, стволовая клетка из мезодермы может стать родоначальником сердечной мышцы, гладкой мускулатуры желудка, кости, хряща, крови, но не нейронов, которые образуются из эктодермы. Фактически, зигота (оплодотворенная яйцеклетка) также является стволовой клеткой.
Эти клетки могут ощущать химические сигналы, призывающие их переместиться в поврежденные ткани и дифференцироваться, после чего они замещают поврежденные или погибшие клетки, способствуя заживлению.
В последнее время в клиническую практику входит трансплантация стволовых клеток — новый подход к лечению множества заболеваний нервной, сердечно-сосудистой и других систем органов, омоложению, заживлению травм, борьбе со злокачественными новообразованиями.
Важнейшим шагом в изучении стволовых клеток стало открытие японцами Катсутоси Такахаси и Cинъя Яманака способов превращения соматических клеток (клеток тела, к которым не относятся половые) в плюрипотентные стволовые клетки. За изучение индуцированных (полученных искусственно) стволовых клеток Cинъя Яманака и Джон Гердон в 2012 году были удостоены Нобелевской премии по физиологии и медицине.
Термин введен в употребление в 1909 году российским гистологом Александром Максимовым, который открыл стволовые клетки элементов крови.
Изображение: PublicDomainPictures/Wikimedia Commons
Стволовые клетки | GxP News
Стволовые клетки — иерархия особых клеток живых организмов, каждая из которых способна впоследствии изменяться (дифференцироваться) особым образом (то есть получать специализацию и далее развиваться как обычная клетка). Стволовые клетки способны асимметрично делиться, из-за чего при делении образуется клетка, подобная материнской (самовоспроизведение), а также новая клетка, которая способна дифференцироваться.
Стволовые клетки способны асимметрично делиться, из-за чего при делении образуется клетка, подобная материнской (самовоспроизведение), а также новая клетка, которая способна дифференцироваться.
Описание стволовых клеток
Корнем иерархии стволовых клеток является тотипотентная зигота. Первые несколько делений зиготы сохраняют тотипотентность и при потере целостности зародыша это может приводить к появлению монозиготных близнецов. К ветвям иерархии относятся плюрипотентные (омнипотентные) и мультипотентные (бластные) стволовые клетки. Листьями (конечными элементами) иерархии являются зрелые унипотентные клетки тканей организма.
Нишами стволовых клеток называются места в ткани, где постоянно залегают стволовые клетки, делящиеся по мере надобности для дальнейшей дифференциации.
Стволовые клетки размножаются путём деления, как и все остальные клетки. Отличие стволовых клеток состоит в том, что они могут делиться неограниченно, а зрелые клетки обычно имеют ограниченное количество циклов деления.
Когда происходит созревание стволовых клеток, то они проходят несколько стадий. В результате, в организме имеется ряд популяций стволовых клеток различной степени зрелости. В нормальном состоянии, чем более зрелой является клетка, тем меньше вероятность того, что она сможет превратиться в клетку другого типа. Но всё же это возможно благодаря феномену трансдифференцировки клеток (англ. Transdifferentiation).
ДНК во всех клетках одного организма (кроме половых), в том числе и стволовых, одинакова. Клетки различных органов и тканей, например, клетки кости и нервные клетки, различаются только тем, какие гены у них включены, а какие выключены, то есть регулированием экспрессии генов, например, путем метилирования ДНК. Фактически, с осознанием существования зрелых и незрелых клеток был обнаружен новый уровень управления клетками. То есть, геном у всех клеток идентичен, но режим работы, в котором он находится — различен.
В различных органах и тканях взрослого организма существуют частично созревшие стволовые клетки, готовые быстро дозреть и превратиться в клетки нужного типа.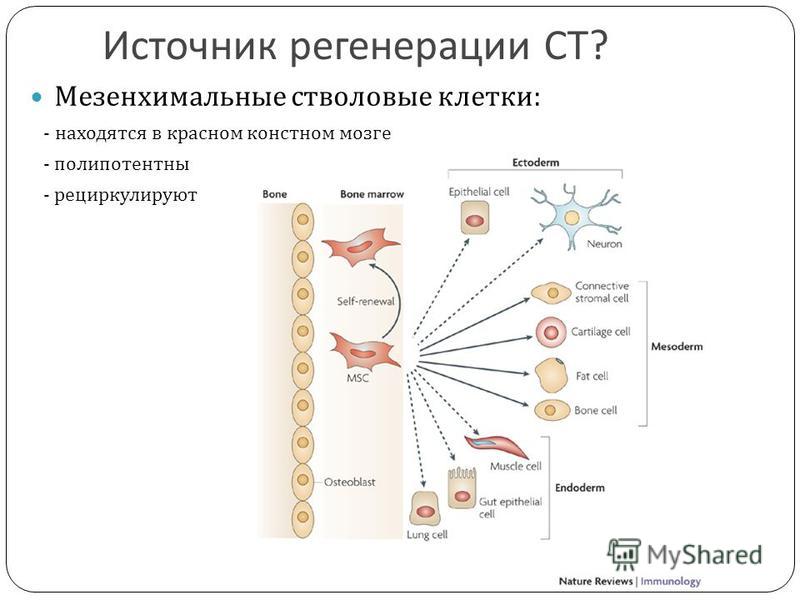 Они называются бластными клетками. Например, частично созревшие клетки мозга — это нейробласты, кости — остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Они называются бластными клетками. Например, частично созревшие клетки мозга — это нейробласты, кости — остеобласты и так далее. Дифференцировку могут запускать как внутренние причины, так и внешние. Любая клетка реагирует на внешние раздражители, в том числе и на специальные сигналы цитокины. Например, есть сигнал (вещество), служащий признаком перенаселённости. Если клеток становится очень много, то этот сигнал сдерживает деление. В ответ на сигналы клетка может регулировать экспрессию генов.
Источник: Википедия
Вернуться на главную страницу Глоссария
Мезенхимальные стволовые клетки | PBKM ITK RU
Мезенхимальные стволовые клетки в настоящее время широко изучаются для использования в регенеративной медицине / клеточной терапии. Результаты испытаний, проводимых более десяти лет, подтвердили эффективность и безопасность применения мезенхимальных стволовых клеток, полученных из спинного мозга, например, в лечении сложных форм лейкемии, осложнений, связанных с трансплантацией кроветворных клеток, а также в других болезнях, таких как: лечении ран, ожогов, повреждений суставов, а также в эстетической медицине. Одним из возможных применений мезенхимальных стволовых клеток, полученных из желе Уортона, является также поддержание лечения БАС.
Одним из возможных применений мезенхимальных стволовых клеток, полученных из желе Уортона, является также поддержание лечения БАС.
Стволовые клетки могут быть взяты из собственных тканей (костного мозга, жира) пациента либо получены от донора. В случае Терапии, проводимой Институтом клеточной терапии, клетки будут отбираться из так называемого желе Уортона. Это желеобразное вещество, обнаруженное в пуповине, чрезвычайно богатая мезенхимальными стволовыми клетками (так называемые WJ-MSC) ткань, окружающая пуповинные сосуды.
Эти клетки обладают способностью дифференцироваться во многие типы специализированных клеток. WJ-MSC обладает характеристиками и свойствами, сходными с мезенхимальными стволовыми клетками из других источников с некоторым преимуществом. Клетки, выделенные из желе Уортона, показывают более короткое время деления и пролиферируют в течение более длительного периода пребывания в культуре, чем клетки BMSC (стволовые клетки, полученные из костного мозга). По сравнению с мезенхимальными клетками костного мозга или жиров, получение WJ-MSC из пуповины — ранее стандартно утилизируемой после родов — намного проще. Получение этих клеток не является источником боли, не создает этических конфликтов и, в отличие от эмбриональных стволовых клеток (ESC), у них нет никаких туморогенных свойств.
Получение этих клеток не является источником боли, не создает этических конфликтов и, в отличие от эмбриональных стволовых клеток (ESC), у них нет никаких туморогенных свойств.
Поскольку мезенхимальные клетки, выделенные из других тканей, WJ-MSC, дифференцируются в остеобласты, адипоциты, хондроциты, эндотелиальные клетки, скелетные мышцы и кардиомиоциты в культуре в пробирке. Кроме того, WJ-MSC клетки обладают способностью трансформироваться в клетки нервной ткани: дофаминергические нейроны, холинергические нейроны, Шванновские клетки, производящие миелиновую оболочку и олигодендроциты. В доклинических исследованиях на крысиной модели инсульта WJ-MSC, введенные в мозг крысы, дифференцируют in vivo в эндотелиальные и нейронные клетки. Таким образом, имплантация клеток WJ-MSC потенциально может внести свой вклад в восстановление тканей нервной системы путем прямого преобразования стволовых клеток в специализированные клетки, позволяя заменить поврежденные болезнью нейроны или олигодендроциты. Кроме того, клетки WJ-MSC также обладают способностью продуцировать белки, секретируемые во внеклеточное пространство, которые стимулируют регенерацию тканей. Среди прочего, WJ-MSC производят ангиогенные факторы, такие как CXCL2, CXCL5 и FGF9 и нейротрофические факторы NTF3, EGF и MDK. Экспрессия этих нейротрофических факторов выше в клетках WJ-MSC по сравнению с BMSC. В исследованиях in vitro показано, что паракринные факторы, продуцируемые WJ-MSC, увеличивают выживаемость и деление первичных кортикальных и мозжечковых нейронов.
Кроме того, клетки WJ-MSC также обладают способностью продуцировать белки, секретируемые во внеклеточное пространство, которые стимулируют регенерацию тканей. Среди прочего, WJ-MSC производят ангиогенные факторы, такие как CXCL2, CXCL5 и FGF9 и нейротрофические факторы NTF3, EGF и MDK. Экспрессия этих нейротрофических факторов выше в клетках WJ-MSC по сравнению с BMSC. В исследованиях in vitro показано, что паракринные факторы, продуцируемые WJ-MSC, увеличивают выживаемость и деление первичных кортикальных и мозжечковых нейронов.
Еще одна особенность WJ-MSC, которая важна с точки зрения клинического применения, — иммуномодулирующие свойства, заключающиеся в ингибировании активации иммунной системы. Лабораторные исследования показали, что WJ-MSC ингибируют пролиферацию стимулированных спленоцитов, Т-лимфоцитов и сами по себе не стимулируют пролиферацию Т-лимфоцитов. Кроме того, WJ-MSC демонстрируют низкую экспрессию костимулирующих рецепторов для Т-лимфоцитов Т CD40, CD80 и CD86, а также высокий уровень экспрессии белков, обладающих иммуносупрессивными свойствами — HLA-G, IL-6, VEGF.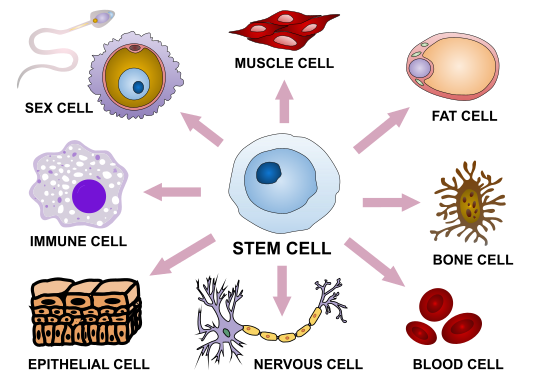 В других исследованиях было продемонстрировано ингибирование дифференцировки моноцитов в дендритные клетки и ингибирование продуцирования провоспалительных факторов TNF-a и IFN-γ стимулированными Т-лимфоцитами.
В других исследованиях было продемонстрировано ингибирование дифференцировки моноцитов в дендритные клетки и ингибирование продуцирования провоспалительных факторов TNF-a и IFN-γ стимулированными Т-лимфоцитами.
Многократное, эффективное использование мезенхимальных стволовых клеток в гематологии, онкологии и трансплантации клеток уже описано, в частности, в:
- предотвращении заболевания трансплантата против хозяина (GvHD)
- лечении острого заболевания трансплантата против хозяина (aGvHD)
- лечения хронической болезни трансплантата против хозяина (cGvHD)
- восстановлении аутологичной гемопоэтической системы
- восстановлении гемопоэтической системы реципиента с помощью аллогенных гематопоэтических стволовых клеток
- лечении токсичности, вызванной химиотерапией и лучевой терапией.
Лимфоцит как общая стволовая клетка различных элементов крови в эмбриональном развитии и постфетальной жизни млекопитающих
Первые клеточные элементы крови образуются, как известно, из так называемых кровяных островков — клеточных скоплений периферического мезенхиматозного мезобласта с неровными границами, связанных между собой в виде сети и расположенных в области area opaca.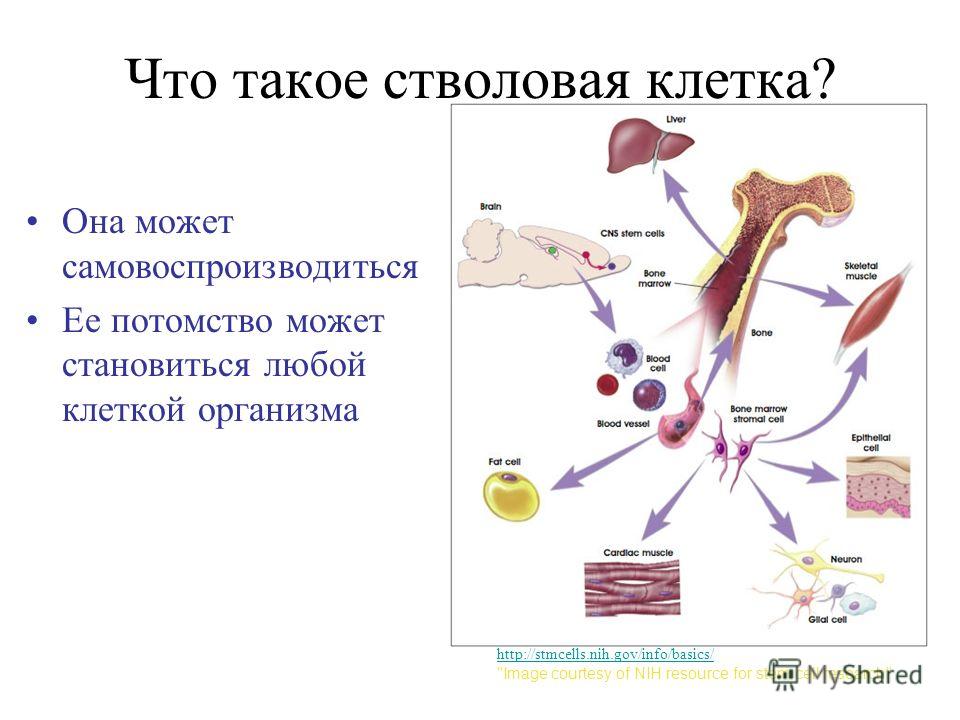 Уплощаясь, периферические клетки кровяных островков становятся эндотелиальными клетками, а внутренние округляются и свободно поступают в качестве первых клеток крови в жидкость, которую можно назвать плазмой крови. Мною теперь обнаружено, что эти примитивные кровяные клетки, как я их называю, никоим образом не являются эритробластами, как следовало бы по общепринятому представлению, а совершенно недифференцированными элементами с круглым светлым ядром и узкой базофильной протоплазмой; они не являются ни красными, ни белыми кровяными тельцами, хотя, скорее всего, их все же можно было бы назвать белыми кровяными тельцами, поскольку они иногда, в особенности у цыплят, имеют амебоидную форму и очень похожи на большие лимфоциты. Они далее размножаются, причем в первое время их число возрастает еще и путем замены эндотелиальных клеток в примитивных сосудах.
Уплощаясь, периферические клетки кровяных островков становятся эндотелиальными клетками, а внутренние округляются и свободно поступают в качестве первых клеток крови в жидкость, которую можно назвать плазмой крови. Мною теперь обнаружено, что эти примитивные кровяные клетки, как я их называю, никоим образом не являются эритробластами, как следовало бы по общепринятому представлению, а совершенно недифференцированными элементами с круглым светлым ядром и узкой базофильной протоплазмой; они не являются ни красными, ни белыми кровяными тельцами, хотя, скорее всего, их все же можно было бы назвать белыми кровяными тельцами, поскольку они иногда, в особенности у цыплят, имеют амебоидную форму и очень похожи на большие лимфоциты. Они далее размножаются, причем в первое время их число возрастает еще и путем замены эндотелиальных клеток в примитивных сосудах.
Спустя некоторое время становится заметным, как эти примитивные кровяные клетки разделяются на два рода. Одни (и таких большинство) вырабатывают в протоплазме гемоглобин и в результате становятся так называемыми примитивными эритробластами. Это – крупные, бурно размножающиеся, и, в конечном счете, весьма богатые гемоглобином клетки с относительно маленькими ядрами. Они служат организму длительное время, но постепенно вымирают и вытесняются дефинитивными эритробластами и эритроцитами.
Это – крупные, бурно размножающиеся, и, в конечном счете, весьма богатые гемоглобином клетки с относительно маленькими ядрами. Они служат организму длительное время, но постепенно вымирают и вытесняются дефинитивными эритробластами и эритроцитами.
Другая часть примитивных клеток крови остается лишенной гемоглобина: эти клетки теперь имеют большое светлое ядро с ядрышками, а также узкий, амебоидный, сильно базофильный ободок протоплазмы. Гистологически они полностью соответствуют понятию большого лимфоцита. Это – первые лейкоциты эмбриона, которые, таким образом, выглядят как лимфоциты.
Как мы теперь увидим, эти внутрисосудистые лимфоциты становятся исходной точкой эритропоэза в area vasculosa. Они образуются при гетеропластическом размножении вторичных эритробластов; вначале появляются мегалобласты меньшего или большего размера со светлыми ядрами, а более поздние поколения все более и более приближаются к типу нормобластов; наконец, в сосудах area vasculosa, среди пестрого клеточного многообразия мы выявляем примитивные эритробласты, очень богатые гемоглобином, а также базофильные лимфоциты и большие количества интенсивно размножающихся мегалобластов и нормобластов, расположенных скоплениями.
Однако, несмотря на продукцию эритробластов, сами эти лимфоциты не могут никак быть описаны как эритробласты, так как уже в желточном мешке они, помимо гемоглобинсодержащих клеток, дают начало также и мегакариоцитам, и различным другим кровяным элементам, не имеющим ничего общего с красными кровяными тельцами.
Эти вторичные эритробласты четко дифференцируются от примитивных и отличаются от них как меньшим объемом, так и, в особенности, у нормобластов, менее крупным и более темным ядром. Наконец, это ядро подвергается пикнозу и в состоянии дегенерации покидает клетку.
Я здесь намеренно не касаюсь вопроса об энуклеации эритробластов, поскольку такая постановка вопроса в настоящее время, как мне кажется, не соответствует имеющемуся в нашем распоряженнии фактическому материалу. Я нахожу, что все известные факты говорят о выталкивании ядра, и ни один – против этого процесса, в то время как за его исчезновение внутри клетки не представлено прямых доказательств – я имею в виду нормальное кроветворение.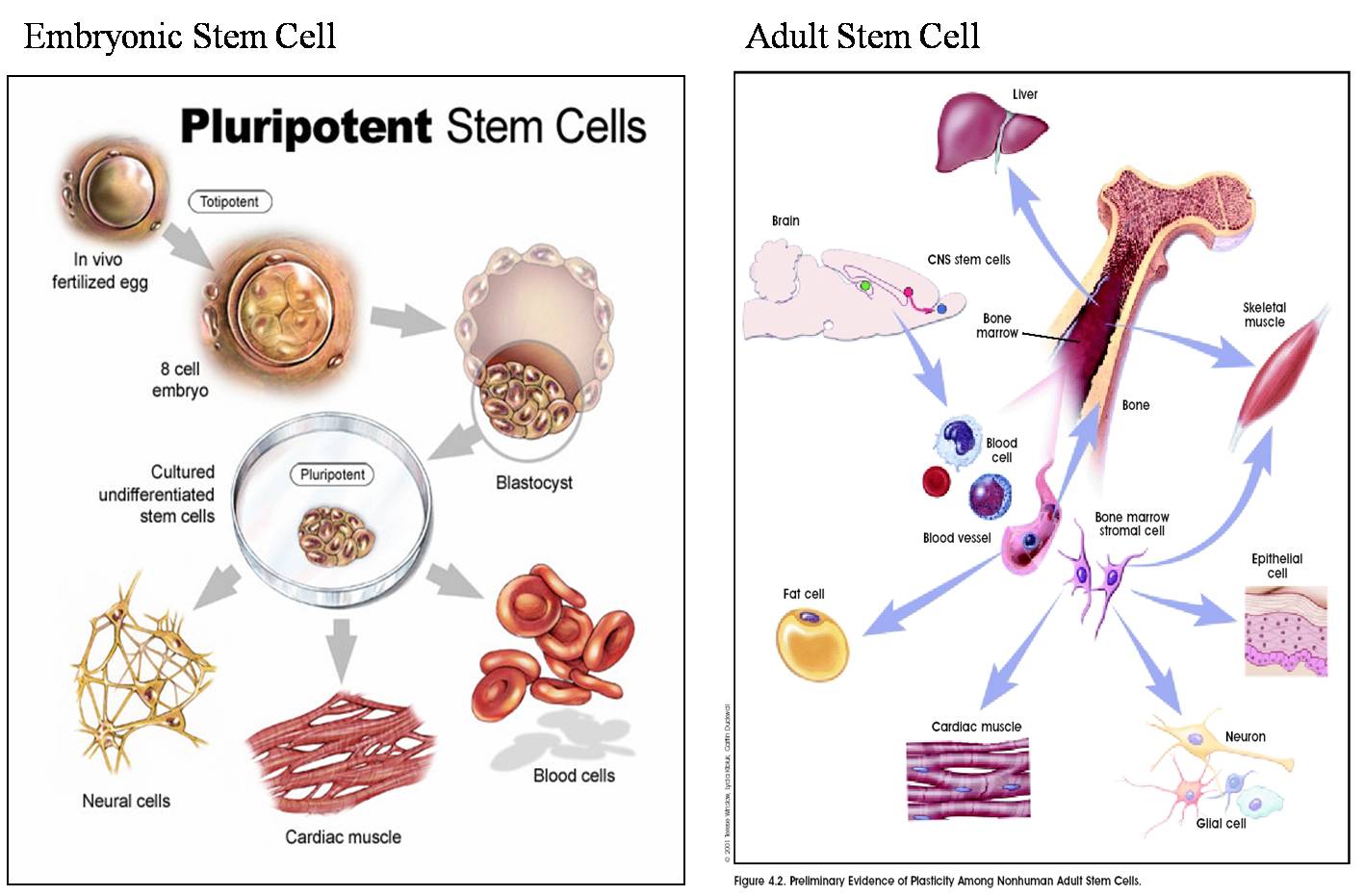
Сосудистая сеть area vasculosa является, таким образом, первым кроветворным органом эмбриона млекопитающих. Здесь возникают лимфоциты, эритроциты и мегакариоциты, но никогда – гранулоциты.
В то время, как разыгрываются описанные процессы во внеэмбриональных областях, в мезенхиме организма, которая вначале полностью свободна от блуждающих клеток, уже на очень ранних стадиях, например, у эмбрионов кроликов и морских свинок длиной 4-5 мм, отмечается появление первых свободных блуждающих клеток. Они возникают путем округления и отделения из обычных недифференцированных ветвистых мезенхимных клеток.
Первые блуждающие клетки в целом сходны с лимфоцитами, что означает, что они большей частью выглядят так же, как и лимфоциты в сосудах area vasculosa.
 Сразу при первом появлении, и еще более на несколько более поздних стадиях, в мезенхиме везде видны также и блуждающие клетки другого рода, например – клетки с бледной, амебоидной, часто вакуолизированной протоплазмой и маленькими, светлыми или темными ядрами неправильной формы. Таким образом, блуждающие клетки в мезенхиме не являются разнообразными, однако они очень полиморфны, и среди них имеются переходные формы. Данные гистологические различия также не имеют особого значения, поскольку основное свойство этих клеток – их прогрессивная способность к развитию – всегда остается неизменным, и все блуждающие клетки мезенхимы равноценны.
Сразу при первом появлении, и еще более на несколько более поздних стадиях, в мезенхиме везде видны также и блуждающие клетки другого рода, например – клетки с бледной, амебоидной, часто вакуолизированной протоплазмой и маленькими, светлыми или темными ядрами неправильной формы. Таким образом, блуждающие клетки в мезенхиме не являются разнообразными, однако они очень полиморфны, и среди них имеются переходные формы. Данные гистологические различия также не имеют особого значения, поскольку основное свойство этих клеток – их прогрессивная способность к развитию – всегда остается неизменным, и все блуждающие клетки мезенхимы равноценны.Однако, наиболее важно то, что блуждающие клетки мезенхимы в морфологическом и физиологическом отношениях также идентичны лимфоцитам area vasculosa, циркулирующим внутри сосудов и в крови. И те, и другие являются свободными амебоидными недифференцированными мезенхимальными клетками, хотя, в зависимости от условий среды, в которой они находятся, эти клетки могут выглядеть очень по-разному.

Так же, как лимфоциты в сосудах area vasculosa, эритробласты продуцируют и мегакариоциты, это происходит и во многих участках мезенхимы. В мезенхиме, однако, дифференцировка и развитие блуждающих клеток или лимфоцитов может проходить еще дальше: часть из них превращается здесь в зернистые миелоциты и лейкоциты. При этом большей частью возникают полиморфноядерные малые абортивные лейкоциты, которые располагаются в ткани как единичные клетки и вскоре подвергаются дегенерации или фагоцитозу.
Доказательством того, что мезенхимные блуждающие клетки идентичы лимфоцитам area vasculosa, является тот факт, что эндотелий определенных тканей, прежде всего аорты, интенсивно разрастается на определенных стадиях и в особых участках, причем возникают большие скопления клеток, которые, выступая в просвет, смываются в кровь и уже в качестве настоящих лимфоцитов примешиваются в циркулирующую кровь. Здесь их совершенно невозможно отличить от лимфоцитов, происходящих из area vasculosa.
Здесь я бы хотел сделать и краткое замечание относительно циркулирующей крови. Несмотря на имеющиеся мнения, фактом является то, что белые кровяные тельца, а также большие лимфоциты, существуют в крови уже с наиболее ранних стадий развития, причем в значительных количествах. Большинство лимфоцитов задерживается, естественно, в качестве продуцентов эритробластов в кроветворной сосудистой сети
Вторым кроветворным органом эмбриона млекопитающих является печень. Среди печеночных клеток и, как известно вне сосудов, здесь образуются эритроциты, мегакариоциты и гранулоциты. Возникает вопрос, а где же искать исходный пункт этого гемопоэза? Если изучать стадии последовательно, то можно обнаружить, что вначале между печеночными клетками и сосудистым эндотелием появляются блуждающие клетки, которые выглядят точно так же, как и блуждающие клетки в остальной мезенхиме; отчасти они сходны с лимфоцитами, но при этом они бледные и имеют мелкие ядра.
 Если же мы пойдем дальше и изучим стадии, на которых балки печеночных клеток врастают в мезенхиму septum transversum, то мы придем к убеждению, что блуждающие клетки являются производными этой мезенхимы. Мезенхимные клетки возникают уже как таковые или еще как блуждающие клетки между печеночными клетками и выстланными эндотелием стенками также растущих сосудов. Здесь вначале они остаются неизменными на протяжении краткого периода. Однако затем они проявляют удивительную способность к развитию. Большинство блуждающих клеток поначалу превращается в растущие большие лимфоциты, которые производят большие количества эритробластов и эритроцитов. Меньшая же их часть превращается в гранулоциты и мегакариоциты. Выходит, что и в печени мы также видим ту же недифференцированную блуждающую мезенхимную клетку, лимфоцит, в качестве исходного пункта гемопоэза. Среди гепатоцитов эта клетка находит весьма благоприятные условия существования, размножается и производит самые различные элементы крови.
Если же мы пойдем дальше и изучим стадии, на которых балки печеночных клеток врастают в мезенхиму septum transversum, то мы придем к убеждению, что блуждающие клетки являются производными этой мезенхимы. Мезенхимные клетки возникают уже как таковые или еще как блуждающие клетки между печеночными клетками и выстланными эндотелием стенками также растущих сосудов. Здесь вначале они остаются неизменными на протяжении краткого периода. Однако затем они проявляют удивительную способность к развитию. Большинство блуждающих клеток поначалу превращается в растущие большие лимфоциты, которые производят большие количества эритробластов и эритроцитов. Меньшая же их часть превращается в гранулоциты и мегакариоциты. Выходит, что и в печени мы также видим ту же недифференцированную блуждающую мезенхимную клетку, лимфоцит, в качестве исходного пункта гемопоэза. Среди гепатоцитов эта клетка находит весьма благоприятные условия существования, размножается и производит самые различные элементы крови.
Третий, конечный орган кроветворения, который выступает на смену печени, — это костный мозг. Его возникновение я также отслеживал с самого начала. Здесь, как мы видим теперь, в молодой, недифференцированной мезенхиме, которая вторгается в хрящ и подвергает его резорбции, часть оседлых элементов превращается в блуждающие клетки, которые вначале выглядят исключительно полиморфными. Здесь почти все они, наконец, приобретают облик типичных лимфоцитов и опять становятся исходным пунктом кроветворения, которое, собственно, протекает так же, как в печени и, как и в ней, возникает вне сосудов, но, в отличие от печени, продолжается всю жизнь. И здесь путем дифференцировки и роста лимфоциты производят эритробласты, мегакариоциты и гранулоциты трех различных видов. Однако часть из них продуцирует также и себе подобных, т.е. типичные агранулярные лимфоциты и тем самым функционируют не только как миелобласты, но и как лимфобласты.
До сих пор, собственно, мы видели в ходе кроветворения только возникновение так называемой миелоидной ткани- эритроцитов, мегакариоцитов и гранулоцитов.
 Теперь можно сказать, а Schridde именно так и заявляет, что клетки, которые я ранее называл лимфоцитами, в действительности являются не таковыми, а миелобластами. Правда, хотя наблюдаемые мной элементы гистологически полностью соответствуют лимфоцитам, можно возразить, что в качестве лимфоцитов или лимфобластов следует описывать лишь те клетки, из которых возникновение типичных малых лимфоцитов является доказанным. Однако по Schridde такие клетки, т.е. истинные лимфобласты должны появляться много позже и выглядеть также совсем по-иному.
Теперь можно сказать, а Schridde именно так и заявляет, что клетки, которые я ранее называл лимфоцитами, в действительности являются не таковыми, а миелобластами. Правда, хотя наблюдаемые мной элементы гистологически полностью соответствуют лимфоцитам, можно возразить, что в качестве лимфоцитов или лимфобластов следует описывать лишь те клетки, из которых возникновение типичных малых лимфоцитов является доказанным. Однако по Schridde такие клетки, т.е. истинные лимфобласты должны появляться много позже и выглядеть также совсем по-иному. Уже, начиная с наиболее ранних стадий, отдельные экземпляры описанных блуждающих клеток могут более или менее походить на типичные малые лимфоциты, но на самом деле последние лишь относительно поздно возникают в организме в больших количествах. В костном мозге мы уже довольно часто видим (и чем позже, тем чаще) как многие клетки-потомки растущих больших лимфоцитов приобретают соответствующий вид. Однако в особо больших количествах малые лимфоциты возникают в тимусе.
 Об этом органе я также в последующем должен сообщить. Знание гистогенеза тимуса очень важно для единого восприятия роли лимфоцитов в организме.
Об этом органе я также в последующем должен сообщить. Знание гистогенеза тимуса очень важно для единого восприятия роли лимфоцитов в организме.Вначале тимус является чисто эпителиальным органом. Затем, уже очень рано в его мезенхимном окружении и других областях организма вновь появляются большие лимфоциты, отчасти – бледные блуждающие клетки с мелкими ядрами. Все эти амебоидные клетки теперь перемещаются в эпителиальную закладку и здесь в кратчайший срок превращаются в типичные большие лимфоциты. Таким образом, вначале происходит, собственно, то же самое, что и в печени: первые лимфоциты тимуса, с точки зрения морфолога, несомненно, являются теми же клетками, что и первые гранулоцитообразующие лимфоциты в печени. Лишь условия существования для этих клеток, очевидно, являются совсем другими, поскольку лимфоциты в тимусе, хотя они и разрастаются исключительно интенсивно, никогда не производят эритробластов и лишь очень малое количество гранулоцитов, но обычно — только подобные себе клетки. Они вскоре инфильтрируют весь орган, становясь при разрастании все мельче и мельче, и, наконец, мы видим неисчислимое множество типичных малых лимфоцитов, которые вымываются в кровь.
Они вскоре инфильтрируют весь орган, становясь при разрастании все мельче и мельче, и, наконец, мы видим неисчислимое множество типичных малых лимфоцитов, которые вымываются в кровь.
Что касается лимфатических узлов, то при возникновении первых из них наблюдается превращение мелких, тесно прилегающих друг к другу недифференцированных мезенхимных клеток в малые амебоидные блуждающие клетки. Здесь также сначала отмечается сильный полиморфизм этих блуждающих клеток; вскоре могут возникать отдельные большие лимфоциты, однако, большей частью вначале появляются совсем небольшие, хотя и амебоидные элементы со светлыми ядрами и скудной протоплазмой. Они разрастаются, при этом частично превращаются в типичные малые лимфоциты с темными ядрами и попадают в лимфатические щели. С другой стороны, видно, что иногда они превращаются и в большие, даже гигантские лимфоциты, которые, как и в тимусе, могут опять производить малые лимфоциты. Таким образом, можно с уверенностью подчеркнуть, что у эмбриона для продукции типичных малых лимфоцитов совсем не обязательно необходимы большие лимфоциты.
__________
Таким образом, исследование фетального кроветворения учит нас, что нельзя различать миелобласты от лимфобластов. Существует единое семейство клеток – повсеместно встречающиеся, недифференцированные, полиморфные, блуждающие мезенхимные клетки, которые, в зависимости от разнообразия условий их обитания в организме эмбриона, выглядят по-разному и могут производить различные клетки-продукты дифференцировки. Чисто гистологически у эмбриона нельзя также отличить лимфобласты от миелобластов.
__________
Рассматривая кроветворение с интересующей нас теперь позиции во взрослом организме, следует, прежде всего, решить два вопроса, которые относятся к клеткам-агранулоцитам. Первый вопрос касается меняющихся взаимоотношений между большими и малыми лимфоцитами. Оба эти понятия были предложены на основе исследований, которые проводились во взрослом организме. Общепринятое представление состоит в том, что малые лимфоциты возникают во взрослом организме фактически путем разрастания более крупных клеток в герминальных центрах, но сами по себе они не способны размножаться далее, превращаясь в большие лимфоциты.
Теперь же, на основании собственных исследований, я думаю занять другую позицию. На самом деле, малые лимфоциты возникают во взрослом организме большей частью путем бурного размножения крупных клеток. Непосредственно после их возникновения, они в течение некоторого времени действительно не способны к размножению. Вероятно, это состояние зависит от особого ядерно-плазматического отношения, связанного с интенсивным предыдущим разрастанием. Однако я считаю с полной уверенностью, что эти зрелые малые лимфоциты в дальнейшем способны к развитию. Они попадают в кровь и циркулируют, а когда встречают подходящие условия, то повторно, в качестве полноценных недифференцированных мезенхимных клеток могут становиться исходным пунктом для разнообразных процессов развития; они, скорее всего, могут, пусть даже путем гипертрофии, вновь трансформироваться в большие лимфоциты, способные к делению. Смысл столь странного явления, состоящего в том, что лимфоциты во взрослом организме большей частью должны проходить стадию маленькой, неспособной к делению в течение определенного период клетки, состоит, как я думаю, в том, что клетки в этом состоянии особенно легко поступают в крово- и лимфоток, а потому могут оказаться повсеместно, во всех органах и тканях. Эта мысль недавно была высказана также Weidenreich.
Малые и большие лимфоциты являются, таким образом, преходящими состояниями в жизни одного и того же семейства клеток – лимфоцитов в наиболее широком смысле слова.
Второй вопрос касается различия между особыми лимфоцитами и миелобластами во взрослом организме. Если это различие в эмбрионе (как мы видели) не имеет обоснования, то исходя из этого, нельзя априорно заключить о невозможности их во взрослом организме. Целый ряд авторов во главе со Schridde также утверждает, что агранулоциты в лимфоидной ткани (с одной стороны) и миелоидной ткани (с другой) являются не одними и теми же большими лимфоцитами, а двумя различными типами клеток, лимфоцитами и миелобластами.
Относительно родовой идентичности двух семейств клеток необходимо, конечно, различать, во-первых, гистологические признаки и, во-вторых – физиологические свойства, в особенности, проспективные потенции к развитию.
Что касается гистологических характеристик обоих семейств клеток, то я дал указания г-ну С.Чащину из моей лаборатории проверить гистологические различия, приведенные Schridde.
Насколько можно судить, исходя из полученных до сих пор результатов, уже у новорожденных животных в большинстве случаев можно отметить соответствующие различия, которые, однако, мало выражены. Лимфоциты обладают, в целом, более узкой, гомогенной каймой протоплазмы, тогда как нуклеолы в ядре крупнее и, как правило, ярко окрашены. Так называемые миелобласты в большинстве случаев, хотя и не всегда, имеют более широкий цитоплазматический ободок с более рыхлой ретикулярной структурой; его базофилия варьирует в широких пределах. Ядро содержит нуклеолы, которые, однако, мельче и не окрашиваются так отчетливо. В целом, миелобласты выглядят намного более полиморфными, нежели лимфобласты, и различия среди самих миелобластов часто более выражены, чем между миелобластами и лимфобластами.
Следует особо обратить внимание на окраску по Altmann-Schridde, которая описана Schridde, как важнейшее средство различения, причем оказалось, что большие клетки, не содержащие гранул при окраске азур-эозином в аденоидной ткани и костном мозге, т.е. лимфобласты и миелобласты по Schridde, в обоих случаях также содержат гранулы, но могут быть как малозернистыми, так и агранулярными; они большей частью содержат лишь немного зерен. Это тоже противоречит Schridde, согласно которому, лимфобласты всегда должны содержать гранулы, а миелобласты, наоборот, их иметь не должны никогда. Напротив, малые и средние лимфоциты содержат всегда многочисленные очень четкие зерна. Наряду с этим окрашиваются также специфические зернышки и эозинофильные гранулы. В целом этот метод дает совершенно такие же картины, как и известные ранее по Altmann, причем он представляется гораздо менее пригодным для изучения клеток крови. Различные детали окраски, на которые ссылается Schridde, не следует серьезно принимать во внимание при различении определенных семейств клеток. Само собой разумеется, что все эти картины зернистости не могут иметь никакого особого значения, поскольку гранулы в одной и той же клетке без сомнения могут возникать заново и опять исчезать в зависимости от ее функционального состояния, даже если они существуют прижизненно.
Следовательно, если налицо определенные нестабильные и с трудом выявляемые гистологические различия, то, с другой стороны, можно предполагать, что клетки лимфатических узлов и костного мозга наверняка находятся в совсем разных условиях среды, и при этом гистологические различия можно было бы удовлетворительно объяснить только этим. Мы же видим, кроме того, что лимфоциты уже после первых эмбриональных стадий отличаются крайней степенью полиморфизма, хотя, несмотря на это, выглядят они совершенно равноценными. Одни лишь гистологические различия не дают нам возможности четкого различения лимфобластов и миелобластов. Такое различение было бы возможным лишь тогда, когда удалось бы доказать, что одни клетки никогда не могут переходить в другие, и что клетки-продукты дифференцировки являются совсем различными для обоих видов при всех возможных условиях.
Мы хотели бы теперь подробнее рассмотреть физиологические или, скорее, продуктивные цитогенетические свойства наших клеток. Если лимфоциты аденоидной ткани и лимфоциты костного мозга являются равноценными клетками, а различные (в норме) продукты дифференцировки можно было бы установить только на основе различных условий существования, то следовало бы попробовать искусственно создать такие условия для лимфоцитов аденоидной ткани, т.е. для предполагаемых лимфобластов, чтобы они смогли дифференцироваться в гранулоциты и эритробласты. Известно однако, что при различных ситуациях в аденоидной ткани может наступать миелоидная трансформация. В целом, теперь также возможно доказать, что последние при этом исходят из аутохтонных элементов. Спрашивается только, какие клетки при этом рассматриваются? Известно, что это не клетки герминальных центров, которые превращаются в миелоциты и эритробласты, но это происходит с клетками, которые расположены в трабекулах лимфатических узлов и красной пульпе селезенки. Как раз теперь дуалисты усматривают в этом доказательство верности их воззрений; по их взглядам, это должны быть особые, предсуществующие миелобласты, совершенно отличные от лимфобластов, которые при этом превращаются в миелоидные элементы или в клетки сосудистой стенки. Другие исследователи опять-таки допускают, что при этом исходным пунктом трансформации являются особые адвентициальные недифференцированные мезенхимные клетки.
В моей лаборатории я дал указание г-же Бабкиной провести специальные опыты на животных, чтобы ближе подойти к решению этого вопроса. В селезенке очень легко удалось вызвать отчасти миелоидное превращение, а именно, образование миелоцитов и миелокариоцитов; для этого достаточно ввести асептическое чужеродное тело в ткань селезенки (в его окружении скоро обнаруживаются многочисленные миелоциты и мегакариоциты). Напротив, в лимфатических узлах пока не удалось вызвать миелоидного превращения этим или другими методами. В селезенке мальпигиевы тельца также остаются неизмененными: миелоциты всегда возникают только в красной пульпе или в венозных синусах.
Эти опыты на первый взгляд указывают также на различия миелобластов и лимфобластов. Тем не менее, я не считаю, что именно такие предварительные результаты могли бы это означать. Мы должны подумать о том, что в аденоидной ткани, в отличие от остальных областей организма, должны господствовать совершенно особые условия, которые, вероятно, пригодны для гомопластического размножения недифференцированных мезенхимных клеток (лимфоцитов). В этих зонах «брожения» обычно полностью отсутствуют предпосылки для миелоидного превращения лимфоцитов. Оба этих варианта условий, которые нужны, с одной стороны, для гомопластического роста в неизмененном недифференцированном состоянии, а с другой – для гетеропластического развития в миелоидные элементы, нельзя, очевидно, объединить друг с другом во взрослом организме. Поэтому и в искусственных условиях не удается заставить клетки герминальных центров и молодые малые лимфоциты на месте их образования переходить непосредственно в гранулоциты и эритробласты. Там же, где начинается миелоидная трансформация, напротив, прекращается гомопластическое разрастание, и зародышевые центры исчезают.
Вероятно, молодость подавляющего большинства лимфоцитов аденоидной ткани сама по себе является препятствием для миелоидного превращения. Для этих клеток, возможно, должно пройти определенное время, пока они станут способными к миелоидной дифференцировке, и, кроме того, они для этого должны попасть в особые подходящие условия существования. Можно предположить, что, например, циркуляция в кровотоке лимфоцитов, происходящих из аденоидной ткани, особенно благоприятствует миелоидному превращению.
Если все это представляет собой косвенные, вероятно, сомнительные указания на равноценность лимфоцитов лимфоидных и миелоидных тканей в отношении их дальнейшей потенции к развитию во взрослом организме, то, по моему мнению, существует и еще одно прямое, пока еще предварительное, доказательство, исходящее от разных авторов, описывавших гетеротопное образование миелоидных тканей, на которое слишком мало обращали внимания.
В свое время я изучал гистогенез миелоидных тканей, который развивается в почках кролика при перевязке их главных сосудов. Этот объект особенно выгоден в том смысле, что в скудной строме почек, наверное, отсутствуют лимфоидные элементы. Выяснилось, что при этом все костномозговые элементы, гранулоциты, мегакариоциты и эритробласты возникают из лимфоцитов циркулирующей крови, т.е. – из клеток, которые, как доказано, происходят из аденоидной ткани с ее зародышевыми центрами. Малые лимфоциты крови при этом превращаются в большие лимфоциты и поступают в ткань в виде малых или уже крупных клеток. Еще внутри сосудов, или же после эмиграции из них, они далее формируют миелоциты (при накоплении гранул в протоплазме), или эритробласты (посредством выработки гемоглобина в эритробластах). Собственно миелобласты в нормальной крови, видимо, не присутствуют, хотя K.Ziegler считает большие мононуклеарные клетки в качестве таких длительно недифференцированных и способных к развитию клеток. Но таковые, согласно новейшим данным, также возникают из обычных лимфоцитов.
Я считаю допустимым, что при гетеротопическом возникновении миелоидных элементов у человека, это может, вероятно, происходить благодаря имеющимся повсюду лимфоцитам циркулирующей крови или совершенно равноценным лимфоцитам соединительной и аденоидной тканей, но не за счет латентных миелобластов или предполагаемых размножающихся адвентициальных клеток, или же клеток сосудистой стенки.
В целом, наконец, я прихожу к заключению о том, что и во взрослом организме нет основания признавать существование двух резко различающихся родов клеток, миелобластов и лимфобластов. В организме млекопитающих существует один вид клеток, лимфоциты в наиболее широком смысле слова, которые, в зависимости от локализации и условий существования выглядят по-разному и могут формировать различные продукты дифференцировки. Лимфоциты вездесущи, они повсюду равноценны и не могут быть различимы с позиций гистогенеза или гематогенеза. В аденоидной ткани при гомопластическом разрастании постоянно продуцируются только лимфоциты. Возникающая при этом легко транспортируемая клеточная форма — малый лимфоцит — циркулирует в крово- и лимфотоке по всему организму и, после определенного периода инактивации, снова приобретает полную способность к развитию.
Оригинальная публикация в: Folia Haematologica 8.1909, 125-134. (Перевод на русский язык для журнала «Клеточная терапия и трансплантация» том 1, номер 3, 2009, подготовили Чухловин А.Б., Неворотин А.И.)
«Гибнут тонны клеток». Как полностью обновить организм человека
https://ria.ru/20210220/kletki-1598229587.html
«Гибнут тонны клеток». Как полностью обновить организм человека
«Гибнут тонны клеток». Как полностью обновить организм человека — РИА Новости, 20.02.2021
«Гибнут тонны клеток». Как полностью обновить организм человека
Каждую секунду в организме человека обновляется почти 3,8 миллиона клеток. В день — около 330 миллиардов. С возрастом или из-за болезней эта способность… РИА Новости, 20.02.2021
2021-02-20T08:00
2021-02-20T08:00
2021-02-20T08:12
наука
здоровье
биология
кровь
клетки
днк
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155159/83/1551598383_0:319:3072:2047_1920x0_80_0_0_ea67ef115b9d82f17c8005e922b28fc0.jpg
МОСКВА, 20 фев — РИА Новости, Альфия Еникеева. Каждую секунду в организме человека обновляется почти 3,8 миллиона клеток. В день — около 330 миллиардов. С возрастом или из-за болезней эта способность слабеет. Но недавно российские ученые выяснили: процессами восстановления можно управлять. Непрерывная регенерацияШведский биолог Джонас Фрисен вместе с коллегами опубликовал в 2005 году работу со скучным названием «Ретроспективный мониторинг рождения человеческих клеток» («Retrospective Birth Dating of Cells in Humans»). Она посвящена продолжительности жизни отдельных клеток организма, которые, как доказали ученые, меняются по-разному в зависимости от типа. Одни — скажем, клетки кишечника — живут в среднем 10,7 года, другие — как эпителий — обновляются каждые пять дней. А некоторые неизменны на протяжении всей жизни — например, клетки сетчатки.Но читатели не из академической среды обратили внимание совсем на другие цифры — на среднюю продолжительность жизни человеческой клетки. По подсчетам Фрисена, она составляет от семи до десяти лет. Неправильная интерпретация этих данных, видимо, и породила миф о том, что тело полностью обновляется каждые семь лет. Однако это не так — процесс замещения старых клеток идет постоянно.»В течение жизни в теле человека образуются и погибают тонны клеток: разрушаются до аминокислот, липидов и нуклеотидов, из которых потом в тех же органах и тканях формируются новые. Регенерация идет за счет трех процессов: деления дифференцированных клеток, дифференцировки стволовых и перепрограммирования одних зрелых клеток в другие», — объясняет Всеволод Ткачук, директор Института регенеративной медицины Медицинского научно-образовательного центра МГУ им. М. В. Ломоносова, академик РАН. Ткань без шрамов и рубцовПо данным израильских ученых, за день в организме человека возникает 330 миллиардов новых клеток. Большинство принадлежит крови — это эритроциты и нейтрофилы. Они образуются из гематопоэтических клеток костного мозга, и на них приходится 86 процентов общей численности ежедневно появляющихся клеток. Еще 12 процентов — это эпителиальные клетки ЖКТ, а 1,1 процента — клетки кожи. На другие типы клеток, которые живут от нескольких дней до 15 лет (например, скелетные мышцы), остается меньше одного процента. Они образуются из плюрипотентных стромальных клеток, открытых в прошлом веке советским биологом Александром Фриденштейном. И именно они больше всего интересуют ученых.»Сегодня понятно, что источник обновления — стволовые клетки. Они трансформируются в клетки крови, нервных тканей, костей, хрящей, жира. С годами количество стволовых клеток уменьшается. Более того, в некоторых органах они иногда заканчиваются раньше времени: например, если человек серьезно болел. И к преклонному возрасту, когда этот ресурс очень нужен, его уже нет. Пока мы не знаем, как регулировать клеточную гибель. Когда мы научимся это делать, сможем управлять процессами обновления внутри организма, а не выращивать что-то вне его, как сейчас происходит в рамках тканевой инженерии и генно-клеточной терапии», — рассказывает Ткачук.По его словам, сейчас уже ясно, что мультипотентные стромальные клетки могут трансформироваться в другие клеточные типы под действием гормонов и особых белков — факторов роста. Именно их и пытаются идентифицировать специалисты, занятые в проекте академика «Фундаментальные проблемы регенеративной медицины: регуляция обновления и репарации тканей человека» (поддержан грантом Президентской программы исследовательских проектов РНФ). Участники проекта обнаружили белок, который позволяет восстанавливать ткани без образования рубцов.»Любое повреждение может заканчиваться формированием рубца. Это трагедия, если, например, задет спинной мозг: через рубец не прорастет ни сосуд, ни нерв. Но есть ткани, где после повреждения идет не фиброз, а регенерация. Например, так восстанавливаются кости. Или эндометрий — у молодых женщин он сотни раз погибает и возрождается без образования рубцов. Оказалось, что его клетки секретируют некий фактор, тормозящий фиброз. Если мы поймем, как им манипулировать, то сможем в будущем разработать препарат для регенерации поврежденных органов», — говорит ученый.Восстановленный мозгНамного дальше исследователи продвинулись в попытках восстановить мозг после инсульта. У больных мышей, которым вкалывали специальный препарат, размеры повреждений мозга значительно уменьшались.»В секретоме (так называют все вырабатываемые клеткой белки. — Прим. ред.) мультипотентных стромальных клеток есть два важных белка — нейротрофный фактор BDNF и урокиназа (uPA). Они стимулируют рост сосудов и нервных волокон. Если ввести эти белки в организм, то они будут действовать всего несколько часов, и толку от этого немного, ведь морфогенез у человека идет недели и месяцы, — продолжает академик. — Поэтому мы применили «эндогенный шприц» с этими веществами. Сконструировали плазмиды (обособленные от хромосом молекулы ДНК. — Прим. ред.), которые несли гены, ответственные за выработку BDNF и урокиназы. Затем ввели эту генетическую конструкцию в зону, где хотели прорастить сосуды или нервные окончания. Плазмида проникла в клетки ткани-мишени, транскрибировалась там, и клетки начали секретировать BDNF и uPA. В результате в местах концентрации этих белков проросли сосуды и аксоны, а поврежденный периферический нерв у мышей регенерировал».По его словам, результаты эксперимента помогут создать эффективное и безопасное средство для лечения геморрагического инсульта. Оно станет вторым на счету исследовательского коллектива. Так, недавно ученые разработали препарат против мужского бесплодия, изучив механизм восстановления сперматогенеза — образования мужских половых клеток — после повреждения. «Мы не ставили перед собой практических целей, просто анализировали на модели, как идет сперматогенез, как он включается и выключается. Оказалось, если мы вносим в семенники секрет мезенхимных (мультипотентных стволовых. — Прим. ред.) клеток или же сами эти клетки, то восстанавливается и морфология органа, и сперматогенез. Мы проверили эти выводы на уровне одиночных клеток, затем на животных. Все работает, — подчеркивает Ткачук. — Сейчас препарат проходит доклинические исследования. Вообще, наши результаты говорят о возможности стимуляции регенеративных процессов путем воздействия на нишу стволовых клеток (так называют микроокружение стволовой клетки, необходимое для ее жизнедеятельности и координации ее поведения с нуждами организма. — Прим. ред.)». Академик отмечает, что человеческий организм — «самообновляющаяся машина» с мощным потенциалом регенерации и репарации. Уже известны сотни гормонов и белков, которые регулируют процессы образования и гибели клетки. Если понять, как ими правильно манипулировать, то в будущем появится совершенно новый вид регенеративной терапии. Она даст возможность не только лечить болезни, но и значительно продлевать жизнь.
https://ria.ru/20201026/kletki-1581559019.html
https://ria.ru/20190301/1551488034.html
https://ria.ru/20191203/1561927944.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155159/83/1551598383_540:299:2872:2048_1920x0_80_0_0_de241265c1c09412b6d841daeb559217.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
здоровье, биология, кровь, клетки, днк
МОСКВА, 20 фев — РИА Новости, Альфия Еникеева. Каждую секунду в организме человека обновляется почти 3,8 миллиона клеток. В день — около 330 миллиардов. С возрастом или из-за болезней эта способность слабеет. Но недавно российские ученые выяснили: процессами восстановления можно управлять.
Непрерывная регенерация
Шведский биолог Джонас Фрисен вместе с коллегами опубликовал в 2005 году работу со скучным названием «Ретроспективный мониторинг рождения человеческих клеток» («Retrospective Birth Dating of Cells in Humans»). Она посвящена продолжительности жизни отдельных клеток организма, которые, как доказали ученые, меняются по-разному в зависимости от типа. Одни — скажем, клетки кишечника — живут в среднем 10,7 года, другие — как эпителий — обновляются каждые пять дней. А некоторые неизменны на протяжении всей жизни — например, клетки сетчатки.Но читатели не из академической среды обратили внимание совсем на другие цифры — на среднюю продолжительность жизни человеческой клетки. По подсчетам Фрисена, она составляет от семи до десяти лет. Неправильная интерпретация этих данных, видимо, и породила миф о том, что тело полностью обновляется каждые семь лет. Однако это не так — процесс замещения старых клеток идет постоянно.
«В течение жизни в теле человека образуются и погибают тонны клеток: разрушаются до аминокислот, липидов и нуклеотидов, из которых потом в тех же органах и тканях формируются новые. Регенерация идет за счет трех процессов: деления дифференцированных клеток, дифференцировки стволовых и перепрограммирования одних зрелых клеток в другие», — объясняет Всеволод Ткачук, директор Института регенеративной медицины Медицинского научно-образовательного центра МГУ им. М. В. Ломоносова, академик РАН. 26 октября 2020, 12:51Распространение коронавирусаВ МГУ выяснили, что стволовые клетки человека могут заражаться SARS-CoV-2Ткань без шрамов и рубцов
По данным израильских ученых, за день в организме человека возникает 330 миллиардов новых клеток. Большинство принадлежит крови — это эритроциты и нейтрофилы. Они образуются из гематопоэтических клеток костного мозга, и на них приходится 86 процентов общей численности ежедневно появляющихся клеток. Еще 12 процентов — это эпителиальные клетки ЖКТ, а 1,1 процента — клетки кожи.На другие типы клеток, которые живут от нескольких дней до 15 лет (например, скелетные мышцы), остается меньше одного процента. Они образуются из плюрипотентных стромальных клеток, открытых в прошлом веке советским биологом Александром Фриденштейном. И именно они больше всего интересуют ученых.
«Сегодня понятно, что источник обновления — стволовые клетки. Они трансформируются в клетки крови, нервных тканей, костей, хрящей, жира. С годами количество стволовых клеток уменьшается. Более того, в некоторых органах они иногда заканчиваются раньше времени: например, если человек серьезно болел. И к преклонному возрасту, когда этот ресурс очень нужен, его уже нет. Пока мы не знаем, как регулировать клеточную гибель. Когда мы научимся это делать, сможем управлять процессами обновления внутри организма, а не выращивать что-то вне его, как сейчас происходит в рамках тканевой инженерии и генно-клеточной терапии», — рассказывает Ткачук.
По его словам, сейчас уже ясно, что мультипотентные стромальные клетки могут трансформироваться в другие клеточные типы под действием гормонов и особых белков — факторов роста. Именно их и пытаются идентифицировать специалисты, занятые в проекте академика «Фундаментальные проблемы регенеративной медицины: регуляция обновления и репарации тканей человека» (поддержан грантом Президентской программы исследовательских проектов РНФ).
Участники проекта обнаружили белок, который позволяет восстанавливать ткани без образования рубцов.
«Любое повреждение может заканчиваться формированием рубца. Это трагедия, если, например, задет спинной мозг: через рубец не прорастет ни сосуд, ни нерв. Но есть ткани, где после повреждения идет не фиброз, а регенерация. Например, так восстанавливаются кости. Или эндометрий — у молодых женщин он сотни раз погибает и возрождается без образования рубцов. Оказалось, что его клетки секретируют некий фактор, тормозящий фиброз. Если мы поймем, как им манипулировать, то сможем в будущем разработать препарат для регенерации поврежденных органов», — говорит ученый.
Восстановленный мозг
Намного дальше исследователи продвинулись в попытках восстановить мозг после инсульта. У больных мышей, которым вкалывали специальный препарат, размеры повреждений мозга значительно уменьшались.«В секретоме (так называют все вырабатываемые клеткой белки. — Прим. ред.) мультипотентных стромальных клеток есть два важных белка — нейротрофный фактор BDNF и урокиназа (uPA). Они стимулируют рост сосудов и нервных волокон. Если ввести эти белки в организм, то они будут действовать всего несколько часов, и толку от этого немного, ведь морфогенез у человека идет недели и месяцы, — продолжает академик. — Поэтому мы применили «эндогенный шприц» с этими веществами. Сконструировали плазмиды (обособленные от хромосом молекулы ДНК. — Прим. ред.), которые несли гены, ответственные за выработку BDNF и урокиназы. Затем ввели эту генетическую конструкцию в зону, где хотели прорастить сосуды или нервные окончания. Плазмида проникла в клетки ткани-мишени, транскрибировалась там, и клетки начали секретировать BDNF и uPA. В результате в местах концентрации этих белков проросли сосуды и аксоны, а поврежденный периферический нерв у мышей регенерировал».
1 марта 2019, 19:13НаукаУченые впервые омолодили стволовые клетки в мозге мышейПо его словам, результаты эксперимента помогут создать эффективное и безопасное средство для лечения геморрагического инсульта. Оно станет вторым на счету исследовательского коллектива. Так, недавно ученые разработали препарат против мужского бесплодия, изучив механизм восстановления сперматогенеза — образования мужских половых клеток — после повреждения.
«Мы не ставили перед собой практических целей, просто анализировали на модели, как идет сперматогенез, как он включается и выключается. Оказалось, если мы вносим в семенники секрет мезенхимных (мультипотентных стволовых. — Прим. ред.) клеток или же сами эти клетки, то восстанавливается и морфология органа, и сперматогенез. Мы проверили эти выводы на уровне одиночных клеток, затем на животных. Все работает, — подчеркивает Ткачук. — Сейчас препарат проходит доклинические исследования. Вообще, наши результаты говорят о возможности стимуляции регенеративных процессов путем воздействия на нишу стволовых клеток (так называют микроокружение стволовой клетки, необходимое для ее жизнедеятельности и координации ее поведения с нуждами организма. — Прим. ред.)».Академик отмечает, что человеческий организм — «самообновляющаяся машина» с мощным потенциалом регенерации и репарации. Уже известны сотни гормонов и белков, которые регулируют процессы образования и гибели клетки. Если понять, как ими правильно манипулировать, то в будущем появится совершенно новый вид регенеративной терапии. Она даст возможность не только лечить болезни, но и значительно продлевать жизнь.
3 декабря 2019, 18:57НаукаУченые придумали, как лечить рак стволовыми клеткамиРоссийские ученые выяснили, что стволовые клетки способны сами определять свою судьбу
Группа ученых из Московского государственного университета имени М.В. Ломоносова, Института физиологии имени И.П. Павлова и Института биологии гена РАН выяснили, что пласт из стволовых клеток обладает очень неоднородной структурой. Для него характерны произвольно сформировавшиеся плотные образования, в которых клетки дифференцируются в кости и хрящи более эффективно, чем остальные. Подобное явление происходит в процессе формирования соединительных тканей плода в утробе матери. Исследование российских ученых опубликовано в научном издании Biomedicines.
Как известно, регенерация выполняет одну из главных защитных функций любого живого организма. В многоклеточных системах обновлением тканей занимаются разнообразные стволовые клетки, обладающие уникальной способностью дифференциации ― превращения в особые клетки одной или нескольких тканей.
Мультипотентные мезенхимные стромальные клетки (ММСК) занимают главное место в процессе регенерации: они служат источником формирования костей, хрящей и жировых тканей. Эти клетки содержатся практически во всех органах. Благодаря сигнальным молекулам костный мозг отправляет ММСК по кровеносным сосудам в участки организма, которые требуют срочного восстановления тканей. Ученые задались вопросом, как именно клетки самостоятельно формируются в упорядоченную структуру, даже если те находятся в самых неподходящих условиях для жизни.
Павел Макаревич, участник исследования, заведующий лабораторией генно-клеточной терапии, кандидат медицинских наук, доцент факультета фундаментальной медицины МГУ имени М.В. Ломоносова, рассказал, что механизм самоорганизации ММСК определяет построение стромы, соединительнотканного компонента любого органа. Взаимодействие ММСК и стромы способствуют выживанию, делению, дифференцировке и миграции стволовых и специализированных клеток. Таким образом, строма определяет дальнейшую судьбу клеток в поврежденной ткани.
«Как правило, при заживлении формируется соединительнотканный рубец, лишенный функции этого органа. Однако если мы поймем, как ММСК определяют, в какой тип клеток превращаться, то мы сможем приблизиться к расшифровке механизма полной регенерации», — объяснил ученый.
В основу исследования легла клеточная модель первичной соединительной ткани на основе пласта, которую также используют при хирургическом устранении повреждений организма. Эти пласты синтезируют в той же среде, в которой формируются костные, жировые и хрящевые ткани. Ученые следили, как изменяется процесс формирования структур ММСК, чтобы оценить различные варианты дифференциации клеток.
В ходе эксперимента клетки формировали уплотнения, в которых создавались соединительные ткани, которые по строению напоминали костные и хрящевые. Впоследствии оказалось, что в этих уплотнениях резко повышалась активность генов, которые отвечают за формирование преимущественно плотных тканей. Также ученые выяснили, что эти гены подавляют образование белковых структур, которые помогают стромальным клеткам преобразовываться в жировые ткани: похожее явление отмечают во время беременности, когда формируются соединительные ткани плода.
«В какой-то степени это новый взгляд на хорошо изученную конструкцию в виде клеточного пласта из ММСК — все его воспринимают как «пластырь» из клеток, однако даже в этой примитивной конструкции мы обнаружили разделение культуры на группы с разными свойствами. Мы пытаемся взглянуть на задачи регенеративной медицины с позиции биологии развития и ищем параллели между процессами, определяющими формирование ткани в эмбриогенезе, и тем, как ведут себя стволовые клетки взрослого организма. Такой подход очень перспективен для восстановления утраченных тканей; в будущем, возможно, мы сможем залечивать раны без рубцов», — прокомментировал Павел Макаревич.
В центре внимания раковые стволовые клетки
История онкологии началась с незапамятных времён. Первые систематические попытки лечения опухолей предпринимались ещё в Древнем мире. С тех пор прошло несколько тысячелетий, но и сейчас в подавляющем большинстве случаев полное излечение злокачественных новообразований недостижимо. Однако теперь мы хотя бы знаем, что за преграда не даёт нам достигнуть заветной цели. Раковые стволовые клетки, практически никому не известные ещё каких-нибудь пятнадцать лет назад, сегодня оказались в центре внимания учёных. Выяснилось, что буквально все клинические проблемы, от устойчивости онкологических заболеваний к различным препаратам до фатальных рецидивов спустя десятилетия после кажущегося исцеления, связаны с этими клетками.Рудольф Людвиг Карл Вирхов (1821—1902) — немецкий врач, антрополог, патолог и биолог, «отец» современной патологии, автор многих открытий.
Питер Ноуэлл (университет Пенсильвании, США, на фото — слева) и Дэвид Хангерфорд (Фокс Чэйс Раковый центр при Институте исследования рака, США) — первооткрыватели филадельфийской хромосомы (1960).
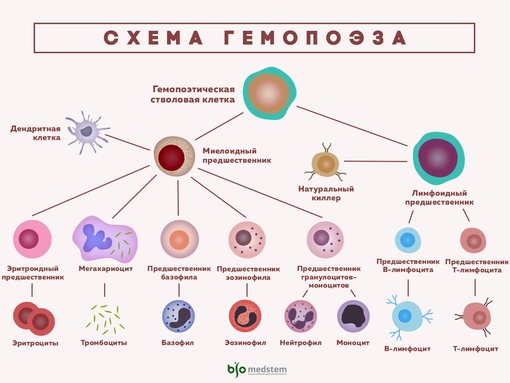
Схема процесса образования клеток крови (гемопоэза). Плюрипотентные кроветворные стволовые клетки костного мозга дифференцируются в стволовые клетки — предшественники миелоидного (миелоидные стволовые клетки) и лимфоидного (лимфоидные стволовые клетки) ря
Схематическое изображение возможных механизмов гетерогенности опухолевых клеток. Внизу — фенотипические различия раковых клеток первичной опухоли и метастазов.
‹
›
Модель раковых стволовых клеток (РСК) подразумевает, что любое злокачественное новообразование (неоплазия) развивается из одной клетки. В результате неких событий генетический аппарат некогда нормальной клетки трансформируется настолько, что происходит её перерождение в инициирующую раковую клетку. В результате последующей пролиферации (деления) этой клетки формируется злокачественная опухоль. Согласно концепции РСК, эта опухоль устроена иерархически, то есть разные типы раковых клеток обладают разной способностью к делению.
Раковые стволовые клетки составляют лишь небольшую популяцию опухолевых клеток. Однако, будучи истинно стволовыми клетками, они (и только они) способны к неограниченному числу делений и постоянному самовоспроизведению. Число делений остальных клеток, если они способны к пролиферации (то есть формально обладают неким стволовым потенциалом), строго ограничено.
В основе процесса самовоспроизведения РСК лежит так называемый асимметричный тип деления стволовых клеток, который заключается в том, что родительская стволовая клетка даёт начало двум клеткам. Одна из них — с такими же стволовыми свойствами, что и материнская, другая же способна к ограниченному числу делений и поэтому называется частично дифференцированной, временно пролиферирующей раковой клеткой. Конечные потомки таких клеток — раковые клетки, не способные к делению. Их называют терминально дифференцированными. Соответственно иерархия опухолевой ткани выглядит так: раковые стволовые клетки → временно пролиферирующие раковые клетки → терминально дифференцированные раковые клетки. Два последних типа клеток образуют при этом основную массу опухоли.
Точно такая же иерархия имеет место и в нормальных тканях, стволовые клетки которых, способные к самовоспроизведению и поддержанию собственной популяции, также дают начало ограниченно пролиферирующим клеткам — предшественникам зрелых клеток. Эти зрелые тканевые клетки не способны к делению вовсе и погибают через какое-то время после выполнения свойственных им функций.
Итак, согласно модели раковых стволовых клеток, не все опухолевые клетки обладают равной способностью к делению и самовоспроизведению. И несмотря на то что основная масса опухоли состоит из злокачественных клеток той или иной степени дифференцировки, её рост и развитие определяются небольшой по численности, но наивысшей в иерархии популяцией раковых стволовых клеток.
Упреждая аргументы критиков РСК-модели, следует отметить, что некоторые злокачественные новообразования не вписываются в эту модель, а, скорее, соответствуют модели клональной эволюции. Есть виды неоплазий, при которых могут встречаться разные популяции раковых стволовых клеток, имеющих разные хромосомные нарушения. Хрестоматийные примеры таких новообразований — хроническая миелоидная лейкемия и колоректальный рак. В этих случаях РСК-модель не может полностью описать развитие опухоли, так как в соответствии с ней все клетки опухоли — потомки одной инициирующей РСК. Здесь же возможна либо инициация опухоли сразу из нескольких злокачественных стволовых клеток, формирующих несколько генетически различающихся клонов, либо эволюция одного клона из другого за счёт последовательного накопления генетических нарушений. Разные клоны могут обладать разной злокачественностью и соответственно могут конкурировать за ресурсы. Иными словами, будет проходить эволюция опухолевых клонов.
Некоторые новообразования, отличающиеся экстремальной злокачественностью, также больше соответствуют модели клональной эволюции, нежели иерархической модели РСК. К ним относятся, например, различные злокачественные меланомы, при которых доля активно делящихся раковых клеток составляет чуть ли не более половины опухолевой массы. При этом в пределах одной опухоли сосуществуют РСК с различными фенотипами, которые при различных воздействиях на опухоль могут легко превращаться один в другой. Очевидно, что и для этих случаев РСК-модель не вполне подходит.
Однако, как можно заметить, в современной интерпретации модели клональной эволюции центральная роль инициирующих раковых стволовых клеток в запуске развития злокачественного новообразования ни в коей мере не оспаривается. Дискуссии продолжаются лишь относительно тех или иных сценариев развития опухоли*. А коли так, мы со спокойной совестью можем говорить о раковых стволовых клетках.
К первым работам, коснувшимся темы раковых стволовых клеток, можно отнести исследования Рудольфа Вирхова (Rudolf Virchow) полуторавековой давности. Вирхов занимался изучением особого вида злокачественных опухолей — тератокарцином. Эта форма новообразований отличается удивительной морфологией. Наряду со слабо дифференцированными, активно делящимися клетками в ней могут присутствовать дифференцированные клетки самых разных тканей (костной, мышечной, жировой, эпителиальной и прочих типов, включая волосы и ткани плаценты). В 1862 году Вирхов обнаружил, что данный тип рака развивается из эмбриональных клеток. Это дало начало теории «зародышевого остатка», постулировавшей развитие раковых заболеваний из клеток, соответствующих ранним этапам развития эмбриона, которые каким-то образом «сохранились» и вновь активировались во взрослом состоянии.
Более полувека спустя, в 1930-х годах, теория зародышевого остатка получила новый импульс. Гистологические наблюдения одной из опухолей мозга — медуллобластомы — показали, что её клетки морфологически очень напоминают клетки эмбрионального мозжечка, на основании чего было выдвинуто предположение, что эта форма опухолей мозга развивается из зародышевого остатка, состоящего из медуллобластов, утративших способность к дифференцировке.
Очередной значительный шаг на пути к концепции раковых стволовых клеток сделан в середине прошлого века. Исследования различных миелопролиферативных заболеваний (особой группы злокачественных новообразований, развившихся из клеток крови**) показали, что в развитие данной группы заболеваний могут быть вовлечены все ветви гемопоэза, за исключением лимфоидных ростков. Это послужило основанием для предположения, что все указанные патологии связаны со злокачественным перерождением клеток — предшественников всех остальных клеток миелоидного ряда, теперь известных как миелоидные cтволовые клетки.
А уже в 1960 году Питер Ноуэл (Peter Nowell) и Дэвид Хангерфорд (David Hungerford) открыли уникальную взаимосвязь так называемой филадельфийской хромосомы с одним из миелопролиферативных заболеваний — хронической миелоидной лейкемией. Филадельфийская хромосома — следствие хромосомной аномалии, которая приводит к образованию мутантного белка BCR-ABL1. К несчастью, этот мутантный белок сохраняет способность одного из своих родительских белков (ABL) к передаче пролиферативного (стимулирующего деление клетки) сигнала внутрь клетки. Более того, он передаёт сигналы гораздо интенсивнее и при этом делится вне зависимости от внешних сигналов. В результате клетки, несущие такую мутацию, начинают быстро и неконтролируемо делиться. В дальнейшем наличие филадельфийской хромосомы при этом заболевании было подтверждено во всех клетках, не относящихся к лимфоидному ряду, на основании чего выдвинули гипотезу о происхождении всех клонов лейкемических клеток от одного предшественника.
В 80-х годах прошлого века появилась стохастическая теория канцерогенеза, давшая начало упомянутой выше модели клональной эволюции опухоли. Стохастическая теория сочетала в себе эволюционную и мутационную теории старения (смерти) многоклеточных организмов. Основной её постулат состоит в том, что стохастическое «подпороговое» (то есть не приводящее к проявлению злокачественности) течение канцерогенных процессов происходит одновременно во многих клетках многоклеточного организма. Суть этих канцерогенных процессов заключается в последовательном накоплении соматических мутаций, то есть мутаций, происходящих в соматических (неполовых) клетках организма, не передающихся по наследству. При случайном стечении обстоятельств, когда эти процессы достигают «порогового» развития (имеют место нарушения в системе репарации ДНК и иммунной защите, а само число мутаций становится критическим), происходит злокачественное перерождение клетки. Скорость деления таких клеток существенно больше, чем у нормальных, что приводит к дальнейшему «лавинообразному» накоплению мутаций, поскольку система репликации (удвоения ДНК) допускает всё больше ошибок. В какой-то момент роста опухоли потомки «родительской» злокачественной клетки начинают различаться числом и качеством накопленных мутаций, что приводит к различиям в их скорости деления, отражающей степень их злокачественности. То есть в терминах эволюционной теории потомки одних раковых клеток будут иметь конкурентное преимущество перед клонами других клеток и в конце концов начнут численно превалировать в опухоли. В результате последующего накопления мутаций на базе «наиболее успешного клона» могут возникнуть ещё более злокачественные клетки, которые, в свою очередь, также займут «лидирующие позиции». Иными словами, будет иметь место клональная эволюция раковых клеток.
Как видно, модель клональной эволюции подразумевает, что одни раковые клоны отличаются большей злокачественностью, другие — меньшей, но в целом все они обладают сопоставимой способностью к делению. И в этом заключается принципиальное отличие стохастической теории канцерогенеза от иерархической теории, которая базируется на модели раковых стволовых клеток.
Основной причиной для критики стохастической теории канцерогенеза и модели клональной эволюции послужило открытое позднее несоответствие их наблюдаемым особенностям метастазирования опухолей. Новые методы исследования позволили обнаружить, что к образованию микрометастазов способно не более 10% циркулирующих в крово- и лимфотоке раковых клеток из первичной опухоли. И лишь доли процента из них образуют «полноценные» вторичные опухоли, снабжённые сосудистой сетью. Стало очевидным, что сопоставимой способностью к делению и инициации опухоли способна лишь малая часть раковых клеток, обладающих стволовыми характеристиками.
Тем не менее, как уже было упомянуто выше, модель клональной эволюции до сих пор не потеряла своей актуальности, поскольку в несколько большей степени, нежели модель РСК, объясняет развитие нескольких типов новообразований.
Долгое время концепция РСК находилась на вторых ролях. Однако в 1997 году Доминик Бонне (Dominique Bonnet, London Research Institute) и Джон Дик (John Dick, Toronto General Research Institute) продемонстрировали, что единичные лейкемические стволовые клетки, взятые у пациентов с острой миелоидной лейкемией, при трансплантации мышам дают начало полному спектру клеток с различными злокачественными фенотипами, наблюдаемыми при этом заболевании у человека. После этой работы число исследований, посвящённых РСК, стало лавинообразно нарастать.
В начале 2000-х годов раковые стволовые клетки были идентифицированы и в солидных опухолях (при одной из форм рака молочной железы). На сегодняшний день РСК описаны для абсолютного большинства форм онкологических заболеваний, и с этими клетками связывают все основные клинические проблемы в онкологии.
Поскольку любое новообразование может развиться только из активно делящейся клетки, наиболее подходящие кандидаты для злокачественной трансформации — нормальные тканевые стволовые клетки (дающие начало полностью дифференцированным клеткам, выполняющим свои узкоспецифические задачи в том или ином типе тканей), так как они обладают длительным сроком жизни и высокой скоростью деления. В соответствии с этим концепция РСК подразумевает, что инициирующее событие в канцерогенезе — злокачественное перерождение нормальных тканевых стволовых клеток***, которые становятся инициирующими РСК.
Однако в последнее время стало очевидным, что самовоспроизведение инициирующих РСК не единственный «источник» раковых стволовых клеток в опухоли. По мере развития (и в особенности под воздействием различных средств терапии) в первичной опухоли происходит генерация «вторичных» РСК из терминально или частично дифференцированных клеток. Скорее всего, именно такие РСК и участвуют в метастазировании. В некоторых работах указывается на то, что «вторичные» РСК могут отличаться по ряду фенотипических особенностей от «первичных» инициирующих РСК. Но принципиальная суть этих различий пока остаётся загадкой.
Здесь мы вплотную подошли к ещё одной концептуальной проблеме онкологии — гетерогенности опухоли. Дело в том, что новые высокоэффективные противоопухолевые лекарственные препараты, в отличие от классической цитотоксической химиотерапии, имеют таргетную (от англ. target — цель) природу. То есть они специфически «нацелены» на строго определённые белковые молекулы, которые, как ранее было установлено, играют важную роль в функционировании опухолевых клеток. Фенотипическая же гетерогенность опухолевых клеток приводит к тому, что определённые белки-мишени экспрессируются не во всех клетках опухоли. Соответственно та часть клеток, где эти белки не экспрессируются, останется нетронутой противоопухолевым препаратом.
Исследования последних лет показали, что опухолевая гетерогенность может быть весьма впечатляющей. Первый уровень гетерогенности заключается в описанной выше пролиферативной иерархии раковых клеток (РСК → временно пролиферирующие частично дифференцированные раковые клетки → неделящиеся полностью дифференцированные раковые клетки). Второй уровень гетерогенности заключается в том, что, как уже упоминалось, часть дифференцированных клеток меняет свой фенотип и «переходит» во вторичные РСК, фенотипически отличающиеся от первичных. Соответственно метастазы, формируемые этими клетками, тоже будут фенотипически отличаться от первичных опухолей. Наконец, ещё один источник гетерогенности — возможность сосуществования в одной опухоли нескольких пулов инициирующих РСК, сформированных в результате независимого злокачественного перерождения двух разных нормальных клеток или «эволюционировавших» одна в другую. Ситуация усугубляется ещё и лабильностью фенотипов РСК (способностью к быстрой смене одного фенотипа на другой). То есть случайно или в результате какого-либо терапевтического воздействия разные пулы РСК могут менять свой фенотип и «переходить» друг в друга.
Очевидно, что опухолевая гетерогенность представляет собой серьёзнейшую проблему. Уже сейчас ни для кого не секрет, что современные препараты годятся не для всех пациентов, в связи с чем персонифицированный подход, при котором лечение подбирается в зависимости от молекулярно-генетических особенностей конкретного пациента, становится новым трендом в медицине. В контексте же опухолевой гетерогенности, как замечают с иронией некоторые специалисты, «персонифицированность» должна теперь сводиться не к отдельно взятому пациенту, а к отдельной клетке (single-cell medicine).
Ещё одна неприятная особенность раковых стволовых клеток — их чрезвычайная устойчивость ко всем известным видам лечения. Какой бы вид противоопухолевой терапии ни применялся (радио-, химио-, иммунотерапия, таргетная), РСК будут погибать последними, когда все дифференцированные раковые клетки уже успешно побеждены.
Известно несколько механизмов терапевтической устойчивости РСК. Во-первых, РСК характеризуются повышенной экспрессией транспортных белков семейства ABC (ATP-binding cassette). Это эволюционно консервативные белки, присутствующие у всех организмов — от бактерий до человека. В норме они локализуются преимущественно в плазматической мембране клеток и отвечают за транспорт полезных веществ (например, витаминов) в клетку и выведение из неё вредных токсинов и ксенобиотиков. В РСК эти белки экспрессируются на особенно высоком уровне и отвечают за выведение из них различных химиотерапевтических препаратов.
Во-вторых, РСК, как никакие другие клетки, отличаются обилием фермента альдегид-дегидрогеназы (ALDH). В норме функция этого белка — окисление токсичных для организма альдегидов до карбоновых кислот. В РСК же он отвечает за инактивацию многих химиотерапевтических препаратов.
В-третьих, РСК отличаются экстремальной устойчивостью к апоптозу — особой молекулярной программе запуска «самоубийства» клетки в ответ на различные повреждающие воздействия. В раковых стволовых клетках эта программа практически заглушена. Именно поэтому после, например, тяжёлого ионизирующего облучения РСК не погибают. Вместо этого они активизируют восстановление повреждений ДНК и через какое-то время вновь приобретают способность к делению. Но поскольку повреждения ДНК «залатываются» экстренно, этот процесс сопровождается новыми мутациями и РСК становятся ещё злокачественнее. Более того, как было показано совсем недавно, даже в тех случаях, когда удаётся добиться апоптоза РСК, эти клетки, при определённых условиях, способны к обратной «самосборке» после их разрушения с полным восстановлением функций и усилением злокачественности.
Это основные, но далеко не все механизмы устойчивости РСК. В тех же случаях, когда системы резистентности РСК к терапии дают сбой, раковые стволовые клетки впадают в дормантность (состояние покоя), в которой они могут пребывать несколько десятилетий, после чего активируются и обусловливают скоротечный фатальный рецидив. Дормантные РСК отличаются очень низким уровнем метаболизма, экстремальной устойчивостью к повреждающим воздействиям и практически не экспрессируют поверхностные белки, которые могли бы послужить мишенями для создания таргетных препаратов. На сегодняшний день дормантные РСК представляют собой наибольшую трудность для лечения. Однако надежда на успех есть. Во-первых, испытываются и неплохо себя проявляют различные сложные комбинации уже существующих таргетных препаратов. Во-вторых, удалось вплотную приблизиться к получению препаратов, воздействующих на процессы, лежащие в основе образования вторичных метастатических РСК. В-третьих, обнаружены белки, отвечающие за дормантность РСК и обеспечение их жизнеспособности в состоянии покоя. Наконец, разрабатываются препараты, способствующие выходу РСК из дормантности, что делает их более чувствительными к существующим формам терапии.
Cловарик к статье
Клеточная дифференцировка — процесс клеточной дифференцировки заключается в так называемом созревании стволовой клетки-предшественника в клетку со строго определённым фенотипом (например, кардиомиоцит или пирамидный нейрон), называемую дифференцированной.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
Репарация ДНК — внутриклеточная молекулярная система восстановления исходной последовательности ДНК после её повреждений.
Стохастический (от греч. στοχαστικός — умеющий угадывать) означает неопределённость, случайность чего-либо.
Фенотип (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития (особенности строения и жизнедеятельности).
Комментарии к статье
* Большинство ведущих специалистов сегодня склоняются к мнению, что универсального сценария развития опухоли не существует. Возможна реализация обеих моделей.
** В просторечии — «рак крови». Терминологически — это грубая ошибка.
*** Само злокачественное перерождение может быть результатом одного или нескольких канцерогенных событий (например, мутаций, но не только их).
Что такое стволовые клетки? | Nature Reports Stem Cells
Стволовые клетки создают ткань тогда и там, где это необходимо.
Без стволовых клеток раны никогда не заживут, ваша кожа и кровь не смогут постоянно обновляться, оплодотворенные яйца не вырастут в младенцев, а младенцы не вырастут во взрослых. Стволовые клетки совершенно не похожи на специализированные или дифференцированные клетки вашего тела, такие как нервные клетки, мышечные клетки и клетки крови, которые позволяют вам функционировать.Напротив, они представляют собой безмолвные резервы организма. В любой момент многие стволовые клетки в вашем теле мало что делают. Они начнут действовать только тогда, когда вам нужно будет производить больше стволовых клеток или производить больше других, специализированных типов клеток. И их можно найти не только в людях. Всем многоклеточным организмам, от растений до людей, нужны стволовые клетки.
Обычно, когда стволовая клетка делится на две, одна дочерняя клетка продолжает производить более специализированный тип клетки или даже дает начало нескольким различным типам клеток.Другая дочерняя клетка остается стволовой, готовой производить больше стволовых клеток, когда они необходимы. Только стволовые клетки обладают такой универсальностью, хотя некоторые полностью специализированные клетки, такие как клетки печени, могут делиться, давая больше клеток, точно таких же, как они сами.
Оплодотворенная яйцеклетка — это высшая стволовая клетка, поскольку она является источником всех типов клеток в организме, от переносящих кислород красных кровяных клеток до проводящих электричество нервных клеток и пульсирующих клеток сердечной мышцы. Но, конечно, это происходит не сразу.По мере того, как оплодотворенная яйцеклетка делится, образуя эмбрион, клетки постепенно становятся специализированными.
В течение трех-шести дней после оплодотворения человеческая яйцеклетка превратилась в клубок из нескольких сотен клеток, который называется бластоцистой . Внутри этого шара находится небольшое количество клеток, из которых впоследствии будет развиваться эмбрион. Ученые научились извлекать эти стволовые клетки из утолщения бластоцисты, называемого внутренней клеточной массой , и выращивать их в лаборатории. Они известны как эмбриональные стволовые клетки , или , ES-клетки, , и они могут продуцировать все типы клеток в организме человека.Когда бластоциста имплантируется в матку женщины, клетки внутренней клеточной массы будут продолжать делиться и дифференцироваться в самые ранние типы эмбриональных клеток. Человеческие ES-клетки в культуре не создаются из яиц, оплодотворенных в организме женщины. Они происходят из внутренних клеточных масс «запасных» бластоцист, которые были созданы в лаборатории в рамках программы in vitro по оплодотворению (ЭКО).
Менее чем через три недели после оплодотворения человеческой яйцеклетки эти наиболее гибкие стволовые клетки исчезли, а потенциал эмбриональных клеток постепенно ограничивается.Вместо того, чтобы делиться с образованием еще одной специализированной дочерней клетки и резервной универсальной стволовой клетки, более поздние эмбриональные клетки при делении с большей вероятностью дадут два типа более дифференцированных клеток. На этом этапе клетки эмбриона «обязались» стать одним из трех основных типов тканей, каждый из которых имеет различные типы стволовых клеток. Многие из них сохраняются во взрослой жизни. По мере продолжения эмбрионального развития клетки становятся еще более специализированными, образуя узнаваемые ткани, такие как сердце, мышцы и кровь.
У взрослых описаны десятки типов стволовых клеток; еще предстоит открыть. Эти стволовые клетки называются тканеспецифическими , поскольку они обычно заменяют только одну конкретную ткань. Их также иногда называют взрослыми стволовыми клетками . Лучше всего изучены стволовые клетки, которые выращивают новые клетки крови, те, которые обновляют кожу, те, которые обновляют слизистую оболочку кишечника, и те, которые могут выращивать новые скелетные мышцы. Стволовые клетки костного мозга образуют клетки крови и уже много лет используются в терапевтических целях.Это клетки, которые позволяют трансплантату костного мозга обновить всю кровеносную систему человека.
Ученые всего мира пытаются выяснить, во что именно эти стволовые клетки способны превращаться в лаборатории и в организме; Сейчас, однако, тканеспецифические стволовые клетки кажутся специалистами, весьма хорошими в создании нескольких типов клеток. Стволовые клетки, обнаруженные в костном мозге, естественным образом производят новые красные кровяные тельца и новые лейкоциты, например, но не новые клетки мозга, по крайней мере, ненадежно.Стволовые клетки, возникающие в головном мозге, создают новые нейроны и поддерживающие их клетки, но, похоже, они не образуют мышечные клетки.
Дон Бишоп / Гетти
Об этой статье
Цитируйте эту статью
Что такое стволовые клетки ?. Стволовые клетки Nat Rep (2007). https://doi.org/10.1038/stemcells.2007.12
Скачать цитату
Поделиться этой статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для совместного использованияИзвините, ссылка для совместного использования в настоящее время недоступно для этой статьи.
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Основные сведения о стволовых клетках
- Geosalud
- Стволовые клетки
- Основы стволовых клеток
Что такое стволовые клетки и почему они важны?
Стволовые клетки обладают замечательным потенциалом превращаться во многие различные типы клеток в организме на ранних этапах жизни и роста.Кроме того, во многих тканях они служат своего рода внутренней системой восстановления, делясь практически без ограничений для пополнения запасов других клеток, пока человек или животное все еще живы. Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать клеткой другого типа с более специализированной функцией, такой как мышечная клетка, красная кровяная клетка или клетка мозга.
Anuncios
Стволовые клетки отличаются от других типов клеток двумя важными характеристиками.Во-первых, это неспециализированные клетки, способные обновляться посредством деления клеток, иногда после длительного периода бездействия. Во-вторых, при определенных физиологических или экспериментальных условиях их можно заставить стать тканеспецифичными или органоспецифичными клетками с особыми функциями. В некоторых органах, таких как кишечник и костный мозг, стволовые клетки регулярно делятся для восстановления и замены изношенных или поврежденных тканей. Однако в других органах, таких как поджелудочная железа и сердце, стволовые клетки делятся только в особых условиях.
До недавнего времени ученые в основном работали с двумя видами стволовых клеток животных и человека: эмбриональными стволовыми клетками и неэмбриональными «соматическими» или «взрослыми» стволовыми клетками. Функции и характеристики этих ячеек будут объяснены в этом документе. Ученые открыли способы получения эмбриональных стволовых клеток из ранних эмбрионов мыши почти 30 лет назад, в 1981 году. Подробное изучение биологии стволовых клеток мыши привело к открытию в 1998 году метода получения стволовых клеток из человеческих эмбрионов и их выращивания. клетки в лаборатории.Эти клетки называются эмбриональными стволовыми клетками человека. Эмбрионы, использованные в этих исследованиях, были созданы для репродуктивных целей с помощью процедур искусственного оплодотворения. Когда они больше не были нужны для этой цели, они были переданы для исследования с информированного согласия донора. В 2006 году исследователи совершили еще один прорыв, определив условия, которые позволили бы некоторым специализированным взрослым клеткам генетически «перепрограммироваться», чтобы они приняли состояние, подобное стволовым клеткам. Этот новый тип стволовых клеток, называемых индуцированными плюрипотентными стволовыми клетками (ИПСК), будет обсуждаться в следующем разделе этого документа.
Стволовые клетки важны для живых организмов по многим причинам. В 3-5-дневном эмбрионе, называемом бластоцистой, внутренние клетки дают начало всему телу организма, включая все многие специализированные типы клеток и органы, такие как сердце, легкие, кожа, сперма, яйца и другие ткани. В некоторых тканях взрослого организма, таких как костный мозг, мышцы и мозг, отдельные популяции взрослых стволовых клеток создают замену клеткам, которые теряются в результате нормального износа, травм или болезней.
Благодаря своей уникальной регенеративной способности стволовые клетки открывают новые возможности для лечения таких заболеваний, как диабет и болезни сердца. Однако в лаборатории и клинике еще предстоит проделать большую работу, чтобы понять, как использовать эти клетки для клеточной терапии для лечения заболеваний, которые также называют регенеративной или репаративной медициной.
Лабораторные исследования стволовых клеток позволяют ученым узнать об основных свойствах клеток и о том, что отличает их от специализированных типов клеток.Ученые уже используют стволовые клетки в лаборатории для проверки новых лекарств и разработки модельных систем для изучения нормального роста и выявления причин врожденных дефектов.
Исследования стволовых клеток продолжают расширять знания о том, как организм развивается из одной клетки и как здоровые клетки заменяют поврежденные клетки во взрослых организмах. Исследование стволовых клеток — одна из самых увлекательных областей современной биологии, но, как и во многих расширяющихся областях научных исследований, исследования стволовых клеток поднимают научные вопросы так же быстро, как и порождают новые открытия.
Anuncios
Каковы уникальные свойства всех стволовых клеток?
Стволовые клетки отличаются от других клеток организма. Все стволовые клетки — независимо от их источника — обладают тремя основными свойствами: они способны делиться и обновляться в течение длительных периодов времени; они неспециализированы; и они могут дать начало специализированным типам клеток.
Anuncios
Стволовые клетки способны делиться и обновляться в течение длительного времени.В отличие от мышечных клеток, клеток крови или нервных клеток, которые обычно не реплицируются, стволовые клетки могут многократно реплицироваться или размножаться. Начальная популяция стволовых клеток, которая размножается в течение многих месяцев в лаборатории, может дать миллионы клеток. Если полученные клетки продолжают оставаться неспециализированными, как родительские стволовые клетки, считается, что клетки способны к долгосрочному самообновлению.
Ученые пытаются понять два фундаментальных свойства стволовых клеток, которые связаны с их долгосрочным самообновлением:
- почему эмбриональные стволовые клетки могут пролиферировать в течение года или более в лаборатории без дифференциации, а большинство неэмбриональных стволовых клеток — нет; и
- какие факторы в живых организмах обычно регулируют пролиферацию и самообновление стволовых клеток?
Обнаружение ответов на эти вопросы может позволить понять, как регулируется пролиферация клеток во время нормального эмбрионального развития или во время аномального деления клеток, которое приводит к раку.Такая информация также позволит ученым более эффективно выращивать эмбриональные и неэмбриональные стволовые клетки в лаборатории.
Специфические факторы и условия, которые позволяют стволовым клеткам оставаться неспециализированными, представляют большой интерес для ученых. Ученым потребовалось много лет проб и ошибок, чтобы научиться получать и поддерживать стволовые клетки в лаборатории без их спонтанной дифференциации в определенные типы клеток. Например, потребовалось два десятилетия, чтобы научиться выращивать эмбриональные стволовые клетки человека в лаборатории после создания условий для выращивания стволовых клеток мыши.Следовательно, понимание сигналов в зрелом организме, которые вызывают пролиферацию популяции стволовых клеток и остаются неспециализированными до тех пор, пока клетки не потребуются. Такая информация крайне важна для ученых, чтобы они могли вырастить в лаборатории большое количество неспециализированных стволовых клеток для дальнейших экспериментов.
Стволовые клетки неспециализированы. Одним из фундаментальных свойств стволовой клетки является то, что у нее нет тканеспецифических структур, которые позволяют ей выполнять специализированные функции.Например, стволовая клетка не может работать со своими соседями, прокачивая кровь по телу (как клетка сердечной мышцы), и не может переносить молекулы кислорода через кровоток (как эритроцит). Однако неспециализированные стволовые клетки могут давать начало специализированным клеткам, включая клетки сердечной мышцы, клетки крови или нервные клетки.
Стволовые клетки могут давать начало специализированным клеткам. Когда неспециализированные стволовые клетки дают начало специализированным клеткам, этот процесс называется дифференцировкой.Во время дифференцировки клетка обычно проходит несколько стадий, становясь более специализированной на каждом шаге. Ученые только начинают понимать сигналы внутри и снаружи клеток, которые запускают каждый стержень процесса дифференцировки. Внутренние сигналы контролируются клеточными генами, которые разбросаны по длинным цепочкам ДНК и несут закодированные инструкции для всех клеточных структур и функций. Внешние сигналы для дифференцировки клеток включают химические вещества, выделяемые другими клетками, физический контакт с соседними клетками и определенные молекулы в микроокружении.Взаимодействие сигналов во время дифференцировки заставляет ДНК клетки приобретать эпигенетические метки, которые ограничивают экспрессию ДНК в клетке и могут передаваться через клеточное деление.
Остается много вопросов о дифференцировке стволовых клеток. Например, одинаковы ли внутренние и внешние сигналы для дифференцировки клеток для всех видов стволовых клеток? Можно ли идентифицировать конкретные наборы сигналов, которые способствуют дифференцировке в определенные типы клеток? Решение этих вопросов может привести ученых к поиску новых способов контроля дифференцировки стволовых клеток в лаборатории, тем самым выращивая клетки или ткани, которые можно использовать для определенных целей, таких как клеточная терапия или скрининг лекарств.
Anuncios
Взрослые стволовые клетки обычно генерируют типы клеток ткани, в которой они находятся. Например, взрослые кроветворные стволовые клетки в костном мозге обычно дают начало многим типам клеток крови. Принято считать, что кроветворная клетка в костном мозге, называемая гемопоэтической стволовой клеткой, не может давать начало клеткам совсем другой ткани, например, нервным клеткам головного мозга. Эксперименты последних нескольких лет имели целью показать, что стволовые клетки из одной ткани могут давать начало клеточным типам совершенно другой ткани.Это остается предметом больших дискуссий в исследовательском сообществе. Это противоречие демонстрирует проблемы изучения взрослых стволовых клеток и предполагает, что необходимы дополнительные исследования с использованием взрослых стволовых клеток, чтобы понять их полный потенциал в качестве будущих методов лечения.
Источник
Национальный институт здоровья
Ресурс для исследования стволовых клеток
Статьи по теме:
Почему стволовые клетки важны?
Основы стволовых клеток
Эмбриональные стволовые клетки
Стволовые клетки взрослого человека
индуцированные плюрипотентные стволовые клетки
Возможное использование стволовых клеток человека
Преимущества стволовых клеток
Рак и стволовые клетки
Стволовые клетки при лейкемии
Стволовые клетки и ВИЧ
Español
Что такое стволовые клетки? | Библиотека Конгресса
Ответ
Стволовые клетки — это клетки, которые могут превращаться в клетки различных типов.Они присутствуют как во время эмбрионального развития (эмбриональные стволовые клетки), так и во взрослом организме (взрослые стволовые клетки).
Человеческие ES-клетки дифференцируются в нейроны. Фото любезно предоставлено Калифорнийским институтом регенеративной медицины. Национальный институт общих медицинских наук, Галерея изображений и видео.Стволовые клетки обладают уникальными свойствами, которых нет у других клеток.
Во-первых, чтобы понять, что такое стволовые клетки, вам нужно понять, как развиваются люди и другие млекопитающие:
- Сперматозоид оплодотворяет яйцеклетку и образует единственную клетку, называемую зиготой .
- Зигота подвергается процессу, известному как митоз , в котором она реплицирует свои хромосомы (которые несут ДНК каждого из родителей), а затем делится, в результате чего образуются две идентичные клетки. Эти клетки называются тотипотентными и обладают способностью развиваться в новый организм. Зигота повторяет процесс митоза в течение примерно 5 или 6 дней, создавая небольшой клубок из нескольких сотен клеток, называемый бластоцистой .
- Бластоциста имеет внешний слой клеток, называемый трофобластом , который в конечном итоге сформирует защитную плаценту.Внутри трофобласта находится группа клеток, называемая внутренней клеточной массой . Организм, находящийся на стадии от зиготы до плода, называется эмбрионом *, а клетки — эмбриональными стволовыми клетками.
На этом этапе эмбриональные стволовые клетки могут стать клеткой для любой части тела (нервов, мышц, крови и т. Д.). Эта способность становиться клеткой любого типа в организме называется плюрипотентной . Разница между тотипотентными и плюрипотентными клетками состоит только в том, что тотипотентные клетки могут давать начало как плаценте, так и эмбриону. - По мере роста эмбриона эти плюрипотентных клеток развиваются в специализированные мультипотентные стволовые клетки. Мультипотентные стволовые клетки обладают способностью к развитию определенных типов клеток (терминально дифференцированные клетки). Например, стволовые клетки крови (мультипотентные) могут развиться в красные кровяные клетки, белые кровяные клетки или тромбоциты (все специализированные клетки). Мультипотентные стволовые клетки используются для всех типов тканей в организме.
* Эмбрион: эмбрион млекопитающих определяется как стадия развития организма между первым делением зиготы и тем временем, когда он становится плодом в результате дальнейшего развития.Для человека эмбрион определяется как имплантация оплодотворенной яйцеклетки в матку на восьмой неделе ее развития. Эмбрион будет называться плодом после восьмой недели до рождения.
Ученый изучает химический стакан с образцами клеток в Центре регенеративной медицины Гейтса — серии лабораторий, работающих с биологией стволовых клеток в медицинском кампусе Аншутц Университета Колорадо в Денвере. Кэрол М. Хайсмит, фотограф, 2016. Отдел эстампов и фотографий, Библиотека Конгресса.Стволовые клетки отличаются от других клеток, потому что:
- Они могут продолжать делиться в течение длительного периода времени: Большинство клеток, таких как клетки кожи, не могут воспроизводить себя через определенный период времени. Стволовые клетки являются самоподдерживающимися, реплицируясь в течение гораздо более длительного периода времени.
- Они неспециализированы: Специализированные ячейки обладают определенными возможностями, которые позволяют им выполнять определенные задачи. Например, эритроцит содержит гемоглобин, который позволяет переносить кислород.Стволовые клетки обладают неспециализированными возможностями и не имеют тканеспецифических структур для выполнения специализированных функций.
- Они могут давать начало специализированным клеткам: Стволовые клетки проходят процесс, называемый дифференцировкой , и создают особые типы клеток (мышцы, нервы, кожа и т. Д.).
Эмбриональные стволовые клетки
Эмбриональные стволовые клетки — это клетки в защитном слое бластоцисты. Они плюрипотентны, что означает, что они могут развиваться в любую из клеток взрослого организма. Исследователи считают, что, поскольку они плюрипотентны и их легко выращивать, они обладают наилучшим потенциалом для замены поврежденных или утраченных тканей или частей тела.
Взрослые стволовые клетки
Также известные как клетки-предшественники или соматические стволовые клетки , взрослые стволовые клетки в небольших количествах располагаются по всему телу и генерируют специализированные клетки для той области, в которой они расположены. Эти клетки не обновляются так же хорошо, как эмбриональные стволовые клетки. Тем не менее, если эти клетки поместить в другую среду, они могут производить клетки другого типа, чем исходная клетка.
Исследования стволовых клеток — это активная область исследований, и ученые каждый день открывают новые характеристики стволовых клеток.Например, недавнее исследование показало, что мультипотентные стволовые клетки из одного типа ткани (крови) могут действительно обладать способностью генерировать клетки для другого типа ткани (нервов).
Ученые продолжают поиск новых источников взрослых стволовых клеток. Некоторые из мест, где были обнаружены стволовые клетки, включают: костный мозг, кожу, печень, кровь и мозг. Некоторые взрослые стволовые клетки, которые уже использовались для лечения болезней, включают гемопоэтических стволовых клеток, стволовых клеток и стволовые клетки пуповинной крови.
Гемопоэтические стволовые клетки расположены в костном мозге и образуют клетки крови. Их успешно применяют для лечения заболеваний крови у более молодых пациентов. Пуповинная кровь стволовые клетки находятся в крови пуповины после рождения. Стволовые клетки пуповины похожи на гематопеитетические стволовые клетки взрослых, но они менее зрелые и имеют гораздо больший потенциал для дифференцировки в различные типы клеток.
В Charles C.В центре регенеративной медицины Гейтса в медицинском кампусе Аншутц Университета Колорадо в пригороде Денвера Аврора ученые и студенты исследуют клетки человека. Запросы центра сосредоточены на взрослых стволовых клетках, а не на эмбриональных клетках, манипулирование которыми вызывает споры с этической и политической точек зрения. Кэрол М. Хайсмит, фотограф, 2016. Отдел эстампов и фотографий, Библиотека Конгресса.Опубликовано: 19.11.2019. Автор: Справочная секция по науке, Библиотека Конгресса
стволовых клеток отличаются от клеток, о которых вы узнали в биологии
Человеческое тело — это красиво сложная система различных структур, каждая из которых имеет свои собственные цели и средства их достижения.Клетки — отличный тому пример. Каждая часть вашего тела состоит из клеток, и все они обладают характеристиками, которые делают их уникальными.
Стволовые клетки часто неправильно понимают.Щелкните здесь, чтобы узнать почему. Дифференциация
Нормальные клетки организма выполняют определенные задачи. Не смотрите дальше клеток крови. Лейкоциты и красные кровяные тельца выполняют уникальные и очень специализированные задачи.Но клетки крови отличаются от клеток мозга, а клетки мозга отличаются от клеток мышц, жира, кожи, нервов и скелета. У каждого есть своя конкретная работа, которую они должны выполнять, чтобы тело работало на наилучшем возможном уровне.
Было бы неправильно сказать, что стволовые клетки недифференцированы. Скорее всего, стволовые клетки еще не дифференцировались. Фактически, все наши клетки возникли как стволовые клетки, которые дифференцировались в соответствующий момент развития. In utero эмбрион формирует скелет, мышечную структуру, нервную систему и все остальное, что дает нам жизнь, потому что эмбриональные стволовые клетки дифференцируются с образованием других структур.После рождения ребенка в организме все еще есть стволовые клетки, но теперь они ждут момента, когда они понадобятся, когда придет время стать более специализированным.
Стволовых клеток больше в определенных областях тела, таких как кровеносные сосуды, кожа, зубы, сердце и костный мозг. Они называются «нишами стволовых клеток», где популяция стволовых клеток многочисленна.
Способные к разделению на длительный период времениСтволовые клетки способны как делиться, так и обновляться в течение длительных периодов времени.Многие клетки обычно не воспроизводят себя, например клетки крови, нервов или мышц. Стволовые клетки, с другой стороны, способны реплицироваться в течение длительного периода времени для увеличения своей популяции: этот процесс известен как пролиферация. Однако это не происходит спонтанно, поскольку стволовые клетки имеют тенденцию не делиться до тех пор, пока они не будут «активированы» потребностью в большем количестве клеток для поддержания тканей, либо болезнью или травмой.
Например, начальная популяция стволовых клеток, которой позволяют размножаться в течение нескольких месяцев в лаборатории, может размножаться и давать миллионы клеток.Кроме того, как показано выше, если эти клетки остаются недифференцированными, их можно использовать для лечения.
Пролиферация клеток в развитии и дифференцировке — Клетка
Раннее развитие характеризуется быстрой пролиферацией эмбриональных клеток, которые затем дифференцируются с образованием многих специализированных типов клеток, из которых состоят ткани и органы многоклеточных животных. По мере дифференциации клеток скорость их пролиферации обычно снижается, и большинство клеток взрослых животных задерживаются на стадии G 0 клеточного цикла.Некоторые типы дифференцированных клеток никогда не делятся снова, но большинство клеток могут возобновить пролиферацию, как требуется, чтобы заменить клетки, которые были потеряны в результате повреждения или гибели клеток. Кроме того, некоторые клетки непрерывно делятся на протяжении всей жизни, заменяя клетки, которые имеют высокую скорость обновления у взрослых животных. Таким образом, пролиферация клеток тщательно уравновешивается гибелью клеток, чтобы поддерживать постоянное количество клеток во взрослых тканях и органах.
Пролиферация дифференцированных клеток
Клетки взрослых животных можно разделить на три основные категории в отношении пролиферации клеток.Некоторые типы дифференцированных клеток, такие как клетки сердечной мышцы человека, больше не способны к делению клеток. Эти клетки производятся во время эмбрионального развития, дифференцируются и затем сохраняются на протяжении всей жизни организма. Если они потеряны из-за травмы (например, гибели клеток сердечной мышцы во время сердечного приступа), их невозможно восстановить.
Напротив, большинство клеток взрослых животных вступают в стадию клеточного цикла G 0 , но возобновляют пролиферацию по мере необходимости для замены поврежденных или погибших клеток.Клетки этого типа включают фибробласты кожи, клетки гладкой мускулатуры, эндотелиальные клетки, выстилающие кровеносные сосуды, и эпителиальные клетки большинства внутренних органов, таких как печень, поджелудочная железа, почки, легкие, простата и грудь. Одним из примеров контролируемой пролиферации этих клеток, обсуждавшейся ранее в этой главе, является быстрое разрастание фибробластов кожи для восстановления повреждений, возникших в результате пореза или раны. Другой яркий пример — клетки печени, которые в норме редко делятся.Однако, если большое количество клеток печени потеряно (например, при хирургическом удалении части печени), оставшиеся клетки стимулируются к пролиферации, чтобы заменить недостающую ткань. Например, хирургическое удаление двух третей печени крысы сопровождается быстрой пролиферацией клеток, что приводит к регенерации всей печени в течение нескольких дней.
Стволовые клетки
Другие типы дифференцированных клеток, включая клетки крови, эпителиальные клетки кожи и эпителиальные клетки, выстилающие пищеварительный тракт, имеют короткую продолжительность жизни и должны заменяться непрерывной пролиферацией клеток у взрослых животных.В этих случаях полностью дифференцированные клетки сами не пролиферируют. Вместо этого они замещаются за счет пролиферации менее дифференцированных клеток, называемых стволовыми клетками (). Стволовые клетки делятся с образованием дочерних клеток, которые могут либо дифференцироваться, либо оставаться в виде стволовых клеток, тем самым служа источником для производства дифференцированных клеток на протяжении всей жизни.
Рисунок 14.43
Размножение стволовых клеток. Стволовые клетки делятся, образуя одну дочернюю клетку, которая остается стволовой, а вторую — дифференцирующуюся (например,g., в кишечную эпителиальную клетку).
Хорошим примером непрерывной пролиферации стволовых клеток является дифференцировка клеток крови. Существует несколько различных типов клеток крови со специализированными функциями: эритроциты (красные кровяные тельца) транспортируют O 2 и CO 2 ; гранулоциты и макрофаги — фагоцитарные клетки; тромбоциты (являющиеся фрагментами мегакариоцитов) участвуют в свертывании крови; а лимфоциты отвечают за иммунный ответ.Все эти клетки имеют ограниченную продолжительность жизни, от менее суток до нескольких месяцев, и постоянно производятся в результате деления обычных стволовых клеток (плюрипотентных стволовых клеток) в костном мозге (). Потомки плюрипотентных стволовых клеток затем становятся преданными специфическим путям дифференцировки. Эти клетки продолжают размножаться и претерпевают несколько раундов деления по мере дифференциации. Однако как только они становятся полностью дифференцированными, они прекращают пролиферацию, поэтому поддержание популяций дифференцированных клеток крови зависит от непрерывной пролиферации плюрипотентных стволовых клеток.
Рисунок 14.44
Образование клеток крови. Все различные типы клеток крови развиваются из плюрипотентных стволовых клеток в костном мозге. Предшественники дифференцированных клеток проходят несколько раундов деления клеток по мере созревания, но пролиферация клеток прекращается на (подробнее …)
Поскольку стволовые клетки могут реплицироваться, а также дифференцироваться, давая начало множеству типов клеток, они относятся к значительный интерес с точки зрения потенциальных медицинских приложений. Например, стволовые клетки можно использовать для лечения заболеваний человека и восстановления поврежденных тканей.Стволовые клетки с самой широкой дифференцирующей способностью — это эмбриональные стволовые клетки (ES-клетки), которые присутствуют в ранних эмбрионах и могут давать начало всем типам дифференцированных клеток взрослых организмов. Как обсуждалось в главе 3, эти клетки можно культивировать из эмбрионов мыши и использовать для введения измененных генов мышам (см.). В 1998 году две группы исследователей сообщили о выделении ES-клеток из человеческих эмбрионов, что повысило вероятность того, что эти человеческие стволовые клетки могут быть использованы в медицинских целях.Примечательно, что этот прогресс последовал за первой демонстрацией в 1997 году того, что ядро взрослой клетки могло дать начало жизнеспособному животному (в данном случае ягненку) после трансплантации в ооцит. Таким образом, теоретически возможно, что ядро взрослой клетки человека может быть использовано для образования ES-клеток, которые затем могут стать источником ткани для лечения этого человека. Кроме того, из взрослых тканей были выделены стволовые клетки, которые дают начало не только клеткам крови, но и многим другим типам клеток, включая нейроны и клетки соединительных тканей, таких как кости, хрящи, жир и мышцы.Терапевтическое применение этих взрослых стволовых клеток может избежать этических проблем, связанных с использованием эмбрионов в качестве источника ES-клеток. Таким образом, продолжение исследований стволовых клеток может открыть новые подходы к лечению широкого спектра заболеваний человека.
Box
Молекулярная медицина: экстракорпоральное оплодотворение.
Основы стволовых клеток | Стволовые клетки
Понимание исследования стволовых клеток
Что такое стволовые клетки?
Стволовые клетки — это фундаментальные клетки для каждого органа, ткани и клетки в организме.Они похожи на пустой микрочип, который в конечном итоге можно запрограммировать для выполнения определенных задач. Стволовые клетки — это недифференцированные или «пустые» клетки, которые еще не полностью специализировались. В надлежащих условиях стволовые клетки начинают развиваться в специализированные ткани и органы. Кроме того, стволовые клетки могут самообновляться, то есть они могут делиться и давать начало большему количеству стволовых клеток.
Что такое эмбриональная стволовая клетка?
Эмбриональные стволовые клетки существуют только на самых ранних стадиях эмбрионального развития и способны производить любой тип клеток в организме.В правильных условиях эти клетки сохраняют способность делиться и копировать себя бесконечно. Ученые начинают понимать, как заставить эти клетки развиться в любой из более чем 200 различных типов клеток человеческого тела.
Что такое взрослая стволовая клетка?
Взрослые стволовые клетки, также известные как тканеспецифические стволовые клетки, присутствуют у взрослых, детей, новорожденных и развивающихся плодов. Взрослые стволовые клетки более ограничены и специализированы, чем эмбриональные стволовые клетки.У них есть способность образовывать только один или два вида тканей, таких как клетки крови и иммунной системы, клетки мозга или мускулы. Взрослые стволовые клетки также имеют более ограниченную способность к самовосстановлению, чем эмбриональные стволовые клетки.
Что такое iPS (индуцированная плюрипотентная стволовая клетка)?
iPS-клетки — это взрослые клетки, перепрограммированные так, чтобы вести себя как эмбриональные стволовые клетки. Хотя iPS-клетки являются захватывающим открытием, эти клетки, возможно, никогда не будут использоваться у пациентов, потому что в настоящее время использование вирусов для репрограммирования этих взрослых клеток может предрасполагать клетки к раку.В результате эти клетки не могут полностью заменить использование эмбриональных стволовых клеток. Среди ведущих исследователей стволовых клеток, включая ученых, которые разработали iPS-клетки, широко распространено мнение, что исследования должны продолжаться на всех типах стволовых клеток, включая полученные из эмбрионов.
Что такое перенос ядра соматической клетки (SCNT)?
Перенос ядра соматической клетки (SCNT) — это метод, при котором ядро соматической клетки, то есть любой клетки тела, кроме сперматозоида или яйцеклетки, переносится в яйцеклетку, у которой было удалено исходное ядро.Яйцо теперь имеет ту же ядерную ДНК или генетический материал, что и донорская соматическая клетка. Получив правильные сигналы, яйцеклетку можно уговорить развиваться, как если бы она была оплодотворена. Яйцо делится, образуя 2 клетки, затем 4 клетки, затем 8 клеток и так далее, пока не сформируется бластоциста. Эмбриональные стволовые клетки могут быть получены из этой бластоцисты для создания клеточных линий, генетически идентичных донорской соматической клетке.
Откуда берутся стволовые клетки?
Эмбриональные стволовые клетки происходят из внутренней клеточной массы бластоцисты: оплодотворенная яйцеклетка, называемая зиготой, делится и образует две клетки; каждая из этих клеток снова делится и так далее.Вскоре появляется полый шар из 150 клеток, называемый бластоцистой, который содержит два типа клеток: трофобласт и внутреннюю клеточную массу. Эмбриональные стволовые клетки получают из внутренней клеточной массы.
Стволовые клетки также можно найти в небольших количествах в различных тканях тела плода и взрослого человека. Например, в костном мозге обнаруживаются стволовые клетки крови, которые дают начало всем специализированным типам клеток крови. Такие тканеспецифические стволовые клетки еще не идентифицированы во всех жизненно важных органах, а в некоторых тканях, таких как мозг, хотя стволовые клетки существуют, они не очень активны и, следовательно, не легко реагируют на повреждение или повреждение клеток.
Стволовые клетки также можно получить из других источников, например, пуповина новорожденного ребенка является источником стволовых клеток крови. Недавно ученые также обнаружили наличие клеток в молочных зубах и околоплодных водах, которые также могут иметь потенциал для образования нескольких типов клеток. Исследования этих клеток находятся на очень ранней стадии.
Недавно из соматических клеток были сконструированы клетки со свойствами, подобными эмбриональным стволовым клеткам, которые называются индуцированными плюрипотентными стволовыми клетками (iPS-клетки) (см. «Что такое индуцированные плюрипотентные стволовые клетки?»).
Что такое линия стволовых клеток?
Линия стволовых клеток — это популяция клеток, которые могут реплицироваться в течение длительных периодов времени in vitro, то есть вне организма. Эти клеточные линии выращивают в инкубаторах со специализированной средой, содержащей фактор роста (жидкий источник пищи), при температуре и смеси кислорода / углекислого газа, сходных с таковой в организме млекопитающих.
Для получения дополнительной информации ознакомьтесь с брошюрой «Факты о стволовых клетках» Международного общества исследований стволовых клеток, независимой некоммерческой организации, обеспечивающей глобальный форум для исследований стволовых клеток и регенеративной медицины.
Источник: Международное общество исследования стволовых клеток
Факты о стволовых клетках.
Введение: что такое стволовые клетки и почему они так важны?
Стволовые клетки обладают замечательным потенциалом превращаться во множество различных типов клеток в организме на ранних этапах жизни и роста. Кроме того, во многих тканях они служат своего рода внутренней системой восстановления, делясь практически без ограничений для пополнения запасов других клеток, пока человек или животное все еще живы.Когда стволовая клетка делится, каждая новая клетка может либо остаться стволовой клеткой, либо стать клеткой другого типа с более специализированной функцией, такой как мышечная клетка, красная кровяная клетка или клетка мозга.
Стволовые клетки отличаются от других типов клеток двумя важными характеристиками. Во-первых, это неспециализированные клетки, способные обновляться посредством деления клеток, иногда после длительного периода бездействия. Во-вторых, при определенных физиологических или экспериментальных условиях их можно заставить стать тканеспецифичными или органоспецифичными клетками с особыми функциями.В некоторых органах, таких как кишечник и костный мозг, стволовые клетки регулярно делятся для восстановления и замены изношенных или поврежденных тканей. Однако в других органах, таких как поджелудочная железа и сердце, стволовые клетки делятся только в особых условиях.
До недавнего времени ученые в основном работали с двумя видами стволовых клеток животных и человека: эмбриональными стволовыми клетками и неэмбриональными «соматическими» или «взрослыми» стволовыми клетками. Функции и характеристики этих ячеек будут объяснены в этом документе.Ученые открыли способы получения эмбриональных стволовых клеток из ранних эмбрионов мыши почти 30 лет назад, в 1981 году. Подробное изучение биологии стволовых клеток мыши привело к открытию в 1998 году метода получения стволовых клеток из человеческих эмбрионов и их выращивания. клетки в лаборатории. Эти клетки называются эмбриональными стволовыми клетками человека. Эмбрионы, использованные в этих исследованиях, были созданы для репродуктивных целей с помощью процедур оплодотворения in vitro, . Когда они больше не были нужны для этой цели, они были переданы для исследования с информированного согласия донора.В 2006 году исследователи совершили еще один прорыв, определив условия, которые позволили бы некоторым специализированным взрослым клеткам генетически «перепрограммироваться», чтобы они приняли состояние, подобное стволовым клеткам. Этот новый тип стволовых клеток, называемых индуцированными плюрипотентными стволовыми клетками (ИПСК), будет обсуждаться в следующем разделе этого документа.
Стволовые клетки важны для живых организмов по многим причинам. В 3-5-дневном эмбрионе, называемом бластоцистой, внутренние клетки дают начало всему телу организма, включая все многие специализированные типы клеток и органы, такие как сердце, легкие, кожа, сперма, яйца и другие ткани.В некоторых тканях взрослого организма, таких как костный мозг, мышцы и мозг, отдельные популяции взрослых стволовых клеток создают замену клеткам, которые теряются в результате нормального износа, травм или болезней.
Благодаря своей уникальной регенеративной способности стволовые клетки открывают новые возможности для лечения таких заболеваний, как диабет и болезни сердца. Однако в лаборатории и клинике еще предстоит проделать большую работу, чтобы понять, как использовать эти клетки для клеточной терапии для лечения заболеваний, которые также называют регенеративной или репаративной медициной.
Лабораторные исследования стволовых клеток позволяют ученым узнать об основных свойствах клеток и о том, что отличает их от специализированных типов клеток. Ученые уже используют стволовые клетки в лаборатории для проверки новых лекарств и разработки модельных систем для изучения нормального роста и выявления причин врожденных дефектов.
Исследования стволовых клеток продолжают расширять знания о том, как организм развивается из одной клетки и как здоровые клетки заменяют поврежденные клетки во взрослых организмах.Исследование стволовых клеток — одна из самых увлекательных областей современной биологии, но, как и во многих расширяющихся областях научных исследований, исследования стволовых клеток поднимают научные вопросы так же быстро, как и порождают новые открытия.
Каковы уникальные свойства всех стволовых клеток?
Стволовые клетки отличаются от других клеток организма. Все стволовые клетки — независимо от их источника — обладают тремя основными свойствами: они способны делиться и обновляться в течение длительных периодов времени; они неспециализированы; и они могут дать начало специализированным типам клеток.
Стволовые клетки способны делиться и обновляться в течение длительных периодов времени . В отличие от мышечных клеток, клеток крови или нервных клеток, которые обычно не реплицируются, стволовые клетки могут многократно реплицироваться или размножаться. Начальная популяция стволовых клеток, которая размножается в течение многих месяцев в лаборатории, может дать миллионы клеток. Если полученные клетки продолжают оставаться неспециализированными, как родительские стволовые клетки, считается, что клетки способны к долгосрочному самообновлению.
Ученые пытаются понять два фундаментальных свойства стволовых клеток, которые связаны с их долгосрочным самообновлением:
- почему эмбриональные стволовые клетки могут пролиферировать в течение года или более в лаборатории без дифференциации, а большинство неэмбриональных стволовых клеток — нет; и
- какие факторы в живых организмах обычно регулируют пролиферацию и самообновление стволовых клеток?
Обнаружение ответов на эти вопросы может позволить понять, как регулируется пролиферация клеток во время нормального эмбрионального развития или во время аномального деления клеток, которое приводит к раку.Такая информация также позволит ученым более эффективно выращивать эмбриональные и неэмбриональные стволовые клетки в лаборатории.
Специфические факторы и условия, которые позволяют стволовым клеткам оставаться неспециализированными, представляют большой интерес для ученых. Ученым потребовалось много лет проб и ошибок, чтобы научиться получать и поддерживать стволовые клетки в лаборатории без их спонтанной дифференциации в определенные типы клеток. Например, потребовалось два десятилетия, чтобы научиться выращивать эмбриональные стволовые клетки человека в лаборатории после создания условий для выращивания стволовых клеток мыши.Следовательно, понимание сигналов в зрелом организме, которые вызывают пролиферацию популяции стволовых клеток и остаются неспециализированными до тех пор, пока клетки не потребуются. Такая информация крайне важна для ученых, чтобы они могли вырастить в лаборатории большое количество неспециализированных стволовых клеток для дальнейших экспериментов.
Стволовые клетки неспециализированные. Одним из фундаментальных свойств стволовой клетки является то, что у нее нет тканеспецифичных структур, которые позволяют ей выполнять специализированные функции.Например, стволовая клетка не может работать со своими соседями, прокачивая кровь по телу (как клетка сердечной мышцы), и не может переносить молекулы кислорода через кровоток (как эритроцит). Однако неспециализированные стволовые клетки могут давать начало специализированным клеткам, включая клетки сердечной мышцы, клетки крови или нервные клетки.
Стволовые клетки могут давать начало специализированным клеткам . Когда неспециализированные стволовые клетки дают начало специализированным клеткам, этот процесс называется дифференцировкой.Во время дифференцировки клетка обычно проходит несколько стадий, становясь более специализированной на каждом шаге. Ученые только начинают понимать сигналы внутри и снаружи клеток, которые запускают каждый стержень процесса дифференцировки. Внутренние сигналы контролируются клеточными генами, которые разбросаны по длинным цепочкам ДНК и несут закодированные инструкции для всех клеточных структур и функций. Внешние сигналы для дифференцировки клеток включают химические вещества, выделяемые другими клетками, физический контакт с соседними клетками и определенные молекулы в микроокружении.Взаимодействие сигналов во время дифференцировки заставляет ДНК клетки приобретать эпигенетические метки, которые ограничивают экспрессию ДНК в клетке и могут передаваться через клеточное деление.
Остается много вопросов о дифференцировке стволовых клеток. Например, одинаковы ли внутренние и внешние сигналы для дифференцировки клеток для всех видов стволовых клеток? Можно ли идентифицировать конкретные наборы сигналов, которые способствуют дифференцировке в определенные типы клеток? Решение этих вопросов может привести ученых к поиску новых способов контроля дифференцировки стволовых клеток в лаборатории, тем самым выращивая клетки или ткани, которые можно использовать для определенных целей, таких как клеточная терапия или скрининг лекарств.
Взрослые стволовые клетки обычно генерируют типы клеток ткани, в которой они находятся. Например, взрослые кроветворные стволовые клетки в костном мозге обычно дают начало многим типам клеток крови. Принято считать, что кроветворная клетка в костном мозге, называемая гемопоэтической стволовой клеткой, не может давать начало клеткам совсем другой ткани, например, нервным клеткам головного мозга. Эксперименты последних нескольких лет имели целью показать, что стволовые клетки из одной ткани могут давать начало клеточным типам совершенно другой ткани.Это остается предметом больших дискуссий в исследовательском сообществе. Это противоречие демонстрирует проблемы изучения взрослых стволовых клеток и предполагает, что необходимы дополнительные исследования с использованием взрослых стволовых клеток, чтобы понять их полный потенциал в качестве будущих методов лечения.
Что такое эмбриональные стволовые клетки?
A. Какие стадии раннего эмбрионального развития важны для образования эмбриональных стволовых клеток?
Эмбриональные стволовые клетки, как следует из их названия, происходят из эмбрионов.Большинство эмбриональных стволовых клеток получают из эмбрионов, которые развиваются из яйцеклеток, оплодотворенных in vitro, — в клинике оплодотворения in vitro, — и затем переданных для исследовательских целей с информированного согласия доноров. Это , а не , полученные из яиц, оплодотворенных в организме женщины.
B. Как эмбриональные стволовые клетки выращивают в лаборатории?
Выращивание клеток в лаборатории называется культурой клеток. Эмбриональные стволовые клетки человека (hESC) генерируются путем переноса клеток из эмбриона на стадии до имплантации в пластиковую лабораторную чашку для культивирования, содержащую питательный бульон, известный как питательная среда.Клетки делятся и распределяются по поверхности блюда. Внутренняя поверхность чашки для культивирования обычно покрыта клетками кожи эмбриона мыши, обработанными таким образом, чтобы они не делились. Этот слой покрытия ячеек называется фидерным слоем. Клетки мыши на дне чашки для культивирования обеспечивают клеткам липкую поверхность, к которой они могут прикрепляться. Кроме того, питающие клетки выделяют питательные вещества в питательную среду. Исследователи разработали способы выращивания эмбриональных стволовых клеток без кормовых клеток мышей.Это значительный научный прогресс из-за риска того, что вирусы или другие макромолекулы в клетках мыши могут передаваться в клетки человека.
Процесс создания линии эмбриональных стволовых клеток несколько неэффективен, поэтому линии не образуются каждый раз, когда клетки эмбриона на стадии доимплантации помещаются в чашку для культивирования. Однако, если посевные клетки выживают, делятся и размножаются достаточно, чтобы заполнить чашку, их осторожно удаляют и высевают в несколько чашек со свежей культурой.Процесс повторного посева или субкультивирования клеток повторяется много раз и в течение многих месяцев. Каждый цикл субкультивирования клеток называется пассажем. Как только клеточная линия создана, исходные клетки дают миллионы эмбриональных стволовых клеток. Эмбриональные стволовые клетки, которые пролиферировали в культуре клеток в течение длительного периода времени без дифференциации, являются плюрипотентными и не имеют генетических аномалий, называются линией эмбриональных стволовых клеток. На любом этапе процесса партии клеток можно заморозить и отправить в другие лаборатории для дальнейшего культивирования и экспериментов.
C. Какие лабораторные тесты используются для идентификации эмбриональных стволовых клеток?
На разных этапах процесса создания линий эмбриональных стволовых клеток ученые тестируют клетки, чтобы увидеть, проявляют ли они те фундаментальные свойства, которые делают их эмбриональными стволовыми клетками. Этот процесс называется характеристикой.
Ученые, изучающие эмбриональные стволовые клетки человека, еще не согласовали стандартный набор тестов, которые измеряют фундаментальные свойства клеток. Однако лаборатории, выращивающие линии эмбриональных стволовых клеток человека, используют несколько видов тестов, в том числе:
- Выращивание и субкультивирование стволовых клеток в течение многих месяцев.Это гарантирует, что клетки способны к долгосрочному росту и самообновлению. Ученые исследуют культуры под микроскопом, чтобы убедиться, что клетки выглядят здоровыми и остаются недифференцированными.
- Использование специальных методов для определения наличия факторов транскрипции, которые обычно продуцируются недифференцированными клетками. Двумя наиболее важными факторами транскрипции являются Nanog и Oct4. Факторы транскрипции помогают включать и выключать гены в нужное время, что является важной частью процессов дифференцировки клеток и эмбрионального развития.В этом случае и Oct 4, и Nanog связаны с поддержанием стволовых клеток в недифференцированном состоянии, способном к самообновлению.
- Использование специальных методов для определения наличия определенных маркеров клеточной поверхности, которые обычно продуцируются недифференцированными клетками.
- Изучение хромосом под микроскопом. Это метод оценки того, повреждены ли хромосомы или изменилось ли количество хромосом. Он не обнаруживает генетических мутаций в клетках.
- Определение возможности повторного выращивания или субкультивирования клеток после замораживания, оттаивания и повторного посева.
- Проверка, являются ли эмбриональные стволовые клетки человека плюрипотентными: 1) позволяет клеткам спонтанно дифференцироваться в культуре клеток; 2) манипулирование клетками таким образом, чтобы они дифференцировались с образованием клеток, характерных для трех зародышевых листков; или 3) инъекции клеток мыши с подавленной иммунной системой для проверки образования доброкачественной опухоли, называемой тератомой.Поскольку иммунная система мыши подавлена, введенные человеческие стволовые клетки не отторгаются иммунной системой мыши, и ученые могут наблюдать рост и дифференцировку человеческих стволовых клеток. Тератомы обычно содержат смесь многих дифференцированных или частично дифференцированных типов клеток — показатель того, что эмбриональные стволовые клетки способны дифференцироваться на несколько типов клеток.
D. Каким образом стимулируются эмбриональные стволовые клетки к дифференцировке?
Рисунок 1.Направленная дифференцировка эмбриональных стволовых клеток мыши. (© 2001 Тереза Уинслоу)
Пока эмбриональные стволовые клетки в культуре выращиваются в соответствующих условиях, они могут оставаться недифференцированными (неспециализированными). Но если клеткам дать возможность сгруппироваться, чтобы сформировать эмбриоидные тела, они начнут спонтанно дифференцироваться. Они могут образовывать мышечные клетки, нервные клетки и многие другие типы клеток. Хотя спонтанная дифференцировка является хорошим показателем того, что культура эмбриональных стволовых клеток является здоровой, она не является эффективным способом получения культур определенных типов клеток.
Итак, чтобы создать культуры определенных типов дифференцированных клеток — например, клеток сердечной мышцы, клеток крови или нервных клеток — ученые пытаются контролировать дифференцировку эмбриональных стволовых клеток. Они изменяют химический состав культуральной среды, изменяют поверхность культуральной чашки или модифицируют клетки, вставляя определенные гены. За годы экспериментов ученые установили некоторые базовые протоколы или «рецепты» для направленной дифференцировки эмбриональных стволовых клеток в определенные типы клеток (рис. 1).(Дополнительные примеры направленной дифференцировки эмбриональных стволовых клеток см. В отчетах NIH о стволовых клетках, доступных на / info / 2006report / и /info/2001report/2001report.htm.)
Если ученые смогут надежно направить дифференцировку эмбриональных стволовых клеток в определенные типы клеток, они смогут использовать полученные дифференцированные клетки для лечения определенных заболеваний в будущем. Заболевания, которые можно лечить путем трансплантации клеток, полученных из эмбриональных стволовых клеток человека, включают болезнь Паркинсона, диабет, травматическое повреждение спинного мозга, мышечную дистрофию Дюшенна, болезни сердца, а также потерю зрения и слуха.
Что такое взрослые стволовые клетки?
Считается, что взрослая стволовая клетка является недифференцированной клеткой, обнаруживаемой среди дифференцированных клеток в ткани или органе, которая может обновляться и дифференцироваться с образованием некоторых или всех основных специализированных типов клеток ткани или органа. Основные функции взрослых стволовых клеток в живом организме — поддерживать и восстанавливать ткань, в которой они находятся. Ученые также используют термин соматические стволовые клетки вместо взрослых стволовых клеток, где соматические относятся к клеткам организма (а не к половым клеткам, сперматозоидам или яйцеклеткам).В отличие от эмбриональных стволовых клеток, которые определяются по их происхождению (клетки эмбриона на доимплантационной стадии), происхождение взрослых стволовых клеток в некоторых зрелых тканях все еще исследуется.
Исследования взрослых стволовых клеток вызвали большой интерес. Ученые обнаружили взрослые стволовые клетки во гораздо большем количестве тканей, чем они когда-то считали возможным. Это открытие заставило исследователей и клиницистов задаться вопросом, можно ли использовать взрослые стволовые клетки для трансплантации. Фактически, взрослые гемопоэтические или кроветворные стволовые клетки из костного мозга использовались при трансплантации уже 40 лет.У ученых теперь есть доказательства существования стволовых клеток в головном мозге и сердце. Если дифференцировку взрослых стволовых клеток можно контролировать в лаборатории, эти клетки могут стать основой терапии, основанной на трансплантации.
История исследований взрослых стволовых клеток началась около 50 лет назад. В 1950-х годах исследователи обнаружили, что костный мозг содержит как минимум два вида стволовых клеток. Одна популяция, называемая гемопоэтическими стволовыми клетками, формирует все типы клеток крови в организме.Вторая популяция, называемая стромальными стволовыми клетками костного мозга (также называемыми мезенхимальными стволовыми клетками или скелетными стволовыми клетками), была обнаружена несколько лет спустя. Эти негемопоэтические стволовые клетки составляют небольшую часть популяции стромальных клеток в костном мозге и могут генерировать кости, хрящи, жир, клетки, которые поддерживают образование крови, и волокнистую соединительную ткань.
В 1960-х годах ученые, изучающие крыс, обнаружили две области мозга, содержащие делящиеся клетки, которые в конечном итоге становятся нервными клетками.Несмотря на эти сообщения, большинство ученых считали, что мозг взрослого человека не может генерировать новые нервные клетки. Только в 1990-х годах ученые пришли к выводу, что мозг взрослого человека действительно содержит стволовые клетки, способные генерировать три основных типа клеток мозга — астроциты и олигодендроциты, которые не являются нейрональными клетками, и нейроны или нервные клетки.
A. Где находятся взрослые стволовые клетки и что они обычно делают?
Взрослые стволовые клетки были идентифицированы во многих органах и тканях, включая мозг, костный мозг, периферическую кровь, кровеносные сосуды, скелетные мышцы, кожу, зубы, сердце, кишечник, печень, эпителий яичников и яички.Считается, что они находятся в определенной области каждой ткани (так называемой «нише стволовых клеток»). Имеющиеся данные свидетельствуют о том, что во многих тканях некоторые типы стволовых клеток представляют собой перициты, клетки, которые составляют самый внешний слой мелких кровеносных сосудов. Стволовые клетки могут оставаться неподвижными (неделящимися) в течение долгих периодов времени, пока они не будут активированы нормальной потребностью в большем количестве клеток для поддержания тканей, либо болезнью, либо повреждением ткани.
Обычно в каждой ткани очень небольшое количество стволовых клеток, и после удаления из организма их способность к делению ограничена, что затрудняет создание большого количества стволовых клеток.Ученые во многих лабораториях пытаются найти более эффективные способы выращивания больших количеств взрослых стволовых клеток в клеточной культуре и манипулирования ими для получения определенных типов клеток, чтобы их можно было использовать для лечения травм или болезней. Некоторые примеры потенциальных методов лечения включают регенерацию кости с использованием клеток, полученных из стромы костного мозга, разработку клеток, продуцирующих инсулин, для лечения диабета 1 типа и восстановление поврежденной сердечной мышцы после сердечного приступа клетками сердечной мышцы.
B. Какие тесты используются для идентификации взрослых стволовых клеток?
Ученые часто используют один или несколько из следующих методов для идентификации взрослых стволовых клеток: (1) маркируют клетки в живой ткани молекулярными маркерами, а затем определяют специализированные типы клеток, которые они генерируют; (2) удалить клетки из живого животного, пометить их в клеточной культуре и трансплантировать их обратно другому животному, чтобы определить, заменяют ли клетки (или «повторно заселяют») исходную ткань.
Важно отметить, что необходимо продемонстрировать, что одна взрослая стволовая клетка может генерировать линию генетически идентичных клеток, которая затем дает начало всем подходящим дифференцированным типам клеток ткани. Чтобы экспериментально подтвердить, что предполагаемая взрослая стволовая клетка действительно является стволовой клеткой, ученые стремятся показать, что либо эта клетка может давать начало этим генетически идентичным клеткам в культуре, и / или что очищенная популяция этих стволовых клеток-кандидатов может повторно заселяться или реформироваться. ткань после трансплантации животному.
C. Что известно о дифференцировке взрослых стволовых клеток?
Рисунок 2. Дифференцировка гемопоэтических и стромальных стволовых клеток (© 2001 Terese Winslow)
Как указано выше, ученые сообщили, что взрослые стволовые клетки встречаются во многих тканях и вступают в нормальные пути дифференцировки с образованием специализированных типов клеток ткани, в которой они находятся.
Нормальные пути дифференцировки взрослых стволовых клеток. У живого животного взрослые стволовые клетки доступны для деления, когда это необходимо, и могут дать начало зрелым типам клеток, которые имеют характерные формы и специализированные структуры и функции конкретной ткани.Ниже приведены примеры путей дифференцировки взрослых стволовых клеток (рис. 2), которые были продемонстрированы in vitro или in vivo .
- Гематопоэтические стволовые клетки дают начало всем типам клеток крови: эритроцитам, В-лимфоцитам, Т-лимфоцитам, естественным киллерам, нейтрофилам, базофилам, эозинофилам, моноцитам и макрофагам.
- Мезенхимальные стволовые клетки дают начало множеству типов клеток: костным клеткам (остеоцитам), хрящевым клеткам (хондроцитам), жировым клеткам (адипоцитам) и другим видам клеток соединительной ткани, таким как клетки сухожилий.
- Нервные стволовые клетки в головном мозге дают начало трем основным типам клеток: нервным клеткам (нейронам) и двум категориям ненейрональных клеток — астроцитам и олигодендроцитам.
- Эпителиальные стволовые клетки выстилки пищеварительного тракта находятся в глубоких криптах и дают начало нескольким типам клеток: абсорбирующим клеткам, бокаловидным клеткам, клеткам Панета и энтероэндокринным клеткам.
- Стволовые клетки кожи встречаются в базальном слое эпидермиса и в основании волосяных фолликулов.Эпидермальные стволовые клетки дают начало кератиноцитам, которые мигрируют на поверхность кожи и образуют защитный слой. Фолликулярные стволовые клетки могут давать начало как волосяному фолликулу, так и эпидермису.
Трансдифференциация. В ряде экспериментов сообщалось, что определенные типы взрослых стволовых клеток могут дифференцироваться в типы клеток, наблюдаемые в органах или тканях, отличные от тех, которые ожидаются от предсказанной линии происхождения клеток (т. Е. Стволовые клетки мозга, которые дифференцируются в клетки крови или кроветворные клетки, которые дифференцируются в клетки сердечной мышцы и т. д.).Это зарегистрированное явление называется трансдифференцировкой.
Хотя отдельные случаи трансдифференцировки наблюдались у некоторых видов позвоночных, в научном сообществе обсуждается, действительно ли это явление происходит у людей. Вместо трансдифференцировки наблюдаемые случаи могут включать слияние донорской клетки с реципиентной клеткой. Другая возможность заключается в том, что трансплантированные стволовые клетки являются секретирующими факторами, которые побуждают собственные стволовые клетки реципиента начать процесс восстановления.Даже когда трансдифференцировка была обнаружена, только очень небольшой процент клеток подвергается этому процессу.
В одном из вариантов экспериментов по трансдифференцировке ученые недавно продемонстрировали, что определенные типы взрослых клеток могут быть «перепрограммированы» в другие типы клеток in vivo с использованием хорошо контролируемого процесса генетической модификации (см. Раздел VI для обсуждения принципов репрограммирования). . Эта стратегия может предложить способ перепрограммировать доступные клетки в другие типы клеток, которые были потеряны или повреждены из-за болезни.Например, один недавний эксперимент показывает, как бета-клетки поджелудочной железы, инсулин-продуцирующие клетки, которые теряются или повреждаются при диабете, могут быть созданы путем перепрограммирования других клеток поджелудочной железы. «Возобновив» экспрессию трех критических генов бета-клеток в дифференцированных экзокринных клетках взрослой поджелудочной железы, исследователи смогли создать клетки, подобные бета-клеткам, которые могут секретировать инсулин. Перепрограммированные клетки были похожи на бета-клетки по внешнему виду, размеру и форме; экспрессированные гены, характерные для бета-клеток; и смогли частично восстановить регуляцию уровня сахара в крови у мышей, чьи собственные бета-клетки были химически разрушены.Не являясь трансдифференцировкой по определению, этот метод перепрограммирования взрослых клеток может использоваться в качестве модели для прямого перепрограммирования других типов взрослых клеток.
Помимо перепрограммирования клеток для превращения их в клетки определенного типа, теперь возможно перепрограммировать взрослые соматические клетки, чтобы они стали подобны эмбриональным стволовым клеткам (индуцированные плюрипотентные стволовые клетки, ИПСК) посредством введения эмбриональных генов. Таким образом, может быть создан источник клеток, специфичных для донора, тем самым увеличивая вероятность совместимости, если такие клетки будут использоваться для регенерации ткани.Однако, как и эмбриональные стволовые клетки, определение методов, с помощью которых ИПСК могут быть полностью и воспроизводимо коммитированы в соответствующие клеточные линии, все еще исследуются.
D. Каковы ключевые вопросы о взрослых стволовых клетках?
Еще предстоит ответить на многие важные вопросы о взрослых стволовых клетках. В их числе:
- Сколько видов взрослых стволовых клеток существует и в каких тканях они существуют?
- Как взрослые стволовые клетки развиваются во время развития и как они поддерживаются у взрослого? Являются ли они «остатками» эмбриональных стволовых клеток или возникают каким-то другим образом?
- Почему стволовые клетки остаются в недифференцированном состоянии, когда все клетки вокруг них дифференцировались? Каковы характеристики их «ниши», которая контролирует их поведение?
- Обладают ли взрослые стволовые клетки способностью к трансдифференцировке и можно ли контролировать этот процесс, чтобы повысить его надежность и эффективность?
- Если положительный эффект трансплантации взрослых стволовых клеток — это трофический эффект, каковы механизмы? Требуется ли контакт донорская клетка-реципиентная клетка, секреция факторов донорской клеткой или и то, и другое?
- Какие факторы контролируют пролиферацию и дифференцировку взрослых стволовых клеток?
- Какие факторы стимулируют перемещение стволовых клеток в места повреждения или повреждения, и как можно улучшить этот процесс для лучшего заживления?
В чем сходство и различие между эмбриональными и взрослыми стволовыми клетками?
Эмбриональные и взрослые стволовые клетки человека имеют свои преимущества и недостатки в отношении потенциального использования в регенеративной терапии на основе клеток.Одно из основных различий между взрослыми и эмбриональными стволовыми клетками заключается в их различных способностях по количеству и типу дифференцированных типов клеток, которыми они могут стать. Эмбриональные стволовые клетки могут стать клетками всех типов тела, потому что они плюрипотентны. Считается, что взрослые стволовые клетки могут дифференцироваться только в разные типы клеток ткани их происхождения.
Эмбриональные стволовые клетки относительно легко выращивать в культуре. Взрослые стволовые клетки редко встречаются в зрелых тканях, поэтому изолировать эти клетки от взрослой ткани сложно, а методы увеличения их количества в культуре клеток еще не разработаны.Это важное различие, поскольку для заместительной терапии стволовыми клетками необходимо большое количество клеток.
Ученые считают, что ткани, полученные из эмбриональных и взрослых стволовых клеток, могут отличаться по вероятности отторжения после трансплантации. Мы еще не знаем, будут ли ткани, полученные из эмбриональных стволовых клеток, вызывать отторжение трансплантата, поскольку первые клинические испытания первой фазы, проверяющие безопасность клеток, полученных из hESCS, только недавно были одобрены Управлением по контролю за продуктами и лекарствами США (FDA).
В настоящее время считается, что взрослые стволовые клетки и ткани, полученные из них, с меньшей вероятностью инициируют отторжение после трансплантации. Это связано с тем, что собственные клетки пациента могут быть увеличены в культуре, уговорены принять определенный тип клеток (дифференциация), а затем повторно введены пациенту. Использование взрослых стволовых клеток и тканей, полученных из собственных взрослых стволовых клеток пациента, будет означать, что клетки с меньшей вероятностью будут отторгаться иммунной системой. Это представляет собой значительное преимущество, поскольку иммунное отторжение можно обойти только путем постоянного приема иммунодепрессантов, а сами лекарства могут вызывать вредные побочные эффекты
Что такое индуцированные плюрипотентные стволовые клетки?
Индуцированные плюрипотентные стволовые клетки (ИПСК) — это взрослые клетки, которые были генетически перепрограммированы в состояние, подобное эмбриональным стволовым клеткам, будучи вынужденными экспрессировать гены и факторы, важные для поддержания определяющих свойств эмбриональных стволовых клеток.Хотя эти клетки соответствуют определяющим критериям плюрипотентных стволовых клеток, неизвестно, отличаются ли ИПСК и эмбриональные стволовые клетки клинически значимыми способами. Впервые ИПСК мыши были описаны в 2006 году, а ИПСК человека впервые были описаны в конце 2007 года. ИПСК мыши демонстрируют важные характеристики плюрипотентных стволовых клеток, включая экспрессию маркеров стволовых клеток, формирование опухолей, содержащих клетки всех трех зародышевых листков, и способность вносить свой вклад в множество различных тканей при введении в эмбрионы мыши на очень ранней стадии развития.ИПСК человека также экспрессируют маркеры стволовых клеток и способны генерировать клетки, характерные для всех трех зародышевых листков.
Хотя необходимы дополнительные исследования, ИПСК уже являются полезными инструментами для разработки лекарств и моделирования заболеваний, и ученые надеются использовать их в трансплантологии. В настоящее время вирусы используются для введения факторов репрограммирования во взрослые клетки, и этот процесс необходимо тщательно контролировать и тестировать, прежде чем этот метод сможет привести к полезным методам лечения людей.В исследованиях на животных вирус, используемый для введения факторов стволовых клеток, иногда вызывает рак. В настоящее время исследователи изучают невирусные стратегии доставки. В любом случае это революционное открытие создало новый мощный способ «дедифференцировки» клеток, судьба развития которых, как предполагалось ранее, была определена. Кроме того, ткани, полученные из ИПСК, будут почти идентичны клеточному донору и, таким образом, вероятно, избежать отторжения иммунной системой. Стратегия ИПСК создает плюрипотентные стволовые клетки, которые вместе с исследованиями других типов плюрипотентных стволовых клеток помогут исследователям научиться репрограммировать клетки для восстановления поврежденных тканей в организме человека.
Каковы потенциальные применения стволовых клеток человека и препятствия, которые необходимо преодолеть, прежде чем эти потенциальные применения будут реализованы?
Есть много способов использования стволовых клеток человека в исследованиях и в клинике. Исследования эмбриональных стволовых клеток человека дадут информацию о сложных событиях, происходящих в процессе развития человека. Основная цель этой работы — определить, как недифференцированные стволовые клетки становятся дифференцированными клетками, из которых формируются ткани и органы.Ученые знают, что включение и выключение генов играет центральную роль в этом процессе. Некоторые из наиболее серьезных заболеваний, такие как рак и врожденные дефекты, возникают из-за аномального деления и дифференцировки клеток. Более полное понимание генетического и молекулярного контроля этих процессов может дать информацию о том, как возникают такие заболевания, и предложить новые стратегии лечения. Предсказуемый контроль пролиферации и дифференцировки клеток требует дополнительных фундаментальных исследований молекулярных и генетических сигналов, которые регулируют деление и специализацию клеток.Хотя недавние разработки с iPS-клетками предполагают некоторые из конкретных факторов, которые могут быть задействованы, необходимо разработать методы, позволяющие безопасно вводить эти факторы в клетки и контролировать процессы, вызываемые этими факторами.
Стволовые клетки человека также могут быть использованы для тестирования новых лекарств. Например, новые лекарства могут быть протестированы на безопасность на дифференцированных клетках, полученных из линий плюрипотентных клеток человека. Таким образом уже используются другие виды клеточных линий. Линии раковых клеток, например, используются для скрининга потенциальных противоопухолевых препаратов.Доступность плюрипотентных стволовых клеток позволит тестировать лекарства на более широком спектре типов клеток. Однако для эффективного скрининга лекарств условия должны быть идентичными при сравнении разных лекарств. Следовательно, ученые должны будут иметь возможность точно контролировать дифференцировку стволовых клеток в клетки определенного типа, на которых будут тестироваться лекарства. Текущие знания о сигналах, контролирующих дифференцировку, не позволяют точно имитировать эти условия для создания чистых популяций дифференцированных клеток для каждого тестируемого лекарства.
Возможно, наиболее важным потенциальным применением стволовых клеток человека является создание клеток и тканей, которые можно было бы использовать для клеточной терапии. Сегодня пожертвованные органы и ткани часто используются для замены больной или разрушенной ткани, но потребность в трансплантируемых тканях и органах намного превышает имеющиеся запасы. Стволовые клетки, предназначенные для дифференциации в определенные типы клеток, предлагают возможность возобновляемого источника замещающих клеток и тканей для лечения заболеваний, включая болезнь Альцгеймера, травму спинного мозга, инсульт, ожоги, болезни сердца, диабет, остеоартрит и ревматоидный артрит.
Рис. 3. Стратегии восстановления сердечной мышцы с помощью взрослых стволовых клеток.
© 2001 Тереза Уинслоу
Например, может стать возможным генерировать здоровые клетки сердечной мышцы в лаборатории, а затем трансплантировать эти клетки пациентам с хроническими заболеваниями сердца. Предварительные исследования на мышах и других животных показывают, что стромальные клетки костного мозга, трансплантированные в поврежденное сердце, могут иметь положительный эффект. Могут ли эти клетки генерировать клетки сердечной мышцы или стимулировать рост новых кровеносных сосудов, которые повторно заселяют сердечную ткань, или помочь через какой-либо другой механизм, активно исследуется.Например, введенные клетки могут выполнять восстановление, секретируя факторы роста, а не фактически внедряясь в сердце. Обнадеживающие результаты исследований на животных послужили основой для небольшого количества поисковых исследований на людях (обсуждение см. В рамке «Могут ли стволовые клетки излечить разбитое сердце?»). Другие недавние исследования систем клеточных культур показывают, что можно направить дифференцировку эмбриональных стволовых клеток или взрослых клеток костного мозга в клетки сердечной мышцы (рис. 3).
Могут ли стволовые клетки излечить разбитое сердце?: Стволовые клетки для будущего лечения сердечных заболеваний
Сердечно-сосудистые заболевания (ССЗ), включающие гипертонию, ишемическую болезнь сердца, инсульт и застойную сердечную недостаточность, считаются причиной смерти номер один в Соединенных Штатах каждый год с 1900 года, за исключением 1918 года, когда страна боролась с эпидемией гриппа. . Ежедневно от сердечно-сосудистых заболеваний умирает около 2600 американцев, примерно один человек каждые 34 секунды. Учитывая старение населения и относительно резкое недавнее увеличение распространенности факторов риска сердечно-сосудистых заболеваний, таких как ожирение и диабет 2 типа, сердечно-сосудистые заболевания станут серьезной проблемой для здоровья и в 21 веке.
Сердечно-сосудистые заболевания могут лишать сердечную ткань кислорода, тем самым убивая клетки сердечной мышцы (кардиомиоциты). Эта потеря вызывает каскад неблагоприятных событий, включая образование рубцовой ткани, перегрузку кровотока и способности к давлению, чрезмерное растяжение жизнеспособных сердечных клеток, пытающихся поддерживать сердечный выброс, что приводит к сердечной недостаточности и, в конечном итоге, к смерти. Таким образом, восстановление поврежденной ткани сердечной мышцы путем восстановления или регенерации является потенциально новой стратегией лечения сердечной недостаточности.
Использование эмбриональных и взрослых стволовых клеток для восстановления сердца является активной областью исследований. Ряд типов стволовых клеток, включая эмбриональные стволовые (ES) клетки, сердечные стволовые клетки, которые естественным образом находятся в сердце, миобласты (мышечные стволовые клетки), взрослые клетки костного мозга, включая мезенхимные клетки (клетки костного мозга, которые дают рост к тканям, таким как мышцы, кости, сухожилия, связки и жировая ткань), эндотелиальные клетки-предшественники (клетки, дающие начало эндотелию, внутренней выстилке кровеносных сосудов) и клетки пуповинной крови, были исследованы как возможные источники для регенерация поврежденной ткани сердца.Все они были исследованы на моделях мышей или крыс, а некоторые были протестированы на более крупных животных моделях, таких как свиньи.
Также было проведено несколько небольших исследований на людях, обычно на пациентах, перенесших операцию на открытом сердце. Некоторые из них продемонстрировали, что стволовые клетки, которые вводятся в кровоток или непосредственно в поврежденную ткань сердца, по-видимому, улучшают сердечную функцию и / или вызывают образование новых капилляров. Механизм этого восстановления остается спорным, и стволовые клетки, вероятно, регенерируют сердечную ткань несколькими путями.Однако популяции стволовых клеток, которые были протестированы в этих экспериментах, сильно различаются, как и условия их очистки и применения. Хотя для оценки безопасности и повышения эффективности этого подхода необходимы гораздо больше исследований, эти предварительные клинические эксперименты показывают, как однажды стволовые клетки могут быть использованы для восстановления поврежденной ткани сердца, тем самым уменьшая бремя сердечно-сосудистых заболеваний.
У людей, страдающих диабетом 1 типа, клетки поджелудочной железы, которые обычно вырабатывают инсулин, разрушаются собственной иммунной системой пациента.Новые исследования показывают, что можно направить дифференцировку эмбриональных стволовых клеток человека в культуру клеток с образованием инсулин-продуцирующих клеток, которые в конечном итоге можно будет использовать в трансплантационной терапии для людей с диабетом.
Чтобы реализовать перспективы новых клеточных методов лечения таких распространенных и изнурительных заболеваний, ученые должны уметь манипулировать стволовыми клетками, чтобы они обладали необходимыми характеристиками для успешной дифференциации, трансплантации и приживления.Ниже приводится список этапов успешного лечения на основе клеток, которым ученым придется научиться управлять, чтобы такие методы лечения были доставлены в клинику. Чтобы стволовые клетки можно было использовать для трансплантации, их необходимо воспроизводить до:
- Широко размножаются и производят достаточное количество ткани.
- Различают клетки желаемого типа.
- Выжить у реципиента после трансплантации.
- После трансплантации интегрируется в окружающие ткани.
- Действовать надлежащим образом на протяжении всей жизни получателя.
- Избегайте причинения вреда получателю.
Кроме того, чтобы избежать проблемы иммунного отторжения, ученые экспериментируют с различными исследовательскими стратегиями для создания тканей, которые не будут отторгаться.

