Почему я отказалась бороться за свою дочь с синдромом Патау | Клуб Анонимных Мам
Вчера мы узнали пол ребенка! И то, что у нашей дочери хромосомные аномалии.
Несколько недель назад во время первого скрининга врач сказал нам, что с точки зрения УЗИ, все идеально, но анализ крови вернулся с повышенным риском развития синдрома Дауна (1 из 77). И она рекомендует сделать неинвазивный тест. Мы согласились.
Тест должен был занять 1 неделю, но прошло полторы, а новостей все не было. Я начала чувствовать, что что-то не так. Вчера днем мне позвонили… Слушая доктора, я едва сдерживала слезы, а когда повесила трубку, то разрыдалась.
Слезы текли быстрее, чем я успевала их вытирать. Моя 2,5-летняя дочка забралась ко мне на колени и начала утешать: «Все хорошо, мама. Что случилось, мама?». Новость, которую я услышала, была шокирующей:
– Тест дал отрицательный результат на синдром Дауна, но положительный на синдром Патау. У вашего ребенка в клетках дополнительная 13-ая хромосома.
У вашего ребенка в клетках дополнительная 13-ая хромосома.
Еще врач сказал, что это может быть ложноположительный результат, и мы должны сделать амниоцентез. Мой разум лихорадочно работал. Я позвонила мужу и рассказала ему, а утром записалась на процедуру.
Врач снова посмотрел на УЗИ и не нашел у ребенка никаких отклонений. Значит, у нас есть 50% шанс, что наша девочка в порядке. Следующий шаг – амниоцентез. Это было не больно, и Эйприл отлично справилась. Она все время двигалась, сердцебиение оставалось ровным.
В оболочке после прокола был небольшой разрыв, поэтому врач хотел, чтобы я немного задержалась и сделала еще одно УЗИ через 10-20 минут. Второй ультразвук выглядел великолепно. Мне сказали отдохнуть и полежать следующие 48 часов.
Врач записал номер моего телефона и сказал, что позвонит, как только получит результаты. Сейчас вечер четверга. Я устала, но не сплю. Мое тело болит от стресса. Мое лицо распухло от слез. Я не верю, что у моей дочери трисомия 13. Я считаю, что она в порядке и здорова.
Я не верю, что у моей дочери трисомия 13. Я считаю, что она в порядке и здорова.
В понедельник мне позвонил генетик. Он сказал, что амниоцентез дал положительный результат на трисомию 13 (исследование показало аномалию в 97,5% ее клеток). После этого я пошла на форумы родителей таких же детей, чтобы узнать у них ответ на один-единственный вопрос:
«Ваши дети выжили после рождения…Я знаю, что они – любовь всей вашей жизни. Я знаю, что вы на 100% рады, чтобы они родились, но мне нужна конкретика. Сколько лет вашему ребенку? Через сколько операций ему пришлось пройти? Какие у него проблемы со здоровьем? Каково качество его жизни?»
Мне нужна была правда.
Не та, где мама фотографирует ребенка-инвалида красиво, а затем выкладывает его снимки в социальные сети и радостно пишет, что он дожил до 3-6 лет и это чудо и такое счастье. Для меня эти вдохновляющие посты дают ложную надежду, и прививают чувство вины любому, кто отказывается бороться.
Ответы, которые я получила в группе родителей, были поверхностными. Очень мало кто рассказал мне о реальности, все говорили о любви и благословении.
Почему я рассматривала аборт по медицинским показаниям?
Я не хотела, чтобы мой ребенок страдал. Я не хотела, чтобы мой ребенок жил в больницах. Да, я люблю свою дочь, но я лучше отпущу ее, чем увижу, как она проходит через эти страдания.
Однако меня мучило чувство вины, потому что все, что я находила по теме, это были эти «вдохновляющие» истории. Ни одна мама не написала, что решилась на аборт или доносила ребенка до срока, но отказалась от реанимации и медицинских процедур.
Вчера вечером я наконец-то успокоилась. Я вспомнила о своем дяде, когда у него был рак. Он испытывал самую невыразимую боль, которую я когда-либо видела. Я бы все отдала, чтобы положить конец его боли – отпустить его.
В 2018 году у Катрин и ее мужа родился здоровый мальчикВ 2018 году у Катрин и ее мужа родился здоровый мальчик
И как только я поняла это, то смирилась с неизбежным: моя дочь смертельно больна. Но я могу отпустить ее быстро и безболезненно, если выберу аборт по медицинским показаниям.
Но я могу отпустить ее быстро и безболезненно, если выберу аборт по медицинским показаниям.
Я бы все отдала, чтобы вылечить свою дочь. Однако спасение ее жизни — это не то же самое, что исцеление. Спасти ее жизнь на несколько дней или даже лет было бы возможно. Но она не будет здорова. Это дорога, которая не подходит нашей семье.
Катрина
Подписывайтесь на нас, если вы — мама и вам интересно читать о материнстве! Больше интересного в нашей группе Вконтакте.
ЧИТАЙТЕ ТАКЖЕ: У моего ребенка после родов нашли синдром «кошачьего крика»
Родилась девочка с синдромом Патау. Виноваты врачи?
Никто не ожидал такого поворота событий. Молодая семья из Гродненской области с нетерпением ждала здоровую девочку, но родился ребенок с редким и неизлечимым синдромом Патау. Речь идет о генной аномалии. «Как такое не могли заметить специалисты на УЗИ?» — вопрос, который мучает супругов больше всего. Историю одного несчастья рассказывает газета «7 дней».
«Как такое не могли заметить специалисты на УЗИ?» — вопрос, который мучает супругов больше всего. Историю одного несчастья рассказывает газета «7 дней».
…Сашенька родилась раньше положенного срока. Малышку маме сразу не показали. Когда женщина наконец-то увидела малютку, которую она с такой любовью носила под сердцем, то потеряла сознание. С младенцем было явно что-то не так: на ручках по шесть пальчиков, деформировано личико, перекручены ножки…
Напуганным родителям никто толком не способен был объяснить, почему Сашенька такой родилась, к чему готовиться и, самое главное, можно ли это еще как-то исправить. У молодых людей лишь только поинтересовались, не собираются ли они отказаться от ребенка.
У девочки нашли синдром Патау. Это хромосомное заболевание человека, при котором в клетках появляется дополнительная хромосома 13. При синдроме Патау наблюдаются тяжелые врожденные пороки и целый букет серьезных патологий — нарушение развития различных отделов центральной нервной системы, низкий скошенный лоб, суженные глазные щели, запавшая переносица, широкое основание носа, деформированные ушные раковины, расщелина верхней губы и неба и т. д. У 80% новорожденных встречаются пороки развития сердца. Характерна задержка умственного развития. Большинство детей с синдромом Патау умирают в первые недели или месяцы жизни.
д. У 80% новорожденных встречаются пороки развития сердца. Характерна задержка умственного развития. Большинство детей с синдромом Патау умирают в первые недели или месяцы жизни.
Несмотря на всю тяжесть положения, супруги не согласились подписать отказную. Они были с малышкой до самого конца, но чуда так и не произошло. Сашеньку успели окрестить в больнице незадолго до смерти.
Почему опытным специалистам не удалось разглядеть вовремя такую тяжелую патологию? За комментарием журналисты обратились к заместителю директора по медицинской генетике Республиканского научно-практического центра «Мать и дитя» Ирине Наумчик.
— Риск рождения ребенка с врожденной аномалией или наследственной патологией есть даже у абсолютно здоровых родителей. Для того чтобы обнаружить максимально рано различные нарушения, у нас в стране используется скрининг беременных. Пройти ультразвуковое обследование в течение беременности женщина должна трижды. Правда, такое исследование помогает заметить только наиболее тяжелые пороки развития, которые рано себя проявляют еще во внутриутробном периоде. Еще одна задача ультразвукового осмотра — формирование группы риска по выявлению хромосомных нарушений у плода в первом триместре. Будущей маме, попавшей в эту группу риска, врачи обязательно предложат пройти дополнительное исследование по изучению хромосом плода.
Еще одна задача ультразвукового осмотра — формирование группы риска по выявлению хромосомных нарушений у плода в первом триместре. Будущей маме, попавшей в эту группу риска, врачи обязательно предложат пройти дополнительное исследование по изучению хромосом плода.
В ряде случаев некоторые изменения могут проявить себя в середине или даже во второй половине беременности. Не всю врожденную патологию можно обнаружить до появления ребенка на свет. Некоторые серьезные заболевания могут проявиться лишь после рождения, когда органы ребенка начинают самостоятельно функционировать.
— То есть опытный врач может не заметить такое страшное хромосомное заболевание, как синдром Патау?
— Во время ультразвукового осмотра нельзя поставить диагноз хромосомного синдрома. Можно только заподозрить ту самую группу риска. Сложно, а порой и невозможно увидеть на ультразвуке те нарушения, которые бы заставили заподозрить заболевание и стали бы показанием для хромосомного обследования.
Синдром Эдвардса диагностика трисомии
Синдром Эдвардса – генетическое заболевание, обусловленное трисомией по 18-й паре хромосом. Это довольно редкая аномалия, которая статистически встречается у 1 из 5000 новорожденных. Доказано, что частота формирования данной хромосомной аномалии выше, однако более чем в 70% такая беременность завершается самопроизвольным абортом или мёртворождением.
Проявления синдрома Эдвардса
Так как этот синдром проявляется серьёзными анатомическими аномалиями и патологией внутренних органов, заподозрить его наличие при рождении достаточно легко, как и заподозрить при УЗИ. На этапе беременности синдром проявляется у плода и матери следующими признаками:
● Недостаточная активность эмбриона в утробе матери.
● Малая частота сердечных сокращений плода.
● Слаборазвитая плацента и ее малый размер относительно размеров плода.
● Грыжи брюшной полости.
● Наличие одной пупочной артерии вместо двух.
● Сплетение сосудов, заметное на УЗИ.
● Малый вес плода.
● Асфиксия, выраженное кислородное голодание плода.
Сами по себе эти признаки не показательны и не являются достаточными для постановки диагноза. Достоверно установить синдром Эдвардса возможно только при генетическом исследовании, причем чрезвычайно важную роль играет именно выявление заболевания на ранних сроках беременности. Если при рождении для анализа берут часть тканей новорожденного, то при пренатальной диагностике исследуют плодную ДНК, получаемую либо инвазивным, либо неинвазивным способом
Почему стоит пройти скрининг на синдром Эдвардса
Как и при большинстве других хромосомных патологий, у детей с синдромом Эдвардса велик риск младенческой смертности. В первые 3 месяца умирает более 60% детей, не более трети от общего числа доживает до года. Выжившие страдают различными формами умственной отсталости, анатомическими аномалиями строения скелета и внутренних органов, множественными системными расстройствами, что в большинстве случаев также приводит к ранней смерти.
Относительно благоприятный прогноз возможен лишь при слабовыраженной мозаичной форме заболевания. При надлежащем уходе некоторые дети с ней могут доживать до 10 лет и более. При этом все они страдают серьёзным отставанием в умственном развитии вплоть до имбецильности.
Для устранения физических аномалий, в ряде ситуаций возможна хирургическая коррекция. Основу составляет постоянный уход и медицинское обеспечение, а также относительная симптоматическая коррекция имеющихся нарушений в течение всей последующей жизни. Обычно операции проводят по достижении ребёнком 2-3-летнего возраста – ранее подобные действия нецелесообразны.
Также выжившим и достигшим 3-летнего возраста детям необходима постоянная серьёзная психологическая помощь. В некоторых случаях удается научить элементарным навыкам общения и самообслуживания. Но, к сожалению, результаты такого лечения все-равно сложно считать удовлетворительными, а вероятность даже такого относительно благоприятного исхода очень мала.
В настоящее время не существует способов предотвращения синдрома Эдвардса и других генетических заболеваний. Прерывание беременности на ранних стадиях позволяет сохранить физическое здоровье матери и уберечь ее от серьёзных психологических травм, связанных с последующей младенческой или подростковой смертью ребёнка.
Диагностика синдрома Эдвардса
Как уже говорилось выше, ультразвуковое исследование позволяет лишь косвенно оценить риски синдрома Эдвардса. Для получения более надёжного результата используют пренатальный скрининг, или неинвазивный пренатальный тест — Prenetix. Суть его в исследовании плодной ДНК, присутствующей в крови матери, что даёт при этом синдроме точность результатов на уровне 98%.
К преимуществам теста Prenetix относятся —
● Возможность выявления хромосомных отклонений на ранних стадиях – начиная с 10 недели. Это позволяет выработать специалистам и беременной женщине верное решение в случае неблагоприятного диагноза и подготовиться к прерыванию беременности.
● Высокая чувствительность и специфичность анализа. Определить наличие синдрома Эдвардса с точностью в 98%.
● Неинвазивность забора биоматериала. Взятие крови на исследование может быть проведено в любом процедурном кабинете.
Риск возникновения генетических мутаций у плода растёт с возрастом родителей. Особенно критичен в этом плане возраст матери. Вероятность рождения ребенка с синдромом Эдвардса (а также выкидыша или мёртворождения из-за этого заболевания) достигает 0,7% у женщин с возраста 35 лет и растёт в дальнейшем. Для мужчины критическим считается возраст начиная с 40-45 лет.
Как пройти тест Prenetix?
Чтобы пройти тест Prenetix, необходимо сделать заявку на исследование и сдать кровь. Забор крови на исследование можно произвести в любом регионе страны – в специализированных медицинских учреждениях или лабораториях, имеющих договор с ЦГРМ Genetico. Далее материал будет отправлен на анализ в московскую лабораторию Genetico. Через 12 дней вы сможете получить результат.
Через 12 дней вы сможете получить результат.
Для получения более подробной информации и записи на анализ свяжитесь с нашими специалистами по указанным телефонным номерам или через онлайн-форму на сайте.
Пренатальный скрининг трисомий I триместра беременности (синдром Дауна), PRISCA
Неинвазивное исследование, которое на основании определенных лабораторных маркеров и клинических данных позволяет при помощи компьютерной программы рассчитать вероятный риск развития хромосомных болезней или других врождённых аномалий плода.
Из-за ограничений в применении расчетных методов определения риска врождённых аномалий плода расчет таких рисков при многоплодной беременности с 3 и более плодами провести невозможно.
Синонимы русские
Биохимический скрининг I триместра беременности, «двойной тест» 1-го триместра.
Синонимы английские
Maternal Screen, First Trimester; Prenatal Screening I; PRISСA I (Prenatal Risk Calculation).
Метод исследования
Твердофазный хемилюминесцентный иммуноферментный анализ («сэндвич»-метод), иммунохемилюминесцентный анализ.
Единицы измерения
ММЕ/мл (милли- международная единица на миллилитр), МЕ/л (международная единица на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу за 24 часа до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Болезнь Дауна – хромосомное заболевание, связанное с нарушением клеточного деления (мейоза) при созревании сперматозоидов и яйцеклеток, которое приводит к образованию дополнительной 21-й хромосомы. Частота в популяции – 1 случай на 600-800 родов. Риск хромосомной аномалии увеличивается с возрастом роженицы и не зависит от состояния здоровья матери ребенка, факторов внешней среды. Синдром Эдвардса (трисомии 18) и синдром Патау (трисомии 13) менее связаны с возрастом матери, а популяционная частота составляет 1 случай на 7000 родов. Для точной пренатальной диагностики генетических заболеваний требуются инвазивные процедуры, которые связаны с большой вероятностью осложнений, поэтому для массового скрининга используются безопасные методы исследования, позволяющие выявить низкий или высокий риск хромосомных аномалий и оценить целесообразность дальнейшего обследования.
Риск хромосомной аномалии увеличивается с возрастом роженицы и не зависит от состояния здоровья матери ребенка, факторов внешней среды. Синдром Эдвардса (трисомии 18) и синдром Патау (трисомии 13) менее связаны с возрастом матери, а популяционная частота составляет 1 случай на 7000 родов. Для точной пренатальной диагностики генетических заболеваний требуются инвазивные процедуры, которые связаны с большой вероятностью осложнений, поэтому для массового скрининга используются безопасные методы исследования, позволяющие выявить низкий или высокий риск хромосомных аномалий и оценить целесообразность дальнейшего обследования.
Пренатальный скрининг трисомий I триместра беременности выполняют, чтобы определить вероятный риск хромосомной патологии плода – трисомии 21 (синдрома Дауна), а также трисомии 18 (синдрома Эдвардса) и трисомии 13 (синдрома Патау) на сроке между 10-й неделей и 13-й неделей и 6 днями беременности. Его рассчитывают с помощью компьютерной программы PRISCA (Prenatal Risk Calculation), разработанной компанией Typolog Software (Германия) и имеющей международный сертификат соответствия. Для исследования определяется содержание свободной бета-субъединицы хорионического гонадотропина (ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-А) в крови беременной.
Для исследования определяется содержание свободной бета-субъединицы хорионического гонадотропина (ХГЧ) и ассоциированного с беременностью белка плазмы А (PAPP-А) в крови беременной.
Фермент PAPP-A обеспечивает полноценный рост и развитие плаценты. Его содержание в крови увеличивается с течением беременности. Уровень РАРР-А существенно не зависит от таких параметров, как пол и масса ребенка. При наличии хромосомной аномалии с пороками развития плода его концентрация в крови значительно уменьшается с 8-й по 14-ю недели беременности. Наиболее резко она снижается при трисомиях по 21-й, 18-й и 13-й хромосомам. При синдроме Дауна показатель PAPP-A на порядок ниже, чем при нормальной беременности. Еще более резкое уменьшение концентрации РАРР-А в сыворотке крови матери наблюдается при наличии у плода генетической патологии с множественными пороками развития – синдроме Корнелии де Ланге. Однако после 14 недель беременности ценность определения PAPP-A в качестве маркера риска хромосомных аномалий утрачивается, так как его уровень тогда соответствует норме даже при наличии патологии.
Для скрининга обязательно учитываются клинические данные (возраст беременной, масса тела, количество плодов, наличие и особенности ЭКО, раса матери, вредные привычки, наличие сахарного диабета, принимаемые лекарственные препараты), данные УЗИ (копчико-теменной размер (КТР) и толщина воротникового пространства (ТВП), длина носовой кости). При наличии данных УЗИ срок беременности рассчитывается по величине КТР, а не по дате последней менструации.
После исследования и расчета риска проводится плановая консультация у врача – акушера-гинеколога.
Результаты скринингового исследования не могут служить критериями для постановки диагноза и поводом для искусственного прерывания беременности. На их основании принимается решение о целесообразности назначить инвазивные методы обследования плода. При высоком риске необходимы дополнительные обследования, в том числе пункция хориона, амниоцентез с генетическим исследованием полученного материала.
Для чего используется исследование?
- Для скринингового обследования беременных, чтобы оценить риск хромосомной патологии плода – трисомии 21 (синдрома Дауна), синдрома Эдвардса.

Когда назначается исследование?
- При обследовании беременных в первом триместре (анализ рекомендован на сроке беременности 10 недель – 13 недель 6 дней), особенно при наличии факторов риска развития патологии:
- возраст старше 35 лет;
- невынашивание и тяжелые осложнения беременности в анамнезе;
- хромосомные патологии, болезнь Дауна или врождённые пороки развития при предыдущих беременностях;
- наследственные заболевания в семье;
- перенесенные инфекции, радиационное облучение, прием на ранних сроках беременности или незадолго до нее лекарственных препаратов, которые обладают тератогенным эффектом.
Что означают результаты?
Референсные значения
- Ассоциированный с беременностью протеин А плазмы (PAPP-A)
|
Неделя беременности |
Референсные значения |
|
8-9-я |
0,17 — 1,54 ММЕ/мл |
|
9-10-я |
0,32 — 2,42 ММЕ/мл |
|
10-11-я |
0,46 — 3,73 ММЕ/мл |
|
11-12-я |
0,79 — 4,76 ММЕ/мл |
|
12-13-я |
1,03 — 6,01 ММЕ/мл |
|
13-14-я |
1,47 — 8,54 ММЕ/мл |
- Свободная бета-субъединица хорионического гонадотропина человека (бета-ХГЧ свободный)
|
Неделя беременности |
Референсные значения |
|
8-9-я |
23,65 — 162,5 нг/мл |
|
9-10-я |
23,58 — 193,13 нг/мл |
|
11-12-я |
17,4 — 130,38 нг/мл |
|
12-13-я |
13,43 — 128,5 нг/мл |
|
13-14-я |
14,21 — 114,7 нг/мл |
|
14-15-я |
8,91 — 79,44 нг/мл |
|
15-16-я |
5,78 — 62,07 нг/мл |
|
16-17-я |
4,67 — 50,05 нг/мл |
|
17-18-я |
3,33 — 42,81 нг/мл |
|
18-19-я |
3,84 — 33,3 нг/мл |
По данным обследования беременной программа PRISCA рассчитывает вероятность возникновения пороков развития. Например, соотношение 1:400 показывает, что, согласно статистическим данным, у одной из 400 беременных женщин с аналогичными значениями показателей рождается ребенок с соответствующим пороком развития.
Например, соотношение 1:400 показывает, что, согласно статистическим данным, у одной из 400 беременных женщин с аналогичными значениями показателей рождается ребенок с соответствующим пороком развития.
Что может влиять на результат?
- На результат влияет точность предоставленной информации и заключений ультразвуковой диагностики.
- Ложноположительный результат (высокий риск) в некоторых случаях может быть связан с повышением бета-субъединицы хорионического гонадотропина на фоне дисфункции плаценты, угрозы прерывания беременности.
Исследование кариотипа (Количественные и структурные аномалии хромосом)
Метод определения Культивирование лимфоцитов периферической крови, микроскопия дифференциально окрашенных метафазных хромосом.
Исследуемый материал Цельная кровь (с гепарином, без геля)
Доступен выезд на дом
ИССЛЕДОВАНИЕ НЕ ЯВЛЯЕТСЯ АНАЛОГОМ АНА-ТЕЛОФАЗНОГО МЕТОДА АНАЛИЗА ХРОМОСОМНЫХ АБЕРРАЦИЙ (100 клеток)!
КАРИОТИПИРОВАНИЕ ВХОДИТ В СОСТАВ ИССЛЕДОВАНИЙ: Генетические VIP-профили
Репродуктивное здоровье
Репродуктивное здоровье женщины
Репродуктивное здоровье мужчины
Кариотип — это совокупность признаков полного набора хромосом соматических клеток организма на стадии метафазы (III фаза деления клетки) – их количество, размер, форма, особенности строения. Исследование кариотипа проводят методом световой микроскопии с целью выявления патологии хромосом. Чаще всего это исследование проводят у детей для выявления заболеваний, обусловленных нарушениями в хромосомах и у супругов при бесплодии или привычном невынашивании беременности. Выявление хромосомных перестроек в этом случае позволяет установить причину бесплодия и прогнозировать риск рождения в данной семье детей с хромосомной патологией. Вне процесса деления клетки хромосомы в её ядре расположены в виде «распакованной» молекулы ДНК, и они трудно доступны для осмотра в световом микроскопе. Для того, чтобы хромосомы и их структура стали хорошо видны используют специальные красители, позволяющие выявлять гетерогенные (неоднородные) участки хромосом и проводить их анализ – определять кариотип. Хромосомы в световом микроскопе на стадии метафазы представляют собой молекулы ДНК, упакованные при помощи особых белков в плотные сверхспирализованные палочковидные структуры. Таким образом, большое число хромосом упаковывается в маленький объём и помещается в относительно небольшом объёме ядра клетки.
Исследование кариотипа проводят методом световой микроскопии с целью выявления патологии хромосом. Чаще всего это исследование проводят у детей для выявления заболеваний, обусловленных нарушениями в хромосомах и у супругов при бесплодии или привычном невынашивании беременности. Выявление хромосомных перестроек в этом случае позволяет установить причину бесплодия и прогнозировать риск рождения в данной семье детей с хромосомной патологией. Вне процесса деления клетки хромосомы в её ядре расположены в виде «распакованной» молекулы ДНК, и они трудно доступны для осмотра в световом микроскопе. Для того, чтобы хромосомы и их структура стали хорошо видны используют специальные красители, позволяющие выявлять гетерогенные (неоднородные) участки хромосом и проводить их анализ – определять кариотип. Хромосомы в световом микроскопе на стадии метафазы представляют собой молекулы ДНК, упакованные при помощи особых белков в плотные сверхспирализованные палочковидные структуры. Таким образом, большое число хромосом упаковывается в маленький объём и помещается в относительно небольшом объёме ядра клетки. Расположение хромосом, видимое в микроскопе, фотографируют и из нескольких фотографий собирают систематизированный кариотип — нумерованный набор хромосомных пар гомологичных хромосом. Изображения хромосом при этом ориентируют вертикально, короткими плечами вверх, а их нумерацию производят в порядке убывания размеров. Пару половых хромосом помещают в самом конце изображения набора хромосом. Современные методы кариотипирования обеспечивают детальное обнаружение хромосомных аберраций (внутрихромосомных и межхромосомных перестроек), нарушения порядка расположения фрагментов хромосом — делеции, дупликации, инверсии, транслокации. Такое исследование кариотипа позволяет диагностировать ряд хромосомных заболеваний, вызванных как грубыми нарушениями кариотипов (нарушение числа хромосом), так и нарушением хромосомной структуры или множественностью клеточных кариотипов в организме. Нарушения нормального кариотипа у человека возникают на ранних стадиях развития организма. Если это происходит в половых клеток будущих родителей (в процессе гаметогенеза), то кариотип зиготы (см.
Расположение хромосом, видимое в микроскопе, фотографируют и из нескольких фотографий собирают систематизированный кариотип — нумерованный набор хромосомных пар гомологичных хромосом. Изображения хромосом при этом ориентируют вертикально, короткими плечами вверх, а их нумерацию производят в порядке убывания размеров. Пару половых хромосом помещают в самом конце изображения набора хромосом. Современные методы кариотипирования обеспечивают детальное обнаружение хромосомных аберраций (внутрихромосомных и межхромосомных перестроек), нарушения порядка расположения фрагментов хромосом — делеции, дупликации, инверсии, транслокации. Такое исследование кариотипа позволяет диагностировать ряд хромосомных заболеваний, вызванных как грубыми нарушениями кариотипов (нарушение числа хромосом), так и нарушением хромосомной структуры или множественностью клеточных кариотипов в организме. Нарушения нормального кариотипа у человека возникают на ранних стадиях развития организма. Если это происходит в половых клеток будущих родителей (в процессе гаметогенеза), то кариотип зиготы (см. ), образовавшейся при слиянии родительских клеток, также оказывается нарушенным. При дальнейшем делении такой зиготы все клетки эмбриона и развившегося из него организма окажутся с одинаково аномальным кариотипом. Однако, нарушения кариотипа могут возникнуть и на ранних стадиях дробления зиготы. Развившийся из такой зиготы организм содержит несколько линий клеток (клеточных клонов) с разными кариотипами. Такое многообразие кариотипов во всём организме или только в некоторых его органах называют мозаицизмом. Как правило, нарушения кариотипа у человека сопровождаются различными, в том числе комплексными, пороками развития, и большинство таких аномалий несовместимо с жизнью. Это приводит к самопроизвольным абортам на ранних стадиях беременности. Однако достаточно большое число плодов (~2,5%) с аномальными кариотипами донашивают до окончания беременности. Ниже приведена таблица, в которой представлены заболевания, обусловленные нарушениями в кариотипе.
), образовавшейся при слиянии родительских клеток, также оказывается нарушенным. При дальнейшем делении такой зиготы все клетки эмбриона и развившегося из него организма окажутся с одинаково аномальным кариотипом. Однако, нарушения кариотипа могут возникнуть и на ранних стадиях дробления зиготы. Развившийся из такой зиготы организм содержит несколько линий клеток (клеточных клонов) с разными кариотипами. Такое многообразие кариотипов во всём организме или только в некоторых его органах называют мозаицизмом. Как правило, нарушения кариотипа у человека сопровождаются различными, в том числе комплексными, пороками развития, и большинство таких аномалий несовместимо с жизнью. Это приводит к самопроизвольным абортам на ранних стадиях беременности. Однако достаточно большое число плодов (~2,5%) с аномальными кариотипами донашивают до окончания беременности. Ниже приведена таблица, в которой представлены заболевания, обусловленные нарушениями в кариотипе.
| Кариотипы | Болезнь | Комментарии |
| 47,XXY; 48,XXXY | Синдром Клайнфельтера | Полисомия по X-хромосоме у мужчин |
| 45X0; 45X0/46XX; 45,X/46,XY; 46,X iso (Xq) | Синдром Шерешевского — Тернера | Моносомия по X-хромосоме, в т. ч. и мозаицизм ч. и мозаицизм |
| 47,ХХX; 48,ХХХХ; 49,ХХХХХ | Полисомии по X хромосоме | Наиболее часто — трисомия X |
| 47,ХХ,+21; 47,ХY,+21 | Болезнь Дауна | Трисомия по 21-й хромосоме |
| 47,ХХ,+18; 47,ХY,+18 | Синдром Эдвардса | Трисомия по 18-й хромосоме |
| 47,ХХ,+13; 47,ХY,+13 | Синдром Патау | Трисомия по 13-й хромосоме |
| 46,XX, 5р- | Синдром кошачьего крика | Делеция короткого плеча 5-й хромосомы |
Смотрите также:
УЗИ сердца (эхокардиография) плода у беременных
УЗИ сердца плода у беременных
В России ежегодно рождается около 10 000 детей с врожденными пороками сердца (ВПС), 30-50% из них – «критические пороки периода новорожденности», т. е. ВПС, при которых специализированная помощь показана в первый год, месяц, день, а подчас и в первые часы жизни ребенка. Это обстоятельство диктует необходимость выявления врожденных пороков системы кровообращения еще до рождения ребенка.
е. ВПС, при которых специализированная помощь показана в первый год, месяц, день, а подчас и в первые часы жизни ребенка. Это обстоятельство диктует необходимость выявления врожденных пороков системы кровообращения еще до рождения ребенка.
Учитывая необходимость проведения эхокардиографического исследования (УЗИ сердца) плода у беременных, медицинский центр «Кардиоплюс» обучил специалиста – врача УЗИ, детского кардиолога Александрову С.А., в Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева, г.Москва, по дополнительной профессиональной программе «Внутриутробная диагностика патологии сердечно-сосудистой системы».
Наиболее углублённым и продуктивным исследованием сердечной системы является УЗИ сердца плода. Его назначают после трёх предшествующих проверок: аускультации, кардиотокографии и ультразвукового обследования. В случае выявления нарушений и предварительных показаний к серьёзной диагностике, УЗИ сердца (эхокардиография) плода является необходимым. Эхокардиография плода – это способ обследования сердца при помощи специального ультразвукового оборудования с встроенными кардиологическими программами. Процедура абсолютно не несёт никакой опасности для матери и плода и болезненных ощущений. Данный способ позволяет диагностировать пороки сердца ребёнка в пренатальный период, до рождения.
Эхокардиография плода – это способ обследования сердца при помощи специального ультразвукового оборудования с встроенными кардиологическими программами. Процедура абсолютно не несёт никакой опасности для матери и плода и болезненных ощущений. Данный способ позволяет диагностировать пороки сердца ребёнка в пренатальный период, до рождения.
В целях выявления ВПС у плода целесообразным является однократное проведение на 20-22 неделе беременности комплексного эхокардиографического исследования плода у женщин с нормально протекающей беременностью, не входящих в группы риска. Женщины, относящиеся к категории повышенного риска, в обязательном порядке подлежат эхокардиографическому контролю плода на 18-20, 26-28 неделях беременности.
Метод УЗИ действительно позволяет определить нарушения в сердечно-сосудистой системе не рожденного ребенка. Некоторые патологии могут быть настолько тяжелыми, что ребенок не сможет самостоятельно существовать с ними вне материнского организма. В тот момент, когда после рождения к малышу перестает поступать пуповинная кровь, и он делает первый вдох, у него запускается малый круг кровообращения, и на сердце падает увеличенная нагрузка. Это может послужить поводом для ухудшения состояния, возможно, даже до уровня критического.
В тот момент, когда после рождения к малышу перестает поступать пуповинная кровь, и он делает первый вдох, у него запускается малый круг кровообращения, и на сердце падает увеличенная нагрузка. Это может послужить поводом для ухудшения состояния, возможно, даже до уровня критического.
Поэтому необходимо заранее знать, какие патологии сердца имеются у плода. Благодаря этим сведениям, врачи смогут в полном объеме оказать необходимую помощь новорожденному. А если ребенку понадобится операция, будущая мама также заранее позаботится о том, чтобы ребенку, которого она ожидает, было подготовлено место в клинике, где ему смогут ее провести.
К факторам, требующим в дальнейшем проведения эхокардиографии плода со стороны матери относят:
- врождённый порок сердца у родителя ребёнка;
- предыдущая беременность с врождённым пороком сердца или атривоентрикулярным блоком;
- общие заболевания матери: диабет Тип 1, Тип 2, фенилкетонурия; употребление медикаментозных препаратов до момента зачатия ребёнка и после: противоэпилептические препараты, литиум, антидепрессанты, ингибиторы ангиотензинпревращающего фермента.

- употребление матерью неспецифических противовоспалительных медикаментов в период беременности 25-30 недель;
- Выявление у беременной инфекционных и вирусных заболеваний (токсоплазмоз, цитомегаловирус, парвовирус В19;
- Аутоиммунные заболевания, поражающие сразу несколько органов;
- Заболевания щитовидной железы;
- Повышенное артериальное давление;
- Употребление матерью во время беременности алкогольных напитков, наркотических средств, таких как: кокаин и марихуана;
- Беременность методом эксктракорпорального оплодотворения.
К факторам, требующим в дальнейшем проведения эхокардиографии, со стороны плода относят:
- Нарушения сердечного ритма с подозрением на врождённый порок сердца;
- Нарушения толщины воротникового пространства;
- Брадикардия (менее 100 ударов в минуту) и тахикардия (более 180 ударов в минуту)
- Факторы плода, вызывающие сердечную несостоятельность, такие как: недостаточность трёхстворчатого клапана, аномальный кровоток в венозном протоке, синдром фето-фетальной трансфузии, монозиготные близнецы, аномальное развитие венозной системы, дефицит железа у плода, врождённое соустье между артерией и веной, единственная артерия пуповины.

- Наследственные заболевания с нарушением структуры хромосом.(Синдром Дауна, Патау, Едварда, Ди Джорджи, Тернера)
- Генетические заболевания с сопутствующей кардиомиопатией.
Своевременное обращение к врачу поможет более ранней диагностике и успешному лечению выявленного заболевания!
Медицинский центр «КАРДИОПЛЮС» расположен в районе общественно делового центра «Город Будущего» по адресу: г. Шахты, ул. Шишкина 162.
Телефоны для записи на прием: 8 (8636) 288-433, 8 (8636) 236-934, 8 (960) 450-94-37.
Закажите обратный звонок для консультации и записи на прием к специалисту!
Хромосомные нарушения
Хромосомные нарушения — это клинические синдромокомплексы, в основе которых лежат нарушения числа или структуры хромосом, то есть избыток или нехватка генетического материала, локализованного в той или иной хромосоме.
В норме у человека число хромосом равно 46, из которых 23 ребенок получает от матери и 23 аналогичные хромосомы от отца. В этом наборе гентического материала есть 2 особые хромосомы, которые были названы «половыми». Они определяют пол ребенка и ряд других важных признаков.
В этом наборе гентического материала есть 2 особые хромосомы, которые были названы «половыми». Они определяют пол ребенка и ряд других важных признаков.
Таким образом, изменения числа хромосом (больше или меньше 46), а также изменение структуры хромосом (например, выпадение или удвоение даже небольшого кусочка хромосомы) получили название «хромосомные мутации».
Наиболее часто из них встречаются изменения модального числа хромосом — это отсутствие в хромосомном наборе какой-либо хромосомы (моносомия) или появление добавочной хромосомы (трисомия, тетрасомия и т.д.).
Число возможных изменений структуры хромосомы неисчислимое множество. К примеру, транслокации (обмен сегментами между разными хромосомами), делеции (выпадение участка хромосомы), дупликации (удвоение части хромосомы), инверсии (переворот сегмента хромосомы на 180 градусов) и т.д.
Хромосомные мутации, возникшие в половых клетках (сперматозоидах или яйцеклетках) или на первых этапах деления клеток зародыша, как правило, передаются большинству клеток развивающегося организма, вызывая множественные аномалии развития, а многие хромосомные изменения плода могут стать причиной спонтанных абортов и выкидышей, что важно учитывать в семьях, воспитывающих детей с задержками развития.
К факторам риска, способствующим их возникновению, относят ионизирующую радиацию, инфекции и интоксикации матери, эндокринные нарушения, психические травмы, воздействие ряда лекарственных препаратов и некоторых физиотерапевтических методов лечения.
Наиболее точно установлено, что причиной появления ребенка с хромосомными мутациями является не молодой возраст матерей (свыше 40 лет).
В последнее время очень большое значение придается факту скрытого носительства хромосомных нарушений у родителей родившегося ребенка (сбалансированные транслокации, мозаицизм). Изучение данного вопроса позволяет предотвратить риск повторного рождения ребенка с аналогичной формой заболевания.
Различают хромосомные синдромы, обусловленные изменением половых хромосом, и синдромы, вызванные аномалиями аутосом (любой из 44 неполовых хромосом).
Основными клиническими проявлениями аутосомных аномалий являются признаки психического и физического недоразвития, дисплазии (неправильное развитие), врожденные пороки развития (аномалии) и умственная отсталость различной степени тяжести. К врожденным порокам можно отнести: аномалии развития сердца, удвоение почки, расщелина неба, особенности строения кистей и стоп и многие другие. При заболеваниях, обусловленных нарушениями в системе половых хромосом, как правило, более характерны недоразвитие половых желез и аномалии развития вторичных половых признаков, также с симптомами задержки психо-речевого развития.
К врожденным порокам можно отнести: аномалии развития сердца, удвоение почки, расщелина неба, особенности строения кистей и стоп и многие другие. При заболеваниях, обусловленных нарушениями в системе половых хромосом, как правило, более характерны недоразвитие половых желез и аномалии развития вторичных половых признаков, также с симптомами задержки психо-речевого развития.
Различные хромосомные синдромы встречаются с разной частотой. По сводным данным многих исследований, распространенность наиболее частых из них среди новорожденных следующая:
трисомия по 21 хромосоме (синдром Дауна) 1:500
XXX (трисомия-Х) 1:1000 (девочек)
ХYY (синдром дубль-Y) 1:1000 (мальчиков)
ХХY (синдром Клайнфелтера) 1:1400 (мальчиков)
Х0 (синдром Шерешевского-Тернера) 1:3300 (девочек)
46,5р del (синдром «кошачьего крика») 1:4000
трисомия по 18 хромосоме (синдром Эдвардса) 1: 6800
трисомия по 13 хромосоме (синдром Патау) 1:7600
Не смотря на казалось бы не частую встречемость каждого отдельного синдрома, в целом хромосомные болезни у новорожденных наблюдаются не редко — с частотой около 1 : 100.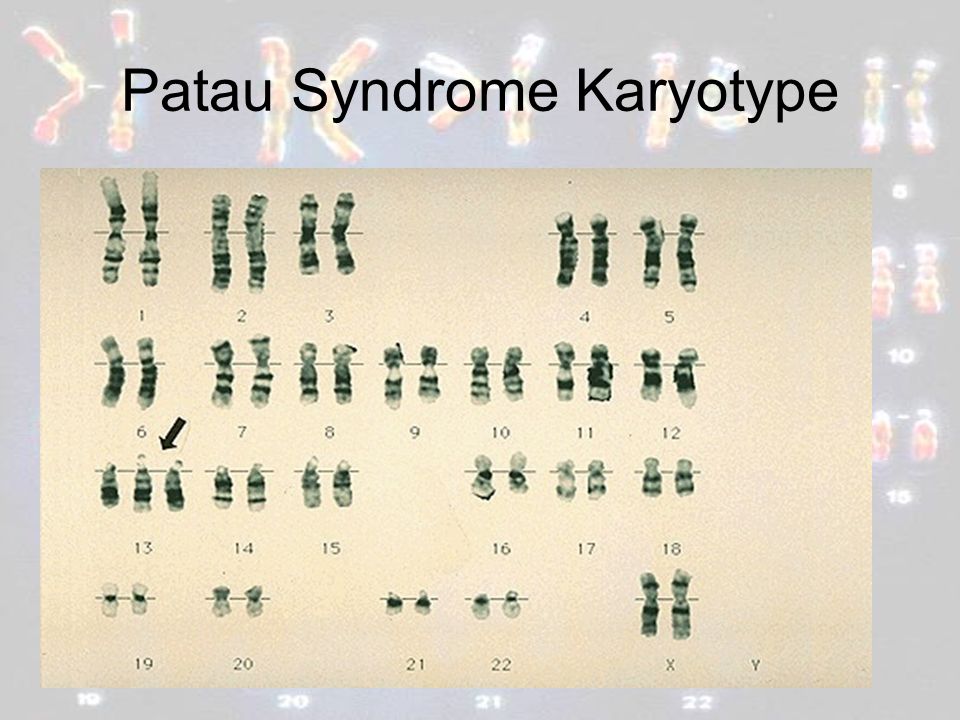 Ежегодно в России рождается свыше 30 тыс. детей с хромосомной патологией. Спонтанные выкидыши являются результатом хромосомной патологии в более чем 50%.
Ежегодно в России рождается свыше 30 тыс. детей с хромосомной патологией. Спонтанные выкидыши являются результатом хромосомной патологии в более чем 50%.
Рассмотрим основные клинические проявления отдельных хромосомных синдромов, сопровождающихся умственной отсталостью и задержками психо-речевого развития.
Синдром Дауна — врожденное заболевание, характеризующееся умственной отсталостью и рядом признаков эндокринной недостаточности.
Синдром впервые описан английским врачом Дауном в 1866 г. Встречается с частотой 1 на 500 новорожденных. Частота встречаемсоти у мальчиков и девочек одинакова. В основе заболевания лежит аномалия хромосомного набора (47 вместо 46). Лишняя хромосома обнаруживается в 21 паре, в связи с чем этот синдром иногда называют «трисомией по 21-й хромосоме» (47, 21+). Выявлена связь частоты рождения больных с увеличением возраста матери. Приблизительно в 3—4% случаев отмечаются транслокационные формы синдрома Дауна, при которых общее число хромосом в кариотипе нормальное — 46, а дополнительная 21-я хромосома транслоцирована (присоединена) на другую аутосому. Это является результатом того, что один из фенотипически здоровых родителей является скрытым носителем сбалансированной транслокации. Именно за счет этих форм повышается риск повторного рождения больного ребенка у молодых матерей. Еще 3-4% случаев синдрома Дауна составляют мозаичные варианты, при которых в организме одновременно обнаруживают и трисомные, и нормальные клетки. Порой, при небольшом проценте трисомных клеток ребенок с ЗПРР внешне может выглядеть абсолютно нормальным.
Это является результатом того, что один из фенотипически здоровых родителей является скрытым носителем сбалансированной транслокации. Именно за счет этих форм повышается риск повторного рождения больного ребенка у молодых матерей. Еще 3-4% случаев синдрома Дауна составляют мозаичные варианты, при которых в организме одновременно обнаруживают и трисомные, и нормальные клетки. Порой, при небольшом проценте трисомных клеток ребенок с ЗПРР внешне может выглядеть абсолютно нормальным.
Установлено, что для синдрома Дауна характерно уменьшение размеров и веса головного мозга, а также аномалии развития мозга и мозговых сосудов. Отмечаются также структурные изменения в железах внутренней секреции, печени и сердце. Клиническая картина синдрома Дауна характеризуется проявлениями симптомов умственной отсталости. Характерен также и внешний вид таких больных: косо расположенные глазные щели, широкая уплощенная переносица, дополнительная кожная складка у внутреннего угла глаз, высокое стояние твердого неба (признаки эмбриональной задержки в развитии лицевого скелета), полуоткрытый рот, увеличенный высунутый язык с выраженными сосочками и глубокими бороздами (признаки дисфункции щитовидной железы), выпадение волос (дисфункция надпочечников), низкий рост, короткая шея, укороченные кисти и стопы, искривление мизинца, на ладонях имеется поперечная складка, на стопах увеличен промежуток между 1 и 2 пальцами, выражены внешние проявления гипогенитализма.
Такие дети с рождения отстают в росте, начинают поздно держать голову, сидеть и ходить. Речь, как правило, невнятная, словарный запас беден, произношение с дефектами в связи с недоразвитием высших мозговых функций, с одной стороны, и анатомическими аномалиями ротовой полости — с другой.
В клинической картине заболевания доминируют симптомы неврологической патологии, диффузная мышечная гипотония (снижение мышечного тонуса), благодаря чему больные гибки и иногда могут складываться как «перочинный ножик», расстройства координации движений, косоглазие, выраженные вегетососудистые нарушения.
Особенностью психического дефекта является относительная сохранность эмоциональной сферы по сравнению с тяжестью интеллектуального недоразвития. Так, больные ласковы, добродушны, послушны. Характерной особенностью таких детей является повышенная внушаемость, что является положительным фактором при проведении коррекционной работы и отрицательным при их развитии.
Уровень социального развития больных с синдромом Дауна зависит от степени и формы заболевания. Так, дети с более легкими формами умственной отсталости, хотя и медленно, но развиваютя, приобретая определенные навыки, знания, осваивая программу нескольких классов вспомогательной школы. Однако, как правило, большинство из них не достигают удовлетворительного уровня социальной адаптации и нуждаются в постоянной опеке. Им может быть оформлена инвалидность детства с момента точной диагностики заболевания. Особенностью возрастной динамики синдрома Дауна является позднее половое созревание и раннее появление признаков инволюции (25—30 лет). Мужчины с синдромом Дауна бесплодны, женщины могут давать потомство, половина которого также страдает синдромом Дауна.
Синдром Шерешевского—Тернера — симптомокомплекс проявлений врожденного, наследственно обусловленного недоразвития половых желез и передней доли гипофиза в сочетании с аномалиями соматического развития.
Впервые заболевание описано отечественным эндокринологом Н.А. Шерешевским (1925), а более подробно — американским эндокринологом Н. Тернером (N.H. Terner) л 1938 г. В основе заболевания лежит отсутствие одной хромосомы (половой Х-хромосомы) (45 вместо 46).
Клиническая картина синдрома характеризуется разной степенью умственной отсталости и ЗПРР, низким конечным ростом (135—145 см), замедлением полового развития, недоразвитием половых желез, аменореей, бесплодием и отсутствием грудных желез. Диспластические расстройства проявляются в виде короткой шеи и особых кожных складок, идущих от затылка к надплечью, укорочением 4 пальцев на руках и искривлением мизинцев, выраженной деформацией ушных раковин, наличием множественных пигментных родинок. Преимущественно данным синдромом страдают лица женского пола.
Синдром Клайнфелтера — заболевание, обусловленное нарушением числа половых хромосом (добавочные Х-хромосомы) (от 47 до 49), характеризующееся умственной отсталостью, нарушением смерматогенеза, недоразвитием яичек и вторичных половых признаков, а также нарушением пропорций тела. Впервые синдром описан американским эндокринологом Клайнфелтером (H.F. Klinfelter) в 1942 г. Его частота, по сводным данным, составляет до 2% среди умственно отсталых и до 0,5% (кадждый двухсотый мужчина) в среднем в мужской популяции.
Впервые синдром описан американским эндокринологом Клайнфелтером (H.F. Klinfelter) в 1942 г. Его частота, по сводным данным, составляет до 2% среди умственно отсталых и до 0,5% (кадждый двухсотый мужчина) в среднем в мужской популяции.
Клинические проявления синдрома Клайнфельтера варьируют от внешне нормального и интеллектуального развития до выраженного евнухоидизма и умеренной умственной отсталости. Однако в ряде случаев уже в раннем возрасте у больных отмечаются характерные своеобразные симптомы физического развития: низкий и узкий лоб, густые и жесткие волосы, высокое стояние таза, короткая, плоская и узкая грудная клетка, недоразвитие половых органов. Более отчетливо вышеперечисленные симптомы начинают обнаруживаться в подростковом, пубертатном возрасте. Характерен внешний вид взрослого больного с синдромом Клайнфельтера: высокий рост, астеническое сложение, узкие плечи, широкий таз, удлиненные конечности, слаборазвитая мускулатура, скудная растительность на лице и в подмышечных впадинах, ожирение и оволосение по женскому типу, сутулость, выраженные евнухоидные пропорции и гинекомастия (набухание грудных желез). Постоянными признаками синдрома Клайнфельтера являются недоразвитие половых органов и бесплодие.
Постоянными признаками синдрома Клайнфельтера являются недоразвитие половых органов и бесплодие.
Степень интеллектуального недоразвития у больных выражена тем глубже, чем больше дополнительных половых хромосом обнаруживается в кариотипе (46 или 49). Так, умеренная умственная отсталость зачастую приближается к психическому инфантилизму, что клинически проявляется недостаточностью внимания, восприятия, памяти, абстрактного мышления, чрезмерной внушаемостью, подражательностью, подчиняемостью, несамостоятельностью, чрезмерной привязанностью к близким, нередко с элементом назойливости. Глубокая незрелость эмоционально-волевой сферы проявляется в виде повышенного настроения, с эйфорическим оттенком, склонностью к эксплозивным аффективным вспышкам, неспособностью к длительному волевому усилию и напряженной деятельности. У больных, как правило, отсутствуют чувство долга и ответственности. При легких формах заболевания больные осознают свою неполноценность, что приводит к внутреннему конфликту и возникновению у них невротических реакций. Данным синдромом страдают лица мужского пола.
Данным синдромом страдают лица мужского пола.
Синдром ломкой Х-хромосомы (Fragile X syndrome, FraХ). Начиная с 1980 года большое значение придают синдрому ломкой Х-хромосомы (Хq27.3) – именно с ним связывают развитие более чем 50 наследственных расстройств, включая ранний детский аутизм и 30% случаев умственной отсталости у мальчиков. Хрупкий участок Х-хромосомы впервые обнаружил Labs (1969).
Полная мутация в Х-хромосоме возникает только у женщин, и происходит это в процессе гаметогенеза, поэтому почти всегда страдают мальчики, получившие единственную Х-хромосому от матери. У девочек, получивших вторую Х-хромосому от отца, также могут быть нарушения развития, но они менее выражены, а тяжелые патологии встречаются много реже, чем у мальчиков. В отдельных случаях девочки могут получить обе ломкие хромосомы от матери, в этом случае частота и тяжесть патологии будет одинаковой с мальчиками.
Клиническую триаду синдрома ломкой Х-хромосомы образуют:
1) умеренная до степени тяжелой умственная отсталость.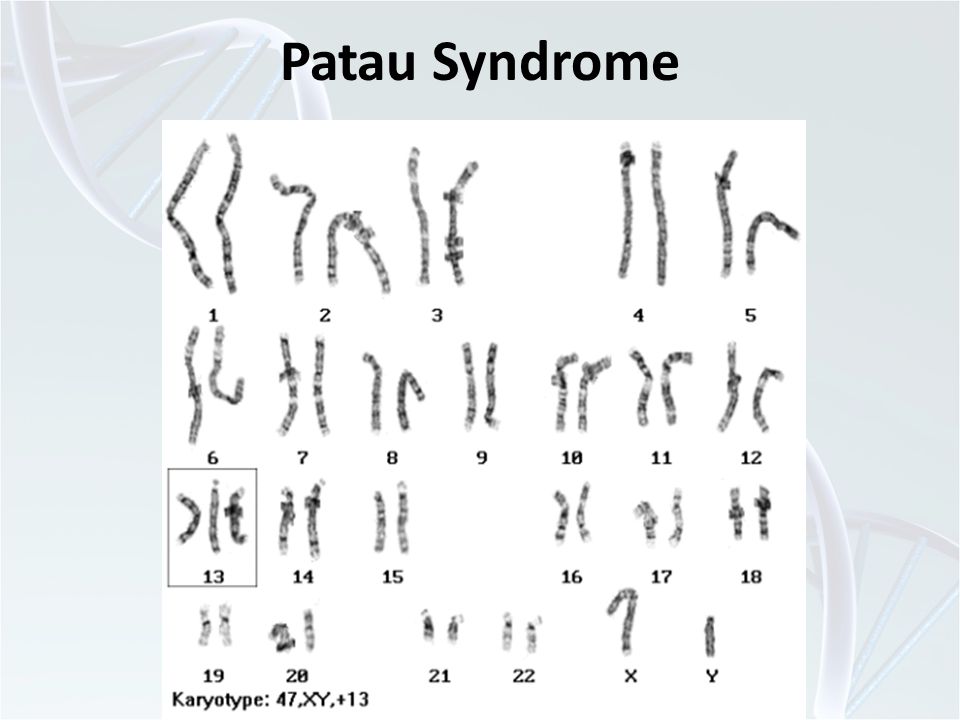 Лишь 30% лиц мужского пола имеют интеллект, стремящийся к нижней границе нормы, а среди женщин – носительниц такой хромосомной патологии примерно у 30% обнаруживаются признаки умственного недоразвития;
Лишь 30% лиц мужского пола имеют интеллект, стремящийся к нижней границе нормы, а среди женщин – носительниц такой хромосомной патологии примерно у 30% обнаруживаются признаки умственного недоразвития;
2) характерные особенности строения лица и черепа: выдающийся вперед высокий лоб, прогнатизм и удлиненные уши;
3) мальчики имеют увеличенные в размерах тестикулы (макроорхидизм).
Наблюдаются, кроме того, эпилептические припадки, синдром гиперактивности с дефицитом внимания, у более чем половины мальчиков аутизм и подобные аутизму расстройства, различные нарушения развития речи, персеверации, эхолалия, другие отклонения.
Женщины, унаследовавшие ломкую Х-хромосому с полной мутацией от своих матерей, могут быть склонны к развитию атипической депрессии, а также шизофреноподобного заболевания.
Синдром «кошачьего крика» — заболевание, обусловленное структурной аномалией 5-й пары хромосом (выпадение участка — делеция). Встречается преимущественно у девочек и характеризуется развитием умеренной или тяжелой умственной отсталости, задержкой физического развития и рядом диспластических признаков («антимонголоидный» разрез глаз, гипертелоризм, низкое расположение ушных раковин, поперечная складка ладоней и др.) Основным симптомом является своеобразный мяукающий тембр плача ребенка, связанный с аномалией строения гортани.
Встречается преимущественно у девочек и характеризуется развитием умеренной или тяжелой умственной отсталости, задержкой физического развития и рядом диспластических признаков («антимонголоидный» разрез глаз, гипертелоризм, низкое расположение ушных раковин, поперечная складка ладоней и др.) Основным симптомом является своеобразный мяукающий тембр плача ребенка, связанный с аномалией строения гортани.
Синдром Вольфа—Хиршхорна.
В основе синдрома лежит изменение длины хромосомы из четвертой пары. Основные признаки заболевания у новорожденных: большое туловище, клювовидный нос и выступающее надпереносье, деформированные ушные раковины со складками, пучеглазие и колобома радужной оболочки (ее частичное отсутствие), общее недоразвитие во время беременности. Отмечается наличие четырех сгибательных складок на пальцах верхних конечностей.
Синдром Патау — комплекс врожденных пороков развития черепа, лица, нервной системы, органов слуха, зрения, внутренних органов. В основе заболевания лежит наличие добавочной хромосомы в 13-й паре. Синдром описан в 1960 г. американским педиатром Патау (К. Patau).
В основе заболевания лежит наличие добавочной хромосомы в 13-й паре. Синдром описан в 1960 г. американским педиатром Патау (К. Patau).
Клиническая картина характеризуется микроцефалией, расщелиной лица, двусторонним расщеплением верхней губы, полным расщеплением неба, маленькими глазными яблоками либо полным их отсутствием, короткой шеей, маленькими деформированными низко расположенными ушами, полидактилией, дистрофическими изменениями ногтей и костного скелета. Отмечаются также пороки развития сердца, желудка, кишечника и других органов.
Синдром трисомии-Х впервые описан в 1959 г. Частота данной патологии составляет среди новорожденных 0,1%, а среди умственно отсталых — 0,6%. Большинство лиц женского пола с трисомией-Х выявляется среди больных психиатрических лечебниц. Клиническая картина характеризуется аномалиями развития скелета, внутренних органов, различными психическими проявлениями и интеллектуальной недостаточностью. Среди полиморфизма признаков трисомии-Х наиболее характерными являются: низкий рост, аномалии ушей, прикуса, высокое стояние твердого неба, короткие пальцы, искривленный мизинец, широкий промежуток между 1 и 2 пальцами на стопах, синдактилия, недоразвитие половых функций.
Умственная отсталость проявляется в виде легкой или умеренной степени. Характерны эмоциональные расстройства (вспыльчивость, агрессивность, неустойчивость настроения и немотивированные поступки). Девочки с синдромом трисомии-Х с трудом, но в большинстве случаев (легкая степень умственной отсталости) обучаются в массовых школах.
Синдром Эдвардса — наследственное заболевание, обусловленное, как правило, трисомией 18-й хромосомы и проявляющееся множественными пороками развития органов и систем. Синдром описан в 1960 г. американским педиатром Эдвардсом (J. Edwards).
Клиническая картина заболевания характеризуется задержкой психического развития, множественными аномалиями лица, костно-мышечной системы, черепа и головного мозга.
К хромосомным синдромам, помимо вышеописанных, относится большая группа так называемых семейных форм умственной отсталости, когда совершенно точно доказано наличие данной патологии у близких родственников.
Синдром Аперта (акроцефалосиндактилия) — наследственное заболевание, характеризующееся умеренной или тяжелой умственной отсталостью, экзофтальмом, деформацией зубов и синдактилиями. Синдром описан французским педиатром Апертом (Е. Apert) в 1906 г.
Синдром Крузона — наследственное заболевание, характеризующееся умеренной или тяжелой умственной отсталостью, преждевременным срастанием швов черепа, уменьшением мозгового вещества, экзофтальмом, вторичной атрофией зрительных нервов, прямоугольным расположением большого пальца к кисти. Впервые синдром описан французским врачом Крузоном (О. Crouson) в 1912 г.
Синдром Сьегрена—Ларссона — наследственное заболевание, которое сопровождается умственной отсталостью, парезами (снижением силы) конечностей и ухудшением зрения.
Синдром Берьесона—Форсмана—Лемана — синдром характеризующийся умственной отсталостью в сочетании с избыточным весом. Впервые описан американскими врачами Берьесоном (М. Berjeson) Форсманом (Н. Foreman) и Леманом (О. Lehman) в 1963 г. Клиническая картина заболевания проявляется выраженным ожирением и прогрессирующей умственной отсталостью. Ожирение носит не равномерный характер. Жир откладывается преимущественно на бедрах, груди и лице, что придает своеобразный вид такому больному (бочкообразная карликовая фигура с заплывшим лицом, большими ушами и узкими разрезами глаз). У больных часто отмечаются эпилептические припадки. Умственная отсталость колеблется от умеренной до тяжелой степени. Данная патология встречается только у лиц мужского пола, но носителями патологического гена являются женщины.
Впервые описан американскими врачами Берьесоном (М. Berjeson) Форсманом (Н. Foreman) и Леманом (О. Lehman) в 1963 г. Клиническая картина заболевания проявляется выраженным ожирением и прогрессирующей умственной отсталостью. Ожирение носит не равномерный характер. Жир откладывается преимущественно на бедрах, груди и лице, что придает своеобразный вид такому больному (бочкообразная карликовая фигура с заплывшим лицом, большими ушами и узкими разрезами глаз). У больных часто отмечаются эпилептические припадки. Умственная отсталость колеблется от умеренной до тяжелой степени. Данная патология встречается только у лиц мужского пола, но носителями патологического гена являются женщины.
Синдром Прадера—Вилли — наследственное заболевание, характеризующееся глубокой умственной отсталостью, низким ростом, гипогенитализмом, ожирением, резко выраженной мышечной гипотонией.
Синдром Книппеля—Фейля (синдром короткой шеи) — наследственное семейное заболевание, обусловленное врожденными аномалиями развития скелета и внутренних органов в сочетании с тяжелой степенью умственной отсталости. Клиника синдрома подробно описана французскими врачами Клиппелем Фейлем в 1912 г.
Клиника синдрома подробно описана французскими врачами Клиппелем Фейлем в 1912 г.
Аномалия развития характеризуется следующими проявлениями: короткой шеей как результат количественного уменьшения шейных позвонков, ограничением подвижности головы, расщеплением твердого неба, бочкообразной грудной клеткой, врожденными пороками сердца, добавочными долями или отсутствием отдельных долей легких, синдактилиями (сращение пальцев конечностей), глухотой вследствие заращения наружных слуховых проходов, сужением анального отверстия и многими другими симптомами. Интеллектуальная недостаточность является результатом тяжелой умственной отсталости
Лечение ЗПРР при хромосомных заболеваниях.
Основой лечения является уникальная методика патогенетической терапии речевых расстройств при хромосомной патологии — биофизическая активация нейромоторных структур, основу которого составляет щадящая стимуляция проводников нервной системы микротоками с использованием нейрофизиологического прибора. Метод лечения базируется как на активации самих речевых центров, так и на восстановлении нарушенных связей между центрами и полушариями головного мозга. Помимо этого, восстанавливаются разрозненные связи речевых центров с другими областями мозга, участвующими в реализации речевой функции. В процессе лечения формируется физиологичное, последовательное взаимодействие всех зон мозга, связанных с речепродукцией. В результате появляется речь.
Метод лечения базируется как на активации самих речевых центров, так и на восстановлении нарушенных связей между центрами и полушариями головного мозга. Помимо этого, восстанавливаются разрозненные связи речевых центров с другими областями мозга, участвующими в реализации речевой функции. В процессе лечения формируется физиологичное, последовательное взаимодействие всех зон мозга, связанных с речепродукцией. В результате появляется речь.
Проведение биофизической активации сочетается с дополнительными методиками лечения, такими как — лимфомежклеточная терапия, которая применяется для регулирования интегративной деятельности и восполнения дефицита энергетической системы мозга и позволяющая применять малые дозы церебропротекторов, которые вводятся эндолимфатически и попадают в ткани головного мозга, минуя гематоэнцефалический барьер.
В качестве другого способа использования препаратов с нейротрофическим и антиоксидантным действием применяется методика эндоназального электрофореза кортексина, что позволяет вводить лекарственные препараты непосредственно в ткани головного мозга.
Исследования последних десятилетий выявили, что у большинства детей с речевыми и поведенческими проблемами в различной степени нарушены функции мозжечка и базальных ганглиев. Именно функционирование мозжечка определяет успешность ребенка в обучении. С этой целью применяется уникальная разработка Центра авиакосмической медицины — подошвенный имитатор опорной нагрузки «Корвит», применяемый для нейрофизиологической регуляции стато-кинетической функции ЦНС. В основе терапевтического воздействия аппарата «Корвит» лежит процесс активации опорной афферентации, отвечающей за нормализацию процессов возбуждения и торможения в центральной нервной системе, что приводит к уменьшению спастичности мышц, развитию и закреплению функциональных связей в головном мозге, способствующих восстановлению координации движений, и, опосредованно, улучшению речи и мышления.
Также для успешного лечения различных форм ЗПРР специалистами применяется одно из достижений современной науки — метод аудиовокальной терапии RUSTOMATIS. Прибор использует звукозаписи высокочастотных и низкочастотных компонентов. При чередовании такой музыки путем напряжения и расслабления у ребенка тренируется аппарат среднего уха – молоточек и стремечко, с помощью чего расширяется диапазон восприятия внешних факторов, увеличивается концентрация внимания, в мозг поступает новая информация и, как следствие исчезают многие нарушения и расстройства.
Прибор использует звукозаписи высокочастотных и низкочастотных компонентов. При чередовании такой музыки путем напряжения и расслабления у ребенка тренируется аппарат среднего уха – молоточек и стремечко, с помощью чего расширяется диапазон восприятия внешних факторов, увеличивается концентрация внимания, в мозг поступает новая информация и, как следствие исчезают многие нарушения и расстройства.
Обязательным звеном в лечебном комплексе у детей с наличием речевых расстройств является занятия с клиническим психологом, а также логопедическая коррекция, которая включает диагностику степени нарушений, ежедневные занятия, направленные на улучшение речевой функции и логопедический массаж для коррекции различных видов дизартрии и дисфагии.
На фоне сочетания проведения биофизической активации со вспомогательными методиками лечения наблюдаются положительные изменения, которые могут быть видны уже через несколько процедур, но максимальный эффект развивается через полтора-три месяца после курса. Как правило, для закрепления полученных результатов и дальнейшего развития двигательных и когнитивных навыков специалистами центра рекомендуется повторный курс лечения через 5-6 месяцев.
Как правило, для закрепления полученных результатов и дальнейшего развития двигательных и когнитивных навыков специалистами центра рекомендуется повторный курс лечения через 5-6 месяцев.
Мой сын умер от синдрома Патау!
Привет, Грейсспасибо за ответ, подумал, что есть еще кое-что, и спасибо, что дали нам кое-что из этого. Вы знаете, что консультирование не всегда для всех, поверьте мне, я никогда этого не хотел и до сих пор не хочу. Но когда я начинаю свой новый курс, я должен иметь и платить за 50-часовой личный терапевтический глоток, который, чтобы быть отточенным, не является чем-то, чего я с нетерпением жду, насколько я понимаю, я не думаю, что для меня будет хорошо тянуть вверх множество вещей, с которыми я помирился.
Моя дочь умерла 30 декабря 1995 года. Я отпустил ее … она была чудо-ребенком во всех отношениях, состояние, которое у нее было, когда все было плохо, ужасно, и что они не говорят вам, так это то, что если ваш ребенок будет процветать в течение первого года, то когда у них есть эпизод, который полностью отключен.
Моя дочь была такой тихой, когда я ее взял, она была эмерг-CS, и она была тихой, как мышь, все остальные числа были в трепете, кроме меня, который знал, что это неправильно.
Она закончила тем, что у нее, черт возьми, мозговые волны, плоская линия, нет надежды и т.д., потом чудесное выздоровление, без повреждений мозга, нормально, они перепроверили ее, потому что думали, что, возможно, они изначально ошибались, но они этого не сделали.Ей было 14 месяцев, когда он ударил, и это сильно ударило по ней, мы были в отпуске в Девоне, не могли вывезти ее за границу в то время, никто ничего не знал об этом, она была 72-м ребенком в мире с ним 26 в Великобритании.
Она вернулась к черту на вертолете рафа, за которым мы должны были следовать в самый ужасный шторм в праздничные дни, когда-либо, а затем мы потеряли морского короля из-за того, что корабль упал у берега, и раф сказал, что они его посадят вплоть до тренировок, потому что больница отказалась оплачивать двухтысячный счет за топливо и хочет отправить ее на машине скорой помощи, черт возьми, сказал, что я так не думаю и т. д.
д.
Тол, короче говоря, она разбилась и сгорела, она была так повреждена дистонией во всех конечностях, что обе ее руки превратились в когти, а все ее суставы и мышцы были напряжены и не могли растягиваться, она потеряла зрение, ее глотательный рефлекс она не могла даже говоря «да да», она потеряла все, что было нанесено повреждениями лобных долей.
Мы прожили с ней еще год, а затем бронхелит вернул ее к чертям и нанес гораздо больший ущерб, для этого состояния нет лечения или лекарства, как и для большинства из них.они сказали, что снова приведут ее к пику и попытаются стабилизировать ее, но профессор хотел, чтобы я подумал о том, чтобы отпустить ее, потому что теперь она все время будет разбиваться.
Итак, я принял решение отпустить ее, я не буду говорить, что сказала семья, потому что они сказали это из-за гнева, беспокойства, горя и т. Д., И я никогда не сдерживал их, доктора сказали, что не более часа, это было 19 часов, которые она держала Это был ад, у меня были люди, которые всю ночь ехали в больницу, чтобы увидеть ее, некоторые были даже пьяны, но отчаянно хотели оказаться там, как только услышат.
, потому что она так много дралась, что я чувствовал себя таким виноватым, потому что я думал, что она не хочет, чтобы я сражался за нее, поэтому я позвонил медсестрам всех врачей, и они сказали, что ничего не могут сделать, я даже не мог пожертвовать ее органы, потому что они были так повреждены . Я позволил ей умереть на руках у ее отца, хотя я отчаянно пытался вырвать ее у него, — он никогда ничего не делал для нее в жизни, поэтому по какой-то причине я позволил ему это, я не жалею об этом, но я рыдаю об этом, просто печатая это. То, что этот парень сделал во время и после ее смерти, — это совсем другой роман, если честно, и это одна из причин, по которой я сейчас тренируюсь, чтобы стать консультантом.
Грейс, в этом году исполнилось 16 лет, и я думаю о ней каждое мгновение каждого дня, походы на кладбище — убийца, и я ненавижу ходить туда, у меня каждый марш и декабрь бывает нервный срыв, и последние несколько лет были было худшим. для меня это приближение к годовщине и путешествие к ее могиле, я там 5 минут, затем я ухожу, и мне снова становится лучше, это странно, не могу объяснить это, но она не для меня, она всегда в моей голове и сердце, и это мое утешение. если вы идете на консультацию, вам не нужно говорить ничего, что они не осуждают, они не подталкивают вас, они не будут говорить о том, чего вы не хотите, если вы пошли в документацию, они могли бы предложить вам первые шесть недель CBT, но я думаю, вам нужно немного больше времени, чем это, если вы можете себе это позволить.Почему бы вам не пойти и не посмотреть, как обстоят дела, они ничего не слышали, возможно, вам нужно увидеть один или два, прежде чем вы освоитесь с одним, в частности. Вещи имеют свойство гноиться, в какой-то момент они вылезут наружу, если с ними не разобраться, ваше подсознание умеет сообщать вам предупреждающие знаки, и если вы их игнорируете, это может вызвать проблемы в дальнейшей жизни.
если вы идете на консультацию, вам не нужно говорить ничего, что они не осуждают, они не подталкивают вас, они не будут говорить о том, чего вы не хотите, если вы пошли в документацию, они могли бы предложить вам первые шесть недель CBT, но я думаю, вам нужно немного больше времени, чем это, если вы можете себе это позволить.Почему бы вам не пойти и не посмотреть, как обстоят дела, они ничего не слышали, возможно, вам нужно увидеть один или два, прежде чем вы освоитесь с одним, в частности. Вещи имеют свойство гноиться, в какой-то момент они вылезут наружу, если с ними не разобраться, ваше подсознание умеет сообщать вам предупреждающие знаки, и если вы их игнорируете, это может вызвать проблемы в дальнейшей жизни.
Я ценю, что вы не знаете, с чего начать, но все должно быть лучше, чем альтернатива ничего.
take care sam x
Синдром Патау (трисомия 13) Информация и прогноз
Синдром Патау (трисомия 13) связан с высоким уровнем смертности с множественными врожденными аномалиями, которые приводят к тяжелым физическим и психическим нарушениям.
- Обычно это происходит из-за автономной трисомии с дополнительной хромосомой номер 13 вместо обычной пары во всех клетках.
- Также может произойти несбалансированная транслокация хромосомы — обычно это Робертсоновская транслокация, при которой дополнительная копия хромосомы 13 прикрепляется к другой хромосоме.
- Могут также существовать мозаичные вариации, при которых одни клетки являются нормальными с 46 хромосомами, а другие имеют дополнительную хромосому. Младенцы с мозаичными вариациями, как правило, страдают в меньшей степени.
Эпидемиология
Распространенность трисомии 13 составляет от 1 на 5 000 до 1 на 29 000 живорожденных, и это третья по частоте аутосомная трисомия у новорожденных после трисомии 21 и трисомии 18 [1] .
Факторы риска
- Личный или близкий семейный анамнез рождения пострадавшего ребенка увеличивает риск.
- Риск возрастает с увеличением возраста матери, но не так сильно, как при синдроме Дауна (трисомия 21) или синдроме Эдвардса (трисомия 18) [2] .
Презентация
[1, 3]Многие плоды никогда не доживают до срока беременности и рождаются мертворожденными или выкидышами самопроизвольно. Характеристики включают:
- Ограничение внутриутробного развития и низкий вес при рождении.
- Врожденные пороки сердца: встречаются у 80%; они включают дефект межпредсердной перегородки, дефект межжелудочковой перегородки, открытый артериальный проток, декстрокардию.
- Голопрозэнцефалия: мозг не делится на две половины; это может проявляться дефектами средней линии лица, включая:
- Расщелина губы и неба.
- Микрофтальм или анофтальм.
- Порок развития носа.
- Гипотелоризм (уменьшение расстояния между глазами) или циклоп.
- Другие аномалии головного мозга и центральной нервной системы, в том числе:
- Дефекты нервной трубки.
- Другие анатомические дефекты головного мозга
- Тяжелая неспособность к обучению.
- Проблемы с контролем дыхания (центральное апноэ).
- Другие черепно-лицевые аномалии включают:
- Микроцефалия.
- Дефекты кожи головы (аплазия кутиса: кожа на коже черепа отсутствует).
- Пороки развития и глухота уха.
- Капиллярные гемангиомы.
- Нарушения со стороны желудочно-кишечного тракта: омфалоцеле, экзомфалоз, грыжи.
- Пороки развития мочеполовой системы: поликистоз почек, микропенис или гипертрофия клитора.
- Аномалии кистей и стоп: полидактилия (лишние пальцы рук или ног), маленькие гипервыпуклые ногти и стопы с коромыслом [4] .
Дифференциальный диагноз
- Младенцы с синдромом Патау и синдромом Эдвардса могут иметь схожие черты, и их трудно дифференцировать.
- Псевдотрисомия 13 используется для описания младенцев с чертами, типичными для трисомии 13, но с нормальным кариотипом [5] .
Исследования и лечение
Цитогенетические исследования и хромосомный анализ подтвердят диагноз. Системам органов потребуется специальное исследование в зависимости от аномалии — например, эхокардиография при сердечных аномалиях; рентгенография скелета и т. д.
Лечение «живорожденного» ребенка обычно является поддерживающим, но меры по поддержанию жизни не всегда проводятся.Перед принятием таких мер, как хирургическая коррекция аномалий, рекомендуется серьезно подумать и обсудить. Назогастральное кормление или кормление через желудок возможно, но врач должен принять во внимание пожелания родителей и любой потенциальный вред, который это может причинить младенцу. Родителям потребуется серьезная поддержка и совет.
Если синдром Патау вызван несбалансированной транслокацией хромосом или структурной хромосомной аномалией, оба родителя должны пройти хромосомный анализ.Возможно, транслокация у младенца произошла de novo, но сбалансированная транслокация может быть обнаружена у одного из родителей. Это имеет значение для будущих беременностей из-за более высокого риска рецидива. Другие члены семьи также могут быть затронуты.
При будущих беременностях следует предлагать скрининг и / или пренатальную диагностику. Женщины, у которых ранее была трисомная беременность, особенно те, кто в то время моложе 35 лет, по-видимому, имеют повышенный риск того, что будущая беременность будет трисомной [6] .См. Также отдельную статью о пренатальной диагностике.
Прогноз
[1]- Продолжительность жизни очень ограничена. Средняя выживаемость составляет 2,5 дня.
- Около 50% живут дольше одной недели.
- 5-10% младенцев живут дольше одного года.
- У выживших возникают серьезные нарушения обучаемости и задержка в развитии. Судороги и трудности с кормлением — обычное явление.
- Однако мозаицизм трисомии 13 вызывает вариабельный фенотип, варьирующийся от полной трисомии 13 с неонатальной смертью до нескольких дисморфических признаков и увеличенной выживаемости [7] .
Скрининг
[8]- Конкретные результаты ультразвукового исследования могут указывать на трисомию 13, и поэтому могут быть показаны последующие цитогенетические исследования. Результаты включают повышенную прозрачность воротниковой зоны, сердечные дефекты, дефекты нервной трубки, расщелину лица, почечные аномалии и омфалоцеле. частота сердечных сокращений плода и обследование плода на голопроэнцефалию, экзомфалос и мегацистис могут выявить> 90% плодов с трисомией 13 [9] .
- Множественный маркерный скрининг в первом триместре (который в настоящее время предлагается для скрининга синдрома Дауна) также может помочь идентифицировать плод с трисомией 13 или 18. Маркеры могут включать возраст матери, измерение затылочной прозрачности, связанный с беременностью плазменный белок А (PAPPA). ) и хорионический гонадотропин человека (ХГЧ). Ультразвук в это время также может показать аномалии плода.
- Скрининговые тесты во втором триместре могут быть предложены, если мать обратилась позже. Дополнительную информацию о скрининговых тестах во втором триместре см. В отдельной статье «Дородовой скрининг синдрома Дауна».
- В исследовании 2003 г., проведенном в Великобритании, было изучено 44 случая трисомии 13 и 88 случаев трисомии 18. 64% были впервые обнаружены хромосомным анализом из-за аномалий, отмеченных при сканировании аномалий плода во втором триместре. 3% случаев были выявлены с помощью программы скрининга сыворотки, предлагаемой в настоящее время для синдрома Дауна. 11% случаев были выявлены послеродовым путем. Следует отметить, что в том же исследовании 12% пар предпочли продолжить беременность после пренатального диагноза [2] .
Пренатальная диагностика
- Амниоцентез или забор проб ворсин хориона необходим для постановки окончательного пренатального диагноза.
- Также возможно проведение цитогенетического исследования крови плода.
- Матери старше 35 могут сразу пройти диагностическое обследование. Другие матери могут выбрать диагностическое обследование после положительного результата скринингового теста.
История
Клаус Патау был американским генетиком, родившимся в Германии. Патау и др. Описали синдром в 1960 году.Клинический вид трисомии 13 был впервые описан Эразмом Бартолином в 1657 году, но он не знал об этиологии.
Скрининг на синдром Дауна и синдромы Эдвардса и Патау
В рамках дородовой помощи NHS примерно с 12 недели беременности вам будут предложены различные сканирования, проверки и тесты, чтобы убедиться, что ваш ребенок здоров и развивается хорошо. Один из этих тестов, называемый комбинированным скрининговым тестом, проверяет синдромы Дауна, Эдвардса и Патау.
Вас спросят, хотите ли вы пройти этот тест; вы можете отказаться, и никто не будет возражать. И мы считаем, что стоит вооружиться некоторой информацией, прежде чем вас попросят принять это решение.
Что именно это за синдромы?Все 3 синдрома — это генетические нарушения, при которых у ребенка есть дополнительная копия (или часть копии) определенной хромосомы, что приводит к определенному набору инвалидности или проблем с ростом. Синдром Эдвардса и Патау очень редки и более серьезны, чем синдром Дауна.
- Синдром Эдвардса или трисомия 18 (T18) вызывает серьезные аномалии головного мозга, а также может вызывать проблемы с сердцем, необычные черты лица и головы и серьезные проблемы роста. Большинство детей с Т18 умрут до того, как родятся, родятся мертвыми или вскоре после рождения.
- Синдром Патау или трисомия 13 (T13) также может вызывать серьезные аномалии головного мозга и проблемы с сердцем, а также расщелину губы и неба, проблемы роста, плохо сформированные глаза и уши и проблемы с почками.Большинство детей с T13 умрут до рождения, родятся мертвыми или вскоре после рождения.
- Синдром Дауна или трисомия 21 (T21) может вызывать задержку роста, легкую или умеренную неспособность к обучению и отличительные черты лица. Многие дети, затронутые этим заболеванием, в случае доношения вырастают и начинают жить счастливыми, здоровыми и полноценными — при необходимости, при необходимости, дополнительной медицинской помощи или помощи специалиста.
Насколько вероятно, что у моего ребенка 1 из этих синдромов?
Маловероятно.Считается, что синдром Дауна встречается у 1 из каждых 500 беременностей, в то время как гораздо более редкий синдром Эдвардса встречается у 1 из каждых 1500 беременностей. Синдром Патау встречается крайне редко и диагностируется менее чем у 200 детей в год.
Будет ли комбинированный скрининговый тест сказать мне наверняка в любом случае?
Нет, мы боимся, что это немного сложнее, потому что этот тест только скажет вам, высока или низкая вероятность того, что у вас родится ребенок от Дауна, Эдвардса или Патау.
Если вам сказали, что у вас низкий шанс родить ребенка с любым из этих состояний (как у подавляющего большинства женщин), вам не потребуется никаких дополнительных анализов; Если вам скажут, что у вас высокий уровень изменения, вам, вероятно, предложат дальнейшие, более точные тесты. Некоторые из этих тестов несут (очень небольшой) риск выкидыша.
«Справедливо сказать, что 95% женщин, прошедших комбинированный скрининговый тест, получают результаты с низкой вероятностью», — говорит Джейн Фишер из благотворительной организации Antenatal Results and Choices (ARC).
Обязательно ли мне проходить комбинированный скрининговый тест?
Нет. Это полностью зависит от вас, есть она у вас или нет. И, если вы все же решите пройти это обследование, вам не нужно проходить обследование на все 3 синдрома, если вы этого не хотите.
Итак, вы можете выбрать:
- Для прохождения теста, отбор на Дауна, Эдвардса и Патау
- Чтобы пройти тест, скрининг Дауна только
- Для прохождения теста, проверка только для Эдвардса и Патау
- Не проходить испытания вообще
Многие беременные женщины решают, что они действительно хотят пройти комбинированный скрининговый тест, потому что, если бы он действительно был высок, они бы тогда захотели пройти другие, более точные тесты — и, если бы они оказались положительными, они могли бы либо принять решение о том, продолжать ли беременность, либо быть готовым к тому, что должно произойти.
Для тех, кто предпочитает не проходить комбинированный отборочный тест, как, например, плакат форума MFM Ninja Pigeon, это зачастую скорее интуитивное решение, и знание большего значения не имеет никакого значения. «У нас не было никаких анализов, кроме обычного ультразвукового сканирования», — говорит она. «Мы говорили об этом, и мы оба согласились, что мы не будем прекращать работу, поэтому тесты были излишними.
«Но я не думаю, что здесь есть что-то хорошее или неправильное. Это очень личный выбор «.
Когда мне нужно пройти комбинированный скрининговый тест?
Вам предложат этот тест перед началом дородового наблюдения NHS, когда вы на сроке от 11 до 14 недель беременности.
Так что именно включает в себя тестирование? Почему это называется «комбинированным»?
«Это называется« комбинированный скрининговый тест », потому что он сочетает в себе сканирование воротниковой прозрачности (NT) с анализом крови», — говорит Найджел Томсон, профессиональный специалист по ультразвуку Общества и колледжа рентгенологов. «Сканирование NT выполняется (если вы согласны на это) во время вашего 1-го обычного ультразвукового исследования, которое часто называется сканированием датирования или 12-недельным сканированием».
Затем результаты NT-сканирования и возраста анализа крови дополнительно комбинируются с вашим возрастом и сроком беременности (сколько недель вашему ребенку кажется, в зависимости от того, как долго он или она измеряли, голова вниз, во время вашего сканирования) .
Вы можете пройти сканирование и анализ крови в один и тот же день или их можно сделать отдельно.
Анализ крови — это обычная процедура «иглой в руке», которую может сделать ваша акушерка или флеботомист (специалист, специализирующийся на взятии образцов крови). Обычно образец крови, необходимый для комбинированного скринингового теста, берут одновременно с взятием крови для обычных анализов крови на беременность (для проверки вашей группы крови и т. Д.), Чтобы избежать двойного удара по руке.
«Во время сканирования NT, — говорит Найджел, — жидкость в задней части шеи вашего ребенка измеряется сонографистом, который проводит ваше ультразвуковое сканирование». (Младенцы с аномалиями склонны накапливать больше жидкости в этом пространстве, чем в среднем на этой стадии беременности.)
Иногда и обычно из-за того, как лежит ребенок, сонографист не может провести измерение NT. Если это так, вам должно быть предложено второе сканирование. Если по-прежнему невозможно получить измерение, тогда вас могут направить на четырехкратный анализ (другой анализ крови, который проверяет на Дауна, но не на Эдвардса или Патау) или, если ваша больница предлагает это, НИПТ (более новая кровь протестируйте эти экраны для десятков условий).
Когда я получу результаты?
Вам могут сообщить результат теста NT в день сканирования. Но время, необходимое для предоставления вам окончательных результатов комбинированных тестов, варьируется и, очевидно, часто зависит от того, проводите ли вы два теста в разные дни, и сколько времени потребуется вашей больнице для обработки всей информации, собранной с помощью тестов.
Обычно вы должны услышать от 1 до 3 недель.
Что означают результаты?
Если вам дадут результат теста NT отдельно, вам сообщат измерение жидкости в миллиметрах: значение 3.5 мм и более предполагает, что у вашего ребенка может быть повышенный риск заболеваний Дауна, Эдвардса и Патау.
Но результат, который действительно имеет значение, — это комбинированный результат, и это 1, который является «баллом». Итак, 2 балла: 1 за вероятность того, что у вашего ребенка болезнь Дауна, и 1 за вероятность того, что у вашего ребенка синдром Эдвардса или Патау (вместе взятые).
«Если вам говорят, что ваш шанс составляет от 1 из 2 до 1 из 150, это считается высоким», — говорит Джейн Фишер. Но это не означает, что у вашего ребенка определенно есть какой-либо из трех синдромов; это просто означает, что вам могут быть предложены другие, более точные тесты.
Все, что больше 1 из 151, считается низким. «Если ваш шанс считается низким, — говорит Джейн, — важно помнить, что это не означает, что у вашего ребенка определенно нет синдрома». Это просто означает, что это крайне маловероятно — настолько маловероятно, что нет необходимости в дальнейшем тестировании.
Насколько точны результаты? Комбинированный скрининговый тест выявляет более 4 из 5 (от 85 до 90%) детей с синдромом Дауна, синдромом Эдвардса и синдромом Патау.
Но в 2 из каждых 100 тестов результат может указывать на то, что у вашего ребенка 1 из синдромов, тогда как у него или нее нет: «ложноположительный».
Если мне скажут, что у меня высокий шанс, что будет дальше?
Вам предложат встречу с акушеркой, чтобы обсудить дальнейшие, более точные анализы. Вам не обязательно их иметь, если вы не хотите.
Вам могут предложить новый скрининговый тест под названием НИПТ (также известный как cffDNA), который представляет собой анализ крови, обеспечивающий более высокую степень точности при выявлении синдромов Дауна, Эдвардса и Патау.Некоторые больницы NHS предлагают НИПТ, но другие еще не предлагают ее, хотя в ближайшее время планируется начать предлагать ее во всех больницах. Возможно, вы сможете пройти НИПТ в своей больнице, если будете готовы заплатить; в качестве альтернативы вы можете заплатить за это в одной из многих частных клиник, которые сейчас его предлагают.
Если у вас нет НИПТ или если результат НИПТ положительный, вам, вероятно, предложат либо амниоцентез, либо сердечно-сосудистую систему — оба теста называются «диагностическими», потому что результаты настолько точны (99%), что, если это положительно для болезней Дауна, Эдвардса или Патау, врачи сочтут это диагнозом.И амниоцентез, и CVS несут в себе небольшой риск выкидыша, поэтому вам придется взвесить, стоит ли пойти на такой небольшой риск, чтобы выяснить (почти полностью) наверняка.
Будьте уверены, что вам будет предложено множество советов и поддержки. И, возможно, вам будет полезно выразить свои чувства на нашем форуме чата.
Подробнее:
Тестирование на синдром Дауна, синдром Эдвардса и синдром Патау: что нужно знать при беременности
Что происходит при тестировании на синдром Дауна, синдром Эдвардса и синдром Патау? Мы разбиваем его, чтобы вы знали, что к чему.
Антенатальный скрининг не является обязательным, и его следует тщательно рассмотреть вместе с вашим партнером. Возможно, вы захотите узнать о различных состояниях, таких как синдром Дауна, перед скринингом, чтобы понять, что это такое и что означает жизнь с этим заболеванием. Это может помочь вам понять, на что вы проводите скрининг, чтобы принять обоснованное решение о том, проводить скрининг или нет, и подготовиться к сканированию.
Стоит подумать, будете ли вы действовать в соответствии с какими-либо результатами или нет, так как это может повлиять на то, будете ли вы проводить скрининг или нет.Если вы решите не проводить скрининг на генетические заболевания, вы все равно можете сделать другое сканирование и получить свои фотографии.
Вы можете найти много информации и поддержки от Ассоциации синдрома Дауна (DSA) и организации «Позитивное отношение к синдрому Дауна» с рассказами и рассказами, написанными родителями и молодыми людьми с синдромом Дауна. Посетите SOFT (Поддержка трисомии 13/18) для получения информации о синдроме Эдварда или Патау.
Комбинированный тест
Всем беременным женщинам в Англии предлагается скрининговый тест, называемый комбинированным тестом, между 10 и 14 неделями беременности (NHS Choices, 2018a).Этот тест сочетает в себе ультразвуковое сканирование с анализом крови на синдром Дауна, синдром Эдвардса и синдром Патау. Он расскажет вам, насколько высоки ваши шансы родить ребенка с одним из этих состояний (NHS Choices, 2018a).
Во время теста измеряется жидкость в задней части шеи ребенка, чтобы определить «затылочную прозрачность». Затылочная прозрачность — это название жидкости под кожей в задней части шеи ребенка. По мере увеличения NT увеличивается вероятность того, что у вашего ребенка будет генетическое заболевание (NHS Choices, 2018a).
У вас также возьмут кровь для проверки уровня двух гормонов беременности. Затем эти два теста будут объединены с вашим возрастом, чтобы определить вероятность того, что у вашего ребенка будет синдром Дауна, синдромы Эдвардса или Патау (Basingstoke and North Hampshire NHS Trust, 2010; Shiefa et al, 2013; Basingstoke and North Hampshire NHS Foundation). Trust, 2016; Insider Radiology, 2017).
Четверной тест
Измерение прозрачности шеи зависит от положения ребенка, поэтому это не всегда возможно.Если в вашем случае это будет сложно, вам предложат другой скрининговый тест крови, называемый четырехкратным тестом, который не так точен, как комбинированный тест (NHS Choices, 2018a).
Результаты скринингового исследования
Если ваш скрининговый тест дает результат с меньшей вероятностью, вероятность того, что у вашего ребенка будет это заболевание, составляет менее одного из 150 (NHS Choices, 2018a).
Если у вас больше шансов получить результат, вам предложат диагностический тест, например, амниоцентез или биопсию ворсин хориона (CVS).Это точно скажет вам, есть ли у ребенка синдром Дауна, синдром Эдвардса или Патау (Health Knowledge, 2017; NHS Choices, 2018a).
Неинвазивное пренатальное тестирование (НИПТ) или бесклеточный ДНК-тест (вкДНК)
Если ваш скрининговый тест показывает больше шансов, вы можете подумать о прохождении НИПТ. Его также называют тестом внеклеточной ДНК (вкДНК). Национальная служба здравоохранения не полностью развернула НИПТ, но частные поставщики медицинских услуг часто предлагают это.
НИПТ — это анализ крови, взятый у мамы, поэтому он не несет риска выкидыша.Однако это не диагностика, поэтому, если НИПТ дает высокочастотный результат, и вы хотите знать наверняка, вам нужно будет пройти инвазивный тест.
Точность правильного результата с высокой вероятностью может составлять всего 48%, если вам 20 лет и вы не проходили никакой другой проверки. Ваш генетический консультант или акушерка могут посоветовать вам об этом. Также есть калькулятор, но его всегда следует использовать при обсуждении с вашим врачом (Positive about Downs, 2019).
Диагностический тест (амниоцентез или ворсинка хориона)
Диагностический тест, такой как амниоцентез или биопсия ворсин хориона (CVS), точно скажет вам, есть ли у вашего ребенка синдром Дауна, Эдварда или Патау.
Амниоцентез включает в себя удаление и тестирование клеток из жидкости, которая окружает вашего будущего ребенка в утробе матери, с помощью длинной тонкой иглы. Женщинам обычно проводят амниоцентез между 15 и 20 неделями беременности, но при необходимости возможно и позже (NHS Choices, 2016).
При взятии проб ворсинок хориона из плаценты берут небольшой образец клеток. Это делается либо с помощью иглы, вводимой в живот, либо с помощью трубки, либо с помощью маленьких щипцов, которые проходят через шейку матки. Женщины обычно проходят анализ ворсин хориона между 11 и 14 неделями беременности или, если необходимо, позже (NHS Choices, 2018b).
Примерно от 0,5 до 1 из 100 тестов амниоцентеза или проб ворсинок хориона приводят к выкидышу, поэтому решение о том, проводить ли их, является важным (NHS Choices, 2018b). Акушерка-акушерка в вашем родильном отделении обсудит с вами дальнейшие тесты.
Доступна специализированная поддержка
Если вы получили диагноз или высокую вероятность результата при каком-либо из состояний, важно постараться получить как можно больше информации. Вы можете взглянуть на следующее:
- Ассоциация синдрома Дауна — это благотворительная организация, которая предоставляет информацию, поддержку и советы людям с синдромом Дауна и их семьям.У них также есть информация об аффилированных местных группах поддержки.
- Mencap — это благотворительная организация, поддерживающая людей с ограниченными возможностями обучения.
- Позитивно о синдроме Дауна рассказывает о реальных историях других родителей и о том, что значит иметь ребенка с синдромом Дауна для всей семьи. Они могут связать вас с местными группами поддержки и семьями, в которых есть ребенок или молодой человек с синдромом Дауна.
- Есть много онлайн-групп поддержки, которые также могут предложить поддержку. Если вы беременны и у вас были высокие шансы / положительный результат, есть закрытая страница Facebook исключительно для тех, кто находится в вашей ситуации.
- Если у вас недавно родился ребенок с синдромом Дауна, вас ждет теплый прием на странице Положительные отзывы о синдроме Дауна.
- Если вам поставили диагноз / высокий шанс синдрома Эдварда или Патау, посетите SOFT (Поддержка трисомии 13/18).
Последнее обновление этой страницы: май 2018 г.
Дополнительная информация
Наша линия поддержки предлагает практическую и эмоциональную поддержку при кормлении вашего ребенка, а также общие вопросы для родителей, членов и волонтеров: 0300 330 0700.
Мы также предлагаем дородовые курсы, которые являются отличным способом узнать больше о рождении, родах и жизни с новым ребенком.
Подружитесь с другими будущими родителями и молодыми родителями в вашем районе для поддержки и дружбы, узнав, какие мероприятия NCT проходят поблизости.
Антенатальные результаты и выбор (ARC) (2018) Скрининг на синдром Дауна, Эдвардса и Патау / Неинвазивное пренатальное тестирование (НИПТ).Доступно по адресу: http://www.arc-uk.org/tests-explained/non-invasive-prenatal-testing-nipt [по состоянию на 3 мая 2018 г.]
Доверительный фонд NHS в Бейзингстоке и Северном Гэмпшире. (2016) Низкая информация PAPP-A для родителей. Доступно по адресу: https://www.hampshirehospitals.nhs.uk/media/423511/low_papp-a.pdf [доступ 3 мая 2018 г.]
Департамент здравоохранения и социальной защиты. (2016) Более безопасное обследование для женщин Доступно по адресу: https://www.gov.uk/government/news/safer-screening-test-for-pregnant-wo… [Доступ 28 мая 2019 г.]
Фишлер К., Кох Р.(1991) Психическое развитие при мозаицизме синдрома Дауна. Американский журнал умственной отсталости 96 (3): 345-351. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pubmed/1836734 [по состоянию на 3 мая 2018 г.]
Gov.UK. (2019) Обновленная информация о внедрении НИПТ — технология тестирования микрочипов и близнецы. Доступно по адресу:
https://phescreening.blog.gov.uk/2019/06/17/update-on-nipt-implementati…; [Доступ: 5 августа 2019 г.]
Health Knowledge (2017) Различия между скрининговыми и диагностическими тестами и выявлением случаев заболевания.Доступно по адресу: https://www.healthknowledge.org.uk/public-health-textbook/disease-causation-diagnostic/2c-diagnosis-screening/screening-diagnostic-case-finding [доступ 3 мая 2018 г.]
Внутренняя радиология. (2018) Сканирование ядерной прозрачности. Доступно по адресу: https://www.insideradiology.com.au/nuchal-translucency-scan/ [по состоянию на 3 мая 2018 г.]
Mégarbané A, Noguier F, Stora S, Manchon L, Mircher C, Bruno R, Ravel, A. (2013). Умственная отсталость трисомии 21: различия в экспрессии генов в серии случаев пациентов с более низким и более высоким IQ.Европейский журнал генетики человека 21 (11): 1253. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pubmed/23422941 [по состоянию на 3 мая 2018 г.]
NDSS (Национальное общество синдрома Дауна). (2018) Синдром Дауна. Доступно по адресу: https://www.ndss.org/about-down-syndrome/down-syndrome/ [по состоянию на 3 мая 2018 г.]
NHS Choices. (2016) Амниоцентез. Доступно по адресу: https://www.nhs.uk/conditions/amniocentesis/ [по состоянию на 3 мая 2018 г.]
NHS Choices. (2017) Синдром Дауна. Доступно по адресу: https: // www.nhs.uk/conditions/downs-syndrome/ [доступ 3 мая 2018 г.]
NHS Choices. (2018a) Скрининг на синдром Дауна, Эдвардса и Патау. Доступно по адресу: https://www.nhs.uk/conditions/pregnancy-and-baby/screening-amniocentesis-downs-syndrome/ [по состоянию на 3 мая 2018 г.]
NHS Choices. (2018b) Взятие пробы ворсинок хориона. Доступно по адресу: https://www.nhs.uk/conditions/chorionic-villus-sampling-cvs/ [по состоянию на 3 мая 2018 г.]
Национальный институт исследования генома человека NIH. (2016) Хромосомные аномалии.Доступно по адресу: https://www.genome.gov/11508982/chromosome-abnormalities-fact-sheet/#al-5 [по состоянию на 3 мая 2018 г.]
Пейн Дж. (2016) Амниоцентез. Доступно по адресу: https://patient.info/doctor/amniocentesis-pro [доступ 26 мая 2019 г.]
Положительные отзывы о Даунсах. (2019). Доступно по адресу https://positiveaboutdownsyndrome.co.uk/
Шифа С., Амарганди М., Бхупендра Дж., Мулали С., Кристин Т. (2013). Скрининг материнской сыворотки в первом триместре с использованием биохимических маркеров PAPP-A и свободного β-ХГЧ для синдрома Дауна, синдрома Патау и синдрома Эдварда.Индийский журнал клинической биохимии 28 (1): 3-12. Доступно по адресу: https://www.ncbi.nlm.nih.gov/pubmed/24381414 [по состоянию на 3 мая 2018 г.]
Дополнительная литература
Американская ассоциация беременности (2016) Квадроэкранный тест. Доступно по адресу: http://americanpregnancy.org/prenatal-testing/quad-screen/ [Доступно 3 мая 2018 г.]
Доверительный фонд NHS в Бейзингстоке и Северном Гэмпшире. (2016) Информационный буклет о ХГЧ. Доступно по адресу: http: //www.hampshirehospitals.nhs.uk/uploaded_files/GP%20section/EPAU/hcg_info_leaflet_march3010.pdf [по состоянию на 3 мая 2018 г.]
NHS Choices. (2016) Сканирование аномалий в середине беременности. Доступно по адресу: https://www.nhs.uk/conditions/pregnancy-and-baby/anomaly-scan-18-19-20-21-weeks-pregnant/ [по состоянию на 3 мая 2018 г.]
NHS Choices. (2017) Сканирование беременности по свиданию. Доступно по адресу: https://www.nhs.uk/conditions/pregnancy-and-baby/dating-scan-ultrasound-10-11-12-13-weeks-pregnant/ [по состоянию на 3 мая 2018 г.]
NHS Choices.(2018) Скрининговые тесты при беременности. Доступно по адресу: https://www.nhs.uk/conditions/pregnancy-and-baby/screening-tests-abnormality-pregnant/ [по состоянию на 3 мая 2018 г.]
NIH Национальная медицинская библиотека США. Состояние здоровья — синдром Дауна https://ghr.nlm.nih.gov/condition/down-syndrome#inheritance [Доступно 3 мая 2018 г.]
Редкое заболевание: окончательный отчет о прогрессе
2. Выявление и профилактика редких заболеваний
Обязательства 9-10
По-прежнему остаются проблемы с выявлением редких заболеваний, однако с достижениями в области геномики и скрининга мы наблюдаем улучшения, которые приносят пользу не только пациентам, но и семьям, а также NHS Шотландия.
Правительство Шотландии хочет, чтобы каждый получил наилучший уход и лечение от наших служб здравоохранения и ухода, и стремится улучшить жизнь людей в Шотландии, затронутых редким генетическим заболеванием, чтобы обеспечить им доступ к правильному лечению в нужное время. . Ранняя диагностика означает, что действия могут быть предприняты раньше и могут предотвратить дальнейшие осложнения и болезни пациента.
2.1 Национальная функция надзора за скринингом
Национальная функция надзора за скринингом ( NSOF ) была создана в 2020 году для обеспечения непрерывного мониторинга эффективности и управления рисками на всем пути скрининга.Его возглавляет директор по отбору и подотчетен Шотландскому комитету по отбору ( SSC ), который руководит политикой и включает руководителей совета директоров NHS . Его создание позволило SSC работать на более стратегическом уровне, предлагая контроль и гарантии для руководителей Совета директоров. В то время как группа по отбору национальных услуг в качестве уполномоченных и координаторов программ скрининга уделяет больше внимания оказанию услуг, чтобы гарантировать высокое качество, безопасность, эффективность и устойчивость услуг, которые отвечают потребностям людей, устраняют неравенство и оптимизируют благосостояние населения.
2.2 Расширение шотландской программы скрининга беременности
Скрининг на беременность предлагается на различных этапах беременности всем женщинам в Шотландии во время их обычных дородовых приемов. Скрининг направлен на выявление шансов, что у женщины или еще не родившегося ребенка есть определенные заболевания, как можно раньше, чтобы помочь защитить свое здоровье и здоровье своего ребенка и гарантировать, что они получат правильную поддержку, совет и уход.
В январе 2016 года Национальный скрининговый комитет UK ( UK NSC ) рекомендовал более ранний скрининг на синдром Эдвардса и синдром Патау, который будет проводиться в рамках комбинированного скрининга первого триместра, уже предложенного для синдрома Дауна.Они также рекомендовали расширить возможности скрининга для беременных двойней, чтобы они соответствовали тем, которые предлагаются для одноплодных беременностей. После обзора неинвазивного пренатального тестирования ( NIPT ) во время беременности было также рекомендовано оценочное развертывание NIPT как часть программы скрининга на беременность.
В июне 2018 года министры Шотландии утвердили три рекомендации UK NSC по программам скрининга беременности и новорожденных, а NHS Шотландии реализовали их в сентябре 2020 года.Эти изменения в скрининге на беременность включают:
- внедрение скрининга на синдром Эдвардса и синдрома Патау как часть комбинированного скрининга первого триместра, уже предложенного для синдрома Дауна.
- Тест второй линии: неинвазивное пренатальное тестирование ( NIPT ) для тех, у кого больше шансов получить результат скринингового теста первой линии.
- обновил варианты скрининга для беременностей двойней.
NIPT повышает точность результатов у женщин, которые уже идентифицированы как имеющие более высокую вероятность рождения ребенка с синдромом Дауна, синдромом Эдвардса или синдромом Патау по результатам скринингового теста первой линии.Это должно уменьшить количество женщин, впоследствии проходящих диагностическое обследование, которое сопряжено с небольшим риском выкидыша, связанного с тестами.
СиндромЭдвардса и синдром Патау — это редкие и серьезные генетические заболевания, которые поражают примерно 2 из каждых 10 000 рождений в UK ежегодно. Как и другие тесты на беременность, NIPT полностью безопасен и не причинит вреда. Женщинам, получившим с высокой вероятностью результат NIPT , будет предложен диагностический тест, но они могут отказаться от дальнейшего тестирования.Женщинам, получившим маловероятный результат, диагностическое обследование не будет предложено. NHS Scotland внедрила NIPT на период оценки не менее трех лет.
Более подробная информация обо всех тестах на беременность доступна на сайте NHS Inform. Поддержка предоставляется через различные организации семьям, чей ребенок имеет шанс заболеть или у него диагностирован синдром Дауна, синдром Эдвардса или синдром Патау. Более подробную информацию можно найти здесь.
2.3 Genetic Alliance
UK Роуд-шоу редких ресурсовВ 2020 году Genetic Alliance UK начал работу по организации Roadshow по редким ресурсам по всей Шотландии, чтобы повысить осведомленность специалистов в области здравоохранения и социальной помощи о редких состояниях, предоставить доступ к высококачественной и надежной информации о редких состояниях и поддержке, доступной для обоих специалистов. и люди, живущие с редким заболеванием.
Роуд-шоу редких ресурсов преследует три основные цели:
- Создавайте локальные редкие сети людей, живущих с редкими условиями, и тех, кто их поддерживает.
- Повышать осведомленность медицинских и социальных работников о редких заболеваниях.
- Предоставьте форум для обмена знаниями и информацией на местном уровне.
Для этого по всей Шотландии были проведены информационные и сетевые встречи. При поддержке Форума детей и молодежи Хайленда и CHIP + в Инвернессе была проведена экспериментальная сессия с участием семей, специалистов в области здравоохранения и социальной защиты. Также был проведен онлайн-веб-семинар, в ходе которого были проведены информационные занятия для педиатров, медперсоналов и акушерок из Хайленда.Отзывы о сессиях были чрезвычайно положительными: профессионалы сообщали о лучшем понимании редких заболеваний и о том, как помочь людям с редкими заболеваниями в их нагрузке.
Цитата родителей из Roadshow Rare Disease:
До того, как у меня родилась дочь, нам действительно не приходилось использовать NHS ни для чего, кроме нескольких приемов на прием к врачу GP . Теперь я чувствую, что знаю каждого человека и каждый уголок нашей больницы.
Из-за пандемии COVID-19 роуд-шоу по редким ресурсам было приостановлено, но вернется в 2021 году с программой информационных мероприятий для людей, живущих с редким заболеванием, включая их родителей и опекунов.Кроме того, будут организованы образовательные мероприятия для специалистов в области здравоохранения и социальной защиты, а также ряд местных мероприятий по созданию редких сетей по всей Шотландии.
трисомия 18. Мы хотели защитить ее
«Она страдает от боли?» — тихо спросила я, когда перламутровое изображение в форме ребенка на экране сложило ножки, а затем вытянуло их.
Радиолог, проводивший мое УЗИ, только что закончил указывать на группу тревожных отклонений у нашей развивающейся дочери, используя множество медицинских терминов, с которыми мой муж и я, оба студенты-медики, были мрачно знакомы. Плевральный выпот : жидкость, окружающая одно из легких, препятствует его расширению и правильному развитию. Асцит : избыток жидкости в брюшной полости, окружающей ее органы. Кистозная гигрома : большая, заполненная жидкостью масса на шее, тесно связанная с хромосомными аномалиями.
Что-то было не так с нашим ребенком.
объявление
Через несколько часов я лежал на больничном столе для осмотра. Сложив руки над головой, я попыталась не двигаться, пока специалист по медицине матери и плода проткнул большую иглу мою брюшную стенку, а затем матку, чтобы взять образец плаценты для генетического тестирования.После мучительных двух недель результаты вернулись: у нашей дочери была трисомия 18. Мы с мужем сразу поняли серьезность этого диагноза — это одно из тех редких состояний, с которыми мы ожидали столкнуться на медосмотре, а не в реальной жизни. .
Трисомия 18 встречается редко, примерно в 1 из 2 500 беременностей. Клетки этих младенцев имеют три копии хромосомы 18 вместо обычных двух. Лекарства нет. Большинство детей с трисомией 18 умирают до рождения. Большинство из тех, кто умирает, умирают в течение 5-15 дней, как правило, из-за серьезных пороков сердца и легких.Те немногие, кто доживают до одного года, имеют серьезные проблемы со здоровьем, такие как у малыша, у которого отсутствуют мышцы брюшной стенки, обнаруживает скользящее движение кишечника под кожей, или годовалый ребенок, который не может самостоятельно испражняться, что требует расширения анального сфинктера. несколько раз в день.
объявление
Актуальные:
CDC расширяет право на вакцинацию против COVID-19 для всех взрослых
В редких случаях дети с трисомией 18 имеют мозаичный вид, что означает, что только некоторые клетки обладают вредной дополнительной хромосомой, что делает болезнь менее серьезной.У нашей дочери не было мозаики.
Как родители, мы считали своим долгом защитить нашу дочь от неизбежных страданий, которые ей пришлось бы испытать, если бы она дожила до срока. Итак, на 15 неделе беременности мы приняли болезненное решение прервать нашу очень желанную беременность.
По мере приближения свидания я носила объемную одежду, чтобы скрыть выпирающий живот — я боялась, что кто-нибудь поздравит меня с беременностью. Каждый день я надеялась, что у нашей дочери не было достаточно нейронных связей, чтобы начать чувствовать, что ее органы выходят из строя.Используя наш домашний доплеровский монитор, рождественский подарок моей сестры, мы слушали ее сердцебиение. Два дня спустя я снова попытался услышать ее сердцебиение, но его больше не было. Она уже умерла.
Когда я очнулся после процедуры дилатации и эвакуации, во время которой ее останки были извлечены из моего тела, я заплакал. Я никогда не чувствовал такой глубокой пустоты.
Нам с мужем подарили небольшую коробку, запечатанную бантом. В нем была крошечная детская шапочка и толстый лист бумаги с пурпурными следами размером с мою ноготь.Ее следы.
Мы кремировали ее останки и поместили ее прах в крошечную белую урну, достаточно маленькую, чтобы поместиться в моей ладони. Было приятно видеть ее дома, даже если все было не так, как мы ожидали.
Для такого душераздирающего события у нас был лучший сценарий. Мы с мужем обладаем медицинской грамотностью. Наши медицинские расходы были полностью покрыты моей страховкой. Меня лечили в одной из лучших больниц страны. Мы получили превосходные консультации от нескольких врачей и консультанта по генетике, которые помогли нам проинформировать и поддержали нас, не диктуя и не осуждая наше решение.В день операции со мной обращались, как с любым другим хирургическим пациентом.
Другим семьям повезло меньше, чем моей. Через несколько месяцев после моей потери моя подруга Джейми прервала беременность из-за трисомии 18. Я был потрясен и опечален ее описанием своего опыта.
Связанный:
Ребенок с геном болезни или без ребенка: генетическое тестирование эмбрионов создает этическое болото
Поскольку Джейми проживала в штате Миссури, страховка не покрывала прерывание беременности в случае серьезной порчи плода.Поскольку их местная больница взимала с них 8000 долларов за процедуру, Джейми и ее муж, бедные из-за недавней покупки дома, решили поехать в клинику для абортов. Протестующие кричали на них, входя в клинику: «Почему вы хотите причинить боль папиной маленькой дочке? Ты убиваешь папину девочку! »
Оказавшись в учреждении, Джейми прошел УЗИ, чтобы подтвердить стоимость процедуры, которая будет зависеть от гестационного возраста ребенка. Она и ее муж были проинформированы, что процедура будет стоить дополнительно 100 долларов, что повысит стоимость до 800 долларов, потому что врачи центра не согласились с гестационным возрастом, о котором сообщили Джейми и ее муж.В клинике утверждали, что ребенок немного старше, что сделало процедуру более дорогостоящей. Джейми и ее муж оказались в извращенном положении, когда им приходилось торговаться ценой собственного кошмара.
В конце концов, Джейми перенес операцию. Ноги в стременах, ей сделали «укол для комфорта» — дополнительные 60 долларов — который, как я позже узнал, означал укол фентанила, сильнодействующего наркотика. На протяжении всей процедуры она не спала, и с тех пор несколько месяцев она активно подавляла смутные, тревожные воспоминания о прекращении лечения.
После того, как все закончилось, Джейми и ее муж не смогли получить останки своего ребенка, а останки не были отправлены на генетический анализ, чтобы определить, была ли трисомия 18 их ребенка наследственной или нет, как мы с мужем узнали. из генетического анализа. Центр отправил акушеру Джейми отчет о патологии только через много недель, и только после того, как она несколько раз позвонила в центр.
По данным Института Гутмахера, 26 штатов запрещают страхование абортов в рыночных планах Закона о доступном медицинском обслуживании, а 11 штатов распространяют эти ограничения на частные страховые компании, по сути дела Roe v.Уэйд. Только один из этих штатов (Юта) делает исключение в случае тяжелого поражения плода. В этих штатах только самые богатые имеют доступ к прерыванию беременности.
Эти ограничения усилились за последнее десятилетие. До 2010 года большинство частных планов медицинского страхования покрывали аборты, но это быстро изменилось в соответствии с Законом о доступном медицинском обслуживании, который позволяет штатам запрещать частным страховым планам предлагать комплексные планы, покрывающие аборты. Я опасаюсь, что в сегодняшней политической и правовой обстановке эта тенденция будет только усиливаться.
Я не понимаю, почему мы так стремимся к тому, чтобы женщины выносили доношенных детей с серьезными нарушениями. К ним относятся дети, у которых отсутствует мозг (анэнцефалия) или легкие которых недостаточно развиты для поддержания жизни (синдром Поттера). Это смертельные диагнозы. Чего можно добиться, заставляя женщин выносить этих детей до срока, кроме обеспечения того, чтобы эти дети были максимально осведомлены о своей боли и были чувствительны к ней?
Мы не могли защитить нашу дочь от трисомии 18, но мы могли оградить ее от любой боли или агонии, которые могут возникнуть с ней.Все родители должны иметь возможность защитить своих будущих детей таким образом — избавить их от боли. Это ужасные решения, которые ни один родитель никогда не должен принимать.
Но когда они это сделают, мы — как профессионалы здравоохранения и как сообщество — должны быть рядом, чтобы поддержать их эмоционально и финансово. Даже если вы считаете, что не станете прерывать беременность при таких обстоятельствах (хотя я призываю вас оставаться скромными, когда дело доходит до предвидения того, что вы можете сделать в экстремальной ситуации), это должен быть выбор, который семьи могут сделать.
Эллисон Чанг, доктор философии, учится на четвертом курсе медицинского факультета Гарвардской медицинской школы.
Варианты лечения и голос родителей при лечении трисомии 13 и 18
Трисомия 13 и 18 (также известная как синдром Патау и синдром Эдвардса, соответственно) в течение многих лет считались летальными расстройствами, и медицинские вмешательства, выходящие за рамки мер комфорта, обычно считались не предлагается. Эти редкие состояния (1 на 10000 живорожденных для трисомии 18 и ~ 0,4 на 10000 для трисомии 13) обычно связаны с аномалиями центральной нервной системы, сердца и желудочно-кишечного тракта, среди прочего, в дополнение к универсальным глубоким нейрокогнитивным дефицитам. [1].С тех пор как эти синдромы были впервые описаны в 1960 году, неонатология добилась значительных успехов в лечении множества других неонатальных состояний, таких как крайняя недоношенность и врожденные пороки сердца, которые когда-то считались повсеместно смертельными [2, 3]. Многие младенцы с заболеваниями, которые когда-то считались смертельными, в настоящее время часто живут значительно дольше, хотя и с широким спектром связанных с ними нарушений из-за процесса, лежащего в основе их заболевания. Это привело к признанию того, что определение «летальной аномалии» больше не является точным для многих расстройств, которые иногда продолжают описывать таким образом, включая трисомию 13 и 18 [4].
Данные последних лет показывают, что некоторые дети с трисомией 13 или 18 могут годами жить дома после медицинского и / или хирургического вмешательства (включая кардиохирургию, респираторную поддержку, гастростомические трубки и т. Д.), С описаниями отдельных случаев. живет более десяти лет. Уровень смертности продолжает оставаться высоким: в исследованиях сообщается, что выживаемость составляет примерно 10–25% через 1 год, хотя интерпретация данных о смертности осложняется тем фактом, что во многих центрах не предпринимаются попытки продлить жизнь этих младенцев. [5, 6].Таким образом, могло существовать самоисполняющееся пророчество о почти всеобщей ранней смертности в этих центрах, как было описано ранее для наиболее недоношенных новорожденных [7]. Феномен самоисполняющегося пророчества представляет собой риск заболеваний с высокой смертностью; если предположить, что пациенты с определенным расстройством не могут выжить, и, таким образом, решит не предлагать потенциально продлевающие жизнь вмешательства, то низкий или нулевой коэффициент выживаемости сохраняется. Это, в свою очередь, укрепляет веру в то, что этих пациентов невозможно спасти, и поэтому попытки сделать это неуместны с медицинской или этической точки зрения.Тем не менее, отчеты показали, что некоторые пациенты с трисомией 13 или 18 могут выжить и выживают в период новорожденности, а у тех, кто выживает в первый год, как правило, улучшаются показатели долгосрочной выживаемости, с общей выживаемостью около 10-15% в возрасте 5 и 5 лет. 10 лет [8].
В этом эссе мы представляем обзор аргументов за и против предложения медицинских и хирургических вмешательств пациентам с трисомией 13 или 18, а также описываем процесс, с помощью которого персонал медицинского центра может пересмотреть свой подход и разработать четкую, последовательную , и честная политика.Завершив такой процесс, факультет неонатологии детской больницы Йель-Нью-Хейвен изменил свой прежний подход и значительно повысил уровень доступного вмешательства. Мы предлагаем, чтобы пациенты с трисомией 13 или 18 лечились, как и все остальные в отделении интенсивной терапии новорожденных, с предложением или предоставлением лечения на основе понимания самых последних прогностических данных, а также соответствующих этических соображений и понимания того, что родители предпочтение, хотя и не является определяющим во всех случаях, следует уважать.
Результаты, развивающиеся руководства и практика
Как справедливо отмечали многие, хорошая этика начинается с хороших данных. Хотя тщательный обзор недавних данных о выживаемости и заболеваемости выходит за рамки этого эссе, некоторые важные моменты, выходящие за рамки данных о выживаемости, упомянутых выше, заслуживают упоминания, прежде чем может произойти убедительное обсуждение действующих этических проблем. Это особенно верно в такой ситуации, когда прогностическая информация, на основании которой действуют многие врачи, может больше не соответствовать действительности.
Последние доступные данные о смертности, как описано выше, демонстрируют, что по крайней мере значительная часть этих пациентов может выжить после периода новорожденности, если будут предприняты усилия для продления жизни. Глубокие нарушения развития и интеллектуальные нарушения, наблюдаемые у пациентов с трисомией 13/18, хорошо задокументированы, но в ходе опросов родителей есть сообщения о некоторых основных этапах, таких как сидение, самостоятельное питание и интерактивные игры, которые встречаются у некоторых детей, выживших в долгосрочной перспективе [9 , 10].Это небольшие и в основном анекдотические исследования, но они предоставляют ограниченные доказательства того, что некоторые выжившие могут добиться прогресса в развитии. Эти опросы родителей детей с трисомией 13/18 показали, что эти дети часто воспринимаются как счастливые и имеющие хорошее качество жизни, а также способные взаимодействовать со своей семьей [10, 11].
Значительное количество детей с трисомией 13 и 18 были госпитализированы и предлагали процедуры в США за последние два десятилетия [12].В период с 1997 по 2009 год было госпитализировано почти 2000 пациентов (1/3 из которых были госпитализированными) за каждый год исследования. Всего было выполнено ~ 2700 процедур за пять изученных периодов времени наблюдения в один год. В частности, один вопрос, который становится все более спорным, заключается в том, следует ли предлагать кардиохирургическое вмешательство этой группе населения, поскольку считается, что польза от него ограничена высоким риском смертности. Это не подтвердилось в недавних исследованиях, показывающих улучшение выживаемости после полного восстановления врожденных пороков сердца [6, 13, 14, 15].Важно отметить, что уровень смертности выше, чем среди населения в целом, но тщательно отобранные пациенты, в идеале в возрасте> 3 месяцев и весом> 3 кг, часто могут переносить процедуру и успешно выписываются домой без ИВЛ [13].
Профессиональные организации используют изменяющиеся данные, чтобы постоянно корректировать свои рекомендации для оптимального управления. Международный комитет по связям по реанимации (ILCOR) публикует рекомендации по реанимации новорожденных каждые 5 лет с 2000 года, включая раздел о том, когда может быть целесообразно воздержаться от вмешательств [16].Трисомия 13 и 18 были прямо упомянуты в руководящих принципах 2000 и 2005 годов в списке, который включал анэнцефалию и младенцев <23 недель, как примеры состояний с «почти неизбежной ранней смертью и когда неприемлемо высокая заболеваемость вероятна среди редких выживших» и, следовательно, «Реанимация не показана» [16, 17]. Интересно, что в обновленных рекомендациях 2010 г. трисомия 18 была удалена из этой категории, а трисомия 13 осталась [18]. В самом последнем руководстве 2015 г. просто говорится, что «не было опубликовано никаких новых данных, которые оправдывали бы изменение этих рекомендаций», и при этом повторяется, что «при обстоятельствах, когда результат остается неясным… желания родителей должны поддерживаться» [19].Здесь предлагается, чтобы трисомия 13/18 попала в эту последнюю категорию, с акцентом на совместное принятие решений, основанное на родительских ценностях.
Обоснование отказа от медицинских и хирургических вмешательств
Отказ от медицинских и хирургических вмешательств у новорожденных с трисомией 13 или 18, то есть отказ от этих вмешательств родителям, является давним подходом, хотя в некоторых центрах он явно развивается. В пользу такого подхода есть несколько аргументов.Возможно, наиболее распространенные из них основаны на тщетности и обязательстве не продлевать и не увеличивать страдания, когда нет возможности принести долгосрочную пользу ребенку.
Термин «бесполезный» обычно используется для описания ситуаций, когда рассматриваемые усилия не могут достичь желаемой цели. Следовательно, чтобы этот термин использовался с какой-либо связностью, необходимо сначала определить желаемую цель. Можно представить себе множество клинических ситуаций, когда определенное вмешательство может добавить часы или дни к жизни пациента, но не более того.Будет ли такое вмешательство рассматриваться как бесполезное, будет зависеть от того, является ли цель выжить еще несколько дней или выжить еще несколько лет. Более того, существуют методы лечения, такие как обезболивание, которые не могут существенно увеличить продолжительность жизни, но имеют разумные шансы на улучшение качества жизни. Опять же, то, будут ли эти вмешательства считаться бесполезными, должно зависеть от определения и формулирования целей. В случае трисомии 13 или 18 данные ясно показывают, что убеждение в том, что выживание после неонатального периода невозможно или почти невозможно, ошибочно.Мы не знаем, сколько из них выжило бы, если бы для каждого ребенка были приложены максимальные усилия, но мы без сомнения знаем, что некоторые из этих детей уже выжили. Таким образом, если невозможность или почти невозможность выживания в течение месяцев или лет является аргументом в пользу отказа от лечения, это не выдерживает критики. Более того, термин «бесполезный» часто используется неуместно в подобных ситуациях. Недавнее заявление нескольких обществ интенсивной терапии справедливо предполагает, что термин «потенциально несоответствующий», а не бесполезный следует использовать для описания методов лечения, которые имеют хотя бы некоторые шансы на достижение желаемой цели, что, по-видимому, часто имеет место для младенцев с трисомией 13. или 18 [20].Однако, если цель родителей состоит в том, чтобы иметь ребенка, который выживает без глубоких когнитивных нарушений (а, насколько нам известно, таких выживших никогда не было), то кажется разумным считать медицинские вмешательства бесполезными, поскольку они не могут достичь этой цели. .
Таким образом, главный вопрос: какова цель? Или, возможно, еще более фундаментальный вопрос: кто должен определять цель? Мы предлагаем, чтобы это было совместное решение родителей и врачей, а родительские ценности были в центре обсуждения.Родители, которые видят ценность в продолжающейся жизни ребенка с серьезной инвалидностью и в своем взаимодействии с этим ребенком, должны иметь возможность продолжать поддерживающее жизнь лечение. И наоборот, если родители считают, что тяжелые нарушения развития нервной системы приведут к страданиям и ухудшению качества жизни их ребенка, их ценности следует поддерживать, и уместны только меры по обеспечению комфорта.
Еще один аргумент против предложения вмешательств, выходящих за рамки мер комфорта, касается надлежащего распределения ограниченных медицинских ресурсов.Можно утверждать, что средства, потраченные на этих детей, лучше использовать для других с лучшим прогнозом на долгосрочное выживание или выживание без серьезной инвалидности. Мы не будем здесь утверждать, что осторожное и справедливое распределение ресурсов не рекомендуется — это, безусловно, нужно. Здравоохранение является ограниченным ресурсом, и хотя в настоящее время в Соединенных Штатах оно не нормируется систематическим образом, существуют ситуации, в которых затраты определяют решения о лечении — на индивидуальном, больничном и национальном уровне.Ограничения на использование ресурсов здравоохранения следует обсуждать открыто и прозрачно с целью оптимизации результатов, повышения эффективности и соблюдения прав человека. Можно было бы с полным основанием утверждать, что такие состояния, как трисомия 13 и 18, с ассоциированной с ними высокой смертностью и плохими исходами развития, будут подходящей средой для введения ограничений на лечение.
Бремя и потенциальный вред для семьи, краткосрочный и, возможно, долгосрочный, в результате ухода за таким серьезно ослабленным ребенком, является еще одним аргументом в пользу отказа от вмешательства.Соображения могут включать влияние на брак и / или на братьев и сестер, а также значительное негативное финансовое воздействие на семью.
Может быть другое, более трудное для оценки бремя, возложенное на родителей, которое следует учитывать в этом анализе. Среди множества эмоций, которые могут испытать родители в этих трудных ситуациях, и потенциально среди самых болезненных, есть чувство вины. В частности, после того, как сделано предложение о медицинском или хирургическом вмешательстве, родители могут чувствовать себя обязанными «сделать все возможное» и чувствовать себя виноватыми, если они решат иначе.Таким образом, можно утверждать, что, предоставляя родителям больше вариантов лечения трисомии 13/18, врачи могут фактически оказать им медвежью услугу, в результате чего родители эмоционально загнаны в угол, заставляя их делать выбор, которого они на самом деле не хотят. Опыт показывает, что иногда это действительно так, и поэтому врачам рекомендуется быть осторожными с тем, что они предлагают родителям и как они это предлагают. Например, проактивно объясняя, почему многие любящие родители выбирают комфортную заботу о младенцах с этими заболеваниями, врачи могут облегчить часть вины родителей, связанной с этим путем.Альтернативой этим вдумчивым и открытым обсуждениям является отказ семьям в выборе, который они могли бы пожелать, рискуя из лучших побуждений, но патерналистской узурпацией их родительских прав.
Обоснование предложения вмешательства
За прошедшее столетие в Соединенных Штатах отношение к людям с умственными и физическими недостатками изменилось в сторону большего признания, что повлекло за собой более высокую оценку их жизни. Трисомия 21 служит ярким примером этого изменения мировоззрения с течением времени как в обществе, так и в медицинской профессии.Предоставление жизненно необходимых медицинских и хирургических вмешательств для младенцев с трисомией 21 развивается с 1970-х годов, когда часто считалось этически допустимым отказ от вмешательств, таких как восстановление атрезии двенадцатиперстной кишки, из-за известной длительной инвалидности [21, 22]. Это, конечно, уже не так, и хирургическое вмешательство при таких заболеваниях, как атрезия двенадцатиперстной кишки или атрезия трахеи и пищевода в условиях трисомии 21, теперь считается обязательным. Дело не в том, что инвалидность при трисомии 13 и 18 аналогична инвалидности при трисомии 21, а в том, что наше отношение к инвалидности изменилось.Таким образом, мы можем рассматривать серьезные нарушения трисомии 13 и 18 в новом свете. Наши ценности как профессии изменились. И, что, возможно, даже более важно, растет признание того, что родительские ценности следует уважать как главный голос в процессе принятия решений детьми. Более того, ценность жизни с тяжелой формой инвалидности может совершенно по-разному восприниматься родителями, самими детьми и врачами, и точка зрения родителей по праву приобретает все большее значение [23, 24].
Различия в предпочтениях врачей и семей в отношении лечения могут, по крайней мере, частично объясняться значительными различиями в их взглядах и опыте. Часто отрицательные последствия гораздо чаще наблюдаются медицинскими работниками — во время острой декомпенсации, госпитализации или хирургических процедур — и усваиваются. Родители, наоборот, могут ценить положительные моменты в семейной жизни слабого с медицинской точки зрения ребенка, а также его трудности. Поэтому некоторые утверждают, что родители лучше всего подходят для оценки качества жизни своего ребенка.Это отражено в опросах, проведенных родителями детей с трисомией 13 и 18, которые показывают, что многие семьи считают, что их ребенок имеет хорошее качество жизни [9,10,11].
Право родителей принимать медицинские решения от имени своих детей, хотя и не является абсолютным, обычно считается далеко идущим [23]. Это право является основным основанием для предоставления им всех вариантов, показанных с медицинской точки зрения, поскольку их способность принимать решения может быть поставлена под угрозу, если на выбор, предлагаемый медицинской бригадой, будут наложены ограничения.Предполагается, что в процессе принятия решений родители в первую очередь заинтересованы в интересах своего ребенка, и они находятся в лучшем положении, чтобы решить, как выглядит приемлемое долгосрочное качество жизни для их семьи. Однако это право не следует рассматривать как абсолютное; например, родительский запрос или требование о лечении, которое не приносит явной пользы ребенку и может причинить вред, не должны предоставляться. Недавно был опубликован превосходный обзор того, как обрабатывать потенциально несоответствующие запросы на лечение, и он выходит за рамки данной статьи [20].У пациентов с ограничивающими жизнь состояниями, такими как трисомия 13 и 18, граница, на которой допустимо позволять родительским желаниям преобладать над рекомендациями врачей, становится размытой из-за отсутствия четких знаний об эффективности конкретных методов лечения в этой популяции и трудностей с эффективным применением. информирование родителей о потенциальных реалиях ухода за ребенком с тяжелой формой инвалидности. Недавние данные о результатах, предполагающие, что вмешательства, такие как восстановление сердца, на самом деле могут продлить жизнь и улучшить качество жизни, должны информировать наши обсуждения с семьей, а также нашу готовность предлагать и выполнять такие процедуры [25].
Сведение к минимуму страданий — важная общая цель как для врачей, так и для семей. Право младенца на получение медицинской помощи, которая может предотвратить или лечить страдания, должно играть важную роль в процессе принятия решений, особенно при менее инвазивных вмешательствах, таких как назальная канюля, назогастральное кормление и лекарства для лечения рефлюкса, апноэ или судорог. Эти меры могут и должны выбираться на индивидуальной основе, исходя из целей ухода за родителями и медицинских потребностей ребенка, не обязывая родителей или команду по уходу работать «полностью или полностью».”
Следует также отметить, что для пациентов с трисомией 13 и 18 существуют вмешательства, такие как медицинское питание и гидратация, которые можно рассматривать как поддерживающие жизнь, так и паллиативные из-за комфорта, обеспечиваемого кормлением для многих младенцев. Кроме того, существует четкая, но редко обсуждаемая возможность того, что ребенок с трисомией 13/18 также подвержен обратимым процессам в неонатальном периоде, таким как респираторный дистресс-синдром, преходящее тахипноэ у новорожденного, гипогликемия и т. Д., Которые могут разрешиться. при рутинных вмешательствах.Должны ли мы позволить этим младенцам умирать или страдать от потенциально обратимых процессов, потому что их основное состояние ограничивает жизнь и связано со значительными нарушениями развития нервной системы? Если цели ухода за семьей сосредоточены на том, чтобы как можно больше времени проводить с живым ребенком, кажется разумным, что доступное медицинское вмешательство должно отражать это желание, особенно при управлении потенциально временными процессами.
Наконец, существует проблема честности или справедливости — ценности, давно признанной и широко принятой в медицинской этике [26].Принцип справедливости предполагает, что мы должны относиться к равным и к неравным неравным. Хотя между диагнозами никогда не может быть идеальной аналогии, следует отметить, что семьям педиатрических пациентов с очень плохим прогнозом, включая очень плохой неврологический прогноз, обычно предоставляется выбор в отношении мер по поддержанию жизни. Рассмотрим, например, новорожденного или ребенка старшего возраста с тяжелой гипоксически-ишемической энцефалопатией или черепно-мозговой травмой. Не сразу понятно, почему родителям детей с трисомией 13 или 18 с таким же мрачным неврологическим прогнозом не следует предоставлять такую же степень полномочий по принятию решений.Это стандартная позиция в медицине, и это справедливо, когда прилагаются все усилия, чтобы продлить жизнь пациента и облегчить его страдания. Когда врачи решают поступить иначе, должно требоваться обоснование. Чаще всего, когда лечение доступно, выполнимо и может продлить жизнь, оправдание отказа от лечения в педиатрических условиях основывается на предпочтениях семьи. Нет четкого обоснования, почему к детям с трисомией 13/18 следует подходить иначе.
Этический анализ
Часто в медицине мы отвечаем на сложные вопросы, основываясь на том, как нас учили, или на нашей прошлой практике. Это неплохое начало, но это только начало, и полная уверенность в таком подходе препятствует медицинскому прогрессу. Никто не должен стремиться стать врачом, который лечит медицинские проблемы так, как это было известно десятилетия назад, без частого рассмотрения новых достижений. Необходимо учитывать новые данные и пересматривать старые подходы в этом свете.То же самое и с этическими вопросами, которые требуют от нас периодического пересмотра не только соответствующих этических принципов, но и самых последних данных. В частности, этическое исследование требует от нас размышлений о том, соответствует ли наша практика нашим собственным провозглашенным ценностям [27]. Моральный прогресс также требует от нас время от времени пересматривать сами эти ценности.
Право пациента или лица, принимающего решение, выбрать конкретное лечение ограничено сочетанием того, что доступно с медицинской точки зрения и допустимо с этической точки зрения.Мы не поддерживаем систему, в которой врач действует исключительно так, как диктуют родители. Напротив, педиатр должен служить проверкой на соответствие требованиям родителей, когда они явно противоречат интересам ребенка [20]. Врачи, как правило, не обязаны предоставлять лечение, которое они считают неэтичным, но важно честно рассмотреть основу такого восприятия и учитывать, что в некоторых ситуациях ценности родителей должны иметь решающее значение. Учитывая наше текущее понимание предубеждений, присущих определению качества и ценности жизни людей с ограниченными возможностями, мы предлагаем, чтобы отказ педиатра предоставить определенное лечение, основанный на оценочных суждениях в условиях инвалидности, имел меньший вес, чем отказ. на основе фактической оценки пользы и нагрузки для пациента.
Были выдвинуты убедительные аргументы за и против этической допустимости принятия во внимание факторов, не связанных с пациентом, таких как финансовое бремя, влияние на других детей в семье и т. Д., При принятии решения о лечении. В политическом заявлении AAP 2016 года об информированном согласии признается подход, основанный на учете интересов семьи в дополнение к интересам пациента, «при условии, что удовлетворяются основные потребности ребенка, медицинские и прочие». [28] С этим связан, но отличается, вопрос о том, этически ли допустимо для врачей учитывать факторы, не связанные с пациентом, при принятии решений о лечении.Хотя эта сложная дискуссия выходит за рамки этого эссе, для врача кажется излишне патерналистским отказываться от лечения ради семьи, если сама семья не разделяет эту точку зрения.
Растущее уважение к родительским ценностям остается предметом разногласий, отчасти из-за озабоченности по поводу случаев воспринимаемых неадекватных родительских требований о вмешательстве, которые считаются бесполезными (т. Е. Не могут достичь заявленной цели), а также теми, которые считаются нежелательными с моральной точки зрения. поставщиками медицинских услуг.Эта борьба за баланс между родительскими правами и желанием предотвратить использование болезненных и бесполезных вмешательств рассматривается в недавнем Руководстве AAP по отказу от поддерживающего жизнь лечения (LSMT). В нем утверждается, что «отказ от LSMT без согласия семьи может быть этически оправданным в редких случаях чрезвычайного бремени лечения без каких-либо преимуществ для пациента, кроме отсрочки смерти» [29]. Напряжение между родителями и поставщиками в этих крайних случаях привело к значительному моральному стрессу и подчеркивает необходимость в механизме, который позволяет поставщикам медицинских услуг останавливать LSMT, когда семья отказывается.Недавнее совместное заявление пяти взрослых групп интенсивной терапии направлено на удовлетворение этой потребности, обеспечивая поэтапный путь к разрешению «бесполезных» случаев, а также инструктирует врачей не проводить действительно бесполезные вмешательства [20]. В педиатрии к этой потребности следует и впредь относиться с большой осторожностью, чтобы маятник не качнулся обратно в сторону чрезмерно патерналистской модели ухода, в результате которой теряется родительский авторитет.
Распределение ресурсов — часто используемый аргумент в пользу отказа от вмешательств для детей с трисомией 13 и 18.В Соединенных Штатах нет стандартизированной политики в отношении любого состояния детства, уход за которым явно ограничен учреждением, регионом или штатом, основанным исключительно на стоимости вмешательств. Справедливость требует, чтобы к равным относились одинаково, поэтому кажется несправедливым вводить в действие руководство, которое приводит к отказу в вмешательстве одной группе младенцев из-за финансовых проблем, если мы не включим всех пациентов с аналогичными прогнозами в отношении выживаемости и заболеваемости. Следует также отметить, что количество ресурсов, затрачиваемых на этих младенцев с течением времени, будет очень небольшим по сравнению с теми, которые тратятся на гораздо большее количество сильно ослабленных взрослых, находящихся в отделении интенсивной терапии ближе к концу жизни [30].Тем не менее, мы признаем, что в какой-то момент может возникнуть необходимость ограничить то, что кому предоставляется. Однако такие решения должны быть справедливыми и прозрачными, а не ограничиваться одной небольшой группой лиц без обоснования.
Здесь не утверждается, что медицинские и хирургические вмешательства при трисомии 13 или 18 должны рассматриваться как этически обязательные. Порог для признания лечения обязательным (т.е.должно предоставляться даже после возражений родителей) должен быть высоким — польза для ребенка должна явно перевешивать бремя.Учитывая серьезность краткосрочных и долгосрочных прогнозов, вмешательство в этой ситуации не соответствует этому пороговому значению, и его не следует добиваться или предоставлять по возражениям родителей. Однако для того, чтобы лечение считалось этически недопустимым, не должно быть никаких шансов на пользу для ребенка, или бремя лечения должно намного перевешивать преимущества. И здесь этот порог не соблюдается. Была продемонстрирована возможность получения выгоды по крайней мере в некоторых случаях. Этим пациентам часто остается золотая середина, при которой лечение следует считать этически допустимым.Если для данного пациента лечение допустимо, даже если нецелесообразно, то выбор должен быть предоставлен родителям. Если врачи сочтут такое лечение нецелесообразным, ему кажется уместным поделиться своей рекомендацией по этому вопросу с родителями и обоснованием этой рекомендации [20]. Однако эта рекомендация не должна содержать запрета на выбор другого этически допустимого варианта.
Разумные, вдумчивые люди могут рассмотреть этические аргументы за и против и прийти к выводу, что медицинские и хирургические вмешательства, помимо мер по обеспечению комфорта, не должны предлагаться пациентам с трисомией 13/18, особенно в районах с ограниченными ресурсами.Однако, исходя из представленных выше соображений, мы полагаем, что аргументы в пользу предложения, но не требования лечения, в конечном итоге более сильны. Мы пришли к выводу, что семьям новорожденных с трисомией 13 и 18 следует предлагать вмешательства на основе принципа справедливости, права на родительский авторитет, уважения родительских ценностей и отсутствия убедительных доказательств того, что такие вмешательства не могут достичь родительских целей по уходу.




