АКДС – что за прививка и как она переноситься
Вопросы, связанные с вакцинацией малыша от инфекционных заболеваний, волнуют всех родителей. Одна из первых прививок, которые получает малыш в самом раннем возрасте – это АКДС. Именно поэтому возникает наибольшее число вопросов – какая может быть реакция на прививку АКДС, как подготовить ребенка к введению вакцины и как реагировать на изменения состояния грудничка после введения вакцины.
От чего ставят прививку АКДС? В состав вакцины входят компоненты от трёх наиболее опасных инфекций бактериального происхождения – это коклюш, дифтерия и столбняк. Поэтому аббревиатура названия расшифровывается – адсорбированная коклюшно-дифтерийно-столбнячная вакцина.
Коклюш – быстро распространяющаяся инфекция, которая опасно преимущественно для детского возраста. Очень тяжело протекает у грудничков. Осложняется поражением дыхательной системы и протекает с воспалением легких, сильным кашлем, судорогами.
Дифтерия – бактериальное заболевание характеризующееся токсическим поражением организма, преимущественно сердечно-сосудистой и нервной систем, а также местным воспалительным процессом с образованием фибринозного налёта, которые могут привести к удушью и смерти.
Столбняк – почвенная инфекция, человек заражается при попадания бактерий в раневые поверхности кожи. Поражает нервную систему и сопровождается высокой летальностью вследствие паралича дыхания и сердечной мышцы. Без специфического лечения высок риск летального исхода.
Согласно инструкции по применению АКДС, препарат предназначен для создания иммунитета к коклюшу, столбняку и дифтерии у детей. Все дети до четырехлетнего возраста должны получить все четыре дозы вакцины. Прививка АКДС обладает максимальной реактогенностью среди всех вакцин, включенных в национальный календарь. Именно поэтому, помимо соблюдения общих правил, необходимо проводить лекарственную подготовку и сопровождение вакцинации АКДС. К общим правилам относят: ребенок должен быть полностью здоров на момент прививки; ребенок должен быть голоден; ребенок должен покакать; ребенок не должен быть одет чересчур жарко.
В детской поликлинике УЗ «Калинковичская ЦРБ» в наличии имеется вакцина АКДС (коклюш, дифтерия, столбняк) для проведения вакцинации детям. Также имеется вакцина «Эупента», производство Корея (коклюш, дифтерия, столбняк, гемофильной инфекции, вирусного гепатита «В» и полиомиелита). Вакцина «Синфлорикс» производство Бельгия для профилактики пневмоний и острых отитов. Дополнительную консультацию можно получить у участкового педиатра детской поликлиники.
Также имеется вакцина «Эупента», производство Корея (коклюш, дифтерия, столбняк, гемофильной инфекции, вирусного гепатита «В» и полиомиелита). Вакцина «Синфлорикс» производство Бельгия для профилактики пневмоний и острых отитов. Дополнительную консультацию можно получить у участкового педиатра детской поликлиники.
Родителям необходимо знать, что только профилактические прививки могут защитить ребенка от таких заболеваний, как полиомиелит, дифтерия, коклюш, туберкулез, столбняк, гепатит «В», корь, эпидемический паротит (свинка), краснуха. Прививая ребенка, вы защищаете его от инфекционных заболеваний и от вызываемых ими тяжелых осложнений и последствий.
Старшая медицинская сестра детской поликлиники Е.А.Бревко
Так ли страшна прививка АКДС?
Помимо перечисленных противопоказаний в инструкции к вакцине «Гексаксим» также есть пункт: «вакцины с содержанием коклюшного компонента нельзя вводить лицам с прогрессирующими неврологическими расстройствами и неконтролируемой эпилепсией до стабилизации состояния, при условии, когда польза от вакцинации значительно превышает риск». Это означает, что стабильные неврологические состояния, такие как ДЦП, синдром Дауна и непрогрессирующее течение эпилепсии, не являются противопоказаниями к вакцинации.
Это означает, что стабильные неврологические состояния, такие как ДЦП, синдром Дауна и непрогрессирующее течение эпилепсии, не являются противопоказаниями к вакцинации.
После — не значит вследствие
Эту парадигму хорошо иллюстрирует история из книги Пола Оффита «Смертельно опасный выбор»: «Один почетный профессор Медицинской школы университета Дьюка рассказывает историю о своем знакомом, который отвез сына к врачу делать прививку АКДС. Он очень долго прождал в очереди и в конце концов устал и поехал домой, так и не сделав ребенку прививку. Через несколько часов отец обнаружил ребенка мертвым в кроватке – видимо, малыш погиб от синдрома внезапной детской смерти. Только представьте себе, каково было бы отцу, если бы его сыну в тот день сделали прививку. Конечно, никакие исследования не убедили бы его, что ребенок погиб не от вакцины, а от каких-то других причин».
Авторы этого материала — тоже родители маленьких детей. И нам понятно отчаяние родителей, которые пытаются найти причину отклонений у ребенка в вакцине. Но это далеко не всегда так, и это доказано множеством статистических исследований в разных странах. Подобные исследования проводились не фармкомпаниями, а самими государствами, чтобы исключить предвзятость. Больше всего исследований приходится как раз на вакцину АКДС и коклюшный компонент, которого так боятся родители. Дети первого года жизни получают, в среднем, три дозы вакцины, в составе которой АКДС компоненты или АбКДС (б – бесклеточный коклюшный компонент, прим V). Большинство генетических заболеваний также проявляются в первый год-полтора жизни детей. Учитывая частоту вакцинации в этот период, достаточно заманчиво связать эти два события между собой.
Но это далеко не всегда так, и это доказано множеством статистических исследований в разных странах. Подобные исследования проводились не фармкомпаниями, а самими государствами, чтобы исключить предвзятость. Больше всего исследований приходится как раз на вакцину АКДС и коклюшный компонент, которого так боятся родители. Дети первого года жизни получают, в среднем, три дозы вакцины, в составе которой АКДС компоненты или АбКДС (б – бесклеточный коклюшный компонент, прим V). Большинство генетических заболеваний также проявляются в первый год-полтора жизни детей. Учитывая частоту вакцинации в этот период, достаточно заманчиво связать эти два события между собой.
Тем не менее, вакцины, как и другие медицинские препараты, могут в редких случаях приводить к осложнениям. Как их распознавать и регистрировать в Казахстане, мы разберем в одном из следующих материалов.
Сравнение вероятности осложнений от вакцин и болезней
В мире, где каждый, преимущественно, сам за себя, довод, что «те, кто не вакцинируются без видимых причин, ставят под угрозу других», работает плохо.
возможные осложнения и побочные эффекты после вакцины
Для начала рассмотрим заболевания, против которых направлена вакцина АКДС. Это даст возможность адекватно оценить необходимость вакцинации и поможет каждому родителю в принятии правильного решения.
Дифтерия
Дифтерия – это бактериальная инфекция, для которой характерны специфические изменения в ротоглотке и выраженный токсический синдром. Дифтерия передается воздушно-капельным путем (от больного или носителя при дыхании), реже контактным (с загрязненных предметов). Заражение наступает примерно на 2-10 день от момента контакта.
Для дифтерии характерны выраженные изменения в ротоглотке. Горло краснеет, затем покрывается плотной фибриновой пленкой, которая тяжело отделяется со слизистых оболочек, и иногда затрудняет дыхание. Дифтерия гортани сопровождается осиплостью и потерей голоса, затруднением дыхания, в некоторых случаях кровотечением.
Дифтерийная палочка – возбудитель инфекции, способна продуцировать токсин. Под его влиянием в организме развивается токсический синдром – отек верхних дыхательных путей, подкожно-жировой клетчатки. При этом у больных выраженно плохое самочувствие: высокая температура, затрудненное дыхание, головные боли. Кроме того, заболевание часто осложняется миокардитами и патологией нервной системы (энцефалит). Для лечения дифтерии применяют антибиотики, а также антитоксическую сыворотку или иммуноглобулин.
Дифтерия сейчас встречается редко. Она не очень «заразна». Но, заболевание это тяжелое, и в допрививочную эпоху именно оно стояло на первых местах, как причина детской смертности.
Коклюш
Коклюш – инфекционное заболевание, передающееся воздушно-капельным путем. Оно проявляется длительным, интенсивным, навязчивым кашлем. Инкубационный период у коклюша длится от 1-й до 2-х недель. После развития заболевания больной может являться источником инфекции до месяца. Кроме того, возможно бессимптомное носительство.
У детей до года инфекция коклюша часто приводит к приступам остановки дыхания. А на этом фоне развиваются осложнения со стороны нервной и сердечно-сосудистой системы. У детей старшего возраста, заболевание начинается с симптомов обычной простуды: повышения температуры, насморка, кашля, покраснения горла. Затем развивается длительный мучительный приступообразный кашель. Приступы иногда сопровождаются рвотой, кровоизлияниями в кожу лица и конъюнктиву, слюно и слезотечением, вздутием вен шеи. Длится такой кашель может до полугода.
Для лечения коклюша используют антибактериальные препараты. Однако, они могут быть эффективны только в начальный период, когда коклюш практически невозможно отличить от других ОРВИ. В период приступообразного кашля антибиотикотерапия не эффективна. Лечение проводится симптоматически и практически не может повлиять на длительность кашля.
В период приступообразного кашля антибиотикотерапия не эффективна. Лечение проводится симптоматически и практически не может повлиять на длительность кашля.
Коклюш чрезвычайно заразен. Им заболевают до 95% контактировавших не привитых. Даже сейчас, на фоне всеобщей вакцинации, случаи коклюша нередки. Особенно опасно заболевание у малышей, еще не успевших получить прививку по какой-то причине.
Столбняк
Столбняк – тяжелая бактериальная инфекция с контактным механизмом передачи, для которой характерно поражение нервной системы с развитием судорог и тонического напряжения мышц. Инфекция передается контактным путем. Микроб широко распространён в природе, особенно в сельскохозяйственных районах. Его находят в почве, воде, домашней пыли. Часто он является обитателем кишечника животных, иногда человека. Столбнячная палочка может образовывать споры, которые устойчивы к воздействию высоких и низких температур, растворов антисептиков.
Свои патогенные свойства столбнячная палочка приобретает в отсутствии кислорода (анаэробной среде). Попадая в рану с загрязненных поверхностей, микроб начинает размножаться и выделять токсин. Токсин через кровь попадает в нервную систему. Развивается клиническая картина. От заражения до первых симптомов проходит примерно от 1-й до 3-х недель. Вначале поражаются мышцы лица и головы – происходит резкий спазм мускулатуры. Затем изменения переходят на туловище и конечности, появляются судороги. Мышечные сокращения могут быть настолько интенсивными, что травмируют суставы и связки. Нередки поражения мышц сердца и дыхательных путей.
Попадая в рану с загрязненных поверхностей, микроб начинает размножаться и выделять токсин. Токсин через кровь попадает в нервную систему. Развивается клиническая картина. От заражения до первых симптомов проходит примерно от 1-й до 3-х недель. Вначале поражаются мышцы лица и головы – происходит резкий спазм мускулатуры. Затем изменения переходят на туловище и конечности, появляются судороги. Мышечные сокращения могут быть настолько интенсивными, что травмируют суставы и связки. Нередки поражения мышц сердца и дыхательных путей.
В современных условиях пациент погибает от столбняка примерно в 20% случаев. Особенно опасна инфекция у детей первого года жизни. Летальность достигает 90-95%. Своевременное лечение позволяет снизить летальность и уменьшит проявления болезни. Однако, даже при его применении выздоровление наступает только после 2-4 месяцев, некоторые последствия остаются необратимые для нервной системы.
Столбняк очень опасная инфекция. До сих пор встретить споры столбнячной палочки в природе не редкость.
Какие бывают прививки от коклюша, дифтерии и столбняка?
- АКДС – в нашей стране применяется наиболее широко писпользуемая вакцина. В нее входит анатоксин (нейтрализованный токсин) столбняка и дифтерии, а также убитые коклюшные бактерии. Помимо основных компонентов в состав вакцины входят адъюванты, антисептики и консерванты, а также основная среда – разбавитель.
- АДС и АДС-М – вакцина без коклюшного компонента. В вакцине АДС-М снижено количество дифтерийного анатоксина. Эти вакцины применяют для ревакцинации у детей после 7-ми лет и у взрослых, когда вакцинация от коклюша уже не показана.
- «Бубо-Кок» – в эту вакцину помимо компонентов АКДС входит часть белка вирусного гепатита В. Это сделано для того, чтобы не делать одновременно малышу два укола, т.к. прививки по календарю делаются вместе.
- «Бубо-М» – вакцина без коклюшного компонента.
- «Пентаксим» – в состав входит столбнячный, дифтерийный и коклюшный анатоксины, частички коклюшного микроба.
 Дополнительно, для удобства использования в эту вакцину ввели полиомиелит. По календарю прививок графики вакцинации АКДС и полиомиелитом совпадают. В эту вакцину из отдельного флакона можно добавить компонент против гемофильной инфекции. Решение о необходимости его введения принимает врач. Вакцина отличается отсутствием целых коклюшных клеток – это вызывает меньше побочных эффектов.
Дополнительно, для удобства использования в эту вакцину ввели полиомиелит. По календарю прививок графики вакцинации АКДС и полиомиелитом совпадают. В эту вакцину из отдельного флакона можно добавить компонент против гемофильной инфекции. Решение о необходимости его введения принимает врач. Вакцина отличается отсутствием целых коклюшных клеток – это вызывает меньше побочных эффектов. - «Инфанрикс» – по составу идентичен «Пентаксиму», за исключением полиомиелитного компонента – в нем он отсутствует.
- «Инфанрикс гекса» – помимо компонентов «Инфанрикса» включает инактивированные вирусы полиомиелита и часть белка вируса гепатита В.
- «Адасель» – включает в себя: дифтерийный, столбнячный, коклюшный анатоксины и фрагменты коклюшной бактерии.
Когда делают прививку АКДС?
Согласно национальному календарю прививка АКДС делается в 3 месяца, 4,5 месяца и 6 месяцев. Ревакцинацию делают в 18 месяцев. Вторая ревакцинация в 6-7 лет проводится без коклюшного компонента. Третья – в 14 лет, а затем каждые 10 лет – также без добавления коклюшного компонента.
Третья – в 14 лет, а затем каждые 10 лет – также без добавления коклюшного компонента.
Как быть, если прививка АКДС не была сделана вовремя?
Если прививки не доделаны, календарь продолжают с теми же промежутками, которые указаны в календаре. Вторую вакцину делают не менее чем, через 1,5 месяца от первой. Третью не менее чем через 1,5 месяца от второй. Ревакцинация не менее, чем через 12 месяцев от последней прививки.
Прививку АКДС делают до 4-х лет. После 4-х делают АаКДС (в этом случае интервал между третьей прививкой и ревакцинацией может быть сокращен до 6 месяцев).
«Инфанрикс гекса», согласно инструкции, делается только до 36 месяцев.
«Инфанрикс» и «Пентаксим» можно делать до 6 лет.
«Адасель» используют только для ревакцинации в 6-7 лет и для прививки взрослым каждые 10 лет.
Дети старше 6 лет прививаются только безкоклюшными вакцинами (АДС, АДС-М, Бубо-М) или вакциной «Адасель». Им делается две прививки с разницей в 1,5 – 2 месяца. Ревакцинация через 9-12 месяцев. И вторая ревакцинация через 2 года.
Им делается две прививки с разницей в 1,5 – 2 месяца. Ревакцинация через 9-12 месяцев. И вторая ревакцинация через 2 года.
Какие осложнения могут быть после прививки АКДС?
АКДС одна из наиболее реактогенных прививок в календаре. Стоит ли ее бояться и отказываться от нее?
Действительно, после введения АКДС часто встречаются побочные реакции:
- Повышение температуры тела до 38,5*С встречается примерно в половине случаев после инъекции прививки АКДС. При применении бесклеточных вакцин («Превенар», «Инфанрикс» или «Адасель») встречается примерно в 2-3 раза реже. Реже встречается повышение температуры до 39*С (примерно в 10% случаев). Крайне редко – до 40*С (менее 0,5% всех привитых). Такое повышение температуры проходит через 1-3 дня после прививки самостоятельно и требует только применения жаропонижающего препарата в возрастной дозе для улучшения самочувствия ребенка.
- Раздражительность и продолжительный плач.
 Тоже довольно частое явление. Для АКДС примерно 40% от всех вакцинаций. Для бесклеточных вакцин этот процент падает примерно до 15%. Проходит самостоятельно за 1-2 дня. Требует только наблюдения и ухода за малышом.
Тоже довольно частое явление. Для АКДС примерно 40% от всех вакцинаций. Для бесклеточных вакцин этот процент падает примерно до 15%. Проходит самостоятельно за 1-2 дня. Требует только наблюдения и ухода за малышом. - Местные реакции в виде отека, покраснения и боли в месте инъекции встречаются с разной интенсивностью примерно у половины привитых. В разы реже местные реакции наблюдаются у привитых бесклеточной вакциной. Болезненность в первые дни после прививки можно уменьшит с помощью тех же лекарств, которыми сбивают высокую температуру. В случае, если краснота, отек и болезненность нарастают, а препараты оказываются малоэффективными малыша имеет смысл показать врачу, чтобы не упустить осложнения связанные с инфицированием места введения, либо нарушением техники введения препарата.
- Иногда несколько дней после прививки малыша беспокоит нарушение аппетита и как следствие потеря веса. Это явление временное, не требующее коррекции.
- Рвота встречается примерно у 15 % привитых детей.
 Никогда не бывает мучительной, многократной и длительной. Не требует лечения. Но вашего лечащего врача о такой реакции стоит оповестить.
Никогда не бывает мучительной, многократной и длительной. Не требует лечения. Но вашего лечащего врача о такой реакции стоит оповестить. - Редко (примерно 0,02% для АКДС и еще ниже для бесклеточных вакцин) у детей после прививки встречаются фебрильные судороги. Такие судороги происходят на высоте подъема температуры. Чаще дети имеют врожденную предрасположенность к развитию таких судорог. Прививка в таких ситуациях служит лишь провоцирующим фактором. В большинстве случаев фебрильные судороги не опасны для малыша, несмотря на то что они очень пугают родителей. Ребенка после судорожного приступа нужно обязательно показать врачу. И предупредить лечащего врача о предыдущих случаях такой побочной реакции.
К тяжелым и редко встречающимся осложнениям после прививки можно отнести:
- Острые аллергические реакции. Сразу после прививки маме с малышом рекомендуют провести около получаса в стенах медицинского учреждения.
- Гипотензивно-гипореспонсивный синдром.
 Его риск имеется примерно первые 12 часов после прививки. Ребенок резко бледнеет, становится вялый, заторможенный. Это осложнение не требует лечения, проходит само, но при нем необходимо наблюдение врача. Гипотензивно-гипореспонсивный синдром после прививки АКДС ставит вопрос о дальнейшей вакцинации.
Его риск имеется примерно первые 12 часов после прививки. Ребенок резко бледнеет, становится вялый, заторможенный. Это осложнение не требует лечения, проходит само, но при нем необходимо наблюдение врача. Гипотензивно-гипореспонсивный синдром после прививки АКДС ставит вопрос о дальнейшей вакцинации.
Чтобы уменьшить риск тяжелых побочных реакций рекомендуют осмотр перед вакцинацией. Ребенок перед прививкой не должен быть болен острой респираторной инфекцией. Хронические заболевания должны быть в стадии ремиссии. При необходимости лечащий врач может назначить ребенку с хроническим заболеванием лечение на время вакцинации.
Надо сказать, что последующая прививка переносится тяжелее предыдущей. У детей с выраженными реакциями вакцину целесообразно заменить на бесклеточную или не содержащую коклюшный компонент.
Когда прививку АКДС делать нельзя?
- Если у ребенка обострение хронического заболевания прививки откладываются до разрешения лечащего врача.

- Если у ребенка есть аллергическая реакция на компоненты препарата, или была острая аллергическая реакция на предыдущее введение.
- Если у ребенка есть тяжелое прогрессирующее заболевание нервной системы.
С осторожностью делают прививки малышу, если после предыдущего введения у него:
- поднялась температура выше 40,5*С;
- были судороги после предыдущего введения препарата;
- возникновение гипотензивно-гипореспонсивный синдрома после предыдущей вакцины.
Онлайн консультация Врача-педиатра Текутьевой Ольги Николаевны
Запись онлайн
В рамках консультации вы сможете озвучить свою проблему, врач уточнит ситуацию, расшифрует анализы, ответит на ваши вопросы и даст необходимые рекомендации.
Мифы об опасностях прививок
Начитавшись слухов в интернете об опасностях лекарств, в том числе вакцин, можно испытывать болезненный страх в принятии решения прививать ребенка. Педиатры говорят, что у них на участках есть такие родители, которые отказываются от вакцинации для своего ребенка из-за заблуждений и страхов.
Как рождаются мифы о вакцинации? Эксперты говорят, что это связано как раз с успехом программ вакцинации. Это известный факт — случаи заболевания в связи с массовой иммунизацией почти исчезают, люди думают, что опасности нет и можно не прививаться.
Но это не так: мы защищены только потому, что массово прививаемся. Высокий охват вакцинацией необходим для предотвращения инфекций. Как показывает опыт, вспышки дифтерии, кори и полиомиелита вернулись из-за отказа людей прививаться.
Как и любое лекарственное средство, вакцины при введении могут вызывать побочные эффекты. Большинство из них — незначительные и быстро проходящие, например, боль в месте укола или незначительное повышение температуры тела. Очень серьезные побочные эффекты встречаются крайне редко, о них нужно сообщать в контролирующие органы (Роспотребнадзор, Росздравнадзор), где эти случаи тщательно разбирают.
Большинство из них — незначительные и быстро проходящие, например, боль в месте укола или незначительное повышение температуры тела. Очень серьезные побочные эффекты встречаются крайне редко, о них нужно сообщать в контролирующие органы (Роспотребнадзор, Росздравнадзор), где эти случаи тщательно разбирают.
Осложнения инфекций, от которых защищают вакцины, гораздо более тяжелые, чем обычные реакции на введение вакцины. Например, полиомиелит может вызвать паралич, корь может вызвать энцефалит и слепоту, многие вакциноуправляемые инфекции могут даже привести к смерти (поэтому и разработаны прививки против них). Преимущества вакцинации значительно перевешивают риски, без вакцинации опасные инфекции быстро вернутся
Вакцинопрофилактика является наиболее надежной мерой предупреждения инфекционных заболеваний. Однако медицинские иммунобиологические препараты (МИБП) могут вызывать вакцинальные реакции, а в редких случаях — тяжелые осложнения.
Разберем основные мифы об опасности прививок.
Миф № 1. АКДС вызывает много осложнений
«Именно после нее у детей бывает высокая температура, детские слезы и вследствие этого — бессонные ночи».
Все побочные действия после прививки делятся на ожидаемые нетяжелые реакции, тяжелые реакции и осложнения. Повышение температуры тела является ожидаемой реакцией, иммунитет реагирует на введение вакцины. Обычно купируется применением жаропонижающего средства. Осложнения – это ненормальная реакция.
Клинические расстройства, возникающие вследствие проведения профилактической прививки и несвойственные обычному течению вакцинального процесса, имеющие с прививкой очевидную или доказанную связь, расценивают как патологические вакцинальные реакции и расследуют таким же образом, как поствакцинальное осложнение (ПВО).
Осложнения встречаются гораздо реже обычных побочных реакций. Если же осложнения на конкретную вакцину встречаются часто, то партия вакцины снимается с применения до проведения повторного контроля качества.
Перечень осложнений вакцинации. Перечень поствакцинальных осложнений, вызванных профилактическими прививками, включенными в национальный календарь профилактических прививок, и профилактическими прививками по эпидемическим показаниям, дающих право гражданам на получение государственных единовременных пособий.
Если врач рассчитывает риск развития реакций на обычную цельноклеточную коклюшную вакцину как достаточно высокий, то он имеет возможность рассмотреть применение бесклеточной коклюшной вакцины, частота развития ожидаемых реакций на которую может быть до 13 раз меньше.
Миф № 2. Прививка от гепатита В действует на печень
«У новорожденных часто бывает желтуха. Наверно, это из-за вакцинации и влияния на печень».
Действительно, вакцинация против вирусного гепатита “влияет на печень”. Защищает ее от заболеваний, вызванных вирусными гепатитами А и В и от осложнений этих гепатитов. Прививка против гепатита В — ЗАЩИТА печени от рака, так как вирус может привести к циррозу и раку печени. Проведенное исследование (И.В. Фельдблюм и соавторы; 2015) показало, что вакцинация новорожденных против гепатита В не влияет на частоту развития желтухи у привитых и даже немного снижает эту частоту.
К тому же все вакцины против этого заболевания содержат не вирус, а частички-антигены, необходимые только для формирования иммунитета, они даже теоретически не могут вызвать развитие инфекции печени.
Миф № 3. Вакцины вызывают аутизм
«А о связи прививки против кори, паротита и краснухи с аутизмом слышали?»; «Все прививки вызывают аутизм!!»
Как обычно, вакцины вызывают много шума, но никто не разбирается из-за чего. Корни этих слухов исходят из статьи, опубликованной английским доктором Уэйкфилдом. Он пришел к выводу, что у большинства из 170 наблюдаемых им детей причиной аутизма стала прививка комбинированной корь-паротит-краснушной вакциной и особенно ее коревым компонентом. Что примечательно и в то же время абсурдно, в этой же статье доктор предложил раздельные прививки (включая ту же коревую), как альтернативу.
Несколько групп британских ученых опровергли выводы Уэйкфилда, а Минздрав Великобритании и ВОЗ признали работу Уэйкфилда ненаучной ввиду ряда грубых нарушений методики проведения научных исследований. Генеральный медицинский совет Великобритании (GMC) лишил его права заниматься медицинской деятельностью.
Члены совета признали Эндрю Уэйкфилда виновным в серьезном должностном проступке, нарушении профессиональной этики, сокрытии конфликта интересов и т.п. (более 30 пунктов обвинения) при проведении и публикации исследования в 1998 году.
В феврале 2010 года журнал The Lancet, опубликовавший упомянутую статью, официально отказался от нее. Тогда же Уэйкфилд признал свою вину в ряде нарушений и отказался от поста исполнительного директора созданного им центра по лечению аутизма в США.
Вынося вердикт об исключении исследователя из врачебного регистра Великобритании, глава GMC Сурендра Кумар (Surendra Kumar) заявил, что его деятельность повредила репутации всей медицинской профессии, и примененные санкции являются «единственными подобающими» и «пропорциональными».
Множество достоверных научных исследований не установили связи вакцинации аутизма и вакцинации.
Однако миф успел сделал свое дело, и следствием паники, посеянной среди родителей, стало увеличение отказов от прививок против кори и возвращение вспышечной заболеваемости корью в ранее благополучных странах.
Удивительно, но некоторые родители до сих пор ошибочно связывают развитие аутизма с вакцинацией, хотя эта связь давно научно опровергнута. В то же время ряд современных исследований показывает, что предпосылки к развитию расстройств аутистического спектра закладываются уже при формировании зародыша из-за случайных генетических аномалий.
Миф №4. Детям первого года жизни вводится слишком много вакцин, это перегружает иммунную систему
Это не так.
Научно доказано, что одновременное введение несколько вакцин не оказывает «перегрузки» иммунитета ребенка. Ежедневно в ходе их обычной жизни дети подвергаются воздействию нескольких сотен инородных веществ, на каждое из них иммунная система дает свою реакцию.
Простой прием пищи вводит новые антигены в организм, а многочисленные бактерии уже живут на коже, в полости рта, носа и кишечника. Ребенок подвергается воздействию значительно большего числа антигенов в результате простуды или ангины, чем при введении вакцины.
Ключевые преимущества введения нескольких вакцин или многокомпонентных вакцин за один раз — меньшее количество уколов и меньшее количество визитов в клинику.
Миф № 5. Лучше пусть ребенок переболеет и получит иммунитеn после болезни, чем после прививки.
«Я считаю, что иммунитет после болезни более стойкий и натуральный»
Это опасное заблуждение. А Вы знаете, что иммунитет после ряда болезней совсем нестойкий и переболевших требуется далее ревакцинировать по обычному графику, даже если человек перенес, например, дифтерию, пневмококковую, менингококковую или ХИБ-инфекцию? Кроме того, любая натуральная инфекция довольно тяжело протекает и может вызвать серьезные осложнения.
Вакцины взаимодействуют с иммунной системой, приводя к выработке иммунного ответа, но они не вызывают заболевания.
Миф № 6. Вакцины содержат консерванты, которые опасны для здоровья
Компоненты современных вакцин, в том числе консерванты, применяются много лет и изучены на безопасность. Консерванты, которые добавляют в некоторые вакцины для сохранения их стерильности, широко используют в мире. В тех дозах, в которых консерванты добавляются в вакцины, они не представляют риска для здоровья. Ряд вакцин для сохранности не требует добавления консервантов и производится без них.Таким образом, ореол мифов, окружающий вакцинацию, может приводить к опасным заблуждениям и отказам от вакцинации. Принимая такие мифы за истину, люди наносят непоправимый вред сохранению здоровья и детей, и взрослых.
Показать источники
Источники
Вовремя поставленная прививка от столбняка может спасти жизнь
В современной медицине самым действенным способом профилактики большинства инфекционных заболеваний является вакцинация, которая помогает организму самостоятельно вырабатывать защитные антитела. Например, прививка от столбняка, поставленная вовремя, может спасти жизнь и взрослому человеку и ребенку.
Столбняк – это инфекционное заболевание с острым характером течения и преимущественным поражением нервной системы. Возбудитель столбняка – Clostridium tetani – подвижная грамположительная палочка, которая может обитать в различной среде (грунт, соленая или пресная вода). Наиболее часто ее обнаруживают в местах, где земля влажная и получает много удобрений. Палочки столбняка все время обитают в кишечнике человека или домашних животных, но они вызывают заболевание. Только попадая в грунт, палочки образуют споры, которые способны прожить в нем несколько лет. Заражение происходит посредством прямого контакта микроорганизма с поврежденным участком кожных покровов – раневой путь передачи.
Как развивается столбняк? Инкубационный период при столбняке колеблется от 5 до 14 дней. При анаэробных условиях в ране споры прорастают и выделяют экзотоксин, который по нейрогенным, гематогенным, лимфогенным путям попадает в центральную нервную систему (спинной мозг, продолговатый мозг, ретикулярная формация ствола), вызывая параличи вставочных нейронов рефлекторных дуг спинного и продолговатого мозга. Вырабатываемые в мотонейронах импульсы поступают к мышцам непрерывно, вызывая тоническое напряжение скелетных мышц. Поражается симпатическая нервная система: повышается артериальное давление, появляется тахикардия, спазм сосудов, гемолиз.
Источником инфекции столбняка являются травоядные животные, у которых вегетативная форма бактерии обитает в кишечнике, не вызывая заболевания.
Палочки в окружающую среду попадают с фекалиями таких животных. При этом наиболее часто остаются в почве. В зависимости от условий, бактерии могут оставаться в вегетативной форме с активным ростом и размножением или переходить в споры. В кишечник травоядных животных клостридии попадают с поедаемой животным травой. В летнее время или в странах с тропическим или субтропическим климатом, клостридии могут активно размножаться и развиваться в почве, если она богата органическими веществами и влагой. Заражение человека происходит раневым путем при попадании почвы или пыли с клостридиями или их спорами в рану.
Диагностика столбняка. Клиническая картина столбняка достаточно специфична для постановки диагноза. Исследованию на предмет выявления возбудителя могут подвергаться материалы вскрытия трупа, перевязочный и шовный материал, смывы с хирургического инструментария, пыль, почва, воздух.
Выделение возбудителя обычно возможно из места попадания инфекции (соскоб или отделяемое в месте повреждения кожи). Иногда возникает необходимость мазков из носа и слизистой глотки, влагалища и матки (при послеродовом или послеабортном столбняке). Исследуя полученный биологический материал, производят выделение столбнячного экзотоксина и биологическую пробу на мышах.
Осложнения. Тяжелыми осложнениями столбняка с высокой вероятностью летального исхода является асфиксия и остановка сердца. Кроме того, столбняк может способствовать возникновению переломов костей, разрывов мышц, компрессионной деформации позвоночного столба. Нередким осложнением столбняка является пневмония, может развиться коронарный спазм и инфаркт миокарда. Во время выздоровления иногда отмечаются контрактуры, параличи третьей, шестой и седьмой пар черепно-мозговых нервов. У новорожденных столбняк может осложниться сепсисом.
Прогноз. Прогноз столбняка зависит от формы течения, которая тем тяжелее, чем короче инкубационный период и быстрее происходит развертывание клинической симптоматики. Тяжелые и молниеносные формы столбняка характеризуются неблагоприятным прогнозом, при неоказании своевременной помощи возможен летальный исход. Легкие формы столбняка при должной терапии благополучно излечиваются.
Профилактика. Основная мера профилактики – вакцинация, которая проводится по схеме, начиная с возраста 3 месяцев, в три этапа. Вакцинация против этого заболевания входит в Национальный календарь прививок. Используют вакцину АКДС или другие, содержащие столбнячный анатоксин. Взрослым необходима ревакцинация, чтобы поддерживать иммунитет против столбняка. Ревакцинация взрослых проводится каждые десять лет.
Конечно, прививка – это не 100% гарантия того, что вы не заболеете, но болезнь будет протекать легко и без тяжелых осложнений. Сегодня учеными доказано, что 95% охват прививками населения, проживающего на отдельной территории, предотвращает заболеваемость столбняком.
АКДС беременным: от столбняка и других болезней
Во время беременности вы можете разными способами заботиться о здоровье малыша и своем. Одна из прививок, которую вам может порекомендовать сделать врач, это АКДС — прививка от столбняка, коклюша и дифтерии. Она поможет защитить ребенка от серьезных заболеваний. Из этой статьи вы узнаете, что такое вакцина АКДС, когда ее стоит делать и в чем ее польза.
Что такое АКДС
АКДС расшифровывается как адсорбированная коклюшно-дифтерийно-столбнячная вакцина. Эта комплексная прививка защищает вас от трех болезней:
столбняка;
дифтерии;
коклюша.
Как долго действует вакцина АКДС
Прививку следует повторять каждые десять лет. Беременным женщинам обычно рекомендуется делать прививку на определенном сроке беременности, чтобы она могла также защитить от коклюша новорожденного малыша.
Когда делают прививку АКДС
Во время планового осмотра врача в третьем триместре, на седьмом месяце беременности, ваш врач может обсудить с вами вакцинацию. Если врач не предложил сделать прививку, спросите почему.
Кому необходима прививка АКДС
Прививка от столбняка, коклюша и дифтерии рекомендована взрослым, подросткам, медицинским работникам и беременным женщинам. Любой, кто находится в близком контакте с ребенком в возрасте до 12 месяцев также должен быть привит.
Почему прививку АКДС делают во время беременности
Эту прививку делают беременным женщинам, так как она защищает малыша от коклюша сразу после рождения. После вакцинации в вашем организме будет высокий уровень антител, которые передадутся ребенку, защищая его от коклюша с рождения до момента, когда ему можно будет сделать первую прививку. Самое ранний возраст, когда можно вакцинировать малыша, — 2 месяца. Подробнее о графике вакцинации младенца — в календаре детских прививок.
Безопасна ли прививка АКДС во время беременности?
Да. Вакцина изготовлена из неактивных бактерий и безопасна во время беременности. По мнению экспертов, риска осложнений беременности, связанных с вакциной АКДС, нет.
Когда нужно делать прививку АКДС
Прививку можно сделать на любом этапе беременности, но наилучшим моментом считается срок между 27-й и 36-й неделей. Для выработки антител вашему организму нужно около двух недель, поэтому вакцинация в третьем триместре гарантирует, что антитела передадутся ребенку до его рождения. Если вы не можете сделать прививку АКДС во время беременности, обсудите с врачом, сможете ли вы сделать ее сразу после родов, до того как покинуть роддом. Также рекомендуется делать прививку АКДС при каждой беременности, так как защитные функции вакцины в одной беременности не действуют во время другой.
Нужно ли делать прививку АКДС всем близким членам семьи?
Да, потому что риск заразиться коклюшем от непривитого человека для малыша выше. Все, кто будет контактировать с младенцем, пока ему не исполнится год, должны быть привиты вакциной АКДС в последние десять лет или минимум за две недели до контакта с ребенком.
Прививка АКДС поможет защитить вас от таких болезней, как столбняк, дифтерия и коклюш. Эта же прививка защитит от коклюша и вашего малыша в первые два месяца жизни, пока ему не сделают отдельную прививку.
Забота о малыше начинается с беременности. А когда он появится на свет, хлопот заметно прибавится, поэтому вам будет удобно заказать товар первой необходимости — подгузники — заранее по выгодной цене.
реакция на вакцинацию — клиника «Добробут»
Прививка от столбняка детям: почему необходима вакцинации
Столбняк – острое инфекционное заболевание, вызванное анаэробной бактерией Clostridium tetani, которая обычно встречается в почве, пыли, навозе. Споры возбудителя, как правило, попадают в организм через рану. Столбнячная палочка вырабатывает токсины, препятствующие мышечным сокращениям, что приводит к характерным признакам заболевания.
Основные симптомы столбняка у человека – мышечные судороги. Они обычно начинаются с челюсти (тризм), а затем переходят на остальную часть тела. Спастические судороги длятся несколько минут и могут быть настолько сильными, что вызывают переломы костей.
Другие симптомы столбняка:
- лихорадка;
- потливость;
- головная боль;
- проблемы с глотанием;
- высокое артериальное давление;
- учащенное сердцебиение.
Симптомы обычно проявляются через 3-21 день после заражения. Выздоровление может занять несколько месяцев. Больной не заразен для окружающих. Около 10% инфицированных умирают.
Действие вакцины от столбняка
Единственный способ избежать заражения – иммунизация противостолбнячной вакциной. Когда и куда делают прививку от столбняка? В детстве рекомендуется введение четырех доз, затем каждые 10 лет – дополнительные дозы. Прививку от столбняка детям до года делают в четырехглавую мышцу бедра, реже в дельтовидную мышцу.
Вакцинацию обычно проводят по графику:
- первую – в возрасте двух месяцев;
- вторую – четырех месяцев;
- третью – шести месяцев;
- четвертую – от пятнадцати до восемнадцати месяцев.
Последующую вакцинацию следует проводить каждые десять лет. Детям старшего возраста, подросткам и взрослым препарат вводят в дельтовидную мышцу.
Действие вакцины от столбняка: тип вакцинации для этого заболевания называется искусственным активным иммунитетом. Такой тип иммунитета возникает, когда мертвый или ослабленный возбудитель в организме вызывает иммунный ответ – выработку антител. Это означает, что если столбнячная палочка когда-либо попадет в организм, иммунная система «узнает» ее и быстро отреагирует. После трех доз вакцины практически у каждого человека вырабатывается иммунитет.
Экстренная профилактика столбняка у взрослых необходима, когда человек не помнит дату последней иммунизации. В этих случаях прививку следует сделать как можно раньше, желательно в течение 48 часов после травмы. Наступил на ржавый гвоздь – в травмпункте, помимо обработки раны, обязательно сделают укол «от столбняка».
Болит место укола после прививки от столбняка
Побочные действия после прививки от столбняка:
- покраснение, припухлость, болезненность вокруг места инъекции наблюдаются у 25–85 процентов привитых;
- повышение температуры, чувство усталости и мышечные боли отмечаются у менее 1% людей;
- тяжелые аллергические реакции встречаются у одного из 100 000 привитых.
Как и любые лекарства, противостолбнячные вакцины имеют побочные эффекты. Болит место укола после прививки от столбняка, наблюдается реакция вокруг области инъекции (покраснение, отек), припухлость всего плеча – значит, организм так «отвечает» на введение вакцины.
В Дании сообщалось о более серьезных реакциях на противостолбнячные вакцины: тяжелых местных отеках, крапивнице, артралгии, поражениях почек, анафилактическом шоке. Ни один из случаев тяжелых побочных эффектов не привел к летальному исходу.
У пациентов, переболевших столбняком, не вырабатывается иммунитет к повторному заражению, что обычно характерно для других инфекционных заболеваний. Поэтому вакцинацию столбнячным анатоксином следует проводить всем без исключения.
Прививка от столбняка: за и против
Детям до семи лет прививки проводят комбинированной вакциной против столбняка, дифтерии и коклюша. Для взрослых и детей старше семи лет обычно используют объединенную вакцину против столбняка и дифтерии.
Всемирная организация здравоохранения удостоверяет, что столбняк матерей и/или новорожденных ликвидирован. Для сертификации страны требуется по меньшей мере два года с менее чем одним случаем заражения на 1000 рождений. О масштабах возможной «столбнячной эпидемии» можно судить по следующим цифрам: в 1998 году в Уганде было зарегистрировано 3433 случая столбняка у новорожденных, из них умерло 2403 человека. После массовой прививочной кампании, Уганда в 2011 году была сертифицирована как страна, ликвидировавшая столбняк. Поэтому всем, кто выступает за отказ от вакцинации, следует напомнить эти цифры. Об основных противопоказаниях к вакцинации читайте на нашем сайте Добробут.ком.
Связанные услуги:
Вакцинация
Прием у педиатра
Могут ли определенные вакцины COVID-19 сделать людей более уязвимыми к вирусу СПИДа? | Наука
Science ‘ Отчетность о COVID-19 поддерживается Пулитцеровским центром и Фондом Хейзинг-Саймонса.
Некоторые вакцины-кандидаты от COVID-19 могут повысить восприимчивость к ВИЧ, предупреждает группа исследователей, которые в 2007 году узнали, что экспериментальная вакцина против ВИЧ повысила у некоторых людей риск заражения вирусом СПИДа.Эти опасения возникли на фоне гонки за вакцину, чтобы остановить пандемию коронавируса, но теперь исследователи обнародовали «поучительную историю» отчасти потому, что испытания этих кандидатов могут вскоре начаться в регионах, где явно выражена эпидемия ВИЧ. , например, Южная Африка.
В основе некоторых одобренных и экспериментальных вакцин лежат различные аденовирусы, которые могут вызывать простуду, но часто безвредны. В злополучном испытании вакцины против ВИЧ использовался искусственно созданный штамм, известный как аденовирус 5 (Ad5), для доставки в организм гена поверхностного белка вируса СПИДа.В четырех вакцинах-кандидатах от COVID-19, которые сейчас проходят клинические испытания в нескольких странах, включая США, Ad5 также служит «вектором» для переноса гена поверхностного белка SARS-CoV-2, вирусной причины пандемии; два из них продвинулись до крупномасштабных исследований эффективности III фазы в России и Пакистане.
В сегодняшнем выпуске The Lancet четыре ветерана-исследователя предупреждают об этих кандидатах на вакцину COVID-19, рассказывая о своем опыте проведения испытаний плацебо-контролируемой вакцины против СПИДа под названием STEP.Промежуточный анализ STEP показал, что необрезанные мужчины, которые были естественно инфицированы Ad5 до вакцинации, стали особенно уязвимыми для вируса СПИДа. Вакцина, созданная Merck, была главной надеждой на то, что тогда было 20-летним поиском вакцины, которая могла бы предотвратить распространение ВИЧ. Но после того, как появились результаты STEP, поле пошло в штопор. «На выздоровление потребовалось десятилетие», — говорит один из соавторов переписки Lancet , Лоуренс Кори из Центра исследования рака Фреда Хатчинсона.
Кори, который в настоящее время является одним из руководителей сети по профилактике COVID-19 в Соединенных Штатах, которая тестирует вакцины по заказу Национальных институтов здравоохранения, говорит, что он и его соавторы стали публичными, потому что вакцины COVID-19 на основе Ad5 вскоре могут быть протестированы в группах населения с высокой распространенностью ВИЧ и, следовательно, с повышенным риском случайного заражения во время клинических испытаний. «Если бы я находился в африканской стране к югу от Сахары и принимал решение о том, что я хочу, чтобы моя страна использовала вакцину SARS-CoV-2 среди населения в целом, я не понимаю, почему бы я выбрал вектор Ad5. [вакцина], когда есть много других альтернативных вариантов », — говорит Кори.
Обратный эффект в STEP, который оценивал эффективность вакцины Merck у людей с высоким риском заражения ВИЧ в Северной и Южной Америке и Австралии, также проявился во втором исследовании той же вакцины, названном Phambili. Он проходил одновременно в Южной Африке и был досрочно остановлен из-за данных STEP.
Остается неясным, как именно вакцина Ad5 компании Merck увеличила риск передачи ВИЧ при STEP и Phambili. Передовая статья Lancet описывает несколько возможностей, включая ослабление иммунитета к ВИЧ, усиление репликации вируса СПИДа или создание для него большего количества клеток-мишеней.
В дополнение к вакцинам-кандидатам Ad5 COVID-19, несколько других ведущих вакцин, в том числе сделанные Johnson & Johnson и AstraZeneca / Оксфордским университетом, используют в качестве векторов различные аденовирусы. Нет никаких доказательств того, что какой-либо из этих аденовирусов увеличивает риск заражения ВИЧ.
Я не понимаю, почему я должен выбрать вектор Ad5 [вакцину], когда есть много других альтернативных вариантов.
- Лоуренс Кори, Онкологический исследовательский центр Фреда Хатчинсона
Из кандидатов на вакцину против COVID-19 на основе Ad5, китайская компания CanSino Biologics разработала дальше всех.В майском отчете Lancet исследователи из компании признали «спорную» возможность того, что их переносчик увеличивает риск заражения ВИЧ, и заявили, что будут следить за этим в ходе испытаний кандидатов. Вакцина CanSino COVID-19 проходит испытания эффективности в России и Пакистане, которые вместе надеются привлечь более 40 000 человек, и компания обсуждает начало исследований в Саудовской Аравии, Бразилии, Чили и Мексике.
Китай уже одобрил вакцину CanSino против лихорадки Эбола, в которой используется вектор Ad5.Ю Сюэфэн, генеральный директор CanSino, сообщил Science , что риск повышенной восприимчивости к ВИЧ может быть ограничен вакцинами Ad5, которые производят белок вируса СПИДа. «Пока нет четкого ответа», — говорит Ю. «Мы, конечно, ничего не видели с вакциной против Эболы». Вакцина против Эболы компании была протестирована на популяции в Сьерра-Леоне, где, как он отмечает, была относительно высокая распространенность ВИЧ, что повысило вероятность обнаружения проблемы, если бы она существовала.
Российский научно-исследовательский институт «Гамалея» имеет кандидатную вакцину против COVID-19, в которой используется комбинация векторов Ad5 и Ad26; в настоящее время в этой стране проходит испытание на его эффективность.
На прошлой неделе ImmunityBio получила одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США на начало испытаний вакцины COVID-19 на людях, в которой в качестве вектора используется Ad5. Первое испытание состоится в Ньюпорт-Бич, Калифорния, но Патрик Сун-Шионг, генеральный директор компании, говорит, что также надеется испытать его в Южной Африке, где он вырос и учился в медицинской школе.
Он называет результаты исследования STEP «очень и очень нечеткими» и подчеркивает, что Ad5 ImmunityBio имеет четыре удаленных гена, которые снижают иммунные реакции, которые он запускает.«Он на 90% приглушен», — говорит он.
ImmunityBio обсуждает риски с учеными и регулирующими органами в Южной Африке в связи с проведением там испытания модифицированной вакцины Ad5 COVID-19. Процесс информированного согласия для этого предлагаемого исследования расскажет участникам о потенциальных рисках с учетом предыдущих результатов STEP и Phambili.
Сун-Шионг подчеркивает, что экспериментальная вакцина COVID-19 его компании, в отличие от всех других кандидатов, использующих аденовирусный вектор, представляет два разных гена SARS-CoV-2 и, следовательно, может обеспечить большую защиту от инфекции или заболевания.Он спрашивает, зачем проверять это только в богатых анклавах Южной Калифорнии? «Почему не Южная Африка? Почему не для малообеспеченных людей мира?»
Педиатр Гленда Грей, возглавляющая Южноафриканский совет медицинских исследований и председатель протокола Phambili, приняла участие в нескольких обсуждениях с командой ImmunoBio. «Когда [Сун-Шионг] связался с Южной Африкой, мы были явно очень обеспокоены», — говорит Грей. «Все мы, находившиеся в Фамбили и весьма травмированные случившимся, спрашивали, есть ли желание что-то сделать в Южной Африке.«
Но после нескольких месяцев обсуждений южноафриканцы пришли к выводу, что регулирующие органы должны рассмотреть возможность небольшого испытания вакцины на людях с низким риском заражения ВИЧ», — говорит Грей. «Мы решили не выбрасывать ребенка вместе с водой из ванны. «пока что», — добавляет она. «Если это произойдет в Южной Африке, необходимо провести обширные консультации с сообществами, и мы должны вдвойне убедиться, что участники понимают, что произошло в прошлом».
Грей говорит, что Южная Африка ценит предложение ImmunoBio разрешить стране производить продукт.«Мы находимся в разгаре эпидемии COVID-19 в Южной Африке, и мы не знаем, получим ли мы когда-нибудь доступ к текущему набору вакцин», производимых в других местах, — говорит она.
Решение двигаться вперед, настаивает она, должно быть оставлено на усмотрение южноафриканских ученых, регулирующих органов и комитетов по этике. «Людям невероятно снисходительно определять, какая наука хороша или плоха для других стран», — говорит она. «Все знают о Phambili и STEP, и ученые понимают, что нужно проявлять осторожность.«
Грей, который является соавтором статей о вакцинах против ВИЧ с Кори и тремя другими авторами переписки Lancet , говорит, что нет простых ответов.« Что, если эта вакцина является наиболее эффективной вакциной? »- спрашивает она. «Если это окажется важной вакциной, у нас будет некоторый опыт с ней».
перспектив создания вакцин для защиты от СПИДа, туберкулеза и малярии | ВИЧ | JAMA
Учитывая масштабы мировых проблем со здоровьем, вызванных приобретенными синдром иммунодефицита, туберкулез и малярия, необходимо, чтобы вакцины должны быть разработаны для предотвращения этих инфекций.Последние достижения в понимание этих заболеваний предполагает, что иммунитет, опосредованный Т-лимфоцитами важен для сдерживания этих инфекций. Применение новой вакцины технологии для выработки этого типа иммунитета обещают обеспечить успешные вакцины для борьбы с распространением этих смертельных инфекций.
Вакцинация, пожалуй, самое мощное из всех медицинских вмешательств. За последние 25 лет вакцинация позволила ликвидировать оспу во всем мире, полиомиелит. из западного полушария и Haemophilus influenzae как причина опасного для жизни заболевания в Северной Америке и Европе.Профилактика заражения с помощью вакцинации улучшила состояние здоровья человека. населения во всем мире. Несмотря на этот рекорд достижений, вирус (вирус иммунодефицита человека [ВИЧ]), бактерия ( Mycobacterium tuberculosis ) и паразит ( Plasmodium falciparum ) в настоящее время ежегодно убивают более 5 миллионов человек. 1 ВИЧ и синдром приобретенного иммунодефицита (СПИД) только стали эпидемия в недавнем прошлом.Появление вируса M tuberculosis с множественной лекарственной устойчивостью и иммуносупрессия, вызванная ВИЧ, резко возросли. увеличил заболеваемость туберкулезом (ТБ) и смертность от ТБ на всей территории мир. Развитие лекарственной устойчивости паразитами и устойчивости к инсектицидам в Anopheles видов комаров, ухудшение политической инфраструктуры и инфраструктуры здравоохранения во многих частях мира, движение неиммунных беженцев в малярийные районы, а население взрыв в Африке к югу от Сахары способствовал увеличению заболеваемости малярии.
СПИД, туберкулез и малярия — более серьезные проблемы в бедных странах, чем в богатых, и эти болезни не получили инвестиций в исследования долларов соразмерно их важности. Есть растущее осознание воздействия этих болезней и растущей веры в то, что эти болезни можно контролировать вакцинацией.
В этой статье мы описываем глобальные последствия СПИДа, туберкулеза и малярии; обобщить текущее понимание того, как иммунная система человека может быть мобилизованы для сдерживания патогенов, вызывающих эти заболевания; и описать подходы к вакцинам, которые обещают устранить эти заболевания.
По данным Объединенной программы Организации Объединенных Наций по ВИЧ / СПИДу, 2 более 18,8 миллиона человек во всем мире умерли СПИДа и 34,3 миллиона инфицированы ВИЧ, причем 5,4 миллиона человек впервые инфицированы ВИЧ только в 1999 году. Более 13,2 миллиона детей были осиротели из-за СПИДа, и эта болезнь сильно повлияла на показатели младенчества, детская и материнская смертность, продолжительность жизни и экономический рост.В 16 страны, более одной десятой взрослого населения в возрасте от 15 до 49 лет инфицирован ВИЧ. В Ботсване 35,8% взрослых инфицированы ВИЧ, а в Южной Африке инфицированы 19,9%. 2
Лекарственная терапия против ВИЧ будет иметь ограниченный эффект на сдерживание СПИДа. эпидемия. Хотя доступные лекарства уменьшают репликацию вируса у инфицированных у людей вирус сохраняется, даже у тех, у кого терапия против ВИЧ устранил измеримый вирус плазмы.Продолжающаяся репликация вируса позволит появление лекарственно-устойчивых вариантов ВИЧ. Что еще более важно, реальные затраты на обеспечение антиретровирусными препаратами миллионов людей, нуждающихся в лечении выходит за рамки финансовых ресурсов населения развивающихся стран. ВИЧ можно контролировать во всем мире только путем разработки эффективной вакцины.
Патогенез СПИДа и иммунное сдерживание распространения ВИЧ
ВИЧ-инфекция чаще всего возникает во всем мире в результате венерических заболеваний. распространять.Хотя редкие люди обладают относительной устойчивостью к ВИЧ-инфекции, все люди в конечном итоге восприимчивы к ВИЧ-инфекции. Предотвращение заражения а патологические последствия инфекции могут быть устранены только через вакцинация.
Хотя ВИЧ вызывает иммунную дисфункцию несколькими механизмами, центральный иммунная аномалия — это потеря CD4-Т-лимфоцитов. 3 Антитела, распознающие гликопротеины оболочки ВИЧ, могут нейтрализовать вирус in vitro и блокирует инфекцию у нечеловеческих приматов.Однако, поскольку крайней изменчивости последовательности гликопротеинов оболочки, таких нейтрализующих антитела обычно специфичны для изолята. Центральная роль, которую играет цитотоксический CD8 Т-лимфоциты (CTL) и Т-лимфоциты CD4 играют роль сдерживания ВИЧ-инфекции у человека и заражение обезьяньим вирусом иммунодефицита обезьян (SIV) было предметом вызывает большой интерес. Во время первичной инфекции репликация ВИЧ и ВИО невозможна. содержащиеся в ответах CTL. 4 , 5 Мощные ответы CTL связаны с низкой вирусной нагрузкой и покоем клиническое заболевание. 6 CD8-лимфоциты истощены обезьяны неспособны сдерживать репликацию ВИО во время первичной или хронической фазы инфекции, 7 и после заражения вирусом, SIV репликация содержится у обезьян с вызванными вакциной CTL. 8 Сохранение ВИЧ-специфической функции Т-лимфоцитов CD4 коррелирует с сдерживанием репликации ВИЧ у инфицированных людей. 9 Взятые вместе, эти наблюдения показывают, что эффективная вакцина против ВИЧ должна вызывают мощные вирус-специфические CTL и CD4 Т-лимфоциты.
Изучаются стратегии вакцинации против ВИЧ
Несколько вакцинных технологий вызывают высокочастотные Т-лимфоциты CD4 и CD8 CTL ответы. 10 Живые рекомбинантные организмы исследуются как потенциальные вакцины. В этом подходе ген, кодирующий белок патогена может быть вставлен в организм, который инфицирует людей но не вызывает болезней.Затем этот рекомбинантный организм будет экспрессировать продукт встроенного гена, и иммунитет к этому продукту гена будет вызван как часть иммунного ответа организма. Гены ВИЧ, M. tuberculosis, и малярии были вставлены в такие разнообразные векторы. как вирусы оспы, бациллы Кальметта-Герена (БЦЖ), аденовирусы и кишечные бактерии. Эти подходы дают возможность вызвать такие же длительные, мощный иммунитет, вызванный заражением живым организмом, но без доставка вакцинируемого потенциально патогенного организма.
Другой подход к индукции Т-клеточного ответа — прямая инъекция плазмидной ДНК, экспрессирующей ген, кодирующий белковый антиген. После внутримышечного или внутрикожной инъекции, плазмиды ДНК захватываются клетками и кодируемые белковые антигены экспрессируются. Белки обрабатываются иммунными клетками. и генерировать сильные, стойкие клеточные иммунные ответы.
В других исследуемых стратегиях сочетаются 2 разные вакцины.Обоснование таких стратегий «простого повышения» заключается в том, что комбинация 2 различных метода иммунизации, которые вызывают клеточный иммунный ответ различные механизмы могут быть объединены и синергетически активировать Т-лимфоциты. иммунитет. Подходы «прайм-буст» могут также включать 1 вариант вакцинации, который вызывает CTL и другой, который вызывает ответы нейтрализующих антител. Эти подходы к вакцинации, вероятно, обеспечат средства стимулирования значимых иммунитет к этим возбудителям.
Все эти стратегии исследуются как потенциальные вакцины. для предотвращения заражения ВИЧ. Потому что все потенциальные вакцины не могут быть оценены для иммуногенности и эффективности в человеческих популяциях потенциальные вакцины оценены на нечеловеческих приматах, и данные этих исследований используются для выбрать наиболее многообещающие подходы для раннего тестирования на людях.
Ожидаемые испытания вакцин на людях
Защита от заражения высокопатогенными изолятами вируса СПИДа еще не было достигнуто в исследованиях нечеловеческих приматов.Тем не менее, данные исследования нечеловеческих приматов предполагают, что формирование Т-клеточного иммунитета вакцинация до заражения вирусом может изменить патогенные последствия инфекции. 8 Например, ранее привитые у обезьян нет измеряемого вируса в плазме и нет потери CD4 Т-лимфоцитов после заражения. Это повышает вероятность того, что предварительная вакцинация может уменьшить репликацию вируса у людей, впоследствии инфицированных ВИЧ. Такие люди прогнозируется снижение бремени болезней и снижение передачи ВИЧ ставки.
Плазмидная ДНК и стратегии рекомбинантной оспы оцениваются на людях. клинические испытания и дополнительные стратегии вакцины против ВИЧ будут оценены в люди в ближайшем будущем. Однако до тех пор, пока вакцина не сможет вырабатывать антитела, которые нейтрализовать разнообразие первичных изолятов ВИЧ от пациентов, настоящая защита от инфекция не может быть достигнута. Улучшенные вирус-специфические Т-клеточные ответы должен содержать репликацию вируса и уменьшать проявления болезни среди тех, кто заразился.
Создание вакцины против ВИЧ возможно, но международное обязательство необходимо было разработать такую вакцину. Промышленно развитые страны мира должны выделить ресурсы на разработку этой вакцины, а развивающиеся страны должен создать и обеспечить инфраструктуру для облегчения тестирования вакцины иммуногены.
Каждый год туберкулез является причиной 8 миллионов новых случаев заболевания и 2 миллионов смертей. во всем мире и способствует гибели еще 900 000 человек со СПИДом. 11 Таким образом, туберкулез и СПИД являются крупнейшими причины смертности от инфекционных заболеваний. Туберкулезом страдают около 16 человек. миллионов человек во всем мире, а уровень летальности при нелеченых заболеваниях составляет 50%. В некоторых странах с самой высокой распространенностью коинфекции ВИЧ смертность ставка составляет около 23%. В исследовании вскрытия трупа в Африке туберкулез стал причиной смерти в 32% случаев смерти от СПИДа и от сопутствующей причины еще в 15–25% случаев. 12 Пик заболеваемости туберкулезом — от 15 до 25 лет. возраста, но инфекция может сохраняться, часто в течение всей жизни, в тихой форме, и может реактивироваться с ВИЧ-инфекцией. 13 Только 1 из 10 человек инфицирован туберкулезом M, определяется с помощью туберкулиновой кожной пробы, заболевает в течение всей жизни, тогда как у людей с иммунодефицитом риск составляет около 8% в год. Этот предполагает, что большинство инфицированных людей защищены иммунным ответом и что усиление естественных иммунных ответов может повысить сопротивляемость к болезни. Эпидемиологические модели предсказывают, что даже противотуберкулезная вакцина с эффективностью 50% окажет серьезное влияние на болезнь и спасет, возможно, 40 миллионов живет более десяти лет. 14 , 15
Возможно, туберкулезная палочка непроницаема из-за своего необычного воскового покрытия. к большинству антибиотиков. Резистентность быстро развивается как к отдельным препаратам, так и к комплексной. режим, известный как лечение под непосредственным наблюдением, короткий курс (ДОТС) требует прием от 3 до 4 препаратов в течение первых 2 месяцев лечения с последующим 2 препаратами в течение 4-7 месяцев. 16 , 17 Полный режим ДОТС доступен только 15% пациентов во всем мире, появился туберкулез с множественной лекарственной устойчивостью, который является чрезвычайно трудным и дорогостоящим. контролировать.Глобализация и миграция представляют собой угрозы для передачи лекарственно-устойчивого туберкулеза в США. Туберкулез с лекарственной устойчивостью — серьезная угроза и подчеркивает необходимость новых средств профилактики и лечения.
Вакцина БЦЖ, аттенуированный штамм Mycobacterium bovis , открытый в 1908 году и впервые использованный на людях в 1921 году, является наиболее широко применяемая вакцина в мире, которую в настоящее время вводят около 104 миллион детей.Вакцина БЦЖ однозначно предотвращает смерть от диссеминированного Туберкулез и туберкулезный менингит у детей, но его эффективность у взрослых варьируется. 18 Например, в большом проспективном исследовании в Великобритания, BCG обеспечила 77% -ную защиту подростков, 19 тогда как подобное испытание в Индии не оказало защитного эффекта ни в одной возрастной группе 20 ; у других испытаний эффективность между этими крайностями. Причины такой большой изменчивости до конца не ясны. С детей составляют только 10% случаев ТБ, влияние БЦЖ на эпидемиологию ТБ у взрослых не было большим.
Механизмы патогенеза и защиты при туберкулезе
Нижнее легкое является мишенью первичной инфекции M tuberculosis, , но бациллы гематогенно распространяются к верхушке легкие или другие органы, где проявляется заболевание. У животных БЦЖ не блокирует инфекцию, но ограничивает гематогенное распространение и болезнь.В иммунные механизмы, обеспечивающие защиту от туберкулеза, не выявлены. Большинство данных указывает на то, что клеточный иммунитет важен для защиты. и что антитела играют небольшую роль. Мыши с целенаправленными нарушениями иммунологической важные функции, например, дефицит CD4 Т-клеток и способность продуцировать интерферон-гамма, становятся очень восприимчивыми к туберкулезу, что указывает на то, что лимфокины и активация макрофагов важны для защиты. Цитотоксические Т-лимфоциты также может потребоваться.
Более 100 вакцин-кандидатов были протестированы на животных моделях. Последовательность генома M tuberculosis завершена, БЦЖ и непатогенные микобактерии в процессе, дополнительные мишени потому что вакцины обязательно появятся. Возможные концепции вакцины включают следующие 21 -23 :
Субъединичные вакцины, состоящие из микобактериальных белковые, липидные и углеводные антигены в различных составах имеют потенциал быть конкретным, определенным и безопасным.Их недостаток ограничен стойкость in vivo, а также характер и продолжительность иммунных ответов, которые они генерировать.
ДНК-вакцины , которые кодируют несколько антигенов M. tuberculosis , обладают защитным действием у мышей. Их легко производить, относительно недорогой и вызывают длительные клеточно-опосредованные иммунные ответы. Составление ДНК в адъювантах и изменение состава ДНК повышают иммуногенность. Безопасность и продолжительность защиты пока не определены.В одном многообещающем отчете указывается, что ДНК-вакцина, кодирующая антиген массой 65 кДа. смог отменить персистентность или задержку в модели мыши, которая жила БЦЖ не смог сделать. 24
Немикобактериальные микробные векторы , такие как спроектированы Сальмонелла и организмы осповакцины, которые экспрессируются микобактериальные антигены. Первый имеет потенциал для индукции иммунитета слизистых оболочек, а последние могут индуцировать CTL.
Живые аттенуированные микобактериальные вакцины, в т.ч. непатогенные виды микобактерий и генно-инженерная БЦЖ, экспрессирующие иммунодоминантные антигены M tuberculosis , находятся под разработка. В испытании в Великобритании: Mycobacterium microti был так же эффективен в защите, как БЦЖ, хотя и давал положительный эффект на кожу конверсия теста только у части вакцинированных. Кроме того, генетически аттенуированные штаммы M tuberculosis, в том числе ауксотрофные мутанты и мутации в генах, относящиеся к устойчивости и вирулентности, — все это в стадии разработки, а некоторые из них эффективны на мышах.У них есть преимущество содержат широкий спектр антигенов, адъювантность, связанная с микобактерии и стойкость, но безопасность у людей с иммунодефицитом не установлено.
Существует 4 общие стратегии тестирования безопасных и иммуногенных вакцин. для эффективности у людей:
Младенцы с высоким риском раннего инфицирования и диссеминированного заболевания или менингит будет вакцинирован незадолго до рождения, и влияние на профилактику инфекции, острого заболевания или персистенции будут оцениваться, возможно, более период от 3 до 5 лет.Неизвестно, действует ли защита от острого заболевания. у маленьких детей можно предсказать эффективность у подростков и взрослых.
Целевая группа — здоровые взрослые люди с положительной реакцией на туберкулин, в регионах с высокой скоростью реактивации, например, 3% в год. Уменьшение реактивации будет оцениваться от 3 до 5 лет. Неясно, являются ли результаты испытаний у людей, уже иммунизированных естественной инфекцией, предсказывает защиту у неиммунизированных лиц.
Перспективное исследование на неинфицированных людях
Исходя из опыта испытаний БЦЖ, эта конструкция потребует большого количества лиц, за которыми следовало бы наблюдать в течение 15-20 лет, но которые обеспечивают наиболее однозначное определение эффективности вакцины.
Иммунизируется популяция, охарактеризованная эпидемиологически.Те уже положительный результат на туберкулин будет проанализирован на защиту через 3-5 лет, и эффективность среди неинфицированных людей может быть определена в такое же испытание в течение более длительного периода времени.
Поскольку испытания эффективности длительные, сложные и дорогие, суррогатные маркеры которые коррелируют с иммунологической защитой. Эти маркеры, будь то лимфокины, CTL или микобактерицидные активности, если их можно быстро измерить и в количественном отношении ускорит разработку и тестирование вакцин.
Хотя туберкулез встречается во всех странах мира, более 80% случаев происходят в развивающихся странах. Это сильно ограничивает рынок противотуберкулезных вакцин. и является серьезным препятствием для их развития фармацевтической промышленностью. Чтобы сделать инвестиции промышленности в разработку вакцин возможными, необходимость в государственно-частном сотрудничестве, в котором инвестиции государственного сектора продвигать исследования вперед («толкать») и обеспечивать рынки сбыта или закупку вакцин признано эффективным («тянуть»).
Наконец, сотрудничество развивающихся стран, где болезнь является наиболее распространенным, будет иметь важное значение для оценки безопасности и эффективности Противотуберкулезные вакцины.
Уровень смертности детей от тяжелой малярии в больницах первичной медико-санитарной помощи в развивающихся странах не снизилась за 25 лет. Во многих частях В мире малярия сегодня более распространена, чем 25 лет назад.Счета по малярии по оценкам, от 300 до 500 миллионов новых инфекций и от 1 миллиона до 3 миллиона смертей ежегодно, и считается, что это приведет к сокращению годового валового внутреннего дохода. продукта в странах Африки к югу от Сахары на 1–4%. 25 В настоящее время вакцины против малярии нет, и перспективы ее внедрения малы. эффективной вакцины против любых малярийных паразитов в ближайшие 5 лет. которые заражают людей.
Успехи и научный фонд
Паразиты, вызывающие малярию, сложнее вирусов и бактерий для которых имеются вакцины, что затрудняет разработку вакцины.Они имеют примерно 6000 генов и многоступенчатый жизненный цикл со стадиями экспрессия многих белков на каждой стадии. Это означает, что антитела против белок на спорозоитах (стадия заражения комарами) обычно не распознает мажорный белок на поверхности мерозоитов эритроцитарной стадии. Один человек может быть инфицирован более чем 5 различными штаммами P falciparum (аллельная вариация) и одним из белков. экспрессируется на поверхности инфицированных эритроцитов, белок, который важен в патогенезе заболевания может уклоняться от ответа антител путем экспрессии от 50 до 100 антигенно разных вариантов.
В отличие от вакцин от других болезней, несколько видов малярии можно представить себе вакцины. Один для неиммунных путешественников предотвратит заражение эритроцитов, тем самым предотвращая все клинические проявления (тип 1). Второй тип детей раннего возраста в Африке к югу от Сахары ограничит воспроизводство на эритроцитарной стадии, не предотвращая инфицирование, тем самым предотвращая от 1 миллиона до 3 миллионов смертей от малярии ежегодно (тип 2). 26 , 27 Также есть интерес к развитию вакцина против малярии, направленная на половую фазу размножения паразитов, не защитит человека, но снизит передачу инфекции внутри сообщества, тем самым снижая бремя болезней.
Считается, что разработка вакцин против малярии осуществима, потому что человеческое доступны модели для подходов. Иммунизация добровольцев экспозицией от укусов более 1000 облученных, инфицированных Anopheles видов комаров обеспечивает более 95% защиты на срок до 9 месяцев против экспериментального заражения множественными штаммами P falciparum . Облученная спорозоитная вакцина была бы идеальным типом 1 вакцина, но это нецелесообразно.Дети в регионах Африки к югу от Сахары с интенсивная передача малярии у людей, живущих в возрасте от 8 до 10 лет, не заболевают тяжелой малярией, но заражаются и заболевают лихорадкой. У этих детей есть иммунный ответ, который не предотвращает инфекцию, но ограничивает патологические и клинические эффекты инфекции. Вакцина, которая фактически превратили младенцев и маленьких детей в 10-летних из иммунологического с точки зрения вакцины кандидат типа 2.
Задача состояла в том, чтобы охарактеризовать иммунные ответы, обеспечивающие защиты, чтобы определить, какие антигены / эпитопы паразитов являются мишенями этих защитные иммунные ответы, а также разработать системы доставки вакцин, которые вызвать соответствующие иммунные ответы. Защита, вызванная облучением спорозоитом против малярии у мышей в первую очередь опосредуется CD8 Т-клетками, которые распознают Пептиды от 8 до 10 аминокислот, полученные от паразита на поверхности инфицированного гепатоциты.Этот иммунитет дополняется антителами, предотвращающими появление спорозоитов. от вторжения в гепатоциты и ответа Т-лимфоцитов CD4 против белков / эпитопов выражен на стадии печени. Другие данные свидетельствуют о том, что естественным путем иммунитет у жителей эндемичных по малярии районов в первую очередь опосредуется антителами которые распознают белки паразита, экспрессируемые на поверхности эритроцитов. стадия мерозоитов или на поверхности инфицированных эритроцитов. Т-клеточные ответы на стадии эритроцитов, антитела против спорозоитов и Т-клеточные ответы против инфицированных гепатоцитов, как полагают, тоже играют определенную роль.
Текущая передовая исследовательская деятельность и критические события
Используются три основных подхода к созданию мультиантигена, многоступенчатая вакцина против малярии.
Первый разработан для усиления ответа Т-лимфоцитов и CD4 против несколько ключевых белков спорозоитов, мерозоитов и половых стадий с использованием очищенных белки или пептиды, вводимые в сильном адъюванте.Самый прогресс был сделан с основным поверхностным белком спорозоитов, циркумспорозоитным белком P falciparum . 28 Состав вакцины, известный как RTS, S / SBAS2 29 постоянно защищает 50% добровольцев от экспериментального заражения малярией на 2–3 недели, но не на 6 месяцев, 30 и среди полуиммунных взрослых Гамбии в Гамбии обеспечено примерно 65% защита в течение 2 месяцев и без защиты в течение 6 месяцев.Это воспроизводимое, но неустойчивая защита — это шаг вперед, но этого недостаточно, и эта вакцина само по себе, скорее всего, не снизит смертность младенцев и детей младшего возраста в развивающемся мире. Белок на поверхности мерозоитов эритроцитарной стадии (поверхностный белок 1 мерозоитов [MSP1]) 31 также является компонент экспериментальной вакцины, SPf66, 32 который, несмотря на ранние обещания, не оказался эффективным в полевых испытаниях в Гамбия, Таиланд, Танзания и Бразилия; MSP1 также входит в состав трехвалентной вакцины. недавно показали себя многообещающими в Папуа, Новая Гвинея.Рекомбинантный P falciparum MSP1 будет протестирован на добровольцах, как отдельно, так и в комбинации. с другими белками, такими как P falciparum циркумспорозоит белок и как минимум 5 других бесполых и половых (блокирующих передачу) эритроцитарных рекомбинантные белки, производные от стадии, будут протестированы в ближайшем будущем. 27
Второй подход разработан для индукции антител и CD8 и CD4 Т-клеток. ответы против белков, экспрессируемых облученными спорозоитами в гепатоцитах (n = 5) и белки, экспрессируемые на или около поверхности эритроцитарной стадии мерозоиты (n = 10).Этот подход казался невозможным с использованием очищенного рекомбинантного белки, но ДНК-вакцины позволяют разрабатывать и оценивать многоступенчатые, мультиантигенные вакцины. Ранние исследования показывают, что CTL 33 и Т-лимфоциты CD8, продуцирующие интерферон гамма, могут быть вызваны в люди-добровольцы. Однако, хотя ДНК-вакцины, по-видимому, заряжают иммунную систему, усиление иммунного ответа рекомбинантными вирусами и рекомбинантными белками по-видимому, обеспечивает более высокий защитный иммунитет, чем иммунизация только ДНК. 34 Продолжаются клинические испытания множественной печени стадия генов только как ДНК-вакцины и в стратегии прайм-буста. 35 , 36
Третий подход использует данные Проекта секвенирования генома малярии. Облученный спорозоит и естественный иммунитет вызывается воздействием всего паразита и может отражать иммунные ответы против многих белков, кодируемых приблизительно 6000 генов в геноме P falciparum .Геномная последовательность P falciparum будет завершена. к концу 2002 г. — 37 , 38 и используются различные методы для определения новых целей при разработке вакцины. Использование генетической последовательности для разработки успешных вакцин потребует новые подходы к созданию ДНК-основанных и полиэпитопных вакцин. 39 Клинические испытания таких вакцин могут начаться в От 3 до 5 лет.
Критические элементы и будущее
Человеческие модели (облученный спорозоит и естественный иммунитет) продемонстрировать возможность создания вакцины против малярии и разработки в области геномики, протеомика, молекулярная иммунология, вакцинология, популяционная генетика и количественная эпидемиология породила большие надежды на разработку эффективных вакцины против малярии.Определить, какие антигены / эпитопы с каких стадий жизненного цикла малярийного паразита требуется устойчивая защита, иммунные ответы которой предсказывают защиту, какая вакцина оптимальные системы доставки, кого и когда в жизни иммунизировать, и истинные воздействие вакцины против малярии. Однако в следующие 10-25 лет должно произойти разработка эффективных вакцин против малярии, которые смягчат последствия болезнь во всем мире и, в сочетании с другими вмешательствами, искоренит малярия во многих областях.(Рисунок 1)
СПИД, туберкулез и малярия вызываются разными патогенами, которые различаются между собой. во многих отношениях. Тем не менее, каждый из них вызывает сильный иммунный ответ и все 3 болезни можно успешно сдержать и, возможно, ликвидировать с помощью вакцинация. клеточный иммунитет может играть центральную роль в контроле эти инфекции. Несколько новых вакцинных стратегий выявляют стойкие клеточно-опосредованные иммунные реакции, которые, по-видимому, способны сдерживать эти инфекции.Эти болезни являются важными проблемами общественного здравоохранения в развивающихся странах, и пострадавшие страны должны предоставить инфраструктуру здравоохранения для решения их. Достижения в понимании этих болезней и технологий иммунизации предполагают, что вакцинационная защита от ВИЧ, M туберкулеза, и паразитов малярии достижима в ближайшие десятилетия. Достижение эти цели требуют согласованного использования научных и экономических ресурсов. этим проблемам общественного здравоохранения.
1.Доклад о состоянии здравоохранения в мире, 2000 г .: Системы здравоохранения: повышение эффективности. Женева, Швейцария: Всемирная организация здравоохранения; 2000.
2.Отчет о глобальной эпидемии ВИЧ / СПИДа. Женева, Швейцария: Объединенная программа Организации Объединенных Наций по ВИЧ / СПИДу; Июнь 2000 г.
3.Fauci AS. Многофакторная природа болезни, вызванной вирусом иммунодефицита человека: последствия для терапии. Наука. 1993; 262: 1011-1018. Google Scholar 4. Куп Р.А., Сафрит Дж. Т., Цао Ю.и другие. Временная ассоциация клеточных иммунных ответов с начальным контроль виремии при синдроме первичного вируса иммунодефицита человека 1 типа. J Virol. 1994; 68: 4650-4655.Google Scholar 5. Курода MJ, Schmitz JE, Charini WA. и другие. Появление CTL совпадает с клиренсом вируса во время первичного обезьяньего инфицирование вирусом иммунодефицита у макак-резусов. J Immunol. 1999; 162: 5127-5133.Google Scholar6.Ogg G, Jin X, Bonhoeffer S. и другие. Количественное определение ВИЧ-1-специфических цитотоксических Т-лимфоцитов и плазменной нагрузки вирусной РНК. Наука. 1998; 279: 2103-2106.Google Scholar 7. Шмитц Дж. Э., Курода М. Дж., Сантра С. и другие. Контроль виремии при инфицировании вирусом иммунодефицита обезьян с помощью лимфоцитов CD8 + . Наука. 1999; 283: 857-860.Google Scholar 8. Баруш Д.Х., Сантра С., Шмитц Дж. Э. и другие. Контроль за вирусом и профилактика клинического СПИДа у макак-резусов путем вакцинации ДНК, усиленной цитокинами. Наука. 2000; 290: 486-492. Google Scholar9.Rosenberg ES, Billingsley JM, Caliendo AM.и другие. Сильные ВИЧ-1-специфические CD4 + Т-клеточные ответы, связанные с контролем виремии. Наука. 1997; 278: 1447-1450.Google Scholar 10. Летвин Н.Л. Прогресс в разработке вакцины против ВИЧ-1. Наука. 1998; 280: 1875-1880.Google Scholar 11. Дай С, Шееле С., Доли П. и другие. Глобальное бремя туберкулеза: оценочная заболеваемость, распространенность и смертность по странам. JAMA. 1999; 282: 677-686. Google Scholar, 12. Лукас С.Б., Хунноу А., Пикок К.и другие. Смертность и патология ВИЧ-инфекции в западноафриканском городе. СПИД. 1993; 7: 1569-1579. Google Scholar 13.МакКинни Дж. Д., Джейкобс-младший В. Р., Блум Б. Сохраняющиеся проблемы при туберкулезе. В: Fauci A, Krause RM, eds. Новые инфекции. Лондон, Англия: Academic Press; 1998: 51-146.
14.Blower SM, Small PM, Hopewell PC. Стратегии борьбы с эпидемиями туберкулеза: новые модели для старых проблем. Наука. 1996; 273: 497-500.Google Scholar15.Мюррей CJ, Salomon JA. Моделирование воздействия глобальных стратегий борьбы с туберкулезом. Proc Natl Acad Sci U S. A. 1998; 95: 13881-13886.Google Scholar 16. Центры по контролю и профилактике заболеваний. Профилактика и лечение туберкулеза у больных, инфицированных вирус иммунодефицита человека: принципы терапии и пересмотренные рекомендации. MMWR Morb Mortal Wkly Rep. 1998; 47: 1-58. Google Scholar 17.Основы эффективной борьбы с туберкулезом. Женева, Швейцария: Всемирная организация здравоохранения; 1994 г.Документ WHO / TB / 94.179.
18.Bloom BR, Fine PEM. Опыт BCG: значение для будущих вакцин против туберкулеза. В: Блум Б.Р., изд. Туберкулез: патогенез, защита & Контроль. Вашингтон, округ Колумбия: ASM Press; 1994: 531-557.
19.Hart PD. Эффективность и применимость массовой вакцинации БЦЖ при туберкулезе контроль. BMJ. 1967; 1: 587-592.Google Scholar20.Baily GV. Испытание по профилактике туберкулеза, Мадрас. Indian J Med Res. 1980; 72 (доп.): 1-74.Google Scholar23.Young DB. Текущая разработка противотуберкулезной вакцины. Clin Infect Dis. 2000; (приложение 3): S254-S256.Google Scholar24.Lowrie DB, Tascon RE, Bonato VL. и другие. Терапия туберкулеза мышей ДНК-вакцинацией. Природа. 1999; 400: 269-271.Google Scholar 25.Сакс Дж. Д., Спилман А. Экономика малярии. Женева, Свитерцланд: Всемирная организация здравоохранения. Под давлением.
26. Миллер Л.Х., Хоффман С.Л. Исследования в отношении вакцин против малярии. Nat Med. 1998; 4: 520-524.Google Scholar 27.Hoffman SL. Разработка вакцины против малярии: мультииммунный ответ Подход. Вашингтон, округ Колумбия: Американское общество микробиологии Press; 1996.
28. Nussenzweig V, Nussenzweig RS. Циркумспорозоитные белки малярийных паразитов. Cell. 1985; 42: 401-403. Google Scholar, 29.Stoute JA, Slaoui M, Heppner DG. и другие. Предварительная оценка рекомбинантного белка циркумспорозоита вакцина против малярии Plasmodium falciparum . N Engl J Med. 1997; 336: 86-91.Google Scholar 30.Stoute JA, Kester KE, Krzych U. и другие. Долгосрочная эффективность и иммунные ответы после иммунизации вакцина против малярии RTS, S. J Infect Dis. 1998; 178: 1139-1144.Google Scholar, 31. Холдер А.А., Фриман Р.Р. Иммунизация против малярии грызунов на стадии крови с использованием очищенных паразитов антигены. Природа. 1981; 294: 361-364.Google Scholar 32. Патарройо М.Э., Амадор Р., Клавихо П. и другие. Синтетическая вакцина защищает людей от заражения бесполым стадия малярии Plasmodium falciparum в крови. Природа. 1988; 332: 158-161. Google Scholar 33. Wang R, Doolan DL, Le TP. и другие. Индукция антиген-специфических цитотоксических Т-лимфоцитов у человека путем ДНК-вакцина против малярии. Наука. 1998; 282: 476-480. Google Scholar, 34. Седегах М., Вайс В., Сакчи Дж. Б. и другие. Повышение защитного иммунитета, индуцированного иммунизацией на основе ДНК: прайминг с антигеном и плазмидной ДНК, кодирующей GM-CSF, и усиление экспрессией антигена рекомбинантный поксвирус. J Immunol. 2000; 164: 5905-5912.Google Scholar 35.Hoffman SL, Doolan DL. Могут ли ДНК-вакцины против малярии сами по себе быть такими же иммуногенными и защитными? как первичный буст-подход к иммунизации? В: Brown F, Cichutek K, Robertson J, eds. Развитие и клинический прогресс ДНК-вакцин. Базель, Швейцария: Каргер; 2000: 121-132.
36.Schneider J, Gilbert SC, Blanchard TJ. и другие. Повышенная иммуногенность для индукции CD8 + Т-клеток и полной защитная эффективность ДНК-вакцинации против малярии путем усиления модифицированной вакциной вирус Анкары. Nat Med. 1998; 4: 397-402. Google Scholar, 37. Гарднер MJ, Tettelin H, Carucci DJ. и другие. Последовательность хромосомы 2 малярийного паразита человека Plasmodium falciparum . Наука. 1998; 282: 1126-1132.Google Scholar 38: Боуман С., Лоусон Д., Бэшем Д. и другие. Полная нуклеотидная последовательность хромосомы 3 Plasmodium falciparum . Природа. 1999; 400: 532-538.Google Scholar 39. Hoffman SL, Rogers WO, Carucci DJ, Venter JC. От геномики к вакцинам: малярия как модельная система. Nat Med. 1998; 4: 1351-1353. Google ScholarCOVID-19 и ВИЧ
Несмотря на то, что они были разработаны очень быстро, клинические испытания вакцин-кандидатов COVID-19 проводились в соответствии с теми же стандартами, включая стандарты безопасности, что и другие клинические испытания. Все вакцины против COVID-19, разрешенные к использованию, прошли этап исследования 3 и признаны безопасными и эффективными. Строгие регулирующие органы одобрили их для использования среди населения.
Люди, живущие с ВИЧ, приняли участие в испытаниях большинства кандидатов на вакцину против COVID-19, в том числе разработанных Pfizer-BioNTech, Moderna и Национальными институтами здравоохранения, AstraZeneca и Оксфордским университетом, Johnson & Johnson, Novavax и Sanofi- GlaxoSmithKline.В большинстве испытаний, участниками которых не были люди, живущие с ВИЧ, изучаются вакцины, аналогичные вакцинам, которые уже были протестированы на людях, живущих с ВИЧ. Поэтому считается, что они безопасны для людей, живущих с ВИЧ.
Доказано, что одобренные в настоящее время вакцины безопасны и эффективны для предотвращения болезней. Это означает, что подавляющее большинство вакцинированных людей не заболели COVID-19. Однако ни одна вакцина не обладает 100% эффективностью, и уровни эффективности варьировались в клинических испытаниях различных вакцин.Большинству вакцин также требуется две дозы для достижения этой эффективности и обеспечения более длительного действия иммунитета, индуцированного вакциной. В некоторых исследуемых вакцинах в настоящее время используется одна доза.
Люди, живущие с ВИЧ, которые получают эффективное лечение с помощью АРВ-терапии, могут иметь незначительный иммунодефицит и хроническое воспаление, которые могут повлиять на восприимчивость к SARS-CoV-2, риск тяжелого заболевания от COVID-19 и реакцию на вакцины против SARS-CoV-2.
Британская ассоциация по борьбе с ВИЧ (BHIVA) заявляет, что люди с ВИЧ, независимо от того, получают ли они антиретровирусные препараты или нет, могут не реагировать на вакцины COVID-19 так же хорошо, возможно потому, что у людей, живущих с ВИЧ, может быть более слабый иммунный ответ, чем у людей, живущих с ВИЧ. отрицательный.BHIVA отслеживает все доказательства, касающиеся COVID-19 и ВИЧ, и при необходимости обновит свои рекомендации.
Нет никаких опасений по поводу безопасности вакцин против COVID-19, взаимодействующих с АРВ-препаратами, или против АРВ-вакцин, влияющих на вакцины против COVID-19.
Иммунология и неуловимая вакцина против СПИДа
Rerks-Ngarm, S. et al. Вакцинация ALVAC и AIDSVAX для предотвращения заражения ВИЧ-1 в Таиланде. N. Engl. J. Med. 361 , 2209–2220 (2009) Первое испытание вакцины против ВИЧ для человека, показавшее снижение заражения ВИЧ после иммунизации, которое состояло из комбинации четырех первичных доз рекомбинантного вектора канареек и двух бустерных инъекций рекомбинантного gp120 ВИЧ. .
CAS PubMed Google ученый
Buchbinder, S.P. et al. Оценка эффективности вакцины против ВИЧ-1 с клеточным иммунитетом (Step Study): двойное слепое рандомизированное плацебо-контролируемое испытание концепции. Ланцет 372 , 1881–1893 (2008)
CAS PubMed PubMed Central Google ученый
МакЭлрат, М.J. et al. Иммунитет, индуцированный вакциной против ВИЧ-1, в тестовом поэтапном исследовании: когортный анализ. Ланцет 372 , 1894–1905 (2008)
CAS PubMed PubMed Central Google ученый
Gilbert, P. B. et al. Корреляция между иммунологическими ответами на вакцину с рекомбинантным гликопротеином 120 и заболеваемостью ВИЧ-1 в фазе 3 испытания превентивной вакцины против ВИЧ-1. J. Infect. Дис. 191 , 666–677 (2005)
CAS PubMed Google ученый
Альтфельд, М.и другие. Суперинфекция ВИЧ-1, несмотря на широкие Т-клеточные ответы CD8 + , содержащие репликацию первичного вируса. Nature 420 , 434–439 (2002)
ADS CAS PubMed Google ученый
Haase, A. T. Нацеливание на раннюю инфекцию для предотвращения передачи ВИЧ-1 через слизистые оболочки. Nature 10.1038 / nature08757 (этот выпуск)
Liu, J. et al. Иммунный контроль заражения SIV с помощью вакцины на основе Т-клеток у макак-резусов. Nature 457 , 87–91 (2009)
ADS CAS PubMed Google ученый
Wilson, N.A. et al. Клеточные ответы, индуцированные вакциной, контролируют репликацию вируса иммунодефицита обезьян после гетерологичного заражения. J. Virol. 83 , 6508–6521 (2009)
CAS PubMed PubMed Central Google ученый
Хансен, С.G. et al. Ответы эффекторных Т-клеток памяти связаны с защитой макак-резусов от заражения обезьяньим вирусом иммунодефицита слизистой оболочки. Nature Med. 15 , 293–299 (2009) Постоянная эффекторная память CD4 и CD8 Т-клеточные ответы были индуцированы у обезьян CMV-векторами, экспрессирующими SIV Gag, Rev-Tat-Nef и Env, и после повторного интраректального заражения низкой дозой с помощью SIV, 4 из 12 иммунизированных обезьян были защищены от системного распространения инфекции.
CAS PubMed Google ученый
Коэн, М.С., Хеллманн, Н., Леви, Дж. А., Декок, К. и Ланге, Дж. Распространение, лечение и профилактика ВИЧ-1: эволюция глобальной пандемии. J. Clin. Инвестировать. 118 , 1244–1254 (2008)
CAS PubMed PubMed Central Google ученый
Кронер, Б. Л., Розенберг, П. С., Аледорт, Л. М., Алворд, В. Г. и Гёдерт, Дж. Дж. Заболеваемость ВИЧ-1 среди лиц с гемофилией в Соединенных Штатах и Западной Европе, 1978–1990 гг.Многоцентровое когортное исследование гемофилии. J. Acquir. Иммунодефицит. Syndr. 7 , 279–286 (1994)
CAS PubMed Google ученый
Fowke, K. R. et al. Устойчивость к ВИЧ-1-инфекции среди постоянно серонегативных проституток в Найроби, Кения. Ланцет 348 , 1347–1351 (1996)
CAS PubMed Google ученый
Салазар-Гонсалес, Дж.F. et al. Генетическая идентичность, биологический фенотип и пути эволюции вирусов-основателей / вирусов-основателей при острой и ранней инфекции ВИЧ-1. J. Exp. Med. 206 , 1273–1289 (2009)
CAS PubMed PubMed Central Google ученый
Дикс, С. Г. и Уокер, Б. Д. Контроллеры вируса иммунодефицита человека: механизмы надежного вирусного контроля в отсутствие антиретровирусной терапии. Иммунитет 27 , 406–416 (2007)
CAS PubMed Google ученый
Дюваль, М.G. et al. Поддержание ВИЧ-специфических CD4 + Т-клеток помогает отличить ВИЧ-2 от инфекции ВИЧ-1. J. Immunol. 176 , 6973–6981 (2006)
CAS PubMed Google ученый
Sodora, D. L. et al. На пути к вакцине против СПИДа: уроки естественного заражения вирусом обезьяньего иммунодефицита африканских приматов-хозяев. Nature Med. 15 , 861–865 (2009)
CAS PubMed Google ученый
Мартин, М.P. et al. Врожденное партнерство подтипов HLA-B и KIR3DL1 против ВИЧ-1. Nature Genet. 39 , 733–740 (2007)
CAS PubMed Google ученый
Наканиши, Ю., Лу, Б., Джерард, К. и Ивасаки, А. CD8 + Мобилизация Т-лимфоцитов в инфицированную вирусом ткань требует помощи Т-лимфоцитов CD4 + . Nature 462 , 510–513 (2009) На модели заражения HSV-2 на мышах показано, что Т-хелперные клетки CD4 контролируют миграцию Т-клеток CD8 в слизистую оболочку посредством секреции IFN-γ и индукции местная секреция хемокинов.
ADS CAS PubMed PubMed Central Google ученый
Douek, D.C. et al. ВИЧ преимущественно инфицирует ВИЧ-специфические CD4 + Т-клетки. Nature 417 , 95–98 (2002)
ADS CAS PubMed Google ученый
Клатт, Н. Р. и др. Наличие активированных CD4 + Т-клеток определяет уровень виремии у естественных SIV-инфицированных сажистых мангабей. J. Clin. Инвестировать. 118 , 2039–2049 (2008)
CAS PubMed PubMed Central Google ученый
Хасенкруг, К. Дж., Брукс, Д. М. и Диттмер, У. Критическая роль CD4 + Т-клеток в контроле репликации и распространения ретровируса у постоянно инфицированных мышей. J. Virol. 72 , 6559–6564 (1998)
CAS PubMed PubMed Central Google ученый
Virgin, H.W., Wherry, E. J. и Ahmed, R. Новое определение хронической вирусной инфекции. Ячейка 138 , 30–50 (2009)
CAS PubMed Google ученый
Matloubian, M., Concepcion, R.J. & Ahmed, R. Cd4 + Т-клетки необходимы для поддержания цитотоксических Т-клеточных ответов Cd8 + во время хронической вирусной инфекции. J. Virol. 68 , 8056–8063 (1994)
CAS PubMed PubMed Central Google ученый
Пайк, Р.и другие. Гонка между распространением ретровирусов и ответом Т-клеток CD4 + определяет исход острой инфекции дружественного вируса. J. Virol. 83 , 11211–11222 (2009)
CAS PubMed PubMed Central Google ученый
Окое, А. и др. Глубокая экспансия CD4 + / CCR5 + Т-клеток индуцируется истощением лимфоцитов CD8 + , но не учитывает ускоренный патогенез ВИО. J. Exp. Med. 206 , 1575–1588 (2009)
CAS PubMed PubMed Central Google ученый
Scheid, J. F. et al. Широкое разнообразие нейтрализующих антител, выделенных из В-клеток памяти у ВИЧ-инфицированных. Nature 458 , 636–640 (2009)
ADS CAS PubMed Google ученый
Hübner, W.и другие. Количественная трехмерная видеомикроскопия передачи ВИЧ через вирусологические синапсы Т-клеток. Наука 323 , 1743–1747 (2009)
ADS PubMed PubMed Central Google ученый
Уокер, Л. М. и др. Широкие и мощные нейтрализующие антитела от африканского донора открывают новую мишень для вакцины против ВИЧ-1. Science 326 , 285–289 (2009) Используя высокопроизводительный метод скрининга, были выделены два мощных и широко перекрестно-реактивных нейтрализующих антитела, которые нацелены на новый широко нейтрализующий эпитоп, экспрессируемый на тримерном белке оболочки и охватывающий консервативные области вариабельные петли субъединицы gp120.
ADS CAS PubMed PubMed Central Google ученый
Derdeyn, C.A. et al. Чувствительный к нейтрализации ВИЧ-1 после гетеросексуальной передачи. Наука 303 , 2019–2022 (2004)
ADS CAS PubMed Google ученый
Chen, L. et al. Структурные основы уклонения от иммунитета в месте прикрепления CD4 на gp120 ВИЧ-1. Наука 326 , 1123–1127 (2009)
ADS CAS PubMed PubMed Central Google ученый
Hessell, A. J. et al. Эффективная защита антител с низким титром от повторного заражения SHIV слизистых оболочек в низких дозах у макак. Nature Med. 15 , 951–954 (2009) Это исследование показывает, что системные антитела могут защищать слизистые оболочки от заражения лабораторными вирусными запасами, что указывает на то, что индукция системного гуморального иммунитета может ингибировать распространение ВИЧ.
CAS PubMed Google ученый
Hessell, A. J. et al. Широко нейтрализующее человеческое антитело против ВИЧ 2G12 эффективно защищает от заражения SHIV слизистой оболочки даже при низких титрах нейтрализации сыворотки. PLoS Pathog. 5 , e1000433 (2009)
PubMed PubMed Central Google ученый
Джонсон, П. Р. и др.Опосредованный вектором перенос генов обеспечивает долгоживущую нейтрализующую активность и защиту от инфекции SIV у обезьян. Nature Med. 15 , 901–906 (2009)
CAS PubMed Google ученый
Nelson, S. et al. Созревание вируса Западного Нила модулирует чувствительность к нейтрализации, опосредованной антителами. PLoS Pathog. 4 , e1000060 (2008) Это исследование показывает, что различия в форме вирусных гликопротеинов на поверхности оболочечного вируса, возникающие во время морфогенеза вируса, могут быть решающим фактором, определяющим степень нейтрализации вируса.
PubMed PubMed Central Google ученый
Квонг, П. Д. и Уилсон, И. А. Антитела к ВИЧ-1 и гриппу: взгляд на антигены по-новому. Nature Immunol. 10 , 573–578 (2009)
CAS Google ученый
Hessell, A. J. et al. Рецептор Fc, но не связывание комплемента, важно для защиты антител от ВИЧ. Nature 449 , 101–104 (2007) Это исследование привлекает внимание к тому факту, что in vivo эффекты антител, полученных с помощью вакцины, могут зависеть от взаимодействий между молекулами антител и рецепторами Fc.
ADS CAS PubMed Google ученый
Мессер, Р. Дж., Диттмер, У., Петерсон, К. Э. и Хасенкруг, К. Дж. Важная роль нейтрализующих вирусов антител в стерилизации иммунитета против ретровирусной инфекции Друга. Proc. Natl Acad. Sci. США 101 , 12260–12265 (2004)
ADS CAS PubMed Google ученый
Тайлер, К. Л., Манн, М. А., Филдс, Б. Н. и Вирджин, Х. У. Защитные моноклональные антитела против реовируса и их влияние на вирусный патогенез. J. Virol. 67 , 3446–3453 (1993)
CAS PubMed PubMed Central Google ученый
Мехлхоп, Э.и другие. Активация комплемента необходима для индукции защитного ответа антител против инфекции вируса Западного Нила. J. Virol. 79 , 7466–7477 (2005)
CAS PubMed PubMed Central Google ученый
Макклеллан, К. Б., Гангаппа, С., Спек, С. Х. и Вирджин, Х. В. Антитело-независимый контроль латентности гамма-герпесвируса посредством индукции В-клетками противовирусных Т-клеточных ответов. PLoS Pathog. 2 , e58 (2006)
PubMed PubMed Central Google ученый
Хасенкруг, К. Дж., Брукс, Д. М. и Чезебро, Б. Пассивная иммунотерапия ретровирусного заболевания: влияние типа главного комплекса гистосовместимости и реакции Т-клеток. Proc. Natl Acad. Sci. США 92 , 10492–10495 (1995)
ADS CAS PubMed Google ученый
Kiepiela, P.и другие. CD8 + Т-клеточные ответы на различные белки ВИЧ имеют противоречивые ассоциации с вирусной нагрузкой. Nature Med. 13 , 46–53 (2007)
CAS PubMed Google ученый
Chung, C. et al. Не все цитокин-продуцирующие Т-клетки CD8 + подавляют репликацию вируса иммунодефицита обезьян. J. Virol. 81 , 1517–1523 (2007)
CAS PubMed Google ученый
Чен, Х.и другие. Дифференциальная нейтрализация репликации вируса иммунодефицита человека (ВИЧ) в аутологичных Т-лимфоцитах CD4 ВИЧ-специфическими цитотоксическими Т-лимфоцитами. J. Virol. 83 , 3138–3149 (2009) Это исследование показывает, что CD8 Т-клетки широко различаются по своей способности ингибировать репликацию ВИЧ в анализе in vitro , что указывает на то, что большая часть ответа Т-лимфоцитов CD8 при хронической инфекции может быть неактуальным.
CAS PubMed PubMed Central Google ученый
День, С.L. et al. Экспрессия PD-1 на ВИЧ-специфических Т-клетках связана с истощением Т-клеток и прогрессированием заболевания. Nature 443 , 350–354 (2006)
ADS CAS PubMed Google ученый
Petrovas, C. et al. PD-1 является регулятором вирус-специфической выживаемости Т-лимфоцитов CD8 + при ВИЧ-инфекции. J. Exp. Med. 203 , 2281–2292 (2006)
CAS PubMed PubMed Central Google ученый
Траутманн, Л.и другие. Повышение экспрессии PD-1 на ВИЧ-специфических Т-клетках CD8 + приводит к обратимой иммунной дисфункции. Nature Med. 12 , 1198–1202 (2006)
CAS PubMed Google ученый
Кауфманн, Д. Э. и др. Повышенная регуляция CTLA-4 ВИЧ-специфическими CD4 + Т-клетками коррелирует с прогрессированием заболевания и определяет обратимую иммунную дисфункцию. Nature Immunol. 8 , 1246–1254 (2007)
CAS Google ученый
Querec, T.D. et al. Подход системной биологии предсказывает иммуногенность вакцины против желтой лихорадки у людей. Nature Immunol. 10 , 116–125 (2009) Это исследование показывает, что ряд ранее неизвестных путей связан с эффективными иммунными ответами, индуцированными вакциной против вируса желтой лихорадки, потенциально изменяя то, как мы определяем эффективные ответы и измеряем корреляты иммунитета.
CAS Google ученый
Мойр, С.и другие. Доказательства истощения связанных с ВИЧ В-клеток в дисфункциональном компартменте В-клеток памяти у ВИЧ-инфицированных виремических людей. J. Exp. Med. 205 , 1797–1805 (2008)
CAS PubMed PubMed Central Google ученый
Moir, S. & Fauci, A. S. B-клетки при ВИЧ-инфекции и заболеваниях. Nature Rev. Immunol. 9 , 235–245 (2009)
CAS Google ученый
Брукс, Д.Дж., Ли, А. М., Эльзессер, Х., МакГаверн, Д. Б. и Олдстон, М. Б. Блокада ИЛ-10 облегчает Т-клеточные ответы, индуцированные ДНК-вакциной, и улучшает выведение стойких вирусных инфекций. J. Exp. Med. 205 , 533–541 (2008)
CAS PubMed PubMed Central Google ученый
Brooks, D. G. et al. IL-10 и PD-L1 действуют разными путями, подавляя активность Т-клеток во время стойкой вирусной инфекции. Proc. Natl Acad. Sci. США 105 , 20428–20433 (2008)
ADS CAS Google ученый
Tinoco, R., Alcalde, V., Yang, Y., Sauer, K. & Zuniga, EI. Внутренняя передача сигналов трансформирующего фактора роста β в клетке опосредует вирус-специфические делеции CD8 + T-клеток и вирусные персистентность in vivo . Иммунитет 31 , 145–157 (2009)
CAS PubMed PubMed Central Google ученый
Fröhlich, A.и другие. IL-21R на Т-клетках имеет решающее значение для устойчивого функционирования и контроля хронической вирусной инфекции. Наука 324 , 1576–1580 (2009)
ADS Google ученый
Elsaesser, H., Sauer, K. & Brooks, D. G. IL-21 необходим для борьбы с хронической вирусной инфекцией. Наука 324 , 1569–1572 (2009)
ADS CAS PubMed PubMed Central Google ученый
Йи, Дж.С., Ду, М. и Зайак, А. Дж. Жизненно важная роль интерлейкина-21 в контроле хронической вирусной инфекции. Наука 324 , 1572–1576 (2009)
ADS CAS PubMed PubMed Central Google ученый
Barber, D. L. et al. Восстановление функции истощенных CD8 Т-лимфоцитов во время хронической вирусной инфекции. Nature 439 , 682–687 (2006)
ADS CAS PubMed Google ученый
Велу, В.и другие. Повышение ВИО-специфического иммунитета in vivo путем блокады PD-1. Nature 458 , 206–210 (2008)
ADS PubMed PubMed Central Google ученый
Ha, S. J. et al. Усиление терапевтической вакцинации путем блокирования ингибирующих сигналов, опосредованных PD-1, во время хронической инфекции. J. Exp. Med. 205 , 543–555 (2008)
CAS PubMed PubMed Central Google ученый
Араки, К.и другие. mTOR регулирует дифференцировку Т-лимфоцитов CD8. Nature 460 , 108–112 (2009) Показано, что введение «иммунодепрессивного» препарата рапамицина усиливает ответы Т-клеток памяти, что повышает вероятность того, что сочетание фармакологического и вакцинного подходов может повысить иммунитет.
ADS CAS PubMed PubMed Central Google ученый
Лу, В., Арраес, Л. К., Феррейра, В.T. & Andrieu, J.M. Терапевтическая вакцина на основе дендритных клеток от хронической инфекции ВИЧ-1. Nature Med. 10 , 1359–1365 (2004)
CAS PubMed Google ученый
Лунд, Дж. М., Хсинг, Л., Фам, Т. и Руденский, А. Ю. Координация раннего защитного иммунитета против вирусной инфекции с помощью регуляторных Т-клеток. Наука 320 , 1220–1224 (2008)
ADS CAS PubMed PubMed Central Google ученый
Чжу, Дж.и другие. Вирус-специфические CD8 + Т-клетки накапливаются возле сенсорных нервных окончаний в коже половых органов во время субклинической реактивации ВПГ-2. J. Exp. Med. 204 , 595–603 (2007)
CAS PubMed PubMed Central Google ученый
Gebhardt, T. et al. Т-клетки памяти в нелимфоидной ткани, которые обеспечивают повышенный местный иммунитет во время заражения вирусом простого герпеса. Nature Immunol. 10 , 524–530 (2009) Это исследование предполагает, что могут иметь место тканеспецифические события, которые контролируют долгосрочное присутствие иммунных лимфоцитов в данном месте.
CAS Google ученый
Чачу, К. А., Лобуэ, А. Д., Стронг, Д. В., Барик, Р. С. и Вирджин, Х. У. Иммунные механизмы, ответственные за вакцинацию против инфекции слизистых оболочек и лимфатических норовирусов и очищение от них. PLoS Pathog. 4 , e1000236 (2008)
PubMed PubMed Central Google ученый
Paavonen, J. et al. Эффективность вакцины с адъювантом вируса папилломы человека (ВПЧ) -16/18 AS04 против инфекции шейки матки и предрака, вызванного онкогенными типами ВПЧ (PATRICIA): окончательный анализ двойного слепого рандомизированного исследования с участием молодых женщин. Ланцет 374 , 301–314 (2009)
CAS PubMed Google ученый
Кауфман, Д.R. et al. Перенос антиген-специфических Т-лимфоцитов CD8 + на поверхности слизистой оболочки после внутримышечной вакцинации. J. Immunol. 181 , 4188–4198 (2008)
CAS PubMed PubMed Central Google ученый
Barton, E. S. et al. Латентный период вируса герпеса обеспечивает симбиотическую защиту от бактериальной инфекции. Nature 447 , 326–329 (2007)
ADS CAS PubMed Google ученый
Вайанд, М.S. et al. Защита живым ослабленным вирусом иммунодефицита обезьян от гетерологичного заражения. J. Virol. 73 , 8356–8363 (1999)
CAS PubMed PubMed Central Google ученый
Бренчли, Дж. М. и др. Микробная транслокация является причиной системной иммунной активации при хронической ВИЧ-инфекции. Nature Med. 12 , 1365–1371 (2006)
CAS PubMed Google ученый
Slack, E.и другие. Врожденный и адаптивный иммунитет гибко взаимодействуют, чтобы поддерживать мутуализм между хозяином и микробиотой. Наука 325 , 617–620 (2009)
ADS CAS PubMed PubMed Central Google ученый
Nix, W. A., Jiang, B., Maher, K., Strobert, E. & Oberste, M. S. Идентификация энтеровирусов у естественно инфицированных приматов, содержащихся в неволе. J. Clin. Microbiol. 46 , 2874–2878 (2008)
CAS PubMed PubMed Central Google ученый
Финкбайнер, С.R. et al. Метагеномный анализ диареи человека: обнаружение и открытие вирусов. PLoS Pathog. 4 , e1000011 (2008)
PubMed PubMed Central Google ученый
McKenna, P. et al. Микробиом кишечника макаки в норме, лентивирусная инфекция и хронический энтероколит. PLoS Pathog. 4 , e20 (2008)
PubMed PubMed Central Google ученый
Иванов, И.I. et al. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Ячейка 139 , 485–498 (2009)
CAS PubMed PubMed Central Google ученый
Корбер Б. Т., Летвин Н. Л. и Хейнс Б. Ф. Стратегии Т-клеточной вакцины против вируса иммунодефицита человека, вируса с тысячей лиц. J. Virol. 83 , 8300–8314 (2009)
CAS PubMed PubMed Central Google ученый
Кил, Б.F. et al. Идентификация и характеристика передаваемых и ранних оболочек вируса-основателя при первичной инфекции ВИЧ-1. Proc. Natl Acad. Sci. США 105 , 7552–7557 (2008)
ADS CAS PubMed Google ученый
Виннуцци, М., Стоун, Дж. К., Арнольд, Дж. Дж., Камерон, К. Э. и Андино, Р. Разнообразие квазивидов определяет патогенез через кооперативные взаимодействия в вирусной популяции. Nature 439 , 344–348 (2006) В этом исследовании утверждается, что квазивиды вируса действуют in vivo , придавая вирусу патогенетические свойства, что указывает на то, что квазивиды вирусов играют роль в патогенезе, помимо иммунного. побег.
ADS CAS PubMed Google ученый
Draenert, R. et al. Ограничения на эволюцию и иммунодоминирование ВИЧ-1 выявлены у взрослых монозиготных близнецов, инфицированных одним и тем же вирусом. J. Exp. Med. 203 , 529–539 (2006)
CAS PubMed PubMed Central Google ученый
Мур, К. Б. и др. Доказательства адаптации ВИЧ-1 к HLA-ограниченным иммунным ответам на популяционном уровне. Наука 296 , 1439–1443 (2002)
ADS CAS PubMed Google ученый
Brumme, Z. L.и другие. HLA-ассоциированные пути иммунного ускользания в белках Gag, Pol и Nef ВИЧ-1 подтипа B. PLoS One 4 , e6687 (2009)
ADS PubMed PubMed Central Google ученый
Miura, T. et al. Элитные контроллеры вируса иммунодефицита человека типа 1 HLA-B57 / B * 5801 отбирают редкие варианты gag, связанные со сниженной репликационной способностью вируса и сильным распознаванием цитотоксических Т-лимфоцитов. Дж.Virol. 83 , 2743–2755 (2009)
CAS PubMed Google ученый
Тройер, Р. М. и др. Влияние мутаций ускользания ВИЧ-1 на приспособленность к ответу цитотоксических Т-лимфоцитов (CTL) варьируется. PLoS Pathog. 5 , e1000365 (2009)
PubMed PubMed Central Google ученый
Schneidewind, A. et al. Структурные и функциональные ограничения ограничивают возможности выхода цитотоксических Т-лимфоцитов в иммунодоминантном HLA-B27-ограниченном эпитопе в капсиде вируса иммунодефицита человека 1 типа. J. Virol. 82 , 5594–5605 (2008)
CAS PubMed PubMed Central Google ученый
Goepfert, P.A. et al. Передача иммунных мутаций ускользания от Gag ВИЧ-1 связана со снижением вирусной нагрузки у связанных реципиентов. J. Exp. Med. 205 , 1009–1017 (2008)
CAS PubMed PubMed Central Google ученый
Аллен Т.M. et al. Селекция, передача и реверсия мутации ускользания цитотоксических Т-лимфоцитов процессинга антигена при инфекции вируса иммунодефицита человека 1 типа. J. Virol. 78 , 7069–7078 (2004)
CAS PubMed PubMed Central Google ученый
Goonetilleke, N. et al. Первый Т-клеточный ответ на переданный вирус / вирус-основатель способствует контролю острой виремии при ВИЧ-1-инфекции. J. Exp. Med. 206 , 1253–1272 (2009)
CAS PubMed PubMed Central Google ученый
Schneidewind, A. et al. Передача и долговременная стабильность компенсированных мутаций ускользания CD8. J. Virol. 83 , 3993–3997 (2009)
CAS PubMed Google ученый
Fischer, W. et al. Поливалентные вакцины для оптимального охвата потенциальных Т-клеточных эпитопов в глобальных вариантах ВИЧ-1. Nature Med. 13 , 100–106 (2007)
CAS PubMed Google ученый
Neil, S. & Bieniasz, P. ВИЧ, факторы ограничения и интерферон. J Интерферон. Цитокин. Res. 29 , 569–80 (2009)
CAS PubMed PubMed Central Google ученый
Bushman, F. D. et al. Факторы клетки-хозяина в репликации ВИЧ: метаанализ полногеномных исследований. PLoS Pathog. 5 , e1000437 (2009)
PubMed PubMed Central Google ученый
Santiago, M. L. et al. Apobec3 кодирует Rfv3, ген, влияющий на нейтрализующие антитела, контролирующие ретровирусную инфекцию. Наука 321 , 1343–1346 (2008)
ADS CAS PubMed PubMed Central Google ученый
Шихи, А.М., Гаддис, Н. С., Чой, Дж. Д. и Малим, М. Х. Выделение человеческого гена, который ингибирует инфекцию ВИЧ-1 и подавляется вирусным белком Vif. Nature 418 , 646–650 (2002)
ADS CAS PubMed Google ученый
Sheehy, A.M, Gaddis, N.C. и Malim, M.H. Антиретровирусный фермент APOBEC3G расщепляется протеасомой в ответ на ВИЧ-1 Vif. Nature Med. 9 , 1404–1407 (2003)
CAS PubMed Google ученый
Диносо, Дж.B. et al. Модель макаки, инфицированной вирусом иммунодефицита обезьян, для изучения вирусных резервуаров, которые сохраняются во время высокоактивной антиретровирусной терапии. J. Virol. 83 , 9247–9257 (2009)
CAS PubMed PubMed Central Google ученый
Blazkova, J. et al. CpG-метилирование контролирует реактивацию ВИЧ с латентного периода. PLoS Pathog. 5 , e1000554 (2009)
PubMed PubMed Central Google ученый
Чжан Дж.X., Дил, Г. Э. и Литтман, Д. Р. Снятие прединтеграционного ингибирования и характеристика дополнительных блоков репликации ВИЧ в первичных Т-клетках мыши. PLoS One 3 , e2035 (2008)
ADS PubMed PubMed Central Google ученый
Hatziioannou, T. et al. Макака, модель инфекции ВИЧ-1. Proc. Natl Acad. Sci. США 106 , 4425–4429 (2009)
ADS CAS PubMed Google ученый
Тиббетс, С.А., Ван Дайк, Л., Спек, С. Х. и Вирджин, Х. В. Иммунный контроль количества и фенотипа реактивации клеток, латентно инфицированных гамма-герпесвирусом. J. Virol. 76 , 7125–7132 (2002)
CAS PubMed PubMed Central Google ученый
Филдс, Б. Н. СПИД: время обратиться к фундаментальной науке. Nature 369 , 95–96 (1994)
ADS CAS PubMed Google ученый
Фаучи, А.S. et al. Исследования вакцины против ВИЧ: путь вперед. Наука 321 , 530–532 (2008)
ADS CAS PubMed Google ученый
Moderna начинает испытания двух экспериментальных вакцин против ВИЧ на людях | Умные новости
Испытания будут проверять безопасность двух экспериментальных вакцин и то, насколько хорошо они стимулируют широкий спектр антител против ВИЧ в организме. На фото: ВИЧ-инфицированная Т-клетка.НИАИДФармацевтическая и биотехнологическая компания Moderna может начать клинические испытания на людях двух новых вакцин против ВИЧ на основе мРНК уже 19 сентября, согласно отчету об исследовании, размещенному в реестре клинических испытаний Национального института здравоохранения США.
Вакцины будут использовать механизм, аналогичный новаторской системе мРНК в вакцине против Covid-19, сообщает Science Alert из Фиона Макдональд. Ожидается, что исследование состоится до мая 2023 года.
В течение нескольких лет ученые изучали эффективность и потенциал мРНК-вакцин для лечения рака и других заболеваний на животных моделях. Вакцины Pfizer-BioNTech и Moderna Covid-19 были первыми мРНК-вакцинами, использованными для людей. Вакцины с мРНК работают, давая клеткам инструкции производить части тех же белков на внешней оболочке вируса. Затем белки заставляют иммунные клетки распознавать и уничтожать вирус, сообщает Сара Чодош для Popular Science .
Исследователи подозревают, что для создания достаточно сильного иммунного ответа для защиты от ВИЧ потребуется несколько вакцин. ВИЧ или вирус иммунодефицита человека — это ретровирус, который атакует иммунную систему организма. По словам Сэмюэля Ловетта для Independent , его трудно предотвратить, потому что он имеет похожий на шип протеин, покрытый сахароподобным остатком, который позволяет ему прятаться от антител при попадании в организм. В настоящее время нет лекарства от ВИЧ, только лекарства, замедляющие его прогрессирование.
Создание вакцины, нацеленной на ВИЧ, является сложной задачей, поскольку ретровирус становится частью генома человека через 72 часа после передачи. Чтобы предотвратить инфекцию, во время передачи должен присутствовать высокий уровень нейтрализующих антител, согласно Popular Science .
Ученые оценит количество В-клеток у каждого участника исследования. В-клетки, также известные как В-лимфоциты, представляют собой тип белых кровяных телец, которые помогают бороться с бактериальными и вирусными инфекциями. «Вакцины предназначены для примирования В-клеток, которые могут продуцировать bnAbs, тип очень мощных нейтрализующих антител», — объясняет Кари Янгдал, представитель Международной инициативы по вакцинам против СПИДа (IAVI).
В прошлом исследовании использовалась система вакцины без мРНК, и у 97 процентов участников действительно развился иммунный ответ, сообщает Popular Science . Хотя исследование еще не было разработано, чтобы привести к защитному иммунному ответу, исследование действительно показало, что очищенная белковая вакцина может стимулировать редкие В-клетки очень специфическим образом, говорит Янгдал.
«Мы и другие ученые много лет назад постулировали, что для того, чтобы индуцировать bnAb, вы должны запустить процесс, запустив правильные В-клетки — клетки, которые обладают особыми свойствами, дающими им возможность развиваться в клетки, секретирующие bnAb», — говорит Уильям Шиф, иммунолог Scripps Research и исполнительный директор по разработке вакцины в Центре нейтрализующих антител IAVI в заявлении о предыдущем исследовании.«В этом испытании клетки-мишени составляли лишь примерно одну из миллиона всех наивных В-клеток. Чтобы получить правильный ответ антител, нам сначала нужно праймировать правильные В-клетки. Данные этого испытания подтверждают способность иммуногена вакцины делать это ».
Новая система вакцины против ВИЧ с мРНКModerna может помочь решить эту проблему, за счет примирования «В-клеток, которые могут продуцировать bnAb», — объясняет Янгдал. Нейтрализующие антитела воздействуют на оболочку вируса — его внешний слой, который защищает его генетический материал, — чтобы не дать вирусу проникнуть в клетки и заразить их.Эти антитела также могут быть нацелены на несколько вариантов ВИЧ.
В ходе испытаний будет проверена безопасность двух экспериментальных вакцин. Вакцины против ВИЧ с мРНК Moderna будут первыми вакцинами такого типа, которые пройдут клинические испытания на людях, сообщает Science Alert . 56 здоровых участников в возрасте от 18 до 56 лет, не инфицированных ВИЧ, получат вакцину, сообщает Independent . Четыре группы будут частью экспериментальных испытаний: две группы получат смесь вакцин, а две другие группы получат только одну из двух вакцин.Все группы будут знать, какой тип вакцины они получают.
«Moderna тестирует сложную концепцию, которая запускает иммунный ответ против ВИЧ», — говорит Робин Шатток, иммунолог из Имперского колледжа Лондона, в интервью Independent . «Это приведет вас к первой базе, но это не хоумран. По сути, мы понимаем, что вам нужна серия вакцин, чтобы вызвать реакцию, которая даст вам широту, необходимую для нейтрализации ВИЧ. Технология мРНК может быть ключом к решению проблемы вакцины против ВИЧ, но это будет многолетний процесс.”
Примечание редактора, 27 августа 2021 г .: В предыдущей версии этой статьи неверно указывалась связь между B-клетками и bnAbs. История была отредактирована, чтобы исправить этот факт. История также была дополнена комментариями IAVI.
СПИД Здоровье ВакцинаРекомендованные видео
SARS-CoV-2 и ВИЧ-1 — сказка о двух вакцинах
Быстрая разработка вакцин против COVID-19 и их внедрение менее чем за год — это научный и медицинский триумф, который поднял ключевой вопрос.Почему у нас есть несколько вакцин против SARS-CoV-2, но нет ни одной вакцины против ВИЧ-1?
Вакцины являются основным средством профилактики инфекционных заболеваний, и их использование улучшает показатели выживаемости, защищает сообщества от новых инфекционных агентов и способствует продуктивности общества. Основным компонентом защитного иммунитета, индуцированного вакциной, для большинства вирусных инфекций являются нейтрализующие антитела, хотя ненейтрализующие антитела и Т-клетки CD8 + могут повысить эффективность защиты вакцины.В декабре 2019 года ВОЗ была уведомлена о кластере вирусной пневмонии неизвестного происхождения, а в январе 2020 года был опубликован первый черновой вариант генома возбудителя SARS-CoV-2. К концу 2020 года несколько SARS-CoV. Разработано 2 вакцины. Два из них показали эффективность ~ 95% в предотвращении симптоматического COVID-19 в исследованиях эффективности фазы III и получили одобрение FDA для развертывания в рамках разрешения на экстренное использование до конца года. Напротив, четыре десятилетия назад, летом 1981 года, были описаны первые люди с так называемым синдромом приобретенного иммунодефицита (СПИД), а в 1983 году был выделен этиологический агент СПИДа, ВИЧ-1, — все же , у нас до сих пор нет вакцины против ВИЧ-1, которая защищает от ВИЧ-1 в глобальном масштабе.Критический вопрос: «Почему вакцина против SARS-CoV-2 была изготовлена так быстро, а вакцина против ВИЧ-1 — так сложно»? Ответ кроется в иммунобиологии взаимодействия вирусов с их хозяевами.
ВИЧ-1, член семейства вирусов Retroviridae, , и SARS-CoV-2, коронавирус подрода Sarbecovirus, представляют собой одноцепочечные РНК-вирусы с положительным смыслом. Однако основное различие между SARS-CoV-2 и ВИЧ-1 заключается в том, что большинство людей, инфицированных SARS-CoV-2, избавляются от вируса, в то время как у людей с ВИЧ-1 нет 1 .Это связано с тем, что SARS-CoV-2 является медленно мутирующим, неинтегрирующимся вирусом, и хозяин может полагаться на примированный вакциной вторичный иммунный ответ, чтобы очистить клетки, инфицированные SARS-CoV-2. Напротив, ВИЧ-1 интегрируется в геном хозяина в течение ~ 72 часов после передачи. К тому времени, когда разовьется вторичный иммунный ответ на ВИЧ-1, примированный вакциной, происходит необратимая инфекция с созданием латентно инфицированного Т-клеточного резервуара CD4 + со встроенной провирусной двухцепочечной ДНК. Таким образом, для успешной вакцины против ВИЧ-1 во время передачи должны присутствовать высокие уровни защитных нейтрализующих антител, чтобы полностью предотвратить инфекцию — что представляет собой очень высокую планку 2 .
Мишенью нейтрализующих антител к SARS-CoV-2 является рецептор-связывающий домен (RBD) шипового (S) гликопротеина, тогда как мишенью нейтрализующих ВИЧ-1 антител является гликопротеин оболочки (Env). Оба типа нейтрализующих антител блокируют связывание вирионов с их рецепторами — ангиотензинпревращающим ферментом 2 для SARS-CoV-2 и молекулой CD4 для ВИЧ-1. Все вакцины против COVID-19, протестированные в фазе III, индуцировали нейтрализующие антитела, нацеленные на белок S, и обладают высокой защитой от симптоматического заболевания.У обезьян корреляты защиты — это прежде всего нейтрализующие антитела 3 . Традиционные схемы первичной или первичной и бустерной вакцины с иммуногенами S-гликопротеина оказались чрезвычайно успешными в качестве вакцин против COVID-19 (рис. 1). Предыдущие работы по спайковому белку 4 ближневосточного респираторного синдрома, по модифицированной мРНК, заключенной в липидные наночастицы 5 , а также по платформам и методам исследования вакцины против ВИЧ-1 6 , позволили быстро разработать вакцину против COVID-19.
Рис. 1: Разработка вакцины против SARS-CoV-2 и ВИЧ-1.Ab, антитело; bnAb, широко нейтрализующее антитело.
Для ВИЧ-1 в ходе испытаний эффективности вакцины были протестированы две общие стратегии: индукция Т-клеток CD8 + , которые убивают ВИЧ-1-инфицированные клетки, и индукция ненейтрализующих антител, защищающих от ВИЧ-1. передача посредством Fc-рецептора-γ (FcRγ) -опосредованных противовирусных эффекторных функций. Как и антитела, нейтрализующие SARS-CoV-2, ненейтрализующие антитела к ВИЧ-1 легко индуцируются любым из ряда мономеров Env или открытых тримеров ВИЧ-1.Однако из семи испытаний эффективности вакцины против ВИЧ-1, проведенных на сегодняшний день, шесть потерпели неудачу. Седьмой, названный RV144, который проводился в Таиланде армией США, показал минимальную защиту ~ 31%, а ненейтрализующие антитела с FcRγ-опосредованными противовирусными эффекторными функциями служили коррелятами снижения риска передачи 7 . Два дополнительных испытания эффективности, направленных на индукцию защитных ненейтрализующих антител, нацеленных на Env, и Т-клеточных ответов продолжаются в надежде, что они продемонстрируют определенную степень защиты.
Тем не менее, конечной целью разработки вакцины против ВИЧ-1 является индукция широко нейтрализующих антител (bnAbs) 8 . В то время как антитела, нейтрализующие SARS-CoV-2, легко индуцируются в течение ~ 10 дней с момента появления симптомов COVID-19 и в течение 2 недель после вакцинации, bnAb ВИЧ-1 нелегко индуцируются ни вакцинацией, ни инфекцией, а возникают только в очень короткие сроки. высокие уровни у ~ 10% людей, инфицированных ВИЧ-1 после многих лет инфицирования. Препятствиями на пути индукции bnAb ВИЧ-1 являются наличие плотного и слабо иммуногенного гликанового экрана Env, молекулярная мимикрия эпитопов Env, которые вызывают перекрестную реакцию антител с белками человека, и вариабельные области петли в Env, которые могут вызывать конкурирующие не- защитные антитела.Наиболее важно то, что bnAb ВИЧ-1 обладают необычными чертами, такими как аутореактивность, участки, определяющие комплементарность длинной третьей тяжелой цепи (HCDR3), и обогащены редкими соматическими мутациями — все это делает предшественников bnAb либо очень редкими из-за делеции иммунной толерантности, либо их трудно активировать. 9,10 .
Эти необычные черты bnAb против ВИЧ-1 потребовали разработки стратегии разработки вакцины против ВИЧ-1, в первую очередь нацеленной на редкие наивные В-клеточные предшественники bnAb, чтобы расширить пул прекурсоров bnAb.Затем последовательные тримеры Env должны быть специально разработаны для отбора промежуточных членов линии B-клеток bnAb с редкими мутациями антител, которые необходимы для созревания bnAb 8,9,10 (рис. 1). Кроме того, чтобы избежать побега вируса-основателя ВИЧ-1, успешная вакцина против ВИЧ-1 должна будет индуцировать клоны В-клеток к нескольким из семи сайтов связывания bnAb на Env ВИЧ-1. Значение успешного нацеливания на зародышевые линии и последовательного дизайна иммуногена ВИЧ-1 выходит за рамки создания долгожданной вакцины против ВИЧ-1.Изучение правил безопасного управления клонами B-клеток bnAb должно улучшить разработку других сложных в изготовлении вакцин, а также извлечь уроки по предотвращению нежелательных иммунных реакций, таких как развитие патогенных аутоантител.
На создание вакцины против SARS-CoV-2 были мобилизованы чрезвычайные ресурсы и беспрецедентное глобальное сотрудничество. Научный и медицинский триумф вакцин против COVID-19 теперь вселяет в новое чувство безотлагательности этой самой сложной работы по разработке вакцины против ВИЧ-1.
История изменений
04 августа 2021 г.
Исправление к этой статье опубликовано: https://doi.org/10.1038/s41577-021-00604-0
Ссылки
- 1.
Sette , А. и Кротти, С. Адаптивный иммунитет к SARS-CoV-2 и COVID-19. Ячейка 184 , 861–880 (2021).
CAS Статья Google ученый
- 2.
МакМайкл А.Дж., Борроу П., Томарас Г.Д., Гунетиллеке Н. и Хейнс Б.Ф. Иммунный ответ во время острой инфекции ВИЧ-1: ключи к разработке вакцины. Нат. Rev. Immunol. 10 , 11–23 (2010).
CAS Статья Google ученый
- 3.
McMahan, K. et al. Корреляты защиты от SARS-CoV-2 у макак-резусов. Природа 590 , 630–634 (2021).
CAS Статья Google ученый
- 4.
Corbett, K. S. et al. Разработка вакцины на основе мРНК SARS-CoV-2 стала возможной благодаря готовности прототипа патогена. Nature 586 , 567–571 (2020).
CAS Статья Google ученый
- 5.
Парди, Н., Хоган, М. Дж. И Вайсман, Д. Последние достижения в технологии вакцины мРНК. Curr. Opin. Иммунол. 65 , 14–20 (2020).
CAS Статья Google ученый
- 6.
Семповски, Г. Д., Сондерс, К. О., Ачарья, П., Вие, К. Дж. И Хейнс, Б. Ф. Готовность к пандемии: разработка вакцин и терапевтических антител для COVID-19. Cell 181 , 1458–1463 (2020).
CAS Статья Google ученый
- 7.
Томарас, Г. Д., Плоткин, С. А. Комплексные иммунные корреляты защиты в испытаниях эффективности вакцины против ВИЧ-1. Immunol. Ред. 275 , 245–261 (2017).
CAS Статья Google ученый
- 8.
Хейнс, Б. Ф., Бертон, Д. Р. и Маскола, Дж. Р. Множественные роли широко нейтрализующих антител к ВИЧ. Sci. Transl Med. 11 , eaaz2686 (2019).
CAS Статья Google ученый
- 9.
Haynes, B.F. и Verkoczy, L. Контроль над вирусами, нейтрализующими ВИЧ. Наука 344 , 588–589 (2014).
Артикул Google ученый
- 10.
Haynes, B.F., Kelsoe, G., Harrison, S.C. и Kepler, T.B. Дизайн иммуногена B-клеточного происхождения при разработке вакцины с ВИЧ-1 в качестве тематического исследования. Нат. Biotechnol. 30 , 423–433 (2012).
CAS Статья Google ученый
Ссылки для скачивания
Благодарности
B.F.H. поддерживается NIH, NIAID, отделом СПИДа, грант AI44371 Консорциум по разработке вакцины против ВИЧ / СПИДа. Автор благодарит К. Сондерса за предоставление изображений иммуногенов ВИЧ-1 на рис. 1.
Информация об авторе
Принадлежность
Duke Human Vaccine Institute и кафедры медицины и иммунологии Медицинской школы Университета Дьюка, Дарем , NC, USA
Barton F. Haynes
Автор, ответственный за переписку
Бартон Ф.Хейнс.
Декларации этики
Конкурирующие интересы
B.F.H. имеет поданные и ожидающие рассмотрения патенты на конструкции, состав и способы их использования коронавирусных шиповых белков (патенты США №№ 63/147,998; 63/149,541; 63/167390), композиции, содержащие модифицированные оболочки ВИЧ (патент США PCT / US2018 / 034,772), и композиции, содержащие оболочки против ВИЧ, для индукции антител к ВИЧ (предварительный патент США 62/739701).
Об этой статье
Цитируйте эту статью
Haynes, B.F. SARS-CoV-2 и ВИЧ-1 — сказка о двух вакцинах. Nat Rev Immunol 21, 543–544 (2021). https://doi.org/10.1038/s41577-021-00589-w
Скачать цитату
Поделиться этой статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для общего доступаИзвините, Ссылка для совместного использования в настоящее время недоступна для этой статьи.
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Четыре десятилетия поисков вакцины против ВИЧ дают новую надежду
Когда вирусолог Хосе Эспарса начал сотрудничать с Всемирной организацией здравоохранения в борьбе с эпидемией СПИДа в 1980-х годах, он и многие его коллеги были убеждены, что вакцина станет решением. — и что это произойдет быстро.
Их оптимизм основывался на твердой науке: исследователи знали, что люди вырабатывают антитела к вирусу иммунодефицита человека, вызывающему СПИД. И побуждение организма к выработке антител уже было распространенной и успешной стратегией вакцинации, которая резко снизила количество случаев кори, оспы и многих других болезней. Борьба со СПИДом казалась столь же выполнимой.
«Мы думали, что это будет кусок пирога», — говорит Эспарза, бывший старший советник Фонда Билла и Мелинды Гейтс, который теперь является аффилированным лицом Медицинской школы Университета Мэриленда.«Мы не знали сложности ВИЧ». Спустя более трех десятилетий до сих пор не существует жизнеспособной вакцины-кандидата от ВИЧ, даже несмотря на то, что ученые создали несколько эффективных вакцин против вируса SARS-CoV-2, который вызывает COVID-19 менее чем через год после его появления.
Теперь недавние открытия вселяют новую надежду. На международной конференции по СПИДу в феврале исследователи из Scripps Research и IAVI, некоммерческой организации по исследованию вакцин, объявили многообещающие результаты анализа крови первого этапа испытаний новой стратегии вакцины против ВИЧ на людях.Результаты, которые до сих пор не опубликованы, привлекли внимание общественности таким образом, что это было возможно только в эпоху социальных сетей. «ЭТО ОГРОМНО», — написал пользователь Twitter @AugustusRotter. В начале апреля твит получил лайки и тысячи раз ретвитнул.
В действительности гораздо больше нюансов, чем можно предположить из шумихи, говорит Уильям Шиф, иммунолог из Скриппса и исполнительный директор по разработке вакцины в Центре нейтрализующих антител IAVI. Хотя иммунный ответ, обнаруженный его командой, является важным подтверждением концепции, по его словам, до производства уколов, снижающих вероятность заражения ВИЧ людей, еще далеко.Даже в этом случае возможная вакцина, вероятно, будет включать в себя несколько прививок, что может оказаться непростой задачей.
«С научной точки зрения это прекрасная концепция», — говорит Эспарса. «Практически реализовать это будет непросто».
Тем не менее, после десятилетий неудач, результаты являются долгожданной новостью — с некоторыми интригующими связями с усилиями по созданию вакцины против COVID-19, которые могут помочь ускорить работу по борьбе с ВИЧ.
«Это своего рода маленький шаг к созданию вакцины против ВИЧ, но это также и гигантский шаг», — говорит Шиф, предлагая жизнеспособный путь вперед.«И на самом деле, в этом конкретном случае это сработало на удивление хорошо».
Три волны надеждыПоиск вакцины против ВИЧ начался вскоре после того, как ученые выделили вирус и подтвердили, что он вызвал СПИД в 1984 году. исторический отчет о поисках вакцины против ВИЧ в 2013 году.
Первая волна была сосредоточена на наиболее устоявшейся идее: попытаться стимулировать иммунную систему человека к выработке так называемых нейтрализующих антител, которые инактивируют определенные вирусы.Это стратегия, которую используют многие другие вакцины, в том числе вакцины против COVID-19. В течение многих лет исследователи работали над определением антител, которые вырабатываются людьми в ответ на ВИЧ-инфекцию, а затем разрабатывали вакцины, которые индуцировали бы выработку аналогичных антител.
Но ВИЧ оказался неуловимым врагом. Антитела нацелены на специфические белки на поверхности вируса. Однако ВИЧ быстро мутирует в варианты, которые антитела не могут распознать, что означает, что он постоянно на шаг впереди иммунной системы.По словам Шифа, в одном классическом исследовании исследователи неоднократно тестировали кровь людей, инфицированных ВИЧ, и обнаружили, что антитела, вырабатываемые их иммунной системой, всегда отставали от вируса примерно на три-шесть месяцев.
«ВИЧ по-прежнему является гораздо более сложной научной мишенью, чем SARS-CoV-2, — говорит Ларри Кори, эксперт в области вирусологии, иммунологии и разработки вакцин из Онкологического исследовательского центра Фреда Хатчинсона в Сиэтле и главный исследователь вакцины против ВИЧ. Сеть испытаний. «Девяносто восемь процентов людей выздоравливают от SARS-CoV-2, и мы равны нулю из 78 миллионов людей, которые самостоятельно выздоравливают от ВИЧ.
К началу 2000-х годов исследователи разрабатывали вторую волну вакцин против ВИЧ, основанную на идее нацеливания на Т-клетки-убийцы, похожие на солдат, вместо того, чтобы пытаться стимулировать антитела. Долгосрочный иммунитет человека зависит от двух основных групп клеток: В-клеток и Т-клеток. Оба помогают производить антитела, но Т-клетки также ищут и уничтожают инфицированные клетки. Идея Т-клеточных вакцин заключалась в том, чтобы стимулировать клетки, распознающие внутренние белки вируса.
В 2007 году эта идея не только не смогла обеспечить защиту в двойном слепом рандомизированном испытании второй фазы под названием STEP, но и увеличила риск заражения ВИЧ.«Судебный процесс с треском провалился», — говорит Эспарса.
Это была далеко не единственная попытка вакцины провалиться. После десятилетий испытаний на людях только один из них продемонстрировал хоть какую-то степень реальной эффективности. Завершенная в 2009 году в Таиланде комбинация двух вакцин, основанная на стратегии индукции антител первой волны, снизила уровень ВИЧ-инфекции на 31 процент — этого недостаточно, чтобы получить одобрение регулирующих органов.
Ориентация на наивные В-клеткиТретья и текущая волна исследований вакцины против ВИЧ началась в конце 2000-х годов, когда исследователи обнаружили, что небольшое меньшинство людей, инфицированных ВИЧ, вырабатывают особенно мощные антитела, которые могут одновременно нейтрализовать многие штаммы ВИЧ. .На данный момент ученые идентифицировали десятки этих широко нейтрализующих антител, которые нацелены на части вирусной поверхности (во многом как белки-шипы на SARS-CoV-2), которые одинаковы от штамма к штамму.
Люди, вырабатывающие эти белки, по-прежнему не могут бороться с ВИЧ, потому что их тела не вырабатывают эти антитела до тех пор, пока вирусная инфекция не распространится, а вирус тем временем продолжает мутировать, говорит Шиф. Но это открытие породило новую идею: возможно, эффективная вакцина могла бы на шаг опередить вирус, нацелившись на так называемые наивные В-клетки (также известные как клетки-предшественники), которые циркулируют в нашей крови, говорит Шиф.Если вакцина может заставить наивные В-клетки приобретать мутации, которые превращают их в клетки, вырабатывающие широко нейтрализующие антитела перед ВИЧ-инфекцией, организм мог бы бороться с ней, когда впервые был представлен вирусом.
В 2010 году группа Шифа начала работать с классом широко нейтрализующих антител под названием VRC01, первым из которых был обнаружен Исследовательским центром вакцин NIH. Во-первых, они разработали белковые наночастицы, которые, как они сообщили, могут связываться с наивными В-клетками в образцах крови человека.В исследованиях на мышах наночастица могла активировать эти клетки и заставить их размножаться и мутировать в направлении производства антител, подобных VRC01. Новое исследование было направлено на то, чтобы выяснить, может ли то же самое происходить с людьми.
Это было большое «если». По словам Шифа, только одна из каждых 300 000 наивных В-клеток может развиться в клетки, вырабатывающие антитела против VRC01. Но при комплексном анализе крови команда обнаружила, что 35 из 36 человек, получивших вакцину, «инженерные белковые наночастицы», вызвали желаемый ответ В-клеток.
Результаты, которые все еще проходят анализ и еще не представлены для публикации, далеки от того, чтобы продемонстрировать какой-либо защитный эффект против ВИЧ, говорит Шиф, даже несмотря на то, что многие активные пользователи социальных сетей заявили, что это звучит так. если вакцина против ВИЧ внезапно не за горами.
«Неделю назад кто-то разослал твит, в котором указывалось, что наше испытание вызывало реакцию, которая могла защитить 97 процентов реципиентов вакцины от ВИЧ», — говорит он.«Это совершенно неправда».
В конце концов, говорит Шиф, люди могут получить серию прививок в течение нескольких недель или лет, начиная с той, которая начинается там же, где и проводилось новое испытание: взаимодействие с правильными наивными В-клетками, чтобы запустить процесс. Последующие выстрелы будут направлять В-клетки к выработке полностью зрелых нейтрализующих антител широкого спектра действия.
«Мы пытаемся занять место водителя с иммунной системой и постепенно обучать ее с помощью вакцины», — говорит Шиф. Та же идея может когда-нибудь привести к созданию вакцин против вируса Зика, гепатита С, малярии и других болезней, включая универсальную вакцину против гриппа и будущие коронавирусы.
Эта работа также является важным признаком того, что ученые на правильном пути, говорит Кори, добавляя к недавнему исследованию, которое показало, что предоставление людям высоких уровней широко нейтрализующих антител может предотвратить ВИЧ.
«Главный прорыв — и я буду использовать слово« прорыв »- исследования Скриппса заключается в том, что мы можем дать антиген, у которого эти предшественники широко распространены среди людей, и они не удаляются, — говорит Кори. «Здесь у нас есть прорыв в том, чтобы сделать первый шаг.”
Использование инфраструктуры вакцины от COVID-19Помимо научных проблем, исследованиям вакцины против ВИЧ долгое время препятствовало отсутствие ощущения срочности. В то время как общественная и политическая воля, наряду с крупными инвестициями в промышленность, подтолкнула усилия по COVID-19 продвигаться вперед рекордными темпами, ВИЧ — это болезнь, которая непропорционально поражает маргинальные группы, говорит Эспарса, и фармацевтические компании не хотели вкладывать средства в дорогостоящие испытания на ВИЧ. пока ученые не установили больше фундаментальной науки.
«Если бы общество действительно ценило вакцину против ВИЧ, мы бы проводили несколько испытаний эффективности параллельно, как это было сделано с COVID», — говорит Эспарса. «Дорого, да. Но цена эпидемии ВИЧ огромна ».
Согласно одному исследованию, расходы на здравоохранение в связи с ВИЧ / СПИДом составили более 562 миллиардов долларов в 188 странах с 2000 по 2015 год.
Итак, пока мир наблюдает, как вакцины от COVID-19 поступают с беспрецедентной скоростью, можно надеяться, что энтузиазм даст импульс для тех видов долгосрочных усилий по разработке вакцин, которые будут иметь решающее значение для борьбы с ВИЧ.
Оба уже подключены. По словам Кори, усилия по созданию вакцины против COVID-19 были совмещены с клинической, лабораторной и биостатистической инфраструктурой, созданной Сетью испытаний вакцины против ВИЧ. В течение многих лет, добавляет Шиф, его группа сотрудничала с Moderna для тестирования доставки мРНК их белков на животных моделях. Они планируют работать вместе, чтобы быстро создать вакцины-кандидаты от ВИЧ для использования в клинических испытаниях на людях.
Учитывая энтузиазм по поводу вакцин против COVID-19 и новую технологию мРНК, которая может быстро создавать вариации вакцины, возможно, пришло время вызвать новый интерес к поиску вакцин против ВИЧ, что также потребует сотрудничества общественности.
«Если мы разработаем вакцину против ВИЧ, — говорит Шиф, — я бы подумал, что мировой опыт использования вакцин COVID может облегчить нам внедрение».


 Дополнительно, для удобства использования в эту вакцину ввели полиомиелит. По календарю прививок графики вакцинации АКДС и полиомиелитом совпадают. В эту вакцину из отдельного флакона можно добавить компонент против гемофильной инфекции. Решение о необходимости его введения принимает врач. Вакцина отличается отсутствием целых коклюшных клеток – это вызывает меньше побочных эффектов.
Дополнительно, для удобства использования в эту вакцину ввели полиомиелит. По календарю прививок графики вакцинации АКДС и полиомиелитом совпадают. В эту вакцину из отдельного флакона можно добавить компонент против гемофильной инфекции. Решение о необходимости его введения принимает врач. Вакцина отличается отсутствием целых коклюшных клеток – это вызывает меньше побочных эффектов.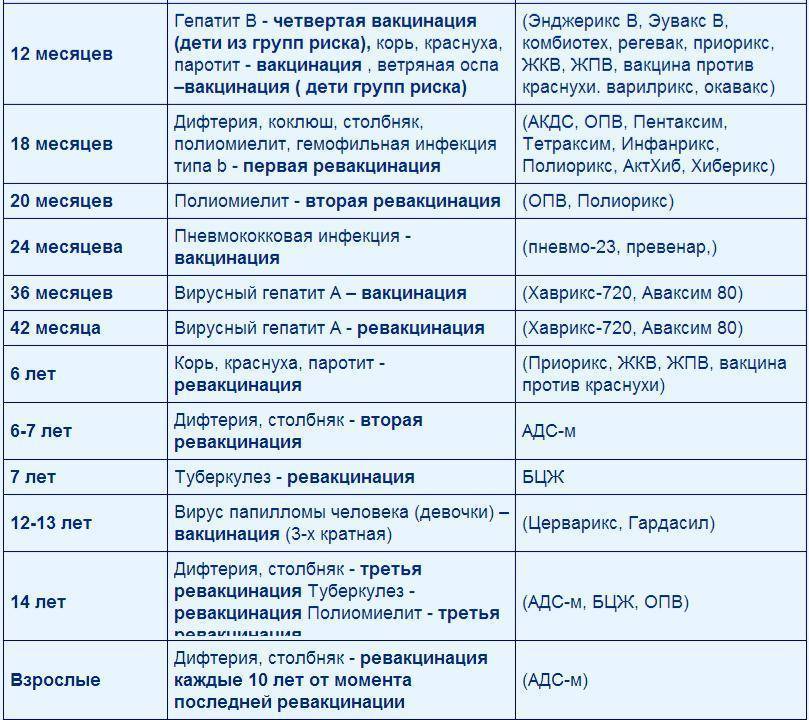 Тоже довольно частое явление. Для АКДС примерно 40% от всех вакцинаций. Для бесклеточных вакцин этот процент падает примерно до 15%. Проходит самостоятельно за 1-2 дня. Требует только наблюдения и ухода за малышом.
Тоже довольно частое явление. Для АКДС примерно 40% от всех вакцинаций. Для бесклеточных вакцин этот процент падает примерно до 15%. Проходит самостоятельно за 1-2 дня. Требует только наблюдения и ухода за малышом. Никогда не бывает мучительной, многократной и длительной. Не требует лечения. Но вашего лечащего врача о такой реакции стоит оповестить.
Никогда не бывает мучительной, многократной и длительной. Не требует лечения. Но вашего лечащего врача о такой реакции стоит оповестить. Его риск имеется примерно первые 12 часов после прививки. Ребенок резко бледнеет, становится вялый, заторможенный. Это осложнение не требует лечения, проходит само, но при нем необходимо наблюдение врача. Гипотензивно-гипореспонсивный синдром после прививки АКДС ставит вопрос о дальнейшей вакцинации.
Его риск имеется примерно первые 12 часов после прививки. Ребенок резко бледнеет, становится вялый, заторможенный. Это осложнение не требует лечения, проходит само, но при нем необходимо наблюдение врача. Гипотензивно-гипореспонсивный синдром после прививки АКДС ставит вопрос о дальнейшей вакцинации.