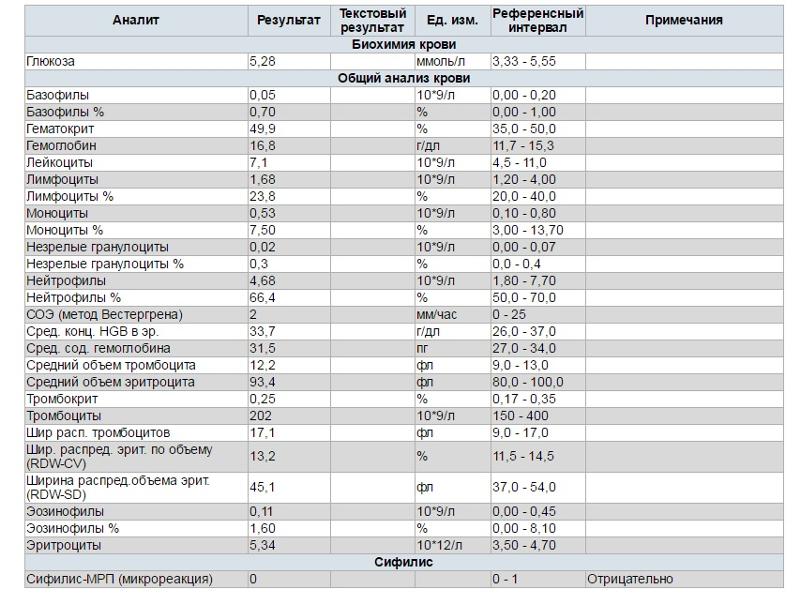
что это, отрицательная, положительная, расшифровка
Исследования крови многообразны и разносторонни. Не последнюю роль играет исследование крови в выявлении заболеваний, передающихся половым путем. Среди прочих анализов встречается экспресс-метод диагностики сифилиса, который называют — микрореакция крови, что показывает это исследование. Эта методика довольно проста и относительно точна, не требует большого количества времени и специальной подготовки.
Что это такое
Бледная трепонема – возбудитель сифилиса, длительное время находится в организме без ярко выраженных симптомов, но именно в этот период человек особенно заразен.
При отсутствии внешних признаков микрореакции, организм упорно борется с возбудителем и активно вырабатывает к нему антитела в крови. Эти самые антитела и обнаруживают в анализе крови на микрореакцию. То есть, то, что определяется в данном лабораторном методе, является не самим возбудителем, а реакцией организма на него, поэтому, здесь возможны погрешности.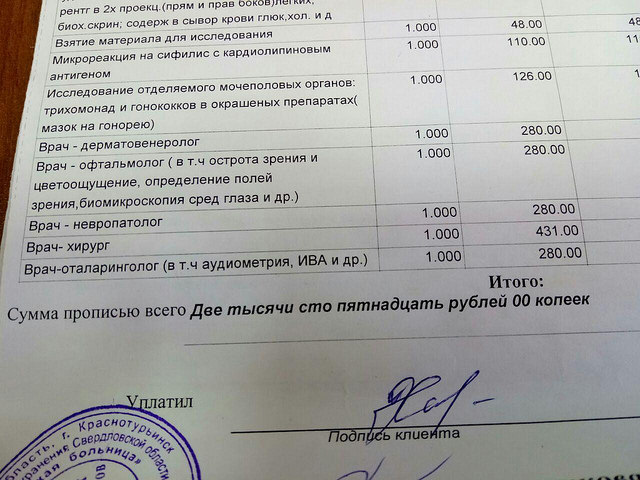
Общий анализ крови на микрореакцию является удобным скринингом широких масс населения. В случае выявления положительного результата, пациенту назначают дополнительное более точное специализированное обследование:
- анализ на РИФ, способный выявить наличие заражения на ранних стадиях с большей степенью достоверности;
- ИФА (иммуноферментный анализ) – обнаруживающий антитела к бледной трепонеме;
- Р П ГА проводится как подтверждающий анализ только после точного выявления заражения, определяет стадию, в которой находится заболевание;
- Исследование РИБТ сдается при ложноположительной микрореакции преципитации.
Как проводят
Кровь сдают из пальца, при этом, соответственно, исследуется капиллярная кровь, можно использовать венозную кровь, взятую для биохимического анализа.
На результат исследования не влияет, откуда берется анализ на микрореакцияю крови и из какого сосудистого русла взят материал. Общие правила сдачи схожи с прочими исследованиями: кровь сдают натощак, исключается прием алкоголя накануне и лекарственных средств; в течение двух часов следует отказаться от сигарет.
Общие правила сдачи схожи с прочими исследованиями: кровь сдают натощак, исключается прием алкоголя накануне и лекарственных средств; в течение двух часов следует отказаться от сигарет.
В настоящее время такой тест на микрореакцию крови можно сдать в любой лаборатории специализированного медицинского учреждения, причем, по желанию, это возможно сделать и анонимно. Антитела к бледной трепонеме могут быть обнаружены в спинномозговой жидкости, но этот вид исследования применяется крайне редко.
Для определения преципитации (выпадения комплекса антиген-антитело в осадок в виде маленьких хлопьев) используется один из тестов:
- макроскопия – определение осадка визуально без использования микроскопической аппаратуры, для чего в сыворотку исследуемой крови добавляется красящий пигмент или небольшое количество угля;
- микроскопия подразумевает использование микроскопа, и не используются определяющие красящие реагенты.
Выявление количества комплекса антиген-антитело, проводится в несколько этапов.
Расшифровка
Расшифровка результатов анализа крови микрореакцию, во многом зависит от момента заражения и стадии, в котором находится заболевание. На ранних стадиях, когда после внедрения трепонемы прошло не более месяца, комплекс антиген-антитело еще не вырабатывается в достаточном количестве и анализ показывает отрицательный результат, который так же называют ложноотрицательным.
Такой же показатель может быть при поздней стадии развития или при терапии антибиотиками по поводу другого сопутствующего заболевания:
- Отрицательная микрореакция крови не выявляет хлопьевидного осадка. Означает отсутствие возбудителя в организме; такая же реакция возможна на ранних этапах заболевания.
- Положительная микрореакция крови говорит о выпадении комплекса в осадок, наблюдается при любом виде сифилитических проявлений; сохраняется некоторое время после излечения.
- Сомнительная микрореакция крови характеризуется незначительным осадком, что может свидетельствовать о низком количестве антител или о проявлении ложноположительного результата.

Выявление ложноположительного результата возможно:
- при беременности, особенно при наличии токсикоза;
- при тяжелых бронхолегочных воспалениях;
- после перенесенной ангины или воспаления носовых пазух;
- при вирусных гепатитах;
- при онкологических заболеваниях;
- при алкогольной и наркотической зависимости.
Показания к диагностике
Диагностика микрореакции преципитации используется как экспресс-диагностика для выявления случаев заражения в больших группах населения:
- Анализ крови обязателен при стационарном лечении, особенно при подготовке к оперативному вмешательству.
- Он сдается беременными женщинами дважды, при постановке на учет и во втором триместре.
- Обязателен для поступающих на военную службу.
- Регулярно сдается донорами перед сдачей крови.
- При ежегодных профилактических осмотрах проверяются работники общепита, медицинские работники и работники школьных и дошкольных учреждений.

- Заключенные при систематическом медицинском обследовании.
Анализ на микрореакцию проводится как контроль над правильностью проводимого лечения, а также дает достоверные данные о выздоровлении пациента.
Группы риска
Существуют официально установленные группы риска, к ним относятся: люди, имеющие беспорядочные половые связи, гомосексуальные контакты; наркозависимые; плод от больной матери; медицинские работники, которые могут заразиться при работе с кровью; доноры крови.
В настоящее время появилась возможность сдать кровь в домашних условиях, для чего используются специальные тест-полоски. Одни из них предназначены для получения немедленного результата, другие оборудованы таким образом, что забранный материал можно доставить в ближайшую лабораторию.
Конечно, такой метод микрореакции не заменит полноценного лабораторного исследования и имеет определенную долю погрешности, поэтому в случае выявления положительного результата по экспресс-полоскам, следует немедленно обратится к врачу.
Сдать анализ на сифилис (RW)- цены на реакцию Вассермана в Москве в ИНВИТРО
Метод определения Флокуляционный (RPR-антиген, использующийся в наборах, является модификацией VDRL антигена).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Анализ крови на сифилис; Неспецифический антифосфолипидный (реагиновый) тест, современный аналог реакции Вассермана (RW).
Краткое описание исследования RPR тест
НRPRтест – чувствительный нетрепонемный тест, используемый для скрининга и комплексной диагностики сифилиса, современный аналог реакции Вассермана (RW) с кардиолипиновым антигеном, модификация VDRL (Venereal Disease Research Laboratory) теста.
RPR – антитела (реагины) классов IgG и IgM, направленные против антигенов липоидного материала, высвобождающегося из поврежденных клеток больного сифилисом. Поскольку эти антитела не являются специфичными к антигенам Treponema pallidum, RPR-тест относят к группе нетрепонемных тестов лабораторной диагностики сифилиса. Это исследование обладает высокой чувствительностью и позволяет выявить активную инфекцию. Применение RPR-теста рекомендовано приказом МЗ РФ для первичного скрининга и наблюдения за ходом лечения сифилиса. Антифосфолипидные (антикардиолипиновые) антитела, выявляемые в данном тесте, находят у 70-80% лиц с первичным сифилисом и почти у 100% пациентов с вторичным и ранним латентным сифилисом.

Антикардиолипиновые (антифосфолипидные) антитела могут появляться не только вследствие сифилиса или других трепонемных инфекций, но и при ряде иных заболеваний и состояний (особенно часто при аутоиммунной патологии, например, системная красная волчанка, антифосфолипидный синдром).
 Такие состояния могут быть причиной ложноположительных результатов RPR-теста при скрининге сифилиса. Поэтому при получении положительного результата в RPR-тесте обязательно проведение дополнительного подтверждающего исследования в специцфическом трепонемном тесте (см. тест № 70), отрицательный результат которого позволяет исключить сифилис. Комбинированное назначение этих тестов представляет оптимальный вариант лабораторного исследования для обнаружения или исключения сифилиса на всех стадиях. Результаты лабораторных исследований следует оценивать в комплексе с клинико-анамнестическими данными, применяя в случае сомнений углубленные исследования с применением альтернативных вариантов трепонемных тестов (см. тесты № 1205, № 1206).
Такие состояния могут быть причиной ложноположительных результатов RPR-теста при скрининге сифилиса. Поэтому при получении положительного результата в RPR-тесте обязательно проведение дополнительного подтверждающего исследования в специцфическом трепонемном тесте (см. тест № 70), отрицательный результат которого позволяет исключить сифилис. Комбинированное назначение этих тестов представляет оптимальный вариант лабораторного исследования для обнаружения или исключения сифилиса на всех стадиях. Результаты лабораторных исследований следует оценивать в комплексе с клинико-анамнестическими данными, применяя в случае сомнений углубленные исследования с применением альтернативных вариантов трепонемных тестов (см. тесты № 1205, № 1206).С какой целью выполняют исследование RPR тест
Что может повлиять на результат исследования RPR тест
Тест не является специфическим. Поэтому иногда возможно возникновение ложноположительных реакций. Антилипоидные антитела могут появляться не только вследствие сифилиса или других трепонемных инфекций, но и в ответ на развитие нетрепонемных заболеваний острой или хронической природы, при которых наблюдается повреждение тканей (особенно часто при аутоиммунных заболеваниях).
При получении положительного результата в RPR-тесте, пациент должен обследоваться дерматовенерологом с повторным исследованием крови с помощью специфического трепонемного диагностического теста (в лаборатории ИНВИТРО – тест № 70 сифилис ИФА, антитела к Treponema pallidum IgG/IgM, выявляющий специфические антитела к антигену Treponema pallidum).Редкие ложноотрицательные результаты в реакции RPR (эффект «прозоны» при очень высоких титрах реагиновых антител) могут быть исключены одновременным назначением теста сифилис ИФА IgG/IgM. Эти два исследования являются взаимодополняющими; комбинированное использование тестов RPR и ИФА-теста IgG/IgM представляет лучший вариант скринингового исследования для обнаружения или исключения сифилиса на всех стадиях.
Положительный результат. Диагноз сифилис | ЗДОРОВЬЕ:Медицина | ЗДОРОВЬЕ
Один, два, три или четыре креста — так недавно отмечали в бланке анализа положительную пробу на RW (реакцию вассермана), то есть присутствие в крови антител к возбудителю сифилиса.
Сегодня бледную спирохету, вызывающую опасную болезнь, определяют уже другим и гораздо более точным методом. Об этом рассказала заведующая централизованной серологической лабораторией Камчатского краевого кожно-венерологического диспансера (КККВД) Лариса Фролова.
Антиген — к антителу
– Любая инфекция, любой чужеродный агент, попадая в наш организм, вызывают ответную реакцию его защитной системы — иммунитета, — говорит Лариса Владимировна. — Обороняясь, иммунная система вырабатывает антитела, предназначенные для уничтожения антигенов — возбудителей инфекции. Каждому антигену соответствуют свои антитела, и по их присутствию в крови можно сделать вывод не только о разновидности инфекции, но и её активности в организме. На этом и основан серологический анализ. А термин «серология» образован от латинского слова serum (сыворотка) и греческого logos (учение), так как все серологические анализы делаются на сыворотке после удаления из венозной крови всех форменных элементов (клеток) и фибриногена — белка, обеспечивающего свёртывание крови.
На этом и основан серологический анализ. А термин «серология» образован от латинского слова serum (сыворотка) и греческого logos (учение), так как все серологические анализы делаются на сыворотке после удаления из венозной крови всех форменных элементов (клеток) и фибриногена — белка, обеспечивающего свёртывание крови.
– Как широко охвачено население Камчатки обследованием на одно из самых грозных венерических заболеваний?
– В настоящее время мы проводим обследование на сифилис всех пациентов, находящихся на стационарном лечении в Петропавловске. Это значит, что анализы крови к нам везут из всех больниц краевой столицы. В день получается несколько сотен исследований. И с 2009 года вместо привычной RW проводится иммуноферментный анализ. Это высокоспецифичное исследование, при котором можно обнаружить антитела к возбудителю инфекции на самой ранней её стадии — второй или третьей неделе от начала заболевания, когда никаких видимых, клинических признаков болезни ещё нет.
– Насколько значима такая диагностика?
– Она очень важна, так как в настоящее время регистрируется немало скрытых форм сифилиса, когда недуг выявляется при случайном обследовании больного, проходящего лечение в стационаре совсем по другому поводу и не подозревающего о спящей инфекции. Только в прошлом году таких случаев было более 30-ти — 72 % от всех вновь выявленных нашей лабораторией форм сифилиса.
За период с 2012 по 2014 гг. в серологической лаборатории краевого кожвендиспансера выполнено 366 017 анализов на сифилис. В 2012 г. в крае было выявлено 156 новых случаев сифилиса, в 2013 — 102, в 2014 — 50. В 2014 г. на полуострове в структуре заболеваемости сифилисом наибольшая доля приходилась на раннюю скрытую форму — 72 %, и вторичный сифилис — 26 %. Формы первичного сифилиса в крае за 2014 год не зарегистрированы.– Заполучить диагноз «сифилис» страшно — это означает постановку на учёт, лечение в стационаре, длительное наблюдение в вендиспансере и проблемы с репутацией…
– Вовсе нет. Люди не должны бояться! Никто их не схватит и не запрёт: пациент вправе сам выбрать способ лечения, амбулаторный или стационарный. Единственное отличие — в стационаре его пролечат бесплатно, а при амбулаторном лечении все лекарства придётся приобретать за свой счёт. И насчёт репутации вы заблуждаетесь: врачебную тайну никто не отменял. Более того, даже при выписке больничного листа диагноз «сифилис» вам никто не напишет по той же причине — соблюдение врачебной тайны. Работодателю диагноз знать не обязательно, поэтому страхи необоснованны, и лечиться надо непременно! Потому что последствия нелеченого сифилиса неизмеримо страшнее боязни мнимой огласки.
Люди не должны бояться! Никто их не схватит и не запрёт: пациент вправе сам выбрать способ лечения, амбулаторный или стационарный. Единственное отличие — в стационаре его пролечат бесплатно, а при амбулаторном лечении все лекарства придётся приобретать за свой счёт. И насчёт репутации вы заблуждаетесь: врачебную тайну никто не отменял. Более того, даже при выписке больничного листа диагноз «сифилис» вам никто не напишет по той же причине — соблюдение врачебной тайны. Работодателю диагноз знать не обязательно, поэтому страхи необоснованны, и лечиться надо непременно! Потому что последствия нелеченого сифилиса неизмеримо страшнее боязни мнимой огласки.
Развёрнутая ясность
– В вашей практике были случаи, когда лабораторным методом выявили запущенный нелеченый сифилис?
– Да, и не один. В неврологическое отделение поступил пациент предпенсионного возраста с диагнозом «прогрессирующий паралич». Серологические реакции оказались положительными. После консультации с дермато-венерологом мужчине был назначен иммуноферментный анализ спинномозговой жидкости, также оказавшийся положительным. В результате больного перевели в КВД с диагнозом «нейросифилис».
После консультации с дермато-венерологом мужчине был назначен иммуноферментный анализ спинномозговой жидкости, также оказавшийся положительным. В результате больного перевели в КВД с диагнозом «нейросифилис».Ещё один случай был с молодым человеком из психоневрологического диспансера — парень находился на стационарном лечении, в тяжёлом состоянии. Никаких проявлений сифилиса на коже и слизистых не было, но серологические реакции оказались положительными. После дополнительных развёрнутых лабораторных исследований у больного выявили ранний нейросифилис и назначили адекватное лечение.
В обоих случаях сифилис протекал скрыто, возможно, на фоне бесконтрольного приёма антибиотиков, которые смазывают клиническую картину болезни. Но современные высокоспецифичные методы анализа всё равно дадут положительный результат.
– Насколько сложен анализ и как быстро готов результат?
– Сегодня используются современные тест-системы и компьютерная, цифровая обработка результатов. Массовым, скрининговым методом исследуются все поступившие образцы крови. На специальном планшете положительные пробы видны даже визуально: в результате реакции антиген — антитело они окрашиваются в жёлтый цвет. Чем интенсивнее окраска, тем активнее инфекция. Конкретную величину титра антител определяет компьютер по оптической плотности образца. И если результат положительный, мы делаем уже развёрнутый анализ из пяти более специфических исследований, по которым становится ясно: свежий это сифилис, скрытый, или человек когда-то уже переболел. Результат выдаётся на следующий день после получения пробы крови.
Массовым, скрининговым методом исследуются все поступившие образцы крови. На специальном планшете положительные пробы видны даже визуально: в результате реакции антиген — антитело они окрашиваются в жёлтый цвет. Чем интенсивнее окраска, тем активнее инфекция. Конкретную величину титра антител определяет компьютер по оптической плотности образца. И если результат положительный, мы делаем уже развёрнутый анализ из пяти более специфических исследований, по которым становится ясно: свежий это сифилис, скрытый, или человек когда-то уже переболел. Результат выдаётся на следующий день после получения пробы крови.Много неясного
– Иммунитет к сифилису у переболевшего им человека сохраняется?
– Здесь много загадок, до сих пор необъяснимых. Иммунитета к сифилису нет, им можно заразиться снова, причём неоднократно. Тем не менее, антитела к бледной трепонеме у людей, прошедших полноценный курс лечения, сохраняются очень долго. Поэтому нередко здоровый человек, сдавая анализы, например, при медосмотре, вынужден объяснять врачу-дерматовенерологу происхождение положительной серологической пробы на сифилис, от которого он вылечился несколько лет назад. Был даже такой случай: у ветерана войны, заразившегося после случайного полового контакта в Германии, до сих пор регистрируется положительная реакция, хотя вылечился он 70 лет назад! А бывает, что антитела исчезают из крови вскоре после излечения болезни. К сожалению, новой информации о сифилисе очень мало, и в механизме выработки к нему иммунного ответа много неясного.
Был даже такой случай: у ветерана войны, заразившегося после случайного полового контакта в Германии, до сих пор регистрируется положительная реакция, хотя вылечился он 70 лет назад! А бывает, что антитела исчезают из крови вскоре после излечения болезни. К сожалению, новой информации о сифилисе очень мало, и в механизме выработки к нему иммунного ответа много неясного.
– В последние годы врачи дермато-венерологи говорят о росте распространения инфекций, передающихся половым путём. С сифилисом картина похожая?
– У нас на Камчатке за последние два года идёт снижение числа новых заражений, причём значительное. Радует, что за этот период не было ни одного случая заражения детей до 14 лет.
Смотрите также:
Какие анализы сдают на сифилис? > MedElement
Заболевание распространяется не только половым путем, но и при использовании зубной щетки, кухонной посуды, полотенца и других бытовых предметов вместе с больным человеком. Иногда болезнь может протекать бессимптомно (пассивный вид), при этом остается риск заражения окружающих. Сдать анализ на сифилис можно в районной поликлинике и частном врачебном кабинете анонимно. Как называется анализ и где его можно сдать.
Материал для исследования
Наиболее часто для анализа на сифилис используется кровь пациента. Иногда в крови содержатся антитела, вызывающие ложноположительную реакцию.
В таких случаях возможный диагноз может быть подтвержден исследованиями другого биологического материала:
- Распространяются по организму и затрагивают спинной мозг. Специальный анализ крови на сифилис Реакция по Вассерману, может подтвердить наличие болезни
- Жидкость, взятая из язвы (твердого шанкра). Исследование вещества имеет высокую достоверность и может быть назначено по клиническим показаниям
- Лимфоузлы в паховой области при развитии болезни воспаляются и увеличиваются. Обследование воспаленных участков может помочь диагностике
- Венозная или артериальная кровь. Кровь на сифилис должна сдаваться натощак из вены или пальца в зависимости от типа анализа
Чтобы узнать, где сдать все анализы на сифилис, нужно обратиться к врачу при первых признаках заболевания. Лабораторные исследования проводятся во многих частных и государственных лабораториях. Сдачу крови на сифилис можно провести в медицинском учреждении или вызвать лаборанта на дом. Должный вид теста определяет врач. Лаборатория проведет тест на сифилис и исследование покажет наличие и отсутствие болезни.
Прямые тесты
Какие анализы сдают на сифилис, этот вопрос часто можно услышать от пациентов. Сегодня существует несколько видов тестов, которые могут показать наличие инфекции в крови. Анализ крови на сифилис, известный как темнопольная микроскопия, является современным методом диагностики с достаточно высокой достоверностью результатов. Исследуемый материал изучается при большом увеличении и специальном подсвечивании образца.
Исследование выявляет наличие бледных трепонем (возбудителя сифилиса) на более темном фоне.
При простом исследовании образца под микроскопом достоверность метода составляет 97% и позволяет обнаружить болезнь у 8 из 10 зараженных. Если анализ крови при сифилисе показывает отрицательный результат, но у пациента имеются ярко выраженные клинические симптомы сифилиса, назначается дополнительное исследование.
Самые точные исследования называются ПЦР анализы на сифилис или полимеразная цепная реакция. Для проведения исследования требуется современное медицинское оборудование и квалифицированные специалисты. Где же можно сдать анализы на сифилис по данному методу? К сожалению, анализ ПЦР могут предложить только частные лаборатории. Ввиду сложности проведения и высокой стоимости анализа, немногие лаборатории предлагают исследование с помощью полимеразной цепной реакции.
В предоставленном образце крови определяется наличие или отсутствие молекул ДНК возбудителя болезни. Достоверность ПЦР на сифилис приближена к 100% и является основой для подтверждения или опровержения диагноза лечащим врачом. Современное молекулярное исследование позволяет обнаружить в исследуемом образце наличие всего двух молекул заболевания. Получить самый точный результат ПЦРа на сифилис можно только при соблюдении всех правил и норм лабораторных исследований. Тест на сифилис может быть готов уже через 5 часов после забора крови. Стоит отметить, что общий анализ крови не выявляет данную инфекцию.
Нетрепонемные исследования
Серологическая диагностика сифилиса предусматривает анализ крови на наличие антител. Существует несколько видов исследований, кровь на которые можно сдать в лаборатории. При проведении медицинских осмотров и обследовании большого количества пациентов назначаются, как правило, один из нетрепонемных (неспецифических) анализов. Если в крови обнаруживаются антитела к сифилису, результат анализа считается положительным. Какие анализы на сифилис следует сдавать пациенту, зависит от клинической картины. На сифилис анализ должен быть назначен квалифицированным врачом.
Реакция Вассермана широко распространенный тест, который может показать заражение на 6 неделе болезни. Другое название исследования «РВ-тест» или «RW». Для проведения анализа необходимо сдать кровь из вены или пальца натощак. Обычно лаборатории проводят забор крови сутра и рекомендуют пациентам воздерживаться ночь (8–12 часов) от еды и напитков, кроме минеральной воды. Реакция Вассермана определяет заражение по количеству титров антител. Отрицательный результат помечается математическим знаком «минус» (-).
Слабоположительный результат маркируется одним или двумя плюсами (+, ++), положительный тремя плюсами (+++) и четыре плюса (++++) означают резко положительную реакцию.
Также к нетрепонемным методам исследований относится RPR тест. Это исследование считается более современным и точным по отношению к RW анализу. RPR проводится на венозной крови пациента и выявляет наличие антител к фосфолипидам цитоплазматической мембраны. РПР тест можно сделать в частной клинике.
Похожим способом является реакция микропреципитаци, которую используют в современных лабораториях.
Микрореакция преципитации (МРП или МР-тест) проводится спустя 4–5 недель после предполагаемого заражения. Для исследования используется капиллярная кровь. Микрореакция на сифилис не относится к точным методам диагностики. Положительная серологическая реакция на сифилис по МРА должна быть подтверждена одним из специфических тестов. Отрицательный результат теста означает начальную стадию или отсутствие заболевания.
Трепонемные исследования
Почему нужно сдавать анализ на сифилис повторно? Часто трепонемные исследования используются в качестве контрольного анализа, чтобы подтвердить или опровергнуть диагноз после нетрепонемного теста. Сомнительный результат первого теста означает, что придется сдать анализы на сифилис повторно.
Реакция пассивной агглютинации (РПГА, РНГА). Анализ на сифилис РПГА является быстрым методом исследования, результат можно узнать уже через час. Чтобы проверить кровь на наличие сифилиса по РПГА-тесту, анализ проводится спустя месяц после контакта с больным. Гемагглютинация может давать ложноположительный результат при мононуклеозе и ряде других заболеваний.
Для диагностики болезни на ранних стадиях применяется Реакция иммунофлюоресценции (РИФ-тест). Анализ крови из пальца или вены с помощью РИФ может выявить заболевание спустя 1,5–2 месяца после контакта с больным.
Во время проведения РИФ-теста антитела четко выделяются свечением в ультрафиолетовом свете.
При беременности или наличии системных заболеваний соединительной ткани (ревматоидный артрит и пр.) РИФ-тест может оказаться ложноположительным. Поэтому очень важно предоставить врачу достоверную информацию о себе и медицинскую карту. Положительная реакция обозначается знаками «+» от одного до четырех.
Реакция иммобилизации бледной трепонемы, также известная как РИБТ-тест пользуется высокой популярностью. Серодиагностика по методу РИБТ достоверна в 99% случаев. Однако анализы крови могут быть назначены только спустя 12 недель после контакта с носителем болезни.
РИБТ-исследование проводится спустя 3,5–4 месяца после возможного заражения. Заболевание определяется с вероятностью 99%.
Иммуноблотинг способен дать 100% результат и реагирует даже на очень маленькое содержание антител в крови пациента.
Иммуноферментный анализ или ИФА способен выявить болезнь уже спустя 3 недели после возможного заражения. Достоверность положительного результата составляет 98%. Этот анализ называют одним из самых точных. Как же очистить кровь от сифилиса? Как лечат сифилис какие нужны повторные обследования скажет квалифицированный врач. Не занимайтесь самолечением!
Экспресс-тест
Может называться и выглядеть по-разному в зависимости от производителя, например, «Сифилис-АгКЛ-РМП» или «Профитест». Тест для самодиагностики не предоставит развернутый анализ, но поможет определить наличие или отсутствие болезни с вероятностью более 98% (при условии, что тест проведен правильно).
Набор РМП на сифилис состоит из пластиковой формы с тестовой полоской, острого инструмента для прокалывания кожи на пальце, одноразовой пластиковой пипетки, бутылочки с раствором для разведения крови и подробной инструкции на русском языке. Перед проведением анализа нужно придерживаться тех же правил, что и в медучреждении, очищать руки и поверхность стола перед работой.
При помощи острого приспособления из набора прокалывают палец, одноразовой пипеткой набирают 1 каплю крови и помещают на обозначенное место тест-полоски. Затем добавляют 2 капли раствора и оставляют тест-полоску на 10 минут. Спустя указанное время, будет готов результат. Какие могут быть варианты? Результата всего два: одна полоса означает отсутствие заболевание, две полосы свидетельствуют о положительной реакции и являются поводом обратиться к врачу.
Подтвердить или опровергнуть результаты домашнего теста может серодиагностика.
Стоит отметить, что тест может показать положительный результат и уже после успешного лечения сифилиса. Все дело в том, что организм помнит о перенесенной инфекции еще несколько лет и продолжает вырабатывать антитела к сифилису. Однако количество этих антител постепенно снижается, и при отсутствии повторного заражения перестают вырабатываться в среднем в течение 2–3 лет после успешного лечения. Однако некоторые факторы могут замедлять этот процесс. К ним относится прием алкоголя и наркотических средств. Поэтому задумываясь, как очистить кровь после сифилиса, в первую очередь откажитесь от вредных привычек.
Лечение
Как избавиться от сифилиса и какое лечение нужно пройти? Сразу стоит отметить, что лечение должен назначать только опытный врач. Терапия от сифилиса проводится с помощью антибиотиков в течение долгого времени. Чтобы кровь очистилась от антител нужно не менее 2 лет. Кровь очищается медленно и постепенно. То есть после полученного лечения антитела вырабатываются все меньше и в конце концов перестают определяться в крови. Чтобы контролировать этот процесс пациентам приходится сдавить анализы в течение 3 лет.
Исследование крови на сифилис обязательно для людей многих профессий (врачи, военные, повара и пр.) для получения допуска к работе. В таком случае постоянно, при каждом медосмотре, будет назначена серология или другой тип анализа. При беременности также обязательно проводится исследование на сифилис, анализы назначает врач. Некоторые типы анализов, например РИФ, часто бывает ложноположительным. Какие сегодня самые точные анализы на сифилис, вам подскажет врач.
krov.expert
Хотите читать всё самое интересное о красоте и здоровье, подпишитесь на рассылку!
Понравился материал? Будем благодарны за репосты
Сифилис (Treponema pallidum) (суммарные антитела)
Выявление суммарных антител класса M и G к возбудителю сифилиса может использоваться как эффективный сверхчувствительный скрининговый тест для диагностики раннего инфицирования сифилисом.
Анализ проводится в целях обнаружения Treponema pallidum (бледной трепонемы) – бактерии, которая вызывает сифилис – хроническое венерическое инфекционное заболевание, которое чаще всего передается половым путем, например при прямом контакте с сифилитической язвой (твердым шанкром), также возможно внутриутробное заражение. Источником инфекции является больной человек. Сифилис легкоизлечим, но грозит серьезными проблемами со здоровьем при бездействии. Инфицированная мать способна передавать заболевание своему плоду, у которого могут развиться серьёзные и необратимые изменения.
Различают несколько стадий сифилиса. Первичная наступает примерно через 2-3 недели после заражения. Одна или иногда несколько язв, называемых шанкром, появляются, как правило, на той части тела, которая контактировала с шанкром больного человека, например пенисом или влагалищем. Зачастую твердый шанкр безболезненный и может оставаться незамеченным, особенно если он находится в прямой кишке или на шейке матки. Исчезает язва через 4-6 недель.
Вторичный сифилис начинается через 2-8 недель после первого появления твердого шанкра. Эта стадия заболевания характеризуется появлением на коже розеолезно-папулезной сыпи, чаще на ладонях и подошвах. Бывают и другие симптомы, такие как лихорадка, усталость, опухание лимфатических узлов, боль в горле и ломота в теле. Если сифилис не лечить, он может развиваться в скрытой форме, при которой у инфицированного человека не проявляется никаких симптомов, но он продолжает оставаться носителем инфекции. Эта стадия иногда длится годами.
У 15 % больных, которые не лечатся, проявляется поздний, или третичный, сифилис, который может продолжаться несколько лет и в заключение приводить к психическим заболеваниям, слепоте, неврологическим проблемам (нейросифилису), болезням сердца и даже к смерти.
Существует несколько методов, которые могут быть использованы для проверки на сифилис. Один из них позволяет определять антитела к T. pallidum в крови. Этот анализ наиболее чувствительный и специфический для обнаружения трепонемных антител на всех стадиях, в том числе и на ранней.
Когда происходит контакт человека с T. pallidum, его иммунная система реагирует, вырабатывая антитела к бактерии. В крови могут быть обнаружены два вида антител к бледной трепонеме: IgM и IgG.
В ответ на инфицирование T. pallidum антитела IgM к T. pallidum вырабатываются организмом в первую очередь. Они выявляются у большинства пациентов в конце второй недели заболевания и присутствуют у них в первичную и вторичную стадию. Иммуноглобулины класса G к T. pallidum в определяемых количествах появляются в крови через 3-4 недели после инфицирования. Концентрация их нарастает и на 6-й неделе начинает преобладать над концентрацией IgM, достигая максимума, а затем сохраняется на определённом уровне в течение длительного времени.
Начиная с 4-й недели в крови нарастает количество обоих видов иммуноглобулинов, что ведет к положительному результату теста на суммарные антитела к T. Pallidum. Это позволяет использовать данное исследование для ранней диагностики инфицирования T. pallidum.
После эффективного лечения концентрация иммуноглобулинов постепенно снижается, но происходит это медленно, в отдельных случаях антитела могут обнаруживаться спустя год и более, антитела IgG сохраняются иногда пожизненно. В этом случае необходимо провести уточняющий дополнительный тест — нетрепонемный антикардиолипиновый тест.
Для чего используется анализ?
- Для диагностики сифилиса.
- Для обследования всех беременных с профилактической целью (желательно на первом приеме гинеколога, при постановке на учет).
Когда назначается анализ?
- При симптомах сифилиса, таких как твердый шанкр на половых органах или в горле.
- Когда пациент лечится от другого ЗППП, например от гонореи.
- При ведении беременности, потому что сифилис может передаться развивающемуся плоду и даже убить его.
- Когда необходимо определить точную причину заболевания, если у пациента неспецифические симптомы, которые схожи с сифилисом (нейросифилисом).
- Если пациент инфицирован, он должен повторить анализ на сифилис через 3, 6, 12 и 24 месяцев, чтобы убедиться, что лечение прошло успешно.
Что означают результаты?
Положительный результат
Положительный результат у ранее серонегативного пациента означает, что у пациента недавно приобретённое инфицирование. Вместе с тем отрицательный результат не всегда означает, что у пациента нет сифилиса.
Обнаружение антител к трепонеме в крови новорождённого помогает подтвердить диагноз «врождённый сифилис».
Кроме того, причиной положительного результата может быть третичный или скрытый сифилис.
Отрицательный результат
Отрицательный результат анализа может свидетельствовать об отсутствии инфицирования или слишком раннем его сроке, когда не выработался иммунный ответ. При этом отсутствие антител у младенца, родившегося от инфицированной матери, не исключает врождённого заболевания, поскольку на момент исследования антитела могут ещё не сформироваться.
Что может влиять на результат?
Могут отмечаться ложноположительные результаты при таких заболеваниях, как ВИЧ, болезнь Лайма, малярия, системная красная волчанка, некоторые виды пневмоний, а также при наркомании и беременности.
Необходимо воздержаться от приема пищи в течение 2-3 часов.
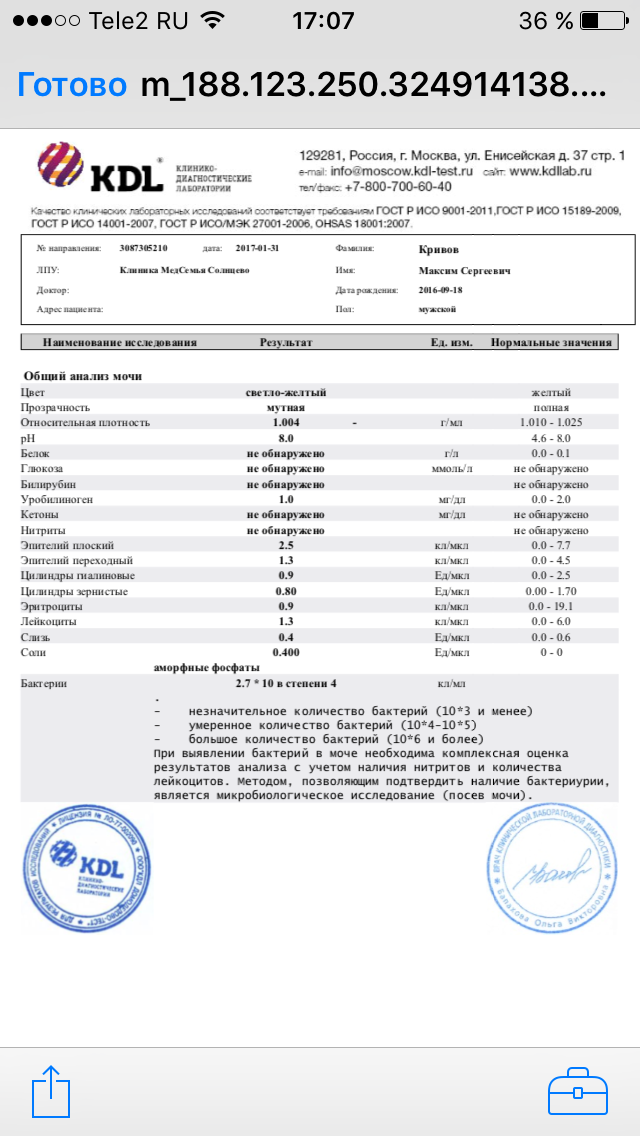
Treponema pallidum, IgG в ликворе: исследования в лаборатории KDLmed
Выявление антител класса IgG против Treponema pallidum в спинномозговой жидкости.
Синонимы русские
Антитела класса IgG к возбудителю сифилиса, иммуноглобулины класса G к бледной трепонеме, спинномозговая (цереброспинальная) жидкость.
Синонимы английские
Syphilis IgG, Antibodies to T. pallidum, IgG, Anti-TP IgG, Cerebrospinal Fluid (CSF).
Метод исследования
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Ликвор.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Treponema pallidum (бледная трепонема) – бактерия из семейства спирохет, возбудитель сифилиса. Есть ряд тропических заболеваний (пинта, беджель и фрамбезия), возбудителями которых являются другие подвиды T. pallidum.
Сифилис – это венерическое заболевание, наиболее часто он передается половым путем. Кроме того, возможно заражение через кровь (например, при совместном использовании шприцев, бритв и пр.), ребенка от матери или бытовым путем (очень редко).
Выделяют врожденный, ранний и поздний сифилис, а также неуточненные формы. В медицинской литературе также используются понятия «первичный», «вторичный» и «третичный сифилис».
Инкубационный период – стадия от момента заражения до первых симптомов (твердого шанкра). Он длится в среднем 21 день (от 10 до 90 дней).
Первичный сифилис – стадия с момента образования твердого шанкра до появления сыпи. Твердый шанкр – это язвочка в том месте, где возбудитель проник в организм (обычно на половых органах). Он не болит и исчезает (без лечения) через 2-6 недель. Шанкр появляется не всегда. Кроме того, на этой же стадии могут увеличиваться лимфоузлы. В первое время заболевший человек остается серонегативным (т. е. в его крови еще не обнаруживаются антитела против сифилиса).
Примерно через 4-8 недель после образования шанкра возникают новые симптомы – это вторичный сифилис: общее недомогание, повышение температуры, головная боль и сыпь. Иногда вторичный сифилис проявляется в виде гепатита (в 10 % случаев), менингита (в 1 %), воспаления надкостницы и др.
Затем симптомы сифилиса проходят и заболевание переходит в латентную фазу. При этом возбудитель не исчезает полностью, поэтому при ослаблении иммунитета могут возникать рецидивы болезни. Их симптомы совпадают с проявлениями вторичного сифилиса.
Иногда сифилис так и остается в латентной форме. Но в ряде случаев, если пациент не лечится, с годами развивается третичный сифилис. При этом поражаются различные органы и ткани: нервная и сердечно-сосудистая система, кости, суставы.
Одна из форм сифилиса, при которой оказывается затронута нервная система, – это нейросифилис. Его внешние проявления становятся заметны на стадии вторичного и третичного сифилиса. Формы нейросифилиса: сифилитический менингит, менинговаскуолярный сифилис, спинная сухотка и прогрессивный паралич.
После заражения сифилисом в крови появляются антитела против T. pallidum. Первыми, через 1-2 недели, возникают IgM, через 6-9 недель их уровень снижается.
Антитела IgG присутствуют в крови в наибольшем количестве (по сравнению с другими типами иммуноглобулинов). Обычно они появляются через 3-4 недели после заражения. В отличие от IgM, уровень иммуноглобулинов G остается высоким долгое время (десятилетия) даже после успешного лечения.
Таким образом, антитела IgG позволяют диагностировать сифилис на любой стадии, начиная с первичного сифилиса (в том числе и латентную форму).
При нейросифилисе антитела присутствуют не только в крови, но и в спинномозговой жидкости. Там можно обнаружить и кардиолипиновые антитела (с помощью нетрепонемных тестов), и специфические антитела против трепонем.
Достаточно часто встречается бессимптомный нейросифилис. Это означает, что воспалительный процесс в нервной системе уже начался, но проявления выражены слабо или отсутствуют.
Для диагностики сифилиса широко используют серологические тесты (т. е. основанные на определении антител). Существует много различных методов, которые можно разделить на две группы: трепонемные и нетрепонемные.
Нетрепонемные тесты выявляют неспецифические антитела, направленные против кардиолипина (липида, который входит в состав мембраны митохондрий и бактерий). Эти антитела появляются в организме со стадии первичного сифилиса. К нетрепонемным тестам относят микрореакции преципитации (например, VDRL или RPR).
Посредством трепонемных тестов детектируют антитела именно против самих бактерий T. pallidum. Специфические трепонемные антигены используются при РПГА (реакции пассивной гемагглютинации), РИФ (реакции иммунофлуоресценции) или ИФА (иммуноферментного анализа).
Для диагностики нейросифилиса исследуют ликвор (спинномозговую жидкость). При заболевании в нем повышены содержание лимфоцитов и уровень белка и присутствуют антитела против T. pallidum.
Для чего используется исследование?
- Чтобы выявить нейросифилис (у больных сифилисом), т. е. определить, затронута ли при сифилисе нервная система. Это позволяет выбрать правильный метод лечения.
- Если есть симптомы поражения нервной системы, тест позволяет уточнить, действительно ли сифилис является их причиной или же существует другой возбудитель.
- Если нет симптомов поражения нервной системы, анализ выявляет бессимптомный нейросифилис.
Когда назначается исследование?
- При раннем сифилисе, если присутствуют симптомы поражения нервной системы.
- При позднем сифилисе и при предполагаемой латентной форме болезни.
Что означают результаты?
Референсные значения
Результат: отрицательно.
КП (коэффициент позитивности): 0 — 0,99.
Отрицательный результат
- Нейросифилиса нет. Если есть симптомы поражения нервной системы, то они объясняются другими причинами (вызваны другим возбудителем).
Положительный результат
- Нейросифилис. Однозначный вывод можно сделать, когда другие данные (симптомы и лабораторные тесты) тоже подтверждают этот диагноз.
- Нейросифилис в прошлом. Уровень IgG остается высоким долгое время, даже если заболевание уже вылечено.
Что может влиять на результат?
Повреждение кровеносных сосудов во время пункции – попадание крови в ликвор – может привести к ложноположительному показателю (если в крови есть антитела, а в ликворе – нет).
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, венеролог.
Литература
- Марданлы С. Г., Дмитриев Г. А. Лабораторная диагностика сифилиса (информационно-методическое пособие). М., 2009.
- Binnicker M. J. et al. Treponema-Speci?c Tests for Serodiagnosis of Syphilis: Comparative Evaluation of Seven Assays. J Clin Microbiol. 2011; 49(4): 1313-1317.
- Timmermans M. et al. Neurosyphilis in the modern era. J Neurol Neurosurg Psychiatry. 2004; 75:1727–1730.
- Goldman’s Cecil Medicine. 24th ed. Goldman L, Schafer A.I., eds. Saunders Elsevier; 2011.
Ложноположительные серологические реакции на сифилис
Что делать, если не болел сифилисом и не имел контакта с больным сифилисом человеком, но результаты обследования показали положительные результаты?
Есть такой термин в дерматовенерологии — ложноположительные серологические реакции на сифилис или же сокращенно ЛПР. Ложноположительными являются положительные результаты серологических реакций (реакции антиген — антитело) на сифилис у людей, которые не болели Lues (сифилисом) и не имели контакты с больными.
Любой чужеродный агент несет в своем составе антиген, что является «врагом» для нашего организма. Попадая внутрь, наша иммунная система отвечает выработкой антитела, который блокирует «врага». Реакция антиген-антитело (серологическая реакция) говорит о столкновении организма с определенным «врагом» и сохраняет эту информацию в памяти иммунной системы.
ЛПР вызываются вариативностью результатов анализаторов и индивидуальностью обменных процессов человека. Условно ЛПР разделяют на острые (менее полугода) и хронические (более полугода).
Острые ЛПР бывают: при менструальном цикле, беременности, после постановки вакцины, при многих инфекционных болезнях (начиная с ОРВИ и гриппа, при ветрянке, вирусном гепатите и ВИЧ-инфекции, заканчивая лепрой и малярией) и заболеваниях кожи, даже после недавно перенесенного инфаркта миокарда.
Хронические ЛПР — в первую очередь при онкопатологии, системных болезнях соединительной ткани, аутоиммунных заболеваниях, хронических болезнях печени и желчевыводящих путей, болезнях крови, сердечно-сосудистой и эндокринной патологии, хронических заболеваниях легких, инъекционном применении наркотиков, в старческом возрасте и др.
Хронические ложноположительные реакции могут служить признаками тяжелых заболеваний.
Получив положительные результаты на сифилис, не стоит паниковать раньше времени, необходимо обратиться к специалисту!
Будьте здоровы!
Рельсы и анкеры: направляющие и улавливающие микрореакторы для капель в двух измерениях
В этой статье представлен метод управления движением капель нанолитра в широком и тонком микроканале путем вытравливания мелких узоров на верхней поверхности канала. Такой контроль возможен для капель, которые сдавливаются кровлей канала, позволяя им снижать свою поверхностную энергию, когда они попадают в локальную депрессию. Результирующий выигрыш в поверхностной энергии втягивает каплю в канавку, так что локализованные отверстия можно использовать в качестве якорей для удержания капель, в то время как линейные узоры могут использоваться как направляющие, чтобы направлять их по сложным траекториям.Закрепленная капля может оставаться неподвижной неопределенно долго, пока скорость движущегося потока ниже критического значения, которое зависит от размера отверстия и капли. Путем микроизготовления отверстий в виде сетки капли могут быть собраны и удержаны в поле наблюдения микроскопа против среднего потока носителя. Затем их содержание можно регулировать за счет газообмена с текущим маслом-носителем. В частности, мы демонстрируем, как можно контролировать уровень pH или кислорода в каплях в пространстве и во времени, либо подвергая ряды капель двум потокам нефти с разными концентрациями газа, либо периодически переключая входы масла для изменения концентрации газа в каплях по мере того, как функция времени.Кислородный контроль используется для избирательной деоксигенации капель, которые инкапсулируют эритроциты пациентов, страдающих серповидно-клеточной анемией, с целью изучения полимеризации внутриклеточного гемоглобина. Циклы оксигенации и деоксигенации закрепленных капель вызывают деполимеризацию и полимеризацию гемоглобина, тем самым обеспечивая метод имитации цикличности физиологических потоков.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?Быстрое обнаружение отдельных бактерий в необработанной крови с помощью интегрированного комплексного цифрового детектирования капель
Обзор IC 3D
Наша система IC 3D объединяет технологию датчика ДНКзима в реальном времени, капельную микрофлюидику и высокопроизводительную систему трехмерного счетчика частиц (рис.1). Используемые здесь сенсоры ДНКзимов представляют собой короткие каталитические олигонуклеотиды, которые идентифицированы с помощью in vitro evolution, чтобы специфически реагировать с лизатами бактерий-мишеней, что приводит к быстрому сигналу флуоресценции 19 . В частности, образцы крови смешиваются с раствором сенсора ДНКзима, включая буфер для лизиса бактерий в микрофлюидном канале, который затем немедленно инкапсулируется в 100 секунд миллионов отдельных пиколитровых капель. Ограничение бактерий в каплях, которые служат «микрореакторами», значительно увеличивает (i) концентрацию высвобожденных молекул-мишеней в каплях, содержащих бактерии, так что отдельные бактерии могут быть быстро обнаружены сенсорами ДНКзима и (ii) мишень / фоновое соотношение для минимизации помех от неспецифического связывания и шума.В системе IC 3D капли после генерации собираются во флакон и анализируются с использованием высокопроизводительной системы подсчета частиц 3D. Трехмерный счетчик частиц был недавно разработан Граттоном и его коллегами и может надежно и точно обнаруживать однофлуоресцентные частицы в миллилитровых объемах в течение минут 20,21 . В системе IC 3D разделенная на отдельные мишени реакция, опосредованная датчиками ДНКзима, имеет решающее значение для «освещения» капель, содержащих бактерии-мишени, чтобы их можно было обнаружить с помощью счетчика частиц 3D с исключительно высокой надежностью и клинически значимой пропускной способностью.
Рисунок 1: Схематическое описание технологии IC 3D.( a ) Образцы крови и датчики ДНКзима смешиваются, а затем инкапсулируются в виде капель размером в миллионы микрометров за 100 секунд. Датчики ДНКзима производят мгновенный сигнал в каплях, содержащих бактерии. ( b ) В IC 3D капли собираются и анализируются с помощью нашего высокопроизводительного трехмерного счетчика частиц, который позволяет точно определять однофлуоресцентные капли в несколько миллилитровом пуле нефлуоресцентных капель в течение нескольких минут.
Датчики ДНКзимов селективно обнаруживают целевые бактерии в массе
ДНКзимы (также называемые «ДНК-ферментами» или «дезоксирибозимами») представляют собой синтетические одноцепочечные ДНК-олигонуклеотиды с каталитической активностью 22,23 . Эти каталитические молекулы ДНК генерируются in vitro из обширной случайной библиотеки с использованием комбинаторного подхода под названием in vitro evolution 24,25 . Одним из наиболее известных ДНКзимов является РНК-расщепляющий ДНК-мотив, который может расщеплять химерный субстрат ДНК-РНК в месте соединения одного рибонуклеотида 22,26 .Али и его коллеги недавно использовали это уникальное свойство для создания сенсоров ДНКзимов, специфичных для бактерий, посредством in vitro эволюции обширной библиотеки ДНК против компонентов неочищенного внеклеточного матрикса (CEM) бактерий-мишеней как сложных мишеней 19 . Более позднее исследование показало, что клеточный лизат производит намного более высокий сигнал флуоресценции по сравнению с CEM сенсорами ДНКзима, предполагая, что клетки содержат большее количество мишеней, чем CEM 27 . Поэтому в нашем исследовании мы решили лизировать клетки для облегчения обнаружения и сначала протестировали серию детергентов и ферментов для оптимизации условий лизиса клеток и определили, что лизоцим наиболее эффективно лизирует бактерии, не влияя на образование и стабильность капель или функцию сенсора ДНКзима ( подробности см. в разделе «Методы»).
Мы стремились использовать эти быстрые флуорогенные датчики ДНКзима в нашей системе IC 3D. Как показано на рис. 2а, датчик содержит домен ДНКзима, который лигирован с химерным субстратом ДНК-РНК, где сайт расщепления рибонуклеотида фланкирован флуорофором и гасителем. Это «неактивное» состояние имеет минимальный сигнал флуоресценции из-за непосредственной близости флуорофора и гасителя. В присутствии бактерий-мишеней, E. coli , используемых здесь в качестве модельной системы, ДНКзимы будут связываться с молекулами-мишенями, продуцируемыми бактериями, и расщеплять субстрат.Событие расщепления (дополнительный рис. 1) освобождает флуорофор от его гасителя, тем самым генерируя высокий сигнал флуоресценции (рис. 2b). Более того, датчик ДНКзима способен отличать мишень E. coli от контрольных бактерий или клеток млекопитающих с высокой селективностью (рис. 2c). Кроме того, мы демонстрируем, что сенсоры ДНКзима, ранее выделенные с использованием исходных изолятов E. coli 19 , могут надежно и выборочно обнаруживать клинические изоляты E. coli , которые были добавлены, а затем лизированы в крови (рис.2г). Интересно отметить, что хотя датчик ДНКзима может обнаруживать все клинические образцы E. coli , интенсивность флуоресценции варьируется между образцами, что может отражать потенциальную молекулярную гетерогенность между различными штаммами E. coli . Кроме того, интенсивность флуоресценции, по-видимому, немного увеличилась в группах C. freundii по сравнению с контролем, получавшим только кровь, но она была статистически значимо меньше, чем в группах E. coli ( P 0.001, двусторонний тест Стьюдента t ) и статистически не отличался от других клинических контрольных изолятов ( P = 0,85, двусторонний тест Стьюдента t ). Тем не менее, это указывает на необходимость тщательной проверки специфичности сенсора с использованием большего количества образцов пациентов в будущем. Это также предполагает, что путем включения соответствующих мишеней положительного и отрицательного отбора в процесс эволюции in vitro можно создать сенсоры ДНКзима, которые могут различать разные штаммы одного и того же вида бактерий, что необходимо будет проверить в будущей работе.Поскольку наша цель — разработать метод смешивания и считывания, в котором используется цельная кровь без обработки образца или с минимальной обработкой образца (например, с разбавлением), мы дополнительно проверили работу датчика в крови и обнаружили, что наш ДНКзим, модифицированный флуоресцеином / дабцилом. сенсоры вырабатывали достаточно высокий сигнал флуоресценции в ответ на добавку E. coli в крови, которая была разбавлена раствором сенсора до различных объемных соотношений (дополнительный рис. 2a) с конечной концентрацией 10% в крови, которая была определена как оптимальная и поэтому использовалась в последующем капельные эксперименты (ниже).Мы предполагаем, что оптимизация пар красителей, особенно с использованием красителей в ближнем инфракрасном диапазоне, которым в будущем будет меньше мешать автофлуоресценция крови, может дополнительно улучшить характеристики сенсора (например, соотношение сигнал / шум) в крови. Мы также продемонстрировали, что сенсоры ДНКзима показали достаточную стабильность в крови в течение периода времени (± 1,5–4 часа), который мы нацелены на будущее клиническое использование (дополнительный рис. 2b). При необходимости использование хорошо зарекомендовавших себя химически модифицированных нуклеотидов (например, фосфоротиоатов) в ДНКзимах или ингибитора РНКазы в буфере для анализа может дополнительно повысить стабильность сенсора в крови.
Рис. 2: Датчики ДНКзима в реальном времени выборочно и быстро обнаруживают целевые лизаты E. coli в большом количестве.( a ) Предлагаемый механизм того, как датчик ДНКзима генерирует флуоресцентный сигнал при взаимодействии с мишенью. Мишень (и), продуцируемая бактерией, связывается с неактивной последовательностью ДНКзима (красная), которая претерпевает конформационные изменения для активации ДНКзима. Активированный ДНКзим катализирует расщепление флуорогенного субстрата на стыке рибонуклеотидов (R), что приводит к разделению флуорофора (F) и гасителя (Q) для получения сигнала высокой флуоресценции.( b ) Сенсор ДНКзима выдает сигнал флуоресценции в реальном времени в присутствии лизатов-мишеней E. coli K12 . Напротив, мутированная последовательность ДНКзима неактивна. Лизаты из 10000 бактерий и 50 нМ ДНКзима смешивали в конечном объеме 50 мкл в буфере HEPES и регистрировали сигнал с помощью считывающего устройства для флуоресцентных планшетов. Результаты представлены в виде среднего значения ± s.e.m ( n = 3). ( c ) Датчик ДНКзима специфически обнаруживает штаммы E. coli , но не бактерии, не являющиеся мишенями, или клетки млекопитающих, лимфобласт CCRF-CEM Т-клеток человека и эндотелиальные клетки пупочной вены человека (HUVEC).Лизаты из 10000 клеток и 50 нМ ДНКзима смешивали в конечном объеме 50 мкл в буфере HEPES и инкубировали в течение 30 мин. Продукты реакции ДНКзима анализировали электрофорезом в полиакриламидном геле. Процентное расщепление для каждой реакции было получено, нормализовано относительно контроля только ДНКзима и представлено как «Относительная флуоресценция». ( d ) Датчики ДНКзима могут выборочно обнаруживать клинические изоляты E. coli . Бактерии (1000 КОЕ), выделенные из 11 различных образцов пациентов, инкубировали со 100 нМ ДНКзима и 1 мг / мл лизоцима -1 в 10% крови в течение 30 минут.Интенсивность флуоресценции получали с использованием флюоресцентного планшет-ридера, обычно по отношению к контролю, содержащему только ДНКзим (con), и выражали как «относительную флуоресценцию». Данные получены в одинарном слепом эксперименте. В c и d все эксперименты были выполнены в трех повторностях. Данные представлены в виде среднего ± стандартное отклонение, n = 3, *** P ≪0,001, **** P 0,0001, двусторонний критерий Стьюдента t .
Датчики ДНКзима быстро обнаруживают отдельные бактерии в каплях
Далее мы интегрировали датчики ДНКзима с системой капельной микрофлюидики, чтобы проверить нашу гипотезу о том, что удержание бактерий в каплях может значительно повысить чувствительность (то есть одноклеточных) и сократить время обнаружения время.Система «капельная микрофлюидика» позволяет генерировать и обрабатывать монодисперсные капли жидкости пиколитрового размера (обычно от 5 до 100 мкм в диаметре) в несмешивающейся масляной жидкости-носителе (то есть эмульсии вода-в-масле) 28,29, 30,31,32,33 . Капельная микрофлюидика — это новая платформа для сверхчувствительного биологического обнаружения и анализа. В частности, новаторская работа групп Weitz и Griffiths, а также компаний, включая Bio-Rad и Raindance, продемонстрировала ряд капельных «цифровых» анализов нуклеиновых кислот (например, цифровая ПЦР), клеток и организмов 10, 31,34 .Однако традиционная капельная система ограничена своей низкой пропускной способностью при анализе капель и поэтому не подходит для анализа проб большого объема (см. Раздел «Быстрое обнаружение отдельных бактерий в клинических образцах крови») 31,34 .
В нашем исследовании капельные микрожидкостные системы были изготовлены с использованием стандартной мягкой литографии и работали в соответствии с ранее установленными процедурами (см. «Изготовление микрожидкостных устройств на основе капель» в разделе «Методы»). 35 . Как показано на рис.3а, чип поли (диметилсилоксана) (PDMS) имеет одно впускное отверстие для масла и два впускных отверстия для воды (одно для бактерий, содержащих буфер или кровь, а другое — для датчика ДНКзима, смешанного с реагентом для лизиса бактерий (лизоцимом)). Однородные капли размером пиколитра были получены с использованием стандартных шприцевых насосов со скоростью приблизительно 2000 Гц путем фокусирования потока полученного потока с помощью фторированного масла HFE-7500, содержащего 1,8% (мас. / Мас.) Перфторированных полиэфиров с поверхностно-активным полиэтиленгликолем (рис. 3b и рис. Дополнительный фильм).Мы генерировали капли разных размеров от 5 до 50 мкм в диаметре, просто настраивая размер микрожидкостного канала и скорость потока. На рис. 3с показано репрезентативное изображение капель размером 30 мкм, содержащих 10% крови. Мы обнаружили, что эти капли могут стабильно храниться без утечки или слияния в течение месяцев при комнатной температуре, даже если они плотно упакованы во флакон. Генерация капель с высокой пропускной способностью может быть достигнута с помощью многослойного микрожидкостного устройства, которое содержит несколько параллельных структур, генерирующих капли (см. «Изготовление микрожидкостного устройства на основе капель» в Способы и на дополнительном рис.3 для восьмиканального устройства). Для достижения клинически полезной пропускной способности в настоящее время мы разрабатываем устройство, которое содержит 256 каналов образования капель, которое способно преобразовывать 1 мл крови в капли размером 25 мкм, содержащие 10% крови, со скоростью генерации 2000 Гц на канал за ± 40 мин. Кроме того, использование капель большего размера и меньшего коэффициента разбавления крови может еще больше значительно сократить время образования капель.
Рисунок 3: Рабочий процесс микрокапсулирования.( a ) Схема микрожидкостного устройства на основе капель.Устройства были спроектированы с тремя входами; один для масла и два других для образцов крови и буфера для лизиса ДНКзима / бактерий. ( b , c ) Репрезентативные микроскопические изображения, показывающие однородные капли размером 30 мкм, содержащие 10% крови и раствор сенсора, были получены с использованием фокусировки потока. Шкала 200 мкм. В c содержимое крови, особенно эритроцитов, четко видно в виде капель. ( d ) Капли, собранные в кювету, использованную для экспериментов с трехмерным счетчиком частиц.( e ) Типичные изображения флуоресцентного микроскопа демонстрируют, что сенсоры ДНКзима (250 нМ) освещают капли, которые содержат одну E. coli K12 в 10% крови после 3-часовой реакции. Левая панель: наложение флуоресценции и светлого поля. Правая панель: флуоресценция. Шкала 200 мкм.
Как и в случае BSI у взрослых, бактерии в крови пациента находятся в небольшом количестве (обычно 1–100 КОЕ / мл -1 ), при инкапсулировании в пиколитровые капли каждая капля будет содержать одну бактерию или не содержать ни одной бактерии.Поэтому очень важно проверить, способна ли наша система обнаруживать одну бактерию в капле. В частности, бактерии статистически разбавляли для достижения диапазона концентраций от 10 до 10 7 мл -1 добавляли в буфер HEPES или кровь и разделяли на капли. В некоторых экспериментах бактерии окрашивали Syto17 (красный), что позволяет нам совместно локализовать бактерию с сигналом датчика ДНКзима (зеленый) в одной и той же капле для определения ложноположительных и отрицательных результатов.В этом разделе флуоресцентные капли визуализировались с помощью обычной флуоресцентной (или конфокальной) микроскопии или подсчитывались на чипе в одномерном микрофлюидном канале с пропускной способностью ~ 200 капель в секунду с использованием настраиваемого конфокального микроскопа, оснащенного детекторами APD (см. ‘1D на -система обнаружения чипов ‘в дополнительных методах). Сначала мы демонстрируем, что в буфере сенсорная система ДНКзима способна обнаруживать единственную цель E. coli K12, которая лизируется в капле (диаметром 5 мкм) в течение 8 минут (дополнительный рис.4). Этот пилотный эксперимент проверил нашу гипотезу о том, что ограничение бактерий в каплях обеспечивает чувствительность отдельных клеток и сокращает время обнаружения. Для обнаружения бактерий в крови нам нужно было оптимизировать размер капель: хотя меньшие размеры капель приводят к более высоким целевым концентрациям отдельных клеток (что увеличивает соотношение сигнал / фон и сокращает время обнаружения), технически сложно инкапсулировать содержимое крови. включение красных и белых кровяных телец в слишком мелкие капли.Мы определили, что капли диаметром 25 мкм являются оптимальными для этой цели и поэтому используются для последующих экспериментов с каплями крови. Используя флуоресцентную микроскопию (рис. 3e) или одномерную систему подсчета капель на кристалле (дополнительный рис. 5), наша система может выборочно обнаруживать единственную цель E. coli K12 в 10% крови в каплях. Кроме того, путем совместной локализации с сигналом Syto17, мы наблюдаем, что наша инкапсулированная сенсорная система ДНКзима имеет нулевую частоту ложных срабатываний и минимальную частоту ложноотрицательных результатов (~ 0.5%) из ~ 70 000 подсчетов капель в трех повторных экспериментах, которые мы выполнили с использованием E. coli K12 в качестве положительной мишени и одного сенсора или контрольных бактерий в качестве отрицательного контроля (дополнительный рисунок 5). Наконец, хотя генерация сигнала сенсора ДНКзима в капле крови размером 25 мкм не такая быстрая, как в капле буфера размером 5 мкм, измеримый сигнал флуоресценции можно наблюдать в течение 3 часов в ответ на одну бактерию в крови (рис. 3e и дополнительный рис. 5; дальнейшие исследования кинетики ДНКзима см. Ниже).
Быстрое обнаружение отдельных бактерий в клинических образцах крови
Выше мы продемонстрировали, что сенсорная система инкапсулированного ДНКзима может быстро обнаруживать целевые бактерии с чувствительностью отдельных клеток в капле. Тем не менее, одномерная система подсчета капель на кристалле (которая также используется в системе цифровой ПЦР капель) и другие системы подсчета частиц, включая проточную цитометрию, страдают от низкой пропускной способности: они обычно работают со скоростью 1000 с частиц в секунду и могут только анализировать всего от 100000 с до 1 миллиона капель (или общий объем пробы ~ десятки микролитров) 31,34 .Следовательно, существующие системы обнаружения капель неизбежно требуют подготовки образца для очистки и обогащения мишеней и уменьшения объема образца перед инкапсуляцией капель. Однако в нашей системе мы хотим быстро анализировать необработанную кровь пациента с объемом клинической пробы, как правило, миллилитрами, что соответствует миллиардам капель. Чтобы эффективно анализировать это множество капель за короткий период времени и обнаруживать отдельные флуоресцентные, содержащие бактерии капли среди миллионов пустых, в систему IC 3D мы интегрировали 3D-счетчик частиц 21 , как мы описали ранее, который может обнаружение флуоресцентных частиц в миллилитровых объемах с чувствительностью к отдельным частицам в течение нескольких минут.Вкратце, как показано на рис. 1b и дополнительном рис. 6, изготовленный на заказ прототип устройства состоит из небольшого портативного микроскопа, имеющего горизонтальную геометрию, и механической части, которая удерживает цилиндрическую кювету диаметром 1 см. Два двигателя обеспечивают вращательное (от 10 до 1100 об / мин) и вертикальное движение вверх-вниз (от 1 до 15 мм с -1 ) кюветы. Свет возбуждения, генерируемый диодным лазером (469 нм), фокусируется в объеме наблюдения, который обычно расположен относительно близко к внутренней стенке кюветы.Излучение образца собирается тем же объективом, проходит через набор дихроичных фильтров, фокусируется линзой в точечное отверстие и затем коллимируется второй линзой на фотоумножитель (ФЭУ). Оптика микроскопа предназначена для измерения относительно большого объема (100 пл) примерно за 0,01 мс. Вращение пробирки по спирали в течение около 100 с позволяет эффективно исследовать около 1 мл пробирки. Подчеркнем, что при использовании этой оптической установки мы проникаем в образец всего на 150 мкм.Следовательно, с сильно рассеивающими образцами, такими как цельная кровь (даже до разбавления), которые имеют коэффициент пропускания при 500 нм около 10% для длины пути 250 мкм, можно легко обрабатывать.
Мы инкапсулировали сенсоры крови и ДНКзима, содержащие бактерии, в капли, как описано ранее. Капли собирали в кювету (рис. 3d), а затем анализировали с помощью системы трехмерного подсчета частиц. Используя эту систему, мы продемонстрировали, что флуоресцентные капли, которые содержат единственную цель E. coli K12 и сенсоры ДНКзима, могут быть обнаружены при чувствительности к единичным каплям из типичного объема образца 2 мл в течение 3 минут измерения (рис.4а, б). Наша текущая система обычно работает с пропускной способностью ~ 100 000 капель в секунду или эффективным объемом наблюдения ~ 0,1 мл мин. -1 . При такой высокой пропускной способности увеличение объема образца в результате разбавления крови в наших экспериментах становится меньшей проблемой. На рис. 4b показана типичная временная диаграмма с пиками интенсивности флуоресценции, полученными от содержащих бактерии капель. Важно подчеркнуть, что в нашем 3D-анализе IC обнаружение «попадания» определяется алгоритмом распознавания образов (рис.4b, вставка и «Принцип алгоритма распознавания образов и количественный критерий обнаружения» в Методах), а не пороговая интенсивность (которая широко используется в обычных системах одномерного подсчета частиц и обычно страдает от более высоких показателей ложноположительных / отрицательных результатов, поскольку интенсивность зависит от многих факторов, включая лазеры и детекторы). Вкратце, флуоресцентная частица (капля в нашей статье) обнаруживается по «форме», создаваемой прохождением частицы в объеме освещения, который для нашего прибора является гауссовым.Распознавание образов определяет время прохождения частицы и амплитуду обнаруженного образа. Заранее определенный с использованием флуоресцентных капель, которые содержат уже расщепленные или прореагировавшие датчики ДНКзима («стандарт»), наш алгоритм распознавания образов может автоматически фильтровать шум и сообщать только истинные бактериосодержащие флуоресцентные капли. Такое распознавание образов позволяет нам добиться исключительно надежного и точного обнаружения низкой концентрации флуоресцентных капель в больших объемах образцов, что приводит к практически нулевому уровню ложноположительных результатов (то есть « попадание » всегда является истинным положительным результатом даже среди сотен образцов. миллионы пустых капель).Это подтверждается нулевым общим количеством контрольных образцов, включая образцы крови здоровых доноров без бактерий ( n = 5; см. Рис. 4a для репрезентативного графика времени и дополнительную таблицу 2 для полного подсчета) или с добавлением нецелевых клинических бактериальных изолятов. ( n = 8; рис. 5 и дополнительная таблица 2).
Рис. 4. Обнаружение бактерий в образцах крови с помощью системы IC 3D.Сгенерированные капли (диаметром 25 мкм), содержащие датчики ДНКзима (250 нМ) и 10% крови с добавлением бактерий, собирали (2 мл) в кювету и анализировали с помощью счетчика частиц 3D.( a ) Одна донорская кровь (без бактерий), смешанная с датчиками ДНКзима, не показывала никакого сигнала. ( b ) Измерение репрезентативного образца бактерий показывает типичную временную кривую с пиками интенсивности флуоресценции, полученными от капель, содержащих одну E. coli K12. Временной профиль анализируется с помощью алгоритма распознавания образов (вставка) для извлечения результатов измерения концентрации и / или яркости капель в образце. В этой серии экспериментов кровь с добавлением бактерий инкубировали с ДНКзимом в каплях в течение 3 часов.Концентрация бактерий составляла 1000 КОЕ / мл -1 капельного раствора. ( c ) Кинетика ДНКзимной реакции для количественного обнаружения бактерий в каплях крови, измеренная с помощью счетчика частиц 3D. Всего в этом образце было добавлено 1000 бактерий. Количество флуоресцентных капель определяли каждые 15 мин с использованием счетчика частиц 3D (дополнительный рисунок 7, дополнительная таблица 1), и количество обнаруженных бактерий наносили на ось y как функцию времени реакции ДНКзима.Данные представлены как среднее ± стандартное отклонение, n = 3. ( d ) Фактическое подсчитанное количество клеток с использованием IC 3D (ось y ) в сравнении с широким диапазоном концентраций добавленных бактерий (ось x : количество бактерий на миллилитр раствора собранных капель; исходные данные представлены в дополнительных Таблица 2). Y = 0,95 X . R 2 = 0,999. Для точного достижения чрезвычайно низкой концентрации бактерий (1–50 клеток на мл –1 ) перед инкапсулированием бактерии собирали и вносили в кровь с помощью системы микроинжектора.Кровь, зараженная бактериями, инкубировали с ДНКзимом в каплях в течение 3 часов в этой серии экспериментов. Данные представлены как среднее ± стандартное отклонение, n = 3. Обратите внимание, что планки ошибок для концентраций 100, 1000 и 10000 клеток на мл слишком малы, чтобы их можно было увидеть.
Рис. 5. Система IC 3D может выборочно обнаруживать клинические изоляты E. coli .Типичные данные трехмерного счетчика частиц демонстрируют, что только целевой изолят E. coli среди 11 различных бактериальных изолятов генерирует типичные всплески интенсивности флуоресценции в одинарном слепом эксперименте.Общее количество подсчитанных клеток в каждом образце показано в полях в верхнем левом углу. E. coli Кровь с добавлением K12 использовали в качестве положительного контроля.
Чтобы определить минимальное время реакции ДНКзима, которое требуется в нашей 3D-системе IC для обнаружения бактерий в необработанной крови, мы отслеживали сигнал от 2-мл капельного раствора с течением времени, используя наш 3D-счетчик частиц (рис. 4c, дополнительный рис. 7 и дополнительная таблица 1). Мы заметили, что всего за 45 минут реакции ДНКзима тест IC 3D может дать результат «да или нет», тогда как 3.Обычно требуется 5 часов для получения абсолютно количественных данных о количестве клеток в образце. Затем мы продемонстрируем, что наша система может обеспечить абсолютное количественное определение целевых бактерий в широком диапазоне чрезвычайно низких концентраций от 1 до 10 000 бактерий на мл с одноклеточной чувствительностью и исключительным пределом обнаружения (LOD) в однозначном режиме (рис. 4d и дополнительная таблица 2 для необработанных данных и ошибок). Существует исключительная линейная корреляция между обнаруженным количеством капель и фактической концентрацией целевых бактерий в образце крови.Что касается частоты ложноотрицательных результатов и аналитических ошибок в этих положительных образцах, то для концентраций 10–10 000 клеток на мл мы всегда можем обнаружить цель E. coli , несмотря на аналитические ошибки, то есть сообщить о «положительном результате». в тесте «да или нет» с нулевой вероятностью ложноотрицательных результатов. Для образцов 1 клетка на мл наш анализ обычно обнаруживает бактерии ~ 77% случаев. Обратите внимание, что время измерения может быть увеличено для уменьшения ошибок 20,21 .Следовательно, LOD находится в однозначном режиме. Наконец, чтобы продемонстрировать потенциальную клиническую применимость, мы протестировали нашу систему с использованием клинических бактериальных изолятов, полученных из положительных культур крови. Мы обнаружили, что наша система IC 3D может выборочно и надежно обнаруживать клинические изоляты E. coli с характеристиками, аналогичными тем, которые мы наблюдали для положительного контроля E. coli K12 (рис. 5).
Термопневматическая аспирационная интегрированная микрофлюидная система анализа крови
Abstract
Анализы крови предоставляют важную диагностическую информацию в отношении нескольких заболеваний.Ключевым фактором, влияющим на точность и достоверность анализов крови, является вмешательство эритроцитов; однако обычные методы отделения крови часто сложны и требуют много времени. В этом исследовании мы разработали простую, но высокоэффективную систему отделения крови на самонагружающемся микрофлюидном устройстве, которое отделяет 99,7 ± 0,3% плазмы всего за 6 минут. Параметры, такие как скорость потока, конструкция желоба для фильтра и относительное положение желоба и канала для фильтра, были оптимизированы с помощью микроскопического мониторинга.Кроме того, в этом устройстве, управляемом перепадом воздуха, используется экономичное и простое в использовании нагревательное устройство, которое создает среду с низким давлением в микроканале за считанные минуты. Обладая вышеупомянутыми преимуществами, это устройство для отделения крови могло бы стать еще одним выбором платформы для тестирования в местах оказания медицинской помощи.
Образец цитирования: Yang C-H, Hsieh Y-L, Tsou P-H, Li B-R (2019) Встроенная система микрожидкостного анализа крови с термопневматическим отсосом. PLoS ONE 14 (3): e0208676. https: // doi.org / 10.1371 / journal.pone.0208676
Редактор: Арум Хан, Техас A&M University College Station, СОЕДИНЕННЫЕ ШТАТЫ
Поступила: 19 ноября 2018 г .; Принята к печати: 13 февраля 2019 г .; Опубликовано: 7 марта 2019 г.
Авторские права: © 2019 Yang et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Это исследование было финансировано Министерством науки и технологий (MOST) Тайваня (106-2113-M-009-013-MY2, BRL) и Центром новых функциональных наук о материи Национального университета Цзяо Дун. , Программа центра исследований избранных областей в рамках проекта «Ростки высшего образования» Министерства образования (МО) Тайваня.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Неспособность быстро диагностировать многочисленные заболевания является важной причиной смерти как от инфекционных, так и от неинфекционных заболеваний в развивающихся странах или регионах с недостаточными медицинскими ресурсами. Анализы крови предоставляют важную диагностическую информацию относительно нескольких заболеваний, включая рак [1], болезнь Альцгеймера [2] и сепсис [3].Золотой стандарт анализа крови пациента требует дорогостоящего лабораторного оборудования и хорошо подготовленных технических специалистов; однако в районах с ограниченными ресурсами часто отсутствует даже базовое диагностическое оборудование и обученный персонал. Кроме того, большинство пациентов находятся далеко от клиники, где доступны лабораторные услуги. Поэтому для быстрого клинического тестирования предпочтительны биосенсоры для обнаружения различных биомаркеров, патогенов или физиологических сигналов [4–8].
Основным ограничением типичных анализов крови является то, что требуются относительно большие объемы (в мл) образцов крови, относительно длительное время анализа (> 1 ч) и сложные этапы обработки [9].Кроме того, надежность результатов тестирования зависит от качества плазмы [10–12]. Поведение клеток крови, например гемолиз и лейколиз, в образце крови может повлиять на качество образца. Обычно кровь отделяют в лаборатории с помощью громоздкого и дорогостоящего оборудования для центрифугирования, которым должны управлять квалифицированные клинические техники [13]. Эти недостатки препятствуют использованию анализов крови в регионах с ограниченными ресурсами.
Микрожидкостная технология считается перспективным подходом к решению вышеупомянутых проблем [14–17].Он миниатюризирует и объединяет большинство лабораторных технологий в один небольшой чип и анализирует небольшие количества образцов за короткое время. Более того, его простая операция сводит сложные многоступенчатые процедуры предварительной обработки проб и анализа к одному шагу; Таким образом, микрофлюидная система может использоваться людьми без профессиональной подготовки. Таким образом, микрофлюидная технология имеет решающее значение для проведения тестирования в месте оказания медицинской помощи (POCT) [18–20]. Преимущества системы теплового аукциона заключаются в простоте конструкции устройства и механизма, небольшого размера системы, что показывает ее потенциал для развития с портативным оборудованием [21, 22].Таким образом, разработанный чип позволяет проводить диагностические тесты у пациента или рядом с ним, а также в месте оказания помощи или лечения [23]. Следовательно, все большее количество устройств для анализа крови в настоящее время основано на микрофлюидной технологии [24–26].
Разделение плазмы играет жизненно важную роль в анализах крови. Для разделения плазмы в микрофлюидных системах использовались многочисленные методы, в том числе электроосмотическая бифуркация потока (эффект Цвайфаха – Фунга) [27], геометрические препятствия [28], силы акустической стоячей волны [29], мембранная фильтрация [30] и перекрестная фильтрация. проточная фильтрация [31].Однако большинство этих методов имеют два основных недостатка, а именно сложность микрожидкостной конструкции и необходимость внешней силы (обеспечиваемой шприцевыми насосами, сжатым воздухом, электропневматическими системами, высоковольтными источниками питания или двигателями). Кроме того, для большинства устройств необходима обработка, например разбавление образцов крови перед выдачей. Таким образом, высокая стоимость, сложность изготовления, низкая портативность и сложные процедуры эксплуатации являются недостатками, связанными с разделением плазмы [32].
Практический метод реализации движения потока на кристалле и разделения плазмы был предложен Димовым и др. [33] Они продемонстрировали автономную, автономную систему, которая использовала вакуумную среду и гравитационное осаждение. Устройство имело относительно простую микрофлюидную конструкцию и рабочий механизм; однако скорость разделения этой системы была нестабильной. Кроме того, требовался вакууматор для создания среды низкого давления для разделения плазмы; это было не только трудоемким и дорогостоящим, но и трудным для использования вне лаборатории.Поэтому мы дополнительно исследовали влияние различных желобов фильтров и микроканалов на скорость разделения. Мы изменили геометрию траншеи, углы наклона и относительное положение траншеи и микроканала. Следовательно, мы нашли подходящую микрофлюидную трехмерную структуру, которая значительно улучшила разделение. Более того, чтобы снизить стоимость и улучшить портативность, мы ввели ленточный нагреватель, чтобы создать среду низкого давления для ввода пробы, вместо вакууматора.
Здесь мы сообщаем о гравитационном устройстве для разделения плазмы с новой микрожидкостной конструкцией после демонстрации его эффективности разделения (в отношении чистоты плазмы) с использованием нового подхода к автономной инжекции (рис. 1). Наши результаты показали, что эффективность разделения улучшилась с 17,1 ± 1% до 99,7 ± 0,3% после корректировки геометрической конструкции канала и желоба фильтра. Создание среды с низким давлением с нагревательным устройством было быстрее и значительно удобнее, чем с помощью вакууматора.Мы разделили утомительную процедуру отделения крови на два более коротких этапа, а именно: нагрев воздуха с помощью нагревателя в течение 90 секунд для создания вакуумоподобной среды и простое нанесение капель крови на входное отверстие. Проба может быть введена и отделена из-за разницы в давлении воздуха. Общее время разделения составляет <4 мин, а стоимость экспериментальных расходных материалов составляет всего 1 доллар США. Разработанное нами устройство для отделения крови имеет два основных достоинства, а именно: чрезвычайно простую конструкцию и рабочую процедуру, а также отсутствие дополнительных трубок или установок для внешнего воздействия.Обладая этими преимуществами, мы разработали экономичную, одноразовую, портативную, быструю, простую в изготовлении и простую в использовании систему, которая имеет большой потенциал для реализации POCT в ближайшем будущем.
Рис. 1. Схема микрожидкостного устройства с автономным питанием, которое объединяет функции отделения и анализа крови.
Нагревательный провод проходит непосредственно под всасывающей камерой. Два последовательно соединенных сухих элемента составляют источник питания.
https://doi.org/10.1371 / journal.pone.0208676.g001
Материалы и методы
Проектирование и изготовление устройства
Наша микрофлюидная система представляла собой устройство на основе PDMS, состоящее из впускного отверстия, канала, желоба для фильтра, тест-полосок и всасывающей камеры (рис. 1). Сначала мы разработали микроканал (размер: 20 мм × 1 мм × 0,1 мм) и камеру всасывания (50 мм × 7 мм × 1 мм) с помощью программного обеспечения Solidwork 2016 (Уолтем, Массачусетс, США) и фрезеровали шаблон с помощью станок с числовым программным управлением (гравировальный станок EGX-400, Roland, США) для изготовления мастер-формы на основе полиметилметакрилата (ПММА).Две плиты PDMS (Sylgard 184 Elastomer Kit, Dow Corning Corporation, США) толщиной 3 мм были изготовлены из смеси 8: 1 (мас. / Мас.). Слябы PDMS обжигали при 80 ° C в течение 1 ч в прецизионной сушильной печи (DOS 300, Dengyng, Тайвань). Затем мы сняли их с формы из ПММА и пробили впускной канал и канал фильтра, используя пробойник для биопсии диаметром 2 мм (Ted Pella Inc., США). Пластины PDMS были необратимо связаны друг с другом посредством инфильтрации устройства в кислородной плазме (Zepto Plasma, Diener, DE, USA) при давлении кислорода 5 Н, равном 1 мбар (0.5 л ч −1 ) при 60 Вт в течение 60 с. На последнем этапе дно желоба фильтра было заклеено лентой Scotch Magic (3M, Maplewood, MN, USA).
Образцы крови
Образцы крови человека были получены от здоровых доноров в соответствии с протоколом, разрешенным Институтом наблюдательного совета (IRB) Национального университета Цзяо Дун (NCTU-REC-107-071) и отделения Синьчжу Национальной больницы Тайваньского университета (NTU-107-073- E). Образцы свежей крови человека были собраны в пробирку Vacutainer от трех здоровых доноров (BD, США) для предотвращения агрегации эритроцитов (RBC).Перед экспериментом мы добавили трипановый синий (Gibco, США) в образец цельной крови в соотношении 3: 100 для окрашивания плазмы для облегчения наблюдения. Как сообщалось в предыдущих исследованиях, образцы цельной крови следует использовать в течение 20 минут после взятия крови у доноров. Содержание гематокрита в каждом экспериментальном образце доводили до 40% с помощью метода центрифуги.
Работа системы
Источником питания для ввода пробы в это устройство для отделения крови является перепад давления воздуха.В этом устройстве мы установили нагревательное устройство, состоящее из коммерческой нихромовой проволоки (Centenary, Тайвань), непосредственно под камерой всасывания, чтобы создать среду с низким давлением внутри микрофлюидной жидкости. Питание нагревателя подавалось последовательно от двух сухих ячеек (Panasonic, Япония) напряжением 1,5 В. Протокол эксперимента был следующим. Воздух в камере нагревали в течение 1 мин с помощью нагревательного устройства. Затем отключили питание, чтобы полоска остыла естественным образом в течение 30 с.Когда образец загружался с помощью пипетки, он автоматически вводился в образец при атмосферном давлении. При установленных нами параметрах для отделения крови требовалось 5 минут, а определение с помощью бумаги для анализа мочи могло быть выполнено в течение нескольких секунд. Все время работы нашей системы составляло <8 минут, а требуемый объем образцов крови составлял всего 10 мкл, которые могут быть собраны непосредственно методом укола пальцем.
Характеристики фильтрационного желоба
Принцип работы отделения основан на гравитационном осаждении, предложенном Димовым и др. [33].Мы использовали их оптимальный параметр для диаметра траншеи, который составляет 2 мм, и дополнительно исследовали, как на эффективность разделения будут влиять глубина, геометрия желоба для фильтра и относительное положение желоба для фильтра и канала. Устройство фиксировалось на препаровальном микроскопе (SL-730, SAGE Vision, США), снабженном дополнительной камерой металл-оксид-полупроводник (700D, Canon, Япония). Мы разработали простую микрофлюидную структуру для определения характеристик с входом, выходом, каналом и желобом для фильтра.На выходе был установлен шприцевой насос (NE-8000, New Era, США), который использовался в качестве силового механизма для всасывания воздуха из канала, чтобы можно было ввести образец. Используемые скорости потока составляли 2 мкл мин. -1 , 1 мкл мин. -1 и 0,5 мкл мин. -1 . Моделирование потока было выполнено с использованием программного обеспечения Solidwork Flow Simulation.
Дизайн микроканала
Для повышения эффективности разделения плазмы было дополнительно исследовано относительное положение желоба фильтра и канала.Были протестированы две (позиционные) конструкции: заглубленный канал и подвесной канал. Обе эти конструкции каналов были изготовлены с использованием двух пластин из ПДМС толщиной 3 мм. Чтобы изготовить заглубленный канал, мы пробили желоб фильтра со стороны канала и скрепили его плоской пластиной из ПДМС. Напротив, подвесной канал был изготовлен путем пробивки канавки фильтра на плоской пластине из PDMS и последующего соединения ее с пластиной из PDMS прямым каналом.
Анализ изображений и определение эффективности разделения
Мы записали результаты на выходе из желоба фильтра в каждом эксперименте с помощью камеры с зарядовой связью, установленной на рассекающем микроскопе.Записанные изображения анализировали с помощью программного обеспечения ImageJ для подсчета пикселей в общем образце и фильтрованной плазме. Интересующая область определялась вручную, а эффективность разделения рассчитывалась по следующей формуле: где η s — коэффициент отделения крови, P b — номер пикселя в области, содержащей клетки крови, и P t — номер пикселя в общей площади плазмы. и клетки крови, прошедшие через желоб фильтра.Следовательно, поскольку система отделила более 2 мкл плазмы без или с небольшим загрязнением эритроцитов, эффективность разделения может превышать 99%. Температуру микрожидкостного устройства контролировали с помощью термографической камеры (E75, FLIR System, США). Характеристики локальной температуры в пространстве и времени в микрофлюидном устройстве собирались с помощью встроенной инфракрасной камеры.
Анализ и обнаружение
Для первоначальной лабораторной демонстрации мы устанавливаем патологические изменения мочи в крови пациента путем изменения цвета в конце микроканала.Здесь мы продемонстрировали результаты изменения уровней глюкозы, белка и pH в качестве примеров.
Результаты и обсуждение
Принцип работы
В этом исследовании мы продемонстрировали модифицированную систему траншейных фильтров для отделения крови с помощью осаждения под действием силы тяжести. Предыдущие исследования показали, что осаждение под действием силы тяжести может отделить плазму от цельной крови. Димов и др. изучили размер и долю кровяных телец в цельной крови [33]. Они обнаружили, что на клетки крови влияет сила гравитационного оседания с поправкой на плавучесть ( F gb ) и сила сопротивления жидкости ( F d ).Таким образом, сила тяжести на клетки крови значительно больше, чем на плазму в траншее для фильтра; следовательно, плазму и клетки крови можно разделить на верхний и нижний слой (S1, фиг.). Основываясь на этом принципе, мы разработали чрезвычайно простую конструкцию, для которой требовался только канал для ввода пробы в желоб фильтра. В нашем устройстве отфильтрованная плазма собирается на выходе из траншеи. Мы разработали нашу систему на основе предыдущего исследования. Кроме того, мы обнаружили, что геометрия желоба фильтра и конструкция канала существенно влияют на эффективность разделения.
Мы предложили термопневматическую микрожидкостную всасывающую систему, которая является относительно практичным методом для встроенной системы, в качестве источника питания этого микрожидкостного устройства. Предлагаемая система экономична, проста в эксплуатации и не требует внешних силовых механизмов, таких как шприцевые насосы, электропневматические системы или источники питания высокого напряжения. Принцип всасывания предельно прост. Фундаментальный принцип термопневматической микрожидкостной системы всасывания основан на законе Чарльза, который описывает объем ( V ) идеального газа как прямо пропорциональный абсолютной температуре ( T , выраженной в K) газа при постоянное давление и количество молей:
Согласно уравнению состояния идеального газа, изменение температуры влияет на количество молекул газа в фиксированном объеме.Поскольку PDMS обладает высокой воздухопроницаемостью, дегазация может быть достигнута за секунды. Поперечное сечение во время рабочего процесса показано на рис. 2. Мы спроектировали всасывающую камеру в конце микроканала и установили нагревательное устройство непосредственно под камерой. Когда нагревательное устройство подключено к батарее и переключатель включен, воздух в камере нагревается за секунды, тем самым создавая среду с низким давлением внутри микрофлюидной камеры. Как только нагревательное устройство выключается, в процессе охлаждения атмосферным давлением создается входящий воздушный поток, и образец может автоматически вводиться в камеру.Еще одно преимущество этого механизма состоит в том, что поступающий внутрь воздушный поток может предотвратить всасывание образца обратно в наконечник пипетки, что является общей проблемой при загрузке образцов небольшого объема.
Рис. 2. Поперечное сечение микрофлюидного устройства во время работы.
(А) исходное состояние; (B) когда нагревательное устройство начинает нагревать воздух в камере, количество молекул газа в нем постепенно уменьшается; (C) выключено питание и загружен образец цельной крови; (D) образец вводится в канал за счет атмосферного давления в процессе охлаждения; (E) цельная кровь поступает в желоб фильтра, и кровяная тельца начинает оседать под действием силы тяжести; и (F) фильтрованная плазма может собираться на выходе из желоба фильтра.Цветная полоса в правом нижнем углу каждого изображения (устройства) представляет собой шкалу цветности, которая показывает изменение температуры нагревательного устройства.
https://doi.org/10.1371/journal.pone.0208676.g002
В предыдущих исследованиях также сообщалось об использовании дифференциального давления в качестве механизма микрожидкостной силы. Однако в большинстве из них описывается использование громоздкого и дорогого оборудования для создания вакуума или среды низкого давления для устройства.Предложенный нами способ устройства нагревателя значительно дешевле и проще, чем описанное ранее оборудование; однако устройство обогревателя имеет большую вариативность. Использование нагревателя снизило наши затраты до <1 доллара США.
Эффективность разделения различных фильтровальных желобов
Три характеристики желоба фильтра могут влиять на эффективность разделения, а именно глубина, геометрия и его положение по отношению к каналу. Мы проверяли производительность, изменяя один фактор за раз, чтобы определить оптимальные параметры для нашей системы.Хотя 10 мкл образца было достаточно для нашего устройства, для завершения экспериментов мы использовали 15 мкл цельной крови для исследования. Геометрия фильтрационного желоба — цилиндрическая, диаметр установлен на уровне 2 мм.
Влияние глубины фильтрующего желоба.
Глубина испытанной канавки фильтра составляла 2 мм, 2,5 мм и 3 мм, что можно было получить, варьируя толщину плиты PDMS. Поскольку взаимосвязь между скоростью потока и глубиной также может влиять на эффективность разделения, мы исследовали коэффициент глубины с различными скоростями потока, а именно 2 мкл мин -1 , 1 мкл мин -1 и 0.5 мкл мин -1 . Результат, показанный на рис. 3, показывает, что в нашем устройстве эффективность разделения прямо пропорциональна глубине траншеи и обратно пропорциональна скорости потока. Гравитация оказывает значительное влияние на клетки крови в желобе фильтра; следовательно, увеличение глубины усиливало седиментационный эффект. В нашем исследовании время разделения представляло собой продолжительность от момента входа образца в траншею до момента, когда отфильтрованная плазма достигла тестовой зоны биомаркера.Наибольшая эффективность разделения наблюдалась при 0,5 мкл мин. -1 ; однако время разделения было> 10 мин. Таким образом, мы рассмотрели 1 мкл мин -1 , время разделения которого составляло 4 мин, оптимальное значение скорости потока для устройства, чтобы соответствовать ожиданиям быстрой работы. Поэтому наша дальнейшая работа заключалась в повышении эффективности разделения устройства за счет рассмотрения других аспектов. Таким образом, оптимальная глубина фильтрационного желоба и скорость потока в этом исследовании составляли 3 мм и 1 мкл мин -1 соответственно.
Влияние геометрии фильтрующего желоба.
При разных углах наклона (-45 °, 0 °, + 45 °) цилиндрическая траншея демонстрировала сильно различающуюся эффективность разделения (рис. 4). Положительный угол указывает на то, что цилиндр наклонен к выпускному отверстию, тогда как отрицательный угол указывает на то, что он наклонен к впускному отверстию. Влияние угла наклона на эффективность разделения можно объяснить с помощью моделирования потока. Когда кровяная клетка или частица подвешены в желобе фильтра, на них воздействуют гравитационная седиментационная сила с поправкой на плавучесть ( F gb ) и сила сопротивления жидкости ( F d ) ( S1 Рис).Вершины кривой указывают, что F d равно 0; следовательно, частица неподвижна в жидкости, и на нее действует только F gb . Это критический этап для отделения плазмы, потому что влияние силы тяжести на клетки крови существенно в области с низкой скоростью. Следовательно, структура с наклоном вперед (+ 45 °) показала более высокую эффективность, чем исходная структура, потому что клетки крови достигли области низкой скорости раньше, и разделение было завершено эффективно.В структуре с наклоном назад турбулентные потоки мешают осаждению клеток крови; поэтому отделение плазмы было затруднено. Мы дополнительно проверили производительность в трех различных геометриях фильтрующей канавки: цилиндрической, треугольной, призматической и трапециевидной столбчатой (S2, рис.). Однако из-за сложности изготовления цилиндрическая геометрия была первым вариантом конструкции траншеи.
Влияние взаимного расположения желоба фильтра и канала.
Мы исследовали влияние взаимного расположения желоба фильтра и канала на эффективность разделения. Канал определялся как заглубленный или подвешенный, если он находился над или внутри траншеи (в разрезе), соответственно. Траншея с наклоном вперед показала значительно более высокую эффективность разделения, чем исходная траншея (73,3% и 17,1% соответственно) (рис. 5A). Однако комбинация наклонной вперед траншеи и подвесного канала дополнительно повысила эффективность разделения до 99.7 ± 0,3%. Хотя гематокрит является решающим фактором, влияющим на эффективность разделения, наклоненная вперед траншея с подвешенным каналом неизменно демонстрировала наивысшую эффективность разделения в каждом повторном эксперименте.
Рис. 5. Эффективность разделения при различных конструкциях канала.
(A) Эффективность разделения, полученная с использованием конструкций заглубленных и подвешенных каналов, проанализирована с помощью моделирования потока. (B) Относительное положение канала и желоба фильтра влияет на эффективность разделения.
https://doi.org/10.1371/journal.pone.0208676.g005
Предположим, что образцы цельной крови, которые текли в заглубленный или подвешенный канал, были идентичны по объему и гематокриту, и, таким образом, количество осажденных эритроцитов было одинаковым. идентичный. В конструкции подвесного канала канал располагался над желобом фильтра; следовательно, расстояние между поверхностью осажденных эритроцитов и микроканалом было больше, чем в заглубленной конструкции. Относительно большое расстояние защищало осажденные эритроциты от вмешательства турбулентных потоков (рис. 5B).Это физическое явление привело к тому, что эритроциты оседали на дне траншеи, не поднимаясь вверх турбулентными потоками. Следовательно, была получена более высокая эффективность разделения с подвешенным каналом, и плазма высокой чистоты могла собираться на выходе из желоба фильтра.
Термопневматическое всасывающее устройство в микрофлюидике
Микрожидкостный чип хорошо подходит для достижения POCT, поскольку он объединяет несколько утомительных лабораторных методов в крошечный чип.Тем не менее, правильный силовой механизм был основной проблемой для фактического применения. Недавно несколько исследовательских групп приняли принцип дифференциального давления для работы микрожидкостных устройств без внешних насосов; однако портативность и коммерциализация не были достигнуты из-за трудностей, связанных с созданием и поддержанием сред с низким давлением.
Использование температуры воздуха для воздействия на плотность воздуха — простой, но эффективный метод создания и поддержания среды с низким давлением.Мы применили нагревательное устройство с микроканалом, чтобы добиться того же эффекта, что и вакуумный генератор. Кроме того, источником питания нагревательного устройства была пара сухих ячеек, недорогих, портативных и многоразовых. Таким образом, среду с низким давлением можно легко создать в любое время и в любом месте. Расход ( Q расход ) определяется как отношение изменения объема ( ΔV ) во времени ( Δt ). Если изменение температуры связано с постоянной скоростью охлаждения k на ΔT = k ∙ Δt , расход можно получить следующим образом: где k — постоянная величина, V p — объем напорной камеры, а T p — температура напорной камеры.Таким образом, поток почти не имеет пульсаций во время хода, и достигается точный контроль температуры.
Наше устройство имело впускной канал и прямой канал с желобом для фильтра в центре, а конец канала был соединен с всасывающей камерой (рис. 1). Нагреватель был свернут в прямоугольную форму и установлен непосредственно под камерой для равномерного нагрева воздуха в камере. Видимые и тепловые изображения процесса нагрева и прошедшего времени показаны на рис. 6А.Из-за структурных свойств микросреды небольшое изменение температуры было эффективным для отсоса образца. Повышения температуры всего на 4 ° C было достаточно для работы устройства (рис. 6). Самое главное, что этот механизм нагрева воздействовал только на зону камеры в течение всего процесса; поэтому риск тепловой денатурации образца, биомаркеров или аналитов был незначительным. Кроме того, критическим фактором, влияющим на эффективность разделения, является регулирование потока. Следовательно, оптимизация скорости потока путем регулирования размера камеры, длины нагревательного устройства и времени нагрева имеет важное значение для этого силового механизма.Для многих применений перекачки, таких как заполнение микросхемы биохимического микрореактора, не требуется постоянных скоростей потока, и достаточно обеспечить транспортировку определенного объема жидкости в измерительную ячейку в течение заданного времени. Однако для отделения крови с использованием системы осаждения под действием силы тяжести идеальная скорость потока либо постоянная, либо немного высокая вначале, а затем плавно замедляется по мере того, как образец крови достигает зоны траншеи фильтра. Стабильная скорость потока важна для предотвращения нарушения потока в колодцах траншеи фильтра, которое может повлиять на осаждение клеток крови.Это требование очень соответствует характеристикам термопневматической микрожидкостной всасывающей системы.
Рис. 6. Введение образцов в микрожидкостную систему с помощью термопневматической аспирационной системы.
(A) Видимые и тепловые изображения микрофлюидного устройства во время нагрева. Нагревательное устройство было свернуто в прямоугольную форму и установлено непосредственно под камерой всасывания для эффективного нагрева воздуха внутри камеры. Красные и синие стрелки указывают на клетки крови и плазму соответственно.Полоса цветности показывает температуру от 26 ° C (комнатная температура) до 38 ° C. Система эффективно работает при относительно небольших колебаниях температуры. (B) График снижения температуры внутри камеры, и шесть реальных изображений, вставленных рядом с кривыми, указывают стадии разделения. График начинается с охлаждения (т.е. с 2 мин). Образец цельной крови засасывался в канал сразу после загрузки. Через 30 с после загрузки образец достигал входа в желоб фильтра и за 6 мин заполнил всю канавку.Через 8 мин фильтрованная плазма попадает в зону обнаружения, и исследование биомаркера может быть выполнено немедленно.
https://doi.org/10.1371/journal.pone.0208676.g006
Термопневматическая микрожидкостная аспирационная система
Учитывая, что устройства POCT ориентированы на экономичную и быструю диагностику, а не на точный анализ, мы продемонстрировали концепцию обнаружения биомаркеров с помощью тест-полосок мочи (белок, глюкоза и pH). Первым шагом было изучение цветовой реакции.Когда использовался образец цельной крови, полоски имели красновато-коричневый цвет из-за интерференции эритроцитов; следовательно, обнаружение изменения цвета было затруднено. Однако, когда использовался отфильтрованный образец плазмы, который был прозрачным, легко обнаруживались цветовые реакции (белок, глюкоза и pH) (S4, рис.). Мы разработали выемку возле выхода из желоба фильтра и установили в нее бумагу для анализа мочи. Цветная реакция была достаточно четкой для наблюдения, что указывает на то, что плазма была эффективно отделена нашей системой, и тест на обнаружение биомаркеров был завершен (рис. 7).График изменения температуры в зоне обнаружения микрожидкостного устройства показывает, что изменение температуры было <0,5 ° C, когда изолированная плазма всасывалась в зону обнаружения (синяя область). Таким образом, образец или аналиты были денатурированы с помощью механизма нагревающей силы (S5 Рис.). Это устройство имеет потенциал для реализации POCT в ближайшем будущем из-за его низкой стоимости, простоты изготовления, простого двухэтапного управления и портативности.
Рис. 7. Сравнение образцов цельной крови и отфильтрованной плазмы на устройствах с желобом для фильтра в середине канала и без него.
Устройство без желоба для фильтра использовало для обнаружения цельную кровь и показало результат с интерференцией эритроцитов. Однако устройство с желобом фильтра отделяло прозрачную плазму; таким образом, изменение цвета можно наблюдать легко и четко.
https://doi.org/10.1371/journal.pone.0208676.g007
Заключение
Портативный, быстрый, простой в изготовлении и простой в использовании микрожидкостный чип был разработан для отделения плазмы от образцов цельной крови.В этом исследовании мы изучили эффективность разделения по многим аспектам, таким как конструкция микроканала, геометрия канавки для фильтра и относительное расположение канавки и канала для фильтра. После оптимизации параметров эффективность разделения увеличилась с 17,1 ± 1% до 99,7 ± 0,3%. Кроме того, в чип были интегрированы устройство отделения крови и система самонагнетания. Для разделения требовался нагревательный механизм, который создавал среду с низким давлением и отделял плазму в течение 2 мин.Предлагаемое устройство сократило все рабочее время до 6 минут и дало> 1 мкл изолированной плазмы, чего достаточно для большинства биологических анализов (таблица 1). Наконец, стоимость расходных материалов с устройством составила всего 1 доллар США, что продемонстрировало его значительный потенциал для реализации концепции POCT в ближайшем будущем.
Дополнительная информация
S1 Рис. Моделирование основной силы, действующей на взвешенную частицу.
Моделирование основной силы, действующей на взвешенную частицу, например, клетку крови в желобе фильтра.Соответствующими силами являются гравитационная седиментационная сила с поправкой на плавучесть F gb и сила сопротивления жидкости F d .
https://doi.org/10.1371/journal.pone.0208676.s001
(TIF)
S2 Рис. Эффективность разделения в различных геометрических формах.
Эффективность разделения в различных геометрических формах. Компания e разработала цилиндрические, наклонные цилиндрические, треугольные призматические и трапециевидные столбчатые траншеи для проверки эффективности разделения в различных геометрических формах.Отфильтрованная плазма должна была быть прозрачной. Появление красновато-коричневой жидкости на выходе из желоба фильтра указывало на присутствие эритроцитов, что было определено как неудачное разделение. После успешного разделения плазмы мы проанализировали и рассчитали эффективность разделения в ImageJ. Хотя треугольные призматические и трапециевидные столбчатые траншеи продемонстрировали высокую эффективность разделения, мы не использовали эти геометрические конструкции из-за сложности их изготовления.
https: // doi.org / 10.1371 / journal.pone.0208676.s002
(TIF)
S3 Рис. Изображение поперечного сечения заглубленного и подвесного каналов.
Изображение поперечного сечения заглубленных и подвесных каналов. Линия пересекает желоб фильтра и показывает структуру микроканала в поперечном сечении.
https://doi.org/10.1371/journal.pone.0208676.s003
(TIF)
S4 Рис. Биологические анализы с содержащимися и удаленными эритроцитами на тестовой бумаге.
Биотесты с эритроцитами, содержащими и удаленными образцами на тестовой бумаге. Диаграмма, показывающая необходимость отделения крови перед исследованием с использованием биомаркеров. Если в образце присутствуют эритроциты, наблюдать цветную реакцию на тестовой бумаге затруднительно из-за влияния гемоглобина.
https://doi.org/10.1371/journal.pone.0208676.s004
(TIF)
S5 Рис. Изменение температуры в зоне обнаружения микрожидкостного чипа.
Диаграмма, показывающая изменение температуры в зоне обнаружения микрожидкостного чипа.При засасывании изолированной плазмы в зону обнаружения (синяя область) температура изменилась на <0,5 ° C. Следовательно, образец или аналиты не были денатурированы механизмом нагревающей силы. Истекшее время измеряли с момента включения нагревательной ленты для нагрева всасывающей камеры.
https://doi.org/10.1371/journal.pone.0208676.s005
(TIF)
Ссылки
- 1. Zhao Z, Yang Y, Zeng Y, He M. Микрожидкостный чип ExoSearch для обнаружения мультиплексированных экзосом с целью диагностики рака яичников на основе крови.Лабораторный чип. 2016; 16 (3): 489–96. ISI: 000368858700009. pmid: 26645590
- 2.
Рэй С., Бричги М., Герберт К., Такеда-Учимура Ю., Боксер А., Бленноу К. и др. Классификация и прогнозирование клинического диагноза Альцгеймера на основе сигнальных белков плазмы. Nat Med. 2007. 13 (11): 1359–62. ISI: 000250736
9. pmid: 17934472
- 3. Эллетт Ф., Йоргенсен Дж., Маранд А.Л., Лю Ю.М., Мартинес М.М., Сейн В. и др. Диагностика сепсиса по капле крови путем измерения спонтанной подвижности нейтрофилов в микрофлюидном анализе.Nat Biomed Eng. 2018; 2 (4): 207–14. ISI: 000435466700007. pmid: 30283724
- 4. Чен К.И., Ли Б.Р., Чен Ю.Т. Биосенсоры на основе полевых транзисторов с кремниевыми нанопроводами для биомедицинской диагностики и исследования клеточной регистрации. Нано сегодня. 2011; 6 (2): 131–54. ISI: 0002200007.
- 5. Шен М.Ю., Ли Б.Р., Ли Ю.К. Биосенсоры на основе полевых транзисторов с кремниевыми нанопроводами: от чувствительных до сверхчувствительных. Biosens Bioelectron. 2014; 60: 101–11. ISI: 0003378634.pmid: 24787124
- 6.
Mittal S, Kaur H, Gautam N, Mantha AK. Биосенсоры для диагностики рака груди: обзор биорецепторов, биотрансдукторов и стратегий усиления сигнала. Biosens Bioelectron. 2017; 88: 217–31. ISI: 00038
00030. pmid: 27567264
- 7. Чанг CY, Lin HJ, Li BR, Li YK. Новая металло-бета-лактамаза, участвующая в резистентности к ампициллину штамма Streptococcus pneumoniae ATCC 49136. PLOS ONE. 2016; 11 (5). doi: ARTN e0155905 10.1371 / journal.pone.0155905. ISI: 000376880200031.
- 8.
Чанг CY, Ли Б.Р., Ли Ю.К. L-аскорбат-6-фосфатлактоназа из штамма Streptococcus pneumoniae ATCC 49136 обнаруживает металло-бета-лактамазную активность. Int J Antimicrob Ag. 2016; 47 (5): 416–8. ISI: 0003772
018. pmid: 27156909
- 9. Чоу Р., Уоссон Н. Анализы крови для диагностики фиброза или цирроза у пациентов с реакцией на хроническую вирусную инфекцию гепатита С. Ann Intern Med. 2013; 159 (5): 372–. ISI: 0003242455. pmid: 24026329
- 10.Mielczarek WS, Obaje EA, Bachmann TT, Kersaudy-Kerhoas M. Микрожидкостное разделение плазмы крови для медицинской диагностики: стоит ли оно того? Лабораторный чип. 2016; 16 (18): 3441–8. ISI: 000382683600003. pmid: 27502438
- 11. Линь PH, Хуан С.К., Чен КП, Ли Б.Р., Ли Ю.К. Эффективное построение слоя бороновой кислоты большой емкости на кристалле кварцевого микровесов для иммобилизации антител высокой плотности. Датчики. 2018; 19 (1): 28. pmid: 30577674
- 12. Ли БР, Шен М.Ю., Ю ХХ, Ли Ю.К.Быстрое создание эффективного противообрастающего слоя на поверхности Au с помощью электроосаждения. Chem Commun. 2014. 50 (51): 6793–6. ISI: 000337095500028. pmid: 24836378
- 13. Коэн Дж. Д., Ли Л., Ван YX, Тоберн С., Афсари Б., Данилова Л. и др. Выявление и локализация хирургически резектабельных раковых опухолей с помощью анализа крови на несколько аналитов. Наука. 2018; 359 (6378): 926– +. ISI: 000425752600047. pmid: 29348365
- 14. Систа Р., Хуа З.С., Твар П., Сударсан А., Сринивасан В., Экхард А. и др.Разработка цифровой микрофлюидной платформы для тестирования на месте. Лабораторный чип. 2008. 8 (12): 2091–104. ISI: 000261686200014. pmid: 172
- 15. Трипати С., Кумар Ю. В., Агравал А., Прабхакар А., Джоши С. С.. Микроустройство для отделения плазмы от цельной крови человека с использованием биофизических и геометрических эффектов. Научные отчеты. 2016; 6: 26749. pmid: 27279146
- 16. Kim B, Oh S, You D, Choi S. Микрожидкостный наконечник для пипетки для высокочистого и высокопроизводительного отделения плазмы крови от цельной крови.Аналитическая химия. 2017; 89 (3): 1439–44. pmid: 28208273
- 17. Maulucci G, Cordelli E, Rizzi A, De Leva F, Papi M, Ciasca G и др. Фазовое разделение плазматической мембраны в эритроцитах человека как потенциальный инструмент для диагностики и мониторинга прогрессирования сахарного диабета 1 типа. PLOS ONE. 2017; 12 (9): e0184109. pmid: 28880900
- 18.
Moon S, Keles HO, Ozcan A, Khademhosseini A, Haeggstrom E, Kuritzkes D и др. Интеграция микрофлюидики и визуализации без линз для тестирования на месте.Biosens Bioelectron. 2009. 24 (11): 3208–14. ISI: 000267577
5. pmid: 19467854
- 19. Губала В., Харрис Л.Ф., Рикко А.Дж., Тан М.Х., Уильямс, Делавэр. Диагностика пункта оказания помощи: состояние и будущее. Аналитическая химия. 2012. 84 (2): 487–515. ISI: 0002900002. pmid: 22221172
- 20. Nayak S, Blumenfeld NR, Laksanasopin T, Sia SK. Диагностика на месте: последние достижения в эпоху подключений. Аналитическая химия. 2017; 89 (1): 102–23. ISI: 0003600008. pmid: 27958710
- 21.Ян YJ, Liao HH. Разработка и характеристика термопневматических перистальтических микронасосов. J Micromech Microeng. 2009; 19 (2). 025003 10.1088 / 0960-1317 / 19/2/025003. ISI: 000262786300004.
- 22. Чиа БТ, Ляо Х.Х., Ян Й.Дж. Новый термопневматический перистальтический микронасос с низким подъемом температуры рабочей жидкости. Датчик Actuat a-Phys. 2011; 165 (1): 86–93. ISI: 000288293600013.
- 23. Шилдс CW, Reyes CD, Lopez GP. Сортировка микрожидкостных клеток: обзор достижений в разделении клеток от удаления массы до выделения редких клеток.Лабораторный чип. 2015; 15 (5): 1230–49. ISI: 000349838200002. pmid: 25598308
- 24.
Либерман Д.А., Вайс Д.Г., Харфорд В.В., Анен Д.Д., Провенцале Д., Зонтаг С.Дж. и др. Одноразовый скрининг на колоректальный рак с комбинированным анализом кала на скрытую кровь и исследованием дистального отдела толстой кишки. New Engl J Med. 2001. 345 (8): 555–60. 10.1056 / Nejmoa010328. ISI: 000170562
1. pmid: 11529208
- 25. Жерве Л., де Рой Н., Деламарш Э. Микрожидкостные чипы для иммунодиагностики на месте.Adv Mater. 2011; 23 (24): h251 – H76. ISI: 000293046600014. pmid: 21567479
- 26. Jiang H, Weng XA, Li DQ. Микрожидкостные иммуноанализы цельной крови. Микрожидкостная нанофлюид. 2011; 10 (5): 941–64. ISI: 000289569600001.
- 27. Fekete Z, Nagy P, Huszka G, Tolner F, Pongracz A, Furjes P. Характеристика характеристик микромашинной системы отделения частиц на основе эффекта Цвайфаха-Фунга. Датчик Actuat B-Chem. 2012. 162 (1): 89–94. ISI: 000301214700013.
- 28.Ди Карло Д., Иримиа Д., Томпкинс Р. Г., Тонер М. Непрерывная инерционная фокусировка, упорядочение и разделение частиц в микроканалах. P Natl Acad Sci USA. 2007. 104 (48): 18892–7. ISI: 000251498700006. pmid: 18025477
- 29.
Петерссон Ф., Нильссон А., Холм С., Йонссон Х., Лорелл Т. Непрерывное отделение липидных частиц от эритроцитов с помощью ламинарного потока и сил акустической стоячей волны. Лабораторный чип. 2005; 5 (1): 20–2. ISI: 00022588
03. pmid: 15616735
- 30.Chen JD, Chen D, Yuan T, Chen X, Xie Y, Fu HL, et al. Микрожидкостный чип отделения плазмы крови с постепенной фильтрацией. Microelectron Eng. 2014; 128: 36–41. ISI: 000340221500007.
- 31. Чиу Ю.Ю., Хуан С.К., Лу Ю.В. Улучшение отделения микрожидкостных частиц с помощью фильтров поперечного потока с гидродинамической фокусировкой. Биомикрофлюидика. 2016; 10 (1). DOI: Artn 011906 10.1063 / 1.4939944. ISI: 000377536500011.
- 32. Подбородок CD, Линдер V, Sia SK. Коммерциализация микрофлюидных диагностических устройств в местах оказания медицинской помощи.Лабораторный чип. 2012; 12 (12): 2118–34. ISI: 000304448700005. pmid: 22344520
- 33. Димов И.К., Басабе-Десмонтс Л., Гарсия-Кордеро Ю.Л., Росс Б.М., Парк Й., Рикко А.Дж. и др. Автономная интегрированная система микрофлюидного анализа крови с автономным питанием (SIMBAS) (том 11, стр. 845, 2011 г.). Лабораторный чип. 2011; 11 (24): 4279–. ISI: 000297353800020.
- 34. Сон Дж. Х., Ли Ш., Хонг С., Пак С. М., Ли Дж., Дики А. М. и др. Разделение плазмы крови без гемолиза. Лабораторный чип. 2014; 14 (13): 2287–92. ISI: 000337096800017.pmid: 24825250
- 35. Мадади Х., Казальс-Терре Дж., Мохаммади М. Микрожидкостный чип сепаратора плазмы крови с автоматическим приводом на основе фильтра для тестирования в местах оказания медицинской помощи. Биофабрикация. 2015; 7 (2). DOI: Artn 025007 10.1088 / 1758-5090 / 7/2/025007. ISI: 000366896300007.
- 36. Сакамото Х., Хацуда Р., Миямура К., Сугияма С. Устройство плазменного разделения ПММА, управляемое капиллярной силой, контролирующей смачиваемость поверхности. Micro Nano Lett. 2012; 7 (1): 64–7. ISI: 000300299500017.
- 37.Ли К.К., Ан Ч. Новый встроенный сепаратор цельной крови / плазмы, управляемый асимметричными капиллярными силами. Лабораторный чип. 2013. 13 (16): 3261–7. ISI: 000321856800014. pmid: 23793507
- 38. Мария М.С., Ракеш ЧП, Чандра Т.С., Сен АК. Капиллярный поток крови в микроканале с дифференциальным смачиванием для отделения плазмы крови и определения глюкозы на чипе. Биомикрофлюидика. 2016; 10 (5): 054108. Epub 2016/10/06. PubMed Central PMCID: PMC5035299. pmid: 27703594
- 39. Мария М.С., Ракеш ЧП, Чандра Т.С., Сен АК.Микрожидкостное устройство, управляемое капиллярным потоком, с градиентом смачиваемости и седиментационным эффектом для отделения плазмы крови. Научные отчеты. 2017; 7. DOI: Artn 43457 10.1038 / Srep43457. ISI: 000396277800001.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
границ | Микрореакторы на основе эмульсии Пикеринга для селективного по размеру межфазного ферментативного катализа
Введение
Ферментативный катализ — один из важных способов достижения экологичных и устойчивых промышленных химических процессов.Однако свободные ферменты обычно обладают некоторыми присущими им недостатками, такими как хрупкие структуры, низкая операционная стабильность и отсутствие возможности повторного использования (Du et al., 2017). Поэтому очень важно иммобилизовать ферменты на твердых носителях, чтобы повысить их стабильность и добиться легкого восстановления во время промышленного применения (Duan et al., 2019). На сегодняшний день значительные усилия были направлены на иммобилизацию ферментов на различных носителях и композитных материалах, таких как гидрогели (Jo et al., 2019), мезопористый кремнезем (Popat et al., 2011; Li et al., 2019), магнитные наночастицы (Desai, Pawar, 2020), полимеры (Kuiper et al., 2008) и белки (Kim et al., 2019).
В последние годы металлоорганические каркасы (MOF), своего рода пористые кристаллические органо-неорганические гибридные материалы, состоящие из неорганических ионов металлов или металлических кластеров и органических лигандов, стали отличным носителем для иммобилизации ферментов из-за их захватывающих физико-химических свойств. такие свойства, как термическая стабильность, большая площадь поверхности, избирательность по размеру пор и биосовместимость (Tan et al., 2019; Чжао и др., 2019; Чжоу и др., 2019). Несколько подходов, включая физическую адсорбцию (Nobakht et al., 2018; Jia et al., 2019), ковалентное связывание (Yue et al., 2016; Nowroozi-Nejad et al., 2019) и биомиметическую минерализацию (Liang et al., 2015; Jiang et al., 2017) были использованы для иммобилизации ферментов в MOF. Среди этих методов физическая адсорбция основана на многочисленных слабых взаимодействиях (например, электростатических взаимодействиях, водородных связях и силах Ван-дер-Ваальса) между молекулами фермента и кристаллами MOF (Drout et al., 2019), поэтому адсорбированные ферменты обычно демонстрируют плохую стабильность в суровых условиях. Ковалентное связывание — отличный способ предотвратить вымывание ферментов, но оно часто вызывает необратимую дезактивацию фермента во время приготовления (Garcia-Galan et al., 2011).
Биомиметическая минерализация позволяет MOF расти вокруг ферментов в мягких условиях реакции. Высокая химическая и структурная стабильность MOF может не только защитить фермент от различных факторов денатурации, но и регулировать доступ субстратов разного размера (Wu et al., 2017). Однако было обнаружено, что введение ферментов в MOF неизбежно оказывает определенное влияние на структурные характеристики MOF. Qi et al. (2019) показали, что размер наночастиц MOF, загруженных липазой из Candida rugosa (CRL), был в 2–3 раза меньше, чем размер чистых наночастиц MOF. Следовательно, переработка композитов фермент-MOF затруднена, поскольку существующие методы разделения, такие как фильтрация и центрифугирование, очевидно, требуют больших затрат времени и энергии, особенно когда размеры катализатора находятся в нанометровом диапазоне.Между тем, ферменты, экспонированные на поверхности наночастиц MOF, увеличивали гидрофильность композитов фермент-MOF. Таким образом, композиты фермент-MOF с большей вероятностью будут агрегировать вместе в органической реакционной системе, что не способствует полному проявлению каталитической активности.
Увеличение размера композитов фермент-MOF является эффективным способом повышения эффективности разделения и однородности распределения в растворителях. Пока что наиболее распространенным методом является сшивание. Химическая модификация ферментов или MOF является необходимой стадией для легкого сшивания, однако, очевидно, она имеет некоторые негативные последствия для эффективности ферментативной реакции (Mehde, 2019; Oliveira et al., 2019). Более того, из-за нерегулярной конгрегации удельная поверхность композитов фермент-MOF значительно уменьшается после сшивания.
В последнее время было предпринято несколько усилий по приготовлению микрокапсул для эффективного катализа (Huo et al., 2015; Zhu et al., 2018). Предварительно синтезированные наноразмерные катализаторы были собраны в микрокапсулы путем самосборки в эмульсии Пикеринга. Полученные микрокапсулы со структурой ядро-оболочка были прочными, с высокой удельной поверхностью и изменяемым размером за счет регулирования размера капель эмульсии.Что еще более важно, было продемонстрировано, что микрокапсулы являются мощными и эффективными биореакторами за счет инкапсуляции и присоединения ферментов (Wang et al., 2012; Liu et al., 2015). Следовательно, создание микрокапсулы на основе композита фермент-MOF является многообещающим способом увеличения размера катализатора при сохранении активности фермента, селективности по размеру и удельной площади поверхности в максимальной степени.
Цеолитные имидазолатные каркасы (ZIF) являются подклассом MOF с цеолитной топологией (Fu et al., 2019). Среди различных материалов ZIF ZIF-8 является одним из наиболее применяемых материалов ZIF из-за его высокой стабильности в воде, а также его можно синтезировать в воде при комнатной температуре, что имеет большое значение для защиты активности фермента во время иммобилизация ферментов (Horcajada et al., 2012).
В этой работе мы разработали простую стратегию создания микрокапсулы на основе MOF путем процесса самосборки наночастиц ZIF-8 на поверхности масло-вода эмульсии Пикеринга с последующим нанесением слоя наночастиц ZIF-8 небольшого размера. вокруг капель эмульсии для повышения стабильности капсулы.Путем введения модельного фермента Candida antarctica липазы B (CalB) непосредственно в ZIF-8 или водную фазу стабилизированной ZIF-8 эмульсии Пикеринга во время процесса приготовления, мы добились иммобилизации фермента в полости или внутри оболочки. микрокапсул соответственно. Биокаталитическая реакция доказала, что синтезированные композиты MOF-фермент обладают превосходной каталитической способностью и селективностью по размеру. Кроме того, из-за значительно увеличенного размера катализатора микрокапсулы могут быть быстро отделены от реакционной системы путем естественного осаждения после реакции.
Материалы и методы
Материалы
Ацетат цинка [Zn (Ac) 2 ⋅2H 2 O, 99,0%], 2-Метилимидазол (2-Melm, 98%), динатриевая соль 2,2′-бихинолин-4,4-дикарбоновой кислоты ( BCA), винилацетат, 3- (4-гидроксифенил) пропан-1-ол и изомер I флуоресцеина изотиоцианата (FITC) были приобретены у Aladdin (Шанхай, Китай). Липаза B Candida Antarctica , рекомбинантная из Aspergillus niger (CalB), и агароза (тип IX-A, сверхнизкая температура гелеобразования) были приобретены у Sigma-Aldrich (Шанхай, Китай).Другие химические вещества были аналитической чистоты и были получены из коммерческих источников. Эмульсии Пикеринга были сформированы с использованием силы сдвига, создаваемой гомогенизатором IKA Ultra-Turrax T25. Лиофилизированные образцы получали с использованием сублимационной сушилки Scientz-10N.
Характеристика
Оптическая микроскопия (ОПМ) измерения проводилась на поляризационном микроскопе MB11 (Шанхайский завод оптических приборов, Китай), оборудованном видеокамерой.
АдсорбциюUV-vis регистрировали на спектрофотометре в ультрафиолетовой и видимой области (Hitachi U-3010, Япония).
Образцы порошковой дифракции рентгеновских лучей (XRD) получали с использованием полностью автоматического прибора XRD D / max-IIIA (Rigaku, Япония) с анодом Cu Kα (λ = 1,5405 Å) при 40 кВ и 30 мА. Порошковые образцы сканировали от 5 до 40 ° (2θ) со скоростью сканирования 4 ° / мин. Спектры1 H-ЯМР были получены на приборе AVANCE digital 400 (Bruker, Германия), работающем на частоте 400 МГц.
Измерения с помощью сканирующей электронной микроскопии (SEM) были выполнены на сканирующем электронном микроскопе Merlin (Zeiss Co., Германия). Образцы для измерений SEM сначала диспергировали в абсолютном этаноле (0,1 мас.%) И обрабатывали ультразвуком в течение 10 мин. Каплю суспензии осторожно помещали на алюминиевую фольгу, прикрепленную к подложке с помощью проводящей ленты, и сушили при комнатной температуре, а затем покрывали распылением тонким слоем проводящего золота для улучшения проводимости.
Инфракрасную спектроскопию с преобразованием Фурье (FTIR)проводили на спектрофотометре Vector 33-MIR FTIR (Brukev Optik, Германия) с использованием метода KBr.
Наличие и пространственное расположение ферментов, меченных флуорофором, в микрокапсулах определяли с помощью инвертированного флуоресцентного микроскопа IX73 (OLYMPUS, Япония).
Синтетические детали
Приготовление CalB @ ZIF-8 и ZIF-8
160 мкл CalB добавляли в раствор 2-Melm (1,25 M, 40 мл) в деионизированной воде. Также был приготовлен отдельный раствор Zn (Ac) 2 ⋅2H 2 O (0.31 M, 4 мл). Эти два раствора смешивали, а затем перемешивали при 500 об / мин в течение 8 ч при комнатной температуре.Затем продукты (названные CalB @ ZIF-8) собирали центрифугированием при 10000 об / мин в течение 10 мин и трижды промывали деионизированной водой для удаления абсорбированных белков. Наконец, центрифугированные образцы были собраны после лиофилизации.
Синтез чистых наночастиц ZIF-8 производился по той же процедуре, что и получение CalB @ ZIF-8, но в отсутствие CalB.
Приготовление эмульсии Пикеринга
CalB находился внутри оболочки микрокапсулы (CalB @ ZIF-8 @ cap): 30 мг наночастиц CalB @ ZIF-8 добавляли к 3 мл триглицеридов со средней длиной цепи (MCT) и гомогенизировали в течение 1 мин для равномерного диспергирования.Затем готовили 1,0% -ный раствор агарозы растворением 0,010 г агарозы в 1 мл буфера PBS (pH = 7,4) при 80 ° C в качестве исходного раствора. После охлаждения до 25 ° C 200 мкл раствора агарозы добавляли к MCT-дисперсии CalB @ ZIF-8 и гомогенизировали при перемешивании со сдвигом при 16000 об / мин в течение 2 минут. Полученную эмульсию Пикеринга типа вода в масле хранили при 4 ° C в течение ночи, чтобы гарантировать полное желирование капель, стабилизированных наночастицами.
CalB был расположен в полости микрокапсулы (ZIF-8 @ cap-CalB): метод приготовления эмульсии Пикеринга вода-в-масле был таким же, как указано выше, за исключением того, что для стабилизации эмульсии Пикеринга применялись чистые наночастицы ZIF-8. и CalB был добавлен к раствору агарозы.Примечательно, что фермент добавляли после охлаждения раствора агарозы до 30 ° C, чтобы предотвратить влияние высокой температуры на активность фермента.
Приготовление микрокапсул
Прежде всего, 2 × 100 мл исходных растворов Zn (NO 3 ) 2 (25 мМ) были приготовлены в изопропаноле и 2-бутаноле и 2 × 100 мл исходных растворов 2-Melm в изопропаноле (100 мл). мМ) и 2-бутанол (75 мМ).
Затем 2,5 мл исходного раствора Zn (NO 3 ) 2 и 2-MeIm в изопропаноле постепенно добавляли к 1 мл капель раствора агарозы и оставляли при -20 ° C на 2 часа перед промыванием свежим изопропанолом.После повторения описанной выше процедуры дважды полученные микрокапсулы погружали в свежую смесь 2,5 мл исходного раствора Zn (NO 3 ) 2 и 2,5 мл исходного раствора 2-MeIm в 2-бутаноле. Смесь оставляли на 1,5 ч при -20 ° C перед промыванием свежим 2-бутанолом. Этот шаг был повторен семь раз, чтобы обеспечить плотную оболочку из наночастиц ZIF-8 небольшого размера на внешней стороне капсулы.
Расчет ферментной нагрузки
Емкость ферментной загрузки наночастиц CalB @ ZIF-8 и микрокапсул, нагруженных CalB, рассчитывалась методом BCA.В частности, 10 мг образца растирали в ступке и затем разрушали путем добавления 6 мл 0,2 М водного раствора HCl и 40 мкл HF (48% водный раствор) с последующим центрифугированием при 10000 об / мин в течение 10 мин. После фильтрации супернатанта через фильтр 0,22 мкм брали 0,2 мл образца и смешивали с 2 мл реагента BCA, который инкубировали при 37 ° C в течение 30 минут перед измерением УФ. Чтобы свести к минимуму потенциальные ошибки, вызванные низким pH, для стандартизации применялись деградированные чистые наночастицы ZIF-8.Разницу интенсивности при 562 нм образца и стандарта использовали для расчета концентрации CalB в наночастицах и микрокапсулах CalB @ ZIF-8.
Расчет ферментной нагрузки основан на формуле. (1)
Ферментная нагрузка (мг⋅г-1) = CVm (1)
, где m (г) — общее количество наночастиц CalB @ ZIF-8 или микрокапсул, нагруженных CalB; C (мг⋅мл –1 ) и V (мл) — концентрация CalB и объем надосадочной жидкости, соответственно.
Биокатализ
Активность CalB определяли путем переэтерификации между двумя группами субстратов в н-гептане: малый субстрат, 1-бутанол и винилацетат; большие субстраты, 3- (4-гидроксифенил) пропан-1-ол и виниллаурат. В частности, что касается небольших субстратов, в раствор субстрата (3 мл), содержащий 1-бутанол (150 ммоль / л) и винилацетат ( 100 ммоль / л) в н-гептане.Затем реакции проводили на шейкере при 35 ° C в течение 48 ч. После определенного интервала отбирали образец раствора объемом 60 мкл и проводили 1H-ЯМР для анализа концентрации продукта. Одна единица активности CalB (U) определяется как количество фермента, необходимое для производства 1 мкмоль продукта в минуту. Активность всех образцов проверяли в одинаковых условиях, и все реакции повторяли не менее трех раз. Реакция на большие субстраты производилась по той же процедуре.
Каталитическая переработка
Восстанавливаемость катализатора оценивалась путем измерения конверсии в каждом цикле. После каждой партии микрокапсулы собирали центрифугированием (800 об / мин), затем промывали н-гептаном и использовали для следующего цикла. Максимальная степень конверсии была определена как 100%, а относительная конверсия (%) представляла отношение остаточной скорости конверсии к максимальной для каждого образца.
Результаты и обсуждение
В этом исследовании были использованы два разных метода для введения CalB в микрокапсулы на основе ZIF-8.Первая стратегия заключалась в инкапсулировании фермента в полости наночастиц ZIF-8 с последующим формированием микрокапсул на основе эмульсии Пикеринга (CalB @ ZIF-8 @ cap). Вторая стратегия заключалась в непосредственном растворении фермента в водной фазе с последующим формированием микрокапсул на основе эмульсии Пикеринга (ZIF-8 @ cap-CalB). В частности, для повышения стабильности обеих микрокапсул необходимо было осаждение слоя наночастиц ZIF-8 небольшого размера вне каждой микрокапсулы (схема 1).
СХЕМА 1. Приготовление двух типов микрокапсул, загруженных CalB.
ЗИФ-8 и CalB @ ЗИФ-8
В этом исследовании наночастицы ZIF-8 и CalB @ ZIF-8 были приготовлены с помощью методов самосборки и биомиметической минерализации, как сообщалось нами (Схема 1; Qi et al., 2019). СЭМ-изображения показали, что наночастицы ZIF-8 и CalB @ ZIF-8 представляют собой ромбический додекаэдр, что указывает на то, что инкапсуляция фермента существенно не влияет на морфологию наночастиц ZIF-8. Однако размер частиц наночастиц CalB @ ZIF-8 (~ 500 нм) был меньше, чем у ZIF-8 (~ 700 нм), что доказывает, что введение ферментов уменьшит размер наночастиц ZIF-8 (рис. ).
Рис. 1. СЭМ-изображения наночастиц (A), ZIF-8 и (B), CalB @ ZIF-8.
Микрокапсулы, загруженные CalB
Поскольку обе микрокапсулы были получены путем самосборки предварительно синтезированных наночастиц на границе раздела масло-вода с последующим осаждением слоя наночастиц ZIF-8 малого размера вне капсул, CalB @ ZIF-8 @ cap и ZIF- 8 @ cap-CalB имел аналогичную морфологию. Под оптическим микроскопом обе микрокапсулы были круглыми или овальными с одинаковым размером от 20 до 40 мкм (рис. 2).Снимки СЭМ четко показали, что оба типа микрокапсул представляют собой неповрежденные сферы, поверхность которых была покрыта слоем плотных малогабаритных наночастиц ZIF-8, и оставались неповрежденными даже после процесса сушки (Рисунки 3A, B). Напротив, микрокапсулы без слоя наночастиц ZIF-8 небольшого размера демонстрировали уязвимую структуру и легко разрушались после высыхания (рисунки 3C, D). Это убедительно продемонстрировало, что наночастицы ZIF-8 небольшого размера, которые росли на поверхности микрокапсул в процессе осаждения, придали микрокапсулам дополнительную структурную стабильность.
Рис. 2. Изображения, полученные с помощью оптического микроскопа (A), CalB @ ZIF-8 @ cap и (B) ZIF-8 @ cap-CalB.
Рисунок 3. Характеристика микрокапсул на основе MOF. СЭМ-изображения синтезированных интактных (A), CalB @ ZIF-8 @ cap и (B) ZIF-8 @ cap-CalB. (C) CalB @ ZIF-8 @ cap и (D) ZIF-8 @ cap-CalB без плотных слоев снаружи оболочки. (E, G) Измельченный образец колпачка CalB @ ZIF-8 @, демонстрирующий структуру полого ядро-оболочку и иерархически структурированную оболочку. (F, H) Измельченный образец ZIF-8 @ cap-CalB, демонстрирующий их полую структуру ядро-оболочку и иерархически структурированную оболочку.
После того, как сформированные сферы были хорошо измельчены в строительном растворе, сломанные сферы обоих типов микрокапсул открыли внутреннюю полость, подтверждая структуру микрокапсул (Рисунки 3E, F). Поперечное сечение оболочки капсулы имело четкую иерархическую структуру и было разделено на два слоя. Внутренняя часть оболочки состояла из непрерывной сети агрегированных наночастиц ZIF-8 или CalB @ ZIF-8 большого размера, которые использовались для стабилизации эмульсии Пикеринга.Снаружи оболочка представляла собой плотное покрытие, нанесенное наночастицами ZIF-8 небольшого размера (Рисунки 3G, H).
С помощью этих двух методов фермент может быть иммобилизован в полости или внутри оболочки микрокапсул. Чтобы дополнительно убедиться в этом, были проведены измерения FTIR чистого ZIF-8, CalB, CalB @ ZIF-8 @ cap и ZIF-8 @ cap-CalB. Как показано на рисунке 4, характерные полосы адсорбции ZIF-8 наблюдались при 1581 и 421 см –1 , приписываемые валентному колебанию C = N на имидазольном кольце и валентному колебанию Zn-N.Характерный пик поглощения для CalB при 1640–1660 см –1 , который соответствует амиду I в основном из валентной моды C = O, также был обнаружен в спектрах CalB @ ZIF-8 @ cap и ZIF-8 @ cap-CalB. . В этом исследовании можно было наблюдать небольшой сдвиг пика амида I в микрокапсулах, нагруженных CalB, что можно отнести к прямому взаимодействию белок-MOF, вызванному координацией между Zn 2+ и карбонильными группами. на белки. Кроме того, уменьшение интенсивности пика может быть связано с количеством CalB (Qi et al., 2019). Эти данные четко подтвердили существование CalB независимо от того, находится ли он внутри оболочки или в полости микрокапсулы. Кроме того, были также проведены рентгенограммы (рис. 5). Резкость и высокая интенсивность дифракционных пиков указывает на высокую кристалличность наночастиц. Между тем, CalB @ ZIF-8 @ cap и ZIF-8 @ cap-CalB представили аналогичные картины дифракции рентгеновских лучей с чистыми наночастицами ZIF-8, предполагая, что инкапсуляция CalB практически не повлияла на кристаллическую структуру ZIF-8.
Рис. 4. FTIR-спектры чистого ZIF-8, CalB, ZIF-8 @ cap-CalB и CalB @ ZIF-8 @ cap.
Рис. 5. Рентгенограммы чистого ZIF-8, ZIF-8 @ cap-CalB и CalB @ ZIF-8 @ cap.
Перед проведением каталитических экспериментов были получены изображения флуоресцентной микроскопии с FITC-меченным CalB для дальнейшего определения распределения ферментов в микрокапсулах. На Фигуре 6 изображения флуоресцентной микроскопии микрокапсул, меченных FITC, показали сильную интенсивность флуоресценции (λ от = 488 нм).Изображение отражения было приписано отраженному свету флуоресцентных молекул от сферической поверхности (Xu et al., 2018). Для FITC-меченного ZIF-8 @ cap-CalB флуоресцентное изображение микрокапсул, меченных FITC, было незначительным, что указывало на то, что CalB не находился на поверхности микрокапсул и, таким образом, они оставались внутри микрокапсул (рис. 6A). Напротив, поскольку фермент был расположен внутри оболочки CalB @ ZIF-8 @ cap, отражение FITC было очевидным (рис. 6B).
Рисунок 6. Флуоресцентный анализ микрокапсул, меченных FITC. Изображения флуоресцентной микроскопии (A), FITC, меченного ZIF-8 @ cap-CalB, и (B) FITC, меченного CalB @ ZIF-8 @ cap.
Биокатализ
CalB — это очень универсальная липаза из-за ее широкой селективности по субстрату и каталитической функциональности. Его можно использовать для катализа различных реакций, включая аминолиз, этерификацию, переэтерификацию и гидролиз, и он стабилен в широком диапазоне биофизических условий, включая pH, температуру и условия растворителя, что делает его отличным модельным ферментом для инкапсуляции и биокаталитических исследований (Monteiro и другие., 2019; Ван Тассель и др., 2020; Zhang et al., 2020). Два типа микрокапсул, нагруженных CalB, получали, как описано ранее. После разложения микрокапсул кислотой рассчитывали загрузку CalB с помощью анализа Брэдфорда. Результаты показали, что загрузка фермента в первом методе (CalB @ ZIF-8 @ cap) составляла 3,96 мг⋅г –1 , а во втором методе (ZIF-8 @ cap-CalB) — 3,52 мг⋅г. –1 .
Каталитические характеристики двух типов микрокапсул, нагруженных CalB, были исследованы путем проведения реакций переэтерификации между парой небольших субстратов, как показано на рисунке 7A.В этой реакции 1-бутанол и винилацетат катализируются липазой с образованием бутилацетата. И субстраты, и продукты этой реакции имели небольшой размер и теоретически могли диффундировать через микропоры наночастиц ZIF-8 (рис. 8). Наночастицы CalB @ ZIF-8 также использовали в качестве положительного контроля. Реакции катализа проводили при 35 ° C в н-гептане, предполагалось встряхивание для обеспечения адекватного контакта между субстратами и катализатором. Каталитические эксперименты проводили в течение 48 часов, образцы отбирали через равные промежутки времени для расчета скорости превращения субстратов с помощью 1 H-ЯМР для оценки активности фермента.
Рис. 7. Биокатализ с использованием микрокапсул, нагруженных CalB. (A) Схема реакции переэтерификации между 1-бутанолом (1) и винилацетатом (2) с получением бутилацетата (3). (B) Зависящее от времени превращение 1 и 2, катализируемое CalB в различных условиях. (C) Схема реакции переэтерификации между 3- (4-гидроксифенил) пропан-1-олом (4) и виниллауратом (5) с получением 3- (4-гидроксифенил) пропилдодеканоата (6). (D) Зависящее от времени превращение 3 и 4, катализируемое CalB в различных условиях.
Рис. 8. Молекулярная модель используемых субстратов и продуктов, образованных после переэтерификации с помощью CalB.
Результаты показали, что положительный контроль занял около 48 часов для достижения 100% конверсии, в то время как обе микрокапсулы, нагруженные CalB, достигли степени конверсии около 70% одновременно (фигура 7B). Эти данные показали, что активность фермента хорошо сохранялась во время образования микрокапсул, а субстраты и продукты могли диффундировать через микропоры каркаса неповрежденной оболочки.Однако каталитическая эффективность двух типов микрокапсул, нагруженных CalB, была ниже, чем у свободных наночастиц CalB @ ZIF-8, что может быть связано со временем, необходимым субстратам и продуктам для прохождения через плотную оболочку микрокапсул.
Между тем было замечено, что ZIF-8 @ cap-CalB имеет немного меньшую каталитическую эффективность, чем CalB @ ZIF-8 @ cap. Это произошло потому, что в первом случае большая часть молекул фермента, расположенных в полости микрокапсул, адсорбировалась и накапливалась на внутренней стенке микрокапсул, что, скорее всего, было поверхностной адсорбцией, вызванной взаимодействиями между многочисленными органическими функциональными группами частицы MOF и фермент (Huo et al., 2015). Следовательно, агрегация фермента позволила субстратам контактировать с ферментом только на границе раздела, тем самым значительно уменьшая эффективную площадь контакта каталитической реакции (рис. 9А). Однако во втором случае большинство молекул фермента, расположенных внутри оболочки микрокапсулы, были равномерно распределены в наночастицах ZIF-8, поэтому субстраты могли контактировать с ферментом со всех сторон наночастиц ZIF-8 (рис. 9B). Таким образом, эффективные площади контакта фермента с субстратами во втором случае были значительно выше, чем в первом.Между тем, иерархическая структура оболочки микрокапсулы значительно увеличивает время прохождения субстратов через оболочку, тем самым побуждая большее количество субстратов участвовать в реакции. Это могло быть причиной того, что каталитическая эффективность CalB @ ZIF-8 @ cap была выше, чем ZIF-8 @ cap-CalB.
Рисунок 9. Модельные схемы поперечного сечения оболочки (A) ZIF-8 @ cap-CalB и (B) CalB @ ZIF-8 @ cap. Белые шестиугольники представляют собой крупноразмерные ZIF-8 или CalB @ ZIF-8, используемые для стабилизации эмульсии Пикеринга.Серые шестиугольники представляют собой нанесенное малогабаритное покрытие ЗИФ-8.
По завершении, из-за большого размера микрокапсул, катализаторы могут быть легко отделены от реакционной системы путем естественного осаждения. По сравнению с традиционными катализаторами, разделенными высокоскоростным центрифугированием, было сэкономлено большое количество энергии, что больше соответствовало требованиям экологичного и устойчивого промышленного развития. Простота восстановления побудила нас исследовать каталитическую возможность вторичной переработки этих двух типов микрокапсул.После реакции переэтерификации между парой небольших субстратов в течение 8 ч, CalB @ ZIF-8 @ cap и ZIF-8 @ cap-CalB отделяли, промывали и снова использовали для дальнейшей реакции. Превращение бутилацетата показало очень хорошую общую пригодность к переработке для обеих микрокапсул с ~ 80% активности, сохраняющейся после шести каталитических циклов (фигура 10). Это показало, что катализатор не только легко отделяется от реакционной системы, но также имеет хорошую каталитическую способность к повторному использованию.
Рисунок 10. Испытания на переработку CalB @ ZIF-8 @ cap и ZIF-8 @ cap-CalB для переэтерификации между парой небольших субстратов.
Оболочки обеих микрокапсул, нагруженных CalB, были нанесены плотным покрытием ZIF-8. Из-за ограничения размера пор наночастиц ZIF-8 (3,4 Å) (Schejn et al., 2014) будет наблюдаться эффект выбора размера субстратов, катализируемый ферментами в обеих микрокапсулах, нагруженных CalB. Для проверки селективности по размеру двух типов микрокапсул, нагруженных CalB, также была проведена реакция переэтерификации между парой больших субстратов, 3- (4-гидроксифенил) пропан-1-олом и виниллауратом (рис. 7C).Результаты показали, что, когда реакция катализируется свободным CalB, конверсия достигает 100% через 24 часа, в то время как при катализе двумя типами микрокапсул, нагруженных CalB, через 48 часов продукт почти не образуется (рис. 7D). Это указывало на то, что через микропоры почти не проходили субстраты для реакции с ферментом, а синтезированные микрокапсулы могли регулировать доступ субстратов различного размера.
Заключение
Таким образом, мы разработали простой и эффективный метод приготовления крупногабаритных и легко разделяемых катализаторов, которые были получены путем самосборки предварительно синтезированных наночастиц ZIF-8 на границе раздела масло-вода.В то же время мы достигли иммобилизации ферментов в различных положениях микрокапсул (в полости микрокапсулы или внутри оболочки микрокапсулы) и продемонстрировали их практическую ценность с точки зрения биокатализа и избирательности по размеру. По сравнению с традиционным катализатором фермент @ MOF, синтезированные загруженные ферментом микрокапсулы с иерархической структурой могут увеличивать размер катализатора от нанометрового до микрометрового масштаба и при этом сохранять высокую каталитическую активность, так что он может быть отделен от реакционной системы с помощью осаждение.Это очень новая стратегия получения крупногабаритных и многофункциональных композитов MOF-биомолекула, которая имеет большой потенциал в транспортировке, микрореакторах и биотехнологиях.
Заявление о доступности данныхВсе наборы данных, созданные для этого исследования, включены в статью / дополнительный материал.
Взносы авторов
JL провел эксперименты и написал рукопись. JL и LQ разработали эксперименты и интерпретировали экспериментальные данные.ZL придумал идею и руководил всем исследованием. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Финансирование
Это исследование было поддержано Национальным фондом естественных наук Китая (21878106), проектом 111 (B17018), ключевым проектом науки и технологий провинции Гуандун (2019A050510005), ключевым проектом науки и технологий зоны экономического развития Гуанчжоу. (2018Gh31) и Ключевой научно-технический проект Гуанчжоу (2010240).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Десаи, М. П., и Павар, К. Д. (2020). Иммобилизация целлюлазы на толерантных к железу Pseudomonas stutzeri биосинтезированных фотокаталитически активных магнитных наночастицах для повышения термической стабильности. Mater. Sci. Англ.С 106: 110169. DOI: 10.1016 / j.msec.2019.110169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Драут, Р. Дж., Робисон, Л., и Фарха, О. К. (2019). Каталитическое применение ферментов, инкапсулированных в металлоорганические каркасы. Coord. Chem. Ред. 381, 151–160. DOI: 10.1016 / j.ccr.2018.11.009
CrossRef Полный текст | Google Scholar
Du, Y., Gao, J., Zhou, L., Ma, L., He, Y., Huang, Z., et al. (2017). Ферментные нанокапсулы, армированные металлоорганическими каркасами: новый подход к приготовлению нанобиокатализатора. Chem. Англ. J. 327, 1192–1197. DOI: 10.1016 / j.cej.2017.07.021
CrossRef Полный текст | Google Scholar
Duan, W., Zhao, Z., An, H., Zhang, Z., Cheng, P., Chen, Y., et al. (2019). Современное состояние и перспективы биомолекул: включение в функциональные металлоорганические каркасы. Верх. Curr. Chem. 377: 34. DOI: 10.1007 / s41061-019-0258-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фу, Х., Оу, П., Чжу, Дж., Сун, П., Ян, Дж., И Ву, Ю. (2019). Повышенная адсорбция белка на волокнистых субстратах, обработанных наночастицами цеолитного имидазолата каркаса-8 (ZIF-8). ACS Appl. Nano Mater. 2, 7626–7636.
Google Scholar
Гарсия-Галан, К., Беренгер-Мурсия, А., Фернандес-Лафуэнте, Р., и Родригес, Р. К. (2011). Возможности различных стратегий иммобилизации ферментов для улучшения работы ферментов. Adv. Synth. Катал. 353, 2885–2904. DOI: 10.1002 / adsc.201100534
CrossRef Полный текст | Google Scholar
Хоркахада, П., Греф Р., Баати Т., Аллан П. К., Маурин Г., Куврёр П. и др. (2012). Металлоорганические каркасы в биомедицине. Chem. Ред. 112, 1232–1268.
Google Scholar
Хо Дж., Агилера-Сигалат Дж., Эль-Ханкари С. и Брэдшоу Д. (2015). Магнитные микрореакторы MOF для вторичного селективного биокатализа. Chem. Sci. 6, 1938–1943.
Google Scholar
Цзя, Ю., Чен, Ю., Ло, Дж., И Ху, Ю. (2019). Иммобилизация лакказы на мезо-MIL-53 (Al) посредством физической адсорбции для каталитического превращения триклозана. Ecotoxicol. Environ. Saf. 184: 109670. DOI: 10.1016 / j.ecoenv.2019.109670
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jiang, W., Wang, X., Chen, J., Liu, Y., Han, H., Ding, Y., et al. (2017). Дейтерогемин-пептидный фермент имитирует внедренные металлоорганические каркасы посредством биомиметической минерализации с эффективной каталитической активностью atrp. ACS Appl. Матер. Интерфейсы 9, 26948–26957. DOI: 10.1021 / acsami.7b09218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джо, С., Park, S., Oh, Y., Hong, J., Kim, H.J., Kim, K.J., et al. (2019). Разработка микросфер гидрогеля целлюлозы для иммобилизации липазы. Biotechnol. Bioprocess Eng. 24, 145–154. DOI: 10.1007 / s12257-018-0335-0
CrossRef Полный текст | Google Scholar
Kim, D., Kwon, S.-J., Sauve, J., Fraser, K., Kemp, L., Lee, I., et al. (2019). Модульная сборка уникальных химерных литических ферментов на белковой основе, обладающих антистафилококковой активностью. Биомакромолекулы 20, 4035–4043.DOI: 10.1021 / acs.biomac.9b01134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Койпер, С. М., Наллани, М., Вриезема, Д. М., Корнелиссен, Дж. Дж., Ван Хест, Дж. К., Нолти, Р. Дж. И др. (2008). Ферменты, содержащие пористые полимерсомы в качестве нанореакционных сосудов для каскадных реакций. Org. Biomol. Chem. 6, 4315–4318. DOI: 10.1039 / b811196k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х., Пан, Ю., Фармакес, Дж., Сяо, Ф., Лю Г., Чен Б. и др. (2019). Сульфированные мезопористые наночастицы диоксида кремния для защиты ферментов от денатурирующих веществ и контролируемого высвобождения в восстанавливающих условиях. J. Colloid Interface Sci. 556, 292–300. DOI: 10.1016 / j.jcis.2019.08.063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лян К., Рикко Р., Доэрти К. М., Стайлз М. Дж., Белл С., Кирби Н. и др. (2015). Биомиметическая минерализация металлоорганических каркасов как защитных покрытий для биомакромолекул. Nat. Commun. 6: 7240. DOI: 10.1038 / ncomms8240
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Л., Сунь Ю., Хе Л., Цзян Л. и Ян С. (2015). Ферменты, инкапсулированные в амфифильные полые углеродные микросферы: легкая иммобилизация и высокие биокаталитические свойства. Enzyme Microb. Technol. 79-80, 19–26. DOI: 10.1016 / j.enzmictec.2015.06.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мехде, А.А. (2019). Разработка магнитно-сшитых агрегатов пероксидазы на крахмале в качестве улучшающей матрицы и их применение для обесцвечивания. Int. J. Biol. Макромол. 131, 721–733. DOI: 10.1016 / j.ijbiomac.2019.03.062
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтейро, Р. Р. С., Нето, Д. М. А., Фешин, П. Б. А., Лопес, А. А. С., Гонсалвес, Л. Р. Б., Дос-Сантос, Дж. С. С. и др. (2019). Синтез этилбутирата, катализируемый липазами A и B из Candida antarctica , иммобилизованных на магнитных наночастицах.повышение эффективности биокатализаторов при ультразвуковом облучении. Int. J. Mol. Sci. 20: 5807. DOI: 10.3390 / ijms20225807
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нобахт Н., Фарамарзи М. А., Шафи А., Хоби М. и Рафи Э. (2018). Полиоксометаллат-металлоорганическая каркасная липаза: эффективный зеленый катализатор для синтеза бензилциннамата путем ферментативной этерификации коричной кислоты. Int. J. Biol. Макромол. 113, 8–19.DOI: 10.1016 / j.ijbiomac.2018.02.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новрузи-Неджад, З., Бахрамян, Б., и Хоссейнхани, С. (2019). Эффективная иммобилизация люциферазы светлячков в металлоорганическом каркасе: fe-MIL-88 (Nh3) в качестве мощной поддержки для этой цели. Enzyme Microb. Technol. 121, 59–67. DOI: 10.1016 / j.enzmictec.2018.10.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оливейра, М., Газзотто, У., Корнеки, Дж. Ф., Фернандес-Лафуэнте, Р., Тардиоли, П. В., и де Арруда Рибейро, М. П. (2019). Комбинированные CLEA глюкозооксидазы и каталазы для преобразования глюкозы в глюконовую кислоту, удаляя перекись водорода для поддержания активности ферментов в реакторе с барботажной колонной. Катализаторы 9: 657. DOI: 10.3390 / catal57
CrossRef Полный текст | Google Scholar
Попат А., Хартоно С. Б., Стар Ф., Лю Дж., Цяо С. З. и Цин Макс Лу Г. (2011). Мезопористые наночастицы кремнезема для биоадсорбции, иммобилизации ферментов и носители для доставки. Наноразмер 3, 2801–2818. DOI: 10.1039 / c1nr10224a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ци, Л., Луо, З., и Лу, X. (2019). Биомиметическая минерализация, индуцирующая нанокомпозит липаза-металл-органический каркас для пикеринга межфазной биокаталитической системы. ACS Sustain. Chem. Англ. 7, 7127–7139. DOI: 10.1021 / acssuschemeng.9b00113
CrossRef Полный текст | Google Scholar
Шейн А., Балан Л., Фальк В., Аранда Л., Меджахди, Г., и Шнайдер, Р. (2014). Управление образованием нано- и микрокристаллов ZIF-8 и реакционной способностью с помощью вариаций соли цинка. CrystEngComm 16, 4493–4500. DOI: 10.1039 / c3ce42485e
CrossRef Полный текст | Google Scholar
Tan, W., Wei, T., Huo, J., Loubidi, M., Liu, T., Liang, Y., et al. (2019). Вызванное электростатическим взаимодействием образование фермента на MOF в качестве хемобиокатализатора для каскадной реакции с неожиданно кислотоустойчивыми каталитическими характеристиками. ACS Appl.Матер. Интерфейсы 11, 36782–36788. DOI: 10.1021 / acsami.9b13080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Тассель, Л., Мойланен, А., и Раддок, Л. В. (2020). Эффективное производство липазы B дикого типа из Candida antarctica в цитоплазме Escherichia coli . Белок. Expr. Purif 165: 105498. DOI: 10.1016 / j.pep.2019.105498
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, З., ван Оерс, М. К., Рутес, Ф. П., и ван Хест, Дж. К. (2012). Полимерсомные коллоидосомы для ферментативного катализа в двухфазной системе. Angew. Chem. Int. Эд. 51, 10746–10750.
Google Scholar
Ву, X., Ян, К., и Ге, Дж. (2017). Зеленый синтез композитов фермент / металл-органический каркас с высокой стабильностью в денатурирующих белки растворителях. Биоресурсы. Биопроцесс. 4:24. DOI: 10.1186 / s40643-017-0154-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, З., Xiao, G., Li, H., Shen, Y., Zhang, J., Pan, T., et al. (2018). Компартментализация внутри самособирающихся наночастиц металлоорганического каркаса для тандемных реакций. Adv. Funct. Матер. 28: 1802479. DOI: 10.1002 / adfm.201802479
CrossRef Полный текст | Google Scholar
Юэ Д., Цянь X., Чжан З., Кан М., Рен М. и Чжао Ю. (2016). Квантовые точки CdTe / CdS Core / Shell, сокатализируемые устойчивыми к сере [Mo3S13] 2– нанокластерами для эффективной эволюции водорода под действием видимого света. ACS Sustain. Chem. Англ. 4, 6653–6658. DOI: 10.1021 / acssuschemeng.6b01520
CrossRef Полный текст | Google Scholar
Zhang, H., Liu, T., Zhu, Y., Hong, L., Li, T., Wang, X., et al. (2020). Липазы, иммобилизованные на модифицированной полипористой магнитной целлюлозной подложке, в качестве эффективного и пригодного для повторного использования катализатора для производства биодизельного топлива из масла семян желтого рога. Обновить. Энергия 145, 1246–1254.
Google Scholar
Чжао, З., Линь, Т., Лю, В., Хоу, Л., Е, Ф., и Чжао, С. (2019). Колориметрическое определение уровня глюкозы в крови на основе каскадной реакции GOx @ ZIF-8 @ Fe-полидофамин. Spectrochim. Acta A Mol. Biomol. Spectrosc. 219, 240–247. DOI: 10.1016 / j.saa.2019.04.061
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhou, M., Ju, X., Zhou, Z., Yan, L., Chen, J., Yao, X., et al. (2019). Разработка иммобилизованной целлюлазной системы на основе металлоорганических каркасов для улучшения устойчивости к ионной жидкости и осахаривания жома in situ. ACS Sustain. Chem. Англ. 7, 19185–19193. DOI: 10.1021 / acssuschemeng.9b05175
CrossRef Полный текст | Google Scholar
Чжу, Г., Чжан, М., Бу, Ю., Лу, Л., Лу, X., и Чжу, Л. (2018). Металлоорганические каркасные коллоидосомы с заделанными ферментами на основе эмульсионного подхода. Chem. Азиатский. J. 13, 2891–2896. DOI: 10.1002 / asia.201800976
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Влияние объема и места взятия крови на результаты посева крови
J Clin Microbiol.2009 ноя; 47 (11): 3482–3485.
Уилсон И. Гонсалвес
Медицинский факультет Университета Крейтон, 1 Отделение патологии, Детская больница, 2 Отделение педиатрии, 3 Отделение эпидемиологии и профилактической медицины, 4 Отделение детских инфекционных болезней Крейтон Медицинский факультет Университета, Омаха, Небраска 5
Нэнси Корниш
Медицинский факультет Университета Крейтон, 1 Отделение патологии, Детская больница, 2 Отделение педиатрии, 3 Отделение эпидемиологии и профилактической медицины, 4 Отделение детских инфекционных заболеваний Медицинский факультет Университета Крейтона, Омаха, Небраска 5
Майкл Мур
Медицинский факультет Университета Крейтон, 1 Отделение патологии, Детская больница, 2 Отделение педиатрии, 3 Кафедра эпидемиологии и пред Ventive Medicine, 4 Отделение детских инфекционных заболеваний Медицинский факультет Университета Крейтон, Омаха, Небраска 5
Аймин Чен
Медицинский факультет Университета Крейтон, 1 Отделение патологии детской больницы, 2 Отделение Педиатрия, 3 Департамент эпидемиологии и профилактической медицины, 4 Департамент детских инфекционных заболеваний Медицинский факультет Университета Крейтон, Омаха, Небраска 5
Мира Варман
Медицинский факультет Университета Крейтон, 1 Департамент патологии , Детская больница, 2 Департамент педиатрии, 3 Департамент эпидемиологии и профилактической медицины, 4 Департамент детских инфекционных заболеваний Медицинский факультет Университета Крейтон, Омаха, Небраска 5
Медицинский факультет Университета Крейтон, 1 Кафедра патологии, Детская больница, 2 Отделение педиатрии, 3 Отделение эпидемиологии и профилактической медицины, 4 Отделение детских инфекционных заболеваний Медицинская школа Университета Крейтон, Омаха, Небраска 5
* Автор для переписки.Почтовый адрес: Отделение детских инфекционных заболеваний, Медицинский центр Университета Крейтон, 601 N. 30th St, Omaha, NE 68131. Телефон: (402) 280-1238. Факс: (402) 280-1234. E-mail: ude.nothgierc@namravareemПоступило 3 ноября 2008 г .; Пересмотрено 10 ноября 2008 г .; Принято 18 сентября 2009 г.
Copyright © 2009, Американское общество микробиологов. Эта статья цитируется в других статьях PMC.Abstract
Загрязнение посевов крови сильно влияет на клинические решения. Следовательно, представляет интерес оценить влияние таких факторов, как объем забираемой крови и место забора крови, на скорость заражения посевов крови.В ретроспективном исследовании посев крови младенцев и детей в возрасте до 18 лет, у которых был хотя бы один положительный посев крови в течение 2006 года, был проанализирован на предмет их объема взятой крови, веса пациента, места взятия крови и посева крови. полученные результаты. Культуры крови считались адекватными коллекциями, если они содержали соответствующий объем крови, зависящий от веса. Более того, результаты посева крови были классифицированы как истинные патогены, контаминанты и отрицательные культуры; затем их сравнивали и анализировали относительно их объема и места забора крови.В течение 2006 г. было собрано 5 023 посевов крови, из которых 843 были проанализированы. Среди 843 проанализированных культур было 306 (36%) положительных культур. Из 306 положительных культур 98 (32%) были контаминантами, а 208 (68%) культур вырастили значимые патогены. Тридцать пять процентов зараженных культур имели адекватный объем по сравнению с 60% в группе истинной бактериемии ( P <0,001). Кроме того, из 843 культур уровни заражения среди различных участков забора крови были следующими: периферическая венепункция - 36%; артериальный - 10%; и центральный венозный доступ - 7% ( P = 0.155). Уровень контаминации был выше при меньших объемах крови, и не было значительных различий в показателях контаминации между разными участками забора крови.
Посев крови жизненно важен для выявления патогенов, вызывающих серьезные инфекции, и для назначения соответствующей антибактериальной терапии. Более того, они остаются стандартным методом выявления бактериемии при обследовании больных (14). К сожалению, заражение посевов крови является обычным явлением и может привести к путанице в отношении значимости положительного посева крови.Наиболее распространенными контаминантами являются виды коагулазонегативного стафилококка, которые также становятся все более распространенными в качестве основного патогена у пациентов с ослабленным иммунитетом и у пациентов с постоянными внутрисосудистыми устройствами (9, 15). Неопределенная клиническая значимость потенциальных контаминантов приводит к более длительному пребыванию в больнице, ненужной терапии антибиотиками и дополнительным лабораторным исследованиям; в результате затраты, понесенные больницей, во много раз превышают затраты лаборатории (2).
Многие факторы влияют на выход посевов крови, но наиболее важным фактором является объем крови.Несколько исследований показали, что скорость выделения патогенов из посевов крови увеличивается с количеством сданной крови (12). Следовательно, посев крови может быть ложноотрицательным из-за посева крови недостаточного объема (6). Кроме того, уровень загрязнения посевов крови обратно коррелирует с объемом крови (3). Также известно, что место и метод сбора крови влияют на скорость заражения культур крови (8). Устройства для сосудистого доступа, такие как артериальные и центральные венозные катетеры, проходят через кожу и подвержены бактериальной колонизации.Следовательно, этим бактериям легко колонизировать и размножаться в этих портах и вокруг них, и они могут попасть в образцы крови, взятые из этих мест. Следовательно, основные цели этого исследования заключались в том, чтобы определить объем крови, полученной для посева в повседневной клинической практике, и оценить, приводят ли недостаточные объемы крови к увеличению числа контаминантов. Наконец, это исследование также оценило, связано ли место взятия крови с увеличением частоты зараженных культур.
МАТЕРИАЛЫ И МЕТОДЫ
Это ретроспективное исследование всех посевов крови младенцев и детей в возрасте до 18 лет, у которых в течение 2006 года был хотя бы один положительный посев крови в Детской больнице Омахи, Омаха, Северная Каролина. Мы получили информацию из системы клинического управления Sunrise, используемой Детской больницей Омахи. Для каждого образца записывались следующие данные: дата посева крови, объем взятой крови, дата рождения пациента, вес пациента при поступлении, источник забора крови, время получения положительного результата посева крови и окончательный результат посева.Источник забора крови классифицировался как центральный, если он поступал из центрального венозного катетера, артериальный, если он поступал из артериальной линии, или периферический, если кровь бралась через периферическую венопункцию. Посевы крови были заказаны в виде набора, который содержал один аэробный флакон и один анаэробный флакон. Общий собранный объем крови должен был быть равномерно распределен между двумя флаконами, присутствующими в каждом наборе для культур крови. Обычно при заказе культур крови для пациента заказывают два набора для посева крови.Для взятия крови использовали только непедиатрические бутыли, а для выращивания этих культур использовали бульонную среду. Культуры помещали в автоматизированную систему непрерывного мониторинга культур крови BacT / Alert (Bio Merieux, Дарем, Северная Каролина). У пациентов с массой тела более 8 кг были взяты два набора культур крови из разных мест. Наборы для посева крови считались адекватными коллекциями, если они содержали соответствующий объем крови, зависящий от веса, согласно таблице. В этой таблице представлен общий объем крови, который необходимо собрать для двух наборов для посева крови, которые используются микробиологической лабораторией Детской больницы Омахи.
ТАБЛИЦА 1.
Объем крови, необходимый для адекватного посева крови в зависимости от веса пациента
| Масса пациента (кг) | Необходимый объем (мл) | Объем (мл) взятых a | |||
|---|---|---|---|---|---|
| 1-й набор для посева крови | 2-й набор для посева крови | ||||
| 1-й флакон | 2-й флакон | 1-й флакон | 2-й флакон | ||
| <3.9 | 1 | 0,5 | 0,5 | ||
| 4-7,9 | 3 | 1,5 | 1,5 | ||
| 1,5 | 1,5 | 1,5 | |||
| 14-18,9 | 12 | 3 | 3 | 3 | 3 |
| 19-25,9 | 16 | 41289 41288 | 41288 | 41288 | |
| 26-39.9 | 20 | 5 | 5 | 5 | 5 |
| 40-53,9 | 32 | 8 | 8 | 8 | 8 |
| 10 | 10 | 10 | |||
Для этого анализа изоляты одной культуры, выращивающие дифтероидные виды, виды микрококков и непневмококковые альфа-гемолитические стрептококки, были классифицированы как контаминанты.Кроме того, коагулазонегативные стафилококки были классифицированы как контаминанты, если они выросли только из одного посева крови с увеличенным временем до положительного результата (> 24 ч) и при отсутствии каких-либо клинических признаков и симптомов, таких как лихорадочный статус, плохое питание и летаргия ( 17). Однако считалось, что они представляют истинную бактериемию, если один и тот же организм рос на нескольких последовательных культурах с очевидными клиническими признаками бактериемического статуса у пациента или без них. Это было подтверждено просмотром медицинских записей во время госпитализации с помощью обзора карты.Эти положения должны быть выполнены, поскольку было несколько эпизодов истинной бактериемии у коагулазонегативных стафилококков из-за значительного размера выборки пациентов с ослабленным иммунитетом и пациентов с давно установленными постоянными сосудистыми катетерами. Наконец, статистический анализ наших результатов был проведен с использованием критерия хи-квадрат с двусторонним тестом и значимостью 0,05. Компьютерное программное обеспечение, используемое для проведения этого статистического анализа, было SAS 9.1 (SAS Inc., Кэри, Северная Каролина).
РЕЗУЛЬТАТЫ
За период исследования с 1 января 2006 г. по 31 декабря 2006 г. в Детской больнице Омахи было взято 5 023 общих посева крови.Из этих общих культур 1231 культура крови была собрана у пациентов, у которых был хотя бы один положительный посев крови. Однако из 1231 вышеупомянутых культур только 843 культуры были проанализированы в нашем исследовании после исключения 388 культур из-за отсутствия данных об объеме крови. Из этих 843 посевов крови 340 (40%) имели недостаточный объем по сравнению с оставшимися 503 (60%) посевами крови. Адекватность объема посева крови для разных весовых групп показана на рис.
Объемы посевов крови определены как адекватные и недостаточные в зависимости от веса пациента. n = 843.
Из 262 эпизодов бактериемии / фунгемии было выделено 274 микроорганизма (12 соответствовали полимикробным случаям). Количество и процентное содержание отдельных выделенных организмов представлено в таблице.
ТАБЛИЦА 2.
Количество и процентное содержание специфических организмов, выделенных у 262 пациентов с эпизодами положительных посевов крови
| Микроорганизм | Кол-во (%) случаев | Кол-во (%) контаминантов | ||
|---|---|---|---|---|
| грамположительные бактерии | 216 (78.8) | 95 (44) | ||
| Staphylococcus aureus | 13 (4,7) | |||
| Метициллин-устойчивый S. aureus | 12 (4,4) | |||
| 123 (44.9) | 83 (67) | |||
| Enterococcus sp. | 9 (3,3) | |||
| Streptococcus pneumoniae | 7 (2.6) | |||
| Группа B Streptococcus | 4 (1,5) | |||
| Другое Streptococcus spp. | 18 (6,6) | 2 (11) | ||
| Corynebacterium sp. | 6 (2.2) | 4 (67) | ||
| Bacillus sp. | 20 (7,3) | 2 (10) | ||
| Micrococcus sp. | 4 (1.5) | 4 (100) | ||
| Грамотрицательные бактерии | 45 (16,4) | |||
| Escherichia coli | 12 (4,4) | 912bs87. | 7 (2,6) | |
| Pseudomonas aeruginosa | 4 (1,5) | |||
| Enterobacter sp. | 8 (2,9) | |||
| Salmonella sp. | 3 (1,1) | |||
| Citrobacter sp. | 2 (0,7) | |||
| Haemophilus sp. | 2 (0,7) | |||
| Roseomonas sp. | 2 (0,7) | |||
| Другое | 5 (1,8) | |||
| Анаэробы | 1 (0,4) | |||
| Clostridium. | 1 (0,4) | |||
| Грибки | 12 (4,4) | |||
| Candida sp. | 12 (4,4) | 3 (25) | ||
| Всего | 274 | 98 |
Из 843 посевов крови, проанализированных в нашем исследовании, 537 (64%) культур были отрицательными, тогда как 306 (36%) культур оказались положительными (рис.). Более того, из 306 положительных культур в 98 (32%) выросли контаминанты, а в 208 (68%) культурах были обнаружены значительные патогены.Из посевов крови, в которых выросли контаминанты, 64 (65%) имели недостаточный объем и 34 (35%) имели адекватный объем. Точно так же из культур с истинной бактериемией 84 (40%) имели недостаточный объем, а 124 (60%) имели адекватный объем. Наблюдалась значительная статистическая разница между 35% культур крови адекватного объема в группе контаминанта и 60% культурами крови адекватного объема в группе истинной бактериемии со значением P <0,001.
Распределение посевов крови по результатам и объемам.
Из 843 культур, использованных в этом исследовании, 41 (5%) были взяты из артериальной линии, 371 (44%) из центрального венозного катетера и 431 (51%) через периферическую венозную пункцию. Из 41 образца артериальной крови 24 (59%) были отрицательными, а 17 (41%) — положительными культурами. Из этих 17 положительных культур 9 (53%) имели адекватные объемы, а 8 (47%) — недостаточные. Кроме того, из этих 9 культур достаточного объема 1 (11%) была контаминантной, а 8 (89%) были зарегистрированы как истинная бактериемия.
Точно так же из 371 культуры, взятой через центральный венозный доступ, 237 (64%) были отрицательными, а 134 (36%) были положительными.Из 134 положительных культур 65 (41%) культур имели адекватный объем, а 69 (59%) — недостаточный. Наконец, из 65 культур достаточного объема 10 (15%) были контаминантами и 55 (85%) были истинными патогенами.
Было проведено 431 посев крови из периферических участков. Из них 276 (64%) были отрицательными, а 155 (36%) — положительными. Из 155 положительных культур 84 (54%) имели адекватный объем крови, тогда как 71 (46%) имели недостаточный объем крови. Наконец, из 84 культур достаточного объема 23 (27%) были контаминантами и 61 (73%) имели значительные патогены.Однако не было значительных статистических различий в скорости заражения между двумя участками, при значении P , равном 0,155.
ОБСУЖДЕНИЕ
Для врачей заражение посевов крови затрудняет принятие решений во время оказания помощи пациенту. У пациента с лихорадкой и лейкоцитозом, если в одном из двух посевов крови вырастают грамположительные кокки, может быть начата эмпирическая терапия ванкомицином. Когда выявляется коагулазонегативный стафилокк и во второй культуре не растут какие-либо организмы, это может рассматриваться как контаминант, что приводит к ненужному использованию антибиотиков, риску лекарственной реакции, лекарственной устойчивости и дополнительным расходам на госпитализацию (4).При дальнейшем исследовании с помощью обзора диаграммы мы обнаружили, что 19 (20%) из 98 посевов крови, в которых выросли контаминанты, привели к использованию несоответствующего эмпирического лечения антибиотиками, что привело к ненужным затратам и потенциальному развитию устойчивости к антибиотикам. Согласно нашим данным, мы рассчитали уровень загрязнения около 1,95% от общего числа 5023 посевов крови, взятых в 2006 году. Приемлемый уровень загрязнения в микробиологических лабораториях по всей стране согласно Американскому обществу микробиологов не должен превышать 3% (16).
Оптимальный объем крови, который следует брать у младенцев и детей, не определен с абсолютной уверенностью, но прошлые данные указывают на прямую зависимость между объемом посевной крови и способностью выявлять инфекции кровотока (1). Используя критерии объема посевов крови, используемые в нашей Детской больнице, наш анализ показал, что значительное количество посевов крови имело недостаточный объем и только 503 (60%) из 843 полных культур крови содержали адекватные объемы.Это было выше, чем результат, полученный Connell et al. в своем исследовании в Детской больнице в Мельбурне, Австралия, где они исследовали 1067 культур крови, из которых 491 (46%) содержали адекватный объем крови (6). Однако наши критерии для объемов крови были основаны на весе пациента, а не на возрасте, который использовался в их исследовании.
Мы заметили увеличение отношения культур недостаточного объема к культурам адекватного объема по мере увеличения веса пациентов (рис.). Это может быть связано с возрастающими требованиями к объему, необходимыми для групп с большим весом. В предыдущем исследовании, проведенном Бекерисом и соавторами, уровень загрязнения посевов крови обратно коррелировал с объемом крови (3). Точно так же наши данные показали, что в группе истинной бактериемии был более высокий процент культур адекватного объема, чем в группе контаминантов, что было статистически значимым (60% против 35%; P <0,001). Мы не уверены, почему культуры недостаточного объема склонны к росту загрязнителей.Мы предполагаем, что при малых объемах крови контаминанты могут иметь более высокие концентрации, чем культуры с адекватным объемом крови. Более того, посевы с низким объемом крови, возможно, могли быть взяты у пациентов с плохой доступностью периферических вен с самого начала и, следовательно, вызывали снижение способности поддерживать стерильную технику во время забора крови.
Когда мы исследовали место забора крови, мы не обнаружили какой-либо существенной статистической разницы между уровнями контаминации между различными местами забора крови.Однако размер выборки артериальной группы составлял только 5% (41/843) от всех заборов крови и, следовательно, был недостаточно большим, чтобы вносить вклад в статистическую значимость. Более того, эти результаты противоречат данным прошлых исследований, которые показывают, что посевы крови, полученные из сосудистых катетеров, с большей вероятностью будут загрязнены, чем культуры, полученные чрескожно, из-за сложности стерилизации катетеров (7, 13). Прошлые исследования заборов крови из артериальных линий в качестве источника для посева крови показывают, что их результаты не связаны с более высокими диагностическими показателями, чем посевы венозной крови, и не рекомендуются (11).
Возможные ограничения нашего исследования включают тот факт, что это был ретроспективный анализ. Поскольку не существует установленных критериев адекватности объемов посевов крови, мы использовали критерии, применяемые в учебной детской больнице. Более того, должны быть отдельные критерии для пациентов с ослабленным иммунитетом, поскольку они, как правило, имеют повышенную бактериальную нагрузку во время инфекций и могут не требовать такого количества крови для посева (5, 10). Все эти факторы делают нашу классификацию объемов, используемых при посеве крови, субъективной.Точно так же, хотя мы тщательно изучили наши диаграммы, чтобы различать микроорганизмы, выращенные как контаминанты, от истинной бактериемии, некоторые из них могли быть неправильно классифицированы. Наконец, в нашем исследовании была проанализирована только часть общих культур крови, взятых в течение 2006 г., из-за отсутствия данных по объему, и, следовательно, это может способствовать систематической ошибке.
Тем не менее, несмотря на эти ограничения, наше исследование подчеркивает частоту неадекватного объема посева крови в рутинной клинической практике.Более того, мы заметили взаимосвязь между скоростью посевов крови в адекватном объеме и уровнем контаминации. Однако мы не обнаружили какой-либо существенной разницы в скорости загрязнения между разными участками забора крови.
Благодарности
Мы благодарим Жанетт Мэнли из микробиологической лаборатории Детской больницы за предоставление списка культур крови для сбора данных.
Сноски
▿ Опубликованы досрочно 30 сентября 2009 г.
СПИСОК ЛИТЕРАТУРЫ
1. Барон, Э. Дж., М. П. Вайнштейн, В. М. Данн, П. Ягупский, Д. Ф. Велч и Д. М. Уилсон. 2005. Cumitech 1C, Посев крови IV. Координирующий ред., Э. Дж. Барон. Американское общество микробиологии, Вашингтон, округ Колумбия.
2. Бейтс, Д. У., и Л. Голдман. 1991. Посевы загрязненной крови и использование ресурсов: истинные последствия ложноположительных результатов. JAMA 265 : 365-369. [PubMed] [Google Scholar] 3. Бекерис, Л., Дж. Творек, М. Уолш и П. Валенштейн. 2005. Тенденции заражения посевов крови: исследование Q-Tracks Колледжа американских патологов в 356 учреждениях. Arch. Патол. Лаборатория. Med. 129 : 1222-1225. [PubMed] [Google Scholar] 4. Э. Буза, Д. Соуза, М. Родригес-Крейксемс, Х. Г. Лечуз и П. Муньос. 2007. Является ли объем посевов крови важным фактором в диагностике инфекций кровотока? J. Clin. Microbiol. 45 : 2765-2769. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Браун Д. Ф. и Р. Э. Уоррен. 1990. Влияние объема пробы на результат посевов крови взрослых пациентов с гематологическими злокачественными новообразованиями. J. Clin. Патол. 43 : 777-779. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Коннелл, Т. Г., М. Реле, Д. Коули, Дж. П. Баттери и Н. Кертис. 2007. Насколько надежен отрицательный результат посева крови? Объем крови, сданной на посев в повседневной практике детской больницы. Педиатрия 119 : 891-896.[PubMed] [Google Scholar] 7. Эвертс, Р. Дж., Э. Н. Винсон, П. О. Адхолла и Л. Б. Реллер. 2000. Загрязнение посевов крови, полученных при помощи катетера. J. Clin. Microbiol. 39 : 3393-3394. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Huebner, J., and D. Goldman. 1999. Коагулазонегативные стафилококки: роль патогенов. Анну. Rev. Med. 50 : 223-236. [PubMed] [Google Scholar] 10. Kellogg, J. A., J. P. Manzella и D. A. Bankert. 2000. Частота низкоуровневой бактериемии у детей от рождения до пятнадцати лет.J. Clin. Microbiol. 38 : 2181-2185. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Левин, П. Д., М. Херш, Б. Руденский и А. М. Йиннон. 2000. Использование артериальной линии как источника посевов крови. Intensive Care Med. 26 : 1350-1354. [PubMed] [Google Scholar] 12. Mermel, L., and D. Maki. 1993. Обнаружение бактериемии у взрослых: последствия культивирования недостаточного объема крови. Анна. Междунар. Med. 119 : 270-272. [PubMed] [Google Scholar] 13. Норберг, А., Н. К. Кристофер, М. Л. Рамундо, Дж. Р. Бауэр и С. А. Берман. 2003. Уровень заражения посевов крови, полученных с помощью специальной флеботомии, по сравнению с внутривенным катетером. JAMA 289 : 726-729. [PubMed] [Google Scholar] 14. Shafazand, S., and A. Weinacker. 2002. Посев крови в отделении интенсивной терапии: улучшение использования и урожайности. Сундук 122 : 1727-1736. [PubMed] [Google Scholar] 15.