Сдать анализ на онкомаркер белок S100 (S100 protein)
Метод определения Электрохемилюминесцентный иммуноанализ, Cobas e601(Roche).Аналитическая чувствительность
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияМаркёр потенциального повреждения мозга, маркёр злокачественной меланомы.
Белки семейства S100 (к настоящему времени известно, по крайней мере, 25 представителей: S100A1 — S100A18, trichohylin, fillagrin, repetin, S100B, S100G, S100P, S100Z) – небольшие димерные кальцийсвязывающие белки с м.
 Предполагается, что S100 белки выполняют как внутриклеточные, так и внеклеточные функции, некоторые S100 белки секретируются и действуют аналогично цитокинам. S100Β, который продуцируется преимущественно астроцитами мозга, является маркёром активации астроглии, опосредующим свои эффекты через взаимодействие с RAGE (receptor for advanced glycation end products — рецепторы конечных продуктов гликозилирования). Показано, что S100Β проявляет нейротрофическую активность при физиологической концентрации и нейротоксическую при высокой концентрации. Различные формы рака проявляют выраженное изменение продукции S100. Повышенная секреция S100Β характерна для злокачественной меланомы. S100 — RAGE взаимодействие играет важную роль в связи воспаления и рака, выживании опухолевых клеток и злокачественной прогрессии. Клинический интерес к S100 связан с применением его как маркёра повреждения мозга при травматических поражениях мозга, болезни Альцгеймера (S100Β, высвобождающийся из некротических тканей может усиливать нейродегенерацию путём S100Β-индуцированного апоптоза), субарахноидальных кровотечениях, инсультах и иных неврологических расстройствах; в мониторинге злокачественной меланомы, других неопластических заболеваний, а также воспалительных болезнях.
Предполагается, что S100 белки выполняют как внутриклеточные, так и внеклеточные функции, некоторые S100 белки секретируются и действуют аналогично цитокинам. S100Β, который продуцируется преимущественно астроцитами мозга, является маркёром активации астроглии, опосредующим свои эффекты через взаимодействие с RAGE (receptor for advanced glycation end products — рецепторы конечных продуктов гликозилирования). Показано, что S100Β проявляет нейротрофическую активность при физиологической концентрации и нейротоксическую при высокой концентрации. Различные формы рака проявляют выраженное изменение продукции S100. Повышенная секреция S100Β характерна для злокачественной меланомы. S100 — RAGE взаимодействие играет важную роль в связи воспаления и рака, выживании опухолевых клеток и злокачественной прогрессии. Клинический интерес к S100 связан с применением его как маркёра повреждения мозга при травматических поражениях мозга, болезни Альцгеймера (S100Β, высвобождающийся из некротических тканей может усиливать нейродегенерацию путём S100Β-индуцированного апоптоза), субарахноидальных кровотечениях, инсультах и иных неврологических расстройствах; в мониторинге злокачественной меланомы, других неопластических заболеваний, а также воспалительных болезнях.
 Превышение пороговой величины теста при мониторировании лечения пациентов с меланомой можно ожидать, в среднем, в % — у пациентов без проявлений заболевания – в 5,5%; с региональными метастазами – в 12,5%; метастазами в коже/дистантных лимфоузлах – в 47,6%; дистантными/висцеральными метастазами – в 42,9% (по результатам последующего наблюдения). В контрольной группе здоровых людей превышение порога наблюдается у 4,9% (доверительный интервал 95%).
В случае выявления повышенного уровня S100 рекомендован повтор исследования в целях исключения ложноположительного результата и проведение соответствующих томографических исследований для повышения точности диагностики.
Взрослые пациенты с потенциальным повреждением мозга. Уровень S100 растёт в спинномозговой жидкости и высвобождается в кровь при различных клинических ситуациях. Измерение S100 при неврологических нарушениях сравнивают c измерением СРБ при системном воспалении. S100 может быть обнаружен у пациентов с повреждениями мозга разного происхождения, включая травматические повреждения или инсульт.
Превышение пороговой величины теста при мониторировании лечения пациентов с меланомой можно ожидать, в среднем, в % — у пациентов без проявлений заболевания – в 5,5%; с региональными метастазами – в 12,5%; метастазами в коже/дистантных лимфоузлах – в 47,6%; дистантными/висцеральными метастазами – в 42,9% (по результатам последующего наблюдения). В контрольной группе здоровых людей превышение порога наблюдается у 4,9% (доверительный интервал 95%).
В случае выявления повышенного уровня S100 рекомендован повтор исследования в целях исключения ложноположительного результата и проведение соответствующих томографических исследований для повышения точности диагностики.
Взрослые пациенты с потенциальным повреждением мозга. Уровень S100 растёт в спинномозговой жидкости и высвобождается в кровь при различных клинических ситуациях. Измерение S100 при неврологических нарушениях сравнивают c измерением СРБ при системном воспалении. S100 может быть обнаружен у пациентов с повреждениями мозга разного происхождения, включая травматические повреждения или инсульт.
Белок S100 | Клинико-диагностические лаборатории «ОЛИМП»
S100 – кальций-связывающий белок, находящийся в основном в клетках нервной ткани и клетках кожи (кератиноцитах). Свое название получил по первому упоминанию, как растворимый белок в 100% растворе сульфата аммония. Как и все белки выполняет ряд жизненно важных функций: структурную, транспортную, сократительную и пр. (см. «общий белок»). Следовательно, белок в небольшом количестве присутствует в крови любого здорового человека. Существует две основных причины патологического повышения концентрации S100 в крови:
(см. «общий белок»). Следовательно, белок в небольшом количестве присутствует в крови любого здорового человека. Существует две основных причины патологического повышения концентрации S100 в крови:
- Массивная гибель клеток нервной ткани и выход из них белка S100 в кровоток в большом количестве;
- Наличие в организме рака кожи меланомы, которая усиленно продуцирует S100.
Такая связь нервной системы и кожных покровов объясняется тем, что в эмбриональный период эти ткани развиваются из одного эктодермального ростка.
Исходя из причин повышения S100, клиническое значение данного анализа заключается в диагностики меланомы и заболеваний ЦНС, характеризующихся гибелью нервных клеток (инсульт, травма головного мозга, болезнь Крейтцфельда-Якоба, нейродегенерация).
Возможно незначительное повышения белка (до 0,4 мкг/л) S100 при некоторых заболеваниях легких, желудочно-кишечного тракта, мочеполовой сферы. Увеличение до 2,0 мкг/л наблюдается при очень тяжелой бактериальной инфекции.
При меланоме I степени количество S100 в крови обычно в пределах нормы, меланома II — III степени выявляется по данному онкомаркеру в 4-20 % случаев. При IV степени уровень S100 в крови повышен в 30-90% случаев.
Само по себе обнаружение S100 в крови не может стать поводом для постановки диагноза. Результат анализа направляет врача на дальнейшую тактику диагностики.
Большим значением анализа является возможность наблюдение за эффективности лечения и выявление рецидива заболевания. В этих случаях концентрация S100 будет изменяться в сравнении с уровнем до начала лечения.
Читайте также: «О чем могут рассказать онкомаркеры», «10 основных симптомов рака, о которых стоит знать»
Диагностика меланомы в Запорожье в МЦ «ШЕКИ, онкомаркер S-100
Белок S-100 является маркером некоторых онкологических заболеваний, ряда неврологических заболеваний, воспалительных процессов и патологий доброкачественной природы. На сегодняшний день, их изучено 25 разновидностей. Для диагностики онкопатологии кожи – меланомы белок S-100 является наиболее специфичным, но при более поздних стадиях. На ранней стадии меланомы, использование только этого маркера не дает истинных результатов.
На сегодняшний день, их изучено 25 разновидностей. Для диагностики онкопатологии кожи – меланомы белок S-100 является наиболее специфичным, но при более поздних стадиях. На ранней стадии меланомы, использование только этого маркера не дает истинных результатов.
В Запорожье сдать анализ на белок S-100
Когда назначается маркер белок S-100?
Данное исследование может назначаться врачами при:
- Подозрении на онкопатологию – меланому, рак яичников, молочной железы, мочевого пузыря, легких, яичка, предстательной железы, поджелудочной железы, желудка. Анализ используется в качестве одного из средств комплексного обследования пациента, поскольку не является специфическим маркером злокачественного процесса
-
При подозрении на неврологические нарушения в организме пациента – после черепно-мозговой травмы, после инсульта, при асфиксии новорожденного, при болезнях нейродегенеративного характера, например, Альцгеймера.

- При кардиологических нарушениях – сердечная недостаточность
- При ревматоидных заболеваниях, аутоиммунных заболеваниях
Референсные значения соответствуют 0 — 0,15 мкг/л. Изменение концентрации маркера свидетельствует о нарушениях работы организма.
Что означает, если уровень белка S-100 повышен?
Важно понимать, что данный биомаркер не является специфичным онкомаркером злокачественного процесса. К причинам повышения его концентрации можно отнести следующие:
- Наличие в организме злокачественной патологии, в особенности – меланомы. На II, III и IV стадиях заболевания, специфичность составляет 94%. Также данный маркер может повышаться при раке молочной железы, поджелудочной железы, легких, предстательной железы, яичника, мочевого пузыря, желудка.
- Болезни сердца
- Заболевания головного мозга
- Аутоиммунные заболевания и болезни ревматоидной природы
Что означает, если уровень белка S-100 снизился?
Если после проведения операции или терапии, уровень концентрации белка S-100 снизился, то этого говорит о том, что терапия выбрана правильно, а операция проведена успешно. Снижение белка может свидетельствовать и о болезни сердца высокой степени тяжести.
Снижение белка может свидетельствовать и о болезни сердца высокой степени тяжести.
Кто назначает данное исследование?
Исследование на определение белка S-100 может назначить врач общей практики, онколог, дерматолог, гинеколог, кардиолог, невропатолог, в зависимости от того, на предмет какого заболевания пациент наблюдается. Данное исследование, как правило, назначается с другими лабораторными исследованиями, а также аппаратными средствами диагностики.
Онкомаркеры
ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ АНАЛИЗА НА ОПРЕДЕЛЕНИЕ УРОВНЯ ОНКОМАРКЕРОВ
Онкомаркеры или выделяются самой опухолью, или соседними с опухолью клетками, или являются реакцией организма на наличие опухоли. Во многих случаях повышение уровня онкомаркеров происходит за несколько месяцев до появления первых симптомов опухолей, определяемых обычными методами исследования (рентген, УЗИ, МРТ).
Одной из особенностей анализов на онкомаркеры является то, что они не обладают достаточной специфичностью. Это означает, что один и тот же показатель может повышаться при опухолях различных органов. Кроме того, чувствительность показателей может быть неодинаковой при различных типах опухолей одного и того же органа. Поэтому для усиления качества диагностики на ранних стадиях наиболее эффективно применение комплекса различных онкомаркеров, так как чем больше данных, тем достовернее обследование. Не всегда повышение уровня онкомаркеров говорит о том, что в организме есть злокачественное заболевание. В некоторых случаях повышение сопровождает доброкачественные состояния. Но и тогда определение уровня онкомаркеров может быть полезным, потому что при увеличении показателя можно заподозрить нарушения в работе тех или иных органов.
Это означает, что один и тот же показатель может повышаться при опухолях различных органов. Кроме того, чувствительность показателей может быть неодинаковой при различных типах опухолей одного и того же органа. Поэтому для усиления качества диагностики на ранних стадиях наиболее эффективно применение комплекса различных онкомаркеров, так как чем больше данных, тем достовернее обследование. Не всегда повышение уровня онкомаркеров говорит о том, что в организме есть злокачественное заболевание. В некоторых случаях повышение сопровождает доброкачественные состояния. Но и тогда определение уровня онкомаркеров может быть полезным, потому что при увеличении показателя можно заподозрить нарушения в работе тех или иных органов.
В ЛАБОРАТОРИИ ВЫПОЛНЯЮТ:
Клинико-диагностическая лаборатория Центра располагает возможностью выявления онкомаркеров:
- РЭА (раково-эмбриональный антиген) / CEA
- АFР (АФП / Альфафетопротеин)
- hCG+b (В-ХГЧ / Хорионический гонадотропин бета субъединица)
- PSA (ПСА / Простатический специфический антиген)
- FPSA (ПСА св.
 / Простатический специфический антиген свободн.)
/ Простатический специфический антиген свободн.) - FPSA/ PSA (при заказе PSA и FPSA)
- СА 125 (РА 125)
- HE4 (Человеческий эпидидимальный протеин 4)
- ROMA (при заказе HE4 и СА 125)
- СА 15-3 (РА 15-3)
- S100
- СА 19-9 (РА 19-9)
- CA 72-4
- CA 21-1 (CYFRA)
- pro – GRP
ПОДГОТОВКА К АНАЛИЗУ
Правила подготовки пациента к сдаче крови на гормональный анализ
КАК СДАТЬ АНАЛИЗ КРОВИ
- В регистратуре заключить договор на оказание платных услуг (если есть направление от врача – показать медрегистратору)
- Оплатить счет в кассе РКМЦ или через ЕРИП
- Сдать анализ.
Материал для исследований принимается в плановом режиме (понедельник-пятница) с 8:00 до 10:00, результаты исследований доступны для врача и пациента с 15:00 в тот же день.
Белок S100
Референсные значения (вариант нормы):
| Параметр | Референсные значения | Единицы измерения |
|---|---|---|
| Белок S 100 (S100 protein) |
<0. 105 105
|
мкг/л |
Дискриминационный уровень*:
* Дискриминационный уровень (ДУ) – верхняя допустимая граница концентраций у здорового человека.
ВНИМАНИЕ! Следует помнить, что незначительное повышение концентрации многих онкомаркёров возможно при различных доброкачественных и воспалительных заболеваниях, физиологических состояниях. Поэтому выявление повышенного содержания того или иного онкомаркёра ещё не является основанием для постановки диагноза злокачественной опухоли, а служит поводом к дальнейшему обследованию.
| Повышение значений |
|---|
|
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Исследование уровня белка S-100 в сыворотке крови, цены в Нижнем Новгороде
Общая информация об исследовании
S100 – кальций-связывающий белок, находящийся в основном в клетках нервной ткани и клетках кожи (кератиноцитах). Свое название получил по первому упоминанию, как растворимый белок в 100% растворе сульфата аммония. Существует две основных причины патологического повышения концентрации S-100 в крови:
массивная гибель клеток нервной ткани и выход из них белка S-100 в кровоток в большом количестве;
наличие в организме рака кожи (меланомы), которая усиленно продуцирует S-100.
Такая связь нервной системы и кожных покровов объясняется тем, что в эмбриональный период эти ткани развиваются из одного эктодермального ростка.
Исходя из причин повышения S-100, клиническое значение данного анализа заключается в диагностики меланомы и заболеваний ЦНС, характеризующихся гибелью нервных клеток (инсульт, травма головного мозга, болезнь Крейтцфельда-Якоба, нейродегенерация).
Возможно незначительное повышения белка (до 0,4 мкг/л) S-100 при некоторых заболеваниях легких, желудочно-кишечного тракта, мочеполовой сферы. Увеличение до 2,0 мкг/л наблюдается при очень тяжелой бактериальной инфекции.
При меланоме I степени количество S-100 в крови обычно в пределах нормы, меланома II — III степени выявляется по данному онкомаркеру в 4-20 % случаев. При IV степени уровень S-100 в крови повышен в 30-90% случаев.
Большим значением анализа является возможность наблюдение за эффективностью лечения и выявление рецидива заболевания. В этих случаях концентрация S-100 будет изменяться в сравнении с уровнем до начала лечения.
Показания для назначения данного исследования:
- диагностика рецидивов меланомы и метастазов;
- контроль эффективности лечения меланомы;
- метод диагностики и мониторинга эффективности терапии при заболеваниях ЦНС.
Литература:
1. Брюс Э. Чебнэр, Томас Дж. Линч, Дэн. Э. Лонго. Руководство по онкологии. М.:- МЕДпресс-информ, 2011.
Э. Лонго. Руководство по онкологии. М.:- МЕДпресс-информ, 2011.
2. Давыдов М.И., Ганцев Ш.Х. Онкология. — М.: ГЕОТАР-Медиа, 2010.
3.Кишкун А.А. Иммунологические исследования и методы диагностики инфекционных заболеваний в клинической практике. — М.: ООО «Медицинское информационное агентство», 2009.
4. Кьюкир Д., Джиндджерелли Ф., Макари-Джадсон Г., МакКалло В. Диагностика и терапия онкологических заболеваний. — М.: Практическая медицина, 2012.
Онкомаркеры — Медицинский центр «Парацельс»
Выбрана услуга:
Выбор услуги специлиста Нажмите для выбора услугиВыбрать дату и адрес
Назад
Повторной считается консультация одного специалиста в течение 30 дней с даты предыдущего приёма. На 31-й день от предыдущего посещения специалиста данного профиля конультация будет первичной.
На 31-й день от предыдущего посещения специалиста данного профиля конультация будет первичной.
Serum S100 — маркер для мониторинга метастатической меланомы
Фон: Белки S100 — это низкомолекулярные кальций-связывающие белки, которые, по-видимому, играют важную роль в различных клеточных процессах, таких как деление и дифференцировка клеток. В гистопатологии S100 широко используется в качестве маркера выбора для иммуногистохимической идентификации злокачественной меланомы.Когда S100 был обнаружен в сыворотке пациентов со злокачественной меланомой, было высказано предположение, что сыворотка S100 может быть полезным маркером стадии заболевания.
Задача: Целью этого исследования было изучить сывороточные концентрации S100 у пациентов с различными стадиями злокачественной меланомы и определить значение сывороточного S100 при последующем наблюдении за пациентами с меланомой во время лечения.
Методы: Сыворотки были получены от 73 пациентов с меланомой на разных стадиях заболевания. Контрольную группу составили 130 здоровых людей. У 4 пациентов с метастатической меланомой уровень S100 в сыворотке измерялся серийно. Уровни в сыворотке измеряли с помощью имеющегося в продаже иммунорадиометрического анализа.
Полученные результаты: При этом только 1 из 25 пациентов I / II стадии и 3 из 14 пациентов с метастазами в лимфатические узлы (стадия III, 21.4%) показали определяемые уровни S100 в сыворотке, 27 из 34 пациентов с диссеминированным заболеванием (стадия IV, 79,4%) имели повышенный уровень S100 в сыворотке. Интересно, что повышение уровня S100 в сыворотке при серийном измерении указывало на прогрессирование заболевания, а полное снижение отражало ремиссию 2 пациентов.
Заключение: Эти данные подтверждают ценность сыворотки S100 как клинического маркера прогрессирования метастатической меланомы и серологического мониторинга во время системной терапии.
Сравнение сывороточных опухолевых маркеров S100 и активности ингибирования меланомы (MIA) при мониторинге пациентов с метастатической меланомой, получающих вакцинацию с помощью иммунотерапии дендритными клетками часто видели. Таким образом, помимо последующего клинического обследования и визуализации, необходимы надежные серологические опухолевые маркеры, специфичные для меланомы.Пациенты и методы: мы ретроспективно сравнили два сывороточных маркера меланомы, S100 и активность, ингибирующую меланому (MIA), для мониторинга пациентов с метастатической меланомой при адъювантной или терапевтической вакцинационной иммунотерапии дендритными клетками (DC).
 Сыворотка была получена в общей сложности у 100 пациентов (28 пациентов на стадии III и 72 пациента на стадии IV, по данным Американского объединенного комитета по раку 2002 г.) через регулярные промежутки времени во время терапии с последующей визуализацией.Результаты: при обнаружении рецидива оба маркера часто оставались в пределах нормы. Напротив, у пациентов с метастатическим поддающимся измерению заболеванием, получавших терапевтическую, а не адъювантную вакцинацию DC, повышение обоих маркеров было сильным индикатором прогрессирования заболевания. При сравнении обоих маркеров во всей исследуемой популяции MIA показала превосходную чувствительность для выявления прогрессирования заболевания. Заключение: S100 и MIA являются высокочувствительными опухолевыми маркерами для мониторинга пациентов с меланомой с текущими метастазами, но менее чувствительны для мониторинга пациентов без опухолей.В текущем исследовании MIA имел немного более высокую чувствительность для выявления прогрессирующего заболевания по сравнению с S100 и, по-видимому, более полезен для мониторинга пациентов с метастатической меланомой, получающих иммунотерапию.
Сыворотка была получена в общей сложности у 100 пациентов (28 пациентов на стадии III и 72 пациента на стадии IV, по данным Американского объединенного комитета по раку 2002 г.) через регулярные промежутки времени во время терапии с последующей визуализацией.Результаты: при обнаружении рецидива оба маркера часто оставались в пределах нормы. Напротив, у пациентов с метастатическим поддающимся измерению заболеванием, получавших терапевтическую, а не адъювантную вакцинацию DC, повышение обоих маркеров было сильным индикатором прогрессирования заболевания. При сравнении обоих маркеров во всей исследуемой популяции MIA показала превосходную чувствительность для выявления прогрессирования заболевания. Заключение: S100 и MIA являются высокочувствительными опухолевыми маркерами для мониторинга пациентов с меланомой с текущими метастазами, но менее чувствительны для мониторинга пациентов без опухолей.В текущем исследовании MIA имел немного более высокую чувствительность для выявления прогрессирующего заболевания по сравнению с S100 и, по-видимому, более полезен для мониторинга пациентов с метастатической меланомой, получающих иммунотерапию.
Обладая способностью распространяться на ранней стадии через лимфатических и гематогенных путей, меланома представляет собой одну из самых агрессивных солидных опухолей. Меланома с толщиной опухоли более 1 мм уже считается «высоким риском», и прогностическая ценность положительного статуса сторожевых лимфатических узлов была одобрена для этой группы пациентов (1-3).У пациентов с неоперабельными отдаленными метастазами ингибиторы киназ и антитела, блокирующие иммунные контрольные точки, увеличили общую выживаемость в клинических испытаниях и были одобрены для лечения метастатической меланомы (4-9). Вакцинационная иммунотерапия дендритными клетками (ДК) у пациентов с метастатической меланомой показала многообещающие результаты в клинических испытаниях (10-13).
Два опухолевых маркера обычно используются для мониторинга пациентов с меланомой: протеины S100 и активность, ингибирующая меланому (MIA).S100 представляет собой семейство кальций-связывающих белков, дифференциально экспрессируемых в большом количестве тканей (14). Они обнаруживаются как в цитозоле, так и вне клетки, но механизм секреции на сегодняшний день не идентифицирован (14). Не обладая ферментативной активностью, S100 в основном осуществляет свои кальций-зависимые сигнальные функции через эффекторные белки (15). У пациентов с меланомой S100, скорее всего, секретируется при повреждении клеток (16) и широко используется в иммуногистохимии (17). Hauschild et al. показал, что уровень S100 в сыворотке действительно коррелирует с клиническим течением у пациентов с меланомой на поздней стадии (18). Более того, немецкие руководящие принципы по меланоме рекомендуют измерение S100 в сыворотке у пациентов с меланомой (19), подчеркивая его надежность при последующем наблюдении за меланомой.
Они обнаруживаются как в цитозоле, так и вне клетки, но механизм секреции на сегодняшний день не идентифицирован (14). Не обладая ферментативной активностью, S100 в основном осуществляет свои кальций-зависимые сигнальные функции через эффекторные белки (15). У пациентов с меланомой S100, скорее всего, секретируется при повреждении клеток (16) и широко используется в иммуногистохимии (17). Hauschild et al. показал, что уровень S100 в сыворотке действительно коррелирует с клиническим течением у пациентов с меланомой на поздней стадии (18). Более того, немецкие руководящие принципы по меланоме рекомендуют измерение S100 в сыворотке у пациентов с меланомой (19), подчеркивая его надежность при последующем наблюдении за меланомой.
MIA представляет собой строго ограниченный белок, активно секретируемый клетками меланомы (20). Предполагается решающая роль МИА в отрыве опухолевых клеток от клеточного матрикса в процессе метастатического распространения (20).Как и S100, сывороточный уровень МИА представляет собой высокоспецифичный опухолевый маркер при меланоме (21).
Однако о превосходстве одного из этих двух сывороточных онкомаркеров над другим в мониторинге меланомы спорят спорно (21-25). Таким образом, в этом исследовании S100 и MIA сравнивались для мониторинга пациентов с метастатической меланомой, получающих вакцинационную иммунотерапию DC. Кроме того, была проанализирована чувствительность обоих сывороточных опухолевых маркеров к обнаружению рецидива заболевания в адъювантном режиме или уменьшения / увеличения опухолевой нагрузки у пациентов с измеримыми метастатическими заболеваниями.
Пациенты и методы
Мы ретроспективно проанализировали S100 и МИА в когорте из 100 пациентов с меланомой, получавших вакцинационную иммунотерапию ДК в период с 2002 по 2009 год (таблица I). Пациенты имели болезнь III или IV стадии по классификации Американского объединенного комитета по раку 2002 г. (26) (Таблица I). Иммунотерапия DC проводилась в рамках клинических испытаний (90 пациентов) (10, 27) или в качестве благотворительного использования (10 пациентов). Клинические испытания были одобрены соответствующим Комитетом по медицинской этике и регулирующими органами, и пациенты подписали письменные формы информированного согласия после подробного устного и письменного объяснения характера, значения и последствий лечения.Лечение начинали либо в адъювантной обстановке у пациентов без опухолей, либо в терапевтических условиях у пациентов с измеримыми и неоперабельными метастазами. Каждые три месяца выполнялась контрольная визуализация с магнитно-резонансной томографией мозга и компьютерной томографией шеи, грудной клетки и живота в дополнение к обследованию кожи всего тела и измерению сывороточных онкомаркеров S100 и MIA. При каждом последующем обследовании стадии (всего 688 событий) заболевание классифицировалось как стабильное, прогрессирующее или находящееся в стадии ремиссии.Прогрессирующее заболевание определялось как увеличение размера или количества метастазов; снижение этих показателей было определено как ремиссия заболевания. В анализ были включены только результаты стадирования с четкой тенденцией в отношении опухолевой нагрузки.
Клинические испытания были одобрены соответствующим Комитетом по медицинской этике и регулирующими органами, и пациенты подписали письменные формы информированного согласия после подробного устного и письменного объяснения характера, значения и последствий лечения.Лечение начинали либо в адъювантной обстановке у пациентов без опухолей, либо в терапевтических условиях у пациентов с измеримыми и неоперабельными метастазами. Каждые три месяца выполнялась контрольная визуализация с магнитно-резонансной томографией мозга и компьютерной томографией шеи, грудной клетки и живота в дополнение к обследованию кожи всего тела и измерению сывороточных онкомаркеров S100 и MIA. При каждом последующем обследовании стадии (всего 688 событий) заболевание классифицировалось как стабильное, прогрессирующее или находящееся в стадии ремиссии.Прогрессирующее заболевание определялось как увеличение размера или количества метастазов; снижение этих показателей было определено как ремиссия заболевания. В анализ были включены только результаты стадирования с четкой тенденцией в отношении опухолевой нагрузки. У здоровых пациентов каждый новый метастаз, обнаруживаемый клинически или с помощью вышеупомянутых визуализирующих исследований, считался прогрессирующим заболеванием.
У здоровых пациентов каждый новый метастаз, обнаруживаемый клинически или с помощью вышеупомянутых визуализирующих исследований, считался прогрессирующим заболеванием.
Лабораторный анализ. С 2002 г. по апрель 2004 г. S100 измеряли с помощью теста LIA-mat® Sangtec®100, двухэтапного анализа инкубации с двумя улавливающими и одним индикаторными антителами, как указано производителем (AB Sangtec Medical, Bromma, Швеция).Верхний нормальный предел составлял 0,15 мкг / л. Начиная с апреля 2004 г. уровни S100 определяли с помощью теста Elecsys® S100 в соответствии с инструкциями производителя (Roche Diagnostics, Mannheim, Germany). Верхний нормальный предел для S100 составлял 0,09 мкг / л до июня 2006 г. и 0,10 мкг / л после июня 2006 г. Уровни МИА измеряли с помощью набора для одноэтапного иммуноферментного анализа (ELISA) в соответствии с инструкциями производителя (Roche Applied Science®, Рош, Мангейм, Германия). Верхний нормальный предел для МВД был 10.0 нг / мл.
Таблица I.
Обзор исследуемых пациентов, классифицированных в соответствии с системой определения стадий Американского объединенного комитета по раку 2002 года (26).
Статистический анализ. Для анализа проявления заболевания у пациентов с метастатической меланомой, получающих адъювантную или терапевтическую вакцинационную иммунотерапию с помощью DC, были выполнены два отдельных анализа характеристик оператора-приемника (ROC) и рассчитана площадь под кривой (AUC). Доверительные интервалы для ROC AUC были проанализированы с использованием метода загрузочного ремня.Все статистические анализы были выполнены с использованием статистической программной среды R, версия 2.9.2. (R Core Team, Вена, Австрия)
Результаты
Пациенты, получавшие адъювантную вакцинационную иммунотерапию ДК (n = 32). В условиях адъювантной терапии уровни S100 и МИА в сыворотке крови были в пределах нормы у 31 и 30 пациентов, соответственно, из 32 пациентов в начале терапии. Последующие обследования и визуализация показали, что в общей сложности у 12 пациентов развился по крайней мере один новый метастаз при вакцинационной терапии. Когда был обнаружен первый новый метастаз, повышенное значение S100 или МИА наблюдалось у пяти пациентов (у двух было повышенное значение S100, у двух повышенное значение МИА и у одного пациента оба маркера были повышены). У этих пяти пациентов наблюдалось дальнейшее прогрессирование болезни и летальный исход. Когда рецидив заболевания был обнаружен у других семи пациентов с прогрессированием заболевания, оба опухолевых маркера оставались в пределах нормы. Ложноположительные повышенные опухолевые маркеры в адъювантных ситуациях были редкими: S100 был ложноположительным в 2 случаях.2% и МВД в 5,1% событий для заданных пороговых значений.
Когда был обнаружен первый новый метастаз, повышенное значение S100 или МИА наблюдалось у пяти пациентов (у двух было повышенное значение S100, у двух повышенное значение МИА и у одного пациента оба маркера были повышены). У этих пяти пациентов наблюдалось дальнейшее прогрессирование болезни и летальный исход. Когда рецидив заболевания был обнаружен у других семи пациентов с прогрессированием заболевания, оба опухолевых маркера оставались в пределах нормы. Ложноположительные повышенные опухолевые маркеры в адъювантных ситуациях были редкими: S100 был ложноположительным в 2 случаях.2% и МВД в 5,1% событий для заданных пороговых значений.
Пациенты, получающие терапевтическую вакцинацию иммунотерапией ДК (n = 68). Сывороточные опухолевые маркеры S100 и MIA были повышены у 34 и 31 пациента соответственно из 68 пациентов в начале лечения. Последующие обследования и визуализация показали повышенный уровень S100 и МИА у 58 и 55 пациентов соответственно. Средняя выживаемость в этой группе пациентов составила 431 день. Из 261 последующей временной точки стабильное заболевание наблюдалось в 106, тогда как прогрессирующее заболевание наблюдалось в 125, а ремиссия — в 30 временных точках.Из 30 пациентов с ремиссией заболевания 10 имели значения S100 в пределах нормы, 13 имели значения МИА в пределах нормы, а у семи пациентов оба маркера оставались в пределах нормы.
Из 261 последующей временной точки стабильное заболевание наблюдалось в 106, тогда как прогрессирующее заболевание наблюдалось в 125, а ремиссия — в 30 временных точках.Из 30 пациентов с ремиссией заболевания 10 имели значения S100 в пределах нормы, 13 имели значения МИА в пределах нормы, а у семи пациентов оба маркера оставались в пределах нормы.
Кривая характеристики оператора приемника (ROC) для опухолевых маркеров S100 и активности ингибирования меланомы (MIA) для обнаружения роста опухоли у пациентов с метастатической меланомой, получающих терапевтическую вакцинационную иммунотерапию дендритными клетками (n = 68). Площадь под кривой для MIA (0.797) выше по сравнению с S100 Roche (0,681) и немного ниже по сравнению с S100 Sangtec (0,807).
Чувствительность определения прогрессирования заболевания по увеличению сывороточных значений показана на кривой ROC (рис. 1). ROC AUC была выше для MIA (0,80), чем для S100, измеренная с помощью анализа Roche (0,68, рисунок 1; таблица II), и сравнима с ROC AUC, измеренная с помощью анализа Sangtec (0,81, рисунок 1; таблица II).
Общий анализ всей исследуемой популяции (n = 100). Был проведен общий анализ, включающий всех 100 пациентов, чтобы проверить чувствительность при различении пациентов без опухолей и пациентов с обнаруживаемыми метастатическими проявлениями (рис. 2). Результаты показывают, что AUC для MIA (0,784 и 0,725, соответственно) была выше, чем AUC для S100 (0,721 и 0,688, соответственно; Рисунок 2, Таблица III).
Обсуждение
В последние годы сравнительные исследования показали, что и S100, и MIA демонстрируют высокую чувствительность при стадировании и мониторинге пациентов с меланомой (21-25).Два исследования с участием 50 и 48 пациентов продемонстрировали более высокую чувствительность МИА по сравнению с S100 (22, 23). С другой стороны, было показано, что S100 демонстрирует более высокую чувствительность при обнаружении рецидивов заболевания у пациентов, получавших адъювантное лечение (24). Более того, в проспективном исследовании изменения обоих маркеров коррелировал с опухолевой массой у пациентов с запущенной стадией заболевания, но не превосходил лактатдегидрогеназу (25).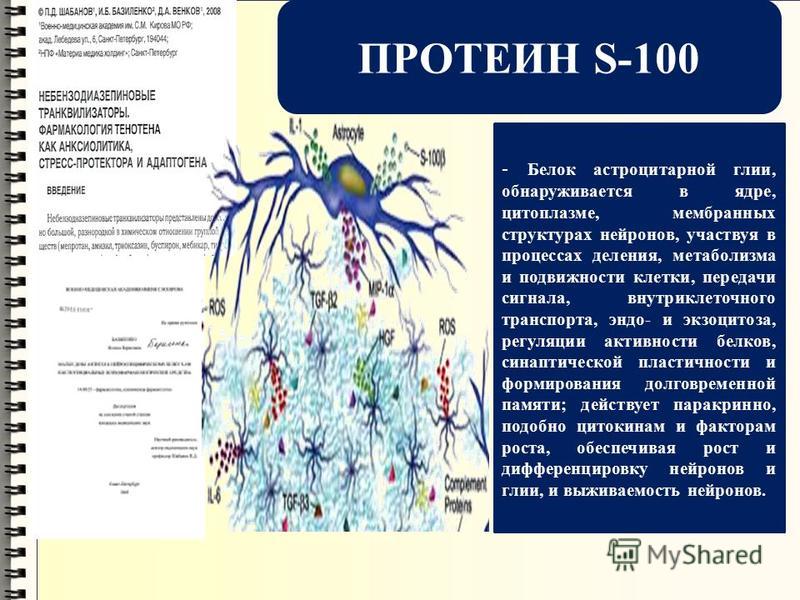
Площадь под кривой (AUC) характеристической кривой оператора приемника для обнаружения опухолевой прогрессии для маркеров опухоли S100 и активности ингибирования меланомы (MIA) с 5% и 95% доверительными интервалами начальной загрузки.Приведены данные для пациентов с метастатической меланомой, получавших терапевтическую вакцинационную иммунотерапию дендритными клетками (n = 68).
Таблица III.Площадь под кривой (AUC) характеристической кривой оператора приемника для обнаружения опухолевых маркеров S100 и активности ингибирования меланомы (MIA) с 5% и 95% доверительными интервалами начальной загрузки. Данные показаны для всей исследуемой популяции (n = 100).
В нашем исследовании и S100, и MIA продемонстрировали высокую чувствительность к меланоме.Это подтверждает выводы Auge et al. , где было показано, что S100 и MIA являются полезными маркерами, связанными с прогностическими факторами у пациентов с метастатической меланомой, будучи даже более эффективными при использовании в комбинации (29). Таким образом, когда наблюдается повышенное значение S100 или МИА в сыворотке крови у пациентов с меланомой без клинических проявлений, необходимо выполнить визуализацию, чтобы исключить отдаленные метастазы. Однако, исходя из наших результатов, чувствительность МИА при обнаружении опухоли кажется выше по сравнению с S100 (рис. 2).
Таким образом, когда наблюдается повышенное значение S100 или МИА в сыворотке крови у пациентов с меланомой без клинических проявлений, необходимо выполнить визуализацию, чтобы исключить отдаленные метастазы. Однако, исходя из наших результатов, чувствительность МИА при обнаружении опухоли кажется выше по сравнению с S100 (рис. 2).
У наших 68 пациентов с метастатической меланомой с поддающимся измерению заболеванием мы обнаружили значения в пределах нормы у 10 пациентов (только S100), у 13 пациентов (только MIA) и у 7 пациентов (оба маркера). Однако у большинства этих пациентов прогрессирование опухоли действительно было идентифицировано с высокой чувствительностью по возрастанию опухолевых маркеров. На кривой ROC для этих пациентов AUC для MIA была сопоставима или выше, чем для S100, что указывает на то, что MIA превосходит S100 (рис. 1).
Поскольку известно, что МИА подавляет пролиферацию иммунных клеток и цитотоксичность (28), он может коррелировать с индуцированной опухолью иммуносупрессией in vivo и с неэффективностью лечения, особенно у пациентов, получающих иммунотерапевтические препараты. Таким образом, необходимы исследования, сравнивающие уровни МИА с ответом на различные методы лечения, чтобы оценить МИА не только для мониторинга течения заболевания, но и в качестве прогностического маркера в иммунотерапии.
Таким образом, необходимы исследования, сравнивающие уровни МИА с ответом на различные методы лечения, чтобы оценить МИА не только для мониторинга течения заболевания, но и в качестве прогностического маркера в иммунотерапии.
Кривая характеристики оператора приемника (ROC) для опухолевых маркеров S100 с помощью двух анализов и активности ингибирования меланомы (MIA) для идентификации присутствия опухоли во всей исследуемой популяции (n = 100). С площадью под кривой 0,784 и 0,725 MIA превосходит S100 (0.721 и 0,688 соответственно).
В заключение, S100 и MIA показали высокую чувствительность и специфичность у наших пациентов с меланомой, получавших адъювантную или терапевтическую вакцинационную иммунотерапию с помощью DC. В условиях адъювантной терапии рецидив заболевания не всегда выявлялся по повышенному уровню S100 или МИА. С другой стороны, у пациентов с поддающимся измерению заболеванием и S100, и MIA показали корреляцию с клиническим течением у большинства пациентов. Однако клинические и визуальные исследования у этих пациентов до сих пор не выявлены.Сравнивая оба маркера, МИА показал более высокую чувствительность в обнаружении прогрессирующего заболевания по сравнению с S100 в нашем исследовании, и поэтому МИА, по-видимому, более полезен для наблюдения за пациентами, получающими иммунотерапию.
Благодарности
Этот проект был поддержан Немецким исследовательским фондом (DFG) через грант Центра совместных исследований SFB 643 (C1).
Сноски
↵ * Эти авторы имеют первое авторство.
Эта статья находится в свободном доступе в Интернете.
- Получено 26 июня 2017 г.
- Исправление получено 11 июля 2017 г.
- Принято 12 июля 2017 г.
- Авторские права © 2017, Международный институт противораковых исследований (д-р Джордж Дж. Делинасиос), Все права защищены
Прогностическая ценность концентрации S-100-β в сыворотке крови у пациентов с увеальной меланомой | Дерматология | JAMA Офтальмология
Фон При кожной меланоме уровень S-100-β в сыворотке распознается как маркер метастатического заболевания.
Цели Определить, присутствует ли S-100-β в сыворотке пациентов с увеальной меланомой, и проверить, связана ли концентрация S-100-β в сыворотке с известными клиническими и гистопатологическими прогностическими факторами у этих пациентов.
Методы Концентрацию S-100-β измеряли в образцах сыворотки, собранных у 64 пациентов с увеальной меланомой до энуклеации и у 58 здоровых контрольных субъектов. Двухсайтовый иммунолюминометрический анализ использовали для количественного определения концентрации S-100-β в сыворотке.Концентрации S-100-β в сыворотке крови пациентов сравнивали с клинико-патологическими переменными опухоли, полом, наличием метастазов и выживаемостью.
Результаты Тридцать семь (57,8%) из 64 пациентов с увеальной меланомой показали определяемые уровни сывороточного S-100-β. Однако не было существенной разницы между уровнями сыворотки пациентов и контрольных субъектов ( P = 0,71). Статистический анализ не показал значимой корреляции между концентрацией S-100-β и какими-либо клинико-патологическими переменными опухоли, наличием метастазов или выживаемостью.Только пол коррелировал с уровнями S-100-β в сыворотке, чего не наблюдалось в контрольной группе.
Выводы В нашем исследовании пациентов с увеальной меланомой концентрация S-100-β в сыворотке не коррелировала с каким-либо исследованным прогностическим фактором и сама по себе не имела прогностического значения. У пациентов женского пола концентрация S-100-β была выше, чем у пациентов мужского пола.
S-100 ЯВЛЯЕТСЯ БЕЛКОМ, который экспрессируется в нервной ткани, нормальных меланоцитах и злокачественной меланоме. 1 , 2 В 1980 году Gaynor et al. 3 сообщили, что клетки кожной меланомы способны секретировать растворимую форму S-100. Было показано, что при кожной злокачественной меланоме сывороточная концентрация белка S-100 и его субъединицы S-100-β коррелирует с клинической стадией, прогнозом и выживаемостью. 4 -16
БелокS-100, кислый белок 21 кДа с кальций-связывающими свойствами, представляет собой димерный белок, состоящий из 2 субъединиц, α и β, с возможными комбинациями αα, αβ и ββ.S-100-β представляет собой гомодимер ββ. 17 , 18 S-100 присутствует в цитоплазме и нуклеоплазме клеток; это может происходить в мембраносвязанной форме или секретироваться. 3 , 19 Сообщалось, что S-100 играет роль в цитоскелетных системах, таких как микротрубочки и микрофиламенты. 2 Было высказано предположение, что присутствие S-100 может играть важную роль в клеточном цикле и разборке цитоплазматических микротрубочек. 2 , 20 , 21
Cochran et al., , 22, сообщили об иммуногистохимической экспрессии S-100 в глазных меланомах, при которых 80% опухолевых клеток содержали S-100 в своей цитоплазме.Позже Kan-Mitchell и его коллеги 23 показали с помощью полимеразной цепной реакции, что S-100-β экспрессируется в увеальной меланоме. Cochran и соавторы 24 исследовали уровень белка S-100 в глазных жидкостях и экстрактах глазных опухолей, но обнаружили, что количественное определение в глазных жидкостях при увеальной меланоме имеет ограниченное применение в качестве диагностического инструмента.
Насколько нам известно, пока нет сообщений об уровнях S-100-β в сыворотке крови у пациентов с меланомой глаза. Используя чувствительный тест на S-100-β, мы определили сывороточные концентрации S-100-β у пациентов с увеальной меланомой и коррелировали данные с клинико-патологическими переменными опухоли, полом, наличием метастазов и выживаемостью.
Пациенты и испытуемые
Образцы сыворотки были получены от 64 последовательных пациентов (32 мужчины и 32 женщины) с диагнозом «внутриглазная увеальная меланома», которые наблюдались в нашей офтальмологической онкологической службе с 9 ноября 1988 г. по 4 июля 1997 г. Сыворотка была собрана до энуклеации глаза. и замораживали при -80 ° C до анализа.На момент постановки диагноза ни у одного из пациентов не было метастазов. Средний период наблюдения после энуклеации составил 60 месяцев (диапазон от 1 до 160 месяцев).
Ткани опухоли были классифицированы гистопатологически и показали, что в 50 из 64 случаев увеальная меланома располагалась в сосудистой оболочке, в 3 случаях — в цилиарном теле, в 10 случаях — в сосудистой оболочке и цилиарном теле и в 1 случае — в радужной оболочке.
В качестве контроля сыворотка была получена от 58 здоровых людей (41 мужчина и 17 женщин), добровольно сдавших кровь для этого исследования. 10 Исследование было проведено в соответствии с Хельсинкской декларацией, информированное согласие было получено от всех пациентов и контрольной группы.
АНАЛИЗ БЕЛКА S-100-β
Уровни S-100-β в сыворотке были определены в Нидерландском онкологическом институте. 10 Концентрацию S-100-β определяли с использованием моноклонального двухсайтового иммунолюминометрического анализа (LIA-mat Sangtec 100; AB Sangtec Medical, Bromma, Швеция).Установлен предел обнаружения 0,02 мкг / л. Диапазон измерения до 20 мкг / л.
КонцентрацииS-100-β сравнивали с гистопатологическими переменными опухоли, полом и частотой метастазов. На основе распределения в контроле уровни S-100-β в сыворотке были разделены на 3 категории для анализа выживаемости: <0,02, 0,02-0,06 и> 0,06 мкг / л.
Для статистического анализа использовалинепараметрических критериев Манна-Уитни и Крускала-Уоллиса, а кривую выживаемости строили по методу Каплана-Мейера.
В 34 (58,6%) проб сыворотки от 58 здоровых добровольцев уровень S-100-β был выше уровня обнаружения, а в 14 (24,1%) превышен уровень 0,06 мкг / л. Среди образцов от пациентов 37 (57,8%) из 64 образцов сыворотки имели определяемые уровни S-100-β, а 17 (26,6%) были выше 0,06 мкг / л. Разница между пациентом и контрольной группой не была статистически значимой ( P = 0,71).
Среднее значение было 0.03 мкг / л для контроля и 0,04 мкг / л для пациентов ( P = 0,71). Поскольку мы наблюдали высокие значения S-100-β в сыворотке крови у некоторых пациентов, мы проанализировали, существует ли корреляция между концентрацией S-100-β в сыворотке и клинико-патологическими переменными (Таблица 1). Переменные, показанные в таблице 1, включая диаметр опухоли и степень выраженности, не показали значительной корреляции с S-100-β, за исключением пола пациентов. У пациентов женского пола концентрация S-100-β в сыворотке была значительно выше, чем у пациентов мужского пола; мы не обнаружили такой разницы в наших контролях (таблица 2).
Кроме того, мы сравнили уровни S-100-β у пациентов, у которых развились отдаленные метастазы, и у тех, у кого их не было. Таблица 3 не показывает значимых различий между этими группами ( P = 0,96). Более того, 55% (11/20) пациентов с метастазами по сравнению с 59,1% (26/44) пациентов без метастазов показали определяемые уровни S-100-β ( P = 0,95). Наконец, мы сравнили время выживания между пациентами, имеющими уровни S-100-β выше и ниже 0,06 мкг / л, потому что предыдущие исследования 5 -16 показали, что при меланоме кожи высокие уровни экспрессии коррелируют с метастазами и худшим прогнозом.Среднее время выживания составляло 5 лет. Кривая выживаемости (рисунок 1) показывает, что пациенты с более высокими уровнями S-100-β (> 0,06 мкг / л) не имели более низкой выживаемости по сравнению с пациентами с более низкими уровнями S-100-β в сыворотке (логарифмический ранг ). P = 0,70).
Такие методы, как офтальмоскопия, флюоресцентная ангиография и ультразвуковое исследование, в большинстве случаев достаточно точны для диагностики увеальной меланомы. Однако в некоторых случаях, таких как неэкссудативная неопластическая отслойка или регматогенная отслойка сетчатки с ассоциированной субретинальной кровью, идентификация внутриглазной меланомы может быть затруднена.Следовательно, был бы желателен сывороточный маркер, чтобы отличать эти меланомы от доброкачественных состояний с аналогичным внешним видом. Кроме того, может быть полезно иметь маркер в сыворотке, который помогает обнаруживать метастазы на ранней стадии.
В этом исследовании мы исследовали прогностическое значение сывороточного S-100-β при увеальной меланоме. Поскольку увеальная меланома, как и меланома кожи, происходит от нервного гребня, те же переменные, которые используются в иммуногистохимическом и серологическом анализах, могут быть полезны для диагностики и прогноза заболеваний.В более ранних исследованиях 5 -16,25 , 26 метастатической злокачественной кожной меланомы уровни S-100-β в сыворотке коррелировали с течением заболевания и продолжительностью жизни. Только одно исследование 27 показало, что диагностическая ценность сывороточных уровней S-100-β недостаточна, чтобы считаться прогностическим фактором меланомы кожи. S-100-β может быть обнаружен в сыворотке с помощью иммунорадиометрического анализа и люминесцентного иммуноанализа. Последний тест доступен с 1997 года и имеет более низкий предел обнаружения по сравнению с иммунорадиометрическим анализом (0.02 против 0,20 мкг / л). Используя люминесцентный анализ S-100-β на злокачественной меланоме, Bonfrer et al. 10 подтвердили значительную корреляцию между стадией и заболеванием меланомы кожи. Кроме того, они обнаружили, что 85% пациентов с метастатическим заболеванием имели повышенные уровни S-100-β.
Хотя в целом существует положительная значимая корреляция между уровнями S-100-β в сыворотке и наличием меланомы кожи, мы не обнаружили такой корреляции для меланомы глаза в этом исследовании.При кожной меланоме была обнаружена корреляция между толщиной опухоли и уровнями S-100-β в сыворотке. 13 Однако ни один из гистопатологических данных в нашем исследовании не показал корреляции с S-100-β. Неожиданным открытием является значительная разница в уровнях S-100-β в сыворотке между пациентами мужского и женского пола, для которой у нас нет объяснения. Наши данные показывают, что определение уровня S-100-β не помогает определить прогноз у пациентов с увеальной меланомой.
Автор, ответственный за переписку: Гай С.О. А. Миссоттен, доктор медицины, отделение офтальмологии, Медицинский центр Лейденского университета, а / я 9600, 2300 RA Лейден, Нидерланды (электронная почта: [email protected]).
Отправлено к публикации 4 апреля 2002 г .; окончательная доработка получена 7 марта 2003 г .; принята к печати 26 марта 2003 г.
Мы благодарим Rotterdamse Vereniging Blindenbelangen, Роттердам, Нидерланды, Gelderse Blinden Vereniging, Арнем, Нидерланды, и Stichting Blinden-Penning, Амстердам, Нидерланды, за их поддержку.
1. Стефанссон KWollmann Р.Еркович Белок M S-100 в опухолях мягких тканей, происходящий из шванновских клеток и меланоцитов. Am J Pathol. 1982; 106261-268PubMedGoogle Scholar2.Baudier JBriving CDeinum Дж. Хаглид KSörskog LWallin M Влияние белков S100β и кальмодулина на вызванную Ca 2+ разборку белков микротрубочек мозга in vitro. FEBS Lett. 1982; 147165-167PubMedGoogle ScholarCrossref 3.Гейнор RIrie RMorton DHerschman Белок HR S100 присутствует в культивируемых злокачественных меланомах человека. Природа. 1980; 286400-401PubMedGoogle ScholarCrossref 4.Fagnart OCSindic CJLaterre C Иммуноферментный анализ белка S100 в сыворотке крови. Clin Chem. 1988; 341387-1391PubMedGoogle Scholar5.Von Schoultz EHansson LODjureen E и другие. Прогностическое значение сывороточных анализов белка S-100 β при злокачественной меланоме. Melanoma Res. 1996; 6133-137PubMedGoogle ScholarCrossref 6.Guo HBСтоффель-Вагнер BBierwirth TMezger Дж. Клингмюллер D Клиническое значение сыворотки S100 при метастатической злокачественной меланоме. Eur J Cancer. 1995; 31A924- 928PubMedGoogle ScholarCrossref 8.Schultz ESDiepgen TLVon Den Driesch P Клиническая и прогностическая значимость сывороточного белка S-100 β при злокачественной меланоме. Br J Dermatol. 1998; 138426-430PubMedGoogle ScholarCrossref 9.Hansson Ловон Шульц ЭДджурин EHansson JNilsson BRingborg U Прогностическое значение анализов сыворотки на белок β S-100 при злокачественной меланоме. Anticancer Res. 1997; 173071-3073PubMedGoogle Scholar11.Kärnell Рвон Шульц EHansson LONilsson BArstrand KKågedal Белок B S100β, 5-S-цистеинилдопа и 6-гидрокси-5-метоксииндол-2-карбоновая кислота в качестве биохимических маркеров прогноза выживаемости у пациентов со злокачественной меланомой. Melanoma Res. 1997; 7393-399PubMedGoogle ScholarCrossref 12.Hauschild AMichaelsen JBrenner W и другие. Прогностическая значимость обнаружения S100β в сыворотке по сравнению с обычными параметрами крови у пациентов с запущенной метастатической меланомой. Melanoma Res. 1999; 9155-161PubMedGoogle ScholarCrossref 13. Карри ЛЮ MHersey P Оценка анализов S-100β для прогнозирования рецидива и прогноза у пациентов с меланомой I-III стадии AJCC. Melanoma Res. 1999; 9557-567PubMedGoogle ScholarCrossref 14.Schmitz CBrenner WHenze EChristophers Э.Хаушильд Сравнительное исследование клинического использования протеина S-100β и MIA (активность ингибирования меланомы) у пациентов с меланомой. Anticancer Res. 2000; 205059-5063PubMedGoogle Scholar15.Mårtenson Э Джурин Ханссон LONilsson B и другие. Белок S-100β в сыворотке крови как прогностический маркер злокачественной меланомы кожи. J Clin Oncol. 2001; 19824-831PubMedGoogle Scholar16.Bonfrer JMKorse CM Мониторинг злокачественной меланомы с помощью онкомаркера S-100β. Последние результаты Cancer Res. 2001; 158149-157PubMedGoogle Scholar18.Isobe TTsugita AOkuyama T Аминокислотная последовательность и субъединичная структура белка S-100 бычьего мозга (PAP I-β). J Neurochem. 1978; 30921-923PubMedGoogle ScholarCrossref 19.Sobue К.Моримото KKanda K и другие.Ca 2+ -зависимое связывание [ 3 H] кальмодулина с микросомальной фракцией мозга. J. Biochem. 1982;3-1320PubMedGoogle Scholar20.Marks APetsche ДО’Хэнлон D и другие. Экспрессия белка S100 в клетках меланомы человека. Exp Cell Res. 1990; 18759-64PubMedGoogle ScholarCrossref 21. Сорчи GAgneletti ALDonato R Влияние S100α1 и S100β на стабильность микротрубочек. Неврология. 2000; 99773-783PubMedGoogle ScholarCrossref 22.Кокран AJHolland GNWen DR и другие. Обнаружение цитоплазматического белка S-100 в первичных и метастатических внутриглазных меланомах. Invest Ophthalmol Vis Sci. 1983; 241153-1155PubMedGoogle Scholar23.Kan-Mitchell JLiggett ПЭТейлор CR и другие. Дифференциальная экспрессия S100 β в меланоме хориоидеи и кожи: количественное определение с помощью полимеразной цепной реакции. Invest Ophthalmol Vis Sci. 1993; 343366-3375PubMedGoogle Scholar24.Кокран AJHolland GNSaxton RE и другие. Обнаружение и количественное определение белка S-100 в тканях и жидкостях глаза пациентов с внутриглазной меланомой. Br J Ophthalmol. 1988; 72874-879PubMedGoogle ScholarCrossref 25.Henze GDummer Ржоллер-Емелька HIBoni RBurg G Serum S100: маркер для мониторинга метастатической меланомы. Дерматология. 1997; 194208-212PubMedGoogle ScholarCrossref 26.Bonfrer JMKorse CMIsraels SP Serum S-100 имеет прогностическое значение при злокачественной меланоме. Anticancer Res. 1997; 172975-2977PubMedGoogle Scholar27.Buer JProbst М.Францке А и другие. Повышенный уровень S100 в сыворотке и выживаемость при метастатической злокачественной меланоме. Br J Рак. 1997; 751373-1376PubMedGoogle ScholarCrossrefРоль сыворотки S100B и ПЭТ-КТ в динамическом наблюдении за пациентами с меланомой кожи | BMC Cancer
Поскольку прогноз пациентов с CM определяется степенью метастатического заболевания, исследования биомаркеров сыворотки и визуализации с использованием методов радиографии и ядерной медицины являются важным компонентом оценки пациента [7].
Почти 10 лет назад исследователи предположили, что измерение S100B после первичной местной хирургической терапии может позволить раннее распознавать прогрессирование заболевания. Было также высказано предположение, что увеличение S100B с последующим сканированием с помощью позитивной эмиссионной томографии (ПЭТ) и соответствующего лечения может привести к увеличению продолжительности жизни пациентов с CM [9]. Несмотря на то, что было показано, что уровни S100B коррелируют со стадией заболевания, степенью метастатического распространения и прогрессирования заболевания, ценность его измерения для последующего наблюдения все еще остается спорной.Это особенно актуально для ранних стадий заболевания. Сообщалось, что диагностическая чувствительность сыворотки S100B у пациентов с ХМ I и II стадии составляет 15% или меньше по сравнению с чувствительностью 60-85% для ХМ стадии IV. Для пациентов с регионарными метастазами чувствительность колеблется от 10% до 50% [1, 7].
Мы проанализировали группу из 115 пациентов, которым была назначена ПЭТ-КТ из-за повышенного значения S100B в сыворотке (33 пациента) или клинических признаков прогрессирования заболевания, обнаруженных во время регулярного наблюдения (82 пациента).В нашем исследовании пациенты с I или II стадией CM имели 51,8% чувствительность и 50,0% специфичность S100B. PPV S100B для этой группы пациентов составлял 80,0%, а NPV — только 21,2%. Аналогичное исследование, проведенное в 2002 году, показало чувствительность от 3% до 9% для стадий I и II. В исследовании описано, что PPV составляет 17% для стадии I и 37% для стадии II, а специфичность составляет 92%. На основании этого авторы пришли к выводу, что S100B не может быть надежным маркером распространения болезни на ранних стадиях [10].
Чувствительность повышенного сывороточного S100B для всей группы пациентов (115 человек) независимо от стадии заболевания в нашем исследовании составила 50.0%, специфичность 47,6%, PPV 81,0% и NPV 17,5%. В исследованиях, в которых участвовали пациенты с наличием или отсутствием клинических симптомов, чувствительность составила 38% с PPV 93% и 37% соответственно [10, 11]. Наши результаты для всей группы пациентов не сильно отличались от результатов для группы пациентов с I или II стадией, что могло свидетельствовать о том, что успешное использование маркера не обусловлено стадией заболевания. Чувствительность и специфичность теста в британском исследовании составила 74% и 87% с PPV 87% и NPV 76% для группы пациентов независимо от стадии CM.Они предположили, что S100B может точно отражать активность заболевания во время отбора проб. Неожиданным открытием этого исследования было то, что этот вывод неверен при наличии церебральных метастазов, даже если были задействованы дополнительные органы [12].
Другие авторы наблюдали, что расположение метастазов влияет на уровень S100B. Авторы сообщают, что от 41 до 68% пациентов с болезнью III стадии не имеют повышенного маркера сыворотки [11, 13-15]. В нашем исследовании 50.0% пациентов с метастазами, ограниченными лимфатическими узлами, и 42,9% пациентов с отдаленными метастазами не имели повышенного уровня сывороточного маркера. Результат может быть следствием меньшей опухолевой нагрузки в случае болезни III стадии, как это было предложено другими [13, 15]. Другая возможность заключается в том, что первичные опухоли имеют разные паттерны экспрессии белка S100B. В случае метастатического заболевания уровни сыворотки будут зависеть от способности клеток CM производить сывороточный маркер, что объясняет ложноотрицательные результаты в случае отдаленных метастазов [12, 13].
Сравнение повышенных уровней сывороточного S100B из разных исследований имеет одно серьезное препятствие, а именно, исследователи используют разные иммуноанализы с немного разными пороговыми значениями сывороточного S100B. Было проведено сравнение различных анализов, используемых в клинической практике, и было определено, что корреляция между анализами является удовлетворительной с индексом корреляции 0,9 или выше для большинства анализов. Тем не менее, данные анализов с использованием раствора бычьего мозга и данных, стандартизированных для человеческого рекомбинантного S100B, не могут быть наложены друг на друга.Также возникают трудности при сравнении верхних пороговых значений в диапазоне от 0,09 до 0,13 мкг / л, что указывает на необходимость международного соглашения в отношении использования единых эталонных стандартов для успешного сравнения различных исследований [16].
Всем пациентам в нашем исследовании была назначена расширенная ПЭТ-КТ всего тела. У одиннадцати пациентов (11/115, 9,5%) был повышенный уровень S100B, но метастазов не было обнаружено ни при ПЭТ-КТ, ни при клиническом наблюдении. Количество зарегистрированных ложноположительных результатов S100B в других исследованиях колеблется от 17 до 41% случаев [15].Есть несколько возможных объяснений ложноположительных результатов. Повышенные уровни S100B наблюдались после травм головы и инсульта и могут отражать травму головного мозга или дисфункцию гематоэнцефалического барьера. Значительно более высокие уровни в сыворотке крови могут быть обнаружены у пациентов с циррозом печени или почечной недостаточностью [15]. Интересно, что 25% здоровых людей также могут иметь повышенный уровень S100B, что можно объяснить повышенным уровнем S100B в сыворотке, измеренным после воздействия УФ-В у некоторых людей [17].
Основным ограничением нашего исследования является то, что пациенты были назначены на ПЭТ-КТ на основании повышенного S100B или клинического подозрения на прогрессирование заболевания, что представляет собой систематическую ошибку отбора, влияющую на NPV и специфичность S100B. Опубликованные ретроспективные исследования также описывают группы пациентов, обследованных с помощью ПЭТ-КТ в связи с повышенным уровнем S100B, и сообщают о подобной систематической ошибке [15]. Наша группа пациентов была выбрана, потому что мы были заинтересованы в клинической ценности измерений S100B в сочетании с ПЭТ-КТ во время регулярного наблюдения.Исследование, опубликованное Aukema, сосредоточено на пациентах с нормальными результатами физикального обследования и повышенным уровнем S100B в сыворотке. При значении отсечения, аналогичном используемому нами, PPV S100B, как сообщается, составляет 50%. Наблюдаемый нами PPV составил 69,7%. Чувствительность и PPV обоих исследований доказывают, что измерение S100B в сыворотке является полезным, но не идеальным методом наблюдения за всеми пациентами с CM [18].
Чувствительность ПЭТ-КТ в нашем исследовании составила 98,9% при специфичности 90,4% для всей группы пациентов и 100% при 90.Специфичность 0% при отсутствии клинических признаков. Сопутствующий PPV составил 97,8% в первой группе и 95,8% в подгруппе пациентов. Aukema сообщила о чувствительности 100%, специфичности 83%, PPV 85% и NPV 100% [18]. Роль ПЭТ-КТ в ведении пациентов с ХМ быстро развивалась. Было показано, что ПЭТ-КТ позволяет более точно определять стадию отдаленных метастазов, чем только ПЭТ или КТ (98% по сравнению с 93% и 84% соответственно), и более точна при диагностике метастазов в лимфатических узлах (98% по сравнению с 86%). ) [7, 15].Диагностика метастазов с помощью ПЭТ-КТ в целом более точна, чем только КТ или МРТ, и в то же время предоставляет ценную информацию хирургу, планирующему оперативную процедуру [7, 18]. Из 95 пациентов, у которых на ПЭТ-КТ были диагностированы подозрительные поражения, у двоих оказался ложноположительный результат (2,1%). Другие авторы также сообщают о ложноположительных результатах [15, 18]. В нашем исследовании одним ложноположительным результатом был случай поражения диаметром 1 см с подозрением на метастазирование. В недавнем отчете, описывающем стадию КМ, было заявлено, что чувствительность ПЭТ-КТ наиболее высока для метастазов диаметром> 1 см, и признано, что в случае меланомы чувствительность метода снижается, когда диаметр опухоль меньше 6 мм [7, 8].Во втором ложноположительном результате ПЭТ-КТ тщательное изучение истории болезни пациента выявило хроническую рану в месте повышенного поглощения ФДГ. Известно, что повышенное поглощение наблюдается не только при неопластических поражениях, но также при грануляционной ткани, инфекции и других воспалительных процессах. Для успешного использования ПЭТ-КТ необходимо оценить размер и интенсивность аномального очагового накопления ФДГ с анамнезом пациента и физическим осмотром [8].
Из-за короткого периода наблюдения мы не исследовали, как результаты регулярных измерений сывороточного S100B и последующего ПЭТ-КТ влияют на общую выживаемость наших пациентов.Известно, что повышенные уровни S100B связаны с прогнозом и выживаемостью пациентов с ХМ. Метаанализ двадцати двух статей, опубликованных до 2008 г., подтвердил, что S100B является независимым прогностическим фактором выживаемости с особым вниманием к пациентам со стадиями I-III [5]. При запущенном заболевании повышенные уровни S100B также демонстрируют сильную корреляцию со снижением выживаемости, поскольку пациенты со стадией III или IV болезни и низким уровнем S100B показали статистически значимое преимущество в выживаемости по сравнению с пациентами с повышенным маркером опухоли [1, 15].Еще предстоит выяснить, может ли ПЭТ-КТ выступать в качестве независимого прогностического фактора [15].
Мы подтвердили метастазы у 20,0% пациентов на основании повышения уровня S100B в сыворотке как единственного предшествующего признака прогрессирования заболевания (23/115). Поскольку анализ сывороточного S100B показал наивысшую чувствительность и специфичность из всех онкомаркеров, исследованных при CM, и он является относительно недорогим, многие клиницисты включают его измерение в рутинное наблюдение за пациентами с CM [7, 19]. В случае мониторинга прогрессирования заболевания повышение уровня сывороточного S100B считается специфическим и чувствительным маркером рецидива заболевания, который может обнаруживать метастазы за 5–23 недели до других клинических и радиологических методов.Во время планового наблюдения повышенные уровни S100B были отмечены за 6 месяцев до того, как УЗИ и рентген грудной клетки смогли выявить диссеминированное заболевание [1]. Сыворотка S100B может использоваться в качестве маркера прогрессирования заболевания, что вместе с последующей ПЭТ-КТ позволяет врачам ранней диагностики метастазов во время регулярного наблюдения.
Если есть реальная польза от тщательно спланированного графика последующего наблюдения для пациентов с CM, еще предстоит выяснить. Исследование, проведенное немецкими учеными, доказало увеличение времени выживания при обнаружении метастазов на ранней стадии развития, помимо эффекта смещения времени заблаговременности.А именно, 10-летняя общая вероятность выживаемости была значительно увеличена для пациентов с метастазами ранней фазы [20].
Онкомаркеры — Knowledge @ AMBOSS
Последнее обновление: 23 августа 2021 г.
Резюме
Онкомаркеры — это биологические вещества, которые могут быть обнаружены в крови, моче или тканях некоторых пациентов с опухолями. Хотя некоторые опухолевые маркеры могут помочь в диагностике рака, они в основном используются для мониторинга реакции на лечение и выявления рецидива рака.Опухолевые маркеры не являются надежными скрининговыми или диагностическими маркерами из-за их низкой чувствительности (т. Е. Не повышается у всех онкологических больных) и низкой специфичности (т. Е. Также повышается у доброкачественных, доброкачественных заболеваний или у здоровых пациентов). Большинство онкомаркеров, используемых в клинических условиях, можно обнаружить в крови. Ряд опухолевых маркеров можно обнаружить при гистопатологии тканей. Их также называют иммуногистохимическими маркерами, и их можно обнаружить с помощью иммуногистохимических методов.Генные мутации и паттерны экспрессии генов также все чаще используются в качестве маркеров опухолей.
Подробную информацию о конкретных карциномах и соответствующих онкомаркерах см. В отдельных статьях о раке.
Обзор
- Определение: вещества (гормоны, ферменты, антигены, иммуноглобулины, гликопротеины), которые могут быть обнаружены в крови, моче или тканях тела некоторых онкологических больных
- Клиническое применение
- Обнаружить рак (не подтверждает диагноз!)
- Прогнозировать терапевтические реакции
- Следите за эффективностью лечения рака
- Выявление рецидива рака и скрининг
- Ограничения
- Не у всех онкологических больных повышены онкомаркеры (низкая чувствительность).
- Не все пациенты с повышенными онкомаркерами болеют раком! (низкая специфичность)
Онкомаркеры обычно не используются для скрининга или диагностики рака.Однако после того, как рак был диагностирован с помощью биопсии, онкомаркеры можно использовать для прогнозирования терапевтического ответа и мониторинга эффективности лечения рака.
Каталожные номера: [1] [2] [3] [4] [5]
Общие онкомаркеры периферической крови
«Альфа-самец, он является ЧЕЛОВЕКОМ»: к ракам, связанным с альфа-фетопротеином, относятся гепатоцеллюлярная карцинома, опухоль энтодермального синуса (опухоль желточного мешка), смешанная опухоль зародышевых клеток, атаксия-телеангиэктазия и дефекты нервной трубки.
β-ХГЧ: пузырный занос, хориокарцинома и гестационная трофобластическая болезнь связаны с маркером
Генные мутации и изменения в экспрессии генов
Аномальные паттерны экспрессии генов и генные мутации в образцах тканей все чаще используются в качестве маркеров опухолей.
Артикул: [8]
Иммуногистохимические маркеры
- Определение: Антигены на поверхности клеток, которые могут быть обнаружены с помощью гистопатологической оценки ткани.
- Клиническая значимость
| Обзор иммуногистохимических маркеров [1] [9] | |||
|---|---|---|---|
| Маркер | Естественная встречаемость | Возникновение в опухолях | 99 | Desmin |
| Мезотелин |
| ||
| Цитокератин | |||
| нейрофиламенты | |||
| Хромогранин | |||
| синаптофизин | |||
| S -100 | |||
GFAP | |||
| PSA | |||
| ЛОВУШКА | |||
| CD8 | |||
| CD4 | |||
| CD45 | |||
DesMin связан с мышечными опухолями, такими как рабдомиосаркома.
ViMEntin ассоциирован с мезенхимальными опухолями.
GFAP окрашивает нейроглиальные клетки, пораженные глиобластомами.
Список литературы
- Ardini E, Magnaghi P, Orsini P, Galvani A, Menichincheri M. Киназа анапластической лимфомы: роль в определенных опухолях и разработка низкомолекулярных ингибиторов для лечения рака. Письмо о Раке . 2010; 299 (2): с.81-94. DOI: 10.1016 / j.canlet.2010.09.001. | Открыть в режиме чтения QxMD
- Каспер Д.Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Д.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона . McGraw-Hill Education ; 2015 г.
- Кампана Д., Нори Ф., Пискителли Л. и др. Хромогранин А: полезный маркер нейроэндокринных опухолей? Дж Clin Oncol . 2007; 25 (15): с.1967-1973. DOI: 10.1200 / jco.2006.10.1535. | Открыть в режиме чтения QxMD
- Нильсен О.С., Манро А.Дж., Дункан В. и др. Является ли плацентарная щелочная фосфатаза (PLAP) полезным маркером семиномы? Eur J Cancer . 1990; 26 год (10): с.1049-54. DOI: 10.1016 / 0277-5379 (90)-у. | Открыть в режиме чтения QxMD
- Художник Дж. Т., Клейтон Н. П., Герберт Р. А.. Полезные иммуногистохимические маркеры дифференцировки опухолей. Токсикол Патол . 2010; 38 (1): с.131-141. DOI: 10.1177 / 0192623309356449. | Открыть в режиме чтения QxMD
- Онкомаркеры. https://www.cancer.gov/about-cancer/diagnosis-staging/diagnosis/tumor-markers-fact-sheet .Обновлено: 4 ноября 2015 г. Доступ: 18 февраля 2017 г.
- Онкомаркеры. https://labtestsonline.org/understanding/analytes/tumor-markers/start/2 . Обновлено: 13 апреля 2016 г. Доступ: 18 февраля 2017 г.
- Diamandis EP, Fritsche HA, Lilja H, Chan DW, Schwartz MK. Онкомаркеры: физиология, патобиология, технология и клиническое применение . Американская ассоциация клинической химии ; 2002 г.
- Инь АЧ, Ки А.С., Люнг Л.С., Тонг Северо-Запад. Рекомендации для медицинских работников по скринингу, раннему выявлению и профилактике рака . Гонконгское противораковое общество ; 2011 г.
- Ле Т., Бхушан В. Первая помощь для USMLE Шаг 1 2015 . McGraw-Hill Education ; 2014 г.
Роль белков S100 в колоректальном канцерогенезе
Семейство белков S100 представляет собой 25 относительно небольших (9–13 кДа) кальций-связывающих белков.Эти белки обладают широким спектром важных внутриклеточных и внеклеточных функций. Колоректальный рак является третьим по распространенности раком у мужчин (после рака легких и простаты) и вторым по частоте онкологическим заболеванием у женщин (после рака груди) во всем мире. Белки S100 участвуют в колоректальном канцерогенезе посредством различных механизмов: они обеспечивают пролиферацию, инвазию и миграцию опухолевых клеток; кроме того, белки S100 усиливают ангиогенез и активируют сигнальный путь NF- κβ , который играет ключевую роль в молекулярном патогенезе, особенно в случае карциномы, ассоциированной с колитом.Экспрессия белков S100 в раковой ткани и уровни белков S100 в сыворотке могут быть использованы в качестве точного диагностического и прогностического маркера у пациентов с подозрением или уже диагностированной колоректальной неоплазией. Возможно, в будущем белки S100 станут терапевтической мишенью для индивидуализированной противоопухолевой терапии.
1. Введение
Семейство белков S100 представляет собой всего по крайней мере 25 относительно небольших (9–13 кДа) Ca 2+ (кальций) связывающих белков. Они экспрессируются исключительно у позвоночных, и их функция изменяется в ответ на изменение концентрации кальция.Их название происходит от того факта, что многие члены растворимы в 100% сульфате аммония при нейтральном pH [1]. Белки S100 имеют широкий спектр функций; они играют роль в регуляции клеточной пролиферации, дифференцировки, апоптоза, энергетического метаболизма, клеточной передачи сигналов и гомеостаза Ca 2+ . Внеклеточные белки S100 действуют через активацию поверхностных рецепторов аутокринным и паракринным образом [2].
2. История
Первое упоминание об «относительно кислых и небольших по размеру» белках появляется в статье, написанной Муром и МакГрегором в 1965 году.Мур и МакГрегор сравнили хроматографические образцы белков, присутствующих в головном мозге и печени кроликов, и обнаружили, что мозг содержит по крайней мере два белка, которые в меньшем количестве или даже отсутствуют в печени [3]. Позже Рубин и Стензель описали синтез мозгового белка in vitro , который происходит в рибосомной системе серого вещества коры головного мозга кролика. В качестве специфического антигена использовали кислый белок, выделенный из мозга Рубином и Стензелем [4].
В 1973 году Кретсингер и Нокольдс описали структуру кальций-связывающего белка, парвальбумина: основная цепь состоит из шести спиралей, A – F.Петли CD и EF связывают кальций, а петля AB — нет; тем не менее, его структура подобна участкам CD и EF, по-видимому, в результате трипликации генов [5]. С тех пор были распознаны различные белки S100 и идентифицирована их экспрессия в различных периферических тканях [6].
3. Структура и функция белков S100
Суперсемейство EF-hand (т. Е. Спираль-петля-спираль) состоит по меньшей мере из сорока пяти различных подсемейств. Их члены содержат от двух до восьми EF-стрелок, узнаваемых по аминокислотной последовательности [7].Мотив EF-руки состоит из двух альфа-спиралей «E» и «F», соединенных промежуточной петлей, связывающей кальций из 12 остатков [8]. Мотивы EF-руки обычно располагаются парами, удерживаемыми вместе короткой антипараллельной β -цепью и многочисленными гидрофобными взаимодействиями между четырьмя спиралями. Белки семейства S100 играют особую роль среди других членов суперсемейства EF-hand из-за их уникальной структуры и свойств [2] 🙁 1) Димерная структура белков S100: белки S100 существуют в димерной структуре, за исключением S100G. , которая является мономерной.Белки S100 могут обмениваться своими субъединицами с другими членами семейства S100 с образованием гомодимеров и гетеродимеров в клеточном компартменте. (2) Состав субъединиц белков S100: каждая субъединица (каждый мономер) состоит из двух мотивов EF-hand. Первый мономер, С-концевой («канонический»), образован 12 остатками и связывает кальций с более высоким сродством. N-концевая (также называемая «псевдоканонической») EF-рука из 14 остатков связывает кальций с более слабым сродством. (3) Экспрессия белков S100: экспрессия белков S100 происходит тканеспецифично и клеточно-специфическим образом. [9].
При низком уровне кальция белки S100 находятся в не содержащем кальция (апо) состоянии. После того, как происходит приток кальция через потенциал-управляемые или опосредованные рецептором каналы, белки S100 связывают кальций и претерпевают специфические конформационные изменения, которые приводят к модификации их гидрофобных поверхностных свойств [2, 9].
Белки, содержащие EF-hand, можно функционально разделить на две группы. К первой группе относятся сенсоры кальция, которые характеризуются способностью транслировать сигнал изменения концентрации ионов Ca 2+ на различные ответы.Вторая группа включает кальциевые буферы, которые связывают свободные ионы Ca 2+ в цитоплазме клетки и могут модулировать кальциевые сигналы. Тем не менее, граница между этими двумя группами не является строгой, и многие белки EF-hand нельзя описать ни как чистые сенсоры, ни как чистые буферы [10].
Как упоминалось выше, повышение уровня кальция приводит к структурным изменениям белков S100, и это позволяет им взаимодействовать с гидрофобными областями белков-мишеней. Для членов семейства S100 человека зарегистрировано более 90 потенциальных внутриклеточных и внеклеточных белков-мишеней: другие связывающие кальций белки (члены семейства аннексинов), ферменты (например,g., альдолаза A / C), компоненты цитоскелета (актин и тубулин), гены-регуляторы клеточного цикла (p53), ферменты, синтезирующие вторичный мессенджер (аденилат и гуанилатциклаза), и киназы относятся к взаимодействующим партнерам [11].
4. Рак желудочно-кишечного тракта и белки S100
Канцерогенез — это многоступенчатый процесс, требующий комбинации генетических и эпигенетических аберраций нормальных клеток человека, которые приводят к их прогрессивной трансформации в высокоразвитые производные.В 2000 году Ханахан и Вайнберг предположили, что злокачественный рост почти всех типов рака является результатом шести существенных изменений в физиологии клетки: самодостаточность факторов роста, нечувствительность к сигналам, подавляющим рост, уклонение от апоптоза, безграничный репликативный потенциал. , устойчивый ангиогенез и способность проникать и метастазировать [12]. В 2011 году Ханахан и Вайнберг добавили еще два признака рака: геномную нестабильность и воспаление. Более того, перепрограммирование энергетического метаболизма и уклонение от иммунной деструкции недавно были включены как два новых признака [13].
В 2012 году во всем мире было диагностировано 14,1 миллиона новых случаев колоректального рака; 32,6 миллиона человек выжили с раком (в течение 5 лет с момента постановки диагноза) и 8,2 миллиона умерли от рака в 2012 году. Согласно этому, колоректальный рак занимает видное место среди злокачественных новообразований человека, занимая третье место по заболеваемости среди мужчин и второе место среди женщин [14 ].
В последнее время наблюдается растущий интерес к белкам S100, поскольку есть четкие доказательства того, что они участвуют в различных биологических событиях, связанных с канцерогенезом.Во-первых, большинство генов S100 обнаружено на хромосоме 1q21 человека, которая является областью, подверженной геномным перестройкам. Во-вторых, измененная экспрессия белков S100 наблюдалась при различных злокачественных новообразованиях. В-третьих, белки S100 взаимодействуют с различными белками, которые играют важную роль в канцерогенезе, а белки S100 также оказывают специфическое действие на белки-мишени, такие как NF- κβ , p53 и β -катенин [15].
Ассоциация белков S100 с различными типами рака желудочно-кишечного тракта показана в таблице 1.
| |||||||||||||||||||||||||||||||||||||||||||||||
| ESCC, плоскоклеточный рак пищевода; ↑, повышенная регуляция; ↓, с пониженной регулировкой. | |||||||||||||||||||||||||||||||||||||||||||||||
5. Колоректальная неоплазия и белки S100
5.1. S100A8 / A9: Кальпротектин
S100A8 и S100A9 также известны как кальгранулины A и B или MRP8 и MRP14. Они экспрессируются во множестве клеток, особенно в миелоидных клетках, включая гранулоциты, моноциты и клетки-супрессоры миелоидного происхождения, MDSC [16]. Гетеродимеризация с S100A8 стабилизирует S100A9 и вызывает удлинение его C-концевой α -спирали. Тетрамеры создают два высокоаффинных сайта связывания Zn 2+ , которые важны для функции кальпротектина, включая его антимикробную активность [2, 16–18].Кальпротектин, гетерокомплекс S100A8 / A9, играет ключевую роль в регуляции различных воспалительных процессов и иммунных реакций. После активации нейтрофилов и / или эндотелиальной адгезии моноцитов кальпротектин начинает секретироваться и может служить маркером воспаления [17]. С другой стороны, кальпротектин оказывает хемотаксическое действие на нейтрофилы [2, 19, 20]. В настоящее время кальпротектин используется в качестве биомаркера, и его уровень в фекалиях обычно измеряется для подтверждения активности воспалительного заболевания кишечника.
Гетерокомплекс S100A8 / S100A9 может влиять на миграцию MDSC и может вызывать инвазию опухолевых клеток [21–23].
Действие кальпротектина на опухолевые клетки зависит от концентрации: при высоких концентрациях гетерокомплекс S100A8 / 9 оказывает апоптотический эффект на клеточные линии карциномы толстой кишки [24], но при низких концентрациях кальпротектин способствует росту опухолевых клеток. [25]. Низкие концентрации S100A8 / 9 стимулируют миграцию опухолевых клеток [26].
Другая важная роль кальпротектина в контексте повышенного риска колоректального рака у пациентов с воспалительными заболеваниями кишечника описана Туровской и соавт.: в ткани опухоли толстой кишки человека миелоидные предшественники инфильтрируют области дисплазии и аденомы и экспрессируют S100A8 и S100A9. RAGE (рецептор конечных продуктов гликирования) является основным рецептором S100A8 / A9 на поверхности опухолевых клеток. Связывание кальпротектина с RAGE активирует сигнальный путь NF- κβ , который играет ключевую роль в молекулярном патогенезе колит-ассоциированной карциномы [27]. Итикава и др. подтвердили, что RAGE и карбоксилированный гликан-зависимое связывание S100A8 / 9 способствует передаче сигналов MAPK (митоген-активируемые протеинкиназы) и NF- κβ [26].
Недавно Lehmann et al. показали, что у большинства пациентов с колоректальным раком уровень фекального кальпротектина был повышен до хирургической резекции опухоли, что сопровождалось значительным снижением через 3 месяца после операции. У пациентов с опухолями T3 и T4 уровень кальпротектина был значительно выше, чем у пациентов с раком T1 и T2 [28].
5.2. S100A4: метастатин-1, кальваскулин
S100A4, многофункциональный белок, локализованный в ядре, цитоплазме и внеклеточном пространстве, сильно связан с метастатическим прогрессированием опухоли [29].Метастатин-1 был впервые описан в 1989 г. Ebralidze et al. [30], которые обнаружили, что он специфически экспрессируется в метастатических клетках. Позже было установлено, что S100A4 является ценным биомаркером для идентификации пациентов, у которых уже развились метастазы или которые имеют высокий риск метахронного развития метастазов. Следовательно, метастатин-1 также является прогностическим биомаркером. Его роль в прогнозировании прогрессирования опухоли и прогноза CRC была подтверждена в метаанализе, проведенном Liu et al. [31]. Boye et al.подчеркнули, что ядерная экспрессия (не цитоплазматическая) S100A4 является новым прогностическим маркером колоректального рака. Они также обнаружили, что прогностическое влияние в основном ограничивалось стадией II TNM, и пациенты с опухолями II стадии, экспрессирующими ядерный S100A4, имели аналогичный прогноз по сравнению с пациентами стадии III [32]. Недавние исследования кальваскулина показали, что S100A4 является не только биомаркером, но также играет причинную роль в опосредовании метастатических процессов [33].
Внутриклеточный S100A4 увеличивает подвижность клеток за счет взаимодействия с белками цитоскелета, такими как актиновые филаменты, немышечный тропомиозин и немышечный миозин II [2, 33].Более того, метастатин-1 вызывает инвазивность первичных опухолей за счет взаимодействия с липрином бета 1, что приводит к модуляции клеточной адгезии, вызывая мигрирующий фенотип [34]. S100A4 способствует развитию более агрессивного клеточного фенотипа за счет связывания с p53, что приводит к модуляции транскрипционной активности p53 [35].
S100A4, когда высвобождается во внеклеточное пространство, обеспечивает ангиогенез за счет стимуляции подвижности эндотелиальных клеток и активации экспрессии матриксных металлопротеиназ, которые расщепляют белки внеклеточного матрикса и тем самым облегчают клеточную инвазию в соседние ткани [29, 33].Внеклеточный ангиогенный эффект S100A4 также индуцируется через его взаимодействие с аннексином II на поверхности эндотелиальных клеток [36].
Мутация гена APC, которая присутствует примерно в 90% случаев колоректального рака, приводит к увеличению цитоплазматического β -катенина, что приводит к его ядерному накоплению и экспрессии генов, участвующих в росте и инвазии опухоли [37, 38] . Sack и Stein описали, что S100A4 является транскрипционной мишенью для β -катенина. Следовательно, нацеливание на путь Wnt / β -катенин с последующим ингибированием экспрессии гена S100A4 будет ограничивать образование метастазов рака толстой кишки [33].Было показано, что кальцимицин ингибирует активность пути Wnt / β -катенин и экспрессию целевого гена β -катенина, S100A4 [39]. Stein et al. продемонстрировали влияние сулиндака на клеточные линии рака толстой кишки: снижение экспрессии β -катенина с последующим уменьшением его ядерной аккумуляции привело к нокдауну экспрессии S100A4. У мышей лечение сулиндаком уменьшало рост опухоли и уменьшало метастазы в печени на модели ксенотрансплантата рака толстой кишки человека [40].
5.3. S100A6: Кальциклин
Кальциклин, первоначально идентифицированный в клетках асцитной опухоли Эрлиха, был первым белком S100, который, как было описано, связан с пролиферацией клеток [61, 62]. Действительно, S100A6 предпочтительно экспрессируется в пролиферирующих клетках по сравнению с покоящимися. Подобно S100A4, кальциклин связан с прогрессированием и инвазией опухоли. Komatsu et al. в своем исследовании обнаружили, что экспрессия S100A6 в колоректальных аденокарциномах человека была значительно выше (2.В 4 раза) по сравнению с экспрессией S100A6 в нормальной слизистой оболочке. Они также продемонстрировали, что антитело S100A6 присутствует в 5% нормальных слизистых оболочек, 46% образцов аденомы, 55% аденокарцином и 100% клеток карциномы, метастазирующих в печень. Была подтверждена значимая связь между стадией опухоли по Дьюку, лимфатической инвазией и экспрессией S100A6 [41]. Стулик и др. продемонстрировали статистически значимую корреляцию между экспрессией S100A6 и прогрессированием рака толстой кишки.Они исследовали S100A6 в нормальной ткани толстой кишки, а также в колоректальных аденомах и карциномах. Они обнаружили, что S100A6 накапливается в инвазивном крае колоректального рака [62]. Было задокументировано несколько механизмов участия кальциклина в колоректальном канцерогенезе: путь Wnt / β -катенин и сам по себе β -катенин могут регулировать экспрессию гена S100A6. Обнаружена совместная локализация кальциклина с β -катенином в тканях колоректального рака. S100A6 взаимодействует с белком под названием ламин A / C, который участвует в канцерогенезе толстой кишки [42].Кроме того, S100A6 взаимодействует с рецептором конечных продуктов гликирования и модулирует выживаемость клеток [63]. Дуан и др. изучили вклад S100A6 в колоректальный канцерогенез и продемонстрировали влияние кальциклина на пролиферацию и миграцию клеток посредством активации митоген-активируемой протеинкиназы in vitro и роста опухоли in vivo . Индуцированная S100A6 пролиферация частично подавлялась ингибитором киназы внеклеточного рецептора; миграция ослаблялась ингибитором митоген-активируемой протеинкиназы p38 [64].
Melle et al. продемонстрировали, что S100A6 значительно усиливается при колоректальном раке и метастазах, происходящих от колоректального рака, по сравнению с гепатоцеллюлярной карциномой. Этот вывод кажется очень благоприятным для клинической практики, когда первичная опухоль неизвестна [65].
5.4. S100A11: Calgizzarin, S100C
Кальгиззарин локализуется в цитоплазме и, в отличие от большинства белков S100, также в ядре клетки [66]. Было описано, что потеря ядерного кальгиззарина в клетках HeLa приводит к потере ингибирования роста клеток [67].S100A11 участвует в регуляции подвижности клеток, прогрессии клеточного цикла, дифференцировке клеток, транскрипции, апоптозе и воспалении [43, 66].
Кальгиззарин был идентифицирован как лиганд рецептора конечных продуктов гликирования [68]. Роль S100A11 сложна, и он может действовать либо как опухолевый супрессор, либо как опухолевый промотор в различных типах опухолей [66]. Melle et al. изучали экспрессию S100A11 в нормальном эпителии толстой кишки, аденоме и колоректальной карциноме и обнаружили повышенную регуляцию кальгиззарина при колоректальном раке по сравнению с аденомой и эпителиальными клетками [43].Стулик и др. также задокументировано возможное участие кальгиззарина в процессе развития рака толстой кишки [69].
5.5. S100B
Было обнаружено, что S100B сверхэкспрессируется в метастазах печени пациентов с колоректальным раком [70]. Кроме того, Хуанг и др. попытался обнаружить циркулирующие опухолевые клетки у пациентов с CRC, поскольку невыявленные микрометастазы играют важную роль в раннем рецидиве CRC. Они продемонстрировали, что послеоперационный рецидив значимо коррелировал со сверхэкспрессией гена, включая S100B.Основываясь на этом открытии, S100B может быть одним из прогностических маркеров для пациентов с CRC [44].
5.6. S100P
S100P была открыта в 1992 г. [45, 71]. С тех пор было доказано, что S100P способен способствовать инвазии опухоли и образованию метастазов [72, 73]. Повышенная регуляция S100P была описана при колоректальной аденоме по сравнению с нормальной тканью [46]. S100P значительно активируется простагландином E2, который обычно сверхэкспрессируется в эпителиальных клетках CRC [47]. Первое доказательство того, что экспрессия S100P в раковых тканях, а также уровни S100P в сыворотке могут быть использованы в качестве потенциального прогностического биомаркера для пациентов с CRC, было задокументировано Wang et al.Результаты их исследования подтвердили значительно более высокую экспрессию белка S100P в раковых тканях по сравнению с парными доброкачественными областями. Интересно, что экспрессия белка S100P была связана с локализацией первичной опухоли CRC: скорость экспрессии S100P увеличивалась справа налево, будучи самой высокой в карциномах прямой кишки. Согласно анализу Каплана-Мейера, общее время выживания пациентов с КРР I – III стадии с экспрессией белка S100P было значительно короче по сравнению с пациентами без экспрессии белка S100P в опухолевой ткани.Время выживания пациентов с CRC также было значительно связано с предоперационными уровнями S100P в сыворотке, исследованными с помощью ELISA [74].
6. Возможное терапевтическое значение белков S100
Данные показывают, что ингибирование белков S100 может играть ключевую роль в преодолении резистентных форм различных злокачественных новообразований. Tasquinimod, новое производное хинолин-3-карбоксамида для перорального применения, обладает множественными эффектами на микроокружение опухоли [75], включая возможное связывание с белком S100A9, что приводит к ингибированию взаимодействия между S100A9 и рецепторами, такими как RAGE и TLR4.Это может иметь значение в терапии рака простаты [76].
Dong et al. обнаружили, что S100P (который обычно сверхэкспрессируется в ткани колоректального рака) снижает химиочувствительность к 5-фторурацилу in vitro [73]. Таким образом, белок S100P не является только прогностическим индикатором, но также служит терапевтической мишенью.
Белок S100A6 стал потенциальным прогностическим биомаркером, а также ценной терапевтической мишенью в исследовании, проведенном Zhang et al.[55]: его ингибирование снижает метастатический потенциал клеток рака желудка.
На данный момент мы считаем, что включение белков / антител S100, направленных на белки S100, улучшит противораковую терапию: сделает ее более индивидуальной, уменьшит ее побочные эффекты и поможет в борьбе с устойчивыми формами рака.
7. Выводы
Белки S100, члены семейства EF-hand, играют важную роль в колоректальном канцерогенезе.
Согласно имеющимся данным, белки S100 могут использоваться в диагностических, прогностических и наблюдательных целях у пациентов, которые находятся в группе риска или уже были диагностированы с колоректальной неоплазией.
Возможно, в самом ближайшем будущем белки S100 могут стать терапевтической мишенью для индивидуализированной противоопухолевой терапии.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарности
Исследование было поддержано исследовательским грантом IGA NT / 13413 (от Министерства здравоохранения Чехии) и исследовательским проектом PRVOUK P37-08 (от медицинского факультета в Градец Кралове, Карлов университет в Праге, Чешская Республика).
| S100A1 | Кардиомиоциты, клетки скелетных мышц, эндотелиальные клетки, неврологические клетки | Сайты связывания факторов транскрипции для Nkx 2.5, Mef2 и CEF | SERCA2a / PLB, RyR2 90 -ATPase, ANT, Titin | Модулирует сократительную способность кардиомиоцитов: взаимодействие с SERCA2a / PLB и RyR2 улучшает систолическое высвобождение Ca 2+ и диастолическое поглощение Ca 2+ ; Связывание с субдоменом PEVK тайтина приводит к улучшению саркомерной податливости Митохондриальный метаболизм: играет роль в гомеостазе сердечной энергии, взаимодействуя с F 1 -АТФазой и ANT | [36,37,256] | ||||||||||
| S100A2 (S100L; CaN19) | Эпителиальная ткань | Активация транскрипции p53 EGF-индуцированная транскрипция в кератиноцитах | p53, RAGE | Супрессор опухоли: кальций-зависимая активация p53 | [51,78] | S )Кутикулярные клетки волоса | PAD3 индуцирует образование гомотетрамера посредством цитруллинирования | RARα | Поддержание текстуры волос: Ca 2+ -зависимое формирование эпителиального барьера и созревание кутикулы | [22,25749815] | S100A4Фибробласты, иммунные клетки, раковые клетки | T транскрипции способствуют β-катенин и факторы роста | актин, NMIIA, тропомиозин, p53, p37, MMP2, липрин-β1, RAGE, TLR4, EGFR, рецептор IL-10, аннексин II | Миграция клеток: взаимодействие с белками цитоскелет и индуцирует секрецию матриксных металлопротеиназ (ММП) Рост и пролиферация клеток: активирует киназы NF-κB и MAP | [45,52,89] |
| S100A5 | обонятельная луковица, ствол мозга, спинной мозг | —RAGE, NCXI | — | [34,259] | |||||||||||
| S100A6 (кальцилин; Кейси; КАВР; PRA) | Фибробласты, эпителиальные клетки | Внеклеточные за счет PDGF, EGF, ретоновой кислоты, эстрогена, гастрина В стрессовых условиях: ишемия, облучение, окислительный стресс Внутриклеточно: NF-κB активирует S100A6-промотор, в то время как транскрипция | косвенно подавляеткальдесмон, кальпонин, тропомиозин, легкая цепь кинезина, RAGE | Контроль развития клеточного цикла: участвует в убиквитинировании β-катенина Регуляция динамики микрофиламентов: взаимодействие с белками цитоскелета Апоптоз нейронов: связывание с RAGE приводит к ROS- зависимая активация JNK, каспазы-3 и каспазы-7 В качестве внеклеточного фактора: участвует в высвобождении лактогена II, инсулина и гистамина | [27,260] | ||||||||||
| S100A7 (псориазин) | Секреция кератиноцитов | 908 вызванные деструктивными стимулами (например,(например, УФ-В, облучение, ретоновая кислота, инфекция бактериями)RAGE, FABP, TGM | Роль как AMP : лизирует бактерии (например, E. coli) Ингибирование эпидермальной дифференцировки: RAGE-зависимая активация передачи сигналов NF-κB приводит к усилению регуляции IL-6 Воспаление: селективный хемотаксис для CD4 + лимфоцитов и нейтрофилов | [28 , 42] | |||||||||||
| S100A8 (Кальгранулин А) | Нейтрофилы, остеокласты, гипертрофические хондроциты, миелоидные дендрические клетки | Индуцированные LPS, IL-10, TLR4, протеиназой | 4, глюкокортикоиды | Хемофакт 908 от окисления за счет улавливания окислителей, действует как NO-челнок, тем самым активируя тучные клетки Регуляция дифференцировки: связывает и ингибирует теломеразу, тем самым способствуя дифференцировке в кератиноцитах | [43,261] | ||||||||||
| S100A9 (Кальгранулин B) | Нейтрофильные гранулоциты, моноциты | Повышенная регуляция глюкокортикоидами, цитокинами и факторами роста | RAGE, TLR4 | Воспаление: Zn 2+ провоспалительных цитокинов (например,g., TNFα) посредством передачи сигналов NF-κB; действует как хемоаттрактант и участвует в дифференцировке миелоидных клеток | [21,40,43] | ||||||||||
| S100A8 / S100A9 (кальпротектин) | Нейтрофилы, моноциты, макрофаги, индуцируемая экспрессия в кератиноцитах (например, ). при воспалительных условиях) | TNFα, IL-1β, HIF-1 стимулируют экспрессию Секреция является зависимой от Ca 2+ | RAGE, TLR4 | Модуляция цитоскелета: взаимодействует с несколькими белками цитоскелета (например.g., кератин и F-актин) и способствует полимеризации микротрубочек Защита от патогенов: эпителиальные клетки, экспрессирующие S100A8 / S100A9, более устойчивы к бактериальной инфекции Воспаление: RAGE- и TLR4-опосредованная активация провоспалительных цитокинов (например, IL -6 и IL-8) и адгезионных белков (например, ICAM-1) | [29] | ||||||||||
| S100A10 (p11) | Эндотелиальные клетки, макрофаги, фибробласты, эпителиальные клетки | Экспрессия может быть индуцирована : Sp1, IFN-γ, глюкокортикоиды, TGFβ, EGF, IL-1β, тромбин, онкогены (например,g., PML-RARα, KRas) | Аннексин II, рецептор 5-HT1B, TRPV5, TRPV6, TASK-1 | Роль рецептора плазминогена: регулирует выработку плазмина путем образования комплекса с аннексином II, что приводит к фибринолизу, активация MMP, деградация ECM, стимуляция сигнального пути JAK1 / TYK2 и рекрутирование макрофагов Перенос белков плазматической мембраны: S100A10 взаимодействует с рецептором 5-HT1B, TRPV5, TRPV6 и TASK-1 и участвует в их передаче | [13,35] | ||||||||||
| S100A11 (S100C; кальгиззарин) | Хондроциты, кератиноциты, фибробласты, лютеиновые клетки | TGFβ и высокие концентрации внеклеточного Ca 2+ 904, стимулируют экспрессию и активность аннексина 908 , нуклеолин | Регуляция роста клеток: внутриклеточный S100A11 ингибирует рост клеток путем связывания с нуклеолином, что делает возможным экспрессию p21, что приводит к ингибированию синтеза ДНК; внеклеточный S100A11 способствует пролиферации клеток посредством RAGE-опосредованной транскрипции EGF . Взаимодействие с RAGE: RAGE активирует киназу p38 MAPK, которая увеличивает коллаген типа X | [49,50] | |||||||||||
| S100A12 (Calgranulin C; EN-RAGE) | Нейтрофильные гранулоциты, моноциты, макрофаги, эпителиальные и дендрические клетки, дифференцирующиеся на ранних стадиях | Повышенная регуляция TNFα и LPS Секреция нейтрофилов включает обмен ROS и K + | RAGE, TLR4, сигнал CIP30 / SIP 908: связывание к CacyBP / SIP и является частью комплекса убиквитинилирования Воспаление: связывание с TLR4 приводит к активации и миграции моноцитов и высвобождению IL-1β, IL-6 и IL-8, RAGE-опосредованная передача сигналов NF-κB и MAPK вызывает секреция TNFα и IL-1β Ингибирование патогенов: противогрибковая и антибактериальная активность через Zn 2+ секвестрация | [41,262,263,264] | |||||||||||
| S100A13 | Клетки Лейдига семенников, фолликулы щитовидной железы, гладкие мышцы, эндотелиальные и эпителиальные клетки | Индуцированные стрессовыми стимулами | RAGE, Syt1, SPHK1 | Неканонический путь секреции: образует медьзависимый мультибелковый комплекс с Syt1 и SPHK и, таким образом, участвует в неклассическом стресс-зависимом высвобождении FGF-1, IL-1α и протимозина-α | [265,266,267] | ||||||||||
| S100A14 | Высокая экспрессия в эпителиальной ткани, более низкая экспрессия в мезенхимальной ткани | Регулируется p53 | RAGE, p53 | Взаимодействие с RAGE: связывание в более низких концентрациях активирует передачу сигналов MAPK и NF-κB, что приводит к пролиферации клеток; связывание в высоких концентрациях активирует продукцию ROS, что приводит к апоптозу | [46,53] | ||||||||||
| S100A15 (S100A7A; коебнеризин) | Дендрические клетки, эндотелиальные клетки, гладкомышечные клетки сосудов, периферические нервы, кератиноциты | Э.coli через TLR4 Транскрипция может быть индуцирована IFN-γ, IL-1β, TNFα и Th2. Коэкспрессия с S100A7 в кератиноцитах | GPCR | Созревание эпидермальных клеток: повышается при дифференцировке эпидермиса Начальный иммунный ответ: функционирует как антибактериальный агент за счет снижения выживаемости E. coli и других штаммов Воспаление: действует как хемоаттрактант для лейкоцитов через GPCR | [23,268] | ||||||||||
| S100A16 | Астроциты, адипоциты | Са 2+ 9015 экспорт | p53 | Избыточная экспрессия в преадипоцитах привела к повышенной пролиферации и снижению инсулино-стимулированного поглощения глюкозы и фосфорилирования Akt | [269,270] | ||||||||||
| S100B | Астровоциты, клетки шимодендроцитов, шимодендроциты, клетки шимодендроцитов, олигодендроциты хондроциты | Секреция регулируется IL-1β, внеклеточным Ca 2+ 9 0152 и K + , ингибиторы щелевых соединений, антиоксиданты, липополисахарид и апоморфин p53 активирует экспрессию | Внеклеточный: RAGE, FGFR1 Внутриклеточный: киназа Ndr, Src, Rac1, IQGAP301, p53 908 регулирует миграцию Актиновый цитоскелет через Src, IQGAP1 и Rac1 Деление клеток: взаимодействие с киназой Ndr приводит к стимулированию передачи сигналов PI3K / Akt Роль в подавлении опухоли: ингибирует активность p53 и снижает p53 Пролиферация: при более высоких концентрациях S100B блокирует RAGE и стимулирует FGFR1, приводя к пролиферации, опосредованной Ras / MEK / Erk; при низких концентрациях S100B дополнительно стимулирует RAGE-опосредованную передачу сигналов p38 MAPK, что приводит к активации митогенной программы | [47,65,271] | |||||||||||
| 100G (CaBP-9k) | Эпителиальные клетки | Витамин D-зависимый кишечник | — | Клеточный гомеостаз Ca 2+ : регулирует внутриклеточные уровни Ca 2+ и предотвращает токсические концентрации | [33] | ||||||||||
| S100P | Эпителиальные клетки, лейкоциты98 Промоторы, | 908 сайтов связывания для SMAD, STAT / CREB и SP / KLFRAGE, IQGAP1, энзрин, NMIIA | Пролиферация и выживаемость клеток: активирует передачу сигналов NF-κB, опосредованную RAGE; взаимодействие с IQGAP1 индуцирует сигнальный каскад MAPK. |



 / Простатический специфический антиген свободн.)
/ Простатический специфический антиген свободн.)