Острый миелоидный лейкоз (ОМЛ) у детей и подростков
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может привести к высокой температуре, повышенной утомляемости, легкому возникновению гематом, кровотечений, инфекций и других нарушений. Обычно при остром лейкозе симптомы ухудшаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
- В США ежегодно регистрируется около 500 новых случаев заболевания у детей. each year. (Это заболевание гораздо чаще возникает у взрослых.)
- ОМЛ является вторым наиболее распространенным детским лейкозом после острого лимфобластного лейкоза (ОЛЛ).
- ОМЛ у детей чаще всего возникает в первые 2 года жизни и в подростковом возрасте.

- Среди заболевших количество мальчиков и девочек, представителей европеоидной и негроидной рас примерно одинаково.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
- Эритроциты
- Разновидность белых клеток крови — гранулоциты
- Тромбоциты
Признаки и симптомы острого миелоидного лейкоза
Возможные признаки и симптомы ОМЛ:
- Жар
- Сильное чувство усталости
- Инфекции
- Легко возникающие гематомы и кровотечения
- Частые носовые кровотечения
- Трудноостанавливаемое кровотечение, даже из небольшого пореза
- Боль в костях или суставах
- Боль или ощущение распирания под грудной клеткой
- Увеличение лимфатических узлов
- Плохой аппетит
Диагностика острого миелоидного лейкоза
Для диагностики лейкоза требуется проведение исследований костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Чтобы определить распространение опухоли, используют такие исследования:
Лечение острого миелоидного лейкоза
Лечение зависит от типа ОМЛ. Лечение трех форм ОМЛ — острого промиелоцитарного лейкоза (ОПМЛ), ОМЛ у детей с синдромом Дауна и ОМЛ с мутацией FLT3 — проводят иначе, чем лечение других форм ОМЛ. Основным методом лечения ОМЛ является химиотерапия. Трансплантациякостного мозга также может быть вариантом терапии.
1. Индукция
Целью индукционной терапии является уничтожение опухолевых клеток в крови и костном мозге и перевод заболевания в ремиссию. Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицина, в сочетании с этопозидом и/или тиогуанином.
2. Консолидация/интенсификация/постиндукция
Целью этой фазы является уничтожение любых оставшихся опухолевых клеток, которые могут растии вызывать рецидив рака. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. У детей, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, риск рецидива наиболее высок.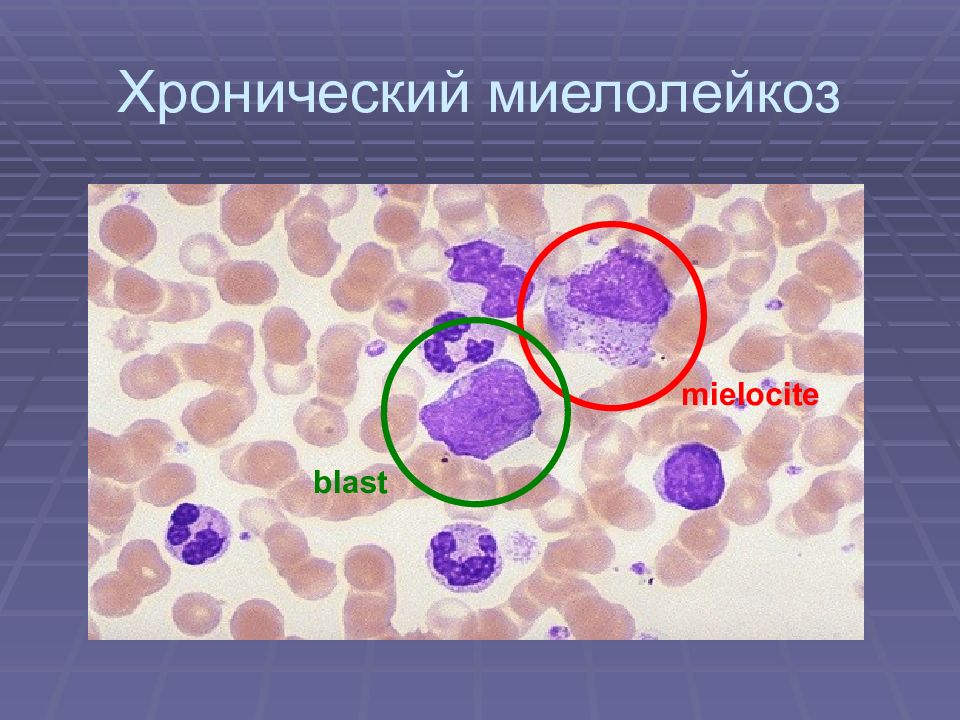
Фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые при индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентностью ОМЛ к лечению. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациенту с ОМЛ могут назначить аллогенную трансплантацию.
При такой трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение.
Прогноз при лечении острого миелоидного лейкоза
5-летняя выживаемость для детей с ОМЛ составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения отсутствуют раковые клетки в крови. Примерно у 30% детей с ОМЛ происходит рецидив илизаболеваниеоказывается устойчивым к лечению (рефрактерным).
Отдаленные последствия острого миелоидного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОМЛ
- Вторичный рак, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цель современных исследований острого миелоидного лейкоза
Текущие исследования направлены на разработку более эффективных методов лечения форм рака, не реагирующих на первоначальную терапию, новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым тканям, и эффективных методов лечения с меньшим количеством побочных эффектов.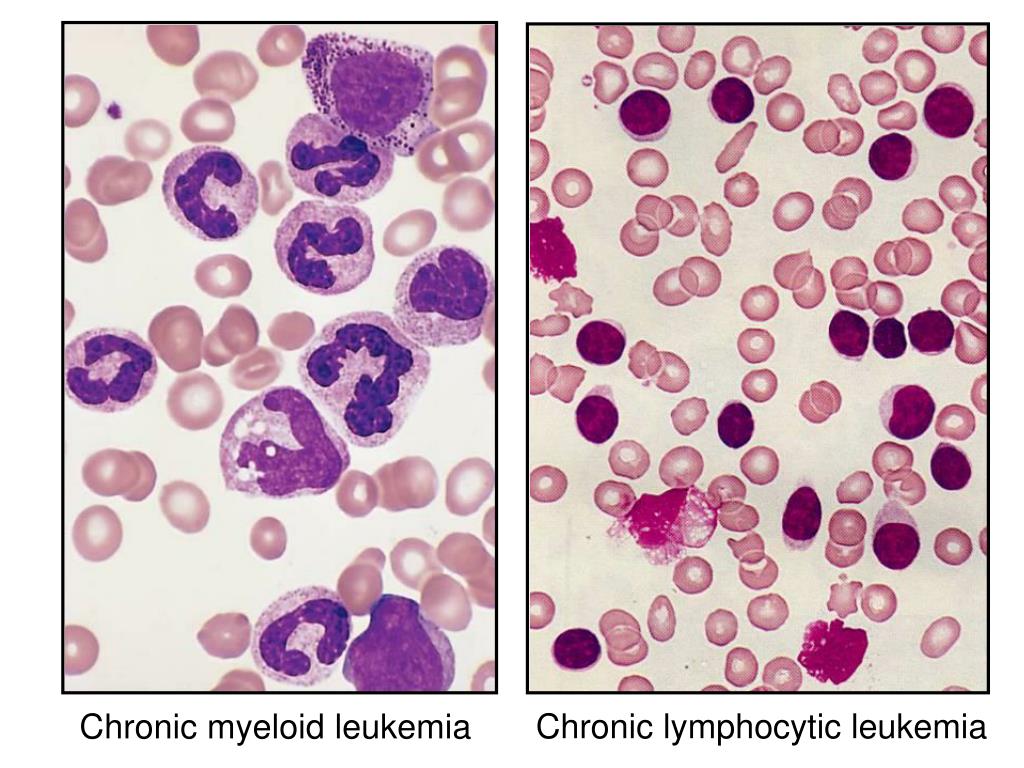
—
Дата изменения: июнь 2018 г.
Острый миелоидный лейкоз (ОМЛ) у детей и подростков
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может привести к высокой температуре, повышенной утомляемости, легкому возникновению гематом, кровотечений, инфекций и других нарушений. Обычно при остром лейкозе симптомы ухудшаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
- В США ежегодно регистрируется около 500 новых случаев заболевания у детей. each year. (Это заболевание гораздо чаще возникает у взрослых.)
- ОМЛ является вторым наиболее распространенным детским лейкозом после острого лимфобластного лейкоза (ОЛЛ).
- ОМЛ у детей чаще всего возникает в первые 2 года жизни и в подростковом возрасте.

- Среди заболевших количество мальчиков и девочек, представителей европеоидной и негроидной рас примерно одинаково.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
- Эритроциты
- Разновидность белых клеток крови — гранулоциты
- Тромбоциты
Признаки и симптомы острого миелоидного лейкоза
Возможные признаки и симптомы ОМЛ:
- Жар
- Сильное чувство усталости
- Инфекции
- Легко возникающие гематомы и кровотечения
- Частые носовые кровотечения
- Трудноостанавливаемое кровотечение, даже из небольшого пореза
- Боль в костях или суставах
- Боль или ощущение распирания под грудной клеткой
- Увеличение лимфатических узлов
- Плохой аппетит
Диагностика острого миелоидного лейкоза
Для диагностики лейкоза требуется проведение исследований костного мозга.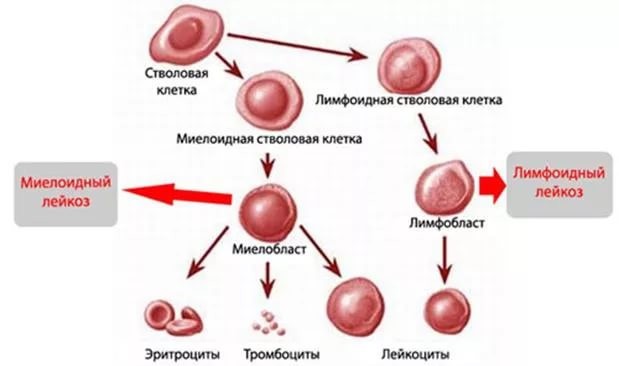
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Чтобы определить распространение опухоли, используют такие исследования:
Лечение острого миелоидного лейкоза
Лечение зависит от типа ОМЛ. Лечение трех форм ОМЛ — острого промиелоцитарного лейкоза (ОПМЛ), ОМЛ у детей с синдромом Дауна и ОМЛ с мутацией FLT3 — проводят иначе, чем лечение других форм ОМЛ. Основным методом лечения ОМЛ является химиотерапия. Трансплантациякостного мозга также может быть вариантом терапии.
1. Индукция
Целью индукционной терапии является уничтожение опухолевых клеток в крови и костном мозге и перевод заболевания в ремиссию.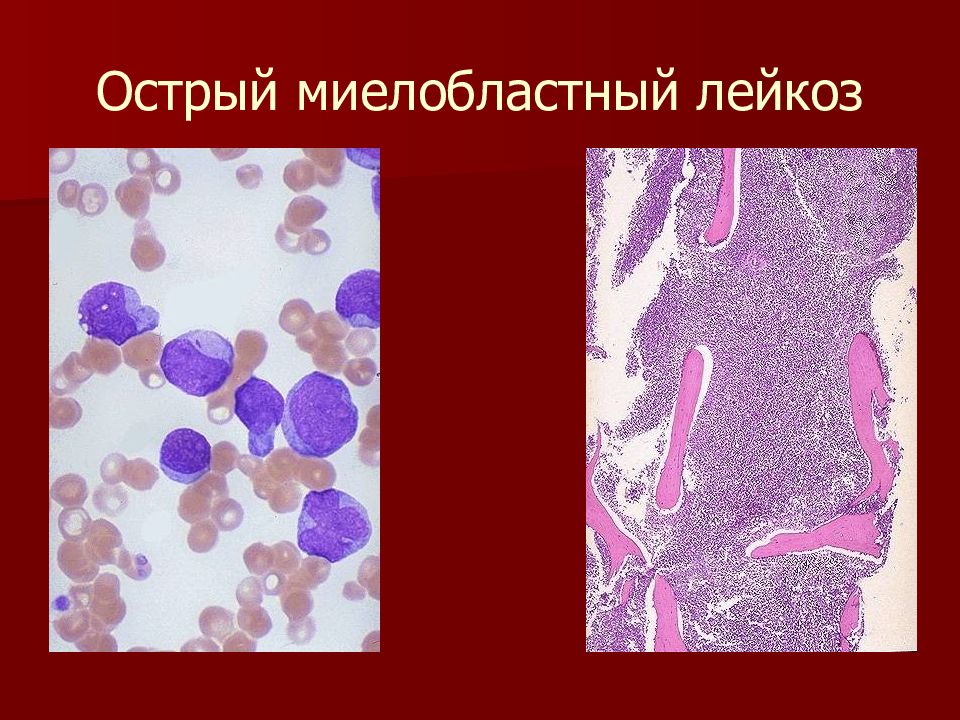 Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицина, в сочетании с этопозидом и/или тиогуанином.
2. Консолидация/интенсификация/постиндукция
Целью этой фазы является уничтожение любых оставшихся опухолевых клеток, которые могут растии вызывать рецидив рака. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. У детей, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, риск рецидива наиболее высок.
Фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые при индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентностью ОМЛ к лечению. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациенту с ОМЛ могут назначить аллогенную трансплантацию.
При такой трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение.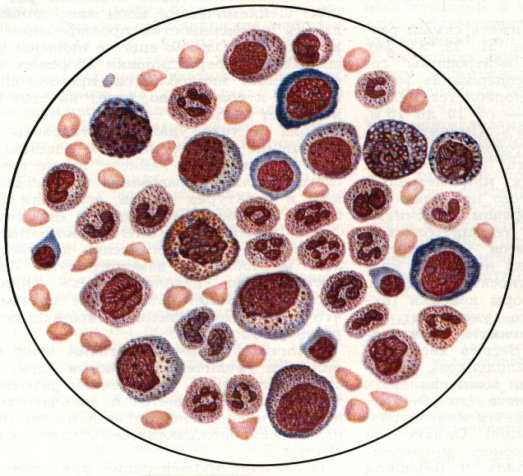 Во время трансплантации пациенту внутривенно вводятся здоровые донорские клетки. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Во время трансплантации пациенту внутривенно вводятся здоровые донорские клетки. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Прогноз при лечении острого миелоидного лейкоза
5-летняя выживаемость для детей с ОМЛ составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения отсутствуют раковые клетки в крови. Примерно у 30% детей с ОМЛ происходит рецидив илизаболеваниеоказывается устойчивым к лечению (рефрактерным).
Отдаленные последствия острого миелоидного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОМЛ
- Вторичный рак, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цель современных исследований острого миелоидного лейкоза
Текущие исследования направлены на разработку более эффективных методов лечения форм рака, не реагирующих на первоначальную терапию, новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым тканям, и эффективных методов лечения с меньшим количеством побочных эффектов.
—
Дата изменения: июнь 2018 г.
Острый миелоидный лейкоз (ОМЛ) у детей и подростков
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может привести к высокой температуре, повышенной утомляемости, легкому возникновению гематом, кровотечений, инфекций и других нарушений. Обычно при остром лейкозе симптомы ухудшаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
- В США ежегодно регистрируется около 500 новых случаев заболевания у детей. each year. (Это заболевание гораздо чаще возникает у взрослых.)
- ОМЛ является вторым наиболее распространенным детским лейкозом после острого лимфобластного лейкоза (ОЛЛ).
- ОМЛ у детей чаще всего возникает в первые 2 года жизни и в подростковом возрасте.

- Среди заболевших количество мальчиков и девочек, представителей европеоидной и негроидной рас примерно одинаково.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
- Эритроциты
- Разновидность белых клеток крови — гранулоциты
- Тромбоциты
Признаки и симптомы острого миелоидного лейкоза
Возможные признаки и симптомы ОМЛ:
- Жар
- Сильное чувство усталости
- Инфекции
- Легко возникающие гематомы и кровотечения
- Частые носовые кровотечения
- Трудноостанавливаемое кровотечение, даже из небольшого пореза
- Боль в костях или суставах
- Боль или ощущение распирания под грудной клеткой
- Увеличение лимфатических узлов
- Плохой аппетит
Диагностика острого миелоидного лейкоза
Для диагностики лейкоза требуется проведение исследований костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Чтобы определить распространение опухоли, используют такие исследования:
Лечение острого миелоидного лейкоза
Лечение зависит от типа ОМЛ. Лечение трех форм ОМЛ — острого промиелоцитарного лейкоза (ОПМЛ), ОМЛ у детей с синдромом Дауна и ОМЛ с мутацией FLT3 — проводят иначе, чем лечение других форм ОМЛ. Основным методом лечения ОМЛ является химиотерапия. Трансплантациякостного мозга также может быть вариантом терапии.
1. Индукция
Целью индукционной терапии является уничтожение опухолевых клеток в крови и костном мозге и перевод заболевания в ремиссию. Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицина, в сочетании с этопозидом и/или тиогуанином.
2. Консолидация/интенсификация/постиндукция
Целью этой фазы является уничтожение любых оставшихся опухолевых клеток, которые могут растии вызывать рецидив рака. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. У детей, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, риск рецидива наиболее высок.
Фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые при индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентностью ОМЛ к лечению. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациенту с ОМЛ могут назначить аллогенную трансплантацию.
При такой трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение. Во время трансплантации пациенту внутривенно вводятся здоровые донорские клетки. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Прогноз при лечении острого миелоидного лейкоза
5-летняя выживаемость для детей с ОМЛ составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения отсутствуют раковые клетки в крови. Примерно у 30% детей с ОМЛ происходит рецидив илизаболеваниеоказывается устойчивым к лечению (рефрактерным).
Отдаленные последствия острого миелоидного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОМЛ
- Вторичный рак, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цель современных исследований острого миелоидного лейкоза
Текущие исследования направлены на разработку более эффективных методов лечения форм рака, не реагирующих на первоначальную терапию, новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым тканям, и эффективных методов лечения с меньшим количеством побочных эффектов.
—
Дата изменения: июнь 2018 г.
Острый миелоидный лейкоз (ОМЛ) у детей и подростков
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может привести к высокой температуре, повышенной утомляемости, легкому возникновению гематом, кровотечений, инфекций и других нарушений. Обычно при остром лейкозе симптомы ухудшаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
- В США ежегодно регистрируется около 500 новых случаев заболевания у детей. each year. (Это заболевание гораздо чаще возникает у взрослых.)
- ОМЛ является вторым наиболее распространенным детским лейкозом после острого лимфобластного лейкоза (ОЛЛ).
- ОМЛ у детей чаще всего возникает в первые 2 года жизни и в подростковом возрасте.
- Среди заболевших количество мальчиков и девочек, представителей европеоидной и негроидной рас примерно одинаково.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
- Эритроциты
- Разновидность белых клеток крови — гранулоциты
- Тромбоциты
Признаки и симптомы острого миелоидного лейкоза
Возможные признаки и симптомы ОМЛ:
- Жар
- Сильное чувство усталости
- Инфекции
- Легко возникающие гематомы и кровотечения
- Частые носовые кровотечения
- Трудноостанавливаемое кровотечение, даже из небольшого пореза
- Боль в костях или суставах
- Боль или ощущение распирания под грудной клеткой
- Увеличение лимфатических узлов
- Плохой аппетит
Диагностика острого миелоидного лейкоза
Для диагностики лейкоза требуется проведение исследований костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно высокое количество незрелых белых клеток крови.
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Чтобы определить распространение опухоли, используют такие исследования:
Лечение острого миелоидного лейкоза
Лечение зависит от типа ОМЛ. Лечение трех форм ОМЛ — острого промиелоцитарного лейкоза (ОПМЛ), ОМЛ у детей с синдромом Дауна и ОМЛ с мутацией FLT3 — проводят иначе, чем лечение других форм ОМЛ. Основным методом лечения ОМЛ является химиотерапия. Трансплантациякостного мозга также может быть вариантом терапии.
1. Индукция
Целью индукционной терапии является уничтожение опухолевых клеток в крови и костном мозге и перевод заболевания в ремиссию. Поскольку пациенты с ОМЛ уязвимы для инфекций, им также назначают поддерживающую терапию антибиотиками. В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицина, в сочетании с этопозидом и/или тиогуанином.
2. Консолидация/интенсификация/постиндукция
Целью этой фазы является уничтожение любых оставшихся опухолевых клеток, которые могут растии вызывать рецидив рака. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. У детей, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, риск рецидива наиболее высок.
Фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые при индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентностью ОМЛ к лечению. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациенту с ОМЛ могут назначить аллогенную трансплантацию.
При такой трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение. Во время трансплантации пациенту внутривенно вводятся здоровые донорские клетки. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Прогноз при лечении острого миелоидного лейкоза
5-летняя выживаемость для детей с ОМЛ составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения отсутствуют раковые клетки в крови. Примерно у 30% детей с ОМЛ происходит рецидив илизаболеваниеоказывается устойчивым к лечению (рефрактерным).
Отдаленные последствия острого миелоидного лейкоза
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
- Рецидив ОМЛ
- Вторичный рак, например рак кожи, головного мозга, костей, молочных желез, мягких тканей и щитовидной железы
- Нарушения функции сердца и легких
- Заболевания костей
- Эндокринные заболевания
- Заболевания желудочно-кишечного тракта
- Нарушения психической гибкости, логического мышления, планирования и организации
- Депрессия
- Нарушения сна
Цель современных исследований острого миелоидного лейкоза
Текущие исследования направлены на разработку более эффективных методов лечения форм рака, не реагирующих на первоначальную терапию, новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым тканям, и эффективных методов лечения с меньшим количеством побочных эффектов.
—
Дата изменения: июнь 2018 г.
Хронический миелоидный лейкоз (ХМЛ) у детей и подростков
Существующие методы лечения ХМЛ у детей основаны на опыте лечения взрослых. Тем не менее, в последние несколько лет, особенно с появлением ИТК, растет обеспокоенность тем, что детский хронический миелоидный лейкоз имеет много уникальных особенностей и их необходимо рассматривать и исследовать отдельно.
Эта концепция подтверждается наличием нескольких геномных различий между детьми и взрослыми пациентами, некоторые из которых связаны с ответом на терапию. Дальнейшее исследование этих открытий и оценка их влияния на течение заболевания имеют большое значение для ведения детей с ХМЛ. Например, обнаружение генетических изменений, на которые можно прицельно воздействовать таргетными препаратами параллельно с применением ИТК, что в настоящее время невозможно без трансплантации костного мозга.
Существующие прогностические шкалы, позволяющие предсказывать исход, не учитывают особенностей детей. Систематическое исследование большого числа детей с ХМЛ, получавших ИТК, может помочь получить информацию для улучшения лечения.
До сих пор неизвестно, почему у подгруппы детей с ХМЛ, получавших ИТК, развиваются побочные эффекты. Вероятно, эти ответы опосредуются генетическими факторами организма. Изучение возможных факторов организма, связанных с токсичностью ИТК, может способствовать выявлению подгруппы пациентов, которым может помочь альтернативное лечение, такое как трансплантация костного мозга.
Еще одной областью клинических испытаний является вмешательство, направленное на уменьшение длительных побочных эффектов, например применение гормона роста у детей с низким ростом, обусловленным приемом ИТК. Принимая во внимание ожидаемую долгую продолжительность жизни детей и относительно короткий период — около 15 лет, — в течение которого использовался ИТК, все еще существует неопределенность относительно потенциальных побочных эффектов у пациентов, подвергавшихся воздействию ИТК в течение длительного времени. Поэтому тщательное наблюдение этих детей представляет собой еще одну область исследований. Показания для трансплантации костного мозга являются областью исследований, в которых преимущества и токсичность трансплантата сравниваются с преимуществами контроля заболевания, а также острыми и отдаленными осложнениями, вызванными применением ИТК.
Наконец, приблизительно у 40% пациентов, которые оставались в молекулярной ремиссии в течение нескольких лет, прекращение приема ИТК было связано с безрецидивным состоянием. Областью исследования также являются попытки выявить пациентов, для которых можно безопасно прекратить применение ИТК.
Городская клиническая больница №31 — Пациентам в помощь. Гематологические заболевания. Часть V. Острый лейкоз (страница 2)
Страница 2 из 5
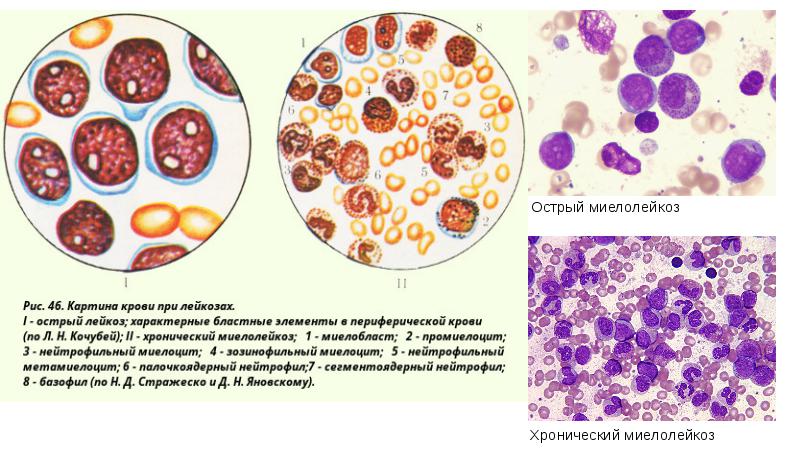
Острый миелобластный (нелимфобластный) лейкоз
Острый миелобластный лейкоз – опухолевая болезнь крови, при которой появляются быстроделящиеся миелоидные клетки-бласты. (О клетках-бластах мы уже рассказали в главе «Острый лейкоз»). Это самый распространенный вид острого лейкоза взрослых.
Диагноз
Чтобы поставить диагноз, необходимо сделать анализ, который называется «проточная цитометрия бластов». С помощью такого анализа можно не только подтвердить, что это именно острый миелобластный лейкоз, но еще и выяснить вариант этого лейкоза. В медицинских документах, указывая диагноз, практические врачи используют ФАБ-классификацию острых миелобластных лейкозов, которую предложила в 1976 году франко-американо-британская рабочая группа ученых. В этой классификации все лейкозы пронумерованы по зрелости больных клеток-предшественников крови: от самых молодых клеток – «М0», до клеток-предшественников постарше – «М7». Сложно сказать, какой вариант лейкоза опаснее для данного больного, не всегда это определяет течение болезни. Важнее определить, есть ли в опухолевых клетках те или иные генетические поломки. Их можно найти при цитогенетическом и молекулярно-генетическом анализе.
Лечение
Все лейкозы лечатся примерно одинаково, химиотерапией. Химиотерапия проходит в 3 этапа: это индукция, консолидация и поддержка. Если лечение идет успешно, то в результате первого этапа происходит полный ответ болезни на лекарства (полная ремиссия) и можно сказать, что пациент стал «временно здоров». В этом случае подавляющее большинство опухолевых клеток погибли, больной чувствует себя значительно лучше, но осталось немного «спящих» опухолевых клеток, поэтому лечение нужно продолжать. Следующий этап называется «консолидация», то есть закрепление достигнутого результата. Как правило, консолидирущую, или «закрепительную» химиотерапию пациент переносит лучше, хотя применяют большие дозы лекарств. В дальнейшем некоторым больным проводят несколько курсов поддерживающей терапии, чтобы небольшими дозами химиопрепаратов уничтожить оставшиеся опухолевые клетки.
Несмотря на то, что чаще всего на начальных этапах химиотерапия действует хорошо и большинство пациентов достигают полного ответа, все же в дальнейшем у многих развивается рецидив, то есть болезнь возвращается. Чтобы избежать этого, молодым пациентам проводят пересадку стволовых клеток крови.
Острый промиелоцитарный лейкоз-М3 считается одним из самых опасных лейкозов, поскольку в начале болезни вероятность тяжелых кровотечений или тромбозов выше, чем при других лейкозах. Однако современная терапия позволяет полностью вылечить около 95% пациентов c М3-вариантом острого лейкоза.
Отметим, что после того, как в крупных городах России начали работать центры трансплантации стволовых клеток крови, результаты лечения наших больных с острыми лейкозами стали гораздо лучше. Они теперь такие же, как в гематологических центрах Северной Америки и Западной Европы.
Острый миелобластный лейкоз у детей. Перспективы оптимизации лечения (обзор литературы) | Румянцев
1. Литвиненко Н.П., Шнейнер М.М., Савва Н.Н. и др. Лечение острого миелолейкоза у детей по протоколу ОМЛ-2000; предварительные результаты исследования кооперированной группы «Россия–Беларусь». Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2006;5(3):23–32. [Litvinko N.P., Shneider M.M., Sawa N.N. et al. Treatment of acute myeloblastic leukemia in children by the AML-MM-2000 protocol: Preliminary results of cooperative Russian–Belarus studies. Voprosy gematologii/onkologii i immunopatologii v pediatrii = Pediatric Hematology/ Oncology and Immunopathology 2006;5(3):23–32. (In Russ.)].
2. Шнейдер М.М. Эффективность риск-адаптированной терапии острого миелоидного лейкоза у детей с использованием режимов интенсивного тайминга и трансплантации гемопоэтических стволовых клеток. Автореф. дис. … канд. мед. наук. М., 2008. 57 с. [Shneider M.M. The effectiveness of risk-adapted therapy of acute myeloid leukemia in children with intensive modes of timing and hematopoietic stem cell transplantation. Dissert. PhD. M., 2008. 57 p. (In Russ.)].
3. Немировченко В.С. Роль вальпроевой и полностью транс-ретиноевой кислот в лечении детей с острыми миелоидными лейкозами. Автореф. дис. … канд. мед. наук. М., 2008. 28 с. [Nemirovchenko V.S. The role of valproic and all-trans retinoic acid in the treatment of children with acute myeloid leukemia. Dissert. PhD. M., 2008. 28 p. (In Russ.)].
4. Баровская Ю.А. Современные аспекты диагностики и лечения острого миелоидного лейкоза у детей. Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2015;14(3):48–54. [Barovskaya Yu.A. Diagnosis and treatment of acute myeloid leukemia in children: Modern aspects. Voprosy gematologii/onkologii i immunopatologii v pediatrii = Pediatric Hematology/Oncology and Immunopathology 2006;5(3):23–32. (In Russ.)].
5. Tsukimoto I., Tawa A., Horibe K. et al. Risk-stratified therapy and the intensive use of cytarabine improves the outcome in childhood acute myeloid leukemia: the AML99 trial from the Japanese Childhood AML Cooperative Study Group. J Clin Oncol 2009;27(24):4007–13.
6. Rubnitz J.E., Inaba H., Dahl G. et al. Minimal residual disease-directed therapy for childhood AML: results of the AML02 multicentre trial. Lancet Oncol 2010;11(6):543–52.
7. Gibson B.E., Webb D.K., Howman A.J. et al. Results of a randomized trial in children with Acute Myeloid Leukaemia: medical research council AML12 trial. Br J Haematol 2011;155(3):366–76.
8. Creutzig U., Zimmermann M., Bourquin J.P. et al. Randomized trial comparing liposomal daunorubicin with idarubicin as induction for pediatric acute myeloid leukemia: results from Study AML-BFM 2004. Blood 2013;122(1):37–43.
9. Pession A., Masetti R., Rizzari C. et al. Results of the AIEOP AML 2002/01 multicenter prospective trial for the treatment of children with acute myeloid leukemia. Blood 2013;122(2):170–8.
10. Vardiman J.W., Thiele J., Arber D.A. et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009;114(5):937–51.
11. Masetti R., Vendemini F., Zama D. et al. Acute myeloid leukemia in infants: biology and treatment. Front Pediatr 2015;3:37.
12. Rubnitz J.E., Inaba H. Childhood acute myeloid leukaemia. Br J Haematol 2012;159(3):259–76.
13. Creutzig U., Zimmermann M., Bourquin J.P. et al. Favorable outcome in infants with AML after intensive first- and second-line treatment: an AML-BFM study group report. Leukemia 2012;26(4):654–61.
14. Balgobind B.V., Hollink I.H., Arentsen-Peters S.T. et al. Integrative analysis of type-I and type-II aberrations underscores the genetic heterogeneity of pediatric acute myeloid leukemia. Haematologica 2011;96(10):1478–87.
15. Hollink I.H., van den Heuvel-Eibrink M.M., Arentsen-Peters S.T. et al. NUP98/ NSD1 characterizes a novel poor prognostic group in acute myeloid leukemia with a distinct HOX gene expression pattern. Blood 2011;118(13):3645–56.
16. Marschalek R. Mechanisms of leukemogenesis by MLL fusion proteins. Br J Haematol 2011;152(2):141–54.
17. Annesley C.E., Brown P. Novel agents for the treatment of childhood acute leukemia. Ther Adv Hematol 2015;6(2):61–79.
18. Juhl-Christensen C., Ommen H.B., Aggerholm A. Genetic and epigenetic similarities and differences between childhood and adult AML. Pediatr Blood Cancer 2012;58(4):525–31.
19. Langemeijer S.M., Jansen J.H., Hooijer J. et al. TET2 mutations in childhood leukemia. Leukemia 2011;25(10):189–92.
20. Inaba H., Rubnitz J.E., Coustan-Smith E. et al. Phase I pharmacokinetic and pharmacodynamic study of the multikinase inhibitor sorafenib in combination with clofarabine and cytarabine in pediatric relapsed/refractory leukemia. J Clin Oncol 2011;29(24):3293–300.
21. Watt T.C., Cooper T. Sorafenib as treatment for relapsed or refractory pediatric acute myelogenous leukemia. Pediatr Blood Cancer 2012;59(4):756–7.
22. Smith C.C., Wang Q., Chin C.S. et al. Validation of ITD mutations in FLT3 as a therapeutic target in human acute myeloid leukaemia. Nature 2012;485(7397):260–3.
23. Ravandi F., Cortes J.E., Jones D. Phase I/II study of combination therapy with sorafenib, idarubicin, and cytarabine in younger patients with acute myeloid leukemia. J Clin Oncol 2010;28(11):1856–62.
24. Deshpande A.J., Chen L., Fazio M. et al. Leukemic transformation by the MLLAF6 fusion oncogene requires the h4K79 methyltransferase Dot1l. Blood 2013;121(13):2533–41.
25. Hasle H., Abrahamsson J., Forestier E. et al. Gemtuzumab ozogamicin as postconsolidation therapy does not prevent relapse in children with AML: results from NOPHO-AML 2004. Blood 2012;120(5):978–84.
26. Gamis A.S., Aplenc R., Alonzo T.A., Sung L. et al. Gemtuzumab Ozogamicin (GO) In Children With De Novo Acute Myeloid Leukemia (AML) Improves EventFree Survival (EFS) By Reducing Relapse Risk – Results From The Randomized Phase III Children’s Oncology Group (COG) Trial, AAML0531. Blood 2013;122:345–55.
27. Ravandi F., Estey E.H., Appelbaum F.R. et al. Gemtuzumab ozogamicin: time to resurrect? J Clin Oncol 2012;30(32):3921–3.
28. Gasiorowski R.E., Clark G.J., Bradstock K., Hart D.N. Antibody therapy for acute myeloid leukaemia. Br J Haematol 2014;164(4):481–95.
29. Gill S., Tasian S.K., Ruella M. et al. Preclinical targeting of human acute myeloid leukemia and myeloablation using chimeric antigen receptor-modified T cells. Blood 2014;123(15):2343–54.
30. Lynn R.C., Poussin M., Kalota A. et al. Targeting of folate receptor β on acute myeloid leukemia blasts with chimeric antigen receptor expressing T-cells. Blood 2015;125(22):3466–76.
31. Cooper T.M., Alonzo T.A., Gerbing R.B. et al. AAML0523: a report from the Children’s Oncology Group on the efficacy of clofarabine in combination with cytarabine in pediatric patients with recurrent acute myeloid leukemia. Cancer 2014;120(16):2482–9.
32. Phillips C.L., Davies S.M., McMasters R. et al. Low dose decitabine in very high risk relapsed or refractory AML in children and young adults. Br J Haematol 2013;161(3):406–10.
33. Pulsipher M.A., Langholz B., Wall D.A. et al. The addition of sirolimus to tacrolimus/methotrexate GVHD prophylaxis in children with ALL: a phase 3 Children’s Oncology Group/Pediatric Blood and Marrow Transplant Consortium trial. Blood 2014;123(13):2017–25.
34. Daver N., Cortes J. Molecular targeted therapy in acute myeloid leukemia. Hematology 2012;17 Suppl 1:S59–62.
35. Попа А.В., Горохова Е.В., Флейшман Е.В. и др. Эпигенетическая терапия – важная составляющая в лечении детей, больных острым миелоидным лейкозом. Клиническая онкогематология 2011;4(1):20–6. [Popa A.V., Gorokhova E.V., Fleyshman E.V. et al. Epigenetic therapy – an important component in the treatment of children with acute myeloid leukemia. Klinicheskaya onkogematologiya = Clinical Oncohematology 2011;4(1):20–6. (In Russ.)].
36. de Rooij J.D.E., Zwaan C.M., van den Heuvel-Eibrink M. Pediatric AML: From Biology to Clinical Management. J Clin Med 2015;4(1):127–49.
37. Рубнитц Дж.Е. Современные стратегии лечения острого миелоидного лейкоза. Российский журнал детской гематологии и онкологии 2016;3(3):47–51. [Rubnitz J.E. Modern strategies in AML treatment. Rossiyskiy zhurnal detskoy gematologii i onkologii = Russian Journal of Pediatric Hematology and Oncology 2016;3(3):47–51. (In Russ.)].
Лечение острого миелоидного лейкоза у взрослых (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении острого миелоидного лейкоза у взрослых.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно пересматривается и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно. Тем не менее, пользователю будет разрешено написать предложение, например: «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение острого миелоидного лейкоза у взрослых. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/leukemia/patient/adult-aml-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389377]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца.Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховании можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Подробнее о том, как связаться с нами или получить помощь при раке.gov можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Острый миелолейкоз — симптомы и причины
Обзор
Острый миелогенный лейкоз (ОМЛ) — это рак крови и костного мозга — губчатой ткани внутри костей, где образуются клетки крови.
Слово «острый» при остром миелолейкозе означает быстрое прогрессирование болезни.Это называется миелогенным (my-uh-LOHJ-uh-nus) лейкозом, потому что он влияет на группу белых кровяных телец, называемых миелоидными клетками, которые обычно развиваются в различные типы зрелых кровяных телец, такие как красные кровяные тельца, белые кровяные тельца. и тромбоциты.
Острый миелолейкоз также известен как острый миелоидный лейкоз, острый миелобластный лейкоз, острый гранулоцитарный лейкоз и острый нелимфоцитарный лейкоз.
Продукты и услуги
Показать больше товаров от Mayo ClinicСимптомы
Общие признаки и симптомы ранних стадий острого миелолейкоза могут имитировать симптомы гриппа или других распространенных заболеваний.
Признаки и симптомы острого миелолейкоза включают:
- Лихорадка
- Боль в костях
- Вялость и утомляемость
- Одышка
- Бледная кожа
- Частые инфекции
- Легкие синяки
- Необычное кровотечение, такое как частое носовое кровотечение и кровотечение из десен
Когда обращаться к врачу
Запишитесь на прием к врачу, если у вас появятся какие-либо признаки или симптомы, которые кажутся необычными или беспокоят вас.
Причины
Острый миелолейкоз возникает, когда в клетке костного мозга развиваются изменения (мутации) в своем генетическом материале или ДНК. ДНК клетки содержит инструкции, которые говорят клетке, что ей делать. Обычно ДНК говорит клетке расти с заданной скоростью и умереть в заданное время. При остром миелолейкозе мутации заставляют клетку костного мозга продолжать расти и делиться.
Когда это происходит, производство клеток крови выходит из-под контроля.Костный мозг производит незрелые клетки, которые развиваются в лейкемические лейкоциты, называемые миелобластами. Эти аномальные клетки не могут функционировать должным образом, они могут накапливаться и вытеснять здоровые клетки.
Неясно, что вызывает мутации ДНК, которые приводят к лейкемии, но врачи выявили факторы, увеличивающие риск.
Факторы риска
Факторы, которые могут увеличить риск острого миелогенного лейкоза (ОМЛ), включают:
- С возрастом. Риск острого миелолейкоза увеличивается с возрастом. Острый миелолейкоз чаще всего встречается у взрослых в возрасте 65 лет и старше.
- Ваш пол. Мужчины более склонны к развитию острого миелолейкоза, чем женщины.
- Предыдущее лечение рака. Люди, прошедшие определенные виды химиотерапии и лучевой терапии, могут иметь больший риск развития AML .
- Воздействие радиации. Люди, подвергшиеся воздействию очень высоких уровней радиации, например выжившие после аварии на ядерном реакторе, имеют повышенный риск развития AML .
- Опасное химическое воздействие. Воздействие определенных химических веществ, таких как бензол, связано с повышенным риском AML .
- Курение. AML связан с сигаретным дымом, который содержит бензол и другие известные канцерогенные химические вещества.
- Другие болезни крови. Люди, у которых было другое заболевание крови, такое как миелодисплазия, миелофиброз, истинная полицитемия или тромбоцитемия, подвержены большему риску развития AML .
- Генетические нарушения. Определенные генетические нарушения, такие как синдром Дауна, связаны с повышенным риском AML .
Многие люди с AML не имеют известных факторов риска, а многие люди, у которых есть факторы риска, никогда не заболевают раком.
10 февраля 2021 г.
Причины, симптомы, диагностика и лечение
Что такое острый миелоидный лейкоз?
Острый миелоидный лейкоз (ОМЛ) — это тип рака крови.Это начинается в вашем костном мозге, мягких внутренних частях костей. ОМЛ обычно начинается в клетках, которые превращаются в белые кровяные тельца, но он может начаться и в других кроветворных клетках.
При остром лейкозе, таком как ОМЛ, клетки костного мозга не растут так, как должны. Эти незрелые клетки, называемые бластами, накапливаются в вашем теле.
Вы можете услышать и другие названия острого миелоидного лейкоза, в том числе:
- Острый миелоцитарный лейкоз
- Острый миелогенный лейкоз
- Острый гранулоцитарный лейкоз
- Острый нелимфоцитарный лейкоз
Если вы не получите лечение быть опасным для жизни.Он может быстро распространиться в вашу кровь и другие части вашего тела, например:
- Лимфатические узлы
- Печень
- Селезенка
- Головной и спинной мозг
- Яички
Насколько острый миелоидный лейкоз влияет на вас, зависит от определенные вещи, в том числе то, насколько хорошо он реагирует на лечение. Ваш прогноз будет лучше, если:
- Вы моложе 60 лет.
- У вас более низкое количество лейкоцитов на момент постановки диагноза.
- У вас не было других заболеваний крови или рака.
- У вас нет определенных изменений в генах или хромосомах.
Причины и факторы риска ОМЛ
Врачи часто не знают, почему кто-то заболевает ОМЛ. Но некоторые вещи могут повысить вероятность того, что вы его получите. Факторы риска острого миелоидного лейкоза включают:
- Курение
- Контакт с определенными химическими веществами, такими как бензол (растворитель, который используется на нефтеперерабатывающих заводах и в других отраслях промышленности и содержится в сигаретном дыме), пестициды, ионизирующее излучение, некоторые чистящие средства, моющие средства и средства для удаления краски
- Некоторые химиотерапевтические препараты, используемые для лечения других видов рака, такие как циклофосфамид, доксорубицин, мелфалан и митоксантрон
- Воздействие высоких доз радиации
- Определенные состояния крови, такие как миелопролиферативные заболевания (например, хронический миелогенный лейкоз) )
- Родитель или брат или сестра, у которых был ОМЛ
- Определенные генетические синдромы, такие как синдром Дауна, трисомия 8, нейрофиброматоз типа 1 и синдром Ли-Фраумени.
Невозможно предотвратить ОМЛ, но вы можете снизить риск, отказавшись от курения и ограничив контакт с химическими веществами.
Симптомы ОМЛ
Острый миелоидный лейкоз часто начинается с гриппоподобных симптомов. У вас могут быть:
- Усталость
- Лихорадка
- Снижение веса или потеря аппетита
- Головные боли
- Необычное кровотечение или синяк
- Маленькие красные пятна на коже (петехии)
- Отек десен
- Отек печени или селезенки
- Больше инфекций, чем обычно
Диагноз AML
Ваш врач спросит о вашей истории болезни.Они проведут медицинский осмотр на предмет признаков кровотечения, синяков или инфекции. У вас могут быть анализы, в том числе:
- Анализы крови. Полный анализ крови показывает, сколько у вас клеток крови каждого типа. Мазок периферической крови проверяет наличие бластных клеток.
- Визуальные тесты. Рентген, компьютерная томография, МРТ и ультразвук дают более четкое представление о том, что происходит внутри вас. Они могут помочь обнаружить инфекции или показать, когда рак распространился на другие части вашего тела.
- Исследования костного мозга. Ваш врач с помощью иглы берет образец костного мозга, крови и кости из бедра или грудины. Специалист смотрит на него под микроскопом на предмет лейкемии.
- Спинальный метчик. Это также называется люмбальной пункцией. Ваш врач использует иглу, чтобы взять немного спинномозговой жидкости из спинного мозга. Специалист проверяет его на наличие лейкозных клеток.
- Генетические тесты. Лаборатория может проверить ваши лейкозные клетки на предмет изменений генов или хромосом.Результаты расскажут вашему врачу больше о вашем AML, чтобы он мог помочь вам выбрать лучшее лечение.
Лечение ОМЛ
Поскольку острый миелоидный лейкоз быстро развивается, важно немедленно начать лечение. Это будет зависеть от нескольких факторов, в том числе от того, какой у вас AML, как далеко он распространился, и от вашего общего состояния здоровья.
У вас будет два этапа лечения:
- Индукционная терапия ремиссии. Это нацелено на уничтожение лейкозных клеток в крови и костном мозге, чтобы вы вступили в ремиссию без каких-либо признаков заболевания.
- Консолидационная терапия. Это также называется терапией после ремиссии или продолжением ремиссии. Он предназначен для уничтожения оставшихся лейкозных клеток, чтобы болезнь не вернулась.
В любой фазе вы можете пройти один или несколько видов лечения:
- Химиотерапия. Некоторые лекарства могут убивать раковые клетки или препятствовать их делению. Вы можете принимать эти лекарства внутрь, через капельницу или через инъекцию в другую часть тела.
- Радиация. Рентгеновские лучи высокой энергии также могут останавливать раковые клетки. Ваш врач может использовать большую машину, чтобы направить радиацию на рак. Или они могут вставить радиоактивную иглу, семя или проволоку в ваше тело на раке или рядом с ним.
- Пересадка стволовых клеток. Поскольку лечение ОМЛ также может убивать здоровые клетки, вы можете получить стволовые клетки, которые могут перерасти в клетки крови. Они могут исходить от вас или от другого человека.
- Таргетная терапия. Использует лекарства для атаки определенных генов и белков, участвующих в росте и распространении раковых клеток.
- Прочие лекарства. Лекарства под названием триоксид мышьяка (Trisenox) и полностью транс-ретиноевая кислота (ATRA) нацелены на раковые клетки при типе AML, который называется острым промиелоцитарным лейкозом.
Вы также можете присоединиться к изучению новых методов лечения. Эти клинические испытания часто являются способом опробовать новое лекарство, доступное далеко не каждому. Ваш врач может сказать вам, подходит ли вам одно из этих исследований.
Перед тем, как подписаться, попросите информацию о том, что будет вовлечено, каковы будут риски и преимущества.
Хронический миелоидный лейкоз | Общество лейкемии и лимфомы
Хронический миелоидный лейкоз (ХМЛ)
- Рак костного мозга и крови
- ХМЛ обычно диагностируется в его хронической фазе, когда лечение очень эффективно для большинства пациентов
- CML имеет три фазы
Щелкните здесь, чтобы получить доступ к статистике CML.
Что следует знать
- Хронический миелоидный лейкоз (ХМЛ) также называют хроническим миелолейкозом, хроническим гранулоцитарным лейкозом и хроническим миелоцитарным лейкозом.ХМЛ — один из четырех основных типов лейкемии.
- Гематологи и онкологи — это специалисты, которые лечат людей с ХМЛ или другими видами рака крови.
- Большинство пациентов с ХМЛ получают ежедневную пероральную лекарственную терапию.
- С момента введения терапии ингибиторами тирозинкиназы (TKI) в 2001 году ХМЛ превратился из опасного для жизни заболевания в управляемое хроническое состояние для большинства пациентов. Люди живут дольше с ХМЛ и испытывают меньше побочных эффектов лечения.
Что делать
- Поговорите со своим врачом о ваших диагностических тестах и о том, что означают их результаты.
- Убедитесь, что ваш врач постоянно следит за вашей реакцией на лекарства, что необходимо для контроля над вашим ХМЛ.
Чтобы загрузить списки предлагаемых вопросов, которые следует задать вашим поставщикам медицинских услуг, щелкните здесь.
Как развивается CML?
ДНК (генетический материал) развивающейся стволовой клетки в костном мозге повреждена.Это называется «приобретенная мутация».
- Стволовые клетки образуют клетки крови (эритроциты, лейкоциты и тромбоциты).
Эта поврежденная клетка становится лейкемической клеткой и размножается во многие клетки ХМЛ. Клетки ХМЛ растут и выживают лучше, чем нормальные клетки.
- ХМЛ не мешает полностью развитию зрелых эритроцитов, лейкоцитов и тромбоцитов. Таким образом, хроническая фаза ХМЛ обычно менее тяжелая, чем острый лейкоз.
В результате количество здоровых кровяных телец (эритроцитов, лейкоцитов и тромбоцитов) обычно ниже нормы.
- Анемия — это состояние, при котором в крови содержится небольшое количество эритроцитов, которое может вызвать усталость и одышку.
- Нейтропения — это состояние, при котором количество лейкоцитов невелико, поэтому иммунная система не может эффективно защищаться от инфекции из-за недостатка нейтрофилов (тип лейкоцитов).
- Тромбоцитопения — это состояние, при котором низкое количество тромбоцитов может вызвать кровотечение и легкие синяки без видимой причины.
- Низкое количество всех трех клеток крови называется панцитопенией.
Филадельфийская хромосома и
BCR-ABL1 Fusion GeneИногда ошибки возникают в процессе копирования ячейки или деления на новые ячейки. Один из типов ошибок называется «перемещением». Транслокация происходит, когда часть одной хромосомы отрывается и прикрепляется к другой хромосоме.Это может привести к «гену слияния», ненормальному гену, который образуется, когда два разных гена сливаются вместе.
Все случаи ХМЛ вызваны гибридным геном BCR-ABL1 . Этот ген не встречается в нормальных клетках крови.
Ген BCR-ABL1 образуется в результате транслокации между частями хромосом 9 и 22 в одной клетке костного мозга во время деления клетки. Аномальная хромосома 22 называется филадельфийской хромосомой (Ph-хромосома). Более 95 процентов пациентов с ХМЛ имеют Ph-хромосому.
Геныпредоставляют инструкции по производству белков. Онкоген BCR-ABL1 продуцирует аномальный белок, называемый «тирозинкиназа BCR-ABL1», который приводит к развитию клеток CML.
Для получения дополнительной информации обратитесь к бесплатному информационному буклету «Хронический миелоидный лейкоз».
Факторы риска
Для большинства людей, страдающих хроническим миелоидным лейкозом (ХМЛ), нет очевидных причин, по которым у них развивается это заболевание. Никто не рождается с ХМЛ.Это происходит, когда есть повреждение ДНК одной клетки костного мозга. Факторы риска ХМЛ:
- Пол — ХМЛ несколько чаще встречается у мужчин, чем у женщин.
- Возраст. Риск развития ХМЛ увеличивается с возрастом.
- Облучение — У небольшого числа пациентов ХМЛ вызывается воздействием очень высоких доз радиации (например, выжившим после взрыва атомной бомбы или аварии на ядерном реакторе). Небольшое увеличение риска также наблюдается у некоторых людей, получающих высокодозную лучевую терапию от других видов рака, таких как лимфома.У большинства людей, леченных от рака с помощью радиации, ХМЛ не развивается, и большинство людей с ХМЛ не подвергались воздействию высоких доз радиации. Воздействие диагностических стоматологических или медицинских рентгеновских лучей не было связано с повышенным риском ХМЛ.
Источник: Хронический миелоидный лейкоз. Отзыв Майкл Дейнингер, доктор медицины, доктор философии
Острый миелоидный лейкоз | Общество лейкемии и лимфомы
Острый миелоидный лейкоз (ОМЛ)
- Рак костного мозга и крови
- Быстро прогрессирует без лечения
- Поражает в основном не полностью развитые клетки — эти клетки не могут выполнять свои нормальные функции
- Заболевание, которое трудно вылечить.Исследователи изучают новые подходы к терапии ОМЛ в клинических испытаниях.
Щелкните здесь, чтобы получить доступ к статистике AML.
Что следует знать
- Очень важно обсудить с врачом наиболее подходящий для вас вариант лечения.
- У некоторых пациентов ОМЛ излечим современными методами лечения.
- Исследователи изучают новые подходы к терапии в клинических испытаниях.
- Гематологи и онкологи — это специалисты, которые лечат людей с ОМЛ или другими видами рака крови.
Что делать
- Обратитесь за помощью в онкологический центр, где врачи имеют опыт лечения пациентов с острым лейкозом.
- Поговорите со своим врачом о
- Ваши диагностические тесты
- Что означают результаты испытаний
- Все варианты лечения
- Результаты, которых можно ожидать от лечения.
Чтобы загрузить списки предлагаемых вопросов, которые следует задать вашим поставщикам медицинских услуг, щелкните здесь.
Как развивается ПОД?
ДНК (генетический материал) развивающейся стволовой клетки в костном мозге повреждена. Это называется «приобретенная мутация».
- Стволовые клетки образуют клетки крови (эритроциты, лейкоциты и тромбоциты).
Эта поврежденная клетка становится лейкемической клеткой и размножается до миллиардов клеток, называемых лейкемическими бластами.
- Лейкозные взрывы
- Не работает нормально
- Блокировать производство нормальных клеток
- Растут и выживают лучше, чем нормальные клетки
В результате количество здоровых кровяных телец (эритроцитов, лейкоцитов и тромбоцитов) обычно ниже нормы.
- Анемия — это состояние, при котором в крови содержится небольшое количество эритроцитов, которое может вызвать усталость и одышку.
- Нейтропения — это состояние, при котором количество лейкоцитов невелико, поэтому иммунная система не может эффективно защищаться от инфекции из-за недостатка нейтрофилов (тип лейкоцитов).
- Тромбоцитопения — это состояние, при котором низкое количество тромбоцитов может вызвать кровотечение и легкие синяки без видимой причины.
- Низкое количество всех трех клеток крови называется панцитопенией.
Факторы риска
Причина большинства случаев AML неизвестна. Для большинства людей, страдающих ОМЛ, нет очевидных причин (факторов риска), по которым у них развилось заболевание. Вы не можете заразиться AML от кого-то другого.
Исследователи определили потенциальные факторы риска, в том числе:
- Повторное воздействие химического бензола, , который повреждает ДНК нормальных клеток костного мозга.По данным Агентства по регистрации токсичных веществ и заболеваний, половина общего воздействия бензола на человека в стране происходит из-за сигаретного дыма, несмотря на то, что нефтепродукты составляют большую часть бензола в атмосфере. Бензол также содержится в некоторых промышленных предприятиях; однако строгое регулирование его использования снизило воздействие бензола на рабочем месте.
- Определенные генетические нарушения , такие как синдром Дауна, нейрофиброматоз 1 типа, синдром Блума, трисомия 8, анемия Фанкони, синдром Клайнфельтера, синдром Вискотта-Олдрича, синдром Костмана и синдром Швахмана-Даймонда.
- Прошедшие курс химиотерапии или лучевой терапии для других видов рака.
- Прогрессирование других видов рака или заболеваний крови , истинная полицитемия, первичный миелофиброз, эссенциальная тромбоцитемия и миелодиспластические синдромы (МДС).
Источник: Острый миелоидный лейкоз. Автор отзыва: Олатойози Оденике, доктор медицины.
Острый миелоидный лейкоз | AML
Что такое лейкемия?
Лейкемия — это термин, обозначающий рак клеток крови.Лейкемия начинается в кроветворных тканях, таких как костный мозг. Костный мозг вырабатывает клетки, которые превращаются в лейкоциты, эритроциты и тромбоциты. У каждого типа ячейки своя работа:
- Белые кровяные тельца помогают организму бороться с инфекцией
- Красные кровяные тельца доставляют кислород из легких в ткани и органы
- Тромбоциты способствуют образованию тромбов, останавливающих кровотечение
Когда у вас лейкемия, ваш костный мозг производит большое количество аномальных клеток.Эта проблема чаще всего возникает с лейкоцитами. Эти аномальные клетки накапливаются в костном мозге и крови. Они вытесняют здоровые клетки крови и мешают вашим клеткам и крови выполнять свою работу.
Что такое острый миелоидный лейкоз (ОМЛ)?
Острый миелоидный лейкоз (ОМЛ) — это разновидность острого лейкоза. «Острый» означает, что лейкемия обычно быстро ухудшается, если ее не лечить. При ОМЛ костный мозг производит аномальные миелобласты (тип лейкоцитов), эритроциты или тромбоциты.Когда аномальные клетки вытесняют здоровые, это может привести к инфекции, анемии и легкому кровотечению. Аномальные клетки также могут распространяться вне крови в другие части тела.
Существует несколько различных подтипов AML. Подтипы основаны на том, насколько развиты раковые клетки на момент постановки диагноза и насколько они отличаются от нормальных клеток.
Что вызывает острый миелоидный лейкоз (ОМЛ)?
AML возникает, когда есть изменения в генетическом материале (ДНК) в клетках костного мозга.Причина этих генетических изменений неизвестна. Однако есть определенные факторы, которые повышают риск AML.
Кто подвержен риску острого миелоидного лейкоза (ОМЛ)?
Факторы, повышающие риск AML, включают
Каковы симптомы острого миелоидного лейкоза (ОМЛ)?
Признаки и симптомы ОМЛ включают
- Лихорадка
- Одышка
- Легкие синяки или кровотечения
- Петехии — крошечные красные точки под кожей.Они вызваны кровотечением.
- Слабость или чувство усталости
- Похудание или потеря аппетита
- Боль в костях или суставах, если аномальные клетки накапливаются рядом с костями или внутри них
Как диагностируется острый миелоидный лейкоз (ОМЛ)?
Ваш лечащий врач может использовать множество инструментов для диагностики AML и определения вашего подтипа:
- Физический осмотр
- История болезни
- Анализы крови, такие как общий анализ крови (CBC) и мазок крови
- Исследования костного мозга.Есть два основных типа — аспирация костного мозга и биопсия костного мозга. Оба теста включают взятие образца костного мозга и кости. Образцы отправляются в лабораторию для тестирования.
- Генетические тесты для поиска изменений генов и хромосом
Если вам поставили диагноз AML, вам могут потребоваться дополнительные тесты, чтобы определить, распространился ли рак. К ним относятся визуализирующие обследования и люмбальная пункция, которая представляет собой процедуру сбора и анализа спинномозговой жидкости (CSF).
Какие методы лечения острого миелоидного лейкоза (ОМЛ)?
Лечение ОМЛ включает
Какое лечение вы чаще всего получаете, зависит от того, какой у вас подтип AML.Лечение обычно проводится в два этапа:
- Цель первой фазы — убить лейкозные клетки в крови и костном мозге. Это приводит к ремиссии лейкемии. Ремиссия означает, что признаки и симптомы рака уменьшились или исчезли.
- Вторая фаза известна как терапия после ремиссии. Его цель — предотвратить рецидив (возврат) рака. Он включает в себя уничтожение всех оставшихся лейкозных клеток, которые могут быть неактивными, но могут начать расти заново.
NIH: Национальный институт рака
Типы лейкемии: общие, редкие и другие разновидности
Лейкоз классифицируется по типу пораженных лейкоцитов и по скорости прогрессирования заболевания. Лимфоцитарный лейкоз (также известный как лимфоидный или лимфобластный лейкоз) развивается в белых кровяных тельцах, называемых лимфоцитами, в костном мозге. Миелоидный (также известный как миелогенный) лейкоз может также начаться в белых кровяных тельцах, помимо лимфоцитов, а также в красных кровяных тельцах и тромбоцитах.
С точки зрения скорости развития или ухудшения лейкемии лейкоз подразделяется на острый (быстрорастущий) или хронический (медленнорастущий). Острый лейкоз быстро прогрессирует и приводит к накоплению незрелых, лишенных функций клеток крови в костном мозге. При этом типе лейкемии клетки воспроизводятся и накапливаются в костном мозге, снижая способность костного мозга производить достаточно здоровых клеток крови. Хронический лейкоз прогрессирует медленнее и приводит к накоплению относительно зрелых, но все еще аномальных лейкоцитов.Как правило, требуется больше времени, чтобы вызвать заметные проблемы, чем при остром лейкозе. Однако хронический, медленно растущий лейкоз лечить труднее.
Согласно данным Программы надзора, эпидемиологии и конечных результатов Национального института рака (SEER), хронический лимфолейкоз является наиболее распространенным типом в США, за ним следуют острый миелоидный лейкоз, хронический миелоидный лейкоз и острый лимфолейкоз.
Объяснение типов лейкемии
Острый лимфоцитарный лейкоз (ОЛЛ) быстро прогрессирует, заменяя здоровые клетки, производящие функциональные лимфоциты, лейкозными клетками, которые не могут созреть должным образом.Клетки лейкемии переносятся с кровотоком в другие органы и ткани, включая мозг, печень, лимфатические узлы и яички, где они продолжают расти и делиться. Рост, деление и распространение этих лейкозных клеток может привести к ряду возможных симптомов, некоторые из которых могут напоминать грипп. Среди других симптомов они включают усталость, одышку, лихорадку, легкие синяки или кровотечения.
ОЛЛ развивается, когда изменения в ДНК (мутации) заставляют костный мозг производить слишком много аномальных лимфоцитов (тип лейкоцитов).Предполагается, что лимфоциты помогают бороться с инфекциями, но те, которые вырабатываются у людей с ОЛЛ, не могут справиться с этим должным образом. Размножение этих аномальных клеток вытесняет и другие типы здоровых клеток крови.
Неизвестно, что именно вызывает мутации, приводящие к ОЛЛ, но определенные факторы могут увеличить риск. Факторы риска для ВСЕХ включают:
- Мужчина, белый, старше 70 лет
- Имеющий в анамнезе химиотерапию или лучевое облучение.
ОЛЛ можно диагностировать с помощью анализов крови, аспирации и биопсии костного мозга, которые включают извлечение образца костного мозга и крошечного кусочка кости с последующим изучением клеток под микроскопом.
Некоторые из распространенных вариантов лечения ВСЕХ включают:
Узнать больше про ВСЕ
Острый миелоидный лейкоз (ОМЛ) , также известный как острый миелогенный лейкоз, острый миелобластный лейкоз, острый гранулоцитарный лейкоз или острый нелимфоцитарный лейкоз, является быстрорастущей формой рака крови и костного мозга.
Как и ВСЕ, ОМЛ заставляет костный мозг чрезмерно производить аномальные белые кровяные тельца, скапливая здоровые кровяные клетки и влияя на способность организма бороться с инфекциями.
Факторы риска AML включают:
- Быть мужчиной
- Курение
- Прошедшие курс химиотерапии или облучение
Некоторые симптомы могут напоминать грипп, например, лихорадка, усталость и ночная потливость. К другим относятся легкие синяки или кровотечения и потеря веса.Анализы крови, аспирация и биопсия костного мозга входят в число тестов, которые могут быть выполнены для диагностики этого рака.
Лечение может включать:
- Химиотерапия
- Лучевая терапия
- Пересадка стволовых клеток
- Таргетная терапия
Подробнее о ПОД
Хронический лимфолейкоз (ХЛЛ) — это обычно медленно растущий рак, который начинается в лимфоцитах костного мозга и распространяется в кровь.Он также может распространяться на лимфатические узлы и органы, такие как печень и селезенка. ХЛЛ развивается, когда растет слишком много аномальных лимфоцитов, вытесняя нормальные клетки крови и затрудняя организму борьбу с инфекцией.
По данным Американского онкологического общества (ACS), около 25 процентов всех случаев лейкемии связаны с ХЛЛ, и примерно у каждого из 175 человек может развиться ХЛЛ в течение своей жизни. ХЛЛ похож на ВСЕ, но он хронический, а не острый, а это означает, что он более медленно растет и дольше вызывает симптомы.
Когда это действительно вызывает симптомы, они могут включать увеличение лимфатических узлов (шеи, подмышек, желудка или паха), усталость, лихорадку, инфекцию, потерю веса и многое другое. Для диагностики ХЛЛ можно использовать различные анализы крови.
CLL может не нуждаться в немедленном лечении, а скорее в наблюдении за любыми проблемами и изменениями, после чего потребность в лечении может быть пересмотрена. Общие варианты лечения включают:
Узнать больше о CLL
Хронический миелоидный лейкоз (ХМЛ) , также известный как хронический миелолейкоз, начинается в кроветворных клетках костного мозга и затем со временем распространяется в кровь.Со временем болезнь распространяется на другие части тела.
ХМЛ растет медленно, но как только он начинает вызывать симптомы, они могут включать усталость, жар, потерю веса и увеличение селезенки. Примерно половина случаев ХМЛ диагностируется с помощью анализа крови до появления симптомов. По данным ACS, около 15 процентов лейкозов — это ХМЛ.
Варианты лечения включают:
- Таргетная терапия
- Химиотерапия
- Иммунотерапия
- Пересадка стволовых клеток
Подробнее о CML
Более редкие формы лейкемии
Среди множества различных типов лейкемии одни встречаются реже, чем другие.Три более редких типа лейкемии — пролимфоцитарный лейкоз (PLL), лейкоз крупных гранулярных лимфоцитов (LGL) и волосатоклеточный лейкоз (HCL) — имеют некоторые из тех же характеристик, что и лимфоцитарный лейкоз, и иногда считаются подтипами хронического или острого лимфолейкоза (CLL и ALL). ). Миелодиспластические синдромы — это состояния, связанные с лейкемией, которые также встречаются редко.
Пролимфоцитарный лейкоз (PLL) может развиваться вместе с ХЛЛ или самостоятельно, но обычно прогрессирует быстрее, чем типичный ХЛЛ.Он отмечен увеличением незрелых лимфоцитов. Если это вызывает симптомы, они могут быть похожи на другие типы лейкемии (симптомы гриппа, легкие синяки, необъяснимая потеря веса). Диагностика может включать анализы крови, а также аспирацию костного мозга и биопсию. PLL обычно хорошо поддается лечению, и варианты лечения могут напоминать те, которые используются для лечения CLL. Однако рецидивы случаются часто.
Крупнозернистые лимфоциты (LGL) лейкоз — это хронический тип лейкемии, при котором в организме вырабатываются аномально большие лимфоциты.К тому времени, когда пациенту ставится диагноз этого состояния, симптомы, как правило, уже присутствуют, включая симптомы гриппа, частые инфекции и необъяснимую потерю веса. Люди с аутоиммунными заболеваниями более подвержены риску развития LGL. Диагностика может включать анализы крови, аспирацию костного мозга и биопсию. Большинству пациентов требуется лечение вскоре после постановки диагноза, которое может включать препараты, подавляющие иммунную систему. Другие могут отложить лечение, чтобы увидеть, не возникнут ли проблемы.Лечение LGL не стандартизировано, и пациентам могут потребоваться разные варианты в зависимости от их состояния.
Волосатоклеточный лейкоз (HCL) — редкий подтип хронического лимфоцитарного лейкоза (CLL), который прогрессирует медленно. По оценкам Американского общества клинической онкологии, около 700 человек ежегодно получают диагноз HCL. HCL возникает, когда костный мозг производит слишком много B-клеток (лимфоцитов), типа белых кровяных телец, которые борются с инфекцией. По мере увеличения количества лейкозных клеток вырабатывается меньше здоровых лейкоцитов, красных кровяных телец и тромбоцитов.Слово «волосатый» происходит от вида производимых клеток. Под микроскопом кажется, что клетки HCL имеют тонкие, похожие на волосы наросты.
Симптомы HCL могут быть похожи на другие типы лейкемии и напоминать грипп. Первичные диагностические инструменты — аспирация костного мозга, биопсия и анализы крови.
HCL часто не нужно лечить немедленно, и пациенты находятся под наблюдением на предмет проблемных изменений, требующих лечения. Когда возникают осложнения, связанные с HCL, такие как низкое количество клеток крови, частые инфекции или отек лимфатических узлов, обычно используется химиотерапия.
Узнать больше о HCL
Миелодиспластические синдромы (МДС) — это группа тесно связанных заболеваний, при которых костный мозг производит слишком мало функционирующих эритроцитов (которые переносят кислород), лейкоцитов (которые борются с инфекцией) или тромбоцитов (которые предотвращают или останавливают кровотечение). ) или любую их комбинацию. Различные типы миелодиспластических синдромов диагностируются на основании определенных изменений в клетках крови и костном мозге.