|
По данным ВОЗ висцеральный и кожный лейшманиозы отнесены к «забытым тропическим болезням». Однако на территории Российской Федерации ежегодно регистрируются завозные случаи. Лейшманиозы вызываются простейшими (род Leishmania) внутриклеточными паразитами – это природно-очаговое, зоонозное, трансмиссивное заболевание человека, то есть для их возникновения нужен переносчик – москит. Различают две группы лейшманиозов человека: висцеральный, или кала-азар (поражение органов ретикуло-эндотелиальной системы: печени, селезенки, костного мозга, лимфатических узлов) и кожный, или болезнь Боровского (локальные патологические изменения кожи, иногда слизистых). Инкубационный период при кожном зоонозном 10-20 дней, может сокращаться до недели и удлиняться до полутора месяцев. При висцеральном лейшманиозе составляет от 20 дней до нескольких (3-5) месяцев. Иногда (довольно редко) затягивается до года Ежегодно в мире (в тропиках и субтропиках): По данным ВОЗ регистрируется около 90% случаев в странах мира: Завозные случаи лейшманиоза регистрируются и в Российской Федерации. 1. Меры по благоустройству населенных пунктов, ликвидация мест расселения москитов (свалок и пустырей, затопленных подвальных помещений), дезинсекция жилых помещений.  2. Индивидуальная профилактика заключается в использовании репеллентов и других средств защиты от укусов москитов при выезде в эндемичные страны. 3. Специфическая иммунопрофилактика (вакцинация) рекомендуется лицам, планирующим посещение эндемичных по кожному лейшманиозу территорий за 3 месяца до выезда, а также неимунному населению очагов инфекции. 4. При обнаружении больного производят химиопрофилактику пириметамином в коллективе. |
Лечение кожного лейшманиоза — все способы лечения
Инфекционисты Москвы — последние отзывы

Марина, 07 октября 2021
Прием состоялся вовремя, на высшем уровне. Доктор сделал все необходимые процедуры на приеме. Кирилл Александрович уважительный, тактичный, грамотный специалист. По итогу приема я получил необходимую справку перед операцией.
Сергей, 07 октября 2021
Обычный врач.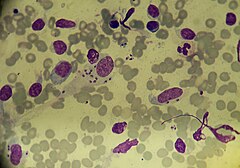 Ничего не могу сказать плохого и восторженного. Доктор направила сдать мне такие анализы, которые я пока найти не могу. По этому считаю, что пока специалист мне никак не помогла. Потому, что таких анализов в Москве пока никто не знает. По приёму у меня претензий нет. Внимательный врач. Светлана Сергеевна выслушала меня от начала до конца и вошла в моё положение. Это вот мне и понравилось. Просто она больше инфекционист, по этому не всё знает по моей проблеме.
Ничего не могу сказать плохого и восторженного. Доктор направила сдать мне такие анализы, которые я пока найти не могу. По этому считаю, что пока специалист мне никак не помогла. Потому, что таких анализов в Москве пока никто не знает. По приёму у меня претензий нет. Внимательный врач. Светлана Сергеевна выслушала меня от начала до конца и вошла в моё положение. Это вот мне и понравилось. Просто она больше инфекционист, по этому не всё знает по моей проблеме.
На модерации, 08 октября 2021
Приём прошёл очень хорошо. Ирина Викторовна грамотный, хороший врач, очень мне понравился.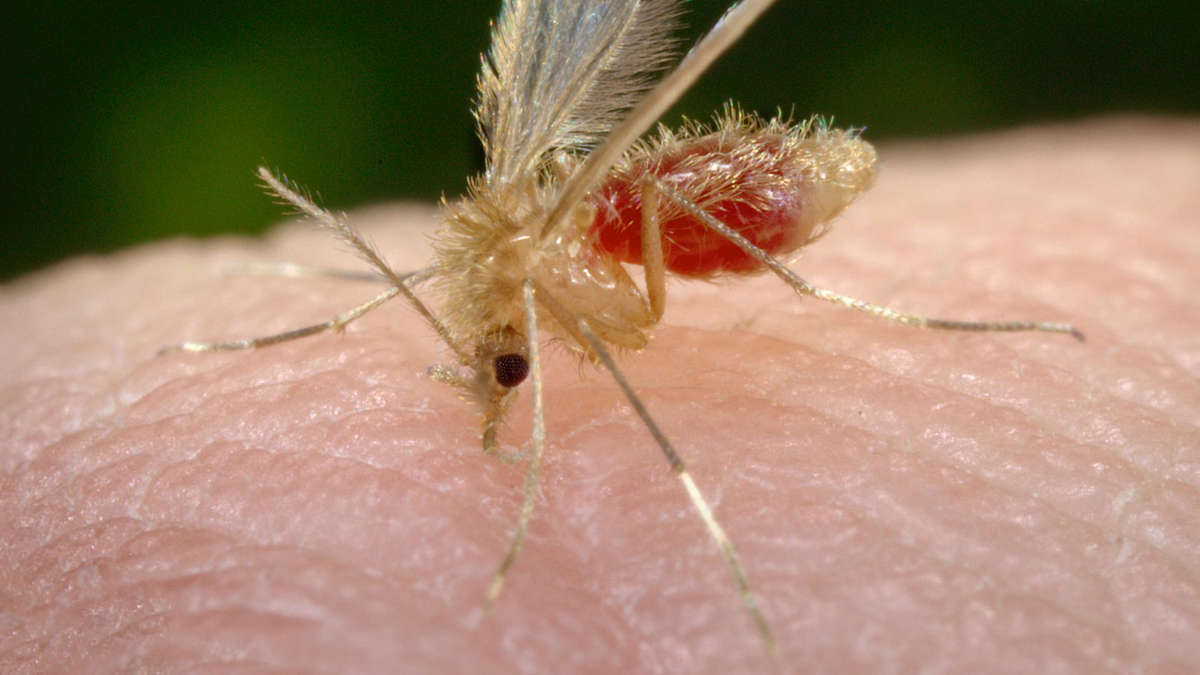
Ольга, 07 октября 2021
Все хорошо было. Мне все понравилось. К данному специалисту обратилась, потому что меня укусил клещ и на ноге раздулась шишка, я искала очень долго врача, этот был близко к работе. На приеме Ирина Владимировна выслушала, я все рассказала, потом посмотрела мою ногу. Сказала что правильно сделал что пришла, это по ее части, выписала мне лекарство. Лечение очень долгое, я в процессе, стала получше себя чувствовать.
Ирина, 07 октября 2021
На приёме доктор меня выслушал, провёл первичный осмотр, дал свои рекомендации и назначил лечение, которое помогло. Он решил мою проблему. Врач внимательный, грамотный, корректный, всё понятно и доступно объясняет. Могу рекомендовать данного специалиста своим знакомым, если потребуется и в случае необходимости могу обратиться повторно. Качеством приёма я осталась довольна.
Ирина, 07 октября 2021
Доктор выписал нам правильное лечение.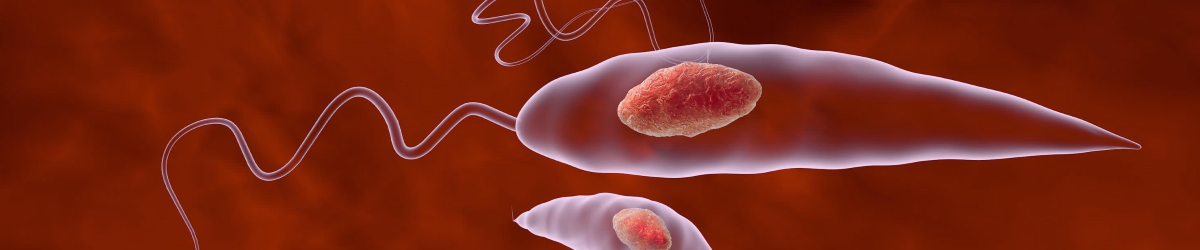 Мы просто после ещё съездили к другому инфекционисту который подтвердил всю полученную нами информацию. Также Павел Владимирович прописал диету и назначил некоторые анализы. Лечимся и надеемся, что всё будет хорошо. Компетентный, знает что говорит и хорошо знающий свою работу врач. Разговаривает строго по делу. На приёме ребёнок дискомфорта не чувствовал.
Мы просто после ещё съездили к другому инфекционисту который подтвердил всю полученную нами информацию. Также Павел Владимирович прописал диету и назначил некоторые анализы. Лечимся и надеемся, что всё будет хорошо. Компетентный, знает что говорит и хорошо знающий свою работу врач. Разговаривает строго по делу. На приёме ребёнок дискомфорта не чувствовал.
Юлия, 06 октября 2021
Доктор человечный, внимательный. Ничего плохого сказать не могу. Все было хорошо. На приеме Наталья Петровна меня внимательно выслушала, поверила в то что я сказала, предложила лечение. Результатов нет. Объяснила все понятно, ответила на все вопросы. Было мало времени для приема, я не все рассказала, поэтому хочу еще раз записаться и добавить и что-то подкорректировать. В целом осталась довольна качеством приема.
Результатов нет. Объяснила все понятно, ответила на все вопросы. Было мало времени для приема, я не все рассказала, поэтому хочу еще раз записаться и добавить и что-то подкорректировать. В целом осталась довольна качеством приема.
Елена, 05 октября 2021
Все хорошо прошло. На приеме Любовь Анатольевна проконсультировала, она задавала вопросы, я задавала. И отвечали, она и я. Мне понравилось. Я записалась на повторный прием. Визит длился минут 15-20 примерно, времени было достаточно.
Олеся, 05 октября 2021
Мне всё понравилось.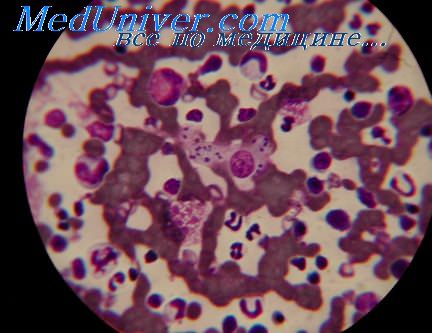 Врач хороший, который идёт на уступки и говорит по факту что нужно. Никаких жалоб не имею. Она назначила мне сдачу анализов, ответила на вопросы и пояснила конкретно, что я не понимала. Я буду сотрудничать с ней дальше.
Врач хороший, который идёт на уступки и говорит по факту что нужно. Никаких жалоб не имею. Она назначила мне сдачу анализов, ответила на вопросы и пояснила конкретно, что я не понимала. Я буду сотрудничать с ней дальше.
Альмана, 04 октября 2021
Показать 10 отзывов из 2734Лейшманиоз собак
Лейшманиоз собак – протозойная трансмиссивная природноочаговая болезнь собак, вызываемая простейшими из семейства Trypanosomatidae, характеризующаяся поражением кожи и внутренних органов. Также восприимчивы человек и грызуны.
Возбудитель. В настоящее время установлено 2 вида возбудителя:
Leishmania tropica – возбудитель кожного лейшманиоза собак и человека, паразитирует в клетках кожи.
Leishmania donovani – возбудитель висцерального лейшманиоза собак и человека, паразитирует в клетках печени, селезенки, костного мозга и крови.
В организме теплокровных животных лейшмании имеют безжгутиковую шаровидную или овальную форму размерами (3-5)-(1-3) мкм. В организме москитов и на искусственных питательных средах лейшмании приобретают веретенообразную форму и имеют жгутик. Размеры паразитов (10-20)-(2-4) мкм. Жгутик имеет длину до 18-20 мкм. В протоплазме одной клетки хозяина могут находиться от одной до нескольких десятков лейшманий (до 100-200). Иногда они располагаются в одиночку и группами около распавшихся или разрушенных при приготовлении мазка клеток, а также в некотором отдалении от них.
Биология развития. Переносчики лейшманий – москиты, широко
распространенные в субтропических и тропических странах. При нападении
на людей и собак, больных лейшманиозом, в организм москитов попадают
безжгутиковые формы паразита. Затем они быстро размножаются и
преобразуются в жгутиковые.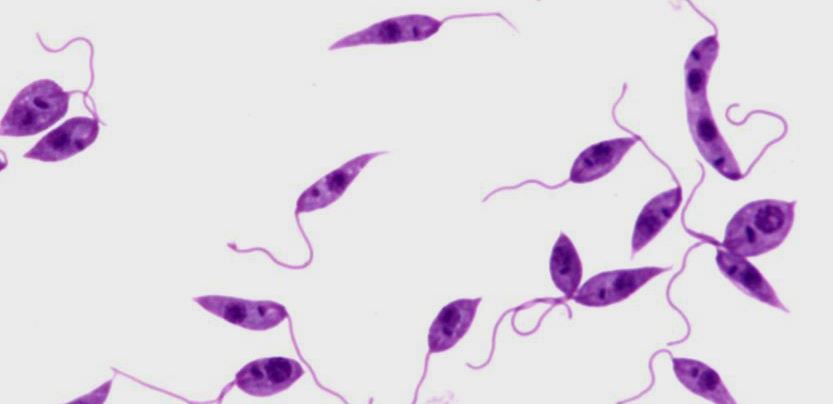 Через 8-10 суток при повторном нападении на
животных паразиты внедряются в кровь и ткани кожи. Во внутренних органах
лейшмании размножаются, теряют жгутики и поражают большое количество
клеток.
Через 8-10 суток при повторном нападении на
животных паразиты внедряются в кровь и ткани кожи. Во внутренних органах
лейшмании размножаются, теряют жгутики и поражают большое количество
клеток.
Эпизоотологические данные. Лейшманиоз — природноочаговое заболевание. Резервуаром возбудителя для москитов могут быть грызуны (песчанки, полевки, суслики), шакалы, дикобразы, лошади, кошки, овцы, собаки и люди. Основные места выхода насекомых — подполья жилых помещений, щели в стенах, умеренно влажные места в хлевах, свалки мусора и т.д. В условиях дикой природы они размножаются в норах грызунов, питаясь их кровью, личинки насекомых питаются пометом и различными органическими субстратами. Обычно перезимовывают личинки четвертой стадии и куколки.
В эпизоотическом очаге москиты бывают инвазированы лейшманиями до 60%.
Болеют главным образом собаки до 2-летнего возраста, и наиболее
восприимчивы животные с короткой шерстью. Заражаются они обычно в теплое
время года, в период максимальной активности лета переносчиков. Переболевшие собаки, как правило, повторно не болеют, у них создается
нестерильный иммунитет.
Переболевшие собаки, как правило, повторно не болеют, у них создается
нестерильный иммунитет.
Симптомы болезни. Инкубационный период от нескольких недель до нескольких месяцев. Различают кожный лейшманиоз с локализацией возбудителей в местах поражения кожи и висцеральный с поражением печени, селезенки, костного мозга, лимфатических узлов и т.д. При кожной форме болезни вначале в месте внедрения возбудителя в области спинки носа, губ, бровей, ушных раковин, пальцах образуются узелки, а затем длительно не заживающие язвы. Лимфатические узлы увеличены, плотные и бугристые на ощупь.
Висцеральный лейшманиоз чаще всего протекает в острой форме и характеризуется повышением температуры тела, потерей аппетита, угнетением. Отмечают анемию, конъюнктивит, расстройство функции пищеварения. Болезнь длится от 3-4 суток до 2-3 недель.
При хроническом течении у больных животных отмечают истощение, повышение
температуры тела. Иногда развивается диарея, слабость конечностей,
параличи.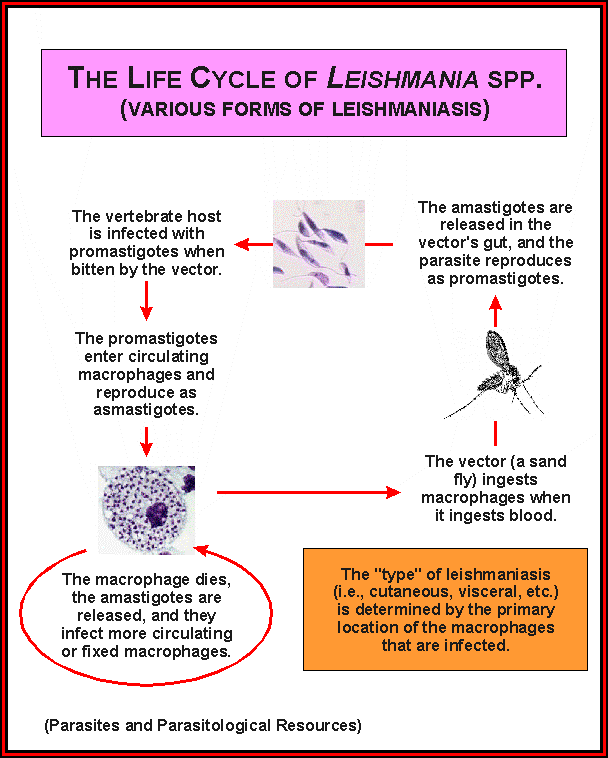
Диагноз ставят комплексно с учетом эпизоотологических данных, клинических признаков болезни и результатов лабораторных исследований. В качестве лабораторной диагностики проводят микроскопию мазков, окрашенных по Романовскому: при кожной форме — готовят мазки с пораженных участков кожи, при висцеральной – из пунктатов костного мозга и лимфатических узлов.
Лечение. При кожной форме лейшманиоза в кожу вокруг язв и в толщу узелков вводят 4-5%-ный раствор акрихина в 1%-ном растворе новокаина.
Стибоглюконат натрия (натриум антимониглюконат) дают в дозе 10-20 мг/кг массы тела раз в день в течение 10 суток. Затем делают перерыв на 10 дней и лечение повторяют.
Глюкантим (метилглюкаминантимониат) применяют внутримышечно в виде 30%-ного раствора в дозе 5-20 мл через каждые 2-3 суток. Кратность введения собакам — от 8 до 12 раз, в более запущенных случаях препарат следует вводить до 20 раз.
Ломидин (пентамидин) вводят внутримышечно в дозе 2-4 мг/кг массы тела с
интервалом 2 дня.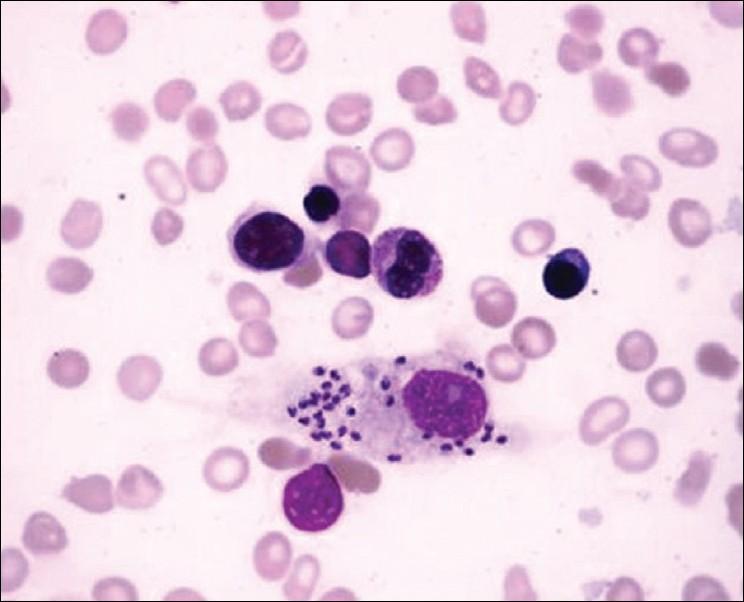 Полное выздоровление наступает после 15-20-кратного
применения препарата. Лечение начинают с дозы 2 мг/кг (0,5 мл 4%-ного
раствора на 10 кг массы тела). После шестого введения дозу ломидина
увеличивают до 3 мг/кг и доводят ее до 4 мг/кг. Некоторый эффект
наступает уже через 6 суток лечения. Иногда у собак на месте введения
препарата отмечают некроз мышц.
Полное выздоровление наступает после 15-20-кратного
применения препарата. Лечение начинают с дозы 2 мг/кг (0,5 мл 4%-ного
раствора на 10 кг массы тела). После шестого введения дозу ломидина
увеличивают до 3 мг/кг и доводят ее до 4 мг/кг. Некоторый эффект
наступает уже через 6 суток лечения. Иногда у собак на месте введения
препарата отмечают некроз мышц.
Солюсурьмин (солюстибозан) — используют при висцеральном лейшманиозе в дозе 100-150 мг/кг массы тела в виде 20%-ного стерильного раствора внутримышечно или подкожно в течение 10-15 суток.
Профилактика и меры борьбы. В очагах лейшманиоза проводят меры по уничтожению грызунов, москитов, отлову бродячих собак. Используют инсектициды и репелленты.
Лейшманиоз — сюрприз с Востока
Ребенок Алина М., 4 года, проживает в Крыму.
Жалобы при поступлении на сыпь в виде язвочек на коже живота, спины и левой руки.
Анамнез болезни. Девочка заболела в августе 2010 года, когда с родителями проживала в Республике Узбекистан (г.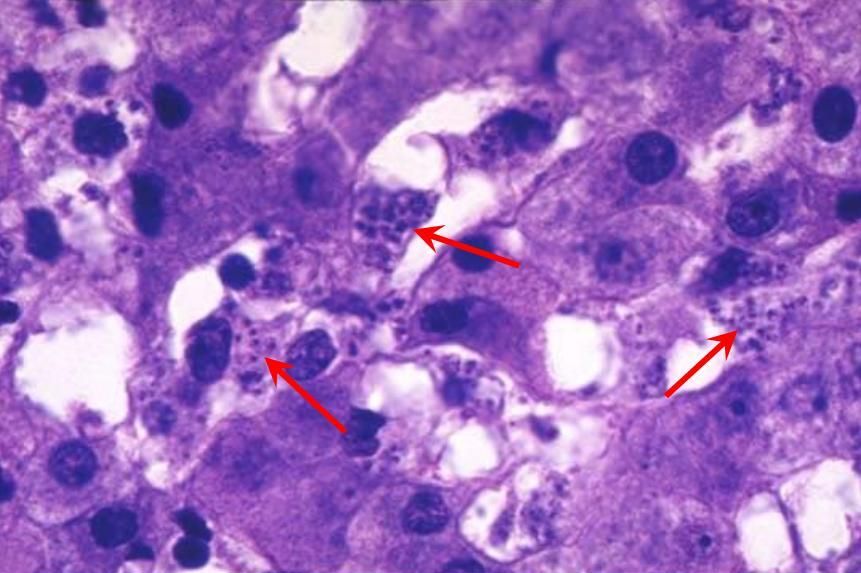 Данзас). 11–14.08.2010 ребенка покусали москиты. Через 2 дня на месте укусов на коже живота, спины, левой руки появилась гиперемия в виде пятен розового цвета диаметром 0,5–0,3 см и бугорков. Через три недели после укусов москитами девочка с семьей приехала в Крым. Бугорки сохранялись до февраля 2011 года. Вокруг них на протяжении всего этого периода отмечалась гиперемия.
Данзас). 11–14.08.2010 ребенка покусали москиты. Через 2 дня на месте укусов на коже живота, спины, левой руки появилась гиперемия в виде пятен розового цвета диаметром 0,5–0,3 см и бугорков. Через три недели после укусов москитами девочка с семьей приехала в Крым. Бугорки сохранялись до февраля 2011 года. Вокруг них на протяжении всего этого периода отмечалась гиперемия.
Девочку неоднократно смотрели педиатры, хирурги, инфекционисты, дерматологи, был поставлен диагноз: контагиозный моллюск. В конце февраля один из бугорков вскрыли, после чего он покрылся корочкой. В конце марта — начале апреля остальные бугорки тоже покрылись корочками, на месте которых образовались кратерообразные язвы, с гиперемией вокруг, диаметром 1–1,5 см, с гнойными корочками на дне. Зуда кожных покровов не было. Мама обрабатывала элементы (папулы и корочки) фукарцином.
Общее состояние ребенка при поступлении было средней степени тяжести. Температура тела 36,7 °С, частота сердечных сокращений — 102 в минуту, частота дыханий — 22 в минуту. Правильного телосложения, умеренного питания, тургор и эластичность мягких тканей сохранены. Кожные покровы бледно-розовые, в околопупочной области, на коже поясницы и внутренней поверхности левого предплечья эритематозные бугорки (Г), кратерообразные язвы диаметром 1–1,5 см, с гиперемией вокруг, с приподнимающимися краями (А), на дне язв гнойное отделяемое (Б) и гнойные корочки (В) (рис. 1).
При пальпации прощупывались периферические лимфоузлы — шейные и паховые — размером 0,5 см в диаметре, мягко-эластической консистенции, единичные. При осмотре ротоглотки слизистые бледные, чистые. В легких выслушивается жесткое дыхание, хрипов нет, перкуторно — ясный легочный звук. Тоны сердца ясные, ритмичные. Живот мягкий, доступен глубокой пальпации. Печень не выступает из-под края реберной дуги, селезенка не пальпируется. Стул 1 раз в день, оформленный, без патологических примесей.
Проф. И.З. Каримов, работавший в молодости в Узбекистане, высказал предположение о кожной форме лейшманиоза. Однако сыпь, появляющаяся при лейшманиозе и имеющаяся у больной, характерна также для контагиозного моллюска, туберкулеза кожи и бугоркового сифилиса.
По клиническим проявлениям бугорок, наблюдаемый у нашей больной, похож на папулу и узелок у больных с контагиозным моллюском. Папула и узелок при этом заболевании представляют собой доброкачественную кожную опухоль, вызванную вирусами семейства Proxivirus. Заражение контагиозным моллюском происходит при непосредственном контакте с больным или через предметы быта. Контагиозный моллюск встречается довольно часто, если существует клеточный иммунный дефицит — приобретенный или врожденный, или при атипичном дерматите. Им страдают от 5 до 18 % ВИЧ-инфицированных людей. Период инкубации после контакта варьирует от нескольких недель до нескольких месяцев, при среднем сроке от двух до семи недель. Инфекция затем распространяется путем аутоинокуляции, каждое поражение при этом развивается в течение нескольких недель. Проявляется плотными белесоватыми папулами в виде жемчужин, полусферическими, 1–6 мм диаметром, с вдавлением в центре. Давление на центр дает характерное беловатое выделение. Поражения обычно множественные, от нескольких элементов до нескольких сотен; они локализуются чаще в промежности и на наружных половых органах, но может быть поражена любая часть тела, за исключением ладоней и подошв. Диагностика клиническая. Подтверждением является обнаружение в отделяемом из папул эозинофильных цитоплазматических включений в кератиноцитах, характерных для поксвирусов. Данная клиническая картина не соответствовала имеющейся у девочки, поэтому диагноз «контагиозный моллюск» был исключен.
От туберкулезной волчанки антропонозный лейшманиоз клинически отличается тем, что может возникнуть в любом возрасте, а не преимущественно в детском. Бугорковые элементы значительно плотнее, в связи с чем феномен проваливания зонда отрицательный. Высыпания туберкулоидного лейшманиоза, хотя и располагаются на рубцах, не склонны к изъязвлению. Значение имеет и характер рубца: при туберкулезной волчанке рубец поверхностный, при лейшманиозе — глубокий, втянутый.
От бугоркового сифилиса антропонозный лейшманиоз кожи отличается локализацией сыпи главным образом на открытых участках тела, меньшей плотностью бугорков, расположением элементов на рубце, положительным феноменом яблочного желе, более поздним изъязвлением, характером рубцов (при сифилисе рубец мозаичный, при лейшманиозе втянутый), отрицательными серологическими реакциями на сифилис.
Кроме того, лейшманиоз на стадии изъязвленных бугорков следует дифференцировать с лепрой, болезнью укуса крысы (содоку), чумой, туляремией, сибирской язвой, сифилитической гуммой и туберкулезом кожи. При ряде болезней возникающая после укуса клещами язва развивается на месте ворот инфекции (первичный аффект). В эту группу входят болезнь Лайма и клещевые боррелиозы.
Результаты проведенных лабораторных исследований представлены ниже (табл. 1, 2).
Исследование мазка с язвы: обнаружены округлые формы Leishmania, 1–2 в поле зрения, в отдельных полях — до 6 экземпляров.
Исследование крови на лейшмании 17.06.11 — лейшманий не выявлено.
Окончательный диагноз: кожный лейшманиоз средней степени тяжести, хроническая форма.
Проведенное лечение: этиотропная терапия проводилась глюкантимом по схеме 1 раз в сутки внутримышечно, курс — 5 дней; с последующим назначением метронидазола 250 мг 3 раза в сутки per os, курс — 10 дней. Местная терапия включала обработку язв мазью лешкутан. С первого дня в стационаре проводятся противоэпидемические мероприятия — в палате установлены москитные сетки, включен «Раптор», в ночное время на место язв накладывается повязка. В результате проведенной терапии состояние больной улучшилось, наблюдалась положительная динамика. Выписана на 17-й день болезни с выздоровлением.
Заключение: у ребенка Алины М., 4 года, после укусов москитов развилась хроническая форма кожного лейшманиоза средней степени тяжести. Из анамнеза известно, что больная проживала в эндемичной по лейшманиозу местности (Республика Узбекистан). Заболевание начиналось с появления в месте укусов эритематозных бугорков (макуло-папул) с последующим образованием поверхностных язв. Лейшманиозные язвы у данного ребенка были множественные, безболезненные, имели хорошо ограниченные, приподнимающиеся края; долго не заживали, локализовались на коже живота, спины и левой руки.
После проведенной этиотропной терапии с одновременным назначением местной терапии отмечалась положительная динамика заболевания и на 17-й день болезни ребенок выписан из стационара.
Литературная справка
Лейшманиозы — группа протозойных заболеваний, характеризующихся интоксикацией, поражением кожи, слизистых оболочек и внутренних органов, склонных к хроническому течению.
Лейшмании — одноклеточные паразитические жгутиковые простейшие. Источником и резервуаром инфекции являются млекопитающие животные (собаки, лисы, грызуны), а также больной лейшманиозом человек. Передача инфекции осуществляется москитами, которые становятся заразными спустя 5–8 суток после попадания в их желудок инфицированной крови. Заражение человека происходит при укусе москита.
Лейшманиоз распространен в основном в Средиземноморье, на Ближнем и Среднем Востоке, полуострове Индостан. В Крыму и Украине заболевание встречается очень редко. Заболеваемость лейшманиозом резко возрастает в июне — сентябре. Сезон заражения связан с периодом лета москитов. Восприимчивость к лейшманиозу высокая. Среди местного населения болеют главным образом дети, среди приезжих — люди любого возраста.
Входными воротами инфекции является поврежденная укусом москита кожа. Инокуляция возбудителя в кожу, как правило, ничем не проявляется, иногда в месте внедрения может образоваться папула или изъязвление.
При висцеральной форме лейшмании размножаются в макрофагах кожи, а затем мононуклеарными фагоцитами разносятся по всей ретикулоэндотелиальной системе, что сопровождается увеличением паренхиматозных органов, особенно селезенки, дистрофическими и некротическими процессами в них.
У детей лейшманиоз может проявляться 3 клиническими формами: висцеральной, кожной и кожно-слизистой. Каждая форма имеет своеобразную клиническую симптоматику.
Инкубационный период при висцеральной форме лейшманиоза колеблется от 3 недель до 10–12 месяцев, в среднем составляет 3–6 месяцев. Заболевание протекает остро или хронически.
Острое течение характерно для большинства детей раннего возраста и начинается с появления симптомов общей интоксикации. Лихорадка интермиттирующего или постоянного характера сохраняется в течение 3–4 недель. Быстро появляются гепатоспленомегалия, лимфаденопатия, прогрессирует дистрофия. При отсутствии специфической терапии развиваются такие осложнения, как септицемия, гастроэнтерит, которые нередко приводят к летальному исходу.
Хроническое течение висцеральной формы лейшманиоза чаще отмечается у детей более старшего возраста. Начало заболевания постепенное, проявляется общей слабостью, утомляемостью, бледностью кожных покровов. Лихорадка длительная, нередко волнообразная, когда подъемы температуры сменяются ремиссией в течение от нескольких дней до нескольких месяцев. Прогрессивно увеличиваются печень и селезенка, периферические лимфоузлы. Кожа становится сухой, шершавой, с участками темного цвета. На стопах появляются отеки, на лице — пастозность. В полости рта нередко возникают язвенно-некротические изменения слизистой оболочки. Несмотря на хороший аппетит, больные худеют и истощаются вплоть до кахексии.
При обоих вариантах течения висцерального лейшманиоза в периферической крови нарастают лейкопения и анемия.
Кожный лейшманиоз протекает в виде антропонозного (городского) и зоонозного (сельского) типов.
Инкубационный период при антропонозном типе длится от 2 недель до нескольких месяцев или лет. Вначале в месте укуса москита появляется конусовидный бугорок величиной 2–3 мм, без признаков воспаления вокруг, красноватого цвета, с сухой чешуйкой в центре. Бугорок медленно растет, корочка утолщается и спустя 3–6 месяцев отторгается, а под ней формируется язва, которая медленно заживает с последующим рубцеванием. Язвы могут быть единичными или множественными, локализуются чаще всего на лице и руках.
Зоонозный тип лейшманиоза протекает с более коротким инкубационным периодом — от 2 недель до 1,5 месяца, в среднем 10–20 дней. На месте укуса москита также возникает конусовидный бугорок с последующим формированием лейшманиомы диаметром 10–15 мм. Через 1–2 недели после ее возникновения в центре начинается некроз с последующим образованием язвы размером 2 ґ 4 мм, с обрывистыми ровными краями, отеком и гиперемией кожи вокруг, болезненной или слабо болезненной при пальпации. Рядом с первичной лейшманиомой часто образуются множественные бугорки обсеменения, которые также впоследствии некротизируются и изъязвляются.
Кожно-слизистый лейшманиоз. Эспундия также начинается с образования кожной язвы, однако спустя длительное время (вероятно, в результате гематогенного распространения) возбудитель попадает на слизистые оболочки носа и носоглотки, вызывая обезображивающие язвенно-некротические изменения, самостоятельно не заживающие.
Случай завозного кожного лейшманиоза в Запорожье
Chemych, M. D., Zarichanska, N. O., Trotska, I. O,. Kulesh, L. P., Snitsar, A. O., Shelokhova, S. Ye. (2010) Vistseralnyi leishmanioz yak SNID-indykatorne zakhvoriuvannia: trudnoschi v diahnostytsi ta likuvanni [Visceral leishmaniasis as an AIDS indikator disease: difficulties in diagnosis and treatment]. Infektsiini khvoroby, 1, 81–84. [in Ukrainian].
Kamolov, Z. R., & Rakhmatov, A. B. (2009) Voprosy diagnostiki i lecheniya zoonoznogo kozhnogo lejshmanioza [Questions of diagnosis and Treatment zoonotic leishmaniasis each]. Ukrainskyi zhurnal dermatolohii, venerolohii, kosmetolohii, 2, 11–15. [in Ukrainian].
Bondarenko, A. M. (2008) Suchasna diahnostyka i terapiia vistseralnoho leishmaniozu [Modern diagnosis and treatment of visceral leishmaniasis]. Infektsiini khvoroby, 3, 68–76. [in Ukrainian].
Bodnya, E. Y., & Velieva, T. A. (2012) Sluchaj visceral’nogo lejshmanioza v Har’kove [Visceral leishmaniasis the case in Kharkiv]. Epidemiolohichni ta klinichni aspekty profilaktyky, diahnostyky ta likuvannya rozpovsyudzhenykh infektsiynykh khvorob suchasnosti. Proceedings of the Scientific and Practical Conference. Kharkov, (рр. 160–161). [in Ukrainian].
McGwire, B. S., Satoskar, A. R. (2014) Leishmaniasis: clinical syndromes and treatment. QJM, 107(1), 7–14. doi: 10.1093/qjmed/hct116.
Stockdale, L., Newton, R. (2013) A review of preventative methods against human leishmaniasis infection. PLoS Negl Trop Dis., 7(6). Retrieved from http://www.ncbi.nlm.nih.gov/pubmed/23818997. doi: 10.1371/journal.pntd.0002278.
Lasram, K., Ben Halim, N., Benrahma, H., Mediene-Benchekor, S., Arfa, I., Hsouna, S., et al. (2013) Leishmania epidemiology, diagnosis, chemotherapy and vaccination approaches in the international network of Pasteur Institutes. Med Sci (Paris), 29(12), 1151–1160.
Kolodiy, M. A. (2012) Leishmanioz u Kharkiskii oblasti [Leishmaniasis in Kharkiv oblast]. Pryrodno-oseredkovi infektsii, Proceedings of the All-Ukrainian Scientific and Practical Conference. Uzhhorod, (рр. 47–49). [in Ukrainian].
Chemych, N. D., & Il’yina, N. I. (2013) Lejshmanioz: sovremennye aspekty [Leishmaniasis: the modern aspects]. Klinicheskaya infektologiya i parazitologiya, 2, 105–113. [in Belarus].
Chemych, N. D., Il’yina, N. I., & Klymenko, N. V. (2011) Osoblyvosti perebihu zavezenoho shkirnoho leishmaniozu [Peculiarities of imported cutaneous leishmaniasis]. Trudnoshchi diahnostyky i terapiyi infektsiynykh khvorob, Proceedings of the All-Ukrainian Scientific and Practical Conference. Sumy, (рр. 349-351). [in Ukrainian].
(2008) Pro mistsevyi vypadok vistseral’noho leyshmaniozu z letal’nym naslidkom: Inform. lyst Tsentral’noyi SES MOZ Ukrayiny vid 20 travnia 2008 roku № 04.3./1017. [in Ukrainian].
Holubovs’kа, O. A. (Ed.) (2012) Infektsiyni khvoroby [Infectious diseases]. Kyiv: Medytsyna. [in Ukrainian].
Oliveira, F. S., Valete-Rosalino, C. M., & Pacheco, S. J. (2013) American tegumentary leishmaniasis caused by Leishmania braziliensis: assessment of parasite genetic variability at intra- and inter-patient levels. Parasit Vectors, 6, 189. doi: 10.1186/1756-3305-6-189.
Ochoa-Diaz, Y. O., Lopez-Moreno, C. Y., & Rendon-Maldonado, J. G. (2012) Molecular diagnosis of Leishmania mexicana in a cutaneous leishmaniasis case in Sinaloa, Mexico. Vector Borne Zoonotic Dis, 12(1), 78–80. doi: 10.1089/vbz.2011.0688.
Taheri, A. R., Pishgooei, N., & Maleki M. (2013) Dermoscopic features of cutaneous leishmaniasis. Int J Dermatol, 52(11), 1361–1366. doi: 10.1111/ijd.12114.
Monge-Maillo, B., López- Vélez, R. (2013) Therapeutic options for old world cutaneous leishmaniasis and new world cutaneous and mucocutaneous leishmaniasis. Drugs, 73(17), 1889–1920. doi: 10.1007/s40265-013-0132-1.
Локальный лейшманиоз слизистой оболочки полости рта — необычная клиника и патогенез (996) — Терапия — Новости и статьи по стоматологии
Термин лейшамиоз объединяет группу заболеваний, вызываемых простейшими под названием лейшмании, переносчиками которых являются самки москитов рода Phlebotomus и Lutzomyia. Они принадлежат к семейству Trypanosomatidae рода Leishmania. Синонимы лейшманиоза kala azar, означающий черная лихорадка в Индии, и эспундия (слизисто-кожная форма). Лейшманиоз определяется по всему миру и является эндемичным в 88 странах. Частота возникновения лейшманиоза как оппортунистической инфекции за последние годы повысилась из-за роста числа людей с приобретенным иммунодифицитом, новообразованиями, получающими иммуносуперссивную терапию, проходящие трансплантацию и зараженные ВИЧ инфекцией. В мире насчитывается около 12 миллионов заболевших с приростом в 1,5-2 миллиона ежегодно. По причине лейшманиоза умирает от 70 000 до 80 000 человек ежегодно.
Заболевание может протекать в трех формах: кожной, слизисто-кожной и висцеральной.
В литературе обсуждают также две дополнительные разновидности: кожный лейшманиоз Старого Света и лейшманиоз Нового света. Кожная форма лейшманиоза (КЛ) вызывает повреждение кожи и хронические язвы. Данное заболевание может быть отграниченным, но также хроническим и прогрессирующим в определенном числе случаев. Кожно-слизистый лейшманиоз вызывается видом лейшманий, распространенных в Америке и Африке, и поражает слизистую оболочку носа, полости рта, глотки, вызывая при этом расстройство функций. Висцеральный лейшманиоз поражает селезенку, печень, костный мозг и лимфатические узлы, вызывая лихорадку и анемию. При отсутствии своевременного лечения такие состояния часто заканчиваются летально.
Лейшманиоз поражает мужчин и женщин примерно в соотношении 2:1. У людей с иммунной недостаточностью полость рта становится второй по частоте локализацией развития патологии в зоне лица и шеи. В полости рта в свою очередь – чаще всего поражается язык. Кожно-слизистая форма развивается из-за распространения локальной кожной инфекции в слои слизистой оболочки напрямую, через кровяное русло или лимфатическую систему. Очаги поражения зачастую затрагивают слизистую оболочку полости рта и носа, а также иногда зону гортани и глотки. Если заболевание вовремя не распознано и не лечится, оно может обусловить развитие осложнений, так как вызывает хроническую местную деструкцию тканей носа, глотки и неба. В основном вовлечение слизистой оболочки происходит спустя 1-5 лет после излечения кожной формы, хотя иногда кожная и слизистая формы могут совпадать. Примерно 90% обратившихся пациентов уже имеют кожный шрам. Иногда поражение слизистой оболочки может развиваться и без предваряющей кожной формы. Одиночное вовлечение слизистой наблюдается весьма редко. В данной статье мы представляем вашему вниманию случай лейшманиоза слизистой оболочки полости рта без вовлечения кожных покровов.
Клинический случай
В клинику обратился 51-летний мужчина с жалобами на кровоточивость десен и изъявления полости рта, которые затрудняют пережевывание и прием пищи (фото 1,2,3). В анамнезе заболевания отмечена лихорадка около 1 месяца назад с лимфаденопатией. Согласно анамнезу жизни больной работает водителем, регулярно курит и употребляет жевательный табак последние 5 лет. При общем осмотре повреждений или шрамов на коже не обнаружено, поражений кожи не отмечал. При внутриротовом осмотре выявлены мягкие, диффузные, множественные изъявленные узелки (менее 1 см в диаметре) по твердому и мягкому небу с шероховатостью на поверхности. Десна с вестибулярной стороны на верхней челюсти имела бугристую поверхность, была эритематозна и воспалена. Гигиена полости рта не удовлетворительная, образования кровоточат при исследовании. В данном клиническом случае отмечалось отграниченное поражение слизистой оболочки, щечной и губной поверхности десен и неба без вовлечения кожных покровов. Осмотр шеи выявил двустороннее увеличение поднижнечелюстных лимфатических узлов. Пациент отправлен на биопсию образований из нескольких локализаций. Один образец ткани взят с вестибулярной десны верхней челюсти, второй – с латерального края неба с края язвы. Окраска препаратов по Giemsa и H&E подтвердили диагноз лейшманиоза (фото 4 и 5). Общий анализ крови выявил лейкоцитоз. Маркеры на ВИЧ, гепатиты B и C отрицательны.
Фото 1: Общий вид больного, кожные покровы не затронуты
Фото 2: Вовлечение слизистой оболочки губ, гипертрофия и кровоточивость десны
Фото 3: Вовлечение твердого и мягкого неба (бугристая поверхность слизистой оболочки твердого неба)
Фото 4: Гистологический анализ слизистой оболочки, демонстрирующий макрофаги, содержащие тельца Лейшмана
Фото 5: Окраска по Giemsa. Амастиготы в круглыми ядрами
Пациент прошел лечение милтефосином и системных натрий стибоглюконатом: 100 мг милтефосина ежедневно в одной капсуле (50 мг) утром и одну капсулу (50мг) вечером после еды, 28 дней, а также 20 мг натрий стибоглюконат (0,2 мл пентостама) на кг веса ежедневно внутривенно в течение 30 дней. Пациент регулярно наблюдался, в течение приема лекарств проводились анализы крови и ЭКГ. Местное лечение очагов (гигиена, анестетик и вяжущий ополаскиватель) и устранение вторичной бактериальной инфекции проводилось параллельно. Реакция пациента на проводимую терапию оказалась положительной, образования регрессировали (фото 6). После улучшения пациент не являлся на контрольные осмотры, поэтому итоговое состояние полости рта оценить не удалось.
Фото 6: Процесс заживления
Обсуждение
Лейшманиоз – это заболевание, вызываемое простейшими рода Leishmania. Самые ранние описания лейшманий при кожных поражениях были сделаны Cunningham, Borovsky И Wright между 1885 и 1903 годами. Другие формы лейшманиозы были описаны несколько позже. В 1903 году Leishman И Donovan независимо друг от друга описали простейшее, найденное в тканях селезенки пациента из Индии. Из одновременное открытие простейшего, названного позже Leishmania donovani, впервые представило научному сообществу причину опасного для жизни заболевания- висцерального лейшманиоза. Данная болезнь была включена ВОЗ в список тропических заболеваний, элиминация которого была запланирована к 2015 году.
Теперь век спустя миллионы людей по-прежнему поражаются лейшманиями. Данное состояние знаменито своей сложностью протекания и многообразием. Оно также является эндемичным в регионах от тропических лесов Южной Америки до пустынь Азии, при этом заражая одинаково сельское и городское население. Все многообразие 21 видов лейшманий классифицируют по возникновению синдромам: кожный, слизисто-кожный и висцеральный, развитие которых зависит от первичной локализации паразитов в макрофагах кожи, слизистой полости носа и рта, внутренних органов. Данные виды простейших переносятся более чем 30 видами москитов.
Клиническое проявление лейшманиоза зависит от комбинации вирулентности микроорганизма и иммунного ответа хозяина. Слизистый лейшманиоз это хроническая инфекция слизистых мембран, которая в большинстве случаев первична, но также может развиваться в течение или после висцерального лейшманиоза. Человека поражает около 30 видов лейшманий, 12 из которых имеют собственные названия.
Патогенез
Лейшмании живут две отдельные жизни: одну в теле москита, вторую в организме млекопитающего. В моските простейшее существует в виде промастиготы (лептоммонады), а в тканях – амастиготы (лейшаниальной или афлагелярной форме). Переносчик инфекции начинает сосание крови у человека или млекопитающего, содержащую простейшее в форме амастиготы (без жгутика). После контакта с пищеварительным трактом москита, паразит трансформирует в промастиготу (образует жгутик) и размножается. Из кишесника переносчика простейшее мигрирует в пищевод, откуда попадает в кожу хозяина при укусе насекомого, затем проникает в кровеносное русло и распространяется по тканям. Промастиготы фагоцитируются макрофагами ретикулоэндотелиальной системы хозяина, где они теряют жгутик и снова трансформируются в амастиготу. Как только пораженные клетки уничтожаются, паразит инфицирует новые клетки и таким образом распространяется по организму. Гистологическая картина лейшманиоза выглядит в виде эпителия с хроническим воспалительным инфильтратом, в основном состоящим из плазматических клеток и гистиоцитов, цитоплазма которых заполнена лейшманиями.
О случаях развития лейшманиоза сообщается по всему миру, и почти все из них затрагивают слизистую оболочку полости рта. Также в литературе описан случай, где рецидивирующий слизистый лейшманиоз протекал на фоне синдрома Гуда (характеризующийся иммунной недостаточностью пациентов с тимомой), состояние лечилось в комплексном режиме. При протекании рецидивирующего лейшманиоза в первую очередь у пациента следует подозревать иммунодефицит.
ВОЗ сообщает, что у 2-3% пациентов со СПИДом лейшманиоз развивается в качестве оппортунистической инфекции. Слизистый лейшманиоз, вызываемый leishmania braziliensis и составляющий около 1-10% всех клинических случаев, часто возникает спустя 1-5 лет после излечения кожного лейшманиоза, хотя в некоторых случаях обе формы возникают одновременно. Такое состояние наиболее опасно, так как оно приводит к деструктивному нарушению тканей лица. Этот вид лейшманиоза зачастую возникает у рабочих, путешественников и посетителей провинциальных и лесистых местностях стран из зона риска.
Лечение
Терапией выбора всех форм лейшманиоза является назначение антимониальных препаратов, таких как меглумин антимониат (Glucantime) и натрий стибоглюконат (Pentostam). Меглумин назначается в дозировке 20 мг/кг в день внутримышечным или внутривенным введением до максимальной дозы в 850 мг/день по крайней мере в течение 20 дней. Возможный побочные эффект приема этого препарата – миалгия, боль в суставах, анорексия, тошнота, рвота, головная боль, гипертрансаминазэмия, лекарственный панкреатит, тромбоцитопения и нейтропения. Дозировка натрий стибоглюконата (Pentostam) основывается на рекомендациях ВОЗ касательно лейшманиоза в обсуждении 2010 года.
Висцеральный лейшманиоз
20 мг пентавалент антимоний (0,2 мл Pentosam) На кг веса ежедневно в виде внутримышечных и внутривенных инъекций в течение 30 дней (или 28 при L. Infantum). Пациенты должны быть повторно исследованы на предмет рецидива спустя 2 и 6 месяцев.
Кожный лейшманиоз, вызванный видом Старый Свет
В некоторых случаях данное заболевание может проходить спонтанно без терапевтического вмешательства. Местная терапия (термотерпия, криотерапия, мазь с паромомицином, местные инфильрации с антимониалем) является хорошим воздействием с малой системной токсичностью, оставляя системные препараты (азол, милтефосин, антимониаль и амфотерицин B) для более сложных случаев.
Для поражений, требующих местного воздействия: 100-500 мг пентавалент антимоний под очаг (инъекция 1-5 мл натрий стилоглюконат) за посещение каждые 3-7 дней, 1-5 раз
Для поражений, требующих системной терапии: 20 мг/кг пентавалент антимоний (0,2 мл инъекция натрий стибоглюконат) внтуримышечно или внутривенно каждые 10-20 дней.
Монотерапия натрий стибоглюконтатом не рекомендуется для лечения кожного лейшманиоза, вызванного l. Aethiopica.
Кожный лейшманиоз, вызванный лейшманиями Нового Света
Большинство клинических случаев с участием этого возбудителя требует использования системной терапии (в основном пентавалент антимония) для ускорения лечения или предотвращения распространения в слизистую носа и полости рта и перехода в слизисто-кожный лейшманиоз.
Для поражений, требующих местной терапии: 100-500 мг под поражение пентавалента амония (1-5 мл инъекции натрий стибоглюконат) за посещение каждые 3-7 дней 1-5 раз.
Для поражений, требующих системной терапии: 20 мг/кг пентавалента антимония (0,2 мл инъекция натрий стибоглюконата) внутримышечно или внутривенно в тчение 20 дней.
Слизисто-кожный лейшманиоз
Пациентов следует лечить 20 мг пентавалента антимония (0,2 мл Пентозам) на кг веса ежедневно внутримышечно или внутривенно в течение 30 дней или инъекциями под поражение натрий стибоглюконат (0,5 -1,0 мл). Последний вариант менее дорогой и вызывает меньше побочных явлений.
Альтернативными перпаратами служат амфотерицин B, пентамидин, рифампицин или кетоконазол. Также возможно использовать фенотиазин, паромомицин, аллопуринол, итраконазол, циклоспорин, милтефосин, дапсон, аминосидин и интерферон. Дополнительными вмешательствами могут быть хирургия, местное лечение, иммунотерапия и инфракрасное облучение.
Были проведены генетические исследования при лейшманиозе для сравнения генетического полиморфизма Leishmania (Viannia) braziliensis в случаях слизистого лейшманиоза у ВИЧ+ и ВИЧ- пациентов. Результаты показали генетически дивергентные профили при кожных и слизистых поражениях у одних и тех же ВИЧ инфицированных пациентов.
Дифференциальный диагноз лейшманиоза слизистой оболочки полости рта должен проводиться с грибковыми инфекциями (бластомикоз), сифилисом, туберкулезом, лепрой, саркоидозом, срединной гранулемой, болезнью Вегнера и новообразованиями.
Заключение
Наиболее частой формой лейшманиоза является кожная. Однако редко возможно вовлечение в процесс слизистой оболочки полости рта, как описано в приведенном случае. Локализованный лейшманиоз слизистой оболочки полости рта – редкое явление, характерное для пациентов с нарушениями в иммунной системе. Стоматологи играют важную роль в диагностике лейшманиоза полости рта, который имеет системное значение. Определение лейшманиоза имеет определенные сложности, но должно учитываться в дифференциальной диагностике экзофитных поражений полости рта. Ранняя постановка диагноза важна для успешного лечения и предотвращения рецидивов.
Авторы: Deepak Passi, Sarang Sharma, Shubharanjan Dutta, Chandan Gupta
In Vivo Infection with Leishmania amazonensis to Evaluate Parasite Virulence in Mice
Анализ инфекции in vivo, описанный в этом протоколе, позволяет любому исследователю оценить in vivo кожный лейшманиоз, рассматривая взаимодействие хозяина-паразита в системном сценарии. Эти анализы были использованы многими группами22,24,27,29,31,32,34,49 и здесь мы составили пошаговой протокол для стандартизации этого метода при рассмотрении ограничений инфраструктуры, которые могут иметь некоторые группы. Этот протокол также может быть использован для оценки вирулентности трансгенных паразитов Лейшмании по in vivo биоизображение50,51,52. Как и любая другая экспериментальная процедура, этот процесс имеет ограничения и критические шаги для выполнения, такие как требование квалифицированного персонала, который комфортно работает с мышами и имеют опыт в выполнении субплантарных инъекций, чтобы избежать случайных инфекций. Стандартизация протоколов чрезвычайно важна для того, чтобы избежать предвзятых результатов и добиться сопоставимых результатов между различными исследовательскими группами.
Основным преимуществом использования L. amazonensis в качестве модели для кожных лейшманиаз является то, что поражения подножия, вызванного этим видом, можно легко оценить у мышей. Отек подножия, определяемый описанным здесь методом, представляет собой сумму двух фенотипов инфекции: воспалительный ответ хозяина и репликацию паразитов. Оба фенотипа могут быть оценены отдельно, связывая метод нагрузки ткани паразита, который отражает внутриклеточную репликацию паразитов с определением прогрессии толщины поражения. Еще одним преимуществом является то, что промастиготы L. amazonensisлегко культивируются в пробирке. Учитывая это, любая исследовательская группа может манипулировать этим видом Лейшмания в соответствии с их потребностями. Выводы из исследований L. amazonensis‘может быть затем по сравнению с другими видами Лейшмании, чтобы определить, является ли конкретный путь эволюционно сохранены или расходятся21,53,54.
В естественном цикле передача Лейшмании позвоночному хозяину происходит при укусе инфицированной песчаной мухи во время трапезы крови. Песчаная муха обычно прививают несколько сотен метациклических промастигот форм Лейшмании в слюне насекомого. В экспериментальных in vivo инфекций, наиболее частым местом прививки является подножия животного22. Интрейдермальная инъекция в ухо или интраперитонеальная инъекция являются альтернативными местами прививки в зависимости от цели исследования, потому что каждый сайт представляет различные типы фагоцитических клеток24,56. Таким образом, некоторые исследовательские группы используют лабораторны инфицированных песчаных мух, чтобы заразить ушную дерму животного, чтобы имитировать естественную передачу56,57,58,59. Однако этот протокол представляет некоторые ограничения, такие как содержание колоний песчаных мух, что требует недоступных для большинства исследовательских групп помещений.
Оригинальная работа, описывающая in vivo C57BL/6 инфекции с La-LIR1-/- использовал очищенные метациклические промастиготы формы14. Тем не менее, Лейшмания генетические манипуляции могут нарушить либо дифференциации promastigotes в апоры amastigotes14 или в метациклических инфекционных форм20. Таким образом, в зависимости от штамма лейшмании, исследователь должен определить наиболее адекватный метод для получения жизнеспособных форм инфекционных паразитов для их изучения. Протокол аксинициготов, отличаемых от описанных здесь культур промастигот, может быть более простой альтернативой, производя сопоставимые результаты во многих случаях19,20,35,37,38,64. Этот подход позволяет избежать использования других методов, которые обычно приводят к снижению урожайности инфекционных паразитов, таких как инкубация promastigotes с конкретными, но не широко доступны антитела65 для метациклической очистки промастиготы, или плотность градиента зависит от экспрессии СУГ метациклов18,66. Эффективность протокола дифференциации можно оценить, определив уровни экспрессии амастин-семейных генов64,67. Амастины являются членами семейства консервированныхгенов,которые дифферепрециально модулируются во время жизненного цикла Лейшмании 68 и связаны с паразитом вирулентности и патогенеза67,69,70. Другие маркеры также могут быть использованы для различения amastigote от промастигот формы. Например, gp63 является downregulated в amastigotes, потому что его роль заключается в защите promastigotes от пищеварительных ферментов насекомых71.
Выбор штамма мыши является еще одним важным шагом, который следует учитывать при разработке стандартизированного протокола инфекции in vivo. Чувствительность и устойчивость к инфекции лейшмании у мышей в основном регулируются генетическим фоном29,30,55. В этом протоколе, штамм C57BL/6 был выбран потому, что его иммунный ответ на L. amazonensis тесно связан ас-энсом со смешанным ответом Th2-Th3 у людей72,73. Экспериментальные инфекции мурина с L. amazonensis были описаны, чтобы вызвать умеренные поражения у мышей C57BL/6 по сравнению с другими штаммами мышей28,34,74. Однако, в зависимости от штамма паразита, различия в размере поражения обнаруживаются только в восприимчивых штаммов мышей, как BALB/c36. Время, течение инфекции также необходимо учитывать и коррелирует с выбранным штаммом мышей29,26,60,61,62,63,75. Ulcerated footpads следует всегда избегать, поскольку это может представлять вторичные инфекции и часто наблюдаются в длительные периоды инфекции, особенно в экспериментах с восприимчивыми штаммами мышей. Назначение времени суток, чтобы начать инфекцию является еще одним шагом, который следует рассмотреть. Как показали в предыдущих исследованиях с L. amazonensis, время суток паразита инокулум влияет на развитие поражения, потому что хозяин-паразит взаимодействия влияет в циркадной образом шишковидной высвобожденный мелатонин в темное время суток75.
Основным недостатком метода инфекции in vivo является то, что эксперимент требует использования значительного числа лабораторных животных и занимает больше времени, чтобы получить окончательные результаты по сравнению с методом инфекции in vitro18. Тем не менее, этот последний аспект можно также рассматривать в качестве преимущества, поскольку результаты in vivo отражают естественный временной ход прогрессирования заболевания более точно, чем результаты, полученные от инфекции in vitro. Что еще более важно, выводы l. amazonensis in vivo инфекции не могут только отражать преходящее изменения в паразитной вирулентности, но и признает системный статус хозяина и всех его игроков. Поэтому, учитывая несколько факторов, упомянутых выше, метод, описанный в этом протоколе, может быть адаптирован для удовлетворения конкретных экспериментальных потребностей в характеристиках других целей и методов лечения, связанных с вирулентностью, позволяющей получить новые идеи для борьбы с кожным лейшманиозами.
Subscription Required. Please recommend JoVE to your librarian.
Лейшманиоз | DermNet NZ
Автор: Ванесса Нган, штатный писатель, 2005 г. Обновлено доктором Катрионой Вуттон, дерматолог, Великобритания, январь 2017 г.
Что такое лейшманиоз?
Лейшманиоз — паразитарное заболевание, передающееся москитами, инфицированными простейшими Leishmania . Лейшманиоз эндемичен более чем в 70 странах мира и поражает около 12 миллионов человек.
Существует несколько клинических форм лейшманиоза.Клиническое проявление инфекции зависит от вида Leishmania , который зависит от географического района и иммунного ответа хозяина.
Паразиты, вызывающие лейшманиоз человека, не обнаружены в Новой Зеландии, Австралии, южной части Тихого океана или Антарктиде.
Лейшманиоз Старого Света
См. Другие изображения лейшманиоза.
Кто болеет лейшманиозом?
Люди всех возрастов, живущие или путешествующие через районы, где москиты и виды Leishmania являются эндемичными, подвержены риску заражения лейшманиозом.Жизнь в сельской местности и времяпрепровождение на земле или рядом с ней увеличивает риск.
Классификация и причины лейшманиоза
Существует более 20 видов паразитов Leishmania, которые могут инфицировать людей; передается через укус москитов-флеботоминов. Москиты — крошечные (1,5–3 мм) насекомые, активно питающиеся кровью на рассвете и в сумерках. Москиты обитают в трещинах стен, норах животных и опавших листьях в тропических и субтропических регионах. Их укус протекает бессимптомно и обычно на открытых участках.
Лейшманиоз имеет несколько признанных клинических форм, и их проявление зависит от инокулированного вида и иммунного ответа хозяина. Наиболее важное различие между американскими и неамериканскими видами Leishmania , поскольку подвид Viannia , обнаруженный в Америке, может привести к кожно-слизистому лейшманиозу.
Кожный лейшманиоз
Кожный лейшманиоз обычно возникает на месте инокуляции. Представление и прогноз будут варьироваться в зависимости от вовлеченных видов.
Неамериканский (Старый Свет) кожный лейшманиоз:
- Ближний Восток, Северная Африка, Азия
- L major, L tropica, L infantum, L donovani
- Синонимы: восточная язва, багдадский нарыв, дели нарыв, салдана, кнопка Алеппо, эндемическая гранулема.
Американский (Новый Свет) кожный лейшманиоз:
- Центральная и Южная Америка
- L mexicana, L braziliensis, L amazonensis
- Синонимы: chiclero ulcer, uta, ulcera de Bauru, forest yaws, pian boi, bejuco.
Кожно-слизистый лейшманиоз
Кожно-слизистый лейшманиоз — деструктивная форма лейшманиоза, которая встречается только у американских видов Leishmania (подвид Viannia ).
Американский кожно-слизистый лейшманиоз:
- Центральная и Южная Америка
- L braziliensis, L guyanensis, L panamensis
- Синоним: espundia.
Диффузный кожный лейшманиоз
Диффузный кожный лейшманиоз — редкое проявление, возникающее в результате анергической реакции хозяина на паразита.
Неамериканский диффузный кожный лейшманиоз:
- Эфиопия, Кения
- L aethiopica.
Американский диффузный кожный лейшманиоз:
- Южная Америка
- L. amazonensis.
Висцеральный лейшманиоз
Висцеральный лейшманиоз возникает в результате поражения внутренних органов и обычно заканчивается летальным исходом при отсутствии лечения. Он также известен как кала-азар или лихорадка Думдум.
Неамериканский висцеральный лейшманиоз:
- Индия, южная Европа, Китай, Северная Африка, Кения
- L. donovani, L. infantum, L. tropica.
Американский висцеральный лейшманиоз:
- Центральная и Южная Америка
- Л чагаси .
Дермальный лейшманиоз после кала-азара
Дермальный лейшманиоз после кала-азара — это форма кожного лейшманиоза, которая может развиваться от месяцев до лет после лечения висцерального лейшманиоза.
Неамериканский кожный лейшманиоз после кала-азара:
- Судан, Индия
- L. donovani, L. infantum, L. tropica.
Американский дермальный лейшманиоз после кала-азара:
- Центральная и Южная Америка
- L чагаси.
Рецидивирующий лейшманиоз
Рецидивирующий лейшманиоз — это редкая кожная форма лейшманиоза, встречающаяся у пациентов с хорошим клеточным иммунным ответом. Он также известен как волчаночный лейшманиоз.
Рецидив лейшманиоза неамериканского происхождения:
- Ближний Восток, Индия, Южная Европа
- л тропика.
Американский рецидив лейшманиоза:
- Центральная и Южная Америка
- L. braziliensis.
Каковы клинические признаки лейшманиоза?
Кожный лейшманиоз
- Кожный лейшманиоз — наиболее частая форма лейшманиоза
- Одиночные поражения типичны, но встречаются множественные поражения
- Первоначальное поражение представляет собой небольшую красную папулу, которая постепенно увеличивается до 2 см в диаметре.
- Типичное центральное изъязвление
- Язвы могут быть влажными с выделением гноя или сухими с коркой
- Язвы обычно появляются на открытых участках кожи, особенно на лице и конечностях
- Время инкубации между укусом инфицированной москиты и развитием поражения составляет от 2 недель до 6 месяцев
- Поражения обычно безболезненны и в большинстве случаев разрешаются спонтанно, часто оставляя остаточные атрофические рубцы
- Время разрешения варьируется от 2 месяцев до более года
- Возможно распространение споротрихоида с лимфокожными узелками
- Может возникать хроническое заболевание, и существует риск распространения у пациентов с иммунодефицитом
Кожно-слизистый лейшманиоз
- Кожно-слизистый лейшманиоз обычно возникает после спонтанного разрешения или местного лечения первичного кожного поражения
- Может развиться в течение месяцев или через много лет
- Пожизненный риск развития кожно-слизистого лейшманиоза после поражения кожи, вызванного L braziliensis , составляет около 5%
- Поражения обычно поражают слизистые оболочки носа и рта, но также могут поражаться слизистые поверхности глаз и половых путей
- Без лечения может произойти изъязвление слизистых оболочек и разрушение подлежащих тканей
- Поражения слизистой оболочки часто болезненны и вызывают вторичную инфекцию, иногда приводящую к сепсису
- Может привести к сильному обезображиванию
Диффузный кожный лейшманиоз
- Диффузный кожный лейшманиоз представляет собой специфическое заболевание; иногда этот термин неправильно используется для описания диссеминированного или множественного кожного лейшманиоза
- Результат анергического ответа на инфекцию из-за снижения клеточного иммунитета
- После первичного поражения кожным лейшманиозом образуются неязвенные узелки и бляшки
- Поражения могут быть многочисленными и могут распространяться на все тело
- Продолжает хроническое рецидивирующее или прогрессирующее течение
- Часто трудно поддается лечению
Висцеральный лейшманиоз
- Висцеральный лейшманиоз поражает внутренние органы, включая селезенку, печень и лимфатические узлы
- Признаки и симптомы включают лихорадку, потерю веса, лимфаденопатию, гепатомегалию и массивную спленомегалию
- Лабораторные исследования могут показать панцитопению и гипергаммаглобулинемию
- Осложнения включают желудочно-кишечное кровотечение, периферические отеки, острую почечную недостаточность и вторичные бактериальные инфекции
- Генерализованная гиперпигментация — поздний признак висцерального лейшманиоза; другое его название, кала-азар, происходит от хинди, что означает «черная лихорадка» .
- Висцеральный лейшманиоз может принимать различные формы — от бессимптомного саморазрешающегося заболевания до молниеносного и опасного для жизни
Кожный лейшманиоз после кала-азара
- Пост-кала-азар — кожная форма лейшманиоза, возникающая как осложнение висцерального лейшманиоза
- Возникает от месяцев до лет после лечения висцерального лейшманиоза
- Большинство случаев заболевания происходит в Судане (до 50%) и Индии (до 10%)
- Поражения представляют собой либо затвердевшие папулы и узелки, либо области гипопигментации желтого пятна
- Чаще всего поражает лицо, туловище и конечности
- Слизистая оболочка полости рта и область гениталий также могут быть поражены
- Прогноз и лечение зависят от местоположения: более чем у 80% суданских пациентов поражения кожного лейшманиоза после кала-азара проходят спонтанно в течение года, тогда как в Индии скорость спонтанного разрешения намного ниже, поэтому системная терапия используется раньше.
Рецидивный лейшманиоз
- Рецидивный лейшманиоз встречается у пациентов с хорошим клеточным иммунным ответом
- Спонтанное разрешение первичного кожного поражения сопровождается развитием новых очагов по краю первичного рубца
- Поражения обычно изъязвляются, а затем заживают
- Цикл продолжается с хроническим рецидивом, обычно длится несколько десятилетий
Кожный лейшманиоз в Шри-Ланке
Как диагностируется кожный лейшманиоз?
Диагноз кожного лейшманиоза обычно основывается на анамнезе и клиническом проявлении поражения.Подробная история путешествий, включая исторические путешествия из-за длительного инкубационного периода, важна в неэндемичных районах. Диагноз можно подтвердить, определив паразита на биопсии или в мазке кожи. Посев и ПЦР также могут использоваться для подтверждения диагноза и определения вида Leishmania, что важно при наличии риска кожно-слизистого лейшманиоза.
Серология используется для подтверждения диагноза висцерального лейшманиоза.
Более чем в 70% случаев биопсия кожи на всю толщину может выявить паразита.Гистопатология также используется для установления кожно-слизистого лейшманиоза и висцерального лейшманиоза. При висцеральном лейшманиозе также следует проводить общий анализ крови и функциональные пробы печени.
Лейшманиоз Нового Света
Что такое дифференциальный диагноз лейшманиоза?
Разнообразие клинических проявлений кожного лейшманиоза приводит к широкому спектру дифференциальных диагнозов:
Как лечить лейшманиоз?
При кожном лейшманиозе варианты лечения различаются в зависимости от того, считается ли поражение простым или сложным.
При неамериканском кожном лейшманиозе поражения считаются сложными, если они превышают 4 см, множественными, связанными с лимфатическим распространением, стойкими (> 6 месяцев), у лиц с ослабленным иммунитетом, расположенными над суставами или в косметически чувствительных областях.
Все случаи американского лейшманиоза следует рассматривать как сложные из-за риска кожно-слизистого лейшманиоза с подвидом Viannia .
Варианты лечения поражений кожного лейшманиоза включают:
- Самовосстановление (только простые поражения)
- Местные средства без сурьмы
- Сурьма внутри очага поражения
- стибоглюконат натрия
- Меглумин сурьмянистый
- Системная терапия без сурьмы
- Системные сурьмы (внутривенные или внутримышечные)
- стибоглюконат натрия
- Меглумин сурьмянистый.
В большинстве случаев простой кожный лейшманиоз проходит спонтанно без лечения, но это может занять много месяцев и привести к рубцеванию.
Системные препараты сурьмы являются основой лечения сложных поражений кожного лейшманиоза, кожно-слизистого лейшманиоза и висцерального лейшманиоза. Их нельзя назначать перорально, а продолжительность лечения при поражениях слизистой оболочки может достигать 28 дней. Лечение требует госпитализации, и существует риск побочных эффектов, в том числе кардиотоксичности.
Вторичные раневые инфекции следует лечить с помощью соответствующей противомикробной терапии.
Хирургическое лечение и лечение испарительным лазером также используются для соответствующих поражений.
См. Рекомендации по ведению лейшманиоза, опубликованные Американским обществом инфекционных болезней (IDSA) и Американским обществом тропической медицины и гигиены (ASTMH) (декабрь 2016 г.).
Профилактика укусов насекомых
Инфекцию можно предотвратить, избегая укусов москитов.Поскольку в настоящее время нет вакцин или лекарств для предотвращения инфекции, путешественники в районы, где распространен лейшманиоз, должны снизить риск укусов, соблюдая следующие меры предосторожности.
- Избегайте активного отдыха, особенно в сумерках и на рассвете, когда москиты наиболее активны.
- Носите рубашки с длинными рукавами, длинные брюки и носки — заправляйте рубашку в брюки.
- Нанесите средство от насекомых на открытые участки кожи, а также под концы рукавов и штанины.Наиболее эффективными репеллентами являются те, которые содержат химический ДЭТА (N, N-диэтил-метатолуамид).
- Обрызгайте одежду, жилые и спальные зоны (включая сетку для кроватей) инсектицидами, содержащими перметрин.
Кожный лейшманиоз — обзор
Кожный лейшманиоз
CL следует заподозрить, если у человека имеется хроническое, обычно безболезненное, узловое или язвенное поражение на открытой коже, а также в анамнезе проживания или поездки в эндемичную область.Нюансы детских случаев показаны во вставке 267.1. Инкубационный период после укуса песчаной мухи составляет от 2 недель до многих месяцев, иногда даже лет. Сначала появляется эритематозное пятно, которое постепенно превращается в воспалительную папулу с прогрессирующим уплотнением (с поверхностным шелушением или без него). По мере увеличения воспаления папула становится узловатой, часто изъязвленной и с приподнятой границей. Морфология поражения сильно варьирует и также включает бляшки, псориазоподобные или бородавчатые поражения. Размер может варьироваться от <1 см до 10 см.Также возникают сателлитные поражения, гиперкератотические струпы, фибринозный экссудат, споротрихоидное (лимфангиитное) распространение и регионарная лимфаденопатия. Поражения обычно безболезненны, если только они не инфицированы вторично. 35,36 Разрешение рубцов (обычно описываемых как бумажные с тонкой кожей) — это правило, которое занимает от месяцев до лет. Поражения лица могут быть весьма уродливыми и могут поражать слизистые оболочки, прилегающие к коже (иногда напоминающие ML). Поражения над суставами могут плохо зажить.
CL у нормального хозяина чаще всего локализуется, но взаимодействие между хозяином и паразитом может привести к широкому спектру проявлений, таких как воспалительные олигопаразитарные поражения (напр.g., рецидивирующий лейшманиоз) или гиперпаразитарные, менее воспалительные поражения (например, диффузный CL) (рис. 267.5). ХЛ у людей с ослабленным иммунитетом, особенно с аномальным клеточным иммунитетом, может иметь особенно длительное течение, более тяжелые или необычные кожные поражения или иногда становиться висцерализованными. 37,38
Множественные клинические синдромы, связанные со многими географически разнообразными видами Leishmania , перечислены в таблице 267.1. CL Old World широко распространен на Ближнем Востоке, в Средиземноморье, в Азии, Африке и на Индийском субконтиненте.Ответственными паразитами обычно являются L. major, L. tropica, и L. aethiopica, , но также L. infantum и L. donovani . Рецидивирующий лейшманиоз почти всегда возникает из-за L. tropica , в основном на лице, обычно на краю зажившего рубца на CL. Поражения включают узелки, папулы и неглубокие язвы, которые могут увеличиваться и уменьшаться с годами, трудно поддаются лечению, являются олигопаразитарными и воспалительными. 39 ML, связанный с CL и VL Старого Света в Судане из-за L.major или L. donovani или из-за L. infantum у людей с ослабленным иммунитетом. 40
New World CL широко распространена в Латинской Америке и вызывается рядом видов из подродов Viannia и Leishmania (см. Таблицу 267.1). Кроме того, L. infantum (син. chagasi ) также может вызывать кожные заболевания. Как и в случае ХЛ Старого Света, первичным проявлением является локализованная ХЛ, но имеет место диффузная ХЛ ( л.mexicana и L . amazonensis ). 41 L. V. braziliensis , особенно к югу от Коста-Рики, ассоциируется с ML, особенно в Боливии, Бразилии и Перу. В меньшей степени L. V. panamensis, L.V. guyanensis, и L . amazonensis также связаны с ML.
Кожный лейшманиоз: иммунные ответы в защите и патогенезе
Alvar, J. et al. Лейшманиоз во всем мире и глобальные оценки его заболеваемости. PLoS ONE 7 , e35671 (2012).
Артикул CAS PubMed PubMed Central Google ученый
Карвалью, Э. М., Барраль, А., Коста, Дж. М., Биттенкур, А. и Марсден, П. Клинические и иммунопатологические аспекты диссеминированного кожного лейшманиоза. Acta Trop. 56 , 315–325 (1994).
Артикул CAS PubMed Google ученый
Баселлар, О.и другие. Повышение регуляции ответов Th2-типа у пациентов с лейшманиозом слизистых оболочек. Заражение. Иммун. 70 , 6734–6740 (2002).
Артикул CAS PubMed PubMed Central Google ученый
Turk, J. L. & Bryceson, A. D. Иммунологические явления при лепре и родственных заболеваниях. Adv. Иммунол. 13 , 209–266 (1971).
Артикул CAS PubMed Google ученый
Скотт П., Натовиц, П., Коффман, Р. Л., Пирс, Э. и Шер, А. Иммунорегуляция кожного лейшманиоза. Линии Т-клеток, передающие защитный иммунитет или обострение, принадлежат к разным подмножествам Т-хелперов и отвечают на разные антигены паразитов. J. Exp. Med. 168 , 1675–1684 (1988).
Артикул CAS PubMed Google ученый
Хайнцель, Ф. П., Садик, М. Д., Холадей, Б. Дж., Коффман, Р. Л. и Локсли, Р.М. Взаимная экспрессия гамма-интерферона или интерлейкина 4 во время разрешения или прогрессирования мышиного лейшманиоза. Доказательства распространения различных подмножеств Т-хелперов. J. Exp. Med. 169 , 59–72 (1989).
Артикул CAS PubMed Google ученый
Кэй, П. и Скотт, П. Лейшманиоз: сложность взаимодействия хозяина и патогена. Нац. Rev. Microbiol. 9 , 604–615 (2011).
Артикул CAS PubMed Google ученый
Sacks, D. & Kamhawi, S. Молекулярные аспекты взаимодействий паразит-переносчик и вектор-хозяин при лейшманиозе. Annu. Rev. Microbiol. 55 , 453–483 (2001).
Артикул CAS PubMed Google ученый
Belkaid, Y. et al. Естественная модель инфекции Leishmania major показывает длительную «молчаливую» фазу размножения паразитов в коже до начала образования поражений и иммунитета. J. Immunol. 165 , 969–977 (2000).
Артикул CAS PubMed Google ученый
Ribeiro-Gomes, F. L. et al. Сайт-зависимое привлечение воспалительных клеток определяет эффективную дозу Leishmania major . Заражение. Иммун. 82 , 2713–2727 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Петерс, Н.C. et al. Визуализация in vivo показывает важную роль нейтрофилов в лейшманиозе, передаваемом москитами. Наука 321 , 970–974 (2008). Эта статья представляет собой первую визуализацию быстрого набора нейтрофилов в место заражения Leishmania .
Артикул CAS PubMed PubMed Central Google ученый
Гимарайнш-Коста, А.B. et al. Leishmania amazonensis промастиготы индуцируют и уничтожаются внеклеточными ловушками нейтрофилов. Proc. Natl Acad. Sci. США 106 , 6748–6753 (2009).
Артикул PubMed Google ученый
Rochael, N.C. et al. Классический ROS-зависимый и ранний / быстрый ROS-независимый выброс нейтрофильных внеклеточных ловушек, запускаемый паразитами Leishmania . Sci. Rep. 5 , 18302 (2015).
Артикул CAS PubMed PubMed Central Google ученый
Chagas, A.C. et al. Лундеп, эндонуклеаза слюны песчаных мух, увеличивает выживаемость паразитов Leishmania в нейтрофилах и ингибирует активацию контакта XIIa в плазме человека. PLoS Pathog. 10 , e1003923 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Новаис, Ф.O. et al. Нейтрофилы и макрофаги взаимодействуют, обеспечивая устойчивость хозяина к инфекции Leishmania braziliensis . J. Immunol. 183 , 8088–8098 (2009).
Артикул CAS PubMed Google ученый
de Souza Carmo, E. V., Katz, S. & Barbieri, C. L. Нейтрофилы уменьшают количество паразитов в макрофагах, инфицированных Leishmania ( Leishmania ) amazonensis . PLoS ONE 5 , e13815 (2010).
Артикул CAS PubMed Google ученый
Сэвилл, Дж., Дрансфилд, И., Грегори, К. и Хаслетт, К. Взрыв из прошлого: клиренс апоптотических клеток регулирует иммунные ответы. Нац. Rev. Immunol. 2 , 965–975 (2002).
Артикул CAS PubMed Google ученый
ван Зандберген, Г.и другие. Передний край: нейтрофильный гранулоцит служит вектором для проникновения Leishmania в макрофаги. J. Immunol. 173 , 6521–6525 (2004).
Артикул CAS PubMed Google ученый
Hurrell, B.P. et al. Быстрая секвестрация нейтрофилами Leishmania mexicana способствует развитию хронического поражения. PLoS Pathog. 11 , e1004929 (2015). Это исследование использует нейтропенических мышей Genista, чтобы продемонстрировать, что нейтрофилы способствуют развитию хронических L. mexicana поражений.
Артикул CAS PubMed PubMed Central Google ученый
Charmoy, M. et al. CCL3, полученный из нейтрофилов, необходим для быстрого рекрутирования дендритных клеток на место инокуляции Leishmania major у устойчивых мышей. PLoS Pathog. 6 , e1000755 (2010).
Артикул CAS PubMed PubMed Central Google ученый
Рибейро-Гомес, Ф. Л., Петерс, Н. К., Дебрабант, А. и Сакс, Д. Л. Эффективный захват инфицированных нейтрофилов дендритными клетками кожи подавляет ранний ответ против лейшмании. PLoS Pathog. 8 , e1002536 (2012).
Артикул CAS PubMed PubMed Central Google ученый
Рибейро-Гомес, Ф.L. et al. Апоптотический клиренс нейтрофилов, инфицированных Leishmania major , дендритными клетками ингибирует CD8 + Т-клеточное праймирование in vitro посредством передачи сигналов, зависящих от тирозинкиназы Mer. Cell Death Dis. 6 , e2018 (2015).
Артикул CAS PubMed PubMed Central Google ученый
Tacchini-Cottier, F. et al. Иммуномодулирующая функция нейтрофилов во время индукции ответа CD4 + Th3 у мышей BALB / c, инфицированных Leishmania major . J. Immunol. 165 , 2628–2636 (2000).
Артикул CAS PubMed Google ученый
Ordonez-Rueda, D. et al. Гипоморфная мутация репрессора транскрипции Gfi1 приводит к новой форме нейтропении. Eur. J. Immunol. 42 , 2395–2408 (2012).
Артикул CAS PubMed Google ученый
Чармой, М.и другие. Инфламмасома Nlrp3, IL-1β и рекрутирование нейтрофилов необходимы для восприимчивости к незаживающему штамму Leishmania major у мышей C57BL / 6. Eur. J. Immunol. 46 , 897–911 (2016). Это исследование предполагает, что инфламмасома и IL-1β необходимы при тяжелом течении хронического лейшманиоза.
Артикул CAS PubMed PubMed Central Google ученый
Ng, L.G. et al. Мигрирующие дермальные дендритные клетки действуют как быстрые сенсоры простейших паразитов. PLoS Pathog. 4 , e1000222 (2008).
Артикул CAS PubMed PubMed Central Google ученый
Goncalves, R., Zhang, X., Cohen, H., Debrabant, A. & Mosser, D. M. Активация тромбоцитов привлекает субпопуляцию эффекторных моноцитов к участкам инфекции Leishmania major . Дж.Exp. Med. 208 , 1253–1265 (2011). Эта статья является первой, демонстрирующей, что воспалительные моноциты быстро рекрутируются в очаг инфекции и убивают паразита Leishmania .
Артикул CAS PubMed PubMed Central Google ученый
Sato, N. et al. Хемокиновый рецептор CC (CCR) 2 необходим для миграции клеток Лангерганса и локализации дендритных клеток, индуцирующих Т-хелперные клетки типа 1 (Th2).Отсутствие CCR2 сдвигает фенотип, устойчивый к Leishmania major, , в чувствительное состояние, в котором преобладают цитокины Th3, рост В-клеток и стойкое нейтрофильное воспаление. J. Exp. Med. 192 , 205–218 (2000).
Артикул CAS PubMed PubMed Central Google ученый
Nacy, C. A., Meltzer, M. S., Leonard, E. J. и Wyler, D. J. Внутриклеточная репликация и индуцированное лимфокином разрушение Leishmania tropica в макрофагах мышей C3H / HeN. J. Immunol. 127 , 2381–2386 (1981).
CAS PubMed Google ученый
Matheoud, D. et al. Leishmania уклоняется от иммунитета хозяина, ингибируя перекрестную презентацию антигена посредством прямого расщепления SNARE VAMP8. Клеточный микроб-хозяин 14 , 15–25 (2013).
Артикул CAS PubMed Google ученый
Новаис, Ф.O. et al. Классические моноциты человека контролируют внутриклеточную стадию Leishmania braziliensis с помощью активных форм кислорода. J. Infect. Дис. 209 , 1288–1296 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Rocha, FJ, Schleicher, U., Mattner, J., Alber, G. & Bogdan, C. Цитокины, сигнальные пути и эффекторные молекулы, необходимые для контроля Leishmania ( Viannia ) braziliensis у мышей. Заражение. Иммун. 75 , 3823–3832 (2007).
Артикул CAS PubMed PubMed Central Google ученый
Green, SJ, Crawford, RM, Hockmeyer, JT, Meltzer, MS & Nacy, CA Амастиготы Leishmania major инициируют L-аргинин-зависимый механизм уничтожения в макрофагах, стимулированных IFN-γ, путем индукции некроза опухоли фактор-α. J. Immunol. 145 , 4290–4297 (1990).
CAS PubMed Google ученый
Bogdan, C., Moll, H., Solbach, W. & Rollinghoff, M. Фактор некроза опухоли-α в сочетании с интерфероном-γ, но не с интерлейкином 4, активирует мышиные макрофаги для устранения Leishmania major амастигот. Eur. J. Immunol. 20 , 1131–1135 (1990).
Артикул CAS PubMed Google ученый
Олехнович, Р., Ryffel, B., Muller, A.J. и Bousso, P. Коллективное производство оксида азота обеспечивает иммунитет в тканях во время инфекции Leishmania . J. Clin. Инвестировать. 124 , 1711–1722 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Wei, X.Q. et al. Измененные иммунные ответы у мышей, лишенных индуцибельной синтазы оксида азота. Nature 375 , 408–411 (1995).
Артикул CAS PubMed Google ученый
Gantt, K. R. et al. Окислительные реакции макрофагов человека и мыши во время фагоцитоза Leishmania chagasi . J. Immunol. 167 , 893–901 (2001).
Артикул CAS PubMed Google ученый
Кадуми, М., Беккер, И., Донхаузер, Н., Роллингхофф, М.И Богдан С. Экспрессия индуцибельной синтазы оксида азота в поражениях кожи пациентов с американским кожным лейшманиозом. Заражение. Иммун. 70 , 4638–4642 (2002).
Артикул CAS PubMed PubMed Central Google ученый
Sypek, J. P. et al. Разрешение кожного лейшманиоза: интерлейкин 12 инициирует защитный иммунный ответ Т-хелперов 1 типа. J. Exp. Med. 177 , 1797–1802 (1993).
Артикул CAS PubMed Google ученый
Хайнцель, Ф. П., Шенхаут, Д. С., Рерко, Р. М., Россер, Л. Е. и Гейтли, М. К. Рекомбинантный интерлейкин 12 лечит мышей, инфицированных Leishmania major . J. Exp. Med. 177 , 1505–1509 (1993).
Артикул CAS PubMed Google ученый
Шателен, Р., Varkila, K. & Coffman, R.L. IL-4 индуцирует ответ Th3 у мышей, инфицированных Leishmania major . J. Immunol. 148 , 1182–1187 (1992).
CAS PubMed Google ученый
von Stebut, E., Belkaid, Y., Jakob, T., Sacks, DL & Udey, MC Поглощение амастигот Leishmania major приводит к активации и высвобождению интерлейкина 12 из дендритных клеток кожи мыши: последствия для инициации иммунитета против Leishmania . J. Exp. Med. 188 , 1547–1552 (1998).
Артикул CAS PubMed PubMed Central Google ученый
Iezzi, G. et al. Резидентные лимфатические узлы, а не дендритные клетки кожи инициируют специфические Т-клеточные ответы после инфекции Leishmania major . J. Immunol. 177 , 1250–1256 (2006).
Артикул CAS PubMed Google ученый
Леон, Б., Lopez-Bravo, M. и Ardavin, C. Дендритные клетки, полученные из моноцитов, сформированные в месте инфекции, контролируют индукцию защитных ответов Т-хелперов 1 против Leishmania . Иммунитет 26 , 519–531 (2007). Комплексное исследование роли ДК, происходящих из моноцитов, в праймировании защитного Т H 1-типа ответа.
Артикул CAS PubMed Google ученый
Scharton, T.М. и Скотт П. Естественные клетки-киллеры являются источником интерферона γ, который стимулирует дифференцировку субпопуляций Т-лимфоцитов CD4 + и индуцирует раннюю устойчивость к Leishmania major у мышей. J. Exp. Med. 178 , 567–577 (1993).
Артикул CAS PubMed Google ученый
Bajenoff, M. et al. Поведение естественных клеток-киллеров в лимфатических узлах, выявленное с помощью статических изображений и изображений в реальном времени. J. Exp. Med. 203 , 619–631 (2006).
Артикул CAS PubMed PubMed Central Google ученый
Laouar, Y., Sutterwala, F. S., Gorelik, L. & Flavell, R. A. Трансформирующий фактор роста β контролирует развитие Т-хелперных клеток 1 типа посредством регуляции естественного интерферона-γ клеток-киллеров. Нац. Иммунол. 6 , 600–607 (2005).
Артикул CAS PubMed Google ученый
Узонна, Дж.E., Joyce, K. L. & Scott, P. Низкая доза Leishmania major стимулирует временный ответ Т-хелперных клеток 2 типа, который подавляется Т-клетками CD8 + , продуцирующими интерферон γ. J. Exp. Med. 199 , 1559–1566 (2004).
Артикул CAS PubMed PubMed Central Google ученый
Belkaid, Y. et al. CD8 + Т-клетки необходимы для первичного иммунитета у мышей C57BL / 6 после внутрикожного заражения низкой дозой Leishmania major . J. Immunol. 168 , 3992–4000 (2002).
Артикул CAS PubMed Google ученый
Филипе-Сантос, О. и др. Динамическая карта распознавания антигена CD4 Т-клетками на участке инфекции Leishmania major . Клеточный микроб-хозяин 6 , 23–33 (2009).
Артикул CAS PubMed Google ученый
Мюллер, А.J. et al. CD4 + Т-клетки полагаются на градиент цитокинов для контроля внутриклеточных патогенов за пределами участков презентации антигена. Иммунитет 37 , 147–157 (2012).
Артикул CAS PubMed Google ученый
Антонелли, Л. Р. и др. Несопоставимые иммунорегуляторные потенциалы для дважды отрицательных (CD4 — CD8 — ) αβ и γδ Т-клеток пациентов с кожным лейшманиозом. Заражение. Иммун. 74 , 6317–6323 (2006).
Артикул CAS PubMed PubMed Central Google ученый
Mou, Z. et al. Врожденные двойные отрицательные Т-клетки, ограниченные MHC класса II, способствуют оптимальному первичному и вторичному иммунитету к Leishmania major . PLoS Pathog. 10 , e1004396 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Лев, Ф.Y., Hale, C. & Howard, J. G. Иммунологическая регуляция экспериментального кожного лейшманиоза. V. Характеристика эффекторных и специфических супрессорных Т-клеток. J. Immunol. 128 , 1917–1922 (1982).
CAS PubMed Google ученый
Белкайд, Ю., Пичцирилло, К. А., Мендес, С., Шевач, Э. М. и Сакс, Д. Л. CD4 + CD25 + регуляторные Т-клетки контролируют Leishmania major устойчивость и иммунитет. Nature 420 , 502–507 (2002).
Артикул CAS PubMed Google ученый
Peters, N.C. et al. Хроническая паразитарная инфекция поддерживает высокие частоты короткоживущих эффекторных Т-клеток Ly6C + CD4 + , которые необходимы для защиты от повторного инфицирования. PLoS Pathog. 10 , e1004538 (2014). Комплексное исследование CD4 + LY6C + эффекторных Т-клеток, которые обеспечивают быструю защиту от инфекции Leishmania .
Артикул CAS PubMed PubMed Central Google ученый
Colpitts, SL, Dalton, NM & Scott, P. Экспрессия рецептора IL-7 обеспечивает потенциал для долгосрочного выживания как Т-клеток центральной памяти CD62L high , так и эффекторных клеток Th2 во время инфекции Leishmania major . J. Immunol. 182 , 5702–5711 (2009).
Артикул CAS PubMed PubMed Central Google ученый
Zaph, C., Узонна, Дж., Беверли, С. М. и Скотт, П. Т-клетки центральной памяти опосредуют длительный иммунитет к Leishmania major в отсутствие устойчивых паразитов. Нац. Med. 10 , 1104–1110 (2004). Эта статья представляет собой первую демонстрацию того, что клетки CD4 + T CM могут сохраняться в течение длительного времени в отсутствие устойчивых паразитов.
Артикул CAS PubMed Google ученый
Colpitts, S.Л. и Скотт П. Раннее поколение гетерогенного ответа Т-лимфоцитов CD4 + на Leishmania major . J. Immunol. 185 , 2416–2423 (2010).
Артикул CAS PubMed PubMed Central Google ученый
Мюллер, С. Н. и Маккей, Л. К. Резидентные в тканях Т-клетки памяти: местные специалисты по иммунной защите. Нац. Rev. Immunol. 16 , 79–89 (2016).
Артикул CAS PubMed Google ученый
Glennie, N.D. et al. Резидентные в коже Т-клетки памяти CD4 + усиливают защиту от инфекции Leishmania major . J. Exp. Med. 212 , 1405–1414 (2015). Эта статья представляет собой первую демонстрацию того, что инфицирование L. major генерирует резидентные в коже CD4 + Т-клетки, которые способствуют развитию иммунитета.
Артикул CAS PubMed PubMed Central Google ученый
Мюллер, И., Кропф, П., Этджес, Р. Дж. И Луи, Дж. А. Гамма-интерфероновый ответ при вторичной инфекции Leishmania major : роль CD8 + Т-клеток. Заражение. Иммун. 61 , 3730–3738 (1993).
CAS PubMed PubMed Central Google ученый
Бертолет, С.и другие. Требования к антигену для эффективного примирования Т-клеток CD8 + дендритными клетками, инфицированными Leishmania major . Заражение. Иммун. 73 , 6620–6628 (2005).
Артикул CAS PubMed PubMed Central Google ученый
Gurunathan, S. et al. Вакцинация ДНК, кодирующей иммунодоминантный паразитарный антиген LACK, придает защитный иммунитет мышам, инфицированным Leishmania major . J. Exp. Med. 186 , 1137–1147 (1997).
Артикул CAS PubMed PubMed Central Google ученый
Jayakumar, A. et al. Активация TLR1 / 2 во время гетерологичной первичной бустерной вакцинации (ДНК-MVA) усиливает ответы Т-клеток CD8 + , обеспечивая защиту от Leishmania ( Viannia ). PLoS Negl. Троп. Дис. 5 , e1204 (2011).
Артикул CAS PubMed PubMed Central Google ученый
Ри, Э.G. et al. Вакцинация убитым нагреванием антигеном лейшмании или рекомбинантным лейшманиальным белком и олигодезоксинуклеотидами CpG индуцирует долговременную память CD4 + и CD8 + Т-клеточные ответы и защиту от инфекции Leishmania major . J. Exp. Med. 195 , 1565–1573 (2002).
Артикул CAS PubMed PubMed Central Google ученый
Кольменарес, М., Kima, P.E., Samoff, E., Soong, L. & McMahon-Pratt, D. Перфорин и γ-интерферон являются критическими CD8 + Т-клеточными ответами в индуцированном вакциной иммунитете против инфекции Leishmania amazonensis , вызванной вакциной. Заражение. Иммун. 71 , 3172–3182 (2003).
Артикул CAS PubMed PubMed Central Google ученый
Ives, A. et al. Вирус РНК Leishmania контролирует тяжесть кожно-слизистого лейшманиоза. Наука 331 , 775–778 (2011). Этот отчет является первым, в котором описано, как вирус РНК Leishmania влияет на тяжесть инфекций, вызываемых лейшманией .
Артикул CAS PubMed PubMed Central Google ученый
Tarr, P. I. et al. LR1: вирус-кандидат РНК Leishmania . Proc.Natl Acad. Sci. США 85 , 9572–9575 (1988).
Артикул CAS PubMed Google ученый
Bourreau, E. et al. Присутствие Leishmania RNA вируса 1 в Leishmania guyanensis увеличивает риск неэффективности лечения первой линии и симптоматического рецидива. J. Infect. Дис. 213 , 105–111 (2016).
Артикул CAS PubMed Google ученый
Адауи, В.и другие. Ассоциация эндобионтного двухцепочечного РНК вируса LRV1 с неэффективностью лечения лейшманиоза человека, вызываемого Leishmania braziliensis в Перу и Боливии. J. Infect. Дис. 213 , 112–121 (2016).
Артикул CAS PubMed Google ученый
Cantanhede, L. M. et al. Еще одно свидетельство связи между присутствием Leishmania RNA вируса 1 и проявлениями слизистой оболочки у пациентов с тегументарным лейшманиозом. PLoS Negl. Троп. Дис. 9 , e0004079 (2015).
Артикул CAS PubMed PubMed Central Google ученый
Salinas, G., Zamora, M., Stuart, K. & Saravia, N. РНК-вирусы Leishmania в Leishmania подрода Viannia . Am. J. Trop. Med. Hyg. 54 , 425–429 (1996).
Артикул CAS PubMed Google ученый
Перейра, Л.и другие. Тяжесть тегументарного лейшманиоза не связана исключительно с инфекцией вируса 1 РНК Leishmania в Бразилии. Mem. Inst. Освальдо Круз 108 , 665–667 (2013).
Артикул CAS PubMed Central Google ученый
МакЭлрат, М. Дж., Каплан, Г., Нусрат, А. и Кон, З. А. Кожный лейшманиоз. Нарушение притока Т-клеток у мышей BALB / c. J. Exp. Med. 165 , 546–559 (1987).
Артикул CAS PubMed Google ученый
de Moura, T. R. et al. К новой экспериментальной модели инфекции для изучения американского кожного лейшманиоза, вызываемого Leishmania braziliensis . Заражение. Иммун. 73 , 5827–5834 (2005).
Артикул CAS PubMed PubMed Central Google ученый
Арредондо, Б.И Перес, Х. Изменения иммунного ответа, связанные с хроническим экспериментальным лейшманиозом. Заражение. Иммун. 25 , 16–22 (1979).
CAS PubMed PubMed Central Google ученый
Nasseri, M. & Modabber, F. Z. Генерализованная инфекция и отсутствие гиперчувствительности замедленного типа у мышей BALB / c, инфицированных Leishmania tropica major . Заражение. Иммун. 26 , 611–614 (1979).
CAS PubMed PubMed Central Google ученый
Sadick, M. D. et al. Лечение мышиного лейшманиоза моноклональными антителами к интерлейкину 4. Доказательства Т-клеточно-зависимого, независимого от интерферона γ-механизма. J. Exp. Med. 171 , 115–127 (1990).
Артикул CAS PubMed Google ученый
Кейн, М.М. и Моссер, Д. М. Роль IL-10 в содействии прогрессированию лейшманиоза. J. Immunol. 166 , 1141–1147 (2001).
Артикул CAS PubMed Google ученый
Anderson, CF, Oukka, M., Kuchroo, VJ & Sacks, D. CD4 + CD25 — Foxp3 — Клетки Th2 являются источником опосредованного IL-10 подавления иммунитета при хронических кожных заболеваниях. лейшманиоз. Дж.Exp. Med. 204 , 285–297 (2007).
Артикул CAS PubMed PubMed Central Google ученый
Майлз, С. А., Конрад, С. М., Алвес, Р. Г., Джеронимо, С. М. и Моссер, Д. М. Роль иммунных комплексов IgG во время инфицирования внутриклеточным патогеном Leishmania . J. Exp. Med. 201 , 747–754 (2005).
Артикул CAS PubMed PubMed Central Google ученый
Джонс, Д.E., Buxbaum, L.U. и Scott, P. Независимое от IL-4 ингибирование чувствительности к IL-12 во время инфекции Leishmania amazonensis . J. Immunol. 165 , 364–372 (2000).
Артикул CAS PubMed Google ученый
Petritus, PM, Manzoni-de-Almeida, D., Gimblet, C., Gonzalez Lombana, C. & Scott, P. Leishmania mexicana вызывает ограниченное привлечение и активацию моноцитов и дендритных клеток, полученных из моноцитов на ранней стадии заражения. PLoS Negl. Троп. Дис. 6 , e1858 (2012).
Артикул CAS PubMed PubMed Central Google ученый
Сунг, Л. Модуляция функции дендритных клеток паразитами Leishmania . J. Immunol. 180 , 4355–4360 (2008).
Артикул CAS PubMed PubMed Central Google ученый
Franca-Costa, J.и другие. Пути аргиназы I, полиамина и простагландина E2 подавляют воспалительную реакцию и способствуют диффузному кожному лейшманиозу. J. Infect. Дис. 211 , 426–435 (2015).
Артикул CAS PubMed Google ученый
Wilhelm, P. et al. Лейшманиоз с быстрым летальным исходом у устойчивых мышей C57BL / 6, лишенных TNF. J. Immunol. 166 , 4012–4019 (2001).
Артикул CAS PubMed Google ученый
Виейра, Л.Q. et al. Мыши, у которых отсутствует рецептор TNF p55, не могут устранить повреждения, вызванные инфекцией Leishmania major , но контролируют репликацию паразита. J. Immunol. 157 , 827–835 (1996).
CAS PubMed Google ученый
Melby, P.C. et al. Повышенная экспрессия провоспалительных цитокинов при хронических поражениях кожного лейшманиоза человека. Заражение. Иммун. 62 , 837–842 (1994).
CAS PubMed PubMed Central Google ученый
Рибейро де Хесус, А., Луна, Т., Пачеко де Алмейда, Р., Мачадо, П.Р. и Карвалью, Е.М. Пентоксифиллин подавляет in vitro Т-клеточные ответы и ослабляет патологию в Leishmania и HTLV -I инфекции. Внутр. Иммунофармакол. 8 , 1344–1353 (2008).
Артикул CAS PubMed Google ученый
Лопес Костка, С.и другие. IL-17 способствует прогрессированию кожного лейшманиоза у восприимчивых мышей. J. Immunol. 182 , 3039–3046 (2009).
Артикул CAS PubMed Google ученый
Faria, D. R. et al. Снижение экспрессии in situ рецептора интерлейкина-10 коррелирует с усилением воспалительных и цитотоксических реакций, наблюдаемых при лейшманиозе слизистой оболочки. Заражение. Иммун. 73 , 7853–7859 (2005).
Артикул CAS PubMed PubMed Central Google ученый
Gonzalez-Lombana, C. et al. IL-17 опосредует иммунопатологию в отсутствие IL-10 после инфекции Leishmania major . PLoS Pathog. 9 , e1003243 (2013).
Артикул CAS PubMed PubMed Central Google ученый
Баселлар, О.и другие. Продукция интерлейкина 17 у пациентов с американским кожным лейшманиозом. J. Infect. Дис. 200 , 75–78 (2009).
Артикул CAS PubMed PubMed Central Google ученый
Boaventura, V. S. et al. Лейшманиоз слизистой оболочки человека: нейтрофилы проникают в участки повреждения тканей, которые экспрессируют высокие уровни Th27-связанных цитокинов. Eur. J. Immunol. 40 , 2830–2836 (2010).
Артикул CAS PubMed Google ученый
Brodskyn, C. I., Barral, A., Boaventura, V., Carvalho, E. & Barral-Netto, M. Управляемая паразитами in vitro цитотоксичность человеческих лимфоцитов в отношении аутологичных инфицированных макрофагов от лейшманиоза слизистых оболочек. J. Immunol. 159 , 4467–4473 (1997).
CAS PubMed Google ученый
Фариа, Д.R. et al. Рекрутирование CD8 + Т-клеток, экспрессирующих гранзим А, связано с прогрессированием поражения при кожном лейшманиозе человека. Parasite Immunol. 31 , 432–439 (2009).
Артикул CAS PubMed PubMed Central Google ученый
Santos Cda, S. et al. CD8 + гранзим B + -опосредованное повреждение ткани по сравнению с опосредованным CD4 + IFNγ + -опосредованное уничтожение паразитов при кожном лейшманиозе человека. J. Invest. Дерматол. 133 , 1533–1540 (2013). Эта работа описывает цитолитическую роль CD8 + Т-клеток у L. braziliensis -инфицированных пациентов.
Артикул CAS PubMed Google ученый
Cardoso, T. M. et al. Защитные и патологические функции CD8 + Т-клеток при инфекции Leishmania braziliensis . Заражение. Иммун. 83 , 898–906 (2015).
Артикул CAS PubMed PubMed Central Google ученый
Novais, F. O. et al. Геномное профилирование поражений человека Leishmania braziliensis позволяет идентифицировать модули транскрипции, связанные с кожной иммунопатологией. J. Invest. Дерматол. 135 , 94–101 (2015).
Артикул CAS PubMed Google ученый
Новаис, Ф.O. et al. Цитотоксические Т-клетки опосредуют патологию и метастазирование при кожном лейшманиозе. PLoS Pathog. 9 , e1003504 (2013). Эта статья — первая, демонстрирующая, что цитолитические CD8 + Т-клетки убивают инфицированные клетки перфорин-зависимым образом, что приводит к тяжелой патологии.
Артикул CAS PubMed PubMed Central Google ученый
Кросби, Э.J., Goldschmidt, M.H., Wherry, E.J. и Scott, P. Взаимодействие NKG2D с Т-лимфоцитами CD8 памяти сторонних наблюдателей способствует усилению иммунопатологии после инфекции Leishmania major . PLoS Pathog. 10 , e1003970 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Да-Крус, А. М., Оливейра-Нето, М. П., Берто, А. Л., Мендес-Агиар, К. О. и Коутиньо, С. Г.Т-клетки, специфичные к Leishmania и другим неродственным микробным антигенам, могут мигрировать в поражения кожи, вызванные лейшманиозом человека. J. Invest. Дерматол. 130 , 1329–1336 (2010).
Артикул CAS PubMed Google ученый
Dotiwala, F. et al. Лимфоциты-киллеры используют гранулизин, перфорин и гранзимы для уничтожения внутриклеточных паразитов. Нац. Med. 22 , 210–216 (2016).
Артикул CAS PubMed Google ученый
Kostka, S. L., Knop, J., Konur, A., Udey, M. C. & von Stebut, E. Различная роль передачи сигналов рецептора IL-1 типа I на ранних стадиях по сравнению с установленными инфекциями Leishmania major . J. Invest. Дерматол. 126 , 1582–1589 (2006).
Артикул CAS PubMed Google ученый
Лима-Юниор, Д.S. et al. Продукция IL-1β, производная инфламмасом, индуцирует опосредованную оксидом азота устойчивость к Leishmania . Нац. Med. 19 , 909–915 (2013). Это исследование показывает, что зависимый от инфламмасомы IL-1β помогает контролировать некоторые виды Leishmania spp. инфекции через NO-зависимый путь.
Артикул CAS PubMed Google ученый
фон Штебут, Э.и другие. Интерлейкин 1α способствует дифференцировке Th2 и ингибирует прогрессирование заболевания у мышей линии , чувствительных к Leishmania major, , BALB / c. J. Exp. Med. 198 , 191–199 (2003).
Артикул CAS PubMed PubMed Central Google ученый
Kautz-Neu, K. et al. Роль IL-1RA, происходящего из лейкоцитов, в гомеостазе DC выявляется по повышенной чувствительности IL-1RA-дефицитных мышей к кожному лейшманиозу. J. Invest. Дерматол. 131 , 1650–1659 (2011).
Артикул CAS PubMed Google ученый
Fernandez-Figueroa, E.A. et al. Тяжесть заболевания у пациентов, инфицированных Leishmania mexicana , относится к IL-1β. PLoS Negl. Троп. Дис. 6 , e1533 (2012).
Артикул CAS PubMed PubMed Central Google ученый
Икедзима, Т., Okusawa, S., Ghezzi, P., van der Meer, J. W. & Dinarello, C. A. Интерлейкин-1 индуцирует фактор некроза опухоли (TNF) в мононуклеарных клетках периферической крови человека in vitro и активность, подобную циркулирующему TNF, у кроликов. J. Infect. Дис. 162 , 215–223 (1990).
Артикул CAS PubMed Google ученый
Gurung, P. et al. Адаптивный иммунный ответ, вызванный NLRP3-индуцированным инфламмасомой Th3, способствует развитию лейшманиоза. J. Clin. Инвестировать. 125 , 1329–1338 (2015).
Артикул PubMed PubMed Central Google ученый
Bryson, K. J., Wei, X. Q. & Alexander, J. Интерлейкин-18 усиливает предвзятый ответ Th3 и чувствительность к Leishmania mexicana у мышей BALB / c. Microbes Infect. 10 , 834–839 (2008).
Артикул CAS PubMed Google ученый
Сюй, Д.и другие. IL-18 индуцирует дифференцировку клеток Th2 или Th3 в зависимости от цитокиновой среды и генетического фона. Eur. J. Immunol. 30 , 3147–3156 (2000).
Артикул CAS PubMed Google ученый
Shio, M. T., Christian, J. G., Jung, J. Y., Chang, K. P. & Olivier, M. PKC / ROS-опосредованная активация воспаления NLRP3 ослабляется цинк-металлопротеазой Leishmania во время инфекции. PLoS Negl. Троп. Дис. 9 , e0003868 (2015).
Артикул CAS PubMed PubMed Central Google ученый
Lefevre, L. et al. Рецепторы лектина С-типа dectin-1, MR и SIGNR3 вносят как положительный, так и отрицательный вклад в ответ макрофагов на Leishmania infantum . Иммунитет 38 , 1038–1049 (2013).
Артикул CAS PubMed Google ученый
Кампанелли, А.P. et al. CD4 + CD25 + Т-клетки в поражениях кожи пациентов с кожным лейшманиозом проявляют фенотипические и функциональные характеристики естественных регуляторных Т-клеток. J. Infect. Дис. 193 , 1313–1322 (2006).
Артикул CAS PubMed Google ученый
Bourreau, E. et al. Супрессивная функция внутриочаговых регуляторных Т-клеток при остром и хроническом кожном лейшманиозе у человека, вызванном Leishmania guyanensis . Заражение. Иммун. 77 , 1465–1474 (2009).
Артикул CAS PubMed PubMed Central Google ученый
Rodriguez-Pinto, D. et al. Регуляторные Т-клетки в патогенезе и лечении хронического кожного лейшманиоза человека, вызванного видами Leishmania ( Viannia ). PLoS Negl. Троп. Дис. 6 , e1627 (2012).
Артикул CAS PubMed PubMed Central Google ученый
Суффиа, И.J., Reckling, S.K., Piccirillo, C.A., Goldszmid, R. S. & Belkaid, Y. Зараженные сайт-рестриктированные естественные регуляторные Т-клетки Foxp3 + специфичны для микробных антигенов. J. Exp. Med. 203 , 777–788 (2006).
Артикул CAS PubMed PubMed Central Google ученый
Юрченко Э. и др. CCR5-зависимый хоминг естественных регуляторных Т-клеток CD4 + в сайты инфекции Leishmania major способствует сохранению патогена. J. Exp. Med. 203 , 2451–2460 (2006).
Артикул CAS PubMed PubMed Central Google ученый
Оквор, И., Лю, Д., Беверли, С. М. и Узонна, Дж. Э. Инокуляция убитых Leishmania major иммунным мышам быстро разрушает иммунитет к вторичному заражению посредством IL-10-опосредованного процесса. Proc. Natl Acad. Sci. США 106 , 13951–13956 (2009).
Артикул PubMed Google ученый
Мендес, С., Реклинг, С. К., Пичцирилло, С. А., Сакс, Д. и Белкайд, Ю. Роль регуляторных Т-клеток CD4 + CD25 + в реактивации стойкого лейшманиоза и контроле сопутствующего иммунитета. J. Exp. Med. 200 , 201–210 (2004).
Артикул CAS PubMed PubMed Central Google ученый
Джи, Дж., Мастерсон, Дж., Сан, Дж. И Сунг, Л. CD4 + CD25 + регуляторные Т-клетки сдерживают патогенные реакции во время инфекции Leishmania amazonensis . J. Immunol. 174 , 7147–7153 (2005).
Артикул CAS PubMed PubMed Central Google ученый
Эрлих А. и др. Иммунотерапевтическая роль регуляторных Т-клеток в инфекции Leishmania ( Viannia ) panamensis . J. Immunol. 193 , 2961–2970 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Коста, Д.L. et al. Tr-1-подобный CD4 + CD25 — CD127 — / низкий FOXP3 — Клетки являются основным источником интерлейкина 10 у пациентов с кожным лейшманиозом, вызванным Leishmania braziliensis . J. Infect. Дис. 211 , 708–718 (2015).
Артикул CAS PubMed Google ученый
Salhi, A. et al. Иммунологические и генетические доказательства решающей роли IL-10 в поражениях кожи у людей, инфицированных Leishmania braziliensis . J. Immunol. 180 , 6139–6148 (2008).
Артикул CAS PubMed Google ученый
Naik, S. et al. Компартментальный контроль кожного иммунитета резидентными комменсалами. Наука 337 , 1115–1119 (2012). Это исследование является первым, показывающим, что кожные комменсалы могут усугублять патологию кожного лейшманиоза.
Артикул CAS PubMed PubMed Central Google ученый
Петерс, Н.C. et al. Передача лейшмании переносчиками аннулирует индуцированный вакциной защитный иммунитет. PLoS Pathog. 5 , e1000484 (2009).
Артикул CAS PubMed PubMed Central Google ученый
Чанг, Дж. Т., Уэрри, Э. Дж. И Голдрат, А. В. Молекулярная регуляция дифференцировки эффекторных Т-клеток и Т-клеток памяти. Нац. Иммунол. 15 , 1104–1115 (2014).
Артикул CAS PubMed PubMed Central Google ученый
Хамесипур, А.и другие. Лейшманизация: использование старого метода оценки кандидатных вакцин против лейшманиоза. Vaccine 23 , 3642–3648 (2005).
Артикул CAS PubMed Google ученый
Рабочая группа по приоритетам исследований для разработки вакцин против лейшманиоза и соавт. Вакцины от лейшманиоза: предложения по исследовательской программе. PLoS Negl. Троп. Дис. 5 , e943 (2011).
Ноазин С. и др. Вакцины против лейшманиоза первого поколения: обзор полевых испытаний эффективности. Vaccine 26 , 6759–6767 (2008).
Артикул CAS PubMed Google ученый
Коффман, Р. Л., Шер, А. и Седер, Р. А. Адъюванты для вакцин: заставляя врожденный иммунитет работать. Иммунитет 33 , 492–503 (2010).
Артикул CAS PubMed PubMed Central Google ученый
Рид, С.Г., Орр, М. Т. и Фокс, К. Б. Ключевые роли адъювантов в современных вакцинах. Нац. Med. 19 , 1597–1608 (2013).
Артикул CAS PubMed Google ученый
Mou, Z. et al. Идентификация широко консервативного межвидового защитного антигена Leishmania и отвечающих на него Т-клеток CD4 + . Sci. Пер. Med. 7 , 310ra167 (2015). Это исследование идентифицирует иммунодоминантный антиген, который обеспечивает длительную защиту нескольких видов Leishmania spp.
Артикул CAS PubMed Google ученый
Рид, С. Г., Колер, Р. Н., Мондал, Д., Камхави, С. и Валенсуэла, Дж. Г. Разработка вакцины против Leishmania : использование интерфейса «хозяин-переносчик-паразит». Expert Rev. Vaccines 15 , 81–90 (2016).
Артикул CAS PubMed Google ученый
Oliveira, F.и другие. Вакцина с белком слюны песчаной мухи демонстрирует эффективность против переносимого переносчиками кожного лейшманиоза у нечеловеческих приматов. Sci. Пер. Med. 7 , 290ra90 (2015).
Артикул CAS PubMed Google ученый
Anderson, C.F., Mendez, S. & Sacks, D. L. Незаживающая инфекция, несмотря на поляризацию Th2, продуцируемую штаммом Leishmania major у мышей C57BL / 6. Дж.Иммунол. 174 , 2934–2941 (2005).
Артикул CAS PubMed Google ученый
МакМахон-Пратт, Д. и Александр, Дж. Имеет ли парадигма патогенеза и защиты Leishmania major и защиты от кожного лейшманиоза Нового Света или висцерального заболевания? Immunol. Ред. 201 , 206–224 (2004).
Артикул PubMed Google ученый
Джи, Дж., Sun, J., Qi, H. & Soong, L. Анализ ответов Т-хелперных клеток во время инфицирования Leishmania amazonensis . Am. J. Trop. Med. Hyg. 66 , 338–345 (2002).
Артикул PubMed Google ученый
Qi, H., Popov, V. & Soong, L. Leishmania amazonensis –дендритные клеточные взаимодействия in vitro и праймирование паразит-специфичных CD4 + Т-клеток in vivo . J. Immunol. 167 , 4534–4542 (2001).
Артикул CAS PubMed Google ученый
Satoskar, A., Bluethmann, H. & Alexander, J. Нарушение гена мышиного интерлейкина-4 тормозит прогрессирование заболевания при инфицировании Leishmania mexicana , но не усиливает контроль над инфекцией Leishmania donovani . Заражение. Иммун. 63 , 4894–4899 (1995).
CAS PubMed PubMed Central Google ученый
Stamm, L. M. et al. Мыши с разрушением гена, нацеленным на STAT6, развивают ответ Th2 и контролируют кожный лейшманиоз. J. Immunol. 161 , 6180–6188 (1998).
CAS PubMed Google ученый
Границы | Биомаркеры кожного лейшманиоза
,00Введение
Кожный лейшманиоз, древняя болезнь с неравномерным глобальным бременем
Leishmaniases включают множество инфекционных заболеваний, вызываемых простейшими из рода Leishmania , которые создают серьезные проблемы для общественного здравоохранения в эндемичных регионах 98 стран (Alvar et al., 2012). Из двух основных форм таких инфекций, известных как висцеральный лейшманиоз (ВЛ) и кожный лейшманиоз (КЛ), последняя является наиболее распространенной формой. Лейшманиоз — это многофакторное заболевание, на исход которого влияет динамическое взаимодействие паразита, его резервуара (резервуаров), его переносчика и, в конечном итоге, иммунной системы человека-хозяина. Экосистемы, в которых присутствуют указанные выше факторы, также могут влиять на инфекционность паразита. Например, изменения климата, способствующие расширению пустынь, могут создать благоприятную среду для распространения переносчиков и резервуаров паразитов, вызывающих CL.Распространенность ХЛ в эндемичных регионах растет из-за естественных благоприятных изменений окружающей среды, усугубляемых антропогенными воздействиями, такими как глобальное потепление, вырубка лесов, региональные конфликты, массовые миграции и урбанизация (González et al., 2010; Du et al. , 2016). В дополнение к существующей сложности, недавние открытия указали на нестабильность генома Leishmania в ответ на давление окружающей среды за счет высокого оборота анеуплоидии и механизмов отбора гаплотипов (Prieto Barja et al., 2017).
Ранее было подсчитано, что ~ 75% глобальных случаев ХЛ обнаруживаются в 10 странах, а именно в Афганистане, Алжире, Колумбии, Бразилии, Иране, Сирии, Эфиопии, Северном Судане, Коста-Рике и Перу (Alvar et al., 2012). Недавнее комплексное эпидемиологическое исследование, основанное на данных на уровне страны (таблица 1), подтвердило, что бремя ХЛ в основном ложится на определенные развивающиеся страны Ближнего Востока и Северной Африки в Старом Свете, а также на несколько стран Южной Америки и Карибского бассейна. в Новом Свете.Общими факторами, присущими всем эндемичным районам КЛ, являются высокая плотность населения и недоедание в сочетании с плохими санитарными условиями (Hotez et al., 2012, 2014; Karimkhani et al., 2016). Помимо экономического бремени, вызванного заболеваемостью CL, социальная стигматизация (Hurrell et al., 2016) и эмоциональное бремя из-за язв, особенно среди пострадавших женщин и детей, представляют собой другие важные последствия, связанные с заболеванием (Chahed et al. ., 2016; Bennis et al., 2017а, б).
Таблица 1 . Бремя ХЛ в странах с наибольшей распространенностью в Старом / Новом Свете (Каримхани и др., 2016).
Взаимодействие
Leishmania и иммунных клетокLeishmania паразитов, таких как Leishmania major, Leishmania tropica, Leishmania braziliensis, L. Mexicana и L. amazonensis , могут передаваться различными зоонозными и антропозоонозными циклами, которые могут включать жизненный цикл домашних и диких млекопитающих через дигенетический цикл. , делятся на внеклеточную и внутриклеточную стадии.Простейшие живут либо в форме промастигота внутри своей самки, питающейся кровью песчаной мухи отряда Diptera , принадлежащих к Phlebotomus ( Ph .; в Старом Свете) или Lutzomyia ( Lu .; в New World) или амастигота внутри паразитофорных вакуолей внутри фагоцитарных клеток (в основном макрофагов) позвоночного-хозяина (Lestinova et al., 2017). Инфекция превращается в изъязвленные поражения кожи, когда клеточно-опосредованный иммунный ответ не может устранить или контролировать резидентных паразитов внутри фагоцитарных клеток.
Считается, что фагоцитарные клетки, такие как нейтрофилы, играют решающую роль во время инфекции, которая может привести либо к выживанию, либо к уничтожению иммунологически неуязвимых паразитов Leishmania . Вскоре после проникновения паразита нейтрофилы массово попадают в очаг инфекции. Эти клетки опосредуют свои защитные функции с помощью двух разных подходов: (i) фагоцитоз и уничтожение паразитов (ii) образование внеклеточных ловушек нейтрофилов (NET) и высвобождение различных микробицидных агентов, связанных с основной цепью ДНК (Brinkmann et al., 2004). Через NET нейтрофилы способны улавливать и подавлять распространение паразитов (Zawrotniak and Rapala-Kozik, 2013). На основании исследований in vitro было показано, что L. major и Leishmania donovani могут выжить внутри нейтрофилов, ингибируя процесс слияния гранул с паразитами, содержащимися внутри фагосом (Gueirard et al., 2008; Hurrell et al., 2016). Кроме того, было показано, что паразиты, такие как L. major и L. braziilensis , способны противостоять микробицидным действиям, связанным с образованием NET через расщепление эндонуклеазами, происходящими либо от паразитов, либо от компонентов песчаных мух.Таким образом, с помощью разных подходов паразиту удается выжить внутри нейтрофилов (Regli et al., 2017). В зависимости от вида Leishmania нейтрофилы могут влиять на исход заболевания и действовать как важные модуляторы лейшманиозов (Hurrell et al., 2016). Более того, показано, что резидентные в коже макрофаги и дендритные клетки (ДК) способны представлять Т-клеткам процессированные антигены амастигот; хотя каждый из них использует разные механизмы (Cecílio et al., 2014).
Интересно, что после встречи с паразитами Leishmania биологическое поведение фагоцитов изменяется настолько, что макрофаги становятся клеткой-хозяином для паразита, а ДК, по-видимому, в основном ответственны за примирование Т-клеток и индукцию защитного иммунитета (фон Стебут и Tenzer, 2017). Нет четких доказательств судьбы паразитов Leishmania в DC. Важность таких антигенпрезентирующих клеток в поддержании паразитов и индукции долговременной памяти также очевидна для излеченных пациентов с ХЛ и может также иметь функции для бессимптомной популяции.Более полное понимание универсальных функций DC в CL и их взаимодействия с другими иммунными клетками может дать новое понимание основных иммунных механизмов, которые контролируют CL.
Биомаркеры CL
Чтобы оценить и сравнить лечебные или профилактические стратегии для людей, затронутых CL, исследователям необходимо определить биомаркеры как индикаторы нормальных биологических процессов, а также инструменты для их обнаружения. Применение биомаркеров в отношении таких заболеваний, как CL, можно разделить на различные подходы, такие как диагностика, прогноз и мониторинг прогрессирования заболевания или результатов клинических вмешательств (Mayeux, 2004).Методология, используемая для оценки биомаркеров, в идеале должна быть безопасной и чувствительной, способной объективно давать согласованные результаты для разных полов и этнических групп (Theppeang et al., 2008; Strimbu and Tavel, 2010). Поскольку ХЛ в основном распространена в развивающихся странах, инструмент для оценки биомаркера ХЛ также должен быть относительно доступным для пострадавших обществ.
Биомаркеры в литературе часто делятся на прямые и косвенные категории. Что касается CL, факторы, продукты или условия, возникшие непосредственно в результате инфекции, могут рассматриваться как прямые биомаркеры.Принимая во внимание, что количественные или качественные биологические реакции хозяина, вызванные лейшманиозной инфекцией, можно рассматривать как косвенные биомаркеры. Выявление биомаркеров, связанных с диагностикой, лечением и особенно исходом заболевания, может помочь в разработке новых идей или инструментов для лучшего понимания механизмов, лежащих в основе защитных иммунных ответов при CL. В последние годы был опубликован всесторонний систематический обзор потенциальных фармакодинамических биомаркеров различных форм лейшманиозов (Kip et al., 2015). Хотя было проведено мало исследований биомаркеров, связанных с ВН, вызываемой Leishmania infantum и L. donovani (Ibarra-Meneses et al., 2016, 2017), мало что известно о биомаркерах ХЛ в целом и бессимптомных биомаркерах ХЛ в специфический. Здесь мы кратко обсудим состояние маркеров CL, хотя и не исчерпывающе. Предполагаемые биомаркеры, основанные на исследованиях CL, разделенные на прямые и косвенные маркеры, сведены в Таблицу 2.
Таблица 2 .Предполагаемые биомаркеры CL.
Обнаружение инфекции
Определение наличия в тканях паразита Leishmania , вызывающего КЛ, можно рассматривать как наиболее прямой биомаркер КЛ. Однако диагностика CL — непростая задача из-за вариабельности поражения по степени тяжести, клиническому проявлению и продолжительности; поэтому разработка чувствительных диагностических биомаркеров пользуется большим спросом (Akhoundi et al., 2017). Иногда диагностическое решение также усложняется из-за сходства клинических симптомов в таких случаях, как бактериальные язвы, проказа, саркоидоз и обыкновенная волчанка.Традиционно окончательный диагноз основывался на визуализации Leishmania в прямом мазке с последующим культивированием и инокуляцией животных. Позже методы молекулярной диагностики приобрели известность благодаря их быстроте, чувствительности и специфичности, что позволило исследователям различать даже различные виды Leishmania с помощью различных видоспецифичных зондов. Существуют также неинвазивные методы отбора проб, при которых ДНК паразита выделяется последовательными полосками ленты с последующим обнаружением паразитов с помощью ПЦР (Taslimi et al., 2017). Хотя не существует специального золотого стандарта для обнаружения и диагностики инфекции Leishmania , полное секвенирование нескольких геномов Leishmania может открыть новые возможности для выявления точных диагностических биомаркеров в будущем (Van der Auwera et al., 2014). Несколько косвенных биомаркеров CL, которые были выяснены до сих пор, упомянуты ниже.
Гиперчувствительность замедленного типа
Размножение паразита внутри макрофагов обычно приводит к типичным язвам, которые могут сохраняться в течение года.После заживления такие язвы оставляют на коже обезображивающие шрамы. Из-за важности клеточно-опосредованного иммунитета (CMI) в исходе CL (Sacks and Noben-Trauth, 2002), состояние CMI у пациентов с подозрением на CL обычно оценивается путем тестирования гиперчувствительности замедленного типа IV [DTH; (Turk, 1979)] против лейшманиальных антигенов. Такие тесты могут быть выполнены с помощью кожной пробы лейшманина (LST; ранее известный как тест Черногории), которая указывает на предыдущее столкновение иммунной системы хозяина с паразитом.О положительном ответе на ГЗТ свидетельствует небольшое уплотнение, которое образуется через 72 часа после внутрикожной инъекции 100 мкл реагента лейшманина (фенолизированные культивируемые промастиготы L. major ). LST остается мощным биомаркером для различения субпопуляций в отношении бессимптомной ХЛ. Более того, результаты LST можно интерпретировать как показатель развитой иммунологической памяти (Andrade-Narvaez et al., 2016).
Субпопуляции Т-клеток и важность цитокинов как предполагаемых биомаркеров
С 1980-х годов исследователи пытались выяснить различные функции Т-клеток, происходящих из тимуса, и их цитокиновые профили в отношении лейшманиозов.Эти исследования на мышах, проведенные в основном с инфекциями L. major , привели к предложению двух контррегуляторных субпопуляций CD4 + Т-клеток, известных как Th2 и Th3, которые используются для контроля устойчивости и восприимчивости к инфекции, соответственно ( Александр и Бромбахер, 2012). Однако до сих пор в исследованиях ХЛ человека не было продемонстрировано такого четко выраженного фенотипа Th2 / Th3. Было показано, что обострение опосредованных клетками Th2 иммунных ответов во время ХЛ, таких как чрезмерная секреция провоспалительного цитокина IFN-γ, вызывает повреждение тканей и, как предполагается, способствует прогрессированию поражения (Maspi et al., 2016).
Помимо важности функций Th2 и Th3 в отношении иммунитета к CL, также были идентифицированы две другие субпопуляции Т-клеток, а именно регуляторные Т-клетки (T reg ) и клетки Th27, которые регулируют иммунитет к CL. Известно, что T reg действует как поддерживающая толерантность и предотвращающая чрезмерные повреждения во время воспалительных реакций (Suffia et al., 2005). Доказательства указывают на то, что при ХЛ, вызванной L. braziliensis и L. guyanensis , функциональный T reg привлекается к участкам поражения (Campanelli et al., 2006; Бурро и др., 2009). Клетки Th27, с другой стороны, были предложены для управления балансом между про- и противовоспалительными цитокинами во время ХЛ, а также для набора нейтрофилов в очаг инфекции (Gonçalves-de-Albuquerque et al., 2017).
Среди цитокинов, исследованных в исследованиях CL, IL-10, по-видимому, служит предполагаемым биомаркером, который может указывать на неэффективность лечения. Было показано, что уровень мРНК этого регуляторного цитокина при поражении КЛ положительно коррелирует с невосприимчивостью к лечению (Louzir et al., 1998; Бурро и др., 2001). Было показано, что уровень мРНК провоспалительного цитокина TNF-α при биопсии поражения КЛ положительно коррелирует с размером поражения (Louzir et al., 1998). Хотя предполагалось, что повышенные уровни TNF-α в сыворотке связаны с тяжестью кожно-слизистого лейшманиоза, вопрос о том, верно ли это для CL, является предметом споров (Barral-Netto et al., 1991; Castes et al. , 1993; Vouldoukis et al., 1994; Da-Cruz et al., 1996; Kocyigit et al., 2002a, b).Кроме того, транскрипт IL-6 в биоптатах очагов CL и белок IL-6 в сыворотке пациентов были связаны с размером поражения у пациентов с CL (Louzir et al., 1998; Kocyigit et al., 2002a). Было показано, что незажившие поражения, а также продолжительность поражения коррелируют с IL-12 p40 (Melby et al., 1996; Louzir et al., 1998).
Ферменты
Аденозиндезаминаза (ADA), обнаруженная в макрофагах, опосредует дезаминирование противовоспалительного нуклеозида аденозина до инозина. Было показано, что уровень ADA значительно повышен в сыворотке и лимфоцитах пациентов с ХЛ (Erel et al., 1998). В недавнем исследовании было показано, что активность ADA в сыворотке у пациентов с активной VL и посткала-азарным дермальным лейшманиозом (PKDL) была значительно выше, чем у их соответствующих пролеченных случаев, а также у здоровых людей. Было обнаружено, что активность ADA в PKDL постепенно снижается на разных этапах лечения, что предполагает, что этот параметр может действовать как маркер патогенеза и прогноза заболевания (Vijayamahantesh et al., 2016).
L-аргинин — это условно незаменимая аминокислота, которая играет роль во многих метаболических путях и служит общим субстратом как для аргиназы, так и для синтазы оксида азота (NOS).В CL аргинин действует как палка о двух концах, так что, хотя он необходим для опосредованного оксидом азота (NO) уничтожения паразитов, он может способствовать репликации паразитов, опосредованной полиамином (Gogoi et al., 2016). Индукция активности аргиназы в очагах поражения CL вызывает истощение аргинина и, следовательно, снижение содержания NO. В целом аргиназа ограничивает доступность аргинина и становится агентом подавления иммунитета и нарушения Т-клеточных ответов. В соответствии с этим представлением было показано, что уровень активности аргиназы значительно повышен в сыворотках пациентов с ХЛ (França-Costa et al., 2015). Более того, у пациентов, инфицированных либо L. major , либо L. tropica , уровни активности аргиназы в очагах поражения у тех, у кого была острая ХЛ (продолжительность ≤ 1 год), были выше, чем у пациентов с хронической ХЛ (длительность ≥2 лет), а также в коже неинфицированных людей (Mortazavi et al., 2016). Интересно, что активность аргиназы в промастиготах L. major , выделенных от пациентов с ХЛ, оказалась значительно выше, чем активность этого фермента в непатогенном штамме этого паразита (Badirzadeh et al., 2017).
Антитела против слюны песчаной мухи
Самки москитов-флеботоминов являются единственными естественными переносчиками видов Leishmania . Важность слюны песчаных мух для распространения инфекции в местах кормления хорошо известна (Maroli et al., 2013). Повреждение кожи, вызванное механикой укуса, создает враждебную среду для питающегося кровью насекомого через гемостаз, воспаление и иммунные реакции. Считается, что паразиту в такой неблагоприятной среде противодействуют антигемостатические, противовоспалительные и иммуномодулирующие компоненты слюны песчаной мухи.Было показано, что несколько иммуномодулирующих компонентов, общих для различных слюн песчаных мух, и в частности ферменты, такие как апираза, гиалуронидазы и эндонуклеазы, регулируют как врожденный, так и адаптивный иммунный ответ (Lestinova et al., 2017).
Было показано, что экспериментальное воздействие на мышей, собак и людей укусов песчаных мух вызывает выработку антител через несколько недель; хотя в таких случаях величина реакции зависит от количества укусов песчаных мух (Abdeladhim et al., 2014). Иммунный ответ на определенный компонент слюны песчаных мух может выступать в качестве надежных биомаркеров воздействия переносчиков. Следовательно, идентификация и характеристика антигенов слюны, специфичных для определенного вида переносчиков, может использоваться в качестве биомаркера воздействия. Слюнный антиген PpSP32 является иммунодоминатной мишенью для ответа антител на укусы Phlebotomus papatasi у человека. Антитело против рекомбинантного PpSP32 (rPpSP32) недавно было протестировано в качестве предполагаемого биомаркера воздействия песчаных мух в Тунисе (Marzouki et al., 2012). Однако ответ против PpSP32 не был зарегистрирован у собак, иммунизированных слюной Ph. Perniciosus (Marzouki et al., 2015). В Южной Америке есть и другие исследования, в которых было показано, что антитела против LJM11 и LJM17 из слюны Lutzomyia longipalpis могут действовать как предполагаемые биомаркеры воздействия переносчиков как на людей, так и на собак (Teixeira et al., 2010). Эти два белка принадлежат к семейству желтых, их много у песчаных мух и отсутствуют в слюне комаров (Xu et al., 2011; Абделадхим и др., 2014). Также примечательно, что кинетика и продолжительность ответа антител также могут рассматриваться как предполагаемый биомаркер воздействия вектора или паразита.
Предполагаемые биомаркеры бессимптомной инфекции CL
Хотя меньшинство людей, живущих в эндемичных районах, заболевает ХЛ и проявляет язвы, у значительной части людей наблюдается положительный ответ на ГЗТ без каких-либо кожных язв. Основной механизм, с помощью которого бессимптомные люди контролируют инфекцию, полностью не изучен.Понимание иммунологической основы бессимптомности ХЛ представляет собой неудовлетворенную потребность, которая, если она будет согласована, может послужить основой для разработки инструментов для выявления и борьбы с ХЛ. Тем не менее, становится все более очевидным, что решение проблем многофакторных сложных заболеваний, таких как лейшманиоз, на которые влияют различные иммунологические, генетические факторы и факторы окружающей среды, выиграет от беспристрастного системного анализа.
Хорошо задокументировано, что после клинического излечения некоторых внутриклеточных патогенов, таких как вирусы герпеса, микобактерии , хламидии и Trypanosoma , в организме может быть обнаружено длительное сохранение этих патогенов (Mendonça et al., 2004). Однако из-за отсутствия адекватных диагностических инструментов сложно отличить людей с устойчивой инфекцией Leishmania от людей с иммунологически сенсибилизирующим воздействием (Andrade-Narvaez et al., 2016). Сообщалось о существовании живых паразитов Leishmania различных штаммов после клинического лечения с помощью химиотерапии. В одном исследовании с применением точных молекулярных подходов было подтверждено присутствие живых паразитов при кожно-слизистом лейшманиозе, вызванном видами Leishmania подрода Viannia .Присутствие Leishmania было продемонстрировано в моноцитах крови, миндалинах и нормальной коже клинически излеченных, а также бессимптомных лиц с использованием амплификации гена 7SLRNA. Как упоминалось ранее, иммунные ответы играют в этом отношении выдающуюся роль. Например, показано, что макрофаги, полученные из моноцитов от людей с бессимптомной ХЛ, вызванной L. braziliensis , контролируют паразита намного сильнее, чем макрофаги от пациентов с поражениями.Эти данные, помимо многих других, могут показать внутренние различия между ответами врожденного иммунитета (Giudice et al., 2012; Scorza et al., 2017).
Было показано, что частота и подавляющая способность регуляторных Т-клеток (CD4 + CD25 высокий FoxP3 +) сопоставимы в периферической крови вылеченных и бессимптомных людей в эндемичной зоне инфекции L. major в Иран. Однако уровень мРНК фактора транскрипции T reg FOXP3 был выше в бессимптомной группе по сравнению с симптомными пациентами.Уровень мРНК фактора транскрипции IL-17 RORC , с другой стороны, существенно не различался между группами (Bahrami et al., 2014).
Недавно было проведено поперечное исследование иммунного профилирования PBMC людей, живущих в эндемичных районах передачи L. major в Тунисе с задокументированным анамнезом заражения (Kammoun-Rebai et al., 2016). Участники были разделены в соответствии с их ответами на LST и наличием рубца на три группы излеченных, бессимптомных и наивных людей.Были подтверждены достоверные ответы, специфичные для Leishmania у лиц с LST + SCAR + и LST + SCAR-, но не у LST-SCAR- (наивные субъекты). Аналогичным образом, уровни IL-2, IL-12p70, IL-13 и IL-18 были значительно выше у всех LST + индивидуумов, но не в когорте LST-. После проверки такие биомаркеры могут потенциально использоваться для стратификации пациентов по различным клиническим / субклиническим проявлениям заболевания.
Хотя LST считается безопасным, его применение требует инвазивной инъекции убитого паразита в растворе фенола.В качестве потенциальной альтернативы LST гомогенаты слюнных желез (SGH) или их белки могут использоваться для определения риска контакта, эпиднадзора за переносчиками и, как таковые, могут использоваться в программах управления заболеванием (Oliveira et al., 2013a). Было показано, что у людей укус москитов индуцирует DTH в местах укусов и может вызывать специфические реакции антител, обнаруживаемые в сыворотке (Oliveira et al., 2013b). Таким образом, DTH и специфические антитела, по-видимому, также могут использоваться в качестве маркеров воздействия укуса вектора на людей и животных.Как упоминалось выше, рекомбинантный PpSP32 из Ph. Papatasi может действовать как сывороточный биомаркер воздействия (Marzouki et al., 2012). Следовательно, идентификация различных биомаркеров от различных инфекционных москитов в сочетании с разработкой простых и надежных инструментов, таких как методы, основанные на методах отбора проб из капилляров пальцем, и аутореактивные полоски с уже фиксированным rPpSP32, может облегчить скрининг целевой популяции в эндемичные районы.
Бессимптомные пациенты с ХЛ служат потенциальными резервуарами
Характеристика Leishmania при бессимптомной инфекции технически сложно из-за ограничений в обнаружении небольшого числа паразитов.Важно отметить, что небольшое количество паразитов, присутствующих в коже бессимптомных людей, может действовать как резервуар инфекции. PKDL — хороший пример таких ситуаций, в которых бессимптомная инфекция может преобразоваться в PKDL (Saha et al., 2017). Следовательно, разработка и использование точных и чувствительных молекулярных инструментов может помочь выявить бессимптомных лиц с низким уровнем инфекции, что, в свою очередь, может облегчить разработку мер по контролю CL.
Существует нехватка документов об обнаружении паразитов в коже или крови бессимптомных пациентов в Старом Свете.Следует отметить, что недавно поступили сообщения об обнаружении L. tropica и L. major у излеченных лиц с ХЛ с различной продолжительностью после выздоровления (Taslimi et al., 2017). Также сообщалось о присутствии Leishmania паразитов в непораженной коже и моноцитах периферической крови американской CL, вызванных видами Leishmania ( Viannia) (Vergel et al., 2006). ДНК кинетопласта Leishmania была обнаружена методом ПЦР в рубцах и периферической крови через несколько лет после заживления.Кроме того, в этом исследовании было продемонстрировано наличие паразитов Leishmania ( Viannia ) в тканях и его доступность в тканях, доступных для москитов. При рассмотрении двух участков тела, состоящих из границы активного поражения и нормального участка кожи, жизнеспособные паразиты были обнаружены на непораженной коже этих людей (Rosales-Chilama et al., 2015). Принимая во внимание вышеупомянутые доказательства и сходство иммунных ответов между излеченными и бессимптомными популяциями в эндемичных областях CL, вполне вероятно, что видов Leishmania и сохраняются внутри кожи бессимптомных людей.Чтобы подтвердить это, следует предпринять усилия по анализу кожи и крови бессимптомных субъектов с подтвержденной ГЗТ в высокоэндемичных регионах.
Перспективы будущего
Хотя с использованием традиционных подходов было предложено несколько индикативных биомаркеров инфекции CL и иммунитета, данные на системном уровне, объединяющие различные уровни информации о реакции хозяина на инфекцию CL, недостаточны. Такая информация может дать исчерпывающее представление о болезни и, предположительно, может идентифицировать ключевые биомаркеры болезни CL и иммунитета.Недавние технологические достижения в области высокопроизводительной омики в сочетании с подходами системной биологии начали давать новое понимание патогенеза различных заболеваний и раскрывать молекулярные сигнатуры вакцин-индуцированных реакций у людей. Недавно к CL был применен анализ транскриптомики всего генома. Мы сообщили об изменениях транскрипта поражений пациентов, инфицированных L. tropica , по сравнению со здоровой нормальной кожей (Masoudzadeh et al., 2017). Мы определили ключевые иммунобиологические пути, которые регулируются после инфицирования L. tropica во время острой фазы заболевания. Другое недавнее исследование транскриптомики биопсий поражений у пациентов L. braziliensis у пациентов выявило активацию В-клеток и сигнатуры транскриптов иммуноглобулинов в поражениях, в зависимости от наличия или отсутствия транскриптов паразитов (Christensen et al., 2016). Основываясь на быстрых темпах развития в этой области, предполагается, что будет выявлено больше предполагаемых биомаркеров, способных предсказать исход инфекции CL, вызванной различными видами Leishmania (Patino and Ramírez, 2017).Однако при интерпретации данных биомаркеров следует проявлять осторожность, поскольку идентифицированные биомаркеры могут просто служить суррогатными маркерами инфекции или иммунитета и как таковые не обязательно могут играть причинную роль в патогенезе или иммунитете к CL.
Когда такая ключевая информация о биомаркерах станет доступной, ее можно будет использовать при разработке рациональной диагностики и стратегий вмешательства для контроля CL. В частности, это может помочь в проверке населения, проживающего в эндемичных районах, на наличие бессимптомных лиц, что, в свою очередь, может предоставить бесценную информацию о том, как гендерные, этнические или географические факторы могут повлиять на бессимптомность.Для этого необходимы точные, неинвазивные и быстрые методы, позволяющие отличить латентную ХЛ от бессимптомной ХЛ. Следует отметить, что необходимо также повысить осведомленность на глобальном и национальном уровнях, чтобы проложить путь к разработке экономически эффективных стратегий диагностики и вмешательства для растущего пострадавшего населения.
Авторские взносы
FB, AH и SR составили черновик рукописи. Все авторы предоставили критические отзывы о рукописи перед публикацией и согласились с окончательным содержанием.
Финансирование
SR поддерживается исследовательским грантом ID
7 от Национального фонда элит при президенте Исламской Республики Иран, FB поддерживается исследовательским грантом ID 760 Института Пастера Ирана, а AH поддерживается Инициативой инновационных лекарственных средств Европейской комиссии в рамках программы BioVacSafe (грант соглашение № 115308), консорциумы VSV-EBOVAC (грантовое соглашение № 115842) и VSV-EBOPLUS (грантовое соглашение № 116068).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы выражают благодарность за поддержку h3020-MSCA-RISE-2017, консорциум LeiSHield-MATI (номер грантового соглашения 778298).
Список литературы
Абделадхим М., Камхави С. и Валенсуэла Дж. Г. (2014). Что стоит за укусом песчаной мухи? Глубокое влияние слюны песчаных мух на гемостаз, воспаление и иммунитет хозяина. Заражение. Genet. Evol. 28, 691–703. DOI: 10.1016 / j.meegid.2014.07.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахунди, М., Даунинг Т., Вотипка Дж., Кулс К., Лукес Дж., Каннет А. и др. (2017). Инфекции Leishmania: молекулярные мишени и диагностика. Мол. Аспекты Мед. 57, 1-29. DOI: 10.1016 / j.mam.2016.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Александр, Дж., И Бромбахер, Ф. (2012). T helper1 / t helper2 клетки и устойчивость / восприимчивость к инфекции Leishmania: актуальна ли эта парадигма? Фронт. Иммунол. 3:80. DOI: 10.3389 / fimmu.2012.00080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альвар, Дж., Велес, И. Д., Берн, К., Эрреро, М., Дежо, П., Кано, Дж. И др. (2012). Лейшманиоз во всем мире и глобальные оценки его заболеваемости. PLoS ONE 7: e35671. DOI: 10.1371 / journal.pone.0035671
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Андраде-Нарваес, Ф. Дж., Лориа-Сервера, Э. Н., Соса-Бибиано, Э. И., и Ван Винсберг, Н. Р. (2016). Бессимптомная инфекция американским кожным лейшманиозом: эпидемиологические и иммунологические исследования. Mem. Inst. Освальдо Круз 111, 599–604. DOI: 10.1590 / 0074-02760160138
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бадирзаде, А., Тахери, Т., Абеди-Астанех, Ф., Таслими, Ю., Абдосамади, З., Монтахаб-Еганех, Х. и др. (2017). Аргиназная активность Leishmania, выделенного от пациентов с кожным лейшманиозом. Parasite Immunol. 39. DOI: 10.1111 / pim.12454
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бахрами, Ф., Дараби, Х., Риази-Рад, Ф., Хазе, В., Аждары, С., и Алимохаммадян, М. Х. (2014). Экспрессия FOXP3 и частота регуляторных Т-клеток у излеченных лиц от инфекции Leishmania major и в бессимптомных случаях. Hum. Иммунол. 75, 1026–1033. DOI: 10.1016 / j.humimm.2014.08.204
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баррал-Нетто, М., Бадаро, Р., Баррал, А., Алмейда, Р. П., Сантос, С. Б., Бадаро, Ф. и др. (1991). Фактор некроза опухоли (кахектин) при висцеральном лейшманиозе человека. J. Infect. Дис. 163, 853–857. DOI: 10.1093 / infdis / 163.4.853
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беннис И., Белаид Л., Де Броувер В., Филали Х., Сахиби Х. и Боэларт М. (2017a). «Комары, разрушающие твое лицо». Социальное воздействие кожного лейшманиоза на юго-востоке Марокко, качественное исследование. PLoS One 12: e0189906. DOI: 10.1371 / journal.pone.0189906
CrossRef Полный текст | Google Scholar
Беннис, И., Thys, S., Filali, H., De Brouwere, V., Sahibi, H., and Boelaert, M. (2017b). Психосоциальное воздействие рубцов, вызванных кожным лейшманиозом, на учащихся старших классов в провинции Эррахидия, Марокко. Заражение. Дис. Бедность 6:46. DOI: 10.1186 / s40249-017-0267-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бурро, Э., Прево, Г., Гардон, Дж., Прадино, Р., и Лонуа, П. (2001). Высокая экспрессия информационной РНК интерлейкина-10 внутри очага поражения при локализованном кожном лейшманиозе связана с невосприимчивостью к лечению. J. Infect. Дис. 184, 1628–1630. DOI: 10.1086 / 324665
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bourreau, E., Ronet, C., Darcissac, E., Lise, M. C., Sainte Marie, D., Clity, E., et al. (2009). Супрессивная функция регуляторных Т-клеток внутри очага поражения при остром и хроническом кожном лейшманиозе человека, вызванном Leishmania guyanensis. Заражение. Иммун. 77, 1465–1474. DOI: 10.1128 / IAI.01398-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бринкманн, В., Reichard, U., Goosmann, C., Fauler, B., Uhlemann, Y., Weiss, D.S, et al. (2004). Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 303, 1532–1535. DOI: 10.1126 / science.10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кампанелли А. П., Розелино А. М., Кавассани К. А., Перейра М. С., Мортара Р. А., Бродскин К. И. и др. (2006). CD4 + CD25 + Т-клетки в поражениях кожи пациентов с кожным лейшманиозом проявляют фенотипические и функциональные характеристики естественных регуляторных Т-клеток. J. Infect. Дис. 193, 1313–1322. DOI: 10.1086 / 502980
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кастес, М., Трухильо, Д., Рохас, М. Э., Фернандес, К. Т., Арайя, Л., Кабрера, М., и др. (1993). Сывороточные уровни фактора некроза опухоли у пациентов с американским кожным лейшманиозом. Biol. Res. 26, 233–238.
PubMed Аннотация | Google Scholar
Сесилио, П., Перес-Кабесас, Б., Сантарен, Н., Масиэль, Дж., Родригес, В., и Кордейро да Силва, А. (2014). Обман и манипуляции: руки лейшмании, успешного паразита. Фронт. Иммунол. 5: 480. DOI: 10.3389 / fimmu.2014.00480
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чахед М. К., Беллали Х., Бен Джемаа С. и Белладж Т. (2016). Психологические и психосоциальные последствия зоонозного кожного лейшманиоза среди женщин в Тунисе: предварительные результаты исследовательского исследования. PLoS Negl. Троп.Дис. 10: e0005090. DOI: 10.1371 / journal.pntd.0005090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристенсен, С. М., Диллон, Л. А., Карвалью, Л. П., Пассос, С., Новаис, Ф. О., Хьюитт, В. К. и др. (2016). Мета-транскриптомный профиль кожного поражения человека — Leishmania braziliensis . PLoS Negl. Троп. Дис. 10: e0004992. DOI: 10.1371 / journal.pntd.0004992
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Да-Крус, А.М., де Оливейра, М. П., Де Лука, П. М., Мендонка, С. К. и Коутиньо, С. Г. (1996). Фактор альфа некроза опухоли при американском тегументарном лейшманиозе человека. Mem. Inst. Освальдо Круз 91, 225–229. DOI: 10.1590 / S0074-02761996000200019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ду Р., Хотез П. Дж., Аль-Салем В. С. и Акоста-Серрано А. (2016). Кожный лейшманиоз Старого Света и кризисы беженцев на Ближнем Востоке и в Северной Африке. PLoS Negl.Троп. Дис. 10: e0004545. DOI: 10.1371 / journal.pntd.0004545
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрель О., Коцигит А., Гурель М. С., Булут В., Сейрек А. и Оздемир Ю. (1998). Активность аденозиндезаминазы в сыворотках, лимфоцитах и гранулоцитах у пациентов с кожным лейшманиозом. Mem. Inst. Освальдо Круз 93, 491–494. DOI: 10.1590 / S0074-02761998000400014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
França-Costa, J., Ван Вейенберг, Дж., Боавентура, В. С., Луз, Н. Ф., Мальта-Сантос, Х., Оливейра, М. К. и др. (2015). Пути аргиназы I, полиамина и простагландина E2 подавляют воспалительную реакцию и способствуют диффузному кожному лейшманиозу. J. Infect. Дис. 211, 426–435. DOI: 10.1093 / infdis / jiu455
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Giudice, A., Vendrame, C., Bezerra, C., Carvalho, L.P., Delavechia, T., Carvalho, E.M, et al. (2012).Макрофаги участвуют в защите хозяина и в патологии болезни, связанной с инфекцией Leishmania braziliensis . BMC Infect. Дис. 12:75. DOI: 10.1186 / 1471-2334-12-75
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гогои М., Дати А., Уилсон К. Т. и Чакравортти Д. (2016). Двойная роль метаболизма аргинина в установлении патогенеза. Curr. Opin. Microbiol. 29, 43–48. DOI: 10.1016 / j.mib.2015.10.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gonçalves-de-Albuquerque, S.D. C., Pessoa, E. S. R., Trajano-Silva, L. A. M., de Goes, T. C., de Morais, R. C. S., da, C., et al. (2017). Однозначная роль клеток Th27 и нейтрофилов в иммунопатогенезе лейшманиоза. Фронт. Иммунол. 8: 1437. DOI: 10.3389 / fimmu.2017.01437
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес, К., Ван, О., Струтц, С. Э., Гонсалес-Салазар, К., Санчес-Кордеро, В., и Саркар, С. (2010). Изменение климата и риск лейшманиоза в Северной Америке: прогнозы на основе моделей экологической ниши переносчиков и резервуарных видов. PLoS Negl. Троп. Дис. 4: e585. DOI: 10.1371 / journal.pntd.0000585
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гейрар П., Лапланте А., Рондо К., Милон Г. и Дежарден М. (2008). Торговля промастигот Leishmania donovani в нелитических компартментах нейтрофилов делает возможным последующий перенос паразитов в макрофаги. Cell. Microbiol. 10, 100–111. DOI: 10.1111 / j.1462-5822.2007.01018.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хотез, П.Дж., Савиоли, Л., и Фенвик, А. (2012). Забытые тропические болезни Ближнего Востока и Северной Африки: обзор их распространенности, распространения и возможностей борьбы. PLoS Negl. Троп. Дис. 6: e1475. DOI: 10.1371 / journal.pntd.0001475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хотез, П. Дж., Вок-Колберн, Л., и Боттацци, М. Э. (2014). Забытые тропические болезни в Центральной Америке и Панаме: обзор их распространенности, групп риска и воздействия на региональное развитие. Внутр. J. Parasitol. 44, 597–603. DOI: 10.1016 / j.ijpara.2014.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харрелл, Б. П., Регли, И. Б., и Таккини-Коттье, Ф. (2016). Различные виды лейшмании управляют разными функциями нейтрофилов. Trends Parasitol. 32, 392–401. DOI: 10.1016 / j.pt.2016.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ибарра-Менесес, А.В., Каррильо, Э., Санчес, К., Гарсия-Мартинес, Дж., Лопес Лакомба, Д., Сан-Мартин, Дж. В. и др. (2016). Интерлейкин-2 как маркер для выявления бессимптомных лиц в районах, где Leishmania infantum является эндемичным. Clin. Microbiol. Заразить. 22: 739.e1–4. DOI: 10.1016 / j.cmi.2016.05.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ибарра-Менесес, А. В., Гош, П., Хоссейн, Ф., Чоудхури, Р., Мондал, Д., Альвар, Дж. И др. (2017). IFN-гамма, IL-2, IP-10 и MIG в качестве биомаркеров воздействия Leishmania spp.и лечения висцерального лейшманиоза человека. Фронт. Клетка. Заразить. Microbiol. 7: 200. DOI: 10.3389 / fcimb.2017.00200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каммун-Ребай В., Науар И., Либри В., Альберт М., Лузир Х., Меддеб-Гарнауи А. и др. (2016). Белковые биомаркеры позволяют различать Leishmania major -инфицированных и неинфицированных людей в районах, эндемичных по кожному лейшманиозу. BMC Infect. Дис. 16: 138.DOI: 10.1186 / s12879-016-1458-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каримхани, К., Ванга, В., Коффенг, Л. Э., Нагхави, П., Деллавалле, Р. П., и Нагхави, М. (2016). Глобальное бремя кожного лейшманиоза: перекрестный анализ из исследования Global Burden of Disease Study 2013. Lancet Infect. Дис. 16, 584–591. DOI: 10.1016 / S1473-3099 (16) 00003-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кип, А.Э., Баласегарам, М., Бейнен, Дж. Х., Шелленс, Дж. Х., де Фрис, П. Дж. И Дорло, Т. П. (2015). Систематический обзор биомаркеров для мониторинга терапевтического ответа при лейшманиозе. Антимикробный. Агенты Chemother. 59, 1–14. DOI: 10.1128 / AAC.04298-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коцигит А., Гур С., Эрель О. и Гурель М. С. (2002a). Связь между концентрациями селена, цинка, меди и железа в плазме и уровнями иммунорегуляторных цитокинов у пациентов с кожным лейшманиозом. Biol. Trace Elem. Res. 90, 47–55. DOI: 10.1385 / BTER: 90: 1-3: 47
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коциигит А., Гур С., Гурель М. С., Булут В. и Улуканлигил М. (2002b). Антимониальная терапия вызывает циркуляцию провоспалительных цитокинов у пациентов с кожным лейшманиозом. Заражение. Иммун. 70, 6589–6591. DOI: 10.1128 / IAI.70.12.6589-6591.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лестинова, Т., Рохусова И., Сима М., де Оливейра К. И. и Вольф П. (2017). Понимание слюны песчаных мух: кровоснабжение и иммунные взаимодействия между москитами, хозяевами и Leishmania. PLoS Negl. Троп. Дис. 11: e0005600. DOI: 10.1371 / journal.pntd.0005600
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лузир Х., Мелби П. К., Бен Салах А., Марракчи Х., Аун К., Бен Исмаил Р. и др. (1998). Иммунологические детерминанты развития заболевания при локализованном кожном лейшманиозе, вызванном Leishmania major . J. Infect. Дис. 177, 1687–1695. DOI: 10.1086 / 515297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мароли М., Фелисиангели М. Д., Бишо Л., Шаррель Р. Н. и Градони Л. (2013). Московские москиты и распространение лейшманиозов и других болезней, вызывающих озабоченность общественного здравоохранения. Med. Вет. Энтомол. 27, 123–147. DOI: 10.1111 / j.1365-2915.2012.01034.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марзуки, С., Абделадхим, М., Абдессалем, К. Б., Оливейра, Ф., Ферджани, Б., Гилмор, Д. и др. (2012). Слюнный антиген SP32 является иммунодоминантной мишенью для ответа антител на укусы Phlebotomus papatasi у человека. PLoS Negl. Троп. Дис. 6: e1911. DOI: 10.1371 / journal.pntd.0001911
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марзуки С., Каммун-Ребай В., Беттаиб Дж., Абделадхим М., Хадж Касем С., Абделькадер Р. и др. (2015). Проверка рекомбинантного белка слюны PpSP32 в качестве подходящего маркера воздействия на человека Phlebotomus papatasi , вектора Leishmania major в Тунисе. PL-oS Negl. Троп. Дис. 9: e0003991. DOI: 10.1371 / journal.pntd.0003991
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Масудзаде Н., Мизбани А., Таслими Ю., Машаехи В., Мортазави Х., Садегипур П. и др. (2017). Leishmania tropica инфицированных очагов поражения человека: профилирование полногеномной транскрипции. Acta Trop. 176, 236–241. DOI: 10.1016 / j.actatropica.2017.08.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маспи, Н., Абдоли, А., Гаффарифар, Ф. (2016). Про- и противовоспалительные цитокины при кожном лейшманиозе: обзор. Pathog. Glob. Здоровье 110, 247–260. DOI: 10.1080 / 20477724.2016.1232042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мелби, П. К., Андраде-Нарваес, Ф., Дарнелл, Б. Дж., И Валенсия-Пачеко, Г. (1996). In situ экспрессия интерлейкина-10 и интерлейкина-12 при активном кожном лейшманиозе человека. FEMS Immunol. Med.Microbiol. 15, 101–107. DOI: 10.1111 / j.1574-695X.1996.tb00059.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мендонса, М. Г., де Брито, М. Э., Родригес, Э. Х., Бандейра, В., Жардим, М. Л., и Абат, Ф. Г. (2004). Сохранение паразитов лейшмании в рубцах после клинического лечения американского кожного лейшманиоза: есть ли бесплодное лекарство? J. Infect. Дис. 189, 1018–1023. DOI: 10.1086 / 382135
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мортазави, Х., Садегипур, П., Таслими, Ю., Хабибзаде, С., Зали, Ф., Захедифард, Ф. и др. (2016). Сравнение острого и хронического кожного лейшманиоза человека, вызванного Leishmania major и Leishmania tropica , с упором на активность аргиназы. J. Eur. Акад. Дерматол. Венереол. 30, 2118–2121. DOI: 10.1111 / jdv.13838
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Oliveira, F., Traore, B., Gomes, R., Faye, O., Gilmore, D.C., Keita, S., et al.(2013b). Гиперчувствительность замедленного типа к слюне песчаных мух у людей из эндемичного по лейшманиозу района Мали является Th2-опосредованной и сохраняется до среднего возраста. J. Invest. Дерматол. 133, 452–459. DOI: 10.1038 / jid.2012.315
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Патино, Л. Х., и Рамирес, Дж. Д. (2017). RNA-seq в кинетопластидах: мощный инструмент для понимания биологии и взаимодействий хозяин-патоген. Заражение. Genet. Evol. 49, 273–282.DOI: 10.1016 / j.meegid.2017.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Прието Барха П., Пешер П., Буссотти Г., Дюметц Ф., Имамура Х., Кедра Д. и др. (2017). Селекция гаплотипа как адаптивный механизм у простейшего патогена Leishmania donovani . Нац. Ecol. Evol. 1, 1961–1969. DOI: 10.1038 / s41559-017-0361-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Регли, И. Б., Пасселли, К., Харрелл, Б.П., и Таккини-Коттье, Ф. (2017). Механизмы выживания, используемые некоторыми видами лейшмании, чтобы избежать гибели нейтрофилов. Фронт. Иммунол. 8: 1558. DOI: 10.3389 / fimmu.2017.01558
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Росалес-Чилама, М., Гонгора, Р. Э., Вальдеррама, Л., Джохоа, Дж., Александер, Н., Рубиано, Л. К. и др. (2015). Паразитологическое подтверждение и анализ разнообразия лейшмании при бессимптомной и субклинической инфекции после разрешения кожного лейшманиоза. PLoS Negl. Троп. Дис. 9: e0004273. DOI: 10.1371 / journal.pntd.0004273
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саха, П., Гангули, С., Чаттерджи, М., Дас, С. Б., Кунду, П. К., Гуха, С. К. и др. (2017). Бессимптомный лейшманиоз в эндемичных районах кала-азар района Мальда, Западная Бенгалия, Индия. PLoS Negl. Троп. Дис. 11: e0005391. DOI: 10.1371 / journal.pntd.0005391
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суффия, И., Реклинг, С. К., Салай, Г., Белкайд, Ю. (2005). Роль CD103 в удержании CD4 + CD25 + Treg и контроле инфекции Leishmania major . J. Immunol. 174, 5444–5455. DOI: 10.4049 / jimmunol.174.9.5444
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таслими Ю., Садегипур П., Хабибзаде С., Машаехи В., Мортазави Х., Мюллер И. и др. (2017). Новый неинвазивный метод диагностики кожного лейшманиоза. PLoS Negl. Троп. Дис. 11: e0005750. DOI: 10.1371 / journal.pntd.0005750
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Teixeira, C., Gomes, R., Collin, N., Reynoso, D., Jochim, R., Oliveira, F., et al. (2010). Обнаружение маркеров воздействия, специфичных для укусов Lutzomyia longipalpis , переносчика Leishmania infantum chagasi в Латинской Америке. PLoS Negl. Троп. Дис. 4: e638. DOI: 10.1371 / journal.pntd.0000638
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Теппеанг, К., Гласс, Т.А., Бандин-Рош, К., Тодд, А.С., Роде, К.А., и Шварц, Б.С. (2008). Гендерные и расовые / этнические различия в биомаркерах дозы свинца. Am. J. Public Health 98, 1248–1255. DOI: 10.2105 / AJPH.2007.118505
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван дер Аувера, Г., Равель, К., Вервей, Дж. Дж., Барт, А., Шонян, Г., и Фельгер, И. (2014). Оценка четырех маркеров одного локуса для различения видов Leishmania путем секвенирования. J. Clin. Microbiol. 52, 1098–1104. DOI: 10.1128 / JCM.02936-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vergel, C., Palacios, R., Cadena, H., Posso, C.J., Valderrama, L., Perez, M., et al. (2006). Доказательства наличия паразитов лейшмании (viannia) в коже и крови пациентов до и после лечения. J. Infect. Дис. 194, 503–511. DOI: 10.1086 / 505583
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виджаямахантеш, А., Mit, A., Dikhit, M. R., Pandey, R.K., Singh, K., Mishra, R., et al. (2016). Повышенная активность ADA в сыворотке как маркер для диагностики и прогноза висцерального лейшманиоза и посткала-азарного кожного лейшманиоза у индийских пациентов. PLoS ONE 11: e0154117. DOI: 10.1371 / journal.pone.0154117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
фон Стебут, Э., и Тензер, С. (2017). Кожный лейшманиоз: отчетливые функции дендритных клеток и макрофагов во взаимодействии иммунной системы хозяина с Leishmania major . Внутр. J. Med. Microbiol. 308, 206–214. DOI: 10.1016 / j.ijmm.2017.11.002
CrossRef Полный текст | Google Scholar
Вулдукис, И., Иссали, Ф., Фуркад, К., Поль-Эжен, Н., Арок, М., Кольб, Дж. П. и др. (1994). Экспрессия CD23 и IgE во время иммунного ответа человека на кожный лейшманиоз: возможная роль в активации моноцитов. Res. Иммунол. 145, 17–27. DOI: 10.1016 / S0923-2494 (94) 80037-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, X., Oliveira, F., Chang, B. W., Collin, N., Gomes, R., Teixeira, C., et al. (2011). Структура и функция «желтого» белка из слюны песчаной мухи Lutzomyia longipalpis , который обеспечивает защитный иммунитет против инфекции Leishmania major . J. Biol. Chem. 286, 32383–32393. DOI: 10.1074 / jbc.M111.268904
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Завротняк М. и Рапала-Козик М. (2013). Внеклеточные ловушки нейтрофилов (NET) — образование и последствия. Acta Biochim. Pol. 60, 277–284.
PubMed Аннотация | Google Scholar
Кожный и слизисто-кожный лейшманиоз: опыт средиземноморской больницы | Паразиты и переносчики
Заболеваемость CL и MCL в нашей области увеличилась с 3,6 до 13,58 случаев на 100 000 жителей за период исследования (2006–2017 гг.), Что совпадает с данными, наблюдаемыми в Испании, вероятно, из-за более высоких показателей. частота клинических подозрений и внедрение NAAT в качестве диагностического инструмента, более чувствительного, чем микроскопические методы.По данным RENAVE (Red Nacional de Vigilancia de la Salud Pública), средняя заболеваемость лейшманиозом в Испании составляла 0,45 случая на 100 000 населения в период с 1996 по 2011 год. Валенсия была одним из регионов с самым высоким уровнем заболеваемости в этот период вместе с Балеарскими островами, Мадридом, Андалусией и Каталонией [16]. В 2012 г. крупная вспышка лейшманиоза, связанная с зайцами, была зарегистрирована в окрестностях Мадрида (21,54 случая на 100 000 жителей) [17]. Кроме того, в ближайшие годы ожидается рост случаев CL в Испании из-за увеличения числа животных-резервуаров (особенно тех, кто живет бесплатно и без какого-либо ветеринарного надзора), иммунодепрессированных хозяев, старения населения, миграционных перемещений и глобального потепления [12, 18, 19].
По оценкам, примерно 7% популяции собак инфицировано L. infantum в Испании, хотя в некоторых регионах, таких как Валенсия и Каталония, этот показатель достигает 30% [20]. В нашем исследовании большинство пациентов, контактировавших с собаками, были иммунокомпетентными. По этой причине анамнез пациентов и знание места проживания (сельская местность, свалки и питомники) необходимы для ранней и правильной диагностики, особенно у иммунокомпетентных пациентов.
Хотя лейшманиоз считается заболеванием, которое чаще встречается у детей, в большинстве случаев у нас были взрослые, особенно старше 65 лет. У маленьких детей ХЛ чаще встречается, чем МКЛ, хотя ВН является основным клиническим проявлением в этой группе [21, 22]. Диагностика ХЛ затруднена у педиатрических пациентов, поскольку у детей часто диагностируется импетиго, почесуха или фолликулит [23]. Кроме того, чтобы избежать биопсии очага поражения у этих пациентов, обычно ставится только клинический диагноз, и вероятность ошибочного диагноза высока.В этих случаях мазок из очага поражения является хорошим вариантом вместо биопсии, что снижает вероятность ошибочного диагноза. В нашей серии биопсия кожи была проведена только у троих детей (3/8).
Как и другие, мы наблюдали преобладание лейшманиоза у пациентов мужского пола [12]. В нашем исследовании большинство пациентов были иммунокомпетентными, хотя иммуносупрессия является хорошо известным фактором риска заболевания [24]. Об огромном количестве случаев CL и MCL было зарегистрировано у пациентов с ВИЧ, но опыт работы с иммуносупрессивными состояниями, не связанными с ВИЧ, в основном основан на отчетах о случаях или небольших сериях случаев.Роль лекарств, особенно анти-TNF и новых противоопухолевых средств, в риске развития лейшманиоза противоречива. Риск кажется выше в первый год лечения и даже больше при использовании инфликсимаба и адалимумаба (моноклональные антитела против TNF), чем при отсутствии моноклональных препаратов, таких как этанерцепт (димерный гибридный белок) [25, 26]. Опыт пациентов с другими биологическими препаратами против интерлейкина, такими как абатацепт, ритуксимаб (antiCD20), анти-интерлейкин-6 (тоцилизумаб), анти-интерлейкин-17 или его рецептор (секукинумаб, иксекизумаб, бродалумаб) или интерлейкин. -12/23 (устекинумаб) гораздо менее убедительны, и необходимы дальнейшие исследования.Кроме того, не следует пренебрегать важностью стероидов как предрасполагающего фактора, в зависимости от дозы и продолжительности лечения [27, 28].
Язвенные поражения чаще встречались у пациентов с ослабленным иммунитетом, что подтверждает предыдущие исследования [18]. Однако не было обнаружено статистически значимых различий между иммуносупрессивными и иммунокомпетентными пациентами, вероятно, из-за небольшого размера выборки. Сосредоточившись на MCL, у всех пациентов были выявлены язвенные поражения, которые также были гнойными, как указано в литературе [8].Как правило, при лейшманиозе часто ставится поздняя диагностика, поскольку поражения обычно безболезненны [17]. В нашем исследовании среднее время от появления симптомов до постановки диагноза было больше у пациентов с ослабленным иммунитетом, вероятно, потому, что большинство пациентов с ослабленным иммунитетом не страдали аутоиммунными дерматологическими заболеваниями (псориаз), не лечились у дерматолога, и постановка диагноза была отложена. . Однако из-за небольшого количества различий между пациентами не было существенной дифференциации между иммунокомпетентными и иммуносупрессивными пациентами.
Дифференциальный диагноз ХЛ довольно велик в зависимости от формы проявления. В нашем исследовании микобактериоз, эпидермоидная карцинома и гангренозная пиодермия были наиболее частыми, как сообщалось ранее [29]. Другими дифференциальными диагнозами могут быть немеланомный рак кожи и условно-патогенные или эндемические грибковые инфекции. Когда поражение кожи проявляется в виде узелков, фиолетово-фиолетовых, не изъязвленных, дифференциальный диагноз должен включать псевдолимфому и кожную лимфому.При этих узловых формах NAAT имеет решающее значение для окончательного диагноза, особенно в тех случаях, когда амастиготы не визуализируются под микроскопом.
В педиатрической популяции поражения имитировали одиночную мастоцитому или ювенильную ксантогранулему, особенно если они не изъязвлены, как также описано Handler et al. [29]. Что касается MCL, в нашем исследовании эпидермоидная карцинома была уникальным дифференциальным диагнозом у всех пациентов, как сообщалось ранее [30]. Однако следует учитывать и другие заболевания, такие как риноспоридиоз или синусит [30].
В университетской больнице Ла-Фе все случаи MCL были вызваны L. infantum , хотя кожно-слизистые формы в основном связаны с L. braziliensis и расположены почти исключительно в Южной Америке [31]. Однако в последние годы в Испании и других европейских странах также были зарегистрированы случаи MCL, вызванные L. infantum [32].
В нашем исследовании NAAT был наиболее чувствительным диагностическим инструментом (более 90%), и между этим методом и гистологией были обнаружены значительные различия.Однако не было обнаружено различий между показателями положительных результатов обоих методов микроскопии и между NAAT и Giemsa, вероятно, из-за количества пациентов, включенных в наше исследование. Микроскопически гранулематозные инфильтраты с большим количеством плазматических клеток с большой вероятностью указывают на лейшманиоз и были визуализированы у 27 пациентов (27/42). Тем не менее, несмотря на низкую чувствительность, эти методы являются хорошими методами для изучения воспалительных инфильтратов, связанных с Leishmania . Методы микроскопии являются хорошим дополнением к NAAT, чтобы избежать ложноположительных результатов из-за загрязнения образца или перекрестных реакций.В нашей серии с помощью NAAT было диагностировано 16 случаев, и гистология была совместима с инфекцией, поскольку были структуры, характеризующиеся Leishmania, заполненными макрофагами и инфильтрацией полиморфноядерных нейтрофилов. С другой стороны, по нашему опыту, полезность окрашенного по Гимзе препарата из мазка поражения приемлема и должна рассматриваться как первый диагностический шаг, особенно в педиатрической популяции. Следовательно, соответствующий диагноз будет поставлен в первую очередь на основании исследования мазка поражения, а в случае отрицательных по Гимза случаях — на основании биопсии и NAAT [33].
У наших пациентов глюкантайм внутри очага поражения был наиболее распространенным лечением при ХЛ, оставляя липосомальный амфотерицин В для МКЛ, для осложненных ХЛ или для пациентов с ослабленным иммунитетом, что совпадает с данными литературы [18]. Независимо от назначенного лечения и иммунного статуса пациента, все пациенты прогрессировали удовлетворительно, рецидивов не наблюдалось.
Кожный лейшманиоз: случай поражения кожи головы — Клинические и видеодермоскопические результаты — FullText — Заболевания придатков кожи 2018, Vol.4, № 2
Аннотация
Кожный лейшманиоз (КЛ) — всемирное инфекционное заболевание, вызываемое жгутиконосными простейшими из рода Leishmania . В Америке виды, наиболее часто вызывающие CL, — это L. mexicana и L. brasiliensis . Обычно в Америке он передается москитами в основном из рода Lutzomyia и Psychodopygus . CL чаще всего поражает открытые участки и характеризуется эритематозным инфильтрированным и изъязвленным папулезным или узловатым поражением.Мы сообщаем о 28-летнем мужчине с 6-месячным анамнезом и предыдущей поездкой в лес на юге Мексики. У него была бессимптомная эритематозная бляшка на коже черепа с медленными и прогрессирующими узловыми поражениями с центральной корковой язвой с приподнятой и четко очерченной границей. При видеодермоскопии мы наблюдали эритематозные гуммиозные образования, желтоватые струпья, а также белые звездочки, точки, шпильки и клубочковые узоры сосудов.
© 2017 S. Karger AG, Базель
Установленные факты
• О лейшманиозе волосистой части головы сообщалось редко.
Novel Insights
• Это второй опубликованный отчет о случае лейшманиоза на коже черепа во всем мире, и, насколько нам известно, о дерматоскопических особенностях ранее не сообщалось.
Введение
Кожный лейшманиоз (КЛ) — это инфекционное заболевание, вызываемое жгутиковидными простейшими из рода Leishmania . В новом мире разновидностями, ответственными за CL, обычно являются L. mexicana и L. brasiliensis [1,2]. В Америке обычно переносят инфекцию такие переносчики, как Lutzomyia и Psychodopygus [3,4].CL имеет мировое распространение, преимущественно в Мексике, Центральной и Южной Америке, Средиземноморье, Азии и Африке [1,3]. Чаще всего поражаются обнаженные части тела, и первоначальное поражение представляет собой эритематозную инфильтрованную папулу или узелок, а затем развивается центральная язва и корка [1].
Дерматоскопия — это неинвазивный диагностический метод, облегчающий наблюдение за кожей in vivo. Его можно использовать для диагностики различных кожных заболеваний, особенно пигментных и непигментированных опухолей, а также воспалительных, паразитарных и инфекционных заболеваний [1,5].
Признаками CL являются генерализованная эритема (наиболее частая), желтые слезы, гиперкератоз, центральная эрозия, изъязвление, белый звездообразный узор и другие типы сосудистых структур [1,5,6].
История болезни
Мы представляем случай 28-летнего мужчины с 6-месячным анамнезом бессимптомного эритематозного налета на коже черепа, с медленно прогрессирующими узелками с центральной язвой и желтоватыми корками, с приподнятыми и хорошо выраженными бляшками. определены границы (рис. 1а). Видеодермоскопия показала эритему и желтоватую корочку, окруженную полиморфными сосудами (рис.2). Амастиготы наблюдались при окраске по Гимзе (импронта), а гистопатологическое исследование показало гиперкератоз, изъязвление фибрином и клеточными остатками, нерегулярный акантоз, области спонгиоз и экзоцитоз лимфоцитов, гистиоцитов и некоторых полиморфно-ядерных клеток. В поверхностной, средней и глубокой дерме наблюдался плотный воспалительный инфильтрат из лимфоцитов, полиморфно-ядерных очагов и гистиоцитов, некоторые из них с многочисленными тельцами включения, эти структуры также являются внеклеточными.Наблюдались расширение и скопление кровеносных сосудов и бесчисленное количество лейшманийных телец (рис. 3). Первоначальное лечение включало внутриочаговое введение сурьмы меглумина 3 раза (каждые 3 недели), а затем пероральный прием итраконазола 200 мг в день в течение 2 месяцев с хорошим ответом (рис. 1b).
Рис. 1
a Макроскопический вид изъязвленного узлового поражения. b Ремиссия пациента.
Рис. 2
Микродермоскопический вид (× 50) язвенного узелкового поражения.
Рис. 3
Изображение патогистологического поражения под микроскопом. × 40.
Обсуждение
CL — инфекционное заболевание, вызываемое жгутиконосными простейшими из рода Leishmania . В основном это вызвано: L. major, L. infantum , L. tropica, L. aethiopica и L. donovani infantum ; однако в новом мире виды, ответственные за CL, обычно — это L. mexicana и L. brasiliensis [1,2].
Клинический диагноз подтверждается простым тестом, обнаруживающим микроскопические амастиготы в мазках, окрашенных по Гимзе, полученных из инфицированной кожи, лимфатического узла, костного мозга, селезенки или спинномозговой жидкости, а также при росте промастигот в Novy-MacNeal. -Nicolle medium до 40% случаев. Другой диагностический тест — демонстрация лейшманиальной ДНК с помощью ПЦР [3].
Гистопатологические данные соответствуют туберкулоидной гранулеме с лимфоцитами, гистиоцитами, плазмой и эпителиоидными клетками [2].Дерматоскопия может снизить потребность в более инвазивных и дорогостоящих диагностических тестах для CL [1,5].
В исследовании, проведенном в Иране Taheri et al. [1], наиболее частым дерматоскопическим обнаружением ХЛ была генерализованная эритема, за которой следовала белая звездообразная картина (паракератотический гиперкератоз, расположенный вокруг поражений), центральные язвы, желтоватые оттенки и желтая каплевидная структура, а также гиперкератоз. Наиболее частым сосудистым признаком был точечный, за которым следовали шпильки, линейные неправильные, запятые и клубочковые узоры сосудов с ветвящимися телеангиэктазиями и сосуды типа «штопор» [1].
В Турции Ayhan et al. [5] обнаружили, что сосудистые структуры, наблюдаемые при дерматоскопии, чаще всего были полиморфными сосудами, за которыми следовали сосуды, похожие на шпильки и ветвящиеся. Наиболее распространенной несосудистой структурой была эритема, за которой следовали корки, эрозии / изъязвления и структуры, похожие на слезы. Они пришли к выводу, что каплевидные структуры могут быть специфическими для лейшманиоза, локализованного на лице и шее [5].
В нашем случае мы наблюдали аналогичные клинические и дерматоскопические признаки на коже черепа, где характерные поражения имели желтоватую корку, окруженную полиморфными сосудами; мы не наблюдали типичных каплевидных структур и белого звездного рисунка.
Наши результаты, вероятно, отличаются от данных, описанных в литературе, поскольку в наше исследование были включены только пациенты с лейшманиозом на лице, шее и конечностях, а не с поражениями на коже черепа.
Клинический дифференциальный диагноз этой локализации ХЛ в коже черепа — kerion celsi. Клинические особенности kerion celsi варьируются от легкого шелушения с небольшой потерей волос до больших воспалительных и пустулезных бляшек с обширной алопецией. В нашем случае мы обнаружили узелки с центральной язвой и желтоватой коркой, с приподнятыми и четко очерченными границами, без алопеции [7].Кроме того, наиболее частыми дерматоскопическими находками kerion celsi являются перифолликулярное шелушение и сломанные волосы. Они отличаются от данных дерматоскопии при КЛ [8].
Лечение ХЛ включает местные агенты (криотерапия, субблезионное применение 5-валентного препарата сурьмы меглумина антимониата [глюкантим, амп. 5 мл], мази, содержащие 15% паромомицина и 10% мочевины, местную термотерапию при температуре 40 ° С). 42 ° C и системные агенты [пятивалентные препараты сурьмы и антибиотики, такие как стибоглюконат натрия и сурьма меглумина, пентамидин, паромомицин, милтефозин]) [1,6,9].В случаях, вызванных L. mexicana , хороший ответ дает итраконазол в дозе 200-400 мг в день в течение 1-2 месяцев [10].
Мы лечили нашего пациента с помощью внутриочагового введения меглумина сурьмы 3 раза и перорального приема итраконазола в дозе 200 мг в течение 2 месяцев с отличным ответом, так как поражения полностью зажили.
Это второй описанный в литературе случай ХЛ волосистой части головы и первый, описывающий результаты трихоскопии.
Заявление об этике
Это исследование не требовало утверждения комитетом института по исследованиям на людях.Пациент дал согласие на использование анонимных фотографий в исследовательских целях.
Заявление о раскрытии информации
У авторов нет конфликта интересов, о котором следует раскрывать.
Список литературы
- Taheri AR, Pishgooei N, Maleki M, Goyonlo VM, Kiafar B, Banihashemi M, et al: Раунды тропической медицины: дерматоскопические особенности кожного лейшманиоза.Int J Dermatol 2013; 1361-1366.
- Маровт М., Кокол Р., Станимирович А., Милькович Дж .: Кожный лейшманиоз: описание случая. Acta Dermatovenerol Alp Pannonica Adriat 2010; 19: 41-43.
- Neupane S, Sharma P, Kumar A, Paudel U, Pokhrel DB: Кожный лейшманиоз: отчет о редких случаях в Непале.Nepal Med Coll J 2008; 10: 64-67.
- Cembrero-saralegui H, Pérez MM, Imbernón-moya A: Дермоскопия острого кожного лейшманиоза. Med Clin (Barc) 2017; 148: e29.
- Ayhan E, Ucmak D, Baykara SN, Akkurt ZM, Arica M: Клиническая и дерматоскопическая оценка кожного лейшманиоза.Int J Dermatol 2015; 54: 193-201.
- Добрев Л.П., Ночева Д.Г., Вучев Д.И., Гранчарова Р.Д. Кожный лейшманиоз — дерматоскопические данные и криотерапия. Folia Med (Пловдив) 2015; 57: 65-68.
- Hay RJ: Tinea capitis: текущее состояние.Микопатология 2017; 182: 87-93.
- Brasileiro A, Campos S, Cabete J, Galhardas C, Lencastre A, Serrao V: Трихоскопия как дополнительный инструмент для дифференциальной диагностики дерматомикоза головы: проспективное клиническое исследование. Br J Dermatol 2016; 175: 208-209.
- Антинори С., Джанелли Е., Калаттини С., Лонги Е., Грамицича М., Корбеллино М.: Кожный лейшманиоз: возрастающая угроза для путешественников.Clin Microbiol Infect 2005; 11: 343-346.
- Торрес-Герреро Э., Кинтанилья-Седильо М.Р., Руис-Эсменжо Дж., Аренас Р.: Лейшманиоз: обзор. F1000Res 2017; 6: 750.
Автор Контакты
Роберто Аренас Гусман
Sección de Micología, Общая больница «Dr.Мануэль Хеа Гонсалес »
Кальсада де Тлалпан 4800, Сексьон XVI
Тлалпан, Мехико 14080 (Мексика)
Электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Получено: 1 июня 2017 г.
Принято: 6 июля 2017 г.
Опубликовано онлайн: 9 сентября 2017 г.
Дата выпуска: апрель 2018 г.
Количество страниц для печати: 3
Количество рисунков: 3
Количество столов: 0
ISSN: 2296-9195 (печатный)
eISSN: 2296-9160 (онлайн)
Для дополнительной информации: https: // www.karger.com/SAD
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарств: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарств, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Однако ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю настоятельно рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным агентом является новый и / или редко применяемый препарат.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, причиненный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Сложность эффективного иммунного ответа хозяина на полиморфное паразитарное заболевание
Этот обзор направлен на предоставление всестороннего обзора иммунного ответа, проявляемого против кожного лейшманиоза (КЛ), наиболее распространенной зоонозной инфекции, вызываемой простейшими паразитами рода Leishmania . Несмотря на полиморфную клиническую картину, классический CL характеризуется лейшманиотическими поражениями на лице и конечностях пациентов, которые могут быть язвенными и даже после заживления могут привести к необратимым травмам и обезображиванию, что значительно влияет на их психологическое, социальное и экономическое благополучие. -существование. Согласно отчету, опубликованному Всемирной организацией здравоохранения, количество лет жизни с поправкой на инвалидность (DALY), потерянных из-за лейшманиоза, приближается к 2,4 миллиона, ежегодно — 1.0–1,5 миллиона новых случаев КЛ, и большая часть населения подвергается риску в эндемичных районах. Несмотря на рост заболеваемости во всем мире, это одна из так называемых забытых тропических болезней. Кроме того, в этом обзоре представлен обзор существующих знаний о врожденном и приобретенном иммунном ответе хозяина на кожные виды Leishmania. Использование моделей на животных и исследований in vitro улучшило понимание взаимодействия паразит-хозяин и сложности задействованных иммунных механизмов.Подчеркивается важность точности диагноза, связанной с эффективным ведением пациентов для снижения CL. Однако множественные факторы, вовлеченные в эпизоологию КЛ, связанные с недоступностью вакцин или лекарств для предотвращения инфекции, затрудняют разработку эффективной стратегии борьбы с КЛ.
1. Введение
Лейшманиозы — это антропонозные и зоонозные заболевания, имеющие глобальное значение для общественного здравоохранения, вызываемые обязательными внутриклеточными дигенетическими паразитами из рода Leishmania [1–3].Эти паразиты передаются людям и млекопитающим-хозяевам через укусы инфицированных москитов из рода Phlebotomus в Старом Свете и Lutzomyia в Новом Свете, вызывая кожный или висцеральный лейшманиоз [4, 5]. По данным ВОЗ, во всем мире идентифицировано более 20 видов Leishmania [1, 5]. Несколько видов Leishmania , принадлежащих как к подроду Leishmania , так и к подроду Viannia , вызывают ХЛ у людей, включая L.tropica , L. major и L. aethiopica в Старом Свете, а также L. mexicana , L. amazonensis , L. venezuelensis , L. braziliensis , L. shawi , L. guyanensis , L. panamensis и L. peruviana , которые встречаются только в Новом Свете [2, 5, 6] (Таблица 1). Различия между видами Leishmania могут приводить к различным клиническим проявлениям и терапевтическим ответам [7–9].Знания о сложных взаимодействиях между этими видами и соответствующими хозяевами, их географическом распределении, гистопатологических эффектах, клинических поражениях и уклонении от иммунитета все еще нуждаются в углублении [2, 4, 5, 7]. Как правило, кожные виды вызывают поражения кожи и слизистых оболочек, которые могут сохраняться в течение длительного времени у пациентов, страдающих этим заболеванием, а также могут рецидивировать во время лечения [10–12]. У некоторых пациентов с ХЛ могут развиться необратимые травмы, которые могут оставить их изуродованными и стигматизированными на всю жизнь [11, 13, 14].Таким образом, этот обзор направлен на предоставление исчерпывающего описания иммунного ответа, генерируемого против кожных видов Leishmania , что свидетельствует о необходимости дальнейших исследований, способных углубить понимание защитных иммунных механизмов, и указывать на возможности, которые могут быть изучены для дальнейшего изучения. уменьшить угрозу CL.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2. Кожный лейшманиоз имеет широкое географическое распространение и имеет наиболее распространенный полиморфизм. Инфекция Leishmania
, поражающая примерно 0.От 7 миллионов до 1,2 миллиона человек [1, 14, 15]. Эта клиническая форма распространена более чем в 90 странах с доказанной эндемической передачей в тропических и субтропических регионах мира, включая сельские районы, тропические леса, засушливые районы, пригородные и городские районы [4, 15, 16]. По данным Maia-Elkhoury et al. [16], увеличение числа случаев может быть связано с изменениями поведения и окружающей среды, определяемыми в основном климатическими, социальными и экономическими условиями, которые влияют на передачу Leishmania .CL присутствует на юге США, где единичные случаи были зарегистрированы в штатах Техас и Оклахома, Центральной и Южной Америке, причем большинство случаев CL зарегистрировано в Бразилии и Перу [16–18], а также в Старом Свете. , в Северной и Восточной Африке, на Ближнем Востоке, а также в Западной и Южной Азии [18–20] (рис. 1). В этих регионах в некоторых городах наблюдается очень высокий уровень уведомлений о новых случаях заболевания CL, например, в Алеппо (Сирия, Западная Азия), где ежегодно регистрируется около 12 000 новых случаев [19–21].
Leishmania поражения без боли или зуда являются обычным явлением, но у некоторых пациентов могут быть болезненными, особенно если язвенные поражения вторично инфицированы бактериями или если эти поражения находятся рядом с суставом [22].CL может варьироваться от ограниченной формы, представляющей только одно или несколько локализованных поражений, до диссеминированной формы с множественными поражениями (таблица 2), включая гиподермальные, бородавчатые, споротрихоидные, импетигоидные, геморрагические, эризипелоидные, шанкриформные, волчаночные, папулезные, псориазиформные и язвенные поражения [11, 23, 24].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Поражения могут начинаться как узелки примерно в 20% случаев во время острых инфекций и сохраняться при хронической инфекции [1].В зависимости от клинического типа и стадии эпидермис может перекрывать плотный дермальный инфильтрат, содержащий преимущественно гистиоциты, лимфоциты и плазматические клетки [25]. У некоторых пациентов с американской ХЛ может развиться региональная лимфаденопатия, иногда бубонный, узловой лимфангит (споротрихоидоподобные подкожные узелки) и сателлитные поражения [1].
В эпидемических регионах Западной Азии, где случаи L. tropica перешли в агрессивное и продолжительное течение болезни, поражения нарушали и, возможно, препятствовали функции жизненно важных органов чувств, включая обонятельное восприятие и зрение [19].
3. Компетенция врожденного и приобретенного иммунного ответа определяет исход инфекции и тяжесть кожного лейшманиоза
Распространение и устойчивость паразитов Leishmania в иммунокомпетентном хозяине зависит от постоянных стратегий паразитов, способных модулировать и разрушать врожденный и адаптивный иммунный ответ [25 –27]. Согласно исследованиям in vitro, генетический фон хозяина, видов Leishmania, видов и различные изоляты паразитов могут влиять на иммунный ответ [28].Возрастающий интерес к изучению иммунного ответа против кожных видов Leishmania на различных животных моделях (таких как чувствительные мыши BALB / c, резистентные мыши C57BL / 6 и нечеловеческие приматы) способствовал лучшему пониманию взаимодействий конкретных паразит-хозяин и очень сложные пути иммунных механизмов, лежащие в основе иммунопатологии ХЛ [25, 29, 30]. Однако полное понимание иммунных механизмов, которые активируются или деактивируются у пациентов с ХЛ, имеет решающее значение для снижения заболеваемости до уровня, который окажет минимальное влияние на здоровье населения.
Иммунная защита характеризуется двумя основными механизмами: врожденным иммунным ответом, который активируется на ранней стадии первичной стадии инфекции, и адаптивным иммунным ответом, который является ответом второй линии. Мост между этими двумя ответами осуществляется антигенпрезентирующими клетками (APC) и цитокинами, высвобождаемыми в микроокружение эффекторными иммунными клетками.
3.1. Инактивация системы комплемента, похоже, способствует возникновению паразитарной инфекции.
Система комплемента играет решающую роль во врожденной иммунной защите.Белки плазмы, составляющие систему комплемента, участвуют в активации классических (CP), альтернативных (AP) и лектиновых путей (LP). Активация комплемента запускает стимуляцию протеолитических каскадов, генерирующих различные молекулы, такие как анафилатоксины, опсонины и комплекс мембранной атаки. В конце каскада комплемента патогены подвергаются лизису и опсонизации, а также возникает воспалительная реакция.
Исследования in vitro показали, что неинфекционные промастиготы Leishmania восприимчивы к комплемент-опосредованному лизису и что инфекционные метациклические промастиготы могут активно сопротивляться [31].
Попадая в дерму млекопитающих, инфекционные промастиготы активируют систему комплемента, а затем срабатывает первый механизм выживания паразита, подавляющий каскад комплемента [32, 33].
Управление каскадом комплемента достигается за счет инактивации опсонинов, способствующих притяжению макрофагов (M Φ ) [26, 30]. Предыдущие исследования показали, что LP эффективно активируется, поскольку маннозосвязывающий лектин, белок, который связывается с липофосфогликаном нескольких микроорганизмов, включая Leishmania , инициирует протеолитический каскад, вызывающий лизис патогенов [33–35].Более того, активация LP запускает C3-конвертазу, которая превращает C3 в C3b, управляя активацией AP [34, 36].
Infective Промастиготы Leishmania разработали механизмы, препятствующие активации AP [37].
Ранее было обнаружено, что поверхностный гликопротеин Leishmania захватывает молекулы C3b [26, 30]. При связывании молекул C3 с гликопротеином 63 кДа (gp63) C3b становится инактивированным (iC3b), что предотвращает образование C3-конвертазы [37]. iC3b, который остается прикрепленным к поверхности паразита, распознается рецептором комплемента-3, который запускает фагоцитоз промастигот с помощью M Φ (Рисунок 2).После поглощения M Φ паразит дифференцируется в форму амастиготы, которая имеет подходящие условия для инициации репликации [26, 30].
Активация комплемента мембранными компонентами L. mexicana , как сообщается, вызывает истощение факторов комплемента [37]. Истощение комплемента может управлять независимым от комплемента захватом паразитов полиморфноядерными нейтрофильными гранулоцитами (PMN), что может продлевать выживаемость паразита [30, 32]. Таким образом, врожденный иммунный ответ, вызванный системой комплемента хозяина, по-видимому, отрицательно влияет на CL, вызванный L.Мексикана.
Тем не менее, предыдущие исследования на мышах BALB / c показали, что комплемент может уменьшить распространение паразитов L. amazonensis в кожных поражениях [38] и исследований in vitro показали, что амастиготы L. tropica были восприимчивы к лизис комплемента [39], предполагая, что во время инфекции амастиготы могут быть восприимчивыми к системе комплемента.
3.2. Нейтрофилы, по-видимому, обладают двойным эффектом, задерживая раннее возникновение инфекции и более позднюю патологию благоприятного поражения
Вскоре после заражения млекопитающих инокуляцией песчаной мухи инфекционные метациклические промастиготы должны уклоняться от врожденного иммунитета хозяина, чтобы выжить [25, 30].
Полиморфноядерные нейтрофилы (PMN) являются первыми клетками-хозяевами, которые мигрируют в место заражения Leishmania (а также в ткань M Φ ), вероятно, в ответ на слюну песчанок [40-42], которая инокулируется вместе с паразиты. Эти короткоживущие клетки, вооруженные набором внутриклеточных и внеклеточных механизмов, могут задерживать и убивать патогены [30, 32].
При встрече с Leishmania PMN могут интернализовать паразита, генерировать ряд внутриклеточных и внеклеточных микробицидных факторов, таких как активные формы кислорода, экзоцитоз гранул, богатого сериновыми протеазами, которые могут повредить мембрану паразита, а также испускать паутину. как липкие структуры (внеклеточные ловушки нейтрофилов (NET)) во внеклеточное пространство, которые могут захватывать и инактивировать паразитов, создавая провоспалительную среду [30–32].Однако, несмотря на разнообразные механизмы, с помощью которых PMN должны содержать патогены, паразиты Leishmania могут выжить, паразитов могут вызывать инфекцию и вызывать заболевание [30, 32, 33].
В модели внутриклеточной инфекции PMN нейтрофилы могут использоваться в качестве «троянских коней», обеспечивающих выживание паразита и интернализацию макрофагами (M Φ ), окончательными клетками-хозяевами, которые также избегают активации механизмов убийства M Φ . Другие исследования, выполненные с L.major показал, что апоптотические PMN мыши могут высвобождать жизнеспособных паразитов в непосредственной близости от окружающих M Φ , способствуя захвату паразитов M Φ (механизм троянского кролика) [28, 43].
Роль PMNs в контроле распространения паразитов на ранней стадии кожных инфекций Leishmania изучалась in vitro, и экспериментальных животных [32]. Исследование in vitro показало, что нейтрофилы мыши, подвергшиеся воздействию L.guyanensis , L. shawi и L. amazonensis продуцировали супероксид, высвобождали ферменты во внеклеточное пространство и генерировали NET. Однако, L. guyanensis и L. shawi ингибировали ферментативную активность, а L. amazonensis снижали эмиссию NET, указывая на модуляцию внеклеточных эффекторных механизмов PMN кожными видами Leishmania [32]. Недавние исследования, проведенные на мышиной модели, показали, что истощение PMN ускоряет распространение L.major и L. amazonensis , что приводит к более серьезному отеку подушечек ног, что указывает на то, что PMN играют роль в сдерживании паразитарной инфекции и контроле развития кожных поражений [44, 45]. Нейтрофилы, по-видимому, распознают этих паразитов посредством механизмов, зависимых от рецептора распознавания образов (PRR-), таких как toll-like рецептор (TLR) 2, тем самым активируя нижестоящие пути, которые могут поставить под угрозу выживание паразитов [32, 46, 47].
После стимуляции in vitro паразитов, PMN кровотока из L.braziliensis -симптомные пациенты были не более микробицидными, чем PMN, полученные от здоровых субъектов, но имели преимущественно провоспалительный профиль, что, возможно, влияло на микросреду и набор лейкоцитов [27, 47]. При контакте с паразитами PMN, выделенные от здоровых доноров крови и от пациентов с американской CL, высвобождали NET, которые содержали и удерживали паразитов, способствуя их разрушению, а также стимулировали активность M Φ для борьбы с паразитарной инфекцией [48, 49].Также было подтверждено in vitro , что взаимодействие L. amazonensis -экспонированных апоптотических или некротических нейтрофилов с M Φ приводило к исходной инфекции M Φ -паразита, определяя исход инфекции [50]. Взятые вместе, эти результаты подчеркивают решающую роль PMNs в ранней инфекции, контроле кожных паразитов Leishmania и задержке становления инфекции и прогрессирования поражений [32, 50].
Нейтрофилы присутствуют в незаживающих кожных поражениях, и недавние исследования, проведенные как на людях, так и на мышах, показали, что инфильтраты PMN в кожных поражениях вызывают иммуноопосредованную патологию тканей [28, 40, 51].
Кроме того, PMN может проявлять гетерогенную функциональную активность против разных кожных видов Leishmania и внутри одного и того же вида, что указывает на специфическое иммунное распознавание паразитов [9]. Различные изоляты L. braziliensis могут способствовать специфической активации человеческих PMN. PMN могут инактивировать паразитов Leishmania или способствовать инфицированию, являясь хозяином жизнеспособных инфекционных паразитов, которые могут быть доставлены в клетку-хозяин. Эти результаты подтверждают гипотезу о том, что PMN могут отбирать наиболее инфекционных паразитов и инактивировать менее вирулентных, что может открыть новые возможности для изучения разработки стратегий, лежащих в основе модуляции рекрутирования и активности PMN, которые могут направлять заживление поражений [52].
Хотя широко признано, что они не играют ключевой роли в паразитарных заболеваниях, вызываемых простейшими, in vivo исследований выявили рекрутирование эозинофилов в поражения L. amazonensis и L. major [53–55]. Также было описано, что у пациентов L. braziliensis, у пациентов, которые находились на ранней стадии лимфаденопатии, наблюдались клеточные инфильтраты, обогащенные эозинофилами. [53]. Более того, при раннем инфицировании L. mexicana были обнаружены эозинофилы в непосредственной близости от дегранулирующих тучных клеток в месте инокуляции паразита [56], что указывает на возникновение перекрестных помех между этими двумя клетками, которые могут способствовать очищению от паразитов.
3.3. Цитотоксические врожденные клетки могут помочь в борьбе с кожной инфекцией
После рекрутирования PMN естественные клетки-киллеры (NK) также рекрутируются на ранней стадии инфекции Leishmania [25, 31]. NK-клетки — это крупные гранулярные лейкоциты, которые играют ключевую роль во врожденном иммунном ответе [57]. Эти клетки имеют решающее значение для определения тяжести заболевания, ограничения раннего распространения паразитов и опосредования прямого лизиса паразитизированных клеток, обеспечивая защитный иммунный ответ против инфекции Leishmania .Исследования, проведенные на мышиной модели с использованием L. amazonensis и L. major , показывают увеличение количества паразитов как прямое следствие истощения NK-клеток [58–60]. Эти клетки рано высвобождают провоспалительные цитокины, такие как интерферон- (IFN-) γ , который способствует дифференцировке клеток CD4 + Th2 и вместе с фактором некроза опухоли- (TNF-) α активирует уничтожение M Φ техника [33, 59, 60]. Однако похоже, что паразиты Leishmania обладают некоторыми механизмами, направленными на подавление активности NK [58–60].
Исследования, проведенные на мышах, инфицированных L. major , показали, что NK-клетки демонстрируют сильную активацию, которая достигает пика через 12–48 часов после заражения, после чего имеет тенденцию к устойчивому снижению [61]. Некоторые авторы связывают это подавление со способностью этого паразита подавлять выработку нейтрофилами хемокина IP-10, привлекающего NK-клетки (CXCL9), который может предотвратить активацию NK-клеток, тем самым предотвращая непрерывное появление NK-клеток из кровотока. [62].Кроме того, было продемонстрировано, что промастиготов L. major , соответствующий неочищенный антиген и gp63 могут ингибировать продукцию IFN-γ NK-клетками. gp63, по-видимому, способен связываться с NK-клетками человека, подавляя способность клеток продуцировать IL-2 и подавлять некоторые рецепторы NK-клеток, такие как CD16 и CD56 [63]. В случае амастигот L. tropica и L. amazonensis подавление активности NK-клеток, по-видимому, связано с низкими уровнями IL-12.Этот интерлейкин, высвобождаемый DC, определяет активацию NK-клеток. У людей было продемонстрировано увеличение NK-клеток CD56 + в местах заживления повреждений [64], что свидетельствует о защитной роли этих клеток при лейшманиозе человека.
Хотя было продемонстрировано, что NK-клетки защищают от CL, некоторые исследования показывают, что эти клетки играют второстепенную роль [31, 53]. Таким образом, возможно, что NK-клетки могут помочь иммунной системе бороться с инфекцией, но участие этих клеток все еще плохо изучено при ХЛ человека и остается спорным при экспериментальном лейшманиозе мышей [53, 54, 65].Однако активность NK-клеток различается у пациентов с локализованным (LCL) и диффузным (DCL) CL L. mexicana . Снижение количества NK-клеток у пациентов с DCL, связанное с пониженной экспрессией TLR и низкой продукцией цитокинов, может быть связано с тяжестью заболевания [65].
Следовательно, возможно, что регуляция NK-клеток может привести к новой возможности для нацеливания на контроль CL.
3.4. Антигенпрезентирующие клетки играют ключевую роль в управлении активностью эффекторов Т-клеток.
Промастиготы также захватываются M Φ , которые являются конечными клетками-хозяевами для паразитов Leishmania [56].Несмотря на то, что они являются предпочтительными для паразитов клетками-хозяевами, поскольку реплицируется внутри M Φ , эти клетки по-прежнему являются иммунным барьером, который паразиты должны преодолеть, чтобы сохраниться в организме хозяина [26, 30]. Внутри фаголизосомы M Φ формы промастигот претерпевают морфологическую дифференциацию на маленькие и неподвижные амастиготы, способные противостоять механизмам уничтожения клеток-хозяев и выживать при высокой температуре млекопитающих (по сравнению с песчаной мухой) [30, 56]. Амастиготы реплицируются и способствуют хроническому развитию кожной инфекции внутри кожного M Φ [30, 56]. Паразиты Leishmania могут индуцировать дифференцировку M Φ на два различных фенотипа: M1 и M2 [30] (рис. 3). M1-M Φ , также называемый классически активированным M Φ , стимулируется провоспалительными цитокинами IFN- γ и TNF- α . Эти цитокины вызывают экспрессию синтазы оксида азота (NO) 2 (NOS2), которая расщепляет аргинин до ОН-аргинина, а затем до NO и цитруллин [31, 66, 67]. NO может далее метаболизироваться до других активных форм азота, в то время как цитруллин может вступать в цикл цитруллин – NO и синтезировать NO [66–68].Этот механизм отвечает за NO-зависимую лейшманицидную активность, которая играет ключевую роль в борьбе с инфекцией Leishmania [67, 68]. Хотя ответ M1-M Φ обычно приводит к борьбе с паразитами, он также способствует некрозу кожных повреждений вследствие интенсивного иммунного ответа, который способствует развитию тяжелых ран [69].
M2-M Φ , также известный как альтернативно активированный M Φ , может быть индуцирован различными иммуномодуляторами, включая M Φ колониестимулирующий фактор (M-CSF), интерлейкин- (IL-) 4 , и ИЛ-1.Согласно стимуляции, M2-M Φ может быть фенотипически идентифицирован как M2a, M2b, M2c или M2d, которые, по-видимому, участвуют в различных иммунных действиях.
M2-M Φ активирует аргининовый путь путем экспрессии аргиназы, фермента, который гидролизует аргинин до мочевины и орнитина. Орнитин далее метаболизируется в полиамин и пролин, которые вызывают клеточную пролиферацию, выработку коллагена и восстановление тканей [68–70].
Более того, в 2007 году Odegaard et al.[71] сообщили, что рецептор, активируемый пролифератором пероксисом- (PPAR-) γ , играет роль в созревании альтернативно активированного M Φ , и показали, что разрушение PPAR- γ в миелоидных клетках предвосхищает M2-M Φ Активация [71, 72]. Фактически, в нескольких исследованиях были получены доказательства того, что M2-M Φ связаны с инфекцией Leishmania . В случае CL об участии PPAR- γ в активации M2-M Φ сообщалось только для L.major , L. amazonensis и L. mexicana [30, 37, 69].
Хотя активация M1-M Φ как IFN- γ , так и TNF- α приводит к контролю инфекции, это наблюдение не может быть истинным предиктором прогрессирования заболевания для всех кожных видов Leishmania , поскольку также сообщается, что IFN- γ -активированный M Φ (M1-M Φ ) не способен выводить из строя L.amazonensis , способствующих выживанию паразитов [30, 50]. У устойчивых мышей L. major , инфицированные M Φ s, будут запускать Т-хелперные 1 (Th2) клетки, управляя выработкой IFN- γ и, следовательно, активируя индуцибельную синтазу оксида азота (iNOS) и приводя к дифференциация М1-М Φ [66, 73]. Это приведет к инактивации паразитов и замедлит распространение паразитов [74].
Кроме того, у пациентов с диффузной ХЛ, вызванной L.amazonensis , аргиназа, полиамины и простагландин E2, липидное соединение, полученное из жирных кислот, обычно связанных с воспаленными тканями, по-видимому, снижает местный воспалительный иммунный ответ по сравнению с пациентами с местной ХЛ [75]. Таким образом, возможно, что вместе эти медиаторы способствуют развитию диффузной ХЛ.
Более поздние исследования продемонстрировали, что аргиназа L. amazonensis может опосредовать посттранскрипционную регуляцию микроРНК M Φ [75].Отсутствие паразитарной аргиназы, по-видимому, способствует активации NOS2 и последующему увеличению продукции NO, что может привести к инактивации паразитов. Кроме того, дальнейшее исследование Badirzadeh et al. не обнаружили значимых корреляций между активностью аргиназы L. major и количеством, размером и продолжительностью поражений у пациентов [76, 77]. С другой стороны, у восприимчивых мышей IL-4, IL-6 и IL-10 были ответственны за подавление iNOS-ассоциированных механизмов и дифференцировку M2-M Φ [30, 78].
Дендритные клетки (DC) и M Φ являются важными APC, которые устанавливают мост между врожденным и адаптивным иммунитетом. Эти клетки представляют чужеродные антигены Т-клеткам-помощникам через молекулы класса II главного комплекса гистосовместимости (MHCII), в то время как эти и другие типы клеток могут представлять антигены цитотоксическим Т-клеткам через молекулы класса I главного комплекса гистосовместимости (MHCI). В дополнение к молекулам MHC, костимулирующие молекулы необходимы для подходящей активации Т-клеток.Подавление костимулирующих молекул приводит к нарушению сигнальных путей и дефектным иммунным ответам [79].
Несколько исследований показали, что DC могут играть дихотомическую функциональную роль в модуляции иммунного ответа хозяина, влияя на адаптивный иммунный ответ и исход заболевания [78]. В кожных поражениях L. amazonensis и L. braziliensis кожные ДК (также называемые клетками Лангерганса) играют разные роли. В L . amazonensis пациентов, ДК связаны с иммунным ответом Th3-типа, а у L.braziliensis пациентов, ДК связаны с защитным иммунным ответом Th2 [79].
С другой стороны, после рестимуляции in vitro моноциты, выделенные от пациентов с ХЛ, вызванной L. braziliensis , показали низкую экспрессию костимулирующих молекул B7-1 (CD80) и B7-2 (CD86). Поскольку костимулирующие молекулы имеют решающее значение для правильной активации Т-клеток, паразиты L. braziliensis , по-видимому, способны регулировать иммунный ответ пациента [80].
Подобно M Φ , Leishmania также вмешивается во внутриклеточную передачу сигналов в DCs [73, 78]. Модуляция активации DC паразитами Leishmania , по-видимому, видоспецифична [30, 78]. Экспериментальные исследования с использованием L. major , L. mexicana , L. amazonensis и L. braziliensis показали, что мигрирующие ДК увеличивают экспрессию MHC и костимулирующих молекул [30, 73, 78]. Гистопатологические наблюдения за биопсиями кожи человека выявляют различия в степени тяжести кожных поражений, которые могут быть связаны с уровнями плотности субпопуляций DC, проявляющих разнообразный фенотип, который, управляя иммунным ответом Т-клеток, может влиять на тяжесть заболевания [3, 81, 82] (таблица 2).
В экспериментальных моделях ДК обрабатывают и обеспечивают первый контакт антигенов Leishmania с Т-клетками, что приводит к предпочтительной стимуляции IFN- γ , продуцируемого Т-клетками CD4 + [30, 82, 83]. С другой стороны, другие исследования, проведенные на инфицированных мышах L. major- , свидетельствуют о том, что дермальные DC могут индуцировать экспансию субпопуляции Treg-клеток [84].
Хотя роль DCs в CL очень сложна, эти клетки могут быть использованы для разработки новых путей, которые могут привести к созданию альтернативных методов лечения и терапевтических вакцин для улучшения лечения инфицированных пациентов [85].
DC и M Φ экспрессируют PRR, которые позволяют обнаруживать паразитов на коже хозяина. TLR являются наиболее изученными, и некоторые из них, такие как TLR3, TLR4, TLR7 и TRL9, как было показано, играют ключевую роль в врожденном восприятии и распознавании Leishmania этими клетками [81]. Это распознавание имеет решающее значение для инициирования воспалительной реакции и контроля репликации паразитов [30, 80].
После рестимуляции in vitro паразитарными антигенами моноциты, выделенные от пациентов с ЦП, вызванным L.braziliensis обнаружил активацию TLR9. Кроме того, была обнаружена связь между более высокой частотой моноцитов TLR9 + и тяжестью поражения. Внутриклеточный сенсор TLR9, трансмембранный белок эндосомных компартментов, связывается с патогенными ДНК, запускающими сигнальные пути, которые приводят к провоспалительному ответу. Таким образом, активация этого сенсора у пациентов с ХЛ указывает на высвобождение провоспалительных цитокинов, которые, по-видимому, не имеют положительного эффекта в снижении тяжести заболевания [80].
3.5. Взаимодействие провоспалительных и регуляторных подгрупп лимфоцитов, по-видимому, является признаком кожного лейшманиоза.
B- и T-клетки являются ключевыми компонентами приобретенного иммунитета. В-клетки отвечают за выработку антиген-специфических антител (гуморальный ответ), и, поскольку они являются APC, они также могут играть роль в активации Т-клеток [86–88]. Эти клетки активируются после воздействия чужеродных антигенов, которые интернализуются, что приводит к репликации и дифференцировке эффекторных В-клеток и высвобождению антител [30, 86].Несколько исследований показывают, что В-клетки могут быть вовлечены в обострение инфекций, вызываемых Leishmania , включая кожные заболевания, вызываемые L. tropica , L. mexicana , L. major , L. braziliensis и L. .. amazonensis , хотя механизм этого до сих пор неизвестен [87, 89, 90].
Однако исследования, проведенные с L. major на моделях устойчивых грызунов (C3H / HeN и C57BL / 6), предполагают, что В-клетки могут играть роль в развитии иммунитета против инфекции Leishmania [91, 92].Кроме того, Mukbel et al. [93] показали, что растворимые факторы, такие как видоспецифические иммуноглобулины, а также CD4 + T- и B-клетки, полученные от мышей, инфицированных L. major , , которые вылечили инфекцию, сыграли ключевую роль в уничтожении L. amazonensis внутриклеточных клеток. паразиты. Кроме того, более недавнее исследование, проведенное Гибсоном-Корли [94], показало, что В-клетки от мышей C3HeB / FeJ, коинфицированных L. major и L. amazonensis , способствуют уничтожению паразитов, в то время как В-клетки от коинфицированных мышей C57BL / 6 неэффективны. в борьбе с инфекцией.Хотя механизм действия В-клеток недостаточно изучен, эти результаты могут указывать на то, что В-клетки могут быть хорошей мишенью для разработки терапевтического средства от кожного лейшманиоза, поскольку эти клетки, по-видимому, играют роль в контроле ХЛ в моделях устойчивых мышей [95 ].
Контроль за инфекцией Leishmania и прогрессированием заболевания долгое время был связан с генерацией провоспалительного и противовоспалительного иммунного ответа [30]. Устойчивый ответ Th2, характеризующийся повышенным уровнем IL-12, IL-2, IFN-, γ и TNF-, α и подавлением продукции IL-4 и IL-10, способствует активации M Φ (Рисунок 4) и, по-видимому, иметь решающее значение для контроля хозяина Leishmania бремя паразитов и клинического лечения [30, 82, 83].
С другой стороны, Th3-родственные цитокины (IL-4, IL-5, IL-10 и IL-13) ингибируют активацию M Φ , способствуя выживанию паразитов [30, 83, 85].
При некоторых клинических формах ХЛ смешанный иммунный ответ Th2 / Th3 возникает во время активной инфекции, что приводит к преобладанию ответа Th3 при активации обоих типов ответов [10]. Расширение ответа Th3 связано с прогрессированием и хроническим поражением кожи, которое часто невосприимчиво к классическому лечению лейшманиоза, что приводит к тяжелым увечьям [10, 83, 85].
Исследования по оценке продукции цитокинов у пациентов с ХЛ, вызванной L. guyanensis , показали высокие уровни ИЛ-2 и ИФН- γ [7]. В очагах была обнаружена высокая плотность Th3-связанных цитокинов, особенно IL-13. Более того, у этих пациентов также может наблюдаться пониженное или необнаруживаемое распознавание антигена, связанное с высокими уровнями IL-10 и IL-5, а также более низкие титры специфических антител. В заключение, усиленные цитокины Th3-типа, которые сдерживают ответ Th2-типа, приводят к иммунной среде, допускающей репликацию паразитов [7, 96, 97].Таким образом, инфекция L. guyanensis влияет на распространение антиген-специфических клонов Т-лимфоцитов, вызывая низкую пролиферацию лимфоцитов и снижая продукцию IFN-γ . Ограниченные клеточные и гуморальные реакции во время инфекции L. guyanensis могут объяснить высокую паразитарную нагрузку и рецидив заболевания [7].
Прогресс в понимании прогрессирования ХЛ показывает, что клеточные взаимодействия более сложны, чем парадигма Th2 / Th3. Кожная инфекция Leishmania следует за сложным набором взаимодействий, которые могут привести к дифференцировке субнабора клеток Th27, который характеризуется высвобождением IL-17 [40, 98].Этот цитокин, признанный провоспалительным модулятором, побуждает другие клетки высвобождать медиаторы воспаления, которые в конечном итоге способствуют привлечению PMN к месту инфекции, поддерживая воспалительную среду, которая может быть связана с персистенцией поражения.
Пациенты с LC, инфицированные L. amazonensis или L. guyanensis , демонстрировали более высокие уровни лимфоцитов Th27 [40]. При инфекциях человека, вызываемых L. major , L. tropica , L.amazonensis , L. braziliensis , L. guyanensis или L. panamensis наблюдалась высокая продукция IL-17, что указывает на рекрутирование PMN и активацию M Φ , что может быть связано с развитием заболевания и поражением. степень тяжести [40, 99]. В исследованиях на мышах клетки Th27 были связаны с разрушением тканей [40, 51, 88, 100].
Регуляторные T (Treg) -лимфоциты считаются критически важной клеточной субпопуляцией, контролирующей обострение воспалительной реакции и регулирующей патологию заболевания.Роль Treg в спектре иммунных ответов на КЛ варьирует у видов Leishmania [40, 88, 100]. У мышей, инфицированных L. major , Treg играют различную роль в исходе заболевания в зависимости от генетического фона и восприимчивости хозяина [101]. Однако в случае инфекции L. panamensis клетки Treg играют роль в подавлении воспалительных цитокинов, которые, по-видимому, ограничивают рекрутирование клеток-хозяев, что приводит к уменьшению размера поражения [101]. Следовательно, роль Tregs, а также Th27 в CL неясна, что требует дальнейших исследований, позволяющих оценить динамику клеток и лучше понять потенциал их использования в качестве биомаркеров тяжести заболевания и мишени для лекарственного лечения.
L. major и L. braziliensis in vivo исследования показывают, что подсемейство IL-10 имеет важное значение для процесса заживления ран, поддержания свойств восстановления кожи и ограничения патологии независимо от борьбы с паразитами [85]. Другие регуляторные механизмы, опосредованные цитокинами, должны быть изучены в будущих исследованиях для контроля иммунопатологии, индуцированной Leishmania [102, 103].
Кроме того, сообщалось, что пациенты с CL, инфицированные L.braziliensis может представлять CD4 — CD8 — (DN) Т-лимфоциты, экспрессирующие αβ, Т-клеточные рецепторы (TCR) и DN T-клетки, экспрессирующие γδ TCR. В то время как подмножество αβ DN Т-клеток было связано с более воспалительной средой, что привело к противопаразитарной активации M Φ , γδ DN Т-клетки, по-видимому, играют регулирующую роль, способствуя снижению воспалительного ответа [103].
При CL правильный местный воспалительный иммунный ответ имеет решающее значение для сдерживания и уменьшения распространения паразитов.Однако обширная или чрезмерная воспалительная реакция может вызвать повреждение тканей. Таким образом, одновременное обнаружение субпопуляций провоспалительных и регуляторных клеток у пациентов с ХЛ, по-видимому, вносит вклад в баланс между защитным иммунным ответом против паразита и естественным внутренним ответом, который обеспечивает иммунный гомеостаз.
NK T (NKT) -клетки, специализированная субпопуляция Т-лимфоцитов, также, по-видимому, играют роль на ранних стадиях инфекций Leishmania [91, 104, 105] (Рисунок 4).Однако на мышах, инфицированных L. major , было продемонстрировано, что NKT-клетки, по-видимому, контролируют количество паразитов в поражениях кожи и в селезенке, но не в лимфатических узлах [54], что указывает на специфическую для этих органов роль. клетки. Более того, в кожных поражениях у инфицированных L. braziliensis- пациентов были идентифицированы NKT-клетки с цитотоксической активностью [104].
4. Проблемы профилактики, диагностики и лечения кожного лейшманиоза
Сведение к минимуму воздействия КЛ зависит от профилактики, диагностики и лечения — трех основных шагов, которые должны объединить разработку новых стратегий для эффективной борьбы с лейшманиозом.
Профилактика — это первая основа, которую необходимо обеспечить для достижения контроля над болезнью. Он включает в себя (i) сокращение воздействия паразитарных переносчиков на популяцию, (ii) меры по снижению роли переносчиков и резервуаров в передаче паразитов, (iii) осведомленность и просвещение населения, подверженного риску заражения этим паразитарным заболеванием, (iv) доступность базовой медицинской помощи и (v) мониторинг распространения и заболеваемости.
Борьба с переносчиками инфекции в основном зависит от использования инсектицидов, помимо того, что они токсичны и требуют регулярного повторного применения, что создает проблемы для групп населения с низким доходом, а также приводит к значительному увеличению числа устойчивых к инсектицидам переносчиков.Кроме того, основными резервуарами паразита являются лесные животные, которые могут взаимодействовать с популяциями, что также увеличивает сложность борьбы с этими паразитами.
Мониторинг CL по-прежнему является непростой задачей, поскольку социальная стигма, войны, бедность и ограниченный доступ к медицинской помощи в значительной степени затрагивают большинство эндемичных регионов, которые связаны с отсутствием оборудования и обученного персонала, еще больше усугубляют эти трудности.
Диагностика и лечение взаимосвязаны, так как стадия прогрессирования заболевания и точность диагноза сильно влияют на эффективность лечения.Ранняя и точная диагностика и эффективное лечение пациентов имеют важное значение для снижения передачи паразитов и увеличения CL.
В эндемичных по ЧЛ районах точность диагноза должна быть сделана при более ранней клинической картине, чтобы избежать осложнений на поздних стадиях заболевания [106]. Конкретные подходы к лечению пациентов с ХЛ должны учитывать этиологический агент, иммунную компетентность пациента, клинические особенности и возникающие осложнения в ходе инфекции Leishmania [11, 19].Атипичные инфекции могут потребовать точного дифференциального диагноза с другими возможными сопутствующими инфекциями, такими как проказа, туберкулез, грибковые инфекции, эктима, фурункул, карбункул, североамериканский бластомикоз, паракокциомикоз, фрамбезия, прототека, остроконечная кондилома, споротрихоз, сифилис, вульгарная волчанка. кожный фурункулярный миаз, тунгиоз, туберозная ксантома, саркоидоз, гангренозная пиодермия и новообразования [107]. Традиционно своевременный диагноз ХЛ достигается путем идентификации форм амастигот (круглые внутриклеточные формы с цифрой 1.5 мкм м до 3 мкм мкм) Leishmania в образцах биопсии поражения кожи (золотой стандарт) при наблюдении под оптическим микроскопом [1]. Для диагностики лейшманиоза могут применяться и другие методики, такие как гистологический анализ кожи, биопсия in vitro и молекулярная диагностика [25]. Иногда лейшманиновая кожная проба (LST), также называемая кожной пробой Черногории (MST) и гиперчувствительностью замедленного типа (DTH), используется при CL в качестве маркера клеточного иммунного ответа (Таблица 2).Когда диагноз ХЛ был однозначно установлен, необходимо применять специфическую таргетную терапию и управлять пациентом, чтобы контролировать инфекцию [12, 14]. В некоторых случаях необходимо отслеживать побочные эффекты, включая миалгию, желудочно-кишечные расстройства, головную боль, анорексию, астению, лихорадку, неврологические изменения и аритмию, а также использовать медицинские методы визуализации, такие как магнитно-резонансная томография (МРТ), чтобы не выявить хрящевой ткани. деструкция или поражение околоносовых органов в тяжелых случаях [12, 108].
Антилейшманиальные препараты, применимые к ХЛ, имеют ограниченный характер, проявляют серьезные побочные эффекты, повышенную стоимость и обычно требуют длительного лечения [109]. Виды Leishmania , вовлеченные в инфекцию, устойчивость к паразитам и сопутствующие инфекции, являются ключевыми факторами, влияющими на эффективность лечения [110, 111]. Другая возможность лечения — использование термотерапии; тем не менее, этот метод не является широко доступным из-за стоимости необходимых устройств и процедур, а также из-за необходимости квалифицированных специалистов здравоохранения для проведения лечения [112].Недавние исследования конкретных вмешательств для лечения ХЛ у детей свидетельствуют о нехватке данных, доступных для поддержки рекомендаций по лечению для этого возрастного диапазона, и о неудовлетворенной потребности в разработке и тестировании лучших вариантов лечения для этой уязвимой группы [113].
Эффективные, недорогие и безопасные методы лечения, такие как профилактические вакцины, лекарства и терапевтические вакцины от кожной инфекции, пока недоступны для лечения лейшманиоза человека. Более того, другие повстанческие проблемы, такие как изменение климата, миграция популяций и доступность переносчиков, могут усложнить борьбу с CL, способствуя распространению болезни [16].Изменения климата могут привести к распространению переносчиков на неэндемичные регионы [1, 114]. Распространение переносчика в сочетании с высокой переносимостью и вседозволенностью может способствовать адаптации паразита в неэндемичных районах, приводя к образованию новых очагов и повышая риск передачи паразита [3, 115, 116]. Кроме того, экономические проблемы, стихийные бедствия и войны, связанные с массовой миграцией и туристами, могут привести к повышенному риску заражения [4, 20, 117].
Кожный лейшманиоз — важная проблема общественного здравоохранения во всем мире. Спектр инфекции Leishmania может быть субклинической, локализованной и диссеминированной и зависит от иммунной компетентности хозяина и инфекционности видов паразитов.
Факт высокой заболеваемости КЛ, главным образом, в районах с нехваткой экономических ресурсов, недостаточно подготовленными медицинскими специалистами и низкой осведомленностью о проблеме лейшманиоза, связанной со здоровьем, в сочетании с отсутствием высокоэффективных средств борьбы с переносчиками и резервуарами, лечения и вакцина, создает среду, которая способствует распространению CL, превращая болезнь в серьезную проблему для глобального здоровья.
Наряду с описанием специфического иммунного ответа человека модели на животных использовались для обширной характеристики иммунного ответа на паразитарные инфекции, вызываемые кожными видами Leishmania. Таким образом, инвестиции в дополнительные исследования CL являются неотложными и важными, поскольку они лежат в основе факторов, регулирующих иммунные патологические реакции, которые необходимы для реализации более эффективных и комплексных стратегий контроля и лечения. Эти усилия незаменимы для населения, пораженного этим заболеванием, которое отчаянно нуждается в доступных и эффективных альтернативах доступным методам лечения, которые связаны с резистентностью к паразитам и тяжелыми токсическими эффектами.
Конфликт интересов
Ни один из авторов не заявляет о конфликте интересов.
Благодарности
Финансирование этой работы было предоставлено Португальским фондом науки и технологий (FCT) в рамках проектов PTDC / CVT-CVT / 28908/2017 и GHTM – UID / Multi / 04413/2013.


 регистрируется (ВОЗ) от 700 тысяч до 1,3 миллиона новых случаев кожного лейшманиоза и 200-400 тысяч случаев висцерального лейшманиоза.
регистрируется (ВОЗ) от 700 тысяч до 1,3 миллиона новых случаев кожного лейшманиоза и 200-400 тысяч случаев висцерального лейшманиоза.