Polysome Profiling in Leishmania, Human Cells and Mouse Testis
В этом исследовании, мы описывают применение polysomal метод профилирования для трех разных источников: паразитарные лейшмании крупных, культивируемых клеток человека и мыши яичка. Клеток лейшмании свободно расти в жидких средах в суспензии, культивируемых клеток человека растут в адэрентных монослоя на тарелки, и яички мыши представляет собой образец ткани. Этот метод можно легко отрегулировать для других типов свободно выросли клеток в суспензии, различные типы тканей, или из другого организма и различные виды культивируемых клеток. Этот подход состоит из четырех основных шагов: lysate подготовки, сахароза градиента подготовка и ultracentrifugation шаг, Полисома фракционирования и образец коллекции следуют анализ фракций. Клетки из разных источников собираются, промывают и анализироваться в буфера lysis проход через иглу или Dounce гомогенизатор. Центрифугирование используется для удаления мусора клеток, уточнения lysate.
Количественного RT-PCR (RT-ПЦР) использовалась для обнаружения ассоциации отдельных лейшмании мРНК рибосомы и polysomes. Сравнительный метод31 CT (ΔΔCТ) является простой и соответствующий подход для изучения уровня относительной mRNAs в клетках. Этот метод требует внутреннего контроля (стабильная мРНК, которая не изменяет выражение во время лечения или условий эксперимента) для расчетов. Однако существует нет внутреннего контроля в polysomal фракций, потому что уровни mRNA или рибосомной РНК будет варьироваться в фракции, в зависимости от их связи с рибосомами, polysomes и  ОмПО мРНК синтезированные в пробирке и добавляется каждой фракции до экстракции РНК в равных количествах. Добавлением синтетических РНК имеет важное значение, потому что это делает вычисления RT-ПЦР данных более точным, выступающей в качестве внутреннего контроля для вычисления методом сравнительного CT (ΔΔCТ).
ОмПО мРНК синтезированные в пробирке и добавляется каждой фракции до экстракции РНК в равных количествах. Добавлением синтетических РНК имеет важное значение, потому что это делает вычисления RT-ПЦР данных более точным, выступающей в качестве внутреннего контроля для вычисления методом сравнительного CT (ΔΔCТ).
Аликвоты градиента фракций были смешаны в три группы: prepolysomes (субъединиц и monosomes), легкие polysomes (состоящий из 2-4 рибосомы) и тяжелых polysomes (состоящий из 5-8 рибосомы). RT-ПЦР была исполнена на РНК из комбинированных фракций для анализа распределения mRNA между этими комбинированных фракций ( рис. 2B). 18s рибосомной РНК использовался в качестве элемента управления. Его относительных уровней определяется RT-ПЦР коррелирует с предполагаемое распределение малых субъединиц рибосомальной (свободной субъединицы и как часть monosomes и polysomes) на спектре. RT-ПЦР анализ показал, что индивидуальных mRNAs испытания имеют разную степень участия в перевод этапе логарифмической лейшмании роста.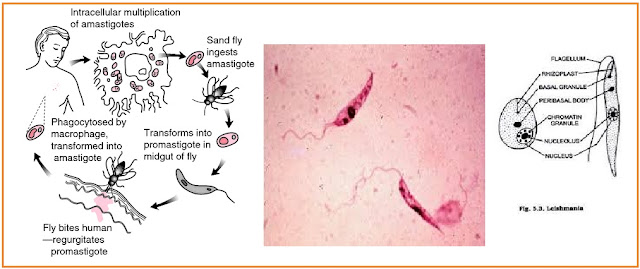 Тубулин мРНК связан преимущественно с тяжелой polysomes, предлагая эффективный перевод. В отличие от Sherp мРНК находится прежде всего с prepolysomes и легких polysomes поддержки менее активным перевода по сравнению с тубулин мРНК.
Тубулин мРНК связан преимущественно с тяжелой polysomes, предлагая эффективный перевод. В отличие от Sherp мРНК находится прежде всего с prepolysomes и легких polysomes поддержки менее активным перевода по сравнению с тубулин мРНК.
 Как в исследованиях, лейшмании , распределение mRNAs определяется RT-ПЦР в долях, представляющих prepolysomes, легкие polysomes и тяжелых polysomes ( рис. 3B). Обнаружение РНК малых субъединицы рибосомальной 18S коррелирует с их предполагаемое распределение в спектрах. НДП mRNAs главным образом были связаны с легкой и тяжелой polysomal фракций, в то время как МВТР mRNAs главным образом были найдены в prepolysome фракций, предполагая, что НДП переводится более эффективно. В то время как НПР является относительно небольшой белок, МВТР является очень большой белок (1480 аминокислотных остатков), состоящий из нескольких доменов, которые самостоятельно раз во время перевода35. Нижних захватов МВТР мРНК с polysomes может отражать медленнее перевода, которая необходима для cotranslational складывания ее отдельных доменов.
Как в исследованиях, лейшмании , распределение mRNAs определяется RT-ПЦР в долях, представляющих prepolysomes, легкие polysomes и тяжелых polysomes ( рис. 3B). Обнаружение РНК малых субъединицы рибосомальной 18S коррелирует с их предполагаемое распределение в спектрах. НДП mRNAs главным образом были связаны с легкой и тяжелой polysomal фракций, в то время как МВТР mRNAs главным образом были найдены в prepolysome фракций, предполагая, что НДП переводится более эффективно. В то время как НПР является относительно небольшой белок, МВТР является очень большой белок (1480 аминокислотных остатков), состоящий из нескольких доменов, которые самостоятельно раз во время перевода35. Нижних захватов МВТР мРНК с polysomes может отражать медленнее перевода, которая необходима для cotranslational складывания ее отдельных доменов.Фракции Полисома также может использоваться для обнаружения белков. Обнаружение белков в градиента фракций было проведено на примере рибосомных белков в клетках Хела (рис.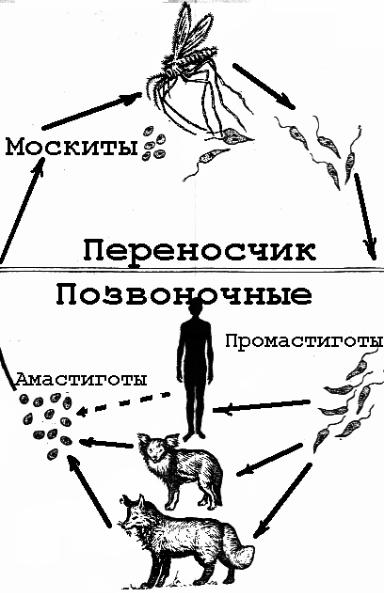
Были использованы многие градиентов концентрации различных сахарозы (к примеру, 7-47%36, 5-50%7, 7-50%6 , 10-50%37, 15-50%8и другие) для polysomes фракционирования. Здесь мы сравнили два градиенты 10-50% и 17-51% (Рисунок 5). Хотя, 17-51% производимого приемлемые результаты, разделение в 10-50% градиент был общий лучше.
Это хорошо документированы, что хелатирующих агентов, таких как ЭДТА, нарушить рибосомы и polysomes 8,9. Как показано на рисунке 6, лечение ЭДТА HeLa lysate до погрузки на градиент приводит к исчезновению пики, соответствующие monosomes и polysomes, и значительное увеличение субъединиц рибосом пиков. Этот эксперимент служил как элемент управления и продемонстрировал, что наблюдаемые пиков без лечения ЭДТА являются фактически рибосомных monosomes и polysomes.
Как показано на рисунке 6, лечение ЭДТА HeLa lysate до погрузки на градиент приводит к исчезновению пики, соответствующие monosomes и polysomes, и значительное увеличение субъединиц рибосом пиков. Этот эксперимент служил как элемент управления и продемонстрировал, что наблюдаемые пиков без лечения ЭДТА являются фактически рибосомных monosomes и polysomes.
Рисунок 7 показывает результаты Полисома фракционирования от мыши яичек. Спектр поглощения имеет сходство с теми, от Leishmania и НеЬа клетки: собственный вершины рибосомальной подразделения, monosomes и polysomes. Их форма и распределение производят внешний вид подписи, что делает его легко идентифицировать их на различных polysomal спектры. Всего РНК были очищены от фракции и РНК из выбранной фракции были проанализированы электрофорезом геля агарозы ( Их острые диапазоны указывают целостности проб. Гель может использоваться для обнаружения индивидуальных mRNAs следующих Северная помарка, или она может использоваться для оценки качества образцов до дальнейших экспериментов на RNA или протеина анализ — рассеянное рибосомной РНК, полосы указывают РНК деградации в образцах.
Их острые диапазоны указывают целостности проб. Гель может использоваться для обнаружения индивидуальных mRNAs следующих Северная помарка, или она может использоваться для оценки качества образцов до дальнейших экспериментов на RNA или протеина анализ — рассеянное рибосомной РНК, полосы указывают РНК деградации в образцах.
В ходе нашего исследования мы использовали АБС битор РНКазы и гепарин как иы АБС битор РНКазы в градиентах лизатов и сахароза. Хотя оба из них представили удовлетворительные результаты, использование АБС битор РНКазы предпочтительнее для анализа РНК, потому, что она не помешает cDNA и RT-ПЦР-реакции. Таким образом он не требует дополнительных шагов очистки РНК. Однако если исследователи решили использовать гепарина во время подготовки Полисома, помните, что гепарин угнетает вниз поток приложения, такие как RT-ПЦР и дополнительного шага очистки РНК необходим (см. раздел 6 протокол).
Рисунок 1 . Профилирование Полисома. (A) схема градиента подготовки, фракционирование и поглощения профиль Полисома. (B) схема анализа дроби. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Профилирование Полисома. (A) схема градиента подготовки, фракционирование и поглощения профиль Полисома. (B) схема анализа дроби. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2 . Анализ Полисома профиля лейшмании основных культуры в логарифмической стадии роста. (A) Эндоплазматический lysate был фракционированный в 10-50% сахарозы градиента. (B) относительное распределение 18S RNA, тубулин и мРНК (%) Sherp в prepolysomes, легкие и тяжелые polysomes журнала клеток анализируемой RT-ПЦР. Фракций, содержащих 40, 60 и monosomes были объединены в prepolysomes. Дроби с 2-4 рибосомы были объединены в легких polysomes, в то время как дроби с 5-8 рибосомы сформированные тяжелых polysomes. Синтетические  Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3 . Полисома фракционирования и анализ рекомбинатных МВТР и НДП mRNAs ассоциации с рибосомы клеток HeLa transfected плазмида ДНК с. (A) Polysomal профиль в клетки HeLa transfected с МВТР и НДП плазмид. 10% — 50% сахарозы градиент был применен для достижения разделения polysomes. Пики для малых (40 лет) и большой (60) подразделения, а также monosome (80) указаны. Фракций были объединены как показано на панели A и используется для дальнейшего анализа. (B) распределение mRNAs МВТР и НДП в различных фракций. Обнаружение 18S, RT-ПЦР был использован как элемент управления для Полисома фракционирования. РНК уровни были оценены RT-ПЦР анализа.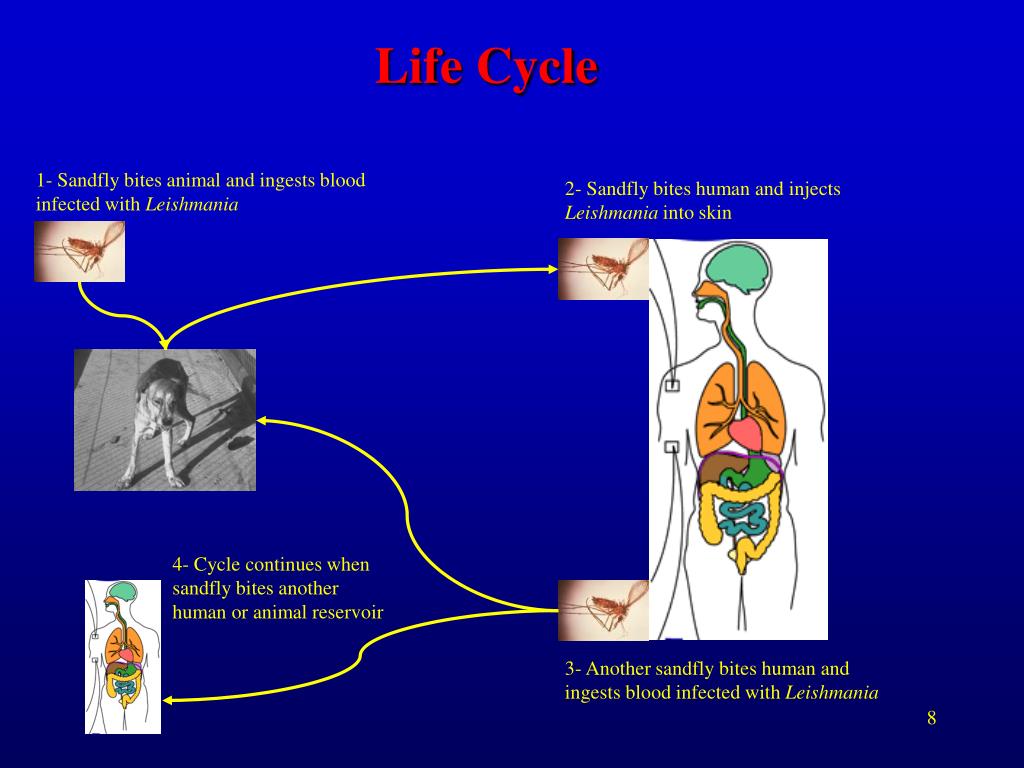 Данные были нормализованы с использованием синтетических мРНК. Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Данные были нормализованы с использованием синтетических мРНК. Сравнительный метод31 CT (ΔΔCТ) был использован для расчета уровней мРНК. Планки погрешностей представляют собой стандартные ошибки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4 . Обнаружение рибосомных белков в polysomal фракций НеЬа. Lysate клетки HELA был подвергнут 10% — 50% сахарозы градиентного центрифугирования. Белки в отдельных фракций были химически осажденный с ГТС и проанализированы электрофорезом в 12% SDS-PAGE с following Западный blotting с помощью мыши RPS6 моноклональных и поликлональных антител RPL11 кролик как первичных антител и Peroxidase-Conjugated коза вторичные антитела анти мыши или анти кролика. Визуализация сигналов было сделано SuperSignal Запад Пико плюс Хемилюминесцентный субстрат. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.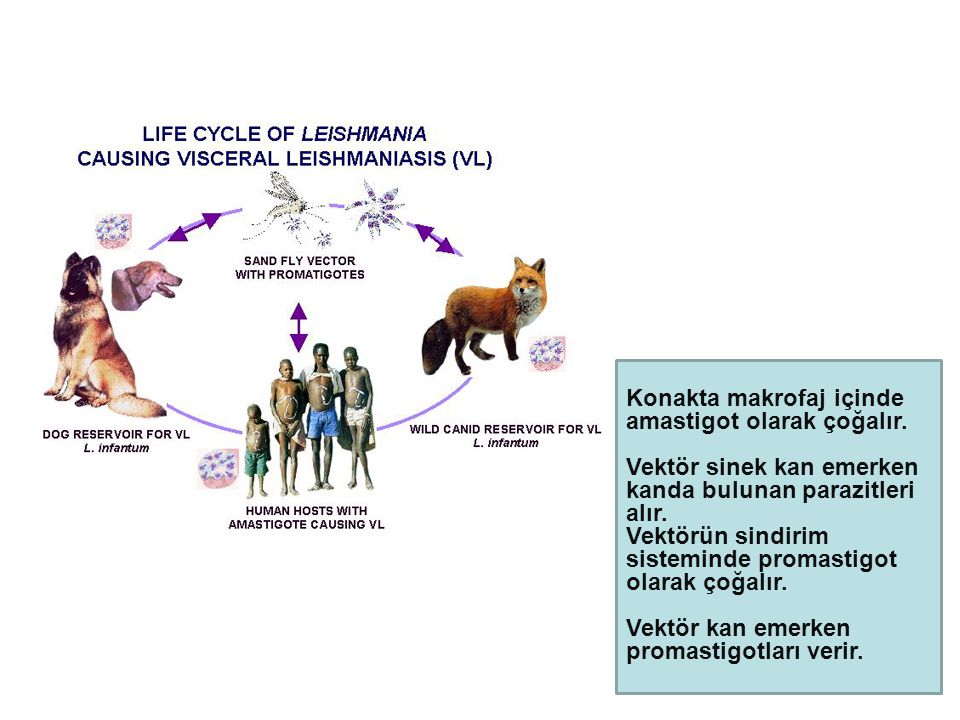
Рисунок 5 . Сравнение HeLa polysomal профилирования в 10% — 50% (черный) или градиенты сахарозы 17-51% (серый). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 6 . Эффект от лечения ЭДТА на polysomal профиле в клетки HeLa. Lysate клетки HELA лечили 10 мм ЭДТА на льду за 10 мин непосредственно перед сахарозы градиентного центрифугирования. MgCl2 был заменен на 5 мм ЭДТА в сахарозу градиента решений. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 7 . Polysomal профиль из ткани яичка мыши lysate. Фракций были подвергнуты РНК добыча с реактивом Очистка РНК и проанализированы электрофорезом геля агарозы 1%. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Subscription Required. Please recommend JoVE to your librarian.
Leishmania donovani
Заболевания Leishmania donovani
просмотров — 246
Leishmania infantum
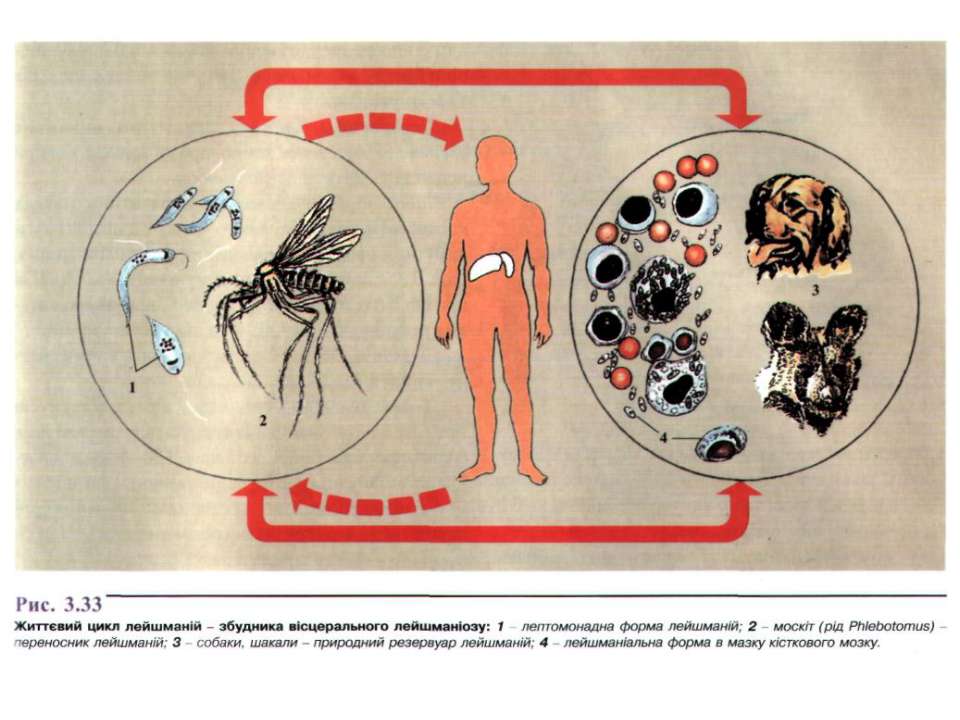
Заболевание: висцеральный лейшманиоз.
Географическое распространение: страны с тропическим и субтропическим климатом (страны Средиземноморья, Средняя Азия, Индия, Африка).
Эпидемиология: антропозооноз, природно-очаговое заболевание (резервуар – шакалы, лисицы, грызуны, домашние хищники).
Жизненный цикл:
Инвазионная форма:лептомонадная (жгутиковая).
Механизм заражения:трансмиссивный.
Путь заражения:инокуляция (при укусе специфического переносчика – москита рода Phlebotomus).
Патогенная форма:лейшманиальная (безжгутиковая).
Локализация паразита в организме человека: ретикулоэндотелиальные клетки различных органов, клетки печени, селезенки, костного мозга, лимфатических узлов, макрофаги моноциты крови.
Патогенное действие:
1. Токсическое. Продукты метаболизма отравляют организм человека.
2. Механическое. Разрушает клетки пораженных органов, вызывает абцессы.
Симптомы:
Болезнь, как правило, развивается постепенно, сопровождается вялостью, потерей аппетита. Кожа бледная с землистым оттенком. Развивается истощение, увеличиваются лимфатические узлы, селезенка, печень. Отекают нижние конечности.
Диагностика: пункция грудины или лимфатических узлов: обнаружение в пунктате при микроскопии лейшманиальных форм как внутри клеток, так и внеклеточно; посев материала, взятого от больного на специальную культуральную среду с последующей микроскопией; биологические пробы – заражение лабораторных животных.
Основные меры профилактики: личная защита от укусов москитов, санитарно-просветительная работа͵ борьба с переносчиками и резервуарами в очагах заболевания, отлов бродячих собак.
Leishmania tropica.
Заболевание: кожный лейшманиоз:
кожный лейшманиоз городского типа — Leishmania tropica minor
кожный лейшманиоз сельского типа — Leishmania tropica major.
Географическое распространение: страны с тропическим и субтропическим климатом.
Эпидемимиология: антропозооноз, природно-очаговое заболевание (резервуар — грызуны).
Жизненный цикл:
Инвазионная форма: лептомонадная (жгутиковая).
Механизм заражения: трансмиссивный.
Путь заражения: инокуляция (при укусе специфического переносчика – москита рода Phlebotomus).
Патогенная форма: лейшманиальная (безжгутиковая).
Локализация паразита в организме человека: клетки кожи.
Патогенное действие:
1. Токсическое. Продукты метаболизма отравляют организм человека.
2. Механическое. Разрушает клетки кожи.
Симптомы: образование язв на коже.
· Лейшманиоз городского типа (страны Ближнего Востока, Западной и Северной Африки, западная часть Индии) – поздно изъязвляющийся, инкубационный период – 6-8 месяцев, продолжительность заболевания – около года.
Читайте также
Морфология: 2-4 мкм безжгутиковая стадия паразитирует в теле человека, жгутиковая стадия – в теле москита, достигает 10-20 мкм в длину.
Строение: оболочка, цитоплазма, ядро, блефаропласт, жгутик.
Пути заражения: укус москита.
Способ заражения: трансмисивный.
Переносчик:… [Ознакомиться подробнее.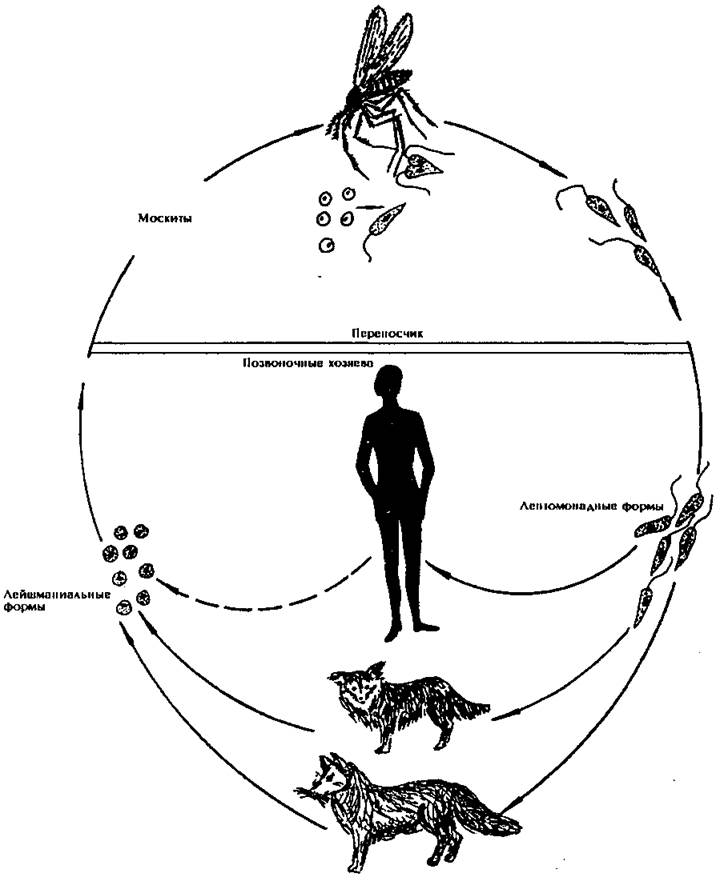 ]
]
Десять простейших паразитов человека
Наталья Резник
Самый большой. Балантидий Balantidium coli
Крупнейшее простейшее — паразит человека, и единственная инфузория в этой компании. Ее размеры варьируют от 30 до 150 мкм в длину и от 25 до 120 мкм в ширину. Для сравнения: длина малярийного плазмодия в самой крупной стадии — около 15 мкм, и в разы меньше балантидия клетки кишечника, среди которых живет инфузория. Слон в посудной лавке.
Распространен везде, где есть свиньи — его основные носители. Обычно живет в подслизистом слое толстой кишки, хотя у людей встречается и в легочном эпителии. Питается B. coli бактериями, частичками пищи, фрагментами хозяйского эпителия. У животных инфекция протекает бессимптомно. У людей может развиться тяжелейшая диарея с кровавыми, слизистыми выделениями (балантидиаз), иногда в стенках толстой кишки образуются язвы. Умирают от балантидиаза редко, однако он вызывает хроническое истощение.
Умирают от балантидиаза редко, однако он вызывает хроническое истощение.
Люди заражаются через грязную воду или продукты, содержащие цисты. Частота инфицирования у людей не превышает 1%, в то время как свиньи могут быть заражены поголовно.
Лечится тетрациклином или метронидазолом, сообщений о лекарственной устойчивости этой инфузории пока не поступало.
Открыт шведским ученым Мальстемом в 1857 году. Сегодня балантидиаз связывают с тропическими и субтропическими районами, бедностью и плохой гигиеной.
Самая первая. Ротовая амеба Entamoeba gingivalis
Первая паразитическая амеба, найденная у человека. Этот человек был москвичом, и описание его амеб опубликовал московский исследователь Г. Гросс в 1849 году в Bulletin de la Société Impériale des Naturalistes de Moscou — старейшем русском научном журнале (выходит с 1829 года и посейчас индексируется ВАК под именем «Бюллетень Московского общества испытателей природы»).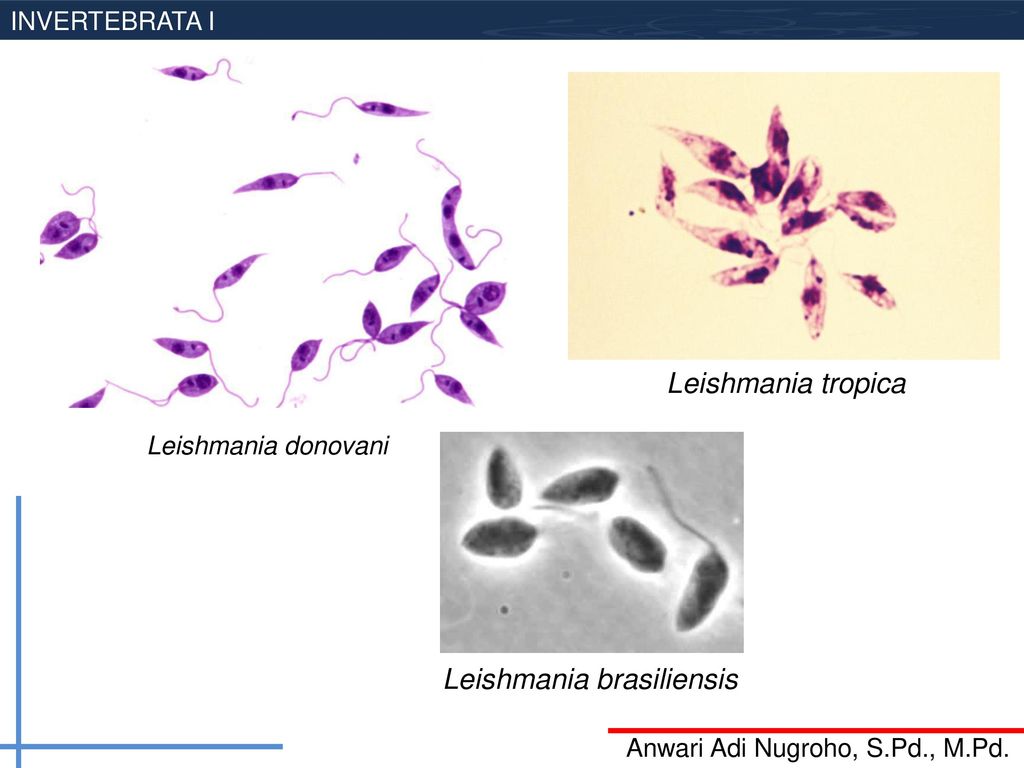 Гросс обнаружил амебу в зубном налете, отсюда и название от латинского gingivae — десны.
Гросс обнаружил амебу в зубном налете, отсюда и название от латинского gingivae — десны.
Живет во рту почти у всех людей с больными зубами или воспаленными деснами, населяет десневые карманы и зубной налет. Питается клетками эпителия, лейкоцитами, микробами, при случае эритроцитами. У людей со здоровой ротовой полостью встречается редко.
Это небольшое простейшее размером 10–35 мкм во внешнюю среду не выходит и цист не образует, к другому хозяину передается при поцелуях, через грязную посуду или зараженную пищу. E. gingivalis считают исключительно человеческим паразитом, но иногда ее находят у кошек, собак, лошадей и обезьян, живущих в неволе.
В начале ХХ века E. gingivalis описали как возбудителя пародонта, поскольку она всегда присутствует в воспаленных зубных ячейках. Однако ее патогенность не доказана.
Лекарства, действующие на эту амебу, неизвестны.
Самый всепроникающий. Дизентерийная амеба Entamoeba histolytica
Дизентерийная амеба Entamoeba histolytica
Этот кишечный паразит с кровью проникает в ткани печени, легких, почек, мозга, сердца, селезенки, половых органов. Ест, что добудет: частички пищи, бактерии, эритроциты, лейкоциты и клетки эпителия.
Распространена повсеместно, особенно в тропиках. Обычно люди заражаются, проглотив цисту.
В странах умеренного климата амеба, как правило, остается в просвете кишечника, и инфекция протекает бессимптомно. В тропиках и субтропиках чаще начинается патологический процесс: E. histolytica атакуют стенки. Причины перехода в патогенную форму пока неясны, но описано уже несколько молекулярных механизмов происходящего. Так, понятно, что амебы выделяют лизирующие вещества, пробиваются через слизь и убивают клетки. По-видимому, амеба может уничтожить хозяйскую клетку двумя способами: запустив у нее апоптоз или просто отгрызая куски. Первый способ долгое время считался единственным.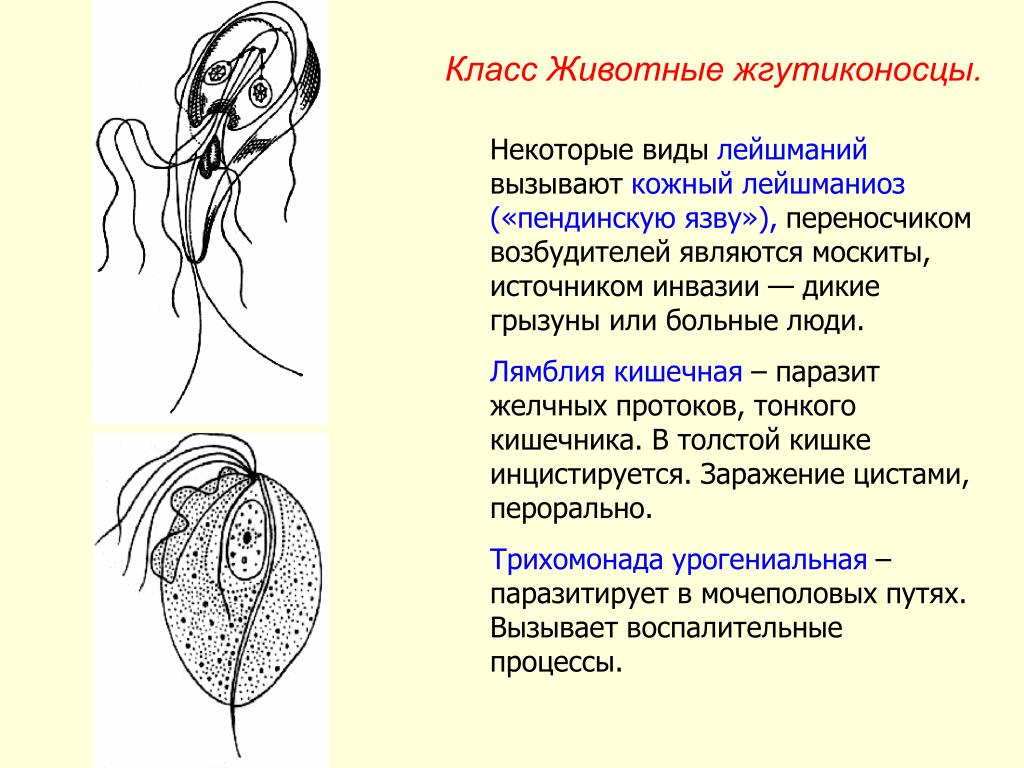 Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
Кстати, механизм клеточного самоубийства с рекордной скоростью — за минуты — так и не выявлен. Второй способ описан совсем недавно, авторы назвали его трогоцитозом от греческого «трого» — грызть. Примечательно, что амебы, кусающие клетки, бросают добычу, как только она погибает. А другие могут фагоцитировать мертвые клетки целиком. Предполагают, что кусающие и пожирающие клетки различаются картиной экспрессии генов.
Сейчас способность амебы проникать в кровяное русло, печень и другие органы связывают именно с трогоцитозом.
Амебиаз — смертельно опасное заболевание, ежегодно от инфекции E. histolytica умирает около 100 тыс. человек.
У дизентерийной амебы есть непатогенный близнец, E. dispar, поэтому для диагностики заболевания микроскопии недостаточно.
Для излечения необходимо уничтожить как подвижных E. histolytica (метронидазол, тинидазол), так и цисты (иодокинол или паромомицин).
Описал E. histolytica в 1875 году петербургский врач Федор Александрович Лёш у больного диареей, он же определил ее патогенную природу. Но латинское название амебе дал в 1903 году немецкий зоолог Фриц Шаудин. Histolytica означает «разрушающая ткани». В 1906 году ученый умер именно от амебного абсцесса кишечника.
Самый распространенный. Кишечная лямблия Giardia lamblia (G.intestinalis)
Лямблия, самый распространенный паразит кишечника, встречается повсеместно. Заражены 3–7% людей в развитых странах и 20–30% в развивающихся. То есть примерно 300 млн. человек.
Обитают паразиты в двенадцатиперстной кишке и желчных протоках хозяина, где то плавают, работая жгутиками, то прикрепляются к эпителию с помощью клейкого диска, расположенного на нижней стороне клетки. На 1 см2 эпителия налипает до миллиона лямблий. Они повреждают ворсинки, что нарушает всасывание питательных веществ, вызывает воспаление слизистой оболочки и диарею.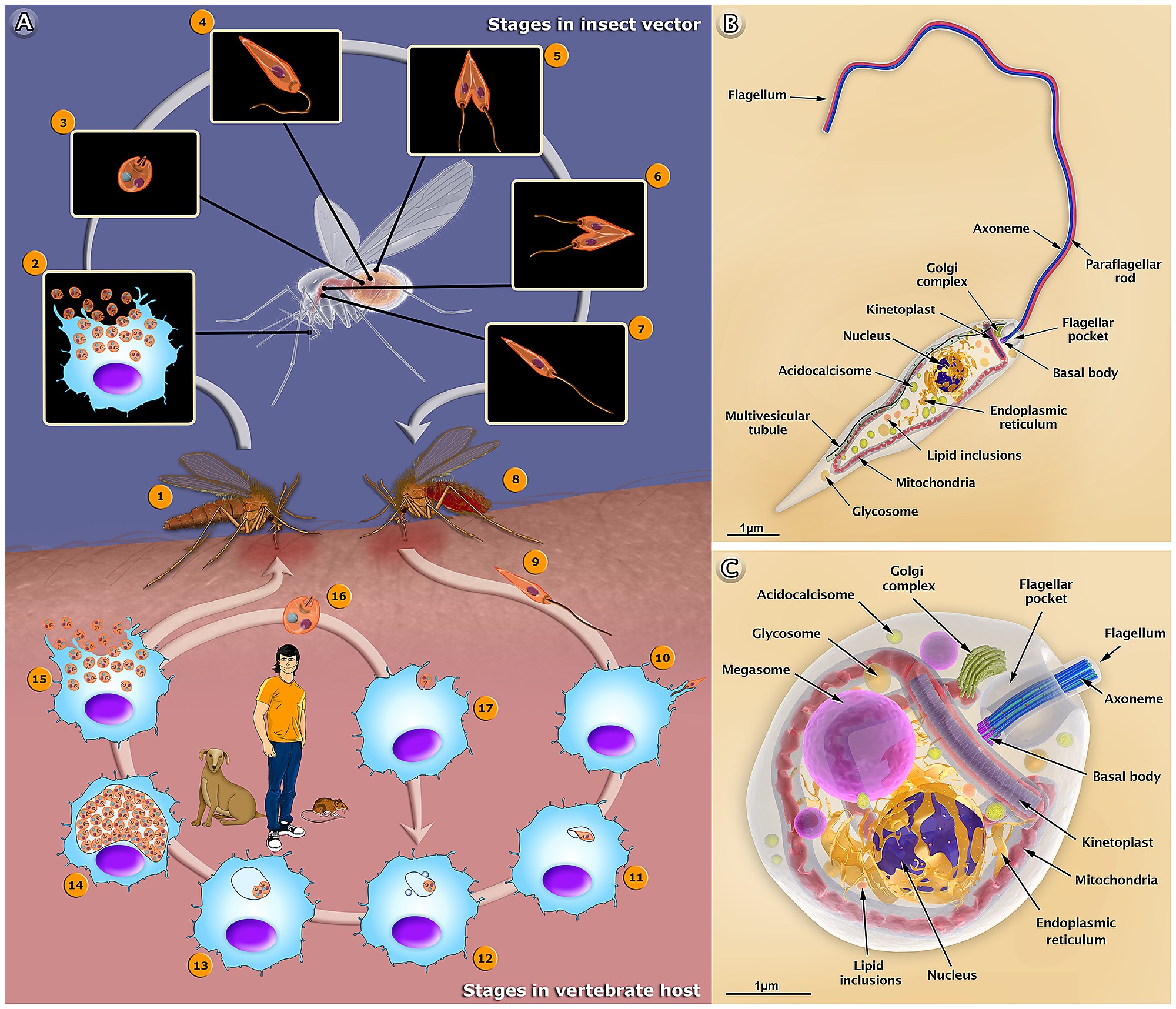 Если болезнь затрагивает желчные протоки, она сопровождается желтухой.
Если болезнь затрагивает желчные протоки, она сопровождается желтухой.
Лямблиоз — болезнь грязных рук, воды и продуктов. Жизненный цикл простейшего прост: в кишечнике — активная форма, а на выходе с фекальными массами — устойчивые цисты. Чтобы заразиться, достаточно проглотить десяток цист, которые в кишечнике опять перейдут в активную форму.
Главный секрет
повсеместности лямблий в изменчивости поверхностных белков. Организм человека борется с лямблиями антителами и, в принципе, способен выработать иммунитет. Но люди, живущие в одной и той же местности и пьющие одну и ту же воду, заражаются снова и снова потомками своих же паразитов. Почему? Потому что при переходе от активной фазы к цисте и обратно лямблия изменяет белки, к которым вырабатываются антитела, — вариант-специфичные поверхностные белки (variant-specific surface protein). В геноме есть около 190 вариантов этих белков, но на поверхности отдельного паразита всегда присутствует лишь один, трансляция остальных прерывается по механизму РНК-интерференции. А смена случается примерно раз на десять поколений.
А смена случается примерно раз на десять поколений.
Лечится метронидазолом. Болезнь проходит за неделю, но при инфицировании желчных протоков рецидивы возможны в течение многих лет. С цистами борются, иодируя воду.
Открыл Giardia lamblia в 1859 году чешский ученый Вилем Ламбль. С тех пор простейшее сменило несколько названий и нынешнее получило в честь первооткрывателя и французского паразитолога Альфреда Жиара, который лямблию не описывал.
А первую зарисовку лямблии сделал Антони ван Левенгук, обнаружив ее в собственном расстроенном стуле. Было это в 1681 году.
Кстати, лямблия еще и очень эволюционно древняя, происходит чуть ли не прямо от предка всех эукариот.
Самый интимный. Влагалищная трихомонада Trichomonas vaginalis.
Простейшее, которое передается половым путем. Обитает во влагалище, а у мужчин — в мочеиспускательном канале, эпидидимисе и предстательной железе, передается половым путем или через влажные мочалки. Младенцы могут заразиться, проходя через родовые пути. У T. vaginalis 4 жгутика на переднем конце и относительно короткая ундулирующая мембрана, при необходимости он выпускает ложноножки. Максимальные размеры трихомонады — 32 на 12 мкм.
Младенцы могут заразиться, проходя через родовые пути. У T. vaginalis 4 жгутика на переднем конце и относительно короткая ундулирующая мембрана, при необходимости он выпускает ложноножки. Максимальные размеры трихомонады — 32 на 12 мкм.
Трихомонада более распространена, чем возбудители хламидиоза, гонореи и сифилиса вместе взятые. Ей поражено около 10% женщин, а возможно и больше, и 1% мужчин. Последняя цифра недостоверна, потому что у мужчин сложнее обнаружить паразита.
T. vaginalis питается микроорганизмами, в том числе молочнокислыми бактериями вагинальной микрофлоры, которые поддерживают кислую среду, и таким образом создает оптимальный для себя рН выше 4.9.
Трихомонада разрушает клетки слизистой оболочки, вызывая воспаление. На симптомы жалуются около 15% инфицированных женщин.
Лечится метронидазолом, но беременным он противопоказан. В качестве профилактики рекомендуют регулярные спринцевания разбавленным уксусом.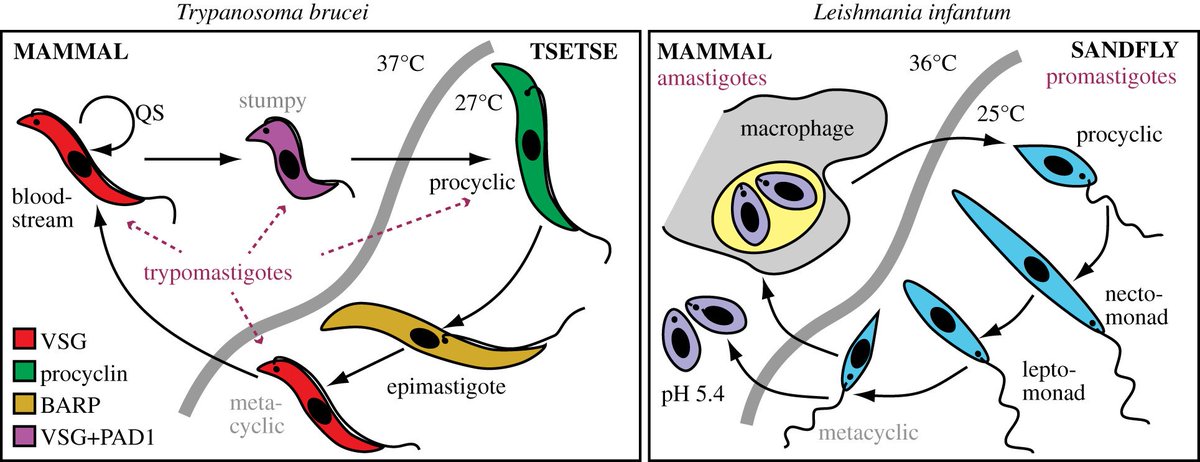
Описан в 1836 году французским бактериологом Альфредом Донне. Ученый не понял, что перед ним патогенный паразит, но определил размеры, внешность и тип движения простейшего.
Самый убийственный. Возбудитель сонной болезни Trypanosoma brucei
Возбудитель африканской сонной болезни — самое убийственное простейшее. Зараженный им человек без лечения умирает. Трипаносома — вытянутый жгутиконосец длиной 15—40 мкм. Известны два подвида, внешне неотличимые. Заболевание, вызванное T. brucei gambiense, длится 2—4 года. T. brucei rhodesiense — более вирулентный, возбудитель скоротечной формы, от которой умирают через несколько месяцев или недель.
Распространен в Африке, между 15-ми параллелями Южного и Северного полушарий, в естественном ареале переносчика — кровососущих насекомых рода Glossina (муха цеце). Из 31 вида мух для человека опасны 11. От сонной болезни страдает население 37 стран к югу от Сахары на 9 млн. км2. Ежегодно заболевает до 20 тыс. человек. Сейчас больных около 500 тыс., 60 млн. живут в зоне риска.
От сонной болезни страдает население 37 стран к югу от Сахары на 9 млн. км2. Ежегодно заболевает до 20 тыс. человек. Сейчас больных около 500 тыс., 60 млн. живут в зоне риска.
Из кишечника мухи T. brucei попадает в кровь человека, оттуда проникает в спинномозговую жидкость и поражает нервную систему. Болезнь начинается с лихорадки и воспаления лимфатических желез, затем следуют апатия, сонливость, мышечный паралич, истощение и необратимая кома.
Смертельность паразита связывают с его способностью преодолевать гематоэнцефалический барьер. Молекулярные механизмы до конца не изучены, но известно, что при проникновении в мозг паразит выделяет цистеиновые протеазы, а также использует некоторые белки хозяина. В центральной нервной системе, с другой стороны, трипаносома укрывается от иммунных факторов.
Первое описание сонной болезни в верховьях Нигера оставил арабский ученый ибн Хальдун (1332—1406). В начале XIX века европейцам был уже хорошо знаком начальный признак заболевания — вздутие лимфатических узлов на задней стороне шеи (симптом Уинтерботтома), и работорговцы обращали на него особое внимание.
Открыл T. brucei шотландский микробиолог Дэвид Брюс, в честь которого она и названа, а в 1903 году он впервые установил связь между трипаносомой, мухой цеце и сонной болезнью.
Лечение зависит от стадии заболевания, лекарства вызывают тяжелые побочные эффекты. Паразит обладает высокой антигенной изменчивостью, поэтому вакцину создать невозможно.
Самый экстравагантный. Лейшмания Leishmania donovani
Лейшмании заслужили звание самых экстравагантных паразитов, потому что живут и размножаются в макрофагах — клетках, призванных паразитов уничтожать. L. donovani — самая опасная из них. Она вызывает висцеральный лейшманиоз, в просторечье лихорадку думдум, или кала-азар, от которой без лечения умирают почти все заболевшие. Зато выжившие приобретают длительный иммунитет.
Существует три подвида паразита. L. donovani infantum (Средиземноморье и Средняя Азия) поражает в основном детей, его резервуаром часто служат собаки. L. donovani donovani (Индия и Бангладеш) опасен для взрослых и пожилых людей, природных резервуаров не имеет. Американский L. donovani chagasi (Центральная и Южная Америка) может жить в крови собак.
L. donovani donovani (Индия и Бангладеш) опасен для взрослых и пожилых людей, природных резервуаров не имеет. Американский L. donovani chagasi (Центральная и Южная Америка) может жить в крови собак.
L. donovani — жгутиконосец не более 6 мкм в длину. Люди заражаются после укуса москитов рода Phlebotomus, иногда при половом контакте, младенцы — проходя через родовые пути. Попав в кровь, L. donovani проникают внутрь макрофагов, которые разносят паразита по внутренним органам. Размножаясь в макрофагах, паразит их разрушает. Молекулярный механизм выживания в макрофагах довольно сложен.
Симптомы заболевания — лихорадка, увеличение печени и селезенки, анемия и лейкопения, которые способствуют вторичной бактериальной инфекции. Ежегодно висцеральным лейшманиозом заболевает 500 тыс. человек и около 40 тыс. умирает.
Лечение тяжелое — внутривенное введение препаратов сурьмы и переливание крови.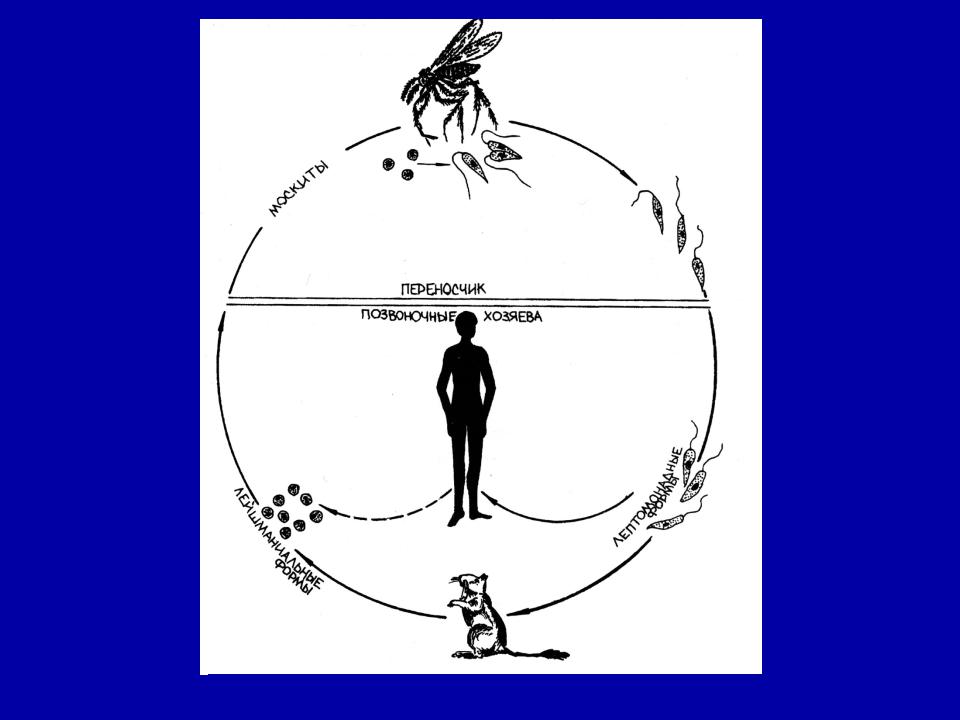
Таксономическую принадлежность L. donovani определил в 1903 году знаменитый исследователь малярии и нобелевский лауреат Рональд Росс. Родовым названием она обязана Уильяму Лейшману, а видовым — Чарльзу Доновану, которые в том же 1903 году независимо обнаружили клетки простейших в селезенке больных, умерших от кала-азара, один — в Лондоне, другой — в Мадрасе.
Самый сложный жизненный цикл. Babesia spp.
Бабезии, помимо многоступенчатого бесполого размножения в эритроцитах млекопитающего и полового в кишечнике клещей рода Ixodes, осложнили свое развитие трансовариальной передачей. Из кишечника самки клеща спорозоиты простейшего проникают в яичники и заражают эмбрионы. Когда личинки клещей вылупляются, бабезии переходят в их слюнные железы и с первым укусом входят в кровь позвоночного.
Распространены бабезии в Америке, Европе и Азии. Их природный резервуар — грызуны, собаки и крупный рогатый скот. Человека заражают несколько видов: B. microti, B. divergens, B. duncani и B. venatorum.
Человека заражают несколько видов: B. microti, B. divergens, B. duncani и B. venatorum.
Симптомы бабезиоза напоминают малярию — периодическая лихорадка, гемолитическая анемия, увеличенные селезенка и печень. Большинство людей выздоравливает спонтанно, для больных с ослабленной иммунной системой бабезиозы фатальны.
Методы лечения еще разрабатывают, пока что прописывают курс клиндамицина с хинином, а в тяжелых случаях — переливание крови.
Описал бабезию румынский микробиолог Виктор Бабеш (1888), обнаруживший ее у больных коров и овец. Он решил, что имеет дело с патогенной бактерией, которую назвал Haematococcus bovis. Бабезию долго считали патогеном животных, пока не обнаружили ее в 1957 году у югославского пастуха, умершего от заражения B. divergens.
Самый влиятельный. Возбудитель токсоплазмоза Toxoplasma gondii
T.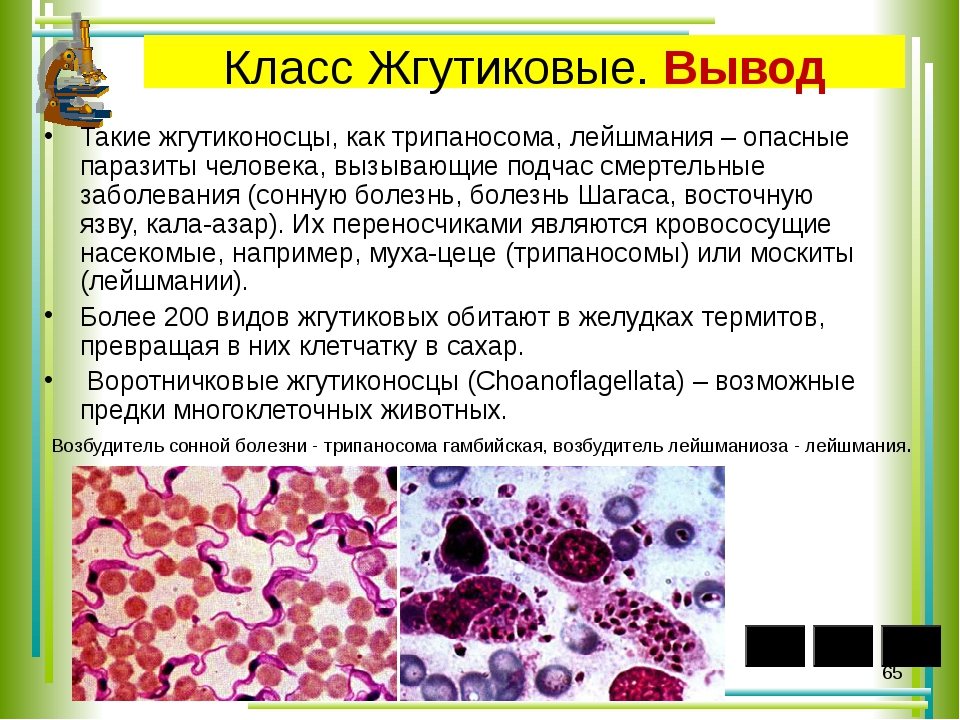 gondii — самый влиятельный паразит, поскольку управляет поведением промежуточных хозяев.
gondii — самый влиятельный паразит, поскольку управляет поведением промежуточных хозяев.
Распространен повсеместно, распределен неравномерно. Во Франции, например, заражено 84% жителей, в Соединенном Королевстве —22%.
Жизненный цикл токсоплазмы состоит из двух стадий: бесполая протекает в организме любых теплокровных, половое размножение возможно только в эпителиальных клетках кошачьего кишечника. Чтобы T. gondii могла завершить развитие, кошка должна съесть зараженного грызуна. Повышая вероятность этого события, T. gondii блокирует естественный страх грызунов перед запахом кошачьей мочи и делает его привлекательным, воздействуя на группу нейронов в миндалине. Как она это делает — неизвестно. Один из предполагаемых механизмов воздействия — локальный иммунный ответ на инфекцию. Он изменяет содержание цитокинов, что, в свою очередь, повышает уровень нейромодуляторов, таких как дофамин. Влияет токсоплазма и на поведение людей, что проявляется даже на популяционном уровне. Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Так, в странах с высоким уровнем токсоплазмоза чаще встречается невротизм и желание избегать неопределенных, новых ситуаций. Возможно, инфицированность T. gondii может привести к культурным изменениям.
Инфекция у человека чаще протекает бессимптомно, но при ослабленном иммунитете разрушает клетки печени, легких, мозга, сетчатки, вызывая острый или хронический токсоплазмоз. Течение инфекции зависит от вирулентности штамма, состояния иммунной системы хозяина и его возраста — пожилые люди менее восприимчивы к T. gondii.
Лечат токсоплазмоз пириметамином и сульфадиазином.
Описан в 1908 году у пустынных грызунов. Эта честь принадлежит сотрудникам Института Пастера в Тунисе Шарлю Николю и Луису Мансо.
Самый патогенный. Малярийный плазмодий Plasmodium spр.
Малярийный плазмодий — самый патогенный паразит человека. Число больных малярией может достигать 300–500 млн. , а смертность во время эпидемий — 2 млн. Болезнь до сих пор уносит в три раза больше жизней, чем вооруженные конфликты.
, а смертность во время эпидемий — 2 млн. Болезнь до сих пор уносит в три раза больше жизней, чем вооруженные конфликты.
Малярию у человека вызывают пять видов плазмодия: Plasmodium vivax, P. falciparum, P. malariae, P. ovale и P. knowlesi, который поражает также макак.
Распространен в ареале переносчиков — комаров Anopheles, которым нужна температура 16–34°С и относительная влажность более 60%.
Сравнение генома самого вирулентного из плазмодиев, P. falciparum, с плазмодиями горилл, позволяет предполагать, что его предком люди заразились именно от этих обезьян. Возникновение этой формы плазмодия связывают с появлением сельского хозяйства в Африке, повлекшего за собой увеличение плотности населения и развитие оросительных систем.
Половое размножение плазмодиев происходит в кишечнике комаров, а в организме человека это внутриклеточный паразит, который живет и размножается в гепатоцитах и эритроцитах до тех пор, пока клетки не лопаются.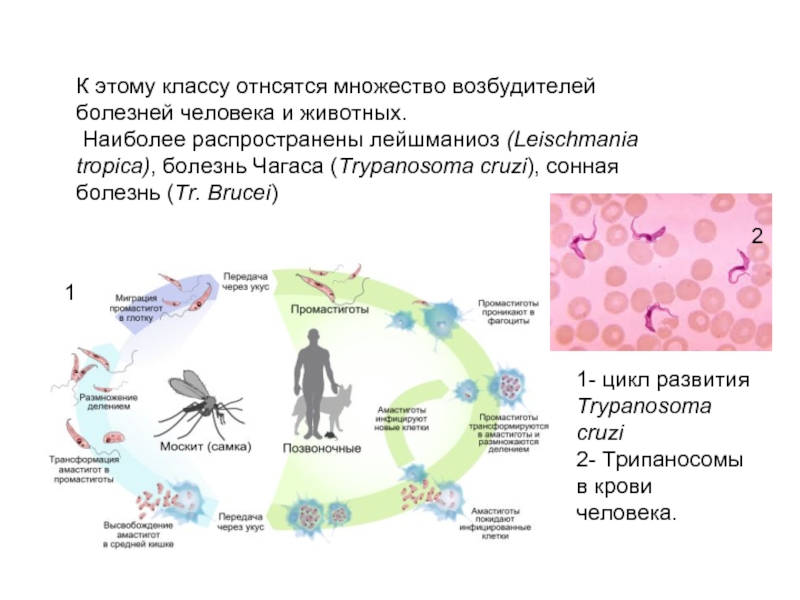 В 1 мл крови больного содержится 1 — 50 тыс. паразитов.
В 1 мл крови больного содержится 1 — 50 тыс. паразитов.
Болезнь проявляется как воспаление, периодическая лихорадка и анемия, в случае беременности опасна для матери и плода. Эритроциты, зараженные P. falciparum, закупоривают капилляры, и в тяжелых случаях развивается ишемия внутренних органов и тканей.
Лечение требует комбинации нескольких препаратов и зависит от конкретного возбудителя. Плазмодии приобретают устойчивость к лекарствам.
ПРОЦЕСС ИНФЕКЦИИ Leishmania ПЕРСПЕКТИВЫ ПАЛЕОПАРАЗИТОЛОГИИ
Реферат
Виды рода Leishmania (Kinetoplastida, Trypanosomatidae)
являются возбудителями лейшманиоза, сложного заболевания с различными клиническими проявлениями.
спектр и эпидемиологическое разнообразие, что в некоторых странах является серьезным
проблема общественного здравоохранения. Происхождение и эволюция лейшманиоза изучены
обсуждение некоторых клинических и паразитологических аспектов.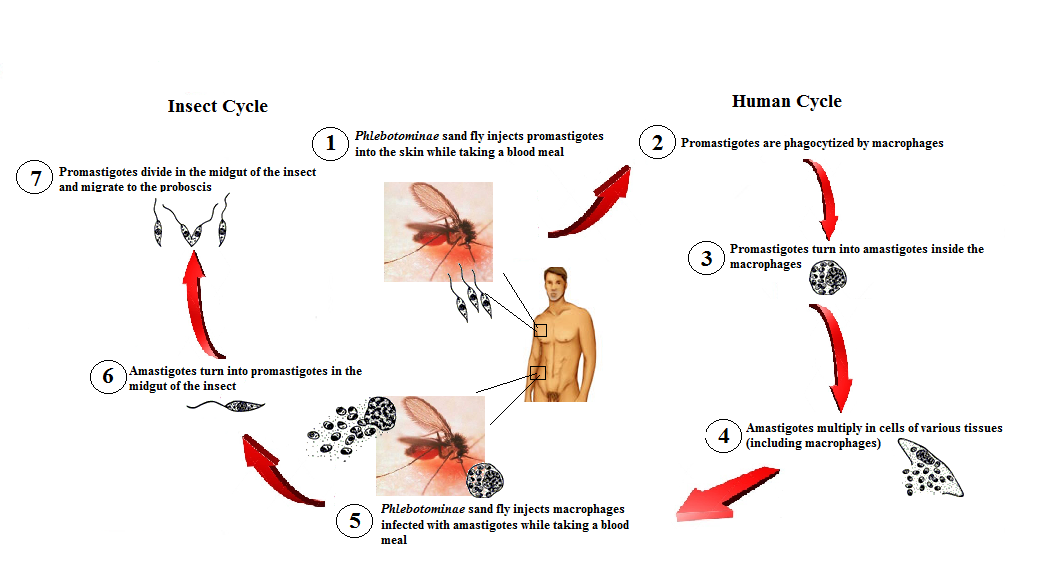 После
внедрение палеопаразитологии, молекулярных методов и методов иммунодиагностики
были применены, позволяющие восстанавливать останки паразитов, а также ставить диагноз
прошлых инфекций у людей и других хозяев.Датировка археологических образцов
позволил паразитологический анализ во времени и пространстве. В этой рукописи представлены
современное состояние лейшманиоза и перспективы палеопаразитологии
исследования и их вклад в эволюционное и филогенетическое прояснение
паразиты, принадлежащие к роду Leishmania , и лейшманиоз
вызванные ими.
После
внедрение палеопаразитологии, молекулярных методов и методов иммунодиагностики
были применены, позволяющие восстанавливать останки паразитов, а также ставить диагноз
прошлых инфекций у людей и других хозяев.Датировка археологических образцов
позволил паразитологический анализ во времени и пространстве. В этой рукописи представлены
современное состояние лейшманиоза и перспективы палеопаразитологии
исследования и их вклад в эволюционное и филогенетическое прояснение
паразиты, принадлежащие к роду Leishmania , и лейшманиоз
вызванные ими.
Ключевые слова: Leishmania, Палеопаразитология, Древняя ДНК, Происхождение и эволюция болезней, Инфекция и болезнь при лейшманиозе
ВВЕДЕНИЕ
Лейшманиоз в настоящее время
Паразиты рода Leishmania являются обязательными внутриклеточными
простейшие, принадлежащие к отряду Kinetoplastida, семейству Trypanosomatidae и являются
возбудители лейшманиоза.Главной особенностью этого ордена является наличие
одиночные разветвленные митохондрии, содержащие расширенную область, называемую кинетопластом. В
кинетопласт, расположенный около базального тела жгутика, имеет генетический материал,
кДНК. Это внеядерная кольцевая ДНК, расположенная в макси и мини-кругах, широко
используется в молекулярном анализе1. Этот паразит
передается через укусы инфицированных самок москитов (Diptera: Psychodidae,
Phlebotominae), рода Phlebotomus (Loew, 1845) в Старом
В мире и Lutzomyia (Франция, 1924 г.) в Северной и Южной Америке2.
В
кинетопласт, расположенный около базального тела жгутика, имеет генетический материал,
кДНК. Это внеядерная кольцевая ДНК, расположенная в макси и мини-кругах, широко
используется в молекулярном анализе1. Этот паразит
передается через укусы инфицированных самок москитов (Diptera: Psychodidae,
Phlebotominae), рода Phlebotomus (Loew, 1845) в Старом
В мире и Lutzomyia (Франция, 1924 г.) в Северной и Южной Америке2.
Заболевание проявляется у хозяина в одной из четырех форм: кожное заболевание с
кожные поражения, язвенные или нет, но ограниченные; кожно-слизистые заболевания, которые могут развиться
к деструктивным поражениям слизистой; кожная диффузная форма заболевания, то есть
распространяется на кожу и возникает у анергических людей или поздно у пациентов с
лечились от висцерального лейшманиоза или кала-азара, формы болезни, при которой
паразит имеет тропизм к клеткам мононуклеарной фагоцитарной системы селезенки,
печень, костный мозг и лимфоидные ткани 3.
Существует несколько видов Leishmania , и по крайней мере 13 видов. связаны с болезнями человека4 , 5. Согласно таксономической классификации из видов, предложенных Lainson & Shaw (1987) 6, которые в настоящее время наиболее часто используются, Leishmania виды делятся на два подрода: Leishmania и Вианния .
Данные Всемирной организации здравоохранения (2014 г.) 7, считают, что лейшманиоз присутствует в 98 странах и трех
территории на пяти континентах.Ежегодно возникает около 1,3 миллиона новых случаев, из которых
300 000 случаев связаны с висцеральным лейшманиозом, 90% из которых приходится на Бангладеш,
Бразилия, Эфиопия, Индия, Непал и Судан; и около 1 000 000 случаев кожного
лейшманиоз в основном встречается в Афганистане, Алжире, Бразилии, Колумбии, исламских странах.
Республика Иран, Пакистан, Перу, Саудовская Аравия, Сирийская Арабская Республика и Тунис; а также
кожно-слизистый лейшманиоз в основном встречается в Бразилии, Перу и Многонациональном Государстве. Боливии. К сожалению, из 1.3 миллиона предполагаемых случаев, только около 600 000 из них
официально сообщается7.
Боливии. К сожалению, из 1.3 миллиона предполагаемых случаев, только около 600 000 из них
официально сообщается7.
Есть виды, присутствие которых описано только у рептилий, поэтому они классифицирован в отдельный род под названием Sauroleishmania 8 , 9. Sauroleishmania — это считается предком подрода рода Leishmania 8. Однако молекулярный анализ выявил близкие отношения между этими видами и видами, которые заражают млекопитающих10 , 11 , 12.Этот подрод содержит виды значительное значение — Leishmania tarentolae .
Первоначально выделен в Tarentolae mauritanica 13, мавританский геккон, л.
tarentolae также был обнаружен в Северной Африке, Франции, Мальте и на Мальте.
Италия8 , 14 , 15 , 16 , 17. Pozio et al. (1983) 16 также обнаружено L. tarentolae в Cryptodactylus kotsehyi Steindacher (1870), у маленькой ящерицы
сожительствует с т. mauritanica . Мохамед Эльвасила18 в 1988 году впервые описал это Leishmania видов у древних ящериц этого вида Tarenrolae annularis извлечено Жоффруа в 1809 году в г.
Хартум, Судан.
mauritanica . Мохамед Эльвасила18 в 1988 году впервые описал это Leishmania видов у древних ящериц этого вида Tarenrolae annularis извлечено Жоффруа в 1809 году в г.
Хартум, Судан.
В Старом Свете после передачи рептилии-хозяину путем заражения переносчиками
принадлежащий к роду Sergentomyia (France & Parrot, 1920),
паразит, кажется, получил доступ к циркуляции хозяина через поверхности
слизистая оболочка кишечника, возможно, оставшаяся в кровотоке рептилий при всей ее
жизнь во внеклеточной форме промастигот 12.Эльвасила (1988) 18, в поисках естественного
инфекций рептилий в Судане, проанализировали в общей сложности 16 рептилий, обнаружив
наличие L. tarentolae в форме амастиготы и трех из них
принадлежал к виду T. annularis . Однако эта форма Leishmania паразитемия была значительно низкой, и только от 3 до 9
внутриклеточные амастиготы можно найти в нескольких лейкоцитах. Хотя и не патогенный
для человека, видов L. tarentolae обладают всеми обнаруженными генами вирулентности
у других видов, патогенных для человека, за исключением A2
ген, ответственный за висцерализацию у видов Leishmania
donovani комплекс, а также играет важную роль в трансформации
из промастигот в формы амастигот 19.Эти формы также можно найти у инфицированных рептилий, у которых передача происходит пассивно.
кожный20 , 21. Тем не менее, Azizi et al.
al. (2009) 19 продемонстрировал, что
этот ген не играет той же роли в непатогенном L.
tarentolae . Таким образом, необходимы дополнительные исследования, чтобы прояснить этот вопрос. это
Следует отметить, что эти генетические характеристики делают L. tarentolae виды — важная модель для работы над разработкой вакцин 22.
tarentolae обладают всеми обнаруженными генами вирулентности
у других видов, патогенных для человека, за исключением A2
ген, ответственный за висцерализацию у видов Leishmania
donovani комплекс, а также играет важную роль в трансформации
из промастигот в формы амастигот 19.Эти формы также можно найти у инфицированных рептилий, у которых передача происходит пассивно.
кожный20 , 21. Тем не менее, Azizi et al.
al. (2009) 19 продемонстрировал, что
этот ген не играет той же роли в непатогенном L.
tarentolae . Таким образом, необходимы дополнительные исследования, чтобы прояснить этот вопрос. это
Следует отметить, что эти генетические характеристики делают L. tarentolae виды — важная модель для работы над разработкой вакцин 22.
Ранее экспериментальные исследования проводились на млекопитающих, в том числе на человеке.
волонтер, которому была сделана прививка промастиготными формами, чтобы наблюдать за развитием
паразита и возможное появление патогенности у этого добровольца. В
результаты показали, что цикл L. tarentolae не развился у человека.
волонтерство, как это происходит с другими видами Leishmania , так как там
не было форм амастигот и патогенеза23.
В
результаты показали, что цикл L. tarentolae не развился у человека.
волонтерство, как это происходит с другими видами Leishmania , так как там
не было форм амастигот и патогенеза23.
Лейшманиоз в Америке
История лейшманиоза изучается в течение долгого времени, что требует дальнейшего изучения. разъяснения относительно происхождения и поведения паразитов, ответственных за эта инфекция, а также отношения паразит-хозяин с течением времени.
Rabello (1925) 24 предположил существование
кожных форм лейшманиоза в Америке в течение многих лет, и это было
впоследствии считалось местной болезнью в Америке, задолго до прибытия
европейцев. Археологические исследования развивались в так называемых «перуанских huacos».
проанализировали антропоморфную керамику, созданную людьми Анд, которые воспроизводили здоровые
человеческие фигуры и изуродованные болезнями, которые могут соответствовать возникновению
«ута» и «эспундия», местные названия кожных и слизистых форм кожных
лейшманиоз, соответственно, у инков в доколумбовский период25.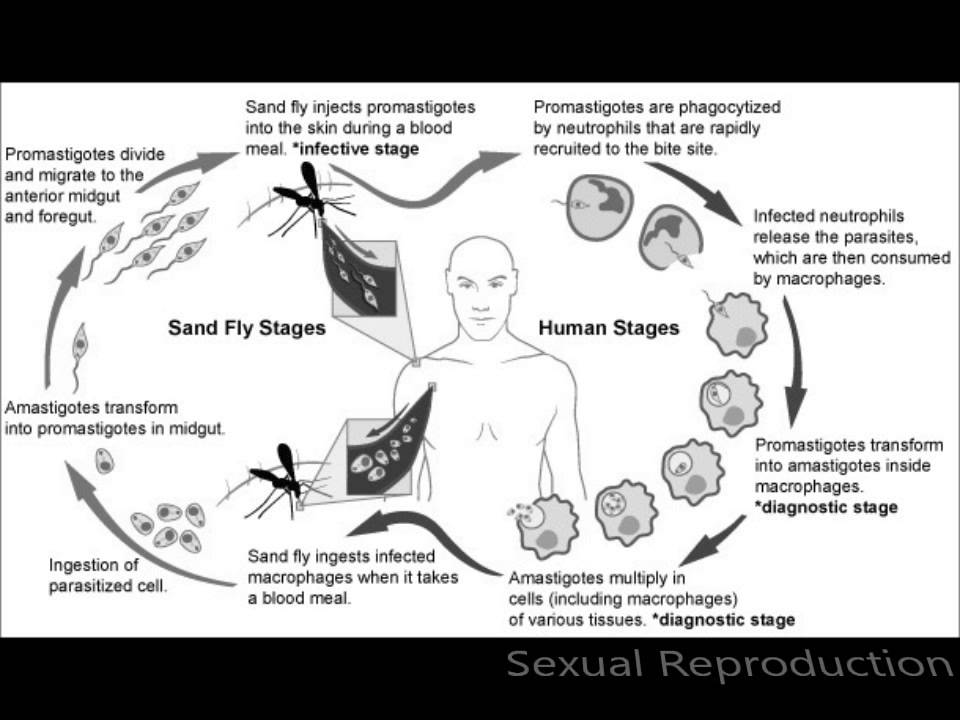 Однако самый верный признак и, вероятно,
самая старая болезнь, существовавшая в регионах, близких к Бразилии, была обнаружена в
Исследование Телло (1908 г.) «Antiguedad de la syphilis en el Peru», в котором описывается
путешествие миссионера Фрея Дом Иполито Санчеса Ранжела Файяс-и-Кироса, который совершил поездку в
1827 год в районе Амазонки, пересекает реку Солимоэс-Амазонас .
Согласно этим записям, миссия имела возможность наблюдать за существованием
людей с язвами на ногах и руках, связанными с укусами насекомых, что приводит к
деструктивные поражения рта и носа.По этому поводу Фрей Иполито подтвердил:
«[…] лос комаров и демас насекомых, сын си но се тиене куидадо, эм poderoso foment
de llagas profundas y fétidas em piernas y brazos, hedor de boca, gallico […] «.
Однако самый верный признак и, вероятно,
самая старая болезнь, существовавшая в регионах, близких к Бразилии, была обнаружена в
Исследование Телло (1908 г.) «Antiguedad de la syphilis en el Peru», в котором описывается
путешествие миссионера Фрея Дом Иполито Санчеса Ранжела Файяс-и-Кироса, который совершил поездку в
1827 год в районе Амазонки, пересекает реку Солимоэс-Амазонас .
Согласно этим записям, миссия имела возможность наблюдать за существованием
людей с язвами на ногах и руках, связанными с укусами насекомых, что приводит к
деструктивные поражения рта и носа.По этому поводу Фрей Иполито подтвердил:
«[…] лос комаров и демас насекомых, сын си но се тиене куидадо, эм poderoso foment
de llagas profundas y fétidas em piernas y brazos, hedor de boca, gallico […] «.
Однако первые сообщения о болезни в Южной Америке были опубликованы
Испанский Бальтазар Рамирес в своей книге «Descripcion del Reyno del Peru» (1580 г.), где
болезнь получила название «Mal de los Andes». В тот же период Фрай Родриго де Лоайса
(1586) отметили наличие поражений носа не только у индейцев, но и у людей.
вход в регион Анд 28.Некоторое время спустя,
В 1884 году в Италии дерматолог Ахилле Бреда описал болезнь в 18
Итальянцы из штата Сан-Паулу . Тем не менее, не удалось
определить природу паразита. Бреда был первым, кто назвал болезнь
«Bouba Brasiliana», а позже, в 1910 году, дерматолог Эдуард Жансельм считал
что Бреда был первым, кто описал клинические аспекты кожного
подробнее о лейшманиозе. По этой причине о заболевании узнали многие.
исследователей как «болезнь Бреда» 27.
В тот же период Фрай Родриго де Лоайса
(1586) отметили наличие поражений носа не только у индейцев, но и у людей.
вход в регион Анд 28.Некоторое время спустя,
В 1884 году в Италии дерматолог Ахилле Бреда описал болезнь в 18
Итальянцы из штата Сан-Паулу . Тем не менее, не удалось
определить природу паразита. Бреда был первым, кто назвал болезнь
«Bouba Brasiliana», а позже, в 1910 году, дерматолог Эдуард Жансельм считал
что Бреда был первым, кто описал клинические аспекты кожного
подробнее о лейшманиозе. По этой причине о заболевании узнали многие.
исследователей как «болезнь Бреда» 27.
Баийский врач Хулиано Морейра в 1894 году представил на собрании
Общество медицины и хирургии Баия , исследование озаглавлено:
«Existe na Bahia o Botão de Birska?». В этом исследовании Морейра тщательно описала
встретились клинические формы, и он назвал его Bahia Button. Этот
Впервые существование пуговицы Birska было продемонстрировано в Бразилии. В
Кроме того, он сообщил о возможности насекомого-переносчика болезни.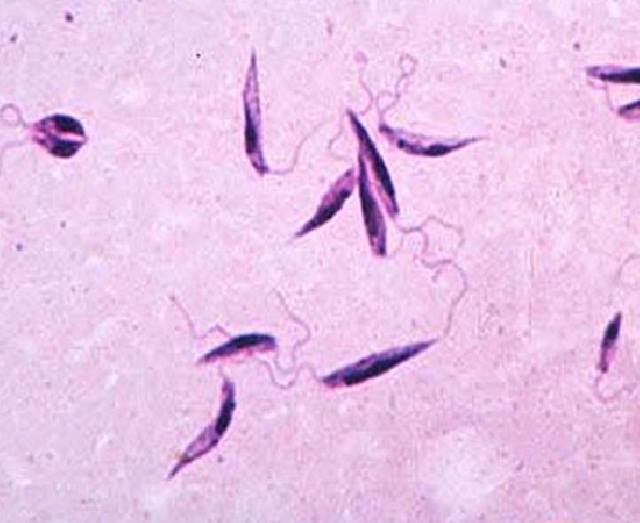 По его словам: «À picada de um insto, o muruim, tem sido muitas vezes attribuido por alguns doentes o início da ffecção «28.
По его словам: «À picada de um insto, o muruim, tem sido muitas vezes attribuido por alguns doentes o início da ffecção «28.
Во время строительства железной дороги на северо-запад Бразилии в 1908 г. пациенты прибыли из районов вырубки леса, особенно из Бауру город в São Paulo State, так что болезнь стала известна как Бауру Язва.
Обнаружение возбудителя кожного лейшманиоза в поражениях слизистой оболочки компанией Splendore (1911) 29 и подтверждение болезнь в нескольких частях страны, как в Вале-ду-Риу-Досе , Minas Gerais , Amazonas и Южный Баия , среди прочего, представлял наиболее успешный период с уважение к исследованиям болезней в Бразилии.
Несмотря на то, что у него была короткая жизнь, Гаспар Вианна был одним из самых известных
личности, участвующие в исследованиях, связанных с лейшманиозом 30. В 1911 году он открыл новый вид рода Leishmania , Leishmania braziliensis , теперь называется л .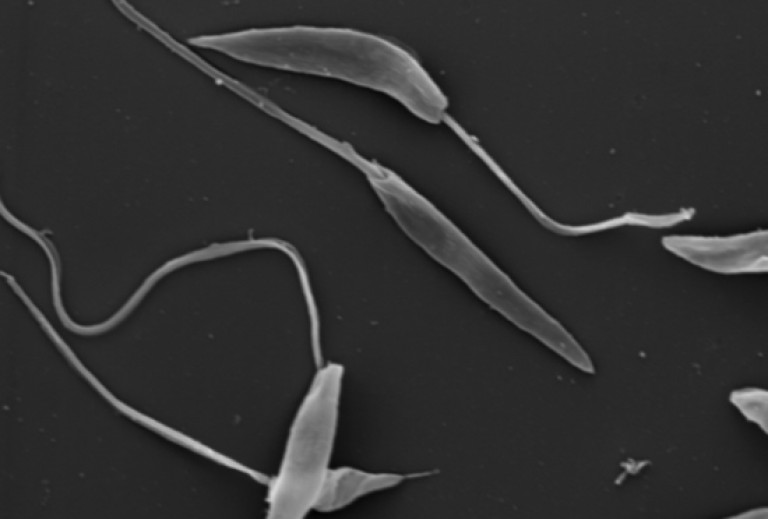 ( Viannia ) braziliensis 31. В следующем году Вианна разработала
лечение кожного лейшманиоза с помощью внутривенных инъекций зубного камня
рвотное 32. Это лечение все еще используется
Настоящее время.
( Viannia ) braziliensis 31. В следующем году Вианна разработала
лечение кожного лейшманиоза с помощью внутривенных инъекций зубного камня
рвотное 32. Это лечение все еще используется
Настоящее время.
Aragão33, в 1922 году продемонстрировал первый время роль передачи кожного лейшманиоза через укусы москитов в Рио-де-Жанейро город, при анализе высокой плотности москита Lutzomyia intermedia , при наличии инфекции у Águas Férreas город, в Laranjeiras район. Подтверждение L. intermedia как потенциального вектор L . ( V .) braziliensis возникла после появления язвы в носу собаки, содержащей амастиготы после инокуляции солевой суспензии, содержащей л.промежуточный ранее кормили пациентов с поражениями кожного лейшманиоза.
В 1939-1940 годах врач общественного здравоохранения Сэмюэл Барнсли Пессоа описал
кожный лейшманиоз как «профессиональное заболевание опушки леса» и в 1941 г.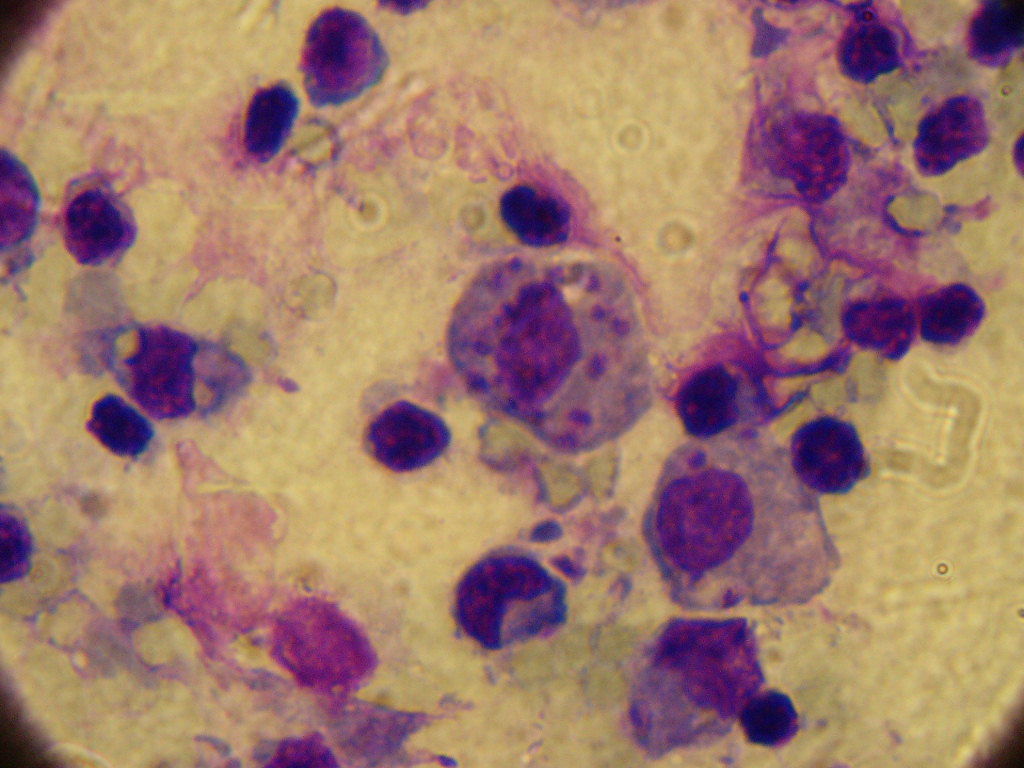 было оценено более чем в 30 000 человек количество больных только в сельской местности, и
эти районы считались высокоэндемичными34.
было оценено более чем в 30 000 человек количество больных только в сельской местности, и
эти районы считались высокоэндемичными34.
Десятилетия с 1950 по 1980 год характеризовались участием Освальдо Фораттини в исследованиях, связанных с кожным лейшманиозом.В этом исследовании Фораттини смог прояснить вопросы передачи, существования естественных Leishmania spp. водохранилищ, описывают семейство Phlebotominae таксономия, а также аспекты экологии и поведения видов-переносчиков это простейшее. За этот период произошло несколько вспышек инфекции в некоторых Штаты Бразилии: Сан-Паулу, Мату-Гросу-ду-Сул, Парана, Рондония и Amapá , открывающие новые возможности Leishmania резервуаров для животных.Результаты их исследования прояснил эпидемиологическую передачу кожного лейшманиоза, а также циклы, которые могут иметь паразитов в природе 35.
До начала 1960-х годов только для видов L . ( В .)
Было установлено, что braziliensis вызывает кожный лейшманиоз. Тем не менее в 1961 году Пессоа36 предложил
подразделение L. braziliensis на сорта L.
braziliensis , Leishmania guyanensis , Leishmania
peruviana , Leishmania mexicana и Leishmania
pifanoi , согласно различиям в клинических формах
болезнь в разных географических регионах.
Тем не менее в 1961 году Пессоа36 предложил
подразделение L. braziliensis на сорта L.
braziliensis , Leishmania guyanensis , Leishmania
peruviana , Leishmania mexicana и Leishmania
pifanoi , согласно различиям в клинических формах
болезнь в разных географических регионах.
С тех пор классификация паразита основывалась на других критериях, таких как как их поведение в культуре, у экспериментальных животных и их переносчиков, что приводит к различие между mexican и braziliensis комплекс 37. Со временем достижения электронной микроскопии, молекулярной биологии, биохимии и иммунология открыли новые перспективы в систематике этих паразитов, и применили новые методы для их характеристики38.
В отличие от кожного лейшманиоза, висцеральный лейшманиоз, известный как Кала-азар (черный
лихорадка) у жителей Ассана, Индия, имеет симптомы, похожие на
других тропических болезней 1. Лихорадка — одна из
основные симптомы, но отсутствуют видимые поражения, препятствующие обнаружению древних
описания в медицинских записях.
Исторические данные очень важны для помощи лабораторным тестам в обнаружении Leishmania ДНК в археологических останках. Исторические документы необходимы, поскольку во многих случаях они могут помочь раскрыть пространство-время лейшманиоз.Фурусава и Борхес (2014) 39, например, на основе анализа посмертных описей рабов, найденных в Документация Исторического центра продемонстрировала возможное существование кожных лейшманиоз в городе Вассурас , Рио-де-Жанейро Штат, Бразилия, в начале девятнадцатого века, до периода, который считался прибытие болезни в Юго-Восточную Бразилию.
Гипотезы происхождения рода
Leishmania и подродов Leishmania и Viannia Несколько возможных источников происхождения рода Leishmania и подродов
Предлагаются Leishmania и Viannia .Некоторые
Авторы предполагают, что род Leishmania возник в
Неотропы (биогеографический регион, включающий Центральную Америку, с юга
часть Мексики и полуостров ниже Калифорнии, южная Флорида и все
Карибские острова, в Южную Америку, в то время как другие предлагали Палеарктику,
зоогеографический регион, включающий Европу, Северную Африку, большую часть Аравии и
Азии к северу от Гималаев или Неарктики (географический регион, включая
Северная Америка) 40 , 41 , 42. За счет использования молекулярной биологии
методы Noyes и др. . (2000) 43 получили важные результаты, подтверждающие гипотезу происхождения
Неотропы. Однако исследования Kerr et al . (2000) 40, на основе интерпретации молекулярных данных
поддерживается биохимическими, молекулярными, биогеографическими, экологическими и энтомологическими
Факторы доказали, что Leishmania возникло в Палеарктике.
Эта гипотеза предполагает, что род Leishmania вошел в
Неарктика через Берингов пролив в олигоцене, быстро рассеялась во время
Плиоцен до неотропов.Учитывая генетический полиморфизм и
клональность рода Leishmania , паразиты, принадлежащие к этому роду
возможно, добрались до того места, где сегодня расположены Америка, еще до того, как
разделение Гондваны около ста миллионов лет назад40.
За счет использования молекулярной биологии
методы Noyes и др. . (2000) 43 получили важные результаты, подтверждающие гипотезу происхождения
Неотропы. Однако исследования Kerr et al . (2000) 40, на основе интерпретации молекулярных данных
поддерживается биохимическими, молекулярными, биогеографическими, экологическими и энтомологическими
Факторы доказали, что Leishmania возникло в Палеарктике.
Эта гипотеза предполагает, что род Leishmania вошел в
Неарктика через Берингов пролив в олигоцене, быстро рассеялась во время
Плиоцен до неотропов.Учитывая генетический полиморфизм и
клональность рода Leishmania , паразиты, принадлежащие к этому роду
возможно, добрались до того места, где сегодня расположены Америка, еще до того, как
разделение Гондваны около ста миллионов лет назад40.
Однако, независимо от происхождения, распространение этого паразита происходило вместе.
с миграцией их векторов и хозяев25. Описание нового рода и вида, Paleoleishmania. proterus , обнаружен в остатках крови на хоботке и пищеварительном тракте
москита мелового периода, найденного в янтаре, показывает, что
отношения паразит-переносчик существовали с древних времен, предполагая, что
Окончательным хозяином этого паразита были рептилии или примитивные млекопитающие44.
proterus , обнаружен в остатках крови на хоботке и пищеварительном тракте
москита мелового периода, найденного в янтаре, показывает, что
отношения паразит-переносчик существовали с древних времен, предполагая, что
Окончательным хозяином этого паразита были рептилии или примитивные млекопитающие44.
Первоначально предполагалось, что появился подрод Leishmania . в палеоцене, вскоре после исчезновения динозавров и появления первые плацентарные млекопитающие 45. В настоящее время это предположил, что был общий предок Leishmania , который возникли две различные клады: род Sauroleishmania , который инфицированных рептилий и Leishmania , которые в настоящее время заражают млекопитающие 45.
С учетом подродов L .( Leishmania ) и л . ( Viannia ) и возможное происхождение в
Палеарктика, современное распространение видов и их молекулярные деревья,
подрод L . ( Leishmania ) был бы первым
всплыть. Но есть разногласия относительно происхождения подрода. л . ( Viannia ) 9. Исследования доказывают, что этот подрод встречается только в Неотропах, в то время как
подрод Leishmania встречается как в Новом Свете (Neotropical
регионов и Южной Неарктики), как и в Старом Свете (Палеарктические регионы, Африка и
Восточная) 46.
Но есть разногласия относительно происхождения подрода. л . ( Viannia ) 9. Исследования доказывают, что этот подрод встречается только в Неотропах, в то время как
подрод Leishmania встречается как в Новом Свете (Neotropical
регионов и Южной Неарктики), как и в Старом Свете (Палеарктические регионы, Африка и
Восточная) 46.
Однако в настоящее время наиболее распространенной теорией является то, что подрод L . ( Viannia ) возникла после разделения Гондваны и подрод L . ( Leishmania ) берет свое начало в Палеарктика, выходящая в Америку через Берингов пролив40.
Предположения о происхождении
видов Leishmania и заражение Leishmania spp. Обсуждения не ограничиваются возможным происхождением рода и подродов.Некоторые
авторы предполагают, например, что в Старом Свете виды, ответственные за висцеральные
лейшманиоз были выделены в L. donovani и Leishmania infantum около 1 миллиона лет назад40. Эту теорию также предложил Маурисио. и др. . (2007) 47 на основе
анализы молекулярных деревьев этих видов. L. donovani вид, таким образом, по всей видимости, произошел из Восточной Африки, того же региона
человеческое происхождение.
Эту теорию также предложил Маурисио. и др. . (2007) 47 на основе
анализы молекулярных деревьев этих видов. L. donovani вид, таким образом, по всей видимости, произошел из Восточной Африки, того же региона
человеческое происхождение.
Для Leishmania ( Leishmania ) major , другой вид, вызывающий кожный лейшманиоз в нескольких регионах мира, предполагается, что его происхождение было в Северной Африке, где регион Сахары был влажный климат и был покрыт лесом47.
До сих пор неясно, привели ли люди инфекцию на Ближний Восток или это было приобрел у других хозяев. Однако москиты-переносчики существовали задолго до прибытие людей и других животных, которые сегодня служат хозяевами в Европе и Азии. Это также было высказано предположение, что инфекция возникла в Центральной Азии в зоонозных водохранилищ, распространяющихся в Индию, Средиземное море и Западную Африку вокруг четырнадцатый век 48.
Тем не менее, динамика населения Южной Америки между Амазонкой и
Межандские регионы были важны для выяснения распространения инфекции, и если это
теория подтверждена, мы сможем сказать, что Анды будут колыбелью
кожный лейшманиоз в Новом Свете 49.
До сих пор исследования не подтвердили существование висцерального лейшманиоза.
до прихода европейцев в Южную Америку50. Исследования SHAW (2006) 51
предполагаем, что Leishmania ( Leishmania ) chagasi родом из Европы и очень похож на
вид L . ( L .) infantum .
Таксономически L . ( L .) младенец (синоним L . ( L .) чагаса ) принадлежит
к комплексу видов L . ( л .) доновани . По словам Абрамсона и др. .
(1995) 52, формирование перешейка
между Северной Америкой и Южной Америкой могло произойти до распространения Leishmania в регионе Амазонки и на северо-востоке Бразилии,
высокоэндемичный ареал л . ( л .) чагасы . Таким образом, возникла идея, что вид L .
( л .) чагаса привезли европейцы.
в пятнадцатом веке53 , 54 усиленный. Другая гипотеза заключается в том, что
этот паразит существовал среди коренных жителей Америки51 , 55 , 56 , 57 , 58 , 59.
Прямые доказательства фрагментов ДНК
Leishmania spp. в археологические находки, полученные различными методамиПалеопаразитология предоставляет новые инструменты для изучения паразитарных заболеваний в который нельзя отделить от комплекса хозяин-паразит-окружающая среда, поскольку он предлагает единственная возможность работы с древними паразитами60, обнаруженными в останках людей и других животных, извлеченных из археологические памятники, палеонтологические или любые другие источники, которые их поддерживали сохранился61.Таким образом, инфекции были поставлен диагноз: Leishmania spp. в древних популяциях применение разных техник.
Пойнар и Пойнар в 2004 году описали новый род и вид трипаносоматид.
( Paleoleishmania proterus ) найден в остатках крови на
хоботок и в желудочно-кишечном тракте москитов, найденных в янтаре из
Меловой период по данным световой микроскопии. Таким образом, они продемонстрировали, что
Взаимоотношения паразит-переносчик существовали с древних времен, что позволяет предположить, что
Окончательным хозяином этого паразита были рептилии или примитивные млекопитающие44.
В некоторых высокогорных районах, например, в пустыне Атакама, Чили, где болезнь обычно не обнаруживаются, присутствие этих паразитов предполагает характер мобильности в эндемичные районы62 , 63, датируемые 1000 годом до нашей эры. Это было обсуждается в исследованиях Коста и др. . (2009) 62, которые идентифицировали уродующие кости лицевые травмы с характеристики лейшманиоза у четырех женщин, умерших в общине, расположенной в высокогорная пустыня, где не было лейшманиоза.Для подтверждения этиологии травм авторы использовали молекулярные методы, которые выявили Leishmania ДНК у трех проанализированных лиц.
Цинк и др. . (2006) 64 б / у молекулярные методы, митохондриальная ДНК (мтДНК) для обнаружения Leishmania ДНК в образцах более 90 мумий происходит из доегипетского Абидоса. Династия (3500–2800 гг. До н.э.) и Западная империя (2050–1650 гг. До н.э.). Анализ ДНК паразита, обнаруженная у 13 из этих мумий, соответствовала ДНК лейшмании ( лейшмании ) donovani , что позволяет предположить висцеральную форму инфекции.
Нерлих и др. . (2012) 65 и Биануччи и др. . (2012) 66 б / у молекулярные и иммунодиагностические тесты для выявления наличия л . ( L .) infantum в костных фрагментах Элеоноры из Толедо (1522–1562), жена Козимо I Медичи и член одной из крупнейших политические итальянские семьи в эпоху Возрождения. Положительная идентификация Инфекция Leishmania в образцах костей была получена с использованием двух самостоятельные подходы.Первым был молекулярный анализ древней ДНК. (аДНК) путем амплификации определенного фрагмента длиной 123 п.н. (пары оснований) из консервативная область молекулы мини-круга Leishmania кинетопластидная митохондриальная ДНК (кДНК) 67 , 68 и результаты были совместимы с л . ( л ). младенец . Этот результат достигается с помощью метода полимеразной цепной реакции (ПЦР), который был воспроизведен в двух независимых лабораториях.Второй подход — анализ белка. который показал положительную реакцию, т. е. распознал L. infantum белка, и одновременно обнаружен IgG против L. infantum . методом вестерн-блоттинга.
Guillen & Allison (2005) 49, исследуя перуанская мумия шестилетней девочки, датированная 800 г. до н.э., обнаружила присутствие макрофаги, содержащие Leishmania , по данным иммуно-гистологического исследования. экспертиза.
Как уже отмечалось, различные использованные методологии оказались продуктивными, обеспечивая значительная информация, которая помогает нам в палеопаразитологических исследованиях этого простейшие.Небольшие фрагменты аДНК, обнаруженные в тканях и костях мумий, а также иммунодиагностические методы, используемые для помощи молекулярным методам, показали, что заражение этим паразитом присутствовало у мумий из разных регионов и разные периоды, уточняющие вопросы об отношениях паразит-хозяин и предоставление доказательств для изучения эволюции и филогении этих паразитов.
Leishmania — инфекция и болезньПаразитарные инфекции и паразитарные заболевания — это две разные ситуации. от одного процесса.Паразит — необходимое условие, но недостаточное, чтобы запустить паразитарное заболевание69. Паразитический болезнь возникает из-за присутствия определенного паразита в определенном хозяине, в данном население, в данной среде и в течение определенного периода совместной эволюции жизни обоих главных героев69.
Первые попытки классификации клинических форм лейшманиоза относятся к раннему возрасту. двадцатый век. Различные клинические формы у пациентов с кожным лейшманиоз побуждает многих специалистов ставить ошибочный диагноз70.Одна из форм очень напоминает проявления гансениоз; в то время называли проказой. Первые атипичные и редкие случаи, один в Бразилия, один в Боливии и два в Венесуэле представили макулопапулезные и узловые поражения и распространение заболевания, его хроничность и устойчивость к лечению, обилие паразитов в очагах и большое сходство с проказой привели к этому клиническое проявление лейшманиоза назвать «лепроматоидной формой» 71 , 72. Дестомбс73, в 1960 г., сравнивая лейшманиоз с полярными формами лепры, рассматривал первичные диффузные кожные и кожные формы лейшманиоза как доброкачественные и злокачественные полюсы болезни.В 1970 году Padilha-Gonçalves74 описал концепцию кожного полярность лейшманиоза, рассматривая кожную форму как доброкачественный полюс, первичный диффузный кожный как полюс злокачественного новообразования и слизистая оболочка как часть граница спектра. Таким образом, Падилья-Гонсалвес упомянул об устойчивом к иммунитету полюсе и иммуносупрессивный полюс 74.
Историческая и классическая классификация лейшманиоза: висцеральный (Калазар) продуцируется видами L. donovani (Laveran, Mesnil, 1903), кожный (Восточная кнопка) производства Leishmania tropica (Wright, 1903) и кожно-слизистая форма (кожная), продуцируемая L.braziliensis (Гаспар Вианна, 1911). Однако эта классификация была произведена исключительно путем наблюдения за клиническим и эволюционным поведением болезни75. Однако, по словам Азулая (1977) 76, который уже обнаружил клинические и иммунопатологические различия между лейшманиозными инфекциями, он связал отличия от защитных реакций человеческого организма. В большинстве случаев клинические описания американского кожного лейшманиоза (ACL) были отнесены к инфекции L.braziliensis 31; тем не менее клинические характеристики инфекции различными видами Leishmania были продемонстрировали, что привело к предложению различных классификаций77 , 78 , 79. Кроме того, существует тесная связь среди встречаемости различных клинических форм заболевания и факторов, связанных к видам и штаммам паразитов, привычкам переносчиков, факторам, связанным с иммунитетом хозяина ответ и на взаимодействие хозяин-паразит. Региональные различия также были наблюдается при возникновении болезни в географических районах6 , 38 , 80.
Учитывая исходное описание видов и предлагаемую классификацию на основе по внешним критериям и по результатам, полученным биохимическими и молекулярными методами, это в настоящее время принято, что существует несколько видов Leishmania , из которых более 20 связаны с болезнями человека в Старом и Новом Мир7.
Несмотря на ограниченность исследований молекулярной палеопаразитологии, в которых только небольшие фрагменты могут быть проанализированы, молекулярные методы недавно предоставили первое свидетельство последовательностей аДНК L.tarentolae видов, обнаруженных в костный мозг и кишечник мумии взрослого мужчины, происходящие из Муниципалитет Итакамбира, штата Минас-Жерайс , Бразилия, датируется колониальный период. Хотя необходимы дополнительные исследования, чтобы попытаться восстановить L. tarentolae ДНК из других регионов, чтобы доказать, что инфекция в мумии не была единичной находкой, этот результат, по крайней мере, открывает некоторые перспективы понимания процесса «здоровье-болезнь». Эта находка возобновляет дискуссию о потенциальном существовании L.tarentolae напряжения в макрофагах человека, а также его способность систематически Распространение81. Тем не менее, как было обсуждается в случае зауролейшмании, до настоящего момента нет патогенного воздействия вызвано L. tarentolae на людях.
Находка этого вида Leishmania в бразильской мумии вызывает важный вопрос, который может быть связан с эпидемиологическими исследованиями проводится в эндемичных районах, в которых были обнаружены положительные серологические результаты, но свидетельств травм не было.Похожую ситуацию продемонстрировал Марзочи. et al. (1980) 82, после анализ частоты титров антител с помощью непрямой иммунофлуоресценции тест и тест Черногории у 47 человек в районе Жакарепагуа, Рио-де-Жанейро Штат, Бразилия подозревается в том, что кожный лейшманиоз. Исследование обнаружило положительные титры антител в 57,2% случаев. лиц без повреждений и шрамов, обследованных в 1974 г. и повторно обследованных в 1978 г. несоответствие между серологическими результатами и клиническими проявлениями уже было были продемонстрированы Pessoa & Barreto (1948) 26 на территории Бразилии и Aston & Thorley (1970) 84, анализируя результаты проведенных испытаний в Черногории. среди индейцев региона национального парка Шингу .
Могут ли это быть случаи заражения Leishmania без болезни? Однако обнаружение фрагмента ДНК, совместимого с L. tarentolae в человеческом хозяине, хотя мумифицированный и датированный 300 лет назад назад, приносит возможность заражения близкородственными видами, неспособными к заражению. причиняя травму, но с потенциалом для стимуляции защиты и иммунитета хозяина.
К сожалению, вопросы, связанные с паразитами рода Leishmania все еще остаются, особенно в отношении происхождения этих паразиты.Палеопаразитология может прояснить события, происходившие в древние времена. среди видов Leishmania и их хозяев, способствующих понимание происхождения и эволюции паразита 84. Хотя иммунодиагностические методы продолжают оставаться применяется в палеопаразитологических исследованиях для диагностики Leishmania spp.66, г. появление молекулярных методов, которые имеют более высокую чувствительность, значительно открыл эту область исследования. Техническая адаптация ПЦР для обнаружения аДНК сделала Возможна диагностика различных инфекций в доисторических популяциях.Однако там всегда есть необходимость в разработке новых методов и корректировок процедур в соответствии с процесс и статус сохранности археологического материала85 , 86 , 87.
Палеопаразитологические шаги обещают прояснить пробелы, которые все еще существуют в отношение к лейшмании. Самым обнадеживающим является то, что есть много возможностей для палеопаразитологических исследований, которые могут принести новые данные о древности и стадии развития взаимоотношений паразит-хозяин, а также эпидемиологические данные которые могут предложить стратегии, применимые сегодня.
Как передается лейшманиоз?
Автор
Craig G Stark, MD, FACP, FFTM, RCPS (Glasg), FISTM Telemedicine and Digital Health, CedarBridge Capital Partners
Craig G Stark, MD, FACP, FFTM, RCPS (Glasg), FISTM является членом следующие медицинские общества: Американский колледж врачей — Американское общество внутренней медицины, Международное общество медицины путешествий, Phi Beta Kappa, Королевский колледж врачей и хирургов Глазго, Общество летных хирургов армии США
Раскрытие: нечего раскрывать.
Соавтор (ы)
Кондживарам Видьяшанкар, доктор медицины, MRCP Специализированный врач по педиатрии, Королевская детская больница Абердина, Шотландия
Кондживарам Видьяшанкар, доктор медицины, MRCP является членом следующих медицинских обществ: Европейского общества педиатрических инфекционных заболеваний, Индийской педиатрической академии Международное общество по СПИДу, Королевский колледж педиатрии и здоровья детей
Раскрытие информации: нечего раскрывать.
Главный редактор
Пранатхарти Харан Чандрасекар, MBBS, доктор медицины Профессор, заведующий отделением инфекционных болезней, факультет внутренней медицины, Медицинский факультет Государственного университета Уэйна
Пранатхарти Харан Чандрасекар, доктор медицинских наук, является членом следующих медицинских обществ: Американский колледж врачей , Американское общество микробиологии, Международное принимающее общество с ослабленным иммунитетом, Американское общество инфекционных заболеваний
Раскрытие: Ничего не раскрывать.
Благодарности
Ручир Агравал, MD Заведующий отделением аллергии и иммунологии, Клиника Авроры Шебойган
Ручир Агравал, доктор медицины, является членом следующих медицинских обществ: Американской академии аллергии, астмы и иммунологии, Американской академии педиатрии, Американского колледжа аллергии, астмы и иммунологии и Американской медицинской ассоциации
.Раскрытие: Ничего не нужно раскрывать.
Пранатхарти Харан Чандрасекар, MBBS, MD Профессор кафедры внутренней медицины, директор стипендии по инфекционным заболеваниям, больница Харпер, медицинский факультет Государственного университета Уэйна
Pranatharthi Haran Chandrasekar, MBBS, MD является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционных болезней Америки
Раскрытие: Ничего не нужно раскрывать.
Дирк М. Элстон, доктор медицины Директор, Академия дерматопатологии Акермана, Нью-Йорк,
Дирк М. Элстон, доктор медицины, является членом следующих медицинских обществ: Американская академия дерматологии
Раскрытие: Ничего не нужно раскрывать.
Джон Халперн, DO, FACEP Доцент кафедры семейной медицины, Колледж остеопатической медицины Юго-Восточного университета Нова; Медицинский директор, Институт карьеры здравоохранения; Медицинский директор отделения неотложной помощи, Больница Палмс Вест
Джон Халперн, DO, FACEP является членом следующих медицинских обществ: Американский колледж врачей скорой помощи
Раскрытие: Ничего не нужно раскрывать.
Эдмонд А. Хукер II, доктор медицинских наук, доктор медицинских наук, FAAEM Доцент, Департамент управления службами здравоохранения, Университет Ксавьера, Цинциннати, Огайо; Доцент кафедры неотложной медицины Медицинского колледжа Университета Цинциннати
Edmond A Hooker II, MD, DrPH, FAAEM является членом следующих медицинских обществ: Американской академии экстренной медицины, Американской ассоциации общественного здравоохранения, Общества академической неотложной медицины и Южной медицинской ассоциации
Раскрытие: Ничего не нужно раскрывать.
Renee Y Hsia, MD, MSc Клинический инструктор, Отделение неотложной медицины, Калифорнийский университет в Медицинской школе Сан-Франциско; Лечащий врач отделения неотложной медицинской помощи больницы общего профиля Сан-Франциско
Раскрытие: Ничего не нужно раскрывать.
Джули Р. Кеннер, доктор медицины, доктор философии Частная практика, Центр дерматологии Кеннера
Джули Р. Кеннер, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии дерматологии и Американского общества дерматологической хирургии
Раскрытие: Ничего не нужно раскрывать.
Томас М. Керкеринг, доктор медицины Заведующий отделением инфекционных болезней Медицинской школы штата Вирджиния Tech Carilion
Томас М. Керкеринг, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американская ассоциация общественного здравоохранения, Американское общество микробиологии, Американское общество тропической медицины и гигиены, Американское общество инфекционных болезней, Медицинское общество Вирджинии и Медицинское общество дикой природы
Раскрытие: Ничего не нужно раскрывать.
Абдул-Гани Кибби, доктор медицины Профессор и заведующий кафедрой дерматологии Медицинского центра Американского университета в Бейруте, Ливан
Раскрытие: Ничего не нужно раскрывать.
Дженнифер Дж. Ли Доктор медицины, доцент, отделение дерматологии, медицинский факультет, Медицинский центр Университета Вандербильта
Дженнифер Джей Ли является членом следующих медицинских обществ: Американская академия дерматологии
Раскрытие: Ничего не нужно раскрывать.
Lester F Libow, MD Дерматопатолог, Южно-Техасская дерматопатологическая лаборатория
Лестер Ф. Либоу, доктор медицины, является членом следующих медицинских обществ: Американской академии дерматологии, Американского общества дерматопатологов и Техасской медицинской ассоциации
.Раскрытие: Ничего не нужно раскрывать.
Гэри Дж. Ноэль, доктор медицины Профессор кафедры педиатрии Медицинского колледжа Вайля Корнелла; Лечащий педиатр пресвитерианской больницы Нью-Йорка
Гэри Дж. Ноэль, доктор медицины, является членом следующих медицинских обществ: Общество педиатрических инфекционных болезней
Раскрытие: Ничего не нужно раскрывать.
Уильям Г. Стеббинс, доктор медицины Доцент кафедры дерматологии, Университет Вандербильта
Уильям Г. Стеббинс, доктор медицины, является членом следующих медицинских обществ: Американской академии дерматологии, Американского общества дерматологической хирургии и Фонда дерматологии
Раскрытие: Ничего не нужно раскрывать.
Russell W. Steele, MD Руководитель отделения детских инфекционных болезней Детского оздоровительного центра Ochsner; Клинический профессор кафедры педиатрии медицинского факультета Тулейнского университета
Рассел Стил, доктор медицины, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологов, Американского общества инфекционных болезней, Медицинского общества штата Луизиана, Общества педиатрических инфекционных болезней, Общество педиатрических исследований и Южная медицинская ассоциация
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Salary Employment
Джетер (Джей) Притчард Тейлор III, MD Специалист по соблюдению нормативных требований, лечащий врач, отделение неотложной медицины, отделение неотложной медицины, Palmetto Health Richland, Школа медицины Университета Южной Каролины; Медицинский директор отделения неотложной медицины, Palmetto Health Baptist
Джетер (Джей) Притчард Тейлор III, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи, Американской медицинской ассоциации и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
N Ewen Wang, MD Консультант, Отделение хирургии, Отделение неотложной медицины, Госпиталь Стэнфордского университета
Раскрытие: Ничего не нужно раскрывать.
Питер Дж. Вейна, доктор медицины, доктор философии , полковник армии США; Заместитель командира / заместитель директора, медицинский директор лаборатории диагностики лейшмании, Армейский научно-исследовательский институт Уолтера Рида
Питер Дж. Вейна, доктор медицинских наук, является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества тропической медицины и гигиены, Ассоциации военных хирургов США и Международного общества медицины путешествий
.Раскрытие: Ничего не нужно раскрывать.
Майкл Дж. Уэллс, доктор медицины Доцент, кафедра дерматологии, Центр медицинских наук Техасского технологического университета, Медицинская школа Пола Л. Фостера
Майкл Дж. Уэллс, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американской академии дерматологии, Американской медицинской ассоциации и Техасской медицинской ассоциации
Раскрытие: Ничего не нужно раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не нужно раскрывать.
Благодарности
Мнения или утверждения, содержащиеся в данном документе, являются частной точкой зрения авторов и не должны рассматриваться как официальные или отражающие точку зрения Министерства армии или Министерства обороны.
Передачачеловеку | IntechOpen
2.1. Жизненный цикл
Leishmania spp .: вектор передачиLeishmania spp. представляет собой паразит с диморфным жизненным циклом, который контролируется переходом от вектора к хозяину [1].Таким образом, паразит развил новые приспособления для выживания в переносчике [2]. Векторная фаза жизненного цикла начинается, когда переносчик проглатывает кровь, содержащую паразитов. После проглатывания паразиты в конечном итоге достигают средней кишки, где они удерживаются в перитрофическом матриксе примерно 4 часа. Там клетки амастиготы дифференцируются в маленькие подвижные клетки с короткими жгутиками, форма, известная как проциклический промастигот. Затем Leishmania инициирует первую стадию жизненного цикла вектора, которая длится следующие 24–48 часов.Тело паразита удлиняется в течение следующих 72 часов, образуя промастигот нектомонад, а затем микроорганизм разрушает перитрофический матрикс, достигая просвета средней кишки и мигрируя в грудную область переносчика. Оказавшись там, промастиготы дифференцируются в промастиготы лептомонад, уменьшаясь в размерах и меняя расположение жгутиков, за которым следует второй цикл репликации в течение 5-7 дней. Этот процесс вызывает массивную инфекцию в передней части средней кишки, где паразиты дифференцируются в метациклические промастиготы внутри стомодального клапана, обеспечивая большое количество паразитов для заражения.Чтобы защитить метациклические промастиготы, лептомонады также дифференцируются в продуцирующие гель промастиготы, которые окружают лептомонады и метациклические промастиготы. Последний тип клеток считается инфекционной формой паразита, потому что он обладает удлиненным жгутиком, который обеспечивает подвижность и устойчивость к лизису, опосредованному комплементом. Когда метациклические промастиготы дифференцируются в промастиготы гаптомонад, они образуют паразитические кольца, которые закупоривают стомодеальный клапан, что в конечном итоге приводит к его дегенерации.Наконец, этот процесс позволяет паразитам проникать в хоботок [2], где они могут заразить хозяина во время кормления вектора.
Попадая в организм хозяина, паразит сначала сталкивается с иммунной реакцией хозяина после активации системы комплемента. В отношении этого процесса были идентифицированы четыре различных пути активации: классический путь, альтернативный путь, лектиновый путь и внешний путь [3]. У человека паразит может уклоняться от иммунного ответа, ингибируя комплемент-опосредованный лизис, который происходит в фаголизосомах макрофагов.Этот защитный эффект обеспечивается мембранной протеазой gp63 или лейшманолизином, которая ингибирует атаки на клеточную мембрану паразита, прикрепляясь к компонентам комплемента [4]. Паразиты на стадии промастиготы дифференцируются в маленькие круглые клетки размером 3-5 мкм, в которых отсутствуют жгутики, известные как амастиготы. Эту форму можно легко наблюдать в клетках-хозяевах под микроскопом, где они называются тельцами Лейшмана-Донована [5]. Наконец, когда размножение паразитов превышает удерживающую способность фагоцитарной клетки, происходит лизис клеток, высвобождая паразитов для заражения новых клеток.
По некоторым консервативным оценкам, вектор может высвобождать от 1 до 1000 метациклических промастигот в хозяина во время кормления [6-7]. Однако другие оценки, основанные на методах молекулярной биологии, показывают, что вектор может высвобождать от 600 до 100 000 метациклических промастигот в течение периода кормления, и что это количество варьируется в зависимости от времени кормления. Кроме того, известно, что большое количество паразитов фактически увеличивает время кормления переносчиков, поскольку паразиты физически препятствуют правильному функционированию хоботка [8].Таким образом, на основании этих результатов от 100 до 100 000 метациклических паразитов обычно используются для инокуляции подушечек лап или ушных раковин животных в in vivo моделях инфекции [8-10].
2.2. Трансплантация органов, переливание крови и гемодиализ
Терапевтические достижения в самых разных областях медицины резко улучшили общее качество и продолжительность жизни в современных обществах. Частично это было достигнуто за счет разработки таких методов, как трансплантация органов, гемодиализ и переливание крови, которые особенно полезны для лечения хронических заболеваний.Однако необходимо учитывать и избегать передачи инфекционных заболеваний во время таких процедур. Более того, миграция людей может легко переносить болезни, передаваемые переносчиками, из эндемичных мест в неэндемичные, как это часто бывает с простейшими паразитами крови, такими как Leishmania [11-12], Trypanosoma и Plasmodium [3]. ].
Во время трансплантации органов существует несколько возможных путей передачи таких микроорганизмов, как Leishmania , включая реактивацию спящих паразитов у реципиента после лечения иммунодепрессантами, заражение паразитами, полученными от донора, передача паразитов при переливании крови во время хирургической процедуры и передачи de novo [11-12]. Leishmania инфекций наблюдались у лиц, перенесших трансплантацию почек [13-16] и печени [17-18], а также у пациентов, перенесших трансплантацию сердца [17, 19-23], легких [24], поджелудочной железы. [25], стволовые клетки [26-27] и трансплантаты костного мозга, хотя они встречаются реже. В целом, количество случаев лейшманиоза в результате трансплантации органов оценивается менее чем в 100 [11, 13–16], которые в основном были связаны с трансплантацией почек. Основным фактором риска передачи является то, проживал ли донор в районе, где лейшманиоз был эндемическим.Однако этот вопрос обычно не рассматривается в процессе скрининга, и соответствующие лабораторные тесты обычно не проводятся на донорах органов [28]. Следовательно, важно собирать и анализировать эпидемиологические данные, касающиеся лейшманиоза, поскольку количество инфицированных, у которых отсутствуют симптомы, может быть даже больше, чем количество тех, у кого проявляются клинические симптомы [17]. Также были сообщения о донорах органов, у которых до операции не было симптомов заболевания, но которые умерли от лейшманиоза через несколько месяцев после процедуры трансплантации.Более того, был как минимум один случай, когда у реципиента органа развились симптомы лейшманиоза через два года после процедуры трансплантации [29]. В случаях, когда у людей проявляются симптомы примерно через месяц после трансплантации, обычно считается, что передача происходит из-за реактивации спящих паразитов внутри реципиента [30]. С другой стороны, в случаях, когда симптомы лейшманиоза наблюдаются примерно через 18 месяцев после получения нового органа, обычно считается, что передача происходит из-за заражения de novo паразитами [11–12, 16].В любом случае предлагаемый курс лечения, способствующий выживаемости трансплантата, включает кортикостероиды [24], иммунодепрессанты [13-14] или моноклональные антитела [11], которые способствуют развитию лейшманиоза.
Редкие или атипичные симптомы могут вызвать позднюю диагностику лейшманиоза. Основными клиническими признаками и симптомами, связанными с инфекциями Leishmania , вызванными трансплантацией органов, являются лихорадка, спленомегалия, гепатомегалия, лейкопения и гипоальбуминемия [14, 31-32].К сожалению, терапевтические реакции в таких случаях часто недостаточны для спасения жизни пациента, что может быть связано с поздними диагнозами, особенно с тяжелыми инфекциями и другими осложнениями со здоровьем [13] из-за длительных режимов иммуносупрессии [16, 24].
Потеря объема крови или недостаток определенных компонентов крови являются показателями того, что может потребоваться переливание крови или ее производных от донора реципиенту. Переливания крови часто выполняются во время или после хирургических вмешательств, а в случае пациентов с лейшманиозом, перенесших в анамнезе трансплантацию органов и переливание крови, заболевание обычно считается осложнением процесса трансплантации [15, 32-33].У пациентов без такого фона обычно считается, что инфекции произошли в результате переливания крови или продуктов, полученных из крови. Первый случай передачи Leishmania через кровь был зарегистрирован в Китае в 1948 году, когда двум девочкам было введено 20 мл крови внутримышечно для стимуляции пассивного иммунитета против кори и краснухи. Кровь поступила от их матери, которая через несколько дней была госпитализирована с симптомами, указывающими на висцеральный лейшманиоз; этот диагноз был поставлен через месяц после ее госпитализации.Поэтому в связи с историей болезни матери за девочками наблюдали в последующие месяцы. Обе девочки заболели лейшманиозом через 9-10 месяцев после переливания крови [34]. Хотя этот случай не был связан с переливанием крови per se , это первый задокументированный случай, когда использование компонентов крови в терапевтических целях привело к сокращению лейшманиоза.
В целом возбудители висцерального лейшманиоза принадлежат к комплексу видов donovani , хотя также были сообщения о висцерализации у видов, более характерных для слизисто-кожных и кожных клинических проявлений заболевания.Эти типы клинических проявлений в основном наблюдались у людей с ослабленной иммунной системой, таких как ВИЧ-положительные пациенты. Однако был зарегистрирован единичный случай пациента с такими характеристиками, который также перенес в анамнезе трансплантацию почки и переливание крови. Кроме того, в анамнезе не было заражения переносчиками инфекции, поскольку пациент не проживал в эндемичном регионе. Гипотеза инфекции была исключена путем поиска признаков Leishmania в крови с помощью ПЦР и поиском специфических антител Leishmania- у донора и реципиента второй почки.Смерть пациента наступила в результате осложнений, связанных с присутствием T. cruzi , S. aureus и L. mexicana . Хотя доноров переливания крови невозможно было оценить, на основании анализа других возможных путей передачи, был сделан вывод, что наиболее вероятный путь заражения — переливание крови [35].
Среди других заметных случаев вторичного лейшманиоза, вызванного продуктами крови и переливаниями, был случай пациента с аутоиммунным заболеванием, идиопатической тромбоцитопенической пурпурой.Пациенту переливали концентрированные тромбоциты несколько раз в течение 2-3 лет до развития лейшманиоза, диагноз, который был подтвержден аспирацией костного мозга [36].
Другой случай связан с младенцем, которому в течение 7 дней после рождения сделали переливание крови из-за бледности кожных покровов с последующим диагнозом миелофиброз. Донором крови был родственник, который умер через три месяца после сдачи крови после развития гепатоспленомегалии, гипертермии и лихорадки неизвестного происхождения; Диагноз поставлен патологоанатомический после обнаружения трупов Лейшмана-Донована.Через месяц после переливания у младенца появилось вздутие живота, жар и бледность кожных покровов. В 5-месячном возрасте висцеральный лейшманиоз был диагностирован на основе аспирата селезенки, который дал положительный результат на тельца Лейшмана-Донована. Лечение лейшманиоза было начато без улучшения, и через два месяца ребенок был повторно госпитализирован с анемией, респираторной недостаточностью, гепатомегалией и спленомегалией. Биопсия печени выявила изменения, соответствующие стеатогепатиту с некротическими очагами и липидными гранулемами.Кроме того, биопсия была положительной на антитела против Leishmania (rK-39), тогда как члены семьи младенца были отрицательными на эти антитела. Из-за тяжелого анемического синдрома младенцу сделали переливание крови. Несмотря на лечение сурьмой, у младенца не было улучшений и действительно ухудшилось состояние с развитием сепсиса, вызванного Staphylococcus , Klebsiella и Pseudomonas . Замена лекарств на амфотерицин B еще больше ухудшила здоровье младенца, и он умер через месяц после поступления [37].
В случае с пожилым пациентом, 77-летняя женщина с хронической фибрилляцией предсердий, гипертонией и хроническим заболеванием почек, леченная гемодиализом, перенесла операцию по поводу холецистита, в течение которой ей сделали две единицы крови. Полтора месяца спустя у нее появились лихорадка, потоотделение и озноб во время сеанса гемодиализа и в течение следующих 24 часов; у нее также иногда наблюдалась диарея и потеря веса. Эти симптомы не улучшились, несмотря на лечение антибиотиками.В отделении интенсивной терапии после гемодиализа у пациента наблюдалась тромбоцитопения и гипотензия с хорошей систолической функцией желудочков, требующей восстановления объема и вазопрессорной терапии; гидрокортизон также был включен в курс лечения. Аспират костного мозга подтвердил наличие внутриклеточных амастигот и многочисленных внеклеточных промастигот, хотя они не наблюдались в периферической крови. Лечение амфотерицином B увеличивало количество тромбоцитов, хотя ухудшение гемодинамики продолжалось до смерти пациентки.Культуры, начатые до смерти, показали присутствие Acinetobacter baumannii , бактерии, устойчивой к нескольким типам антибиотиков. Во время патологоанатомического исследования было проверено наличие паразитов Leishmania в желчи из-за предшествующих желудочно-кишечных симптомов. Передача Leishmania через кровь была подтверждена, когда один из ее доноров (до источника единиц, перелитых во время холецистэктомии) дал положительный результат на антитела, специфичные для Leishmania [38].
Семь американских военных групп, участвовавших в операции «Буря в пустыне» в 1990-х годах, обнаружили нетипичные клинические проявления инфекции L. donovani , которые наводили на мысль о Кала-азар. Симптомы включали скованность, непродуктивный кашель, диффузную болезненность живота, диарею, тошноту, головную боль, миалгию и артралгию без органегалии. У одного из пациентов не было симптомов, тогда как у двоих были заболевания, подрывающие их иммунную систему: карцинома почек и ВИЧ. Диагностика проводилась с использованием иммунофлуоресцентного теста на антитела (IFAT).Во всех случаях появление симптомов происходило через 1–14 месяцев после пребывания в Саудовской Аравии, и ни в одном из них не было выявлено поражений, которые могли бы помочь в диагностике лейшманиоза [39]. Эти клинические случаи побудили власти США рекомендовать отказать всем кандидатам, посетившим Персидский залив, как донорам крови. Ситуация осложнялась еще и тем, что условия, при которых паразит Leishmania мог выжить в продуктах крови банковской крови, были неизвестны. В результате было выполнено анализов in vitro на паразитах, выделенных у солдат.Паразиты Leishmania , выделенные от людей, участвовавших в операции «Буря в пустыне», включали L. tropica , L. major и L. donovani . Этих паразитов поддерживали в культуре лог-фазы и использовали для инокуляции образцов донорской крови, которые затем хранили при 4ºC в течение 35 дней или при 24ºC в течение 5 дней. Было замечено, что в единицах цельной крови, хранящихся в этих обычных условиях банка крови, внутриклеточных паразитов L. tropica в моноцитах могли выжить до 30 дней при 4ºC и до 5 дней при 24ºC, в отличие от промастиготов в стационарной фазе. или бесплатные амастиготы, которых нет.Что касается свежезамороженной плазмы, было замечено, что внутриклеточные паразиты могут выжить внутри моноцитов в течение 25 дней при 4 ° C и не менее 5 дней во фракции тромбоцитов при 24 ° C. Для фракций эритроцитов, замороженных глицерином, время выживания паразита составляло 35 дней при 4ºC [40]. Понятно, что Leishmania демонстрирует низкотемпературную устойчивость, подчеркивая вполне реальную возможность передачи паразитов от инфицированных людей, на доклинической или бессимптомной стадии, людям с ослабленным иммунитетом через продукты крови.
Передача Leishmania при переливании крови была продемонстрирована на домашних животных [41] и модельных организмах, и они обычно проявляются симптомами после лечения либо инфицированной кровью человека, либо кровью экспериментально инфицированных животных [40, 42-43]. Например, переливание крови можно проводить грызунам путем переноса 0,1–1,0 мл крови через хвостовую вену [40] или внутрисердечную инъекцию [43]. В исследовании с участием хомяков все группы, получившие инфицированную кровь, проявили симптомы через 90–120 дней после переливания [43].Было обнаружено, что 22,1% перелитых хомяков дали положительный результат на Leishmania с помощью ПЦР-анализа, а 14,75% остались положительными при повторном проведении теста через 12 месяцев. Все культуры моноцитов были отрицательными. Кроме того, было продемонстрировано, что 29,5% перелитых хомяков дали положительный результат, по крайней мере, одним из методов, причем ПЦР является наиболее чувствительным методом [44].
Были также проведены различные клинические исследования на лицах, посещающих банки крови, в которых присутствие паразита оценивалось с использованием таких методов, как ELISA (иммуноферментный анализ) [45], IFAT [46], вестерн-блоттинг, культивирование и ПЦР [44-45].Эксперименты ELISA показали, что 2,4% индивидуумов имели антитела, специфичные для Leishmania , тогда как 3,5% дали положительный результат по данным вестерн-блоттинга; оба теста показали распространенность серотипа 7,6%.
Кроме того, опроса может быть недостаточно для исключения доноров, которые посетили эндемичные районы в течение последних 12 месяцев или у которых был клинический диагноз лейшманиоза, как рекомендовано в публикации ВОЗ Отбор доноров крови: руководство по оценке пригодности доноров для сдачи крови .Следовательно, существует явная необходимость в разработке лабораторных методов для идентификации этого микроорганизма в крови или ее производных, и действительно, было проведено несколько исследований для обнаружения присутствия антител, специфичных к Leishmania , у здоровых людей, сдавших кровь.
У кожных видов, например, принадлежащих к комплексу L. mexicana , неизвестно, может ли паразит передаваться через кровь человеку в тех же условиях, что и висцеральный вид.Однако, как уже упоминалось ранее, следует отметить, что есть случаи, когда пациенты с ВИЧ заболевают висцеральным лейшманиозом при заражении кожными видами [35].
У людей с хроническим заболеванием почек гемодиализ — это терапия, которая может значительно улучшить прогноз пациентов, а также продлить и улучшить качество их жизни. Однако, как и многие другие терапевтические процедуры, гемодиализ может иметь побочные эффекты, включая бактериемию и сепсис из-за плохих методов асептики во время лечения [47].Действительно, документально подтверждено, что если не принять надлежащих мер по стерилизации оборудования для гемодиализа, включая очистку и замену одноразовых деталей, существует высокий риск заражения инфекционными / заразными заболеваниями [47], включая паразитарные инфекции. В отличие от ситуации с Toxoplasma , [48] Leishmania не было напрямую связано с пациентами, находящимися на гемодиализе, хотя были проведены большие анализы на Leishmania -специфических антител [49-50], которые обнаружили паразита в 9-25. % пациентов в эндемичных районах [50].Несмотря на то, что никакие исследования напрямую не связывают инфекцию Leishmania с лечением гемодиализом, возможно, потому, что большинство пациентов с заболеванием почек, которые лечатся с помощью гемодиализа, также имеют в истории болезни иммуносупрессивное лечение кровью, трансплантацию органов и множественные переливания крови [38, 50-51 ]. Все эти условия увеличивают вероятность заражения лейшманиозом и негативно влияют на здоровье пациента, затрудняя анализ причинных факторов.
2.4. Врожденная передача
2.4.1. Врожденный лейшманиоз у людей
Вертикальная передача определяется как врожденная передача патогенного микроорганизма, состояния или характеристики от одного поколения к другому через плаценту, гематогенный путь, родовые пути или грудное вскармливание матери [64]. Вертикальная передача была продемонстрирована для висцерального лейшманиоза, вызываемого L. donovani и L. infantum. Первый случай вертикальной передачи лейшманиоза был зарегистрирован в 1926 году у беременной женщины, у которой в первом триместре беременности начали проявляться симптомы, указывающие на лейшманиоз.Лечение висцерального лейшманиоза проводилось после исключения малярии и брюшного тифа в качестве дифференциального диагноза по результатам лабораторных исследований. После лечения симптомы исчезли, и беременность продолжилась. Роды прошли без осложнений через вагинальный канал, новорожденный имел нормальный вес. Однако как у матери, так и у новорожденного сразу после родов наблюдалось общее ухудшение состояния. Не было подозрений на висцеральный лейшманиоз, симптомы включали лихорадку, диарею и боль в животе.Из-за состояния матери кормление грудью не происходило. В течение первого года за ребенком наблюдали анемию и спленомегалию. Биопсия селезенки показала наличие тел Лейшмана-Донована [65], что указывает на вертикальную передачу лейшманиоза.
Эпидемиологические предшественники лейшманиоза имеют решающее значение, когда у детей или детей детородного возраста появляются симптомы, указывающие на лейшманиоз. Мать, которой поставили диагноз: L.Infantum с помощью ELISA находилась на ферме, когда она находилась на сроке от 28 до 30 недель беременности. Ребенок родился путем планового кесарева сечения на 38 неделе в неэндемичной зоне на Украине. В возрасте восьми месяцев у грудного ребенка внезапно поднялась температура, снизился аппетит, появилась слабость, бледность кожных покровов, синяки, гепатоспленомегалия, тахипноэ и лимфаденопатия. Аспират костного мозга выявил яйцевидные клетки размером 3-5 мкм, которые были идентифицированы как тельца Лейшмана-Донована [66].
В Германии было зарегистрировано два случая лейшманиоза у матерей, которые посетили эндемичные зоны до своей беременности.Первый случай произошел с 16-месячным педиатрическим пациентом с висцеральным лейшманиозом, мать которого за два года до этого побывала в эндемичных зонах [67]. Второй случай — 15-месячный ребенок с висцеральным лейшманиозом, мать которого находилась на ферме в эндемической зоне между 20 и 22 неделями беременности [68].
Хронический висцеральный лейшманиоз связан с преждевременными родами и материнско-плодной смертью. [69] Гистологический анализ плаценты и аспирата лимфатического ганглия выявил наличие тромботических сосудистых изменений в плаценте у плода на пятом месяце беременности у матери, инфицированной лейшманиозом в течение двух месяцев [70] .Новорожденные, доношенные от инфицированных матерей, не имели симптомов в течение первых недель или месяцев жизни. Однако в конечном итоге тельца Лейшмана были обнаружены в костном мозге, а также были обнаружены антитела против Leishmania , что подтверждает диагноз лейшманиоза [65, 69, 71].
Лейшманиоз может сопровождаться сопутствующими инфекциями организмами аналогичных родов. Во втором триместре беременная пациентка сначала лечилась от лейшманиоза, и через 30 дней у нее наступило улучшение.Ребенок родился вагинально на 36 неделе без осложнений и весил 1700 граммов. Через три дня он был повторно госпитализирован в связи с ухудшением состояния из-за вероятной малярии и туберкулеза, но после лечения улучшения не наблюдалось. Амастиготы обнаружены в аспирате лимфатического узла матери. Кроме того, у ребенка были обнаружены антитела IgG; эти антитела были приписаны пассивной трансплацентарной передаче паразитоспецифических антител от матери к плоду, что исключает необходимость лечения.Он был госпитализирован еще раз в возрасте семи месяцев с симптомами, указывающими на Plasmodium falciparum, , и он не показал улучшения после лечения. Аспират костного мозга показал Leishmania . Однако, несмотря на лечение, младенец умер. Вскрытие показало, что паразитов Leishmania в почках, селезенке, тимусе, костном мозге, печени и легких и Candida spp. в дыхательных путях [70].
Люди, будь то матери или потомки, в эндемичных зонах могут быть инфицированы в течение месяцев или лет до появления симптомов.Например, женщина посетила эндемичную зону и через два года забеременела. У нее не было никаких симптомов во время беременности или в послеродовом периоде в неэндемичной зоне, а также не было доказательств существования переносчика в этой географической зоне. В то время как мать оставалась бессимптомной, у младенца проявлялись симптомы возможного висцерального лейшманиоза, что было подтверждено различными лабораторными исследованиями [67].
Имеются данные о том, что кожный лейшманиоз связан с перинатальными проблемами со здоровьем, как это наблюдалось в Бразилии, где женщины с L.braziliensis -опосредованный кожный лейшманиоз развил вегетативные или атипичные поражения на 18 -й неделе беременности. Из этих пациентов 10% родили преждевременно, а еще в 10% случаев плод умер. Биопсия одного из плодов выявила интенсивный воспалительный экссудат с преобладанием нейтрофилов, а с помощью электрофореза выявляли паразитов [72].
2.4.2. Врожденный лейшманиоз у животных
В Бразилии испытание проводилось на бессимптомных и симптоматических собаках смешанных пород, инфицированных L.donovani и L. infantum . В каждой группе было по четыре собаки, и печень, селезенка, лимфатические узлы, костный мозг, почки и сердце их потомков были проанализированы с помощью ПЦР на наличие инфекции. Количество потомков, полученных от матерей с симптомами или бессимптомно (26 против 27), было почти одинаковым. Плаценты и потомство были проанализированы с помощью ПЦР, и 13 из 26 плацент и 9 из 26 потомков матерей с симптомами были положительными на паразита, в то время как 13 из 27 плаценты и 8 из 27 потомков от бессимптомных матерей были положительными. .Кроме того, было отмечено, что ПЦР более чувствительна к обнаружению паразитов по сравнению с иммуногистохимией и окрашиванием гематоксилином и эозином [73]. В другом исследовании, проведенном в Италии, участвовали семь сук, у которых с помощью серологии, микроскопии и ПЦР был диагностирован лейшманиоз. Двое из семи получали N-метилглюкамин до беременности, а один из семи лечился во время беременности. Детенышей обследовали в возрасте от 3 до 30 дней. Паразит был обнаружен у 8 из 31 детеныша в обеих группах, и только у 2 из 8 детенышей развились симптомы [74].
2.4.3. Экспериментальные модели врожденной передачи
В мышиной модели висцерального лейшманиоза двадцать 12-недельных самок мышей BALB / c были инфицированы L. infantum . Через 8 недель они были скрещены со здоровыми самцами, а самок умерщвлен на 13 и 18 дни беременности. Потомство разделяли пополам для ПЦР-анализа. У 15 из 20 беременных мышей паразит был обнаружен методом ПЦР в селезенке. В потомстве 3 из 88 плацент и 4 из 88 детенышей дали положительный результат на Leishmania с помощью ПЦР [75].В исследованиях по определению вертикальной передачи Leishmania у гончих паразитемия была обнаружена в печени, селезенке и костном мозге потомства [63].
В экспериментальной модели, в которой хомяки были инфицированы 10 6 паразитов / мл L. panamensis в течение первой недели беременности, 24 из 93 (25,8%) потомков от инфицированных матерей оказались положительными на Leishmania. , через 2 месяца после рождения [76]. Кроме того, мышей, инфицированных высокими инокулятами л.mexicana , известный как причина кожного лейшманиоза, показал, что все самки и их плаценты были положительными при ПЦР-анализе, и выявили, что инфекция присутствовала у 39 из 110 потомков инфицированных матерей, также наблюдались гибель плода и резорбция [77] . Затем важно знать, что лейшманиоз может передаваться трансплацентарно и вызывать резорбцию плода, смерть и снижение массы тела потомства.
Инфекция Leishmania у грызунов в Греции — Цакмакидис — 2017 — Тропическая медицина и международное здравоохранение
Введение
Паразиты рода Leishmania (отряд Kinetoplastida, семейство Trypanosomidae) передаются через укусы инфицированных самок москитов ( Phlebotomus spp.в Старом Свете и Lutzomyia, spp. в Новом Свете), которые являются возбудителями лейшманиоза у млекопитающих 1, 2. Лейшманиоз эндемичен во всех южных странах Европы, где существует два цикла передачи: (i) зоонозный висцеральный и кожный лейшманиоз, вызываемый Leishmania infantum и ( ii) антропонозный кожный лейшманиоз, вызываемый Leishmania tropica, , который спорадически встречается только в Греции 3, 4. Собаки считаются основным резервуаром L.infantum в Европе, а распространенность лейшманиоза собак колеблется от 2% до 50% в эндемичных районах 5-7, что не всегда коррелирует с распространенностью среди людей.
Помимо собак, было высказано предположение, что несколько других животных могут быть вовлечены в эпидемиологию паразита, выступая в качестве альтернативного резервуарного хозяина 8-11. Действительно, естественная инфекция L. infantum была зарегистрирована у различных видов, как домашних, так и диких.У домашних животных ряд исследований выявил инфекцию или признаки инфекции у кошек, лошадиных, овец и коз 12-17. Среди диких животных рыжая лисица изучалась больше, чем другие, и была обнаружена инфицированной в разных странах с распространенностью от 0% до 74,6%, в зависимости от района и применяемого метода (ПЦР или серология) 18–23. Другими инфицированными хищниками являются серые волки, шакалы, европейские дикие кошки, хорьки, сосновые куницы, каменные куницы, обыкновенные генетики, иберийские рыси, египетские мангусты, европейские барсуки, ласки и европейские норки 9, 24-26.Более того, зайцеобразные играют решающую роль в сохранении паразитов в природе, поскольку дикие кролики и зайцы считаются важными резервуарами в Испании 10, 26-29.
Помимо вышеупомянутых видов, грызуны представляют особый интерес в отношении передачи L. infantum в Европе, где черная крыса ( Rattus rattus), норвежская крыса ( Rattus norvegicus), домашняя мышь ( Mus musculus ), лесная мышь ( Apodemus sylvaticus ) и алжирская мышь ( Mus spretus ) оказались инфицированными 30.Эти животные существуют огромными популяциями и считаются возможными резервуарами паразита 31, но их роль в эпидемиологии лейшманиоза все еще в значительной степени неизвестна и требует дальнейшего изучения и выяснения 32, 33.
Греция считается эндемиком лейшманиоза человека и собак 34. Недавнее эпидемиологическое исследование, проведенное во всех 54 префектурах страны, показало, что средняя серопозитивность у собак составляет 22,09% 7. В период 2004–2014 гг. Было официально зарегистрировано 644 автохтонных случая лейшманиоза человека. сообщалось, из которых 94% были висцеральными и 6% кожными формами, что привело к среднегодовой частоте встречаемости 0.51 / 100.000 согласно последним данным Греческого центра по контролю и профилактике заболеваний.
Идентификация естественных хозяев паразитов, помимо собак, таких как грызуны, может стать важным шагом для лучшего понимания эпидемиологии лейшманиоза. На сегодняшний день в Греции существует только одно соответствующее расследование, касающееся инфекции Leishmania у грызунов, ограниченное небольшим количеством ( n = 16) животных только одного вида ( R. norvegicus ), при этом одно животное было обнаружено инфицированным 35 .В этом контексте целью данного исследования было изучить в более широком масштабе распространенность инфекции Leishmania у различных видов грызунов в северной Греции, чтобы улучшить понимание эпидемиологии лейшманиоза и собрать информацию о возможном заражении. животных, альтернативных собаке, в поддержании паразита в этом конкретном районе Средиземноморского бассейна.
Материалы и методы
Животные
В течение двухлетнего периода (12 / 2013–1 / 2016) было собрано 97 взрослых грызунов, не более 12 часов вскрытие , в результате программ истребления крыс (борьба с вредителями), проводимых специалистами или отдельными лицами. .Вид грызуна определялся по внешним морфологическим и морфометрическим характеристикам, включая цвет, длину тела, длину хвоста, форму мочки уха, форму и положение глаз, а также форму носа и лица 36, 37. Кроме того, дату и место отлова. , пол и наличие собак или других животных в этом районе регистрировались для каждого животного. Всех грызунов обследовали на наличие внешних и висцеральных признаков заболевания.
Образцы тканей
У каждого грызуна были собраны фрагменты печени, селезенки и кровь, если таковая имеется.Чтобы избежать перекрестного заражения, для сбора каждого висцерального образца использовали стерильный скальпель. Мазки-отпечатки были взяты из печени и селезенки. Образцы ткани селезенки разрезали на фрагменты по 20-25 мг, помещали в стерильные пробирки и хранили при -80 ° C до экстракции ДНК. Селезенка была выбрана для исследований ДНК, потому что, как показали экспериментальные исследования на мышах, ожидается раннее распространение паразитов в этом органе 38, а также бремя паразитов в этом органе все еще остается на очень высоком уровне, в то время как в других органах, таких как как и печень, она в конечном итоге снижается 39.
Паразитологическое исследование (цитологические мазки)
Мазки отпечатков печени и селезенки фиксировали метанолом в течение 5 мин, окрашивали красителем Гимза, разведенным 1/20, и наблюдали под 1000-кратным увеличением в оптическом микроскопе. В каждом препарате исследовали весь мазок (когда было <1000 полей обзора или до 1000 полей обзора).
Серологическое исследование
Образцы сыворотки можно было собрать только у 43 из 97 животных из-за отсутствия крови во многих случаях при вскрытии грызунов, а также из-за того, что сгустки крови не всегда обеспечивали необходимое количество сыворотки.Образцы крови получали из камер сердца и / или грудной полости и центрифугировали при 3000 g в течение 15 мин. Сыворотки собирали и хранили при -20 ° C. Наличие антител IgG против Leishmania spp. был обнаружен с помощью собственного иммуноферментного анализа (ELISA), как описано ранее 16, 40, с использованием специфических вторичных антител (конъюгата щелочной фосфатазы против IgG мыши, A-3562 Sigma-Aldrich Chemie GmbH, Steinheim, Германия). Оптическую плотность измеряли с помощью измерения 405 нм и эталонного фильтра 630 с использованием считывающего устройства для микропланшетов Asys Expert Plus (Biochrom, Кембридж, Великобритания).
Пороговое значение определяли добавлением трех стандартных отклонений к средней абсорбции сывороток отрицательного контроля, полученных от выращенных в лаборатории R. norvegicus (крысы Wistar) 41.
Извлечение ДНК
ДНКэкстрагировали из образцов ткани селезенки с использованием набора NucleoSpin Tissue Kit (Macherey-Nagel, Düren, Германия) в соответствии с инструкциями производителя. Концентрацию и качество ДНК определяли спектрофотометрически, и образцы хранили при -20 ° C до использования.
ПЦР в реальном времени
Для обнаружения Leishmania spp. Была применена ПЦР в реальном времени в сочетании с анализом кривой плавления, как описано ранее 42, 43. Вкратце, пара праймеров Leish71up: 5΄-CCAAACTTTTCTGGTCCTYCGGGTAG-3΄ и Leish71do: 5΄- TGAACGGGATTTCTGCACCCATTTTTC-3΄ использовали для амплификации 71-п.н. области кинетопластной ДНК миникольца. ПЦР в реальном времени (20 мкл) состояла из 1 × F-517 Optimized DyNAzymeTM EXT Buffer, не содержащего детергентов [Состав: 50 мМ Трис-HCl, 1.5 мм MgCl 2 , 15 мм (NH 4 ) 2 SO 4 , Thermo Fischer Scientific, Вантаа, Финляндия], 0,2 мм каждого дНТФ, 1,5 мм MgSO 4 (New England Biolabs, Ipswich , MA), 3 единицы ДНК-полимеразы HotStartTaq (Qiagen, Hilden, Германия), 0,3 мкм Leish71up, 0,2 мкм Leish71do, EvaGreen TM 1 × краситель (Biotium, Hayward, CA) и 2 мкл экстракта ДНК. Экстракты ДНК из лейкоцитов крови двух крыс Wistar, выращенных в лаборатории, использовали в качестве отрицательного контроля.Два положительных контроля были также сконструированы путем добавления в вышеупомянутые экстракты ДНК, выделенной из лимфатических узлов собаки, положительной (цитологически и молекулярно) L. infantum (цитологически и молекулярно). Анализ выполняли с использованием системы обнаружения ПЦР в реальном времени C1000 / CFX96 Touch ™ (Bio-Rad Laboratories, Hercules, США). Принятые условия термоциклирования: 94 ° C в течение 15 минут, затем 46 циклов в 2 этапа: а) 95 ° C в течение 20 с (денатурация) и b) 60 ° C в течение 40 с (комбинированный отжиг / удлинение). Уровни флуоресценции измеряли в конце каждого цикла.После завершения циклов пробирки нагревали при 90 ° C в течение 30 с с последующей инкубацией при 72 ° C в течение 4 минут. Затем была построена кривая плавления при нагревании от 72 до 86 ° C с шагом 0,1 ° C / 5 с. Анализ данных флуоресценции выполняли с использованием программного обеспечения CFX ™ Manager (версия 3.1, Bio-Rad Laboratories, Hercules, США). Все ампликоны ПЦР, которые дали ожидаемые кривые плавления с пиками при 80,8 ° C, были дополнительно проанализированы электрофорезом на 1,5% агарозных гелях, окрашены бромидом этидия и визуализированы на УФ-трансиллюминаторе.В двух образцах с высокими значениями Ct (39–40) окончательная проверка специфичности продукта была проведена путем клонирования и секвенирования продукта ПЦР.
ПЦР-амплификация области ITS1
ПЦР на основе геля, направленная на область внутреннего транскрибированного спейсера 1 (ITS1), была проведена, как описано ранее 44, параллельно с ПЦР в реальном времени, чтобы повысить чувствительность нашего диагноза. Вкратце, 2 мкл экстрагированной ДНК подвергали ПЦР (25 мкл), состоящей из 1 × ПЦР-буфера [50 мМ KCl, 10 мМ Трис-HCl pH 8.5, 3 мм MgCl2, 0,1% Triton X-100], ДНК-полимераза 2U Taq (MINOTECH, Гераклион, Греция), 0,2 мм dNTP и 0,5 мкм каждого праймера (LITSR: 5΄-CTGGATCATTTTCCGATG-3΄ и L5. 8S: 5΄-TGATACCACTTATCGCACTT-3΄). Условия термоциклирования составляли 94 ° C в течение 5 минут с последующими 35 циклами в 3 этапа: (i) 94 ° C в течение 30 секунд, (ii) 53 ° C в течение 30 секунд и (iii) 72 ° C в течение 60 секунд 44. ДНК, выделенная из культур штаммов 7 L. infantum (MCAN / GR / 2009 / GD70) и L. tropica (MCAN / GR / 2009 / GD52), выделенных в Лаборатории клинической бактериологии, паразитологии, зоонозов и географии. Медицина медицинского факультета Критского университета использовалась в качестве положительного контроля.Отрицательные контроли включали образцы крови и тканей собак, родившихся и живущих в неэндемичных районах (на высоте> 1000 м), которые оказались отрицательными в отношении Leishmania согласно серологическому анализу, ПЦР (амплификация ITS1) и посеву. Все образцы были протестированы в двух экземплярах.
Статистический анализ
Размер выборки изучаемой популяции ( n = 97) был рассчитан для обнаружения хотя бы одного инфицированного животного путем оценки 95% доверительного интервала (ДИ) реальной доли инфицированных грызунов с погрешностью 8%. , учитывая, что ожидаемый процент Leishmania spp.Согласно недавним исследованиям 7, 45, распространенность среди собак, вероятно, составляет около 20%.
Статистический анализ был применен к результатам молекулярного исследования, так как он считался наиболее надежным методом обнаружения инфекции 46, 47. Таким образом, статистический анализ был использован для оценки влияния различных факторов риска на Leishmania spp. вхождение. Эти факторы риска были связаны с видом животного, полом, сезоном отбора проб (зима, весна, лето и осень), префектурой (Салоники, Килкис, Иматия, Халкидики) и регионом (сельский, полугородский и городской), где было собрано животное. , состояние тела животного (хорошее или плохое), наличие собак в этом районе (да или нет) и определение специфических антител IgG (положительный или отрицательный по ИФА).Количество инфицированных животных (19), выявленное с помощью молекулярных исследований, предполагает, что двусторонний точный критерий Фишера является наиболее подходящим для применения для проверки соответствия между возможными факторами риска и возникновением инфекции Leishmania 48. Кроме того, относительный процент в пределах каждого значения каждого фактора риска был представлен с использованием 100% подавленных гистограмм и был определен с использованием отношения шансов с соответствующим 95% доверительным интервалом. Статистический анализ был реализован с использованием пакета R версии 3.2.2, URL: http://www.R-project.org/ 49.
Результаты
Животные
Собранные грызуны были обнаружены в городских ( n = 17), пригородных (63) и сельских районах (17) в четырех префектурах Центральной Македонии на севере Греции: Салоники ( n = 72), Халкидики (). n = 11), Килкис ( n = 11) и Иматия ( n = 3) (рисунок 1). Животные принадлежали к видам Mus musculus (66), Rattus norvegicus (19) и R.раттус (12). Сорок восемь животных были самками (5 R. rattus , 13 R. norvegicus , 30 M. musculus ) и 46 самцов (6 R. rattus , 5 R. norvegicus , 35 M. musculus ), а у трех пол не определен (таблица 1). При внешнем и внутреннем осмотре 74 грызуна находились в хорошем состоянии тела, 22 — в плохом и 1 не был определен в соответствии с параметрами вида 37, 50. Никаких внешних повреждений, спленомегалии или гепатомегалии не наблюдалось.
Префектуры северной Греции, где были отловлены грызуны. Салоники (1, n = 72), Халкидики (2, n = 11), Килкис (3, n = 11) и Иматия (4, n = 3).
Таблица 1. Состав и распределение грызунов, исследованных на инфекцию Leishmania в северной Греции, и результаты всех применяемых диагностических методов: серология (Se) и ПЦР (в реальном времени и на основе геля)| Виды ( n ) | F | M | н / д | S1 | S2 | S3 | S4 | Se + / всего | ПЦР + / всего (%) | ПЦР в реальном времени + (%) | ПЦР на геле + (%) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mus musculus (66) | 30 | 35 | 1 | 55 | 0 | 9 | 2 | 13/26 | 16/66 (24.5) | 15 (22,72%) | 10 (15.15) |
| Rattus norvegicus (19) | 13 | 5 | 1 | 9 | 7 | 2 | 1 | 7/10 | 0/19 (0) | 0 (0) | 0 (0) |
| Rattus rattus (12) | 5 | 6 | 1 | 8 | 4 | 0 | 0 | 8/4 | 3/12 (25) | 3 (25) | 2 (16.66) |
| Всего (97) | 48 | 46 | 3 | 72 | 11 | 11 | 3 | 24a / 44 | 19b / 97 (19.58) | 18 (18,55) | 12 (12,37) |
- F, самка; М, самец; Н / Д, пол не определен. S1: Салоники, S2: Халкидики, S3: Килкис, S4: Иматия.
- Из серопозитивных животных пять M.musculus и один R. rattus также были ПЦР-положительными.
- б 11 животных были положительными в обоих методах ПЦР, семь только в режиме реального времени и одно только в ПЦР на основе геля.
Обнаружение заражения
Амастиготы Leishmania не были обнаружены ни в одном из мазков печени и / или селезенки всех 97 исследованных животных.При серологическом исследовании специфические антитела IgG к Leishmania были обнаружены в 24 (54,55%) из 44 сывороток (таблица 1).
Из 97 проанализированных образцов селезенки 19 (19,58%) были признаны положительными по крайней мере одним молекулярным методом. Из этих 19 образцов 18 (18,55%) были положительными при ПЦР в реальном времени и 12 (12,37%) были положительными при ПЦР на основе геля. Одиннадцать образцов были положительными в обоих молекулярных методах, семь были положительными только в ПЦР в реальном времени, а один был положительным только в ПЦР на основе геля.Секвенирование, проведенное в продуктах ПЦР двух образцов ДНК, подтвердило, что образцы принадлежали к роду Leishmania в соответствии с последовательностями, представленными в GenBank (ДНК кинетопласта миникольца, номер доступа AJ275333.1 и Z35276.1). Положительные образцы принадлежали 16 грызунам вида M. musculus (16/66, 24,2%) и трем грызунам вида R. rattus (3/12, 25%). обнаружен вид R. norvegicus (0/19) (Таблица 1).Все образцы, положительные по молекулярному методу, принадлежали серопозитивным животным.
Статистический анализ
Статистические результаты ассоциации между инфекцией грызунов и факторами риска, связанными с характеристиками животного, а также районом и сезоном отлова животного, показаны в таблице 2. Пол и состояние тела животного, время года, префектура и наличие собаки в этом районе не были связаны с инфекцией, обнаруженной с помощью ПЦР.Напротив, вид животного и область поимки животного были значимо связаны с инфекцией Leishmania (точный тест Фишера, P <0,05). Таким образом, распространенность Leishmania у M. musculus и R. rattus примерно одинакова (наблюдаемые проценты против ,25%) независимо от количества исследованных животных (66 против ,12. ), но соответствующий процент у R. norvegicus намного ниже, поскольку ни одно животное этого вида не было обнаружено инфицированным.Тот же результат может быть получен с использованием значения отношения шансов M. musculus против R. rattus , которое было рассчитано равным 0,96 (очень близко к 1), что указывает на отсутствие существенной разницы между распространенностью инфекции Leishmania у этих видов. С другой стороны, относительная распространенность инфекции Leishmania показывает, что ни одно из животных, живущих в сельской местности, не было инфицировано Leishmania . Причем более высокий относительный процент инфицированных животных был зарегистрирован у животных из пригородных территорий (28.57%, 18/63), в то время как соответствующие проценты для животных из городских и сельских районов составляли 5,88% (1/17) и 0% (0/17). Отношение шансов двух последних категорий (таблица 2) показывает, что грызуны, живущие в пригородных районах, в 6,3 раза чаще заражаются Leishmania , чем грызуны в городских районах, исследованных в настоящем исследовании.
Таблица 2. Статистический анализ ассоциации инфекции Leishmania у грызунов в северной Греции с различными факторами| переменная | Точный тест Фишера P -значение | Отношение шансов (95% ДИ отношения шансов) |
|---|---|---|
| Виды | 0.032 | |
| M. musculus против R. rattus | 0,96 (0,21, 6,18) | |
| Сезон | 0.218 | |
| Секс | 0,999 | |
| Префектура | 0,196 | |
| Регион | 0.005 | |
| Пригород и . городской | 6,30 (0,85, 282,69) | |
| Состояние кузова | 0,364 | |
| Наличие собак | 0.130 |
Обсуждение
Многие виды грызунов как в Старом, так и в Новом Свете были предложены в качестве возможных резервуарных хозяев для различных Leishmania видов 51-56. В странах южной Европы исследования причастности диких грызунов к сохранению Leishmania в природе ограничены.Однако есть свидетельства того, что эти животные играют роль в эпидемиологии L. infantum , демонстрируя характеристики, ожидаемые от резервуарного хозяина, такие как пролиферация, выживаемость достаточно долго, чтобы поддерживать доступность паразитов в течение по крайней мере одного года, демонстрируя высокие показатели инфекция и в большинстве случаев указывает на непатогенную инфекцию 57, 58.
Что касается Греции, то в единственном релевантном исследовании, проведенном в городах Афины и Пирей 35, одна из 16 селезенок дикой природы R.norvegicus , исследованный с помощью ПЦР, оказался положительным в отношении L. infantum , тогда как в нашем исследовании ни один из исследованных R. norvegicus ( n = 19) не был инфицирован. Однако этот результат нельзя охарактеризовать как противоречащий первому из-за небольшого числа R. norvegicus , исследованных в обоих исследованиях, и низкой распространенности инфекции, обнаруженной в предыдущем исследовании 35. Единственная дополнительная информация об этом виде грызунов в Европа происходит из Португалии, где одна из трех р.norvegicus оказался паразитологически положительным 57.
Точно так же только несколько домовых мышей ( M. musculus ) были исследованы в Европе на предмет наличия инфекции Leishmania . В Португалии и Испании 10 из 27 и два из четырех животных соответственно, исследованные с помощью ПЦР или цитологии, оказались инфицированными 31, 57. Инфекция M. musculus , обнаруженная с помощью ПЦР в настоящем исследовании (16 из 67 животных) находится в соответствии с существующими данными об этом виде животных, показывая, что он может представлять собой важный резервуар паразита.
Инфекция Leishmania у черной крысы ( R. rattus ) была подтверждена у 15–45% и 33,3% животных, обследованных в Италии и Португалии, соответственно 31, 58, 59. Процент инфицированных R. rattus , обнаруженный по крайней мере одним молекулярным методом в настоящем исследовании, также был относительно высоким (25%), что можно считать важным и предупреждающим, поскольку R. rattus является одним из немногих диких животных в Европе, которые были подтверждено ксенодиагностикой как способное инфицировать компетентный вектор 60 Leishmania и, таким образом, может быть естественным резервуаром.
Результаты применения различных молекулярных методов не всегда совпадали. Это может быть связано с тем, что у этих методов были разные ДНК-мишени. ПЦР в реальном времени считается очень чувствительной 61, а использование кДНК-мишеней увеличивает чувствительность ПЦР, так как эти мишени многочисленны и часто повторяются 62. Можно предположить, что настоящие результаты соответствуют вышеупомянутым наблюдениям, поскольку ПЦР в реальном времени выявила большинство положительных образцов.
Обнаружение специфических антител серологическими методами также может предоставить полезную информацию о контакте животных с паразитом. Довольно часто регистрируют животных, которые являются серопозитивными в отношении Leishmania , но в то же время отрицательными в паразитологических тестах 46, вероятно, из-за того, что они подверглись заражению и либо смогли уничтожить паразита (и превратятся в серонегативных), либо были способен держать паразита под контролем, не допуская длительного размножения в тканях.Эти животные не обязательно важны как резервуары паразита 46, так как передаваемость паразита в естественных условиях зависит от паразитарной нагрузки, особенно в коже 63. В Европе существует только два соответствующих серологических исследования: первое проводится в Италии, где 57,5% из R. rattus и 33,3% из R. norvegicus оказались серопозитивными 59 и вторым на Кипре, с распространенностью 11,2% у R. rattus и 5,6% у R.norvegicus 64. Согласно результатам серологического исследования, проведенного в настоящем исследовании, 54,55% грызунов подверглись воздействию Leishmania spp. В частности, процент серопозитивных R. rattus и R. norvegicus был высоким, что согласуется с распространенностью, обнаруженной у этих животных в Италии 59. Интересно, что на сегодняшний день нет опубликованных данных относительно серологической распространенности Leishmania в M. musculus в Европе, и поэтому, насколько известно авторам, настоящие результаты представляют собой первую запись такой информации.
Трудно полностью интерпретировать результаты серологического анализа, потому что чувствительность серологии у этих видов животных неизвестна 65. Более того, нельзя исключать возможное присутствие других трипаносоматид, которые могут привести к перекрестным реакциям 26. Различие между Результаты между серологией и ПЦР также можно объяснить тем фактом, что паразиты неравномерно распределены в органах и тканях хозяина, и, таким образом, возможно, что паразиты присутствовали в других фрагментах селезенки или, как следствие, а также в других органах 57.Другой возможный сценарий может заключаться в том, что, хотя многие грызуны вступают в контакт с паразитом и, таким образом, вызывают сероконверсию, они иммунологически реагируют таким образом, что установление инфекции и, следовательно, присутствие паразитов в тканях происходит редко. Различия в уровне распространенности серологических и молекулярных методов также были зафиксированы в предыдущих исследованиях. Например, в Италии у некоторых серопозитивных черных крыс была отрицательная реакция на ПЦР, и , наоборот, , некоторые животные, положительные с помощью ПЦР-анализа, были серонегативными 59.В случае настоящего исследования все ПЦР-положительные животные также были серопозитивными, что, возможно, связано с примененным высокочувствительным анализом (ИФА), который также подтверждает специфичность примененных молекулярных методов.
В отличие от непрямых методов выявления инфекции, таких как серология или внутрикожное тестирование на лейшманин (тест Черногории), микроскопическое обнаружение амастигот является абсолютным доказательством инфекции. Однако все образцы, исследованные цитологически в настоящем исследовании, были отрицательными.Это может быть связано с низкой паразитарной нагрузкой, ожидаемой у этих животных 35, так как в методах прямого наблюдения чувствительность зависит от паразитарной нагрузки образцов 66 и от случайно выбранных фрагментов для подготовки мазка 57. Замечательно низкая паразитарная нагрузка в образцах была также продемонстрировано тем фактом, что для выявления положительных образцов необходимо большое количество реакционных кружков (Ct ≥33) в ПЦР в реальном времени.
Выявленную здесь распространенность инфекции среди грызунов можно считать высокой.Однако высокие темпы инфицирования сами по себе не доказывают, что эти виды могут действовать как резервуары 30. Среди критических факторов для вида, который следует охарактеризовать как таковой, — способность поддерживать инфекцию в течение долгого времени и способность инфицировать переносчиков 67. Ибо Например, на кроликах были сделаны некоторые противоречивые выводы, поскольку исследование в Испании показало, что у этих животных был очень низкий риск хронической инфекции, что свидетельствует о том, что они не имеют большого значения как резервуары 68, тогда как другие исследования, наоборот, показали, что они могут играть роль в Leishmania передача 26, 28, 29.В этом контексте стоит отметить, что среди исследованных животных 2 M. musculus были инфицированы зимой, когда активность песчаных мух отсутствует 69, что позволяет предположить, что эти животные могут способствовать поддержанию Leishmania . С другой стороны, очень низкая нагрузка паразитов у исследованных грызунов предполагает, что естественное заражение переносчиков, вероятно, не произойдет легко. Эти результаты, кажется, противоречат друг другу и требуют дальнейших исследований, чтобы окончательно прояснить роль этих животных в эпидемиологии лейшманиоза в Греции.
На данный момент способность грызунов передавать паразита москитам, Phlebotomus perniciosus и P. perfiliewi , подтверждена ксенодиагностикой только для черных крыс 60. Следует учитывать, что в Греции, хотя наличие P. perniciosus не было доказано, P. perfiliewi , один из предполагаемых переносчиков L. infantum, был зарегистрирован 7. Отсутствие кожных повреждений у исследованных животных, возможно, указывает на висцеротропную инфекцию .Однако явных признаков болезни не было, что могло способствовать роли этих животных в качестве резервуара. Следовательно, поскольку средняя продолжительность жизни этих грызунов составляет от 12 ( M. musculus ) до 24 месяцев ( R. rattus и R. norvegicus ), можно сделать вывод, что они живут достаточно долго, чтобы поддерживать паразит. доступен в течение достаточного периода времени 56, 57, 66.
Распространенность инфекции, обнаруженная здесь, убедительно свидетельствует о том, что грызуны не только часто контактируют с паразитом, но также потенциально могут передавать его, что позволяет ему распространять через кормление песчаных мух .Однако было бы важно исследовать присутствие паразитов в коже этих животных, факт, который облегчил бы передачу 67.
Статистический анализ показал, что грызуны в пригородных районах значительно чаще заражались, чем животные, живущие в городских районах. Насколько известно авторам, соответствующие данные об инфицировании грызунов Leishmania отсутствуют. Однако аналогичные результаты в отношении лейшманиоза собак показали, что собаки в сельской местности подвержены более высокому риску заражения по сравнению с городскими районами 70, 71.Возможное объяснение этого заключается в том, что пригородные районы богаче растительностью и деревьями, что способствует развитию москитов 72, а также имеет популяцию собак, которые проводят больше времени на открытом воздухе, что является доказанным фактором риска лейшманиоза у собак 73. Частое воздействие заражение собак москитами из-за их образа жизни на открытом воздухе может быть фундаментальным фактором, влияющим на инфекционное давление на других хозяев в той же среде. Точно так же отсутствие каких-либо инфицированных грызунов в обследованных сельских районах можно объяснить тем фактом, что плотность популяции собак в этих средах намного ниже.
Вышеупомянутое свидетельство соответствует некоторым критериям 34, 74, которые могут свидетельствовать о том, что млекопитающее является резервуарным хозяином. Таким образом, можно предположить, что грызуны могут играть потенциальную роль в качестве альтернативных резервуарных хозяев для Leishmania spp. в Греции.
Это первое сообщение о заражении Leishmania грызунов видов R. rattus и M. musculus в Греции. Эти виды адаптированы к среде обитания человека и чрезвычайно плодовиты 31, 50.Из-за близости грызунов, людей и собак эти животные играют важную роль в эпидемиологическом цикле болезни, как это уже было описано в других частях мира 75. Важно, чтобы исследования в области ксенодиагностики продолжались. оценить способность M. musculus и R. norvegicus заражать москитов, чтобы однозначно охарактеризовать эти виды как резервуарные хозяева для видов Leishmania , что дает важную информацию для будущих стратегий борьбы и профилактики здоровье населения и животных.
Благодарности
Авторы хотели бы поблагодарить профессора Иоанниса Тайцоглу за предоставленный материал о крысах Вистар, доктора Константиноса Эфтимиу за его техническую поддержку и г-жу Анн Биван за редактирование английского языка.
IAMAT | Лейшманиоз
Описание
Лейшманиоз — это паразитарная инфекция, вызываемая различными видами Leishmania простейших.Он передается через укусы инфицированных самок москитов, принадлежащих к видам Phlebotomus, Lutzomyia, и Psychodopygus . Эти ночные насекомые кусаются от заката до рассвета и часто встречаются в лесах, трещинах каменных и глиняных стен и норах животных. Это очень крошечные бесшумные летуны — они не гудят — и их укус может остаться незамеченным. Лейшманиоз клинически делится на три основные категории — кожный, слизисто-кожный и висцеральный — и является забытым тропическим заболеванием (NTD) *.
* Забытые тропические болезни — это хронические инфекции, которые обычно эндемичны в странах с низким уровнем доходов. Они не позволяют пострадавшим взрослым и детям ходить в школу, работать или полноценно участвовать в жизни сообщества, что способствует стигме и порочному кругу бедности.
Риск Путешественники, орнитологи, миссионеры, военнослужащие, строители и исследователи, выполняющие ночные задания, подвергаются более высокому риску контакта с москитами.
Кожный лейшманиоз является наиболее распространенной формой инфекции и встречается в двух географических регионах:
- Кожный лейшманиоз Старого Света присутствует в Средиземноморском бассейне (южная Европа и Северная Африка), на Ближнем Востоке, в Юго-Западной и Центральной Азии и в тропических регионах. районы Африки. Большинство случаев зарегистрировано в следующих странах: Афганистан, Алжир, Иран, Ирак, Саудовская Аравия и Сирия.Кожный лейшманиоз Старого Света — это в основном самоограничивающееся кожное заболевание у взрослых, но в зависимости от вида у инфицированных младенцев и детей может развиться висцеральная форма .
- Кожный лейшманиоз Нового Света распространен в сельской местности, но также может передаваться в пригородных и городских районах. Он также встречается в тропических лесах и засушливых районах. Кожный лейшманиоз Нового Света присутствует на юге США (единичные случаи зарегистрированы в штатах Техас и Оклахома), Мексике, Центральной и Южной Америке, при этом Бразилия и Перу сообщают о большинстве случаев.
Симптомы кожного лейшманиоза: Первоначальные симптомы включают поражения кожи, которые развиваются через несколько недель или месяцев после заражения, и опухшие железы. Поражения — закрытые или открытые — могут со временем меняться по размеру и внешнему виду. Обычно они безболезненны, но могут стать болезненными при заражении бактериями. Поражения могут долго заживать и обычно оставляют рубцы. Инфекции, вызванные некоторыми штаммами кожного лейшманиоза Нового Света, могут перерасти в Кожно-слизистый лейшманиоз через лет после того, как первоначальные поражения кожи, по-видимому, полностью зажили.Инфекция распространяется на нос, рот и горло, вызывая язвы и кровотечение. Это осложнение может возникнуть, если исходная инфекция кожного лейшманиоза не лечилась.
Висцеральный лейшманиоз, , также известный как кала-азар, вызывается примерно видами Leishmania , которые поражают печень, селезенку, костный мозг и кожу. Эта форма лейшманиоза очень редко встречается у путешественников, но поражает местное население в отдаленных районах Индии, Непала, Бангладеш, Судана, Южного Судана, Эфиопии и Бразилии.
Симптомы висцерального лейшманиоза: Обычно симптомы появляются через несколько недель или месяцев после заражения и включают лихорадку, потерю веса и увеличение печени. Запущенный нелеченый висцеральный лейшманиоз может быть фатальным, особенно если присутствуют другие ранее существовавшие заболевания, такие как туберкулез, пневмония и дизентрия.
Профилактика- Избегайте активного отдыха от заката до рассвета.
- Если возможно, пропитайте или опрыскайте верхний слой одежды и снаряжения перметрином.
- Используйте репеллент, содержащий 20% -30% ДЭТА или 20% пикаридина на открытых участках кожи. Повторно нанесите в соответствии с указаниями производителя.
- Спите под сеткой, обработанной перметрином, или в комнате с кондиционером. Москиты очень маленькие, 2-3 мм, и могут проникать через обычные сетки и сети. Обработанные инсектицидами сетки и сетки могут снизить риск проникновения.
Профилактической вакцинации или лекарств от лейшманиоза не существует. Варианты лечения зависят от выявления инфекционного leishmania видов и степень заражения, но включает противогрибковые препараты и антибиотики.
Leishmania изображений простейших, жизненный цикл и карты распространения:
Инфекция Пейзажи
Последнее обновление информации: 28 сентября 2020 г.
- Jeronimo S, de Queiroz Sousa A, Pearson R. Leishmaniasis. В: Guerrant, R; Уокер D; Веллер П., ред. Тропические инфекционные болезни. 3 -е изд. Нью-Йорк: Сондерс Эльзевир; 2011: 696-706.
- Magill, A. Leishmaniasis. В: McGill, A; Райан, Э; Хилл, Д; Соломон, Т., ред. Тропическая медицина Хантера и новые инфекционные заболевания. 9 -е изд. Нью-Йорк: Сондерс Эльзевир; 2012: 739-760.
- Вертхайм, Хейман; Хорби, Питер; Вудалл, Джон, ред. Атлас инфекционных болезней человека . Оксфорд: Уайли-Блэквелл; 2012. 273 с.
- Центры по контролю и профилактике заболеваний: лейшманиоз
- Всемирная организация здравоохранения: Лейшманиоз
Риск лейшманиоза присутствует в следующих странах:
Недавние случаи лейшманиоза подтверждены в следующих странах:
Инфекция Leishmania donovani стромальных макрофагов костного мозга избирательно усиливает миелопоэз за счет механизма, включающего GM-CSF и TNF-α | Кровь
бедра были подготовлены для криосрезов, как описано в другом месте.41,42 Их фиксировали инкубацией в течение ночи при 4 ° C в периодат-лизин-параформальдегиде (0,1 моль / л периодата натрия, растворенного в 3 частях 0,1 моль / л лизин-HCl, 0,05 моль / л Na 2 PO 4 , pH 7,4 и 1 часть 4% [мас. / об.] параформальдегида), 5,4% (мас. / об.) глюкозы (оба BDH, Лестершир, Великобритания) в деионизированной воде). Затем бедренные кости переносили в 10% (мас. / Об.) EDTA, 0,1 моль / л Трис (оба BDH), pH 6,95 в течение 5 дней при 4 ° C, чтобы обеспечить декальцификацию. После последней инкубации в течение ночи в 15% (мас. / Об.) Сахарозе (BDH) в фосфатно-солевом буфере (PBS) при 4 ° C бедренные кости помещали в соединение OCT (Raymond Lamb, Лондон, Великобритания) на пробковом блоке.Блоки мгновенно замораживали в изопентане (BDH), охлажденном в жидком азоте, затем хранили при -70 ° C до тех пор, пока не потребовалось. Затем криосрезы размером 4 мкм нарезали на предметные стекла из полилизинового стекла (BDH) с использованием криостата (Bright Instrument Co. Ltd., Хантингдон, Великобритания) и сушили на воздухе перед фиксацией ледяным ацетоном в течение 10 минут при комнатной температуре. Срезы блокировали 1,5% (об. / Об.) Сыворотки в PBS в течение 30 минут, а затем инкубировали с mAb SER4 (крысиный IgG2a против сиалоадгезина мыши; подарок доктора П. Крокера, Университет Данди, Великобритания) или RAM34 (крысиный IgG2a анти- мышь CD34; Фарминген, Сан-Диего, Калифорния).Через 30 минут срезы промывали PBS, а затем инкубировали с 5 мкг / мл биотинилированного кроличьего антитела против IgG (Vector Laboratories, Питерборо, Великобритания). Через 30 минут срезы промывали, гасили активность эндогенной пероксидазы (0,3% [об. / Об.] H 2 O 2 в метаноле) и добавляли комплексы биотинилированный авидин-HRP (Vector Laboratories). Срезы проявляли с использованием проявляющего субстрата 3,3-диаминобензидинтетрагидрохлорида (Vector Laboratories), который прекращали в водопроводной воде.Срезы контрастировали гематоксилином Harris (Sigma, Poole, UK), обезвоживали этанолом и ксилолом и помещали в DePeX (BDH). По крайней мере, 2 среза были исследованы от 3 отдельных мышей за временной курс и от 2 независимых экспериментальных инфекций.
вирусов обостряют болезнь, вызванную паразитом Leishmania — Медицинская школа Вашингтонского университета в Сент-Луисе
Посетите новостной центрЭволюция паразитарных вирусов намекает на то, как Leishmania впервые заразила позвоночных.
Getty ImagesСтивен Беверли, доктор философии, обнаружил, что вирусы, спрятанные внутри паразита Leishmania (вверху), усугубляют болезнь, вызванную паразитом.Теперь, эволюционный обзор вирусов у родственных паразитов показывает, что вирусы Leishmania, возможно, помогли ему перейти от заражения насекомых к заражению позвоночных.
Более миллиона человек в тропических странах заражаются паразитом Leishmania каждый год через укусы инфицированных москитов. У большинства людей в местах укусов появляются обезображивающие, но не опасные для жизни поражения кожи. Но если паразит распространяется на внутренние органы, он вызывает заболевание, известное как висцеральный лейшманиоз, от которого ежегодно умирает около 30 000 человек.
Стивен Беверли, доктор философии, профессор Марвина А. Бреннеке и глава отделения молекулярной микробиологии Медицинской школы Вашингтонского университета в Сент-Луисе, является мировым экспертом по смертоносным паразитам. Он изучал основную биологию Leishmania , когда по счастливой случайности обновил область вирусологии паразитов. Вместе с давним сотрудником Николасом Фазелем, доктором философии из Университета Лозанны в Швейцарии, и другими коллегами Беверли обнаружил, что паразитов Leishmania , инфицированных вирусом, получивших название Leishmaniavirus , вызывают значительно более тяжелые заболевания, чем те, у которых нет вируса.Позже другие исследователи показали, что вирусы родственных паразитов, такие как Trichomonas , вызывающие вагинальные инфекции, и потенциально Cryptosporidium , вызывающие диарею, также могут обострять болезнь.
Беверли рассказал о зарождающейся области паразитарной вирусологии и своей новейшей статье, эволюционном исследовании, которое предполагает, что вирусы Leishmania могли помочь паразитам инфицировать позвоночных. Статья была опубликована 25 декабря в Proceedings of the National Academy of Sciences.
Что такое вирусы-паразиты?
Давно известно, что паразиты, как и любое другое существо, имеют свою долю вирусов. Но долгое время они никого не интересовали. Очень немногие из них были заразными, они никогда не были связаны с какими-либо заболеваниями, и их более или менее считали диковинками. Но шесть или семь лет назад в процессе сбора доказательств, чтобы ответить на другой вопрос, мы — вместе с лабораторией Фазеля — обнаружили несколько действительно хороших доказательств, которые показали, что Leishmaniavirus играет роль в развитии болезни.Если паразит Leishmania является переносчиком этого вируса, это означает более тяжелое заболевание, большее количество паразитов и вероятность метастазирования инфекции. Это не то, что мы стремились изучить, но вы следите за тем, куда идут данные. Данные привели нас сюда, и мы поехали.
Как паразитарные вирусы ухудшают паразитарные заболевания?
Важно помнить, что люди не заражаются паразитами и вирусами. Скорее люди заражаются паразитом, внутри которого спрятан вирус.Мы думаем, что иммунные клетки убивают некоторых вторгшихся паразитов, высвобождая вирус. Затем организм генерирует иммунный ответ для борьбы с вирусом. Но когда вы заражены паразитом, это неправильный иммунный ответ. Он не убивает паразитов; кажется, это помогает паразиту усугубить болезнь.
Можно ли уменьшить количество паразитарных заболеваний, избавившись от вируса?
Мы так думаем и пытаемся сделать это двумя способами. Во-первых, мы знаем, что медикаментозное лечение с большей вероятностью потерпит неудачу у людей, инфицированных Leishmania , которые являются переносчиками вируса.Поскольку вирус увеличивает количество паразитов, мы думаем, что такой сценарий потребовал бы более высокой дозы, чтобы убить их всех. Итак, мы ведем переговоры с работниками в странах, где паразиты являются эндемичными, для разработки программы скрининга для выявления людей, инфицированных паразитами Leishmania , которые переносят Leishmaniavirus . Затем их можно было лечить более высокой дозой лекарства. Еще мы пытаемся вылечить паразита от вируса. Мы обнаружили некоторые противовирусные соединения, которые отлично работают в посуде для культивирования, и оцениваем, могут ли они избавиться от вируса, который находится внутри паразитов, находящихся внутри животных, и, возможно, внутри людей.
Что вы узнали из изучения истории эволюции паразитарных вирусов?
Leishmania произошел от паразитов, заражающих насекомых, и только на поздних этапах эволюции он научился заражать позвоночных, а затем людей, и стал для нас проблемой. Это исследование началось с обследования семейства насекомых-паразитов, связанных с Leishmania , которое мы провели в сотрудничестве с командой под руководством Вячеслава Юрченко из Чешской Республики.Но затем мы задались вопросом, могут ли эти насекомые-паразиты переносить вирусы. Многие исследователи проделывают потрясающую работу по обнаружению вирусов, но очень немногие из них охотились за этими чудаковатыми паразитами. Когда мы это сделали, мы обнаружили много новых вирусов, некоторые из которых были совершенно уникальными. Но не менее интересно то, что мы не обнаружили — в частности, родственников Leishmaniavirus в других родословных. Это говорит о том, что Leishmania приобрело Leishmaniavirus примерно в то же время, когда оно научилось паразитировать на позвоночных.
Мы были рады обнаружить, что одна вирусная группа, обычная для насекомых-паразитов, включала вирусы, отдаленно связанные с буньявирусами, которые часто являются патогенами животных. Мы назвали новый вирус паразита, который поразил паразитов насекомых, « Leishbunyavirus, » или LBVs. В то время как LBV, инфицировавшие паразитов у насекомых, были очень похожи на другие буньявирусы, в ходе текущей работы мы обнаружили, что LBV в Leishmania претерпели большие изменения, которые снова кажутся связанными с повышенной вирулентностью, посредством механизма, совершенно отличного от механизма исходный Leishmaniavirus .
Итак, у нас есть две линии доказательств, которые предполагают, что что-то произошло с вирусами в то же самое время, когда паразит совершил переход от насекомых к позвоночным. Очень сложно доказать роль вирусов в развитии болезни путем изучения эволюции, но два вирусных «скачка», которые мы обнаружили, служат отличным подтверждением нашей экспериментальной работы, которая показывает, что эти вирусы способствовали увеличению выживаемости паразитов Leishmania и патологии болезней у позвоночных. Возможно, если бы эти вирусы не действовали глубоко в эволюции, эти болезни стали бы гораздо менее серьезными и ужасными, чем сейчас.
Грибчук Д., Акопянц Н.С., Костыгов А.Ю., Коноваловас А., Лай Л.Ф., Добсон Д.Е., Цангер Х., Фазель Н., Бутенко А., Фролов А.О., Вотыпка Ю., д’Авила-Леви С.М., Кулич П., Моравцова Ю., Плевка П., Рогозин И.Б., Серва С., Лукеш Дж., Беверли С.М., Юрченко В. Открытие вирусов и разнообразие простейших трипаносоматид с акцентом на родственников паразита человека Leishmania. Труды Национальной академии наук. Неделя от 25 декабря 2017 г.
Эта работа была поддержана Национальными институтами здравоохранения (NIH), номера грантов R01-AI029646 и R56-AI099364; Программа очных исследований Национальной медицинской библиотеки NIH; Грантовое агентство Чешской Республики, номера наград 17-10656S и 16-18699S; Моравскослезский край, № ДТ01-021358; РФФИ, проект № 15-29-02734; Государственное задание Зоологического института № АААА-А17-117030310322-3; СТОИМОСТЬ действия CM1307; и Министерство образования, молодежи и спорта Чешской Республики в Национальной программе технико-экономических обоснований I, проект LO1208 TEWEP.
Медицинский факультет Вашингтонского университета насчитывает 2100 штатных и добровольных врачей-преподавателей, которые также входят в медицинский персонал детских больниц Барнс-Еврей и Сент-Луис. Медицинский факультет — одно из ведущих медицинских исследовательских, учебных и лечебных учреждений в стране, которое в настоящее время занимает седьмое место в стране по версии U.

