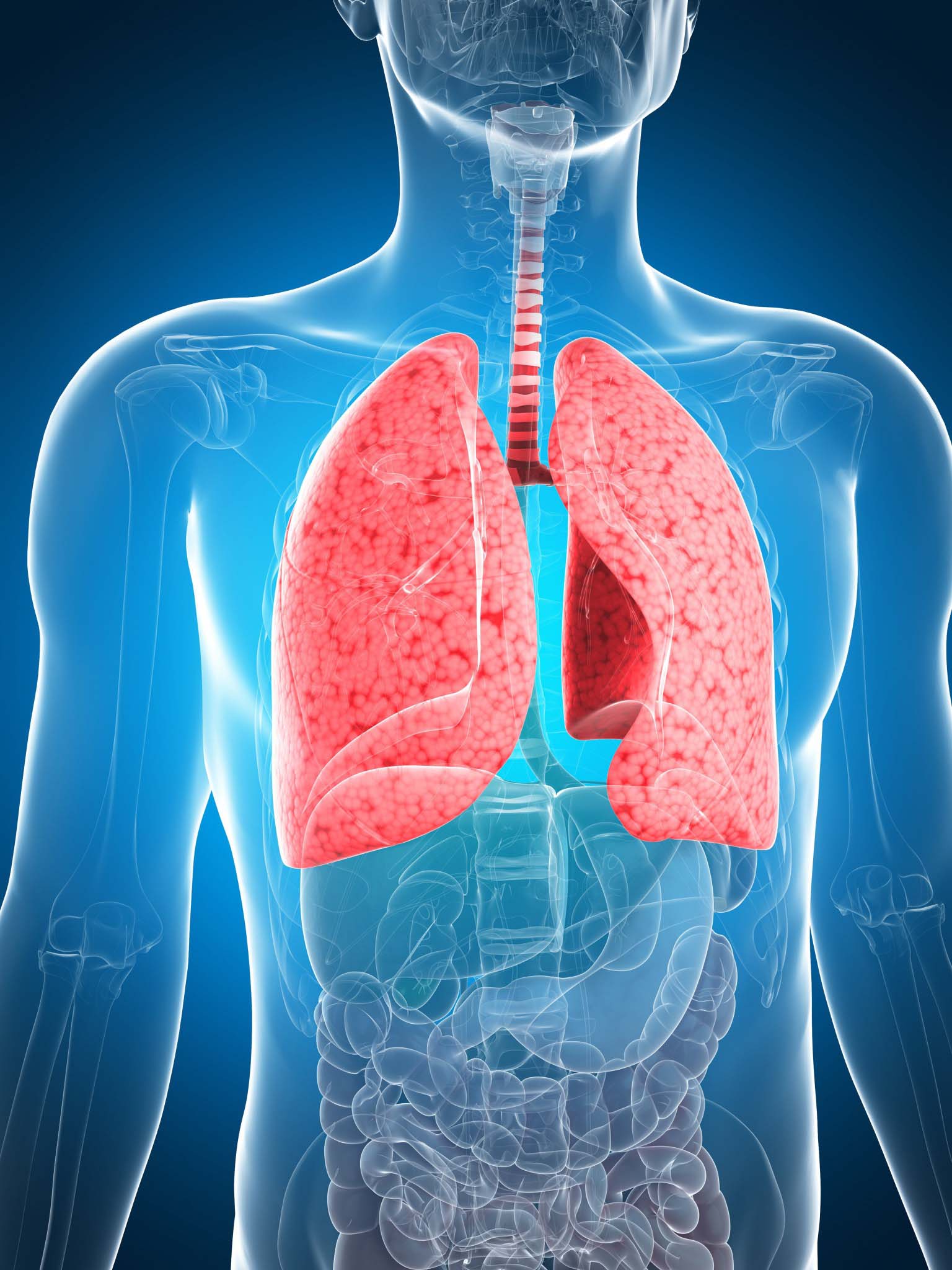
Врач-пульмонолог: чем занимается врач
Пульмонология – сравнительно новое направление медицины, которое особенно активно стало развиваться в начале ХХ века, когда ученые научились дифференцировать туберкулез и другие легочные заболевания. Несмотря на такую научную «молодость», пульмонология является одной из важнейших наук, поскольку она занимается изучением и лечением органов дыхательной системы. В современных условиях она тесно переплетается с такими отраслями как онкология и аллергология.
Пульмонолог – это врач, который занимается диагностикой и терапией патологий бронхов, легких, гортани и других органов дыхательной системы. Специалисты в этой отрасли также много внимания уделяют профилактическим мероприятиям.
Когда нужно обращаться к пульмонологу
Кашель – это симптом, который часто связывают с ангиной, гриппом или ОРВИ. Разумеется, если речь идет о сезонной респираторной инфекции, обращаться к пульмонологу необязательно.
Следует записаться на прием пульмонолога при наличии таких симптомов:
- Сухой или влажный кашель, который не прекращается в течение нескольких недель.
- Характерный кашель, который беспокоит пациента в основном по утрам и сопровождается вязкими выделениями. Хотя считается, что такой кашель в основном присущ курильщикам, на самом деле он возникает у всех, кто страдает хронической формой бронхита (например, у людей, которые работают на вредных производствах).
- Кашель сопровождается появлением одышки, которая возникает даже при незначительных физических нагрузках и в состоянии покоя. Если одышка сама по себе сопровождается затрудненным выдохом, это тоже должно стать поводом для обращения к врачу.
- Длительный кашель, при котором мокрота меняет цвет (например, становится выраженного желтого, розоватого или зеленого оттенка). Еще более тревожный симптом – появление в ней сгустков крови.

- Сонливость в течение дня, которая сопровождается сухостью во рту и гортани сразу после пробуждения.
- Кашель сопровождается болями в грудной клетке, которые усиливаются при глубоком вдохе и выдохе и др.
Очень часто запись к пульмонологу рекомендует терапевт, который либо обнаруживает какие-то изменения на флюорографии, либо затрудняется интерпретировать данные исследования.
Также записаться на прием к пульмонологу стоит аллергикам, если у них есть симптомы бронхиальной астмы: кашель носит приступообразный характер, сопровождается чиханием, слезотечением, зудом в глазах. В таких случаях пациент может испытывать ощущение нехватки воздуха, из-за этого появляются головные боли, нарушается сон.
Консультация пульмонолога рекомендуется и будущим мамам. Во время беременности у многих женщин обостряются хронические заболевания, в том числе и органов дыхания. Кроме того, перестройка гормональной системы может привести к нарушению функции легких. В то же время опытный врач в таких случаях поможет избавиться от неприятных симптомов, подобрав безопасные для матери и ребенка препараты или порекомендовав физиотерапевтические процедуры.
В то же время опытный врач в таких случаях поможет избавиться от неприятных симптомов, подобрав безопасные для матери и ребенка препараты или порекомендовав физиотерапевтические процедуры.
Людям, которые работают на вредных производствах, а также курильщикам рекомендуется проходить регулярный профилактический осмотр у пульмонолога с периодичностью 1-2 раза в год.
Кроме того, в международной практике есть еще ряд критериев, при которых консультация пульмонолога считается необходимой. Помимо уже упомянутого кашля и одышки, это еще и частые ОРВИ – больше, чем 3 раза в год.
Какими патологиями занимается пульмонолог?
Этот специалист занимается лечением таких заболеваний как:- бронхиты различной этиологии, в том числе и инфекционные,
- острая и хроническая форма пневмонии,
- различные заболевания легких (например, эмфизема, ХОБЛ),
- плевриты,
- наследственные патологии органов дыхательной системы,
- заболевания бронхов и легких, спровоцированные вредными факторами окружающей среды или травмами грудной клетки,
- грибковые поражения органов дыхания.

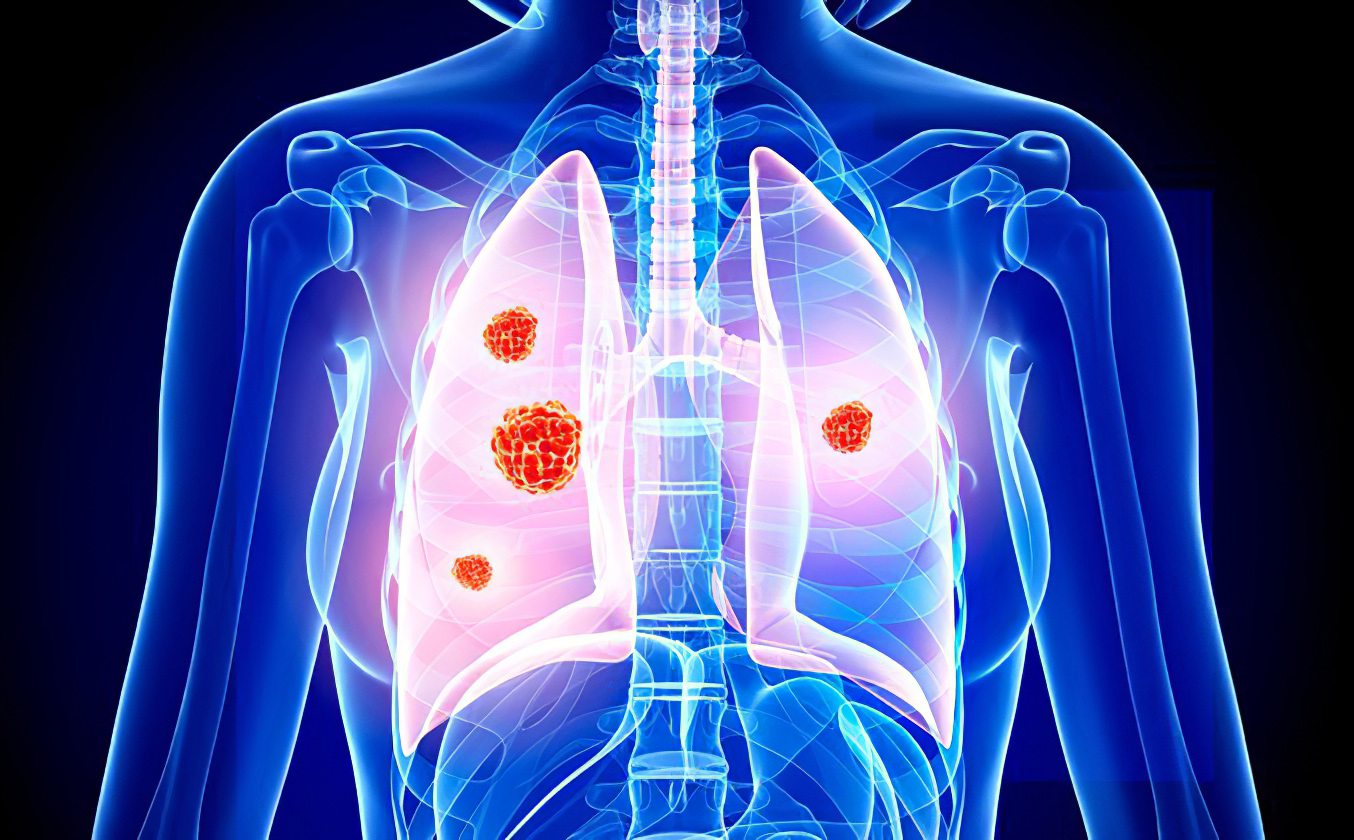
Также пульмонолог участвует в терапии онкологических заболеваний легких.
Проведение диагностики
Современная медицина использует самые разные методики для выявления заболеваний. Диагностика в пульмонологии состоит из нескольких этапов. Важную роль играет опрос больного, объективный осмотр с применением методов пальпации и перкуссии.
Однако все большее значение приобретают методы инструментальной диагностики. Пульмонолог может направить пациента на рентгенограмму органов грудной клетки, а в случае необходимости – и на компьютерную томографию, поскольку она является более информативным методом диагностики. Также проводятся такие исследования как спирография, которая показывает нарушения дыхания. Дополнительно может назначаться эхокардиография, ведь одышка может быть симптомом не только легочного, но и сердечного заболевания.
Важную роль играет и лабораторная диагностика, которая включает общий анализ крови, исследование сыворотки крови на наличие иммуноглобулинов (оно, например, необходимо аллергикам).
Поскольку очень часто описанные выше симптомы могут возникать при различных системных заболеваниях, пульмонолог может дополнительно направлять пациента на консультацию к аллергологу, эндокринологу, другим специалистам.
Как лечит пульмонолог?
Врач-пульмонолог лечение назначает разное. В некоторых случаях достаточно консервативного лечения, при котором применение антибактериальных и отхаркивающих препаратов может сочетаться с ингаляциями и физиотерапевтическими процедурами. В ряде случаев применяются эндоскопические методы, например, тогда, когда нет другой возможности очистить бронхи от слизи и гноя.
В нашей клинике прием пациентов ведет врач-пульмонолог Цапаева Мария Юрьевна – опытный специалист. Она проведет диагностику, назначит лечение, поможет подобрать дыхательную гимнастику или составить профилактическую программу.
Записаться на прием к врачу можно по тел 8(83159) 9-22-10.
Кто такой пульмонолог и что он лечит
Пульмонолог – это врач-терапевт, спецификой деятельности которого являются заболевания, связанные с патологией лёгких, дыхательных путей, плевры. Пульмонология – медицинское направление, которое охватывает все болезни органов дыхания. На консультацию к доктору, желательно, приходить с рентгеновскими снимками грудной клетки, ЭКГ, анализом крови для исследования лейкоформулы. Готовиться специально не нужно.
Если нет перечисленных результатов обследования, на первом же приёме специалист после осмотра пациента определится с методами первичной диагностики. Без объективного обследования поставить верный диагноз и назначить действенные препараты невозможно.
Какие органы и заболевания лечит врач пульмонолог
По сути, врач пульмонолог занимается исследованием и лечением органов дыхательной системы:
- Дыхательных путей: верхних (носоглотки) и нижних (гортани, бронхов, трахеи).
- Мышечных структур, необходимых в процессе дыхания.

- Лёгких.
- Висцеральной оболочки – плевры.
- Дыхательного центра в отделах мозга, связанного с функцией выполнения своевременных вдохов и выдохов.
Консультация пульмонолога необходима как при хронических недугах, так и в остром периоде заболевания. К доктору обращаются со многими болезнями:
- Обструктивными и хроническими бронхитами, сопровождающимися слабым выходом мокроты.
- Воспалениями лёгких (пневмонией).
- При дыхательной недостаточности.
- Плевритами (воспалительными процессами оболочек лёгкого).
- Бронхиальной астмой и астмой.
- При хронической обструктивной болезни лёгких.
- Абсцессами (гнойные состояния).
- Воспалением альвеол – мельчайшими структурами организма).
- Эмфиземами и эмпиемами.
- Также при пневмотораксе, гемотораксе, саркоидозе, муковисцидозе и других патологических изменениях.
Что лечит пульмонолог, мы разобрались. Врач также диагностирует туберкулёз, рак лёгкого, но лечением этих недугов занимаются фтизиатр и пульмонолог онколог соответственно.
В каких случаях обращаться к врачу?
Обращаться к специалисту нужно по направлению терапевта или при обнаружении одного из следующих симптомов:
- Появление непродуктивного надрывного кашля в сочетании с симптоматикой дыхательной недостаточности.
- Затяжной кашлевый рефлекс.
- Сильные острые боли в груди с усилением болевых ощущений во время дыхания.
- Видоизменение выделений при кашле: мокрота становится кровяной, может содержать гной или быть в виде розовой пены.
- Проявление спазмов в грудной области с затруднительными вдохами при резких запахах, смене температурного режима, в условиях пыльности.
- Высокая температура в сочетании с признаками интоксикации (слабость, потоотделение, одышка и т. д.
- Появление удушающих приступов ближе ко сну или ночью.
- Перехватывание дыхания, лорингоспазмы, продолжительный насморк с обильными выделениями.
Запись к врачу чаще происходит через терапевта, поскольку многие не знают кто такой пульмонолог. Если судить глобально, к такому узкому специалисту с обычным кашлем или насморком идти нет смысла, он занимается более серьёзными проблемами.
Если судить глобально, к такому узкому специалисту с обычным кашлем или насморком идти нет смысла, он занимается более серьёзными проблемами.
Методы диагностики
У доктора целый арсенал диагностических методов: от визуального исследования до аппаратных диагностик и обследования биоматериала.
В основном, диагностические процедуры состоят из:
- Методов лучевой диагностики – рентгена и рентгеноскопии. Первый выдаёт фотокартинку, во время второго можно провести диагностику в реальном времени, оценивая состояние больного.
- Компьютерной томографии – посрезовая картинка отдельных тканей поражённой структуры. К рассмотрению берут опухоли, абсцессы, гнойники, фиброзные кисты и т. д.
- Бронхоскопии – изучение слизистой изнутри с забором материала для обследования.
- Методов функциональной диагностики.
- Разных методик исследования биоматериала: от клинического анализа крови, бакпосевов до аллергических проб на ряд аллергенов и генетической диагностики для выявления мутаций.

После тщательной диагностики пульмонолог назначает адекватное лечение и подбирает соответствующие лекарства.
Методы лечения
Если после обследования врач пульмонолог выбирает радикальное лечение, пациента готовят к оперативному вмешательству. В обратном случае проводится медикаментозная терапия или лечение на аппаратах, больной соблюдает диету, определённый режим дня и т. д.
В зависимости от симптомов и поставленного диагноза, лечение проходит в виде:
- антибактериальной терапии;
- противовоспалительной терапии;
- назначения противокашлевых средств;
- приёма специальных препаратов для расширения бронхов и исключения бронхоспазмов;
- введения антисептических средств внутрь эндоскопическим методом или с привлечением плевральной пункции.
В качестве аппаратного лечения можно задействовать: электрофорез, бронхоскопию, прогревание.
Профилактические консультации
Также пульмонолог проводит профилактические консультации для хронических больных. Доктор исследует текущее состояние, помогает продлить период ремиссии и сгладить симптоматику, назначает терапию в период обострений.
Доктор исследует текущее состояние, помогает продлить период ремиссии и сгладить симптоматику, назначает терапию в период обострений.
Врач советует пациентам отказаться от курения, не провоцировать состояние присутствием аллергенов, следить за рационом питания, тренировать органы дыхания. Важно защитить больного от инфекций с помощью разъяснения правил личной гигиены, вакцинации. Целесообразным являются процедуры, закаляющие организм и активный образ жизни.
Пульмонология в Терапевтической клинике ЕМС
- Широкий спектр рентгенологических, спирографических, инструментальных (в т.ч. бронхоскопия) и лабораторных исследований для диагностики заболеваний легких
- Компьютерная томография легких проводится круглосуточно
- Опытные эндоскописты-бронхологи
- Лечение в соответствии с международными и российскими протоколами, включает современные методы лекарственной и нелекарственной терапии (в т.ч. физиотерапевтическое лечение)
- Мультидисциплинарный подход к диагностике и лечению в рамках многопрофильного медицинского центра
Пульмонология — раздел медицины, посвященный диагностике и лечению заболеваний легких и дыхательных путей. Пульмонолог – терапевтическая специальность. При необходимости хирургического вмешательства операции проводят торакальные хирурги.
Пульмонолог – терапевтическая специальность. При необходимости хирургического вмешательства операции проводят торакальные хирурги.
Пульмонолог – это врач, который лечит широкий спектр болезней, таких как:
- Бронхиальная астма
- Хронический бронхит
- ХОБЛ (хроническая обструктивная болезнь легких)
- Пневмония
- Бронхоэктазы
- Интерстициальные болезни
Когда требуется консультация пульмонолога?
Наиболее частые симптомы, которые могут свидетельствовать о заболеваниях легких и дыхательных путей, — это кашель, свист и хрип в груди, одышка. Однако эти симптомы неспецифичны, и могут указывать на другие заболевания. Так, по статистике, на первом месте по причинам кашля стоят патологии носа, на втором – желудка, и лишь на третьем – легочные заболевания.
Именно поэтому при появлении подобных симптомов мы рекомендуем в первую очередь обращаться к врачам общей практики (GP), которые проведут необходимые исследования, и при подозрении на легочные патологии порекомендуют записаться на консультацию к пульмонологу ЕМС (прием платный).
Диагностика (Прием пульмонолога в EMC)
Прием пульмонолога включает проведение диагностики. В ЕМС представлен широкий спектр рентгенологических, спирографических, инструментальных (в т.ч. бронхоскопия) и лабораторных исследований для диагностики заболеваний легких. Компьютерная томография (КТ) легких в клиниках проводится круглосуточно. В состав ЕМС входят собственные клинико-диагностическая и гистологическая лаборатории, что позволяет проводить исследования в короткие сроки и получать точные результаты. В ЕМС работают высококвалифицированные эндоскописты-бронхологи.Заболевания легких — особенности лечения в EMC
Лечение у пульмонолога EMC проходит в соответствии с международными и российскими протоколами и включает в себя современные методы лекарственной и нелекарственной терапии (в т.ч. физиотерапевтическое лечение). В ЕМС ведут прием лучшие врачи-пульмонологи Москвы. Мультидисциплинарный подход в рамках многопрофильного медицинского центра позволяет осуществлять эффективное лечение даже в самых сложных случаях. При необходимости в принятии решения относительно тактики ведения пациента участвует аллерголог.
При необходимости в принятии решения относительно тактики ведения пациента участвует аллерголог.
Факторы риска и профилактика заболеваний легких
Не секрет, что курение и избыточный вес негативно влияют на легкие и дыхательные пути, поэтому справедливо сказать о том, что во многих случаях пациенты сами провоцируют развитие легочных заболеваний. Кроме того, не стоит забывать об экологической обстановке, в которой мы живем. Помимо этого, существует ряд наследственных, генетических факторов. Именно поэтому в пульмонологии ключевую роль играет своевременная и точная диагностика.
Специалисты ЕМС рекомендуют ежегодно проводить флюорографию/низкодозовую КТ легких для ранней диагностики и исключения таких заболеваний, как туберкулез и опухоли легких.
Кто такой пульмонолог и какие заболевания он лечит
-
Какие болезни лечит пульмонолог
-
В каких случаях нужно обращаться к пульмонологу
-
Как ставят диагноз
-
Методы лечения
-
Профилактика
Пульмонолог – специалист, который выявляет и лечит заболевания органов дыхания. В эту категорию входят патологии дыхательных путей, легких, плевры. Как отдельная отрасль медицины пульмонология начала свое существование лишь в 20-м веке. Ранее болезнями органов дыхания занимались терапевты, хирурги. В настоящее время пульмонологи работают в тесной связи со специалистами других профилей. В первую очередь, это — фтизиатры, которые занимаются лечением туберкулеза.
В эту категорию входят патологии дыхательных путей, легких, плевры. Как отдельная отрасль медицины пульмонология начала свое существование лишь в 20-м веке. Ранее болезнями органов дыхания занимались терапевты, хирурги. В настоящее время пульмонологи работают в тесной связи со специалистами других профилей. В первую очередь, это — фтизиатры, которые занимаются лечением туберкулеза.
Если заболевание дыхательной системы создает угрозу для жизни пациента, к процессу лечения подключается реаниматолог, который снимает острое состояние. Когда человек нуждается в операции, им занимается торакальный хирург.
Если на приеме у пульмонолога диагностированы заболевания верхних дыхательных путей, врач дает направление к ЛОРу. При нарушении функций дыхательного аппарата на фоне аллергической реакции пациенту требуется консультация аллерголога. Отдельным направлением в пульмонологии является лечение опухолевых процессов в тканях органов дыхательной системы. Им занимается пульмонолог-онколог.
В группу заболеваний входят:
Симптомы пульмонологических заболеваний схожи с простудой, патологиями ЛОР-органов. В большинстве случаев пациенты обращаются к терапевту или отоларингологу, прежде чем попасть на прием к пульмонологу.
Все легочные заболевания условно делятся на две группы: обструктивные и рестриктивные. К обструктивным относят бронхит, астму, эмфизему, муковисцидоз. Общим между этими патологиями является то, что они вызывают трудности при выдыхании воздуха. Скорость выдоха ниже, чем у здоровых людей, в легких остается больше воздуха. Симптомы обструктивных заболеваний усиливаются при физических нагрузках, когда дыхание учащается.
При рестриктивных болезнях нарушается процесс вдоха. Это происходит в связи с невозможностью легких расшириться до нормального объема. Такое явление происходит при легочном фиброзе, мышечной дистрофии, болезнях позвоночника.
Во всех случаях патологии проявляют себя одышкой, которая усиливается при физической активности.
В каких случаях нужно обращаться к пульмонологуОсновным признаком нарушения работы бронхолегочной системы является кашель. Рекомендуется консультация пульмонолога в следующих случаях:
-
у пациента сильный надрывный кашель без слизистых выделений с признаками затрудненного дыхания;
-
кашель сохраняется длительное время, он может быть сухим или с мокротой;
-
в мокроте обнаружены примеси крови, гноя;
-
кашель сопровождается болью в груди, при вдохе ощущения усиливаются;
-
у пациента на фоне кашля наблюдаются другие симптомы: температура, слабость, повышенное потовыделение, одышка;
-
кашель усиливается в вечернее и ночное время, появляются признаки удушья;
-
при воздействии холода, тепла, пыли и других факторов пациент испытывает проблемы с дыханием;
-
наблюдаются постоянные обильные выделения из носа, при глубоком вдохе возникают спазмы.

Причин возникновения бронхолегочных заболеваний достаточно много. В первую очередь, это курение, дыхание загрязненным воздухом. В группе риска — работники вредного производства, жители крупных городов с плохой экологической обстановкой.
Многие болезни носят инфекционный характер: их вызывают вирусы и бактерии. Тяжелее всего такие заболевания протекают у детей и людей пожилого возраста. При наличии хронических болезней верхних дыхательных путей, частых простудах также повышается вероятность бронхолегочной патологии.
Она может возникнуть при приеме лекарственных препаратов, прохождении лучевой терапии. Некоторые заболевания имеют врожденный характер. К данной группе относят муковисцидоз, который является генетической патологией. Она может проявлять себя с первых дней жизни или уже во взрослом возрасте. С неблагоприятной наследственностью также связывают развитие саркоидоза, который представляет собой аутоиммунное заболевание. Оно поражает легкие и другие органы.
Оно поражает легкие и другие органы.
Для диагностики пульмонологического заболевания пациенту назначается комплекс процедур. В первую очередь речь идет об исследовании биоматериала: крови и мокроты. Общеклинический анализ крови показывает уровень лейкоцитов и эритроцитов. По нему определяют, есть ли в организме воспалительное заболевание, в какой фазе оно находится. Также могут быть назначены аллергопробы, которые помогают подтвердить или исключить аллергическую природу болезни.
Информативным является бакпосев мокроты. По нему определяют возбудителя патологии и подбирают антибактериальную терапию.
При подозрении на муковисцидоз назначаются специальные диагностические исследования, которые помогают выявить мутации генов.
Из аппаратных методов чаще всего используют рентгенографию и рентгеноскопию. Оба относятся к методам лучевой диагностики. При рентгенографии врач получает снимок грудной клетки и оценивает текущее состоянии. При рентгеноскопии вместо фотографии получается видео. По нему можно оценить работу органа в процессе дыхания.
При рентгеноскопии вместо фотографии получается видео. По нему можно оценить работу органа в процессе дыхания.
Аналогичными возможностями обладает бронхоскопия, благодаря которой можно рассмотреть слизистую бронхов, взять образцы биоматериала. При подозрении на кисту, опухоль пациенту показана компьютерная томография.
Во время осмотра пациента врач использует методы функциональной диагностики для оценки объема вдоха, скорости дыхания и других показателей.
Методы леченияДля лечения пульмонологических заболеваний используются хирургические методы, лекарственная терапия, физиотерапевтические процедуры. По результатам обследования врач подбирает комплексное лечение, которое направлено на облегчение симптомов и устранение их причины.
При воспалительных заболеваниях бактериальной этиологии назначают антибактериальные препараты. Они используются в лечении бронхитов и пневмоний. Нестероидные противовоспалительные средства показаны при отеках.
Для улучшения отделения мокроты назначают отхаркивающие препараты. Также используются препараты для устранения бронхоспазма, средства для расширения бронхов, подавления кашлевого рефлекса. При плевритах и пневмотораксе показано введение в пораженную область антисептических средств. Оно выполняется при помощи эндоскопии или методом плевральной пункции. Предварительно торакальный хирург откачивает жидкость или гной, затем приступает к антисептической обработке полости.
Из физиотерапевтических процедур используется электрофорез, прогревания, ингаляции, лечебная физкультура, дыхательная гимнастика.
Многие пульмонологические заболевания несут прямую угрозу для жизни. Например, пневмония — воспаление легких — занимает шестое место по количеству смертей во всем мире. Пациенту с тяжелыми патологиями может потребоваться срочная хирургическая помощь, кислородная терапия. В данном случае лечение производится на базе медицинского учреждения.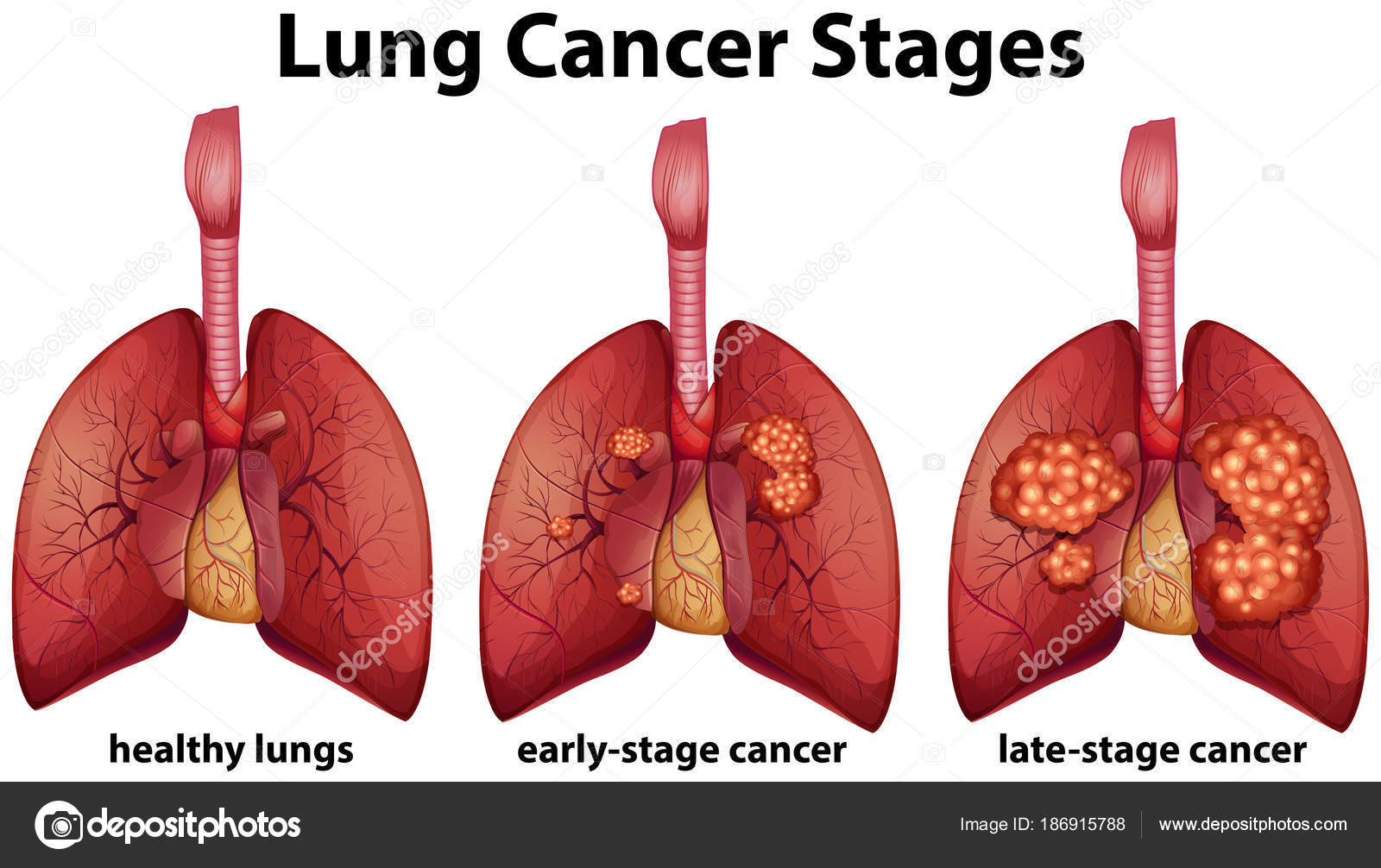 При хронической патологии врач подбирает индивидуальную программу лечения, которая направлена на купирование симптомов и профилактику обострений.
При хронической патологии врач подбирает индивидуальную программу лечения, которая направлена на купирование симптомов и профилактику обострений.
Профилактика бронхолегочных заболеваний заключается в отказе от вредных привычек, соблюдении мер безопасности при работе в неблагоприятных условиях (пыль, химические испарения), регулярном прохождении флюорографии для оценки состояния органов дыхания.
Для защиты от инфекционных заболеваний важно соблюдать правила личной гигиены, принимать меры безопасности в период неблагоприятной эпидемиологической обстановки. Закаливание, правильное питание — важные факторы, которые помогают сохранить хороший иммунитет и снизить риск заражения.
Для тренировки дыхательной системы полезно заниматься физическими упражнениями, петь, играть на духовых инструментах.
Если у пациента диагностированы патологические процессы в легких, важно регулярно проходить профилактические осмотры, соблюдать рекомендации лечащего врача.
Врач Пульмонолог. Запись на прием, цены на услуги, отзывы. Клиника МЭДИС. Санкт-Петербург.
Информация
Пульмонология – раздел медицины, занимающийся изучением, диагностикой и лечением заболеваний лёгких и дыхательных путей. Врач-пульмонолог занимается всеми проблемами, которые связаны с нарушениями в дыхательных путях и лёгких.
Заболевания органов дыхания очень распространены и разнообразны по своим проявлениям. Частой причиной их развития являются бактерии, вирусы и другие микроорганизмы (грибы, паразиты). Заболевания лёгких могут вызвать химические вещества (например, курение, вредные условия на производстве, экологические факторы). Заметно повышают риск развития бронхо-лёгочных заболеваний отягощённая наследственность, ослабление местного и общего иммунитета.
Наиболее часто у врача-пульмонолога наблюдаются и получают лечение пациенты со следующими заболеваниями:
- бронхиальная астма
- пневмония
- острые и хронические бронхиты
- хроническая обструктивная болезнь лёгких
- аспергилломикоз
Наименее часто (но в последнее время число данных заболеваний растёт) встречаются интерстициальные поражения лёгких:
- саркоидоз
- идиопатический фиброзирующий альвеолит
- поражение лёгких при системных заболеваниях соединительной ткани (системная красная волчанка, склеродермия, полимиозит, дерматомиозит)
- болезни лёгких, вызванные лекарственными средствами
- лёгочные гипертензии
- гранулематоз Вегенера
- поражение лёгких при аллергических реакциях
Также к пульмонологу могут обратиться пациенты с лёгочными жалобами, связанными с особыми условиями труда (длительный кашель, сухой или с выделением мокроты, Это так называемые «профессиональные» болезни лёгких: асбестоз, пневмокониоз шахтёров, биссиноз, профессиональная астма и другие.
На обследование и лечение к врачу-пульмонологу направляют терапевт и другие врачи-специалисты в случаях, если назначенное лечение неэффективно, болезнь протекает нетипично, возникли осложнения. Наблюдение и лечение у пульмонолога требуется пациентам, перенёсшим тяжёлое заболевание лёгких, а также при врождённой и хронической лёгочной патологии.
К врачу-пульмонологу следует обратиться при следующих симптомах:
- кашель, длительно не проходящий кашель, кашель по утрам (кашель курильщика)
- одышка в покое или при физической нагрузке
- приступы удушья и затруднённого дыхания
- выделение мокроты
- выделение мокроты необычного цвета: жёлтая, зелёная, красная, коричневая
- боли в грудной клетке при дыхании
Очень важно не упустить начало таких хронических заболеваний, как хронический бронхит и бронхиальная астма. При своевременном обращении к врачу лечение будет значительно более лёгким, эффективным и поможет предотвратить прогрессирование заболевания. Одышка с затрудненным выдохом может быть первым симптомом бронхиальной астмы и обструктивного бронхита.
Одышка с затрудненным выдохом может быть первым симптомом бронхиальной астмы и обструктивного бронхита.
В настоящее время часто встречающейся патологией является хроническая обструктивная болезнь лёгких. Риск её возникновения наиболее высок у курильщиков, особенно с длительным стажем курения. Это состояние опасно тем, что со временем осложняется эмфиземой лёгких и дыхательной недостаточностью, низким качеством жизни.
На приеме врач-пульмонолог выслушает жалобы, расспросит о перенесенных заболеваниях, условиях дома и на работе, вредных привычках, наследственной патологии. После осмотра врач назначит необходимое обследование (рентген грудной клетки, лабораторные исследования и др.), лечение, даст рекомендации по образу жизни. При необходимости, прямо на приеме, пульмонолог проведет исследование функции внешнего дыхания.
Исследование функции внешнего дыхания (спирометрия, спирография).
Отзывы
Добрый день, хочу поблагодарить терапевта Лукьянову Оксану Николаевну. Спасибо ей огромное за её профессионализм, четкое и внимательно отношение, грамотное и эффективное лечение ОРВИ и бронхита.Замечательный специалист!
Спасибо ей огромное за её профессионализм, четкое и внимательно отношение, грамотное и эффективное лечение ОРВИ и бронхита.Замечательный специалист!
Анна
Здравствуйте,проходил лечение пневмонии у терапевта Лукьянова О.Н С 15.10.16-25.10.26! Оксана Николаевна очень квалификацированный специалист,знает своё дело! Это лучший врач,кто когда-либо меня лечил,правда) И как человек,женщина очень хорошая и приятная! Лечиться у такой одно удовольствие) Спасибо большое вашей клинике Медис,таким прекрасным отзывчивым сотрудником! Вы все супер!)
Иван
Я очень благодарна доктору Лукьяновой Оксане Николаевне, которая работет в клинике «МЭДИС». Великолепный специалист, настоящий ДОКТОР. У меня очень запущена астма и только Оксана Николаевна подошла со знанием дела, квалифицированно. Во-первых, сняла приступ, направила на правильное лечение, увидела то, что годами не могли увидеть врачи мои, местные с поликлиники, и даже во 2й городской больнице. Меня только гормонами пичкали, а мне было только хуже от их лечения. Оксана Николаевна разобралась и назначила правильное лечение, направила на дополнительные анализы и у меня появилась надежда на спасение, я Д Ы Ш У. Продолжаю лечиться , нахожусь под наблюдением. Низкий поклон дорогая спасительница Оксаночка Николаевна Лукьянова. СПАСИБО!!! И девочкам спасибо из МЭДИСА, Верочке на рецепшене на Петропавловской 4, и медсестрам , которые делали капельницы. Клиника очень хорошая, люди приветливые. Всем рекомендую попадать к таким врачам и в такую клинику. С уважением пациентка Татьяна Васильевна
Оксана Николаевна разобралась и назначила правильное лечение, направила на дополнительные анализы и у меня появилась надежда на спасение, я Д Ы Ш У. Продолжаю лечиться , нахожусь под наблюдением. Низкий поклон дорогая спасительница Оксаночка Николаевна Лукьянова. СПАСИБО!!! И девочкам спасибо из МЭДИСА, Верочке на рецепшене на Петропавловской 4, и медсестрам , которые делали капельницы. Клиника очень хорошая, люди приветливые. Всем рекомендую попадать к таким врачам и в такую клинику. С уважением пациентка Татьяна Васильевна
Татьяна Васильевна
Этот врач действительно высокий специалист в своей области. При моем хроническом бронхите и заболеваниях желудочно-кишечного тракта, мне далеко не все лекарства подходят. Оксана Николаевна всегда находит альтернативный метод лечения. Она вылечила мне бронхоспазм, сопровождавшийся приступами удушья после сна, при просыпании я не мог вдохнуть какое-то время. Она нашла лекарство, которое реально помогло! Огромное ей спасибо!!!
Алексей
Очень благодарен Оксане Николаевне за то что крайне внимательно выслушала, разобралась, диагностировала и помогла в лечении за 2 недели. Очень подробно объяснила что происходит, как, что и зачем делать. Другой врач не смог с этим справиться за 4 месяца.
Очень подробно объяснила что происходит, как, что и зачем делать. Другой врач не смог с этим справиться за 4 месяца.
14.05.2019
Евгений
Мне понравилось, что все быстро, четко и по делу! Лишнего времени доктор не потратила. Рекомендации мне ее помогают, диагноз мне поставил доктор — обострение на фоне возникновения аллергии на кота. Врач порекомендовал мне лечение: капельницы и таблетки, и назначил повторный прием. Оксана Николаевна провела осмотр, на обследования она не направляла меня. С собой я не приносила никаких исследований. Мы с доктором побеседовали, я рассказала ей про причину, а она мне объяснила уже в чем дело. По моему мнению, Лукьянова О.Н. активная, доброжелательная и быстро поняла в чем дело. Прием начался раньше назначенного времени, доктор не отвлекалась. Все ее назначения мне были понятны, врач объяснила как нужно принимать препарат. Мне все понравилось! От лечения мне стало гораздо лучше!
13.09.2019
Ольга
Оксана Николаевна (Лукьянова) — профессиональный, внимательный, знающий свое дело доктор. Спасибо большое ещё и за человеческое внимательное отношение к людям.
Спасибо большое ещё и за человеческое внимательное отношение к людям.
13.02.2020
Ирина
Была на первично приеме. Отмечу такие качества как, оперативность и профессионализм. Быстро доктор Оксана Николаевна определила проблему. Все мне пояснила. На все вопросы ответила и назначила лечение. Времени достаточно уделила и не торопилась. Я осталась довольна посещением.
02.11.2017
Ольга
Выражаю благодарность терапевту Лукьяновой. Уже не первый раз лечит меня и успешно. Каждый раз ставит, как мне кажется, правильный диагноз, заботится о здоровье пациента, назначая внимательно лекарственные препараты, которые дают успешный результат. От того что болею удовольствие не получаю, однако грамотный сотрудник вашей клиники просто доставляет удовольствие своей работой. Стоит отметить, что хороших врачей со знаниями очень мало. Но я считаю, что данный врач профессионал высшей категории, так как лечит меня уже давно и успешно. Очень надеюсь, что вы в своей клинике сохраните его, и я смогу и в дальнейшем обращаться именно к нему. Прошу ознакомить сотрудника с моим отзывом, считаю, что положительная работа должна не остаться без внимания руководства клиники Мэдис.
Прошу ознакомить сотрудника с моим отзывом, считаю, что положительная работа должна не остаться без внимания руководства клиники Мэдис.
01.12.2016
Антон Евгеньевич
Был на приёме 07/08/2020.Грамотно и профессионально сделали анализы,дали нужные рекомендации.Рекомендую.Спасибо.
08.08.2020
Сергей
Сегодня был на приеме у терапевта Лукьяновой. Унес с собой исключительно приятное впечатление. Очень компетентный и доброжелательный, искренне доброжелательный специалист.
03.02.2015
Николай
Впечатления от работы Лукьяновой О.Н. исключительно положительные: быстро и без суеты осмотрела, выдала назначения, не стала преждевременно выписывать антибиотики (что особенно приятно) и отправила на дополнительную консультацию к лору. Отдельно хочу отметить, что опрос по заболеваниям врач провела просто прекрасно, задала все необходимые опросы, чем зачастую пренебрегали терапевты, к которым я обращалась. Слушала внимательно и ничего не упустила.
01.02.2019
Ксения
Врач очень квалифицированный. Сразу было назначено нужное лечение абструктивного хронического бронхита. Через неделю почувствовала себя лучше. В грудной клетке стало меньше болеть. Хорошо меня прослушала. Сразу определила, что есть свисты в грудной клетке. После вызова на дом скорой по ОМС, посещений поликлиники, сразу определила, что надо снимать абструкции как можно быстрее. Супер врач!
Людмила Николаевна
Оксана Николаевна два года назад порекомендовала мне препарат с действующим веществом монтелукаст. Всю жизнь мучался с аллергией, а теперь — ну, небольшие неприятности весной берёза доставляет, терпимо. Огромное ей спасибо!
Максим
Врач-пульмонолог: «Лёгкие лучше не испытывать на прочность» | Здоровая жизнь | Здоровье
Об этом и многом другом мы беседуем с главным пульмонологом ФМБА России, директором Научно-исследовательского института пульмонологии, доктором медицинских наук Александром Аверьяновым.
Число больных растёт
Татьяна Гурьянова, «Здоровье АиФ»: Александр Вячеславович, какие заболевания лёгких чаще всего появляются в медицинских картах жителей России?
Александр Аверьянов: В них доминируют три основных заболевания: хроническая обструктивная болезнь лёгких (ХОБЛ), бронхиальная астма и пневмония. Есть болезни, с которыми врачи встречаются реже. Например, идиопатический лёгочный фиброз – быстро прогрессирующее заболевание, при котором в лёгких образуются рубцы, что приводит к развитию дыхательной недостаточности, а в дальнейшем – к летальному исходу. Или саркоидоз – системное заболевание, которого боятся и пациенты, и врачи, хотя эта болезнь часто протекает доброкачественно и порой даже не требует лечения, а лишь наблюдения.
– Людей с болезнями лёгких стало больше?
– Увы. Растёт число больных ХОБЛ и раком лёгких, на рак приходится 10–15% всех лёгочных заболеваний.
– И это несмотря на глобальную кампанию борьбы с курением, успешно стартовавшую у нас в стране четыре года назад?
– От снижения числа курящих, которое наблюдается в последнее время, невозможно ожидать быстрой отдачи. Ведь болезни лёгких развиваются в результате длительного потребления табака, поэтому и снижение заболеваемости, с ним связанное, будет отсроченным. Но благодаря усилиям государства ситуация, конечно, будет меняться к лучшему.
Ведь болезни лёгких развиваются в результате длительного потребления табака, поэтому и снижение заболеваемости, с ним связанное, будет отсроченным. Но благодаря усилиям государства ситуация, конечно, будет меняться к лучшему.
Атака на пневмонию
– Среди причин ухода из жизни наших сограждан по-прежнему значится пневмония. Почему, несмотря на прогресс медицины, эту болезнь никак не удаётся победить?
– Нужно различать два вида пневмоний. Внебольничную (среди её возбудителей доминирует пневмококк) эффективно предотвращает пневмококковая вакцина (она внесена в Национальный календарь прививок*).
С внутрибольничной пневмонией, нередко возникающей у послеоперационных и лежачих больных, всё сложнее: больничная флора, которая их вызывает, очень агрессивна и устойчива ко многим антибиотикам. Но и у этой проблемы есть решение: ранняя реабилитация и активизация больных как в отделениях интенсивной терапии, где находятся послеоперационные пациенты, так и в обычных отделениях, где люди вынуждены долгое время пребывать на постельном режиме.
– Это работает?
– Работает. Мы убедились в этом на примере нашей клиники ФНКЦ ФМБА России (бывшая 83‑я КБ ФМБА России), которая теперь является основной базой НИИ пульмонологии. Оснастив в 2013–2014 годах палаты реанимации и интенсивной терапии реабилитационным оборудованием, введя в штат методистов‑реабилитологов и применив программы ранней активизации пациентов, мы только за один год снизили число внутрибольничных пневмоний в 3 раза! На столько же уменьшилось и потребление антибиотиков.
Новые возможности
– Сегодняшняя медицина становится очень технологичной. Пульмонология – не исключение?
– Да. У нас появились новые диагностические возможности, благодаря которым в течение суток можно идентифицировать возбудителя заболевания и определить его лекарственную устойчивость. Активно развиваются и эндобронхиальные диагностические технологии.
– Речь о пугающей многих больных бронхоскопии?
– Сейчас она уже перестала быть пугающей. Её делают в условиях медикаментозного сна. Правда, к сожалению, эта удобная для пациентов и врачей технология пока не покрывается полисом ОМС.
Её делают в условиях медикаментозного сна. Правда, к сожалению, эта удобная для пациентов и врачей технология пока не покрывается полисом ОМС.
Другое перспективное диагностическое направление – эндобронхиальное УЗИ, во время которого больному в бронхи вводится ультразвуковой датчик, позволяющий точно определить расположение очага, из которого нужно взять образец ткани. Развиваются и методы навигационной биопсии, но они пока доступны лишь пациентам ведущих федеральных клиник.
– А что с лекарствами?
– Если речь идёт о дорогостоящем лечении, увы, здесь тоже всё упирается в возможности того или иного региона. Сложная ситуация, к примеру, сложилась с больными идиопатическим лёгочным фиброзом. До недавнего времени их выживаемость была ниже, чем при большинстве форм рака. Но благодаря новым препаратам, замедляющим развитие болезни, удалось увеличить продолжительность и качество жизни таких больных. Однако доступны эти препараты пока немногим. Надеюсь, что государство всё же пойдёт навстречу таким больным и обеспечит им инновационное лечение.
Надеюсь, что государство всё же пойдёт навстречу таким больным и обеспечит им инновационное лечение.
Кашель – не повод
– А пульмонологическая помощь в России доступна?
– Она далека от идеала. На всю страну у нас чуть больше 1700 врачей-пульмонологов. Правда, обращаться к пульмонологу нужно далеко не всегда.
– Даже с кашлем?
– Кашель кашлю рознь. Ведь этот симптом может быть вовсе не связан с заболеваниями лёгких, а может быть вызван, например, приёмом препаратов, снижающих давление, – ингибиторов ангиотензипревращающего фермента (АПФ). 15% таких больных приходят к врачу с жалобами на кашель. Но разобраться с этим должен всё же думающий, внимательный терапевт.
– Есть ли надёжные методы профилактики болезней лёгких?
– Они просты: здоровый образ жизни, отказ от курения и других нефизиологичных нашему организму воздействий (ароматизаторов, синтетических добавок). Ведь лёгкие – это единственный внутренний орган, который постоянно находится во взаимодействии с внешней средой. На прочность их лучше не испытывать.
На прочность их лучше не испытывать.
Когда обращаться к пульмонологу
Это обязательно нужно сделать, если:
- участковый терапевт не смог поставить вам диагноз, если назначенное им лечение не приносит облегчения;
- есть изменения в лёгких на компьютерной томографии, которые сложно интерпретировать врачу первичного звена;
- кашель длится больше 8 недель;
- появилась кровь в мокроте;
- вы испытываете одышку при повседневной активности: когда поднимаетесь по лестнице, например.
*Прививку против пневмококковой инфекции получают дети в возрасте 2 и 4,5 месяца (ревакцинация в 15 месяцев), взрослые из групп риска, включая лиц, подлежащих призыву на военную службу, а также лица старше 60 лет, страдающие хроническими заболеваниями лёгких.
Пульмонолог в Челябинске — платный прием и консультацию у хорошего врача-пульмонолога
Безобидные предвестники серьезных заболеваний или когда необходимо проверяться у пульмонолога?
Многие люди напрасно не придают большого значения кашлю и одышке. Иногда на первый взгляд безобидные проблемы являются симптомами серьезных заболеваний. Просто запишитесь на прием к специалисту и проверьте дыхательную систему!
Иногда на первый взгляд безобидные проблемы являются симптомами серьезных заболеваний. Просто запишитесь на прием к специалисту и проверьте дыхательную систему!
Кто лечит болезни легких и горла?
Современная пульмонология – это направление медицины, сосредоточенное на изучении заболеваний дыхательной системы. Пульмонолога можно назвать терапевтом узкого профиля, который занимается диагностикой и лечением:
- бронхита;
- злокачественного плеврита;
- пневмонии;
- лихорадки неизвестной этимологии;
- фарингит;
- ринит;
- и другие заболевания.
В сферу изучения врача данной специализации входят легкие, трахея, гортань, придаточные пазухи носа и другие органы дыхательной системы. Людям из группы риска необходимо регулярно посещать этого специалиста для прохождения профилактических осмотров. К числу последних относятся курильщики и представители «вредных» профессий – основной костяк данной категории пациентов составляют сотрудники промышленных предприятий.
Причины для обращения
Вы сами можете определить, когда необходима консультация у специалиста по характерным симптомам. Пройти осмотр рекомендуется при появлении:
- сильного кашля;
- болей в области грудной клетки;
- затрудненности дыхания на вдохе или выдохе;
- одышки в состоянии покоя;
- изменений в легких, которые обнаружены в результате флюорографического исследования на рентгеновском снимке.
Ребенка с подобными симптомами необходимо показать специалисту «детского» профиля. В клинике Вся Медицина прием ведет высококвалифицированный врач пульмонолог.
Платная консультация пульмонолога
Не бойтесь доверять свое здоровье специалистам частного медцентра, которые позволят сэкономить не только ваше время, но и уберечь здоровье. У государственных учреждений здравоохранения наблюдается недостаток врачей узкого профиля на протяжении многих лет. Иногда пациентам сначала приходится обращаться к терапевту, который выписывает направление в больницу и только через месяц или более наступает дата приема. Иногда такое промедление недопустимо, поэтому из-за недостатка квалифицированного персонала многие пациенты приходят в частные клиники Челябинска.
Иногда такое промедление недопустимо, поэтому из-за недостатка квалифицированного персонала многие пациенты приходят в частные клиники Челябинска.
Преимущества Клиники Вся Медицина:
Вам необходимо попасть на прием к пульмонологу в Челябинске? Наберите номер Клиники Вся Медицина и выберите удобное время для визита! Наша клиника предлагает множество преимуществ:
- высококвалифицированный персонал;
- современное диагностическое оборудование;
- эффективные методики лечения;
- выбор удобного времени приема;
- доступная цена приема;
- индивидуальный подход к каждому пациенту.
Благодаря большому опыту наши специалисты добиваются результатов даже в сложных случаях. Вы хотите проверить дыхательную систему или выяснить причину подозрительных симптомов? Тогда позвоните нам прямо сейчас 240-03-03!
Регенерация и восстановление в заживающем легком
Clin Transl Immunology. 2020; 9 (7): e1152.
2020; 9 (7): e1152.
Эндрю Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Джо Яса
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Микаэла Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Автор, ответственный за переписку. * Переписка
* Переписка Эндрю Лукас, Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт, Вашингтон 6009, Австралия.
Эл. Почта: [email protected],
Поступила в редакцию 3 декабря 2019 г .; Пересмотрено 26 мая 2020 г .; Принята в печать 10 июня 2020 г.
Авторские права © 2020 Авторы. Клиническая и трансляционная иммунология , опубликованная John Wiley & Sons Australia, Ltd от имени Австралийско-новозеландского общества иммунологии, Inc. Это статья в открытом доступе на условиях http: // creativecommons.org / licenses / by / 4.0 / License, которая разрешает использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Легкое обеспечивает эффективный газообмен между сложной нестерильной атмосферой и телом через тонкую и обширную эпителиальную поверхность с высокой эффективностью из-за упругой деформации, позволяющей увеличивать и уменьшать объем в процессе дыхания и из-за обширной сосудистой сети, которая способствует быстрой диффузии газа./female-hispanic-doctor-examines-chest-x-rays-136644830-5a29c09b494ec900363525d7.jpg) Большая площадь поверхности легких подвергает орган постоянному риску повреждения патогенами, токсинами или раздражителями; однако повреждение легких можно быстро вылечить с помощью регенеративных процессов, которые восстанавливают его структуру и функцию. В ответ на устойчивое и обширное повреждение легкое заживает посредством нерегенеративного процесса, в результате чего рубцовая ткань локально укрепляет ее структуру, что со временем приводит к серьезной потере функции легких и увеличению заболеваемости. В этом обзоре обсуждается то, что известно о факторах, влияющих на заживление легкого путем регенерации или восстановления, и какие потенциальные новые терапевтические подходы могут положительно повлиять на заживление легких.
Большая площадь поверхности легких подвергает орган постоянному риску повреждения патогенами, токсинами или раздражителями; однако повреждение легких можно быстро вылечить с помощью регенеративных процессов, которые восстанавливают его структуру и функцию. В ответ на устойчивое и обширное повреждение легкое заживает посредством нерегенеративного процесса, в результате чего рубцовая ткань локально укрепляет ее структуру, что со временем приводит к серьезной потере функции легких и увеличению заболеваемости. В этом обзоре обсуждается то, что известно о факторах, влияющих на заживление легкого путем регенерации или восстановления, и какие потенциальные новые терапевтические подходы могут положительно повлиять на заживление легких.
Ключевые слова: воспаление, легкое, регенерация, восстановление, терапия
Abstract
В этом обзоре обсуждается то, что известно об обнаружении, ответе и устранении повреждения легких, а также то, что может повлиять на заживление легкого путем регенерации или восстановления. В нем также представлены потенциальные терапевтические подходы, которые могут положительно повлиять на заживление легких.
В нем также представлены потенциальные терапевтические подходы, которые могут положительно повлиять на заживление легких.
Введение
Оксигенация тканей позвоночных зависит от структур легких, которые являются одновременно хрупкими и уязвимыми для повреждения.В течение жизни человека легкие подвергаются воздействию сотен миллионов литров нестерильного воздуха, сохраняя при этом свою функцию и целостность. Несмотря на эндемические респираторные инфекции, иммунитета легких обычно достаточно для излечения без длительного структурного повреждения. Такие благоприятные исходы были значительно улучшены благодаря использованию терапевтических антибактериальных средств. Тем не менее, устойчивые или более обширные легочные инфекции могут приводить к накоплению фиброзных повреждений, которые хронически влияют на гибкость легких и проницаемость для кислорода.1
Факторы, которые могут повлиять на тяжесть и частоту респираторных инфекций, включают предрасположенность к развитию астмы, недостаточность иммунитета и / или доступ к соответствующим вакцинациям, а также мутации, которые напрямую влияют на физиологию легких, например, при муковисцидозе. Кроме того, длительное воздействие токсинов, например, привычка к курению и / или длительное воздействие высоких уровней переносимых по воздуху загрязнителей, может напрямую повреждать ткань легких и способствовать менее эффективному избавлению от инфекций легких.2
Несмотря на клинически идентифицируемые факторы риска, невозможно своевременно диагностировать и вмешаться, чтобы предотвратить прогрессирующие дегенеративные фиброзные заболевания легких.
Кроме того, длительное воздействие токсинов, например, привычка к курению и / или длительное воздействие высоких уровней переносимых по воздуху загрязнителей, может напрямую повреждать ткань легких и способствовать менее эффективному избавлению от инфекций легких.2
Несмотря на клинически идентифицируемые факторы риска, невозможно своевременно диагностировать и вмешаться, чтобы предотвратить прогрессирующие дегенеративные фиброзные заболевания легких.
В этом обзоре делается попытка сравнить физиологическую регенерацию легких после повреждения с восстановлением, в результате которого рубцовая ткань нарушает нормальную структуру легкого. Мы анализируем вклад иммунного ответа на эти исходы. Несомненно, уровень воспаления в легких в результате повреждения ткани является одним из ключевых факторов, регулирующих физиологическое восстановление по сравнению с фиброзным.Мы обсуждаем последние разработки в этой области, в конечном итоге пытаясь понять, можем ли мы использовать эти знания для модуляции воспалительной реакции в поврежденных легких с целью повышения их регенеративного потенциала.
От чего зависит, как легкие заживают после повреждения?
Высокая уязвимость легких к повреждениям связана с его структурой. Во-первых, легкое имеет очень низкую плотность клеток по сравнению с его объемом. Во-вторых, функциональная эффективность легких зависит от организации и состава ряда типов клеток, структурные характеристики которых отвечают за сочетание эластичности и проницаемости.Клетки легких, наиболее уязвимые для повреждения, находятся на поверхности слизистой оболочки. Повреждение эпителиальных клеток стимулирует быстрое размножение, дифференциацию и набор замещающих клеток и может привести к регенерации барьерной функции ткани. Однако изменение клеточной организации, вызванное процессами восстановления, включающими рубцевание, обязательно изменяет критические структурные характеристики, что приводит к ухудшению функции легких. Такие факторы, как количество и типы поврежденных клеток, нарушение барьерной функции, а также сила и продолжительность местного иммунного ответа, могут определять, восстанавливается ли поврежденное легкое, восстанавливается или не восстанавливается, что приводит к хроническому заболеванию легких.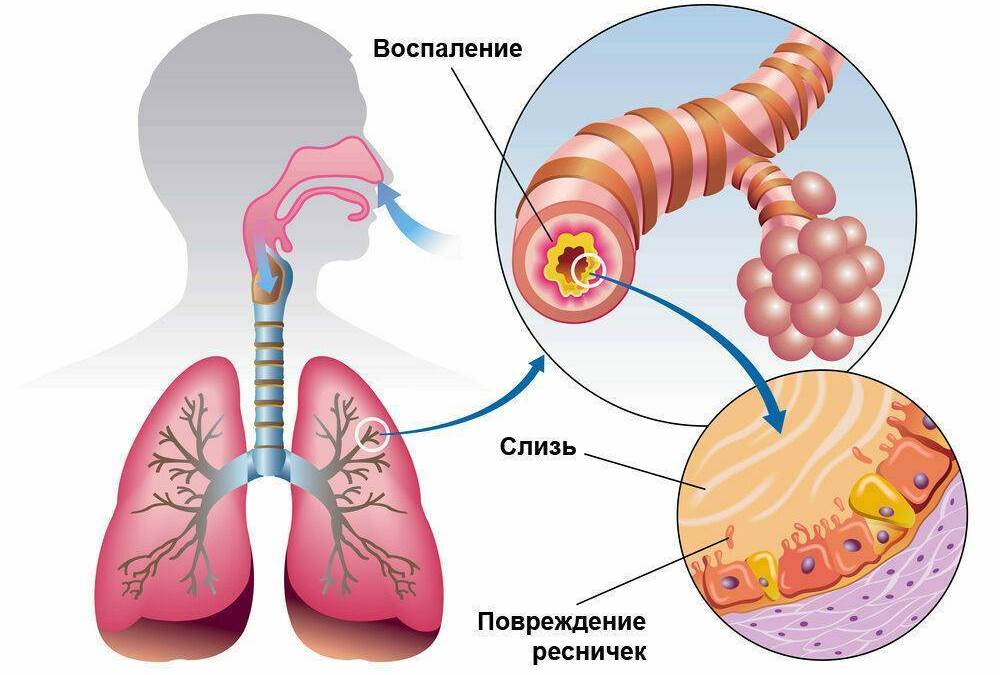
Ранний ответ имеет значение
Нарушение гомеостаза тканей, вызванное повреждением, быстро изменяет локальную микросреду, прилегающую к поврежденному легкому. Окружающая среда раны становится положительной для молекул, происходящих от патогенов, которые ее загрязняют, и из внутриклеточной среды умирающих клеток. Преимущество выживания, обеспечиваемое быстрым обнаружением повреждения ткани, привело к эволюции клеточных рецепторов, которые распознают консервативные структурные элементы, часто обнаруживаемые в патогенах, и на внутриклеточных компонентах клетки, которые высвобождаются только после повреждения.Такие рецепторы называются рецепторами распознавания образов (PRR) и включают Toll-подобные рецепторы и рецепторы, подобные гену I (RIG-1), индуцируемому ретиноевой кислотой. Молекулы, происходящие от патогенов и распознаваемые специфической PRR, называются патоген-ассоциированными молекулярными паттернами (PAMP), в то время как лиганды, происходящие из поврежденных клеток-хозяев, известны как связанные с опасностями молекулярные паттерны (DAMP). 3
3
Рано после травмы поврежденные клетки высвобождают DAMP, такие как IL (интерлейкин) -1α (рисунок), в то время как другие провоспалительные молекулы высвобождаются компонентами начальной воспалительной реакции, такими как тромбоциты, которые накапливаются для стабилизации кровопотери в этом месте. ущерба.Другие провоспалительные сигналы генерируются стромальными клетками в ответ на изменения в гомеостатической среде, такие как изменение давления кислорода. 4 и окислительно-восстановительное состояние ткани 5 и изменения во внеклеточном матриксе ткани (ЕСМ), которые запускают передачу сигналов, включающую перекрестные помехи опухоли Вильмса-1 (WT1), Yes-ассоциированного белка (YAP) -1 и E-кадгерина. 6 запуск эпителиально-мезенхимальных переходов (ЭМП) как часть процесса заживления раны. 7
От первоначального повреждения до возникновения воспаления. (а) Клетки, поврежденные повреждением, высвобождают молекулы, такие как IL-1α, доставляя мощные провоспалительные сигналы через рецепторы ассоциированного с опасностью молекулярного паттерна (DAMP), в то время как патогены распознаются рецепторами патоген-ассоциированного молекулярного паттерна (PAMP). Передача сигналов через оба этих класса рецепторов активирует множество дополнительных процессов напрямую или через инфламмасому, включая изменения в экспрессии генов, секрецию биоактивных молекул, таких как IL-1β и PGE 2 . (b) Действие секретируемых цитокинов и простагландинов привлекает врожденные иммунные клетки к области повреждения и изменяет поведение местного эндотелия, инициирующего воспаление. Врожденные иммунные клетки, преимущественно нейтрофилы, прибывают и перемещаются из кровеносных сосудов в ткань, фагоцитируют или убивают патогены, а затем умирают. Другие врожденные клетки, такие как макрофаги, фагоцитируют мертвые и умирающие нейтрофилы, способствуя снижению провоспалительной передачи сигналов. 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; ASC, спек-подобный белок, связанный с апоптозом; BLT1, рецептор лейкотриена; ch2, ch3, хромосома 1 или 2; ЦОГ-2, циклооксигеназа 2; DAMP, молекула, связанная с опасностью; FcεR1, рецептор 1 FC-эпсилон; IgE, иммуноглобулин E; IL-1R, рецептор интерлейкина 1; LTB 4 , лейкотриен B4; Mϕ, макрофаг; NLPR3, детектор криопирина PAMP; PAMP, молекулярный паттерн, связанный с патогенами; PGE 2 , простагландин E2.
Передача сигналов через оба этих класса рецепторов активирует множество дополнительных процессов напрямую или через инфламмасому, включая изменения в экспрессии генов, секрецию биоактивных молекул, таких как IL-1β и PGE 2 . (b) Действие секретируемых цитокинов и простагландинов привлекает врожденные иммунные клетки к области повреждения и изменяет поведение местного эндотелия, инициирующего воспаление. Врожденные иммунные клетки, преимущественно нейтрофилы, прибывают и перемещаются из кровеносных сосудов в ткань, фагоцитируют или убивают патогены, а затем умирают. Другие врожденные клетки, такие как макрофаги, фагоцитируют мертвые и умирающие нейтрофилы, способствуя снижению провоспалительной передачи сигналов. 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; ASC, спек-подобный белок, связанный с апоптозом; BLT1, рецептор лейкотриена; ch2, ch3, хромосома 1 или 2; ЦОГ-2, циклооксигеназа 2; DAMP, молекула, связанная с опасностью; FcεR1, рецептор 1 FC-эпсилон; IgE, иммуноглобулин E; IL-1R, рецептор интерлейкина 1; LTB 4 , лейкотриен B4; Mϕ, макрофаг; NLPR3, детектор криопирина PAMP; PAMP, молекулярный паттерн, связанный с патогенами; PGE 2 , простагландин E2.
Обнаружение PAMP / DAMPs индуцирует внутриклеточные сигнальные пути, которые сходятся при активации NFκB и последующей повышенной транскрипции множества генов, включая про-IL-1β, фактор некроза опухоли α (TNFα) и компонент NLRP3 инфламмасомы. Повышенная активность инфламмасом вызывает активацию выработки про-ИЛ-1 β, а высвобождение этого и других цитокинов приводит к сильному провоспалительному ответу. Стромальные клетки отвечают секрецией дополнительных провоспалительных цитокинов, таких как IL-6, уровень которого имеет решающее значение для развития фиброза (обзор Garth et al .8
). Этот ранний ответ включает высвобождение факторов роста, хемокинов, нуклеотидов (АТФ или АДФ), простагландинов и лейкотриенов как из стромальных клеток, так и из тромбоцитов,
9
,
10
,
11
индукция новых паттернов экспрессии и пролиферации генов, активация местного эндотелия, увеличение перфузии в ткани и рекрутирование лейкоцитов. Важно отметить, что передача сигналов IL-1 сильно влияет на активацию активности циклооксигеназы-2 (COX-2), что приводит к усилению биосинтеза ряда простагландинов, которые вносят вклад в воспалительный каскад. 12
12
Лейкоциты, которые экспрессируют ряд PRR, быстро рекрутируются в поврежденную ткань и активируются посредством распознавания PRR патогенов, с которыми они сталкиваются. Модуляция местной сосудистой сети, инициация связывания тромбоцитов проксимальнее повреждения ткани и активация эндотелия, прилегающего к повреждению, приводят к притоку нейтрофилов и других лейкоцитов, локальному отеку и увеличению поступления питательных веществ в поврежденный участок. . Нейтрофилы, которые доминируют над притоком, экспрессируют несколько Toll-подобных рецепторов (TLR) и специфически активируются лигандами, связанными с встречающимися патогенами или высвобождаемыми из поврежденных тканевых клеток, содержащих консервативные структурные элементы.На важность быстроты этого ответа, опосредованного в первую очередь привлечением гранулоцитов из кровотока, указывают пациенты с нейтропеническим раком, испытывающие гораздо более высокий относительный риск смерти. 13
Если у хозяина уже есть гуморальный иммунитет к вторгающимся патогенам, происходит взаимодействие с врожденным иммунным ответом. Низкоаффинные рецепторы Fcγ типа I (FcγR), гетерогенно экспрессирующиеся на лейкоцитах,
14
не связывают мономерные подтипы IgG, но активируются патоген-специфическими иммунокомплексами.Циркулирующие иммуноглобулины против патогенов связываются со своим специфическим антигеном, и полученные иммунокомплексы связываются рецепторами Fc, что приводит к защитным иммунным ответам. Такое связывание вызывает активацию эффекторных лейкоцитов,
15
и перекрестное связывание FcγR на гранулоцитах запускает дегрануляцию и антибактериальную активность,
16
с перекрестным связыванием FcγRIIIa, экспрессируемого на NK-клетках, аналогичным образом приводит к клеточной активации и дегрануляции эффекторных молекул.
17
Кроме того, некоторые антигены паразитов распознаются специфическими антителами IgE, обычно связанными с FcεRI, экспрессируемыми на резидентных в ткани тучных клетках и базофилах, вызывая реакции гиперчувствительности немедленного типа.18
Низкоаффинные рецепторы Fcγ типа I (FcγR), гетерогенно экспрессирующиеся на лейкоцитах,
14
не связывают мономерные подтипы IgG, но активируются патоген-специфическими иммунокомплексами.Циркулирующие иммуноглобулины против патогенов связываются со своим специфическим антигеном, и полученные иммунокомплексы связываются рецепторами Fc, что приводит к защитным иммунным ответам. Такое связывание вызывает активацию эффекторных лейкоцитов,
15
и перекрестное связывание FcγR на гранулоцитах запускает дегрануляцию и антибактериальную активность,
16
с перекрестным связыванием FcγRIIIa, экспрессируемого на NK-клетках, аналогичным образом приводит к клеточной активации и дегрануляции эффекторных молекул.
17
Кроме того, некоторые антигены паразитов распознаются специфическими антителами IgE, обычно связанными с FcεRI, экспрессируемыми на резидентных в ткани тучных клетках и базофилах, вызывая реакции гиперчувствительности немедленного типа.18
При отсутствии ранее существовавшего иммунитета активация нейтрофилов и других лейкоцитов, таких как тканевые иммунные клетки, такие как альвеолярные макрофаги,
19
дендритные клетки (DC
20
) и резидентные лимфоциты тканевой памяти (TMR
21 год
) регулируется концентрацией PAMP или DAMP, присутствующих в поврежденной ткани. Активация нейтрофилов приводит к дегрануляции токсичных молекул, таких как протеазы, и активному или пассивному высвобождению внеклеточных ловушек нейтрофилов (NET).
22
), которые уничтожают патогены, но также вызывают повреждение тканей хозяина, повышая уровень DAMP и дополнительно активируя дополнительные тканевые клетки.Это приводит к дальнейшему усилению воспалительной реакции за счет привлечения и секреции провоспалительных цитокинов резидентными клетками ткани.
23
Активация нейтрофилов приводит к дегрануляции токсичных молекул, таких как протеазы, и активному или пассивному высвобождению внеклеточных ловушек нейтрофилов (NET).
22
), которые уничтожают патогены, но также вызывают повреждение тканей хозяина, повышая уровень DAMP и дополнительно активируя дополнительные тканевые клетки.Это приводит к дальнейшему усилению воспалительной реакции за счет привлечения и секреции провоспалительных цитокинов резидентными клетками ткани.
23
В частности, секреция IL-12 и IL-23 локальными DC влияет на дифференцировку Т-хелперных (Th) -1 клеток и Th27 клеток, соответственно.
24
,
25
Стимуляция клеток Th27 IL-23 сильно индуцирует IL-17.
26 год
и секреция IL-22 из клеток Th27 рекрутируется в поврежденную ткань.
27
Продукция IL-22 происходящими из костного мозга DC в ответ на стимуляцию селективными PAMPs также указывает на то, что резидентные в ткани DC также могут вносить дополнительный вклад в уровни IL-22.28 год
И IL-17, и IL-22 стимулируют эпителиальные клетки легких, что приводит к секреции широкого спектра провоспалительных хемокинов. Кроме того, IL-22 вызывает высвобождение ряда антибактериальных пептидов из эпителиальных клеток легких, которые действуют синергично, усиливая ответы против патогенов.
27
В противовес этой петле положительной обратной связи провоспалительной передачи сигналов, активированные PAMP альвеолярные макрофаги секретируют IL-27.
29
который обладает мощным противовоспалительным действием, включая блокирование секреции IL-17 клетками Th27 и индукцию иммуномодулирующих рецепторов на эффекторных Т-клетках и Т-регуляторных клетках, что приводит к секреции противовоспалительного IL-10.30
Кроме того, активированные iTr35Tregs (iTr35) секретируют родственный цитокин IL-35, который обладает мощными противовоспалительными свойствами, опосредованными ингибированием пролиферации Т-клеток.
31 год
Кроме того, IL-22 вызывает высвобождение ряда антибактериальных пептидов из эпителиальных клеток легких, которые действуют синергично, усиливая ответы против патогенов.
27
В противовес этой петле положительной обратной связи провоспалительной передачи сигналов, активированные PAMP альвеолярные макрофаги секретируют IL-27.
29
который обладает мощным противовоспалительным действием, включая блокирование секреции IL-17 клетками Th27 и индукцию иммуномодулирующих рецепторов на эффекторных Т-клетках и Т-регуляторных клетках, что приводит к секреции противовоспалительного IL-10.30
Кроме того, активированные iTr35Tregs (iTr35) секретируют родственный цитокин IL-35, который обладает мощными противовоспалительными свойствами, опосредованными ингибированием пролиферации Т-клеток.
31 год
Поддержание структурной интеграции ткани поддерживает регенерацию
Параллельно с местным иммунным ответом клетки ткани стимулируются к секреции компонентов внеклеточного матрикса и протеаз, необходимых для его ремоделирования. Клетки пролиферируют и / или дифференцируются, и, наконец, избыточные клетки подвергаются апоптозу в ответ на снижение локальных уровней факторов роста,
32
что привело к реформированию предыдущей архитектуры ткани.Регенерация ткани зависит от поступления клеток из соседних здоровых тканей или популяций клеток-предшественников. Вероятность того, что такие клетки доступны, частично связана с уровнем повреждений, естественным течением и, возможно, возрастом человека.
33
Если стимулы, инициирующие исцеляющую микросреду, не уменьшаются, клеточные ответы продолжаются, и это поддерживает активацию и дифференцировку миофибробластов.
34
Следовательно, преобладают процессы репарации, и поврежденная ткань замещается преимущественно фиброзной рубцовой тканью.
Клетки пролиферируют и / или дифференцируются, и, наконец, избыточные клетки подвергаются апоптозу в ответ на снижение локальных уровней факторов роста,
32
что привело к реформированию предыдущей архитектуры ткани.Регенерация ткани зависит от поступления клеток из соседних здоровых тканей или популяций клеток-предшественников. Вероятность того, что такие клетки доступны, частично связана с уровнем повреждений, естественным течением и, возможно, возрастом человека.
33
Если стимулы, инициирующие исцеляющую микросреду, не уменьшаются, клеточные ответы продолжаются, и это поддерживает активацию и дифференцировку миофибробластов.
34
Следовательно, преобладают процессы репарации, и поврежденная ткань замещается преимущественно фиброзной рубцовой тканью.
Регенерация после острого, но ограниченного повреждения
В легких эпителиальная выстилка дыхательных путей очень чувствительна к повреждению от инфекций, передающихся воздушно-капельным путем, раздражителей или переносимых по воздуху токсинов. Эти накладки легко регенерируются после поверхностного повреждения, которое не разрушило нижележащую структуру ткани и внеклеточный матрикс. В легких острое повреждение эпителия может стимулировать эффективную регенеративную реакцию, обусловленную пролиферативными ответами со стороны здорового соседнего эпителия.35 год
,
36
Эти накладки легко регенерируются после поверхностного повреждения, которое не разрушило нижележащую структуру ткани и внеклеточный матрикс. В легких острое повреждение эпителия может стимулировать эффективную регенеративную реакцию, обусловленную пролиферативными ответами со стороны здорового соседнего эпителия.35 год
,
36
Важность, которую ремоделирование тканей играет во время эффективного процесса регенерации, показано в исследовании Шиллера и его коллег.
37
В этом исследовании измерялась динамика внеклеточных компонентов от момента повреждения легких, вызванного блеомицином, временного фиброзного восстановления через 2 недели до регенерации легких через 4–8 недель. Блеомицин — это молекула бактериального происхождения, токсичность которой связана с селективным ингибированием синтеза нуклеиновых кислот и которая вызывает гибель ряда типов эпителиальных клеток, включая AEC1, AEC II, Club-клетки и эндотелиальные клетки, в первые 7 дней после воздействия.В результате связанного с блеомицином повреждения клеток в оставшейся ткани происходит большое количество изменений, и, в частности, некоторые белки внеклеточного матрикса, такие как Emilin2, который взаимодействует с эластином, становятся сильно регулируемыми.
Считается, что во время эффективной регенерации легких базальная мембрана, лежащая под слоями эпителиальных и эндотелиальных клеток, имеет решающее значение для поддержки миграции стволовых клеток в поврежденную область за счет обеспечения каркаса. 38 и способность концентрировать паракринные секретируемые биоактивные молекулы.39
На 3 день, который соответствует пику воспалительной реакции после лечения блеомицином, наблюдается значительная активация секретируемого ингибитора эластазы нейтрофилов, α2-макроглобулина и ряда ингибиторов сериновых протеаз (серпинов),
37
необходимо для контроля степени опосредованного протеазой повреждения структур, таких как базальная мембрана. Точно так же есть данные об усиленной экспрессии протеогликановых молекул декорина и бигликана. Эти молекулы связываются с коллагеном I и могут секвестрировать секретируемый TGF-β, снижая его сигнальную активность и уровень фиброгенеза.37
,
40
Присутствие декорина и бигликана может влиять на связывание фибробластов, что инициирует внутриклеточную передачу сигналов для путей, связанных с миграцией, таких как Rac1 и RhoA, и, таким образом, способствует миграции клеток. 41 год
Редкость декорина из-за снижения продукции фибробластов связана с хронической воспалительной средой, связанной с тяжелой эмфиземой.
42 Исследования in vitro показали, что мРНК декорина может быть увеличена кортикостероидом, дексаметазоном (Dex), в то время как мРНК бигликана увеличивается при лечении транс-ретиноевой кислотой (ATRA).43 год
41 год
Редкость декорина из-за снижения продукции фибробластов связана с хронической воспалительной средой, связанной с тяжелой эмфиземой.
42 Исследования in vitro показали, что мРНК декорина может быть увеличена кортикостероидом, дексаметазоном (Dex), в то время как мРНК бигликана увеличивается при лечении транс-ретиноевой кислотой (ATRA).43 год
Восстановление легких после нарушения структуры ткани
В условиях хронического воспаления продолжающееся рекрутирование, активация и дегрануляция нейтрофилов приводит к повреждению ткани, опосредованному протеазами, включая эластазу, которая переваривает белки внеклеточного матрикса и может нарушить структуру, обеспечиваемую легким путем базальная мембрана, лежащая в основе альвеолярного эпителия. Когда структурная целостность легкого нарушена, процессы восстановления преобладают над регенерацией.Это проиллюстрировано в элегантном исследовании с использованием модели хронического повреждения легких эластазой, где степень повреждения легкого титровалась с помощью 4 последовательных еженедельных низких доз панкреатической свиной эластазы (PPE). 44
После одной инстилляции эластазы не наблюдалось значительного снижения содержания эластина в альвеолярных перегородках, но наблюдался значительный инфильтрат мононуклеарных клеток в паренхиму легких. Вторая установка привела к структурной деформации альвеол и снижению содержания эластина в альвеолярных перегородках.Однако только после третьей инстилляции эластазы, которая еще больше снизила содержание эластина в альвеолярных перегородках, были обнаружены признаки фиброза, о чем свидетельствовало усиление окрашивания на содержание коллагеновых волокон в альвеолах и мелких дыхательных путях.
44
После одной инстилляции эластазы не наблюдалось значительного снижения содержания эластина в альвеолярных перегородках, но наблюдался значительный инфильтрат мононуклеарных клеток в паренхиму легких. Вторая установка привела к структурной деформации альвеол и снижению содержания эластина в альвеолярных перегородках.Однако только после третьей инстилляции эластазы, которая еще больше снизила содержание эластина в альвеолярных перегородках, были обнаружены признаки фиброза, о чем свидетельствовало усиление окрашивания на содержание коллагеновых волокон в альвеолах и мелких дыхательных путях.
Недавние сравнения сходств и различий повреждающего действия кремнезема, блеомицина и параквата на животных моделях позволяют предположить, что эти агенты повреждают легкие разными и характерными способами.
45
На мышиной модели всасывание всех этих агентов из глотки инициировало воспалительную реакцию, пик которой достигался на 7-й день после лечения.Хотя гистопатология и генетический анализ продемонстрировали много схожих характеристик между тремя повреждающими молекулами, существуют явные различия с точки зрения природы гистопатологии, степени иммунного вовлечения, уровня и типа клеточного повреждения, уровня генов, связанных с модификацией ВКМ, и интересных различных наборов генов. хемокины.
45
Большое количество уникальных иммунно-ассоциированных генов, активируемых после воздействия кремнезема, может иметь важные корреляты для воздействия кремнезема на людей, где у некоторых пациентов были зарегистрированы признаки аутоиммунного заболевания, а также фиброза.46
,
47
Хотя кажется, что существуют общие причины ранних пролиферативных и воспалительных реакций, возникающих после повреждения легких, отдельные генетические ответы, выявленные после различных типов повреждений, предполагают, что необходимо исследовать терапевтические цели, связанные с повреждением.
хемокины.
45
Большое количество уникальных иммунно-ассоциированных генов, активируемых после воздействия кремнезема, может иметь важные корреляты для воздействия кремнезема на людей, где у некоторых пациентов были зарегистрированы признаки аутоиммунного заболевания, а также фиброза.46
,
47
Хотя кажется, что существуют общие причины ранних пролиферативных и воспалительных реакций, возникающих после повреждения легких, отдельные генетические ответы, выявленные после различных типов повреждений, предполагают, что необходимо исследовать терапевтические цели, связанные с повреждением.
Хроническое заболевание легких возникает в результате нерегулируемых процессов восстановления
Последствия длительных или повторяющихся периодов инфекции, раздражителей или токсинов могут вызвать состояние хронического воспаления, тканевой среды, в которой происходят процессы восстановления, которые заменяют нормальную структуру ткани фиброзной тканью. предпочтительнее регенерации тканей.Если таким образом поражаются несколько областей легкого, функция легких постепенно и необратимо ухудшается.
Структурные характеристики легких приводят к динамическим и отчетливым экологическим и механическим свойствам, которые меняются по вентиляционному дереву от трахеи до концевых альвеол. Понимание дифференциальной восприимчивости структур легких было получено путем интеграции физиологических измерений внутридыхательного давления.
48
и ультраструктурный анализ, изначально предоставленный стереологией
49
,
50
и совсем недавно с помощью исследований с помощью микрокомпьютерной томографии (мкКТ).51
Такие исследования способствовали разработке моделей, которые предсказывают, что проникновение частиц в легкие связано с их размером и скоростью воздушного потока. Ряд экспериментальных и математических моделей подчеркивает, что осаждение частиц распределяется неравномерно, а место пика расположения смещается от дистальных областей легких к проксимальным областям с поверхностной дозой, которая намного выше в проводящих дыхательных путях, чем в альвеолах.
52
,
53
Учитывая, что сопротивление дыхательных путей и количество дыхательных путей увеличиваются с каждым уровнем разветвления и сужением диаметра дыхательных путей, Hogg et al . предположили, что небольшие дыхательные пути подвержены повреждению частицами, которое предшествует коллапсу терминальных бронхиол, что приводит к опасному для жизни увеличению сопротивления дыхательных путей, характерному для патологического прогрессирования хронической обструктивной болезни легких (ХОБЛ).
54
Наличие маркеров клеточного старения в популяциях клеток легких пациентов с ХОБЛ согласуется с подавляющей репаративной способностью легких в ответ на продолжающийся стресс и травмы.
55
предположили, что небольшие дыхательные пути подвержены повреждению частицами, которое предшествует коллапсу терминальных бронхиол, что приводит к опасному для жизни увеличению сопротивления дыхательных путей, характерному для патологического прогрессирования хронической обструктивной болезни легких (ХОБЛ).
54
Наличие маркеров клеточного старения в популяциях клеток легких пациентов с ХОБЛ согласуется с подавляющей репаративной способностью легких в ответ на продолжающийся стресс и травмы.
55
Напротив, заболевания легких, такие как фиброз легких, по-видимому, не связаны преимущественно с повреждением частицами и последующим хроническим воспалением и нечувствительны к противовоспалительному лечению.56
Скорее, они характеризуются гетерогенным паттерном прогрессирующих структурных изменений легких, опосредованных изменением регуляции или функции фибробластов легких. Очаги пролиферирующих фибробластов характерны для IPF и, как полагают, отражают повреждение альвеолярных эпителиальных клеток и последующий коллапс дистального воздушного пространства. 57 год
Несмотря на то, что ряд воздействий, включая курение, считаются независимыми факторами риска ИЛФ, причинный агент (ы) не идентифицирован. В недавнем исследовании было обнаружено, что все обследованные пациенты с IPF показали сверхэкспрессию гликопротеина муцина 5b.
58
натолкнул на мысль, что аберрантный мукоцилиарный клиренс может способствовать изменению микробиома легких.
59
причинение вреда из-за врожденных иммунных реакций, поддерживающих развитие IPF.Обнаружение повышенной легочной экспрессии в небольшой группе пациентов IPS IL25, который является профиброзным в моделях на животных и выделяется местными популяциями клеток ILC2, согласуется с этой гипотезой.
60
57 год
Несмотря на то, что ряд воздействий, включая курение, считаются независимыми факторами риска ИЛФ, причинный агент (ы) не идентифицирован. В недавнем исследовании было обнаружено, что все обследованные пациенты с IPF показали сверхэкспрессию гликопротеина муцина 5b.
58
натолкнул на мысль, что аберрантный мукоцилиарный клиренс может способствовать изменению микробиома легких.
59
причинение вреда из-за врожденных иммунных реакций, поддерживающих развитие IPF.Обнаружение повышенной легочной экспрессии в небольшой группе пациентов IPS IL25, который является профиброзным в моделях на животных и выделяется местными популяциями клеток ILC2, согласуется с этой гипотезой.
60
Терапевтические подходы для модуляции повреждения / усиления регенерации вместо восстановления
Текущие и предлагаемые терапевтические подходы для остановки хронического повреждения легких включают уменьшение воспаления легких, при этом наиболее распространенные схемы лечения направлены на широкое снижение провоспалительной передачи сигналов за счет использования ингаляционных кортикостероидов . Однако, как обсуждалось выше, современные противовоспалительные подходы неэффективны при лечении ИЛФ. Иллюстрация того, как лечение кортикостероидами может иметь нежелательные негативные эффекты на поврежденное легкое, представлена в недавнем исследовании, в котором оценивалась способность лечения Dex улучшать исход после повреждения легких, вызванного блеомицином. Это исследование показало, что у мышей, получавших Dex, наблюдалось снижение концентрации фактора некроза опухоли (TNF) -α в жидкости лаважа; однако значительного снижения числа нейтрофилов у мышей, получавших Dex, не наблюдалось.Кроме того, культуры первичных альвеолярных эпителиальных клеток, обработанных Dex, показали замедленную и дозозависимую более низкую скорость восстановления, чем культуры, обработанные контрольным физиологическим раствором.
61
Однако, как обсуждалось выше, современные противовоспалительные подходы неэффективны при лечении ИЛФ. Иллюстрация того, как лечение кортикостероидами может иметь нежелательные негативные эффекты на поврежденное легкое, представлена в недавнем исследовании, в котором оценивалась способность лечения Dex улучшать исход после повреждения легких, вызванного блеомицином. Это исследование показало, что у мышей, получавших Dex, наблюдалось снижение концентрации фактора некроза опухоли (TNF) -α в жидкости лаважа; однако значительного снижения числа нейтрофилов у мышей, получавших Dex, не наблюдалось.Кроме того, культуры первичных альвеолярных эпителиальных клеток, обработанных Dex, показали замедленную и дозозависимую более низкую скорость восстановления, чем культуры, обработанные контрольным физиологическим раствором.
61
Существуют важные клинические проблемы, связанные с эффективностью этих схем лечения у людей, включая развитие стероидорезистентного воспаления.
62
что связано с обострениями аллергической астмы с накоплением нейтрофилов. Считается, что развитие устойчивости к противовоспалительным кортикостероидам является многофакторным, включая высокие уровни провоспалительного действия, обеспечиваемые повышенной экспрессией провоспалительного цитокинового фактора ингибирования миграции макрофагов (MIF), чрезмерной активацией митоген-активированного белка ( MAP) киназных путей, которые подавляют подавляющий эффект глюкокортикоидного рецептора связывающего элемента ответа циклического АМФ белка (CBP) и нарушение ядерного рекрутирования гистондеацетилазы-2 (HDAC2), что опять же, как правило, действует для подавления экспрессии про -Воспалительные гены.63
,
64
,
65
Считается, что развитие устойчивости к противовоспалительным кортикостероидам является многофакторным, включая высокие уровни провоспалительного действия, обеспечиваемые повышенной экспрессией провоспалительного цитокинового фактора ингибирования миграции макрофагов (MIF), чрезмерной активацией митоген-активированного белка ( MAP) киназных путей, которые подавляют подавляющий эффект глюкокортикоидного рецептора связывающего элемента ответа циклического АМФ белка (CBP) и нарушение ядерного рекрутирования гистондеацетилазы-2 (HDAC2), что опять же, как правило, действует для подавления экспрессии про -Воспалительные гены.63
,
64
,
65
Нацеленность на воспалительный каскад для лечения заболеваний легких
Идентификация DAMP и PAMP как молекул, критически важных для инициирования и поддержания воспаления, побудила доклинические исследования для оценки эффективности блокады DAMP / PAMP в разрешении воспаления. Хотя технически это не является DAMP, IL-1β является важной частью сигнальной амплификации, которая следует за активацией DAMP или PAMP комплекса инфламмасом. Существует три типа реагентов, нацеленных на IL-1, которые были оценены на противовоспалительную активность в контексте заболеваний легких: анакинра является антагонистом рецептора IL-1,
66
MEDI8968 представляет собой гуманизированное антитело против IL-1R, а канакинумаб представляет собой блокирующее антитело против IL-1β.Хотя эти подходы успешно использовались на мышиных моделях для уменьшения воспаления, связанного с IL-1, и несмотря на то, что канакинумаб и анакинра показали эффективность в лечении редкого воспалительного заболевания, начинающегося у взрослых, болезнь Стилла,
67
в клинических испытаниях пациентов с ХОБЛ, принимавших канакинумаб, не было обнаружено улучшенных показателей функции легких.
68
или MEDI8968.
69
О недавно завершенных клинических испытаниях по оценке эффективности канакинумаба при лечении легочного саркоидоза еще не сообщалось.
70
в то время как предлагается исследование для оценки эффективности анакинры при лечении муковисцидоза.71
Существует три типа реагентов, нацеленных на IL-1, которые были оценены на противовоспалительную активность в контексте заболеваний легких: анакинра является антагонистом рецептора IL-1,
66
MEDI8968 представляет собой гуманизированное антитело против IL-1R, а канакинумаб представляет собой блокирующее антитело против IL-1β.Хотя эти подходы успешно использовались на мышиных моделях для уменьшения воспаления, связанного с IL-1, и несмотря на то, что канакинумаб и анакинра показали эффективность в лечении редкого воспалительного заболевания, начинающегося у взрослых, болезнь Стилла,
67
в клинических испытаниях пациентов с ХОБЛ, принимавших канакинумаб, не было обнаружено улучшенных показателей функции легких.
68
или MEDI8968.
69
О недавно завершенных клинических испытаниях по оценке эффективности канакинумаба при лечении легочного саркоидоза еще не сообщалось.
70
в то время как предлагается исследование для оценки эффективности анакинры при лечении муковисцидоза.71
Цитокин IL-5 является современной противовоспалительной терапевтической мишенью и был обнаружен в биоптатах бронхов легких у астматиков. 72
в котором антиген-специфические CD4 Т-клетки ответственны за его секрецию.
73
Поскольку IL-5 может мобилизовать эозинофилы из пула костного мозга,
74
его регулирование считается критическим. Экспериментальные доказательства центральной роли IL-5 обеспечиваются защитой мышей, у которых отсутствует ген IL-5, от антиген-зависимых моделей аллергического заболевания дыхательных путей.
75
Эти многообещающие исследования побудили к клиническим испытаниям, направленным на нейтрализацию активности IL-5 в контексте острого заболевания дыхательных путей.Недавний метаанализ, охватывающий использование лечения против IL-5, меполизумаба, пришел к выводу, что при правильном нацеливании на лечение пациентов с тяжелой эозинофильной астмой это лечение значительно снижает общее количество обострений на пациента, а также количество обострений. обострений, требующих госпитализации.
72
в котором антиген-специфические CD4 Т-клетки ответственны за его секрецию.
73
Поскольку IL-5 может мобилизовать эозинофилы из пула костного мозга,
74
его регулирование считается критическим. Экспериментальные доказательства центральной роли IL-5 обеспечиваются защитой мышей, у которых отсутствует ген IL-5, от антиген-зависимых моделей аллергического заболевания дыхательных путей.
75
Эти многообещающие исследования побудили к клиническим испытаниям, направленным на нейтрализацию активности IL-5 в контексте острого заболевания дыхательных путей.Недавний метаанализ, охватывающий использование лечения против IL-5, меполизумаба, пришел к выводу, что при правильном нацеливании на лечение пациентов с тяжелой эозинофильной астмой это лечение значительно снижает общее количество обострений на пациента, а также количество обострений. обострений, требующих госпитализации.
Другие реагенты, оцениваемые для лечения заболеваний легких, включают тоцилизумаб, гуманизированное моноклональное антитело, которое блокирует активность рецептора интерлейкина-6 (IL-6R). Этот реагент был опробован в контексте интерстициального заболевания легких (ILD), которое связано с системным склерозом у пациентов с диагнозом менее 2 лет.
76
Пациенты, получавшие тоцилизумаб, показали сохраненную функцию легких по сравнению с пациентами, получавшими плацебо. В небольшом внеплановом исследовании, посвященном лечению пациентов с прогрессирующим заболеванием и не прошедшим другие виды иммунотерапевтического лечения, 4 из 9 показали стабилизацию заболевания.
77
Этот реагент был опробован в контексте интерстициального заболевания легких (ILD), которое связано с системным склерозом у пациентов с диагнозом менее 2 лет.
76
Пациенты, получавшие тоцилизумаб, показали сохраненную функцию легких по сравнению с пациентами, получавшими плацебо. В небольшом внеплановом исследовании, посвященном лечению пациентов с прогрессирующим заболеванием и не прошедшим другие виды иммунотерапевтического лечения, 4 из 9 показали стабилизацию заболевания.
77
Многочисленные исследования на животных продемонстрировали роль цитокинов семейства IL-17 в воспалительном заболевании легких и блокирование IL-17a.
78
или IL-17e, также известный как IL-25
79
уменьшает патологию легких.Кроме того, было показано, что ингибиторы фосфоинозитид-3-киназ (PI3K), которые активируются после передачи сигналов IL-25, эффективны в снижении астмы, такой как гиперчувствительность дыхательных путей и воспаление дыхательных путей.
80
Гуманизированное антитело против ИЛ-17а, секукинумаб, которое успешно применялось для лечения псориаза, безуспешно испытывалось в когорте кортикостероидорезистентных астматиков. 81 год
81 год
В целом, неспособность продемонстрировать улучшенные результаты после лечения биологическими препаратами, направленными против ряда воспалительных цитокинов, обескураживает, но с учетом эффективности таких подходов в лечении других воспалительных состояний, а затем дополнительных подходов к дозированию или, возможно, многоцелевых биопрепаратов 82 может привести к эффективному лечению заболеваний легких человека.
Как описано выше, легкие обладают способностью к регенерации, особенно эпителий легких, процесс, который зависит от выживания подходящих клеток-предшественников, расположенных на жизнеспособном расстоянии от места повреждения. Недавнее отслеживание клонов судьбы альвеолярных клеток-предшественников у мышей описывает продолжающееся, но нечастое образование новых альвеолярных единиц, при этом клетки ATII действуют как предшественники для клеток ATI.
38
(Фигура ). После специфического повреждения ATI гипероксигенацией большое количество клеток ATII способствует обновлению популяции ATI. Важно отметить, что авт. Обнаружили интактный компартмент ATII как у молодых, так и у старых мышей.
33
Фенотип дополнительных клеток-предшественников определялся различными поверхностными маркерами, включая бронхоальвеолярные стволовые клетки (BASC) в соединениях бронхоальвеолярных протоков, мультипотентные эпителиальные стволовые / предшественники.
83
и клетки-предшественники, отрицательные по клону, которые размножаются после повреждения. Вклад мезенхимальных стромальных клеток в RLG не выяснен, хотя McQualter продемонстрировал доказательства того, что пролиферация эпителиальных стволовых / предшественников клеток зависит от факторов роста, высвобождаемых резидентными мезенхимальными стромальными клетками во взрослом легком.83
Недавнее исследование показало, что мезенхимальные стромальные клетки от старых мышей слабо пролиферируют в ответ на пневмонэктомию по сравнению с молодыми мышами.
33
Более того, новая альвеоляризация требует образования новых перегородок, управляемых альфа-гладкомышечным актином + интерстициальных миофибробластов, которые происходят из субпопуляции тромбоцитов фактора роста-альфа + фибробластов, которые отвечают на рецептор-γ, активированный пролифератором пероксисом.
Важно отметить, что авт. Обнаружили интактный компартмент ATII как у молодых, так и у старых мышей.
33
Фенотип дополнительных клеток-предшественников определялся различными поверхностными маркерами, включая бронхоальвеолярные стволовые клетки (BASC) в соединениях бронхоальвеолярных протоков, мультипотентные эпителиальные стволовые / предшественники.
83
и клетки-предшественники, отрицательные по клону, которые размножаются после повреждения. Вклад мезенхимальных стромальных клеток в RLG не выяснен, хотя McQualter продемонстрировал доказательства того, что пролиферация эпителиальных стволовых / предшественников клеток зависит от факторов роста, высвобождаемых резидентными мезенхимальными стромальными клетками во взрослом легком.83
Недавнее исследование показало, что мезенхимальные стромальные клетки от старых мышей слабо пролиферируют в ответ на пневмонэктомию по сравнению с молодыми мышами.
33
Более того, новая альвеоляризация требует образования новых перегородок, управляемых альфа-гладкомышечным актином + интерстициальных миофибробластов, которые происходят из субпопуляции тромбоцитов фактора роста-альфа + фибробластов, которые отвечают на рецептор-γ, активированный пролифератором пероксисом. (PPAR ‐ γ).
84
Кроме того, есть доказательства того, что клетки костного мозга вносят вклад в RLG.85
Иммунные клетки, такие как альвеолярные макрофаги, являются потенциальными источниками факторов роста и протеаз, которые могут иметь решающее значение для ремоделирования тканей. Таким образом, вполне вероятно, что клетки-предшественники, резидентные и инфильтрирующие клетки необходимы для успешной регенерации легких, и дефекты в любой из этих популяций могут ограничивать регенеративный потенциал.
(PPAR ‐ γ).
84
Кроме того, есть доказательства того, что клетки костного мозга вносят вклад в RLG.85
Иммунные клетки, такие как альвеолярные макрофаги, являются потенциальными источниками факторов роста и протеаз, которые могут иметь решающее значение для ремоделирования тканей. Таким образом, вполне вероятно, что клетки-предшественники, резидентные и инфильтрирующие клетки необходимы для успешной регенерации легких, и дефекты в любой из этих популяций могут ограничивать регенеративный потенциал.
Локализация предшественников эпителиальных клеток, которые способствуют неоальвеоляризации. Исследования по отслеживанию клонов выявили новую роль клеток-предшественников дыхательных путей в восстановлении и регенерации альвеол.38
CCSP + клубные клетки могут самообновляться и давать реснитчатые клетки для восстановления дыхательных путей. Клетки клуба, характеризующиеся экспрессией CYP2F2, могут дифференцироваться в клетки AECII и AECI. Клетки клуба с низкой экспрессией CYP2F2 (вариантные клетки клуба, расположенные рядом с нейроэндокринными телами) устойчивы к повреждениям, вызванным нафталином, и помогают регенерировать обнаженные дыхательные пути и альвеолярные области. Активация предшественников p63 + после инфицирования вирусом гриппа h2N1 дает стручки p63 + / KRT5 + , которые могут мигрировать из эпителия дистальных отделов дыхательных путей в оголенные альвеолярные области для участия в неоальвеоляризации.BASCs, расположенные в соединении бронхоальвеолярных протоков, могут дифференцироваться на клетки клубов дыхательных путей и AECIIs. SP ‐ C + Клетки, продуцирующие сурфактант AECII, считаются классическими предшественниками AECI; однако вариант AECII, характеризующийся экспрессией SP-C — / α6β4 + , представляет собой дополнительный источник AECII и AECI. AECI, которые покрывают 90% альвеолярного эпителия, считаются терминально дифференцированными и характеризуются экспрессией AQP5, PDPN, HOPX и AGER.Пластичность AEC1s была продемонстрирована с помощью методов отслеживания клонов, которые показали, что AECI HOPX + / Igfbp2 — могут дифференцироваться от AECIIs.
Активация предшественников p63 + после инфицирования вирусом гриппа h2N1 дает стручки p63 + / KRT5 + , которые могут мигрировать из эпителия дистальных отделов дыхательных путей в оголенные альвеолярные области для участия в неоальвеоляризации.BASCs, расположенные в соединении бронхоальвеолярных протоков, могут дифференцироваться на клетки клубов дыхательных путей и AECIIs. SP ‐ C + Клетки, продуцирующие сурфактант AECII, считаются классическими предшественниками AECI; однако вариант AECII, характеризующийся экспрессией SP-C — / α6β4 + , представляет собой дополнительный источник AECII и AECI. AECI, которые покрывают 90% альвеолярного эпителия, считаются терминально дифференцированными и характеризуются экспрессией AQP5, PDPN, HOPX и AGER.Пластичность AEC1s была продемонстрирована с помощью методов отслеживания клонов, которые показали, что AECI HOPX + / Igfbp2 — могут дифференцироваться от AECIIs./cough_doctor-patient-576a98685f9b58346a27bbae.jpg) 38
38
Демонстрация плюрипотентности мезенхимальных стволовых клеток (МСК) естественным образом подтолкнула к предположению, что они могут играть отдельно друг от друга в регенеративных процессах. В многочисленных исследованиях было показано, что адоптивная трансплантация МСК оказывает прорегенеративное и противовоспалительное действие, часто когда они накапливаются в тканях легких.Например, адоптивно перенесенные МСК показали положительные преимущества в контексте вызванного блеомицином повреждения легких у мышей,
86
эффект, приписываемый продукции антагониста рецептора IL-1 МСК. Общей особенностью, описанной во многих протоколах адаптивной передачи MSC, является низкая частота и долговечность MSC, которые обнаруживаются более чем через 1 день после передачи. Дальнейшие исследования in vitro и продемонстрировали, что экзосомы, которые представляют собой небольшие мембранные везикулы, содержащие смешанные концентрации цитоплазматических молекул, высвобождаются из культивированных MSC, полученных из жировой ткани.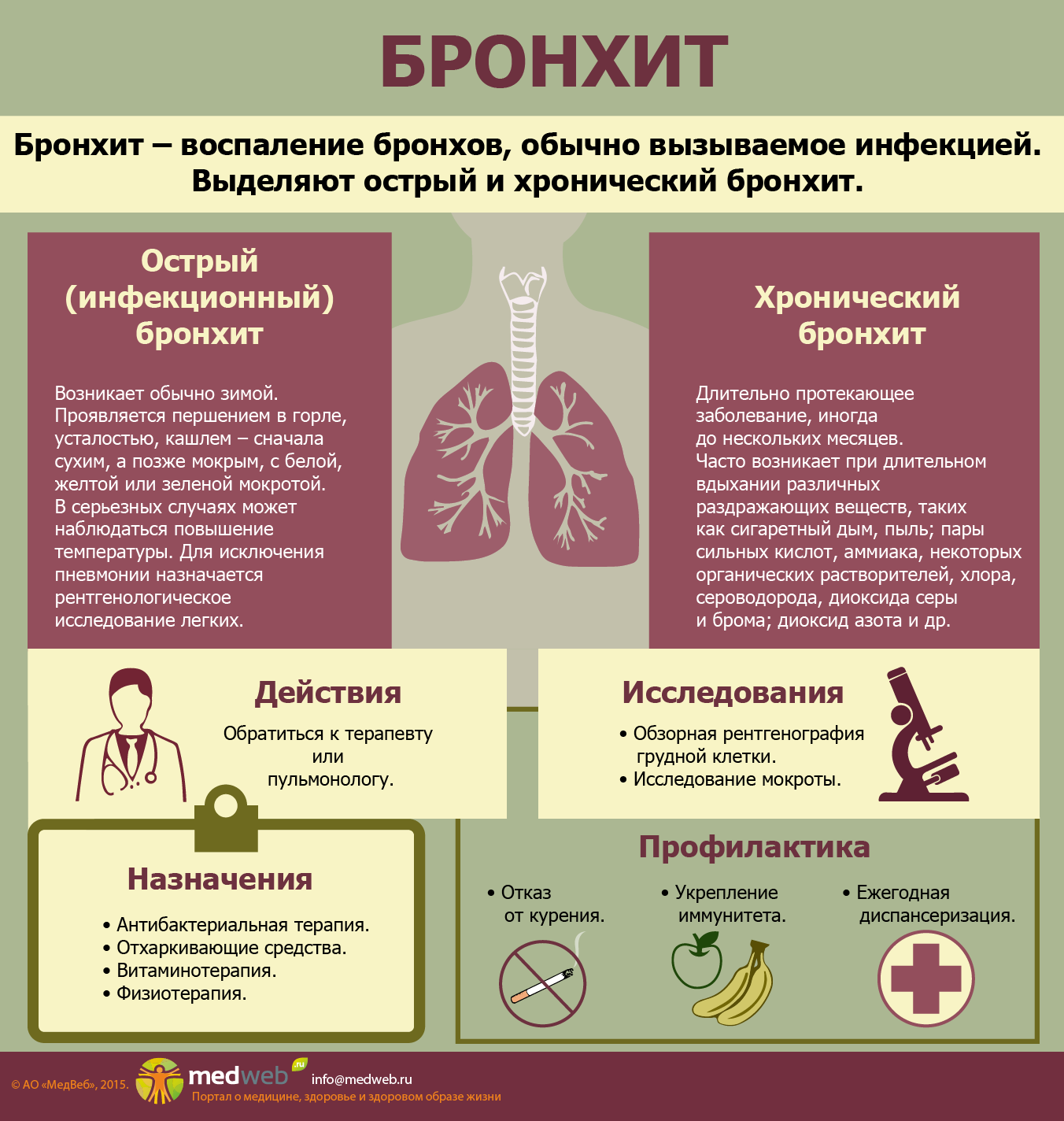 Эти экзосомы содержат и экспрессируют альфа-1-антитрипсин на своей поверхности,
87
молекула, которая сильно ингибирует активность протеазы. Было продемонстрировано, что эти экзосомы проявляют антиэластазную активность и обеспечивают доказательство концепции бесклеточных систем доставки, которые могут использоваться для подавления модуляции протеаз, активных в местах хронического воспаления.
Эти экзосомы содержат и экспрессируют альфа-1-антитрипсин на своей поверхности,
87
молекула, которая сильно ингибирует активность протеазы. Было продемонстрировано, что эти экзосомы проявляют антиэластазную активность и обеспечивают доказательство концепции бесклеточных систем доставки, которые могут использоваться для подавления модуляции протеаз, активных в местах хронического воспаления.
В других исследованиях изучалась эффективность лечения повреждений легких всей транс-ретиноевой кислотой (ATRA), учитывая, что она имеет структурную связь с витамином А и, как было показано, участвует в развитии легких.88 В ряде исследований опубликованы улучшенные результаты с использованием ATRA после повреждения легких, вызванного эластазой, у крыс и мышей. 89 , 90 Недавно Такеда и др. . 91 продемонстрировали потенциальное усиление эффекта восстановительного адоптивного переноса МСК в легкое мыши, поврежденное эластазой, путем одновременного системного лечения с помощью ATRA. Они описали, что MCS вызывал синергетический восстановительный ответ, который включал уменьшение среднего линейного расстояния пересечения, увеличение податливости легкого и увеличение площади поверхности легкого.Авторы представили доказательства того, что мишень млекопитающих для функции рапамицина (mTor), связанная с активностью киназы кофактора S6k1, имеет решающее значение для восстановительного эффекта и что синергизм с ATRA блокируется, когда функция mTor ингибируется препаратом рапамицин.
Как обсуждалось ранее, провоспалительные медиаторы, выделяемые PAMP- и DAMP-активированными клетками, включают простагландины, которые действуют на эндотелиальные клетки, увеличивая местный кровоток, на местные нервы, вызывая боль, и влияют на функцию лейкоцитов, включая нейтрофилы.Ферменты циклооксигеназы (ЦОГ) -1 и 2 участвуют в биосинтезе простагландинов и являются мишенями нестероидных противовоспалительных ингибиторов, в том числе аспирина. Активация нейтрофилов простагландином-E 2 (PGE 2) вызывает переключение производства провоспалительного лейкотриена бета-4 (LTB 4 ) на молекулу липоксина, которая снижает дальнейшее рекрутирование нейтрофилов ( Фигура ). Производство других противовоспалительных молекул также было обнаружено в результате исследования модуляции биосинтеза жирных кислот во время воспаления (обзор Serhan et al .92 ), включая резольвины, протектины и марезины серий D и E. Эти молекулы образуются либо как прямые биохимические продукты путей биосинтеза полиненасыщенных жирных кислот, либо в ответ на блокирование активности циклооксигеназы такими молекулами, как аспирин. Исходным сырьем для этих молекул являются омега-3 жирные кислоты, и это дает механистическое объяснение связанных с ними преимуществ для здоровья диет, содержащих продукты, богатые этими липидами. 93 Возможность модуляции продукции этих молекул in vivo или их терапевтического использования только устанавливается, и имеются доказательства того, что лечение резольвином E1 может уменьшить воспаление легких в зависимости от апоптоза, 94 в то время как исследования, посвященные применению так называемого иммунного питания, демонстрируют некоторую клиническую эффективность в измеримом повышении уровней резолвина E1 в плазме и снижении уровней IL-6 в плазме.95
Переназначение биосинтеза простагландинов для создания факторов расслаивания ран. Незаметные, но глубокие изменения метаболизма различных жирных кислот прекурсоры возникают из-за изменения активности ферментов, таких как липоксигеназы и высвобождают противовоспалительные молекулы, такие как липоксины и резолвины, могут изменить баланс с провоспалительной среды на благоприятную для заживления. 15-HETE, 15-гидроксиэйкозатетраеновая кислота; 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; BLT1, рецептор лейкотриена; ЦОГ-2, циклооксигеназа 2; DHA, докозагексаеновая кислота; EPA, эйкозапентаеновая кислота; FPRL, рецептор формилпептида, подобный-1; LXA 4 , липоксин А4; LXB 4 , липоксин B4; Mϕ, макрофаг; Омега-3 жирные кислоты, содержащие омега-3 жирные кислоты; PGE 2 , простагландин E2.
Эти доклинические исследования дают надежду на то, что даже в сильно поврежденных легких функция может быть частично восстановлена, при этом ясно, что более глубокое понимание механизмов, лежащих в основе восстановления легких, еще не достигнуто.
Выводы
Задача перспективной помощи в восстановлении после повреждения легких и улучшения клинических исходов заключается в разработке методов лечения, которые улучшают регенеративные процессы, а не процессы восстановления. Как обсуждалось выше, управление воспалительной реакцией кажется ключом к этим улучшениям.Тогда можно было бы рассмотреть возможность применения анти-цитокиновых агентов, доступных в настоящее время в клинике, таких как анти-IL-1 и анти-IL-6, для модуляции острых воспалительных реакций с потенциальными преимуществами, уравновешенными другими клиническими факторами риска. Например, повышенный риск заражения можно снизить за счет совместного лечения с антипатогенными препаратами. Дальнейшее понимание масштабов и силы эндогенных противовоспалительных молекул, таких как резольвиноподобные молекулы, эффективность которых может зависеть от диеты, может положительно повлиять на потенциал заживления легких на популяционном уровне.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
JY был поддержан международной стипендией для аспирантов Университета Мердока. Авторы выражают признательность покойному профессору Джеффри Лорану за наставничество.
Список литературы
2. Arcavi L, Benowitz NL. Курение сигарет и инфекция. Arch Intern Med 2004; 164: 2206–2216. [PubMed] [Google Scholar] 3. Принц Л.Р., Уайт МК, Сабро I, Паркер Л.С. Роль TLR в активации нейтрофилов.Curr Opin Pharmacol 2011; 11: 397–403. [PubMed] [Google Scholar] 4. Элсон Д.А., Райан Х.Э., Сноу Д.В., Джонсон Р., Арбейт Дж. М.. Координированная активация генов-мишеней фактора, индуцируемого гипоксией (HIF) -1альфа и HIF-1, во время многоступенчатого эпидермального канцерогенеза и заживления ран. Рак Res 2000; 60: 6189–6195. [PubMed] [Google Scholar] 5. Исии Й, Ито К., Моришима Й и др. Фактор транскрипции Nrf2 играет ключевую роль в защите от вызванного эластазой воспаления легких и эмфиземы.J Immunol 2005; 175: 6968–6975. [PubMed] [Google Scholar] 6. Пак Джей, Ким Д.Х., Шах С.Р. и др. Подобное переключателю усиление эпителиально-мезенхимального перехода с помощью YAP посредством регуляции обратной связи WT1 и GTPases семейства Rho. Nat Commun 2019; 10: 2797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Stone RC, Pastar I, Ojeh N и др. Эпителиально-мезенхимальный переход при восстановлении тканей и фиброзе. Клеточная ткань Res 2016; 365: 495–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Гарт Дж., Барнс Дж. В., Крик С. Ориентация на цитокины как развивающиеся стратегии лечения хронических воспалительных заболеваний дыхательных путей. Int J Mol Sci 2018; 19: 3402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Мацуо Р., Охкохти Н., Мурата С. и др. Тромбоциты сильно индуцируют пролиферацию гепатоцитов с помощью IGF-1 и HGF in vitro . J Surg Res 2008; 145: 279–286. [PubMed] [Google Scholar] 11. Serhan CN. Фаза разрешения воспаления: новые эндогенные противовоспалительные и пролонгирующие липидные медиаторы и пути.Анну Рев Иммунол 2007; 25: 101–137. [PubMed] [Google Scholar] 12. Лайонс-Джордано Б., Пратта М.А., Гэлбрейт В., Дэвис Г.Л., Арнер Э.С. Интерлейкин-1 дифференциально модулирует хондроцитарную экспрессию циклооксигеназы-2 и фосфолипазы А2. Exp Cell Res 1993; 206: 58–62. [PubMed] [Google Scholar] 13. Жорж К., Азулай Э, Мокарт Д. и др. Влияние нейтропении на смертность больных раком в критическом состоянии: результаты метаанализа индивидуальных данных. Crit Care 2018; 22: 326. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15.Свенсон Дж. А., Хоппе А. Д.. Координация передачи сигналов во время фагоцитоза, опосредованного Fc-рецептором. J Leukoc Biol 2004; 76: 1093–1103. [PubMed] [Google Scholar] 16. Чжоу MJ, Браун EJ. CR3 (Mac-1, альфа M бета 2, CD11b / CD18) и Fc гамма RIII взаимодействуют в генерации респираторного выброса нейтрофилов: потребность в Fc гамма RIII и фосфорилировании тирозина. J Cell Biol 1994; 125: 1407–1416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пигната К., Прасад К.В., Робертсон М.Дж., Левин Х., Радд С.Е., Ритц Дж.Передача сигналов, опосредованная Fc gamma RIIIA, включает lck семейства src в естественных клетках-киллерах человека. J Immunol 1993; 151: 6794–6800. [PubMed] [Google Scholar] 18. Kinet JP. Рецептор IgE с высоким сродством (Fc epsilon RI): от физиологии к патологии. Анну Рев Иммунол 1999; 17: 931–972. [PubMed] [Google Scholar] 19. Хассел Т., Белл Т.Дж. Альвеолярные макрофаги: пластичность в тканевом контексте. Нат Рев Иммунол 2014; 14: 81–93. [PubMed] [Google Scholar] 20. Копф М, Шнайдер С, Нобс С.П. Развитие и функция резидентных в легких макрофагов и дендритных клеток.Нат Иммунол 2015; 16: 36–44. [PubMed] [Google Scholar] 21. Хоган Р.Дж., Чжун В., Ушервуд Э.Дж., Кукенхэм Т., Робертс А.Д., Вудленд Д.Л. Защита от респираторных вирусных инфекций может быть обеспечена антиген-специфическими CD4 + Т-клетками, которые сохраняются в легких. J Exp Med 2001; 193: 981–986. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Бринкманн В., Райхард Ю., Гусманн С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 2004; 303: 1532–1535. [PubMed] [Google Scholar] 23.Холт П.Г., Стрикленд Д.Х., Викстром Мэн, Янсен Флорида. Регуляция иммунологического гомеостаза в дыхательных путях. Нат Рев Иммунол 2008; 8: 142–152. [PubMed] [Google Scholar] 24. Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O’Garra A, Murphy KM. Развитие Th2CD4 + T-клеток посредством IL-12, продуцируемого Listeria-индуцированными макрофагами. Наука 1993; 260: 547–549. [PubMed] [Google Scholar] 25. Welsby I, Goriely S. Регулирование экспрессии интерлейкина-23 при здоровье и болезни.Adv Exp Med Biol 2016; 941: 167–189. [PubMed] [Google Scholar] 26. Куа DJ, Шерлок Джей, Чен И и др. Интерлейкин-23, а не интерлейкин-12, является критическим цитокином для аутоиммунного воспаления головного мозга. Природа 2003; 421: 744–748. [PubMed] [Google Scholar] 27. Ауйла С.Дж., Чан Ю.Р., Чжэн М. и др. IL-22 обеспечивает защиту слизистой оболочки хозяина от грамотрицательной бактериальной пневмонии. Нат Мед 2008; 14: 275–281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Фумагалли С., Торри А., Папанья А., Читтерио С., Майнольди Ф, Фоти М.IL-22 быстро индуцируется стимуляцией рецепторов распознавания патогенов в дендритных клетках костного мозга в отсутствие IL-23. Научный представитель 2016; 6: 33900. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мати С.А., Диксон К.Л., Уокер С.А. и др. Альвеолярные макрофаги являются стражами легочного гомеостаза мыши после заражения ингаляционным антигеном. Аллергия 2015; 70: 80–89. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Делонг Дж. Х., О’Хара Холл А, Рауш М. и др. Стимуляция IL-27 и TCR способствуют экспрессии множественных ингибирующих рецепторов Т-клетками.Иммунохоризонты 2019; 3: 13–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Коллисон Л. В., Чатурведи В., Хендерсон А. Л. и др. ИЛ-35-опосредованная индукция мощной регуляторной популяции Т-клеток. Нат Иммунол 2010; 11: 1093–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Кулашекаран П., Скавон Калифорния, Роджерс Д.С., Аренберг Д.А., Танникал В.Дж., Горовиц Дж.С. Эндотелин-1 и трансформирующий фактор роста-бета1 независимо индуцируют устойчивость фибробластов к апоптозу через активацию AKT. Am J Respir Cell Mol Biol 2009; 41: 484–493.[Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Паксон Дж. А., Грунтман А. М., Дэвис А. М., Паркин С. М., Ингенито Е. П., Хоффман А. М.. Возрастная зависимость динамики мезенхимальных стромальных клеток легких после пневмонэктомии. Stem Cells Dev. 2013; 22: 3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ли CC, Ван CN, Ли Ю.Л., Цай Ю.Р., Лю Дж.Дж. Блок 1 группы с высокой подвижностью индуцировал дифференцировку миофибробластов легких человека и усиленную миграцию за счет активации MMP-9. PLoS One 2015; 10: e0116393. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35.Giangreco A, Arwert EN, Rosewell IR, Snyder J, Watt FM, Stripp BR. Стволовые клетки незаменимы для гомеостаза легких, но восстанавливают дыхательные пути после травмы. Proc Natl Acad Sci USA 2009; 106: 9286–9291. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Рок JR, Баркаускас CE, Cronce MJ и др. Множественные популяции стромы способствуют легочному фиброзу без доказательств перехода эпителия в мезенхиму. Proc Natl Acad Sci USA 2011; 108: E1475 – E1483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Шиллер Х. Б., Фернандес И. Е., Бургшталлер Г. и др. Протеомное профилирование внеклеточной ниши с разрешением по времени и компартментам при повреждении и восстановлении легких. Мол Сист Биол 2015; 11: 819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Десаи Т.Дж., Браунфилд Д.Г., Краснов М.А. Альвеолярные клетки-предшественники и стволовые клетки в развитии, обновлении и раке легких. Природа 2014; 507: 190–194. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Дин БС, Нолан Диджей, Го П и др. Ангиокринные сигналы, полученные из эндотелия, вызывают и поддерживают регенеративную альвеоляризацию легких.Клетка 2011; 147: 539–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Kolb M, Margetts PJ, Sime PJ, Gauldie J. Протеогликаны, декорин и бигликан по-разному модулируют опосредованные TGF-бета фиброзные ответы в легких. Am J Physiol Lung Cell Mol Physiol 2001; 280: L1327 – L1334. [PubMed] [Google Scholar] 41. Tufvesson E, Westergren-Thorsson G. Бигликан и декорин вызывают морфологические и цитоскелетные изменения, включая передачу сигналов малыми GTPasesRhoA и Rac1, что приводит к миграции фибробластов легких.J Cell Sci 2003; 116: 4857–4864. [PubMed] [Google Scholar] 42. Нордхук Дж.А., Постма Д.С., Чонг Л.Л. и др. Различная модуляция продукции декорина фибробластами легких у пациентов с легкой и тяжелой эмфиземой. ХОБЛ 2005; 2: 17–25. [PubMed] [Google Scholar] 43. Кахари В.М., Хаккинен Л., Вестермарк Дж., Ларджава Х. Дифференциальная регуляция экспрессии гена декорина и бигликана дексаметазоном и ретиноевой кислотой в культивируемых фибробластах кожи человека. J Invest Dermatol 1995; 104: 503–508. [PubMed] [Google Scholar] 44.Оливейра М.В., Абреу СК, Падилья Г.А. и др. Характеристика модели эмфиземы на мышах, вызванной множественными инстилляциями низкой дозы эластазы. Front Physiol 2016; 7: 457. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Dong J, Yu X, Porter DW, Battelli LA, Kashon ML, Ma Q. Общие и отдельные механизмы индуцированного легочного фиброза твердыми частицами и растворимыми химическими фиброгенными агентами. Arch Toxicol 2016; 90: 385–402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Миллер Ф. В., Альфредссон Л., Костенбадер К. Х. и др. Эпидемиология воздействия окружающей среды и аутоиммунных заболеваний человека: результаты семинара экспертной группы Национального института наук об окружающей среде.J Аутоиммунный 2012; 39: 259–271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Янаи М., Секизава К., Охруи Т., Сасаки Х., Такисима Т. Место обструкции дыхательных путей при легочной болезни: прямое измерение внутрибронхиального давления. J Appl Physiol 1992; 72: 1016–1023. [PubMed] [Google Scholar] 49. Weibel ER. Принципы и методы морфометрического исследования легкого и других органов. Лаборатория Инвест 1963; 12: 131–155. [PubMed] [Google Scholar] 50. Хорсфилд К., Камминг Г. Морфология бронхиального дерева у человека.J Appl Physiol 1968; 24: 373–383. [PubMed] [Google Scholar] 51. McDonough JE, Yuan R, Suzuki M и др. Обструкция мелких дыхательных путей и эмфизема легких при хронической обструктивной болезни легких. N Engl J Med 2011; 365: 1567–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Ю. П., Диу СК. Общее и региональное выпадение вдыхаемых аэрозолей на человека. J Aerosol Sci 1983; 14: 599–609. [Google Scholar] 53. Ким С.С., Ху СК, ДеВитт П., Джеррити Т.Р. Оценка регионального отложения вдыхаемых частиц в легких человека методом серийной болюсной доставки.J Appl Physiol (1985). 1996; 81: 2203–2213. [PubMed] [Google Scholar] 54. Hogg JC, McDonough JE, Suzuki M. Малая обструкция дыхательных путей при ХОБЛ: новые идеи, основанные на изображениях микро-КТ и МРТ. Грудь 2013; 143: 1436–1443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Мюллер К.С., Велкер Л., Пааш К. и др. Фибробласты легких пациентов с эмфиземой обнаруживают маркеры старения in vitro . Respir Res 2006; 7: 32. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. RyuJH Colby TV, Hartman TE, Vassallo R.Интерстициальные заболевания легких, связанные с курением: краткий обзор. Eur Respir J 2001; 17: 122–132. [PubMed] [Google Scholar] 57. Каспер М., Хароске Г. Изменения в альвеолярном эпителии после травмы, приводящие к фиброзу легких. Гистол гистопатол 1996; 11: 463–483. [PubMed] [Google Scholar] 58. Сейболд М.А., Мудрый А.Л., Шпир М.С. и др. Обычный полиморфизм промотора MUC5B и фиброз легких. N Engl J Med 2011; 364: 1503–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Molyneaux PL, Cox MJ, Willis ‐ Owen SA и др. Роль бактерий в патогенезе и прогрессировании идиопатического фиброза легких.Am J Respir Crit Care Med 2014; 190: 906–913. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хэмс Э., Армстронг МЭ, Барлоу Дж.Л. и др. IL-25 и врожденные лимфоидные клетки 2-го типа вызывают фиброз легких. Proc Natl Acad Sci USA 2014; 111: 367–372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Обен Вега М., Чупен К., Паскариу М. и др. Дексаметазон не может улучшить вызванное блеомицином острое повреждение легких у мышей. Physiol Rep 2019; 7: e14253. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.Чармандари Э, Кино Т, Итиджо Т, Хрусос ГП. Общая резистентность к глюкокортикоидам: клинические аспекты, молекулярные механизмы и последствия редкого генетического нарушения. J Clin Endocrinol Metab 2008; 93: 1563–1572. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Donnelly SC, Bucala R. Фактор ингибирования миграции макрофагов: регулятор активности глюкокортикоидов с критической ролью в воспалительном заболевании. Мол Мед сегодня 1997; 3: 502–507. [PubMed] [Google Scholar] 64. Барнс П.Дж., Адкок И.М. Устойчивость к глюкокортикоидам при воспалительных заболеваниях.Ланцет 2009; 373: 1905–1917. [PubMed] [Google Scholar] 65. Ито К., Герберт К., Зигл Дж. С. и др. Стероид-резистентное нейтрофильное воспаление на мышиной модели острого обострения астмы. Am J Resp Cell Mol 2008; 39: 543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Эрнандес М.Л., Миллс К, Миндаль М и др. Антагонист рецептора IL-1 снижает вызванное эндотоксином воспаление дыхательных путей у здоровых добровольцев. J Allergy Clin Immunol 2015; 135: 379–385. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.Galozzi P, Baggio C, Bindoli S, Oliviero F, Sfriso P. Развитие и роль в терапии канакинумаба при болезни, начинающейся у взрослых. Фронт Фармакол 2018; 9: 1074. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Calverley PMA, Sethi S, Dawson M и др. Рандомизированное плацебо-контролируемое исследование моноклонального антитела MEDI8968 против рецептора 1 интерлейкина-1 при хронической обструктивной болезни легких. Resp Res 2017; 18: 153. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Хамид К., Аззави М., Инь С. и др. Экспрессия мРНК интерлейкина-5 в биоптатах слизистой оболочки бронхов от астмы.J Clin Invest 1991; 87: 1541–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Хоган С.П., Коскинен А., Маттеи К.И., Янг И.Г., Фостер П.С. Т-клетки CD4 + , продуцирующие интерлейкин 5, играют ключевую роль в эозинофилии, вызванной аэроаллергеном, гиперреактивности бронхов и повреждении легких у мышей. Am J Respir Crit Care Med 1998; 157: 210–218. [PubMed] [Google Scholar] 74. Mold AW, Matthaei KI, Young IG, Foster PS. Связь между интерлейкином-5 и эотаксином в регуляции эозинофилии крови и тканей у мышей.J Clin Invest 1997; 99: 1064–1071. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Фостер П.С., Хоган С.П., Рамзи А.Дж., Маттеи К.И., Янг И.Г. Дефицит интерлейкина 5 устраняет эозинофилию, гиперреактивность дыхательных путей и повреждение легких на модели астмы у мышей. J Exp Med 1996; 183: 195–201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Khanna D, Jahreis A, Lin CJF. Ответ на: Нарваез «Эффективность и безопасность тоцилизумаба для лечения рефрактерного системного склероза, связанного с интерстициальным заболеванием легких: серия случаев».Энн Рум Дис 2019; 78: e124. [PubMed] [Google Scholar] 77. Нарваез Дж., Л.Луч Дж., Алегри Санчо Дж. Дж., Молина-Молина М., Нолла Дж. М., Кастельви И. Эффективность и безопасность тоцилизумаба для лечения интерстициального заболевания легких, связанного с рефрактерным системным склерозом: серия случаев. Энн Рум Дис 2019; 78: e123. [PubMed] [Google Scholar] 78. Чиполла Э., Фишер А.Дж., Гу Х. и др. Дефицит IL-17A снижает вызванную блеомицином активацию комплемента во время фиброза легких. FASEB J 2017; 31: 5543–5556.[Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Баллантайн С.Дж., Барлоу Д.Л., Джолин Х.Э. и др. Блокирование IL-25 предотвращает гиперреактивность дыхательных путей при аллергической астме. J Allergy Clin Immunol 2007; 120: 1324–1331. [PubMed] [Google Scholar] 80. Хуан П, Ли И, Ур З и др. Комплексное ослабление индуцированной IL-25 гиперчувствительности дыхательных путей, воспаления и ремоделирования с помощью ингибитора PI3K LY294002. Респирология 2017; 22: 78–85. [PubMed] [Google Scholar] 82. Ван И, Ву Цю, Лю Цзинь и др. Рекомбинантные IgG-подобные биспецифические антитела, действующие как ингибитор интерлейкина-1бета и интерлейкина-17А, демонстрируют многообещающую эффективность при ревматоидном артрите.Biomed Pharmacother 2017; 89: 426–437. [PubMed] [Google Scholar] 83. McQualter JL, Yuen K, Williams B, Bertoncello I. Доказательства иерархии эпителиальных стволовых / предшественников в легких взрослых мышей. Proc Natl Acad Sci USA 2010; 107: 1414–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Чен Л., Аччиани Т., Ле Крас Т., Лутцко С., Perl AK. Динамическая регуляция экспрессии альфа-рецептора фактора роста тромбоцитов в альвеолярных фибробластах во время реальвеоляризации. Am J Resp Cell Mol 2012; 47: 517–527.[Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Шуга А., Уэда К., Такемото Ю. и др. Значительная роль клеток костного мозга в компенсаторном регенеративном росте легких. J Surg Res 2013; 183: 84–90. [PubMed] [Google Scholar] 86. Ортис Л.А., Дутрейл М., Фаттман С. и др. Антагонист рецептора интерлейкина 1 опосредует противовоспалительный и антифибротический эффект мезенхимальных стволовых клеток при повреждении легких. Proc Natl Acad Sci USA 2007; 104: 11002–11007. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87.Бари Э., Ферраротти I, Ди Сильвестр Д. и др. Жировые мезенхимальные внеклеточные везикулы как физиологические системы доставки альфа-1-антитрипсина для регенерации легких. Клетки 2019; 8: 965. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Массаро Г.Д., Массаро Д. Лечение ретиноевой кислотой устраняет вызванную эластазой эмфизему легких у крыс. Нат Мед 1997; 3: 675–677. [PubMed] [Google Scholar] 90. Сейфарт C, Муйал JP, Плагенс А и др. Полностью транс-ретиноевая кислота приводит к нерегулярному восстановлению перегородок и не может подавлять провоспалительные макрофаги.Eur Respir J 2011; 38: 425–439. [PubMed] [Google Scholar] 91. Такеда К., Нин Ф., Доменико Дж. и др. Активация киназы p70S6-1 в мезенхимальных стволовых клетках важна для восстановления ткани легких. Стволовые клетки Transl Med 2018; 7: 551–558. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92. Serhan CN, Levy BD. Резолвины в воспалении: появление про-разрешающего суперсемейства медиаторов. J Clin Invest 2018; 128: 2657–2669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Фарзан-Фар Р., Харрис В.С., Гарг С., На Б., Вули М.А.Обратная связь уровней жирных кислот n-3 в эритроцитах с воспалительными биомаркерами у пациентов со стабильной ишемической болезнью сердца: исследование сердца и души. Атеросклероз 2009; 205: 538–543. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Эль Кебир Д., Гьорструп П., Филеп Дж. ResolvinE1 способствует апоптозу нейтрофилов, вызванному фагоцитозом, и ускоряет разрешение легочного воспаления. Proc Natl Acad Sci USA 2012; 109: 14983–14988. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Uno H, Furukawa K, Suzuki D и др. Иммунное питание подавляет острые воспалительные реакции за счет модуляции резольвина E1 у пациентов, перенесших обширную резекцию гепатобилиарной системы.Операция 2016; 160: 228–236. [PubMed] [Google Scholar]Регенерация и восстановление в заживающем легком
Clin Transl Immunology. 2020; 9 (7): e1152.
, 1 , 2 и 1 , 3Эндрю Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Джо Яса
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Микаэла Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Автор, ответственный за переписку. * ПерепискаЭндрю Лукас, Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт, Вашингтон 6009, Австралия.
Эл. Почта: [email protected],
Поступила в редакцию 3 декабря 2019 г .; Пересмотрено 26 мая 2020 г .; Принята в печать 10 июня 2020 г.
Авторские права © 2020 Авторы. Клиническая и трансляционная иммунология , опубликованная John Wiley & Sons Australia, Ltd от имени Австралийско-новозеландского общества иммунологии, Inc. Это статья в открытом доступе на условиях http: // creativecommons.org / licenses / by / 4.0 / License, которая разрешает использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Легкое обеспечивает эффективный газообмен между сложной нестерильной атмосферой и телом через тонкую и обширную эпителиальную поверхность с высокой эффективностью из-за упругой деформации, позволяющей увеличивать и уменьшать объем в процессе дыхания и из-за обширной сосудистой сети, которая способствует быстрой диффузии газа.Большая площадь поверхности легких подвергает орган постоянному риску повреждения патогенами, токсинами или раздражителями; однако повреждение легких можно быстро вылечить с помощью регенеративных процессов, которые восстанавливают его структуру и функцию. В ответ на устойчивое и обширное повреждение легкое заживает посредством нерегенеративного процесса, в результате чего рубцовая ткань локально укрепляет ее структуру, что со временем приводит к серьезной потере функции легких и увеличению заболеваемости. В этом обзоре обсуждается то, что известно о факторах, влияющих на заживление легкого путем регенерации или восстановления, и какие потенциальные новые терапевтические подходы могут положительно повлиять на заживление легких.
Ключевые слова: воспаление, легкое, регенерация, восстановление, терапия
Abstract
В этом обзоре обсуждается то, что известно об обнаружении, ответе и устранении повреждения легких, а также то, что может повлиять на заживление легкого путем регенерации или восстановления. В нем также представлены потенциальные терапевтические подходы, которые могут положительно повлиять на заживление легких.
Введение
Оксигенация тканей позвоночных зависит от структур легких, которые являются одновременно хрупкими и уязвимыми для повреждения.В течение жизни человека легкие подвергаются воздействию сотен миллионов литров нестерильного воздуха, сохраняя при этом свою функцию и целостность. Несмотря на эндемические респираторные инфекции, иммунитета легких обычно достаточно для излечения без длительного структурного повреждения. Такие благоприятные исходы были значительно улучшены благодаря использованию терапевтических антибактериальных средств. Тем не менее, устойчивые или более обширные легочные инфекции могут приводить к накоплению фиброзных повреждений, которые хронически влияют на гибкость легких и проницаемость для кислорода.1 Факторы, которые могут повлиять на тяжесть и частоту респираторных инфекций, включают предрасположенность к развитию астмы, недостаточность иммунитета и / или доступ к соответствующим вакцинациям, а также мутации, которые напрямую влияют на физиологию легких, например, при муковисцидозе. Кроме того, длительное воздействие токсинов, например, привычка к курению и / или длительное воздействие высоких уровней переносимых по воздуху загрязнителей, может напрямую повреждать ткань легких и способствовать менее эффективному избавлению от инфекций легких.2 Несмотря на клинически идентифицируемые факторы риска, невозможно своевременно диагностировать и вмешаться, чтобы предотвратить прогрессирующие дегенеративные фиброзные заболевания легких.
В этом обзоре делается попытка сравнить физиологическую регенерацию легких после повреждения с восстановлением, в результате которого рубцовая ткань нарушает нормальную структуру легкого. Мы анализируем вклад иммунного ответа на эти исходы. Несомненно, уровень воспаления в легких в результате повреждения ткани является одним из ключевых факторов, регулирующих физиологическое восстановление по сравнению с фиброзным.Мы обсуждаем последние разработки в этой области, в конечном итоге пытаясь понять, можем ли мы использовать эти знания для модуляции воспалительной реакции в поврежденных легких с целью повышения их регенеративного потенциала.
От чего зависит, как легкие заживают после повреждения?
Высокая уязвимость легких к повреждениям связана с его структурой. Во-первых, легкое имеет очень низкую плотность клеток по сравнению с его объемом. Во-вторых, функциональная эффективность легких зависит от организации и состава ряда типов клеток, структурные характеристики которых отвечают за сочетание эластичности и проницаемости.Клетки легких, наиболее уязвимые для повреждения, находятся на поверхности слизистой оболочки. Повреждение эпителиальных клеток стимулирует быстрое размножение, дифференциацию и набор замещающих клеток и может привести к регенерации барьерной функции ткани. Однако изменение клеточной организации, вызванное процессами восстановления, включающими рубцевание, обязательно изменяет критические структурные характеристики, что приводит к ухудшению функции легких. Такие факторы, как количество и типы поврежденных клеток, нарушение барьерной функции, а также сила и продолжительность местного иммунного ответа, могут определять, восстанавливается ли поврежденное легкое, восстанавливается или не восстанавливается, что приводит к хроническому заболеванию легких.
Ранний ответ имеет значение
Нарушение гомеостаза тканей, вызванное повреждением, быстро изменяет локальную микросреду, прилегающую к поврежденному легкому. Окружающая среда раны становится положительной для молекул, происходящих от патогенов, которые ее загрязняют, и из внутриклеточной среды умирающих клеток. Преимущество выживания, обеспечиваемое быстрым обнаружением повреждения ткани, привело к эволюции клеточных рецепторов, которые распознают консервативные структурные элементы, часто обнаруживаемые в патогенах, и на внутриклеточных компонентах клетки, которые высвобождаются только после повреждения.Такие рецепторы называются рецепторами распознавания образов (PRR) и включают Toll-подобные рецепторы и рецепторы, подобные гену I (RIG-1), индуцируемому ретиноевой кислотой. Молекулы, происходящие от патогенов и распознаваемые специфической PRR, называются патоген-ассоциированными молекулярными паттернами (PAMP), в то время как лиганды, происходящие из поврежденных клеток-хозяев, известны как связанные с опасностями молекулярные паттерны (DAMP). 3
Рано после травмы поврежденные клетки высвобождают DAMP, такие как IL (интерлейкин) -1α (рисунок), в то время как другие провоспалительные молекулы высвобождаются компонентами начальной воспалительной реакции, такими как тромбоциты, которые накапливаются для стабилизации кровопотери в этом месте. ущерба.Другие провоспалительные сигналы генерируются стромальными клетками в ответ на изменения в гомеостатической среде, такие как изменение давления кислорода. 4 и окислительно-восстановительное состояние ткани 5 и изменения во внеклеточном матриксе ткани (ЕСМ), которые запускают передачу сигналов, включающую перекрестные помехи опухоли Вильмса-1 (WT1), Yes-ассоциированного белка (YAP) -1 и E-кадгерина. 6 запуск эпителиально-мезенхимальных переходов (ЭМП) как часть процесса заживления раны. 7
От первоначального повреждения до возникновения воспаления. (а) Клетки, поврежденные повреждением, высвобождают молекулы, такие как IL-1α, доставляя мощные провоспалительные сигналы через рецепторы ассоциированного с опасностью молекулярного паттерна (DAMP), в то время как патогены распознаются рецепторами патоген-ассоциированного молекулярного паттерна (PAMP). Передача сигналов через оба этих класса рецепторов активирует множество дополнительных процессов напрямую или через инфламмасому, включая изменения в экспрессии генов, секрецию биоактивных молекул, таких как IL-1β и PGE 2 . (b) Действие секретируемых цитокинов и простагландинов привлекает врожденные иммунные клетки к области повреждения и изменяет поведение местного эндотелия, инициирующего воспаление. Врожденные иммунные клетки, преимущественно нейтрофилы, прибывают и перемещаются из кровеносных сосудов в ткань, фагоцитируют или убивают патогены, а затем умирают. Другие врожденные клетки, такие как макрофаги, фагоцитируют мертвые и умирающие нейтрофилы, способствуя снижению провоспалительной передачи сигналов. 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; ASC, спек-подобный белок, связанный с апоптозом; BLT1, рецептор лейкотриена; ch2, ch3, хромосома 1 или 2; ЦОГ-2, циклооксигеназа 2; DAMP, молекула, связанная с опасностью; FcεR1, рецептор 1 FC-эпсилон; IgE, иммуноглобулин E; IL-1R, рецептор интерлейкина 1; LTB 4 , лейкотриен B4; Mϕ, макрофаг; NLPR3, детектор криопирина PAMP; PAMP, молекулярный паттерн, связанный с патогенами; PGE 2 , простагландин E2.
Обнаружение PAMP / DAMPs индуцирует внутриклеточные сигнальные пути, которые сходятся при активации NFκB и последующей повышенной транскрипции множества генов, включая про-IL-1β, фактор некроза опухоли α (TNFα) и компонент NLRP3 инфламмасомы. Повышенная активность инфламмасом вызывает активацию выработки про-ИЛ-1 β, а высвобождение этого и других цитокинов приводит к сильному провоспалительному ответу. Стромальные клетки отвечают секрецией дополнительных провоспалительных цитокинов, таких как IL-6, уровень которого имеет решающее значение для развития фиброза (обзор Garth et al .8 ). Этот ранний ответ включает высвобождение факторов роста, хемокинов, нуклеотидов (АТФ или АДФ), простагландинов и лейкотриенов как из стромальных клеток, так и из тромбоцитов, 9 , 10 , 11 индукция новых паттернов экспрессии и пролиферации генов, активация местного эндотелия, увеличение перфузии в ткани и рекрутирование лейкоцитов. Важно отметить, что передача сигналов IL-1 сильно влияет на активацию активности циклооксигеназы-2 (COX-2), что приводит к усилению биосинтеза ряда простагландинов, которые вносят вклад в воспалительный каскад.12
Лейкоциты, которые экспрессируют ряд PRR, быстро рекрутируются в поврежденную ткань и активируются посредством распознавания PRR патогенов, с которыми они сталкиваются. Модуляция местной сосудистой сети, инициация связывания тромбоцитов проксимальнее повреждения ткани и активация эндотелия, прилегающего к повреждению, приводят к притоку нейтрофилов и других лейкоцитов, локальному отеку и увеличению поступления питательных веществ в поврежденный участок. . Нейтрофилы, которые доминируют над притоком, экспрессируют несколько Toll-подобных рецепторов (TLR) и специфически активируются лигандами, связанными с встречающимися патогенами или высвобождаемыми из поврежденных тканевых клеток, содержащих консервативные структурные элементы.На важность быстроты этого ответа, опосредованного в первую очередь привлечением гранулоцитов из кровотока, указывают пациенты с нейтропеническим раком, испытывающие гораздо более высокий относительный риск смерти. 13
Если у хозяина уже есть гуморальный иммунитет к вторгающимся патогенам, происходит взаимодействие с врожденным иммунным ответом. Низкоаффинные рецепторы Fcγ типа I (FcγR), гетерогенно экспрессирующиеся на лейкоцитах, 14 не связывают мономерные подтипы IgG, но активируются патоген-специфическими иммунокомплексами.Циркулирующие иммуноглобулины против патогенов связываются со своим специфическим антигеном, и полученные иммунокомплексы связываются рецепторами Fc, что приводит к защитным иммунным ответам. Такое связывание вызывает активацию эффекторных лейкоцитов, 15 и перекрестное связывание FcγR на гранулоцитах запускает дегрануляцию и антибактериальную активность, 16 с перекрестным связыванием FcγRIIIa, экспрессируемого на NK-клетках, аналогичным образом приводит к клеточной активации и дегрануляции эффекторных молекул. 17 Кроме того, некоторые антигены паразитов распознаются специфическими антителами IgE, обычно связанными с FcεRI, экспрессируемыми на резидентных в ткани тучных клетках и базофилах, вызывая реакции гиперчувствительности немедленного типа.18
При отсутствии ранее существовавшего иммунитета активация нейтрофилов и других лейкоцитов, таких как тканевые иммунные клетки, такие как альвеолярные макрофаги, 19 дендритные клетки (DC 20 ) и резидентные лимфоциты тканевой памяти (TMR 21 год ) регулируется концентрацией PAMP или DAMP, присутствующих в поврежденной ткани. Активация нейтрофилов приводит к дегрануляции токсичных молекул, таких как протеазы, и активному или пассивному высвобождению внеклеточных ловушек нейтрофилов (NET). 22 ), которые уничтожают патогены, но также вызывают повреждение тканей хозяина, повышая уровень DAMP и дополнительно активируя дополнительные тканевые клетки.Это приводит к дальнейшему усилению воспалительной реакции за счет привлечения и секреции провоспалительных цитокинов резидентными клетками ткани. 23
В частности, секреция IL-12 и IL-23 локальными DC влияет на дифференцировку Т-хелперных (Th) -1 клеток и Th27 клеток, соответственно. 24 , 25 Стимуляция клеток Th27 IL-23 сильно индуцирует IL-17. 26 год и секреция IL-22 из клеток Th27 рекрутируется в поврежденную ткань. 27 Продукция IL-22 происходящими из костного мозга DC в ответ на стимуляцию селективными PAMPs также указывает на то, что резидентные в ткани DC также могут вносить дополнительный вклад в уровни IL-22.28 год И IL-17, и IL-22 стимулируют эпителиальные клетки легких, что приводит к секреции широкого спектра провоспалительных хемокинов. Кроме того, IL-22 вызывает высвобождение ряда антибактериальных пептидов из эпителиальных клеток легких, которые действуют синергично, усиливая ответы против патогенов. 27 В противовес этой петле положительной обратной связи провоспалительной передачи сигналов, активированные PAMP альвеолярные макрофаги секретируют IL-27. 29 который обладает мощным противовоспалительным действием, включая блокирование секреции IL-17 клетками Th27 и индукцию иммуномодулирующих рецепторов на эффекторных Т-клетках и Т-регуляторных клетках, что приводит к секреции противовоспалительного IL-10.30 Кроме того, активированные iTr35Tregs (iTr35) секретируют родственный цитокин IL-35, который обладает мощными противовоспалительными свойствами, опосредованными ингибированием пролиферации Т-клеток. 31 год
Поддержание структурной интеграции ткани поддерживает регенерацию
Параллельно с местным иммунным ответом клетки ткани стимулируются к секреции компонентов внеклеточного матрикса и протеаз, необходимых для его ремоделирования. Клетки пролиферируют и / или дифференцируются, и, наконец, избыточные клетки подвергаются апоптозу в ответ на снижение локальных уровней факторов роста, 32 что привело к реформированию предыдущей архитектуры ткани.Регенерация ткани зависит от поступления клеток из соседних здоровых тканей или популяций клеток-предшественников. Вероятность того, что такие клетки доступны, частично связана с уровнем повреждений, естественным течением и, возможно, возрастом человека. 33 Если стимулы, инициирующие исцеляющую микросреду, не уменьшаются, клеточные ответы продолжаются, и это поддерживает активацию и дифференцировку миофибробластов. 34 Следовательно, преобладают процессы репарации, и поврежденная ткань замещается преимущественно фиброзной рубцовой тканью.
Регенерация после острого, но ограниченного повреждения
В легких эпителиальная выстилка дыхательных путей очень чувствительна к повреждению от инфекций, передающихся воздушно-капельным путем, раздражителей или переносимых по воздуху токсинов. Эти накладки легко регенерируются после поверхностного повреждения, которое не разрушило нижележащую структуру ткани и внеклеточный матрикс. В легких острое повреждение эпителия может стимулировать эффективную регенеративную реакцию, обусловленную пролиферативными ответами со стороны здорового соседнего эпителия.35 год , 36
Важность, которую ремоделирование тканей играет во время эффективного процесса регенерации, показано в исследовании Шиллера и его коллег. 37 В этом исследовании измерялась динамика внеклеточных компонентов от момента повреждения легких, вызванного блеомицином, временного фиброзного восстановления через 2 недели до регенерации легких через 4–8 недель. Блеомицин — это молекула бактериального происхождения, токсичность которой связана с селективным ингибированием синтеза нуклеиновых кислот и которая вызывает гибель ряда типов эпителиальных клеток, включая AEC1, AEC II, Club-клетки и эндотелиальные клетки, в первые 7 дней после воздействия.В результате связанного с блеомицином повреждения клеток в оставшейся ткани происходит большое количество изменений, и, в частности, некоторые белки внеклеточного матрикса, такие как Emilin2, который взаимодействует с эластином, становятся сильно регулируемыми.
Считается, что во время эффективной регенерации легких базальная мембрана, лежащая под слоями эпителиальных и эндотелиальных клеток, имеет решающее значение для поддержки миграции стволовых клеток в поврежденную область за счет обеспечения каркаса. 38 и способность концентрировать паракринные секретируемые биоактивные молекулы.39
На 3 день, который соответствует пику воспалительной реакции после лечения блеомицином, наблюдается значительная активация секретируемого ингибитора эластазы нейтрофилов, α2-макроглобулина и ряда ингибиторов сериновых протеаз (серпинов), 37 необходимо для контроля степени опосредованного протеазой повреждения структур, таких как базальная мембрана. Точно так же есть данные об усиленной экспрессии протеогликановых молекул декорина и бигликана. Эти молекулы связываются с коллагеном I и могут секвестрировать секретируемый TGF-β, снижая его сигнальную активность и уровень фиброгенеза.37 , 40 Присутствие декорина и бигликана может влиять на связывание фибробластов, что инициирует внутриклеточную передачу сигналов для путей, связанных с миграцией, таких как Rac1 и RhoA, и, таким образом, способствует миграции клеток. 41 год Редкость декорина из-за снижения продукции фибробластов связана с хронической воспалительной средой, связанной с тяжелой эмфиземой. 42 Исследования in vitro показали, что мРНК декорина может быть увеличена кортикостероидом, дексаметазоном (Dex), в то время как мРНК бигликана увеличивается при лечении транс-ретиноевой кислотой (ATRA).43 год
Восстановление легких после нарушения структуры ткани
В условиях хронического воспаления продолжающееся рекрутирование, активация и дегрануляция нейтрофилов приводит к повреждению ткани, опосредованному протеазами, включая эластазу, которая переваривает белки внеклеточного матрикса и может нарушить структуру, обеспечиваемую легким путем базальная мембрана, лежащая в основе альвеолярного эпителия. Когда структурная целостность легкого нарушена, процессы восстановления преобладают над регенерацией.Это проиллюстрировано в элегантном исследовании с использованием модели хронического повреждения легких эластазой, где степень повреждения легкого титровалась с помощью 4 последовательных еженедельных низких доз панкреатической свиной эластазы (PPE). 44 После одной инстилляции эластазы не наблюдалось значительного снижения содержания эластина в альвеолярных перегородках, но наблюдался значительный инфильтрат мононуклеарных клеток в паренхиму легких. Вторая установка привела к структурной деформации альвеол и снижению содержания эластина в альвеолярных перегородках.Однако только после третьей инстилляции эластазы, которая еще больше снизила содержание эластина в альвеолярных перегородках, были обнаружены признаки фиброза, о чем свидетельствовало усиление окрашивания на содержание коллагеновых волокон в альвеолах и мелких дыхательных путях.
Недавние сравнения сходств и различий повреждающего действия кремнезема, блеомицина и параквата на животных моделях позволяют предположить, что эти агенты повреждают легкие разными и характерными способами. 45 На мышиной модели всасывание всех этих агентов из глотки инициировало воспалительную реакцию, пик которой достигался на 7-й день после лечения.Хотя гистопатология и генетический анализ продемонстрировали много схожих характеристик между тремя повреждающими молекулами, существуют явные различия с точки зрения природы гистопатологии, степени иммунного вовлечения, уровня и типа клеточного повреждения, уровня генов, связанных с модификацией ВКМ, и интересных различных наборов генов. хемокины. 45 Большое количество уникальных иммунно-ассоциированных генов, активируемых после воздействия кремнезема, может иметь важные корреляты для воздействия кремнезема на людей, где у некоторых пациентов были зарегистрированы признаки аутоиммунного заболевания, а также фиброза.46 , 47 Хотя кажется, что существуют общие причины ранних пролиферативных и воспалительных реакций, возникающих после повреждения легких, отдельные генетические ответы, выявленные после различных типов повреждений, предполагают, что необходимо исследовать терапевтические цели, связанные с повреждением.
Хроническое заболевание легких возникает в результате нерегулируемых процессов восстановления
Последствия длительных или повторяющихся периодов инфекции, раздражителей или токсинов могут вызвать состояние хронического воспаления, тканевой среды, в которой происходят процессы восстановления, которые заменяют нормальную структуру ткани фиброзной тканью. предпочтительнее регенерации тканей.Если таким образом поражаются несколько областей легкого, функция легких постепенно и необратимо ухудшается.
Структурные характеристики легких приводят к динамическим и отчетливым экологическим и механическим свойствам, которые меняются по вентиляционному дереву от трахеи до концевых альвеол. Понимание дифференциальной восприимчивости структур легких было получено путем интеграции физиологических измерений внутридыхательного давления. 48 и ультраструктурный анализ, изначально предоставленный стереологией 49 , 50 и совсем недавно с помощью исследований с помощью микрокомпьютерной томографии (мкКТ).51 Такие исследования способствовали разработке моделей, которые предсказывают, что проникновение частиц в легкие связано с их размером и скоростью воздушного потока. Ряд экспериментальных и математических моделей подчеркивает, что осаждение частиц распределяется неравномерно, а место пика расположения смещается от дистальных областей легких к проксимальным областям с поверхностной дозой, которая намного выше в проводящих дыхательных путях, чем в альвеолах. 52 , 53 Учитывая, что сопротивление дыхательных путей и количество дыхательных путей увеличиваются с каждым уровнем разветвления и сужением диаметра дыхательных путей, Hogg et al .предположили, что небольшие дыхательные пути подвержены повреждению частицами, которое предшествует коллапсу терминальных бронхиол, что приводит к опасному для жизни увеличению сопротивления дыхательных путей, характерному для патологического прогрессирования хронической обструктивной болезни легких (ХОБЛ). 54 Наличие маркеров клеточного старения в популяциях клеток легких пациентов с ХОБЛ согласуется с подавляющей репаративной способностью легких в ответ на продолжающийся стресс и травмы. 55
Напротив, заболевания легких, такие как фиброз легких, по-видимому, не связаны преимущественно с повреждением частицами и последующим хроническим воспалением и нечувствительны к противовоспалительному лечению.56 Скорее, они характеризуются гетерогенным паттерном прогрессирующих структурных изменений легких, опосредованных изменением регуляции или функции фибробластов легких. Очаги пролиферирующих фибробластов характерны для IPF и, как полагают, отражают повреждение альвеолярных эпителиальных клеток и последующий коллапс дистального воздушного пространства. 57 год Несмотря на то, что ряд воздействий, включая курение, считаются независимыми факторами риска ИЛФ, причинный агент (ы) не идентифицирован. В недавнем исследовании было обнаружено, что все обследованные пациенты с IPF показали сверхэкспрессию гликопротеина муцина 5b. 58 натолкнул на мысль, что аберрантный мукоцилиарный клиренс может способствовать изменению микробиома легких. 59 причинение вреда из-за врожденных иммунных реакций, поддерживающих развитие IPF.Обнаружение повышенной легочной экспрессии в небольшой группе пациентов IPS IL25, который является профиброзным в моделях на животных и выделяется местными популяциями клеток ILC2, согласуется с этой гипотезой. 60
Терапевтические подходы для модуляции повреждения / усиления регенерации вместо восстановления
Текущие и предлагаемые терапевтические подходы для остановки хронического повреждения легких включают уменьшение воспаления легких, при этом наиболее распространенные схемы лечения направлены на широкое снижение провоспалительной передачи сигналов за счет использования ингаляционных кортикостероидов .Однако, как обсуждалось выше, современные противовоспалительные подходы неэффективны при лечении ИЛФ. Иллюстрация того, как лечение кортикостероидами может иметь нежелательные негативные эффекты на поврежденное легкое, представлена в недавнем исследовании, в котором оценивалась способность лечения Dex улучшать исход после повреждения легких, вызванного блеомицином. Это исследование показало, что у мышей, получавших Dex, наблюдалось снижение концентрации фактора некроза опухоли (TNF) -α в жидкости лаважа; однако значительного снижения числа нейтрофилов у мышей, получавших Dex, не наблюдалось.Кроме того, культуры первичных альвеолярных эпителиальных клеток, обработанных Dex, показали замедленную и дозозависимую более низкую скорость восстановления, чем культуры, обработанные контрольным физиологическим раствором. 61
Существуют важные клинические проблемы, связанные с эффективностью этих схем лечения у людей, включая развитие стероидорезистентного воспаления. 62 что связано с обострениями аллергической астмы с накоплением нейтрофилов. Считается, что развитие устойчивости к противовоспалительным кортикостероидам является многофакторным, включая высокие уровни провоспалительного действия, обеспечиваемые повышенной экспрессией провоспалительного цитокинового фактора ингибирования миграции макрофагов (MIF), чрезмерной активацией митоген-активированного белка ( MAP) киназных путей, которые подавляют подавляющий эффект глюкокортикоидного рецептора связывающего элемента ответа циклического АМФ белка (CBP) и нарушение ядерного рекрутирования гистондеацетилазы-2 (HDAC2), что опять же, как правило, действует для подавления экспрессии про -Воспалительные гены.63 , 64 , 65
Нацеленность на воспалительный каскад для лечения заболеваний легких
Идентификация DAMP и PAMP как молекул, критически важных для инициирования и поддержания воспаления, побудила доклинические исследования для оценки эффективности блокады DAMP / PAMP в разрешении воспаления. Хотя технически это не является DAMP, IL-1β является важной частью сигнальной амплификации, которая следует за активацией DAMP или PAMP комплекса инфламмасом. Существует три типа реагентов, нацеленных на IL-1, которые были оценены на противовоспалительную активность в контексте заболеваний легких: анакинра является антагонистом рецептора IL-1, 66 MEDI8968 представляет собой гуманизированное антитело против IL-1R, а канакинумаб представляет собой блокирующее антитело против IL-1β.Хотя эти подходы успешно использовались на мышиных моделях для уменьшения воспаления, связанного с IL-1, и несмотря на то, что канакинумаб и анакинра показали эффективность в лечении редкого воспалительного заболевания, начинающегося у взрослых, болезнь Стилла, 67 в клинических испытаниях пациентов с ХОБЛ, принимавших канакинумаб, не было обнаружено улучшенных показателей функции легких. 68 или MEDI8968. 69 О недавно завершенных клинических испытаниях по оценке эффективности канакинумаба при лечении легочного саркоидоза еще не сообщалось. 70 в то время как предлагается исследование для оценки эффективности анакинры при лечении муковисцидоза.71
Цитокин IL-5 является современной противовоспалительной терапевтической мишенью и был обнаружен в биоптатах бронхов легких у астматиков. 72 в котором антиген-специфические CD4 Т-клетки ответственны за его секрецию. 73 Поскольку IL-5 может мобилизовать эозинофилы из пула костного мозга, 74 его регулирование считается критическим. Экспериментальные доказательства центральной роли IL-5 обеспечиваются защитой мышей, у которых отсутствует ген IL-5, от антиген-зависимых моделей аллергического заболевания дыхательных путей. 75 Эти многообещающие исследования побудили к клиническим испытаниям, направленным на нейтрализацию активности IL-5 в контексте острого заболевания дыхательных путей.Недавний метаанализ, охватывающий использование лечения против IL-5, меполизумаба, пришел к выводу, что при правильном нацеливании на лечение пациентов с тяжелой эозинофильной астмой это лечение значительно снижает общее количество обострений на пациента, а также количество обострений. обострений, требующих госпитализации.
Другие реагенты, оцениваемые для лечения заболеваний легких, включают тоцилизумаб, гуманизированное моноклональное антитело, которое блокирует активность рецептора интерлейкина-6 (IL-6R).Этот реагент был опробован в контексте интерстициального заболевания легких (ILD), которое связано с системным склерозом у пациентов с диагнозом менее 2 лет. 76 Пациенты, получавшие тоцилизумаб, показали сохраненную функцию легких по сравнению с пациентами, получавшими плацебо. В небольшом внеплановом исследовании, посвященном лечению пациентов с прогрессирующим заболеванием и не прошедшим другие виды иммунотерапевтического лечения, 4 из 9 показали стабилизацию заболевания. 77
Многочисленные исследования на животных продемонстрировали роль цитокинов семейства IL-17 в воспалительном заболевании легких и блокирование IL-17a. 78 или IL-17e, также известный как IL-25 79 уменьшает патологию легких.Кроме того, было показано, что ингибиторы фосфоинозитид-3-киназ (PI3K), которые активируются после передачи сигналов IL-25, эффективны в снижении астмы, такой как гиперчувствительность дыхательных путей и воспаление дыхательных путей. 80 Гуманизированное антитело против ИЛ-17а, секукинумаб, которое успешно применялось для лечения псориаза, безуспешно испытывалось в когорте кортикостероидорезистентных астматиков. 81 год
В целом, неспособность продемонстрировать улучшенные результаты после лечения биологическими препаратами, направленными против ряда воспалительных цитокинов, обескураживает, но с учетом эффективности таких подходов в лечении других воспалительных состояний, а затем дополнительных подходов к дозированию или, возможно, многоцелевых биопрепаратов 82 может привести к эффективному лечению заболеваний легких человека.
Как описано выше, легкие обладают способностью к регенерации, особенно эпителий легких, процесс, который зависит от выживания подходящих клеток-предшественников, расположенных на жизнеспособном расстоянии от места повреждения. Недавнее отслеживание клонов судьбы альвеолярных клеток-предшественников у мышей описывает продолжающееся, но нечастое образование новых альвеолярных единиц, при этом клетки ATII действуют как предшественники для клеток ATI. 38 (Фигура ). После специфического повреждения ATI гипероксигенацией большое количество клеток ATII способствует обновлению популяции ATI.Важно отметить, что авт. Обнаружили интактный компартмент ATII как у молодых, так и у старых мышей. 33 Фенотип дополнительных клеток-предшественников определялся различными поверхностными маркерами, включая бронхоальвеолярные стволовые клетки (BASC) в соединениях бронхоальвеолярных протоков, мультипотентные эпителиальные стволовые / предшественники. 83 и клетки-предшественники, отрицательные по клону, которые размножаются после повреждения. Вклад мезенхимальных стромальных клеток в RLG не выяснен, хотя McQualter продемонстрировал доказательства того, что пролиферация эпителиальных стволовых / предшественников клеток зависит от факторов роста, высвобождаемых резидентными мезенхимальными стромальными клетками во взрослом легком.83 Недавнее исследование показало, что мезенхимальные стромальные клетки от старых мышей слабо пролиферируют в ответ на пневмонэктомию по сравнению с молодыми мышами. 33 Более того, новая альвеоляризация требует образования новых перегородок, управляемых альфа-гладкомышечным актином + интерстициальных миофибробластов, которые происходят из субпопуляции тромбоцитов фактора роста-альфа + фибробластов, которые отвечают на рецептор-γ, активированный пролифератором пероксисом. (PPAR ‐ γ). 84 Кроме того, есть доказательства того, что клетки костного мозга вносят вклад в RLG.85 Иммунные клетки, такие как альвеолярные макрофаги, являются потенциальными источниками факторов роста и протеаз, которые могут иметь решающее значение для ремоделирования тканей. Таким образом, вполне вероятно, что клетки-предшественники, резидентные и инфильтрирующие клетки необходимы для успешной регенерации легких, и дефекты в любой из этих популяций могут ограничивать регенеративный потенциал.
Локализация предшественников эпителиальных клеток, которые способствуют неоальвеоляризации. Исследования по отслеживанию клонов выявили новую роль клеток-предшественников дыхательных путей в восстановлении и регенерации альвеол.38 CCSP + клубные клетки могут самообновляться и давать реснитчатые клетки для восстановления дыхательных путей. Клетки клуба, характеризующиеся экспрессией CYP2F2, могут дифференцироваться в клетки AECII и AECI. Клетки клуба с низкой экспрессией CYP2F2 (вариантные клетки клуба, расположенные рядом с нейроэндокринными телами) устойчивы к повреждениям, вызванным нафталином, и помогают регенерировать обнаженные дыхательные пути и альвеолярные области. Активация предшественников p63 + после инфицирования вирусом гриппа h2N1 дает стручки p63 + / KRT5 + , которые могут мигрировать из эпителия дистальных отделов дыхательных путей в оголенные альвеолярные области для участия в неоальвеоляризации.BASCs, расположенные в соединении бронхоальвеолярных протоков, могут дифференцироваться на клетки клубов дыхательных путей и AECIIs. SP ‐ C + Клетки, продуцирующие сурфактант AECII, считаются классическими предшественниками AECI; однако вариант AECII, характеризующийся экспрессией SP-C — / α6β4 + , представляет собой дополнительный источник AECII и AECI. AECI, которые покрывают 90% альвеолярного эпителия, считаются терминально дифференцированными и характеризуются экспрессией AQP5, PDPN, HOPX и AGER.Пластичность AEC1s была продемонстрирована с помощью методов отслеживания клонов, которые показали, что AECI HOPX + / Igfbp2 — могут дифференцироваться от AECIIs. 38
Демонстрация плюрипотентности мезенхимальных стволовых клеток (МСК) естественным образом подтолкнула к предположению, что они могут играть отдельно друг от друга в регенеративных процессах. В многочисленных исследованиях было показано, что адоптивная трансплантация МСК оказывает прорегенеративное и противовоспалительное действие, часто когда они накапливаются в тканях легких.Например, адоптивно перенесенные МСК показали положительные преимущества в контексте вызванного блеомицином повреждения легких у мышей, 86 эффект, приписываемый продукции антагониста рецептора IL-1 МСК. Общей особенностью, описанной во многих протоколах адаптивной передачи MSC, является низкая частота и долговечность MSC, которые обнаруживаются более чем через 1 день после передачи. Дальнейшие исследования in vitro и продемонстрировали, что экзосомы, которые представляют собой небольшие мембранные везикулы, содержащие смешанные концентрации цитоплазматических молекул, высвобождаются из культивированных MSC, полученных из жировой ткани.Эти экзосомы содержат и экспрессируют альфа-1-антитрипсин на своей поверхности, 87 молекула, которая сильно ингибирует активность протеазы. Было продемонстрировано, что эти экзосомы проявляют антиэластазную активность и обеспечивают доказательство концепции бесклеточных систем доставки, которые могут использоваться для подавления модуляции протеаз, активных в местах хронического воспаления.
В других исследованиях изучалась эффективность лечения повреждений легких всей транс-ретиноевой кислотой (ATRA), учитывая, что она имеет структурную связь с витамином А и, как было показано, участвует в развитии легких.88 В ряде исследований опубликованы улучшенные результаты с использованием ATRA после повреждения легких, вызванного эластазой, у крыс и мышей. 89 , 90 Недавно Такеда и др. . 91 продемонстрировали потенциальное усиление эффекта восстановительного адоптивного переноса МСК в легкое мыши, поврежденное эластазой, путем одновременного системного лечения с помощью ATRA. Они описали, что MCS вызывал синергетический восстановительный ответ, который включал уменьшение среднего линейного расстояния пересечения, увеличение податливости легкого и увеличение площади поверхности легкого.Авторы представили доказательства того, что мишень млекопитающих для функции рапамицина (mTor), связанная с активностью киназы кофактора S6k1, имеет решающее значение для восстановительного эффекта и что синергизм с ATRA блокируется, когда функция mTor ингибируется препаратом рапамицин.
Как обсуждалось ранее, провоспалительные медиаторы, выделяемые PAMP- и DAMP-активированными клетками, включают простагландины, которые действуют на эндотелиальные клетки, увеличивая местный кровоток, на местные нервы, вызывая боль, и влияют на функцию лейкоцитов, включая нейтрофилы.Ферменты циклооксигеназы (ЦОГ) -1 и 2 участвуют в биосинтезе простагландинов и являются мишенями нестероидных противовоспалительных ингибиторов, в том числе аспирина. Активация нейтрофилов простагландином-E 2 (PGE 2) вызывает переключение производства провоспалительного лейкотриена бета-4 (LTB 4 ) на молекулу липоксина, которая снижает дальнейшее рекрутирование нейтрофилов ( Фигура ). Производство других противовоспалительных молекул также было обнаружено в результате исследования модуляции биосинтеза жирных кислот во время воспаления (обзор Serhan et al .92 ), включая резольвины, протектины и марезины серий D и E. Эти молекулы образуются либо как прямые биохимические продукты путей биосинтеза полиненасыщенных жирных кислот, либо в ответ на блокирование активности циклооксигеназы такими молекулами, как аспирин. Исходным сырьем для этих молекул являются омега-3 жирные кислоты, и это дает механистическое объяснение связанных с ними преимуществ для здоровья диет, содержащих продукты, богатые этими липидами. 93 Возможность модуляции продукции этих молекул in vivo или их терапевтического использования только устанавливается, и имеются доказательства того, что лечение резольвином E1 может уменьшить воспаление легких в зависимости от апоптоза, 94 в то время как исследования, посвященные применению так называемого иммунного питания, демонстрируют некоторую клиническую эффективность в измеримом повышении уровней резолвина E1 в плазме и снижении уровней IL-6 в плазме.95
Переназначение биосинтеза простагландинов для создания факторов расслаивания ран. Незаметные, но глубокие изменения метаболизма различных жирных кислот прекурсоры возникают из-за изменения активности ферментов, таких как липоксигеназы и высвобождают противовоспалительные молекулы, такие как липоксины и резолвины, могут изменить баланс с провоспалительной среды на благоприятную для заживления. 15-HETE, 15-гидроксиэйкозатетраеновая кислота; 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; BLT1, рецептор лейкотриена; ЦОГ-2, циклооксигеназа 2; DHA, докозагексаеновая кислота; EPA, эйкозапентаеновая кислота; FPRL, рецептор формилпептида, подобный-1; LXA 4 , липоксин А4; LXB 4 , липоксин B4; Mϕ, макрофаг; Омега-3 жирные кислоты, содержащие омега-3 жирные кислоты; PGE 2 , простагландин E2.
Эти доклинические исследования дают надежду на то, что даже в сильно поврежденных легких функция может быть частично восстановлена, при этом ясно, что более глубокое понимание механизмов, лежащих в основе восстановления легких, еще не достигнуто.
Выводы
Задача перспективной помощи в восстановлении после повреждения легких и улучшения клинических исходов заключается в разработке методов лечения, которые улучшают регенеративные процессы, а не процессы восстановления. Как обсуждалось выше, управление воспалительной реакцией кажется ключом к этим улучшениям.Тогда можно было бы рассмотреть возможность применения анти-цитокиновых агентов, доступных в настоящее время в клинике, таких как анти-IL-1 и анти-IL-6, для модуляции острых воспалительных реакций с потенциальными преимуществами, уравновешенными другими клиническими факторами риска. Например, повышенный риск заражения можно снизить за счет совместного лечения с антипатогенными препаратами. Дальнейшее понимание масштабов и силы эндогенных противовоспалительных молекул, таких как резольвиноподобные молекулы, эффективность которых может зависеть от диеты, может положительно повлиять на потенциал заживления легких на популяционном уровне.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
JY был поддержан международной стипендией для аспирантов Университета Мердока. Авторы выражают признательность покойному профессору Джеффри Лорану за наставничество.
Список литературы
2. Arcavi L, Benowitz NL. Курение сигарет и инфекция. Arch Intern Med 2004; 164: 2206–2216. [PubMed] [Google Scholar] 3. Принц Л.Р., Уайт МК, Сабро I, Паркер Л.С. Роль TLR в активации нейтрофилов.Curr Opin Pharmacol 2011; 11: 397–403. [PubMed] [Google Scholar] 4. Элсон Д.А., Райан Х.Э., Сноу Д.В., Джонсон Р., Арбейт Дж. М.. Координированная активация генов-мишеней фактора, индуцируемого гипоксией (HIF) -1альфа и HIF-1, во время многоступенчатого эпидермального канцерогенеза и заживления ран. Рак Res 2000; 60: 6189–6195. [PubMed] [Google Scholar] 5. Исии Й, Ито К., Моришима Й и др. Фактор транскрипции Nrf2 играет ключевую роль в защите от вызванного эластазой воспаления легких и эмфиземы.J Immunol 2005; 175: 6968–6975. [PubMed] [Google Scholar] 6. Пак Джей, Ким Д.Х., Шах С.Р. и др. Подобное переключателю усиление эпителиально-мезенхимального перехода с помощью YAP посредством регуляции обратной связи WT1 и GTPases семейства Rho. Nat Commun 2019; 10: 2797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Stone RC, Pastar I, Ojeh N и др. Эпителиально-мезенхимальный переход при восстановлении тканей и фиброзе. Клеточная ткань Res 2016; 365: 495–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Гарт Дж., Барнс Дж. В., Крик С. Ориентация на цитокины как развивающиеся стратегии лечения хронических воспалительных заболеваний дыхательных путей. Int J Mol Sci 2018; 19: 3402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Мацуо Р., Охкохти Н., Мурата С. и др. Тромбоциты сильно индуцируют пролиферацию гепатоцитов с помощью IGF-1 и HGF in vitro . J Surg Res 2008; 145: 279–286. [PubMed] [Google Scholar] 11. Serhan CN. Фаза разрешения воспаления: новые эндогенные противовоспалительные и пролонгирующие липидные медиаторы и пути.Анну Рев Иммунол 2007; 25: 101–137. [PubMed] [Google Scholar] 12. Лайонс-Джордано Б., Пратта М.А., Гэлбрейт В., Дэвис Г.Л., Арнер Э.С. Интерлейкин-1 дифференциально модулирует хондроцитарную экспрессию циклооксигеназы-2 и фосфолипазы А2. Exp Cell Res 1993; 206: 58–62. [PubMed] [Google Scholar] 13. Жорж К., Азулай Э, Мокарт Д. и др. Влияние нейтропении на смертность больных раком в критическом состоянии: результаты метаанализа индивидуальных данных. Crit Care 2018; 22: 326. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15.Свенсон Дж. А., Хоппе А. Д.. Координация передачи сигналов во время фагоцитоза, опосредованного Fc-рецептором. J Leukoc Biol 2004; 76: 1093–1103. [PubMed] [Google Scholar] 16. Чжоу MJ, Браун EJ. CR3 (Mac-1, альфа M бета 2, CD11b / CD18) и Fc гамма RIII взаимодействуют в генерации респираторного выброса нейтрофилов: потребность в Fc гамма RIII и фосфорилировании тирозина. J Cell Biol 1994; 125: 1407–1416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пигната К., Прасад К.В., Робертсон М.Дж., Левин Х., Радд С.Е., Ритц Дж.Передача сигналов, опосредованная Fc gamma RIIIA, включает lck семейства src в естественных клетках-киллерах человека. J Immunol 1993; 151: 6794–6800. [PubMed] [Google Scholar] 18. Kinet JP. Рецептор IgE с высоким сродством (Fc epsilon RI): от физиологии к патологии. Анну Рев Иммунол 1999; 17: 931–972. [PubMed] [Google Scholar] 19. Хассел Т., Белл Т.Дж. Альвеолярные макрофаги: пластичность в тканевом контексте. Нат Рев Иммунол 2014; 14: 81–93. [PubMed] [Google Scholar] 20. Копф М, Шнайдер С, Нобс С.П. Развитие и функция резидентных в легких макрофагов и дендритных клеток.Нат Иммунол 2015; 16: 36–44. [PubMed] [Google Scholar] 21. Хоган Р.Дж., Чжун В., Ушервуд Э.Дж., Кукенхэм Т., Робертс А.Д., Вудленд Д.Л. Защита от респираторных вирусных инфекций может быть обеспечена антиген-специфическими CD4 + Т-клетками, которые сохраняются в легких. J Exp Med 2001; 193: 981–986. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Бринкманн В., Райхард Ю., Гусманн С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 2004; 303: 1532–1535. [PubMed] [Google Scholar] 23.Холт П.Г., Стрикленд Д.Х., Викстром Мэн, Янсен Флорида. Регуляция иммунологического гомеостаза в дыхательных путях. Нат Рев Иммунол 2008; 8: 142–152. [PubMed] [Google Scholar] 24. Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O’Garra A, Murphy KM. Развитие Th2CD4 + T-клеток посредством IL-12, продуцируемого Listeria-индуцированными макрофагами. Наука 1993; 260: 547–549. [PubMed] [Google Scholar] 25. Welsby I, Goriely S. Регулирование экспрессии интерлейкина-23 при здоровье и болезни.Adv Exp Med Biol 2016; 941: 167–189. [PubMed] [Google Scholar] 26. Куа DJ, Шерлок Джей, Чен И и др. Интерлейкин-23, а не интерлейкин-12, является критическим цитокином для аутоиммунного воспаления головного мозга. Природа 2003; 421: 744–748. [PubMed] [Google Scholar] 27. Ауйла С.Дж., Чан Ю.Р., Чжэн М. и др. IL-22 обеспечивает защиту слизистой оболочки хозяина от грамотрицательной бактериальной пневмонии. Нат Мед 2008; 14: 275–281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Фумагалли С., Торри А., Папанья А., Читтерио С., Майнольди Ф, Фоти М.IL-22 быстро индуцируется стимуляцией рецепторов распознавания патогенов в дендритных клетках костного мозга в отсутствие IL-23. Научный представитель 2016; 6: 33900. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мати С.А., Диксон К.Л., Уокер С.А. и др. Альвеолярные макрофаги являются стражами легочного гомеостаза мыши после заражения ингаляционным антигеном. Аллергия 2015; 70: 80–89. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Делонг Дж. Х., О’Хара Холл А, Рауш М. и др. Стимуляция IL-27 и TCR способствуют экспрессии множественных ингибирующих рецепторов Т-клетками.Иммунохоризонты 2019; 3: 13–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Коллисон Л. В., Чатурведи В., Хендерсон А. Л. и др. ИЛ-35-опосредованная индукция мощной регуляторной популяции Т-клеток. Нат Иммунол 2010; 11: 1093–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Кулашекаран П., Скавон Калифорния, Роджерс Д.С., Аренберг Д.А., Танникал В.Дж., Горовиц Дж.С. Эндотелин-1 и трансформирующий фактор роста-бета1 независимо индуцируют устойчивость фибробластов к апоптозу через активацию AKT. Am J Respir Cell Mol Biol 2009; 41: 484–493.[Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Паксон Дж. А., Грунтман А. М., Дэвис А. М., Паркин С. М., Ингенито Е. П., Хоффман А. М.. Возрастная зависимость динамики мезенхимальных стромальных клеток легких после пневмонэктомии. Stem Cells Dev. 2013; 22: 3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ли CC, Ван CN, Ли Ю.Л., Цай Ю.Р., Лю Дж.Дж. Блок 1 группы с высокой подвижностью индуцировал дифференцировку миофибробластов легких человека и усиленную миграцию за счет активации MMP-9. PLoS One 2015; 10: e0116393. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35.Giangreco A, Arwert EN, Rosewell IR, Snyder J, Watt FM, Stripp BR. Стволовые клетки незаменимы для гомеостаза легких, но восстанавливают дыхательные пути после травмы. Proc Natl Acad Sci USA 2009; 106: 9286–9291. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Рок JR, Баркаускас CE, Cronce MJ и др. Множественные популяции стромы способствуют легочному фиброзу без доказательств перехода эпителия в мезенхиму. Proc Natl Acad Sci USA 2011; 108: E1475 – E1483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Шиллер Х. Б., Фернандес И. Е., Бургшталлер Г. и др. Протеомное профилирование внеклеточной ниши с разрешением по времени и компартментам при повреждении и восстановлении легких. Мол Сист Биол 2015; 11: 819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Десаи Т.Дж., Браунфилд Д.Г., Краснов М.А. Альвеолярные клетки-предшественники и стволовые клетки в развитии, обновлении и раке легких. Природа 2014; 507: 190–194. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Дин БС, Нолан Диджей, Го П и др. Ангиокринные сигналы, полученные из эндотелия, вызывают и поддерживают регенеративную альвеоляризацию легких.Клетка 2011; 147: 539–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Kolb M, Margetts PJ, Sime PJ, Gauldie J. Протеогликаны, декорин и бигликан по-разному модулируют опосредованные TGF-бета фиброзные ответы в легких. Am J Physiol Lung Cell Mol Physiol 2001; 280: L1327 – L1334. [PubMed] [Google Scholar] 41. Tufvesson E, Westergren-Thorsson G. Бигликан и декорин вызывают морфологические и цитоскелетные изменения, включая передачу сигналов малыми GTPasesRhoA и Rac1, что приводит к миграции фибробластов легких.J Cell Sci 2003; 116: 4857–4864. [PubMed] [Google Scholar] 42. Нордхук Дж.А., Постма Д.С., Чонг Л.Л. и др. Различная модуляция продукции декорина фибробластами легких у пациентов с легкой и тяжелой эмфиземой. ХОБЛ 2005; 2: 17–25. [PubMed] [Google Scholar] 43. Кахари В.М., Хаккинен Л., Вестермарк Дж., Ларджава Х. Дифференциальная регуляция экспрессии гена декорина и бигликана дексаметазоном и ретиноевой кислотой в культивируемых фибробластах кожи человека. J Invest Dermatol 1995; 104: 503–508. [PubMed] [Google Scholar] 44.Оливейра М.В., Абреу СК, Падилья Г.А. и др. Характеристика модели эмфиземы на мышах, вызванной множественными инстилляциями низкой дозы эластазы. Front Physiol 2016; 7: 457. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Dong J, Yu X, Porter DW, Battelli LA, Kashon ML, Ma Q. Общие и отдельные механизмы индуцированного легочного фиброза твердыми частицами и растворимыми химическими фиброгенными агентами. Arch Toxicol 2016; 90: 385–402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Миллер Ф. В., Альфредссон Л., Костенбадер К. Х. и др. Эпидемиология воздействия окружающей среды и аутоиммунных заболеваний человека: результаты семинара экспертной группы Национального института наук об окружающей среде.J Аутоиммунный 2012; 39: 259–271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Янаи М., Секизава К., Охруи Т., Сасаки Х., Такисима Т. Место обструкции дыхательных путей при легочной болезни: прямое измерение внутрибронхиального давления. J Appl Physiol 1992; 72: 1016–1023. [PubMed] [Google Scholar] 49. Weibel ER. Принципы и методы морфометрического исследования легкого и других органов. Лаборатория Инвест 1963; 12: 131–155. [PubMed] [Google Scholar] 50. Хорсфилд К., Камминг Г. Морфология бронхиального дерева у человека.J Appl Physiol 1968; 24: 373–383. [PubMed] [Google Scholar] 51. McDonough JE, Yuan R, Suzuki M и др. Обструкция мелких дыхательных путей и эмфизема легких при хронической обструктивной болезни легких. N Engl J Med 2011; 365: 1567–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Ю. П., Диу СК. Общее и региональное выпадение вдыхаемых аэрозолей на человека. J Aerosol Sci 1983; 14: 599–609. [Google Scholar] 53. Ким С.С., Ху СК, ДеВитт П., Джеррити Т.Р. Оценка регионального отложения вдыхаемых частиц в легких человека методом серийной болюсной доставки.J Appl Physiol (1985). 1996; 81: 2203–2213. [PubMed] [Google Scholar] 54. Hogg JC, McDonough JE, Suzuki M. Малая обструкция дыхательных путей при ХОБЛ: новые идеи, основанные на изображениях микро-КТ и МРТ. Грудь 2013; 143: 1436–1443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Мюллер К.С., Велкер Л., Пааш К. и др. Фибробласты легких пациентов с эмфиземой обнаруживают маркеры старения in vitro . Respir Res 2006; 7: 32. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. RyuJH Colby TV, Hartman TE, Vassallo R.Интерстициальные заболевания легких, связанные с курением: краткий обзор. Eur Respir J 2001; 17: 122–132. [PubMed] [Google Scholar] 57. Каспер М., Хароске Г. Изменения в альвеолярном эпителии после травмы, приводящие к фиброзу легких. Гистол гистопатол 1996; 11: 463–483. [PubMed] [Google Scholar] 58. Сейболд М.А., Мудрый А.Л., Шпир М.С. и др. Обычный полиморфизм промотора MUC5B и фиброз легких. N Engl J Med 2011; 364: 1503–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Molyneaux PL, Cox MJ, Willis ‐ Owen SA и др. Роль бактерий в патогенезе и прогрессировании идиопатического фиброза легких.Am J Respir Crit Care Med 2014; 190: 906–913. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хэмс Э., Армстронг МЭ, Барлоу Дж.Л. и др. IL-25 и врожденные лимфоидные клетки 2-го типа вызывают фиброз легких. Proc Natl Acad Sci USA 2014; 111: 367–372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Обен Вега М., Чупен К., Паскариу М. и др. Дексаметазон не может улучшить вызванное блеомицином острое повреждение легких у мышей. Physiol Rep 2019; 7: e14253. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.Чармандари Э, Кино Т, Итиджо Т, Хрусос ГП. Общая резистентность к глюкокортикоидам: клинические аспекты, молекулярные механизмы и последствия редкого генетического нарушения. J Clin Endocrinol Metab 2008; 93: 1563–1572. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Donnelly SC, Bucala R. Фактор ингибирования миграции макрофагов: регулятор активности глюкокортикоидов с критической ролью в воспалительном заболевании. Мол Мед сегодня 1997; 3: 502–507. [PubMed] [Google Scholar] 64. Барнс П.Дж., Адкок И.М. Устойчивость к глюкокортикоидам при воспалительных заболеваниях.Ланцет 2009; 373: 1905–1917. [PubMed] [Google Scholar] 65. Ито К., Герберт К., Зигл Дж. С. и др. Стероид-резистентное нейтрофильное воспаление на мышиной модели острого обострения астмы. Am J Resp Cell Mol 2008; 39: 543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Эрнандес М.Л., Миллс К, Миндаль М и др. Антагонист рецептора IL-1 снижает вызванное эндотоксином воспаление дыхательных путей у здоровых добровольцев. J Allergy Clin Immunol 2015; 135: 379–385. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.Galozzi P, Baggio C, Bindoli S, Oliviero F, Sfriso P. Развитие и роль в терапии канакинумаба при болезни, начинающейся у взрослых. Фронт Фармакол 2018; 9: 1074. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Calverley PMA, Sethi S, Dawson M и др. Рандомизированное плацебо-контролируемое исследование моноклонального антитела MEDI8968 против рецептора 1 интерлейкина-1 при хронической обструктивной болезни легких. Resp Res 2017; 18: 153. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Хамид К., Аззави М., Инь С. и др. Экспрессия мРНК интерлейкина-5 в биоптатах слизистой оболочки бронхов от астмы.J Clin Invest 1991; 87: 1541–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Хоган С.П., Коскинен А., Маттеи К.И., Янг И.Г., Фостер П.С. Т-клетки CD4 + , продуцирующие интерлейкин 5, играют ключевую роль в эозинофилии, вызванной аэроаллергеном, гиперреактивности бронхов и повреждении легких у мышей. Am J Respir Crit Care Med 1998; 157: 210–218. [PubMed] [Google Scholar] 74. Mold AW, Matthaei KI, Young IG, Foster PS. Связь между интерлейкином-5 и эотаксином в регуляции эозинофилии крови и тканей у мышей.J Clin Invest 1997; 99: 1064–1071. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Фостер П.С., Хоган С.П., Рамзи А.Дж., Маттеи К.И., Янг И.Г. Дефицит интерлейкина 5 устраняет эозинофилию, гиперреактивность дыхательных путей и повреждение легких на модели астмы у мышей. J Exp Med 1996; 183: 195–201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Khanna D, Jahreis A, Lin CJF. Ответ на: Нарваез «Эффективность и безопасность тоцилизумаба для лечения рефрактерного системного склероза, связанного с интерстициальным заболеванием легких: серия случаев».Энн Рум Дис 2019; 78: e124. [PubMed] [Google Scholar] 77. Нарваез Дж., Л.Луч Дж., Алегри Санчо Дж. Дж., Молина-Молина М., Нолла Дж. М., Кастельви И. Эффективность и безопасность тоцилизумаба для лечения интерстициального заболевания легких, связанного с рефрактерным системным склерозом: серия случаев. Энн Рум Дис 2019; 78: e123. [PubMed] [Google Scholar] 78. Чиполла Э., Фишер А.Дж., Гу Х. и др. Дефицит IL-17A снижает вызванную блеомицином активацию комплемента во время фиброза легких. FASEB J 2017; 31: 5543–5556.[Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Баллантайн С.Дж., Барлоу Д.Л., Джолин Х.Э. и др. Блокирование IL-25 предотвращает гиперреактивность дыхательных путей при аллергической астме. J Allergy Clin Immunol 2007; 120: 1324–1331. [PubMed] [Google Scholar] 80. Хуан П, Ли И, Ур З и др. Комплексное ослабление индуцированной IL-25 гиперчувствительности дыхательных путей, воспаления и ремоделирования с помощью ингибитора PI3K LY294002. Респирология 2017; 22: 78–85. [PubMed] [Google Scholar] 82. Ван И, Ву Цю, Лю Цзинь и др. Рекомбинантные IgG-подобные биспецифические антитела, действующие как ингибитор интерлейкина-1бета и интерлейкина-17А, демонстрируют многообещающую эффективность при ревматоидном артрите.Biomed Pharmacother 2017; 89: 426–437. [PubMed] [Google Scholar] 83. McQualter JL, Yuen K, Williams B, Bertoncello I. Доказательства иерархии эпителиальных стволовых / предшественников в легких взрослых мышей. Proc Natl Acad Sci USA 2010; 107: 1414–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Чен Л., Аччиани Т., Ле Крас Т., Лутцко С., Perl AK. Динамическая регуляция экспрессии альфа-рецептора фактора роста тромбоцитов в альвеолярных фибробластах во время реальвеоляризации. Am J Resp Cell Mol 2012; 47: 517–527.[Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Шуга А., Уэда К., Такемото Ю. и др. Значительная роль клеток костного мозга в компенсаторном регенеративном росте легких. J Surg Res 2013; 183: 84–90. [PubMed] [Google Scholar] 86. Ортис Л.А., Дутрейл М., Фаттман С. и др. Антагонист рецептора интерлейкина 1 опосредует противовоспалительный и антифибротический эффект мезенхимальных стволовых клеток при повреждении легких. Proc Natl Acad Sci USA 2007; 104: 11002–11007. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87.Бари Э., Ферраротти I, Ди Сильвестр Д. и др. Жировые мезенхимальные внеклеточные везикулы как физиологические системы доставки альфа-1-антитрипсина для регенерации легких. Клетки 2019; 8: 965. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Массаро Г.Д., Массаро Д. Лечение ретиноевой кислотой устраняет вызванную эластазой эмфизему легких у крыс. Нат Мед 1997; 3: 675–677. [PubMed] [Google Scholar] 90. Сейфарт C, Муйал JP, Плагенс А и др. Полностью транс-ретиноевая кислота приводит к нерегулярному восстановлению перегородок и не может подавлять провоспалительные макрофаги.Eur Respir J 2011; 38: 425–439. [PubMed] [Google Scholar] 91. Такеда К., Нин Ф., Доменико Дж. и др. Активация киназы p70S6-1 в мезенхимальных стволовых клетках важна для восстановления ткани легких. Стволовые клетки Transl Med 2018; 7: 551–558. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92. Serhan CN, Levy BD. Резолвины в воспалении: появление про-разрешающего суперсемейства медиаторов. J Clin Invest 2018; 128: 2657–2669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Фарзан-Фар Р., Харрис В.С., Гарг С., На Б., Вули М.А.Обратная связь уровней жирных кислот n-3 в эритроцитах с воспалительными биомаркерами у пациентов со стабильной ишемической болезнью сердца: исследование сердца и души. Атеросклероз 2009; 205: 538–543. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Эль Кебир Д., Гьорструп П., Филеп Дж. ResolvinE1 способствует апоптозу нейтрофилов, вызванному фагоцитозом, и ускоряет разрешение легочного воспаления. Proc Natl Acad Sci USA 2012; 109: 14983–14988. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Uno H, Furukawa K, Suzuki D и др. Иммунное питание подавляет острые воспалительные реакции за счет модуляции резольвина E1 у пациентов, перенесших обширную резекцию гепатобилиарной системы.Операция 2016; 160: 228–236. [PubMed] [Google Scholar]Регенерация и восстановление в заживающем легком
Clin Transl Immunology. 2020; 9 (7): e1152.
, 1 , 2 и 1 , 3Эндрю Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Джо Яса
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Микаэла Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Автор, ответственный за переписку. * ПерепискаЭндрю Лукас, Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт, Вашингтон 6009, Австралия.
Эл. Почта: [email protected],
Поступила в редакцию 3 декабря 2019 г .; Пересмотрено 26 мая 2020 г .; Принята в печать 10 июня 2020 г.
Авторские права © 2020 Авторы. Клиническая и трансляционная иммунология , опубликованная John Wiley & Sons Australia, Ltd от имени Австралийско-новозеландского общества иммунологии, Inc. Это статья в открытом доступе на условиях http: // creativecommons.org / licenses / by / 4.0 / License, которая разрешает использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Легкое обеспечивает эффективный газообмен между сложной нестерильной атмосферой и телом через тонкую и обширную эпителиальную поверхность с высокой эффективностью из-за упругой деформации, позволяющей увеличивать и уменьшать объем в процессе дыхания и из-за обширной сосудистой сети, которая способствует быстрой диффузии газа.Большая площадь поверхности легких подвергает орган постоянному риску повреждения патогенами, токсинами или раздражителями; однако повреждение легких можно быстро вылечить с помощью регенеративных процессов, которые восстанавливают его структуру и функцию. В ответ на устойчивое и обширное повреждение легкое заживает посредством нерегенеративного процесса, в результате чего рубцовая ткань локально укрепляет ее структуру, что со временем приводит к серьезной потере функции легких и увеличению заболеваемости. В этом обзоре обсуждается то, что известно о факторах, влияющих на заживление легкого путем регенерации или восстановления, и какие потенциальные новые терапевтические подходы могут положительно повлиять на заживление легких.
Ключевые слова: воспаление, легкое, регенерация, восстановление, терапия
Abstract
В этом обзоре обсуждается то, что известно об обнаружении, ответе и устранении повреждения легких, а также то, что может повлиять на заживление легкого путем регенерации или восстановления. В нем также представлены потенциальные терапевтические подходы, которые могут положительно повлиять на заживление легких.
Введение
Оксигенация тканей позвоночных зависит от структур легких, которые являются одновременно хрупкими и уязвимыми для повреждения.В течение жизни человека легкие подвергаются воздействию сотен миллионов литров нестерильного воздуха, сохраняя при этом свою функцию и целостность. Несмотря на эндемические респираторные инфекции, иммунитета легких обычно достаточно для излечения без длительного структурного повреждения. Такие благоприятные исходы были значительно улучшены благодаря использованию терапевтических антибактериальных средств. Тем не менее, устойчивые или более обширные легочные инфекции могут приводить к накоплению фиброзных повреждений, которые хронически влияют на гибкость легких и проницаемость для кислорода.1 Факторы, которые могут повлиять на тяжесть и частоту респираторных инфекций, включают предрасположенность к развитию астмы, недостаточность иммунитета и / или доступ к соответствующим вакцинациям, а также мутации, которые напрямую влияют на физиологию легких, например, при муковисцидозе. Кроме того, длительное воздействие токсинов, например, привычка к курению и / или длительное воздействие высоких уровней переносимых по воздуху загрязнителей, может напрямую повреждать ткань легких и способствовать менее эффективному избавлению от инфекций легких.2 Несмотря на клинически идентифицируемые факторы риска, невозможно своевременно диагностировать и вмешаться, чтобы предотвратить прогрессирующие дегенеративные фиброзные заболевания легких.
В этом обзоре делается попытка сравнить физиологическую регенерацию легких после повреждения с восстановлением, в результате которого рубцовая ткань нарушает нормальную структуру легкого. Мы анализируем вклад иммунного ответа на эти исходы. Несомненно, уровень воспаления в легких в результате повреждения ткани является одним из ключевых факторов, регулирующих физиологическое восстановление по сравнению с фиброзным.Мы обсуждаем последние разработки в этой области, в конечном итоге пытаясь понять, можем ли мы использовать эти знания для модуляции воспалительной реакции в поврежденных легких с целью повышения их регенеративного потенциала.
От чего зависит, как легкие заживают после повреждения?
Высокая уязвимость легких к повреждениям связана с его структурой. Во-первых, легкое имеет очень низкую плотность клеток по сравнению с его объемом. Во-вторых, функциональная эффективность легких зависит от организации и состава ряда типов клеток, структурные характеристики которых отвечают за сочетание эластичности и проницаемости.Клетки легких, наиболее уязвимые для повреждения, находятся на поверхности слизистой оболочки. Повреждение эпителиальных клеток стимулирует быстрое размножение, дифференциацию и набор замещающих клеток и может привести к регенерации барьерной функции ткани. Однако изменение клеточной организации, вызванное процессами восстановления, включающими рубцевание, обязательно изменяет критические структурные характеристики, что приводит к ухудшению функции легких. Такие факторы, как количество и типы поврежденных клеток, нарушение барьерной функции, а также сила и продолжительность местного иммунного ответа, могут определять, восстанавливается ли поврежденное легкое, восстанавливается или не восстанавливается, что приводит к хроническому заболеванию легких.
Ранний ответ имеет значение
Нарушение гомеостаза тканей, вызванное повреждением, быстро изменяет локальную микросреду, прилегающую к поврежденному легкому. Окружающая среда раны становится положительной для молекул, происходящих от патогенов, которые ее загрязняют, и из внутриклеточной среды умирающих клеток. Преимущество выживания, обеспечиваемое быстрым обнаружением повреждения ткани, привело к эволюции клеточных рецепторов, которые распознают консервативные структурные элементы, часто обнаруживаемые в патогенах, и на внутриклеточных компонентах клетки, которые высвобождаются только после повреждения.Такие рецепторы называются рецепторами распознавания образов (PRR) и включают Toll-подобные рецепторы и рецепторы, подобные гену I (RIG-1), индуцируемому ретиноевой кислотой. Молекулы, происходящие от патогенов и распознаваемые специфической PRR, называются патоген-ассоциированными молекулярными паттернами (PAMP), в то время как лиганды, происходящие из поврежденных клеток-хозяев, известны как связанные с опасностями молекулярные паттерны (DAMP). 3
Рано после травмы поврежденные клетки высвобождают DAMP, такие как IL (интерлейкин) -1α (рисунок), в то время как другие провоспалительные молекулы высвобождаются компонентами начальной воспалительной реакции, такими как тромбоциты, которые накапливаются для стабилизации кровопотери в этом месте. ущерба.Другие провоспалительные сигналы генерируются стромальными клетками в ответ на изменения в гомеостатической среде, такие как изменение давления кислорода. 4 и окислительно-восстановительное состояние ткани 5 и изменения во внеклеточном матриксе ткани (ЕСМ), которые запускают передачу сигналов, включающую перекрестные помехи опухоли Вильмса-1 (WT1), Yes-ассоциированного белка (YAP) -1 и E-кадгерина. 6 запуск эпителиально-мезенхимальных переходов (ЭМП) как часть процесса заживления раны. 7
От первоначального повреждения до возникновения воспаления. (а) Клетки, поврежденные повреждением, высвобождают молекулы, такие как IL-1α, доставляя мощные провоспалительные сигналы через рецепторы ассоциированного с опасностью молекулярного паттерна (DAMP), в то время как патогены распознаются рецепторами патоген-ассоциированного молекулярного паттерна (PAMP). Передача сигналов через оба этих класса рецепторов активирует множество дополнительных процессов напрямую или через инфламмасому, включая изменения в экспрессии генов, секрецию биоактивных молекул, таких как IL-1β и PGE 2 . (b) Действие секретируемых цитокинов и простагландинов привлекает врожденные иммунные клетки к области повреждения и изменяет поведение местного эндотелия, инициирующего воспаление. Врожденные иммунные клетки, преимущественно нейтрофилы, прибывают и перемещаются из кровеносных сосудов в ткань, фагоцитируют или убивают патогены, а затем умирают. Другие врожденные клетки, такие как макрофаги, фагоцитируют мертвые и умирающие нейтрофилы, способствуя снижению провоспалительной передачи сигналов. 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; ASC, спек-подобный белок, связанный с апоптозом; BLT1, рецептор лейкотриена; ch2, ch3, хромосома 1 или 2; ЦОГ-2, циклооксигеназа 2; DAMP, молекула, связанная с опасностью; FcεR1, рецептор 1 FC-эпсилон; IgE, иммуноглобулин E; IL-1R, рецептор интерлейкина 1; LTB 4 , лейкотриен B4; Mϕ, макрофаг; NLPR3, детектор криопирина PAMP; PAMP, молекулярный паттерн, связанный с патогенами; PGE 2 , простагландин E2.
Обнаружение PAMP / DAMPs индуцирует внутриклеточные сигнальные пути, которые сходятся при активации NFκB и последующей повышенной транскрипции множества генов, включая про-IL-1β, фактор некроза опухоли α (TNFα) и компонент NLRP3 инфламмасомы. Повышенная активность инфламмасом вызывает активацию выработки про-ИЛ-1 β, а высвобождение этого и других цитокинов приводит к сильному провоспалительному ответу. Стромальные клетки отвечают секрецией дополнительных провоспалительных цитокинов, таких как IL-6, уровень которого имеет решающее значение для развития фиброза (обзор Garth et al .8 ). Этот ранний ответ включает высвобождение факторов роста, хемокинов, нуклеотидов (АТФ или АДФ), простагландинов и лейкотриенов как из стромальных клеток, так и из тромбоцитов, 9 , 10 , 11 индукция новых паттернов экспрессии и пролиферации генов, активация местного эндотелия, увеличение перфузии в ткани и рекрутирование лейкоцитов. Важно отметить, что передача сигналов IL-1 сильно влияет на активацию активности циклооксигеназы-2 (COX-2), что приводит к усилению биосинтеза ряда простагландинов, которые вносят вклад в воспалительный каскад.12
Лейкоциты, которые экспрессируют ряд PRR, быстро рекрутируются в поврежденную ткань и активируются посредством распознавания PRR патогенов, с которыми они сталкиваются. Модуляция местной сосудистой сети, инициация связывания тромбоцитов проксимальнее повреждения ткани и активация эндотелия, прилегающего к повреждению, приводят к притоку нейтрофилов и других лейкоцитов, локальному отеку и увеличению поступления питательных веществ в поврежденный участок. . Нейтрофилы, которые доминируют над притоком, экспрессируют несколько Toll-подобных рецепторов (TLR) и специфически активируются лигандами, связанными с встречающимися патогенами или высвобождаемыми из поврежденных тканевых клеток, содержащих консервативные структурные элементы.На важность быстроты этого ответа, опосредованного в первую очередь привлечением гранулоцитов из кровотока, указывают пациенты с нейтропеническим раком, испытывающие гораздо более высокий относительный риск смерти. 13
Если у хозяина уже есть гуморальный иммунитет к вторгающимся патогенам, происходит взаимодействие с врожденным иммунным ответом. Низкоаффинные рецепторы Fcγ типа I (FcγR), гетерогенно экспрессирующиеся на лейкоцитах, 14 не связывают мономерные подтипы IgG, но активируются патоген-специфическими иммунокомплексами.Циркулирующие иммуноглобулины против патогенов связываются со своим специфическим антигеном, и полученные иммунокомплексы связываются рецепторами Fc, что приводит к защитным иммунным ответам. Такое связывание вызывает активацию эффекторных лейкоцитов, 15 и перекрестное связывание FcγR на гранулоцитах запускает дегрануляцию и антибактериальную активность, 16 с перекрестным связыванием FcγRIIIa, экспрессируемого на NK-клетках, аналогичным образом приводит к клеточной активации и дегрануляции эффекторных молекул. 17 Кроме того, некоторые антигены паразитов распознаются специфическими антителами IgE, обычно связанными с FcεRI, экспрессируемыми на резидентных в ткани тучных клетках и базофилах, вызывая реакции гиперчувствительности немедленного типа.18
При отсутствии ранее существовавшего иммунитета активация нейтрофилов и других лейкоцитов, таких как тканевые иммунные клетки, такие как альвеолярные макрофаги, 19 дендритные клетки (DC 20 ) и резидентные лимфоциты тканевой памяти (TMR 21 год ) регулируется концентрацией PAMP или DAMP, присутствующих в поврежденной ткани. Активация нейтрофилов приводит к дегрануляции токсичных молекул, таких как протеазы, и активному или пассивному высвобождению внеклеточных ловушек нейтрофилов (NET). 22 ), которые уничтожают патогены, но также вызывают повреждение тканей хозяина, повышая уровень DAMP и дополнительно активируя дополнительные тканевые клетки.Это приводит к дальнейшему усилению воспалительной реакции за счет привлечения и секреции провоспалительных цитокинов резидентными клетками ткани. 23
В частности, секреция IL-12 и IL-23 локальными DC влияет на дифференцировку Т-хелперных (Th) -1 клеток и Th27 клеток, соответственно. 24 , 25 Стимуляция клеток Th27 IL-23 сильно индуцирует IL-17. 26 год и секреция IL-22 из клеток Th27 рекрутируется в поврежденную ткань. 27 Продукция IL-22 происходящими из костного мозга DC в ответ на стимуляцию селективными PAMPs также указывает на то, что резидентные в ткани DC также могут вносить дополнительный вклад в уровни IL-22.28 год И IL-17, и IL-22 стимулируют эпителиальные клетки легких, что приводит к секреции широкого спектра провоспалительных хемокинов. Кроме того, IL-22 вызывает высвобождение ряда антибактериальных пептидов из эпителиальных клеток легких, которые действуют синергично, усиливая ответы против патогенов. 27 В противовес этой петле положительной обратной связи провоспалительной передачи сигналов, активированные PAMP альвеолярные макрофаги секретируют IL-27. 29 который обладает мощным противовоспалительным действием, включая блокирование секреции IL-17 клетками Th27 и индукцию иммуномодулирующих рецепторов на эффекторных Т-клетках и Т-регуляторных клетках, что приводит к секреции противовоспалительного IL-10.30 Кроме того, активированные iTr35Tregs (iTr35) секретируют родственный цитокин IL-35, который обладает мощными противовоспалительными свойствами, опосредованными ингибированием пролиферации Т-клеток. 31 год
Поддержание структурной интеграции ткани поддерживает регенерацию
Параллельно с местным иммунным ответом клетки ткани стимулируются к секреции компонентов внеклеточного матрикса и протеаз, необходимых для его ремоделирования. Клетки пролиферируют и / или дифференцируются, и, наконец, избыточные клетки подвергаются апоптозу в ответ на снижение локальных уровней факторов роста, 32 что привело к реформированию предыдущей архитектуры ткани.Регенерация ткани зависит от поступления клеток из соседних здоровых тканей или популяций клеток-предшественников. Вероятность того, что такие клетки доступны, частично связана с уровнем повреждений, естественным течением и, возможно, возрастом человека. 33 Если стимулы, инициирующие исцеляющую микросреду, не уменьшаются, клеточные ответы продолжаются, и это поддерживает активацию и дифференцировку миофибробластов. 34 Следовательно, преобладают процессы репарации, и поврежденная ткань замещается преимущественно фиброзной рубцовой тканью.
Регенерация после острого, но ограниченного повреждения
В легких эпителиальная выстилка дыхательных путей очень чувствительна к повреждению от инфекций, передающихся воздушно-капельным путем, раздражителей или переносимых по воздуху токсинов. Эти накладки легко регенерируются после поверхностного повреждения, которое не разрушило нижележащую структуру ткани и внеклеточный матрикс. В легких острое повреждение эпителия может стимулировать эффективную регенеративную реакцию, обусловленную пролиферативными ответами со стороны здорового соседнего эпителия.35 год , 36
Важность, которую ремоделирование тканей играет во время эффективного процесса регенерации, показано в исследовании Шиллера и его коллег. 37 В этом исследовании измерялась динамика внеклеточных компонентов от момента повреждения легких, вызванного блеомицином, временного фиброзного восстановления через 2 недели до регенерации легких через 4–8 недель. Блеомицин — это молекула бактериального происхождения, токсичность которой связана с селективным ингибированием синтеза нуклеиновых кислот и которая вызывает гибель ряда типов эпителиальных клеток, включая AEC1, AEC II, Club-клетки и эндотелиальные клетки, в первые 7 дней после воздействия.В результате связанного с блеомицином повреждения клеток в оставшейся ткани происходит большое количество изменений, и, в частности, некоторые белки внеклеточного матрикса, такие как Emilin2, который взаимодействует с эластином, становятся сильно регулируемыми.
Считается, что во время эффективной регенерации легких базальная мембрана, лежащая под слоями эпителиальных и эндотелиальных клеток, имеет решающее значение для поддержки миграции стволовых клеток в поврежденную область за счет обеспечения каркаса. 38 и способность концентрировать паракринные секретируемые биоактивные молекулы.39
На 3 день, который соответствует пику воспалительной реакции после лечения блеомицином, наблюдается значительная активация секретируемого ингибитора эластазы нейтрофилов, α2-макроглобулина и ряда ингибиторов сериновых протеаз (серпинов), 37 необходимо для контроля степени опосредованного протеазой повреждения структур, таких как базальная мембрана. Точно так же есть данные об усиленной экспрессии протеогликановых молекул декорина и бигликана. Эти молекулы связываются с коллагеном I и могут секвестрировать секретируемый TGF-β, снижая его сигнальную активность и уровень фиброгенеза.37 , 40 Присутствие декорина и бигликана может влиять на связывание фибробластов, что инициирует внутриклеточную передачу сигналов для путей, связанных с миграцией, таких как Rac1 и RhoA, и, таким образом, способствует миграции клеток. 41 год Редкость декорина из-за снижения продукции фибробластов связана с хронической воспалительной средой, связанной с тяжелой эмфиземой. 42 Исследования in vitro показали, что мРНК декорина может быть увеличена кортикостероидом, дексаметазоном (Dex), в то время как мРНК бигликана увеличивается при лечении транс-ретиноевой кислотой (ATRA).43 год
Восстановление легких после нарушения структуры ткани
В условиях хронического воспаления продолжающееся рекрутирование, активация и дегрануляция нейтрофилов приводит к повреждению ткани, опосредованному протеазами, включая эластазу, которая переваривает белки внеклеточного матрикса и может нарушить структуру, обеспечиваемую легким путем базальная мембрана, лежащая в основе альвеолярного эпителия. Когда структурная целостность легкого нарушена, процессы восстановления преобладают над регенерацией.Это проиллюстрировано в элегантном исследовании с использованием модели хронического повреждения легких эластазой, где степень повреждения легкого титровалась с помощью 4 последовательных еженедельных низких доз панкреатической свиной эластазы (PPE). 44 После одной инстилляции эластазы не наблюдалось значительного снижения содержания эластина в альвеолярных перегородках, но наблюдался значительный инфильтрат мононуклеарных клеток в паренхиму легких. Вторая установка привела к структурной деформации альвеол и снижению содержания эластина в альвеолярных перегородках.Однако только после третьей инстилляции эластазы, которая еще больше снизила содержание эластина в альвеолярных перегородках, были обнаружены признаки фиброза, о чем свидетельствовало усиление окрашивания на содержание коллагеновых волокон в альвеолах и мелких дыхательных путях.
Недавние сравнения сходств и различий повреждающего действия кремнезема, блеомицина и параквата на животных моделях позволяют предположить, что эти агенты повреждают легкие разными и характерными способами. 45 На мышиной модели всасывание всех этих агентов из глотки инициировало воспалительную реакцию, пик которой достигался на 7-й день после лечения.Хотя гистопатология и генетический анализ продемонстрировали много схожих характеристик между тремя повреждающими молекулами, существуют явные различия с точки зрения природы гистопатологии, степени иммунного вовлечения, уровня и типа клеточного повреждения, уровня генов, связанных с модификацией ВКМ, и интересных различных наборов генов. хемокины. 45 Большое количество уникальных иммунно-ассоциированных генов, активируемых после воздействия кремнезема, может иметь важные корреляты для воздействия кремнезема на людей, где у некоторых пациентов были зарегистрированы признаки аутоиммунного заболевания, а также фиброза.46 , 47 Хотя кажется, что существуют общие причины ранних пролиферативных и воспалительных реакций, возникающих после повреждения легких, отдельные генетические ответы, выявленные после различных типов повреждений, предполагают, что необходимо исследовать терапевтические цели, связанные с повреждением.
Хроническое заболевание легких возникает в результате нерегулируемых процессов восстановления
Последствия длительных или повторяющихся периодов инфекции, раздражителей или токсинов могут вызвать состояние хронического воспаления, тканевой среды, в которой происходят процессы восстановления, которые заменяют нормальную структуру ткани фиброзной тканью. предпочтительнее регенерации тканей.Если таким образом поражаются несколько областей легкого, функция легких постепенно и необратимо ухудшается.
Структурные характеристики легких приводят к динамическим и отчетливым экологическим и механическим свойствам, которые меняются по вентиляционному дереву от трахеи до концевых альвеол. Понимание дифференциальной восприимчивости структур легких было получено путем интеграции физиологических измерений внутридыхательного давления. 48 и ультраструктурный анализ, изначально предоставленный стереологией 49 , 50 и совсем недавно с помощью исследований с помощью микрокомпьютерной томографии (мкКТ).51 Такие исследования способствовали разработке моделей, которые предсказывают, что проникновение частиц в легкие связано с их размером и скоростью воздушного потока. Ряд экспериментальных и математических моделей подчеркивает, что осаждение частиц распределяется неравномерно, а место пика расположения смещается от дистальных областей легких к проксимальным областям с поверхностной дозой, которая намного выше в проводящих дыхательных путях, чем в альвеолах. 52 , 53 Учитывая, что сопротивление дыхательных путей и количество дыхательных путей увеличиваются с каждым уровнем разветвления и сужением диаметра дыхательных путей, Hogg et al .предположили, что небольшие дыхательные пути подвержены повреждению частицами, которое предшествует коллапсу терминальных бронхиол, что приводит к опасному для жизни увеличению сопротивления дыхательных путей, характерному для патологического прогрессирования хронической обструктивной болезни легких (ХОБЛ). 54 Наличие маркеров клеточного старения в популяциях клеток легких пациентов с ХОБЛ согласуется с подавляющей репаративной способностью легких в ответ на продолжающийся стресс и травмы. 55
Напротив, заболевания легких, такие как фиброз легких, по-видимому, не связаны преимущественно с повреждением частицами и последующим хроническим воспалением и нечувствительны к противовоспалительному лечению.56 Скорее, они характеризуются гетерогенным паттерном прогрессирующих структурных изменений легких, опосредованных изменением регуляции или функции фибробластов легких. Очаги пролиферирующих фибробластов характерны для IPF и, как полагают, отражают повреждение альвеолярных эпителиальных клеток и последующий коллапс дистального воздушного пространства. 57 год Несмотря на то, что ряд воздействий, включая курение, считаются независимыми факторами риска ИЛФ, причинный агент (ы) не идентифицирован. В недавнем исследовании было обнаружено, что все обследованные пациенты с IPF показали сверхэкспрессию гликопротеина муцина 5b. 58 натолкнул на мысль, что аберрантный мукоцилиарный клиренс может способствовать изменению микробиома легких. 59 причинение вреда из-за врожденных иммунных реакций, поддерживающих развитие IPF.Обнаружение повышенной легочной экспрессии в небольшой группе пациентов IPS IL25, который является профиброзным в моделях на животных и выделяется местными популяциями клеток ILC2, согласуется с этой гипотезой. 60
Терапевтические подходы для модуляции повреждения / усиления регенерации вместо восстановления
Текущие и предлагаемые терапевтические подходы для остановки хронического повреждения легких включают уменьшение воспаления легких, при этом наиболее распространенные схемы лечения направлены на широкое снижение провоспалительной передачи сигналов за счет использования ингаляционных кортикостероидов .Однако, как обсуждалось выше, современные противовоспалительные подходы неэффективны при лечении ИЛФ. Иллюстрация того, как лечение кортикостероидами может иметь нежелательные негативные эффекты на поврежденное легкое, представлена в недавнем исследовании, в котором оценивалась способность лечения Dex улучшать исход после повреждения легких, вызванного блеомицином. Это исследование показало, что у мышей, получавших Dex, наблюдалось снижение концентрации фактора некроза опухоли (TNF) -α в жидкости лаважа; однако значительного снижения числа нейтрофилов у мышей, получавших Dex, не наблюдалось.Кроме того, культуры первичных альвеолярных эпителиальных клеток, обработанных Dex, показали замедленную и дозозависимую более низкую скорость восстановления, чем культуры, обработанные контрольным физиологическим раствором. 61
Существуют важные клинические проблемы, связанные с эффективностью этих схем лечения у людей, включая развитие стероидорезистентного воспаления. 62 что связано с обострениями аллергической астмы с накоплением нейтрофилов. Считается, что развитие устойчивости к противовоспалительным кортикостероидам является многофакторным, включая высокие уровни провоспалительного действия, обеспечиваемые повышенной экспрессией провоспалительного цитокинового фактора ингибирования миграции макрофагов (MIF), чрезмерной активацией митоген-активированного белка ( MAP) киназных путей, которые подавляют подавляющий эффект глюкокортикоидного рецептора связывающего элемента ответа циклического АМФ белка (CBP) и нарушение ядерного рекрутирования гистондеацетилазы-2 (HDAC2), что опять же, как правило, действует для подавления экспрессии про -Воспалительные гены.63 , 64 , 65
Нацеленность на воспалительный каскад для лечения заболеваний легких
Идентификация DAMP и PAMP как молекул, критически важных для инициирования и поддержания воспаления, побудила доклинические исследования для оценки эффективности блокады DAMP / PAMP в разрешении воспаления. Хотя технически это не является DAMP, IL-1β является важной частью сигнальной амплификации, которая следует за активацией DAMP или PAMP комплекса инфламмасом. Существует три типа реагентов, нацеленных на IL-1, которые были оценены на противовоспалительную активность в контексте заболеваний легких: анакинра является антагонистом рецептора IL-1, 66 MEDI8968 представляет собой гуманизированное антитело против IL-1R, а канакинумаб представляет собой блокирующее антитело против IL-1β.Хотя эти подходы успешно использовались на мышиных моделях для уменьшения воспаления, связанного с IL-1, и несмотря на то, что канакинумаб и анакинра показали эффективность в лечении редкого воспалительного заболевания, начинающегося у взрослых, болезнь Стилла, 67 в клинических испытаниях пациентов с ХОБЛ, принимавших канакинумаб, не было обнаружено улучшенных показателей функции легких. 68 или MEDI8968. 69 О недавно завершенных клинических испытаниях по оценке эффективности канакинумаба при лечении легочного саркоидоза еще не сообщалось. 70 в то время как предлагается исследование для оценки эффективности анакинры при лечении муковисцидоза.71
Цитокин IL-5 является современной противовоспалительной терапевтической мишенью и был обнаружен в биоптатах бронхов легких у астматиков. 72 в котором антиген-специфические CD4 Т-клетки ответственны за его секрецию. 73 Поскольку IL-5 может мобилизовать эозинофилы из пула костного мозга, 74 его регулирование считается критическим. Экспериментальные доказательства центральной роли IL-5 обеспечиваются защитой мышей, у которых отсутствует ген IL-5, от антиген-зависимых моделей аллергического заболевания дыхательных путей. 75 Эти многообещающие исследования побудили к клиническим испытаниям, направленным на нейтрализацию активности IL-5 в контексте острого заболевания дыхательных путей.Недавний метаанализ, охватывающий использование лечения против IL-5, меполизумаба, пришел к выводу, что при правильном нацеливании на лечение пациентов с тяжелой эозинофильной астмой это лечение значительно снижает общее количество обострений на пациента, а также количество обострений. обострений, требующих госпитализации.
Другие реагенты, оцениваемые для лечения заболеваний легких, включают тоцилизумаб, гуманизированное моноклональное антитело, которое блокирует активность рецептора интерлейкина-6 (IL-6R).Этот реагент был опробован в контексте интерстициального заболевания легких (ILD), которое связано с системным склерозом у пациентов с диагнозом менее 2 лет. 76 Пациенты, получавшие тоцилизумаб, показали сохраненную функцию легких по сравнению с пациентами, получавшими плацебо. В небольшом внеплановом исследовании, посвященном лечению пациентов с прогрессирующим заболеванием и не прошедшим другие виды иммунотерапевтического лечения, 4 из 9 показали стабилизацию заболевания. 77
Многочисленные исследования на животных продемонстрировали роль цитокинов семейства IL-17 в воспалительном заболевании легких и блокирование IL-17a. 78 или IL-17e, также известный как IL-25 79 уменьшает патологию легких.Кроме того, было показано, что ингибиторы фосфоинозитид-3-киназ (PI3K), которые активируются после передачи сигналов IL-25, эффективны в снижении астмы, такой как гиперчувствительность дыхательных путей и воспаление дыхательных путей. 80 Гуманизированное антитело против ИЛ-17а, секукинумаб, которое успешно применялось для лечения псориаза, безуспешно испытывалось в когорте кортикостероидорезистентных астматиков. 81 год
В целом, неспособность продемонстрировать улучшенные результаты после лечения биологическими препаратами, направленными против ряда воспалительных цитокинов, обескураживает, но с учетом эффективности таких подходов в лечении других воспалительных состояний, а затем дополнительных подходов к дозированию или, возможно, многоцелевых биопрепаратов 82 может привести к эффективному лечению заболеваний легких человека.
Как описано выше, легкие обладают способностью к регенерации, особенно эпителий легких, процесс, который зависит от выживания подходящих клеток-предшественников, расположенных на жизнеспособном расстоянии от места повреждения. Недавнее отслеживание клонов судьбы альвеолярных клеток-предшественников у мышей описывает продолжающееся, но нечастое образование новых альвеолярных единиц, при этом клетки ATII действуют как предшественники для клеток ATI. 38 (Фигура ). После специфического повреждения ATI гипероксигенацией большое количество клеток ATII способствует обновлению популяции ATI.Важно отметить, что авт. Обнаружили интактный компартмент ATII как у молодых, так и у старых мышей. 33 Фенотип дополнительных клеток-предшественников определялся различными поверхностными маркерами, включая бронхоальвеолярные стволовые клетки (BASC) в соединениях бронхоальвеолярных протоков, мультипотентные эпителиальные стволовые / предшественники. 83 и клетки-предшественники, отрицательные по клону, которые размножаются после повреждения. Вклад мезенхимальных стромальных клеток в RLG не выяснен, хотя McQualter продемонстрировал доказательства того, что пролиферация эпителиальных стволовых / предшественников клеток зависит от факторов роста, высвобождаемых резидентными мезенхимальными стромальными клетками во взрослом легком.83 Недавнее исследование показало, что мезенхимальные стромальные клетки от старых мышей слабо пролиферируют в ответ на пневмонэктомию по сравнению с молодыми мышами. 33 Более того, новая альвеоляризация требует образования новых перегородок, управляемых альфа-гладкомышечным актином + интерстициальных миофибробластов, которые происходят из субпопуляции тромбоцитов фактора роста-альфа + фибробластов, которые отвечают на рецептор-γ, активированный пролифератором пероксисом. (PPAR ‐ γ). 84 Кроме того, есть доказательства того, что клетки костного мозга вносят вклад в RLG.85 Иммунные клетки, такие как альвеолярные макрофаги, являются потенциальными источниками факторов роста и протеаз, которые могут иметь решающее значение для ремоделирования тканей. Таким образом, вполне вероятно, что клетки-предшественники, резидентные и инфильтрирующие клетки необходимы для успешной регенерации легких, и дефекты в любой из этих популяций могут ограничивать регенеративный потенциал.
Локализация предшественников эпителиальных клеток, которые способствуют неоальвеоляризации. Исследования по отслеживанию клонов выявили новую роль клеток-предшественников дыхательных путей в восстановлении и регенерации альвеол.38 CCSP + клубные клетки могут самообновляться и давать реснитчатые клетки для восстановления дыхательных путей. Клетки клуба, характеризующиеся экспрессией CYP2F2, могут дифференцироваться в клетки AECII и AECI. Клетки клуба с низкой экспрессией CYP2F2 (вариантные клетки клуба, расположенные рядом с нейроэндокринными телами) устойчивы к повреждениям, вызванным нафталином, и помогают регенерировать обнаженные дыхательные пути и альвеолярные области. Активация предшественников p63 + после инфицирования вирусом гриппа h2N1 дает стручки p63 + / KRT5 + , которые могут мигрировать из эпителия дистальных отделов дыхательных путей в оголенные альвеолярные области для участия в неоальвеоляризации.BASCs, расположенные в соединении бронхоальвеолярных протоков, могут дифференцироваться на клетки клубов дыхательных путей и AECIIs. SP ‐ C + Клетки, продуцирующие сурфактант AECII, считаются классическими предшественниками AECI; однако вариант AECII, характеризующийся экспрессией SP-C — / α6β4 + , представляет собой дополнительный источник AECII и AECI. AECI, которые покрывают 90% альвеолярного эпителия, считаются терминально дифференцированными и характеризуются экспрессией AQP5, PDPN, HOPX и AGER.Пластичность AEC1s была продемонстрирована с помощью методов отслеживания клонов, которые показали, что AECI HOPX + / Igfbp2 — могут дифференцироваться от AECIIs. 38
Демонстрация плюрипотентности мезенхимальных стволовых клеток (МСК) естественным образом подтолкнула к предположению, что они могут играть отдельно друг от друга в регенеративных процессах. В многочисленных исследованиях было показано, что адоптивная трансплантация МСК оказывает прорегенеративное и противовоспалительное действие, часто когда они накапливаются в тканях легких.Например, адоптивно перенесенные МСК показали положительные преимущества в контексте вызванного блеомицином повреждения легких у мышей, 86 эффект, приписываемый продукции антагониста рецептора IL-1 МСК. Общей особенностью, описанной во многих протоколах адаптивной передачи MSC, является низкая частота и долговечность MSC, которые обнаруживаются более чем через 1 день после передачи. Дальнейшие исследования in vitro и продемонстрировали, что экзосомы, которые представляют собой небольшие мембранные везикулы, содержащие смешанные концентрации цитоплазматических молекул, высвобождаются из культивированных MSC, полученных из жировой ткани.Эти экзосомы содержат и экспрессируют альфа-1-антитрипсин на своей поверхности, 87 молекула, которая сильно ингибирует активность протеазы. Было продемонстрировано, что эти экзосомы проявляют антиэластазную активность и обеспечивают доказательство концепции бесклеточных систем доставки, которые могут использоваться для подавления модуляции протеаз, активных в местах хронического воспаления.
В других исследованиях изучалась эффективность лечения повреждений легких всей транс-ретиноевой кислотой (ATRA), учитывая, что она имеет структурную связь с витамином А и, как было показано, участвует в развитии легких.88 В ряде исследований опубликованы улучшенные результаты с использованием ATRA после повреждения легких, вызванного эластазой, у крыс и мышей. 89 , 90 Недавно Такеда и др. . 91 продемонстрировали потенциальное усиление эффекта восстановительного адоптивного переноса МСК в легкое мыши, поврежденное эластазой, путем одновременного системного лечения с помощью ATRA. Они описали, что MCS вызывал синергетический восстановительный ответ, который включал уменьшение среднего линейного расстояния пересечения, увеличение податливости легкого и увеличение площади поверхности легкого.Авторы представили доказательства того, что мишень млекопитающих для функции рапамицина (mTor), связанная с активностью киназы кофактора S6k1, имеет решающее значение для восстановительного эффекта и что синергизм с ATRA блокируется, когда функция mTor ингибируется препаратом рапамицин.
Как обсуждалось ранее, провоспалительные медиаторы, выделяемые PAMP- и DAMP-активированными клетками, включают простагландины, которые действуют на эндотелиальные клетки, увеличивая местный кровоток, на местные нервы, вызывая боль, и влияют на функцию лейкоцитов, включая нейтрофилы.Ферменты циклооксигеназы (ЦОГ) -1 и 2 участвуют в биосинтезе простагландинов и являются мишенями нестероидных противовоспалительных ингибиторов, в том числе аспирина. Активация нейтрофилов простагландином-E 2 (PGE 2) вызывает переключение производства провоспалительного лейкотриена бета-4 (LTB 4 ) на молекулу липоксина, которая снижает дальнейшее рекрутирование нейтрофилов ( Фигура ). Производство других противовоспалительных молекул также было обнаружено в результате исследования модуляции биосинтеза жирных кислот во время воспаления (обзор Serhan et al .92 ), включая резольвины, протектины и марезины серий D и E. Эти молекулы образуются либо как прямые биохимические продукты путей биосинтеза полиненасыщенных жирных кислот, либо в ответ на блокирование активности циклооксигеназы такими молекулами, как аспирин. Исходным сырьем для этих молекул являются омега-3 жирные кислоты, и это дает механистическое объяснение связанных с ними преимуществ для здоровья диет, содержащих продукты, богатые этими липидами. 93 Возможность модуляции продукции этих молекул in vivo или их терапевтического использования только устанавливается, и имеются доказательства того, что лечение резольвином E1 может уменьшить воспаление легких в зависимости от апоптоза, 94 в то время как исследования, посвященные применению так называемого иммунного питания, демонстрируют некоторую клиническую эффективность в измеримом повышении уровней резолвина E1 в плазме и снижении уровней IL-6 в плазме.95
Переназначение биосинтеза простагландинов для создания факторов расслаивания ран. Незаметные, но глубокие изменения метаболизма различных жирных кислот прекурсоры возникают из-за изменения активности ферментов, таких как липоксигеназы и высвобождают противовоспалительные молекулы, такие как липоксины и резолвины, могут изменить баланс с провоспалительной среды на благоприятную для заживления. 15-HETE, 15-гидроксиэйкозатетраеновая кислота; 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; BLT1, рецептор лейкотриена; ЦОГ-2, циклооксигеназа 2; DHA, докозагексаеновая кислота; EPA, эйкозапентаеновая кислота; FPRL, рецептор формилпептида, подобный-1; LXA 4 , липоксин А4; LXB 4 , липоксин B4; Mϕ, макрофаг; Омега-3 жирные кислоты, содержащие омега-3 жирные кислоты; PGE 2 , простагландин E2.
Эти доклинические исследования дают надежду на то, что даже в сильно поврежденных легких функция может быть частично восстановлена, при этом ясно, что более глубокое понимание механизмов, лежащих в основе восстановления легких, еще не достигнуто.
Выводы
Задача перспективной помощи в восстановлении после повреждения легких и улучшения клинических исходов заключается в разработке методов лечения, которые улучшают регенеративные процессы, а не процессы восстановления. Как обсуждалось выше, управление воспалительной реакцией кажется ключом к этим улучшениям.Тогда можно было бы рассмотреть возможность применения анти-цитокиновых агентов, доступных в настоящее время в клинике, таких как анти-IL-1 и анти-IL-6, для модуляции острых воспалительных реакций с потенциальными преимуществами, уравновешенными другими клиническими факторами риска. Например, повышенный риск заражения можно снизить за счет совместного лечения с антипатогенными препаратами. Дальнейшее понимание масштабов и силы эндогенных противовоспалительных молекул, таких как резольвиноподобные молекулы, эффективность которых может зависеть от диеты, может положительно повлиять на потенциал заживления легких на популяционном уровне.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
JY был поддержан международной стипендией для аспирантов Университета Мердока. Авторы выражают признательность покойному профессору Джеффри Лорану за наставничество.
Список литературы
2. Arcavi L, Benowitz NL. Курение сигарет и инфекция. Arch Intern Med 2004; 164: 2206–2216. [PubMed] [Google Scholar] 3. Принц Л.Р., Уайт МК, Сабро I, Паркер Л.С. Роль TLR в активации нейтрофилов.Curr Opin Pharmacol 2011; 11: 397–403. [PubMed] [Google Scholar] 4. Элсон Д.А., Райан Х.Э., Сноу Д.В., Джонсон Р., Арбейт Дж. М.. Координированная активация генов-мишеней фактора, индуцируемого гипоксией (HIF) -1альфа и HIF-1, во время многоступенчатого эпидермального канцерогенеза и заживления ран. Рак Res 2000; 60: 6189–6195. [PubMed] [Google Scholar] 5. Исии Й, Ито К., Моришима Й и др. Фактор транскрипции Nrf2 играет ключевую роль в защите от вызванного эластазой воспаления легких и эмфиземы.J Immunol 2005; 175: 6968–6975. [PubMed] [Google Scholar] 6. Пак Джей, Ким Д.Х., Шах С.Р. и др. Подобное переключателю усиление эпителиально-мезенхимального перехода с помощью YAP посредством регуляции обратной связи WT1 и GTPases семейства Rho. Nat Commun 2019; 10: 2797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Stone RC, Pastar I, Ojeh N и др. Эпителиально-мезенхимальный переход при восстановлении тканей и фиброзе. Клеточная ткань Res 2016; 365: 495–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Гарт Дж., Барнс Дж. В., Крик С. Ориентация на цитокины как развивающиеся стратегии лечения хронических воспалительных заболеваний дыхательных путей. Int J Mol Sci 2018; 19: 3402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Мацуо Р., Охкохти Н., Мурата С. и др. Тромбоциты сильно индуцируют пролиферацию гепатоцитов с помощью IGF-1 и HGF in vitro . J Surg Res 2008; 145: 279–286. [PubMed] [Google Scholar] 11. Serhan CN. Фаза разрешения воспаления: новые эндогенные противовоспалительные и пролонгирующие липидные медиаторы и пути.Анну Рев Иммунол 2007; 25: 101–137. [PubMed] [Google Scholar] 12. Лайонс-Джордано Б., Пратта М.А., Гэлбрейт В., Дэвис Г.Л., Арнер Э.С. Интерлейкин-1 дифференциально модулирует хондроцитарную экспрессию циклооксигеназы-2 и фосфолипазы А2. Exp Cell Res 1993; 206: 58–62. [PubMed] [Google Scholar] 13. Жорж К., Азулай Э, Мокарт Д. и др. Влияние нейтропении на смертность больных раком в критическом состоянии: результаты метаанализа индивидуальных данных. Crit Care 2018; 22: 326. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15.Свенсон Дж. А., Хоппе А. Д.. Координация передачи сигналов во время фагоцитоза, опосредованного Fc-рецептором. J Leukoc Biol 2004; 76: 1093–1103. [PubMed] [Google Scholar] 16. Чжоу MJ, Браун EJ. CR3 (Mac-1, альфа M бета 2, CD11b / CD18) и Fc гамма RIII взаимодействуют в генерации респираторного выброса нейтрофилов: потребность в Fc гамма RIII и фосфорилировании тирозина. J Cell Biol 1994; 125: 1407–1416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пигната К., Прасад К.В., Робертсон М.Дж., Левин Х., Радд С.Е., Ритц Дж.Передача сигналов, опосредованная Fc gamma RIIIA, включает lck семейства src в естественных клетках-киллерах человека. J Immunol 1993; 151: 6794–6800. [PubMed] [Google Scholar] 18. Kinet JP. Рецептор IgE с высоким сродством (Fc epsilon RI): от физиологии к патологии. Анну Рев Иммунол 1999; 17: 931–972. [PubMed] [Google Scholar] 19. Хассел Т., Белл Т.Дж. Альвеолярные макрофаги: пластичность в тканевом контексте. Нат Рев Иммунол 2014; 14: 81–93. [PubMed] [Google Scholar] 20. Копф М, Шнайдер С, Нобс С.П. Развитие и функция резидентных в легких макрофагов и дендритных клеток.Нат Иммунол 2015; 16: 36–44. [PubMed] [Google Scholar] 21. Хоган Р.Дж., Чжун В., Ушервуд Э.Дж., Кукенхэм Т., Робертс А.Д., Вудленд Д.Л. Защита от респираторных вирусных инфекций может быть обеспечена антиген-специфическими CD4 + Т-клетками, которые сохраняются в легких. J Exp Med 2001; 193: 981–986. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Бринкманн В., Райхард Ю., Гусманн С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 2004; 303: 1532–1535. [PubMed] [Google Scholar] 23.Холт П.Г., Стрикленд Д.Х., Викстром Мэн, Янсен Флорида. Регуляция иммунологического гомеостаза в дыхательных путях. Нат Рев Иммунол 2008; 8: 142–152. [PubMed] [Google Scholar] 24. Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O’Garra A, Murphy KM. Развитие Th2CD4 + T-клеток посредством IL-12, продуцируемого Listeria-индуцированными макрофагами. Наука 1993; 260: 547–549. [PubMed] [Google Scholar] 25. Welsby I, Goriely S. Регулирование экспрессии интерлейкина-23 при здоровье и болезни.Adv Exp Med Biol 2016; 941: 167–189. [PubMed] [Google Scholar] 26. Куа DJ, Шерлок Джей, Чен И и др. Интерлейкин-23, а не интерлейкин-12, является критическим цитокином для аутоиммунного воспаления головного мозга. Природа 2003; 421: 744–748. [PubMed] [Google Scholar] 27. Ауйла С.Дж., Чан Ю.Р., Чжэн М. и др. IL-22 обеспечивает защиту слизистой оболочки хозяина от грамотрицательной бактериальной пневмонии. Нат Мед 2008; 14: 275–281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Фумагалли С., Торри А., Папанья А., Читтерио С., Майнольди Ф, Фоти М.IL-22 быстро индуцируется стимуляцией рецепторов распознавания патогенов в дендритных клетках костного мозга в отсутствие IL-23. Научный представитель 2016; 6: 33900. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мати С.А., Диксон К.Л., Уокер С.А. и др. Альвеолярные макрофаги являются стражами легочного гомеостаза мыши после заражения ингаляционным антигеном. Аллергия 2015; 70: 80–89. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Делонг Дж. Х., О’Хара Холл А, Рауш М. и др. Стимуляция IL-27 и TCR способствуют экспрессии множественных ингибирующих рецепторов Т-клетками.Иммунохоризонты 2019; 3: 13–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Коллисон Л. В., Чатурведи В., Хендерсон А. Л. и др. ИЛ-35-опосредованная индукция мощной регуляторной популяции Т-клеток. Нат Иммунол 2010; 11: 1093–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Кулашекаран П., Скавон Калифорния, Роджерс Д.С., Аренберг Д.А., Танникал В.Дж., Горовиц Дж.С. Эндотелин-1 и трансформирующий фактор роста-бета1 независимо индуцируют устойчивость фибробластов к апоптозу через активацию AKT. Am J Respir Cell Mol Biol 2009; 41: 484–493.[Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Паксон Дж. А., Грунтман А. М., Дэвис А. М., Паркин С. М., Ингенито Е. П., Хоффман А. М.. Возрастная зависимость динамики мезенхимальных стромальных клеток легких после пневмонэктомии. Stem Cells Dev. 2013; 22: 3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ли CC, Ван CN, Ли Ю.Л., Цай Ю.Р., Лю Дж.Дж. Блок 1 группы с высокой подвижностью индуцировал дифференцировку миофибробластов легких человека и усиленную миграцию за счет активации MMP-9. PLoS One 2015; 10: e0116393. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35.Giangreco A, Arwert EN, Rosewell IR, Snyder J, Watt FM, Stripp BR. Стволовые клетки незаменимы для гомеостаза легких, но восстанавливают дыхательные пути после травмы. Proc Natl Acad Sci USA 2009; 106: 9286–9291. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Рок JR, Баркаускас CE, Cronce MJ и др. Множественные популяции стромы способствуют легочному фиброзу без доказательств перехода эпителия в мезенхиму. Proc Natl Acad Sci USA 2011; 108: E1475 – E1483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Шиллер Х. Б., Фернандес И. Е., Бургшталлер Г. и др. Протеомное профилирование внеклеточной ниши с разрешением по времени и компартментам при повреждении и восстановлении легких. Мол Сист Биол 2015; 11: 819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Десаи Т.Дж., Браунфилд Д.Г., Краснов М.А. Альвеолярные клетки-предшественники и стволовые клетки в развитии, обновлении и раке легких. Природа 2014; 507: 190–194. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Дин БС, Нолан Диджей, Го П и др. Ангиокринные сигналы, полученные из эндотелия, вызывают и поддерживают регенеративную альвеоляризацию легких.Клетка 2011; 147: 539–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Kolb M, Margetts PJ, Sime PJ, Gauldie J. Протеогликаны, декорин и бигликан по-разному модулируют опосредованные TGF-бета фиброзные ответы в легких. Am J Physiol Lung Cell Mol Physiol 2001; 280: L1327 – L1334. [PubMed] [Google Scholar] 41. Tufvesson E, Westergren-Thorsson G. Бигликан и декорин вызывают морфологические и цитоскелетные изменения, включая передачу сигналов малыми GTPasesRhoA и Rac1, что приводит к миграции фибробластов легких.J Cell Sci 2003; 116: 4857–4864. [PubMed] [Google Scholar] 42. Нордхук Дж.А., Постма Д.С., Чонг Л.Л. и др. Различная модуляция продукции декорина фибробластами легких у пациентов с легкой и тяжелой эмфиземой. ХОБЛ 2005; 2: 17–25. [PubMed] [Google Scholar] 43. Кахари В.М., Хаккинен Л., Вестермарк Дж., Ларджава Х. Дифференциальная регуляция экспрессии гена декорина и бигликана дексаметазоном и ретиноевой кислотой в культивируемых фибробластах кожи человека. J Invest Dermatol 1995; 104: 503–508. [PubMed] [Google Scholar] 44.Оливейра М.В., Абреу СК, Падилья Г.А. и др. Характеристика модели эмфиземы на мышах, вызванной множественными инстилляциями низкой дозы эластазы. Front Physiol 2016; 7: 457. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Dong J, Yu X, Porter DW, Battelli LA, Kashon ML, Ma Q. Общие и отдельные механизмы индуцированного легочного фиброза твердыми частицами и растворимыми химическими фиброгенными агентами. Arch Toxicol 2016; 90: 385–402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Миллер Ф. В., Альфредссон Л., Костенбадер К. Х. и др. Эпидемиология воздействия окружающей среды и аутоиммунных заболеваний человека: результаты семинара экспертной группы Национального института наук об окружающей среде.J Аутоиммунный 2012; 39: 259–271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Янаи М., Секизава К., Охруи Т., Сасаки Х., Такисима Т. Место обструкции дыхательных путей при легочной болезни: прямое измерение внутрибронхиального давления. J Appl Physiol 1992; 72: 1016–1023. [PubMed] [Google Scholar] 49. Weibel ER. Принципы и методы морфометрического исследования легкого и других органов. Лаборатория Инвест 1963; 12: 131–155. [PubMed] [Google Scholar] 50. Хорсфилд К., Камминг Г. Морфология бронхиального дерева у человека.J Appl Physiol 1968; 24: 373–383. [PubMed] [Google Scholar] 51. McDonough JE, Yuan R, Suzuki M и др. Обструкция мелких дыхательных путей и эмфизема легких при хронической обструктивной болезни легких. N Engl J Med 2011; 365: 1567–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Ю. П., Диу СК. Общее и региональное выпадение вдыхаемых аэрозолей на человека. J Aerosol Sci 1983; 14: 599–609. [Google Scholar] 53. Ким С.С., Ху СК, ДеВитт П., Джеррити Т.Р. Оценка регионального отложения вдыхаемых частиц в легких человека методом серийной болюсной доставки.J Appl Physiol (1985). 1996; 81: 2203–2213. [PubMed] [Google Scholar] 54. Hogg JC, McDonough JE, Suzuki M. Малая обструкция дыхательных путей при ХОБЛ: новые идеи, основанные на изображениях микро-КТ и МРТ. Грудь 2013; 143: 1436–1443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Мюллер К.С., Велкер Л., Пааш К. и др. Фибробласты легких пациентов с эмфиземой обнаруживают маркеры старения in vitro . Respir Res 2006; 7: 32. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. RyuJH Colby TV, Hartman TE, Vassallo R.Интерстициальные заболевания легких, связанные с курением: краткий обзор. Eur Respir J 2001; 17: 122–132. [PubMed] [Google Scholar] 57. Каспер М., Хароске Г. Изменения в альвеолярном эпителии после травмы, приводящие к фиброзу легких. Гистол гистопатол 1996; 11: 463–483. [PubMed] [Google Scholar] 58. Сейболд М.А., Мудрый А.Л., Шпир М.С. и др. Обычный полиморфизм промотора MUC5B и фиброз легких. N Engl J Med 2011; 364: 1503–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Molyneaux PL, Cox MJ, Willis ‐ Owen SA и др. Роль бактерий в патогенезе и прогрессировании идиопатического фиброза легких.Am J Respir Crit Care Med 2014; 190: 906–913. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хэмс Э., Армстронг МЭ, Барлоу Дж.Л. и др. IL-25 и врожденные лимфоидные клетки 2-го типа вызывают фиброз легких. Proc Natl Acad Sci USA 2014; 111: 367–372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Обен Вега М., Чупен К., Паскариу М. и др. Дексаметазон не может улучшить вызванное блеомицином острое повреждение легких у мышей. Physiol Rep 2019; 7: e14253. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.Чармандари Э, Кино Т, Итиджо Т, Хрусос ГП. Общая резистентность к глюкокортикоидам: клинические аспекты, молекулярные механизмы и последствия редкого генетического нарушения. J Clin Endocrinol Metab 2008; 93: 1563–1572. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Donnelly SC, Bucala R. Фактор ингибирования миграции макрофагов: регулятор активности глюкокортикоидов с критической ролью в воспалительном заболевании. Мол Мед сегодня 1997; 3: 502–507. [PubMed] [Google Scholar] 64. Барнс П.Дж., Адкок И.М. Устойчивость к глюкокортикоидам при воспалительных заболеваниях.Ланцет 2009; 373: 1905–1917. [PubMed] [Google Scholar] 65. Ито К., Герберт К., Зигл Дж. С. и др. Стероид-резистентное нейтрофильное воспаление на мышиной модели острого обострения астмы. Am J Resp Cell Mol 2008; 39: 543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Эрнандес М.Л., Миллс К, Миндаль М и др. Антагонист рецептора IL-1 снижает вызванное эндотоксином воспаление дыхательных путей у здоровых добровольцев. J Allergy Clin Immunol 2015; 135: 379–385. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.Galozzi P, Baggio C, Bindoli S, Oliviero F, Sfriso P. Развитие и роль в терапии канакинумаба при болезни, начинающейся у взрослых. Фронт Фармакол 2018; 9: 1074. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Calverley PMA, Sethi S, Dawson M и др. Рандомизированное плацебо-контролируемое исследование моноклонального антитела MEDI8968 против рецептора 1 интерлейкина-1 при хронической обструктивной болезни легких. Resp Res 2017; 18: 153. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Хамид К., Аззави М., Инь С. и др. Экспрессия мРНК интерлейкина-5 в биоптатах слизистой оболочки бронхов от астмы.J Clin Invest 1991; 87: 1541–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Хоган С.П., Коскинен А., Маттеи К.И., Янг И.Г., Фостер П.С. Т-клетки CD4 + , продуцирующие интерлейкин 5, играют ключевую роль в эозинофилии, вызванной аэроаллергеном, гиперреактивности бронхов и повреждении легких у мышей. Am J Respir Crit Care Med 1998; 157: 210–218. [PubMed] [Google Scholar] 74. Mold AW, Matthaei KI, Young IG, Foster PS. Связь между интерлейкином-5 и эотаксином в регуляции эозинофилии крови и тканей у мышей.J Clin Invest 1997; 99: 1064–1071. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Фостер П.С., Хоган С.П., Рамзи А.Дж., Маттеи К.И., Янг И.Г. Дефицит интерлейкина 5 устраняет эозинофилию, гиперреактивность дыхательных путей и повреждение легких на модели астмы у мышей. J Exp Med 1996; 183: 195–201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Khanna D, Jahreis A, Lin CJF. Ответ на: Нарваез «Эффективность и безопасность тоцилизумаба для лечения рефрактерного системного склероза, связанного с интерстициальным заболеванием легких: серия случаев».Энн Рум Дис 2019; 78: e124. [PubMed] [Google Scholar] 77. Нарваез Дж., Л.Луч Дж., Алегри Санчо Дж. Дж., Молина-Молина М., Нолла Дж. М., Кастельви И. Эффективность и безопасность тоцилизумаба для лечения интерстициального заболевания легких, связанного с рефрактерным системным склерозом: серия случаев. Энн Рум Дис 2019; 78: e123. [PubMed] [Google Scholar] 78. Чиполла Э., Фишер А.Дж., Гу Х. и др. Дефицит IL-17A снижает вызванную блеомицином активацию комплемента во время фиброза легких. FASEB J 2017; 31: 5543–5556.[Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Баллантайн С.Дж., Барлоу Д.Л., Джолин Х.Э. и др. Блокирование IL-25 предотвращает гиперреактивность дыхательных путей при аллергической астме. J Allergy Clin Immunol 2007; 120: 1324–1331. [PubMed] [Google Scholar] 80. Хуан П, Ли И, Ур З и др. Комплексное ослабление индуцированной IL-25 гиперчувствительности дыхательных путей, воспаления и ремоделирования с помощью ингибитора PI3K LY294002. Респирология 2017; 22: 78–85. [PubMed] [Google Scholar] 82. Ван И, Ву Цю, Лю Цзинь и др. Рекомбинантные IgG-подобные биспецифические антитела, действующие как ингибитор интерлейкина-1бета и интерлейкина-17А, демонстрируют многообещающую эффективность при ревматоидном артрите.Biomed Pharmacother 2017; 89: 426–437. [PubMed] [Google Scholar] 83. McQualter JL, Yuen K, Williams B, Bertoncello I. Доказательства иерархии эпителиальных стволовых / предшественников в легких взрослых мышей. Proc Natl Acad Sci USA 2010; 107: 1414–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Чен Л., Аччиани Т., Ле Крас Т., Лутцко С., Perl AK. Динамическая регуляция экспрессии альфа-рецептора фактора роста тромбоцитов в альвеолярных фибробластах во время реальвеоляризации. Am J Resp Cell Mol 2012; 47: 517–527.[Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Шуга А., Уэда К., Такемото Ю. и др. Значительная роль клеток костного мозга в компенсаторном регенеративном росте легких. J Surg Res 2013; 183: 84–90. [PubMed] [Google Scholar] 86. Ортис Л.А., Дутрейл М., Фаттман С. и др. Антагонист рецептора интерлейкина 1 опосредует противовоспалительный и антифибротический эффект мезенхимальных стволовых клеток при повреждении легких. Proc Natl Acad Sci USA 2007; 104: 11002–11007. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87.Бари Э., Ферраротти I, Ди Сильвестр Д. и др. Жировые мезенхимальные внеклеточные везикулы как физиологические системы доставки альфа-1-антитрипсина для регенерации легких. Клетки 2019; 8: 965. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Массаро Г.Д., Массаро Д. Лечение ретиноевой кислотой устраняет вызванную эластазой эмфизему легких у крыс. Нат Мед 1997; 3: 675–677. [PubMed] [Google Scholar] 90. Сейфарт C, Муйал JP, Плагенс А и др. Полностью транс-ретиноевая кислота приводит к нерегулярному восстановлению перегородок и не может подавлять провоспалительные макрофаги.Eur Respir J 2011; 38: 425–439. [PubMed] [Google Scholar] 91. Такеда К., Нин Ф., Доменико Дж. и др. Активация киназы p70S6-1 в мезенхимальных стволовых клетках важна для восстановления ткани легких. Стволовые клетки Transl Med 2018; 7: 551–558. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92. Serhan CN, Levy BD. Резолвины в воспалении: появление про-разрешающего суперсемейства медиаторов. J Clin Invest 2018; 128: 2657–2669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Фарзан-Фар Р., Харрис В.С., Гарг С., На Б., Вули М.А.Обратная связь уровней жирных кислот n-3 в эритроцитах с воспалительными биомаркерами у пациентов со стабильной ишемической болезнью сердца: исследование сердца и души. Атеросклероз 2009; 205: 538–543. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Эль Кебир Д., Гьорструп П., Филеп Дж. ResolvinE1 способствует апоптозу нейтрофилов, вызванному фагоцитозом, и ускоряет разрешение легочного воспаления. Proc Natl Acad Sci USA 2012; 109: 14983–14988. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Uno H, Furukawa K, Suzuki D и др. Иммунное питание подавляет острые воспалительные реакции за счет модуляции резольвина E1 у пациентов, перенесших обширную резекцию гепатобилиарной системы.Операция 2016; 160: 228–236. [PubMed] [Google Scholar]Регенерация и восстановление в заживающем легком
Clin Transl Immunology. 2020; 9 (7): e1152.
, 1 , 2 и 1 , 3Эндрю Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Джо Яса
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Микаэла Лукас
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
1 Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
2 Центр клеточной терапии и регенеративной медицины, Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
3 Школа медицины и фармакологии, Университет Западной Австралии (UWA), Перт Вашингтон, Австралия,
Автор, ответственный за переписку. * ПерепискаЭндрю Лукас, Школа биомедицинских наук, Университет Западной Австралии (UWA), Перт, Вашингтон 6009, Австралия.
Эл. Почта: [email protected],
Поступила в редакцию 3 декабря 2019 г .; Пересмотрено 26 мая 2020 г .; Принята в печать 10 июня 2020 г.
Авторские права © 2020 Авторы. Клиническая и трансляционная иммунология , опубликованная John Wiley & Sons Australia, Ltd от имени Австралийско-новозеландского общества иммунологии, Inc. Это статья в открытом доступе на условиях http: // creativecommons.org / licenses / by / 4.0 / License, которая разрешает использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Легкое обеспечивает эффективный газообмен между сложной нестерильной атмосферой и телом через тонкую и обширную эпителиальную поверхность с высокой эффективностью из-за упругой деформации, позволяющей увеличивать и уменьшать объем в процессе дыхания и из-за обширной сосудистой сети, которая способствует быстрой диффузии газа.Большая площадь поверхности легких подвергает орган постоянному риску повреждения патогенами, токсинами или раздражителями; однако повреждение легких можно быстро вылечить с помощью регенеративных процессов, которые восстанавливают его структуру и функцию. В ответ на устойчивое и обширное повреждение легкое заживает посредством нерегенеративного процесса, в результате чего рубцовая ткань локально укрепляет ее структуру, что со временем приводит к серьезной потере функции легких и увеличению заболеваемости. В этом обзоре обсуждается то, что известно о факторах, влияющих на заживление легкого путем регенерации или восстановления, и какие потенциальные новые терапевтические подходы могут положительно повлиять на заживление легких.
Ключевые слова: воспаление, легкое, регенерация, восстановление, терапия
Abstract
В этом обзоре обсуждается то, что известно об обнаружении, ответе и устранении повреждения легких, а также то, что может повлиять на заживление легкого путем регенерации или восстановления. В нем также представлены потенциальные терапевтические подходы, которые могут положительно повлиять на заживление легких.
Введение
Оксигенация тканей позвоночных зависит от структур легких, которые являются одновременно хрупкими и уязвимыми для повреждения.В течение жизни человека легкие подвергаются воздействию сотен миллионов литров нестерильного воздуха, сохраняя при этом свою функцию и целостность. Несмотря на эндемические респираторные инфекции, иммунитета легких обычно достаточно для излечения без длительного структурного повреждения. Такие благоприятные исходы были значительно улучшены благодаря использованию терапевтических антибактериальных средств. Тем не менее, устойчивые или более обширные легочные инфекции могут приводить к накоплению фиброзных повреждений, которые хронически влияют на гибкость легких и проницаемость для кислорода.1 Факторы, которые могут повлиять на тяжесть и частоту респираторных инфекций, включают предрасположенность к развитию астмы, недостаточность иммунитета и / или доступ к соответствующим вакцинациям, а также мутации, которые напрямую влияют на физиологию легких, например, при муковисцидозе. Кроме того, длительное воздействие токсинов, например, привычка к курению и / или длительное воздействие высоких уровней переносимых по воздуху загрязнителей, может напрямую повреждать ткань легких и способствовать менее эффективному избавлению от инфекций легких.2 Несмотря на клинически идентифицируемые факторы риска, невозможно своевременно диагностировать и вмешаться, чтобы предотвратить прогрессирующие дегенеративные фиброзные заболевания легких.
В этом обзоре делается попытка сравнить физиологическую регенерацию легких после повреждения с восстановлением, в результате которого рубцовая ткань нарушает нормальную структуру легкого. Мы анализируем вклад иммунного ответа на эти исходы. Несомненно, уровень воспаления в легких в результате повреждения ткани является одним из ключевых факторов, регулирующих физиологическое восстановление по сравнению с фиброзным.Мы обсуждаем последние разработки в этой области, в конечном итоге пытаясь понять, можем ли мы использовать эти знания для модуляции воспалительной реакции в поврежденных легких с целью повышения их регенеративного потенциала.
От чего зависит, как легкие заживают после повреждения?
Высокая уязвимость легких к повреждениям связана с его структурой. Во-первых, легкое имеет очень низкую плотность клеток по сравнению с его объемом. Во-вторых, функциональная эффективность легких зависит от организации и состава ряда типов клеток, структурные характеристики которых отвечают за сочетание эластичности и проницаемости.Клетки легких, наиболее уязвимые для повреждения, находятся на поверхности слизистой оболочки. Повреждение эпителиальных клеток стимулирует быстрое размножение, дифференциацию и набор замещающих клеток и может привести к регенерации барьерной функции ткани. Однако изменение клеточной организации, вызванное процессами восстановления, включающими рубцевание, обязательно изменяет критические структурные характеристики, что приводит к ухудшению функции легких. Такие факторы, как количество и типы поврежденных клеток, нарушение барьерной функции, а также сила и продолжительность местного иммунного ответа, могут определять, восстанавливается ли поврежденное легкое, восстанавливается или не восстанавливается, что приводит к хроническому заболеванию легких.
Ранний ответ имеет значение
Нарушение гомеостаза тканей, вызванное повреждением, быстро изменяет локальную микросреду, прилегающую к поврежденному легкому. Окружающая среда раны становится положительной для молекул, происходящих от патогенов, которые ее загрязняют, и из внутриклеточной среды умирающих клеток. Преимущество выживания, обеспечиваемое быстрым обнаружением повреждения ткани, привело к эволюции клеточных рецепторов, которые распознают консервативные структурные элементы, часто обнаруживаемые в патогенах, и на внутриклеточных компонентах клетки, которые высвобождаются только после повреждения.Такие рецепторы называются рецепторами распознавания образов (PRR) и включают Toll-подобные рецепторы и рецепторы, подобные гену I (RIG-1), индуцируемому ретиноевой кислотой. Молекулы, происходящие от патогенов и распознаваемые специфической PRR, называются патоген-ассоциированными молекулярными паттернами (PAMP), в то время как лиганды, происходящие из поврежденных клеток-хозяев, известны как связанные с опасностями молекулярные паттерны (DAMP). 3
Рано после травмы поврежденные клетки высвобождают DAMP, такие как IL (интерлейкин) -1α (рисунок), в то время как другие провоспалительные молекулы высвобождаются компонентами начальной воспалительной реакции, такими как тромбоциты, которые накапливаются для стабилизации кровопотери в этом месте. ущерба.Другие провоспалительные сигналы генерируются стромальными клетками в ответ на изменения в гомеостатической среде, такие как изменение давления кислорода. 4 и окислительно-восстановительное состояние ткани 5 и изменения во внеклеточном матриксе ткани (ЕСМ), которые запускают передачу сигналов, включающую перекрестные помехи опухоли Вильмса-1 (WT1), Yes-ассоциированного белка (YAP) -1 и E-кадгерина. 6 запуск эпителиально-мезенхимальных переходов (ЭМП) как часть процесса заживления раны. 7
От первоначального повреждения до возникновения воспаления. (а) Клетки, поврежденные повреждением, высвобождают молекулы, такие как IL-1α, доставляя мощные провоспалительные сигналы через рецепторы ассоциированного с опасностью молекулярного паттерна (DAMP), в то время как патогены распознаются рецепторами патоген-ассоциированного молекулярного паттерна (PAMP). Передача сигналов через оба этих класса рецепторов активирует множество дополнительных процессов напрямую или через инфламмасому, включая изменения в экспрессии генов, секрецию биоактивных молекул, таких как IL-1β и PGE 2 . (b) Действие секретируемых цитокинов и простагландинов привлекает врожденные иммунные клетки к области повреждения и изменяет поведение местного эндотелия, инициирующего воспаление. Врожденные иммунные клетки, преимущественно нейтрофилы, прибывают и перемещаются из кровеносных сосудов в ткань, фагоцитируют или убивают патогены, а затем умирают. Другие врожденные клетки, такие как макрофаги, фагоцитируют мертвые и умирающие нейтрофилы, способствуя снижению провоспалительной передачи сигналов. 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; ASC, спек-подобный белок, связанный с апоптозом; BLT1, рецептор лейкотриена; ch2, ch3, хромосома 1 или 2; ЦОГ-2, циклооксигеназа 2; DAMP, молекула, связанная с опасностью; FcεR1, рецептор 1 FC-эпсилон; IgE, иммуноглобулин E; IL-1R, рецептор интерлейкина 1; LTB 4 , лейкотриен B4; Mϕ, макрофаг; NLPR3, детектор криопирина PAMP; PAMP, молекулярный паттерн, связанный с патогенами; PGE 2 , простагландин E2.
Обнаружение PAMP / DAMPs индуцирует внутриклеточные сигнальные пути, которые сходятся при активации NFκB и последующей повышенной транскрипции множества генов, включая про-IL-1β, фактор некроза опухоли α (TNFα) и компонент NLRP3 инфламмасомы. Повышенная активность инфламмасом вызывает активацию выработки про-ИЛ-1 β, а высвобождение этого и других цитокинов приводит к сильному провоспалительному ответу. Стромальные клетки отвечают секрецией дополнительных провоспалительных цитокинов, таких как IL-6, уровень которого имеет решающее значение для развития фиброза (обзор Garth et al .8 ). Этот ранний ответ включает высвобождение факторов роста, хемокинов, нуклеотидов (АТФ или АДФ), простагландинов и лейкотриенов как из стромальных клеток, так и из тромбоцитов, 9 , 10 , 11 индукция новых паттернов экспрессии и пролиферации генов, активация местного эндотелия, увеличение перфузии в ткани и рекрутирование лейкоцитов. Важно отметить, что передача сигналов IL-1 сильно влияет на активацию активности циклооксигеназы-2 (COX-2), что приводит к усилению биосинтеза ряда простагландинов, которые вносят вклад в воспалительный каскад.12
Лейкоциты, которые экспрессируют ряд PRR, быстро рекрутируются в поврежденную ткань и активируются посредством распознавания PRR патогенов, с которыми они сталкиваются. Модуляция местной сосудистой сети, инициация связывания тромбоцитов проксимальнее повреждения ткани и активация эндотелия, прилегающего к повреждению, приводят к притоку нейтрофилов и других лейкоцитов, локальному отеку и увеличению поступления питательных веществ в поврежденный участок. . Нейтрофилы, которые доминируют над притоком, экспрессируют несколько Toll-подобных рецепторов (TLR) и специфически активируются лигандами, связанными с встречающимися патогенами или высвобождаемыми из поврежденных тканевых клеток, содержащих консервативные структурные элементы.На важность быстроты этого ответа, опосредованного в первую очередь привлечением гранулоцитов из кровотока, указывают пациенты с нейтропеническим раком, испытывающие гораздо более высокий относительный риск смерти. 13
Если у хозяина уже есть гуморальный иммунитет к вторгающимся патогенам, происходит взаимодействие с врожденным иммунным ответом. Низкоаффинные рецепторы Fcγ типа I (FcγR), гетерогенно экспрессирующиеся на лейкоцитах, 14 не связывают мономерные подтипы IgG, но активируются патоген-специфическими иммунокомплексами.Циркулирующие иммуноглобулины против патогенов связываются со своим специфическим антигеном, и полученные иммунокомплексы связываются рецепторами Fc, что приводит к защитным иммунным ответам. Такое связывание вызывает активацию эффекторных лейкоцитов, 15 и перекрестное связывание FcγR на гранулоцитах запускает дегрануляцию и антибактериальную активность, 16 с перекрестным связыванием FcγRIIIa, экспрессируемого на NK-клетках, аналогичным образом приводит к клеточной активации и дегрануляции эффекторных молекул. 17 Кроме того, некоторые антигены паразитов распознаются специфическими антителами IgE, обычно связанными с FcεRI, экспрессируемыми на резидентных в ткани тучных клетках и базофилах, вызывая реакции гиперчувствительности немедленного типа.18
При отсутствии ранее существовавшего иммунитета активация нейтрофилов и других лейкоцитов, таких как тканевые иммунные клетки, такие как альвеолярные макрофаги, 19 дендритные клетки (DC 20 ) и резидентные лимфоциты тканевой памяти (TMR 21 год ) регулируется концентрацией PAMP или DAMP, присутствующих в поврежденной ткани. Активация нейтрофилов приводит к дегрануляции токсичных молекул, таких как протеазы, и активному или пассивному высвобождению внеклеточных ловушек нейтрофилов (NET). 22 ), которые уничтожают патогены, но также вызывают повреждение тканей хозяина, повышая уровень DAMP и дополнительно активируя дополнительные тканевые клетки.Это приводит к дальнейшему усилению воспалительной реакции за счет привлечения и секреции провоспалительных цитокинов резидентными клетками ткани. 23
В частности, секреция IL-12 и IL-23 локальными DC влияет на дифференцировку Т-хелперных (Th) -1 клеток и Th27 клеток, соответственно. 24 , 25 Стимуляция клеток Th27 IL-23 сильно индуцирует IL-17. 26 год и секреция IL-22 из клеток Th27 рекрутируется в поврежденную ткань. 27 Продукция IL-22 происходящими из костного мозга DC в ответ на стимуляцию селективными PAMPs также указывает на то, что резидентные в ткани DC также могут вносить дополнительный вклад в уровни IL-22.28 год И IL-17, и IL-22 стимулируют эпителиальные клетки легких, что приводит к секреции широкого спектра провоспалительных хемокинов. Кроме того, IL-22 вызывает высвобождение ряда антибактериальных пептидов из эпителиальных клеток легких, которые действуют синергично, усиливая ответы против патогенов. 27 В противовес этой петле положительной обратной связи провоспалительной передачи сигналов, активированные PAMP альвеолярные макрофаги секретируют IL-27. 29 который обладает мощным противовоспалительным действием, включая блокирование секреции IL-17 клетками Th27 и индукцию иммуномодулирующих рецепторов на эффекторных Т-клетках и Т-регуляторных клетках, что приводит к секреции противовоспалительного IL-10.30 Кроме того, активированные iTr35Tregs (iTr35) секретируют родственный цитокин IL-35, который обладает мощными противовоспалительными свойствами, опосредованными ингибированием пролиферации Т-клеток. 31 год
Поддержание структурной интеграции ткани поддерживает регенерацию
Параллельно с местным иммунным ответом клетки ткани стимулируются к секреции компонентов внеклеточного матрикса и протеаз, необходимых для его ремоделирования. Клетки пролиферируют и / или дифференцируются, и, наконец, избыточные клетки подвергаются апоптозу в ответ на снижение локальных уровней факторов роста, 32 что привело к реформированию предыдущей архитектуры ткани.Регенерация ткани зависит от поступления клеток из соседних здоровых тканей или популяций клеток-предшественников. Вероятность того, что такие клетки доступны, частично связана с уровнем повреждений, естественным течением и, возможно, возрастом человека. 33 Если стимулы, инициирующие исцеляющую микросреду, не уменьшаются, клеточные ответы продолжаются, и это поддерживает активацию и дифференцировку миофибробластов. 34 Следовательно, преобладают процессы репарации, и поврежденная ткань замещается преимущественно фиброзной рубцовой тканью.
Регенерация после острого, но ограниченного повреждения
В легких эпителиальная выстилка дыхательных путей очень чувствительна к повреждению от инфекций, передающихся воздушно-капельным путем, раздражителей или переносимых по воздуху токсинов. Эти накладки легко регенерируются после поверхностного повреждения, которое не разрушило нижележащую структуру ткани и внеклеточный матрикс. В легких острое повреждение эпителия может стимулировать эффективную регенеративную реакцию, обусловленную пролиферативными ответами со стороны здорового соседнего эпителия.35 год , 36
Важность, которую ремоделирование тканей играет во время эффективного процесса регенерации, показано в исследовании Шиллера и его коллег. 37 В этом исследовании измерялась динамика внеклеточных компонентов от момента повреждения легких, вызванного блеомицином, временного фиброзного восстановления через 2 недели до регенерации легких через 4–8 недель. Блеомицин — это молекула бактериального происхождения, токсичность которой связана с селективным ингибированием синтеза нуклеиновых кислот и которая вызывает гибель ряда типов эпителиальных клеток, включая AEC1, AEC II, Club-клетки и эндотелиальные клетки, в первые 7 дней после воздействия.В результате связанного с блеомицином повреждения клеток в оставшейся ткани происходит большое количество изменений, и, в частности, некоторые белки внеклеточного матрикса, такие как Emilin2, который взаимодействует с эластином, становятся сильно регулируемыми.
Считается, что во время эффективной регенерации легких базальная мембрана, лежащая под слоями эпителиальных и эндотелиальных клеток, имеет решающее значение для поддержки миграции стволовых клеток в поврежденную область за счет обеспечения каркаса. 38 и способность концентрировать паракринные секретируемые биоактивные молекулы.39
На 3 день, который соответствует пику воспалительной реакции после лечения блеомицином, наблюдается значительная активация секретируемого ингибитора эластазы нейтрофилов, α2-макроглобулина и ряда ингибиторов сериновых протеаз (серпинов), 37 необходимо для контроля степени опосредованного протеазой повреждения структур, таких как базальная мембрана. Точно так же есть данные об усиленной экспрессии протеогликановых молекул декорина и бигликана. Эти молекулы связываются с коллагеном I и могут секвестрировать секретируемый TGF-β, снижая его сигнальную активность и уровень фиброгенеза.37 , 40 Присутствие декорина и бигликана может влиять на связывание фибробластов, что инициирует внутриклеточную передачу сигналов для путей, связанных с миграцией, таких как Rac1 и RhoA, и, таким образом, способствует миграции клеток. 41 год Редкость декорина из-за снижения продукции фибробластов связана с хронической воспалительной средой, связанной с тяжелой эмфиземой. 42 Исследования in vitro показали, что мРНК декорина может быть увеличена кортикостероидом, дексаметазоном (Dex), в то время как мРНК бигликана увеличивается при лечении транс-ретиноевой кислотой (ATRA).43 год
Восстановление легких после нарушения структуры ткани
В условиях хронического воспаления продолжающееся рекрутирование, активация и дегрануляция нейтрофилов приводит к повреждению ткани, опосредованному протеазами, включая эластазу, которая переваривает белки внеклеточного матрикса и может нарушить структуру, обеспечиваемую легким путем базальная мембрана, лежащая в основе альвеолярного эпителия. Когда структурная целостность легкого нарушена, процессы восстановления преобладают над регенерацией.Это проиллюстрировано в элегантном исследовании с использованием модели хронического повреждения легких эластазой, где степень повреждения легкого титровалась с помощью 4 последовательных еженедельных низких доз панкреатической свиной эластазы (PPE). 44 После одной инстилляции эластазы не наблюдалось значительного снижения содержания эластина в альвеолярных перегородках, но наблюдался значительный инфильтрат мононуклеарных клеток в паренхиму легких. Вторая установка привела к структурной деформации альвеол и снижению содержания эластина в альвеолярных перегородках.Однако только после третьей инстилляции эластазы, которая еще больше снизила содержание эластина в альвеолярных перегородках, были обнаружены признаки фиброза, о чем свидетельствовало усиление окрашивания на содержание коллагеновых волокон в альвеолах и мелких дыхательных путях.
Недавние сравнения сходств и различий повреждающего действия кремнезема, блеомицина и параквата на животных моделях позволяют предположить, что эти агенты повреждают легкие разными и характерными способами. 45 На мышиной модели всасывание всех этих агентов из глотки инициировало воспалительную реакцию, пик которой достигался на 7-й день после лечения.Хотя гистопатология и генетический анализ продемонстрировали много схожих характеристик между тремя повреждающими молекулами, существуют явные различия с точки зрения природы гистопатологии, степени иммунного вовлечения, уровня и типа клеточного повреждения, уровня генов, связанных с модификацией ВКМ, и интересных различных наборов генов. хемокины. 45 Большое количество уникальных иммунно-ассоциированных генов, активируемых после воздействия кремнезема, может иметь важные корреляты для воздействия кремнезема на людей, где у некоторых пациентов были зарегистрированы признаки аутоиммунного заболевания, а также фиброза.46 , 47 Хотя кажется, что существуют общие причины ранних пролиферативных и воспалительных реакций, возникающих после повреждения легких, отдельные генетические ответы, выявленные после различных типов повреждений, предполагают, что необходимо исследовать терапевтические цели, связанные с повреждением.
Хроническое заболевание легких возникает в результате нерегулируемых процессов восстановления
Последствия длительных или повторяющихся периодов инфекции, раздражителей или токсинов могут вызвать состояние хронического воспаления, тканевой среды, в которой происходят процессы восстановления, которые заменяют нормальную структуру ткани фиброзной тканью. предпочтительнее регенерации тканей.Если таким образом поражаются несколько областей легкого, функция легких постепенно и необратимо ухудшается.
Структурные характеристики легких приводят к динамическим и отчетливым экологическим и механическим свойствам, которые меняются по вентиляционному дереву от трахеи до концевых альвеол. Понимание дифференциальной восприимчивости структур легких было получено путем интеграции физиологических измерений внутридыхательного давления. 48 и ультраструктурный анализ, изначально предоставленный стереологией 49 , 50 и совсем недавно с помощью исследований с помощью микрокомпьютерной томографии (мкКТ).51 Такие исследования способствовали разработке моделей, которые предсказывают, что проникновение частиц в легкие связано с их размером и скоростью воздушного потока. Ряд экспериментальных и математических моделей подчеркивает, что осаждение частиц распределяется неравномерно, а место пика расположения смещается от дистальных областей легких к проксимальным областям с поверхностной дозой, которая намного выше в проводящих дыхательных путях, чем в альвеолах. 52 , 53 Учитывая, что сопротивление дыхательных путей и количество дыхательных путей увеличиваются с каждым уровнем разветвления и сужением диаметра дыхательных путей, Hogg et al .предположили, что небольшие дыхательные пути подвержены повреждению частицами, которое предшествует коллапсу терминальных бронхиол, что приводит к опасному для жизни увеличению сопротивления дыхательных путей, характерному для патологического прогрессирования хронической обструктивной болезни легких (ХОБЛ). 54 Наличие маркеров клеточного старения в популяциях клеток легких пациентов с ХОБЛ согласуется с подавляющей репаративной способностью легких в ответ на продолжающийся стресс и травмы. 55
Напротив, заболевания легких, такие как фиброз легких, по-видимому, не связаны преимущественно с повреждением частицами и последующим хроническим воспалением и нечувствительны к противовоспалительному лечению.56 Скорее, они характеризуются гетерогенным паттерном прогрессирующих структурных изменений легких, опосредованных изменением регуляции или функции фибробластов легких. Очаги пролиферирующих фибробластов характерны для IPF и, как полагают, отражают повреждение альвеолярных эпителиальных клеток и последующий коллапс дистального воздушного пространства. 57 год Несмотря на то, что ряд воздействий, включая курение, считаются независимыми факторами риска ИЛФ, причинный агент (ы) не идентифицирован. В недавнем исследовании было обнаружено, что все обследованные пациенты с IPF показали сверхэкспрессию гликопротеина муцина 5b. 58 натолкнул на мысль, что аберрантный мукоцилиарный клиренс может способствовать изменению микробиома легких. 59 причинение вреда из-за врожденных иммунных реакций, поддерживающих развитие IPF.Обнаружение повышенной легочной экспрессии в небольшой группе пациентов IPS IL25, который является профиброзным в моделях на животных и выделяется местными популяциями клеток ILC2, согласуется с этой гипотезой. 60
Терапевтические подходы для модуляции повреждения / усиления регенерации вместо восстановления
Текущие и предлагаемые терапевтические подходы для остановки хронического повреждения легких включают уменьшение воспаления легких, при этом наиболее распространенные схемы лечения направлены на широкое снижение провоспалительной передачи сигналов за счет использования ингаляционных кортикостероидов .Однако, как обсуждалось выше, современные противовоспалительные подходы неэффективны при лечении ИЛФ. Иллюстрация того, как лечение кортикостероидами может иметь нежелательные негативные эффекты на поврежденное легкое, представлена в недавнем исследовании, в котором оценивалась способность лечения Dex улучшать исход после повреждения легких, вызванного блеомицином. Это исследование показало, что у мышей, получавших Dex, наблюдалось снижение концентрации фактора некроза опухоли (TNF) -α в жидкости лаважа; однако значительного снижения числа нейтрофилов у мышей, получавших Dex, не наблюдалось.Кроме того, культуры первичных альвеолярных эпителиальных клеток, обработанных Dex, показали замедленную и дозозависимую более низкую скорость восстановления, чем культуры, обработанные контрольным физиологическим раствором. 61
Существуют важные клинические проблемы, связанные с эффективностью этих схем лечения у людей, включая развитие стероидорезистентного воспаления. 62 что связано с обострениями аллергической астмы с накоплением нейтрофилов. Считается, что развитие устойчивости к противовоспалительным кортикостероидам является многофакторным, включая высокие уровни провоспалительного действия, обеспечиваемые повышенной экспрессией провоспалительного цитокинового фактора ингибирования миграции макрофагов (MIF), чрезмерной активацией митоген-активированного белка ( MAP) киназных путей, которые подавляют подавляющий эффект глюкокортикоидного рецептора связывающего элемента ответа циклического АМФ белка (CBP) и нарушение ядерного рекрутирования гистондеацетилазы-2 (HDAC2), что опять же, как правило, действует для подавления экспрессии про -Воспалительные гены.63 , 64 , 65
Нацеленность на воспалительный каскад для лечения заболеваний легких
Идентификация DAMP и PAMP как молекул, критически важных для инициирования и поддержания воспаления, побудила доклинические исследования для оценки эффективности блокады DAMP / PAMP в разрешении воспаления. Хотя технически это не является DAMP, IL-1β является важной частью сигнальной амплификации, которая следует за активацией DAMP или PAMP комплекса инфламмасом. Существует три типа реагентов, нацеленных на IL-1, которые были оценены на противовоспалительную активность в контексте заболеваний легких: анакинра является антагонистом рецептора IL-1, 66 MEDI8968 представляет собой гуманизированное антитело против IL-1R, а канакинумаб представляет собой блокирующее антитело против IL-1β.Хотя эти подходы успешно использовались на мышиных моделях для уменьшения воспаления, связанного с IL-1, и несмотря на то, что канакинумаб и анакинра показали эффективность в лечении редкого воспалительного заболевания, начинающегося у взрослых, болезнь Стилла, 67 в клинических испытаниях пациентов с ХОБЛ, принимавших канакинумаб, не было обнаружено улучшенных показателей функции легких. 68 или MEDI8968. 69 О недавно завершенных клинических испытаниях по оценке эффективности канакинумаба при лечении легочного саркоидоза еще не сообщалось. 70 в то время как предлагается исследование для оценки эффективности анакинры при лечении муковисцидоза.71
Цитокин IL-5 является современной противовоспалительной терапевтической мишенью и был обнаружен в биоптатах бронхов легких у астматиков. 72 в котором антиген-специфические CD4 Т-клетки ответственны за его секрецию. 73 Поскольку IL-5 может мобилизовать эозинофилы из пула костного мозга, 74 его регулирование считается критическим. Экспериментальные доказательства центральной роли IL-5 обеспечиваются защитой мышей, у которых отсутствует ген IL-5, от антиген-зависимых моделей аллергического заболевания дыхательных путей. 75 Эти многообещающие исследования побудили к клиническим испытаниям, направленным на нейтрализацию активности IL-5 в контексте острого заболевания дыхательных путей.Недавний метаанализ, охватывающий использование лечения против IL-5, меполизумаба, пришел к выводу, что при правильном нацеливании на лечение пациентов с тяжелой эозинофильной астмой это лечение значительно снижает общее количество обострений на пациента, а также количество обострений. обострений, требующих госпитализации.
Другие реагенты, оцениваемые для лечения заболеваний легких, включают тоцилизумаб, гуманизированное моноклональное антитело, которое блокирует активность рецептора интерлейкина-6 (IL-6R).Этот реагент был опробован в контексте интерстициального заболевания легких (ILD), которое связано с системным склерозом у пациентов с диагнозом менее 2 лет. 76 Пациенты, получавшие тоцилизумаб, показали сохраненную функцию легких по сравнению с пациентами, получавшими плацебо. В небольшом внеплановом исследовании, посвященном лечению пациентов с прогрессирующим заболеванием и не прошедшим другие виды иммунотерапевтического лечения, 4 из 9 показали стабилизацию заболевания. 77
Многочисленные исследования на животных продемонстрировали роль цитокинов семейства IL-17 в воспалительном заболевании легких и блокирование IL-17a. 78 или IL-17e, также известный как IL-25 79 уменьшает патологию легких.Кроме того, было показано, что ингибиторы фосфоинозитид-3-киназ (PI3K), которые активируются после передачи сигналов IL-25, эффективны в снижении астмы, такой как гиперчувствительность дыхательных путей и воспаление дыхательных путей. 80 Гуманизированное антитело против ИЛ-17а, секукинумаб, которое успешно применялось для лечения псориаза, безуспешно испытывалось в когорте кортикостероидорезистентных астматиков. 81 год
В целом, неспособность продемонстрировать улучшенные результаты после лечения биологическими препаратами, направленными против ряда воспалительных цитокинов, обескураживает, но с учетом эффективности таких подходов в лечении других воспалительных состояний, а затем дополнительных подходов к дозированию или, возможно, многоцелевых биопрепаратов 82 может привести к эффективному лечению заболеваний легких человека.
Как описано выше, легкие обладают способностью к регенерации, особенно эпителий легких, процесс, который зависит от выживания подходящих клеток-предшественников, расположенных на жизнеспособном расстоянии от места повреждения. Недавнее отслеживание клонов судьбы альвеолярных клеток-предшественников у мышей описывает продолжающееся, но нечастое образование новых альвеолярных единиц, при этом клетки ATII действуют как предшественники для клеток ATI. 38 (Фигура ). После специфического повреждения ATI гипероксигенацией большое количество клеток ATII способствует обновлению популяции ATI.Важно отметить, что авт. Обнаружили интактный компартмент ATII как у молодых, так и у старых мышей. 33 Фенотип дополнительных клеток-предшественников определялся различными поверхностными маркерами, включая бронхоальвеолярные стволовые клетки (BASC) в соединениях бронхоальвеолярных протоков, мультипотентные эпителиальные стволовые / предшественники. 83 и клетки-предшественники, отрицательные по клону, которые размножаются после повреждения. Вклад мезенхимальных стромальных клеток в RLG не выяснен, хотя McQualter продемонстрировал доказательства того, что пролиферация эпителиальных стволовых / предшественников клеток зависит от факторов роста, высвобождаемых резидентными мезенхимальными стромальными клетками во взрослом легком.83 Недавнее исследование показало, что мезенхимальные стромальные клетки от старых мышей слабо пролиферируют в ответ на пневмонэктомию по сравнению с молодыми мышами. 33 Более того, новая альвеоляризация требует образования новых перегородок, управляемых альфа-гладкомышечным актином + интерстициальных миофибробластов, которые происходят из субпопуляции тромбоцитов фактора роста-альфа + фибробластов, которые отвечают на рецептор-γ, активированный пролифератором пероксисом. (PPAR ‐ γ). 84 Кроме того, есть доказательства того, что клетки костного мозга вносят вклад в RLG.85 Иммунные клетки, такие как альвеолярные макрофаги, являются потенциальными источниками факторов роста и протеаз, которые могут иметь решающее значение для ремоделирования тканей. Таким образом, вполне вероятно, что клетки-предшественники, резидентные и инфильтрирующие клетки необходимы для успешной регенерации легких, и дефекты в любой из этих популяций могут ограничивать регенеративный потенциал.
Локализация предшественников эпителиальных клеток, которые способствуют неоальвеоляризации. Исследования по отслеживанию клонов выявили новую роль клеток-предшественников дыхательных путей в восстановлении и регенерации альвеол.38 CCSP + клубные клетки могут самообновляться и давать реснитчатые клетки для восстановления дыхательных путей. Клетки клуба, характеризующиеся экспрессией CYP2F2, могут дифференцироваться в клетки AECII и AECI. Клетки клуба с низкой экспрессией CYP2F2 (вариантные клетки клуба, расположенные рядом с нейроэндокринными телами) устойчивы к повреждениям, вызванным нафталином, и помогают регенерировать обнаженные дыхательные пути и альвеолярные области. Активация предшественников p63 + после инфицирования вирусом гриппа h2N1 дает стручки p63 + / KRT5 + , которые могут мигрировать из эпителия дистальных отделов дыхательных путей в оголенные альвеолярные области для участия в неоальвеоляризации.BASCs, расположенные в соединении бронхоальвеолярных протоков, могут дифференцироваться на клетки клубов дыхательных путей и AECIIs. SP ‐ C + Клетки, продуцирующие сурфактант AECII, считаются классическими предшественниками AECI; однако вариант AECII, характеризующийся экспрессией SP-C — / α6β4 + , представляет собой дополнительный источник AECII и AECI. AECI, которые покрывают 90% альвеолярного эпителия, считаются терминально дифференцированными и характеризуются экспрессией AQP5, PDPN, HOPX и AGER.Пластичность AEC1s была продемонстрирована с помощью методов отслеживания клонов, которые показали, что AECI HOPX + / Igfbp2 — могут дифференцироваться от AECIIs. 38
Демонстрация плюрипотентности мезенхимальных стволовых клеток (МСК) естественным образом подтолкнула к предположению, что они могут играть отдельно друг от друга в регенеративных процессах. В многочисленных исследованиях было показано, что адоптивная трансплантация МСК оказывает прорегенеративное и противовоспалительное действие, часто когда они накапливаются в тканях легких.Например, адоптивно перенесенные МСК показали положительные преимущества в контексте вызванного блеомицином повреждения легких у мышей, 86 эффект, приписываемый продукции антагониста рецептора IL-1 МСК. Общей особенностью, описанной во многих протоколах адаптивной передачи MSC, является низкая частота и долговечность MSC, которые обнаруживаются более чем через 1 день после передачи. Дальнейшие исследования in vitro и продемонстрировали, что экзосомы, которые представляют собой небольшие мембранные везикулы, содержащие смешанные концентрации цитоплазматических молекул, высвобождаются из культивированных MSC, полученных из жировой ткани.Эти экзосомы содержат и экспрессируют альфа-1-антитрипсин на своей поверхности, 87 молекула, которая сильно ингибирует активность протеазы. Было продемонстрировано, что эти экзосомы проявляют антиэластазную активность и обеспечивают доказательство концепции бесклеточных систем доставки, которые могут использоваться для подавления модуляции протеаз, активных в местах хронического воспаления.
В других исследованиях изучалась эффективность лечения повреждений легких всей транс-ретиноевой кислотой (ATRA), учитывая, что она имеет структурную связь с витамином А и, как было показано, участвует в развитии легких.88 В ряде исследований опубликованы улучшенные результаты с использованием ATRA после повреждения легких, вызванного эластазой, у крыс и мышей. 89 , 90 Недавно Такеда и др. . 91 продемонстрировали потенциальное усиление эффекта восстановительного адоптивного переноса МСК в легкое мыши, поврежденное эластазой, путем одновременного системного лечения с помощью ATRA. Они описали, что MCS вызывал синергетический восстановительный ответ, который включал уменьшение среднего линейного расстояния пересечения, увеличение податливости легкого и увеличение площади поверхности легкого.Авторы представили доказательства того, что мишень млекопитающих для функции рапамицина (mTor), связанная с активностью киназы кофактора S6k1, имеет решающее значение для восстановительного эффекта и что синергизм с ATRA блокируется, когда функция mTor ингибируется препаратом рапамицин.
Как обсуждалось ранее, провоспалительные медиаторы, выделяемые PAMP- и DAMP-активированными клетками, включают простагландины, которые действуют на эндотелиальные клетки, увеличивая местный кровоток, на местные нервы, вызывая боль, и влияют на функцию лейкоцитов, включая нейтрофилы.Ферменты циклооксигеназы (ЦОГ) -1 и 2 участвуют в биосинтезе простагландинов и являются мишенями нестероидных противовоспалительных ингибиторов, в том числе аспирина. Активация нейтрофилов простагландином-E 2 (PGE 2) вызывает переключение производства провоспалительного лейкотриена бета-4 (LTB 4 ) на молекулу липоксина, которая снижает дальнейшее рекрутирование нейтрофилов ( Фигура ). Производство других противовоспалительных молекул также было обнаружено в результате исследования модуляции биосинтеза жирных кислот во время воспаления (обзор Serhan et al .92 ), включая резольвины, протектины и марезины серий D и E. Эти молекулы образуются либо как прямые биохимические продукты путей биосинтеза полиненасыщенных жирных кислот, либо в ответ на блокирование активности циклооксигеназы такими молекулами, как аспирин. Исходным сырьем для этих молекул являются омега-3 жирные кислоты, и это дает механистическое объяснение связанных с ними преимуществ для здоровья диет, содержащих продукты, богатые этими липидами. 93 Возможность модуляции продукции этих молекул in vivo или их терапевтического использования только устанавливается, и имеются доказательства того, что лечение резольвином E1 может уменьшить воспаление легких в зависимости от апоптоза, 94 в то время как исследования, посвященные применению так называемого иммунного питания, демонстрируют некоторую клиническую эффективность в измеримом повышении уровней резолвина E1 в плазме и снижении уровней IL-6 в плазме.95
Переназначение биосинтеза простагландинов для создания факторов расслаивания ран. Незаметные, но глубокие изменения метаболизма различных жирных кислот прекурсоры возникают из-за изменения активности ферментов, таких как липоксигеназы и высвобождают противовоспалительные молекулы, такие как липоксины и резолвины, могут изменить баланс с провоспалительной среды на благоприятную для заживления. 15-HETE, 15-гидроксиэйкозатетраеновая кислота; 15-ЛО, 15-липоксигеназа; 5-ЛО, 5-липоксигеназа; АК, арахидоновая кислота; BLT1, рецептор лейкотриена; ЦОГ-2, циклооксигеназа 2; DHA, докозагексаеновая кислота; EPA, эйкозапентаеновая кислота; FPRL, рецептор формилпептида, подобный-1; LXA 4 , липоксин А4; LXB 4 , липоксин B4; Mϕ, макрофаг; Омега-3 жирные кислоты, содержащие омега-3 жирные кислоты; PGE 2 , простагландин E2.
Эти доклинические исследования дают надежду на то, что даже в сильно поврежденных легких функция может быть частично восстановлена, при этом ясно, что более глубокое понимание механизмов, лежащих в основе восстановления легких, еще не достигнуто.
Выводы
Задача перспективной помощи в восстановлении после повреждения легких и улучшения клинических исходов заключается в разработке методов лечения, которые улучшают регенеративные процессы, а не процессы восстановления. Как обсуждалось выше, управление воспалительной реакцией кажется ключом к этим улучшениям.Тогда можно было бы рассмотреть возможность применения анти-цитокиновых агентов, доступных в настоящее время в клинике, таких как анти-IL-1 и анти-IL-6, для модуляции острых воспалительных реакций с потенциальными преимуществами, уравновешенными другими клиническими факторами риска. Например, повышенный риск заражения можно снизить за счет совместного лечения с антипатогенными препаратами. Дальнейшее понимание масштабов и силы эндогенных противовоспалительных молекул, таких как резольвиноподобные молекулы, эффективность которых может зависеть от диеты, может положительно повлиять на потенциал заживления легких на популяционном уровне.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
JY был поддержан международной стипендией для аспирантов Университета Мердока. Авторы выражают признательность покойному профессору Джеффри Лорану за наставничество.
Список литературы
2. Arcavi L, Benowitz NL. Курение сигарет и инфекция. Arch Intern Med 2004; 164: 2206–2216. [PubMed] [Google Scholar] 3. Принц Л.Р., Уайт МК, Сабро I, Паркер Л.С. Роль TLR в активации нейтрофилов.Curr Opin Pharmacol 2011; 11: 397–403. [PubMed] [Google Scholar] 4. Элсон Д.А., Райан Х.Э., Сноу Д.В., Джонсон Р., Арбейт Дж. М.. Координированная активация генов-мишеней фактора, индуцируемого гипоксией (HIF) -1альфа и HIF-1, во время многоступенчатого эпидермального канцерогенеза и заживления ран. Рак Res 2000; 60: 6189–6195. [PubMed] [Google Scholar] 5. Исии Й, Ито К., Моришима Й и др. Фактор транскрипции Nrf2 играет ключевую роль в защите от вызванного эластазой воспаления легких и эмфиземы.J Immunol 2005; 175: 6968–6975. [PubMed] [Google Scholar] 6. Пак Джей, Ким Д.Х., Шах С.Р. и др. Подобное переключателю усиление эпителиально-мезенхимального перехода с помощью YAP посредством регуляции обратной связи WT1 и GTPases семейства Rho. Nat Commun 2019; 10: 2797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Stone RC, Pastar I, Ojeh N и др. Эпителиально-мезенхимальный переход при восстановлении тканей и фиброзе. Клеточная ткань Res 2016; 365: 495–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8.Гарт Дж., Барнс Дж. В., Крик С. Ориентация на цитокины как развивающиеся стратегии лечения хронических воспалительных заболеваний дыхательных путей. Int J Mol Sci 2018; 19: 3402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Мацуо Р., Охкохти Н., Мурата С. и др. Тромбоциты сильно индуцируют пролиферацию гепатоцитов с помощью IGF-1 и HGF in vitro . J Surg Res 2008; 145: 279–286. [PubMed] [Google Scholar] 11. Serhan CN. Фаза разрешения воспаления: новые эндогенные противовоспалительные и пролонгирующие липидные медиаторы и пути.Анну Рев Иммунол 2007; 25: 101–137. [PubMed] [Google Scholar] 12. Лайонс-Джордано Б., Пратта М.А., Гэлбрейт В., Дэвис Г.Л., Арнер Э.С. Интерлейкин-1 дифференциально модулирует хондроцитарную экспрессию циклооксигеназы-2 и фосфолипазы А2. Exp Cell Res 1993; 206: 58–62. [PubMed] [Google Scholar] 13. Жорж К., Азулай Э, Мокарт Д. и др. Влияние нейтропении на смертность больных раком в критическом состоянии: результаты метаанализа индивидуальных данных. Crit Care 2018; 22: 326. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15.Свенсон Дж. А., Хоппе А. Д.. Координация передачи сигналов во время фагоцитоза, опосредованного Fc-рецептором. J Leukoc Biol 2004; 76: 1093–1103. [PubMed] [Google Scholar] 16. Чжоу MJ, Браун EJ. CR3 (Mac-1, альфа M бета 2, CD11b / CD18) и Fc гамма RIII взаимодействуют в генерации респираторного выброса нейтрофилов: потребность в Fc гамма RIII и фосфорилировании тирозина. J Cell Biol 1994; 125: 1407–1416. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Пигната К., Прасад К.В., Робертсон М.Дж., Левин Х., Радд С.Е., Ритц Дж.Передача сигналов, опосредованная Fc gamma RIIIA, включает lck семейства src в естественных клетках-киллерах человека. J Immunol 1993; 151: 6794–6800. [PubMed] [Google Scholar] 18. Kinet JP. Рецептор IgE с высоким сродством (Fc epsilon RI): от физиологии к патологии. Анну Рев Иммунол 1999; 17: 931–972. [PubMed] [Google Scholar] 19. Хассел Т., Белл Т.Дж. Альвеолярные макрофаги: пластичность в тканевом контексте. Нат Рев Иммунол 2014; 14: 81–93. [PubMed] [Google Scholar] 20. Копф М, Шнайдер С, Нобс С.П. Развитие и функция резидентных в легких макрофагов и дендритных клеток.Нат Иммунол 2015; 16: 36–44. [PubMed] [Google Scholar] 21. Хоган Р.Дж., Чжун В., Ушервуд Э.Дж., Кукенхэм Т., Робертс А.Д., Вудленд Д.Л. Защита от респираторных вирусных инфекций может быть обеспечена антиген-специфическими CD4 + Т-клетками, которые сохраняются в легких. J Exp Med 2001; 193: 981–986. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Бринкманн В., Райхард Ю., Гусманн С. и др. Внеклеточные ловушки нейтрофилов убивают бактерии. Наука 2004; 303: 1532–1535. [PubMed] [Google Scholar] 23.Холт П.Г., Стрикленд Д.Х., Викстром Мэн, Янсен Флорида. Регуляция иммунологического гомеостаза в дыхательных путях. Нат Рев Иммунол 2008; 8: 142–152. [PubMed] [Google Scholar] 24. Hsieh CS, Macatonia SE, Tripp CS, Wolf SF, O’Garra A, Murphy KM. Развитие Th2CD4 + T-клеток посредством IL-12, продуцируемого Listeria-индуцированными макрофагами. Наука 1993; 260: 547–549. [PubMed] [Google Scholar] 25. Welsby I, Goriely S. Регулирование экспрессии интерлейкина-23 при здоровье и болезни.Adv Exp Med Biol 2016; 941: 167–189. [PubMed] [Google Scholar] 26. Куа DJ, Шерлок Джей, Чен И и др. Интерлейкин-23, а не интерлейкин-12, является критическим цитокином для аутоиммунного воспаления головного мозга. Природа 2003; 421: 744–748. [PubMed] [Google Scholar] 27. Ауйла С.Дж., Чан Ю.Р., Чжэн М. и др. IL-22 обеспечивает защиту слизистой оболочки хозяина от грамотрицательной бактериальной пневмонии. Нат Мед 2008; 14: 275–281. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Фумагалли С., Торри А., Папанья А., Читтерио С., Майнольди Ф, Фоти М.IL-22 быстро индуцируется стимуляцией рецепторов распознавания патогенов в дендритных клетках костного мозга в отсутствие IL-23. Научный представитель 2016; 6: 33900. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мати С.А., Диксон К.Л., Уокер С.А. и др. Альвеолярные макрофаги являются стражами легочного гомеостаза мыши после заражения ингаляционным антигеном. Аллергия 2015; 70: 80–89. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Делонг Дж. Х., О’Хара Холл А, Рауш М. и др. Стимуляция IL-27 и TCR способствуют экспрессии множественных ингибирующих рецепторов Т-клетками.Иммунохоризонты 2019; 3: 13–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Коллисон Л. В., Чатурведи В., Хендерсон А. Л. и др. ИЛ-35-опосредованная индукция мощной регуляторной популяции Т-клеток. Нат Иммунол 2010; 11: 1093–1101. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Кулашекаран П., Скавон Калифорния, Роджерс Д.С., Аренберг Д.А., Танникал В.Дж., Горовиц Дж.С. Эндотелин-1 и трансформирующий фактор роста-бета1 независимо индуцируют устойчивость фибробластов к апоптозу через активацию AKT. Am J Respir Cell Mol Biol 2009; 41: 484–493.[Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Паксон Дж. А., Грунтман А. М., Дэвис А. М., Паркин С. М., Ингенито Е. П., Хоффман А. М.. Возрастная зависимость динамики мезенхимальных стромальных клеток легких после пневмонэктомии. Stem Cells Dev. 2013; 22: 3214–3225. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ли CC, Ван CN, Ли Ю.Л., Цай Ю.Р., Лю Дж.Дж. Блок 1 группы с высокой подвижностью индуцировал дифференцировку миофибробластов легких человека и усиленную миграцию за счет активации MMP-9. PLoS One 2015; 10: e0116393. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35.Giangreco A, Arwert EN, Rosewell IR, Snyder J, Watt FM, Stripp BR. Стволовые клетки незаменимы для гомеостаза легких, но восстанавливают дыхательные пути после травмы. Proc Natl Acad Sci USA 2009; 106: 9286–9291. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Рок JR, Баркаускас CE, Cronce MJ и др. Множественные популяции стромы способствуют легочному фиброзу без доказательств перехода эпителия в мезенхиму. Proc Natl Acad Sci USA 2011; 108: E1475 – E1483. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Шиллер Х. Б., Фернандес И. Е., Бургшталлер Г. и др. Протеомное профилирование внеклеточной ниши с разрешением по времени и компартментам при повреждении и восстановлении легких. Мол Сист Биол 2015; 11: 819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Десаи Т.Дж., Браунфилд Д.Г., Краснов М.А. Альвеолярные клетки-предшественники и стволовые клетки в развитии, обновлении и раке легких. Природа 2014; 507: 190–194. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Дин БС, Нолан Диджей, Го П и др. Ангиокринные сигналы, полученные из эндотелия, вызывают и поддерживают регенеративную альвеоляризацию легких.Клетка 2011; 147: 539–553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Kolb M, Margetts PJ, Sime PJ, Gauldie J. Протеогликаны, декорин и бигликан по-разному модулируют опосредованные TGF-бета фиброзные ответы в легких. Am J Physiol Lung Cell Mol Physiol 2001; 280: L1327 – L1334. [PubMed] [Google Scholar] 41. Tufvesson E, Westergren-Thorsson G. Бигликан и декорин вызывают морфологические и цитоскелетные изменения, включая передачу сигналов малыми GTPasesRhoA и Rac1, что приводит к миграции фибробластов легких.J Cell Sci 2003; 116: 4857–4864. [PubMed] [Google Scholar] 42. Нордхук Дж.А., Постма Д.С., Чонг Л.Л. и др. Различная модуляция продукции декорина фибробластами легких у пациентов с легкой и тяжелой эмфиземой. ХОБЛ 2005; 2: 17–25. [PubMed] [Google Scholar] 43. Кахари В.М., Хаккинен Л., Вестермарк Дж., Ларджава Х. Дифференциальная регуляция экспрессии гена декорина и бигликана дексаметазоном и ретиноевой кислотой в культивируемых фибробластах кожи человека. J Invest Dermatol 1995; 104: 503–508. [PubMed] [Google Scholar] 44.Оливейра М.В., Абреу СК, Падилья Г.А. и др. Характеристика модели эмфиземы на мышах, вызванной множественными инстилляциями низкой дозы эластазы. Front Physiol 2016; 7: 457. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Dong J, Yu X, Porter DW, Battelli LA, Kashon ML, Ma Q. Общие и отдельные механизмы индуцированного легочного фиброза твердыми частицами и растворимыми химическими фиброгенными агентами. Arch Toxicol 2016; 90: 385–402. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Миллер Ф. В., Альфредссон Л., Костенбадер К. Х. и др. Эпидемиология воздействия окружающей среды и аутоиммунных заболеваний человека: результаты семинара экспертной группы Национального института наук об окружающей среде.J Аутоиммунный 2012; 39: 259–271. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Янаи М., Секизава К., Охруи Т., Сасаки Х., Такисима Т. Место обструкции дыхательных путей при легочной болезни: прямое измерение внутрибронхиального давления. J Appl Physiol 1992; 72: 1016–1023. [PubMed] [Google Scholar] 49. Weibel ER. Принципы и методы морфометрического исследования легкого и других органов. Лаборатория Инвест 1963; 12: 131–155. [PubMed] [Google Scholar] 50. Хорсфилд К., Камминг Г. Морфология бронхиального дерева у человека.J Appl Physiol 1968; 24: 373–383. [PubMed] [Google Scholar] 51. McDonough JE, Yuan R, Suzuki M и др. Обструкция мелких дыхательных путей и эмфизема легких при хронической обструктивной болезни легких. N Engl J Med 2011; 365: 1567–1575. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Ю. П., Диу СК. Общее и региональное выпадение вдыхаемых аэрозолей на человека. J Aerosol Sci 1983; 14: 599–609. [Google Scholar] 53. Ким С.С., Ху СК, ДеВитт П., Джеррити Т.Р. Оценка регионального отложения вдыхаемых частиц в легких человека методом серийной болюсной доставки.J Appl Physiol (1985). 1996; 81: 2203–2213. [PubMed] [Google Scholar] 54. Hogg JC, McDonough JE, Suzuki M. Малая обструкция дыхательных путей при ХОБЛ: новые идеи, основанные на изображениях микро-КТ и МРТ. Грудь 2013; 143: 1436–1443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Мюллер К.С., Велкер Л., Пааш К. и др. Фибробласты легких пациентов с эмфиземой обнаруживают маркеры старения in vitro . Respir Res 2006; 7: 32. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. RyuJH Colby TV, Hartman TE, Vassallo R.Интерстициальные заболевания легких, связанные с курением: краткий обзор. Eur Respir J 2001; 17: 122–132. [PubMed] [Google Scholar] 57. Каспер М., Хароске Г. Изменения в альвеолярном эпителии после травмы, приводящие к фиброзу легких. Гистол гистопатол 1996; 11: 463–483. [PubMed] [Google Scholar] 58. Сейболд М.А., Мудрый А.Л., Шпир М.С. и др. Обычный полиморфизм промотора MUC5B и фиброз легких. N Engl J Med 2011; 364: 1503–1512. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Molyneaux PL, Cox MJ, Willis ‐ Owen SA и др. Роль бактерий в патогенезе и прогрессировании идиопатического фиброза легких.Am J Respir Crit Care Med 2014; 190: 906–913. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Хэмс Э., Армстронг МЭ, Барлоу Дж.Л. и др. IL-25 и врожденные лимфоидные клетки 2-го типа вызывают фиброз легких. Proc Natl Acad Sci USA 2014; 111: 367–372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Обен Вега М., Чупен К., Паскариу М. и др. Дексаметазон не может улучшить вызванное блеомицином острое повреждение легких у мышей. Physiol Rep 2019; 7: e14253. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.Чармандари Э, Кино Т, Итиджо Т, Хрусос ГП. Общая резистентность к глюкокортикоидам: клинические аспекты, молекулярные механизмы и последствия редкого генетического нарушения. J Clin Endocrinol Metab 2008; 93: 1563–1572. [Бесплатная статья PMC] [PubMed] [Google Scholar] 63. Donnelly SC, Bucala R. Фактор ингибирования миграции макрофагов: регулятор активности глюкокортикоидов с критической ролью в воспалительном заболевании. Мол Мед сегодня 1997; 3: 502–507. [PubMed] [Google Scholar] 64. Барнс П.Дж., Адкок И.М. Устойчивость к глюкокортикоидам при воспалительных заболеваниях.Ланцет 2009; 373: 1905–1917. [PubMed] [Google Scholar] 65. Ито К., Герберт К., Зигл Дж. С. и др. Стероид-резистентное нейтрофильное воспаление на мышиной модели острого обострения астмы. Am J Resp Cell Mol 2008; 39: 543–550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Эрнандес М.Л., Миллс К, Миндаль М и др. Антагонист рецептора IL-1 снижает вызванное эндотоксином воспаление дыхательных путей у здоровых добровольцев. J Allergy Clin Immunol 2015; 135: 379–385. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.Galozzi P, Baggio C, Bindoli S, Oliviero F, Sfriso P. Развитие и роль в терапии канакинумаба при болезни, начинающейся у взрослых. Фронт Фармакол 2018; 9: 1074. [Бесплатная статья PMC] [PubMed] [Google Scholar] 69. Calverley PMA, Sethi S, Dawson M и др. Рандомизированное плацебо-контролируемое исследование моноклонального антитела MEDI8968 против рецептора 1 интерлейкина-1 при хронической обструктивной болезни легких. Resp Res 2017; 18: 153. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Хамид К., Аззави М., Инь С. и др. Экспрессия мРНК интерлейкина-5 в биоптатах слизистой оболочки бронхов от астмы.J Clin Invest 1991; 87: 1541–1546. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Хоган С.П., Коскинен А., Маттеи К.И., Янг И.Г., Фостер П.С. Т-клетки CD4 + , продуцирующие интерлейкин 5, играют ключевую роль в эозинофилии, вызванной аэроаллергеном, гиперреактивности бронхов и повреждении легких у мышей. Am J Respir Crit Care Med 1998; 157: 210–218. [PubMed] [Google Scholar] 74. Mold AW, Matthaei KI, Young IG, Foster PS. Связь между интерлейкином-5 и эотаксином в регуляции эозинофилии крови и тканей у мышей.J Clin Invest 1997; 99: 1064–1071. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Фостер П.С., Хоган С.П., Рамзи А.Дж., Маттеи К.И., Янг И.Г. Дефицит интерлейкина 5 устраняет эозинофилию, гиперреактивность дыхательных путей и повреждение легких на модели астмы у мышей. J Exp Med 1996; 183: 195–201. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Khanna D, Jahreis A, Lin CJF. Ответ на: Нарваез «Эффективность и безопасность тоцилизумаба для лечения рефрактерного системного склероза, связанного с интерстициальным заболеванием легких: серия случаев».Энн Рум Дис 2019; 78: e124. [PubMed] [Google Scholar] 77. Нарваез Дж., Л.Луч Дж., Алегри Санчо Дж. Дж., Молина-Молина М., Нолла Дж. М., Кастельви И. Эффективность и безопасность тоцилизумаба для лечения интерстициального заболевания легких, связанного с рефрактерным системным склерозом: серия случаев. Энн Рум Дис 2019; 78: e123. [PubMed] [Google Scholar] 78. Чиполла Э., Фишер А.Дж., Гу Х. и др. Дефицит IL-17A снижает вызванную блеомицином активацию комплемента во время фиброза легких. FASEB J 2017; 31: 5543–5556.[Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Баллантайн С.Дж., Барлоу Д.Л., Джолин Х.Э. и др. Блокирование IL-25 предотвращает гиперреактивность дыхательных путей при аллергической астме. J Allergy Clin Immunol 2007; 120: 1324–1331. [PubMed] [Google Scholar] 80. Хуан П, Ли И, Ур З и др. Комплексное ослабление индуцированной IL-25 гиперчувствительности дыхательных путей, воспаления и ремоделирования с помощью ингибитора PI3K LY294002. Респирология 2017; 22: 78–85. [PubMed] [Google Scholar] 82. Ван И, Ву Цю, Лю Цзинь и др. Рекомбинантные IgG-подобные биспецифические антитела, действующие как ингибитор интерлейкина-1бета и интерлейкина-17А, демонстрируют многообещающую эффективность при ревматоидном артрите.Biomed Pharmacother 2017; 89: 426–437. [PubMed] [Google Scholar] 83. McQualter JL, Yuen K, Williams B, Bertoncello I. Доказательства иерархии эпителиальных стволовых / предшественников в легких взрослых мышей. Proc Natl Acad Sci USA 2010; 107: 1414–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Чен Л., Аччиани Т., Ле Крас Т., Лутцко С., Perl AK. Динамическая регуляция экспрессии альфа-рецептора фактора роста тромбоцитов в альвеолярных фибробластах во время реальвеоляризации. Am J Resp Cell Mol 2012; 47: 517–527.[Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Шуга А., Уэда К., Такемото Ю. и др. Значительная роль клеток костного мозга в компенсаторном регенеративном росте легких. J Surg Res 2013; 183: 84–90. [PubMed] [Google Scholar] 86. Ортис Л.А., Дутрейл М., Фаттман С. и др. Антагонист рецептора интерлейкина 1 опосредует противовоспалительный и антифибротический эффект мезенхимальных стволовых клеток при повреждении легких. Proc Natl Acad Sci USA 2007; 104: 11002–11007. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87.Бари Э., Ферраротти I, Ди Сильвестр Д. и др. Жировые мезенхимальные внеклеточные везикулы как физиологические системы доставки альфа-1-антитрипсина для регенерации легких. Клетки 2019; 8: 965. [Бесплатная статья PMC] [PubMed] [Google Scholar] 89. Массаро Г.Д., Массаро Д. Лечение ретиноевой кислотой устраняет вызванную эластазой эмфизему легких у крыс. Нат Мед 1997; 3: 675–677. [PubMed] [Google Scholar] 90. Сейфарт C, Муйал JP, Плагенс А и др. Полностью транс-ретиноевая кислота приводит к нерегулярному восстановлению перегородок и не может подавлять провоспалительные макрофаги.Eur Respir J 2011; 38: 425–439. [PubMed] [Google Scholar] 91. Такеда К., Нин Ф., Доменико Дж. и др. Активация киназы p70S6-1 в мезенхимальных стволовых клетках важна для восстановления ткани легких. Стволовые клетки Transl Med 2018; 7: 551–558. [Бесплатная статья PMC] [PubMed] [Google Scholar] 92. Serhan CN, Levy BD. Резолвины в воспалении: появление про-разрешающего суперсемейства медиаторов. J Clin Invest 2018; 128: 2657–2669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Фарзан-Фар Р., Харрис В.С., Гарг С., На Б., Вули М.А.Обратная связь уровней жирных кислот n-3 в эритроцитах с воспалительными биомаркерами у пациентов со стабильной ишемической болезнью сердца: исследование сердца и души. Атеросклероз 2009; 205: 538–543. [Бесплатная статья PMC] [PubMed] [Google Scholar] 94. Эль Кебир Д., Гьорструп П., Филеп Дж. ResolvinE1 способствует апоптозу нейтрофилов, вызванному фагоцитозом, и ускоряет разрешение легочного воспаления. Proc Natl Acad Sci USA 2012; 109: 14983–14988. [Бесплатная статья PMC] [PubMed] [Google Scholar] 95. Uno H, Furukawa K, Suzuki D и др. Иммунное питание подавляет острые воспалительные реакции за счет модуляции резольвина E1 у пациентов, перенесших обширную резекцию гепатобилиарной системы.Операция 2016; 160: 228–236. [PubMed] [Google Scholar]Заживают ли легкие курильщиков после того, как они бросили курить?
Сигаретный дым может иметь самые разные последствия для здоровья, а легкие и дыхательные пути — две из наиболее пострадавших областей.
Но хорошая новость заключается в том, что после того, как человек бросит курить, легкие могут в определенной степени зажить, — сказал доктор Норман Эдельман, старший научный советник Американской ассоциации легких и специалист по легочной медицине.
Как только человек вдыхает химические вещества, содержащиеся в сигаретном дыме, нежная оболочка легких воспаляется и раздражается.В течение нескольких часов после курения крошечные волоски, называемые ресничками, которые выстилают легкие, замедляют их движение, похожее на щетку. Это приводит к их временному параличу и снижению эффективности очистки дыхательных путей от слизи и других веществ, таких как частицы пыли.
Еще одно изменение, наблюдаемое в легких курильщиков, — это увеличение густоты и выработка слизи. Поскольку реснички не могут вывести слизь из легких так быстро, как она образуется, она накапливается в дыхательных путях, забивает их и вызывает кашель.Накопление слизи также может вызвать больше инфекций легких, таких как хронический бронхит. [Избавьтесь от привычки: 10 научных советов по отказу от курения]
Как заживают легкие
В целом, по словам Эдельмана, некоторые краткосрочные воспалительные изменения в легких можно обратить вспять, если бросить курить. Другими словами, отек спадает на поверхности легких и дыхательных путей, и клетки легких производят меньше слизи, сказал он. Он добавил, что новые реснички могут расти, и они лучше очищают выделения от слизи.
Через несколько дней или недель после отказа от курения бывшие курильщики заметят, что у них меньше одышка во время тренировок, сказал Эдельман Live Science. По его словам, не совсем понятно, почему это происходит, но отчасти это связано с выведением окиси углерода из крови. Этот газ, содержащийся в сигаретном дыме, может мешать транспортировке кислорода, потому что окись углерода связывается с эритроцитами вместо кислорода. Это может объяснить одышку, которую испытывают некоторые курильщики.
Другая причина, по которой у бывших курильщиков улучшилось дыхание, заключается в уменьшении воспаления в слизистой оболочке дыхательных путей; По словам Эдельмана, это происходит потому, что облицовка больше не подвергается воздействию химических раздражителей дыма.Это уменьшенное набухание дает больше места для воздуха, проходящего через проходы.
Как это ни парадоксально, бывшие курильщики могут кашлять сильнее в течение первых нескольких недель после того, как бросили курить, чем когда они курили. Но это хорошо; Это означает, что реснички легких снова активны, и эти тонкие волоски теперь могут перемещать избыточные выделения слизи из легких в дыхательные пути и к горлу, где они могут кашлять, сказал Эдельман.
«Кашель убирает мусор из легких», — объяснил Эдельман.
Еще одна польза для здоровья от отказа от курения — это снижение риска рака легких, сказал он. По словам Эдельмана, чем дольше бывшие курильщики проводят без прикуривания, тем ниже их риск заболеть раком, хотя этот риск никогда не исчезает полностью.
Например, по данным Центров по контролю и профилактике заболеваний, через 10 лет после отказа от курения шансы бывшего курильщика заболеть раком легких примерно вдвое меньше, чем у курильщика. Но у бывшего курильщика все же больше шансов умереть от рака легких, чем у никогда не курившего.
Не все изменения обратимы.
Организм очень хорошо восстанавливает некоторые повреждения клеток и тканей легких, вызванные курением, но не все повреждения обратимы.
Повреждение легких и ухудшение функции легких напрямую связаны с количеством пачек сигарет, которое человек обычно выкуривает в день, умноженным на количество лет, которые он выкуривает, — показатель, известный как «годы упаковки», — сказал Эдельман. Он отметил, что чем больше лет стаи, тем больше вероятность необратимого повреждения легких.
Хотя у легких есть способы защитить себя от повреждений , , эта защита снижается при длительном воздействии вредных химических веществ, вдыхаемых от сигарет. В результате легочная ткань может воспаляться и образовываться рубцами от курения, поэтому легкие теряют эластичность и больше не могут эффективно обменивать кислород.
Длительное курение может привести к эмфиземе, разновидности хронической обструктивной болезни легких (ХОБЛ). Это состояние разрушает часть легких, известную как альвеолы, где происходит обмен кислорода и углекислого газа, сказал Эдельман.У людей с ХОБЛ наблюдается одышка и затрудненное дыхание.
Когда легкие человека повреждаются до эмфиземы, стенки дыхательных путей теряют свою форму и эластичность, что затрудняет выталкивание всего воздуха из легких. Эти изменения в легких являются постоянными и необратимыми, сказал Эдельман.
Используя МРТ, ученые недавно узнали, что повреждение дыхательных путей, связанное с эмфиземой, начинается через несколько лет после того, как человек начинает курить, хотя симптомы болезни могут проявляться только через 20-20 часов. По словам Эдельмана, через 30 лет.
Но бросить курить никогда не поздно, и отказ от курения в любом возрасте может помочь людям дышать лучше и увеличить продолжительность их жизни, сказал Эдельман.
Первоначально опубликовано на Live Science .
сканирований легких пациентов с коронавирусом показывают, что повреждения со временем заживают
Идет загрузка.Во-первых, плохие новости: согласно недавнему отчету, через шесть недель после выписки из больницы у большинства пациентов с COVID-19 все еще наблюдались признаки повреждения легких.
Но исследование, которое было представлено на Международном конгрессе Европейского респираторного общества в начале этого месяца, также вселяло некоторую надежду: у некоторых пациентов наблюдались признаки улучшения через 12 недель.
В рамках исследования, которое все еще продолжается, исследователи из Австрии обследовали 86 пациентов, которые ранее были госпитализированы с коронавирусом. Они обнаружили, что у 88% пациентов на компьютерной томографии наблюдались белые пятна через шесть недель после выписки. Эти пятна, известные как помутнения из матового стекла, указывают на наличие жидкости и воспаления в легких.
Но через шесть недель после этого (12 недель после выписки) только 56% пациентов имели повреждение легких на компьютерной томографии. Некоторым пациентам также стало легче дышать. Только 39% пациентов заявили, что у них проблемы с дыханием через 12 недель, по сравнению с 47% через шесть недель.
Исследование подтверждает, что вирус может вызывать длительные физические повреждения, но также предполагает, что легкие пациентов могут со временем зажить.
Это хорошая новость для растущей доли пациентов с COVID-19, процесс выздоровления которых длился намного дольше, чем они посещали больницу. Итальянское исследование, проведенное в июле, показало, что 87% пациентов, госпитализированных с COVID-19, все еще имели симптомы, включая затрудненное дыхание, через два месяца после начала болезни. А в прошлом месяце британское исследование, которое все еще ожидает экспертной оценки, показало, что у 12% пациентов с COVID-19 были аномальные рентгеновские снимки грудной клетки через 12 недель после их поступления в больницу.
Сканирование легких со временем показывает улучшение
Ученые опасаются, что рубцевание легких — клинически известное как фиброз легких — у пациентов с коронавирусом может быть постоянным и привести к проблемам с дыханием на всю жизнь.
Но австрийские исследователи обнаружили, что меньше частей легкого было повреждено через шесть недель по сравнению с тем, когда пациенты поступали в больницу, и дальнейшее улучшение наблюдалось через двенадцать недель.
Один 56-летний пациент мужского пола заразился COVID-19 в марте и был госпитализирован в отделение интенсивной терапии с тяжелым повреждением легких, что показано красным на скане ниже.
Проф.Герлиг Видманн, доктор Кристоф Швабль, доктор Анна Люгер — отделение радиологии, Медицинский университет ИнсбрукаМужчина выписан в конце апреля. Шесть недель спустя его сканирование резко улучшилось, что видно на сканированном изображении слева внизу. Через 12 недель (снимок справа) большая часть его легких начала заживать.
Проф.Герлиг Видманн, доктор Кристоф Швабль, доктор Анна Люгер — отделение радиологии, Медицинский университет Инсбрука«Вы собираетесь выбрать одну из трех траекторий: либо все изменится в обратном направлении в течение следующих трех-шести месяцев, здесь вы увидите плато, а для некоторых пациентов это может постепенно ухудшиться», — доктор Панагис Галиатсатос. , врач-пульмонолог из Медицинского центра Джонса Хопкинса Бэйвью, который не участвовал в исследовании, сказал Business Insider.
Прямо сейчас, сказал он, прогнозировать вероятность необратимого повреждения легких у пациентов с коронавирусом — все равно что подбрасывать монетку.
«Долгосрочное повреждение, которое мы могли бы увидеть, например фиброз, не происходит быстро», — сказал он. «Это может занять до года, прежде чем оно разовьется. Вы, конечно, можете увидеть ранние признаки при компьютерной томографии, но даже в этом случае трудно понять, повернется ли это вспять или нет».
Рубцы необратимы, но не всегда приводят к проблемам с дыханием
Чтобы увидеть, как пациент выздоравливает от коронавируса, врачи также проводят дыхательные тесты для оценки функции легких, измеряя, сколько воздуха пациент может вдохнуть или сколько кислород переходит из легких в кровь.
Пациенты, у которых проблемы с дыханием, не всегда имеют признаки повреждения на снимках компьютерной томографии. А у пациентов с аномальными результатами сканирования легких могут не возникать проблемы с дыханием.
«Верите или нет, ко мне приходят пациенты, и их компьютерная томография все еще выглядит ужасно, но они чувствуют себя прекрасно. Они говорят:« Нет, я снова бегу на милю », — сказал Галиатсатос. . «Для меня это часть процесса исцеления».
Галиатсатос сказал, что обычно он не объявляет что-либо постоянным, пока это не продлится год или более.Но как только легочная ткань заменяется рубцовой тканью, физическое повреждение невозможно исправить.
Тем не менее, даже пациенты с рубцовой тканью могут в конечном итоге снова почувствовать себя нормальными.
«Я определенно ставлю намного больше запаса прочности», — сказал Галиатсатос. «Люди с рубцами все еще могут жить счастливой жизнью».
Вентиляторы могут вызвать некоторые повреждения.
Галиатсатос сказал, что большая часть повреждений легких у пациентов с COVID-19, вероятно, вызвана вирусом, но этому могут способствовать и другие факторы.По мере того как врачи узнают больше о том, как лечить тяжелые случаи, они начали переосмысливать использование аппаратов ИВЛ для всех случаев, кроме самых тяжелых.
Июльское исследование Нью-Йоркского университета показало, что 22% госпитализированных пациентов с COVID-19 были переведены на искусственную вентиляцию легких в разгар пандемии в Нью-Йорке. У этих пациентов был более высокий уровень повреждения легких от аппаратов ИВЛ, чем у пациентов, которых интубировали по поводу других заболеваний.
Но Галиатсатос сказал, что аппараты ИВЛ не должны причинять большого вреда при правильном применении.
«Как и любое медицинское вмешательство, если оно не выполнено должным образом, оно может представлять опасность для пациента», — сказал он. «Если кто-то войдет и включит вентилятор на максимальное давление, со временем вы можете нанести непоправимый вред легким».
Пациент, страдающий коронавирусом, носит маску для подводного плавания, преобразованную в вентилятор, в Париже, Франция, 1 апреля 2020 года.Бенуа Тесье / ReutersБолее того, сказал он, беспокоит то, что пациенты на аппаратах ИВЛ не тренируют свои дыхательные мышцы, особенно если они проводят в больнице от недель до месяцев.
По сравнению с большинством посещений ОИТ, пациенты с COVID-19 остаются в больнице ненормально долго, сказал Галиатсатос: Один из его пациентов находится в отделении интенсивной терапии с апреля.
Функцию легких можно улучшить с помощью реабилитации
Другие недавние исследования показывают, что физиотерапия может ускорить процесс выздоровления у пациентов с COVID-19 с повреждением легких.
Программа реабилитации от коронавируса в клинике Dieulefit Santé во Франции недавно отслеживала выздоровление 17 пациентов, которые в среднем провели три недели в отделении интенсивной терапии. Они обнаружили, что пациенты, которые выздоравливали быстрее, проводили меньше времени прикованными к постели.
«Чем раньше началась реабилитация и чем дольше она длилась, тем быстрее и лучше улучшилась ходьба, способность дышать и мышечная масса пациентов», — говорится в заявлении Яра Аль Чихани, аспиранта, возглавляющего исследование.«Пациенты, которые начали реабилитацию через неделю после отключения аппарата ИВЛ, прогрессировали быстрее, чем те, кто был госпитализирован через две недели».
Пациент с коронавирусом проходит физиотерапию в клинике Dieulefit Santé во Франции.Центр легочной реабилитации Dieulefit SantéГалиатсатос также управляет реабилитационной клиникой для пациентов с коронавирусом в Johns Hopkins.
«Я всегда говорю пациентам: нет лекарства, которое могло бы сделать ваши легкие сильнее. Единственный способ сделать их сильнее — это использовать их», — сказал он. «Каждый раз, когда вы делаете упражнения и так далее, в легкие поступает больше крови.Больший кровоток означает, что больше заживляющих клеток будет исцелять поврежденные части ».
В этом отношении процесс выздоровления пациентов с COVID-19 сродни восстановлению разорванной мышцы или сломанной кости.
« У меня есть пациент прямо сейчас они пришли в клинику [после того, как они] потеряли 20% функции легких », — сказал Галиатсатос.« Прямо сейчас, из-за реабилитации, они чувствуют себя так же, как и до COVID ».
LoadingSomething is loading.EACH Breath Blog | Американская ассоциация легких
В последние годы натуральные лечебные средства и диеты «детоксикации» стали популярными как быстрый и модный способ вывести токсины из организма.В то время как некоторые продукты продаются для помощи в потере веса за ночь, улучшении пищеварения или повышении уровня энергии, другие утверждают, что они помогают обратить вспять годы повреждения органов, таких как легкие.
С быстрым поиском в Интернете вы можете найти бесчисленное количество продуктов, которые якобы очищают ваши легкие за считанные дни или даже быстрее. Разнообразные таблетки, витамины, чаи, масла, солевые ингаляторы и маски — это всего лишь несколько типов продуктов, которые продаются как панацея от повреждений легких, например, вызванных курением. Но действительно ли эти продукты работают?
Когда дело доходит до здоровья легких, лучше всего следовать следующему правилу: не доверяйте быстрым решениям.
Хотя средства детоксикации кажутся отличной концепцией, к сожалению, многие заявления компаний, продающих опасные и недоказанные методы лечения, преувеличены и даже могут быть вредными, особенно продукты, которые можно вдыхать.
«Есть некоторые аэрозольные продукты (или вейпы), которые содержат« эфирные масла », которые рекламируются как полезные для здоровья, но вдыхание любого вида масла или других липидных [масел] может быть опасным», — сказал д-р Норман Эдельман, старший научный советник. в Американскую ассоциацию легких.
Было доказано, что некоторые общие ингредиенты в очищающих средствах на основе добавок дают положительные результаты, например, витамин D, который играет важную роль в усилении реакции иммунной системы и помогает уменьшить воспаление дыхательных путей. Но большинство этих продуктов детоксикации не одобрены FDA и не имеют достаточных научных данных, чтобы рекомендовать регулярное использование натуральных средств профилактики.
Можно ли безопасно «очистить» легкие?
Хорошие новости: есть — это способ улучшить здоровье легких без таблеток и отваров.Легкие — это самоочищающиеся органы, которые начнут излечивать себя, как только перестанут подвергаться воздействию загрязняющих веществ. Лучший способ обеспечить здоровье легких — избегать вредных токсинов, таких как сигаретный дым и загрязнение воздуха, а также регулярно заниматься спортом и хорошо питаться.
Вот несколько советов, которым нужно следовать для оптимального здоровья легких:
- Отказ от курения — это наиболее эффективный способ минимизировать и излечить повреждение легких. Курите ли вы три дня или 30 лет, отказ от курения — это первый шаг к здоровью легких.
- Изменение диеты также может помочь улучшить здоровье легких, особенно если вы живете с хроническим заболеванием. Добавление продуктов, богатых антиоксидантами, и диета с разнообразными витаминами и питательными веществами сохранят здоровье вашего ума и тела.
- Регулярные упражнения — часть здорового образа жизни, даже если у вас хроническое заболевание легких. Правильное количество и вид активности имеют много преимуществ, включая естественное и здоровое восстановление ваших легких. Обязательно проконсультируйтесь с врачом, прежде чем вносить изменения в свой распорядок тренировок.
- Качество воздуха , которым мы дышим, играет огромную роль в здоровье наших легких. Чтобы ваши легкие были здоровыми, важно знать о вредных загрязнителях и по возможности избегать их. Вы можете проверить свой местный индекс качества воздуха (AQI) с помощью онлайн-инструмента на сайте airnow.