Каким будет мир без антибиотиков — Look At Me
Сегодня устойчивость бактерий к антибиотикам, о которой предупреждал Флеминг, — это одна из главных проблем в медицине и в мире. С изобретением пенициллина человечество вступило в гонку: мы пытаемся обогнать эволюцию, открывая всё новые антибиотики, пока бактерии приспосабливаются к старым. Антибиотик тетрациклин появился в 1950 году, первые бактерии с устойчивостью к нему — в 1959-м. Метициллин в 1960 году, устойчивые к нему бактерии — в 1962-м. Ванкомицин — в 1972 году, а устойчивые бактерии — в 1988-м. Даптомицин появился в 2003-м, первые признаки устойчивости к нему — уже в 2004-м и так далее.
Дело в том, что бактерии размножаются и развиваются очень быстро. Новое поколение бактерий появляется каждые 20 минут. Поэтому микроорганизмы так быстро эволюционируют и адаптируются под внешние угрозы. Более того, чем чаще мы используем тот или иной антибиотик, тем больше шансов мы даём бактериям развить к ним устойчивость.
Об устойчивости к антибиотикам говорят давно.
Теперь устойчивость к антибиотикам начинает принимать поистине апокалиптические масштабы. Мы используем их всё так же много — и почти перестали открывать новые. Разработка нового антибиотика стоит около $1 млн, и фармацевтические компании перестали этим заниматься — невыгодно. Новых типов антибиотиков не появляется, мы используем старые, и устойчивость к ним растёт. Более того, стали появляться так называемые панрезистентные микроорганизмы, устойчивые к нескольким типам антибиотиков, а иногда и ко всем.
В 2009 году один из пациентов в больнице Святого Винсента в Нью-Йорке заразился после операции инфекцией, вызванной бактерией Klebsiella pneumoniae. Бактерия была устойчива ко всем антибиотикам. Он умер через 14 дней после заражения. Британское правительство запустило проект по прогнозированию устойчивости к антибиотикам: учёные считают, что если ситуация будет развиваться так же, как и сегодня, то к 2050 году 10 млн человек в год будут умирать из-за устойчивых бактерий.
Самое печальное, что человечество виновато в этом само. Мы обращались с антибиотиками крайне неаккуратно. Большинство людей не понимают, как работает устойчивость к антибиотикам и как они должны быть использованы. Мы постоянно лечимся ими, когда это совсем не нужно. Немало стран, где антибиотики до сих пор можно купить в аптеке без рецепта. Даже в России, где официально их продают только по рецепту, можно свободно купить многие из 30 видов антибиотиков, доступных на рынке. В США 50% антибиотиков в больницах прописывают без необходимости.
Одна из последних новостей об устойчивости к антибиотикам как раз связана с препаратами, используемыми на животных и растениях. В Китае обнаружили бактерии с устойчивостью к группе полимиксинов, а конкретно — к антибиотику колистину. В лечении колистин используют как препарат «последнего шанса», то есть им лечат пациента, когда никакие другие препараты уже не действуют. Но устойчивость в Китае была обнаружена при других обстоятельствах: они использовали колистин на свиньях.
75 лет назад медики впервые удачно применили пенициллин для лечения бактериальной инфекции
В эти дни в научном и медицинском сообществе вспоминают открытие, которое обеспечило прорыв в лечении инфекций. 75 лет исполнилось с момента первого удачного клинического применения пенициллина. И хотя с тех пор ученым стал более понятен мир бактерий, сейчас главная проблема — их устойчивость к антибиотикам. Станут ли инфекционные болезни опять неизлечимыми, что ищут на дне океана, и как могут помочь лягушки?
75 лет исполнилось с момента первого удачного клинического применения пенициллина. И хотя с тех пор ученым стал более понятен мир бактерий, сейчас главная проблема — их устойчивость к антибиотикам. Станут ли инфекционные болезни опять неизлечимыми, что ищут на дне океана, и как могут помочь лягушки?
Жидкость в ампуле — антибиотик четвертого поколения, который может действовать сразу против 50 штаммов микроорганизмов. Миллионные поставки суперлекарств — реальность сегодняшнего дня. Но секрет антибиотиков не давался человечеству столетиями. Одно из первых научных описаний подобных веществ сделал итальянец Винченцо Тиберио в XIX веке.
В среде учёных ходит легенда. Якобы Тиберио, когда жил в небольшом городке Арцано, заметил одну странность. Как только местный колодец чистили, в семьях по округе вспыхивала дизентерия. И тогда итальянец подумал, а вдруг в колодце до того, как его почистили, было нечто, что мешало развитию опасных бактерий? К его большому удивлению, это оказалась плесень! Но Тиберио не довёл работу до конца.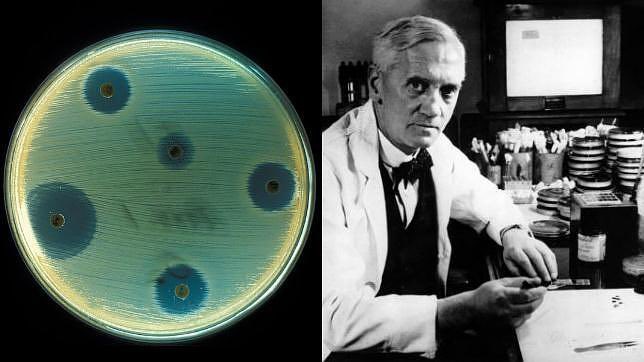 Успех ждал другого.
Успех ждал другого.
В 1928 году на заплесневелую чашку Петри в своей лаборатории натыкается ученый Александр Флеминг и не верит глазам: плесень остановила размножение бактерий стафилококка, которые там хранились. Бактериолог получает чудо-вещество — естественное оружие плесневого гриба против микробов. К сороковым годам о пенициллине уже говорит весь мир.
«В медицине это было эпохальное, революционное событие, которое абсолютно изменило тактику лечения заболеваний, инфекционных осложнений, различных ранений. Потому что как пытались лечить гнойные раны сулемой — это тяжёлый металл, содержащий ртуть, от него гибнет всё», — поясняет профессор кафедры клинической фармакологии РНИМУ им. Н.И. Пирогова Сергей Зырянов.
В феврале 1941 года пенициллин испытали на первом пациенте. К 1942 году препарат — уже на фронтах Второй Мировой. Ивана Котова, тогда молодого хирурга, направляют на работу в госпиталь. Через его руки прошли сотни раненых. Осложнения — самое страшное. Пневмония, гангрена, заражение крови. Антибиотик впервые в истории позволял спасать таких раненых и избегать ампутаций. Уже в 1945 году Александр Флеминг получает за своё открытие Нобелевскую премию.
Антибиотик впервые в истории позволял спасать таких раненых и избегать ампутаций. Уже в 1945 году Александр Флеминг получает за своё открытие Нобелевскую премию.
И всё же, откуда плесень взялась на рабочем столе у Флеминга? Художница из Москвы Дарья Фёдорова, по сути, раз за разом воспроизводит сценарий того, что случилось в лаборатории бактериолога. В чашках Петри девушка выращивает десятки видов плесени. Красивая и отталкивающая, оказывается, она просто всегда рядом с нами.
«Можно сначала потрогать все дверные ручки, которые есть в доме, потом этой же рукой просто дотронуться до чашки. Можно просто в воздухе движения поделать, и соответственно, засеять то, что находится в воздухе», — объясняет она.
Величайшее открытие в медицине — чистая случайность, Флеминг это признавал. Как выигрыш в лотерею, в чашку со стафилококком попал гриб, который убивал стафилококк. Но в этой истории есть ещё один сюрприз — неприятный. За 75 лет бактерии научились противостоять антибиотикам.
«Не исключена возможность развития ситуации, когда инфекционные болезни опять станут неизлечимыми. Во внутрибольничной среде появились микробы, которые характеризуются сейчас устойчивостью практически ко всем, а иногда даже ко всем антибиотикам», — рассказывает профессор кафедры госпитальной терапии Первого МГМУ имени И.М. Сеченова Сергей Яковлев.
В лабораториях по всему миру ищут способы победить новые супербактерии, устойчивые к лекарствам. А виновных в проблеме уже нашли. Это… мы сами! Антибиотики в домашней аптечке, антибиотики при малейшем чихе… Чем чаще мы принимали эти лекарства, тем лучше бактерии к ним адаптировались. Открывать новые антибиотики всё сложнее, сейчас их ищут на дне океанов, в антарктических грунтах, в растениях и даже на коже лягушек.
Вещества, которые учёные химического факультета МГУ обнаружили в защитной слизи лягушек, могут стать заменой антибиотиков. Принцип действия «антимикробных пептидов» совершенно другой — они не останавливают размножение, а буквально прокалывают мембраны клеток опасных микробов — бьют наповал. К такому нельзя приспособиться.
К такому нельзя приспособиться.
«Поскольку лягушки живут миллионы и миллионы лет, и их ещё не съели, бактерии не могут приноровиться к такому оружию, каким являются пептиды», — объясняет заведующий лабораторией органического анализа, профессор химического факультета МГУ Альберт Лебедев.
Это всего лишь один из вариантов лекарств будущего. Но вполне возможный. Для скептиков у учёных простой ответ — если 75 лет назад миллионы жизней спасла плесень, то чем лягушки хуже?
Аугментин — один из лучших антибиотиков
|
ОТ ПЕНИЦИЛЛИНА К АУГМЕНТИНУ: ДОРОГУ ОСИЛИТ ИДУЩИЙ
Как известно, Александр Флеминг открыл пенициллин в 1928–1929 гг. 10 лет это открытие оставалось просто неким лабораторным феноменом, известным узкому кругу специалистов до тех пор, пока профессор Флори не выявил, что плесень, открытая Флемингом, может стать антибиотиком (сам Флеминг был скептически настроен к своему детищу, заявив, что «этим не стоит заниматься»).
В конце 30-х годов ХХ в. судьба свела в лаборатории микробиологии Оксфордского университета австралийца Гаварда Флори и сына выходца из России Эрнста Бориса Каина (англицированное звучание — Чейн). Оба были биохимиками и занимались борьбой с болезнетворными микроорганизмами. Их маленькая группа, получившая в истории медицины название Оксфордской команды, включила в свои исследования, помимо двух других химических соединений, еще и Penicillium notatum, о котором они вычитали в работах профессора Флеминга. В 1939 г. группе удалось получить, хотя и очень грубо очищенный, пенициллин. А 13 августа 1940 г. немцы начали бомбить Лондон. Флори, Чейн и их коллега Норман Хитли пропитали пенициллином свою одежду на тот случай, если лаборатория будет разрушена или если им придется уничтожить запас пенициллина при оккупации Лондона. Положение было отчаянным. Летом 1941 г. Флори отправился за помощью в США.
|
Перед учеными возникало еще много проблем. Об одной из них читаем в биографии Александра Флеминга, написанной французским писателем Андре Моруа. Существовавший запас пенициллина был получен из той самой плесени (плесень — лат. penicillium) — Penicillium notatum — которая в 1928 г. залетела в окно к Александру Флемингу, осела на приготовленном им стрептококковом бульоне и внезапно очистила его, убив все микробы. Однако для массового производства пенициллина нужно было найти нечто новое. Тип плесени, который можно было бы легко выращивать в огромных количествах. Но что бы ни пробовали ученые, им никак не удавалось достичь нужных результатов. В конце концов они наняли женщину по имени Мэри, которая приносила им с базара разные виды заплесневевших овощей и фруктов. В городке ее тут же прозвали «заплесневелая Мэри». Однажды, осенью 1941 г., она принесла им маленькую оранжевую дыню. На ней была плесень Penicillium chrisogenum. Ее споры прорастали с неимоверной скоростью.
Об одной из них читаем в биографии Александра Флеминга, написанной французским писателем Андре Моруа. Существовавший запас пенициллина был получен из той самой плесени (плесень — лат. penicillium) — Penicillium notatum — которая в 1928 г. залетела в окно к Александру Флемингу, осела на приготовленном им стрептококковом бульоне и внезапно очистила его, убив все микробы. Однако для массового производства пенициллина нужно было найти нечто новое. Тип плесени, который можно было бы легко выращивать в огромных количествах. Но что бы ни пробовали ученые, им никак не удавалось достичь нужных результатов. В конце концов они наняли женщину по имени Мэри, которая приносила им с базара разные виды заплесневевших овощей и фруктов. В городке ее тут же прозвали «заплесневелая Мэри». Однажды, осенью 1941 г., она принесла им маленькую оранжевую дыню. На ней была плесень Penicillium chrisogenum. Ее споры прорастали с неимоверной скоростью.
Во время войны, когда главную угрозу жизни раненых представляли инфекции, пенициллин помог спасти тысячи жизней. Благодаря тому, что в начале войны пенициллин не был патентованным лекарственным средством, информация о нем стала доступна всем. В те же годы, что и за рубежом, над созданием пенициллина работали и в Советском Союзе. В невероятно трудных условиях военного времени, да и вообще при очень убогих возможностях лабораторной техники были проведены исключительные исследования. В одном из московских подвалов ученые выявили штамм
Благодаря тому, что в начале войны пенициллин не был патентованным лекарственным средством, информация о нем стала доступна всем. В те же годы, что и за рубежом, над созданием пенициллина работали и в Советском Союзе. В невероятно трудных условиях военного времени, да и вообще при очень убогих возможностях лабораторной техники были проведены исключительные исследования. В одном из московских подвалов ученые выявили штамм
Героем легенды о пенициллине стал, конечно, один человек — сэр Александр Флеминг. Ученый мир оценил троих. В 1945 г. Нобелевскую премию за создание пенициллина получили кроме Флеминга еще сэр Эрнст Борис Чейн и лорд Гавард Флори.
После того, как была доказана возможность получения антибиотиков из микроорганизмов, открытие новых препаратов стало вопросом времени.

|
Природные пенициллины, полученные в 40–50-е годы ХХ в., были неэффективны при приеме внутрь, так как разрушались в кислой среде желудка. Впоследствии был создан метод получения полусинтетических пенициллинов. Для этого молекулу пенициллина «разрезали» с помощью фермента пенициллиназы и, используя одну из частей, создавали новые соединения. Таким способом удалось получить препараты более широкого спектра действия, чем исходный пенициллин. Так в 1972 г. специалистами Beecham Research Laboratories (подразделения компании, вошедшей впоследствии в состав «ГлаксоСмитКляйн») был разработан амоксициллин. Результатами множества исследований было доказано, что он обладает превосходным спектром антибактериальной активности, но в отличие от своего предшественника — ампициллина — лучше всасывается при пероральном приеме и создает в тканях и биологических жидкостях организма более высокие концентрации, позволяющие эффективно бороться с микроорганизмами. Амоксициллин не утратил своего значения и сейчас. Этот прекрасный препарат обладает достаточно широким спектром действия, включая анаэробную флору. Он хорошо переносится пациентами, ему не присущи такие побочные эффекты, как нефро- и гепатотоксичность, которые, к сожалению, возникают при приеме многих современных антибактериальных средств.
Для этого молекулу пенициллина «разрезали» с помощью фермента пенициллиназы и, используя одну из частей, создавали новые соединения. Таким способом удалось получить препараты более широкого спектра действия, чем исходный пенициллин. Так в 1972 г. специалистами Beecham Research Laboratories (подразделения компании, вошедшей впоследствии в состав «ГлаксоСмитКляйн») был разработан амоксициллин. Результатами множества исследований было доказано, что он обладает превосходным спектром антибактериальной активности, но в отличие от своего предшественника — ампициллина — лучше всасывается при пероральном приеме и создает в тканях и биологических жидкостях организма более высокие концентрации, позволяющие эффективно бороться с микроорганизмами. Амоксициллин не утратил своего значения и сейчас. Этот прекрасный препарат обладает достаточно широким спектром действия, включая анаэробную флору. Он хорошо переносится пациентами, ему не присущи такие побочные эффекты, как нефро- и гепатотоксичность, которые, к сожалению, возникают при приеме многих современных антибактериальных средств. Последнее обстоятельство имеет особое значение при выборе терапии у пациентов с сопутствующей патологией, лиц пожилого возраста, у которых, как правило, имеются возрастные нарушения со стороны печени и почек, а также у детей.
Последнее обстоятельство имеет особое значение при выборе терапии у пациентов с сопутствующей патологией, лиц пожилого возраста, у которых, как правило, имеются возрастные нарушения со стороны печени и почек, а также у детей.
С создания пенициллина прошли десятки лет. Появились новые поколения пенициллинов: второе, третье… Но все острее встает вопрос о том, что антибиотики теряют свою действенность. Микроорганизмы «научились» бороться и побеждать в «войне» с антибактериальными препаратами. Они выработали различные механизмы защиты, и одним из основных стала способность вырабатывать особые ферменты — β-лактамазы, разрушающие антибактериальные препараты. Этот механизм является одним из ведущих для таких клинически значимых возбудителей, как S. aureus, Н. influenzae, M. catarrhalis, E. coli, K. pneumoniae, В. fragilis. Вскоре были синтезированы первые пероральные цефалоспорины, устойчивые к действию β-лактамаз, однако они оказались значительно менее активными в отношении стрептококков, пневмококков, гемофильной палочки, моракселлы. Поэтому к середине 60-х годов XX в. стало очевидно, что необходимо создать вещество, которое поможет антибактериальным препаратам пенициллинового ряда преодолеть действие β-лактамаз.
Поэтому к середине 60-х годов XX в. стало очевидно, что необходимо создать вещество, которое поможет антибактериальным препаратам пенициллинового ряда преодолеть действие β-лактамаз.
|
Соответствующая программа исследований была начата в 1967 г. учеными лаборатории Beecham, которая в настоящее время входит в состав «ГлаксоСмитКляйн». Это привело к открытию в начале 70-х годов ХХ в. клавулановой кислоты, связывающей β-лактамазы микроорганизмов. Она выступила как защитный компонент в составе препарата, где в качестве антибактериальной составляющей был представлен амоксициллин (оригинальная разработка той же лаборатории), который уже успел подтвердить свою эффективность и завоевать популярность у врачей. Таким образом, неслучайно именно амоксициллин был выбран для соединения с клавулановой кислотой, и эта комбинация, получившая торговое название АУГМЕНТИН™, 17 сентября 1981 г. была впервые представлена в Великобритании, а вскоре после этого — в Европе, США и других странах мира. Именно за изобретение клавулановой кислоты ученые-разработчики были удостоены награды Королевы Великобритании — за лучшее инновационное лекарственное средство.
клавулановой кислоты, связывающей β-лактамазы микроорганизмов. Она выступила как защитный компонент в составе препарата, где в качестве антибактериальной составляющей был представлен амоксициллин (оригинальная разработка той же лаборатории), который уже успел подтвердить свою эффективность и завоевать популярность у врачей. Таким образом, неслучайно именно амоксициллин был выбран для соединения с клавулановой кислотой, и эта комбинация, получившая торговое название АУГМЕНТИН™, 17 сентября 1981 г. была впервые представлена в Великобритании, а вскоре после этого — в Европе, США и других странах мира. Именно за изобретение клавулановой кислоты ученые-разработчики были удостоены награды Королевы Великобритании — за лучшее инновационное лекарственное средство.
АУГМЕНТИН
™: ЭПОХА РЕНЕССАНСА ПЕНИЦИЛЛИНОВАУГМЕНТИН™ представляет собой оригинальную разработку известной компании «ГлаксоСмитКляйн» и является комбинацией амоксициллина — одного из лучших антибиотиков пенициллинового ряда — и самого мощного из известных ингибиторов бета-лактамаз — клавулановой кислоты. Сочетание этих двух компонентов в АУГМЕНТИНЕ приводит к появлению особых свойств.
Сочетание этих двух компонентов в АУГМЕНТИНЕ приводит к появлению особых свойств.
В препарате реализуется концепция «нападая, защищаюсь»: клавулановая кислота необратимо блокирует β-лактамазы как патогенных, так и непатогенных микроорганизмов, открывая амоксициллину свободный путь для атаки на возбудителей инфекции. Такие свойства позволили проявить препарату высокую клиническую эффективность при многих инфекциях различных органов и систем, которая не изменяется со временем, о чем свидетельствует более чем 25-летний опыт успешного применения во всем мире. С появлением АУГМЕНТИНА наступила эпоха ренессанса пенициллиновых антибиотиков. Они восстановлены в своих правах, и вполне заслуженно.
Применение АУГМЕНТИНА в клинической практике имеет солидную доказательную базу — ведь именно для этого оригинального препарата были проведены многочисленные клинические исследования, подтверждающие его эффективность при лечении респираторных инфекций. Высокая клиническая эффективность АУГМЕНТИНА при различных инфекциях доказана в контролированных исследованиях с участием десятков тысяч пациентов на протяжении 25 лет. Всего же в мире сегодня насчитывается около 50 000 публикаций, содержащих данные об успешном применении АУГМЕНТИНА в клинической практике, что делает его, пожалуй, самым изученным после пенициллина антибиотиком в мире. Чувствительность микроорганизмов к АУГМЕНТИНУ на протяжении десятилетий его успешного применения практически не изменилась, что подтверждают результаты крупных исследований (Alexander Project, 1992–1996 и других). В частности, данные крупномасштабного международного многоцентрового микробиологического исследования Alexander Project (проект назван по имени Александра Македонского, который, вероятно, умер в результате инфекции дыхательных путей) свидетельствуют о высокой активности АУГМЕНТИНА и чувствительности к нему микроорганизмов, вызывающих негоспитальные инфекции дыхательной системы. Также было выявлено еще одно удивительное свойство препарата, отличающее его от других современных противомикробных средств, — несмотря на то, что препарат используют с 1981 г., чувствительность микроорганизмов к АУГМЕНТИНУ практически не изменилась.
Всего же в мире сегодня насчитывается около 50 000 публикаций, содержащих данные об успешном применении АУГМЕНТИНА в клинической практике, что делает его, пожалуй, самым изученным после пенициллина антибиотиком в мире. Чувствительность микроорганизмов к АУГМЕНТИНУ на протяжении десятилетий его успешного применения практически не изменилась, что подтверждают результаты крупных исследований (Alexander Project, 1992–1996 и других). В частности, данные крупномасштабного международного многоцентрового микробиологического исследования Alexander Project (проект назван по имени Александра Македонского, который, вероятно, умер в результате инфекции дыхательных путей) свидетельствуют о высокой активности АУГМЕНТИНА и чувствительности к нему микроорганизмов, вызывающих негоспитальные инфекции дыхательной системы. Также было выявлено еще одно удивительное свойство препарата, отличающее его от других современных противомикробных средств, — несмотря на то, что препарат используют с 1981 г., чувствительность микроорганизмов к АУГМЕНТИНУ практически не изменилась.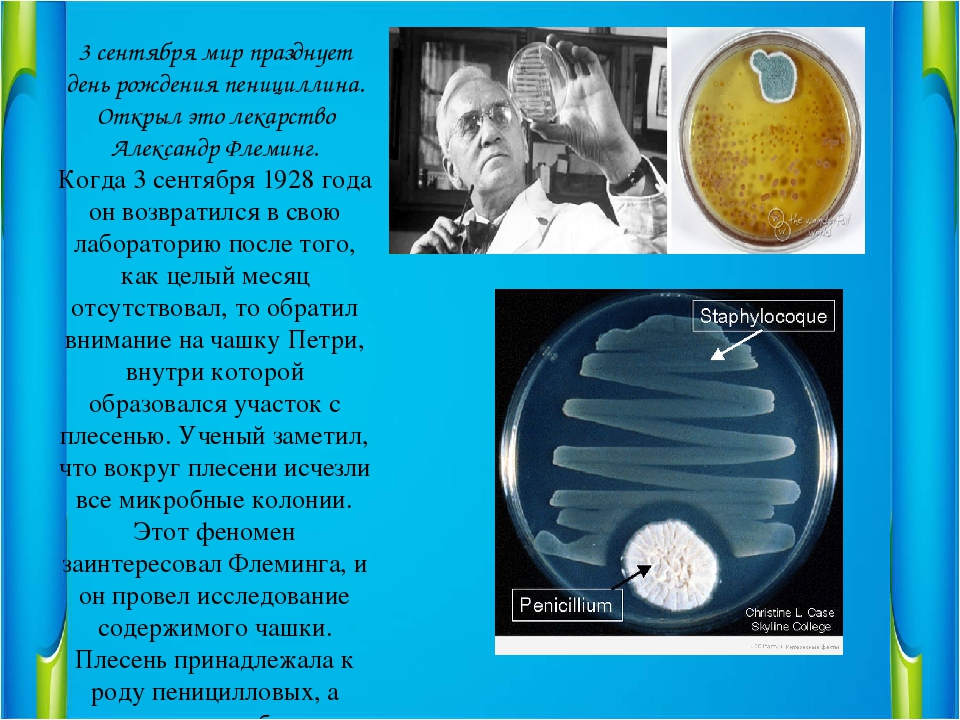
|
Область применения АУГМЕНТИНА широка благодаря высокой способности бактерицидно воздействовать на аэробную и анаэробную флору (как грамположительную, так и грамотрицательную).
Широкий спектр активности АУГМЕНТИНА позволяет проводить монотерапию этим препаратом даже в тех случаях, когда при его отсутствии понадобилось применение комбинации двух или более антибиотиков. Это снижает частоту развития побочных реакций и лишает микроорганизмы возможности вырабатывать устойчивые штаммы.
Препарат показан при инфекциях верхних и нижних дыхательных путей (тонзиллит, синусит, средний отит, обострение хронического бронхита, пневмония), инфекциях мочеполовой системы (цистит, уретрит, пиелонефрит, инфекции, передающиеся половым путем, гинекологические и акушерские инфекции), кожи и мягких тканей, костей и суставов (остеомиелит), а также для периоперационной профилактики хирургической инфекции.
Кроме высокой клинической и бактериологической эффективности, сохраняющейся с течением времени, АУГМЕНТИН™ обладает благоприятным профилем безопасности и переносимости. Поэтому не удивительно, что АУГМЕНТИН™ получил заслуженное признание врачей. Он зарегистрирован и применяется практически во всем мире.
При этом в руководствах по антибиотикотерапии многих развитых стран АУГМЕНТИН™ рекомендуют применять как антибиотик первого выбора для эмпирической терапии различных инфекций.
О признании высокой эффективности АУГМЕНТИНА свидетельствует то, что в 1995 г. Национальный комитет по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards) объявил АУГМЕНТИН™ золотым стандартом среди пенициллиновых антибиотиков, то есть тем, с которым cравниваются все вновь созданные антибиотики (Legnani D., 1997). Несмотря на длительность применения АУГМЕНТИНА в клинической практике, он не уступает по эффективности многим вновь созданным противомикробным средствам.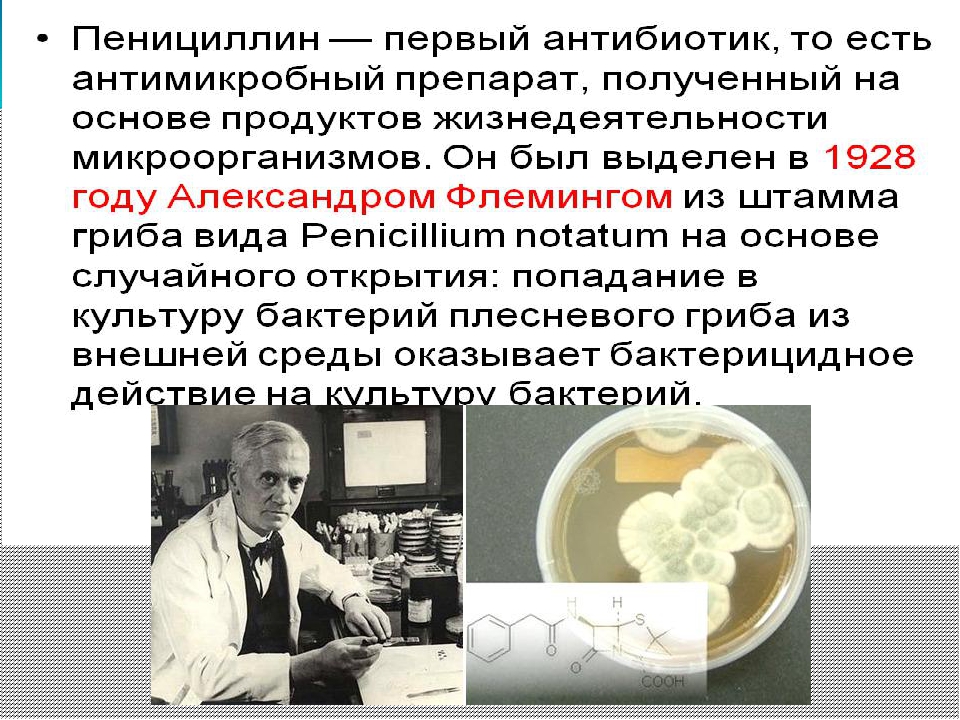
АУГМЕНТИН™: СИЛА В ПОСТОЯННОМ РАЗВИТИИ
Специалисты компании «ГлаксоСмитКляйн» не останавливались на достигнутом: разрабатывались новые схемы лечения, новые дозировки, новые лекарственные формы. Такие новации не остались незамеченными, и в 1986 г. ученым-разработчикам АУГМЕНТИНА были присуждены награда Королевы Великобритании, премия Галена во Франции и награда правительства Испании.
Научные изыскания продолжались, и впоследствии была разработана лекарственная форма препарата для двукратного приема — АУГМЕНТИН™ BD таблетки, покрытые оболочкой, 625 мг (500 мг амоксициллина и 125 мг клавулановой кислоты) и новая форма 1000 мг (875 мг амоксициллина и 125 мг клавулановой кислоты). В новой форме амоксициллин и клавуланат находятся в соотношении 7:1. Такое повышение дозы амоксициллина по отношению к клавулановой кислоте усиливает бактерицидный эффект и увеличивает период, в течение которого сохраняется активность препарата АУГМЕНТИН™ 1000 мг в отношении микроорганизмов, продуцирующих β-лактамазы.
Исход заболевания зависит не только от правильного выбора препарата, но и от четкого соблюдения кратности его применения. В этом и состоит одна из причин погрешности лечения, поскольку часто пациенты пропускают время приема очередной дозы лекарственного средства. Применение новой лекарственной формы АУГМЕНТИН™ 1000 мг позволит снизить частоту приема препарата до 2 раз в сутки, что, несомненно, более удобно для пациента. АУГМЕНТИН™ 1000 мг при приеме 2 раза в сутки — эффективный и удобный вариант лечения пациентов с тяжелыми инфекциями дыхательных путей.
АУГМЕНТИН™ по праву занимает одно из ведущих мест среди средств для эмпирической антибиотикотерапии пациентов благодаря высокой эффективности, надежности, безопасности и, что немаловажно, экономической доступности для жителей Украины. o
Пресс-служба «Еженедельника АПТЕКА»
Назад в будущее: к чему может привести бесконтрольный приём антибиотиков
Врачи Педиатрического университета рассказали об открытии пенициллина и риске вернуться в эпоху, когда антибактериальных препаратов ещё не изобрели.
17 сентября 1928 года Александр Флеминг открыл пенициллин. Это событие буквально перевернуло мир медицины – не сразу, правда, а спустя 20 лет. Человечество тогда вздохнуло с облегчением: туберкулез и многие другие инфекции перестали быть приговором, да и риск умереть от случайной царапины свёлся к минимуму.
Но уже в нобелевской речи 1945-го года Флеминг предупредил о новой глобальной угрозе – устойчивости бактерий к антибиотикам.
– Человек, бездумно играющийся с пенициллином для лечения всего подряд, в конце концов, окажется морально ответственным за смерть того, кто не смог побороть инфекцию, которая оказалась устойчива к пенициллину, — писал первооткрыватель.
В 2014 году ООН опубликовала отчет о масштабах уже свершившейся катастрофы. Исследование показало, что каждый год в мире более 700 тысяч человек умирает от инфекций, вызванных устойчивыми микробами.
– Почти половину антибиотиков используют при лечении заболеваний органов дыхания, хотя чаще они имеют вирусную природу. Профилактическое назначение антибиотиков не спасает от развития бактериальных осложнений, в первую очередь, от пневмонии. А вот устойчивость к ним возникает очень быстро! Этому способствует самолечение, возможность покупки антибиотиков без рецепта, а, значит, бесконтрольное использование антибактериальных препаратов пациентами или их родителями, несоблюдения дозирования, частоты введения и длительности курса, – говорит Светлана Петрова, доцент кафедры факультетской педиатрии СПбГПМУ.
При этом создание принципиально новых антимикробных препаратов – большая проблема.
– Вывод очевиден – есть вероятность возврата в доантибиотическую эру! – считает Светлана Петрова.
Но почему, собственно, возникает антибиотикорезистентность? Ответ на этот вопрос даёт иммунолог, врач-педиатр приемного отделения СПбГПМУ Андрей Гоголев.
– Как и все живые организмы, микробы постоянно эволюционируют. Они делятся и в процессе деления возможны изменения генетического материала, и микробы приобретают новые свойства. К новым свойствам микробов можно отнести, в том числе, и антибиотикорезистентность, резистентность к пенициллину, естественному антибиотику. Некоторые микробы выделяют особые ферменты, которые растворяют пенициллин. Поэтому сейчас естественный пенициллин уже практически не применяется. Приходится использовать полусинтетические или синтетические пенициллины, защищенные от бактериальных ферментов, — объясняет специалист.
Важно помнить, что бесконтрольный приём серьёзных лекарств – угроза не только для самого пациента, но и для его окружающих.
– Это популяционная проблема. Даже если человек никогда не пил антибиотики, но его заражает больной, у которого уже резистентный штамм, то лечение всё равно будет проходить сложно, – поясняет Андрей Гоголев.
Нередко врачи назначают антибактериальные препараты, чтобы перестраховаться. Как себя вести родителям в сомнительных случаях?
– Надо дать время организму ребенка справился с инфекцией самостоятельно. Обязательно вызвать врача. Должны быть четкие критерии: если повышенная температура тела держится больше 4 суток, то нужно сдать клинический анализ крови — это поможет врачу поставить точный диагноз. Если действительно это бактериальная инфекция – назначаем антибиотики первой линии, то есть пенициллинового ряда. Применяем ступенчатый подход — не надо сразу бить широкоспектральными антибиотиками. Если это вирусная инфекция — то назначение антибиотиков не требуется вообще. Если при вирусной инфекции после улучшения снова происходит ухудшение состояния, то назначение антибактериального препарата может быть необходимым, но только после клинического анализа крови. В котором доктор увидит изменение соответствующих показателей — отметил доктор Гоголев.
Добавим, что не менее важна и профилактика инфекций: если люди постараются избегать бактерий, то и применять антибиотики придется реже. Чаще всего микробы попадают в организм человека через пищу, поэтому ВОЗ сформулировала несколько несложных правил, чтобы обезопасить себя от пищевых инфекций:
- Подвергайте пищу тщательной термической обработке. Температура продукта должна быть минимум 70 °С.
- Съедайте приготовленную пищу горячей, поскольку при остывании велика вероятность размножения в ней различного рода бактерий. Если разогреваете пищу, то делайте это при той же температуре – не ниже 70 °С.
- Храните пищу при температуре не выше 10 °С.
- Не допускайте контакта сырой и приготовленной пищи. Например, не стоит резать ножом сырое мясо, а потом сразу сыр.
- Мойте руки перед приготовлением еды. Тщательно мойте фрукты и овощи.
- Держите кухню и все кухонные принадлежности в чистоте, не допускайте появления насекомых, и тем более, мышей и крыс.
- Помните, что опасные бактерии могут попасть в пищу от собак, кошек, птиц и других домашних животных. Соблюдайте простые правила гигиены и следите за здоровьем ваших питомцев.
Эпоха антибиотиков — Медиапроект s-t-o-l.com
Об изобретении, спасшем 200 миллионов жизней, рассказывает преподаватель Свято-Филаретовского института генетик Галина Муравник
Александр Флеминг был не первым, кого интересовал вопрос, можно ли плесень использовать во благо. Ещё древние египтяне, и греки, и китайцы, и индийцы применяли плесень для лечения инфицированных ран. Брали заплесневевший хлеб, счищали с него эту плесень и прикладывали к нагноившимся ранам или использовали просто кусочки такого хлеба. Каким образом в те отдалённые времена люди разных стран и культур догадались, что это помогает, неизвестно – это какое-то интуитивное знание. Однако в 1873 году русский врач Алексей Полотебнов опубликовал своё исследование о том, как можно использовать зелёную плесень для лечения кожных болезней. Но почему-то этот метод тогда не вошел в клиническую практику, впрочем, как и наблюдения других ученых, подметивших, что плесень выделяет какое-то вещество бактериостатического действия. До Александра Флеминга всё это были лишь отдельные несистематические исследования.
Детские слёзы
История открытия пенициллина описана и самим Флемингом, и многократно пересказана. Она стала почти легендой. Во время Первой мировой войны, работая в госпитале, Флеминг видел, что глубокие осколочные раны, как бы тщательно их ни обрабатывали имевшимися дезинфицирующими средствами, продолжали нагнаиваться, далее начиналось общее воспаление, сепсис, и человек умирал. В те годы была высочайшая смертность даже от неопасных ран. Многие искали средства, чтобы с этим бороться. Флеминг по какой-то причине решил для экспериментов брать слизь из собственного носа. В чашках Петри он сеял на неё бактерии. Возможно, он рассуждал примерно так: нос – это первый «рубеж обороны»: мы вдыхаем нестерильный воздух со множеством вирусов и бактерий, и в нём всё должно проходить какую-то очистку, чтобы в легкие воздух попадал чистым. Он понимал, что у заболевшего человека неспроста в носу накапливается много слизи, поскольку организм борется с болезнью, и слизь в этой борьбе принимает какое-то участие. Ему удалось из слизи выделить вещество лизоцим, которое, как теперь хорошо известно, разрушает бактериальную стенку, следовательно, бактерия погибает. Флеминг потратил немало усилий, чтобы выделить и изучить этот лизоцим. Так оказалось, что он содержится не только в носу, но и во многих других жидкостях в организме, таких как слёзы, слюна, кожные выделения. Пишут, что он брызгал своим сотрудникам в глаза сок лимона, чтобы у них текли слёзы, и затем эти слёзы собирал. Была даже такая лабораторная шутливая карикатура: Флеминг сечёт детей, они плачут, а он собирает слёзы в банки для экспериментов.
Александр Флеминг
Но потом произошло то, что одни считают случайностью, другие – Божьим промыслом. Видимо, в его микробиологической лаборатории не была обеспечена полная стерильность, поэтому в одной из чашек Петри с посеянными бактериями золотистого стафилококка он вдруг увидел выросшие ниточки плесневого гриба. К его удивлению, в этом месте вместо колонии бактерий получилось какое-то месиво, жижа. Флеминг догадался, что плесень выделяет что-то, что не позволяет размножаться бактериям. Он не прошел мимо этого необычного, непонятного в то время факта и продолжил исследования. В результате из плесени ему удалось выделить некое вещество. Как автор открытия он дал ему название – пенициллин, поскольку плесень, а это один из видов низших грибов, по-латыни называется Penicillium.
Пенициллина много не бывает
Новое вещество удавалось выделять в крошечных количествах: трудность состояла в отсутствии эффективных методов очистки пенициллина от других белков плесени. Но важно другое – Флеминг доказал, что пенициллин обладает мощными бактерицидными свойствами, он не позволяет синтезироваться бактериальной стенке, поэтому бактерии не могут размножаться и гибнут. Сразу встал вопрос, как этот драгоценный пенициллин нарабатывать хотя бы для экспериментов, потому что нужно было выяснить, на какие штаммы бактерий он действует, а какие к нему устойчивы, в каких дозах работает препарат, не токсичен ли он для животных и человека.
Флеминг долго искал учёных для совместной работы и только в начале 40-х годов вышел на группу Чейна и Флори в Оксфорде. Эрнст Чейн взялся выделять вещество, а Говард Флори – испытывать его на животных. Исследования показали, что пенициллин действует на так называемые грамположительные бактерии: стафилококки, стрептококки, гонококки, возбудители сифилиса. И, главное, удалось установить, что он не токсичен для животных.
Первое испытание на человеке произошло в феврале 1941 года. В лондонской клинике от заражения крови умирал полицейский, он был уже в коме, когда ему ввели пенициллин. Словно по мановению волшебной палочки, умирающий пришёл в себя. Через два дня у него снизилась температура, он начал есть – дело шло к выздоровлению. Но тут произошло трагическое: тот пенициллин, который огромными усилиями удалось наработать, закончился, а курс лечения не был завершён. У больного произошел рецидив, и он умер. Однако принципиально стало ясно, что открыто лекарство, которое обладает мощными антибактериальными свойствами.
В 1943 году Флори передал технологию его производства в США – видимо, в Англии во время войны не было возможности эффективно заниматься наукой и налаживать его синтез. В кратчайшие сроки, уже к 1944 году, американцы наладили промышленный выпуск пенициллина. Буквально за несколько лет вся Северная Америка была снабжена этим чудо-препаратом. Так началась эпоха антибиотиков.
Если в XIX веке от послеоперационного сепсиса умирали 60% пациентов, поскольку не было эффективных средств борьбы с бактериями, то теперь ситуация кардинально изменилась. В тех странах, где начали использовать антибиотики, средняя продолжительность жизни в кратчайшие сроки повысилась на 20-25 лет! Хотя надо признать, что этот показатель не совсем «чистый», поскольку на эти же годы приходится начало активной, систематической вакцинации от самых разных инфекций, что внесло свой вклад в повышение продолжительности жизни и предотвращение смертности, в том числе детской. Но то, что в этом «демографическом рекорде» есть и заслуга антибиотиков, несомненно.
Соцсоревнование антибиотиков
Интересно, что и наш российский, тогда советский, микробиолог Зинаида Виссарионовна Ермольева ещё в тридцатые годы, чуть позже Флеминга, также из плесени выделила антибактериальное вещество. Это был другой штамм и несколько другое вещество, которое она назвала крустозином. Но судьба её открытия была совсем иной. Произошло то, что неоднократно происходило в нашей стране в советское время. Отдел по науке ЦК решил, что из «этой гадости» – плесени ничего хорошего получить нельзя, поэтому исследования запретили, а лабораторию Зинаиды Виссарионовны закрыли. Ермольева не смогла отстоять свое право на продолжение работы, поскольку была в «чёрных списках». В 1937 году повторно арестовали её первого мужа, величайшего вирусолога Льва Зильбера, по доносу о попытке заражения Москвы энцефалитом через городской водопровод, а второго её мужа, микробиолога Алексея Захарова, в 1938 году расстреляли на печально известном спецобъекте «Коммунарка» в Москве. Вероятно, судьба не только открытия, но и сама жизнь Ермольевой висела на волоске. И лишь в 1943 году, когда американцы начали выпускать пенициллин, вспомнили о её работах и дали возможность возобновить исследования. Позднее был организован Институт пенициллина (ныне Институт антибиотиков).
Зинаида Ермольева
Известна любопытная история – «соревнование» антибиотиков, которое устроили в начале 1944 года, когда Флори впервые привез в Москву свой пенициллин. Английским и советским пенициллинами лечили две группы раненых с сепсисом, находившихся в одинаково тяжелом состоянии. Оказалось, что крустозин Ермольевой в меньшей дозе дает такой же терапевтический эффект, то есть её штамм плесени более активен, чем тот, который обнаружил Флеминг…
И всё же первыми были они – Флеминг, Флори и Чейн, в 1945 году удостоенные Нобелевской премии, а имя Зинаиды Ермольевой осталось лишь а анналах истории отечественной медицины и микробиологии. Кто теперь подсчитает, сколько людей, погибших от раневых инфекций, было бы спасено во время войны, не запрети партия эти работы. Зинаида Ермольева сказала как-то, что Пушкин не умер бы от раны, полученной в живот, если бы в XIX веке был пенициллин. Ведь у поэта начался перитонит, который сейчас успешно лечат антибиотиками.
Грибы против бактерий и наоборот
После пенициллина как из рога изобилия посыпались открытия других антибиотиков. Зельман Ваксман открыл стрептомицин и получил Нобелевскую премию в 1952 году, потом открыли грамицидин, хлорамфеникол и так далее. Сейчас уже получены десятки тысяч разных – и выделенных, и синтетических антибиотиков, которые применяют для лечения не только бактериальных инфекций, но даже для борьбы с онкологическими заболеваниями. Раковые клетки тоже оказались чувствительны к некоторым из них.
«Механизм» действия антибиотиков основан на банальной межвидовой борьбе за существование. Грибы и бактерии занимают одну экологическую нишу, а потому стараются вытеснить друг друга. И грибы нашли своего рода «химическое оружие» – они синтезируют вещество, которое убивает бактерии.
Кстати, Флеминг уже в начале применения антибиотиков предвидел связанную с ними проблему. Он неоднократно говорил и писал о том, что ни в коем случае нельзя нарушать дозировки и сроки применения лекарства. А ведь как порой бывает: человек начал принимать антибиотик, ему стало лучше, он думает, зачем я буду зря свой организм травить этой «химией» – и прекращает приём. Как видно, история с первым пациентом, которого лечили и не долечили пенициллином, ничему нас не научила. И ещё Флеминг говорил, что нельзя принимать антибиотики профилактически, чтобы впредь не болеть, не кашлять, не сморкаться – это бессмысленно. Эти нарушения использования антибиотиков приводят к выработке у бактерий сопротивляемости (резистентности) к действию антибиотиков. Александр Флеминг не мог знать механизма приобретения резистентности, который сводит на нет усилия больших групп учёных: они открывают новый антибиотик, проводят длительные испытания, налаживают производство, но проходит несколько лет – и бактерии к нему адаптируются, ведь они тоже ищут способы выживания и мутируют. Эти бактерии-мутанты, на которых лекарство уже не действует, быстро распространяются в человеческой популяции. Теперь хорошо известно, что гены устойчивости, или резистентности, передаются через плазмиды – небольшие кольцевые молекулы ДНК. Бактерии, пользуясь этими плазмидами как транспортным средством, обмениваются между собой генетической информацией, таким образом, она довольно быстро распространяется в популяции. А если антибиотик не работает, значит надо искать другой, но бактерии и к нему через несколько лет опять становятся устойчивыми. Причиной этого «соревнования» антибиотиков и бактерий отчасти являются люди, которые сами себе назначают препараты и неправильно их принимают. Или начинают лечить антибиотиками вирусные инфекции, что совершенно недопустимо, поскольку на вирусы антибиотик не действует, так как у него нет клеточной стенки, ведь вирусы – это неклеточная форма жизни.
200 000 000 жизней
Переоценить вклад Флеминга в медицину и историю человечества невозможно. По разным оценкам, благодаря его открытию были спасены около двухсот миллионов жизней. Когда в 1955 году Александр Флеминг умер, в Греции, где они никогда не был, объявили национальный траур, в Барселоне цветочницы высыпали все цветы к мемориальной доске с его именем, а в Мадриде перед ареной Пласа-де-Торос-де-Лас-Вентас, где проходят корриды, ему поставили памятник на средства, собранные местными тореро. Дело в том, что матадоры часто гибли от сепсиса после операций и травм. Так провожали Флеминга, которого считали благодетелем человечества, полагая, что теперь при помощи медицинских открытий мы вот-вот справимся со всеми бактериальными болезнями.
Пожалуй, только одно открытие можно сравнить с антибиотиками – вакцинацию. Когда появились эффективные, надежные вакцины, и во всех странах были введены национальные календари профилактических прививок, продолжительность жизни резко пошла вверх. Закончились эпидемии и целые пандемии, когда гибли миллионы людей от чёрной оспы, чумы, дифтерии, кори, скарлатины…
Остается ещё череда непобедимых смертельных болезней – наиболее известные, наверное, рак и СПИД. Но есть надежда, что в XXI веке, неслучайно названном веком генетики, мы научимся справляться с ними и другими заболеваниями. И поможет в этом генетическая терапия, за которой, я думаю, будущее медицины. После 2003 года, когда был полностью прочитан геном человека, началось изучение работы генов в норме и при патологиях. Это открыло путь к профилактической медицине с учётом индивидуальных генетических особенностей каждого человека. Генотерапия позволит лечить болезнь не после того, когда она уже поразила человека, а до этого. Существует огромное количество наследственных синдромов, их описано около семи тысяч, и прочтение генома человека даёт надежду на то, что все эти болезни будут рано или поздно изучены, мы будем понимать, что произошло в том или ином гене, какая «опечатка», или мутация, которая привела к тем или иным сбоям. По прогнозам Френсиса Коллинза, руководителя проекта «Геном человека», к 2040 году всё здравоохранение будет полностью основано именно на геномике. И тогда лекарства в привычном понимании будут заменяться продуктами генов – организм сам будет вырабатывать «лекарства»-генетические пули, бьющие точно в цель тот ген, в котором возникла «неполадка». Это будущее рождается на наших глазах. Нет-нет да появляется сообщение, что, к примеру, с помощью генной терапии лечат тяжёлые формы наследственного иммунодефицита (так называемые «дети в пузыре»), некоторые виды лейкемии, фенилкетонурию, дистрофию Дюшена и ещё много тяжёлых болезней. Недавно в США начались клинические испытания, связанные с болезнью Паркинсона. И уже сейчас развернулась дискуссия о том, имеем ли мы право ещё до зачатия редактировать геномы эмбрионов или половых клеток, несущие те или иные мутантные гены.
Галина Муравник
Конечно, в связи с генетической терапией, собственно как и в борьбе с онкологией и другими тяжелыми болезнями, есть еще один сдерживающий фактор – не научный. Это проблема доступности. Генотерапевтическая помощь, конечно, пока очень дорогая – она высокотехнологична, трудоемка. Но порой те, кто владеют медицинскими технологиями, всё больше ориентированы на рынок и меньше – на исцеление больных. Патентуются не только сами технологии и лекарства, но и конкретные мутантные гены. Информация стоит больших денег. У нас в России завышаются цены и на лекарства, например, необходимые для поддержания жизни ВИЧ-инфицированных – в разы, по сравнению с европейскими странами, где и уровень жизни, и доходы выше. Так что вызов медицине брошен не только со стороны патогенных микроорганизмов и поврежденных мутациями генов. Много сил и стараний нужно инвестировать еще во что-то, чтобы человечество не пало жертвой внутривидовой борьбы, подобной той, которая существует между грибами и бактериями.
Как антибиотики становятся всё менее эффективными и почему важно ими не злоупотреблять? Рассказывает микробиолог
Почему борьба с микробами делает их еще более устойчивыми, как из-за этого усложняется лечение болезней, почему фармацевтическим компаниям невыгодно искать новые антибиотики и из-за чего люди часто заболевают в больницах?
Публикуем лекцию микробиолога Ильи Сережкина «Почему эпохе антибиотиков приходит конец» с фестиваля Science Bar Hopping, который Группа РОСНАНО и «Бумага» провели в Москве.
Микробиолог, сотрудник лаборатории микробной биотехнологии биофака МГУ
Когда в Европе в XIV веке распространилась чума, эпидемиология была на крайне низком уровне. Люди не понимали, что происходит, почему возникает болезнь, от которой абсолютно нет лечения. Считается, что в ходе эпидемии погибло около 60 миллионов человек. Cмертность составляла порядка 60-80 %.
Чуму пытались лечить, но ученые Средневековья, к сожалению, были далеки от истины и применяли такие методы лечения, как кровопускание, прижигание язв раскаленной кочергой и использовали снадобья из шкур жаб.
Тогда было две больших теории о том, как передаются заболевания. Первая — теория миазмов. Ученые считали, что заболевания передаются путем вдыхания человеком запаха. Ветер разносит ароматические молекулы, и таким образом болезнь распространяется. Идея интересная, но далека от истины. Вторая теория состояла в том, что между людьми распространяются некие семена болезни. Ученые того времени не могли понять, что это за семена, но у них была идея, что передача идет от человека к человеку.
Если собрать две эти теории вместе, то мы в принципе подойдем очень близко к тому, как на самом деле распространяются инфекционные заболевания. Только в конце XIX века ученые выяснили, что возбудителем чумы является бактерия под названием Yersinia pestis.
К XX веку наступил момент, когда микробов смогли не только идентифицировать, но и стали пытаться с ними взаимодействовать. Одним из тех, кто занялся этой проблемой, был британский ученый Александр Флеминг. Занимаясь исследованием золотистого стафилококка с помощью посевов на чашки Петри, он случайно обнаружил пенициллин. Тогда, в 1928 году, он не смог его полностью очистить и применить для лечения инфекций. Но через несколько лет двое английских ученых [Говард] Флори и [Эрнст Борис] Чейн обратили внимание на открытие Флеминга и продолжили его работу.
Поскольку в то время было неспокойно (близилась Вторая мировая война) ученые понимали, что будет необходимо средство для лечения инфекций, и они решили все-таки выделить пенициллин в чистом виде. Англия была под угрозой оккупации и выведенные штаммы пеницилла ученые взяли с собой. Легенда гласит, что они пропитали ими подложки своих пиджаков и уехали в США, чтобы сохранить ценную культуру микроорганизма и дальше с ней работать. Не знаю, насколько это правда, но очень похоже.
Флори и Чейн стали работать в Штатах. На улице, на рынках они брали образцы плесени и несли в лабораторию, чтобы найти более активные штаммы пеницилла. Поскольку у них было очень мало времени, они наняли для этого женщину по имени Мэри. Она обходила местные рынки и однажды принесла ученым заплесневелую дыню, пеницилл из которой дал наибольшую активность по выделению действующего вещества пенициллина. Таким образом, все ключевые продуценты пенициллина на земле являются потомками того пеницилла, который Мэри нашла на одной из дынь на местном рынке в Штатах.
В начале 1940-x годов пенициллин смогли применить для лечения заболеваний, и это открытие сыграет очень большую роль в истории человечества.
Вместе с внедрением антибиотиков появляются штаммы, которые абсолютно невосприимчивы к их действию. Так, в 1972 году в широкую практику вошел антибиотик ванкомицин. В 1988, через 16 лет, уже появились энтерококки, которые этот антибиотик не убивал. В 2002 году, спустя 30 лет, появились устойчивые стафилококки.
Если мы взглянем на современную динамику, то это нас еще менее порадует. Очень часто в новостях всплывают сообщения от американских или британских ученых о том, что появилась суперустойчивая бактерия, которую нельзя никак вылечить и которая может захватить всю планету. На самом деле это не означает, что болезнь действительно так широко распространится. Это означает, что нашли еще один микроб, который нельзя вылечить теми антибиотиками, которые имеются сейчас на рынке.
Устойчивость к антибиотику у разных видов микробов распространяется очень быстро. Это их механизм захвата мира. У этой проблемы есть очень далеко идущие последствия. На данный момент наиболее актуальная проблема штаммов в западном мире — проблема госпитальных (внутрибольничных инфекций). В больницах и стационарах микробы постоянно пытаются чем-то задушить. Либо это антисептики, либо антибиотики, которыми обрабатывают всё вокруг. И логично, что там будут выживать те микробы, которые устойчивы ко всем возможным воздействиям.
Больницы — это еще и отличное место для размножения микробов, так как это относительно замкнутая система и там находятся люди с ослабленным иммунитетом. Поэтому у микробов есть отличный выбор хозяев. По статистике, порядка 20-30 % людей, которые проходят лечение в стационарах в США, заболевают внутрибольничной инфекцией.
Процент микробов, устойчивых к различному спектру антибиотиков, с годами увеличивается всё больше. Одно из проявлений антибиорезистентности —усложнение лечения гонореи. В XX веке это заболевание лечилось довольно просто: с помощью пенициллина от нее предлагали избавиться за четыре часа. Но чем больше ее лечили, тем большую устойчивость к антибиотикам приобретали микробы. Сейчас вылечить гонорею стало довольно сложно.
Если сейчас количество случаев смертности от инфекций, вызываемых микробами, устойчивыми к антибиотикам, составляет примерно 700 тысяч человек на земле, то в 2050 году, по оценкам ученых, оно возрастет примерно до 10 млн ежегодно. Это больше смертности от рака и диабета вместе взятых. Причем проблема не только в самих смертях, но и в экономике. Ведь есть ещё и огромное количество людей, на лечение которых больницы и клиники государства потратят миллиарды долларов.
Проблема есть, и с ней пытаются работать. Но есть огромное число сложностей, и главное из них — что на данный момент большая часть антибиотиков уже открыта. С 2010 года я не видел ни одной новой статистики не только по открытию, но и по введении в практику новых классов антибиотиков.
Научные исследования требуют достаточно большого финансирования, и фармацевтическим компаниям просто не выгодно заниматься поиском новых антибиотиков. Пока работают те, которые сейчас есть на рынке, зачем заниматься поиском чего-то нового? Сложно, невыгодно, да и незачем. Если в 1990 году в США было 18 компаний, которые занимались этим, то в 2010 году их осталось всего четыре.
Тем не менее ученые работают над поиском новых антибиотиков и стараются что-то сделать. Но не факт, что они найдут эффективные подходы для лечения заболеваний. На наш век антибиотиков точно хватит, но мы не знаем, что будет через 50 лет. Возможно, на Земле никогда не появится инфекция, которая сможет убить всё человечество, а, возможно, это не так.
Но многое зависит от нас: мы должны ответственно подходить к нашим заболеваниям, не использовать антибиотики чрезмерно и советоваться с лечащим врачом.
Антибиотики: когда ждать новых препаратов?
Кто знает, как долго человечество еще обходилось бы без антибиотиков, если бы не случай. В начале XX века в Шотландии местный фермер спас утопающего в болоте мальчика, который оказался сыном лорда. Поскольку благородный спаситель отказался от денег, в благодарность аристократ пообещал оплатить для сына фермера наилучшее образование. Обещание он сдержал, чем, как мы теперь понимаем, оказал неоценимую услугу всему человечеству. Парень получил блестящее образование, и изучая плесневые грибы, в 1928 году открыл первый в мире антибиотик – пенициллин. Благодаря этому открытию, кстати, сын лорда был спасен в 1943 году во второй раз – уже от пневмонии. В дальнейшем, спасенный проживет долгую жизнь и, безусловно, войдет в историю человечества. Его имя – сэр Уи́нстон Леона́рд Спе́нсер-Че́рчилль. А человеком, который открыл для человечества Эру антибиотиков, был сэр Александр Флеминг.
Антибиотики – вещества природного происхождения или синтезированные, способные угнетать рост живых клеток или вызывать их гибель.
Золотая Эра антибиотиков начиналась бурно!Как это часто бывает в науке, открытие пенициллина послужило ключом к появлению новых антибиотиков, и до определенного времени этот процесс был достаточно активным. За несколько десятилетий человечество получило возможность победить практически любую инфекцию.
- 1928 – Пенициллин
- 1932 – Сульфонамид
- 1943 – Стрептомицин
- 1948 – Цефалоспорин
- 1987 – Даптомицин
Начиная с конца 60-х создавалось все меньше принципиально новых молекул, – рассказывает Анна Владимировна Зайченко, доктор медицинских наук, заведующая кафедрой фармакологии Национального медицинского университета им. А.А. Богомольца. – К примеру, в педиатрии за последние 30 лет (!) не было создано ни одной новой молекулы антибиотика. И даже, когда мы говорим о том, что в 2015 году из бактерии Eleftheria terrae в США было выделено антибактериальное вещество теиксобактин, нужно понимать, что это не значит, что оно стопроцентно когда-нибудь будет использоваться в лечебной практике и, в частности, в педиатрии.
Фармация действительно не имеет новых молекул. Но не потому, что нет источников, их много, но все сложнее и дороже становится выделять и получать те молекулы, которые безопасны для организма человека. Если посмотреть на всю линейку антибактериальных препаратов, представленных антибиотиками, то увидим, что из 20 групп с принципиально разной структурой и механизмами действия препаратов, есть только три механизма, обеспечивающих гибель микроорганизмов или замедление их жизнедеятельности.
Как видно из исследований последних лет, ученые уже ведут поиск антибиотиков среди макроорганизмов. Например, из крови крокодила выделено мощнейший антибиотик, равных которому нет. Оказалось, что между зубов этой рептилии живут анаэробные бактерии, вызывающие тяжелейший сепсис и очень быструю гибель животного – жертвы крокодила. Но ведь крокодилы и друг друга ранят во время драк, а у них при этом даже воспалений практически никогда не наблюдается! Этот факт побудил ученых подробно исследовать кровь рептилий и из нее впоследствии была выделена некая субстанция, которая способна справиться даже с патогенами, резистентными к антибиотикам. Продолжение следует?! В любом случае, препараты, которые проходят сейчас доклинические исследования (всего, по данным ВОЗ, таких более 250, но только 2-3 из них появятся на фармрынке в ближайшее десятилетие), хоть и отличаются инновационным характером, но до их практического внедрения может пройти достаточно много времени.
Сейчас наиболее перспективные для ближайших десяти лет исследований антибиотики выделены из членистоногих, крокодилов и саранчи.
Но есть и другая причина «тормозящая» разработку новых молекул – экономическая. Ведь цены на АБ остаются низкими, что не особо стимулирует фармпроизводителей к разработкам.
По заявлению Всемирной организации здравоохранения: «Сокращение объемов инвестиций частного сектора и низкий уровень инноваций в области создания новых антибиотиков подрывают усилия по борьбе с лекарственно-устойчивыми инфекциями».
Чувствительность и другие важные свойства антибиотиков
Терапевтическая эффективность любого лекарственного препарата – это совокупность случайностей и закономерностей, особенностей химической структуры и лекарственной формы.
В одном случае, нужны АБ, которые связываются с белком недостаточно сильно (т.е., уже находятся в активной форме и могут сразу начинать активно выполнять свою функцию – убивать микроорганизмы или замедлять их жизнедеятельность), поскольку, когда связь с белком прочнее и лекарственный препарат дольше циркулирует, то, увы, его фармакологическая активность наступает не сразу.
Важным показателем для антибиотика является минимальная ингибирующая концентрация: чем меньшей дозой препарата можно добиться антибактериального эффекта, тем меньше метаболическая нагрузка на организм (печень, органы экскреции, почки и др.), следовательно, тем эффективнее и безопаснее антибиотик.
Терапевтическая эффективность антибиотиков обуславливается 2 характеристиками:
- 1. Низкий уровень связывания с белками.
- 2. Низкая минимальная ингибирующая концентрация (МИК90):
- чувствительными являются микроорганизмы, которым достаточно 1 мг/л и менее;
- умеренно чувствительные – 2 мг/л;
- стойкие/резистентные – ≥ 4 мг/л.
Последний уровень чувствительности практически свидетельствует о том, инфекцию не удается контролировать, патологический процесс продолжается и нарастает, как нарастают и побочные эффекты ксенобиотика: органотоксичность, ототоксичность, нефротоксичность и прочие, а пациент погибает от инфекционно-токсического шока.
Липофильность, водорастворимость или гидрофильность влияют на выбор конкретного препарата.
Все зависит от того, в какую ткань необходимо доставить лекарство. Если это липофильная ткань и нужно проникнуть через мембраны липофильных органов центральной нервной системы (менингит, нервная ткань) – нужны липофильные препараты. А для лечения огнестрельных ранений, инфекций кожи, мягких тканей, мышц, связок и легких подходят только гидрофильные АБ.
Знать и использовать все фармакологические аспекты препаратов – большое искусство. По сути, именно провизор может помочь врачу сделать верный выбор препарата, поскольку более подробно изучал именно эту сторону медицины.
- На долю АБ приходится до 25% всех врачебных назначений (каждое четвертое назначаемое лекарство – антибиотик!)
- Затраты на АБ составляют от 30 до 50% затрат стационаров на лекарственные средства
В то же время до 50% назначений АБ являются нерациональными или не обоснованными.
Устойчивость к антибиотикам развивается у бактерий, а не у людей или животныхВсе больше инфекционных заболеваний, среди которых пневмония, туберкулез, гонорея и сальмонеллез, труднее поддаются лечению из-за снижения эффективности антибиотиков. Каждый день нерациональной антибактериальной терапии увеличивает риск развития резистентности микроорганизмов на 4%
Поэтому еще одной задачей терапии является достижение селекции и предотвращение антибиотикорезестентности. Важно помнить о том, что как только мы начинаем использовать АБ (а это химиотерапия, поскольку все антибиотики принадлежат к химиотерапевтическим средствам), мы обязаны минимизировать риски появления антибиотикорезистентных штаммов микроорганизмов. Ведь антибиотики – это средства, эффективность которых, к сожалению, снижается со временем и развитием антибиотикорезистентности, являющейся причиной ˃25000 смертей ежегодно в странах ЕС и ˃ 1,5 млрд евро материальных убытков.
Александр Флеминг Открытие и разработка пенициллина — ориентир
Пенициллин, Второй мировой войны и промышленное производство
Все более очевидная ценность пенициллина в военных действиях побудила Совет по военному производству (WPB) в 1943 году взять на себя ответственность за увеличение производства этого препарата. WPB исследовал более 175 компаний, прежде чем выбрать 21 компанию для участия в программе по пенициллину под руководством Альберта Элдера; Помимо Lederle, Merck, Pfizer и Squibb, Abbott Laboratories (которая также была одним из основных производителей клинических поставок пенициллина до середины 1943 года) была одной из первых компаний, начавших крупномасштабное производство.Эти фирмы получили первоочередное внимание на строительные материалы и другие материалы, необходимые для достижения производственных целей. WPB контролировал утилизацию всего производимого пенициллина.
Одна из основных целей состояла в том, чтобы иметь под рукой достаточный запас препарата для предполагаемого вторжения в Европу в день «Д». Ощущение военного патриотизма сильно стимулировало работу над пенициллином в Соединенном Королевстве и Соединенных Штатах. Например, Альберт Элдер писал производителям в 1943 году: «Вам настоятельно рекомендуется убедить каждого рабочего на вашем предприятии, что производимый сегодня пенициллин спасет чью-то жизнь через несколько дней или излечит болезнь кого-то, кто сейчас находится в недееспособности.Разместите лозунги на своем заводе! Помещайте извещения в конверты с зарплатой! Развивайте энтузиазм в работе вплоть до самого низшего рабочего на вашем предприятии ».
Когда общественность стала известна об этом новом «чудо-лекарстве», спрос на пенициллин увеличился. Но поначалу запасы были ограничены, и приоритет отдавался военному использованию.
Перед доктором Честером Кифером из Бостона, председателем комитета по химиотерапии Национального исследовательского совета, стояла незавидная задача — нормировать поставки препарата для использования в гражданских целях.Киферу пришлось ограничить использование препарата случаями, когда другие методы лечения не помогли. В его обязанности входил также сбор подробной клинической информации об использовании препарата, чтобы можно было лучше понять его потенциал и ограничения. Неудивительно, что Кифера осаждали просьбы о применении пенициллина. В газете «New York Herald Tribune» от 17 октября 1943 г. говорилось: «Многие миряне — мужья, жены, родители, братья, сестры, друзья — умоляют доктора Кифера дать пенициллин.В каждом случае заявителю предлагается организовать, чтобы лечащий врач отправил полное досье о состоянии пациента. Когда оно получено, решение принимается на основе медицинского, а не эмоционального обоснования ».
К счастью, производство пенициллина начало резко увеличиваться к началу 1944 года. Производство этого препарата в США подскочило с 21 миллиарда единиц в 1943 году до 1,663 миллиарда единиц в 1944 году, до более чем 6,8 триллиона единиц в 1945 году, и изменилась технология производства. по масштабу и сложности от литровых колб с выходом менее 1% до резервуаров на 10 000 галлонов с выходом 80-90%.В конечном итоге американское правительство смогло снять все ограничения на его доступность, и с 15 марта 1945 года пенициллин распространялся по обычным каналам и был доступен потребителю в его или ее угловой аптеке.
К 1949 году годовое производство пенициллина в Соединенных Штатах составляло 133 229 миллиардов единиц, а цена упала с двадцати долларов за 100 000 единиц в 1943 году до менее чем десяти центов. Большинство британских компаний перешли на производство пенициллина с глубокой ферментацией в резервуарах, впервые примененное в Соединенных Штатах после окончания войны для удовлетворения гражданских потребностей.В Соединенном Королевстве пенициллин впервые поступил в продажу в качестве лекарственного средства, отпускаемого только по рецепту, 1 июня 1946 года.
В Великобритании Чейн и Абрахам продолжали работать над структурой молекулы пенициллина, чему способствовала работа Дороти Ходжкин по рентгеновской кристаллографии, также в Оксфорде. Уникальной особенностью структуры, которая была окончательно установлена в 1945 году, является четырехчленное высоколабильное бета-лактамное кольцо, слитое с тиазолидиновым кольцом. В том же году Александр Флеминг, Ховард Флори и Эрнст Чейн были удостоены Нобелевской премии за свои исследования пенициллина.
Совместные усилия американских химиков, инженеров-химиков, микробиологов, микологов, правительственных агентств, а также производителей химикатов и фармацевтических препаратов были равны задаче, поставленной Ховардом Флори и Норманом Хитли в 1941 году. Как заметил Флори в 1949 году, «слишком высокий показатель. Нельзя отдать должное предприимчивости и энергии, с которой американские фирмы-производители взялись за крупномасштабное производство этого лекарства. Если бы не их усилия, к дню «Д» в Нормандии в 1944 году наверняка не хватило бы пенициллина для лечения все тяжелые потери, как британские, так и американские.«
К началу
История антибиотиков — HealthyChildren.org
Антибиотики: что в названии?
Термин «антибиотики» буквально означает «против жизни»; в данном случае против микробов. Существует много типов антибиотиков: антибактериальные, противовирусные, противогрибковые и противопаразитарные. Некоторые лекарства эффективны против многих организмов; их называют антибиотиками широкого спектра действия. Другие эффективны только против нескольких организмов и называются антибиотиками узкого спектра.Наиболее часто используемые антибиотики — это антибактериальные средства. Ваш ребенок мог получить ампициллин от ушной инфекции или пенициллин от ангины.
Когда ребенок болеет, родители волнуются. Даже если у него только легкая простуда, из-за которой он становится капризным и беспокойным, или болит ухо немного, это время может быть очень стрессовым. Конечно, вы хотите, чтобы он получил наилучшее лечение. Для многих родителей это означает отвести его к педиатру и покинуть кабинет с рецептом на антибиотики.
Но это не обязательно то, что произойдет во время визита к врачу. После осмотра вашего ребенка ваш педиатр может сказать вам, что на основании симптомов вашего ребенка и, возможно, некоторых результатов анализов, антибиотики просто не нужны.Многие родители удивлены таким решением. В конце концов, антибиотики — мощные лекарства, которые десятилетиями облегчают человеческую боль и страдания. Они даже спасли жизни. Но большинство врачей не так быстро достают свои рецептурные блокноты, как раньше.В последние годы они понимают, что у выбора антибиотиков есть обратная сторона: если эти лекарства используются, когда они не нужны или принимаются неправильно, они могут подвергнуть вашего ребенка большему риску для здоровья. Совершенно верно — антибиотики нужно назначать и использовать с осторожностью, иначе их потенциальная польза для всех уменьшится.
Взгляд назад
Серьезные болезни, от которых ежегодно умирают тысячи молодых людей, были почти ликвидированы во многих частях мира благодаря широкому использованию детских прививок.
Точно так же открытие противомикробных препаратов (антибиотиков) было одним из самых значительных медицинских достижений 20 века. Существует несколько типов противомикробных препаратов: антибактериальные, противовирусные, противогрибковые и противопаразитарные. (Хотя антибактериальные препараты часто называют общим термином «антибиотики», мы будем использовать более точный термин.) Конечно, противомикробные препараты — не волшебные палочки, которые могут вылечить любую болезнь. При своевременном использовании они могут вылечить многие серьезные и опасные для жизни заболевания.
Антибактериальные препараты специально разработаны для лечения бактериальных инфекций. Миллиарды микроскопических бактерий обычно живут на коже, в кишечнике, во рту и горле. Большинство из них безвредны для человека, но некоторые из них являются патогенными (вызывают заболевания) и могут вызывать инфекции ушей, горла, кожи и других частей тела. В доантибиотическую эру начала 1900-х годов у людей не было лекарств от этих распространенных микробов, и в результате человеческие страдания были огромными. Несмотря на то, что иммунная система организма, борющаяся с болезнями, часто может успешно бороться с бактериальными инфекциями, иногда микробы (микробы) слишком сильны, и ваш ребенок может заболеть.Например,
До лечения антибиотиками 90% детей с бактериальным менингитом умирали. Среди выживших детей у большинства были тяжелые и стойкие нарушения, от глухоты до умственной отсталости.
Стрептококковая инфекция в горле иногда была смертельной болезнью, а ушные инфекции иногда передавались из уха в мозг, вызывая серьезные проблемы.
Другие серьезные инфекции, от туберкулеза до пневмонии и коклюша, были вызваны агрессивными бактериями, которые размножались с необычайной скоростью и приводили к серьезным заболеваниям, а иногда и к смерти.
Появление пенициллина
С открытием пенициллина и началом эры антибиотиков собственная защита организма обрела мощного союзника. В 1920-х годах британский ученый Александр Флеминг работал в своей лаборатории в больнице Святой Марии в Лондоне, когда почти случайно обнаружил естественно растущее вещество, которое могло атаковать определенные бактерии. В одном из своих экспериментов в 1928 году Флеминг наблюдал колонии обычных бактерий Staphylococcus aureus, которые были истощены или уничтожены плесенью, растущей на той же чашке или чашке Петри.Он определил, что плесень представляет собой вещество, способное растворять бактерии. Он назвал это вещество пенициллин в честь плесени Penicillium, из которой оно изготовлено. Флеминг и другие провели серию экспериментов в течение следующих двух десятилетий с использованием пенициллина, удаленного из культур плесени, которые показали его способность уничтожать инфекционные бактерии.
Вскоре другие исследователи в Европе и США начали воссоздавать эксперименты Флеминга. Они смогли произвести достаточно пенициллина, чтобы начать его тестирование на животных, а затем на людях.Начиная с 1941 года они обнаружили, что даже низкие уровни пенициллина излечивают очень серьезные инфекции и спасают множество жизней. За свои открытия Александр Флеминг получил Нобелевскую премию по физиологии и медицине.
Фармацевтические компании были очень заинтересованы в этом открытии и начали производить пенициллин в коммерческих целях. Он широко использовался для лечения солдат во время Второй мировой войны, лечения ран на полях сражений и пневмонии. К середине-концу 1940-х годов он стал широко доступен для широкой публики.Заголовки газет приветствовали его как чудодейственное лекарство (хотя ни одно лекарство никогда не подходило под это описание).
С успехом пенициллина началась гонка за производством других антибиотиков. Сегодня педиатры и другие врачи могут выбирать из десятков антибиотиков, представленных на рынке, и их назначают в очень большом количестве. Ежегодно в Соединенных Штатах выписывается не менее 150 миллионов рецептов на антибиотики, многие из которых предназначены для детей.
Проблемы с антибиотиками
Успех антибиотиков был впечатляющим.В то же время, однако, ажиотаж по поводу них был сдержан феноменом, называемым устойчивостью к антибиотикам. Эта проблема возникла вскоре после введения пенициллина и теперь ставит под угрозу полезность этих важных лекарств.
Практически с самого начала врачи отметили, что в некоторых случаях пенициллин был бесполезен против определенных штаммов Staphylococcus aureus (бактерий, вызывающих кожные инфекции). С тех пор эта проблема устойчивости обострилась, вовлекая другие бактерии и антибиотики.Это проблема общественного здравоохранения. Все чаще некоторые серьезные инфекции становится все труднее лечить, что вынуждает врачей прописывать второй или даже третий антибиотик, когда первое лечение не помогает.
В свете растущей устойчивости к антибиотикам многие врачи стали более осторожными при назначении этих лекарств. Они видят важность назначения антибиотиков только тогда, когда они абсолютно необходимы. Фактически, одно недавнее исследование офисных врачей, опубликованное в JAMA: The Journal of the American Medical Association в 2002 году, показало, что врачи снизили количество рецептов на антибиотики, которые они выписывали детям с распространенными респираторными инфекциями, примерно на 40% в течение 1990-х годов. .
Антибиотики следует использовать с умом и только в соответствии с указаниями вашего педиатра. Следуя этим рекомендациям, их жизненно важные свойства будут сохранены для вашего ребенка и будущих поколений.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Открытие антибиотиков — Часть 1 — ReAct
Антибиотики изменили здоровье человека, спасая миллионы жизней и облегчая многие человеческие страдания. Однако в большинстве стран мира легко принять лечение антибиотиками как должное, и мы склонны забывать, что лекарства были открыты менее века назад.
В 1928 году шотландский бактериолог Александр Флеминг вернулся из летних каникул и был встречен неожиданным зрелищем в своей лаборатории в Св.Больница Мэри, Лондон. Некоторые из его чашек Петри, содержащие бактерию Staphylococcus aureus , были заражены плесенью. Тщательно поместив чашки под микроскоп, он заметил, что плесень создала зону, свободную от микробов, в которой бактерии не росли. Флеминг пришел к выводу, что плесень должна продуцировать антибактериальный агент, который не только подавляет рост стафилококков, но, что более важно, может использоваться для борьбы с инфекционными заболеваниями. Известно, что Флеминг написал об этой красной букве даты:
.«Когда я проснулся сразу после рассвета 28 сентября 1928 года, я определенно не планировал произвести революцию во всей медицине, открыв первый в мире антибиотик или убийцу бактерий.Но я думаю, что это именно то, что я сделал ».
Однако заслуга Флеминга заключалась не только в том, что первый антибиотик, который он позже назвал пенициллин, стал одним из наиболее широко используемых лекарств в мире. Примерно десять лет спустя австралийский патолог Ховард Флори и биохимик немецкого происхождения Эрнст Чейн выделили активное вещество пенициллин и провели первые тесты на мышах. С многообещающими результатами новый препарат был готов к использованию на людях в 1941 году.
Одним из первых пациентов, прошедших курс лечения пенициллином, был британский полицейский по имени Альберт Александер, который заболел смертельной инфекцией после того, как поцарапался о куст роз.После пяти дней инъекций пенициллина инфекция начала исчезать, но, поскольку чистого пенициллина для полного излечения было недостаточно, у Александра в конце концов случился рецидив, и он умер через месяц.
Позже в том же году Флори и Чейну удалось разработать методы массового производства пенициллина, который как раз был вовремя для лечения множества раненых солдат во время Второй мировой войны. В следующем году было произведено 400 миллионов единиц чистого пенициллина, а к концу войны американские фармацевтические компании производили 650 миллиардов единиц в месяц.Эпоха антибиотиков действительно началась, и в 1945 году Флеминг, Флори и Чейн были совместно удостоены Нобелевской премии по физиологии и медицине.
Сотрудники лаборатории по разработке пенициллина, Англия (1943 г.). Автор фотоотдела Министерства информации, Стоун Ричард [общественное достояние], через Wikimedia Commons.На волне безудержного оптимизма одним из первых, кто призвал к осторожности в отношении нового препарата, был сам Флеминг. В своей Нобелевской лекции 1945 года Флеминг дальновидно предупреждал об опасностях злоупотребления пенициллином:
«В лаборатории нетрудно сделать микробов устойчивыми к пенициллину, подвергая их концентрациям, недостаточным для их уничтожения, и то же самое время от времени происходило в организме.Может наступить время, когда пенициллин сможет купить кто угодно в магазинах. Тогда есть опасность, что невежественный человек может легко недодозировать себя и, подвергая свои микробы воздействию нелетального количества препарата, сделает их устойчивыми ».
Вскоре предсказания Флеминга сбылись. Первый случай устойчивости к пенициллину был зарегистрирован в 1947 году. Период между 1950 и 1960 годами часто называют золотым веком открытия антибиотиков, поскольку половина антибиотиков, обычно используемых сегодня, была открыта именно в эти годы.
Новые возможности для человечества
С появлением антибиотиков инфекционные заболевания, которые раньше приводили к гибели людей или тяжелым увечьям, теперь стали рассматриваться как легко поддающиеся лечению. Например, выживаемость при бактериальной пневмонии резко увеличилась с 20% до 85% в период с 1937 по 1964 год.
Без сомнения, антибиотики произвели революцию в медицине во многих отношениях и являются предпосылкой современного высокотехнологичного здравоохранения. Возможно, большинство людей связывают антибиотики с успешным лечением бактериальных инфекций дыхательных путей (например,например, пневмония, отит и синусит), инфекции мочевыводящих путей (ИМП) или желудочно-кишечные инфекции. Однако без антибиотиков было бы невозможно проводить трансплантацию органов, химиотерапию рака, интенсивную терапию и другие хирургические процедуры, такие как замена тазобедренного сустава. Кроме того, уход за недоношенными детьми станет более трудным и потенциально опасным для жизни, поскольку эти дети менее способны бороться с инфекциями.
По сути, неправильное использование антибиотиков ускоряет появление и распространение устойчивых к антибиотикам бактерий.Сегодня мы также наблюдаем тревожный рост числа новых штаммов бактерий, устойчивых к нескольким антибиотикам одновременно (известных как бактерии с множественной лекарственной устойчивостью или супербактерии). Такие бактерии могут в конечном итоге стать устойчивыми ко всем существующим антибиотикам, и тогда мы вступим в постантибиотическую эру.
© Уппсальский университет
История разработки антибиотиков — Антибиотики — ReAct
Краткая история разработки антибиотиков как лекарств
1928: Александр Флеминг открыл первый антибиотик — пенициллин.Однако прошло более десяти лет, прежде чем пенициллин стал применяться для лечения бактериальных инфекций
1930-е годы: Первым коммерчески доступным антибактериальным средством был пронтозил, сульфонамид, разработанный немецким биохимиком Герхардом Домагком.
1945: Пенициллин широко применялся для лечения бактериальных инфекций. Это стало возможным благодаря работе Флори и Чейна, которым удалось эффективно очистить антибиотик и увеличить производство.Введение пенициллина положило начало так называемой «золотой эре» антибиотиков
1940-1962: Золотая эра антибиотиков. Большинство классов антибиотиков, которые мы используем сегодня в качестве лекарств, были открыты и представлены на рынке. Каждый класс обычно содержит несколько антибиотиков, которые были обнаружены с течением времени или являются модифицированными версиями предыдущих типов. Например, существует множество β-лактамов (выраженных бета-лактамов), таких как различные пенициллины и цефалоспорины.
Отсутствие новых антибиотиков
Сегодня в разработке очень мало новых антибиотиков. В то же время устойчивые к антибиотикам бактерии, которые выживают после лечения антибиотиками, становятся все более и более распространенными, что делает доступные антибиотики неэффективными. Таким образом, мы неизбежно сталкиваемся с серьезной проблемой со здоровьем. Подробнее о проблемах с открытием и разработкой антибиотиков читайте в разделе «Как мы здесь оказались?» — Несколько антибиотиков в стадии разработки.
Избранные ресурсы
| Ресурс | Описание |
| Сайт изучения устойчивости к противомикробным препаратам — Исторические перспективы | Сайт курса .Исторический обзор лечения бактериальных заболеваний с древних времен до эпохи до антибиотиков, вплоть до открытия и разработки антибиотиков. Включает видео / документальные фильмы. Прокрутите вниз, чтобы получить доступ к учебным модулям «Эра до антибиотиков» и «Золотой век антибиотиков и синтетических антибактериальных препаратов». |
| Антибиотики и устойчивость к бактериям в 21 веке | Журнальная статья , в которой описаны подходы к разработке антибактериальных средств и история установленных классов антибиотиков. |
Александр Флеминг, первооткрыватель антибиотических эффектов пенициллина · Frontiers for Young Minds
Абстрактные
В 1928 году сэр Александр Флеминг наблюдал бактерицидный эффект пенициллина в своей лаборатории в Лондоне. Это был первый шаг к открытию одного из важнейших столпов современной медицины: антибиотиков. Потребовалось много лет, чтобы найти способ производить пенициллин в больших количествах, а крупномасштабное производство началось только в 1945 году.Однако до сих пор Флеминг считается отцом антибиотиков, и без его открытия мы не смогли бы лечить многие инфекции, вызванные бактериями. Это означает, что без антибиотиков даже небольшая инфицированная рана может стать смертельной. Кроме того, хирургическое вмешательство намного безопаснее с антибиотиками, и люди со слабой иммунной системой (например, дети или пожилые люди) теперь могут легко вылечиться от бактериальных инфекций. Однако бактерии становятся устойчивыми к антибиотикам, что также было предсказано Флемингом в 1945 году во время его речи на присуждении Нобелевской премии.
Маленькие враги и друзья
Бактерии очень важны для нас. Они живут на нас и внутри нас, и мы используем их для получения определенных питательных веществ из пищи, среди прочего (подробнее читайте в этой статье «Молодые умы»; Мы никогда не одиноки: жизнь с человеческой микробиотой [1]). Но некоторые бактерии, называемые патогенами , также могут вызывать инфекции, а некоторые патогены могут быть очень опасными. Патогенные бактерии являются одним из основных предметов микробиологии [2], которая изучает микроорганизмы: крошечные формы жизни, которые нельзя увидеть невооруженным глазом.Микробиологи сталкиваются с теми же вопросами с момента открытия бактерий. Как бактерии заражают людей и, самое главное, можно ли что-нибудь сделать, чтобы их остановить?
Отдельную бактерию можно увидеть только в микроскоп. Однако большинство бактерий хорошо растут в среде с большим количеством питательных веществ, и бульоны, очень богатые питательными веществами (также известные как жидкая среда), могут использоваться для выращивания бактерий [2]. Если пробирку со стерильным бульоном и небольшим количеством бактерий в ней инкубировать при определенной температуре, жидкость в течение нескольких часов станет мутной и даже может изменить цвет.Если в бульон добавить желеобразное вещество, и смесь нагреть до плавления желе, это вещество можно затем разлить по тарелкам (также известным как чашки Петри ), чтобы остыть, вы получите богатый питательными веществами желе, также известное как твердая среда. Бактерии можно культивировать на поверхности твердой среды. Если мы добавим достаточно бактерий, они покроют всю поверхность богатого питательными веществами желе. Если бактерии разбавить и распределить по пластине в достаточной степени, отдельная бактерия будет размножаться настолько, что в конечном итоге образует большую группу бактерий, видимую невооруженным глазом, которую мы называем бактериальной колонией .Если исходный источник бактерий содержал более одного типа, на твердой среде могли расти колонии различных видов бактерий. Когда мы касаемся только одной из этих колоний стерильным предметом и переносим бактерии в стерильную жидкую или твердую среду, мы можем получить чистую культуру, которая должна содержать только один тип бактерий [2]. Обычно микробиологи работают с чистыми культурами, чтобы сделать четкие выводы из своих экспериментов с одним типом бактерий. Однако, если их работа не выполняется в стерильных условиях, пробирки и чашки могут быть заражены другими бактериями или даже некоторыми микроскопическими грибами, живущими в окружающей среде.Если это произойдет, большинство микробиологов откажутся от этой культуры и начнут заново. Но Флеминг отличался от большинства микробиологов.
Авария ждет своего часа…
Утром в понедельник, 3 сентября 1928 года, Флеминг возвращался с семейного отдыха [3]. Перед отъездом в отпуск Флеминг работал с очень распространенным патогеном: Staphylococcus aureus . Флеминг оставил на своем лабораторном столе несколько стеклянных чашек Петри, где эти бактерии росли на поверхности твердой среды.Обычно эти чашки стерилизуют лаборант, чтобы повторно использовать их в других экспериментах. Однако Флеминг всегда окончательно смотрел на все свои эксперименты, прежде чем выбросить их, даже если они неделями стояли на скамейке (рис. 1А). Он наугад брал образцы из стопки тарелок, чтобы посмотреть, не произошло ли что-нибудь интересное за последние несколько недель. Поскольку его лаборатория была довольно примитивной, на тарелках Флеминга обычно были загрязнения, которые часто вызывались дрожжами и плесенью из окружающей среды.Но одна тарелка выглядела совсем иначе, и когда он заметил эту тарелку, он, как известно, сказал: «Это забавно…». Планшет был засеян плотной культурой бактерий, но он также был заражен микроскопическим грибком, который образовал большую колонию на боковой стороне чашки. Что было необычно, так это то, что бактерии не могли расти в области, близкой к колонии грибов. Вокруг грибка была хорошо видимая область, полностью свободная от бактерий; сегодня мы называем это зоной подавления (рис. 1В).Таким образом, Флеминг обнаружил, что гриб ( Penicillium notatum ) производит нечто, убивающее Staphylococcus aureus , опасный патоген. Флеминг только что открыл антибиотик и сначала назвал его «плесневым соком» [3].
- Рисунок 1 — (A) Сэр Александр Флеминг на своем лабораторном столе в Лондоне (1943 г.).
- (B) Флеминг заметил, что колония гриба ( Penicillum notatum ) заразила чашку Петри, засеянную S.aureus , опасный бактериальный патоген. Интересно, что S. aureus не смог расти на территории, окружающей колонию P. notatum . Флеминг пришел к выводу, что грибок вырабатывает что-то, что убивает S. aureus в зоне ингибирования.
В то время ни Флеминг, ни его коллеги не думали, что это открытие может иметь какое-либо реальное значение, а реальное значение было продемонстрировано только спустя более десяти лет. Однако Флеминг только что открыл биологическую войну, которая существует между различными микроорганизмами, борющимися за космос в среде, богатой питательными веществами [2].Флеминг не создавал пенициллин, он заметил, что колония микроскопического гриба вырабатывает пенициллин как способ конкурировать с бактериями за питательные вещества на почти выброшенной тарелке. С тех пор микробиологи вели поиск новых антибиотиков в природе, чтобы проверить, могут ли какие-либо другие микроорганизмы продуцировать антибиотики, и этот подход оказался очень успешным. После идентификации нового противомикробного вещества это вещество очищается и может быть химически модифицировано, чтобы упростить производство нового антибиотика в больших количествах или создание новых версий исходного вещества.Мы все еще ищем новые антибиотики, и каждый может принять в этом участие с помощью таких инициатив, как «Swab and Send» [4].
Как работает пенициллин?
Способ, которым пенициллин препятствует росту бактерий, не был понят до 1980 года. Теперь мы знаем, что пенициллин подавляет активность определенных ферментов в бактериях, называемых пенициллин-связывающими белками (PBP), которые необходимы большинству бактерий для создания стены, покрывающей их клетки. Без этой стенки бактериальные клетки гораздо больше подвержены воздействию окружающей среды и могут очень легко погибнуть при изменении окружающей среды.В присутствии пенициллина бактерии не могут производить эту клеточную стенку, чтобы защитить себя, и они умирают. Пенициллин является частью семейства аналогичных антибиотиков, называемых β-лактамами, и многие бактерии становятся устойчивыми к β-лактамам либо за счет выработки ферментов, которые расщепляют эти антибиотики, либо путем приобретения модифицированных версий PBP, которые больше не связываются с пенициллином [2 ].
Сопротивление растет…
Во время своего выступления на вручении Нобелевской премии 1945 года Флеминг также предсказал, что бактерии могут стать устойчивыми к антибиотикам.Это просто происходит из-за эволюции, потому что бактерии могут очень быстро адаптироваться, чтобы преодолеть любые препятствия, ограничивающие их рост. Изменения, которые помогают бактериям адаптироваться, могут быть вызваны случайными мутациями в их ДНК, и этот процесс происходит очень быстро — вы почти можете видеть, как это происходит в реальном времени! [5]. Кроме того, многие из микроорганизмов, продуцирующих антибиотики, также имеют гены, которые делают их устойчивыми к этим антибиотикам. Бактерии очень хорошо получают ДНК от других организмов, чтобы получить новые способности.Это называется горизонтальным переносом генов [2]. Если патогенные бактерии приобретают гены, которые делают их устойчивыми к определенному антибиотику, этот антибиотик становится бесполезным в клинике. Чтобы предотвратить резистентность к антибиотикам, антибиотики следует использовать только при необходимости (например, вирусы не могут быть уничтожены антибиотиками, поэтому их не следует принимать при вирусных инфекциях), следует использовать правильную дозу (поскольку слишком низкая доза может помочь создать устойчивые штаммы), и мы должны принимать антибиотики в течение всего времени, пока они прописаны, чтобы убивать все бактерии, вызывающие инфекцию.Если мы не предпримем эти шаги, мы можем способствовать распространению устойчивости к антибиотикам, а это огромная проблема. Фактически, наиболее опасные бактериальные патогены становятся устойчивыми ко многим антибиотикам [2]. Компании-производители лекарств теряют интерес к разработке новых антибиотиков, потому что эти лекарства могут быть нерентабельными по мере роста устойчивости к антибиотикам. Следовательно, скорость открытия новых антибиотиков недостаточна, чтобы справиться с появлением новых, устойчивых к антибиотикам патогенов.Вскоре мы можем вернуться в доантибиотическую эру, когда людей, инфицированных бактериями, нельзя было эффективно лечить.
Заключение
Открытие пенициллина было возможно только в лаборатории, где заражение было обычным явлением. Случайность, безусловно, сыграла роль в открытии первого антибиотика, но обучение и лабораторная практика Флеминга были важны для него, чтобы определить одно из самых важных лекарств в истории человечества. К сожалению, из-за устойчивости к антибиотикам микробиологи участвуют в гонке с бактериальными патогенами, чтобы найти новые способы лечения инфекций.Сегодня мы лучше понимаем, как патогены взаимодействуют со своими хозяевами, как действуют противомикробные препараты и каковы механизмы устойчивости к антибиотикам. Но даже через 90 лет после открытия пенициллина предстоит еще многое сделать для борьбы с нынешним кризисом в области антибиотиков. Вы можете стать частью этого, приняв участие в инициативе Swab and Send!
Глоссарий
Патоген : ↑ Микроорганизм, который проникает в организм и вызывает инфекцию.
Чашка Петри : ↑ Стеклянная или пластиковая чашка с крышкой, используемая для культивирования живых клеток.
Бактериальная колония : ↑ Группа бактериальных клеток, растущих вместе на поверхности твердой среды, видимых невооруженным глазом.
Зона ингибирования : ↑ Область, окружающая источник антибиотика, в которой не растут бактериальные колонии.
Конфликт интересов
Автор заявляет, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
[1] ↑ Да Силва, Г., и Домингес, С. 2017. Мы никогда не одиноки: живем с человеческой микробиотой. Фронт. Молодые умы 5:35. DOI: 10.3389 / frym.2017.00035
[2] ↑ Мэдиган Т. М., Бендер К. С., Бакли Д. Х., Саттли В. М. и Шталь Д. А. 2018. Брок Биология микроорганизмов. 15-е издание . Лондон: Пирсон.
[3] ↑ Brown, K. 2017. Penicillin Man, Alexander Fleming and the Antibiotic Revolution .Челтенхэм: История Press.
[4] ↑ Swab and Send Initiative. Доступно в Интернете по адресу: https://www.lstmed.ac.uk/public-engagement/swab-send
[5] ↑ Кишони Р. 2016. Эволюция бактерий на чашке Петри «Мега-тарелка» . Доступно в Интернете по адресу: https://commons.wikimedia.org/wiki/File:Kishony_lab-The_Evolution_of_Bacteria_on_a_Mega-Plate.webm
Реальная история создания пенициллина
Открытие пенициллина, одного из первых в мире антибиотиков, знаменует собой настоящий поворотный момент в истории человечества — когда у врачей наконец появился инструмент, который мог полностью вылечить своих пациентов от смертельных инфекционных заболеваний.
Многие школьники могут читать основы. Пенициллин был открыт в Лондоне в сентябре 1928 года. Как гласит история, доктор Александр Флеминг, дежурный бактериолог в больнице Святой Марии, вернулся из летних каникул в Шотландии и обнаружил грязный лабораторный стол и многое другое.
Изучив несколько колоний Staphylococcus aureus, доктор Флеминг заметил, что плесень под названием Penicillium notatum заразила его чашки Петри. Аккуратно поместив чашки под микроскоп, он с удивлением обнаружил, что плесень препятствует нормальному росту стафилококков.
Сэр Александр Флеминг (1881-1955) изучает культуру из пробирки с помощью ручной линзы. Фото Криса Уэра / Getty Images.
Флемингу понадобилось еще несколько недель, чтобы вырастить достаточно привередливой плесени, чтобы он смог подтвердить свои выводы. Его выводы оказались феноменальными: в плесени Penicillium был некий фактор, который не только подавлял рост бактерий, но, что более важно, мог использоваться для борьбы с инфекционными заболеваниями.
Как известно д-р Флеминг об этой красной дате: «Когда я проснулся сразу после рассвета 28 сентября 1928 года, я определенно не планировал произвести революцию во всей медицине, открыв первый в мире антибиотик или убийцу бактерий.Но я думаю, что это именно то, что я сделал ».
Четырнадцать лет спустя, в марте 1942 года, Энн Миллер стала первым гражданским пациентом, успешно прошедшим курс лечения пенициллином. Она лежала при смерти в больнице Нью-Хейвен в Коннектикуте после выкидыша и развития инфекции, приведшей к заражению крови.
Но в этой исторической последовательности событий есть гораздо больше.
На самом деле, у Флеминга не было ни лабораторных ресурсов в Сент-Мэри, ни химического образования, чтобы предпринять следующие гигантские шаги по выделению активного ингредиента сока пенициллиевой плесени, его очистке, выяснению, против каких микробов он эффективен и как его использовать. Это.Эта задача выпала на долю доктора Ховарда Флори, профессора патологии, который был директором Школы патологии сэра Уильяма Данна при Оксфордском университете. Он был мастером в получении исследовательских грантов от скупых бюрократов и абсолютным волшебником в управлении большой лабораторией, заполненной талантливыми, но необычными учеными.
Эта знаковая работа началась в 1938 году, когда Флори, который давно интересовался тем, как бактерии и плесень естественным образом убивают друг друга, наткнулся на статью Флеминга о плесени пеницилла, листая некоторые старые выпуски Британского журнала экспериментальной патологии.Вскоре после этого Флори и его коллеги собрались в его хорошо укомплектованной лаборатории. Они решили разгадать науку о том, что Флеминг назвал «антибактериальным действием пенициллия».
Чашка Петри с пенициллином, демонстрирующая его ингибирующее действие на одни бактерии, но не на другие. Фото Keystone Features / Getty Images.
Одним из самых талантливых сотрудников Флори был биохимик, доктор Эрнст Чейн, еврейский немецкий эмигрант. Чейн был резким, резким и остро чувствительным человеком, который постоянно боролся с Флори из-за того, кто заслужил признание за разработку пенициллина.Несмотря на свои сражения, они произвели серию неочищенных экстрактов культуральной жидкости из пенициллий-плесени.
Летом 1940 года их эксперименты были сосредоточены на группе из 50 мышей, которых они заразили смертельным стрептококком. Половина мышей умерла ужасной смертью от тяжелого сепсиса. Остальные, которым вводили пенициллин, выжили.
Именно тогда Флори понял, что у него достаточно многообещающей информации, чтобы испытать препарат на людях. Но оставалась проблема: как произвести достаточно чистого пенициллина для лечения людей.Несмотря на усилия по увеличению урожайности культур плесени, потребовалось 2000 литров жидкости для культивирования плесени, чтобы получить достаточно чистого пенициллина для лечения одного случая сепсиса у человека.
В сентябре 1940 года 48-летний констебль оксфордской полиции Альберт Александер представил первый тестовый пример. Александр порезался, работая в розарии. Царапина, зараженная стрептококками и стафилококками, распространилась на его глаза и кожу головы. Хотя Александра поместили в больницу Рэдклиффа и лечили дозами сульфамидных препаратов, инфекция обострилась и привела к тлеющим абсцессам в глазу, легких и плече.Флори и Чейн услышали об ужасном случае за высоким столом однажды вечером и сразу же спросили врачей Рэдклиффа, могут ли они попробовать их «очищенный» пенициллин.
После пяти дней уколов Александр начал поправляться. Но у Чейна и Флори не было достаточно чистого пенициллина, чтобы искоренить инфекцию, и Александр в конце концов умер.
Лаборант исследует флаконы с культурой пенициллина, взятые Джеймсом Ярчем для журнала Illustrated в 1943 году.
Другой важной фигурой в лаборатории был биохимик д-р.Норман Хитли, который использовал все доступные контейнеры, бутылки и поддоны для выращивания чанов с плесенью пенициллина, откачал жидкость и разработал способы очистки антибиотика. Самодельная фабрика по производству пресс-форм, которую он построил, была настолько удалена, насколько это возможно, от огромных резервуаров для ферментации и сложной химической технологии, которые характерны для современного производства антибиотиков сегодня.
Летом 1941 года, незадолго до того, как Соединенные Штаты вступили во Вторую мировую войну, Флори и Хитли вылетели в Соединенные Штаты, где они работали с американскими учеными в Пеории, штат Иллинойс., чтобы разработать средство массового производства того, что стало известно как чудо-наркотик.
Зная, что гриб Penicillium notatum никогда не даст достаточно пенициллина для надежного лечения людей, Флори и Хитли искали более продуктивный вид.
В один жаркий летний день приехала лаборант Мэри Хант с дыней, которую она купила на рынке и была покрыта «красивой золотой плесенью». По счастливой случайности плесень оказалась грибком Penicillium chrysogeum, и она давала в 200 раз больше пенициллина, чем виды, описанные Флемингом.Тем не менее, даже этот вид требовал улучшения с помощью вызывающих мутации рентгеновских лучей и фильтрации, что в конечном итоге произвело в 1000 раз больше пенициллина, чем первые партии из Penicillium notatum.
На войне пенициллин доказал свою стойкость. На протяжении всей истории главным убийцей в войнах была инфекция, а не боевые травмы. Во время Первой мировой войны уровень смертности от бактериальной пневмонии составлял 18 процентов; во время Второй мировой войны он упал до менее 1 процента.
Это таблица пенициллина в U.Эвакуационный госпиталь С. в Люксембурге в 1945 году. Фото Photo12 / UIG.
С января по май 1942 года было произведено 400 миллионов единиц чистого пенициллина. К концу войны американские фармацевтические компании производили 650 миллиардов единиц в месяц.
По иронии судьбы, Флеминг мало работал над пенициллином после своих первых наблюдений в 1928 году. Начиная с 1941 года, после того, как репортеры начали освещать первые испытания антибиотика на людях, невзрачный и мягкий Флеминг прославился как первооткрыватель пенициллина.И, к тихому ужасу Флори, вклад Оксфордской группы практически не был учтен.
Эта проблема была частично исправлена в 1945 году, когда Флеминг, Флори и Чейн — но не Хитли — были удостоены Нобелевской премии по физиологии и медицине. В своей приветственной речи Флеминг дальновидно предупредил, что чрезмерное употребление пенициллина может привести к резистентности бактерий.
В 1990 году Оксфорд восполнил оплошность Нобелевского комитета, присвоив Хитли первую за свою 800-летнюю историю почетную докторскую степень по медицине.
Может быть, 28 сентября, празднуя великое достижение Александра Флеминга, мы вспомним, что пенициллин также требовал акушерства Флори, Чейна и Хитли, а также целой армии лабораторных работников.
У вас есть вопрос к доктору Маркелю о том, как возник конкретный аспект современной медицины? Отправьте их нам по адресу [email protected].
Александр Флеминг | Институт истории науки
В 1928 году Александр Флеминг открыл пенициллин, хотя и не осознавал всей важности своего открытия по крайней мере еще десять лет.В конце концов он получил Нобелевскую премию по физиологии и медицине в 1945 году.
Еще в 19 веке наблюдался антагонизм между некоторыми бактериями и плесневыми грибами, и этому явлению было дано название — антибиоз — но из этих наблюдений было сделано мало. Так же игнорировалась народная традиция использования форм в медицине. В 1928 году Александр Флеминг (1881–1955) открыл пенициллин, полученный из плесени Penicillium notatum , но он не получил Нобелевской премии по физиологии и медицине за свое открытие до 1945 года.Сам Флеминг не осознавал, насколько важным было его открытие; в течение десятилетия после этого он вместо этого сосредоточился на возможном использовании пенициллина в качестве местного антисептика при ранах и поверхностных инфекциях, а также в качестве средства изоляции определенных бактерий в лабораторных культурах. Его товарищам по Нобелевской премии, Говарду Флори и Эрнсту Чейну, было предоставлено продемонстрировать в 1940 году, что пенициллин можно использовать в качестве терапевтического средства для борьбы с большим количеством бактериальных заболеваний.
Дорога к церкви Святой Марии
Флеминг родился в Лочфилде, Эйршир, Шотландия. Он был седьмым из восьми выживших детей в фермерской семье.Его отец умер, когда ему было семь лет, оставив свою мать управлять фермой со своим старшим пасынком. Флеминг, получив хорошее базовое образование в местных школах, последовал за сводным братом, уже практикующим врачом, в Лондон, когда ему было 13 лет. В подростковом возрасте он посещал классы Политехнического института на Риджент-стрит, работал клерком и некоторое время служил в нем. армию во время англо-бурской войны (1899–1902), хотя он не участвовал в боях. Затем, в 1901 году, он выиграл стипендию в Медицинской школе больницы Святой Марии в Паддингтоне, Лондон, которая оставалась его профессиональным домом на всю оставшуюся жизнь.
Подходы к борьбе с инфекционными заболеваниями
Флеминг принял должность медицинского бактериолога в больнице Святой Марии после завершения учебы, а в 1906 году он присоединился к персоналу отделения прививок под руководством сэра Альмрота Райта. Райт твердо верил в укрепление собственной иммунной системы организма с помощью вакцинации, а не химиотерапии — введения внешних химических агентов (см. Пол Эрлиха). Тем не менее, он передал Флемингу образцы нового препарата, сальварсана, синтезированного Полом Эрлихом и его коллегами для лечения сифилиса.Опыт Флеминга в применении препарата пациентам был положительным, и после этого он продолжил небольшую, но прибыльную практику назначения сальварсана богатым пациентам, страдающим сифилисом. Во время Первой мировой войны Флеминг работал в специальной лаборатории по исследованию ран в Булони, Франция, которую возглавлял Райт. Там он начал исследования, которые дали результаты, более соответствующие взглядам Райта. Он смог продемонстрировать, что обычно используемые тогда химические антисептики, такие как карболовая кислота, не стерилизуют зазубренные раны; скорее гной обладает собственными антибактериальными свойствами.Используя клетки на предметном стекле, он смог показать, что химические антисептики в безвредных для бактерий разведениях на самом деле повреждают белые кровяные тельца (лейкоциты) — первую линию защиты организма.
После Первой мировой войны Флеминг продолжал работать над лейкоцитами и антисептикой. В 1921 году он обнаружил в носовой слизи вещество, которое вызывает разрушение бактерий. Впоследствии Флеминг и его коллеги обнаружили это вещество, которое он назвал лизоцимом, в сыворотке крови человека, слезах, слюне, молоке и множестве других жидкостей.В своем естественном состоянии лизоцим оказался более эффективным против безвредных бактерий, переносимых по воздуху, чем против болезнетворных бактерий. И попытки сконцентрировать его, усилив тем самым его антисептические свойства, не увенчались успехом.
Пенициллин, обнаруженный в результате несчастного случая
Легендарное открытие пенициллина Флемингом произошло в 1928 году, когда он исследовал стафилококк, распространенный тип бактерий, вызывающих фурункулы, а также вызывающих опасные инфекции у пациентов с ослабленной иммунной системой.Перед отъездом Флеминга в двухнедельный отпуск чашку Петри с культурой стафилококка оставили на лабораторном столе и никогда не помещали в инкубатор, как предполагалось. Каким-то образом при приготовлении культуры спора плесени Penicillium была случайно внесена в среду — возможно, она проникла через окно или, что более вероятно, поднялась по лестнице из лаборатории внизу, где культивировались различные формы. Температурные условия, которые преобладали во время отсутствия Флеминга, позволяли расти как бактериям, так и спорам плесени; если бы инкубатор использовался, могли расти только бактерии.
Лабораторные записные книжки Флеминга отрывочны, и его последующие отчеты об открытии противоречивы. Свидетельства первой культуры, которые он сфотографировал, показали, что он наблюдал лизис, ослабление и разрушение бактерий — как и в его исследованиях лизоцима. Но иногда он описывал ключевое наблюдение как пример подавления или предотвращения роста бактерий в областях, пораженных «соком» плесени, о чем свидетельствует чистая зона, окружающая плесень. Хотя эти два эффекта происходят в совершенно разных условиях, Флеминг, вероятно, забыл, какое наблюдение было первым, поскольку в течение месяцев после первоначального наблюдения он провел множество экспериментов, систематически меняя условия.
Он обнаружил, что антибактериальное вещество продуцируется не всеми плесневыми грибами, а только некоторыми штаммами Penicillium , а именно Penicillium notatum . Хотя выделить его не удалось, он назвал действующее вещество «пенициллин». Он изучил методы получения нечистого продукта и определил его стабильность при различных температурах и в течение различных периодов времени. Он исследовал его влияние на многие микробы, любопытно исключив знакомую спирохету, вызывающую сифилис (которую Сальварсан контролировал, но не устранял).Он проверил его токсичность на лабораторной мыши и кролике. С тех пор всегда оставалось загадкой, почему он не вводил этим или другим лабораторным животным стафилококк или другие болезнетворные бактерии, прежде чем вводить им жидкость, содержащую пенициллин. Возможно, объяснение кроется в его вере в то, что лечение исходит изнутри самого тела, а не от внешнего агента. Таким образом, он не искал лечебного средства, а скорее сосредоточился на своей новой находке в качестве местного антисептика. В последующие годы он утверждал, что трудности, с которыми он столкнулся при выделении и стабилизации пенициллина, не говоря уже о проблемах производства достаточных количеств для клинических испытаний, не позволили ему в полной мере реализовать плоды своих исследований.
На самом деле, в 1930-е годы научное сообщество не обратило внимания на его статью, опубликованную в Британском журнале экспериментальной патологии (июнь 1929 г.). Те немногие ученые, которые прислали образцы и попытались лучше понять свойства пенициллина, не смогли или не смогли извлечь выгоду из открытия Флеминга.
Информация, содержащаяся в этой биографии, последний раз обновлялась 5 декабря 2017 г.
.

 Кардинальные изменения в противостоянии инфекциям произошли после открытия Антонио Левенгуком микромира, а также после определения Луи Пастером его клинической роли в качестве главного виновника всех бед человечества, связанных с инфекционными болезнями. Последовательный переход от использования антисептиков к химиотерапии, а с середины XX ст. — наступление эры антибиотиков кардинально изменили результативность противостояния инфекционным заболеваниям. С открытием антибиотиков патогенной микрофлоре был нанесен сокрушительный удар. Однако вскоре стали появляться бактерии устойчивые, иначе говоря, резистентные к их действию. Микроорганизмы «научились» бороться и побеждать в «войне» с антибактериальными препаратами.
Кардинальные изменения в противостоянии инфекциям произошли после открытия Антонио Левенгуком микромира, а также после определения Луи Пастером его клинической роли в качестве главного виновника всех бед человечества, связанных с инфекционными болезнями. Последовательный переход от использования антисептиков к химиотерапии, а с середины XX ст. — наступление эры антибиотиков кардинально изменили результативность противостояния инфекционным заболеваниям. С открытием антибиотиков патогенной микрофлоре был нанесен сокрушительный удар. Однако вскоре стали появляться бактерии устойчивые, иначе говоря, резистентные к их действию. Микроорганизмы «научились» бороться и побеждать в «войне» с антибактериальными препаратами.