Канцероматоз: причины, симптомы, диагностика, лечение
Канцероматоз представляет собой процесс, в ходе которого происходит метастазирование клеток с измененным состоянием в серозных оболочках, что в дальнейшем приводит к поражению различных органов в организме человека. Такой процесс часто наблюдается на последних стадиях онкологии. Он проявляется в виде поражения таких органов, как брюшная полость и плевра.
Данный вид патологии специалисты не относят к самостоятельному новообразованию, а считают продолжением предыдущих раковых образований.
Клетки, подвергшиеся изменениям, передвигаются внутри организма по крови (гематогенно) или используя лимфы. Такое перемещение становится возможным из-за того, что мутировавшие клетки не обладают межклеточной памятью. Поэтому они не связаны с другими похожими по строению клетками. Передвигаясь по плевре или брюшной полости, измененные клетки проникают в серозную оболочку, что приводит к губительным последствиям для других органов, независимо от того, где они расположены.
Современные исследования демонстрируют следующую статистику: в 35% случаев раковые опухоли приводят к развитию канцероматоза брюшины. При этом специалисты пока не могут определить причины столь широкого распространения патологии. В большинстве случаев доктора, наблюдая канцероматоз, диагностируют, что у пациента тяжелая форма рака, вылечить которую очень сложно.
Метастазы на плевре в основном наблюдаются в процессе развития онкологии молочных желез или легких. Периодически встречаются случаи поражения канцероматозом полости груди.
Канцероматоз брюшной полости также наблюдается очень часто. Ему сопутствует развитие новообразований в печени, поджелудочной железе, матке, яичниках, кишечнике, желудке.
Поражение такой формой болезни головного мозга происходит в 10% случаев онкологии. При таком развитии заболевания опухоль распространяется по крови, заполняя верхнюю часть оболочки мозга. Измененные клетки, проникая внутрь головного или спинного мозга, вызывают нарушение в процессе циркуляции мозговых жидкостей, что в конечном итоге приводит к гидроцефалии.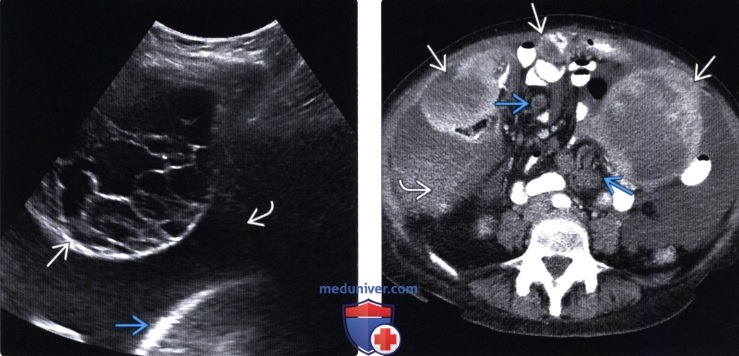
Причины появления канцероматоза
Канцероматоз представляет вторичный этап развития онкологии. Он возникает из-за ускоренного развития раковых клеток. Обладая большой активностью, эти клетки начинают мигрировать внутри организма, распространяя тем самым патологию.
Чаще всего канцероматоз развивается при таких онкологиях, как:
- рак желудка;
- желчевыводящих органов;
- поджелудочной железы;
- яичников;
- кишечника тонкого.
Также большой риск развития канцероматоза есть у людей, страдающих от рака печени. Во всех случаях основной причиной возникновения осложнений является первичное заболевание. Хотя это трудно выявить при обследованиях.
Злокачественные процессы, развивающиеся внутри кишечника или желудка, приводят к тому, что раковые клетки врастают в органы, что приводит к развитию недифференцированных форм рака.
У представительниц женского пола канцероматоз чаще всего развивается на фоне онкологии яичников или матки.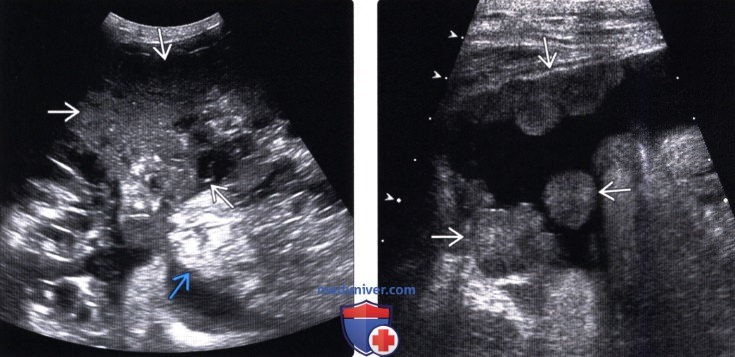
Оказавшись внутри брюшной полости, измененные клетки проникают внутрь брюшных складок. Они оказываются в пространстве между кольцами кишечника.
Прикрепившись к здоровому органу, злокачественные клетки моментально начинают процесс деления и развития, закрывая собой орган. Чем больше развивается опухоль, тем хуже работают органы. Наглядным последствием патологии становится асцит, при котором в брюшине начинает скапливаться жидкость.
Канцероматоз плевры в основном образуется на фоне таких онкологий, как:
- рак плевры;
- желудка;
- молочной железы;
- легких.
На первой стадии опухоль прирастает к легким, а уже позже переходит полость плевры. Поэтому провокатором канзероматоза плевры чаще всего становиться рак легких на поздней стадии. Количество возникших в процессе заболевания метастаз зависит от того, насколько эффективное лечение получает больной, а также от скорости перемещения измененных клеток в организме конкретного человека.
Развитие патологии
Онкологический канцероматоз протекает в несколько этапов.
- Первый этап – возникновение клеток и их постепенное распространение по организму. Причем следует отметить, что спровоцировать процесс развития патологии могут не только измененные клетки, но и определенные вмешательства в организм, например, операция или травма внутренних органов. Оказавшись внутри брюшины, клетки начинают передвигаться в ходе сокращения органов. Именно поэтому болезнь часто проявляется в нижней части брюшной полости.
- Второй этап. В этот момент измененные клетки начинают прирастать к внутренним органам, закрепляясь в серозных тканях. Особенно часто клетки, подвергшиеся мутации, скапливаются в прямой кишке, в сальнике, в слепой кишке. При этом они начинают активно размножаться. Процесс ускоряется из-за соприкосновений брюшины и пораженных органов с кровеносными сосудами.
Симптомы болезни
Главным симптомом развития данной болезни является наличие опухлости пораженного органа.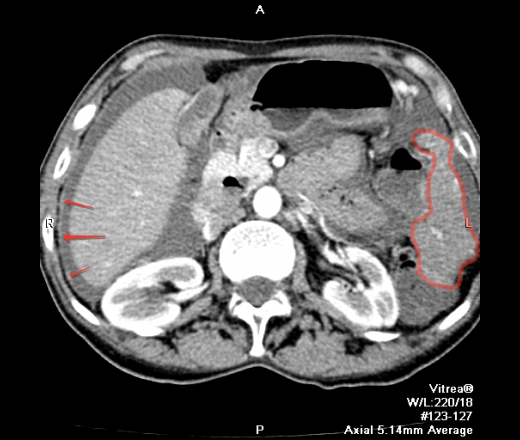 Были случаи, когда появившиеся симптомы сразу указывали врачам на развитие канцероматоза. В такой ситуации докторам действовать намного проще, – они могут сразу определить проблему и назначить терапию.
Были случаи, когда появившиеся симптомы сразу указывали врачам на развитие канцероматоза. В такой ситуации докторам действовать намного проще, – они могут сразу определить проблему и назначить терапию.
Среди основных симптомов заболевания следует выделить:
- периодические или постоянные спазмы в районе живота;
- быстро увеличивается объем живота из-за скопления жидкости;
- появляется рвота, часто тошнит;
- колики в области живота;
- высокая температура;
- одышка и боли в районе грудной клетки;
- аритмия.
При этом нужно понимать, что симптомы различаются по интенсивности в зависимости от стадии болезни.
Когда нужно идти к врачу
Даже далекие от медицины люди слышали об онкологических заболеваниях. Специалисты, работающие в области медицины, которая борется с последствиями рака, знают – чем раньше будет выявлена патология, тем эффективней будет ее лечение. Поэтому люди должны знать, что в случае возникновения вышеописанных симптомов им стоит обратиться к врачам и пройти обследование.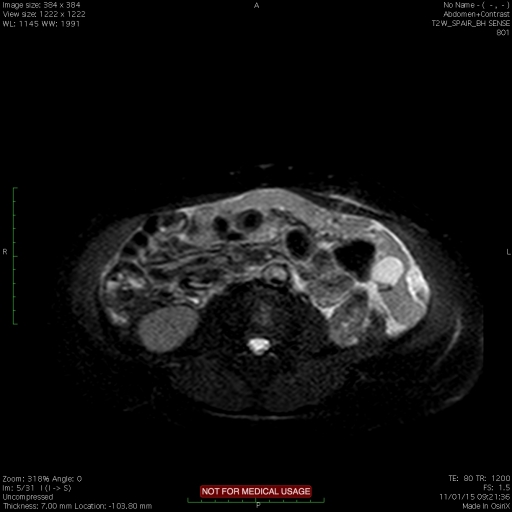
Пройти диагностику, определить стадию канцероматоза, а также начать лечение канцероматоза можно в онкоцентре София, которая расположена в центре Москвы. Опытные специалисты, работающие в нашем центре, смогут понять, какая степень канцероматоза у пациента и предложат ему курс эффективной терапии.
Стадии заболевания
Внутри брюшной полости человека находится множество важнейших органов. При этом они не имеют четких границ. Именно поэтому диагностировать и определить стадию канцераматоза сложно даже опытному специалисту. Важную роль в такой ситуации играет первичное заболевание, из-за которого в дальнейшем развивается канцероматоз.
Чаще всего определить обширность поражения полости доктор может, оценив состояние серозной оболочки.
Сейчас специалисты отмечают три стадии определение диагноза кацероматоза:
- контур опухоли имеет один пораженный участок серозной ткани;
- поражены несколько участков, между которым находится здоровая оболочка;
- в полости наблюдаются сильные изменения, поражен большой участок ткани.
 В основном это происходит на 4 стадии онкологии.
В основном это происходит на 4 стадии онкологии.
Диагностика болезни
Диагностировать канцероматоз крайне сложно. В этом случае многое зависит от врача, который до этого наблюдал развитие опухоли у пациента. Информация приходит постепенно в ходе нескольких обследований. Причем обследования должны проводить разные специалисты, что позволит понять полную картину патологии.
Диагностировать заболевание и определить стадию канцероматоза можно в онкоцентре София, которая расположена в центральном округе Москвы. В этом центре применяется самое современное оборудование, с помощью которого специалисты могут определить степень канцероматоза у пациента.
Личный осмотр
Опытный онколог может определить заболевание даже в процессе первичного осмотра пациента. Применяя специальные приемы, осуществляя нажимы на брюшную полость, врач старается понять, где скопилась жидкость и какие размеры имеет опухоль.
Обследование с помощью оборудования
Современные медицинские аппараты позволяют с высокой эффективностью ставить диагноз по онкологическим заболеваниям.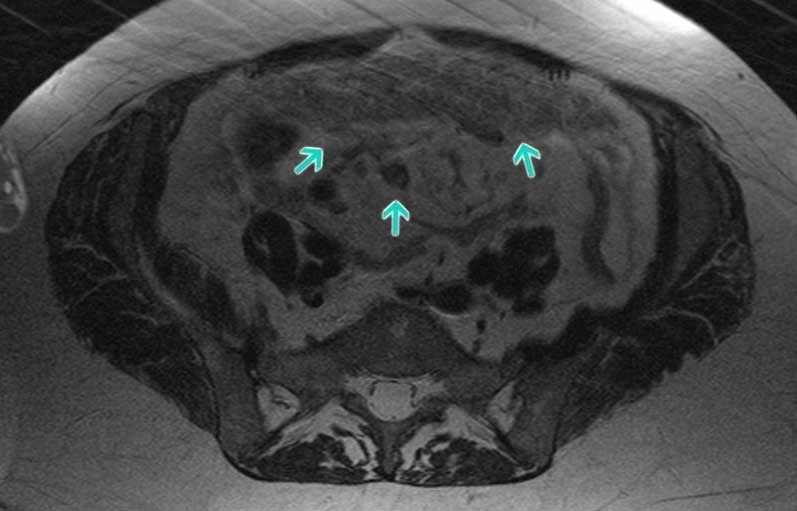
К таким аппаратам относится:
- рентген;
- УЗИ внутренних органов;
- КТ;
- МСКТ, МРТ;
- биопсия;
- лапароскопия.
Лабораторные исследования
С помощью проведенных в лаборатории анализов врачи могут с высокой вероятностью определить состояние организма человека, а также понять, как работают его внутренние органы, есть ли сбой.
Лечение болезни
Сегодня используется множество методик лечения канцероматоза. Благодаря новым технологиям и современному оборудованию доктора могут помочь даже пациентам с запущенной стадией рака.
Среди основных методик лечения следует выделить: химиотерапию, оперативное вмешательство. Также лечение включает послеоперационную реабилитацию
Сейчас в центре Москвы все желающие могут пройти обследование в онкоцентре София. При выявлении и заболевания пациент сможет пройти курс лечения канцероматоза в клинике.
Прогноз
Прогноз эффективного лечения канцероматоза определяется в каждом конкретном случае. Все зависит от общего состояния пациента и стадии канцероматоза. Получить точный прогноз сейчас можно в онкологическом центре София, которая расположена в центральном округе.
Все зависит от общего состояния пациента и стадии канцероматоза. Получить точный прогноз сейчас можно в онкологическом центре София, которая расположена в центральном округе.
Как попасть к специалистам онкоцентра София
Записаться к специалистам онкоцентра София можно, воспользовавшись формой обратной связи на сайте. Сделать это можно и по телефону +7 (495) 995-00-34. Мы располагаемся по адресу: Москва, 2-й Тверской-Ямской переулок, дом 10, метро «Маяковская».
Рак костного мозга: причины, симптомы, диагностика, лечение
Специалисты считают, что рак костного мозга является некорректным названием для заболевания. Однако именно этот термин описывает все заболевания, которые характеризуются ростом злокачественной опухоли в клетках костного мозга.
Среди этих заболеваний выделяют:
- меланому. Меланомой называют злокачественную опухоль, которая начинает свой рост в плазматических клетках;
- лейкозы. Данное заболевание, а именно новообразования, появляющиеся в кроветворной системе, являются наиболее распространенными злокачественными проблемами костного мозга;
- лимфомы. Лимфомы возникают в лимфатической ткани и представляют собой злокачественные новообразования. Лимфомы сначала поражают лимфоузлы, но в редких случаях они могут начать проявлять себя сразу в тканях костного мозга. Обычно костный мозг злокачественная опухоль начинает поражать только в начале четвертой стадии заболевания.
Причины возникновения
Наиболее частой причиной онкологии костного мозга является мутация в стволовых клетках. На самом деле, мутации в человеческом организме происходят регулярно, но есть специальные механизмы, которые могут исправить ошибки или же убить мутировавшие клетки.
Когда у человека начинает развиваться онкология, в частности рак костного мозга, эти механизмы перестают работать, так как клетки мутируют в большом количестве, в результате чего организм перестает воспринимать их как чужеродные. В конечном итоге раковые клетки вытесняют здоровые, не тронутые мутацией клетки. Для развития рака необходимы мутации в уже мутировавших ранее клетках или же сбои в иммунной системе организма человека, так как из-за этого могут возникнуть различные патологии.
В конечном итоге раковые клетки вытесняют здоровые, не тронутые мутацией клетки. Для развития рака необходимы мутации в уже мутировавших ранее клетках или же сбои в иммунной системе организма человека, так как из-за этого могут возникнуть различные патологии.
Кто может заболеть раком костного мозга?
Групп риска тех, кто может заболеть онкологией костного мозга, довольно немало. Это лица, чьи ближайшие родственники страдали от одной из форм рака костного мозга. Также люди, у которых обнаружен иммунодефицит.
У некоторых людей обнаруживают заболевания, которые называют располагающими к онкологии костного мозга, среди них моноклональная гаммапатия, а также мононуклеоз. Пациенты, которые принимают лекарственную терапию, направленную на борьбу с опухолью, тоже рискуют заболеть раком костного мозга.
Симптомы и признаки рака костного мозга
Если у человека миелома, то он будет ощущать боль в костях. Чаще всего такие боли проявляются не в одном месте. Они мигрируют.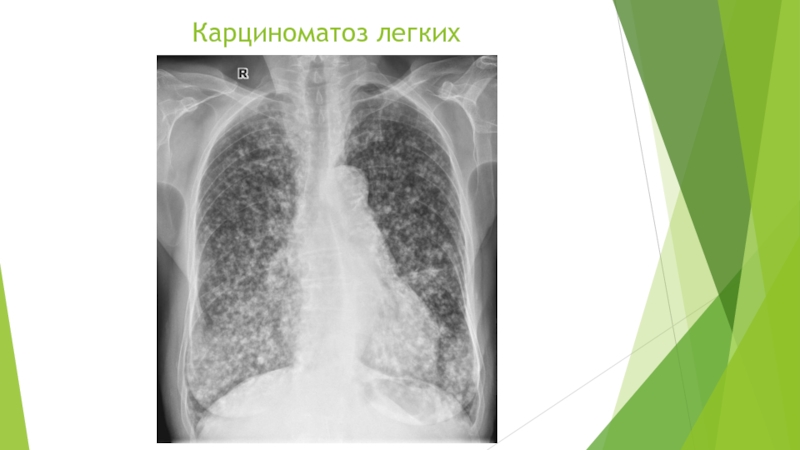 Также боль обычно ощущается во время передвижения. С течением времени боль будет становиться все сильнее, в конечном итоге она может стать невыносимый. Есть вероятность, что больной останется обездвиженным.
Также боль обычно ощущается во время передвижения. С течением времени боль будет становиться все сильнее, в конечном итоге она может стать невыносимый. Есть вероятность, что больной останется обездвиженным.
Также одним из признаков миеломы считается расплавление костной ткани, то есть в организме человека будет сильно превышен уровень кальция, человек будет постоянно чувствовать тошноту, сознание будет нарушаться. В самых тяжелых случаях больной может впасть в кому.
Поражение почек, нарушение зрения и частые кровотечения тоже являются признаками появления в организме человека онкологии костного мозга, а именно, миеломы.
При миеломе повреждаются корешки спинномозговых нервов, в результате чего у человека могут неметь конечности и происходить параличи.
Симптомы лейкоза проявляются не так выражено. При лейкозе опухолевые клетки начинают вытеснять здоровые ростки кровотечения, в результате человек начинает страдать от анемии, постоянных кровотечений и иммунодефицита.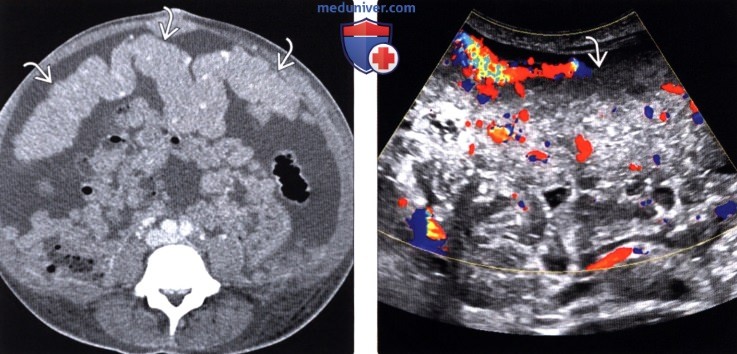 Если у человека развивается нейролейкемия, то он ощущает постоянные головные боли, тошноту, рвоту.
Если у человека развивается нейролейкемия, то он ощущает постоянные головные боли, тошноту, рвоту.
Диагностика рака костного мозга в онкоцентре
Для того чтобы выявить рак костного мозга, требуется комплексный подход к обследованию. У человека производится сбор анамнеза и проводится физикальный осмотр. При этом специалист должен узнать обо всех жалобах и симптомах, которые ощущает сам пациент. Далее пациента направляют на обследование. Подозрения в наличие миеломы могут появиться после рентгенограммы костей. Лейкозы можно выявить, сделав общий анализ крови.
Подтверждение диагноза
Для того чтобы точно сказать о том, есть ли у человека онкология костного мозга, нужно провести морфологической исследование субстрата опухоли. Для этого пациент должен пройти пункцию или биопсию костного мозга.
Также специалисты онкоцентра проводят тесты, которые уточнят молекулярно-генетический профиль рака.
Все эти исследования необходимы для того, чтобы выбрать наиболее точную и наиболее действенную тактику лечения больного. Кроме того, данные анализов и тестов помогут выбрать оптимальный метод химиотерапии.
Кроме того, данные анализов и тестов помогут выбрать оптимальный метод химиотерапии.
Где можно пройти обследование?
Пройти обследование можно в онкоцентре София: 2-й Тверской-Ямской переулок, 10. Наши специалисты готовы обследовать всех пациентов с профессионализмом и точностью, а также приняться за лечение в случае обнаружения болезни.
Лечение рака костного мозга
В большинстве случаев вылечить рак костного мозга полностью невозможно. Можно лишь замедлить его развитие и продлить пациенту жизнь, так как эта болезнь является системной, а опухолевая масса с кровью распространяется по всему телу.
Стоит отметить, что при онкологии костного мозга наблюдается огромное количество опухолевой массы в организме человека. Если речь идет о радикальном лечении заболевания, то придется воздействовать на организм системно, что невозможно без иммунотерапии, химиотерапии и таргетной терапии.
Схема лечения определяется врачами в зависимости от разновидности рака.
Система лечения при лейкозе
При диагностировании лейкоза сначала проводится индукция ремиссии, то есть человек лечится при помощи химиотерапии, так как преследуется цель в уничтожении как можно большего количества раковых клеток. Организм человека переживает серьезные негативные воздействия продуктов распада опухоли и компонентов химиотерапии. При этом проявляется немало побочных эффектов.
Консолидационная терапия является вторым этапом лечения. С помощью химиотерапии невозможно избавиться от всех раковых клеток мозга, так как часть из них на ранних этапах находится в спящем состоянии, то есть эти клетки просыпаются позже и начинают активизировать повторный рост опухоли, поэтому такая терапия просто необходима.
Реиндукция ремиссии является точной копией индукционной терапии, на данном этапе продолжается уничтожение клеток. Последним этапом является поддерживающая терапия, которая призвана уничтожить оставшиеся злокачественные клетки.
Химиотерапия
Чаще всего химиотерапию используют в комбинации с лучевым воздействием. Одновременно с этим пациент должен принимать гормональные препараты для улучшения состояния крови и всего организма, так как во время химиотерапии на организм оказывается сильнейшее воздействие.
Одновременно с этим пациент должен принимать гормональные препараты для улучшения состояния крови и всего организма, так как во время химиотерапии на организм оказывается сильнейшее воздействие.
У человека могут выпасть волосы, и резко ухудшиться состояние здоровья. Также врачи назначают применение препаратов, которые призваны бороться с разрушением костной ткани в организме. Мембранный плазмаферез – процедура, которую назначаю с целью продления срока жизни больного.
Хирургический способ лечения
При хирургическом вмешательстве, которое является наиболее эффективным способом лечения онкологии костного мозга, специалисты проводят пересадку костного мозга. Такая процедура осложняется тем, что найти донора для пересадки крайне сложно, так как организм может отторгнуть новый костный мозг.
Также эта процедура довольно дорогостоящая. Чаще всего в качестве доноров подходят ближайшие родственники. От хирургического вмешательства отказываются в том случае, когда пациент находится в тяжелом состоянии или органы поражены отдалёнными метастазами.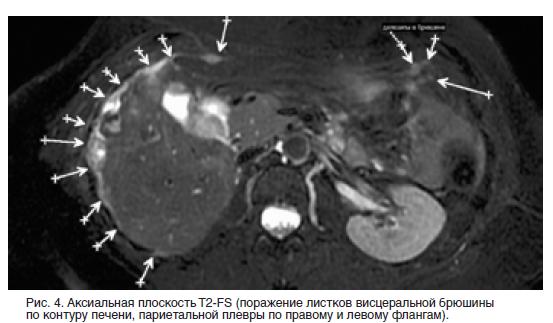
Прогнозы
От вида опухоли зависит прогноз выживаемости человека при онкологии костного мозга. При остром лейкозе человек может прожить без рецидива в течение пяти лет в 80% случаев. Чем дольше длится ремиссия, тем больше вероятность полного отступления болезни, однако при раке костного мозга в большинстве случаев происходит рецидив, то есть пациенту требуется повторное лечение.
Некоторые пациенты сталкиваются с несколькими рецидивами. В каждом случае вернуться к состоянию ремиссии становится всё сложнее. Однако были случаи, когда люди выздоравливали даже после нескольких рецидивов.
Миелома является неизлечимым заболеванием. Даже после пересадки костного мозга в течение 3-5 лет рак костного мозга может вернуться. Хронические лейкозы практически не поддаются лечению, они протекают с обострениями и затуханиями. Чаще всего такое заболевание возникает у людей, чей возраст приближается к пожилому. В таком случае интенсивное лечение противопоказано, остается только проводить поддерживающую терапию.
Осложнения
При стремительном развитии онкологии костного мозга здоровые клетки с невероятно быстрой скоростью замещаются раковыми клетками. Кроветворение сильно замедляется, человек страдает от анемии, кровотечений и иммунодефицита. Для миеломы и лейкозов характерны сильнейшие боли, которые можно снять только с использованием наркотических анальгетиков.
Рецидив
Вид онкологии костного мозга определяет вероятность появления рецидива. Некоторые формы лейкоза поддаются лечению, то есть у человека есть возможность на полное выздоровление. Хронические формы рака практически неизлечимы, миеломы тоже считаются неизлечимыми. Если применяется стандартная терапия, то рецидив должен наступить примерно через 29 месяцев. Если же произошла тандемная трансплантация, то пациент может продержаться в состоянии ремиссии на протяжении более 40 месяцев.
Как записаться к специалисту в онкоцентре София?
На прием к специалистам онкоцентра София можно записаться по телефону +7(495)995-00-33 или с помощью формы на сайте.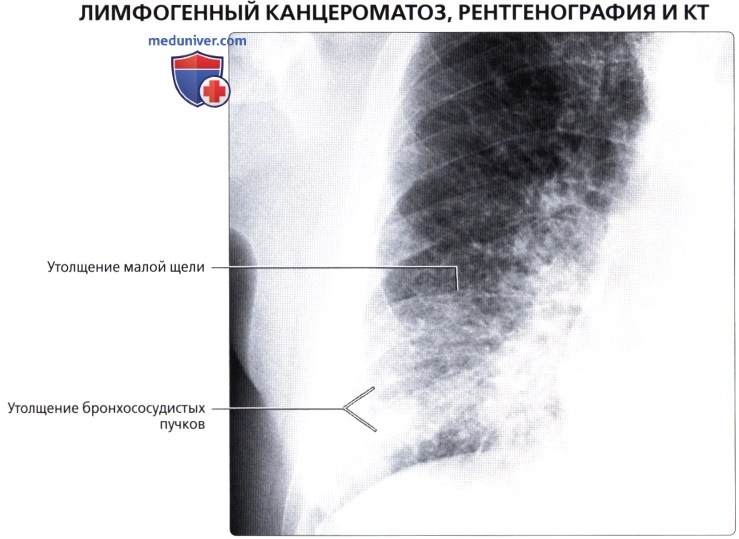 Адрес: 2-й Тверской-Ямской пер., д. 10.
Адрес: 2-й Тверской-Ямской пер., д. 10.
Вы можете прийти как на консультативный прием или сразу же осуществить запись на диагностику. После получения результатов врачи определят степень распространения рака и назначат оптимальный вариант лечения. Заметим, что наши специалисты учитывают не только тип заболевания, но и индивидуальные особенности организма человека.
Перитонеальный канцероматоз-симпотмы , признаки.
Перитонеальный канцероматозВам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Наверняка вы задаётесь вопросом: что же теперь делать? Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.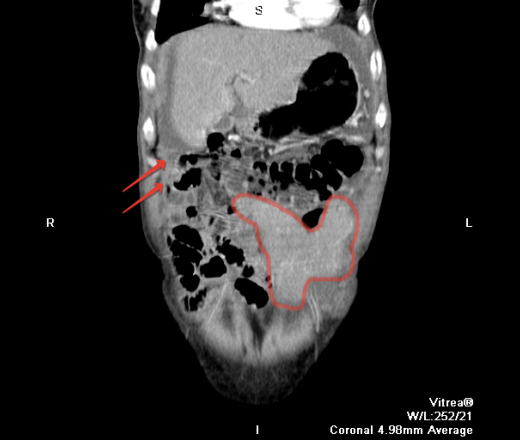
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматозМНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ВведениеПеритонеальный канцероматоз (опухоль брюшины) — одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% — при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматозаПеритонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже — первичными опухолями брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматозаЕдиная классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматозаПеритонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматозаПеритонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматозаХирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматозаДлительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава РоссииПрограмма лечения перитонеального канцероматоза определяется междисциплинарным консилиумом врачей, в который входят специалисты экспертного класса ФГБУ «НМИЦ радиологии» Минздрава России. Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
Возможности лечения канцероматоза
Канцероматоз представляет собой один из наиболее неблагоприятных вариантов метастазирования некоторых злокачественных опухолей, при котором на брюшине (то есть внутренней оболочке, покрывающей брюшную полость и внутренние органы) образуются многочисленные опухолевые узлы или диссеминаты. Наиболее часто он наблюдается при раке желудка, злокачественных опухолях червеобразного отростка, раке толстой кишки, раке яичников и т.д.
Наличие канцероматоза свидетельствует о далеко зашедшем опухолевом процессе, то есть о IV стадии заболевания. Кроме того, выделяют первичные злокачественные поражения брюшины, к которым относится мезотелиома брюшины. Редким вариантом метастатического поражения брюшины является псевдомиксома брюшины, при которой в полости брюшины накапливаются слизеподобные массы различной плотности. При данном заболевании первичная злокачественная опухоль локализуется в червеобразном отростке (муцинозная аденокарцинома) или в яичниках (пограничная муцинозная опухоль). Довольно часто, особенно при раке желудка, канцероматоз развивается в отдаленные сроки после радикальной операции, негативно влияя на прогноз заболевания.
Симптомы
Поскольку канцероматоз не является самостоятельным заболеванием, то его клиническая картина определяется как клиническими проявлениями первичной опухоли, так и собственно признаками злокачественного поражения брюшины. Наиболее типичным симптомом является появление в брюшной полости свободной жидкости, так называемого асцита. Зачастую асцит является единственным симптомом у данных пациентов. Кроме этого, могут иметь место ряд неспецифических признаков, таких как значительная потеря веса, тошнота, рвота, выраженная утомляемость, слабость.
Лечение
Наиболее распространенным вариантом лечения большинства злокачественных опухолей, осложненных формированием канцероматоза, является проведение системной химиотерапии, эффективность которой в данной ситуации крайне сомнительна. Дело в том, что благодаря наличию так называемого гематоперитонеального барьера противоопухолевые препараты практически не достигают опухолевых узелков (диссеминатов) на брюшине.
Новые перспективы открывает применение проведение внутрибрюшной перфузионной термохимиотерапии, при которой во время хирургической операции наряду с удалением первичного очага (рак желудка, рак толстой кишки и т.д.) и пораженной брюшины (перитонэктомия) в брюшную полость вводят подогретый до 420С раствор, содержащий противоопухолевые препараты. Процедуру выполняют с применением современного оборудования (рисунок).
На фоне высокой температуры, создаваемой вводимым в брюшную полость раствором, создаются условия не только для уничтожения опухолевых клеток, но и для проникновения противоопухолевых препаратов в диссеминаты, находящиеся на поверхности брюшины. Эффективность подобного комплексного воздействия повышается в случае возможности выполнения так называемой циторедуктивной операции, которая заключается в удалении первичной опухоли с регионарными метастазами и отсевами по брюшине. После операции таким пациентам назначается системная химиотерапия, направленная на предупреждение возврата болезни.
Проведение внутрибрюшной термохимиотерапии абсолютно показано пациентам, у которых диагностирован рак желудка, особенно при массивном поражении желудочной стенки. В данной ситуации даже удаление желудка с опухолью не гарантирует выздоровление, поскольку в различные сроки после проведения лечения возможно развитие канцероматоза. Внутрибрюшная термохимиотерапия в данной ситуации как раз дает надежду на предупреждение прогрессирования опухолевого процесса в последующем.
Консультация специалиста строго по целевому направлению с предварительно записью по телефонам +375 (17) 389-99-00 и +375 (17) 389-99-10 с 8.00 до 20.00 понедельник — пятница.
Канцероматоз плевры легких — причины развития и методы лечения
Канцероматоз плевры — что это?
Общее
Речь пойдет о поражении листков плевры метастазами. Листки с внутренней стороны обволакивают легкие и грудную клетку. Проникновение метастазов раковой опухоли может происходить практически из любого органа. В данном случае чаще всего они проникают из легких, молочной железы, органов малого таза, почек, костей.
Клиническая картина патологии схода с картиной, которую можно наблюдать при плеврите. Не случайно, конечно: сам механизм развития одной и другой патологий схож – стенки сосудов становятся излишне про проницаемые, сбивается работа лимфооттока, что провоцирует увеличенное скопление жидкой массы.
В нормальном состоянии в сутки организмом вырабатывается в полость плевры до 10 мл жидкой массы. Это необходимо для смягчения трения при процессе дыхания и работы мышцы сердца. Онкологические очаги приводят к тому, что сила трения увеличивается, это нарушает нормальное дыхание и работу сердца.
Симптомы
Симптоматика патологии такова:
- Одышка;
- Сухой кашель;
- Болевой синдром различной степени интенсивности;
- Дискомфорт в момент глубокого вдоха;
- Постоянная икота;
- Слабость, быстрая утомляемость;
- Потеря аппетита;
- Потеря веса.
Как показывает медицинская статистика, патологию часто обнаруживают случайно при диспансеризации или обследовании больного с раковым заболеванием.
Возможные осложнения
Патология еще более осложняет проблемы, связанные с легкими, так как на ее основе возникает и развивается плеврит, который представляет собой инфекционно-воспалительное поражение листков плевры.
Наиболее опасны формы патологии гнойной и гнойно-гнилостной. Во время их протекания наблюдают токсемию, т.е. отравление продуктами, которые вырабатывают бактерии. Оно приводит к спутанности сознания и коме.
Кожа на лице становится синюшной, шейные вены и межреберья выбухают. Человек испытывает значительный дискомфорт.
Еще одно осложнение патологии – асцит. Это скопление избыточной жидкой массы в животе. Связано это с тем, что работа сердца и кругов кровообращения ухудшается. Больной жалуется на болевой синдром в животе, одышку, которая постоянно нарастает, наблюдается отечность. Быстрое развитие асцита становится причиной тромбоза венозного ствола.
Причины развития
Говоря о первичном поражении листков плевры, стоит отметить: патология эта встречается нечасто – на миллион взрослого населения всего несколько случаев. Выявляется оно обычно у мужчин, как правило, работавших с асбестом.
Гораздо чаще наблюдается поражение вторичное. Листки плевры поражают метастазы онкологии легкого либо молочной железы.
Отметим, что злокачественный процесс в любом органе может вызвать метастатические поражения листков плевры. Однако не всегда начинается процесс скапливания избыточной жидкой массы.
Диагностика
Поражение листов плевры выявляется с помощью:
- Рентгенографии;
- Компьютерной томографии;
- Томографии магнитно-резонансной.
Последние два метода наиболее точны, так как позволяют обнаружить узелки всего в несколько миллиметров.
В стандарт обследования включена также торакоскопия, специальное оборудование, применяемое здесь, дает возможность не просто обнаружить изменения, но и взять биоптат для анализа.
Говоря о плеврите, скажем, что обычно достаточно исследования взятой при пунктировании жидкости под микроскопом.
Выявить первичную патологию способны опухолевые маркеры, выявляемые при иммуногистохимии крови.
Лечение
Онкологии плевры не предусматривает таких форм лечения, как радикальное оперативное и лучевое. Обычно применяют химиотерапию.
Результат лечения определяется чувствительностью метастазов к применяемым препаратам. При онкологии молочной железы эффективность химиотерапевтического и гормонального воздействия может длительный период давать результат.
Основные методы лечения:
- Химиотерапия;
- Оперативное вмешательство по удалению опухоли первичной и очагов метастазов;
- Терапия таргетная – прицельная блокировка роста раковых клеток.
Прогноз
При онкологии легкого прогноз зависит от наличия первичной опухоли, в большинстве случаев приводящей к несовместимому с жизнью осложнению — кровотечению, тяжелой легочно-сердечной недостаточности вкупе с раковой интоксикацией.
Лечение мезотелиомы предполагает очень травматичную операционную манипуляцию, в ходе которой полностью удаляют плевру и легкое, а также часть диафрагмы и сердечной сумки.
Предоперационная и послеоперационная терапия делает возможным 8 из 10 пациентов прожить больше двух лет. Химиотерапевтическое лечение без хирургического вмешательство укорачивает этот срок более чем в половину.
Развитый плеврит осложняет процесс терапии и сокращает продолжительность жизни пациента. Здесь важную роль играет профессиональная паллиативная помощь и своевременная эвакуация накопившейся жидкостной массы.
Клиника интегративной онкологии Onco.Rehab поможет Вам в Ваших проблемах. Onco.Rehab – это современное лечение по международным протоколам.
Канцероматоз брюшной полости лечение, прогнозы и стадии
Канцероматоз брюшной полости: причины возникновения, симптомы
Данная патология возникает вследствие вторичного поражения брюшной полости раковыми образованиями, образующимися в ЖКТ (40% случаев) и системе репродукции (30%), иногда, что бывает намного реже, развивается из-за перитонеальных опухолей.
Раковые клетки попадают в брюшную полость, отделяясь от опухоли первичной, с серозной жидкостью. Начинается данный процесс с момента утраты клетками взаимодействия и способности прикрепляться к соседним клеткам (адгезия).
Причины появления заболевания
Оторвавшись от раковой опухоли, клетки способны перемещаться по крови и лимфе на значительные расстояния. Они поражают даже далеко расположенные органы, внедряются в клетки здоровые. После того как клетка закрепилась на новом для нее месте, начинается процесс бесконтрольного ее деления.
Помимо передвижения по крови и лимфе распространение раковых клеток в полости брюшины идет трансцеломически. Это происходит, видимо, оттого, что условия для них благоприятны. Значительная часть метастазов локализуется в зонах, где отмечается слабое ритмическое сокращение стенок органов либо там, где происходит чрезмерное всасывание внутрибрюшной жидкой массы.
Нередко разброс клеток ниже в процессе оперативного вмешательства и лапароскопии, чем при оперативном вмешательстве классическом. Оперативная манипуляция предполагает профилактику распространения опухолевого процесса по организму посредством применения уникальных обрабатывающих растворов. Наиболее эффективный способ очистки – HIPEC, предполагающий внутриполостную химиотерапию в сочетании с гипертермией.
Заболевания, способствующие возникновению патологии
Каждый третий пациент с онкологией ЖКТ сталкивается с канцероматозом. Метастазы, поразившие брюшную полость, могут быть следствием развития карциномы поджелудочной железы и желудка. Это происходит примерно в 40% случаев. Еще у 10% наблюдается патология как следствие онкологии кишечника. Очень велика доля пациентов с онкологией яичников, почти 2/3.
На вероятность возникновения заболевания влияют два основных фактора:
- Агрессивность мутированных клеток;
- Объем первичного злокачественного новообразования.
Причинами развития патологии, кроме перечисленных выше, могут стать опухоли любого органа: простаты, легкого, молочной железы и т.д.
Диагностические мероприятия
Обнаружить поражение брюшной полости при асците не представляет проблемы. Для этого применимы ультразвуковое исследование, компьютерная томография с использованием контраста.
Ультразвуковое исследование помогает обнаружить напластования, толщина которых несколько сантиметров, но обнаружить узелки мелкие не представляется возможным.
Применение компьютерной томографии с контрактом — более информативный метод диагностики, потому что обнаруживаются сантиметровые образования.
Лапароскопия еще более точна, она считается наиболее эффективным диагностическим методом. В обязательном порядке ее применяют при опухоли желудка и яичников. При этом одновременно выполняется и диагностика, и оперативное лечение.
Жидкую массу, изъятую в процессе лапароскопии либо выполнения прокола, отправляют на лабораторный анализ, который позволяет определить первоисточник онкологического процесса.
Клиническая практика показывает, что самым оптимальным диагностическим методом является биопсия, в ходе которой забирается кусочек ракового образования для дальнейшего лабораторного исследования. Однако проводить ее, зная первоисточник патологии либо пройдя в недалеком прошлом лечение первичного очага, нецелесообразно.
Классификации
Не существует единой классификации. Это связано с тем, что первичные раковые очаги, которые приводят к появлению заболевания, разные по своим характеристикам. Одной из самых распространенных градаций канцероматоза брюшной полости является та, в основу которой положены зависимость от числа метастазов и их локализация. Данная классификация выделяет 3 степени заболевания:
- Р1– поражение брюшной полости локального характера;
- Р2– выявлено несколько очагов заболевания, которые разделены здоровыми участками брюшной полости;
- Р3– наблюдается множество очагов поражения брюшной полости.
Также применима методика определения индекса канцероматоза брюшной полости, в ходе которой подсчитывается сумма баллов (от 0 до 3) измерения очагов максимального поражения в каждой из наиболее вероятных областей поражения полости брюшины.
Симптоматические проявления
Патология перитонеальная на первых этапах своего развития может никак не обнаруживать себя, в особенности, когда отсутствует излишняя жидкая масса в полости брюшины.
При этом жидкая масса может накапливаться без участия метастазов. Симптоматические проявления заболевания в большинстве случаев неспецифичны, однако, как правило, отмечаются:
- Дискомфортное состояние в животе;
- Сильная слабость;
- Необъяснимое снижение массы тела;
- Потеря веса при стабильном диетическом режиме;
- Потеря аппетита;
- Сбой в работе органов ЖКТ.
По мере развития заболевания злокачественные клетки приводят к:
- Отравлению организма;
- Сдавлению желудка опухолью;
- Состоянию тошноты, рвоты;
- Нарушениям стула;
- Поднятию температуры тела выше нормы.
Возникший асцит негативно сказывается на процессе дыхания, что приводит к сердечной недостаточности, не проходящим отекам, белковой недостаточности вследствие частой эвакуации жидкой массы.
Лечение
Радикально избавиться от опухоли невозможно, но грамотно подобранная лечебная тактика может в значительной степени улучшить состояние больного и существенно продлить его жизнь.
Традиционная хирургическая операция очень сложна и хирурга, и для пациента, поскольку в ходе нее необходимо удалить первичный опухолевый очаг, пораженные лимфоузлы, сумки сальников и все выявленные опухолевые новообразования.
Применима в лечении патологии перитонэктомия. Это вмешательство поэтапное, при котором удалению подлежат некоторые органы полости брюшины, например, селезенка либо части кишечника.
Стандартным лечением канцероматоза брюшной полости считается химиотерапия системного и локального характера. Проходит такое лечение после решения проблемы с асцитом либо посредством лапаропорта, который устанавливают в процессе оперативного вмешательства.
Лучшие методики
Клиническая практика показывает, что наибольший положительный эффект достигается комбинацией 3-х лечебных методов:
- Циторедукция – вмешательство, в ходе которого удаляют максимум раковых опухолей;
- Гипертермия локального характера;
- Введение внутрь полости химических препаратов.
Если в ходе операции используют интраперитонеальную гипертермическую химиотерапию (ИГХТ либо HIPEC), то возможно на долгое время добиться поддержания значительной концентрации медицинского препарата в области локации опухоли и тем самым обеспечить высокий лекарственный эффект. Перспективы такого лечения обнадеживают.
Фотодинамическая терапия интраоперационная (ФДТ) с ее воздействием на опухоль фотосенсибилизатором по положительному результату уступает HIPEC. Это объясняется тем, что лазер проникает не во все зоны брюшины. Однако при опухолях значительных по объему либо опухолях немногочисленных данный метод отлично зарекомендовал себя.
Прогноз
Прогноз зависит от таких факторов, как степень поражения, степень развития патологии, восприимчивость опухоли к химиотерапевтическому лечению. Конечно же, важную роль играет опыт врача и выбор адекватного лечения.
В клинике интегративной онкологии Onco.Rehab работают врачи, вошедшие в ТОП лучших онкохирургов России. Их талант и опыт помогают нашим пациентам справиться с канцероматозом брюшной полости.
Канцероматоз плевры при раке — описание и причины
Возможные осложнения
Канцероматоз плевры усугубляет проблемы с легкими. Развивается экссудативный плеврит – инфекционно-воспалительный процесс листков плевры. Особенно опасны для жизни гнойная и гнойно-гнилостная формы. При гнойном плеврите наблюдается отравление продуктами жизнедеятельности бактерий (токсемия). Завершается подобное состояние спутанностью сознания и комой.
У пациента появляется синюшность кожи лица, шейные вены и межреберья выбухают. Больной чувствует себя комфортно только в вынужденном положении.
Другим осложнением канцероматоза может стать асцит – скопление жидкости в животе. Ухудшение работы сердца, кругов кровообращения приводит к застойным явлениям в брюшной полости. Пациенты жалуются на боль в животе, нарастающую одышку, отечность. Стремительно развивающийся асцит приводит к тромбозу воротной вены.
Из-за чего при раке развивается симптом
Причина первичной онкопатологии плевральных листков – работа на вредном производстве. Чаще всего развитие заболевания связывают с асбестовой промышленностью.
Вторичный процесс обусловлен метастазированием. Метастатические узелки обсеменяют листы плевральной полости при различных вариантах рака – новообразованиях легких, груди, яичников, почек.
Патологический выпот может быть вызван не только злокачественным перерождением плевральных листков, но и метастатическим поражением лимфоузлов средостения (группа органов, расположенных в плевральной полости).
При некоторых видах рака (онкопроцесс яичников) канцероматоз плевры является следствием запущенного злокачественного асцита.
Связано это с механическим нарушением лимфооттока. Избыточная жидкость при плеврите исчезает после эвакуации выпота из брюшной полости.
Практически любая онкопатология может сопровождаться поражением плевры. При этом накопление жидкости в патологическом объеме не обязательно. Также и наличие выпота не всегда связано с раковой опухолью, а может быть следствием функциональных расстройств организма.
Методы диагностики в Медскан
В диагностическом центре клиники Медскан выполняется весь необходимый комплекс лабораторно-инструментальных исследований. С их помощью специалисты в короткие сроки устанавливают диагноз, определяя дальнейший план лечения.
Обследование включает следующие пункты:
- Рентгенографическое исследование грудной клетки выявляет уровень жидкости в полости плевры.
- Компьютерная томография и магнитно-резонансная томография – довольно информативный метод, позволяющий визуализировать метастатические очаги размером пару миллиметров.
- Видеоторакоскопия. Через небольшой прокол в стенке грудной клетки вводят оптический прибор – торакоскоп. С его помощью на экране аппарата можно увидеть патологические изменения слизистой, а также взять на анализ фрагмент новообразования.
- Иммуногистохимический анализ крови выявляет особые белковые соединения – онкомаркеры.
По показаниям специалист назначает дополнительные методы исследования для постановки окончательного диагноза.
Методы лечения в Медскан
Современные технологии и оборудование помогают справиться с наиболее серьезными формами заболевания. В клинике Медскан пациенту с канцероматозом плевры проведут лечение не только пораженных легких, но и первичного патологического очага. Помогут в этом высококвалифицированные опытные специалисты Медскан, а также диагностическая и лечебная аппаратура экспертного уровня.
К основным методам онкопомощи можно отнести:
- Химиотерапия. Применение химиотерапевтических препаратов актуально как до операции, так и после.
- Оперативное вмешательство. Удаляются первичная опухоль и метастатические очаги.
- Таргетная терапия предполагает блокировку роста атипичных клеток путем воздействия препаратов на определенные («целевые») молекулы. Несомненное преимущество этого вида лечения – его низкая токсичность на организм пациента.
В Медскан широко распространена услуга «второе мнение» от ведущих израильских специалистов, что бывает необходимо для решения спорных моментов лечения.
Причина, симптомы, диагностика и лечение
Карциноматоз брюшины — редкая форма рака, поражающая брюшину — тонкую оболочку, окружающую ваши органы брюшной полости. Обнаружить, что он есть у вас или у вашего любимого человека, может быть сложно, а понимание этого рака может помочь вам обрести чувство контроля.
Карциноматоз брюшной полости чаще всего развивается, когда другие опухоли брюшной полости распространяются на брюшину, приводя к множественным новым опухолям на поверхности этой оболочки. Если вы заболели карциноматозом брюшины, это обычно означает, что ваш рак брюшной полости находится на поздней стадии.Также очень редки случаи первичного карциноматоза брюшины, который начинается в самой брюшине. Эти случаи обычно случаются у женщин с высоким риском развития рака яичников.
Факторы риска карциноматоза брюшины
Поскольку карциноматоз брюшины чаще всего развивается при распространении существующего рака, основным фактором риска являются другие запущенные формы рака, в том числе:
Первичный карциноматоз брюшины почти всегда встречается у женщин. Помимо пола, к другим факторам риска первичного перитонеального карциноматоза относятся:
Симптомы перитонеального карциноматоза
На ранних стадиях симптомы могут отсутствовать, или у вас могут быть нечеткие симптомы, напоминающие другие состояния.На более поздних стадиях рак вызывает такие симптомы, как:
Эти проблемы могут быть вызваны многими другими причинами.
Карциноматоз брюшины, вызванный раком брюшной полости, может привести к асциту (скоплению жидкости в брюшине), что затем приводит к другим симптомам, таким как:
Как врачи диагностируют перитонеальный карциноматоз
Если врач считает, что у вас перитонеальный карциноматоз, вы можете сделать анализ крови, компьютерную томографию, МРТ или биопсию, чтобы подтвердить это. Иногда карциноматоз брюшины диагностируется во время операции по поводу другого рака, когда хирург замечает опухоль в брюшине.
Лечение перитонеального карциноматоза
Поскольку перитонеальный карциноматоз обычно представляет собой запущенную форму инвазивного рака, который распространился из другой опухоли, его трудно лечить. Большинство опухолей перитонеального карциноматоза не сокращаются в значительной степени или вообще не уменьшаются в ответ на химиотерапию. Из-за этого многие врачи сосредотачиваются на паллиативной помощи, чтобы справиться с симптомами, облегчить боль и улучшить качество вашей жизни. Есть врачи, специализирующиеся на паллиативной помощи, предназначенной для всех, кто страдает серьезным заболеванием.Уход в хосписе — это вариант, если проблемы, связанные с окончанием жизни, становятся необходимостью.
В зависимости от вашего конкретного случая могут быть доступны и другие варианты лечения.
- Циторедуктивная хирургия. Хирург удаляет опухоли брюшины и, в некоторых случаях, близлежащих органов брюшной полости.
- Гипертермическая внутрибрюшинная химиотерапия . Этот метод, который часто используется сразу после циторедуктивной хирургии, омывает внутреннюю часть живота, где находится брюшина, нагретыми химиотерапевтическими препаратами, чтобы убить оставшиеся раковые клетки.
- Перитонэктомия — это операция по удалению брюшины.
Карциноматоз. Метастатическая карцинома при раке. Информация.
Описание
Карциноматоз — это состояние, при котором одновременно развиваются множественные карциномы, обычно после распространения из первичного источника. Это означает больше, чем распространение на регионарные узлы, и даже больше, чем просто метастатическое заболевание. Этот термин обычно означает, что на нескольких сайтах есть несколько вторичных серверов.
Строго говоря, его следует использовать только при эпителиальном раке или карциноме, но не при саркомах или лимфомах, но он был расширен для включения всех типов рака, которые распространились. Это слово теперь используется для описания любого широко распространенного рака в организме, а также состояний с определенным анатомическим распространением, например:
Лептоменингеальный карциноматоз
[1, 2]- Вовлечение лептоменингов через посев через спинномозговую жидкость. , который происходит либо путем прямого распространения, либо через кровоток.
- Это необычное и обычно позднее осложнение рака.
- Причиной этого может быть любой рак, но чаще всего поражаются аденокарциномы. Рак груди — одна из самых частых причин.
- Проявления очень разнообразны и могут быть неспецифическими (например, головная боль или спутанность сознания) или с очаговыми или мультифокальными неврологическими нарушениями (например, параличи черепных нервов).
- Диагноз ставится на основании тщательного анамнеза и неврологического обследования, цитологического исследования спинномозговой жидкости и нейровизуализации (предпочтительно МРТ с усилением гадолиния).
Легочный лимфангитный карциноматоз
[3]- Диффузная инфильтрация легких с закупоркой лимфатических каналов.
- Может возникать при различных формах рака, чаще всего рака груди, желудка, поджелудочной железы, легких и простаты.
- Лимфангитный карциноматоз также может поражать почки и обычно проявляется острым повреждением почек (ОПП) [4] .
Карциноматоз брюшины
[5]- Распространение метастазов в брюшину, обычно в результате гинекологического (обычно яичникового) и желудочно-кишечного рака.
- Было показано, что возникновение перитонеального карциноматоза значительно снижает общую выживаемость у пациентов с метастазами в печень и / или внебрюшинными метастазами желудочно-кишечного тракта.
Презентация
Карциноматоз может быть прогрессированием известного заболевания. Это может быть проявление рецидива или может быть основным признаком. Презентация будет зависеть от того, где это затронуто.
- В легких может проявляться одышкой и кровохарканьем.
- В печени часто проявляется желтухой.
- В головном мозге могут быть головные боли, рвота и очаговые неврологические особенности.
- В костях может быть боль или патологический перелом.
- Поражение брюшины может проявляться различными симптомами, включая асцит, боль, тошноту, кахексию и непроходимость кишечника.
Дифференциальный диагноз
При наличии этих признаков возникает вопрос, является ли это частью известного заболевания или чем-то еще.Например, вызвана ли желтуха метастатической карциномой в печени или желчными камнями.
При карциноматозе первичную опухоль обычно ищут с помощью визуализации и гистологии.
Исследования
Цель исследований — подтвердить природу заболевания и оценить его тяжесть и степень.
- Анализы крови: в случаях неизвестного первичного FBC может выявить дефицит железа, указывающий на злокачественные новообразования желудочно-кишечного тракта, микроскопическая гематурия может выявить скрытое злокачественное новообразование мочеполовой системы, а скрытая кровь может указывать на колоректальную причину.В случаях, когда известно первичное, FBC, U&E, креатинин и LFT могут указывать на тяжесть.
- Визуализация: новые методы визуализации, такие как УЗИ, КТ и МРТ, а также более старые исследования, такие как рентгенография, дают очень хорошую информацию, хотя при перитонеальном карциноматозе иногда может потребоваться исследовательская лапаротомия. Как указано выше, МРТ с усилением гадолиния является предпочтительным методом выбора при подозрении на лептоменингеальное поражение [2] .
- Биопсия: может быть желательно получить ткань для гистологии.Трансбронхиальная биопсия обеспечивает окончательный диагноз легочного лимфангитного карциноматоза [3] . Гистологический анализ помогает выбрать метод лечения и является одним из факторов, которые необходимо учитывать при принятии решения о целесообразности агрессивного хирургического вмешательства и / или химиотерапии. Развитие молекулярной патологии позволило ей внести значительный вклад в принятие управленческих решений [6] .
Лечение
[5, 7]Поскольку это состояние может возникать по разным причинам, варианты конкретной стратегии лечения также многочисленны и могут быть нацелены на конкретный рак.Во многих случаях нет реальной надежды на излечение, хотя химиотерапия и лучевая терапия могут иметь паллиативный эффект. Хирургическое вмешательство может быть паллиативным, и может оказаться полезным «удаление опухоли» перед химиотерапией. Резекция метастазов в печени, вторичных по отношению к колоректальному раку, имела некоторый успех при ограниченном заболевании. Есть несколько подгрупп пациентов, которые относительно хорошо переносят лечение.
Мультимодальное лечение (паллиативное хирургическое вмешательство, лучевая терапия и / или химиотерапия, вводимая системно или непосредственно в спинномозговую жидкость) может применяться у пациентов с лептоменингеальными метастазами, вторичными по отношению к раку груди, хотя прогноз остается неблагоприятным.Мультимодальный подход (циторедукционная операция с последующей гипертермической внутрибрюшинной химиотерапией) также используется у отдельных людей с перитонеальным карциноматозом и в некоторых случаях может значительно улучшить прогноз.
Химиотерапия- Карциноматоз брюшины в некоторых случаях можно лечить с помощью внутрибрюшинной и / или внутривенной химиотерапии. Лечение можно начать после операции или химиотерапевтические препараты можно закапывать в брюшную полость во время или после операции.При раке яичников с перитонеальным распространением химиотерапия является более стандартной, чем при других первичных заболеваниях, и прогноз часто значительно улучшается.
- Интратекальный трастузумаб в некоторых случаях может быть эффективным вариантом лечения HER2-положительных пациентов с раком молочной железы с лептоменингеальным поражением, но все еще исследуется [8, 9] . Метотрексат (интра-CSF) — более распространенный вариант химиотерапии для пациентов с раком груди с лептоменингеальным поражением.
- Транскатетерная артериальная химиоэмболизация (ТАХЭ) привела к успешному результату, особенно у пациентов с нейроэндокринными опухолями и колоректальными метастазами.Его все чаще используют при лечении злокачественных опухолей печени. Микрокатетер вводится в печеночный кровоток и вводится комбинация химиотерапевтических агентов и агентов для эмболии. Радиоэмболизация обещает сыграть все более важную роль в методах лечения метастатических заболеваний, но необходимы дальнейшие испытания, особенно сравнения с режимами химиотерапии.
- Паллиативная лучевая терапия часто используется для:
- Уменьшения или устранения боли при метастазах в кости.
- Паллиативные метастазы в головной мозг.
- Снимите компрессию спинного мозга или симптомы сжатия от висцеральных метастазов (например, обструкции дыхательных путей или желудочно-кишечного тракта).
- Контролируемое кровотечение — например, кровохарканье или гематурия.
- Для уничтожения метастазов в печени использовались различные абляционные методы, включая замораживание, микроволны, лазеры и использование переменного тока в радиочастотном диапазоне.
- Хотя паллиативная операция по поводу злокачественной непроходимости кишечника, вызванной карциноматозом, может принести пользу пациентам, она достигается за счет высокой смертности и заболеваемости по сравнению с оставшимся временем выживания пациента [13] .
- Текущие данные об эффективности циторедукционной хирургии (CRS) с последующей гипертермической интраоперационной перитонеальной химиотерапией (HIPEC) при перитонеальном карциноматозе показывают некоторое улучшение выживаемости у отдельных пациентов с колоректальными метастазами, но доказательства ограничены или неоднозначны для других типов рака [ 14, 15] .
- Хирургическое лечение некоторых костных метастазов может иметь значение для увеличения продолжительности и качества жизни [16] .
Для неизлечимых пациентов необходимо откровенное и честное обсуждение.Для этого может потребоваться более одного сеанса и навыки, чтобы сообщать плохие новости. Другими причинами могут быть смерть дома и одышка при паллиативной помощи. Обезболивание при неизлечимой помощи и тошнота и рвота при паллиативной помощи также могут требовать внимания.
Хорошая паллиативная помощь, вероятно, потребует многопрофильного командного подхода. Раннее направление в бригаду паллиативной помощи важно для помощи специалиста с контролем симптомов и эмоциональными проблемами для пациентов и родственников [17] .
Рак брюшины | Сидарс-Синай
Что такое рак брюшины?
Рак, распространившийся на поверхности слизистой оболочки брюшной (брюшной) полости из-за рака яичников, первичного колоректального рака, рака аппендикса или мезотелиомы и псевдомиксомы брюшины, известных как перитонеальный карциноматоз, часто называют раком брюшины. Независимо от того, начинается ли рак брюшины в брюшине или распространяется откуда-то еще (толстая кишка, аппендикс, яичник), он считается продвинутым (стадия IV), когда попадает в брюшину, и может быть назван перитонеальным карциноматозом.
Кто подвержен риску рака брюшины?
Точно неизвестно, что вызывает рак брюшины, хотя процесс начинается, когда серия мутаций в клетках брюшины приводит к неконтролируемому росту. Это может быть связано с предшествующим раком, который теперь распространился на брюшину, или с другим типом рака, известным как первичный рак брюшины.
Как лечится?
- В зависимости от типа опухоли вам может быть назначена операция по удалению всей опухоли, известная как циторедукция, с последующей HIPEC.Этот метод, сочетающий хирургическое вмешательство с химиотерапией, произвел революцию в лечении рака брюшной полости (брюшной полости), который возникает из рака толстой кишки, желудка, яичников и придатков, а также мезотелиомы и псевдомиксомы брюшины. HIPEC — это, по сути, химиотерапевтическая «ванна», которая доставляет горячую химиотерапию непосредственно в брюшную полость, где она напрямую проникает в пораженные ткани. Этот целевой контакт нагретого лекарства убивает опухолевые узелки, что увеличивает абсорбцию химиотерапевтического раствора.Имеются убедительные клинические доказательства того, что HIPEC является эффективным средством лечения пациентов с псевдомиксомой брюшины, муцинозной аденокарциномой аппендикса и мезотелиомой брюшины. Кроме того, у значительного числа пациентов можно успешно лечить перитонеальные метастазы рака толстой кишки.
- Существует вероятность того, что вам может потребоваться внутривенная или пероральная химиотерапия до или после операции в зависимости от вашего конкретного типа опухоли. Это будет определять ваша лечащая бригада.
- Дополнительные методы лечения также могут быть использованы для лечения вашего конкретного типа опухоли. Таргетная терапия может использоваться для лечения некоторых запущенных первичных карцином брюшины. Иногда препарат таргетной терапии сочетают с химиотерапевтическим препаратом. Гормональная терапия может быть назначена в дополнение к химиотерапии для лечения запущенной первичной карциномы брюшины. Наконец, лучевая терапия иногда используется для лечения запущенной первичной или рецидивирующей карциномы брюшины.
Когда мне следует позвонить своему провайдеру?
Вам следует позвонить своему врачу, если у вас есть симптомы, включая необъяснимую потерю веса, анорексию, боль в животе, вздутие живота, тошноту или рвоту или изменения в привычках кишечника.
Основные сведения о раке брюшины
- Многие виды рака, которые лечатся с помощью HIPEC, являются заболеваниями, которые лечатся в различных областях медицины и хирургии. Важно, чтобы пациент обсудил терапию HIPEC со своим онкологом и хирургом, которые могут соответствующим образом направить его терапию.
- HIPEC имеет несколько преимуществ перед стандартной химиотерапией:
- Это однократное лечение, проводимое в операционной, вместо нескольких процедур в течение нескольких недель.
- 90% препарата остается в брюшной полости (непосредственно в области рака), уменьшая токсическое воздействие на остальные части тела.
- Позволяет проводить более интенсивную химиотерапию.
- Если операция невозможна из-за особенностей расположения опухолей и невозможности удалить все видимые формы рака, мы будем работать с вами, чтобы рекомендовать другие варианты, которые могут включать таргетную терапию или иммунную терапию для персонализации вашего рака. лечение.
© 2000-2021 Компания StayWell, LLC. Все права защищены. Эта информация не предназначена для замены профессиональной медицинской помощи. Всегда следуйте инструкциям лечащего врача.
Программа по борьбе с злокачественными новообразованиями на поверхности брюшины | Johns Hopkins Medicine
Злокачественное новообразование поверхности брюшины, широко известное как перитонеальный карциноматоз, представляет собой рак внутри брюшной полости. Брюшная полость — это пространство между органами в брюшной полости, выстланное брюшиной, которая обычно представляет собой тонкую защитную мембрану.Рак брюшины часто вызывается распространением раковых клеток из ранее существовавшего рака. Наиболее распространенными видами рака, вызывающими карциноматоз брюшины, являются:
Лечение злокачественных опухолей поверхности брюшины
Воспроизвести видео:Циторедуктивная хирургия и HIPEC
Благодаря недавним достижениям в хирургических методах, мы теперь можем предложить больше вариантов лечения некоторых поздних стадий рака, чем когда-либо прежде. Было показано, что метод, называемый удалением опухоли или циторедуктивной операцией (CRS), и гипертермической внутрибрюшинной химиотерапией (HIPEC) является эффективным вариантом лечения для некоторых пациентов со злокачественными новообразованиями на поверхности брюшины.
Эта сложная хирургическая процедура представляет собой двухэтапный процесс:
- Хирургическое удаление любой видимой опухоли или рака (CRS)
- Доставка нагретых химиотерапевтических препаратов в брюшную полость (HIPEC)
Первая фаза лечения, CRS, включает удаление любых видимых опухолей в брюшной полости, которые могут включать пораженные органы. Объем операции будет зависеть от размера опухоли в брюшной полости. Хирурги тщательно соотносят риски и преимущества удаления органа с вашим лечением рака и общим состоянием здоровья и подробно обсудят это с вами до операции.
Во время второй фазы лечения нагретый химиотерапевтический раствор циркулирует в брюшной полости для лечения любых раковых клеток, которые могут остаться. Комбинация тепла и химиотерапии, проводимая непосредственно в брюшную полость в операционной, считается более эффективной, чем только хирургическое вмешательство для некоторых пациентов с заболеванием брюшины, потому что оно может получить доступ и убить больше раковых клеток, чем можно обнаружить невооруженным глазом.
Недавние исследования показали, что CRS / HIPEC полезен для некоторых пациентов с поздними стадиями рака желудочно-кишечного тракта и рака яичников.Процедура потенциально может продлить жизнь, а также улучшить качество жизни пациентов. Поскольку химиотерапия вводится в виде одноразовой дозы непосредственно в брюшную полость, традиционных побочных эффектов пероральных или внутривенных химиотерапевтических препаратов можно избежать; однако многим пациентам все еще требуется внутривенная химиотерапия до или после операции.
Качество обслуживания
Многопрофильная группа специалистов в области здравоохранения внимательно изучит ваши медицинские записи и встретится с вами, чтобы определить, может ли эта операция оказаться для вас эффективным лечением.Два фактора имеют решающее значение для успешных результатов: во-первых, тщательный отбор пациентов для определения того, кто может получить наибольшую пользу с наименьшим риском, и, во-вторых, выполнение этой операции профессионалами в загруженном национальном онкологическом центре, таком как больница Джона Хопкинса. имеет опыт лечения сложных онкологических больных.
Насколько инвазивна процедура?
В настоящее время большая часть CRS / HIPEC выполняется через открытый разрез, проходящий от нижней части грудины до лобковой кости.Мы тесно сотрудничаем с нашими коллегами по анестезии, чтобы минимизировать дискомфорт после операции.
Каково время восстановления пациента с CRS / HIPEC?
От двух до трех месяцев — это среднее время, которое требуется большинству пациентов, чтобы прийти в норму.
Есть ли побочные эффекты от операции?
- Усталость является обычным явлением, когда организм восстанавливается после этой сложной операции и постепенно улучшается с ежедневной активностью и периодами отдыха по мере необходимости.
- С тошнотой можно справиться с помощью лекарств и постепенного перехода от жидкой пищи к твердой.
- Боль купируется с помощью внутривенных или эпидуральных лекарств, а затем и пероральных лекарств для достижения контроля.
- Потеря аппетита — обычное явление, которое постепенно улучшается при частом приеме пищи небольшими порциями.
- Выпадение волос носит временный характер и обычно улучшается при правильном питании и времени.
- Как и во всех крупных хирургических вмешательствах, существуют стандартные риски кровотечения, инфекции и последствий анестезии.Большинство из них незначительны, но некоторым требуется дальнейшее пребывание в больнице для лечения.
- Другие хирургические риски зависят от степени удаления органа и будут обсуждены с вами во время вашего предоперационного визита.
Как долго я буду в больнице?
Будьте готовы пробыть в больнице 10–14 дней. В среднем пациентов выписывают примерно на 8 или 9 день.
Как на меня повлияет химиотерапия?
Одноразовая доза химиотерапии, вводимая в брюшную полость при повышенной температуре, вызывает следующее:- Кишечник временно замедляется
- Изменения в лабораторных результатах, таких как количество лейкоцитов и тромбоцитов
Мы из другого города; где может остаться моя семья?
Найдите информацию о жилых помещениях, предлагающих скидки для пациентов и членов их семей.
Познакомьтесь с нашими экспертами
Наша многопрофильная команда состоит из хирургов, онкологов, врачей-терапевтов, радиологов, анестезиологов, медсестер, диетологов и социальных работников, которые стремятся предоставить комплексный уход, основанный на лучших доказательствах, для улучшения результатов лечения пациентов и качества лечения. жизнь для людей с диагнозом перитонеальный карциноматоз.
Хирургическая онкология
Крапива, Бренда Смит DNP, ACNP-BC
Практикующая медсестра Школа медицины Университета Джона Хопкинса, Балтимор, Мэриленд
Гинекология и акушерство
Медицинская онкология
Радиология
Пределы диагноза и футляр для жидкостной биопсии
Онкотоваргет.2017 июн 27; 8 (26): 43481–43490.
Джеймс Р.В. Макмаллен
1 Департамент фундаментальных наук, Центр диспропорций в отношении здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Мэтью Селлек
2 Департамент Хирургия, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Натан Р. Уолл
1 Отдел фундаментальных наук, Центр различий в состоянии здоровья и молекулярной медицины, Отделение биохимии, Университет Лома Линда Медицинский центр, Лома Линда, Калифорния, США
Махесвари Сентил
2 Отделение хирургии, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
1 Отделение фундаментальных наук, Центр по проблемам здоровья и молекулярной медицины, Отдел биохимии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
2 Отделение хирургии, Отделение хирургической онкологии, Медицинский центр Университета Лома Линда, Лома Линда, Калифорния, США
Поступило 21 января 2017 г .; Принята в печать 15 марта 2017 г.
Эта статья распространяется в соответствии с условиями лицензии Creative Commons Attribution License (CC-BY), которая разрешает неограниченное использование и распространение при условии указания автора и источника. Эта статья цитируется в других статьях PMC.Abstract
Карциноматоз брюшины (ПК) — это проявление на поздней стадии нескольких злокачественных новообразований желудочно-кишечного тракта, включая рак аппендикса, толстой кишки и желудка. При РПЖ опухоли метастазируют и откладываются на поверхности брюшины и часто оставляют пациентам только варианты паллиативного лечения.При колоректальном РПЖ средняя выживаемость составляет примерно пять месяцев, а паллиативная системная терапия может продлить ее примерно до 12 месяцев. Однако циторедуктивная хирургия с гипертермической внутрибрюшинной химиотерапией (CRS / HIPEC) с лечебной целью возможна у некоторых пациентов с ограниченной опухолевой нагрузкой. Сообщается, что у тщательно отобранных пациентов, перенесших полную циторедукцию, средняя выживаемость составляет 63 месяца. Выявление пациентов на более раннем этапе, которые либо подвержены риску ПК, либо у которых недавно развился ПК, может предоставить им дополнительные варианты лечения, такие как CRS / HIPEC.ПК диагностируется поздно по результатам визуализации или часто во время инвазивных процедур, таких как лапароскопия или лапаротомия. Чтобы улучшить результаты у пациентов с ПК, необходимо разработать минимально инвазивный, точный и специфический метод скрининга ПК. Используя циркулирующие биомаркеры ПК в сыворотке крови пациентов, можно создать «жидкую биопсию», которая позволит разработать индивидуальный план лечения и раннее вмешательство. Экзосомы, стабильные нанопузырьки, полученные от пациентов, присутствующие в крови, моче и многих других жидкостях организма, являются многообещающим инструментом для оценки лабильных биомаркеров.Если жидкие биопсии могут быть усовершенствованы на ПК, проявления этого рака можно будет более эффективно лечить, тем самым повышая выживаемость.
Ключевые слова: карциноматоз брюшины, жидкостная биопсия, биомаркер, экзосомы
ВВЕДЕНИЕ
Карциноматоз брюшины (ПК) является поздней стадией проявления нескольких злокачественных новообразований желудочно-кишечного тракта, характеризующихся отложением опухоли на поверхности брюшины [1]. Это может быть полностью бессимптомным на ранних стадиях или по мере прогрессирования заболевания могут развиваться такие симптомы, как тошнота, диарея, боль в животе, вздутие живота и потеря веса [1].Заболевание часто обнаруживается при развитии асцита или кишечной непроходимости, обычно возникающих при большей опухолевой нагрузке, которую труднее лечить [2]. Раннее обнаружение ПК при ограниченной опухолевой нагрузке может повысить эффективность существующих вариантов лечения [3].
Колоректальный рак (CRC), третий по распространенности рак в мире, является хорошим примером ПК. По оценкам, в 2016 году в США будет 95 270 случаев рака прямой кишки и почти 1.4 миллиона случаев во всем мире [4]. Синхронный ПК диагностируется примерно во время постановки диагноза первичной опухоли, в то время как метахронный ПК диагностируется позднее, обычно через месяцы или годы после первоначального диагноза [5]. Частота синхронного изолированного перитонеального карциноматоза у пациентов с CRC несколько колеблется в литературе от 4% до 18% [6–9]. Это может быть даже заниженная оценка, учитывая недостаточную чувствительность изображений для ПК и то, что это не может быть обнаружено до хирургического исследования. Между тем, метахронный ПК был зарегистрирован у 5-19% пациентов после окончательного лечения.
ЦИТОРЕДУКТИВНАЯ ХИРУРГИЯ (CRS)
Раньше ПК считался смертельным заболеванием, не имевшим возможности хирургического лечения. Однако растущее признание СВК с гипертермической внутрибрюшинной химиотерапией (HIPEC) открыло возможность повышения выживаемости для тщательно отобранных пациентов [3]. В этом методе используется «циторедукция» для хирургического удаления крупных видимых опухолевых отложений с последующим прямым контактом с нагретыми цитотоксическими химиотерапевтическими агентами для воздействия на любую остаточную болезнь.Применяемый во время операции, этот протокол максимизирует потенциальный контакт с поверхностью брюшины, сводя к минимуму системную токсичность. В частности, гипертермия между 41 и 43 градусами по Цельсию сочетается с лекарствами с большой молекулярной массой, которые проникают между несколькими клетками на глубину до 3 мм, вызывая цитотоксические эффекты [10]. Доктору Полу Шугарбейкеру приписывают разработку этого варианта лечения путем объединения этих элементов в лечебный подход к перитонеальному распространению злокачественных новообразований желудочно-кишечного тракта [11, 12].Средняя выживаемость CRC PC без какого-либо лечения составляет приблизительно 4-7 месяцев, в то время как паллиативная системная терапия может продлить ее до 12-23 месяцев на основании нескольких серий [13-15]. Сообщается, что медиана общей выживаемости с CRS / HIPEC составляет от 22 до 63 месяцев с 5-летней выживаемостью 40-51% у выбранных пациентов [13, 15, 16]. На исходы CRS / HIPEC сильно влияет тщательный отбор пациентов и полная циторедукция (CC-0) (см. Таблицу) [17]. Выживаемость пациентов с колоректальным раком, получивших менее чем полную циторедукцию (CC-1 или CC-2) или имеющих более высокое бремя заболевания, на что указывает индекс перитонеального карциноматоза (PCI) (см. Рисунок), значительно ниже по сравнению с индексом перитонеального карциноматоза (PCI) (см. Рисунок). Резекция CC-0 [17–19].Обширное бремя болезни при выявлении часто оставляет пациентам только варианты паллиативного лечения [20]. Несмотря на преимущества CRS / HIPEC, только около 25% пациентов с ПК будут подходить для этого подхода с учетом позднего обращения и бремени болезни. Чтобы расширить возможности пациентов и предложить лечение с лечебной целью, необходимо раннее выявление ПК до того, как разовьется значительная опухолевая нагрузка.
Таблица 1
CC — оценка полноты циторедукции
| Оценка полноты циторедукции | |
|---|---|
| Оценка | Размер наибольшей 033 остаточной опухоли после операции | 904 Нет видимой опухоли
| CC-1 | Менее 0.25 см |
| CC-2 | Между 0,25 см и 2,5 см |
| CC-3 | > 2,5 см или сливной |
PCI является диагностической и прогностический инструмент, который представляет собой сумму баллов по тринадцати областям брюшной полости. Каждый получает оценку от 0 до 3 на основании самого большого размера опухоли в каждой области. Баллы варьируются от 0 до 39. Более высокие баллы указывают на более распространенные и / или более крупные опухоли в брюшной полости.
ИЗОБРАЖЕНИЕ
Традиционные методы визуализации, такие как КТ и МРТ, не обладают чувствительностью как для обнаружения, так и для оценки бремени болезни на ПК. Признаки классической компьютерной томографии (КТ) ПК, такие как «спекание сальника», утолщение сальника и узелки брюшины, не являются обычными рентгенографическими находками при «ранних» болезненных состояниях. Несколько исследований, разработанных для определения специфичности и точности КТ при оценке опухолевой нагрузки на ПК, показали, что КТ значительно занижает количество заболеваний, присутствующих в брюшной полости [21–24].Сообщалось, что чувствительность КТ-обнаружения опухолевых узлов размером менее 0,5 см и 1 см составляет 11% и 25-50% соответственно [23]. Это особенно важно при колоректальном ПК, где ЧКВ является критическим фактором, определяющим полную циторедукцию и долгосрочные результаты [25]. В исследовании, проведенном Кохом и соавторами, изучавшим ПК при КРР, они определили, что КТ значительно недооценивает клиническое ЧКВ [23]. Фактически чувствительность поражения тонкой кишки в каждой области колебалась в пределах 8-17%. Несмотря на это, Пятый международный семинар по злокачественным новообразованиям брюшной полости в Милане определил КТ в качестве основного метода визуализации для оценки пригодности для лечения СВК [26].Ультразвук также имеет очень ограниченную чувствительность для обнаружения узелков ПК [27–29]. В проспективных исследованиях было продемонстрировано, что магнитно-резонансная томография (МРТ) и, в частности, диффузионно-взвешенные изображения имеют повышенную точность при обнаружении карциноматоза в определенных областях брюшной полости [30]. Однако это имеет свои ограничения из-за артефактов движения перистальтики, стоимости и необходимости радиологов, обученных их интерпретации и вариациям между наблюдателями. Кроме того, позитронно-эмиссионная технология (ПЭТ) может иметь повышенную чувствительность, но аналогичные ограничения и отсутствие дополнительной клинической ценности часто препятствуют ее использованию для определения резектабельности [24, 31–33].Эти трудности, особенно ограниченная чувствительность, отсутствие значимой клинической корреляции и высокая стоимость, снижают полезность неинвазивной визуализации для раннего обнаружения ПК. При современных технологиях для подтверждения диагноза и степени ПК часто требуется лапароскопия или диагностическая хирургия (см. Таблицу) [34].
Таблица 2
В этой таблице приведены плюсы и минусы каждого метода неинвазивной визуализации при оценке ПК
| Утилита неинвазивной визуализации при обнаружении ПК | |||||||
|---|---|---|---|---|---|---|---|
| Модальность изображения | Плюсы | Чувствительность / специфичность по сравнению с хирургическим анализом | Ссылки | ||||
| Ультразвук | Недорого, эффективно для обнаружения асцита | Ограниченная чувствительность узелков ПК, сильно зависит от оператора | 24 Неспецифические [26] | [26] | [26] | [26] , 25]. 26] | [18–21] |
| МРТ | Высокая чувствительность ПК | Относительно дорого, небольшая перистальтика мо артефакт, вариабельность между наблюдателями | 90% / 95.5% (взвешенный по диффузии) [26] | [28] | |||
| ПЭТ / ПЭТ-КТ | Высокая чувствительность ПК | Относительно дорого, Артефакт движения перистальтики | 78-97% / 55-90% [26 ] | [27, 28] | |||
ЖИДКАЯ БИОПСИЯ
Учитывая узкую подгруппу пациентов, которым предлагается CRS / HIPEC, потенциально спасающее жизнь лечение, мы нуждаемся в изменении парадигмы. Пациенты, которые либо подвержены риску развития ПК, либо находятся на самой ранней стадии этого болезненного процесса, могут значительно выиграть от расширенных вариантов лечения.Термин «жидкая биопсия» получил широкое распространение, поскольку крупномасштабные исследования направлены на выявление опухолевых маркеров в сыворотке крови. Обычно это относится к молекулярным диагностическим исследованиям, которые проводятся на крови или биологической жидкости, а не на самой раковой ткани [35]. Множественные сывороточные опухолевые маркеры: карциноэмбриональный антиген (CEA), углеводный антиген CA 19-9 и CA 125 обычно повышены у пациентов с ПК, и степень повышения имеет тенденцию коррелировать с распространением ПК [36]. Однако этих сывороточных онкомаркеров недостаточно для раннего выявления ПК.Более того, им не хватает специфичности для прогнозирования наличия или риска ПК у пациентов с CRC. Существует критическая клиническая потребность в идентификации циркулирующих опухолевых биомаркеров агрессивности, вероятности рецидива, риска метастазов, таких как ПК, или даже наличия злокачественного новообразования, чтобы лучше подбирать терапию для пациентов. Например, если известно, что у пациента с впервые диагностированным колоректальным раком III стадии существует значительный риск рецидива брюшной полости из-за наличия определенного набора биомаркеров в их сыворотке, он может получить пользу от профилактического HIPEC.Это лишь один пример того, как можно применить эту технологию.
Если обнаруживаются биомаркеры ПК с кровью, обладающие высокой чувствительностью и специфичностью, пациенты, у которых развивается ПК, могут быть быстро идентифицированы с помощью анализа крови, жидкой биопсии. Один из таких типов биомаркеров, микроРНК (miR), короткие некодирующие РНК, которые регулируют мРНК, продемонстрировал диагностическую полезность, правильно идентифицируя несколько видов рака неизвестной первичной с разумной точностью [37]. Диагностический профиль miR, который использовался в этом исследовании, был получен из анализа miR в хорошо дифференцированных первичных опухолях [37].Некоторые miRs, такие как miR-21, были связаны с раком желудочно-кишечного тракта в качестве потенциальных диагностических целей и прогностических индикаторов [38]. Однако эти miRs и другие типы РНК быстро разрушаются в плазме [39–41].
ЭКЗОСОМЫ
Экзосомы, везикулы, происходящие из мелких клеток (рисунок), могут защищать РНК и миРНК от разрушения [42–46]. Когда исследователи подвергли miRs воздействию РНКазы, miR, находившиеся в экзосомах и клетках, были защищены, в то время как свободные РНК деградировали [42].Когда экзосомы подвергались действию РНКазы, содержащиеся в них РНК были защищены от деградации, в то время как клеточная РНК расщеплялась той же самой РНКазой [45]. Экзосомы обладают большим потенциалом как для диагностики, так и для прогнозирования заболеваний и исключительно полезны в качестве биомаркеров рака [47]. Когда панель miR, ассоциированных с раком легких, была исследована в солидных опухолях и опухолевых экзосомах из плазмы пациентов, было обнаружено, что большинство miR имеют очень сопоставимые уровни экспрессии (см. Таблицу для miR) [48, 49]. Экзосомы (TEX), производные от опухолевой линии клеток рака шейки матки, содержат сурвивин, который способствует агрессивности рака и метастатическому потенциалу [50, 51].В исследовании рака яичников большее количество экзосом рака было обнаружено в сыворотке по мере изучения более поздних стадий рака [52]. Кроме того, примерно в четыре раза больше экзосом в сыворотке крови было обнаружено у пациентов с раком легкого по сравнению с контрольной группой без рака, и экзосомы содержали более чем в два раза больше miR [48]. В нашем исследовании мы обнаружили повышенные уровни экзосом в сыворотке крови у пациентов с раком простаты и молочной железы по сравнению с контрольной группой без заболевания [53–55]. TEX преобладают в сыворотке пациентов от нескольких типов рака и защищают лабильные биомаркеры от деградации [42, 45, 48, 53–55].
Опухолевые клетки выделяют нанопузырьки, называемые экзосомами, которые несут РНК, включая микроРНК и информационные РНК, и белки
Таблица 3
Эти miR, связанные с раком легких, были обнаружены как в солидной опухоли, так и в экзосомах опухоли
| miR-17-3p | miR-21 | miR-106a | miR-146 | miR-155 | miR-191 | |||
| miR-192 | miR-203 | miR-203 | miR-203 | miR-203 -210 | miR-212 | miR-214 |
Экзосомы не были широко изучены в диагностике ПК.Андре и его коллеги исследовали экзосомы асцита у пациентов с ПК и обнаружили, что опухолеспецифические маркеры Her2 / Neu, TRP1 и Mart1 присутствуют в экзосомах асцитных опухолей [56]. Tokuhisa с коллегами идентифицировали несколько РНК, присутствующих в экзосомах перитонеального асцита, перитонеального лаважа и метастатических клеточных линий PC [57]. После скрининга miR экзосом 5 miRNA были отобраны в качестве панели значительно дифференцированно регулируемых РНК: miR 1202, 1207-5p, 1225-5p, 320c и 4270 [57]. miR 21 имеет самую высокую интенсивность сигнала при злокачественном асците [57].Экзосомы из перитонеального лаважа исследовали на miR 21, 1225-5p и 320c; Было обнаружено, что miR 21 и 1225-5p активируются на более поздних стадиях рака желудка и коррелируют с серозной инвазией [57]. В исследовании ткани первичного рака желудка активность miR 1255-5p в целом подавлялась, и было обнаружено, что она ингибирует рост раковых клеток, их подвижность, а также инвазию рака [58]. Этот явно противоречивый результат предполагает, что miR 1225-5p в перитонеальном лаваже либо высвобождается незлокачественной тканью в попытке остановить аномальный рост, либо используется раком для облегчения лучшего прикрепления к брюшине.В очевидно противоречащих результатам вышеупомянутого исследования, в клеточных линиях рака желудка и in vivo , miR 1255-5p, как правило, подавляется и, как было обнаружено, ингибирует рост и подвижность клеток, а также инвазию рака [58].
Было обнаружено, что проспективные биомаркеры miR PC желудочного сока, описанные в исследовании Tokuhisa с коллегами [57], также связаны с другими видами рака (см. Таблицу). Примечательно, что miR 1202, 1207-5p, 1225-5p и 4270 были обнаружены в крови больных раком груди [59].В образцах ткани рака мочевого пузыря человека уровень miR 320c был значительно подавлен [60]. В образцах ткани гепатоцеллюлярной карциномы было обнаружено, что miR 1207-5p значительно подавлен [61]. В образцах ткани карциномы коры надпочечников было обнаружено, что повышенная экспрессия miR 1202 связана со значительным сокращением продолжительности жизни пациентов [62]. Пробелы в наших знаниях о передаче сигналов РНК при раке сразу видны из таблицы. Наблюдение, что эти miRs, индивидуально или в группе, связаны с несколькими типами рака и обнаруживаются в экзосомах из брюшной полости, предполагает потенциал экзосомальной диагностики PC.
Таблица 4
Рак желудка PC-ассоциированные экзосомальные миРи и их распространенность при различных раковых заболеваниях
| Рак желудка | Рак легких | Рак печени | 9048 Рак предстательной железы 9048 Рак молочной железы 9048 | Рак надпочечников | |||
|---|---|---|---|---|---|---|---|
| miR 1202 | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | X | X | ↑ экзосомы сыворотки 33 X [54] | опухолевая ткань [62]|||
| miR 1207-5p | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52], ↓ тНм опухолевой ткани [63], ↓ опухолевой ткани [64] | X | ↓ солидная опухоль [56] | ↑ экзосомы сыворотки [54] | ↑ сыворотка [65] | ↑ солидная опухоль [66] | X |
| miR 1225-5p | ↑ tnM p жидкость эритонеального лаважа [52], ↓ раковая ткань [53] | X | ↓ кровь [67] | ↑ экзосомы сыворотки [54] | ↑ кровь [68], ↓ солидная опухоль [69] | ↓ солидная опухоль [70] | ↓ несколько типов солидных опухолей [71] |
| miR 320c | ↔ злокачественный асцит, жидкость перитонеального лаважа, культура клеток [52] | ↓ солидная опухоль [72] | X | X | X | X | X |
| miR 4270 | ↔ злокачественный асцит, жидкость из перитонеального лаважа, культура клеток [52] | X | X↑ | ↑ экзос. | X | X |
РНК И РАК ЖЕЛУДКА
Обнаружено, чтоРНК глобально подавляются при раке [37].Повышенная регуляция РНК и miR, вероятно, связана с ростом и функцией рака или реакцией организма на рак. miR 320c ингибирует рост и подвижность клеток при раке мочевого пузыря [60]. miR 1207-5p функционирует, чтобы ингибировать рост клеток и инвазию при раке печени, но функционирует для увеличения стволовости при колоректальном раке [61, 63]. Поскольку эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, появляется возможность адаптации лечения ПК на основе того, какие биомаркеры обнаружены в экзосомах пациента.miR 320c ингибирует рост и подвижность клеток, а miR 1207-5p действует, ингибируя рост и инвазию клеток. Наблюдение за тем, что эти ассоциированные с экзосомами miRs обладают известными функциями в опухолях, открывает возможность использования этих биомаркеров для адаптации лечения отдельного пациента. [60, 61]
НАПРАВЛЕНИЯ НА БУДУЩЕЕ
Для определения биомаркеров перитонеального карциноматоза необходимы дополнительные исследования. Отличить метастатическое заболевание перитонеального происхождения от метастазов в солидный орган должно быть как биологически возможным, так и клинически полезным.Поскольку мы обращаемся к экзосомам, чтобы получить представление об этой области, необходимо будет решить общие проблемы, связанные с изоляцией и валидацией нанопузырьков. Для клинического использования необходимо разработать надежные и эффективные методы, а также признанные стандарты. Будущая клиническая работа в этой области должна включать проспективный сбор образцов для ретроспективного исследования. Это будет способствовать установлению клинической валидности и полезности. Мы надеемся, что совместная работа многих продолжит приносить успехи в уменьшении бремени жизни, потерянного в результате этого агрессивного недуга.
ВЫВОДЫ
В последнее время TEX были вовлечены в облегчение метастазирования. TEX могут поглощаться несколькими типами клеток, включая эндотелиальные клетки, клетки-предшественники костного мозга и другие раковые клетки [64–67]. Эти экзосомы продемонстрировали способность доставлять функциональные РНК и белки к реципиентным клеткам, модифицируя их паттерны роста, делая их проонкогенными [65, 66]. Кроме того, TEX продемонстрировали способность значительно увеличивать количество метастатических опухолей на модели мышей [64].Изучение TEX в контексте метастазирования — многообещающая область. ПК в настоящее время трудно обнаружить в самом начале. Позднее обнаружение ПК обычно оставляет болезнь неизлечимой. ПК должен быть обнаружен раньше для улучшения результатов лечения пациентов. Неинвазивная визуализация нецелесообразна для раннего обнаружения ПК. Обнаружение ПК с помощью маркеров в биологических жидкостях пациента, таких как сывороточная «жидкая биопсия», было бы идеальным. И сыворотка, и асцит содержат биомаркеры, выделяемые ПК. Экзосомы попадают в сыворотку при различных типах рака и защищают свое содержимое от разложения в крови.Они предоставляют нам вероятный источник чувствительного и специфического диагностического метода для обнаружения ПК на самой ранней стадии, из которой он поддается лечению.
Благодарности
Авторы хотели бы поблагодарить Центр неравенства в отношении здоровья и молекулярной медицины за его поддержку. Они также хотели бы поблагодарить сотрудников Wall Laboratory за внимательное рассмотрение этой рукописи.
Сноски
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
ФИНАНСИРОВАНИЕ
Исследование, представленное в этой публикации, было поддержано наградой NIH P20MD006988 (NRW).
ССЫЛКИ
1. Леви А.Д., Шоу Дж. С., Собин Л. Х. Вторичные опухоли и опухолевидные поражения брюшной полости: особенности визуализации с патологической корреляцией. RadioGraphics. 2009; 29: 347–73. DOI: 10.1148 / rg.292085189. [PubMed] [CrossRef] [Google Scholar] 2. Садеги Б., Арвье С., Глеен О., Божар А.С., Ривуар М., Болье Дж., Фонтаумар Э., Браше А., Кайо Дж. Л., Фор Дж. Л., Поршерон Дж., Пейш Дж. Л., Франсуа И. и др.Карциноматоз брюшины от негинекологических злокачественных новообразований. Рак. 2000; 88: 358–63. DOI: 10.1002 / (SICI) 1097-0142 (20000115) 88: 2 <358 :: AID-CNCR16> 3.0.CO; 2-O. [PubMed] [CrossRef] [Google Scholar] 3. Chia CS, You B, Decullier E, Vaudoyer D, Lorimier G, Abboud K, Bereder JM, Arvieux C, Boschetti G, Glehen O, Group tBIGR Пациенты с перитонеальным карциноматозом от рака желудка, леченные с помощью циторедуктивной хирургии и гипертермической интраперитонеальной терапии Возможность? Анналы хирургической онкологии.2016: 1–9. DOI: 10.1245 / s10434-015-5081-3. [PubMed] [CrossRef] [Google Scholar] 4. Сигел Р.Л., Миллер К.Д., Джемаль А. Статистика рака, 2016. CA Cancer J Clin. 2016; 66: 7–30. DOI: 10.3322 / caac.21332. [PubMed] [CrossRef] [Google Scholar] 5. Mekenkamp LJ, Koopman M, Teerenstra S, van Krieken JH, Mol L, Nagtegaal ID, Punt CJ. Клинико-патологические особенности и исходы у пациентов с запущенным колоректальным раком с синхронными и метахронными метастазами. Br J Рак. 2010 (103): 159–64. DOI: 10.1038 / sj.bjc.6605737.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Клавер Ю.Л., Лемменс В.Е., Ниенхейс С.В., Луйер, доктор медицинских наук, де Хинг И.Х. Карциноматоз брюшины колоректального происхождения: заболеваемость, прогноз и варианты лечения. Всемирный журнал гастроэнтерологии. 2012; 18: 5489–94. DOI: 10.3748 / wjg.v18.i39.5489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. Klaver CE, Musters GD, Bemelman WA, Punt CJ, Verwaal VJ, Dijkgraaf MG, Aalbers AG, van der Bilt JD, Boerma D, Bremers AJ, Burger JW, Buskens CJ, Evers P и др.Адъювантная гипертермическая внутрибрюшинная химиотерапия (HIPEC) у пациентов с раком толстой кишки с высоким риском перитонеального карциноматоза; рандомизированное многоцентровое исследование COLOPEC. BMC Рак. 2015: 15. DOI: 10.1186 / s12885-015-1430-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Mitry E, Guiu B, Cosconea S, Jooste V, Faivre J, Bouvier AM. Эпидемиология, лечение и прогноз колоректального рака с метастазами в легкие: 30-летнее популяционное исследование. Кишечник. 2010; 59: 1383–8. DOI: 10,1136 / киш.2010.211557. [PubMed] [CrossRef] [Google Scholar] 9. Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживаемость перитонеального карциноматоза от колоректального рака: популяционное исследование. Заболевания толстой и прямой кишки. 2015; 58: 743–52. DOI: 10.1097 / DCR.0000000000000412. [PubMed] [CrossRef] [Google Scholar] 10. Ян Т.Д., Цао CQ, Мункхольм-Ларсен С. Фармакологический обзор внутрибрюшинной химиотерапии при злокачественных новообразованиях брюшины. Мир J Gastrointest Oncol.2010; 2: 109–16. DOI: 10.4251 / wjgo.v2.i2.109. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Гудман, доктор медицины, Макпартланд С., Детелич Д., Саиф М.В. Химиотерапия для внутрибрюшинного применения: обзор гипертермической внутрибрюшинной химиотерапии и ранней послеоперационной внутрибрюшинной химиотерапии. J Гастроинтест Онкол. 2016; 7: 45–57. DOI: 10.3978 / j.issn.2078-6891.2015.111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Sugarbaker PH, Kern K, Lack E. Злокачественная псевдомиксома брюшины толстой кишки.Естествознание и представление лечебного подхода к лечению. Dis Colon Rectum. 1987. 30: 772–9. [PubMed] [Google Scholar] 13. Elias D, Lefevre JH, Chevalier J, Brouquet A, Marchal F, Classe JM, Ferron G, Guilloit JM, Meeus P, Goéré D, Bonastre J. Полная циторедуктивная хирургия плюс внутрибрюшинная химиогипертермия с оксалиплатином для перитонеального карциноматоза кишечника. Журнал клинической онкологии. 2009. 27: 681–5. DOI: 10.1200 / JCO.2008.19.7160. [PubMed] [CrossRef] [Google Scholar] 14.Франко Дж., Ши К., Голдман С.Д., Покай Б.А., Нельсон Г.Д., Голдберг Р.М., Пито Х.С., Гротей А., Альбертс С.Р., Сарджент Д.Д. Лечение колоректального перитонеального карциноматоза с помощью системной химиотерапии: объединенный анализ исследований N9741 и N9841 группы лечения рака Северной Центральной группы III фазы. Журнал клинической онкологии. 2012; 30: 263–7. DOI: 10.1200 / JCO.2011.37.1039. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H, Zoetmulder FA.Рандомизированное испытание циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака. Журнал клинической онкологии. 2003; 21: 3737–43. DOI: 10.1200 / JCO.2003.04.187. [PubMed] [CrossRef] [Google Scholar] 16. Chua TC. Прогресс в комбинированном лечении карциноматоза брюшины. Журнал хирургической онкологии. 2010; 102: 728–9. DOI: 10.1002 / jso.21748. [PubMed] [CrossRef] [Google Scholar] 17.Sugarbaker PH. Успешное лечение микроскопической резидуальной болезни при раке толстой кишки. Химиотерапия и фармакология рака. 1999; 43: S15 – S25. DOI: 10.1007 / s002800051093. [PubMed] [CrossRef] [Google Scholar] 18. Хармон Р.Л., Шугарбейкер PH. Прогностические показатели при карциноматозе брюшины при раке желудочно-кишечного тракта. Международные семинары по хирургической онкологии. 2005; 2: 3. DOI: 10.1186 / 1477-7800-2-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Verwaal VJ, van Ruth S, Witkamp A, Boot H, van Slooten G, Zoetmulder FA.Долгосрочная выживаемость при карциноматозе брюшины колоректального происхождения. Анналы хирургической онкологии. 2004; 12: 65–71. DOI: 10.1007 / s10434-004-1167-z. [PubMed] [CrossRef] [Google Scholar] 20. Verwaal VJ, Kusamura S, Baratti D, Deraco M. Право на местно-региональное лечение злокачественных новообразований на поверхности брюшины. Журнал хирургической онкологии. 2008. 98: 220–3. DOI: 10.1002 / jso.21060. [PubMed] [CrossRef] [Google Scholar] 21. Dromain C, Leboulleux S, Auperin A, Goere D, Malka D, Lumbroso J, Schumberger M, Sigal R, Elias D.Стадия перитонеального карциноматоза: усиленная КТ по сравнению с ПЭТ / КТ. Визуализация брюшной полости. 2007; 33: 87–93. DOI: 10.1007 / s00261-007-9211-7. [PubMed] [CrossRef] [Google Scholar] 22. Эскивель Дж., Чуа Т.С., Стоядинович А., Мелеро Дж. Т., Левин Э.А., Гутман М., Ховард Р., Писо П., Ниссан А., Гомес-Портилья А., Гонсалес-Байон Л., Гонсалес-Морено С., Шен П. и др. Точность и клиническая значимость интерпретации компьютерной томографии индекса рака брюшины при колоректальном раке перитонеальный карциноматоз: мультиинституциональное исследование.Журнал хирургической онкологии. 2010; 102: 565–70. DOI: 10.1002 / jso.21601. [PubMed] [CrossRef] [Google Scholar] 23. Ко Дж. Л., Ян Т. Д., Гленн Д., Моррис Д. Л.. Оценка предоперационной компьютерной томографии в оценке индекса рака брюшины при колоректальном перитонеальном карциноматозе. Анналы хирургической онкологии. 2008. 16: 327–33. DOI: 10.1245 / s10434-008-0234-2. [PubMed] [CrossRef] [Google Scholar] 24. Low RN, Barone RM, Lucero J. Сравнение МРТ и КТ для прогнозирования индекса рака брюшины (ЧКВ) до операции у пациентов, рассматриваемых для циторедуктивных хирургических процедур.Анналы хирургической онкологии. 2015; 22: 1708–15. DOI: 10.1245 / s10434-014-4041-7. [PubMed] [CrossRef] [Google Scholar] 25. да Силва Р.Г., Sugarbaker PH. Анализ прогностических факторов у семидесяти пациентов, прошедших полную циторедукцию плюс периоперационную внутрибрюшинную химиотерапию по поводу карциноматоза колоректального рака. J Am Coll Surg. 2006; 203: 878–86. DOI: 10.1016 / j.jamcollsurg.2006.08.024. [PubMed] [CrossRef] [Google Scholar] 26. Баратти Д., Кусамура С., Дерако М. Пятый международный семинар по злокачественным новообразованиям брюшной полости (Милан, Италия, 4-6 декабря 2006 г.): методология консенсуса по конкретным заболеваниям.Журнал хирургической онкологии. 2008. 98: 258–62. DOI: 10.1002 / jso.21056. [PubMed] [CrossRef] [Google Scholar] 27. Реписо А., Гомес-Родригес Р., Лопес-Пардо Р., Ломбера М. М., Ромеро М., Арансана А., Абад С., Родригес-Мерло Р., Лопес Л., Карболес Дж. М.. Использование эндоскопической ультрасонографии в предоперационной стадии рака желудка: диагностическая ценность и терапевтическое влияние. Revista Española De Enfermedades Digestivas. 2010; 102: 413–20. [PubMed] [Google Scholar] 28. Savelli L, De Iaco P, Ceccaroni M, Ghi T, Ceccarini M, Seracchioli R, Cacciatore B.Трансвагинальные сонографические особенности перитонеального карциноматоза. Ультразвук в акушерстве и гинекологии. 2005; 26: 552–7. DOI: 10.1002 / uog.2587. [PubMed] [CrossRef] [Google Scholar] 30. Фенигер Дж., Томас С., Лендьель Э., Ляо К., Тенни М., Ото А., Ямада С. Д.. Проспективное исследование по оценке диффузно-взвешенной магнитно-резонансной томографии (DW-MRI) в выявлении перитонеального карциноматоза при подозрении на гинекологические злокачественные новообразования. Gynecol Oncol. 2016; 142: 169–75. DOI: 10.1016 / j.ygyno.2016.04.018. [PubMed] [CrossRef] [Google Scholar] 31.Де Вос Н., Геталс И., Селен В. Клиническая ценность (18) F-FDG-PET-CT в предоперационной стадии перитонеального карциноматоза колоректального происхождения. Acta Chirurgica Belgica. 2014; 114: 370–5. [PubMed] [Google Scholar] 32. Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C. Предоперационная оценка перитонеального карциноматоза: внутрииндивидуальное сравнение 18F-FDG ПЭТ / КТ и МРТ. Визуализация брюшной полости. 2012; 38: 64–71. DOI: 10.1007 / s00261-012-9881-7.[PubMed] [CrossRef] [Google Scholar] 33. Low RN, Barone RM, Lacey C, Sigeti JS, Alzate GD, Sebrechts CP. Опухоль брюшины: МРТ с разбавленным пероральным барием и внутривенным введением контрастного вещества, содержащего гадолиний, по сравнению с неулучшенной МРТ и КТ. Радиология. 1997; 204: 513–20. DOI: 10.1148 / радиология.204.2.9240546. [PubMed] [CrossRef] [Google Scholar] 34. Йонемура Й, Канбай Э, Эндоу Й, Ишибаши Х, Мизумото А, Миура М, Ли И, Лю И, Такешита К., Ичиносе М, Такао Н., Хирано М, Сако С. и др. Лечение рака брюшины.Мнение эксперта по фармакотерапии. 2014; 15: 623–36. DOI: 10.1517 / 14656566.2014.879571. [PubMed] [CrossRef] [Google Scholar] 35. Кин С., Кидесс Э., Поултсайдс Г.А., Виссер BC, Джеффри С.С. Диагностика рака прямой кишки: биомаркеры, внеклеточная ДНК, циркулирующие опухолевые клетки и определение гетерогенных популяций с помощью одноклеточного анализа. Экспертный обзор молекулярной диагностики. 2013; 13: 581–99. DOI: 10.1586 / 14737159.2013.811896. [PubMed] [CrossRef] [Google Scholar] 36. Wagner PL, Austin F, Sathaiah M, Magge D, Maduekwe U, Ramalingam L, Jones HL, Holtzman MP, Ahrendt SA, Zureikat AH, Pingpank JF, Zeh HJ, Bartlett DL, et al.Значение уровней сывороточных опухолевых маркеров при перитонеальном карциноматозе аппендикулярного происхождения. Анналы хирургической онкологии. 2013: 20. DOI: 10.1245 / s10434-012-2627-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 37. Лу Дж., Гетц Дж., Миска Е. А., Альварес-Сааведра Э., Лэмб Дж., Пек Д., Свит-Кордеро А., Эберт Б. Л., Мак Р. Х., Феррандо А. А., Даунинг Дж. Р., Джекс Т., Хорвиц Х. Р. и др. Профили экспрессии микроРНК позволяют классифицировать рак человека. Природа. 2005; 435: 834–8. DOI: 10,1038 / природа03702. [PubMed] [CrossRef] [Google Scholar] 38.Инь Ц., Чжоу X, Данг И, Ян Дж., Чжан Г. Потенциальная роль циркулирующего MiR-21 в диагностике и прогнозе рака пищеварительной системы: систематический обзор и метаанализ. Медицина (Балтимор) 2015; 94: e2123. DOI: 10.1097 / MD.0000000000002123. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Чен Х, Ба И, Ма Л, Цай Х, Инь И, Ван К., Го Дж, Чжан И, Чен Дж, Го Х, Ли Кью, Ли Х, Ван В. и др. Характеристика микроРНК в сыворотке: новый класс биомаркеров для диагностики рака и других заболеваний.Клеточные исследования. 2008; 18: 997–1006. DOI: 10.1038 / cr.2008.282. [PubMed] [CrossRef] [Google Scholar] 40. Митчелл П.С., Паркин Р.К., Крох Е.М., Фриц Б.Р., Вайман С.К., Погосова-Агаджанян Е.Л., Петерсон А., Нотабум Дж., О’Брайант К.С., Аллен А., Лин Д.В., Урбан Н., Дрешер К.В. и др. Циркулирующие микроРНК как стабильные маркеры крови для обнаружения рака. Труды Национальной академии наук. 2008. 105: 10513–8. DOI: 10.1073 / pnas.0804549105. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 41. Цуй Н.Б., Нг ЭК, Ло Ю.М.Стабильность эндогенной и добавленной РНК в образцах крови, сыворотке и плазме. Клиническая химия. 2002; 48: 1647–53. [PubMed] [Google Scholar] 42. Кога А., Аояги К., Имаидзуми Т., Мияги М., Широузу К. Сравнение между клеточной линией рака желудка MKN-45 и линией клеток с высоким потенциалом распространения перитонеального рака желудка MKN-45P. Медицинский журнал Куруме. 2011; 58: 73–9. DOI: 10.2739 / kurumemedj.58.73. [PubMed] [CrossRef] [Google Scholar] 43. Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, van Eijndhoven MA, Hopmans ES, Lindenberg JL, de Gruijl TD, Würdinger T, Middeldorp JM.Функциональная доставка вирусных miRNA через экзосомы. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6328–33. DOI: 10.1073 / pnas.0914843107. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 44. Ског Дж., Вурдингер Т., ван Рейн С., Мейер Д., Гайнче Л., Сена-Эстевес М., Карри В. Т., Картер Р. С., Кричевский А. М., Брейкфилд XO. Микровезикулы глиобластомы транспортируют РНК и белок, которые способствуют росту опухоли и обеспечивают диагностические биомаркеры. Природа клеточной биологии. 2008; 10: 1470–6.DOI: 10,1038 / NCB1800. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 45. Валади Х., Экстрём К., Боссиос А., Сьёстранд М., Ли Дж. Дж., Лётвалл Дж. Опосредованный экзосомами перенос мРНК и микроРНК — это новый механизм генетического обмена между клетками. Природа клеточной биологии. 2007; 9: 654–9. DOI: 10,1038 / NCB1596. [PubMed] [CrossRef] [Google Scholar] 46. Ченг Л., Шарплз Р.А., Шиклуна Б.Дж., Хилл А.Ф. Экзосомы обеспечивают защитный и обогащенный источник miRNA для профилирования биомаркеров по сравнению с внутриклеточной и бесклеточной кровью.J Внеклеточные везикулы. 2014; 3 DOI: 10.3402 / jev.v3.23743. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 48. Рабиновиц Г., Герчель-Тейлор С., Дэй Дж. М., Тейлор Д. Д., Клоекер Г. Х. Экзосомальная микроРНК: диагностический маркер рака легких. Клинический рак легкого. 2009; 10: 42–6. DOI: 10.3816 / CLC.2009.n.006. [PubMed] [CrossRef] [Google Scholar] 49. Янаихара Н., Кэплен Н., Боуман Э., Сейке М., Кумамото К., Йи М., Стивенс Р.М., Окамото А., Йокота Дж., Танака Т., Калин Г.А., Лю К.Г., Кроче С.М. и др. Уникальные молекулярные профили микроРНК в диагностике и прогнозе рака легких.Раковая клетка. 2006; 9: 189–98. DOI: 10.1016 / j.ccr.2006.01.025. [PubMed] [CrossRef] [Google Scholar] 50. Хан С., Аспе-младший, Асумен М.Г., Альмагуэль Ф., Одумосу О., Асеведо-Мартинес С., Де Леон М., Лэнгридж WH, Уолл Н.Р. Внеклеточный, проницаемый для клеток сурвивин ингибирует апоптоз, способствуя пролиферативному и метастатическому потенциалу. Br J Рак. 2009; 100: 1073–86. DOI: 10.1038 / sj.bjc.6604978. 6604978 [pii] [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 51. Хан С., Джатзи Дж. М., Аспе Дж. Р., МакГрегор Д. В., Нейди Дж. В., Уолл Н. Р..Сурвивин высвобождается из раковых клеток через экзосомы. Апоптоз. 2011; 16: 1–12. DOI: 10.1007 / s10495-010-0534-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 52. Тейлор Д.Д., Герсель-Тейлор С. Сигнатуры микроРНК экзосом, полученных из опухоли, как диагностические биомаркеры рака яичников. Гинекологическая онкология. 2008; 110: 13–21. DOI: 10.1016 / j.ygyno.2008.04.033. [PubMed] [CrossRef] [Google Scholar] 53. Хан С., Беннит Х. Ф., Турай Д., Перес М., Миршахиди С., Юань Ю., Уолл Н. Р.. Ранняя диагностическая ценность сурвивина и его альтернативных вариантов сплайсинга при раке молочной железы.BMC Рак. 2014; 14: 176. DOI: 10.1186 / 1471-2407-14-176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 54. Хан С., Джутзи Дж. М., Валенсуэла М. М., Турай Д., Аспе Дж. Р., Ашок А., Миршахиди С., Меркола Д., Лилли МБ, Уолл Н. Р.. Экзосомальный сурвивин, полученный из плазмы, вероятный биомаркер для раннего выявления рака простаты. PLoS One. 2012; 7: e46737. DOI: 10.1371 / journal.pone.0046737. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 55. Турай Д., Хан С., Диас Остерман С.Дж., Кертис М.П., Хайра Б., Нейдиг Д.В., Миршахиди С., Касиано, Калифорния, Уолл Н.Р.Протеомное профилирование экзосом, полученных из сыворотки крови у пациентов с раком предстательной железы, принадлежащих к разным этническим группам. Рак Инвест. 2016; 34: 1–11. DOI: 10.3109 / 07357907.2015.1081921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 56. Андре Ф, Шарц Н. Э., Мовассаг М., Фламент С, Полье П., Морис П., Помель С., Ломм С., Эскудье Б., Ле Шевалье Т., Турс Т., Амигорена С., Рапосо Дж. И др. Злокачественные выпоты и экзосомы, полученные из иммуногенных опухолей. Ланцет. 2002; 360: 295–305. [PubMed] [Google Scholar] 57. Токухиса М., Итикава Ю., Косака Н., Очия Т., Яширо М., Хиракава К., Косака Т., Макино Х., Акияма Х., Кунисаки К., Эндо И.Экзосомальные миРНК из жидкости промывания брюшины как потенциальные прогностические биомаркеры перитонеальных метастазов при раке желудка. PLoS One. 2015; 10: e0130472. DOI: 10.1371 / journal.pone.0130472. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 58. Zheng H, Zhang F, Lin X, Huang C, Zhang Y, Li Y, Lin J, Chen W., Lin X. MicroRNA-1225-5p ингибирует пролиферацию и метастазирование карциномы желудка посредством репрессии субстрата-1 рецептора инсулина и активации β -катенин сигнализация. Oncotarget. 2015; 7: 4647–63.DOI: 10.18632 / oncotarget.6615. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 59. Хамам Р., Али А.М., Альсале К.А., Кассем М., Альфаез М., Альдахмаш А., Аладжез Н.М. Профили экспрессии микроРНК у отдельных пациентов с раком груди позволяют идентифицировать новую панель циркулирующих микроРНК для раннего обнаружения. Научные отчеты. 2016; 6: 25997. DOI: 10,1038 / srep25997. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 60. Wang X, Wu J, Lin Y, Zhu Y, Xu X, Xu X, Liang Z, Li S, Hu Z, Zheng X, Xie L. MicroRNA-320c ингибирует опухолевое поведение при раке мочевого пузыря, воздействуя на циклин-зависимую киназу 6.Журнал экспериментальных и клинических исследований рака. 2014; 33: 69. DOI: 10.1186 / s13046-014-0069-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 61. Zhao G, Dong L, Shi H, Li H, Lu X, Guo X, Wang J. MicroRNA-1207-5p ингибирует рост и инвазию клеток гепатоцеллюлярной карциномы через путь передачи сигналов Akt / mTOR, опосредованный синтазой жирных кислот. Отчеты онкологии. 2016; 36: 1709–1. DOI: 10.3892 / или 2016.4952. [PubMed] [CrossRef] [Google Scholar] 62. Озата Д.М., Карамута С., Веласкес-Фернандес Д., Акчакая П., Се Х., Хёг А, Зедениус Дж., Бэкдал М., Ларссон С., Луи В.О.Роль дерегуляции микроРНК в патогенезе адренокортикальной карциномы. Эндокринный рак. 2011; 18: 643–55. DOI: 10.1530 / ERC-11-0082. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 63. Фархана Л., Ф. Антаки, Анис М. Р., Нангиа-Маккер П., Джадд С., Хадден Т., Леви Е., Муршед Ф., Ю Й, Ван Бурен Е., Ахмед К., Дайсон Г., Маджумдар А. П.. Роль раковых стволовых клеток в расовом неравенстве при колоректальном раке. Онкологическая медицина. 2016; 5: 1268–78. DOI: 10.1002 / cam4.690. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 64.Хосино А., Коста-Силва Б., Шен Т.Л., Родригес Дж., Хашимото А., Тесич Марк М., Молина Х., Косака С., Ди Джаннатале А., Седер С., Сингх С., Уильямс К., Соплоп Н. и др. Интегрины экзосом опухоли определяют органотропные метастазы. Природа. 2015; 527: 329–35. DOI: 10,1038 / природа15756. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 65. Paggetti J, Haderk F, Seiffert M, Janji B, Distler U, Ammerlaan W., Kim YJ, Adam J, Lichter P, Solary E, Berchem G, Moussay E. Экзосомы, высвобождаемые клетками хронического лимфоцитарного лейкоза, вызывают переход стромальных клеток в ассоциированные с раком фибробласты.Кровь. 2015; 126: 1106–17. DOI: 10.1182 / кровь-2014-12-618025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 66. Peinado H, Aleckovic M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, Garcia-Santos G, Ghajar C, Nitadori-Hoshino A, Hoffman C, Badal K и др. al. Экзосомы меланомы приучают клетки-предшественники костного мозга к прометастатическому фенотипу посредством MET. Nat Med. 2012; 18: 883–91. DOI: 10,1038 / нм 2753. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 67.Franzen CA, Simms PE, Van Huis AF, Foreman KE, Kuo PC, Gupta GN. Характеристика поглощения и интернализации экзосом клетками рака мочевого пузыря. Biomed Res Int. 2014; 2014: 619829. DOI: 10.1155 / 2014/619829. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 68. Хуанг KH, Lan YT, Fang WL, Chen JH, Lo SS, Li AF, Chiou SH, Wu CW, Shyr YM. Корреляция между miRNA и метастазами в лимфатические узлы при раке желудка. BioMed Research International 2015. 2015 DOI: 10.1155 / 2015/543163. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 69.Chen L, Lü MH, Zhang D, Hao NB, Fan YH, Wu YY, Wang SM, Xie R, Fang DC, Zhang H, Hu CJ, Yang SM. miR-1207-5p и miR-1266 подавляют рост и инвазию рака желудка, воздействуя на обратную транскриптазу теломеразы. Смерть и болезнь клеток. 2014; 5: e1034. DOI: 10.1038 / cddis.2013.553. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 70. Moltzahn F, Olshen AB, Baehner L, Peek A, Fong L, Stöppler H, Simko J, Hilton JF, Carroll P, Blelloch R. Мультиплексная qRT-PCR на основе микрофлюидов определяет диагностические и прогностические сигнатуры микроРНК в сыворотках пациентов с раком простаты.Исследования рака. 2011; 71: 550–60. DOI: 10.1158 / 0008-5472.CAN-10-1229. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 71. Zhu J, Chen L, Zou L, Yang P, Wu R, Mao Y, Zhou H, Li R, Wang K, Wang W, Hua D, Zhang X. MiR-20b, -21 и -130b подавляют экспрессию PTEN, что приводит к в сверхэкспрессии B7-h2 при распространенном колоректальном раке. Иммунология человека. 2014; 75: 348–53. DOI: 10.1016 / j.humimm.2014.01.006. [PubMed] [CrossRef] [Google Scholar] 72. Фрике А., Ульрих П.В., Хайнц Дж., Пфайфер Д., Шолбер Дж., Хергет Г.В., Хаушильд О., Бронсерт П., Старк Г.Б., Баннаш Х., Эйзенхардт С.У., Брейг Д.Идентификация передаваемой через кровь сигнатуры miRNA синовиальной саркомы. Молекулярный рак. 2015: 14. DOI: 10.1186 / s12943-015-0424-z. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 73. Leidinger P, Hart M, Backes C, Rheinheimer S, Keck B, Wullich B, Keller A, Meese E. Дифференциальная диагностика доброкачественной гиперплазии предстательной железы и рака простаты на основе крови: miRNA как источник биомаркеров независимо от уровня PSA, шкалы Глисона, или статус TNM. Биология опухоли. 2016; 37: 10177–85. DOI: 10.1007 / s13277-016-4883-7.[PubMed] [CrossRef] [Google Scholar] 74. He HC, Han ZD, Dai QS, Ling XH, Fu X, Lin ZY, Deng YH, Qin GQ, Cai C, Chen JH, Jiang FN, Liu X, Zhong WD. Глобальный анализ дифференциально экспрессируемых miRNA рака простаты у китайских пациентов. BMC Genomics. 2013; 14: 757. DOI: 10.1186 / 1471-2164-14-757. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 75. Бартли А.Н., Яо Х., Барко Б.А., Иван С., Мишра Б.М., Рашид А., Калин Г.А., Лутра Р., Гамильтон С.Р. Сложные паттерны измененной экспрессии микроРНК во время последовательности аденома-аденокарцинома для микросателлитно-стабильного колоректального рака.Клинические исследования рака. 2011; 17: 7283–93. DOI: 10.1158 / 1078-0432.CCR-11-1452. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 76. Веласкес-Фернандес Д., Карамута С., Озата Д.М., Лу М., Хёог А., Бэкдал М., Ларссон С., Луи В.О., Зедениус Дж. Паттерны экспрессии микроРНК, связанные с гиперфункционирующими и негиперфункциональными фенотипами адренокортикальных аденом. Европейский журнал эндокринологии. 2014; 170: 583–91. DOI: 10.1530 / EJE-13-0817. [PubMed] [CrossRef] [Google Scholar] 77. Лэй Т., Чжу И, Цзян Ц., Ван И, Фу Дж, Фань З, Цинь Х.МикроРНК-320 подавлялась при немелкоклеточном раке легкого и подавляла пролиферацию, миграцию и инвазию клеток, воздействуя на синтазу жирных кислот. Отчеты по молекулярной медицине. 2016; 14: 1255–62. DOI: 10.3892 / mmr.2016.5370. [PubMed] [CrossRef] [Google Scholar]Перитонеальные метастазы — StatPearls — NCBI Bookshelf
Непрерывное обучение
Термин перитонеальный карциноматоз (ПК) обычно относится к метастатическому поражению брюшины. Название было впервые придумано в 1931 году Сэмпсоном для подробного описания метастатического поражения поверхности стромы брюшины клетками рака яичников.С тех пор это относится практически к любым перитонеальным метастатическим отложениям, метастатический рак в брюшину встречается чаще, чем первичное злокачественное новообразование брюшины. Часто возникает при злокачественных новообразованиях желудочно-кишечного тракта или гинекологии на поздних стадиях с локорегиональным поражением. В этом упражнении рассказывается, как правильно оценить это состояние, и подчеркивается роль межпрофессиональной группы в уходе за пациентами с этим заболеванием.
Цели:
Опишите типы злокачественных новообразований брюшины.
Обрисуйте представление о перитонеальных метастазах.
Обобщите лечение перитонеальных метастазов.
Объясните способы улучшения координации помощи между членами межпрофессиональной группы с целью улучшения результатов для пациентов, пострадавших от перитонеальных метастазов.
Введение
Брюшина представляет собой сплошную мембрану, покрывающую брюшную и тазовую полости.Анатомически он состоит из двух слоев, которые сами по себе непрерывны. Один из них — париетальная брюшина, которая покрывает внутренние поверхности брюшной полости и стенок таза, а другой слой — висцеральная брюшина, которая покрывает органы брюшной полости и их подвешивающие структуры в брюшно-тазовой полости. [1] Большой сальник, выступающая брюшная складка, также называемая желудочно-ободочной связкой, называют «полицейским брюшной полости», признавая ее роль в сдерживании воспаления и минимизации распространения инфекции или местного заболевания в брюшно-тазовой полости.Эта уникальная природа сальника подвергает его риску заражения любыми злокачественными новообразованиями брюшной полости из-за местного распространения болезни.
Термин перитонеальный карциноматоз (ПК) обычно относится к метастатическому поражению брюшины. Название было впервые придумано в 1931 году Сэмпсоном для подробного описания метастатического поражения поверхности стромы брюшины клетками рака яичников. [2] С тех пор это относится практически к любым перитонеальным метастатическим отложениям, метастатический рак в брюшину встречается чаще, чем первичное злокачественное новообразование брюшины.Часто возникает при злокачественных новообразованиях желудочно-кишечного тракта или гинекологии на поздних стадиях с локорегиональным поражением. Исторически, наличие метастатических отложений в брюшной полости предполагало неизлечимое смертельное заболевание, при котором лечебное хирургическое лечение больше не было разумным вариантом. Новые хирургические методы и инновации в стратегиях медицинского управления кардинально изменили течение болезни за последние годы. Разработаны эффективные подходы к лечению, позволяющие улучшить безрецидивную и общую выживаемость.[3]
Этиология
Поражение брюшины наиболее часто встречается при раке желудочно-кишечного тракта (ЖКТ), репродуктивных и мочеполовых путей. Рак яичников, толстой кишки и желудка является наиболее распространенным заболеванием, проявляющимся на поздних стадиях с метастазами в брюшину. Раковые заболевания, поражающие другие органы, такие как поджелудочная железа, аппендикс, тонкий кишечник, эндометрий и простата, также могут вызывать перитонеальные метастазы, но такие возникают реже. Хотя карциноматоз брюшины может возникать в результате экстраабдоминальных первичных злокачественных новообразований, такие случаи встречаются редко; и они составляют примерно 10% диагностированных случаев перитонеальных метастазов.[4] Примеры включают рак груди, рак легких и злокачественную меланому. [5] [6]
Эпидемиология
Перитонеальные метастазы (ПМ) — относительно редкий диагноз. Из-за отсутствия удовлетворительных методов предоперационной диагностики и визуализационных исследований точные данные о заболеваемости отсутствуют.Хотя данные реестра свидетельствуют о росте общей заболеваемости злокачественными новообразованиями брюшины за последние два десятилетия, в области медицинских технологий для лечения этого состояния были достигнуты успехи. Карциноматоз брюшины имеет первичное перитонеальное происхождение только в 3% случаев; чаще всего это результат метастазирования. Одно крупное популяционное исследование, проведенное в Ирландии, показало, что ежегодная частота перитонеальных метастазов увеличилась с 228 в 1994 году до 402 в 2012 году. На долю женщин приходилось большинство случаев, а 70% пациентов были в возрасте 60 лет и старше на момент обследования. время постановки диагноза.[12]
Уровень заболеваемости различается среди различных типов первичного рака, приводящего к перитонеальному карциноматозу. В США колоректальный рак является одним из наиболее распространенных видов рака с более высокой частотой встречаемости. По оценкам, заболеваемость перитонеальным карциноматозом при колоректальном раке составляет от 5 до 8%, что составляет от 2 до 3 из 100 000 человек в год. [13] [7] Нейроэндокринные опухоли желудочно-кишечного тракта вызывают перитонеальные метастазы у 1,6 на 1 миллион человек в год в США.С. [9]
Патофизиология
Метастазирование раковых клеток — сложное явление, включающее многоэтапный процесс и разнонаправленное распространение. Распространение, адгезия, инвазия и пролиферация являются важными этапами развития перитонеальных метастазов из любого первичного. Первичные злокачественные клетки могут распространяться через локальную инвазию, лимфатические сосуды или кровь к дистальным участкам. В случае метастазов в брюшину злокачественные клетки, происходящие из первичных органов брюшной полости, обычно распространяются по транскеломному механизму.Перитонеальная жидкость циркулирует через брюшную полость в определенном направлении, и это может распространять раковые клетки определенным образом. В настоящее время обширные исследования дали более подробные сведения о патофизиологии перитонеальных метастазов. Этот сложный процесс включает многоуровневые реакции между молекулярными и клеточными компонентами первичного очага опухоли, а также брюшины. Мезотелиальные клетки брюшины обеспечивают адгезию к вторгающимся раковым клеткам и компонентам стромы, а эндотелиальные клетки помогают в пролиферации.[14] Первоначальная теория «семян и почвы» Педжета очень хорошо описывает модель перитонеальных метастазов при раковых заболеваниях яичников, толстой кишки, желудка и т.д. метастатические опухолевые клетки («семя») и микроокружение их органов («почва»), что широко продемонстрировали несколько исследований [15].
Одна теория описывает, что перитонеальный карциноматоз от рака желудочно-кишечного тракта может возникать двумя разными способами: 1) через поперечный рост и 2) через внутрибрюшинное распространение.Поперечный рост означает, что опухолевые клетки могут отслаиваться от первичной опухоли в брюшную полость, что также известно как синхронный перитонеальный карциноматоз. Этот вариант обычно возникает до операции. Внутрибрюшинное распространение подразумевает распространение из-за хирургической травмы, когда опухолевые клетки непреднамеренно высвобождаются из перерезанного лимфатического узла или кровеносного сосуда или при манипуляциях с первичной опухолью во время манипуляции, это называется метахронным карциноматозом брюшины . Наиболее частое распространение злокачественных клеток в брюшине происходит из-за спонтанного отшелушивания.Связанные с лейкоцитами адгезионные молекулы, такие как CD44, селектины и / или интегрин, были идентифицированы для адгезии раковых клеток. Строма брюшины является богатым источником всех факторов, необходимых для пролиферации [16].
Гематогенное распространение в брюшную полость может происходить у пациентов со злокачественной меланомой, раком легких и молочной железы. В таких случаях эмболический метастатический очаг начинается с небольшого узелка с возможным прогрессированием. Лимфатическое распространение обычно вращается вокруг связок и брыжейки, и такое распространение может происходить при неходжкинской лимфоме или нейроэндокринной опухоли (NET).
Биологические исследования описывают три типа распространения рака брюшины, которые полезно понимать для руководства хирургическим лечением:
Случайное проксимальное распространение (RPD): Обычно возникает при раке средней и высокой степени злокачественности на ранней стадии имплантации из-за приверженности к лечению. молекулы на раковых клетках рядом с областью опухоли. Примеры включают аденокарциному и карциноид аппендикса, немицинозный колоректальный рак, рак желудка и серозный рак яичников.
Полное перераспределение (CRD): Здесь нет адгезии к брюшине вблизи первичной опухоли из-за низкой биологической активности раковых клеток.Примеры — псевдомиксома брюшины, диффузная злокачественная мезотелиома.
Широкое распространение рака (WCD): Присутствие адгезионных молекул на раковых клетках, наряду с образованием слизи, приводит к агрессивному и широко распространенному распространению рака. Примеры в этой категории включают муцинозный колоректальный рак, муцинозный рак яичников, цистаденокарциному аппендикса.
Такое понимание характера распространения помогает определить лучший хирургический подход: лечение RPD лучше всего путем выборочной перитонэктомии макроскопически пораженных областей.В то время как лечение CRD и WCD должно сопровождаться полной перитонэктомией и обширной циторедукционной терапией [17].
История и физика
Пациенты с перитонеальными метастазами обычно появляются на поздней стадии заболевания. Обычно они проявляются симптомами и признаками, связанными с их распространенным первичным раком. Часто карциноматоз брюшины является случайной находкой во время хирургического вмешательства для удаления первичной опухоли или во время других плановых процедур. Двумя наиболее важными клиническими проявлениями, связанными с перитонеальным карциноматозом, были асцит и непроходимость кишечника.Однако клинически они обнаруживаются менее чем у 50% пациентов. [18] [19] Как и при любом другом раке, пациенты могут жаловаться на потерю аппетита, специфические для органа симптомы, такие как боль в животе, тошнота, рвота, запор, вздутие живота, потеря веса и т. Д. Два основных клинических признака, которые могут вызвать подозрение на метастазы в брюшину, включают 1) наличие злокачественных клеток в асцитической жидкости (от 28% до 30% пациентов с колоректальным перитонеальным метастазом) и 2) кишечная непроходимость (от 8% до 20% пациентов с колоректальным перитонеальным метастазом.[20]
Учитывая неспецифическую клиническую картину, связанную с пациентами с перитонеальными метастазами, это состояние крайне непредсказуемо и трудно диагностировать только на основании клинических проявлений. Однако всякий раз, когда появляется возможность предположить возможность рака брюшной полости, клиницисты должны поддерживать низкий порог для рассмотрения наличия запущенной стадии заболевания, о чем свидетельствует наличие перитонеальных метастазов, даже если визуализация не показывает это с готовностью.Брюшину и любую асцитическую жидкость можно обследовать во время хирургического обследования во время плановой или экстренной процедуры.
Оценка
Метастатический рак брюшины часто является случайной находкой, обнаруживаемой во время хирургического вмешательства или при диагностической визуализации с помощью таких методов, как компьютерная томография или МРТ, выполняемая по другим показаниям. Биопсия обнаруженных опухолей или поражений является подтверждающим тестом для определения типа раковых клеток и дифференциации его от первичного рака брюшины.
Основными задачами методов обследования и исследования, используемых в случаях подозрения на перитонеальные метастазы, являются следующие:
Раннее выявление возможных перитонеальных метастазов у пациента с недавно диагностированным злокачественным новообразованием брюшной полости или таза и исключение его наличия. отдаленных метастазов в экстраабдоминальные области, что становится абсолютным противопоказанием для хирургического вмешательства с лечебной целью.
Для определения степени, размера и поражения основных органов метастатическим раком для принятия решения о правильном выборе пациентов для циторедуктивной хирургии (CRS) и гипертермической внутрибрюшинной химиотерапии (HIPEC).
Ранняя стадия ПК для получения ценной информации о потенциальных результатах и прогнозирования прогноза после лечения.
Раковые поражения брюшины иногда видны с помощью компьютерной томографии, МРТ и позитронно-эмиссионной томографии с 18F-фтордезоксиглюкозой (ФДГ), ПЭТ / КТ. Каждый метод имеет свое значение в зависимости от типа рака и области поражения. В настоящее время система оценки индекса карциноматоза брюшины (PCI), предложенная доктором Дж.Sugarbacker предоставляет полезный инструмент для лучшего отбора пациентов для операции и лучшего понимания прогноза и исхода (описанных в разделе управления и стадирования ниже). Таким образом, большинство визуализационных исследований используются для определения их диагностических параметров в зависимости от того, насколько точно они могут повлиять на оценку ЧКВ до операции. [21]
Компьютерная томография : может выявить соответствующее локальное поражение рака брюшной полости. Важнейшими признаками метастазов в брюшину являются очаговое или диффузное утолщение брюшных складок, которое может проявляться в виде склеротических, узловых, ретикулярных, ретикулонодулярных или крупных бляшкообразных структур.Иногда между брюшной стенкой и петлями кишечника можно увидеть большой толстый слой неоднородной плотности, который иногда называют «сальниковой лепешкой». Это неопластический тканевый слой. КТ также обнаружит макронодули и микронодули, если они лежат на поверхности печени или селезенки. Асцит также можно обнаружить, если он превышает 50 мл. [22] Чувствительность компьютерной томографии брюшной полости и таза для диагностики ПМ, связанных с колоректальным раком, составляет 90% для раковых узлов размером более 5 см, но снижается до менее 25% для поражений размером менее 5 см.[23] Компьютерная томография, используемая для обнаружения опухолей брюшины для принятия будущих решений по лечению, также имеет различия между наблюдателями среди радиологов и не считается самым надежным инструментом для этих же целей. [24] Кроме того, КТ неэффективна при оценке поражений тонкой кишки, что может привести к заниженной оценке ЧКВ до операции. Тем не менее, это все еще действенный инструмент для достижения оптимальной циторедукции в случаях метастазов в яичниках с умеренной точностью [25]. В настоящее время КТ органов брюшной полости и таза является первым направлением исследования для выявления метастазов в брюшину при наличии любых первичных абдоминальных заболеваний.
МРТ: Это также один из диагностических инструментов для обнаружения перитонеальных метастазов. Однако существенного превосходства над компьютерной томографией он не показал. Одно исследование продемонстрировало преимущество МРТ по сравнению с одинарной спиральной КТ в обнаружении метастазов над брюшиной, сальником и кишечником. [26] Комбинированное использование МРТ и КТ улучшило предоперационную оценку ЧКВ по сравнению с только определенным КТ ЧКВ. [27] Диффузно-взвешенная МРТ больше используется для диагностики, и одно недавно опубликованное исследование показало значительные результаты.Диффузно-взвешенная воображаемая МРТ всего тела (WB-DWI / MRI) была значительно лучше в прогнозировании неоперабельности при перитонеальном карциноматозе, чем КТ с чувствительностью 90,6%, специфичностью 100%, PPV 100% и NPV 90,3%. Для одного только CT эти значения составляли 25,0, 92,9, 80,0 и 52,0% соответственно. [28]
ПЭТ-сканирование: Использование ПЭТ-КТ более полезно, чем просто ПЭТ-сканирование, поскольку добавление компьютерной томографии позволяет улучшить анатомическую визуализацию. Позитронно-эмиссионная томография с 18F-фтордезоксиглюкозой (ФДГ) ПЭТ / КТ является предпочтительной визуализацией, которая может обнаруживать наличие раковых поражений на основе поглощения глюкозы клетками.Он может быть ложноотрицательным, если клетки не показывают хорошего поглощения глюкозы. Таким образом, в случаях, когда он используется для послеоперационной визуализации, было бы лучше задокументировать предоперационные результаты для сравнения, чтобы избежать ложноотрицательных результатов. [22] Чтобы определить точную локализацию и площадь перитонеальных метастазов, ПЭТ-КТ обеспечивает лучшую точность и, особенно, более высокое NPV, чем МРТ [29]. ПЭТ-КТ дает хорошее дополнение к традиционной визуализации, в основном для мониторинга реакции на терапию, особенно при долгосрочном наблюдении.[30]
Диагностическая лапароскопия: Хирурги рекомендуют предоперационное использование диагностической лапароскопии для оценки резектабельности перитонеальных опухолевых узлов перед циторедуктивной операцией (CRS). Этот подход полезен для пациентов, для которых предыдущие исследования воображения недостаточны для предоставления адекватной информации о степени поражения заболевания. Однако иногда это не приветствуется из-за трудностей, связанных с введением троакара, и опасения рецидива опухоли в области порта.Но в настоящее время многие хирурги отстаивают его важную роль в принятии утвердительных решений, прежде чем фактически прибегать к лапаротомии. В одном исследовании было обнаружено, что его положительная прогностическая ценность составляет 83,3%. Это также помогло избежать ненужной лапаротомии в 45% случаев без рецидивов или осложнений после 18 месяцев [31]. Аналогичным образом, другое исследование предложило подробные технические аспекты диагностической лапароскопии, с более чем 94% подтверждающих результатов с использованием только двух троакаров и 99% для всех случаев.[22] Потребуются обширные исследования, чтобы получить больше доказательств для его повседневного практического использования.
Предлагаемые новые методы диагностики
Различные группы хирургов предложили новые диагностические методы для оптимального выявления перитонеального карциноматоза и более точного понимания его степени и размера, прежде чем рассматривать возможность хирургического обследования:
- Обнаружение асцитического CEA (эмбрионального антигена карциномы) является полезным методом диагностики колоректальный рак (CRC) с ПМ.[32]
- Обширное поражение тонкой кишки перитонеальным карциноматозом исключает использование циторедуктивной хирургии. КТ не хватает точности в предоперационном выявлении заболевания тонкой кишки, которое впоследствии может повлиять на решение предложить CRS. Одна группа исследователей продемонстрировала, что CT-энтероклиз (CTE) очень полезен для обнаружения раковых имплантатов в тонкой кишке / брыжейке. Он показал 92% чувствительность, 96% специфичность, 97% PPV и 91% NPV. [33]
- Другая группа исследователей изучала использование гибкой эндоскопии с одним разрезом (SIFE) для определения стадии диагностики перед операцией и сравнила ее с жесткой эндоскопией (SIRE).Основная цель заключалась в том, чтобы избежать метастазирования в области троакара, уменьшив потребность в дополнительном использовании троакара. Исследование показало выполнимость в 94% случаев с SIFE и продемонстрировало превосходство над SIRE с точки зрения технических исследований и результатов. Необходимы дальнейшие исследования, чтобы сравнить это с традиционной лапароскопией. [34]
Лечение / ведение
Последние достижения в хирургических методах и благоприятные исходы, связанные с таргетной химиотерапией, стимулировали агрессивное лечение ПК, когда это возможно и доступно.Полная циторедуктивная хирургия (CRS) в сочетании с гипертермической внутрибрюшинной химиотерапией (HIPEC) и системной химиотерапией стала основным методом лечения перитонеального карциноматоза (PC), происходящего из большинства карцином желудочно-кишечного тракта и мочеполовых путей. Эффективность этого лечения была подтверждена в 2003 году рандомизированным клиническим испытанием, в котором сравнивали СВК в сочетании с HIPEC и только системную химиотерапию (медиана выживаемости: 22,3 против 12,6 месяцев, P = 0,032) [35]. Макроскопически полный CRS (CRS-R0) является основным прогностическим фактором, при этом 5-летняя выживаемость достигает 45% по сравнению с менее 10% при неполном CRS.[36] Доктор Шугарбейкер изменил восприятие перитонеального карциноматоза с терминальной стадии рака на локально-региональное заболевание и рекомендовал агрессивный хирургический подход с CRS, учитывая положительные преимущества выживаемости.
Первым шагом в центрах управления является выбор подходящего пациента для операции.
Выбор пациентов
Характеристики пациента: возраст, сопутствующие заболевания, общее состояние и функциональное состояние. Цель состоит в том, чтобы определить пригодность пациента к ожидаемой хирургической травме и ее периоперационному воздействию.
Исключить генерализованное метастатическое заболевание: Как указано в разделе диагностики, КТ и / или МРТ или иногда ПЭТ / КТ могут использоваться для исследования потенциальных дистальных метастазов в зависимости от типа рака. Возможные места для поиска: грудная клетка, кости позвоночника, головной мозг и т. Д.
Степень заболевания брюшины:
КТ / МРТ является основным инструментом исследования для определения размера, степени и типа перитонеальных поражений. . Система оценки PCI, описанная на рисунке 1, обычно используется для определения хирургической возможности операции и, возможно, благоприятного прогноза.Диагностическая лапароскопия обеспечивает очень точные оценки ЧКВ наряду с вероятной полнотой индекса циторедукции (СС) и оценкой результатов с точки зрения выживаемости без болезней, общей выживаемости и качества жизни. Поражение тонкой кишки влияет на оценку ЧКВ и может указывать на плохой прогноз. Ниже приведены обычные хирургические участки, используемые для предоперационного определения степени заболевания для исключения из CRS. [22]
Массивная инфильтрация корня брыжейки, не поддающаяся полному циторедукции
Значительная инфильтрация капсулы поджелудочной железы или поражение поджелудочной железы, требующее обширной резекции, неосуществимо или не поддается полной хирургической циторедукции
Более одной трети тонкой кишки длина поражения, требующая резекции
Обширные метастазы в печень
Некоторые хирурги рекомендуют использовать шкалу тяжести заболевания поверхности брюшины (PSDSS) для ранней предоперационной оценки прогноза на основе симптомов, индекса PCI и гистологии первичной опухоли.Однако необходимы обширные результаты исследований, чтобы внедрить его в регулярную практику. [37]
Циторедуктивная хирургия (CRS) и гипертермическая внутрибрюшинная химиотерапия
После определения пригодности пациента к операции с отбором, основанным на критериях выполнимости, CRS обычно выполняется через открытый разрез брюшной стенки вместе с периоперационной внутрибрюшинной химиотерапией. Этот новый вариант лечения стал реальностью для хирургов благодаря обширной работе доктора Ф.Sugarbacker [38] и предложенные им хирургические методы. Циторедуктивная хирургия включает перитонэктомию и индивидуальную ручную резекцию опухолевых образований из разных областей брюшной стенки и брыжейки. В настоящее время перитонэктомия классифицируется как метод лечения пациентов с перитонеальным карциноматозом, причем последний рассматривается как локально-региональное распространение, а не системное заболевание. Обычное хирургическое вмешательство при любом лечении рака — это удаление всех раковых клеток посредством блочной резекции с четкими границами.Однако при карциноматозе брюшины очень трудно добиться полного удаления злокачественных клеток. Идея циторедукции состоит в том, чтобы достичь полного удаления любых макроскопических повреждений, и одновременное использование HIPEC потенциально может удалить микроскопические раковые образования. [39] [40] Этот технический подход показал огромные преимущества в плане выживаемости наряду с выживаемостью без болезней и улучшением качества жизни пациентов. В настоящее время CRS в сочетании с HIPEC является лечением первой линии для PM, связанных с раком аппендикса и колоректального рака.[41] [42] Он также показал многообещающую роль в опухолях яичников, желудка и нейроэндокринной системы. [43] [8] [44]
Внутрибрюшинная аэрозольная химиотерапия под давлением (PIPAC)
Это новое инновационное терапевтическое вмешательство может быть использовано у пациентов с обширным перитонеальным карциноматозом, которые могут считаться неоперабельными или непригодными для хирургического вмешательства. В основе аэрозольной химиотерапии лежит предпосылка о том, что внутрибрюшное применение химиотерапевтических препаратов под давлением может потенциально улучшить проникновение в ткани и увеличить распространение.[45] Также было обнаружено, что он обладает превосходными преимуществами доставки лекарств в опухолевую ткань со значительным влиянием на регресс опухоли, чем обычная внутрибрюшинная химиотерапия или системная химиотерапия. [46] Этот вариант лечения полезен для пациентов с экстраперитонеальными метастазами, у которых этот метод может работать как эффективный вариант паллиативного лечения. Дальнейшие текущие проспективные испытания определят его будущую роль и регулярное использование.
Дифференциальный диагноз
Первичная злокачественная опухоль брюшины
Мезотелиома брюшины
Туберкулез брюшины
Перитонит
Медицинская онкология
HIPECОграниченная эффективность системной химиотерапии опухолей брюшины, в основном из-за плохого кровоснабжения опухоли и плохого проникновения, препятствует ее применению после СВК.Напротив, внутрибрюшинная химиотерапия является обычным вариантом в сочетании с СВК, особенно при наличии ПК. Гипертермия добавляет прямое цитотоксическое преимущество. [47] Основная цель HIPEC — устранить потенциальные микрометастазы, которые невозможно удалить хирургическим путем. В современной клинической практике используются два основных химиотерапевтических агента: 1) оксалиплатин и 2) митомицин С. [48] Это алкилирующие агенты, не зависящие от клеточного цикла, с повышенной цитотоксичностью при гипертермии и максимальным проникновением в ткань до менее или равного 2.5 мм. [49]
Практическая роль этого подхода в отношении дополнительных преимуществ выживания показала вариабельность. Одно многоцентровое рандомизированное контролируемое исследование в Нидерландах показало значительное улучшение выживаемости без признаков заболевания и общей выживаемости в группе пациентов, получавших CRS + HIPEC, по сравнению с группой, получавшей только хирургическое лечение, по поводу распространенного заболевания яичников [50]. Кроме того, первое РКИ продемонстрировало лучшие результаты выживаемости при лечении HIPEC. Но они также подчеркнули, что полное достижение циторедукции является важным фактором, учитывая исключительную 5-летнюю выживаемость 45% при резекции R1.[36] В то время как французское исследование Prodige-7 поставило под сомнение фактическое преимущество HIPEC по сравнению с системной терапией в отношении распространенного колоректального рака, разница в результатах может иметь отношение к различиям в параметрах, используемых в HIPEC. Определенные параметры, которые, как было установлено, влияют на эффективность HIPEC, включают тип используемого химиотерапевтического препарата, его концентрацию, раствор-носитель, объем перфузата, температуру перфузата, продолжительность лечения, метод доставки и выбор пациента.[51] Хирурги, выполняющие HIPEC-лечение в разных странах, показали различия в типе используемой ими техники доставки (открытая или закрытая) и температуре перфузата (от 41 до 43 ° C). ASPSM (Американское общество злокачественных новообразований на поверхности брюшины) предложило стандартизированное использование HIPEC для лечения ПК, вызванного колоректальным раком. Консенсус хирургов привел к 7 параметрам HIPEC. [52] Ниже приведены их рекомендуемые технические характеристики:
Метод HIPEC: закрытый.
Лекарственное средство: Митомицин C
Дозировка: 40 мг
Время доставки лекарства: 30 мг за 0, 10 мг за 60 мин.
Объем перфузата: 3 л
Температура притока: 42 ° C
Продолжительность перфузии: 90 мин.
Однако необходимы дальнейшие исследования для изучения относительного вклада или эффективности каждого из параметры. Распространение лечебных центров HIPEC и продолжающиеся проспективные исследования, возможно, помогут в стандартизации лечения и отборе пациентов для достижения оптимальных результатов в ближайшем будущем.
PIPAC
Другой новый терапевтический подход, недавно принятый в лечении перитонеального карциноматоза, — это химиотерапия внутрибрюшинным аэрозолем под давлением (PIPAC). Этот инновационный подход демонстрирует безопасность и осуществимость, наряду с системной химиотерапией, при лечении пациентов с ПК и экстраперитонеальными метастазами. Он также показал меньшую почечную и гепатотоксичность, а также меньшее количество побочных эффектов. [53] Он основан на предположении и связанных с ним доказательствах эффективности моделей ex-vivo и in vitro, которые показывают, что 1) внутрибрюшное применение химиотерапии под давлением увеличивает поглощение лекарственного средства опухолью, 2) аэрозолизация и химиотерапия с распылением увеличивают площадь покрытой поверхности брюшины. лекарством, и что этот механический подход (3) приводит к улучшенной противоопухолевой эффективности.[54] Основным преимуществом аэрозольной химиотерапии является лапароскопическая доставка и меньшее количество хирургических травм. Он также показал превосходство распределения лекарств и проникновения в ткани над HIPEC и системной химиотерапией. [46] Текущие клинические испытания продолжаются. Одно исследование на основе реестра показало возможное и безопасное использование нескольких методов лечения PIPAC с нулевой смертностью и минимальной заболеваемостью. Это значительно улучшило асцит и прогрессирование опухоли. [55] Доступные предварительные данные свидетельствуют об улучшении качества жизни и / или отсрочке ухудшения качества жизни в контексте терминальной стадии болезни.Это лечение является недавно появившимся вариантом паллиативного лечения пациентов с обширным распространенным раком [54].
Стадия
Классификация Джилли: Эта система используется в основном для прогностической оценки.
Стадия 0: Отсутствие макроскопического заболевания
Стадия 1: Злокачественные имплантаты размером менее 5 мм, локализованные в одной части брюшной полости
Стадия 2: Распространение на всю брюшную полость
Стадия 3: Имплантаты от 5 мм до 2 см
Стадия 4: Большие злокачественные узелки — более 2 см
Оценка ЧКВ: Как показано на рисунке, оценка ЧКВ является методом определения стадии, наиболее часто используемым до и во время операции для отбора хирургических пациентов , определение прогноза и прогнозирование будущих результатов.
Оценка CC: Полнота циторедукции: хирурги используют эту систему баллов для оценки хирургической резекции с целью выявления прогностических преимуществ. Они подразделяются на следующие уровни баллов в зависимости от наличия карциноматозных поражений после операции в любом квадранте брюшной полости. Показатели CC 0 и CC 1 предполагают лучшие результаты выживания. Усилия по-прежнему направлены на достижение полной циторедукции, когда это возможно.
Прогноз
Количественные прогностические показатели, используемые в настоящее время для перитонеального карциноматоза, следующие: [21]
Параметры первичного исхода, такие как общая выживаемость, выживаемость без признаков заболевания и 5-летняя выживаемость, зависят от типа первичного рака. достижение циторедукции (на основе оценки CC), лечение HIPEC и / или биологическая активность рака.
Перитонеальные метастазы неизвестной первичной опухоли (UPT) имеют плохой прогноз, продолжительность жизни составляет всего три месяца. Хотя определенные гистологические подтипы показали благоприятную выживаемость, усилия должны быть сосредоточены на обнаружении и идентификации первичной опухоли, потенциально увеличивая прогностические преимущества лечения. [11]
Осложнения
Осложнения, связанные с нелеченым / неоперабельным ПК: [56]
Рефрактерный асцит
Кишечная непроходимость
Желудочно-кишечная нарушение моторики
e Нарушение моторики легких
e Пермобарозное поражение
e Легочное поражение связанные с портальной гипертензией, включая кровотечение из верхних отделов ЖКТ, связанное с варикозным расширением вен пищевода, спленомегалией, печеночной энцефалопатией и асцитом
Кишечный свищ
Осложнение, связанное с СВК:
Послеоперационные осложнения, такие как кровотечение, инфекция, непроходимость кишечника или перитонит.
Осложнение, связанное с HIPEC:
Оксалиплатин используется с растворами декстрозы, поэтому он потенциально может способствовать послеоперационному ацидозу и гипергликемии
Митомицин C может вызывать нейтропению примерно у одной трети пациентов
Другие GI побочные эффекты
Сдерживание и обучение пациентов
Перитонеальные метастазы в результате метастазирования, естественно, представляют собой огромную проблему для пациентов. Таким образом, медицинские работники должны проконсультировать их по поводу состояния и при необходимости направить к психологу.Кроме того, следует бороться с третьим интервалом, ведущим к асциту, с ограничением соли и воды.
Улучшение результатов команды здравоохранения
Часто, когда пациенты узнают о перитонеальном карциноматозе, они становятся охваченными страхом и тревогой, теряя надежду на излечение. Эволюция хирургического и медикаментозного лечения карциноматоза брюшины обеспечила столь необходимую поддержку, лучшие результаты и улучшенное качество жизни для некоторых из этих пациентов. Медицинские работники должны все больше осознавать потенциальные преимущества циторедуктивной хирургии и HIPEC при правильном применении.Они должны поощрять и вооружать недавно диагностированных пациентов доступной в настоящее время информацией и помогать в организации соответствующих направлений для рассмотрения вариантов хирургического лечения, предпочтительно в межпрофессиональных онкологических учреждениях, если таковые имеются.
В надежде на наилучшие возможные исходы пациентам и их медицинским работникам рекомендуется не недооценивать общие абдоминальные и кишечные симптомы, особенно если они указывают на кишечную непроходимость, и сохранять злокачественные новообразования, в том числе перитонеальный карциноматоз, при дифференциальной диагностике по возможности раннее выявление и лечение.
Общий прогноз для пациентов с ПК плохой. Таким образом, очень важно подходить к этим случаям в рамках межпрофессионального командного подхода, включая врачей, специалистов, медсестер, прошедших специальную подготовку, и фармацевтов. Сертифицированный онколог-фармацевт должен работать с онкологом над выбором и дозированием агента, а также обучать пациента управлению болью и доступным возможностям. [Уровень 5] Проконсультируйтесь со службами обезболивания, медсестрой хосписа, и паллиативная помощь заслуживает рассмотрения на раннем этапе лечения.
Рисунок
Индекс рака брюшины (данные Jacquet P, Sugarbaker PH. Текущие методики клинической оценки пациентов с перитонеальным карциноматозом. J Exp Clin Cancer Res 1996; 15 (1): 49–58, и доступно в Creative Commons Attribution (подробнее …)
Ссылки
- 1.
- Blackburn SC, Stanton MP. Анатомия и физиология брюшины. Semin Pediatr Surg. 2014 Dec; 23 (6): 326-30. [PubMed: 25459436]
- 2.
- Sampson JA.Имплантация перитонеального карциноматоза яичников. Am J Pathol. 1931 Сен; 7 (5): 423-444.39. [Бесплатная статья PMC: PMC2062808] [PubMed: 19969977]
- 3.
- Klos D, Riško J, Stašek M, Loveček M, Hanuliak J, Skalický P, Lemstrová R, Mohelníková BD, Študentová H, Melichar Béral Текущее состояние циторедуктивной хирургии (CRS) и внутрибрюшинной гипертермической химиотерапии (HIPEC) в мультимодальном лечении злокачественных новообразований на поверхности брюшины. Cas Lek Cesk. 17 декабря 2018 г .; 157 (8): 419-428.[PubMed: 30754979]
- 4.
- Фланаган М., Солон Дж., Чанг К. Х., Диди С., Моран Б., Кэхилл Р., Шилдс С., Мулсов Дж. Метастазы в брюшину от экстраабдоминального рака — популяционное исследование. Eur J Surg Oncol. 2018 ноя; 44 (11): 1811-1817. [PubMed: 30139510]
- 5.
- Lengyel E. Развитие и метастазирование рака яичников. Am J Pathol. 2010 сентябрь; 177 (3): 1053-64. [Бесплатная статья PMC: PMC2928939] [PubMed: 20651229]
- 6.
- Heintz AP, Odicino F, Maisonneuve P, Quinn MA, Benedet JL, Creasman W.T., Ngan HY, Pecorelli S, Beller U.Карцинома яичника. 26-й ежегодный отчет FIGO о результатах лечения гинекологического рака. Int J Gynaecol Obstet. 2006 ноябрь; 95 Приложение 1: S161-92. [PubMed: 17161157]
- 7.
- Quere P, Facy O, Manfredi S, Jooste V, Faivre J, Lepage C, Bouvier AM. Эпидемиология, лечение и выживаемость перитонеального карциноматоза от колоректального рака: популяционное исследование. Dis Colon Rectum. 2015 август; 58 (8): 743-52. [PubMed: 26163953]
- 8.
- Гилл Р.С., Аль-Адра Д.П., Нагендран Дж., Кэмпбелл С., Ши Икс, Хаасе Э., Шиллер Д.Лечение рака желудка с перитонеальным карциноматозом с помощью циторедуктивной хирургии и HIPEC: систематический обзор выживаемости, смертности и заболеваемости. J Surg Oncol. 2011 г., 01 ноября; 104 (6): 692-8. [PubMed: 21713780]
- 9.
- Мадани А., Томассен И., ван Гестель YRBM, ван дер Билт JDW, Хаак Х.Р., де Хинг IHJT, Lemmens VEPP. Перитонеальные метастазы из гастроэнтеропанкреатических нейроэндокринных опухолей: частота, факторы риска и прогноз. Энн Сург Онкол. 2017 августа; 24 (8): 2199-2205. [PubMed: 28204963]
- 10.
- Серено М., Родригес-Эстебан I, Гомес-Рапосо С., Мерино М., Лопес-Гомес М., Замбрана Ф., Касадо Э. Рак легких и карциноматоз брюшины. Oncol Lett. 2013 сентябрь; 6 (3): 705-708. [Бесплатная статья PMC: PMC3789112] [PubMed: 24137394]
- 11.
- Thomassen I, Verhoeven RH, van Gestel YR, van de Wouw AJ, Lemmens VE, de Hingh IH. Заболеваемость, лечение и выживаемость в популяции пациентов с перитонеальными метастазами неизвестного происхождения. Eur J Cancer. 2014 Янв; 50 (1): 50-6. [PubMed: 24011935]
- 12.
- Solon JG, O’Neill M, Chang KH, Deady S, Cahill R, Moran B, Shields C, Mulsow J. 18-летнее популяционное исследование места происхождения и исхода пациентов со злокачественными новообразованиями брюшины в Ирландии. Eur J Surg Oncol. 2017 Октябрь; 43 (10): 1924-1931. [PubMed: 28583791]
- 13.
- Klaver YL, Lemmens VE, Nienhuijs SW, Luyer MD, de Hingh IH. Карциноматоз брюшины колоректального происхождения: заболеваемость, прогноз и варианты лечения. Мир Дж. Гастроэнтерол. 2012 г., 21 октября; 18 (39): 5489-94.[Бесплатная статья PMC: PMC3482634] [PubMed: 23112540]
- 14.
- Mikuła-Pietrasik J, Uruski P, Tykarski A., Ksiek K. Перитонеальная «почва» для ракового «семени»: всесторонний обзор патогенеза метастазов внутрибрюшинного рака. Cell Mol Life Sci. 2018 Февраль; 75 (3): 509-525. [Бесплатная статья PMC: PMC5765197] [PubMed: 28956065]
- 15.
- Лэнгли Р.Р., Фидлер И.Дж. Пересмотр гипотезы семян и почвы — роль взаимодействий опухоль-строма в метастазировании в различные органы.Int J Cancer. 2011 июн 01; 128 (11): 2527-35. [Бесплатная статья PMC: PMC3075088] [PubMed: 21365651]
- 16.
- Terzi C, Arslan NC, Canda AE. Карциноматоз брюшины при опухолях желудочно-кишечного тракта: где мы сейчас? Мир Дж. Гастроэнтерол. 2014 21 октября; 20 (39): 14371-80. [Бесплатная статья PMC: PMC4202366] [PubMed: 25339824]
- 17.
- Кусамура С., Баратти Д., Заффарони Н., Вилла Р., Латерза Б., Балестра М.Р., Дерако М. Патофизиология и биология перитонеального карциноматоза. Мир J Gastrointest Oncol.2010 15 января; 2 (1): 12-8. [Бесплатная статья PMC: PMC2999153] [PubMed: 21160812]
- 18.
- Chu DZ, Lang NP, Thompson C, Osteen PK, Westbrook KC. Карциноматоз брюшины при негинекологических злокачественных новообразованиях. Проспективное исследование прогностических факторов. Рак. 1989, 15 января; 63 (2): 364-7. [PubMed: 2
4]
- 19.
- Sadeghi B, Arvieux C, Glehen O, Beaujard AC, Rivoire M, Baulieux J, Fontaumard E, Brachet A, Caillot JL, Faure JL, Porcheron J, Peix JL, François Y, Виньял Дж., Джилли Ф.Н.Карциноматоз брюшины от негинекологических злокачественных новообразований: результаты многоцентрового проспективного исследования EVOCAPE 1. Рак. 2000, 15 января; 88 (2): 358-63. [PubMed: 10640968]
- 20.
- Джейн Д.Г., Фук С., Лой С., Сео-Чун Ф. Карциноматоз брюшины, вызванный колоректальным раком. Br J Surg. 2002 декабрь; 89 (12): 1545-50. [PubMed: 12445064]
- 21.
- Хармон Р.Л., Шугарбейкер PH. Прогностические показатели при карциноматозе брюшины при раке желудочно-кишечного тракта. Int Semin Surg Oncol.2005 г., 8 февраля; 2 (1): 3. [Бесплатная статья PMC: PMC549516] [PubMed: 15701175]
- 22.
- Валле М., Федеричи О., Гарофало А. Отбор пациентов для циторедуктивной хирургии и гипертермической внутрибрюшинной химиотерапии, а также роль лапароскопии в диагностике, определении стадии и лечении. Surg Oncol Clin N Am. 2012 Октябрь; 21 (4): 515-31. [PubMed: 23021713]
- 23.
- Archer AG, Sugarbaker PH, Jelinek JS. Радиология карциноматоза брюшины. Cancer Treat Res. 1996; 82: 263-88. [PubMed: 8849956]
- 24.
- de Bree E, Koops W., Kröger R, van Ruth S, Witkamp AJ, Zoetmulder FA. Карциноматоз брюшины от колоректального или аппендикулярного происхождения: корреляция предоперационной КТ с интраоперационными данными и оценка согласия между наблюдателями. J Surg Oncol. 2004 г. 01 мая; 86 (2): 64-73. [PubMed: 15112247]
- 25.
- Ferrandina G, Sallustio G, Fagotti A, Vizzielli G, Paglia A, Cucci E, Margariti A, Aquilani L, Garganese G, Scambia G. Роль компьютерной томографии и клинической оценки в предоперационном прогнозировании оптимальной циторедукции при распространенном раке яичников: проспективное исследование.Br J Рак. 6 октября 2009 г .; 101 (7): 1066-73. [Бесплатная статья PMC: PMC2768100] [PubMed: 19738608]
- 26.
- Low RN, Semelka RC, Worawattanakul S, Alzate GD. Внепеченочная абдоминальная визуализация у пациентов со злокачественными новообразованиями: сравнение МРТ и спиральной компьютерной томографии у 164 пациентов. J. Магнитно-резонансная томография. 2000 августа; 12 (2): 269-77. [PubMed: 10931590]
- 27.
- Dohan A, Hoeffel C, Soyer P, Jannot AS, Valette PJ, Thivolet A, Passot G, Glehen O, Rousset P. Оценка индекса карциноматоза брюшины с помощью КТ и МРТ.Br J Surg. 2017 август; 104 (9): 1244-1249. [PubMed: 28376270]
- 28.
- Dresen RC, De Vuysere S, De Keyzer F, Van Cutsem E, Prenen H, Vanslembrouck R, De Hertogh G, Wolthuis A, D’Hoore A, Vandecaveye V. Все тело диффузионно-взвешенная МРТ для оценки работоспособности у пациентов с колоректальным раком и перитонеальными метастазами. Визуализация рака. 2019 Янв 07; 19 (1): 1. [Бесплатная статья PMC: PMC6322317] [PubMed: 30616608]
- 29.
- Klumpp BD, Schwenzer N, Aschoff P, Miller S, Kramer U, Claussen CD, Bruecher B, Koenigsrainer A, Pfannenberg C.Предоперационная оценка перитонеального карциноматоза: внутриличностное сравнение ПЭТ / КТ с 18F-ФДГ и МРТ. Визуализация брюшной полости. 2013 Февраль; 38 (1): 64-71. [PubMed: 22476333]
- 30.
- De Gaetano AM, Calcagni ML, Rufini V, Valenza V, Giordano A, Bonomo L. Визуализация перитонеального карциноматоза с помощью FDG PET-CT: диагностические шаблоны, примеры случаев и подводные камни. Визуализация брюшной полости. 2009 май-июнь; 34 (3): 391-402. [PubMed: 18446399]
- 31.
- Bravo R, Jafari MD, Pigazzi A. Полезность диагностической лапароскопии у пациентов, оцениваемых для циторедуктивной хирургии и гипертермической перитонеальной химиотерапии.Am J Clin Oncol. 2018 декабрь; 41 (12): 1231-1234. [PubMed: 29782364]
- 32.
- Сонг С.Е., Чой П., Ким Дж. Х., Чон К., Ким С. Е., Мун В., Парк М. И., Пак С. Дж. Диагностическая ценность карциноэмбрионального антигена при асците при колоректальном раке с перитонеальным карциноматозом. Корейский J Gastroenterol. 2018 25 июня; 71 (6): 332-337. [PubMed: 29943560]
- 33.
- Courcoutsakis N, Tentes AA, Astrinakis E, Zezos P, Prassopoulos P. CT-Enteroclysis в предоперационной оценке поражения тонкой кишки у пациентов с перитонеальным карциноматозом, кандидатов на циторедуктивную операцию и гипертермическая внутрибрюшинная химиотерапия.Визуализация брюшной полости. 2013 Февраль; 38 (1): 56-63. [PubMed: 22410875]
- 34.
- Najah H, Lo Dico R, Grienay M, Dohan A, Dray X, Pocard M. Гибкая эндоскопия с одним разрезом (SIFE) для обнаружения и определения стадии перитонеального карциноматоза. Surg Endosc. 2016 сентябрь; 30 (9): 3808-15. [PubMed: 26659231]
- 35.
- Verwaal VJ, van Ruth S, de Bree E, van Sloothen GW, van Tinteren H, Boot H, Zoetmulder FA. Рандомизированное исследование циторедукции и гипертермической внутрибрюшинной химиотерапии по сравнению с системной химиотерапией и паллиативной хирургией у пациентов с перитонеальным карциноматозом колоректального рака.J Clin Oncol. 15 октября 2003 г .; 21 (20): 3737-43. [PubMed: 14551293]
- 36.
- Verwaal VJ, Bruin S, Boot H, van Slooten G, van Tinteren H. 8-летнее наблюдение рандомизированного исследования: циторедукция и гипертермическая внутрибрюшинная химиотерапия в сравнении с системной химиотерапией у пациентов с перитонеальной карциноматоз колоректального рака. Энн Сург Онкол. 2008 сентябрь; 15 (9): 2426-32. [PubMed: 18521686]
- 37.
- Esquivel J, Lowy AM, Markman M, Chua T., Pelz J, Baratti D, Baumgartner JM, Berri R, Bretcha-Boix P, Deraco M, Flores-Ayala G, Glehen O , Gomez-Portilla A, González-Moreno S, Goodman M, Halkia E, Kusamura S, Moller M, Passot G, Pocard M, Salti G, Sardi A, Senthil M, Spilioitis J, Torres-Melero J, Turaga K, Форель Р.Оценка степени тяжести поверхностных заболеваний брюшины (PSDSS) у 1013 пациентов с колоректальным раком с перитонеальным карциноматозом, проведенная Американским обществом злокачественных новообразований брюшной полости (ASPSM). Энн Сург Онкол. 2014 декабрь; 21 (13): 4195-201. [PubMed: 24854493]
- 38.
- Sugarbaker PH. Процедуры перитонэктомии. Surg Oncol Clin N Am. 2003 июл; 12 (3): 703-27, xiii. [PubMed: 14567026]
- 39.
- Sugarbaker PH. Эволюция циторедуктивной хирургии и периоперационной внутрибрюшинной химиотерапии при перитонеальном карциноматозе: есть ли альтернативы лечению? Am J Surg.2011 Февраль; 201 (2): 157-9. [PubMed: 20870209]
- 40.
- Sugarbaker PH. Хирургические обязанности при лечении карциноматоза брюшины. J Surg Oncol. 15 июня 2010 г .; 101 (8): 713-24. [PubMed: 20512948]
- 41.
- Бирн Р.М., Гилберт Э.В., Дьюи Э.Н., Херциг Д.О., Лу К.С., Биллингсли К.Г., Девени К.Э., Цикитис В.Л. Кто проходит циторедуктивную хирургию и периоперационную внутрибрюшинную химиотерапию при раке аппендикса? Анализ национальной базы данных рака. J Surg Res.2019 июн; 238: 198-206. [PubMed: 30772678]
- 42.
- Elias D, Gilly F, Boutitie F, Quenet F, Bereder JM, Mansvelt B, Lorimier G, Dubè P, Glehen O. Перитонеальный колоректальный карциноматоз, леченный хирургическим путем и периоперационная внутрибрюшинная химиотерапия. анализ 523 пациентов из многоцентрового французского исследования. J Clin Oncol. 01 января 2010; 28 (1): 63-8. [PubMed: 19917863]
- 43.
- Deraco M, Kusamura S, Virzì S, Puccio F, Macrì A, Famulari C, Solazzo M, Bonomi S, Iusco DR, Baratti D.Циторедуктивная хирургия и гипертермическая внутрибрюшинная химиотерапия в качестве предварительной терапии распространенного эпителиального рака яичников: многоинституциональное исследование фазы II. Gynecol Oncol. 2011 Август; 122 (2): 215-20. [PubMed: 21665254]
- 44.
- Elias D, David A, Sourrouille I, Honoré C, Goéré D, Dumont F, Stoclin A, Baudin E. Нейроэндокринные карциномы: оптимальная хирургия перитонеальных метастазов (и связанных с ними внутрибрюшных метастазов ). Операция. 2014 Янв; 155 (1): 5-12. [PubMed: 24084595]
- 45.
- Грасс Ф., Вуаньо А., Тейшейра-Фаринья Х., Леманн К., Демартинес Н., Хюбнер М. Систематический обзор химиотерапии внутрибрюшинным аэрозолем под давлением для лечения распространенного перитонеального карциноматоза. Br J Surg. 2017 Май; 104 (6): 669-678. [PubMed: 28407227]
- 46.
- Hübner M, Teixeira H, Boussaha T., Cachemaille M, Lehmann K, Demartines N. [PIPAC — Внутрибрюшинная аэрозольная химиотерапия под давлением. Новое лечение карциноматоза брюшины. Rev Med Suisse. 2015, 17 июня; 11 (479): 1325-30.[PubMed: 26255492]
- 47.
- Roti Roti JL. Клеточные реакции на гипертермию (40-46 градусов C): убийство клеток и молекулярные события. Int J Hyperthermia. 2008 Февраль; 24 (1): 3-15. [PubMed: 18214765]
- 48.
- Prada-Villaverde A, Esquivel J, Lowy AM, Markman M, Chua T, Pelz J, Baratti D, Baumgartner JM, Berri R, Bretcha-Boix P, Deraco M, Flores- Ayala G, Glehen O, Gomez-Portilla A, González-Moreno S, Goodman M, Halkia E, Kusamura S, Moller M, Passot G, Pocard M, Salti G, Sardi A, Senthil M, Spiliotis J, Torres-Melero J , Турага К, Траут Р.Оценка Американским обществом злокачественных новообразований поверхности брюшины HIPEC с митомицином C по сравнению с оксалиплатином у 539 пациентов с раком толстой кишки, перенесших полную циторедуктивную операцию. J Surg Oncol. 2014 декабрь; 110 (7): 779-85. [PubMed: 25088304]
- 49.
- Dovern E, de Hingh IH, Verwaal VJ, van Driel WJ, Nienhuijs SW. Гипертермическая внутрибрюшинная химиотерапия добавлена к лечению рака яичников. Обзор достигнутых результатов и осложнений. Eur J Gynaecol Oncol. 2010; 31 (3): 256-61.[PubMed: 21077465]
- 50.
- van Driel WJ, Koole SN, Sikorska K, Schagen van Leeuwen JH, Schreuder HWR, Hermans RHM, de Hingh IHJT, van der Velden J, Arts HJ, Massuger LFAG, Aal Verwaal VJ, Kieffer JM, Van de Vijver KK, van Tinteren H, Aaronson NK, Sonke GS. Гипертермическая внутрибрюшинная химиотерапия при раке яичников. N Engl J Med. 2018 18 января; 378 (3): 230-240. [PubMed: 29342393]
- 51.
- Helderman RFCPA, Löke DR, Kok HP, Oei AL, Tanis PJ, Franken NAPK, Crezee J.Варианты клинического применения гипертермической внутрибрюшинной химиотерапии: обзор. Раки (Базель). 11 января 2019; 11 (1) [Бесплатная статья PMC: PMC6357036] [PubMed: 30641919]
- 52.
- Турага К., Левин Э., Барон Р., Стикка Р., Петрелли Н., Ламберт Л., Нэш Г., Морс М., Адбель-Миси Р., Александр Х. Р., Аттие Ф., Бартлетт Д., Бастидас А., Блейзер Т., Чу К., Чунг К., Домингес-Парра Л., Эспат, штат Нью-Джерси, Фостер Дж., Фурнье К., Гарсия Р., Гудман М., Ханна Н., Харрисон L, Hoefer R, Holtzman M, Kane J, Labow D, Li B, Lowy A, Mansfield P, Ong E, Pameijer C, Pingpank J, Quinones M, Royal R, Salti G, Sardi A, Shen P, Skitzki J, Спеллман Дж., Стюарт Дж., Эскивел Дж.Консенсусное руководство Американского общества злокачественных новообразований брюшной полости по стандартизации проведения гипертермической внутрибрюшинной химиотерапии (HIPEC) у пациентов с колоректальным раком в США. Энн Сург Онкол. 2014 Май; 21 (5): 1501-5. [PubMed: 23793364]
- 53.
- Робелла М., Вайра М., Де Симоне М. Безопасность и осуществимость химиотерапии внутрибрюшинным аэрозолем под давлением (PIPAC), связанной с системной химиотерапией: инновационный подход к лечению перитонеального карциноматоза.Мир J Surg Oncol. 2016 29 апреля; 14:128. [Бесплатная статья PMC: PMC4850728] [PubMed: 27125996]
- 54.
- Tempfer CB. Химиотерапия с помощью внутрибрюшинного аэрозоля под давлением как инновационный подход к лечению перитонеального карциноматоза. Мед-гипотезы. 2015 Октябрь; 85 (4): 480-4. [PubMed: 26277656]
- 55.
- Курц Ф., Струллер Ф., Хорват П., Соласс В., Бёсмюллер Х., Кенигсрайнер А., Реймонд Массачусетс. Осуществимость, безопасность и эффективность химиотерапии внутрибрюшинным аэрозолем под давлением (PIPAC) при перитонеальных метастазах: исследование реестра.Гастроэнтерол Рес Прак. 2018; 2018: 2743985. [Бесплатная статья PMC: PMC6220392] [PubMed: 30473706]
- 56.
- Lambert LA, Hendrix RJ. Паллиативное лечение распространенного перитонеального карциноматоза. Surg Oncol Clin N Am. 2018 июл; 27 (3): 585-602. [PubMed: 29935691]
Является ли перитонеальный карциноматоз неизлечимым заболеванием или контролируемым локорегиональным заболеванием? — проблема хирургов при внутрибрюшинной гипертермической химиотерапии | Японский журнал клинической онкологии
Карциноматоз брюшины — наиболее частая терминальная стадия рака брюшной полости.Для желудочно-кишечных хирургов и медицинских онкологов это неприятное состояние, потому что, хотя болезнь ограничена перитонеальной поверхностью, полное хирургическое удаление невозможно, а системная химиотерапия бессильна. Карциноматоз брюшины обычно считается неизлечимым заболеванием, которое заставляет врачей отказываться от дальнейшего агрессивного лечения.
У гинекологов разные взгляды на рак яичников. Они испробовали обширную хирургическую операцию по уменьшению объема брюшины с последующей внутрибрюшинной (т.п.) химиотерапия на основе цисплатина. Большое рандомизированное контролируемое исследование недавно показало значительное улучшение выживаемости i.p. цисплатин по сравнению с внутривенным цисплатином у пациентов с раком яичников III стадии и остаточными опухолевыми массами 2 см и менее (1). Само собой разумеется, что эта стратегия лечения рака яичников основана на высокой чувствительности опухоли к возбудителям. В таких ситуациях циторедуктивная операция может даже рассматриваться как неоадъювантное лечение химиотерапии. Однако при раке желудочно-кишечного тракта такой эффективности химиотерапевтический режим не показал.
Теоретическое преимущество i.p. Введение заключается в том, что может быть достигнута высокая местная концентрация потенциально эффективного лекарственного средства, в то время как его концентрация в сыворотке остается низкой, тем самым сводя к минимуму системные побочные эффекты. Отношение концентрации лекарственного средства в брюшине / плазме является высоким для многих химиотерапевтических агентов, включая митомицин-С и цисплатин. Однако в клинической практике частота ответа желудочно-кишечного карциноматоза на i.p. химиотерапия была низкой.
Желудочно-кишечные хирурги, возможно, сделали прорыв в гипертермии.Известно, что опухолевые клетки чувствительны к теплу, вероятно, из-за их чувствительного микроокружения с низким pH, низким давлением кислорода и потерей адаптивного расширения сосудов. Хотя эффект одной гипертермии ограничен, поскольку тепло проникает только на 1-3 мм от поверхности солидных опухолей, экспериментальные исследования показали синергетический эффект химиотерапии и гипертермии. Этот синергизм объясняется увеличением проницаемости клеточной мембраны и активным переносом лекарств, а также изменением клеточного метаболизма.На основе этих открытий возникла идея внутрибрюшинной перфузии нагретой жидкости, содержащей химиотерапевтические агенты.
Spratt et al. (2) впервые сообщили о клиническом применении внутрибрюшинной гипертермической химиотерапии в 1980 году. Этот захватывающий опыт был подробно описан в Cancer Research как клинический случай: пациент с рецидивирующей псевдомиксомой брюшины, отчаянно ищущий новое лечение, связался с исследователем через после прочтения статьи позвонил по телефону и настоял на том, чтобы стать первым пациентом, который будет лечиться с помощью недавно созданной перфузионной системы.Пациенту была проведена операция по удалению опухоли с последующей перфузионной терапией (тиотепа и метотрексат, 42 ° C), и он благополучно вернулся к социальной жизни.
Со времени этого отчета были проведены многочисленные фундаментальные и клинические исследования гипертермической химиотерапии (3,4). Система перфузии претерпела несколько улучшений. В первом случае Spratt et al. началась перитонеальная перфузия после закрытия брюшной полости. Позже другие хирурги разработали методы открытой брюшной полости с использованием «расширителя брюшной полости» (5) или «техники Колизея», так что вся перитонеальная поверхность кишечника в достаточной степени подвергается воздействию нагретого перфузата.В этой открытой системе хирурги обычно в течение часа вручную перемешивают теплую брюшную «ванну». Между тем, фармакокинетические исследования продемонстрировали высокое соотношение перитонеальный объем к плазме и повышенную цитотоксичность, связанную с гипертермией, для широкого спектра агентов. Не только хорошо известные митомицин-C и цисплатин, но также доксорубицин, иринотекан, фактор некроза опухоли (TNF) -α и интерлейкин 1α и т. Д. Проявляют in vitro синергизм с гипертермией.
В этом выпуске журнала доктор Пол Шугарбейкер, один из пионеров и наиболее преданных сторонников внутрибрюшинной гипертермической химиотерапии, написал обзорную статью о своем обширном опыте и публикациях (6).Он охватывает все теоретические и практические аспекты лечения, разработанные его группой, включая теорию барьера между плазмой и брюшиной, оценку полноты циторедукции (СС), «технику Колизея» и их стандартные формы заказа для периоперационного ведения. Он настаивает, основываясь на результатах выживаемости его пациентов, что хирурги должны взять на себя ответственность за грамотное лечение перитонеального карциноматоза.
Сегодня более 30 учреждений по всему миру имеют значительный опыт гипертермической химиоперфузии при перитонеальном карциноматозе (3).Другими словами, это все еще особый метод, доступный только в специализированных учреждениях. Легко представить, что обширная циторедуктивная хирургия и немедленная гипертермическая перфузия цитотоксическими агентами вызовут различные заболевания, связанные с лечением. Перфузионное оборудование потребует значительных начальных и текущих ресурсов для безопасного и эффективного использования. Следовательно, это лечение нельзя начинать где-либо немедленно. Для широкого использования химиоперфузии необходимы доказательства высокого уровня эффективности и создание соответствующей системы обучения.
Большинство опубликованных исследований этого лечения представляют собой ретроспективный анализ ограниченного числа пациентов с различными участками первичной опухоли, получавших различные схемы лечения в течение длительного периода. Это понятно в новаторских работах, особенно в области хирургической онкологии. Пришло время разработать проспективные исследования, чтобы прояснить различные моменты. Технические проблемы, которые необходимо решить, включают методы перфузии (закрытые или открытые с использованием перитонеальных расширителей), температурный диапазон (41–44 ° C), продолжительность и количество раз перфузии, выбор химиотерапевтических агентов и объем циторедуктивной хирургии.Заболеваемость и смертность вместе с токсичностью каждой схемы следует предварительно регистрировать. Выживаемость пациентов должна быть строго проанализирована в соответствии с гистологией каждой первичной опухоли. Важным представляется сотрудничество специализированных центров.
Рандомизированные контролируемые исследования дадут доказательства, и такое исследование продолжается в Нидерландах по поводу перитонеального карциноматоза, вызванного колоректальным раком (7). Однако, учитывая специализацию и доступность техники, шансы на исследования фазы III кажутся очень ограниченными.Между тем, накопление хорошо спланированных проспективных исследований фазы II имеет большое значение для научной оценки этого многообещающего лечения состояния, которое обычно считается неизлечимым.
Список литературы
1.Альбертс Д.С., Лю П.Й., Ханниган Э.В., О’Тул Р., Уильямс С.Д., Янг Дж. Интраперитонеальный цисплатин плюс внутривенный циклофосфамид по сравнению с внутривенным цисплатином плюс внутривенным циклофосфамидом при раке яичников III стадии.
N Engl J Med
1996
;335
:1950
–5.2.Spratt JS, Adcock RA, Muskovin M, Sherrill W, McKeown J. Система клинической доставки для внутрибрюшинной гипертермической химиотерапии.
Cancer Res
1980
;40
:256
–60.3.Ceelen WP, Hesse U, de Hemptinne B, Pattyn P. Гипертермическая внутрибрюшинная химиоперфузия в лечении местнораспространенного внутрибрюшного рака.
Br J Surg
2000
;87
:1006
–15.4.Pilati P, Rossi CR, Mocellin S, Foletto M, Scagnet B, Pasetto L, Lise M.Мультимодальное лечение карциноматоза и саркоматоза брюшины.
евро J Surg Oncol
2001
;27
:125
–34,5.Fujimura T, Yonemura Y, Muraoka K, Takamura H, Hirono Y, Sahara H и др. Непрерывная гипертермическая перфузия брюшины для предотвращения перитонеального рецидива рака желудка: рандомизированное контролируемое исследование.
World J Surg
1994
;18
:150
–5.6.Шугарбейкер П. Обзор личного опыта лечения карциноматоза и саркоматоза.
Jpn J Clin Oncol
2001
;31
:573
–83.7.Witkamp AJ, de Bree E, Kaag MM, Boot H, Beijnen JH, van Slooten GW, et al. Обширная циторедуктивная хирургия с последующей интраоперационной гипертермической внутрибрюшинной химиотерапией митомицином-С у пациентов с перитонеальным карциноматозом колоректального происхождения.
евро J Cancer
2001
;37
:979
–84. .

 В основном это происходит на 4 стадии онкологии.
В основном это происходит на 4 стадии онкологии.