Опьянение и отрезвление — Alkoinfo.ee
Степени опьянения и время вытрезвления
От чего зависит опьянение?
То, насколько повышается содержание алкоголя в крови, зависит от множества факторов. Однако общее правило заключается в том, что чем больше алкоголя, тем выше его содержание в крови. В то же время многое зависит от темпа употребления: если пить быстро, содержание алкоголя в крови увеличивается сильнее, чем при медленном употреблении. При пустом желудке алкоголь всасывается полностью и быстрее, чем у сытого человека. Крепкие напитки всасываются быстрее, чем легкие, создавая большую концентрацию алкоголя в крови. Важна и масса тела: на худощавых людей то же количество алкоголя оказывает больший эффект. Кроме того, алкоголь по-разному действует на женщин и мужчин. Поскольку в организме женщин обычно содержится меньше воды, при том же количестве выпитого алкоголя его содержание в крови женщины будет выше даже при одинаковой с мужчиной массе тела.
Измерение степени опьянения
Степень опьянения измеряется в промилле. Промилле показывает массу алкоголя в 1000 мл крови. Например, 0,5-процентное опьянение означает, что в 1000 мл циркулирующей в организме крови содержится 0,5 г чистого алкоголя.
Степень опьянения оценивается как по выдыхаемому воздуху, так и с помощью анализа крови. Содержание алкоголя в выдыхаемом воздухе измеряется в миллиграммах на литр. Однако чаще используется понятие промилле. Для того, чтобы миллиграммы на литр выразить в промилле, нужно полученное число умножить на 2,1. Например, опьянение с 0,5 мл/л в выдыхаемом воздухе соответствует около 1,05 процента.
Согласно законодательству Эстонии, различаются следующие степени опьянения:
признаки употребления алкоголя – содержание алкоголя от 0,10 до 0,24 миллиграмма в литре выдыхаемого воздуха, либо от 0,20 до 0,49 промилле в крови;
легкое алкогольное опьянение – содержание алкоголя от 0,1 до 0,75 миллиграмма в литре выдыхаемого воздуха, либо от 0,20 до 1,50 промилле в крови;
умеренное алкогольное опьянение – содержание алкоголя от 0,76 до 1,25 миллиграмма в литре выдыхаемого воздуха, либо от 1,51 до 2,5 промилле в крови;
тяжелое алкогольное опьянение – содержание алкоголя свыше 1,25 миллиграмма в литре выдыхаемого воздуха, либо свыше 2,5 промилле в крови.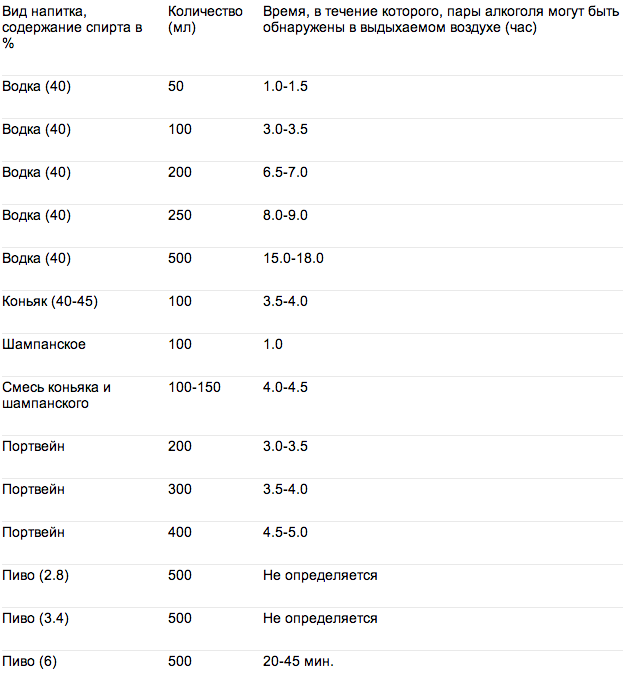
Управление транспортным средством в состоянии опьянения – это преступление! Производство о правонарушении проводится в случае, если содержание алкоголя в одном грамме крови водителя составляет 0,20 мг и больше, либо если в одном литре выдыхаемого им воздуха содержится 0,10 мг или больше алкоголя.
Воздействие опьянения на восприятие и поведение
У некоторых людей симптомы опьянения наступают быстрее и легче, чем у других. Есть и люди, у которых уже образовалась толерантность, из-за чего они не способны почувствовать, насколько пьяны.
В общих чертах все же можно определить, как меняется настроение и поведение при разных степенях опьянения.
0,2–0,3 промилле Вы можете чувствовать себя слегка расслабленным, внутренние ограничения несколько ослабляются. После приема алкоголя настроение начинает подниматься.
0,4–0,6 промилле Вы чувствуете тепло и расслабленность. Ваше поведение может быть более вызывающим: речь становится смелее и быстрее, а голос громче, чем обычно.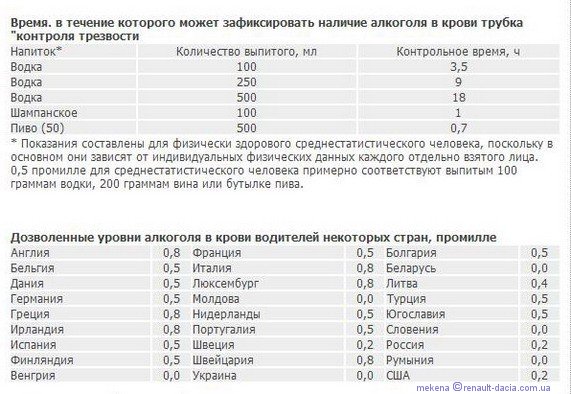 Усиливаются эмоции – хорошее настроение становится еще лучше и точно так же усиливаются отрицательные эмоции. Вы можете ощущать легкую эйфорию. Мыслительные способности и память могут слегка нарушиться, делая вас неосмотрительным.
Усиливаются эмоции – хорошее настроение становится еще лучше и точно так же усиливаются отрицательные эмоции. Вы можете ощущать легкую эйфорию. Мыслительные способности и память могут слегка нарушиться, делая вас неосмотрительным.
0,7–0,9 промилле При этой степени опьянения начинаются нарушения равновесия, двигательных функций, четкости речи, скорости реакции, зрения и слуха. Нарушается самоконтроль и способность рассуждать, вы считаете, что действуете лучше обычного и вам трудно не продолжить пить. Вы можете чувствовать эйфорию.
1,0–1,2 промилле У вас эйфория, хотя моторные функции, координация, скорость реакции и равновесие уже сильно нарушены. То же со способностью рассуждать и с памятью. В действительности вы не помните, сколько порций уже выпили. Ваши эмоции усиливаются. Некоторые люди становятся очень шумными и агрессивными.
1,3–1,5 промилле Отсутствует равновесие, зрение затуманено, возникают трудности с передвижением и с речью. Мышление, восприятие и способность к принятию решений сильно нарушены. Эйфория понемногу проходит и сменяется неприятными чувствами, такими как тревожность, беспокойство, гнев и подавленность.
Мышление, восприятие и способность к принятию решений сильно нарушены. Эйфория понемногу проходит и сменяется неприятными чувствами, такими как тревожность, беспокойство, гнев и подавленность.
1,6–1,9 промилле Вас наполняют сильные отрицательные эмоции, в результате вы можете стать агрессивным – и ненамеренно причинить вред себе или другим. На этой стадии могут образоваться т.н. провалы памяти – мозг больше не фиксирует происходящее. Моторные функции сильно нарушены.
более 2 промилле Вам не скрыть спутанности сознания, бестолковости и неспособности понимать происходящее. Вам нужна помощь, чтобы встать или ходить. Если вы нанесете себе травму, то скорее всего не осознаете этого, поскольку не чувствуете боли. Вас тошнит или рвет (у некоторых эти симптомы могут возникнуть раньше). Поскольку рвотный рефлекс нарушен, есть опасность захлебнуться собственной рвотой. На этой стадии часты провалы памяти, поэтому вы, очевидно, на следующее утро ничего не вспомните.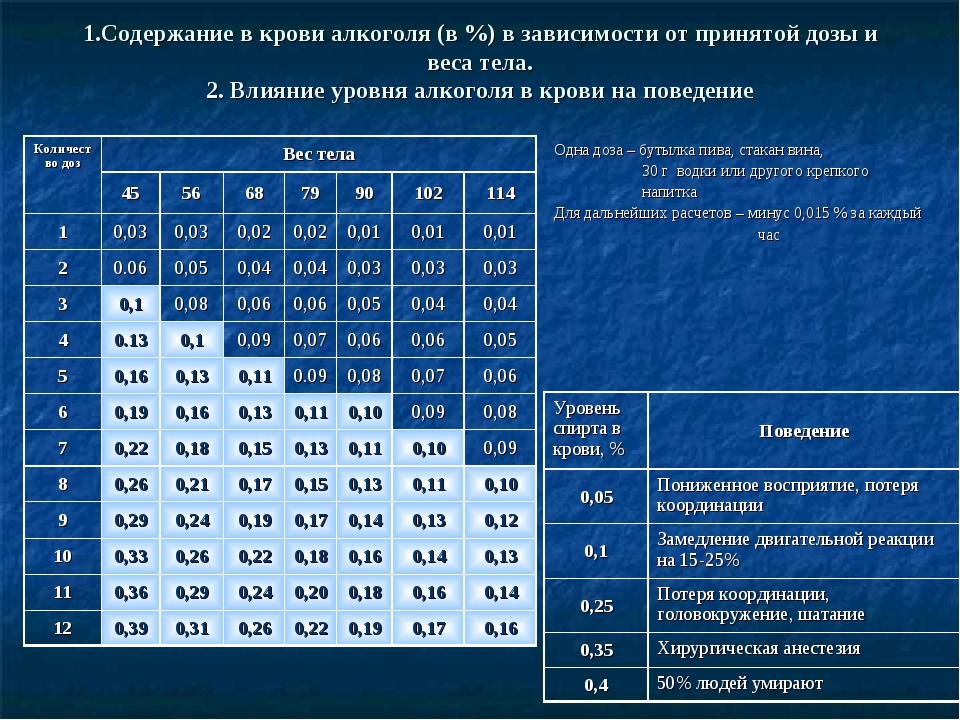
более 2,5 промилле
Сильно нарушены все психические и физические функции, в том числе восприятие. Наступает эмоциональная бесчувственность. Повышен риск захлебнуться собственной рвотой, упасть и нанести себе серьезную травму или стать жертвой другого несчастного случая.более 3 промилле Вы в полубессознательном состоянии. Вы не понимаете, где находитесь. Вы можете внезапно потерять сознание, вас трудно привести в чувство.
более 3,5 промилле Такая доза алкоголя действует как наркоз, используемый при операциях. Возможно, вы впадете в кому. Дыхание может стать прерывистым.
более 4 промилле Нарушается работа сердца и дыхание. Фактически, вы в коме или уже мертвы.
Время на вытрезвление
В среднем алкоголь выводится из организма человека со скоростью 0,1 промилле в час. Скорость процесса зависит от пола, массы тела, роста и того, сколько было съедено до приема алкоголя. Поэтому следующие таблицы, показывающие время отрезвления, являются информативными и не должны использоваться для расчета, когда можно будет сесть за руль.Проверяйте трезвость алкометром!
Женщина
Здоровая женщина весом 60 кг
| Количество выпитых алкогольных напитков | Приблизительное время, необходимое для полного вытрезвления |
| 1 бокал (0,125 л) вина (12%) | 0,36 промилле (красный 3, оранжевый 1) |
| 1 бутылка (0,33 л) сидра (4,5%) | 0,35 промилле (красный 3, оранжевый 1) |
| 2 бокала (0,3 л) игристого вина (7,5%) | 0,53 промилле (красный 5, оранжевый 1,5) |
| 2 стопки (0,08 л) водки (40%) | 0,77 промилле (красный 7, оранжевый 1,5) |
| 3 бутылки (0,5 л) пива (4,5%) | 1,6 промилле (красный 15, оранжевый 1,5) |
Мужчина
Здоровый мужчина весом 80 кг
| Количество выпитых алкогольных напитков | Приблизительное время, необходимое для полного вытрезвления |
| 1 бокал (0,125 л) вина (12%) | 0,22 промилле (красный 2, оранжевый 1) |
| 1 бутылка (0,5 л) пива (4,5%) | 0,32 промилле (красный 3, оранжевый 1) |
| 2 стопки (0,08 л) водки (40%) | 0,46 промилле (красный 4, оранжевый 1,5) |
| 4 стопки (0,16 л) ликера (35%) | 0,81 промилле (красный 8, оранжевый 1,5) |
| 5 бутылок (2 л) пива (4,5%) | 1,6 промилле (красный 16, оранжевый 2) |
(При калькуляции использована формула Видмарка)
Мифы об алкоголе и действительность
Можно ли ускорить процесс расщепления алкоголя?
95% алкоголя выводится из организма благодаря работе печени.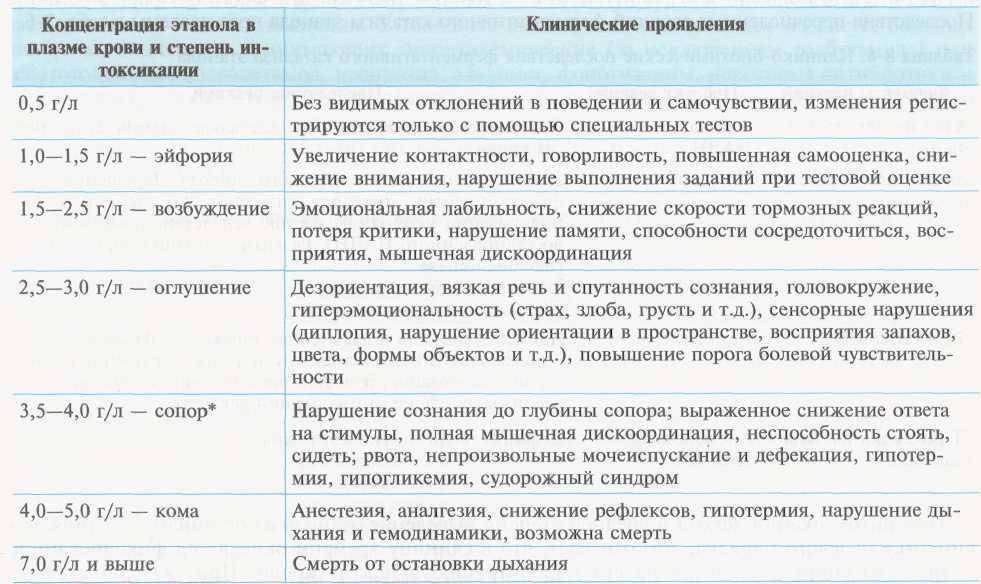 Небольшое количество выделяется с выдыхаемым воздухом, с мочой и через кожу. Единственный способ протрезветь – выждать время.
Небольшое количество выделяется с выдыхаемым воздухом, с мочой и через кожу. Единственный способ протрезветь – выждать время.
Как влияет на отрезвление сауна?
Поскольку менее 5% алкоголя покидает организм с потом и мочой, процесс сжигания алкоголя не ускоряет ни сауна, ни потение в жаркий летний день. Под действием алкоголя ускоряется частота сердцебиения, повышается потребление сердцем кислорода. Одной из причин ускорения сердечной деятельности является расширение кровеносных сосудов. Кровь приливает к коже, давление крови падает, и потому сердце начинает биться сильнее, чтобы снабжать кровью другие органы. Поэтому сауна и у здорового человека может вызвать опасные изменения кровообращения. В состоянии опьянения человек недостаточно хорошо переносит жар сауны и возникающую в ней потерю жидкости.
Как влияют на отрезвление кофе, энергетические напитки или холодный душ?
Содержащийся в кофе кофеин обладает стимулирующим действием, но в действительности лишь бодрит человека, а не снимает опьянение. Аналогично кофе действует и душ: процесс сжигания алкоголя происходит прежде всего в печени, и его скорость изменить невозможно. Совместное употребление алкоголя и энергетических напитков повышает вероятность алкогольного отравления. Оно также может вызвать обезвоживание, сопровождающееся диареей, тошнотой или рвотой, мышечными судорогами, усталостью и головной болью.
Аналогично кофе действует и душ: процесс сжигания алкоголя происходит прежде всего в печени, и его скорость изменить невозможно. Совместное употребление алкоголя и энергетических напитков повышает вероятность алкогольного отравления. Оно также может вызвать обезвоживание, сопровождающееся диареей, тошнотой или рвотой, мышечными судорогами, усталостью и головной болью.
Можно ли быстрее протрезветь за счет тренировки?
Все-таки нельзя. В результате физической нагрузки в мышцах скапливается молочная кислота, которая вызывает боль. Печень не может одновременно выводить алкоголь и молочную кислоту. Поэтому работоспособность мышц будет низкой, а концентрация молочной кислоты – выше нормы. Алкоголь опустошает в печени запасы гликогена, являющегося для организма источником энергии именно при физических нагрузках.
Алкоголь вызывает обезвоживание, снижает уровень энергии, лишает организм витаминов и минералов и понижает уровень тестостерона. Большая физическая нагрузка в состоянии опьянения скорее опасна для здоровья.
Можно ли опьянеть от кефира и конфет?
В кефире и некоторых конфетах в действительности содержится минимум алкоголя (1–2% от общей массы), но столь малое количество не вызывает алкогольного опьянения.
Смертельная доза водки | От чего умирают алкоголики
Безопасная и смертельная доза алкоголя
То, что алкоголь – это яд, знают многие, если не все. Но почему-то считают, что если употреблять его по праздникам или выходным, то ничего страшного не случится. А ведь беда может произойти с каждым. Например, человек может потерять над собой контроль и принять намного большую дозу этанола, чем может переработать его организм без вреда для здоровья. Кроме того, существует алкоголизм выходного дня, когда еженедельный прием спиртного по выходным, превращает человека в настоящего алкоголика. Что такое безопасная доза алкоголя и от каких факторов она зависит, а также при какой дозе этанола может наступить смертельный исход рассказывает психиатр-нарколог Владислав Сипович, Главный врач Медицинского многопрофильного центра «Гармония здоровья».
Какая доза этилового спирта считается безопасной и какому количеству разных алкогольных напитков она соответствует?
По рекомендациям ВОЗ безопасная доза потребления алкоголя определяется исходя из стандартной дозы («дринк»), равной 10 г чистого этилового спирта. Для разных спиртосодержащих напитков эта величина эквивалентна:
25-30 мл крепкого 40% алкоголя (водка, бренди, виски, коньяк и др.).
50-60 мл крепленых сладких вин, портвейна и иных напитков с концентрацией алкоголя 17-20 % объемных.
100 мл сухого вина крепостью 10-13 объемных %. Кстати, в бутылке вина на 0,7 л крепостью 12,5% содержится 7 дринков – самое то для недельной нормы женщинам.
200-250 мл светлого пива с содержанием алкоголя 4,5-5 объемных %.
Для здорового мужчины весом 80 кг безопасное количество алкоголя составляет 14-28 дринков в неделю, а для женщин допустимое потребление алкоголя в 2 раза меньше – 7-14 дринков. Причем действуют эти нормы при приеме алкоголя не больше 5 дней в неделю, т.е. должны быть 2 дня, абсолютно свободных от употребления спиртного в любом виде. Кроме того, безопасная доза алкоголя зависит от индивидуальных особенностей организма – пола, возраста, веса, генетики и национальности. Например, в Ирландии стандартная доза равняется 10 г, а в Великобритании – 8 г.
Причем действуют эти нормы при приеме алкоголя не больше 5 дней в неделю, т.е. должны быть 2 дня, абсолютно свободных от употребления спиртного в любом виде. Кроме того, безопасная доза алкоголя зависит от индивидуальных особенностей организма – пола, возраста, веса, генетики и национальности. Например, в Ирландии стандартная доза равняется 10 г, а в Великобритании – 8 г.
Согласно рекомендациям ВОЗ мужчина без вреда для здоровья может выпивать до 10 л чистого алкоголя в год, а женщины на треть меньше. Кстати, когда говорят о чистом алкоголе, это не означает, что можно пить чистый спирт. Подразумевается эквивалентное этой величине количество спиртных напитков, которое легко рассчитать по формуле, зная процентное содержание в них этилового спирта. Например, для водки крепостью 40% годовая допустимая величина будет составлять 10х100/40=25 литров, где:
10 – годовая доза чистого спирта в литрах;
100 – процент чистого алкоголя;
40 – крепость водки в %.

Подставляя в формулу вместо 40 % содержание алкоголя в конкретных спиртосодержащих напитках, получают их годовую норму.
Отечественные наркологи считают нормы ВОЗ слишком лояльными и фактически приводящими к развитию алкоголизма. Наши ученые считают, что рамки потребления чистого алкоголя в год ограничиваются 8 л при 3-4 трезвых днях в течение недели.
В Минздраве РФ дозой незначительного риска для здоровья считают 20–30 г чистого этанола (20 г – для женщин, 30 г – для мужчин). Это соответствует 200-300 мл вина крепостью 12% или 600-900 мл светлого 4,5% пива.
Смертельная доза алкоголя – это сколько?
Токсический эквивалент чистого алкоголя, приводящий к летальному исходу составляет 7-8 г на 1 кг массы тела. При весе 64 кг это составит 500 г чистого этанола. А смертельная доза водки крепостью 40 об. % в этом случае равняется 1200 мл. Так как большинство наших соотечественников предпочитают из всех алкогольных напитков именно водку, то я и акцентирую внимание именно на этой цифре. Кроме того, Россия относится к странам с «северным» типом употребления алкоголя, как и Украина, Беларусь, Прибалтика, когда спиртное принимают ударными дозами. При этом риск принятия смертельной дозы очень велик. Для стран «южного» типа приема алкогольных напитков (Италия, Франция, Испания, Греция) характерна регулярность их потребления, но в меньших количествах и не таких крепких. К примеру, бокал вина за обедом или ужином.
Кроме того, Россия относится к странам с «северным» типом употребления алкоголя, как и Украина, Беларусь, Прибалтика, когда спиртное принимают ударными дозами. При этом риск принятия смертельной дозы очень велик. Для стран «южного» типа приема алкогольных напитков (Италия, Франция, Испания, Греция) характерна регулярность их потребления, но в меньших количествах и не таких крепких. К примеру, бокал вина за обедом или ужином.
Смертельная концентрация алкоголя в крови составляет 4-6 промилле, что соответствует 400-450 г принятого чистого алкоголя или 1-1,25 л 40% водки, выпитой практически разом за короткий промежуток времени. Таким образом, полторы-две бутылки водки, принятые «на грудь» могут стать последними в жизни даже для абсолютно здорового человека. Летальный исход наступает в течение 20-40 часов после принятия смертельной дозы водки для человека и сопровождается понижением температуры тела на 3-4 градуса, алкогольной комой и быстрым развитием полиорганной недостаточности.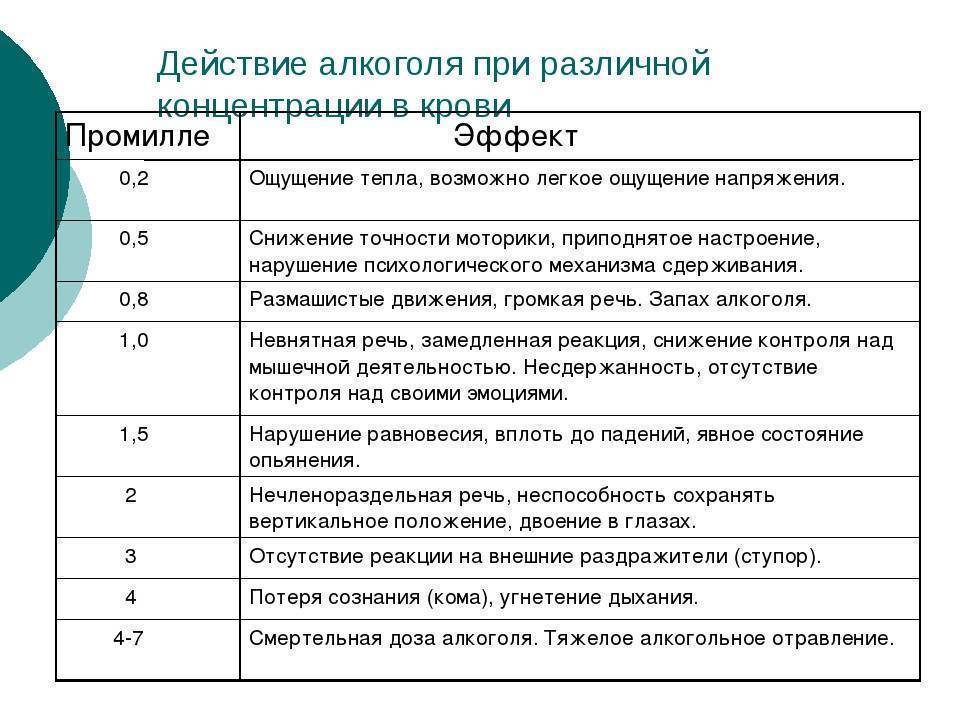
Смертельную дозу алкоголя в литрах легко рассчитать исходя из объемной концентрации чистого спирта в алкогольном напитке. Например, если взять крепленое вино с 20% содержанием алкоголя, то его смертельные 400 г будут содержаться в 2 л напитка, или в трех бутылках емкостью 0,7 л. Формула расчета очень проста 400х100/20 = 0,4/0,2=2, где 0,4 – смертельная доза чистого алкоголя в граммах, 0,2 – концентрация алкоголя в напитке, выраженная десятичной дробью, 2 – смертельная доза напитка в литрах. Данный расчет применим для всех видов спиртного. В формуле меняется только показатель концентрации алкоголя в конкретном напитке.
Конечно, никто не будет в компании занимается расчетами смертельной дозы выставленного на стол спиртного. Но нужно иметь хотя бы приблизительное представление об опасных дозах того или иного алкогольного напитка – водка максимум 1 л, крепленое вино и портвейн не более 2 литров. Что касается сухого вина или пива, то человек просто физически не сможет выпить столько литров, чтобы получить смертельное отравление алкоголем.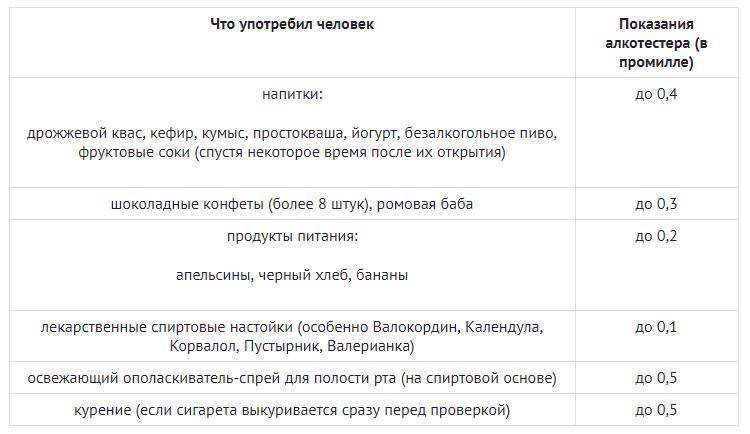 Но тяжелое похмелье при передозировке этих напитков гарантировано. Как избавиться от симптомов похмелья читайте в нашей статье.
Но тяжелое похмелье при передозировке этих напитков гарантировано. Как избавиться от симптомов похмелья читайте в нашей статье.
Кроме того, смертельное действие алкоголя зависит от возраста, пола и индивидуальных особенностей организма. Если выпитый литр водки для молодого здорового 20-летнего парня может ограничиться лишь тяжелым похмельем, то у 40-летнего мужчины он может вызвать смертельное отравление. У женщин меньшее, чем у мужчин, содержание алкогольных дегидрогеназ, участвующих в переработке этанола до конечных продуктов. Именно поэтому алкоголь и токсичные продукты его промежуточного распада дольше задерживаются в организме и вызывают более тяжелое отравление.
Что касается конкретного индивида, то существует большая градация переносимости больших доз спиртного. Для одного выпитая бутылка водки не приведет ни к каким особым последствиям, кроме похмелья, а для другого может оказаться смертельной. Довольно часто в компании одинаково выпивающих друзей находится тот, который пьянеет и отключается быстрее других. Попытки уложить его отсыпаться, иногда заканчиваются плачевно – человек впадает в алкогольную кому и оставленный без врачебной помощи погибает. Особенно это актуально для юношеских компаний, когда прием алкоголя в больших дозах является первым в жизни молодого человека испытанием.
Попытки уложить его отсыпаться, иногда заканчиваются плачевно – человек впадает в алкогольную кому и оставленный без врачебной помощи погибает. Особенно это актуально для юношеских компаний, когда прием алкоголя в больших дозах является первым в жизни молодого человека испытанием.
От чего умирают алкоголики?
На вопрос, от чего умирают алкоголики, можно ответить, что в основном от систематического отравления организма алкоголем. Не исключено и острое отравление смертельной дозой алкоголя или суррогатов, к которым относят этиленгликоль и метанол. Последние содержатся в антифризах, тормозной жидкости, растворителях. Для человека смертельная доза этиленгликоля составляет 100-150 мл, а метанола – всего 30 мл.
При алкоголизме страдают все органы и системы организма – центральная и вегетативная нервная система, сердце и сосуды, печень, кишечник, поджелудочная железа, почки, опорно-двигательный аппарат, кровь и др. Органами-мишенями, максимально страдающими от алкоголизма являются:
ЦНС, которая наиболее подвержена негативному действию алкоголя.
 При ее поражении наблюдается гибель нейронов, уменьшение объема головного мозга, нарушение деятельности жизненно важных нервных центров, заканчивающиеся их параличом и в конце концов гибелью больного.
При ее поражении наблюдается гибель нейронов, уменьшение объема головного мозга, нарушение деятельности жизненно важных нервных центров, заканчивающиеся их параличом и в конце концов гибелью больного.Печень, гепатоциты которой постепенно подвергаются жировому перерождению, приводящему к алкогольному стеатозу и циррозу печени. Метаболические и структурные изменения печеночной паренхимы приводят к тому, что она перестает выполнять свои функции и обезвреживать токсические вещества. В итоге происходит отравление организма продуктами собственного метаболизма и гибель организма в результате печеночной недостаточности.
Желудок и кишечник реагируют на раздражающее действие алкоголя воспалением слизистой, атрофией желез, появлением эрозий, язв, гибелью полезных микроорганизмов, ответственных не только за процессы пищеварения, но и за синтез витаминов группы В. Развивающийся авитаминоз приводит к снижению защитных сил организма и иммунитета, язвы желудка и 12-перстной кишки могут привести к профузному кровотечению и гибели человека.
Поджелудочная железа, выполняющая экзокринную и эндокринную функцию, на злоупотребление алкоголем может отвечать развитием ферментной и инсулиновой недостаточности, острым алкогольным панкреатитом и даже тотальным панкреонекрозом. Последний протекает в особо опасной молниеносной форме, когда ферменты поджелудочной железы буквально «съедают» ее за считанные часы. Больного иногда не успевают даже привезти в больницу. Летальность при алкогольном панкреонекрозе чрезвычайно высока.
Поражения сердечно-сосудистой системы при алкоголизме проявляются кардиомиопатиями и гипертензией. Известен такой термин, как «сердце алкоголика». При этом оно увеличивается в размерах за счет разрастающейся соединительной ткани, заменяющей его функциональные мышечные структуры. Это приводит к нарушению проводимости и возбудимости сердечной мышцы с возникновением аритмий, снижением сократительной способности миокарда. В конечном итоге на стадии декомпенсации развивается сердечная недостаточность, отеки всех органов и тканей, которые в конечном итоге приводят к смерти алкоголика.
Иммунная система также страдает при алкоголизме – уменьшается количество лимфоцитов (иммунокомпетентных клеток), блокируется фагоцитоз и выработка лизоцима в секретах, формируются стойкие очаги хронической инфекции (абсцессы, пневмонии, гепатиты). Кроме того, наблюдается извращенная иммунная реакция на клетки собственного организма. Например, у каждого второго алкоголика образуются аутоиммунные антитела на клетки печени, а у четверти зависимых – на клетки селезенки.
Как видите, систематическое злоупотребление спиртным приводит к функциональным и органическим поражениям жизненно-важных органов, рано или поздно заканчивающимся гибелью больного. Алкоголь также негативно влияет на репродуктивную систему как женщин так и мужчин. Алкоголизм сокращает жизнь человека на 15-20 лет. Причем на последних стадиях заболевания человек фактически уже мертв для общества. От него часто отворачиваются близкие и друзья, с жалостью или отвращением смотрят посторонние, вся его жизнь сосредотачивается на добыче очередной дозы спиртного и постоянного стресса.
На вопрос, как умирает алкоголик, можно ответить одной фразой – тяжело и в полном одиночестве. Большинство алкоголиков даже не попадают в больницы – они умирают от несчастных случаев на дороге, замерзают на лавочках или в сточных канавах, травятся суррогатами, становятся жертвами разгулявшихся компаний, устраивающих сафари на бомжей.
Избежать подобной участи можно двумя способами – не начинать пить и вовремя остановиться. Если первое зависит только от самого человека, то второе невозможно без профессиональной помощи психиатров-наркологов. Избавление от алкоголизма, особенно на 2-3 стадиях, процесс сложный и долговременный, требующий желания самого алкоголика излечиться от зависимости, поддержки его близких и естественно квалифицированной помощи специалистов.
В нашем центре «Гармония здоровья» есть все возможности для лечения разных видов и стадий алкоголизма:
опытные квалифицированные врачи, владеющие инновационными методиками;
современное оборудование для диагностики и инструментальных методов терапии;
индивидуальный подход к каждому конкретному пациенту.
Мы сможем оказать как экстренную медицинскую помощь, так и обеспечить полноценный реабилитационный процесс. Обратившись к нам, вы сможете обезопасить себя и своих близких, избежать преждевременной смерти и восстановить утраченное здоровье. Главное – не затягивайте с обращением, промедление в этом случае действительно смерти подобно. К тому же стоимость помощи демократичная, а спасаем мы самое ценное – жизнь.
Как не превысить 0,16 промилле
+ A —
С 1 сентября 2013 в силу вступит ФЗ №196 об изменениях в статье 28 Федерального закона «О безопасности дорожного движения»
Согласно новому документу, допускается 0,16 миллиграмма алкоголя на литр выдыхаемого воздуха. Сколько это «на пальцах», и как не переступить тонкую грань?
Говоря привычным языком, 0,16 мг алкоголя на 1 л выдыхаемого воздуха составляет примерно 0,3 промилле (0,3 г алкоголя на 1 л крови). Однако терять голову рано. Власти уточняют, что пить за рулём по-прежнему нельзя и указанная цифра была принята для того, чтобы защитить тех, у кого может быть обнаружен фоновый алкоголь от приёма лекарств, выпитого кваса или кефира, а также с учётом возможной погрешности алкотестеров.
Таким образом, не стоит заблуждаться, будто теперь можно немного выпить, проветриться и через пару часов снова сесть за руль. Придётся дождаться полного отрезвления, прежде чем управлять транспортным средством, причём надо помнить, что у одного и того же человека время переработки алкоголя может меняться под воздействием разных факторов, например, текущего состояния здоровья, пищи, принятой во время употребления спиртных напитков, бодрствования либо сна после парочки рюмок и т.д.
Например, за один час перерабатывается в среднем 7-10 г алкоголя. В итоге, 40 г этилового спирта, которые содержатся в 100 г водки «выветриваются» из организма здорового мужчины весом около 100 кг примерно за 3,5-4 часа с момента употребления напитка.Если после принятого мужчина не уснёт, а будет активен, то время сократится в среднем на 20%. В случае сна период отрезвления может затянуться, при этом отдых в прохладном помещении немного сократит его, а в душном и тёплом — увеличит. Как видите, грань очень зыбкая, и может не хватить буквально одного часа,чтобы прийти в себя, перед встречей с алкотестером.
В связи с этим врач психиатр-нарколог, к.м.н. А.П. Добровольский рекомендует тем, кто постоянно водит машину, но все же по каким-то причинам немного выпил, придерживаться следующих правил:
1. Обильно закусывать. Лучше всего употреблять пищу с большим содержанием жиров, которые уменьшают всасываемость алкоголя в кровь, соответственно, способствуют его скорейшему «выветриванию» из организма.
2. Не спать, бодрствовать. В активном состоянии ускоряется обмен веществ, что стимулирует работу печени и она быстрее перерабатывает алкоголь.
3. Принять энтеросорбент, например Энтеросгель. Буквально 3-4 ложки сорбента сразу после застолья впитывают в себя остатки алкоголя, а заодно и продукты распада этилового спирта, что спасает и печень, и ваш организм от похмелья. В любом случае, перед применением, проконсультируйтесь со специалистом и ознакомьтесь с инструкцией.
Помните, что эти простые правила могут повлиять на показатели алкотестера только в случае умеренного потребления алкоголя. При приёме большого количества спиртного протрезвление будет долгим и безрадостным.
Есть ещё одна новость, связанная с поправками к ФЗ. Теперь те водители, которых лишили прав за содержание алкоголя в выдохе менее 0,16 мг на литр воздуха до вступления в силу нового закона, могут вернуть их обратно. Для этого надо обратиться в суд с просьбой пересмотреть дело.
Наш алкотест: что значат «разрешенные» промилле? | 74.ru
Вот и складывается практика, при которой никто толком не знает, какая именно погрешность у прибора. Инспекторам удобнее считать, что она минимальная (основная), водителям – что она предельная, с учетом всех мыслимых поправок. Истина где-то посередине, но для ее поиска нужен компетентный эксперт, а нам, как понимаете, не до жиру – реформы кругом.
Собственно, этот порог – 0,16 мг/л – так и появился: как некая осредненная погрешность, выведенная «Росстандартом» на основе анализа «матчасти». Поэтому не надейтесь, что 0,16 мг/л разрешают принять сколько-то там граммов за рулем: лишний глоток и уже 0,17 мг/л.
Проблема даже сложнее. Вот как прокомментировал проблему практикующий автоюрист Лев Воропаев: «Во многих регионах ситуация очень жесткая, потому что судьи до сих пор при лишении «прав» существенное значение придают клиническим признакам опьянения, установленных врачом. Когда человека привозят на медосвидетельствование, первым делом врач заполняет акт, в котором указывается наличие или отсутствие стандартных признаков опьянения: нетвердость позы, запах изо рта, невозможность коснуться носа пальцем, покраснение роговиц глаз и т.д. При этом приказ №308 МЗ РФ был изменен, и де-факто клинические признаки опьянения вынесены за скобки: решение об установлении состояния опьянения может приниматься врачом только на основании измерений, а клинические признаки являются лишь поводом для более тщательных исследований. Но беда в том, что многие суды по-прежнему лишают водителей «прав», мотивируя это наличием клинических признаков, и в этом смысле показания прибора оказываются вторичными».
Фактически, с нулевым промилле нет никаких проблем, если подкрепить концепцию солидной метрологической и процессуальной базой, когда все звенья цепочки – инспекторы, медики, суды – в полной мере соблюдают процедуру измерения и учитывают нюансы. Коль скоро в России проблема профессионализма стоит не менее остро, чем пьянства за рулем, реализовать идею «полного нуля» оказалось невозможно, и власть включила заднюю.
Но все-таки остается вопрос – не перестаралась ли? Мы не можем завуалировать тот факт, что предложенный лимит не вполне коррелирует с широко разрекламированным полным запретом алкоголя за рулем, и хотя количество конфликтных ситуаций сократится, почти наверняка возрастет число водителей, рискнувших пройтись по бровке. А вместе с ними и количество новых конфликтных ситуаций из разряда: «Да у меня же всего 0,17, да это же почти норма…» А хуже того, возрастет число тех, кто не смог удержаться и пошел вразнос…
Страница не найдена – Avtogide – автомобильный журнал
Полезные советы
Доброго дня всем добрым людям. Сегодня статья расскажет, как выехать на автомобиле за границу
Автообзоры
Новая Ауди Ку 7 с двигателем 3.0 – это машина, которая имеет множество преимуществ
Автообзоры
В начале 2017 года, на автосалоне в Детройте был представлен предсерийный спортивный внедорожник Audi
Автообзоры
В 2003 году компания General Motors явила в Лос-Анжелесе новый компактный Хаммер h4 T,
Автообзоры
Первые Brilliance модели V5 появились в России в 2014 году, тогда компания предприняла отчаянную
Полезные советы
Без сцепления невозможно функционирование механической коробки передач автомобиля. Главная задача сцепления состоит в передаче
Промилле проверили на соответствие Конституции – Газета Коммерсантъ № 121 (4662) от 06.07.2011
Как стало известно «Ъ», Конституционный суд РФ признал легитимным введение по инициативе президента «сухого закона» для водителей в 2010 году. До этого в России существовал минимально допустимый уровень содержания алкоголя в крови и в выдыхаемом воздухе, как этого требует Венская конвенция о дорожном движении, ратифицированная Россией. Однако суд не увидел противоречия между конвенцией и российским «сухим законом», так как оба документа преследуют цель повысить безопасность дорожного движения.
В распоряжении «Ъ» оказалось определение Конституционного суда (КС) РФ N 736-O-O за подписью председателя суда Валерия Зорькина, в котором жителю Подмосковья Денису Асауляку отказано в рассмотрении жалобы на нарушение его прав законом N 169-ФЗ. В 2010 году этот документ ввел для водителей так называемый сухой закон, отменив норму о минимально допустимом уровне содержания алкоголя в крови и в выдыхаемом воздухе.
Напомним, что норма была введена в 2007 году, при этом ГИБДД, готовившая поправки к КоАПу, ссылалась на мировую практику. Еще в 1974 году СССР присоединился к Венской конвенции о дорожном движении 1968 года, которая гласит, что в национальном законодательстве стран должен быть предусмотрен допустимый уровень содержания алкоголя на литр крови и выдыхаемого воздуха (не более 0,5 г и 0,25 мг соответственно). При этом, когда норму ввели в России, в обществе сформировалось устойчивое мнение, что таким образом водителям разрешили выпить за рулем. На самом деле на Западе эта норма существует для того, чтобы учитывать так называемый эндогенный алкоголь, который вырабатывается в процессе жизнедеятельности человека (у некоторых людей он достигает 0,1-0,2 мг на литр выдыхаемого воздуха).
Однако в конце декабря 2009 года президент Дмитрий Медведев раскритиковал европейский опыт. «Мы пока не готовы к тому, чтобы разрешать употребление алкоголя за рулем даже в небольших, ограниченных количествах,— заявил он.— Это, к сожалению, провоцирует реальное пьянство, перед тем как человек садится за руль. Мы же знаем, как это обычно бывает. Сначала рюмку — вроде, можно теперь. Потом две, три… А потом — ладно, поехали».
Фото: Роман Яровицын, Коммерсантъ
По поручению главы государства были внесены поправки в КоАП, которые были оперативно подготовлены и приняты Госдумой. 4 августа 2010 года «сухой закон» вступил в силу, а норма содержания алкоголя, просуществовав три года, была отменена, несмотря на протесты водителей и правозащитников. Ажиотаж был вызван, в частности, слухами о том, что алкогольный «осадок» могут давать квас и кефир, а также некоторые спиртосодержащие лекарства (например, валидол или корвалол), однако в Минздравсоцразвития эту информацию опровергли. Тем не менее в блогах до сих регулярно появляются истории про лишение прав за «пьянку» после бутылки кваса.
Заложником президентского решения стал и Денис Асауляк, направивший жалобу в КС. При проведении медицинского освидетельствования зимой 2011 года выяснилось, что уровень содержания алкоголя в его крови составляет 0,058 мг, после чего судья лишил его прав. Почему в крови господина Асауляка обнаружили алкоголь, адвокат заявителя Лев Воропаев объяснить Ъ не смог. Денис Асауляк пожаловался, что, если бы в РФ применялись нормы конвенции, он не был бы наказан. При этом он ссылается на ст. 15 Конституции, которая гласит, что «международные договоры РФ являются составной частью ее правовой системы», а если ими «установлены иные правила, чем предусмотренные законом, то применяются правила международного договора».
Как рассказал «Ъ» Лев Воропаев, за последний год им было предпринято три попытки пожаловаться в КС, однако до сих пор в рассмотрении жалобы отказывали без каких-либо объяснений. На этот раз суд разъяснил свою позицию. В определении, в частности, подробно объясняется, что «сухой закон» был принят ради снижения смертности на дорогах. «Оспариваемые положения закона, отменяющие нормы, регламентирующие допустимый уровень содержания алкоголя, не могут рассматриваться как нарушающие конституционные права граждан,— сказано в документе.— Такому решению не препятствуют положения Европейского соглашения, дополняющего Конвенцию о дорожном движении, на которые ссылается заявитель, поскольку они направлены на повышение безопасности международного дорожного движения». Вопросы эндогенного алкоголя и европейской практики в определении судом не затронуты.
Фото: Сергей Воронин, Коммерсантъ
«Определение суда вполне логично и находится в русле всех наших подходов к вопросам пьянства за рулем,— заявил «Ъ» зампред комитета Госдумы по конституционному законодательству и госстроительству Александр Москалец, один из авторов «сухого закона».— Венская конвенция — это документ не для водителей, а для специалистов. И норму, о которой в ней говорится, должны устанавливать врачи, проводящие медосвидетельствование. Ни европейское, ни российское законодательство не разрешает употреблять спиртное за рулем».
«Фактически суд признал, что наше дорожное движение не является частью европейской системы и конвенцию применять в России не нужно,— считает адвокат Лев Воропаев.— Оговоренную Конституцией норму суд проигнорировал, приведя вялое и слабо мотивированное решение. Мы будем направлять жалобу в Страсбургский суд. Во всяком случае он уже признавал решения КС противоречащими различным конвенциям, на что мы и рассчитываем». Впрочем, в Госдуме на осень запланировано рассмотрение законопроекта, отменяющего обязанность российских судов пересматривать собственные решения в случаях, если Европейский суд признал их противоречащими нормам международных конвенций.
Иван Буранов
Дышите в трубочку! — Орск: Orsk.ru
С 1 июля сотрудники ГИБДД будут на месте устанавливать, пьян водитель или нет
Напрасно законодатели, разъясняя поправки в Кодекс об административных правонарушениях, взялись сравнивать, какому количеству выпитого будет соответствовать оговоренная в законе допустимая норма в крови алкоголя 0,3 промилле. Потому как русскому человеку наглядность – лучший друг. Сказали, что 0,3 промилле равно примерно рюмке водки или бокалу сухого вина – отчего ж не выпить!? И кто потом вспомнит, что норма прописана исключительно для того, чтобы учесть наличие в организме так называемого эндокринного алкоголя – результата употребляемых в пищу продуктов, провоцирующих при пищеварении процессы брожения. Сказали рюмку коньяку можно – наливай! Не привыкли мы вникать в самые тонкости. И оттого рискуем.Рискуем иметь неприятных разговор с инспектором, лишиться прав. Рискуем, в первую очередь, жизнью и здоровьем. Своим и окружающих. Ради сомнительного удовольствия пропустить грамм двести пива с приятелем перед тем, как сесть за руль и поехать по неотложным делам. Эта соблазнительная норма в 0,3 промилле, конечно, дестабилизирует и без того не совсем сознательное сознание российского автомобилиста. Зачем было что-то менять, оставили бы, как было – 0,0 – и никаких душевных метаний.
По словам разработчиков проекта и помогавших им специалистов Минздрава РФ, эта норма дает более точное определение, кто все-таки сел за руль подшофе, а кто просто переборщил, к примеру, с квасом. Российские суды за последние годы рассмотрели тысячи исков, в которых стороны судились за одну или две десятые промилле. Водитель утверждал, что виноградом в саду увлекся, а инспектор кивал на изменившую цвет «трубочку». И предугадать, на чьей стороне окажется в итоге переменчивая Фемида, было невозможно. Теперь судьям дали четкий критерий, определивший границу между кефиром и пивом. Любопытные результаты исследований приводит на своем сайте Юрий Гейко, обозреватель программы «Автоликбез» на Авторадио: – Норма 0,3 промилле не допускает употребления алкоголя вообще! Испытано в Институте наркологии и проверено на алкотестерах отечественного и импортного производства: бутылка пива, 40 грамм водки или бокал сухого белого вина, выпитые мужчиной комплекции около 80 килограмм, дают 0,5 промилле и выветриваются до 0,3 промилле как минимум за 60-70 минут. А 0,3 промилле – это максимум глоток пива.
Кроме того, сотрудникам ГИБДД вновь вернули право проводить освидетельствование водителя прямо на месте. Для этого требуется только сертифицированный алкотестер и двое понятых. Дальше процедура известная. Если прибор ничего не показал – счастливого пути. Появилась реакция – проедемте до ближайшего наркодиспансера. Водитель по-прежнему сам вправе настаивать на прохождении освидетельствования в медицинском учреждении, особенно, если показания прибора по каким-то причинам вызывают у него сомнения. Так что вопрос «пить или не пить?» по-прежнему имеет однозначный ответ – нет. И это не обсуждается. Однако лишь 0,3 промилле нововведения, вступающие в силу с 1 июля текущего года, не ограничиваются. В частности, на дорогах начнут действовать приборы фото- и видеофиксаций нарушений. Эти приборы будут фиксировать нарушения в автоматическом режиме, и на основе их показаний владельцам транспортных средств будут отправляться штрафы. А чтобы система видеофиксации работала полноценно, законодатели серьезно поправили статью о презумпции невиновности. В ней появились исключения.
Теперь, если автомобилем управлял кто-то по доверенности, а не хозяин авто, именно хозяину, получившему по почте квитанцию о штрафе, придется доказывать, что не он управлял машиной в момент нарушения правил. Чуть легче станет любителям припарковать машину в неположенном месте. Эвакуация и первые сутки хранения теперь будут бесплатны. Запрещена эксплуатация незастрахованного по ОСАГО транспорта. В случае нарушения будут сниматься регистрационные знаки. Эта же мера будет применяться к владельцам тех автомобилей, у которых превышен выброс загрязняющих веществ или уровень шума.
Сергей Листровой
Модуль комментирования материалов сайтов hypercomments.com не является частью сайта Orsk.Ru, а является сторонним сервисом. Мнение редакции может не совпадать с мнением комментаторов.
3.4 Прочие единицы измерения концентраций растворов — химия
Цели обучения
К концу этого раздела вы сможете:
- Определите единицы концентрации: массовый процент, объемный процент, массово-объемный процент, доли на миллион (ppm) и доли на миллиард (ppb)
- Выполнение вычислений, связанных с концентрацией раствора и объемами и / или массами его компонентов
В предыдущем разделе мы ввели молярность, очень полезную единицу измерения для оценки концентрации растворов.Однако молярность — это только одна мера концентрации. В этом разделе мы познакомимся с некоторыми другими единицами концентрации, которые обычно используются в различных приложениях, либо для удобства, либо по соглашению.
Ранее в этой главе мы ввели процентный состав как меру относительного количества данного элемента в соединении. Проценты также обычно используются для выражения состава смесей, включая растворы. Массовый процент компонента раствора определяется как отношение массы компонента к массе раствора, выраженное в процентах:
[латекс] \ text {массовый процент} = \ frac {\ text {масса компонента}} {\ text {масса раствора}} \ times 100 \% [/ latex]
Обычно нас больше всего интересует массовый процент растворенных веществ, но также возможно вычислить массовый процент растворителя.
Массовый процент также упоминается схожими названиями, такими как массовых процента, массовых процентов, массовых процентов и других вариаций на эту тему. Наиболее распространенный символ массового процента — это просто знак процента,%, хотя часто используются более подробные символы, включая% массы,% веса и (вес / вес)%. Использование этих более подробных символов может предотвратить смешение массовых процентов с другими типами процентов, такими как объемные проценты (которые будут обсуждаться позже в этом разделе).
Массовые проценты — популярные единицы концентрации для потребительских товаров. На этикетке типичного флакона с жидким отбеливателем (рис. 1) указано, что концентрация его активного ингредиента, гипохлорита натрия (NaOCl), составляет 7,4%. Таким образом, образец отбеливателя весом 100,0 г будет содержать 7,4 г NaOCl.
Рисунок 1. Жидкий отбеливатель — это водный раствор гипохлорита натрия (NaOCl). Эта марка имеет концентрацию NaOCl 7,4% по массе.Пример 1
Расчет массовых процентов
A 5.Образец спинномозговой жидкости 0 г содержит 3,75 мг (0,00375 г) глюкозы. Каков процент глюкозы в спинномозговой жидкости по массе?
Раствор
Образец спинномозговой жидкости содержит примерно 4 мг глюкозы в 5000 мг жидкости, поэтому массовая доля глюкозы должна быть немного меньше одной части на 1000, или около 0,1%. Подставляя данные массы в уравнение, определяющее массовые проценты, получаем:
[латекс] \% \; \ text {глюкоза} = \ frac {3,75 \; \ text {мг глюкозы} \ times \ frac {1 \; \ text {g}} {1000 \; \ text {мг}} } {5.0 \; \ text {спинномозговая жидкость}} = 0,075 \% [/ latex]
Рассчитанный массовый процент согласуется с нашей приблизительной оценкой (немного меньше 0,1%).
Обратите внимание, что хотя любая единица массы может использоваться для вычисления массового процента (мг, г, кг, унция и т. Д.), Одна и та же единица должна использоваться как для растворенного вещества, так и для раствора, чтобы единицы массы отменяли, давая безразмерное соотношение. В этом случае мы преобразовали единицы растворенного вещества в числителе из мг в г, чтобы они соответствовали единицам в знаменателе.С таким же успехом мы могли бы вместо этого преобразовать знаменатель с г в мг. Если для растворенного вещества и раствора используются одинаковые единицы массы, вычисленный массовый процент будет правильным.
Проверьте свои знания
Флакон средства для чистки плитки содержит 135 г HCl и 775 г воды. Какой процент по массе HCl в этом очищающем средстве?
Пример 2
Расчеты с использованием массового процента
«Концентрированная» соляная кислота — это водный раствор 37.2% HCl, который обычно используется в качестве лабораторного реактива. Плотность этого раствора 1,19 г / мл. Какая масса HCl содержится в 0,500 л этого раствора?
Раствор
Концентрация HCl составляет около 40%, поэтому порция этого раствора в 100 г будет содержать около 40 г HCl. Поскольку плотность раствора не сильно отличается от плотности воды (1 г / мл), разумная оценка массы HCl в 500 г (0,5 л) раствора примерно в пять раз больше, чем в 100 г порции, или 5 × × 40 = 200 г.Чтобы получить массу растворенного вещества в растворе из его массового процента, нам необходимо знать соответствующую массу раствора. Используя заданную плотность раствора, мы можем преобразовать объем раствора в массу, а затем использовать данный массовый процент для расчета массы растворенного вещества. Этот математический подход представлен на этой блок-схеме:
Для правильной отмены единицы объем 0,500 л преобразуется в 500 мл, а массовый процент выражается как отношение, 37,2 г HCl / г раствора:
[латекс] 500 \; \ text {мл раствор} \; (\ frac {1.19 \; \ text {g solution}} {\ text {mL solution}}) (\ frac {37.2 \; \ text {g HCl}} {100 \; \ text {g solution}}) = 221 \; \ текст {g HCl} [/ latex]
Эта масса HCl соответствует нашей приблизительной оценке примерно в 200 г.
Проверьте свои знания
Какой объем концентрированного раствора HCl содержит 125 г HCl?
Объемы жидкости в широком диапазоне величин удобно измерять с помощью обычного и относительно недорогого лабораторного оборудования. Концентрация раствора, образованного растворением жидкого вещества в жидком растворителе, поэтому часто выражается как объемных процентов , об.% Или (об. / Об.)%:
[латекс] \ text {объемный процент} = \ frac {\ text {объем растворенного вещества}} {\ text {объем раствор}} \ times 100 \% [/ latex]
Пример 3
Расчеты с использованием объемного процента
Медицинский спирт (изопропанол) обычно продается в виде 70% -ного водного раствора.Если плотность изопропилового спирта составляет 0,785 г / мл, сколько граммов изопропилового спирта содержится в 355-миллилитровой бутылке медицинского спирта?
Раствор
Согласно определению процентного объема, объем изопропанола составляет 70% от общего объема раствора. Умножение объема изопропанола на его плотность дает требуемую массу:
[латекс] (335 \; \ text {мл раствора}) (\ frac {70 \; \ text {изопропиловый спирт}} {100 \; \ text {мл раствора}}) (\ frac {0.785 \; \ text {g изопропиловый спирт}} {1 \; \ text {мл изопропиловый спирт}}) = 195 \; \ text {g изопропиловый спирт} [/ латекс]
Проверьте свои знания
Вино по объему содержит примерно 12% этанола (CH 3 CH 2 OH).Этанол имеет молярную массу 46,06 г / моль и плотность 0,789 г / мл. Сколько молей этанола содержится в бутылке вина объемом 750 мл?
«Смешанные» процентные единицы, полученные из массы растворенного вещества и объема раствора, популярны для определенных биохимических и медицинских применений. массово-объемный процент — это отношение массы растворенного вещества к объему раствора, выраженное в процентах. Конкретные единицы, используемые для массы растворенного вещества и объема раствора, могут варьироваться в зависимости от раствора.Например, физиологический солевой раствор, используемый для приготовления внутривенных жидкостей, имеет концентрацию 0,9% по массе / объему (м / об), что указывает на то, что состав составляет 0,9 г растворенного вещества на 100 мл раствора. Концентрация глюкозы в крови (обычно называемая «сахар в крови») также обычно выражается в единицах отношения массы к объему. Хотя не выражается явно в процентах, его концентрация обычно указывается в миллиграммах глюкозы на децилитр (100 мл) крови (рис. 2).
Рисунок 2. «Смешанные» единицы массы-объема обычно встречаются в медицинских учреждениях. (а) Концентрация NaCl в физиологическом растворе составляет 0,9% (м / об). (b) Это устройство измеряет уровень глюкозы в образце крови. Нормальный диапазон концентрации глюкозы в крови (натощак) составляет около 70–100 мг / дл. (Фото а: модификация работы «Национальной гвардии» / Flickr; кредит б: модификация работы Бисварупа Гангули)Очень низкие концентрации растворенных веществ часто выражаются с использованием подходящих малых единиц, таких как частей на миллион (ppm) или частей на миллиард (ppb) .9 \; \ text {ppm} [/ latex]
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы. Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 3).
Рис. 3. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде. (кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia Commons)Пример 4
Расчет частей на миллион и частей на миллиард концентраций
Согласно EPA, когда концентрация свинца в водопроводной воде достигает 15 частей на миллиард, необходимо предпринять определенные корректирующие действия. 9 \; \ text {ppb}} [/ latex]
[латекс] \ text {масса solute} = \ frac {15 \; \ text {ppb} \; \ times \; 300 \; \ text {mL} \ times \ frac {1.{-6} \; \ text {g}} = 4.5 \ mu \ text {g} [/ latex]
Проверьте свои знания
Было установлено, что образец промышленных сточных вод весом 50,0 г содержит 0,48 мг ртути. Выразите концентрацию ртути в сточных водах в единицах ppm и ppb.
Ответ:
9,6 частей на миллион, 9600 частей на миллиард
Помимо молярности, в различных приложениях используется ряд других единиц измерения концентрации раствора. Процентные концентрации, основанные на массе компонентов раствора, объемах или обоих, полезны для выражения относительно высоких концентраций, тогда как более низкие концентрации удобно выражать с использованием единиц ppm или ppb.9 \; \ text {ppb} [/ latex]
Химия: упражнения в конце главы
- Обдумайте вопрос: Какая масса концентрированного раствора азотной кислоты (68,0% HNO 3 по массе) необходима для приготовления 400,0 г 10,0% раствора HNO 3 по массе?
(a) Опишите шаги, необходимые для ответа на вопрос.
(b) Ответьте на вопрос.
- Какая масса 4,00% раствора NaOH по массе содержит 15,0 г NaOH?
- Какая масса твердого NaOH (97.0% NaOH по массе) требуется для приготовления 1,00 л 10,0% раствора NaOH по массе? Плотность 10,0% раствора составляет 1,109 г / мл.
- Какая масса HCl содержится в 45,0 мл водного раствора HCl, который имеет плотность 1,19 г · см –3 и содержит 37,21% HCl по массе?
- Жесткость воды (количество жесткости) обычно выражается в частях на миллион (по массе) CaCO 3 , что эквивалентно миллиграмму CaCO 3 на литр воды.Какова молярная концентрация ионов Ca 2+ в пробе воды с показателем жесткости 175 мг CaCO 3 / л?
- Предполагалось, что уровень ртути в потоке превышает минимально безопасный уровень (1 часть на миллиард по весу). Анализ показал, что концентрация составляла 0,68 частей на миллиард. Примите плотность 1,0 г / мл и рассчитайте молярность ртути в потоке.
- В Канаде и Великобритании устройства, измеряющие уровень глюкозы в крови, выдают показания в миллимолях на литр.Если наблюдается размер 5,3 м M , какова концентрация глюкозы (C 6 H 12 O 6 ) в мг / дл?
- Горловой спрей содержит 1,40 мас.% Фенола, C 6 H 5 OH, в воде. Если раствор имеет плотность 0,9956 г / мл, рассчитайте молярность раствора.
- Йодид меди (I) (CuI) часто добавляют в поваренную соль в качестве диетического источника йода. Сколько молей CuI содержится в 1 фунте (454 г) поваренной соли, содержащей 0.0100% CuI по массе?
- Сироп от кашля содержит 5,0% этилового спирта, C 2 H 5 OH, по массе. Если плотность раствора составляет 0,9928 г / мл, определите молярность спирта в сиропе от кашля.
- D5W — раствор, используемый в качестве жидкости для внутривенного введения. Это 5,0% -ный по массе раствор декстрозы (C 6 H 12 O 6 ) в воде. Если плотность D5W составляет 1,029 г / мл, рассчитайте молярность декстрозы в растворе.
- Найдите молярность числа 40.0% по массе водный раствор серной кислоты, H 2 SO 4 , плотность которого составляет 1,3057 г / мл.
Глоссарий
- массовая доля
- отношение массы растворенного вещества к массе раствора, выраженное в процентах
- массово-объемные проценты
- Отношение массы растворенного вещества к объему раствора, выраженное в процентах
- частей на миллиард (ppb)
- отношение массы растворенного вещества к массе раствора, умноженное на 10 9
- частей на миллион (ppm)
- отношение массы растворенного вещества к массе раствора, умноженное на 10 6
- объем в процентах
- отношение объема растворенного вещества к объему раствора, выраженное в процентах
Решения
Ответы на упражнения в конце главы по химии
1.(a) Можно использовать уравнение разбавления, соответствующим образом измененное для учета единиц концентрации на основе массы: [латекс] \% \ text {масса} _1 \ times \; \ text {масса} _1 = \% \ text {масса} _2 \ times \; \ text {mass} _2 [/ латекс]
Это уравнение можно переформулировать, чтобы выделить массу 1 и указанные величины подставить в это уравнение.
(б) 58,8 г
3. 114 г
5. 1,75 × 10 −3 M
7. 95 мг / дл
9. 2.38 × 10 −4 моль
11.0,29 моль
Другие единицы для концентраций растворов
Результаты обучения
- Определите единицы концентрации: массовый процент, объемный процент, массово-объемный процент, доли на миллион (ppm) и доли на миллиард (ppb)
- Выполнение вычислений, связанных с концентрацией раствора и объемами и / или массами его компонентов
В предыдущем разделе мы ввели молярность, очень полезную единицу измерения для оценки концентрации растворов.Однако молярность — это только одна мера концентрации. В этом разделе мы познакомимся с некоторыми другими единицами концентрации, которые обычно используются в различных приложениях, либо для удобства, либо по соглашению.
Массовый процент
Ранее мы узнали о процентном составе как мере относительного количества данного элемента в соединении. Проценты также обычно используются для выражения состава смесей, включая растворы. Массовый процент компонента раствора определяется как отношение массы компонента к массе раствора, выраженное в процентах:
[латекс] \ text {массовый процент} = \ dfrac {\ text {масса компонента}} {\ text {масса раствора}} \ times 100 \% [/ latex]
Обычно нас больше всего интересует массовый процент растворенных веществ, но также возможно вычислить массовый процент растворителя.
Массовый процент также упоминается схожими названиями, такими как массовых процента, массовых процентов, массовых процентов и других вариаций на эту тему. Наиболее распространенный символ массового процента — это просто знак процента,%, хотя часто используются более подробные символы, включая% массы,% веса и (вес / вес)%. Использование этих более подробных символов может предотвратить смешение массовых процентов с другими типами процентов, такими как объемные проценты (которые будут обсуждаться позже в этом разделе).
Массовые проценты — популярные единицы концентрации для потребительских товаров. На этикетке типичного флакона с жидким отбеливателем (рис. 1) указано, что концентрация его активного ингредиента, гипохлорита натрия (NaOCl), составляет 7,4%. Таким образом, образец отбеливателя весом 100,0 г будет содержать 7,4 г NaOCl.
Рис. 1. Жидкий отбеливатель — это водный раствор гипохлорита натрия (NaOCl). Эта марка имеет концентрацию NaOCl 7,4% по массе.
Пример 1:
Расчет массовых процентовА 5.Образец спинномозговой жидкости 0 г содержит 3,75 мг (0,00375 г) глюкозы. Каков процент глюкозы в спинномозговой жидкости по массе?
Показать решениеОбразец спинномозговой жидкости содержит примерно 4 мг глюкозы в 5000 мг жидкости, поэтому массовая доля глюкозы должна быть немного меньше одной части из 1000, или около 0,1%. Подставляя данные массы в уравнение, определяющее массовые проценты, получаем:
[латекс] \% \ text {глюкоза} = \ dfrac {3,75 \ text {мг глюкозы} \ times \ frac {1 \ text {g}} {1000 \ text {mg}}} {5.0 \ text {g спинномозговой жидкости}} = 0,075 \% [/ latex]
Рассчитанный массовый процент согласуется с нашей приблизительной оценкой (немного меньше 0,1%).
Обратите внимание, что хотя любая единица массы может использоваться для вычисления массового процента (мг, г, кг, унция и т. Д.), Одна и та же единица должна использоваться как для растворенного вещества, так и для раствора, чтобы единицы массы отменяли, давая безразмерное соотношение. В этом случае мы преобразовали единицы растворенного вещества в числителе из мг в г, чтобы они соответствовали единицам в знаменателе. С таким же успехом мы могли бы вместо этого преобразовать знаменатель с г в мг.Если для растворенного вещества и раствора используются одинаковые единицы массы, вычисленный массовый процент будет правильным.
Проверьте свои знанияФлакон средства для чистки плитки содержит 135 г HCl и 775 г воды. Какой процент по массе HCl в этом очищающем средстве?
Пример 2:
Расчеты с использованием массового процента«Концентрированная» соляная кислота — это водный раствор 37,2% HCl, который обычно используется в качестве лабораторного реагента.Плотность этого раствора 1,19 г / мл. Какая масса HCl содержится в 0,500 л этого раствора?
Показать решениеКонцентрация HCl составляет около 40%, поэтому порция этого раствора в 100 г будет содержать около 40 г HCl. Поскольку плотность раствора не сильно отличается от плотности воды (1 г / мл), разумная оценка массы HCl в 500 г (0,5 л) раствора примерно в пять раз больше, чем в 100 г порции, или [латекс] 5 \ times 40 = 200 \ text {g.} [/ latex] Чтобы вывести массу растворенного вещества в растворе из его массового процента, нам нужно знать соответствующую массу раствора.Используя заданную плотность раствора, мы можем преобразовать объем раствора в массу, а затем использовать данный массовый процент для расчета массы растворенного вещества. Этот математический подход представлен на блок-схеме ниже:
Для правильной отмены единицы объем 0,500 л преобразуется в 500 мл, а массовый процент выражается как отношение, 37,2 г HCl / г раствора:
[латекс] \ text {500 мл раствора} \ left (\ dfrac {1.19 \ text {g solution}} {\ text {mL solution}} \ right) \ left (\ dfrac {37.2 \ text {g HCl}} {100 \ text {g solution}} \ right) = 221 \ text {g HCl} [/ latex]
Эта масса HCl соответствует нашей приблизительной оценке примерно в 200 г.
Проверьте свои знанияВ каком объеме концентрированного раствора HCl содержится 125 г HCl?
Объем в процентах
Объемы жидкости в широком диапазоне величин удобно измерять с помощью обычного и относительно недорогого лабораторного оборудования. Концентрация раствора, образованного растворением жидкого вещества в жидком растворителе, поэтому часто выражается как объемных процентов , об.% Или (об. / Об.)%:
[латекс] \ text {объемный процент} = \ dfrac {\ text {объем растворенного вещества}} {\ text {объемный раствор}} \ times 100 \% [/ latex]
Пример 3:
Расчеты с использованием процентного содержания объемаМедицинский спирт (изопропанол) обычно продается в виде 70% -ного водного раствора.Если плотность изопропилового спирта составляет 0,785 г / мл, сколько граммов изопропилового спирта содержится в 355-миллилитровой бутылке медицинского спирта?
Показать решениеСогласно определению процентного объема, объем изопропанола составляет 70% от общего объема раствора. Умножение объема изопропанола на его плотность дает требуемую массу:
.[латекс] \ left (355 \ text {мл раствора} \ right) \ left (\ dfrac {70 \ text {мл изопропилового спирта}} {100 \ text {мл раствора}} \ right) \ left (\ dfrac { 0,785 \ text {г изопропилового спирта}} {1 \ text {мл изопропилового спирта}} \ right) = 195 \ text {г изопропилового спирта} [/ латекс]
Проверьте свои знанияВино содержит приблизительно 12% этанола (CH 3 CH 2 OH) по объему.Этанол имеет молярную массу 46,06 г / моль и плотность 0,789 г / мл. Сколько молей этанола содержится в бутылке вина объемом 750 мл?
Показать решение1,5 моль этанола
Вы можете просмотреть стенограмму «Массовый процент и объемный процент — практические задачи химического состава раствора» здесь (открывается в новом окне).
Массовый объем в процентах
«Смешанные» процентные единицы, полученные из массы растворенного вещества и объема раствора, популярны для определенных биохимических и медицинских применений. массово-объемный процент — это отношение массы растворенного вещества к объему раствора, выраженное в процентах. Конкретные единицы, используемые для массы растворенного вещества и объема раствора, могут варьироваться в зависимости от раствора. Например, физиологический солевой раствор, используемый для приготовления внутривенных жидкостей, имеет концентрацию 0,9% по массе / объему (м / об), что указывает на то, что состав составляет 0,9 г растворенного вещества на 100 мл раствора. Концентрация глюкозы в крови (обычно называемая «сахар в крови») также обычно выражается в виде отношения массы к объему.Хотя его концентрация не выражается явно в процентах, его концентрация обычно выражается в миллиграммах глюкозы на децилитр (100 мл) крови (рис. 2).
Рис. 2. «Смешанные» единицы массы-объема обычно встречаются в медицинских учреждениях. (а) Концентрация NaCl в физиологическом растворе составляет 0,9% (м / об). (b) Это устройство измеряет уровень глюкозы в образце крови. Нормальный диапазон концентрации глюкозы в крови (натощак) составляет около 70–100 мг / дл. (Фото а: модификация работы «Национальной гвардии» / Flickr; кредит б: модификация работы Бисварупа Гангули)
частей на миллион и частей на миллиард
Очень низкие концентрации растворенных веществ часто выражаются с использованием подходящих малых единиц, таких как частей на миллион (ppm) или частей на миллиард (ppb) .{9} \ text {ppb} [/ latex]
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей обычно очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы. Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 3).
Рис. 3. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде. (кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia Commons)
Вы можете просмотреть стенограмму для «Частей на миллион (ppm) и частей на миллиард (ppb) — Концентрация раствора» здесь (открывается в новом окне).
Пример 4:
Расчет частей на миллион и частей на миллиард концентрацийСогласно EPA, когда концентрация свинца в водопроводной воде достигает 15 частей на миллиард, необходимо принять определенные меры по исправлению положения. Что это за концентрация в промилле? Какая масса свинца (мкг) при такой концентрации содержится в типичном стакане воды (300 мл)?
Показать решениеОпределения единиц ppm и ppb могут использоваться для преобразования данной концентрации из частей на миллиард в ppm.{3} \ text {ppb}} = 0,015 \ text {ppm} [/ latex]
Определение единицы ppb может использоваться для расчета запрошенной массы, если указана масса раствора. Однако указан только объем раствора (300 мл), поэтому мы должны использовать плотность, чтобы получить соответствующую массу. Мы можем предположить, что плотность водопроводной воды примерно такая же, как у чистой воды (~ 1,00 г / мл), поскольку концентрации любых растворенных веществ не должны быть очень большими. {9} \ text {ppb}} \ end {array} [ / латекс]
[латекс] \ text {масса растворенного вещества} = \ dfrac {15 \ text {ppb} \ times 300 \ text {mL} \ times \ frac {1.{-6} \ text {g}} = 4.5 \ mu \ text {g} [/ latex]
Проверьте свои знанияОбразец промышленных сточных вод массой 50,0 г содержит 0,48 мг ртути. Выразите концентрацию ртути в сточных водах в единицах ppm и ppb.
Показать решение9,6 частей на миллион, 9600 частей на миллиард
Ключевые концепции и резюме
Помимо молярности, в различных приложениях используется ряд других единиц измерения концентрации раствора. Процентные концентрации, основанные на массе компонентов раствора, объемах или обоих, полезны для выражения относительно высоких концентраций, тогда как более низкие концентрации удобно выражать с использованием единиц ppm или ppb.{9} \ text {ppb} [/ latex]
Попробуйте
- Обдумайте вопрос: Какая масса концентрированного раствора азотной кислоты (68,0% HNO 3 по массе) необходима для приготовления 400,0 г 10,0% раствора HNO 3 по массе?
- Обрисуйте шаги, необходимые для ответа на вопрос.
- Ответьте на вопрос.
- Какая масса 4,00% раствора NaOH по массе содержит 15,0 г NaOH?
- Какая масса твердого NaOH (97.0% NaOH по массе) требуется для приготовления 1,00 л 10,0% раствора NaOH по массе? Плотность 10,0% раствора составляет 1,109 г / мл.
- Какая масса HCl содержится в 45,0 мл водного раствора HCl, который имеет плотность 1,19 г · см –3 и содержит 37,21% HCl по массе?
- Жесткость воды (количество жесткости) обычно выражается в частях на миллион (по массе) CaCO 3 , что эквивалентно миллиграмму CaCO 3 на литр воды.Какова молярная концентрация ионов Ca 2+ в пробе воды с показателем жесткости 175 мг CaCO 3 / л?
- Предполагалось, что уровень ртути в потоке превышает минимально безопасный уровень (1 часть на миллиард по весу). Анализ показал, что концентрация составляла 0,68 частей на миллиард. Примите плотность 1,0 г / мл и рассчитайте молярность ртути в потоке.
- В Канаде и Великобритании устройства, измеряющие уровень глюкозы в крови, выдают показания в миллимолях на литр.Если наблюдается размер 5,3 м M , какова концентрация глюкозы (C 6 H 12 O 6 ) в мг / дл?
- Горловой спрей содержит 1,40 мас.% Фенола, C 6 H 5 OH, в воде. Если раствор имеет плотность 0,9956 г / мл, рассчитайте молярность раствора.
- Йодид меди (I) (CuI) часто добавляют в поваренную соль в качестве диетического источника йода. Сколько молей CuI содержится в 1 фунте (454 г) поваренной соли, содержащей 0.0100% CuI по массе?
- Сироп от кашля содержит 5,0% этилового спирта, C 2 H 5 OH, по массе. Если плотность раствора составляет 0,9928 г / мл, определите молярность спирта в сиропе от кашля.
- D5W — раствор, используемый в качестве жидкости для внутривенного введения. Это 5,0% -ный по массе раствор декстрозы (C 6 H 12 O 6 ) в воде. Если плотность D5W составляет 1,029 г / мл, рассчитайте молярность декстрозы в растворе.
- Найдите молярность числа 40.0% по массе водный раствор серной кислоты, H 2 SO 4 , плотность которого составляет 1,3057 г / мл.
1. Ответы следующие:
- Можно использовать уравнение разбавления, соответствующим образом измененное с учетом единиц концентрации на основе массы:
[латекс] \% {\ text {масса}} _ {1} \ times {\ text {mass}} _ {1} = \% {\ text {mass}} _ {2} \ times {\ text {mass}} _ {2} [/ latex]
Это уравнение можно преобразовать, чтобы выделить массу 1 , и данные величины подставляются в это уравнение .{-1} \ right) = 1029 \ text {g} \\ \ text {mol dextrose} = 1029 \ cancel {\ text {g}} \ times 0,050 \ times \ dfrac {1 \ text {mol}} {180,2 \ cancel {\ text {g}}} = 0,29 \ end {array} [/ latex][латекс] 0,29 \ text {mol C} _ {6} \ text {H} _ {12} \ text {O} _ {6} [/ latex]
Поскольку мы выбрали объем равным 1,00 л, молярность декстрозы составляет [латекс] \ text {molarity} = \ dfrac {\ text {mol}} {\ text {L}} = \ dfrac {0,29 \ text {mol }} {1,00 \ text {L}} = 0,29 \ text {mol} [/ latex].
Глоссарий
массовый процент: отношение массы растворенного вещества к массе раствора, выраженное в процентах
массово-объемный процент: отношение массы растворенного вещества к объему раствора, выраженное в процентах
частей на миллиард (ppb): отношение массы растворенного вещества к массе раствора , умноженное на 10 9
частей на миллион (ppm): отношение массы растворенного вещества к раствору, умноженное на 10 6
объемный процент: отношение объема растворенного вещества к объему раствора, выраженное в процентах
Как рассчитать концентрацию в PPM
Обновлено 9 марта 2020 г.
Ли Джонсон
Проверено: Lana Bandoim, B.S.
Когда вы работаете с растворами в химии, очень важно выразить концентрацию одного компонента по отношению ко всей смеси.
В большинстве случаев вы можете использовать более «повседневные» меры, такие как процент, чтобы передать прочность смеси, но в других случаях вам понадобятся менее распространенные единицы, такие как части на миллион или PPM.
Это в основном то, на что это похоже: количество частей вещи, которые вас интересуют, на каждый миллион частей решения.Но важно знать, как выполнить базовый расчет PPM, если вы собираетесь общаться с другими учеными.
Объяснение расчета PPM
Ключевым моментом PPM является то, что он показывает, сколько « единиц » вещества A у вас есть на каждый миллион единиц всего раствора или смеси. Напротив, процентный показатель показывает, сколько чего-то у вас есть «на сотню», и поэтому он очень похож на PPM. Точно так же вы можете сказать, что у вас есть 7-процентное решение, вы можете сказать, что у вас есть решение на 36 PPM.
Самая важная вещь, о которой следует помнить при выполнении расчета PPM, — это то, что единицы, которые вы выбираете для раствора, и единицы для вещества, которое вас интересует, должны совпадать. Вы не можете использовать массу растворенного вещества и объем для всего раствора, например, вы должны использовать массу и массу или объем и объем, чтобы получить ощутимый результат.
PPM в простых случаях
Есть несколько ситуаций, когда расчет PPM выполнить очень просто. Одним из них является преобразование процентного значения в значение PPM, потому что 1 PPM всего в 10 000 раз больше, чем один процент.Затем, чтобы выполнить преобразование, просто умножьте значение в процентах на 10 000 или 10 4 . Например, если у вас 0,02-процентный раствор, это эквивалентно 0,02 × 10 4 = 200 частей на миллион, что является гораздо более удобной цифрой для , чем крошечный процент.
Еще один простой пример — это редкий случай, когда можно легко смешивать массы и объемы и конвертировать в PPM. Поскольку 1 литр воды имеет массу 1 кг, любая концентрация, выраженная в мг / л, равна уже в PPM, потому что это эквивалентно мг / кг.Так что, если у вас есть смесь 132 мг / л, то это 132 частей на миллион, и вы даже можете выполнять простые преобразования из таких вещей, как г / л в PPM, используя этот факт (просто преобразуйте массу в мг и все готово).
Общая формула для PPM
В целом, однако, вы всегда можете рассчитать PPM, используя один подход и простую формулу . Первое, что вам нужно сделать, это измерить количество растворенного вещества или вещества, которое вас интересует, а затем провести такое же измерение для всего раствора, например.6
Вы можете разбить его на двухэтапный процесс, если это помогает: во-первых, разделите количество растворенного вещества на количество всего раствора, чтобы получить измерение концентрации «частей на 1».
С этого момента вы просто умножаете его на 1000000, чтобы преобразовать его в измерение PPM, или, альтернативно (если это лучше подходит для концентрации, с которой вы работаете), вы можете умножить на 100, чтобы преобразовать его в процент, или 1000000000, чтобы превратить его в значение частей на миллиард (PPB).Просто помните, что вам нужно сохранить те же единицы измерения, и процесс прост.
Как рассчитать PPM | Sciencing
Обновлено 9 марта 2020 г.
Ли Джонсон
Проверено: Lana Bandoim, B.S.
Число частей на миллион (ppm) говорит вам, сколько конкретного вещества содержится в более крупной смеси. Другими словами, это мера концентрации и широко используется в таких областях, как химия, и даже как измерение таких вещей, как количество углекислого газа в атмосфере.
Понимание того, как работает мера и что она на самом деле означает, позволяет рассчитать ее без использования специального калькулятора частей на миллион, но они также доступны, если вы не хотите вычислять ее вручную. Если вы изучаете химию или изучаете науку в целом, гораздо важнее понимать, что это значит, даже если вы используете специальный инструмент для расчетов.
Что такое PPM?
частей на миллион или частей на миллион — это безразмерная мера концентрации одного вещества, смешанного с другим.Например, количество свинца в пробе воды или количество CO 2 в атмосфере. По сути, это процентное соотношение, которое вы могли бы аналогичным образом назвать «частями на сотню», но PPM лучше подходит для веществ с гораздо меньшими концентрациями .
Важен тот факт, что PPM является безразмерной мерой. Вы должны убедиться, что способ измерения как интересующего вас вещества, так и того, в чем оно разбавлено, одинаков.
Итак, если у вас есть объем воды с чем-то растворенным в ней, вам нужно либо использовать объем другого вещества (т.е.е. растворенное вещество) или используйте массу обоих. Использование объема воды, но массы растворенного вещества приведет к бессмысленному результату.
PPM по объему или массе
Выполнение базовых расчетов PPM по объему или массе поможет закрепить концепции, которые вам необходимо понять. Что касается массы, представьте, что у вас есть 0,98 литра воды с 0,2 г растворенной в ней соли, при этом обратите внимание, что 1 литр воды = 1 кг массы, поэтому общая масса в примере составляет 1 кг. После преобразования обоих в одну и ту же единицу массы, доля соли в воде определяется как:
Таким образом, это в основном «части на часть», что означает, что для одной части раствора у вас есть 0.0002 части соли. Но, конечно, иметь такое количество десятичных знаков не совсем удобно, поэтому для преобразования в PPM вы умножаете на 1000000 = 10 6 , что дает: 0,0002 × 10 6 = 220 PPM.
Общий подход работает и для расчета объема . Представьте, что у вас есть проба воздуха размером 1 м 3 с 0,0004 м 3 углекислого газа в смеси: Какова концентрация углекислого газа в PPM? Начиная с расчета «частей на деталь» или «частей на 1»:
А затем умножьте это на 10 6 , чтобы завершить преобразование PPM: 0.0004 × 10 6 = 400 частей на миллион.
Калькулятор PPM и формула
Приведенный выше подход легко обобщается, помня, что вам нужно использовать один и тот же тип количества в обеих частях дроби:
Это достаточно просто в использовании, но есть много веб-сайтов с онлайн-калькуляторами PPM, которые вы можете использовать (см. Ресурсы). Также следует отметить, что, поскольку 1 л воды имеет массу 1 кг, мера воды в мг / л также является количеством PPM по массе.
Преобразование PPM из процента
Выполнить преобразование PPM из процента довольно просто.4
Проще говоря, умножьте процентное значение на 10 000, чтобы получить значение PPM.
единиц концентрации — Chemistry LibreTexts
Растворы — это гомогенные смеси , содержащие одно или несколько растворенных веществ в растворителе . Растворитель, из которого состоит большая часть раствора, тогда как растворенное вещество — это вещество, растворенное внутри растворителя.
Единицы относительной концентрации
Концентрации часто выражаются в относительных единицах (например,г. процентов) с тремя различными типами обычно используемых процентных концентраций:
- Массовый процент : Массовый процент используется для выражения концентрации раствора, когда масса растворенного вещества и масса раствора даны: \ [\ text {Mass Percent} = \ dfrac {\ text {Масса растворенного вещества}} {\ text {Масса раствора}} \ times 100 \% \ label {1} \]
- Объемный процент : Объемный процент используется для выражения концентрации раствора, когда объем растворенного вещества и объем раствора заданы: \ [\ text {Volume Percent} = \ dfrac {\ text {Объем Раствор}} {\ text {Объем раствора}} \ times 100 \% \ label {2} \]
- Массовый / объемный процент: Другой вариант процентной концентрации — массовый / объемный процент, который измеряет массу или вес растворенного вещества в граммах (например,г., в граммах) по сравнению с объемом раствора (например, в мл). Примером может служить раствор 0,9% (вес / объем) \ (NaCl \) в медицинских солевых растворах, который содержит 0,9 г \ (NaCl \) на каждые 100 мл раствора (см. Рисунок ниже). Процент массы / объема используется для выражения концентрации раствора, когда даны масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица измерения концентрации не является истинной относительной единицей (например, процентами), однако ее часто используют в качестве простой единицы измерения концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса.Более того, поскольку плотность разбавленных водных растворов близка к 1 г / мл, если объем раствора измеряется в мл (согласно определению), то это хорошо аппроксимирует массу раствора в граммах (что составляет истинную относительную единицу (м / м)).
\ [\ text {Масса / Объем в процентах} = \ dfrac {\ text {Масса растворенного вещества (г)}} {\ text {Объем раствора (мл)}} \ times 100 \% \ label {3} \ ]
Рисунок использован с разрешения Википедии.Пример \ (\ PageIndex {1} \): «Доказательство» алкоголя как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как удвоенное процентное содержание алкоголя по объему (об. / Об.), Называемое доказательством.Какая концентрация алкоголя в крепких спиртных напитках Bacardi 151 , которые продаются по цене 151 (отсюда и название)?
Рисунок: почти пустая бутылка Bacardi 151. из Википедии.Решение
Он будет иметь содержание алкоголя 75,5% (мас. / Мас.) В соответствии с определением «доказательство».
При вычислении этих процентных соотношений единицы растворенного вещества и раствора должны быть эквивалентными (а вес / объемный процент (вес / объем%) определяется в граммах и миллилитрах).
Вы НЕ МОЖЕТЕ подключить… Невозможно подключить… (2 г растворенного вещества) / (1 кг раствора) (2 г растворенного вещества) / (1000 г раствора) или (0,002 кг растворенного вещества) / (1 кг раствора) (5 мл растворенного вещества) / (1 л раствора) (5 мл растворенного вещества) / (1000 мл раствора) или (0.005 л растворенного вещества) / (1 л раствора) (8 г растворенного вещества) / (1 л раствора) (8 г растворенного вещества) / (1000 мл раствора) или (0,008 кг растворенного вещества) / (1 л раствора) Единицы концентрации разбавленных
Иногда, когда растворы слишком разбавлены, их процентные концентрации оказываются слишком низкими. Таким образом, вместо использования действительно низких процентных концентраций, таких как 0,00001% или 0.000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций похож на рецепты приготовления. Например, в рецепте вы можете использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет вам использовать в своем уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо использования рецепта «1 часть на десять» химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
- Частей на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (то же самое, что и 1 мг растворенного вещества и 1 л раствора), создаст очень небольшую процентную концентрацию. Поскольку такой раствор будет настолько разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г / мл (но будет другим для разных растворителей). Итак, после выполнения вычислений и преобразования миллилитров раствора в граммы раствора (при условии, что растворителем является вода): \ [\ dfrac {\ text {1 г растворенного вещества}} {\ text {1000000 мл раствора}} \ times \ dfrac {\ text {1 мл}} {\ text {1 г}} = \ dfrac {\ text {1 г растворенного вещества}} {\ text {1000000 г раствора}} \] Получаем (1 г растворенного вещества) / (1000000 г решение).Поскольку и растворенное вещество, и раствор теперь выражены в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \ [\ text {1 ppm} = \ dfrac {\ text {1 мг растворенного вещества}} {\ text {1 л раствора}} \] Единицу ppm также можно использовать в единицах объема / объема (об. / об.). (см. пример ниже).
- Частей на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз больше разбавленного, чем 1 ppm. \ [\ text {1 ppb} = \ dfrac {1 \; \ mu \ text {g Solute}} {\ text {1 L Solution}} \]
- Частей на триллион : Так же, как и частей на миллиард, идея частей на триллион (частей на миллион) аналогична понятию частей на миллион.Однако 1 ppt — это в 1000 раз больше разбавления, чем 1 ppb, и в 1000000 раз больше, чем 1 ppm. \ [\ text {1 ppt} = \ dfrac {\ text {1 ng Solute}} {\ text {1 L Solution}} \]
Пример \ (\ PageIndex {2} \): ppm в атмосфере
Вот таблица с объемными процентами различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент по массе отличается от композиции по массе или композиции по количеству молей.
Имя элемента Объем в процентах (об. / Об.) частей на миллион (об. / Об.) Азот 78.084 780 840 Кислород 20,946 209 460 Водяной пар 4,0% 40 000 Аргон 0.934 9,340 Двуокись углерода 0,0379 379 * (но быстро растет) Неон 0,008 8,0 Гелий 0,000524 5,24 Метан 0,00017 1,7 Криптон 0.000114 1,14 Озон 0,000001 0,1 Окись азота 0,00003 0,305 Единицы концентрации в молях
- Мольная доля : Мольная доля вещества — это доля всех его молекул (или атомов) от общего числа молекул (или атомов).Иногда это также может пригодиться при работе с уравнением \ (PV = nRT \). \ [\ chi_A = \ dfrac {\ text {количество молей вещества A}} {\ text {общее количество молей в растворе}} \] Также имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \ [\ chi_A + \ chi_B + \ chi_C \; + \; … \; = 1 \]
- Молярный процент : Молярный процент (вещества A) равен \ (\ chi_A \) в процентной форме. \ [\ text {Молярный процент (вещества A)} = \ chi_A \ times 100 \% \]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора.\ [M = \ dfrac {\ text {Моли растворенного вещества}} {\ text {Литры раствора}} \]
- Моляльность : Моляльность (м) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \ [m = \ dfrac {\ text {Молей растворенного вещества}} {\ text {Килограммы растворителя}} \]
Уравнения молярности и моляльности отличаются только своими знаменателями.Однако это огромная разница. Как вы помните, объем варьируется в зависимости от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Следовательно, молярность растворов также меняется при разных температурах. Это создает преимущество использования молярности перед молярностью. Использование молярности вместо молярности для лабораторных экспериментов лучше всего поможет сохранить результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, он делает моляльность независимой от температуры.
Практические задачи
- В растворе присутствует 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый / объемный процент растворенного вещества.
- С помощью раствора, показанного на рисунке ниже, найдите молярный процент вещества C.
- 1,5 л раствор состоит из 0,25 г NaCl, растворенного в воде. Найдите его молярность.
- 0,88 г NaCl растворяют в 2.0л воды. Найдите его молярность.
Решения
1:
Массовый процент
= (Масса растворенного вещества) / (Масса раствора) x 100% |
= (6,0508 г) / (110,605 г + 6,0508 г) x 100%
= (0,0518688312) x 100%
= 5,186883121%
Массовый процент = 5,186%
Объем в процентах
= (Объем растворенного вещества) / (Объем раствора) x 100%
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100%
= (0.04507
) х 100%
= 4,507
9% Объем в процентах = 4,51%
Масса / Объем в процентах
= (Масса растворенного вещества) / (Объем раствора) x 100%
= (6,0508 г) / (111,0 мл + 5,24 мл) x 100%
= (0,0520) х 100%
= 5,205%
Масса / Объем в процентах = 5,2054%
2. Моль C = (5 молекул C) x (1 моль C / 6.022×10 23 молекул C) = 8.30288941×10 -24 моль C
Всего молей = (24 молекулы) x (1 моль / 6.022×10 23 молекул) = 3.98538691×10 -23 моль всего
X C = (8.30288941×10 -24 моль C) / (3.98538691×10 -23 моль) = .2083333333
Молярный процент C
= X C x 100%
= (o.2083333333) x 100%
= 20,83333333
Мол. Процент C = 20%
3. Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (молей растворенного вещества) / (литры раствора)
= (0.004277 моль NaCl) / (1,5 л)
= 0,002851 М
Молярность = 0,0029M
4. Моль NaCl = (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl
Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг / 1000 г) = 2,0 кг воды
Моляльность
= (молей растворенного вещества) / (кг растворителя)
= (0,01506 моль NaCl) / (2,0 кг)
= 0,00752 м
Моляльность = 0,0075 м
Список литературы
- Петруччи, Харвуд, Селедка.Общая химия: принципы и современные приложения. 8-е изд. Аппер-Сэдл-Ривер, Нью-Джерси: Пирсон / Прентис-Холл, 2002. 528-531
Авторы и авторство
- Кристиан Рэй Фигероа (UCD)
Руководство по управлению SO2 и калькулятор SO2
22.02.2012 Введение в управление SO2Если мы хотим производить высококачественные вина, то одна из самых важных вещей, которые нам, как виноделам, необходимо изучить, — это как эффективно управлять уровнем сульфита в наших винах.Если все сделано правильно, поддержание надлежащего количества сульфитов в вине защищает его от окисления и микробного загрязнения во время выдержки / хранения. Это позволяет вину безопасно развиваться на протяжении всего срока службы. Тем не менее, чтобы эта защита была эффективной, необходимо постоянно поддерживать требуемые уровни сульфита. Это делается путем регулярного тестирования уровней SO2 в наших винах и, если мы не достигаем желаемого диапазона, путем добавления дополнительной серы, чтобы компенсировать разницу.Однако, каким бы простым это ни казалось, точное управление сульфитом на самом деле представляет собой гораздо больший практический процесс, чем простое добавление время от времени общего количества SO2 и его использование. Вот почему: есть 2 технические концепции, которые необходимо учитывать при добавлении серы, иначе мы рискуем получить неточные результаты:
- Связывание: Из-за сложного взаимодействия добавок сульфита с различными химическими соединениями и твердыми веществами, которые естественным образом присутствуют в наших винах, количество свободного сульфита, остающегося в вине после внесения добавки, часто не соответствует нашему расчетному целевому показателю.Эта потеря происходит из-за явления связывания, которое необходимо учитывать и исправлять, иначе наши вина рискуют оказаться незащищенными, несмотря на то, что мы добавляем серу.
- Количество SO2, необходимое для защиты вина, зависит от pH: Уровни свободного SO2 *, необходимые для защиты вина, зависят от pH: по мере повышения pH для защиты вина требуются более высокие уровни свободного SO2. Другими словами, вы можете иметь в вине 25 ppm свободного SO2 и думать, что все в порядке, но если ваш pH выше 3.3 вино до сих пор не защищено должным образом! Когда дело доходит до добавок сульфита, однозначно не подходит для всех! ( * Примечание: подробное объяснение понятий «бесплатный» и «общий» SO2 скоро появится!)
Поскольку понимание этих концепций является ключом к нашей способности правильно контролировать уровни серы, первая половина этого руководства будет посвящена именно им. Затем, когда мы заложим эту основу, во второй половине руководства будет показано, как включить эти знания в технически обоснованный протокол, который позволит нам эффективно управлять нашими уровнями SO2 с уверенностью.Поехали!
Понимание теории управления SO2
Что такое SO2?Начнем с основ. Диоксид серы, или SO2, представляет собой химическое соединение, используемое виноделами для защиты своего вина от негативного воздействия кислорода, а также от микроорганизмов, вызывающих порчу. Диоксид серы известен виноделам под разными названиями, наиболее распространенными из которых являются «SO2», «метабисульфит» и просто «сульфит».«В виноделии концентрация SO2 в вине измеряется в частях на миллион, или ppm, что относится к количеству частей сульфита на миллион частей вина. Эта единица измерения эквивалентна мг / л, или миллиграмм SO2, на литр вина.
Что такое управление SO2?
Когда вино содержит надлежащее количество сульфитов, создается защитный буфер, который помогает вину выдерживать любое случайное воздействие кислорода или микробов, которое может произойти в процессе выдержки / хранения.Сульфит делает это, действуя как посредническая сила, которая быстро перехватывает и вступает в реакцию с нарушающим элементом или организмом, прежде чем он сможет повредить вино. Однако это билет в один конец, и мы узнаем, что, когда сульфит израсходуется, он больше не сможет реагировать на будущие угрозы. Он по-прежнему является частью «общего» количества SO2 в вине, но он больше не является «бесплатным» для защиты вина (подробнее чуть позже). В своей основной форме управление SO2 просто сводится к пониманию того, как создать и поддерживать небольшой стабильный резерв Free SO2.
Каждое вино уникально:
Понимание феномена «связывания»Многие твердые вещества и химические соединения в вине (как хорошие, так и плохие) взаимодействуют с сульфитом, и их концентрация / присутствие напрямую влияет на поведение добавки SO2. Начнем с того, что нет двух одинаковых вин; каждый из них обладает уникальным соотношением химических соединений и твердых веществ, которые присутствуют в различных концентрациях. В зависимости от техники виноделия, обработки или даже санитарных условий, эти различия могут быть весьма заметными.Именно из-за этих внутренних различий два, казалось бы, идентичных вина (например, оба сухие с одинаковым pH и TA) часто могут иметь разные уровни свободного SO2 после равных добавок сульфита.
Упомянутое выше несоответствие между тем, что мы рассчитали на бумаге, и количеством свободного SO2, которое фактически остается в вине, происходит из-за явления, известного как «связывание». Он основан на том факте, что при добавлении сульфита в вино части добавки вступают в реакцию и становятся химически связанными с альдегидами, кислотами, фурфуролом, сахарами, твердыми веществами, дрожжами / бактериями и т. Д., Которые естественным образом присутствуют в вине.Связывание продолжается до тех пор, пока все различные реакционноспособные элементы в вине либо не свяжутся, либо не останется свободного сульфита для взаимодействия. Это связывающее действие на самом деле служит для защиты вина; пока присутствует свободная сера, она может реагировать и эффективно нейтрализовать угрозы окисления и микробной порчи. Фактически, бесплатный SO2 можно рассматривать как страховой полис, который винодел оформляет на случай, если у вина возникнут какие-либо проблемы в течение его срока службы: пока у вас есть рекомендованное количество бесплатного SO2, ваше вино защищено (подробнее об этом позже).
Разумнее лучше!
Поддержание резерва свободной серы означает, что, как только вино начинает терять содержание свободного SO2, мы обязаны добавить больше сульфита, чтобы снова поднять его. Тем не менее, хорошего может быть слишком много. Если мы не контролируем наши количества и вслепую продолжаем добавлять серу в вино, пытаясь поддерживать требуемый пул свободного SO2, можно добавить так много, что общее количество серы в вине станет ощутимым по вкусу, что отрицательно. воздействуя на вино.Это одна из тонких линий, по которой мы, виноделы, идем, еще один пример соединения искусства и науки, то есть виноделия. Нам необходимо иметь достаточное количество серы, чтобы поддерживать уровень свободного SO2, необходимый для защиты вина, но мы не хотим, чтобы общий уровень был настолько высоким, чтобы быть заметным, когда мы его пьем. Поэтому цель правильного управления сульфитом в виноделии — научиться создавать необходимое количество свободного SO2 в вине при использовании минимально возможного общего количества сульфита.Чтобы помочь нам в этом, важно глубже изучить последствия процесса привязки.
Три агента, связывающих SO2
Управление уровнем свободного SO2 начинается, как только закончится последняя ферментация (алкогольная или яблочно-молочная). Когда мы делаем нашу первую добавку SO2 (путем расчета, тестирования результатов и корректировки до желаемого уровня, если необходимо — подробнее об этом позже), мы устанавливаем нашу отправную точку для получения свободного SO2 в вине.Как только эта базовая линия установлена, пока вино остается полностью герметичным и лишенным кислорода
контакт уровень свободного SO2 должен оставаться достаточно стабильным с течением времени. Однако, как только мы начнем открывать сосуды для дегустации, тестирования, смешивания, очистки или доливки (для бочек), мы начнем видеть явное падение свободного SO2. Это падение может быть небольшим или довольно резким, в зависимости от того, как обрабатывается вино. Есть три основные причины явления связывания, ответственного за это падение уровня свободного SO2 в вине: образование альдегидов, организмы порчи и попадание твердых веществ в вино.- Альдегиды: Когда вино подвергается воздействию кислорода, спирт в нем окисляется до химических соединений, называемых альдегидами. Альдегиды — это класс химических соединений, которые связываются с SO2, что приводит к снижению уровня свободного SO2. Фактически, существует эффект снежного кома, часто связанный с образованием альдегидов: по мере того, как альдегиды развиваются и реагируют со свободным SO2 в вине, меньше SO2 доступно для перехвата кислорода. В результате поступающий кислород затем вступает в реакцию с большим количеством спирта с образованием большего количества альдегида — и так далее, и тому подобное.Это наиболее частая причина снижения содержания свободного SO2 в вине и наиболее частая причина порчи, связанной с кислородом, которую мы наблюдаем в домашних винах. Примечание: Бочки и резервуары с свободным пространством над водой имеют тенденцию терять свободный SO2 быстрее, чем полностью заполненные инертные сосуды. Это связано с взаимодействием вина с кислородом в окружающей среде / свободном пространстве. Однако важно отметить, что даже при отсутствии воздействия кислорода уровни свободного SO2 могут постепенно снижаться во время выдержки из-за нормальных химических реакций, протекающих в вине по мере того, как оно продолжает развиваться (чем выше pH, тем выше уровень уменьшения).
- Организмы, вызывающие порчу: Если условия благоприятны и организмы, вызывающие порчу, загрязняют вино, это может привести к образованию клеточной массы, которая связывается с SO2. Конечным результатом является более низкий уровень свободной серы в вине. Чаще всего такими организмами являются Acetobacter (бактерии уксуса) , Lactobacillus, Pediococcus и пленочные дрожжи (часто, если присутствует один организм, вызывающий порчу, другие также присутствуют). Проблемы порчи обычно возникают, когда пониженный уровень свободного SO2 — обычно из-за чрезмерного воздействия кислорода — делает вино уязвимым.
- Введение твердых веществ: Каждый раз, когда мы добавляем в вино твердые вещества, такие как дуб (который, будучи пористым, также приносит с собой кислород), дубильные вещества, сахар, специальные дрожжевые продукты, осветляющие вещества и т. Д., У нас будет некоторое количество связывания происходит, тем самым снижая свободный SO2.
Методы ограничения привязки
Теперь, когда мы внимательно рассмотрели элементы, которые могут связывать наши уровни свободного SO2, мы можем сосредоточиться на том, как устранить или, по крайней мере, минимизировать нежелательное влияние, которое они оказывают на наше вино.Для каждой из этих трех проблем есть проактивные меры, которые мы можем предпринять, чтобы минимизировать возможные вредные последствия:
- Образование альдегида: Поскольку альдегиды образуются при окислении спирта, если мы устраняем или ограничиваем количество кислорода, с которым вступает в контакт вино, мы также эффективно устраняем или ограничиваем количество альдегида, который образуется в наших винах. Это может быть достигнуто путем промывки любых воздушных пространств, которые будет занимать вино, инертным газом.Примеры этих «воздушных пространств» включают свободные пространства сосудов, перекачивающих линий, насосных полостей, корпусов фильтров и т. Д.
- Организмы, вызывающие порчу: Надлежащие методы санитарной обработки и бдительность в отношении содержания свободного SO2 на необходимом уровне помогут предотвратить любые микробные проблемы. Это не только предотвращает появление привкуса вина из-за нежелательного микробного воздействия, но также ограничивает общее добавление SO2 до минимума, уменьшая риск негативного сенсорного воздействия SO2.
- Введение твердых веществ: Наконец, при добавлении каких-либо твердых веществ в вино, помните, что небольшая часть сульфита будет связана с вновь введенным элементом в вино. Следовательно, нам нужно будет добавить немного больше SO2, чтобы это компенсировать. После первоначального воздействия на уровень сульфита ваш дуб или другие добавки не должны продолжать адсорбировать части будущих добавок SO2.
Обобщение теории управления SO2
В этом первом разделе мы узнали, что фактическое количество сульфита, необходимое для поддержания желаемого уровня свободного SO2, никогда не является фиксированным, «универсальным» количеством.В зависимости от вашего вина, простого добавления 50 ppm SO2 время от времени во время выдержки может быть или недостаточно для защиты вашего вина. И мы упоминали, что уровень SO2, необходимый для защиты вина, зависит от его pH, и этот уровень необходимо поддерживать постоянно, чтобы вино было защищено (мы внимательно рассмотрим это в следующем разделе). Однако каждый раз, когда мы добавляем серу, часть нашего свободного SO2 может связываться с различными элементами, которые естественным образом содержатся в вине. Когда происходит это связывание, снижается количество свободного SO2, остающегося в вине после добавления.Следовательно, если мы хотим поддерживать точные уровни свободного SO2, нам необходимо протестировать наши вина после добавления и восполнить любые потери свободного SO2, которые стали связанными.
Примечание: Если у вас стабильный уровень сульфита в вине, это не значит, что вы можете внезапно стать небрежным в обращении! Как мы видели, неправильное обращение с вином вызовет только связывающие реакции, которых мы надеемся избежать, и в результате свободный SO2 будет падать и заставлять нас продолжать добавлять все больше и больше серы в наши вина.Зная, как работает явление связывания, теперь вы можете лучше предотвратить этот сценарий.
Тестирование и расчет добавок SO2
Теперь, когда у нас есть лучшее теоретическое понимание того, что необходимо для правильного управления сульфитом, давайте применим его, протестировав и вычислив фактическое добавление. Начнем с определения количества сульфита, необходимого для защиты вина. Затем мы рассмотрим, как проверить количество свободного SO2, которое у нас действительно есть в вине.Наконец, если уровень свободного сульфита ниже желаемого диапазона, мы сосредоточимся на том, как поднять его, чтобы компенсировать разницу.
Бесплатно SO2: сколько мне нужно?
Как упоминалось ранее, количество SO2, необходимое для защиты вина, зависит от его pH. Для проверки: чем выше pH, тем больше потребуется SO2, и, наоборот, чем ниже pH, тем меньше SO2 потребуется для достижения идеального уровня. Давайте посмотрим на следующую диаграмму, чтобы увидеть, как все это сочетается: Чтобы использовать эту диаграмму, просто найдите pH вашего вина на нижней оси, а затем проследите за ним, пока не дойдете до красной линии.С этого места посмотрите полностью влево от диаграммы, чтобы увидеть число, соответствующее этой высоте. Это число представляет собой количество промилле свободного SO2, необходимое для защиты вина при таком pH. Так, например, если у вашего вина pH 3,6, вам понадобится 50 ppm свободного SO2, чтобы оно было защищено.
Примечание: , если ваш pH находится на полпути между значениями на диаграмме, просто сделайте логический вывод (например, для pH 3,65 (1/2 разницы между 3,6 и 3,7) потребуется 57 ppm свободного SO2 (1 / 2 между отметками 50 и 60 ppm).
Протестируйте бесплатный SO2: сколько у меня есть?
После того, как вы ознакомитесь с таблицей и узнаете количество SO2, необходимое для защиты вашего вина, вам нужно будет проверить уровень свободного SO2 в вине, чтобы увидеть, где он находится в настоящее время. Это определит, требуется ли добавление. Есть несколько способов сделать это:
- «Titrets»: Самым простым решением для домашнего винодела было бы использование набора производства CHEMetrics.Это ячейка для титрования методом Риппера, выпускаемая под торговой маркой «Titrets» (W510). Они относительно дешевы и довольно просты в использовании, но не очень точны. Однако надежные установки для тестирования SO2 требуют определенных инвестиций, и в результате многие люди предпочитают принимать эту неточность. Примечание: , если вы делаете небольшое количество вина и потребляете его быстро, то рисковать тем, что титры будут достаточно близко для выполнения работы, вероятно, нормально.Однако, если вы делаете большие объемы, которые потребуют значительного количества времени и денег, мы рекомендуем вам инвестировать в точную установку для тестирования SO2 или отправить ее в винную лабораторию для анализа (например, вино MoreWine! услуги тестирования).
- Установка MoreWine! Экономичный А.О. (MT140): Это ручная установка для влажного лабораторного тестирования для тестирования свободного SO2. В отличие от Titrets, MT140 очень точен. Экономика А.О. установка именно такая, экономичная и простая в использовании.Стоимость одного теста составляет 0,50 доллара США. Единственные недостатки: 1) срок годности некоторых реагентов истекает через 3-4 месяца, и их необходимо будет пополнять несколько раз в год, чтобы обеспечить точность (однако их замена дешево), и 2) на один образец уходит 15-20 мин на подготовку и запуск. Примечание: MT140 позволит вам делать только SO2 бесплатно. Если вы хотите также использовать общий SO2, вам понадобится титратор Hanna SO2 (MT680).
- Титратор Hanna SO2 (MT680): Полностью автоматизированный, очень простой, точный бесплатный + общий анализ SO2 прямо из коробки.Реагенты для титратора Hanna SO2 стабильны до 4 лет, а свободный SO2 может работать в среднем 2 мин / тест. (На нашей собственной винодельне это быстрое время завершения позволило нам протестировать и отрегулировать сульфит в каждой из наших винтажных партий объемом 20 баррелей за один вечер во время доливки. То, что раньше занимало большую часть дня, теперь занимает 2 часы!). Единственным недостатком MT680 является то, что выполнение каждого теста стоит 2 доллара США, а датчик время от времени требует чистки и обслуживания.
Следуя инструкциям, проверьте вино с помощью набора для тестирования сульфита, чтобы определить уровень свободного SO2 в вашем вине.Узнав результаты, сравните их с идеальным количеством, которое должно быть в вине (которое вы определили по таблице). Если количество сульфита находится на желаемом уровне, все готово; в добавлении не требуется. Однако, если количество свободного SO2 в вине меньше нашего целевого значения, нам нужно будет восполнить разницу, чтобы восстановить / поддерживать защиту в вине.Расчет добавления SO2
Допустим, у нас есть 5.5 галлонов вина с pH 3,65. Когда мы проверяем уровни SO2, мы обнаруживаем, что у нас 18 ppm свободно. Если мы посмотрим на диаграмму дозировки pH / SO2, то увидим, что при pH 3,65 нам действительно нужно 55 ppm свободного SO2, чтобы защитить вино. Поскольку у нас 18 частей на миллион, но нам нужно 55 частей на миллион, нам нужно будет компенсировать разницу. Если мы вычтем 18 из 55, мы получим 37. Следовательно, нам нужно добавить достаточно сульфита, чтобы добавить 37 ppm свободного SO2 в вино.
Расчет количества метабисульфита для желаемого PPM
PPM означает «части на миллион» и является мерой концентрации, которая может быть выражена как 1 мг / л.Когда мы говорим о 20 ppm SO2 в нашем вине, мы говорим, что на каждый миллион частей вина приходится 20 мг SO2. Чтобы узнать, сколько метабисульфита калия необходимо для добавления желаемых частей на миллион SO2 в определенный объем вина (в данном случае 37 частей на миллион SO2 в наши 5,5 галлона), мы используем следующее уравнение:
Требуется PPM свободного SO2 * x 3,785 x галлонов (США) вина, которое вы регулируете
0,57 (фактический% SO2, который содержится в метабисульфите по весу)( * Примечание: ). Важно, чтобы десятичная точка, которую вы получаете для «желаемых частей на миллион свободного SO2» для вашей корректировки, должна была сдвинуться на три позиции влево, прежде чем вы включите его в уравнение! Например, необходимые 37 ppm свободного SO2 входят в уравнение как .037 ).
Поскольку 37 ppm — это количество SO2, которое мы хотим добавить, давайте подключим его к уравнению:
0,037 x 3,785 x 5,5 (у нас 5,5 галлона вина) = 1,35 грамма .
0,57
Итак, количество метабисульфита калия, необходимое для добавления 37 частей на миллион свободного SO2 в наши 5,5 галлона (чтобы вывести вас с 18 частей на миллион до необходимых 55 частей на миллион), составляет 1,35 грамма .Компенсация реакций связывания: 2 ступени точности:
Поскольку вы никогда не знаете, сколько из 37 ppm SO2, которое вы добавляете, станет связанным (и, следовательно, уменьшите количество свободного SO2, которое вы думаете, что добавляете свое вино), получение наших 55 ppm свободных будет двухэтапным процессом:- Сначала мы выполним наш расчет, чтобы определить, сколько граммов SO2 необходимо, чтобы добавить 37 ppm свободного SO2 к нашим 5,5 галлонам и добавить это в вино (осторожно, но тщательно перемешивая).
- Затем, как только добавление произведено, мы рекомендуем проверить свободный SO2 через несколько дней, чтобы увидеть, сколько из добавленного нами сульфита стало связанным. В этот момент, если свободный SO2 ниже нашего целевого уровня, мы просто добавляем количество, необходимое для возврата к желаемым 55 ppm. Примечание: После того, как вы внесли это исправление, можете переходить к следующей настройке SO2 .
Если у вас нет шкалы:
¼ чайной ложки SO2 на 5 галлонов (США) = 50 частей на миллион.Фадж соответственно.
1 чайная ложка SO2 = 5,9 грамма.Примечание: Поскольку легче измерять пипеткой, чем взвешивать SO2 каждый раз, когда это необходимо, вы также можете сделать 10% запас
раствора и добавьте SO2 с помощью градуированной пипетки на 5 мл (: в бутылку на 750 мл (стандартный размер винной бутылки) добавьте 75 граммов (около 12 чайных ложек) метабисульфита калия. Наполните бутылку на ½ стакана теплой водой, встряхните до кристаллов. растворяются, затем долить холодной водой.Добавьте его в соответствии со следующей таблицей:Количество 10% раствора SO2, необходимого для добавления:
Желаемая доза
10 частей на миллион:
30 страниц в минуту:
50 страниц в минуту:
На литр:
.18 мл
0,53 мл
0,88 мл
на галлон (США):
0,67 мл
2,00 мл
3,33 мл
Если у вас нет pH-метра или набора для тестирования SO2:
Как правило, вы можете просто добавить 50 частей на миллион (1/4 чайной ложки на 5 галлонов) SO2.С другой стороны, если в вашем винограде были сгнившие или покрытые пузырями гроздья, или вы провели тесты и обнаружили, что у вас высокий уровень сахара / низкий уровень кислоты / высокий уровень pH, тогда вы можете захотеть добавить до 80- 100 ppm для этого первого добавления. Правда, это звучит очень много, но имейте в виду, что сусло сразу после измельчения будет содержать много твердых частиц в растворе, поэтому значительная часть 80-100 ppm SO2 на этом этапе станет связанной. (Тем не менее, вы захотите сохранить низкий уровень SO2, если вы будете проводить MLF.В этом случае не добавляйте более 50 частей на миллион перед ферментацией).
Пост-ферментация (после того, как MLF будет завершена), вы захотите увеличить уровень SO2 во время ваших переносов еще на 25-50 ppm. Наконец, вы добавите еще 40-50 частей на миллион во время розлива. Поступая так, вы будете поддерживать только общий уровень SO2, и вы, очевидно, рискуете получить его слишком много или слишком мало *. Тем не менее, это намного лучше, чем вообще этого не делать.
* Примечание: эти общие уровни SO2 основаны на вине с pH около 3.5-3.6. Если у вашего вина pH выше этого, вашему вину потребуется больше SO2, чтобы оно было безопасным. Вернитесь к таблице дозировки SO2 / pH и отрегулируйте ее соответствующим образом.
Просто важное напоминание:
Вместе со всеми преимуществами метабисульфита калия возникает необходимость уважать его природу. Его пары очень едкие, и при обращении с ним следует проявлять осторожность (в зависимости от того, насколько вы к нему чувствительны, вы можете использовать резиновые перчатки). Вы должны избегать его вдыхания и не попадать в рот или в глаза.
Сопутствующие товары
Авторские права на все содержимое принадлежат MoreFlavor Inc., 2021 г. Все права защищены. Никакая часть этого документа или связанных файлов не может быть воспроизведена или передана в любой форме и любыми средствами (электронными, фотокопировальными, записывающими или иными) без предварительного письменного разрешения издателя.
Спектры ядерного магнитного резонанса высокого разрешения (ЯМР)
ЯМР-СПЕКТРЫ ВЫСОКОГО РАЗРЕШЕНИЯ
На этой странице описывается, как интерпретировать простые спектры ядерного магнитного резонанса (ЯМР) высокого разрешения.Предполагается, что вы уже прочитали справочную страницу о ЯМР, чтобы понять, как выглядит спектр ЯМР, и об использовании термина «химический сдвиг». Также предполагается, что вы знаете, как интерпретировать простые спектры низкого разрешения.
Примечание: Если вы не читали фоновую страницу о ЯМР или страницу о ЯМР низкого разрешения, вам действительно следует прочитать их, прежде чем продолжить.
Разница между спектрами высокого и низкого разрешения
О чем говорит спектр ЯМР низкого разрешения
Помните:
Количество пиков говорит вам о количестве различных сред, в которых находятся атомы водорода.
Отношение площадей под пиками говорит вам о соотношении количества атомов водорода в каждой из этих сред.
Химические сдвиги дают важную информацию о том, в какой среде находятся атомы водорода.
Спектры ЯМР высокого разрешения
В спектре с высоким разрешением вы обнаружите, что многие из того, что выглядело как одиночные пики в спектре с низким разрешением, разбиты на группы пиков.
Для целей A’level вам нужно будет учитывать только следующие возможности:
1 пик синглет 2 пика в кластере дублет 3 пика в кластере 3 пика в кластере квартет Вы можете получить точно такую же информацию из спектра высокого разрешения, как и из спектра низкого разрешения — вы просто обрабатываете каждый кластер пиков , как если бы он был единственным в спектре низкого разрешения.
Но, кроме того, количество расщеплений пиков дает вам важную дополнительную информацию.
Интерпретация спектра высокого разрешения
Правило n + 1
Величина расщепления говорит вам о количестве атомов водорода, присоединенных к атому или атомам углерода по соседству с тем, который вас интересует в настоящее время.
Количество субпиков в кластере на на больше, чем количество атомов водорода, присоединенных к следующему атому углерода (а).
Итак — при предположении, что есть только один атом углерода с атомами водорода рядом с интересующим нас углеродом (обычно верно на уровне A!):
синглет рядом с углеродом без присоединенного водорода дублет рядом с группой CH тройной 902 902 902 902 902 902 902 квартет рядом с каналом сбыта 3 группа
Примечание: Вероятно, вам не нужно знать происхождение правила n + 1, но если вам интересно, есть страница о причинах разделения, на которую вы можете посмотреть.
Использование правила n + 1
Какую информацию можно получить из этого спектра ЯМР?
Примечание: ЯМР-спектры на этой странице получены на основе данных, взятых из системы базы спектральных данных для органических соединений (SDBS) Национального института материалов и химических исследований в Японии.Любые мелкие ошибки, которые я внес в процессе их преобразования для использования на этом сайте, никоим образом не повлияют на аргумент.
Предположим, вы знаете, что указанное выше соединение имеет молекулярную формулу C 4 H 8 O 2 .
Рассматривая это как спектр низкого разрешения для начала, есть три группы пиков и, таким образом, три различных окружения для атомов водорода. Водороды в этих трех средах находятся в соотношении 2: 3: 3. Поскольку всего имеется 8 атомов водорода, это представляет группу CH 2 и две группы CH 3 .
А как насчет расщепления?
Группа CH 2 с концентрацией около 4,1 ppm представляет собой квартет. Это говорит о том, что он находится по соседству с углеродом с тремя присоединенными атомами водорода — группой CH 3 .
Группа CH 3 с концентрацией около 1,3 ppm представляет собой триплет. Это должно быть по соседству с группой CH 2 .
Эта комбинация этих двух кластеров пиков — один квартет, а другой триплет — типичен для этильной группы, CH 3 CH 2 .Это очень распространено. Узнай это!
Наконец, группа CH 3 с концентрацией около 2,0 м.д. является синглетом. Это означает, что к соседнему углероду не присоединены водороды.
Так что это за соединение? Вы также можете использовать данные о химическом сдвиге, чтобы определить среду, в которой находилась каждая группа, и в конечном итоге вы получите:
Примечание: Теперь вы знаете, как получить необходимую информацию из спектров ЯМР, но часто бывает непросто уместить всю эту информацию в окончательную формулу.Вам просто нужно практиковаться! Просмотрите все примеры из прошлых работ вашей экзаменационной комиссии. Насколько они сложны, будет заметно варьироваться от доски к доске. Некоторые из соединений, с которыми вы столкнетесь, могут быть очень незнакомы. Не забывайте использовать информацию из таблиц химического сдвига — если ваши экзаменаторы включают какую-то малоизвестную группу, вам почти наверняка понадобится ее использовать. Возьмите все подсказки, которые собираетесь!
Два особых случая
Спирты
Где пик -O-H?
Это очень сбивает с толку! В разных источниках приводятся совершенно разные химические сдвиги для атома водорода в группе -ОН в спиртах — часто непоследовательно.Например:
В книге данных Наффилда указано 2,0 — 4,0, но в учебнике Наффилда показано, что пик составляет около 5,4.
Лист данных OCR для использования в экзаменах цитирует 3.5 — 5.5.
Надежный учебник по органической химии цитирует 1,0–5,0, но затем показывает спектр ЯМР для этанола с пиком около 6,1.
База данных SDBS (используемая на этом сайте) дает пик -ОН в этаноле около 2.6.
Проблема, по-видимому, в том, что положение пика -ОН резко меняется в зависимости от условий — например, от используемого растворителя, концентрации и чистоты спирта — особенно от того, является ли он полностью сухим.
Помогите! Вам нужно об этом беспокоиться? Не совсем — вы можете предположить, что в экзаменационном вопросе любой спектр ЯМР будет соответствовать данным химического сдвига, которые вам предоставлены.
Умный способ определения пика -OH
Если вы измеряете спектр ЯМР для спирта, такого как этанол, а затем добавляете в раствор несколько капель оксида дейтерия, D 2 O, даете ему отстояться, а затем повторно измеряете спектр, пик -OH исчезает. ! Сравнивая два спектра, вы можете сразу определить, какой пик принадлежит группе -ОН.
Примечание: Оксид дейтерия (иногда называемый «тяжелой водой») — это просто вода, в которой все нормальные атомы водорода-1 заменены его изотопом, водородом-2 (или дейтерием).
Причина потери пика кроется во взаимодействии оксида дейтерия со спиртом. Все спирты, такие как этанол, очень и очень слабокислые. Водород группы -ОН переходит в одну из неподеленных пар кислорода молекулы воды. Тот факт, что здесь у нас «тяжелая вода», не имеет никакого значения.
Образовавшийся отрицательный ион, скорее всего, столкнется с простой молекулой оксида дейтерия, чтобы регенерировать спирт, за исключением того, что теперь группа -ОН превратилась в группу -OD.
Атомы дейтерия не дают пиков в той же области спектра ЯМР, что и обычные атомы водорода, поэтому пик исчезает.
Вы можете задаться вопросом, что происходит с положительным ионом в первом уравнении и OD – во втором. Они теряются в нормальном равновесии, которое существует везде, где есть молекулы воды — тяжелые или другие.
Отсутствие расщепления с -ОН группами
За исключением случаев, когда спирт абсолютно не содержит воды, водород в группе -ОН и любые атомы водорода в соседнем углероде не взаимодействуют, чтобы произвести какое-либо расщепление.Пик -ОН является синглетом, и вам не нужно беспокоиться о его влиянии на ближайшие водороды.
Левая группа пиков принадлежит группе CH 2 . Это квартет из-за 3 атомов водорода в соседней группе CH 3 . Вы можете игнорировать влияние водорода -ОН.
Точно так же пик -ОН в середине спектра является синглетом. Не превратился в триплет из-за влияния группы CH 2 .
Примечание: Причина этого довольно сложна и определенно выходит за рамки A’level. Он заключается в очень быстром обмене, который происходит между атомами водорода в группе -ОН и молекулами воды или других молекул спирта. Чтобы узнать об этом, вам нужно будет прочитать либо книгу по органической химии на уровне ученой степени, либо книгу, посвященную ЯМР.Для целей A’level просто примите тот факт, что -OH производит синглет и не влияет на соседние группы!
Если вам интересно, вы можете узнать больше о группе ОН в ЯМР в двух статьях из Университета штата Мичиган:
ЯМР1 См. Раздел «Гидроксильный протонный обмен и влияние водородных связей»
ЯМР2 Посмотрите в разделе «Влияние водородных связей»
Не ждите, что это будет легкое чтение — это материал университетского уровня.
Эквивалентные атомы водорода
Считается, чтоатомов водорода, присоединенных к одному и тому же атому углерода, составляют эквивалентов. Эквивалентные атомы водорода не влияют друг на друга — так что один атом водорода в группе CH 2 не вызывает расщепления в спектре другого.
Но атомы водорода на соседних атомах углерода также могут быть эквивалентными, если они находятся в одном и том же окружении.Например:
Эти четыре атома водорода абсолютно эквивалентны. Вы получите единственный пик без разделения.
Достаточно совсем немного изменить молекулу, чтобы это перестало быть правдой.
Поскольку молекула теперь содержит разные атомы на каждом конце, водороды больше не все в одной и той же среде. Это соединение должно давать два отдельных пика в спектре ЯМР низкого разрешения. Спектр высокого разрешения показал бы, что оба пика подразделяются на триплеты, потому что каждый находится рядом с по-разному размещенной группой CH 2 .
Комментарий о ЯМР и бензольных кольцах
На этом вводном уровне все, что вы можете с уверенностью сказать об атомах водорода, прикрепленных к бензольному кольцу, — это их количество. Если у вас есть молекулярная формула, содержащая 6 или более атомов углерода, то она вполне может содержать бензольное кольцо.
Ищите пики ЯМР в диапазоне 6,0–9,0. Если рядом с пиком вам присвоено число вроде 5 или 4, это просто говорит вам, сколько атомов водорода присоединено к кольцу.
Если к кольцу присоединено 5 атомов водорода, то в кольцо замещена только одна группа. Если к нему присоединено 4 атома водорода, то замещаются две отдельные группы и так далее. К кольцу всегда должно быть прикреплено всего 6 вещей. Каждый недостающий атом водорода был заменен чем-то другим.
Схемы расщепления с участием бензольных колец слишком сложны для этого уровня, обычно производя сложные схемы расщепления, называемые мультиплетами.
Примечание: Если вам не повезло с экзаменаторами, которые спрашивают о плевании бензольных колец на этом уровне (для студентов-химиков от 16 до 18 лет), внимательно посмотрите на схему вопросов и отметок, чтобы вы могли точно увидеть, что они хотите, и просто научитесь этому. Но вполне может быть, что все, что они хотят, — это чтобы вы заметили количество атомов водорода, участвующих в кольце (см.



 При ее поражении наблюдается гибель нейронов, уменьшение объема головного мозга, нарушение деятельности жизненно важных нервных центров, заканчивающиеся их параличом и в конце концов гибелью больного.
При ее поражении наблюдается гибель нейронов, уменьшение объема головного мозга, нарушение деятельности жизненно важных нервных центров, заканчивающиеся их параличом и в конце концов гибелью больного.