Токсокароз IgG | Клинико-диагностические лаборатории «ОЛИМП»
Токсокароз – паразитарное заболевание, передающееся человеку только через животных, возбудителем которого является личинка круглых червей рода Toxocara canis. Общепринятым мнением является факт, что болезнь передается только через зараженных собак, о причастности кошек ведутся споры.
Человек заболевает следующим образом: больное животное выделяет в окружающую среду вместе с калом яйца паразитов. Человек из-за несоблюдения правил личной гигиены проглатывает частички зараженной почвы (например, при употреблении немытых фруктов). Далее происходит прикрепления яиц в тонком кишечнике, откуда вылупляются личинки. Личинки проникают через стенку кишечника в кровоток и попадают с током крови в печень, оттуда в сердце и затем разносятся по всему организму. Клиническая картина заболевания зависит от органа, в котором «застряла» личинка токсокары. В организме человека из личинок токсокар половозрелые особи не образуются и паразиты не могут размножаться.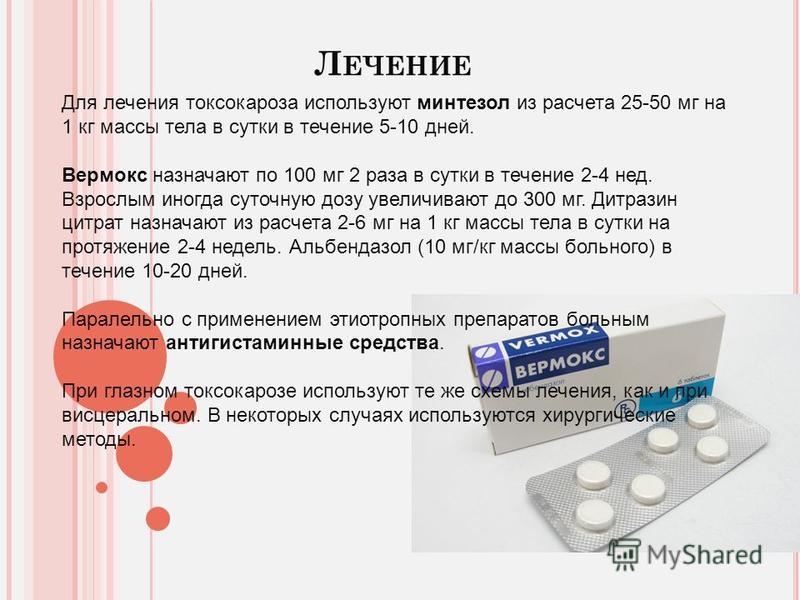
Токсокароз имеет широкую распространенность в связи с биологическими особенностями возбудителя. Половозрелая особь живет 4-6 месяцев. Ежедневно откладывает около 200 тысяч яиц. По проведенным исследованиям из 42 000 обследованных собак по всему миру 15,2% были заражены токсокарозом. В пробе почв обнаруживается личинки токсокар в 1-60% случаев в зависимости от климатических условий окружающей среды (чем холоднее – тем меньше обсемененность). Например, в Москве 8,5% проб почвы оказались зараженными. В США (Markell and Voge’s Medical Parasitology, 2006) 5% детей страдают токсокарозом или 14% всего населения (Centers for Disease Control and Prevention, Division of Parasitic diseases, 2009). В России в 1999 году было выявлено 184 000 случаев токсокароза у детей до 14 лет и 366 000 старше 14 лет.
В групп риска входят:
- Дети;
- Работники, контактирующие с землей и животными;
- Владельцы огородов, домашних животных, в частности собак; охотники;
- Лица, у которых не всегда есть возможность соблюдать правила гигиены в силу особенностей проживания, условий труда, привычек.

Симптоматика токсокароза малоспецифична, зависит от количества и локализации возбудителя. Острое течение: Легочной синдром (от кашля до удушья), t=37-39 С, боли в животе, головные и мышечные боли, боли в животе, миокардит, панкреатит, судорожные припадки, высыпания на коже (по типу крапивницы). Хроническое течение: проявления затухают, отмечается склонность к аллергиям. Самое серьезное осложнение: связь с бронхиальной астмой.
«У всех больных токсокарозом выявлена неспецифическая гиперреактивность бронхов к метахолину, при этом только у больных токсокарозом с легочным синдромом имеется клинически выраженная и инструментально подтвержденная бронхиальная обструкция».
Особое внимание уделяется глазной токсокароза, который имеет следующие формы ( по Черненко, 1985г.):
- гранулемы в заднем отделе глаза;
- периферические гранулемы;
- увеит;
- парс-планит;
- хронический эндофтальмит;
- абсцесс в стекловидном теле;
- неврит зрительного нерва;
- кератит;
- мигрирующие личинки в стекловидном теле.

Особенностью диагностики является то, что стандартный метод микроскопии кала не может выявить личинки или яйца, так как паразит в теле человека не размножается!
Самым оптимальным является ИФА-метод диагностики токсокароза, который выявляет антитела класса IgG к личинкам Toxocara canis. Антитела – это компоненты иммунной системы организма, которые вырабатывается для уничтожения определенного чужеродного белка-антигена. В данном случае антигеном является личинка токсокары. Существует несколько разновидностей антител: IgA, IgD, IgE, IgG и IgM. Тем не менее, иммунитет не может справиться с паразитом даже при очень высокой концентрации антител. Каждому из перечисленных антител свойственна своя функция и свой период появления. IgG продуцируется через 15-20 дней после заражения и сохраняется в крови длительное время. Следовательно, обнаружение такого IgG в крови свидетельствует о хроническом течении токсокароза.
Читайте также: «ТОКСОКАРОЗ – ЛЕГКО ЗАРАЗИТЬСЯ, ТЯЖЕЛО ЗАПОДОЗРИТЬ…»
Токсокароз ≡ лечение и препараты для лечения токсокароза
Токсокароз
Токсокароз – паразитарная болезнь, вызываемая гельминтом токсокарой из группы круглых червей. Гельминтоз проявляется в форме лихорадки, хронического бронхита, пневмонии и прочих токсико-аллергических реакций. Для патологии характерно длительное рецидивирующее течение.
Гельминтоз проявляется в форме лихорадки, хронического бронхита, пневмонии и прочих токсико-аллергических реакций. Для патологии характерно длительное рецидивирующее течение.
Причины болезни
Механизм передачи токсокароза – фекально-оральный. Человек заглатывает яйца токсокар во время еды или питья. Инфицирование возможно, если продукты не были обработаны должным образом или же если пациент пренебрегает мытьем рук перед едой. Заразиться можно при контакте с больным животным: собакой или котом.
При попадании в организм человека возбудитель достигает личиночной стадии и паразитирует в тканях и кровотоке носителя. При кишечной форме возбудитель токсокароза достигает половозрелой стадии развития и начинает размножаться.
Инфицированию поддаются пациенты со слабой иммунной системой. Также могут пострадать люди с крепким иммунитетом, если в их организм попало слишком большое количество яиц токсокары.
Формы и симптомы
Токсокароз у человека может проявиться в двух формах:
- личиночная, которая протекает в тканях или поражает органы зрения
- имагинальная (половозрелая), развивающаяся в кишечнике
Симптомы личиночной формы:
- аллергические реакции в форме кожных высыпаний, зуда
- одутловатость лица
- лихорадочное состояние
- сильный кашель, удушье
- бронхопневмония
- гепатоспленомегалия
- эозинофилия
- поражение глаз (хориоретинит, кератит)
При личиночной форме у больного образуются гранулемы, содержащие личинки гельминта. Такие скопления могут появиться в любом из органов, поэтому у пациентов встречаются и другие симптомы, обусловленные локализацией образований. Большую опасность представляет миграция личинок в стекловидное тело – они могут привести к необратимому повреждению глаза.
Такие скопления могут появиться в любом из органов, поэтому у пациентов встречаются и другие симптомы, обусловленные локализацией образований. Большую опасность представляет миграция личинок в стекловидное тело – они могут привести к необратимому повреждению глаза.
Кишечный токсокароз у взрослых и детей встречается очень редко. Его симптомы – тошнота, отсутствие аппетита, обильное слюноотделение, боли в животе.
Кто чаще болеет?
Чаще всего заболевание встречается у детей от года до 4 лет. Именно в этом возрасте ребенок активно познает мир и тянет в рот все, что попадется. К тому же дети любят гладить кошек и собак, которые могут быть переносчиками токсокары.
К группе риска также относятся взрослые, которые работают с животными: ветеринары, сотрудники груминг-салонов, кинологи, волонтеры из приютов для бездомных животных и т. д. Сюда же можно отнести специалистов и исполнителей, работающих в сельскохозяйственной сфере.
Диагностика заболевания
Постановка диагноза не вызывает затруднений. Врач изучает клиническую картину, проводит осмотр и опрос. Для подтверждения диагноза необходимы анализы: в лаборатории исследуют сыворотку крови пациента на наличие титров антител.
Врач изучает клиническую картину, проводит осмотр и опрос. Для подтверждения диагноза необходимы анализы: в лаборатории исследуют сыворотку крови пациента на наличие титров антител.
Как лечить?
При своевременном начале лечения прогноз для всех форм заражения благоприятный. Терапия заключается в систематическом приеме медпрепаратов.
Препараты от токсокароза
При легких формах противопаразитарные препараты не прописывают. В таких случаях с паразитами справляется иммунная система, а в помощь пациенту назначают лишь антигистаминные (Диазолин и др.) и дезинтоксикационные средства (Аллохол, Энтеросгель, Полисорб).
При средней и тяжелой формах заболеваний необходимы противопаразитарные препараты: Альдазол, Вормил, Зентел. Для лечения кишечной формы используют Пирантел и Левамизол.
Во время приема противопаразитарных препаратов нужен контроль за состоянием печени.
Острый токсокароз у детей лечат в условиях стационара под постоянным наблюдением врача.
После излечения рекомендуется наблюдение в течение 6-12 месяцев. В этот период пациенты несколько раз сдают анализы, по итогам которых определяют окончательное выздоровление.
Профилактические меры
Лучший способ уберечься от инфицирования – строгое соблюдение правил личной гигиены. Очень важно мыть руки перед едой, особенно после контактов с животными. Хозяевам домашних животных нужно соблюдать график дегельминтизации.
Необходимо тщательно мыть фрукты и овощи, особенно те, которые контактировали с почвой (зелень, ягоды, корнеплоды).
Доля ответственности за профилактику заболевания лежит на административных структурах. На них возлагается обязанность обеспечить чистоту на улицах, организовать уборку собачьих фекалий, выделить специальные места для выгула домашних животных, контролировать численность бродячих собак.
Какие могут быть осложнения?
Тяжелые формы токсокароза без должного лечения могут привести к серьезным последствиям. У пациентов могут развиться:
У пациентов могут развиться:
- хроническая бронхопневмония, сопровождающаяся мучительными приступами кашля, удушья
- бронхиальная астма
- гнойный абсцесс в одном/нескольких органах
- сердечная недостаточность
- гепатит
- менингит и др
При глазном токсокарозе возможна потеря зрения. При тяжелых иммунодефицитах (СПИД) поражение токсокарой может привести к летальному исходу. Смерть происходит вследствие обширной инвазии.
Список использованной литературы
Паразитарные болезни человека (протозоозы и гельминтозы) / В.П. Сергиев, Ю.В. Лобзин, С.С. Козлов. — СПб: Фолиант, 2011. — С. 463-468.
В.С. Ершов и др. Паразитология и инвазионные болезни сельскохозяйственных животных. — М., 1959. — 492 с.
Популярные вопросы про токсокароз
Какие симптомы при токсокарозе?
Инфицирование личинками круглых червей проявляется в форме аллергических и токсикологических реакций. Чаще всего у пациентов страдают бронхи и легкие.
Как вывести из организма человека токсокароз?
Чтобы вывести паразитов, нужно принимать лекарство от токсокароза. Препарат и дозировку назначает лечащий врач. Помимо противопаразитарных препаратов пациентам показаны антиаллергенные и дезинтоксикационные средства.
Как долго живет токсокара у человека?
Пребывание гельминтов в гранулемах ограничивает возможности иммунной системы, поэтому личинки паразита сохраняют жизнеспособность длительное время.
Что такое токсокароз?
Токсокароз – инфицирование гельминтами из класса круглых червей. Токсокара, как правило, поражает домашних животных, от которых, в свою очередь, заражаются люди. Средние и тяжелые формы болезни требуют медикаментозного лечения.
Внимание! Карта симптомов предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. Наш сайт не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Наш сайт не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Глазной токсокароз
Паразиты рода Toxocara — нематоды (круглые черви). Их основные хозяева — это собаки для Toxocara canis и кошки для Toxocara cati. Наряду с грызунами промежуточным хозяином может оказаться и человек.
Исследования распространенности показали, что в западных странах токсокарозом в любой форме больны 2–5 % городских жителей и 14,2–37 % сельских. Показатели распространенности заболевания для стран с тропическим климатом превышают 60 %.
Собаки и кошки заражаются токсокарозом в возрасте до пяти недель, когда их иммунитет еще слаб. Личинка паразита попадает в организм щенков преимущественно через плаценту, а котят — при кормлении молоком. В обоих случаях мать должна быть носителем личинки паразита, то есть промежуточным хозяином. До наступления беременности личинка находится в тканях организма в дремлющем состоянии, а затем активируется за счет изменения гормонального фона.
В тонком кишечнике своего основного хозяина личинка развивается в половозрелого паразита. Самки токсокар способны откладывать до 200 000 яиц в сутки. Эти неактивные яйца попадают во внешнюю среду вместе с фекалиями и лишь потом становятся заразными (инвазионными).
В работе «Toxocara eggs in public places worldwide — A systematic review and meta-analysis» международная команда ученых исследовала распространенность яиц Toxocara в общественных местах по всему миру, в том числе на пляжах, в парках и на детских площадках. Для этого они провели системный обзор и мета-анализ литературы, которая появилась в международных базах данных до 20 апреля 2018 года. Оказалось, что суммарное распространение составляет 21 %.
Чтобы заразиться токсокарозом, человек должен проглотить инвазионное яйцо паразита T. canis или T. cati. Яйцо может попасть в организм человека с частицами земли на плохо вымытых овощах или после контакта с заразным животным.
После вылупления в кишечнике личинка начинает передвижение по организму промежуточного хозяина — соматическая миграция. Пройдя слизистую оболочку стенки кишечника, личинка попадает в кровяное русло, которое приведет ее в левый желудочек сердца, а оттуда уже в капилляры и ткани. В тканях печени, легких, сердца, глаза и мозга паразит может осесть на многие месяцы и даже годы.
Пройдя слизистую оболочку стенки кишечника, личинка попадает в кровяное русло, которое приведет ее в левый желудочек сердца, а оттуда уже в капилляры и ткани. В тканях печени, легких, сердца, глаза и мозга паразит может осесть на многие месяцы и даже годы.
Соматическая миграция личинок не проходит бесследно. Они оставляют за собой геморрагии, некрозы, очаги воспаления. Личинки также могут периодически возобновлять миграцию.
Наш иммунитет способен бороться с паразитом. Основную роль в этой борьбе играют клетки иммунной системы — эозинофилы. Им неизменно сопутствует иммуноглобулин Е (IgE). Поэтому при токсокарозе и других гельминтозах их уровень повышен. Иммунный ответ вызывается экскреторно-секреторным антигеном TES-Ag, который личинка выделяет во время соматической миграции.
Предполагается, что личинки могут быть уничтожены и в печени, куда они попадают как в ловушку на пути миграции. Об этом свидетельствует повышенный уровень фермента гамма-глутамилтрансферазы у пациентов, инфицированных токсокарозом. Уровень содержания эозинофилов в крови этих же пациентов не отклоняется от нормы.
Уровень содержания эозинофилов в крови этих же пациентов не отклоняется от нормы.
Клинические проявления
Глазным токсокарозом чаще болеют дети и подростки, чем взрослые. Обычно лишь одна личинка находится в одном глазу. Оба глаза поражены редко. Так как личинка небольшая и всего одна, диагностировать болезнь бывает трудно.
Есть два основных проявления глазного токсокароза: эндофтальмиты и солитарные гранулемы в разных анатомических структурах глаза.
Эндофтальмит — это гнойное воспаление внутренних оболочек глаза. Оно характеризуется видимым воспалением, резкой болью в глазу и снижением остроты зрения вплоть до его потери. В тяжелых случаях приходится удалять глазное яблоко полностью.
Для токсокароза характерны воспалительные состояния сосудистой оболочки глаза — увеиты. В зависимости от пораженной анатомической структуры увеиты выделяют следующие четыре группы: передний увеит, промежуточный увеит, задний увеит и панувеит.
Передний увеит. Воспаление может быть ограничено двумя анатомическими структурами: радужной оболочкой (ирит) или радужной оболочкой и цилиарным телом (иридоциклит).
Воспаление может быть ограничено двумя анатомическими структурами: радужной оболочкой (ирит) или радужной оболочкой и цилиарным телом (иридоциклит).
Симптомы переднего увеита иногда проявляются в острой стадии глазного токсокароза. На задней поверхности роговицы появляются отложения (преципитаты), на дне передней камеры глаза оседают лейкоциты (гипопион).
Рисунок 1 | Преципитаты на задней поверхности роговицы.
Промежуточный увеит. Воспалительные изменения происходят в стекловидном теле (витреит). На периферии сетчатки и в области плоской части цилиарного тела pars plana можно наблюдать скопления воспалительных клеток, так называемый беловатый экссудат в виде «снежных шаров» (англ. snowballs).
Рисунок 2 | Снежные шары в стекловидном теле.
Задний увеит. Характерно воспаление сосудистой оболочки (хориоидеи) задней части глаза (хориоидит), иногда в воспалительный процесс вовлечена и сетчатка (хориоретинит). Острота зрения снижается, появляются боли в глазу и его видимые покраснения.
Острота зрения снижается, появляются боли в глазу и его видимые покраснения.
Панувеит. Воспалительный процесс затрагивает почти все структуры глаза. При токсокарозе встречается редко.
Также глазной токсокароз проявляется в виде солитарных (одиночных) гранулем. Это воспаления в виде узелков в различных частях глаза. Периферические гранулемы развиваются, когда личинка находится в сосудах на периферии сетчатки. Часто встречаются гранулемы заднего полюса.
Диагностика
Лабораторные исследования — наиболее надежный способ диагностики глазного токсокароза. Для этого заболевания характерно повышенное содержание IgE, а эозинофилия может отсутствовать.
Обычно определяют уровень эозинофилов и содержание иммуноглобулина Е в сыворотке крови. Для этого проводят серологические реакции с антигеном TES-Ag. Однако титр специфических антител выше в жидкостях глаза, чем в сыворотке крови. Поэтому для более точной диагностики глазного токсокароза лучше использовать жидкость передней камеры глаза и биоптат стекловидного тела.
На основе одних лишь положительных результатов лабораторных исследований нельзя поставить точный диагноз. Чтобы назначить лечение от глазного токсокароза, нужно учитывать три фактора: результаты анализов, клинические симптомы и наличие контакта с носителем паразита (из анамнеза).
Подвижную личинку иногда удается обнаружить при осмотре глазного дна. Однако этот способ используется редко, так как скорее всего обнаружить паразита таким образом не получится попросту из-за его малого размера.
Лечение
Контролируемые клинические испытания препаратов для лечения глазного токсокароза пока не проводились. Поэтому единого принятого лечения не существует. Основное медикаментозное лечение — это применение кортикостероидов. Они эффективны для уменьшения воспаления и предотвращают серьезные повреждения глаза.
Если этого недостаточно, врач назначает глистогонные средства. Самыми эффективными на практике считаются производные бензимидазола. Например, мебендазол. Кортикостероиды подавляют действие этих препаратов, поэтому их не следует принимать одновременно.
Кортикостероиды подавляют действие этих препаратов, поэтому их не следует принимать одновременно.
Есть и физические методы лечения. Лазерная фотокоагуляция может быть полезна, если известно место нахождения личинки в глазном яблоке.
Для удаления гранулем используется криоретинопексия.
Источники:
-
Bogitsch, Burton J. Human parasitology // Elsevier Inc. – 2005.
-
Matthews, Bernard E. An Introduction into Parasitology // Cambridge University press. – 1998.
-
Шлоте Т. Атлас по офтальмологии // МЕДпресс-информ. – 2010. – С. 136-144.
-
Сенченко Н. Я. Увеиты // ГЭОТАР-Медиа. – 2010. – С. 101-105.
-
Jean-Francois Magnaval et al. Highlights of human toxocariasis. – 2001. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2721060/
-
Fakhri Y. et al. Toxocara eggs in public places worldwide — A systematic review and meta-analysis.
 – 2018. https://www.sciencedirect.com/science/article/pii/S0269749118326708#!
– 2018. https://www.sciencedirect.com/science/article/pii/S0269749118326708#!
Антитела IgG к токсокаре | Новая диагностика
Токсокароз (Toxocariasis) — это инфекция, вызванная паразитом рода Toxocara семейства аскарид (как правило, Тохосатcanis и редко — Тохосатcаti). Заболевание возникает через заглатывание почвы, загрязненной яйцами эмбрионов паразита, выделяемыми животными-хозяевами с фекалиями. Эмбриогенез происходит в почве (являются геогельминтами) в течение 2–5 недель после элиминации яиц животными. Таким образом, инфицирование людей происходит не в результате контакта свежими фекалиями. Собака является окончательным хозяином Тохосаrcanis. Собака заражается несколькими способами: через заглатывание яиц-эмбрионов, трансплацентарно, или при кормлении молоком детенышей инфицированной самкой. Непосредственным результатом является массовое загрязнение почвы яйцами и тем самым увеличивается риск заражения. Проблема загрязнения окружающей среды яйцами Тохосаr и питание с нарушением правил гигиены способствует распространению инфекции. У детей главным источником инфекции является игровая площадка, куда имеют доступ животные. В таких случаях человек является промежуточным случайным и нетипичным хозяином. В кишечнике личинки выходят из оболочки, проникают в стенку и мигрируют в кровоток, начиная околокишечный цикл. Во время миграции через печень, легкие, почки, мышцы, ЦНС, глаза реакция организма предотвращает развитие личинки, которые достигают так называемый «тупик паразита», инактивируются, а затем разрушаются и подвергаются резорбции. По этой причине инфицированные лица не могут передавать инфекцию другим. Клинические и патологические проявления, сопровождающиеся местными и общими реакциями организма, при наличии личинок других видов аскарид, иных, чем обычно, паразитируют в организме человека, представляют так называемый синдром висцеральной Ларва Мигранс. Клинические проявления зависят от количественной инфицированности паразитом и возраста хозяина. Многие инфекции протекают бессимптомно, только эозинофилия в общем анализе крови является единственным показателем.
У детей главным источником инфекции является игровая площадка, куда имеют доступ животные. В таких случаях человек является промежуточным случайным и нетипичным хозяином. В кишечнике личинки выходят из оболочки, проникают в стенку и мигрируют в кровоток, начиная околокишечный цикл. Во время миграции через печень, легкие, почки, мышцы, ЦНС, глаза реакция организма предотвращает развитие личинки, которые достигают так называемый «тупик паразита», инактивируются, а затем разрушаются и подвергаются резорбции. По этой причине инфицированные лица не могут передавать инфекцию другим. Клинические и патологические проявления, сопровождающиеся местными и общими реакциями организма, при наличии личинок других видов аскарид, иных, чем обычно, паразитируют в организме человека, представляют так называемый синдром висцеральной Ларва Мигранс. Клинические проявления зависят от количественной инфицированности паразитом и возраста хозяина. Многие инфекции протекают бессимптомно, только эозинофилия в общем анализе крови является единственным показателем. Симптомы появляются, в основном, при состояниях, при которых гибнут личинки. Смерть личинок обуславливают реакции гиперчувствительности немедленного типа и позднего типа, с формированием гранулем с участием эозинофилов. В этих случаях периферичнаяэозинофилия может достигать 70–80%. Также могут наблюдаться увеличения уровня сывороточного IgE.
Симптомы появляются, в основном, при состояниях, при которых гибнут личинки. Смерть личинок обуславливают реакции гиперчувствительности немедленного типа и позднего типа, с формированием гранулем с участием эозинофилов. В этих случаях периферичнаяэозинофилия может достигать 70–80%. Также могут наблюдаться увеличения уровня сывороточного IgE.
Наиболее распространенными клиническими формами являются:
— аллергические проявления;
— легочные поражения: кашель, одышка, субфебрилитет, рентгенограмма с застойными инфильтративными и миграционными процессами;
— печеночные поражения: боли в печеночном ложе, гепатомегалия, ано-рексия, тошнота, лихорадка;
— поражения глаз (самые тяжелые): увеит, нейроретинит, неврит зрительного нерва, —
гранулематозные поражения сетчатки, отслоение сетчатки.
Не существует окончательного метода диагностики инфекций Тохосаrа, а истинная чувствительность и специфичность серологических тестов не могут быть обусловлены точностью. Постановка диагноза осложняется изменчивостью гуморального иммунного ответа, который зависит от инфицированности паразитами и локализации инфекции. Однако многочисленные исследования показывают, что иммуноферментные тесты, которые используют очищенный антиген, выделенный из личиночной стадии, обладают значительно лучшей чувствительностью и специфичностью, по сравнению с другими тестами, использующими необработанные антигены.
Постановка диагноза осложняется изменчивостью гуморального иммунного ответа, который зависит от инфицированности паразитами и локализации инфекции. Однако многочисленные исследования показывают, что иммуноферментные тесты, которые используют очищенный антиген, выделенный из личиночной стадии, обладают значительно лучшей чувствительностью и специфичностью, по сравнению с другими тестами, использующими необработанные антигены.
Анализы в KDL. Антитела к токсокарам (Toxocara canis), IgG
Токсокароз – широко распространенное паразитарное заболевание, вызываемое личинками круглых червей Toxocara canis. Окончательный хозяин в цикле развития токсокар – собаки и другие представители семейства псовых (лисы, волки), в их организме гельминт размножается и выделяет яйца, которые попадают в окружающую среду. Человек заражается при проглатывании яиц с водой, почвой, пищей или при контакте с шерстью зараженных животных. Из яиц созревают личинки, которые проникают через стенку кишечника в кровеносное русло и распространяются по сосудам в различные органы и ткани (симптом «блуждающей личинки), что обуславливает разнообразие клинических проявлений. При токсокарозе возможно повышение температуры тела, увеличение лимфоузлов, кожная сыпь по типу крапивницы, приступы бронхиальной астмы, диспепсические расстройства, увеличение печени и селезенки, поражение нервной системы. Отдельно выделяют глазную форму токсокароза. Степень клинических симптомов варьирует от скрытых до тяжелых форм заболевания. Характерный лабораторный признак – высокий уровень эозинофилов в клиническом анализе крови с лейкоцитарной формулой. В кале яйца токсокар при личиночной форме заболевания не определяются, т.к личинки в организме человека не дозревают до стадии размножения.
При токсокарозе возможно повышение температуры тела, увеличение лимфоузлов, кожная сыпь по типу крапивницы, приступы бронхиальной астмы, диспепсические расстройства, увеличение печени и селезенки, поражение нервной системы. Отдельно выделяют глазную форму токсокароза. Степень клинических симптомов варьирует от скрытых до тяжелых форм заболевания. Характерный лабораторный признак – высокий уровень эозинофилов в клиническом анализе крови с лейкоцитарной формулой. В кале яйца токсокар при личиночной форме заболевания не определяются, т.к личинки в организме человека не дозревают до стадии размножения.
Очень редко у человека возникает имагинальная форма токсокароза, когда происходит заражение более зрелыми личинками, способными дозреть до половозрелой особи в организме человека. Клинически проявляется различными кишечными расстройствами. В таком случае можно обнаружить яйца токсокар при исследовании кала.
Антитела к токсокарам (Toxocara canis), IgG вырабатываются через 6-8 недель от момента попадания личинок токсокар в организм человека, являются маркерами хронической или перенесенной инфекции. Определение IgG к токсокарам используют как подтверждающий тест в составе комплексной диагностики личиночной формы заболевания наряду с клиникой, наличием повышенного числа эозинофилов в крови Наличие антител при отсутствии клиники и высоком уровне эозинофилов может расцениваться как токсокароносительство.
Определение IgG к токсокарам используют как подтверждающий тест в составе комплексной диагностики личиночной формы заболевания наряду с клиникой, наличием повышенного числа эозинофилов в крови Наличие антител при отсутствии клиники и высоком уровне эозинофилов может расцениваться как токсокароносительство.
В каких случаях обычно назначают исследование на определение уровня антител к токсокарам IgG?
- при подозрении на токсокароз по клиническим проявлениям – для подтверждения личиночной формы токсокароза
- при выявлении высокого уровня эозинофилов – для дифференциальной диагностики глистных инвазий
- По эпидемиологическим показаниям
Что означают результаты теста?
Референсные значения:
- <1 — результат отрицательный
- 1-4,3 — результат слабоположительный
- >=4,4 — результат положительный
Результат <1 — антитела не обнаружены
- Отсутствие инвазии токсокарами.

- Или сдача анализа в ранний период токсокароза, когда ещё не успели выработаться IgG (при наличии клиники).
Результат >=4,4 — антитела обнаружены
- Текущий токсокароз – при наличии клинических признаков, эпиданамнеза, уровне эозинофилии более 10%.
- Перенесенный токсокароз.
- На основании только определения IgG невозможно достоверно определить давность инфекции.
Результат в интервале от 1 до 4,3 — слабоположительный результат.
- При эозинофилии до 10% вероятно токсокароносительство
Сроки выполнения теста.
3-4 дня
Как подготовиться к анализу?
Можно сдать кровь утром натощак или в течение дня через 3 часа после необильного приёма пищи.
Лечение остеопороза
Лечение остеопороза направлено на снижение риска переломов; изменение образа жизни пациента и снижение частоты падений имеет здесь очень большую роль. К сожалению, обычно все внимание уделяется фармакотерапии, а вопросы физических упражнений и профилактики падений не поднимаются. Профилактика переломов наиболее эффективна тогда, когда рассматриваются как внутренние факторы, так и внешние условия. По возможности, следует ограничить прием седативных препаратов, рекомендовать регулярные физические упражнения, информировать о изменении внешних условий (установка дополнительных опор в квартире, устранение таких помех, как провода на полу, загибающиеся коврики и др.). Помимо этого, целесообразно рекомендовать пациенту носить ортопедическую защиту тазобедренного сустава, которая эффективно перераспределяет векторы сил при падении.
Профилактика переломов наиболее эффективна тогда, когда рассматриваются как внутренние факторы, так и внешние условия. По возможности, следует ограничить прием седативных препаратов, рекомендовать регулярные физические упражнения, информировать о изменении внешних условий (установка дополнительных опор в квартире, устранение таких помех, как провода на полу, загибающиеся коврики и др.). Помимо этого, целесообразно рекомендовать пациенту носить ортопедическую защиту тазобедренного сустава, которая эффективно перераспределяет векторы сил при падении.
У пациентов с остеопорозом эффективны программы по улучшению баланса (тренировка равновесия), позы и силы. Физические упражнения снижают риск падений у пожилых пациентов на 47% [Gehrig et al., 2008]. При выполнении физических упражнений нужно быть осторожным и учитывать вероятность остеопорозного перелома, поэтому пациентам с диагностированным остеопорозом противопоказаны высокоинтенсивные упражнения из положения стоя и прыжки.
Лекарственная терапия остеопороза
Назначение добавок цитрата или карбоната кальция и витамина Д необходимо всем пациентам с системным остеопорозом, однако обязательным является назначение антирезорбтивной или анаболической терапии. Препаратами первой линии для лечения остеопороза были и остаются бисфосфонаты (главный эффект – антирезорбтивное действие), в российские и европейские рекомендации в качестве препарата первой линии включен и ранелат стронция, в американские – терипаратид, поскольку именно эти группы препаратов доказали снижение частоты вертебральных и других переломов у лиц с остеопорозом [Gehrig et al., 2008; Беневоленская, Лесняк, 2009; US National Osteoporosis Foundation, 2010]
Препаратами первой линии для лечения остеопороза были и остаются бисфосфонаты (главный эффект – антирезорбтивное действие), в российские и европейские рекомендации в качестве препарата первой линии включен и ранелат стронция, в американские – терипаратид, поскольку именно эти группы препаратов доказали снижение частоты вертебральных и других переломов у лиц с остеопорозом [Gehrig et al., 2008; Беневоленская, Лесняк, 2009; US National Osteoporosis Foundation, 2010]
Стронция ранелат (препарат широко используется в Европе, в том числе в России , но не зарегистрирован в США) доказал снижение частоты как первых, так и повторных вертебральных, вневертебральных переломов, включая переломы шейки бедра у пациенток с постменопаузальным остеопорозом (Kanis J.A., Burlet N, Cooper C et al European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008). Изучается целесообразность использования комбинаций бисфосфонатов с ЗГТ или ралоксифеном, что может быть использовано при наличии показаний. Изолированное применение добавок кальция и витамина Д допустимо только с целью профилактики, но не лечения остеопороза.
Изолированное применение добавок кальция и витамина Д допустимо только с целью профилактики, но не лечения остеопороза.
Пациентам с остеопорозом показано длительное медикаментозное лечение. Терапия бисфосфонатами (Фосамакс, Бонвива, Акласта) или ранелатом стронция (Бивалос) проводится в течение 3-5 лет; эффективность лечения мониторируют с помощью ежегодной денситометрии и определения лабораторных маркеров костной резорбции и формации (костно-специфичная щелочная фосфатаза и остеокальцин, N-концевой телопептид коллагена 1 типа в моче (NTx) и C-концевой телопептид коллагена 1 типа в сыворотке). У пациентов с тяжелым остеопорозом (или с недостаточным ответом на терапию) после курса лечения антирезорбтивными агентами может быть эффективной анаболическая терапия паратиреоидным гормоном (терипаратид) [Gehrig et al., 2008; US National Osteoporosis Foundation, 2010; Kanis J.A., Burlet N, Cooper C et al European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008], к сожалению, в настоящее время в России малодоступным.
Кальцитонин (Миакальцик, Алостин) относится к препаратам с антирезорбтивным действием. Он эффективно ингибирует резорбцию кости путем снижения активности остеокластов, однако его эффект обратим и непостоянен. Назальный спрей кальцитонина в настоящее время рассматривается как препарат второй линии в лечении первичного остеопороза [Беневоленская, 2003; Gehrig et al., 2008; Беневоленская, Лесняк, 2009; US National Osteoporosis Foundation, 2010]. Тем не менее, в связи с анальгетическим эффектом при переломах позвонков он является препаратом выбора у пациентов с острым болевым синдромом в этой ситуации, а также у пациентов с хроническим болевым синдромом при наличии переломов позвонков в анамнезе. Кальцитонин также может использоваться для предотвращения потери костной массы у пациентов, получающих длительную системную терапию глюкокортикоидами.
Итак, основой фармакотерапии у пациента с системным остеопорозом является комбинация одного из препаратов первой линии (бисфофонат или ранелат стронция, при тяжелом остеопорозе – терипаратид) с активными формами витамина Д и карбонатом или цитратом кальция.
Литература:
1.Беневоленская Л.И. (ред). Руководство по остеопорозу. М., Бином, 2003
2.Беневоленская Л.И., Лесняк О.М. (ред). Остеопороз. Клинические рекомендации. / М.:ГЭОТАР-Медиа, 2009
3.Delmas P.D., Bjarnason N.H., Mitlak B.H. et al. Effects of raloxifene on bone mineral density, serum cholesterol concentrations, and uterine endometrium in postmenopausal women. N Engl J Med. 1997 Dec 4;337(23):1641-7)
4.Gehrig L., Lane J. O’Connor M. I. Osteoporosis: Management and Treatment Strategies for Orthopaedic Surgeons. J Bone Joint Surg Am. 2008; 90:1362-1374.
5.Kanis J.A., Burlet N, Cooper C et al European guidance for the diagnosis and management of osteoporosis in postmenopausal women, 2008
6.US National Osteoporosis Foundation. Clinician’s Guide to Prevention and Treatment of Osteoporosis – 2010
7.WHO Scientific Group on the Prevention and Management of Osteoporosis: report of a WHO scientific group. (WHO Technical Report series; 921) 2000.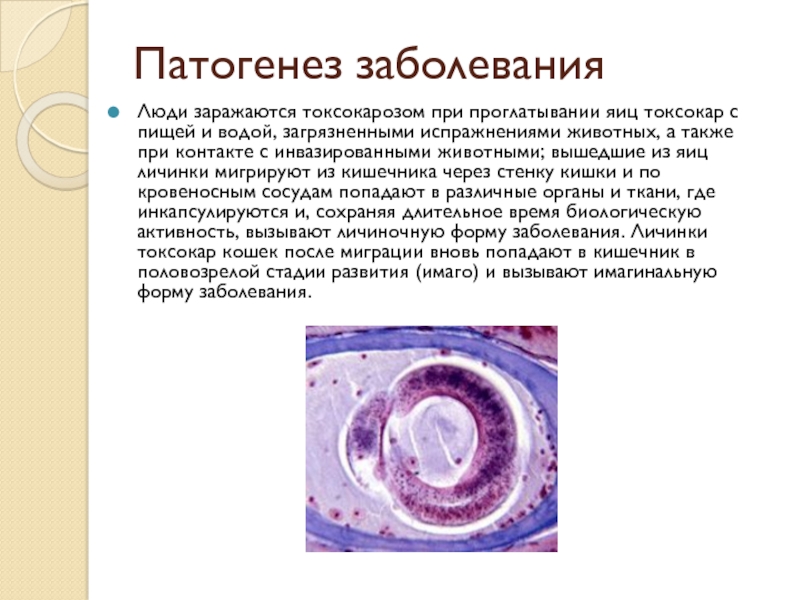 Geneva, Switzerland.
Geneva, Switzerland.
Глисты не только снижают иммунитет человека, все гельминты
ДОСЬЕ «КП»
Сергей Жаворонок, 66 лет, доктор медицинских наук, врач-инфекционист. Профессор кафедры инфекционных болезней БГМУ. Окончил Витебский государственный медуниверситет. С 1999 года — ректор Гомельского государственного мединститута. С января 2008-го — директор Республиканского методического центра по высшему и среднему медицинскому и фармацевтическому образованию. В 2011 — 2015 годах — первый проректор БГМУ. Подготовил свыше 35 докторов и кандидатов наук.
— Сергей Владимирович, в интернете куча страшилок про то, что глисты сжирают нас изнутри. Кому и когда стоит волноваться?
— В литературе описано более 200 видов глистов, которые могут быть у человека. В нашем регионе встречались около 20 видов. Глисты делятся на две большие группы: круглые и плоские, включая сосальщиков. Хотя бывают и исключительные ситуации. Например, недавно с коллегами обсуждали, что у пациента диагностировали дифиллоботриоз (широкий лентец) — глист растет в длину до 8 метров, притом что кишечник человека гораздо короче. Заражение — от сырой речной рыбы — чаще происходит в долине сибирских рек, где едят сырую строганину. От сырой рыбы заражаются собаки и другие животные (медведи, волки и др.), которые потом продолжают заражать все вокруг уже через фекалии, которые снова попадают в воду и через ракушек — в рыбу. Поэтому суши из сырой речной рыбы есть нельзя — попадая в организм, паразиты разрастаются на весь кишечник. Правда, дифиллоботриоз легко лечится. В литературе даже описаны случаи, когда японские женщины, чтобы похудеть, старались заразить себя этим паразитом. Он отъедался внутри организма, а похудевшие женщины потом от него избавлялись при помощи таблеток. Но находясь в организме, эти паразиты усиленно поглощают витамин В12, и у человека развивается пернициозная анемия.
Заражение — от сырой речной рыбы — чаще происходит в долине сибирских рек, где едят сырую строганину. От сырой рыбы заражаются собаки и другие животные (медведи, волки и др.), которые потом продолжают заражать все вокруг уже через фекалии, которые снова попадают в воду и через ракушек — в рыбу. Поэтому суши из сырой речной рыбы есть нельзя — попадая в организм, паразиты разрастаются на весь кишечник. Правда, дифиллоботриоз легко лечится. В литературе даже описаны случаи, когда японские женщины, чтобы похудеть, старались заразить себя этим паразитом. Он отъедался внутри организма, а похудевшие женщины потом от него избавлялись при помощи таблеток. Но находясь в организме, эти паразиты усиленно поглощают витамин В12, и у человека развивается пернициозная анемия.
«Нельзя есть даже соленую речную рыбу»
— Как понять, что в организме завелся паразит?
— Глисты хорошо приспособились: они вроде большие, но только в определенной фазе или только если находятся не в кишечнике, а в тканях, могут давать о себе знать.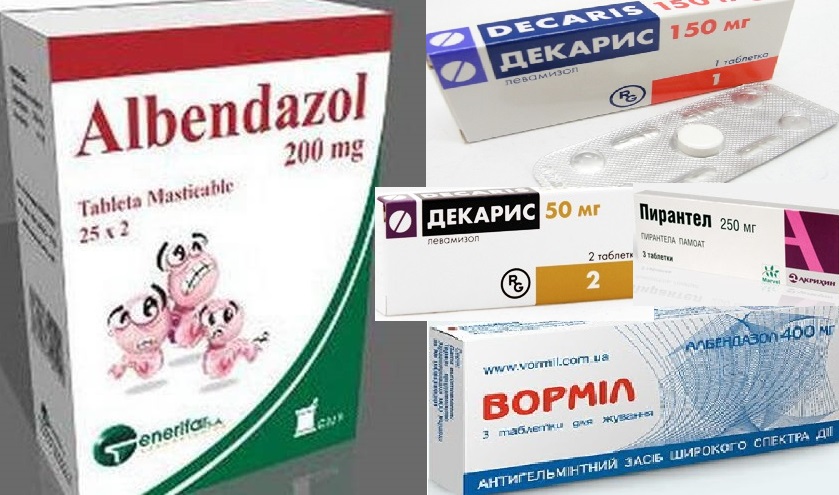 А так о них можно и не догадываться. Еще в наших краях появился описторхоз — это маленькие паразиты, которые тоже передаются с рыбой, но живут у человека в печени, в желчных ходах и вызывают холангит и холецистит. Во всех наших реках — Сож, Припять, Двина, Неман, Днепр — у рыб выявлен описторхоз. Так что сырую рыбу есть нельзя ни в коем случае.
А так о них можно и не догадываться. Еще в наших краях появился описторхоз — это маленькие паразиты, которые тоже передаются с рыбой, но живут у человека в печени, в желчных ходах и вызывают холангит и холецистит. Во всех наших реках — Сож, Припять, Двина, Неман, Днепр — у рыб выявлен описторхоз. Так что сырую рыбу есть нельзя ни в коем случае.
Сергей Жаворонок, доктор медицинских наук, врач-инфекционист
— Самим солить рыбу тоже нельзя?
— Чтобы такая рыба была безопасна, вначале ее придется сильно пересолить, а потом отмачивать от соли. Ведь паразиты в рыбе живые, и погибают они только от термической обработки или от очень большого количества соли. Если недосолить, они выживут, и заражение неизбежно. Помню, как ловили щуку, доставали ее икру и, чуть посолив, сразу ели. У меня есть слайд — на нем щучья икра, а на ней плероцеркоид (личинка ленточного глиста. — Ред.). Он небольшой, не зная, можно и не заметить. Из плоских гельминтов в Беларуси распространен бычий цепень, он живет в говядине, а это недожаренные шашлыки и люля-кебабы. Да, мясо должны проверять — делают специальные надрезы, но не всегда в этом надрезе можно обнаружить гельминт или его яйца. Животные заражаются от собак и других плотоядных, они переносчики паразитов. Бывает свиной цепень, тоже плоский и тоже растет до двух метров, причем быстро. Во время роста в организме человека от него отделяются небольшие членики — и тогда пациенты рано утром уже под кабинетом доктора. Если из человека вышел членик бычьего цепня, а он еще и шевелится, — люди пугаются: «Из меня кишечник живой вышел!» Они могут выходить из человека даже вне акта дефекации: проснулся, а там что-то в постели рядом шевелится, сантиметра два в длину. Лечение свиного цепня сложнее, чем бычьего. Если человека со свиным цепнем внутри неправильно лечить или если человек сам от себя заражается или других заразит через грязные руки, то развивается совсем другое заболевание — цистицеркоз. Паразиты проникают в ткани, мышцы, в глаз, а также в головной мозг человека. Проявляется клиника энцефалита — у человека начинается неадекватное поведение, боли, может возникнуть косоглазие, судороги — лечение должно быть оперативным.
Да, мясо должны проверять — делают специальные надрезы, но не всегда в этом надрезе можно обнаружить гельминт или его яйца. Животные заражаются от собак и других плотоядных, они переносчики паразитов. Бывает свиной цепень, тоже плоский и тоже растет до двух метров, причем быстро. Во время роста в организме человека от него отделяются небольшие членики — и тогда пациенты рано утром уже под кабинетом доктора. Если из человека вышел членик бычьего цепня, а он еще и шевелится, — люди пугаются: «Из меня кишечник живой вышел!» Они могут выходить из человека даже вне акта дефекации: проснулся, а там что-то в постели рядом шевелится, сантиметра два в длину. Лечение свиного цепня сложнее, чем бычьего. Если человека со свиным цепнем внутри неправильно лечить или если человек сам от себя заражается или других заразит через грязные руки, то развивается совсем другое заболевание — цистицеркоз. Паразиты проникают в ткани, мышцы, в глаз, а также в головной мозг человека. Проявляется клиника энцефалита — у человека начинается неадекватное поведение, боли, может возникнуть косоглазие, судороги — лечение должно быть оперативным.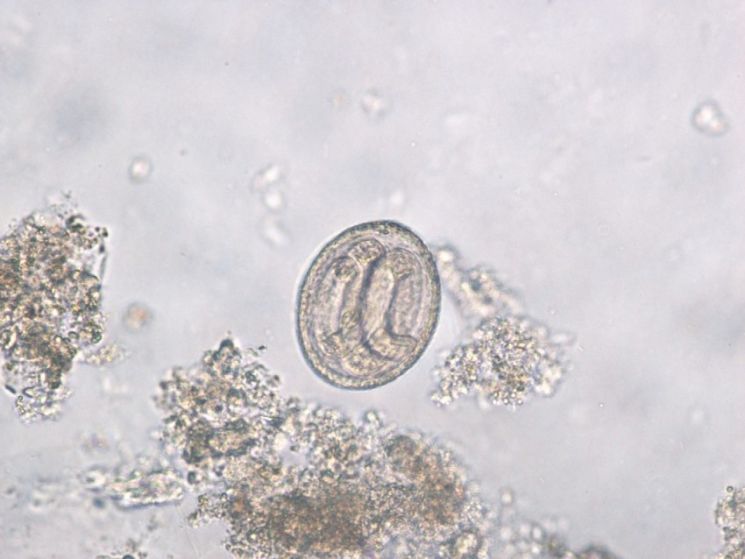 Причем такой человек может не есть мясо, а заразиться, например, от другого человека-носителя паразита. В моей практике был случай: коллега-профессор жаловался на головные боли в течение всей жизни. Оказалось, в детстве его лечили чесноком от ленточного гельминта. Лечили неправильно, последствия — головные боли на всю жизнь. Да и сейчас, как коснулось — а препарата от ленточных гельминтов в нашей стране в наличии нет. Он импортный, и его не поставляют — покупать массово его не будут, а ради разовых покупателей невыгодно оформлять на препарат регистрацию.
Причем такой человек может не есть мясо, а заразиться, например, от другого человека-носителя паразита. В моей практике был случай: коллега-профессор жаловался на головные боли в течение всей жизни. Оказалось, в детстве его лечили чесноком от ленточного гельминта. Лечили неправильно, последствия — головные боли на всю жизнь. Да и сейчас, как коснулось — а препарата от ленточных гельминтов в нашей стране в наличии нет. Он импортный, и его не поставляют — покупать массово его не будут, а ради разовых покупателей невыгодно оформлять на препарат регистрацию.Однажды пришла пациентка, которую раньше отправляли к психиатру, когда она говорила: «Доктор, у меня под кожей что-то ползет». Пока ходила к психиатрам, червь полз по предплечью через шею, вытянули его в районе глаза офтальмологи 10 городской клинической больницы. Эти гельминты похожи на тонкую подвижную медную проволоку под кожей, до 10 сантиметров в длину, человеку передаются от собак, волков через комаров. В месте, где он ползет, бывает припухлость. Такие случаи были в Полоцком районе, в Орше, в бассейне Припяти.
Такие случаи были в Полоцком районе, в Орше, в бассейне Припяти.
«У ребенка может начаться аллергический кашель»
— Некоторые врачи говорят, что гельминтов можно и не обнаружить при помощи анализа кала или крови. Иногда люди обращаются к околомедицинским способам выявления и лечения гельминтов…
— Парамедицинские методы — это обман и способы увода денег. Знаю случаи, когда по пальцу при помощи какого-то препарата человеку диагностировали множество гельминтов. У меня ответ один — только лабораторная диагностика, анализ кала на яйца глистов, не крови. Анализ крови показывает наличие антител — а это может означать не только наличие глистов в организме, но и то, что когда-то этот паразит в организме этого человека присутствовал. А есть сейчас или нет — может подтвердить только анализ кала на яйца глистов. Для достоверности можно сдать его несколько раз, чтобы точно подтвердить или исключить положительный результат.
Через собак человеку передается одно очень распространенное заболевание — токсокароз. Я, когда вижу, что собак выгуливают у детских песочниц или прямо в них — всегда делаю замечание. Многие не понимают — нельзя выгуливать собак рядом с песочницами! Особенно у молодых собак очень много токсокароза. Зеленой территории в Минске мало, собакам этим некуда деваться. Но ни в коем случае нельзя подпускать их к местам, где играют дети, особенно в песочницы. Через грязные руки яйца глистов попадают в организм, в кишечник, где буравят дырку, проникая в кровь. В этот период у ребенка может начинаться аллергический кашель вроде бронхиальной астмы. В крови повышаются эозинофилы, хотя анализ может быть в норме. Иногда гельминта могут обнаружить на рентгене.
Я, когда вижу, что собак выгуливают у детских песочниц или прямо в них — всегда делаю замечание. Многие не понимают — нельзя выгуливать собак рядом с песочницами! Особенно у молодых собак очень много токсокароза. Зеленой территории в Минске мало, собакам этим некуда деваться. Но ни в коем случае нельзя подпускать их к местам, где играют дети, особенно в песочницы. Через грязные руки яйца глистов попадают в организм, в кишечник, где буравят дырку, проникая в кровь. В этот период у ребенка может начинаться аллергический кашель вроде бронхиальной астмы. В крови повышаются эозинофилы, хотя анализ может быть в норме. Иногда гельминта могут обнаружить на рентгене.
Ни в коем случае нельзя подпускать собак к местам, где играют дети, — ведь через собак человеку передается токсокароз.
— Гельминты могут понижать иммунитет человека?
— Мало того что они понижают иммунитет, все гельминты онкогенные. Попадая в организм человека, гельминты активируют проонкогены. А через сколько-то лет это может выстрелить — поломка обернется онкологией.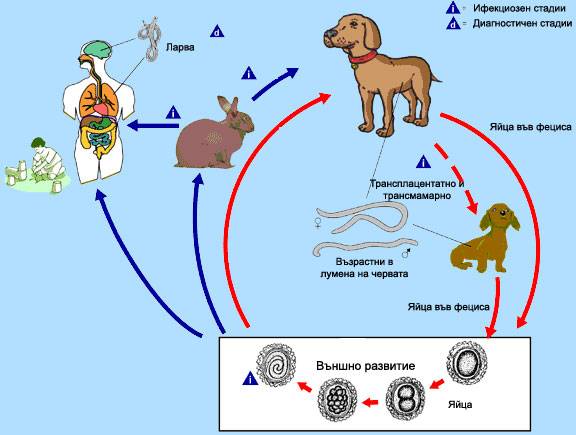 Например, трихинеллы живут во всех тканях, а поломки происходят в лимфоцитах. Подобным образом запускается онкогенез. Глисты стимулируют не только онкогенез, но и всевозможные аллергические заболевания. Бронхиальные астмы, поллинозы, крапивницы — все они тоже запускают механизмы, которые выстрелят впоследствии, не сразу.
Например, трихинеллы живут во всех тканях, а поломки происходят в лимфоцитах. Подобным образом запускается онкогенез. Глисты стимулируют не только онкогенез, но и всевозможные аллергические заболевания. Бронхиальные астмы, поллинозы, крапивницы — все они тоже запускают механизмы, которые выстрелят впоследствии, не сразу.
— Такие страшилки… Неудивительно, что некоторые пьют таблетки от глистов пару раз в год профилактически…
— Ни в коем случае нельзя пить такие таблетки профилактически. Есть сильные препараты, которые нельзя давать беременным, маленьким детям, они все токсичны и тоже вызывают аллергические реакции. Собакам и другим животным для профилактики давать можно, людям — нет. Сначала диагностика — и только потом лекарство.
«Зуд купальщиков некоторым внешне напоминает герпес»
— В Беларуси порой запрещают купаться в водоемах — тоже из-за глистов?
— Обычно из-за кишечной палочки, но она работает как маркер. Значит, и другие инфекционные агенты, в том числе яйца глистов, там будут. К тому же они из-за липидной (жировой) оболочки всплывают на поверхность водоема и плавают сверху — таким образом заражая людей. Причем происходит заражение не только гельминтами, но также вирусами и бактериями. Еще бывает зуд купальщиков — утиный шистосомоз, на Нарочи не так давно подняли шум из-за этого. Чаще всего его переносят утки, в венах которых живут шистосомы, иногда так бывает и у людей. Шистосомы выходят в воду из вен заднего прохода уток, заражая воду. Очень плохо, когда их начинают подкармливать с берега в районе пляжа, чего ни в коем случае нельзя делать. Попадая в воду, шистосомы проходят цикл развития в улитках, а затем по ошибке вместо уток нападают на купальщиков — пробуравливают кожу, но дальше не идут. На коже образуются, как при ветрянке, нагнаивающиеся пузыри. В районе пляжей не должно быть не только уток, но и растительности, на которой живут улитки.
К тому же они из-за липидной (жировой) оболочки всплывают на поверхность водоема и плавают сверху — таким образом заражая людей. Причем происходит заражение не только гельминтами, но также вирусами и бактериями. Еще бывает зуд купальщиков — утиный шистосомоз, на Нарочи не так давно подняли шум из-за этого. Чаще всего его переносят утки, в венах которых живут шистосомы, иногда так бывает и у людей. Шистосомы выходят в воду из вен заднего прохода уток, заражая воду. Очень плохо, когда их начинают подкармливать с берега в районе пляжа, чего ни в коем случае нельзя делать. Попадая в воду, шистосомы проходят цикл развития в улитках, а затем по ошибке вместо уток нападают на купальщиков — пробуравливают кожу, но дальше не идут. На коже образуются, как при ветрянке, нагнаивающиеся пузыри. В районе пляжей не должно быть не только уток, но и растительности, на которой живут улитки.
— Внешне эти пузыри на коже похожи на герпес?
— Да, только не так болит, как чешется. Называется зуд купальщиков. Со временем проходит сам, но чтобы не было нагноения, можно смазать зеленкой.
Иногда гельминтов завозят из жарких стран (для паразитов важно находиться в тепле). Да, плохо, что нам зимой не хватает тепла, но хорошо, что некоторые насекомые благодаря холодным зимам до нас не долетают и благодаря морозам у нас нет некоторых глистных инвазий.
— Бывает самоизлечение от глистов?
— Бывает, они же не живут вечно. Если не будет автоинвазии, когда сам себя заразил, как бывало с острицами. Раньше было тотальное заражение в садах и школах: чесали попы и заражались при этом, заражая и всех вокруг. Сейчас вроде в школах чистота, уже нет этой кружки, привязанной к бачку, как раньше. Меняется снабжение, питание, менталитет — кишечных инфекций как таковых уже не стало. Студентам, бывает, даже нечего на занятиях показать. Но проблема все равно остается.
Суши из сырой речной рыбы употреблять в пищу очень опасно.
— Что любят или не любят глисты? Правда, что их можно вывести тыквенными семечками?
— Раньше так думали, но чтобы глисты вывести — нужно съесть килограмм семечек. Кто такое выдержит? Глисты не любят чеснок, горькое. А вот от сладкого, как некоторые считают, глисты не заводятся. Но оно им нравится, они же должны чем-то питаться. Лучшая профилактика — это гигиена: не пей воду из колодца и открытых источников, мой руки перед едой, особенно после работы с почвой. Собак держите отдельно от детских площадок, а детей — от песочниц, в которых гуляют собаки. Потому что диагнозы потом не все ставят, найти паразита сложно, они погибают и в головном мозге, и в глазу, во всех органах. Не только на коже, где их легко распознать по аллергической реакции.
— Но если они погибают — может, и ничего страшного для человека?
— Если паразиты попали в кровь — они уже везде, они заблудились в организме человека, и последствия непредсказуемы. Если погибают в головном мозге, в почке или печени — на МРТ или УЗИ можно увидеть горошинку непонятного происхождения, кисты, а это может наводить на ложный след. Многие кишечные глисты — вернее, их яйца — вначале попадают в кишечник, из яиц выходят мелкие личинки и, пробуравив стенку кишечника, попадают в кровь, затем с кровью проникают в легкие — они ищут кислород. Человек откашливает такую мокроту, культурный человек не будет плевать — значит, заглатывает, и таким образом происходит заражение самого себя. Такой путь проходят и наши аскариды.
Сейчас почти нет случаев, когда грядки поливают фекалиями. Раньше это было повсюду. А раз поливали фекалиями — значит, там возможно и заражение глистами, их яйца живут долго. Огурец-то помоют, а капусты, например, белокочанную или цветную, хорошенько вымыть сложно. Так что с малых лет, чтобы не кормить паразитов, важно знать нехитрые правила: руки, как и питьевая вода, должны быть чистые, сырые фрукты-овощи — тщательно вымыты, а остальная еда — термически обработана.
Автор: Татьяна Шахнович
Фото: Святослав Зоркий, Алексей Булатов, Михаил Фролов
Комсомольская правда в Белоруссии, 25 сентября 2019
Основные характеристики токсокароза человека
Лекарственные препараты
Несмотря на то, что на животных моделях было протестировано множество антигельминтных средств, контролируемые рандомизированные исследования на людях проводились редко, поэтому для лечения человеческого заболевания доступно очень мало лекарств.
Производные бензимидазола включают тиабендазол (TBZ), мебендазол (MBZ) и альбендазол (ABZ) в зависимости от стажа работы.
Когда TBZ вводился перорально каждый день в дозах от 25 мг / кг ч / м (Magnaval and Charlet, 1987) до 50 мг / кг ч / м (Bass et al., 1987; Sturchler et al., 1989) в течение 3-7 дней, улучшение клинических проявлений было обнаружено у 50% (Magnaval and Charlet, 1987) до 53% (Sturchler et al., 1989). Побочные эффекты, включающие головокружение, тошноту и рвоту, наблюдались у 50% (Magnaval and Charlet, 1987) и 60% (Sturchler et al., 1989).
Что касается MBZ, то наилучшая схема лечения составляла 20-25 мг / кг ч / б ежедневно в течение 3 недель, что привело к снижению клинических проявлений на 70%.Побочные эффекты, включающие слабость, головокружение, тошноту, боль в животе и желудке, были легкими и наблюдались у 17% пациентов (Magnaval, 1995).
При введении ABZ в дозе 10 мг / кг ч / б ежедневно в течение 5 дней клиническое улучшение было обнаружено у 47% пациентов с токсокарозом (Stürchler et al., 1989). Шестьдесят процентов пациентов жаловались на незначительные побочные эффекты. Несмотря на эти неоднозначные результаты, обзор недавней литературы обнаружил многочисленные анекдотические сообщения, свидетельствующие о том, что ABZ стал широко используемым лекарством для лечения токсокароза, возможно, из-за его широкой доступности в большинстве стран.
И MBZ, и ABZ плохо всасываются из желудочно-кишечного тракта, и их следует вводить с жирной пищей.
Диэтилкарбамазин, или ДЭК, был основой химиотерапии филяриатоза с 1949 года. Механизм действия сложен и до сих пор частично неизвестен. При филяриозах он включает усиление как присоединения, так и цитотоксичности нейтрофилов и эозинофилов по отношению к микрофиляриям (Piessens and Beldekas, 1979), наряду с активацией тромбоцитов, выделяющих свободные радикалы.Это действие не зависит от антител и запускается филяриальным экскреторным антигеном (Cesbron et al., 1987). Более того, DEC вмешивается в метаболизм арахидоновой кислоты и вызывает продукцию PGE2, PGE12 и тромбоксана как у филяриального паразита, так и у его хозяина (Martin et al., 1997).
В контролируемом рандомизированном исследовании по сравнению с MBZ, ДЭК вводили в дозе 3-4 мг / кг ч / б ежедневно в течение 21 дня. Терапевтический график начинался с 25 мг в день, и доза постепенно увеличивалась в попытке избежать побочных реакций, вызванных лизисом паразитов.Антигистаминные препараты не применялись. Этот режим привел к значительному снижению тяжести клинических признаков на 70%. Двадцать восемь процентов пациентов сообщили о незначительных побочных эффектах, включая повышенную слабость, головокружение, тошноту, рвоту или боль в животе. Эти нарушения были дозозависимыми и уменьшались при уменьшении суточной дозы. У 10% испытуемых наблюдалась реакция, подобная Маззотти (зуд, крапивница и / или отек), что свидетельствует об ускоренном лизисе личинок (Magnaval, 1995).
Было показано, что ивермектин является высокоэффективным и значительно улучшает прогноз для людей с онхоцеркозом, причиной речной слепоты (Boussinesq et al., 1997). Ивермектин также был недавно зарегистрирован в Европейском Союзе и США для лечения стронгилоидоза (Marti et al., 1996). Что касается токсокароза, контролируемых исследований его эффективности не проводилось. При испытании на серии из 17 случаев распространенного токсокароза ивермектин оказался только на 40% эффективным в уменьшении клинических проявлений, и не было значительного снижения количества эозинофилов в крови (Magnaval, 1998).Таким образом, ивермектин не следует использовать для лечения токсокароза человека, особенно OLM, до тех пор, пока не будет тщательно изучен вопрос о его эффективности.
Подходит ли человек с токсокарозом для лечения, зависит от типа и тяжести клинических признаков. Острый VLM у детей и взрослых обычно лечится симптоматически или с помощью специфической противогельминтной терапии. Пациенты с обычным токсокарозом (Glickman et al., 1987; Magnaval et al., 1994a) или скрытым токсокарозом (Taylor et al., 1988) наряду с периферической эозинофилией часто лечат консервативно, поскольку эти формы заболевания обычно проходят самостоятельно. Поэтому антигельминтное лечение не начинается немедленно, но может быть рассмотрено для пациентов, у которых сохраняются симптомы, несмотря на усилия по предотвращению повторного заражения яйцами Toxocara . Бессимптомные пациенты с хронической эозинофилией и пациенты со скрытым токсокарозом в отсутствие эозинофилии обычно не нуждаются в какой-либо специальной терапии.
Что касается OLM, то на сегодняшний день не проводились контролируемые клинические испытания для лечения этой формы заболевания. Однако неофициальные данные и сообщения о случаях заболевания (Dinning et al., 1988; Gillespie et al., 1993; Glickman and Magnaval, 1993; Lobovska and Zackova, 1994; Saint-Blancat et al., 1997; Dietrich et al., 1998) предполагают что использование кортикостероидов для уменьшения воспаления эффективно и может минимизировать необратимое повреждение глаза, вызванное локальным высвобождением TES-Ag в результате миграции личинок в глазу.Обычный режим составляет примерно 1 мг / кг ч / б ежедневно в течение 1 месяца или более, при необходимости дозу уменьшают. Среди физических методов показана лазерная фотокоагуляция, когда личинка может быть идентифицирована путем прямой визуализации в глазу (Gass, Braunstein, 1983; Casella et al., 1998). Глазные гранулемы можно лечить криопексией (El Matri et al., 1990; Zygulska et al., 1993). Pars plana Витрэктомия может использоваться для удаления эпиретинального, а также субретинального компонента гранулемы сетчатки Toxocara (Werner et al., 1999). Если применение пероральных и / или местных кортикостероидов не приводит к полному выздоровлению, следует рассмотреть возможность применения специфических глистогонных препаратов. Не установлено, хорошо ли проникают производные бензимидазола или их активные метаболиты в глаз человека. Дополнительные косвенные доказательства проникновения этого ДЭК в глаз получены из опыта его широкого использования для лечения онхоцеркоза человека (Dadzie et al., 1987). Поэтому DEC может быть лучшим выбором для лечения OLM.Поскольку действие DEC может подавляться кортикостероидами (Maizels and Denham, 1992), оба препарата не следует назначать вместе.
Лечение пациентов с неврологическим токсокарозом состояло из комбинации кортикостероидов и DEC (Komiyama et al., 1995), или MBZ (Duprez et al., 1996), или TBZ (Kumar and Kimm, 1994), или использование только DEC (Ruttinger and Hadidi, 1991) или только TBZ (Russegger and Schmutzhard, 1989; Wang et al., 1983). Результаты этих исследований неоднозначны.
Основные аспекты токсокароза человека
Лекарственные препараты
Несмотря на то, что на животных моделях было протестировано множество антигельминтных средств, контролируемые рандомизированные исследования на людях проводились редко, поэтому для лечения человеческого заболевания доступно очень мало лекарств.
Производные бензимидазола включают тиабендазол (TBZ), мебендазол (MBZ) и альбендазол (ABZ) в зависимости от стажа работы.
Когда TBZ вводился перорально каждый день в дозах от 25 мг / кг ч / м (Magnaval and Charlet, 1987) до 50 мг / кг ч / м (Bass et al., 1987; Sturchler et al., 1989) в течение 3-7 дней, улучшение клинических проявлений было обнаружено у 50% (Magnaval and Charlet, 1987) до 53% (Sturchler et al., 1989). Побочные эффекты, включающие головокружение, тошноту и рвоту, наблюдались у 50% (Magnaval and Charlet, 1987) и 60% (Sturchler et al., 1989).
Что касается MBZ, то наилучшая схема лечения составляла 20-25 мг / кг ч / б ежедневно в течение 3 недель, что привело к снижению клинических проявлений на 70%.Побочные эффекты, включающие слабость, головокружение, тошноту, боль в животе и желудке, были легкими и наблюдались у 17% пациентов (Magnaval, 1995).
При введении ABZ в дозе 10 мг / кг ч / б ежедневно в течение 5 дней клиническое улучшение было обнаружено у 47% пациентов с токсокарозом (Stürchler et al., 1989). Шестьдесят процентов пациентов жаловались на незначительные побочные эффекты. Несмотря на эти неоднозначные результаты, обзор недавней литературы обнаружил многочисленные анекдотические сообщения, свидетельствующие о том, что ABZ стал широко используемым лекарством для лечения токсокароза, возможно, из-за его широкой доступности в большинстве стран.
И MBZ, и ABZ плохо всасываются из желудочно-кишечного тракта, и их следует вводить с жирной пищей.
Диэтилкарбамазин, или ДЭК, был основой химиотерапии филяриатоза с 1949 года. Механизм действия сложен и до сих пор частично неизвестен. При филяриозах он включает усиление как присоединения, так и цитотоксичности нейтрофилов и эозинофилов по отношению к микрофиляриям (Piessens and Beldekas, 1979), наряду с активацией тромбоцитов, выделяющих свободные радикалы.Это действие не зависит от антител и запускается филяриальным экскреторным антигеном (Cesbron et al., 1987). Более того, DEC вмешивается в метаболизм арахидоновой кислоты и вызывает продукцию PGE2, PGE12 и тромбоксана как у филяриального паразита, так и у его хозяина (Martin et al., 1997).
В контролируемом рандомизированном исследовании по сравнению с MBZ, ДЭК вводили в дозе 3-4 мг / кг ч / б ежедневно в течение 21 дня. Терапевтический график начинался с 25 мг в день, и доза постепенно увеличивалась в попытке избежать побочных реакций, вызванных лизисом паразитов.Антигистаминные препараты не применялись. Этот режим привел к значительному снижению тяжести клинических признаков на 70%. Двадцать восемь процентов пациентов сообщили о незначительных побочных эффектах, включая повышенную слабость, головокружение, тошноту, рвоту или боль в животе. Эти нарушения были дозозависимыми и уменьшались при уменьшении суточной дозы. У 10% испытуемых наблюдалась реакция, подобная Маззотти (зуд, крапивница и / или отек), что свидетельствует об ускоренном лизисе личинок (Magnaval, 1995).
Было показано, что ивермектин является высокоэффективным и значительно улучшает прогноз для людей с онхоцеркозом, причиной речной слепоты (Boussinesq et al., 1997). Ивермектин также был недавно зарегистрирован в Европейском Союзе и США для лечения стронгилоидоза (Marti et al., 1996). Что касается токсокароза, контролируемых исследований его эффективности не проводилось. При испытании на серии из 17 случаев распространенного токсокароза ивермектин оказался только на 40% эффективным в уменьшении клинических проявлений, и не было значительного снижения количества эозинофилов в крови (Magnaval, 1998).Таким образом, ивермектин не следует использовать для лечения токсокароза человека, особенно OLM, до тех пор, пока не будет тщательно изучен вопрос о его эффективности.
Подходит ли человек с токсокарозом для лечения, зависит от типа и тяжести клинических признаков. Острый VLM у детей и взрослых обычно лечится симптоматически или с помощью специфической противогельминтной терапии. Пациенты с обычным токсокарозом (Glickman et al., 1987; Magnaval et al., 1994a) или скрытым токсокарозом (Taylor et al., 1988) наряду с периферической эозинофилией часто лечат консервативно, поскольку эти формы заболевания обычно проходят самостоятельно. Поэтому антигельминтное лечение не начинается немедленно, но может быть рассмотрено для пациентов, у которых сохраняются симптомы, несмотря на усилия по предотвращению повторного заражения яйцами Toxocara . Бессимптомные пациенты с хронической эозинофилией и пациенты со скрытым токсокарозом в отсутствие эозинофилии обычно не нуждаются в какой-либо специальной терапии.
Что касается OLM, то на сегодняшний день не проводились контролируемые клинические испытания для лечения этой формы заболевания. Однако неофициальные данные и сообщения о случаях заболевания (Dinning et al., 1988; Gillespie et al., 1993; Glickman and Magnaval, 1993; Lobovska and Zackova, 1994; Saint-Blancat et al., 1997; Dietrich et al., 1998) предполагают что использование кортикостероидов для уменьшения воспаления эффективно и может минимизировать необратимое повреждение глаза, вызванное локальным высвобождением TES-Ag в результате миграции личинок в глазу.Обычный режим составляет примерно 1 мг / кг ч / б ежедневно в течение 1 месяца или более, при необходимости дозу уменьшают. Среди физических методов показана лазерная фотокоагуляция, когда личинка может быть идентифицирована путем прямой визуализации в глазу (Gass, Braunstein, 1983; Casella et al., 1998). Глазные гранулемы можно лечить криопексией (El Matri et al., 1990; Zygulska et al., 1993). Pars plana Витрэктомия может использоваться для удаления эпиретинального, а также субретинального компонента гранулемы сетчатки Toxocara (Werner et al., 1999). Если применение пероральных и / или местных кортикостероидов не приводит к полному выздоровлению, следует рассмотреть возможность применения специфических глистогонных препаратов. Не установлено, хорошо ли проникают производные бензимидазола или их активные метаболиты в глаз человека. Дополнительные косвенные доказательства проникновения этого ДЭК в глаз получены из опыта его широкого использования для лечения онхоцеркоза человека (Dadzie et al., 1987). Поэтому DEC может быть лучшим выбором для лечения OLM.Поскольку действие DEC может подавляться кортикостероидами (Maizels and Denham, 1992), оба препарата не следует назначать вместе.
Лечение пациентов с неврологическим токсокарозом состояло из комбинации кортикостероидов и DEC (Komiyama et al., 1995), или MBZ (Duprez et al., 1996), или TBZ (Kumar and Kimm, 1994), или использование только DEC (Ruttinger and Hadidi, 1991) или только TBZ (Russegger and Schmutzhard, 1989; Wang et al., 1983). Результаты этих исследований неоднозначны.
Основные аспекты токсокароза человека
Лекарственные препараты
Несмотря на то, что на животных моделях было протестировано множество антигельминтных средств, контролируемые рандомизированные исследования на людях проводились редко, поэтому для лечения человеческого заболевания доступно очень мало лекарств.
Производные бензимидазола включают тиабендазол (TBZ), мебендазол (MBZ) и альбендазол (ABZ) в зависимости от стажа работы.
Когда TBZ вводился перорально каждый день в дозах от 25 мг / кг ч / м (Magnaval and Charlet, 1987) до 50 мг / кг ч / м (Bass et al., 1987; Sturchler et al., 1989) в течение 3-7 дней, улучшение клинических проявлений было обнаружено у 50% (Magnaval and Charlet, 1987) до 53% (Sturchler et al., 1989). Побочные эффекты, включающие головокружение, тошноту и рвоту, наблюдались у 50% (Magnaval and Charlet, 1987) и 60% (Sturchler et al., 1989).
Что касается MBZ, то наилучшая схема лечения составляла 20-25 мг / кг ч / б ежедневно в течение 3 недель, что привело к снижению клинических проявлений на 70%.Побочные эффекты, включающие слабость, головокружение, тошноту, боль в животе и желудке, были легкими и наблюдались у 17% пациентов (Magnaval, 1995).
При введении ABZ в дозе 10 мг / кг ч / б ежедневно в течение 5 дней клиническое улучшение было обнаружено у 47% пациентов с токсокарозом (Stürchler et al., 1989). Шестьдесят процентов пациентов жаловались на незначительные побочные эффекты. Несмотря на эти неоднозначные результаты, обзор недавней литературы обнаружил многочисленные анекдотические сообщения, свидетельствующие о том, что ABZ стал широко используемым лекарством для лечения токсокароза, возможно, из-за его широкой доступности в большинстве стран.
И MBZ, и ABZ плохо всасываются из желудочно-кишечного тракта, и их следует вводить с жирной пищей.
Диэтилкарбамазин, или ДЭК, был основой химиотерапии филяриатоза с 1949 года. Механизм действия сложен и до сих пор частично неизвестен. При филяриозах он включает усиление как присоединения, так и цитотоксичности нейтрофилов и эозинофилов по отношению к микрофиляриям (Piessens and Beldekas, 1979), наряду с активацией тромбоцитов, выделяющих свободные радикалы.Это действие не зависит от антител и запускается филяриальным экскреторным антигеном (Cesbron et al., 1987). Более того, DEC вмешивается в метаболизм арахидоновой кислоты и вызывает продукцию PGE2, PGE12 и тромбоксана как у филяриального паразита, так и у его хозяина (Martin et al., 1997).
В контролируемом рандомизированном исследовании по сравнению с MBZ, ДЭК вводили в дозе 3-4 мг / кг ч / б ежедневно в течение 21 дня. Терапевтический график начинался с 25 мг в день, и доза постепенно увеличивалась в попытке избежать побочных реакций, вызванных лизисом паразитов.Антигистаминные препараты не применялись. Этот режим привел к значительному снижению тяжести клинических признаков на 70%. Двадцать восемь процентов пациентов сообщили о незначительных побочных эффектах, включая повышенную слабость, головокружение, тошноту, рвоту или боль в животе. Эти нарушения были дозозависимыми и уменьшались при уменьшении суточной дозы. У 10% испытуемых наблюдалась реакция, подобная Маззотти (зуд, крапивница и / или отек), что свидетельствует об ускоренном лизисе личинок (Magnaval, 1995).
Было показано, что ивермектин является высокоэффективным и значительно улучшает прогноз для людей с онхоцеркозом, причиной речной слепоты (Boussinesq et al., 1997). Ивермектин также был недавно зарегистрирован в Европейском Союзе и США для лечения стронгилоидоза (Marti et al., 1996). Что касается токсокароза, контролируемых исследований его эффективности не проводилось. При испытании на серии из 17 случаев распространенного токсокароза ивермектин оказался только на 40% эффективным в уменьшении клинических проявлений, и не было значительного снижения количества эозинофилов в крови (Magnaval, 1998).Таким образом, ивермектин не следует использовать для лечения токсокароза человека, особенно OLM, до тех пор, пока не будет тщательно изучен вопрос о его эффективности.
Подходит ли человек с токсокарозом для лечения, зависит от типа и тяжести клинических признаков. Острый VLM у детей и взрослых обычно лечится симптоматически или с помощью специфической противогельминтной терапии. Пациенты с обычным токсокарозом (Glickman et al., 1987; Magnaval et al., 1994a) или скрытым токсокарозом (Taylor et al., 1988) наряду с периферической эозинофилией часто лечат консервативно, поскольку эти формы заболевания обычно проходят самостоятельно. Поэтому антигельминтное лечение не начинается немедленно, но может быть рассмотрено для пациентов, у которых сохраняются симптомы, несмотря на усилия по предотвращению повторного заражения яйцами Toxocara . Бессимптомные пациенты с хронической эозинофилией и пациенты со скрытым токсокарозом в отсутствие эозинофилии обычно не нуждаются в какой-либо специальной терапии.
Что касается OLM, то на сегодняшний день не проводились контролируемые клинические испытания для лечения этой формы заболевания. Однако неофициальные данные и сообщения о случаях заболевания (Dinning et al., 1988; Gillespie et al., 1993; Glickman and Magnaval, 1993; Lobovska and Zackova, 1994; Saint-Blancat et al., 1997; Dietrich et al., 1998) предполагают что использование кортикостероидов для уменьшения воспаления эффективно и может минимизировать необратимое повреждение глаза, вызванное локальным высвобождением TES-Ag в результате миграции личинок в глазу.Обычный режим составляет примерно 1 мг / кг ч / б ежедневно в течение 1 месяца или более, при необходимости дозу уменьшают. Среди физических методов показана лазерная фотокоагуляция, когда личинка может быть идентифицирована путем прямой визуализации в глазу (Gass, Braunstein, 1983; Casella et al., 1998). Глазные гранулемы можно лечить криопексией (El Matri et al., 1990; Zygulska et al., 1993). Pars plana Витрэктомия может использоваться для удаления эпиретинального, а также субретинального компонента гранулемы сетчатки Toxocara (Werner et al., 1999). Если применение пероральных и / или местных кортикостероидов не приводит к полному выздоровлению, следует рассмотреть возможность применения специфических глистогонных препаратов. Не установлено, хорошо ли проникают производные бензимидазола или их активные метаболиты в глаз человека. Дополнительные косвенные доказательства проникновения этого ДЭК в глаз получены из опыта его широкого использования для лечения онхоцеркоза человека (Dadzie et al., 1987). Поэтому DEC может быть лучшим выбором для лечения OLM.Поскольку действие DEC может подавляться кортикостероидами (Maizels and Denham, 1992), оба препарата не следует назначать вместе.
Лечение пациентов с неврологическим токсокарозом состояло из комбинации кортикостероидов и DEC (Komiyama et al., 1995), или MBZ (Duprez et al., 1996), или TBZ (Kumar and Kimm, 1994), или использование только DEC (Ruttinger and Hadidi, 1991) или только TBZ (Russegger and Schmutzhard, 1989; Wang et al., 1983). Результаты этих исследований неоднозначны.
Основные аспекты токсокароза человека
Лекарственные препараты
Несмотря на то, что на животных моделях было протестировано множество антигельминтных средств, контролируемые рандомизированные исследования на людях проводились редко, поэтому для лечения человеческого заболевания доступно очень мало лекарств.
Производные бензимидазола включают тиабендазол (TBZ), мебендазол (MBZ) и альбендазол (ABZ) в зависимости от стажа работы.
Когда TBZ вводился перорально каждый день в дозах от 25 мг / кг ч / м (Magnaval and Charlet, 1987) до 50 мг / кг ч / м (Bass et al., 1987; Sturchler et al., 1989) в течение 3-7 дней, улучшение клинических проявлений было обнаружено у 50% (Magnaval and Charlet, 1987) до 53% (Sturchler et al., 1989). Побочные эффекты, включающие головокружение, тошноту и рвоту, наблюдались у 50% (Magnaval and Charlet, 1987) и 60% (Sturchler et al., 1989).
Что касается MBZ, то наилучшая схема лечения составляла 20-25 мг / кг ч / б ежедневно в течение 3 недель, что привело к снижению клинических проявлений на 70%.Побочные эффекты, включающие слабость, головокружение, тошноту, боль в животе и желудке, были легкими и наблюдались у 17% пациентов (Magnaval, 1995).
При введении ABZ в дозе 10 мг / кг ч / б ежедневно в течение 5 дней клиническое улучшение было обнаружено у 47% пациентов с токсокарозом (Stürchler et al., 1989). Шестьдесят процентов пациентов жаловались на незначительные побочные эффекты. Несмотря на эти неоднозначные результаты, обзор недавней литературы обнаружил многочисленные анекдотические сообщения, свидетельствующие о том, что ABZ стал широко используемым лекарством для лечения токсокароза, возможно, из-за его широкой доступности в большинстве стран.
И MBZ, и ABZ плохо всасываются из желудочно-кишечного тракта, и их следует вводить с жирной пищей.
Диэтилкарбамазин, или ДЭК, был основой химиотерапии филяриатоза с 1949 года. Механизм действия сложен и до сих пор частично неизвестен. При филяриозах он включает усиление как присоединения, так и цитотоксичности нейтрофилов и эозинофилов по отношению к микрофиляриям (Piessens and Beldekas, 1979), наряду с активацией тромбоцитов, выделяющих свободные радикалы.Это действие не зависит от антител и запускается филяриальным экскреторным антигеном (Cesbron et al., 1987). Более того, DEC вмешивается в метаболизм арахидоновой кислоты и вызывает продукцию PGE2, PGE12 и тромбоксана как у филяриального паразита, так и у его хозяина (Martin et al., 1997).
В контролируемом рандомизированном исследовании по сравнению с MBZ, ДЭК вводили в дозе 3-4 мг / кг ч / б ежедневно в течение 21 дня. Терапевтический график начинался с 25 мг в день, и доза постепенно увеличивалась в попытке избежать побочных реакций, вызванных лизисом паразитов.Антигистаминные препараты не применялись. Этот режим привел к значительному снижению тяжести клинических признаков на 70%. Двадцать восемь процентов пациентов сообщили о незначительных побочных эффектах, включая повышенную слабость, головокружение, тошноту, рвоту или боль в животе. Эти нарушения были дозозависимыми и уменьшались при уменьшении суточной дозы. У 10% испытуемых наблюдалась реакция, подобная Маззотти (зуд, крапивница и / или отек), что свидетельствует об ускоренном лизисе личинок (Magnaval, 1995).
Было показано, что ивермектин является высокоэффективным и значительно улучшает прогноз для людей с онхоцеркозом, причиной речной слепоты (Boussinesq et al., 1997). Ивермектин также был недавно зарегистрирован в Европейском Союзе и США для лечения стронгилоидоза (Marti et al., 1996). Что касается токсокароза, контролируемых исследований его эффективности не проводилось. При испытании на серии из 17 случаев распространенного токсокароза ивермектин оказался только на 40% эффективным в уменьшении клинических проявлений, и не было значительного снижения количества эозинофилов в крови (Magnaval, 1998).Таким образом, ивермектин не следует использовать для лечения токсокароза человека, особенно OLM, до тех пор, пока не будет тщательно изучен вопрос о его эффективности.
Подходит ли человек с токсокарозом для лечения, зависит от типа и тяжести клинических признаков. Острый VLM у детей и взрослых обычно лечится симптоматически или с помощью специфической противогельминтной терапии. Пациенты с обычным токсокарозом (Glickman et al., 1987; Magnaval et al., 1994a) или скрытым токсокарозом (Taylor et al., 1988) наряду с периферической эозинофилией часто лечат консервативно, поскольку эти формы заболевания обычно проходят самостоятельно. Поэтому антигельминтное лечение не начинается немедленно, но может быть рассмотрено для пациентов, у которых сохраняются симптомы, несмотря на усилия по предотвращению повторного заражения яйцами Toxocara . Бессимптомные пациенты с хронической эозинофилией и пациенты со скрытым токсокарозом в отсутствие эозинофилии обычно не нуждаются в какой-либо специальной терапии.
Что касается OLM, то на сегодняшний день не проводились контролируемые клинические испытания для лечения этой формы заболевания. Однако неофициальные данные и сообщения о случаях заболевания (Dinning et al., 1988; Gillespie et al., 1993; Glickman and Magnaval, 1993; Lobovska and Zackova, 1994; Saint-Blancat et al., 1997; Dietrich et al., 1998) предполагают что использование кортикостероидов для уменьшения воспаления эффективно и может минимизировать необратимое повреждение глаза, вызванное локальным высвобождением TES-Ag в результате миграции личинок в глазу.Обычный режим составляет примерно 1 мг / кг ч / б ежедневно в течение 1 месяца или более, при необходимости дозу уменьшают. Среди физических методов показана лазерная фотокоагуляция, когда личинка может быть идентифицирована путем прямой визуализации в глазу (Gass, Braunstein, 1983; Casella et al., 1998). Глазные гранулемы можно лечить криопексией (El Matri et al., 1990; Zygulska et al., 1993). Pars plana Витрэктомия может использоваться для удаления эпиретинального, а также субретинального компонента гранулемы сетчатки Toxocara (Werner et al., 1999). Если применение пероральных и / или местных кортикостероидов не приводит к полному выздоровлению, следует рассмотреть возможность применения специфических глистогонных препаратов. Не установлено, хорошо ли проникают производные бензимидазола или их активные метаболиты в глаз человека. Дополнительные косвенные доказательства проникновения этого ДЭК в глаз получены из опыта его широкого использования для лечения онхоцеркоза человека (Dadzie et al., 1987). Поэтому DEC может быть лучшим выбором для лечения OLM.Поскольку действие DEC может подавляться кортикостероидами (Maizels and Denham, 1992), оба препарата не следует назначать вместе.
Лечение пациентов с неврологическим токсокарозом состояло из комбинации кортикостероидов и DEC (Komiyama et al., 1995), или MBZ (Duprez et al., 1996), или TBZ (Kumar and Kimm, 1994), или использование только DEC (Ruttinger and Hadidi, 1991) или только TBZ (Russegger and Schmutzhard, 1989; Wang et al., 1983). Результаты этих исследований неоднозначны.
клинические особенности, диагностика, лечение и профилактика
Asia Pac Allergy. 2014 июл; 4 (3): 134–141.
, 1, 2 , 1 и 1Сеонг Джун Ан
1 Кафедра офтальмологии, Больница Бунданг Сеульского национального университета, Медицинский колледж Сеульского национального университета, Соннам, 463-707 Корея.
2 Отделение офтальмологии, Столичный госпиталь Вооруженных сил, Соннам 463-040, Корея.
Na-Kyung Ryoo
1 Отделение офтальмологии, Госпиталь Бунданг Сеульского национального университета, Медицинский колледж Сеульского национального университета, Соннам 463-707, Корея.
Се Джун Ву
1 Отделение офтальмологии, Больница Бунданг Сеульского национального университета, Медицинский колледж Сеульского национального университета, Соннам 463-707, Корея.
1 Отделение офтальмологии, Больница Бунданг Сеульского национального университета, Медицинский колледж Сеульского национального университета, Соннам 463-707, Корея.
2 Отделение офтальмологии, Столичный госпиталь Вооруженных сил, Соннам 463-040, Корея.
Автор, ответственный за переписку. Переписка: Се Джун У. Отделение офтальмологии, Больница Бунданг Сеульского национального университета, Медицинский колледж Сеульского национального университета, 82 Gumi-ro 173beon-gil, Bundang-gu, Seongnam 463-707, Корея. Тел .: + 82-31-787-7377, Факс: + 82-31-787-4057, rk.ca.uns@1noojesПолучено 20 июля 2014 г .; Принято 23 июля 2014 г.
Copyright © 2014.Азиатско-Тихоокеанская ассоциация аллергии, астмы и клинической иммунологии. Это статья в открытом доступе, распространяемая в соответствии с условиями некоммерческой лицензии Creative Commons Attribution (http://creativecommons.org/licenses/by-nc/3.0/), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях PMC.Abstract
Несмотря на то, что токсокароз человека является одной из самых распространенных зоонозных инфекций во всем мире, он остается одной из забытых тропических болезней.Хотя большинство инфекций человека протекает бессимптомно, классически признаются два основных синдрома токсокароза человека: системный токсокароз, который включает заболевания основных органов; и глазной токсокароз (ОТ), заболевание глаза или зрительного нерва, вызванное миграцией личинок токсокар в глаз. ОТ обычно является односторонним заболеванием, которое обычно проявляется в виде гранулемы сетчатки, желтоватого или беловатого воспалительного образования в заднем полюсе или периферической сетчатке. Сама гранулема или другие сопутствующие заболевания, такие как эпиретинальная мембрана, отек желтого пятна и отслоение сетчатки, могут привести к необратимому повреждению сетчатки и потере зрения на глазах при ОТ.Клинический диагноз ОТ диагностируется путем выявления клинических признаков при офтальмологическом обследовании. Серологические тесты, такие как иммуноферментный анализ (ELISA) для обнаружения сывороточных антител против личинок Toxocara, могут подтвердить диагноз. Кроме того, сывороточный иммуноглобулин E и обнаружение антител к токсокарам в глазной жидкости с помощью ELISA могут оказать дополнительную помощь в диагностике. Стандартное лечение ОТ — кортикостероиды у пациентов с активным внутриглазным воспалением. Хотя роль противогельминтной терапии неясна, сообщалось о благоприятном исходе комбинированной терапии кортикостероидами и альбендазолом в глазах с активным воспалением.Профилактика за счет повышения осведомленности общественности и снижения риска заражения также важна. Недавно сообщалось о связи между употреблением сырого мяса или печени и токсокарозом, особенно у взрослых пациентов. Необходимо провести дальнейшие исследования потенциального источника инфекции, диагностики и лечения.
Ключевые слова: Диагностика, Токсокароз, Лечение, Глазной токсокароз
ТОКСОКАРИАЗ, ГЛАЗНЫЙ ТОКСОКАРИАЗ
Токсокароз — одна из наиболее распространенных зоонозных инфекций во всем мире, чаще всего вызываемая Toxocara canis и реже другими видами Toxocara canis и реже другими [1, 2].Токсокароз распространяется по всему миру, а серопозитивность антител к токсокарам колеблется от 2,4% [3] до 76,6% [4]. Исторически сложилось так, что в 1952 году Бивер и др. [5] идентифицировали этиологический агент, личинок T. canis , в эозинофильных гранулемах в биоптатах печени, взятых у трех детей. Четыре года спустя Николс [6] продемонстрировал присутствие личинок второй стадии T. canis в гистологических срезах 24 глаз, энуклеированных при подозрении на внутриглазные злокачественные новообразования.Эти данные привели к общей этиологии системных и глазных заболеваний — токсокарозу человека.
Люди заражаются Toxocara, когда они непреднамеренно проглатывают зародыши яиц или личинок, которые были пролиты с фекалиями инфицированных животных или сырых паратенических хозяев () [1, 2, 7]. После того, как человек проглотил яйца, инфекционные личинки высвобождаются в тонкий кишечник, а затем проникают через стенку кишечника, попадают в кровоток и мигрируют в органы, где вызывают воспалительные реакции и симптомы [1, 2].Клинический спектр токсокароза у людей варьируется от бессимптомной инфекции до тяжелого поражения органов, в зависимости от паразитарной нагрузки, мест миграции личинок и воспалительной реакции хозяина [1]. В частности, в зависимости от пораженного органа могут возникать два четко определенных клинических синдрома: системный токсокароз (также известный как мигрирующая висцеральная личинка) и глазной токсокароз (ОТ) [1].
Упрощенный рисунок, показывающий жизненный цикл Toxocara canis , а также пути его передачи и миграции у человека.
ОТ — это клинически четко выраженное проявление внутриглазной инфекции, вызванной личинками токсокар [1, 7]. ОТ затрагивает как детей, так и взрослых, средний возраст начала заболевания колеблется от 6,4 [8] до 51,7 [9] лет в различных исследованиях. Известно, что это важная причина нарушения зрения в детстве [10]. Хотя токсокароз человека является одной из наиболее распространенных зоонозных инфекций во всем мире, существует лишь несколько отчетов, в которых оценивается частота ОТ. Например, количество случаев потери зрения в офтальмологических клиниках в Алабаме за 6 месяцев составило 11 случаев на 1000 пациентов, а один случай на 1000 человек в общей популяции, по оценкам, имел ОТ [11].Исследование, проведенное на ирландском языке, оценило распространенность ОТ как 9,7 на 100 000 школьников (4-19 лет) [12]. Одно японское эпидемиологическое исследование в Азии показало, что на ОТ приходится 1,1% всех случаев увеита [13]. В прошлом считалось, что большинство ОТ развивается у педиатрических пациентов. Однако в последнее время ОТ в основном страдают взрослые пациенты, особенно азиаты, что может быть связано с их пищевыми привычками [9, 14, 15]. В Корее системный токсокароз был основной причиной высокой распространенности эозинофилии, составляющей 67-87% (4.0-12,2%). Около 60-90% пациентов с системным токсокарозом употребляли в анамнезе сырую коровью печень [15]. Отсутствие знаний и халатность приводят к тому, что многие пациенты с токсокарозом остаются брошенными, а часть пациентов может страдать от ОТ.
Поскольку ОТ остается относительно неизвестным широкой публике, а также клиницистам, здесь рассматриваются клинические особенности, диагностика, лечение и профилактика ОТ с акцентом на новые разработки в серологической диагностике и новые результаты клинических исследований в литературе.
КЛИНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Возраст обращения пациентов с ОТ может варьироваться от 1 до 77 лет [9, 16, 17]. В большинстве предыдущих исследований сообщалось, что это чаще встречается у мужчин, поскольку соотношение мужчин и женщин обычно было больше 1: 1 [8, 12, 18, 19, 20, 21, 22], вплоть до 4,5: 1 [23]. ]. Большинство случаев были односторонними, а двусторонние случаи были менее 40% [20] в литературе. Его клинические проявления можно классифицировать по одной из четырех форм: гранулема заднего полюса, периферическая гранулема, нематодный эндофтальмит и атипичные проявления [16].
Гранулема заднего полюса (), очаговая, беловатая субретинальная или интраретинальная воспалительная масса, обычно менее 1 диаметра диска с пигментацией или без нее, присутствует в заднем полюсе с признаками острого воспаления и мутным стекловидным телом или без них [16]. Wilkinson и Welch [24] показали, что эта форма является наиболее частой формой клинической картины, составляющей 44% случаев ОТ. Поражения желтого пятна, скорее всего, будут симптоматическими и, следовательно, побуждают пациентов обращаться за медицинской помощью, что, возможно, объясняет предрасположенность к гранулеме заднего полюса.
Фотографии глазного дна гранулемы сетчатки у 67- (A) и 31-летнего мужчины (B) пациентов с глазным токсокарозом. (A) Гранулема заднего полюса выглядит как овальное поражение белого цвета на заднем полюсе сетчатки. (B) Периферическая гранулема представлена аморфной беловатой массой с тракционной мембраной и отслоением сетчатки.
Периферическая гранулема (), очаговый приподнятый белый узелок на периферии сетчатки, может иметь различную степень окружающих оболочек и пигментных изменений [16].У некоторых пациентов с периферической гранулемой воспаление может быть диффузным и проявляться в виде «сугроба» [10]. Можно наблюдать фиброцеллюлярные связки, идущие к задней части сетчатки или зрительному нерву, иногда образующие складку сетчатки. Локальная тракция сетчатки также может привести к тракционной отслойке сетчатки или регматогенной отслойке сетчатки из-за образования отверстий или разрывов сетчатки.
Эндофтальмит нематод — это тип панувеита, проявляющийся в виде покраснения болезненных глаз с диффузным внутриглазным воспалением [16].В тяжелых случаях может наблюдаться гипопион и плотный клеточный инфильтрат в стекловидном теле. Гранулема сетчатки может наблюдаться через помутнение стекловидного тела по мере его исчезновения [24]; поэтому для дифференциальной диагностики важны кропотливые усилия по обнаружению гранулемы сетчатки. Пациенты с нематодным эндофтальмитом, как правило, немного моложе, чем пациенты с локализованной гранулемой.
Атипичные проявления включают воспаление и отек головки зрительного нерва (проявляющиеся как неврит зрительного нерва), подвижность субретинальных личинок и диффузный хориоретинит [1, 7, 10].Также могут наблюдаться признаки переднего сегмента, такие как конъюнктивит, кератит, иридоциклит, очаговые узелки радужки и катаракта [1]. В нашем недавнем сообщении небольшое, круглое, белое помутнение, подобное гранулеме, перемещающееся на субкапсулярном уровне хрусталика, наблюдалось в глазах с ОТ [25].
Помимо воспаления глаз и проявлений, связанных с гранулемой, следует внимательно рассмотреть сопутствующие заболевания глаз с ОТ, поскольку они могут быть другими источниками потери зрения и могут прогрессировать при отсутствии лечения.Такие сопутствующие витреоретинальные патологии при ОТ включают эпиретинальную мембрану, помутнение стекловидного тела, тракционную / регматогенную отслойку сетчатки, отек желтого пятна, катаракту и отверстие желтого пятна [9, 10]. Хотя типичное проявление ОТ, гранулемы с внутриглазным воспалением, можно лечить медикаментозно, случаи с комбинированными витреоретинальными сопутствующими заболеваниями иногда требуют хирургического вмешательства для анатомического и визуального восстановления.
В нескольких отчетах указывались причины потери зрения у пациентов с ОТ. Стюарт и др.[10] сообщили, что витрит является наиболее частой причиной потери зрения при ОТ, за ним следуют кистозный макулярный отек, тракционная отслойка сетчатки и эпиретинальная мембрана. Кроме того, в глазах с макулярной гранулемой сама гранулема может привести к значительной потере зрения, поскольку она повреждает пораженную сетчатку и фоторецепторы [9]. Таким образом, причины потери зрения на глазах при ОТ можно разделить на 3 категории: повреждение сетчатки, вызванное самой гранулемой, сопутствующие заболевания сетчатки и внутриглазное воспаление.В нашей серии случаев ОТ средняя острота зрения с наилучшей коррекцией составляла 20/64 эквивалента Снеллена на исходном уровне, что было сопоставимо с эквивалентом 20/56 Снеллена при последнем посещении, когда внутриглазное воспаление в основном уменьшалось [9]. Это указывает на то, что в случаях ухудшения зрения следует учитывать и тщательно оценивать другие причины, такие как поражение сетчатки гранулемой или другие сопутствующие заболевания, во время клинического обследования пациентов с ОТ.
Примечательно, что уникальной особенностью ОТ по сравнению с другими воспалительными заболеваниями или заболеваниями сетчатки является внутриглазная миграция () [9, 26, 27].В двух описаниях клинических случаев индивидуально продемонстрирована внутриглазная миграция гранулемы [26, 27]. Было два типа внутриглазной миграции: непрерывная (гранулема мигрировала рядом с первоначально наблюдаемым местоположением) или прерывистая (новая гранулема далеко от исходного местоположения) [9]. В течение клинического периода непрерывная и прерывистая миграция гранулемы наблюдалась в 12,9% и 4,3% глаз с ОТ, соответственно [9]. Поскольку мигрирующая гранулема является патогномоничной для ОТ, эта уникальная особенность может быть полезна для дифференциации ОТ от других заболеваний сетчатки, таких как глазной токсоплазмоз, саркоидоз, туберкулез и грибковые инфекции [9].
Две модели миграции гранулемы Toxocara: непрерывная (A) и прерывистая (B). (A) Гранулема переходит на височную сторону через месяц после первого посещения (A, слева). Пунктирная линия на панели A обозначает контрольную линию, соединяющую две контрольные точки. (B) По сравнению с исходным уровнем в макуле и нижневисочной сетчатке появляются две новые гранулемы.
ДИАГНОСТИКА
Окончательный диагноз глазного токсокароза может быть получен путем гистологической демонстрации личинки токсокара или ее фрагментов при биопсии инфицированной ткани.Однако сбор подходящего биопсийного материала опасен и труден для глаз с ОТ и редко оправдан клиническими соображениями. Таким образом, современный диагноз ОТ ставится клинически по выявлению типичных офтальмологических признаков и по наличию сывороточных антител к личинкам Toxocara [1, 7, 16].
Как упоминалось выше, клинические проявления локализованной гранулемы в заднем полюсе или на периферии сетчатки типичны для постановки предполагаемого диагноза ОТ. В случаях нематодного эндофтальмита, при котором исследование глазного дна невозможно из-за помутнения стекловидного тела, для дифференциальной диагностики могут быть полезны специальные дополнительные тесты, такие как ультразвуковое исследование (отображение сильно отражающей массы с полосой стекловидного тела или без нее), и следует повторно выявить наличие гранулемы сетчатки. — оценивается для постановки точного диагноза, когда стекловидное тело становится прозрачным [1, 24].
Серологически стандартным современным тестом для диагностики токсокароза человека является непрямой иммуноферментный анализ (ИФА), основанный на экскреторно-секреторных антигенах T. canis . ELISA (Biokema-Affinity Products, Crissier-Lausanne, Швейцария) [28] при титре сыворотки более 1:32 имеет 78% чувствительность для выявления токсокароза [29] и Hagler et al. [30] предположили, что титр сыворотки 1: 8 достаточен для подтверждения диагноза глазного токсокароза, если у пациента есть признаки и симптомы, совместимые с этим заболеванием.В дополнение к коммерческому набору ELISA, серодиагностика с помощью ELISA с использованием неочищенного антигена личинок токсокар, разработанная исследователями из Сеульского национального университета в Южной Корее, также показала приемлемую диагностическую ценность с чувствительностью 92,2% и специфичностью 86,6% [31]. Сообщалось, что рекомбинантные антигены [32] могут предложить дополнительные решения для серологической диагностики, обеспечивая повышенную чувствительность и специфичность по сравнению с нативными экскреторно-секреторными антигенами. Однако из-за неспособности паразита развиться во взрослую форму у человека поиск T.canis или Яйца T. cati в фекалиях человека не нужны. Общенациональное исследование в США показало, что 17 из 25 пациентов (68%) с ОТ, у которых были зарегистрированы результаты ELISA, имели положительные результаты [16]. Однако чувствительность и специфичность ELISA для диагностики ОТ не были полностью оценены на больших выборках. Более того, к сожалению, такие антитела часто могут быть неопределяемыми или их титр может быть ниже порогового уровня в сыворотках пациентов с ОТ [33], возможно, из-за относительно низкой паразитарной нагрузки у пациентов с ОТ.Следовательно, отсутствие сывороточных антител не исключает диагноза ОТ. В этом случае другие дополнительные тесты могут быть полезны для подтверждения инфекции Toxocara.
В качестве дополнительного теста у пациентов с токсокарозом человека была определена роль определения антител к иммуноглобулину Е (IgE) [7, 34]. Что касается роли в ОТ, наша серия случаев на ОТ показала, что 69,6% клинически и серологически диагностированных пациентов показали повышенные уровни IgE, что позволяет предположить, что IgE может играть дополнительную роль в диагностике ОТ [9].Кроме того, уровни IgE показали снижение после лечения токсокароза человека, что указывает на то, что это может быть полезно для мониторинга терапевтического эффекта. Это требует дальнейшего исследования роли антител IgE у пациентов с ОТ.
Хотя системная эозинофилия является важным признаком системного токсокароза [14, 35, 36, 37, 38], количество эозинофилов обычно не увеличивается у пациентов с ОТ. Например, наша серия случаев показала, что только 11,6% (10 из 86) пациентов с ОТ имели эозинофилию [9].Таким образом, подсчет эозинофилов может быть не так полезен, как тест ELISA или уровень общего IgE; однако эозинофилия может указывать на возможность одновременного возникновения системного и глазного токсокароза [1, 34], что требует системной оценки и соответствующего лечения.
Некоторые авторы предположили, что улучшенная чувствительность может быть достигнута с помощью ELISA-анализа внутриглазных жидкостей [17, 33, 39]. Однако при использовании того же порогового значения для сывороточных антител положительные показатели ELISA для стекловидного тела были всего лишь 33% среди пациентов с ОТ, что требует дальнейшего исследования подходящего порогового значения для обнаружения ОТ [9].В случаях хирургического лечения остатки организмов Toxocara иногда обнаруживаются в образцах витрэктомии, полученных во время операции, что является прямым доказательством внутриглазной инфекции личинки Toxocara [40]. Цитологическое исследование водянистой влаги или стекловидного тела также может быть полезным для подтверждения диагноза ОТ. Однако в настоящее время нет доступных данных о частоте выявления цитологии стекловидного тела или биопсии среди глаз с ОТ, и, таким образом, цитология и биопсия могут быть зарезервированы для пациентов с подозрением на ОТ, которым предварительно запланирована витреоретинальная хирургия.
ЛЕЧЕНИЕ
Глаза с ОТ можно лечить медикаментозно или хирургическим путем, в зависимости от тяжести внутриглазного воспаления и сопутствующих заболеваний. Во-первых, в случае активного воспаления следует рассмотреть возможность медикаментозной терапии. В настоящее время стандартным лечением глазного токсокароза является назначение кортикостероидов пациентам с активным внутриглазным воспалением. Местные и системные кортикостероиды полезны при лечении внутриглазного воспаления и могут уменьшить помутнение стекловидного тела и образование мембран [9, 24, 39, 41, 42].
Роль антигельминтной терапии при ОТ остается спорной, поскольку не было рандомизированных контролируемых испытаний по использованию антигельминтных средств при ОТ. Опубликованы результаты лишь нескольких контролируемых испытаний глистогонных препаратов для лечения системного токсокароза [43, 44]. Поскольку паразитологическое излечение не может быть точно оценено, результат, использованный в опубликованных испытаниях, был просто улучшением клинических признаков и симптомов. Альбендазол (400 мг 2 раза в день в течение 7-14 дней) является рекомендуемым стандартным препаратом при системном токсокарозе и, по-видимому, превосходит тиабендазол (принимаемый в дозе 50 мг / кг / день в течение 3-7 дней) [43], который также сильно тормозит миграцию личинок [45].Диэтилкарбамазин (вводимый в дозе 3-4 мг / кг / день в течение 21 дня, начиная с 25 мг / день для каждого взрослого пациента и постепенно увеличивая дозу) также оказался эффективным для лечения системного токсокароза [44].
Однако не доказано, что антигельминтная терапия может убить внутриглазных личинок токсокар, поскольку внутриглазные фармакокинетические и фармакодинамические исследования антигельминтных средств не проводились. Таким образом, роль антигельминтной терапии при ОТ остается неясной. Тем не менее, использование глистогонных препаратов в сочетании с кортикостероидами показало благоприятные результаты во многих исследованиях.Например, Barisani-Asenbauer et al. [41] сообщили, что системный альбендазол (800 мг два раза в день для взрослых и 400 мг два раза в день для детей) в сочетании со стероидом приводил к улучшению зрения без рецидивов увеита у 5 пациентов в течение 13,8-месячного периода наблюдения. В нашем исследовании комбинированная терапия кортикостероидами и альбендазолом значительно снизила 6-месячные рецидивы (17,4%) по сравнению с группой, принимавшей только кортикостероиды (54,5%), хотя терапевтическое улучшение воспаления и зрения было сходным с терапией альбендазолом и без нее [9] .Считается, что гибель личинки связана с воспалительной реакцией, которая не доказана. Однако монотерапия альбендазолом у пациентов с ОТ с неактивным внутриглазным воспалением не выявила обострения внутриглазного воспаления [9]. В отношении подходящей дозировки системной терапии альбендазолом клиницисты не пришли к единому мнению. Например, 200 мг два раза в день в течение одного месяца и 400 или 800 мг два раза в день в течение 2 недель были рекомендованы для пероральной терапии альбендазолом для пациентов с ОТ, которые никогда не сравнивались в одном исследовании [9, 41] .
Также существует сообщение о том, что подвижная субретинальная личинка уничтожена с помощью фотокоагуляции [46]. В другом сообщении было показано, что интравитреальный ранибизумаб эффективен для лечения хориоидальной неоваскуляризации, вторичной по отношению к ОТ [47].
Медикаментозная терапия системными или местными кортикостероидами эффективна для уменьшения внутриглазного воспаления и улучшения симптомов, связанных с воспалением, но имеет ограниченную эффективность для устранения структурных осложнений сетчатки. Отслоение сетчатки, эпиретинальная мембрана и стойкое помутнение стекловидного тела являются частыми хирургическими показаниями к витреоретинальной хирургии, выполняемой на глазах с помощью ОТ, и несколько авторов сообщили о результатах хирургического лечения.Giuliari et al. [48] сообщили о хороших анатомо-функциональных результатах хирургического лечения у 45 пациентов с ОТ. В нашей серии случаев 32 из 101 пациента (31,7%) потребовалось хирургическое лечение, каждому по поводу эпиретинальной мембраны (n = 19), помутнения стекловидного тела (n = 9) и / или отслоения сетчатки (n = 2). Успешный хирургический результат был достигнут у 68,4%, 88,9% и 50% пациентов с эпиретинальной мембраной, помутнением стекловидного тела и отслоением сетчатки соответственно [9]. Обеспечивая структурную модификацию, т. Е., пилинг мембраны, удаление помутнения стекловидного тела или повторное прикрепление сетчатки, хирургическое вмешательство при ОТ могут привести к стабилизации или улучшению зрительной функции.
ПРОФИЛАКТИКА
В условиях недостаточной осведомленности об ОТ, повышение осведомленности населения о токсокарозе и сокращение воздействия токсокар на человека имеют важное значение для предотвращения этого заболевания. Чтобы снизить риск заражения, в первую очередь следует выяснить источник передачи.
Предыдущие исследования установили, что владение собакой или кошкой является фактором риска заражения токсокарой.Прямой контакт с необработанными инфицированными щенками считается важным источником передачи инфекции. Однако общенациональное исследование, проведенное в США, показало, что процент владения домашними животными среди пациентов с ОТ составлял менее 50% (45% для собак и 26% для кошек), что свидетельствует о том, что контакт с нелеченными инфицированными щенками может недостаточно объяснить источники передачи. . Случайное проглатывание яиц с зародышем в результате геофагии также было предложено как еще один важный источник передачи [1, 2, 7].Поскольку заболевание обычно возникает у детей, следует уделять особое внимание соблюдению правил гигиены, например мытье рук, особенно после пребывания в зонах повышенного риска, таких как песочницы, парк под открытым небом и игровые площадки. Действительно, песочницы, парки под открытым небом и детские площадки могут быть сильно загрязнены зародышами яиц токсокары, поскольку люди обычно выгуливают своих питомцев в этих местах [2, 49, 50, 51, 52], а в теплых условиях яйца с зародышами могут оставаться жизнеспособными в течение многих лет. [53]. Кроме того, владельцев домашних животных следует посоветовать незамедлительно избавляться от фекалий, часто убирать жилые помещения домашних животных и отвозить домашних животных к ветеринару для регулярной дегельминтизации [16].
У взрослых пациентов источник передачи может несколько отличаться от источника передачи у детей, поскольку вероятность случайного проглатывания яиц с эмбрионами ниже. Недавно сообщалось о связи между сырым мясом, особенно сырой коровьей печенью, и токсокарозом среди взрослого населения [9, 14]. В некоторых странах Азии сырое мясо потребляют, в основном, взрослые, что может увеличить число взрослых пациентов с токсокарозом [15]. В Корее употребление сырой коровьей печени в анамнезе было обнаружено у 60-90% пациентов с системным токсокарозом и у 80.8% ОТ. Отношение шансов ОТ составляло 14,9 для употребления сырой коровьей печени и 2,28 для употребления сырого мяса [9]. Это указывает на то, что источник заражения токсокарозом и демографические особенности пациентов могут различаться в зависимости от географических и поведенческих (особенно пищевых привычек) моделей. Практикующий общественный врач должен учитывать местный культурный контекст при выявлении вероятных источников инфекции у пациентов с токсокарозом и обучать людей не есть сырое мясо, чтобы предотвратить заражение токсокарой.
ВЫВОДЫ
Наши нынешние представления о диагностике, лечении и профилактике токсокароза человека и поражения глаз ограничены, хотя это одна из самых распространенных зоонозных инфекций во всем мире. Клинический диагноз ОТ можно диагностировать по определенным признакам. Однако серологический диагноз, который дает доказательства инфекции Toxocara, может в значительной степени подтвердить диагноз у пациентов с предполагаемым ОТ. Таким образом, необходимо дальнейшее улучшение диагностики для лучшего обнаружения и быстрой диагностики ОТ.В частности, в будущих исследованиях следует изучить потенциальные источники инфекции и стандартизировать медикаментозное и хирургическое лечение ОТ, чтобы минимизировать анатомические и функциональные последствия. Просвещение общественности и кампании по предотвращению переваривания сырых продуктов животного происхождения, особенно печени, также могут снизить заболеваемость токсокарозом и ОТ.
Ссылки
1. Rubinsky-Elefant G, Hirata CE, Yamamoto JH, Ferreira MU. Токсокароз человека: диагностика, распространенность серотипов в мире и клинические проявления системных и глазных форм.Ann Trop Med Parasitol. 2010; 104: 3–23. [PubMed] [Google Scholar] 2. Деспомье Д. Токсокароз: клинические аспекты, эпидемиология, медицинская экология и молекулярные аспекты. Clin Microbiol Rev.2003; 16: 265–272. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Стенсволд ЧР, Сков Дж., Моллер Л.Н., Йенсен П.М., Капель С.М., Петерсен Э., Нильсен Х.В. Распространенность токсокароза человека в Дании. Clin Vaccine Immunol. 2009. 16: 1372–1373. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Fan CK, Hung CC, Du WY, Liao CW, Su KE.Сероэпидемиология инфекции Toxocara canis среди школьников горных аборигенов, проживающих в загрязненных районах на востоке Тайваня. Trop Med Int Health. 2004. 9: 1312–1318. [PubMed] [Google Scholar] 5. Бивер ПК, Снайдер СН, Каррера Дж. Х., Дент Дж. Х., Лафферти Дж. У. Хроническая эозинофилия, вызванная мигрирующей висцеральной личинкой; отчет о трех случаях. Педиатрия. 1952; 9: 7–19. [PubMed] [Google Scholar] 6. Николс Р.Л. Этиология висцеральной мигрирующей личинки. I. Диагностическая морфология инфекционных личинок токсокар второй стадии.J Parasitol. 1956; 42 (4 секция 1): 349–362. [PubMed] [Google Scholar] 7. Смит Х., Холланд С., Тейлор М., Магнавал Дж. Ф., Шанц П., Майзельс Р. Насколько распространен токсокароз у человека? К стандартизации наших знаний. Trends Parasitol. 2009. 25: 182–188. [PubMed] [Google Scholar] 8. Biglan AW, Glickman LT, Lobes LA., Jr. Сыворотка и антитело к токсокарам стекловидного тела при эндофтальмите нематод. Am J Ophthalmol. 1979; 88: 898–901. [PubMed] [Google Scholar] 9. Ан SJ, Woo SJ, Jin Y, Chang YS, Kim TW, Ahn J, Heo JW, Yu HG, Chung H, Park KH, Hong ST.Клиника и течение глазного токсокароза у взрослых. PLoS Negl Trop Dis. 2014; 8: e2938. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Стюарт JM, Cubillan LD, Cunningham ET., Jr. Распространенность, клинические особенности и причины потери зрения среди пациентов с глазным токсокарозом. Сетчатка. 2005. 25: 1005–1013. [PubMed] [Google Scholar] 11. Maetz HM, Kleinstein RN, Federico D, Wayne J. Оценка распространенности глазного токсоплазмоза и токсокароза в Алабаме. J Infect Dis. 1987; 156: 414. [PubMed] [Google Scholar] 12.Good B, Holland CV, Taylor MR, Larragy J, Moriarty P, O’Regan M. Глазной токсокароз у школьников. Clin Infect Dis. 2004. 39: 173–178. [PubMed] [Google Scholar] 13. Гото Х, Мочизуки М., Ямаки К., Котаке С., Усуи М., Оно С. Эпидемиологическое исследование внутриглазного воспаления в Японии. Jpn J Ophthalmol. 2007; 51: 41–44. [PubMed] [Google Scholar] 14. Choi D, Lim JH, Choi DC, Paik SW, Kim SH, Huh S. Токсокароз и употребление сырой коровьей печени у пациентов с эозинофилией. Корейский J Parasitol. 2008. 46: 139–143.[Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Вудхолл Д., Старр М.С., Монтгомери С.П., Джонс Дж.Л., Лам Ф., Рид Р.У., Мурти Р.С. Глазной токсокароз: эпидемиологические, анатомические и терапевтические варианты на основе опроса узких офтальмологов. Офтальмология. 2012; 119: 1211–1217. [PubMed] [Google Scholar] 18. Йокои К., Гото Х., Сакаи Дж., Усуи М. Клинические особенности глазного токсокароза в Японии. Ocul Immunol Inflamm. 2003; 11: 269–275. [PubMed] [Google Scholar] 19. Мирда Б.Р., Хокар СК. Глазной токсокароз у населения Северной Индии.J Trop Pediatr. 2002. 48: 328–330. [PubMed] [Google Scholar] 20. Park SP, Park I, Park HY, Lee SU, Huh S, Magnaval JF. Пять случаев глазного токсокароза подтверждены серологическими исследованиями. Корейский J Parasitol. 2000. 38: 267–273. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Гиллеспи Ш., Диннинг У. Дж., Фоллер А., Кроукрофт Н. С.. Спектр глазного токсокароза. Глаз (Лондон) 1993; 7 (Pt 3): 415–418. [PubMed] [Google Scholar] 22. Ёсида М., Сирао Й, Асаи Х, Нагасе Х, Накамура Х, Окадзава Т., Кондо К., Такаянаги Т.Х., Фудзита К., Акао Н.Ретроспективное исследование глазного токсокароза в Японии: корреляция с распространенностью антител и офтальмологическими данными пациентов с увеитом. J Helminthol. 1999. 73: 357–361. [PubMed] [Google Scholar] 23. Ван В.Л., Кано М.Р., Пинс К.Дж., Грин Р.Л. Эхографические характеристики глазного токсокароза. Офтальмология. 1991; 98: 28–32. [PubMed] [Google Scholar] 24. Уилкинсон С.П., Уэлч РБ. Внутриглазные токсокары. Am J Ophthalmol. 1971; 71: 921–930. [PubMed] [Google Scholar] 25. Ан SJ, Woo SJ, Hyon JY, Park KH. Образование катаракты, связанное с токсокарозом глаз.J Cataract Refract Surg. 2013; 39: 830–835. [PubMed] [Google Scholar] 26. Сиваратнам Д., Субрайан В., Али Н.А. Трансвитреальная миграция личинки Toxocara, приводящая ко второй хориоретинальной гранулеме. Jpn J Ophthalmol. 2008. 52: 416–417. [PubMed] [Google Scholar] 27. Сузуки Т., Джоко Т., Акао Н., Охаши Ю. После миграции личинки токсокары в сетчатке с помощью оптической когерентной томографии и флуоресцентной ангиографии. Jpn J Ophthalmol. 2005. 49: 159–161. [PubMed] [Google Scholar] 28. Жакье П., Готштейн Б., Стингелин И., Эккерт Дж.Иммунодиагностика токсокароза у людей: оценка нового набора для иммуноферментного анализа. J Clin Microbiol. 1991; 29: 1831–1835. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Шанц PM. Личинка токсокары мигрирует сейчас. Am J Trop Med Hyg. 1989; 41 (3 доп.): 21–34. [PubMed] [Google Scholar] 30. Хаглер WS, Поллард ZF, Джарретт WH, Доннелли Э. Результаты операции по поводу окулярного Toxocara canis. Офтальмология. 1981; 88: 1081–1086. [PubMed] [Google Scholar] 31. Джин И, Шен Си, Хэ С, Сон В.М., Чой М.Х., Хонг СТ.Серодиагностика токсокароза методом ИФА с использованием неочищенного антигена личинок Toxocara canis. Корейский J Parasitol. 2013; 51: 433–439. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Лукас А., Муллин Н.П., Теттех К.К., Моенс Л., Майзелс Р.М. Новый лектин С-типа, секретируемый паразитической нематодой, обитающей в тканях. Curr Biol. 1999; 9: 825–828. [PubMed] [Google Scholar] 33. Шарки Дж. А., Маккей П. С.. Глазной токсокароз у пациента с неоднократно отрицательным титром по ИФА на Toxocara canis. Br J Ophthalmol. 1993; 77: 253–254. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34.Элефант Г.Р., Симидзу С.Х., Санчес М.С., Джейкоб С.М., Феррейра А.В. Серологическое наблюдение за больными токсокарозом после химиотерапии, основанное на обнаружении антител IgG, IgA и IgE с помощью иммуноферментного анализа. Анал J Clin Lab. 2006. 20: 164–172. [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Со М, Юн СК. Сероэпидемиологическое исследование токсокароза среди пациентов с эозинофилией в Чхунчхон-Намдо. Корейский J Parasitol. 2012; 50: 249–251. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Kim YH, Huh S, Chung YB.Распространенность токсокароза среди здоровых людей с эозинофилией. Корейский J Parasitol. 2008; 46: 29–32. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Квон Н.Х., О MJ, Ли SP, Ли Би Джей, Чхве, округ Колумбия. Распространенность и диагностическая ценность токсокароза при неизвестной эозинофилии. Ann Hematol. 2006. 85: 233–238. [PubMed] [Google Scholar] 38. Ариас Иригойен J, сенатор Санчес CJ. Токсокароз: причина гипер-IgE и эозинофилии. J Исследование Allergol Clin Immunol. 1995; 5: 232–234. [PubMed] [Google Scholar] 39. Shields JA.Глазной токсокароз. Обзор. Surv Ophthalmol. 1984; 28: 361–381. [PubMed] [Google Scholar] 40. Магуайр AM, Грин WR, Michels RG, Erozan YS. Восстановление внутриглазного Toxocara canis путем витрэктомии pars plana. Офтальмология. 1990; 97: 675–680. [PubMed] [Google Scholar] 41. Барисани-Асенбауэр Т., Мака С.М., Хауфф В., Камински С.Л., Домановиц Х., Хеер И., Ауэр Х. Лечение глазного токсокароза альбендазолом. J Ocul Pharmacol Ther. 2001; 17: 287–294. [PubMed] [Google Scholar] 42. Bird AC, Smith JL, Curtin VT. Нематодный неврит зрительного нерва.Am J Ophthalmol. 1970; 69: 72–77. [PubMed] [Google Scholar] 43. Stürchler D, Schubarth P, Gualzata M, Gottstein B, Oettli A. Тиабендазол против альбендазола в лечении токсокароза: клиническое испытание. Ann Trop Med Parasitol. 1989. 83: 473–478. [PubMed] [Google Scholar] 44. Magnaval JF. Сравнительная эффективность диэтилкарбамазина и мебендазола для лечения токсокароза человека. Паразитология. 1995. 110 (Pt 5): 529–533. [PubMed] [Google Scholar] 45. Абдель-Хамид А.А. Влияние тиабендазола на миграцию личинок Toxocara canis у мышей.J Parasitol. 1984; 70: 226–231. [PubMed] [Google Scholar] 46. Zygulska-Machowa H, Ziobrowski S. Случай глазного токсокароза, леченный ксеноновой фотокоагуляцией. Klin Oczna. 1987. 89: 213–214. [PubMed] [Google Scholar] 47. Lyall DA, Hutchison BM, Gaskell A, Varikkara M. Интравитреальный ранибизумаб в лечении хориоидальной неоваскуляризации, вторичной по отношению к глазному токсокарозу, у 13-летнего мальчика. Глаз (Лондон) 2010; 24: 1730–1731. [PubMed] [Google Scholar] 48. Джулиари ГП, Рамирес Г, Кортез РТ. Хирургическое лечение токсокароза глаз: анатомо-функциональные результаты у 45 пациентов.Eur J Ophthalmol. 2011; 21: 490–494. [PubMed] [Google Scholar] 49. Queiroz ML, Simonsen M, Paschoalotti MA, Chieffi PP. Частота заражения почвы яйцами Toxocara canis в южном регионе муниципалитета Сан-Паулу (SP, Бразилия) за 18-месячный период. Rev Inst Med Trop Сан-Паулу. 2006. 48: 317–319. [PubMed] [Google Scholar] 50. Кастильо Д., Паредес С., Занарту С., Кастильо Дж., Меркадо Р., Муньос В., Шеноне Х. Загрязнение окружающей среды Toxocara sp. яйца на площадях и в парках Сантьяго, Чили, 1999.Bol Chil Parasitol. 2000; 55: 86–91. [PubMed] [Google Scholar] 51. Джакометти А., Кириони О, Фортуна М., Осимани П., Антоничелли Л., Дель Прете М.С., Рива А., Д’Эррико М.М., Петрелли Э., Скализ Г. Экологические и серологические доказательства наличия токсокароза в городской зоне Анконы, Италия . Eur J Epidemiol. 2000. 16: 1023–1026. [PubMed] [Google Scholar] 52. Akdemir C. Висцеральная личинка мигрирует среди детей в Кютахья (Турция) и оценка игровых площадок для яиц T. canis. Turk J Pediatr. 2010. 52: 158–162.[PubMed] [Google Scholar]Медицинская помощь, хирургическая помощь, консультации
Ан С.Дж., Рю Н.К., Ву С.Дж. Глазной токсокароз: клиника, диагностика, лечение и профилактика. Азия Пацан аллергия . 2014 июл.4 (3): 134-41. [Медлайн]. [Полный текст].
Moreira GM, Telmo PD, Mendonça M, Moreira AN, McBride AJ, Scaini CJ, et al. Токсокароз человека: современные достижения в диагностике, лечении и вмешательствах. Тенденции Паразитол .2014 Сентябрь 30 (9): 456-464. [Медлайн].
Центры по контролю и профилактике заболеваний. Глазной токсокароз — США, 2009-2010 гг. MMWR Morb Mortal Wkly Rep . 2011, 10 июня. 60 (22): 734-6. [Медлайн].
Нельсон С, Грин Т, Эрнхарт CB. Инфекция Toxocara canis у детей дошкольного возраста: факторы риска и когнитивное развитие детей дошкольного возраста. Нейротоксикол Тератол . 1996 март-апрель. 18 (2): 167-74. [Медлайн].
Chomel BB, Kasten R, Adams C, et al. Серологическое исследование некоторых основных зоонозных инфекций у детей и подростков на Бали, Индонезия. Юго-Восточная Азия J Trop Med Public Health . 24 июня 1993 г. (2): 321-6. [Медлайн].
Magnaval JF, Мишо А., Калон Н. и др. Эпидемиология токсокароза человека на Реюньоне. Транс Р Соц Троп Мед Хиг . 1994 сентябрь-октябрь. 88 (5): 531-3. [Медлайн].
Ли Р.М., Мур Л.Б., Боттацци, штат Мэн, Хотез П.Дж.Токсокароз в Северной Америке: систематический обзор. PLoS Негл Троп Дис . 2014 8 (8) августа: e3116. [Медлайн]. [Полный текст].
CDC. Рекомендации CDC для ветеринаров: предотвращение зоонозной передачи аскарид и анкилостомов собак и кошек. Доступно по адресу http://www.cdc.gov/NCIDOD/DPD/PARASITES/ascaris/prevention.htm.
CDC. Центры по контролю и профилактике заболеваний (CDC). Доступно по адресу http://www.cdc.gov/NCIDOD/DPD/PARASITES/toxocara/factsht_toxocara.htm.
Choi D, Lim JH, Choi DC, et al. Передача Toxocara canis через проглатывание сырой коровьей печени: кросс-секционное исследование у здоровых взрослых. Корейский J Parasitol . 2012 марта 50 (1): 23-7. [Медлайн]. [Полный текст].
Choi D, Lim JH, Choi DC, Paik SW, Kim SH, Huh S. Токсокароз и употребление сырой коровьей печени у пациентов с эозинофилией. Корейский J Parasitol . 2008 Сентябрь 46 (3): 139-43. [Медлайн]. [Полный текст].
Congdon P, Lloyd P.Инфекция токсокарами в Соединенных Штатах: значимость бедности, географии и демографии как факторов риска и значение для оценки распространенности в округах. Int J Общественное здравоохранение . 2011 Февраль 56 (1): 15-24. [Медлайн].
Иддавела Р.Д., Раджапаксе Р.П., Перера Н.А. и др. Характеристика видоспецифического экскреторно-секреторного антигена Toxocara canis (TcES-57) и разработка двойного сэндвич-ELISA для диагностики висцеральной мигрирующей личинки. Корейский J Parasitol .2007 Март 45 (1): 19–26. [Медлайн].
Квон С.И., Ли Дж. П., Парк С. П., Ли Е. К., Ха С., Парк И. В.. Глазной токсокароз в Корее. Jpn J Ophthalmol . 2011 Март 55 (2): 143-7. [Медлайн].
Lee SU, Yu JR, Huh S. Ультраструктурная локализация личиночного антигена Toxocara canis реагировала с серопозитивной сывороткой человека. Корейский J Parasitol . 2009 Март 47 (1): 65-8. [Медлайн]. [Полный текст].
Magnaval JF.Сравнительная эффективность диэтилкарбамазина и мебендазола для лечения токсокароза человека. Паразитология . 1995 июнь 110 (Pt 5): 529-33. [Медлайн].
Magnaval JF, Fabre R, Maurieres P и др. Применение процедуры вестерн-блоттинга для иммунодиагностики токсокароза человека. Parasitol Res . 1991. 77 (8): 697-702. [Медлайн].
Magnaval JF, Fabre R, Maurieres P и др. Оценка иммуноферментного анализа, выявляющего специфический иммуноглобулин Е против Toxocara для диагностики и последующего наблюдения после лечения токсокароза человека. Дж Клин Микробиол . 1992 30 сентября (9): 2269-74. [Медлайн].
Magnaval JF, Glickman LT, Dorchies P, et al. Основные моменты токсокароза человека. Корейский J Parasitol . 2001 марта 39 (1): 1-11. [Медлайн].
Magnaval JF, Малард Л., Морассин Б. и др. Иммунодиагностика токсокароза глаз с использованием вестерн-блоттинга для выявления специфических антител к Toxocara IgG и CAP для измерения специфических антител к Toxocara IgE. Дж Гельминтол .2002 декабрь 76 (4): 335-9. [Медлайн].
Мойяди А., Махадеван А., Ананд Б. и др. Висцеральные мигрирующие личинки проявляются в виде множественных внутричерепных и внутриспинальных абсцессов. Невропатология . 2007 августа 27 (4): 371-4. [Медлайн].
Муньос-Гусман М.А., дель Рио-Наварро BE, Вальдивия-Анда Г., Альба-Уртадо Ф. Повышение серологической распространенности Toxocara canis у детей с астмой связано с перекрестной реакцией с антигенами Ascaris suum. Аллергол иммунопатол (Мадр) .2010 май-июнь. 38 (3): 115-21. [Медлайн].
Орян А., Саджади С.М., Азизи С. Продолжительность жизни личинок Toxocara cati и патология в тканях экспериментально зараженных цыплят. Корейский J Parasitol . 2010 Март 48 (1): 79-80. [Медлайн]. [Полный текст].
Park HY, Lee SU, Huh S и др. Сероэпидемиологическое исследование токсокароза у практически здоровых жителей в Канвондо, Корея. Корейский J Parasitol . 2002 Сентябрь 40 (3): 113-7.[Медлайн].
Park SP, Huh S, Magnaval JF и др. Случай предполагаемого глазного токсокароза у 28-летней женщины. Корейский J Офтальмол . 1999 г., 13 (2): 115-9. [Медлайн].
Park SP, Park I, Park HY и др. Пять случаев глазного токсокароза подтверждены серологическими исследованиями. Корейский J Parasitol . 2000 Декабрь 38 (4): 267-73. [Медлайн].
Smith HV. Реактивность антител при токсокарозе человека. Льюис Дж. У., Майзелс Р. М., ред. Токсокара и токсокароз: клинические, эпидемиологические и молекулярные перспективы . Лондон: Институт биологии и Британское общество паразитологов; 1993. 91-109.
Sun T, Bellosa ML, Lucio-Forster A, et al. Сравнение белковых составляющих основных частей тела аскариды собаки Toxocara canis. Ветеринарный паразит . 2007 30 ноября. 150 (1-2): 111-5. [Медлайн].
Вон К., Крушон-Моран Д., Шанц П. и др.Резюме 56-го Американского общества тропической медицины и гигиены. Национальная распространенность и факторы риска зоонозов Toxocara spp. Заражение . Филадельфия, Пенсильвания; 4-8 ноября 2007 г.
Вон KY, Kruszon-Moran D, Schantz PM, Jones JL. Национальная распространенность и факторы риска зоонозов Toxocara spp. инфекционное заболевание. Ам Дж. Троп Мед Хиг . 2008 Октябрь 79 (4): 552-7. [Медлайн]. [Полный текст].
Токсокароз (для родителей) — Nemours KidsHealth
Что такое токсокароз?
Токсокароз (tox-oh-keh-RYE-eh-sis) — это инфекция человека, вызываемая червем, который может жить в кишечнике собак и кошек.Чаще всего встречается у маленьких детей и владельцев домашних животных, но заразиться может любой.
Что вызывает токсокароз?
Яйца собачьего червя Toxocara canis или кошачьего червя Toxocara cati переходят в их фекалии (фекалии). Яйца могут долго храниться в почве дворов, парков и детских площадок. Люди могут проглотить эти яйца, если на их еде или руках есть загрязненная грязь. Это чаще случается с детьми, которые не всегда моют руки хорошо или достаточно часто и которые любят засовывать руки в рот.
В редких случаях люди могут заразиться, употребляя в пищу недоваренное мясо, которое содержит личинок токсокары (детенышей глистов).
Что происходит при токсокарозе?
Проглоченные яйца попадают в кишечник, где из них вылупляются личинки. Личинки проходят через стенку кишечника и попадают в кровоток. Затем они попадают в другие части тела, такие как печень, легкие, сердце, мозг или мышцы.
Личинки не превращаются в кишечных червей у людей, как у собак или кошек.Но они могут жить в человеке месяцами или даже годами и могут повредить любой заразившийся орган.
Каковы признаки и симптомы токсокароза?
Многие люди с токсокарозом не имеют никаких симптомов. Если симптомы действительно появляются, они могут варьироваться от легких до тяжелых.
Симптомы зависят от того, какая часть тела поражена, и могут включать:
- лихорадка
- кашель или хрип
- боль в животе
- увеличенная печень
- потеря аппетита
- сыпь, иногда напоминающая крапивницу
- увеличенные лимфатические узлы («опухшие железы»)
- проблемы со зрением.Глаза могут быть красными и болезненными, глаза могут выглядеть скрещенными, зрение может быть нечетким или затуманенным. Если не лечить, это может привести к слепоте на пораженный глаз.
Как диагностируется токсокароз?
Поскольку у детей не всегда есть симптомы, во многих случаях токсокароз не диагностируется. При появлении симптомов врачи проведут осмотр и назначат анализы крови, а иногда и другие анализы.
Как лечится токсокароз?
Ребенок с легкими симптомами может не нуждаться в лечении, потому что инфекция пройдет сама по себе, когда личинки умрут.Детей с симптомами, которые влияют на легкие, глаза или другие важные органы, можно лечить антипаразитарными препаратами, которые убивают личинок.
Иногда врачи также назначают стероиды для облегчения воспаления в поврежденных органах. Они также могут направить ребенка к специалисту (например, к офтальмологу, если поражен глаз).
Можно ли предотвратить токсокароз?
Чтобы защитить ваших детей от контакта с яйцами или личинками, вызывающими токсокароз:
- Отнесите домашних животных к ветеринару для дегельминтизации, особенно щенков младше 6 месяцев.
- Часто очищайте и дезинфицируйте жилое пространство вашего питомца и после этого хорошо мойте руки.
- Каждый член семьи должен хорошо мыть руки после игры с домашними или другими животными, после игры на улице, а также перед прикосновением к еде или приемом пищи.
- Учите маленьких детей не класть грязные руки в рот и не есть грязь или землю.
- Не подпускайте детей к местам с их фекалиями.
- Если у вас есть песочница, не подпускайте к ней домашних животных и накрывайте ее, когда она не используется.



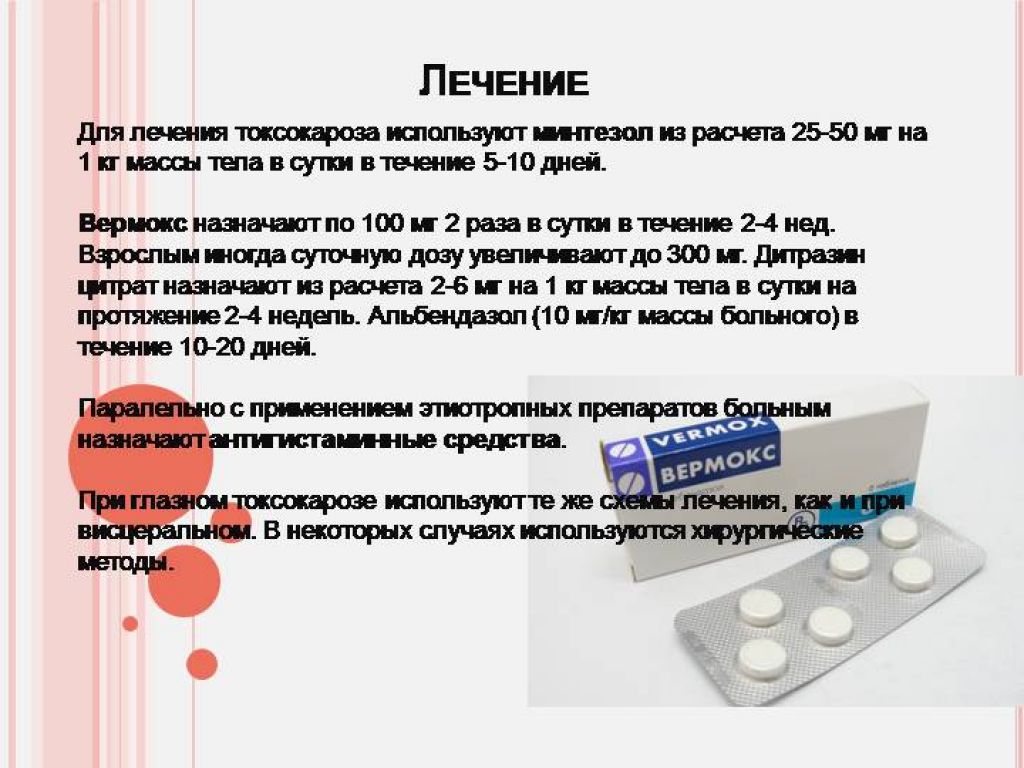
 – 2018. https://www.sciencedirect.com/science/article/pii/S0269749118326708#!
– 2018. https://www.sciencedirect.com/science/article/pii/S0269749118326708#!