Восстанавливаем микрофлору кишечника народными средствами
Простудные заболевания, антибиотики, некачественная еда — вот и причина дисбактериоза.
Но есть очень эффективная процедура, которая вполне может быть проведена в домашних условиях.
Надо сказать, что флора, живущая в кишечнике каждого человека, очень чутка и ранима, навредить ей очень легко. Повредить или даже уничтожить флору кишечника может множество факторов. И если уничтожить микроорганизмы, живущие в кишечники очень просто, то их восстановление может занять продолжительное время.
Ученые утверждают, что микроорганизмы в кишечнике неоднородны, всего в желудочно-кишечном тракте могут проживать до пятисот видов разнообразных крохотных организмов. Повредить микроорганизмам могут самые разные причины и факторы.
Во-первых, уничтожить флору кишечника могут различные врожденные болезни, которые приводят к недостатку (или переизбытку) фермента.
Во-вторых, флора может быть уничтожена вследствие принятия медикаментозных средств (например антибиотиков), а также из-за неправильного питания, различных инфекций и излишка алкогольных напитков.
Кроме того, радиация всех видов (включая рентгеновские лучи) могут убивать флору кишечника.
Поэтому восстановление микрофлоры кишечника народными средствами крайне важно, так как от этого зависит здоровье человека. Благо, существует огромное количество лекарственных трав, которые помогут решить эту проблему.
• Так, в частности, для того чтобы быстро восстановить микрофлору кишечника, можно сделать сладкую и полезную смесь. Изготавливается такая смесь из меда, кураги и чернослива. Твердые ингредиенты необходимо размельчить с помощью блендера или мясорубки, а после смешать их с медом. Употреблять такую смесь надо по одной столовой ложке в день.
• Восстановление микрофлоры кишечника народными средствами можно проводить с помощью классических круп. К примеру, очень помогают каши из геркулеса или гречки, съеденные за завтраком. Не будет лишним добавить к каше качественный чернослив.
Также восстановлению микрофлоры очень хорошо помогает компот из сухофруктов.
К обеду добавляйте винегрет или любой другой салат из свеклы.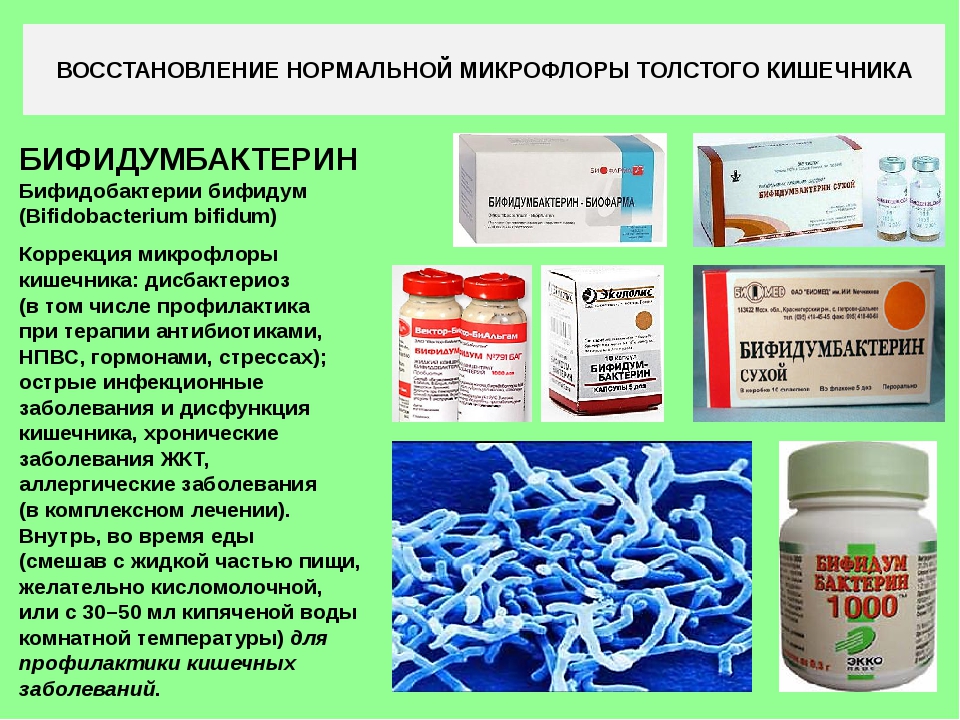 Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
Пейте чай с добавлением кусочка лимона, ежедневно съедайте 2 зубчика чеснока для уничтожения злотворных бактерий.
• Конечно же, оптимальным вариантом будет употреблять различные кисломолочные продукты, такие как кефир и творог. Есть их можно без ограничений, так как эти продукты приносят организму исключительно пользу. Достаточно большой эффективностью отличается прием кумыса или ряженки (до двух стаканов в сутки).
• Восстановление микрофлоры кишечника народными средствами можно осуществлять с помощью корней кровохлебки. Для этого нужно 200 граммов корня кровохлебки залить стаканом воды и оставить вариться на медленном огне 15-20 минут. Получившийся отвар нужно принимать внутрь пять-шесть раз в день по одной столовой ложке. Подобное лечение нужно проводить как минимум месяц.
• Также можно приготовить отличный рецепт из четырех чайных ложек семян укропа. Семена укропа нужно залить стаканом кипятка и оставить настаиваться в течение двух часов. После этого полученный настой следует принимать каждые два часа.
• Подорожник с корнем аира – отличный способ восстановить флору кишечника. Как и в предыдущих случаях, 2 ч ложки смеси лекарственных трав заливают кипятком и настаивают полчаса, после чего принимают в течение десяти дней по 50 миллилитров за полчаса перед каждым приемом пищи.
• Восстановление микрофлоры кишечника после антибиотиков брагой. Это самый что ни на есть народный рецепт.
В пол-литра теплой воды добавляете по 1 ст ложке меда и сахара и примерно 2 г дрожжей. Все тщательно перемешиваете и оставляете бродить на пАру часов в теплое место. Дольше не стоит, иначе получится хмельная брага. Выпить следует сразу все за раз залпом. Выпивать по времени ровно между приемами пищи. Это получится 2 кружки в день. Этим средством вы сразу поселяете в кишечник бродильные микроорганизмы, тем самым восстанавливаете его нормальную работу.
• Еще запомните — все кислые ягоды, типа клюквы, и плоды шиповника — это очень хорошее лекарство для восстановления микрофлоры кишечника. Ешьте их ежедневно и у вас все будет хорошо.
Ешьте их ежедневно и у вас все будет хорошо.
• Уже ни для кого не секрет, что тыквенные семечки хорошо очищают кишечник от паразитов. Усильте их действие таким рецептом: в равных количествах измельчите в блендере тыквенные семечки, семечки от подсолнуха и грецкие орехи. 2 ст ложки получившегося порошка размешиваете в половине стакана кипяченой воды и выпиваете. Курс приема 2 раза в день 10 дней.
Стоит отметить, что восстановление флоры кишечника — процедура, которая требует терпения и кропотливой работы.
Для полного излечения нужно принимать целебные травы как минимум десять дней, и при этом нельзя игнорировать диету.
По материалам сайта «ПроЗдоровье»
Перед применением посоветуйтесь с врачом об отсутствии у вас противопоказаний.
____________________
Нашли ошибку или опечатку в тексте выше? Выделите слово или фразу с ошибкой и нажмите Shift + Enter или сюда.
Как восстановить микрофлору кишечника • Причины, симптомы и признаки нарушения микрофлоры
Миллиарды полезных бактерий, живущих в ЖКТ человека, делают незаметную, но нужную работу. От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
От чего возникает дисбактериоз и можно ли восстановить микрофлору кишечника?
«Миллиарды» – это не преувеличение, а преуменьшение. Биологи подсчитали, что в кишечнике здорового человека проживает примерно 50 триллионов микроорганизмов. Хотя человек может жить с нарушениями микрофлоры ЖКТ или даже при полном ее отсутствии, это считается отклонением от нормы. Также нежелателен дисбаланс между разными микроорганизмами или преобладание патогенных видов. Поэтому важно поддерживать здоровье кишечника и его обитателей – и речь здесь не столько о лечении, сколько о правильном питании и образе жизни.
Что такое микрофлора кишечника
Микрофлора кишечника – это совокупность всех микроорганизмов, которые живут в ЖКТ здорового человека. При этом в желудке их намного меньше, поскольку кислая среда неблагоприятна для большинства бактерий. Большая часть микрофлоры сосредоточена в тонком и толстом кишечнике. В основном это – лактобациллы, бифидобактерии и бактероиды.
Причины нарушения микрофлоры кишечника
В очень редких случаях микрофлора кишечника исчезает полностью. Гораздо чаще врачи сталкиваются с уменьшением количества нужных видов микроорганизмов и ростом патогенной флоры. Произойти это может по нескольким причинам:
- пищевое или химическое отравление;
- хронические заболевания ЖКТ;
- инфекционное заболевание;
- лечение антибиотиками или иными подавляющими микрофлору препаратами.
Это состояние врачи называют дисбактериозом или дисбиозом кишечника. Важно понимать, что это не самостоятельная болезнь, а синдром. Поэтому правильнее лечить первопричину, а не сам дисбактериоз.
Симптомы и признаки нарушения микрофлоры кишечника
Даже сегодня микрофлора кишечника изучена недостаточно. Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
Например, ученые до сих пор не могут ответить на вопрос: почему нарушение ее состава у одних людей протекает тяжело, а у других – бессимптомно и без ухудшения самочувствия. Так или иначе, предположить нарушение микрофлоры ЖКТ можно по следующим клиническим проявлениям:
- боль или чувство распирания в животе;
- диарея и/или метеоризм;
- ухудшение аппетита.
Диагностировать нарушение микрофлоры кишечника сложно, поскольку у каждого человека она уникальна. Поэтому врач будет в первую очередь искать причину дисбактериоза, а именно – заболевание, которое могло к этому привести.
Как восстановить микрофлору кишечника народными средствами
К сожалению, достоверных исследований, которые бы показали действенность альтернативной медицины в данном случае, нет. Нормализовать микрофлору кишечника можно лишь опосредованно: улучшая качество жизни. Речь идет не только о правильном питании, но и о физических активностях, отказе от вредных привычек и др. В частности, рацион с высоким содержанием растительных волокон (фрукты, овощи, злаки) благоприятно влияет на микрофлору кишечника, поскольку некоторые бактерии питаются клетчаткой.
В частности, рацион с высоким содержанием растительных волокон (фрукты, овощи, злаки) благоприятно влияет на микрофлору кишечника, поскольку некоторые бактерии питаются клетчаткой.
Восстановление микрофлоры после антибиотиков
После приема некоторых лекарств (в частности, антибиотиков) в микрофлоре кишечника может наблюдаться дисбаланс. Например, место убитых лекарствами лактобактерий могут занять грибковые культуры или протеи, на которых антибиотики не действуют. Непосредственного лечения, позволяющего быстро восстановить микрофлору кишечника, современная медицина предложить не может. Чаще всего микрофлора приходит в норму самостоятельно, через некоторое время после отмены антибиотиков. Как долго придется ждать? Как правило, несколько недель. По результатам анализов врач дополнительно может назначить средства, подавляющие патогенную флору (например, противогрибковые препараты).
К сожалению, широко рекламируемые пробиотики и препараты с лакто– и бифидобактериями не имеют доказанной эффективности. Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Проблема в том, что полезные микроорганизмы невозможно доставить туда, где они нужны, живыми. Так, двенадцатиперстная кишка человека содержит агрессивные пищеварительные ферменты, которые убивают большинство микроорганизмов. Поэтому до кишечника «полезные бактерии в капсулах» просто не доходят.
Какие продукты восстанавливают микрофлору кишечника
Важно понимать, что какими бы полезными не были продукты, в кишечник они попадают в полностью переваренном состоянии. И однозначно говорить, например, что кефир улучшает микрофлору за счет содержания полезных бактерий, не совсем верно. Поэтому после отравления, диареи или иного расстройства ЖКТ необходимо, в первую очередь, снизить нагрузку на организм, придерживаясь определенной диеты.
Вот пример лечебного питания, назначаемого при заболеваниях кишечника:
| Можно | Нельзя |
|---|---|
| Сухари из белого хлеба (без добавления сахара, соли и специй) | Сдобные мучные изделия, черный хлеб, пирожные |
| Супы на обезжиренном бульоне или овощном отваре | Наваристые мясные бульоны, грибные супы |
| Нежирные сорта мяса и птицы в виде отварных и паровых блюд | Жирное мясо и рыбу, жареные блюда, колбасы, соленая рыба и икра |
| Каши на воде (рис, греча, овсянка, манка) | Перловка, макароны, бобовые |
| Творог и кисломолочные продукты | Цельное молоко и сливки |
| Свежие или печеные фрукты без кожуры (в том числе в виде пюре) | Фрукты и овощи, содержащие много грубой клетчатки (капуста, морковь, груши, абрикосы) |
| Кисели, желе, отвар шиповника, разбавленные ягодные соки | Газированные напитки, алкоголь, кофе |
Несмотря на то, что сырые фрукты и овощи надо вводить в меню аккуратно, полностью отказываться от них нельзя. Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Помимо содержания необходимых витаминов, клетчатка стимулирует перистальтику, что может уберечь от запора. А вот отвары лечебных трав без рекомендации врача принимать не стоит.
Читайте также:
Идеи для быстрого и здорового перекуса
Как правильно выбрать хороший мед
Как восстановить микрофлору кишечника с помощью питания и лекарственных препаратов?
В кишечнике каждого человека обитает около 50 триллионов разнообразных микроорганизмов, без которых пищеварительный тракт не смог бы полноценно выполнять свою основную функцию – усваивать питательные вещества из продуктов. Общий вес этих маленьких «жильцов» может достигать 3 кг, все они образуют кишечную микрофлору.
У здорового человека микрофлора состоит из 1% условно-патогенных микроорганизмов, среди которых дрожжеподобные грибки, стафилококки и клостридии. Остальные 99% совершенно безвредны. К ним относят бифидо- и лактобактерии, кишечные палочки, энтерококков, аэробов. Если баланс микроорганизмов отклоняется в сторону вредных, и их численность начинает превышать положенный 1%, а популяция полезных бактерий сокращается, значит у человека развивается дисбактериоз.
К ним относят бифидо- и лактобактерии, кишечные палочки, энтерококков, аэробов. Если баланс микроорганизмов отклоняется в сторону вредных, и их численность начинает превышать положенный 1%, а популяция полезных бактерий сокращается, значит у человека развивается дисбактериоз.
Внимание! Нарушение микрофлоры кишечника возникает по многочисленным причинам. Основные – затяжной прием слабительных, гормональных, антибактериальных препаратов, неправильное питание, диеты и голодания, болезни эндокринной системы, снижение иммунитета, оперативные вмешательства, частые стрессы и депрессии, переутомления, вредные привычки, последствия самостоятельной чистки организма.Очень важно поддерживать микрофлору кишечника. С этими задачами справляется комплекс пробиотиков Эльбифид — Essential Probiotics, который поддерживает баланс естественной микрофлоры кишечника, ответственной за качество иммунного ответа и гармонизацию работы пищеварительной системы.
Cтоит также обратить ваше внимание на Бифидогенный бальзам — Сибирский прополис Агатовый, который также плодотворно влияет на естественный баланс микрофлоры кишечника, стимулируя её рост. Улучшенная формула бальзама содержит ещё больше лактулозы и сибирских целебных трав.
Лекарственная терапия
При выраженном дисбактериозе микрофлору кишечника восстанавливают медикаментозным способом. Самостоятельно принимать препараты нельзя, поскольку можно еще сильнее усугубить ситуацию. Следует обратиться к врачу, который подберет наиболее подходящий метод лечения дисбактериоза и лекарственные средства. Могут быть назначены:
- антибиотики – показаны только в запущенных случаях для устранения вредной флоры;
- пребиотики – для создания благоприятных условий для жизни полезных микроорганизмов;
- пробиотики – живые микроорганизмы, аналогичные тем, которые обитают в здоровом кишечнике;
- симбиотики – для заселения кишечника полезными бактериями и создания подходящих условий для их жизнедеятельности;
- ферменты – для улучшения процесса переваривания пищи.

На какое средство падет выбор врача, зависит от симптоматики у больного. При диарее назначаются пробиотики, при задержке стула – пребиотики, при непостоянном стуле – симбиотики.
Питание
Микрофлору помогают восстановить некоторые продукты и народные средства. Соблюдение правильного питания – одно из важнейших условий для эффективного лечения дисбактериоза. Именно грамотно подобранные продукты позволяют наладить пищеварение, избавиться от проблем со стулом и снабдить организм недостающими микроорганизмами и витаминами.
При задержке стула рекомендовано употребление чернослива, свеклы, отрубей, семян льна, овсяной каши. При диарее – цветной капусты, печеных яблок, моркови, риса, приготовленных на пару рыбных и мясных блюд. При метеоризме – легкие бульоны, картофель, омлеты. Исключить в последнем случае придется бобовые, молоко, сладости и выпечку.
Ощутить комфорт и лёгкость в желудке благодаря уникальной композиции сибирских трав вам поможет Фиточай из диких трав № 5 (Комфортное пищеварение) из серии Baikal Tea Collection. Ромашка, курильский чай, подорожник и володушка нормализуют работу пищеварительной системы и восстанавливают микрофлору кишечника.
Ромашка, курильский чай, подорожник и володушка нормализуют работу пищеварительной системы и восстанавливают микрофлору кишечника.
В качестве перекуса можно использовать Питательный коктейль Ванильная лукума — Yoo Gо, богатый витаминами, аминокислотами и полезными жирами. Каждая порция — это полноценный полезный перекус, наполненный пищевыми волокнами, омега-3 ПНЖК, белком и L-карнитином. Сбалансированный состав обеспечивает организм жизненно важными нутриентами и помогает сохранить ощущение сытости долгое время.
Внимание! Для восстановления кишечной микрофлоры в домашних условиях все равно придется принимать пребиотики и пробиотики. Первые можно получить из чеснока, лука, банана, спаржи, отрубей. Вторые – из кефира и натурального йогурта. Обоими компонентами организм можно снабдить с помощью пищевых добавок.
При дисбактериозе полезно употреблять в пищу паровые овощи, запеченные фрукты, некислые соки, легкие супы, молочные и кисломолочные продукты, цельнозерновые крупы, миндаль. Можно включить в рацион нежирные сорта мяса и рыбы, зачерствелый белый хлеб, отруби, галеты. Под строгим запретом – жирные сорта мяса и рыбы, копчености, соленые, острые, маринованные, кислые продукты, жареные блюда, консервы, мороженое, мучные и кондитерские изделия, концентрированные бульоны, шоколад, перловка, соуса, крепкий чай и кофе, бобовые, грибы, алкоголь.
Можно включить в рацион нежирные сорта мяса и рыбы, зачерствелый белый хлеб, отруби, галеты. Под строгим запретом – жирные сорта мяса и рыбы, копчености, соленые, острые, маринованные, кислые продукты, жареные блюда, консервы, мороженое, мучные и кондитерские изделия, концентрированные бульоны, шоколад, перловка, соуса, крепкий чай и кофе, бобовые, грибы, алкоголь.
Как восстановить микрофлору кишечника после приема антибиотиков?
Прием антибиотиков и его последствия
Без применения препаратов, способных бороться с сильнейшими микробами атаковавшими наш организм, уже не обойтись. Назначение антибиотиков теперь привычное дело, ведь их спектр настолько широк, что позволяет очень точно подобрать правильный тип препарата. Почти всегда после такого лечения возникает задача восстановить микрофлору кишечника после приема антибиотиков. Устраняя патологические процессы, уничтожая как вредные, так и полезные микроорганизмы, чудесные помощники превращаются одновременно во вредителей, вызывая нарушение микрофлоры.
Зачастую пациенты боятся принимать противомикробные препараты, ожидая от них больше вреда, чем помощи. Основное побочное действие, которого опасаются многие принимающие антибактериальные препараты, – это дисбактериоз кишечника. Действительно, кроме проблем со здоровьем от протекания болезни добавляются дискомфорт, боли в ЖКТ. Но так же, как для борьбы с болезнями, широко применяются средства, помогающие нивелировать вредное действие антибиотиков, восстановить нормальную микрофлору.
Кишечник заселен как полезными бактериями – это бифидо, лакто-бактерии, так и не очень полезными – это дрожжевые грибы, кишечная палочка, другие множественные бактерии. При лечении антибиотиками страдает первая и вторая группа, одинаково уменьшаясь при воздействии лекарства. Конечно же важно сохранить максимально количество полезных бактерий для нормального функционирования процесса пищеварения. Ведь полезные бактерии помогают расщеплять белки, кислоты, синтезировать иммуноглобулин, укрепляя иммунную систему, устранять процессы гниения, справляться с токсинами. Соответственно когда их не хватает, в организме начинаются неприятные изменения – боли в животе, проблемы с опорожнением кишечника, метеоризм, нарушение работы печени, проявление аллергии, например высыпаниями на коже.
Соответственно когда их не хватает, в организме начинаются неприятные изменения – боли в животе, проблемы с опорожнением кишечника, метеоризм, нарушение работы печени, проявление аллергии, например высыпаниями на коже.
Вследствие ослабления иммунитета могут быть нарушения работы других органов, возникнуть гормональные нарушения, прочие неприятные явления. Пройдя курс лечения антибиотиками, но не позаботившись о помощи своему ЖКТ, вы заметите повышенную утомляемость, вялость, снижение жизненной энергии, проблемы с настроением, эмоциональными реакциями.
Организм сам подскажет, что ему нужна помощь, если вам не назначили препараты для восстановления микрофлоры с прописанным курсом лечения антибиотиками. Если вы заметили такие симптомы у себя в процессе лечения или по окончании его, можете быть уверены – нарушение нормального функционирования работы ЖКТ произошло, даже если прием антибиотиков составил 3-7 дней:
- регулярные, беспокоящие боли в животе;
- нарушение дефекации;
- ощущение тяжести после приема пищи;
- выраженный метеоризм;
Перед началом какого-либо лечения стоит посетить врача для консультации, чтобы установить точную причину недомоганий и получить правильные рекомендации насчет питания и терапии после курса антибиотиков. Обычно ферментные препараты и пробиотики назначает лечащий врач, сразу же комплексно с выписанным назначением по основному заболеванию. Если же таковых назначений не было сделано, стоит посетить гастроэнтеролога и получить нужные рекомендации.
Обычно ферментные препараты и пробиотики назначает лечащий врач, сразу же комплексно с выписанным назначением по основному заболеванию. Если же таковых назначений не было сделано, стоит посетить гастроэнтеролога и получить нужные рекомендации.
Режим питания
Первое, с чего стоит начать помощь своему организму, чтобы быстро восстановить микрофлору кишечника после приема антибиотиков, – это режим питания, а также его состав. При лечении антибиотиками ЖКТ страдает от нагрузки, в это время стоит его оградить от переваривания тяжелых продуктов, особенно ненатуральных, с использованием консервантов. Об исключении приема алкоголя, конечно же, напоминать не стоит, это прописано в инструкции к антибиотикам, а также будет уточнено лечащим врачом.
Продукты должны быть легкоусваиваемыми, натурального происхождения, несложной термической обработки, без чрезмерной обжарки, копчения, соления, приправ. Правильные продукты помогут быстрее вернуться к привычному питанию, любимым яствам. Если у вас началось расстройство кишечника, старайтесь употреблять следующие блюда: рисовую или гречневую кашу, отварные яйца, мясо, рыбу паровую, цветную капусту вареную, морковь, кабачки, галетное печенье, кисель из черники.
Если у вас началось расстройство кишечника, старайтесь употреблять следующие блюда: рисовую или гречневую кашу, отварные яйца, мясо, рыбу паровую, цветную капусту вареную, морковь, кабачки, галетное печенье, кисель из черники.
Когда наоборот мучает запор, список продуктов будет таков: овсяная каша, вареная свекла, чернослив и фрукты. Исключить придется хлеб, капусту, картофель, груши, бобовые. Фруктовый сок, минеральная вода также разрешены. Продукты, содержащие клетчатку, хорошо способствуют опорожнению кишечника. При метеоризме не употребляйте капусту, сахар, молоко, бобовые. Стоит увеличить потребление вареного мяса, рыбы, омлета, вареного или печеного картофеля.
Ферментные препараты
Кроме того, что страдает пищеварительная система, проявляющаяся нарушениями стула, неприятными ощущениями в животе, происходят нарушения в работе печени, поджелудочной железе. Им также может потребоваться помощь, которую оказывает прием ферментных препаратов. Для того чтобы определить какой из них требуется именно вам, стоит посетить специалиста. С учетом описанных симптомов, назначенных анализов, их результатов, врач-гастроэнтеролог подберет самый подходящий.
С учетом описанных симптомов, назначенных анализов, их результатов, врач-гастроэнтеролог подберет самый подходящий.
Для восстановления нормальной микрофлоры кишечника после лечения антибиотиками потребуются препараты такие как креон, мезим, панкреатин . Но прием каждого из них должен быть согласован с врачом, ведь у каждого из них также имеются противопоказания, побочные эффекты, поэтому самолечение данными препаратами недопустимо. Тем более что, например, дозировку препарата креон самостоятельно определить невозможно, она подбирается исключительно по симптоматике, показателям в анализах.
Пребиотики и пробиотики
Обязательными к приему после лечения антибиотиками являются препараты, содержащие полезные бактерии. У каждого из них своя роль. Пробиотики, попадая в организм, помогают восстановить микрофлору кишечника после приема антибиотиков, запустить механизм возрождения, формирования собственных видов лактобактерий и бифидобактерий. Пребиотики – это уже готовые препараты, содержащие нужные бактерии, но при ослабленном состоянии организма они бессильны. Поэтому их назначают тогда, когда просто имеется недостаток своих собственных лактобактерий. Уже после лечения антибиотиками, после приема пробиотиков, стоит принимать пребиотики.
Поэтому их назначают тогда, когда просто имеется недостаток своих собственных лактобактерий. Уже после лечения антибиотиками, после приема пробиотиков, стоит принимать пребиотики.
Препараты пробиотического действия это Линекс, Ацилакт, Бифиформ, Хилак-форте. Их должен назначить врач во время определения тактики лечения основного заболевания антибиотиками, расписав с какого дня курса лечения начинать их прием, также определив дозировку. Затем, после принятого курса пробиотиков, возможно назначение пребиотиков. Эти лекарства также не рекомендуется выбирать самому, а стоит обратиться за консультацией к врачу.
Кисломолочные продукты
Кроме аптечных лекарств, таблеток, порошков, существуют вполне привычные нам продукты, обладающие теми же свойствами что пребиотики. Это доступные всем, вкусные средства для восстановления микрофлоры кишечника после приема антибиотиков. Помочь восстановить нормальный уровень бактерий могут те, где добавлены живые бактерии – биойогурты, биокефир, ряженка термостатная с ацидофильными палочками, мацони с лактобактерями. Употребление этих напитков каждый день способствует пополнению собственного запаса живых клеток молочнокислых бактерий. Они помогают победить дисбиоз в самые короткие сроки, при отсутствии тяжелых нарушений со стороны других органов.
Употребление этих напитков каждый день способствует пополнению собственного запаса живых клеток молочнокислых бактерий. Они помогают победить дисбиоз в самые короткие сроки, при отсутствии тяжелых нарушений со стороны других органов.
Народные средства
Помимо приема аптечных средств и кисломолочных продуктов, существуют народные средства для помощи организму в борьбе с дисбактериозом. Один из рецептов для пополнения ферментов таков – нужно употреблять квашеную капусту в небольших количествах ежедневно. Кроме этой функции, капустный сок способствует заживлению слизистой кишечника и обладает антибактериальным действием, уменьшая количество патогенных микробов.
Компот из смородины, морс из малины – улучшают пищеварение, придют силы. Укропная вода устраняет метеоризм. Чтобы приготовить её возьмите 1 чайную ложку семян, залейте 100 мл кипятка, дайте настояться в течение 40 минут, употребляйте 3 раза в день по чайной ложке. Свекольный сок поможет улучшить кровоснабжение. Пить его нужно, разбавив водой кипяченой на 1 ст.л. сока 4 ст.л. воды. Лучше комбинировать с морковным соком, в пропорции 1 к 8, употребляя по 50 мл смеси за час до еды.
Пить его нужно, разбавив водой кипяченой на 1 ст.л. сока 4 ст.л. воды. Лучше комбинировать с морковным соком, в пропорции 1 к 8, употребляя по 50 мл смеси за час до еды.
Еще одним средством, которое может заменить таблетки, является чайный гриб. Настой из него пьют до еды, употребляя за один раз 1 стакан напитка. Готовится настой 4 дня, но польза уже через неделю будет заметна, а добавив еще одно любое средство для восстановления микрофлоры, состояние значительно улучшится.
Как победить состояние дисбактериоза у детей?
Дисбактериоз в последнее время — весьма распространённое состояние у детей, особенно у грудничков. Оно доставляет дискомфорт малышам, ухудшая их общее состояние, самочувствие, мешает нормальному набору веса ребенка и причиняет массу беспокойств их родителям. Кроме того, микрофлора играет немаловажную роль в жизнедеятельности человека. Она регулирует перистальтику кишечника, поддерживает и стимулирует иммунную систему, синтезирует многие витамины, обеспечивает противовирусную защиту хозяина, нормализует обменные процессы, помогает усваивать многие микроэлементы и аминокислоты, помогает очищать организм от токсинов и препятствует проникновению чужеродных микробов в кровь. Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
Всего в организме человека в кишечнике в высушенном виде находится 1,5 килограмма полезных микробов – это целый «орган». Их деятельность, значимость, можно сравнить с функцией двух органов печени и почек вместе взятых! О причинах возникновения дисбактериоза и методах борьбы с ним рассказывает заведующий отделением детской гастроэнтерологии Челябинской областной детской клинической больницы, врач высшей категории Вадим Земляков.
— Вадим Леонидович, дисбактериоз некоторые врачи считают болезнью. Каково Ваше мнение по этому поводу?
— Дисбактериоз – это состояние, которое может развиваться при различных заболеваниях или неблагоприятных окружающих условиях человека. Приведу простой пример: вы сидите на лекции или в кино, в зале душно нарастает количество углекислого газа в воздухе. В этой ситуации постепенно начинает развиваться состояние дисбактериоза. На работе отругал начальник, человек получил новую порцию стресса, усилилась моторика кишечника, положено начало к развитию состояния дисбактериоза. На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
На нормальную кишечную флору, и не только кишечную, но и на флору всех полостных органов влияет: неправильное питание, плохая экология, изменение климата, различные ионизирующие излучения, которые окружают человека в повседневной жизни, воспалительные заболевания, прием лекарственных средств. Но это не болезнь – это изменение флоры (состояние временное) в зависимости от внешних условий воздействия.
— Дисбактериоз может быть только в кишечнике или этому подвержены все слизистые оболочки организма?
— Нарушенная кишечная флора будет отрицательно действовать на слизистую всех полостных органов в которых она имеется (полость рта, пищевод, желудок, кишечник, влагалище и др.). Здесь появляется цепочка взаимосвязей: болезнь слизистой кишки влияет на состояние микрофлоры, нарушенная микрофлора – на слизистую.
— По каким признакам родители могут определить, что у ребенка имеется состояние дисбактериоза?
— Родителям стоит задуматься, если у ребенка снижается аппетит, ребенок бледный с синюшными кругами под глазами и под носом. Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2. При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
Если у ребенка периодически отмечается подташнивание, бурчание и боли в животе, меняется стул, в кале присутствует зелень или кусочки непереваренной пищи. Ребенок плохо прибавляет в весе, срыгивает, начинает часто болеть простудными заболеваниями. Возможно, вечером, а именно в семь часов, отмечается субфебрильная температура — 37,1-37,2. При условии, что держат ртутный стеклянный (а не электронный) градусник именно 10 минут — это очень важно. Данные признаки могут говорить о болезнях органов пищеварения и в частности о состоянии дисбактериоз.
— Насколько состояние кишечной флоры влияет на иммунитет ребенка?
— При изменении кишечной микрофлоры ребенка в худшую сторону происходит снижение иммунитета. Когда у ребенка появляются частые простудные заболевания, это тоже говорит о том, что органы пищеварения не позволяют иметь 100%-ный иммунитет. Ведь у человека иммунитет на 98% зависит от состояния микрофлоры толстой кишки. И когда она нарушается, иммунитет падает, а, значит, появляются частые простуды.
— То есть, если у родителей часто болеет ребенок, они должны задуматься о посещении гастроэнтеролога?
— Как один из моментов. Мы знаем, что многие болезни: кожи, зубов, слизистых, вплоть до бронхиальной астмы, – это порой осложнение болезней органов пищеварения. Когда мне задают подобные вопросы, я сразу вспоминаю один случай: выходит конферансье на сцену и говорит: «У меня сегодня что-то болит голова». Его напарник отвечает: «Наверное, ты что-то не то съел». Зрители в зале смеются, но ведь он сказал все правильно. Головная боль может быть прямым следствием проблем желудочно-кишечного тракта.
— Как врач определяет наличие у ребенка состояния дисбактериоза?
— Существуют различные методы исследования микробной флоры у человека. Очень важно при оценке анализа кала на дисбактериоз учитывать возраст пациента, принципы его питания, период посева: как его собирали, и когда был сдан кал. И без учета данных факторов нельзя правильно оценить полученный результат. Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
Потому что цифры в конечном итоге будут разные. Приведу простой пример: если пациент употребляет больше кисломолочных продуктов, то у него бактерий coli будет значительно меньше, но это не значит, что это болезнь. Если он ест больше мяса, у него бактерий coliбудет больше, а бифидум меньше и так далее. Поэтому сам анализ нужно интерпретировать с учетом этих всех моментов.
— Когда ребенок сдает анализ, все эти факторы обследуются досконально?
— Нет, конечно.
— Тогда получается нельзя с точностью определить у ребенка наличие дисбактериоза?
— Без учета данных факторов нельзя. Поэтому многие родители, когда обращаются к нам за помощью, часто удивляются, почему мы спрашиваем все тонкости и подробности питания, которые в принципе никто никогда не спрашивает. Поэтому мы положительно отличаемся и в плане лечения, и в плане диагностики, и в плане результата. И поэтому к нам всегда огромная очередь.
— Какие методы лечения состояния дисбактериоза существуют и надо ли его вообще лечить?
— Лечить обязательно надо! Начинать лечение необходимо с основного заболевания, приведшего к этому состоянию или с той причины, которая привела к нему. Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже. Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
Естественно, первично назначаются лекарственные препараты, которые воздействуют непосредственно на устранение основной причины. Предположим, у ребенка имеется гастрит, проводится его лечение и плюс назначаются препараты улучшающие микрофлору кишечника ребенка. Если ребенок находится в помещениях, где имеются различные домашние «приборы-излучатели» (телевизор, компьютер, микроволновая печь, радиотелефон, и другие, то, соответственно, их необходимо использовать, как можно реже. Если фактором, приводящим к болезни, являются лекарственные препараты (антибиотики и др.), то их по возможности надо заменить или исключить совсем. То есть, сначала необходимо убрать факторы, отрицательно влияющие на нормальную кишечную флору ребенка. И только после этого, появляется возможность ее восстанавливать.
— Врач сможет точно определить, отчего именно развился дисбактериоз?
— Чаще всего, мы видим причину.
— Существует ли профилактика дисбактериоза?
— В первую очередь необходимо следить за состоянием здоровья ребенка. Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы. Это будет способствовать восстановлению нормальной кишечной флоры.
Обязательно нужно придерживаться принципов здорового питания. В ежедневном рационе ребенка должна содержаться растительная клетчатка (овощи, фрукты, зерновые каши), которая способствует восстановлению кишечной микрофлоры. Естественно, набор должен быть полный: микроэлементы, витамины, ферменты. В рационе должна преобладать растительная пища, обязательно ребенку необходимо употреблять кисломолочные продукты и белки, в виде яиц, мяса, курицы, рыбы. Это будет способствовать восстановлению нормальной кишечной флоры.
— Можно вести здоровый образ жизни, но ведь от стрессов и излучений уберечься гораздо сложнее. Какой выход в этом случае?
— Единственный – избавиться от источника негатива. Если, допустим, у вас стресс на работе, то нужно заменить место работы. И это абсолютно серьезно, ведь мы живем один раз. Быть в постоянном стрессе и лечиться от болезней – это не лучшее решение проблемы. Это просто бессмысленно. Не зря считают японцы, что место работы надо менять один раз в пять лет. И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
И на каждом предприятии у них имеется комната разгрузки, в которой стоят муляжи начальников. Если начальник тебя обидел, заходишь в эту комнату и имеющейся там палкой лупишь по данному муляжу. Начальника, чей муляж разрушается быстрее остальных, увольняют с предприятия. Это и есть профилактика болезней у сотрудников и борьба за более высокую производительность на предприятии.
— Получается, что также не рационально жить в Челябинской области, где экология не самая лучшая?
— Безусловно, проживать у Средиземного моря или в горах Грузии гораздо полезнее, чем в Челябинской области. Приведу простой пример: в 1991 году мы по линии «Зеленого креста» детей с гастроэнтерологической паталогией вывозили для оздоровления в Карловы Вары. Я взял с собой огромную коробку с лекарствами на случай обострения болезней, потому что каждый ребенок имел серьезное заболевание органов пищеварения. И прожив там 1,5 месяца, ни один из детей не пожаловался на плохое самочувствие. Но как только мы пересекли Брест и сходили в ресторан в поезде, ровно в течение двух суток, которые мы ехали, были использованы все припасенные лекарства. У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
У детей начались проблемы со здоровьем в связи с ухудшением качества питания, воды и воздуха.
— А какова роль наследственности в развитии болезней ЖКТ?
— Безусловно, большую роль в здоровье ребенка играет здоровье его родителей. Они передают ему предрасположенность к заболеваниям органов пищеварения. Если мама нездорова, то качество ее грудного молока будет низким, что является следующим фактором не в пользу ребенка.
— Во время грудного вскармливания мама должна соблюдать особый режим питания или диету?
— Питание должно быть полноценным и разнообразным. При наличии заболеваний ЖКТ у матери с профилактической целью могут быть назначены лекарства, улучшающие ее состояние. На это мама сама должна обратить внимание врача-гинеколога, потому что ее состояние здоровья на момент рождения ребенка играет большую роль в формировании здоровья малыша. В частности, насколько полноценным будет состав его микрофлоры кишечника. Ведь заселение нормальных микробов в кишечник ребенка происходит в утробе матери, начиная 26-28 недели.
— Какие продукты детям не рекомендуется употреблять в пищу?
— Существует пять основных вредных продуктов – это газированные напитки, майонез, кетчуп, чипсы и жевательная резинка. Это все продукты генной инженерии. Например, длительное использование жевательной резинки приводит к слабоумию (наличие в ней фенолов). Более того, она покрыта вредным вкусообразующим веществом. А частое ее использование ведет к нарушению пищевого рефлекса. И в следующий раз при глотании пищи желудок не будет готов к ее перевариванию.
— А какие продукты лучше не давать до трех лет?
— Все продукты до трех лет должны быть натуральными, не консервированными! Использовать их можно в сыром или вареном виде. Жареное и копченое, маринованное, шоколадное, естественно, нельзя. Хотя в последнее время надо уже говорить и о вредных привычках у детей раннего возраста, когда малышам матери начинают давать по чайной ложке водки на ночь, чтобы они лучше спали. А для аппетита детям стали давать пиво. Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
Это встречается достаточно часто в последнее время. К нам поступают дети раннего возраста с циррозом печени, потому что мама, вскармливая ребенка грудью, употребляла алкогольные напитки и курила.
— Как вы относитесь к употреблению молока в питании детей?
— Учитывая тот факт, что идеально здоровых детей нет, употребление молока многим из них может быть не на пользу. Молоко может способствовать излишнему росту микрофлоры, а порой, организм ребенка не способен его переварить (лактазная недостаточность). Поэтому мы, гастроэнтерологи, больше ратуем за употребление кисломолочных продуктов, сыров.
— Если ребенок вынужден принимать антибиотики, что нужно делать в профилактических целях, чтобы не развился дисбактериоз?
— Лучше всего прием антибиотиков сочетать с отваром трав, например, тысячелистника, подорожника, ромашки или душицы. Они на 80% снижают отрицательное воздействие антибиотиков на слизистую кишечника и его микрофлору.
— Как часто встречаются заболевания органов пищеварения?
— Заболевания желудочно-кишечного тракта у детей находятся на втором месте после респираторных инфекций. И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
И это если учесть, что ребенок болеет ОРВИ 2-3 раза за год, а диагноз заболевания ЖКТ ставится однократно.
— Вы лечите детей только с области или из Челябинска тоже?
— ЧОДКБ обслуживает жителей Челябинской области вне зависимости от ее территорий, то есть сюда входит и Челябинск. Но учитывая тот факт, что в Челябинске имеются в достаточном количестве гастроэнтерологические койки и специалисты, диагностика тоже на высоком уровне, мы стараемся брать из Челябинска только самые тяжелые и сложные случаи. И последним этапом, если уже мы не можем оказать помощь, пациентами занимается институт педиатрии в Москве.
— Каким образом дети попадают к вам?
— Они приезжают по направлению врачей из территорий области на консультативный прием в детскую областную поликлинику к специалисту-гастроэнтерологу. Осмотрев ребенка, и проведя необходимые исследования, врач решает необходимость его госпитализации или лечения в амбулаторных условиях. Вторым вариантом прибытия пациента в областную детскую поликлинику или на госпитализацию в отделение является осмотр врача-гастроэнтеролога «выездной поликлиники». Это когда наши специалисты консультируют детей по месту их проживания.
Это когда наши специалисты консультируют детей по месту их проживания.
Ольга Мельчакова, информационное агентство «Уралпресс»
Как восстановить микрофлору кишечника народными средствами в домашних условиях?
Нормальная работа кишечника напрямую влияет на общие состояние, иммунитет человека и его внешний вид.
Функционирование этого органа связано с бактериями, которые находятся в нем. Если деятельность полезных микроорганизмов подавлена, то стенки кишечника начинают зашлаковываться. В результате появляются проблемы со стулом и ухудшается самочувствие.
Это серьезная проблема, которую нельзя оставлять без внимания. Процесс усвоения необходимых витаминов и минералов невозможен без заселения кишечника полезными бактериями.
Поэтому очень важно знать, как восстановить микрофлору кишечника народными средствами.
Причины нарушений в кишечнике
Полезная кишечная палочка и определенное число лактобактерий и бифидобактерий — это составляющие здоровой микрофлоры кишечника. Снижение количества таких микроорганизмов вызывает дисбактериоз.
Снижение количества таких микроорганизмов вызывает дисбактериоз.
Основные факторы, которые провоцируют такое состояние:
- Неправильное питание. Частое голодание и переедание вызывают нарушение в пищеварительном тракте. В следствии появляются проблемы со стулом.
- Употребление вредной пищи. Такие продукты, как колбаса, сосиски, ветчина, сладкие газированные напитки, подавляют жизнедеятельность здоровой микрофлоры и питают патогенные бактерии.
- Заболевания ЖКТ. Дисбактериоз может появиться в результате отравления острыми кишечными инфекциями, нарушениями секреторной функции, а также операцией на брюшной полости.
- Прием агрессивных антибактериальных и гормональных препаратов, антибиотиков. Неправильное применение убывает полезные бактерии.
- Постоянные стрессы, расстройства психики, хроническое недосыпание, употребление напитков-энергетиков.
- Возникновение дисбактериоза может спровоцировать некачественная питьевая вода и неблагоприятная окружающая экологическая среда.

Симптомы недуга у взрослых
Появление следующих признаков у взрослого человека свидетельствует о проблемах с кишечной микрофлорой:
- неустойчивый стул, который часто переходит в диарею;
- болевые ощущения в нижнем брюшном отделе;
- метеоризм, вздутие живота;
- повышенная утомляемость и слабость, головные боли;
- неудовлетворительное состояние волос, ногтей и кожи, которое возникает через плохое усвоение полезных веществ;
- состояние апатии, депрессии.
При наличии хоть одного из этих симптомов, нужно обязательно пересмотреть свой рацион и ввести в него продукты, которые положительно влияют на кишечник.
Симптомы дисбактериоза у ребенка
Дисбактериоз у детей развивается в результате неполноценного питания, отсутствия режима, врожденных или приобретенных патологий ЖКТ, заболеваний печени, поджелудочной железы, желчного пузыря, толстой и тонкой кишки.
Основные симптомы у ребенка 3 лет и младше, на которые следует обратить внимание:
- вздутие, скопление газов;
- ощущения боли в области кишечника;
- частые запоры или поносы;
- отсутствие аппетита, тошнота;
- рвота, частые срыгивания у детей до года;
- не полностью переваренная пища в кале;
- неприятный запах изо рта;
- запах гнили при опорожнении у ребенка;
- потеря веса у детей 2 лет;
- постоянная вялость, слабость и сонливость малыша;
- плач без причины у грудничков, при этом они прижимают ручки и ножки, плохо спят и кушают.

Отсутствие необходимой терапии ухудшит состояния малыша. Родителям следует обратиться за медицинской помощью. Несвоевременная реакция может привести к таким осложнениям:
- железодефицитная анемия;
- авитаминоз;
- воспаление прямой кишки;
- острая кишечная инфекция;
- хронический энтероколит;
- сепсис.
Если лечение будет применено вовремя, то можно избежать опасных последствий дисбактериоза у малышей разного возраста.
Восстановление микрофлоры кишечника
Народная медицина имеет множество эффективных рецептов, которые помогут восстановить кишечную микрофлору:
- Устранят боль и восстановят микрофлору травяные настои. Для приготовления понадобятся измельченные травы зверобоя, цветков ромашки, мелисы и семена льна по 2 столовых ложки каждой. Все следует перемешать и отделить в небольшую емкость столовую ложку сбора. Затем добавить 500 миллилитров кипятка.
 Настоять не менее часа, процедить и принимать по 0,5 стакана каждый день до еды.
Настоять не менее часа, процедить и принимать по 0,5 стакана каждый день до еды. - Восстановить микрофлору кишечника в домашних условиях можно при помощи корня кровохлебки. Из этого сырья следует приготовить отвар. Понадобится 300 грамм корня, предварительно измельченного, залить 300 миллилитров кипятка и проварить на медленном огне в течение 10 минут. Принимать отвар по 2 столовых ложки каждые два часа. Курс лечения составляет 1 месяц.
- Вздутие живота и метеоризм устранит настой из таких трав: эвкалипт, перечная мята и семена укропа. Пропорции трав — 5:3:1. Все хорошо перемешать и отделить одну столовую ложку в кастрюлю. Затем добавить 1 литр кипяченой воды и закрыть крышкой. Настоять не менее часа, процедить и принимать по 1 стакану до еды ежедневно на протяжении часа.
- Еще один способ, как улучшить микрофлору кишечника — это использование настоя девясила. Для приготовления необходимо измельчить корень растения и настоять в воде одну ночь.
 На 200 миллилитров чистой холодной воды понадобится ложка сырья. Утром процедить и пить по 50 миллилитров перед едой.
На 200 миллилитров чистой холодной воды понадобится ложка сырья. Утром процедить и пить по 50 миллилитров перед едой. - Нормализует работу кишечника настой подорожника с корнем аира. Такие травы нужно высушить и смешать. Затем залить столовую ложку измельченных трав стаканом кипятка. Настоять не меньше часа и принимать по 50 миллилитров перед едой.
- Устранит запоры, улучшит работу кишечника, нормализует микрофлору настой из аниса, мяты, кориандра, ромашки, базилика, душицы и полыни. Их нужно пить натощак две недели подряд.
Продукты для нормализации кишечной флоры
С лечебной и профилактической целью можно употреблять продукты, какие восстанавливают работу кишечника. Это лук, черемша и чеснок. Они пагубно действуют на болезнетворные микробы, обладают антибактериальными свойствами.
Рекомендуется в ежедневное меню включить немного этих овощей. Можно приготовить отдельные рецепты:
- Для этого 5 головок чеснока следует измельчить на мясорубке и залить 1 литром оливкового или льняного масла.
 Настоять на протяжении трех дней и принимать непроцеженное масло по чайной ложке утром.
Настоять на протяжении трех дней и принимать непроцеженное масло по чайной ложке утром. - Очень полезно натощак после сна употреблять зубок чеснока. Запивать теплой водой с добавлением оливкового или льняного растительного масла в небольшом количестве.
- Нормализует микрофлору чеснок с простоквашей. Понадобится 2 зубчика чеснока или немного свежей черемши смешать со стаканом простокваши. Употреблять такой напиток следует ежедневно перед сном.
- Чернослив, курага и мед. Эта сладкая и полезная смесь поможет наладить работу кишечника. Для приготовления эти компоненты нужно измельчить в блендере или мясорубке, соединить, залить медом и хорошо перемешать. Принимать по 1 столовой ложке в день. Действие такого рецепта проявится через продолжительное время.
- Решить проблему помогут обычные каши. Отлично подойдет геркулесовая или гречневая в жидком виде. Их употребление натощак поможет постепенно восстановить микрофлору кишечника и наладит работу желудка.
 Для разнообразия к кашам можно добавлять курагу, чернослив или яблоки. Запивать можно узваром, он поддерживает жизнедеятельность полезных бактерий. Каши выводят из организма токсины, шлаки, нормализуют обмен веществ.
Для разнообразия к кашам можно добавлять курагу, чернослив или яблоки. Запивать можно узваром, он поддерживает жизнедеятельность полезных бактерий. Каши выводят из организма токсины, шлаки, нормализуют обмен веществ. - При патогенной микрофлоре положительный эффект окажет употребление кисломолочных продуктов: творог, кефир, кумыс, ряженка. Если каждый день выпивать по два стакана таких напитков, то со временем полностью восстановятся все процессы кишечника.
- Все кислые ягоды и фрукты, которые содержат много органических кислот помогут эффективно устранить проблемы с кишечником. Среди них: клюква, шиповник, алыча, вишни, лимоны, яблоки.
- Отлично очищают кишечник от паразитов тыквенные семечки. Для приготовления следует измельчить тыквенные семечки в блендере и в таком же количестве семечки подсолнуха и грецкие орехи. Затем в 0,5 стакана кипятка добавить 2 столовых ложки полученного порошка, размешать и употреблять 2 раза в день на протяжении 10 дней.

- В народной медицине существует эффективный рецепт, как восстановить микрофлору кишечника после антибиотиков. Для этого используется брага. В 0,5 литра теплой воды нужно добавить 1 столовую ложку меда, сахара и 2 грамма дрожжей. Все хорошо перемешать и оставить бродить на два часа в теплое место. Передерживать не нужно, иначе получится хмельная брага. Приготовленное средство необходимо разделить на две части и выпить в перерывах между едой. Брага поселяет в кишечник бродильные микроорганизмы, которые помогают восстановить его работу.
Народные средства для устранения недуга у детей
Народные средства можно применять для восстановления микрофлоры кишечника у детей. Наиболее действенные рецепты:
- Отвар семян фенхеля подойдет для детей любого возраста. Нужно взять три столовых ложки семян и залить 500 миллилитров очищенной воды. Поместить в кастрюлю, поставить на огонь и прокипятить 5 минут. Когда отвар остынет его следует процедить и давать ребенку пить на протяжении дня.

- Паста из семян льна, тыквы, подсолнуха и кураги. Сладкая паста быстро восстановит работу кишечника. В равных пропорциях следует измельчить на мясорубке сухофрукты, а семечки в кофемолке. Полученные массы соединить и перемешать. Принимать утром и вечером три месяца подряд.
- Каша из овса, семян укропа и фенхеля. Для приготовления крупу нужно залить водой и оставить на ночь, это ускорит процесс приготовления. Утром проварить овес 10 минут, снять с плиты, добавить укроп и фенхель. На 200 грамм каши понадобится по 0,5 чайных ложек семян. Можно немного посолить и заправить столовой ложкой оливкового или льняного масла.
- Прополис — очень популярный продукт при лечении дисбактериоза. Для приготовления нужно довести до кипения любое растительное масло и добавить измельченный прополис, не снимая с плиты. Проварить ингредиенты 5 минут. Когда средство остынет, процедить его через марлю и принимать по маленькой ложке натощак.
 Затем через несколько минут съесть чайную ложку меда.
Затем через несколько минут съесть чайную ложку меда. - Отвар листьев смородины и вишни. Листья смородины и вишни следует соединить с травой донника желтого по 3 столовых ложки каждого ингредиента. Затем поставить на водяную баню на 20 минут. Настоять полчаса, процедить и пить по 35 миллилитров три раза в день. Отвар хранить в холодильнике.
Правильное использование природных ресурсов дает возможность полностью заменить медикаментозные препараты.
Восстанавливающая диета
Налаженный режим питания — это залог успешного и быстрого восстановления микрофлоры кишечника.
Очень важно не переедать, так как это перегружает слабые органы пищеварения. А также следует делать суточные разгрузочные дни на воде, овсянке, кефире или яблоках.
Такой режим питания способствует активации работы полезных бактерий, что быстро нормализует кишечную микрофлору. Кроме того, необходимо вести активный образ жизни, много ходить, бегать, заниматься спортом.
Правильное питание заключается в том, что вся еда должна готовиться на пару или вариться. Соль следует ограничить. Основу питания должны составлять слизистые каши, они имеют вяжущее действие.
Очень хорошо, если в рационе будут присутствовать овощи и фрукты, которые содержат растительную клетчатку. Лучше всего восстанавливают микрофлору кишечника кефир, йогурт и ряженка.
Не стоит забывать о благотворительном воздействии воды. При дисбактериозе следует пить 2 литра воды в день. Сразу после сна можно выпить стакан воды, слегка подсоленной или с добавлением лимона.
Продукты, которые нельзя употреблять при дисбактериозе:
- жирные сорта мяса и рыбы;
- копченые, соленые, острые, пряные, маринование и кислые продукты;
- консервы;
- жареные яйца, или сваренные вкрутую;
- хлеб из муки высших сортов;
- сдобное и слоеное тесто;
- холодные напитки, мороженое;
- кондитерские изделия с кремом, шоколад;
- насыщенные бульоны;
- перловую и ячневую крупы, пшено;
- чеснок, лук, редис, грибы, бобовые;
- горчицу, кетчуп, майонез, острые соусы;
- крепкий чай, кофе с молоком, какао, алкоголь.

При нарушении микрофлоры кишечника принимать пищу нужно только в теплом виде. Перерыв между приемами еды должен составлять 2-3 часа.
Рецепты народной медицины для восстановления кишечной микрофлоры, не менее эффективны дорогих медикаментозных средств. Применять их следует с осторожностью и придерживаться рекомендаций.
Важным моментом является диета при дисбактериозе. Правильное питание, отсутствие стрессовых ситуаций, активный образ жизни помогут избежать проблем с ЖКТ.
Эти материалы будут вам интересны:
Похожие статьи:
- Чистка кишечника народными средствами в домашних условиях Здоровый кишечник – это не только хорошее самочувствие, слаженная работа…
- Как вывести газы из кишечника в домашних условиях? Повышенное газообразование в кишечнике является следствием самых разных нарушений. К…
- Как улучшить пищеварение народными средствами? На фоне заболеваний или индивидуальных особенностей, ввиду возраста или малоподвижного…
10 причин, почему стоит начать пить кефир уже сегодня
Несмотря на то, что сегодня на полках магазинов можно найти огромный ассортимент продуктов, кефир остается одним из полезнейших для здоровья напитков. Предлагаем вам 10 причин, почему стоит начать пить кефир уже сегодня. Ведь все гениальное просто.
1. Кефир улучшает микрофлору кишечника
В основном благодаря содержанию полезных бактерий пробиотиков. Многочисленные исследования подтвердили, что богатая пробиотиками диета помогает очистить организм, улучшить пищеварение, ускорить метаболизм, восстановить микрофлору кишечника после приема антибиотиков, повысить иммунитет и даже снизить риск некоторых видов рака. И все это можно получить, просто регулярно потребляя кефир!
Читайте также: Что есть, чтобы быть здоровым — 10 богатых пробиотиками продуктов
2. В кефире много витаминов и полезных микроэлементов
В кефире много кальция, необходимого для здоровья костей. Кефир богат витаминами группы В, в частности В1 и В12, а также биотином, который помогает переработать углеводы в энергию, витамином Dи рибофлавином. Также, кефир — хороший источник аминокислоты триптофан, которая необходима для нормального функционирования нервной системы и здорового сна.
Читайте также: Как приготовить вкусные пышные оладьи на кефире — 6 рецептов
3. Кефир нейтрализует вредное воздействие антибиотиков
Антибиотики убивают вредные бактерии, а вместе с ними и полезные бактерии, которые нужны для того, чтобы защитить организм от инфекций. Как следствие, из-за приема антибиотиков страдает микрофлора кишечника. Богатый пробиотиками кефир помогает восстановить микрофлору кишечника и вернуть организм в норму.
4. Кефир нейтрализует вредные бактерии
Как известно, в кефире содержатся пробиотики, которые защищают от инфекций. Например, полезные бактерии lactobacillus kefiri сдерживают рост таких вредных бактерий как Salmonella, Helicobacter Pylori и E. Coli. Полисахарид кефиран, который содержится в кефире, также обладает антибактериальными свойствами.
Читайте также: Кисломолочные продукты — что подходит именно вам
5. Кефир снижает риск остеопороза
Остеопороз — заболевание костей, при котором ухудшается состояние костной ткани и повышается риск переломов. С возрастом, риск остеопороза увеличивается. Одно из необходимых условий предотвращения остеопороза — это потребление богатых кальцием продуктов. В кефире содержится большое количество кальция, а также витамин К2, который нужен для усваивания кальция.
Читайте также: Сколько кальция нужно, чтобы быть здоровым, и где его брать — 10 богатых кальцием продуктов
6. Кефир защищает от рака
Рак — одна из основных причин преждевременной смерти. При раковых опухолях в организме происходит неконтролируемый рост злокачественных клеток. Исследования подтвердили, что пробиотики могут не только улучшать состояние имунной системы, но и затормаживать рост опухолей и снижать образование канцерогенных веществ.
Читайте также: Кефирные смузи — очищаем организм после новогодних праздников
7. Кефир незаменим при заболеваниях ЖКТ
Пробиотики, которые содержатся в кефире, восстанавливают микрофлору кишечника и помогают при различных заболеваниях пищеварительного тракта: диарее, синдроме раздраженного кишечника, заболеваний, вызванных инфекцией H. pylori, и многих других.
Читайте также: Соусы и заправки для салатов — 10 оригинальных рецептов на кефире
8. Кефир нормально переносится людьми с непереносимостью лактозы
В обычном коровьем молоке содержится природный сахар, известный как лактоза. У некоторых взрослых людей встречается непереносимость лактозы — когда в организме отсутствуют ферменты, необходимые для переваривания лактозы. В ферментированных продуктах, таких как кефир и йогурт, лактозы намного меньше, чем в обычном молоке. Поэтому обычно кефир хорошо переносится людьми, у которых непереносимость лактозы.
Читайте также: Продукты с пробиотиками — учимся готовить холодные супы на кефире
9. Кефир полезен при многих заболеваниях
Например, при аллергиях и астме, при нарушениях нервной системы, высоком уровне стресса и бессоннице, повышенном уровне холестерина и гипертонии, и др. Если начать регулярно употреблять кефир уже сейчас, можно существенно улучшить работу желудка и кишечника, очистить организм и похудеть, улучшить состояние кожи, повысить иммунитет, а также снизить риск многих заболеваний.
Читайте также: Как похудеть быстро, легко и без вреда для здоровья — диета на гречке и кефире
10. Кефир — это просто вкусно
За исключением совсем маленьких детей, кефир будет полезен практически всем! Тем более, что сейчас в продаже есть кефир разной жирности: 0%, 1%, 2%, 2,5%, 3,2%. В зависимости от жирности, в напитке будет разное количество калорий и полезных микроэлементов. С кефиром можно готовить вкусные фруктовые и овощные смузи — которые помогут вам очистить организм и насытить его полезными веществами. Также, на кефире можно готовить холодные супы, соусы и заправки для салатов, а также многое другое.
Читайте также: Кефир для идеальной кожи и роскошных волос — простые рецепты
Восстановление микробиоты кишечника после приема антибиотиков зависит от диеты хозяина, условий сообщества и условий окружающей среды
https://doi.org/10.1016/j.chom.2019.10.011Получить права и контентОсновные моменты
- •
Человек микробиоты были устойчивыми и быстро восстанавливались во время приема антибиотиков
- •
Диета с низким содержанием клетчатки усугубляла коллапс микробиоты и замедляла выздоровление от ципрофлоксацина
- •
Перепрограммирование микробиоты и передача инфекции
- 9000 9000 9000 9000 9000 придали устойчивость к повторному лечению
Одно жилье нарушило восстановление, подчеркивая роль водохранилищ и канализации
Резюме
Антибиотики изменяют состав микробиоты и повышают восприимчивость к инфекциям.Однако общие эффекты антибиотиков и влияние факторов окружающей среды на кишечные комменсалы остаются неясными. Чтобы решить эту проблему, мы отслеживали динамику микробиоты с высоким временным и таксономическим разрешением во время лечения антибиотиками в контролируемой мышиной системе, выделяя такие переменные, как диета, история лечения и проживание сожителей. Человеческие микробиоты были в высшей степени устойчивыми и восстанавливались во время лечения антибиотиками, с временным преобладанием резистентных бактерий Bacteroides и сокращением таксон-асимметричного разнообразия.В некоторых случаях чувствительность in vitro и не позволяла предсказать ответов in vivo , что подчеркивает важность контекста хозяина и сообщества. Диета с дефицитом клетчатки усугубляет коллапс микробиоты и замедляет выздоровление. Замещение видов посредством перекрестного содержания после лечения ципрофлоксацином показало устойчивость ко второму лечению. Отдельные дома резко подорвали восстановление, подчеркнув важность экологических резервуаров. Наши результаты подчеркивают детерминированную адаптацию микробиоты к возмущениям и трансляционный потенциал для изменения диеты, санитарии и состава микробиоты во время приема антибиотиков.
Ключевые слова
микробиота кишечника
антибиотики
устойчивость
пересев
совместное размещение
копрофагия
нарушения микробиоты
Бактероидес C 924-7000 © 2019 Elsevier Inc. Антибиотики могут действовать как мощная линия защиты от бактериальных инфекций.Они чрезвычайно эффективны в уничтожении вредных бактерий, вызывающих болезни. К сожалению, они также имеют свою цену. «Антибиотики играют решающую роль в борьбе с бактериальными инфекциями», — объясняет Жасмин Омар, доктор медицины, специалист по внутренним болезням в системе здравоохранения Генри Форда. «Но прием этих лекарств также может привести к побочным реакциям, включая тошноту, лекарственную аллергию, диарею, связанную с антибиотиками, и дрожжевые инфекции». Антибиотики по-прежнему являются наиболее часто назначаемым лекарством в Соединенных Штатах, но не все болезни требуют антибиотиков.Фактически, два самых распространенных недуга — простуда и грипп — не поддаются лечению антибиотиками. Если у вас есть заболевание, требующее применения антибиотиков, например ангина, бактериальная пневмония или инфекции мочевыводящих путей, важно понимать, как эти лекарства влияют на ваш организм — как во время их приема, так и в долгосрочной перспективе. Поскольку вокруг использования антибиотиков так много путаницы и противоречий, мы попросили доктора Омара ответить на часто задаваемые вопросы пациентов. В: Как антибиотики действуют в организме? A: Большинство антибиотиков убивают бактерии или предотвращают их рост. К сожалению, большинство антибиотиков не могут отличить хорошие бактерии от плохих. Это означает, что они могут нанести ущерб здоровым бактериям в кишечнике. Фактически, многие люди страдают от стойких изменений кишечной флоры в результате приема антибиотиков. В: Нужно ли мне беспокоиться о взаимодействии с пищей или лекарствами, пока я принимаю антибиотики? A: Некоторые антибиотики, например метронидазол, могут взаимодействовать с алкоголем.Если вы принимаете эти лекарства, важно избегать употребления алкоголя во время лечения. Другие, например рифампицин, могут влиять на эффективность оральных контрацептивов (противозачаточных таблеток). В целях безопасности мы иногда рекомендуем людям использовать запасные противозачаточные средства, например носить презерватив, пока они принимают определенные антибиотики. Обязательно прочтите и следуйте инструкциям и любым предупреждениям, предоставленным вашей аптекой по вашему конкретному рецепту. Q: Какие побочные эффекты часто возникают при приеме антибиотиков? A: Прием антибиотиков может резко изменить количество и тип бактерий в кишечнике.Эти изменения микрофлоры кишечника могут привести к диарее, связанной с приемом антибиотиков, тошноте, рвоте и другим побочным эффектам со стороны желудочно-кишечного тракта. Это одна из причин, по которой врачи рекомендуют принимать антибиотики во время еды. Прием антибиотиков также может привести к вагинальным дрожжевым инфекциям. Как и кишечник, влагалище является домом для полезных бактерий, на которые может негативно повлиять лечение антибиотиками. В: Некоторые люди более чувствительны к побочным эффектам антибиотиков, чем другие? A: Да.Если вы заметили серьезные побочные эффекты, обратитесь к врачу. Он или она может посоветовать, как их уменьшить, или прописать другой антибиотик с меньшим количеством побочных эффектов, или прописать лекарства для противодействия отрицательным побочным эффектам. В: Какие антибиотики вызывают больше всего побочных эффектов? A: Существует много разных типов антибиотиков. Некоторые из них имеют широкий спектр действия, что означает, что они нацелены на широкий спектр бактерий. Другие нацелены на определенные виды бактерий.Ваш врач определит, какой антибиотик лучше всего подходит для вашей инфекции, в зависимости от типа вашего заболевания и истории вашего здоровья. В: Почему так важна защита здоровых кишечных бактерий? A: В вашем кишечнике содержится более 100 триллионов видов бактерий. Они расщепляют вашу пищу, помогают поддерживать сильную иммунную систему и поддерживать естественный порядок функций вашего организма. Некоторые врачи считают, что прием пробиотических добавок во время лечения антибиотиками может уменьшить негативное воздействие на кишечную флору и потенциально повысить ваш иммунный ответ.Но доказательств в поддержку этой идеи мало. Перед приемом пробиотических добавок проконсультируйтесь с врачом, поскольку они могут быть вредными для людей с нарушениями иммунной системы. В: Что показывают последние исследования пробиотиков? A: Есть некоторые свидетельства того, что прием определенных штаммов пробиотиков, таких как Lactobacilli и Saccharomyces, может защитить от диареи, связанной с антибиотиками. К сожалению, это исследование не рассматривает потенциальный вред от приема пробиотиков.Недавнее исследование показало, что прием пробиотиков может замедлить нормальное восстановление естественной микробиоты кишечника. Итог: мы до сих пор не знаем, какие виды бактерий полезны и могут ли они быть вредными. В: Есть ли особые инструкции по дозировке пробиотиков? A: Не совсем. Врачи, рекомендующие пробиотики, обычно рекомендуют принимать их через несколько часов после приема антибиотика. В противном случае два лекарства могут нейтрализовать друг друга.Некоторые врачи даже предлагают подождать до начала приема пробиотиков через несколько дней после завершения курса антибиотиков. В: Как я могу лучше поддерживать свой кишечник и иммунную систему при приеме антибиотиков? A: Без веских доказательств, подтверждающих использование пробиотиков наряду с антибиотикотерапией, лучше всего употреблять продукты, содержащие полезные бактерии, например йогурт, кефир, кимчи и квашеную капусту. Вы также можете накормить бактерии в кишечнике, употребляя в пищу продукты, богатые клетчаткой, такие как орехи, семена, бобы, чечевицу, горох и ягоды. Прием ненужных антибиотиков может привести к устойчивости к антибиотикам, а это означает, что болезни, которые раньше легко лечились с помощью антибиотиков, больше не поддаются лечению. «Мы действительно пытаемся убедиться, что прописываем правильные лекарства по правильным причинам», — говорит д-р Омар. «Когда антибиотики не показаны, они неэффективны и могут вызывать негативные, а иногда и долгосрочные побочные эффекты». К сожалению, пробиотики — не выход.Хотя пробиотики «общепризнаны как безопасные», они подходят не всем. Фактически, прием пробиотиков может быть вредным для людей с ослабленным иммунитетом и таких состояний, как разрастание тонкой кишки. Не знаете, как лучше переносить болезнь и лечение антибиотиками? Поговорите со своим врачом, чтобы принять решение о лечении и минимизировать побочные эффекты лекарств. Чтобы найти врача у Генри Форда, посетите Генрифорд.com или позвоните по телефону 1-800-HENRYFORD (436-7936). Хотите получить дополнительную информацию от наших экспертов по оздоровлению? Подпишитесь сегодня, чтобы получать еженедельные электронные письма с нашими последними советами. Доктор Жасмин Омар, врач-терапевт, принимает пациентов в больнице Генри Форда в Детройте. Теги: Первичная помощь, Жасмин Омар World J Gastroenterol. 2017 июл 7; 23 (25): 4491–4499. Франческа Романа Понциани, Мария Ассунта Зокко, Франческа Д’Аверса, Маурицио Помпили, Антонио Гасбаррини, Отделение внутренних болезней, гастроэнтерологии и гепатологии, Госпиталь Агостино Джемелли, 00168 Рим, Италия Для корреспонденции: Франческа Романа Понциани, доктор медицины, отделение внутренней медицины, гастроэнтерологии и гепатологии, больница Агостино Джемелли, ларго Агостино Джемелли 8, 00168 Рим, Италия[email protected] Телефон: + 39-347-1227242 Факс: + 39-063-0156265 Получено 25 февраля 2017 г .; Пересмотрено 14 апреля 2017 г .; Принято 19 мая 2017 г. Эта статья находится в открытом доступе, она была выбрана штатным редактором и полностью рецензирована внешними рецензентами. Распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0) лицензия, которая позволяет другим распространять, ремикшировать, адаптировать, развивать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно процитирована и использование не является коммерческим. Антибиотики обычно назначают для лечения инфекций, но они также обладают значительным модулирующим действием на микробиоту кишечника. Сообщалось о нескольких изменениях кишечного бактериального сообщества во время лечения антибиотиками, включая уменьшение количества полезных бактерий, а также альфа-разнообразия микробов.Хотя после прекращения лечения антибиотиками наблюдается тенденция к восстановлению исходного состояния, новое устойчивое состояние отличается от предыдущего, как если бы антибиотики вызвали какое-то необратимое нарушение микробного сообщества кишечника. Плохо абсорбируемый антибиотик рифаксимин, по-видимому, отличается от других антибиотиков, поскольку он оказывает нетрадиционные эффекты в дополнение к бактерицидной / бактериостатической активности на микробиоту кишечника.Рифаксимин способен снижать вирулентность и транслокацию бактерий, обладает противовоспалительными свойствами и, как было продемонстрировано, положительно модулирует микробный состав кишечника. Модели на животных, культуральные исследования и метагеномные анализы продемонстрировали увеличение численности Bifidobacterium , Faecalibacterium prausnitzii и Lactobacterium после лечения рифаксимином, вероятно, вследствие индукции устойчивости бактерий без значительных изменений в общем составе микробиоты кишечника.Следовательно, антибиотики являются модуляторами симбиотических отношений между хозяином и кишечной микробиотой. Специфические антибиотики, такие как рифаксимин, также могут вызывать эубиотические изменения в экосистеме кишечника; это дополнительное свойство может представлять терапевтическое преимущество в конкретных клинических условиях. Ключевые слова: Кишечные бактерии, Антибиотик, Рифаксимин, Микробиота кишечника, Эубиоз, Дисбиоз, Модуляция микробиоты кишечника Основной совет: Традиционное использование антибиотиков в клинической практике — противодействие местным или системным инфекциям.Однако антибиотики вызывают несколько изменений микробиоты кишечника, включая уменьшение количества полезных бактерий, а также микробного разнообразия. Рифаксимин — невсасывающийся антибиотик с широким спектром действия и нетрадиционным антимикробным действием. Рифаксимин может вызывать положительную модуляцию микробиоты кишечника, способствуя росту бактерий, полезных для хозяина, без изменения его общего состава. Следовательно, рифаксимин можно определить не только как антибиотик, но и как «эубиотик», а именно как положительный модулятор экосистемы кишечника. Микробиота кишечника человека была основным объектом научных исследований в последние годы. Исследования, основанные на метагеномных методах, выявили многогранные способности кишечных микробов, от метаболических функций до иммуномодуляции, от антипатогенной активности до формирования поведения [1-5]. Поскольку микробиота кишечника играет решающую роль в поддержании здоровья человека, менее или более специфические изменения микробиоты кишечника связаны с различными желудочно-кишечными заболеваниями [6-20].Эти результаты убедительно подтверждают использование модуляторов кишечной микробиоты, таких как антибиотики, пребиотики и пробиотики, в качестве лечения выбора почти при всех желудочно-кишечных расстройствах. Помимо умозрительной и интригующей ценности этих физиопатологических открытий, также интересно выяснить, какие изменения микробиоты кишечника могут произойти после терапевтического вмешательства, такого как лечение антибиотиками. В частности, недавние метагеномные исследования выявили положительную модуляцию кишечных бактерий, связанную с введением рифаксимина, одного из антибиотиков, наиболее часто используемых для лечения заболеваний пищеварительной системы.Это открыло сценарий для новой концепции модуляции кишечной микробиоты, связанной с антибиотиками, которая преодолевает традиционные бактерицидные и бактериостатические эффекты и включает возможность более сложных взаимодействий, приводящих к модуляции кишечной флоры, благоприятной для хозяина. В этой статье мы сосредоточимся на влиянии антибиотиков, в частности рифаксимина, на кишечные бактерии, обсудим его традиционные и нетрадиционные свойства и определим новую концепцию «эубиотической модуляции» кишечной микробиоты. Традиционно антибиотики используются в клинической практике для борьбы с местными или системными инфекциями. Однако после открытия потенциала кишечной микробиоты несколько исследований были сосредоточены на влиянии терапии антибиотиками на комменсальные кишечные микробы [21–27]. Бета-лактамины, фторхинолоны, глицилциклины, линкозамид, нитроимидазол и различные комбинации антибиотиков способны вызывать глубокое изменение состава кишечной микробиоты, которое в основном характеризуется сокращением автохтонных таксонов и увеличением числа потенциально патогенных бактерий, таких как как Enterobacteriaceae.Напротив, количество Bifidobacteria , Faecalibacterium prausnitzii и Lactobacilli , которые обычно оказывают благоприятное воздействие на кишечник, по-видимому, уменьшается после лечения антибиотиками. Бифидобактерии входят в состав нескольких пробиотических препаратов и обладают кишечным и системным противовоспалительным действием, а также защищают от диареи, связанной с антибиотиками, и инфекционного колита [28-53]. Faecalibacterium prausnitzii — бактерия, продуцирующая бутират, с высокой метаболической активностью [54]; бутират участвует в жизненном цикле кишечных клеток, обладает иммуномодулирующим действием и защищает от инфекций, вызываемых патогенами [55,56].Наконец, Lactobacilli известны своими противовоспалительными, иммуномодулирующими, антиоксидантными, антибактериальными и противовирусными свойствами [57]. Помимо воздействия на определенные бактериальные штаммы, лечение антибиотиками снижает таксономическое богатство, разнообразие и равномерность микробного сообщества кишечника, вызывая переход к альтернативному состоянию, отличному от исходного [27,58]. Эти изменения, кажется, проходят после окончания приема антибиотиков; однако микробный состав кишечника не возвращается к состоянию до обработки, а скорее приобретает новый оттенок, похожий (но не идентичный) исходному.Все эти модификации сильно различаются у разных людей, и последствия нарушения кишечной микробиоты, связанного с приемом антибиотиков, у людей остаются неизвестными. Morgun et al [59] проанализировали метагеномные и метатранскриптомные изменения на мышиной модели истощения микробиоты после введения коктейля антибиотиков (ампициллин, ванкомицин, неомицин и метронидазол). Основными зарегистрированными эффектами, помимо снижения общей бактериальной массы и появления резистентных штаммов, были (1) нарушение местного иммунитета слизистой оболочки с истощением иммунных клеток в собственной пластинке и ворсинчатом эпителии, а также плазматических клеток, продуцирующих IgA; и (2) митохондриальная токсичность, приводящая к усилению апоптоза и гибели клеток в кишечном эпителии обработанных животных.Авторы пришли к выводу, что истощение кишечной микробиоты, а также развитие устойчивости среди оставшихся бактерий и последующее воздействие на ткани хозяина были основными последствиями, вызываемыми антибиотиками в кишечнике. Таким образом, следует выделить два основных свойства антибиотиков: классический эффект против патогенов, который является основным показанием для их использования в клинической практике, и модуляция микробиоты комменсального кишечника, которая является «побочным» эффектом. Хотя последствия этой последней особенности для хозяина все еще не ясны, уменьшение количества полезных бактерий может привести к утрате благоприятного влияния кишечной микробиоты на здоровье человека. Это может обоснованно предполагать пагубное влияние антибиотиков на экологию кишечника. Однако не все антибиотики. Недавние открытия показали, что рифаксимин может положительно влиять на микробиоту кишечника. Эта особенная характеристика может отличать рифаксимин от других системных антибиотиков. Рекомендуемые статьи
Цитирование статей
Антибиотики и пробиотики: как лекарства влияют на ваш кишечник
Часто задаваемые вопросы об антибиотиках
Безопасность антибиотиков
Нарушение традиционных концепций модуляции микробиоты кишечника
Abstract
ВВЕДЕНИЕ
АНТИБИОТИКИ И МИКРОБИОТА КИШКИ
РИФАКСИМИН: АНТИБИОТИК С НЕДОСТАТОЧНЫМ АНТИБИОТИКОМ С НЕТРАДИЦИОННЫМ ДЕЙСТВИЕМ НА БАКТЕРИИ ЖКТ такие состояния, как колит
Clostridium difficile [60–62].Вследствие незначительной системной абсорбции (<0,4%) [63] рифаксимин достигает высоких концентраций в тканях, вплоть до 8000 мкг / г в образцах фекалий после 3-дневного режима приема 800 мг в день [64], что намного превышает допустимую норму. минимальные ингибирующие концентрации, наблюдаемые для местных микробных изолятов. Другой характеристикой рифаксимина является растворимость, зависящая от желчных кислот; это делает препарат более эффективным в тонком кишечнике, в то время как бактерии толстого кишечника подавляются слабо [65]. Действительно, изменения в составе микробиоты толстой кишки постепенно, но полностью обращаются вспять после прекращения приема рифаксимина, в отличие от эффектов на бактерии двенадцатиперстной кишки, которые кажутся более стабильными [66].
В дополнение к бактерицидной и бактериостатической активности, типичной для антибиотиков, рифаксимин может также оказывать нетрадиционное воздействие на микробиоту кишечника (рисунок). В частности, рифаксимин может подавлять воспалительную реакцию, запускаемую кишечными микробами, путем ингибирования активации ядерного фактора (NF) -κB через рецептор прегнана X (PXR) и за счет снижения экспрессии провоспалительных цитокинов. интерлейкин (IL) -1B и фактор некроза опухоли-альфа (TNFα) [67-71].
Влияние антибиотиков на микробиоту кишечника. Системные антибиотики в основном используются для лечения внекишечных инфекций, но они косвенно влияют на состав микробиоты кишечника. Рифаксимин — плохо абсорбируемый антибиотик, проявляющий свое действие исключительно в желудочно-кишечном тракте. В дополнение к ожидаемым антимикробным свойствам рифаксимин подавляет вирулентность бактерий, подавляет воспалительную реакцию и может положительно влиять на состав микробного сообщества кишечника.
Кроме того, рифаксимин изменяет вирулентность бактерий за счет ингибирования адгезии, интернализации и транслокации [72–75] и может изменять метаболизм бактерий [76].
Модуляция рифаксимином микробного состава кишечника также относится к нетрадиционным свойствам этого плохо всасываемого антибиотика.
ЭУБИОТИЧЕСКОЕ ВЛИЯНИЕ РИФАКСИМИНА НА МИКРОБИОТУ кишечника
В дополнение к вышеупомянутой активности против бактериальной адгезии, интернализации и транслокации, а также к противовоспалительным эффектам, имеются данные о положительной модуляции микробиоты кишечника в результате лечения рифаксимином. (Стол ).
Таблица 1
Исследования, изучающие влияние рифаксимина на состав кишечной микробиоты
| Ref . | Пациенты / модель | Методика | Доза рифаксимина | Изменения микробиоты кишечника после рифаксимина |
| Brigidi et al [77], 2002 12 | 9030 Стандарт U4 бактериологические процедуры1800 мг / сут, 3 цикла по 10 дней с последующими промывками 25 дней | Энтерококки : < | ||
| Колиформные бактерии : = | ||||
| Бифидобактерии :> | Lactobacilli : < | |||
| Clostridium perfrigens :> than < | ||||
| Bacteroides : | ||||
| непредсказуемые вариации | ||||
| 1 | ||||
| не исследовано | ||||
| Maccaferri et al [78], 2010 | 4 балла colonic active CD | Continuous | 1800 mg / d | Bifidobacterium:> |
| модель культуральной системы толстой кишки, FISH, количественная ПЦР, ПЦР-денатурирующий градиентный гель-электрофорез | Атопобий:> | prausnitzii :> | ||
| Общий состав: = | ||||
| Bajaj et al [76], 2013 | 20 баллов HE | 454 пиросеквенирование | 1100 мг / сут | Xu et al [79], 2014 | Модель висцеральной гипералгезии на крысах | Количественная ПЦР, 454 пиросеквенирование | 150 мг / кг, два раза в день | Lactobacillus :> |
| Clostrichacepochacepidiae, Elostochacepidiacepidia, Elostochacepidiacepidiae, Elostochacepidiacecepidia, Elostochacepidiacepidia, < | ||||
| Общая композиция: снижение бактериальной нагрузки на 84% | ||||
| Soldi et al [8 0], 2015 | 15 точек, не связанных с СРК | ПЦР в реальном времени, пиросеквенирование Illumina | 1650 мг / сут в течение 14 дней | Faecalibacterium prausnitzii:> |
| Clostridiaceae, Streptococcaceae , Prevotellaceae:> | ||||
| Общий состав: = | ||||
| Ponziani et al [81], 2016 | 20 точек CD, UC, не-C IBS, DD, HE | 454 пиросеквенирование | 1200 мг / день для 14 дней | Lactobacillus :> |
| Roseburia , Haemophilus , Veillonella и | ||||
| Streptococcus : < | = | | Общий состав исследование, которое впервые продемонстрировало увеличение количества полезных бактериальных штаммов, связанных с приемом рифаксимина, было проведено более десяти лет назад на двенадцати пораженных пациентах. язвенным колитом [77].Рифаксимин вводили в дозе 1800 мг в день в течение 3 циклов лечения, каждый продолжительностью 10 дней, с последующим периодом вымывания продолжительностью 25 дней. С помощью стандартного бактериологического анализа авторы наблюдали увеличение концентрации Bifidobacteria после лечения, которая имела тенденцию к снижению в интервальных периодах. Последующее исследование той же группы с использованием модели непрерывного культивирования кишечной микробиоты четырех пациентов с активной болезнью Крона (БК) [78] также подтвердило этот предварительный результат.Действительно, введение рифаксимина в той же дозе 1800 мг в день не изменило общий состав микробиоты кишечника, но способствовало росту Bifidobacterium , Atopobium и Faecalibacterium prausnitzii . | Совсем недавно Xu et al [79] продемонстрировали, что Lactobacilli могут расти в ответ на введение рифаксимина. В частности, на мышиной модели висцеральной гипералгезии, использованной в исследовании, введение рифаксимина увеличивало количество Lactobacilli в подвздошной кишке; этот эффект был ограничен только этим антибиотиком, поскольку в тех же экспериментальных условиях введение другого плохо абсорбируемого антибиотика, неомицина, приводило только к увеличению протеобактерий. Наконец, недавно были опубликованы два метагеномных анализа кишечной микробиоты людей, страдающих заболеваниями желудочно-кишечного тракта и печени. В первом исследовании [80] пациенты с синдромом раздраженного кишечника без запора получали рифаксимин в дозе 550 мг три раза в сутки в течение 14 дней. Образцы фекалий собирали перед началом лечения, в конце его и после 6-недельного периода отмывки. В качестве одного из наиболее интригующих результатов исследования авторы наблюдали увеличение численности Faecalibacterium prausnitzii в конце лечения без каких-либо серьезных изменений в общем составе микробиоты кишечника. Во втором исследовании [81] рифаксимин вводили в дозе 1200 мг ежедневно в течение 10 дней пациентам с различными желудочно-кишечными заболеваниями, включая синдром раздраженного кишечника, БК, язвенный колит и дивертикулярную болезнь, а также пациентам с циррозом печени. осложняется печеночной энцефалопатией. Образцы стула анализировали до, в конце и через 1 мес. После окончания лечения рифаксимином. Численность Lactobacillus увеличивалась в конце лечения рифаксимином и через 1 месяц после этого, при этом не наблюдалось никаких изменений общего состава кишечной микробиоты, даже при стратификации пациентов в соответствии с временными точками лечения и с учетом исходного заболевания. В заключение, рифаксимин способен увеличивать количество полезных кишечных бактерий, сохраняя при этом стабильный общий состав микробного сообщества кишечника. Хотя это своеобразное поведение было описано до сих пор только в связи с рифаксимином, оно связано с одним из наиболее распространенных последствий лечения антибиотиками: развитием резистентности микробов. Действительно, представители родов Bifidobacterium , Lactobacillus , Bacteroides , Clostridium , Eubacterium , Atopobium и Collinsella могут развить механизмы устойчивости после воздействия рифаксимина, становясь способными расти при более высоких концентрациях, чем рифаксимин. 1024 мг / л [82,83]. В ранее опубликованном исследовании Brigidi et al [77] продемонстрировали, что увеличение количества бифидобактерий в результате вмешательства рифаксимина было связано с увеличением значений минимальных ингибирующих концентраций (МИК) с 16 мкг / мл до 40 мкг / мл. Примечательно, что рифаксимин ингибирует синтез бактериальной РНК, действуя на β-субъединицу РНК-полимеразы, и миссенс-мутации центральной области гена rpoB, кодирующего β-субъединицу РНК-полимеразы, были описаны в Bifidobacterium infantis после воздействия рифаксимина [84,85 ].Следовательно, в случае рифаксимина приобретение устойчивости может представлять преимущество для хозяина, а не пагубное последствие. Однако для развития устойчивости к рифаксимину требуется хромосомная мутация, которая передается вертикально и поэтому редко распространяется среди кишечных микроорганизмов [61]; как следствие, почти все резистентные бактерии исчезают в течение нескольких недель после прекращения лечения [86]. Данные метагеномных исследований отражают эту характеристику. Действительно, сразу после начала лечения рифаксимином бактериальное альфа-разнообразие демонстрирует тенденцию к снижению, возвращаясь к значениям, аналогичным значениям до лечения после периода вымывания [80,81]. Основываясь на этих соображениях, а также на предварительных доказательствах того, что эффекты рифаксимина не исчезают внезапно после прекращения лечения, длящегося в течение короткого периода времени, необходимы дальнейшие исследования для изучения возможности сохранения положительной модуляции микробиоты кишечника, продуцируемой рифаксимином. со временем. РИФАКСИМИН КАК ЭУБИОТИЧЕСКИЙ АГЕНТ В КЛИНИЧЕСКОЙ ПРАКТИКЕПомимо благоприятной модуляции микробиоты кишечника, рифаксимин обладает и другими особенностями, которые делают его безопасное применение в клинической практике. Рифаксимин плохо всасывается, и после перорального приема с мочой выводится незначительная концентрация. Эта особенность типична для фирменного препарата препарата, который содержит только кристаллический полиморф -α, в то время как более высокая системная биодоступность была продемонстрирована для универсального препарата, содержащего аморфную форму молекулы [87]. Следует также учитывать осторожность при использовании рифаксимина в условиях, повышающих проницаемость кишечника, таких как нарушение функции печени.Системное воздействие рифаксимина увеличивается в 10, 13 и 20 раз у детей с циррозом печени A, B и C, соответственно; хотя производитель не требует корректировки дозы, в этой клинической обстановке рекомендуется осторожное применение [88]. Ожидается, что лекарственные взаимодействия рифаксимина будут редкими, что подтверждено двумя исследованиями, в которых участвовали здоровые люди, принимавшие субстраты CYP450 [89,90]. Р-гликопротеин также участвует в метаболизме рифаксимина, но клинические последствия совместного введения ингибиторов р-гликопротеина неизвестны. Рифаксимин также безопасно применялся у лиц пожилого возраста [91] и детей [92]. Однако тератогенное действие на плод было продемонстрировано на животных моделях, и преимущества рифаксимина у беременных женщин следует сопоставить с этим риском [88]. В заключение следует рассмотреть вопрос о переносимости рифаксимина в клинической практике. В крупных исследованиях, посвященных применению рифаксимина при желудочно-кишечных заболеваниях и печеночной энцефалопатии, была зарегистрирована низкая частота нежелательных явлений, в основном легкой / низкой степени и с той же частотой, что и в группе плацебо [93].Наиболее частыми из них были головная боль, тошнота, головокружение, диспепсия, дискомфорт в животе, вздутие живота, диарея, запор и метеоризм. Частота инфекций также была низкой, и несколько случаев колита C. difficile , зарегистрированных во время лечения рифаксимином, обычно были связаны с предрасполагающими условиями, такими как госпитализация и длительное применение антибиотиков. Таким образом, эубиотические свойства рифаксимина связаны с хорошим профилем безопасности и переносимости, что делает возможным широкое использование этой молекулы в различных клинических условиях. ЭУБИОЗ: НОВАЯ СТАРАЯ КОНЦЕПЦИЯУвеличение количества бактерий, полезных для кишечника, связанное с лечением рифаксимином, вместе с его дополнительными свойствами и его местным действием, обоснованно поддерживает реклассификацию этой молекулы, которую можно определить не только как антибиотик, но также и «эубиотик», а именно положительный модулятор экосистемы кишечника. Обычно люди живут в комменсальных и мутуалистических симбиотических отношениях со своей кишечной микробиотой, которые представляют собой длительную и тесную связь, приносящую пользу одному или обоим организмам [94]. Однако термин «симбиоз» не полностью описывает точную природу этого сотрудничества, не отражая динамизм, который является виновником этих отношений. В самом деле, хотя человеческий организм-хозяин может считаться относительно стабильной системой, получить статическую картину микробиоты кишечника чрезвычайно сложно. Однако, пытаясь частично обобщить высокую изменчивость микробной экосистемы, можно выделить два основных условия: «дисбактериоз» и «эубиоз». Дисбиоз был определен как состояние, характеризующееся «несбалансированным микробным сообществом кишечника с количественными и качественными изменениями в составе самой микробиоты, ее метаболической активности или локальном распределении ее членов» [94]; напротив, правильного определения эубиоза еще не дано.Интуитивно, количественный и качественный гармонический баланс микробных компонентов кишечника, приводящий к здоровому метаболическому и иммунологическому сотрудничеству с хозяином, должен быть главной особенностью эубиоза. Однако, помимо инфекций, вызванных условно-патогенными и неопортунистическими патогенами, трудно определить, какое изменение может быть основным изменением, обусловливающим переход от эубиоза к дисбактериозу при других патологических состояниях (, например, ., Синдром раздраженного кишечника, воспалительный процесс кишечника). болезни и т. д. .). Вероятно, дисбактериоз может возникать временно у здоровых людей, обычно разрешаясь спонтанно без каких-либо клинических проявлений или проявляясь легкими симптомами. И наоборот, изменения в составе кишечной микробиоты, наблюдаемые у пациентов с желудочно-кишечными заболеваниями, могут быть сконфигурированы как стойкость дисбиотических изменений, которые не восстанавливаются, что способствует возникновению и прогрессированию патологического состояния у предрасположенных лиц. в отношении ухудшения клинических симптомов.Это объясняет эффективность эубиотических соединений, таких как рифаксимин, в этих клинических условиях: полезная модуляция микробиоты кишечника, продуцируемая рифаксимином, вместе с другими его нетрадиционными эффектами, приводит к благоприятному противовоспалительному и трофическому действию на кишечник. ЗАКЛЮЧЕНИЕСимбиотические отношения микробиоты кишечника и хозяина — это условие гармонии отношений, колеблющейся между эубиозом и дисбиозом. Поскольку дисбактериоз играет роль в патогенезе и прогрессировании некоторых желудочно-кишечных и системных заболеваний, использование эубиотиков, таких как рифаксимин, должно быть пересмотрено в этих условиях в свете положительного модулирующего воздействия на микробное сообщество кишечника и их использование следует и далее поддерживать и интегрировать с другими доступными видами лечения. СноскиИсточник рукописи: Приглашенная рукопись Тип специальности: Гастроэнтерология и гепатология Страна происхождения: Италия Классификация экспертной оценки Оценка A (отлично): 0 Оценка B (очень хорошо): B Оценка C (хорошо): C Оценка D (удовлетворительная): 0 Оценка E (плохая): 0 Заявление о конфликте интересов: о потенциальных конфликтах интересов, относящихся к этой статье, не сообщалось. Рецензирование началось: 27 февраля 2017 г. Первое решение: 7 апреля 2017 г. Статья в прессе: 19 мая 2017 г. P- Рецензент: Джамареллос-Бурбулис EJ, Tosetti C S- Редактор: Qi Y L — Редактор: A E- Редактор: Zhang FF Ссылки1. Nieuwdorp M, Gilijamse PW, Pai N, Kaplan LM. Роль микробиома в регуляции энергии и метаболизме. Гастроэнтерология. 2014; 146: 1525–1533. [PubMed] [Google Scholar] 2. Холлистер Е.Б., Гао С., Версалович Дж. Составные и функциональные особенности желудочно-кишечного микробиома и их влияние на здоровье человека.Гастроэнтерология. 2014; 146: 1449–1458. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Зоммер Ф., Бэкхед Ф. Микробиота кишечника — мастера развития хозяина и физиологии. Nat Rev Microbiol. 2013; 11: 227–238. [PubMed] [Google Scholar] 4. Секиров И., Рассел С.Л., Antunes LC, Финлей ББ. Микробиота кишечника в здоровье и болезнях. Physiol Rev.2010; 90: 859–904. [PubMed] [Google Scholar] 5. Tremaroli V, Bäckhed F. Функциональные взаимодействия между кишечной микробиотой и метаболизмом хозяина. Природа. 2012; 489: 242–249. [PubMed] [Google Scholar] 6.Франк Д. Н., Сент-Аманд А. Л., Фельдман Р. А., Boedeker EC, Harpaz N, Pace NR. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci USA. 2007; 104: 13780–13785. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Сокол Х., Сексик П. Кишечная микробиота при воспалительных заболеваниях кишечника: время для связи с хозяином. Курр Опин Гастроэнтерол. 2010; 26: 327–331. [PubMed] [Google Scholar] 9. Machiels K, Joossens M, Sabino J, De Preter V, Arijs I, Eeckhaut V, Ballet V, Claes K, Van Immerseel F, Verbeke K и др.Уменьшение количества видов Roseburia hominis и Faecalibacterium prausnitzii, продуцирующих бутират, определяет дисбактериоз у пациентов с язвенным колитом. Кишечник. 2014; 63: 1275–1283. [PubMed] [Google Scholar] 10. Хансен Р., Рассел Р.К., Рейфф К., Луис П., Макинтош Ф., Берри С.Х., Мухопадхья И., Биссет В.М., Барклай А.Р., Бишоп Дж. И др. Микробиота педиатрической ВЗК de novo: увеличение Faecalibacterium prausnitzii и снижение бактериального разнообразия при болезни Крона, но не при язвенном колите. Am J Gastroenterol. 2012; 107: 1913–1922.[PubMed] [Google Scholar] 11. Лепаж П., Хеслер Р., Спельманн М.Э., Рехман А., Звирблиене А., Бегун А., Отт С., Купчинскас Л., Доре Дж., Рэдлер А. и др. Двойное исследование указывает на потерю взаимодействия между микробиотой и слизистой оболочкой пациентов с язвенным колитом. Гастроэнтерология. 2011; 141: 227–236. [PubMed] [Google Scholar] 12. Райилич-Стоянович М., Бьяджи Э., Хейлиг Х.Г., Каяндер К., Кекконен Р.А., Тимс С., де Вос WM. Глобальный и глубокий молекулярный анализ сигнатур микробиоты в образцах кала пациентов с синдромом раздраженного кишечника.Гастроэнтерология. 2011; 141: 1792–1801. [PubMed] [Google Scholar] 13. Яланка-Туовинен Дж., Салоярви Дж., Салонен А, Иммонен О, Гарсед К., Келли Ф.М., Зайтун А, Палва А, Спиллер Р.С., де Вос WM. Состав фекальной микробиоты и перекрестный диалог между хозяином и микробом после гастроэнтерита и при постинфекционном синдроме раздраженного кишечника. Кишечник. 2014; 63: 1737–1745. [PubMed] [Google Scholar] 14. Lin HC. Разрастание бактерий в тонком кишечнике: основы понимания синдрома раздраженного кишечника. ДЖАМА. 2004. 292: 852–858. [PubMed] [Google Scholar] 15.Риордан С.М., Ким Р. Избыточный бактериальный рост как причина синдрома раздраженного кишечника. Курр Опин Гастроэнтерол. 2006. 22: 669–673. [PubMed] [Google Scholar] 16. Bouhnik Y, Alain S, Attar A, Flourié B, Raskine L, Sanson-Le Pors MJ, Rambaud JC. Бактериальные популяции, загрязняющие верхний отдел кишечника у пациентов с синдромом избыточного бактериального роста в тонком кишечнике. Am J Gastroenterol. 1999; 94: 1327–1331. [PubMed] [Google Scholar] 17. Санчес Э., Донат Э., Рибес-Конинккс С., Фернандес-Мурга М.Л., Санз Ю. Бактерии слизистой оболочки двенадцатиперстной кишки, связанные с глютеновой болезнью у детей.Appl Environ Microbiol. 2013; 79: 5472–5479. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Olivares M, Neef A, Castillejo G, Palma GD, Varea V, Capilla A, Palau F, Nova E, Marcos A, Polanco I и др. Генотип HLA-DQ2 выбирает ранний состав кишечной микробиоты у младенцев с высоким риском развития глютеновой болезни. Кишечник. 2015; 64: 406–417. [PubMed] [Google Scholar] 19. Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза И., Ван Треурен В., Рен Б., Швагер Е., Найтс Д., Сонг С.Дж., Яссур М. и др.Микробиом, ранее не получавший лечения, при впервые возникшей болезни Крона. Клеточный микроб-хозяин. 2014; 15: 382–392. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Костич А.Д., Ксавье Р.Дж., Геверс Д. Микробиом при воспалительном заболевании кишечника: текущее состояние и будущее. Гастроэнтерология. 2014; 146: 1489–1499. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Пендерс Дж., Тийс С., Винк С., Стелма Ф.Ф., Снидерс Б., Куммелинг И., ван ден Брандт П.А., Стобберинг Э. Факторы, влияющие на состав кишечной микробиоты в раннем детстве.Педиатрия. 2006. 118: 511–521. [PubMed] [Google Scholar] 22. Донски С.Дж., Худжер А.М., Дас С.М., Пульц, штат Нью-Джерси, Бономо Р.А., Райс Л.Б. Использование денатурирующего градиентного гель-электрофореза для анализа микробиоты стула госпитализированных пациентов. J Microbiol Methods. 2003. 54: 249–256. [PubMed] [Google Scholar] 23. De La Cochetière MF, Durand T., Lepage P, Bourreille A, Galmiche JP, Doré J. Устойчивость доминирующей фекальной микробиоты человека при кратковременном введении антибиотиков. J Clin Microbiol. 2005; 43: 5588–5592. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24.Молодой В.Б., Шмидт TM. Диарея, связанная с приемом антибиотиков, сопровождающаяся крупномасштабными изменениями в составе фекальной микробиоты. J Clin Microbiol. 2004. 42: 1203–1206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Бассис СМ, Териот СМ, Янг В.Б. Изменение микробиоты желудочно-кишечного тракта мышей тигециклином приводит к повышенной восприимчивости к инфекции Clostridium difficile. Антимикробные агенты Chemother. 2014. 58: 2767–2774. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Джернберг С., Лёфмарк С., Эдлунд С., Янссон Дж.Долгосрочное воздействие антибиотиков на микробиоту кишечника человека. Микробиология. 2010; 156: 3216–3223. [PubMed] [Google Scholar] 27. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc Natl Acad Sci USA. 2011; 108 Приложение 1: 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Корреа Н.Б., Перет Филью Л.А., Пенна Ф.Дж., Лима FM, Николи-младший. Рандомизированное контролируемое исследование Bifidobacterium lactis и Streptococcus thermophilus для профилактики диареи, связанной с приемом антибиотиков, у младенцев.J Clin Gastroenterol. 2005; 39: 385–389. [PubMed] [Google Scholar] 29. Вейцман З., Асли Г., Альшейх А. Влияние пробиотической детской смеси на инфекции в детских учреждениях: сравнение двух пробиотических агентов. Педиатрия. 2005; 115: 5–9. [PubMed] [Google Scholar] 30. Kajander K, Myllyluoma E, Rajilić-Stojanović M, Kyrönpalo S, Rasmussen M, Järvenpää S, Zoetendal EG, de Vos WM, Vapaatalo H, Korpela R.Клиническое испытание: добавка многовидовых пробиотиков облегчает симптомы синдрома раздраженного кишечника и стабилизирует микробиоту кишечника. .Алимент Pharmacol Ther. 2008. 27: 48–57. [PubMed] [Google Scholar] 31. Guyonnet D, Chassany O, Ducrotte P, Picard C, Mouret M, Mercier CH, Matuchansky C.Влияние ферментированного молока, содержащего Bifidobacterium animalis DN-173 010, на качество жизни, связанное со здоровьем, и симптомы синдрома раздраженного кишечника у взрослых в первичная медико-санитарная помощь: многоцентровое рандомизированное двойное слепое контролируемое исследование. Алимент Pharmacol Ther. 2007. 26: 475–486. [PubMed] [Google Scholar] 32. Agrawal A, Houghton LA, Morris J, Reilly B, Guyonnet D, Goupil Feuillerat N, Schlumberger A, Jakob S, Whorwell PJ.Клинические испытания: влияние кисломолочного продукта, содержащего Bifidobacterium lactis DN-173 010, на вздутие живота и желудочно-кишечный транзит при синдроме раздраженного кишечника с запором. Алимент Pharmacol Ther. 2009. 29: 104–114. [PubMed] [Google Scholar] 33. Guyonnet D, Schlumberger A, Mhamdi L, Jakob S, Chassany O. Ферментированное молоко, содержащее Bifidobacterium lactis DN-173 010, улучшает состояние желудочно-кишечного тракта и улучшает пищеварительные симптомы у женщин, сообщающих о незначительных пищеварительных симптомах: рандомизированное двойное слепое параллельное контролируемое исследование .Br J Nutr. 2009. 102: 1654–1662. [PubMed] [Google Scholar] 34. Marteau P, Guyonnet D, Lafaye de Micheaux P, Gelu S. Рандомизированное, двойное слепое, контролируемое исследование и объединенный анализ двух идентичных испытаний ферментированного молока, содержащего пробиотик Bifidobacterium lactis CNCM I-2494, на здоровых женщинах, сообщающих о незначительных пищеварительных симптомах. Нейрогастроэнтерол Мотил. 2013; 25: 331 – e252. [PubMed] [Google Scholar] 35. Tillisch K, Labus J, Kilpatrick L, Jiang Z, Stains J, Ebrat B, Guyonnet D, Legrain-Raspaud S, Trotin B, Naliboff B и др.Потребление кисломолочного продукта с пробиотиком модулирует деятельность мозга. Гастроэнтерология. 2013; 144: 1394–1401, 1401.e1-1401.e4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Уоллер PA, Gopal PK, Leyer GJ, Ouwehand AC, Reifer C, Stewart ME, Miller LE. Дозозависимый эффект Bifidobacterium lactis HN019 на время прохождения через весь кишечник и функциональные желудочно-кишечные симптомы у взрослых. Сканд Дж Гастроэнтерол. 2011; 46: 1057–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Lin HC, Hsu CH, Chen HL, Chung MY, Hsu JF, Lien RI, Tsao LY, Chen CH, Su BH.Пероральные пробиотики предотвращают некротический энтероколит у недоношенных детей с очень низкой массой тела при рождении: многоцентровое рандомизированное контролируемое исследование. Педиатрия. 2008. 122: 693–700. [PubMed] [Google Scholar] 38. Kajander K, Hatakka K, Poussa T., Färkkilä M, Korpela R. Пробиотическая смесь облегчает симптомы у пациентов с синдромом раздраженного кишечника: контролируемое 6-месячное вмешательство. Алимент Pharmacol Ther. 2005; 22: 387–394. [PubMed] [Google Scholar] 39. Исикава Х., Мацумото С., Охаши Ю., Имаока А., Сетояма Х., Умесаки Ю., Танака Р., Отани Т.Благоприятные эффекты пробиотических бифидобактерий и галактоолигосахаридов у пациентов с язвенным колитом: рандомизированное контролируемое исследование. Пищеварение. 2011; 84: 128–133. [PubMed] [Google Scholar] 40. Алмейда СС, Лорена С.Л., Паван С.Р., Акасака Х.М., Мескита Массачусетс. Благоприятные эффекты длительного употребления пробиотической комбинации Lactobacillus casei Shirota и Bifidobacterium breve Yakult могут сохраняться после приостановки терапии у пациентов с непереносимостью лактозы. Nutr Clin Pract. 2012; 27: 247–251. [PubMed] [Google Scholar] 41.О’Махони Л., Маккарти Дж., Келли П., Херли Дж., Луо Ф, Чен К., О’Салливан Г.К., Кили Б., Коллинз Дж. К., Шанахан Ф. и др. Lactobacillus и bifidobacterium при синдроме раздраженного кишечника: реакции симптомов и взаимосвязь с профилями цитокинов. Гастроэнтерология. 2005; 128: 541–551. [PubMed] [Google Scholar] 42. Уорвелл П.Дж., Альтрингер Л., Морел Дж., Бонд Й., Шарбонно Д., О’Махони Л., Кили Б., Шанахан Ф., Куигли Е.М. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника.Am J Gastroenterol. 2006; 101: 1581–1590. [PubMed] [Google Scholar] 43. Гругер Д., О’Махони Л., Мерфи Е. Ф., Бурк Дж. Ф., Динан Т. Г., Кили Б., Шанахан Ф., Куигли Е. М.. Bifidobacterium infantis 35624 модулирует воспалительные процессы хозяина за пределами кишечника. Кишечные микробы. 2013; 4: 325–339. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Lin HC, Su BH, Chen AC, Lin TW, Tsai CH, Yeh TF, Oh W. Пероральные пробиотики снижают частоту и тяжесть некротического энтероколита у младенцев с очень низкой массой тела при рождении. Педиатрия. 2005; 115: 1–4.[PubMed] [Google Scholar] 45. Бин-Нун А., Бромикер Р., Вильшански М., Каплан М., Руденски Б., Каплан М., Хаммерман С. Пероральные пробиотики предотвращают некротический энтероколит у новорожденных с очень низкой массой тела при рождении. J Pediatr. 2005. 147: 192–196. [PubMed] [Google Scholar] 46. Миле Э., Паскарелла Ф., Джаннетти Э., Квальетта Л., Балдассано Р.Н., Стаяно А. Влияние пробиотического препарата (VSL # 3) на индукцию и поддержание ремиссии у детей с язвенным колитом. Am J Gastroenterol. 2009. 104: 437–443. [PubMed] [Google Scholar] 47.Guandalini S, Magazzù G, Chiaro A, La Balestra V, Di Nardo G, Gopalan S, Sibal A, Romano C, Canani RB, Lionetti P и др. VSL # 3 улучшает симптомы у детей с синдромом раздраженного кишечника: многоцентровое рандомизированное плацебо-контролируемое двойное слепое перекрестное исследование. J Педиатр Гастроэнтерол Нутр. 2010; 51: 24–30. [PubMed] [Google Scholar] 48. Суд А, Мидха V, Махария Г.К., Ахуджа В., Сингал Д., Госвами П., Тандон Р.К. Пробиотический препарат VSL # 3 вызывает ремиссию у пациентов с легким или умеренно активным язвенным колитом.Клин Гастроэнтерол Гепатол. 2009; 7: 1202–1209, 1209.e1. [PubMed] [Google Scholar] 49. Tursi A, Brandimarte G, Papa A, Giglio A, Elisei W, Giorgetti GM, Forti G, Morini S, Hassan C, Pistoia MA, et al. Лечение рецидивирующего язвенного колита легкой и средней степени тяжести пробиотиком VSL # 3 в качестве дополнения к стандартному фармацевтическому лечению: двойное слепое рандомизированное плацебо-контролируемое исследование. Am J Gastroenterol. 2010; 105: 2218–2227. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Gionchetti P, Rizzello F, Helwig U, Venturi A, Lammers KM, Brigidi P, Vitali B, Poggioli G, Miglioli M, Campieri M.Профилактика поучита с помощью пробиотической терапии: двойное слепое плацебо-контролируемое исследование. Гастроэнтерология. 2003. 124: 1202–1209. [PubMed] [Google Scholar] 51. Мимура Т., Риццелло Ф., Хельвиг У., Поджиоли Дж., Шрайбер С., Талбот И.К., Николлс Р.Дж., Джиончетти П., Кампьери М., Камм М.А. Терапия пробиотиками в высоких дозах (VSL # 3) один раз в день для поддержания ремиссии при рецидивирующем или рефрактерном поухите. Кишечник. 2004. 53: 108–114. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Pronio A, Montesani C, Butteroni C, Vecchione S, Mumolo G, Vestri A, Vitolo D, Boirivant M.Назначение пробиотика пациентам с анастомозом подвздошно-анальный мешок по поводу язвенного колита связано с разрастанием регуляторных клеток слизистой оболочки. Воспаление кишечника. 2008. 14: 662–668. [PubMed] [Google Scholar] 53. Селинджер С.П., Белл А., Кэрнс А., Локетт М., Себастьян С., Хаслам Н. Пробиотик VSL # 3 предотвращает диарею, связанную с антибиотиками, в двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании. J Hosp Infect. 2013; 84: 159–165. [PubMed] [Google Scholar] 54. Флинт HJ, Скотт КП, Дункан С.Х., Луи П., Форано Э.Микробное разложение сложных углеводов в кишечнике. Кишечные микробы. 2012; 3: 289–306. [Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Macfarlane GT, Macfarlane S. Ферментация в толстой кишке человека: ее физиологические последствия и потенциальный вклад пребиотиков. J Clin Gastroenterol. 2011; 45 Приложение: S120 – S127. [PubMed] [Google Scholar] 56. Плёгер С., Штумпфф Ф., Пеннер Г.Б., Шульцке Дж.Д., Гебель Г., Мартенс Х., Шен З., Гюнцель Д., Ашенбах-младший. Микробный бутират и его роль в барьерной функции желудочно-кишечного тракта.Ann N Y Acad Sci. 2012; 1258: 52–59. [PubMed] [Google Scholar] 57. Di Cerbo A, Palmieri B, Aponte M, Morales-Medina JC, Iannitti T. Механизмы и терапевтическая эффективность лактобактерий. J Clin Pathol. 2016; 69: 187–203. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, как показало глубокое секвенирование 16S рРНК. PLoS Biol. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Моргун А., Дзуцев А., Донг Икс, Грир Р.Л., Секстон Д.Д., Равель Дж., Шустер М., Сяо В., Мацингер П., Шульженко Н.Выявление эффектов антибиотиков на хозяина и микробиоту с использованием генных сетей транскингдома. Кишечник. 2015; 64: 1732–1743. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Scarpignato C, Pelosini I. Экспериментальная и клиническая фармакология рифаксимина, селективного желудочно-кишечного антибиотика. Пищеварение. 2006; 73 Дополнение 1: 13–27. [PubMed] [Google Scholar] 61. Scarpignato C, Pelosini I. Рифаксимин, плохо всасывающийся антибиотик: фармакология и клинический потенциал. Химиотерапия. 2005; 51 Приложение 1: 36–66. [PubMed] [Google Scholar] 62.Марчезе А, Салерно А, Пеше А, Деббиа Э.А., Шито ГК. Активность рифаксимина, метронидазола и ванкомицина против Clostridium difficile in vitro и скорость отбора спонтанно устойчивых мутантов против репрезентативных анаэробных и аэробных бактерий, включая виды, продуцирующие аммиак. Химиотерапия. 2000. 46: 253–266. [PubMed] [Google Scholar] 63. Чанг Ы, Лан МЫ, Ву ХС, Хуан Ш., Чен СС, Лю Дж. С.. Снижение мышечного поглощения радионуклидов при сцинтиграфии Tc-99m MIBI во время паралитической фазы тиреотоксического периодического паралича.Clin Nucl Med. 2008. 33: 297–298. [PubMed] [Google Scholar] 64. Jiang ZD, Ke S, Palazzini E, Riopel L, Dupont H. Активность рифаксимина in vitro и концентрация рифаксимина в фекалиях после перорального приема. Антимикробные агенты Chemother. 2000; 44: 2205–2206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Дарко С., Лихтенбергер Л.М., Аджами Н., Дайал Э.Дж., Цзян З.Д., DuPont HL. Желчные кислоты улучшают антимикробный эффект рифаксимина. Антимикробные агенты Chemother. 2010; 54: 3618–3624. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66.Ким М.С., Моралес В., Хани А.А., Ким С., Ким Г., Вайцман С., Чанг С., Пиментел М. Влияние рифаксимина на флору кишечника и устойчивость к стафилококкам. Dig Dis Sci. 2013; 58: 1676–1682. [PubMed] [Google Scholar] 67. Mencarelli A, Migliorati M, Barbanti M, Cipriani S, Palladino G, Distrutti E, Renga B, Fiorucci S. Рецептор прегнана-X опосредует противовоспалительную активность рифаксимина в путях детоксикации в эпителиальных клетках кишечника. Biochem Pharmacol. 2010. 80: 1700–1707. [PubMed] [Google Scholar] 68.Hirota SA. Понимание молекулярных механизмов рифаксимина в лечении желудочно-кишечных заболеваний — фокус на модуляции функции ткани хозяина. Mini Rev Med Chem. 2015; 16: 206–217. [PubMed] [Google Scholar] 69. Cheng J, Shah YM, Ma X, Pang X, Tanaka T, Kodama T, Krausz KW, Gonzalez FJ. Терапевтическая роль рифаксимина при воспалительном заболевании кишечника: клиническое значение активации рецептора прегнана X человека. J Pharmacol Exp Ther. 2010. 335: 32–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70.Ма X, Шах YM, Guo GL, Wang T, Krausz KW, Idle JR, Gonzalez FJ. Рифаксимин представляет собой активатор кишечного рецептора прегнана X человека. J Pharmacol Exp Ther. 2007. 322: 391–398. [PubMed] [Google Scholar] 71. Mencarelli A, Renga B, Palladino G, Claudio D, Ricci P, Distrutti E, Barbanti M, Baldelli F, Fiorucci S. Ингибирование NF-κB с помощью PXR-зависимого пути опосредует контррегулирующую активность рифаксимина в отношении врожденного иммунитета в кишечнике. эпителиальные клетки. Eur J Pharmacol. 2011; 668: 317–324. [PubMed] [Google Scholar] 72.Цзян З.Д., Ке С., Дюпон Х.Л. Рифаксимин-индуцированное изменение вирулентности вызывающих диарею Escherichia coli и Shigella sonnei. Int J Antimicrob Agents. 2010. 35: 278–281. [PubMed] [Google Scholar] 73. Браун Э.Л., Сюэ Q, Цзян З.Д., Сюй Y, Dupont HL. Предварительная обработка эпителиальных клеток рифаксимином изменяет профили прикрепления и интернализации бактерий. Антимикробные агенты Chemother. 2010. 54: 388–396. [Бесплатная статья PMC] [PubMed] [Google Scholar] 74. Schrodt C, McHugh EE, Gawinowicz MA, Dupont HL, Brown EL.Рифаксимин-опосредованные изменения протеома эпителиальных клеток: 2-мерный гель-анализ. PLoS One. 2013; 8: e68550. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Fiorucci S, Distrutti E, Mencarelli A, Barbanti M, Palazzini E, Morelli A. Ингибирование кишечной бактериальной транслокации с помощью рифаксимина модулирует реактивность моноцитарных клеток собственной пластинки и защищает от воспаления в модели колита на грызунах. Пищеварение. 2002; 66: 246–256. [PubMed] [Google Scholar] 76. Bajaj JS, Heuman DM, Sanyal AJ, Hylemon PB, Sterling RK, Stravitz RT, Fuchs M, Ridlon JM, Daita K, Monteith P и др.Модуляция метабиома рифаксимином у пациентов с циррозом печени и минимальной печеночной энцефалопатией. PLoS One. 2013; 8: e60042. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Бриджиди П., Свеннен Э., Риццелло Ф., Боццоласко М., Маттеуцци Д. Влияние введения рифаксимина на микробиоту кишечника у пациентов с язвенным колитом. J Chemother. 2002; 14: 290–295. [PubMed] [Google Scholar] 78. Маккаферри С., Витали Б., Клиндер А., Колида С., Ндагижимана М., Лаги Л., Каланни Ф., Бриджиди П., Гибсон Г. Р., Костабиле А.Рифаксимин модулирует микробиоту толстой кишки пациентов с болезнью Крона: подход in vitro с использованием модельной системы непрерывного культивирования толстой кишки. J Antimicrob Chemother. 2010; 65: 2556–2565. [PubMed] [Google Scholar] 79. Xu D, Gao J, Gillilland M 3rd, Wu X, Song I, Kao JY, Owyang C. Рифаксимин изменяет кишечные бактерии и предотвращает вызванное стрессом воспаление кишечника и висцеральную гипералгезию у крыс. Гастроэнтерология. 2014; 146: 484–496. E4. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Soldi S, Vasileiadis S, Uggeri F, Campanale M, Morelli L, Fogli MV, Calanni F, Grimaldi M, Gasbarrini A.Модуляция состава кишечной микробиоты рифаксимином у пациентов с синдромом раздраженного кишечника без запора: молекулярный подход. Clin Exp Gastroenterol. 2015; 8: 309–325. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Понциани Ф. Р., Скальдаферри Ф., Петито В., Парони Стербини Ф., Печере С., Лопетузо Л. Р., Палладини А., Герарди В., Масуччи Л., Помпили М. и др. Роль антибиотиков в модуляции кишечной микробиоты: эубиотические эффекты рифаксимина. Dig Dis. 2016; 34: 269–278. [PubMed] [Google Scholar] 82. Finegold SM, Molitoris D, Väisänen ML.Изучение in vitro активности рифаксимина и агентов сравнения против 536 анаэробных кишечных бактерий с точки зрения потенциальной пользы при патологии, связанной с кишечной флорой. Антимикробные агенты Chemother. 2009. 53: 281–286. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Гиллис Дж. С., Брогден Р. Н.. Рифаксимин. Обзор его антибактериальной активности, фармакокинетических свойств и терапевтического потенциала в условиях, опосредованных желудочно-кишечными бактериями. Наркотики. 1995; 49: 467–484. [PubMed] [Google Scholar] 84.Витали Б., Туррони С., Серина С., Сосио М., Ваннини Л., Кандела М., Герцони М. Э., Бриджиди П. Молекулярные и фенотипические признаки отобранных in vitro мутантов Bifidobacterium, устойчивых к рифаксимину. Int J Antimicrob Agents. 2008. 31: 555–560. [PubMed] [Google Scholar] 85. Витали Б., Туррони С., Даль Пиаз Ф., Кандела М., Вазингер В., Бриджиди П. Генетическая и протеомная характеристика устойчивости к рифаксимину у Bifidobacterium infantis BI07. Res Microbiol. 2007. 158: 355–362. [PubMed] [Google Scholar] 86. Де Лео Ц., Эфтимиади Ц., Шито ГК.Быстрое исчезновение из кишечного тракта бактерий, устойчивых к рифаксимину. Препараты Exp Clin Res. 1986; 12: 979–981. [PubMed] [Google Scholar] 87. Blandizzi C, Viscomi GC, Marzo A, Scarpignato C. Является ли генерический рифаксимин все еще плохо всасывающимся антибиотиком? Сравнение фирменных и генерических рецептур у здоровых добровольцев. Pharmacol Res. 2014; 85: 39–44. [PubMed] [Google Scholar] 89. Trapnell CB, Connolly M, Pentikis H, Forbes WP, Bettenhausen DK. Отсутствие влияния перорального рифаксимина на фармакокинетику этинилэстрадиола / норгестимата у здоровых женщин.Энн Фармакотер. 2007. 41: 222–228. [PubMed] [Google Scholar] 90. Pentikis HS, Connolly M, Trapnell CB, Forbes WP, Bettenhausen DK. Влияние многократного приема перорального рифаксимина на фармакокинетику мидазолама для внутривенного и перорального введения у здоровых добровольцев. Фармакотерапия. 2007. 27: 1361–1369. [PubMed] [Google Scholar] 91. Bass NM, Mullen KD, Sanyal A, Poordad F, Neff G, Leevy CB, Sigal S, Sheikh MY, Beavers K, Frederick T. и др. Лечение рифаксимином при печеночной энцефалопатии. N Engl J Med. 2010; 362: 1071–1081.[PubMed] [Google Scholar] 92. Scarpellini E, Giorgio V, Gabrielli M, Filoni S, Vitale G, Tortora A, Ojetti V, Gigante G, Fundarò C, Gasbarrini A. Лечение рифаксимином избыточного бактериального роста в тонком кишечнике у детей с синдромом раздраженного кишечника. Eur Rev Med Pharmacol Sci. 2013; 17: 1314–1320. [PubMed] [Google Scholar] 93. Ponziani FR, Pecere S, Lopetuso L, Scaldaferri F, Cammarota G, Gasbarrini A. Рифаксимин для лечения синдрома раздраженного кишечника — оценка безопасности препарата. Экспертное мнение Drug Saf.2016; 15: 983–991. [PubMed] [Google Scholar] 94. Стечер Б., Майер Л., Хардт В.Д. «Цветение» в кишечнике: как дисбактериоз может способствовать эволюции патогенов. Nat Rev Microbiol. 2013; 11: 277–284. [PubMed] [Google Scholar]Изменения микробиоты кишечника человека, вызванные антибиотиками, для наиболее часто назначаемых антибиотиков в учреждениях первичной медико-санитарной помощи в Великобритании: систематический обзорВведениеВ Великобритании в период с 2000 по 2014 год количество рецептов на антибиотики увеличилось от 14,3 до 19,7 установленных суточных доз (DDD) на 1000 жителей в сутки.С тех пор объем прописывания антибиотиков снизился, достигнув 18,7 DDD на 1000 жителей в день в 2016 г. (http://www.oecd.org/). Неправильное и чрезмерное использование противомикробных препаратов не только в медицинском, но и в ветеринарном и сельскохозяйственном секторах приводит к повышению устойчивости, что в глобальном масштабе ограничивает наши возможности по борьбе с инфекциями. Снижение потребления антибиотиков — ключевая цель решения этой проблемы, и Соединенное Королевство внедрило меры по управлению противомикробными препаратами в системе первичной медико-санитарной помощи1 и разработало 5-летний план действий по борьбе с устойчивостью к противомикробным препаратам.2 Данные, проанализированные из базы данных The Health Improvement Network (THIN), показали, что средний показатель назначения антибиотиков среди участвующих практик составлял 626 назначений антибиотиков на 1000 пациентов (543–699 IQR), 69% из которых могут быть связаны с системой организма и / или клиническое состояние.3 Из этих назначений 46% были связаны с инфекциями дыхательных путей (ИРО) и 22,7% — с инфекциями урогенитального тракта. Около половины всех прописанных антибиотиков составляли пенициллин, из которых примерно 55% составлял амоксициллин; за этим следует 13% макролидов и 12% тетрациклина.3 Частота консультаций с терапевтом (GP) в Англии и Уэльсе показывает, что четверть населения будет посещать своего терапевта из-за ИРТ каждый год.4 Использование антибиотиков для лечения такой инфекции варьируется в зависимости от врача и страны, 4–6, но составляет 60% всех назначений антибиотиков в общей врачебной практике.7–9 Аналогичным образом, инфекции мочевыводящих путей (ИМП) часто наблюдаются в учреждениях первичной медико-санитарной помощи.10 Пациенты часто лечатся антибиотиками, даже если инфекция часто не подтверждается микробиологически.11 Чрезмерное использование антибиотиков при состояниях, которые не являются серьезными или при которых лечение антибиотиками не подходит для болезни, привело к снижению их эффективности и появлению устойчивых бактерий. Нормальная микробиота кишечника состоит из примерно 800–1000 различных видов бактерий и более 7000 различных штаммов.12 «Нормальный» определяется как виды-комменсалы, которые преимущественно и постоянно встречаются в кишечнике здорового человека. Состав микробиомов пищевода и желудка отличается от микробиомов толстой кишки.Существует большее разнообразие видов и их количество на грамм содержимого в толстой кишке, что отражает более высокий уровень pH.13 14 В ядре микробиома здоровых людей преобладают типы Firmicutes и Bacteroidetes (более 90%), за которыми следуют Verrucomicrobia и Actinobacteria.13 Некоторые важные функции здоровой микробиоты кишечника включают выработку витаминов, метаболизм питательных веществ, иммуномодуляцию и защиту от инфекций путем ингибирования колонизации кишечника патогенами. Исследования микробиомов кишечника в разных странах выявили различия в разнообразии, которые отражают различия в диете, географии, воздействиях в раннем возрасте и генетике.15 Возраст, диета, антибиотики, пробиотики и пребиотики — все это способствует формированию здоровой микробиоты кишечника, и это продолжается динамично на протяжении всей жизни.13 14 16 Эти различия приводят к дисбиозу микробиома, и все больше доказательств того, что изменения микробиома человека могут влиять насколько хорошо функционирует иммунная система и ее способность противостоять инфекции17 18; повышают риск развития болезни Паркинсона, рассеянного склероза и болезни Альцгеймера 19, риска депрессии, тревоги или психоза20; и косвенно влияют на здоровье в долгосрочной перспективе и риск ожирения и диабета.21 Появляется все больше свидетельств того, что микробиом имеет решающее значение для риска инфекционных осложнений у онкологического пациента.22 Недавние исследования показали, что воздействие антибиотиков в детстве связано с повышенным риском развития ряда заболеваний, включая ожирение, диабет 1 и 2 типов, воспалительные заболевания кишечника и т. Д. Болезнь Крона, целиакия, аутоиммунные заболевания, такие как аллергия, ювенильный идиопатический артрит и астма.23–26. Похоже, что эти эффекты наиболее выражены, если антибиотики потребляются в течение первых 2 лет жизни, и эффекты вполне могут быть кумулятивными.17 27 28 Это особенно важно для маленьких детей, когда микробиом взрослого еще не сформировался полностью 29 30 После прекращения лечения антибиотиками микробиом может обладать определенной степенью устойчивости, будучи способным вернуться к составу, аналогичному исходному. один, но это плохо изучено и может занять месяцы или даже годы17. и в разных странах, но также и в рамках конкретной группы практикующих врачей, таких как терапевты.Необходимо четко понимать реальную стоимость наиболее часто назначаемых антибиотиков в первичной медико-санитарной помощи, включая различия между отдельными противомикробными препаратами в их воздействии на микробиом. Эта информация будет особенно полезна для управления противомикробными препаратами в первичной медико-санитарной помощи. ЦельЭто исследование было направлено на изучение вызванных антибиотиками изменений микробиоты кишечника при применении наиболее часто назначаемых антибиотиков в учреждениях первичной медико-санитарной помощи в Великобритании: тех, которые назначаются при ИРО и ИМП.Нашим первичным результатом было определение любых вызванных антибиотиками изменений в составе микробиома кишечника, измеряемых (1) численностью и / или (2) разнообразием микробов, в то время как наш вторичный результат измерял время, необходимое для восстановления микробиома. состояние до антибиотика. МетодыБыл проведен систематический обзор литературы по исследованиям, в которых оценивалась связь между антибиотиками, обычно назначаемыми при ИМП и ИМП в первичной медико-санитарной помощи, и их влиянием на микробиом кишечника.В качестве основы для этого обзора использовались предпочтительные элементы отчетности для систематических обзоров и метаанализов (PRISMA) и контрольный список (см. Дополнительную онлайн-таблицу S1, контрольный список PRISMA) 32. Протокол исследования был зарегистрирован под номером PROSPERO CRD42017073750 (http: // www. .crd.york.ac.uk / ПРОСПЕРО). Стратегия поискаЭлектронные базы данных MEDLINE, EMBASE и AMED использовались для поиска соответствующих статей до мая 2020 года на английском языке и доступны в виде полного текста. Комбинация поисковых запросов включала следующие ключевые слова: (антибактериальные средства ИЛИ бактериальные инфекции) И (микробиота ИЛИ микробиом).Стратегия была разработана для выявления исследований, проводимых в любой стране, по изучению вызванных антибиотиками изменений в микробиоте кишечника человека; анализируется на индивидуальном или популяционном уровне, публикуется на любом языке (вставка 1). Списки литературы включенных исследований и соответствующие обзоры были изучены вручную для выявления дополнительных подходящих исследований. Все отобранные рефераты и цитаты были экспортированы из научных баз данных в программу управления ссылками EndNote X9 (Thompson Reuters, Нью-Йорк, Нью-Йорк, США), дубликаты исключены. Box 1Стратегия поиска
|




 Настоять не менее часа, процедить и принимать по 0,5 стакана каждый день до еды.
Настоять не менее часа, процедить и принимать по 0,5 стакана каждый день до еды. На 200 миллилитров чистой холодной воды понадобится ложка сырья. Утром процедить и пить по 50 миллилитров перед едой.
На 200 миллилитров чистой холодной воды понадобится ложка сырья. Утром процедить и пить по 50 миллилитров перед едой. Настоять на протяжении трех дней и принимать непроцеженное масло по чайной ложке утром.
Настоять на протяжении трех дней и принимать непроцеженное масло по чайной ложке утром. Для разнообразия к кашам можно добавлять курагу, чернослив или яблоки. Запивать можно узваром, он поддерживает жизнедеятельность полезных бактерий. Каши выводят из организма токсины, шлаки, нормализуют обмен веществ.
Для разнообразия к кашам можно добавлять курагу, чернослив или яблоки. Запивать можно узваром, он поддерживает жизнедеятельность полезных бактерий. Каши выводят из организма токсины, шлаки, нормализуют обмен веществ.
 Затем через несколько минут съесть чайную ложку меда.
Затем через несколько минут съесть чайную ложку меда.