Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
14151617181920
21222324252627
282930
12
12
1
3031
12
15161718192021
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Июл
Авг
Сен
ОктНоя
Дек
Метки
Настройки
для слабовидящих
Диагностика и лечение синдрома диссеминированного внутрисосудистого свертывания (ДВС)
С. Кероак, Ж.Л. Кадоре
Кероак, Ж.Л. Кадоре
Диссеминированная внутрисосудистая коагуляция (ДВС) — это первичное или вторичное нарушение гемостаза, характеризующееся ассоциацией феноменов тромбообразования и геморрагии. ДВС синдром, возникший в случае первичного нарушения, при проведении успешной терапии всегда носит обратимый характер.
Гемостаз — это основная физиологическая функция, обеспечивающая выживаемость у представителей класса млекопитающих. Нарушения целостности сосудов приводят к каскаду сложных реакций, которые определяют формирование стабильных сгустков и прерывают геморрагию (приложение 1). Многие процессы с воспалительным компонентом могут вызывать избыточную активацию в виде цепных реакций и провоцировать множественное формирование тромбов. При этом избыточная утилизация тромбоцитов и факторов коагуляции в организме ведет к постепенному уменьшению их количества (деплеции), что может разрешиться геморрагическим диатезом. ДВС синдром — это сложный патологический феномен, проявляющийся клиническими манифестациями вследствие ассоциации противоречий, возникающих на уровне гиперкоагуляции и геморрагического синдрома.
В начале статьи рассматриваются механизмы развития ДВС, затем внимание уделяется лечению.
Приложение 1. Физиология нормального гемостаза
Понимание особенностей возникновения, течения и лечения ДВС требует четких знаний о первичном и вторичном гемостазе, а также о процессах фибринолиза и субстанциях, которые лимитируют чрезмерные реакции (рис. 1).
Рисунок 1. Общее представление о феноменах первичного и вторичного гемостаза (по Cloet-Chabre et Green).Мы напомним о хорошо известных механизмах гемостаза, кроме того познакомим читателя с некоторыми недавним исследованиям в области физиологии, в отношении локального реологического* (*Реология (англ. rheology) – область физики, где изучают текучесть материи и деформации тел в результате воздействия на них различных сил.) контроля эндотелия за гемостазом. В целом, этот однослойный эпителий при контакте с циркулирующими клетками крови (тромбоцитами) секретирует гуморальные факторы, действие которых основано на обеспечении равновесия вазомоторного тонуса и потока крови (Moncada S. , Palmer R.M.J., Higgs E.A., 1991).
, Palmer R.M.J., Higgs E.A., 1991).
Первичный гемостаз
Первичный гемостаз проявляется при наличии нарушения целостности сосуда, ведущей к экспозиции субэндотелиального коллагена. Возникает локальная вазоконстрикция вследствие нарушения равновесия между вазомоторным тонусом и потоком крови, которая облегчает адгезию тромбоцитов к поврежденному участку. С другой стороны, нарушения эндотелия ведут к исчезновению локальных антивазодилатирующих и антиагрегирующих эндотелиальных факторов, что в свою очередь усиливает агрегацию тромбоцитов. Одновременно происходит активация циркулирующего фактора Вон Виллебранда (Von Willebrand). Активированные тромбоциты высвобождают много субстанций: аденозиндифосфат (АДФ), тромбоксан А2 и серотонин, которые отвечают за вазоконстрипцию. С другой стороны, они вовлекают в данный процесс другие тромбоциты, которые образуют своеобразную пробку, формирующую из этих клеток «белый тромб». Этот «белый тромб» неустойчив, его стабилизация зависит от внедрения фибрина, конечного продукта плазматической коагуляции, который и формирует защитную сеть, адгезирующуюся к рецепторам фибриногена, α2 β3 интегрина активированных тромбоцитов (Boudreux M.
Вторичный гемостаз
Плазматическая коагуляция включает в процесс эндогенный и экзогенный пути, которые в конечном результате образуют фибрин. Эндогенный путь начинается через взаимоотношения между контактными факторами (фактор XII, калликреин, кининоген с высоким молекулярным весом, HMWK) и субэндотелиальным коллагеном. Через непосредственную активацию фактора IX осуществляется экзогенный путь. Экзогенный путь активируется, когда фактор III (тканевый фактор или тромбопластин) вступает в контакт с компонентами крови, обеспечивая появление кальцийзависимого комплекса с фактором VII. Два пути завершают активацию фактора Х, соответствующего началу общего пути с конечным результатом трансформации протромбина в тромбин. Тромбин катализирует формирование фибрина, начиная от фибриногена, а также вызывает активацию тромбоцитов. В отличие от условий  Активация их начинается одновременно и фактор IX эндогенного пути может непосредственно активироваться через действие фактора VIIa экзогенного пути. Активация in vivo двух путей плазматической коагуляции одновременно может дополняться тканевым фактором.
Активация их начинается одновременно и фактор IX эндогенного пути может непосредственно активироваться через действие фактора VIIa экзогенного пути. Активация in vivo двух путей плазматической коагуляции одновременно может дополняться тканевым фактором.
Регуляция гемостаза
Регуляция плазматической коагуляции зависит от антитромбогенного качества здорового эндотелия, располагающегося вкруг бреши в сосуде, что ограничивает разрастание сгустка крови. Эндотелиальные клетки продуцируют простациклин (PGI2), АДФ-азу (разрушает аденозиндифосфат) и моноксид азота (NO). Эти вещества являются вазодилататорами и ингибиторами агрегации тромбоцитов (Hackner S.G., 1996). С другой стороны, поверхность эндотелия содержит гликозаминогликаны, а также рецепторы тромбина и тромбомодулина (Welss D.J., Rachid J., 1998), которые потенциируют активность антитромбина III (АIII). Альфа-2 глобулин, синтезируемый печенью, является очень важным ингибитором плазматической коагуляции (80% антикоагулянтной активности) (Hackner S.
Фибринолиз
Система фибринолиза активируется в тот же время, как и каскад коагуляции, и ведет к постепенному растворению сгустка фибрина. Фибринолиз зависит от трансформации плазмогена в плазмин, который гидролизует фибрин на фрагменты: продукты деградации фибрина и фибриногена (ПДФ). Фибринолиз протекает в течение нескольких часов, обеспечивая полное растворение тромба и рубцевание поврежденного сосуда.
Развитие ДВС
ДВС — это нарушение гемостаза приобретенной природы, часто встречаемое в ветеринарной медицине (Chabre B., Corlouer J.P.H., 1994). Заболевание также упоминается как «коагулопатия потребления» и «диссеминированный внутрисосудистый тромбоз» (Feldman B.F., 1996), но эта терминология в настоящее время не нашла всеобщего признания.
Природа
Многие нарушения воспалительной природы могут спровоцировать развитие ДВС через различные механизмы, которые вызывают избыточное образование тромбина и фибрина в системе гемоциркуляции (табл. 1). Утечка тканевых факторов из поврежденных клеток, нарушение эндотелия с экспозицией субэндотелиальных структур, стаз сосудов, ассоциирующийся с метаболическим ацидозом и расстройством электролитного состава, — это основные факторы риска развития ДВС (Green R.A., 1995).
Таблица 1. Первичные причины ДВС у собаки, кошки и лошади.
| Собака | Кошка | Лошадь |
| Новообразования — Гемангиосаркома — Лимфома/карцинома | Новообразования — Лимфома — Лейкемия — Новообразования молочной железы | Новообразования |
| Инфекции — Бактериальной природы: пиометра/бронхопневмония, эндотоксемия — Вирусной природы: чума бабезиоз (пироплазмоз) | Инфекции — Бактерии — Эндотоксемия — Вирусы: инфекционный перитонит кошек | Инфекции — Септицемия — Эндотоксемия — Метрит — Плевропневмония — Виремия |
| Заболевание печени — Гиповолемический шок — Анестезия — Заворот желудка | Заболевание печени — Липидоз печени | Нарушение желудочно-кишечного тракта — Колики: — Удар — Энтерит/колит — Заворот |
| Травматизм тканей — Травма/ожог — Тепловой удар | — | — |
| Другие причины — Осложнения во время родов — Острый панкреатит — Укус змеи — Несопоставимость при трансфузии — Гемолитическая анемия — Амилоидоз почки | Другие причины — Заворот кишечника — Острый панкреатит — Недостаточность сердца — Травма — Интоксикация — FIV/FeLV (?) | Другие причины — Заболевание печени — Заболевание почек — Васкулит — Ожог — Осложнения во время родов |
Совокупность трех факторов (гиперкоагуляция, повреждения сосудов, сосудистый стаз) называют «Триадой Вирхова». Она составляет общую основу всех синдромов гиперкоагуляции (Hackner S.G., 1996). Согласно этому принципу ДВС может стать следствием множества первичных нарушений: неопластических заболеваний, инфекции вирусной, бактериальной и паразитарной природы, осложнений во время родов, состояния шока, травмы, иммунных патологических процессов и патологии печени.
Она составляет общую основу всех синдромов гиперкоагуляции (Hackner S.G., 1996). Согласно этому принципу ДВС может стать следствием множества первичных нарушений: неопластических заболеваний, инфекции вирусной, бактериальной и паразитарной природы, осложнений во время родов, состояния шока, травмы, иммунных патологических процессов и патологии печени.
Механизм
Для того, чтобы иметь представление о развитии ДВС, следует учитывать три механизма.
- Наиболее частой причиной ДВС, вероятно, является нарушение экзогенного пути плазматической коагуляции вследствие выделения тканевого фактора из поврежденных или некротизированных клеток, например, при завороте желудка у собаки или кишечника у лошади.
- Второй механизм обусловлен повреждением эндотелиального слоя и экспозицией субэндотелиальной матрицы, которая активирует первичный гемостаз и эндогенный путь. Этот феномен мы можем наблюдать во время солнечного удара, сосудистой неоплазии (гемангиосаркома) или при септицемии.

- Факторы коагуляции могут активироваться непосредственно через избыточное накопление энзимов в системе гемоциркуляции после укуса некоторыми ядовитыми змеями или при остром панкреатите.
Эволюция исследований в этой области позволила углубить знание о пусковых факторах развития ДВС: избыточная стимуляция иммунитета ведет к общему воспалению в организме (синдром генерализованной воспалительной реакции СГВР), что лежит в основе активации системы коагуляции. Активированные цитокины, например опухолевый фактор некроза (Tumor Necrosis Factor, TNF), а также интерлейкины являются пусковыми элементами. Они вызывают через макрофаги эксперссию различных факторов прокоагуляции, среди которых наиболее важным является тромбопластин. C другой стороны, эти же цитокины стимулируют выработку энзимов, индуцирующих воспаление, таких как NO-синтетаза (NOS2) и циклооксигеназа (COX2). В отличие от своих гомологов NOS1 и 3, COX1, они индуцируют тысячекратное увеличение гуморальных факторов (NO, простагландины) (Troncy E. , 1999), которые, как правило, оказывает благоприятное действие, необходимое для ответа на воздействие инфекционного агента. Но в избыточном количестве эти вещества могут спровоцировать развитие СГВР. Противовоспалительные цитокины, кроме того, приводят к экспрессии адгезинов на поверхности эндотелия и циркулирующих в крови клеток, что в свою очередь усугубляет повреждения эндотелиального слоя сосудов, обнажая субэндотелиальную матрицу и обеспечивая повторный выброс тканевого фактора. Совокупность указанных феноменов, вероятно, фигурирует почти во всех случаях развития ДВС, в частности во время сепсиса (Bateman S.W., Mathewsky K.A., Abrams-Ogg A.C.G., 1998).
, 1999), которые, как правило, оказывает благоприятное действие, необходимое для ответа на воздействие инфекционного агента. Но в избыточном количестве эти вещества могут спровоцировать развитие СГВР. Противовоспалительные цитокины, кроме того, приводят к экспрессии адгезинов на поверхности эндотелия и циркулирующих в крови клеток, что в свою очередь усугубляет повреждения эндотелиального слоя сосудов, обнажая субэндотелиальную матрицу и обеспечивая повторный выброс тканевого фактора. Совокупность указанных феноменов, вероятно, фигурирует почти во всех случаях развития ДВС, в частности во время сепсиса (Bateman S.W., Mathewsky K.A., Abrams-Ogg A.C.G., 1998).
Последствия
После включения в процесс каскада свертывания крови чрезмерная активация тромбоцитов и факторов коагуляции обеспечивает внезапное появление множественных тромбозов. Если животное пережило эту фазу, то постепенное снижение элементов, участвующих в гемостазе, ведет к развитию геморрагического синдрома с аномалиями первичного и вторичного гемостаза. В циркулирующей крови мы наблюдаем увеличение фибринолитической активности и последующую аккумуляцию продуктов деградации фибрина и фибриногена (ПДФ). При этом поглощение естественных регуляторов гемостаза, в частности антитромбина III (АIII), может усугубить клинические симптомы.
В циркулирующей крови мы наблюдаем увеличение фибринолитической активности и последующую аккумуляцию продуктов деградации фибрина и фибриногена (ПДФ). При этом поглощение естественных регуляторов гемостаза, в частности антитромбина III (АIII), может усугубить клинические симптомы.
Эволюция
Проявление ДВС зависит от природы, тяжести, течения (сверхострое, острое или хроническое), сопутствующего заболевания, интенсивности образования фибрина, содержания АIII, а также от способности печени и костного мозга компенсировать факторы свертывания крови и поглощаемые тромбоциты. Метаболический ацидоз, гипоксия, сосудистый стаз и недостаточность печени отягощают клиническую картину заболевания.
ДВС становится декомпенсированным вследствие мощных стимулов, например при развитии острой ишемии, которая вызывает эквивалентный ответ в системе воспаления и гемостаза. Эта внезапная и быстрая реакция не позволяет включить в данный процесс компенсаторные механизмы. Нарушения, приводящие к тромбозам и геморрагиям, становятся необратимыми.
При хронической и компенсаторной ДВС наблюдается другая ситуация. Активация системы коагуляции протекает незаметно и позволяет организму найти равновесное состояние благодаря увеличению продукции тромбоцитов и факторов свертывания крови. Клинические симптомы при этом отсутствуют или дискретны. Если ДВС и первичные нарушения лечению не подвергать, то ДВС, эволюционируя в стадию декомпенсации, проявляется соответствующими симптомами (Bateman S.W., Mathewsky K.A., Abrams-Ogg A.C.G., 1998).
Клиническая картина
Клиницист должен прибегнуть к обследованию пациента, находящегося в асимптоматической стадии развития ДВС. При этом клиническая картина варьируется как при компенсированном, так и при декомпенсированном процессах в зависимости от течения заболевания (хроническое или острое). Клинические симптомы, ассоциирующиеся с ДВС, иногда трудно наблюдать при хроническом течении заболевания. Они могут быть выявлены при общем биохимическом исследовании. С другой стороны, симптомы, связанные с первичным заболеванием, могут полностью камуфлировать признаки развития ДВС (например, в случае гемоперитонита, который может быть вызван разрывом селезенки вследствие гемангиосаркомы или аутоиммунной анемии).
С другой стороны, симптомы, связанные с первичным заболеванием, могут полностью камуфлировать признаки развития ДВС (например, в случае гемоперитонита, который может быть вызван разрывом селезенки вследствие гемангиосаркомы или аутоиммунной анемии).
При развитии острого или сверх острого ДВС у животного часто отмечают клинические признаки тромбоза, геморрагии и/или шока. Это побуждает к поиску провоцирующего фактора или первичного нарушения.
Симптомы, наблюдаемые при тромбоэмболии, как правило, связаны с функциональной недостаточностью поврежденного органа. Обструкция на уровне микроциркуляции или, что бывает реже, сосудов крупного калибра, может привести к острой почечной недостаточности, выраженному диспноэ, ишемическому некрозу органа в брюшной полости, ассоциирующегося с илеусом. Возможно нарушение циркуляции вследствие шока.
У лошади ДВС часто возникает при эндотоксемии вследствие колик или септицемии. При этом клиническая манифестация чаще имеет не геморрагическую, а тромбоэмболическую природу (фото 1) (Morris D. D., 1998). Геморрагии проявляются у всех видов животных в виде петехий (фото 2), кровоподтеков, экхимозов, гематом (фото 3) и кровотечений, возникающих на уровне слизистых или полостей носа, а также мелены и гематурии. Кроме того, мы можем наблюдать длительное кровотечение и гематому при пункции вены или вокруг введенного в нее катетера. В постоперационный период, в частности в случае ишемии (заворот желудка, колики у лошади), ДВС может проявляться в виде кровотечения из раны в течение нескольких часов или суток после проведения операции.
D., 1998). Геморрагии проявляются у всех видов животных в виде петехий (фото 2), кровоподтеков, экхимозов, гематом (фото 3) и кровотечений, возникающих на уровне слизистых или полостей носа, а также мелены и гематурии. Кроме того, мы можем наблюдать длительное кровотечение и гематому при пункции вены или вокруг введенного в нее катетера. В постоперационный период, в частности в случае ишемии (заворот желудка, колики у лошади), ДВС может проявляться в виде кровотечения из раны в течение нескольких часов или суток после проведения операции.
У кошки ДВС наблюдается редко и часто протекает дискретно. Преобладает хроническое течение (Couto C.G., Hammer A.S., 1994).
| Фото 1. Тромбоз яремной вены у лошади. | Фото 2. Наличие петехий на уровне слизистой предверья ротовой полости у больной собаки. | Фото 3. Наличие экхимоза на поверхности кожи. |
Диагноз
ДВС характеризуется нарушением первичного или вторичного гемостаза с увеличением фибринолиза и снижением функции регуляторов гемостаза, в частности, на уровне антитромбина III. Биохимическое исследование не позволяет поставить окончательный диагноз. Следовательно, клиническое предположение на ДВС подтверждают на основании совокупности клинических симптомов и результатов лабораторного исследования (табл. 2 и приложение 2). Обязательно проводят подсчет тромбоцитов, учитывают время коагуляции (temps de Quick, время активности цефалина) и определяют концентрации фибриногена, АIII и ПДФ. При кровотечении дополнительные исследования по возможности выполняют непосредственно по месту нахождения больного. Подсчет форменных элементов часто является первым методом исследования. Тромбоцитопению наблюдают в 80% случаев при ДВС у собаки (Bateman S.W., Mathews K.A., Abrams-Ogg A.G.G., 1998). В начале развития ДВС можно наблюдать тромбоцитоз в случае, если костный мозг проявляет высокую степень активности. Снижение количества тромбоцитов часто сопровождает усугубление гиперкоагуляции. В случае срочной необходимости, когда нет возможности воспользоваться услугами лаборатории, микроскопическое исследование мазка крови под иммерсией (с увеличением объектива ×100), позволяет уточнить количество тромбоцитов, при условии, что их нормальное содержание в поле зрения микроскопа соответствует 8-10 клеткам у собаки и 6-10 у лошади.
Биохимическое исследование не позволяет поставить окончательный диагноз. Следовательно, клиническое предположение на ДВС подтверждают на основании совокупности клинических симптомов и результатов лабораторного исследования (табл. 2 и приложение 2). Обязательно проводят подсчет тромбоцитов, учитывают время коагуляции (temps de Quick, время активности цефалина) и определяют концентрации фибриногена, АIII и ПДФ. При кровотечении дополнительные исследования по возможности выполняют непосредственно по месту нахождения больного. Подсчет форменных элементов часто является первым методом исследования. Тромбоцитопению наблюдают в 80% случаев при ДВС у собаки (Bateman S.W., Mathews K.A., Abrams-Ogg A.G.G., 1998). В начале развития ДВС можно наблюдать тромбоцитоз в случае, если костный мозг проявляет высокую степень активности. Снижение количества тромбоцитов часто сопровождает усугубление гиперкоагуляции. В случае срочной необходимости, когда нет возможности воспользоваться услугами лаборатории, микроскопическое исследование мазка крови под иммерсией (с увеличением объектива ×100), позволяет уточнить количество тромбоцитов, при условии, что их нормальное содержание в поле зрения микроскопа соответствует 8-10 клеткам у собаки и 6-10 у лошади. У кошки рекомендуется внимательно обследовать тонкий слой мазка крови нанесенного на предметное стекло, для того чтобы определить скопления тромбоцитов.
У кошки рекомендуется внимательно обследовать тонкий слой мазка крови нанесенного на предметное стекло, для того чтобы определить скопления тромбоцитов.
Таблица 2. Биохимическая оценка гемостаза: практические рекомендации
| Биохимические исследования | Способы исследования | Этапы оценки | Нормы |
| Подсчет тромбоцитов | Пункция в вену — Кровь в пробирке с EDTA | Первичный гемостаз | Собака: 200-500×109/л Кошка: 300-800×109/л Лошадь: 100-300×109/л |
| Время кровотечения | Надрез десны — Промокнуть кровь без соприкосновения с раной — Отметить время кровотечения | Первичный гемостаз | 1-5 минут |
| Коагуляции в сухой пробирке | Пункция вены — Кровь в стеклянную пробирку с поддержанием температуры 37°С (в водяной бане или руке) — Отметить время коагуляции | Вторичный гемостаз | 4-10 минут |
| Время активированного цефалина или каолина — Temps de Quick | Пункция вены и забор крови в пробирку с цитратом — Центрифугировать и отделить к контролю плазму — Послать анализ в лабораторию в течение 2 часов (комнатная t°C) — Дополнительно направить здоровую плазму для контроля | Эндогенный путь Экзогенный путь | Менее чем на 20% увеличение по отношению к контролю |
| Фибриноген | Послать цитратную плазму + контрольную плазму — Хранить в течение 8 часов при 20°С | Плазматическая коагуляция при остром воспалительном процессе | Собака: 2-4 г/л Кошка: 0,5-3 г/л Лошадь: 1-4 г/л |
| Антитромбин III | Послать цитрированную сыворотку в лабораторию — Хранить 8 часов при t 20°C | Регуляция гемостаза | 8-120% |
| ПДФ | 1 мл цитратной плазмы — Хранить 24 часа при 2-8°С | Фибринолиз | Менее 10-20 мг/мл |
Приложение 2. Когда следует думать о ДВС?
Когда следует думать о ДВС?
Предварительный диагноз на ДВС ставят на основании нескольких клинических признаков. ДВС может осложнять первичное нарушение или составлять лишь часть его общего проявления. ДВС также входит в дифференциальную диагностику геморрагического приобретенного синдрома. Таким образом, мы резюмируем клиническую ситуацию, на основании которой и следует думать о наличии ДВС.
ДВС возникает, когда функция первичного и вторичного гемостаза изменена.
Если животное имеет геморрагии, анамнез и клиническое обследование часто позволяют ориентироваться в диагностике. Остается только определить нарушение первично или нет.
В процессе общего распространения некоторых неоплазм, в частности в предоперационной фазе или до назначения химиотерапии.
Гемангиосаркомы и злокачественные гемопатии часто осложненяются ДВС: раннее определение крайне необходимо перед проведением операции или перед назначением L-Аспарагиназы.
В процессе распространения злокачественное образование приводит к эндотоксемии. Она возникает также при нарушениях желудочно-кишечного тракта инфекционной природы или может быть связана с ишемиями.
Она возникает также при нарушениях желудочно-кишечного тракта инфекционной природы или может быть связана с ишемиями.
Токсины Грам — отрицательных бактерий провоцируют гиперагрегацию тромбоцитов и могут непосредственно приводить к плазматической коагуляции (Thomas J.S., Green R.A., 1998).
В постоперационном периоде, в частности при иссечении новообразования или вследствие травматического или ишемического феномена.
Направленное клиническое обследование и надлежащий биохимический анализ позволяют достаточно рано выявить ДВС. Прогноз варьируется в зависимости от обратимости первичного нарушения.
При общем системном нарушении
Развитие каскада коагуляции может сопровождать многие заболевания. Речь идет о тщательном контроле в случае возможного панкреатита, гемолитической анемии, гипертермии, бронхопневмонии, состоянии шока, коликов, а также инфекционного перитонита у кошек, гепатита и т.д. Частичное обследование осуществляют путем подсчета количественного содержания тромбоцитов, времени активированного цефалина и temps de Quick. В случае результатов, указывающих на нарушение, следующим этапом будет выявление ПДФ и оценка АIII. Клиническое предположение является главным: нормальные показатели при биохимическом исследовании не могут исключить компенсаторную фазу ДВС.
В случае результатов, указывающих на нарушение, следующим этапом будет выявление ПДФ и оценка АIII. Клиническое предположение является главным: нормальные показатели при биохимическом исследовании не могут исключить компенсаторную фазу ДВС.
Кровотечение может возникнуть по причине одной лишь тромбоцитопении, если количество кровяных пластинок ниже 30×109 на один литр (Godeau B., Bierling P., 1997). Оценку плазматической коагуляции и функции тромбоцитов проводят при геморрагическом синдроме, ассоциирующемся с умеренной тромбоцитопенией. Для этого определяют время кровотечения из слизистой преддверия ротовой полости (в области щек), учитывая, что в норме оно должно быть менее пяти минут.
За исключением обширной геморрагии или сопутствующей гемопатии, количество эритроцитов при ДВС существенно не изменяется. Морфологическое обследование эритроцитов под микроскопом имеет большое значение: шизоциты, кератоциты или клетки в форме каски часто наблюдают вследствие фрагментации эритроцитов. Это объясняется тем, что филаменты циркулирующего фибрина адгезируются на эритроцитах и буквально отсекают часть их мембраны при пассаже в системе микроциркуляции, провоцируя тем самым изменение морфологии. Во всяком случае, такие аномалии и фрагментация эритроцитов не являются патогномоничным признаком ДВС. Их можно обнаружить при анемии с тельцами Гейнца, а также при анемии, вызванной дефицитом железа и аномалиями структур сердца и сосудов (например, при гемангиосаркоме) (Slappendel R.J., 1988). При ДВС плазматическую коагуляцию определяют по temps de Quick (экзогенный путь), времени цефалина с активатором (эндогенный путь) и времени тромбина (общий путь), которое возрастает более чем на 25% в сравнении с контролем. Это увеличение является вторичным, связано с поглощением сывороточных факторов коагуляции и снижением их концентрации (фибриногена и факторов V и VIII) (Green R.A., 1995). Время активации цефалина увеличивается в большей степени, чем temps de Quick. Тем не менее, иногда время плазматической коагуляции соответствует норме, в частности при хроническом течении ДВС с компенсаторной продукцией факторов коагуляции печенью.
Это объясняется тем, что филаменты циркулирующего фибрина адгезируются на эритроцитах и буквально отсекают часть их мембраны при пассаже в системе микроциркуляции, провоцируя тем самым изменение морфологии. Во всяком случае, такие аномалии и фрагментация эритроцитов не являются патогномоничным признаком ДВС. Их можно обнаружить при анемии с тельцами Гейнца, а также при анемии, вызванной дефицитом железа и аномалиями структур сердца и сосудов (например, при гемангиосаркоме) (Slappendel R.J., 1988). При ДВС плазматическую коагуляцию определяют по temps de Quick (экзогенный путь), времени цефалина с активатором (эндогенный путь) и времени тромбина (общий путь), которое возрастает более чем на 25% в сравнении с контролем. Это увеличение является вторичным, связано с поглощением сывороточных факторов коагуляции и снижением их концентрации (фибриногена и факторов V и VIII) (Green R.A., 1995). Время активации цефалина увеличивается в большей степени, чем temps de Quick. Тем не менее, иногда время плазматической коагуляции соответствует норме, в частности при хроническом течении ДВС с компенсаторной продукцией факторов коагуляции печенью. Продукты деградации фибрина и фибриногена (ПДФ) легко определяют в условиях лаборатории методом полуколичественной агглютинации, который применяют в гуманитарной медицине. Определение ПДФ относительно достоверно у собаки и лошади. Существуют трудности в интерпретации данного показателя у кошки, так как он может быть нестабильным и варьируется (Slappendel R.J., 1988). Относительно специфичным считают количественный показатель в пределах 10-20 мкг/мл (Dossin O., 1995; Furic F., Heripret D., Olivry T., 1992). Увеличение ПДФ до 40 мкг/мл при ДВС является патогномоничным (Lassen E.D., Swardson C.J., 1995). Такое увеличение при внезапном появлении фибринолиза в дифференциальной диагностике классифицируется как первичный фибринолиз (недостаточно документированное заболевание в ветеринарной медицине) (Furic F., Heripret D., Olivry T., 1992; Green R.A., 1995). Феномен может быть также при выраженной недостаточности печени (нарушение элиминации ПДФ) (Green R.A., 1995) или тромбоэмболии. Активный фибринолиз ведет к гипофибриногенемии, редко наблюдаемой у лошади, потому что фибриноген быстро синтезируется печенью в ответ на острую воспалительную реакцию (Furic F.
Продукты деградации фибрина и фибриногена (ПДФ) легко определяют в условиях лаборатории методом полуколичественной агглютинации, который применяют в гуманитарной медицине. Определение ПДФ относительно достоверно у собаки и лошади. Существуют трудности в интерпретации данного показателя у кошки, так как он может быть нестабильным и варьируется (Slappendel R.J., 1988). Относительно специфичным считают количественный показатель в пределах 10-20 мкг/мл (Dossin O., 1995; Furic F., Heripret D., Olivry T., 1992). Увеличение ПДФ до 40 мкг/мл при ДВС является патогномоничным (Lassen E.D., Swardson C.J., 1995). Такое увеличение при внезапном появлении фибринолиза в дифференциальной диагностике классифицируется как первичный фибринолиз (недостаточно документированное заболевание в ветеринарной медицине) (Furic F., Heripret D., Olivry T., 1992; Green R.A., 1995). Феномен может быть также при выраженной недостаточности печени (нарушение элиминации ПДФ) (Green R.A., 1995) или тромбоэмболии. Активный фибринолиз ведет к гипофибриногенемии, редко наблюдаемой у лошади, потому что фибриноген быстро синтезируется печенью в ответ на острую воспалительную реакцию (Furic F. , Heripret D., Olivry T., 1992; Lassen E.D., Swardson C.J., 1995). Общий фибриноген наиболее часто снижен у собаки, но оказалось, что он может быть в пределах физиологической нормы при остром воспалительном или хроническом течении заболевания, в процессе которого его продукция превышает избыточное потребление. Определение концентрации антитромбина III очень широко используется для постановки диагноза на ДВС и позволяет ориентироваться при лечении и прогнозе заболевания (Bateman S.W., Mathews K.A., Abrams-Ogg F.G.G., 1998; Green R.A., 1995). Антитромбин III формирует неактивный комплекс с тромбином и факторами коагуляции, которые затем элиминируется печенью. Пониженный уровень циркулирующего АIII является специфическим диагностическим элементом на ДВС. Более 80% подверженных заболеванию собак (Green R.A., 1995) и свыше 50% лошадей (при исследовании на ДВС, ассоциированный с коликами) АIII существенно снижен (Welch R.D., Watkins J.P., Taylor T.S., Cohen N.D., Carter G.K., 1992). В исследовании, опубликованном Thomas J.
, Heripret D., Olivry T., 1992; Lassen E.D., Swardson C.J., 1995). Общий фибриноген наиболее часто снижен у собаки, но оказалось, что он может быть в пределах физиологической нормы при остром воспалительном или хроническом течении заболевания, в процессе которого его продукция превышает избыточное потребление. Определение концентрации антитромбина III очень широко используется для постановки диагноза на ДВС и позволяет ориентироваться при лечении и прогнозе заболевания (Bateman S.W., Mathews K.A., Abrams-Ogg F.G.G., 1998; Green R.A., 1995). Антитромбин III формирует неактивный комплекс с тромбином и факторами коагуляции, которые затем элиминируется печенью. Пониженный уровень циркулирующего АIII является специфическим диагностическим элементом на ДВС. Более 80% подверженных заболеванию собак (Green R.A., 1995) и свыше 50% лошадей (при исследовании на ДВС, ассоциированный с коликами) АIII существенно снижен (Welch R.D., Watkins J.P., Taylor T.S., Cohen N.D., Carter G.K., 1992). В исследовании, опубликованном Thomas J. S., Green R.A., 1998, все кошки, подверженные ДВС, имеют снижение АIII. При этом выявление АIII более чем на 50% по сравнению с нормой является негативным элементом в прогнозе заболевания (Welch R.D., Watkins J.P., Taylor T.S., Cohen N.D., Carter G.K., 1992). Другие наиболее точные методы для постановки диагноза в настоящее время используются в гуманитарной медицине, но они не отработаны для домашних животных. Определение количества специфических пептидов прокоагулирующей и фибринолитической активации, а также потребления ингибиторов позволяют наиболее рано определить наличие ДВС у человека.
S., Green R.A., 1998, все кошки, подверженные ДВС, имеют снижение АIII. При этом выявление АIII более чем на 50% по сравнению с нормой является негативным элементом в прогнозе заболевания (Welch R.D., Watkins J.P., Taylor T.S., Cohen N.D., Carter G.K., 1992). Другие наиболее точные методы для постановки диагноза в настоящее время используются в гуманитарной медицине, но они не отработаны для домашних животных. Определение количества специфических пептидов прокоагулирующей и фибринолитической активации, а также потребления ингибиторов позволяют наиболее рано определить наличие ДВС у человека.
Диагноз на ДВС в ветеринарной медицине зависит от ассоциации составляющей клинического состояния пациента (кровотечение, сопутствующие заболевания, предрасполагающие к ДВС) и аномалий, выявляемых у него методами лабораторного исследования.
Таким образом, мы считаем, что трехкратное исследование, свидетельствующее о нарушении количества тромбоцитов, времени коагуляции, ПДФ, а также снижении АIII, фибриногена и изменении морфологии эритроцитов необходимы для постановки диагноза на ДВС (Bateman S. W., Mathewc K.A., Abrams-Ogg A.G.G., 1998) Совокупность результатов лабораторного исследования позволяет дифференцировать ДВС от других коагулопатий (табл. 3).
W., Mathewc K.A., Abrams-Ogg A.G.G., 1998) Совокупность результатов лабораторного исследования позволяет дифференцировать ДВС от других коагулопатий (табл. 3).
Таблица 3. Сравнение аномалий при дополнительном исследовании в случае ДВС и нарушении гемостаза, часто встречающемся у домашних животных.
ПДФ — продукты деградации фибрина и фибриногена; + увеличение; — снижение, 1 — антитромбин III снижается при выраженном нарушении печени; 2 — элиминация ПДФ может запаздывать при выраженном нарушении печени; 3 — некоторые аномалии эритроцитов могут выявляться при нарушениях печени в сиблированных клетках.
| Тромбо-цитопения | Тромбо-цитопатия | Антивитамин К | Гемофилия | Недостаточность печени | ДВС | |
| Подсчет тромбоцитов | — | норма | норма | норма | норма | — |
| Время кровотечения из десны | + | + | норма | норма | норма | + |
| Время активированного цефалина или каолина | норма | норма | + 2е | + | + | — |
| Temps de Quick | норма | норма | +1e | норма | + | + |
| Время тромбина | норма | норма | + 3е | норма | + | + |
| Антитромлин III | норма | норма | норма | норма | —1 | — |
| ПДФ | норма | норма | норма | норма | норма или +2 | + |
| Морфологи эритроцитов | норма | норма | норма | норма | норма или нарушения3 | нарушения |
Лечение
Лечение ДВС нуждается в корректировке пусковых факторов. Если этого не происходит, несмотря на применение симптоматической терапии продолжается активация процессов коагуляции. Хронический и слабовыраженный ДВС синдром при ликвидации первопричины может самоустраняться спонтанно. Цель терапевтического вмешательства заключается в элиминации причины заболевания, обеспечении нормального функционирования АIII, торможении каскада плазматической коагуляции и агрегации тромбоцитов, а также в адаптации поддерживающего лечения к каждому случаю (приложение 3). Иногда бывает трудно применить быстрое и эффективное лечение и устранить пусковой элемент, в частности при неоплазии или воспалительном процессе, например инфекционном перитоните у кошки. По данным авторов (Bateman S.W., Mathewc K.A., Abrams-Ogg A.G.G., 1998; Doliger S., 1996; Furic F., Heripret D., Olivry T., 1993) новообразования являются одной из причин развития ДВС у собаки. Гемангиосаркомы, первичные новообразования печени или метастазы, лимфомы, миеломы и карциномы наиболее часто участвуют в данном процессе (Doliger S.
Если этого не происходит, несмотря на применение симптоматической терапии продолжается активация процессов коагуляции. Хронический и слабовыраженный ДВС синдром при ликвидации первопричины может самоустраняться спонтанно. Цель терапевтического вмешательства заключается в элиминации причины заболевания, обеспечении нормального функционирования АIII, торможении каскада плазматической коагуляции и агрегации тромбоцитов, а также в адаптации поддерживающего лечения к каждому случаю (приложение 3). Иногда бывает трудно применить быстрое и эффективное лечение и устранить пусковой элемент, в частности при неоплазии или воспалительном процессе, например инфекционном перитоните у кошки. По данным авторов (Bateman S.W., Mathewc K.A., Abrams-Ogg A.G.G., 1998; Doliger S., 1996; Furic F., Heripret D., Olivry T., 1993) новообразования являются одной из причин развития ДВС у собаки. Гемангиосаркомы, первичные новообразования печени или метастазы, лимфомы, миеломы и карциномы наиболее часто участвуют в данном процессе (Doliger S. , 1996). Обнаружение сопутствующей ДВС усугубляют прогноз заболевания. Лечение злокачественных новообразований (хирургия, химиотерапия, радиотерапия и т.д.) должны проводиться быстро после начала специфического лечения ДВС.
, 1996). Обнаружение сопутствующей ДВС усугубляют прогноз заболевания. Лечение злокачественных новообразований (хирургия, химиотерапия, радиотерапия и т.д.) должны проводиться быстро после начала специфического лечения ДВС.
Приложение 3. Алгоритм лечения ДВС.
1. Элиминировать факторы развития заболевания
Факторы развития данной патологии должны быть устранены и подвержены лечению как можно быстрее, эффективность лечения и определяет состояние ДВС.
2. Поддерживать состояние нормальной гидратации
Необходимо внутривенно ввести катетер и назначить инфузионную терапию, чтобы скорректировать дегидратацию, восстановить электролитный и кислотно-щелочной баланс, вывести пациента из состояния шока.
3. Тормозить внутрисосудистую коагуляцию
* Гепарин: 5-10 МЕ/кг каждые восемь часов.
100-200 МЕ/кг каждые восемь часов, если нет улучшения.
Эффективность проявляется улучшением общего состояния и нормализацией времени коагуляции при дозе гепарина ниже на 150 МЕ/кг ранее назначаемой.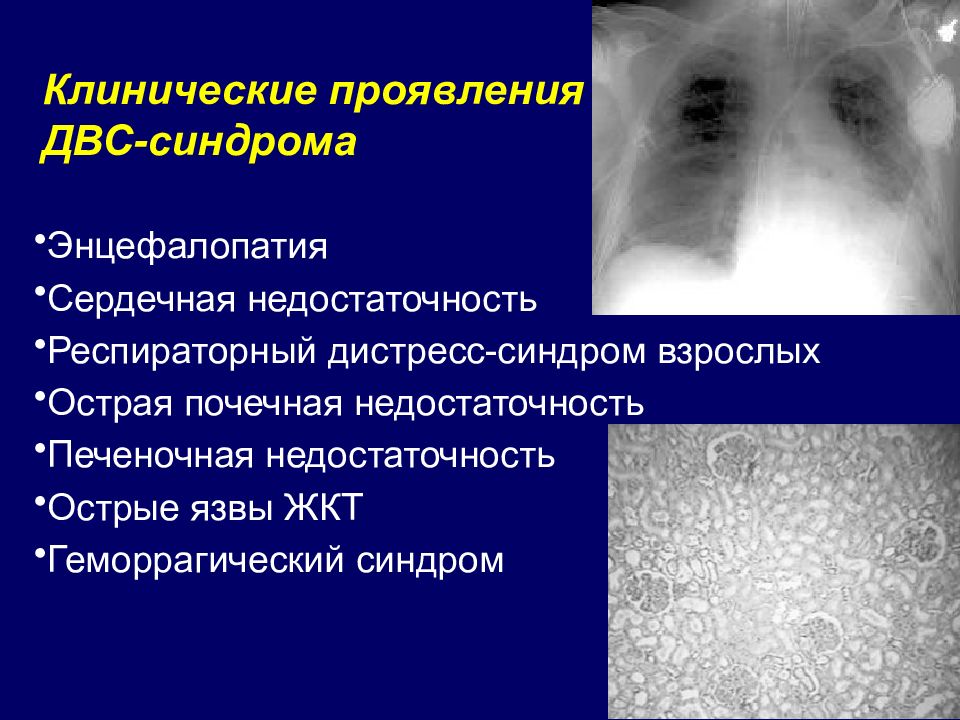
* Назначение крови:
Цельная кровь 10-20 мл/кг.
Свежая или свежая замороженная плазма 6-10 мл/кг 1-2 раза/сутки.
Гемотрансфузию назначают животному по необходимости, но следует иметь в виду, что она должна содержать АIII, также факторы коагуляции и иногда тромбоциты или эритроциты.
4. Поддерживающая терапия и профилактика осложнений
Оксигенотерапия, антибиотикотерапия, контроль за температурой, гигиена, анальгезия, мониторинг жизненных показателей (сердечно-сосудистая система, респираторный аппарат и почки).
Лечение ДВС, возникающее вследствие гиповолемического шока или септицемии, может увенчаться успехом (Slappendel R.J., 1988) в связи ее обратимостью после специфического лечения (инфузионная терапия, антибиотикотерапия и т.д.). Поддерживающая инфузионная терапия является основным элементом для обеспечения выживаемости животного, подверженного острому течению ДВС. Инфузия изотоническим раствором позволяет восстановить объем в системе гемоциркуляции, избежать микрообструкции вследствие тромбирования и венозного стаза, скорректировать дегидратацию, метаболический ацидоз, снизить концентрацию факторов коагуляции (Furic F., Heripret D., Olivry T., 1992). Назначение инфузий основано на определении состояния гидратации, электролитного состава и кислотно-щелочного равновесия в организме животного. В случае необходимости инфузионные растворы должны быть обогащены бикарбонатом натрия и хлоридом калия. Назначение гипертонических или коллоидных растворов (декстраны, гидроксиэтиломедоны) может оказаться необходимыми для обеспечения гемодинамических параметров в случае пребывания пациента в состоянии тяжелого шока.
Оксигенотерапию назначают, когда у животного выявляют вторичные респираторные нарушения, вызванные тромбоэмболией легких, в случае первичного нарушения респираторного аппарата (гнойная бронхопневмония), а также при выраженной анемии. Подачу кислорода осуществляют через маску, носовой зонд или путем помещения животного в герметичную камеру.
Применяют и другие способы паллиативного лечения, например антибиотикотерапию при бактериальной инфекции, регулирование температуры (подогрев или охлаждение), анальгезию. Необходим очень четкий контроль состояния пациента, так как оно может быстро ухудшаться, даже если кажется стабильным. Оценка артериального и висцерального венозного давления, а также содержания газов в крови и мочеотделения (через зонд и закрытую систему мочесборника) — необходимые элементы, которые используют, несмотря на сложность в организации при рутинной клинической практике.
Одним из ключевых моментов специфического лечения является применение АIII. Он содержится в свежей крови, свежей или замороженной плазме (назначают из расчета 10-20 мл/кг в/в). При хранении плазмы в замороженном виде АIII остается стабильным в течение года. Свежую кровь используют при дефиците эритроцитов и тромбоцитов.
Гепарин также применяют при специфической терапии ДВС. Было предложено несколько схем назначения данного препарата. Минимальную терапевтическую дозу (5-10 МЕ/кг 3 раза в сутки) и низкую дозу «low dose» (75-200 МЕ/кг 3 раза в сутки) применяют при слабо выраженных симптомах заболевания. Средняя (300-500 МЕ/кг три раза в сутки) и высокая — (750-1000 МЕ/кг 3 раза в сутки) дозы исплользуются при выраженных тромбоэмболической или геморрагической манифестациях. Гепарин преимущественно назначают подкожно или внутривенно. Он также может быть введен в плазму за 30 минут до начала трансфузии, что обеспечивает формирование активного комплекса АIII-гепарин в условиях in vitro. Он полностью теряет активность, если пороговая концентрация АIII у животного ниже физиологической нормы на 40% (Green R.A., 1995), а также в случае выраженного метаболического ацидоза или неадекватной перфузии тканей. Терапия гепарином противопоказана на период проведения операции (предпочтительнее вводить кровь или плазму вплоть до конца хирургического вмешательства).
Эффективность лечения всегда трудно оценить, потому что нормализация времени коагуляции маскируется увеличением концентрации назначаемого гепарина. Некоторые авторы рекомендуют применять низкие дозы препарата (75 МЕ/кг 3 раза в сутки), который не оказывает существенного влияния на время коагуляции, но в тоже время позволяет оценить улучшение ДВС через нормализацию биохимических показателей (Slappendel R.J., 1988). На человеке было показано, что назначение минимальных терапевтических доз гепарина также эффективно при лечении острого течения ДВС, как и назначение более высоких его доз.
Нестероидные противовоспалительные средства (НПВС) были предложены для лечения ДВС у некоторых видов животных. НПВС снижают агрегацию тромбоцитов и продукцию медиаторов воспалегния (простагландины), а также вызывают анальгезию. Флюниксин меглумин (flunixine meglumine, Finadine) из расчета 0,25 мг/кг также можно применять для лошадей, например во время коликов. Для собак некоторые авторы предлагают назначение аспирина (5-10 мг/кг утром и вечером) (Nelson R.W., Couto C.G., 1998). Однако какого-либо специального исследования в отношении НПВС с целью выявления их значимости при лечении ДВС у домашних животных не проводили. В связи с этим их можно использовать лишь эмпирически и с осторожностью, в виду их побочных эффектов (изъязвления желудочно-кишечного тракта и почечная недостаточность). Противовоспалительные стероидные препараты для лечения ДВС не рекомендуют, потому что они снижают активность мононуклеарных фагоцитов и, воздействуя на катехоламины, потенцируют вазоконстрикцию. Их применение может иметь место в случае необходимости проведения специфической терапии первичного заболевания (например, аутоиммунная гемолитическая анемия).
Заключение
Знания в отношении ДВС за последнее время значительно эволюционировали, но методы диагностики и лечения остались на прежнем уровне. Смертность по-прежнему высокая! Такая ситуация объясняется тяжестью первичных заболеваний и методами диагностики, которые в ветеринарной медицине запаздывают (поздняя консультация пациентов, слабая доступность методов лабораторного исследования и т.д.). Кроме того, отсутствует специфическое лечение ДВС. Согласно данным литературы, общая смертность варьирует в пределах 50-78% (Bateman S.W., Mathews K.A., Abrams-Ogg A.C.G., 1998), поэтому прогноз всегда сдержанный и сомнительный.
В настоящее время ведутся научные исследования в отношении синдрома генерализованной воспалительной реакции. Возможно, будут разработаны диагностические тесты, обеспечивающие раннее выявление феноменов гиперкоагуляции. Определение фибронектина, D-димера (продуктов специфической деградации фибрина) или активированных тромбоцитов в настоящее время недоступно в рутинной клинической практике и заимствовано из гуманитарной медицины, либо используется в рамках экспериментальных исследований. С другой стороны, новые подходы в лечении могут появиться значительно быстрее. В гуманитарной медицине уже используют три категории лекарственных препаратов: ингибиторы эндотоксинов и медиаторов, отвечающих за воспаление; ингибиторы системы коагуляции и тромбоцитов. Это Анти-TNF антитела или антифакторы тканевой природы, активированный протеин С или тромбомодулин, а также ингибиторы фактора активации тромбоцитов (Wels D.J., Rachid J., 1998), возможно в ближайшее время пополнят часть нашего терапевтического арсенала в лечении СГВР и ДВС.
Основные положение
— Диссеминированная внутрисосудистая коагуляция (ДВС) — это сложный патологический феномен, проявляющийся клинически вследствие ассоциаций противоречий состояния повышенной коагуляции и геморрагического синдрома.
— Клиническая картина варьируется в зависимости от острого или хронического компенсаторного и декомпенсированного течения заболевания. У кошки ДВС встречается редко, и его клинические манифестации часто протекают дискретно, преобладает хроническое течение (Couto C.G., Hammer A.S., 1994).
— Биохимического исследования, позволяющего поставить точный диагноз, к сожалению нет. Следовательно, клиническое предположение о наличие ДВС подтверждают на основании совокупности симптомов и результатов лабораторного анализа.
— Принято считать, что три результата исследования образца, свидетельствующие о нарушении тромбоцитов, времени коагуляции, ПДФ, АIII, фибриногена и морфологии эритроцитов, необходимы для постановки диагноза на ДВС (Bateman S.W., Mathews K.A., Fbrams- Ogg A.C.G., 1998)
СВМ № 4/2003
Оценить материал
НравитсяНравится Поздравляю Сочувствую Возмутительно Смешно Задумался Нет слов
1
26.3.2. Хронический двс-синдром
Хронический ДВС-синдром достаточно часто встречается у больных с на различных стадиях опухолевого процесса, с хрониосепсисом, на начальном этапе почечной недостаточности (в том числе в условиях камнеобразования), при пневмониях, при замедлении кровотока в системе воротной вены, гриппе и других ОРВИ. Хронический ДВС-синдром характеризуется длительной локальной гиперкоагуляцией и флеботромбозами в венах нижних конечностей, реже в венах малого таза и верхних конечностей (синдром Труссо). Хронический ДВС-синдром чаще развивается у больных со злокачественными опухолями легкого, яичников, карциномой молочной железы, карциномой простаты,диссеминированнной нейробластомой, метастатической аденокарциномой желудка, карциномой толстой кишки. Процесс метастазирования плотных опухолей в 75% случаев сопровождается мигрирующими флеботромбозами.
Для клинициста появление признаков персистирующего флеботромбоза на фоне нормального соматического статуса и состоятельности венозного русла всегда должно служить основанием для дополнительного обследования больного и исключения онкологической патологии.
Хронический ДВС-синдром развивается при хронической печеночной недостаточности с выраженной гипокоагуляцией, при микротромбоваскулитах (гемолитикоуремическом синдроме, тромботической тромбоцитопенической пурпуре).
Гемолитико-уремический синдром (синдром Гассера) отмечается при вирусной, бактериальной инфекции у детей и родивших их женщин. Образующиеся микротромбы, состоящие в основном из тромбоцитов, закупоривают микрососуды почек и инициируют развитие острой преренальной почечной недостаточности и острой надпочечниковой недостаточности. Смертность больных составляет свыше 70%. Тромботическая тромбоцитопеническая пурпура (болезнь Мошковиц) фактически повторяет картину гемолитико — уремического синдрома: лихорадка, геморрагический синдром, острая почечная недостаточность, микроангиопатическая гемолитическая анемия. Внутрисосудистое свертывание крови отмечается во всех органах.
При болезни Шенлейна-Геноха развитие ДВС-синдрома обусловлено формированием генерализованного микротромбоваскулита, в основе которого лежит повреждение микрососудов циркулирующими иммунными комплексами и активированными компонентами системы комплемента. Мембраноатакующий комплекс приводит к осмотическому лизису клеток, в том числе и эндотелиальных, что активирует внутренний путь свертывания крови и тромбоцитарно-сосудистый гемостаз. Маркером эндотелиального повреждения служит рост уровня ф.W., что используется в клинике. Фактором, индуцирующим ДВС-синдром при гипертонической болезни, при гемодинамическом стрессе вероятнее всего является повреждение мембран эндотелиоцитов.
Микро- или макроангиопатии у больных сахарном диабетом являются условием развития хронического ДВС-синдрома. Этому способствует гиперкоагуляция в сочетании с гипофибринолизом и высокой реактивностью тромбоцитов.
Определенное значение в патогенезе ДВС-синдрома имеет длительное локализованное внутрисосудистое свертывание крови в различных органах, которые, как правило, повреждены воспалительным процессом. Это особенно характерно для гломерулонефрита, острых пневмоний, некоторых диффузных повреждений паренхимы печени, метроэндометритов, сальпингоофоритах . В патогенезе этих состояний отмечают стадию гиперкоагуляции различной продолжительности и выраженности, которая определяется степенью повреждения тканей и последующим хроническим высвобождением тканевого тромбопластина, а также хроническим повреждением эндотелия иммунными комплексами. Сосуды микроциркуляторного русла этих органов постепенно заполняются микротромбами, что способствует истощению коагуляционного потенциала и активации фибринолиза с развитием в дальнейшем гипокоагуляции. Отмечена возможность развития ДВС-синдрома при циркулировании в кровотоке значительного количества стрептококков, которые могут поступать в системный кровоток из микрососудов, в том числе и зубо-челюстной системы при проведении определенных лечебных стоматологических вмешательств. Стрептококки вызывают внутрисосудистую агрегацию тромбоцитов, способствуют формированию и «рассылке» микротромбов, в том числе в микрососуды миокарда. У больных могут отмечатся случаи инфаркта миокарда и даже развития септического шока.
Тромбиновое время | Медицинский центр «Широких сердец»
/Услуги
/ / / /Тромбиновое время
Цены
| Тромбиновое время | 110 ₽ |
Наименование на английском языке: Thrombin time, TT, Thrombin Clotting Time, TCT, antithrombin I, AT I.
Тромбиновое время — это время, необходимое для формирования фибринового сгустка при добавлении к плазме тромбина — фермента (фактор IIа), появляющегося в итоге взаимодействия факторов свертывания крови при повреждении сосуда.
Тромбин необходим для заключительного этапа коагуляционного каскада — превращения молекулы фибриногена в нерастворимый фибрин, который способен полимеризовываться и образовывать стабильный фибриновый сгусток, обеспечивающий остановку кровотечения при повреждении мелких и средних сосудов и содержащий кроме полимеров фибрина клеточные элементы — тромбоциты и эритроциты.
Качественные или количественные изменения фибриногена приводят к недостаточной/избыточной продукции фибрина, что проявляется повышенной кровоточивостью или склонностью к тромбозам.
В лабораторных условиях заключительный этап коагуляционного каскада воспроизводится путем добавления готового тромбина к плазме, а изменения структуры или концентрации фибриногена отражаются в увеличении или уменьшении тромбинового времени.
Фибриноген представляет собой гликопротеин, секретирующийся гепатоцитами в кровь. Кроме того что он является фактором свертывания крови (фактор I), он также обеспечивает и некоторые реакции фибринолиза, процесса растворения сгустков крови, — связывает избыточный тромбин (поэтому фибриноген также называют антитромбин I) и активирует плазминоген. В связи с этим заболевания с изменением структуры или концентрации фибриногена могут проявляться и кровотечением, и тромбозом, а также в некоторых случаях их сочетанием.
Патологии, которые сопровождаются дефицитом фибриногена, называются:
- Гипофибриногенемия
- Афибриногенемия
- Дисфибриногенемия — при нарушенных структуре и функциях фибриногена
- Данные патологии могут быть наследственными или приобретенными.
К приобретенным патологиям относятся:
- заболевания печени
- синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром)
- первичный фибринолиз
- реакции, вызванные лекарствами (например, тромболитическими агентами и L-аспарагиназой)
Самая частая причина приобретенной дисфибриногенемии — заболевания печени. При циррозе, хроническом активном гепатите, острой печеночной недостаточности, обструктивных заболеваниях печени и гепатоме к секретируемому фибриногену присоединяется слишком много сиаловых кислот. Такой модифицированный фибриноген имеет больший отрицательный заряд, который препятствует полимеризации молекул фибрина.
У пациентов с заболеваниями печени есть множественные нарушения коагуляции, которые проявляются повышенной кровоточивостью. Определение тромбинового времени — основной скрининговый тест, позволяющий заподозрить дисфибриногенемию как одну из причин кровотечения. Аномальный фибриноген также синтезируется некоторыми опухолями (некоторыми формами плоскоклеточного рака шейки матки, аденокарциномы молочной железы, гипернефромы, гепатомы). При определенных заболеваниях, сопровождающихся синтезом антител, взаимодействующих с фибриногеном (системной красной волчанке, множественной миеломе), его активность снижается, что проявляется увеличением тромбинового времени.
Самой частой причиной приобретенной гипофибриногенемии является — ДВС — СИНДРОМ
ДВС – синдром
ДВС — синдром — это системное тромбогеморрагическое расстройство, при котором происходит избыточное образование фибриновых микротромбов и потребление факторов свертывания крови и тромбоцитов. ДВС — синдром всегда развивается вторично, как осложнение какого-либо заболевания.
Различают острый и хронический ДВС-синдром.
Причинами острого ДВС-синдрома являются:
- инфекционные заболевания (E. coli — сепсис, HIV, цитомегаловирусная инфекция, малярия)
- острые миелобластные лейкозы
- осложнения беременности и родов (преждевременная отслойка плаценты, эклампсия, эмболия околоплодными водами)
- обширные ожоги
- массивные гемотрансфузии и другие.
Причины хронического ДВС-синдрома:
- солидные опухоли
- хронические лейкозы
- осложнения беременности (внутриутробная гибель плода)
- миелопролиферативные заболевания
- ревматоидный артрит
- болезнь Рейно
- инфаркт миокарда
- неспецифический язвенный колит и болезнь Крона и др.
«Запускает» развитие ДВС — синдрома при всех перечисленных состояниях поступление в кровь большого количества тромбопластина (тканевого фактора, фактора III). При этом, в сосудах почек, головного мозга, печени, легких образуются множественные микротромбы, которые и обуславливают клиническую картину синдрома в виде полиорганной недостаточности. В результате массивного потребления фибриногена и других факторов свертывания крови развивается их вторичная недостаточность и на смену гиперкоагуляции приходит гипокоагуляция и диссеминированная кровоточивость. Необходимо отметить, что гиперкоагуляция и гипокоагуляция часто присутствуют одновременно у одного и того же больного, поэтому выделение последовательных периодов ДВС — синдрома весьма условно.
Особенности клинической картины ДВС — синдрома приводят к тому, что диагностика этого состояния остается одной из самых сложных задач современной медицины. В этой ситуации контроль тромбинового времени в сочетании с другими лабораторными тестами необходим для оценки риска и ранней диагностики ДВС — синдрома, а также на этапе контроля его лечения.
Наследственные нарушения фибриногена встречаются достаточно редко. Известно около 80 мутаций, вызывающих дефицит или отсутствие фибриногена. Как правило, такие мутации приводят к полной остановке синтеза фибриногена или формированию измененного фибриногена, который не может быть секретирован из гепатоцитов и накапливается в них. При афибриногенемии фибриноген в плазме отсутствует, это самая тяжелая форма его дефицита. Заболевание наследуется по аутосомно-рецессивному типу и встречается с частотой 1:1 000 000. Как правило, афибриногенемия проявляется уже в неонатальном периоде (первые 28 дней с рождения). При этом отмечается кровотечение при пересечении пуповины, геморрагии в коже, желудочно-кишечном и мочеполовом тракте, внутричерепное кровоизлияние. Однако это заболевание может впервые проявиться позже, в детском и даже во взрослом возрасте. Для женщин с афибриногенемией характерны метро-, меноррагия, привычный самопроизвольный выкидыш, кровотечение в послеродовом периоде. У некоторых пациентов с афибриногенемией наряду с повышенной кровоточивостью наблюдаются симптомы тромбоза (чаще венозного, чем артериального).
Гипофибриногенемия встречается гораздо чаще, чем афибриногенемия (1:500). Как правило, она протекает бессимптомно, так как того количества фибриногена, которое все же присутствует, достаточно для остановки небольших кровотечений из мелких и средних сосудов и вынашивания беременности. Однако при обширных травмах, операциях, а также при сопутствующей патологии свертывания крови гипофибриногенемия может сопровождаться угрожающим жизни кровотечением.
Наследственные дисфибриногенемии — это гетерогенная группа заболеваний, при которых нарушена структура фибриногена. При этом его концентрация в плазме остается нормальной или незначительно понижена (гиподисфибриногенемия). На сегодняшний день известно около 400 мутаций, приводящих к замене аминокислот в последовательности фибриногена. Такая замена приводит к снижению его активности, нарушению его взаимодействия с тромбином или отсутствию дальнейшей полимеризации фибрина.
У большинства пациентов с дисфибриногенемией (55%) нет клинических проявлений болезни. Заболевание предполагается на основании случайно выявленных отклонений в лабораторных тестах или при установлении диагноза у одного из членов семьи.
У 25% больных дисфибриногенемией отмечаются эпизоды повышенной кровоточивости (обычно после травмы, хирургического вмешательства или в послеродовом периоде), у 20% есть склонность к тромбозам (чаще венозным, чем артериальным), а у 27% — сочетание обоих состояний. В некоторых случаях аномальный фибриноген откладывается в ткани почек в виде амилоида. Такая форма наследственного амилоидоза характеризуется ранним развитием хронической почечной недостаточности.
В то время как основная функция фибриногена заключается в образовании фибринового тромба, он также участвует в некоторых других процессах: воспалении, ангиогенезе и заживлении ран. Кроме того, считается, что он способствует формированию атеросклеротических бляшек в сосудах, разрастанию гладкомышечных клеток и захвату окисленных липидов макрофагами. Установлено, что высокие концентрации фибриногена в крови связаны с повышенным риском артериальных тромбозов.
Показания к назначению исследования
- При заболеваниях печени: циррозе, хроническом активном гепатите, обструктивных заболеваниях печени, гепатомах.
- При симптомах гипо(а)фибриногенемии и дисфибриногенемии: повышенной кровоточивости (метро-, меноррагии, носовом кровотечении, гематомах мягких тканей, кровотечении в послеродовом или послеоперационном периоде) или склонности к тромбозам (флеботромбозам, тромбоэмболии ветвей легочной артерии, артериальным тромбозам), а также при сочетании обоих состояний.
- При двух и более самопроизвольных прерываниях беременности в сроки до 22 недель.
- При заболеваниях, сопровождающихся высоким риском развития ДВС-синдрома: тяжелых инфекционных заболеваниях, острых и хронических лейкозах, осложнениях беременности и родов, тяжело протекающих аутоиммунных заболеваниях.
- При имеющихся факторах риска артериальных тромбозов: высокой концентрации гомоцистеина и С — реактивного белка.
Исследуемый материал
Венозная кровь
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т. д.
Единицы измерения: Сек. (секунда).
Референтные значения: 9–12 сек
С этим исследованием сдают
Почему у нас
-
В медицинском центре «Широких сердец» вы можете не только сдать все виды анализов, но и оперативно пройти все необходимые исследования для получения полной картины состояния здоровья.
-
Специалисты нашего центра осуществляют забор и исследование биоматериала без возрастных ограничений, в том числе, и у грудных детей.
-
Использование современного, одноразового инструментария в стерильном процедурном кабинете — обеспечивают безболезненность и безопасность процедур.
-
Возможен выезд для забора крови на дом.
-
Для удобства пациентов, лаборатория начинает работу в 08:00, что позволяет успеть на приём к узким специалистам к моменту начала работы центра — в 09:00.
-
График работы лаборатории: 08:00 — 20:30 по будням; 08:00 — 18:00 в субботу; 08:00 — 15:00 в воскресенье.
Адреса наших филиалов:
г. Воронеж, ул. Владимира Невского, 19, ул. Пограничная, 2.
Узнайте больше о лабораторных исследованиях у администраторов в МЦ «Широких сердец»
Предварительная запись по тел.: (473) 280-20-30
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ПАТОГЕНЕЗ, ДИАГНОСТИКА И ПРОФИЛАКТИКА НАРУШЕНИЙ СИСТЕМЫ ГЕМОСТАЗА У БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ
А.В. Маджуга, О.В. Сомонова, А.Л. Елизарова
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
На высокую частоту тромботических осложнений у больных злокачественными новообразованиям и на взаимосвязь этих двух заболеваний клиницисты обратили внимание уже давно. Наиболее известными являются наблюдения французского врача Труссо, который отмечал, что мигрирующие, плохо поддающиеся лечению тромбофлебиты поверхностных или глубоких вен могут быть первыми признаками скрыто протекающего злокачественного процесса, нередко опережающими клинические проявления опухоли. Следует отметить, что у самого Труссо развился длительно текущий тромбофлебит, на основании которого он заподозрил и позднее диагностировал у себя рак желудка, от которого спустя несколько месяцев скончался.
Современные многоцентровые исследования показали, что риск ранних тромбоэмболических осложнений у онкологических больных в несколько раз выше по сравнению со здоровыми людьми того же возраста, а немотивированное учащение рецидивов тромбирования вен у больных с варикозной болезнью должно настораживать врачей в отношении наличия у них злокачественного процесса, так как у онкологических больных частота таких рецидивов возрастает с 6-10 до 35%.
Наиболее часто тромботические осложнения развиваются при опухолях яичников, поджелудочной железы, желудка, легких, прямой и толстой кишки, молочной железы и могут носить самый разнообразный характер: от тромбозов глубоких и поверхностных вен нижних конечностей, подключичных вен, тромбозов верхней полой вены, не бактериального тромботического эндокардита и др. до различных форм синдрома ДВС. В настоящее время установлено, что трмбоэмболические осложнения являются второй причиной смерти у больных злокачественными новообразования.
Основную роль в патогенезе различного рода тромботических осложнений, а также синдрома ДВС у онкологических больных играют изменения системы гемостаза, вызываемые как самой опухолью, так и различными (хирургическим, химиотерапевтическим, гормональным) методами лечения.
Исследования последних лет показали, что у больных злокачественными новообразованиями имеет место активация системы гемостаза, осуществляемая преимущественно по внешнему механизму процесса свертывания крови. Она обусловлена поступлением в кровоток из опухолевых клеток высокоактивного тканевого тромбопластина, образующего комплекс с фактором VII, активизирующего факторы IX и X, запускающего процессы внутрисосудистого свертывания крови. Опухолевые клетки также выделяют в кровь специфический раковый прокоагулянт, представляющий собой Са-зависимую цистеиновую протеазу, которая непосредственно активизирует фактор Х. Кроме того, различные цитокины и, главным образом, туморо-некротический фактор путем сложных взаимодействий с тканевым фактором тромбомодулином существенно повышают прокоагулянтную и снижают антикоагулянтную и фибринолитическую активность сосудистых эндотелиальных клеток. Наряду с активацией прокоагулянтного звена, опухолевые клетки могут непосредственно воздействовать на тромбоцитарное звено системы гемостаза, вызывая агрегацию тромбоцитов и образование опухолево-тромбоцитарных микроэмболов, кроме того, в процессе роста опухоли в кровь выделяются различные индукторы агрегации тромбоцитов, такие как АДФ, тромбин и другие.
Наши собственные исследования системы гемостаза, проведенные у 680 больных с различными злокачественными новообразованиями (легких, яичников, толстой кишки, желудка и др.), показали, что у них имеет место повышение концентрации фибриногена в 2-2,5 раза по сравнению со здоровыми людьми, увеличение содержания РКМФ по данным этаноловой и ортофенантролиновой пробы; одновременно у онкологических больных отмечается существенное (в 4-4,5 раза) повышение концентрации ПДФ, увеличение содержания Д-димера. Отмечаются изменения со стороны тромбоцитарного звена в виде усиления агрегационной способности тромбоцитов с отсутствием дезагрегации у 37% больных. Кроме того, наблюдается извращенная реакция тромбоцитов на малые дозы АДФ, при которой степень агрегации была выше, чем с большой дозой АДФ, что повышает склонность к образованию тромбоцитарных агрегатов.
Указанные изменения свидетельствуют о развитии у онкологических больных I фазы хронического диссеминированного внутрисосудистого свертывания крови. Наиболее выраженные признаки внутрисосудистого свертывания наблюдаются у больных с III-IV стадией заболевания. Тромбозы в системе нижней полой вены (синдром Труссо) до начала лечения имел место у 16,5% больных. Наблюдения показали, что на фоне имеющейся гиперкоагуляции такие клинические факторы риска, как длительная иммобилизация в постели, способствующая замедлению кровотока, особенно в сосудах нижних конечностей, частые венепункции, инфекции, сопутствующая патология, предрасполагают к развитию тромботических осложнений у онкологических больных.
Наиболее часто указанные осложнения встречаются на этапах хирургического лечения. Согласно литературным данным послеоперационные тромбозы глубоких вен нижних конечностей, являющиеся основными источниками ТЭЛА, развиваются у 50-70% онкологических больных, причем около половины из них формируется уже на операционном столе и большая часть их протекает бессимптомно.
Мы исследовали состояние системы гемостаза до операции на основных этапах оперативного вмешательства и в динамике в течение двух недель в послеоперационном периоде у больных, оперированных по поводу различных злокачественных новообразований. Диагностику венозных тромбозов осуществляли с помощью фибриногена, меченного J125. Проведенные исследования показали, что оперативные вмешательства независимо от их вида вызывают однотипные изменения системы гемостаза, которые во время операции проявляются укорочением АЧТВ, умеренным повышением содержания РКМФ и ПДФ, а также фактора 4 тромбоцитов. Особое внимание обращает на себя существенное снижение до 60% уровня антитромбина III, расходующегося на инактивацию появившегося в кровотоке тромбина и активированных факторов свертывания крови. Во время операции активизируется фибринолиз как защитная реакция, препятствующая тромбообразованию. В послеоперационном периоде изменения системы гемостаза развивались в виде гиперкомпенсированной формы хронического ДВС. На фоне нарастающей гиперкоагуляции и сниженного уровня антитромбина III фибринолитическая активность резко снижалась, что способствовало усилению процессов тромбообразования. Методом радиоизотопной диагностики тромбозы глубоких вен нижних конечностей были обнаружены у 60% оперированных больных. Большая часть венозных тромбозов (72%) формировалась в 1-3 сутки после операции, и большинство из них протекало бессимптомно. Сравнительный анализ информативности диагностических тестов позволил нам заключить, что наиболее ценными являются определение содержания РКМФ, Д-димера, ПДФ, антитромбина III. Агрегация тромбоцитов у 56% была повышенной, у 44% — сниженной вследствие рефрактерного состояния и перевозбуждения их индукторами агрегации во время операции.
Наряду с тромботическими осложнениями, оперативные вмешательства у онкологических больных часто осложняются кровотечениями, в патогенезе которых также ведущую роль играют нарушения системы гемостаза. Проведенные нами исследования системы гемостаза у 130 больных с интраоперационной кровопотерей от 60 до 467% ОЦК показали, что нарушения системы гемостаза развиваются уже на операционном столе и носят характер острого или подострого синдрома ДВС, сопровождающегося активацией фибринолиза разной степени выраженности, а также в виде гемодилюционной коагулопатии или их сочетания и являются следствием массивных кровопотерь, обусловленных травматичностью хирургических вмешательств у онкологических больных. Острый синдром ДВС характеризовался тяжелой гипокоагуляцией вследствие резкого дефицита факторов свертывания крови (удлинение АЧТВ до 120-180 сек.), снижения концентрации фибриноген до1 г/л, падения числа тромбоцитов до 50000 в 1 мкл и менее с полным отсутствием их способности к агрегации, одновременно при этом определяется высокий уровень Д-димера и фактора 4 тромбоцитов. Особенно важно подчеркнуть, что лабораторные признаки острого синдрома ДВС опережают его выраженную клиническую манифестацию. Гемостазиологический мониторинг с помощью комплекса экспресс методов в процессе длительных травматичных операций позволяет своевременно провести коррекцию выявленных нарушений и избежать развития тяжелых коагулопатических кровотечений.
Химиотерапия, по данным литературы и нашим собственным наблюдениям, повышает риск развития тромботических осложнений, особенно при распространенном процессе. Одним из главных механизмов активации системы гемостаза при химиотерапии является повреждение сосудистых эндотелиальных клеток, прямая активация тромбоцитов, снижение фибринолитической активности и освобождение прокоагулянтов из опухолевых клеток. Наиболее выраженное влияние оказывает применение при гемобластозах L-аспарагиназы, которая повышает образование тромбина с одновременным увеличением концентрации фибриногена, ПДФ, Д-димера, числа тромбоцитов, что приводит к тромботическим осложнениям. При лечении высокими дозами химиопрепаратов, включающих цитозин-арабинозид, было обнаружено увеличение антигена фибринопиптида А, активности ингибитора активатора плазминогена. Литературные данные свидетельствуют также о повышении риска тромботических осложнений при использовании тамоксифена, особенно в сочетании с химиотерапией.
В качестве профилактики нарушений системы гемостаза и связанных с ними тромботических осложнений у больных злокачественными новообразованиями широко используется гепарин, и наиболее эффективными считаются низкомолекулярные гепарины (клексан, фраксипарин, фрагмин). Как показали исследования, гепарины в комплексе с антитромбином III не только блокируют тромбин, а низкомолекулярные их формы в еще большей степени фактор Ха, но и обладают способностью стимулировать выход из эндотелия ингибитора внешнего пути свертывания TFP1, что для онкологических больных имеет особое значение. Низкомолекулярные гепарины обладают высокой биодоступностью, с целью профилактики вводятся 1-2 раза в сутки и в гораздо меньшей степени вызывают тромбоцитопению, индуцированную гепарином. По данным многоцентровых исследований, профилактика с помощью низкомолекулярных гепаринов послеоперационных венозных тромбозов снижает их частоту в 10-12 раз. Использование низкомолекулярных гепаринов не требует лабораторного контроля, что делает удобным их применение не только для профилактики, но и лечения венозных тромбозов амбулаторным больным, что особенно важно для улучшения качества жизни онкологических больных. Важно, однако, подчеркнуть, что различные низкомолекулярные гепарины имеют разный клинический эффект, и их профили безопасности и эффективности не могут быть полностью экстраполированы от одного препарата к другому.
Мы использовали низкомолекулярный гепарин Клексан фирмы «Аventis Farma» в дозе 20-40 мг с целью профилактики послеоперационных венозных тромбозов у больных, оперированных по поводу различных злокачественных новообразований, и в дозе 40 мг у больных с выраженной гиперкоагуляцией при проведении химиотерапии. Препарат продемонстрировал высокую эффективность в профилактике тромботических осложнений и хронических форм синдрома ДВС.
В настоящее время ведется разработка новых противотромботических препаратов, которые, взаимодействуя с тканевым фактором и комплексами фактора VIIа/ТФ, по предварительным данным, могут оказывать не только противотромботический эффект, но и приостанавливать первичный рост и метастазирование опухоли.
Таким образом, в профилактике тромботических осложнений у больных злокачественными новообразованиями достигнуты существенные успехи, и продолжающиеся научные исследования еще раз подтверждают взаимосвязь между биологией опухоли и системой гемостаза.
DoctorSPB.ru — информационно-справочный портал о медицинеDoctorSPB.ru — информационно-справочный портал о медицине, здоровье и красоте. Методы лечения ВИЧ,СПИД и гепатита,обзор фармакологических препаратов.Диагностика венерических заболеваний. На сайте размещены учебные медицинские фильмы,медицинские книги и методические пособия, рефераты и историй болезней для студентов и практикующих врачей. Задачей медицинской генетики является выявление и профилактика наследственных болезней. Генетика человека изучает явления наследственности и изменчивости в популяциях людей, особенности наследования нормальных и патологических признаков, зависимость заболевания от генетической предрасположенности и факторов среды.Читать полностью… Для диагностики острого инфаркта миокарда довольно широко использовалось определение в крови концентрации миоглобина. Специфичным лабораторным тестом острого инфаркта миокарда является определение МВ-фракции КФК. Любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. Читать полностью… Болезни печени сопровождаются рядом лабораторных синдромов. При анализе результатов биохимического исследования у больных с заболеваниями печени целесообразно выделять четыре лабораторных синдрома, каждый из которых в известной степени соответствует определенным морфологическим и функциональным изменениям в органе: цитолитический синдром, мезенхимально-воспалительный синдром, холестатический синдром (синдом холестаза), синдром малой печеночно-клеточной недостаточности. Обычно в каждом конкретном случае заболевания имеет место сочетание нескольких биохимических синдромов. Читать полностью… В настоящее время продолжается интенсивный поиск новых препаратов, обладающих анксиолитическим действием и вместе с тем более безопасных и эффективных, чем существующие лекарственные средства. Транквилизаторы – это особая группа психотропных средств, которые уменьшают или устраняют страх, тревогу, беспокойство, раздражительность, эмоциональную напряженность, выраженность эмоциональной насыщенности переживаний, то есть оказывают антиневротическое действие. Читать полностью… Боль в животе практически во всех случаях достаточно серьезное явление, к которому нельзя относиться безразлично. При заболеваниях желудка боли беспокоят в верхней половине живота. Боль обуславливается повышением секреторной и моторной функции. К болевым синдромам относится «гиперсекреторный невроз», описанный Райхманом. для него характерна повторная рвота с большим количеством кислого содержимого в сочетании с резкой болью. Чаще приступы возникают натощак и ночью, могут сопровождаться развитием гипохлоремической тетании, напоминают картину гипергатросуккореи, характерную для пилородуоденальной локализации язвенной болезни. Читать полностью… Внутривенное введение сверхвысоких, ударных доз глюкокортикостероидных гормонов, или пульс-терапия, получило наибольшее распространение в медицине критических состояний – септический шок, астматический статус, острый инфаркт миокарда с развитием синдрома Дресслера, отек Квинке, отек мозга, синдром Лайела, рассеянный склероз и др. Стандартным считается применение пульс-терапии для профилактики и купирования криза отторжения трансплантата. Именно успешное применение пульс-терапии у больных с кризом отторжения, в основе которого лежит целый ряд иммунных нарушений, послужило основой для использования пульс-терапии у больных с аутоиммунными ревматическими заболеваниями. Читать полностью… Основным элементом дегенерации межпозвонкового диска является уменьшение количества протеингликанов. Происходит фрагментация аггреканов, потеря глюкозаминогликанов, что приводит к падению осмотического давления и, как следствие, дегидратации диска. Однако даже в дегенерированных дисках клетки сохраняют способность к продуцированию нормальных аггреканов. Одной из основных причин дегенерации межпозвонкового диска является нарушение адекватного питания его клеточных элементов. In vitro было показано, что клетки межпозвонкового диска достаточно чувствительны к дефициту кислорода, глюкозы и изменению pH. Читать полностью… Дисбиозы – это микроэкологические нарушения, которые выражаются в нарушениях состава и функций нормальной микрофлоры. Состояние здоровья человека во многом определяется его микрофлорой. Именно поэтому современные стоматологи уделяют такое внимание проблеме дисбиоза и дисбактериоза полости рта. В полости рта и глотке человека встречается более 300 видов микробов. Читать полностью… Это лечение больных сифилисом с установленным и подтвержденным диагнозом. Арсенал применяемых противосифилитических препаратов включает: (1) антибиотики, которые в свою очередь подразделяются на антибиотики выбора и антибиотики резерва, а также (2) препараты висмута и йода, которые применяют значительно реже. Поскольку лечение сифилиса проводится почти исключительно антибиотиками, то до начала терапии необходимо собрать аллергологический анамнез в отношении их переносимости, а перед первыми инъекциями назначить антигистаминные средства. Читать полностью… Снижение массы тела не является самостоятельным диагнозом – этот симптом лишь свидетельствует о происходящем в организме патологическом процессе. Вместе с массой тела человек теряет и компенсаторные возможности, становясь уязвимым к любым неблагоприятным воздействиям окружающей среды. Поэтому любой случай похудения заслуживает адекватного внимания и лечения. Читать полностью… 777 Original умеет соревноваться с другими клубами, и отлично справляется с ролью лучшего. Читать полностью… Массажный стол – это основное оборудование специалиста, который выполняет лечебно-оздоровительные манипуляции. При его правильном выборе гарантируется максимальная комфортность пациентов и удобство работы мастера. Читать полностью… |
ДВС-синдром, описание заболевания на портале Medihost.ru
ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания, он же тромбогеморрагический синдром) — это процесс, в результате которого происходит нарушение свертывания крови и образования внутрисосудистых тромбов. Клиническая картина ДВС-синдрома разнообразна и может проявляться в виде геморрагической сыпи, сильных наружных и внутренних кровотечений, или же вовсе протекать бессимптомно, будучи заметным только по лабораторным показателям.
ДВС-синдром — это обязательная составляющая шоков различного генеза.
Причины возникновения ДВС-синдромаОсновной причиной возникновения ДВС-синдрома являются генерализованные вирусные и бактериальные инфекции, сепсис. Помимо этого причинами могут стать такие состояния, как акушерская патология, злокачественные опухоли, травмы, ожоги, обморожения, иммунокомплексный васкулит, использование аппаратов «искусственное сердце» и «искусственная почка», снижение в крови уровня естественного антикоагулянта антитромбина III и многие другие.
Также следует помнить, что агрегацию клеток могут вызывать такие препараты, как адреналин, оральные контрацептивы, аминокапроновая кислота. Особенно опасно комбинированное использование данных медикаментов.
Патогенез ДВС-синдромаКлючевым моментом в возникновении ДВС-синдрома является агрегация тромбоцитов с последующим тромбообразованием, а также процесс фибринолиза. К примеру, тканевый тромбопластин начинает циркулировать в крови после различных операций, инфаркта миокарда, в процессе родов и после них, а также при серьезных травмах, связанных с размозжением тканей. Активируют процесс свертывания крови и иммунные комплексы, появляющиеся после перенесенных инфекционных заболеваний и васкулитов. Помимо этого, любое стрессовое для организма состояние ведет к выбросу катехоламинов и кининов, которые также влияют на возникновение ДВС-синдрома.
Фазы ДВС-синдромаВыделяют 4 фазы ДВС-синдрома:
I фаза — это фаза гиперкоагуляции. В результате потери крови уменьшается количество факторов свертывания, что увеличивает время образования сгустка и удлиняет период капиллярного кровотечения.
II фаза — гипокоагуляция. Происходит процесс активации фибринолиза и агрегации клеток крови.
III фаза связана с усилением активации фибринолиза и быстрым лизисом сформировавшихся сгустков крови
IV фаза период генерализованного фибринолиза. Отсутствует полноценное свертывание крови в капиллярах, наблюдается внутреннее кровотечение из паренхимы органов, возникновение геморрагической сыпи на коже, появление крови в моче, кровотечения из ротовой полости и т.д.
Диагностика ДВС-синдромаДиагностика ДВС-синдрома осуществляется на основе данных анамнеза, клинических проявлений и данных лабораторных исследований. Следует помнить, что ДВС-синдром является осложнением, а не самостоятельным заболеванием.
Что касается прогноза, то определяется он также тяжестью основного заболевания, а также оперативностью начала лечения.
Лечение ДВС-синдромаПрежде всего терапия при ДВС-синдроме включает в себя лечение основного заболевания. Также, чтобы подобрать правильную терапию, необходимо знать количество тромбоцитов в крови, их активность, а также данные по факторам свертываемости. В экстренном плане проводятся реанимационные мероприятия, трансфузия свежезамороженной плазмы, введение дезагрегантов, подкожное введение гепарина, плазмаферез, инфузионная терапия и введение антибиотиков.
Профилактика ДВС-синдромаПрежде всего с профилактической целью следует проводить мониторинг групп риска, в которые входят люди с пониженным уровнем антитромбина III и эритроцитозом, а также лица пожилого возраста. Им следует уделять особое внимание в период проведения операций, а также помнить об опасности возникновения скрытого ДВС-синдрома при тяжелых хронических заболеваниях.
Иридокорнеальный эндотелиальный синдром и глаукома
Авторы: Сарват Салим, доктор медицины, FACS, и М. Брюс Шилдс, доктор медицины
Отредактировали Ингрид У. Скотт, доктор медицины, магистр здравоохранения, и Шарон Фекрат, доктор медицины
Эта статья опубликована в октябре 2011 г. и может содержать устаревшие материалы.
Синдром иридокорнеального эндотелия (ICE) включает спектр трех клинических вариаций: синдром Чандлера, прогрессирующая атрофия радужки и синдром Когана-Риза.Хотя первоначально описанные отдельно и с отчетливыми клиническими проявлениями, эти варианты связаны фундаментальным дефектом эндотелия роговицы, как показали гистопатологические и ультраструктурные исследования. Это приобретенное заболевание обычно носит односторонний характер и поражает преимущественно женщин в раннем и среднем зрелом возрасте, хотя сообщалось о двусторонних случаях и возникновении у детей 1 .
Потеря зрения, связанная с синдромом ДВС, обычно является вторичной по отношению к декомпенсации роговицы или рефрактерной глаукоме, которая часто требует хирургического вмешательства с разной степенью успеха.
Клинические особенности
Отличительные клинические признаки синдрома ДВС заключаются в следующем.
Симптомы. Распространенная жалоба — это приобретенное отклонение формы или положения одного зрачка. Некоторые пациенты с синдромом ДВС сообщают о снижении зрения, которое обычно ухудшается по утрам из-за отека роговицы, который развивается, когда веки закрываются во время сна, и улучшается в течение дня, поскольку роговица обезвоживается на воздухе.
Знаков. Клиническое обследование пациента с синдромом ДВС обычно выявляет аномалии роговицы, угла передней камеры и радужки. Типичная аномалия роговицы при синдроме ICE проявляется при осмотре с помощью щелевой лампы в виде тонкого серебристого цвета задней части роговицы, похожего на дистрофию Фукса, но менее грубого. При зеркальной микроскопии эндотелиальные клетки роговицы уменьшаются в количестве и обнаруживают различную степень плеоморфизма по размеру и форме с потерей гексагональных краев. Эти аномальные клетки также показывают инверсию темного света, при этом границы клеток выглядят яркими, а поверхности клеток темными (рис.1). Эти клетки иногда называют «клетками ICE», а ткань, которую они образуют, — «тканью ICE».
Типичная аномалия угла передней камеры, которая также является общей для всех вариантов синдрома ICE, при гониоскопии определяется как периферические передние синехии, которые могут распространяться кпереди от линии Швальбе (рис. 2). Эти иридотрабекулярные спайки имеют широкую основу и обычно постепенно прогрессируют по окружности угла, что в конечном итоге приводит к закрытию угла и повышению ВГД.
Различия в аномалиях радужной оболочки являются основным средством различения клинических вариантов синдрома ДВС:
- Синдром Чандлера обычно проявляется отеком роговицы и минимальными изменениями радужной оболочки.Хотя это наиболее распространенный вариант ICE, он часто не распознается врачами на начальном этапе. Могут также встречаться промежуточные вариации, при которых степень иректопии и атрофии стромальной радужки более обширна, чем при типичном синдроме Чандлера, но характерное образование отверстий на всю толщину прогрессирующей атрофии радужки отсутствует.
- Прогрессирующая атрофия радужной оболочки характеризуется выраженной атрофией радужной оболочки, связанной с различной степенью коректопии и эктропиона сосудистой оболочки глаза.Отличительным признаком прогрессирующей атрофии радужки является образование отверстий в радужке, которое бывает двух форм: отверстия растяжения и отверстия плавления. Растягивающие отверстия возникают в результате истончения радужки в квадранте от направления зрачкового искажения (рис. 3 и 4). Дыры плавления развиваются без сопутствующей иректопии или истончения радужной оболочки. Флуоресцентные ангиографические исследования предполагают, что эти отверстия связаны с ишемией радужной оболочки.
- Синдром Когана-Риза характеризуется любой степенью атрофии радужки, но преобладающим признаком является наличие множественных пигментированных узелков радужки на ножке (рис.5). Эти узелки состоят из ткани, напоминающей строму радужной оболочки, и часто окружены эндотелиальной тканью. В некоторых случаях другие признаки синдрома ДВС могут присутствовать за много лет до появления узелков.
В их классическом представлении можно легко различить три варианта. Однако, учитывая прогрессирующее течение этого заболевания, иногда трудно четко выделить их среди них, так как клинические проявления могут меняться на разных стадиях заболевания.
Механизм
Основным механизмом, связывающим все три варианта, является аномалия эндотелия роговицы. Как упоминалось ранее, эндотелиальные клетки уменьшаются в количестве, становятся плеоморфными и показывают инверсию темного света. Эндотелиальные клетки приобретают характеристики эпителиальных клеток, такие как наличие десмосом, внутрицитоплазматических нитей и микроворсинок. Затем эти аномальные клетки мигрируют в соседние структуры, включая радужную оболочку и трабекулярную сеть.
Было показано, что эти измененные эндотелиальные клетки секретируют аномальную базальную мембрану, подобную мембране Десцемета. Сокращение этой базальной мембраны приводит к изменениям радужки, иридотрабекулярным синехиям и вторичной закрытоугольной глаукоме. 2
Этиология
Хотя механизм изменений угла передней камеры и радужной оболочки хорошо установлен, точная этиология синдрома ICE остается неясной. История иридоциклита в некоторых пораженных глазах и наличие воспалительных клеток в образцах роговицы побудили некоторых исследователей предположить вирусную этиологию.Например, серологические исследования у пациентов с синдромом ДВС предполагают, но не доказали этиологическую роль вируса Эпштейна-Барра.
Более убедительные данные свидетельствуют о том, что вирус простого герпеса (ВПГ) может играть жизненно важную роль в патогенезе синдрома ДВС. Данные, полученные с помощью пар праймеров и методов полимеразной цепной реакции (ПЦР), выявили присутствие ДНК ВПГ в эндотелии в образцах роговицы пациентов с синдромом ДВС. Этот результат отсутствовал в нормальных роговицах и роговицах пациентов с тремя другими хроническими заболеваниями роговицы (афакическая буллезная кератопатия, интерстициальный кератит и кератоконус). 3
Кроме того, образцы роговицы дали отрицательные результаты на ВПГ после удаления эндотелиального слоя на глазах с синдромом ICE.
Дифференциальная диагностика
Несколько других заболеваний роговицы и радужной оболочки, многие из которых связаны с глаукомой, можно спутать с синдромом ДВС. 4
Заболевания роговицы. Двумя основными дифференциальными диагнозами эндотелиальных заболеваний роговицы являются задняя полиморфная дистрофия (PPMD) и эндотелиальная дистрофия Фукса.Пациенты с PPMD могут демонстрировать нерегулярный зрачок, изменения радужной оболочки и изменения угла передней камеры, которые напоминают синдром ICE, но тщательный анализ результатов зеркальной микроскопии, упомянутых выше, помогает дифференцировать эти две сущности. Более того, PPMD - двустороннее заболевание с аутосомно-доминантным наследованием. Эндотелиальные изменения роговицы при эндотелиальной дистрофии Фукса больше напоминают таковые при синдроме ICE, но у пациентов с Fuchs не наблюдается угла передней камеры или особенностей радужной оболочки, наблюдаемых при синдроме ICE.
Заболевания радужной оболочки. Заболевания радужной оболочки, которые можно спутать с синдромом ДВС, включают синдром Аксенфельда-Ригера, аниридию и иридошизис. Из них синдром Аксенфельда-Ригера имеет поразительное клиническое и гистопатологическое сходство с синдромом ICE, но отличается тем, что является двусторонним и врожденным. Клинические проявления синдрома Аксенфельда-Ригера обычно являются стационарными, хотя с течением времени может наблюдаться некоторое прогрессирование. Кроме того, изменения радужки и угла при синдроме Аксенфельда-Ригера связаны с удержанием и сокращением первичного эндотелиального слоя, тогда как изменения при синдроме ICE являются вторичными по отношению к миграции и последующему сокращению аномальных эндотелиальных клеток роговицы.Узелковые поражения радужки, которые можно спутать с синдромом Когана-Риза, включают меланому радужки и узелки Лиша, наблюдаемые при нейрофиброматозе, а также воспалительные узелки при гранулематозных увеитических состояниях, таких как саркоидоз.
Глаукома
Глаукома встречается примерно у половины пациентов с синдромом ДВС. Большинство исследований показывают, что глаукома более тяжелая и ее трудно контролировать у пациентов с прогрессирующей атрофией радужной оболочки или вариациями Когана-Риза, чем у пациентов с синдромом Чандлера.Некоторые исследователи коррелировали возникновение глаукомы с зеркальной микроскопией и обнаружили, что глаукома чаще встречается, когда аномальные эндотелиальные клетки поражают всю заднюю поверхность роговицы. 5
Считается, что механизм глаукомы при синдроме ДВС связан с клеточной мембраной. Хотя угол передней камеры кажется нормальным на ранних этапах синдрома ICE из-за наличия этой прозрачной мембраны, прогрессирование заболевания с течением времени может привести к сокращению аномальной базальной мембраны и образованию периферических передних синехий.Они часто доходят до линии Швальбе, препятствуя оттоку водянистой влаги и достигая высшей точки во вторичной закрытоугольной глаукоме.
Лечение
Лечение глаукомы часто бывает затруднительным для глаз с синдромом ДВС.
Медицинские подходы. Медикаментозное лечение глаукомы обычно начинается с водных супрессивных средств, но зачастую оно не дает результатов. Миотики обычно неэффективны, и роль гипотензивных липидов в этих глазах полностью не изучена.
Хирургические доступы. Лазерная трабекулопластика неэффективна из-за структурных изменений угловой выемки. Послеоперационная операция в конечном итоге требуется большому проценту пациентов. Наиболее часто выполняемая хирургическая процедура — трабекулэктомия, эффективность которой составляет от 60 до 70 процентов и 29 процентов, соответственно, через один и пять лет после операции. 4,5 Эффективность фильтрационной хирургии глаукомы может быть немного выше при использовании антифибротических агентов. 5,6 В целом, более высокая частота неудач после трабекулэктомии связана с более молодой группой пациентов с чрезмерным рубцеванием.(Поскольку ICE поражает людей в раннем и среднем зрелом возрасте, эти пациенты, как правило, моложе типичных пациентов с глаукомой.) Эндотелиализация с накоплением аномальной базальной мембраны в устье фильтрующего пузыря также вызывает поздние отказы.
В одной небольшой серии имплантаты водного дренажа дали благоприятные результаты, но потребовались дополнительные операции для ревизии и изменения положения трубки. 7 Авторы исследования предлагают модификации хирургической техники, чтобы избежать риска окклюзии или миграции трубки кпереди из-за продолжающегося сокращения аномальной эндотелиальной мембраны.Предлагаемые модификации включали более длинные дистальные трубки, изогнутый ход трубки на пути к передней камере и размещение трубки в pars plana в псевдофакичных глазах.
Как и в случае других форм глаукомы, когда ВГД невозможно контролировать с помощью более традиционных методов лечения, могут оказаться полезными циклодеструктивные процедуры, особенно трансклеральная циклофотокоагуляция.
___________________________
1 Salim, S. et al. J Pediatr Ophthalmol Strabismus 2006; 43 (5): 308–310.
2 Campbell, D. G. et al. Am J Ophthalmol 1978; 86 (3): 317–324.
3 Alvarado, J. A. et al. Arch Ophthalmol 1994; 112 (12): 1601–1609.
4 Салим С. и М. Б. Шилдс. «Претрабекулярные механизмы повышения внутриглазного давления», в Механизмы глауком, изд. J. Tombran-Tink et al. (Тотова, Нью-Джерси: Humana Press, 2008), 83–97.
5 Laganowski, H.C. et al. Arch Ophthalmol 1992; 110 (3): 346–350.
6 Доу, Э.A. et al. Офтальмология 2001; 108 (10): 1789–1795.
7 Kim, D. K. et al. Офтальмология 1999; 106 (5): 1030–1034.
___________________________
Доктор Салим — адъюнкт-профессор офтальмологии и директор службы глаукомы в Университете Теннесси, Мемфис; Доктор Шилдс — профессор и почетный председатель офтальмологии Йельского университета.
Диагностика и лечение иридокорнеального эндотелиального синдрома
Biomed Res Int.2015; 2015: 763093.
, 1 , * , 2 , 3 , 4 , 1 и 1Марта Саккетти
1 Отделение роговицы и поверхности глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия
Флавио Мантелли
2 Департамент биологии, Колледж науки и технологий, Университет Темпл, 1900 N. 12 Street, Philadelphia, PA 19122, USA
Marco Marenco
3 Департамент органов чувств, Университет Сапиенца, Viale del Policlinico 155, 00186 Рим, Италия
Ilaria Macchi
4 Отделение офтальмологии , Campus Bio-Medico University, Via Alvaro del Portillo 200, 00128 Рим, Италия
Oriella Ambrosio
1 Отделение поверхности глаза и роговицы, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия
Паоло Рама
1 Отделение роговицы и поверхности глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия
1 Cornea and Ocular Su rface Unit, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия
2 Отделение биологии, Колледж науки и технологий, Университет Темпл, 1900 N.12 Street, Philadelphia, PA 19122, USA
3 Department of Sense Organs, University Sapienza, Viale del Policlinico 155, 00186 Rome, Italy
4 Отделение офтальмологии, Campus Bio-Medico University, Via Alvaro del Portillo 200, 00128 Рим, Италия
Академический редактор: Ахим Лангенбухер
Поступила в редакцию 27 марта 2015 г .; Пересмотрено 2 июля 2015 г .; Принято 26 июля 2015 г.
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Эта статья цитируется в других статьях в PMC.Abstract
Синдром иридокорнеального эндотелия (ICE) — редкое глазное заболевание, которое включает группу состояний, характеризующихся структурными и пролиферативными аномалиями эндотелия роговицы, угла передней камеры и радужки. Общие клинические признаки включают отек роговицы, вторичную глаукому, атрофию радужной оболочки и аномалии зрачков, от деформации до поликории. Основными подтипами этого синдрома являются прогрессирующая атрофия радужной оболочки, синдром Когана-Риза и синдром Чандлера.Синдром ДВС обычно диагностируется у женщин в зрелом возрасте. Для постановки диагноза необходимы анамнез и полное обследование глаз, включая тонометрию и гониоскопию. Методы визуализации, такие как конфокальная микроскопия in vivo и ультразвуковая биомикроскопия, используются для подтверждения диагноза путем выявления присутствия «ICE-клеток» на эндотелии роговицы и структурных изменений угла передней камеры. Ранняя диагностика помогает лучше справиться с наиболее серьезными осложнениями, такими как вторичная глаукома и отек роговицы.Лечение глаукомы, связанной с ICE, часто требует хирургического вмешательства по фильтрации глаукомы с применением антифибротических агентов, и использование дренажных имплантатов для глаукомы следует рассматривать на ранних этапах ведения таких пациентов. С нарушением зрения и болью, связанной с отеком роговицы, можно успешно справиться с помощью эндотелиальной кератопластики.
1. Введение
Синдром иридокорнеального эндотелия (ICE) — редкое заболевание (ORPHA64734, доступное по адресу http://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=en&Expert=64734), характеризующееся пролиферативным структурные аномалии эндотелия роговицы, прогрессирующая обструкция иридокорнеального угла и аномалии радужной оболочки, такие как атрофия и образование отверстий [1].Последствиями этих изменений являются декомпенсация роговицы и глаукома, которые представляют собой наиболее частые причины потери зрительной функции у пациентов с синдромом ДВС [2]. Синдром ICE включает ряд клинических проявлений: прогрессирующую атрофию эссенциальной радужки, синдром Когана-Риза и синдром Чандлера [3].
В 1903 году Хармс подробно описал редкое глазное заболевание, характеризующееся атрофией радужной оболочки и глаукомой, известное как «прогрессирующая атрофия эссенциальной радужки» [4, 5]. Пятьдесят лет спустя Чандлер описал редкое одностороннее состояние глаз, характеризующееся атрофией радужной оболочки, связанной с изменениями эндотелия роговицы, отеком роговицы и глаукомой [6].Впоследствии было высказано предположение, что этот «синдром Чендлера» и «прогрессирующая атрофия эссенциальной радужки» являются двумя разными формами одного и того же заболевания [6, 7]. Когда Коган и Риз описали подобное состояние, связанное с узелками радужки, была выявлена третья клиническая сущность, впоследствии названная «невус радужки» или «синдром Когана-Риза» [8–10]. Последующие исследования подтвердили, что эти клинические образования имеют схожий анамнез и клинические данные и имеют одни и те же патогенные механизмы, характеризующиеся аномальной пролиферацией эндотелия роговицы, и объединяющий термин «иридокорнеальный эндотелиальный синдром» был предложен Яноффом [1, 3, 7, 9, 11].
ДВС появляется спорадически; он обычно односторонний и обычно поражает взрослых пациентов (чаще женщин в третьем-пятом десятилетии) и в конечном итоге серьезно ухудшает зрительную функцию, если не лечить должным образом [1]. Даже при своевременном лечении хирургические вмешательства при этих состояниях имеют переменную эффективность, и лечение синдрома ДВС представляет собой проблему для офтальмологов.
2. Этиология
Этиология синдрома ДВС до сих пор в значительной степени неизвестна; однако был описан ряд возможных триггерных событий, и споры об этиологии синдрома ДВС все еще продолжаются спустя более века.
Воспаление у пациентов с синдромом ДВС упоминалось в нескольких ранних сообщениях, и более чем один автор описал начало увеита у этих пациентов [10, 12]. Scheie и Yanoff сообщили о скоплениях хронических воспалительных клеток в радужной оболочке и стекловидном теле одного глаза, исследованных гистопатологически, а Shields и его коллеги наблюдали воспаление передней камеры в 3 случаях [1, 10]. Patel и его коллеги также упомянули, что случайные макрофаги наблюдались на эндотелии роговицы в 2 случаях [13].Точно так же Игл-младший и его коллеги описали легкий хронический иридоциклит у 10 из 16 последовательных пациентов с диагнозом синдрома Когана-Риза [3]. Этот опыт согласуется с отчетом группы Альварадо, которая описала 16 из 25 пациентов с синдромом ДВС с красными глазами или умеренным увеитом до начала заболевания, а также задокументировала фотографически наличие кератических преципитатов у одного из этих пациентов [ 12].
Группа Альварадо первой предположила, что эндотелиопатия, ответственная за развитие этого синдрома, может иметь вирусное происхождение [12].Фактически, они отметили, что эндотелиальные изменения, наблюдаемые у пациентов с синдромом ДВС, аналогичны изменениям, наблюдаемым при вирусных заболеваниях. В соответствии с этой гипотезой, болезни с синдромом ДВС обычно являются монолатеральными приобретенными расстройствами, что позволяет предположить, что у пораженных пациентов один глаз в первую очередь поражен вирусом в послеродовом возрасте, а другой глаз защищен иммунным надзором, установленным через несколько недель после первой инфекции. Редко описываемое двустороннее возникновение синдрома ДВС можно объяснить одновременным инфицированием обоих глаз [12].Кроме того, ДНК ВПГ была обнаружена в водянистой жидкости у пациентов с идиопатической эндотелиопатией роговицы, что свидетельствует о вирусном происхождении этих нарушений. Тем не менее, прямых доказательств связи между синдромом ДВС и кератитом простого герпеса, возникающим в одном глазу, не было [12, 14]. Однако первые восемь лет исследований и экспериментов с использованием ультраструктурных методов и вирусных культур для подтверждения гипотезы о вирусном происхождении синдрома ICE закончились полным провалом.Тем не менее, они не потеряли веру в свою гипотезу и позже решили использовать новый метод, который казался выгодным для обнаружения вирусной ДНК: полимеразную цепную реакцию (ПЦР). Этот «новый» метод наконец позволил им обнаружить ДНК вируса простого герпеса (HSV-) в тканях роговицы и в образцах водянистой влаги у пациентов с синдромом ICE [12]. В частности, авторы обнаружили ДНК ВПГ более чем в 60% протестированных образцов. Они также оценили возможное присутствие ДНК различных вирусов, чтобы объяснить наличие ВПГ-отрицательных образцов; однако вирусы опоясывающего лишая и вирусы Эпштейна-Барра обнаружены не были.Чтобы еще раз доказать свои результаты, авторы также провели ПЦР для обнаружения вирусной ДНК в образцах от здоровых субъектов и пациентов, страдающих различными заболеваниями роговицы, включая буллезную кератопатию и кератоконус, и все они были отрицательными. Интересно отметить, что авторы также провели тест ПЦР на непораженном глазу пациента с синдромом ДВС, который также был отрицательным [12]. Другие авторы показали, что вирус Эпштейна-Барра также может играть роль в развитии болезни [15].
Новаторская работа Альварадо и его коллег убедительно свидетельствует о том, что ВПГ может играть важную этиологическую роль в развитии синдрома ДВС. Однако это может быть не единственная причина или предрасполагающий фактор, и еще многое предстоит узнать об этиологии заболевания, которая остается частично неизвестной на сегодняшний день.
3. Патогенез
Патогенетические механизмы, лежащие в основе клинических изменений, наблюдаемых при синдроме ДВС, были идентифицированы в аномальной пролиферации эндотелия роговицы [16–18].
Эндотелий роговицы представляет собой единый слой однородных гексагональных клеток, локализованных на внутренней поверхности роговицы в передней камере глаза. Эндотелий роговицы лежит на базальной мембране, десцеметовой мембране. Эндотелиальные клетки роговицы имеют эмбриологическое происхождение от нервных гребней. В послеродовом возрасте они постмитотические и в нормальных условиях не делятся. В зрелом возрасте плотность эндотелиальных клеток роговицы составляет примерно 3000 клеток / мм² и с возрастом она несколько снижается [19].Функция эндотелия роговицы заключается в активном поддержании прозрачности роговицы за счет регулирования транспорта жидкости, питательных веществ и растворенных веществ между водянистой влагой и структурами роговицы [20].
В 1978 году Кэмпбелл и его коллеги предложили «мембранную теорию» для объяснения патогенеза синдрома ДВС. В частности, они выдвинули гипотезу, что при синдроме ICE эндотелиальные клетки роговицы поражаются в первую очередь и демонстрируют пролиферативные и структурные аномалии и способность мигрировать в окружающие ткани [7].Эта гипотеза подтверждается данными исследований с помощью зеркальной микроскопии, которые показали морфологические изменения размера и формы эндотелиальных клеток, напоминающих эпителиальные клетки, также на самых ранних стадиях всех синдромов ICE [16, 17, 21–23]. Более того, гистопатологические исследования глаз с синдромом ICE показали измененные эндотелиальные клетки роговицы с морфологическими характеристиками, напоминающими эпителиально-подобный фенотип, названный в 1985 г. «ICE-клетками» Шеррардом и его коллегами [17, 18]. Другие наблюдения, подтверждающие эту гипотезу, получены из гистологических исследований, которые продемонстрировали присутствие мембраны, состоящей из эндотелиально-подобных клеток с базальной мембраной, препятствующей углу передней камеры и покрывающей радужную оболочку [1, 24].
Именно с помощью просвечивающей электронной микроскопии было окончательно подтверждено, что эндотелиальные клетки пораженных пациентов являются аномальными, поскольку они развивают уникальные характеристики эпителиальных клеток [25]. В частности, электронно-микроскопическое исследование этих клеток выявило десмосомы, внутрицитоплазматические филаменты, филоподии и микроворсинки [12, 13, 25, 26]. Следует отметить, что отек роговицы, наблюдаемый у пациентов с синдромом ДВС, до этих электронно-микроскопических исследований объяснялся только уменьшением количества эндотелиальных клеток.Однако теперь мы знаем, что это не так, поскольку отек роговицы скорее вызван измененной функцией эндотелиальных клеток, вызванной множественными нарушениями барьера эндотелиальных клеток. В соответствии с гипотезой об аномальной функции эндотелия, а не об уменьшении количества эндотелиальных клеток, Bourne и Brubaker также показали, что до развития хронического отека эндотелиальный барьер на самом деле более непроницаем, чем у здоровых людей [27]. Это наблюдение также очень хорошо коррелирует с гипотезой о том, что весь патогенез заболевания может быть связан с репаративной активностью, вызванной повреждением эндотелиальных клеток, вызванным вирусной инфекцией или воспалением.Фактически, образование микроворсинок и филоподий хорошо известно во время процесса заживления ран на животных моделях эндотелиального повреждения, а также у людей, эндотелиальные клетки которых были случайно повреждены аргоновым или YAG-лазером [28]. Таким образом, наличие этих эндотелиальных аномалий при синдроме ICE может просто отражать тот факт, что эндотелий участвует в репаративной деятельности. Однако, к сожалению, эта активация позже сопровождается повреждением и потерей функции клеток, некрозом и продолжающимся снижением плотности клеток, что, опять же, можно объяснить вирусной / воспалительной этиологией заболевания [29].
Иммуногистохимические исследования показали наличие виментина и цитокератинов (ЦК) в ICE-клетках [18, 30, 31]. Леви и др. продемонстрировали, что ICE-клетки экспрессируют профиль маркеров дифференцировки (CK5 и CK19, но не CK3, CK8 и CK18), который напоминает профиль нормальных лимбальных эпителиальных клеток, предполагая, что синдром ICE может быть результатом эктопического эмбрионального поверхностного эпителия глаза [32]. С другой стороны, эти данные согласуются с метапластическим стимулом, приводящим к глубокому изменению фенотипа нормальных эндотелиальных клеток роговицы [31, 32].
Независимо от этиологического триггера, конечным результатом всех этих клеточных изменений является то, что аномальные эндотелиальные клетки при синдроме ICE мигрируют назад за линию Швальбе, чтобы перекрыть иридокорнеальный угол, и в переднюю камеру, чтобы покрыть радужку, где они образуют аномальная базальная мембрана, которая в конечном итоге сокращается, вызывая аномалии формы зрачка, атрофическое повреждение радужки и образование синехий между соседними структурами [7].
Угловая обструкция также вызывает повышение внутриглазного давления (ВГД) и последующее развитие глаукомы у 46–82% пациентов с синдромом ДВС [2].
4. Клиническая картина
Синдром ДВС обычно диагностируется у молодых людей, чаще всего у женщин, хотя описано несколько случаев с ранним началом у детей [33–35].
Пациенты обычно обращаются к офтальмологу по поводу изменения формы или положения зрачка. В других случаях пациенты относят нарушение зрительной функции, которое варьируется от ухудшения зрительной функции утром из-за декомпенсации роговицы на ранней стадии до нечеткости зрения и / или ореолов вокруг света из-за глаукомы, к постоянному снижению остроты зрения.В качестве альтернативы, первый диагноз синдрома ДВС ставится во время обычного осмотра глаз, после визуализации аномального эндотелия роговицы и / или после оценки угла передней камеры с помощью гониоскопии во время клинических исследований у подозреваемого на глаукому.
Хотя клинические характеристики синдрома ДВС могут помочь в постановке правильного диагноза, в некоторых случаях при тяжелом отеке роговицы диагностика может быть затруднена [2, 36]. Это может быть связано с трудностями при визуализации структур передней камеры, закрытых отеком.
Когда эндотелиальная функция роговицы достаточна для гарантии прозрачности роговицы, тщательное обследование эндотелия роговицы может помочь в диагностике синдрома ICE: исследование с помощью щелевой лампы с большим увеличением может показать мелкое, «чеканное серебро» или «бронзово-бронзовый» вид эндотелия подобен тому, который обычно наблюдается при дистрофии Фукса (FECD). Изменения эндотелия роговицы при синдроме ICE можно визуализировать и оценить с помощью зеркальной микроскопии, а в последнее время — конфокальной микроскопии роговицы in vivo [17, 37].Демонстрация наличия «ICE-клеток» при зеркальной микроскопии позволяет подтвердить диагноз синдрома ICE. Эти ICE-клетки, как правило, аномальные, округлые, большие и плеоморфные, с зеркальным рефлексом, показывающим типичный «поворот света на темноту», состоящий из темной поверхности, со случайными центральными светлыми пятнами и межклеточными светлыми границами [17, 21, 23] . Четыре морфологических вида этих клеток, описанные Sherrard et al. сосуществуют с другими типами клеток, давая начало четырем основным вариантам ICE: (i) диссеминированный ICE, при этом ICE-клетки разбросаны по эндотелию, который в остальном выглядит по существу нормальным; (ii) тотальный ICE, при котором ICE-клетки полностью замещают нормальный эндотелий; (iii) субтотальный ICE (+), при этом ICE-клетки заменяют вариабельную часть эндотелия, а оставшаяся часть состоит из очень маленьких клеток; и (iv) субтотальный ICE (-), при этом ICE-клетки замещают вариабельную часть эндотелия, а оставшаяся часть состоит из увеличенных клеток [17].
Конфокальная микроскопия in vivo (IVCM) — это неинвазивный метод визуализации с высоким разрешением, который представляет собой полезный диагностический инструмент при синдроме ICE, а также у пациентов с отеком роговицы.
Он позволяет изучать все структуры роговицы на клеточном уровне, обеспечивая изображения in vivo всех слоев клеток роговицы, сравнимые с гистохимическими методами ex vivo. Конфокальная микроскопия in vivo у пациентов с синдромом ICE выявляет присутствие «ICE-клеток» в виде плеоморфных эпителиоподобных эндотелиальных клеток с гиперрефлективными ядрами и границами клеток, которые выглядят ярче, чем поверхность клеток [38].Различные «эпителиоподобные» представления эндотелиальных клеток были описаны на IVCM: один тип аномального эндотелия с довольно правильным размером и формой, второй тип клеток, более неправильный по размеру и форме, подобный эпителиальным крыловым клеткам на IVCM, и в-третьих, крайне нерегулярный клеточный узор, напоминающий поверхностный эпителий роговицы. Было высказано предположение, что эти различные наблюдения могут быть связаны со стадией заболевания [21, 39, 40].
Тем не менее, хотя визуализация этих клеток может позволить поставить диагноз, обычно считается обязательным подтверждение клинического диагноза с помощью гониоскопии: на самом деле, аномалии угла передней камеры являются общими для всех подтипов синдрома ДВС и включают широкий спектр иридотрабекулярные синехии, которые постепенно прогрессируют до полного закрытия угла, если не лечить должным образом.Хотя визуализация этих угловых изменений, как правило, не представляет трудностей, необходимо иметь в виду, что мембрану, препятствующую трабекулярной сети, может быть изначально трудно визуализировать с помощью гониоскопии, и состояние пациентов можно спутать с более распространенной открытоугольной глаукомой. . Это особенно верно, если считается, что отек роговицы является вторичным по отношению к повышению внутриглазного давления, а не к недостаточности функции эндотелиального насоса.
Использование ультразвуковой биомикроскопии (УБМ) может представлять собой полезный инструмент для обнаружения изменений структур угла передней камеры при синдроме ICE, особенно при наличии отека роговицы, который не позволяет визуализировать гониоскопию [41].Кроме того, сочетание УБМ с гониоскопической оценкой периферических передних синехий (ПАС) может позволить лучше охарактеризовать степень (гониоскопия) и форму (УБМ) ПА при синдроме ДВС. Чжан и его коллеги сообщили о UBM-анализе 21 глаза с синдромом ICE и наблюдали наличие PAS у всех пациентов, связанных с уменьшением глубины передней камеры по сравнению с нормальными предметами. Авторы продемонстрировали, что УБМ более эффективен в выявлении атрофии как ПАВ, так и радужной оболочки, чем клиническая оценка при биомикроскопии с щелевой лампой и гониоскопии.У четырех пациентов также было обнаружено закрытие угла парного глаза при обследовании UBM. Кроме того, UBM может идентифицировать специфические особенности различных клинических форм синдрома ICE [42]. В частности, у пациентов с прогрессирующей атрофией радужной оболочки UBM выявила выраженную атрофию радужной оболочки, а PAS были менее выражены, чем у пациентов с синдромом Когана-Риза. UBM при синдроме Чандлера показал наличие выраженного отека роговицы с десцеметовыми складками, тогда как PAS были менее выражены. Пациенты с синдромом Когана-Риза имели более обширный, часто «ветвистый» ПА.Более тяжелая протяженность и высота PAS, наблюдаемые UBM при прогрессирующей атрофии радужной оболочки и синдроме Когана-Риза, подтверждают доказательства более тяжелой глаукомы, наблюдаемой при этих подтипах ICE, чем при синдроме Чандлера [1, 42].
В любом случае у пациентов с синдромом ДВС всегда должно проводиться строгое наблюдение по поводу глаукомы путем периодического измерения внутриглазного давления, гониоскопии, а также исследований поля зрения и сетчатки [43, 44].
Как упоминалось ранее, после того, как диагноз синдрома ДВС поставлен на основании этих общих клинических признаков, имеется по крайней мере три различных клинических подтипа синдрома ДВС ().Уилсон и Шилдс описали серию из 37 пациентов с синдромом ДВС с существенной атрофией радужной оболочки (22%), синдромом Чандлера (57%) и синдромом Когана-Риза (22%), чтобы охарактеризовать это состояние и описать клиническое течение в течение 12 лет [ 35]. Большинство клинических различий, позволяющих провести дифференциальный диагноз между ними, основаны на разном уровне поражения радужной оболочки и типе / тяжести аномалий радужной оболочки ().
Таблица 1
Клинические особенности различных подтипов синдрома ДВС.
| Радужная оболочка | Зрачок | Роговица | Угол передней камеры | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Синдром Чандлера | Зоны атрофии (не полные | и ранние отверстия). эндотелиальная дистрофия и ICE-клетки при конфокальной микроскопииПередние периферические синехии | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Прогрессирующая атрофия радужки | Отверстие на всю толщину | Поликория | Эндотелиальная дистрофия, ICE-клетки при конфокальной микроскопии и отек роговицы могут возникать | Передняя периферическая синехия | 06 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Синдром Когана-Риза | Узелки и атрофия радужной оболочки | Изменения нечасто | Эндотелиальная дистрофия, ICE-клетки при конфокальной микроскопии и отек роговицы могут возникать | Периферическая 935312 Прогрессивная ирферическая | характеризуется выраженной атрофией радужной оболочки и образованием отверстий (ов), которые могут быть двух различных подтипов: отверстия растяжения, возникающие в результате истончения радужной оболочки по другую сторону от направления зрачкового искажения, и отверстия плавления, в которых ткань радужки исчезает без предварительного признаки ишемии тканей ().Гониоскопия может показать наличие PAS, вызывающего закрытие угла различной степени и, как следствие, повышение внутриглазного давления. Два пациента с эссенциальной атрофией радужной оболочки с обширной атрофией радужной оболочки и периферическими передними синехиями (a, b) и отеком роговицы (b). При синдроме Чандлера изменения радужной оболочки минимальны, и заболевание чаще диагностируется на ранней стадии врачами, начиная с наблюдения отека роговицы. Когда диагноз ставится поздно и аномалии радужной оболочки более выражены, могут наблюдаться области атрофии радужной оболочки, но обычно они не приводят к полному отверстию радужной оболочки ().Глаукома может развиться из-за обструкции угла и ПАВ. Пациент с синдромом Чандлера и глаукомой правого глаза с умеренным отеком роговицы (a), поликорией (b) и периферическими передними синехиями. 7 лет назад перенесла трабекулэктомию. Острота зрения правого глаза 0,2 десятичной единицы. Наконец, при синдроме Когана-Риза могут наблюдаться различные степени атрофии радужной оболочки; однако диагноз обычно ставится после наблюдения другого признака: наличия множественных узелков радужки, обычно на ножке, окруженных стромальной радужкой, что свидетельствует о потере крипт и матовости.Узелки радужки при синдроме Когана-Риза могут развиваться на поздних стадиях болезни, они выглядят как мелкие желтоватые узелки на поверхности радужки, а позже, по мере развития болезни, они становятся коричневыми и их количество увеличивается. Хотя из всего вышеперечисленного может показаться, что диагноз различных синдромов ДВС довольно прост, в клинической практике прогрессирующее течение болезни часто приводит к сложному диагнозу, при этом большой процент случаев проявляется как смешанные формы в различных формах. стадии болезни.Как будет подробно описано ниже, клиническое ведение, включая хирургический подход, обычно не связано с точным диагнозом клинического подтипа, а со степенью осложнений, таких как отек роговицы или глаукома. Наконец, поскольку были зарегистрированы двусторонние случаи синдрома ДВС и описаны субклинические изменения в контралатеральном непораженном глазу, следует провести тщательное обследование парного глаза, включая оценку структур переднего сегмента с помощью щелевой лампы, гониоскопию и т. Д. тонометрия и оценка эндотелия с помощью зеркальной и / или конфокальной микроскопии in vivo [45–48]. 5. Дифференциальный диагнозСиндром ДВС следует учитывать при дифференциальной диагностике любого молодого взрослого (особенно женщин) с односторонними аномалиями радужной оболочки, глаукомой и / или отеком роговицы [1]. Фактически, хотя аспект синдрома ДВС является характерным, существуют различные заболевания переднего сегмента, которые могут имитировать его и которые могут осложняться такими же проблемами, как отек роговицы и глаукома. Среди них при дифференциальной диагностике следует учитывать эндотелиальные расстройства роговицы, такие как задняя полиморфная дистрофия (ХДНП) и эндотелиальная дистрофия Фукса, и расстройства радужной оболочки, такие как синдром Аксенфельда-Ригера, меланома радужной оболочки или воспалительные узелки радужки, а также аниридия. В частности, эндотелиальные клетки в PPCD и FECD обнаруживают эпителиально-подобные изменения и экспрессируют цитокератины подобно синдрому ICE [49, 50]. Среди них FECD является наиболее простым для диагностики, поскольку это заболевание имеет схожие (но более грубые) эндотелиальные аномалии обоих глаз и не показывает изменения передней камеры, иридокорнеального угла или изменений радужной оболочки, которые всегда наблюдаются при синдроме ICE. Дифференциальный диагноз может быть легко установлен с помощью IVCM, который идентифицирует присутствие «ICE-клеток» на эндотелии роговицы, подтверждая диагноз синдрома ICE [51]. Пациенты с ХДНП, с другой стороны, могут иметь несколько признаков, которые строго напоминают синдром ДВС, что усложняет дифференциальный диагноз: фактически, при эндотелиальной метаплазии ХДНП, аномалии зрачка, изменения радужной оболочки, отек роговицы и глаукома, вызванные может наблюдаться закрытие угла [49]. Обычно естественная история болезни и оценка с помощью конфокальной микроскопии могут помочь в постановке правильного диагноза, поскольку вместо типичных «ICE-клеток» в ХДНП наблюдается смешанный диапазон эндотелиальных пузырьков и полос.Однако, вероятно, наиболее очевидным отличием синдрома ДВС является то, что ХДНП двусторонний, и пациенты также имеют типичный знакомый анамнез, поскольку это аутосомно-доминантное заболевание [52]. Еще одно заболевание, которое может быть очень сложно отличить от синдрома ДВС, — это синдром Аксенфельда-Ригера. Фактически, даже патогенез этого синдрома похож, поскольку изменения радужной оболочки и иридокорнеального угла, наблюдаемые при синдроме Аксенфельда-Ригера, также вызваны слоем эндотелиальных клеток.Единственное отличие состоит в том, что при синдроме Аксенфельда-Ригера они не вторичны по отношению к миграции, а скорее к наличию первичного эндотелиального слоя. Таким образом, с клинической точки зрения, единственное различие между этими двумя синдромами состоит в том, что у Axenfeld-Rieger результаты являются двусторонними и врожденными, часто являются стационарными или имеют лишь незначительное прогрессирование с течением времени. Кроме того, при конфокальной микроскопии эндотелий роговицы у этих пациентов не кажется измененным [53]. Наконец, поскольку при аниридии часто наблюдаются рудиментарные культи радужки, а не полное ее отсутствие, это заболевание можно спутать с прогрессирующей атрофией радужки на поздней стадии.Фактически, и то и другое может быть осложнено глаукомой и помутнением роговицы. Однако при аниридии помутнение роговицы обычно вызывается паннусом из-за дефицита лимбальных стволовых клеток, а не дисфункцией эндотелиальных клеток. Кроме того, аниридия — это двустороннее врожденное заболевание, вызванное дефектом гена PAX6; поэтому часто присутствуют дополнительные врожденные пороки развития глаз, включая гипоплазию зрительного нерва, и у пациентов обычно очень плохое зрение и нистагм [54]. Узелки радужки, наблюдаемые при синдроме Когана-Риза, также требуют дифференциальной диагностики с другими состояниями, показывающими аналогичные изменения радужной оболочки, такими как нейрофиброматоз, меланома радужной оболочки и саркоидоз.Нейрофиброматоз фон Реклингхаузена показывает пигментные узелки радужки, которые, в отличие от узелков с синдромом Когана-Риза, являются двусторонними, более плоскими и более похожими на невусы радужки [55]. Наличие внутриглазного воспаления может помочь дифференцировать узелки радужки при саркоидозе, которые присутствуют при синдроме Когана-Риза. Другой важный дифференциальный диагноз узелков радужки при синдроме Когана-Риза — злокачественная меланома радужки. Наличие эндотелиальных изменений и отека роговицы, ПАВ и атрофии радужной оболочки может правильно ориентировать диагноз на синдром ДВС [56]. 6. Ведение и лечениеГипотеза HSV в патогенезе синдрома ICE предполагает, что противовирусное лечение может быть полезным при лечении этого заболевания [12]. Однако это еще предстоит доказать, и на сегодняшний день не существует медицинского или хирургического лечения, которое определенно могло бы решить любой из подтипов синдрома ДВС, и конечной терапевтической целью является профилактика и лечение осложнений, ухудшающих зрение, а именно роговицы. отек и глаукома. Использование гипертонического солевого раствора, закапываемого в виде глазных капель, может быть полезным по утрам для уменьшения отека роговицы, когда он более выражен. Местные противоглаукомные препараты обычно являются первой линией лечения, поскольку снижение внутриглазного давления также может улучшить отек роговицы. Подавители продукции водянистой влаги, включая местные бета-блокаторы, альфа-агонисты и ингибиторы карбоангидразы, являются предпочтительными и обычно сопровождаются миотиками, хотя их добавленная ценность считается минимальной [57]. Поскольку роль HSV в синдромах ICE не исключена полностью, простагландины следует использовать с осторожностью у пациентов с глаукомой, связанной с ICE, поскольку их использование, как сообщается, стимулирует рецидив простого герпеса [58].В литературе сообщается о высокой частоте неудач (от 60% до 88%) медикаментозного лечения глаукомы, и когда местные методы лечения неэффективны или недостаточны, используются хирургические подходы [2, 11]. В серии из 82 последовательных случаев 37 (45%) потребовались одна или несколько трабекулэктомий [59]. Операции по фильтрации при глаукоме, связанной с ICE, показали меньшую эффективность, чем при других типах глаукомы [2, 59, 60]. Исследования показали, что выживаемость после трабекулэктомии составляет около 60% через 1 год и 40% через 2 года наблюдения [59].Эти проценты снижаются при повторных вмешательствах ниже 20% от успешности [2]. Были предложены антифибротические агенты для повышения эффективности фильтрующих операций при синдроме ДВС. Применение послеоперационного 5-фторурацила показало неэффективность у 5 из 9 пациентов, которым потребовалось дополнительное хирургическое вмешательство по поводу глаукомы в течение 1 года [61]. Интраоперационное применение митомицина-С у 10 пациентов с синдромом ДВС и глаукомой показало хороший контроль ВГД в 8 из 10 глаз после среднего периода наблюдения 14,9 месяцев [60]. Более крупное исследование 26 пациентов с глаукомой, связанной с ICE, показало, что выживаемость после трабекулэктомии с антифибротическими средствами составила 73% через 1 год и 44% и 29% через 3 и 5 лет [62].В этом исследовании также сообщается, что игла и манипуляции с пузырчатым и трабекулярным лоскутом у этих пациентов не увеличивали вероятность успеха [62]. Неудача операции фильтрации может быть связана с прогрессирующим ростом аномальной эндотелиальной мембраны, распространяющейся по трабекулярной сети и месту фильтрации [3, 13]. С этой точки зрения, дренажные имплантаты от глаукомы (GDI) могут преодолеть повторный рост мембраны в месте фильтрации, и исследования эффективности GDI при глаукоме, связанной с ICE, показали высокий уровень успеха около 70% через 1 год, из 70 % до 40% через 3 года и 53% через 5 лет [62, 63].В этих исследованиях от 20% до 50% пациентов требовалась замена или изменение положения трубки, и авторы советуют удлинить трубку, чтобы обеспечить возможность изменения положения в будущем, и держать кончик трубки подальше от структур роговицы и радужки [62]. В некоторых исследованиях сообщалось о более высоком уровне успешности лечения глаукомы и хирургического вмешательства у пациентов с синдромом Чандлера, и авторы предполагают, что этот различный клинический результат может быть связан с менее агрессивным пролиферативным ростом эндотелия, наблюдаемым у этих пациентов [35, 59, 62] .Независимо от типа хирургического вмешательства, циклодеструктивные процедуры, такие как циклофотокоагуляция, по-прежнему очень часто необходимы, потому что контроль внутриглазного давления очень сложен у пациентов с синдромом ДВС, которые моложе типичного пациента с глаукомой и, следовательно, имеют более выраженный рубцовый ответ что может привести к сбою всех процедур фильтрации [2]. В запущенных случаях отека роговицы с хорошо контролируемым ВГД следует рассмотреть возможность хирургического вмешательства на роговице для улучшения зрительной функции и уменьшения боли.Проникающая кератопластика (ПК) была предложена в нескольких небольших отчетах с коротким периодом наблюдения с переменным успехом от 83% до 100% [64–67]. Проникающая кератопластика помогла улучшить зрительную функцию и облегчить боль у пациентов с синдромом ICE; это также позволило получить прозрачную среду для мониторинга изменений диска зрительного нерва и поля зрения у пациентов с ассоциированной глаукомой. Долгосрочные результаты DeBroff и Thoft сообщили о несостоятельности трансплантата в 83% и отторжении трансплантата в 2 из 6 глаз пациентов с эссенциальной атрофией радужной оболочки, получавших PK.Они также сообщили о наличии послеоперационного переднего увеита, резистентного к лечению кортикостероидами, на всех глазах [68]. Alvim и его коллеги пересмотрели результаты хирургического вмешательства у 14 пациентов с синдромом ICE, наблюдавшихся в течение 58 месяцев после ПК. Они сообщили о ранней неудаче трансплантата у 50% пациентов из-за отторжения у 6 пациентов и эндотелиальной недостаточности у 1 пациента. В конце периода наблюдения чистый трансплантат был зарегистрирован в 85% случаев, при этом 6 пациентам потребовалась повторная ПК [69]. В 2007 году М.О.Price и F. W. Price Jr. сообщили об успешном использовании десцемет-стриппинга с эндотелиальной кератопластикой (DSEK) у 3 пациентов с псевдофакией с синдромом ICE и отеком роговицы, введя эндотелиальную хирургию в хирургическое лечение синдрома ICE [70]. Эндотелиальная кератопластика — это хирургическая процедура, которая выборочно заменяет дисфункциональный эндотелий, щадя строму и эпителий роговицы. Этот хирургический метод предлагает несколько преимуществ для лечения отека роговицы при синдроме ICE по сравнению с PK.Фактически, эндотелиальная кератопластика обеспечивает быстрое восстановление зрения с минимальными изменениями рефракции, позволяет избежать использования швов и лучше поддерживает целостность и иннервацию роговицы реципиента [71]. И глубокая ламеллярная эндотелиальная кератопластика (DLEK), и десцеметовая эндотелиальная кератопластика (DSEK) успешно выполнялись у пациентов с синдромом ICE [70, 72, 73]. Процедура DSEK заключается в замене аномального эндотелия и десцеметовой мембраны, в то время как DLEK требует иссечения задней ламеллы стромы роговицы реципиента.DSEK проще и менее инвазивен и позволяет быстрее восстанавливать зрительную функцию по сравнению с DLEK [74]. Тем не менее, DLEK может предложить некоторые преимущества для глаз с синдромом ICE, характеризующимся аномалиями радужной оболочки, PAS и более плоской передней камерой. В серии случаев из 7 факичных глаз с синдромом ICE DLEK была успешно выполнена Huang и коллегами, которые предпочли DLEK, потому что иссечение ложа реципиента позволило легче позиционировать донорский трансплантат с меньшими манипуляциями [75]. Недавно была введена новая эндотелиальная кератопластика, эндотелиальная кератопластика десцеметовой мембраны (DMEK), для достижения лучшего восстановления зрения и уменьшения иммунологического отторжения [76, 77].Однако эффективность этого хирургического подхода у пациентов со сложными заболеваниями переднего сегмента глаза, такими как синдром ICE, еще не была продемонстрирована. Очевидно, поскольку все операции на роговице не удаляют полностью аномальный эндотелий, они не могут остановить прогрессирование ПА и глаукомы у пациентов с ДВС [66]. Наконец, стоит отметить, что реконструкция радужки с использованием или без использования внутриглазного протеза была предложена при синдроме ICE как по косметическим причинам, так и для уменьшения зрительных нарушений поликории [78]. Конфликт интересовАвторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи. Ссылки1. Шилдс М. Б. Прогрессирующая эссенциальная атрофия радужной оболочки, синдром Чандлера и синдром невуса радужки (Когана-Риза): спектр заболеваний. Обзор офтальмологии . 1979; 24 (1): 3–20. DOI: 10.1016 / 0039-6257 (79)-7. [PubMed] [CrossRef] [Google Scholar] 2. Лагановски Х. С., Мьюир М. Г. К., Хитчингс Р. А. Глаукома и иридокорнеальный эндотелиальный синдром. Архив офтальмологии . 1992. 110 (3): 346–350. DOI: 10.1001 / archopht.1992.01080150044025. [PubMed] [CrossRef] [Google Scholar] 3. Игл Р. К., младший, Фонт Р. Л., Янофф М., Файн Б. С. Пролиферативная эндотелиопатия с аномалиями радужной оболочки. Иридокорнеальный эндотелиальный синдром. Архив офтальмологии . 1979. 97 (11): 2104–2111. DOI: 10.1001 / archopht.1979.01020020422002. [PubMed] [CrossRef] [Google Scholar] 4. Harms C. Einseitige spontone Liickenbildung der Iris durch Atrophie ohne Mechanische Zerrung. Klinische Monatsblätter für Augenheilkunde . 1903; 41: 522–528. [Google Scholar] 5. Lohelein H. Ztur Kenntnis der essentiellen fortschreitenideni Irisatrophie Illit Lochbildung unld Glaukom. Klin Monbl Augenheilkd Augenarztl Fortbild . 1951; 118: 379–388. [PubMed] [Google Scholar] 6. Чандлер П. А. Атрофия стромы радужной оболочки: эндотелиальная дистрофия, отек роговицы и глаукома. Американский журнал офтальмологии . 1956. 41 (4): 607–615. DOI: 10,1016 / 0002-9394 (56) -5.[PubMed] [CrossRef] [Google Scholar] 7. Кэмпбелл Д. Г., Шилдс М. Б., Смит Т. Р. Эндотелий роговицы и спектр атрофии эссенциальной радужки. Американский журнал офтальмологии . 1978. 86 (3): 317–324. DOI: 10.1016 / 0002-9394 (78) -5. [PubMed] [CrossRef] [Google Scholar] 8. Коган Д. Г., Риз А. Б. Синдром узелков радужки, эктопической десцеметовой мембраны и односторонней глаукомы. Documenta Ophthalmologica . 1969; 26 (1): 424–433. DOI: 10.1007 / bf03186675. [PubMed] [CrossRef] [Google Scholar] 9.Янов М. Иридокорнеальный эндотелиальный синдром: унификация спектра заболеваний. Обзор офтальмологии . 1979; 24 (1): 1-2. DOI: 10.1016 / 0039-6257 (79)-5. [PubMed] [CrossRef] [Google Scholar] 10. Шей Х. Г., Янофф М. Синдром невуса радужки (Когана-Риза). Причина односторонней глаукомы. Архив офтальмологии . 1975. 93 (10): 963–970. DOI: 10.1001 / archopht.1975.01010020761004. [PubMed] [CrossRef] [Google Scholar] 11. Шилдс М. Б., Кэмпбелл Д. Г., Симмонс Р. Дж. Атрофия эссенциальной радужки. Американский журнал офтальмологии . 1978. 85 (6): 749–759. DOI: 10,1016 / s0002-9394 (14) 78101-2. [PubMed] [CrossRef] [Google Scholar] 12. Альварадо Дж. А., Андервуд Дж. Л., Грин В. Р. и др. Обнаружение ДНК вируса простого герпеса при иридокорнеальном эндотелиальном синдроме. Архив офтальмологии . 1994. 112 (12): 1601–1609. DOI: 10.1001 / archopht.1994.010107034. [PubMed] [CrossRef] [Google Scholar] 13. Патель А., Кеньон К. Р., Херст Л. В. и др. Клинико-патологические особенности синдрома Чандлера. Обзор офтальмологии . 1983. 27 (5): 327–344. DOI: 10.1016 / 0039-6257 (83)-5. [PubMed] [CrossRef] [Google Scholar] 14. Охаши Ю., Ямамото С., Нисида К. и др. Демонстрация ДНК вируса простого герпеса при идиопатической эндотелиопатии роговицы. Американский журнал офтальмологии . 1991. 112 (4): 419–423. DOI: 10.1016 / S0002-9394 (14) 76251-8. [PubMed] [CrossRef] [Google Scholar] 15. Цай С. С., Ритч Р., Страус С. Э., Перри Х. Д., Сие Ф. Ю. Антитела к вирусу Эпштейна-Барра при иридокорнеальном эндотелиальном синдроме. Архив офтальмологии . 1990. 108 (11): 1572–1576. DOI: 10.1001 / archopht.1990.01070130074034. [PubMed] [CrossRef] [Google Scholar] 16. Лю Ю.-К., Ван И.-Дж., Ху Ф.-Р., Хунг П.-Т., Чанг Х.-В. Клинические и зеркально-микроскопические проявления иридокорнеального эндотелиального синдрома. Японский офтальмологический журнал . 2001. 45 (3): 281–287. DOI: 10.1016 / s0021-5155 (00) 00383-х. [PubMed] [CrossRef] [Google Scholar] 17. Шеррард Э. С., Франгулис М. А., Мьюир М. Г. К., Бакли Р. Дж. Задняя поверхность роговицы при иридо-роговичном эндотелиальном синдроме: исследование под зеркальной микроскопией. Сделки офтальмологических обществ Соединенного Королевства . 1985. 104 (7): 766–774. [PubMed] [Google Scholar] 18. Херст Л. В., Бэнкрофт Дж., Ямаути К., Грин В. Р. Иммуногистохимическая патология эндотелия роговицы при иридокорнеальном эндотелиальном синдроме. Исследовательская офтальмология и визуализация . 1995. 36 (5): 820–827. [PubMed] [Google Scholar] 19. Уилсон Р. С., Ропер-Холл М. Дж. Влияние возраста на количество эндотелиальных клеток в нормальном глазу. Британский офтальмологический журнал .1982; 66 (8): 513–515. DOI: 10.1136 / bjo.66.8.513. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 20. Тафт С. Дж., Костер Д. Дж. Эндотелий роговицы. Глаз . 1990. 4 (3): 389–424. DOI: 10,1038 / глаз.1990.53. [PubMed] [CrossRef] [Google Scholar] 21. Херст Л. В., Куигли Х. А., Старк В. Дж., Шилдс М. Б. Зеркальная микроскопия синдрома иридокорнеального эндотелия. Американский журнал офтальмологии . 1980. 89 (1): 11–21. DOI: 10.1016 / 0002-9394 (80)-8. [PubMed] [CrossRef] [Google Scholar] 22.Ли В. Р., Маршалл Г. Э., Киркнесс К. М. Аномалии эндотелиальных клеток роговицы на ранней стадии иридокорнеального эндотелиального синдрома. Британский офтальмологический журнал . 1994. 78 (8): 624–631. DOI: 10.1136 / bjo.78.8.624. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 23. Шеррард Э. С., Франгулис М. А., Мьюир М. Г. К. О морфологии клеток задней роговицы при иридокорнеальном эндотелиальном синдроме. Роговица . 1991. 10 (3): 233–243. DOI: 10.1097 / 00003226-19 00-00009.[PubMed] [CrossRef] [Google Scholar] 24. Куигли Х. А., Форстер Р. Ф. Гистопатология роговицы и радужной оболочки при синдроме Чандлера. Архив офтальмологии . 1978; 96 (10): 1878–1882. DOI: 10.1001 / archopht.1978.030382018. [PubMed] [CrossRef] [Google Scholar] 25. Херст Л. В., Грин В. Р., Луккенбах М., де ла Круз З., Старк В. Дж. Эпителиальные характеристики эндотелия при синдроме Чандлера. Исследовательская офтальмология и визуализация . 1983. 24 (5): 603–611. [PubMed] [Google Scholar] 26.Игл Р. К., младший, Фонт Р. Л., Янофф М., Файн Б. С. Синдром радужной оболочки глаза (Когана-Риза): световые и электронные микроскопические наблюдения. Британский офтальмологический журнал . 1980. 64 (6): 446–452. DOI: 10.1136 / bjo.64.6.446. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27. Борн В. М., Брубакер Р. Ф. Снижение проницаемости эндотелия при иридокорнеальном эндотелиальном синдроме. Офтальмология . 1982. 89 (6): 591–595. DOI: 10,1016 / s0161-6420 (82) 34745-4. [PubMed] [CrossRef] [Google Scholar] 28.Минковски Дж. С., Бартельс С. П., Делори Ф. С., Ли С. Р., Кеньон К. Р., Нойфельд А. Х. Функция и структура эндотелия роговицы после крио-травмы у кролика. Исследовательская офтальмология и визуализация . 1984. 25 (12): 1416–1425. [PubMed] [Google Scholar] 30. Хауэлл Д. Н., Даммс Т., Берчетт Дж. Л. младший, Грин В. Р. Эндотелиальная метаплазия при иридокорнеальном эндотелиальном синдроме. Исследовательская офтальмология и визуализация . 1997. 38 (9): 1896–1901. [PubMed] [Google Scholar] 31.Крамер Т. Р., Гроссниклаус Х. Э., Виньесваран Н., Варинг Г. О., Козарский А. Экспрессия цитокератина в эндотелии роговицы при иридокорнеальном эндотелиальном синдроме. Исследовательская офтальмология и визуализация . 1992. 33 (13): 3581–3585. [PubMed] [Google Scholar] 32. Леви С. Г., Маккартни А. С. Э., Багхай М. Х., Барретт М. К., Мосс Дж. Патология иридокорнеально-эндотелиального синдрома: ICE-клетки. Исследовательская офтальмология и визуализация . 1995. 36 (13): 2592–2601.[PubMed] [Google Scholar] 33. Салим С., Шилдс М. Б., Уолтон Д. Иридокорнеальный эндотелиальный синдром у ребенка. Журнал детской офтальмологии и косоглазия . 2006. 43 (5): 308–310. [PubMed] [Google Scholar] 34. Тан В., Ван К., Чжан К., Сунь С., Чжан Ю., Ву З. Иридокорнеальный эндотелиальный синдром у китайского ребенка. Глазная наука . 2013. 28 (3): 153–156. [PubMed] [Google Scholar] 35. Уилсон М.С., Шилдс М.Б. Сравнение клинических вариаций иридокорнеального эндотелиального синдрома. Архив офтальмологии . 1989. 107 (10): 1465–1468. DOI: 10.1001 / archopht.1989.01070020539035. [PubMed] [CrossRef] [Google Scholar] 36. Лихтер П. Р. Спектр синдрома Чандлера: часто упускаемая из виду причина односторонней глаукомы. Офтальмология . 1978. 85 (3): 245–251. DOI: 10,1016 / s0161-6420 (78) 35677-3. [PubMed] [CrossRef] [Google Scholar] 37. Le Q.-H., Sun X.-H., Xu J.-J. Конфокальная микроскопия иридокорнеального эндотелиального синдрома in vivo. Международная офтальмология .2009. 29 (1): 11–18. DOI: 10.1007 / s10792-007-9187-х. [PubMed] [CrossRef] [Google Scholar] 38. Чиу А. Г.-Й., Кауфман С. С., Бойерман Р. В., Охта Т., Яйлали В., Кауфман Х. Э. Конфокальная микроскопия при иридокорнеальном эндотелиальном синдроме. Британский офтальмологический журнал . 1999. 83 (6): 697–702. DOI: 10.1136 / bjo.83.6.697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 39. Le Q.-H., Xu J.-J., Sun X.-H., Zheng T.-Y. Морфологические изменения роговицы при иридокорнеальном эндотелиальном синдроме под конфокальной микроскопией. Китайский офтальмологический журнал . 2008. 44 (11): 987–992. [PubMed] [Google Scholar] 40. Пецци П. П., Маренко М., Козими П., Маннино Г., Яннетти Л. Прогресс эссенциальной атрофии радужной оболочки, изученный с помощью конфокальной микроскопии и ультразвуковой биомикроскопии: отчет о болезни за 5 лет. Роговица . 2009. 28 (1): 99–102. DOI: 10.1097 / ico.0b013e3181822579. [PubMed] [CrossRef] [Google Scholar] 41. Дада Т., Гадиа Р., Шарма А. и др. Ультразвуковая биомикроскопия при глаукоме. Обзор офтальмологии .2011. 56 (5): 433–450. DOI: 10.1016 / j.survophthal.2011.04.004. [PubMed] [CrossRef] [Google Scholar] 42. Чжан М., Чен Дж., Лян Л., Латиес А. М., Лю З. Ультразвуковая биомикроскопия китайских глаз с иридокорнеальным эндотелиальным синдромом. Британский офтальмологический журнал . 2006. 90 (1): 64–69. DOI: 10.1136 / bjo.2005.074864. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 43. Скудери Г. Л., Чезарео М., Пердикки А., Рекуперо С. М. Стандартная автоматическая периметрия и алгоритмы для мониторинга прогрессирования глаукомы. Прогресс в исследованиях мозга . 2008. 173: 77–99. DOI: 10.1016 / s0079-6123 (08) 01107-2. [PubMed] [CrossRef] [Google Scholar] 44. Истер М., Пердикки А., Каприс Э., Синискалько А., Калабрия Г., Рекуперо С. М. Сравнение моделей дискриминантного анализа и «шкалы вероятности глаукомы» для обнаружения глаукоматозных изменений головки зрительного нерва. Журнал глаукомы . 2008. 17 (7): 535–540. DOI: 10.1097 / ijg.0b013e3181622568. [PubMed] [CrossRef] [Google Scholar] 45. Лукас-Гласс Т. К., Барац К. Х., Нельсон Л. Р., Ходж Д. О., Борн В. М. Контралатеральный эндотелий роговицы при иридокорнеальном эндотелиальном синдроме. Архив офтальмологии . 1997. 115 (1): 40–44. DOI: 10.1001 / archopht.1997.01100150042006. [PubMed] [CrossRef] [Google Scholar] 46. Лю З., Чжан М., Чен Дж. И др. Контралатеральный глаз у пациентов с односторонним иридокорнеальным эндотелиальным синдромом. Китайский офтальмологический журнал . 2002. 38 (1): 16–20. [PubMed] [Google Scholar] 47. Хуна Р., Барак А., Меламед С. Двусторонний иридокорнеальный эндотелиальный синдром, представленный как синдром Когана-Риза и Чандлера. Журнал глаукомы . 1996. 5 (1): 60–62. [PubMed] [Google Scholar] 48. Лобо А.-М., Ри Д. Дж. Отсроченный интервал поражения второго глаза у пациента мужского пола с двусторонним синдромом Чандлера. Британский офтальмологический журнал . 2012. 96 (1): 134–147. DOI: 10.1136 / bjo.2009.177931. [PubMed] [CrossRef] [Google Scholar] 49. Андерсон Н. Дж., Бадави Д. Ю., Гроссниклаус Х.Э., Стултинг Р. Д. Задняя полиморфная мембранозная дистрофия с перекрывающимися признаками иридокорнеального эндотелиального синдрома. Архив офтальмологии . 2001. 119 (4): 624–625. DOI: 10.1001 / archopht.119.4.624. [PubMed] [CrossRef] [Google Scholar] 50. Хидаят А.А., Кокерхэм Г.С. Эпителиальная метаплазия эндотелия роговицы при эндотелиальной дистрофии Фукса. Роговица . 2006. 25 (8): 956–959. DOI: 10.1097 / 01.ico.0000228786.84581.ee. [PubMed] [CrossRef] [Google Scholar] 51. Шеппард Дж.Д., младший, Латтанцио Ф. А., младший, Уильямс П. Б., Митрев П. В., Аллен Р. С. Конфокальная микроскопия, используемая в качестве окончательного раннего метода диагностики синдрома Чандлера. Роговица . 2005. 24 (2): 227–229. DOI: 10.1097 / 01.ico.0000141233.41343.d4. [PubMed] [CrossRef] [Google Scholar] 52. Лагановски Х. С., Шеррард Э. С., Мьюир М. Г. К., Бакли Р. Дж. Отличительные особенности иридокорнеального эндотелиального синдрома и задней полиморфной дистрофии: значение эндотелиальной зеркальной микроскопии. Британский офтальмологический журнал .1991. 75 (4): 212–216. DOI: 10.1136 / bjo.75.4.212. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 53. Шилдс М. Б. Аксенфельд-Ригер и иридокорнеальные эндотелиальные синдромы: два спектра заболеваний с поразительными сходствами и различиями. Журнал глаукомы . 2001; 10 (5): S36 – S38. DOI: 10.1097 / 00061198-200110001-00014. [PubMed] [CrossRef] [Google Scholar] 54. Вайс Дж. С., Демартини Д., Браун Р., Форстер Р. К. Зеркальная микроскопия при аниридиях. Роговица . 1987. 6 (1): 27–31. DOI: 10.1097 / 00003226-198706010-00003. [PubMed] [CrossRef] [Google Scholar] 55. Рикетта А., Джустини С., Рекуперо С. М. и др. Узелки Лиша радужки при нейрофиброматозе 1 типа. Журнал Европейской академии дерматологии и венерологии . 2004. 18 (3): 342–344. DOI: 10.1111 / j.1468-3083.2004.00915.x. [PubMed] [CrossRef] [Google Scholar] 56. Шилдс К. Л., Шилдс М. В., Вилория В., Перлштейн Х., Сэй Э. А. Т., Шилдс Дж. А. Иридокорнеальный эндотелиальный синдром, маскирующийся под меланому радужной оболочки в 71 случае. Архив офтальмологии . 2011. 129 (8): 1023–1029. DOI: 10.1001 / archophthalmol.2011.70. [PubMed] [CrossRef] [Google Scholar] 57. Салим А.А., Али М., Ахтар Ф. Иридокорнеальный эндотелиальный синдром. Журнал Колледжа врачей и хирургов Пакистана . 2014; 24: S112 – S114. [PubMed] [Google Scholar] 58. Палочка М., Гилберт С. М., Лизеганг Т. Дж. Латанопрост и кератит, вызванный простым герпесом. Американский журнал офтальмологии . 1999. 127 (5): 602–604. DOI: 10,1016 / s0002-9394 (99) 00050-1.[PubMed] [CrossRef] [Google Scholar] 59. Кидд М., Хетерингтон Дж., Маги С. Хирургические результаты иридокорнеального эндотелиального синдрома. Архив офтальмологии . 1988. 106 (2): 199–201. DOI: 10.1001 / archopht.1988.01060130209027. [PubMed] [CrossRef] [Google Scholar] 60. Ланцл И. М., Уилсон Р. П., Дадли Д., Аугсбургер Дж. Дж., Асланидес И. М., Спет Г. Л. Результат трабекулэктомии митомицином-С при иридокорнеальном эндотелиальном синдроме. Офтальмология . 2000. 107 (2): 295–297. DOI: 10.1016 / S0161-6420 (99) 00077-9. [PubMed] [CrossRef] [Google Scholar] 61. Райт М. М., Граевски А. Л., Кристол С. М., Пэрриш Р. К. 5-фторурацил после трабекулэктомии и иридокорнеальный эндотелиальный синдром. Офтальмология . 1991. 98 (3): 314–316. DOI: 10.1016 / S0161-6420 (91) 32294-2. [PubMed] [CrossRef] [Google Scholar] 62. Доу Э. А., Буденц Д. Л., Гедде С. Дж., Имами Н. Р. Отдаленные хирургические результаты пациентов с глаукомой, вторичной по отношению к иридокорнеальному эндотелиальному синдрому. Офтальмология .2001. 108 (10): 1789–1795. DOI: 10.1016 / s0161-6420 (01) 00725-4. [PubMed] [CrossRef] [Google Scholar] 63. Ким Д. К., Асланидес И. М., Шмидт К. М., младший, Спет Г. Л., Уилсон Р. П., Аугсбургер Дж. Дж. Отдаленные результаты хирургии водного шунта у десяти пациентов с иридокорнеальным эндотелиальным синдромом. Офтальмология . 1999. 106 (5): 1030–1034. DOI: 10.1016 / S0161-6420 (99) 00529-1. [PubMed] [CrossRef] [Google Scholar] 64. Шилдс М. Б., Маккракен Дж. С., Клинтворт Г. К., Кэмпбелл Д. Г. Отек роговицы при атрофии эссенциальной радужки. Офтальмология . 1979; 86 (8): 1533–1548. DOI: 10,1016 / s0161-6420 (79) 35384-2. [PubMed] [CrossRef] [Google Scholar] 65. Бакстон Дж. Н., Лэш Р. С. Результаты проникающей кератопластики при иридокорнеальном эндотелиальном синдроме. Американский журнал офтальмологии . 1984. 98 (3): 297–301. DOI: 10.1016 / 0002-9394 (84)-2. [PubMed] [CrossRef] [Google Scholar] 66. Кроуфорд Дж. Дж., Салтинг Р. Д., Кавана Х. Д., Уоринг Г. О., III. Проникающая кератопластика в лечении иридокорнеального эндотелиального синдрома. Роговица . 1989. 8 (1): 34–40. [PubMed] [Google Scholar] 67. Чанг П. С. Т., Сунг Х. К., Коуто М. Ф., Мейер Р. Ф., Шугар А. Прогноз при проникающей кератопластике при иридокорнеальном эндотелиальном синдроме. Рефракционная хирургия и хирургия роговицы . 1993. 9 (2): 129–132. [PubMed] [Google Scholar] 68. ДеБрофф Б. М., Тофт Р. А. Хирургические результаты проникающей кератопластики при атрофии эссенциальной радужки. Журнал рефракционной и роговичной хирургии . 1994. 10 (4): 428–432. [PubMed] [Google Scholar] 69.Алвим П. Д. Т. С., Коэн Э. Дж., Рапуано К. Дж. И др. Проникающая кератопластика при иридокорнеальном эндотелиальном синдроме. Роговица . 2001. 20 (2): 134–140. DOI: 10.1097 / 00003226-200103000-00003. [PubMed] [CrossRef] [Google Scholar] 70. Прайс М.О., Прайс Ф.У., мл. Удаление десцемета с эндотелиальной кератопластикой для лечения иридокорнеального эндотелиального синдрома. Роговица . 2007. 26 (4): 493–497. DOI: 10.1097 / ICO.0b013e318030d274. [PubMed] [CrossRef] [Google Scholar] 71. Терри М. А., Оусли П.J. Глубокая ламеллярная эндотелиальная кератопластика: острота зрения, астигматизм и выживаемость эндотелия в большой проспективной серии. Офтальмология . 2005. 112 (9): 1541–1548. DOI: 10.1016 / j.ophtha.2005.03.026. [PubMed] [CrossRef] [Google Scholar] 72. Бахар И., Кайзерман И., Байс Ю., Рутман Д. Удаление десцемета с эндотелиальной кератопластикой при иридокорнеальном эндотелиальном синдроме. Лазеры и визуализация для офтальмологической хирургии . 2008. 39 (1): 54–56. DOI: 10.3928 / 15428877-20080101-01. [PubMed] [CrossRef] [Google Scholar] 73.Кимионис Г. Д., Контадакис Г. А., Агорогианнис Г. И., Беннетт М., Ангелиду Ф. Десцемет-автоматическая эндотелиальная кератопластика в сочетании с факоэмульсификацией при синдроме Чандлера. Европейский журнал офтальмологии . 2011. 21 (4): 495–497. DOI: 10.5301 / ejo.2010.6210. [PubMed] [CrossRef] [Google Scholar] 74. Прайс М.О., Прайс Ф.У., младший эндотелиальная кератопластика Десцемета. Текущее мнение в офтальмологии . 2007. 18 (4): 290–294. DOI: 10.1097 / ICU.0b013e3281a4775b.[PubMed] [CrossRef] [Google Scholar] 75. Хуанг Т., Ван Ю., Цзи А., Гао Н., Чен Дж. Глубокая пластическая эндотелиальная кератопластика при иридокорнеальном эндотелиальном синдроме факичных глаз. Архив офтальмологии . 2009. 127 (1): 33–36. DOI: 10.1001 / archophthalmol.2008.537. [PubMed] [CrossRef] [Google Scholar] 76. Yoeruek E., Bayyoud T., Röck D., Szurman P., Bartz-Schmidt K.-U. Клинические результаты после эндотелиальной кератопластики десцеметной мембраны. Klinische Monatsblatter fur Augenheilkunde .2012. 229 (6): 615–619. DOI: 10.1055 / с-0032-1312913. [PubMed] [CrossRef] [Google Scholar] 77. Велдман П. Б., Терри М. А., Страйко М. Д. Новые показания к автоматизированной эндотелиальной кератопластике по десцемету. Текущее мнение в офтальмологии . 2014. 25 (4): 306–311. DOI: 10.1097 / ICU.0000000000000073. [PubMed] [CrossRef] [Google Scholar] 78. Хнг К., Снайдер М. Э. Реконструкция радужной оболочки с помощью многосекционного эндокапсулярного протеза при иридокорнеальном эндотелиальном синдроме. Журнал катарактальной и рефракционной хирургии .2005. 31 (11): 2051–2054. DOI: 10.1016 / j.jcrs.2005.04.030. [PubMed] [CrossRef] [Google Scholar] | Диагностика и лечение иридокорнеального эндотелиального синдромаBiomed Res Int. 2015; 2015: 763093. , 1 , * , 2 , 3 , 4 , 1 и 1Marta Sacchetti1 Отделение роговицы и поверхности глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия Flavio Mantelli2 Департамент биологии, Колледж науки и технологий, Университет Темпл, 1900 Н.12 Street, Philadelphia, PA 19122, USA Marco Marenco3 Департамент органов чувств, Университет Ла Сапиенца, Viale del Policlinico 155, 00186 Рим, Италия Ilaria Macchi4 Департамент биологии кемпинга, офтальмология -Medico University, Via Alvaro del Portillo 200, 00128 Rome, Italy Oriella Ambrosio1 Отделение поверхности роговицы и глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия Паоло Рама1 Блок роговицы и поверхности глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия 1 Блок роговицы и поверхности глаза, Ospedale San Raffaele IRCCS, Via Olgettina 60, 20132 Милан, Италия 2 Отделение биологии, колледж науки и технологий, университет Темпл, 1900 г.12 Street, Philadelphia, PA 19122, USA 3 Department of Sense Organs, University Sapienza, Viale del Policlinico 155, 00186 Rome, Italy 4 Отделение офтальмологии, Campus Bio-Medico University, Via Alvaro del Portillo 200, 00128 Рим, Италия Академический редактор: Ахим Лангенбухер Поступила в редакцию 27 марта 2015 г .; Пересмотрено 2 июля 2015 г .; Принято 26 июля 2015 г. Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы. Эта статья цитируется в других статьях в PMC.AbstractСиндром иридокорнеального эндотелия (ICE) — редкое глазное заболевание, которое включает группу состояний, характеризующихся структурными и пролиферативными аномалиями эндотелия роговицы, угла передней камеры и радужки. Общие клинические признаки включают отек роговицы, вторичную глаукому, атрофию радужной оболочки и аномалии зрачков, от деформации до поликории. Основными подтипами этого синдрома являются прогрессирующая атрофия радужной оболочки, синдром Когана-Риза и синдром Чандлера.Синдром ДВС обычно диагностируется у женщин в зрелом возрасте. Для постановки диагноза необходимы анамнез и полное обследование глаз, включая тонометрию и гониоскопию. Методы визуализации, такие как конфокальная микроскопия in vivo и ультразвуковая биомикроскопия, используются для подтверждения диагноза путем выявления присутствия «ICE-клеток» на эндотелии роговицы и структурных изменений угла передней камеры. Ранняя диагностика помогает лучше справиться с наиболее серьезными осложнениями, такими как вторичная глаукома и отек роговицы.Лечение глаукомы, связанной с ICE, часто требует хирургического вмешательства по фильтрации глаукомы с применением антифибротических агентов, и использование дренажных имплантатов для глаукомы следует рассматривать на ранних этапах ведения таких пациентов. С нарушением зрения и болью, связанной с отеком роговицы, можно успешно справиться с помощью эндотелиальной кератопластики. 1. ВведениеСиндром иридокорнеального эндотелия (ICE) — редкое заболевание (ORPHA64734, доступное по адресу http://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=en&Expert=64734), характеризующееся пролиферативным структурные аномалии эндотелия роговицы, прогрессирующая обструкция иридокорнеального угла и аномалии радужной оболочки, такие как атрофия и образование отверстий [1].Последствиями этих изменений являются декомпенсация роговицы и глаукома, которые представляют собой наиболее частые причины потери зрительной функции у пациентов с синдромом ДВС [2]. Синдром ICE включает ряд клинических проявлений: прогрессирующую атрофию эссенциальной радужки, синдром Когана-Риза и синдром Чандлера [3]. В 1903 году Хармс подробно описал редкое глазное заболевание, характеризующееся атрофией радужной оболочки и глаукомой, известное как «прогрессирующая атрофия эссенциальной радужки» [4, 5]. Пятьдесят лет спустя Чандлер описал редкое одностороннее состояние глаз, характеризующееся атрофией радужной оболочки, связанной с изменениями эндотелия роговицы, отеком роговицы и глаукомой [6].Впоследствии было высказано предположение, что этот «синдром Чендлера» и «прогрессирующая атрофия эссенциальной радужки» являются двумя разными формами одного и того же заболевания [6, 7]. Когда Коган и Риз описали подобное состояние, связанное с узелками радужки, была выявлена третья клиническая сущность, впоследствии названная «невус радужки» или «синдром Когана-Риза» [8–10]. Последующие исследования подтвердили, что эти клинические образования имеют схожий анамнез и клинические данные и имеют одни и те же патогенные механизмы, характеризующиеся аномальной пролиферацией эндотелия роговицы, и объединяющий термин «иридокорнеальный эндотелиальный синдром» был предложен Яноффом [1, 3, 7, 9, 11]. ДВС появляется спорадически; он обычно односторонний и обычно поражает взрослых пациентов (чаще женщин в третьем-пятом десятилетии) и в конечном итоге серьезно ухудшает зрительную функцию, если не лечить должным образом [1]. Даже при своевременном лечении хирургические вмешательства при этих состояниях имеют переменную эффективность, и лечение синдрома ДВС представляет собой проблему для офтальмологов. 2. ЭтиологияЭтиология синдрома ДВС до сих пор в значительной степени неизвестна; однако был описан ряд возможных триггерных событий, и споры об этиологии синдрома ДВС все еще продолжаются спустя более века. Воспаление у пациентов с синдромом ДВС упоминалось в нескольких ранних сообщениях, и более чем один автор описал начало увеита у этих пациентов [10, 12]. Scheie и Yanoff сообщили о скоплениях хронических воспалительных клеток в радужной оболочке и стекловидном теле одного глаза, исследованных гистопатологически, а Shields и его коллеги наблюдали воспаление передней камеры в 3 случаях [1, 10]. Patel и его коллеги также упомянули, что случайные макрофаги наблюдались на эндотелии роговицы в 2 случаях [13].Точно так же Игл-младший и его коллеги описали легкий хронический иридоциклит у 10 из 16 последовательных пациентов с диагнозом синдрома Когана-Риза [3]. Этот опыт согласуется с отчетом группы Альварадо, которая описала 16 из 25 пациентов с синдромом ДВС с красными глазами или умеренным увеитом до начала заболевания, а также задокументировала фотографически наличие кератических преципитатов у одного из этих пациентов [ 12]. Группа Альварадо первой предположила, что эндотелиопатия, ответственная за развитие этого синдрома, может иметь вирусное происхождение [12].Фактически, они отметили, что эндотелиальные изменения, наблюдаемые у пациентов с синдромом ДВС, аналогичны изменениям, наблюдаемым при вирусных заболеваниях. В соответствии с этой гипотезой, болезни с синдромом ДВС обычно являются монолатеральными приобретенными расстройствами, что позволяет предположить, что у пораженных пациентов один глаз в первую очередь поражен вирусом в послеродовом возрасте, а другой глаз защищен иммунным надзором, установленным через несколько недель после первой инфекции. Редко описываемое двустороннее возникновение синдрома ДВС можно объяснить одновременным инфицированием обоих глаз [12].Кроме того, ДНК ВПГ была обнаружена в водянистой жидкости у пациентов с идиопатической эндотелиопатией роговицы, что свидетельствует о вирусном происхождении этих нарушений. Тем не менее, прямых доказательств связи между синдромом ДВС и кератитом простого герпеса, возникающим в одном глазу, не было [12, 14]. Однако первые восемь лет исследований и экспериментов с использованием ультраструктурных методов и вирусных культур для подтверждения гипотезы о вирусном происхождении синдрома ICE закончились полным провалом.Тем не менее, они не потеряли веру в свою гипотезу и позже решили использовать новый метод, который казался выгодным для обнаружения вирусной ДНК: полимеразную цепную реакцию (ПЦР). Этот «новый» метод наконец позволил им обнаружить ДНК вируса простого герпеса (HSV-) в тканях роговицы и в образцах водянистой влаги у пациентов с синдромом ICE [12]. В частности, авторы обнаружили ДНК ВПГ более чем в 60% протестированных образцов. Они также оценили возможное присутствие ДНК различных вирусов, чтобы объяснить наличие ВПГ-отрицательных образцов; однако вирусы опоясывающего лишая и вирусы Эпштейна-Барра обнаружены не были.Чтобы еще раз доказать свои результаты, авторы также провели ПЦР для обнаружения вирусной ДНК в образцах от здоровых субъектов и пациентов, страдающих различными заболеваниями роговицы, включая буллезную кератопатию и кератоконус, и все они были отрицательными. Интересно отметить, что авторы также провели тест ПЦР на непораженном глазу пациента с синдромом ДВС, который также был отрицательным [12]. Другие авторы показали, что вирус Эпштейна-Барра также может играть роль в развитии болезни [15]. Новаторская работа Альварадо и его коллег убедительно свидетельствует о том, что ВПГ может играть важную этиологическую роль в развитии синдрома ДВС. Однако это может быть не единственная причина или предрасполагающий фактор, и еще многое предстоит узнать об этиологии заболевания, которая остается частично неизвестной на сегодняшний день. 3. ПатогенезПатогенетические механизмы, лежащие в основе клинических изменений, наблюдаемых при синдроме ДВС, были идентифицированы в аномальной пролиферации эндотелия роговицы [16–18]. Эндотелий роговицы представляет собой единый слой однородных гексагональных клеток, локализованных на внутренней поверхности роговицы в передней камере глаза. Эндотелий роговицы лежит на базальной мембране, десцеметовой мембране. Эндотелиальные клетки роговицы имеют эмбриологическое происхождение от нервных гребней. В послеродовом возрасте они постмитотические и в нормальных условиях не делятся. В зрелом возрасте плотность эндотелиальных клеток роговицы составляет примерно 3000 клеток / мм² и с возрастом она несколько снижается [19].Функция эндотелия роговицы заключается в активном поддержании прозрачности роговицы за счет регулирования транспорта жидкости, питательных веществ и растворенных веществ между водянистой влагой и структурами роговицы [20]. В 1978 году Кэмпбелл и его коллеги предложили «мембранную теорию» для объяснения патогенеза синдрома ДВС. В частности, они выдвинули гипотезу, что при синдроме ICE эндотелиальные клетки роговицы поражаются в первую очередь и демонстрируют пролиферативные и структурные аномалии и способность мигрировать в окружающие ткани [7].Эта гипотеза подтверждается данными исследований с помощью зеркальной микроскопии, которые показали морфологические изменения размера и формы эндотелиальных клеток, напоминающих эпителиальные клетки, также на самых ранних стадиях всех синдромов ICE [16, 17, 21–23]. Более того, гистопатологические исследования глаз с синдромом ICE показали измененные эндотелиальные клетки роговицы с морфологическими характеристиками, напоминающими эпителиально-подобный фенотип, названный в 1985 г. «ICE-клетками» Шеррардом и его коллегами [17, 18]. Другие наблюдения, подтверждающие эту гипотезу, получены из гистологических исследований, которые продемонстрировали присутствие мембраны, состоящей из эндотелиально-подобных клеток с базальной мембраной, препятствующей углу передней камеры и покрывающей радужную оболочку [1, 24]. Именно с помощью просвечивающей электронной микроскопии было окончательно подтверждено, что эндотелиальные клетки пораженных пациентов являются аномальными, поскольку они развивают уникальные характеристики эпителиальных клеток [25]. В частности, электронно-микроскопическое исследование этих клеток выявило десмосомы, внутрицитоплазматические филаменты, филоподии и микроворсинки [12, 13, 25, 26]. Следует отметить, что отек роговицы, наблюдаемый у пациентов с синдромом ДВС, до этих электронно-микроскопических исследований объяснялся только уменьшением количества эндотелиальных клеток.Однако теперь мы знаем, что это не так, поскольку отек роговицы скорее вызван измененной функцией эндотелиальных клеток, вызванной множественными нарушениями барьера эндотелиальных клеток. В соответствии с гипотезой об аномальной функции эндотелия, а не об уменьшении количества эндотелиальных клеток, Bourne и Brubaker также показали, что до развития хронического отека эндотелиальный барьер на самом деле более непроницаем, чем у здоровых людей [27]. Это наблюдение также очень хорошо коррелирует с гипотезой о том, что весь патогенез заболевания может быть связан с репаративной активностью, вызванной повреждением эндотелиальных клеток, вызванным вирусной инфекцией или воспалением.Фактически, образование микроворсинок и филоподий хорошо известно во время процесса заживления ран на животных моделях эндотелиального повреждения, а также у людей, эндотелиальные клетки которых были случайно повреждены аргоновым или YAG-лазером [28]. Таким образом, наличие этих эндотелиальных аномалий при синдроме ICE может просто отражать тот факт, что эндотелий участвует в репаративной деятельности. Однако, к сожалению, эта активация позже сопровождается повреждением и потерей функции клеток, некрозом и продолжающимся снижением плотности клеток, что, опять же, можно объяснить вирусной / воспалительной этиологией заболевания [29]. Иммуногистохимические исследования показали наличие виментина и цитокератинов (ЦК) в ICE-клетках [18, 30, 31]. Леви и др. продемонстрировали, что ICE-клетки экспрессируют профиль маркеров дифференцировки (CK5 и CK19, но не CK3, CK8 и CK18), который напоминает профиль нормальных лимбальных эпителиальных клеток, предполагая, что синдром ICE может быть результатом эктопического эмбрионального поверхностного эпителия глаза [32]. С другой стороны, эти данные согласуются с метапластическим стимулом, приводящим к глубокому изменению фенотипа нормальных эндотелиальных клеток роговицы [31, 32]. Независимо от этиологического триггера, конечным результатом всех этих клеточных изменений является то, что аномальные эндотелиальные клетки при синдроме ICE мигрируют назад за линию Швальбе, чтобы перекрыть иридокорнеальный угол, и в переднюю камеру, чтобы покрыть радужку, где они образуют аномальная базальная мембрана, которая в конечном итоге сокращается, вызывая аномалии формы зрачка, атрофическое повреждение радужки и образование синехий между соседними структурами [7]. Угловая обструкция также вызывает повышение внутриглазного давления (ВГД) и последующее развитие глаукомы у 46–82% пациентов с синдромом ДВС [2]. 4. Клиническая картинаСиндром ДВС обычно диагностируется у молодых людей, чаще всего у женщин, хотя описано несколько случаев с ранним началом у детей [33–35]. Пациенты обычно обращаются к офтальмологу по поводу изменения формы или положения зрачка. В других случаях пациенты относят нарушение зрительной функции, которое варьируется от ухудшения зрительной функции утром из-за декомпенсации роговицы на ранней стадии до нечеткости зрения и / или ореолов вокруг света из-за глаукомы, к постоянному снижению остроты зрения.В качестве альтернативы, первый диагноз синдрома ДВС ставится во время обычного осмотра глаз, после визуализации аномального эндотелия роговицы и / или после оценки угла передней камеры с помощью гониоскопии во время клинических исследований у подозреваемого на глаукому. Хотя клинические характеристики синдрома ДВС могут помочь в постановке правильного диагноза, в некоторых случаях при тяжелом отеке роговицы диагностика может быть затруднена [2, 36]. Это может быть связано с трудностями при визуализации структур передней камеры, закрытых отеком. Когда эндотелиальная функция роговицы достаточна для гарантии прозрачности роговицы, тщательное обследование эндотелия роговицы может помочь в диагностике синдрома ICE: исследование с помощью щелевой лампы с большим увеличением может показать мелкое, «чеканное серебро» или «бронзово-бронзовый» вид эндотелия подобен тому, который обычно наблюдается при дистрофии Фукса (FECD). Изменения эндотелия роговицы при синдроме ICE можно визуализировать и оценить с помощью зеркальной микроскопии, а в последнее время — конфокальной микроскопии роговицы in vivo [17, 37].Демонстрация наличия «ICE-клеток» при зеркальной микроскопии позволяет подтвердить диагноз синдрома ICE. Эти ICE-клетки, как правило, аномальные, округлые, большие и плеоморфные, с зеркальным рефлексом, показывающим типичный «поворот света на темноту», состоящий из темной поверхности, со случайными центральными светлыми пятнами и межклеточными светлыми границами [17, 21, 23] . Четыре морфологических вида этих клеток, описанные Sherrard et al. сосуществуют с другими типами клеток, давая начало четырем основным вариантам ICE: (i) диссеминированный ICE, при этом ICE-клетки разбросаны по эндотелию, который в остальном выглядит по существу нормальным; (ii) тотальный ICE, при котором ICE-клетки полностью замещают нормальный эндотелий; (iii) субтотальный ICE (+), при этом ICE-клетки заменяют вариабельную часть эндотелия, а оставшаяся часть состоит из очень маленьких клеток; и (iv) субтотальный ICE (-), при этом ICE-клетки замещают вариабельную часть эндотелия, а оставшаяся часть состоит из увеличенных клеток [17]. Конфокальная микроскопия in vivo (IVCM) — это неинвазивный метод визуализации с высоким разрешением, который представляет собой полезный диагностический инструмент при синдроме ICE, а также у пациентов с отеком роговицы. Он позволяет изучать все структуры роговицы на клеточном уровне, обеспечивая изображения in vivo всех слоев клеток роговицы, сравнимые с гистохимическими методами ex vivo. Конфокальная микроскопия in vivo у пациентов с синдромом ICE выявляет присутствие «ICE-клеток» в виде плеоморфных эпителиоподобных эндотелиальных клеток с гиперрефлективными ядрами и границами клеток, которые выглядят ярче, чем поверхность клеток [38].Различные «эпителиоподобные» представления эндотелиальных клеток были описаны на IVCM: один тип аномального эндотелия с довольно правильным размером и формой, второй тип клеток, более неправильный по размеру и форме, подобный эпителиальным крыловым клеткам на IVCM, и в-третьих, крайне нерегулярный клеточный узор, напоминающий поверхностный эпителий роговицы. Было высказано предположение, что эти различные наблюдения могут быть связаны со стадией заболевания [21, 39, 40]. Тем не менее, хотя визуализация этих клеток может позволить поставить диагноз, обычно считается обязательным подтверждение клинического диагноза с помощью гониоскопии: на самом деле, аномалии угла передней камеры являются общими для всех подтипов синдрома ДВС и включают широкий спектр иридотрабекулярные синехии, которые постепенно прогрессируют до полного закрытия угла, если не лечить должным образом.Хотя визуализация этих угловых изменений, как правило, не представляет трудностей, необходимо иметь в виду, что мембрану, препятствующую трабекулярной сети, может быть изначально трудно визуализировать с помощью гониоскопии, и состояние пациентов можно спутать с более распространенной открытоугольной глаукомой. . Это особенно верно, если считается, что отек роговицы является вторичным по отношению к повышению внутриглазного давления, а не к недостаточности функции эндотелиального насоса. Использование ультразвуковой биомикроскопии (УБМ) может представлять собой полезный инструмент для обнаружения изменений структур угла передней камеры при синдроме ICE, особенно при наличии отека роговицы, который не позволяет визуализировать гониоскопию [41].Кроме того, сочетание УБМ с гониоскопической оценкой периферических передних синехий (ПАС) может позволить лучше охарактеризовать степень (гониоскопия) и форму (УБМ) ПА при синдроме ДВС. Чжан и его коллеги сообщили о UBM-анализе 21 глаза с синдромом ICE и наблюдали наличие PAS у всех пациентов, связанных с уменьшением глубины передней камеры по сравнению с нормальными предметами. Авторы продемонстрировали, что УБМ более эффективен в выявлении атрофии как ПАВ, так и радужной оболочки, чем клиническая оценка при биомикроскопии с щелевой лампой и гониоскопии.У четырех пациентов также было обнаружено закрытие угла парного глаза при обследовании UBM. Кроме того, UBM может идентифицировать специфические особенности различных клинических форм синдрома ICE [42]. В частности, у пациентов с прогрессирующей атрофией радужной оболочки UBM выявила выраженную атрофию радужной оболочки, а PAS были менее выражены, чем у пациентов с синдромом Когана-Риза. UBM при синдроме Чандлера показал наличие выраженного отека роговицы с десцеметовыми складками, тогда как PAS были менее выражены. Пациенты с синдромом Когана-Риза имели более обширный, часто «ветвистый» ПА.Более тяжелая протяженность и высота PAS, наблюдаемые UBM при прогрессирующей атрофии радужной оболочки и синдроме Когана-Риза, подтверждают доказательства более тяжелой глаукомы, наблюдаемой при этих подтипах ICE, чем при синдроме Чандлера [1, 42]. В любом случае у пациентов с синдромом ДВС всегда должно проводиться строгое наблюдение по поводу глаукомы путем периодического измерения внутриглазного давления, гониоскопии, а также исследований поля зрения и сетчатки [43, 44]. Как упоминалось ранее, после того, как диагноз синдрома ДВС поставлен на основании этих общих клинических признаков, имеется по крайней мере три различных клинических подтипа синдрома ДВС ().Уилсон и Шилдс описали серию из 37 пациентов с синдромом ДВС с существенной атрофией радужной оболочки (22%), синдромом Чандлера (57%) и синдромом Когана-Риза (22%), чтобы охарактеризовать это состояние и описать клиническое течение в течение 12 лет [ 35]. Большинство клинических различий, позволяющих провести дифференциальный диагноз между ними, основаны на разном уровне поражения радужной оболочки и типе / тяжести аномалий радужной оболочки (). Таблица 1Клинические особенности различных подтипов синдрома ДВС.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


