11.08.2017 Чем опасен описторхоз?
Описторхоз – одно из самых распространенных паразитарных заболеваний человека. Это гельминтное заболевание, вызываемое плоскими паразитическими червями класса сосальщиков или, как их ещё называют, двуустками. У человека поражаются печень и желчевыводящие пути. Дело может дойти до инфекционных заболеваний, например, до гепатита. Или даже до онкологии. Заразиться можно, съев сырую, термически плохо обработанную речную рыбу, икру.
За семь месяцев текущего года в нашей поликлинике выявлено три больных описторхозом. Заразившиеся были выявлены в ходе проведения профилактического осмотра – по результатам анализа кала.
Как пояснила врач-инфекционист поликлиники Елена Шестакова, для нашей области описторхоз — актуальное заболевание. Заразиться можно и привозной рыбой семейства карповых, и выловленной в местных водоемах. Для нашей местности характерно употребление в пищу такой рыбы, как карп, карась, красноперка, щука, язь и других.
Как же паразиты попадают к человеку?
Ленточные черви с длиной тела от 8 до 18 мм и шириной от 1 до 2 мм сначала находятся в моллюсках и речной рыбе, а затем переходят к постоянным носителям — человеку или домашним животным. Источником размножения паразитов в реке являются улитки. А затем двуустка заселяется в рыбу. Человек съедает зараженную рыбу, и паразиты попадают в желчный пузырь, а потом в печень. Приблизительно через две недели они становятся половозрелыми и приступают к откладыванию яиц.
Как болезнь протекает
Это заболевание может протекать в средней, легкой и тяжелой форме. Легкая форма характеризуется плохим самочувствием, слабостью, обильной потливостью и незначительным повышением температуры. Средняя форма заболевания протекает с повышением температуры тела до 40 градусов и выше и с симптомами поражения верхних дыхательных путей.
Надо помнить, что описторхоз – хроническое заболевание. Когда болезнь только начинается, то её очень сложно распознать, а переход из одной формы в другую происходит очень быстро.
Уберечься от последствий можно, если вовремя распознать проживание паразита в организме и немедленно приступить к квалифицированному лечению под строгим наблюдением врачей. Лечение описторхоза требует комплексного подхода. Наряду с приемом специфических противогельминтных средств врач предпринимает меры, направленные на восстановление нарушенной работы органов желудочно-кишечного тракта.
Лечение описторхоза требует комплексного подхода. Наряду с приемом специфических противогельминтных средств врач предпринимает меры, направленные на восстановление нарушенной работы органов желудочно-кишечного тракта.
Как избежать заболевания
Но лечение этого заболевания – дело сложное и длительное. Поэтому важно предпринять все профилактические меры, чтобы избежать заражения. Для этого надо правильно рыбу приготовить.
Не менее важно, покупая рыбу, тщательно ее осмотреть и убедиться, что внутри нет паразитов, а запах и вид -нормальные.
Употреблять в пищу можно только хорошо прожаренную и проваренную, а также тщательно просоленную рыбу. Кроме того, следует обеззараживать продукт при помощи его глубокой заморозки.
Варить, жарить рыбу семейства карповых следует порционными кусками. Время ее приготовления должно быть не менее 20 минут с момента закипания бульона, начала жарки. И готовить рыбу в кастрюле или на сковороде лучше с закрытой крышкой.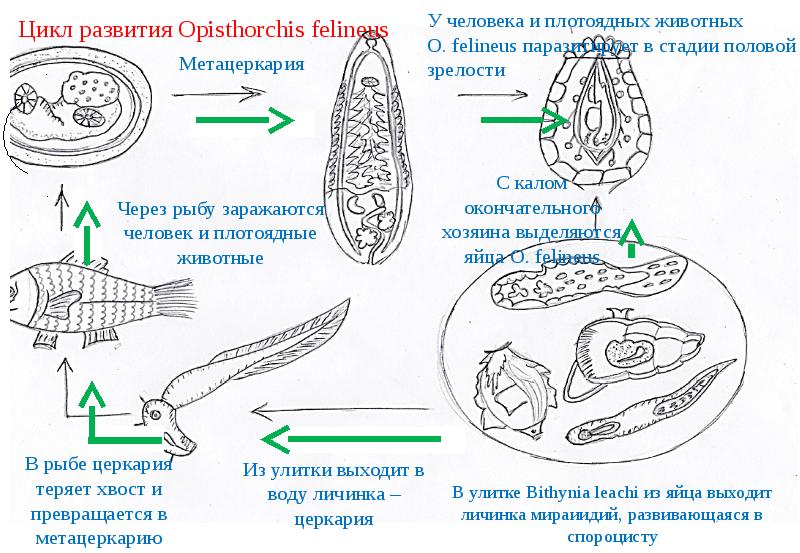 Рыбные пельмени необходимо варить дольше 5 минут. В процессе жарки котлет из карпа или его кусков необходимо следить за тем, чтобы каждая сторона продукта находилась в кипящем жиру не менее ¼ часа. Мелкую рыбу можно обрабатывать на плите в целом виде также не менее 15-25 минут. Рыбные пироги желательно выпекать около часа.
Рыбные пельмени необходимо варить дольше 5 минут. В процессе жарки котлет из карпа или его кусков необходимо следить за тем, чтобы каждая сторона продукта находилась в кипящем жиру не менее ¼ часа. Мелкую рыбу можно обрабатывать на плите в целом виде также не менее 15-25 минут. Рыбные пироги желательно выпекать около часа.
Для соления на 1 килограмм рыбы нужно брать не менее 300 грамм соли. Тёплым раствором рыбу солят не менее двух недель. Вяленую рыбу нужно засолить, а после выдерживать не менее трёх недель
Ни в коем случае нельзя употреблять в пищу сырую рыбу или пробовать рыбный фарш. Недопустимым является и кормление домашних питомцев сырой рыбой.
Во время разделки рыбы надо пользоваться специально отведёнными для этих целей кухонными принадлежностями.
Категорически запрещается выбрасывать на мусорные свалки и в водоемы отходы переработки рыбы, а также скармливать их животным, в том числе домашним, без предварительного обеззараживания.
Сегодня в мире выявлено более 21 миллиона человек, болеющих описторхозом.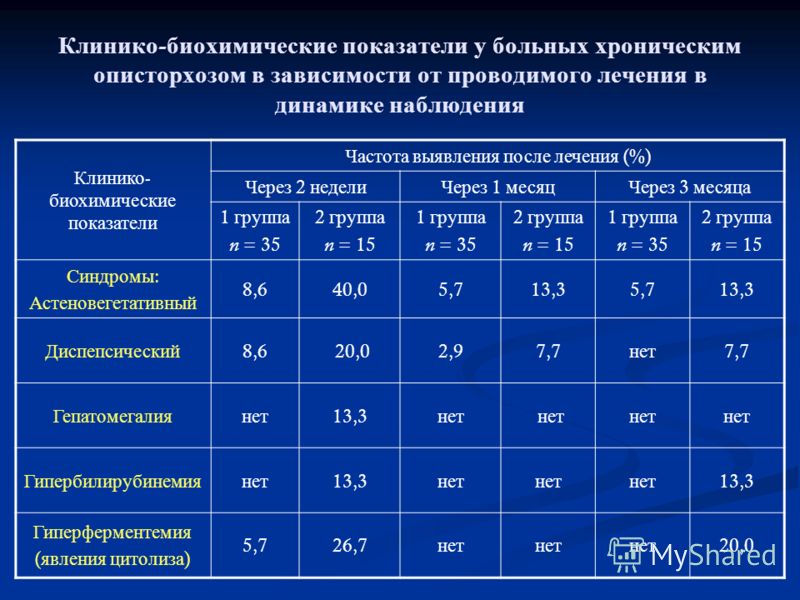 В нашей стране насчитывается более двух миллионов людей, пораженных этим паразитозом. Без соответствующего лечения организм человека приобретает множество сопутствующих болезней, победить которые не так просто. Однако своевременное выявление паразитов и качественное лечение поможет полностью избавиться от этой болезни. Но лучше всего вовсе постараться избежать этого заболевания. Сделать это можно, соблюдая перечисленные нами санитарно-гигиенические требования и правила.
В нашей стране насчитывается более двух миллионов людей, пораженных этим паразитозом. Без соответствующего лечения организм человека приобретает множество сопутствующих болезней, победить которые не так просто. Однако своевременное выявление паразитов и качественное лечение поможет полностью избавиться от этой болезни. Но лучше всего вовсе постараться избежать этого заболевания. Сделать это можно, соблюдая перечисленные нами санитарно-гигиенические требования и правила.
Симптомы описторхоза у взрослых и детей. Диагностика, лечение
Летом часто обостряются заболевания желудочно-кишечного тракта. Одна из неприятных болезней – описторхоз. Её симптомы можно легко принять за гастрит. Но точный диагноз могут поставить только в медицинских центрах. Что такое описторхоз, как он себя проявляет и куда обращаться с первыми неприятными симптомами, рассказываем в этой статье.
Что такое описторхоз?
Трематодоз, вызванный плоскими червями.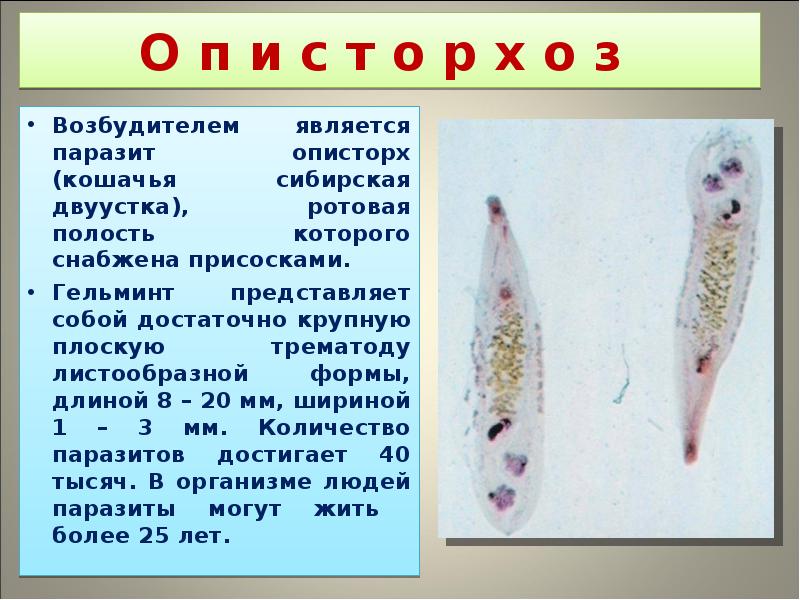 Возбудитель описторхоза, попадая в организм человека, концентрируется в печени и желчевыводящей системе. Паразит попадает в организм человека из плохо термически обработанных морепродуктов – сырой, вяленой, копченой рыбы или представителей семейства карповых.
Возбудитель описторхоза, попадая в организм человека, концентрируется в печени и желчевыводящей системе. Паразит попадает в организм человека из плохо термически обработанных морепродуктов – сырой, вяленой, копченой рыбы или представителей семейства карповых.
Чем опасен описторхоз?
Возбудитель заболевания двуустка кошачья паразитирует в желчном пузыре и желчных протоках и пожирает слизистую оболочку органов. Постепенно ухудшается нормальный пищеварительный процесс. Возникает дисбактериоз, появляется аллергическая реакция непонятного происхождения, воспаляются ближайшие к желчному пузырю внутренние органы, формируются камни.
Если патология появляется во время беременности, паразит оказывает угнетающее действие на развитие плода, физическое и умственное развитие. Одно из самых страшных последствий – рак печени, желчного пузыря, поджелудочной железы.
Помимо органов желудочно-кишечного тракта, у больного страдают сердце и сосуды, обмен веществ, нервная система. Как следствие, может возникать вегетососудистая дистония, бессонница, нервозность, появляется тремор конечностей, снижается аппетит, изменяется менструальный цикл.
Как следствие, может возникать вегетососудистая дистония, бессонница, нервозность, появляется тремор конечностей, снижается аппетит, изменяется менструальный цикл.
Первые симптомы описторхоза
Первые признаки появляются при снижении защитной функции иммунитета. На ранних стадиях пациент сталкивается с появлением общей слабости, усиливается потоотделение. Острая форма описторхоза проявляется следующим образом:
-
появление бессонницы и нервозности;
-
боль в правом подреберье;
-
болевые ощущения в спине и животе;
-
наличие астматического бронхита;
-
ощущение ломоты в теле и повышение температуры;
-
появление на коже аллергических высыпаний;
-
присутствие метеоризма, тошноты, рвоты, болей в животе, общего дискомфорта;
-

При обследовании организма врач может обнаружить увеличенную печень, повышенное количество эозинофилов в общем анализе крови.
Симптомы описторхоза у взрослых несколько отличаются от первых признаков детей. У маленьких непосед заболевание выражается в проявлении устойчивого аллергоза, интоксикации всего организма и иммунодепрессивном состоянии. Также может повышаться температура и держаться до 2-3 недель.
Симптомы у женщин проявляются наиболее ярко во время менструального цикла. Если в печени женщины есть паразит, то менструации становятся очень болезненными, а цикл становится нестабильным.
Как быстро проявляется патология?
Когда паразиты попадают в организм человека, начинают снижаться защитные функции иммунитета. После этого в течение 20 дней могут проявляться первые признаки. Человек испытывает общую слабость, недомогание, учащенное сердцебиение, повышение температуры тела, сильное потоотделение.
Примерно через 30 дней заболевание переходит в хроническую стадию и его симптомы становятся похожи на хронический холецистит, гастродуоденит, панкреатит, гепатит. Беспокоят приступы боли в правом подреберье, схожие с желчными коликами. Появляется нервозность, нарушения сна, хроническая усталость, частые аллергические высыпания на коже, дрожат руки, веки.
Период острого этапа заболевания – от нескольких дней до 3 месяцев, иногда дольше. К симптомам присоединяются признаки лёгочных заболеваний, увеличивается печень, могут выявиться эрозии и язвы слизистых оболочек и тканей желудка, двенадцатиперстной кишки во время проведения исследования.
Стадии острого описторхоза
-
Тифоподобное протекание – присутствуют симптомы панкреатита, желтухи и гепатита, увеличенная печень, есть гастрит, эозинофилы в крови до 90%.

-
Гепатохолангетический тип – панкреатит, ноющие боли в животе, поражается печень, нарушается функция поджелудочной железы.
-
Гастроэнтерологический – наличие энтероколита, язвы желудка, эрозивного гастрита, наблюдаются нарушения стула.
-
Поражение дыхательных путей – присутствие бронхита астматического типа, плеврита и пневмонии.
Как проводится диагностика заболевания?
Первое, что нужно сделать, если обнаружили у себя признаки описторхоза, — это не заниматься самолечением, а обратиться за консультацией гастроэнтеролога. Врач проведет визуальный осмотр, соберет анамнез и направит на анализы и дуоденальное зондирование. Это метод обследования пациента, который проводится при заболеваниях желчевыводящих путей и желчного пузыря для забора желчи на лабораторное исследование.
Другие виды диагностики:
-
общий анализ крови;
-
исследование внутренних органов с помощью УЗИ;
-
анализ кала на яйца глистов;
-
полимеразная цепная реакция (ПЦР).

После проведения диагностики, врач изучает результаты всех анализов и исследований, ставит пациенту точный диагноз. После постановки точного диагноза пациенту назначается лечение. Оно проходит под строгим наблюдением.
Лечение описторхоза
Лечение патологии должно проводиться независимо от стадии и вида описторхоза. Чем быстрее начато лечение, тем меньше вероятность того, что паразит нанесет сильные увечья вашему организму.
Для того, чтобы начать лечение, необходимо иметь свежие результаты общего анализа крови и мочи, биохимический анализ крови, ФГДС, УЗИ органов брюшной полости, для пациентов старше 40 лет также ЭКГ.
Использование медикаментозных препаратов снимает воспаление. Если есть аллергические реакции, интоксикация, то эту проблему устраняют за счет использования антигистаминных средств. Назначаются желчегонные препараты, которые принимаются в назначенные врачом сроки, прописывают антибиотики. Препараты чаще всего принимаются сроком до 14 дней. Для больного устанавливается специальная диета, которую он обязан соблюдать.
Препараты чаще всего принимаются сроком до 14 дней. Для больного устанавливается специальная диета, которую он обязан соблюдать.
После курса лечения будет сделано контрольное дуоденальное зондирование, вы получите полное медицинское заключение и рекомендации врача, которых нужно придерживаться в течение всей жизни.
После проведения противопаразитарной терапии наступает период реабилитации. Он может длиться на протяжении 3-4 месяцев, основными его задачами являются:
-
восстановление нормальной работы органов пищеварительной системы;
-
полное избавление от мертвых гельминтов, которые остались в организме;
-
устранение последствий жизнедеятельности гельминтов в человеческом организме.
Лечение описторхоза в Красноярске
Диагностику и лечение паразитов можно пройти в частной медицинской клинике «Медюнион». В период пандемии мы оказываем все медицинские услуги согласно масочному режиму. Соблюдается дистанция между пациентами и работниками клиники, все рабочие поверхности обрабатываются каждый час. Наши пациенты могут воспользоваться масками и дезинфекторами для обработки рук.
В период пандемии мы оказываем все медицинские услуги согласно масочному режиму. Соблюдается дистанция между пациентами и работниками клиники, все рабочие поверхности обрабатываются каждый час. Наши пациенты могут воспользоваться масками и дезинфекторами для обработки рук.
Стоимость диагностики и лечения будет зависеть о проводимых процедур. Чтобы узнать больше информации, запишитесь на прием к гастроэнтерологу, который проведет осмотр, назначит анализы и лечение. Чтобы записаться, позвоните по телефону +7 391 202-95-54 или заполните онлайн-форму. Укажите необходимую вам процедуру и оставьте свои данные – наш специалист перезвонит вам и обсудит удобное время процедуры.
Кроме того, в клинике действует комплексная программа диагностики «Золотой стандарт». Она включает в себя все виды анализов, в том числе и на паразитов.
Хронический описторхоз и билиарная дисфункция
Резюме. Проведена оценка особенностей клинического течения функциональных расстройств билиарного тракта на фоне хронического описторхоза и возможностей медикаментозной коррекции имеющихся нарушений. Обследовано 77 больных (30 женщин и 47 мужчин). Хронический описторхоз у всех пациентов был диагностирован впервые при проведении дуоденального зондирования. Исследования проводили до курса дегельминтизации и по его окончании через 4 месяца после курса реабилитационной терапии. Хронический описторхоз нередко ассоциируется с функциональными расстройствами билиарного тракта, что требует дополнительных и специальных методов обследования. Обнаруженные физико-химические нарушения со стороны желчи обусловлены наличием паразитарной инфекции. Отмечен позитивный эффект курсовой медикаментозной терапии гимекромоном при билиарной дисфункции при проведении реабилитационной терапии после дегельминтизации.
Обследовано 77 больных (30 женщин и 47 мужчин). Хронический описторхоз у всех пациентов был диагностирован впервые при проведении дуоденального зондирования. Исследования проводили до курса дегельминтизации и по его окончании через 4 месяца после курса реабилитационной терапии. Хронический описторхоз нередко ассоциируется с функциональными расстройствами билиарного тракта, что требует дополнительных и специальных методов обследования. Обнаруженные физико-химические нарушения со стороны желчи обусловлены наличием паразитарной инфекции. Отмечен позитивный эффект курсовой медикаментозной терапии гимекромоном при билиарной дисфункции при проведении реабилитационной терапии после дегельминтизации.
Ключевые слова: хронический описторхоз, билиарная дисфункция, физико-химические свойства желчи, лечение.
Chronic opisthorchiasis and biliary dysfunction
A.B. Krivosheev, MD, professor of faculty therapy FGBOU НЕ NSMU Russian Ministry of Health
L. A. Khvan, the highest category doctor, head of the department gastroenterology
A. Khvan, the highest category doctor, head of the department gastroenterology
Summary. The evaluation of the clinical course of functional disorders of the biliary tract on the background of chronic opisthorchiasis and possibilities of drug correction of existing violations. Examined 77 patients (30 women and 47 men). Chronic opisthorchiasis all patients were diagnosed for the first time at carrying out of duodenal intubation. The study was performed to course of de-worming and at the end of 4 months after a course of rehabilitation therapy. Chronic opisthorchiasis often associated with functional disorders of the biliary tract, which requires additional and special methods of examination. Discovered physico-chemical disorders of the bile due to the presence of parasitic infection. Marked positive effect of a course of drug therapy emiramona in biliary dysfunction during rehabilitation therapy after deworming. Key words. Chronic opisthorchiasis, biliary dysfunction, physico-chemical properties of bile, treatment.
В Российской Федерации насчитывается более 2 миллионов человек, пораженных описторхозом. Хронический описторхоз для Западно-Сибирского региона имеет важное клинико-эпидемиологическое значение [1,2]. Обь-Иртышский бассейн является наиболее крупным эндемичным природным очагом описторхоза. Жители данного региона поражены в среднем в 49,2% случаев. Инвазированность взрослого населения Западной Сибири в ряде регионов достигает 64,9–95,0% [3,4]. Возбудитель описторхоза был открыт, и впервые описан S. Rivolta в 1884 г. у кошек, и назван Opisthorchis (Distomum) felineus — это небольшой гельминт из класса трематод, известный под названием «кошачий сосальщик» [5]. Название «кошачий сосальщик» описторхис получил из-за того, что впервые был обнаружен в печени кошек. Наличие двух присосок послужило основанием для другого названия — «двуустка». У человека гельминт впервые был выделен и описан в 1891 г. профессором Томского университета К.Н. Виноградовым, который при вскрытии трупа человека обнаружил подобного гельминта, подробно описал его и назвал Distomum sibiricum (сибирская двуустка) [6].
Хронический описторхоз нередко сочетается с патологией органов пищеварения. В этом отношении расстройства билиарного тракта в структуре заболеваний органов пищеварения занимают одно из первых мест. На их долю приходится до 25–30% случаев [7,8]. Данная патология относится к двигательным нарушениям и включает в себя как нарушения функционирования сфинктера Одди, так и расстройства деятельности желчного пузыря и желчных протоков [9,10]. Характеризуется разнообразием клинических симптомов, длительностью течения и проявляется различными болевыми ощущениями, которые обусловлены перерастяжением желчного пузыря, билиарной гипертензией, спазмом гладкой мускулатуры, и, как следствие, может приводить к развитию воспалительного процесса [11,12,13].
Изучение литературы по проблеме сочетания билиарной дисфункции с хроническим описторхозом позволило обнаружить единичные работы, касающиеся изменений в гепатобилиарной системе при данной сочетанной патологии [3,4,14].
Согласно современной классификации препаратов, используемых в лечении ОА [7], их подразделяют на следующие группы:
В связи с этим целью нашей работы явилась оценка особенностей клинического течения функциональных расстройств билиарного тракта на фоне хронического описторхоза и возможностей медикаментозной коррекции имеющихся нарушений.
Материал и методы
Обследовано 77 больных в возрасте от 24 до 59 лет (средний возраст 40,3±1,4 года) из них 30 женщин и 47 мужчин. Всем пациентам проводилось комплексное обследование, в ходе которого определяли показатели функции печени, липидного и углеводного обмена. Контролировали артериальное давление, записывали ЭКГ, проводили ультрасонографию органов брюшной полости, в ходе которой определяли признаки дисфункции сфинктера Одди и желчного пузыря [15]. У всех пациентов хронический описторхоз был диагностирован впервые при проведении минутированного дуоденального зондирования по стандартной методике, в ходе которой в полученных порциях желчи обнаруживались яйца Opisthorchis felineus.
Дополнительно проводили специальные исследования, позволяющие оценить физико-химические и реологические свойства желчи. В ходе полученной при дуоденальном зондировании желчи в порции В (пузырная желчь) и порции С (печеночная желчь) определяли ее вязкость на капиллярном вискозиметре КВ-1 (Россия) и рН на ионометре (Россия). Стандартными унифицированными методиками определяли содержание в желчи общего холестерина (ОХС), общего билирубина (ОБ) иС-реактивного белка(СРБ).В исследование не включали лиц с желчнокаменной болезнью, пациентов, которым была проведена холецистоэктомия, а также пациентов, у которых при контрольном обследовании после курса дегельминтизации и реабилитационной терапии сохранялась паразитарная инфекция. Все исследования проводили в динамике наблюдения: до проведения курса дегельминтизации празиквантелем и через 4 месяца при контрольном обследовании после курса реабилитационной терапии.Терапия включала применениежелчегонных фитосборов,проведение тюбажей и назначения гимекромона в суточной дозе 600 мг курсомна 2 недели.За период реабилитации пациент получал 2–3 курса гимекромона.
Одним из актуальных вопросов терапии расстройств билиарного тракта становится выбор лекарственных средств, обладающих наиболее физиологичным механизмом коррекции существующих нарушений и имеющих минимальное количество нежелательных явлений. Одним из них является гимекромон.Это международное непатентованное наименование препарата, имеет код АТС-А05АХ02, химическую формулу — С10-Н8-03, молекулярный вес 176, терапевтическую категорию холерическое средство, химическое наименование — 4-Methylumbelliferon, 7-Hydroxy-4-methylcoumarine (в регистре ВОЗ). Гимекромон на территории Российской Федерации зарегистрирован подторговым наименованием Одестон. Регистриционное удостоверение принадлежит компании Адамед. Препарат увеличивает производство и выделение желчи. Оказывает селективный спазмолитический эффект, направленный на желчные протоки и сфинктер Одди, не нарушая перистальтику желудочно-кишечного тракта и не влияя на артериальное давление, снижает застой желчи, предотвращается кристаллизация ОХС и возникновение холелитиаза. [16,17].
Гимекромон всасывается в тонкой кишке и по воротной вене поступает в печень, где захватывается переносчиком органических анионов гепатоцитов (organic anions transportingpump,OATP).Наличие гидроксильнойгруппы в структуре4-метил-умбеллиферона дает ему преимущество связывания с OATP и ускоряет перенос в цитоплазму, что объясняет низкую системную биодоступность препарата (менее 3%).Вгепатоцитах90%гимекромонапретерпевает конъюгацию с глюкуроновой кислотой, затем происходит его экскреция в желчь, сопряженная с секрецией Na+, K+, бикарбонатов и пассивным транспортом воды; таким образом, проявляется холеретический эффект. Этот процесс опосредован мультиспецифическим транспортером органических анионов (canalicular multispecific organic anion transporter, cMOAT). Гидроксильная группа в молекуле гимекромона ускоряет его связывание, выведение в желчь, таким образом, обеспечивая выраженный холерез. Препарат не усиливает синтез желчных кислот [18].
Полученные результаты оценивали дифференцированно и сравнивали с данными обследования 40 практически здоровых лиц. Результаты исследований обрабатывали методами вариационной статистики с использованием компьютерной программы Microsoft Excel (версия 6). Различия между средними величинами изучаемых биохимических признаков в абсолютном исчислении считали достоверными при р<0,05.
Результаты и обсуждение
Наблюдаемые пациенты были разделены на 2 группы. В 1-ю группу включено 38 больных с признаками билиарной дисфункции. 2-ю группу составили 39 пациентов, у которых признаки билиарной дисфункции отсутствовали. При поступлении в клинику большинство больных предъявляли жалобы на абдоминальный дискомфорт и диспепсические расстройства (63 человека, 81,8%), реже беспокоило повышение артериального давления и чувство сдавления за грудиной (ангинозные боли), сухость во рту, жажда, полиурия. Давность этих симптомов колебалась от 2 до 7 лет (в среднем 3,5±1,2 года).
У 45 больных (58,4%) наблюдалась патология органов пищеварения: язвенная болезнь желудка и двенадцатиперстной кишки у 7 пациентов, эрозивный гастродуоденит у13,гастроэзофагеальная рефлюксная болезньу16,грыжа пищеводного отверстия диафрагмы у 6, неалкогольная жировая болезнь печени у 3. Заболевания сердечнососудистой системы выявлены у 16 пациентов (20,8%). Из них у 5 артериальная гипертония и у 11 ишемическая болезнь сердца (стенокардия напряжения и нарушения ритма). Патологические отклонения в углеводном обмене обнаружены у 3 больных (3,9%). Согласно современной этиологической классификации нарушений гликемии они соответствовали сахарному диабету типа 2.
При исследовании липидного обмена у 23 больных (29,9%) обнаружена гиперхолестеринемия (5,5–8,6 ммоль/л, в среднем 5,8±0,4 ммоль/л, при норме 4,6±0,2 ммоль/л; р<0,002), а у 34 пациентов (44,2%) — гипертриглицеридемия (1,8— 4,1 ммоль/л, в среднем 2,2±0,2 ммоль/л, при норме 1,1±0,1 ммоль/л; р<0,001).
Примечание: различия статистически достоверны (р < 0,001-0,05): одна звёздочка с контролем, две – с контролем и исходным уровнем, три – с исходным уровнем. Первое значение – до лечения, второе значение – после лечения.
Клинические признаки функциональной дисфункции билиарного тракта наблюдались у 38 больных 1-й группы.Пациентов беспокоили периодически возникающие кратковременные боли в эпигастральной области и правом подреберье, тошнота, отрыжка, реже изжога. Продолжительность их не превышала 5–18 месяцев (в среднем 1,1±0,2 мес.). При оценке выраженности клинической картины диспепсии по шкале Likert данные симптомы были заметны, но не нарушали дневную активность и сон. Возникающие симптомы пациенты связывали с различными нарушениями режима питания и целенаправленно не обследовались.Практически аналогичная симптоматика наблюдалась и у пациентов 2-й группы, но она, как правило, была обусловлена сопутствующей патологией органов пищеварения.
У пациентов 1-й группы при ультрасонографии наблюдали различные деформации желчного пузыря (16 человек, 42,1%) и увеличение его размеров (8 человек, 21,1%). Проведение минутированного дуоденального зондирования позволило зарегистрировать различные варианты дисфункций желчевыводящих путей.Чаще регистрировали смешанную или диссоциированную дискинезию (19 человек, 50,0%), функциональную гипертензию сфинктера Одди зафиксировали у 6 человек (15,8%). Нарушение функции желчного пузыря обнаружили у 8 больных (21,1%), которая характеризовалась признаками гипотонии (5 человек) и гиперкинезией (3 человека). У 15 человек (39,5%) отмечены сочетанные расстройства, характеризовавшиеся комбинациями различных деформаций желчного пузыря и нарушением моторно-двигательной функции.
При изучении физико-химических свойств желчи (табл.) у всех обследованных больных значения рН желчи не превышали нормального уровня. Также в пределах нормы варьировали показатели ОХС и ОБ. Напротив, уровень вязкости исследованной желчи в обеих порциях оказался повышенным и существенно (р<0,001—0,02) превышал контрольные значения. Также был высоким и уровень СРБ (р<0,001—0,05). Физико-химические параметры желчи, исходный уровень которых не превышал контрольных значений (рН желчи, ОХС и ОБ) на фоне проводимой терапии существенных изменений не претерпевали. Значения вязкости желчи и уровень СРБ у пациентов 1-й и 2-й группы по окончании курса лечения существенно улучшились (табл.).
Одним из клинических критериев проводимой терапии являлась оценка динамики болевого синдрома и диспепсических расстройств. У пациентов 1-й группы клинический эффект зарегистрировали уже на 2–5 сутки лечения. К концу первого курса лечения гимекромоном болевые ощущения и диспепсические расстройства разрешились у 35 пациентов (92,1%). У пациентов 2-й группы постепенное уменьшение болевого и прекращение диспепсических расстройств отметили только после 6-8 дней лечения.Полностью эти симптомы разрешились по окончании курса лечения гимекромоном только у 32 пациентов (82,1%).
Полученные результаты позволяют обсудить ряд вопросов. Во-первых, наше исследование показало, что хронический описторхоз нередко протекает на фоне различных заболеваний желудочно-кишечного тракта, в том числе и функциональных расстройств билиарного тракта, что требует дополнительных и специальных методов обследования. Во-вторых, результаты проведенных нами клинических исследований позволяют отметить, что обнаруженные физико-химические нарушения со стороны желчи обусловлены наличием паразитарной инфекции. В-третьих, необходимо отметить позитивный эффект курсовой медикаментозной терапии гимекромоном при билиарной дисфункции при проведении реабилитационной терапии после дегельминтизации.Из клинических симптомов при данной патологии наиболее значимым у наблюдаемого контингента больных являлось купирование болевого синдрома и диспепсических нарушений. Ведущая роль в развитии этих симптомов принадлежит повышению тонуса или спазму сфинктера Одди, его несогласованной деятельности по отношению к другим отделам желчевыделительнойсистемы, что приводит к повышению давления в желчных путях и застою желчи. Разрешение этих симптомов регистрировалось у большинства пациентов 1-й группы и наступало в более короткие сроки (в среднем в 1,5 раза быстрее), что существенно повышало их качество жизни. Вероятно, устранение болевого и диспепсического синдромов может быть обусловлено улучшением физико-химических свойств желчи, в частности с улучшением её реологических характеристик. Такие изменения способствуют не только понижению давления в желчных протоках, но и восстановлению согласованной деятельности различных отделов желчевыделительной системы. Кроме того, обнаруженное достоверное снижение уровня СРБ косвенно указывало на уменьшение воспалительных проявлений в желчном пузыре.
Таким образом, применение гимекромона в комплексной терапии при билиарной дисфункции, а также его включение в реабилитационную терапию после курса дегельминтизации у пациентов с хроническим описторхозом мы считаем обоснованной.
Это заболевание лечить нужно. Описторхоз
Окружному месячнику профилактики краевой патологии посвящается…
Это заболевание вылечить можно и даже нужно
Описторхозом болеют люди всех возрастов. Досадно, когда мы выявляем описторхоз у маленьких детей. Некоторые считают, что описторхозом можно заразиться через сырую воду. Это не верно. А вот не соблюдение правил гигиены при разделке рыбы и приготовлении детского питания может привести к заражению ребенка через разделочную доску или нож, которым резали рыбу, а потом, не достаточно промыв, другие продукты питания. Признаки описторхоза разнообразны. Заболевание может протекать в острой и хронической формах. Острая стадия протекает чаще всего, как острый аллергоз, проявляется через 2-6 недель после употребления зараженной рыбы. Острое начало описторхоза в детском возрасте встречается редко. Заподозрить наличие инвазии можно, если ребенок стал часто болеть ОРЗ, так как под воздействием гельминта угнетается иммунная система.
При ОРЗ часто наблюдается астмоидный компонент, появляются аллергические высыпания на коже, эозинофилия в крови, неустойчивый стул, непостоянные боли в животе. В результате воздействия червей и продуктов их жизнедеятельности в печени, желчном пузыре и поджелудочной железе возникает вначале острое воспаление, а спустя 2-3 месяца – хроническое. Больных беспокоят тяжесть и боли в правом подреберье, в области желудка, снижение аппетита, изжога, отрыжка, тошнота, вздутие живота, расстройства стула. При прогрессе воспалительного процесса у больных хроническим описторхозом могут возникнуть различные осложнения: кисты печени и поджелудочной железы, рубцовые сужения протоков, камнеобразование, механическая желтуха, в запущенных случаях рак печени, при которых показано хирургическое лечение. Лечение необходимо. Обязательно.
Среди населения бытует мнение, что лечить описторхоз, пока живешь на Севере, не обязательно. Это совершенно ошибочное мнение. Лечить описторхоз необходимо и у взрослых, и в особенности, у детей. Причем, чем раньше проводится лечение, тем оно эффективнее и легче переносится. Лечение описторхоза назначает врач-педиатр или врач-инфекционист. Для дегельминтизации применяется препарат, который парализует мышечную систему гельминта, в результате чего он открепляется от стенки желчных протоков и выводится с желчью. Через 3-4 месяца после лечения необходимо провести контроль излеченности методом исследования кала на яйца глист 3-х кратно. Контрольное обследование на яйцевыделение необходимо также повторить через 6 и 12 месяцев после дегельминтизации, так как за этот период при несоблюдении правил обработки и приготовления рыбы возможно повторное заражение описторхозом. Предупрежден – значит вооружен. Рыба – прекрасный продукт, богатый кальцием, фосфором, которые так необходимы для растущего организма, и есть её можно и нужно, только надо правильно приготовить.
Причиной большинства случаев заражения описторхозом является употребление соленого или вяленого язя, вяленых чебачков. Заражение широким лентецом происходит при употреблении рыбы хищных пород: щуки, окуня, налима, ерша. Особенно опасна слабосоленая щучья икра. Чтобы избежать заражения этими паразитами необходимо соблюдать следующие меры профилактики: • Рыбу готовить мелкими кусками, прожаривать небольшие куски или котлеты из рыбного фарша не менее 20 минут в большом количестве жира. • В ухе рыбу варить также небольшими кусками в течение 15- 20 минут с момента закипания. • Выпекать рыбные пироги не менее 45-60 минут. • Солить рыбу следует в течение 14 дней с использованием 2 кг соли на 10 кг рыбы. Крупная рыба (более 25 см) должна просаливаться 40 суток. Посол икры производить в течение 12 часов при количестве соли 6% к весу икры (60гр. соли на 1 кг. икры). • Вялить мелкую рыбу карповых пород необходимо в течение 3-х недель с предварительным трехдневным крепким посолом. Чем крупнее рыба, тем дольше она должна находиться в рассоле и затем дольше вялиться. • Нельзя употреблять строганину из свежезамороженной и свежевыловленной рыбы. Нужно помнить, что при замораживании рыбы в бытовых холодильниках, личинки описторхоза остаются жизнеспособными. • При приготовлении рыбы обязательно нужно соблюдать правила санитарии: иметь отдельный разделочный инвентарь, тщательно мыть ножи, разделочные доски и руки после обработки рыбы. А если все-таки болезнь не обошла Вас стороной, не тяните, обратитесь к врачу за консультацией и лечением.
Описторхоз: диагностика, лечение
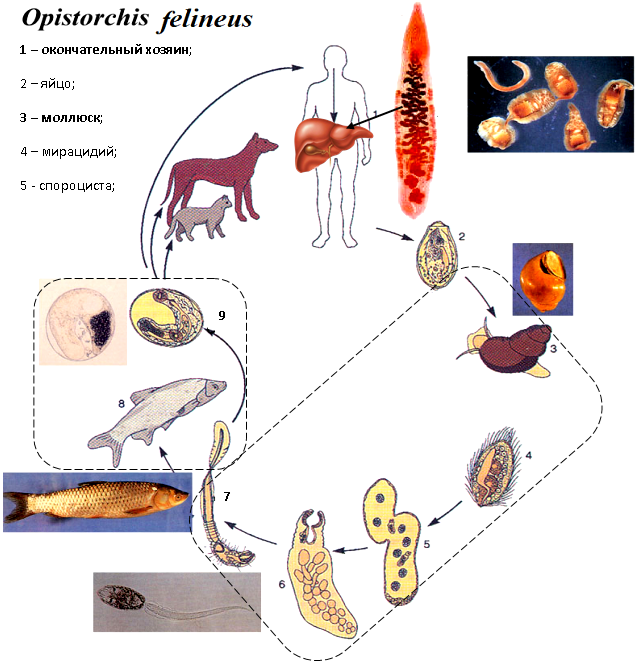
Описторхо́з (лат. opisthorchiasis) – это опасное паразитарное заболевание, вызываемое паразитическими плоскими червями из рода Описторхис. Употребление в пищу речной рыбы вызывает непосредственное заражение до 95 % населения Обь-Иртышского бассейна. Возбудителями описторхоза являются печеночные сосальщики двух видов: двуустка кошачья и двуустка сибирская – мелкий паразит ланцетовидной формы длиной 8–18 мм и шириной 1,2–2 мм.
Описторхисы паразитируют в желчных протоках печени, желчном пузыре и поджелудочной железе. Как происходит жизненный цикл паразита? Яйца описторхисов заглатывают пресноводные моллюски (рачки) рода Codiella, обитающие в пресных водоёмах. В теле моллюска происходит образование церкарий (личинок), они покидают моллюска и активно внедряются в тело речной рыбы.
В теле рыбы паразит располагается в мышцах и подкожной клетчатке. Здесь он переходит к следующей стадии развития и превращается в метацеркарий, который лежит в округлой цисте (защитной оболочке) серого цвета. Поэтому уже при чистке рыбы происходит обсеменение кухонных поверхностей и последующее заражение человека, даже если он не ест речную рыбу.
У освобождённого метацеркария хорошо видны две присоски и экскреторный пузырёк, заполненный чёрными гранулами. Через 6 недель после заражения рыбы паразит становится способным заражать конечного хозяина, в съедобной части одной рыбы может находиться до 20 000 личинок. Потенциальными носителями личинок описторхиса являются: язь, елец, плотва, красноперка, лещ, пескарь, карась, сазан и другие карповые виды рыб. В настоящее время установлено, что описторхисами заражено 29 видов рыб, в том числе такие «благородные» как стерлядь и муксун!
Конечные хозяева паразитов (человек, кошки, собаки, лисицы, песцы, хорьки и другие плотоядные животные) заражаются после поедания речной рыбы. В желудке и начальном отделе тонкого кишечника конечного хозяина метацеркарии освобождаются от цист, после чего проникают через желчные протоки в желчный пузырь и желчные ходы печени. Здесь они через 10–12 дней достигают половой зрелости и начинают откладывать яйца.
Яйца паразита, попавшие на почву, погибают в течение 8–10 дней, при попадании же в воду сохраняют жизнеспособность до года. В теле конечного хозяина паразит может обитать в течение десятков лет.
Следует обратить внимание, что люди, кошки, собаки и другие плотоядные животные так как они выделяют только яйца, а не личинки!
Различают острый описторхоз (от нескольких дней до 4–8 недель), он развивается у впервые заболевших людей, недавно попавших в зону распространения описторхоза и хронический описторхоз, который характерен для жителей эндемичных районов (Западная Сибирь и другие), продолжается 15–25 лет и пожизненно!
Негативное воздействие описторхоза на организм человека. Какой вред приносят описторхисы?
Хроническая интоксикация, обусловленная описторхозом, может являться также причиной возникновения различных аллергических проявлений вплоть до отека Квинке. У больных отмечаются аллергические кожные реакции (дерматит, экзема, псориаз и др.), аллергические суставные боли. Хронические тонзиллит, аденоидит, бронхит, бронхиальная астма и другие заболевания зачастую вызываются токсическим действием описторхисов. Дети отстают в росте и весе, хуже учатся в школе.
Клинически выявить этот паразитоз невозможно, он проявляется симптомами различных заболеваний. При хроническом описторхозе часто выявляются гастрит, дуоденит, язвенная болезнь желудка или двенадцатиперстной кишки, рефлюкс-эзофагит (ГЭРБ), панкреатит, холецистит, желчекаменная болезнь, цирроз печени, ВСД (вегетососудистая дистония), сахарный диабет 2 типа, аллергические и аутоиммунные заболевания и их различные последствия. Симптоматика часто бывает не ярко выраженной. Он может протекать бессимптомно, возможно проявление клинических симптомов через 10–20 лет после заражения.
У отдельных больных хронический описторхоз может проявляться только симптомами холецистита, холангита, у других – преимущественно признаками недостаточности пищеварительных ферментов – плохим пищеварением, у третьих – общетоксическими и аллергическими реакциями.
При хроническом описторхозе часто возникают нарушения психоэмоционального состояния, которые могут проявляться головной болью, головокружением, нарушением сна, эмоциональной неустойчивостью, апатией, депрессией, гиперактивностью у детей, раздражительностью, частой сменой настроения и др. После снижения токсического воздействия описторхисов психоэмоциональная сфера, как правило, нормализуется.
При описторхозе нередко возникают признаки поражения сердца: больные жалуются на боль или неприятные ощущения в области сердца, аритмию. Нам известны случаи, когда у больных с обострением сердечной патологии значительно улучшалось состояние здоровья после лечения описторхоза.
Наличие описторхоза часто сопровождается снижением иммунитета, вирусными и бактериальными инфекциями. По словам больного с большим стажем описторхоза, при лечении в стационаре сахарного диабета 2 типа, который возник у него вследствие паразитоза, он переболел тремя внутрибольничными инфекциями! Настолько был снижен иммунитет.
Особая опасность описторхоза заключается еще и в том, что по данным ученых Института цитологии и генетики СО РАН, выделения описторхисов, кроме общего токсического действия, обладают генотоксическим действием, могут повреждать ДНК и вызывать предраковые изменения клеток. Любителям речной рыбы следует знать, что описторхоз увеличивает риск онкологических заболеваний!
Возможен также своеобразный симбиоз описторхисов и микробов. Так, Е.Н. Ильинских (2002) установил, что описторхисы, по выражению автора, буквально «начинены» микроорганизмами, в том числе лямблиями, сальмонеллами, Helicobacter pylori и др. Нередко у больных описторхозом возникают проблемы с желудком, у них обнаруживают бактерии Helicobacter pylori, назначается медикаментозное лечение желудочной патологии.
Коварство описторхоза и заключается в том, что врачи годами лечат заболевания отдельных органов и систем, не связывая ухудшение состояния с патологическим действием описторхисов.
Диагностика описторхоза до сих пор остается серьезной проблемой и осуществляется по наличию яиц в кале, при дуоденальном зондировании, методом иммунно-ферментного анализа крови. Определить их наличие можно только в период активности, а этот период у каждого симбиоза: человек-паразит свой (далеко не всегда весной и осенью, как принято считать).
Например, нам известен случай, когда у больного, по его словам завзятого рыбака, с явными клиническими проявлениями возможного описторхоза: хронический холецистит, суставная, кожная патология и др., описторхоз был выявлен только на пятом дуоденальном зондировании, которое было проведено с момента поступления в стационар. /Ранее по просьбе заведующего отделением мы провели обследование этого больного и установили описторхоз./
Мы используем инновационную методику диагностики описторхоза без дуоденального зондирования с помощью диагностического прибора «Кирлиан-биоэлектрограф» по характерной картине свечения пальцев рук и ног.
Прибор покажет особенности свечения, излучаемого вашими пальцами. Многолетние исследования показали, что у больных описторхозом отмечаются косвенные признаки описторхоза – тотальное (повсеместное) распространение маркеров интоксикации — токсических пятен свечения на фотографиях свечения (кирлианограммах) пальцев рук и ног.
Кирлианограммы пальцев рук и ног пациентов с подтвержденным диагнозом «Описторхоз» — токсические пятна свечения:
Результаты такой диагностики описторхоза подтверждаются методом дуоденального зондирования и другими рутинными методами. Ниже вы увидите, как разительно меняется картина свечения после курса лечения по программе, разработанной в нашем медицинском центре.
Лечение описторхоза в настоящее время проводится, в основном, с помощью медикаментозного препарата бильтрицид (празиквантель) под защитой капельниц в условиях стационара. Считается, что эффективность действия препарата составляет 85–90 %, но проблема в том, что полностью освободить организм от паразитов не удается, а сам препарат обладает рядом побочных эффектов, особенно страдает печень.
Проблема лечения описторхоза заключается в том, что личинок паразита в виде цист (в защитных оболочках) в организме может быть большое количество. При заражении не все личинки развиваются в половозрелые особи, которые дают потомство в виде яиц. Множество личинок (цист) могут годами и десятилетиями находиться в организме в «спящем состоянии». После лечения и уничтожения половозрелых особей «спящие» просыпаются и начинается заново процесс развития паразита.
А у человека, несмотря на отказ в употреблении речной рыбы, возникает рецидив заболевания, в анализах снова появляются яйца описторхисов, снова проявляются клинические нарушения: кожная сыпь и другие проявления. Такие случаи известны и в нашей практике встречались не раз.
Поэтому однократное лечение описторхоза даже эффективным препаратом бильтрицид не дает желаемого результата, а более двух курсов лечения вследствие токсичности лекарства проводить запрещается. Кроме того, само по себе «уничтожение» какого-то количества описторхисов не дает стойкого улучшения здоровья, ведь организм остается «отравленным».
В связи с широким распространением описторхоза среди населения и его негативным воздействием на состояние всего организма, нами была разработана немедикаментозная программа лечения описторхоза. Она оказалась простой и эффективной, будет описана ниже.
Лечение описторхоза без химии, очищение организма (лимфосанация)
Программа выполняется амбулаторно (в домашних условиях) в 3 этапа, курс –5 недель.
1 этап – подготовка: общее очищение организма – энтеросорбенты (поглощающие токсины), очищение желчных протоков — применяются желчегонные препараты, гепатопротекторы, проводится тюбаж печени и желчевыводящих путей (шиповник и сорбит, магнезия). Курс 2 недели, в зависимости от степени интоксикации может быть продлен.
2 этап – дегельминтизация (уничтожение) описторхисов: препарат Экорсол (экстракт коры осины), курс 7 дней, при необходимости дополнительно применяется препарат Фиторал № 2.
3 этап – лимфосанация: усиление очищения межклеточного пространства, лимфостимуляция, очищение печени и желчевыводящих путей, восполнение витаминов, микроэлементов и других нутриентов. Курс 2 недели.
Лечение описторхоза с помощью программы позволяет улучшить состояние при самых различных патологиях, потому что устраняется причина – загрязнение межклеточного пространства.
Кирлианограммы пальцев конечностей пациентки М.
D.S. Хронический описторхоз, два года назад прошла курс лечения бильтрицидом
По данным метода Кирлиан-диагностики – косвенные признаки описторхоза (тотальное распространение токсических пятен свечения), диагноз подтвердился при дуоденальном зондировании. После выполнения программы – положительная динамика свечения. Прошли боли в спине, суставах ног, исчезли фурункулы, которые безуспешно лечили различными способами, нормализовались биохимические показатели крови. Улучшились состояние и цвет кожи, исчезло депрессивное состояние, появился блеск в глазах, «прилив сил».
Программа доказала свою эффективность при оздоровлении людей с самыми различными патологиями: сахарный диабет 2 типа, аллергия, бронхиальная астма, полиартрит, псориаз и другими.
Для профилактики рецидивов и сохранения хорошего уровня здоровья программу рекомендуется повторять 1 – 2 раза в год.
Хроническая болезнь почек у больных псориазом, хроническим описторхозом и при их сочетании | Колосовская
1. Алексеева М.И. Поражение почек при паразитозах: учебное пособие. М., 1989. 35 c.
2. Белозѐров Е.С., Шувалова Е.П. Описторхоз. Л., 1981. 96 с.
3. Зубов Н.А. Патологическая анатомия описторхоза и его осложнений: Автореф. дис. … д-ра мед. наук. Свердловск, 1973. 35 с.
4. Ентина П.Я., Шлычков А.В., Новикова М.А. Системные аллергические васкулиты при описторхозной инвазии // Клинико-иммунол. аспекты внутренней и инфекц. патологии в эндемичном очаге описторхоза: сб. науч. трудов. Омск, 1987. С. 69—75.
5. Калюжина М.И., Калюжин О.В., Калюжин В.В., Шкалев М.В. Резидуальный описторхоз. М.: РАМН, 2004. 213 с.
6. Котряхова Л.П. Влияние сопутствующих заболеваний на течение и исход псориаза: автореф. дис. … канд. мед. наук. СПб., 2001. 22 с.
7. Лаптева Г.Ф. Описторхозная нефропатия // Врач. дело. 1990. № 2. С. 67—69.
8. Локтева И.М. Хронический описторхоз и функция почек // Журн. практ. врача. 1997. № 2. С. 19—20.
9. Озерецковская Н.Н., Бычков В.Г., Скареднов Н.И. Хронический описторхоз // Мед. паразитология и паразитар. болезни. 1985. № 5. С. 3—11.
10. Павлов Б.А. Острый описторхоз: клиника, диагностика, лечебно-оздоровительные мероприятия. Томск, 1990. 110 с.
11. Пальцев А.И., Мигуськина Е.И. Болезни органов пищеварения при хроническом описторхозе // Практ. врач. 1999. № 3. С. 23—26.
12. Панасюк Н.Н. Поражение почек при псориазе (клиникоморфологическое исследование): автореф. дис. … канд. мед. наук. М., 1990. 16 с.
13. Рычкова Е.К., Козина О.И., Сазонова Л.В. Поражение почек при описторхозе // Материалы 1-го съезда терапевтов Тюменской области. Тюмень, 1970. С. 88—90.
14. Смирнов А.В., Есаян А.М., Каюков И.Г. Хроническая болезнь почек: на пути к единству представлений // Нефрология. 2002. № 4. С. 11—17.
15. Шилов В.Н. Псориаз — решение проблемы (этиология, патогенез, лечение). М.: Медицина, 2001. 304 с.
16. Хардикова С.А. Патология желудочно-кишечного тракта у больных псориазом в сочетании с хроническим описторхозом: автореф. дис. … д-ра мед. наук. Томск, 2003. 56 с.
17. Шульцев Г.П., Цаленчук Я.П., Ольхин В.А. Нефротический синдром при описторхозе // Клинич. медицина. 1973. № 8. С. 132—135.
18. Boonpucknavid S., Boonpucknavid V., Tanvanich S. Development of immune — complex glomerulonephritis and and amiloidosis in Syrian golden hamsters infected with opistorhorchis viverrini // J. Med. Assoc. Thai. 1992. V. 75, № 1. P. 7—9.
| Авторы |
Афтаева Лариса Николаевна, кандидат медицинских наук, доцент, кафедра микробиологии, эпидемиологии и инфекционных болезней, Медицинский институт, Пензенский государственный университет (Россия, г. Пенза, ул. Красная, 40), E-mail: [email protected] |
Список литературы |
1. Аринжанов, А. Е. Описторхоз: эпидемиология, профилактика, лечение / А. Е. Аринжанов, А. Ю. Лядова // Территория науки. – 2016. – № 6. – С. 7–13. |
CDC — DPDx — Описторхоз
Возбудители
Трематоды (сосальщики) Opisthorchis viverrini (печеночный двуусток из Юго-Восточной Азии) и Opisthorchis felineus (печеночный двуусток кошачьей двуустки).
Жизненный цикл
Взрослые двуустки откладывают полностью развитые яйца, которые выводятся с калом. После проглатывания подходящей улиткой (первым промежуточным хозяином) из яиц выделяются мирацидии, которые проходят у улитки несколько стадий развития (спороцисты, редии, церкарии).Церкарии высвобождаются из улитки и проникают в пресноводную рыбу (второй промежуточный хозяин), инцистируя метацеркарии в мышцах или под чешуей. Окончательный хозяин-млекопитающее (кошки, собаки и различные рыбоядные млекопитающие, включая человека) заражаются при поедании недоваренной рыбы, содержащей метацеркарии. После проглатывания метацеркарии выходят из двенадцатиперстной кишки и поднимаются через ампулу Фатера в желчные протоки, где они прикрепляются и развиваются во взрослых особей, откладывающих яйца через 3-4 недели.Взрослые двуустки ( O. viverrini : от 5 мм до 10 мм от 1 мм до 2 мм; O. felineus : от 7 мм до 12 мм от 2 мм до 3 мм) обитают в желчных и панкреатических протоках млекопитающих. хозяин, где они прикрепляются к слизистой оболочке.
Географическое распространение
Opisthorchis viverrini встречается в основном на северо-востоке Таиланда, Лаосе, Камбодже, а также в центральном и южном Вьетнаме. Opisthorchis felineus встречается в основном в Италии, Германии, Беларуси, России, Казахстане и Украине.
Клиническая презентация
Большинство инфекций протекает бессимптомно. Большинство патологических проявлений возникает в результате воспаления и периодической непроходимости желчных протоков. В легких случаях проявления включают диспепсию, боль в животе, диарею или запор. При более длительных инфекциях симптомы могут быть более серьезными, могут присутствовать гепатомегалия и недоедание. В редких случаях может развиться холангит, холецистит и холангиокарцинома. Кроме того, инфекции, вызванные Opisthorchis felineus , могут иметь острую фазу, напоминающую лихорадку Катаяма (шистосомоз), с лихорадкой, отеком лица, лимфаденопатией, артралгиями, сыпью и эозинофилией.Хронические формы инфекций Opisthorchis felineus имеют те же проявления, что и Opisthorchis viverrini , но с поражением протоков поджелудочной железы.
Описторхоз — обзор | Темы ScienceDirect
124.1 Описторхоз и клонорхоз
Введение
Описторхоз и клонорхоз вызываются печеночными сосальщиками из рода Opisthorchiadae и Clonorchiadae . Три наиболее распространенных вида, вызывающих заболевания у человека, — это Opisthorchis viverrini, O.felineus и Clonorchis sinensis .
Эпидемиология
Opisthorchis viverrini является эндемиком Юго-Восточной Азии, в основном Таиланда, Лаосской Народно-Демократической Республики, южной части Вьетнама и Камбоджи. Распространенность на северо-востоке Таиланда составляла 90% в 1980-х годах и остается около 20%, несмотря на меры контроля. Opisthorchis felineus является эндемиком России и Восточной Европы, а C. sinensis обычен в Корее, Китае и северном Вьетнаме.В эндемичных районах дети в возрасте от 1 года были инфицированы O. viverrini .
Естественная история, патогенез и патология
Люди являются случайным хозяином O. viverrini, O. felineus и Clonorchis sinensis . Употребление в пищу сырых или недоваренных карповых рыб (например, карпа), содержащих метацеркарию — инфекционную стадию этих сосальщиков, — приводит к инфицированию. Метацеркария, выделяющаяся в кишечнике, перемещается через ампулу Фатера в общий желчный проток к желчному пузырю и периферическим желчным протокам в печени и превращается во взрослых червей (рис.124,1). Взрослые черви выделяют яйца, которые выводятся с калом. Попав в пресную воду, из яиц вылупляются мирацидии, которые поглощаются улитками, в которых происходит размножение паразитов. Церкарии выходят из улиток и заражают восприимчивых пресноводных рыб, инцистируя их как метацеркарии.
Присутствие взрослых червей в желчных протоках вызывает хроническое раздражение; черви также выделяют токсичные метаболические вещества. Иммунный ответ приводит к инфильтрации эозинофилами и мононуклеарными клетками в перидуктальных областях; могут возникнуть вторичные бактериальные инфекции.Наблюдается десквамация эпителиальных клеток желчных протоков, гиперплазия эпителиальных клеток и железистая пролиферация (рис. 124.2). Внутрипеченочные желчные протоки расширяются с появлением булавы на дистальной части и кистозными изменениями. Желчный пузырь может быть расширен и содержать белесую желчь [1], а на его стенке могут быть видны гипертрофированные эпителиальные клетки. Степень тяжести патологии зависит как от интенсивности, так и от продолжительности инфекции. Хронические изменения в сочетании с эндогенными и экзогенными канцерогенами, особенно с нитрозаминами, вызывают мутагенные изменения в эпителии желчных протоков и могут привести к холангиокарциноме.
Клинические характеристики
Острые симптомы чаще встречаются при заражении C. sinensis и O. felineus и редко встречаются при O. viverrini . Высокая температура, артралгия, миалгия, увеличение лимфатических узлов, эозинофилия и, иногда, отек лица могут возникать через 2–3 недели инфекции во время миграции и развития глистов [2]. Поскольку черви еще не созрели, на этой стадии яйцеклетки в кале обнаруживаться не будут. Заболевание обычно длится 1-2 недели. Иногда наблюдается аллергический гепатит, особенно в тяжелых случаях.
Хронические инфекции обычно протекают бессимптомно. Большинство инфекций обнаруживается при обычном осмотре кала. В симптоматических случаях жалобами являются неспецифические симптомы, такие как усталость, анорексия, метеоризм, дискомфорт в животе, плохой аппетит и периодический жидкий стул. Своеобразное ощущение жара в правой верхней части живота — характерный симптом, обнаруживаемый при инфекции O. viverrini . При обследовании обнаруживается субфебрильная температура и гепатомегалия [3].
Осложнения, такие как рецидивирующий холангит или абсцесс, вызванные вторичными бактериальными инфекциями, часто встречаются при запущенной инфекции.Пациенты обращаются с лихорадкой, желтухой и болями в животе с гепатомегалией и увеличенным желчным пузырем. Холангиокарцинома тесно связана с инфекциями описторхиса и клонорхиса [4], особенно в сочетании с диетой с высоким содержанием нитрозаминов. Исследования на животных документально подтвердили, что у хомяков, инфицированных O. viverrini , развилась холангиокарцинома при питании с высоким содержанием нитрозаминов [5].
Оценка пациента и дифференциальный диагноз
Поскольку пациенты с ранней или легкой инфекцией могут протекать бессимптомно, диагноз обычно основывается на рутинном исследовании стула.Люди в эндемичных районах, которые едят сырую рыбу и имеют неспецифические абдоминальные симптомы, должны ежегодно проходить обследование стула на Opisthorchis или Clornorchis ova. Однако эти яйцеклетки трудно отличить от сосальщиков, присутствующих в тонком кишечнике [6]. Пациенты с инфекцией кишечного сосальщика обычно страдают хронической водянистой диареей.
Острый описторхоз или клонорхоз отличаются от острого фасциолеза, острого шистосомоза и других тканевых паразитов по анамнезу и эпидемиологии.
На поздних стадиях болезни пациенты могут иметь механическую желтуху, холангит или холангиокарциному; другие причины механической желтухи, такие как камни желчных путей, должны быть исследованы.
Диагноз
Обследование кала на Opisthorchis или Clonorchis ova является стандартом диагностики. Другие образцы, которые можно использовать для обнаружения яйцеклеток, — это двенадцатиперстная жидкость или желчь, взятые с помощью эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) или во время операции.
Серология может использоваться для диагностики острой инфекции, но не помогает при хронической инфекции или повторном инфицировании в эндемичных районах, так как положительные антитела сохранятся после лечения. Обнаружение со-проантигена можно использовать как «тест на излечение» после лечения.
ПЦР позволяет обнаруживать ДНК Opisthorchis в образцах фекалий и отличать их от кишечных сосальщиков с высокой чувствительностью и специфичностью. Это также полезно для эпидемиологических обследований [7].
Ультрасонография печени и желчного пузыря на ранних стадиях инфекции обычно показывает увеличенный нефункционирующий желчный пузырь с осадком.Инфекции на более поздних стадиях могут проявляться расширением внутрипеченочных желчных протоков или образованием. Новообразование в печени с расширением желчных протоков внутри очага поражения свидетельствует о холангиокарциноме. Холангиография проводилась до того, как стала доступна компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Могут быть визуализированы расширенные внутрипеченочные желчные протоки с дистальной булавой (рис. 124.3), а также случайные дефекты наполнения из-за наличия взрослых сосальщиков (рис. 124.4). КТ или МРТ полезны для определения стадии холангиокарциномы.
Лечение
Opisthorchis viverrini
Празиквантел — препарат выбора. При дозе 25 мг / кг массы тела перорально три раза в течение 1-2 дней показатель излечения составил 100% [8]. Однократная доза 40 мг / кг перед сном дала 91–95% излечение, тогда как доза 50 мг / кг дала 97% излечение, но с более высокой частотой нежелательных явлений [9, 10]. Поэтому для массового лечения рекомендуется празиквантел в дозе 40 мг / кг.
Альбендазол в дозе 400 мг два раза в день в течение 3–7 дней показал частоту излечения только 40–63% [11].
Clonorchis sinensis
Празиквантел эффективен при клонорхозе. Двадцать пять мг / кг три раза в день в течение 1 дня дают 85% излечение, в то время как та же доза, вводимая в течение 2 дней, излечивает до 100%. Однократная доза 40 мг / кг дала только 25% излечение [12].
Пациентам с вторичным холангитом следует назначать противомикробные препараты. При раннем обнаружении холангиокарцинома может быть удалена. Однако при позднем обнаружении паллиативное лечение путем оттока желчи может помочь облегчить симптомы механической желтухи.Прогноз для этих пациентов плохой, поскольку химиотерапия или лучевая терапия обычно не эффективны при холангиокарциноме.
Профилактика и контроль
Тщательное приготовление рыбы — лучший способ предотвратить заражение. Это должно быть обеспечено посредством непрерывного санитарного просвещения в эндемичных районах. Меры борьбы с помощью программ массового лечения и улучшения санитарии могут снизить распространенность.
Биомаркер поздних почечных и гепатобилиарных патологий при хроническом описторхозе
Abstract
Примерно 680 миллионов человек подвержены риску заражения Opisthorchis viverrini (OV) и Clonorchis sinensis , при этом только в Юго-Восточной Азии около 10 миллионов инфицированы OV.В то время как описторхоз связан с гепатобилиарными патологиями, такими как продвинутый перидуктальный фиброз (APF) и холангиокарцинома (CCA), животные модели инфекции OV показывают, что иммунный комплексный гломерулонефрит является важной патологией почек, которая развивается одновременно с гепатобилиарной патологией. Кардинальным признаком иммунокомплексного гломерулонефрита является экскреция с мочой иммуноглобулина G (IgG) (микропротеинурия). В исследованиях на уровне сообществ в эндемичных по OV районах вдоль реки Чи на северо-востоке Таиланда мы обнаружили, что более половины участников имели IgG в моче против неочищенного экстракта антигена OV (антиген OV).Мы также наблюдали, что повышенные уровни IgG в моче к антигену OV не были связаны с интенсивностью инфекции OV, но, вероятно, были результатом иммунного комплексного гломерулонефрита, как это видно на животных моделях инфекции OV. Более того, мы наблюдали, что IgG к антигену OV с мочой экскретировались в концентрациях, в 21 раз выше у лиц с APF и в 158 раз выше у лиц с CCA, чем в контрольной группе. Мы также заметили, что повышенный уровень IgG в моче к антигену OV может идентифицировать APF + и CCA + индивидуумов от не больных.Наконец, люди с IgG в моче к антигену OV имели больший риск APF, как определено отношением шансов (OR = 6,69; 95% CI: 2,87, 15,58) и больший риск CCA (OR = 71,13; 95% CI: 15,13, 334,0), чем у лиц без определяемого уровня IgG к антигену OV в моче. Здесь мы впервые показываем обширное бремя почечной патологии в эндемичных для OV областях и что биомаркер мочи может служить для оценки риска как почечных, так и гепатобилиарных патологий во время инфекции OV, то есть служить «синдромным биомаркером » запущенные патологии от описторхоза.
Сведения об авторе
Примерно 680 миллионов человек рискуют заразиться трематодами пищевого происхождения, включая Opisthorchis viverrini (OV). Модели на животных показывают, что значительная патология почек является результатом инфекции OV, определяемой антителами в моче (микропротеинурия). Однако патология почек у людей, инфицированных OV, часто упускается из виду, поскольку она развивается вместе с более серьезными патологиями, такими как фиброз желчных протоков и рак желчных протоков. В северо-восточном Таиланде исследователи обнаружили, что у людей, инфицированных OV, был повышенный уровень IgG в моче против антигена OV, который не был связан с уровнем инфекции OV.Исследователи заметили, что IgG в моче к антигену OV были связаны с фиброзом желчных протоков и раком желчных протоков. Более того, люди с IgG мочи к антигену OV также имели повышенный риск фиброза желчных протоков и рака желчных протоков, чем люди без IgG мочи к антигену OV. Впервые было показано, что инфекция OV приводит к серьезному заболеванию почек у людей, которое также тесно связано с патологией желчных протоков. Анализ мочи, который может указать на патологию как почек, так и желчных протоков, вызванную инфекцией OV, принесет большую пользу в Юго-Восточной Азии, особенно в странах с ограниченными ресурсами в странах бассейна Меконга в Таиланде, Лаосе и Камбодже.
Образец цитирования: Saichua P, Sithithaworn P, Jariwala AR, Deimert DJ, Sithithaworn J, Sripa B, et al. (2013) Микропротеинурия во время инфекции Opisthorchis viverrini : биомаркер поздних почечных и гепатобилиарных патологий при хроническом описторхозе. PLoS Negl Trop Dis 7 (5): e2228. https://doi.org/10.1371/journal.pntd.0002228
Редактор: Сяо-Нун Чжоу, Национальный институт паразитарных заболеваний Китайский центр по контролю и профилактике заболеваний, Китай
Поступила: 28 февраля 2013 г. ; Одобрена: 9 апреля 2013 г .; Опубликовано: 23 мая 2013 г.
Авторские права: © 2013 Saichua et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Описанная здесь работа была поддержана доктором философии Royal Golden Jubilee. Программа (грант № PHD / 0252/2549 для П. Сайчуа), Продвижение исследований в области высшего образования и Управление Комиссии по высшему образованию, через кластер здравоохранения (SHeP-GMS), а также награды R01CA155297 (JMB и JPM) от Национальный институт рака и P50 AI098639 (BS, P.Saichua, TL, и JMB) от Национального института аллергии и инфекционных заболеваний и поддержки стипендий (JPM) от Национального совета по здравоохранению и медицинским исследованиям Австралии. Авторы несут исключительную ответственность за содержание и не обязательно отражают официальную точку зрения доктора философии Royal Golden Jubilee. Программа, NIAID, NCI, NIH или NHMRC. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, решении опубликовать или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Трематодозы пищевого происхождения представляют собой важную группу инфекционных заболеваний и некоторые из наиболее клинически значимых забытых тропических болезней (NTD), поражающих Восточную Азию. Примерно 680 миллионов человек подвержены риску заражения печеночными двуустками человека Opisthorchis viverrini и Clonorchis sinensis [1]. Только в Юго-Восточной Азии до 67 миллионов человек подвержены риску заражения O. viverrini (OV), при этом 10 миллионов человек, по оценкам, инфицированы этим патогеном в субрегионе бассейна реки Меконг в Таиланде и Лаосской Народно-Демократической Республике [2], [3].Люди заражаются OV при употреблении в пищу сырой или недоваренной рыбы, имеющей инфекционную метацеркариальную стадию (см. Обзор [4]). Хотя инфекция может быть устранена с помощью антигельминтного празиквантела, экологические и культурные факторы региона бассейна Меконга сильно способствуют повторному инфицированию [4]. Несмотря на усилия по массовому введению лекарств (MDA) в северо-восточном регионе Таиланда (Исаан), распространенность OV остается неизменно высокой [5], [6].
Наши ультразвуковые исследования по месту жительства в O.viverrini в эндемичных районах бассейна реки Чи в Кхон Каене, Таиланд, показали, что значительная заболеваемость возникает на ранних этапах хронической инфекции OV, включая запущенные гепатобилиарные патологии, такие как расширенный фиброз желчных протоков (перидуктальный) и рак желчных протоков ( холангиокарцинома или CCA) [7], [8]. Поскольку у людей симптомы не проявляются до поздних стадий этих заболеваний, раннее выявление остается важной задачей общественного здравоохранения [4], [6]. Хотя почечная недостаточность обычно не считается одной из наиболее серьезных патологий хронического описторхоза, как и многих других паразитарных инфекций (например,г. Plasmodium spp, Schistosoma spp, Filarioidea ) [9], гломерулопатия была обнаружена на лабораторных животных моделях инфекции OV [10], [11]. Более конкретно, в начале экспериментальной инфекции OV (8 недель) у хомяков развивается «мезангиопролиферативный гломерулонефрит», характеризующийся отложением иммунных комплексов (IC), состоящих из иммуноглобулина (Ig) G, компонента 3 (C3) комплемента и тегументального антигена OV. [10]. Через 12 недель у инфицированных хомячков наблюдается полное устаревание клубочков, характеризующееся отложением амилоида (белок AA), тубулярной атрофией, интерстициальным воспалением и канальцевым фиброзом, которые сочетаются с APF и CCA [10].Интересно отметить, что ухудшение функции почек было зарегистрировано у людей с механической желтухой из-за OV-ассоциированного CCA в эндемичных районах Таиланда [12], хотя это, вероятно, является проявлением «гепаторенального синдрома» (HRS), a частое осложнение терминальной стадии хронических заболеваний печени, таких как цирроз печени и рак печени [13].
Предыдущие исследования пытались показать корреляцию между интенсивностью инфекции OV и уровнями IgG в моче к различным неочищенным экстрактам антигена OV [14] — [16].Хотя моча может содержать небольшие количества «интактного» иммуноглобулина, а также фрагменты легких и тяжелых цепей иммуноглобулина, ограничительный радиус пор почечного клубочкового фильтра в здоровой почке человека не может фильтровать макромолекулы размером с интактный IgG (см. Обзор [ 17]). Таким образом, частое наблюдение повышенных уровней IgG к антигену OV в моче в областях с высокой передачей OV [14] — [16], скорее всего, отражает структурное повреждение в результате отложения иммунных комплексов в клубочках, как это наблюдалось в модели инфекции OV у хомяков [ 10], [11].В текущей рукописи мы исследовали присутствие IgG в моче к неочищенному экстракту антигена OV взрослых (антиген OV) у жителей эндемичных по OV районов вдоль бассейна реки Чи в Кхонкэне, Таиланд. Наша гипотеза состоит в том, что если уровни IgG к антигену OV в моче повышены у лиц с патологиями почек и гепатобилиарной системы, то этот неинвазивный и легко анализируемый биомаркер может служить единственным маркером для обеих патологий, то есть синдромным биомаркером « ». »Запущенных патологий хронического описторхоза.
Материалы и методы
Выборка исследования и дизайн исследования
В этом исследовании используются исходные данные из когорты больных раком Кхон Каен (KKCC), которая проводилась в семи (7) деревнях с высоким уровнем передачи ОВ в бассейне реки Чи в Кхон Каен, Таиланд. Подробное описание KKCC и методов, используемых для построения этой когорты, можно найти в нескольких рукописях [7], [8], [18]. Набор данных из KKCC включал 296 человек, разделенных на три клинические группы, описанные ниже и показанные в таблице 1.Вкратце, в KKCC были зачислены 148 мужчин и 148 женщин. По данным микроскопического исследования кала, из мужчин и женщин в этом наборе данных 256 (86,4%) были инфицированы OV. Участники KKCC были разделены на группы на основании ультразвукового исследования брюшной полости (УЗИ) и микроскопического исследования кала на наличие инфекции OV. Группа 1 состояла из 40 человек, считавшихся «эндемическими нормальными» (EN), которые были по возрасту, полу и «ближайшим подходящим соседом», соответствующим случаям (Группа 3), и были отрицательными на OV (OV-) и APF-отрицательными (APF-). как определено УЗИ брюшной полости.Группа 2 состояла из 139 человек, считавшихся «контрольной», которые были по возрасту, полу и «ближайшим подходящим соседом», соответствующим случаям (Группа 3), и были положительными на OV (OV +) и отрицательными на APF (APF-). Группа 3 состояла из 117 человек, считающихся «больными», которые были положительными по APF (APF +). Группа 4 не входила в состав KKCC и состояла из 98 человек с гистологически подтвержденным CCA, связанным с описторхозом, чьи образцы сыворотки и мочи были взяты из хранилища биологических образцов Исследовательского центра Liver Fluke и холангиокарциномы Университета Хон Каен, Таиланд.Лица, инфицированные OV, были направлены в местный пункт здравоохранения для лечения празиквантелом.
Заявление о соблюдении этических норм
Все субъекты в группах 1–3 предоставили письменное информированное согласие с использованием форм, утвержденных Комитетом по этике медицинского факультета Университета Кхон Каен, Кхон Каен, Таиланд (номер ссылки HE480528), и Советом по институциональному обзору Медицинского факультета Университета Джорджа Вашингтона. Вашингтон, округ Колумбия (GWUMC IRB # 020864). Сыворотка и моча из группы 4 были получены из хранилища биологических образцов Центра исследований печеночной двуустки и холангиокарциномы Университета Кхон Каен, Таиланд, с использованием протокола, одобренного Этическим комитетом по исследованиям на людях медицинского факультета Университета Кхон Каен, Таиланд ( справочные номераHE450525 и HE531061).
Клиническая оценка и сбор образцов
Оценка гепатобилиарного статуса проводилась с помощью абдоминального УЗИ с положительными результатами, оцененными как APF + или APF-, как описано ранее [7], [8]. Два образца фекалий были собраны в последовательные дни у каждого участника в группах 1-3; Образцы кала не были доступны для пациентов группы 4 (случаи CCA). Инфекцию OV определяли и количественно оценивали (количество яиц на грамм фекалий или epg) с помощью микроскопического исследования кала с использованием метода концентрирования формалин-этилацетат (FECT), как описано Elkins et al [19], на двух последовательных днях анализа фекалий.Кроме того, следующие образцы были также собраны из групп 1-3: тридцать (30) миллилитров (мл) венозной крови, собранной в силиконизированные пробирки после ночного голодания, и первые утренние пробы мочи в середине потока, собранные в стерильные контейнеры. Образцам венозной крови давали возможность свернуться при комнатной температуре в течение 30 минут после сбора, центрифугировали, сыворотку удаляли и отбирали аликвоты для хранения при -20 ° C в морозильной камере с контролируемой температурой. Образцы мочи центрифугировали, супернатант отбирали на аликвоты и хранили при -20 ° C в морозильной камере с контролируемой температурой.В случае пациентов с ОСО (группа 4) образцы сыворотки или мочи были получены путем простой случайной выборки из коллекции биологических образцов в хранилище Исследовательского центра печеночной двуустки и холангиокарциномы Университета Кхон Каен, Таиланд.
Тестирование на протеинурию в пунктах оказания медицинской помощи
Индивидуальных субъектов просили слить утреннюю мочу в чистые полипропиленовые контейнеры, которые держали на льду во время транспортировки в лабораторию. Необработанные образцы мочи проверяли на белок с помощью полоски мочи (ARKRAY’s AUTION Sticks, Япония), а затем анализировали с использованием автоматического химического анализатора мочи (AUTION MAX AX-4280, Arkray, США).
Получение неочищенного взрослого
экстракта антигена O. viverriniВзрослые особи O. viverrini от экспериментально инфицированных хомяков промывали трижды стерильным фосфатно-солевым буфером (PBS pH 7,2), содержащим 0,149 М хлорида натрия (Fisher Scientific, Нью-Джерси), 8,29 мМ динатрия гидрофосфата (Acros Organics, Нью-Джерси) и 18 мМ моногидрат дигидрофосфата натрия (Fisher Scientific, NJ) в деионизированной (DI) воде. К червям добавляли 100-кратный коктейль ингибиторов протеазы (Calbiochem, CA) в PBS, которые затем гомогенизировали с использованием измельчителя тканей на льду.Осадок червя гомогенизировали с помощью ультразвукового дезинтегратора (MISONIC sonicator 3000, США), а затем центрифугировали при 4 ° C, 14000 об / мин в течение 30 мин. Набор для анализа белка BCA ™ (PIERCE, IL) использовали для определения выхода белка из сырого соматического экстракта взрослого антигена О. viverrini . Супернатант собирали и хранили при -80 ° C до использования.
Разработка квалифицированного непрямого твердофазного иммуноферментного анализа (ELISA) для количественного определения антител к неочищенному экстракту антигена взрослых OV
96-луночные планшеты для микротитрования с плоским дном (Maxisorb, NUNC, DN) были покрыты 1 мкг / мл неочищенного соматического вещества O.viverrini взрослый антиген в буфере PBS (pH 7,2), который затем накрывали герметизирующей пленкой и инкубировали в течение ночи при 4 ° C в темноте. На следующий день планшеты промывали 5 раз буфером, содержащим 0,05% Tween20 в PBS (pH 7,2), с использованием автоматического устройства для промывки планшетов (Thermoelectron, MA). После промывания во все лунки добавляли 250 мкл блокирующего буфера, содержащего 5% BSA (Fitzgerald, MA) в PBS и 0,5% Tween-20 (Fisher, NJ), и планшеты инкубировали при комнатной температуре (RT) в течение 1 часа. . Образцы сыворотки разводили в буфере, который содержал 5% BSA (Fitzgerald, MA) в PBS и 0.5% Tween-20 (Fisher, NJ) и добавляли в лунки (100 мкл / лунку) в двух экземплярах и инкубировали в течение ночи при 4 ° C. Неразбавленные супернатанты мочи добавляли в лунки (100 мкл / лунку) в двух экземплярах и инкубировали в течение ночи при 4 ° C. Затем планшеты 5 раз промывали буфером PBS и 0,5% Tween-20, вторичное антитело, конъюгированное с пероксидазой хрена (HRP), добавляли во все лунки и инкубировали в течение 2 часов при комнатной температуре. HRP-козьи антитела против IgG человека (Zymed, CA) использовали для обнаружения IgG в сыворотке и моче. HRP-мышиный антител к человеческому IgG1 (Southern Biotech, AL) и HRP-мышиный антител к человеческому IgG4 (Zymed, Калифорния) использовали для обнаружения IgG1 и IgG4 в сыворотке соответственно.После инкубации и промывки раствор субстрата, который состоял из орто-фенилендиамина (Sigma, Миссури), 53 мМ лимонной кислоты безводной (Фишер, Нью-Джерси), 102 мМ додекагидрата двухосновного фосфата натрия (Acros Organics, Нью-Джерси) и 30% по массе водорода. перекись (Fisher, NJ) в деионизированной воде добавляли в лунки и инкубировали при комнатной температуре в темноте в течение 30 мин. Реакцию останавливали добавлением 2 н. Серной кислоты (BDH, PA), и планшеты считывали с помощью считывающего устройства для планшетов (система SpectraMax 340PC 384 ) при 492 нм.
Разработка непрямого ИФА для измерения IgG к OV-антигену в моче и сыворотке
Следуя методу Куинна и его коллег [20] — [22], мы разработали диагностический анализ с использованием непрямого ИФА, который включает «гомологичную интерполяцию» для определения концентрации анализируемого вещества (например, анти-OV IgG) в любой из разбавленных сывороток. или пробы неразбавленного супернатанта мочи путем интерполяции OD тестируемой сыворотки или супернатанта мочи при 492 нм на стандартную калибровочную кривую (SCC) на каждом микротитровальном планшете.Вкратце, стандартные контрольные сыворотки (SRS) и стандартный контрольный раствор мочи (SRS) были получены путем объединения сывороток или супернатантов мочи с известными высокими уровнями IgG и его подклассов против антигена Ov от людей, которые были положительными на O. viverrini ( см. ссылки на подробности этого метода [20] — [22]). Каждый SRS сыворотки и SRS мочи последовательно разводят на каждом микротитровальном планшете в два этапа с использованием буфера для разведения (5% бычий сывороточный альбумин в PBS и 0,5% Tween-20 при pH 7.2). OD каждой точки разбавления затем используются для создания SCC с помощью 4-PL регрессионного моделирования (программное обеспечение SOFTmax PRO версии 5.4) [23], [24]. Для создания SCC произвольные единицы (AU) антитела присваиваются стандартным калибровочным кривым, как показано в таблице S1. Функция 4-PL используется для моделирования характеристической кривой для SRS. Как показано Куинном и др. [22], SRS при серийном разведении должен иметь сигмоидальную форму при нанесении на шкалу разбавления OD-log10. Функция 4-PL соответствует этим данным с высокой степенью точности и расширяет диапазон анализа, обеспечивая более точное измерение концентрации антител в сыворотках пациентов [20] — [22].Кроме того, 8 лунок на каждый планшет для ELISA были назначены в качестве внутреннего контроля, состоящего из двух холостых проб (без образца с / без вторичного антитела), положительного контроля сыворотки и мочи и отрицательного контроля сыворотки и мочи. ELISA был аттестован на точность и прецизионность, как описано ранее [22].
Предел надежного обнаружения (RDL) непрямого ELISA
На рисунке S1 графически представлены методы, использованные для получения RDL, который использовался в качестве порогового значения, выше которого образец сыворотки или мочи считался положительным на антитела против антигена OV.Рисунок S1. Панели A, C, E и G показывают среднее значение объединенных SCC для каждой пары антитело-антиген (например, сывороточный IgG1 к антигену OV) и их 95% интервалы доверительного интервала. Рисунок S1. Панели B, D, F и H показывают вывод RDL. Аналогично Quinn et al. [22], RDL был получен из уровня AU для каждого антитела против OV-антигена, соответствующего интерполированному пересечению верхней асимптоты 95% ДИ с нижним 95% ДИ данных стандартов, как показано на Рисунке S1 Панели B , D, F и H.Образец супернатанта человеческой сыворотки или мочи с единицами произвольного антитела выше RDL был определен как «реактивный» (положительный), а образец с единицами произвольного антитела ниже RDL как «нереактивный» (отрицательный), как показано в таблице 2.
Рабочие характеристики непрямого ИФА
Снова, следуя Quinn et al., [22], мы определили «точность» анализа ELISA как точность анализа для измерения известного истинного значения анти-OV IgG в моче и его повторного измерения и выразили точность анализа в процентах. ошибка между значениями, определенными анализом, и назначенным значением для этой сыворотки.Ошибка в процентах ≤20% считалась приемлемым уровнем точности для представленных здесь ELISA [22], [25]. Мы также определили «точность» анализа согласно Quinn et al [22], [25] как меру степени повторяемости анализа при нормальных рабочих условиях и выразили точность анализа как коэффициент вариации (CV) концентраций. рассчитаны для разведений SCC в одном планшете для анализа (точность внутри анализа) и между разными планшетами (точность между анализами), определенных с течением времени и контролируемых разными операторами.Приемлемые уровни точности внутри анализа и между анализами составляют 10% и 20% соответственно [22], [25]. «Степень соответствия» каждого SCC использовалась для определения того, насколько точно каждая SRS соответствует модели 4-PL. Качество подгонки выражалось как коэффициент регрессии ( R 2 ) SCC. Значение R 2 , которое приближается к единице (1,00), указывает на хорошее соответствие данных кривой [22], [25], и они показаны для каждого SCC на рисунке S1, панели A, C, E и Г.
Анализ клинических данных
Распределения данных оценивались на нормальность. Для нормально распределенных данных различия между AU антитела к антигену OV сравнивали между разными матрицами (мочой или сывороткой) по клиническим группам или по различным матрицам, используя интенсивность инфекции OV с помощью t-критерия Стьюдента. Непараметрические данные сравнивались с использованием U-критерия Манна-Уитни. Односторонний дисперсионный анализ ANOVA (нормально распределенные данные) или тесты Краскела-Уоллиса (ненормально распределенные данные) использовались для определения статистически значимых ассоциаций между вышеупомянутыми группами с последующим попарным сравнением с поправкой Бонферонни при сравнении пар в каждой группе.Все статистические анализы были выполнены с использованием SAS 9.2. Результаты считались значимыми, когда значение p было меньше <0,05.
Чувствительность рассчитывалась как количество людей с уровнем IgG в сыворотке или моче к антигену OV выше порогового значения для каждого анализа, определяемого с помощью кривых характеристик оператора приемника (ROC), полученных с помощью программного обеспечения ROCKIT1.1. Специфичность рассчитывалась как количество людей с сывороточными или мочевыми IgG к антигену OV ниже порогового значения, установленного для каждого анализа, деленное на общее количество контрольных индивидуумов (EN или APF-).Поскольку мы предлагаем эти анализы в качестве скрининговых тестов, мы выбрали пороговые значения для достижения максимальной чувствительности без потери специфичности: т. Е. Наилучшего компромисса между высокой чувствительностью и умеренной специфичностью. Площадь под кривой (AUC) является мерой достоверности ROC. Линия под углом 45 градусов в каждом анализе кривой ROC включает площадь, равную 0,50, и эквивалентна использованию процедуры подбрасывания монеты для классификации участников. Чтобы рассчитать положительные прогностические значения (PPV) для каждого анализа, мы использовали 50% -ную распространенность инфекции OV, определенную с помощью микроскопического исследования кала в возрастном диапазоне от 20 до 60 лет из наших предыдущих исследований KKCC [7], [8] ], [18].Следующая формула была использована для оценки положительной прогностической ценности с распространенностью, установленной на уровне 0,50 для каждого:
Результаты
Характеристики исследуемой выборки
В таблице 1 показан возраст участников исследования по клиническим группам. Из двухсот девяноста шести (296) человек, предоставивших образцы кала для исследования методом FECT (группы 1, 2 и 3), 256 (86,4%) были подтверждены как инфицированные OV при микроскопическом исследовании кала. Сто семнадцать человек (n = 117) получили статус APF + и статус дела.Кроме того, 139 индивидуумам OV + и APF- были присвоены статусы по возрасту, полу и соответствующая контрольная группа «ближайший приемлемый сосед» (группа 2). Обратите внимание, что больший размер выборки контролей связан с тем, что 22 случая были сопоставлены с двумя контролями для большего размера выборки. Сорок (n = 40) индивидуумов OV- и APF- были присвоены статусы эндемичных нормальных животных. Наконец, 98 образцов сыворотки были получены путем простой случайной выборки из банка биологических образцов Центра исследования печеночной двуустки и холангиокарциномы Университета Кхон Каен, Таиланд; только у 8 из этих людей есть образцы мочи.Образцы кала у пациентов с ОСО отсутствовали.
Рабочие характеристики анти-OV IgG ELISA
На рисунке S2 показана параллельность каждого SCC путем построения линеаризованных версий каждого SCC для сывороточного IgG ( P = 0,225) (рисунок S2, панель A), сывороточного IgG1 ( P = 00,240) (рисунок S2, панель B), сыворотки. IgG4 ( P = 0,136) (рисунок S2, панель C) и IgG в моче ( P = 0,402) (панель D). Наклоны регрессии подобранных SCC существенно не различались, как определено с помощью ANOVA (p> 0.05), что указывает на параллелизм между каждой группой SCC [24].
Сывороточные IgG и IgG1 против антигена OV были обнаружены почти у всех людей (100% и 98% соответственно), включая людей из группы эндемичных нормальных (EN)
Используя RDL, показанный на рисунке S1, панель B, в качестве порога обнаружения, таблица 2 показывает, что сывороточный IgG против антигена OV был обнаружен у всех лиц (100%; n = 394) в исследовании. Аналогичным образом, таблица 2 также показывает, что при использовании RDL, показанного на рисунке S1, панель D, в качестве порога обнаружения антигена OV анти-IgG1, почти все (98%; n = 387) индивидуумов в исследовании имели определяемые уровни этого сывороточного антитела до Опять же, антиген OV, независимо от OV или клинического статуса.Наконец, используя RDL, показанный на рисунке S1, панель F, в качестве порога обнаружения, таблица 2 показывает, что от трети до половины людей в каждой клинической группе имели определяемые уровни IgG4 к антигену OV.
Только у половины лиц с APF + обнаруживаемый уровень IgG в моче к антигену OV
Используя RDL в качестве порога обнаружения (рис. S1, панель H), таблица 2 показывает, что более 60% людей с APF + имели определяемые уровни IgG к антигену OV в моче. Меньшая доля (38%) лиц, которые были OV + и APF- (подобранный контроль), имели определяемые уровни IgG в моче к антигену OV.У всех восьми (n = 8) пациентов с CCA, у которых были образцы мочи, были обнаруживаемые уровни IgG к OV в моче.
Уровни сывороточных IgG и IgG1 были значительно повышены у лиц со средней и тяжелой инфекцией OV (≥500 яиц на грамм кала, epg) по сравнению с группой EN и с людьми с более легкими уровнями инфекции OV (1–499 epg)
Уровни сывороточного IgG (рис. 1, панель A) и сывороточного IgG1 (рис. 1, панель B) к антигену OV были значительно выше (P <0,001 для обоих) у лиц как с более легкой (1–499 эпг), так и более тяжелой (≥500) epg) инфекции OV по сравнению с людьми EN (отсутствие яиц в кале).Кроме того, у лиц с более тяжелой инфекцией OV были более высокие уровни сывороточного IgG1 к антигену OV, чем у лиц с более легкой инфекцией OV (рис. 1, панель B). Уровни IgG в моче не были значительно повышены ни в одной из инфекционных групп (рис. 1, панель D).
Рис. 1. Связь между инфекцией Opisthorchis viverrini и антителами к антигену OV в сыворотке и моче.
Статус инфекции O. viverrini определяли с помощью микроскопического исследования кала.Индивидуумы были разделены на категории по интенсивности инфекции OV по среднему геометрическому количеству яиц на грамм фекалий следующим образом: «отрицательный» или «0» (в фекалиях не обнаружено яиц), «слабо инфицированные (1–499 яиц на грамм фекалий)». фекалий) или «от средней до сильной» (≥500 яиц на грамм фекалий). В случае пациентов с ОСО образцы сыворотки и мочи были получены из гистологически подтвержденных случаев холангиокарциномы, связанной с описторхозом, из хранилища биологических образцов Исследовательского центра печеночной двуустки и холангиокарциномы Университета Хон Каен, Таиланд.С помощью непрямого ELISA определяли уровни следующих антител к неочищенному экстракту антигена взрослого OV: сывороточный IgG (, панель A, ), сывороточный IgG1 (, панель B, ), сывороточный IgG4 (, панель C, ) и IgG в моче (, панель C, ). Панель D ). Уровни антител в каждой группе инфекции оценивали по среднему значению, показанному красной горизонтальной линией в каждой группе, и тестировали с использованием ANOVA с последующим попарным тестированием каждой группы с поправкой Бонферрони для множественного тестирования.
https: // doi.org / 10.1371 / journal.pntd.0002228.g001
Уровень IgG в моче к антигену OV был значительно повышен у лиц с продвинутым перидуктальным фиброзом (APF +) или с гистологически подтвержденным CCA по сравнению с контрольными EN и APF-
Рисунок 2 Панель D показывает, что уровни IgG к антигену OV в моче были значительно выше (P <0,001) у лиц с APF +, чем у лиц в группах EN или APF-: то есть, в среднем, в 21 раз выше у лиц с APF +, чем у лиц с EN и В 7 раз выше у индивидуумов APF +, чем у APF-.Аналогичным образом, на фиг. 2, панель D показано, что уровни IgG к антигену OV в моче были значительно выше (P <0,001) у лиц с CCA +, чем у лиц в группах EN, APF- и APF +. В среднем уровни IgG к антигену OV в моче были в 158 раз выше у лиц с CCA +, чем у лиц с EN; В 21 раз выше у лиц с CCA +, чем у лиц APF-; и в 7 раз выше у лиц с CCA +, чем у лиц с APF +.
Рисунок 2. Взаимосвязь между гепатобилиарной патологией и уровнями антител к антигену OV в сыворотке и моче.
Лица, которые были положительными на O. viverrini , но отрицательными на APF при абдоминальном УЗИ, были определены как «контрольные» и сопоставлены со случаями по возрасту (по десятилетним диапазонам), полу и методу ближайшего подходящего соседа. С помощью непрямого ELISA определяли уровни следующих антител (Ab) к неочищенному экстракту антигена взрослого OV: сывороточный IgG (, панель A, ), сывороточный IgG1 (, панель B, ), сывороточный IgG4 (, панель C, ) и моча. IgG ( панель D ). Уровень Ат в каждой группе инфицирования оценивали по среднему значению, показанному красной горизонтальной линией в каждой группе, и тестировали с использованием дисперсионного анализа (ANOVA) с последующим попарным тестированием каждой группы с поправкой Бонферрони для множественного тестирования.
https://doi.org/10.1371/journal.pntd.0002228.g002
Не наблюдалось связи между уровнями IgG к антигену OV в сыворотке крови и уровнями IgG к антигену OV в моче
Рисунок S3 Панель A показывает отсутствие связи между уровнями сывороточного IgG к антигену OV и уровнями IgG к антигену OV в моче у одних и тех же людей. Это было обнаружено для всех инфекционных и клинических категорий. На рис. S3, панель B показано, что у немногих из лиц с OV + в любой группе (APF- или APF +) была протеинурия, определенная тестированием в месте оказания медицинской помощи с использованием полоскового реагента для мочи, с положительным тестом мочи на белок, определяемым изменение цвета на «+» или больше, что соответствует по меньшей мере 30 мг / л белка.
Повышенные уровни IgG1 к OV-антигену имели лучшую площадь под кривой (AUC), а также самую высокую положительную прогностическую ценность (PPV) для инфекции OV
В таблице 3 показана площадь под кривой (AUC) для анализов кривой ROC с PPV, определенными с использованием 50% распространенности: например, сывороточный IgG против антигена OV имел AUC 0,68 и PPV 0,60 с использованием порогового значения 35,66 AU, полученного из ROC. кривая анализа с максимально возможной чувствительностью без снижения специфичности анализа.Используя эти пороговые значения, мы оценили грубые и скорректированные отношения шансов (95% доверительный интервал) риска OV-положительности. Кривые ROC для сывороточного IgG1 против OV-антигена имели наилучшую AUC с 0,68 с использованием отсечки антител 9,21 AU. Использование этого порогового значения привело к PPV, равному 0,61, а также скорректированному OR 2,51 (95% ДИ 1,26, 5,00) для риска положительности OV. Несмотря на плохую AUC и слабую PPV, IgG мочи указывал на значительный риск инфекции OV с приблизительным OR 7,60 (95% CI 3,56, 16,20) и скорректированным OR 7.68 (95% ДИ 3,58, 16,50).
Повышенные уровни IgG1 к антигену OV также имели лучшую AUC, а также самую высокую PPV для тяжелой инфекции OV
Таблица 4 показывает, что повышенные уровни сывороточного IgG1 к антигену OV имели наилучшее сочетание чувствительности и специфичности для прогнозирования тяжелой инфекции OV (> 500 epg) по сравнению с людьми, отрицательными для OV. Кроме того, повышенные уровни сывороточных IgG и IgG1 к антигену OV продемонстрировали превосходную способность указывать на риск высокой инфекции OV, что определяется значительными грубыми и скорректированными OR (таблица 4).Хотя сывороточный IgG4 к антигену OV и IgG в моче к антигену OV продемонстрировал умеренную дискриминационную способность к инфекции OV, таблица 4 показывает, что повышенные уровни IgG в моче к антигену OV все еще могут прогнозировать риск инфекции OV, как показано в скорректированном OR 7,88 (95% ДИ: 2,64, 23,51).
Повышенные уровни IgG в моче к OV-антигену позволяют выявить людей с APF + по сравнению с индивидуумами EN или APF-
Таблица 5 показывает, что повышенные уровни IgG в моче могут отличать людей, которые были APF-положительными, от людей с EN, с AUC, равной 0.72 и PPV 0,67 с использованием порогового значения 4,00 AU мочи IgG к антигену OV. Кроме того, IgG в моче к антигену OV показал значительный общий и скорректированный OR для прогнозирования риска APF: общий OR = 6,34 (95% ДИ: 2,75, 14,66) и скорректированный OR = 6,69 (95% ДИ: 2,87, 15,58). Повышенные уровни IgG в моче к антигену OV также могут отличать людей с APF от соответствующих контрольных APF-, а также OR, который указывает на риск APF в скорректированных и нескорректированных моделях. Таблица S2 показывает, что сывороточный IgG к антигену OV также может незначительно отличать APF-положительных индивидуумов от индивидуумов из EN-группы с AUC, равным 0.52, PPV 0,52 и скорректированный OR 2,71 (95% ДИ: 1,26, 5,84).
Уровни IgG в моче к OV-антигену могут отличать людей с подтвержденным CCA от других патологий, связанных с OV
Таблица 5 также показывает, что повышенные уровни IgG в моче к антигену OV могут различать лучше, чем сывороточные антитела, индивидуумы с подтвержденным CCA по сравнению с эндемическими нормальными, с AUC 0,97 для анализа кривой ROC и PPV 0,79 при пороговом значении антител 2,84 AU. используется.Кроме того, в таблице 5 показано, что повышенные уровни IgG к антигену OV в моче сильно связаны с CCA: грубый OR = 85,00 (95% ДИ: 19,89, 362,0) и скорректированный с учетом пола и возраста OR = 71,13 (95% ДИ: 15,13, 334,0). Таблица S3 показывает, что сывороточные антитела к антигену OV не обладают ни чувствительностью, ни специфичностью для прогнозирования CCA, ни грубыми и скорректированными отношениями шансов, чтобы указать риск CCA по сравнению с IgG в моче к антигену OV.
Обсуждение
В данной рукописи мы показываем, что более половины людей, проживающих в эндемичных районах бассейна реки Чи в Кхон Каен, северо-восточный (Исаан) Таиланд, имеют определяемые уровни IgG в моче к экстракту антигена взрослого OV.Более того, повышенные уровни IgG в моче к антигену OV не были связаны ни с интенсивностью инфекции OV (измеряемой по количеству яиц в кале), ни с уровнями сывороточных антител к антигену OV. Эти данные подтверждают нашу гипотезу о том, что IgG в моче к антигену OV, скорее всего, представляет собой почечную патологию в виде структурного повреждения клубочков (повреждение подоцитов) и канальцевого интерстиция, опосредованного иммунным комплексом, как это наблюдалось на животных моделях инфекции OV [10]. , [11]. Интересно, что мы обнаружили, что IgG к антигену OV выявлялись в моче при концентрациях в 21 раз выше у лиц с APF, индуцированных OV, и в 158 раз выше у лиц с CCA, индуцированным OV, по сравнению с контрольной группой.Как показано в таблице 5, люди с повышенным уровнем IgG в моче к антигену OV имели повышенный риск APF (скорректированный OR 6,69; 95% CI: 2,87, 15,58) и повышенный риск CCA (скорректированный OR 71,13; 95% CI: 15.13, 334.0), чем у людей, у которых не было обнаруживаемых уровней IgG к антигену OV в моче. Мы также обнаружили, что однократное измерение уровня IgG в моче к антигену OV имело хорошую прогностическую ценность для обнаружения как APF, так и CCA по сравнению с возрастом, полом и не совпадающими с ближайшими соседями (отрицательные контроли EN или APF).Следовательно, как показано на рисунке 3, наше исследование добавляет к литературе по патофизиологии описторхоза возможность того, что почечная патология возникает одновременно с запущенными гепатобилиарными патологиями, более часто связанными с этой инфекцией, и что почечная патология может быть обнаружена по повышенным уровням IgG в моче. к антигену OV [10], [11]. Анализ мочи, позволяющий одновременно оценивать клинический статус людей с патологией почек и гепатобилиарной системы, вызванной хроническим описторхозом, будет иметь большое значение в Юго-Восточной Азии, особенно в условиях ограниченных ресурсов в странах бассейна Меконга, таких как Таиланд, Лаос и другие страны. Камбоджа.
Рисунок 3. Почечная патология в прогрессировании от инфекции Opisthorchis viverrini до холангиокарциномы.
Рисунок 3 представляет собой адаптацию пути к патогенезу инфекции OV, как ранее опубликовано в [40]. Здесь мы добавили в зеленую рамку роль почечной патологии, формы микропротеинурии в прогрессировании от хронического описторхоза до ОСО. Эта почечная патология, скорее всего, является результатом длительного системного воздействия паразитарной инфекции на иммунный ответ хозяина (т.гломерулопатия, опосредованная иммунным комплексом). Несмотря на отсутствие общего патогенетического механизма, почечные и гепатобилиарные патологии, связанные с инфекцией OV, развиваются одновременно в модели лабораторных животных и (как предполагается в этой рукописи) у людей, хронически инфицированных OV. Таким образом, биомаркер почечной патологии может в равной степени указывать на риск APF и CCA, то есть «синдромный биомаркер» для запущенных патологий, связанных с хроническим описторхозом.
https: // doi.org / 10.1371 / journal.pntd.0002228.g003
Давно известно, что антитела играют центральную роль в иммунном ответе на инфекцию Opisthorchis viverrini [14], [26] — [36]. У людей и животных, инфицированных этой пищевой трематодой, наблюдаются высокие уровни в сыворотке / плазме классических антител, связанных с гельминтозными инфекциями, таких как IgG, IgG1, IgG4 и IgE, к неочищенным экстрактам антигена OV. Таким образом, была выдвинута гипотеза, что циркулирующие антитела к антигенам OV могут «просачиваться» из плазмы в мочу на уровнях, пропорциональных интенсивности инфекции OV [14], [16].Однако, как видно из этих других исследований [14], [16], мы обнаружили, что IgG в моче к антигену OV является плохим методом диагностики инфекции OV и еще более плохим методом прогнозирования интенсивности инфекции OV (таблицы 3 и 4). . Кроме того, мы наблюдали только слабую корреляцию между циркулирующими уровнями сывороточного IgG к антигену OV и уровнями IgG в моче к антигену OV. Эти результаты согласуются с нашим текущим пониманием патофизиологии протеинурии мочи (например, IgG в моче) в различных клинических условиях [9], [11], [17], [37], [38].Здоровая стенка капилляров клубочка должна эффективно ограничивать прохождение IgG из крови (плазмы) в пространство Боумена на основе размера молекулы, электрического заряда и стерической конфигурации этого интактного иммуноглобулина; например, рестриктивный радиус пор почечного клубочкового фильтра составляет 45 Ångstroms (Å), тогда как интактный IgG имеет молекулярный радиус 55 Å (см. отличный обзор [17]). Кроме того, IgG является катионным белком, что означает, что он прочно связывается с отрицательно заряженными клетками проксимальных канальцев [17].Следовательно, даже если небольшие количества IgG фильтруются в пространство Боумена и, следовательно, в просвет канальцев, они легко реабсорбируются в проксимальных канальцах. В соответствии с аналогичными результатами, полученными на экспериментальных моделях инфекции OV на животных [10], мы предполагаем, что частое обнаружение IgG в моче у людей, инфицированных OV, отражает гломерулопатию. В частности, мы подозреваем, что это отражает структурное повреждение стенки капилляров клубочков, характеризующееся повреждением подоцитов, что приводит к увеличению проницаемости клубочков или увеличению размера пор клубочков, что позволяет прохождение макромолекул, таких как IgG.Кроме того, способность эпителиальных клеток проксимальных канальцев к реабсорбции также может быть нарушена. Повреждение клубочков и канальцев является кардинальным признаком заболевания почек [17], [37], [38].
Тот факт, что IgG, обнаруженный в моче, специфичен к антигену OV, заставляет нас предположить, что наблюдаемая почечная патология является результатом отложения иммунных комплексов, аналогичного тому, что наблюдается в моделях OV на животных [10]. Почечная патология, вызванная отложением иммунных комплексов, была описана в связи с другими паразитарными гельминтозными инфекциями, такими как шистосомоз [9].Иммунные комплексы предположительно откладываются в субэндотелии клубочков, что приводит к активации комплемента, хемоаттракции лейкоцитов и воспалительной реакции, которая приводит к разрушению базальной мембраны клубочков с увеличением пор гломерулярного барьера, что обеспечивает прохождение высокомолекулярных веществ (HMW). макромолекулы, такие как IgG, для которых базальная мембрана обычно непроницаема [17], [38]. Повышенная нагрузка макромолекул HMW в просвет канальцев приводит к насыщению механизма реабсорбции канальцевыми клетками.Как упоминалось выше, почечная патология, наблюдаемая у хомяков, инфицированных OV, представляет собой мезангиальный пролиферативный гломерулонефрит с иммунными комплексами, состоящими из IgG, компонента комплемента 3 (C3) и антигена OV [10], [11], [39]. Иммунные комплексы накапливаются в клубочках почек хомяка либо путем (а) пассивного захвата циркулирующих иммунных комплексов, либо (б) образования in situ путем связывания антитела с антигеном OV, который ранее был депонирован в клубочках. В ходе единственной экспериментальной инфекции OV у хомячков развивается прогрессирующий склероз клубочков, атрофия канальцев, а также интерстициальное воспаление и фиброз, которые, по-видимому, совпадают с развитием фиброза желчных протоков и рака желчных протоков [10].
Однако не у всех людей, хронически инфицированных O. viverrini , развиваются почечные или гепатобилиарные аномалии. Из наших исследований на уровне сообществ в эндемичных по OV районах на северо-востоке Таиланда мы наблюдали, что подгруппа людей, инфицированных OV, реагирует на хроническое воспаление в ответ на инфекцию OV патологиями [7], [8], [18]. Мы назвали этих людей «провоспалительным» фенотипом [40]. Настоящее исследование дополняет нашу гипотезу доказательствами того, что «провоспалительный» фенотип распространяется на почечную патологию, связанную с хроническим описторхозом (т.е., APF и CCA). Мы подозреваем, что у людей с «провоспалительным фенотипом» наблюдается нарушение регуляции выработки воспалительных цитокинов в ответ на хроническую инфекцию двуустки, которая проявляется в виде воспаления в почечных фильтрах (клубочках), увеличивая их для прохождения макропротеинов (например, интактного IgG). к антигену OV) из плазмы. Как видно на модели хомяка, мы также подозреваем, что со временем происходит прогрессирующее устаревание клубочков, атрофия канальцев, интерстициальное воспаление и почечный фиброз, связанные с этой протеинурией [10], [11], [39].Поскольку IgG к антигену OV в моче является легкодоступным биомаркером, мы предполагаем, что он может служить биомаркером множественных воспалительных патологий описторхоза.
Важным вопросом, возникающим в результате нашего исследования, является отсутствие протеинурии, поддающейся обнаружению с помощью тестирования в месте оказания медицинской помощи с использованием устройства для анализа мочи на основе полосок. Теоретически повышенная проницаемость клубочкового барьера, позволяющая фильтровать IgG, также должна приводить к пропорциональным потерям альбумина с мочой, который является основным белковым компонентом, обнаруживаемым тестом на индикаторной полоске мочи [37].Есть две возможности, которые объясняют ложноотрицательные результаты анализа мочи. Во-первых, общая концентрация белка в моче зависит от степени гидратации (то есть от удельного веса мочи). Ложноотрицательные результаты могут относиться к тому, как были взяты образцы мочи [37], включая сбор всего образца мочи, а не средний образец мочи (который представляет мочу из почек) или сбор первой утренней мочи ( 24-часовой образец мочи), который представляет собой скопление мочи, которое может привести к разбавлению образца, что снизит чувствительность тест-полоски для выявления протеинурии [37].С другой стороны, непрямой ELISA будет намного более чувствительным к присутствию IgG в моче, чем тест с полосками, потому что (а) моча концентрируется на этапе подготовки перед иммуноанализом и (б) используются моноклональные антитела к человеческому IgG. в ELISA намного более чувствительны и специфичны, чем колориметрический метод тест-полоски, который используется в первую очередь для определения альбумина в моче. Вторая гипотеза — это возможность ограничительного механизма, который запрещает фильтрацию альбумина в мочу, но допускает утечку IgG.Многочисленные исследователи (см. Обзор [37]) наблюдали, что движение альбумина в пространство Боумена ограничивается не размером пор, а его отрицательным зарядом и последующими отталкивающими электростатическими взаимодействиями с отрицательно заряженным эндотелием клубочков. Следовательно, вполне возможно, что присутствие IgG в моче из-за инфекции OV не сопровождается заметной альбуминурией — гипотеза, которая явно заслуживает дальнейшего изучения.
Последний вопрос — взаимосвязь между сопутствующими почечными и гепатобилиарными патологиями, наблюдаемыми в этом исследовании.Самая сильная связь в текущем исследовании была между повышенным уровнем IgG в моче к антигену OV и APF или CCA: люди с повышенным уровнем IgG в моче к антигену OV имели в 6 раз больший риск наличия APF и в 71 раз больший риск наличия CCA ( Таблица 5 скорректированный OR), чем у лиц, у которых в моче не обнаруживается IgG к антигену OV. Кроме того, однократное измерение IgG в моче к антигену OV имело хорошую положительную прогностическую ценность для обнаружения как APF, так и CCA. Однако, как показано на модели хомяка для индуцированного OV фиброза желчных протоков и CCA [10], не существует правдоподобной физиологической взаимосвязи между гепатобилиарной и почечной патологиями, вызванными хронической инфекцией OV.Похоже, что они являются результатом двух различных патологических механизмов, которые развиваются одновременно во время инфекции OV. Как мы уже много писали, гепатобилиарная патология при хроническом описторхозе, вероятно, является результатом повторного повреждения желчного эпителия в результате сочетания механических, токсических и иммунных поражений, связанных с присутствием двуустки в желчном протоке [для обзора см. [8], [18]). Поскольку люди инфицированы O. viverrini в течение многих лет (часто в течение всей жизни), во внутрипеченочных желчных протоках имеет место постоянный цикл повреждения и восстановления тканей, создавая хроническую воспалительную среду, которая стимулирует перидуктальный фиброгенез и туморогенез [8], [18].Наблюдаемое здесь почечное повреждение является вероятным следствием хронической инфекции OV, возникающей в результате устойчивых системных эффектов паразитарной инфекции на иммунный ответ хозяина (т.е. гломерулопатия, опосредованная иммунным комплексом).
Несмотря на отсутствие общего патогенетического механизма, почечные и гепатобилиарные патологии, связанные с инфекцией OV, развиваются одновременно на животных моделях и, вероятно, также и у людей. Таким образом, биомаркер почечной патологии может в равной степени указывать на риск APF и CCA.Следует также отметить, что еще в 1990 г. Mairiang et al. [12] сообщили об острой почечной недостаточности почти у всех пациентов с механической желтухой, вызванной ОСА, вызванной описторхозом. Это согласуется с нашими собственными данными о повышении уровня IgG в моче к антигену OV в случаях ОСО. Однако в случае терминальной стадии CCA обнаружение протеинурии может отражать «гепаторенальный синдром» (HRS), который является частым осложнением у пациентов с запущенными формами заболевания печени, такими как CCA и цирроз [13], и вызван интенсивное сужение почечного кровообращения, приводящее к выраженному снижению перфузии и фильтрации клубочков [13].HRS обычно возникает на поздних стадиях тяжелого заболевания печени, когда у пациентов уже проявились серьезные осложнения цирроза. HRS — это острое заболевание с очень плохим прогнозом. Таким образом, остается вопрос, является ли почечная патология, предположительно хроническая по своей природе, которая наблюдается у лиц с описторхозом, вызванным ОПФ, такой же, как и среди случаев ОСО, поскольку последняя может отражать HRS, а не связанный с иммунным комплексом. гломерулонефрит.
Как показали наши исследования на уровне сообществ [7], [8], [18], хронический O.viverrini приводит к стойкой иммунологической и воспалительной проблеме у человека-хозяина. Мы впервые показали, что хроническая инфекция OV может также привести к значительному бремени почечной недостаточности в форме гломерулопатии, опосредованной иммунным комплексом. Важность этого исследования заключается в наблюдении, что эта почечная патология может быть легко обнаружена в моче с помощью иммуноанализа на IgG против OV-антигена и что повышенные уровни мочевого IgG к OV-антигену также тесно связаны с гепатобилиарными патологиями.В будущих исследованиях мы планируем улучшить чувствительность и специфичность этого биомаркера путем скрининга мочи на специфические антигены, распознаваемые IgG в неочищенном экстракте антигена OV взрослых, используемом здесь. Последние достижения в иммуномике, в которых протеом O. viverrini может быть собран на микрочипе, позволяют проводить высокопроизводительный скрининг образцов мочи для определения наиболее широко распознаваемых белков. Впоследствии они могут быть разработаны как рекомбинантные белки в качестве реагентов для диагностических тестов мочи.Таким образом, скрининг на IgG в моче к специфическим рекомбинантным антигенам OV может использоваться для выявления риска нескольких патологий, которые могут возникать в результате хронического описторхоза, и, таким образом, использоваться в качестве «синдромного биомаркера » хронического описторхоза.
Дополнительная информация
Рисунок S1.
Рабочие характеристики ELISA для обнаружения антител в сыворотке и моче O. viverrini антиген. Панель A показывает среднее значение и 95% доверительный интервал для 12 стандартных калибровочных кривых (SCC) для сывороточного IgG к антигену OV, а панель B показывает оценку RDL.Панель C показывает среднее значение и 95% доверительный интервал для 12 SCC для сывороточного IgG1 к OV-антигену, а панель D показывает оценку RDL. Панель E показывает среднее значение и 95% доверительный интервал для 12 SCC для сывороточного IgG4 к антигену OV, а панель F показывает оценку RDL. Панель G показывает среднее значение и 95% доверительный интервал для 10 SCC для IgG в моче к антигену OV, а панель H показывает оценку RDL.
https://doi.org/10.1371/journal.pntd.0002228.s002
(PDF)
Рисунок S2.
Параллельность стандартных калибровочных кривых для определения IgG к антигену OV в сыворотке и моче. Линеаризованное 4-параметрическое логистическое логарифмическое моделирование (4-PL) либо стандартной контрольной сыворотки (для IgG, IgG1 и IgG4), либо стандартного контрольного раствора мочи для определения IgG к антигену OV. Каждый SRS серийно разбавляют на планшете для ELISA, где оптическая плотность (OD) 492 нм наносится на график против log 10 разведения. Горизонтальная ось на каждой панели представляет логарифм разбавления каждого SRS, а вертикальная ось представляет logit оптической плотности (OD) при 492 нм. Сигмоидальные линии 4PL линеаризуются и сравниваются на параллельность.Панель A показывает анализ параллельности SCC сывороточного IgG к антигену OV; Панель B для сывороточного IgG1 к антигену OV; Панель C для сывороточного IgG4 против антигена OV; и Панель D IgG мочи против антигена OV. Значение p≥0,05 показывает незначительное отклонение от параллелизма.
https://doi.org/10.1371/journal.pntd.0002228.s003
(PDF)
Рисунок S3.
Уровни сывороточных IgG и IgG в моче к антигену OV и протеинурии. Панель A показывает линейную зависимость между произвольными единицами сывороточного IgG и мочевого IgG к неочищенному экстракту антигена OV у 256 человек, которые являются OV-положительными в исследовании.На панели B показаны уровни протеинурии по клиническим группам, определенные с помощью тест-полоски для определения мочи в местах оказания медицинской помощи.
https://doi.org/10.1371/journal.pntd.0002228.s004
(PDF)
Благодарности
Мы хотели бы поблагодарить Алекса Лукаса, Университет Джеймса Кука, Кэрнс, QLD, Австралия, и Пола Дж. Бриндли, Университет Джорджа Вашингтона, Вашингтон, округ Колумбия, США, за их идеи и поддержку этой работы.
Вклад авторов
Эксперимент задумал и спроектировал: П.Сайчуа, П. Сититаворн, А. Джаривала, Дж. Сититаворн, Б. Срипа, Э. Миаранг, Дж. М. Бетони. Выполняли опыты: Сайчуа П. Джаривала, Дж. Сититаворн, Э. Майианг, К. Пайроджкул, Н. Кхунтикео, Дж. Мулвенна, Дж. М. Бетони. Проанализированы данные: П. Сайчуа, П. Сититаворн, А.Р. Джаривала, Д.Дж. Деймерт, Дж. Сититаворн, Б. Срипа, Э. Майианг, Дж. Малвенна, Дж. М. Бетони. Предоставленные реагенты / материалы / инструменты анализа: П. Сайчуа, П. Сититаворн, А.Р. Джаривала, Б. Срипа, Э. Майианг, Ч. Пайройкул, Т.Laha, J. Mulevenna, C. Pairojkul, N. Khuntikeo, J.M. Bethony. Автор статьи: П. Сайчуа, П. Сититаворн, Д.Дж. Деймерт, Б. Срипа, М.В. Периаго, Т. Лаха, Дж. Малвенна, Дж. М. Бетони.
Список литературы
- 1. Кейзер Дж., Утцингер Дж. (2005) Новый трематодоз пищевого происхождения. Emerg Infect Dis 11: 1507–1514.
- 2. Sithithaworn P, Haswell-Elkins M (2003) Эпидемиология Opisthorchis viverrini . Acta Trop 88: 187–194.
- 3. Срипа Б., Бетони Дж. М., Сититхаворн П., Каукес С., Майианг Е. и др.(2011) Описторхоз и холангиокарцинома, ассоциированная с описторхозом, в Таиланде и Лаосе. Acta Trop 120 Приложение 1: S158–168.
- 4. Sripa B, Kaewkes S, Sithithaworn P, Mairiang E, Laha T. и др. (2007) Печеночная двуустка вызывает холангиокарциному. PLoS Med 4: e201.
- 5. Sriamporn S, Pisani P, Pipitgool V, Suwanrungruang K, Kamsa-ard S и др. (2004) Распространенность инфекции Opisthorchis viverrini и заболеваемость холангиокарциномой в Кхон Каене, Северо-Восточный Таиланд.Trop Med Int Health 9: 588–594.
- 6. Сититаворн П., Эндрюс Р.Х., Нгуен В.Д., Вонгсародж Т., Синуон М. и др. (2012) Текущее состояние описторхоза и клонорхоза в бассейне реки Меконг. Паразитол Инт 61: 10–16.
- 7. Майианг Э., Лаха Т., Бетони Дж. М., Думхемроп Б., Кеукес С. и др. (2012) Ультрасонографическая оценка патологий гепатобилиарной системы у 3359 пациентов с инфекцией Opisthorchis viverrini в эндемичных районах Таиланда. Parasitol Int 61: 208–211.
- 8. Sripa B, Mairiang E, Thinkhamrop B, Laha T, Kaewkes S и др. (2009) Развитый перидуктальный фиброз в результате инфицирования канцерогенным печеночным двуустком человека Opisthorchis viverrini коррелирует с повышенным уровнем интерлейкина-6. Гепатология 50: 1273–1281.
- 9. van Velthuysen ML, Florquin S (2000) Гломерулопатия, связанная с паразитарными инфекциями. Clin Microbiol Rev 13: 55–66 содержание.
- 10. Boonpucknavig S, Boonpucknavig V, Tanvanich S, Doungchawee G, Thamavit W (1992) Развитие иммунного комплексного гломерулонефрита и амилоидоза у сирийских золотых хомяков, инфицированных Opisthorchis viverrini .J Med Assoc Thai 75 Suppl 1: 7–19.
- 11. Boonpucknavig V, Soontornniyomkij V (2003) Патология почечных заболеваний в тропиках. Семин Нефрол 23: 88–106.
- 12. Mairiang P, Bhudhisawasdi V, Borirakchanyavat V, Sitprija V (1990) Острая почечная недостаточность при механической желтухе при холангиокарциноме. Arch Intern Med 150: 2357–2360.
- 13. Гевара М, Арройо V (2011) Гепаторенальный синдром. Экспертное мнение Pharmacother 12: 1405–1417.
- 14.Савангсода П., Сититаворн Дж., Тесана С., Пинлаор С., Бунмарс Т. и др. (2012) Диагностические значения выявления паразитоспецифических антител в слюне и моче по сравнению с сывороткой при описторхозе. Parasitol Int 61: 196–202.
- 15. Makarananda K, Wild CP, Jiang YZ, Neal GE (1991) Возможное влияние инфекции, вызванной печеночной двуусткой ( Opisthorchis viverrini ), на мониторинг мочи с помощью иммуноферментного анализа на воздействие афлатоксинов на человека.IARC Sci Publ 96–101.
- 16. Tesana S, Srisawangwong T, Sithithaworn P, Itoh M, Phumchaiyothin R (2007) Обнаружение на основе ELISA IgG и IgG4 к Opisthorchis viverrini против Opisthorchis viverrini в образцах мочи и сыворотки человека из эндемичного района на северо-востоке Таиланда. Энн Троп Мед Паразитол 101: 585–591.
- 17. D’Amico G, Bazzi C (2003) Патофизиология протеинурии. Почки Int 63: 809–825.
- 18. Sripa B, Thinkhamrop B, Mairiang E, Laha T, Kaewkes S и др.(2012) Повышенный уровень IL-6 в плазме связан с повышенным риском развития фиброза и холангиокарциномы у лиц, инфицированных Opisthorchis viverrini . PLoS Negl Trop Dis 6: e1654.
- 19. Элкинс Д.Б., Хасвелл-Элкинс М.Р., Майианг Э., Майианг П., Сититаворн П. и др. (1990) Высокая частота гепатобилиарной болезни и подозрение на холангиокарциному, ассоциированную с тяжелой инфекцией Opisthorchis viverrini , в небольшом сообществе на северо-востоке Таиланда. Trans R Soc Trop Med Hyg 84: 715–719.
- 20. Jariwala AR, Oliveira LM, Diemert DJ, Keegan B, Plieskatt JL, et al. (2010) Тестирование эффективности экспериментальной вакцины Na -GST-1 от анкилостомы. Expert Rev Vaccines 9: 1219–1230.
- 21. Миура К., Оркатт А.С., Муратова О.В., Миллер Л.Х., Саул А. и др. (2008) Разработка и характеристика стандартизированного ELISA, включая контрольную сыворотку на каждом планшете для обнаружения антител, индуцированных экспериментальными вакцинами против малярии. Vaccine 26: 193–200.
- 22.Куинн С.П., Семенова В.А., Эли С.М., Ромеро-Штайнер С., Грин С. и др. (2002) Специфический, чувствительный и количественный иммуноферментный анализ на антитела человеческого иммуноглобулина G к защитному антигену токсина сибирской язвы. Emerg Infect Dis 8: 1103–1110.
- 23. Пликайтис Б.Д., Карлоне Г.М. (2005) Статистические соображения для испытаний иммуногенности вакцины. Часть 1: Введение, дизайн и анализ биопроб. Vaccine 23: 1596–1605.
- 24. Пликайтис Б.Д., Холдер П.Ф., Паис Л.Б., Масланка С.Е., Геслинг Л.Л. и др.(1994) Определение параллельности и непараллельности кривых разведения биопроб. J Clin Microbiol 32: 2441–2447.
- 25. O’Connell M, Belanger B, Halland P (1993) Разработка калибровки и анализа с использованием четырехпараметрической логистической модели Chemometrics and Intelligent Laboratory. Системы 20: 97–114.
- 26. Акаи П.С., Пунгпак С., Чайкумпа В., Китикун В., Руангкунапорн Ю. и др. (1995) Реакции сывороточных антител при описторхозе. Int J Parasitol 25: 971–973.
- 27. Акаи П.С., Пунгпак С., Чайкумпа В., Виродж К., Буннаг Д. и др. (1994) Сывороточный антительный ответ на антиген Opisthorchis viverrini как маркер холангиокарциномы, ассоциированной с описторхозом. Trans R Soc Trop Med Hyg 88: 471–474.
- 28. Akai PS, Pungpak S, Kitikoon V, Bunnag D, Befus AD (1994) Возможный защитный иммунитет при описторхозе человека. Parasite Immunol 16: 279–288.
- 29. Boonpucknavig S, Kurathong S, Thamavit W (1986) Обнаружение антител в сыворотке от пациентов с описторхозом.J Clin Lab Immunol 19: 135–137.
- 30. Элкинс Д. Б., Сититаворн П., Хасвелл-Элкинс М., Кеукс С., Авачараган П. и др. (1991) Opisthorchis viverrini : взаимосвязь между подсчетом яиц, обнаруженными червями и уровнями антител в эндемичном сообществе на северо-востоке Таиланда. Паразитология 102, ч. 2: 283–288.
- 31. Haswell-Elkins MR, Elkins DB, Sithithaworn P, Treesarawat P, Kaewkes S (1991) Модели распространения Opisthorchis viverrini в человеческом сообществе.Паразитология 103 Pt 1: 97–101.
- 32. Haswell-Elkins MR, Sithithaworn P, Mairiang E, Elkins DB, Wongratanacheewin S, et al. (1991) Иммунная реакция и уровни паразитоспецифических антител при гепатобилиарной болезни человека, ассоциированной с инфекцией Opisthorchis viverrini . Clin Exp Immunol 84: 213–218.
- 33. Хондзё С., Шриватанакул П., Сриплунг Х., Кикукава Х., Ханаи С. и др. (2005) Генетические и экологические детерминанты риска холангиокарциномы через Opisthorchis viverrini в густо зараженной местности в Накхон Пханом, северо-восток Таиланда.Int J Cancer 117: 854–860.
- 34. Пинлаор П., Понгсамарт П., Хонгсричан Н., Сангка А., Шрилунчанг Т. и др. (2012) Специфические сывороточные IgG, но не IgA, антитела против очищенного антигена Opisthorchis viverrini , связанного с гепатобилиарной болезнью и холангиокарциномой. Parasitol Int 61: 212–216.
- 35. Pinlaor S, Sripa B, Sithithaworn P, Yongvanit P (2004) Изменения гепатобилиарной системы, реакция антител и изменение ферментов печени у хомяков, повторно инфицированных Opisthorchis viverrini .Exp Parasitol 108: 32–39.
- 36. Sripa B, Kaewkes S (2000) Взаимосвязь между паразит-специфическими реакциями антител и интенсивностью инфекции Opisthorchis viverrini у хомяков. Parasite Immunol 22: 139–145.
- 37. Lamb EJ, MacKenzie F, Stevens PE (2009) Как следует обнаруживать и измерять протеинурию? Энн Клин Биохим 46: 205–217.
- 38. Левинский Р.Дж. (1981) Роль циркулирующих иммунных комплексов при почечных заболеваниях.Дж. Клин Патол 34: 1214–1222.
- 39. Sripa B (2003) Патобиология описторхоза: обновленная информация. Acta Trop 88: 209–220.
- 40. Срипа Б., Бриндли П.Дж., Малвенна Дж., Лаха Т., Смаут М.Дж. и др. (2012) Онкогенный печеночный сосальщик Opisthorchis viverrini — множественные пути к раку. Trends Parasitol 28: 395–407.
Описторхоз и холангиокарцинома в Юго-Восточной Азии: неразрешенная проблема
Thomas Hughes, 1, * Thomas O’Connor, 1, * Anchalee Techasen, 2,3 Nisana Namwatome, 2,3 , Watcharin 2,3 Ross H Andrews, 2–4 Narong Khuntikeo, 3,5 Puangrat Yongvanit, 3,6 Paiboon Sithithaworn, 3,7 Саймон Д. Тейлор-Робинсон 1
1 1 1 Отделение здоровья пищеварительной системы, Отделение хирургии и рака, Имперский колледж Лондона, Лондон, Великобритания; 2 Кафедра биохимии, Медицинский факультет, Центр по изучению заболеваний печени и холангиокарциномы, 3 Программа скрининга и лечения холангиокарциномы (CASCAP), Университет Хон Каен, Хон Каен, Таиланд; 4 Медицинский факультет, кампус Святой Марии, Имперский колледж, Лондон, Великобритания; 5 Отделение хирургии, 6 Отделение биохимии, 7 Отделение паразитологии, Медицинский факультет, Центр болезни печени и холангиокарциномы, Университет Кхон Каен, Кхон Каен, Таиланд
Резюме: Распространенность холангиокарциномы ( CCA) в Юго-Восточной Азии намного выше, чем в других регионах мира.Употребление в пищу сырых, ферментированных или недоваренных карповых рыб, инфицированных печеночной двуусткой, Opisthorchis viverrini sensu lato (sl), приводит к хроническому воспалению желчных путей, перидуктальному фиброзу и повышению риска рака. Может быть сопутствующий гломерулонефрит. Процесс заражения трудно прервать, потому что оказалось чрезвычайно трудно изменить привычки питания, а жизненный цикл двуустки не может быть нарушен из-за высокой распространенности у собак и кошек-резервуарных хозяев. Для диагностики описторхоза можно использовать анализ кала и иммуноферментный анализ.Диагностика ОСА является сложной, отчасти из-за отсутствия точных характеристик визуализации, но также из-за сложности получения образцов для цитологии или гистологии. Доказано, что этот рак устойчив к обычным химиотерапевтическим методам лечения, поэтому существуют два возможных метода лечения — это хирургическая резекция и трансплантация печени, которые требуют раннего обнаружения опухоли для достижения наилучших шансов на успех. Позднее проявление симптомов снижает шансы на успешное хирургическое вмешательство.Хотя инфекции печеночного двуустки можно лечить с помощью празиквантела, люди часто инфицируются повторно, и множественные повторные инфекции могут быть более опасными, чем единичная длительная инфекция. Для ранней диагностики необходимы ключевые исследования по обнаружению и характеристике новых биомаркеров на всех этапах канцерогенного пути.
Ключевые слова: Opisthorchis viverrini , CCA, Таиланд, Лаос, лечение, паразиты, канцероген, общественное здравоохранение, гельминты
Биология Opisthorchis viverrini
Opisthorchis viverrini sl — это печеночная двуустка человека, которая в настоящее время поражает 10 миллионов человек в Северо-Восточном Таиланде и в Лаосской Народно-Демократической Республике. 1,2 Это комплекс видов, включающий множество генетически различных криптических видов (некоторые из которых идентичны морфологически), которые инфицируют различные генетические популяции улиток, связанные с конкретными речными заболоченными территориями. Таким образом, он упоминается как Opisthorchis viverrini sensu lato (sl) или O. viverrini sl. 3,4 Первыми промежуточными хозяевами в жизненном цикле (рис. 1) являются улиток Bithynia , видовой комплекс, включающий по крайней мере 11 криптических видов, соответствующих O.viverrini sl. Следовательно, существует высокая степень генетической изменчивости в обоих комплексах видов, связанных с географическим положением (например, между водно-болотными угодьями реки Чи и водно-болотными угодьями реки Нам Нгум) 5 (Рисунок 2; Таблица 1).
Рисунок 1 Жизненный цикл Opisthorchis viverrini sensu lato. Примечание: Предоставлено Nadda Kiatsopit. |
Рисунок 2 Карта речных водно-болотных угодий, показывающая географическое распределение скрытых видов улиток Bithynia . Примечания: В таблице 1 перечислены места, отмеченные сокращениями. Воспроизведено с разрешения Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Инт Дж Паразитол . 2007. 37 (6): 695–703. 3 |
Таблица 1 Подробная информация о местах, из которых были обнаружены загадочные виды Bithynia Примечания: Местоположение показано на рисунке 2.Воспроизведено с разрешения Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Инт Дж Паразитол . 2007. 37 (6): 695–703. 3 |
Эти улитки, Bithynia siamensis goniomphalos , Bithynia siamensis и Bithynia funiculata (рисунок 1), являются первыми промежуточными хозяевами O.viverrini sl, до 8,37% которых могут быть инфицированы, хотя в большинстве регионов этот показатель составляет <1%. 5–8 После развития зрелых церкарий (личинок трематодных червей) они выходят из улитки-хозяина в воду и активно ищут вторичного промежуточного хозяина, рыб семейства Cyprinidae . 9 В течение 3 недель церкарии превращаются в инфекционные метацеркарии (инцистированные личинки). 10–12 Рыбы накапливают инфекционные метацеркарии, особенно в области головы и плавников, и имеют гораздо более высокую распространенность инфекции — от 42.От 9% (у Henicorhynchus lineatus ) до 100% (у Amblyrhynchichthys усекает ). 13 Люди могут заразиться, если они едят инфицированную карповую рыбу без достаточного нагревания мяса в сырых, частично приготовленных или ферментированных блюдах, таких как Koi Pla . 14,15 Блюда, подобные этому, имеют социальное и культурное значение, что затрудняет поддержку изменений в режимах питания. 16 Таким образом, повторное инфицирование является обычным явлением, несмотря на простоту лечения инфекции с помощью празиквантела. 17
Проглоченные метацеркарии вылупляются в двенадцатиперстной кишке, а затем перемещаются через общий желчный проток в дистальный желчный проток, где они созревают в течение 2 месяцев. 10,11 Собаки и представители семейства кошачьих действуют как резервуарные хозяева. Кошки, по-видимому, имеют более высокую распространенность инфекции, чем собаки (36,4% по сравнению с 3,8%), и это может быть связано со способом передачи. 18 Этих животных часто кормят остатками пищи (что соответствует традиционному образу жизни семей, поедающих сырую рыбу), а кошки, по-видимому, более склонны есть рыбьи головы и плавники, оставленные для них. 18 Взрослые печеночные двуустки производят яйца в желчном пузыре, желчных протоках и протоках поджелудочной железы, которые попадают в пищеварительную систему с желчью и выводятся вместе с калом. Фекальное загрязнение воды, содержащей улиток Bithynia , является большой проблемой и вызывает завершение жизненного цикла (рис. 1). Хотя плохая санитария может быть основной причиной попадания фекалий человека в пресную воду, улучшения, скорее всего, не предотвратят продолжение передачи O. viverrini sl, поскольку резервуарные хозяева кошек и собак будут продолжать передавать яйца (рис. 1).
Путь холангиокарциномы (CCA), индуцированной Opisthorchis viverrini
Всемирная организация здравоохранения классифицировала O. viverrini sl как канцероген группы один из-за его роли в индукции CCA. 19,20 Первоначально инфекции, вызванные двуусткой, вызывают острое воспаление крупных желчных протоков и портальной соединительной ткани. 21 Однако было показано, что хронические инфекции и воспаление являются факторами риска развития множественных стадий канцерогенеза. 22 Несмотря на простоту лечения и массовое распространение противоглистного препарата, празиквантела, множественное повторное инфицирование является обычным явлением, а инфекции, как правило, носят хронический характер. 15
При хронических инфекциях в эпителии желчных протоков могут наблюдаться гиперплазия, аденоматозные образования и гранулематозное воспаление. 21 Они вызваны механическими травмами и продуктами обмена веществ двуустки. Оральные и вентральные присоски двуустки вызывают механические повреждения во время процессов питания и миграции, что приводит к изъязвлению перидуктальной ткани.Это позволяет яйцам двуустки проникать в ткань, что, в свою очередь, вызывает гранулематозное воспаление ткани вокруг них. 15 Продукты метаболизма Fluke могут быть токсичными или иммуногенными и могут взаимодействовать с эпителием желчных протоков, вызывая гиперплазию. 23 Инфильтрация воспалительных клеток была связана с присутствием антигенов O. viverrini sl, в том числе в областях, где сами печеночные сосальщики не обнаружены (например, желчные протоки слишком малы в диаметре, чтобы они могли проникнуть). 15,21 Было высказано предположение, что это воспаление может быть опосредовано паразитоспецифическим воспалительным цитокином интерлейкином (ИЛ) -6, а позже было продемонстрировано повышение уровня ИЛ-6 до O. viverrini sl уровня экскреторных / секреторных веществ. связан с повышенным на 63% риском развития продвинутой PDF (симптом хронической инфекции O. viverrini sl и индикатор высокого риска развития CCA), и что у лиц, находящихся в третьем квартиле по выработке IL-6, уровень выработки IL-6 на 127% выше. риск развития продвинутой PDF, чем люди в первом квартиле производства IL-6. 17 В настоящее время хорошо известно, что хроническое воспаление, вызванное длительными или повторяющимися инфекциями O. viverrini sl, играет большую роль в развитии многих факторов и событий, которые приводят к ОСА, в первую очередь повышенного производства оксид азота (NO). 24–27
NO, а также другие кислородные радикалы, такие как супероксид (O 2 — ), образуются в хронически воспаленных тканях (с использованием индуцибельной NO-синтазы или iNOS в случае NO) как иммунный ответ, направленный на уничтожение паразита. 25 Паразитоспецифические Т-клетки и цитокины активируют такие клетки, как макрофаги, тучные клетки, эозинофилы и эпителиальные клетки, для синтеза NO, который является как цитотоксичным (повреждение клеток), так и генотоксическим (повреждение ДНК). 28 Это в значительной степени является результатом образования активных форм кислорода и активных форм азота (ROS / RNS). NO может реагировать с супероксидом с образованием пероксинитрита (ONOO —), высокореакционной молекулы, которая может вызывать окислительное и нитратное повреждение ДНК за счет образования аддуктов ДНК, таких как 8-оксо-7,8-дигидро-2′-дезоксигуанозин ( 8oxodG) и 8-нитрогуанин. 26 Это результирующее повреждение ДНК было связано с увеличением пролиферации клеток, вызванным накоплением ядерного антигена пролиферирующих клеток (PCNA) в эпителии желчных протоков (особенно при повторных инфекциях). 29 Кроме того, было показано, что NO дополнительно увеличивает возможность канцерогенеза за счет ингибирования репарации ДНК и ингибирования апоптоза. 30–32 Избыточное производство NO в результате длительной инфекции и воспаления O. viverrini sl может также увеличить потенциал эндогенного синтеза N-нитрозаминов, таких как канцерогенный N-диметилнитрозамин (NDMA ).Было показано, что эта реакция возникает в воспаленном желчном протоке. 28,33,34 Уровни NDMA были связаны с лимфопролиферативным ответом на антигенов O. viverrini sl и могут быть обнаружены в моче инфицированных людей. 35
Другой эффект связанных с воспалением ROS / RNS — перекисное окисление липидов. Продукты окисления липидов (такие как транс-4-гидрокси-2-ноненаль) могут реагировать с основаниями ДНК с образованием аддуктов этено-ДНК 1, N 6 -этено-2′-дезоксиаденозин (εdA) и 3, N 4 -этено-2′-дезоксицитидин (εdC). 36 Эти поражения могут инициировать канцерогенез посредством специфических замен пар оснований и, как было показано, накапливаются в лейкоцитах O. viverrini sl-инфицированных индивидуумов вместе с 8-oxodG. 36 Присутствие аддуктов ДНК, 8oxodG и 8-нитрогуанина, в эпителии желчных протоков и присутствие NDMA в моче у O. viverrini sl-инфицированных людей исчезают с лечением празиквантелом, что сильно усиливает связь между ними. эффекты и О.viverrini sl инфекция. 35,37 Количество аддуктов ДНК, εdA и εdC, также значительно снижается при лечении противопаразитарными препаратами, и их также можно измерить в моче. 36 Было показано, что без лечения празиквантелом 8-нитрогуанин и 8-oxodG остаются в эпителии хомяков через 180 дней после заражения. 29 Однако было показано, что повторное инфицирование увеличивает скорость инфильтрации воспалительных клеток, экспрессию iNOS в эпителии, выработку NO и образование 8-нитрогуанина и 8oxodG с каждой повторной инфекцией, что в конечном итоге увеличивает повреждение ДНК и риск развития рака. 29 Это поднимает вопрос о том, лучше ли лечить людей с высоким риском повторного заражения празиквантелом, поскольку он может принести больше вреда, чем пользы. У этого вопроса много социальных и моральных сложностей, но дополнительные исследования эффектов препарата и повторного заражения могут помочь приблизиться к поиску ответа.
Снижение иммунного ответа на хроническую инфекцию O. viverrini sl может частично объяснить, почему множественное повторное инфицирование может быть более разрушительным, чем одна хроническая инфекция, но также предполагает наличие иммуносупрессии. 38 Со временем можно увидеть постепенное уменьшение воспаления с соответствующим увеличением PDF — одного из ключевых этапов и индикаторов риска развития ОСО. 29 На протяжении всего инфекционного процесса воспаления происходит прогрессирующее разрушение и ремоделирование эпителия желчных протоков, наряду с увеличением синтеза коллагена типа I и типа III. 17,39 Связь PDF с повышенным риском развития CCA означает, что в Северо-восточном Таиланде наличие PDF используется для определения группы риска для расширенного планирования ультразвукового сканирования. 40
Взаимодействие между факторами риска
Риски для здоровья, связанные с образом жизни, и генетические полиморфизмы могут взаимодействовать с эффектами инфекции O. viverrini sl, усиливая потенциальные канцерогенные эффекты. На животных моделях инфекций O. viverrini sl было показано, что нитрозамины являются важным элементом холангиоканцерогенеза. 41 Диета в Северо-Восточном Таиланде, обычно содержащая ферментированную, сушеную или соленую рыбу и свинину, с высоким содержанием предварительно образованных нитрозаминов и, следовательно, может быть ключевой причиной высокой распространенности CCA, помимо риска содержания метацеркарий. 42 В Северо-восточном Таиланде также часто наблюдается высокий уровень их в колодезной воде. 43 Алкоголь и курение, особенно в сочетании друг с другом, могут усиливать канцерогенный эффект инфекции O. viverrini sl. Курение дополнительно вводит в организм нитрозамины, а также многие другие известные канцерогенные вещества. 44 Алкоголь влияет на метаболизм, распределение и канцерогенное действие нитрозаминов, тем самым повышая риск канцерогенеза для людей с высоким потреблением нитрозаминов. 45 Генетические полиморфизмы, такие как нулевой вариант фермента глутатион-S-трансферазы (GSTM1), также могут повышать риск рака в сочетании с инфекцией O. viverrini sl. Считается, что неэффективная форма этого фермента, выводящего канцерогены, приводит к увеличению выработки эндогенного нитрозамина у инфицированных O. viverrini sl – и к усилению канцерогенного эффекта. 43 Существует множество других заболеваний, поражающих желчевыводящие пути, которые связаны с заболеваемостью ОСА, например первичный склерозирующий холангит, врожденный фиброполикистоз печени, аденомы желчных протоков, билиарный папилломатоз, гепатолитиаз и цирроз, и есть даже слабые связи с гепатитом. B и C. 46 Однако существует очень мало опубликованных исследований комбинированных эффектов, которые они могут иметь при инфекции O. viverrini sl. Еще одним новым фактором риска для CCA является воздействие асбеста. 47 Было бы интересно изучить степень воздействия, которое это могло оказать на Юго-Восточную Азию, особенно в связи с инфекцией O. viverrini sl. Дальнейшие исследования могут дать более полное представление о влиянии комбинации факторов риска на риск О.viverrini sl и, возможно, поможет сформировать образование и политику в этой области в Юго-Восточной Азии.
Коморбидность почек
Было обнаружено, что почечные патологии развиваются вторично по отношению к гепатобилиарным аномалиям. В исследовании с хомячками, инфицированными O. viverrini sl, мезангиопролиферативная гломерулопатия развивалась через 8 недель, за которой следовали тубулярная атрофия и фиброз, а также отложение амилоида, что совпало с PDF и CCA. 48 Одно исследование обнаружило иммуноглобулины к O.viverrini sl в моче, что свидетельствует о гломерулонефрите, и заключил, что IgG против O. viverrini sl может иметь потенциал в качестве биомаркера из-за положительной корреляции с прогрессированием заболевания. 49 Считается, что это вызвано отложением иммунных комплексов, приводящим к хемоаттракции лейкоцитов и воспалению, таким образом увеличивая размер пор клубочков. Чем больше размер пор, тем больше IgG достигает мочи до такого уровня, что он перегружает реабсорбционную способность проксимального канальца. 50,51 Этот аспект описторхоза заслуживает дополнительных исследований, чтобы позволить правильно диагностировать заболевание и лечить его как синдром.
Диагноз
Метод седиментации формалина и этилацетата (FECT) в настоящее время считается золотым стандартом для определения инфекции O. viverrini sl и использует микроскоп для подсчета любых яиц, присутствующих в фекалиях, и количественной оценки интенсивности инфекции в организме. яйца на грамм (epg). 52,53
FECT — это простая, неинвазивная процедура, но требует наличия опытного микроскописта из-за часто низкой яйценоскости отдельных особей, а также нескольких образцов и повторов для уменьшения количества ложноотрицательных результатов. 52 Этот метод также основан на том, что паразиты достигли уровня зрелости, необходимого для выпуска яиц в желудочно-кишечный тракт, что приводит к низкой специфичности, поскольку яйца могут отсутствовать, несмотря на инфекцию O. viverrini sl. Более того, яиц O. viverrini sl можно легко спутать с яйцами других паразитов, например мелких кишечных сосальщиков, что приводит к ложноположительным результатам. 54 Таким образом, FECT часто используется вместе с твердофазным иммуноферментным анализом на основе моноклональных антител (mAb) (ELISA) или непрямым ELISA на антитела.
mAb ELISA обнаруживает антигенов O. viverrini sl в кале или копроантигенов и является более чувствительным, чем FECT. Он не перекрестно реагирует с сосальщиками, в отличие от непрямого ELISA на антитела, но выявляет только текущие инфекции, в то время как непрямой ELISA на антитела может обнаруживать прошлые инфекции, поскольку антитела сохраняются в жидкостях организма после лечения празиквантелом. 55 Те, у кого в прошлом были инфекции, все еще подвержены риску CCA, поэтому непрямой иммуноферментный анализ на антитела полезен для идентификации этой когорты.
Непрямой иммуноферментный анализ антител используется, когда доступен только образец крови или мочи. Хотя уровни антител в сыворотке выше, моча является неинвазивной альтернативой, не требующей быстрой обработки или квалифицированного флеботомиста. 56 Оба теста ELISA более чувствительны к инфекциям O. viverrini sl, чем FECT. Распространенность инфекций O. viverrini sl означает, что некоторые люди, вероятно, инфицированы червями, которые еще не достигли зрелости и поэтому не выделяют яйца, что свидетельствует о необходимости использования ELISA для подтверждения результата FECT и предотвращения ложноотрицательные. 57
Следующим шагом будет определение степени заболевания. Имеющиеся симптомы ОСО не могут обеспечить дифференциальный диагноз, поэтому для диагностики PDF и ОСА часто используются методы визуализации и эндоскопические методы. 58 Ультразвук является основным инструментом визуализации в Юго-Восточной Азии из-за его низкой стоимости и портативности. Он чувствителен к расширению желчных протоков и может обнаруживать PDF, но не злокачественные новообразования. Поэтому при обнаружении аномалий в больнице проводят МРТ и КТ. 59 И КТ, и МРТ могут определять злокачественность, но МРТ обеспечивает превосходное разрешение мягких тканей, может определять перидуктальную инфильтрацию и степень локализации опухоли, а также может идентифицировать небольшие поражения в большей степени, чем КТ. 60,61 Однако компьютерная томография стоит дешевле и поэтому широко используется в Юго-Восточной Азии в качестве альтернативы. 62 Эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) используется для визуализации билиарного дерева, а также получения желчных щеток и образцов желчи для гистопатологии и цитологии. 63,64 Однако фиброзная природа опухоли может привести к низкому результату сбора образцов, а ряд других ошибок выборки и интерпретации снижает специфичность этого метода. 65,66 Существует также терапевтическая ценность, поскольку можно использовать пластиковые или саморасширяющиеся металлические стенты для дренажа желчных протоков. 67 Магнитно-резонансная холангиопанкреатография (MRCP) — это сканирование с помощью магнитно-резонансной томографии, оптимизированное для желчевыводящих и панкреатических протоков, и его все чаще предпочитают в качестве диагностического теста выбора из-за его неинвазивной природы в отличие от ERCP. 68 Использование высокого содержания воды в желчи в качестве контрастного вещества, это отличный метод для оценки обструкции желчных путей и локализации поражений, но ERCP по-прежнему часто требуется для биопсии и установки стентов. 69
Всем доступным в настоящее время биомаркерам не хватает специфичности и чувствительности, поэтому настоящее исследование сосредоточено на надежных биомаркерах, позволяющих проводить ранний мониторинг описторхоза. 70,71
Биомаркеры
Визуализация PDF-файла чрезвычайно субъективна; следовательно, необходимы биомаркеры для определения лиц, подверженных риску развития ОСО, для мониторинга заболевания. 72 CCA имеет несколько путей, поэтому в идеале необходимо несколько биомаркеров, чтобы охватить все пути, что требует различных направлений исследований. 73
В одном из таких подходов использовалась магнитно-резонансная спектроскопия для анализа химического состава желчи у лиц с ОСА по сравнению с контрольной группой и оценки того, можно ли использовать какие-либо отличающиеся молекулы в качестве биомаркеров. Используя многомерный анализ распознавания образов, образцы CCA были успешно выделены для образцов без CCA с чувствительностью 80% и специфичностью 95%, при этом фосфатидилхолин, желчные кислоты H-18 и желчные кислоты, конъюгированные с таурином, были наиболее полезными метаболитами для дифференциация образцов. 69 Было обнаружено, что содержание глицин-конъюгированных желчных кислот значительно повышается в желчи пациентов с ОСА, что позволяет сделать вывод о том, что первичные желчные кислоты, а также желчные кислоты, конъюгированные с глицином, могут иметь потенциал для использования в качестве биомаркеров. 69
Продукты, вызванные окислительным повреждением ДНК, часто могут использоваться в качестве биомаркеров. Было показано, что хомяки, инфицированные O. viverrini sl, экспрессируют iNOS в эпителиальных клетках желчных протоков и воспалительных клетках, что приводит к избытку ROS / RNS и образованию аддуктов ДНК, таких как 8-нитрогуанин и 8-oxodG . 74 Было обнаружено, что уровни двух аддуктов ДНК увеличиваются с увеличением числа повторных инфекций. 29 8-oxodG был обнаружен в лейкоцитах и значительно коррелировал с уровнями в моче и с прогрессированием заболевания. 75
Одно исследование показало, что уровни 8-oxodG в моче значительно различались между контрольными людьми (здоровые и продвинутые PDF-отрицательные — APF–) и люди с прогрессирующим гепатобилиарным заболеванием (CCA и продвинутый PDF-положительный — APF +).Не было значительной разницы между пациентами с CCA и APF.
Площадь под кривой (AUC) кривой рабочих характеристик приемника для диагностики APF составляла 0,74 и 0,88 для CCA. 76 Таким образом, 8-oxodG был классифицирован как надежный, точный, воспроизводимый и стабильный; однако, поскольку уровни повышаются при некоторых других формах рака, способность 8-oxodG действовать как биомаркер снижается. 77,78
Иммуноглобулины против антигенов O. viverrini sl значительно усиливаются в процессе канцерогенеза, и уровни коррелируют с прогрессированием заболевания. 29 Почечные аномалии, которые возникают наряду с гепатобилиарными патологиями, означают, что чем более запущено заболевание, тем выше повреждение клубочков, что позволяет большему количеству IgG проникать в мочу. 47 Одно исследование показало, что> 60% людей, которые были APF +, и все люди с CCA, дали положительный результат на IgG против антигена O. viverrini sl в моче, но почти у всех людей он был в крови. Это означает, что только у людей с запущенными гепатобилиарными патологиями развиваются почечные осложнения, достаточно значительные для присутствия IgG в моче.Уровни IgG в моче против O. viverrini sl были значительно выше у лиц с гепатобилиарными аномалиями по сравнению с контрольной группой, были способны различать ОСА и другие стадии описторхоза и могли различать легкую и тяжелую O. viverrini sl инфекции. 48
Мутации ДНК
CpG-островки являются потенциальным источником биомаркеров и часто метилируются при раке, что приводит к подавлению транскрипции. 79,80 Одно исследование было направлено на поиск гиперметилирования в определенных локусах для поиска прогностических или диагностических биомаркеров. 81 Для анализа данных был создан индекс метилирования (MI), который представлял собой отношение количества метилированных островков CpG к общему количеству изученных островков CpG. 82 В результате ИМ для ОСА (0,12) был значительно выше, чем для нормальных тканей (0,02). Опиоид-связывающий белок / молекула клеточной адгезии, подобная гену (OPCML), была наиболее часто метилированной (72.5%). 80 Он не был обнаружен метилированным в нормальных тканях и был связан с менее дифференцированным CCA, что привело к худшему прогнозу и увеличению вероятности метастазирования. 83,84
OPCML является геном-супрессором опухоли и метилирован при некоторых других раковых заболеваниях, таких как рак яичников, и поэтому мало пригоден при использовании отдельно. 85 PTEN, HIC1 и SFRP1 также часто были сильно метилированы и, как полагают, играют роль в увеличении пролиферации и выживаемости, а также обладают антиапоптотическим эффектом.Было обнаружено, что пациенты, у которых было метилирование в локусе DcR1, имели более длительную выживаемость, чем пациенты без него, что позволяет предположить, что DcR1 может использоваться для определения прогноза пациентов с CCA. 80
MicroRNA
Многие виды рака вызывают повышенную / понижающую регуляцию определенных miRNA, которые могут быть обнаружены в жидкостях организма. 86 В CCA было обнаружено изменение уровней нескольких miRNA, таких как miR-141, которая увеличивается, miR-370, которая уменьшается, и miR-21, которая, как было обнаружено, коррелирует с прогрессированием заболевания у хомяков. 71,87,88 Одно исследование показало, что уровни miR-192 в сыворотке у пациентов с CCA были значительно выше, чем у здоровых субъектов, с AUC 0,803, но не были значительно увеличены по мере прогрессирования описторхоза.
Несмотря на это, увеличение уровней miR-192 на всем пути канцерогенеза означает, что это повышение вызвано воспалением, управляемым паразитами. Высокие уровни также имеют значительную корреляцию с метастазами в лимфатические узлы и снижением выживаемости, что означает, что их можно использовать в качестве прогностического маркера. 89
Использование miR-192 в качестве биомаркера при обнаружении в моче также было исследовано вместе с miR-21. В моче уровни miR-192 значительно различались у здоровых и инфицированных O. viverrini sl, здоровых и PDF и здоровых и CCA. Не только это, но и уровень miRNA-192 между здоровыми и другими воспалительными заболеваниями не был значительным и поэтому может быть описан как специфический для заболевания. Было обнаружено, что miR-21 значительно выше для PDF, CCA и других воспалительных заболеваний, чем у здоровых субъектов, что делает его полезным потенциальным биомаркером, хотя он не является уникальным для CCA.Когда две miRNA были объединены, результаты дифференциации между индивидуумами улучшились и устранили проблему того, что miR-21 не является специфичной для заболевания. 90
Текущее лечение
Празиквантел — дешевый и эффективный противогельминтный препарат для лечения инфекций O. viverrini sl, который в начале 1980-х годов использовался для массового введения лекарств в Таиланде для предотвращения ОСО. Это эффективно снизило распространенность с 80% до 15-20% к 1997 году. 91 Хотя празиквантел остановит паразитарную инфекцию, любое воспаление и фиброз в желчных протоках, которые останутся, будут фактором риска развития ОСО.Еще одна проблема заключается в том, что многие люди будут повторно инфицированы O. viverrini sl, что может увеличить риск CCA из-за острой воспалительной фазы повторного инфицирования, в отличие от хронического воспаления. 92 Таким образом, повторное введение лекарств может увеличить риск холангиоканцерогенеза, если люди продолжают есть сырую рыбу и повторно заражаются после лечения празиквантелом.
Эффективное лечение CCA ограничено, демонстрирует устойчивость к химиотерапии, с очень низким уровнем ответа. 93 Одно исследование потенциально нашло будущее применение химиотерапии: для предотвращения резистентности к TRAIL (лиганд, индуцирующий фактор некроза опухоли). При использовании в сочетании с рекомбинантными TRAIL или агонистическими моноклональными антителами к рецепторам TRAIL, это потенциально является селективным лечением CCA, поскольку опухолевые клетки намного более чувствительны, чем нормальные клетки, к TRAIL-индуцированному апоптозу. 80
Тем не менее, в Юго-Восточной Азии единственными действующими эффективными методами лечения являются хирургическая резекция и трансплантация печени.К моменту появления ОСА прогноз обычно плохой, так как опухоль слишком развита для удаления. В то время как внутригрудные опухоли можно агрессивно лечить с помощью портальной эмболизации наряду с резекциями печени и воротной вены, внепеченочный рост опухоли является противопоказанием для хирургического вмешательства. Отчеты показывают, что из тех, у кого была «успешная» резекция, то есть резекция R0, 5-летняя выживаемость все еще составляла всего 25–30%, снижаясь до 0–12% для пациентов с положительными границами. 94,95 Исследовательской группе из Северо-Восточного Таиланда удалось получить многообещающую частоту резекции R0 в 64% у 83 пациентов.5-летняя выживаемость для всей группы составила 21%, а для группы R0 — 30%. 96 Несмотря на плохой общий прогноз, при использовании неоадъювантной химиотерапии можно достичь 65% излечения в случаях перихилярной ОСА. 97
Если резекция не является вариантом для внутрипеченочного ОСА, пациенты без внепеченочного роста могут иметь право на трансплантацию печени. 93 В прошлом трансплантация печени рассматривалась как неэффективная при лечении ОАС с 5-летней выживаемостью 0–20% в серии публикаций, опубликованных в Королевском колледже Лондона и Ганновера. 98,99 Однако недавние исследования возобновили интерес к трансплантации печени: в одном из центров США 5-летняя выживаемость составила> 70% при использовании неоадъювантной химиотерапии в тщательно отобранной группе. 100 Другая группа из Скандинавии достигла 50% 5-летней выживаемости, опять же при очень строгом отборе пациентов. 101 Как правило, эти случаи связаны с очень маленькими опухолями, которые считаются неоперабельными и возникают в перихилярной области печени. Только несколько процентов от числа рассмотренных считаются правомочными.Эти исследования показывают, что вместо того, чтобы рассматривать трансплантацию печени как плохую альтернативу, руководящие принципы, на которые могут претендовать пациенты, должны быть более строгими.
Иммунотерапия — это новый многообещающий метод лечения, который будет использоваться в качестве дополнения к хирургическому вмешательству и / или химиотерапии. Наличие лейкоцитов в инфицированных участках позволяет использовать иммунную систему для борьбы с опухолью. 102 Персональные пептидные вакцины, которые иммунизируют пациента против хозяина антигенов, и дендритные вакцины, которые иммунизируют против одного антигена без необходимости обработки и сниженного аутоиммунитета, значительно более эффективны при адъювантном применении с химиотерапией по сравнению с одной химиотерапией. 103 Так же, как и при химиотерапии, дендритные вакцины обеспечивали среднее время выживания 17,4 месяца при введении вместе с хирургическим вмешательством по сравнению с 7,7 месяцами при использовании только хирургического вмешательства. 104 Метаанализ показал, что более высокая экспрессия иммунных активных факторов привела к значительно лучшему прогнозу ( P <0,00001) и что изменение микросреды опухоли для увеличения инфильтрации Т-клеток значительно увеличивало 6-месячное прогрессирование - коэффициент свободной выживаемости ( P <0.05). 101 Цитотоксический Т-лимфоцитарный антиген 4 и взаимодействие между запрограммированной гибелью клеток 1 (PD1) и его лигандом (PDL1) являются путями, которые опухоль использует для уклонения от иммунной системы. Пассивная иммунотерапия использует моноклональные антитела, чтобы блокировать эти взаимодействия, чтобы иммунная система могла бороться с опухолью. Однако, хотя это было сделано при других злокачественных новообразованиях, таких как меланома, опубликованных данных об эффективности против CCA нет. 105
Когда опухоль слишком развита для лечения, единственным другим вариантом является паллиативная помощь.В Северо-Восточном Таиланде более 95% случаев имеют ОСО 4 стадии, поэтому 70–80% пациентов получают паллиативное лечение с использованием стентов для дренажа желчных путей. 106,107 Большое количество случаев ОСО 4 стадии подчеркивает необходимость исследования более ранней диагностики, чтобы выявить случаи на более раннем этапе их прогрессирования.
Резюме
Высокий уровень инфицирования O. viverrini sl в Юго-Восточной Азии привел к тому, что Северо-Восточный Таиланд имеет самый высокий уровень заболеваемости ОАС в мире.Инфекцию печеночной двуусткой можно легко диагностировать с помощью FECT или ELISA, при этом в качестве лечения используется празиквантел. Однако из-за того, что пациенты с CCA остаются бессимптомными до последних стадий заболевания, уровень излечения без ранней диагностики и вмешательства ужасен. Таким образом, в настоящее время ультразвук обычно используется для скрининга людей на потенциально ранние стадии ОСА или лиц из группы риска с PDF. МРТ и КТ используются в дальнейшем для оценки потенциального злокачественного новообразования, а ERCP могут использоваться для дальнейшего подтверждения. O. viverrini sl также был вовлечен в патологию почек, вызванную иммунным ответом с последующим гломерулонефритом. Образующийся в результате IgG, обнаруженный в моче, может использоваться в качестве синдромного биомаркера. В настоящее время проводятся исследования биомаркеров различных аспектов канцерогенного пути для выявления CCA на ранних стадиях и повышения шансов на успешное вмешательство.
Заключение
Чтобы лучше всего бороться с CCA в Юго-Восточной Азии в краткосрочной перспективе, исследования должны быть сосредоточены на ранней и более точной диагностике CCA и ее тревожных признаках.Продолжение усилий по созданию ряда биомаркеров для различных стадий канцерогенного пути может привести к резкому снижению уровня смертности и улучшению прогнозов для пациентов. В долгосрочной перспективе государственные образовательные программы, такие как организованные Программой скрининга и лечения холангиокарциномы (CASCAP), следует продолжать внедрять и расширять, чтобы информировать население об опасностях употребления в пищу определенных видов сырой, частично приготовленной или ферментированной рыбы. и, возможно, со временем разовьются практики, касающиеся «грубого отношения».” 14 Исследование недостаточно изученных почечных эффектов описторхоза также может помочь понять сложный эффект долгосрочной инфекции O. viverrini и то, как с ней бороться как с синдромом.
Благодарности
Все авторы выражают признательность Национальному институту медицинских исследований, Центру биомедицинских исследований при Имперском колледже Лондона за поддержку инфраструктуры. SDT-R имеет гранты Совета медицинских исследований Соединенного Королевства.Сотрудничество было поддержано грантом Wellcome Trust ISSF Имперскому колледжу Лондона. PS и RHA были поддержаны грантами Таиландского исследовательского фонда (TRF). Авторы хотели бы поблагодарить доктора Шахида Кхана и Мэри Кросси за их помощь и советы по содержанию этого обзора, а также Надду Киацопит за создание рисунка 1.
Раскрытие
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Ссылки
1. | Кейзер Дж., Утзингер Дж.Трематодозы пищевого происхождения. Clin Microbiol Rev. 2009; 22 (3): 466–483. | |
2. | Andrews RH, Sithithaworn P, Petney TN. Opisthorchis viverrini: недооцененный паразит в мировом здравоохранении. Trends Parasitol. 2008; 24 (11): 497–501. | |
3. | Saijuntha W., Sithithaworn P, Wongkham S, et al. Свидетельства видового комплекса трематоды пищевого происхождения Opisthorchis viverrini и возможной совместной эволюции с их первыми промежуточными хозяевами. Int J Parasitol. 2007; 37 (6): 695–703. | |
4. | Сититаворн П., Эндрюс Р. Х., Петни Т. Н., Сайджунта В., Лаопром Н. Систематика и популяционная генетика Opisthorchis vrini sensu lato: значение для эпидемиологии паразитов и протоков. Parasitol Int. 2012; 61 (1): 32–37. | |
5. | Kiatsopit N, Sithithaworn P, Saijuntha W, Petney TN, Andrews RH. Opisthorchis viverrini : последствия систематики первых промежуточных хозяев, Bithynia видов улиток в Таиланде и Лаосской НДР. Infect Genet Evol. 2013; 14: 313–319. | |
6. | Brockelman WY, Upatham ES, Viyanant V, Ardsungnoen S, Chantanawat R. Полевые исследования передачи человеческой печеночной двуустки, Opisthorchis viverrini : изменения населения на северо-востоке Таиланда промежуточного хозяина улитки. Int J Parasitol. 1986; 16 (5): 545–552. | |
7. | Намсанор Дж., Сититаворн П., Кополрат К. и др. Сезонная передача Opisthorchis viverrini sensu lato и лецитодендриидных трематод в улитках Bithynia siamensis goniomphalos на северо-востоке Таиланда. Am J Trop Med Hyg. 2015; 93 (1): 87–93. | |
8. | Kiatsopit N, Sithithaworn P, Saijuntha W, et al.Исключительно высокая распространенность инфекции Bithynia siamensis goniomphalos и Opisthorchis viverrini cercariae на различных водно-болотных угодьях в Таиланде и Лаосской Народно-Демократической Республике. Am J Trop Med Hyg. 2012; 86 (3): 464–469. | |
9. | Haas W, Granzer M, Brockelman CR. Opisthorchis viverrini : обнаружение и распознавание рыбы-хозяина по церкариям. Exp Parasitol. 1990; 71 (4): 422–431. | |
10. | Sithithaworn P, Yongvanit P, Duenngai K, Kiatsopit N, Pairojkul C. Роли инфекции печеночного двуустника как фактора риска холангиокарциномы. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 301–308. | |
11. | Sithithaworn P, Haswell-Elkins M. Эпидемиология Opisthorchis viverrini . Acta Trop. 2003; 88 (3): 187–194. | |
12. | Kopolrat K, Sithithaworn P, Kiatsopit N, et al. Сравнение инфекционности, метацеркарии и смертности хозяев, вызванных Opisthorchis viverrini sensu lato cercariae из Лаосской НДР, по сравнению с Таиландом у карповых рыб, Barbonymus gonionotus . Trans R Soc Trop Med Hyg. 2016; 110 (1): 46–54. | |
13. | Donthaisong C, Arunsan P, Suwannatrai K, et al. Экспериментальное заражение Opisthorchis viverrini cercariae карповым рыбам, Barbonymus gonionotus . Acta Trop. 2014; 136: 118–122. | |
14. | Гранди-Уорр К., Эндрюс Р. Х., Сититаворн П. и др. Грубое отношение, культура водно-болотных угодий, жизненные циклы: социокультурная динамика, относящаяся к Opisthorchis viverrini в бассейне Меконга. Parasitol Int. 2012; 61 (1): 65–70. | |
15. | Sripa B, Kaewkes S, Sithithaworn P, et al. Печеночная двуустка вызывает холангиокарциному. PLoS Med. 2007; 4 (7): e201. | |
16. | Macpherson CN. Поведение человека и эпидемиология паразитарных зоонозов. Int J Parasitol. 2005; 35 (11–12): 1319–1331. | |
17. | Sripa B, Mairiang E, Thinkhamrop B, et al. Продвинутый перидуктальный фиброз в результате инфицирования канцерогенным печеночным двуустком человека Opisthorchis viverrini коррелирует с повышенным уровнем интерлейкина-6. Гепатология. 2009; 50 (4): 1273–1281. | |
18. | Enes JE, Wages AJ, Malone JB, Tesana S. Распространенность инфекции Opisthorchis viverrini среди собак и кошек в трех деревнях, провинция Кхон Каен, Таиланд. Юго-Восточная Азия J Trop Med Public Health. 2010; 41 (1): 36–42. | |
19. | Янг Н.Д., Кэмпбелл Б.Э., Холл Р.С. и др.Разблокирование транскриптомов двух канцерогенных паразитов, Clonorchis sinensis и Opisthorchis viverrini . PLoS Negl Trop Dis. 2010; 4 (6): e719. | |
20. | Всемирная организация здравоохранения. Биологические агенты — обзор канцерогенов человека. IARC Monogr Eval Carcinog Risks Hum. 2014; 100B: 341–371. | |
21. | Bhamarapravati N, Thammavit W, Vajrasthira S.Изменения печени у хомяков, инфицированных печеночной двуусткой человека, Opisthorchis viverrini . Am J Trop Med Hyg. 1978; 27 (4): 787–794. | |
22. | Mantovani A, Allavena P, Sica A, Balkwill F. Воспаление, связанное с раком. Природа. 2008; 454 (7203): 436–444. | |
23. | Пунгпак С., Чалермрут К., Харинасута Т. и др. Инфекция Opisthorchis viverrini в Таиланде: симптомы и признаки инфекции — популяционное исследование. Trans R Soc Trop Med Hyg. 1994; 88 (5): 561–564. | |
24. | Holzinger F, Z’Graggen K, Buchler MW. Механизмы канцерогенеза желчевыводящих путей: патогенетический многоступенчатый каскад к холангиокарциноме. Ann Oncol. 1999; 10 Дополнение 4: 122–126. | |
25. | Ohshima H, Bartsch H. Хронические инфекции и воспалительные процессы как факторы риска рака: возможная роль оксида азота в канцерогенезе. Mutat Res. 1994; 305 (2): 253–264. | |
26. | Иноуэ С., Каваниши С. Окислительное повреждение ДНК, вызванное одновременным образованием оксида азота и супероксида. FEBS Lett. 1995; 371 (1): 86–88. | |
27. | Каваниши С., Хираку Ю. Окислительные и нитратные повреждения ДНК как биомаркеры канцерогенеза с особым упором на воспаление. Антиоксидный окислительно-восстановительный сигнал. 2006; 8 (5–6): 1047–1058. | |
28. | Йонгванит П., Пинлаор С., Барч Х. Окислительное и нитративное повреждение ДНК: ключевые события в канцерогенезе, вызванном описторхозом. Parasitol Int. 2012; 61 (1): 130–135. | |
29. | Pinlaor S, Sripa B, Sithithaworn P, Yongvanit P. Изменения гепатобилиарной системы, антительный ответ и изменение ферментов печени у хомяков, повторно инфицированных Opisthorchis viverrini. Exp Parasitol. 2004; 108 (1-2): 32-39. | |
30. | Jaiswal M, LaRusso NF, Burgart LJ, Gores GJ. Воспалительные цитокины вызывают повреждение ДНК и ингибируют репарацию ДНК в клетках холангиокарциномы по механизму, зависимому от оксида азота. Cancer Res. 2000; 60 (1): 184 — 190. | |
31. | Jaiswal M, LaRusso NF, Shapiro RA, Billiar TR, Gores GJ.Опосредованное оксидом азота ингибирование репарации ДНК усиливает окислительное повреждение ДНК в холангиоцитах. Гастроэнтерология. 2001; 120 (1): 190–199. | |
32. | Torok NJ, Higuchi H, Bronk S, Gores GJ. Оксид азота подавляет апоптоз после высвобождения цитохрома С за счет нитрозилирования каспазы 9. Cancer Res. 2002; 62 (6): 1648–1653. | |
33. | Srivatanakul P, Ohshima H, Khlat M, et al. Opisthorchis viverrini Инвазия и эндогенные нитрозамины как факторы риска холангиокарциномы в Таиланде. Int J Cancer. , 1991; 48 (6): 821–825. | |
34. | Satarug S, Haswell-Elkins MR, Tsuda M, et al. Нитрозирование, не зависящее от тиоцианата, у людей с канцерогенной паразитарной инфекцией. Канцерогенез. 1996; 17 (5): 1075–1081. | |
35. | Satarug S, Haswell-Elkins MR, Sithithaworn P, et al.Связь между синтезом N-нитрозодиметиламина и иммунным ответом на хроническую инфекцию канцерогенным паразитом, Opisthorchis viverrini , у мужчин. Канцерогенез. 1998; 19 (3): 485–491. | |
36. | Dechakhamphu S, Pinlaor S, Sitthithaworn P, Nair J, Bartsch H, Yongvanit P. Перекисное окисление липидов и аддукты этено-ДНК в белых кровяных тельцах пациентов, инфицированных двуусткой печени альфа-токоферол плазмы и празиквантел. Биомаркеры эпидемиологии рака Пред. 2010; 19 (1): 310–318. | |
37. | Pinlaor S, Hiraku Y, Yongvanit P и др. iNOS-зависимое повреждение ДНК через экспрессию NF-kappaB у хомяков, инфицированных Opisthorchis viverrini , и его подавление антигельминтным препаратом празиквантел. Int J Cancer. 2006; 119 (5): 1067–1072. | |
38. | Sripa B, Kaewkes S.Связь между паразитоспецифическими реакциями антител и интенсивностью инфекции Opisthorchis viverrini у хомяков. Parasite Immunol. 2000; 22 (3): 139–145. | |
39. | Chotigeat W, Ruenwongsa P. Типы коллагена в Opisthorchis viverrini инфицированная печень хомяка. Mol Biochem Parasitol. 1986; 18 (3): 377–387. | |
40. | Mairiang E, Elkins DB, Mairiang P, et al.Взаимосвязь между интенсивностью инфекции Opisthorchis viverrini и гепатобилиарной болезнью, обнаруженной при ультразвуковом исследовании. J Gastroenterol Hepatol. 1992; 7 (1): 17–21. | |
41. | Thamavit W, Bhamarapravati N, Sahaphong S, Vajrasthira S., Angsubhakorn S. Влияние диметилнитрозамина на индукцию холангиокарциномы в сирийской опухоли. Cancer Res. 1978; 38 (12): 4634–4639. | |
42. | Srivatanakul P, Sukaryodhin S, Ohshima H, et al. Opisthorchis viverrini Инвазия и эндогенные нитрозамины как факторы риска холангиокарциномы в Таиланде. Инт Дж. Рак . 1991; 48: 821–825. | |
43. | Honjo S, Srivatanakul P, Sriplung H, et al. Генетические и экологические детерминанты риска холангиокарциномы через Opisthorchis viverrini в густо зараженной местности в Накхон Пханом, северо-восток Таиланда. Инт Дж. Рак . 2005. 117: 854–860. | |
44. | Трикер AR. N-нитрозосоединения и человек: источники воздействия, эндогенное образование и наличие в жидкостях организма. Eur J Cancer Назад . 1997. 6 (3): 226–268. | |
45. | Swann PF. Влияние этанола на метаболизм и распределение нитрозаминов. Значение роли нитрозаминов в развитии рака у человека и влияние употребления алкоголя на заболеваемость раком. IARC Sci Publ. 1984; (57): 501–512. | |
46. | Хан С.А., Толедано МБ, Тейлор-Робинсон С.Д. Эпидемиология, факторы риска и патогенез холангиокарциномы. HPB . 2008; 10: 77–82. | |
47. | Brandi G, Di Girolamo S, Farioli A, et al. Асбест: скрытый игрок в росте холангиокарциномы? Результаты анализа случай-контроль. Контроль причин рака. 2013; 24 (5): 911–918. | |
48. | Boonpucknavig S, Boonpucknavig V, Tanvanich S, Doungchawee G, Thamavit W. Развитие иммунного комплексного гломерулонефрита и амилоидоза у сирийских золотистых хомячков . J Med Assoc Thai. 1992; 75 (Дополнение 1): 7–19. | |
49. | Saichua P, Sithithaworn P, Jariwala AR, et al.Микропротеинурия во время инфекции Opisthorchis viverrini : биомаркер поздних почечных и гепатобилиарных патологий, вызванных хроническим описторхозом. PLoS Negl Trop Dis. 2013; 7 (5): e2228. | |
50. | D’Amico G, Bazzi C. Патофизиология протеинурии. Kidney Int. 2003; 63 (3): 809–825. | |
51. | Левинский Р.Дж. Роль циркулирующих иммунных комплексов при заболеваниях почек. J Clin Pathol. 1981; 34 (11): 1214–1222. | |
52. | CDC-DPDx. DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность в области общественного здравоохранения. DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность общественного здравоохранения 2016; DPDx — Лабораторная идентификация паразитарных заболеваний, вызывающих озабоченность общественного здравоохранения. По состоянию на 19 марта 2016 г. | |
53. | Johansen MV, Lier T, Sithithaworn P.На пути к улучшенной диагностике запущенных зоонозных трематод с использованием подхода «Единое здоровье». Acta Trop. 2015; 141 (Pt B): 161–169. | |
54. | Утцингер Дж., Браттиг Н.В., Леонардо Л., Чжоу XN, Бергквист Р. Прогресс в исследованиях, контроле и ликвидации гельминтозов в Азии. Acta Trop. 2015; 141 (Pt B): 135–145. | |
55. | Джаморнтханьяват Н. Диагностика описторхоза человека. Юго-Восточная Азия J Trop Med Public Health. 2002; 33 Дополнение 3: 86–91. | |
56. | Савангсода П., Сититаворн Дж., Тесана С. и др. Диагностические значения определения паразитоспецифических антител в слюне и моче по сравнению с сывороткой при описторхозе. Parasitol Int. 2012; 61 (1): 196–202. | |
57. | Worasith C, Kamamia C, Яковлева А и др. Достижения в диагностике описторхоза человека: разработка обнаружения антигена Opisthorchis viverrini в моче. PLoS Negl Trop Dis. 2015; 9 (10): e0004157. | |
58. | Накиб А., Питт Х.А., Сон Т.А. и др. Холангиокарцинома. Спектр внутрипеченочных, перихилярных и дистальных опухолей. Ann Surg. , 1996, 224 (4): 463–473; обсуждение 473–465. | |
59. | Заброн А., Эдвардс Р.Дж., Хан С.А. Проблема холангиокарциномы: анализ молекулярных механизмов коварного рака. Dis Model Mech. 2013; 6 (2): 281–292. | |
60. | Chamadol N, Pairojkul C, Khuntikeo N, et al. Гистологическое подтверждение перидуктального фиброза при ультразвуковой диагностике у пациентов с холангиокарциномой. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 316–322. | |
61. | Wadsworth CA, Lim A, Taylor-Robinson SD, Khan SA. Факторы риска и диагностика холангиокарциномы. Hepatol Int. 2013; 7 (2): 377–393. | |
62. | Ибрагим Р. С.С., Мазли М., Амризал М., Альджунид С. Стоимость магнитно-резонансной томографии (МРТ) и компьютерной томографии (КТ) в UKMMC. BMC Health Serv Res. 2012; 12 (1): 11. | |
63. | Хан С.А., Дэвидсон Б.Р., Голдин Р. и др. Рекомендации по диагностике и лечению холангиокарциномы: согласованный документ. Gut. 2002; 51 Приложение 6: VI1–9. | |
64. | Boberg KM, Jebsen P, Clausen OP, Foss A, Aabakken L, Schrumpf E. Диагностическая польза цитологии желчных протоков при холангиокарциноме при первичном склерозирующем холангите. J Hepatol. 2006; 45 (4): 568–574. | |
65. | Weber A, von Weyhern C, Fend F, et al. Эндоскопическая транспапиллярная щеточная цитология и щипцовая биопсия у пациентов с внутригрудной холангиокарциномой. World J Gastroenterol. 2008; 14 (7): 1097–1101. | |
66. | Бесплатный словарь. Чистка желчевыводящих путей; 2016. Доступно по ссылке: http://medical-dictionary.thefreedictionary.com/bilary+brushing. По состоянию на 7 сентября 2016 г. | |
67. | Содерлунд С., Линдер С. Покрытые металлические стенты в сравнении с пластиковыми при злокачественном стенозе общего желчного протока: проспективное рандомизированное контролируемое исследование. Gastrointest Endosc. 2006; 63 (7): 986–995. | |
68. | Прасад С.Р., Сахани Д., Саини С. Клинические применения магнитно-резонансной холангиопанкреатографии. Дж Клин Гастроэнтерол. 2001; 33 (5): 362–366. | |
69. | Romagnuolo J, Bardou M, Rahme E, Joseph L, Reinhold C, Barkun AN. Магнитно-резонансная холангиопанкреатография: метаанализ результатов теста при подозрении на заболевание желчевыводящих путей. Ann Intern Med. 2003; 139 (7): 547–557. | |
70. | Sharif AW, Williams HR, Lampejo T. и др. Метаболический профиль желчи при холангиокарциноме с использованием магнитно-резонансной спектроскопии in vitro. HPB (Оксфорд). 2010; 12 (6): 396–402. | |
71. | Альваро Д. Сывороточные и желчные биомаркеры холангиокарциномы. Curr Opin Gastroenterol. 2009; 25 (3): 279–284. | |
72. | Yongvanit P, Pinlaor S, Loilome W. Биомаркеры риска для оценки и химиопрофилактики холангиокарциномы, связанной с двуустками печени. J Hepatobiliar Pancreat Sci. 2014; 21 (5): 309–315. | |
73. | Kelloff GJ, Boone CW, Crowell JA и др. Биомаркеры риска и современные стратегии химиопрофилактики рака. J Cell Biochem Suppl. 1996; 25: 1–14. | |
74. | Pinlaor S, Yongvanit P, Hiraku Y, et al. Образование 8-нитрогуанина в печени хомяков, инфицированных Opisthorchis viverrini . Biochem Biophys Res Commun. 2003; 309 (3): 567–571. | |
75. | Танан Р., Мурата М., Пинлаор С. и др. 8-оксо-7,8-дигидро-2′-дезоксигуанозин в моче у пациентов с паразитарной инфекцией и действие противопаразитарных препаратов в отношении холангиоканцерогенеза. Биомаркеры эпидемиологии рака Пред. 2008; 17 (3): 518–524. | |
76. | Сайчуа П., Яковлева А., Камамиа С. и др. Уровни 8-oxodG позволяют прогнозировать гепатобилиарную патологию в эндемичных по Opisthorchis viverrini местах в Таиланде. PLoS Negl Trop Dis. 2015; 9 (7): e0003949. | |
77. | Европейский комитет по стандартам в отношении поражения мочевыводящих путей A, Evans MD, Olinski R, Loft S, Cooke MS.К консенсусу в анализе 8-оксо-7,8-дигидро-2’-дезоксигуанозина в моче как неинвазивного биомаркера окислительного стресса. FASEB J. 2010; 24 (4): 1249–1260. | |
78. | Габриелли А., Свеглиати С., Морончини Г., Амико Д. Новое понимание роли окислительного стресса в фиброзе склеродермии. Open Rheumatol J. 2012; 6: 87–95. | |
79. | Иллингворт Р.С., Берд А.П.Острова CpG — «приблизительный ориентир». FEBS Lett. 2009; 583 (11): 1713–1720. | |
80. | Эстеллер М. Epigenetics обеспечивает новое поколение онкогенов и генов-супрессоров опухолей. руб. J Рак. 2006; 94 (2): 179–183. | |
81. | Sriraksa R, Zeller C, El-Bahrawy MA, et al. Исследование метилирования CpG-островков холангиокарциномы, связанной с двуусткой печени. руб. J Рак. 2011; 104 (8): 1313–1318. | |
82. | Gutierrez MI, Siraj AK, Khaled H, Koon N, El-Rifai W., Bhatia K. CpG-островное метилирование при шистосоме и раке мочевого пузыря, не связанном с шистосомой. Mod Pathol. 2004; 17 (10): 1268–1274. | |
83. | ||
84. | Всемирная организация здравоохранения. Патология и генетика опухолей пищеварительной системы. 1 изд. Лион: IARC Press; 2000. | |
85. | Теодоридис Дж. М., Холл Дж., Марш С. и др. CpG-островное метилирование генов ответа на повреждение ДНК при распространенном раке яичников. Cancer Res. 2005; 65 (19): 8961–8967. | |
86. | Косака Н., Игучи Х., Очия Т. Циркуляция микроРНК в жидкости организма: новый потенциальный биомаркер для диагностики и прогноза рака. Cancer Sci. 2010; 101 (10): 2087–2092. | |
87. | Менг Ф, Хенсон Р., Ланг М. и др. Участие микро-РНК человека в росте и ответе на химиотерапию в клеточных линиях холангиокарциномы человека. Гастроэнтерология. 2006; 130 (7): 2113–2129. | |
88. | Менг Ф., Вехбе-Янек Х., Хенсон Р., Смит Х., Патель Т. Эпигенетическая регуляция микроРНК-370 интерлейкином-6 в злокачественных холангиоцитах человека. Онкоген. 2008; 27 (3): 378–386. | |
89. | Silakit R, Loilome W, Yongvanit P и др. Циркуляция miR-192 у пациентов с холангиокарциномой, ассоциированной с двуусткой печени: проспективный прогностический индикатор. J Hepatobiliar Pancreat Sci. 2014; 21 (12): 864–872. | |
90. | Silakit R, Loilome W, Yongvanit P и др. МикроРНК-192 и микроРНК-21 в моче как потенциальные индикаторы для группы риска холангиокарциномы, ассоциированной с двуустками печени. Parasitol Int. 2015; 66 (4): 479–485. | |
91. | Jongsuksuntigul P, Imsomboon T. Борьба с описторхозом в Таиланде. Acta Trop. 2003; 88 (3): 229–232. | |
92. | Камса-Ард С., Лувира В., Пугкхем А. и др. Связь между лечением празиквантелом и холангиокарциномой: исследование методом случай-контроль на базе стационара. BMC Рак. 2015; 15: 776. | |
93. | Scheithauer W. Обзор применения гемцитабина при карциноме желчных путей. Semin Oncol. 2002; 29 (6 приложение 20): 40–45. | |
94. | Холангиокарцинома Фримана С. — современные варианты лечения. Scand J Surg. 2011; 100 (1): 30–34. | |
95. | Jang JY, Kim SW, Park DJ и др. Фактический отдаленный исход рака внепеченочного желчного протока после хирургической резекции. Ann Surg. 2005; 241 (1): 77–84. | |
96. | Ланг Х., Сотиропулос Г.К., Сгуракис Г. и др.Операции по поводу внутрипеченочной холангиокарциномы: единичный опыт 158 пациентов. J Am Coll Surg. 2009; 208 (2): 218–228. | |
97. | ||
98. | Ringe B, Wittekind C, Bechstein WO, Bunzendahl H, Pichlmayr R. Роль трансплантации печени в гепатобилиарной злокачественности. Ретроспективный анализ 95 пациентов с особым учетом стадии опухоли и рецидива. Ann Surg. 1989; 209 (1): 88–98. | |
99. | O’Grady JP, RJ .; Роллс, К .; Уильямс, Р. Трансплантация печени при злокачественных заболеваниях. Ann Surg. 1988; 207 (4): 7. | |
100. | Rosen CB, Heimbach JK, Gores GJ. Трансплантация печени при холангиокарциноме. Transpl Int. 2010; 23 (7): 692–697. | |
101. | Friman S, Foss A, Isoniemi H, et al. Трансплантация печени при холангиокарциноме — выбор необходим для получения приемлемых результатов. Сканд Дж Гастроэнтерол . 2011. 46 (3): 370–375. | |
102. | Wang Y, Ding M, Zhnag Q и др. Активация или подавление медиаторов иммунного ответа у пациентов с раком желчных путей (BTC): систематический обзор и метаанализ. J Рак. 2017; 8 (1): 74–84. | |
103. | Marks EI, Yee NS. Иммунотерапевтические подходы при карциноме желчных путей: текущее состояние и новые стратегии. World J Gastrointest Oncol. 2015; 7 (11): 338–346. | |
104. | Такахаши Р., Йошитоми М., Ютани С. и др. Текущее состояние иммунотерапии для лечения рака желчных путей. Hum Vaccin Immunother. 2013; 9 (5): 1069–1072. | |
105. | Gubin MM, Zhang X, Schuster H, Caron E. Контрольные точки, блокирующие иммунотерапию рака, нацелены на опухолеспецифические мутантные антигены. Природа. 2014; 515 (7528): 577–581. | |
106. | Wiangnon S, Kamsa-ard S, Suwanrungruang K, et al. Тенденции заболеваемости гепатоцеллюлярной карциномой, 1990-2009 гг., Кхон Каен, Таиланд. Азиатский Pac J Cancer Prev. 2012; 13 (3): 1065–1068. | |
107. | Martin RC, Vitale GC, Reed DN, Larson GM, Edwards MJ, McMasters KM. Сравнение стоимости эндоскопического стентирования и хирургического лечения неоперабельной холангиокарциномы. Эндоскопическая хирургия. 2002; 16 (4): 667–670. |
История и симптомы описторхоза — wikidoc
Главный редактор: C. Майкл Гибсон, M.S., M.D. [1]
История болезни и симптомы
Большинство инфекций протекает бессимптомно. В легких случаях проявления включают диспепсию, боль в животе, диарею или запор. При более длительных инфекциях симптомы могут быть более серьезными, могут присутствовать гепатомегалия и недоедание.В редких случаях может развиться холангит, холецистит и холангиокарцинома. Кроме того, инфекции, вызванные O. felineus, могут иметь острую фазу, напоминающую лихорадку Катаяма (шистосомоз), с лихорадкой, отеком лица, лимфаденопатией, артралгиями, сыпью и эозинофилией. Хронические формы инфекций O. felineus имеют те же проявления, что и O. viverrini, с поражением протоков поджелудочной железы.
Симптомы описторхоза (вызванного Opisthorchis spp.) неотличимы от клонорхоза (вызываемого Clonorchis sinensis ), поэтому болезнь следует отнести к клонорхозу.
Около 80% инфицированных людей не имеют симптомов, хотя у них может быть эозинофилия. Это когда инфекция слабая и в фекалиях содержится менее 1000 яиц в одном грамме.
Когда в одном грамме кала 10–30 000 яиц, значит, инфекция тяжелая. Симптомы более тяжелых инфекций, вызванных Opisthorchis viverrini , могут включать: диарею, боль в эпигастрии и боль в правом верхнем квадранте, отсутствие аппетита (анорексия), усталость, пожелтение глаз и кожи (желтуха) и умеренный жар.
Эти паразиты являются долгоживущими и вызывают тяжелые хронические инфекции, которые могут приводить к накоплению жидкости в ногах (отек) и в брюшной полости (асцит), увеличению нефункционального желчного пузыря, а также холангиту, что может привести к перидуктальному фиброзу. , холецистит и желчекаменная болезнь, механическая желтуха, гепатомегалия и / или фиброз перипортальной системы.
Важно отметить, что как экспериментальные, так и эпидемиологические данные убедительно указывают на причастность инфекций Opisthorchis viverrini к этиологии злокачественного рака желчных протоков (холангиокарциномы) у людей с очень плохим прогнозом.Действительно, Clonorchis sinensis и Opisthorchis viverrini классифицируются Международным агентством по изучению рака (IARC) как канцерогены группы 1.
У людей начало холангиокарциномы происходит при хроническом описторхозе, связанном с гепатобилиарным поражением, воспалением, перидуктальным фиброзом и / или клеточными ответами на антигены от инфекционного сосальщика. Эти состояния предрасполагают к холангиокарциноме, возможно, из-за повышенной восприимчивости ДНК к повреждению канцерогенами.Сообщается, что хроническое гепатобилиарное повреждение является многофакторным и возникает в результате продолжающегося механического раздражения эпителия присутствующими сосальщиками, особенно через их присоски, метаболиты и выделяемые / секретируемые антигены, а также иммунопатологические процессы. В регионах, где Opisthorchis viverrini является высокоэндемичным, заболеваемость холангиокарциномой беспрецедентна. Например, холангиокарциномы составляют 15% первичного рака печени во всем мире, но в регионе Таиланда Кхон Каен эта цифра возрастает до 90%, что является самым высоким зарегистрированным показателем заболеваемости этим раком в мире.С 2002 г. 0,02% всех раковых заболеваний во всем мире были холангиокарциномой, вызванной Opisthorchis viverrini .
Рак желчных протоков, вызванный описторхозом, в Таиланде встречается в возрасте 25–44 лет.
Список литературы
Шаблон: WH Шаблон: WS
Оценка связи хронического описторхоза с инфекцией вируса Эпштейна-Барра, а также некоторых цитогенетических и иммунологических параметров в двух сопоставимых регионах Сибири на JSTOR
АбстрактныйПредыдущие исследования показали увеличение частоты хромосомных аномалий в лимфоцитах периферической крови у пациентов с описторхозом.Некоторые данные свидетельствуют о том, что существует связь между хроническим описторхозом и некоторыми вирусами герпеса. Чтобы изучить связь описторхоза с реактивацией инфекции вирусом Эпштейна-Барра (ВЭБ), а также влияние инфекции описторхом на некоторые цитогенетические и иммунологические параметры, мы использовали непрямую иммунофлуоресценцию для измерения некоторых вирус-специфических антител, лимфоцитов, блокирующих цитокинез. micronucleus и метод количественной иммунодиффузии для измерения концентраций иммуноглобулинов в сыворотке.Всего было обследовано 1580 человек в двух сопоставимых сибирских регионах: в районе реки Обь, эндемически связанной с описторхозом, вызываемым Opisthorchis felineus, и в неэндемичном контрольном районе реки Енисей. Между двумя неинфицированными контролями из эндемичного Обского и неэндемичного регионов Енисея не было существенной разницы по каждому из тестируемых параметров. Мы обнаружили значительную разницу (p
Информация о журналеЕвропейский журнал эпидемиологии, публикуется впервые в 1985 г. — форум по эпидемиологии инфекционных и неинфекционных заболеваний. болезни и борьба с ними.Важны результаты эпидемиологических исследований. аргументы в пользу действий в области политики и усилий общественного здравоохранения сделано, чтобы привлечь внимание к журналу лиц, принимающих решения. Журнал также источник материала для тех, кто активно занимается преподаванием эпидемиологии. Журнал охватывает различные области эпидемиологии, науки, которая всегда был междисциплинарным по своей природе: взносы приветствуются из областей планирования и контроля общественного здравоохранения, экономики, профилактики медицина, клинические испытания, вакцинология, психология, молекулярная биология, математическая моделирование и компьютерные науки.
Информация об издателеSpringer — одна из ведущих международных научных издательских компаний, издающая более 1200 журналов и более 3000 новых книг ежегодно по широкому кругу вопросов, включая биомедицину и науки о жизни, клиническую медицину, физика, инженерия, математика, компьютерные науки и экономика.
Печеночный двуустник Opisthorchis felineus как канцероген III или I группы
4open 2019, 2 , 23Статья о пересмотре
Печеночная двуустка
Opisthorchis felineus как канцероген III или I группыМария Юрьевна Пахарукова 1 , 2 , Жозе Мануэль Коррейя да Коста 3 , 4 и Вячеслав Алексеевич Мордвинов 1 *
1 Лаборатория молекулярных механизмов патологических процессов, Институт цитологии и генетики СО РАН, 630090 Новосибирск, проспект Лаврентьева, 10
2 Новосибирский государственный университет, ул. Пирогова, 2, 630090 Новосибирск, Россия
3 Центр исследований в области зоотехники, ICETA, Университет Порту, Rua de D.Manuel II, Apt 55142, 4051-401 Порту, Португалия
4 Центр иммунологии и биологии паразитов, отделение инфекционных заболеваний, INSA, Rua Alexandre Herculano 321, 4000-055 Порту, Португалия
* Автор, ответственный за переписку: [email protected]
Поступило:
31 год
Октябрь
2018 г.
Принято:
10
Май
2019 г.
Аннотация
Описторхоз, вызванный печеночной двуусткой Opisthorchis felineus — одна из самых распространенных гельминтозных инфекций в Российской Федерации.Наибольший ареал, пораженный описторхозом кошачьих, занимает почти всю территорию Западной Сибири и простирается на север Казахстана и часть Уральского региона. Природные эндемичные регионы описторхоза существуют также в европейской части России, а также в регионах Западной и Восточной Европы. Согласно официальной статистике Российской Федерации, ежегодно в стране регистрируется до 40 000 больных описторхозом.
Описторхоз кошачьих поражает гепатобилиарную систему и вызывает серьезные заболевания печени, включая рак желчевыводящих путей.Другие паразиты, описторхоз viverrini и клонорхоз, широко распространены в Юго-Восточной Азии и Китае. Возбудители этих заболеваний, печеночные двуустки O. viverrini и Clonorchis sinensis , официально признаны биологическими канцерогенами 1-й группы и относятся к основным факторам риска холангиокарциномы. O. felineus входит в группу 3 биологических канцерогенов и официально не считается канцерогенным для человека. Серьезные исследования канцерогенного потенциала этой печеночной двуустки и эпидемиологии холангиокарциномы в Российской Федерации начались совсем недавно.Тем не менее, у нас есть некоторые свидетельства того, что инфицирование O. felineus приводит к предраковому состоянию эпителия желчных протоков. Это состояние в сочетании с дополнительными факторами риска создает реальный риск холангиокарциномы. На наш взгляд, с учетом накопленных фактов, классификация канцерогенного потенциала O. felineus требует пересмотра. В этом обзоре мы сосредоточимся на соответствующих характеристиках биологии и эпидемиологии этого гельминта, а также на экспериментальных данных о кошачьем описторхозе; эта информация может прояснить канцерогенность O.felineus людям.
Ключевые слова: Рак / Канцерогены / Канцерогенез / Карцинома / Переход клеток / Церкария / Холангиоцеллюлярная карцинома / Клонорхис / Cyprinidae / Эпидемиология / Рыбы / Гельминтоз / Гепатоцеллюлярная карцинома / Печеночные двуустки / Злокачественность / Описторхоз / Описторхоз / Опухоль
© М. Пахарукова и др., Опубликовано EDP Sciences, 2019
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), что разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Введение
Opisthorchis felineus ( O. felineus ) — это печеночная двуустка пищевого происхождения, представитель рода Opisthorchis , семейства Opisthorchiidae, отряда Digenea, класса Trematoda, типа Platyhelminthes и царства Animalia. Эта печеночная двуустка является возбудителем кошачьего описторхоза, гельминтоза, поражающего в основном гепатобилиарную систему и поджелудочную железу.Заражение происходит после употребления в пищу сырой или недоваренной пресноводной рыбы, зараженной личинками гельминтов. Болезнь человека характеризуется длительностью, частыми обострениями и возможным индукцией первичного рака печени [1–6].
Печеночные двуустки O. viverrini и Clonorchis sinensis , также входящие в семейство Opisthorchiidae, вызывают виверринный описторхоз и клонорхоз, заболевания, которые очень похожи на описторхоз кошачьих по симптоматике и патофизиологии [7–10].Описторхоз и клонорхоз — трематодозы, естественные горячие точки которых охватывают значительную часть Европы и Азии. Тем не менее, в настоящее время эти заболевания можно условно отнести к естественным очаговым инфекциям. Многие мигранты из Азии живут в неэндемичных по описторхозу и клонорхозу районах, и поток туристов между различными странами неуклонно растет. Следовательно, пациенты с инфекцией печеночного двуустника могут быть зарегистрированы далеко от соответствующих эндемичных регионов [6].
Международное агентство по изучению рака (IARC) классифицировало печеночных двуусток O. viverrini и C. sinensis как агентов группы 1, т. Е. Агентов, канцерогенных для человека [7], и как основных причинных факторов холангиокарциномы ( CCC) в эндемичных регионах [7–9]. ССС с особенностями дифференцировки холангиоцитов является одним из основных гистологических типов злокачественных опухолей эпителия желчных путей и относительно редким типом рака печени [10]. Тем не менее, за последние 15 лет заболеваемость неуклонно росла во всем мире, и в настоящее время он представляет собой второй по распространенности тип первичного рака печени (15–20% случаев) после гепатоцеллюлярной карциномы [11].Единственное доступное лечение CCC — хирургическая резекция или трансплантация печени. Обычно CCC диагностируется на поздних стадиях и рассматривается как неизлечимый и смертельный рак с низкой выживаемостью <24 месяцев [12]. Как экспериментальные, так и эпидемиологические данные убедительно указывают на причастность инфекции печеночного двуустки к этиологии ССС [13].
Opisthorchis felineus все еще официально классифицируется как канцероген Группы 3; в эту группу входят факторы, не классифицируемые как канцерогенные для человека [7].Между тем накапливаются данные, которые показывают канцерогенный потенциал O. felineus и подтверждают его классификацию как биологический канцероген для человека. В этом обзоре обобщены данные, указывающие на то, что O. felineus является недооцененным паразитом и что существует необходимость пересмотреть и пересмотреть статус этой печеночной двуустки.
Биология
Сложный жизненный цикл O. felineus включает первого и второго промежуточных хозяев и одного конечного хозяина (рис.1) [14, 15]. Попадая в воду, содержащую фекалии людей и животных, яйца могут быть съедены водными брюхоногими улитками из рода Bithynia. В их кишечнике из яиц вылупляются подвижные личинки (мирацидии), проникают через стенку кишечника в полость тела моллюска и превращаются в спороцисты. Последние порождают редии, которые затем могут производить церкарии: свободноживущие подвижные личинки, попадающие в воду, где они активно плавают. Партеногенетическая фаза жизненного цикла гельминта (от стадии спороцист до выделения церкарий) длится ~ 2 месяца.Развитию препятствует диапауза хозяина в зимний период (замерзание рек) в Западной Сибири. Первые церкарии появляются в мае следующего года. Зрелые церкарии подвижны и начинают выходить из моллюсков в яркую солнечную погоду со скоростью до нескольких сотен в день [15].
| фигура 1 Жизненный цикл O. felineus [15] . Яйца откладываются в желчевыводящих путях, попадают в кишечник и выводятся с калом.Они должны быть съедены пресноводными брюхоногими моллюсками Bithynia , первым промежуточным хозяином, чтобы развиться в спороцисты, редии и свободно плавающие церкарии: инфекционная стадия для второго промежуточного хозяина, карповых рыб. Люди и другие рыбоядные млекопитающие и птицы могут служить окончательным хозяином после поедания зараженной рыбы. Попадая в организм хозяина, метацеркарии поражают желчевыводящие пути млекопитающих, где они превращаются во взрослых червей. Изображения церкарий и яиц взяты из [15]; Bithynia Улитка, метацеркария и имаго O.felineus — это оригинальные картинки. |
Пресноводные рыбы, восприимчивые к заражению описторхидами, представлены видами Cyprinidae: язь Leuciscus idus , ельца L. leuciscus , плотва Rutilus rutilus и солнечник Leucaspius delineatus [14, 15]. Когда рыба и церкарии встречаются друг с другом, церкарии прикрепляются к ним, отбрасывают хвост и проникают через кожу в мышцы, где они образуют внутреннюю мембрану, затем внешнюю соединительнотканную капсулу и переходят в следующую стадию — метацеркарии.Через 3–4 недели метацеркарии становятся инвазивными и могут инфицировать окончательных хозяев: домашних рыбоядных животных (кошек, собак и свиней), диких плотоядных животных (ондатр, водяных полевок, лисиц, медведей и волков) и людей [14–14]. 23]. В кислой среде желудка окончательного хозяина мембрана метацеркарии разрушается, и молодые особи мигрируют по желчным протокам в печень и желчный пузырь, где через 25–30 дней гельминт достигает созревания [14, 15].
Заражение человека, скорее всего, вызвано употреблением недоваренной рыбы, поскольку вяленая, слабосоленая и слегка маринованная рыба — традиционные закуски к пиву (рис.2). Кроме того, в северных регионах Западной Сибири популярной традицией является употребление в пищу замороженных лент из пресноводного сига со специями, так называемой строганины [1, 23].
| фигура 2 Малое озеро, приток реки Оби (г. Новосибирск) и промежуточный хозяин печеночной двуустки Opisthorchis felineus . (А) Малое озеро. (B) Заводь Малого озера, место обитания вифинских улиток, улиток. (C) Свежий язь ( L. idus ) во льду на рынке. |
Многие авторы продемонстрировали присутствие в дикой природе метацеркарий и взрослых особей O. felineus . Однако полный жизненный цикл O. felineus продемонстрировал только Федоров, а также предоставил данные о структуре и сроках развития личиночных форм [15]. Сообщалось, что рыжие лисы Vulpes vulpes L. играют определенную роль в поддержании естественных горячих точек описторхоза в Европе, вызываемого трематодой O.felineus [16–21]. Естественным хозяином для O. felineus в России считается ондатра Ondatra zibethicus [15], завезенная в начале 1920-х годов. В Западной Сибири ондатры являются основным вкладом в естественные причины заболеваний, вызываемых многими описторхидами, такими как O. felineus , O. longissimus и Metorchis bilis [15]. Ондатра ведет полуводный образ жизни и селится по берегам рек, озер и пресноводных болот.Предпочитает неглубокие (глубиной 1-2 м) водоемы, которые не замерзают, с берегами, покрытыми густой травой [15].
Эпидемиология
Трематода O. felineus — эпидемиологически важная печеночная двуустка. Этот возбудитель описторхоза был обнаружен в течение примерно 150 лет у кошек, собак, лисиц, диких медведей и других животных (окончательные хозяева), а также у моллюсков и карпов (промежуточных хозяев) в Западной и Восточной Европе (Россия, Украина, Россия, США). Белоруссия, Испания, Португалия, Германия, Италия) [14, 24, 25].Все эти данные свидетельствуют о широте ареала описторхоза и несомненном участии животных в циркуляции возбудителя на этой территории, тогда как описторхоз человека носит разрозненный локальный (очаговый) характер. Наибольшее значение человека в циркуляции инфекции наблюдается в Западной Сибири, а именно в Обь-Иртышском бассейне, о чем свидетельствует высокая распространенность инфекции в этой популяции (до 60% в некоторых сельских регионах). Таким образом, скорее всего, в этом регионе участие человека в поддержании инфекции почти наверняка.Ближе к периферии бассейна до Северного Ледовитого океана процент населения, проживающего в этом районе, падает до менее одного человека на квадратный километр. Тем не менее, распространенность инфекции среди чувствительных видов рыб в этом регионе практически максимальна по сравнению с другими территориями и может достигать 100% (иде). Следовательно, циркуляция инфекции в дикой природе становится более зоонозной (в основном с участием домашних и диких животных).
В соответствии с российскими клиническими стандартами диагностика описторхоза основана на микроскопическом обнаружении яиц в кале и / или яйцах и взрослых гельминтов в образцах желчи после дуоденальной интубации [26].Средняя заболеваемость описторхозом в России с 1991 по 1993 и 2011–2013 гг. Была относительно постоянной (26,5–24,7 случая на 100 000 человек в год). Заболеваемость описторхозом в России неравномерно распределена по регионам. Соответственно, существуют гиперэндемичные районы (с коэффициентами распространенности> 100 на 100 000 человек), регионы с высокой распространенностью (53–100), регионы со средней распространенностью (22-52) и регионы с низкой частотой заболевания (< 22). Обь-Иртышский бассейн в Западной Сибири считается гиперэндемичным районом.В этом регионе распространенность описторхоза превышает 100 на 100 000 человек [1]: Ханты-Мансийский автономный округ (600 на 100 000 человек), Тюменская область (201 на 100 000 человек), Томская область (189 на 100 000 человек), Новосибирская область (127 на 100 000 человек). В большинстве регионов России, Восточной Сибири и Дальнего Востока сообщается только о низкой распространенности (2,5 на 100 000 населения; обзор см. В [1]).
С другой стороны, краткосрочные программы скрининга в некоторых сельских регионах этой области показали, что реальная частота O.felineus значительно выше [5, 27]. В частности, уровень распространенности в Томской области составляет 18–20% [27]; Тюменская область — 37%; и Челябинская область — 18,6%. По данным аутопсии, 18,3–45,0% лиц инфицированы описторхозом [5, 28, 29].
Канцерогенный потенциал
O. felineus1. Экспериментальные данные
Сегодня считается, что канцерогенез запускается хроническим воспалением и изменениями в клеточном микроокружении, которые приводят к предраковому состоянию и мутациям, которые приводят к пролиферации клеток и злокачественным новообразованиям [30].В следующих разделах статьи мы представляем экспериментальные данные о гистопатологии описторхоза кошачьего в печени хомяка и метаболитов O. felineus , которые могут вызывать мутации в хромосомной дезоксирибонуклеиновой кислоте (ДНК) клеток-хозяев. Сравнительное исследование описторхоза felinea и viverrini на модели хомяка предполагает, что гистопатология инфекции O. felineus включает дисплазию желчных протоков, перидуктальный фиброз и воспалительную инфильтрацию и может считаться более серьезной, чем у O.viverrini [31].
Основными гистопатологическими признаками инфекции O. felineus у грызунов являются обширный перидуктальный фиброз, хроническое воспаление, разрастание желчных протоков, дисплазия желчных протоков, гранулемы яиц и интраэпителиальная неоплазия желчных протоков (BilIN) со степенью 1–3. BilIN является предшественником инвазивной аденокарциномы в желчных путях [32–34] и представляет собой многоступенчатый процесс канцерогенеза. Билиарная интраэпителиальная неоплазия с поражением 1 степени (BilIN-1) и билиарная интраэпителиальная неоплазия с поражением 2 степени (BilIN-2) были продемонстрированы у O.felineus — зараженные хомяки. Совокупность биохимических и гистопатологических изменений указывает на то, что инфекция O. felineus в этой модели на грызунах вызывает предраковые поражения, способствующие развитию злокачественной опухоли.
Инфекция Opisthorchis felineus приводит к развитию CCC у экспериментальных животных, если она сопровождается химическим канцерогеном (например, диэтилнитрозамином или диметилнитрозамином). Было показано, что гистопатологические особенности CCC проявляются в печени хомяков через 18 недель после заражения [35].В одном исследовании через 26 недель у трех из шести хомяков был обнаружен массообразующий CCC, а через 30 недель после инфицирования CCC был обнаружен у всех хомяков [35].
Накопленные данные по гистопатологии млекопитающих позволяют предположить, что канцерогенный потенциал O. felineus в экспериментальной модели очень похож на канцерогенность O. viverrini и C. sinensis [31, 35]. Три вида эпидемиологически важных описторхов тесно связаны друг с другом с точки зрения фенотипа взрослых особей, среды обитания на разных стадиях жизни и генетики.Инфекции печеночного двуустника имеют сходные характеристики патогенеза (то есть механизма). Кроме того, способность секретировать белки и метаболиты оксистерина также характерна для печеночных сосальщиков, включая O. felineus .
Патогенез ССС в результате инфицирования печеночными сосальщиками неизвестен [13, 36]. Тем не менее, можно предположить, что здесь задействовано несколько важных факторов. В частности, одним из важнейших факторов является механическое повреждение стенки желчного протока от присосок гельминтов.При повреждении ткани запускается каскад иммунологических реакций как против разрушенных клеток, так и против антигенов и яиц гельминтов.
Другим важным фактором, определяющим взаимодействие паразит-хозяин, которое, вероятно, вносит значительный вклад в эпителиальную неоплазию, являются секреторные продукты гельминтов, состоящие из большого количества белков, которые индуцируют пролиферацию клеток и ингибируют апоптоз [36–38]. Такой эффект на пролиферацию эпителиальных клеток желчных протоков продемонстрирован для O.viverrini гранулин-1 [36]. Результаты редактирования генома CRISPR / Cas9 гранулина-1 O. viverrini подтвердили предположение о его роли в гепатобилиарной заболеваемости инфекцией печеночного двуустника [37]. Более того, для другого белка O. viverrini , тиоредоксинпероксидазы (TpX), был продемонстрирован иммуномодулирующий эффект [36]. В частности, тиоредоксинпероксидаза может ингибировать Т-хелпер 1 (Th2) -тип иммунного ответа и активировать Th3-тип. Замечательное влияние на взаимодействие хозяин-паразит было также продемонстрировано для защитной молекулы гельминта Fasciola hepatica .Этот белок ингибирует презентацию антигена макрофагами из-за его сродства к мембране макрофагов хозяина [39].
Экскреторно-секреторные продукты (ESP) печеночной двуустки стимулируют хроническое воспаление и разрастание эпителия желчных протоков. Протеомная масс-спектрометрия белков в ESP O. felineus идентифицировала 37 белков [40]. Некоторые из O. felineus ESP являются высокоиммуногенными [41, 42], гомологи молекулы защиты хозяина (HDM), TpX и глутатион-S-трансферазы (GST) были обнаружены в O.felineus ESP [40]. Более того, ESP O. felineus могут взаимодействовать с эпителием и накапливаться внутри клеток, поскольку они обнаружены в желчном пузыре хомяков с экспериментальным описторхозом и пациентов с инфекцией [41, 42].
Кроме того, можно предположить, что специфические низкомолекулярные метаболиты холестерина, которые также обнаруживаются в секреторном продукте гельминтов, по-видимому, обладают окислительными и генотоксическими свойствами, т. Е. Могут повреждать ДНК клеток-хозяев [13, 32] .Такие низкомолекулярные метаболиты (катехол-эстрогены и оксистерины) были продемонстрированы у других видов гельминтов, некоторые из которых связаны с инициированием рака и признаны биологическими канцерогенами. В частности, трематоды O. viverrini , O. felineus и S. haematobium продуцируют специфические оксистерины и катехолэстрогены. Оксистерин-подобные метаболиты в яйцах и взрослых червях, а также в желчи, сыворотке и моче хомяков, инфицированных O. felineus , были обнаружены с помощью жидкостной хроматографии с масс-спектроскопией [32].Родственные аддукты ДНК предполагают, что ассоциированные с инфекцией оксистерины вызывают хромосомные повреждения в клетках-хозяевах [13]. Была предложена связь между оксистерином и возникновением и прогрессированием рака толстой кишки, легких, груди и желчных протоков [43, 44].
Происхождение этих метаболитов неизвестно. Можно предположить, что существует два пути их синтеза: ферментативный и неферментативный. Неферментный путь — это реакция со свободными формами кислорода и азота [45].Ферментативный путь является результатом активности сети метаболизма ксенобиотиков печеночной двуустки [46, 47].
Принято считать, что опухоли CCC в этой модели хомяка возникают в результате комбинированного действия инфекции, вызываемой печеночными двуустками, O. felineus , O. viverrini или C. sinensis и воздействием N- нитрозодиметиламин [35]. Напротив, серия исследований патогенеза описторхоза кошачьих выявила повышенную экспрессию p53 и наличие интраэпителиальной неоплазии желчных протоков [32, 35].Недавние исследования также показали, что эпителиально-мезенхимальный переход (ЭМП) участвует в хроническом описторхозе у грызунов. На 22 неделе хронического описторхоза у хомяков усиливаются процессы ЭМП в печени [48]. Повышенная экспрессия маркеров сигнального пути SMAD и усиленное накопление белка α-гладкомышечного актина (α-SMA) были показаны с помощью иммуногистохимии. Повышенная экспрессия матричной рибонуклеиновой кислоты (мРНК) генов трансформирующего фактора роста бета 1 ( Tgfb1 ), аннексина A1 ( Anxa1 ), экзостозингликозилтрансферазы 1 ( Ext1 ) и кератина 7 ( Krt7 ) в печени O.felineus -инфицированные хомяки [48]. Взятые вместе, эти данные показывают, что предраковые изменения могут происходить у хомяков без воздействия экзогенного канцерогена, такого как N-нитрозодиметиламин (NDMA). Эти процессы вызывают повреждение генетического материала, при этом мутации фиксируются во время репликации ДНК. В конце концов, накопление мутаций может привести к злокачественной трансформации холангиоцитов и прогрессированию до CCC [13].
1. Связь между инфекцией O. felineus и CCC у людей
Самый важный шаг в подтверждении результатов, полученных при исследовании канцерогенного потенциала O.felineus в экспериментальной модели представляет собой анализ ассоциации кошачьего описторхоза и CCC у людей. Учитывая отсутствие системных эпидемиологических и клинических программ по борьбе с описторхозом в России, решение этой проблемы остается трудным. Несомненно, сходство клинических проявлений, нарушений, вызываемых O. felineus и O. viverrini [28, 29], и данные о патогенезе этих двух гельминтозов, полученные на экспериментальных моделях описторхоза [1, 31, 32 , 34] наводят на мысль о достаточно высокой вероятности O.felineus участвует в индукции этих опухолей. Здесь мы кратко обсуждаем опубликованные в российской медицинской литературе данные об осложнениях, связанных с описторхозом, а также данные из больниц и моргов по результатам аутопсий за длительный период. К сожалению, данные о распространенности рака печени имеют определенные недостатки, в частности, проведенные исследования и критерии отбора контрольных групп недостаточно детализированы. Тем не менее, в отсутствие других эпидемиологических данных, количество случаев, зарегистрированных в больницах в течение определенного периода, также является ценной информацией, конечно, с оговоркой, что это простая регистрация количества случаев, а не полноценные эпидемиологические исследования.
В целом сообщается, что заболеваемость злокачественными опухолями, в частности первичным раком печени, значительно выше в регионах с высокой распространенностью описторхоза. В ряде регионов Западной Сибири в период 1962–1971 гг. Распространенность первичного рака печени составляла 9,4 случая на 100 000 человек [49, 50] (см. Обзор [7]). В период 1990–2001 гг. Рак печени занимал седьмое место среди наиболее распространенных онкологических заболеваний, зарегистрированных в Томской области (3,9%). Распространенность этого вида рака у мужчин в этот период составляла 11.2 случая на 100 000 человек [51]. Это почти в 2,5 раза превышает средний показатель распространенности рака печени в РФ в 2012 г., согласно официальной статистике [51, 52]. Для сравнения, в Москве и Московской области (неэндемичные по описторхозу районы) распространенность первичного рака печени составила 1,77 и 2,3 случая на 100 000 человек соответственно [53]. Заболеваемость первичным раком печени в этих регионах не коррелирует с потреблением алкоголя, в частности Московская область входила в тройку лидеров по потреблению крепких алкогольных напитков (2016–2017 гг.), Тогда как Томская и Тюменская области (гиперэндемичные) были с низкие или средние баллы [54].
В отечественной медицинской литературе есть сведения, указывающие на связь между инфицированием O. felineus и раком печени у населения Западной Сибири. Так, при анализе результатов более 2250 вскрытий, проведенных за 37 лет в городском морге Тобольска, установлено, что в 45% случаев инфицирование описторхозом было. Первичный рак печени диагностирован у 8,7% инфицированных пациентов [55]. По данным Томского городского морга, среди лиц с подтвержденным диагнозом хронический описторхоз [~ 350 вскрытий] случаи ХОК зарегистрированы у 5% группы [28, 29].Кроме того, по данным Томского гепатологического центра, ~ 3% больных хроническим описторхозом оперированы по поводу рака желчных путей и рака поджелудочной железы [29].
Интересное исследование было проведено в другом регионе Западной Сибири — Тюменской области. Там были определены показатели распространенности различных типов рака печени у описторхоз-положительных (целевая группа) и отрицательных лиц (контрольная группа). Установлено, что CCC наиболее часто встречается при описторхозе: по результатам гистологического анализа в целевой группе этот диагноз поставлен в 77% случаев.Гепатоцеллюлярная карцинома (ГЦК) в той же группе пациентов выявлялась в 19% случаев, а у 4% пациентов имелись другие виды злокачественных опухолей печени. В контрольной группе ССС встречалась у 34% пациентов, гепатоцеллюлярная карцинома — в 56% случаев, а другие опухоли печени — у 10% [49].
В соответствии с этими результатами данные, полученные в Тюменской области — после вскрытия 44 человек с подтвержденным первичным раком печени — показали, что ССС присутствовал почти в 80% случаев.Важно отметить, что инфекция O. felineus была подтверждена в 42 из 44 случаев в этом исследовании (обзор см. В [7, 56]). Таким образом, в эндемичных регионах злокачественные опухоли желчевыводящих путей являются одними из наиболее распространенных типов рака печени. Примечательно, что при наличии инфекции O. felineus распространенность ССС превосходит другие виды рака печени в 4 раза (или на 400%). Недавно были зарегистрированы два случая ХСС, ассоциированного с хроническим описторхозом.В обоих случаях наблюдались неспецифические симптомы и тяжелые патологические осложнения. Оба пациента проживали в эндемичных районах [26].
В неэндемичных по описторхозу регионах России доля ССС не превышает 15% от всех случаев рака печени. Например, по обобщенным данным, накопленным в РОНЦ им. Блохина (Москва), на ХБК приходится 14,9%, а на гепатоцеллюлярный рак — 85,1% случаев рака печени [57]. В целом данные о распространенности CCC в эндемичных и неэндемичных регионах хорошо соответствуют общей эпидемиологии этого типа рака в других эндемичных и неэндемичных регионах мира [9, 58].
Профилактика
Профилактика описторхоза основана, прежде всего, на инактивации личинок O. felineus в рыбе путем правильного приготовления, диагностики заболевания и эффективного лечения пациентов. Профилактические меры включают (i) защиту резервуаров от яиц паразита, (ii) инактивацию метацеркарий у соответствующих видов рыб и (iii) санитарные / образовательные программы для населения.
В России, где уровень заражения описторхиями среди рыб высок, разработаны стандарты борьбы с заражением рыб личинками эпидемиологически важных печеночных двуусток, в том числе O.felineus , M. bilis и C. sinensis [59]. Эти стандарты оговаривают, прежде всего, посол, заморозку и термообработку. Посол следует производить достаточным количеством соли при температуре 1–20 ° С, когда массовая доля соли в рыбе составляет 14%. Продолжительность засолки должна составлять 10 дней для уклейки Alburnus alburnus , пескаря Gobio gobio , гольяна Phoxinus percnurus и уклейки Leucaspius delineatus ; 21 сутки для плотвы Р.rutilus , ельца L. leuciscus , красноперка Scardinius erythrophthalmus , лещ мелкий Abramis brama и язь Leuciscus idus ; 40 дней для крупного леща и язя [60].
Стандартыобеспечивают устойчивость метацеркарий к низким температурам. Рыбу замораживают при следующих условиях: −40 ° C в течение 7 часов; −35 ° C в течение 14 ч; −28 ° C в течение 32 ч [58]. Горячее и холодное копчение, вяление и сушка, проведенные должным образом в соответствии с официальными стандартами, дезинфицируют все виды рыбы, кроме язя.К сожалению, меры по инактивации метацеркарий трудно использовать при переработке рыбы в домашних условиях. Таким образом, обеспечить необходимые условия для заморозки в домашних холодильниках практически невозможно [61]. Традиционная сушка рыбы и холодное копчение не инактивируют личинок паразитов [62]. Разработаны современные методы инактивации личинок, например, продемонстрирована высокая эффективность использования микроволновых печей при дезинфекции крупной рыбы по сравнению с другими методами [63].
Следует отметить, что с точки зрения борьбы с описторхозом образовательные программы для населения Западной Сибири не реализуются активно [64]. Так, значительная часть населения севера Тюменской области считает сырую рыбу здоровой пищей (32% опрошенного населения) и менее половины населения знают об инфекциях печеночной двуусткой (45,9% населения). Распространенность инфекции среди населения этого региона составляет ~ 40%. Примечательно, что быстро заражаются и новички: в первый год после приезда — 2%, в течение пяти лет — 10%, а в течение 10 лет заражаются 25% новичков.В первый год после приезда только 8% новичков считают сырую рыбу здоровой пищей, но через 5–10 лет их количество значительно увеличивается и составляет 17%. Эти данные свидетельствуют об успешной адаптации поселенцев к особенностям местного питания и их привычкам питания в аборигенном стиле.
Только 39% медицинских работников региона умеют пользоваться технологией маринования, гарантирующей обеззараживание рыбы. Стоит отметить, что сушка в этом регионе — один из самых распространенных способов обработки рыбы.Только 9% врачей, 27% эпидемиологов и 11,5% других медицинских работников в регионе владеют надлежащей технологией сушки рыбы, которая гарантирует обеззараживание [64]. Соответственно, уровень знаний о нашествии описторхиидов на рыбу и об опасностях заражения низок даже среди людей с медицинским образованием в этом регионе. По-видимому, все эти факторы в совокупности приводят к высокой распространенности заражения описторхиидами в этом регионе.
Вывод
Канцерогенный потенциал трематод O.felineus , по-видимому, плохо изучен по сравнению с таковыми близкородственных печеночных двуусток O. viverrini и C. sinensis . Тем не менее, ареал O. felineus охватывает обширные территории в Европе и Азии, и вспышки описторхоза, вызванные этим гельминтом, ожидаются во многих странах. Таким образом, описторхоз, вызываемый O. felineus , становится масштабной проблемой, выходящей за рамки мер здравоохранения и общественного здравоохранения в отдельных регионах.
Описторхоз — распространенный гельминтоз человека в России. В Таиланде и Корее традиционно широко распространено потребление сырой рыбы; В России традиция употребления в пищу сырой рыбы не так популярна, как употребление вяленой и малосоленой рыбы, очевидно зараженной метацеркарией паразита. В отличие от Таиланда (эндемичный район для O. viverrini) , где CCC является преобладающим типом рака, первичный рак печени не является ведущим видом рака в России.Вероятно, существуют некоторые дополнительные факторы, которые приводят к канцерогенезу у человека. По-видимому, одним из ключевых факторов, как показали эксперименты на модельных животных, является наличие в пище слабых канцерогенов, таких как нитрозамины, которые действуют как инициаторы канцерогенеза. Следовательно, ожидается, что эта хроническая инфекция будет способствовать возникновению рака желчных путей. Есть и другие факторы, которые являются относительными рисками и кофакторами образования CCC. В Таиланде и Республике Корея самый высокий относительный риск был скорректирован на потребление алкоголя, курение и физиологические характеристики, такие как пол и возраст [7].Эти факторы следует учитывать и в районах, эндемичных по описторхозу кошачьих.
На сегодняшний день МАИР классифицировал инфекцию O. felineus как канцероген группы 3, то есть еще недостаточно доказательств для ее классификации как канцерогенной, в отличие от ситуации с близкородственными печеночными двуустками O. viverrini и C. sinensis и кровяной двуусток S. haematobium , которые являются канцерогенами группы 1: определенно канцерогенными для человека.Для утверждения МАИР O. felineus как канцерогена группы 1 канцерогенная активность должна быть продемонстрирована в исследованиях на животных и людях.
Накопленные данные по гистопатологии на животных моделях показывают, что канцерогенная активность O. felineus в экспериментальной модели очень похожа на канцерогенность O. viverrini и C. sinensis . Все виды эпидемиологически важных описторхов похожи друг на друга по фенотипу взрослых особей, средам обитания на разных стадиях жизни и генетике.Инфекции печеночного двуустника имеют почти одинаковый патогенез и гистопатологию печени хозяина. Кроме того, способность секретировать белки и метаболиты оксистерина характерна для печеночных сосальщиков, включая O. felineus .
Крупномасштабные исследования ассоциации описторхоза кошачьего с ССС у людей не проводились, но такую информацию можно найти, по крайней мере, частично в опубликованной литературе и в больничных записях. Обобщенные данные показывают, что распространенность первичного рака печени в регионах Западной Сибири, крупнейшем в мире эндемичном ареале кошачьего описторхоза, значительно выше, чем в неэндемичных регионах.Тем не менее, представленные данные были получены отдельными группами исследователей и не могут дать исчерпывающую картину связи описторхоза и рака печени. Эта задача требует крупномасштабных эпидемиологических исследований, в которых используется опыт, накопленный в аналогичных исследованиях в других странах [9].
| Рисунок 3 Гистологические особенности желчных путей в биоптатах печени хомяков с экспериментальным описторхозом felinea. (А) Целое животное.(B) Неоплазия желчных путей высокой степени, вызванная O. felineus через три месяца p.i. (C) Холангиокарцинома в печени хомяка в результате комбинированного действия O. felineus и диметилнитрозоамина, три месяца p.i. BD, желчный проток; OF, O. felineus ; ССС, холангиокарцинома. Неоплазия желчных путей высокой степени обозначена стрелками. Рисунки 3А и 3С любезно предоставлены Максимовой Г.А. |
Сокращения, используемые в тексте и на рисунках
α-SMA: α-актин гладких мышц
Anxa1 : Аннексин A1
BD: Желчный проток
BilIN-1: Билиарная интраэпителиальная неоплазия с 1 степенью
BilIN-2: Билиарная интраэпителиальная неоплазия 9000 9000 степени 2 CCC: холангиокарцинома
ДНК: дезоксирибонуклеиновая кислота
EMT: эпителиально-мезенхимный переход
ESP: экскреторно-секреторные продукты
Ext1 : экзостозин-гликозилтрансфераза
000-гликозилтрансфераза 1 9 -0009000-гликозилтрансфераза 9CC карциномаHDM: защитная молекула хозяина
IARC: Международное агентство по изучению рака
Krt7 : кератин 7
мРНК: рибонуклеиновая кислота-мессенджер
NDMA: N-нитрозодиметиламин
OF:
OF:felineus
p.i .: Постинфекция
Tgfb1 : Трансформирующий фактор роста бета 1
TpX: Тиоредоксинпероксидаза
Благодарности
Рисунки 3А и ВС любезно предоставлены Максимовой Галиной А. (ИЦиГ СО РАН, Новосибирск, Россия). Авторы выражают признательность за поддержку участникам TOPIC [Томский консорциум ОПИсторхоза]. Английский язык был исправлен и сертифицирован shevchuk-editing.com.
Финансирование
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, https: // www.rfbr.ru/rffi/rus [No. 18-04-00417А [ВАМ] и государственный проект Института цитологии и генетики СО РАН [проект № 0324-2019-0041] (МИП, ВАМ). Спонсор не играл никакой роли в этом исследовании, такой как дизайн исследования, сбор данных или решение о публикации.
Конфликт интересов
Авторы заявляют, что у них нет конкурирующих интересов.
Список литературы
- Пахарукова М.Ю., Мордвинов В.А. (2016), Печеночный двуустник Opisthorchis felineus: биология, эпидемиология, канцерогенный потенциал.Trans R Soc Trop Med Hyg 110, 28–36. https://doi.org/10.1093/trstmh/trv085. [CrossRef] [PubMed] [Google Scholar]
- Шайн А.А. (1974), Симптоматология первичного рака печени.Вопр Онкол 20, 9, 50–56. [PubMed] [Google Scholar]
- Блохин Н.Н., Клименков А.А., Итин А.В., Комов Д.В., Ассекритова И.В. (1978), Первичный рак печени по материалам Научного онкологического центра АМН СССР.Вестн Акад Мед Наук СССР 5, 3–9. [Google Scholar]
- Бир С.А. (2005), Биология возбудителя описторхоза, КМК, Москва. ISBN 5-87317-204-8. [Google Scholar]
- Зубов Н.А., Беликов Е.С., Зайцева Л.Н. (1989), Описторхоз в Тобольске по данным аутопсии 1950–1987 гг.Мед Паразитол [Моск] 5, 10–13. [Google Scholar]
- Tselepatiotis E, Mantadakis E, Papoulis S, Vassalou E, Kotsakis P, Samonis G (2003), Случай заражения Opisthorchis felineus у пилота из Греции. Инфекция 31, 6, 430–432.https://doi.org/10.1007/s15010-003-3225-z. [Google Scholar]
- Рабочая группа МАИР по оценке канцерогенных рисков для человека (2012 г.), Биологические агенты. Том 100 B. Обзор канцерогенов человека. IARC Monogr Eval Carcinog Risks Risks Hum, 100, Pt B, 1–441.[Google Scholar]
- Sithithaworn P, Yongvanit P, Duenngai K, Kiatsopit N, Pairojkul C (2014), Роль инфекции печеночного двуустника как фактора риска холангиокарциномы. J. Hepatobilary Pancreat Sci 21, 301–308. https://doi.org/10.1002/jhbp.62. [CrossRef] [PubMed] [Google Scholar]
- Sripa B, Tangkawattana S, Laha T, Kaewkes S, Mallory FF, Smith JF, Wilcox BA (2015), На пути к комплексной борьбе с описторхозом на северо-востоке Таиланда: проект Lawa.Acta Trop 141, 361–367. https://doi.org/10.1016/j.actatropica.2014.07.017. [CrossRef] [PubMed] [Google Scholar]
- Гибсон Дж. Б. (1978), Гистологическое типирование опухолей печени, желчных путей и поджелудочной железы, в: Гибсон Дж. Б., Собин Л. Х. (ред.), Международной гистологической классификации опухолей нет. 20, Центр публикаций Всемирной организации здравоохранения, Женева. ISBN 3-540-60280-1 [Google Scholar]
- Pellino A, Loupakis F, Cadamuro M, Dadduzio V, Fassan M, Guido M, Cillo U, Indraccolo S, Fabris L (2018), Прецизионная медицина при холангиокарциноме.Перевод Гастроэнтерол Гепатол 3, 40. https://doi.org/10.21037/tgh.2018.07.02. [CrossRef] [PubMed] [Google Scholar]
- Blechacz B, Gores GJ (2008), Холангиокарцинома: достижения в области патогенеза, диагностики и лечения.Гепатология 48, 308–321. https://doi.org/10.1002/hep.22310. [CrossRef] [PubMed] [Google Scholar]
- Бриндли П.Дж., Коста JMCD, Срипа Б. (2015), Почему заражение некоторыми гельминтами вызывает рак? Тенденции рака 1, 3, 174–182.https://doi.org/10.1016/j.trecan.2015.08.011. [Google Scholar]
- Федоров К.П., Наумов В.А., Кузнецова В.Г., Белов Г.Ф. (2002), Некоторые реальные проблемы описторхоза человека. Мед Паразитол (Моск) 3, 7–9. Русский. [Google Scholar]
- Федоров К.П. (1968), Роль ондатры в распространении описторхоза на севере Томской области.Паразитология 11, 3, 258–259. [Google Scholar]
- Сеговия Дж. М., Торрес Дж., Микель Дж. (2004), Паразиты гельминтов красной лисицы (Vulpes vulpes L., 1758) на Пиренейском полуострове: экологическое исследование. Acta Parasitol 49, 67–79. [Google Scholar]
- Сеговия Дж. М., Торрес Дж., Микель Дж. (2002), Рыжая лисица, Vulpes vulpes L., как потенциальный резервуар зоонозных сосальщиков на Пиренейском полуострове. Acta Parasitol 47, 163–166. [Google Scholar]
- Rajkovic-Janje R, Marinculic A, Bosnic S, Benic M, Vinkovic B, Mihaljevic Z (2002), Распространенность и сезонное распространение паразитов гельминтов у красных лисиц (Vulpes vulpes) из Загребской жупании (Хорватия).Z Jagdwiss 48, 151–160. [Google Scholar]
- Шималов В.В., Шималов В.Т., Шималов А.В. (2000), Гельминтофауна выдры (Lutra lutra Linnaeus, 1758) Белорусского Полесья. Parasitol Res 86, 6, 528. https://doi.org/10.1007/s004360050708.[Google Scholar]
- Шималов В.В., Шималов В.Т. (2001), Гельминтофауна американской норки (Mustela vison Schreber, 1777) на Белорусском Полесье. Parasitol Res 87, 886–887. https://doi.org/10.1007/s004360100461. [Google Scholar]
- Шималов В. В., Шималов В. Т. (2003), Гельминтофауна рыжей лисицы (Vulpes vulpes Linnaeus, 1758) на юге Беларуси.Parasitol Res 89, 77–78. https://doi.org/10.1007/s00436-002-0701-9. [Google Scholar]
- Мордвинов В.А., Юрлова Н.И., Огородова Л.М., Катохин А.В. (2012), Opisthorchis felineus и Metorchis bilis являются основными возбудителями инфекции человека печеночной двуусткой в России.Паразитол Инт 61, 25–31. https://doi.org/10.1016/j.parint.2011.07.021. [CrossRef] [PubMed] [Google Scholar]
- Мордвинов В.А., Фурман Д.П. (2010), Паразит Digenea Opisthorchis felineus: цель для открытия и разработки новых лекарств.Infect Disord Drugs Targets 10, 385–401. https://doi.org/10.2174/1871526107 858. [Google Scholar]
- Pozio E, Armignacco O, Ferri F, Gomez Morales MA (2013), Opisthorchis felineus, новая инфекция в Италии и ее последствия для Европейского Союза.Acta Trop 126, 54–62. https://doi.org/10.1016/j.actatropica.2013.01.005. [CrossRef] [PubMed] [Google Scholar]
- Акуффо Х., Линдер Э., Люнгстрем И., Вальгрен М. (2002), Паразиты более холодного климата, CRC Press, Лондон, Нью-Йорк.ISBN 978042
74. [CrossRef] [Google Scholar]
- Ковширина Ю.В., Федорова О.С., Вторушин С.В., Ковширина А.Е., Иванов С.Д., Чижиков А.В., Онищенко С.В., Огородова Л.М., Одерматт П. (2019), История болезни: два случая холангиокарциномы у пациентов с инфекцией Opisthorchis felineus в Западной Сибири, Российская Федерация.Am J Trop Med Hyg 100, 3, 599–603. https://doi.org/10.4269/ajtmh.18-0652. [CrossRef] [PubMed] [Google Scholar]
- Ильинских Е.Н., Новицкий В.В., Ильинских Н.Н., Лепёхин А.В. (2007), инфекции Opisthorchis felineus (Rivolta, 1884) и Metorchis bilis (Braun, 1890) у населения некоторых регионов бассейна Оби.Паразитол (Моск) 41, 55–64. [по-русски]. [Google Scholar]
- Бражникова Н.А., Толкаева М.В. (2002), Рак печени, желчевыводящих путей и поджелудочной железы при хроническом описторхозе. Булл Сиб Мед 2, 71–77. [по-русски]. [Google Scholar]
- Бражникова Н.А., Цхай В.Ф. (2009), Гнойный холангит, вызванный описторхозом.Анналы хирургической гепатологии [Ann Surg Hepatol, Моск] 14, 28–33. [по-русски]. [Google Scholar]
- Брюхер Б.Л., Джамалл И.С. (2014), Эпистемология происхождения рака: новая парадигма. BMC Cancer 10, 14, 331. https://doi.org/10.1186 / 1471-2407-14-331. [Google Scholar]
- Львова М.Н., Тангкаваттана С., Балтайсонг С., Катохин А.В., Мордвинов В.А., Срипа Б. (2012), Сравнительная гистопатология Opisthorchis felineus и Opisthorchis viverrini на модели хомяка: свидетельство высокой патогенности европейского печеночного двуустки.Паразитол Инт 61, 167–172. https://doi.org/10.1016/j.parint.2011.08.005. [CrossRef] [PubMed] [Google Scholar]
- Gouveia MJ, Пахарукова М.Ю., Laha T, Sripa B, Максимова GA, Rinaldi G, Brindley PJ, Mordvinov VA, Amaro T, Santos LL, Correia da Costa JM, Vale N (2017), Инфекция Opisthorchis felineus вызывает интраэпителиальную неоплазию желчные пути на модели грызуна.Канцерогенез 38, 929–937. https://doi.org/10.1093/carcin/bgx042. [CrossRef] [PubMed] [Google Scholar]
- Zen Y, Adsay NV, Bardadin K, Colombari R, Ferrell L, Haga H, Hong SM, Hytiroglou P, Klöppel G, Lauwers GY, van Leeuwen DJ, Notohara K, Oshima K, Quaglia A, Sasaki M, Sessa F, Suriawinata A, Tsui W, Atomi Y, Nakanuma Y (2007), Билиарная интраэпителиальная неоплазия: международное исследование соглашения между наблюдателями и предложение по диагностическим критериям.Мод Pathol 20, 701–709. https://doi.org/10.1038/modpathol.3800788. [CrossRef] [PubMed] [Google Scholar]
- Tsokos CG, Krings G, Yilmaz F, Ferrell LD, Gill RM (2016), Индекс пролиферации облегчает различение доброкачественных поражений желчных путей и внутрипеченочной холангиокарциномы.Хум Патол 57, 61–67. https://doi.org/10.1016/j.humpath.2016.06.019. [CrossRef] [PubMed] [Google Scholar]
- Максимова Г.А., Пахарукова М.Ю., Кашина Е.В., Жукова Н.А., Ковнер А.В., Львова М.Н., Катохин А.В., Толстикова Т.Г., Срипа Б., Мордвинов В.А. (2017), Влияние инфекции Opisthorchis felineus и введения диметилнитрозамина на индукцию холангиокарциномы при сирийской карциноме.Паразитол Инт 66, 458–463. https://doi.org/10.1016/j.parint.2015.10.002. [CrossRef] [PubMed] [Google Scholar]
- Sripa B, Brindley PJ, Mulvenna J, Laha T, Smout MJ, Mairiang E, Bethony JM, Loukas A (2012), Канцерогенные печеночные двуустки Opisthorchis viverrini с множественными путями к раку.Trends Parasitol 28, 395–407. https://doi.org/10.1016/j.pt.2012.07.006. [CrossRef] [PubMed] [Google Scholar]
- Arunsan P, Ittiprasert W, Smout MJ, Cochran CJ, Mann VH, Chaiyadet S, Karinshak SE, Sripa B, Young ND, Sotillo J, Loukas A, Brindley PJ, Laha T (2019), Программная нокаутная мутация аттенуирует гранулин печеночной двуустки вирулентность гепатобилиарной заболеваемости, вызванной инфекциями.Elife 8, e41463, https://doi.org/10.7554/eLife.41463. [CrossRef] [PubMed] [Google Scholar]
- Чайядет С., Сотилло Дж., Смаут М., Кантакесси С., Джонс М.К., Джонсон М.С., Тернбулл Л., Уитчерч CB, Потрике Дж., Лаохавиродж М., Малвенна Дж., Бриндли П.Дж., Бетони Дж. М., Лаха Т., Срипа Б., Лукас А. (2015) , Канцерогенные печеночные двуустки секретируют внеклеточные везикулы, которые способствуют принятию холангиоцитами онкогенного фенотипа.J Infect Dis 212, 1636–1645. https://doi.org/10.1093/infdis/jiv291. [CrossRef] [PubMed] [Google Scholar]
- Robinson MW, Alvarado R, To J, Hutchinson AT, Dowdell SN, Lund M, Turnbull L, Whitchurch CB, O’Brien BA, Dalton JP, Donnelly S (2012), Кателицидин-подобный белок гельминтов подавляет процессинг и презентацию антигена в макрофаги за счет ингибирования лизосомальной вАТФазы.FASEB J 26, 11, 4614–4627. https://doi.org/10.1096/fj.12-213876. [CrossRef] [PubMed] [Google Scholar]
- Львова М.Н., Дужак Т.Г., Центалович Ю.П., Катохин А.В., Мордвинов В.А. (2014), Секретом взрослой печеночной двуустки Opisthorchis felineus.Паразитология 48, 3, 169–184. [PubMed] [Google Scholar]
- Пахарукова М.Ю., Ковнер А.В., Триголюбов А.Н., Федин Е.Н., Михайлова Е.С., Штофин С.Г., Аутеншлюс А.И., Мордвинов В.А. (2017), Механизмы патогенности трематодозов: наличие секреторных белков печеночного двуустника Opisthorchis felineus в тканях желчного пузыря больные хроническим описторхозом.Вавилов Ж. Генет Порода 21, 3, 312–316. https://doi.org/10.18699/VJ16.17-o. [CrossRef] [Google Scholar]
- Петренко В.А., Пахарукова М.Ю., Ковнер А.В., Львова М.Н., Ляхович В.В., Мордвинов В.А. (2017), Секреция белка тиоредоксинпероксидазы двуустки печени кошки Opisthorchis felineus при моделировании экспериментального описторхоза.Bull Exp Biol Med 162, 6, 773–776. https://doi.org/10.1007/s10517-017-3710-5. [CrossRef] [PubMed] [Google Scholar]
- Кавальери Э.Л., Роган Э.Г. (2010), Депуринизация аддуктов эстроген-ДНК в этиологии и профилактике рака груди и других видов рака человека.Будущее Онкол 6, 75–91. https://doi.org/10.2217/fon.09.137. [Google Scholar]
- Jaworski CJ, Moreira E, Li A, Lee R, Rodriguez IR (2001), Семейство из 12 человеческих генов, содержащих оксистерин-связывающие домены. Геномика 78, 185–196. https: // doi.org / 10.1006 / geno.2001.6663. [CrossRef] [PubMed] [Google Scholar]
- Йонгванит П., Пинлаор С., Барч Х (2012), Окислительное и нитративное повреждение ДНК: ключевые события в канцерогенезе, вызванном описторхозом.Паразитол Инт 61, 130–135. https://doi.org/10.1016/j.parint.2011.06.011. [CrossRef] [PubMed] [Google Scholar]
- Пахарукова М.Ю., Ершов Н.И., Воронцова Е.В., Катохин А.В., Меркулова Т.И., Мордвинов В.А. (2012), Цитохром P450 двуустки Opisthorchis felineus: идентификация и характеристика.Мол Биохим Паразитол 181, 2, 190–194. https://doi.org/10.1016/j.molbiopara.2011.11.005. [Google Scholar]
- Пахарукова М.Ю., Вавилин В.А., Срипа Б., Лаха Т., Бриндли П.Дж., Мордвинов В.А. (2015), Функциональный анализ уникального цитохрома P450 печеночного двуустника Opisthorchis felineus.PLoS Negl Trop Dis 9, e0004258. https://doi.org/10.1371/journal.pntd.0004258. [CrossRef] [PubMed] [Google Scholar]
- Ковнер А.В., Максимова Г.А., Мордвинов В.А. (2016), Роль эпителиально-мезенхимального перехода в печени при инфицировании Opisthorchis felineus // Тезисы докладов Международного симпозиума по системной биологии и биомедицине (SBIOMED-2016), ИЦиГ СО РАН, Новосибирск. .ISBN 978-5-
-025-8. [Google Scholar] - Чаклин А.В., Шаин А.А. (1976), Результаты эпидемиологических исследований первичного рака печени в Тюменской области. Вопр Онкол 22, 76–82. [Google Scholar]
- Шайн А.А. (1971), Описторхоз и рак печени среди населения Ханты-Мансийского национального округа.Вопр Онкол 17, 34–39. [PubMed] [Google Scholar]
- Писарева Л.Ф., Чойнзонов Ю.Л., Бояркина А.П. (2003), Особенности заболеваемости онкологическими заболеваниями населения Томской области (1990–2001 гг.).Булл Сиб Мед 4, 86–97. [Google Scholar]
- Каприн А.Д., Старинский В.В., Петрова Г.В. (2013), Состояние онкологической помощи в России в 2012 году, Москва, ФГБУ МНИОИ им. Минздрава России, Герцен. ISBN 978-5-85502-187-5. [Google Scholar]
- Каприн А.Д., Старинский В.В., Петрова Г.В. (2018), Злокачественные новообразования в России в 2017 году (заболеваемость и смертность), Москва, ФГБУ МНИОИ им. Минздрава России, Герцен.ISBN 978-5-85502-243-8. [Google Scholar]
- Попова А.Ю. (2017), О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2016 году: государственный отчет Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Москва.https://www.rospotrebnadzor.ru/upload/iblock/0b3/gosudarstvennyy-doklad-2016.pdf. [Google Scholar]
- Зубов Н.А., Амелин С.П., Третьяков А.М. (1991), Исходы повреждений печени и желчного пузыря у больных описторхозом. Хирургия (Моск) 2, 63–66.[Google Scholar]
- Глумов В.И., Котриков В.В., Третьякова Н.А. (1974), Патогенез и морфология первичного рака печени, развивающегося на фоне описторхоза. Вопр Онкол 20, 46–50. [по-русски]. [Google Scholar]
- Патютко И.И., Сагайдак И.В., Чучуев Е.С. (2008), Хирургическое лечение первичного рака печени.Практик Онкол 9, 197–201. [Google Scholar]
- Паркин Д.М., Уилан С.Л., Ферлай Дж., Теппо Л., Томас Д.Б. (2002), Заболеваемость раком на пяти континентах, Vol. VIII, Международное агентство по изучению рака, Лион. ISBN 978-92-832-2155-5. [Google Scholar]
- Попова А.Ю. (2015), Профилактика паразитарных заболеваний на территории Российской Федерации [Санитарные правила и нормы СанПиН 3.2.3215-14], Информационно-издательский центр Минздрава, Москва. http://docs.cntd.ru/document/420233490. [Google Scholar]
- Пелгунов А.Н., Казаков Б.Е., Федоров К.П. (2006), Паразитарная фауна рыб бассейна Оби // Павлов Д., Мочек А.Д.// Экология рыб Обь-Иртышского бассейна. Москва. КМК. ISBN 5-87317-300-1 [Google Scholar]
- Фаттахов Р.Г. (2002), Заражение рыб личинками описторхиса в России и некоторых сопредельных странах (по материалам «Кадастра очагов заражения описторхом в России в 1994 году»].Мед Паразитол (Моск) 1, 25–27. Русский. [Google Scholar]
- Сидоров Е.Г., Белякова Ю.В., Кукашев ДШ (1991), Оценка описторхозной ситуации в районе канала Иртыш-Караганда. Мед Паразитол (Моск) 3, 40–42. Русский.[Google Scholar]
- Пелгунов А.Н., Рябов И.Н., Филиппова А.Ю. (2005), Использование микроволновых печей для профилактики описторхоза. Мед Паразитол (Моск) 3, 42–45. [по-русски]. [Google Scholar]
- Пустовалова Виа (2002), Особенности санитарно-просветительской работы при описторхозе в условиях миграционного давления в эндемичном регионе.Мед Паразитол (Моск) 3, 10–13. Русский. [Google Scholar]
Цитируйте эту статью как : Пахарукова М.Ю., Коррейя да Коста Ю.М., Мордвинов В.А., 2019. Печеночный двуустник Opisthorchis felineus как канцероген III или I группы. 4open, 2 , 23.
Все рисунки
фигура 1 Жизненный цикл O. felineus [15] . Яйца откладываются в желчевыводящих путях, попадают в кишечник и выводятся с калом. Они должны быть съедены пресноводными брюхоногими моллюсками Bithynia , первым промежуточным хозяином, чтобы развиться в спороцисты, редии и свободно плавающие церкарии: инфекционная стадия для второго промежуточного хозяина, карповых рыб. Люди и другие рыбоядные млекопитающие и птицы могут служить окончательным хозяином после поедания зараженной рыбы.Попадая в организм хозяина, метацеркарии поражают желчевыводящие пути млекопитающих, где они превращаются во взрослых червей. Изображения церкарий и яиц взяты из [15]; Bithynia улитка, метацеркария и имаго O. felineus — оригинальные изображения.
По тексту фигура 2 Малое озеро, приток реки Оби (г. Новосибирск) и промежуточный хозяин печеночной двуустки Opisthorchis felineus .(А) Малое озеро. (B) Заводь Малого озера, место обитания вифинских улиток, улиток. (C) Свежий язь ( L. idus ) во льду на рынке.
По тексту Рисунок 3 Гистологические особенности желчных путей в биоптатах печени хомяков с экспериментальным описторхозом felinea. (А) Целое животное. (B) Неоплазия желчных путей высокой степени, вызванная O. felineus через три месяца p.