Вирус герпеса человека 6 типа, впг 6 типа у детей
Вирус герпеса человека 6 типа (ВГЧ-6) – ДНК–содержащий вирус семейства Herpesviridae подсемейства Betaherpesvirinae рода Roseolavirus. ВГЧ-6 был впервые выделен в 1986 г. из В-лимфоцитов периферической крови больных неходжкинскими лимфомами, которые возникают у больных ВИЧ-инфекцией. Вирус относится к подсемейству бета-герпес-вирусов, является ближайшим генетическим родственником ЦМВ, выделяют два варианта: ВГЧ-6А и ВГЧ-6В.
Репликация вируса в мононуклеарах периферической крови происходит относительно медленно и сопровождается лизисом клетки-хозяина. Для ВГЧ-6, как и для других герпес-вирусов, характерна способность к персистенции и латенции в организме инфицированного человека. Вирус проявляет тропизм к широкому спектру клеток хозяина: его обнаруживали в лимфатических узлах, лимфоцитах периферической крови, моноцитах, макрофагах, клетках почек, в слюнных железах, мозге.
Инфекция ВГЧ-6 – антропоноз. Источник инфекции – человек, страдающий манифестной или латентной формой инфекции, а также вирусоносители. Пути передачи инфекции – воздушно-капельный, контактно-бытовой, парентеральный, трансплацентарный. Факторы передачи – слюна, мокрота, кровь. Инфекция отличается всеобщей восприимчивостью.
Показана высокая патогенетическая значимость ВГЧ-6: он может вызывать острые поражения кожи у детей раннего возраста (внезапная экзантема новорожденных), лихорадку новорожденных с судорожным синдромом, синдром хронической усталости (в то же время последние работы придают большее значение в развитии данной патологии ВГЧ-7), мононуклеозоподобный синдром; у иммунокомпрометированных лиц – быть причиной лихорадки, пневмонии, гепатита, поражения ЦНС.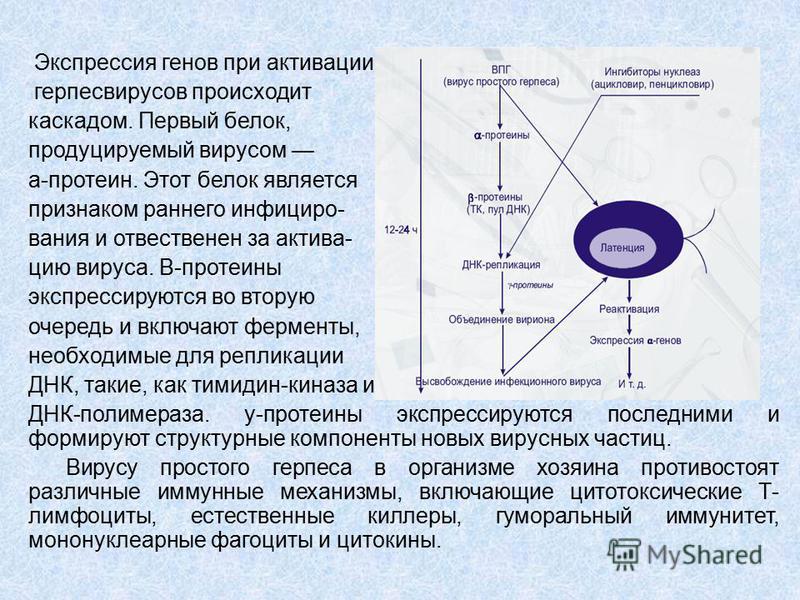
Верификация диагноза ВГЧ-6 инфекции осуществляется только при положительных результатах лабораторных исследований.
Дифференциальная диагностика. Энтеро- и аденовирусная инфекция, корь, краснуха, скарлатина, пневмония, средний отит, острый пиелонефрит, менингит, пневмококковая бактериемия, аллергические высыпания.
Показания к обследованию
- Пятнисто-папулезная сыпь (экзантема) в сочетании с лимфаденопатией после непродолжительной лихорадки;
- увеличение затылочных, заднешейных и/или околоушных лимфатических узлов;
- исследование после контакта с больным внезапной экзантемой или другой инфекцией, вызванной ВГЧ-6 или с подозрением на данные нозологические формы;
- дифференциальная диагностика экзантемных заболеваний;
- иммунодефицитные состояния;
- хроническая усталость и снижение работоспособности более чем на 50% с длительностью около 6 месяцев при отсутствии других заболеваний, вызывающих аналогичные признаки;
- симптоматика врожденной инфекции, пороки развития у новорожденных.

Этиологическая лабораторная диагностика включает выявление возбудителя в культуре клеток, обнаружение ДНК вируса, определение специфических АТ IgM, IgG к антигенам ВГЧ-6.
Материал для исследования
- Плазма крови, СМЖ, лейкоцитарная фракция крови, слюна – выделение ДНК, выявление возбудителя в культуре клеток;
- сыворотка крови – определение АТ.
Сравнительная характеристика методов лабораторной диагностики. Выявление возбудителя в культуре клеток в настоящее время для рутинной диагностики инфекции, вызываемой вирусом ВГЧ-6, не применяются ввиду трудоемкости, длительности исполнения и необходимости определенных условий проведения исследований.
Основным методом дифференциальной диагностики инфекции является детектирование и определение концентрации ДНК ВГЧ-6 методом ПЦР. При исследовании цельной крови для диагностики инфекции предпочтительно количественное определение ДНК, которое позволит дифференцировать латентную и активную инфекцию, поскольку вирус может присутствовать в лейкоцитах здоровых лиц.
Для выявления специфических АТ IgM, IgG к АГ ВГЧ-6 используют преимущественно ИФА. Определение АТ IgG может быть выполнено в качественном и количественном формате. Обнаружение АТ IgM позволяет установить диагноз текущей первичной ВГЧ-6-инфекции, результаты определения АТ IgG в количественном формате – провести динамическое наблюдение, оценить состояние постинфекционного иммунитета к ВГЧ-6.
Показания к применению различных лабораторных исследований (герпес 6 типа – анализ). Индикаторами активной инфекции служат наличие ДНК ВГЧ-6 и АТ IgM. АТ IgM появляются в крови на 4–7 сутки от начала болезни и сохраняются в течение нескольких месяцев.
Особенности интерпретации результатов лабораторных исследований. Выявление специфического фрагмента ДНК ВГЧ-6 в образцах биоматериала пациента (плазма крови, СМЖ, соскобы со слизистой оболочки ротоглотки) позволяет при однократном тестировании подтвердить факт инфицирования ВГЧ 6 типа.
Обнаружение специфических АТ IgМ, маркеров острой фазы заболевания, свидетельствует о первичном инфицировании или реактивации инфекции. Однократное обнаружение АТ IgG не является однозначным свидетельством первичной инфекции.
Human Herpes Virus 6, IgG
Антитела класса IgG к человеческому герпес-вирусу 6-го типа (ВГЧ-6) вырабатываются иммунной системой начиная со второй недели после заражения вирусом и сохраняются на протяжении всей жизни. Их выявление служит надежным свидетельством инфицированности ВГЧ-6.
Их выявление служит надежным свидетельством инфицированности ВГЧ-6.
Синонимы русские
Антитела класса IgG к ВГЧ-6, иммуноглобулины класса G к вирусу человеческого герпеса 6-го типа.
Синонимы английские
Anti-HHV-6 IgG, Human Herpes Virus type 6 IgG antibodies, Anti–Human Herpes Virus 6 IgG, HHV-6 Antibodies.
Метод исследования
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
6-й тип герпес-вируса человека (ВГЧ-6) впервые был выделен относительно недавно, в 1986 г. (в клетках крови пациентов, зараженных ВИЧ). К настоящему времени установлено, что инфекция ВГЧ-6 широко распространена и имеет 2 подтипа – А и В, – которые отличаются генетически и эпидемиологически: чаще встречается подтип В, а подтип А обычно обнаруживают у пациентов с иммунодефицитами.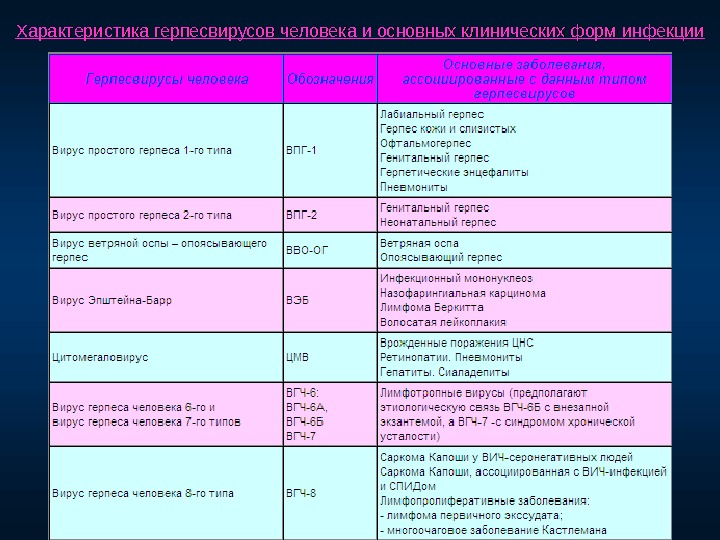 Подтип В является основной причиной внезапной экзантемы – детской болезни, сопровождающейся высокой температурой и сыпью. Кроме того, герпес-вирус может протекать бессимптомно и в виде неспецифического лихорадочного заболевания. В некоторых случаях наблюдаются осложнения со стороны центральной нервной системы (судороги на фоне высокой температуры, редко другие неврологические осложнения, включая энцефалит, менингоэнцефалит, серозный менингит).
Подтип В является основной причиной внезапной экзантемы – детской болезни, сопровождающейся высокой температурой и сыпью. Кроме того, герпес-вирус может протекать бессимптомно и в виде неспецифического лихорадочного заболевания. В некоторых случаях наблюдаются осложнения со стороны центральной нервной системы (судороги на фоне высокой температуры, редко другие неврологические осложнения, включая энцефалит, менингоэнцефалит, серозный менингит).
Антитела IgG к данному вирусу выявляются у 70-90 % взрослых людей. Первичная инфекция ВГЧ-6 у взрослых встречается редко, она может быть связана с фульминантным гепатитом, с инфекционным мононуклеозом, отрицательным по вирусу Эпштейна – Барр.
Наиболее вероятный путь передачи инфекции – воздушно-капельный, со слюной, не исключена «вертикальная» передача – от матери к ребенку во время беременности. Вирус склонен поражать лимфоциты. Репликация вируса происходит главным образом в Т-лимфоцитах, но он может быть выявлен и в других клетках – моноцитах, В-лимфоцитах, – а также в ткани мозга, печени, слюнных желез, в эндотелии.
Как и другие герпес-вирусы, ВГЧ-6 после первичного инфицирования способен персистировать в организме, активируясь при угнетении иммунитета. Трансплантация стволовых клеток и пересадка внутренних органов повышает риск инфекций, вызванных ВГЧ-6 (в большинстве случаев это, видимо, обусловлено реактивацией латентной инфекции в результате угнетения иммунитета на фоне иммуносупрессивной терапии).
Анализ на ВГЧ-6, наряду с проверкой на цитомегаловирус и вирус Эпштейна – Барр, рекомендуется для как можно более раннего выявления вирус-ассоциированных заболеваний и успешности трансплантации.
В настоящее время активно исследуется возможная роль ВГЧ-6 в развитии рассеянного склероза, синдрома хронической усталости, лимфопролиферативных заболеваний, его влияние на течение ВИЧ-инфекции.
Для диагностики ВГЧ-6 широко применяется выявление вирусоспецифических антител класса IgG, которые делятся на подклассы:
1) Антитела IgG к предранним (неструктурным) белкам ВГЧ-6
Эти антитела появляются в ответ на активацию вируса в инфицированной им клетке. Они очень специфичны, поэтому при их обнаружении не наблюдается ложноположительных результатов. Наличие IgG к предранним белкам ВГЧ-6 – однозначный признак активности вируса. Они вырабатываются как при первичной острой инфекции, так и при рецидиве хронической инфекции и реинфекции ВГЧ-6.
Они очень специфичны, поэтому при их обнаружении не наблюдается ложноположительных результатов. Наличие IgG к предранним белкам ВГЧ-6 – однозначный признак активности вируса. Они вырабатываются как при первичной острой инфекции, так и при рецидиве хронической инфекции и реинфекции ВГЧ-6.
2) Низкоавидные антитела IgG к ВГЧ-6
Через 10-14 дней после первичного заражения ВГЧ-6 у человека без иммунодефицита появляются антитела IgG с низкой авидностью (слабой силой связывания антигенов ВГЧ-6), при этом авидность антител IgG постоянно возрастает, а доля низкоавидных антител IgG уменьшается, так что они полностью исчезают через 1-3 месяца. Обнаружение среди IgG более 50 % низкоавидных IgG к ВГЧ-6 – однозначный признак первичного заражения этим вирусом.
3) Высокоавидные антитела IgG к ВГЧ-6
Начинают вырабатываться практически одновременно с низкоавидными антителами IgG и циркулируют в крови носителя ВГЧ-6 всю жизнь.
Анализ на IgG к ВГЧ-6 с классификацией их по вышеописанным подклассам, безусловно, очень информативен, однако применяется редко, поскольку требует дорогостоящих иммунодиагностических наборов. В связи с этим стандартным исследованием на IgG-антитела к ВГЧ-6 является иммуноферментный анализ (ИФА) сыворотки крови с определением диагностического титра всех вирусоспецифических IgG в целом и учет его изменений.
В связи с этим стандартным исследованием на IgG-антитела к ВГЧ-6 является иммуноферментный анализ (ИФА) сыворотки крови с определением диагностического титра всех вирусоспецифических IgG в целом и учет его изменений.
Первичная инфекция
Первичное заражение ВГЧ-6, как правило, происходит в детстве (до 3 лет) и в большинстве случаев (70-80 %) не приводит к острому инфекционному процессу, а переходит в латентное, бессимптомное, течение (вирусоносительство). Тем не менее иммунная система человека отвечает на вторжение вируса продукцией антител. IgG появляются на 2-й неделе после заражения в небольшой концентрации, которая непрерывно нарастает и достигает максимума через месяц. При отсутствии активного размножения вируса достигнутый уровень специфических IgG-антител с незначительными колебаниями сохраняется в течение жизни. Из этого следует, что если при анализе не обнаружено вирусоспецифических IgG или они обнаружены в невысоком титре, то необходимо повторное исследование через 2 недели после первого.
Если после первичного заражения вирус начинает активно размножаться, развивается острая первичная ВГЧ-6-инфекция, которая в подавляющем большинстве случаев проявляется крупными высыпаниями на коже и повышением температуры. При этом вирусоспецифические антитела IgG также достигают пика через месяц, но их титр в 2-4 раза выше, чем при латентном течении. После нейтрализации активных вирусов титр вирусоспецифических IgG начинает постепенно снижаться и через 1-1,5 месяца приближается к уровню антител при латентном течении.
Вторичная инфекция
Хроническое (латентное) течение ВГЧ-6 может сопровождаться обострениями первично-латентного процесса или рецидивами первичной инфекции. Кроме того, редко, когда в результате антивирусной терапии, эффективной иммунной защиты первичное заражение ВГЧ-6 завершилось устранением вируса, возможно повторное заражение ВГЧ-6 или реинфекция.
Для всех случаев вторичной инфекции характерно наличие в организме уже существующих антител IgG к ВГЧ-6. Тем не менее обострение, рецидив и реинфекция стимулируют дополнительную продукцию вирусоспецифических IgG, причем их титр начинает возрастать на 1-3-й день инфекционного процесса. Однако, поскольку вторичная инфекция развивается, как правило, из-за снижения существующего антивирусного иммунитета, титр IgG-антител может оказаться существенно ниже, а сроки достижения пика их продукции существенно больше наблюдаемых при нормально функционирующей иммунной системе. Как и при первичной острой инфекции, после нейтрализации активных вирусов ГЧ-6 уровень IgG начинает снижаться и достигает исходного значения через 1-1,5 месяца после наступления клинической ремиссии.
Тем не менее обострение, рецидив и реинфекция стимулируют дополнительную продукцию вирусоспецифических IgG, причем их титр начинает возрастать на 1-3-й день инфекционного процесса. Однако, поскольку вторичная инфекция развивается, как правило, из-за снижения существующего антивирусного иммунитета, титр IgG-антител может оказаться существенно ниже, а сроки достижения пика их продукции существенно больше наблюдаемых при нормально функционирующей иммунной системе. Как и при первичной острой инфекции, после нейтрализации активных вирусов ГЧ-6 уровень IgG начинает снижаться и достигает исходного значения через 1-1,5 месяца после наступления клинической ремиссии.
Таким образом, при обнаружении в крови IgG-антител к ВГЧ-6 следует повторить исследование через 2 недели после предыдущего и через 1-1,5 месяца после ремиссии.
Для чего используется это исследование?
Чтобы установить инфицированность ВГЧ-6 и характер инфекции:
- первичная инфекция (острое течение, латентное течение, носительство),
- вторичная инфекция (хроническое течение, обострение/рецидив, реинфекция).

Когда назначается исследование?
- При дифференциальной диагностике детских инфекций, протекающих с высокой температурой и сыпью.
- При диагностике инфекционного мононуклеоза, отрицательного по вирусу Эпштейна – Барр.
- В комплексе обследований пациентов с лимфопролиферативными заболеваниями и гемобластозами.
- В комплексе обследований реципиентов органов и тканей до и после трансплантации.
- При диагностике вирусассоциированных заболеваний у ВИЧ-инфицированных и при других иммунодефицитных состояниях (синдроме хронической усталости).
Что означают результаты?
Референсные значения
Результат: отрицательный.
КП (коэффициент позитивности): 0 — 0,79.
Положительный результат
Однократный положительный результат однозначно свидетельствует о наличии ВГЧ-6. Однако с учетом широкого распространения среди населения этого вируса в неактивной форме для выяснения характера хронической вирусной инфекции (активная/неактивная) необходим повторный анализ на IgG через 2 недели после предыдущего. Увеличение титра антител хотя бы в 1,5-2 раза по сравнению с предыдущим указывает на активность ВГЧ-6. Для подтверждения ремиссии вирусной инфекции требуется еще два повторных теста: первый выполняется при симптомах ремиссии, второй – через 1 месяц после предыдущего. Снижение титра вирусоспецифических IgG во втором исследовании минимум в 1,5 раза по сравнению с предыдущим позволяет с уверенностью говорить об отсутствии активных ВГЧ-6 и наступлении ремиссии вирусной инфекции.
Увеличение титра антител хотя бы в 1,5-2 раза по сравнению с предыдущим указывает на активность ВГЧ-6. Для подтверждения ремиссии вирусной инфекции требуется еще два повторных теста: первый выполняется при симптомах ремиссии, второй – через 1 месяц после предыдущего. Снижение титра вирусоспецифических IgG во втором исследовании минимум в 1,5 раза по сравнению с предыдущим позволяет с уверенностью говорить об отсутствии активных ВГЧ-6 и наступлении ремиссии вирусной инфекции.
Отрицательный результат
- Однократный отрицательный результат может свидетельствовать об отсутствии ВЧГ-6 или о ранней стадии заражения (до двух недель). Необходимо провести повторное исследование не менее чем через 2 недели.
- Повторный отрицательный результат однозначно свидетельствует об отсутствии ВЧГ-6.
Что может влиять на результат?
Помимо нарушений, связанных со взятием, хранением, транспортировкой биоматериала и проведением исследования, на результат влияет состояние иммунитета. В связи с тем что иммунная система новорождённых, детей раннего возраста нестабильна, а доноры крови, тканей и органов подвергаются иммуноугнетающей терапии, иммунитет таких пациентов на момент исследования бывает ослабленным (скомпрометированным). В этом случае производство антител IgG может оказаться сниженным, что приведет к ложноотрицательному результату анализа.
В связи с тем что иммунная система новорождённых, детей раннего возраста нестабильна, а доноры крови, тканей и органов подвергаются иммуноугнетающей терапии, иммунитет таких пациентов на момент исследования бывает ослабленным (скомпрометированным). В этом случае производство антител IgG может оказаться сниженным, что приведет к ложноотрицательному результату анализа.
Важные замечания
- При вирусной инфекции, опосредованной ВГЧ-6, главное – определить характер ее течения (активная/неактивная). С этой целью при подозрении на ВГЧ-6 требуется следить за динамикой уровня IgG-антител – при любом результате первого исследования необходим повторный тест не менее чем через 2 недели. Для пациентов с предположительно скомпрометированной иммунной системой серологическое исследование следует дополнить выявлением генома вируса с помощью ПЦР в реальном времени.
Также рекомендуется
Кто назначает исследование?
Вирусолог, иммунолог, серолог, акушер, гинеколог, инфекционист, педиатр, невропатолог, гематолог, трансплантолог./147/147.jpg)
Литература
- Salahuddin S.Z., Albashi D.V.,Markham P.D., et.al., (1986) Isolation of a new virus, HBLB, in patient with lymphoproliferative disorders. Science 234:596-601.
- Kruegar G.R.F., Koch B., Ramon A., et al.(1988) Antibody prevalence to HBLV (human herpesvirus-6, HHV-6) and suggestive pathogenecity in the general population and in patients with immune deficiency syndromes. J.Virol.Methods 21:125-131.
- Yamanishi K., Okuno T., Shiraki K., et al. (1988) Identigication of human herpesvirus-6 as casual agent for exanthem subitum. Lancet 1:1065-1067.
- Asano Y., Yoshikawa T., Kajita Y et al.(1992) Fatal encephalitis/encephalopathy in primary human herpesvirus-6 infection. Arch. Dis. Child. 67:1484-1485.
- Asano Y., Yoshikawa T., Suga S., et al. (1990) Fatal fulminant hepatitis in an infant with human herpesvirus-6 infection. Lancet 335: 862-863.
- Preziozo P.J., Cangiarella J., Lee M., et al.
 (1992) Fatal disseminated infection with humanherpesvirus-6. J.Pediatrics 120:921-923.
(1992) Fatal disseminated infection with humanherpesvirus-6. J.Pediatrics 120:921-923. - Steeper T.A., Horwiitz C.A., Ablashi D.V. et al. (1990) The spectrum of clinical and laboratory findings for Human Herpesvirus-6 (HHV-6) in patients with mononucleosis-like illness not resulting from Epsein-Barr virus or cytomegalovirus. Am.J.Clin.Pathol. 93:776-783.
- Dubedat S.and Kappadoga N.(1989) Hepatitis due to human herpesvirus-6. Lancet 2:1463-1464.
- Eizuru Y., Minematsu T., Minamishima Y., et al. (1989) Human herpesvirus-6 in lymph nodes. Lancet 1:40.
- Drobyski W.R., Dunne W.M., Burd E.M., et al. (1993) Human herpesvirus-6 (HHV-6) infection in allogenic bone marrow transplantant recipients:Evidence of a marrow-supressive role for HHV-6 in vivo. J.Inf.Dis. 167:735-739
- Gautheret-Dejean, A J Virol Methods. 2002 Feb;100(1-2):27-35. Development of a real-time polymerase chain reaction assay for the diagnosis of human herpesvirus-6 infection and application to bone marrow transplant patients.
- Buchwald D., Cheney P.R., Peterson D.L.,et al (1992) A chronic illness characterized by fatigue, neurologic and immunologic disorders, and active human herpesvirus-6 infection. Ann.Intern.Med. 116:103-113.
- Dr. K. N. Ward, J. J. Gray, M. E. Joslin, M. J. Sheldon Avidity of IgG antibodies to human herpesvirus-6 distinguishes primary from recurrent infection in organ transplant recipients and excludes cross-reactivity with other herpesviruses Journal of Medical Virology Volume 39, Issue 1, pages 44–49, January 1993.
- Krueger GR, Ablashi DV, Josephs SF, Salahuddin SZ, Lembke U, Ramon A, Bertram G.Clinical indications and diagnostic techniques of human herpesvirus-6 (HHV-6) infection.n Vivo. 1991 May-Jun;5(3):287-95.
- T. Sloots, John Kapeleris, I. Mackay, M. Batham, and P. Devine. Evaluation of a Commercial Enzyme-Linked Immunosorbent Assay for Detection of Serum Immunoglobulin G Response to Human Herpesvirus 6 JOURNAL OF CLINICAL MICROBIOLOGY, Mar. 1996, p. 675–679 Vol. 34, No. 3.
Human Herpes Virus 6, ДНК [реал-тайм ПЦР]
Исследование для выявления возбудителя герпес-вирусной инфекции 6-го типа (Human Herpes Virus 6), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени (РТ-ПЦР) определяется генетический материал (ДНК) вируса в образце биоматериала.
Синонимы русские
Герпес-вирус 6-го типа, ВГЧ-6, РТ-ПЦР.
Синонимы английские
HHV-6, DNA [Real-time PCR].
Метод исследования
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Биоптат, венозную кровь, ликвор, мазок из зева (ротоглотки), слюну.
Общая информация об исследовании
6-й тип герпес-вируса человека (ВГЧ-6) впервые был определен относительно недавно, в 1986 г., в крови ВИЧ-инфицированных пациентов. К настоящему времени установлено, что инфекция ВГЧ-6 широко распространена и имеет 2 подтипа, отличающихся генетически, – А и В. В целом более распространен подтип В, однако подтип А чаще обнаруживают у пациентов с иммунодефицитами.
Полная репликация вируса происходит только в Т-лимфоцитах, но ВГЧ-6 может быть выявлен и в других клетках – моноцитах, В-лимфоцитах, а также в ткани мозга, печени, слюнных желез, в эндотелии.
Наиболее вероятный путь заражения – воздушно-капельный, со слюной, не исключена передача инфекции от матери к ребенку во время беременности.
Также существует возможность инфицирования при трансплантации органов, гемотрансфузиях, через медицинские инструменты. Наркоманы и медицинские работники могут заразиться при случайном уколе иглой шприца, содержащего кровь больного либо инфицированного.
Первый раз заражение практически всегда происходит в возрасте от 4 до 24 месяцев. В большинстве случаев ВГЧ-6 протекает бессимптомно, а если проявляется, то чаще всего как внезапная экзантема и быстро развивающаяся сильная лихорадка, продолжающаяся 3-4 дня. Через несколько часов после нормализации температуры появляются эритематозные пятна или пятнисто-папулезная сыпь. Сходство внезапной экзантемы с симптомами кори или краснухи зачастую приводит к постановке ошибочного диагноза.
В некоторых случаях бывают осложнения со стороны центральной нервной системы (судороги на фоне высокой температуры, редко энцефалит, менингоэнцефалит, серозный менингит).
Взрослые редко инфицируются ВГЧ-6, причем заражение у них может сопровождаться симптомами инфекционного мононуклеоза (вирус Эпштейна – Барр в таком случае отсутствует) или фульминантного гепатита.
ВГЧ-6 способен вызвать отторжение трансплантата у реципиентов. Осложнения вследствие активации ВГЧ-6 отмечены у пациентов после пересадки костного мозга, почек, печени, легких. В частности, пациенты после трансплантации костного мозга часто страдают от заболеваний, обусловленных HHV-6 (интерстициальная пневмония, супрессия костного мозга, менингоэнцефалит). Активация ВГЧ-6 является причиной 80 % случаев идиопатической лейкопении после трансплантации печени. К счастью, при своевременной диагностике ВГЧ-6 поддается лечению с помощью лекарственных препаратов.
ВИЧ-инфицированные составляют еще одну категорию лиц с иммунодефицитом, у которых активация ВГЧ-6 способна приводить к серьезным осложнениям (к поражениям ЦНС, к пневмонии и пр.) и прогрессированию основного заболевания. Кроме того, активный ВГЧ-6 может способствовать переходу ВИЧ из латентной в активную форму, поэтому регулярный контроль активности ВГЧ-6 у ВИЧ-положительных пациентов важен для своевременного начала антивирусной терапии.
Сегодня активно исследуется возможная роль ВГЧ-6 в развитии рассеянного склероза, синдрома хронической усталости, лимфопролиферативных заболеваний.
Так как ВГЧ-6 в латентной форме распространен практически повсеместно, очень важно вовремя устанавливать характер его течения – активный/неактивный. Активация любой вирусной инфекции начинается с размножения (репликации) вируса в клетке-хозяине. Далее в большинстве случаев клетки-хозяева погибают, а новые вирусы выходят в межклеточное пространство (внутритканевую жидкость) для заражения новых клеток. Оттуда вирусные частицы попадают в различные биологические жидкости (кровь, мочу, ликвор) и железистые секреты, где могут быть легко обнаружены с помощью ПЦР. Выявление вирусных ДНК/РНК в бесклеточных образцах биологических жидкостей или железистых секретах является однозначным указанием на активную вирусную инфекцию. Однако диагностика инфекции осложняется тем, что ВГЧ-6 после репликации в клетке-хозяине заражает другие клетки напрямую, проникая через межклеточные перегородки и избегая межклеточных пространств. Таким образом, подтверждение активности ВГЧ-6 посредством ПЦР в бесклеточных образцах биологических жидкостей и секретах удается не во всех случаях. В связи с этим возникает необходимость подтверждения активности/неактивности ВГЧ-6 с помощью серологических методов.
Когда назначается исследование?
- При дифференциальной диагностике детских инфекций, протекающих с высокой температурой и сыпью.
- При диагностике инфекционного мононуклеоза при отрицательном тесте на вирус Эпштейна – Барр.
- В комплексе обследований пациентов с лимфопролиферативными заболеваниями и гемобластозами.
- При обследовании реципиентов органов и тканей до и после трансплантации.
- При диагностике вирус-ассоциированных заболеваний у ВИЧ-инфицированных и при других иммунодефицитных состояниях (например, синдроме хронической усталости).
- При контроле за эффективностью проведенного антивирусного лечения.
Для чего используется исследование?
- Для подтверждения наличия/отсутствия инфекции.
- Для того чтобы определить характер течения инфекции – активный/неактивный.
- Для дифференциальной диагностики герпетических инфекций.
Что означают результаты?
Референсные значения
Результат: отрицательный.
Причины положительного результата
- Однократный положительный результат реал-тайм ПЦР однозначно свидетельствует об активной ВГЧ-6 инфекции.
Причины отрицательного результата
- Однократный отрицательный результат реал-тайм ПЦР может быть признаком отсутствия активной ВГЧ-6-инфекции и нуждается в дополнительном подтверждении с помощью ретроспективных исследований вирусоспецифических IgG-антител.
Что может влиять на результат?
Свойство ВГЧ-6 поражать другие клетки напрямую, не выходя за их пределы, способствует ложноотрицательному результату.
Скачать пример результатаВажные замечания
- Лимфоциты и моноциты крови являются местом постоянного обитания и размножения ВГЧ-6 у инфицированных людей, поэтому надежным свидетельством активации/реактивации ВГЧ-6 служит обнаружение ДНК ВГЧ-6 в бесклеточных производных крови – сыворотке или бесклеточной плазме.
Также рекомендуется
- Human Herpes Virus 6, IgG
Кто назначает исследование?
Аллерголог-иммунолог, акушер, гинеколог, инфекционист, педиатр, невролог, гематолог, хирург.
Литература
- Nolan T, Hands RE, Bustin SA (2006). «Quantification of mRNA using real-time RT-PCR.». Nat. Protoc. 1: 1559-1582.
- VanGuilder HD, Vrana KE, Freeman WM (2008). «Twenty-five years of quantitative PCR for gene expression analysis». Biotechniques 44: 619–626.
- Salahuddin S.Z., Albashi D.V.,Markham P.D., et.al., (1986) Isolation of a new virus, HBLB, in patient with lymphoproliferative disorders. Science 234:596-601.
- Asano Y., Yoshikawa T., Kajita Y et al.(1992) Fatal encephalitis/encephalopathy in primary human herpesvirus-6 infection. Arch. Dis. Child. 67:1484-1485.
- Zhen Z, J Virol. 2005 Sep;79(18):11914-24.The human herpesvirus 6 G protein-coupled receptor homolog U51 positively regulates virus replication and enhances cell-cell fusion in vitro.
- Gautheret-Dejean, A J Virol Methods. 2002 Feb;100(1-2):27-35. Development of a real-time polymerase chain reaction assay for the diagnosis of human herpesvirus-6 infection and application to bone marrow transplant patients.
- Krueger GR, Ablashi DV, Josephs SF, Salahuddin SZ, Lembke U, Ramon A, Bertram G.Clinical indications and diagnostic techniques of human herpesvirus-6 (HHV-6) infection.n Vivo. 1991 May-Jun;5(3):287-95.
- Yamanishi K., Okuno T., Shiraki K., et al. (1988) Identification of human herpesvirus-6 as casual agent for exanthem subitum. Lancet 1:1065-1067.
- Preziozo P.J., Cangiarella J., Lee M., et al. (1992) Fatal disseminated infection with humanherpesvirus-6. J.Pediatrics 120:921-923.
Педиатр Михаил Никольский: Герпес – лечить или не лечить — СМИ о нас
Александра Петровская: Добрый день. Это программа для самых больших. С нами в студии врач-педиатр и кандидат медицинских наук Михаил Никольский. Михаил Андреевич, здравствуйте.
Михаил Никольский: Добрый день.
А.П.: Мы сегодня собрались здесь по поводу вашей научной работы, посвященной герпесу 6 и 7 типа. Давайте попытаемся объяснить слушателям, что это такое, а, самое главное, откуда эти типы взялись, и какие еще типы – первый, второй, третий и так далее – идут до 6 и 7.
М.Н.: В общей сложности выделяют 8 или 9 типов герпеса, смотря как считать. Первый и второй типы – это обычный герпес, который вызывает простуду на губах. Третий тип – это вирус герпес зостер, который вызывает ветрянку или опоясывающий лишай у взрослых людей.
А.П.: То есть то, что мы называем ветрянкой, это, на самом деле, тот же самый герпес?
М.Н.: Не тот же самый, это совершенно другой герпес, но тоже герпес.
А.П.: По какому принципу они все объединены под этим названием?
М.Н.: Это сложно. Когда ученые изучали ДНК этих вирусов, выяснилось, что у всех у них имеются похожие родственные черты. Четвертый тип, вирус Эпштейна-Барр, вызывает инфекционный мононуклеоз инфекционный. Пятый тип – это то, что все знают как цитомегаловирус. Это тоже часто инфекции, причем преимущественно детские.
И, наконец, 6 и 7 тип – это то, чем я занимаюсь. Чаще всего они вызывают у детей розеолу – трехдневную лихорадку или внезапную экзантему. Далее идет восьмой тип герпеса, он встречается при саркоме Капоши. Это тяжелое заболевание, которое преимущественно встречается у ВИЧ-инфицированных пациентов.
А.П.: Что, помимо общего названия и некого сходства ДНК, их еще объединяет? Может, есть общие методы терапии или сходные последствия воздействия вируса на организм?
М.Н.: Во-первых, в отличие от многих других вирусов, против герпесов есть лекарство. Это во многом отличает эти вирусы от других, потому что от огромного числа вирусов нет никаких лекарств.
А.П.: А как же все эти модные противовирусные, которые везде рекламируют?
М.Н.: Все, что рекламируют по телевизору — это, к сожалению, скорее фейки.
А.П.: Фейки запрещены.
М.Н.: Фейки запрещены, но, видимо, реклама лекарств без доказанной эффективности разрешена.
А.П.: Это тема для отдельной программы.
М.Н.: Это беда нашей страны, потому что у нас фейки влезли даже в клинические рекомендации. И мы лечим людей всеми этими «фуфломицинами». Более того, мы ими обязаны лечить, потому что у нас есть соответствующие клинические рекомендации.
А.П.: Это кто-то лоббирует?
М.Н.: Конечно, это лоббируется, это проплачено. А что взять, если, уж извините меня, у нас один из членов Российской академии наук — гомеопат.
А.П.: В этих словах чувствуется Ваше презрение к гомеопатии.
М.Н.: С точки зрения клинического врача в какой-то степени это да, презрение, это правда.
Вернемся к герпесам. У них есть уникальная особенность. После того, как человек заболел первичной герпесной инфекцией, эти вирусы не уходят из организма человека. Все герпесы, с которыми человек столкнулся в жизни, остаются в нем навсегда.
А.П.: Я встречалась с утверждением, что трудно встретить на Земле человека старше 10 лет, который не имел бы антител к тому или иному виду герпеса.
М.Н.: И не только антител, но даже и самих герпесов. Практически у всех людей после определенного возраста в слюне, в крови или в других тканях можно найти те или иные герпесы. С этим и связана проблема их диагностики — врачи очень часто путаются. Коллеги по незнанию, но из лучших побуждений назначают часто болеющим пациентам, предположим, анализы слюны на вирус Эпштейна-Барр, на цитомегаловирус, на герпес 6 типа, 7 типа, и находят их в слюне. А это является нормой.
А.П.: А они начинают лечить?
М.Н.: Да, совершенно верно. Пациент-то не знает, что это норма. Он видит, что у него «страшный» анализ, что нашли такое-то количество этих герпесов, и врач, скорее всего, сам по незнанию, по непониманию этой проблемы начинает лечить нормальное носительство герпесов. А чем он лечит? Теми же фуфломицинами и лечит. И ничего не происходит.
А.П.: Итог – герпес лечить не надо?
М.Н.: Надо, если он вызвал тяжелое заболевание – а все герпесы в определенных случаях могут вызывать тяжелые заболевания. Например, герпес 6-го типа – частая причина тяжелых состояний у пациентов после пересадки костного мозга. Если герпес после пересадки костного мозга обострился на фоне снижения, фактического уничтожения собственного иммунитета, то терапия обязательно требует мощных противовирусных средств.
Да вот взять ветрянку – казалось бы, безобидное заболевание. Но после 11 лет оно тяжело проходит и может иметь последствия. Поэтому считается, что если пациент младше 11 лет, то оно часто проходит само по себе. А если старше 11 лет, то лучше не рисковать, а назначить ацикловир.
А.П.: Это препарат с доказанной эффективностью?
М.Н.: Да, он действует именно на вирус ветрянки.
А.П.: Выходит, что герпес, который всегда находится в организме, в какой-то момент обостряется. Я, например, слышала про герпес 6-го типа, что это характерное заболевание для детей до 2-3 лет. Выходит, что нет.
М.Н.: Дело в том, что герпес 6-го типа – это та самая наиболее частая инфекция, которая вызывает всегда внезапную экзантему или трехдневную лихорадку или розеолу. В принципе, очень понятная инфекция: три дня у ребенка высокая температура, потом появляется типичная пятнисто-папулезная сыпь. В течение двух дней она исчезает сама по себе, и человек выздоравливает.
Само заражение может произойти хоть через обычный поцелуй, как это и происходит со многими герпесами. То есть в организм ребенка вирус может попасть через контакт со слюной матери, бабушки, любого взрослого человека, которые обычно и являются носителем всех герпесов. И вот ребенок переносит эту первичную инфекцию через вирус герпеса человека 6-го типа, и после этого герпес человека 6-го типа остается в этом ребенке навсегда. И никуда он не денется, и никак от него не избавиться.
Но лечить его надо только в одной ситуации – если он вызвал какое-то тяжелое заболевание, что у здоровых людей практически никогда не встречается. Только при тяжелых иммунодефицитах, которые обычно возникают при трансплантации органов и тканей. Вот там бывают ситуации, когда требуется интенсивное лечение герпеса 6-го типа.
Во всех остальных случаях ударно лечить его не надо. И надо иметь в виду, что герпесы – это очень модная сейчас тема. Вирус герпеса 6-го типа легко найти, а, значит, его можно предъявить практически при любой болезни в качестве возможного диагноза. И многие врачи этим пользуются. Например: «Я не знаю, что с вами. Давайте поищем у вас то, что точно есть». И тут герпес 6-го типа — он точно есть, и он находится.
А.П.: Еще такой момент. Какие другие заболевания могут быть связаны с вирусами герпеса, которые присутствуют в организме?
М.Н.: Как я уже сказал, герпесы 6-го и 7-го типа «классически» вызывают розеолу у детей. Еще герпес 6-го и иногда, но редко, 7-го типа ассоциированы с фебрильными судорогами у детей. Есть исследования, которые показывают связь определенных видов эпилепсии с вирусом герпеса человека 6-го типа. Так что получается, что герпес 6-го типа фактически вызывает одну из разновидностей эпилепсии.
А.П.: Присутствует этот вирус в организме почти каждого, а эпилепсия при этом далеко не у всех. То есть это говорит о том, что какой-то прямой связи нет, есть и другие факторы, влияющие на появление этого заболевания?
М.Н.: Конечно, тут много факторов. Например, два человека подхватили одну и ту же инфекцию: но у одного насморк, а у второго менингит. А инфекция одна и та же. Конечно, тут задействовано много факторов.
Также проводилось исследование, которое ассоциировало вирусы герпеса человека 6-го и 7-го типов с другими заболеваниями, предположив связь с рассеянным склерозом. Но это не доказано. Это уже область науки, то у нас нет четких указаний на то, герпесы — это именно то самое, что вызывает рассеянный склероз.
А.П.: В ходе программы мы с вами коротко поговорили обо всех герпесах, обозначили все важные моменты. И, завершая беседу, хочу вернуться к началу. Какие вопросы в этой области сегодня стоят перед наукой?
М.Н.: Кстати, забыл сказать, что особой формой герпеса человека 6-го типа является хромосомная интегрированная форма этого вируса, когда герпес 6-го типа внедряется в хромосому человека и начинает передаваться по наследству всем поколениям.
Сейчас мы в Петербурге получили грант. Мы проводим бесплатные обследования всех желающих по определенным показаниям на наличие хромосомно-интегрированного герпеса человека 6-го типа. Как раз-таки наличие хромосомно-интегрированного герпеса человека 6-го типа, возможно, дает связи с некоторыми болезнями. Оказывается, что чуть ли не 1% населения земного шара имеет встроенный в свой геном хромосомно-интегрированный вирус.
А.П.: Хорошо. Вспоминая мои студенческие годы, какая гипотеза стоит у вас в этом научном исследования? Если что – то что?
М.Н.: Мы пока набираем референсную группу, мы ищем людей, их обследуем. Меня лично сейчас больше всего интересует, есть ли клинические проявления хромосомной интеграции герпеса человека 6-го типа у новорожденных детей. На мой взгляд, это самая интересная концепция, еще никто в мире это направление не разрабатывал. Пока что есть предварительные результаты, но я их еще не готов озвучивать.
А.П.: У нас в гостях был Михаил Никольский, врач-педиатр и кандидат медицинских наук. Спасибо и хорошего всем дня!
ДНК ВГЧ-6 – прямой маркер инфицирования вирусом герпеса 6 типа. Вирус герпеса человека 6 типа (ВГЧ-6) – ДНК–содержащий вирус семейства Herpesviridae, рода Roseolavirus. Для ВГЧ-6, как и для других герпес-вирусов, характерна способность к сохранению в латентной (скрытой) форме в организме инфицированного человека. Источник инфекции – человек, страдающий манифестной или латентной формой инфекции, а также вирусоносители. Факторы передачи – слюна, мокрота, кровь. Наиболее вероятный путь заражения – воздушно-капельный, со слюной, также не исключена передача инфекции от матери к ребенку во время беременности. ВГЧ-6 может вызывать острые поражения кожи у детей раннего возраста (внезапную экзантему новорожденных), лихорадку новорожденных с судорожным синдромом, синдром хронической усталости, мононуклеозоподобный синдром. Может быть причиной лихорадки, пневмонии, гепатита, поражения ЦНС у иммунокомпрометированных лиц. Первый раз заражение практически всегда происходит в возрасте от 4 до 24 месяцев. В большинстве случаев ВГЧ-6 протекает бессимптомно, а если проявляется, то чаще всего как внезапная экзантема и быстро развивающаяся сильная лихорадка, продолжающаяся 3-4 дня. Через несколько часов после нормализации температуры появляются эритематозные пятна или пятнисто-папулезная сыпь. Сходство внезапной экзантемы с симптомами кори или краснухи зачастую приводит к постановке ошибочного диагноза. Основным методом дифференциальной диагностики инфекции является детектирование и определение концентрации ДНК ВГЧ-6 методом ПЦР. При исследовании предпочтительно количественное определение ДНК, которое позволит дифференцировать латентную и активную инфекцию, поскольку вирус может присутствовать в лейкоцитах здоровых лиц. Обнаружение ДНК вируса в плазме, но не в цельной крови, подтверждает наличие активной инфекции. Результаты определения ДНК ВГЧ-6 в количественном формате позволяют провести динамическое наблюдение: на основании увеличения концентрации в лейкоцитах, слюне установить активность инфекционного процесса, выявить реактивацию, оценить эффективность проводимой терапии. |
Герпес. Чем опасен этот вирус и как им не заразиться
По данным Всемирной организации здравоохранения (ВОЗ), герпесвирусная инфекция занимает второе место среди вирусных заболеваний человека (на первом месте – грипп).
Заболеванию подвержены как дети, так и взрослые, независимо от пола. Инфицированность населения герпетической инфекцией очень высокая. Вирусоносительство распространено повсеместно. Проведенные за последние 10 лет эпидемиологические исследования показали, что к 15-летнему возрасту инфицировано 80 процентов детей, а к 30 годам 90 процентов населения имеют антитела к вирусам герпеса того или иного типа.
Наиболее распространены герпесвирусы первого типа (вызывает герпес на губах) и второго (является причиной генитального герпеса). Источником инфекции являются вирусоносители и больные с различными формами болезни.
Как утверждают специалисты Центра медицинской профилактики министерства здравоохранения Краснодарского края, с вирусом герпеса можно и нужно бороться, но проблема в том, что практически 80 процентов вирусоносителей даже не подозревают об этом. Мало того, даже те, кто уже знает о наличии герпеса, относятся к нему несерьезно.
Герпес – вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках. Это наиболее распространенное вирусное заболевание, возбудителем которого является вирус простого герпеса (ВПГ).
А ведь герпес может нанести необратимый вред здоровью, иногда даже разрушить судьбу. Ведь беременная женщина через плаценту может передать вирус своему еще не рожденному ребенку на стадии развития важных органов и систем, а это чревато врожденными аномалиями развития плода.
– Важным принципом профилактики этого заболевания является прекращение близких контактов с больным человеком в период обострения, – рассказала главный врач краевого Центра медпрофилактики Ирина Трубицына. – Профилактика герпеса первого типа сводится к соблюдению общих правил предупреждения респираторных заболеваний, а второго – к профилактике инфекций, передающихся половым путем.
Герпес – вирусное заболевание с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках. Это наиболее распространенное вирусное заболевание, возбудителем которого является вирус простого герпеса (ВПГ). Семейство вирусов «Нerpesviridae» может вызывать опасные для жизни болезни, инфекции, рецидивирующие заболевания, трансплацентарные инфекции, которые могут быть причиной врожденных уродств у детей.
С наступлением холодов людей с характерной сыпью на губах появляется все больше. Казалось бы, это нередкое и нисколько не загадочное заболевание, однако среднестатистический пациент ничего не знает о герпесе – разве что «это такая лихорадка на губах». О герпесе писал еще Геродот за сто лет до нашей эры: именно «отец истории» дал герпесу современное название (от греческого «herpein» – ползать) – из-за способности герпетических язв «расползаться» в разные стороны от первичного пузырька на коже. За много веков «общения» с герпесом это заболевание обросло мифами.
- Миф 1. Герпес не заразен
С точностью да наоборот. Герпес передается воздушно-капельным (при кашле, чихании, разговоре), контактным (при поцелуях, пользовании общей посудой, помадой) и половым путями. Возможно также заражение ребенка от матери при прохождении через родовые пути. Обычно это случается, если мать заразилась генитальным герпесом на третьем триместре беременности. При этом в ее организме не успевают произвестись антитела, которые она передает ребенку. А если есть повреждение плаценты, ребенок может заразиться в утробном периоде развития – такой герпес называется врожденным.
- Миф 2. Герпес – проявление «простуды»
В действительности герпес – это самостоятельное заболевание, которое предопределяет вирус простого герпеса. Обычно он активизируется при переохлаждении, стрессе, переутомлении, обострении хронических заболеваний или снижении общего иммунитета.
- Миф 3. Если появилась сыпь на губах, простуда пошла на убыль.
Эта распространенная точка зрения, однако, не имеет ничего общего с действительностью. В реальности появление сыпи означает, что перенесенная респираторная инфекция ослабила иммунитет, и это дало вирусу герпеса возможность активно действовать.
- Миф 4. Если сыпь прошла – герпес вылечен
Это было бы очень здорово, но, к сожалению, удалить вирус из организма невозможно. Он остается с человеком на всю жизнь, и можно лишь заставить его находиться в «спящем» состоянии. Поэтому вирус герпеса есть у 95 процентов людей, причем большинство приобретает его в возрасте 3–4 лет.
- Миф 5. Заразиться герпесом можно только при наличии сыпи
Действительно, в активной фазе болезни выделяется большее количество вирусных частиц и вероятность заражения более высокая. Но передача инфекции может произойти в любой момент через невидимые микротравмы кожи и слизистых оболочек.
- Миф 6. Лучшее лечение – прижигание спиртом, йодом или зеленкой
Прижигание не влияет на вирус герпеса и его активность, а вот обжечь поврежденную кожу и слизистую оболочку таким способом очень легко. Лучше аккуратно смазать сыпи антисептиком, который не содержит спирта, чтобы не присоединилась гнойная инфекция. Проявления герпеса лечат специальными противовирусными препаратами, например, ацикловиром, который препятствует размножению вируса. При частых обострениях используют лекарства, которые стимулируют иммунитет, и общеукрепляющие средства.
- Миф 7. Герпес – безопасное заболевание и поражает только кожу
Вообще-то, герпес занимает второе место по смертности от вирусных инфекций, уступая только ОРВИ. Вирус простого герпеса встраивается в геном нервных клеток, поэтому сыпь возникает в местах нервных окончаний и сопровождается сильной болью. Теоретически герпес может оказаться везде, где есть нервная ткань, а значит – практически в любом органе.
При снижении общего и местного иммунитета герпетическое воспаление может развиться в слизистой оболочке рта и гортани, роговице и конъюнктиве глаза, лимфатических узлах, внутренних половых органах, кишечнике, печени, почках, легких и центральной нервной системе. При поражении головного мозга большинство больных умирают или остаются инвалидами. Кроме того, при врожденном герпесе вероятны множественные изъяны развития и даже смерть младенца, а генитальный герпес значительно повышает риск относительно развития рака шейки матки у женщин и рака предстательной железы у мужчин.
Как не заразиться герпесом
-
Строго соблюдайте правила личной гигиены. Лабиальный герпес – инфекционное заболевание! Тщательно мойте руки с мылом до и после контакта с герпесом, после нанесения антивирусного крема.
-
Не касайтесь руками глаз! Это особенно касается женщин, поскольку они делают макияж.
-
Не используйте слюну для увлажнения контактных линз.
-
Не касайтесь участков, пораженных герпесом! Невзирая на сильные зуд и боль, ни в коем случае не касайтесь герпетической сыпи, не целуйтесь, особенно с детьми, не пользуйтесь чужой помадой и никому не одалживайте собственную, не делите одну сигарету с приятелем.
-
Не пытайтесь избавиться от волдырей или снять струпья во избежание попадания инфекции на другие участки тела.
-
Пользуйтесь отдельным полотенцем и посудой, не пейте из чужих стаканов.
Лабораторная диагностика герпеса в СЗЦДМ
Герпес ― это вирус семейства герпесвирусов. Их существует свыше 100 видов, но только 8 из них поражают человека. Преимущественно заражение происходит в раннем детстве. По данным ВОЗ, около 13% населения инфицировано вирусом HSV-2 и около 67% HSV-1, из них 90% не подозревают о наличии инфекции. У подавляющего большинства вирус находится в латентном состоянии. Активизируется в периоды стрессов, при ослаблении иммунитета.
ВидыГерпесвирусы семейства Herpesviridae, инфицирующие человека:
-
Альфа-герпесвирусы ― это наиболее распространенные типы HSV-1 (ротовой герпес), HSV-2 (генитальный герпес) и ветряная оспа. Отличительной особенностью группы является быстрое разрушение инфицированных клеток.
-
Бета-герпесвирусы ― это наиболее патогенные инфекционные агенты герпеса 6 типа, 7 типа и цитомегаловируса. Они вызывают менее выраженные дегенеративные изменения в клетках,
-
Гамма-герпесвирусы ― это герпес 8 типа и вирус Эпштейна-Барр. Они способны инфицировать системы мононуклеарных макрофагов (иммунных клеток), вызывая процессы клеточной гибели.
Вирус невозможно удалить из клеток хозяина, он пожизненно сохраняются в организме. Лечение направлено на уменьшение проявлений симптоматики, сопутствующих заболеваний, облегчение жизни пациента. Вакцина разрабатывается.
Цитомегаловирус (Cytomegalovirus)Этот вид вируса вызывает цитомегаловирусную инфекцию (ЦМВИ, цитомегалия). Имеет крупный ДНК-геном и относительно низкую патогенность. Развивается без повреждения клетки. Образующиеся новые вирусные частицы уже внутри организма инфицируют макрофаги, эпителии, миелоидные клетки. В них вирус переходит в латентную фазу. Считается, что из-за цитомегалии у человека с возрастом начинают развиваться патологические воспалительные процессы.
Источник заражения ― инфицированный человек. Цитомегаловирус передается воздушно-капельным путем и через все существующие жидкости: половые выделения, кровь, слюна, материнское молоко.
Вирус, медленно распространяясь по организму, провоцирует изменение инфицированных клеток с увеличением размера. У здоровых людей цитомегалия протекает легко или бессимптомно. Особую опасность представляет для лиц с патологией иммунной системы, у маленьких детей и у беременных женщин из-за риска заражения плода. У пациентов с иммунодефицитами ЦМВ-инфекция является одной из причин болезней и смертей.
Приобретенная цитомегалия имеет симптомы схожие с сезонными простудами. Врожденная (внутриутробная), может стать причиной выкидыша, привести к патологии плода. У детей до 3 месяцев и у взрослых с патологией иммунной системы или онкологией цитомегаловирусная инфекция может проходить в тяжелой форме. Среди осложнений поражение легких, вирусный энцефалит, изменение печени, почек, органов ЖКТ.
Вирус Эпштейна – Барр (EBV)Относится к 4 группе герпесвируса (Herpesviridae). Выглядит как двуспиральная молекула ДНК. Не встраивается в клеточный геном инфицированной клетки, а пребывает в ядре. Существует два типа вируса Эпштейна ― Барра: EBV-1 и EBV-2. Они одинаково распространены, имеют схожую симптоматику. Отличаются способностями к трансформированию и характеристиками латентного течения. Вирус реплицируется в лимфоцитах, эпителии, разрушение не вызывает.
Источник заражения ― инфицированный человек с манифестной и скрытой формой. Инфекция распространяется воздушно-капельным способом.
Заболевание при сильном иммунитете почти всегда протекает без симптомов. У иммунокомпрометированных больных проявляется инфекционным мононуклеозом. При манифестной (активной) форме EBV-инфекции возрастает уровень ЦИК, а активность лейкоцитов, наоборот, снижается. Это может привести к неблагоприятным иммунопатологическим реакциям.
При иммунодефиците вирус Эпштейна – Барр может спровоцировать развитие лимфопролиферативных расстройства, запустить онкологию. У людей с аутоиммунными заболеваниями влияет на общее самочувствие, вызывая синдром хронической усталости.
Инфекционный мононуклеозОстрая болезнь, вызываемая вирусом Эпштейна – Барр. Развивается на фоне ослабленного иммунитета, в основном у детей и взрослых в возрасте до 40 лет. Может протекать в легкой, среднетяжелой и тяжелой форме.
Среди часто встречающихся клиники лихорадка, поражение ротовой полости, лимфоаденопатия. Реже значительное увеличение селезенки, приводящее к разрывам. Атипичная форма мононуклеоза также может вызвать острую полиорганную недостаточность, миокардит, менингит.
Висцеральная форма течения болезни характеризуется серьезными полиорганными поражениями. В патологические процессы вовлекаются центральная и периферическая нервные системы, органы сердечно-сосудистой системы, почки, надпочечники и другие жизненно важные органы.
Вирус герпеса 6 типа (ВГЧ-6)В основном вирус реплицируется в Т-лимфоцитах, но иногда его выявляют в В-лимфоцитах, системе мононуклеарных макрофагов, гепатоцитах и иных клетках. Источник ― инфицированный человек. Герпесвирус передается воздушно-капельным способом и прямым путем ребенку от матери.
Список заболеваний, вызываемых ВГЧ-6 достаточно широк. Чаще патологии возникают у людей с подавленной иммунной системой. В остальных случаях симптоматики нет.
У новорожденных на фоне инфекции возникают экзантемы, первая в жизни лихорадка. У взрослых и детей постарше заболевание протекает как мононуклеоз. У носителей ВГЧ-6 возрастает риск развития злокачественной лимфомы, гистиоцитарного лимфаденита, Т-клеточную лейкемии и В-клеточной лимфомы. У иммунно иммунокомпрометированных лиц инфицирование проходит более тяжело. В некоторых случаях приводит к пневмонии, гепатиту, энцефалиту.
Вирус герпеса 7 типаВГЧ-7, как правило, обнаруживают вместе с ВГЧ-6. Они незначительно отличаются друг от друга ― массой тела и количеством пар оснований. Вирус герпеса 7 типа в основном локализуется в CD4+ Т-клетках. Он подавляет CD4, а также оказывает влияние на синцитий, вызывает незапрограммированную гибель клеток, изменяет уровень цитокинов.
Особенности воздействия ВГЧ 7 типа отдельно от ВГЧ-6 пока недостаточно изучены. Однако, известно, что этот тип воздействует на CD4, как и ВИЧ-инфекция, а значит, оказывает негативное воздействие на течение зимеющихся заболеваний. Способена поддерживать существование латентных инфекций.
Вирус герпеса 8 типаВирус HHV-8 ― герпесвирус саркомы Капоши (KSHV) стимулирует синтез лимфоидных, дендритных, эпителиальных клеток и секрецию эпителии простаты. Наличие ВГЧ-8 в организме увеличивает риск развития опухолевых заболеваний.
Основные способы инфицирования: половой, гематогенный (переливания крови), горизонтальный (со слюной), трансплацентарный (плод заражается во время беременности). Наибольшее число копий вируса находится в слюне.
Вирус герпеса 8 типа может стимулировать возникновение новообразований:
-
саркома Капоши;
-
лимфома;
-
множественная миелома;
-
болезнь Кастельмана.
Патологии возникают на фоне старения, иммунодефицита и при ВИЧ-инфекции. Почти у половины ВИЧ-инфицированных ВПЧ-8 в течение 10 лет после заражения развивается саркома Капоши. У всех ВИЧ-инфицированных с саркомой Капоши определяется вирус герпеса 8 типа.
Выживаемость 72% при раннем диагностировании и проведение терапевтических процедур. Однако, HHV-8 сложнее остальных типов поддается лечению. В настоящий момент достаточно эффективных медикаментов не разработано.
Как правило, симптоматика проявляется только у маленьких детей или у взрослых с патологией иммунной системы, ВИЧ-инфицированных, принимающих медикаменты подавляющие иммунитет. Может возникнуть после перенесенных серьезных заболеваний, трансплантации и иных хирургических вмешательства. Симптоматика достаточно обширна, но чаще выражается в лихорадке и сыпи на коже и слизистых.
Цитомегаловирусная инфекция
-
При приобретенной форме наблюдается:
-
Повышение температуры.
-
Общее недомогание, слабость.
-
Головные боли.
-
Увеличение лимфоузлов шеи, боль в горле.
Редко возникают осложнения в виде пневмонии, артритов, отмечаются симптомы гепатита.
Врожденная выражается в следующих симптомах:
-
Гепатоспленомегалия ― увеличение селезёнки и печени.
-
Микроцефалия ― значительное уменьшение размера черепа и, соответственно, головного мозга.
-
Желтуха кожных покровов и склер.
-
Петехии ― геморрагическая сыпь, возникающая из-за повреждения внутрикожных капилляров.
-
Неврологические аномалии.
Заражение цитомегаловирусом во время беременности может привести к гибели эмбриона и к патологическим поражения плода. Сред них геморрагический синдром, поражения нервной системы. Чаще наблюдается нейросенсорная тугоухость и расстройство равновесия, реже ― интеллектуальные расстройства, эпилепсия, ДЦП, нарушение зрения, микроцефалия.
Вирус Эпштейна – Барр
Для первичного инфицирования характерны:
-
Катаральная ангина.
-
Заложенность носа.
-
Увеличение лимфоузлов.
-
Умеренное увеличение лимфоцитов.
Манифестная форма ― инфекционный мононуклеоз сопровождается:
-
лихорадкой;
-
общим недомоганием;
-
головной болью;
-
ангиной;
-
увеличением шейных лимфоузлов, болезненностью;
-
спленомегалей;
-
гепатомегалией;
-
желтухой.
Инфекционный мононуклеоз:
-
Высокая температура.
-
Головная боль.
-
Воспаление зева и миндалин.
-
Увеличение и болезненность лимфоузлов.
-
Увеличение печени и селезенки.
При тяжелой форме заболевания могут возникнуть осложнения в виде отита, синусита, гепатита, паратонзиллярного абсцесса, пневмонии.
Вирус герпеса ВГЧ-6
Обладает широкой симптоматикой, наиболее часто отмечают следующие признаки:
-
температура до +40 °С;
-
симптомы интоксикации;
-
эритематозная или папулезная сыпь;
-
неяркая гиперемия зева.
Если у человека сильная иммунная система, без патологий, то ГЧ-6 протекает бессимптомно.
Вирус герпеса ВГЧ-7
Симптомы не выявлены. У лиц с иммунодефицитом может вызвать псевдокраснуху, лихорадку, розовый лишай, судороги, синдром хронической усталости.
Вирус герпеса ВГЧ-8 (HHV-8, саркома Капоши)
Клинические проявления наблюдаются только при иммунодепрессии. Они выражены в появлении сосудистых уплотнений, образуются на коже и во рту. Это множественные геморрагические новообразования злокачественного характера. Со временем вирус может дать осложнение на легкие, желчный пузырь, желчевыводящие пути и иные внутренние органы.
Диагностирование инфекций, вызванных герпесвирусами основывается на лабораторных анализах. Используют методы полимеразной цепной реакции, выполняемые в режиме реального времени.
ПЦР ― это самый точный способ обнаружения всех видов герпеса. Он также один из самых быстрых в производстве, позволяет выявить возбудителя на ранней стадии заболевания. Для получения результат достаточно небольшого количества искомого материала.
Особенностью ПРЦ-метода заключена в копировании специфичного для возбудителя участка ДНК. Он воспроизводится такое количества раз, которое увеличивает образец до приемлемого для диагностики размера.
В качестве образца подойдет любой биологический материал:
-
венозная кровь;
-
семенная жидкость;
-
выделения из влагалища;
-
слюна;
-
ликвор;
-
биоптат и иное.
Среди других методов диагностики герпеса молекулярно-биологические исследования биоптатов кожи для диагностики Саркомы Капоши. Исследуют волосяные фолликулы для подтверждения или исключения ВГЧ-6. Метод цифровой капельной ПЦР помогает выявить хромосомно-интегрированные и наследуемые формы вируса 6 типа. При тканево-инвазивной ЦМВ отдают предпочтение гистологическим и иммуногистохимическим исследованиям.
Когда назначают анализ на герпесвирусы
-
При наличии симптоматики, указывающей на заболевания, вызываемые вирусами герпеса.
-
Для дифференцирования герпесвирусных и других инфекций.
-
При планировании беременности и при наличии патологии беременности.
-
При комплексном обследовании ВИЧ-пациентов и людей с иммунодефицитом.
-
Перед проведением иммуносупрессивной терапии.
-
Для контроля за эффективностью терапевтических мероприятий.
Необходимо пройти анализ на герпес пациентам с гемобластозами, лимфопролиферативными болезнями. Показано исследование перед трансплантацией и после ее проведения.
Поскольку вирус герпеса встраивается в геном клетки человека, удалить его невозможно. Терапевтические мероприятия направлены на заболевания, вызываемые герпесвирусами. Для лечения назначают этиотропных препараты и средства для снятия симптоматики. Выбор медикаментов, дозировка и метод лечения выбирают индивидуально, исходят из состояния больного, наличия осложнений и сопутствующих заболеваний.
Вирусы герпеса активизируются на фоне подавленного иммунитета, большинство пациентов ВИЧ-инфицированные. При этом лечение показано при иммунологически благоприятном состоянии, в этом случае риск осложнений меньше, шансы на излечение выше. Тем не менее, больные с плохим прогнозом тоже проходят индивидуальное, не всегда систематическое лечение.
Анализы
перейти к анализам
Вирус герпеса типа 6 — StatPearls
Продолжение образовательной деятельности
Хотя наиболее частым проявлением вируса герпеса человека 6 (HHV-6) является субитумная сыпь экзантемы, также называемая младенческой розеолой, известно, что вирус HHV-6 вызывает более опасные проявления. инфекция у лиц с ослабленным иммунитетом. Члены межпрофессиональной группы должны понимать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом появляются изменения в поведении с сыпью или без нее.Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6 и подчеркивается роль межпрофессиональной группы в уходе за больными пациентами.
Целей:
Опишите патофизиологию вируса герпеса человека 6.
Обрисуйте типичное представление пациента с вирусом герпеса человека 6.
Краткое изложение рекомендаций по лечению пациентов, инфицированных вирусом герпеса 6 человека.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) был первоначально обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был обозначен как В-лимфотропный вирус человека.Дальнейшие исследования идентифицировали HHV-6 в лимфоцитах CD4 + и как члена герпесвирусов. Поскольку это был шестой изолированный вирус герпеса, впоследствии он был переименован в вирус герпеса человека 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B. HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами в семействе герпесвирусов.Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяев с ослабленным иммунитетом. Напротив, исследования идентифицировали HHV-6B как этиологический агент подпункта экзантемы детской болезни (roseola infantum) [1]. Приобретение HHV-6B довольно распространено среди молодежи и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B — это повсеместный вирус, более 90% населения которого инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 все имеют некоторый уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-вирусом герпеса человека.[1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются рецепторами, используемыми для входа в клетки. В отличие от кластерной дифференцировки 46 человека (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B. [2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, связанный с саркомой Капоши (KSHV) и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус онкоген и разрушает аутоиммунные клетки.После связывания с соответствующим рецептором HHV-6 устанавливает латентный период в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
К зрелому возрасту более 95% населения являются серопозитивными по HHV-6A, HHV-6B или обоим вариантам. Существующие серологические методы неэффективны для изоляции одного варианта от другого. [4] В настоящее время хорошо известно, что HHV-6 является основной причиной младенческой розеолы в детстве. HHV-6B в первую очередь инфицирует младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим HHV-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией HHV-6 имели вирусную ДНК в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги [5]. Напротив, другие исследователи определили распространенность ДНК HHV-6 только от 0% до 4% в спинномозговой жидкости детей с фебрильными припадками и пациентов со СПИДом с неврологическими симптомами.[5] Эти вирусы связаны с заболеваниями пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования определили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
Эпидемиология
Исследователи определили HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы HHV-6 в какой-то момент своей жизни, первичное инфицирование HHV-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у подгруппы детей будут проявляться классические проявления младенческой розеолы [1]. В нескольких отчетах о расследованиях зафиксировано снижение серопозитивности с возрастом [4]. Хотя первичная инфекция HHV-6 редко встречается у взрослых, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет сексуальной склонности и может встречаться у людей всех рас.
HHV-6 — это повсеместный вирус, обнаруженный во всем мире. В большом проспективном исследовании североамериканских детей пиковый возраст инфицирования HHV-6 был между 6 и 9 месяцами. [1] Как и в США, в Великобритании и Японии от 97 до 100% первичных инфекций возникают в результате HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичное инфицирование этим конкретным вариантом часто протекает бессимптомно.[7] Однако несколько групп зарегистрировали HHV-6A у детей из Африки и США с симптомами. Более того, HHV-6A был идентифицирован как преобладающая форма вируса, выделяемого у ВИЧ-положительных младенцев в эндемичном регионе Африки к югу от Сахары [7]. Среди разных групп населения распространенность серотипа сильно различается. Существует документально подтвержденный показатель серологической распространенности 20% у беременных марокканских женщин и 100% у бессимптомных взрослых китайцев. Распространенность серотипа колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых фебрильных заболеваний у детей раннего возраста. Это также важная причина посещений отделения неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Вирионная частица имеет характерную структуру вируса герпеса, с центральным ядром, содержащим вирусную ДНК, капсид и богатый белком слой тегумента, окруженный мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая CD4 + Т-клетка. [1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после присоединения к клеточному рецептору CD46. Посредством рецептор-опосредованного эндоцитоза HHV-6 проникает в клетки с последующей вирусной репликацией (Ablashi). После первичного инфицирования ДНК вируса живет в мононуклеарных клетках периферической крови (PBMC).[1]
Хотя точный механизм передачи HHV-6 все еще исследуется, несколько исследований выявили передачу вируса через слюну. Похоже, что передача через слюну от матери к ребенку является наиболее распространенным путем. В нескольких ранних отчетах описывался инфекционный HHV-6, присутствующий в слюне почти каждого испытуемого. [4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК HHV-6, в то время как в другом исследовании на основе ПЦР только 3% человек были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также появился в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что ЦНС и слюнные железы являются резервуаром латентного вируса и стойкой инфекции. . [1] [4]
История и физика
Хотя различные клинические признаки и заболевания, связанные с HHV-6, все еще исследуются, уже хорошо проведенные исследования подтверждают, что HHV-6 играет значительную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантата.[8] Инфекция HHV-6 обычно протекает доброкачественно и проходит самостоятельно. Симптомы — это, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
HHV-6B является возбудителем экзантемы subitum (также известной как младенческая розеола), детской болезни, характеризующейся высокой температурой и легкой кожной сыпью, и составляет от 10 до 17% обращений в отделения неотложной помощи у детей с острой лихорадкой. до 36-месячного возраста. [9] Первичная инфекция HHV-6 составляет более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев и почти исключительно вызвана HHV-6B, а не HHV-6A.[9] [8] [10]
Диагноз детской розеолы является клиническим. Его часто вызывает внезапное начало высокой температуры, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей будет периорбитальный отек, конъюнктивит или воспаление барабанных перепонок, в то время как многие другие будут активными и здоровыми [9]. Другие симптомы у детей включают лимфаденопатию, симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита. [9] У реципиентов трансплантата симптомы часто включают лихорадку, болезнь «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь. [12]
Результаты физикального осмотра обычно соответствуют ранее описанным симптомам. У детей с пониженной температурой лихорадки часто возникает бледная пятнисто-папулезная сыпь розово-розового цвета размером примерно от 2 до 5 мм с окружающим ореолом.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи [13]. Воспаление барабанных перепонок и признаки инфекций верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании могут отмечаться лихорадка, гепатоспленомегалия и лимфаденопатия [12].
Оценка
Вирус герпеса человека 6 (HHV-6) может быть диагностирован с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако лабораторное тестирование у иммунокомпетентных людей вряд ли возможно из-за самоограничивающего характера заболевания. Слюна является основным резервуаром передачи вируса, поскольку она часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, документально подтверждено наличие HHV-6 после трансплантации органов [12]. Большинство исследователей твердо убеждены в том, что инфицирование HHV-6B происходит в раннем возрасте, а инфицирование HHV-6A развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически инфицируют множество людей.
Лабораторные исследования HHV-6 могут показать лейкоцитоз, лейкопению и анемию. [13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует проводить исследования почек и печени соответственно, чтобы исключить электролитные нарушения и гепатит.
Показания для радиологического воображения зависят от клинических проявлений, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть проведена, чтобы исключить другие этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть проведена для поиска других излечимых заболеваний. В случаях поражения центральной нервной системы может быть проведена люмбальная пункция. Инфекция ЦНС HHV-6 часто имеет легкий плеоцитоз с повышенным содержанием белка. ЦСЖ можно отправить на ПЦР-исследования HHV-6 для подтверждения диагноза.[14]
Лечение / ведение
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения HHV-6, и нет вакцины. [8] Как правило, не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии ганцикловиром и фоскарнетом внутривенно, продолжительность лечения составляет от 3 до 4 недель [15]. У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет документально подтвержденные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции HHV-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с младенческой розеолой обычно является поддерживающим. [12] Жаропонижающие средства, такие как парацетамол или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если происходит фебрильный припадок, в противоэпилептических средствах нет необходимости. Лица, у которых присутствует инфекция HHV-6, проявляющаяся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз включает:
Инфекционный мононуклеоз
Цитомегаловирусная инфекция
Вирусный гепатит
Вирус простого герпеса
Вирусная пневмония
Медикаментозная сыпь с эозинофилией и системными симптомами (синдром DRESS)
менинговая инфекция
У детей с классической детской розеолой этиологический патоген является HHV-6.Однако некоторые другие заболевания могут вызывать жар и сыпь. Более серьезные и менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, следует исключить ВЭБ и ЦМВ. Пациенты с ослабленным иммунитетом, особенно те, кто получает трансплантацию органов, и больные СПИДом, как правило, имеют симптомы. Эта группа людей с заболеванием HHV-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и синдром DRESS. [16] Кроме того, имеется документация по HHV-6 в случаях рассеянного склероза энцефалита и интерстициального пневмонита. [17] Стоит отметить, что только HHV-6A ассоциируется с тиреоидитом Хашимото. [12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и те, кто обладает иммунитетом, выживают без последствий.В сообщениях описывается более тяжелое заболевание у лиц с ослабленным иммунитетом. Имеются документы о пневмоните, гепатите и отторжении органов у пациентов, перенесших трансплантацию, со смертельным исходом у пациентов с энцефалитом и менингоэнцефалитом [18]. Аналогичным образом, в Японии в 2003–2004 годах обследование пациентов с энцефалитом, ассоциированным с экзантемой, имело необычно плохой прогноз [19] с зарегистрированными летальными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое нарушение митохондрий.[20]
Осложнения
Обычно первичная инфекция HHV-6 протекает доброкачественно со спонтанным разрешением в течение 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что подчеркивается в случаях, когда центральная нервная система оказывается под угрозой, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус захватывает мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появляются записи о случаях острого или подострого энцефалита, иногда связанного с диффузной или мультифокальной демиелинизацией. [4] HHV-6 нечасто вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT). [4]
Сдерживание и обучение пациентов
У здорового ребенка с младенческой розеолой образование родителей имеет решающее значение для уменьшения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии с жаропонижающими средствами и бесполезность антибиотиков требует объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются пунктами консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Жемчуг и другие проблемы
Принято считать, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22] 1. Отличие случаев первичной инфекции HHV-6 с типичной детской сыпью при розеолах от других болезней является ключом к устранению более серьезных диагнозов. Наиболее частым осложнением инфекции HHV-6 является младенческая розеола, а на HHV-6 приходится примерно от 10 до 20% фебрильных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Лихорадочные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является принятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и скрыт в мононуклеарных клетках периферической крови. Диагностика HHV-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Однако ПЦР, серологические исследования или вирусный посев часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к задокументированным осложнениям со стороны центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, получившие аллогенные трансплантаты, а также люди с иммуносупрессивными расстройствами, подвержены риску реактивации HHV-6. В таких случаях у людей может появиться лихорадка, сыпь и уменьшение количества циркулирующих гранулоцитов и эритроидных клеток. [12] Хотя не существует одобренных методов лечения только инфекции HHV-6, противовирусное лечение ганцикловиром и / или фоскарнетом оказалось успешным в лечении ранее описанных неврологических осложнений.
Улучшение результатов команды здравоохранения
HHV-6 обычно проявляется сыпью у детей, обращающихся в отделение неотложной помощи и у педиатров. Хотя определение высыпаний может быть сложной задачей, выделение конкретных сопутствующих симптомов обязательно, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекает бессимптомно, преходяще и не требует противовирусного лечения. [Уровень II] Педиатрическая консультация — это рекомендация для младенцев с младенческой розеолой, у которых наблюдаются фебрильные судороги.Известны осложнения HHV-6, и тем людям с более угрожающими признаками и симптомами, включая изменения психического статуса и органную недостаточность, будет полезен межпрофессиональный подход. В таких случаях необходима информация от врачей-неврологов и инфекционистов. При подозрении на сердечную недостаточность, ассоциированную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
Скоординированный уход квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями жизненно важных функций.Точно так же не следует сбрасывать со счетов помощь лаборатории в ускорении предпочтительных методов обнаружения вирусов в крови или спинномозговой жидкости с помощью ПЦР или вирусных антигенов в тканях с помощью иммуногистохимии. (Уровень II) Наконец, фармацевт является неотъемлемой частью обеспечения антивирусной терапии ганцикловиром и фоскарнетом при энцефалите, ассоциированном с HHV-6. [24] [Уровень III] Совместно рекомендуется ориентированный на пациента межпрофессиональный командный подход среди клиницистов, включая врачей, лабораторию, специально обученных медсестер и аптек, которые открыто общаются как медицинская бригада, для улучшения результатов в сложных случаях и обеспечения наилучшего исходы для пациентов.[Уровень 5]
Рисунок
Это гистологический слайд вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, который был обнаружен в октябре 1986 года. Это микрофотография инфицированного человека. клетки с телами включения как в ядре, так и в цитоплазме. (подробнее …)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Human herpesvirus 6. Clin Infect Dis. 2001 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая SN, Medveczky PG. Задержка, интеграция и реактивация вируса герпеса человека-6. Вирусы. 2017 г. 24 июля; 9 (7) [Бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Дж., Кроуфорд-младший, Фан Т.Л., Аблаши Д., Hudnall SD. Человеческий герпесвирус 6 и злокачественные новообразования: обзор. Фасад Онкол. 2018; 8: 512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Браун Д.К., Домингес Дж., Пеллетт ЧП. Вирус герпеса человека 6.Clin Microbiol Rev.1997 июл; 10 (3): 521-67. [Бесплатная статья PMC: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Герпесвирусы человека 6 и 7 и инфекция центральной нервной системы у детей. Emerg Infect Dis. 2004 августа; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях герпесвирусами человека 6A, 6B и 7. Med Mal Infect. 2017 Март; 47 (2): 83-91. [PubMed: 27773488]
- 7.
- Ablashi D, Agut H, Alvarez-Lafuente R, Clark DA, Dewhurst S, DiLuca D, Flamand L, Frenkel N, Gallo R, Gompels UA, Höllsberg P, Jacobson S, Luppi M, Lusso P, Malzatiky M, Medvecky P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Arch Virol. 2014 Май; 159 (5): 863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- Де Болле Л., Нейсенс Л., Де Клерк Э. Обновленная информация о биологии вируса герпеса 6 человека, клинических особенностях и терапии.Clin Microbiol Rev.2005, январь; 18 (1): 217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичного инфицирования розеоловирусами. Curr Opin Virol. 2014 декабрь; 9: 91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Инфекция герпеса человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 18 августа 1994; 331 (7): 432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в ассоциации с розеолой. Педиатр Emerg Care. 2020 Октябрь; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций вируса герпеса человека 6. Clin Microbiol Rev.2015, апрель; 28 (2): 313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Люпанц Т., Уршич Т., Петровец М. Инфекция, вызванная вирусом герпеса человека 6, проявляется как острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Case Rep Pediatr. 2016; 2016: 2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Явариан Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости у детей с возможным энцефалитом. Jundishapur J Microbiol. 2014 сентябрь; 7 (9): e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард Миннесота, Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 декабрь; 9: 148-53. [Бесплатная статья PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Шиохара Т., Иидзима М., Икэдзава З., Хашимото К. Диагноз синдрома DRESS был достаточно установлен на основании типичных клинических признаков и вирусной реактивации . Br J Dermatol. 2007 Май; 156 (5): 1083-4. [PubMed: 17381452]
- 17.
- Marks GL, Nolan PE, Erlich KS, Ellis MN.Распространение через слизистую оболочку устойчивого к ацикловиру вируса простого герпеса у пациента со СПИДом. Rev Infect Dis. 1989 май-июнь; 11 (3): 474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I., Cizman M. Смертельный мультифокальный менингоэнцефалит, связанный с вирусом герпеса человека 6, у взрослой пациентки. Scand J Infect Dis. 2001; 33 (12): 942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаши М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Энцефалит, ассоциированный с Exanthem subitum: общенациональное исследование в Японии. Pediatr Neurol. 2009 ноя; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Аль-Зубейди Д., Тангарадж М., Патак С., Кай С., Шлаггар Б.Л., Сторч Г.А., Грейндж Д.К., Уотсон М.Э. Смертельный энцефалит, связанный с вирусом герпеса 6 человека, у двух мальчиков с основными митохондриальными нарушениями POLG. Pediatr Neurol. 2014 сентябрь; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после тощей кишки.Surg Gynecol Obstet. 1976 Февраль; 142 (2): 177-83. [PubMed: 813311]
- 22.
- de Andrade RP. Многоцентровая клиническая оценка новой монофазной комбинации: Minulet (гестоден и этинилэстрадиол). Int J Fertil. 1989 Сентябрь; 34 Дополнение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого человека. кардиомагнитный резонанс в мультидисциплинарном подходе.Тираж. 2013 декабря 03; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Ле Дж, Гант С., Сообщество специалистов по инфекционным заболеваниям AST. Человеческий герпесвирус 6, 7 и 8 при трансплантации твердых органов. Am J Transplant. 2013 Март; 13 Дополнение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Продолжение образовательной деятельности
Хотя наиболее частым проявлением вируса герпеса человека 6 (HHV-6) является субитумная сыпь экзантемы, также называемая младенческой розеолой, у HHV-6 есть известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной группы должны понимать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом появляются изменения в поведении с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6 и подчеркивается роль межпрофессиональной группы в уходе за больными пациентами.
Целей:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичное представление пациента с вирусом герпеса человека 6.
Обобщите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) был первоначально обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был обозначен как В-лимфотропный вирус человека. Дальнейшие исследования идентифицировали HHV-6 в лимфоцитах CD4 + и как члена герпесвирусов. Поскольку это был шестой изолированный вирус герпеса, впоследствии он был переименован в вирус герпеса человека 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами в семействе герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяев с ослабленным иммунитетом. Напротив, исследования идентифицировали HHV-6B как этиологический агент подпункта экзантемы детской болезни (roseola infantum) [1]. Приобретение HHV-6B довольно распространено среди молодежи и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B — это повсеместный вирус, более 90% населения которого инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 все имеют некоторый уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-вирусом герпеса человека. [1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются рецепторами, используемыми для входа в клетки. В отличие от кластерной дифференцировки 46 человека (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B. [2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, связанный с саркомой Капоши (KSHV) и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус онкоген и разрушает аутоиммунные клетки.После связывания с соответствующим рецептором HHV-6 устанавливает латентный период в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
К зрелому возрасту более 95% населения являются серопозитивными по HHV-6A, HHV-6B или обоим вариантам. Существующие серологические методы неэффективны для изоляции одного варианта от другого. [4] В настоящее время хорошо известно, что HHV-6 является основной причиной младенческой розеолы в детстве. HHV-6B в первую очередь инфицирует младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим HHV-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией HHV-6 имели вирусную ДНК в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги [5]. Напротив, другие исследователи определили распространенность ДНК HHV-6 только от 0% до 4% в спинномозговой жидкости детей с фебрильными припадками и пациентов со СПИДом с неврологическими симптомами.[5] Эти вирусы связаны с заболеваниями пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования определили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
Эпидемиология
Исследователи определили HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы HHV-6 в какой-то момент своей жизни, первичное инфицирование HHV-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у подгруппы детей будут проявляться классические проявления младенческой розеолы [1]. В нескольких отчетах о расследованиях зафиксировано снижение серопозитивности с возрастом [4]. Хотя первичная инфекция HHV-6 редко встречается у взрослых, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет сексуальной склонности и может встречаться у людей всех рас.
HHV-6 — это повсеместный вирус, обнаруженный во всем мире. В большом проспективном исследовании североамериканских детей пиковый возраст инфицирования HHV-6 был между 6 и 9 месяцами. [1] Как и в США, в Великобритании и Японии от 97 до 100% первичных инфекций возникают в результате HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичное инфицирование этим конкретным вариантом часто протекает бессимптомно.[7] Однако несколько групп зарегистрировали HHV-6A у детей из Африки и США с симптомами. Более того, HHV-6A был идентифицирован как преобладающая форма вируса, выделяемого у ВИЧ-положительных младенцев в эндемичном регионе Африки к югу от Сахары [7]. Среди разных групп населения распространенность серотипа сильно различается. Существует документально подтвержденный показатель серологической распространенности 20% у беременных марокканских женщин и 100% у бессимптомных взрослых китайцев. Распространенность серотипа колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых фебрильных заболеваний у детей раннего возраста. Это также важная причина посещений отделения неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Вирионная частица имеет характерную структуру вируса герпеса, с центральным ядром, содержащим вирусную ДНК, капсид и богатый белком слой тегумента, окруженный мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая CD4 + Т-клетка. [1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после присоединения к клеточному рецептору CD46. Посредством рецептор-опосредованного эндоцитоза HHV-6 проникает в клетки с последующей вирусной репликацией (Ablashi). После первичного инфицирования ДНК вируса живет в мононуклеарных клетках периферической крови (PBMC).[1]
Хотя точный механизм передачи HHV-6 все еще исследуется, несколько исследований выявили передачу вируса через слюну. Похоже, что передача через слюну от матери к ребенку является наиболее распространенным путем. В нескольких ранних отчетах описывался инфекционный HHV-6, присутствующий в слюне почти каждого испытуемого. [4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК HHV-6, в то время как в другом исследовании на основе ПЦР только 3% человек были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также появился в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что ЦНС и слюнные железы являются резервуаром латентного вируса и стойкой инфекции. . [1] [4]
История и физика
Хотя различные клинические признаки и заболевания, связанные с HHV-6, все еще исследуются, уже хорошо проведенные исследования подтверждают, что HHV-6 играет значительную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантата.[8] Инфекция HHV-6 обычно протекает доброкачественно и проходит самостоятельно. Симптомы — это, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
HHV-6B является возбудителем экзантемы subitum (также известной как младенческая розеола), детской болезни, характеризующейся высокой температурой и легкой кожной сыпью, и составляет от 10 до 17% обращений в отделения неотложной помощи у детей с острой лихорадкой. до 36-месячного возраста. [9] Первичная инфекция HHV-6 составляет более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев и почти исключительно вызвана HHV-6B, а не HHV-6A.[9] [8] [10]
Диагноз детской розеолы является клиническим. Его часто вызывает внезапное начало высокой температуры, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей будет периорбитальный отек, конъюнктивит или воспаление барабанных перепонок, в то время как многие другие будут активными и здоровыми [9]. Другие симптомы у детей включают лимфаденопатию, симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита. [9] У реципиентов трансплантата симптомы часто включают лихорадку, болезнь «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь. [12]
Результаты физикального осмотра обычно соответствуют ранее описанным симптомам. У детей с пониженной температурой лихорадки часто возникает бледная пятнисто-папулезная сыпь розово-розового цвета размером примерно от 2 до 5 мм с окружающим ореолом.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи [13]. Воспаление барабанных перепонок и признаки инфекций верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании могут отмечаться лихорадка, гепатоспленомегалия и лимфаденопатия [12].
Оценка
Вирус герпеса человека 6 (HHV-6) может быть диагностирован с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако лабораторное тестирование у иммунокомпетентных людей вряд ли возможно из-за самоограничивающего характера заболевания. Слюна является основным резервуаром передачи вируса, поскольку она часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, документально подтверждено наличие HHV-6 после трансплантации органов [12]. Большинство исследователей твердо убеждены в том, что инфицирование HHV-6B происходит в раннем возрасте, а инфицирование HHV-6A развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически инфицируют множество людей.
Лабораторные исследования HHV-6 могут показать лейкоцитоз, лейкопению и анемию. [13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует проводить исследования почек и печени соответственно, чтобы исключить электролитные нарушения и гепатит.
Показания для радиологического воображения зависят от клинических проявлений, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть проведена, чтобы исключить другие этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть проведена для поиска других излечимых заболеваний. В случаях поражения центральной нервной системы может быть проведена люмбальная пункция. Инфекция ЦНС HHV-6 часто имеет легкий плеоцитоз с повышенным содержанием белка. ЦСЖ можно отправить на ПЦР-исследования HHV-6 для подтверждения диагноза.[14]
Лечение / ведение
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения HHV-6, и нет вакцины. [8] Как правило, не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии ганцикловиром и фоскарнетом внутривенно, продолжительность лечения составляет от 3 до 4 недель [15]. У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет документально подтвержденные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции HHV-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с младенческой розеолой обычно является поддерживающим. [12] Жаропонижающие средства, такие как парацетамол или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если происходит фебрильный припадок, в противоэпилептических средствах нет необходимости. Лица, у которых присутствует инфекция HHV-6, проявляющаяся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз включает:
Инфекционный мононуклеоз
Цитомегаловирусная инфекция
Вирусный гепатит
Вирус простого герпеса
Вирусная пневмония
Медикаментозная сыпь с эозинофилией и системными симптомами (синдром DRESS)
менинговая инфекция
У детей с классической детской розеолой этиологический патоген является HHV-6.Однако некоторые другие заболевания могут вызывать жар и сыпь. Более серьезные и менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, следует исключить ВЭБ и ЦМВ. Пациенты с ослабленным иммунитетом, особенно те, кто получает трансплантацию органов, и больные СПИДом, как правило, имеют симптомы. Эта группа людей с заболеванием HHV-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и синдром DRESS. [16] Кроме того, имеется документация по HHV-6 в случаях рассеянного склероза энцефалита и интерстициального пневмонита. [17] Стоит отметить, что только HHV-6A ассоциируется с тиреоидитом Хашимото. [12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и те, кто обладает иммунитетом, выживают без последствий.В сообщениях описывается более тяжелое заболевание у лиц с ослабленным иммунитетом. Имеются документы о пневмоните, гепатите и отторжении органов у пациентов, перенесших трансплантацию, со смертельным исходом у пациентов с энцефалитом и менингоэнцефалитом [18]. Аналогичным образом, в Японии в 2003–2004 годах обследование пациентов с энцефалитом, ассоциированным с экзантемой, имело необычно плохой прогноз [19] с зарегистрированными летальными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое нарушение митохондрий.[20]
Осложнения
Обычно первичная инфекция HHV-6 протекает доброкачественно со спонтанным разрешением в течение 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что подчеркивается в случаях, когда центральная нервная система оказывается под угрозой, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус захватывает мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появляются записи о случаях острого или подострого энцефалита, иногда связанного с диффузной или мультифокальной демиелинизацией. [4] HHV-6 нечасто вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT). [4]
Сдерживание и обучение пациентов
У здорового ребенка с младенческой розеолой образование родителей имеет решающее значение для уменьшения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии с жаропонижающими средствами и бесполезность антибиотиков требует объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются пунктами консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Жемчуг и другие проблемы
Принято считать, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22] 1. Отличие случаев первичной инфекции HHV-6 с типичной детской сыпью при розеолах от других болезней является ключом к устранению более серьезных диагнозов. Наиболее частым осложнением инфекции HHV-6 является младенческая розеола, а на HHV-6 приходится примерно от 10 до 20% фебрильных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Лихорадочные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является принятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и скрыт в мононуклеарных клетках периферической крови. Диагностика HHV-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Однако ПЦР, серологические исследования или вирусный посев часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к задокументированным осложнениям со стороны центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, получившие аллогенные трансплантаты, а также люди с иммуносупрессивными расстройствами, подвержены риску реактивации HHV-6. В таких случаях у людей может появиться лихорадка, сыпь и уменьшение количества циркулирующих гранулоцитов и эритроидных клеток. [12] Хотя не существует одобренных методов лечения только инфекции HHV-6, противовирусное лечение ганцикловиром и / или фоскарнетом оказалось успешным в лечении ранее описанных неврологических осложнений.
Улучшение результатов команды здравоохранения
HHV-6 обычно проявляется сыпью у детей, обращающихся в отделение неотложной помощи и у педиатров. Хотя определение высыпаний может быть сложной задачей, выделение конкретных сопутствующих симптомов обязательно, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекает бессимптомно, преходяще и не требует противовирусного лечения. [Уровень II] Педиатрическая консультация — это рекомендация для младенцев с младенческой розеолой, у которых наблюдаются фебрильные судороги.Известны осложнения HHV-6, и тем людям с более угрожающими признаками и симптомами, включая изменения психического статуса и органную недостаточность, будет полезен межпрофессиональный подход. В таких случаях необходима информация от врачей-неврологов и инфекционистов. При подозрении на сердечную недостаточность, ассоциированную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
Скоординированный уход квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями жизненно важных функций.Точно так же не следует сбрасывать со счетов помощь лаборатории в ускорении предпочтительных методов обнаружения вирусов в крови или спинномозговой жидкости с помощью ПЦР или вирусных антигенов в тканях с помощью иммуногистохимии. (Уровень II) Наконец, фармацевт является неотъемлемой частью обеспечения антивирусной терапии ганцикловиром и фоскарнетом при энцефалите, ассоциированном с HHV-6. [24] [Уровень III] Совместно рекомендуется ориентированный на пациента межпрофессиональный командный подход среди клиницистов, включая врачей, лабораторию, специально обученных медсестер и аптек, которые открыто общаются как медицинская бригада, для улучшения результатов в сложных случаях и обеспечения наилучшего исходы для пациентов.[Уровень 5]
Рисунок
Это гистологический слайд вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, который был обнаружен в октябре 1986 года. Это микрофотография инфицированного человека. клетки с телами включения как в ядре, так и в цитоплазме. (подробнее …)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Human herpesvirus 6. Clin Infect Dis. 2001 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая SN, Medveczky PG. Задержка, интеграция и реактивация вируса герпеса человека-6. Вирусы. 2017 г. 24 июля; 9 (7) [Бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Дж., Кроуфорд-младший, Фан Т.Л., Аблаши Д., Hudnall SD. Человеческий герпесвирус 6 и злокачественные новообразования: обзор. Фасад Онкол. 2018; 8: 512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Браун Д.К., Домингес Дж., Пеллетт ЧП. Вирус герпеса человека 6.Clin Microbiol Rev.1997 июл; 10 (3): 521-67. [Бесплатная статья PMC: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Герпесвирусы человека 6 и 7 и инфекция центральной нервной системы у детей. Emerg Infect Dis. 2004 августа; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях герпесвирусами человека 6A, 6B и 7. Med Mal Infect. 2017 Март; 47 (2): 83-91. [PubMed: 27773488]
- 7.
- Ablashi D, Agut H, Alvarez-Lafuente R, Clark DA, Dewhurst S, DiLuca D, Flamand L, Frenkel N, Gallo R, Gompels UA, Höllsberg P, Jacobson S, Luppi M, Lusso P, Malzatiky M, Medvecky P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Arch Virol. 2014 Май; 159 (5): 863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- Де Болле Л., Нейсенс Л., Де Клерк Э. Обновленная информация о биологии вируса герпеса 6 человека, клинических особенностях и терапии.Clin Microbiol Rev.2005, январь; 18 (1): 217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичного инфицирования розеоловирусами. Curr Opin Virol. 2014 декабрь; 9: 91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Инфекция герпеса человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 18 августа 1994; 331 (7): 432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в ассоциации с розеолой. Педиатр Emerg Care. 2020 Октябрь; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций вируса герпеса человека 6. Clin Microbiol Rev.2015, апрель; 28 (2): 313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Люпанц Т., Уршич Т., Петровец М. Инфекция, вызванная вирусом герпеса человека 6, проявляется как острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Case Rep Pediatr. 2016; 2016: 2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Явариан Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости у детей с возможным энцефалитом. Jundishapur J Microbiol. 2014 сентябрь; 7 (9): e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард Миннесота, Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 декабрь; 9: 148-53. [Бесплатная статья PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Шиохара Т., Иидзима М., Икэдзава З., Хашимото К. Диагноз синдрома DRESS был достаточно установлен на основании типичных клинических признаков и вирусной реактивации . Br J Dermatol. 2007 Май; 156 (5): 1083-4. [PubMed: 17381452]
- 17.
- Marks GL, Nolan PE, Erlich KS, Ellis MN.Распространение через слизистую оболочку устойчивого к ацикловиру вируса простого герпеса у пациента со СПИДом. Rev Infect Dis. 1989 май-июнь; 11 (3): 474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I., Cizman M. Смертельный мультифокальный менингоэнцефалит, связанный с вирусом герпеса человека 6, у взрослой пациентки. Scand J Infect Dis. 2001; 33 (12): 942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаши М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Энцефалит, ассоциированный с Exanthem subitum: общенациональное исследование в Японии. Pediatr Neurol. 2009 ноя; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Аль-Зубейди Д., Тангарадж М., Патак С., Кай С., Шлаггар Б.Л., Сторч Г.А., Грейндж Д.К., Уотсон М.Э. Смертельный энцефалит, связанный с вирусом герпеса 6 человека, у двух мальчиков с основными митохондриальными нарушениями POLG. Pediatr Neurol. 2014 сентябрь; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после тощей кишки.Surg Gynecol Obstet. 1976 Февраль; 142 (2): 177-83. [PubMed: 813311]
- 22.
- de Andrade RP. Многоцентровая клиническая оценка новой монофазной комбинации: Minulet (гестоден и этинилэстрадиол). Int J Fertil. 1989 Сентябрь; 34 Дополнение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого человека. кардиомагнитный резонанс в мультидисциплинарном подходе.Тираж. 2013 декабря 03; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Ле Дж, Гант С., Сообщество специалистов по инфекционным заболеваниям AST. Человеческий герпесвирус 6, 7 и 8 при трансплантации твердых органов. Am J Transplant. 2013 Март; 13 Дополнение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Продолжение образовательной деятельности
Хотя наиболее частым проявлением вируса герпеса человека 6 (HHV-6) является субитумная сыпь экзантемы, также называемая младенческой розеолой, у HHV-6 есть известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной группы должны понимать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом появляются изменения в поведении с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6 и подчеркивается роль межпрофессиональной группы в уходе за больными пациентами.
Целей:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичное представление пациента с вирусом герпеса человека 6.
Обобщите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) был первоначально обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был обозначен как В-лимфотропный вирус человека. Дальнейшие исследования идентифицировали HHV-6 в лимфоцитах CD4 + и как члена герпесвирусов. Поскольку это был шестой изолированный вирус герпеса, впоследствии он был переименован в вирус герпеса человека 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами в семействе герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяев с ослабленным иммунитетом. Напротив, исследования идентифицировали HHV-6B как этиологический агент подпункта экзантемы детской болезни (roseola infantum) [1]. Приобретение HHV-6B довольно распространено среди молодежи и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B — это повсеместный вирус, более 90% населения которого инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 все имеют некоторый уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-вирусом герпеса человека. [1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются рецепторами, используемыми для входа в клетки. В отличие от кластерной дифференцировки 46 человека (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B. [2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, связанный с саркомой Капоши (KSHV) и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус онкоген и разрушает аутоиммунные клетки.После связывания с соответствующим рецептором HHV-6 устанавливает латентный период в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
К зрелому возрасту более 95% населения являются серопозитивными по HHV-6A, HHV-6B или обоим вариантам. Существующие серологические методы неэффективны для изоляции одного варианта от другого. [4] В настоящее время хорошо известно, что HHV-6 является основной причиной младенческой розеолы в детстве. HHV-6B в первую очередь инфицирует младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим HHV-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией HHV-6 имели вирусную ДНК в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги [5]. Напротив, другие исследователи определили распространенность ДНК HHV-6 только от 0% до 4% в спинномозговой жидкости детей с фебрильными припадками и пациентов со СПИДом с неврологическими симптомами.[5] Эти вирусы связаны с заболеваниями пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования определили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
Эпидемиология
Исследователи определили HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы HHV-6 в какой-то момент своей жизни, первичное инфицирование HHV-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у подгруппы детей будут проявляться классические проявления младенческой розеолы [1]. В нескольких отчетах о расследованиях зафиксировано снижение серопозитивности с возрастом [4]. Хотя первичная инфекция HHV-6 редко встречается у взрослых, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет сексуальной склонности и может встречаться у людей всех рас.
HHV-6 — это повсеместный вирус, обнаруженный во всем мире. В большом проспективном исследовании североамериканских детей пиковый возраст инфицирования HHV-6 был между 6 и 9 месяцами. [1] Как и в США, в Великобритании и Японии от 97 до 100% первичных инфекций возникают в результате HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичное инфицирование этим конкретным вариантом часто протекает бессимптомно.[7] Однако несколько групп зарегистрировали HHV-6A у детей из Африки и США с симптомами. Более того, HHV-6A был идентифицирован как преобладающая форма вируса, выделяемого у ВИЧ-положительных младенцев в эндемичном регионе Африки к югу от Сахары [7]. Среди разных групп населения распространенность серотипа сильно различается. Существует документально подтвержденный показатель серологической распространенности 20% у беременных марокканских женщин и 100% у бессимптомных взрослых китайцев. Распространенность серотипа колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых фебрильных заболеваний у детей раннего возраста. Это также важная причина посещений отделения неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Вирионная частица имеет характерную структуру вируса герпеса, с центральным ядром, содержащим вирусную ДНК, капсид и богатый белком слой тегумента, окруженный мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая CD4 + Т-клетка. [1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после присоединения к клеточному рецептору CD46. Посредством рецептор-опосредованного эндоцитоза HHV-6 проникает в клетки с последующей вирусной репликацией (Ablashi). После первичного инфицирования ДНК вируса живет в мононуклеарных клетках периферической крови (PBMC).[1]
Хотя точный механизм передачи HHV-6 все еще исследуется, несколько исследований выявили передачу вируса через слюну. Похоже, что передача через слюну от матери к ребенку является наиболее распространенным путем. В нескольких ранних отчетах описывался инфекционный HHV-6, присутствующий в слюне почти каждого испытуемого. [4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК HHV-6, в то время как в другом исследовании на основе ПЦР только 3% человек были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также появился в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что ЦНС и слюнные железы являются резервуаром латентного вируса и стойкой инфекции. . [1] [4]
История и физика
Хотя различные клинические признаки и заболевания, связанные с HHV-6, все еще исследуются, уже хорошо проведенные исследования подтверждают, что HHV-6 играет значительную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантата.[8] Инфекция HHV-6 обычно протекает доброкачественно и проходит самостоятельно. Симптомы — это, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
HHV-6B является возбудителем экзантемы subitum (также известной как младенческая розеола), детской болезни, характеризующейся высокой температурой и легкой кожной сыпью, и составляет от 10 до 17% обращений в отделения неотложной помощи у детей с острой лихорадкой. до 36-месячного возраста. [9] Первичная инфекция HHV-6 составляет более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев и почти исключительно вызвана HHV-6B, а не HHV-6A.[9] [8] [10]
Диагноз детской розеолы является клиническим. Его часто вызывает внезапное начало высокой температуры, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей будет периорбитальный отек, конъюнктивит или воспаление барабанных перепонок, в то время как многие другие будут активными и здоровыми [9]. Другие симптомы у детей включают лимфаденопатию, симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита. [9] У реципиентов трансплантата симптомы часто включают лихорадку, болезнь «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь. [12]
Результаты физикального осмотра обычно соответствуют ранее описанным симптомам. У детей с пониженной температурой лихорадки часто возникает бледная пятнисто-папулезная сыпь розово-розового цвета размером примерно от 2 до 5 мм с окружающим ореолом.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи [13]. Воспаление барабанных перепонок и признаки инфекций верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании могут отмечаться лихорадка, гепатоспленомегалия и лимфаденопатия [12].
Оценка
Вирус герпеса человека 6 (HHV-6) может быть диагностирован с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако лабораторное тестирование у иммунокомпетентных людей вряд ли возможно из-за самоограничивающего характера заболевания. Слюна является основным резервуаром передачи вируса, поскольку она часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, документально подтверждено наличие HHV-6 после трансплантации органов [12]. Большинство исследователей твердо убеждены в том, что инфицирование HHV-6B происходит в раннем возрасте, а инфицирование HHV-6A развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически инфицируют множество людей.
Лабораторные исследования HHV-6 могут показать лейкоцитоз, лейкопению и анемию. [13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует проводить исследования почек и печени соответственно, чтобы исключить электролитные нарушения и гепатит.
Показания для радиологического воображения зависят от клинических проявлений, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть проведена, чтобы исключить другие этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть проведена для поиска других излечимых заболеваний. В случаях поражения центральной нервной системы может быть проведена люмбальная пункция. Инфекция ЦНС HHV-6 часто имеет легкий плеоцитоз с повышенным содержанием белка. ЦСЖ можно отправить на ПЦР-исследования HHV-6 для подтверждения диагноза.[14]
Лечение / ведение
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения HHV-6, и нет вакцины. [8] Как правило, не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии ганцикловиром и фоскарнетом внутривенно, продолжительность лечения составляет от 3 до 4 недель [15]. У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет документально подтвержденные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции HHV-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с младенческой розеолой обычно является поддерживающим. [12] Жаропонижающие средства, такие как парацетамол или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если происходит фебрильный припадок, в противоэпилептических средствах нет необходимости. Лица, у которых присутствует инфекция HHV-6, проявляющаяся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз включает:
Инфекционный мононуклеоз
Цитомегаловирусная инфекция
Вирусный гепатит
Вирус простого герпеса
Вирусная пневмония
Медикаментозная сыпь с эозинофилией и системными симптомами (синдром DRESS)
менинговая инфекция
У детей с классической детской розеолой этиологический патоген является HHV-6.Однако некоторые другие заболевания могут вызывать жар и сыпь. Более серьезные и менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, следует исключить ВЭБ и ЦМВ. Пациенты с ослабленным иммунитетом, особенно те, кто получает трансплантацию органов, и больные СПИДом, как правило, имеют симптомы. Эта группа людей с заболеванием HHV-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и синдром DRESS. [16] Кроме того, имеется документация по HHV-6 в случаях рассеянного склероза энцефалита и интерстициального пневмонита. [17] Стоит отметить, что только HHV-6A ассоциируется с тиреоидитом Хашимото. [12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и те, кто обладает иммунитетом, выживают без последствий.В сообщениях описывается более тяжелое заболевание у лиц с ослабленным иммунитетом. Имеются документы о пневмоните, гепатите и отторжении органов у пациентов, перенесших трансплантацию, со смертельным исходом у пациентов с энцефалитом и менингоэнцефалитом [18]. Аналогичным образом, в Японии в 2003–2004 годах обследование пациентов с энцефалитом, ассоциированным с экзантемой, имело необычно плохой прогноз [19] с зарегистрированными летальными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое нарушение митохондрий.[20]
Осложнения
Обычно первичная инфекция HHV-6 протекает доброкачественно со спонтанным разрешением в течение 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что подчеркивается в случаях, когда центральная нервная система оказывается под угрозой, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус захватывает мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появляются записи о случаях острого или подострого энцефалита, иногда связанного с диффузной или мультифокальной демиелинизацией. [4] HHV-6 нечасто вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT). [4]
Сдерживание и обучение пациентов
У здорового ребенка с младенческой розеолой образование родителей имеет решающее значение для уменьшения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии с жаропонижающими средствами и бесполезность антибиотиков требует объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются пунктами консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Жемчуг и другие проблемы
Принято считать, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22] 1. Отличие случаев первичной инфекции HHV-6 с типичной детской сыпью при розеолах от других болезней является ключом к устранению более серьезных диагнозов. Наиболее частым осложнением инфекции HHV-6 является младенческая розеола, а на HHV-6 приходится примерно от 10 до 20% фебрильных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Лихорадочные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является принятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и скрыт в мононуклеарных клетках периферической крови. Диагностика HHV-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Однако ПЦР, серологические исследования или вирусный посев часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к задокументированным осложнениям со стороны центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, получившие аллогенные трансплантаты, а также люди с иммуносупрессивными расстройствами, подвержены риску реактивации HHV-6. В таких случаях у людей может появиться лихорадка, сыпь и уменьшение количества циркулирующих гранулоцитов и эритроидных клеток. [12] Хотя не существует одобренных методов лечения только инфекции HHV-6, противовирусное лечение ганцикловиром и / или фоскарнетом оказалось успешным в лечении ранее описанных неврологических осложнений.
Улучшение результатов команды здравоохранения
HHV-6 обычно проявляется сыпью у детей, обращающихся в отделение неотложной помощи и у педиатров. Хотя определение высыпаний может быть сложной задачей, выделение конкретных сопутствующих симптомов обязательно, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекает бессимптомно, преходяще и не требует противовирусного лечения. [Уровень II] Педиатрическая консультация — это рекомендация для младенцев с младенческой розеолой, у которых наблюдаются фебрильные судороги.Известны осложнения HHV-6, и тем людям с более угрожающими признаками и симптомами, включая изменения психического статуса и органную недостаточность, будет полезен межпрофессиональный подход. В таких случаях необходима информация от врачей-неврологов и инфекционистов. При подозрении на сердечную недостаточность, ассоциированную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
Скоординированный уход квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями жизненно важных функций.Точно так же не следует сбрасывать со счетов помощь лаборатории в ускорении предпочтительных методов обнаружения вирусов в крови или спинномозговой жидкости с помощью ПЦР или вирусных антигенов в тканях с помощью иммуногистохимии. (Уровень II) Наконец, фармацевт является неотъемлемой частью обеспечения антивирусной терапии ганцикловиром и фоскарнетом при энцефалите, ассоциированном с HHV-6. [24] [Уровень III] Совместно рекомендуется ориентированный на пациента межпрофессиональный командный подход среди клиницистов, включая врачей, лабораторию, специально обученных медсестер и аптек, которые открыто общаются как медицинская бригада, для улучшения результатов в сложных случаях и обеспечения наилучшего исходы для пациентов.[Уровень 5]
Рисунок
Это гистологический слайд вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, который был обнаружен в октябре 1986 года. Это микрофотография инфицированного человека. клетки с телами включения как в ядре, так и в цитоплазме. (подробнее …)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Human herpesvirus 6. Clin Infect Dis. 2001 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая SN, Medveczky PG. Задержка, интеграция и реактивация вируса герпеса человека-6. Вирусы. 2017 г. 24 июля; 9 (7) [Бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Дж., Кроуфорд-младший, Фан Т.Л., Аблаши Д., Hudnall SD. Человеческий герпесвирус 6 и злокачественные новообразования: обзор. Фасад Онкол. 2018; 8: 512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Браун Д.К., Домингес Дж., Пеллетт ЧП. Вирус герпеса человека 6.Clin Microbiol Rev.1997 июл; 10 (3): 521-67. [Бесплатная статья PMC: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Герпесвирусы человека 6 и 7 и инфекция центральной нервной системы у детей. Emerg Infect Dis. 2004 августа; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях герпесвирусами человека 6A, 6B и 7. Med Mal Infect. 2017 Март; 47 (2): 83-91. [PubMed: 27773488]
- 7.
- Ablashi D, Agut H, Alvarez-Lafuente R, Clark DA, Dewhurst S, DiLuca D, Flamand L, Frenkel N, Gallo R, Gompels UA, Höllsberg P, Jacobson S, Luppi M, Lusso P, Malzatiky M, Medvecky P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Arch Virol. 2014 Май; 159 (5): 863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- Де Болле Л., Нейсенс Л., Де Клерк Э. Обновленная информация о биологии вируса герпеса 6 человека, клинических особенностях и терапии.Clin Microbiol Rev.2005, январь; 18 (1): 217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичного инфицирования розеоловирусами. Curr Opin Virol. 2014 декабрь; 9: 91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Инфекция герпеса человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 18 августа 1994; 331 (7): 432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в ассоциации с розеолой. Педиатр Emerg Care. 2020 Октябрь; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций вируса герпеса человека 6. Clin Microbiol Rev.2015, апрель; 28 (2): 313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Люпанц Т., Уршич Т., Петровец М. Инфекция, вызванная вирусом герпеса человека 6, проявляется как острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Case Rep Pediatr. 2016; 2016: 2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Явариан Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости у детей с возможным энцефалитом. Jundishapur J Microbiol. 2014 сентябрь; 7 (9): e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард Миннесота, Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 декабрь; 9: 148-53. [Бесплатная статья PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Шиохара Т., Иидзима М., Икэдзава З., Хашимото К. Диагноз синдрома DRESS был достаточно установлен на основании типичных клинических признаков и вирусной реактивации . Br J Dermatol. 2007 Май; 156 (5): 1083-4. [PubMed: 17381452]
- 17.
- Marks GL, Nolan PE, Erlich KS, Ellis MN.Распространение через слизистую оболочку устойчивого к ацикловиру вируса простого герпеса у пациента со СПИДом. Rev Infect Dis. 1989 май-июнь; 11 (3): 474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I., Cizman M. Смертельный мультифокальный менингоэнцефалит, связанный с вирусом герпеса человека 6, у взрослой пациентки. Scand J Infect Dis. 2001; 33 (12): 942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаши М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Энцефалит, ассоциированный с Exanthem subitum: общенациональное исследование в Японии. Pediatr Neurol. 2009 ноя; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Аль-Зубейди Д., Тангарадж М., Патак С., Кай С., Шлаггар Б.Л., Сторч Г.А., Грейндж Д.К., Уотсон М.Э. Смертельный энцефалит, связанный с вирусом герпеса 6 человека, у двух мальчиков с основными митохондриальными нарушениями POLG. Pediatr Neurol. 2014 сентябрь; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после тощей кишки.Surg Gynecol Obstet. 1976 Февраль; 142 (2): 177-83. [PubMed: 813311]
- 22.
- de Andrade RP. Многоцентровая клиническая оценка новой монофазной комбинации: Minulet (гестоден и этинилэстрадиол). Int J Fertil. 1989 Сентябрь; 34 Дополнение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого человека. кардиомагнитный резонанс в мультидисциплинарном подходе.Тираж. 2013 декабря 03; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Ле Дж, Гант С., Сообщество специалистов по инфекционным заболеваниям AST. Человеческий герпесвирус 6, 7 и 8 при трансплантации твердых органов. Am J Transplant. 2013 Март; 13 Дополнение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Продолжение образовательной деятельности
Хотя наиболее частым проявлением вируса герпеса человека 6 (HHV-6) является субитумная сыпь экзантемы, также называемая младенческой розеолой, у HHV-6 есть известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной группы должны понимать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом появляются изменения в поведении с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6 и подчеркивается роль межпрофессиональной группы в уходе за больными пациентами.
Целей:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичное представление пациента с вирусом герпеса человека 6.
Обобщите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) был первоначально обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был обозначен как В-лимфотропный вирус человека. Дальнейшие исследования идентифицировали HHV-6 в лимфоцитах CD4 + и как члена герпесвирусов. Поскольку это был шестой изолированный вирус герпеса, впоследствии он был переименован в вирус герпеса человека 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами в семействе герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяев с ослабленным иммунитетом. Напротив, исследования идентифицировали HHV-6B как этиологический агент подпункта экзантемы детской болезни (roseola infantum) [1]. Приобретение HHV-6B довольно распространено среди молодежи и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B — это повсеместный вирус, более 90% населения которого инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 все имеют некоторый уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-вирусом герпеса человека. [1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются рецепторами, используемыми для входа в клетки. В отличие от кластерной дифференцировки 46 человека (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B. [2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, связанный с саркомой Капоши (KSHV) и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус онкоген и разрушает аутоиммунные клетки.После связывания с соответствующим рецептором HHV-6 устанавливает латентный период в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
К зрелому возрасту более 95% населения являются серопозитивными по HHV-6A, HHV-6B или обоим вариантам. Существующие серологические методы неэффективны для изоляции одного варианта от другого. [4] В настоящее время хорошо известно, что HHV-6 является основной причиной младенческой розеолы в детстве. HHV-6B в первую очередь инфицирует младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим HHV-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией HHV-6 имели вирусную ДНК в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги [5]. Напротив, другие исследователи определили распространенность ДНК HHV-6 только от 0% до 4% в спинномозговой жидкости детей с фебрильными припадками и пациентов со СПИДом с неврологическими симптомами.[5] Эти вирусы связаны с заболеваниями пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования определили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
Эпидемиология
Исследователи определили HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы HHV-6 в какой-то момент своей жизни, первичное инфицирование HHV-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у подгруппы детей будут проявляться классические проявления младенческой розеолы [1]. В нескольких отчетах о расследованиях зафиксировано снижение серопозитивности с возрастом [4]. Хотя первичная инфекция HHV-6 редко встречается у взрослых, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет сексуальной склонности и может встречаться у людей всех рас.
HHV-6 — это повсеместный вирус, обнаруженный во всем мире. В большом проспективном исследовании североамериканских детей пиковый возраст инфицирования HHV-6 был между 6 и 9 месяцами. [1] Как и в США, в Великобритании и Японии от 97 до 100% первичных инфекций возникают в результате HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичное инфицирование этим конкретным вариантом часто протекает бессимптомно.[7] Однако несколько групп зарегистрировали HHV-6A у детей из Африки и США с симптомами. Более того, HHV-6A был идентифицирован как преобладающая форма вируса, выделяемого у ВИЧ-положительных младенцев в эндемичном регионе Африки к югу от Сахары [7]. Среди разных групп населения распространенность серотипа сильно различается. Существует документально подтвержденный показатель серологической распространенности 20% у беременных марокканских женщин и 100% у бессимптомных взрослых китайцев. Распространенность серотипа колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых фебрильных заболеваний у детей раннего возраста. Это также важная причина посещений отделения неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Вирионная частица имеет характерную структуру вируса герпеса, с центральным ядром, содержащим вирусную ДНК, капсид и богатый белком слой тегумента, окруженный мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая CD4 + Т-клетка. [1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после присоединения к клеточному рецептору CD46. Посредством рецептор-опосредованного эндоцитоза HHV-6 проникает в клетки с последующей вирусной репликацией (Ablashi). После первичного инфицирования ДНК вируса живет в мононуклеарных клетках периферической крови (PBMC).[1]
Хотя точный механизм передачи HHV-6 все еще исследуется, несколько исследований выявили передачу вируса через слюну. Похоже, что передача через слюну от матери к ребенку является наиболее распространенным путем. В нескольких ранних отчетах описывался инфекционный HHV-6, присутствующий в слюне почти каждого испытуемого. [4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК HHV-6, в то время как в другом исследовании на основе ПЦР только 3% человек были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также появился в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что ЦНС и слюнные железы являются резервуаром латентного вируса и стойкой инфекции. . [1] [4]
История и физика
Хотя различные клинические признаки и заболевания, связанные с HHV-6, все еще исследуются, уже хорошо проведенные исследования подтверждают, что HHV-6 играет значительную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантата.[8] Инфекция HHV-6 обычно протекает доброкачественно и проходит самостоятельно. Симптомы — это, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
HHV-6B является возбудителем экзантемы subitum (также известной как младенческая розеола), детской болезни, характеризующейся высокой температурой и легкой кожной сыпью, и составляет от 10 до 17% обращений в отделения неотложной помощи у детей с острой лихорадкой. до 36-месячного возраста. [9] Первичная инфекция HHV-6 составляет более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев и почти исключительно вызвана HHV-6B, а не HHV-6A.[9] [8] [10]
Диагноз детской розеолы является клиническим. Его часто вызывает внезапное начало высокой температуры, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей будет периорбитальный отек, конъюнктивит или воспаление барабанных перепонок, в то время как многие другие будут активными и здоровыми [9]. Другие симптомы у детей включают лимфаденопатию, симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита. [9] У реципиентов трансплантата симптомы часто включают лихорадку, болезнь «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь. [12]
Результаты физикального осмотра обычно соответствуют ранее описанным симптомам. У детей с пониженной температурой лихорадки часто возникает бледная пятнисто-папулезная сыпь розово-розового цвета размером примерно от 2 до 5 мм с окружающим ореолом.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи [13]. Воспаление барабанных перепонок и признаки инфекций верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании могут отмечаться лихорадка, гепатоспленомегалия и лимфаденопатия [12].
Оценка
Вирус герпеса человека 6 (HHV-6) может быть диагностирован с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако лабораторное тестирование у иммунокомпетентных людей вряд ли возможно из-за самоограничивающего характера заболевания. Слюна является основным резервуаром передачи вируса, поскольку она часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, документально подтверждено наличие HHV-6 после трансплантации органов [12]. Большинство исследователей твердо убеждены в том, что инфицирование HHV-6B происходит в раннем возрасте, а инфицирование HHV-6A развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически инфицируют множество людей.
Лабораторные исследования HHV-6 могут показать лейкоцитоз, лейкопению и анемию. [13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует проводить исследования почек и печени соответственно, чтобы исключить электролитные нарушения и гепатит.
Показания для радиологического воображения зависят от клинических проявлений, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть проведена, чтобы исключить другие этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть проведена для поиска других излечимых заболеваний. В случаях поражения центральной нервной системы может быть проведена люмбальная пункция. Инфекция ЦНС HHV-6 часто имеет легкий плеоцитоз с повышенным содержанием белка. ЦСЖ можно отправить на ПЦР-исследования HHV-6 для подтверждения диагноза.[14]
Лечение / ведение
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения HHV-6, и нет вакцины. [8] Как правило, не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии ганцикловиром и фоскарнетом внутривенно, продолжительность лечения составляет от 3 до 4 недель [15]. У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет документально подтвержденные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции HHV-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с младенческой розеолой обычно является поддерживающим. [12] Жаропонижающие средства, такие как парацетамол или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если происходит фебрильный припадок, в противоэпилептических средствах нет необходимости. Лица, у которых присутствует инфекция HHV-6, проявляющаяся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз включает:
Инфекционный мононуклеоз
Цитомегаловирусная инфекция
Вирусный гепатит
Вирус простого герпеса
Вирусная пневмония
Медикаментозная сыпь с эозинофилией и системными симптомами (синдром DRESS)
менинговая инфекция
У детей с классической детской розеолой этиологический патоген является HHV-6.Однако некоторые другие заболевания могут вызывать жар и сыпь. Более серьезные и менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, следует исключить ВЭБ и ЦМВ. Пациенты с ослабленным иммунитетом, особенно те, кто получает трансплантацию органов, и больные СПИДом, как правило, имеют симптомы. Эта группа людей с заболеванием HHV-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и синдром DRESS. [16] Кроме того, имеется документация по HHV-6 в случаях рассеянного склероза энцефалита и интерстициального пневмонита. [17] Стоит отметить, что только HHV-6A ассоциируется с тиреоидитом Хашимото. [12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и те, кто обладает иммунитетом, выживают без последствий.В сообщениях описывается более тяжелое заболевание у лиц с ослабленным иммунитетом. Имеются документы о пневмоните, гепатите и отторжении органов у пациентов, перенесших трансплантацию, со смертельным исходом у пациентов с энцефалитом и менингоэнцефалитом [18]. Аналогичным образом, в Японии в 2003–2004 годах обследование пациентов с энцефалитом, ассоциированным с экзантемой, имело необычно плохой прогноз [19] с зарегистрированными летальными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое нарушение митохондрий.[20]
Осложнения
Обычно первичная инфекция HHV-6 протекает доброкачественно со спонтанным разрешением в течение 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что подчеркивается в случаях, когда центральная нервная система оказывается под угрозой, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус захватывает мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появляются записи о случаях острого или подострого энцефалита, иногда связанного с диффузной или мультифокальной демиелинизацией. [4] HHV-6 нечасто вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT). [4]
Сдерживание и обучение пациентов
У здорового ребенка с младенческой розеолой образование родителей имеет решающее значение для уменьшения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии с жаропонижающими средствами и бесполезность антибиотиков требует объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются пунктами консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Жемчуг и другие проблемы
Принято считать, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22] 1. Отличие случаев первичной инфекции HHV-6 с типичной детской сыпью при розеолах от других болезней является ключом к устранению более серьезных диагнозов. Наиболее частым осложнением инфекции HHV-6 является младенческая розеола, а на HHV-6 приходится примерно от 10 до 20% фебрильных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Лихорадочные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является принятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и скрыт в мононуклеарных клетках периферической крови. Диагностика HHV-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Однако ПЦР, серологические исследования или вирусный посев часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к задокументированным осложнениям со стороны центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, получившие аллогенные трансплантаты, а также люди с иммуносупрессивными расстройствами, подвержены риску реактивации HHV-6. В таких случаях у людей может появиться лихорадка, сыпь и уменьшение количества циркулирующих гранулоцитов и эритроидных клеток. [12] Хотя не существует одобренных методов лечения только инфекции HHV-6, противовирусное лечение ганцикловиром и / или фоскарнетом оказалось успешным в лечении ранее описанных неврологических осложнений.
Улучшение результатов команды здравоохранения
HHV-6 обычно проявляется сыпью у детей, обращающихся в отделение неотложной помощи и у педиатров. Хотя определение высыпаний может быть сложной задачей, выделение конкретных сопутствующих симптомов обязательно, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекает бессимптомно, преходяще и не требует противовирусного лечения. [Уровень II] Педиатрическая консультация — это рекомендация для младенцев с младенческой розеолой, у которых наблюдаются фебрильные судороги.Известны осложнения HHV-6, и тем людям с более угрожающими признаками и симптомами, включая изменения психического статуса и органную недостаточность, будет полезен межпрофессиональный подход. В таких случаях необходима информация от врачей-неврологов и инфекционистов. При подозрении на сердечную недостаточность, ассоциированную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
Скоординированный уход квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями жизненно важных функций.Точно так же не следует сбрасывать со счетов помощь лаборатории в ускорении предпочтительных методов обнаружения вирусов в крови или спинномозговой жидкости с помощью ПЦР или вирусных антигенов в тканях с помощью иммуногистохимии. (Уровень II) Наконец, фармацевт является неотъемлемой частью обеспечения антивирусной терапии ганцикловиром и фоскарнетом при энцефалите, ассоциированном с HHV-6. [24] [Уровень III] Совместно рекомендуется ориентированный на пациента межпрофессиональный командный подход среди клиницистов, включая врачей, лабораторию, специально обученных медсестер и аптек, которые открыто общаются как медицинская бригада, для улучшения результатов в сложных случаях и обеспечения наилучшего исходы для пациентов.[Уровень 5]
Рисунок
Это гистологический слайд вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, который был обнаружен в октябре 1986 года. Это микрофотография инфицированного человека. клетки с телами включения как в ядре, так и в цитоплазме. (подробнее …)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Human herpesvirus 6. Clin Infect Dis. 2001 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая SN, Medveczky PG. Задержка, интеграция и реактивация вируса герпеса человека-6. Вирусы. 2017 г. 24 июля; 9 (7) [Бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Дж., Кроуфорд-младший, Фан Т.Л., Аблаши Д., Hudnall SD. Человеческий герпесвирус 6 и злокачественные новообразования: обзор. Фасад Онкол. 2018; 8: 512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Браун Д.К., Домингес Дж., Пеллетт ЧП. Вирус герпеса человека 6.Clin Microbiol Rev.1997 июл; 10 (3): 521-67. [Бесплатная статья PMC: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Герпесвирусы человека 6 и 7 и инфекция центральной нервной системы у детей. Emerg Infect Dis. 2004 августа; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях герпесвирусами человека 6A, 6B и 7. Med Mal Infect. 2017 Март; 47 (2): 83-91. [PubMed: 27773488]
- 7.
- Ablashi D, Agut H, Alvarez-Lafuente R, Clark DA, Dewhurst S, DiLuca D, Flamand L, Frenkel N, Gallo R, Gompels UA, Höllsberg P, Jacobson S, Luppi M, Lusso P, Malzatiky M, Medvecky P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Arch Virol. 2014 Май; 159 (5): 863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- Де Болле Л., Нейсенс Л., Де Клерк Э. Обновленная информация о биологии вируса герпеса 6 человека, клинических особенностях и терапии.Clin Microbiol Rev.2005, январь; 18 (1): 217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичного инфицирования розеоловирусами. Curr Opin Virol. 2014 декабрь; 9: 91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Инфекция герпеса человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 18 августа 1994; 331 (7): 432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в ассоциации с розеолой. Педиатр Emerg Care. 2020 Октябрь; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций вируса герпеса человека 6. Clin Microbiol Rev.2015, апрель; 28 (2): 313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Люпанц Т., Уршич Т., Петровец М. Инфекция, вызванная вирусом герпеса человека 6, проявляется как острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Case Rep Pediatr. 2016; 2016: 2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Явариан Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости у детей с возможным энцефалитом. Jundishapur J Microbiol. 2014 сентябрь; 7 (9): e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард Миннесота, Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 декабрь; 9: 148-53. [Бесплатная статья PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Шиохара Т., Иидзима М., Икэдзава З., Хашимото К. Диагноз синдрома DRESS был достаточно установлен на основании типичных клинических признаков и вирусной реактивации . Br J Dermatol. 2007 Май; 156 (5): 1083-4. [PubMed: 17381452]
- 17.
- Marks GL, Nolan PE, Erlich KS, Ellis MN.Распространение через слизистую оболочку устойчивого к ацикловиру вируса простого герпеса у пациента со СПИДом. Rev Infect Dis. 1989 май-июнь; 11 (3): 474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I., Cizman M. Смертельный мультифокальный менингоэнцефалит, связанный с вирусом герпеса человека 6, у взрослой пациентки. Scand J Infect Dis. 2001; 33 (12): 942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаши М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Энцефалит, ассоциированный с Exanthem subitum: общенациональное исследование в Японии. Pediatr Neurol. 2009 ноя; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Аль-Зубейди Д., Тангарадж М., Патак С., Кай С., Шлаггар Б.Л., Сторч Г.А., Грейндж Д.К., Уотсон М.Э. Смертельный энцефалит, связанный с вирусом герпеса 6 человека, у двух мальчиков с основными митохондриальными нарушениями POLG. Pediatr Neurol. 2014 сентябрь; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после тощей кишки.Surg Gynecol Obstet. 1976 Февраль; 142 (2): 177-83. [PubMed: 813311]
- 22.
- de Andrade RP. Многоцентровая клиническая оценка новой монофазной комбинации: Minulet (гестоден и этинилэстрадиол). Int J Fertil. 1989 Сентябрь; 34 Дополнение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого человека. кардиомагнитный резонанс в мультидисциплинарном подходе.Тираж. 2013 декабря 03; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Ле Дж, Гант С., Сообщество специалистов по инфекционным заболеваниям AST. Человеческий герпесвирус 6, 7 и 8 при трансплантации твердых органов. Am J Transplant. 2013 Март; 13 Дополнение 4: 128-37. [PubMed: 23465006]
Вирус герпеса типа 6 — StatPearls
Продолжение образовательной деятельности
Хотя наиболее частым проявлением вируса герпеса человека 6 (HHV-6) является субитумная сыпь экзантемы, также называемая младенческой розеолой, у HHV-6 есть известно, что он вызывает более опасную инфекцию у лиц с ослабленным иммунитетом.Члены межпрофессиональной группы должны понимать, что дальнейшая оценка этого состояния оправдана, когда у пациента с ослабленным иммунитетом появляются изменения в поведении с сыпью или без нее. Раннее распознавание приведет к ускоренному лечению, улучшению ухода за пациентами и предотвращению неблагоприятных исходов. В этом упражнении рассматривается диагностика, ведение и лечение вируса герпеса человека 6 и подчеркивается роль межпрофессиональной группы в уходе за больными пациентами.
Целей:
Опишите патофизиологию вируса герпеса человека 6.
Опишите типичное представление пациента с вирусом герпеса человека 6.
Обобщите рекомендации по лечению пациентов, инфицированных вирусом герпеса человека 6.
Объясните важность улучшения координации помощи между межпрофессиональной командой для улучшения оказания помощи пациентам, инфицированным вирусом герпеса человека 6, особенно тем, кто подвержен риску более тяжелой инфекции.
Введение
Вирус герпеса человека 6 (HHV-6) был первоначально обнаружен в лимфоцитах крови взрослых с лимфопролиферативными заболеваниями или СПИДом и был обозначен как В-лимфотропный вирус человека. Дальнейшие исследования идентифицировали HHV-6 в лимфоцитах CD4 + и как члена герпесвирусов. Поскольку это был шестой изолированный вирус герпеса, впоследствии он был переименован в вирус герпеса человека 6. Известно, что HHV-6, типичный для вируса герпеса, вызывает острую, непрекращающуюся и постоянную инфекцию.
HHV-6 — собирательное название двухцепочечных ДНК-вирусов HHV-6A и HHV-6B.HHV-6A и HHV-6B официально признаны отдельными вирусами, а не вариантами в семействе герпесвирусов. Хотя о HHV-6A известно гораздо меньше, он чаще встречается у хозяев с ослабленным иммунитетом. Напротив, исследования идентифицировали HHV-6B как этиологический агент подпункта экзантемы детской болезни (roseola infantum) [1]. Приобретение HHV-6B довольно распространено среди молодежи и часто наблюдается в отделениях неотложной помощи по всему миру. HHV-6B — это повсеместный вирус, более 90% населения которого инфицировано в течение первых 3 лет жизни.
Этиология
HHV-6A, HHV-6B и HHV-7 все имеют некоторый уровень гомологии с цитомегаловирусом человека (CMV), единственным другим бета-вирусом герпеса человека. [1] И HHV-6A, и HHV-6B реплицируются в Т-клетках. Однако они различаются рецепторами, используемыми для входа в клетки. В отличие от кластерной дифференцировки 46 человека (CD46), используемой вирусом HHV-6A, исследования показывают, что кластерная дифференцировка 134 (CD134) является первичным рецептором для HHV-6B. [2] CD134 экспрессируется только на активированных Т-клетках. [3] Подобно HHV-8, также известному как вирус герпеса, связанный с саркомой Капоши (KSHV) и вирус Эпштейна-Барра (EBV), исследования HHV-6 доказывают, что вирус онкоген и разрушает аутоиммунные клетки.После связывания с соответствующим рецептором HHV-6 устанавливает латентный период в лимфоцитах и обладает сильной иммуномодулирующей способностью, которая может запускать как иммуносупрессивные, так и хронические воспалительные пути. [3]
К зрелому возрасту более 95% населения являются серопозитивными по HHV-6A, HHV-6B или обоим вариантам. Существующие серологические методы неэффективны для изоляции одного варианта от другого. [4] В настоящее время хорошо известно, что HHV-6 является основной причиной младенческой розеолы в детстве. HHV-6B в первую очередь инфицирует младенцев и является основной причиной реактивации вируса как у иммунокомпетентных, так и у иммунокомпрометированных хозяев.[1] В общей популяции подавляющее большинство взрослых с хроническим HHV-6 остаются бессимптомными. Исследования HHV-6 и его роли в центральной нервной системе продолжаются. В одном исследовании более 70% детей с первичной инфекцией HHV-6 имели вирусную ДНК в спинномозговой жидкости. У этих детей одновременно с первичной инфекцией HHV-6 были неврологические осложнения, включая частые фебрильные судороги [5]. Напротив, другие исследователи определили распространенность ДНК HHV-6 только от 0% до 4% в спинномозговой жидкости детей с фебрильными припадками и пациентов со СПИДом с неврологическими симптомами.[5] Эти вирусы связаны с заболеваниями пациентов с ослабленным иммунитетом и могут играть роль в этиологии болезни Ходжкина и других злокачественных новообразований. [4] Кроме того, успешные исследования определили HHV-6A и HHV-6B как источник оппортунистических инфекций у пациентов с ослабленным иммунитетом, включая пациентов с энцефалитом, гепатитом, колитом и пневмонитом. [6]
Эпидемиология
Исследователи определили HHV-6B как этиологический патоген, ответственный за большинство инфекций HHV-6, проявляющихся симптомами.Хотя исследования подтверждают, что большинство людей были инфицированы HHV-6 в какой-то момент своей жизни, первичное инфицирование HHV-6 происходит в течение первых 2 лет. В этой возрастной группе это обычно связано с недифференцированным лихорадочным заболеванием, хотя у подгруппы детей будут проявляться классические проявления младенческой розеолы [1]. В нескольких отчетах о расследованиях зафиксировано снижение серопозитивности с возрастом [4]. Хотя первичная инфекция HHV-6 редко встречается у взрослых, реактивация может произойти в любом возрасте.Инфекция HHV-6 не имеет сексуальной склонности и может встречаться у людей всех рас.
HHV-6 — это повсеместный вирус, обнаруженный во всем мире. В большом проспективном исследовании североамериканских детей пиковый возраст инфицирования HHV-6 был между 6 и 9 месяцами. [1] Как и в США, в Великобритании и Японии от 97 до 100% первичных инфекций возникают в результате HHV-6B. Хотя эпидемиологические отчеты о HHV-6A ограничены, исследования показывают, что инфекция HHV-6A приобретается в более позднем возрасте и что первичное инфицирование этим конкретным вариантом часто протекает бессимптомно.[7] Однако несколько групп зарегистрировали HHV-6A у детей из Африки и США с симптомами. Более того, HHV-6A был идентифицирован как преобладающая форма вируса, выделяемого у ВИЧ-положительных младенцев в эндемичном регионе Африки к югу от Сахары [7]. Среди разных групп населения распространенность серотипа сильно различается. Существует документально подтвержденный показатель серологической распространенности 20% у беременных марокканских женщин и 100% у бессимптомных взрослых китайцев. Распространенность серотипа колебалась примерно от 39 до 80% среди этнически разнообразного взрослого населения из Танзании, Малайзии, Таиланда и Бразилии.[4]
Патофизиология
В целом, первичная инфекция HHV-6 является одной из наиболее распространенных причин острых фебрильных заболеваний у детей раннего возраста. Это также важная причина посещений отделения неотложной помощи, госпитализаций и фебрильных судорог [1]. HHV-6 принадлежит к подсемейству Betaherpesvirinae и роду Roseolovirus . Вирионная частица имеет характерную структуру вируса герпеса, с центральным ядром, содержащим вирусную ДНК, капсид и богатый белком слой тегумента, окруженный мембраной.
Основной клеткой-мишенью для HHV-6 является зрелая CD4 + Т-клетка. [1] Вирус продемонстрировал плейотропное действие на иммунную систему, включая модуляцию функции естественных клеток-киллеров. In vivo HHV-6 в первую очередь инфицирует и реплицируется в лимфоцитах CD4 после присоединения к клеточному рецептору CD46. Посредством рецептор-опосредованного эндоцитоза HHV-6 проникает в клетки с последующей вирусной репликацией (Ablashi). После первичного инфицирования ДНК вируса живет в мононуклеарных клетках периферической крови (PBMC).[1]
Хотя точный механизм передачи HHV-6 все еще исследуется, несколько исследований выявили передачу вируса через слюну. Похоже, что передача через слюну от матери к ребенку является наиболее распространенным путем. В нескольких ранних отчетах описывался инфекционный HHV-6, присутствующий в слюне почти каждого испытуемого. [4] Кроме того, образцы слюны 90% обследованных лиц содержали ДНК HHV-6, в то время как в другом исследовании на основе ПЦР только 3% человек были положительными, хотя 63% образцов биопсии слюнных желез были положительными.[4] Геном HHV-6 также появился в спинномозговой жидкости детей во время первичных и латентных инфекций, а также в мозговом веществе нормальных взрослых при вскрытии, что позволяет предположить, что ЦНС и слюнные железы являются резервуаром латентного вируса и стойкой инфекции. . [1] [4]
История и физика
Хотя различные клинические признаки и заболевания, связанные с HHV-6, все еще исследуются, уже хорошо проведенные исследования подтверждают, что HHV-6 играет значительную роль в заболеваниях центральной нервной системы и у лиц с ослабленным иммунитетом, включая реципиентов трансплантата.[8] Инфекция HHV-6 обычно протекает доброкачественно и проходит самостоятельно. Симптомы — это, как правило, младенцы или взрослые с ослабленным иммунитетом, у которых наблюдается реактивация болезни.
HHV-6B является возбудителем экзантемы subitum (также известной как младенческая розеола), детской болезни, характеризующейся высокой температурой и легкой кожной сыпью, и составляет от 10 до 17% обращений в отделения неотложной помощи у детей с острой лихорадкой. до 36-месячного возраста. [9] Первичная инфекция HHV-6 составляет более 36% всех случаев острой лихорадки у детей в возрасте от 12 до 15 месяцев и почти исключительно вызвана HHV-6B, а не HHV-6A.[9] [8] [10]
Диагноз детской розеолы является клиническим. Его часто вызывает внезапное начало высокой температуры, достигающей 40 ° C (104 F) в течение трех-пяти дней. Во время начальной лихорадочной фазы у некоторых детей будет периорбитальный отек, конъюнктивит или воспаление барабанных перепонок, в то время как многие другие будут активными и здоровыми [9]. Другие симптомы у детей включают лимфаденопатию, симптомы со стороны желудочно-кишечного тракта (ЖКТ), включая дисфункцию печени и гепатит, а также выбухание родничков.[11] У взрослых часто встречаются гепатит и симптомы, характерные для энцефалита. [9] У реципиентов трансплантата симптомы часто включают лихорадку, болезнь «трансплантат против хозяина» (РТПХ), симптомы отторжения трансплантата, интерстициальный пневмонит, миелит и сыпь. [12]
Результаты физикального осмотра обычно соответствуют ранее описанным симптомам. У детей с пониженной температурой лихорадки часто возникает бледная пятнисто-папулезная сыпь розово-розового цвета размером примерно от 2 до 5 мм с окружающим ореолом.Сыпь обычно сохраняется в течение одного-двух дней и часто распространяется центробежно. Однако есть задокументированные случаи лихорадки без сыпи [13]. Воспаление барабанных перепонок и признаки инфекций верхних или нижних дыхательных путей часто встречаются у детей, в то время как у взрослых при физикальном обследовании могут отмечаться лихорадка, гепатоспленомегалия и лимфаденопатия [12].
Оценка
Вирус герпеса человека 6 (HHV-6) может быть диагностирован с помощью полимеразной цепной реакции (ПЦР), серологии или вирусных культур, причем ПЦР является преобладающим методом.[12] Однако лабораторное тестирование у иммунокомпетентных людей вряд ли возможно из-за самоограничивающего характера заболевания. Слюна является основным резервуаром передачи вируса, поскольку она часто выделяется в слюнных железах. Хотя сообщений о передаче вируса при переливании крови и грудном вскармливании не поступало, документально подтверждено наличие HHV-6 после трансплантации органов [12]. Большинство исследователей твердо убеждены в том, что инфицирование HHV-6B происходит в раннем возрасте, а инфицирование HHV-6A развивается позже.Оба варианта вируса были одновременно обнаружены у взрослых, что позволяет предположить, что вирусы хронически инфицируют множество людей.
Лабораторные исследования HHV-6 могут показать лейкоцитоз, лейкопению и анемию. [13] У пациентов с трансплантацией почки и пациентов с дисфункцией печени следует проводить исследования почек и печени соответственно, чтобы исключить электролитные нарушения и гепатит.
Показания для радиологического воображения зависят от клинических проявлений, особенно у лиц с ослабленным иммунитетом.Рентгенография грудной клетки может быть проведена, чтобы исключить другие этиологии у взрослых, включая пневмонию и пневмонит. У детей потребность в визуализации возникает реже. Компьютерная томография (КТ) головы с контрастом или без него может быть проведена для поиска других излечимых заболеваний. В случаях поражения центральной нервной системы может быть проведена люмбальная пункция. Инфекция ЦНС HHV-6 часто имеет легкий плеоцитоз с повышенным содержанием белка. ЦСЖ можно отправить на ПЦР-исследования HHV-6 для подтверждения диагноза.[14]
Лечение / ведение
В настоящее время не существует утвержденного соединения, предназначенного исключительно для лечения HHV-6, и нет вакцины. [8] Как правило, не рекомендуется проводить противовирусную профилактику инфекции HHV-6. Вместо этого рекомендуется проводить раннее противовирусное лечение, особенно в случаях энцефалита HHV-6. Рекомендуется терапия первой линии ганцикловиром и фоскарнетом внутривенно, продолжительность лечения составляет от 3 до 4 недель [15]. У пациентов, перенесших трансплантацию стволовых клеток, лечение ганцикловиром имеет документально подтвержденные преимущества и является рекомендуемым противовирусным препаратом выбора.[15]
Инфекции HHV-6 у иммунокомпетентных детей проходят самостоятельно и не требуют лечения. Лечение младенцев с младенческой розеолой обычно является поддерживающим. [12] Жаропонижающие средства, такие как парацетамол или ибупрофен, рекомендуются для лечения сильной лихорадки и лиц с риском фебрильных судорог. Если происходит фебрильный припадок, в противоэпилептических средствах нет необходимости. Лица, у которых присутствует инфекция HHV-6, проявляющаяся поражением ЦНС, включая фебрильные судороги, должны быть госпитализированы.
Дифференциальный диагноз
Дифференциальный диагноз включает:
Инфекционный мононуклеоз
Цитомегаловирусная инфекция
Вирусный гепатит
Вирус простого герпеса
Вирусная пневмония
Медикаментозная сыпь с эозинофилией и системными симптомами (синдром DRESS)
менинговая инфекция
У детей с классической детской розеолой этиологический патоген является HHV-6.Однако некоторые другие заболевания могут вызывать жар и сыпь. Более серьезные и менее доброкачественные причины таких симптомов требуют исключения. У иммунокомпетентных взрослых инфекция HHV-6 проявляется аналогично мононуклеозу. Таким образом, следует исключить ВЭБ и ЦМВ. Пациенты с ослабленным иммунитетом, особенно те, кто получает трансплантацию органов, и больные СПИДом, как правило, имеют симптомы. Эта группа людей с заболеванием HHV-6 часто одновременно инфицирована ЦМВ, и противовирусное лечение следует начинать незамедлительно.HHV-6 коррелирует с несколькими другими заболеваниями, включая гепатит, простой герпес, менингит, краснуху, вирусную пневмонию и синдром DRESS. [16] Кроме того, имеется документация по HHV-6 в случаях рассеянного склероза энцефалита и интерстициального пневмонита. [17] Стоит отметить, что только HHV-6A ассоциируется с тиреоидитом Хашимото. [12]
Прогноз
Как правило, первичная инфекция HHV-6 проходит самостоятельно, и те, кто обладает иммунитетом, выживают без последствий.В сообщениях описывается более тяжелое заболевание у лиц с ослабленным иммунитетом. Имеются документы о пневмоните, гепатите и отторжении органов у пациентов, перенесших трансплантацию, со смертельным исходом у пациентов с энцефалитом и менингоэнцефалитом [18]. Аналогичным образом, в Японии в 2003–2004 годах обследование пациентов с энцефалитом, ассоциированным с экзантемой, имело необычно плохой прогноз [19] с зарегистрированными летальными исходами у двух детей с энцефалопатией, вторичной по отношению к инфекции HHV-6. У детей было обнаружено генетическое нарушение митохондрий.[20]
Осложнения
Обычно первичная инфекция HHV-6 протекает доброкачественно со спонтанным разрешением в течение 5–7 дней. Наиболее частым осложнением детской розеолы являются фебрильные судороги. Дополнительные осложнения часто возникают из-за нейротрофических эффектов HHV-6, что подчеркивается в случаях, когда центральная нервная система оказывается под угрозой, например, в случаях менингоэнцефалита и энцефалопатии. В этих случаях вирус захватывает мозг во время первичной инфекции и может оставаться в спящем состоянии в тканях мозга.[21] Впоследствии появляются записи о случаях острого или подострого энцефалита, иногда связанного с диффузной или мультифокальной демиелинизацией. [4] HHV-6 нечасто вызывает оппортунистическую инфекцию у лиц с ослабленным иммунитетом. Активность HHV-6A и HHV-6B была обнаружена после трансплантации почек, печени и костного мозга (BMT). [4]
Сдерживание и обучение пациентов
У здорового ребенка с младенческой розеолой образование родителей имеет решающее значение для уменьшения беспокойства по поводу лихорадки и возможных фебрильных судорог.Важность поддерживающей терапии с жаропонижающими средствами и бесполезность антибиотиков требует объяснения. У лиц с ослабленным иммунитетом сложные симптомы и другие вторичные вирусные заболевания, которые могут сопровождать инфекцию HHV-6, являются пунктами консультирования с упором на раннее обращение за медицинской помощью при появлении симптомов.
Жемчуг и другие проблемы
Принято считать, что HHV-6B является причинным вариантом, ответственным за большинство первичных инфекций, в то время как HHV-6A приобретается после HHV-6B в результате бессимптомной инфекции.[22] 1. Отличие случаев первичной инфекции HHV-6 с типичной детской сыпью при розеолах от других болезней является ключом к устранению более серьезных диагнозов. Наиболее частым осложнением инфекции HHV-6 является младенческая розеола, а на HHV-6 приходится примерно от 10 до 20% фебрильных заболеваний у детей в возрасте от 6 месяцев до 3 лет. Лихорадочные судороги, симптомы со стороны желудочно-кишечного тракта и дыхательных путей встречаются реже и обычно проходят самостоятельно. Поддерживающая терапия с отдыхом и гидратацией является принятым подходом к лечению в этой подгруппе.Подобно другим вирусам герпеса, HHV-6 реплицируется в слюнных железах и скрыт в мононуклеарных клетках периферической крови. Диагностика HHV-6 с помощью лабораторных исследований у иммунокомпетентного хозяина обычно не требуется. Однако ПЦР, серологические исследования или вирусный посев часто необходимы для лиц с ослабленным иммунитетом, подозреваемых в наличии HHV-6.
Инфекция HHV-6 коррелирует с более тяжелыми заболеваниями, включая мононуклеоз, колит, миокардит и гепатит, в дополнение к задокументированным осложнениям со стороны центральной нервной системы в виде энцефалита и менингоэнцефалита.Раннее распознавание и лечение неврологических осложнений являются неотъемлемой частью предотвращения неблагоприятных исходов. Дети и взрослые, больные раком, получившие аллогенные трансплантаты, а также люди с иммуносупрессивными расстройствами, подвержены риску реактивации HHV-6. В таких случаях у людей может появиться лихорадка, сыпь и уменьшение количества циркулирующих гранулоцитов и эритроидных клеток. [12] Хотя не существует одобренных методов лечения только инфекции HHV-6, противовирусное лечение ганцикловиром и / или фоскарнетом оказалось успешным в лечении ранее описанных неврологических осложнений.
Улучшение результатов команды здравоохранения
HHV-6 обычно проявляется сыпью у детей, обращающихся в отделение неотложной помощи и у педиатров. Хотя определение высыпаний может быть сложной задачей, выделение конкретных сопутствующих симптомов обязательно, чтобы различать более токсичные и доброкачественные заболевания. Большинство инфекций HHV-6 протекает бессимптомно, преходяще и не требует противовирусного лечения. [Уровень II] Педиатрическая консультация — это рекомендация для младенцев с младенческой розеолой, у которых наблюдаются фебрильные судороги.Известны осложнения HHV-6, и тем людям с более угрожающими признаками и симптомами, включая изменения психического статуса и органную недостаточность, будет полезен межпрофессиональный подход. В таких случаях необходима информация от врачей-неврологов и инфекционистов. При подозрении на сердечную недостаточность, ассоциированную с HHV-6, ранняя консультация кардиолога имеет решающее значение для лечения инфекционного миокардита у иммунокомпетентных взрослых пациентов. [23] [Уровень IV]
Скоординированный уход квалифицированных медсестер целесообразен для наблюдения за ухудшением состояния и изменениями жизненно важных функций.Точно так же не следует сбрасывать со счетов помощь лаборатории в ускорении предпочтительных методов обнаружения вирусов в крови или спинномозговой жидкости с помощью ПЦР или вирусных антигенов в тканях с помощью иммуногистохимии. (Уровень II) Наконец, фармацевт является неотъемлемой частью обеспечения антивирусной терапии ганцикловиром и фоскарнетом при энцефалите, ассоциированном с HHV-6. [24] [Уровень III] Совместно рекомендуется ориентированный на пациента межпрофессиональный командный подход среди клиницистов, включая врачей, лабораторию, специально обученных медсестер и аптек, которые открыто общаются как медицинская бригада, для улучшения результатов в сложных случаях и обеспечения наилучшего исходы для пациентов.[Уровень 5]
Рисунок
Это гистологический слайд вируса герпеса человека-6 (HHV-6), ранее известного как HBLV, типа вируса герпеса, который был обнаружен в октябре 1986 года. Это микрофотография инфицированного человека. клетки с телами включения как в ядре, так и в цитоплазме. (подробнее …)
Ссылки
- 1.
- Caserta MT, Mock DJ, Dewhurst S. Human herpesvirus 6. Clin Infect Dis. 2001 15 сентября; 33 (6): 829-33. [PubMed: 11512088]
- 2.
- Кладовая SN, Medveczky PG. Задержка, интеграция и реактивация вируса герпеса человека-6. Вирусы. 2017 г. 24 июля; 9 (7) [Бесплатная статья PMC: PMC5537686] [PubMed: 28737715]
- 3.
- Элиассен Э., Лум Э., Притчетт Дж., Онгради Дж., Крюгер Дж., Кроуфорд-младший, Фан Т.Л., Аблаши Д., Hudnall SD. Человеческий герпесвирус 6 и злокачественные новообразования: обзор. Фасад Онкол. 2018; 8: 512. [Бесплатная статья PMC: PMC6277865] [PubMed: 30542640]
- 4.
- Браун Д.К., Домингес Дж., Пеллетт ЧП. Вирус герпеса человека 6.Clin Microbiol Rev.1997 июл; 10 (3): 521-67. [Бесплатная статья PMC: PMC172933] [PubMed: 9227865]
- 5.
- Ансари А., Ли С., Абзуг М.Дж., Вайнберг А. Герпесвирусы человека 6 и 7 и инфекция центральной нервной системы у детей. Emerg Infect Dis. 2004 августа; 10 (8): 1450-4. [Бесплатная статья PMC: PMC3320425] [PubMed: 15496247]
- 6.
- Agut H, Bonnafous P, Gautheret-Dejean A. Обновленная информация об инфекциях герпесвирусами человека 6A, 6B и 7. Med Mal Infect. 2017 Март; 47 (2): 83-91. [PubMed: 27773488]
- 7.
- Ablashi D, Agut H, Alvarez-Lafuente R, Clark DA, Dewhurst S, DiLuca D, Flamand L, Frenkel N, Gallo R, Gompels UA, Höllsberg P, Jacobson S, Luppi M, Lusso P, Malzatiky M, Medvecky P, Mori Y, Pellett PE, Pritchett JC, Yamanishi K, Yoshikawa T. Классификация HHV-6A и HHV-6B как отдельных вирусов. Arch Virol. 2014 Май; 159 (5): 863-70. [Бесплатная статья PMC: PMC4750402] [PubMed: 24193951]
- 8.
- Де Болле Л., Нейсенс Л., Де Клерк Э. Обновленная информация о биологии вируса герпеса 6 человека, клинических особенностях и терапии.Clin Microbiol Rev.2005, январь; 18 (1): 217-45. [Бесплатная статья PMC: PMC544175] [PubMed: 15653828]
- 9.
- Tesini BL, Epstein LG, Caserta MT. Клинические последствия первичного инфицирования розеоловирусами. Curr Opin Virol. 2014 декабрь; 9: 91-6. [Бесплатная статья PMC: PMC4267952] [PubMed: 25462439]
- 10.
- Hall CB, Long CE, Schnabel KC, Caserta MT, McIntyre KM, Costanzo MA, Knott A, Dewhurst S, Insel RA, Epstein LG. Инфекция герпеса человека-6 у детей. Проспективное исследование осложнений и реактивации.N Engl J Med. 18 августа 1994; 331 (7): 432-8. [PubMed: 8035839]
- 11.
- Кристофоро Т., Ле Н.К., Рай-Бэкингем С., Хадсон В.Б., Кэрролл Л.Ф. Не очень мягкое пятно: патофизиология выпуклого родничка в ассоциации с розеолой. Педиатр Emerg Care. 2020 Октябрь; 36 (10): e576-e578. [PubMed: 29489601]
- 12.
- Agut H, Bonnafous P, Gautheret-Dejean A. Лабораторные и клинические аспекты инфекций вируса герпеса человека 6. Clin Microbiol Rev.2015, апрель; 28 (2): 313-35. [Бесплатная статья PMC: PMC4402955] [PubMed: 25762531]
- 13.
- Арнеж М., Авшич-Люпанц Т., Уршич Т., Петровец М. Инфекция, вызванная вирусом герпеса человека 6, проявляется как острое лихорадочное заболевание, связанное с тромбоцитопенией и лейкопенией. Case Rep Pediatr. 2016; 2016: 2483183. [Бесплатная статья PMC: PMC5131235] [PubMed: 27980872]
- 14.
- Явариан Дж., Гаввами Н., Мамиши С. Обнаружение вируса герпеса человека 6 в спинномозговой жидкости у детей с возможным энцефалитом. Jundishapur J Microbiol. 2014 сентябрь; 7 (9): e11821. [Бесплатная статья PMC: PMC4255374] [PubMed: 25485059]
- 15.
- Причард Миннесота, Уитли Р.Дж. Разработка новых методов лечения вируса герпеса человека 6. Curr Opin Virol. 2014 декабрь; 9: 148-53. [Бесплатная статья PMC: PMC4267975] [PubMed: 25462447]
- 16.
- Шиохара Т., Иидзима М., Икэдзава З., Хашимото К. Диагноз синдрома DRESS был достаточно установлен на основании типичных клинических признаков и вирусной реактивации . Br J Dermatol. 2007 Май; 156 (5): 1083-4. [PubMed: 17381452]
- 17.
- Marks GL, Nolan PE, Erlich KS, Ellis MN.Распространение через слизистую оболочку устойчивого к ацикловиру вируса простого герпеса у пациента со СПИДом. Rev Infect Dis. 1989 май-июнь; 11 (3): 474-6. [PubMed: 2546244]
- 18.
- Beović B, Pecaric-Meglic N, Marin J, Bedernjak J, Muzlovic I., Cizman M. Смертельный мультифокальный менингоэнцефалит, связанный с вирусом герпеса человека 6, у взрослой пациентки. Scand J Infect Dis. 2001; 33 (12): 942-4. [PubMed: 11868775]
- 19.
- Йошикава Т., Охаши М., Мияке Ф., Фудзита А., Усуи С., Сугата К., Суга С., Хашимото С., Асано Ю.Энцефалит, ассоциированный с Exanthem subitum: общенациональное исследование в Японии. Pediatr Neurol. 2009 ноя; 41 (5): 353-8. [PubMed: 19818937]
- 20.
- Аль-Зубейди Д., Тангарадж М., Патак С., Кай С., Шлаггар Б.Л., Сторч Г.А., Грейндж Д.К., Уотсон М.Э. Смертельный энцефалит, связанный с вирусом герпеса 6 человека, у двух мальчиков с основными митохондриальными нарушениями POLG. Pediatr Neurol. 2014 сентябрь; 51 (3): 448-52. [PubMed: 25160553]
- 21.
- Mason EE, Printen KJ. Метаболические аспекты восстановления тонкой кишки после тощей кишки.Surg Gynecol Obstet. 1976 Февраль; 142 (2): 177-83. [PubMed: 813311]
- 22.
- de Andrade RP. Многоцентровая клиническая оценка новой монофазной комбинации: Minulet (гестоден и этинилэстрадиол). Int J Fertil. 1989 Сентябрь; 34 Дополнение: 22-30. [PubMed: 2576253]
- 23.
- Ashrafpoor G, Andréoletti L, Bruneval P, Macron L, Azarine A, Lepillier A, Danchin N, Mousseaux E, Redheuil A. Миокардит, вызванный вирусом герпеса 6 человека, у иммунокомпетентного взрослого человека. кардиомагнитный резонанс в мультидисциплинарном подходе.Тираж. 2013 декабря 03; 128 (23): e445-7. [PubMed: 24297820]
- 24.
- Ле Дж, Гант С., Сообщество специалистов по инфекционным заболеваниям AST. Человеческий герпесвирус 6, 7 и 8 при трансплантации твердых органов. Am J Transplant. 2013 Март; 13 Дополнение 4: 128-37. [PubMed: 23465006]
Вирус герпеса человека 6 — HealthyChildren.org
Розеола, также называемая exanthem subitum и шестая болезнь, является распространенной контагиозной вирусной инфекцией, вызываемой вирусом герпеса человека (HHV) 6. Этот штамм герпеса вирус отличается от вируса, вызывающего герпес или генитальный герпес.
Розеола чаще всего встречается у детей в возрасте от 6 до 24 месяцев. У молодых обычно высокая температура (выше 103 ° F или 39,5 ° C) в течение 3–7 дней. После того, как температура исчезнет, на туловище появится сыпь, которая распространится на руки, ноги, спину и лицо. Эта сыпь обычно длится несколько часов, но в некоторых случаях сохраняется в течение нескольких дней. У некоторых детей бывают судороги, связанные с высокой температурой, но чаще лихорадка сопровождается снижением аппетита, легким кашлем и насморком.Такая картина, когда высокая температура сменяется сыпью, поможет вашему педиатру поставить диагноз этой инфекции. Однако HHV-6 также может вызывать лихорадку без сыпи или сыпь без лихорадки.
Вирус герпеса человека 6 передается от человека к человеку через выделения из дыхательных путей. Вы можете снизить вероятность заражения вашего ребенка, если будете тщательно и часто мыть руки. Специального лечения розеолы не существует, и обычно она проходит, не вызывая никаких осложнений.Если у вашего ребенка повышенная температура, попросите своего педиатра снизить температуру с помощью ацетаминофена.
Подобные симптомы связаны с другой герпесвирусной инфекцией, вызываемой HHV-7. Многие дети, инфицированные HHV-7, имеют лишь легкое заболевание. Вирус герпеса человека 7 может быть причиной повторных или повторных случаев розеолы, которые первоначально были вызваны HHV-6. Как и все вирусы семейства герпесных, эти вирусы остаются в организме на всю жизнь. Если иммунная система человека ослабляется из-за болезни или лекарств, вирус может появиться снова, вызывая лихорадку и инфекцию в легких или головном мозге.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать лечение по-разному, исходя из индивидуальных фактов и обстоятельств.
Вирус герпеса человека 6: новый патоген — том 5, номер 3 — июнь 1999 г. — журнал Emerging Infectious Diseases
Открытие вируса герпеса человека 6 (HHV-6)
Первоначально обозначенный как HBLV для B-лимфотропного вируса человека, HHV-6 был случайно выделен в 1986 году из стимулированных интерлейкином 2 мононуклеарных клеток периферической крови (PBMC) пациентов со СПИДом или лимфопролиферативными расстройствами (1).Культуры PBMC проявляли необычный цитопатический эффект, характеризующийся увеличением размеров баллоноподобных клеток. Возбудитель был идентифицирован как вирус герпеса с помощью электронной микроскопии и отсутствия перекрестной гибридизации с рядом вирусов герпеса человека (2). Штамм GS является прототипом первых изолятов. Два дополнительных изолята лимфотропных вирусов герпеса человека, U1102 и Gambian, генетически сходные с HBLV, были получены через год от PBMC больных СПИДом в Африке. Все изоляты могли расти в Т-клетках (CEM, H9, Jurkat), в моноцитах (HL60, U937), в глиальных клетках (HED), а также в линиях B-клеток (Raji, RAMOS, L4, WHPT) ( 3,4).Новый вариант, Z29, который, как впоследствии было показано, отличается от GS-подобных штаммов по структуре эндонуклеаз рестрикции, был выделен из PBMC пациентов со СПИДом (5). Клетки, поддерживающие рост вируса, были охарактеризованы как CD4 + Т-лимфоциты (6). Обозначение HHV-6 было предложено через год после открытия первого изолята, чтобы соответствовать правилам, установленным Международным комитетом по таксономии вирусов (7).
Более 100 дополнительных штаммов HHV-6 было выделено из PBMC детей с субитумным или фебрильным синдромом (8), из бесклеточной слюны здоровых или ВИЧ-инфицированных пациентов (9,10), из PBMC пациентов с хронической усталостью. синдрома (CFS) (11), и из PBMC здоровых взрослых — эти PBMC культивировали для выделения вируса герпеса 7 (HHV-7) человека (12).
HHV-6 и HHV-7 принадлежат к роду Roseolovirus подсемейства ß-герпесвирусов; Виды HHV-6 делятся на два варианта: HHV-6A и HHV-6B. Частица вириона имеет размер от 160 до 200 нм и имеет морфологические особенности, типичные для частиц вириона герпеса (центральное ядро, содержащее вирусную ДНК, капсид размером от 90 до 110 нм и слой тегумента, окруженный мембранной структурой) (13 ). Кратко опишем ключевые особенности.
Рисунок 1
Рисунок 1. Схематическое изображение геномов HHV-6 и HHV-7.Геномы колинеарны. Гомологии составляют от 46,6% до 84,9%. Красные блоки представляют основные гены вируса герпеса, пронумерованные от I до VII. Желтые блоки представляют …
геномов HHV-6A длиной от 159 до 170 т.п.н. Согласно секвенированию, геном штамма U1102 имеет длину 159 т.п.н. (14); геном HHV-6B секвенирован лишь частично. Семь генных блоков в центральной области (I-VII), обозначенные как основные гены вируса герпеса, являются общими для всех Herpesviridae. Другой блок, охватывающий открытые рамки считывания (ORF) от U2 до U14, содержит гены, специфичные для ß-герпесвирусов.Еще одна область, охватывающая ORF U15-U25, содержит гены, специфичные для рода Roseolovirus . Три гена (U22, U83, U94) специфичны для HHV-6 и отсутствуют для HHV-7 (рис. 1). Наиболее близка к гомологии и сходству в организации генома с HHV-7 и рядом с цитомегаловирусом человека (HCMV). Сходство аминокислот с HHV-7 составляет от 46,6% до 84,9% и с HCMV от 41,0% до 75,8% (14,16). Геном HHV-6 состоит из уникальной последовательности (от 85% до 90% генома), заключенной в скобки с прямыми повторами (от 10% до 15% генома), которые содержат последовательности расщепления и упаковки pac -1 и pac. -2 и единственный ориджин репликации (OriLyt), расположенный в 70 кб генома.Количество предсказанных ORF, 102 или 85, варьируется в зависимости от значений, используемых для определения ORF, и было отнесено в основном на основании сходства с аналогами HCMV (14) или HHV-7 (17). К настоящему времени охарактеризовано несколько генных продуктов. Они включают немедленный ранний ген IE-A, который вместе с IE-B составляет локус IE, область с высокой степенью сплайсинга с расположением, аналогичным таковому у HCMV (18); ген U3, гомолог гена HCMV U L 24, с трансактивирующей активностью (19); белок, связывающий источник (20), протеаза U53 (21); и p100, также обозначаемый как p101, высокоиммуногенный и, скорее всего, составляющий тегумента (22,23).Кроме того, HHV-6 (но не HHV-7) несет гомолог аденоассоциированного гена rep парвовируса 2 типа (24), который транскрибируется в латентно инфицированных клетках (25). Недавно белок U12 был признан рецептором ß-хемокинов (26). Основное внимание уделяется области гликопротеинов. Было идентифицировано пять гликопротеинов: gB (U39, gp116) (27-30), gH (U48, gp100) (31) и gL (U82, gp80), которые образуют по крайней мере гетеродимер, gM (U72) и gp82- 105 (U100) (29,30,32,33). Было показано, что gB и gH / gL являются составляющими вириона, а антитело к gH может нейтрализовать инфекционность вириона и образование синцитий, что предполагает роль gH в проникновении вируса и в индуцированном вирусом слиянии клеток (31).Последовательность генома HHV-6 предсказывает локус гликопротеинов U20-U24 и U85, которые специфичны для рода Roseolovirus (14), но эти белки еще не идентифицированы. U20 и U85 имеют предсказанную структуру иммуноглобулина.
Вариант A и вариант B Штаммы HHV-6
Frenkel и соавторы (34), Ablashi et al. (35) и Aubin et al. (36) были первыми, кто обнаружил, что изоляты HHV-6 обнаруживают генетические и фенотипические вариации. Все штаммы, полученные до сих пор, делятся на две группы, вариант A и вариант B, чья геномная организация, по-видимому, перекрывается.Вирусы, принадлежащие к двум вариантам, различаются по нескольким свойствам. Различия в сайтах расщепления рестрикционной эндонуклеазой разбросаны по всем геномам. Степень гомологии на уровне нуклеотидов варьирует от 99% до 95% для наиболее консервативных генов, расположенных в центре генома, до примерно 75% для наиболее расходящихся частей, расположенных в непосредственной ранней области. Основные различия в биологических свойствах касаются клеточного тропизма in vitro, регуляции транскрипции и паттернов сплайсинга, реактивности по отношению к некоторым MAb, направленной на вариант-специфические эпитопы (29,34,35).Обычно вирусы варианта A реплицируются в клетках HSB-2, тогда как вирусы варианта B растут в менее дифференцированных линиях Т-клеток Molt3. Вирусы варианта B растут до более высоких урожаев, чем вирусы варианта A, в первичных астроцитах плода человека и требуют PBMC, активируемых IL-2 и фитогемагглютинином. Различия между двумя вариантами влияют на регуляцию транскрипции некоторых ORF непосредственного раннего региона-B и-A (U16, U17, U91) и паттерн сплайсинга ORF U18-U20 (37). Различия в отношении инфицирования людей (эпидемиология, корреляция с патологическими признаками, тропизм тканей) подробно описаны ниже и в таблице.
Все штаммы относятся к той или иной группе вариантов. Нет никаких доказательств рекомбинации или генетического градиента, что позволяет предположить, что in vivo две группы вирусов занимают разные экологические ниши. Любой изолят, характеризующийся более чем одним маркером, однозначно отнесен к той или иной группе вариантов. Обозначение двух групп как вариантов было очень спорным и противоречивым (38). Ключевой вопрос заключается в том, соответствуют ли два варианта критериям, определенным Международным комитетом по таксономии вирусов для классификации в качестве разных видов (13).По нашему мнению, обобщенная информация указывает на то, что две группы вариантов могут относиться к разным видам; поэтому вопрос о номенклатуре следует пересмотреть.
Естественная история инфекции HHV-6
Инфекция HHV-6 очень распространена, ее серологическая распространенность приближается к 100%. Исключения, если они подтвердятся, представлены странами (например, Марокко), где распространенность серотипов намного ниже (20%) (39). Титры антител высоки у новорожденных детей, падают через 3–9 месяцев после рождения, затем на короткое время снова повышаются и остаются повышенными до 60 лет и старше.Эта закономерность указывает на то, что новорожденные несут материнские антитела, и первичная инфекция происходит в первые 3 года жизни, чаще всего в первый год. Трансплацентарные инфекции очень редки, но могут способствовать серопозитивности по HHV-6 у новорожденных (40).
Рисунок 2
Рисунок 2. Стадии естественного течения инфекции HHV-6: I. Первичная инфекция возникает у младенцев, может привести к появлению экзантемы subitum (сыпь на груди у ребенка) и распространяется на органы. Знаки вопроса обозначают…
В естественном течении инфекции HHV-6 можно выделить три стадии (рис. 2). Первый представлен острой первичной инфекцией у младенцев. Второй встречается у здоровых детей и взрослых; вирус реплицируется в слюнных железах и секретируется в слюну (для HHV-6B), не вызывая какой-либо очевидной патологии, остается латентным, по крайней мере, в лимфоцитах и моноцитах, и сохраняется в различных тканях, возможно, с низким уровнем репликации. Третья стадия встречается нечасто, обычно у людей с ослабленным иммунитетом, и связана с реактивацией вируса в латентном периоде или повторным заражением.Другие патологические состояния, в основном рассеянный склероз, опухоли и CFS, были связаны с HHV-6.
Первичная инфекция
Однозначное доказательство того, что первичная инфекция HHV-6B вызывает младенческую розеолу, было предоставлено Yamanishi et al. (8), которые исследовали корреляцию между сероконверсией к HHV-6B и детскими инфекционными заболеваниями и обнаружили, что сероконверсия происходит одновременно с roseola infantum, также называемой exanthem subitum или шестым заболеванием, распространенным легким острым лихорадочным заболеванием младенцев.Лихорадка длится несколько дней и иногда сопровождается макулопапулезной сыпью, которая проходит самопроизвольно. Первичная инфекция может протекать бессимптомно или вызывать другие клинические проявления, кроме классической exanthem subitum. В четырех исследованиях дети, госпитализированные в клиники неотложной помощи с лихорадочными заболеваниями, были положительны по HHV-6 примерно в 10–15% случаев, а в одном исследовании — примерно в 45% случаев, что определялось выделением вируса, сероконверсией или обнаружением вирусной инфекции. Последовательности ДНК в PBMC. Помимо сыпи, симптомы включали отит, желудочно-кишечную или респираторную недостаточность и судороги (41–44).Осложнения первичных инфекций HHV-6 необычны и редко приводят к летальному исходу; они были описаны в основном как сообщения о клинических случаях и включают вторжение в центральную нервную систему (ЦНС) с припадками, гиперпирексией, рвотой, диареей, кашлем, эмофагоцитарным синдромом, молниеносным гепатитом, диссеминированной инфекцией и гепатоспленомегалией. Эти осложнения предполагают, что вирус может распространяться на ряд органов, которые могут представлять собой потенциальные участки персистенции вируса или латентного периода и (впоследствии) реактивации. Например, судороги и другие осложнения со стороны ЦНС являются явным признаком инвазии этого органа и хорошо коррелируют с нейротропизмом HHV-6.Первичная инфекция HHV-6 составляет от 10% до 45% случаев у детей, поступивших в клиники неотложной помощи с лихорадкой, и 1% случаев у госпитализированных детей (42).
HHV-6B — не единственный возбудитель exanthem subitum. Иногда HHV-7 может вызывать лихорадку с сыпью или без нее. Первичное инфицирование HHV-7 происходит в несколько более позднем возрасте, чем HHV-6B. Первоначально предполагалось, что патологические проявления, наблюдаемые при первичной инфекции HHV-7, были следствием реактивации HHV-6 вирусом HHV-7.Доказательства того, что HHV-7 сам по себе вызывает экзантематическое заболевание, хотя и реже, чем HHV-6B, основаны на обнаружении того, что дети с exanthem subitum сероконверсией к HHV-7, но остаются HHV-6B-отрицательными (45,46).
Вирус, реплицирующийся в слюнных железах и секретируемый со слюной, является эпидемиологически доказанным источником передачи. Предлагались и другие пути передачи, но их еще предстоит доказать. ДНК HHV-6B была выделена из тканей и секрета шейки матки (47–49), но дети, рожденные от матерей с положительными мазками из шейки матки, не заразились инфекцией.Внутриутробная передача была подтверждена положительным результатом полимеразной цепной реакции (ПЦР) некультивируемых мононуклеарных клеток (CBMC) пуповинной крови в 1,6% случаев и случаем аборта у HHV-6-положительного плода (40). Передача при грудном вскармливании также сомнительна, поскольку ДНК HHV-6, в отличие от HHV-7, не обнаруживается в грудном молоке (50). Интеграция генома HHV-6 в лимфобласты больного лейкемией и его потомства повысила вероятность генетической передачи. Поскольку вертикальная передача не наблюдалась в других случаях интеграции генома, присутствие ДНК HHV-6 у потомства было альтернативно интерпретировано как тенденция HHV-6 к интеграции в определенных хромосомных локусах (51,52).
За исключением сильной связи HHV-6A с фебрильными синдромами у замбийских детей (43), что может отражать эндемический вариант A горячей точки, HHV-6A редко был изолирован или обнаружен у детей с первичной инфекцией HHV-6 ( 53,54). Возраст, в котором возникает первичная инфекция HHV-6A, и явно связанные с ней заболевания не установлены.
HHV-6 у здоровых людей
Вторая стадия инфекции HHV-6 встречается у здоровых детей и взрослых, у которых вирус активно реплицируется в слюнных железах, латентен по крайней мере в лимфоцитах и моноцитах и сохраняется в различных тканях.Репликация в слюнных железах — наблюдаемая для HHV-6B, но не для HHV-6A (9,10,47) — определяет путь передачи и высокую частоту обнаружения и выделения вируса в слюне. Лимфоциты и, вероятно, моноциты представляют два известных латентных участка, поскольку вирус может реактивироваться из PBMC и прикрепленных моноцитов при культивировании (55), а последовательности вирусной ДНК обнаруживаются в PBMC у 90% населения. Вероятно, существуют дополнительные латентные сайты, поскольку вирус или вирусные последовательности могут быть легко обнаружены в ряде тканей.Форма латентной инфекции представлена интеграцией генома HHV-6 в хромосомы хозяина (51,52). Персистенция HHV-6 в клетках и тканях обсуждается в разделе «Тропизм in vivo».
Недостающим звеном в нашем понимании естественной истории инфекции HHV-6 является источник вируса, который распространяется на органы. Моноциты имеют короткий период полураспада; они могут быть переносчиками вируса, распространяющимся на органы, но сами должны быть инфицированы. Возможным источником может быть вирус, продуцируемый слюнными железами.В одном случае было обнаружено, что ранние клетки-предшественники костного мозга латентно инфицированы in vivo (56), что повышает вероятность того, что они могут представлять латентный участок, и, как следствие, при реактивации вируса с латентного периода, альтернативный источник, с помощью которого вирус распространяется на ткани.
У иммунокомпетентных взрослых инфицирование или реактивация HHV-6 на участках, отличных от слюнных желез, встречается редко. Иногда инфекция приводит к лимфоаденопатии, молниеносному гепатиту, мононуклеозоподобному синдрому или генерализованной инфекции.
HHV-6 при иммуносупрессии
Третья стадия инфекции HHV-6, которая возникает при иммуносупрессии, ответственна за наиболее серьезные клинические проявления, связанные с инфекцией HHV-6 или реактивацией. Лица, входящие в группу риска, — это получатели трансплантатов костного мозга, почек и печени, у которых иммуносупрессия индуцируется по терапевтическим причинам. У этих пациентов инфекция или реактивация HHV-6 может привести к подавлению костного мозга, пневмониту, энцефалиту, энцефалопатии, гепатиту, лихорадке и кожной сыпи или может осложнить приживление трансплантированного органа и привести к отторжению и смерти.По мере увеличения числа лиц, перенесших трансплантацию органов и, следовательно, подвергшихся терапевтической иммуносупрессии, число лиц, находящихся в группе риска, увеличивается. Оценка вклада HHV-6 в посттрансплантационные осложнения затрудняется присутствием других условно-патогенных вирусов и недостаточностью тщательных исследований всех вирусов, присутствующих в этих органах. Таким образом, большинство сообщений о присутствии HHV-6 не касалось того факта, что реактивация HCMV часто встречается у реципиентов трансплантата (особенно в почках) и может происходить вместе с реактивацией HHV-6.При детальном исследовании синергетический эффект HHV-6 и HCMV был очевиден у реципиентов почечного трансплантата, а одновременное обнаружение ДНК HHV-6 и HCMV в моче или сыворотке или антител к иммуноглобулину (Ig) M было самым сильным прогностическим фактором. вирусное заболевание и тяжесть заболевания (57,58). HHV-7 также может реактивироваться у реципиентов трансплантата (59), опять же самостоятельно и в сочетании с HHV-6 или HCMV. Каждый из этих вирусов сам по себе является патогеном и в сочетании с другим может вызывать заболевание, гораздо более серьезное по исходу и клиническим проявлениям, чем он сам по себе.Во многих исследованиях не было предпринято никаких попыток идентифицировать вариант HHV-6. Когда варианты были охарактеризованы, выявилась довольно неоднородная картина. В PBMCs преобладали штаммы варианта B головного мозга и легких (60-62), тогда как в спинномозговой жидкости и сыворотке преобладали штаммы варианта A (63,64). Примерно у 30% реципиентов трансплантата костного мозга, у которых развился пневмонит, одновременно были обнаружены оба варианта (62), что в остальном редкое явление.
больных СПИДом составляют вторую группу лиц с ослабленным иммунитетом, подверженных риску инфицирования HHV-6 и оппортунистических вирусных инфекций, связанных с HCMV.Общая заболеваемость этими инфекциями значительно снизилась после введения высокоактивной антиретровирусной терапии. Инфекция / реактивация HHV-6 у пациентов со СПИДом приводит к увеличению нагрузки HHV-6 как в лимфатических узлах, так и генерализованной, при виремии, диссеминированной инфекции во многих органах, активной инфекции ЦНС, пневмоните и ретините и может быть причиной смерти. (65-67). Эти данные приводят к предположению, что HHV-6 действует как кофактор в прогрессировании СПИДа и в переключении ВИЧ из латентного состояния в репликативное (68).Хотя значительного увеличения вирусной нагрузки HHV-6 не наблюдалось в PBMC ВИЧ-серопозитивных лиц (68,69), HHV-6 и ВИЧ могли взаимодействовать в лимфатических узлах. Возможность того, что HHV-6 действует как кофактор в прогрессировании СПИДа, подтолкнула к интенсивным исследованиям взаимных взаимодействий между HHV-6 и ВИЧ в клеточных культурах и бесклеточных системах. В дополнение к коинфекции, наблюдаемой in vivo и in vitro, HHV-6 способствует репликации ВИЧ за счет активации цитокинов (например, TNF- и IL-1ß) и за счет трансактивации длинного концевого повтора IE-A и IE-B (68 ).Возможность того, что инфекция HHV-6 in vivo может привести к реактивации ВИЧ, недавно была исследована на ВИЧ-положительных детях. Дети, у которых СПИД прогрессировал быстро, заразились первичной инфекцией HHV-6 позже, чем дети, у которых ВИЧ прогрессировал медленно; однако при быстром прогрессировании СПИДа вирусная нагрузка ВИЧ не увеличивалась в результате инфекции HHV-6. Поздно при СПИДе обнаружение HHV-6 в PBMC снижается, скорее всего, из-за истощения Т-клеток (69). Как правило, штаммы варианта А чаще ассоциируются с больными СПИДом.
Распределение тканей in vivo
В дополнение к слюнным железам, HHV-6 часто выделяется из культивируемых PBMC пациентов со СПИДом или детей с экзантемой поджелудочной железы или фебрильными заболеваниями. Это привело к первоначальному определению HHV-6 как лимфотропного вируса. В лимфоцитах вирус устанавливает латентную инфекцию, которую легко контролировать с помощью ПЦР-амплификации последовательностей вирусной ДНК в некультивируемых PBMC (47). Кроме того, в некоторых случаях продуктивная инфекция отслеживается с помощью иммуногистохимии (например,g., в CD4 + Т-лимфоцитах) (70). В отличие от более раннего представления о HHV-6 как о Т-лимфотропном вирусе, недавние исследования обнаружили HHV-6 во многих тканях. Несмотря на обилие исследований присутствия HHV-6 у людей, наши знания фрагментарны. Путем иммуногистохимического окрашивания активная инфекция HHV-6 была обнаружена в различных клетках (например, в клетках CD68 + линии моноцитов / макрофагов в саркоме Капоши [71], эпителиальных клетках и макрофагах легких, дендритных клетках и макрофагах лимфатических узлов и инфильтрирующих лимфоцитах органов. неотобранных пациентов, умерших от СПИДа, эпителиальных клеток канальцев почек) и подчелюстных желез (67,72).В соответствии с этим более широким кругом хозяев, последовательности ДНК HHV-6 были обнаружены в ряде органов (например, в коже, селезенке, легких, сердце, почках, надпочечниках, пищеводе, двенадцатиперстной кишке, толстой кишке, печени и ранних клетках-предшественниках костного мозга) от пациентов, умерших от сердечного приступа или несчастных случаев (47,56,65). Поскольку в многочисленных исследованиях обнаружение проводилось с помощью ПЦР, латентные, стойкие или продуктивные инфекции не дифференцировались, а также не определялась природа инфицированных клеток. Штаммы варианта B чаще встречаются как в PBMC, так и в твердых тканях.Вирусы варианта А преобладают в коже и могут реплицироваться в первичных культурах фибробластов, что указывает на предпочтительный тропизм для кожи (47). HHV-6 является комменсалом мозга (см. Раздел «Нейротропизм и рассеянный склероз»).
In vitro HHV-6 инфицирует и реплицируется с наивысшими титрами в PBMC и CBMC. В этих гетерогенных культурах восприимчивыми клетками являются CD4 + Т-лимфоциты, а также CD4-CD3 + CD8 + и естественные клетки-киллеры CD4-CD3 (68). Поскольку экспрессия CD4 не является требованием для восприимчивости к инфекции HHV-6, а растворимые формы CD4 и антитела к CD4 не способны подавлять инфекционность вируса (73), CD4 не является необходимым компонентом клеточного рецептора для HHV-6.В дополнение к первичным Т-лимфоцитам, линии Т-лимфоцитов (например, HSB-2, SupT1, Molt3, JJhan, MT-4, ET62) поддерживают рост HHV-6. Вирусы двух вариантов демонстрируют различный диапазон хозяев, поскольку штаммы варианта A обычно не реплицируются в клетках Molt3, тогда как штаммы варианта B не реплицируются в клетках HSB-2. К пермиссивным клеткам других линий, кроме Т-лимфоцитов, относятся линия клеток печени HepG2 (74) и ряд линий клеток человека и нечеловеческого происхождения, в которых вирус обычно растет с очень низким выходом (например,g., линии клеток шейки матки, первичные астроциты человека [вариант B не очень хорошо реплицируется] нейробластома, моноциты клеток кишечника человека, эндотелиальные клетки мегакариоцитов, эпителиальные клетки легких норки NBL-7 и PBMC нескольких видов Macaca) (75- 77). В целом, как в культурах клеток, так и in vivo, HHV-6, по-видимому, имеет более широкий круг хозяев, чем первоначально предполагалось, и выходит за пределы Т-лимфоцитов. Хотя это имеет значение для исследований естественной истории инфекции, практическое использование этих клеток в лаборатории затруднено из-за очень низкого выхода вируса.Даже в самых разрешающих системах (PBMC, CBMC и Т-клеточные линии) выход вируса очень низкий. По нашему опыту, культуры CBMC, наиболее продуктивный тип клеток, не дают более 10 4 инфекционных единиц на мл, тогда как титр запаса вируса простого герпеса типа 1 обычно достигает 10 9 -10 10 бляшкообразующих единиц на мл.
Нейротропизм и рассеянный склероз
HHV-6, вероятно, является наиболее известным нейротропным вирусом. Нейроинвазия была зарегистрирована у младенцев с первичной инфекцией, при очаговом энцефалите, у детей и взрослых со СПИДом, у реципиентов трансплантата костного мозга, а также у иммунологически компетентных детей и взрослых.Challoner et al. (78) сообщили о вирусных ДНК-последовательностях примерно в двух третях образцов мозга и об экспрессии вирусных антигенов в ряде типов клеток (например, астроцитах, макрофагах, эпителиальных клетках, эндотелиальных клетках кровеносных сосудов) с очень сходной частотой в образцах от здоровых людей и людей. больные рассеянным склерозом. Было подтверждено, что астроциты являются восприимчивой клеточной популяцией, хотя в последующем исследовании только образцы от пациентов со СПИДом были положительными (79).
Оба вариантных вируса были обнаружены в головном мозге пациентов, умерших от причин, связанных или не связанных с HHV-6, что демонстрирует, что оба вариантных вируса могут проникать в мозг и скапливаться в нем (61,78-82).Хотя исследования дифференциального распределения двух групп вариантов дали противоречивые результаты (78,83), для HHV-6B инвазия ЦНС была задокументирована при первичной инфекции. Напротив, для HHV-6A время инвазии в ЦНС не задокументировано.
Возможная корреляция между активной инфекцией HHV-6 и рассеянным склерозом была в центре внимания в последние несколько лет. Рассеянный склероз — тяжелое заболевание ЦНС молодых людей, характеризующееся прогрессирующей демиелинизацией нервов, которая приводит к прогрессирующему параличу и, в конечном итоге, к смерти.Заболевание представляет собой аутоиммунную реакцию на миелин, оболочку нервных волокон. Вирусы долгое время считались этиологическими агентами миелопатий, и последовательности ДНК ряда вирусов, в частности вирусов герпеса, были обнаружены, хотя и не всегда. Кроме того, поскольку рассеянный склероз сопровождается характерным повышением титра IgG в сыворотке и спинномозговой жидкости, часто проводился поиск антител к различным вирусам (включая HHV-6). Даже иммунологические исследования были безрезультатными, скорее всего потому, что увеличение ответа антител отражает иммунную дисфункцию или другой генетический фон вместе с повреждением гематоэнцефалического барьера, а не эпидемиологическую корреляцию с каким-либо данным вирусом.
Исследования инфекции или реактивации HHV-6 у пациентов с рассеянным склерозом дали противоречивые результаты. В первоначальных сообщениях об активной инфекции предполагалось повышение титра IgG как в сыворотке, так и в спинномозговой жидкости, но не было подтверждено увеличением положительности ПЦР PBMC (84). Путем ПЦР с разницей представлений Challoner et al. (78) обнаружили, что образцы рассеянного склероза содержат последовательности ДНК HHV-6B. Экспрессия антигена HHV-6B выявлялась с большей частотой в бляшках рассеянного склероза, чем в гистологически нормальных образцах.Ядра олигодендроцитов были положительными в образцах рассеянного склероза (80%), но не в контрольных образцах (0%), и были интерпретированы как признак связи между активной или реактивируемой инфекцией HHV-6 и заболеванием. Попытки воспроизвести иммуногистохимические результаты не увенчались успехом, и вирусная экспрессия, подтвержденная с помощью обратной транскриптазы (RT) -PCR, также была отрицательной (85). В пользу корреляции свидетельствуют последующие данные о том, что частота и титр антител IgM к HHV-6 выше в образцах от пациентов с рассеянным склерозом, чем в контрольной (73% vs.18%) и что сывороточная ДНКемия была специфически положительной у пациентов с рассеянным склерозом (30% против 0%) (86). Последовательности ДНК HHV-6 были обнаружены в спинномозговой жидкости, но не в сыворотке крови пациентов с рассеянным склерозом (87). Критическую интерпретацию этих данных можно резюмировать следующим образом. Серологические анализы трудно интерпретировать, поскольку это заболевание характеризуется иммунологической дисрегуляцией; следовательно, повышение титра антител может быть признаком заболевания, а не причиной. Данные ПЦР не подтвердились.Таким образом, не было зарегистрировано статистической разницы в ДНК-положительности бляшек (32% активных против 17% неактивных бляшек) (88), ДНК не была обнаружена в образцах сыворотки и спинномозговой жидкости (89-91), и вирусная РНК не была обнаружена. ОТ-ПЦР в образцах головного мозга с рассеянным склерозом (85). Различия в результатах ПЦР могут отражать различия в условиях ПЦР (например, праймеры, количество циклов, характеристики амплифицированных последовательностей, природа и сохранность проанализированных образцов), но не учитывать наблюдаемые расхождения.Таким образом, корреляция между активной инфекцией HHV-6 и рассеянным склерозом все еще остается спорным вопросом, а не твердо установленным выводом.
Рисунок 3
Рисунок 3. Экспрессия антигенов вируса герпеса человека 6B (HHV-6B) и HHV-7 в серийных срезах образцов саркомы Капоши. Панели AC: В среде саркомы Капоши клетки могут быть дважды инфицированы HHV-6B и HHV-7: …
Саркома Капоши — мультифокальное ангиопролиферативное заболевание, локализующееся преимущественно на коже или слизистых оболочках, а также в других висцеральных органах и лимфатических узлах. .Помимо классических, ятрогенных и эндемических форм, заболевание встречается у больных СПИДом часто и агрессивно. Последовательности вируса герпеса 8 человека (HHV-8) были впервые обнаружены в образцах саркомы Капоши (92,93) с помощью анализа репрезентативных различий ПЦР; HHV-8 исследуется как возможный этиологический агент. Эпидемиологические исследования давно предполагают вирусную этиологию, и многие вирусы, включая HHV-6 и HHV-7, были обнаружены в тканях саркомы Капоши. Хотя ни HHV-6, ни HHV-7, по-видимому, не способствуют его этиологии, саркома Капоши представляет собой уникальную и интересную среду для этих вирусов, и они могут играть роль в прогрессировании опухоли.С помощью иммуногистохимии HHV-6B был локализован в клетках CD68 + моноцитарного макрофагального происхождения. Эти клетки либо индивидуально инфицированы HHV-6 или HHV-7, либо дважды инфицированы HHV-6 и HHV-7 (рис. 3) (71). Хотя некоторые ткани содержат оба вируса, хотя и в разных клетках (например, в легких и слюнных железах), клетки, дважды инфицированные HHV-6 и HHV-7, не были обнаружены ни в одной ткани, кроме поражений саркомы Капоши (94). Кроме того, в случае HHV-7 клетки CD68 + представляют собой тип клеток, инфицированных, однократно или дважды, ни в одной другой ткани, кроме этой опухоли (71).Данные свидетельствуют о том, что конкретное микроокружение очагов саркомы Капоши, богатое хемокинами и цитокинами, привлекает циркулирующие лимфоциты и моноциты, содержащие HHV-6 и HHV-7 в латентной или устойчивой форме, индуцирует вирусную реактивацию и способствует росту вирусов. В этой своеобразной среде происходят две необычные ситуации. Урожайность вирусов высока как для HHV-6, так и для HHV-7. Этим объясняется вероятность двойного инфицирования HHV-6 и HHV-7, которое, скорее всего, имеет место в самой опухоли.Тропизм HHV-7 также не ограничивается Т-лимфоцитами и распространяется на клетки CD68 + — линию, не восприимчивую к инфекции HHV-7 в других тканях. Предполагаемый хемокин (U83), кодируемый HHV-6, может вносить вклад в нарушение регуляции клеточной экспрессии хемокинов или передачи сигналов. Кроме того, вирус экспрессирует собственные хемокиновые рецепторы, кодируемые генами U12 и, возможно, U51. Как только HHV-6 реактивируется и активно реплицируется, HHV-6 может играть роль в прогрессировании опухоли через эти молекулы и механизмы.Различные исследования выявили разные вариантные штаммы в опухолях саркомы Капоши (95,96). Причина такого несоответствия неизвестна.
Лимфопролиферативные и неопластические заболевания
Первоначальная изоляция HHV-6 от пациентов с лимфопролиферативными расстройствами стимулировала исследования возможной ассоциации HHV-6 с пролиферативными заболеваниями, особенно лимфоидного происхождения, с целью продемонстрировать либо трансформирующий потенциал вируса в культурах клеток, либо эпидемиологические и молекулярные взаимосвязи между HHV. -6 и различные виды новообразований.
В пользу возможного онкогенного потенциала свидетельствует трансформирующая способность трех фрагментов вирусной ДНК в клеточных линиях фибробластов мыши или эпидермальных кератиноцитах человека. Один кодирует DR7 (97), а два других охватывают области, охватывающие U2-U20 и U31-U37. Полученные клеточные клоны были злокачественными и канцерогенными у бестимусных мышей (98,99). DR7 и два других локуса также содержат гены с трансактивирующей активностью в отношении LTR ВИЧ.
Был проведен обзор клинических и молекулярных исследований, посвященных HHV-6 и различным типам опухолей (13).Общая важность этих результатов остается спорной, главным образом потому, что критерии для установления связи между вирусом и его онкогенным потенциалом не были соблюдены. Таким образом, ожидается, что последовательности вирусной ДНК, обнаруженные в опухоли, будут такими же, как последовательности с трансформирующим потенциалом in vitro, а клетки, трансформированные in vitro, должны быть канцерогенными у животных. В опухоли данного типа вирусные последовательности должны постоянно совпадать. Трансформированные in vitro клетки и опухоли должны экспрессировать одни и те же продукты вирусных генов.Онкогенный потенциал вируса должен быть продемонстрирован на подходящей животной модели (которая отсутствует для HHV-6). Хромосомная интеграция ДНК HHV-6 в клетки лимфом (51,52) может открыть новый сценарий.
СХУ — заболевание, характеризующееся нарушением памяти и внимания, болью в мышцах и суставах, неосвежающим сном и слабостью, длящимися более 6 месяцев. Этиология заболевания неизвестна, и многие вирусы были исследованы как возможные возбудители. Общий сценарий во многом аналогичен сценарию рассеянного склероза.Серологический анализ на наличие антител к HHV-6 дал неубедительные данные. Было обнаружено увеличение титра IgG и IgM в сыворотке большого числа пациентов с CFS (119 из 154) по сравнению с таковым в контрольной популяции (77% против 12%) (100). Однако это не было специфическим, поскольку также было обнаружено увеличение антител к другим вирусам, что, вероятно, отражает иммунологическую дисфункцию. Молекулярный анализ показал более высокую распространенность HHV-6A, но не HHV-6B или HHV-7 у пациентов с CFS (64, 101, 102), и HHV-6A также может быть изолирован от этих пациентов (103).Отражает ли это ассоциацию или последствия нарушения иммунной регуляции, еще предстоит определить.
Обобщенные здесь эпидемиологические и клинические исследования устанавливают четкую корреляцию между первичной инфекцией HHV-6B и exanthem subitum, а также между инфекцией / реактивацией HHV-6 и рядом патологических состояний у пациентов с ослабленным иммунитетом и реципиентов трансплантата. Твердая связь с другими заболеваниями остается сомнительной. В случае рассеянного склероза четко установленная корреляция может выявить пациентов, которым может помочь специфическая химиотерапия против HHV-6.
Еще одна область, заслуживающая внимания, — это состояние вируса у здоровых людей, что является ключевым условием для понимания поведения вируса при патологических состояниях. Мы подчеркнули, что в дополнение к установлению истинной латентной инфекции, выявленной в более ранних исследованиях, HHV-6 сохраняется в организме хозяина за счет комбинации устойчивой инфекции на низком уровне различных клеток и тканей, ситуация, аналогичная той, что недавно была описана для HHV- 7 (94). Сайты с латентностью могут представлять собой резервуар вируса, который после реактивации может подпитывать сайты с устойчивостью.
Патогенные механизмы HHV-6 на молекулярном, клеточном и тканевом уровнях остаются в значительной степени неясными. Прошло почти 10 лет между первым выделением HHV-6 и публикацией последовательности всего генома. Теперь продукты одного гена можно изучать в контексте вирусного генома и в гетерологичных системах экспрессии. Хотя система мутагенеза вирусного генома еще не разработана, все готово для того, чтобы задать вопросы о молекулярных механизмах, лежащих в основе патогенности вируса.Предстоящая область исследований, вероятно, будет сосредоточена на связях между функцией продуктов одного гена и механизмами патогенеза и распространения вируса. Ключевой особенностью образа жизни HHV-6 у человека-хозяина является его способность инфицировать и выживать — в латентной или устойчивой форме — в клетках иммунной системы, а патогенный потенциал HHV-6 связан с его способность уклоняться от контроля иммунной системы. Анализ геномной последовательности показывает кандидатов на стратегии уклонения от иммунитета. Яманиши и его коллеги сообщили, что 7-трансмембранный белок, кодируемый U12, действует как рецептор ß-хемокинов (26).Поскольку ß-хемокины являются ключевыми медиаторами иммунного ответа, рецептор ß-хемокинов может вычитать эти медиаторы в конкретном микроокружении. Стратегия уклонения от иммунитета должна быть более сложной, поскольку анализ последовательности вирусной ДНК показывает дополнительных кандидатов, например, предсказанный хемокин, кодируемый ORF U83, и второй 7-трансмембранный белок — структурная особенность, типичная для хемокиновых рецепторов, кодируемая ORF U51. Этот последний белок обладает очень необычным свойством транспорта, зависящим от клеточного типа (поскольку он транспортируется к плазматической мембране как в инфицированных, так и в трансфицированных Т-лимфоцитах), но не может транспортироваться к плазматической мембране в трансфицированных монослойных клетках человека (104), повышая вероятность того, что его функция регулируется клеточно-зависимым образом посредством модуляции экспрессии на клеточной поверхности.Также U51, по-видимому, нарушает регуляцию экспрессии клеточных хемокинов (105). Исследования продуктов одного гена, вероятно, приведут к идентификации иммунодоминантных белков и разработке стандартизированных рекомбинантных диагностических реагентов.
Доктор Кампаделли-Фиуме — профессор микробиологии Болонского университета. Ее исследовательские интересы сосредоточены на вирусах герпеса 6 и 7 человека; идентификация, картирование и исследования экспрессии основных вирусных гликопротеинов и иммунодоминантных белков тегумента; и определение естественного течения инфекций.Ее исследования вируса простого герпеса 1 касаются в первую очередь механизмов проникновения вируса в клетки и идентификации клеточных рецепторов для входа, а также механизмов транспорта и выхода HSV через экзоцитарный путь.
верхний
Выводы, выводы и мнения, выраженные авторами, работающими в этом журнале, не обязательно отражают официальную позицию Министерства здравоохранения и социальных служб США, Службы общественного здравоохранения, Центров по контролю и профилактике заболеваний или аффилированных с авторами учреждения.


/ST70/Untitled-6.gif)
 (1992) Fatal disseminated infection with humanherpesvirus-6. J.Pediatrics 120:921-923.
(1992) Fatal disseminated infection with humanherpesvirus-6. J.Pediatrics 120:921-923.