клетка — это… Что такое G-клетка?
У этого термина существуют и другие значения, см. G. Место G-клеток в регуляции секреции соляной кислоты в желудкеG-клетки — эндокринные клетки слизистой оболочки желудочно-кишечного тракта, секретирующие гастрин.
G-клетки относятся к апудоцитам и входят в состав гастроэнтеропанкреатической эндокринной системы, которая является частью диффузной эндокринной системы (синоним АПУД-система).
Локализация
G-клетки, в основном, располагаются в антральной части желудка. В меньшей степени они представлены в двенадцатиперстной кишки, в проксимальной её части. У человека число G-клеток в 1 мм² пилорического отдела желудка примерно 220—490, в луковице двенадцатиперстной кишки 6 — 76.[1] G-клетки составляют 26 % от всех нейроэндокринных клеток желудка здорового человека.[2]
В теле желудка и в области дна желудка G-клетки отсутствуют.[3] G-клетки в небольшом количестве обнаружены в тощей кишке и поджелудочной железе.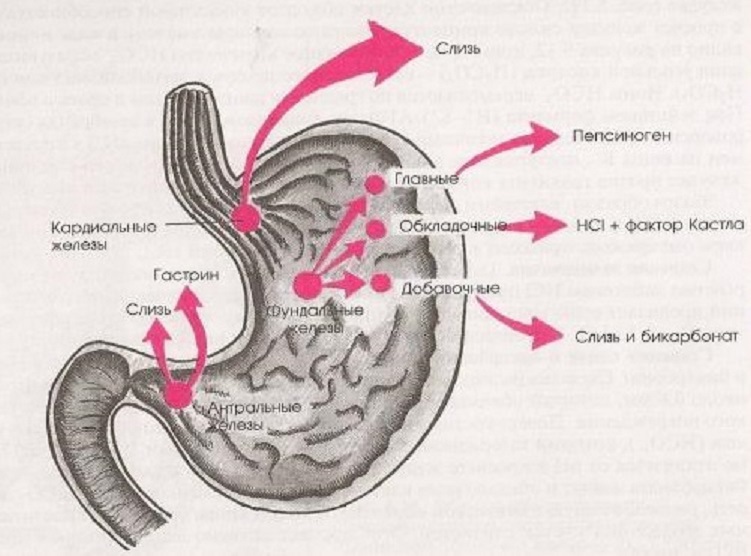
Функции
G-клетки желудка и двенадцатиперстной кишки вырабатывают гастрин нескольких изоформ. Через кровеносную систему гастрин или непосредственно воздействует на париетальные клетки, или опосредованно, через стимулирование выработки ECL-клетками гистамина и усиливает секрецию соляной кислоты и пепсиногена. Кроме того, гастрин усиливает секрецию поджелудочной железы, стимулирует моторику желудка, тонкой и толстой кишок и желчного пузыря.[2]
G-клетки имеют мембранные рецепторы, открытые в просвет желудочно-кишечного тракта. С этой стороны они стимулируются пептидными компонентами недопереваренной пищи, а также аминокислотами, соединениями кальция. Жиры и углеводы стимулируют G-клетки в значительно меньшей степени. Важным для секреции гастрина фактором является величина кислотности, которая должна быть в пределах от 5 до 7 рН. Стимуляторами секреции гастрина являются холецистокинин и ацетилхолин.
Ингибиторами, тормозящими секрецию гастрина, являются соматостатин, а также кислотность желудочного содержимого меньшая 5 рН. При кислотности ниже 1,7 рН секреция гастрина подавляется полностью.[3]
При кислотности ниже 1,7 рН секреция гастрина подавляется полностью.[3]
Гиперплазия G-клеток
При гиперплазии G-клеток образуется гастринома — доброкачественная или злокачественная опухоль, локализующаяся в поджелудочной железе, двенадцатиперстной или тощей кишке, или даже в перипанкреатических лимфатических узлах, в воротах селезёнки или стенке желудка. Эта опухоль вырабатывает большее количество гастрина, возникает гипергастринимия, которая, через механизм стимуляции париетальных клеток, является причиной чрезмерной продукции соляной кислоты и пепсина. В нормальной ситуации G-клетки под воздействием соляной кислоты тормозят выработку гастрина, но на G-клетки гастрино́м фактор кислотности не влияет. В результате развиваются множественные пептические язвы желудка, двенадцатиперстной или тощей кишки. Секреция гастрина гастриномами особенно резко усиливается после приема пищи.
Клиническое проявление гипергастринимии — синдром Золлингера — Эллисона (1-го типа). [4]
[4]
История
Впервые G-клетки были обнаружены E. Solcia в антральной части желудка в 1967 году. Solcia предполагал, что G-клетки могут секретировать гастрин. McGuigan с помощью прямой иммунофлюоресценции определил, что в G-клетках имеется гастрин.[5]
Примечания
- ↑ Лещенко В. И., Зверков И. В., Нечаев B. M., Ивашкин В. Т. Регуляторные пептиды и гастроинтестинальные эндокринные клетки у больных с грыжей пищеводного отверстия диафрагмы и пептическим эзофагитом. Русский Медицинский Журнал.
- ↑ 1 2 Коротько Г. Ф. Физиология системы пищеварения. — Краснодар: 2009. — 608 с. Изд-во ООО БК «Группа Б». ISBN 5-93730-021-1.
- ↑ 1 2 Бельмер С. В., Коваленко А. А. Желудочная секреция и методы ее оценки. В кн. «Кислотозависимые состояния у детей». Под ред. акад. РАМН В. А. Таболина. М.: РГМУ, 1999, 120 с.

- ↑ Охлобыстин А. В. Диагностика и лечение синдрома Золлингера–Эллисона. Русский Медицинский Журнал. — 1998. — т. 6. — № 7.
- ↑ Ивашкин В. Т. Иван Петрович Павлов. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. № 6, т. 14, 2004, с. 4 — 28.
Кафедра внутрішньої медицини № 3 та ендокринології
Основные эффекты гастроинтестинальных гормонов
Гормон | Место образования | Эффекты |
| Гастрин | Антральный отдел Ж и проксимальный отдел ТонК-ш (G-клетки) | Усиление секреции соляной кислоты (HCl) и пепсиногена желудком (Ж) и сока поджелудочной железы (ПЖЖ). Стимуляция моторики Ж, тонкой (ТонК) и толстой кишки (ТолК), желчного пузыря (ЖП) |
| Гастрон | Антральный отдел Ж (G-клетки) | Торможение секреции желудочного сока |
| Бульбогастрон | Антральный отдел Ж (G-клетки) | Торможение секреции и моторики Ж |
| Энтерогастрон | Проксимальный отдел ТонК (ЕС1-клетки) | Торможение секреции и моторики Ж |
| Секретин | ТонК, преимущественно в проксимальный отдел ( S-клетки) | Увеличение секреции бикарбонатов ПЖЖ, торможение секреции HCl в Ж, усиление желчеобразования и секреции ТонК. Торможение моторики Ж, усиление моторики кишечника (Кш) и сокращения пилорического сфинктера Торможение моторики Ж, усиление моторики кишечника (Кш) и сокращения пилорического сфинктера |
| Холецистокинин- Панкреозимин (ХЦК-ПЗ) | ТонК, преимущественно проксимальный отдел (1-клет) | Усиление моторики ЖП и секреции ферментов ПЖЖ, торможение секреции HCl в Ж и его моторики, усиление секреции пепсиногена, стимуляция моторики ТонК и ТолК, расслабление сфинктера Одди. Угнетение аппетита |
| Гастроингибирующий (желудочный ингиби-рующий) пептид (ГИП или ЖИП) | Тон.К-ш (К-клетки) | Глюкозозависимое усиление высвобождения ПЖЖ инсулина. Уменьшение секреции (HCl и пепсиногена) и моторики Ж путем высвобождения гастрина. Стимуляция секреции кишечного сока, угнетение всасывания электролитов в ТонК |
| Бомбезин | Ж и проксимальный отдел ТонК (Р-клетки) | Стимуляция секреции Ж путем усиления высвобождения гастрина. Усиление сокращений ЖП и секреции ферментов ПЖЖ путем стимуляции высвобождения ХЦК-ПЗ, усиление высвобождения энтероглюкагона, нейротензина и ПП Усиление сокращений ЖП и секреции ферментов ПЖЖ путем стимуляции высвобождения ХЦК-ПЗ, усиление высвобождения энтероглюкагона, нейротензина и ПП |
| Соматостатин | Ж, ТонК, преимущественно прокси-мальный отдел, ПЖЖ (D-клетки) | Торможение выделения секретина, ГИПа, мотилина, гастрина, инсулина и глюкагона |
| Мотилин | ТонК, преимущестенно прокси-мальный отдел (ЕС-2- клетки ) | Усиление моторики Ж и ТонК, усиление секреции пепсиногена Ж |
| Панкреатический пептид (ПП) | ПЖЖ (ПП-клетки) | Антагонист ХЦК-ПЗ. Уменьшение секреции ферментов бикарбонатов ПЖЖ, усиление пролиферации ТонК, ПЖЖ и печени, усиление моторики Ж. Участие в обмене углеводов и липидов слизистой оболочки |
| Гистамин | Желудочно-кишечный тракт (ЖКТ) (ECL-клетки) | Стимуляция секреции HCl Ж, сока ПЖЖ. Усиление моторики Ж и Кш. Расширение кровеносных капилляров Усиление моторики Ж и Кш. Расширение кровеносных капилляров |
| Нейротензин | ТонК, дистальный отдел (N-клетки) | Уменьшение секреции HCl Ж, усиление секреции ПЖЖ |
| Субстанция Р | ТонК (ЕС-1-клетки) | Усиление моторики Кш, слюноотделения, торможение высвобождения инсулина и всасывания натрия |
| Вилликинин | Прокс. отдел ТонК (ЕС-1- клетки) | Стимуляция сокращений ворсинок ТонК |
| Энкефалин | Тон.К, немного в ПЖЖ (G-клетки) | Торможение секреции ферментов ПЖЖ |
| Энтероглюкагон | ТонК (ЕС-1-клетки) | Мобилизация углеводов. Торможение секреции Ж и ПЖЖ, моторики Ж и Кш. Пролиферация слизистой оболочки ТонК |
| Серотонин | ЖКТ (ЕС-1, ЕС-2-клетки) | Торможение выделения HCl в Ж, стимуляция выделения пепсина. Стимуляция секреции ПЖЖ, кишечной секреции, желчевыделения Стимуляция секреции ПЖЖ, кишечной секреции, желчевыделения |
| Вазоактивный интестиналъный пептид (ВИП) | ЖКТ (Д1-клетки) | Расслабление гладких мышц кровеносных сосудов, ЖП, сфинктеров. Торможение секреции Ж, усиление секреции бикарбонатов ПЖЖ и кишечной секреции. Торможение действия ХЦК-ПЗ |
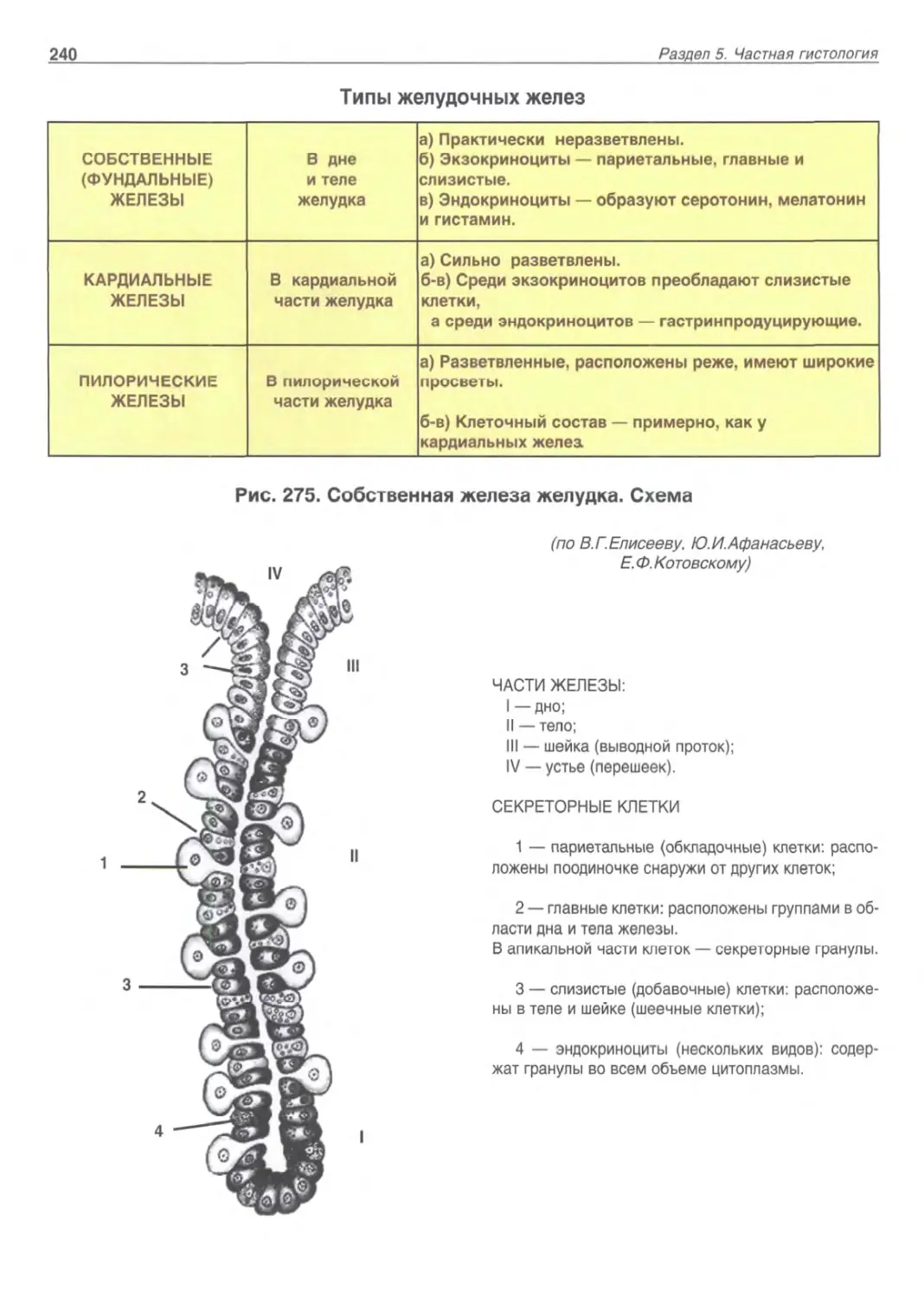
Типы клеток слизистой оболочки желудка (СОЖ)
Главные клетки | Париетальные (обкладочные) | Добавочные | Мукоциты |
Активируются гастрином |  Активируются Н2-рец-гистамина Активируются Н2-рец-гистамина |
| |
| |||
Синтез пепсиногенов | Синтез HCl | синтез мукоидного секрета | |
Превращение в пепсин при контакте с HCl | Денатурация белков | ||
Активация пепсиногенов | |||
Оптимум протеазной активности – рН 1,5-2 | Кислая рН активирует ферменты | ||
Антибактериальная активность | |||
Оптимум гастриксина при рН 3,2-3,5 | Стимуляция эвакуации пищи, открытие пилорического сфинктера | ||
Расщепляют белки до пептонов | Стимуляция пакреатической секреции | ||
Типы желез желудка
Кардиальные | Фундальные (собственные) | Пилорические |
| Серкция слизи постоянно | Активируются после еды.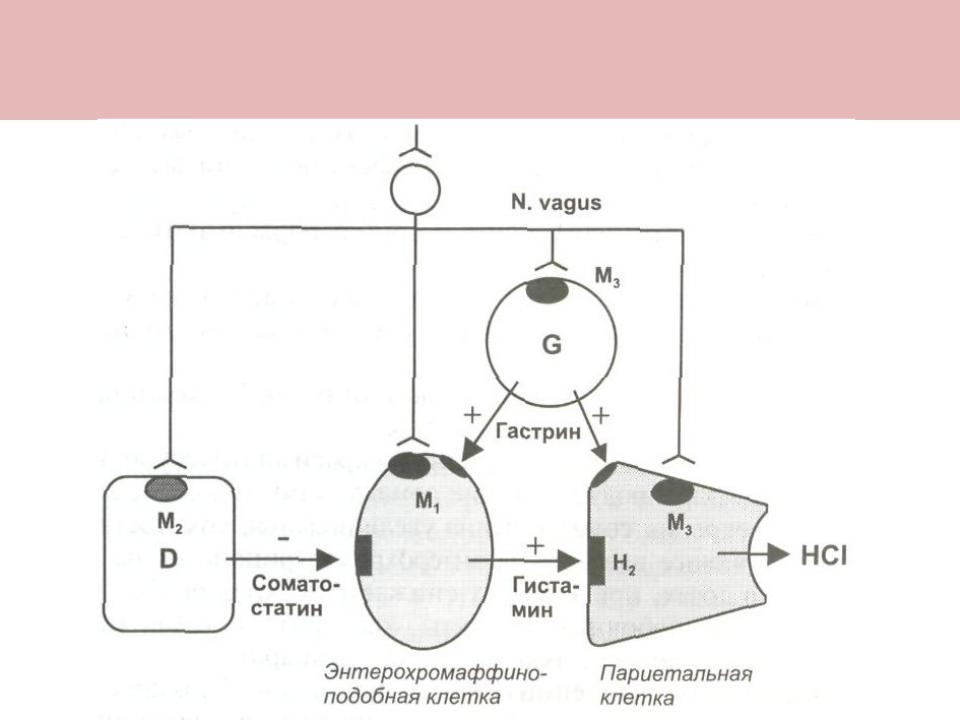 Условно-рефлекторная (мозговая) фаза. Безусловно-рефлекторная фаза. Желудочная фаза (vagus + gastrin). | Пилорический секрет щелочной, выделяется постоянно |
| Содержат все 3 типа клеток | ||
| Секрет содержит и HCl, и пепсиногены | ||
| Ведущая роль в пищеварении |
Моторика гастродуоденальной зоны
(моторно-эвакуаторная функция желудка)
Физиологическая моторика | Гастропарез – ослабление моторно-эвакуаторной ф-и |
| Поступление пищевого комка в желудок | |
| Рецептивная релаксация проксимального отдела желудка | Нарушение релаксации желудка |
| Адаптивная релаксация дна и тела желудка | |
| Аккомодация желудка к большому объему пищи без напряжения стенки желудка | Нарушение аккомодации пищи в дне желудка |
Перистальтика дна желудка 1 сокращение/мин.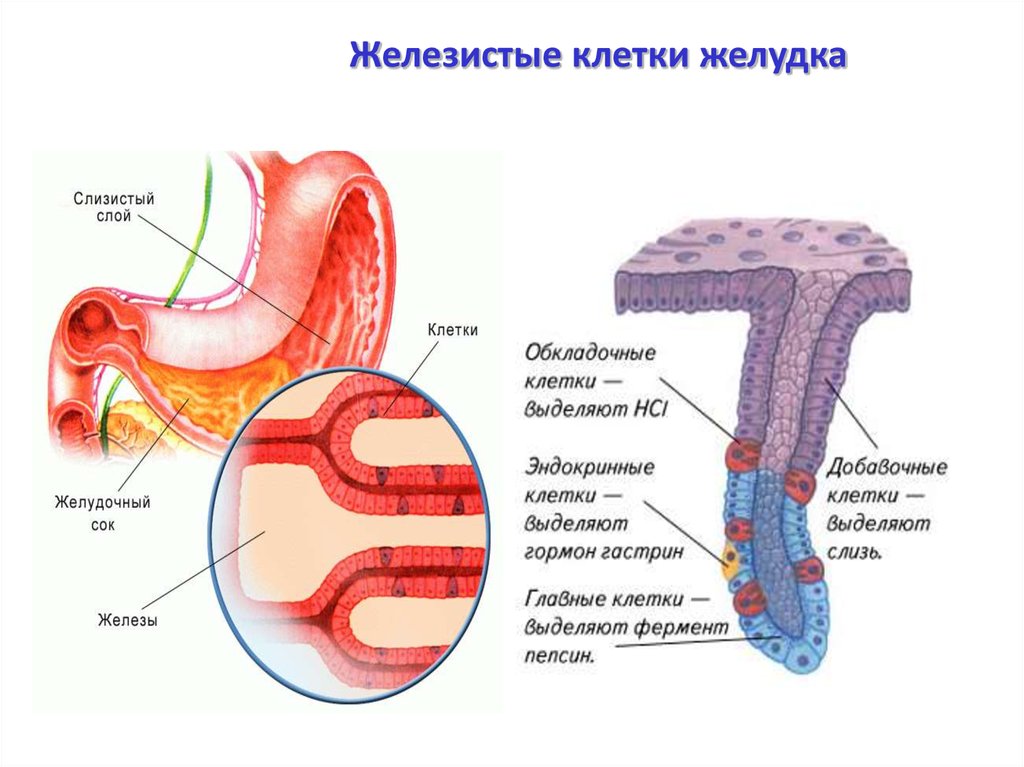 перемещает содержимое из фундального отдела в тело желудка | Нарушение распределения пищи внутри желудка |
| В теле желудка содержимое измельчается и перемешивается. При измельчении до 1 мм пищевой химус готов к эвакуации. | Нарушение циклической активности: желудочные дисритмии (тахигастрия, брадигастрия, антральная фибрилляция) |
| Антродуоденальная координация – синхронизация перистальтики антрального отдела желудка с открытием пилорического сфинктера. | Нарушение антродуоденальной координации |
Состав и свойства панкреатического сока
1,5-2,0 л воды | сухой остаток (0,12%) | |||
катионы Na+, Ca2+, К+, Мg+ | анионы Cl-, SO32-, HPO42-. | рН сока 7,8-8,5 | ||
Органические вещества | ||||
| Ферменты протеолитические | Протеолитические ферменты (протеазы) секретируются в виде проэнзимов – трипсиногена, химотрипсиногена, прокарбоксипептидазы А и В, проэластазы | |||
| Трипсиноген | Неактивный предшественник. Под влиянием энтерокиназы 12-ПК трипсиноген превращается в трипсин | |||
| Трипсин | Трипсин действует аутокаталитически на оставшееся количество трипсиногена и на другие пропептидазы, превращая их в активные ферменты | |||
| Расщепляет внутренние пептидные связи белков пищи с образованием низкомолекулярных пептидов и аминокислот | ||||
| Химотрипсиноген | Неактивный предшественник | |||
| Химотрипсин | Расщепляет внутренние пептидные связи белков пищи с образованием низкомолекулярных пептидов и аминокислот | |||
| Проэластаза | ||||
| Эластаза | Расщепляет внутренние пептидные связи белков пищи с образованием низкомолекулярных пептидов и аминокислот | |||
| Прокарбоксипептидаза А и В | Расщепляют С-концевые связи в белках и пептидах | |||
| Нуклеаза | секретируется в активном состоянии | |||
| Рибо- и дезокси- рибонуклеазы | Расщепляют нуклеиновые кислоты | |||
| Ферменты липолитические | В присутствии ионов Са гидролиз жиров усиливается | |||
| Панкреатическая липаза | Секретируется в активном состоянии. Расщепляет липиды до Расщепляет липиды домоноглицеридов и жирных кислот. Активная в присутствии солей желчных кислот | |||
| Фосфолипаза А | ||||
| Эстераза В | ||||
Ферменты амилолитические
Альфа-амилаза | Секретируется в активном состоянии. Расщепляет полисахариды до олиго-, ди- и моносахаридов |
Регуляция секреции поджелудочной железы (нервные механизмы)
| Блуждающий нерв | усиливает секрецию поджелудочной железы (ПЖ) | |||
Симпатические нервы | ||||
| бета- адренергический эффект | Уменьшают количество секрета | Усиливают синтез органических веществ | ||
| альфа-адрен- ергический эффект | Снижение секреции ПЖ за счет уменьшения кровоснабжения (сужение кровеносных сосудов) | |||
Вызывают торможение секреции ПЖ | ||||
| Напряженная физическая и умственная работа | боль | сон | ||
Гуморальные механизмы регуляции ПЖ
Усиливают секрецию ПЖ | |||||||||
ХЦК-ПЗ | Стимулирует выделение сока, богатого ферментами | Секретин | Стимулирует выделение сока, богатого бикарбонатами | ||||||
Гастрин | Инсулин | Бомбезин | Серотонин | Соли желчных кислот | |||||
Химоденин | Стимулирует секрецию химотрипсиногена | ||||||||
Тормозят секрецию ПЖ | |||||||||
Глюкагон | Кальцитонин | ЖИП | Соматостатин | Энкефалин | ПП | ||||
3 фазы панкреатической секреции
сложнорефлекторная | желудочная | кишечная | |
На отделение сока поджелудочной железы влияет характер принятой пищи | |||
Экстрактивные вещества мяса, овощей, продукты переваривания белков | стимулируют выработку секретина | ||
усиливают секрецию соляной кислоты в желудке | приводят к выделению поджелудочного сока, богатого бикарбонатами | ||
Продукты начального гидролиза белков и жиров стимулируют секрецию ХЦК-ПЗ | способствует выделению сока с большим количеством ферментов | ||
Внутрисекреторная активность ПЖ (образование гормонов)
инсулин | липоксин | соматостатин | гастрин | панкреатический полипептид | |
глюкагон | ваготонин | серотонин | энкефалин | калликреин | ВИП |
Пищеварение В тонкой кишке
основные процессы переваривания пищевых веществ | ||||
Особенно велика роль начального отдела – 12ПК | ||||
панкреатический сок | кишечный сок | желчь | ||
гидролиз белков | гидролиз жиров | гидролиз углеводов | ||
Кишечный сок | ||||
секрет желез, расположенных в слизистой оболочке вдоль всей тонкой кишки | ||||
дуоденальных желез (бруннеровых) | желез кишечных крипт (либеркюновых) | кишечных эпителиоцитов | ||
бокаловидных клеток, клеток Панета | ||||
2 – 3 л кишечного сока/сутки | рН от 7,2 до 9,0 | |||
Неорганические вещества
бикарбонаты | хлориды | фосфат натрия | фосфат кальция | фосфат калия |
Органические вещества
белки | аминокислоты | слизь | ||||
>20 ферментов | обеспечивают конечные стадии переваривания пищевых веществ | |||||
амилаза | пептидазы | щелочная фосфатаза | липаза | |||
лактаза | сахараза | нуклеаза | энтерокиназа | фосфолипаза | ||
Основная часть ферментов | поступает в кишечный сок | при отторжении клеток слизистой оболочки кишки | ||||
Значительная часть ферментов | адсорбируется на поверхности эпителиальных клеток кишки | осуществляя пристеночное пищеварение | ||||
Регуляция кишечной секреции: местные нервно-рефлекторные механизмы
Регуляция кишечной секреции: Гуморальные влияния | ||||
Усиливают кишечное сокоотделение | Тормозное действие оказывает | |||
ГИП | ВИП | мотилин | соматостатин | |
энтерокринин стимулирует либеркюновы железы | дуокринин стимулирует бруннеровы железы | |||
1. Полостное пищеварение в тонкой кишке
Полостное пищеварение в тонкой кишке
с помощью ферментов пищеварительных секретов | поступающих в полость тонкой кишки | поджелудочный сок, желчь, кишечный сок |
крупномолекулярные вещества (полимеры) | гидролизуются до | стадии олигомеров |
2. Пристеночное пищеварение в тонкой кишке – дальнейший гидролиз олигомеров
идет в зоне, прилегающей к СО | и непосредственно на СО | |
слой слизистых наложений над гликокаликсом | зона гликокаликса | поверхность микроворсинок |
состоит из слизи и слущиваю-щегося кишечного эпителия | адсорбирует из полости ТонК ферменты пищеварительных соков | апикальные мембраны энтеро-цитов, в которые встроены кишечные ферменты |
много ферментов ПЖЖ и кишечного сока | осуществляют собственно мембранное пищеварение | |
питательные вещества, проходя через слой слизи, подвергаются воздействию этих ферментов | промежуточные стадии гидролиза всех основных питательных веществ | в результате образуются мономеры, способные всасываться |
близко расположены встроенные в мембрану собственные кишечные ферменты | ||
и транспортные системы, обеспечивающие их всасывание | ||
сопряжение процессов конечного гидролиза питательных веществ и их всасывания | ||
Пищеварение в толстой кишке
Из тонкой кишки химус | через илеоцекальный сфинктер (баугиниеву заслонку) | переходит в толстую кишку |
концентрирование химуса путем всасывания воды | формирование каловых масс | эвакуация каловых масс из кишечника |
Всасывание в толстой кишке
электролитов | водорастворимых витаминов | жирных кислот | углеводов |
Секреторная функция толстой кишки
Железы СО толстой кишки | выделяют небольшое количество сока | рН 8,5-9,0 | ||||
Слизь | Отторгнутые эпителиальные клетки | Небольшое количество ферментов со значительно меньшей активностью, чем в тонкой кишке | ||||
Механическое раздражение СОК | пептидазы | липаза | амилаза | |||
усиливает секрецию в 8 -10 раз | нуклеаза | ЩФ | катепсин | |||
Моторика пищеварительного тракта
Моторная функция ЖКТ осуществляется во всех его отделах | ||
заключается в измельчении пищи | перемешивании | продвижении пищи |
Сокращение и расслабление сфинктеров | Движение ворсинок и микроворсинок ТонК-ш | Удаление непереваренных остатков пищи |
Сфинктеры выполняют роль клапанов (около 35 сфинктеров) | обеспечивают движение пищевого содержимого в каудальном направлении | и однонаправленное движение пищеварительных соков |
Мышцы тонкой кишки
наружные продольные | внутренние (кольцевые) |
Обеспечивают перемешивание химуса с соком поджелудочной железы и кишечным соком | |
и продвижение химуса по тонкой кишке | |
В тонкой кишке осуществляются несколько видов движений
ритмическая сегментация | маятникообразные сокращения | перистальтические сокращения | тонические сокращения |
Обусловлены сокращением кольцевых мышц | Обусловлены последовательным сокращением кольцевых и продольных мышц | Обусловлены согласованными сокращениями продольных и кольцевых мышц | Все сокращения происходят на фоне общего тонуса стенок кишки |
Образуются поперечные перехваты | Отрезок кишки то укорачивается и расширяется, то удлиняется и суживается | За счет сокращения кольцевых мышц верхнего отрезка кишки происходит выдавливание химуса | Отсутствие тонуса мышц (атония) при парезах делает невозможным любой вид сокращений |
которые делят кишку (и пищевую кашицу) на небольшие сегменты | Это приводит к перемещению химуса то в одну, то в другую сторону, наподобие маятника | в одновременно расширяющийся за счет сокращения продольных мышц нижний участок | Происходит постоянное сокращение и расслабление ворсинок кишки |
что способствует растиранию химуса и перемешиванию его с пищеварительными соками | что способствует тщательному пере-мешиванию химуса с пищеварительными соками | что обеспечивает продвижение химуса по кишечнику | что обеспечивает соприкосновение их с новыми порциями химуса, ↑ всасывание и отток лимфы |
Двигательная активность тонкой кишки регулируется
миогенными механизмами | нервными механизмами | гуморальными механизмами | ||
| Спонтанная двигательная активность гладких мышц кишечника | Нейроны ауэрбаховского нервного сплетения обладают ритмической фоновой активностью | Стимулируют двигательную активность тонкой кишки: | ||
| клетчатка | ||||
| кислоты, щелочи | ||||
| обусловлена их автоматизмом: два “датчика ритма” кишечных сокращений | обеспечивают организованную фазную сократительную деятельность кишки | концентрированные р-ры солей | ||
| жиры, продукты гидролиза жиров | ||||
| Один водитель ритма находится у места впадения общего желчного протока в 12ПК | Парасимпатические нервы в основном возбуждают сокращения тонкой кишки | Гуморальные вещества непосредственно влияют или на миоциты, или на энтеральные нейроны. | ||
| Другой водитель ритма находится в подвздошной кишке | Симпатические нервы в основном тормозят сокращения тонкой кишки | Стимулируют моторику | ||
| вазопрессин, окситоцин, брадики-нин, серотонин, гистамин, гастрин, мотилин, ХЦК-ПЗ, веществоР | ||||
| Эффекты раздражения вегетативных нервов зависят от исходного состояния мышц, частоты и силы раздражения | ||||
| Тормозят моторику | ||||
| секретин, ВИП, ГИП | ||||
Рефлексы с различных отделов пищеварительного тракта
Возбуждающие рефлексы | |||
пищеводно-кишечный | желудочно-кишечный и | кишечно-кишечный | |
Тормозные рефлексы | |||
кишечно-кишечный | ректоэнтеральный | ||
рецепторное торможение тонкой кишки (рецепторная релаксация) во время еды | |||
затем сменяется усилением моторики тонкой кишки | |||
Рефлекторные дуги этих рефлексов замыкаются | |||
| на уровне интрамуральных ганглиев внутриорганного отдела вегетативной нервной системы | на уровне ядер блуждающих нервов в продолговатом мозге и | в узлах симпатической нервной системы | |
Моторная функция толстой кишки обеспечивает
резервную функцию | высушивающую ф-ю | эвакуаторную функцию |
накопление кишечного содержимого | активное всасывание воды | периодическое удаление каловых масс из кишечника |
Виды сокращений в толстой кишке | ||
пропульсивные |
| ритмическая сегментация |
перистальтические | маятникообразные | антиперистальтические |
Мышцы толстой кишки
Наружный продольный слой мышц | Циркулярный мышечный слой |
| Располагается в виде полос | Сокращения отдельных участков образуют складки и вздутия (гаустры) |
| Находится в постоянном тонусе | |
| 3-4 раза в сутки возникает сильная пропульсивная перистальтика, продвигает содержимое кишки в дистальном направлении | Волны гаустрации медленно проходят по толстой кишке |
Регуляция двигательной активности толстой кишки
осуществляется преимущественно внутриорганным отделом вегетативной нервной системы | ||
интрамуральными нервными сплетениями (ауэрбаховским и мейсснеровским) | ||
Стимулирующие рефлексы при раздражении рецепторов | Коррекция центрами ВНС местных рефлексов | Механические и химические раздражители |
пищевода, желудка, тонкой кишки, толстой кишки | Симпатические нервные волокна в составе чревных нервов, тормозят моторику | ↑ двигательную активность, ускоряют продвижение химуса |
Раздражение рецепторов прямой кишки тормозит моторику толстой кишки | Парасимпатические волокна в составе блуждающих и тазо-вых нервов ↑ моторику | Серотонин, адреналин, глюкагон тормозят моторику |
Кортизон – стимулирует | ||
Акт дефекации и его регуляция
сложнорефлекторный процесс опорожнения дистального отдела толстой кишки | ||
через задний проход. | ||
При наполнении ампулы прямой кишки калом | повышении в ней давления до 40 – 50 см вод.ст | происходит раздражение механо- и барорецепторов |
Возникшие при этом импульсы | ||
по афферентным волокнам тазового (парасимпатического) нерва и срамного (соматического) нер. | ||
направляются в центр дефекации | ||
непроизвольный центр дефекации в поясничной и крестцовой частях спинного мозга | ||
Из спинного мозга по эфферентным волокнам тазового нерва | ||
импульсы идут к внутреннему сфинктеру, вызывая его расслабление | ||
и одновременно усиливают моторику прямой кишки | ||
Произвольный акт дефекации
осуществляется при участии коры полушарий, гипоталамуса и продолговатого мозга | ||
оказывают свой эффект через центр непроизвольной дефекации | ||
От альфа-мотонейронов крестцового отдела спинного мозга | Одновременно происходит сокращение диафрагмы и брюшных мышц | |
по соматическим волокнам срамного нерва | что ведет к уменьшению объема брюшной полости | |
импульсы поступают к наружному (произвольному) сфинктеру | повышению внутрибрюшного давления | |
тонус которого вначале повышается | что способствует акту дефекации | |
а при увеличении силы раздражения тормозится | ||
Продолжительность эвакуации (время, в течение которого происходит освобождение кишок от содержимого) у здорового человека достигает 24-36 часов | ||
Парасимпатические нервные волокна | Симпатические нервы | |
тормозят тонус сфинктеров | повышают тонус сфинктеров | |
усиливают моторику прямой кишки | тормозят моторику прямой кишки | |
стимулируют акт дефекации | ||
Гастринома | Лабораторія Др.
 РьодгераКлинический фон
РьодгераКлинический фонГастриномы являются наиболее распространенными эндокринноактивными опухолями поджелудочной железы после инсулиномы. Они возникают спорадически или в 25% всех случаев в контексте множественной эндокринной неоплазии типа 1 (МЭН1). Частота возникновения гастриномы составляет 1-5 случаев/на 1 миллион человек в год, распространенность дана как 0,1% от всех пациентов с язвой двенадцатиперстной кишки. Средний возраст на момент постановки диагноза — 41 год, время между появлением симптомов и диагнозом составляет 5,2 года. 60 % всех спорадических гастрином являются злокачественными, при постановке диагноза у 25-30% пациентов наблюдается метастазирование, преимущественно в печень.
Спорадические гастриномы составляют 38% в поджелудочной железе, 4% локализованы в лимфатических узлах около 12-перстной кишки и 20% — в других органах, таких как желудок, тощая кишка, печень, желчевыводящие пути, яичники, привратник желудка и легкие. В рамках МЭН1 возникают дуоденальные, в основном множественные гастриномы (70–100 %). Они обычно хорошо дифференцированы гистологически, метастазы в лимфоузлы встречаются часто, а диарея встречается редко.
В рамках МЭН1 возникают дуоденальные, в основном множественные гастриномы (70–100 %). Они обычно хорошо дифференцированы гистологически, метастазы в лимфоузлы встречаются часто, а диарея встречается редко.
Клинически гастринома проявляется повышенной кислотностью желудочного сока (низким значением pH) и изъязвлениями в верхних отделах желудочно- кишечного тракта, также называемым синдромом Золлингера-Эллисона.
При наличии гастриномы всегда следует исследовать возможную связь с множественной эндокринной неоплазией 1 типа (МЭН1). Характеризуется совместно с появлением следующих опухолей, которые затем следует исключить:
■ Аденома паращитовидной железы или аденома(ы) при первичном гиперпаратиреозе.
■ Аденома передней доли гипофиза (увеличенная продукция пролактина, СТГ, АКТГ, очень редко ФСГ, ТТГ, Меланотропина).
■ Гастроэнтеропанкреатические опухоли, такие как инсулинома, глюкагонома, ВИПома, ППома (панкреатический полипептидома).
■ Опухоли надпочечников (увеличение продукции кортизола, адреналина, норадреналина).
■ Опухоли кожи (липома).
Одновременное или временное раздельное возникновение опухолей по меньшей мере в двух из указанных органов (паращитовидные железы, гипофиз, поджелудочная железа и надпочечники) вызывает подозрение на диагноз МЭН1. (Генетическая диагностика МЭН1: известно более 500 мутаций).
Результаты теста | Gastropanel.co.uk
С помощью анализа GastroPanel измеряются концентрации четырех биомаркеров в пробе крови. Биомаркерами, секретируемыми клетками слизистой желудка, являются пепсиноген I (PGI), пепсиноген II (PGII) и гастрин-17b (G17b). Кроме того, определяются антитела к Helicobacter pylori.
Обобщающая интерпретация результатов определения всех четырех биомаркеров обеспечивает более надежное и полное понимание состояния и функционирования слизистой желудка, чем достигаемое с использованием результатов определения концентраций только одного или двух биомаркеров. По существу, очевидно, что GastroPanel является тест-панелью на четыре биомаркера, так как панель — это больше, чем сумма ее частей. Мы также рекомендуем ознакомиться с блок-схемой GastroPanel (ниже), в которой представлены примеры порядка интерпретации результатов определения биомаркеров. Однако отметьте, что отчет GastroPanel обеспечивает более точную интерпретацию результатов.
Мы также рекомендуем ознакомиться с блок-схемой GastroPanel (ниже), в которой представлены примеры порядка интерпретации результатов определения биомаркеров. Однако отметьте, что отчет GastroPanel обеспечивает более точную интерпретацию результатов.
Референс-диапазоны биомаркеров основаны на результатах клинических испытаний с участием пациентов с диспепсией. В этих испытаниях результаты пациентов при анализах GastroPanel сравнивались с данными гастроскопии и биопсии слизистой их желудков.
Отчет GastroPanel является инструментом, разработанным в помощь врачам при интерпретации результатов анализов GastroPanel. Отчет содержит результаты определения биомаркеров, в том числе референс-диапазоны и краткую письменную интерпретацию результатов. Интерпретация предоставляет информацию о состоянии слизистой желудка, о любом снижении секреции кислоты и о связанных с этим рисках. Где это уместно, отчет также содержит рекомендации о необходимости проведения лечения для устранения Helicobacter и прохождения гастроскопии.
Пример отчета GastroPanel 1: атрофия тела желудка
Пример отчета GastroPanel 2: желудок в норме
Создайте свой собственный отчет GastroPanel, используя приложение GastroPanel report.
| референс-диапазон* | |
| Пепсиноген I (PGI) | 30 — 160 мкг/л |
| Пепсиноген II (PGII) | 3 — 15 мкг/л |
| PGI/PGII | 3 — 20 |
| Гастрин-17b (G17b) | 1 — 7 пмоль/л |
| Гастрин-17s (G17s) | 3 — 30 пмоль/л |
| IgG к H. pylori (HPAbG) | < 30 EIU |
*Референс-диапазоны для GastroPanel могут быть уточнены данными последующих новых клинических испытаний.
Антитела IgG к Helicobacter (IgG к H. pylori)
Helicobacter pylori обитает в слизистой оболочке желудка зараженного человека. Данная инфекция, как правило, приобретается в детстве и вызывает воспаление (гастрит), которое, если его не лечить, становится хроническим и пожизненным. Данная инфекция в особенности широко распространена среди пожилых людей. У некоторых зараженных людей слизистая оболочка желудка атрофируется через несколько десятилетий. Гастрит и атрофия могут повысить риск различных заболеваний (рак желудка, язва двенадцатиперстной кишки, пептическая язва) и нарушения всасывания некоторых витаминов, минералов и лекарственных веществ (нехватки витамина B12, железа, кальция и магния). Уровень антител выше 30 иммуноферментных единиц (EIU) указывает на вероятное наличие инфекции Helicobacter.
Пепсиноген I (PGI)
Концентрация пепсиногена I в крови — индикатор структуры и функционирования слизистой оболочки тела желудка. При атрофии слизистой оболочки тела желудка концентрация пепсиногена I в крови опускается ниже 30 мкг/л.
Пепсиноген II (PGII)
Концентрация пепсиногена II в крови — индикатор структуры и функционирования слизистой оболочки желудка. Его концентрация в крови часто растет при воспалении слизистой оболочки желудка (пороговое значение — 10 мкг/л). Наиболее распространенная причина — инфекция Helicobacter pylori, но иногда гастрит могут вызвать и другие факторы (обезболивающее, крепкий алкоголь, острые специи, билиарный рефлюкс).
Пепсиноген I / Пепсиноген II (PGI / PGII)
Отношение пепсиноген I / пепсиноген II заметно падает (< 3) при атрофии тела желудка.Б
азальный гастрин-17 (G-17b)
Концентрация гастрина-17 в крови (натощак) — индикатор структуры и функционирования антрального отдела желудка. Моноклональные антитела компании Biohit измеряют только уровень амидированного гастрина-17 — специфического рецептора париетальных клеток. Гастрин-17 секретируется только G-клетками антрального отдела желудка. Он ускоряет секрецию соляной кислоты в париетальных клетках тела желудка. Уровень гастрина-17 выше 10 пмоль/л обычно свидетельствует об анацидном желудке (например, пациент принимает ИПП или страдает атрофией слизистой оболочки, ограниченной телом желудка). По мере повышения кислотности содержимого желудка уровень гастрина-17 в крови падает (pH < 2,5). Уровень гастрина-17 также падает при атрофии слизистой оболочки антрального отдела желудка, поскольку G-клетки исчезают. Низкий уровень гастрина-17, следовательно, свидетельствует либо об атрофии слизистой оболочки антрального отдела желудка, либо о повышенной секреции соляной кислоты.
Стимулированный гастрин-17 (G-17s)
Для дифференциальной диагностики атрофии слизистой оболочки антрального отдела желудка и повышенной секреции соляной кислоты, можно провести гастроскопию или определить уровень гастрина-17 после белковой стимуляции . Низкий уровень стимулированного гастрина-17 (менее 3 пмоль/л) свидетельствует об атрофическом гастрите антрального отдела желудка. Если человек был инфицирован H.pylori, а значение гастрина-17 остается низким после стимуляции белком (менее 3 пмоль / л), это может указывать на атрофический гастрит в антральном отделе желудка. Однако, если уровни антител H.pylori не повышены, результаты указывают на повышенную секрецию соляной кислоты.
Гастрин (Gastrin) — узнать цены на анализ и сдать в Москве
Метод определения Иммуноанализ (специфичность преимущественно к G-17 и меньше к G-34 и G-14).
Исследуемый материал Сыворотка крови
Онлайн-регистрацияОсновной гормон желудочно-кишечного тракта.
Гастрин продуцируется в G-клетках слизистой желудка и 12-перстной кишки, а также островковых клетках поджелудочной железы. Существует в 3 основных формах – G-17 (little), G-34 (big) и G-14 (mini) (обозначаемых по числу аминокислотных остатков). В норме основное количество гастрина образуется в желудке. Главная функция гастрина — стимуляция выделения соляной кислоты париетальными клетками дна желудка. Помимо этого, гастрин стимулирует выделение пепсиногена, внутреннего фактора, секретина, а также бикарбонатов и ферментов поджелудочной железой, желчи в печени, активирует моторику желудочно-кишечного тракта.
Основными физиологическими стимулами образования гастрина служат приём белковой пищи и снижение кислотности желудочного сока. Выделение гастрина повышается также под действием нервных стимулов, адреналина, увеличения уровня кальция. Снижение секреции гастрина вызывает повышение кислотности желудочного сока, а также секретин, соматостатин, вазоактивный кишечный полипептид (VIP), гастроингибирующий полипептид (GIP), глюкагон и кальцитонин.
Определение содержания гастрина в крови играет важную роль в диагностике опухолей Золлингера-Элисона (гастрином), при которых повышенный уровень гастрина приводит к гиперсекреции кислоты и образованию язв. Обычно уровень гастрина натощак у больных с синдромом Золлингера-Элисона значительно превышает референсные пределы. Эти пациенты характеризуются также резким повышением продукции гастрина в ответ на стимуляцию при введении кальция, секретина (парадоксальное повышение) или приёме пищи.
Гипергастринемия может выявляться также при нарушениях секреции кислоты в желудке, когда уровень гормона адекватно повышен, например, при пернициозной анемии, хроническом атрофическом гастрите, раке желудка, а также при стенозе привратника, ваготомии без резекции желудка, у части пациентов с обычной язвенной болезнью. Поскольку уровень гастрина в значительной мере зависит от приёма пищи, исследование должно проводиться строго натощак. Многие лекарственные препараты, направленные на терапию язв, повышают уровень гастрина, в частности, h3-антагонисты, антацидные препараты, блокаторы H+-помпы (омепразол). Оптимальным является исследование уровня гастрина до начала лечения медикаментозными средствами или после его окончания. Уровень гастрина может повышать употребление кофе и курение.
Пределы определения: 10 мЕд/мл -5000 мЕд/мл
Содержание сывороточного гастрина у пациентов с рефлюкс-гастритом
Статья опубликована на с. 32-36
Функционирование пищеварительной системы, взаимодействие таких процессов, как моторика, секреция и всасывание, регулируются сложной системой нервных и гуморальных механизмов. В свою очередь, огромную роль в гуморальной регуляции пищеварительных функций играют гастроинтестинальные гормоны. Эти вещества продуцируются эндокринными клетками слизистой оболочки желудка, двенадцатиперстной кишки, поджелудочной железы и представляют собой пептиды и амины, оказывающие регуляторное влияние на клетки-мишени.
Роль гастроинтестинальных гормонов в патогенезе заболеваний желудочно-кишечного тракта многогранна и окончательно не выяснена. Особенно актуальным является вопрос о состоянии динамического равновесия между гастроинтестинальными гормонами и возникновением нарушений во взаимосвязях между ними при патологии и после оперативных вмешательств на желудочно-кишечном тракте. Для патологии верхних отделов пищеварительной системы наиболее значимым является гормон гастрин, продуцируемый в G-клетках слизистой желудка и двенадцатиперстной кишки, а также островковых клетках поджелудочной железы. Существует гастрин в 3 основных формах — G-17 (little), G-34 (big) и G-14 (mini) (обозначаемых по числу аминокислотных остатков). В норме основное количество гастрина образуется в желудке [1, 2].
Главная функция гастрина — стимуляция выделения соляной кислоты париетальными клетками дна желудка. Связываясь с гастриновыми рецепторами в желудке и активируя через аденилатциклазную систему синтез желудочного сока, он стимулирует секрецию соляной кислоты (НСl), пепсиногена, бикарбонатов и слизи в слизистой желудка. Схематично роль гастрина в процессе кислотообразования представлена на рис. 1.
Гастрин увеличивает продукцию простагландина E в слизистой желудка, что приводит к местному расширению сосудов, усилению кровоснабжения, физиологическому отеку слизистой желудка и к миграции лейкоцитов в слизистую. Лейкоциты принимают участие в процессах пищеварения, секретируя различные ферменты и производя фагоцитоз.
Гастрин тормозит опорожнение желудка, что обеспечивает достаточную для переваривания пищи длительность воздействия соляной кислоты и пепсина на пищевой комок.
Рецепторы к гастрину имеются и в тонкой кишке и поджелудочной железе. Гастрин увеличивает секрецию секретина, холецистокинина, соматостатина и ряда других гормонально-активных кишечных и панкреатических пептидов, а также секрецию кишечных и панкреатических ферментов. Тем самым гастрин создает условия для осуществления следующей, кишечной фазы пищеварения.
Гипергастринемия может выявляться при нарушениях секреции кислоты в желудке, когда уровень гормона адекватно повышен, например при пернициозной анемии, хроническом атрофическом гастрите, раке желудка, а также при стенозе привратника, ваготомии без резекции желудка, у части пациентов с обычной язвенной болезнью [3].
Гиперплазия и гиперфункция гастринпродуцирующих гландулоцитов (G-клеток) могут отягощать течение и прогноз заболевания, в частности быть причиной упорного рецидивирования дуоденальных язв [4].
Малоизученным и спорным является вопрос о состоянии гастринпродуцирующей системы желудка при различных формах хронического гастрита, в частности в условиях Нр-инфицирования или повреждающего действия желчного рефлюктата. В развитии рефлюкс-гастрита (РГ), обусловленного дуоденогастральным рефлюксом (ДГР), основными механизмами являются антродуоденальная дисмоторика и нарушение естественного антирефлюксного барьера. Результатом негативного воздействия желчи и панкреатического секрета являются дистрофические и некробиотические изменения желудочного эпителия с последующим нарастанием атрофических изменений, прогрессированием и искажением процессов пролиферации, развитием дисплазии, увеличивающей риск малигнизации [5, 6]. По данным ряда авторов, заброс желчи при ДГР может вызывать увеличение количества и повышение функциональной активности G-клеток, стимулируя выделение гастрина, однако этот вопрос окончательно не изучен. В ряде работ установлено, что возбуждение гастриновых рецепторов сопровождается слабым прямым влиянием на секрецию HCl. Однако гипергастринемия не всегда связана с гиперсекрецией HCl, поэтому роль гастриновых рецепторов париетальных клеток в кислотообразовании также дискутируется. В то же время активизация гастрином соответствующих рецепторов оказывает трофическое влияние на париетальные клетки, увеличивая их массу и скорость созревания. Значительный рост числа париетальных клеток в случае гастриновой стимуляции — сложный процесс, возникающий, по некоторым данным, через 3–9 лет после появления первых симптомов болезни [1, 5]. Гипергастринемия, таким образом, связана с гиперпролиферацией ЕСL- и париетальных клеток, но вопрос о возможности дальнейшей прогрессии в дисплазию и карциноид дискутируется [7, 8].
С другой стороны, увеличение синтеза гастрина G-клетками может происходить вследствие инфицирования Н.pylori. Это происходит из-за того, что аммиак, образующийся под действием уреазы Н.pylori, повышает рН слизистой оболочки желудка. Предполагается, что постоянное образование аммиака в процессе жизнедеятельности Н.pylori обусловливает непрерывное защелачивание антрального отдела желудка, нарушает ингибиторный механизм секреции гастрина и повышает уровень соляной кислоты, что приводит к гиперпродукции гастрина и гипергастринемии. Воспаление слизистой при Н.руlori-инфекции также вызывает стимуляцию секреции гастрина [5, 9].
Таким образом, поскольку сегодня нет единого мнения относительно роли гастрина в механизмах регуляции пищеварения во всех аспектах данной проблемы, изучение состояния гастринпродуцирующей системы желудка в условиях воздействия различных факторов является актуальной задачей гастроэнтерологии.
Цель исследования — изучить взаимосвязь между уровнем гастрина, желчных кислот, уровнем ацидности желудочного сока и наличием Н.руlori в желудке у пациентов с рефлюкс-гастритом.
Материалы и методы
В исследовании приняли участие 60 больных с РГ в возрасте от 19 до 79 лет, в среднем (49,4 ± 1,8) года. Среди них женщин было 46 (76,7 %), мужчин — 14 (23,3 %). Для оценки лабораторных данных проведены аналогичные исследования у 20 здоровых лиц в возрасте от 19 до 59 лет.
Эндоскопические исследования выполняли по общепринятой методике с помощью гастрофиброскопа Оlympus ХР-20. Для стандартизации результатов эндоскопического исследования использовали минимальную стандартную терминологию в эндоскопии пищеварительной системы, которая рекомендована для использования Всемирной организацией эндоскопии пищеварительной системы [10].
Верификацию диагноза РГ проводили на основании исследования биоптатов, полученных во время ЭГДС, которые были обработаны по методике Л.И. Аруина. Н.руlori определяли с помощью цитологического, 13С-дыхательного уреазного (инфракрасный анализатор IRIS) и быстрого уреазного тестов непосредственно в эндоскопическом кабинете. Пациентов считали H.рylori-инфицированными, если результаты не менее двух методов были положительными. Исследование секреторной функции желудка выполняли с помощью экспресс-рН-метрии. Результаты оценивали по методике В.М. Чернобрового [11].
Для оценки степени ДГР исследовался уровень желчных кислот в желудочном соке. Использована биохимическая методика [12], в основе которой лежит взаимодействие желчных кислот с хлорным железом в смеси с уксусной и серной кислотами.
У всех больных натощак утром исследовали межпищеварительный (базальный) уровень гастрина в сыворотке крови методом иммуноферментного анализа.
Статистическая обработка результатов исследований осуществлялась методами вариационной статистики с использованием стандартного пакета прикладных программ SРSS 13.0 [13]. Сравнение средних значений осуществляли с помощью параметрических методов (t-критерия Стьюдента) при нормальном распределении данных признаков, в остальных случаях использовали непараметрический метод (U-критерий Манна — Уитни). Разница считалась достоверной, если достигнутый уровень значимости (р) был ниже 0,05. Корреляционный анализ выполняли по Пирсону и Спирмену (в зависимости от того, по каким шкалам оценивали данные).
Результаты и обсуждение
Результаты исследований свидетельствуют, что у большинства больных с РГ (96,7 %) наблюдалось повышение уровня гастрина до (245,6 ± 15,5) пг/мл. В то же время, по данным литературы, при хроническом гастрите нерефлюксной этиологии может наблюдаться нормальное и пониженное выделение гастрина [1, 12].
Так как ДГР имел разное происхождение, то сначала оценивали содержание сывороточного гастрина в зависимости от фонового диагноза (рис. 2).
Как видно из рис. 2, в группе больных с РГ неустановленной этиологии в среднем наблюдалась гипергастринемия на уровне (244,6 ± 23,8) пг/мл. Содержание гастрина было повышено у всех 17 больных и колебалось в пределах от 125,2 до 477,0 пг/мл. Обследование больных с РГ при ЯБЖ и ДПК показало, что среднее содержание гастрина в сыворотке крови зафиксировано на уровне (225,9 ± 20,9) пг/мл, что также свидетельствует о его гиперпродукции. Из них у 1 больного (5,6 %) уровень был в пределах нормы, тогда как у 17 из 18 (94,4 %) он был повышен и колебался в пределах от 128,7 до 389,2 пг/мл. У больных с РГ при ПХЭС уровень гастрина в сыворотке крови достоверно превышал средний показатель нормы — (100,6 ± 2,9) пг/мл — в 2,5 раза и составил (260,6 ± 30,3) пг/мл. Также только у 1 больного уровень был в пределах нормы, тогда как у 24 из 25 (96,0 %) — повышен в пределах от 124,5 до 646,0 пг/мл.
Не выявлено достоверной разницы между группами больных с РГ по среднему уровню гастрина (р > 0,05). Это позволяет предположить, что этиология рефлюкса не влияет на продукцию гастрина у данной категории пациентов.
Проведенный литературный анализ факторов, влияющих на продукцию гастрина и его взаимосвязь с ДГР у обследованных больных, показал, что наиболее значимо на продукцию гастрина воздействует рН желудка (закисление способствует ингибированию секреции гастрина, защелачивание — повышению секреции гастрина) [6, 12].
В связи с этим нами проведено сопоставление уровня рН антрального отдела желудка с данными рН-метрии и концентрацией гастрина.
Данные рН-метрии у больных с РГ представлены на рис. 3.
Анализ показателей рН-метрии по минимальному значению продемонстрировал, что во всех группах у половины больных наблюдались проявления гипоацидности в желудке, что может объясняться ощелачивающим действием дуоденального рефлюктата. При этом у части больных наблюдались нормацидность (6,7 %) и гиперацидность (26,7 %), которая была более выражена у больных с РГ при ЯБЖ и ДПК (33,3 %).
Средний уровень рН у больных составил 4,77 ± 0,22, что свидетельствовало об ощелачивании желудка и соответствовало диагнозу ДГР.
Результаты сравнения рН антрального отдела желудка и концентрации гастрина показали, что между ними наблюдалась четкая взаимозависимость — коэффициент корреляции составил 0,468 (р < 0,001).
Учитывая литературные данные о связи гастрина и рН в антральном отделе, выявленную нами прямую достоверную, но достаточно невысокую связь между этими показателями, проведено изучение других факторов, влияющих на уровень гастрина, таких как наличие Н.руlori-инфекции, степень выраженности ДГР, возраст больного.
Поскольку основным биохимическим показателем ДГР являются желчные кислоты, то сравнивали их уровень с концентрацией гастрина.
Анализ уровня гастрина в зависимости от степени интенсивности ДГР выявил, что у больных с I–II степенью ДГР (уровень желчных кислот 1,0–1,7 ммоль/л) содержание гастрина в среднем повышалось до (240,2 ± 13,3) пг/мл, тогда как у больных с III–IV степенью (уровень желчных кислот 1,8–2,0 ммоль/л и более) — до (461,5 ± 48,5) пг/мл. У здоровых этот показатель составил (100,6 ± 2,9) пг/мл. Следовательно, продукция гастрина существенно зависит от выраженности ДГР.
Взаимосвязь продукции гастрина и содержания желчных кислот в желудке подтвердил и корреляционный анализ (рис. 4).
Установлено, что высокая прямая корреляционная связь между содержанием гастрина и желчных кислот в рефлюктате наблюдалась как при РГ вообще (0,838), так и при распределении по группам, что может свидетельствовать о непосредственной стимуляции желчными кислотами G-клеток антрального отдела желудка.
В то же время уровни гастрина и желчных кислот не зависели от возраста больных (r = 0,085 и r = –0,055; р > 0,05 соответственно), что противоречит литературным данным [3].
На следующем этапе анализа сравнивали уровень гастрина с наличием Н.руlori-инфекции у больных. Частота выявления Н.руlori по результатам быстрого уреазного теста у этих больных составила 68,3 %. Показатели сывороточного гастрина у Н.руlori-позитивных и Н.руlori-негативных пациентов, а также у условно-здоровых лиц приведены в табл. 1.
Как у Н.руlori-позитивных, так и Н.руlori—негативных больных с РГ уровень гастрина в среднем был повышен в отличие от здоровых (р < 0,001). В то же время у больных, инфицированных Н.руlori, уровень гастрина был выше в 1,8 раза ((285,7 ± 19,0) пг/мл), чем у больных без установленной Н.руlori-инфекции ((159,26 ± 12,41) пг/мл). Это соответствует данным о стимулирующем влиянии Н.руlori на G-клетки.
Как видно из табл. 1, в группах наблюдалась аналогичная картина. При этом существенной разницы между группами также не выявлено.
Для сравнения степени влияния различных факторов проведена корреляция между наличием Н.руlori-инфекции и содержанием гастрина. Бисериальный коэффициент корреляции составил 0,697, что указывает на значимое влияние Н.руlori на уровень гастрина.
При ранжировании степени влияния исследуемых факторов на продукцию гастрина установлено, что первое место принадлежит содержанию желчных кислот в рефлюктате (r = 0,838; р < 0,05), второе — Н.руlori-инфекции (r = 0,697; р < 0,05), третье — уровню рН желудка (r = 0,468; р < 0,05). Последний факт может быть связан с тем, что рН в антральном отделе желудка является комбинированным суммарным показателем, на который влияет как кислотообразующая функция желудка, так и защелачивающая.
Для выбора тактики лечения больных с РГ чрезвычайно важным является факт стимулирования продукции гастрина прямым действием дуоденального рефлюктата, что свидетельствует также о самостоятельности патологического процесса при РГ.
Выводы
1. У подавляющего числа больных с РГ наблюдалось повышение содержания гастрина в сыворотке крови более чем в 2 раза.
2. Продукция гастрина напрямую зависит от таких факторов, как уровень желчных кислот в желудке (r = 0,838; р < 0,05), наличие H.pylori-инфекции (r = 0,697; р < 0,05) и ощелачивание желудка (r = 0,468, р < 0,05).
3. Синтез гастрина и содержание желчных кислот не зависели от возраста больных.
Страница не найдена |
Страница не найдена |404. Страница не найдена
Архив за месяц
ПнВтСрЧтПтСбВс
15161718192021
22232425262728
2930
12
12
1
3031
12
15161718192021
25262728293031
123
45678910
12
17181920212223
31
2728293031
1
1234
567891011
12
891011121314
11121314151617
28293031
1234
12
12345
6789101112
567891011
12131415161718
19202122232425
3456789
17181920212223
24252627282930
12345
13141516171819
20212223242526
2728293031
15161718192021
22232425262728
2930
Архивы
Метки
Настройки
для слабовидящих
Physiology, Gastrin — StatPearls — NCBI Bookshelf
Введение
Гастрин — это пептидный гормон, в первую очередь отвечающий за усиление роста слизистой оболочки желудка, перистальтику желудка и секрецию соляной кислоты (HCl) в желудок. Он присутствует в G-клетках антрального отдела желудка и двенадцатиперстной кишки. Гастрин в первую очередь высвобождается в ответ на стимуляцию блуждающего нерва и гастрин-высвобождающего пептида (GRP), вторичный по отношению к приему пептидов, аминокислот, вздутию желудка и повышенному pH желудка.[1] [2] И наоборот, высвобождение гастрина снижается в ответ на паракринное ингибирование соматостатином и снижение рН желудка.
Гастрин секретируется в кровь и переносится на дно желудка и сердце, где находится большая часть париетальных клеток, секретирующих HCl. HCl необходим для преобразования неактивного пепсиногена в активный пепсин, который помогает переваривать белок в желудке и высвобождать кобаламин (витамин B12) из его носителя R-белка слюны. Основным клиническим показанием для определения гастрина является диагностика гастрин-продуцирующей опухоли, гастриномы.Кроме того, похоже, появляются данные, которые предполагают, что гастрин может играть роль в некоторых видах рака, таких как рак желудка.
Проблемы, вызывающие озабоченность
G-клетки секретируют гастрин в системный кровоток, что обеспечивает доставку гастрина к париетальным клеткам и энтерохромаффиноподобным (ECL) клеткам дна желудка и сердца. Гастрин стимулирует пролиферацию эндокринных клеток слизистой оболочки желудка (париетальных клеток, клеток ECL). Это трофическое качество гастрина может быть связано с потенцированием некоторых видов рака.Также было обнаружено, что гастрин взаимодействует с ацинарными клетками поджелудочной железы, гладкомышечными клетками желудка, эндокринными клетками и некоторыми лейкоцитами.
Было обнаружено, что гастрин модулирует иммунитет и воспаление посредством белых кровяных клеток, экспрессирующих CCKB / рецептор гастрина. В частности, экспрессия CCKB была зарегистрирована в некоторых полиморфно-ядерных лейкоцитах (PMN), мононуклеарных клетках и эндотелиальных клетках. Он продемонстрировал способность стимулировать высвобождение гистамина тучными клетками, лимфоцитарную секрецию IL-2, эндотелиальную экспрессию VCAM-1 и P-селектина и эндотелиальную секрецию IL-8.[3]
Клеточные
G-клетки — это нейроэндокринные клетки, ответственные за синтез и секрецию гастрина. В основном они обнаруживаются в антральном отделе привратника, но также могут быть обнаружены в двенадцатиперстной кишке и поджелудочной железе. Они секретируют гастрин, когда стимулируются непосредственно эфферентными нейронами блуждающего нерва, а также нейронами GRP. GRP-нейроны стимулируются присутствием аминокислот в желудке, растяжением желудка и эфферентной стимуляцией блуждающего нерва. Гастрин, секретируемый этими клетками, в первую очередь действует на париетальные клетки и энтерохромаффиноподобные клетки (клетки ECL) в ямках желудка, но также взаимодействует с клетками гладких мышц желудка, ацинарными клетками поджелудочной железы, лимфоцитами, PMN и эндотелиальными клетками.Следовательно, гастрин стимулирует секрецию кислоты непосредственно через париетальные клетки и активирует клетки ECL для секреции гистамина, что приводит к образованию кислоты.
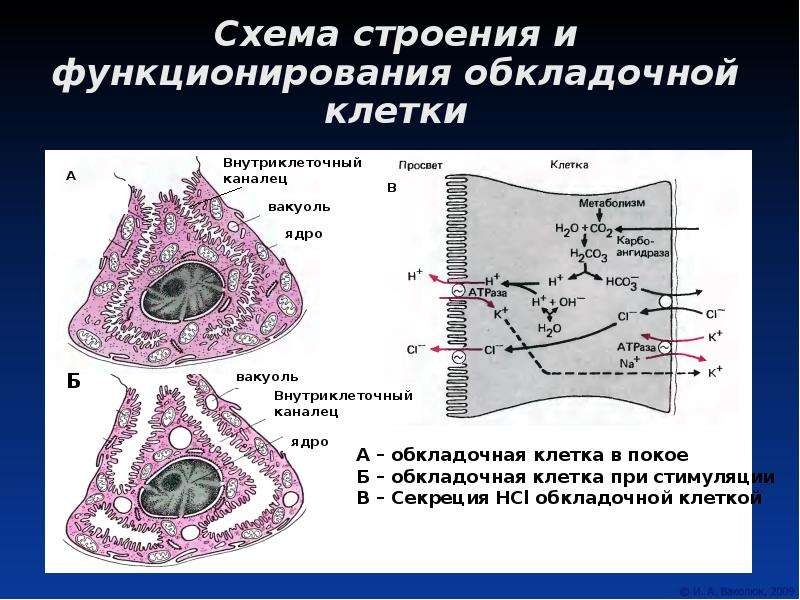
Париетальные клетки, обнаруженные в ямках дна желудка и кардии, секретируют соляную кислоту в просвет желудка через K / H-АТФазу на апикальной (просветной) мембране. Гастрин связывает рецепторы холецистокинина (CCK) B на базальной мембране париетальных клеток, чтобы индуцировать экспрессию K / H-АТФазы. Повышенная экспрессия и активность K / H-АТФазы приводит к повышенной секреции ионов водорода (желудочного сока) в желудок.
Энтерохромаффиноподобные клетки, обнаруженные в ямках желудочного дна и кардии желудка, секретируют гистамин, который затем связывает рецепторы h3 на соседних париетальных клетках и дополнительно усиливает секрецию желудочной кислоты париетальными клетками. Ацинарные клетки, обнаруженные в поджелудочной железе, отвечают за синтез, хранение и секрецию пищеварительных ферментов поджелудочной железы. Гастрин связывает рецепторы CCK2 на ацинарных клетках, вызывая секрецию накопленных в клетке пищеварительных ферментов.[4]
Развитие
Биология развития клеток гастрина и соматостатина происходит в антропилорической слизистой оболочке желудка. [5] Клетки, экспрессирующие гастрин (G-клетки), развиваются из мультигормональных преэндокринных клеток, обнаруженных в регенеративном перешейке желудочных ям. Эти преэндокринные клетки подвергаются асимметричному делению, при каждом делении образуя дочернюю клетку, экспрессирующую гастрин, и дочернюю клетку, экспрессирующую соматостатин. Это асимметричное деление способствует паракринной организации этих клеток, позволяя зрелым экспрессирующим соматостатин D-клеткам регулировать рост и активность соседних с ними G-клеток, экспрессирующих гастрин.Созревание D-клеток и G-клеток регулируется множеством факторов транскрипции, содержащих гомеобоксовые мотивы, включая Pdx-1, Pax 4, Pax 6, Isl-1 и Nkx6.1.
Гастрин представляет собой линейный пептид, который изначально переводится как препрогастрин. Препрогастрин подвергается посттрансляционному расщеплению, в результате чего образуется семейство гастриновых пептидов переменной длины, наиболее распространенным из которых является «большой гастрин», пептид, состоящий из 34 аминокислот. Биоактивность гастрина сохраняется в 5-аминокислотной последовательности, называемой «пентагастрин», которая находится на 5-С-конце всех членов семейства гастринов, независимо от общего размера пептида гастрина.5 C-концевых аминокислот гастрина и холецистокинина (CCK) идентичны. [6]
Вовлеченные системы органов
Гастрин в первую очередь поражается в верхних отделах желудочно-кишечного тракта, особенно в желудке и, в меньшей степени, в двенадцатиперстной кишке и поджелудочной железе. Гастрин в первую очередь влияет на клетки ECL и париетальные клетки дна желудка и кардии. Роль гастрина также влияет на иммунную систему через плохо изученные механизмы с участием рецептора CCKB на моноцитах, лимфоцитах и тучных клетках.
Функция
Подводя итог функции гастрина:
Вызывает секрецию желудочной кислоты в желудке через Са-зависимый механизм высвобождения
Действует на энтерохромаффиноподобные (ECL) клетки дна желудка, вызывая высвобождение гистамина.
Обеспечивает поддержку и пролиферацию эпителия желудка
- Подавляет апоптоз эпителиальных клеток желудка и поддерживает миграцию эпителиальных клеток [7]
Механизм
Действие гастрина в первую очередь опосредуется связыванием холецистокина (CCKB) рецептор.Рецептор CCKB представляет собой рецептор, связанный с G-белком, который после активации гастрином начинает передачу сигналов через каскад фосфолипаза C — диацилглицерин + инозитолтрифосфат — кальций — протеинкиназа C. [8]
Рецептор CCKB в основном обнаруживается в центральной нервной системе (ЦНС) и желудочно-кишечном тракте (ЖКТ), но также экспрессируется на эндотелиальных клетках и некоторых лейкоцитах (WBC). Рецепторы CCK могут также индуцировать сигнальные пути через рецепторы тирозинкиназ в более ограниченной степени, и это было продемонстрировано при трансактивации EGFR.
Сопутствующие исследования
Основным показанием к анализу гастрина является диагностика синдрома Золлингера-Эллисона, который представляет собой гастрин-продуцирующую опухоль, приводящую к рецидивирующей, не поддающейся лечению язвенной болезни и диарее.
Однако у пентагастрина есть и другие показания. Парентеральная инъекция синтетического пентагастрина использовалась в качестве диагностического средства для карциноидного синдрома, вызывая симптомы у пациентов, которые трудно различить из-за минимального наличия симптомов.Он также использовался в ядерной медицине для обнаружения дивертикула Меккеля.
Тест на кальцитонин, стимулированный пентагастрином, может использоваться у пациентов с нормальным уровнем кальцитонина, подозреваемых в наличии медуллярной карциномы щитовидной железы. Если результат положительный, уровень кальцитонина в сыворотке пациента поднимется до уровней, значительно превышающих нормальный диапазон. Кроме того, у этих пациентов в послеоперационном периоде можно использовать стимулированное пентагастрином высвобождение кальцитонина для обнаружения любых оставшихся секретирующих кальцитонин парафолликулярных клеток (С-клеток).[6]
Патофизиология
Любой патологический процесс, приводящий к беспрепятственной секреции кислоты желудочного сока, приведет к язвенной болезни. Некоторые из этих патологических процессов происходят из-за неингибированной секреции желудочного сока, опосредованной гастрином.
Гастрит, вызванный Helicobacter pylori, связан с повышенным уровнем гастрина, что, вероятно, является вторичным по отношению к снижению секретирующих соматостатин D-клеток и последующему нарушению регуляции секреции гастрина G-клетками. [9] Этот дисбаланс приводит к снижению pH, что, следовательно, подавляет защитные силы слизистой оболочки желудка, что часто приводит к повреждению слизистой оболочки желудка и образованию пептических язв.
Гипохлоргидрия, вторичная по отношению к разрушению париетальных клеток желудка при пернициозной анемии, связана с повышенной активностью G-клеток, что приводит к гипергастринемии. Диффузные гиперпластические узелки, обнаруживаемые в слизистой оболочке желудка у пациентов с пернициозной анемией, могут быть связаны с трофическим действием гастрина на эндокринные клетки желудка. [10]
Прекращение терапии ингибиторами протонной помпы (ИПП) пациентами, которые постоянно получали ИПП, часто приводит к рефрактерному гастриту.Это связано с парадоксальным увеличением гастрина в ответ на ингибирование H / K-АТФазы ИПП. После прекращения терапии ИПП неингибированная H / K-АТФаза становится гиперактивной в присутствии повышенных уровней гастрина, что приводит к гастриту. К счастью, этот рефрактерный гастрит проходит самостоятельно, так как уровни гастрина вернутся к норме при продолжительном прекращении терапии ИПП. [11]
Из-за трофического эффекта гастрина повышенные уровни гастрина у пациентов, получающих хроническую терапию ИПП, также вызывают опасения по поводу потенцирования рака желудка.Хронически повышенный уровень гастрина также вызывает озабоченность из-за трофического эффекта гастрина и его связи с раком желудочно-кишечного тракта. Рецепторы CCKB активируются при раке желудка, и исследования in vitro продемонстрировали способность гастрина усиливать пролиферацию клеточных линий рака желудка человека и клеточных линий рака толстой кишки. [12] [13] Кроме того, гастрин проявляет ангиогенные и антиапоптотические свойства при нескольких злокачественных новообразованиях, включая рак желудка. Повышенные уровни гастрина также были связаны с развитием карциноидных опухолей желудка, возникающих из клеток ECL желудка.[14] При этих опухолях желудка с положительным рецептором CCKB и карциноидных опухолях желудка терапевтические препараты, такие как лорглумид и девазепид, которые нацелены на рецепторы CCKB, могут быть существенно полезными. [15] [16] [17] Кроме того, карциноидные опухоли желудка связаны со снижением уровня витамина B12 в сыворотке крови. Следовательно, уровни витамина B12 в сыворотке крови требуют мониторинга у всех пациентов, получающих хроническую терапию ИПП. Однако необходимы дальнейшие исследования для определения стратегий, нацеленных на рецепторы гастрин-CCK в качестве терапевтических мишеней.
Синдром Золлингера-Эллисона (ЗЭС) характеризуется наличием гастриномы, гиперсекрецией желудочного сока, пептической язвой и секреторной диареей. Гастринома — это нерегулируемая нейроэндокринная опухоль (НЭО), секретирующая гастрин. Биопсия опухоли выявляет типичные гистологические паттерны NET, которые дают положительную окраску на хромогранин А, синаптофизин и гастрин. Нерегулируемая секреция гастрина гастриномами приводит к гиперстимуляции и гиперплазии париетальных клеток слизистой оболочки желудка и клеток ECL.Гиперплазия и гиперактивность этих клеток приводят к чрезмерной секреции желудочного сока в желудок. Желудочная кислота впоследствии подавляет защитные механизмы слизистой оболочки желудка, вызывая язвы желудка и двенадцатиперстной кишки.
ZES подтверждается наличием повышенной концентрации гастрина в сыворотке крови натощак, намного превышающей 100 пг / мл, в сочетании с повышенной базальной секрецией кислоты желудочного сока и / или низким pH желудочного сока ниже 2,0. Еще один полезный тест для подтверждения диагноза — тест стимуляции секретином, потенциально приводящий к увеличению гастрина более чем на 120 пг / мл по сравнению с базальным уровнем.[18] Секретин — это пептидный гормон, вырабатываемый S-клетками двенадцатиперстной кишки в ответ на кислотность и высвобождаемый в кровоток для воздействия на несколько органов, таких как желудок, поджелудочная железа и печень. В желудке секретин препятствует высвобождению желудочной кислоты из париетальных клеток. В поджелудочной железе секретин вызывает высвобождение бикарбоната из клеток протока. В печени он вызывает выделение желчи, которая расщепляет пищевые жиры. [19]
Нормальный уровень гастрина в сыворотке крови натощак практически исключает ЗЭС.От 70% до 75% гастрином являются спорадическими; однако от 25% до 30% этих опухолей связаны с множественной эндокринной неоплазией 1 типа (MEN1). [20] У пациентов с множественной эндокринной неоплазией I типа (MEN1), аутосомно-доминантным заболеванием, наблюдается скопление опухолей гипофиза, паращитовидной железы и поджелудочной железы. Пациенты с диагнозом гастринома должны быть обследованы на предмет наличия симптомов МЭН1, задав вопросы о семейном анамнезе, симптомах гиперпаратиреоза (гиперкальциемия, нефролитиаз) или симптомах опухолей гипофиза (чаще всего пролактинома, которая вызывает галакторею у женщин, но вызывает головную боль и битемпоральную гемианопсию у мужчин).Лаборатории необходимы для измерения сывороточного кальция, паратироидного гормона и пролактина. [21] Вместо гастриномы они также могут проявляться инсулиномой (симптомы гипогликемии), глюкагономами (некротическая мигрирующая эритема (NME), диабет, потеря веса, анемия) или ViPoma (водянистая диарея, гипокалиемия, гипохлоргидрия). [22] Доступны различные методы визуализации для определения опухоли, включая КТ, МРТ, сцинтиграфию рецепторов соматостатина. Пациенты с диагнозом гастринома должны быть обследованы на предмет MEN1 в отношении семейного анамнеза, истории гиперкальциемии, нефролитиаза или опухолей гипофиза, а также необходимы лаборатории для измерения сывороточного кальция, паратиреоидного гормона и пролактина.
Важно управлять симптомами, связанными с повышенным уровнем гастрина, особенно язвенной болезнью. Хирургия — единственная лечебная терапия гастриномы. Он рекомендован пациентам с неметастатическими спорадическими гастриномами или гастриномами, ассоциированными с MEN1, более 2 см в диаметре. В частности, удаление / энуклеация гастрином поджелудочной железы является эффективным, в то время как гастриномы двенадцатиперстной кишки часто требуют дуоденэктомии, поскольку обычно присутствуют множественные опухоли двенадцатиперстной кишки. Хирургическое вмешательство не рекомендуется при гастриномах, ассоциированных с МЭН1, менее 2 см в диаметре, поскольку операция редко бывает излечивающей при наличии МЭН1.[23] [24]
Безоперационная терапия ЗЭС основана на лечении симптомов и профилактике вторичных осложнений пептической язвы. Ингибиторы протонной помпы (ИПП) — это лекарственная терапия первой линии. Они непосредственно уменьшают секрецию желудочного сока в желудок, тем самым снижая способность желудочного сока подавлять защитные силы слизистой оболочки и предотвращать возникновение язвенной болезни. В первоначальном проспективном исследовании пациентов с гастриномой, рефракционной к терапии блокаторами h3, симптомы исчезли у 23 из 29 пациентов.Благодаря высокому успеху в лечении этих пациентов с помощью ИПП, хирургическое вмешательство больше не требуется для лечения гиперсекреции желудочной кислоты [25].
Клиническая значимость
Ведение и терапия гастрин-связанного заболевания, как и в большинстве областей медицины, требует командного межпрофессионального подхода. Гипергастринемию, вторичную по отношению к инфекциям Helicobacter pylori, можно контролировать с помощью лечения инфекционных заболеваний, не требующего эндокринного специалиста или хирургического вмешательства. И наоборот, пациент с гастриномой (ZES) должен лечиться скоординированной командой эндокринологов, гастроэнтерологов, радиологов и хирургов.Определение причины гипергастринемии — это также командный подход, требующий, в частности, первичной медицинской помощи, гастроэнтерологов, эндокринологов, патологов.
Ссылки
- 1.
- Schubert ML. Секреция желудочного сока. Курр Опин Гастроэнтерол. 2016 ноя; 32 (6): 452-460. [PubMed: 27607343]
- 2.
- Xiaoli L, Wu CW, Kim HY, Tian W, Chiang FY, Liu R, Anuwong A, Randolph GW, Dionigi G, Lavazza M. Секреция желудочной кислоты и высвобождение гастрина во время непрерывного вагуса нейромониторинг в хирургии щитовидной железы.Langenbecks Arch Surg. 2017 Март; 402 (2): 265-272. [PubMed: 28105483]
- 3.
- Аль-Эзи AIA. Иммунопатологические и модулирующие эффекты генотипа Cag A + на слизистую желудка, воспалительный ответ, пепсиногены и секрецию гастрина-17 у иракских пациентов, инфицированных H. pylori . Открытый доступ Maced J Med Sci. 2018 20 мая; 6 (5): 794-802. [Статья без PMC: PMC5985861] [PubMed: 29875848]
- 4.
- Петерсен О.Н., Уэда Н. Ацинарные клетки поджелудочной железы: влияние ацетилхолина, панкреозимина, гастрина и секретина на мембранный потенциал и резистентность in vivo и in vitro.J Physiol. 1975 Май; 247 (2): 461-71. [Бесплатная статья PMC: PMC1309479] [PubMed: 168355]
- 5.
- Larsson LI. Биология развития клеток гастрина и соматостатина в антропилорической слизистой оболочке желудка. Microsc Res Tech. 2000, 01 марта; 48 (5): 272-81. [PubMed: 10700044]
- 6.
- Majumdar AP, Johnson LR. Пролиферация клеток слизистой оболочки желудка во время развития у крыс и эффекты пентагастрина. Am J Physiol. 1982 Февраль; 242 (2): G135-9. [PubMed: 7065140]
- 7.
- Коппс Дж., Мерфи Р.Ф., Ловас С. Производство и роль гастрина-17 и гастрина-17-гли при раке желудочно-кишечного тракта. Protein Pept Lett. 2009; 16 (12): 1504-18. [Бесплатная статья PMC: PMC2872940] [PubMed: 20001914]
- 8.
- Sturany S, Van Lint J, Gilchrist A, Vandenheede JR, Adler G, Seufferlein T. Механизм активации протеинкиназы D2 (PKD2) CCK (B) / рецептор гастрина. J Biol Chem. 2002 16 августа; 277 (33): 29431-6. [PubMed: 12058027]
- 9.
- Пак С.М., Ли Х.Р., Ким Дж. Г., Пак Дж. У., Юнг Дж., Хан Ш., Чо Дж. Х., Ким М. К..Влияние инфекции Helicobacter pylori на антральные клетки гастрина и соматостатина и на концентрацию гастрина в сыворотке. Korean J Intern Med. 1999 Янв; 14 (1): 15-20. [Бесплатная статья PMC: PMC4531904] [PubMed: 10063309]
- 10.
- Hughes JW, Muegge BD, Tobin GS, Litvin M, Sun L, Saenz JB, Gyawali CP, McGill JB. ПАТОЛОГИЯ ЖЕЛУДКА ВЫСОКОГО РИСКА И РАСПРОСТРАНЕННЫЕ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С ПЕРНИЦИЗНОЙ АНЕМИЕЙ. Endocr Pract. 2017 ноя; 23 (11): 1297-1303. [PubMed: 291
- ]
- 11.
- Мартин-Алколеа М., Родригес-Эрнандес I, Алдеа М., Росас I, Хунка Дж, Гранада М.Л.Хроническая терапия ингибирования протонной помпы в диагностической точности сывороточных концентраций пепсиногена I и гастрина для выявления злокачественной анемии. Clin Biochem. 2017 июн; 50 (9): 481-484. [PubMed: 28109748]
- 12.
- Смит Дж. П., Ши А.Х., Вотринг М.Г., Маклафлин П.Дж., Загон И.С. Характеристика CCK-B / гастриноподобных рецепторов при карциноме желудка человека. Int J Oncol. 1998 Февраль; 12 (2): 411-9. [PubMed: 9458369]
- 13.
- Уотсон С., Даррант Л., Моррис Д. Гастрин: эффекты усиления роста на опухолевые клетки желудка и толстой кишки человека.Br J Рак. 1989 Апрель; 59 (4): 554-8. [Бесплатная статья PMC: PMC2247137] [PubMed: 2713241]
- 14.
- Grozinsky-Glasberg S, Alexandraki KI, Angelousi A, Chatzellis E, Sougioultzis S, Kaltsas G. Карциноиды желудка. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 645-660. [PubMed: 30098721]
- 15.
- González-Puga C, García-Navarro A, Escames G, León J, López-Cantarero M, Ros E, Acuña-Castroviejo D. Селективный рецептор CCK-A, но не рецептор CCK-B антагонисты подавляют пролиферацию клеток HT-29: синергизм с фармакологическими уровнями мелатонина.J Pineal Res. 2005 Октябрь; 39 (3): 243-50. [PubMed: 16150104]
- 16.
- Fino KK, Matters GL, McGovern CO, Gilius EL, Smith JP. Подавление рецептора CCK-B в клетках рака поджелудочной железы блокирует пролиферацию и способствует апоптозу. Am J Physiol Gastrointest Liver Physiol. 2012 июн 01; 302 (11): G1244-52. [Бесплатная статья PMC: PMC3378167] [PubMed: 22442157]
- 17.
- Бойс М., Ллойд К.А., Притчард Д.М. Возможные клинические показания для антагониста рецепторов CCK 2 .Curr Opin Pharmacol. 2016 декабрь; 31: 68-75. [PubMed: 27710813]
- 18.
- Мендельсон А.Х., Доновиц М. Ловля зебры: клинические жемчужины и подводные камни для успешной диагностики синдрома Золлингера-Эллисона. Dig Dis Sci. 2017 сентябрь; 62 (9): 2258-2265. [PubMed: 28776139]
- 19.
- Afroze S, Meng F, Jensen K, McDaniel K, Rahal K, Onori P, Gaudio E, Alpini G, Glaser SS. Физиологические роли секретина и его рецептора. Ann Transl Med. 2013 Октябрь; 1 (3): 29. [Бесплатная статья PMC: PMC4200670] [PubMed: 25332973]
- 20.
- Виник А., Перри Р. Р., Хьюз М. С., Фелиберти Е. Множественная эндокринная неоплазия типа 1. В: Фейнголд К. Р., Анавальт Б., Бойс А., Хрусос Г., де Гердер В. В., Дхатария К., Дунган К., Гроссман А., Хершман Д. М., Hofland J, Kalra S, Kaltsas G, Koch C, Kopp P, Korbonits M, Kovacs CS, Kuohung W, Laferrère B, McGee EA, McLachlan R, Morley JE, New M, Purnell J, Sahay R, Singer F, Stratakis CA , Трэнс Д.Л., Уилсон Д.П., редакторы. Эндотекст [Интернет]. MDText.com, Inc .; Южный Дартмут (Массачусетс): 7 октября 2017 г. [PubMed: 29465925]
- 21.
- Джусти Ф, Марини Ф, Брэнди МЛ. Множественная эндокринная неоплазия, тип 1. В: Адам М. П., Ардингер Х. Х., Пагон Р. А., Уоллес С. Е., Бин Л. Дж. Х., Мирзаа Г., Амемия А., редакторы. GeneReviews ® [Интернет]. Вашингтонский университет, Сиэтл; Сиэтл (Вашингтон): 31 августа 2005 г. [PubMed: 20301710]
- 22.
- Сонг X, Чжэн С., Ян Дж., Сюн Дж., Цао З., Фэн М., Чжан Т., Чжао Ю. Глюкагонома и синдром глюкагономы . Oncol Lett. 2018 Март; 15 (3): 2749-2755. [Бесплатная статья PMC: PMC5778850] [PubMed: 29435000]
- 23.
- Нортон Дж. А., Фостер Д. С., Ито Т., Дженсен РТ. Гастриномы: медикаментозное или хирургическое лечение. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 577-601. [Бесплатная статья PMC: PMC6092039] [PubMed: 30098717]
- 24.
- Дои Р. Детерминанты хирургической резекции нейроэндокринных опухолей поджелудочной железы. J Hepatobilation Pancreat Sci. 2015 августа; 22 (8): 610-7. [PubMed: 25773163]
- 25.
- van Leeuwaarde RS, de Laat JM, Pieterman CRC, Dreijerink K, Vriens MR, Valk GD. Будущее: медицинские достижения в терапевтических подходах и стратегиях управления МЭН1.Endocr Relat Cancer. 2017 Октябрь; 24 (10): T179-T193. [PubMed: 28768698]
Физиология, гастрин — StatPearls — NCBI Bookshelf
Введение
Гастрин — это пептидный гормон, который в первую очередь отвечает за усиление роста слизистой оболочки желудка, моторики желудка и секреции соляной кислоты (HCl) в желудок. Он присутствует в G-клетках антрального отдела желудка и двенадцатиперстной кишки. Гастрин в первую очередь высвобождается в ответ на стимуляцию блуждающего нерва и гастрин-высвобождающего пептида (GRP), вторичный по отношению к приему пептидов, аминокислот, вздутию желудка и повышенному pH желудка.[1] [2] И наоборот, высвобождение гастрина снижается в ответ на паракринное ингибирование соматостатином и снижение рН желудка.
Гастрин секретируется в кровь и переносится на дно желудка и сердце, где находится большая часть париетальных клеток, секретирующих HCl. HCl необходим для преобразования неактивного пепсиногена в активный пепсин, который помогает переваривать белок в желудке и высвобождать кобаламин (витамин B12) из его носителя R-белка слюны. Основным клиническим показанием для определения гастрина является диагностика гастрин-продуцирующей опухоли, гастриномы.Кроме того, похоже, появляются данные, которые предполагают, что гастрин может играть роль в некоторых видах рака, таких как рак желудка.
Проблемы, вызывающие озабоченность
G-клетки секретируют гастрин в системный кровоток, что обеспечивает доставку гастрина к париетальным клеткам и энтерохромаффиноподобным (ECL) клеткам дна желудка и сердца. Гастрин стимулирует пролиферацию эндокринных клеток слизистой оболочки желудка (париетальных клеток, клеток ECL). Это трофическое качество гастрина может быть связано с потенцированием некоторых видов рака.Также было обнаружено, что гастрин взаимодействует с ацинарными клетками поджелудочной железы, гладкомышечными клетками желудка, эндокринными клетками и некоторыми лейкоцитами.
Было обнаружено, что гастрин модулирует иммунитет и воспаление посредством белых кровяных клеток, экспрессирующих CCKB / рецептор гастрина. В частности, экспрессия CCKB была зарегистрирована в некоторых полиморфно-ядерных лейкоцитах (PMN), мононуклеарных клетках и эндотелиальных клетках. Он продемонстрировал способность стимулировать высвобождение гистамина тучными клетками, лимфоцитарную секрецию IL-2, эндотелиальную экспрессию VCAM-1 и P-селектина и эндотелиальную секрецию IL-8.[3]
Клеточные
G-клетки — это нейроэндокринные клетки, ответственные за синтез и секрецию гастрина. В основном они обнаруживаются в антральном отделе привратника, но также могут быть обнаружены в двенадцатиперстной кишке и поджелудочной железе. Они секретируют гастрин, когда стимулируются непосредственно эфферентными нейронами блуждающего нерва, а также нейронами GRP. GRP-нейроны стимулируются присутствием аминокислот в желудке, растяжением желудка и эфферентной стимуляцией блуждающего нерва. Гастрин, секретируемый этими клетками, в первую очередь действует на париетальные клетки и энтерохромаффиноподобные клетки (клетки ECL) в ямках желудка, но также взаимодействует с клетками гладких мышц желудка, ацинарными клетками поджелудочной железы, лимфоцитами, PMN и эндотелиальными клетками.Следовательно, гастрин стимулирует секрецию кислоты непосредственно через париетальные клетки и активирует клетки ECL для секреции гистамина, что приводит к образованию кислоты.
Париетальные клетки, обнаруженные в ямках дна желудка и кардии, секретируют соляную кислоту в просвет желудка через K / H-АТФазу на апикальной (просветной) мембране. Гастрин связывает рецепторы холецистокинина (CCK) B на базальной мембране париетальных клеток, чтобы индуцировать экспрессию K / H-АТФазы. Повышенная экспрессия и активность K / H-АТФазы приводит к повышенной секреции ионов водорода (желудочного сока) в желудок.
Энтерохромаффиноподобные клетки, обнаруженные в ямках желудочного дна и кардии желудка, секретируют гистамин, который затем связывает рецепторы h3 на соседних париетальных клетках и дополнительно усиливает секрецию желудочной кислоты париетальными клетками. Ацинарные клетки, обнаруженные в поджелудочной железе, отвечают за синтез, хранение и секрецию пищеварительных ферментов поджелудочной железы. Гастрин связывает рецепторы CCK2 на ацинарных клетках, вызывая секрецию накопленных в клетке пищеварительных ферментов.[4]
Развитие
Биология развития клеток гастрина и соматостатина происходит в антропилорической слизистой оболочке желудка. [5] Клетки, экспрессирующие гастрин (G-клетки), развиваются из мультигормональных преэндокринных клеток, обнаруженных в регенеративном перешейке желудочных ям. Эти преэндокринные клетки подвергаются асимметричному делению, при каждом делении образуя дочернюю клетку, экспрессирующую гастрин, и дочернюю клетку, экспрессирующую соматостатин. Это асимметричное деление способствует паракринной организации этих клеток, позволяя зрелым экспрессирующим соматостатин D-клеткам регулировать рост и активность соседних с ними G-клеток, экспрессирующих гастрин.Созревание D-клеток и G-клеток регулируется множеством факторов транскрипции, содержащих гомеобоксовые мотивы, включая Pdx-1, Pax 4, Pax 6, Isl-1 и Nkx6.1.
Гастрин представляет собой линейный пептид, который изначально переводится как препрогастрин. Препрогастрин подвергается посттрансляционному расщеплению, в результате чего образуется семейство гастриновых пептидов переменной длины, наиболее распространенным из которых является «большой гастрин», пептид, состоящий из 34 аминокислот. Биоактивность гастрина сохраняется в 5-аминокислотной последовательности, называемой «пентагастрин», которая находится на 5-С-конце всех членов семейства гастринов, независимо от общего размера пептида гастрина.5 C-концевых аминокислот гастрина и холецистокинина (CCK) идентичны. [6]
Вовлеченные системы органов
Гастрин в первую очередь поражается в верхних отделах желудочно-кишечного тракта, особенно в желудке и, в меньшей степени, в двенадцатиперстной кишке и поджелудочной железе. Гастрин в первую очередь влияет на клетки ECL и париетальные клетки дна желудка и кардии. Роль гастрина также влияет на иммунную систему через плохо изученные механизмы с участием рецептора CCKB на моноцитах, лимфоцитах и тучных клетках.
Функция
Подводя итог функции гастрина:
Вызывает секрецию желудочной кислоты в желудке через Са-зависимый механизм высвобождения
Действует на энтерохромаффиноподобные (ECL) клетки дна желудка, вызывая высвобождение гистамина.
Обеспечивает поддержку и пролиферацию эпителия желудка
- Подавляет апоптоз эпителиальных клеток желудка и поддерживает миграцию эпителиальных клеток [7]
Механизм
Действие гастрина в первую очередь опосредуется связыванием холецистокина (CCKB) рецептор.Рецептор CCKB представляет собой рецептор, связанный с G-белком, который после активации гастрином начинает передачу сигналов через каскад фосфолипаза C — диацилглицерин + инозитолтрифосфат — кальций — протеинкиназа C. [8]
Рецептор CCKB в основном обнаруживается в центральной нервной системе (ЦНС) и желудочно-кишечном тракте (ЖКТ), но также экспрессируется на эндотелиальных клетках и некоторых лейкоцитах (WBC). Рецепторы CCK могут также индуцировать сигнальные пути через рецепторы тирозинкиназ в более ограниченной степени, и это было продемонстрировано при трансактивации EGFR.
Сопутствующие исследования
Основным показанием к анализу гастрина является диагностика синдрома Золлингера-Эллисона, который представляет собой гастрин-продуцирующую опухоль, приводящую к рецидивирующей, не поддающейся лечению язвенной болезни и диарее.
Однако у пентагастрина есть и другие показания. Парентеральная инъекция синтетического пентагастрина использовалась в качестве диагностического средства для карциноидного синдрома, вызывая симптомы у пациентов, которые трудно различить из-за минимального наличия симптомов.Он также использовался в ядерной медицине для обнаружения дивертикула Меккеля.
Тест на кальцитонин, стимулированный пентагастрином, может использоваться у пациентов с нормальным уровнем кальцитонина, подозреваемых в наличии медуллярной карциномы щитовидной железы. Если результат положительный, уровень кальцитонина в сыворотке пациента поднимется до уровней, значительно превышающих нормальный диапазон. Кроме того, у этих пациентов в послеоперационном периоде можно использовать стимулированное пентагастрином высвобождение кальцитонина для обнаружения любых оставшихся секретирующих кальцитонин парафолликулярных клеток (С-клеток).[6]
Патофизиология
Любой патологический процесс, приводящий к беспрепятственной секреции кислоты желудочного сока, приведет к язвенной болезни. Некоторые из этих патологических процессов происходят из-за неингибированной секреции желудочного сока, опосредованной гастрином.
Гастрит, вызванный Helicobacter pylori, связан с повышенным уровнем гастрина, что, вероятно, является вторичным по отношению к снижению секретирующих соматостатин D-клеток и последующему нарушению регуляции секреции гастрина G-клетками. [9] Этот дисбаланс приводит к снижению pH, что, следовательно, подавляет защитные силы слизистой оболочки желудка, что часто приводит к повреждению слизистой оболочки желудка и образованию пептических язв.
Гипохлоргидрия, вторичная по отношению к разрушению париетальных клеток желудка при пернициозной анемии, связана с повышенной активностью G-клеток, что приводит к гипергастринемии. Диффузные гиперпластические узелки, обнаруживаемые в слизистой оболочке желудка у пациентов с пернициозной анемией, могут быть связаны с трофическим действием гастрина на эндокринные клетки желудка. [10]
Прекращение терапии ингибиторами протонной помпы (ИПП) пациентами, которые постоянно получали ИПП, часто приводит к рефрактерному гастриту.Это связано с парадоксальным увеличением гастрина в ответ на ингибирование H / K-АТФазы ИПП. После прекращения терапии ИПП неингибированная H / K-АТФаза становится гиперактивной в присутствии повышенных уровней гастрина, что приводит к гастриту. К счастью, этот рефрактерный гастрит проходит самостоятельно, так как уровни гастрина вернутся к норме при продолжительном прекращении терапии ИПП. [11]
Из-за трофического эффекта гастрина повышенные уровни гастрина у пациентов, получающих хроническую терапию ИПП, также вызывают опасения по поводу потенцирования рака желудка.Хронически повышенный уровень гастрина также вызывает озабоченность из-за трофического эффекта гастрина и его связи с раком желудочно-кишечного тракта. Рецепторы CCKB активируются при раке желудка, и исследования in vitro продемонстрировали способность гастрина усиливать пролиферацию клеточных линий рака желудка человека и клеточных линий рака толстой кишки. [12] [13] Кроме того, гастрин проявляет ангиогенные и антиапоптотические свойства при нескольких злокачественных новообразованиях, включая рак желудка. Повышенные уровни гастрина также были связаны с развитием карциноидных опухолей желудка, возникающих из клеток ECL желудка.[14] При этих опухолях желудка с положительным рецептором CCKB и карциноидных опухолях желудка терапевтические препараты, такие как лорглумид и девазепид, которые нацелены на рецепторы CCKB, могут быть существенно полезными. [15] [16] [17] Кроме того, карциноидные опухоли желудка связаны со снижением уровня витамина B12 в сыворотке крови. Следовательно, уровни витамина B12 в сыворотке крови требуют мониторинга у всех пациентов, получающих хроническую терапию ИПП. Однако необходимы дальнейшие исследования для определения стратегий, нацеленных на рецепторы гастрин-CCK в качестве терапевтических мишеней.
Синдром Золлингера-Эллисона (ЗЭС) характеризуется наличием гастриномы, гиперсекрецией желудочного сока, пептической язвой и секреторной диареей. Гастринома — это нерегулируемая нейроэндокринная опухоль (НЭО), секретирующая гастрин. Биопсия опухоли выявляет типичные гистологические паттерны NET, которые дают положительную окраску на хромогранин А, синаптофизин и гастрин. Нерегулируемая секреция гастрина гастриномами приводит к гиперстимуляции и гиперплазии париетальных клеток слизистой оболочки желудка и клеток ECL.Гиперплазия и гиперактивность этих клеток приводят к чрезмерной секреции желудочного сока в желудок. Желудочная кислота впоследствии подавляет защитные механизмы слизистой оболочки желудка, вызывая язвы желудка и двенадцатиперстной кишки.
ZES подтверждается наличием повышенной концентрации гастрина в сыворотке крови натощак, намного превышающей 100 пг / мл, в сочетании с повышенной базальной секрецией кислоты желудочного сока и / или низким pH желудочного сока ниже 2,0. Еще один полезный тест для подтверждения диагноза — тест стимуляции секретином, потенциально приводящий к увеличению гастрина более чем на 120 пг / мл по сравнению с базальным уровнем.[18] Секретин — это пептидный гормон, вырабатываемый S-клетками двенадцатиперстной кишки в ответ на кислотность и высвобождаемый в кровоток для воздействия на несколько органов, таких как желудок, поджелудочная железа и печень. В желудке секретин препятствует высвобождению желудочной кислоты из париетальных клеток. В поджелудочной железе секретин вызывает высвобождение бикарбоната из клеток протока. В печени он вызывает выделение желчи, которая расщепляет пищевые жиры. [19]
Нормальный уровень гастрина в сыворотке крови натощак практически исключает ЗЭС.От 70% до 75% гастрином являются спорадическими; однако от 25% до 30% этих опухолей связаны с множественной эндокринной неоплазией 1 типа (MEN1). [20] У пациентов с множественной эндокринной неоплазией I типа (MEN1), аутосомно-доминантным заболеванием, наблюдается скопление опухолей гипофиза, паращитовидной железы и поджелудочной железы. Пациенты с диагнозом гастринома должны быть обследованы на предмет наличия симптомов МЭН1, задав вопросы о семейном анамнезе, симптомах гиперпаратиреоза (гиперкальциемия, нефролитиаз) или симптомах опухолей гипофиза (чаще всего пролактинома, которая вызывает галакторею у женщин, но вызывает головную боль и битемпоральную гемианопсию у мужчин).Лаборатории необходимы для измерения сывороточного кальция, паратироидного гормона и пролактина. [21] Вместо гастриномы они также могут проявляться инсулиномой (симптомы гипогликемии), глюкагономами (некротическая мигрирующая эритема (NME), диабет, потеря веса, анемия) или ViPoma (водянистая диарея, гипокалиемия, гипохлоргидрия). [22] Доступны различные методы визуализации для определения опухоли, включая КТ, МРТ, сцинтиграфию рецепторов соматостатина. Пациенты с диагнозом гастринома должны быть обследованы на предмет MEN1 в отношении семейного анамнеза, истории гиперкальциемии, нефролитиаза или опухолей гипофиза, а также необходимы лаборатории для измерения сывороточного кальция, паратиреоидного гормона и пролактина.
Важно управлять симптомами, связанными с повышенным уровнем гастрина, особенно язвенной болезнью. Хирургия — единственная лечебная терапия гастриномы. Он рекомендован пациентам с неметастатическими спорадическими гастриномами или гастриномами, ассоциированными с MEN1, более 2 см в диаметре. В частности, удаление / энуклеация гастрином поджелудочной железы является эффективным, в то время как гастриномы двенадцатиперстной кишки часто требуют дуоденэктомии, поскольку обычно присутствуют множественные опухоли двенадцатиперстной кишки. Хирургическое вмешательство не рекомендуется при гастриномах, ассоциированных с МЭН1, менее 2 см в диаметре, поскольку операция редко бывает излечивающей при наличии МЭН1.[23] [24]
Безоперационная терапия ЗЭС основана на лечении симптомов и профилактике вторичных осложнений пептической язвы. Ингибиторы протонной помпы (ИПП) — это лекарственная терапия первой линии. Они непосредственно уменьшают секрецию желудочного сока в желудок, тем самым снижая способность желудочного сока подавлять защитные силы слизистой оболочки и предотвращать возникновение язвенной болезни. В первоначальном проспективном исследовании пациентов с гастриномой, рефракционной к терапии блокаторами h3, симптомы исчезли у 23 из 29 пациентов.Благодаря высокому успеху в лечении этих пациентов с помощью ИПП, хирургическое вмешательство больше не требуется для лечения гиперсекреции желудочной кислоты [25].
Клиническая значимость
Ведение и терапия гастрин-связанного заболевания, как и в большинстве областей медицины, требует командного межпрофессионального подхода. Гипергастринемию, вторичную по отношению к инфекциям Helicobacter pylori, можно контролировать с помощью лечения инфекционных заболеваний, не требующего эндокринного специалиста или хирургического вмешательства. И наоборот, пациент с гастриномой (ZES) должен лечиться скоординированной командой эндокринологов, гастроэнтерологов, радиологов и хирургов.Определение причины гипергастринемии — это также командный подход, требующий, в частности, первичной медицинской помощи, гастроэнтерологов, эндокринологов, патологов.
Ссылки
- 1.
- Schubert ML. Секреция желудочного сока. Курр Опин Гастроэнтерол. 2016 ноя; 32 (6): 452-460. [PubMed: 27607343]
- 2.
- Xiaoli L, Wu CW, Kim HY, Tian W, Chiang FY, Liu R, Anuwong A, Randolph GW, Dionigi G, Lavazza M. Секреция желудочной кислоты и высвобождение гастрина во время непрерывного вагуса нейромониторинг в хирургии щитовидной железы.Langenbecks Arch Surg. 2017 Март; 402 (2): 265-272. [PubMed: 28105483]
- 3.
- Аль-Эзи AIA. Иммунопатологические и модулирующие эффекты генотипа Cag A + на слизистую желудка, воспалительный ответ, пепсиногены и секрецию гастрина-17 у иракских пациентов, инфицированных H. pylori . Открытый доступ Maced J Med Sci. 2018 20 мая; 6 (5): 794-802. [Статья без PMC: PMC5985861] [PubMed: 29875848]
- 4.
- Петерсен О.Н., Уэда Н. Ацинарные клетки поджелудочной железы: влияние ацетилхолина, панкреозимина, гастрина и секретина на мембранный потенциал и резистентность in vivo и in vitro.J Physiol. 1975 Май; 247 (2): 461-71. [Бесплатная статья PMC: PMC1309479] [PubMed: 168355]
- 5.
- Larsson LI. Биология развития клеток гастрина и соматостатина в антропилорической слизистой оболочке желудка. Microsc Res Tech. 2000, 01 марта; 48 (5): 272-81. [PubMed: 10700044]
- 6.
- Majumdar AP, Johnson LR. Пролиферация клеток слизистой оболочки желудка во время развития у крыс и эффекты пентагастрина. Am J Physiol. 1982 Февраль; 242 (2): G135-9. [PubMed: 7065140]
- 7.
- Коппс Дж., Мерфи Р.Ф., Ловас С. Производство и роль гастрина-17 и гастрина-17-гли при раке желудочно-кишечного тракта. Protein Pept Lett. 2009; 16 (12): 1504-18. [Бесплатная статья PMC: PMC2872940] [PubMed: 20001914]
- 8.
- Sturany S, Van Lint J, Gilchrist A, Vandenheede JR, Adler G, Seufferlein T. Механизм активации протеинкиназы D2 (PKD2) CCK (B) / рецептор гастрина. J Biol Chem. 2002 16 августа; 277 (33): 29431-6. [PubMed: 12058027]
- 9.
- Пак С.М., Ли Х.Р., Ким Дж. Г., Пак Дж. У., Юнг Дж., Хан Ш., Чо Дж. Х., Ким М. К..Влияние инфекции Helicobacter pylori на антральные клетки гастрина и соматостатина и на концентрацию гастрина в сыворотке. Korean J Intern Med. 1999 Янв; 14 (1): 15-20. [Бесплатная статья PMC: PMC4531904] [PubMed: 10063309]
- 10.
- Hughes JW, Muegge BD, Tobin GS, Litvin M, Sun L, Saenz JB, Gyawali CP, McGill JB. ПАТОЛОГИЯ ЖЕЛУДКА ВЫСОКОГО РИСКА И РАСПРОСТРАНЕННЫЕ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С ПЕРНИЦИЗНОЙ АНЕМИЕЙ. Endocr Pract. 2017 ноя; 23 (11): 1297-1303. [PubMed: 291
- ]
- 11.
- Мартин-Алколеа М., Родригес-Эрнандес I, Алдеа М., Росас I, Хунка Дж, Гранада М.Л.Хроническая терапия ингибирования протонной помпы в диагностической точности сывороточных концентраций пепсиногена I и гастрина для выявления злокачественной анемии. Clin Biochem. 2017 июн; 50 (9): 481-484. [PubMed: 28109748]
- 12.
- Смит Дж. П., Ши А.Х., Вотринг М.Г., Маклафлин П.Дж., Загон И.С. Характеристика CCK-B / гастриноподобных рецепторов при карциноме желудка человека. Int J Oncol. 1998 Февраль; 12 (2): 411-9. [PubMed: 9458369]
- 13.
- Уотсон С., Даррант Л., Моррис Д. Гастрин: эффекты усиления роста на опухолевые клетки желудка и толстой кишки человека.Br J Рак. 1989 Апрель; 59 (4): 554-8. [Бесплатная статья PMC: PMC2247137] [PubMed: 2713241]
- 14.
- Grozinsky-Glasberg S, Alexandraki KI, Angelousi A, Chatzellis E, Sougioultzis S, Kaltsas G. Карциноиды желудка. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 645-660. [PubMed: 30098721]
- 15.
- González-Puga C, García-Navarro A, Escames G, León J, López-Cantarero M, Ros E, Acuña-Castroviejo D. Селективный рецептор CCK-A, но не рецептор CCK-B антагонисты подавляют пролиферацию клеток HT-29: синергизм с фармакологическими уровнями мелатонина.J Pineal Res. 2005 Октябрь; 39 (3): 243-50. [PubMed: 16150104]
- 16.
- Fino KK, Matters GL, McGovern CO, Gilius EL, Smith JP. Подавление рецептора CCK-B в клетках рака поджелудочной железы блокирует пролиферацию и способствует апоптозу. Am J Physiol Gastrointest Liver Physiol. 2012 июн 01; 302 (11): G1244-52. [Бесплатная статья PMC: PMC3378167] [PubMed: 22442157]
- 17.
- Бойс М., Ллойд К.А., Притчард Д.М. Возможные клинические показания для антагониста рецепторов CCK 2 .Curr Opin Pharmacol. 2016 декабрь; 31: 68-75. [PubMed: 27710813]
- 18.
- Мендельсон А.Х., Доновиц М. Ловля зебры: клинические жемчужины и подводные камни для успешной диагностики синдрома Золлингера-Эллисона. Dig Dis Sci. 2017 сентябрь; 62 (9): 2258-2265. [PubMed: 28776139]
- 19.
- Afroze S, Meng F, Jensen K, McDaniel K, Rahal K, Onori P, Gaudio E, Alpini G, Glaser SS. Физиологические роли секретина и его рецептора. Ann Transl Med. 2013 Октябрь; 1 (3): 29. [Бесплатная статья PMC: PMC4200670] [PubMed: 25332973]
- 20.
- Виник А., Перри Р. Р., Хьюз М. С., Фелиберти Е. Множественная эндокринная неоплазия типа 1. В: Фейнголд К. Р., Анавальт Б., Бойс А., Хрусос Г., де Гердер В. В., Дхатария К., Дунган К., Гроссман А., Хершман Д. М., Hofland J, Kalra S, Kaltsas G, Koch C, Kopp P, Korbonits M, Kovacs CS, Kuohung W, Laferrère B, McGee EA, McLachlan R, Morley JE, New M, Purnell J, Sahay R, Singer F, Stratakis CA , Трэнс Д.Л., Уилсон Д.П., редакторы. Эндотекст [Интернет]. MDText.com, Inc .; Южный Дартмут (Массачусетс): 7 октября 2017 г. [PubMed: 29465925]
- 21.
- Джусти Ф, Марини Ф, Брэнди МЛ. Множественная эндокринная неоплазия, тип 1. В: Адам М. П., Ардингер Х. Х., Пагон Р. А., Уоллес С. Е., Бин Л. Дж. Х., Мирзаа Г., Амемия А., редакторы. GeneReviews ® [Интернет]. Вашингтонский университет, Сиэтл; Сиэтл (Вашингтон): 31 августа 2005 г. [PubMed: 20301710]
- 22.
- Сонг X, Чжэн С., Ян Дж., Сюн Дж., Цао З., Фэн М., Чжан Т., Чжао Ю. Глюкагонома и синдром глюкагономы . Oncol Lett. 2018 Март; 15 (3): 2749-2755. [Бесплатная статья PMC: PMC5778850] [PubMed: 29435000]
- 23.
- Нортон Дж. А., Фостер Д. С., Ито Т., Дженсен РТ. Гастриномы: медикаментозное или хирургическое лечение. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 577-601. [Бесплатная статья PMC: PMC6092039] [PubMed: 30098717]
- 24.
- Дои Р. Детерминанты хирургической резекции нейроэндокринных опухолей поджелудочной железы. J Hepatobilation Pancreat Sci. 2015 августа; 22 (8): 610-7. [PubMed: 25773163]
- 25.
- van Leeuwaarde RS, de Laat JM, Pieterman CRC, Dreijerink K, Vriens MR, Valk GD. Будущее: медицинские достижения в терапевтических подходах и стратегиях управления МЭН1.Endocr Relat Cancer. 2017 Октябрь; 24 (10): T179-T193. [PubMed: 28768698]
Физиология, гастрин — StatPearls — NCBI Bookshelf
Введение
Гастрин — это пептидный гормон, который в первую очередь отвечает за усиление роста слизистой оболочки желудка, моторики желудка и секреции соляной кислоты (HCl) в желудок. Он присутствует в G-клетках антрального отдела желудка и двенадцатиперстной кишки. Гастрин в первую очередь высвобождается в ответ на стимуляцию блуждающего нерва и гастрин-высвобождающего пептида (GRP), вторичный по отношению к приему пептидов, аминокислот, вздутию желудка и повышенному pH желудка.[1] [2] И наоборот, высвобождение гастрина снижается в ответ на паракринное ингибирование соматостатином и снижение рН желудка.
Гастрин секретируется в кровь и переносится на дно желудка и сердце, где находится большая часть париетальных клеток, секретирующих HCl. HCl необходим для преобразования неактивного пепсиногена в активный пепсин, который помогает переваривать белок в желудке и высвобождать кобаламин (витамин B12) из его носителя R-белка слюны. Основным клиническим показанием для определения гастрина является диагностика гастрин-продуцирующей опухоли, гастриномы.Кроме того, похоже, появляются данные, которые предполагают, что гастрин может играть роль в некоторых видах рака, таких как рак желудка.
Проблемы, вызывающие озабоченность
G-клетки секретируют гастрин в системный кровоток, что обеспечивает доставку гастрина к париетальным клеткам и энтерохромаффиноподобным (ECL) клеткам дна желудка и сердца. Гастрин стимулирует пролиферацию эндокринных клеток слизистой оболочки желудка (париетальных клеток, клеток ECL). Это трофическое качество гастрина может быть связано с потенцированием некоторых видов рака.Также было обнаружено, что гастрин взаимодействует с ацинарными клетками поджелудочной железы, гладкомышечными клетками желудка, эндокринными клетками и некоторыми лейкоцитами.
Было обнаружено, что гастрин модулирует иммунитет и воспаление посредством белых кровяных клеток, экспрессирующих CCKB / рецептор гастрина. В частности, экспрессия CCKB была зарегистрирована в некоторых полиморфно-ядерных лейкоцитах (PMN), мононуклеарных клетках и эндотелиальных клетках. Он продемонстрировал способность стимулировать высвобождение гистамина тучными клетками, лимфоцитарную секрецию IL-2, эндотелиальную экспрессию VCAM-1 и P-селектина и эндотелиальную секрецию IL-8.[3]
Клеточные
G-клетки — это нейроэндокринные клетки, ответственные за синтез и секрецию гастрина. В основном они обнаруживаются в антральном отделе привратника, но также могут быть обнаружены в двенадцатиперстной кишке и поджелудочной железе. Они секретируют гастрин, когда стимулируются непосредственно эфферентными нейронами блуждающего нерва, а также нейронами GRP. GRP-нейроны стимулируются присутствием аминокислот в желудке, растяжением желудка и эфферентной стимуляцией блуждающего нерва. Гастрин, секретируемый этими клетками, в первую очередь действует на париетальные клетки и энтерохромаффиноподобные клетки (клетки ECL) в ямках желудка, но также взаимодействует с клетками гладких мышц желудка, ацинарными клетками поджелудочной железы, лимфоцитами, PMN и эндотелиальными клетками.Следовательно, гастрин стимулирует секрецию кислоты непосредственно через париетальные клетки и активирует клетки ECL для секреции гистамина, что приводит к образованию кислоты.
Париетальные клетки, обнаруженные в ямках дна желудка и кардии, секретируют соляную кислоту в просвет желудка через K / H-АТФазу на апикальной (просветной) мембране. Гастрин связывает рецепторы холецистокинина (CCK) B на базальной мембране париетальных клеток, чтобы индуцировать экспрессию K / H-АТФазы. Повышенная экспрессия и активность K / H-АТФазы приводит к повышенной секреции ионов водорода (желудочного сока) в желудок.
Энтерохромаффиноподобные клетки, обнаруженные в ямках желудочного дна и кардии желудка, секретируют гистамин, который затем связывает рецепторы h3 на соседних париетальных клетках и дополнительно усиливает секрецию желудочной кислоты париетальными клетками. Ацинарные клетки, обнаруженные в поджелудочной железе, отвечают за синтез, хранение и секрецию пищеварительных ферментов поджелудочной железы. Гастрин связывает рецепторы CCK2 на ацинарных клетках, вызывая секрецию накопленных в клетке пищеварительных ферментов.[4]
Развитие
Биология развития клеток гастрина и соматостатина происходит в антропилорической слизистой оболочке желудка. [5] Клетки, экспрессирующие гастрин (G-клетки), развиваются из мультигормональных преэндокринных клеток, обнаруженных в регенеративном перешейке желудочных ям. Эти преэндокринные клетки подвергаются асимметричному делению, при каждом делении образуя дочернюю клетку, экспрессирующую гастрин, и дочернюю клетку, экспрессирующую соматостатин. Это асимметричное деление способствует паракринной организации этих клеток, позволяя зрелым экспрессирующим соматостатин D-клеткам регулировать рост и активность соседних с ними G-клеток, экспрессирующих гастрин.Созревание D-клеток и G-клеток регулируется множеством факторов транскрипции, содержащих гомеобоксовые мотивы, включая Pdx-1, Pax 4, Pax 6, Isl-1 и Nkx6.1.
Гастрин представляет собой линейный пептид, который изначально переводится как препрогастрин. Препрогастрин подвергается посттрансляционному расщеплению, в результате чего образуется семейство гастриновых пептидов переменной длины, наиболее распространенным из которых является «большой гастрин», пептид, состоящий из 34 аминокислот. Биоактивность гастрина сохраняется в 5-аминокислотной последовательности, называемой «пентагастрин», которая находится на 5-С-конце всех членов семейства гастринов, независимо от общего размера пептида гастрина.5 C-концевых аминокислот гастрина и холецистокинина (CCK) идентичны. [6]
Вовлеченные системы органов
Гастрин в первую очередь поражается в верхних отделах желудочно-кишечного тракта, особенно в желудке и, в меньшей степени, в двенадцатиперстной кишке и поджелудочной железе. Гастрин в первую очередь влияет на клетки ECL и париетальные клетки дна желудка и кардии. Роль гастрина также влияет на иммунную систему через плохо изученные механизмы с участием рецептора CCKB на моноцитах, лимфоцитах и тучных клетках.
Функция
Подводя итог функции гастрина:
Вызывает секрецию желудочной кислоты в желудке через Са-зависимый механизм высвобождения
Действует на энтерохромаффиноподобные (ECL) клетки дна желудка, вызывая высвобождение гистамина.
Обеспечивает поддержку и пролиферацию эпителия желудка
- Подавляет апоптоз эпителиальных клеток желудка и поддерживает миграцию эпителиальных клеток [7]
Механизм
Действие гастрина в первую очередь опосредуется связыванием холецистокина (CCKB) рецептор.Рецептор CCKB представляет собой рецептор, связанный с G-белком, который после активации гастрином начинает передачу сигналов через каскад фосфолипаза C — диацилглицерин + инозитолтрифосфат — кальций — протеинкиназа C. [8]
Рецептор CCKB в основном обнаруживается в центральной нервной системе (ЦНС) и желудочно-кишечном тракте (ЖКТ), но также экспрессируется на эндотелиальных клетках и некоторых лейкоцитах (WBC). Рецепторы CCK могут также индуцировать сигнальные пути через рецепторы тирозинкиназ в более ограниченной степени, и это было продемонстрировано при трансактивации EGFR.
Сопутствующие исследования
Основным показанием к анализу гастрина является диагностика синдрома Золлингера-Эллисона, который представляет собой гастрин-продуцирующую опухоль, приводящую к рецидивирующей, не поддающейся лечению язвенной болезни и диарее.
Однако у пентагастрина есть и другие показания. Парентеральная инъекция синтетического пентагастрина использовалась в качестве диагностического средства для карциноидного синдрома, вызывая симптомы у пациентов, которые трудно различить из-за минимального наличия симптомов.Он также использовался в ядерной медицине для обнаружения дивертикула Меккеля.
Тест на кальцитонин, стимулированный пентагастрином, может использоваться у пациентов с нормальным уровнем кальцитонина, подозреваемых в наличии медуллярной карциномы щитовидной железы. Если результат положительный, уровень кальцитонина в сыворотке пациента поднимется до уровней, значительно превышающих нормальный диапазон. Кроме того, у этих пациентов в послеоперационном периоде можно использовать стимулированное пентагастрином высвобождение кальцитонина для обнаружения любых оставшихся секретирующих кальцитонин парафолликулярных клеток (С-клеток).[6]
Патофизиология
Любой патологический процесс, приводящий к беспрепятственной секреции кислоты желудочного сока, приведет к язвенной болезни. Некоторые из этих патологических процессов происходят из-за неингибированной секреции желудочного сока, опосредованной гастрином.
Гастрит, вызванный Helicobacter pylori, связан с повышенным уровнем гастрина, что, вероятно, является вторичным по отношению к снижению секретирующих соматостатин D-клеток и последующему нарушению регуляции секреции гастрина G-клетками. [9] Этот дисбаланс приводит к снижению pH, что, следовательно, подавляет защитные силы слизистой оболочки желудка, что часто приводит к повреждению слизистой оболочки желудка и образованию пептических язв.
Гипохлоргидрия, вторичная по отношению к разрушению париетальных клеток желудка при пернициозной анемии, связана с повышенной активностью G-клеток, что приводит к гипергастринемии. Диффузные гиперпластические узелки, обнаруживаемые в слизистой оболочке желудка у пациентов с пернициозной анемией, могут быть связаны с трофическим действием гастрина на эндокринные клетки желудка. [10]
Прекращение терапии ингибиторами протонной помпы (ИПП) пациентами, которые постоянно получали ИПП, часто приводит к рефрактерному гастриту.Это связано с парадоксальным увеличением гастрина в ответ на ингибирование H / K-АТФазы ИПП. После прекращения терапии ИПП неингибированная H / K-АТФаза становится гиперактивной в присутствии повышенных уровней гастрина, что приводит к гастриту. К счастью, этот рефрактерный гастрит проходит самостоятельно, так как уровни гастрина вернутся к норме при продолжительном прекращении терапии ИПП. [11]
Из-за трофического эффекта гастрина повышенные уровни гастрина у пациентов, получающих хроническую терапию ИПП, также вызывают опасения по поводу потенцирования рака желудка.Хронически повышенный уровень гастрина также вызывает озабоченность из-за трофического эффекта гастрина и его связи с раком желудочно-кишечного тракта. Рецепторы CCKB активируются при раке желудка, и исследования in vitro продемонстрировали способность гастрина усиливать пролиферацию клеточных линий рака желудка человека и клеточных линий рака толстой кишки. [12] [13] Кроме того, гастрин проявляет ангиогенные и антиапоптотические свойства при нескольких злокачественных новообразованиях, включая рак желудка. Повышенные уровни гастрина также были связаны с развитием карциноидных опухолей желудка, возникающих из клеток ECL желудка.[14] При этих опухолях желудка с положительным рецептором CCKB и карциноидных опухолях желудка терапевтические препараты, такие как лорглумид и девазепид, которые нацелены на рецепторы CCKB, могут быть существенно полезными. [15] [16] [17] Кроме того, карциноидные опухоли желудка связаны со снижением уровня витамина B12 в сыворотке крови. Следовательно, уровни витамина B12 в сыворотке крови требуют мониторинга у всех пациентов, получающих хроническую терапию ИПП. Однако необходимы дальнейшие исследования для определения стратегий, нацеленных на рецепторы гастрин-CCK в качестве терапевтических мишеней.
Синдром Золлингера-Эллисона (ЗЭС) характеризуется наличием гастриномы, гиперсекрецией желудочного сока, пептической язвой и секреторной диареей. Гастринома — это нерегулируемая нейроэндокринная опухоль (НЭО), секретирующая гастрин. Биопсия опухоли выявляет типичные гистологические паттерны NET, которые дают положительную окраску на хромогранин А, синаптофизин и гастрин. Нерегулируемая секреция гастрина гастриномами приводит к гиперстимуляции и гиперплазии париетальных клеток слизистой оболочки желудка и клеток ECL.Гиперплазия и гиперактивность этих клеток приводят к чрезмерной секреции желудочного сока в желудок. Желудочная кислота впоследствии подавляет защитные механизмы слизистой оболочки желудка, вызывая язвы желудка и двенадцатиперстной кишки.
ZES подтверждается наличием повышенной концентрации гастрина в сыворотке крови натощак, намного превышающей 100 пг / мл, в сочетании с повышенной базальной секрецией кислоты желудочного сока и / или низким pH желудочного сока ниже 2,0. Еще один полезный тест для подтверждения диагноза — тест стимуляции секретином, потенциально приводящий к увеличению гастрина более чем на 120 пг / мл по сравнению с базальным уровнем.[18] Секретин — это пептидный гормон, вырабатываемый S-клетками двенадцатиперстной кишки в ответ на кислотность и высвобождаемый в кровоток для воздействия на несколько органов, таких как желудок, поджелудочная железа и печень. В желудке секретин препятствует высвобождению желудочной кислоты из париетальных клеток. В поджелудочной железе секретин вызывает высвобождение бикарбоната из клеток протока. В печени он вызывает выделение желчи, которая расщепляет пищевые жиры. [19]
Нормальный уровень гастрина в сыворотке крови натощак практически исключает ЗЭС.От 70% до 75% гастрином являются спорадическими; однако от 25% до 30% этих опухолей связаны с множественной эндокринной неоплазией 1 типа (MEN1). [20] У пациентов с множественной эндокринной неоплазией I типа (MEN1), аутосомно-доминантным заболеванием, наблюдается скопление опухолей гипофиза, паращитовидной железы и поджелудочной железы. Пациенты с диагнозом гастринома должны быть обследованы на предмет наличия симптомов МЭН1, задав вопросы о семейном анамнезе, симптомах гиперпаратиреоза (гиперкальциемия, нефролитиаз) или симптомах опухолей гипофиза (чаще всего пролактинома, которая вызывает галакторею у женщин, но вызывает головную боль и битемпоральную гемианопсию у мужчин).Лаборатории необходимы для измерения сывороточного кальция, паратироидного гормона и пролактина. [21] Вместо гастриномы они также могут проявляться инсулиномой (симптомы гипогликемии), глюкагономами (некротическая мигрирующая эритема (NME), диабет, потеря веса, анемия) или ViPoma (водянистая диарея, гипокалиемия, гипохлоргидрия). [22] Доступны различные методы визуализации для определения опухоли, включая КТ, МРТ, сцинтиграфию рецепторов соматостатина. Пациенты с диагнозом гастринома должны быть обследованы на предмет MEN1 в отношении семейного анамнеза, истории гиперкальциемии, нефролитиаза или опухолей гипофиза, а также необходимы лаборатории для измерения сывороточного кальция, паратиреоидного гормона и пролактина.
Важно управлять симптомами, связанными с повышенным уровнем гастрина, особенно язвенной болезнью. Хирургия — единственная лечебная терапия гастриномы. Он рекомендован пациентам с неметастатическими спорадическими гастриномами или гастриномами, ассоциированными с MEN1, более 2 см в диаметре. В частности, удаление / энуклеация гастрином поджелудочной железы является эффективным, в то время как гастриномы двенадцатиперстной кишки часто требуют дуоденэктомии, поскольку обычно присутствуют множественные опухоли двенадцатиперстной кишки. Хирургическое вмешательство не рекомендуется при гастриномах, ассоциированных с МЭН1, менее 2 см в диаметре, поскольку операция редко бывает излечивающей при наличии МЭН1.[23] [24]
Безоперационная терапия ЗЭС основана на лечении симптомов и профилактике вторичных осложнений пептической язвы. Ингибиторы протонной помпы (ИПП) — это лекарственная терапия первой линии. Они непосредственно уменьшают секрецию желудочного сока в желудок, тем самым снижая способность желудочного сока подавлять защитные силы слизистой оболочки и предотвращать возникновение язвенной болезни. В первоначальном проспективном исследовании пациентов с гастриномой, рефракционной к терапии блокаторами h3, симптомы исчезли у 23 из 29 пациентов.Благодаря высокому успеху в лечении этих пациентов с помощью ИПП, хирургическое вмешательство больше не требуется для лечения гиперсекреции желудочной кислоты [25].
Клиническая значимость
Ведение и терапия гастрин-связанного заболевания, как и в большинстве областей медицины, требует командного межпрофессионального подхода. Гипергастринемию, вторичную по отношению к инфекциям Helicobacter pylori, можно контролировать с помощью лечения инфекционных заболеваний, не требующего эндокринного специалиста или хирургического вмешательства. И наоборот, пациент с гастриномой (ZES) должен лечиться скоординированной командой эндокринологов, гастроэнтерологов, радиологов и хирургов.Определение причины гипергастринемии — это также командный подход, требующий, в частности, первичной медицинской помощи, гастроэнтерологов, эндокринологов, патологов.
Ссылки
- 1.
- Schubert ML. Секреция желудочного сока. Курр Опин Гастроэнтерол. 2016 ноя; 32 (6): 452-460. [PubMed: 27607343]
- 2.
- Xiaoli L, Wu CW, Kim HY, Tian W, Chiang FY, Liu R, Anuwong A, Randolph GW, Dionigi G, Lavazza M. Секреция желудочной кислоты и высвобождение гастрина во время непрерывного вагуса нейромониторинг в хирургии щитовидной железы.Langenbecks Arch Surg. 2017 Март; 402 (2): 265-272. [PubMed: 28105483]
- 3.
- Аль-Эзи AIA. Иммунопатологические и модулирующие эффекты генотипа Cag A + на слизистую желудка, воспалительный ответ, пепсиногены и секрецию гастрина-17 у иракских пациентов, инфицированных H. pylori . Открытый доступ Maced J Med Sci. 2018 20 мая; 6 (5): 794-802. [Статья без PMC: PMC5985861] [PubMed: 29875848]
- 4.
- Петерсен О.Н., Уэда Н. Ацинарные клетки поджелудочной железы: влияние ацетилхолина, панкреозимина, гастрина и секретина на мембранный потенциал и резистентность in vivo и in vitro.J Physiol. 1975 Май; 247 (2): 461-71. [Бесплатная статья PMC: PMC1309479] [PubMed: 168355]
- 5.
- Larsson LI. Биология развития клеток гастрина и соматостатина в антропилорической слизистой оболочке желудка. Microsc Res Tech. 2000, 01 марта; 48 (5): 272-81. [PubMed: 10700044]
- 6.
- Majumdar AP, Johnson LR. Пролиферация клеток слизистой оболочки желудка во время развития у крыс и эффекты пентагастрина. Am J Physiol. 1982 Февраль; 242 (2): G135-9. [PubMed: 7065140]
- 7.
- Коппс Дж., Мерфи Р.Ф., Ловас С. Производство и роль гастрина-17 и гастрина-17-гли при раке желудочно-кишечного тракта. Protein Pept Lett. 2009; 16 (12): 1504-18. [Бесплатная статья PMC: PMC2872940] [PubMed: 20001914]
- 8.
- Sturany S, Van Lint J, Gilchrist A, Vandenheede JR, Adler G, Seufferlein T. Механизм активации протеинкиназы D2 (PKD2) CCK (B) / рецептор гастрина. J Biol Chem. 2002 16 августа; 277 (33): 29431-6. [PubMed: 12058027]
- 9.
- Пак С.М., Ли Х.Р., Ким Дж. Г., Пак Дж. У., Юнг Дж., Хан Ш., Чо Дж. Х., Ким М. К..Влияние инфекции Helicobacter pylori на антральные клетки гастрина и соматостатина и на концентрацию гастрина в сыворотке. Korean J Intern Med. 1999 Янв; 14 (1): 15-20. [Бесплатная статья PMC: PMC4531904] [PubMed: 10063309]
- 10.
- Hughes JW, Muegge BD, Tobin GS, Litvin M, Sun L, Saenz JB, Gyawali CP, McGill JB. ПАТОЛОГИЯ ЖЕЛУДКА ВЫСОКОГО РИСКА И РАСПРОСТРАНЕННЫЕ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ У ПАЦИЕНТОВ С ПЕРНИЦИЗНОЙ АНЕМИЕЙ. Endocr Pract. 2017 ноя; 23 (11): 1297-1303. [PubMed: 291
- ]
- 11.
- Мартин-Алколеа М., Родригес-Эрнандес I, Алдеа М., Росас I, Хунка Дж, Гранада М.Л.Хроническая терапия ингибирования протонной помпы в диагностической точности сывороточных концентраций пепсиногена I и гастрина для выявления злокачественной анемии. Clin Biochem. 2017 июн; 50 (9): 481-484. [PubMed: 28109748]
- 12.
- Смит Дж. П., Ши А.Х., Вотринг М.Г., Маклафлин П.Дж., Загон И.С. Характеристика CCK-B / гастриноподобных рецепторов при карциноме желудка человека. Int J Oncol. 1998 Февраль; 12 (2): 411-9. [PubMed: 9458369]
- 13.
- Уотсон С., Даррант Л., Моррис Д. Гастрин: эффекты усиления роста на опухолевые клетки желудка и толстой кишки человека.Br J Рак. 1989 Апрель; 59 (4): 554-8. [Бесплатная статья PMC: PMC2247137] [PubMed: 2713241]
- 14.
- Grozinsky-Glasberg S, Alexandraki KI, Angelousi A, Chatzellis E, Sougioultzis S, Kaltsas G. Карциноиды желудка. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 645-660. [PubMed: 30098721]
- 15.
- González-Puga C, García-Navarro A, Escames G, León J, López-Cantarero M, Ros E, Acuña-Castroviejo D. Селективный рецептор CCK-A, но не рецептор CCK-B антагонисты подавляют пролиферацию клеток HT-29: синергизм с фармакологическими уровнями мелатонина.J Pineal Res. 2005 Октябрь; 39 (3): 243-50. [PubMed: 16150104]
- 16.
- Fino KK, Matters GL, McGovern CO, Gilius EL, Smith JP. Подавление рецептора CCK-B в клетках рака поджелудочной железы блокирует пролиферацию и способствует апоптозу. Am J Physiol Gastrointest Liver Physiol. 2012 июн 01; 302 (11): G1244-52. [Бесплатная статья PMC: PMC3378167] [PubMed: 22442157]
- 17.
- Бойс М., Ллойд К.А., Притчард Д.М. Возможные клинические показания для антагониста рецепторов CCK 2 .Curr Opin Pharmacol. 2016 декабрь; 31: 68-75. [PubMed: 27710813]
- 18.
- Мендельсон А.Х., Доновиц М. Ловля зебры: клинические жемчужины и подводные камни для успешной диагностики синдрома Золлингера-Эллисона. Dig Dis Sci. 2017 сентябрь; 62 (9): 2258-2265. [PubMed: 28776139]
- 19.
- Afroze S, Meng F, Jensen K, McDaniel K, Rahal K, Onori P, Gaudio E, Alpini G, Glaser SS. Физиологические роли секретина и его рецептора. Ann Transl Med. 2013 Октябрь; 1 (3): 29. [Бесплатная статья PMC: PMC4200670] [PubMed: 25332973]
- 20.
- Виник А., Перри Р. Р., Хьюз М. С., Фелиберти Е. Множественная эндокринная неоплазия типа 1. В: Фейнголд К. Р., Анавальт Б., Бойс А., Хрусос Г., де Гердер В. В., Дхатария К., Дунган К., Гроссман А., Хершман Д. М., Hofland J, Kalra S, Kaltsas G, Koch C, Kopp P, Korbonits M, Kovacs CS, Kuohung W, Laferrère B, McGee EA, McLachlan R, Morley JE, New M, Purnell J, Sahay R, Singer F, Stratakis CA , Трэнс Д.Л., Уилсон Д.П., редакторы. Эндотекст [Интернет]. MDText.com, Inc .; Южный Дартмут (Массачусетс): 7 октября 2017 г. [PubMed: 29465925]
- 21.
- Джусти Ф, Марини Ф, Брэнди МЛ. Множественная эндокринная неоплазия, тип 1. В: Адам М. П., Ардингер Х. Х., Пагон Р. А., Уоллес С. Е., Бин Л. Дж. Х., Мирзаа Г., Амемия А., редакторы. GeneReviews ® [Интернет]. Вашингтонский университет, Сиэтл; Сиэтл (Вашингтон): 31 августа 2005 г. [PubMed: 20301710]
- 22.
- Сонг X, Чжэн С., Ян Дж., Сюн Дж., Цао З., Фэн М., Чжан Т., Чжао Ю. Глюкагонома и синдром глюкагономы . Oncol Lett. 2018 Март; 15 (3): 2749-2755. [Бесплатная статья PMC: PMC5778850] [PubMed: 29435000]
- 23.
- Нортон Дж. А., Фостер Д. С., Ито Т., Дженсен РТ. Гастриномы: медикаментозное или хирургическое лечение. Endocrinol Metab Clin North Am. 2018 сентябрь; 47 (3): 577-601. [Бесплатная статья PMC: PMC6092039] [PubMed: 30098717]
- 24.
- Дои Р. Детерминанты хирургической резекции нейроэндокринных опухолей поджелудочной железы. J Hepatobilation Pancreat Sci. 2015 августа; 22 (8): 610-7. [PubMed: 25773163]
- 25.
- van Leeuwaarde RS, de Laat JM, Pieterman CRC, Dreijerink K, Vriens MR, Valk GD. Будущее: медицинские достижения в терапевтических подходах и стратегиях управления МЭН1.Endocr Relat Cancer. 2017 Октябрь; 24 (10): T179-T193. [PubMed: 28768698]
G Cell — обзор
Гастрин
Гастрин продуцируется G-клетками антрального отдела желудка и слизистой оболочки луковицы двенадцатиперстной кишки. Сначала синтезируется предшественник из 101 аминокислоты, препрогастрин, который подвергается процессингу с образованием различных активных молекулярных форм длиной 14, 17 и 34 аминокислоты. Его активность зависит от небольшого сегмента С-концевой части полипептида. Пентагастрин , синтетический пептид, содержащий последние пять аминокислотных остатков гастрина, используется для стимуляции желудочной секреции.
Пептиды с иммунореактивностью гастрина были идентифицированы в центральной и периферической нервной системе, гипофизе и надпочечниках, а также в дыхательных и половых путях. Поджелудочная железа плода производит амидированный гастрин, что предполагает возможную роль этого гормона в развитии поджелудочной железы.
Высвобождение гастрина обычно происходит в ответ на растяжение желудка и присутствие в желудке продуктов, богатых белком.Ароматические аминокислоты, небольшие пептиды и кальций являются мощными стимулами для секреции гастрина.
Гастрины, амидированные из 17 и 34 аминокислот, связываются с рецепторами, сопряженными с белками G q , запускают систему передачи сигналов фосфатидилинозитолбисфосфата, активируют PLC и стимулируют высвобождение гистамина. Гистамин связывается с рецепторами H 2 в базолатеральной мембране париетальных клеток и вызывает выработку и секрецию соляной кислоты. Кроме того, гастрин оказывает геномное действие, модулируя экспрессию генов в париетальных клетках.Кроме того, гастрин активирует сократительную способность гладких мышц желудка, ускоряя опорожнение желудка.
Гастрин также секретируется β-клетками островков Лангерганса поджелудочной железы.
Гастрин-секретирующие опухоли (гастринома) поджелудочной железы производят большое количество гастрина. Они вызывают синдром Золлингера-Эллисона , который характеризуется изъязвлением слизистой оболочки желудочно-кишечного тракта, хронической диареей, рвотой и потерей веса и аппетита. Гастриномы могут проявляться как одиночные опухоли или как множественные опухоли в поджелудочной железе, двенадцатиперстной кишке, лимфатических узлах, гипофизе и других органах, составляя синдром множественной эндокринной неоплазии I типа.
Gastrin Cell — обзор
G-Cell Function
Gastrin-продуцирующие G-клетки могут быть обнаружены у плода человека уже на 12 неделе беременности. 69 Интересно, что большинство этих ранних G-клеток также экспрессируют тироид-рилизинг-гормон (TRH), и количество TRH-положительных G-клеток увеличивается, достигая максимума между 26 и 36 неделями беременности. 69 После этого количество TRH-положительных G-клеток уменьшается, и в зрелом желудке человека их не обнаруживают.Более того, неизвестна физиологическая роль TRH в развивающемся желудке, а TRH не обнаруживается в G-клетках других развивающихся животных. У крыс иммунореактивность гастрина обнаруживается в островках поджелудочной железы до того, как она будет обнаружена в антральном отделе желудка. 70 По мере развития плода экспрессия гастрина увеличивается в антральном отделе и уменьшается в островках. По-видимому, гастрин поджелудочной железы плода в сочетании с трансформирующим фактором роста α играет важную роль в регенерации островков. 71
Уровни гастрина в плазме человека у новорожденных примерно в три раза выше, чем у взрослых и беременных женщин. 42 К сожалению, физиологическое значение неонатальной гипергастринемии неизвестно. Было высказано предположение, что эти повышенные уровни могут играть роль в росте и развитии желудочно-кишечного тракта. 72 Чтобы изучить роль гастрина в развитии кишечника, две группы вывели мышей с дефицитом гастрина. 73-75 Эти мыши жизнеспособны и нормально развиваются с нормальным набором веса. Это говорит о том, что гастрин не является жизненно важным гормоном. Однако как базальная, так и стимулированная секреция кислоты желудочного сока серьезно нарушены у гомозиготных животных. Кроме того, наблюдается уменьшение толщины слизистой оболочки желудка с уменьшением всех трех типов клеток. Хотя CCK может связываться с рецептором гастрина, CCK не заменяет гастрин, потому что мыши с дефицитом гастрина и дефицитом рецептора гастрина имеют сходный желудочный фенотип. 76
Содержание антрального гастрина увеличивается у развивающихся крыс до отъема. Раннее отлучение от груди или введение кортикостероидов или гормона щитовидной железы увеличивает содержание антрального гастрина и способствует созреванию гастриновых рецепторов слизистой оболочки желудка. 52,55,65 Неизвестно, возникает ли подобное явление в желудке человека при изменении диеты, но уровни гастрина в плазме человека остаются повышенными в течение нескольких месяцев после рождения, в то время как младенцев кормят в основном молоком. 77 Причина неонатальной гипергастринемии многофакторна, и крыса, кажется, представляет собой подходящую модель для исследования (рис. 111-3). Молочная диета с высоким содержанием известных стимуляторов секреции гастрина, таких как аминокислоты и кальций 78 , может быть причиной гипергастринемии. Как у крыс, так и у людей наблюдается пониженная секреция кислоты желудочного сока из-за уменьшения количества функциональных париетальных клеток. У зрелых людей это подавляет секрецию соматостатина, что увеличивает секрецию гастрина.С этим согласуется открытие, что содержание соматостатина в антральном отделе желудка крысы низкое при рождении и постепенно увеличивается до отлучения от груди примерно на 21-й день. 79 Более того, инфузия соматостатина не ингибирует высвобождение гастрина у новорожденных крысят до 18-го дня. жизнь, предполагая, что рецептор соматостатина или пострецепторные механизмы функционально зрелы до отлучения от груди. 80 Комбинированный эффект низкого содержания соматостатина и сниженного ответа на экзогенный соматостатин перед отлучением от груди предполагает, что соматостатин играет главную роль в неонатальной гипергастринемии.
Точная природа роли, которую гастрин играет в секреции желудочного сока у новорожденных, также полностью не выяснена. Например, гастрин является основным медиатором секреции желудочной кислоты во время еды у зрелых людей. 35 Однако неясно, является ли это прямым действием на париетальные клетки, поскольку антагонисты рецептора H 2 блокируют большую часть этого ответа. Это предполагает, что действие гастрина на секрецию кислоты опосредуется высвобождением гистамина из клеток ECL.У других видов кажется, что гастрин имеет более прямое воздействие на париетальные клетки. У развивающихся крыс секреция кислоты, стимулированная гастрином, не блокируется антагонистами рецептора H 2 , но частично ослабляется у взрослых животных. 81 В настоящее время неизвестно, оказывает ли гастрин свое действие непосредственно на париетальные клетки грудных детей или его эффекты опосредуются высвобождением гистамина.
Гастрин, как и другие регуляторные нейропептиды, первоначально синтезируется в виде большого биологически неактивного предшественника, называемого прогастрин (рис. 111-4).Эндопротеолитический процессинг прогастрина в G-клетках приводит к образованию удлиненной глицином формы гастрина (G-Gly), которая обнаруживается в высоких концентрациях в развивающемся антральном отделе желудка крысы. 82 G-Gly служит субстратом для фермента амидирования, пептидилглицин-α-амидирующей монооксигеназы, которая катализирует образование полностью переработанного зрелого амидированного гастрина. 83 Гастрин (G-NH 2 ) требует своей карбоксиконцевой амидной части для полной биологической активности, опосредованной рецепторами гастрин-CCK B .Действительно, удаление карбоксиконцевого амида в гастрине полностью устраняет его кислотные стимулирующие эффекты, опосредованные стандартными рецепторами гастрина-CCK B , а непосредственный предшественник амидированных гастринов, G-Gly, по крайней мере на четыре порядка менее эффективен, чем G-NH 2 для стимуляции секреции кислоты париетальными клетками желудка. 84 Тем не менее, интерес к физиологическим эффектам G-Gly подогревался наблюдениями, что G-Gly накапливается в тканях мозга и кишечника, 85 секретируется с G-NH 2 из антральных G-клеток в кровообращение и достигает концентрации в плазме, примерно эквивалентной концентрации G-NH 2 . 86 Более того, G-Gly наблюдается в более высоких концентрациях, чем G-NH 2 во время развития и в некоторых злокачественных тканях, экспрессирующих гастрин, таких как опухоли Золлингера-Эллисона и рак толстой кишки. 87,88 Наконец, биосинтетические исследования показали, что G-Gly может быть отдельным конечным продуктом процессинга прогастрина. 89 Таким образом, данные указывают на роль G-Gly как фактора роста, но не как непосредственного активатора секреции кислоты.
Чтобы дополнительно охарактеризовать потенциальные трофические эффекты G-Gly, мы исследовали, может ли G-Gly функционировать как фактор роста способом, который можно отличить от его относительно слабого воздействия на стандартный рецептор гастрин-CCK B . 84 Мы сравнили способность G-NH 2 и G-Gly стимулировать синтез ДНК. 90 И G-NH 2 , и G-Gly стимулировали включение [ 3 H] тимидина дозозависимым образом. Как и ожидалось, стимуляция, индуцированная G-NH 2 , была полностью отменена селективными антагонистами рецептора гастрина-CCK B . В дальнейших исследованиях мы охарактеризовали отдельный рецептор и сигнальный каскад для G-Gly. 91 Однако неспособность исследователей выделить комплементарную ДНК, кодирующую предполагаемый рецептор G-Gly, помешала дальнейшим исследованиям в этой области.Другие данные помогают подтвердить роль, которую G-Gly может играть в физиологии желудочно-кишечного тракта. G-Gly может стимулировать рост аутокринным способом. 92 Хотя однократное введение G-Gly не влияет на секрецию желудочного сока, 84,93 хроническое введение G-Gly заметно усиливает стимулированную, но не базальную секрецию кислоты изолированными париетальными клетками и in vivo. Это действие G-Gly опосредуется увеличением экспрессии H + , K + -АТФазы в париетальных клетках желудка. 94 G-Gly может играть роль в росте толстой кишки. 95,96 Действительно, у мышей с дефицитом гастрина наблюдается пониженный индекс пролиферации толстой кишки, а у трансгенных мышей со сверхэкспрессией G-Gly наблюдается усиленная пролиферация толстой кишки. 97 Эти наблюдения предполагают, что рецепторы роста G-Gly работают совместно с G-NH 2 , улучшая функциональное развитие кишечника (рис. 111-5).
Гастрин
Гастрин
Гастрин — главный физиологический регулятор секреции желудочного сока. Он также имеет важное трофическое или стимулирующее влияние на слизистую желудка. Гастрин синтезируется в G-клетках, которые расположены в ямках желудка, прежде всего в антральном отделе желудка, и связывает рецепторы, обнаруженные преимущественно на париетальных и энтерохромаффиноподобных клетках.
Структура гастрина и рецептора гастрина
Гастрин представляет собой линейный пептид, который синтезируется как препрогормон и посттрансляционно расщепляется с образованием семейства пептидов с идентичными карбоксиконцами.Преобладающей циркулирующей формой является гастрин-34 («большой гастрин»), но полная биологическая активность присутствует в самом маленьком пептиде (гастрин-14 или минигастрин). Кроме того, полная биоактивность сохраняется в пяти С-концевых аминокислотах гастрина, который известен как пентагастрин . Пять C-концевых аминокислот гастрина и холецистокинина идентичны, что объясняет их перекрывающиеся биологические эффекты.
Рецептор гастрина также является одним из рецепторов, связывающих холецистокинин, и известен как рецептор CCK-B.Он является членом семейства рецепторов, связанных с G-белком. Связывание гастрина стимулирует увеличение внутриклеточного Ca ++, активацию протеинкиназы C и производство инозитолфосфата.
Контроль и физиологические эффекты гастрина
Первичным стимулом для секреции гастрина является присутствие определенных пищевых продуктов, особенно пептидов, определенных аминокислот и кальция, в просвете желудка. Кроме того, еще не идентифицированные соединения в кофе, вине и пиве являются мощными стимуляторами секреции гастрина.Секреция этого гормона подавляется, когда pH просвета желудка становится очень низким (менее примерно 3).
Гастрин, по-видимому, оказывает по крайней мере два основных эффекта на функцию желудочно-кишечного тракта:
- Стимуляция секреции кислоты в желудке: Гастриновые рецепторы обнаруживаются на париетальных клетках, и связывание гастрина вместе с гистамином и ацетилхолином приводит к полностью стимулированной секреции кислоты этими клетками. Париетальные клетки собак имеют примерно 44000 рецепторов гастрина каждая, и у этого вида было продемонстрировано, что иммунонейтрализация гастрина блокирует секрецию кислоты в ответ на внутрижелудочное введение пептидов.Энтерохромаффиноподобные (ECL) клетки также несут рецепторы гастрина, и недавние данные показывают, что эта клетка может быть самой важной мишенью гастрина в отношении регуляции секреции кислоты. Стимуляция клеток ECL гастрином приводит к высвобождению гистамина, и связывание гистамина с рецепторами h3 на париетальных клетках необходимо для полноценной секреции кислоты.
- Стимуляция роста слизистой оболочки желудка: Гастрин явно обладает способностью стимулировать многие аспекты развития и роста слизистой оболочки желудка.Лечение гастрином стимулирует синтез ДНК, РНК и белка в слизистой оболочке желудка и увеличивает количество париетальных клеток. Еще одно наблюдение, подтверждающее эту функцию, заключается в том, что у людей с гипергастринемией (аномально высоким уровнем гастрина в крови) постоянно наблюдается гипертрофия слизистой оболочки желудка.
В дополнение к мишеням париетальных клеток и клеток ECL, гастрин также стимулирует ацинарные клетки поджелудочной железы посредством связывания с рецепторами холецистокинина, а рецепторы гастрина были продемонстрированы в определенных популяциях гладкомышечных клеток желудка, что подтверждает фармакологические исследования, демонстрирующие роль гастрина в регуляции желудочного сока. моторика.
Болезненные состояния
Чрезмерная секреция гастрина или гипергастринемия — хорошо известная причина тяжелого заболевания, известного как синдром Золлингера-Эллисона, которое редко встречается у людей и собак. Отличительным признаком этого заболевания является язвенная болезнь желудка и двенадцатиперстной кишки из-за чрезмерной и нерегулируемой секреции желудочной кислоты. Чаще всего гипергастринемия является результатом секретирующих гастрин опухолей (гастрином), которые развиваются в поджелудочной железе или двенадцатиперстной кишке.
Отправляйте комментарии [email protected]
Желудок — Knowledge @ AMBOSS
Последнее обновление: 31 августа 2021 г.
Сводка
Желудок — это полый внутрибрюшинный орган в левом верхнем квадранте живота, между пищеводом и двенадцатиперстной кишкой в желудочно-кишечном тракте. Снабжена артериальной кровью из чревного ствола и его ветвей. Вены желудка впадают в воротную вену, а лимфатические сосуды в конечном итоге стекают в чревные лимфатические узлы.Он иннервируется симпатической и парасимпатической нервной системой, а также мышечно-кишечным сплетением и подслизистым сплетением кишечной нервной системы. Желудок имеет четыре гистологических слоя: слизистую оболочку, подслизистую оболочку, собственную мышечную оболочку и серозную оболочку. Слизистая оболочка выстлана многочисленными железами, содержащими специализированные клетки, вырабатывающие различные секреты: например, париетальные клетки, которые секретируют желудочную кислоту и внутренний фактор, и главные клетки желудка, которые секретируют пепсиноген. Ацетилхолин (АХ), гастрин и гистамин являются основными стимуляторами желудочной секреции.Соматостатин, холецистокинин (CCK), секретин и желудочный ингибирующий пептид (GIP) являются основными ингибиторами.
Макроанатомия
Обзор
[1]- Характеристики
- Расположение
- LUQ живота
- Области живота: эпигастральная, левое подреберье и пупочная область
- Перед желудком
- Кзади от желудка
- Функция
Анатомические части
- Секции желудка
- Кардия: часть желудка, которая расположена непосредственно дистальнее гастроэзофагеального сфинктера
- Дно желудка: куполообразная область желудка чуть латеральнее кардии
- Тело (желудок): основная часть желудка. желудок, который находится между дном и привратником
- Привратник: конечное коническое сужение желудка, которое можно подразделить на проксимальный антральный отдел и дистальный пилорический канал
- Искривления желудка
- Сфинктеры желудка
Антральный отдел и нижняя часть малой кривизны являются наиболее частыми участками язвенной болезни желудка.
Желудок — внутрибрюшинный орган.
Сосудистая сеть, лимфатические сосуды и иннервация желудка
[1]Артерии
Вены
Варикозное расширение вен пищевода развивается при портальной гипертензии из-за портосистемного шунтирования крови из левой желудочной вены (портальная система) в вены пищевода (полая система).
Лимфатическая система
Иннервация
Левый блуждающий нерв находится кпереди от желудка, а правый — кзади от него.Это можно запомнить с помощью мнемонического LARP: левый передний, правый задний.
Микроскопическая анатомия
Функция
Типы пищеварения
- Механическое пищеварение: перистальтика желудка относительно закрытого пилорического сфинктера → расщепление пищи на более мелкие частицы
- Химическое пищеварение: ферментативное расщепление пищи на химус (полужидкая смесь переваренной пищи и пищеварительных ферментов) желудочной кислотой и ферментами.
См. «Секреторные и регулирующие продукты желудочно-кишечного тракта.”
Желудочная кислота содержит большое количество соляной кислоты (HCl). Следовательно, повторная рвота может вызвать метаболический алкалоз из-за потери кислоты (H + ).
Фазы
Нарушения секреции желудка
Эмбриология
Клиническое значение
Источники
- Ольшевский П.К., Ли Д.