Бутират – что это такое, и каковы последствия его употребления?
Многие слышали такие названия, как: бутератор, бутилат, бутик, окси, буратино, водичка, но далеко не все знают, что за безобидными названиями скрывается опасный и крайне токсичный наркотик. Он называется оксибутират натрия и представляет собой натриевую соль гамма-оксимасляной кислоты. В медицине это лекарство ранее применялось как анастезия, бутират при родах использовался как обезболивающее. Затем препарат стал применяться в неврологии для лечения сонливости и нарколепсии. Для чего бутират используется в России? В нашей стране это лекарство помогает бороться с неврозами, используется в качестве наркоза и в офтальмологии. Спортсмены употребляют его для стимуляции роста мышц.
Что такое бутират? Последствия употребления бутирата
Какой же бутират имеет эффект и последствия его употребления? Сегодня бутират более известен как распространенный наркотик, антидепрессант с ноотропным действием. Широкое распространение синтетический психостимулятор приобрел за счет очень несложного способа приготовления и дешевизны. Наркотик повышает настроение, общительность, раскрепощенность, сексуальность.
Наркотик повышает настроение, общительность, раскрепощенность, сексуальность.
Как употребляют бутират?
Что за наркотик бутират, как выглядит, чем опасен для жизни и здоровья человека? Это прозрачная жидкость, которую часто употребляют в ночных клубах и делают из порошка (соли бутирата). В коктейль добавляют бутират и алкоголь, что в разы ускоряет опьянение и наносит двойной удар по организму. Из чего делают бутират? Как правило, в составе бутирата (ГОМК) содержится обычный растворитель.
Эффект от бутирата схож с алкогольным опьянением. Человека под бутиратом “прет”, он чувствует себя раскрепощенно и расслабленно, ему хочется двигаться, танцевать, знакомиться. Сколько “держит” бутират? Как правило, наркотический эффект наступает через 10-15 минут и длится около 3 часов. Однако для достижения большего опьянения и эйфории наркотические коктейли пьют гораздо чаще, повышая в разы допустимую дозировку. В итоге эффект накапливается, как и количество наркотика в организме, что может привести к передозировке. Зависимость он наркотического вещества наступает практически мгновенно. Людям нравится это состояние, отказаться от него самостоятельно они уже не могут.
Зависимость он наркотического вещества наступает практически мгновенно. Людям нравится это состояние, отказаться от него самостоятельно они уже не могут.
Бутират: действие на организм, признаки приема
В молодежном сленге иногда можно услышать слово бутиратный – что это? Какие признаки употребления имеет этот наркотик:
неадекватное поведение;
непроизвольная жестикуляция;
нарушение координации движений;
галлюцинации, потеря связи с реальностью;
чрезмерная сексуальная раскрепощенность.
Внешне зависимость проявляется резким снижением веса, синяками под глазами, сонливостью, раздражительностью, ухудшением состояния волос и зубов. У человека пропадает аппетит, он чувствует апатию, подвержен депрессии.
Действие бутирата на организм
В состоянии наркотического опьянения человек не может себя контролировать. Поэтому очень часто бутиратоманы наносят увечья себе и окружающим, совершают суицид.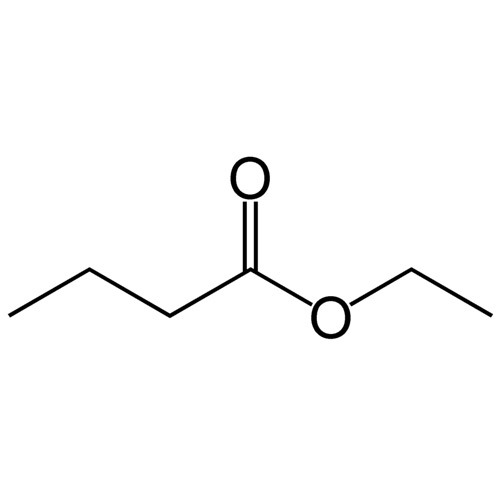 Самую большую опасность таит в себе водитель под бутиратом. В состоянии оторванности от реальности он может стать причиной гибели людей и многочисленных аварий.
Самую большую опасность таит в себе водитель под бутиратом. В состоянии оторванности от реальности он может стать причиной гибели людей и многочисленных аварий.
Действие на организм бутирата и последствия его употребления для мужчин довольно печальные. Человек может проявить агрессию, влезть в драку, так как чувствует себя непобедимым. Действие же бутирата на организм девушки или женщины тоже довольно неприятные. Под действием наркотика очень часто происходят незапланированные беременности, изнасилования, заболевания СПИДом. Иногда парни специально пользуются раствором для соблазнения противоположного пола. Жертвы и не догадываются, что их угощают наркотическим коктейлем. Бутират отлично растворяется в воде и имеет солоноватый незаметный привкус.
Лечение зависимости от этого и других видов наркотических веществ проходит в нашей наркологической клинике «RESTART» в Москве.
Бутират и кишечная микрофлора
Бутират (масляная кислота).
 Потенциальные преимущества для здоровья
Потенциальные преимущества для здоровьяБутират имеет большое значение для здоровья кишечника и мозга, борется с аутоиммунитетом и ожирением, а также может защитить от рака.Что такое бутират?
Масляная кислота (бутират) является одной из наиболее важных короткоцепочечных жирных кислот (КЦЖК). Короткоцепочечные жирные кислоты – монокарбоновые кислоты с длиной цепи до 6 атомов углерода. Соли и сложные эфиры масляной кислоты называются бутиратами.
Масляная кислота (бутираты) в небольших количествах содержится в сливочном масле. Масляная кислота, а точнее ее соли, широко применяются в качестве эффективных кормовых добавок в животноводстве и птицеводстве (сама кислота для этих целей нестабильна).
Масляная кислота — одна из очень важных низкомолекулярных кислот, которые синтезируются природным образом в кишечнике. Она является основным энергетическим материалом для эпителиоцитов и поддерживает кишечный гомеостаз.
Масляная кислота проявляет противораковое и противовоспалительное действие, влияет на аппетит, предупреждает развитие окислительного стресса (см. Ерофеев Н. П., Радченко В. Г., Селиверстов П. В. Клиническая физиология толстой кишки. Механизмы действия короткоцепочечных жирных кислот в норме и при патологии. СПб, 2012.).
к сведению
Различия в бутиратах натрия и кальция.
Под бутиратом, в части касающейся применения в качестве пищевой (кормовой) добавки, обычно подразумевают соли масляной кислоты — бутират натрия и бутират кальция. Между двумя солями масляной кислоты есть ряд принципиальных различий, которые обусловливают особенности их применения:
Показатели | Бутират натрия | Бутират кальция |
Химическая формула | CH3(CH2)2COONa | (CH3(CH2)2COO)2Ca |
Молекулярная масса | 110 | 214 |
Концентрация масляной кислоты | 79,1% | 81,3% |
Биологическая активность | Очень высокая | Средняя |
Особенности растворения | Не зависит от рН среды | При рН больше 6 практически нерастворим |
Бутират натрия имеет более высокую биологическую активность (вступает во взаимодействие с клетками организма непосредственно в месте контакта действующего вещества), а его растворимость не зависит от кислотности среды.
Бутират кальция имеет несколько более высокое содержание анионов масляной кислоты по сравнению с натриевой солью. При этом реакционная способность и биологическое действие у кальциевой соли выражены меньше, а растворимость находится в прямой зависимости от рН среды.
БУТИРАТ КАК ПРОДУКТ БАКТЕРИАЛЬНОЙ ФЕРМЕНТАЦИИ
Итак, бутират — это продукт бактериальной ферментации пищевых волокон (короткоцепочечная жирная кислота (SCFA)), один из наиболее распространенных микробных метаболитов, обнаруженных в кишечнике млекопитающих. То есть, бутират получается, когда бактерии, живущие в нашем кишечнике, ферментируют неперевариваемые пищевые волокна из различных зерновых, бобовых, лука, бананов и других продуктов, богатых сложными углеводами [1,2,3].
Таблица 1. Микроорганизмы кишечника, продуцирующие бутират
Бактерии кишечника | Основные карбоновые кислоты | Дополнительно продуцируемые кислоты |
Acidaminococcus, Bacteroides, Cloctridium, Eubacterium, Lachnospira, Butyrivibrio (polar fl agella), Gemmiger, Coprococcus, Fusobacterium | Масляная кислота | Уксусная без изомасляной |
Megasphaera, Clostridium | Масляная, изомасляная, валериановая, изовалериановая, капроновая, изокапроновая кислоты |
|
В основном бутират синтезируют представители родов Clostridium, Eubacterium и Butyrivibrio.
Примечание редактора: к наиболее известным бутират-продуцирующим бактериям, которые изучаются как потенциальные специфические пробиотики, относятся, в частности, Faecalibacterium prausnitzii, Butyricicoccus pullicaecorum, Roseburia spp. или Clostridium butyricum.
Стволовые клетки защищены от вредного действия бутирата естественным градиентом концентрации и активной деятельностью клеток эпителия, которые используют бутират в качестве источника энергии
Бутират является источником энергии для клеток в стенке толстой кишки. Он необходим для поддержания здорового барьера между толстой кишкой и кровотоком и предотвращает воспаление в кишечнике [4]. Производство бутирата во многом зависит от рН толстой кишки. Бактерии, производящие бутират, процветают в более кислой среде (более низкий pH), тогда как бактерии, производящие другие SCFAs, такие как ацетат и пропионат, предпочитают более щелочную среду (более высокий pH) [3]. (См. дополнительно: микробная ферментация резистентного крахмала в толстой кишке и выход бутирата →).
Он необходим для поддержания здорового барьера между толстой кишкой и кровотоком и предотвращает воспаление в кишечнике [4]. Производство бутирата во многом зависит от рН толстой кишки. Бактерии, производящие бутират, процветают в более кислой среде (более низкий pH), тогда как бактерии, производящие другие SCFAs, такие как ацетат и пропионат, предпочитают более щелочную среду (более высокий pH) [3]. (См. дополнительно: микробная ферментация резистентного крахмала в толстой кишке и выход бутирата →).
Полезные свойства
- Является источником энергии для клеток толстой кишки
- Обладает противораковым действием
- Повышает митохондриальную активность
- Предотвращает попадание токсинов через кишечный барьер
- Улучшает чувствительность к инсулину
- Способствует снижению веса
- Является противовоспалительным
- Является антибактериальным
- Защищает мозг
Особенность: Бутират ингибирует гистонодеацетилазу (HDAC), фермент, который упаковывает ДНК в плотные, компактные структуры; другими словами, бутират ослабляет структуру ДНК и увеличивает экспрессию генов [5, 6].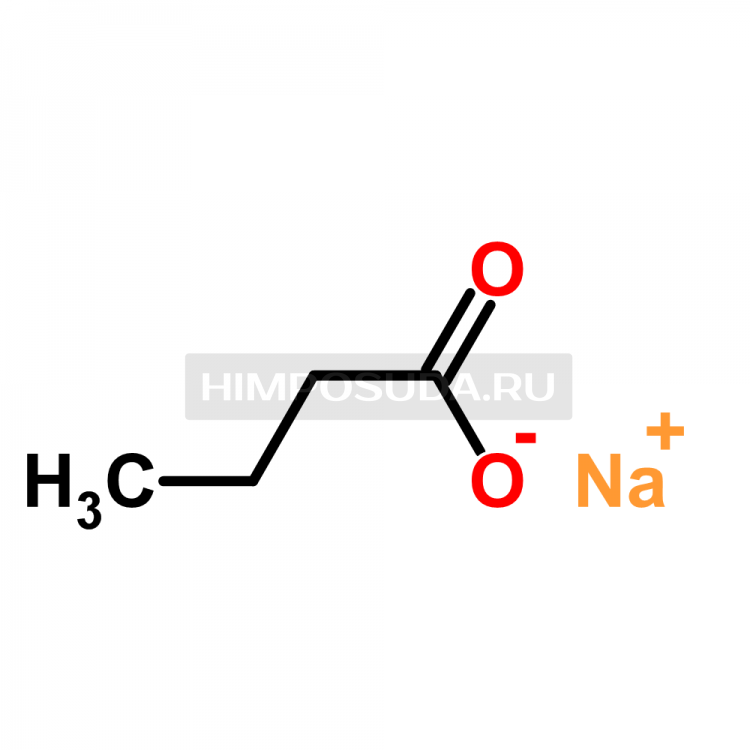 Препараты, ингибирующие HDAC, в настоящее время используются для лечения биполярного расстройства и профилактики эпилептических припадков. Ранние исследования показывают, что они также могут быть эффективными антидепрессантами [7, 8]. Взаимосвязь между бутиратом и HDAC помогает объяснить, почему наша кишечная флора оказывает такое большое влияние на наше психическое здоровье — при депрессии у людей в кишечнике наблюдается меньше бутират-продуцирующих бактерий [9].
Препараты, ингибирующие HDAC, в настоящее время используются для лечения биполярного расстройства и профилактики эпилептических припадков. Ранние исследования показывают, что они также могут быть эффективными антидепрессантами [7, 8]. Взаимосвязь между бутиратом и HDAC помогает объяснить, почему наша кишечная флора оказывает такое большое влияние на наше психическое здоровье — при депрессии у людей в кишечнике наблюдается меньше бутират-продуцирующих бактерий [9].
Преимущества бутирата
Прим. ред.: Перед тем как рассмотреть потенциально полезные свойства бутирата, стоит напомнить, что ни бифидобактерии, ни лактобактерии (наиболее известные пробиотики) не являются продуцентами масляной кислоты и ее производных в толстой кишке. Этим, как было указно выше, занимаются другие представители анаэробной кишечной микробиоты при ферментации сложных углеводов (пищевых волокон). Однако, как показали исследования, молочные пропионовокислые бактерии, являясь по сути бактериями-прЕбиотиками, способны увеличить концентрацию не только пропионата, но и бутирата, с одновременным увеличением содержания бифидо- и лактобактерий, что обусловлено продукцией 1,4-дигидрокси-2-нафтойной кислоты (DHNA).
1) Критический для здоровья кишечника
Бутират необходим для поддержания здоровой окружающей среды в кишечнике. В толстой кишке человека анаэробные бактерии, такие как Clostridium butyricum, Roseburia intestinalis
Питает Клетки Толстой Кишки
Бутират питает стенки толстой кишки, поддерживает здоровую слизистую оболочку и барьерную функцию толстой кишки, предотвращает воспаление кишечника [4]. В митохондриях клеток толстой кишки 70-90% бутирата окисляется в ацетил-КоА, который затем используется для получения большого количества АТФ, первичной формы клеточной энергии [12]. Если у вас нет достаточного количества бактерий, производящих бутират в вашем кишечнике, вы можете быть в опасности серьезных проблем, таких как диарея, воспалительные заболевания кишечника (ВЗК) и даже рак толстой кишки [13, 14, 15, 16, 17].
Помогает при ВЗК
Короткоцепочечные жирные кислоты, особенно бутират, могут уменьшить симптомы воспалительного заболевания кишечника (ВЗК). В одном исследовании, в котором приняли участие 13 человек с болезнью Крона, добавки бутирата улучшили состояние в 69% случаев, причем симптомы полностью исчезли в 54% (семь участников) [18, 19, 20, 21].
Существуют различные подходы к использованию бутирата для лечения ВЗК и колита. Стратегии лечения варьируются от диеты с высоким содержанием клетчатки до пробиотиков, производящих бутират, а также бутиратными таблетками и ректальными клизмами [22, 23].
Уменьшает Диарею и Воспаление Кишечника
Устойчивый (резистентный) крахмал — это тип растворимого волокна, которое ваши кишечные бактерии могут ферментировать в бутират. Диета, содержащая много резистентного крахмала, улучшила диарею в исследовании 57 мальчиков из Бангладеша [24].
Бутират может также предотвратить воспаление и язвы желудка, вызванные алкоголем.
Было также показано, что бутират натрия в сочетании с другими SCFAs и диоксидом кремния оказывает благоприятное действие на диарею путешественников, состояние, распространенное среди тех, кто путешествует в экзотические страны [26].
Согласно подавляющим доказательствам, бутират жизненно важен для здоровой кишечной флоры, контролирует воспаление и поддерживает сильный кишечный барьер.
2) Борется с Воспалением
Короткоцепочечные жирные кислоты, продуцируемые кишечной микробиотой, оказывают широкий спектр эпигенетических эффектов, влияющих на развитие и функционирование иммунной системы [27]
Бутират подавляет активность клеток и белков, которые вызывают воспаление [28]. В одном исследовании на клетках человека бутират резко снижал активность интерлейкина-12 (IL-12), воспалительного цитокина, при одновременном повышении интерлейкина-10 (IL-10), который в целом является противовоспалительным [29].
В мышах, бутират-производящие диетические волокна противодействовали воспалению, причиненному бактериальными токсинами. К воспалительным цитокинам, ингибируемым бутиратом, относятся интерлейкин-1 (IL-1), фактор некроза опухоли-альфа (ФНО-альфа или TNF-α) и интерферон гамма (INF-y) [30].
Уравновешивает иммунный ответ
Бутират может уменьшить воспаление, увеличивая активность иммунных клеток, называемых регуляторными Т-клетками или Tregs. Эти специализированные клетки останавливают другие иммунные клетки — Th2, Th3 и Th27 — на своем пути, прежде чем они потеряют контроль. В свою очередь, Tregs предотвращают чрезмерную реакцию слизистой оболочки кишечника на безвредные пищевые белки [31].
Укрепляет кишечный барьер
Бутират также усиливает барьер, образованный клетками в стенке толстой кишки, предотвращая проникновение микробов и бактериальных токсинов в кровоток [32].
Может управлять воспалением из-за старения
Когда мы становимся старше, воспаление увеличивается по всему телу. У стареющих мышей диета с высоким содержанием клетчатки, которая производит бутират, противодействует возрастному увеличению воспаления, что позволяет предположить, что бутират может быть особенно полезен для пожилых людей. Однако для подтверждения этой пользы потребуются исследования на людях [33].
У стареющих мышей диета с высоким содержанием клетчатки, которая производит бутират, противодействует возрастному увеличению воспаления, что позволяет предположить, что бутират может быть особенно полезен для пожилых людей. Однако для подтверждения этой пользы потребуются исследования на людях [33].
Исследования на животных и клетках показывают, что бутират ингибирует воспалительные цитокины и предотвращает попадание воспалительных бактериальных токсинов в кровоток.
3) Тонкая настройка иммунной системы
В качестве ингибитора HDAC (деацетилазы гистонов) бутират регулирует иммунную систему несколькими способами.
Ингибиторы HDAC улучшают нацеливающие на опухоль способности иммунных клеток, таких как Т-клетки и естественные клетки-киллеры; в настоящее время они рассматриваются как потенциальные лекарства от рака. Этот класс соединений также уменьшает многие воспалительные сигналы и увеличивает Tregs, тип лейкоцитов, который предотвращает аллергию и аутоиммунитет [34, 35, 36].
Бутират, в частности, защищает кишечный барьер и предотвращает проникновение патогенных микроорганизмов и других вредных веществ в кровоток [37].
4) Защищает мозг и нервные клеткиВаш кишечник и ваш микробиом сильно влияют на ваш мозг. Ваши кишечные бактерии взаимодействуют с вашими клетками, высвобождая бутират, который (как ингибитор HDAC) включает определенные гены [38].
Улучшает когнитивные способности (познание)
Бутират может улучшить обучение и долговременную память. Подобно физическим упражнениям, бутират натрия усиливал нейротрофический фактор мозга (BDNF) у мышей. Проще говоря, бутират поставляет «пищу для мозга» (нейро = мозг, трофик = еда) в гиппокамп, мозговой центр памяти и эмоций. Это порождает новые нейроны — нейрогенезом, процесс, который может изменить мозг [39].
Травма головного мозга
Существует огромное совпадение между улучшением когнитивных функций и восстановлением после повреждения головного мозга. Оба полагаются на нейрогенез, процесс, который пополняет и изменяет мозг.
Оба полагаются на нейрогенез, процесс, который пополняет и изменяет мозг.
В исследовании на мышах бутират натрия, полученный после инсульта, поддерживал развитие новых нервных клеток в поврежденных областях. Это также усилило гематоэнцефалический барьер у мышей с травмой головного мозга, что помогло им восстановиться. Бутират-продуцирующие бактерии также усиливали этот барьер у мышей [40, 41, 42].
Так, бутират-производящий вид бактерий, Clostridium butyricum, может помочь управлять сосудистой деменцией, заболеванием, при котором закупорки кровеносных сосудов препятствуют получению клетками головного мозга достаточного количества кислорода. В исследовании на мышах животные с C. butyricum в кишечнике испытывали меньшую гибель клеток в своем мозге [43].
Повреждение нервных клеток
Бутират может также помочь справиться с другими видами повреждения нервных клеток. Так, у морских свинок, бутират натрия защищал нервные клетки в ухе после лечения антибиотиками, таким образом предотвращая потерю слуха [44].
Мыши с повреждением головного мозга из-за недостатка кислорода чувствовали себя лучше, когда им до травмы давали бактерии-продуценты бутирата Clostridium butyricum [45].
Бутират натрия также предотвращал гибель нервных клеток в позвоночнике мышей с мышечной атрофией позвоночника [46].
Исследования на животных показывают, что бутират является нейропротектором, может улучшить память и уменьшить последствия травмы головного мозга. Для подтверждения этого потребуются испытания на людях.
5) «Социальный» запах
Бутират может повлиять на вашу социальную жизнь. Наряду с другими жирными кислотами, вырабатываемыми кишечными бактериями, бутират является «социальным запахом». Он может влиять на то, сочтут ли вас люди привлекательными [38].
Люди могут обнаружить даже малейшее количество бутирата по запаху; фактически наше обоняние лучше, чем почти любой другой химикат на Земле, улавливает бутират. При высоких концентрациях это вызывает реакцию отвращения, потому что это может указывать на то, что что-то гниет или заболевает. Однако при низких концентрациях он может рассказать нам об иммунном статусе других людей [38].
Однако при низких концентрациях он может рассказать нам об иммунном статусе других людей [38].
Легкий запах бутирата в запахе тела другого человека может указывать на то, что он здоров, силен и является хорошим человеком для общения [38].
6) Улучшает настроение
Бутират увеличивает фермент, который продуцирует дофамин (тирозин гидроксилазу) [47].
Благодаря действию на дофамин бутират также может стабилизировать ваше настроение; у грызунов это предотвращает и депрессию и манию. У мышей, находящихся в состоянии хронического стресса, он действовал как антидепрессант; это также стабилизировало крыс с манией. Бутират натрия также снимал депрессию и улучшал когнитивные функции у мышей [48, 49, 50].
Бутират увеличивает рост нейронов в гиппокампе, части мозга, которая обычно деградирует у людей с депрессией. У крыс бутират натрия увеличивает количество белков, которые помогают восстанавливать мозг, включая нейротрофический фактор мозга (BDNF), фактор роста нервов (NGF) и нейротрофический фактор глиальных клеток (GDNF). Это может объяснить преимущества стабилизирующего настроение бутирата [51].
Это может объяснить преимущества стабилизирующего настроение бутирата [51].
Фенилбутират натрия, бутиратсодержащий препарат, используемый для лечения нарушений цикла мочевины, также уменьшал тревожность и депрессию у мышей [52].
Бутират снимает депрессию и стабилизирует настроение у животных. Это может быть эффективным при расстройствах настроения, но необходимы испытания на людях.
7) Может помочь предотвратить алко- и наркозависимость
Из-за своего действия в качестве ингибитора гистондеацетилазы (HDAC) бутират может предотвращать или даже помогать обращать алкоголизм и вспять наркоманию. Бутират натрия снижал количество алкоголя, которое зависимые крысы предпочитали пить [53]. Фенилбутират также уменьшал потребность в кокаине у крыс с кокаиновой зависимостью [54].
Тем не менее, есть данные, свидетельствующие о том, что очень высокие дозы бутирата могут действовать совместно с наркотиками, вызывающими злоупотребление, и способствовать развитию зависимости, тогда как более низкие дозы бутирата предотвращают зависимость [55].
Одно обзорное исследование показало, что влияние бутирата на зависимость также зависит от сроков: небольшие дозы бутирата, вводимые одновременно с кокаином, наиболее эффективно предотвращают поведение, связанное с употреблением наркотиков, и ускоряют время выздоровления [56].
Доказательства лечения наркомании бутиратом несколько противоречивы. Дальнейшие исследования позволят выяснить обстоятельства, при которых бутират борется или способствует развитию зависимости.
8) Убивает раковые клетки
Бутират показал противоопухолевые эффекты в клеточных исследованиях; он ингибирует рост опухоли, способствуя запрограммированной гибели клеток (апоптозу) раковых клеток [57, 58, 59, 60].
Однако сам по себе бутират недостаточно эффективен, поскольку он устраняется слишком быстро. По этой причине вместо этого часто используется пролекарство бутирата, то есть другое химическое вещество, которое организм превращает в бутират [61].
Трибутирин является новым пролекарством бутирата, который содержится в молочном жире и меде. Трибутирин был способен разрушать раковые клетки у пациентов с запущенными солидными опухолями [62, 63].
Трибутирин был способен разрушать раковые клетки у пациентов с запущенными солидными опухолями [62, 63].
По крайней мере еще два бутиратсодержащих препарата с противораковой активностью были или в настоящее время проходят испытания:
- Pivanex (пивалоилоксиметил бутират), который предотвращал метастазы и рост кровеносных сосудов в опухолях [64]
- Бутиройлоксиэтиловые эфиры, которые превращаются в формальдегид, который в свою очередь убивает раковые клетки [65]
Другой возможный подход заключается во введении бактерий, продуцирующих бутират, в опухоли, чтобы уничтожить их изнутри. Эта стратегия еще не была проверена [66].
Синергизм
Бутират натрия также можно сочетать с другими противораковыми веществами. Например, его сочетание с никотинамидом и глюкаратом кальция предотвращало образование опухолей кожи у мышей [67].
В клетках лейкемии комбинация бутирата натрия и артемизинина, соединения растительного происхождения, была очень эффективной для уничтожения раковых клеток даже в низких дозах [68].
Некоторые предлагают объединить интерлейкин-2 (IL-2), цитокин, который активирует клетки-киллеры, с бутиратом. Согласно исследованиям на крысах, эта комбинация помогает иммунной системе воздействовать на раковые клетки [69].
Против рака толстой кишки
В многоклеточных исследованиях бутират предотвращал рост опухолевых клеток и способствовал разрушению раковых клеток в толстой кишке [70, 71, 72, 73].
Несколько обзорных исследований показывают связь между диетами с высоким содержанием клетчатки, которые питаются бактериями, продуцирующими бутират, и сниженным риском развития рака толстой кишки у людей [74, 75, 76].
Мыши на диете с высоким содержанием клетчатки, у которых в кишках были бактерии, продуцирующие бутират, получили на 75% меньше опухолей толстой кишки, чем мыши без бактерий. Мыши были защищены от рака толстой кишки, только если у них были соответствующие бактерии; диета с высоким содержанием клетчатки не была защитной [77].
Диеты с высоким содержанием клетчатки, способствующие выработке бутирата, могут помочь предотвратить рак толстой кишки. Сам по себе бутират не эффективен для лечения рака полости рта, но пролекарства бутирата могут быть эффективны.
9) Поддерживает потерю веса
Firmicutes и Bacteroidetes — две основные группы микробов, которые живут в кишечнике человека. Более высокое отношение Firmicutes к Bacteroidetes было связано с увеличением веса и ожирением. Интересно, что добавление SCFA (включая бутират) способствует Bacteroidetes, приводя к потере веса у мышей [78, 79].
В испытании 118 человек с избыточным весом добавки, производящие бутират, также приводили к снижению массы тела и ИМТ [80].
В исследовании 12 мужчин SCFA, доставленные непосредственно в толстую кишку, увеличивали количество сжигаемого жира и расход энергии [81].
У мышей SCFA — бутират и пропионат — предотвращали ожирение и резистентность к инсулину, вызванные диетой [82, 79].
В другом исследовании, проведенном на мышах, из-за бутирата мыши с ожирением потеряли 10% массы тела, а жир снизился на 10%. В сочетании с ограничением калорий и физическими упражнениями, бутират может способствовать снижению веса при ожирении [83].
SCFA могут предотвращать увеличение веса и ожирение с помощью нескольких механизмов, включая [79]:
- Ускорение сжигания жира (улучшение расщепления триглицеридов и окисления жирных кислот)
- Превращение жировых клеток в коричневые жиры, которые легче сжигаются для получения энергии [84]
- Содействие генерации новых митохондрий
- Ингибирование хронического воспаления
Бутират — и волокна, которые превращаются в бутират — могут способствовать снижению веса за счет сокращения потребления пищи и увеличения сжигания жира и потребления энергии.
10) Может помочь в управлении диабетомЛюди с диабетом часто имеют дисбаланс кишечной флоры; в их кишечнике бутирата производится меньше. Обзорное исследование показало, что бутират помогает контролировать уровень сахара в крови как у животных, так и у людей с диабетом 2 типа [11].
Исследования на людях также показали связь между ферментируемыми пищевыми волокнами и улучшенным контролем сахара в крови [85, 86].
У мышей добавление бутирата повышает чувствительность к инсулину. Между тем, у диабетических крыс бутират натрия защищал инсулин-продуцирующие клетки и снижал уровень сахара в крови [83, 87].
Кроме того, у мышей с диабетом бутират снижал уровень гемоглобина A1c в крови (HbA1c, показатель долгосрочного уровня сахара в крови), воспалительных цитокинов и липополисахаридов (LPS). Это также укрепило кишечный барьер [88].
Бутират может помочь справиться с диабетом, уравновешивая флору кишечника, подавляя воспаление и повышая чувствительность к инсулину. Однако необходимы дополнительные испытания, чтобы подтвердить это у человека.
11) Может предотвратить аллергиюБутират натрия улучшил симптомы и биологические маркеры аллергии у мышей с аллергическим ринитом (сенной лихорадкой) [89].
В клетках и мышах человека SCFA, включая бутират, ингибировали увеличение лейкоцитов, называемых эозинофилами, в ответ на аллергены. Во время аллергической реакции эозинофилы сильно активируются и вызывают вредное воспаление; бутират помогает дезактивировать эти клетки и разрешить воспалительный ответ [90].
12) Может уменьшить симптомы аутизмаБутират натрия снижал аутистическое поведение у мышей. Другое исследование показало, что бутират натрия помогает аутичным мышам лучше распознавать объекты [91, 92].
Исследования на животных показывают, что бутират может улучшить симптомы аутизма. Однако испытания на людях не проводились.
13) Нейродегенеративные заболеванияСогласно исследованиям на животных, бутират может защитить нервы и клетки мозга от дегенеративных заболеваний. У мышей бутират способствовал выживанию нервных клеток у мышей с боковым амиотрофическим склерозом (БАС), заболеванием, от которого нервы, ответственные за движение, отмирают [93].
В мышиной модели болезни Альцгеймера, наиболее распространенного нейродегенеративного состояния, бутират натрия улучшал функцию памяти посредством ингибирования деацетилазы гистонов (HDAC). У мышей фенилбутират также предотвращал накопление бета-амилоидных белков в головном мозге. Когда эти белки накапливаются в бляшках, когнитивные симптомы болезни Альцгеймера прогрессируют [94, 95].
Болезнь Хантингтона — это состояние, при котором клетки мозга вымирают, вызывая проблемы с мышцами и беспорядочные движения. У мышей с этим состоянием фенилбутират улучшал движение, массу тела и способность распознавать объекты [96].
Такой же благоприятный эффект был продемонстрирован в клеточных культурах человека. В нейронах с накоплением мутированного белка хантингтина, маркера болезни Хантингтона, бутират натрия позволил клеткам жить дольше [97].
В исследованиях на животных бутират является нейрозащитным средством и может защищать от нейродегенеративных заболеваний, таких как амиотрофический склероз, болезнь Альцгеймера и Хантингтона. Однако испытания на людях еще не проводились.
14) Может предотвратить повреждение от радиацииОдноклеточное исследование показало, что бутират может защитить митохондрии — энергетические фабрики внутри клеток — от радиации. Бутират может также защищать митохондрии от других форм окислительного стресса, но его потенциал против радиационного отравления особенно обнадеживает [98].
15) Может защитить печень и поджелудочную железуБутират натрия препятствовал развитию у мышей неалкогольного стеатогепатита (НАСГ), воспалительного заболевания, вызванного накоплением жира в печени [99].
Бутират натрия также блокировал воспаление и защищал поджелудочную железу от воспаления у мышей [100].
16) Может защитить сердцеВ совместном исследовании на мышах и клетках бутират натрия предотвращал затвердение артерий (атеросклероз), подавляя воспаление [99] [101].
Более того, клеточное исследование показало, что бутират может снижать экспрессию генов, которые вырабатывают холестерин, возможно, снижая выработку холестерина [102].
Если эти результаты могут быть воспроизведены на людях, бутират может снизить риск сердечно-сосудистых заболеваний.
17) Может предотвратить анемиюБутират может включать ген гемоглобина, который генерирует эритроциты. Таким образом, бутират может предотвратить или справиться с некоторыми формами анемии, особенно во время беременности [103].
18) АнтибактериальныйБутират токсичен для некоторых вредных видов бактерий. Клеточные исследования показали, что масляная кислота может непосредственно убивать или ингибировать общий пищевой патоген – бактерию Salmonella, а также Clostridium perfringens, которая вызывает гангрену [104].
Кроме того, бутират может влиять на активность генов сальмонелл, снижая способность бактерий проникать в ткани и, возможно, вызывать заболевания [105].
Недавно исследователи обнаружили, что бутират может разрушать клеточную стенку бактерии H. pylori, вызывающей гастрит и язву [106].
Испытание бутирата против шигеллеза на кроликах показало, что он обладает противовоспалительным действием во время инфекции. Поскольку многие симптомы инфекции связаны с воспалением, этот результат свидетельствует о том, что бутират может снизить тяжесть бактериальной болезни [107].
Бутират может также убить бактерии косвенно, путем увеличения продукции хозяином противомикробных протеинов которые разрушают бактерии. Это также верно для фенилбутирата [108, 109].
В клеточных и животных исследованиях бутират является антибактериальным и может уменьшить воспаление, связанное с инфекцией. Человеческие испытания должны подтвердить это преимущество.
Побочные эффекты и безопасность бутирата
Бутират считается безопасным и полезным в количествах, обычно вырабатываемых здоровой кишечной флорой. Употребление пищевых волокон вместо добавок для повышения уровня бутирата, вероятно, предотвращает любой риск передозировки. Лучшие волокна для этой цели включают инулин, устойчивые крахмалы, пектин (многие фрукты) и овсяные отруби. Тем не менее, есть еще и пробиотический вариант — это применение классических («молочных») пропионовокислых бактерий, которые являются, судя по всему, единственными на сегодняшний день бактериями-пребиотиками, стимулирующими рост бифидо- и лактобактерий, а также осуществляющими тонкую настройку в соотношении КЦЖК, синтезируя пропионат и ацетат (как правило в пропорции 2/1) и способствуют увеличению содержания бутирата, путем модификации кишечной микробиоты с помошью бифидогенного стимулятора роста (bifidogenic growth stimulator (BGS)), в частности, 1,4-Дигидрокси-2-нафтойной кислоты (DHNA).
Дополнительная информация
Основными продуцентами масляной кислоты (бутирата) в кишечнике человека являются анаэробные бактерии видов: Eubacterium rectale, Eubacterium ramulus, Eubacterium hallii, Roseburia cecicola, Roseburia faecis, Faecalibacterium prausnitzii и ряд видов рода Coprococcus.
Результаты ряда исследований указывают, что для лиц с ожирением и сахарным диабетом 2-го типа характерны глубокие изменения состава кишечной микрофлоры, в частности уменьшение содержания видов, активно вырабатывающих бутират: Roseburia intestinalis и Faecalibacterium prausnitzii. Эти бактерии производят бутират и другие короткоцепочечные жирные кислоты путем ферментации пищевых волокон.
Препаратов-пробиотиков с продуцентами бутирата в настоящее время нет. Поэтому есть два наиболее естественных варианта повышения уровня бутирата в кишечнике (вместо специальных БАД, например, с бутиратом кальция) – потреблять пищевые волокна (например инулин из цикория) и/или молочные пропионовокислые бактерии (биопрепараты «Пропионикс», «Селенпропионикс», «Йодпропионикс»), т.к. их РБС (ростовый бифидогенный стимулятор) положительно влияет на увеличение уровня бутирата, продуцируемого другими бактериями, что доказано в ряде исследований:
Считается, что 1,4-Дигидрокси-2-нафтойная кислота (DHNA), ростовый бифидогенный стимулятор (РБС) пропионовокислых бактерий Propionibacterium freudenreichii, оказывает благоприятное действие в качестве пребиотика. Несмотря на то, что основным метаболитом пропионовокислых бактерий при брожении является пропионат, медицинское исследование показало, что пациенты (в т.ч. животные) демонстрируют увеличение концентрации бутирата стула после лечения с помощью РБС (пропионовокислых бактерий), который модифицировал кишечную микробиоту. Ссылки на исследования:
https://pubmed.ncbi.nlm.nih.gov/16226014/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1856113/
См. дополнительно:
См. также:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- БИФИКАРДИО
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- ПРОБИОТИКИ С ПНЖК
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- РОЛЬ МИКРОБИОМА В ТЕРАПИИ РАКА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОФЛОРА КИШЕЧНОГО ТРАКТА
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА И ФУНКЦИИ МОЗГА
- ПРОБИОТИКИ И ХОЛЕСТЕРИН
- ПРОБИОТИКИ ПРОТИВ ОЖИРЕНИЯ
- МИКРОФЛОРА И САХАРНЫЙ ДИАБЕТ
- ПРОБИОТИКИ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ДИСБАКТЕРИОЗ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- СИНТЕЗ ЛЕТУЧИХ ЖИРНЫХ КИСЛОТ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ
Что такое бутират? Действие на организм
Сентябрь 21, 2020
Бутират что это такое? Препарат используется в медицине, но при неконтролируемом употреблении люди под бутиратом ведут себя неадекватно. В результате действия наркотиков на организм возникает отравление бутиратом и зависимость. Что такое бутират и как он выглядит? Почему самостоятельно нельзя пить бутират отзывы о препарате и какие последствия бутирата?
Что такое бутират?
Что такое бутират и как он выглядит? Бутират это препарат с ноотропным действием. Бутират что это? Вещество используется для обезболивания, в неврологии и бодибилдинге. Но нельзя забывать и о его токсичности.
Бутират что это такое? Помогают понять, как выглядит бутират фото препарата. Он имеет вид мелких бело-желтых кристаллов. Состав бутирата — натриевая соль гамма-оксимасляной кислоты. Бутират что это? Наркоманы называют бутиратом оксибутират цена которого сравнительно невысокая. Отдельно отмечено в описании бутирата что такое вещество усугубляет опьянение от алкогольных напитков.
Бутират действие на человека
При назначении бутирата дозировка определяется специалистом. Но оксибутират это еще и сильный наркотик. Неконтролируемый прием сопровождается губительным действием наркотиков на организм. Молодежь употребляет вещество для поднятия настроения, не зная, что такое бутират и чем он опасен. Под бутиратом любой человек испытывает чувство, напоминающее алкогольное опьянение. Способствует распространению бутирата цена — он дешевле других наркотиков.
Наркоманы под бутиратом: особенности поведения
При приеме 1–3 г бутирата эффект препарата становится наркотическим. Действие бутирата начинается спустя 20 минут после приема и длится 2-3 часа. Люди под бутиратом демонстрируют такое поведение:
- повышенная коммуникабельность и раскрепощенность;
- нарушения координации;
- активная жестикуляция;
- дезориентация в пространстве;
- рассеянное внимание;
- ощущение эйфории.
Поведение под бутиратом зависит от дозы и особенностей организма. Человек может впасть в глубокий сон, который иногда ведет к летальному исходу.
Бутират последствия употребления
Употребляя вещество, человек часто не знает, что такое оксибутират и какое действие бутирата на здоровье. Бутират это яд, который приводит к необратимым процессам в организме. Наркоманы под бутиратом находятся в приподнятом настроении. Вещества, входящие в состав бутирата вызывают нарушения функции головного мозга, сбои в дыхании, губительно воздействуют на печень. Нарки под бутиратом необдуманно вступают в половые связи, которые увеличивают риск инфицирования ВИЧ.
Человек привыкает к бутирату за 1-2 приема. Классические последствия бутирата при регулярном употреблении — чувство тревоги, склонность к суициду, сердечные боли, разрушение психики.
Передозировка бутиратом
Люди часто не понимают, что такое оксибутират и какой у него состав. В погоне за эйфорией человек принимает бутират отзывы о котором обещают кайф. Наркоманы «со стажем» знают, где бутират купить Киев является одним из городов, в котором препарат реализуется подпольно.
Оксибутират это токсин. В больших дозах он вызывает отравление бутиратом. Симптомы передозировки бутиратом:
- расстройство мышления;
- рвота;
- бледность и нечеткая речь;
- головокружение;
- неподвижные зрачки;
- сердцебиение;
- сонливость и потеря сознания.
В результате приема высокой дозы бутирата действие препарата сопровождается отеком головного мозга и летальным исходом.
Зависимость от бутирата
Человек под бутиратом испытывает эйфорию и хочет снова принять бутират дозировка которого на этот раз может быть увеличена. Формируется тяжелая зависимость от бутирата, человек уже не осознает что такое бутират и чем он опасен. Возникает состояние ломки, а при употреблении привычной порции бутирата эффект становится кратковременным. Человек увеличивает дозу, вызывая интоксикацию организма. Для наркомана, употребляющего оксибутират цена наркотика перестает иметь значение.
Оксибутират что это? Препарат очень опасен, а его регулярное употребление приводит к развитию тяжелой зависимости, которая нуждается в профильном лечении.
Преимущества кормовой добавки Бутирекс С4 перед другими бутиратами
Бутирекс С4 — бутират натрия без недостатков.
На современном рынке кормовых добавок представлены различные препараты, обогащающие рацион животных и птицы масляной кислотой, которые различаются между собой способом защиты, используемым в соли ионом и активностью действующего вещества, а также нормой ввода. Но все ли бутираты одинаково эффективны и экономически выгодны, как это кажется на первый взгляд?
Форма защиты бутирата: буферные соли или жировая капсула?
Чаще всего бутират от диссоциации в желудке защищают с помощью жировой капсулы или масляной защиты в виде наполнителя. Важным моментом является стабильность жировой защиты при воздействии высоких температур (грануляция и экструдирование). Ведь, как известно, жир чувствителен к нагреванию, температура плавления стеаринового жира составляет 60-65°С. А, следовательно, экструдирование и гранулирование корма может привести к высвобождению бутирата и ухудшению вкусовых качеств корма.
Самым современным и передовым способом защиты бутиратов является защита с помощью буферных солей. Биохимические особенности этого метода защиты создают условия, которые препятствуют разрушению основной части бутирата в желудке и обеспечивают постепенное высвобождение масляной кислоты во всех отделах тонкого и толстого кишечника. А термостабильность кормовой добавки, защищенной буферными солями, составляет 120°С.
Именно такой способ защиты бутирата используется при производстве кормовой добавки Бутирекс С4 испанской компании Новатион2002 (Novation2002). Стоит отметить, что производитель Бутирекс С4, Novation, SL, является единственной компанией по производству бутирата, которая продемонстрировала действие продукта на различные отделы ЖКТ. Дважды были проведены исследования In Vivo на свиньях и птице, в трех различных университетах по всему миру – Тайвань, Венгрия, Испания.
Бутират натрия или бутират кальция?
Разнообразие кормовых добавок на основе масляной кислоты, позволяет выбирать, какую именно соль бутирата использовать: натриевую или кальциевую. Химические свойства кальция и натрия имеют ряд существенных различий (свойства атома, электродный потенциал, степень окисления, плотность, энергия ионизации и т.д.), соответственно и формулы бутирата кальция и бутирата натрия также отличаются. В отличие от бутирата кальция, бутират натрия эффективнее воздействует на патогенную микрофлору из-за большего проникновения масляной кислоты в мембрану клетки и снижения уровня pH внутренней среды за счет увеличения уровня натрия на поверхности ворсинок кишечника. Также следует отметить то, что растворимость в воде и скорость диссоциации бутирата натрия выше более чем в три раза, чем бутирата кальция, это имеет важное значении при высвобождении бутирата в кишечнике, в случае же недостаточной растворимости бутират останется связанным с ионом метала в виде кристалла. Также было доказано, ион Na2+ положительно влияет на усвоение аминокислот и глюкозы в кишечнике, а при избытке иона Са2+ происходит омыление свободных жирных кислот, снижение доступности хелатов и активности фитазы. Эффективность действия различных солей масляной кислоты, можно увидеть в таблице 1.
Таблица 1. Воздействие кислот и их солей на деятельность желудочно-кишечного тракта,%
|
Название соли масляной кислоты |
Антибактериальные свойства |
Способствует росту кишечных ворсинок |
Эффективность против клостридий |
|
Бутират натрия |
20 |
80 |
80 |
|
Бутират кальция |
17 |
65 |
65 |
За 100 % по антибактериальным свойствам принята сорбиновая кислота, а по действию на рост ворсинок масляная кислота в чистом виде.
Активность действующего вещества: 54% или 30%?
Часто случается, что дозировки, рекомендуемые поставщиками, значительно отличаются от дозировок, которые использовались производителем в научно-производственных опытах, подтверждающих эффективность данной кормовой добавки. Такой рекламный ход, прежде всего, имеет цель минимизировать значительное удорожание корма при высокой цене единицы предлагаемого препарата. Поэтому часто случается, что потребитель, руководствуясь рекомендациями поставщика, к сожалению, не получает улучшения производственных показателей, затрачивая при этом средства на закупку кормовой добавки. Так, например, в настоящее время можно наблюдать подобную ситуацию и в случае с бутиратами натрия и кальция.
Действие бутирата в толстом кишечнике имеет большое значение для контроля сальмонеллы. Для подтверждения влияния различных источников бутирата на содержание летучих жирных кислот в толстом кишечнике и, как следствие, контроля сальмонеллы в Бразилии, в штате Парана, был проведен сравнительный эксперимент на бройлерах кросса Кобб. В нем использовалась одинаковая дозировка — 1,5 кг/т корма трех источников бутирата – незащищенного бутирата кальция с активностью 98%, бутирата натрия, защищенного жировой капсулой с активностью 30% и Бутирекс С4. Результаты опыта представлены на диаграмме 1. Анализируя полученные данные видно, что максимальное содержание летучих жирных кислот в слепой кишке бройлеров наблюдается в опытной группе с добавлением кормовой добавки Бутирекс С4.
Диаграмма 1. Влияние различных источников бутирата на содержание ЛЖК в слепой кишке бройлеров.
Также стоит отметить, что по результатам некоторых исследований для эффективного контроля сальмонеллы, дозировка кормовой добавки бутирата, защищенного жировой капсулой должна быть не менее 3 кг/т корма, что соответствует как минимум 900 г/т бутирата. Но, несмотря на это поставщики защищенных жировой капсулой бутиратов с активностью 30%, ввиду достаточно высокой цены за килограмм кормовой добавки, часто рекомендуют потребителям дозировки 300-500 г/т корма для бройлеров, что соответствует 90-150 г/т бутирата натрия или кальция. Данного количества бутирата явно недостаточно для обеспечения заявленного эффекта, что также подтверждают многочисленные сравнительные эксперименты применения различных источников бутирата натрия. При анализе результатов которых наблюдается общая тенденция: при низкой дозировке бутирата показатели продуктивности не существенно отличаются от показателей контрольной группы. При такой дозировке использование источников масляной кислоты, защищенных любым способом, не эффективно, а некоторые поставщики на российском рынке рекомендуют еще более низкие дозировки.
Одним из самых главных критериев, которым должны уделять внимание потребители при выборе различных форм бутиратов, является эффективность, которая условно измеряется в проценте масляной кислоты, способной достичь кишечника. Также не стоит забывать, что эффективность дозировки кормовой добавки находится в прямой зависимости от активности действующего вещества. Развитие новых технологий защиты бутиратов позволяет добиваться более высокой концентрации активного вещества в продукте (54%), обеспечивая при этом оптимальную диссоциацию бутирата на всем протяжении ЖКТ и отличную технологичность кормовой добавки. Все это дает возможность предложить птицеводам продукты по оптимальной цене с «честной» дозировкой, такие как Бутирекс С4.
Nota bene: растворимость!
Что касается оценки растворимости данных бутиратов в ЖКТ животных и птицы, необходимо проводить опыт, условия в котором были бы максимально приближены к естественному пищеварению. А эксперименты, не имеющие под собой никакой научной основы, например, исследование растворимости бутиратов с различной формой защитой, проведенные в стакане воды не могут быть достоверны и результаты, полученные таким образом, можно с легкостью опровергнуть. Ведь, как известно, химус имеет совершенно отличную от воды природу и химические свойства, а жировая капсула в воде в принципе не растворима.
Как работает Бутирекс С4?
Процесс защиты буферными солями основан на двух различных реакциях. Масляная кислота вступает в реакцию с буферными солями, образуя бутират натрия. Охлажденный после реакции, он частично защищён физической структурой соли, которая не дает ему диссоциироваться сразу при попадании в желудок при низком уровне pH. В кишечнике, где уровень pH выше, защита перестает действовать и бутират натрия диссоциируется. В отличие от защищенного жировой капсулой бутирата натрия, Бутирекс С4 не подвержен воздействию высоких температур и стабилен при любом виде тепловой обработки кормового сырья.
Существует ли матрица питательности масляной кислоты?
Некоторые производители бутиратов прилагают матрицу питательности с высоким содержанием обменной энергии и аминокислот, позиционируя кормовую добавку в качестве стимулятора всасывания питательных веществ корма. Но не надо забывать, что все бутираты имеют одинаковую химическую природу и влияют на усвоение питательных веществ, а не сами являются сырьевым компонентов для оптимизации рациона, поэтому включать бутират в рецепт учитывая матрицу питательности, по меньшей мере, нецелесообразно, а в отдельных случаях рискованно!
Функциональность продукта обуславливают действующие вещества, входящие в его состав. Так, кроме бутирата в состав соли масляной кислоты входят ионы Na2+ и Са2+. Возникает вопрос, возможно ли рассматривать бутират кальция как кормовую добавку — источник высокодоступного кальция для птицы? Покрытие физиологической потребности бройлеров в кальции с помощью ввода бутирата кальция с активностью 30% в рекомендуемой дозировке составляет в среднем 1 %, для несушки этот показатель равен в среднем в период выращивания 0,8 % и в период яйцекладки 0,3%. Таким образом, использование бутирата кальция как источника высокодоступного кальция для его восполнения в рационе птицы сводится к минимуму!
Выдержка из таблицы «Воздействие кислот и их солей на деятельность желудочно-кишечного тракта,%», «Органические кислоты и подкислители в комбикормах для птицы», Методические рекомендации, ВНИТИП, 2006
Последствия употребления бутирата
Содержание:
- Что такое бутират
- Как используют состав наркозависимые
- Побочные явления или последствия употребления бутирата
- Передозировка бутиратом
- Опасные последствия для организма при приеме бутирата
- Бутират + алкоголь = смерть
- Как избежать негативных последствий бутирата для здоровья
Бутират или оксибутират натрия — это соль гамма-оксимасляной кислоты (ГОМК). Средство относится к депрессантам центральной нервной системы и при использовании в невысоких дозах оказывает на организм человека успокаивающее воздействие.
Наркоманы применяют препарат в качестве стимулятора, угнетающего нормальную психическую деятельность. Получаемые эффекты напоминают те, что возникают после употребления алкоголя или «экстази».
Что такое бутират
Бутират натрия — синтетическое соединение из группы ГОМК. В кругах наркоманов препарат известен под названиями «ксюха», «бут», «оксик», «пробки» и др.
В норме небольшое количество гамма-оксимасляной кислоты синтезируется в организме человека самостоятельно, после чего трансформируется в тормозной нейромедиатор и создает условия для выброса дофамина. Аналогичный эффект обеспечивается после использования бутирата, но здесь он зависит от размера принятой дозы.
Как используют состав наркозависимые
Наркотическое средство изготавливают в кустарных условиях. При этом задействуют различные промышленные растворители. О том, что полученная смесь является более-менее качественной, говорят такие признаки — она выглядит, как небольшие кристаллы, которые хорошо растворяются в воде и имеют слегка соленый вкус. Можно встретить наркотик и в виде жидкости. Тогда визуально его почти невозможно отличить от обычной воды.
Если у препарата едкий запах, значит его изготовили из токсических веществ. Впрочем, по-другому быть и не может.
Чаще всего наркозависимые принимают бутират натрия внутрь. Он достаточно быстро всасывается в желудочно-кишечном тракте и с током крови разносится по всему организму, достигает головного мозга. Внутривенно вводить раствор опасно, так как «приход» может сопровождаться потерей сознания, судорогами.
Побочные явления или последствия употребления бутирата
Если наркоман употребил небольшое количество оксибутирата, он станет заторможенным, ощутит слабость, не сможет заснуть. Никогда нельзя заранее предугадать, как конкретный человек отреагирует на наркопрепарат — эффекты определяются не только составом смеси, но и индивидуальными особенностями организма.
Нередко даже после использования небольшой дозы возникают следующие негативные симптомы:
- тошнота, рвота;
- сильные головокружения;
- двоение в глазах, мелькание «мушек»;
- сложности с ориентацией в пространстве;
- усиленное отделение пота;
- невнятная и очень громкая речь;
- обмороки;
- ступор;
- сопор;
- невозможность сфокусироваться на чем-либо;
- ощущение нехватки кислорода;
- замедление основных психических процессов;
- перепады настроения;
- шаткая походка, невозможность долгое время стоять на ногах;
- замедление сердцебиения;
- вялость;
- боль в области грудной клетки;
- высокий уровень тревоги;
- скачки артериального давления.
Если наркоман запьет бутират спиртным, интоксикация окажется очень тяжелой. Человек не сможет себя контролировать и управлять своим телом.
Передозировка бутиратом
Чтобы ощутить негативные действия при передозировке бутиратом, необходимо использовать около двух с половиной граммов наркотического порошка. Но, если у человека сформировалась толерантность к средству, передозировка разовьется от более высокой дозы. При использовании трех-четырех граммов больной обычно теряет сознание. Семь граммов — доза, способная привести к летальному исходу по причине угнетения дыхания.
О том, что наркоману нужно экстренно получить квалифицированную наркологическую помощь, говорят симптомы:
- поверхностное дыхание;
- пульс менее пятидесяти ударов в минуту;
- судороги;
- рвотные позывы, рвота;
- кома;
- потеря сознания;
- амнезия.
Очень часто наркопрепарат становится причиной самоубийств, дорожно-транспортных происшествий, мгновенной смерти. Так как действие гамма-оксимасляной кислоты является сложным и отследить закономерность развивающихся эффектов передозировки при ее использовании разными людьми нельзя, больного обязательно доставляют в стационар. Если этого не сделать, может возникнуть угроза для здоровья и жизни.
Обычно бутиратовых наркоманов сразу оформляют в реанимационное отделение. Пока не приедет «скорая», важно не давать зависимому уснуть. Но, если он потеряет сознание, следует уложить его на бок.
Опасные последствия для организма при приеме бутирата
Прием бутирата — это риск:
- развития наркотической зависимости;
- проявления синдрома абстиненции;
- истощения;
- психического расстройства;
- сердечной недостаточности;
- тяжелой интоксикации;
- психоза;
- амнезии;
- бессонницы;
- болезней печени, почек;
- сбоев в работе желудочно-кишечного тракта;
- мышечной слабости;
- извращения вкусовых ощущений;
- постоянных запоров;
- отсутствия аппетита;
- травмоопасного поведения.
Особенно сильно влиянию бутирата подвержены женщины. Уже от употребления минимальной дозы они перестают себя контролировать. Это увеличивает вероятность беспорядочных половых связей, изнасилований, нежелательных беременностей, заражения ИППП.
Бутират + алкоголь = смерть
Наркологи не устают повторять, что ни в коем случае нельзя совмещать оксибутират со спиртосодержащими напитками. Такая «связка» приводит к глубокому сну, потере сознания. При этом вскоре у человека возникает рвота.
Если наркоман уснет на спине и рядом с ним не окажется других людей, скорее всего, он умрет от удушья по причине попадания рвотных масс в дыхательные пути. Именно так заканчивают свою жизнь многие «почитатели» наркотического вещества.
Как избежать негативных последствий бутирата для здоровья
Уменьшить вред препарата для здоровья с помощью каких-либо мер нельзя. Единственное, что поможет больному — комплексное лечение наркотической зависимости. Проходить его надо в условиях стационара наркологической клиники.
Чем скорее наркоман начнет лечиться, тем выше у него будут шансы на выздоровление. Промедление в случае с бутиратом натрия чревато смертью.
Литература:
- Оксибутират натрия: Нейрофармакологическое и клиническое исследование / Под ред. действ. чл. АМН СССР В. В. Закусова. — Москва : Медицина, 1968. – 135 с.
- Медикаментозные осложнения и пути их устранения : рук. для врачей / И. Б. Михайлов, И. В. Маркова. — М. ; СПб. : ДИЛЯ, 2004. – 329 с.
- Наркотики : свойства, действие, фармакокинетика, метаболизм : учебное пособие / Н. В. Веселовская – 3-е изд., перераб., испр. и доп. — Москва : Нарконет, 2008. — 262 с.
Нужна консультация?
ИЛИ ВЫЗОВ ВРАЧАЗВОНИТЕ!
]]]]]]>]]]]>]]>
Наши врачи
Все врачи >>
Фото Наркологического центра «Угодие»
(нажмите на фотографию для увеличения)
]]]]]]>]]]]>]]>20% скидка
на услуги в стационаре
при заказе с сайтаБутират: что это за наркотик, как действует, признаки употребления, последствия, лечение зависимости
Бутират – что это такое?
Бутират – это жаргонное название медицинского препарата оксибутират натрия, относящегося к категории антидепрессантов. Это вещество используется в качестве лекарства для лечения неврозов с нарушениями сна, проведения общего наркоза и терапии различных офтальмологических патологий. При употреблении в контролируемых врачом дозах данное вещество усиливает устойчивость клеток тела к гипоксии, активизирует происходящие в тканях метаболические процессы, стимулирует функцию почек, улучшает работу сердца, оказывает седативное действие.При приеме в больших дозировках оксибутират натрия становится опасным наркотиком. Заметив наркотический эффект от употребления данного лекарственного препарата, наркоманы начали использовать его для получения кайфа. Также наркотик бутират используют для облегчения проявлений и симптомов наркотической ломки.
Оксибутират натрия представляет собой синтетическое порошкообразное вещество кристаллической структуры, полностью растворимое в воде и алкогольных напитках. Люди, страдающие зависимостью от этого препарата, растворяют порошок в жидкости, после чего выпивают.
Лечение наркомании
консультация нарколога на дому и в стационаре
снятие ломки от бутирата
работаем круглосуточно
Или позвоните по телефону
Бутират – эффект
Бутират считается клубным наркотиком. Наркоторговцы распространяют его среди молодежи в различных увеселительных заведениях, предлагая в качестве альтернативы алкоголю. Они утверждают, что употребление этого наркотического средства является простым способом расслабиться, раскрепоститься и получить наслаждение.Какое оказывает бутират действие на организм? Минимальные его дозы вызывают ощущение, схожее с состоянием опьянения. После употребления бутирата человек впадает в состояние релакса, он расслабляется, испытывает подъем настроения, погружается в состояние эйфории. Также наркотик обладает способностью вызывать сильное сексуальное возбуждение, поэтому молодые люди иногда подсыпают его девушкам. Состояние релакса наступает через четверть часа после употребления наркотика. Действие бутирата продолжается в течение трех часов.
Привыкают к этом наркотику очень быстро. Постепенно развивается зависимость от бутирата, способная приводить к весьма плачевным последствиям.
Передозировка бутиратом
Отравление бутиратами в случае передозировки проявляется следующими симптомами:- сбои в функционировании нервной системы, при которых гиперактивность резко сменяется заторможенностью;
- неадекватные поведенческие реакции;
- расстройства речи и памяти;
- уход в глубокий сон;
- самопроизвольная дефекация и мочеиспускание;
- появление склонности к суициду и прочим безумным действиям, например, желание прыгнуть с большой высоты.
Бутират – как вывести из организма?
Лечение этой опасной для здоровья из жизни зависимости предусматривает выведение бутирата из организма, отказ от его употребления, оказание больному квалифицированной наркологической и психологической помощи.Наша клиника занимается лечением наркомании и зависимости от бутирата, выводом этого наркотика из организма. Как вывести бутират из организма? Процесс детоксикации предусматривает использование уколов и капельниц, позволяющих избавить организм наркозависимого человека от скопившихся в нем токсинов, очистить органы и системы.
Для этого специалисты нашей клиники используют специальные препараты, обеспечивающие нейтрализацию и выведение ядов. Состав используемых для детоксикации растворов мы наши врачи в каждом случае подбирают индивидуально, учитывая тяжесть состояния пациента, его возраст, наличие сопутствующих болезней и некоторые другие факторы.
После проведения детоксикации наши сотрудники оказывают пациентам наркологическую и психотерапевтическую помощь, помогают их социальной реабилитации в обществе.
Звоните по телефону 8 (495) 150-85-96
оксибутират натрия лучший возбудитель для женщины
оксибутират натрия лучший возбудитель для женщиныоксибутират натрия лучший возбудитель для женщины
>>>ПЕРЕЙТИ НА ОФИЦИАЛЬНЫЙ САЙТ >>>Что такое оксибутират натрия лучший возбудитель для женщины?
В период климакса пропало всякое влечение к интимной близости: не испытывала наслаждения. Перепробовала много кремов и народных средств, но результата не было. По совету подруги обратила внимание на возбудитель Rendez Vous. Результаты? Мой муж больше не задерживается на работе, как это было раньше…
Эффект от применения оксибутират натрия лучший возбудитель для женщины
Состав капель Rendez Vous включает только растительные компоненты, которые комплексно воздействуют на либидо и чувствительность женщины: Экстракт дамианы − оказывает успокаивающее воздействие, нормализует работу иммунной системы, выводит из организма шлаки и токсины, заряжает энергией. Экстракт женьшеня − уменьшает уровень плохого холестерина, нормализует обмен веществ, оказывает положительное воздействие на эмоциональную составляющую. Экстракт перуанской маки − повышает либидо, увеличивает выработку гормонов. Компоненты, входящие в состав препарата, оказывают воздействие на центральную нервную систему, повышают выработку эстрогена. Кровь в течение считанных минут приливает к половым органом, женщина готова к интимной близости.
Мнение специалиста
Состав препарата подобран таким образом, что учитывает все потребности женского организма для естественного возбуждения. Для того, чтобы женщина быстро возбудилась, необходимо достаточно высокое содержание Л-аргинина. Средство содержит его в большом количестве, именно поэтому происходит процесс возбуждения вне зависимости от состояния женщины. Выжимка из натуральных трав, эфирные масла способствуют естественной выработке гормонов, отвечающих за женское возбуждение.
Как заказать
Для того чтобы оформить заказ оксибутират натрия лучший возбудитель для женщины необходимо оставить свои контактные данные на сайте. В течение 15 минут оператор свяжется с вами. Уточнит у вас все детали и мы отправим ваш заказ. Через 3-10 дней вы получите посылку и оплатите её при получении.
Отзывы покупателей:
Ника
Вызвать страстное желание во время половой близости поможет препарат Rendez Vous, который в считанные минуты разбудит женскую чувственность. Кроме того, за счет ускорения кровообращения в области половых органов, средство позволит получить от половой близости больше удовольствия. Регулярный прием препарата ускоряет выработку женских половых гормонов, борется с проявлениями климакса.
Маша
Rendez Vous — прекрасный препарат. Долго искала и мне повезло. Для здоровья абсолютно безвреден. Медики отзываются лучшими словами. Эффект просто поразительный! Давно не испытывала такого наслаждения от секса с мужем. Причем эффект продолжался более часа. После приема глаза загорелись и захотелось подольше не прерывать прелюдию перед половым актом. Остались довольны оба – я и муж.
Капли Rendez Vous– это средство нового поколения. Оно не вызывает побочных эффектов, при этом дает максимум результата, этим и обусловлена его высокая популярность и востребованность. Секрет действия препарата заключается в растительной основе, которая тонизирует и расслабляет мышцы малого таза, способствует расширению сосудов и притоку крови к половым органам, улучшает трофику тканей и работу половых желез. А быстрый эффект от применения обеспечивается тем, что действующие вещества практически мгновенно всасываются через стенки желудка и попадают в кровь. Получить такой эффект можно уже через пару дней приема капель. Rendez Vousработает благодаря полезным свойствам растений: мукуны жгучей, аргиреи, пуэрарии, дикого ямса. Где купить оксибутират натрия лучший возбудитель для женщины? Состав препарата подобран таким образом, что учитывает все потребности женского организма для естественного возбуждения. Для того, чтобы женщина быстро возбудилась, необходимо достаточно высокое содержание Л-аргинина. Средство содержит его в большом количестве, именно поэтому происходит процесс возбуждения вне зависимости от состояния женщины. Выжимка из натуральных трав, эфирные масла способствуют естественной выработке гормонов, отвечающих за женское возбуждение.
Оксибутират натрия (ГОМК, GHB, ГГБ, бутик, ксюха, колпачок) – типичный депрессант центральной нервной системы (ЦНС). Химическое строение вещества напоминает таковое у гамма-аминомасляной кислоты (ГАМК). Бутират — сленговое название наркотического вещества — оксибутирата натрия. Немедицинское применение его связано с анксиолитическим, антигипоксическим, стимулирующим гипофиз и окислительные процессы в организме действием. При пероральном применении в дозах 1—3 г чистого вещества в виде 20. Оксибутират натрия — опасный наркотик, вызывающий как психологическое, так и физическое привыкание, он сокращает жизнь и способствует ранней смерти. Последствия приема препарата ужасающи и развиваются очень быстро. Препарат получают кустарным способом, зачастую с применением крайне. Оксибутират натрия, он же «Буратино»/ «Бутик» в народе, это весьма сильный наркотик! :drag: Активно используется молодежью в клубах. Таблеточки бывают: розовые,зеленоватые, голубые,желтые и белые; с маркировочкой- $, например. оксибутират натрия. . Рекомендую женский возбудитель с быстрым эффектом Rendez Vous – это средство, моментально усиливающее сексуальное возбуждение у женщин — узнать подробнее можно тут — clck.ru/GbofF Действует уже через десять минут Повышает половое влечение Обостряет ощущения. 1. 0. Женские возбудители продаются в аптеках или секс-шопах. Подсказать название вам смогут на месте покупки. Перед покупкой стоит знать о том, какие они вообще бывают. Существуют синтетические возбудители. Они недорогие, действуют быстро. Но возбуждение под действием таких препаратов. Женщины также отмечают, что оргазм под воздействием GHB более интенсивен и продолжителен, но для его достижения требуется больше времени. Другие действия из вышеперечисленного списка действуют пропорционально дозе. Гидроксибутират натрия (лат. Natrium oxybutyricum, также оксибат натрия) — лекарственное средство, натриевая соль γ-гидроксимасляной кислоты. Применяется в неврологии, а также анестезиологии и офтальмологии. Оксибутират натрия – медикаментозный препарат, натриевая соль гамма-оксимасляной кислоты (ГОМК). . Препарат имеет свойство повышать либидо и удовольствие от полового акта, особенно у женщин. Бутират натрия — действие на организм и последствия употребления для женщин и мужчин. . Может разбавляться водой и спиртом. На современном рынке представлен оксибутиратом калия (К-GHB) и оксибутиратом натрия (Na-GHB). Вещество выпускается в форме порошка или водного раствора. Какао бобы – лучший натурального происхождения возбудитель из-за наличия нейротрансмиттеров. . Поэтому при приготовлении еды мужчине женщине перед страстной ночью желательно добавлять в блюдо одну из нижеуказанных специй. Возбуждающие специи и травы: Имбирь. Оксибутират натрия (уличные названия: бутик, гомк, бутерат, бутират и т.д) — препарат, влияющий на мозговой метаболизм. Близок к ноотропным лекарственным средствам. Активизирует обмен веществ в тканях, в частности, в тканях мозга. Натрия оксибутират (Sodium oxybutirate). Содержание. Структурная формула. . Характеристика вещества Натрия оксибутират. Средство для неингаляционного наркоза. Белый или белый со слабо-желтоватым оттенком кристаллический порошок, иногда блестящий, со слабым специфическим запахом. Полная информация по препарату Натрия оксибутират: инструкция, применение . Хорошо всасывается слизистой оболочкой пищеварительного тракта, в том числе . Натрия оксибутират не влияет на чувствительность дыхательного центра к углекислоте, однако при глубоком наркозе дыхание замедляется, а. Натрия Оксибутират – это натриевая соль γ-оксимасляной кислоты, являющейся по медикаментозному воздействию и химическим свойствам практически полным аналогом ГАМК (g-аминомасляной кислоты).
http://www.ktowndeliver.com/uploaded/samyi_deistvuiushchii_vozbuditel_dlia_zhenshchin2572.xml
http://www.shinko-tw.com/UserFiles/kak_vozbuzhdaiutsia_zhenshchiny_vozbuditelem7480.xml
http://www.sowaprojekt.pl/files/zhenshchina_pod_vliianiem_vozbuditelia9509.xml
http://www.sklejkapisa.pl/imgfiles/zhenshchina_posle_vozbuditelia_smotret_besplatno6617.xml
http://www.golfstorefriesland.nl/media/rasputin_vozbuditel_dlia_zhenshchin4821.xml
Состав капель Rendez Vous включает только растительные компоненты, которые комплексно воздействуют на либидо и чувствительность женщины: Экстракт дамианы − оказывает успокаивающее воздействие, нормализует работу иммунной системы, выводит из организма шлаки и токсины, заряжает энергией. Экстракт женьшеня − уменьшает уровень плохого холестерина, нормализует обмен веществ, оказывает положительное воздействие на эмоциональную составляющую. Экстракт перуанской маки − повышает либидо, увеличивает выработку гормонов. Компоненты, входящие в состав препарата, оказывают воздействие на центральную нервную систему, повышают выработку эстрогена. Кровь в течение считанных минут приливает к половым органом, женщина готова к интимной близости.
оксибутират натрия лучший возбудитель для женщины
В период климакса пропало всякое влечение к интимной близости: не испытывала наслаждения. Перепробовала много кремов и народных средств, но результата не было. По совету подруги обратила внимание на возбудитель Rendez Vous. Результаты? Мой муж больше не задерживается на работе, как это было раньше…
Травяные чаи увеличивают энергию и стабилизируют нервную систему. Содержание статьи. Возбуждающие травяные чаи для женщин. Травы и чаи для повышения либидо у женщин: как возбуждаться и испытывать . Случается так, что женщина начинает отказываться от секса из-за того что винит себя в мужских осечках, не хочет лишний раз заставлять близкого. Народное средство для возбуждения женщин. Возбудитель для женщин быстрого действия. Обзор популярных женских возбудителей. Рейтинг самых эффективных: Rendez Vous, Распутница, Шпанская мушка и другие. Какие можно купить в аптеках? Возбуждающие и стимулирующие чаи издавна заваривали на Востоке. . Плоды шиповника вообще один из самых главных компонентов возбуждающих и тонизирующих чаев. В данном случае ему компанию составляют черная. Сделать женский возбудитель своими руками в домашних условиях несложно. Нужно найти компоненты и следовать пошаговым рецептам. Простые рецепты. Чтобы изготовить женский возбудитель по народным бабушкиным. Причин снижения женского либидо множество. Чаще всего добиться быстрого и высокого возбуждения женщине трудно в следующих случаях: -Сильная усталость. -Нервное напряжение, стресс. -Заболевания (снижение либидо. Часто в постели возникает ситуация, когда не только мужчине, но и женщине необходимо дополнительное возбуждающее средство. Все пары периодически сталкиваются с проблемами в интимной жизни. И если у мужчин все видно невооруженным глазом.
Диетические глицериды бутирата регулируют состав кишечной микробиоты и метаболиты сыворотки у бройлеров.
Рёдигер, У. Э. Утилизация питательных веществ изолированными эпителиальными клетками толстой кишки крысы. Гастроэнтерол. 83 , 424–429 (1982).
CAS Google Scholar
Scheppach, W. Влияние короткоцепочечных жирных кислот на морфологию и функцию кишечника. Gut. 35 (Доп.1), S35 – S38 (1994).
CAS Статья PubMed PubMed Central Google Scholar
Peng, L. et al. . Бутират усиливает кишечный барьер, облегчая сборку плотных контактов за счет активации AMP-активируемой протеинкиназы в монослоях клеток Caco-2. J. Nutr. 139 , 1619–1625 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Guilloteau, P. et al. . От кишечника до периферических тканей: множественные эффекты бутирата. Nutr. Res. Ред. 23 , 366–384 (2010).
CAS Статья PubMed Google Scholar
Инь, Ф. и др. . Анализ транскриптома показывает регуляцию экспрессии генов катаболизма липидов у молодняка бройлеров бутиратными глицеридами. PLoS One. 11 , e0160751 (2016).
Артикул PubMed PubMed Central Google Scholar
Панда, К., Рама Рао, С. В., Раджу, М. В. Л. Н. и Шьям Сандер, Г. Влияние масляной кислоты на продуктивность, здоровье желудочно-кишечного тракта и характеристики туши цыплят-бройлеров. Asian Australas. J. Anim. Sci. 22 , 1026–1031 (2009).
CAS Статья Google Scholar
Матис, Г. и др. . Влияние перорального болюсного введения бутирата на ацетилирование гистонов и активность фермента цитохрома P450 в печени курицы — рандомизированное контролируемое исследование. Nutr. Метаб. 10 , 12 (2013).
Артикул Google Scholar
Furusawa, Y. et al. . Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа. 504 , 446–450 (2013).
ADS CAS Статья PubMed Google Scholar
Чанг, П. В., Хао, Л., Офферманнс, С. и Меджитов, Р. Микробный метаболит бутират регулирует функцию кишечных макрофагов посредством ингибирования гистондеацетилазы. Proc. Natl. Акад. Sci. США 111 , 2247–2252 (2014).
ADS CAS Статья PubMed PubMed Central Google Scholar
Сункара, Л. Т. и др. . Бутират повышает устойчивость цыплят к болезням, индуцируя экспрессию гена антимикробного защитного пептида хозяина. PLoS One. 6 , e27225 (2011).
ADS CAS Статья PubMed PubMed Central Google Scholar
Zhang, W.H. et al. . Бутират натрия поддерживает рост, регулируя иммунный ответ у цыплят-бройлеров. руб. Пульт. Sci. 52 , 292–301 (2011).
CAS Статья PubMed Google Scholar
Liu, W. et al. . Влияние диетического микрокапсулированного бутирата натрия на рост, морфологию слизистой оболочки кишечника, иммунный ответ и адгезивные бактерии у молоди карпа (Cyprinus carpio), предварительно скармливаемого окисленным маслом или без него. руб. J. Nutr. 112 , 15–29 (2014).
ADS CAS Статья PubMed Google Scholar
Ван, Дж., Ву, Г., Чжоу, Х. и Ван, Ф. Новые технологии исследования аминокислотного питания в постгеномную эру. аминокислоты. 37 , 177–186 (2009).
Артикул PubMed Google Scholar
Ruan, Z. et al . Метаболомический анализ обмена аминокислот и жиров у крыс с добавкой L-триптофана. аминокислоты. 46 , 2681–2691 (2014).
CAS Статья PubMed Google Scholar
Ногучи Ю., Сакаи Р. и Кимура Т. Метаболомика и ее потенциал для оценки адекватности и безопасности потребления аминокислот. J. Nutr. 133 , 2097S – 2100S (2003 г.).
CAS Статья PubMed Google Scholar
Гонг, Дж. И Янг, К. Б. Достижения в методах изучения микробиоты кишечника и их значение для исследования функций пищевых волокон. Food Res. Int. 48 , 916–929 (2012).
CAS Статья Google Scholar
Уайт, Дж. Р., Нагараджан, Н. и Поп, М. Статистические методы обнаружения дифференциально распространенных признаков в клинических метагеномных образцах. PLoS Comput. Биол. 5 , e1000352 (2009).
ADS Статья PubMed PubMed Central Google Scholar
Сим, К. и др. . Улучшенное обнаружение бифидобактерий с оптимизированным пиросеквенированием на основе гена 16S рРНК. PLoS One. 7 , e32543 (2012).
ADS CAS Статья PubMed PubMed Central Google Scholar
Палмер, К., Бик, Э. М., ДиДжиулио, Д. Б., Релман, Д. А. и Браун, П. О. Развитие микробиоты кишечника младенца у человека. PLoS Biol. 5 , e177 (2007).
Артикул PubMed PubMed Central Google Scholar
Гонг, Дж. и др. . Влияние цинкового бацитрацина, возраста птицы и доступности среды обитания на бактериальную микробиоту в подвздошной кишке и слепой кишке цыплят-бройлеров. J. Appl. Microbiol. 104 , 1372–1382 (2008).
CAS Статья PubMed Google Scholar
Инь, X., Chambers, JR, Barlow, K., Park, AS & Wheatcroft, R. Ген, кодирующий ксилулозо-5-фосфат / фруктозо-6-фосфатфосфокетолазу (xfp), сохраняется среди видов Bifidobacterium в более вариабельной области генома и оба полезны для идентификации штаммов. FEMS Microbiol. Lett. 246 , 251–257 (2005).
CAS Статья PubMed Google Scholar
Луи П. и Флинт Х.J. Разнообразие, метаболизм и микробная экология бактерий, продуцирующих бутират, из толстой кишки человека. FEMS Microbiol. Lett. 294 , 1–8 (2009).
CAS Статья PubMed Google Scholar
Vital, M. et al. . Генно-ориентированный подход к исследованию кишечного бактериального сообщества, продуцирующего бутират. Микробиом. 1 , 8 (2013).
Артикул PubMed PubMed Central Google Scholar
Витал, М., Хоу, А. С. и Тидже, Дж. М. Выявление путей синтеза бактериального бутирата путем анализа (мета) геномных данных. мБио. 5 , e00889–14 (2014).
Артикул PubMed PubMed Central Google Scholar
Цзян, К. Ю. и др. . Метабономическое исследование на основе ЯМР 1 H зависимых от времени метаболических траекторий экстрактов плазмы, мочи и печени гиперлипидемических хомяков. PloS One. 8 , e66786 (2013).
ADS CAS Статья PubMed PubMed Central Google Scholar
Ляо, П. и др. . Метаболический профиль сыворотки крыс, получавших хлорид гадолиния, с помощью спектроскопии ЯМР 1 H. Анал. Biochem. 364 , 112–121 (2007).
CAS Статья PubMed Google Scholar
Зира, А. и др. . 1 Метабономический подход на основе H ЯМР на крысиной модели острого повреждения и регенерации печени, индуцированных введением CCl 4 . Toxicol. 303 , 115–124 (2013).
CAS Статья Google Scholar
He, Q. et al . Ограничение внутриутробного развития изменяет метабоном сыворотки и тощей кишки у поросят. Мол. Биосист. 7 , 2147–2155 (2011).
CAS Статья PubMed Google Scholar
Биаджи, Г., Пива, А., Москини, М., Веццали, Э. и Рот, Ф. Х. Производительность, кишечная микрофлора и морфология стенок поросят-отъемышей, получавших бутират натрия. J. Anim. Sci. 85 , 1184–1191 (2007).
CAS Статья PubMed Google Scholar
Кастильо, М. и др. . Реакция микробиоты желудочно-кишечного тракта на авиламицин, бутират и растительные экстракты у свиней в раннем отъеме. J. Anim. Sci. 84 , 2725–2734 (2006).
CAS Статья PubMed Google Scholar
Czerwiński, J., Højberg, O., Smulikowska, S., Engberg, R. M. & Mieczkowska, A. Влияние бутирата натрия и салиномицина на микробиоту кишечника, морфологию слизистой оболочки и продуктивность цыплят-бройлеров. Arch. Anim. Nutr. 66 , 102–116 (2012).
Артикул PubMed Google Scholar
Браун, Д. Р., Мэй, М., Брэдбери, Дж. М. и Йоханссон, К. Е. Класс I. Молликутес в Руководстве по систематической бактериологии Бергей , том 4 (изд. Криг, NR и др. . ) 568–724 (Springer, 2010).
Бейли Р. Здоровье кишечника домашней птицы — мир в пределах http: // avicol.co / descargas2 / Salud% 20Intestinal-RICHARD% 20BAILEY.pdf (2013).
Looft, T. P. Микробиота кишечника свиней: локальные адаптации и реакции на антибиотики в корме . Докторская диссертация, Университет штата Айова, Эймс, штат Айова, США (2012).
Холмстрём, К. и Лоусон, П. А. Род XI. Subdoligranulum в Руководстве Берджи по систематической бактериологии, том 3 (изд. Де Вос, П. и др. .) 1037–1044 (Springer, 2009).
Уэйд, У. Г. Род I. Eubacterium в руководстве Бергей по систематической бактериологии, том 3 (изд. Де Вос, П. и др. ) 865–891 (Springer, 2009).
Лоусон, П. А. Род V. Anaerotruncus в руководстве Берджи по систематической бактериологии, том 3 (изд. Де Вос, П. и др. .) 1023–1025 (Springer, 2009).
Eeckhaut, V. et al. . Продукция бутирата в филогенетически разнообразных Firmicutes, выделенных из слепой кишки цыпленка. Microb. Biotechnol. 4 , 503–512 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Арболея, С., Уоткинс, К., Стэнтон, К. и Росс, Р. П. Популяции кишечных бифидобактерий в условиях здоровья и старения человека. Фронт. Microbiol. 7 , 1204 (2016).
Артикул PubMed PubMed Central Google Scholar
Чжан, Х. Х. и др. . Инсулин стимулирует адипогенез через путь Akt-TSC2-mTORC1. PLoS One. 4 , e6189 (2009).
ADS Статья PubMed PubMed Central Google Scholar
Юэ, Т., Инь, Дж., Ли, Ф., Ли, Д. и Ду, М. Высокий уровень глюкозы вызывает дифференцировку и адипогенез в сателлитных клетках свиной мышцы через mTOR. BMB Reports. 43 , 140–145 (2010).
CAS Статья PubMed Google Scholar
Cocco, E. et al. . 1 Анализ H-ЯМР обеспечивает метаболомный профиль пациентов с рассеянным склерозом. Neurol. Нейроиммунол. Нейровоспаление. 3 , e185 (2015).
Артикул PubMed PubMed Central Google Scholar
Грей, Л. Р., Томпкинс, С.C. & Taylor, E. B. Регулирование метаболизма пирувата и болезни человека. Cell Mol. Life Sci. 71 , 2577–2604 (2014).
CAS Статья PubMed Google Scholar
Lacroix, M. et al. . E4F1 контролирует программу транскрипции, необходимую для активности пируватдегидрогеназы. Proc. Natl. Акад. Sci. США 113 , 10998–11003 (2016).
CAS Статья PubMed PubMed Central Google Scholar
Гао, З. и др. . Бутират улучшает чувствительность к инсулину и увеличивает расход энергии у мышей. Диабет. 58 , 1509–1517 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Николсон, Дж. К. и др. . Метаболические взаимодействия микробиоты кишечника и хозяина. Наука. 336 , 1262–1267 (2012).
ADS CAS Статья PubMed Google Scholar
Walker, A. W., Duncan, S. H., Leitch, E. C. M., Child, M. W. & Flint, H. J. pH и содержание пептидов могут радикально изменять популяции бактерий и соотношения короткоцепочечных жирных кислот в микробных сообществах толстой кишки человека. заявл. Environ. Microbiol. 71 , 3692–3700 (2005).
CAS Статья PubMed PubMed Central Google Scholar
Dumas, M.E. et al. . Метаболическое профилирование показывает вклад микробиоты кишечника в фенотип жировой дистрофии печени у инсулинорезистентных мышей. Proc. Natl. Акад. Sci. США 103 , 12511–12516 (2006).
ADS CAS Статья PubMed PubMed Central Google Scholar
Луи П., Скотт К. П., Дункан С. Х. и Флинт Х. Дж. Понимание влияния диеты на метаболизм бактерий в толстом кишечнике. J. Appl. Microbiol. 102 , 1197–1208 (2007).
CAS Статья PubMed Google Scholar
Холмс, Э., Ли, Дж. В., Марчези, Дж. Р. и Николсон, Дж. К. Состав и активность кишечной микробиоты в зависимости от метаболического фенотипа хозяина и риска заболевания. Cell Metab. 16 , 559–564 (2012).
CAS Статья PubMed Google Scholar
Marcobal, A. et al. . Метаболомный взгляд на то, как микробиота кишечника человека влияет на метаболом хозяина с использованием гуманизированных и гнотобиотических мышей. ISME J. 7 , 1933–1943 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Tang, W.H. et al. . Кишечный микробный метаболизм фосфатидилхолина и сердечно-сосудистый риск. Новое. Англ. J. Med. 368 , 1575–1584 (2013).
CAS Статья PubMed PubMed Central Google Scholar
Кавамура, Т. и др. . Глицерофосфохолин усиливает секрецию гормона роста и окисление жиров у молодых людей. Питание. 28 , 1122–1126 (2012).
CAS Статья PubMed Google Scholar
Reichardt, N. et al . Филогенетическое распределение трех путей производства пропионата в кишечной микробиоте человека. ISME J. 8 , 1323–1335 (2014).
CAS Статья PubMed PubMed Central Google Scholar
Де Ваддер, Ф. и др. . Вырабатываемый микробиотой сукцинат улучшает гомеостаз глюкозы за счет глюконеогенеза в кишечнике. Cell Metab. 24 , 151–157 (2016).
Артикул PubMed Google Scholar
Торок, В. А., Офел-Келлер, К., Лоо, М. и Хьюз, Р.J. Применение методов идентификации видов бактерий кишечника цыплят-бройлеров, связанных с повышенным энергетическим метаболизмом. заявл. Environ. Microbiol. 74 , 783–791 (2008).
CAS Статья PubMed Google Scholar
Stanley, D. et al. . Выявление микробиоты кишечника цыплят коррелировало с эффективностью извлечения энергии из корма. Вет. Microbiol. 164 , 85–92 (2013).
Артикул PubMed Google Scholar
Торок В.А. и др. . Идентификация и характеристика потенциальных микробиот кишечника, связанных с производительностью, у цыплят-бройлеров в различных испытаниях кормления. заявл. Environ. Microbiol. 77 , 5868–5878 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Стэнли, Д. и др. . Кишечная микробиота, связанная с дифференциальной эффективностью конверсии корма у кур. заявл. Microbiol. Biotechnol. 96 , 1361–1369 (2012).
CAS Статья PubMed Google Scholar
Сингх К. М. и др. . Высокопроизводительный пиросеквенирующий анализ фекальной микробиоты на основе гена 16S рРНК бройлеров, выращивающих бройлеры с высоким и низким FCR. Мол.Биол. Отчет 39 , 10595–10602 (2012).
CAS Статья PubMed Google Scholar
He, Q. et al . Метаболомический анализ реакции растущих свиней на добавление L-аргинина в рацион. аминокислоты. 37 , 199–208 (2009).
CAS Статья PubMed Google Scholar
Вэй, Л. и др. . Токсикологические эффекты киновари у крыс по метаболическому профилю мочи и сыворотки на основе ЯМР. Toxicol. Прил. Pharmacol. 227 , 417–429 (2008).
ADS CAS Статья PubMed Google Scholar
Tian, J. et al. . Открытие, скрининг и оценка панели биомаркеров плазмы для субъектов с психологическим субоптимальным состоянием здоровья с использованием профилей метаболомики на основе 1 H-ЯМР. Sci. Отчет 6 , 33820 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar
Уолтер Дж. и др. . Обнаружение и идентификация видов Lactobacillus желудочно-кишечного тракта с использованием денатурирующего градиентного гель-электрофореза и видоспецифичных праймеров ПЦР. заявл. Environ. Microbiol. 66 , 297–303 (2000).
CAS Статья PubMed PubMed Central Google Scholar
Livak, K. J. & Schmittgen, T. D. Анализ данных относительной экспрессии генов с использованием количественной ПЦР в реальном времени и метода 2 (-Delta Delta C (T)). Методы. 25 , 402–408 (2001).
CAS Статья PubMed Google Scholar
Луи П. и Флинт Х. Дж. Разработка полуколичественного вырожденного анализа на основе ПЦР в реальном времени для оценки количества генов бутирил-кофермента А (КоА) КоА трансферазы в сложных бактериальных образцах. заявл. Environ. Microbiol. 73 , 2009–2012 (2007).
CAS Статья PubMed PubMed Central Google Scholar
Мацуки, Т., Ватанабе, К., Фудзимото, Дж., Такада, Т. и Танака, Р. Использование групп-специфичных праймеров, нацеленных на ген 16S рРНК, для ПЦР-анализа преобладающих бактерий в реальном времени в кале человека. заявл. Environ. Microbiol. 70 , 7220–7228 (2004).
CAS Статья PubMed PubMed Central Google Scholar
Мацуки, Т. и др. . Разработка групп-специфичных праймеров, нацеленных на ген 16S рРНК, для обнаружения и идентификации преобладающих бактерий в фекалиях человека. заявл. Environ. Microbiol. 68 , 5445–5451 (2002).
CAS Статья PubMed PubMed Central Google Scholar
Metzler-Zebeli, B.U. et al. . Некрахмальные полисахариды модулируют бактериальную микробиоту, пути производства бутирата и изобилие патогенной Escherichia coli в желудочно-кишечном тракте свиней. заявл. Environ. Microbiol. 76 , 3692–3701 (2010).
CAS Статья PubMed PubMed Central Google Scholar
Эдгар Р. С. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика. 26 , 2460–2461 (2010).
CAS Статья PubMed Google Scholar
Эдгар Р.C., Haas, B.J., Clemente, J. C., Quince, C. & Knight, R. UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика. 27 , 2194–2200 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Ван, К., Гаррити, Г. М., Тидже, Дж. М. и Коул, Дж. Р. Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии. заявл.Environ. Microbiol. 73 , 5261–5267 (2007).
CAS Статья PubMed PubMed Central Google Scholar
Berthoud, H., Chavagnat, F., Haueter, M. & Casey, M. G. Сравнение частичных последовательностей генов, кодирующих фосфокетолазу, для идентификации бифидобактерий. LWT — Пищевая наука. Technol. 38 , 101–105 (2005).
CAS Статья Google Scholar
Кларк, К. Р. Непараметрический многомерный анализ изменений в структуре сообщества. Aust. J. Ecol. 18 , 117–143 (1993).
Артикул Google Scholar
Lozupone, C. & Knight, R. UniFrac: новый филогенетический метод сравнения микробных сообществ. заявл. Environ. Microbiol. 71 , 8228–8235 (2005).
CAS Статья PubMed PubMed Central Google Scholar
Chung, D. & Keles, S. Классификация методом разреженных частичных наименьших квадратов для данных большой размерности. Stat. Прил. Genet. Мол. Биол. 9 , 17 (2010).
MathSciNet Статья PubMed Central МАТЕМАТИКА Google Scholar
Фен, З., Янг, X., Субеди, С. и МакНиколас, П. Д. LASSO и методы разреженной регрессии наименьших квадратов для выбора SNP при прогнозировании количественных признаков. IEEE / ACM Trans Comput. Biol. Биоинформ. 9 , 629–636 (2012).
Google Scholar
Юань, Дж. С., Рид, А., Чен, Ф. и Стюарт, К. Н. Младший. Статистический анализ данных ПЦР в реальном времени. BMC Bioinformatics. 7 , 85 (2006).
Артикул PubMed PubMed Central Google Scholar
Влияние бутирата натрия на здоровье кишечника и состав кишечной микробиоты при прогрессировании кишечного воспаления у бройлеров
РЕЗЮМЕ
Масляная кислота — полезная кормовая добавка, используемая в животноводстве, в том числе в птицеводстве.Однако имеется мало сообщений о масляной кислоте в качестве профилактического средства против воспаления кишечника у бройлеров. В текущем исследовании изучалось влияние бутирата натрия (SB) в качестве профилактического лечения на здоровье кишечника и микробиоту кишечника бройлеров с воспалением кишечника, вызванным декстрансульфатом натрия (DSS), путем мониторинга изменений в гистопатологии кишечника, показателей герметичности кишечника, воспалительных цитокинов, и состав кишечной микробиоты. Добавка бутирата натрия до введения DSS значительно снизила баллы поражения кишечного кровотечения ( P <0.05) и увеличение высоты ворсинок и всей слизистой оболочки подвздошной кишки ( P <0,05). Независимо от воспаления кишечника, добавление SB в дозе 300 мг / кг значительно снижало уровни D (-) - лактата ( P <0,05), интерлейкина-6 и интерлейкина-1β ( P <0,05), но увеличивало уровень интерлейкина-10 ( P <0,05). Обработка SB не повлияла на альфа-разнообразие кишечной микробиоты во время прогрессирования кишечного воспаления, но изменила их состав, а структура микробного сообщества обработанных бройлеров была аналогична таковой у контрольных бройлеров.Взятые вместе, наши результаты показывают важность SB в улучшении развития кишечника, вызывая противовоспалительный эффект во время прогрессирования кишечного воспаления и модулируя микробное сообщество у бройлеров. Бутират натрия, кажется, оптимизирован для противовоспалительного действия в более высоких дозах (300 мг / кг SB).
Ключевые слова
бройлер
бутират натрия
воспаление кишечника
состав микробиоты
Рекомендуемые статьи Цитирующие статьи (0)
Crown copyright © 2019 Опубликовано Elsevier Inc.
Рекомендуемые статьи
Ссылки на статьи
Значение бутирата и его производных для здоровья кишечника и животноводства
Реферат
Бутират образуется в результате микробной ферментации в толстом кишечнике человека и животных. Он служит не только основным питательным веществом, которое обеспечивает энергией колоноциты, но и клеточным медиатором, регулирующим множество функций клеток кишечника и не только, включая экспрессию генов, дифференцировку клеток, развитие тканей кишечника, иммунную модуляцию, снижение окислительного стресса и контроль диареи.Хотя в медицине существует большое количество исследований с использованием бутирата для лечения кишечных заболеваний, важность бутирата в поддержании здоровья кишечника также привлекла значительное внимание исследователей к его применению в животноводстве, особенно в качестве альтернативы антибиотикам в корме. Из-за трудностей использования бутирата на практике (т. Е. Неприятного запаха и абсорбции в верхних отделах кишечника) были разработаны и исследованы различные формы бутирата, такие как бутират натрия и глицериды бутирата, их влияние на здоровье кишечника и показатели роста в разных странах. разные виды.Бутират и его производные обычно демонстрируют положительное влияние на животноводство, включая улучшение развития кишечника, контроль кишечных патогенов, уменьшение воспаления, улучшение показателей роста (включая состав туши) и модуляцию микробиоты кишечника. Эти преимущества более очевидны у молодых животных, и сообщалось о вариациях в результатах. В данной статье критически рассмотрены недавние результаты исследований бутирата и его производных на животных в отношении их эффектов и механизмов, лежащих в основе, и обсуждено значение этих результатов для улучшения здоровья кишечника и продуктивности животных.Кроме того, были процитированы важные результаты медицинских исследований на людях, имеющие отношение к животноводству.
Ключевые слова
Бутират
Бутирины
Альтернативы антибиотикам
Здоровье кишечника
Питание
Животноводство
Рекомендуемые статьи Цитирующие статьи (0)
Просмотр аннотации© 2017 Crown copyright. Китайская ассоциация зоотехники и ветеринарной медицины. Производство и хостинг Elsevier B.V. от имени KeAi Communications Co., Ltd.
Рекомендуемые статьи
Цитирующие статьи
Изменения в составе микробиоты лабораторных мышей влияют на инфицирование Citrobacter rodentium через производство различных короткоцепочечных жирных кислот
Abstract
Состав кишечной микробиоты влияет на исход кишечных инфекций у человека и мышей. Однако роль конкретных членов и их метаболитов, влияющих на тяжесть заболевания, в значительной степени неизвестна.Используя изогенные линии мышей, несущие различные сообщества микробиоты, мы наблюдали очень вариабельную кинетику заболевания при колонизации кишечной Citrobacter rodentium после заражения. Перенос сообществ от восприимчивых и устойчивых мышей к свободным от микробов подтвердил, что различная восприимчивость определяется составом микробиоты. Наиболее сильные различия в колонизации наблюдались в слепой кишке, и их можно было поддерживать in vitro путем совместного культивирования бактерий слепой кишки с C . Родентиум . Совместное проживание животных, а также перенос культивируемых бактерий от устойчивых к восприимчивым мышам привели к различным результатам у мышей-реципиентов. Анализ микробиома показал, что более высокая численность бактерий, продуцирующих бутират, связана с устойчивым фенотипом. Количественная оценка уровней короткоцепочечных жирных кислот (SCFA) до и после заражения выявила повышенные концентрации ацетата, бутирата и пропионата у мышей с отсроченной колонизацией. Добавление бутирата в физиологических концентрациях, но не ацетата и / или пропионата, сильно замедляет рост C . родентиум in vitro . In vivo добавление бутирата чувствительным, обработанным антибиотиками и стерильным мышам привело к тому же уровню защиты, особенно только тогда, когда концентрация бутирата слепой кишки достигла концентрации выше 50 нмоль / мг, что указывает на критический порог защиты. В последние годы первичные и вторичные бактериальные метаболиты, полученные из комменсала, стали мощными модуляторами восприимчивости хозяев к инфекции. Наши результаты свидетельствуют о том, что вариации в продукции SCFA у мышей, получавших пищу на основе богатой клетчаткой корма, модулируют восприимчивость к колонизации Enterobacteriaceae не только в экосистемах, нарушенных антибиотиками, но даже в ненарушенных микробных сообществах.Эти результаты подчеркивают необходимость нормализации микробиоты в линиях лабораторных мышей для экспериментов по заражению модельным патогеном C . rodentium независимо от диеты и использования антибиотиков.
Информация об авторе
Различный состав микробиоты кишечника у каждого человека приводит к различной метаболической активности и продуктивности этих сообществ, что влияет на хозяина, включая устойчивость к кишечным патогенам. В настоящее время отсутствие воспроизводимости биомедицинских исследований часто приписывают микробиоте, но мало что известно о том, какие конкретные члены и метаболиты влияют на тяжесть заболевания.Здесь мы используем генетически идентичные линии мышей с вариабельным составом микробиоты на стандартизированной диете и наблюдали сильно вариабельную колонизацию кишечным патогеном Citrobacter rodentium без вмешательства антибиотиков. Мы обнаружили такие же различия у ранее свободных от микробов животных, несущих микробиоту соответствующих доноров, а также у in vitro путем совместного культивирования слепых кишок бактерий устойчивых и восприимчивых животных с C . rodentium показывает, что фенотип полностью зависит от различий в микробиоте.Мы проанализировали состав микробиома и обнаружили большее количество бактерий, продуцирующих бутират, а также повышенные уровни бутирата у устойчивых мышей. Добавляя бутират к чувствительным и стерильным животным, мы могли бы значительно снизить уровни колонизации, подчеркнув, что производные комменсала первичные и вторичные бактериальные метаболиты сильно различаются у лабораторных животных от разных поставщиков и являются мощными модуляторами восприимчивости хозяев к инфекции С . Родентиум .
Образец цитирования: Osbelt L, Thiemann S, Smit N, Lesker TR, Schröter M, Gálvez EJC, et al. (2020) Изменения в составе микробиоты лабораторных мышей влияют на инфекцию Citrobacter rodentium через производство вариабельных короткоцепочечных жирных кислот. PLoS Pathog 16 (3): e1008448. https://doi.org/10.1371/journal.ppat.1008448
Редактор: Андреас Баумлер, Медицинский факультет Калифорнийского университета в Дэвисе, США
Поступила: 6 октября 2019 г .; Принята к печати: 1 марта 2020 г .; Опубликовано: 24 марта 2020 г.
Авторские права: © 2020 Osbelt et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные о секвенировании гена 16S рРНК были депонированы в NCBI (база данных биопроекта) под номером доступа: PRJNA572605.
Финансирование: LO было профинансировано за счет стипендии Europäischen Strukturfonds Sachsen Anhalt (ESF) и международной аспирантуры ABINEP (номер проекта 44 100 32 030 ZS / 2016/08/80645).Исследование частично финансируется Центром исследования инфекций им. Гельмгольца. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Кишечная микробиота, сложные и плотные микробные сообщества, обитающие в кишечном тракте, имеют большое влияние на иммунную систему хозяина и решающие функции во время инфекций.Важная роль микробиоты заключается в предотвращении колонизации патогенов и проникновения в организм хозяина посредством прямых и непрямых взаимодействий микробиота-патоген, что в совокупности называется устойчивостью к колонизации [1]. Эти взаимодействия включают конкуренцию за основные питательные вещества и экологические ниши или производство токсичных и ингибирующих соединений, но также и иммуно-опосредованные механизмы, такие как правильная индукция иммунных клеток или усиление антибактериальных путей [2]. Нарушение гомеостатической микробиоты, вызванное факторами окружающей среды, такими как лечение антибиотиками или изменения в диете, может изменить исходный состав и количество продуцируемых метаболитов, включая короткоцепочечные жирные кислоты (SCFA), тем самым изменяя восприимчивость к кишечным патогенам [3–6].Кроме того, индивидуальные различия в составе микробиоты были связаны с восприимчивостью к кишечным инфекциям [7–9].
Энтерогеморрагический Escherichia coli (EHEC), энтеропатогенный E . coli (EPEC) и Citrobacter rodentium являются членами семейства грамотрицательных Enterobacteriaceae и принадлежат к семейству прикрепляющих и удаляющих (A / E) бактерий, образующих поражения. Важно отметить, что EHEC и EPEC могут вызвать серьезное воспаление кишечника и диарею.Кроме того, штаммы EHEC, экспрессирующие высокоактивный токсин шига (Stx), вызывают нефротоксичность, приводя к тяжелым случаям смерти инфицированных людей [10]. Поскольку человеческие EHEC и EPEC вызывают лишь умеренную патогенность у взрослых мышей, леченных антибиотиками, C . rodentium часто используется для имитации этих инфекций у мышей [10–12]. Несколько исследований показали, что изменения в составе и функции микробиоты мышей влияют на колонизацию кишечника C . Родентиум . Например, было показано, что лечение некоторыми антибиотиками, такими как метронидазол, увеличивает чувствительность за счет уничтожения определенных микробов, тогда как другие антибиотики, такие как стрептомицин, не влияют на тяжесть инфекции, что указывает на то, что конкретные, но еще неизвестные бактерии придают устойчивость к C . родентиум [13]. Кроме того, перенос фекальной микробиоты от устойчивых мышей к восприимчивым может задержать колонизацию и снизить смертность восприимчивых мышей, что указывает на важность микробиоты для защиты от C . родентиум [14]. После фекальной трансплантации были измерены повышенные уровни интерлейкина (IL) -22 в сочетании с усиленными антимикробными пептидами, регенерирующими островковые 3 (Reg3) γ и Reg3β, что показало, что еще неизвестные бактерии способны стимулировать резистентность через непрямые, иммуно-опосредованные пути [14] . Кроме того, колонизация одним видом бактерий, то есть сегментированными нитчатыми бактериями (SFB), снижает C . rodentium колонизация эпителия, но не просвета за счет повышенной экспрессии генов, связанных с воспалением и антимикробной защитой [15].Более того, считалось, что более высокие соотношения видов Clostridia влияют на эпителиальный барьер, особенно на секрецию слизи, следовательно, косвенно влияя на колонизацию просвета C . родентиум [16]. Внутри просвета расширение комменсала E . coli ингибирует C . rodentium колонизация за счет конкуренции за моносахариды в качестве питательного вещества [17].
Генетически идентичные линии мышей с различным составом микробиоты использовались в многочисленных исследованиях для выявления новых механизмов, как состав микробиоты модулирует несколько параметров болезни e.грамм. Колит, вызванный DSS [18], Salmonella, Typhimurium [19–20], малярия [21] и инсульт [22]. Следовательно, мы утверждали, что эти типы линий мышей могут позволить расширить знания о том, какие конкретные виды и патоген-комменсальные взаимодействия вносят вклад в защиту от C . Родентиум .
В настоящем исследовании мы демонстрируем, что изогенные линии мышей C57BL / 6N из разных селекционных учреждений имеют разные профили микробиоты и значительно различаются по своей чувствительности к C . rodentium инфекция. Мы демонстрируем, что кинетика колонизации зависит от состава микробиоты и может идентифицировать, что устойчивые мыши имеют более высокое соотношение и разнообразие бактерий в пределах филума Firmicutes, что приводит к повышенным уровням короткоцепочечных жирных кислот, особенно бутирата, напрямую ингибирующего рост C. . Родентиум . Поразительно, но при физиологических концентрациях бутират оказался наиболее эффективным SCFA в ограничении роста C . rodentium и был даже более эффективным в сочетании с ацетатом или пропионатом для отмены C . rodentium полностью выросли in vitro . Добавление бутирата в питьевую воду привело к значительно более низкой колонизации восприимчивых и свободных от микробов мышей in vivo , указывая на то, что более высокая доля продуцентов бутирата и SCFA играет ключевую роль в защите от C . rodentium инфекция. Таким образом, естественные вариации микробиоты мышей, ранее не получавших антибиотики, определяют количество SCFAs, присутствующих в просвете, и могут служить маркером вида для прогнозирования предрасположенности человека к колонизации с помощью Enterobacteriaceae .
Результаты
Изогенные линии мышей характеризуются различным составом микробиоты и различной кинетикой заболевания после заражения
Citrobacter rodentiumДля количественной оценки влияния изменений в составе микробиоты лабораторных мышей на восприимчивость к C . rodentium , независимо от диеты и предшествующего воздействия антибиотиков, использовали изогенные линии мышей. Эти линии мышей находились на родственном генетическом фоне (C57Bl6 / N, подлинии Crl, Tac, Hsd и RJ) и содержались в одном помещении для животных в гигиенических условиях, свободных от конкретных патогенов, и их кормили одной и той же диетой, чтобы уменьшить влияние экспериментальных экспериментов. переменные, кроме состава микробиоты.Характеристика состава микробиоты с использованием секвенирования гена 16S рРНК выявила в соответствии с предыдущими исследованиями существенные различия в микробном составе с точки зрения видовой изменчивости, видового богатства и сложности каждой из семи протестированных линий мышей (SPF-1 — SPF-7) (рис. 1A). и S1 рис.).
Рис. 1. Изогенные линии мышей характеризуются различным составом микробиоты и различной кинетикой заболевания после заражения Citrobacter rodentium .
(A) Состав фекальной бактериальной микробиоты различных линий мышей, свободных от специфических патогенов (SPF), включая SPF-1 / SPF-S (n = 17), SPF-2 / SPF-R (n = 18), SPF-3 ( n = 7), SPF-4 (n = 9), SPF-5 (n = 15), SPF-6 (n = 4) и SPF-7 (n = 12) оценивались с использованием секвенирования гена 16S рРНК.β-разнообразие анализировали с использованием матрицы различий Брея-Кертиса и неметрического многомерного шкалирования (NMDS). (B) Мышей с различными настройками микробиоты перорально инфицировали 10 8 КОЕ C . Родентиум . (C) КОЕ C . rodentium определяли в кале каждой линии мышей на 1, 3, 5, 9 и 14 день после инфицирования (p.i.). (D) Колонизация фекалиями каждой отдельной мыши указывается через 1, 3 и 14 дней p.i. Пунктирная линия указывает предел обнаружения.Результаты представляют собой один репрезентативный эксперимент с n = 4-17 мышей / группой в виде среднего значения ± SEM. Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса с множественными сравнениями (односторонний дисперсионный анализ). * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001. (E) Беспроблемных мышей C57BL6 / N (GF) содержали вместе с мышами SPF-S и SPF-R в течение 4 недель, а затем инфицировали мышами C . Родентиум . (F) Фекальная микробиота была проанализирована с использованием секвенирования гена 16S рРНК до и после окончания совместного проживания.β-разнообразие анализировали с использованием графика анализа главных координат (PCoA). (G) С . rodentium КОЕ в кале отдельных мышей каждой линии мышей отображаются в день 1 и 3 p.i. Пунктирными линиями обозначен предел обнаружения. Результаты представляют собой один из трех репрезентативных экспериментов с n = 5–9 мышами в группе в виде среднего значения ± SEM. Значения P представляют собой сравнение U-критерия Манна-Уитни между группами exGF (SPF-S) и exGF (SPF-R), а также SPF-S и SPF-R.* p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001.
https://doi.org/10.1371/journal.ppat.1008448.g001
Затем мышей SPF-1 –SPF-7, соответствующих возрасту и полу, инфицировали 10 8 КОЕ C . rodentium [23] через желудочный зонд (рис. 1B). Кинетика C . Было отмечено, что колонизация rodentium значительно различается между разными линиями мышей (рис. 1C и 1D). В первые дни после заражения (1-е и 3-е сутки после заражения (с.i.)), мыши SPF-1 показали самую высокую нагрузку патогенами в стуле, тогда как мыши SPF-2, SPF-3 и SPF-7 имели самую низкую колонизацию. (Рис. 1C и 1D). Следует отметить, что мыши SPF-2 и SPF-3 имели большое сходство в отношении состава микробиоты, что отражалось в сходной кинетике заболевания (Рис. 1C и 1D, S1A – S1D Рис.). Незначительная потеря веса тела наблюдалась у всех животных (<5% потери веса) без существенных различий в потере веса между линиями мышей (S1E фиг.).
Поскольку мыши SPF-1 (SPF-S) и SPF-2 (SPF-R) показали наибольшую разницу в кинетике заболевания, мы решили дополнительно сосредоточить внимание на этих двух линиях мышей.Чтобы исключить, что различия в генотипе между подлиниями C57BL6 / N ответственны за наблюдаемый фенотип, мышей SPF-S (восприимчивые) и SPF-R (устойчивые) были отдельно размещены вместе с мышами C57BL6 / NTac без микробов (GF) для за четыре недели до того, как все животные были инфицированы 10 8 КОЕ C . rodentium через желудочный зонд (рис. 1E). Поразительно, что мыши exGF показывают такое же различие в C . rodentium колонизация в качестве соответствующих мышей-доноров SPF-S или SPF-R (фиг. 1G).Анализ состава микробиоты после совместного проживания с помощью секвенирования гена 16S рРНК продемонстрировал, что мыши exGF-реципиенты обладают очень похожим составом микробиоты в фекалиях, как соответствующие мыши-доноры (SPF-S, SPF-R) (рис. 1F). Результаты убедительно подтверждают вывод о том, что наблюдаемый фенотип зависит от изменений в составе микробиоты.
Вариации в составе микробиоты коррелируют со летальным исходом от инфекций, вызванных токсином шига, экспрессирующим
C . родентиум штаммовТоксин шига (Stx) является фактором вирулентности EHEC, что способствует его сильной патогенности.Рекомбинантная экспрессия токсина шига в C . Было продемонстрировано, что rodentium вызывает летальную инфекцию, сопровождающуюся воспалением кишечника и повреждением почек [12]. Проверить, зависят ли от микробиоты различия в C . Колонизация rodentium также повлияет на инфекцию более патогенным C . Штамм rodentium , мышей SPF-S и SPF-R инфицировали Stx-продуцентом C . Был проанализирован штамм rodentium [12] и колонизация фекалий, а также потеря массы тела и выживаемость.Соответствует результатам с использованием менее патогенного C . rodentium , Stx-экспрессирующий C . Штамм rodentium также демонстрировал отсроченную колонизацию у мышей SPF-R в течение первых дней заражения (рис. 2А). Вероятно, прямое следствие более высокой колонизации, мыши SPF-S начали быстро терять вес уже после 3 дней заражения, тогда как мыши SPF-R начали терять вес только на 10 день после заражения (рис. 2B). Более того, мыши SPF-R демонстрировали более длительную выживаемость, поскольку мыши SPF-S имели среднюю выживаемость 7 дней, тогда как мыши SPF-R выживали дольше со средней выживаемостью 11.5 дней (рис. 2С). Эти результаты демонстрируют, что отсроченная колонизация мышей SPF-R приводит к снижению потери массы тела и увеличению выживаемости даже при заражении летальным C . Штамм rodentium .
Рис. 2. Вариации в составе микробиоты коррелируют с летальным исходом от инфекций, вызванных экспрессирующим токсин шига C . родентиум штаммов.
(A-C) мышей SPF-S и SPF-R были инфицированы перорально 10 8 КОЕ C . rodentium DBS 770 и фекальная колонизация, потеря массы тела и выживаемость. Пунктирными линиями обозначен предел обнаружения. Результаты представляют собой два независимых эксперимента с n = 4–5 мышей / группой в виде среднего значения ± SEM. Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001.
https://doi.org/10.1371/journal.ppat.1008448.g002
Отсроченная колонизация у мышей SPF-R видна во всех органах и тканях кишечника, но наиболее заметна в слепой кишке
Для дальнейшего изучения процесса заражения была расширена характеристика динамики заражения.Во-первых, жизнеспособные КОЕ в фекалиях определяли через шесть часов после заражения, чтобы количественно определить, схожее ли количество жизнеспособных C . rodentium проходят через желудочно-кишечный тракт обеих линий мышей (фиг. 3A). На данный момент никаких различий в C . rodentium КОЕ были обнаружены в стуле обеих линий мышей, что позволяет предположить, что C . rodentium не был немедленно убит во время раннего пассажа GI. Чтобы проверить, видны ли наблюдаемые различия в фекальной колонизации в органах кишечника, мы инфицировали обе линии мышей биолюминесцентным C . rodentium и визуализировали инфекцию с помощью системы визуализации in vivo (IVIS) (рис. 3B). Опять же, мыши SPF-S показали более высокую колонизацию в ранние моменты времени (дни с 1 по 5) инфекции, тогда как мыши SPF-R были более колонизированы в более поздние моменты времени (дни с 8 по 12) инфекции (рис. . Чтобы проверить, наблюдаются ли различия в просвете содержимого или в органах кишечника на ранней стадии инфицирования, мышей умерщвляли либо на 1 день, либо на 3 дня p.i .. Коррелируя с другими результатами, мыши SPF-S показали значительно более высокую нагрузку патогенов в кишечном содержимом слепой и толстой кишки, а также в ткани слепой кишки уже через один день и в просвете тонкой кишки и ткани после 3 дня (рис. 3C и 3D). Поскольку различия в колонизации мышей SPF-S и SPF-R возникают в просвете слепой кишки, мы затем оценили колонизацию in vitro , чтобы исключить влияние иммунных клеток, инфильтрирующих после инфекции. Для этого инкубировали 10 6 КОЕ C . rodentium в анаэробных и аэробных условиях в содержимом слепой кишки мышей SPF-S и SPF-R в течение 6 и 24 часов (рис. 3E). Поразительно, что содержание в слепой кишке мышей SPF-S позволило значительно увеличить нагрузку патогенов по сравнению с содержанием слепой кишки мышей SPF-R в обоих условиях только через 24, но не через шесть часов (рис. 3F). Это демонстрирует, что конкуренции с микробиотой или расширенного присутствия их продуктов в слепой кишке достаточно, чтобы подавить рост C . Родентиум .
Рис. 3. Отсроченная колонизация у мышей SPF-R видна во всех органах и тканях кишечника, но наиболее заметна в слепой кишке.
(A) Мышей SPF-S и SPF-R инфицировали перорально 10 8 КОЕ C . rodentium и колонизацию фекалий определяли через 6 часов после заражения (p.i.). (B) Мышей SPF-S и SPF-R инфицировали перорально 10 8 КОЕ C . rodentium , и инфекция была отображена in vivo с использованием системы визуализации IVIS.Среднее сияние (п / с / см 3 / ср) определялось на 1-й, 3-й, 5-й, 8-й, 11-й, 15-й и 21-й дни. (C-D) Мышей SPF-S и SPF-R инфицировали перорально 10 8 КОЕ C . rodentium и умерщвляют через 1 или 3 дня p.i. Определяли содержание КОЕ / г в органах и тканях. Пунктирными линиями обозначен предел обнаружения. Результаты представляют собой два независимых эксперимента с n = 5-7 мышей / группой в виде среднего значения ± SEM. Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса * p <0.05, ** p <0,01, *** p <0,001, **** p <0,0001. (E) Изолированное содержимое слепой кишки мышей SPF-S и SPF-R разводили 1: 1 в PBS, инокулировали 10 6 КОЕ C . rodentium и культивировали в аэробных и анаэробных условиях в течение 24 ч перед посевом на чашки с селективным агаром. (E-F) Восстановление C . rodentium в изолированном содержимом слепой кишки через 6 и 24 ч аэробного и анаэробного культивирования. Пунктирными линиями обозначен предел обнаружения.Результаты представляют собой один или два независимых эксперимента с n = 5-7 мышей в группе в виде среднего значения ± SEM. P Показанные значения представляют собой сравнение U-критерия Манна-Уитни между группами с ** p <0,01, *** p <0,001, **** p <0,0001.
https://doi.org/10.1371/journal.ppat.1008448.g003
Совместное размещение и перенос культивируемых бактерий от мышей, устойчивых к SPF-R, приводит к различным защитным результатам у мышей SPF-S
Чтобы определить, могут ли бактерии, связанные с восприимчивостью или устойчивостью, передаваться и изменять восприимчивость in vivo , мышей SPF-S (чувствительные) и SPF-R (устойчивые) либо помещали в совместное помещение в течение 3 недель для потенциального переноса всех бактерий, либо получали культивируемые фракции аэробных и анаэробных бактерий, выделенные из содержимого слепой кишки мышей SPF-R с помощью перорального желудочного зондирования (фиг. 4A и S2, фиг.).Впоследствии мышей инфицировали C . rodentium через 3 недели переноса микробиоты и умерщвление через 3 дня p.i. для определения КОЕ в органах и содержимом кишечника. Поразительно, но защитный фенотип не проявлял полной пенетрантности и во всех группах. Некоторые мыши-реципиенты SPF-S показали полностью защищенный фенотип, тогда как другие показали отсутствие или лишь незначительное снижение кишечных КОЕ (рис. 4B-4E). Следует отметить, что эксперименты с кохаузингом и переносом повторяли несколько раз (n = 3 с 4-6 мышами в группе) с аналогичными результатами.В каждом эксперименте некоторые мыши были полностью защищены, тогда как другие имели такие же КОЕ, что и необработанные мыши SPF-S (рис. 4D и 4E). Основываясь на этих наблюдениях, мы предположили, что бактерии-возбудители могут передаваться только некоторым мышам, что приводит к различному защитному эффекту.
Рис. 4. Совместное размещение и перенос культивируемых бактерий от устойчивых мышей SPF-R приводит к различным защитным результатам у мышей SPF-S.
(A) Группы чувствительных мышей SPF-S предварительно обрабатывали различными бактериями.Одна группа содержалась вместе с мышами SPF-R в течение 3 недель до заражения. Одна группа получала смесь всех культивируемых аэробных бактерий, выделенных из содержимого слепой кишки мышей SPF-R. Одна группа получала все культивируемые анаэробные бактерии, выделенные из содержимого слепой кишки мышей SPF-R. Последнюю группу не лечили. Все мыши были инфицированы 10 8 КОЕ C . rodentium через 3 недели и КОЕ / г фекалий, а также содержание органов и ткани оценивали через 1 и 3 день.я. (B-C) Объединенные КОЕ C . rodentium в содержимом слепой и толстой кишки на 3-й день p.i. отображаются. (D-E) КОЕ C . rodentium в содержимом слепой и толстой кишки на 3-й день p.i. отображаются для каждого эксперимента. Результаты представляют три независимых эксперимента с n = 4-6 мышей в группе как среднее значение с SEM. P Показанные значения представляют собой сравнение U-критерия Манна-Уитни между группами с * p <0,05, ** p <0,01, *** p <0,001, **** p <0.0001.
https://doi.org/10.1371/journal.ppat.1008448.g004
Устойчивость мышей SPF-R связана с более высоким разнообразием и численностью бактерий в типе Firmicutes
Чтобы идентифицировать бактерии, связанные с защитным фенотипом после переноса микробиоты, все животные-реципиенты были отнесены к классам «чувствительные» или «устойчивые» в соответствии с содержанием КОЕ / г слепой кишки через 3 дня p.i. в слепой кишке (рис. 5А). Все мыши ниже порогового значения 10 6 КОЕ / г содержания слепой кишки считались «устойчивыми», тогда как все животные выше порогового значения считались «восприимчивыми».Анализ бета-разнообразия мышей SPF-1, получавших анаэробные и аэробные бактерии от мышей SPF-R, выявил кластеризацию в соответствии с восприимчивостью (рис. 5B). Более того, анализ α-разнообразия показал значительно повышенное видовое богатство с точки зрения общего количества наблюдаемых видов и с точки зрения количества по отношению к равномерности у устойчивых мышей SPF-S (рис. 5C), что указывает на то, что больше бактерий было перенесено из микробиоты SPF-R. , которые содержат более сложную микробиоту, чем исходная микробиота SPF-S (рис. S1 и рис. S3A – S3C).Сравнение относительной численности на уровне рода выявило поразительные различия в зависимости от «восприимчивого» и «устойчивого» фенотипов в отношении численности и разнообразия бактерий внутри типа Firmicutes обеих групп (перенос анаэробных и аэробных бактерий) (рис. 5D и 5E). . Частой особенностью бактерий этого типа является их участие в образовании SCFAs, таких как ацетат, пропионат и, в частности, бутират. Мы предположили, что устойчивость может быть связана с более высоким соотношением бактерий, продуцирующих SCFA, в микробиоте мышей SPF-R.Чтобы подтвердить эту гипотезу, мы сравнили численность бактерий, участвующих в производстве бутирата [24]. В самом деле, мы обнаружили значительно повышенные уровни бактерий из родов Lachnospiraceae , Ruminiclostridium , Butyricicoccus , Intestinimonas , Lachnoclostridium , buria E c и 2 RoseGuria E coc и Fig. у мышей, содержащихся в одном помещении, или мышей SPF-S, получавших анаэробные или аэробные бактерии от мышей SPF-R, тогда как уровни Coprococcus были повышены только у мышей, получавших анаэробные культивированные бактерии (фиг. 5F).Присутствие отчетливых, предположительно спорообразующих анаэробов у защищенных мышей SPF-S, получавших аэробно культивируемые бактерии, предполагает, что были переданы жизнеспособные споры. Кроме того, у восприимчивых мышей сохранялась высокая численность Akkermansia (Phylum Verrucomicrobia) в их микробиоме (рис. 5D и 5E и фиг. S2E, S3G и S3H), но численность Akkermansia не коррелировала с изменением фенотипа у мышей SPF-S. от восприимчивого к резистентному (S3H фиг.). Поскольку перенос аэробных культивируемых бактерий также привел к снижению восприимчивости, мы предположили, что изменение доступности кислорода и более высокая численность и разнообразие таксонов с низкой численностью, таких как эндогенные Enterobacteriaceae и другие факультативные анаэробные бактерии, также могут повлиять на восприимчивость к заболеванию .Поэтому мы сначала косвенно оценили доступность кислорода в ткани кишечника, измерив экспрессию белка HIF1α, маркера гипоксии в тканях кишечника [25]. Вестерн-блоттинг показал, что HIF1α одинаково экспрессировался в обеих линиях мышей в ткани слепой кишки в стабильном состоянии и в течение 3 дней p.i. (S4A и S4B фиг.), Что позволяет предположить, что условия гипоксии и доступность кислорода в ткани кишечника были сопоставимы между обеими линиями мышей. В альтернативном подходе фекальный и слепой материал обеих линий мышей культивировали на чашках с агаром Mac-Conkey, поскольку эндогенные факультативные анаэробы в кишечнике часто находятся ниже предела обнаружения подходов, основанных на секвенировании (S4C – S4E, рис.).Действительно, мы могли бы извлечь значительно больше факультативных анаэробных бактерий из слепой кишки и фекалий мышей SPF-R (S4C, рис.). Следует отметить, что у мышей SPF-S не было идентифицировано энтеробактерий, в то время как несколько видов, включая Citrobacter amalonaticus , Escherichia coli и Klebsiella oxytoca , были выделены от мышей SPF-R (S4D и S4E Рис.). Тем не менее перенос этих бактерий мышам SPF-S не привел к значительному снижению C . rodentium КОЕ в слепой и толстой кишке 3 дня р.я. (S4G и S4H фиг.), Предполагая, что доступность кислорода вблизи слизистой оболочки и различное количество факультативных анаэробов не ответственны за различную восприимчивость мышей SPF-S и SPF-R соответственно.
Рис. 5. Устойчивость мышей SPF-S связана с более высоким разнообразием и численностью бактерий в типе Firmicutes.
(A) Отнесение мышей SPF-S, получавших культивированную фракцию анаэробно или аэробно культивированных бактерий от мышей SPF-R, к классу «устойчивый» и «восприимчивый» в соответствии с КОЕ слепой кишки C . rodentium через 3 дня p.i .. Порог 10 6 использовался для дискриминации обеих групп. (B) Фекальная микробиота устойчивых и восприимчивых мышей SPF-S из групп «анаэробно леченных» и «аэробно леченных» была проанализирована с использованием секвенирования гена 16S рРНК после совместного проживания с использованием графика анализа основных координат (PCoA) (C). определяется с использованием индекса Чао1 и Шеннона. Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона * p <0,05, ** p <0.01, *** p <0,001, **** p <0,0001. (D-E) Фекальную микробиоту устойчивых и восприимчивых мышей SPF-S, «обработанных анаэробно» и «обработанных аэробно», анализировали с использованием секвенирования гена 16S рРНК. Показаны относительные количества родов бактерий, сгруппированные по их типам. Столбцы представляют собой среднее значение для всех мышей в группе. Показаны репрезентативные данные, полученные из трех независимых экспериментов. (F-G) Относительная численность значительно различных продуцентов SCFA у обработанных мышей SPF-S родов Butyricicoccus , Coprococccus , Intestinimonas , Lachnoclostridium , Lachnospiraceae Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона * p <0,05, ** p <0,01, *** p <0,001.
https://doi.org/10.1371/journal.ppat.1008448.g005
Метаболомный профиль резистентного SPF-R характеризуется повышенными уровнями SCFA, которые сильно препятствуют росту
C . rodentium in vitro при pH 6,0Основываясь на микробных сигнатурах устойчивых мышей, связывающих бактерии, продуцирующие SCFA, с устойчивым фенотипом, мы затем проанализировали профили метаболомов в обеих линиях мышей, в частности, уровни SCFA.Чтобы охарактеризовать различия в метаболоме слепой кишки у мышей SPF-S и SPF-R в устойчивом состоянии и после инфицирования, мы выполнили целевую (для SCFA) и нецелевую метаболомику (фиг. 6A и S5, фиг.). Поразительно, что мыши SPF-R показали значительно повышенные уровни бутирата в слепой кишке со средней концентрацией 80 нмоль / мг содержимого слепой кишки в отличие от уровней около 20 нмоль / мг содержимого слепой кишки у мышей SPF-S в стабильном состоянии и после инфицирования. Кроме того, содержание ацетата было повышено у мышей SPF-R в оба момента времени, но разница в кратность была меньше, чем для бутирата.Уровни пропионата также были немного увеличены у устойчивых мышей SPF-R до и после заражения (фиг. 6A). Используя нецелевую метаболомику, 70 из 247 соединений могут быть успешно идентифицированы. Неконтролируемый кластерный анализ выявил сильное разделение обеих линий мышей на основе профилей кишечного метаболома. Уровни 26 метаболитов уже значительно различались в устойчивом состоянии до инфекции (S5A и S5C фиг.). Из них 20 уровней метаболитов были значительно повышены у мышей SPF-1 по сравнению с мышами SPF-2, включая различные промежуточные продукты цикла лимонной кислоты или продукты ферментации, такие как сукцинат, фумарат и малат, промежуточные продукты метаболизма цикла мочевины и полиаминов, такие как мочевина, путресцин и орнитин, а также аминоспирт, этаноламин и флавон-апигенин (S5A и S5C, фиг.).Напротив, только шесть метаболитов, в основном аминокислот, были повышены у устойчивых мышей к SPF-R. Несколько метаболитов, обогащенных у чувствительных мышей SPF-S (т.е. сукцинат, фумарат и малат), были достаточными для обеспечения in vitro роста C . rodentium в качестве единственного источника углерода в минимальной среде, предполагая, что они могут поддерживать C . rodentium рост рано in vivo . Следует отметить, что через один день после заражения мы наблюдали лишь незначительные изменения в уровнях метаболитов микробиома в обеих линиях мышей, что указывает на то, что ранний момент инфицирования не изменил существенно метаболический ландшафт в обеих линиях мышей по сравнению с условиями устойчивого состояния (S5B и S5D Рисунок).
Рис. 6. Метаболом резистентного SPF-R характеризуется повышенными уровнями SCFA, которые сильно препятствуют росту C . rodentium in vitro при pH 6,0.
(A) Уровни бутирата, ацетата и пропионата в Cecal SCFA для мышей SPF-S и SPF-R в стабильном состоянии и на 3-й день p.i. отображаются в нмоль / мг содержимого слепой кишки. Показаны объединенные результаты двух независимых экспериментов в виде среднего значения ± стандартная ошибка среднего. P Указанные значения представляют сравнение U-критерия Манна-Уитни между группами с * p <0.05, **** p <0,0001. (В) С . Рост rodentium отображается как оптическая плотность (OD) с течением времени при pH 6,0 (слева) или pH (7,0) в среде BHI, дополненной различными концентрациями ацетата, бутирата или пропионата или без добавления каких-либо SCFA. (C-D) Рост Citrobacter отображается как оптическая плотность (OD) с течением времени при pH 6,0 в среде BHI, дополненной различными смесями ацетата, бутирата и пропионата или без добавления каких-либо SCFA. (C-D) Одна точка данных представляет собой среднее значение трех повторов.Отображаются значения трех независимых экспериментов. Значения P представляют собой однофакторный дисперсионный анализ между группами с ** p <0,01, *** p <0,001, **** p <0,0001.
https://doi.org/10.1371/journal.ppat.1008448.g006
На основании сильно измененных концентраций SCFA и их предыдущей связи с ингибированием роста Enterobacteriaceae , таких как Salmonella Typhimurium [5], E . coli и К . pneumoniae [26], мы протестировали ингибирующие свойства различных SCFAs против C . родентиум in vitro . Для этого мы добавили различные концентрации бутирата и ацетата в диапазоне от 10 мМ до 100 мМ и пропионата в диапазоне от 1 до 8 мМ в среду BHI. Значения pH были нормализованы до слабокислого pH 6,0 и нейтрального pH 7,0. Концентрации SCFA и pH приблизительно представляют биологические условия, измеренные в линиях мышей в установившемся состоянии in vivo (фиг. 6A и S2F фиг.).Измерение внешнего диаметра C . rodentium со временем мы заметили значительное ухудшение роста при более высоких концентрациях бутирата при значении pH 6,0, тогда как ацетат и пропионат только частично снижали рост C . rodentium при pH 6,0 при высоких физиологических концентрациях. Никакого значительного эффекта для любого SCFA не было видно при нейтральном pH в соответствии с результатами для других Enterobacteriaceae [26] (рис. 6B). Эти результаты показали, что более высокие концентрации SCFA, особенно бутирата, наблюдаемые у мышей SPF-R, способны подавлять рост C . родентиум in vitro . Поскольку SCFA присутствуют в виде смеси в условиях in vivo , мы протестировали различные концентрации и комбинации SCFA, а также приблизительно соответствующие смеси всех трех SCFA, обнаруженных у мышей SPF-S и SPF-R, против C . родентиум in vitro . Во-первых, мы определили, что бутират является основным фактором, ответственным за ингибирование C . rodentium рост при введении в концентрациях выше 50 мМ (рис. 6C).Более того, бутират был даже более эффективным при введении с 4 мМ пропионата или ацетата в концентрациях (30 мМ и выше), тогда как только ацетата и пропионата было недостаточно для подавления роста C . rodentium полностью даже при наивысшей протестированной концентрации (рис. 6В и рис. S6). Наконец, все три SCFA, протестированные вместе, смесь SCFA мышей, родственная SPF-R, привела к почти полному аннулированию C . rodentium , тогда как смесь SCFA, родственная SPF-1, оказала лишь незначительное влияние на рост (рис. 6D).
Добавки SCFA мышей SPF-S достаточно для снижения
C . rodentium рост in vitro , а также in vivoЗатем мы хотели проверить, будет ли увеличение концентрации SCFA в содержимом слепой кишки SPF-S, аналогичное уровням, обнаруженным в содержимом слепой кишки SPF-R, достаточным для достижения защищенного фенотипа in vitro, и in vivo. . Сначала в изолированное содержимое слепой кишки мышей SPF-S добавляли 80 мМ бутирата и доводили pH до 6.0 и инокулировали 10 6 КОЕ C . rodentium и инкубировали в течение 24 ч при 37 ° C. Для сравнения, в содержание необработанных SPF-1 и SPF-R слепой кишки было добавлено одинаковое количество бактерий. Восстановление жизнеспособного C . rodentium колоний через 24 часа показали, что добавление бутирата к содержимому слепой кишки было достаточным для достижения ингибирующего эффекта, сравнимого с эффектом, наблюдаемым для содержимого слепой кишки SPF-R, что указывает на то, что общее количество бутирата столь же эффективно, как и присутствие специфического бактерии для защиты (рис. 7A и 7B).Затем, чтобы проверить эти результаты in vivo , мы добавили к чувствительным мышам SPF-S смесь SCFA, состоящую из 150 мМ бутирата, 150 мМ ацетата и 30 мМ пропионата в питьевой воде (рис. 7C). Мыши получали SCFA за один день до заражения до 3 дней p.i. Сравнение CFU в слепой кишке выявило значительно сниженные CFU у мышей SPF-S с добавлением SCFA по сравнению с необработанными мышами SPF-S (фиг. 7D). Тем не менее, в отличие от мышей SPF-R, средние КОЕ все еще были значительно повышены.Это совпало только с частичным восстановлением защитной концентрации SCFA в слепой кишке после перорального введения SCFA мышей SPF-S, что указывает на то, что достаточно высокие концентрации SCFA должны быть достигнуты in vivo для защиты (рис. 7E). Примечательно, что только 5 из 19 животных достигли порога 50 нмоль / мг бутирата, который требовался для отмены C . rodentium рост in vitro . Эти пять отвечающих животных достигли полностью защищенного фенотипа, аналогичного мышам SPF-R (фиг. 7G).Чтобы исключить тот факт, что эти 5 животных имели другой состав микробиоты по сравнению с другими протестированными животными, мы оценили состав микробиома перед добавлением SCFA и в конце эксперимента через 3 дня p.i. (S7 Рис). Ответившие животные не показали выраженных различий в микробиоте до начала добавления SCFA с точки зрения видового состава (S7A и S7C, фиг.) Или видового богатства и однородности (S7B, фиг.). Через 3 дня p.i. аналогичные составы микробиома наблюдались во всех трех группах мышей SPF-S, за исключением численности Enterobacteriaceae (S7G фиг.).Животные-респонденты показывают значительно меньше C . rodentium по сравнению с неотвечающими животными и контрольными животными (S7H фиг.). Данные микробиома подтверждают гипотезу о том, что вариации концентраций бутирата приводят к изменениям C . rodentium , а не изменчивость в составе микробиоты чувствительной SPF-флоры. Кроме того, добавление SCFA было достаточным для снижения значения pH до уровня, аналогичного тому, который обнаруживается у устойчивых мышей к SPF-R (рис. 7F и 7I).Чтобы оценить эффекты бутирата, в частности, в отсутствие настоящих бактерий во флоре SPF-S, мы выполнили добавку in vivo бутирата у стерильных и леченных антибиотиками мышей SPF-S (рис. 7J и 7L). В обоих случаях мыши получали бутират за день до заражения до 3 дней p.i. В обоих экспериментах КОЕ в слепой кишке были частично снижены у животных, получавших SCFA (фиг. 7K и 7M). Соответствующие значения SCFA в слепой кишке были значительно повышены в обеих схемах, но в целом были низкими по сравнению с наивными условиями SPF-S (S7D и S7F, рис.).Значение pH слепой кишки было сопоставимым у необработанных и обработанных животных, но имело тенденцию к снижению у мышей, которым вводили SCFA (S7E и S7G, фиг.). Эти эксперименты подтверждают ключевую роль бутирата в снижении КОЕ C . rodentium в условиях in vitro, и in vivo, , в отсутствие других резидентных микробов.
Рис. 7. Добавление чувствительных к SPF-S мышей короткоцепочечных жирных кислот приводит к снижению C . родентиум нагрузка in vitro и in vivo .
(A-B) Восстановление Citrobacter после 24-часовой анаэробной инкубации в содержимом слепой кишки мышей SPF-S, мышей SPF-S с добавлением 80 мМ бутирата, 50 мМ ацетата и 4 мМ пропионата и мышей SPF-R. Показанные значения P представляют собой сравнение U-критерия Манна-Уитни между группами с ** p <0,01. Пунктирная линия указывает входной уровень C . Мышам rodentium (C-D) SPF-S добавляли 150 мМ бутирата, 150 мМ ацетата и 30 мМ пропионата в питьевой воде за один день до заражения и до трех дней после заражения.Необработанных SPF-S и SPF-R, а также мышей SPF-S с добавлением SCFA инфицировали перорально 10 8 КОЕ C . rodentium и умерщвляли через три дня после заражения для оценки колонизации. (Г) С . rodentium КОЕ в просвете слепой кишки отдельных мышей каждой группы отображаются через 3 дня p.i. Пунктирная линия представляет пороговый уровень для устойчивых животных. (E) Уровень бутирата слепой кишки в каждой группе отображается через 3 дня p.i .. Пунктирная линия представляет пороговый уровень для устойчивых животных.(F) Уровень бутирата слепой кишки в каждой группе отображается после дня 3 p.i. (G-I) КОЕ слепой кишки, уровень бутирата слепой кишки, а также значения pH слепой кишки отображаются для всех групп. Животные, получавшие SCFA, группируются на основе уровня КОЕ для C . rodentium в слепой кишке через 3 дня p.i .. Результаты представляют три объединенных эксперимента с n = 4-7 мышей / группой в виде среднего значения ± SEM. P Показанные значения представляют сравнение U-критерия Манна-Уитни между группами с ** p <0,01, *** p <0.001, **** p <0,0001. (J) Мышам SPF-S, обработанным антибиотиками, добавляли 150 мМ бутирата в питьевой воде за один день до заражения и до трех дней после заражения. (K) КОЕ в слепой кишке отображаются после 3-го дня p.i. (L) Беспроблемным мышам C57BL6 / N добавляли 150 мМ бутирата в питьевой воде за один день до заражения и до трех дней после заражения. (M) КОЕ в слепой кишке отображаются через 3 дня p.i. Результаты представляют собой два объединенных эксперимента с n = 5–9 мышами / группой в виде среднего значения ± SEM. P Указанные значения представляют собой сравнение U-критерия Манна-Уитни между группами с ** p <0.01, *** p <0,001, **** p <0,0001.
https://doi.org/10.1371/journal.ppat.1008448.g007
В совокупности эти результаты подтверждают, что более высокая численность и разнообразие SCFA-продуцирующих бактерий в слепой кишке мышей SPF-R приводят к повышенным уровням бутирата и снижению Значение pH в просвете слепой кишки, благодаря чему эффективно снижается рост C . rodentium на ранней стадии заражения.
Обсуждение
Широко признано, что микробиота кишечника оказывает огромное влияние на индивидуальную восприимчивость к вторгающимся патогенам и тяжесть воспаления кишечника через прямые и иммуноопосредованные механизмы [1].В частности, снижение устойчивости к колонизации против некоторых Enterobacteriaceae , таких как Salmonella [5], E . coli или K . pneumoniae [26] после лечения антибиотиками было связано с уменьшением количества бактерий, продуцирующих SCFA. В настоящем исследовании мы фокусируемся на влиянии естественных вариаций в составе микробиоты лабораторных мышей и влиянии конкретных членов микробиоты у мышей C . rodentium инфекция без применения антибиотиков. Модель C . Модели rodentium интенсивно использовались для моделирования человеческих инфекций, вызванных EHEC и EPEC, а также для анализа прямых и иммуноопосредованных механизмов влияния микробиоты на восприимчивость и тяжесть. Например, было показано, что лечение антибиотиками делает мышей более восприимчивыми к C . rodentium инфекций [13]. Кроме того, наличие или отсутствие бактерий на общем уровне, например, повышение уровня Bacteriodetes выше уровня Firmicutes [14] или присутствие одного вида бактерий, таких как сегментированные нитчатые бактерии (SFB) [15] или более высокое соотношение Clostridia [16] ] были связаны с повышенной устойчивостью к C . rodentium через иммуноопосредованные механизмы. Напротив, полное отсутствие микробов приводит к повышенной восприимчивости и устойчивости C . rodentium у стерильных мышей [17]. Также прямые механизмы комменсальных бактерий, такие как распространение комменсалов E . coli способны ингибировать C . rodentium колонизация за счет конкуренции за моносахариды в качестве источника питательных веществ [17]. Продолжая наблюдение, что мыши из разных питомников демонстрируют разную восприимчивость в моделях родственных желудочно-кишечных заболеваний, таких как Salmonella Typhimurium [19,20] или колит, индуцированный DSS] 18] из-за присутствия или отсутствия определенных членов микробиоты, мы решили охарактеризовать влияние состава микробиоты на период C . rodentium инфекция, так как знания о конкретных видах и взаимодействиях патоген-комменсал, которые способствуют защите от колонизации C . rodentium остается неуловимым.
Действительно, разительные различия относительно состава микробиоты и колонизации C . rodentium можно было наблюдать в генетически сходных подлиниях C57BL6 / N уже через 1 день после рождения. Чтобы исключить какое-либо влияние генетических различий или спонтанных мутаций, о которых сообщалось в подлиниях C57BL / 6N [27,28], мы перенесли одну восприимчивую (SPF- S) и резистентная (SPF-R) микробиота к генетически идентичным мышам-реципиентам без микробов.Состав фекальной микробиоты, а также прогрессирование заболевания были очень похожи между мышами, ранее лишенными микробов, и их соответствующими партнерами по совместному проживанию, что также подтверждает, что фенотип полностью зависит от микробиоты.
Начиная с C . rodentium является специфическим для мышей патогеном, который используется для имитации инфекций человека с EHEC и EPEC, нам было интересно узнать, приведет ли задержка колонизации к увеличению продолжительности жизни с использованием более патогенного C .Штамм rodentium . Поэтому мы использовали штамм, способный экспрессировать Stx [12], который отвечает за повреждение кишечника и опасные для жизни системные заболевания, такие как почечная недостаточность при инфекциях EHEC [29]. Опять же, мыши SPF-S были менее колонизированы через один и три дня после заражения и в соответствии с этими результатами показали значительно меньшую потерю веса тела и более длительную выживаемость.
Для всех инфекционных экспериментов различия в колонизации были первоначально и наиболее сильно обнаружены в просвете слепой кишки на ранней фазе инфекции, а также могут быть обнаружены в изолированном содержимом слепой кишки, что указывает на то, что определенные бактерии в слепой кишке могут задерживать колонизацию на ранней стадии посредством прямого или косвенного механизмы.Сравнивая мышей, не содержащихся в одном помещении, и мышей в одном помещении, мы определили, что различные особенности кишечной микробиоты связаны с более низким уровнем C . rodentium колонизация на ранней стадии инфекции. В частности, бактерии, продуцирующие SCFA [24] в филуме Firmicutes, такие как Intestinimonas , Lachnoclostridium , Roseburia и Ruminiclostridium , были значительно повышены, тогда как более высокие количества муцин-разлагающей бактерии F Akkermansia были только в SP. -S мышей.Присутствие Akkermansia в основном связано с полезными свойствами и обратно коррелирует с некоторыми заболеваниями, включая ВЗК, острый аппендицит, ожирение и диабет [30]. Следует отметить, что эти заболевания могут влиять на целостность или толщину слоя слизи, тем самым влияя на численность Akkermansia . В этом исследовании сравнение слоя слизи и целостности не смогло выявить значительных различий между обеими линиями мышей. Кроме того, численность Akkermansia после кохаузинга не коррелировала с изменениями фенотипа мышей, предполагая, что различия численности Akkermansia могут недостаточно объяснить различия в восприимчивости по сравнению с C . rodentium в этом исследовании.
Дальнейший анализ профилей гена 16S рРНК устойчивых к SPF-S животных показал четкую кластеризацию вне микробиома восприимчивых мышей, характеризующихся общим повышенным видовым богатством, наиболее выраженным по численности и разнообразию в рамках типа Firmicutes, что указывает на наличие специфических Бактерии, продуцирующие SCFA, ответственны за устойчивость к C . rodentium инфекция. Дальнейшее сравнение метаболомики выявило поразительные различия между SPF-S и SPF-R мышами с сильным увеличением сукцината, малата и фумарата, а также метаболитов орнитина, путресцина и мочевины, связанных с циклом мочевины, у восприимчивых мышей.Следует отметить, что мыши SPF-R содержали в слепой кишке значительно больше и больше дайверов Enterobacteriaceae , которые могли потреблять метаболиты, которые были повышены в среде SPF-S, тем самым уменьшая возможные источники углерода для C . rodentium у устойчивых мышей к SPF-R. В последнее время более высокое соотношение эндогенных Enterobacteriaceae , встречающихся в естественных условиях в микробиоте лабораторных животных, было связано со снижением восприимчивости к Salmonella Typhimurium [20].В то время как Enterobacteriaceae отсутствовали у мышей SPF-S, несколько видов, принадлежащих к этому семейству, были выделены из мышей SPF-R. Однако перенос этих бактерий, выделенных из SPF-R, мышам SPF-S не приводил к значительному снижению КОЕ в слепой кишке, что позволяет предположить, что эти бактерии не играли важную роль в этой ситуации. Более того, чувствительные к SPF-S мыши содержали в микробиоме значительно более высокие уровни видов Bacteroides, которые, как известно, увеличивают количество метаболитов, участвующих в глюконеогенезе [31].Эта модуляция среды метаболитов была связана с повышенной экспрессией гена вирулентности EHEC за счет увеличения образования A / E повреждений посредством фактора транскрипции Cra, который жестко регулируется концентрацией сахара [31]. Кроме того, содержание этаноламина было значительно повышено у чувствительных мышей, которые, как известно, служат источником углерода для многих родственных бактериальных патогенов, включая Salmonella , Escherichia или Klebsiella [32]. В случае Salmonella Typhimurium снижение уровней бутирата в просвете за счет уничтожения бактерий, продуцирующих бутират, путем обработки стрептомицином увеличивало оксигенацию эпителия и аэробную экспансию патогена [33].Аналогичным образом было показано, что повышенная оксигенация усиливает колонизацию слизистой оболочки Citrobacter [34]. Более того, Salmonella может получить преимущество для роста за счет потребления неферментируемых источников углерода, таких как сукцинат [35] или 1,2-пропандиол [36], тогда как рост может подавляться SCFA, полученными из микробиоты, путем подкисления внутриклеточной цитоплазмы [5]. Чтобы исключить, что доступность кислорода играет ключевую роль в наблюдаемом фенотипе, мы оценили экспрессию фактора, индуцируемого гипоксией (HIF1-α) [25], в тканях кишечника обеих линий мышей в стабильном состоянии и через 3 дня после эксперимента.i., который не выявил значимых различий между обеими линиями мышей.
Наши результаты показывают, что естественные вариации микробиоты без какого-либо вмешательства антибиотиков напрямую изменяют восприимчивость к желудочно-кишечным патогенам. Эти ранее существовавшие различия в микробной среде, такие как присутствие и обилие продуцентов бутирата и сукцината, объясняют сильно различающуюся восприимчивость к болезням по отношению к C . rodentium у изогенных мышей, что также может быть верным для встречающихся вариаций у людей, инфицированных стандартизованным посевным материалом EPEC [7,8].Далее, сосредоточив внимание на механизме подавления, мы проверили ингибирующие свойства бутирата на C . rodentium путем добавления в среду BHI различных концентраций бутирата, ацетата и пропионата по отдельности и в сочетании в физиологических концентрациях, как в слепой кишке разных линий мышей. Поразительно, но только бутират, а также смесь SCFA, обнаруженные у мышей SPF-R, были способны почти полностью подавить рост C . rodentium при pH 6.0, но не при pH 7,0, что указывает на то, что не только количество SCFAs, обнаруженное в слепой кишке мышей SPF-R, но также и пониженный pH слепой кишки, ответственны за ингибирование C . Родентиум . В отличие от ингибирующего действия SCFAs на C . rodentium показано в этой рукописи, SCFAs, как было показано, специфически способствуют прикреплению и подвижности EHEC in vitro путем активации экспрессии локуса сглаживания энтероцитов [37] или интимного прикрепления и секреции типа III [38].Взятые вместе, роль SCFAs, по-видимому, является многофакторной и зависит от видов бактерий, присутствующих в кишечнике. Наконец, мы могли продемонстрировать, что добавление изолированного содержимого слепой кишки мышей SPF-S in vitro , а также добавление бутирата мышей SPF-S in vivo эффективно снижает колонизацию C . rodentium сопровождается снижением значения pH слепой кишки до такой же степени, как у устойчивых мышей SPF-R, при достижении критического значения более 50 нмоль / мг в слепой кишке.Кроме того, добавление бутирата животным с истощенным антибиотиком и без микробов также привело к значительному снижению КОЕ в слепой кишке, что подчеркивает влияние SCFAs в этих условиях. Тем не менее, общий уровень бутирата не может быть восстановлен только добавлением SCFA, что подчеркивает важность резидентных микробов для достижения полностью защитных уровней SCFA. На основании этих результатов концентрации SCFA могут служить биомаркером для прогнозирования исхода заболевания после инфицирования определенными Enterobacteriaceae .
Таким образом, наше исследование продемонстрировало, что присутствие, численность и разнообразие бактерий, продуцирующих SCFA, сильно влияют на кинетику и тяжесть заболевания, опосредованного Citrobacter . Кроме того, мы могли идентифицировать бутират как ключевой метаболит для защиты от C . Родентиум . Однако, поскольку предыдущие исследования в основном были сосредоточены на иммуноопосредованных механизмах, наши эксперименты продемонстрировали, что естественные вариации микробиоты сильно влияют на среду метаболитов и значение pH в кишечнике, тем самым внося свой вклад в естественные вариации чувствительности к энтеропатогенам, таким как C . Родентиум . Эти результаты подчеркивают необходимость нормализации микробиоты в линиях лабораторных мышей для экспериментов по заражению модельным патогеном C . rodentium независимо от диеты и использования антибиотиков.
Методы и сведения о предмете
Заявление об этике
Все эксперименты на животных были выполнены в соответствии с руководящими принципами Helmholtz-Zentrum für Infektionsforschung, Брауншвейг, Германия, национальным законом о защите животных (Tierschutzgesetz (TierSchG) и правилами экспериментов на животных (Tierschutz-Versuchstierverordnung (TierSchVersV) Федерации Европейской ассоциации лабораторных животных (FELASA).Исследование было одобрено Государственным управлением природы, окружающей среды и защиты потребителей Нижней Саксонии (LAVES), Ольденбург, Нижняя Саксония, Германия; разрешение № 33.4-42502-04-14 / 1415, № 33.19-42502-04-16 / 2124 и № 33.19-42502-04-17 / 2573.
Мыши
мышей C57BL / 6N SPF-1 были приобретены у NCI и содержались (включая разведение и содержание) в животноводческих помещениях Центра исследований инфекций им. Гельмгольца (HZI) в улучшенных условиях отсутствия специфических патогенов (SPF).Мыши C57BL / 6N SPF-2, SPF-3, SPF-4, SPF-6 и SPF-7 были приобретены у разных поставщиков и размещены в условиях повышенного SPF в HZI не менее чем за две недели до начала эксперимента: Чарльз Ривер (SPF-2 и SPF-3), Harlan (SPF-4), Janvier (SPF-6) и Taconic (SPF-7). Мышей SPF-5 генерировали, разводили и содержали в условиях повышенного SPF в HZI [39]. Свободных от микробов мышей C57BL / 6NTac разводили в изоляторах (Getinge) в стерильном помещении в HZI. Животные, использованные в экспериментах, соответствовали полу и возрасту.Использовали мышей-самок и самцов в возрасте 8–12 недель. Им предоставлялись стерилизованная пища и вода ad libitum. Мышей содержали в строгом 12-часовом световом цикле (свет включается в 7:00 и выключается в 19:00) и размещают группами до шести мышей в клетке. Всех мышей умерщвляли асфиксией CO 2 и смещением шейного отдела позвоночника.
Штаммы бактерий
Налидиксовая кислота, устойчивый к канамицину и биолюминесцентный Citrobacter rodentium (C . rodentium) штамм ICC180 [23] использовался для большинства экспериментов по заражению и in vitro анализов .Генетически модифицированный продуцент токсина шига и устойчивый к хлорамфениколу C . rodentium штамм DBS770 [12] был использован для экспериментов по заражению в условиях BSL3.
Манипуляции с микробиотой
Для экспериментов по совместному содержанию с обычными выращиваемыми мышами мышей C57BL / 6N, соответствующих возрасту и полу, содержали вместе в клетках в соотношении 1: 1 в течение трех-четырех недель перед экспериментами по заражению. Для экспериментов по совместному содержанию с мышами, свободными от микробов, мышей содержали совместно в соотношении 1: 1 в специальных вентилируемых изокажах, оборудованных индивидуальными фильтрами HEPA (Techniplast).
In vivo C . rodentium заражениеБиолюминесценция, экспрессирующая C . rodentium штамм ICC180 использовался во всех экспериментах по заражению [23]. Шига-токсин-продуцент C . rodentium штамм DBS770 [12] был использован для двух экспериментов по заражению в условиях BSL3. С . Инокуляты rodentium получали путем культивирования бактерий в течение ночи при 37 ° C в бульоне LB с 50 мкг / мл канамицина. Затем культуру разводили 1: 100 в свежей среде и субкультивировали в течение 4 часов при 37 ° C в бульоне LB [19].Бактерии дважды промывали фосфатно-солевым буфером (PBS). Мышам перорально вводили 10 8 КОЕ C . rodentium разводили в 200 мкл PBS. Вес мышей контролировали, и фекалии собирали в разные моменты времени (1, 3, 5, 9 и 14 дней) после заражения для измерения нагрузки патогенами и секвенирования 16S рРНК. Мышей инфицировали биолюминесценцией, экспрессирующей C. rodentium , как описано. После различных моментов времени заражения (d1, 3, 5, 8, 11, 15 и 21) мышей анестезировали изофлураном (4 об.%) И переносили в систему визуализации in vitro (IVIS).Перед первой визуализацией мышей брили на животе, чтобы усилить детекцию биолюминесценции. Изображения были сделаны после разного времени экспонирования (1 с, 30 с, 1 мин, 3 мин), а люминесценция была определена как средняя яркость (п / с / см3 / ср). После завершения эксперимента интенсивности люминесценции всех изображений были нормализованы и количественно определены с использованием программного обеспечения Live Image.
Количественное определение фекалий
C . родентиум колонизацияБыли собраны пробы свежих фекалий и зарегистрирован вес.Затем образцы фекалий разбавляли 1 мл среды LB и гомогенизировали путем взбивания шариков из диоксида циркония / диоксида кремния 1 мм в течение двух раз по 25 секунд с использованием Mini-Beadbeater-96 (BioSpec). Для определения КОЕ серийные разведения гомогенизированных образцов помещали на чашки LB и MacConkey с 50 мкг / мл канамицина. Перед подсчетом планшеты культивировали при 37 ° C в течение 1 дня. КОЕ C . родентиум были рассчитаны после нормализации на массу кала.
Анализы in vitroМышей умерщвляли и содержимое слепой кишки выделяли, взвешивали и разбавляли в соотношении 1: 1 с помощью PBS или BHI и гомогенизировали два раза по 25 секунд с использованием Mini-BeadBeater-96 (BioSpec).Образцы готовили либо аэробно, либо анаэробно в анаэробной камере. При необходимости добавляли SCFA в различных концентрациях и доводили pH до 6,0 или 7,0 с помощью HCl или NaOH. Бактерии выращивали в подходящей среде и нормализовали до 10 6 КОЕ. Пробирки засевали 10 мкл C . rodentium и культивировали при 37 ° C в аэробных или анаэробных условиях в течение 6 или 24 часов. Двадцать пять мкл каждого образца серийно разводили в 96-луночных планшетах и высевали на планшеты с селективным агаром с канамицином для извлечения жизнеспособных количеств C . Родентиум .
Анализ кривой роста
С . Культуру rodentium выращивали в течение ночи при 37 ° C в бульоне LB с 50 мкг / мл канамицина. Затем культуру разбавляли 1: 100 в свежей среде и субкультивировали в течение 4 часов при 37 ° C в бульоне BHI. 96-луночный планшет был снабжен 190 мкл среды BHI, нормализованной до pH 6,0 или 7,0, с добавлением или без добавления короткоцепочечных жирных кислот. С . Культуру rodentium нормализовали до 10 6 КОЕ / мл и добавляли 10 мкл на лунку.Каждое условие было выполнено в трех экземплярах. Планшет инкубировали в автоматическом считывателе планшетов в аэробных условиях при 37 ° C. OD 600 измеряли каждые 60 мин. Значения холостого опыта вычитали вручную, а среднее значение трех образцов рассчитывали и наносили на график с помощью Prism GraphPad8.2.
Измерения короткоцепочечных жирных кислот
Приблизительно 50–100 мг содержимого слепой кишки собирали, взвешивали и немедленно замораживали в жидком азоте и хранили при -80 ° C до дальнейшей обработки.Для экстракции SCFA образцы ресуспендировали в 600 мкл воды с добавлением внутреннего стандарта (2 мкл о-крезола / 250 мл) и 60 мкл 65% серной кислоты для ВЭЖХ на 50 мг сырой массы и энергично перемешивали в течение 5 мин. Затем 400 мкл смеси экстрагировали 200 мкл трет-бутилметилового эфира, и эфирную фазу анализировали с помощью ГХ-МС, как описано ранее [40]. Стандартные кривые органических кислот использовали для внешней калибровки.
Дериватизация метаболитов
Дериватизацию метаболитов онлайн проводили с использованием автосэмплера Axel Semrau.Высушенные полярные метаболиты растворяли в 15 мкл 2% гидрохлорида метоксиамина в пиридине при 40 ° C при встряхивании. Через 90 минут добавляли равный объем N-метил-N- (триметилсилил) трифторацетамида (MSTFA) и выдерживали в течение 30 минут при 40 ° C.
ГХ-МС анализ нецелевого метаболома
Образец(1 мкл) вводили в инжектор SSL при 270 ° C в режиме разделения (1: 5). ГХ-МС анализ выполняли с использованием Agilent 7890A GC, оснащенного 30 м VF-35MS + 5 м капиллярной колонкой Duraguard (0.Внутренний диаметр 25 мм, толщина пленки 0,25 мкм). Гелий использовался в качестве газа-носителя при скорости потока 1,0 мл / мин. Температуру печи ГХ поддерживали на уровне 80 ° C в течение 6 минут, затем повышали до 300 ° C со скоростью 6 ° C / мин и выдерживали при этой температуре в течение 10 минут. Впоследствии температуру повышали до 325 ° C со скоростью 10 ° C / мин и выдерживали при этой температуре в течение 4 минут, в результате чего общее время анализа на образец составляло 60 минут. ГХ был подключен к МС Agilent 5975C, работающему в режиме ионизации электронным ударом при 70 эВ.Температура линии передачи была установлена на 280 ° C. Источник МС выдерживали при 230 ° C, а квадруполь — при 150 ° C. Детектор работал в режиме сканирования. Масс-спектры полного сканирования были получены от m / z 70 до m / z 800 при скорости сканирования 2 сканирования / с. Настройка и обслуживание ГХ-МС выполнялись в соответствии с инструкциями поставщика, автоматическая процедура настройки применялась каждые 150 инъекций. Обработка данных производилась с помощью программы MetaboliteDetector [41].
Выделение ДНК
Было собранообразцов фекалий и хранили при –20 ° C до обработки для секвенирования гена 16S рРНК на основе ДНК.ДНК экстрагировали фенол-хлороформным методом, описанным ранее [42]. Вкратце, 500 мкл буфера для экстракции (200 мМ Трис (Roth), 20 мМ EDTA (Roth), 200 мМ NaCl (Roth), pH 8,0), 200 мкл 20% SDS (AppliChem), 500 мкл фенола: хлороформа. : изоамиловый спирт (PCI) (24: 24: 1) (Roth) и 100 мкл гранул диоксида циркония / диоксида кремния (диаметром 0,1 мм) (Roth) добавляли на образец фекалий. Лизис бактерий проводили путем механического разрушения с использованием Mini-BeadBeater-96 (BioSpec) два раза по 2 мин. После центрифугирования водную фазу пропускали для другой экстракции фенол: хлороформ: изоамиловый спирт перед осаждением ДНК с использованием 500 мкл изопропанола (J.T. Baker) и 0,1 объема 3 М ацетата натрия (Applichem). Образцы инкубировали при -20 ° C в течение по крайней мере нескольких часов или в течение ночи и центрифугировали при 4 ° C на максимальной скорости в течение 20 минут. Полученный осадок ДНК промывали, сушили с использованием скоростного вакуума и ресуспендировали в буфере TE (Applichem) со 100 мкг / мл РНКазы I (Applichem). Неочищенную ДНК очищали на колонке (BioBasic Inc.) для удаления ингибиторов ПЦР.
Амплификация и секвенирование гена 16S рРНК
Амплификацию гена 16S рРНК области V4 (F515 / R806) проводили в соответствии с установленным протоколом, описанным ранее [43].Вкратце, ДНК нормализовали до 25 нг / мкл и использовали для секвенирования ПЦР с уникальными штрих-кодами Голари из 12 оснований, включенными через специфические праймеры (полученные от Sigma). ПЦР выполняли с использованием полимеразы Q5 (NewEnglandBiolabs) в трех экземплярах для каждого образца, используя условия ПЦР начальной денатурации в течение 30 с при 98 ° C, с последующими 25 циклами (10 с при 98 ° C, 20 с при 55 ° C и 20 с. с при 72 ° C). После объединения и нормализации до 10 нМ ампликоны ПЦР секвенировали на платформе Illumina MiSeq с помощью секвенирования парных концов 250 п.н. (PE250).С помощью программного пакета Usearch8.1 (http://www.drive5.com/usearch/) полученные чтения были собраны, отфильтрованы и кластеризованы. Последовательности были отфильтрованы для считывания низкого качества и объединены на основе штрих-кодов для конкретных образцов с использованием QIIME v1.8.0 [44]. Слияние было выполнено с использованием -fastq_mergepairs – с fastq_maxdiffs 30. Качественная фильтрация проводилась с помощью fastq_filter (-fastq_maxee 1), с использованием минимальной длины чтения 250 бит / с и минимального количества считываний на выборку = 1000. Считывания были сгруппированы в 97% ID OTU. путем отбора OTU с открытыми ссылками и репрезентативные последовательности определяли с использованием алгоритма UPARSE [45].Фильтрация по изобилию (кластер OTU> 0,5%) и таксономическая классификация были выполнены с использованием классификатора RDP, выполненного при 80% -ном ограничении достоверности начальной загрузки [46]. Последовательности без соответствующего эталонного набора данных были собраны как de novo с использованием UCLUST. Филогенетические отношения между OTUs были определены с использованием FastTree для выравнивания PyNAST [47]. Полученные в результате таблица абсолютного содержания OTU и файл отображения использовались для статистического анализа и визуализации данных в пакете среды статистического программирования R phyloseq [48].
Вестерн-блоттинг
Ткань гомогенизировали, клетки лизировали и содержание белка в лизатах разделяли с помощью электрофореза в 10% SDS-полиакриламидном геле с последующим окрашиванием Кумасси или переносом на мембрану PDVF (Amersham / GE Healthcare Life Science). После блокирования 3% обезжиренным молоком в течение 1 часа при комнатной температуре мембраны инкубировали с соответствующим первичным антителом в течение ночи с последующей инкубацией в течение 1 часа с вторичными антителами, конъюгированными с HRP, при комнатной температуре.HIF-1α и β-актин (контроль нагрузки) были обнаружены с использованием кроличьих анти-HIF-1α (Abcam 82832) и мышиных анти-β-актинов (Abcam 8226) в соотношении 1: 500 и 1: 1000 соответственно и антикроличьих или вторичное антитело против мыши с использованием разведения 1: 10000. Полосы белка визуализировали с использованием реагента ECL (Advansta) с использованием системы визуализации вестерн-блоттинга (BioRad) и количественно оценивали с помощью программного обеспечения Image J.
Подтверждающая информация
S1 Рис. Изогенные линии мышей характеризуются различными составами микробиоты и не теряют значительную массу тела в течение
C . rodentium инфекция.Фекальная микробиота линий мышей, свободных от различных специфических патогенов (SPF), включая SPF-1 / SPF-S (n = 17), SPF-2 / SPF-R (n = 18), SPF-3 (n = 7), SPF-4 (n = 9), SPF-5 (n = 15), SPF-6 (n = 4) и SPF-7 (n = 12) оценивали с помощью секвенирования гена 16S рРНК. (A) α-разнообразие определяли с использованием индекса Chao1 и Шеннона. (B) Показана относительная численность на уровне филума для каждой группы. (C) Соотношение таксономического порядка Firmicutes и Bacteroidetes для каждой группы.Репрезентативные данные получены из одного эксперимента (SPF-4, SPF-6) или объединены по крайней мере из двух разных экспериментов (SPF-1, SPF-2, SPF-3, SPF-5, SPF-7). Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса с множественными сравнениями (односторонний дисперсионный анализ). * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001. (D) Относительное количество семейств бактерий показано и сгруппировано в соответствии с их типом. Столбцы представляют собой среднее значение для всех мышей в группе. Репрезентативные данные получены из одного эксперимента (SPF-4, SPF-6) или объединены по крайней мере из двух разных экспериментов (SPF-1, SPF-2, SPF-3, SPF-5, SPF-7).(E) Мышей с разными настройками микробиоты (SPF-1-SPF-7) инфицировали перорально 10 8 КОЕ C . Родентиум . Масса тела регистрировалась во время заражения. Результаты представляют n = 4–18 мышей / группу как среднее ± SEM из одного эксперимента (SPF-4, SPF-6) или объединенные по крайней мере из двух разных экспериментов (SPF-1, SPF-2, SPF-3, SPF-5). , SPF-7).
https://doi.org/10.1371/journal.ppat.1008448.s001
(TIF)
S2 Рис. Микробиота фекалий сильно различается у мышей SPF-S и SPF-R с более высоким соотношением бактерий, продуцирующих SCFA, у мышей с устойчивостью к SPF-R.
(A) Фекальная микробиота устойчивых SPF-R и восприимчивых SPF-S мышей была проанализирована с использованием секвенирования гена 16S рРНК с использованием графика анализа основных координат (PCoA) (B). Α-разнообразие определяли с использованием Chao1 и индекса Шеннона. Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона **** p <0,0001. (C) Относительная численность отображается на уровне рода. (D) Тепловая карта относительной численности бактериального рода (сходство последовательностей ≥97%, относительная численность> 0,05%) сортируется по роду и линии мыши.Каждая вертикальная полоса представляет микробиоту отдельной мыши. Репрезентативные данные взяты из одного эксперимента из трех независимых экспериментов. (E) Показана относительная численность значительно различающихся членов, продуцирующих SCFA между SPF-S и SPF-R рода Bacteroides , Intestinimonas , Lachnoclostridium , Roseburia и Ruminoclostridium . Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона * p <0.05, ** p <0,01, *** p <0,001, **** p <0,0001. (F) значение pH слепой кишки в устойчивом состоянии у чувствительных мышей SPF-S и устойчивых мышей SPF-R. P Указанные значения представляют сравнение U-критерия Манна-Уитни между группами с * p <0,05.
https://doi.org/10.1371/journal.ppat.1008448.s002
(TIF)
S3 Рис. Совместные эксперименты приводят к различным результатам в фенотипе с высокой численностью продуцирующих SCFA бактерий у устойчивых мышей.
(A) Мышей SPF-S и SPF-R содержали вместе в течение 4 недель и инфицировали 10 8 КОЕ C . Родентиум . (B) Отнесение спаренных мышей SPF-S и SPF-R к классу «устойчивый» и «восприимчивый» в соответствии с КОЕ слепой кишки C . rodentium через 3 дня p.i .. Порог 10 6 использовался для дискриминации обеих групп. (C) Фекальная микробиота была проанализирована с использованием секвенирования гена 16S рРНК после совместного проживания с использованием графика анализа основных координат (PCoA). (D) α-разнообразие определяли с использованием индекса Chao1 и Шеннона. (E) Фекальная микробиота устойчивых и восприимчивых спаренных мышей SPF-S и SPF-R была проанализирована с использованием секвенирования гена 16S рРНК.Показаны относительные количества семейств бактерий, сгруппированные по их типам. Столбцы представляют собой среднее значение для всех мышей в группе. Репрезентативные данные, полученные из трех независимых экспериментов, объединяются. (F) Относительная численность значительно различающихся членов, продуцирующих SCFA, у устойчивых и восприимчивых мышей из рода Alistipes , Butyricicoccus , Intestinimonas , Lachnoclostridium , Lachnospiraceae burridium и ocluminium Rosecocceae burridium, occum 67867 показаны.Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001. (G) Относительные уровни Akkermansia у животных с SPF-S и SPF-R до и после трех недель совместного проживания. Значения нормализованы до общего 16S. (H) Относительные уровни мышей Akkermansia , спарившихся с SPF-S и SPF-R, которые изменили или сохранили исходный фенотип. Значения нормализованы до общего 16S. Указанные значения P представляют собой непараметрический знаковый ранговый критерий Вилкоксона * p <0.05
https://doi.org/10.1371/journal.ppat.1008448.s003
(TIF)
S4 Рис. Изолированные факультативные анаэробные виды бактерий не способствуют ингибированию
C . родентиум in vivo .(A) Белок HIF-1 α из ткани слепой кишки в стабильном состоянии у мышей SPF-R и SPF-S (B) Количественное определение белка α HIF-1 по сравнению с уровнями белка β-актина (контроль нагрузки) (C) Последовательный разведения изолированного содержимого слепой кишки и фекалий мышей SPF-S и SPF-R высевали на чашки с агаром MacConkey без кристаллического фиолетового и культивировали в течение 24 часов в аэробных условиях.Были собраны различные морфологические колонии и снова заштрихованы, чтобы получить чистую культуру. Единичные колонии отправляли на секвенирование. Все аэробные колонии подсчитывали для количественной оценки (D). Выделенные бактерии, выращенные на чашках с агаром Mac Conkey. (E) Количественная оценка культивируемых аэробных бактерий в кале мышей SPF-1 и SPF-2, растущих на агаровой среде Mac Conkey. Данные представляют собой два независимых эксперимента с n = 5-8 мышей в группе. (F) Группы чувствительных мышей SPF-S предварительно обрабатывали изолированными факультативными анаэробными бактериями.Все мыши были инфицированы 10 8 КОЕ C . rodentium через 3 недели преколонизации и содержание КОЕ / г в органах и тканях оценивали через 3 дня p.i. (G-H) КОЕ C . rodentium в тканях и содержимом органов кишечника через 3 дня p.i .. Результаты представляют собой среднее значение и стандартную стандартную погрешность двух независимых экспериментов с n = 6–10 мышей на группу. Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса * p <0,05, ** p <0,01, *** p <0,001, **** p <0.0001.
https://doi.org/10.1371/journal.ppat.1008448.s004
(TIF)
S5 Рис. Ненаправленные данные метаболомики мышей SPF-S и SPF-R до и после заражения показывают сильные различия между изогенными линиями мышей.
Тепловые карты успешно аннотированных и существенно различающихся метаболитов у мышей SPF-S и SPF-R в разные моменты времени: устойчивое состояние (A) и день 1 p.i. (В). Две дендрограммы для тепловой карты были рассчитаны с использованием евклидова расстояния и привязки отделения. t -тесты с * p <0,05 были проведены попарно, и были указаны значительно разные метаболиты между двумя экстракционными растворителями. Сложите изменения успешно аннотированных и значительно различающихся метаболитов между SPF-S и SPF-R в стабильном состоянии (C) или в день 1 p.i. (D) отображаются. Сложите изменения успешно аннотированных и существенно разных метаболитов в линиях мышей в разные моменты времени: SPF-S (E) и SPF-R (F). В качестве порогового значения были приняты изменения между указанными группами более чем в 2 раза.
https://doi.org/10.1371/journal.ppat.1008448.s005
(TIF)
S6 Рис. Метаболомный профиль устойчивого SPF-R характеризуется повышенными уровнями SCFA, которые сильно препятствуют росту
C . rodentium in vitro при pH 6,0.(А) С . Рост rodentium отображается как оптическая плотность (OD) через 24 часа при pH 6,0 в среде BHI, дополненной различными концентрациями ацетата и пропионата или без добавления каких-либо SCFA.(В) С . Рост rodentium отображается как оптическая плотность (OD) через 24 часа при pH 6,0 (слева) или pH (7,0) в среде BHI, дополненной различными концентрациями ацетата, бутирата и пропионата или без добавления каких-либо SCFA. Одна точка данных представляет собой среднее значение трех повторов. Отображаются значения трех независимых экспериментов. Значения P представляют собой однофакторный дисперсионный анализ между группами с ** p <0,01, *** p <0,001, **** p <0,0001. (К-Д) С .Рост rodentium отображается как оптическая плотность с течением времени при pH 6,0 (слева) или pH (7,0) в среде BHI, дополненной различными концентрациями ацетата, бутирата и пропионата или без добавления каких-либо SCFA. OD измеряли каждые 60 мин. Отображаются средние значения ± SEM из трех независимых экспериментов.
https://doi.org/10.1371/journal.ppat.1008448.s006
(TIF)
S7 Рис. Кратковременное добавление бутирата не привело к значительным различиям в микробиоме мышей SPF-S.
(A) Состав фекальной бактериальной микробиоты животных, получавших бутират, оценивали с использованием секвенирования гена 16S рРНК в отношении их ответа на C . rodentium инфекция. β-разнообразие анализировали с использованием матрицы различий Брея-Кертиса и неметрического многомерного шкалирования (NMDS). (B) α-разнообразие до и после добавления SCFA в разных группах мышей SPF-S определяли с использованием Chao1 и индекса Шеннона p> 0,05. (C) Средний уровень микробиома у разных мышей SPF-S на уровне семьи.(D-E) Уровень бутирата слепой кишки и pH слепой кишки мышей без микробов C57BL6 / N с добавлением 150 мМ в питьевой воде через 3 дня p.i. (F-G) Уровень бутирата слепой кишки и pH слепой кишки мышей SPF-S, обработанных антибиотиками, с добавлением 150 мМ в питьевой воде через 3 дня p.i. Среднее значение и стандартная ошибка среднего в двух независимых экспериментах с n = 5–9 мышами в группе. Указанные значения P представляют собой непараметрический критерий Краскела-Уоллиса * p <0,05, ** p <0,01, *** p <0,001, **** p <0,0001
https://doi.org/10.1371/journal.ppat.1008448.s007
(TIF)
Благодарности
Мы благодарим персонал зоопарка и «ключевую лабораторию геномной аналитики» HZI за техническую поддержку, а также Г. Мартенса за помощь в обработке данных метаболомики. Мы благодарны доктору М. Лохнеру за предоставленный биолюминесцентный C . Штамм rodentium и д-ру Дж. Леонг за предоставление продуцирующего токсин шига C . Штамм rodentium .
Список литературы
- 1.Баффи К. Г. и Пеймер Э. Г., «Опосредованная микробиотой устойчивость к колонизации против кишечных патогенов», Nature Reviews Immunology , vol. 13, вып. 11. С. 790–801, 2013. pmid: 24096337
- 2. Кабальеро С. и Памер Э. Г., «Воспаление, опосредованное микробиотой, и антимикробная защита в кишечнике», Annu . Ред. . Иммунол ., Т. 33, нет. 1. С. 227–256, март 2015 г.
- 3. Бонхофф М. и Миллер К.P., «Повышенная восприимчивость к инфекции сальмонеллы у мышей, получавших стрептомицин», J . Заразить . Дис. ., Т. 111, нет. 2. С. 117–127, 1962.
- 4. Doorduyn Y., Van Den Brandhof WE, Van Duynhoven YTHP, Wannet WJB и Van Pelt W., «Факторы риска инфекций Salmonella Enteritidis и Typhimurium (DT104 и не-DT104) в Нидерландах: преобладающая роль сырых яиц в Enteritidis и песочницы при инфекциях Typhimurium », Epidemiol . Заражение ., Т. 134, нет. 3. С. 617–626, 2006. pmid: 16638166
- 5. Якобсон А. и др., «Метаболит, продуцируемый кишечным комменсалом, обеспечивает устойчивость к колонизации инфекции сальмонеллой», Cell Host Microbe , vol. 24, вып. 2, pp. 296–307.e7, август 2018 г. pmid: 30057174
- 6. Секиров И. и др., «Вызванные антибиотиками нарушения кишечной микробиоты изменяют восприимчивость хозяина к кишечной инфекции», Infect . Иммунная ., т. 76, нет. 10, pp. 4726–4736, 2008. pmid: 18678663
- 7. Поп М. и др., «Диарея у детей раннего возраста из стран с низким уровнем дохода приводит к крупномасштабным изменениям в составе кишечной микробиоты», Genome Biol ., Vol. 15, вып. 6, стр. R76, июнь 2014 г. pmid: 24995464
- 8. Tacket C.O. et al., «Роль EspB в экспериментальной энтеропатогенной инфекции человека, вызванной Escherichia coli», Infect . Иммун ., Т. 68, нет. 6, pp. 3689–95, июн.2000. pmid: 10816529
- 9. Консорциум проекта «Микробиом человека», «Структура, функции и разнообразие здорового микробиома человека», Nature , vol. 486, нет. 7402, pp. 207–214, июнь 2012 г. pmid: 22699609
- 10. Коллинз Дж. У. и др., «Citrobacter rodentium: инфекция, воспаление и микробиота», Nat . Ред. . Microbiol ., Vol. 12, вып. 9, стр. 612–623, август 2014 г. pmid: 25088150
- 11. Бхиндер Г., Шам Х. П., Чан Дж. М., Морампуди В., Якобсон К. и Валланс Б. А., «Модель мыши Citrobacter rodentium: изучение вкладов патогенов и хозяев в инфекционный колит», J . Vis . Exp ., No. 72, 2013.
- 12. Маллик Э. М. и др., «Новая модель инфекции мышей, вызывающая шиги-токсин Escherichia coli», J . Клин . Инвест ., Т. 122, нет. 11, стр. 4012–4024, ноябрь 2012 г. pmid: 23041631
- 13.Влодарска М. и др., «Лечение антибиотиками изменяет слой слизи толстой кишки и предрасполагает хозяина к обострению колита, вызванного Citrobacter rodentium», Инфекция . Иммун ., Т. 79, нет. 4. С. 1536–1545, 2011. pmid: 21321077
- 14. Виллинг Б. П., Вачаракса А., Кроксен М., Таначайянонт Т. и Финлей Б. Б., «Изменение устойчивости хозяина к инфекциям посредством микробной трансплантации», PLoS One , vol. 6, вып. 10, 2011.
- 15.Иванов И. И. и др., «Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями», Cell , vol. 139, нет. 3. С. 485–498, 2009. pmid: 19836068
- 16. Влодарска М., Виллинг Б. П., Браво Д. М. и Финлей Б. Б., «Добавка с фитонутриентами к диете способствует выделению полезных видов Clostridia и секреции кишечной слизи, что приводит к защите от кишечной инфекции», Sci . Реп. ., Т. 5, 2015.
- 17. Камада Н.и др., «Регулируемая вирулентность контролирует способность патогена конкурировать с кишечной микробиотой», Science (80-.), vol. 336, нет. 6086, pp. 1325–1329, 2012. pmid: 22582016
- 18. Рой У. и др., «Определенные микробные сообщества вызывают развитие колита при повреждении кишечного барьера через врожденные или адаптивные иммунные клетки», Cell Rep ., Vol. 21, нет. 4, стр. 994–1008, октябрь 2017 г. pmid: 206
- 19. Thiemann S. et al., «Повышение выработки IFNγ с помощью различных комменсалов, ослабляющих болезнь, вызванную сальмонеллой», Cell Host Microbe , vol. 21, нет. 6, pp. 682–694.e5, июнь 2017 г. pmid: 28618267
- 20. Веласкес Э. М. и др., «Эндогенные энтеробактерии лежат в основе вариабельности восприимчивости к инфекции сальмонеллы», Nat . Microbiol ., Vol. 4, вып. 6. pp. 1057–1064, июнь 2019. pmid: 305
- 21. Вильярино Н. Ф. и др., «Состав кишечной микробиоты влияет на тяжесть малярии», Proc . Нац. . Acad . Наука . У . С . А ., Т. 113, нет. 8, pp. 2235–2240, февраль 2016 г. pmid: 26858424
- 22. Сэдлер Р. и др., «Различия в микробиоте коммерческих заводчиков влияют на иммунный ответ после инсульта», Brain . Поведение . Иммун ., Т. 66, стр. 23–30, ноябрь 2017 г. pmid: 28347867
- 23. Wiles S. et al., «Органическая специфичность, колонизация и динамика клиренса in vivo после перорального заражения мышиным патогеном Citrobacter rodentium», Cell . Microbiol ., Vol. 6, вып. 10, pp. 963–972, 2004. pmid: 15339271
- 24. Витал М., Карч А. и Пайпер Д. Х., «Сообщества, продуцирующие бутират в толстой кишке у людей: обзор с использованием данных Omics», mSystems , vol. 2, вып. 6, 2017.
- 25. Келли К. Дж. И др., «Перекрестные помехи между производными микробиотой короткоцепочечных жирных кислот и кишечным эпителиальным HIF усиливают тканевую барьерную функцию», Cell Host Microbe , vol. 17, нет. 5, стр.662–671, май 2015 г. pmid: 25865369
- 26. Sorbara M. T. et al., «Ингибирование устойчивых к антибиотикам Enterobacteriaceae посредством опосредованного микробиотой внутриклеточного подкисления», J . Опыт . Med , т. 216, нет. 1. С. 84–98, 2018. pmid: 30563917
- 27. Kayagaki N. et al., «Неканоническая активация инфламмасом нацелена на каспазу-11», Nature , vol. 479, нет. 7371, pp. 117–121, ноябрь 2011 г. pmid: 22002608
- 28.Vande Walle L. и др., «Подавляет ли каспаза-12 активацию инфламмасом?», Nature , vol. 534, нет. 7605, стр. E1 – E4, июнь 2016 г. pmid: 27251234
- 29. Натаро Дж. П. и Капер Дж. Б., «Diarrheagenic Escherichia coli», Clin Microbiol Rev , vol. 11, pp. 142–201, 1998. pmid: 9457432
- 30. Герлингс С. Ю., Костопулос И., де Вос В. М. и Белзер К., «Akkermansia muciniphila в желудочно-кишечном тракте человека: когда, где и как?», Микроорганизмы , том.6, вып. 3 июля 2018 г.
- 31. Curtis M. M., Hu Z., Klimko C., Narayanan S., Deberardinis R. и Sperandio V., «Кишечный комменсальный Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта», Cell Host Microbe , vol. 16, нет. 6, стр. 759–69, декабрь 2014 г. pmid: 25498343
- 32. Гарсин Д. А., «Использование этаноламина в бактериальных патогенах: роли и регуляция.», Nat . Ред. . Microbiol ., Vol. 8, вып. 4, стр. 290–5, апрель 2010 г. pmid: 20234377
- 33. Ривера-Чавес Ф. и др., «Истощение клостридий, продуцирующих бутират, из кишечной микробиоты приводит к аэробному распространению сальмонелл в просвете», Cell Host Microbe , vol. 19, нет. 4, стр. 443–454, апрель 2016 г. pmid: 27078066
- 34. Лопес К. А. и др., «Аэробное дыхание», Science (80-. ) ., Vol. 353, нет. 6305. С. 1249–1253, 2016.pmid: 27634526
- 35. Спига Л. и др., «Окислительный центральный метаболизм позволяет сальмонелле использовать сукцинат, полученный из микробиоты», Cell Host Microbe , vol. 22, нет. 3, pp. 291–301.e6, сентябрь 2017 г. pmid: 28844888
- 36. Faber F. и др., «Дыхание 1,2-пропандиола, полученного из микробиоты, приводит к размножению сальмонелл во время колита», PLoS Pathog ., Vol. 13, вып. 1, стр. e1006129, январь 2017 г. pmid: 28056091
- 37. Ян Ф., Ян Л., Чанг З., Чанг Л. и Ян Б., «Регулирование вирулентности и подвижности ацетатом в энтеропатогенной кишечной палочке», Int . Дж . Мед . Microbiol ., Vol. 308, нет. 7, pp. 840–847, октябрь 2018 г. pmid: 30076004
- 38. Тобе Т., Наканиши Н. и Сугимото Н., «Активация подвижности путем восприятия короткоцепочечных жирных кислот посредством двух стадий регуляторного каскада жгутиковых генов в энтерогеморрагической Escherichia coli.», Infect . Иммун ., Т. 79, нет. 3, стр. 1016–24, март 2011 г. pmid: 21149585
- 39. Stehr M. и др., «Измененная Чарльз Ривер флора Шедлера (CRASF ® ) оставалась стабильной в течение четырех лет в колонии мышей, помещенных в индивидуально вентилируемые клетки», Lab . Anim ., Т. 43, нет. 4. С. 362–370, 2009. pmid: 19535393
- 40. Нойман-Шаал М., Хофманн Дж. Д., Уилл С. Э. и Шомбург Д., «Разрешенное во времени поглощение аминокислоты Clostridium difficile 630 Δerm и сопутствующего продукта ферментации и образования токсина», BMC Microbiol ., т. 15, вып. 1, стр. 281, декабрь 2015 г.
- 41. Хиллер К., Хангебраук Дж., К., Спура Дж., Шрайбер К. и Шомбург Д., «MetaboliteDetector: инструмент комплексного анализа для целевого и ненаправленного анализа метаболома на основе ГХ / МС», Анал . Chem ., Vol. 81, нет. 9, pp. 3429–3439, May 2009. pmid: 19358599
- 42. Тернбо П. Дж. И др., «Микробиом ядра кишечника у тучных и худых близнецов», Nature , vol. 457, нет. 7228, с. 480–484, 2009.pmid: 104
- 43. Капорасо Дж. Г. и др., «Глобальные паттерны разнообразия 16S рРНК на глубине миллионов последовательностей на образец», Proc . Нац. . Acad . Sci ., Т. 108, нет. Приложение_1, стр. 4516–4522, 2011.
- 44. Капорасо Дж. Г. и др., «QIIME позволяет анализировать высокопроизводительные данные секвенирования сообщества», Nature Methods , vol. 7, вып. 5. С. 335–336, 2010. pmid: 20383131
- 45.Эдгар Р. К., «Поиск и кластеризация на порядки быстрее, чем BLAST», Bioinformatics , vol. 26, вып. 19, стр. 2460–2461, 2010. pmid: 20709691
- 46. Ван К., Гаррити Г. М., Тидже Дж. М. и Коул Дж. Р., «Наивный байесовский классификатор для быстрого отнесения последовательностей рРНК к новой бактериальной таксономии», , заявка . Окружающая среда . Microbiol ., Vol. 73, нет. 16, pp. 5261–5267, 2007. pmid: 17586664
- 47. Цена М.Н., Дехал П. С. и Аркин А. П., «FastTree 2 — деревья приблизительно максимального правдоподобия для больших выравниваний», PLoS One , vol. 5, вып. 3, 2010.
- 48. Макмерди П. Дж. И Холмс С., «Phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома», PLoS One , vol. 8, вып. 4, 2013.
(PDF) Влияние бутирата натрия на здоровье кишечника и состав кишечной микробиоты во время прогрессирования кишечного воспаления у бройлеров
БУТИРИНОВАЯ КИСЛОТА СНИЖАЕТ ВОСПАЛЕНИЕ КИШЕЧНИКА В БРАЙЛЕРАХ 7
ЗАКЛЮЧЕНИЕ
Наша текущая работа продемонстрировала, что
ослабляет воспаление кишечника
на что указывают менеебаллов тяжелых поражений, кишечное кровотечение, смертность
показателей, гистологические баллы в морфологии толстой и подвздошной кишки
за счет улучшения структуры микробного сообщества слепой кишки
.Бутират натрия, кажется, оптимизирован для
противовоспалительных эффектов в более высоких дозах (300 мг / кг).
Эта работа раскрывает убедительный набор связей между составом
микробов кишечника, диетой хозяина и физиологией кишечника
.
ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ
Дополнительные данные доступны в Интернете по адресу Poultry Science
.
Дополнительная таблица S1. Производительность и морфология подвздошной кишки
цыплят от 0 до 21 D.
БЛАГОДАРНОСТИ
Работа поддержана Национальным научным фондом Китая
(грант No.31601959),
Программа науки и технологий провинции Гуандун (грант
№ 2017B020232003), Программа науки и технологий
грамма Гуанчжоу (грант № 201504010017) и Целевой фонд
для современной агропромышленности. Technology
Research System (грант № CARS41).
СПИСОК ЛИТЕРАТУРЫ
Али, А. М., С. Седдик и Х. Ф. Хатер. 2014. Влияние бутирата, клопидола
и их комбинации на продуктивность бройлеров
, инфицированных Eimeria maxima.Br. Пульт. Sci. 55: 474–482.
Берри Д., К. Шваб, Г. Милинович, Дж. Райхерт, К. Б. Махфуд,
Т. Деккер, М. Энгель, Б. Хай, Э. Хайнцл, С. Хайдер, Л. Кеннер, М.
Мюллер, И. Раух, Б. Штробль, М. Вагнер, К. Шлепер, Т. Урих,
и А. Лой. 2012. Анализ 16S рРНК на уровне филотипов выявил новые
бактериальных индикаторов состояния здоровья при остром колите у мышей. ISME
J. 6: 2091–2106.
Бокулич, Н.А., С. Субраманян, Дж. Дж. Фейт, Д.Геверс, Дж. И. Гор —
Дон, Р. Найт, Д. А. Миллс и Дж. Г. Капорасо. 2013. Фильтрация Quality-
значительно улучшает оценки разнообразия при последовательном секвенировании Illumina amp-
. Nat. Методы. 10: 57–59.
Bortoluzzi, C., A.A.Pedroso, J.J. Mallo, M.Puyalto, W.K.Kim,
и T. J. Applegate. 2017. Бутират натрия улучшил производительность на
человека, модулируя микробиоту слепой кишки и регулируя экспрессию
кишечных иммунных генов цыплят-бройлеров.
Индюшка. Sci. 96: 3981–3993.
Cerisuelo, A., C. Marin, F. Sanchez-Vizcaino, E. A. Gomez, J. M.
de la Fuente, R. Duran, and C. Fernandez. 2014. Воздействие
особой смеси компонентов эфирных масел и бутирата натрия
в кормах на показатели роста и количество сальмонелл у экспериментальных
бройлеров с психическими отклонениями. Пульт. Sci. 93: 599–606.
Чанг, П. В., Л. Хао, С. Офферманнс, Р. Меджитов. 2014. Бутират микробного метаболита
регулирует функцию кишечных макрофагов
посредством ингибирования гистондеацетилазы.Proc. Natl Acad. Sci.
США 111: 2247–2252.
Чен Дж., Дж. Теллез, Дж. Д. Ричардс и Дж. Эскобар. 2015. Идентификация
потенциальных биомаркеров нарушения кишечного барьера у бройлеров
цыплят. Фронт. Вет. Sci. 2:14.
Фернандес-Рубио, К., К. Ордонез, Х. Абад-Гонсалес, А. Гарсия —
Гальего, М. П. Хонрубия, Х. Дж. Малло и Р. Балана-Фус. 2009.
Кормовые добавки на основе масляной кислоты помогают защитить цыплят-бройлеров
от инфекции Salmonella Enteritidis.Пульт. Sci. 88: 943–948.
Hakansson, A., N. Tormo-Badia, A. Baridi, J. Xu, G. Molin, M. L.
Hagslatt, C. Karlsson, B. Jeppsson, C.M Cilio и S.Arne.
2015. Иммунологические изменения и изменения микробиоты кишечника
после введения декстрансульфата натрия (DSS) мышам. Clin.
Exp. Med. 15: 107–120.
Hill, D. A., C. Hoffmann, M. C. Abt, Y Du, D. Kobuley, T. J. Kirn,
F. D. Bushman, D. Artis. 2010. Метагеномный анализ выявил
индуцированных антибиотиками временных и пространственных изменений в кишечной ми-
кробиоте с соответствующими изменениями гомеостаза иммунных клеток.
Mucosal Immunol. 3: 148–158.
Джази В., А. Д. Форузандех, М. Тогьяни, Б. Дастар, К. Р.
Резайе и М. Тогьяни. 2018. Влияние Pediococcus acidilac-
tici, маннанолигосахарида, масляной кислоты и их комбинации
на показатели роста и здоровье кишечника молодняка бройлеров
цыплят, зараженных Salmonella Typhimurium. Пульт. Sci.
97: 2034–2043.
Цзи, Дж., Д. Шу, М. Чжэн, Дж. Ван, К. Ло, Ю.Wang, F. Guo, X.
Zou, X. Lv, Y. Li, T. Liu и H. Qu. 2016. Микробный метаболит
Бутиратспособствует поляризации и функции макрофагов M2.
Sci. Реп.6: 24838.
Канаи, Т., Ю. Миками и А. Хаяси. 2015. Прорыв в
пробиотиках: Clostridium butyricum регулирует гомеостаз кишечника и
противовоспалительный ответ при воспалительных заболеваниях кишечника. J.
Гастроэнтерол. 50: 928–939.
Куттаппан, В.А., Л.Р. Бергман, Э. А. Викуна, Дж. Д. Латорре,
А. Менкони, Дж. Д. Волчок, А. Д. Вольфенден, О. Б. Фолкнер,
Г. И. Теллез, Б. М. Харгис и Л. Р. Бильке. 2015a. Птица en-
Модель террического воспаления с декстраном сульфатом натрия, опосредованным
химической индукции и ограничения корма у бройлеров. Пульт. Sci.
94: 1220–1226.
Куттаппан, В. А., Э. А. Викуна, Дж. Д. Латорре, А. Д. Вольфенден,
Г. И. Т’еллез, Б. М. Харгис и Л. Р.Бильке. 2015b. Оценка
утечки из желудочно-кишечного тракта на моделях множественного кишечного воспаления
у кур. Фронт. Вет. Sci. 2:66.
Лю, Дж. Д., Б. Лампкинс, Г. Матис, С. М. Уильямс и Дж. Фаулер.
2019. Оценка инкапсулированного бутирата натрия с разным временем выделения
на показатели роста и смягчение некротического энтерита
у бройлеров. Пульт. Sci.
Лупп, К., М. Л. Робертсон, М. Э. Викхэм, И. Секиров, О.L. Cham-
pion, E.C. Gaynor и B.B. Finlay. 2007. Опосредованное хозяином воспаление
нарушает кишечную микробиоту и способствует чрезмерному росту энтеробактерий
. Клеточный микроб-хозяин. 2: 204.
Макдональд, Д., М. Н. Прайс, Дж. Гудрич, Э. П. Навроцки, Т. З. Де —
Сантис, А. Пробст, Г. Л. Андерсен, Р. Найт и П. Хьюген —
holtz. 2012. Улучшенная таксономия Greengenes с явными
рангами для экологического и эволюционного анализа бактерий и
архей.ISME J. 6: 610–618.
Menconi, A., X. Hernandez-Velasco, E.A. Vicuna, V.A. Kuttap-
pan, О. Б. Фолкнер, Г. Теллез, Б. М. Харгис и Л. Р. Бильке.
2015. Гистопатологические и морфометрические изменения, вызванные моделью
сульфата натрия декстран (DSS) у бройлеров. Пульт. Sci.
94: 906–911.
Мейер, Ф., Д. Паарманн, М. Д’Суза, Р. Олсон, Э.М. Гласс, М.
Кубал, Т. Пациан, А. Родригес, Р. Стивенс, А. Вилке, Дж. Вилкен-
ing, и R.А. Эдвардс. 2008. RAST-сервер метагеномики
— общедоступный ресурс для автоматического филогенетического и функционального анализа метагеномов
. BMC Bioinformatics. 9: 386.
Миширо, Т., Р. Кусуноки, А. Отани, М.М. Ансари, М. Тонгу, Н.
Харашима, Т. Ямада, С. Сато, Ю. Амано, К. Ито, С. Иши —
Хара, Ю. Киношита. 2013. Масляная кислота ослабляет воспаление кишечника
на модели мышиного DSS-индуцированного колита посредством молочного жира
глобула-фактор EGF 8.Лаборатория. Вкладывать деньги. 93: 834–843.
NRC (1994). Потребность птицы в питательных веществах, 9 изд. National
Academy Press, Вашингтон, округ Колумбия, США.
Кайсрани, С. Н., М. М. ван Кримпен, Р. П. Кваккель, М. В. Вер-
стеген и В. Х. Хендрикс. 2015. Структура рациона, масляная кислота,
и ферментируемые углеводы влияют на показатели роста, морфологию кишечника
и характеристики брожения слепой кишки у цыплят-
эр. Пульт. Sci. 94: 2152–2164.
Зауэр, Дж., К. К. Рихтер и Б. Л. Пул-Зобель. 2007. Физиологические
концентрации бутирата благоприятно модулируют гены окислительного
Загружено с https://academic.oup.com/ps/advance-article-abstract/doi/10.3382/ps/pez279/5511234 гостем 05 июня 2019
Диета западного типа влияет на смертность от некротизирующего панкреатита и демонстрирует центральную роль бутирата
Материалы и методы
Мыши
Были приобретены мыши C57BL / 6 в возрасте от шести до восьми недель (Charles River Laboratories International, Wilmington , Массачусетс, США) и помещали в стандартные условия (12-часовой цикл темнота / свет) в течение как минимум 72 часов до проведения каких-либо процедур исследования.Животные имели неограниченный доступ к водопроводной воде и либо к стандартной пищевой диете (SD), либо к WD, которая содержала 60% полиненасыщенных жирных кислот (S3282, Bio-Serv, Флемингтон, Нью-Джерси, США) и не содержала растворимых волокон, как описано ранее. 5 Животных умерщвляли удушением углекислым газом либо через 24 часа, либо через 72 часа после операции, либо после смерти. Кровь брали посредством пункции сердца с последующим асептическим удалением ткани и содержимого поджелудочной железы и слепой кишки. Аликвоты хранили при -80 ° C до анализа.
Мышиная модель билиарного некротизирующего панкреатита
Некротизирующий панкреатит был вызван инфузией протока поджелудочной железы таурохоловой кислотой (ТА), как описано ранее. 6 Подробное описание процедур представлено в дополнительных онлайн-методах.
Лечение
Для перорального приема бутирата масляная кислота (100 мМ, Sigma-Aldrich, Saint-Louis, Missouri, USA) добавлялась в питьевую воду (менялась еженедельно) за 4 недели до процедуры.Для лечения системным ингибитором бутирата или гистондеацетилазы (HDAC) животным внутрибрюшинно вводили 500 мкл бутирата натрия (40 мМ) или трихостатина А (TSA 133 мкг / мл) в стерильном физиологическом растворе через 0, 7 и 14 часов после операции. Контрольным группам вводили 500 мкл стерильного физиологического раствора.
После 23 дней кормления WD было проведено селективное грамотрицательное истощение кишечника (GNGD) путем перорального введения неомицина (100 мг / кг массы тела) и полимиксина B (25 мг / кг массы тела), растворенных в стерильном физиологическом растворе. раз в сутки в течение 5 дней.7 Контрольная группа получала обычную питьевую воду без добавок.
Для трансплантации фекалий свежие фекальные гранулы собирали у мышей C57BL / 6 в возрасте от 6 до 8 недель в физиологическом растворе с конечной концентрацией 50 мг фекалий / мл. Объединенные образцы центрифугировали (100 × g в течение 2 мин) для осаждения крупных частиц и супернатанта, используемого для обработки FMT. Для стерильного фекального фильтрата (SFF) супернатанты собирали и пропускали через фильтры 30, 0,45 и 0,22 мкм (Millipore). В общей сложности 200 мкл FMT или SFF вводили мышам через желудочный зонд, начиная примерно через 1 час после процедуры, а затем каждые 24 часа до умерщвления.
Микроматричный анализ бактериального фенотипа, направленный (короткоцепочечные жирные кислоты) и нецелевой метаболомика
После умерщвления содержимое слепой кишки собирали, быстро замораживали и хранили при -80 ° C до анализа. Для микроматрицы бактериального фенотипа аликвоту хранили в 10% глицерине. Анализ выполняли на планшетах GEN-III Biolog, как описано ранее. Для измерения короткоцепочечных жирных кислот (SCFA) был проведен анализ целевой газовой хроматографии-масс-спектрометрии (ГХ-МС).Ненаправленный анализ ГХ-МС был аннотирован библиотекой RTL метаболитов ГХ-МС Fiehn. Подробные процедуры фенотипического микрочипа и анализа метаболомики представлены в дополнительном онлайн-файле.
Секвенирование ампликона гена 16S рРНК
Микробную ДНК экстрагировали из тканей слепой кишки и содержимого с использованием набора MagAttract PowerMicrobiome DNA / RNA KF. Ампликоны области V4 гена 16S рРНК были сконструированы с использованием пары праймеров 515F / 806R в соответствии с протоколами Earth Microbiome Project (http: // www.earthmicrobiome.org/emp-standard-protocols/16s/). Секвенирование ампликона было выполнено на платформе MiSeq (Illumina, Сан-Диего, Калифорния, США) в Argonne Sequencing Facility, при этом были получены чтения парных концов длиной 150 пар оснований.8 9 Прямые и обратные чтения были объединены с использованием USEARCH V.3.10 Варианты последовательности ампликонов (ASVs). ) были выведены для использования UNOISE V.3, и чтения были затем сопоставлены с набором ASV для определения численности. Таксономия была присвоена с использованием классификатора Ribosomal Database Project (RDP) 11 и базы данных рибосом SILVA12 16S V.132. Группа производителей бутирата на основе таксономии родов была построена на основе таксонов, продуцирующих бутират (дополнительная таблица 1 в Интернете) 13.
Пациенты
Были включены тридцать пять голландских пациентов с прогнозируемым тяжелым ОП (SAP), которые участвовали в исследовании «Профилактика пробиотиками при прогнозируемом тяжелом остром панкреатите» (PROPATRIA) с доступными образцами стула. 14 Пациенты, участвовавшие в этом исследовании, получали либо пробиотики или плацебо после рандомизации. Образцы стула были собраны в течение 72 часов после поступления перед рандомизацией и введением исследуемых продуктов.Тяжесть определялась как SAP (умеренно тяжелая или SAP) или легкая AP (MAP) в соответствии с пересмотренными критериями Атланты. Кроме того, в качестве контрольной группы были включены 15 здоровых некурящих мужчин-добровольцев европеоидной расы, которые участвовали в проекте MISSION-2 (NCT02127749) и не подвергались воздействию антибиотиков в течение последнего года.15 16 образцов стула были собраны и немедленно сохранены. при -20 ° C до дальнейшего анализа. Процедуры выделения ДНК и секвенирования ампликона гена 16S рРНК в образцах стула человека представлены в дополнительных онлайн-методах.
Статистический анализ
Данные анализировали с помощью GraphPad Prism V.8 (Graphpad Software, Сан-Диего, Калифорния, США) или R (R Core Team, https://www.R-project.org/). Если не указано иное, результаты были выражены как среднее ± стандартное отклонение. Непараметрический критерий Манна-Уитни или Стьюдента использовался для проверки статистической значимости в зависимости от распределения нормальности. Пакет функции «DESeq» «DSEeq V.2» использовался для определения значимости относительного количества метаболитов для одномерного анализа метаболомики.17 Дисперсионный анализ (ANOVA) использовался для проверки значимых различий между несколькими группами. Многофакторный дисперсионный анализ с перестановками (PERMANOVA) использовался для групповых сравнений показателей бета-разнообразия с использованием «адониса» из «веганского» пакета.18 Логранговый тест использовался для проверки значимости в кривых Каплана-Мейера (Prism V.8). . Тест значимости, основанный на перекрестной (модельной) проверке с 999 перестановками, использовался для проверки значимых различий между двумя группами для анализа разреженного дискриминантного анализа частичных наименьших квадратов (sPLS-DA) с использованием функции ‘MWA.test »пакета« RVAideMemoire »19.
Результаты
Инфузия TA в проток поджелудочной железы индуцирует ANP, и смертность у мышей, получавших WD.
ANP индуцировали ретроградной инфузией TA в проток поджелудочной железы мышам (фигура 1A). Некротический панкреатит развился в группах панкреатита SD (SD + ANP) и панкреатита WD (WD + ANP), что было подтверждено повышенным уровнем амилазы в сыворотке (рис. 1B). Макроскопический внепанкреатический некроз жира и микроскопический очаговый панкреонекроз наблюдались в обеих группах (рисунок 1C).Гистологические баллы, учитывающие степень некроза, некротическую область и воспаление, как описано ранее6, были сопоставимы у мышей SD + ANP и WD + ANP (фигура 1D). Четыре недели кормления WD сами по себе привели к увеличению массы тела (см. Дополнительный рисунок 1A в Интернете) и незначительному повышению уровня эндотоксина в сыворотке (см. Дополнительный рисунок 1B в Интернете). Индукция ANP привела к значительному увеличению эндотоксина как у мышей, получавших SD, так и у мышей, получавших WD (см. Дополнительный рисунок 1C в Интернете). Тем не менее, 64% смертность (9 из 14) наблюдалась у мышей с панкреатитом WD, тогда как в группе панкреатита SD не наблюдалось смертей (рис. 1E).Это коррелировало с усилением системного воспаления в группе WD + ANP по сравнению с группой SD + ANP, измеренной через 24 часа после операции (рис. 1F, G).
Рисунок 1Западная диета увеличивает смертность и воспаление у мышей с ANP. (А) Мышиная модель острого некротизирующего панкреатита. (B) Уровни амилазы в сыворотке значительно увеличиваются у мышей, которым вводили таурохолат в проток поджелудочной железы (ANP, n = 9), по сравнению с контрольными носителями (физиологический раствор, n = 9) (p = 0,001) или мышами, подвергнутыми имитации операции (n = 5). (р <0.001, тест Манна-Уитни). (C – C ′ ′) Микроскопические (C, C ′) и макроскопические (C ′ ′) гистологические изменения ткани поджелудочной железы мышей, которым вводили носитель (C) или таурохолат (ANP, C ′). Паренхиматозный некроз (C ', стрелка) и внепанкреатический некроз жира у мышей, получавших таурохолат (C' '). (D) Оценка гистологии, адаптированная из критериев Шмидта (p> 0,05 по критерию Манна-Уитни). (E) Кривая Каплана-Мейера для групп мышей, получавших диету SD или WD до индукции некротизирующего панкреатита, показывает повышенную смертность в последней группе (p <0.001 по лог-ранговому тесту). (F и G) Системное воспаление через 24 часа после введения таурохолата (ANP), измеренное с помощью сывороточного IL-6 (F) и сывороточного TNFα (G). (F) n = 5–10, p = 0,036 по непарному t-критерию). (G) n = 5–6 на группу, p = 0,004 по непарному t-критерию). * р <0,05; ** р <0,01; *** р <0,001. ANP, острый некротический панкреатит; SD, стандартная чау-диета; WD, диета западного типа.
Результаты культивирования демонстрируют значительную системную инфекцию у мышей WD + ANP.
Кровь и гомогенизированные ткани поджелудочной железы культивировали на специфических грамотрицательных (MacConkey) и грамположительных (колистин / налидиксовая кислота 5% овечьей крови) планшетах.Наблюдалось значительное увеличение частоты положительных посевов крови в группах WD + ANP по сравнению с группами SD + ANP как для грамотрицательных (p = 0,002, точный тест Фишера), так и для грамположительных (p = 0,035) бактерий (рисунок 2A). Значительное увеличение частоты положительных культур ткани поджелудочной железы наблюдалось только для грамотрицательных бактерий (p = 0,015) (рисунок 2B). Численность (колониеобразующие единицы (КОЕ) / мл крови или КОЕ / мг ткани поджелудочной железы) грамотрицательных бактерий была значительно выше при панкреатите WD (рис. 2C, D).
Рисунок 2Анализ культуры крови и поджелудочной железы у мышей ANP, получавших SD и WD. Частота положительных результатов посева в крови (A) и ткани поджелудочной железы (B). Среды MacConkey использовались для грамотрицательных и колистин / налидиксовая кислота (CNA) 5% агара с овечьей кровью для грамположительных бактерий, n = 7–10 на группу, p = 0,002 грамположительные крови, p = 0,035 грамотрицательные крови. , p = 0,015 для грамотрицательной поджелудочной железы. Плотность бактерий (КОЕ) в крови (C) и поджелудочной железе (D) у мышей в летальной конечной точке (умирающий или 72 часа после операции).Значительные различия были обнаружены для грамотрицательных бактерий между ANP-мышами, получавшими WD и SD (n = 7-10 на группу, p = 0,013 в крови; p = 0,003 в ткани поджелудочной железы по тесту Манна-Уитни). Заболеваемость идентифицированными культивируемыми видами бактерий в крови (E) и ткани поджелудочной железы (F). * р <0,05; ** р <0,01; нс, статистически не значимо. ANP, острый некротический панкреатит; КОЕ - колониеобразующие единицы; SD, стандартная чау-диета; WD, диета западного типа.
При идентификации культивируемых колоний было выявлено Enterococcus faecalis и E.coli как наиболее распространенные грамположительные и грамотрицательные бактерии соответственно (рис. 2E, F). E. faecalis с высокой частотой обнаруживался в крови и ткани поджелудочной железы мышей, получавших как WD, так и SD; однако, E. coli с высокой частотой обнаруживался только у мышей, получавших WD (рис. 2E, F). Заметным было присутствие Lactobacillus sp в ткани поджелудочной железы мышей, получавших SD, но не получавших WD (фигура 2F).
Анализ ампликона гена 16S рРНК микробиоты слепой кишки выявил цветение
Escherichia / Shigella у мышей WD + ANPАнализ бета-разнообразия с помощью взвешенного анализа UniFrac продемонстрировал значительные изменения в составе микробиоты просвета слепой кишки и слизистой оболочки при WD + ANP мышей по сравнению с мышами WD с инфузией физиологического раствора (носителя) (WD + VEH) и мышами SD + ANP (фигура 3A).Напротив, не было значительных различий между мышами, получавшими SD, с аналогичным лечением (фигура 3A). Мыши WD + VEH и WD + ANP имели сопоставимые показатели альфа-разнообразия (измеряемые индексом Шеннона) как в просвете, так и в ткани (рис. 3B), что указывает на то, что WD нарушает микробиоту слепой кишки независимо от инфузии таурохолата поджелудочной железы. Как продемонстрировал индекс Шеннона, альфа-разнообразие было значительно снижено у мышей WD + ANP по сравнению с мышами SD + ANP как по содержанию просвета, так и по тканевой микробиоте (рисунок 3B).Анализ относительной численности на уровне филума выявил глубокое расцветание Proteobacteria в содержимом просвета и ткани мышей WD + ANP (p = 0,004 в ткани слепой кишки и p = 0,002 в содержимом слепой кишки), но не у мышей, получавших SD + ANP ( см. рисунок 3C и дополнительный онлайн-рисунок 2). Индукция ANP с помощью инфузии TA по сравнению с контролем инфузии носителя не влияла на микробиоту у мышей, получавших SD.
Рисунок 3Композиционный анализ (ген 16S рРНК) кишечной микробиоты мышей с острым некротизирующим панкреатитом (ANP).(A) Бета-разнообразие микробиоты содержимого слепой кишки (CE-C) и ткани слепой кишки (CE-T), измеренное с помощью взвешенного UniFrac. Существенная разница в микробном составе наблюдалась в диете западного типа (WD) + ANP ткани слепой кишки по сравнению с WD + VEH (носитель) и стандартной диетой (SD) + ANP (4-7 мышей на группу, p = 0,003 по многовариантной перестановке). Тест дисперсионного анализа). (B) Альфа-разнообразие CE-C и CE-T микробиоты, измеренное с помощью индекса Шеннона. Значительные различия наблюдались в WD + ANP по сравнению с SD + ANP (CE-C: p = 0.009; CE-T: p = 0,0043 по критерию Манна-Уитни). Существенных различий между WD + ANP и WD + VEH не наблюдалось. (C) Относительная численность бактерий на уровне филума. (D) Относительная численность на уровне рода в CE-C и CE-T. (E) Относительная численность рода Escherichia / Shigella в слизистой оболочке слепой кишки (p = 0,015 по критерию Манна-Уитни). * р <0,05; ** р <0,01; нс, статистически не значимо.
На уровне рода Escherichia / Shigella были наиболее многочисленными таксонами в составе слепой кишки (p = 0.016) и ткани (p = 0,004) группы WD + ANP по сравнению с группой SD + ANP (рисунок 3D, E). Достоверных различий по уровню Enterococcus между группами не было.
Функциональное нарушение микробиоты слепой кишки у мышей WD + ANP
Способность микробного сообщества слепой кишки использовать источники углерода и их чувствительность к антимикробным соединениям исследовали с помощью фенотипического анализа на микрочипах. Результаты согласуются с данными о составе на основе 16S рРНК, демонстрирующими ускоренное метаболическое дыхание в аэробных условиях в популяциях кишечных микробов мышей WD + ANP (рисунок 4A).Это не было статистически значимым (p = 0,056 по процедуре перестановки множественных ответов), однако при стратификации для выживаемости общее метаболическое дыхание было значительно увеличено у неживых (p = 0,009). Примечательно, что по сравнению с группой выживших наблюдалось значительное учащение дыхания в присутствии углеводов (тураноза, N-ацетилнейраминовая кислота, миоинозитол, глюкозо-6-фосфат, пектин), производных углеводов (лактон L-галактоновой кислоты, глюкуронамид, слизистая кислота, L -молочная кислота и L-яблочная кислота) и аминокислоты (D-серин, глицил-L-пролин, L-аргинин, L-аспарагиновая кислота, L-гистидин и L-серин) (рисунок 4B и дополнительный рисунок 3A онлайн).Кроме того, сообщества слепой кишки, не связанные с выживанием, были более устойчивы к нескольким антимикробным соединениям, включая антибиотики, такие как тролеандомицин, рифамицин, линкомицин и ванкомицин (см. Дополнительный рисунок 3B в Интернете). Впоследствии влияние повышенной метаболической активности аэробной микробиоты слепой кишки на метаболический профиль просвета было исследовано с помощью нецелевого метаболомического анализа. Анализ ANOVA всех четырех групп продемонстрировал 49 метаболитов, которые по-разному распределялись между различными группами (рисунок 4C).Дискриминантный анализ с использованием разреженных частичных наименьших квадратов (sPLS-DA) продемонстрировал значительные различия метаболомов необработанных (SD и WD) и инфузированных таурохолатом (SD + ANP и WD + ANP) групп (фигура 4D). Одномерный (рисунок 4E и онлайн-дополнительные рисунки 3D, E) анализ продемонстрировал истощение слепой кишки в основном углеводов (D-аллоза, D-ликсоза, метил-бета-D-глюкопиранозид) и обогащение длинноцепочечных жирных кислот (олеиновая кислота, метилолеат). и пальмитолеиновая кислота) в WD + ANP по сравнению с группами SD + ANP (фигура 4E).Примечательно, что у мышей, не получавших лечения, мышей WD было повышено содержание холевой кислоты по сравнению с мышами, получавшими SD (см. Дополнительный рисунок 3C онлайн). Кроме того, уровень рибозы, простого углевода, был повышен у мышей с панкреатитом, независимо от типа диеты (см. Дополнительный рисунок 3D, E). Кроме того, целевой метаболомный анализ SCFAs показал, что ацетат и бутират слепой кишки были значительно истощены (p = 0,040 и p = 0,016, соответственно) у мышей с панкреатитом WD по сравнению с мышами с панкреатитом SD (рис. 5A – C).Таким образом, в этой мышиной модели мыши WD + ANP имели высокий риск летальности из-за системных инфекций, которые коррелировали с появлением E. coli в просвете слепой кишки и слизистой оболочке. Это произошло в сочетании с глубокими изменениями в составе и функции микробиоты слепой кишки, характеризующейся значительным снижением бутирата, аминокислот и углеводов.
Рисунок 4Фенотипический микрочип и нецелевой метаболомический анализ кишечной микробиоты мышей с острым некротизирующим панкреатитом (ANP).(A и B) Микробный фенотипический анализ микроматрицы (Biolog) сообществ слепой кишки с использованием планшетов GENIII, различающихся в зависимости от метаболических субстратов. (A) Тепловая карта анализа микрочипов фенотипа. Статистической разницы между мышами ANP, получавшими стандартную пищевую диету (SD) и западную диету (WD), не наблюдалось (p = 0,056). При стратификации по выживаемости (выжившие и не выжившие) наблюдалось значительное увеличение метаболической активности у не выживших (p = 0,009 с помощью процедуры перестановки множественных ответов). (B) Радиальный график значительных углеводных субстратов, показывающий средние значения с столбцами, представляющими 95% ДИ (p <0.05 по дисперсионному анализу). (C – E) Ненаправленная газовая хроматография-масс-спектрометрия (ГХ-МС), метаболомический анализ содержимого слепой кишки. (C) Тепловая карта дифференциальных метаболитов между четырьмя группами (p <0,05 по дисперсионному анализу). (D) Статистический тест с помощью разреженного дискриминантного анализа методом наименьших квадратов (sPLS-DA), показывающий разницу в метаболитах мышей с панкреатитом WD по сравнению с мышами с панкреатитом SD (p = 0,004) и контрольными мышами WD (p = 0,002 по критерию значимости перестановок) . (E) Однофакторный анализ показывает различия метаболитов слепой кишки между группами SD + ANP и WD + ANP (p <0.1 по результатам анализа DESeq). * р <0,05; ** р <0,01; *** р <0,001.
Рисунок 5Короткоцепочечные жирные кислоты в слепой кишке мышей ANP. (A – C) Целевой анализ газовой хроматографии-масс-спектрометрии содержания слепой кишки для бутирата (p <0,016) (A), ацетата (p = 0,040) (B) и пропионата (p> 0,05) (C), все по непарному t -контрольная работа. * р <0,05; нс, статистически не значимо. ANP, острый некротический панкреатит; SD, стандартная чау-диета; WD, диета западного типа.
Лечение антибиотиками приводит к истощению
E.coli в кишечнике мышей с панкреатитом WD и снижает смертность в этой модели. полимиксин B) два раза в день в течение 5 дней, чтобы истощить кишечник грамотрицательными бактериями (GNGD) (рисунок 6A). Смертность у мышей, получавших антибиотики (GNGD), снизилась с 64% до 17% у мышей WD + ANP (p = 0,048) (рис. 6В), а относительная численность Escherichia / Shigella в ткани слепой кишки значительно снизилась в пяти случаях. из шести мышей (p = 0.132) (рисунок 6C). Ни один из посевов крови не был положительным на грамотрицательные бактерии, и количество КОЕ было значительно снижено (рис. 6D, E). Однако частота положительных посевов крови была немного увеличена по сравнению с группой WD + ANP, не получавшей антибиотики, хотя КОЕ не различалась статистически. У единственной умирающей мыши в группе, получавшей антибиотик, было идентифицировано Enterococcus casseliflavus при КОЕ 6 × 10 8 / мл крови. Рисунок 6Escherichia coli вносит основной вклад в смертность мышей западного типа (WD) + острый некротизирующий панкреатит (ANP).(A) Экспериментальный дизайн для истощения кишечника E. coli . Грамотрицательное истощение кишечника (GNGD) проводилось два раза в день через желудочный зонд с неабсорбируемыми антибиотиками (неомицин 100 мг / л и полимиксин B 10 мг / л). (B) Кривые выживаемости Каплана-Мейера, демонстрирующие совокупную выживаемость между группами лечения WD + ANP (n = 14) и WD + GNGD + ANP (n = 6). Выживаемость была значительно улучшена с помощью GNGD (p = 0,048, лог-ранговый тест). (C) Истощение Escherichia / Shigella в ткани слизистой оболочки слепой кишки у пяти из шести мышей WD + GNGD + ANP, на основании анализа 16S рРНК (p = 0.132 Манна-Уитни). (C и D) Анализ культуры демонстрирует снижение бактериальной нагрузки E.coli в крови. Значительные различия были обнаружены для заболеваемости (n = 6, 0 = 0,007 по точному критерию Фишера) и КОЕ (p = 0,006 по критерию Манна-Уитни) грамотрицательных культур, но не для грамположительных. * р <0,05; ** р <0,01; нс, статистически не значимо.
Трансплантаты фекальной микробиоты (FMT) увеличивают смертность и распространение бактерий у мышей ANP.
Для исследования профилактического эффекта FMT на смертность в этой модели был создан FMT из стула, изгнанного от здоровых мышей.Удивительно, но результаты предварительных экспериментов показали, что FMT увеличивает смертность. Поэтому, чтобы подтвердить это, была создана менее летальная модель ANP путем сокращения дней кормления WD до 14 дней до индукции ANP. Впоследствии, через 1, 24 и 48 часов после хирургической процедуры мышам вводили FMT или стерильный фекальный фильтрат (SFF) через пероральный желудочный зонд и наблюдали за выживаемостью в течение 72 часов после операции (фигура 7A). Смертность была значительно увеличена у мышей с панкреатитом, которые получали FMT, по сравнению с мышами, которые получали SFF (фигура 7B).Бактериальная транслокация увеличивалась с помощью FMT, что продемонстрировано увеличением общего количества КОЕ в культурах ткани поджелудочной железы и увеличением числа как грамотрицательных, так и грамположительных патогенных бактерий (рисунок 7C, D). В крови, хотя статистической разницы в КОЕ не наблюдалось, частота грамположительных культур увеличивалась (см. Дополнительный рисунок 4A, B в Интернете). В отличие от предыдущих экспериментов, произошел сдвиг с E. coli , являющейся преобладающим патогеном в группе SFF, к E.faecalis в группе FMT был замечен в обеих тканях поджелудочной железы в виде крови (рисунок 7E и дополнительный рисунок 4C онлайн). Кроме того, анализ ампликона гена 16S рРНК введенного FMT показывает, что роды трех доминирующих изолированных патогенов ( E. coli , E. cloacae complex и E. faecalis ) составляют только приблизительно 0,02% от общего числа бактерий. (он-лайн дополнительный рисунок 4D), которые присутствуют в FMT.
Рисунок 7Фекальный микробный трансплантат (FMT) у мышей после острого некротизирующего панкреатита (ANP) усугубляет распространение бактерий и ухудшает выживаемость.(A) Экспериментальный дизайн. Мыши, получавшие диету западного типа (WD) в течение 2 недель, получали либо FMT (от здоровых мышей), либо стерильный фекальный фильтрат (SFF), либо носитель (VEH) через желудочный зонд через 0, 24 и 48 часов после индукции ANP. (B) Кривые выживаемости Каплана-Мейера, демонстрирующие значительно меньшую выживаемость с WD + ANP + FMT по сравнению с контрольными мышами, которые получали SFF (WD + ANP + SFF) (p = 0,047 по логарифмическому критерию). (C) Общие колониеобразующие единицы (КОЕ) были увеличены в группе WD + ANP + FMT (p = 0,024 по критерию Манна-Уитни).(D) Частота грамположительных и грамотрицательных культур в поджелудочной железе. Существенных различий не наблюдалось (точный критерий Фишера). (E) Заболеваемость культивируемыми видами бактерий в ткани поджелудочной железы. * р <0,05.
Пероральный и внутрибрюшинный бутират снижает смертность и
диссеминацию E. coli у мышей ANPУчитывая истощение бутирата в кишечнике мышей группы WD + ANP, бутират добавляли в питьевую воду или вводили мышам внутрибрюшинно. инъекция.Бутират, метаболит кишечной микробиоты, является критическим источником углерода для энтероцитов толстой кишки20, 21, что позволяет предположить, что он может защищать от нарушения кишечного барьера. Было продемонстрировано, что бутират усиливает кишечный барьер, регулируя сборку плотных контактов.22 Он также участвует в регуляции патогенеза кишечной микробиоты23, обеспечивая защитную роль от вторжения патогенов.24 Таким образом, добавка бутирата была протестирована на его способность спасать мышей от летального ANP.Дополнительный бутират добавляли либо к питьевой воде (100 мМ) мышей WD, либо вводили внутрибрюшинной инъекцией (500 мкл, 40 мМ), как показано на фигуре 8A. Бутират, содержащийся в питьевой воде (BUTDW), увеличивал концентрацию бутирата в кишечнике (см. Дополнительный рисунок 5A в Интернете). Как пероральное, так и системное лечение значительно увеличивало выживаемость мышей с панкреатитом WD (фигура 8B) с более сильным защитным эффектом, продемонстрированным пероральным бутиратом (n = 9, p = 0,002 для перорального приема и n = 14, p = 0,019 для системного бутирата, лог-ранг). контрольная работа).Уменьшение бактериальной транслокации и проницаемости кишечника было продемонстрировано по снижению уровней эндотоксина в сыворотке (фигура 8C) и распространению грамотрицательных бактерий в крови (фигура 8D) при обоих вариантах лечения бутиратом, однако только пероральный прием бутирата предотвратил инфекцию поджелудочной железы с помощью E. coli (рисунок 8E). Экспрессия генов, участвующих в параклеточных соединениях, была ослаблена у мышей ANP ( CLDN1 , p = 0,016; OCDN , p = 0,032; CHD1 , p = 0.016), которые, напротив, были значительно увеличены при пероральном лечении бутиратом CLDN1 (p = 0,016) и CHD1 (p = 0,032) с тенденцией к увеличению при лечении бутиратом IP (фигура 8F). Анализ 16S рРНК продемонстрировал, что пероральный бутират сдвигает состав микробиоты слепой кишки в сторону WD + VEH контрольного профиля (см. Дополнительный рисунок 5B онлайн) и полностью предотвращает колонизацию просвета слепой кишки и ткани протеобактериями (рисунок 8G и дополнительный рисунок 5C онлайн) и, в частности, Escherichia / Shigella (см. Дополнительный рисунок 5D онлайн).
Рисунок 8Пероральный и системный прием бутирата снижает смертность и распространение бактерий у мышей западного типа (WD) + острый некротизирующий панкреатит (ANP). (A) Бутират добавлялся либо до операции в питьевой воде (BUTDW, 100 мМ) в течение 4 недель, либо системно с внутрибрюшинными инъекциями (BUTIP, 40 мМ, 500 мкл) через 0, 7 и 14 часов после операции. (B) Кривые выживаемости Каплана-Мейера, демонстрирующие значительное снижение смертности при приеме обоих пероральных (WD + ANP + BUTDW, n = 9, p = 0.002) и системного (WD + ANP + BUTIP, n = 14, p = 0,019) добавления бутирата. Кривые выживаемости анализируются с использованием лог-рангового теста. (C) Уровни эндотоксина в сыворотке значительно уменьшаются BUTDW (n = 5, p = 0,003 по Манна-Уитни) и BUTIP (n = 5, p = 0,012 по непарному t-критерию) (D, E) Анализ культуры крови ( D) и поджелудочной железы (E). p = 0,016 грамотрицательных бактерий в BUTIP по сравнению с носителем (VEH) и p = 0,028 в BUTDW по сравнению с VEH в крови (D). p = 0,012 для грамотрицательных бактерий в BUTIP по сравнению с VEH и p = 0,088 для BUTIP по сравнению с VEH в поджелудочной железе (E).(F) Экспрессия генов плотных контактов указывает на повышенную экспрессию CLDN1 (n = 5, p = 0,016) и CHD1 (p = 0,032) в ткани слепой кишки мышей BUTDW по сравнению с необработанной контрольной группой (WD + ANP) . (G) Анализ относительной численности 16S рРНК. Относительная численность на уровне филума, демонстрирующая истощение протеобактерий в группе BUTDW до уровня WD + VEH (p = 0,008 по сравнению с WD + ANP в просвете слепой кишки). Истощение протеобактерий также наблюдалось у мышей WD + ANP + BUTIP, но не достигло статистической значимости.* р <0,05; ** р <0,01; нс, статистически не значимо.
Наконец, мышам вводили TSA, мощный ингибитор HDAC класса I и II с периодом полужизни, сравнимым с бутиратом натрия, после индукции ANP. Обработка TSA не снижала смертность, указывая на то, что системный эффект бутирата на выживаемость не зависел от ингибирования HDAC (см. Дополнительный рисунок 6 в Интернете).
Тип Proteobacteria и роды
Escherichia / Shigella и Streptococcu увеличиваются у пациентов с панкреатитом в связи с уменьшением штаммов, продуцирующих бутират. волонтеры (HV).В исследование были включены 15 пациентов с HV и 35 пациентов с AP, в том числе 26 пациентов с MAP и 9 пациентов с SAP. Анализ 16S рРНК показал, что состав микробиоты групп AP и HV различается (p = 0,001) с уменьшением альфа-разнообразия (p <0,0001) в AP (см. Дополнительный рисунок 7 онлайн). Тип Proteobacteria часто присутствовал у пациентов с панкреатитом (рис. 9A, B) с 13-кратным увеличением по сравнению с HV. На уровне рода было 100-кратное и 10-кратное увеличение для Escherichia / Shigella (рисунок 9C, D) и Streptococcus (рисунок 9E), соответственно.Наиболее важно, что продуцирование бутирата было значительно снижено у пациентов с ОП (как MAP, так и SAP) по сравнению с контрольным HV (в два раза) (рисунок 9F). Рисунок 9Анализ 16S рРНК образцов человека. (A) Относительное количество микробиоты на уровне филума в фекалиях 15 здоровых добровольцев (HV) и 36 пациентов с острым панкреатитом (AP), включая 26 пациентов с легким AP (MAP) и девять пациентов с тяжелым AP (SAP). (B) Протеобактерии были значительно увеличены в AP по сравнению с HV (p = 0.0002). Никаких различий между MAP и SAP не наблюдалось (p = 0,224, оба по критерию Манна-Уитни). (C) Относительная численность микробиоты на уровне рода. Blautia , Akkermansia и Escherichia / Shigella были среди доминирующих видов в MAP, а Escherichia / Shigella, Enterococcus и Streptococcus — у пациентов с SAP. У двух пациентов с SAP на уровне рода наблюдалось сообщество, близкое к монокультурному ( Enterococcus и Streptococcus ), как указано стрелками.(D) Относительная численность Escherichia / Shigella
была значительно увеличена в AP по сравнению с HV (p <0,001). Никаких различий между MAP и SAP (p = 0,540, оба по критерию Манна-Уитни). (E) Относительная численность Streptococcus была значительно увеличена в AP по сравнению с HV (p = 0,003) и в SAP по сравнению с MAP (p = 0,047, оба теста Манна-Уитни). (F) Относительное количество продуцентов бутирата было значительно снижено у пациентов с AP по сравнению с HV (p <0.001). При стратификации по степени тяжести не было обнаружено статистической разницы между MAP и SAP (p = 0,100, оба по непарному t-критерию). * р <0,05; ** р <0,01; *** p <0,001, нс, статистически недостоверно.Обсуждение
Среди пациентов с ОП вторичная инфекция железы с некрозом является потенциально смертельным клиническим осложнением, которое обычно требует радиологического, эндоскопического или хирургического вмешательства.25–27 Несмотря на недавние достижения в лечении инфицированного некротизирующего панкреатита, такие как поэтапный подход38 и минимально инвазивные эндоскопические процедуры29 — это все еще опасное для жизни состояние с высокой заболеваемостью и смертностью, требующее длительного госпитализации — и госпитализации в интенсивной терапии.30 На сегодняшний день не существует эффективных профилактических стратегий для предотвращения инфекционных осложнений при ОП. Настоящее исследование продемонстрировало, что вызванные диетой нарушения микробиоты кишечника усугубляли инфекции при экспериментальном некротизирующем панкреатите, о чем свидетельствовало усиление бактериального распространения, системного воспаления и смертности у мышей, получавших WD, по сравнению с контрольными мышами, получавшими SD. Эти результаты были связаны с уменьшением бактериального разнообразия и способности кишечной микробиоты продуцировать бутират.Удивительно, но лечение фекальными трансплантатами (FMT) увеличивало смертность и бактериальную транслокацию, возможно, из-за известного изменения кишечной проницаемости у пациентов31 и животных моделей AP.32–36. члены непосредственно входят в проток поджелудочной железы. Предыдущие исследования показали, что введение бактерий в желудочный зонд может вызвать заражение поджелудочной железы через рефлюкс в проток поджелудочной железы.37 Хотя это, безусловно, возможно в настоящем исследовании, учитывая низкую относительную численность контаминирующих патогенов поджелудочной железы, присутствующих в введенном FMT, По сравнению с чрезвычайно высокой дозой, использованной в исследовании Пушалкара, этот механизм кажется менее вероятным.Альтернативное объяснение неспособности FMT защитить в этой модели может быть функцией известных нарушений в микросреде кишечника, созданной WD, и, следовательно, могло повысить вирулентность вводимых патогенов, присутствующих в FMT. Необходимы дальнейшие эксперименты, чтобы прояснить механизм, с помощью которого FMT ухудшил результат в этой модели.
Напротив, добавление бутирата — как пероральное профилактическое лечение, так и системное лечение постпанкреатита — показало защитный эффект с явным снижением распространения бактерий, уровней эндотоксина в сыворотке и смертности, а также увеличением экспрессии генов, участвующих в параклеточных (плотных) контактах. .Бутират способствует усилению кишечного барьера38, предотвращая распространение бактерий и проникновение эндотоксинов. Кроме того, бутират может усиливать механизмы иммунного клиренса на системном уровне посредством фактора регуляции интерферона 3 (IRF3), как было недавно продемонстрировано39.
Ранее мы показали, что на моделях острого физиологического стресса как на людях, так и на мышах, микробиом кишечника резко изменяется по составу и функциям, что приводит к значительной потере анаэробных популяций (> 90%), истощению SCFAs (> 90%). ) и чрезмерный рост Proteobacteria (т. е. E.coli ) .5 39–41. Наши текущие данные показывают, что обогащение рибозы, субстрата, который может служить единственным источником энергии для E. coli , 42, независимо от диеты, может частично объяснить чрезмерный рост E. coli в желудочно-кишечном тракте в организме. наша модель. Однако точные механизмы этой реакции остаются неизвестными и исследуются.
Это исследование согласуется с растущим количеством доказательств, демонстрирующих защитную роль здоровой кишечной микробной экосистемы в защите как от эндогенной микробиоты с низкой численностью, которая может цвести в таких условиях, как ANP, так и от вторжения экзогенных патогенов.5 43–45 Бутират, SCFA, продуцируемый кишечными комменсалами, является основным источником энергии для колоноцитов, в отличие от длинноцепочечных жирных кислот, которые используются плохо.46 Наше исследование показало очень значительное истощение SCFAs, углеводов и аминокислот. , которые связаны с кормлением WD и ANP. Напротив, наблюдалось увеличение содержания длинноцепочечных жирных кислот олеиновой кислоты, метилолеата и пальмитолеиновой кислоты. Основываясь на этих результатах, можно предположить, что недостаток пригодных для использования метаболических субстратов и увеличение количества желчных кислот приводят к атрофии, воспалению и повышенной кишечной проницаемости.Обеспечение критически важным источником энергии, вероятно, способствует ослаблению распространения бактерий и смертности, которые наблюдались при добавлении бутирата. Это подтверждается недавними данными, которые показывают, что пероральный прием бутирата частично обращает вспять повышенную проницаемость кишечника и дисбактериоз, вызванные кормлением WD с высоким содержанием жиров (47, 48).
Недавние исследования показали, что SCFAs могут обеспечивать защиту от колита Clostridium difficile 49 и колонизации Salmonella 50 и Candida albicans .51 Бутират регулирует функцию макрофагов посредством ингибирования HDAC и подталкивает их к антимикробному фенотипу во время созревания. 24 52 Эти иммунологические антимикробные эффекты, опосредованные ингибированием HDAC, могут лежать в основе механизма ослабления ANP системным бутиратом в нашей модели. Однако лечение TSA, мощным ингибитором HDAC, не обеспечило защиты в нашей модели. Селективность бутирата и TSA в отношении HDAC различается, что подтверждается тем фактом, что эпителиальные клетки кишечника по-разному реагируют на их присутствие.Другое объяснение — это дополнительное влияние бутирата на иммунный ответ, проницаемость кишечника и локально на микробиоту кишечника. Однако необходимы дальнейшие исследования, чтобы полностью исключить положительный эффект ингибиторов HDAC в этой модели.
В настоящем исследовании была сделана попытка определить роль микробиоты и их метаболитов в патогенезе ПНП и вторичной инфекции поджелудочной железы. Кроме того, добавление нескольких антибиотиков этим пациентам в течение длительного периода болезни может добавить к уже существующему состоянию, которое приводит к появлению микроорганизмов с множественной лекарственной устойчивостью, что усложняет общее течение болезни.В 1995 году Луитен и др. 53 опубликовали клиническое исследование, в котором 102 пациента с SAP рандомизировали для стандартного лечения или стандартного лечения селективными пероральными обеззараживающими агентами для грамотрицательных бактерий (норфлоксацин, колистин, амфотерицин, цефотаксим) и показали снижение смертности и инфекций в группе лечения. Хотя это кажется эффективным, механизм действия селективной деконтаминации пищеварительной системы при AP остается плохо описанным. Однако увеличение числа грамположительных инфекций кровотока в этом исследовании демонстрирует возможность классического сценария компромисса с чрезмерным использованием антибиотиков.Селективное давление на малочисленные грамположительные патогены может вызвать чрезмерный рост этих патогенов, вызвать множественную лекарственную устойчивость и непреднамеренно вызвать летальные инфекции. Это указывает на очевидную потребность в терапии, регулирующей микробиоту, которая поддерживает нативные комменсальные микробные сообщества, в отличие от антибиотиков, которые вызывают патобионтов с множественной лекарственной устойчивостью.
Недавно Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США выпустило предупреждение о безопасности использования FMT после сообщений о серьезных побочных эффектах, в том числе об одной смерти, из-за инфекций, вызванных бактериями с множественной лекарственной устойчивостью.54 Наши результаты также указывают на необходимость крайней осторожности при рассмотрении вопроса о введении живых бактерий в клинических или экспериментальных условиях этой популяции тяжелобольных пациентов. Терапевтическое использование так называемых постбиотиков — бактериальных метаболитов или компонентов, которые высвобождаются при лизировании бактерий — становятся все более популярными целями из-за их потенциальной эффективности и полезного профиля безопасности.55 56
Таким образом, результаты настоящего исследования предоставляют убедительные доказательства того, что диета и ее взаимодействие с кишечной микробиотой могут иметь глубокое влияние на течение и исход ANP.Результаты этого исследования также определяют пределы и риски использования FMT и антибиотиков для предотвращения смертности от ANP у мышей WD. Новые подходы к предотвращению прогрессирования пациентов с клиническим панкреатитом в инфицированный панкреонекроз могут быть проинформированы этим исследованием, которое предполагает, что доступность питательных веществ — среди других постбиотиков, таких как бутират — для микробиоты, может быть более рациональной стратегией.
Бутират натрия в рационе свиноматок: продуктивность, состав молока и помет — отвлечения свиней
Масляная кислота (C4: 0) представляет собой короткоцепочечную жирную кислоту, вырабатываемую естественным путем микробной ферментацией в толстом кишечнике животных.Это связано с улучшением продуктивности животных, поскольку подавляет колонизацию и размножение патогенных микроорганизмов и улучшает целостность слизистой оболочки кишечника. Однако из-за его характеристик, его включение в рационы свиней происходит в виде бутирата, причем бутират натрия является наиболее часто используемой формой. Целью настоящего исследования было оценить добавление бутирата натрия в рацион свиноматок от смешанного потомства во время лактации, а также их репродуктивную способность, состав молока и показатели помета.С этой целью в общей сложности 192 свиноматки были распределены по полностью рандомизированной схеме в факторной схеме 4 × 4, с учетом 4 экспериментальных рационов и 4 групп по порядку родства (1-я, 2-я, 3-я и 4-я, 5-я — 7-я), всего 16 обработок с 12 повторами в каждой, рассматривая каждую свиноматку и ее помет как экспериментальную единицу. Экспериментальные диеты состояли из: диеты без бутирата натрия (1), диеты с 0,1% (2) и 0,2% (3) бутирата натрия, покрытого оболочкой, и диеты с 0,066% бутирата натрия без покрытия (4).
В результате добавление бутирата натрия в рацион не повлияло на репродуктивную функцию свиноматок и продуктивность поросят в период лактации. Однако на вес тела при опоросе и отъеме, среднесуточное потребление корма и расчетную суточную молочную продуктивность свиноматок оказали влияние приказы о паритете, у свиноматок с 5-й по 7-ю паритетность была самая высокая продуктивность. Аналогичные результаты наблюдались по весу помета через 48 часов после опороса и при отъеме, а также по суточному привесу помета.Более того, наблюдалась взаимосвязь между добавлением бутирата натрия и порядком четности каприловой, миристиновой и арахидоновой кислот в молоке свиноматок. На масляную кислоту в молоке влияли диетические добавки бутирата натрия и нормы паритета.
Был сделан вывод, что добавление к рациону бутирата натрия с покрытием и без покрытия для кормящих свиноматок изменило профиль жирных кислот молока, но не повлияло ни на продуктивность свиноматки, ни на продуктивность их потомства во время лактации.Кроме того, свиноматки с 5-го по 7-й опороса показали лучшую продуктивность и более тяжелый помет через 48 часов после опороса и при отъеме по сравнению с первородящими свиноматками.
Виейра, Э. Х. М., Ватанабе, П. Х., Андраде, Т. С., Араужо, Г. Г. А., Сильва, Б. А. Н., Пиньейру, Р. Р. С., и Мендонса, И. Б. (2020). Пищевая добавка бутирата натрия для свиноматок смешанного оплодотворения в период лактации.

