Интерферон альфа 2б человека | Научно-технологический центр «Биоинвест»
Описание
Интерфероны (ИФН) – обширная группа цитокинов, сходных между собой в структурном и функциональном отношении, которые обычно продуцируются клетками организма в ответ на вирусное заражение. Общим свойством всех известных сегодня видов интерферонов (альфа-, бета-, гамма-, эпсилон-, омега-, лямбда- и др.) является наличие у них противовирусной, антипролиферативной (способности подавлять размножение клеток) и иммуномодулирующей (способности влиять на состояние иммунной системы организма) активности.
Основным источником интерферона типа альфа в организме являются лейкоциты, в связи с чем его обычно называют «лейкоцитарным» интерфероном. У большинства млекопитающих альфа-ИФН кодируется целым семейством генов, образуя соответствующее семейство «продуктов» (подтипов ИФН-альфа), которых у человека известно порядка 20.
Наиболее широко используемыми в медицинской практике сегодня являются интерфероны человека, относящиеся к подтипу альфа-2, и особенно альфа-2b.
Лекарственные препараты на основе природного или рекомбинантного чИФН-альфа2b применяются в терапии таких вирусных заболеваний, как острый и хронический гепатит В, хронический гепатит С, грипп и острые респираторно-вирусные инфекции, клещевой энцефалит, конъюнктивит, кератит, кератоконъюнктивит, цитомегаловирусная инфекция, герпесвирусная инфекция, папилломатоз, гнойно-септические послеоперационные осложнения; широко используются в онкологии, в частности при лечении лимфобластного лейкоза, волосатоклеточного лейкоза, кожной Т-клеточной лимфомы, злокачественной меланомы, множественной миеломы, саркомы Капоши на фоне ВИЧ-инфекции, почечно-клеточной карциномы и других.
Характеристики
- Источник: Е.coli
- Молекулярная масса: 19,3 кДа
- Чистота по ВЭЖХ: не менее 95 %
- Бактериальные эндотоксины: не более 100 ЕЭ/мг
- Белки штамма-продуцента: не более 200 нг/мг
- Активность: не менее 1,4*108 МЕ/мг
Препарат соответствует требованиям Европейской Фармакопеи (INTERFERON ALFA-2 CONCENTRATED SOLUTION).
ИММУНОМОДУЛИРУЮЩЕЕ ДЕЙСТВИЕ ПРЕПАРАТОВ ИНТЕРЛЕЙКИНА-2 И ИНТЕРФЕРОНА-АЛЬФА В КОМБИНАЦИИ С СЕАНСАМИ ОБЩЕЙ ГИПЕРТЕРМИИ НА ЭТАПАХ ИНТЕНСИВНОЙ ХИМИОТЕРАПИИ У ДЕТЕЙ С ДАЛЕКО ЗАШЕДШИМИ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ | Исмаил-заде
1. Буглова С.Е., Исмаил-заде Р.С., Савицкий В.П., Жаврид Э.А., Белевцев М.В., Потапнев М.П. Иммуномодулирующий эффект термохимиотерапии с ронколейкином при лечении далеко зашедших злокачественных опухолей у детей // Иммунология, 2003. — N2. — С. 107-110.
2. Зеленина Н.В., Андреева Л.И., Горянчук В.В. Действие непродолжительного умеренного нагревания организма здорового человека на периферические лимфоциты // Цитология, 2000. — №42 (2). — С.166-169.
3. Исмаил-заде Р.С., Буглова С.Е., Белевцев М.В. Иммунный статус больных с распространенными злокачественными опухолями при лечении с использованием общей гипертермии // Материалы международного научного форума “ Онкология на рубеже ХХI века. Возможности и перспективы”. — Москва, 1999. — C. 144-145.
Возможности и перспективы”. — Москва, 1999. — C. 144-145.
4. Исмаил-заде Р.С., Буглова С.Е., Потапнев М.П., Сачивко Н.В., Семенов А.С., Рудько В.С., Шман Т.В., Жаврид Э.А. Термохимиотерапия при рефрактерных и далеко зашедших злокачественных опухолях у детей// Вопр. онкол. — 2002. — №48(3). — С. 351-355.
5. Карев И.Д., Родина А.А., Карева А.И. Общая гипертермия (42,0-43,4°С) в лечении больных с саркомами мягких тканей // Рос. онкол журн. — 2003. — N 6. — С. 29-32.
6. Курпешов О.К., Цыб АФ., Мардынский Ю.С., Бердов Б.А. Механизмы развития и пути преодоления химиорезистентности опухолей // Рос. онкол. журнал. — 2003. — N 3. — С.50-53.
7. Kiss C., Kiss M., Szegedi I., Arvai K. , Toth J., Olah E. Interferon-alpha therapy in children with malignant disease: clinical experience in twenty-four patients treated in a single pediatric oncology unit // Med. Pediatric Oncol. — 2002. — Vol.39. — P.115-119.
, Toth J., Olah E. Interferon-alpha therapy in children with malignant disease: clinical experience in twenty-four patients treated in a single pediatric oncology unit // Med. Pediatric Oncol. — 2002. — Vol.39. — P.115-119.
8. Oldham R.K. Principles of Cancer Biotherapy // Kluwer Academic Publishers. — 2003. — P. 230 c.
10. Atanackovic D., Nierhause A., Neumeier M., Hossfeld D.K., Hegewish-Becker S. 41,8°С Whole body hyperthermia as an adjunct to chemotherapy induces prolonged T cell activation in patients with various malignant diseases // Cancer. Immunol. Immunother. — 2002. — Vol. 51. — P.603-613.
51. — P.603-613.
11. Blazickova S., Rovensky J, Koska J, Vigas M. Effect of hyperthermic water bath on parameters of cellular Immunity // Int. J. Clin. Pharmacol. Res. — 2000. — Vol.20(1-2). — P.41-46.
12. Dieing A., Ahler O., Kerner T., Wust O., Felix R., Loffel J., Riess H., Hildebrandt B. Whole body hyperthermia induces apoptosis in subpopulation of blood lymphocytes // Immunobiology. — 2003. — 207(4). — P. 265-273.
13. Flow Cytometry: A Practical Approach / Ed. M.G.Ormerod- 2-nd Ed. – New York. 1994.
14. Hegewisch-Becker S., Nierhause A., Panse J., WiedemannG., Hossfeld D.K. Whole body hyperthermia has a stimulatory effect оn the immune cell activity in cancer patients // Ann. Oncol. — 1998. — Vol.9. — P.653.
Oncol. — 1998. — Vol.9. — P.653.
15. Hildebrandt B.,Wust T., Ahlers O., Dieing A., Sreenivisa G., Kerner T., Felix R., Riess H. The cellular and molecular basis of hyperthermia // Crit. Rev. Oncol. Hematol. — 2002. — Vol.43. — P.33-56.
16. Hammami M.M., Bouchama A., Shail E., Aboul-Enein H.Y., Al-Sedairy S. Lymphocyte subsets and adhesion molecules expression in heat stroke and heat stress // J. Appl. Physiol. — 1998. — Vol.84. — P.1615-1621.
17. Kappel M., Poulsen T.D., Hansen M.B., Gabbo H., Pedersen B.K. Somatostatin attenuates the hyperthermia induced increase in neutrophil concentration // Europ. J. Appl. Physiol. — 1998. — Vol. 77(1-2). — P.149-156.
18. Katschinski D. M., Wiedemann G.J. Longo W., d’Oleire F.R., Spriggs D., Robins H.I. Whole body hyperthermia cytokine induction: a review, and unifying hypothesis for myeloprotection in the setting of cytotoxic therapy // Cytokine Growth Factor Rev. — 1999. — Jun; 10 (2). — P. 93-97.
M., Wiedemann G.J. Longo W., d’Oleire F.R., Spriggs D., Robins H.I. Whole body hyperthermia cytokine induction: a review, and unifying hypothesis for myeloprotection in the setting of cytotoxic therapy // Cytokine Growth Factor Rev. — 1999. — Jun; 10 (2). — P. 93-97.
19. Kearns R.J., Ringler S., Krakowka S. Talmann R., Sites J., Oglesbee M.G. The effects of extracorporal whole body hyperthermia on the functional and phenotypic features of canine peripheral blood mononuclear cells (PBMC) // Clin. Exp. Immunol. — 1999. — Apr; 116(1). — P.188-192.
20. Oglesbee M.J., Diehl K, Krawford E, Kearns R.J, Krakowka S. Whole body hyperthermia: effects upon canine immune and hemostatic functions // Vet Immunol Immunopathol. — 1999. -Aug 2. — Vol.69(2-4). — P.185-199.
21.
22. Robins H.I., Kutz M., Wiedemann G.J., Katschinski D.M., Paul D., Grosen E., Tiggelaar G.L., Spriggs D., Gillis W., d’Oleire F.R. Cytokine induction by 41.8 degrees C whole body hyperthermia // Cancer Lett. — 1995. — Nov 6. — Vol.97(2). — P.195-201.
РАЗРАБОТКА И ВАЛИДАЦИЯ МЕТОДИКИ ОПРЕДЕЛЕНИЯ ИММУНОГЕННОСТИ ПРЕПАРАТА ИНТЕРФЕРОНА АЛЬФА-2A | Митюшова
1. S.A. Stifter, C.G. Feng. Interfering with immunity: detrimental role of type I IFNs during infection // Journal of Immunology. 2015. V. 194. P.
2. L. Grine, L. Dejager, C. Libert, R.E. Vandenbroucke. An inflammatory triangle in psoriasis: TNF, type I IFNs and IL-17 // Cytokine & Growth Factor Reviews. 2015. V. 26. P. 25-33.
3. Ю.А. Вавиленкова. Современные представления о системе интерферона // Вестник Смоленской государственной медицинской академии. 2012. Т. 11(2). С. 74-82.
4. И.Г. Никитин. Пегилированные интерфероны-альфа: новые возможности лечения хронического гепатита С // Фарматека. 2002. Т. 9. С. 4.
5. I. Garcia, P.A. Prats, M. Cervantes et al. Factors that influence the immunogenicity of human recombinant interferon alpha-2b in mice // Biotechnologia Applicada. 2002. V. 19. P.15-18.
6. R.S. Yalow, S.A. Berson. Immunoassay of endogenous plasma insulin in man // Journal of Clinical Investigation. 1960. V.39. P. 1157-1175.
R.S. Yalow, S.A. Berson. Immunoassay of endogenous plasma insulin in man // Journal of Clinical Investigation. 1960. V.39. P. 1157-1175.
7. М. Тертон, Д.Р. Бангхем, К.А. Колкотт. Новые методы иммуноанализа. — М.: Мир. 1991. 280 c.
8. Иммунологические методы / Под ред. Г.Фримеля. — М.: Медицина. 1987. 472 с.
9. ELISA Instruction Manual (Cloud Clone Corp). URL: http://www.cloud-clone.us/manual/ELISA-Kit-for-Immunoglobulin-G-(IgG)-E90544Mu.pdf (Дата обращения 24.11.2015).
10. М.В. Шестакова, О.К. Викулова. Биосимиляры: презумпция «виновности» // Сахарный диабет. 2011. № 4. С. 91-99.
11. P. Tagliaferri, P. Tassone, S. Blotta et al. Antitumor therapeutic strategies based on the targeting of epidermal growth factor-induced survival pathways // Cancer Immunology, Immunotherapy. 2005. V.54. P.1-10.
Tassone, S. Blotta et al. Antitumor therapeutic strategies based on the targeting of epidermal growth factor-induced survival pathways // Cancer Immunology, Immunotherapy. 2005. V.54. P.1-10.
12. Directive 2010/63/EU of 22/09/2010 Guide for the care and use of laboratory animals 8th edition. National Academy of Sciences. Washington, D.C. 2010.
13. Руководство по валидации методик анализа лекарственных средств. — М.: Министерство здравоохранения и социального развития РФ. 2007. 49 с.
14. M. Deutsch, S.J. Hadziyannis. Old and emerging therapies in chronic hepatitis C: an update // Journal of Viral Hepatitis. 2008. V.15. P.2-11.
15. G.V. Papatheodoridis, S. Manolakopoulos, A. J. Archimandritis. Current treatment indications and strategies in chronic hepatitis B virus infection // World Journal of Gastroenterology. 2008. V.14. P.6902-6910.
J. Archimandritis. Current treatment indications and strategies in chronic hepatitis B virus infection // World Journal of Gastroenterology. 2008. V.14. P.6902-6910.
16. Guidance for Industry: Bioanalytical method validation. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evolution and Research (CDER). U.S. Government Printing Office: Washington, DC, 2001.
17. Валидация методов контроля химических и физико-химических показателей качества МИБП: порядок проведения и представления результатов. Методические указания. МУ 3.3.2.1886-04. 2004.
18. Н.В. Свежова, Д.Б. Шаркова, В.А. Громов и др. Методы математической обработки данных в иммуноферментном анализе // Клиническая лабораторная диагностика. 2008. №1. С. 3-9
19. А.М. Егоров, А.П. Осипов, Б.Б. Дзантиев, Е.М. Гаврилова. Теория и практика иммуноферментного анализа. — М.: Высшая школа. 1991. 288 с.
А.М. Егоров, А.П. Осипов, Б.Б. Дзантиев, Е.М. Гаврилова. Теория и практика иммуноферментного анализа. — М.: Высшая школа. 1991. 288 с.
Аналитическая справка по доклинической и клинической разработке аналогичных лекарственных препаратов, содержащих рекомбинантный интерферон альфа
Аналитическая справка по доклинической и клинической разработке аналогичных лекарственных препаратов, содержащих рекомбинантный интерферон альфаNon-clinical and clinical development of similar medicinal products containing recombinant interferon alpha
В настоящей аналитической справке рассмотрены вопросы доклинической и клинической разработки лекарственных препаратов, содержащих рекомбинантный интерферон альфа, заявленных как аналогичные ранее зарегистрированному такому препарату.
Лечение вирусных гепатитов непэгилированными рекомбинантными интерферонами альфа на сегодняшний день не является стандартом лечения в Европейском союзе. В настоящей аналитической справке представлены некоторые принципы, применимые к разработке аналогичных биологических лекарственных препаратов, содержащих рекомбинантный интерферон альфа, и в дальнейшем упоминаемых как интерферон альфа.
В настоящей аналитической справке представлены некоторые принципы, применимые к разработке аналогичных биологических лекарственных препаратов, содержащих рекомбинантный интерферон альфа, и в дальнейшем упоминаемых как интерферон альфа.
В доклиническом разделе представлены принципы сравнительной фармако-токсикологической оценки, а клиническом — требования к исследованиям сравнительной фармакокинетики, фармакодинамики, эффективности и безопасности, а также плану управления рисками.
Интерфероны альфа-2a и 2b — хорошо известные и охарактеризованные белки, состоящие из 165 аминокислот. Молекулярная масса негликозилированного белка составляет порядка 19 240 Да. Он содержит два дисульфидных мостика: один между остатками цистеина в 1-ом и 98-ом положениях, второй — между остатками цистеина в 29-ом и 138-ом положениях. Последовательность содержит участки потенциального O-гликозилирования. Для описания свойств белка разработаны физико-химические и биологические методы.
Рекомбинантные интерфероны альфа-2a и 2b разрешены к медицинскому применению по целому ряду показаний: вирусные гепатиты B и C, лейкоз, лимфома, почечно-клеточный рак и множественная миелома. Клиническое применение интерферонов альфа-2a и 2b различается. Интерферон альфа применяется как в монотерапии, так и в составе комбинированной терапии. Интерферон альфа может вызывать несколько фармакодинамических эффектов. Относительная важность этих эффектов в зависимости от показаний к применению неизвестна. Применение интерферонов альфа-2a и 2b по онкологическим показаниям, в целом, значительно сократилось; на замену им пришли другие методы лечения.
Клиническое применение интерферонов альфа-2a и 2b различается. Интерферон альфа применяется как в монотерапии, так и в составе комбинированной терапии. Интерферон альфа может вызывать несколько фармакодинамических эффектов. Относительная важность этих эффектов в зависимости от показаний к применению неизвестна. Применение интерферонов альфа-2a и 2b по онкологическим показаниям, в целом, значительно сократилось; на замену им пришли другие методы лечения.
В зависимости от показаний к применению доза и режим дозирования, необходимые для достижения терапевтического эффекта, сильно различаются.
Интерферон альфа чаще всего вводят путем подкожных инъекций, однако возможны внутримышечный и внутривенный пути введения. При лечении интерферонами альфа-2a и 2b возникает ряд нежелательных реакций, включая гриппоподобный синдром, утомляемость и миалгию. К тому же интерферон альфа может вызывать психические, гематологические и почечные нежелательные реакции.
Лечение интерферонами альфа-2a и 2b может приводить к формированию аутоантител.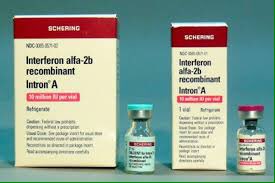 При применении интерферона альфа наблюдались различные иммуноопосредованные нарушения, включая заболевания щитовидной железы, ревматоидный артрит, системную красную волчанку, нефропатии и васкулит.
При применении интерферона альфа наблюдались различные иммуноопосредованные нарушения, включая заболевания щитовидной железы, ревматоидный артрит, системную красную волчанку, нефропатии и васкулит.
После введения интерферона альфа обнаружены как нейтрализующие, так и не обладающие такой способностью антитела.
В настоящей препарат-специфичном аналитической справке отражены современные подходы к проведению доклинических и клинических исследований, необходимых для подтверждения сопоставимости двух лекарственных препаратов, содержащих рекомбинантный непэгилированный интерферон альфа; оно неразрывно связано с требованиями, изложенными в фармацевтическом законодательстве ЕС и прочих применимых руководствах КМЛП (см. ссылки).
Директива 2001/83/EC в действующей редакции и часть II Дополнения I Директивы 2001/83/EC в действующей редакции.
Полный текст документа доступен после покупки в личном кабинете.
Библиотека PharmAdvisor даёт вам доступ к действующим нормативно-правовым актам, а также научным и административным руководствам ICH, EC, EMA, FDA. Они хорошо и точно переведены на русский язык, их современная реализация позволяет работать с ними когда вам удобно.
Они хорошо и точно переведены на русский язык, их современная реализация позволяет работать с ними когда вам удобно.
Где можно посмотреть примеры переводов?
В открытом доступе много полноценных документов.
Существуют ли скидки для учебных заведений?
Да, мы предоставляем скидки студентам и учебным заведениям. Пожалуйста, напишите нам по электронной почте с запросом.
Какие существуют способы оплаты кроме кредитной карты?
Мы принимаем различные способы оплаты, включая безналичный перевод, PayPal и наличными курьеру.
В каком формате предоставляются руководства?
При заказе вы получаете моментальный и неограниченный доступ к купленным документам в личном кабинете через специальный интерфейс. Обратите внимание, что для покупки целого пакета документов PharmAdvisor необходимо связаться с нами.
Другие вопросы?
Пишите на [email protected]
Ученые раскрыли тайну феномена устойчивости к заражению COVID-19
Российские ученые установили три фактора иммунной защиты организма от коронавирусной инфекции, благодаря чему некоторые люди не заражаются COVID-19, даже тесно контактируя с больными.
— Повышенной защитой обладают люди с высоким уровнем интерферона альфа, с высоким содержанием лимфоцитов в крови и носители некоторых генетических маркеров, — заявил aif.ru директор НИИ эпидемиологии и микробиологии имени Пастера, академик РАН Арег Тотолян.
Альфа-интерферон -это главный противовирусный белок, который препятствует проникновению вируса в клетки организма. Препарат широко используется в лечении больных гепатитом С.
С учеными из Санкт-Петербурга солидарны их коллеги из Москвы.
— В 2020 году под нашим наблюдением находилось более двух тысяч таких больных (гепатитом С). Что интересно, ни у одного из них не было подтвержденных случаев COVID-19. Это, конечно, не строгое исследование, проведенное по канонам доказательной медицины, а просто клиническое наблюдение. Но удивительно, что среди такого большого количества пациентов не было коронавирусной инфекции. И первая причина, объясняющая это, — высокий уровень альфа-интерферона в их организме из-за того, что его вводили в качестве препарата, — рассказывает доктор медицинских наук, профессор Сеченовского университета Алексей Буеверов.
При этом медики отмечают, что обнаруженные факторы повышенной защиты организма от COVID-19 требуют более тщательного изучения.
— Если все подтвердится, это будет очень хорошей новостью для многих пациентов, вынужденных лечиться альфа-интерфероном. Но назначать такие инъекции для профилактики здоровым людям нецелесообразно и очень дорого, — говорит Буеверов.
Кстати
В январе 2021 года ученые под руководством Антонио Боньянни из Миланского университета установили, почему жители острова Джильо не восприимчивы к COVID-19. Иммунитет островитян к SARS-CoV-2 мог быть клоном Т-лимфоцитов CD4, реагирующим на антигены эндемичных коронавирусов, вызывающих простуду.
учёные исследовали связь простуды, интерферона и COVID-19 — РТ на русском
Исследователи из США проследили связь между обычной простудой, интерферонами и коронавирусом. Они выяснили, что воздействие риновируса, наиболее частой причины простуды, может защитить от заражения COVID-19. В ходе эксперимента обычный респираторный вирус активировал иммунную систему и способствовал выработке интерферона, который прекратил размножение коронавируса в инфицированных тканях дыхательных путей. Использование препаратов интерферона для предотвращения и лечения вирусных заболеваний было известно ещё советским учёным, подтвердил в беседе с RT академик РАН Александр Караулов. При этом он напомнил, что лучшим средством противовирусной профилактики была и остаётся массовая вакцинация.
В ходе эксперимента обычный респираторный вирус активировал иммунную систему и способствовал выработке интерферона, который прекратил размножение коронавируса в инфицированных тканях дыхательных путей. Использование препаратов интерферона для предотвращения и лечения вирусных заболеваний было известно ещё советским учёным, подтвердил в беседе с RT академик РАН Александр Караулов. При этом он напомнил, что лучшим средством противовирусной профилактики была и остаётся массовая вакцинация.
Исследователи Йельского университета (США) обнаружили, что воздействие риновируса, наиболее частой причины простудных заболеваний, может защитить от COVID-19. По данным учёных, размножение коронавируса прекращается благодаря интерферону, который при простуде вырабатывает иммунная система человека. Об этом сообщается в Journal of Experimental Medicine.
Срабатывание защитных механизмов организма при простуде может предотвратить или даже вылечить инфекцию на ранней стадии заражения, считает ведущий автор исследования, ассистент-профессор лаборатории медицины и иммунобиологии медицинского факультета Йельского университета Эллен Фоксман.
Однако, отмечает Фоксман, болеть простудой для предотвращения COVID-19 вовсе не обязательно, ведь интерфероны доступны в виде лекарственных препаратов. Фоксман уверена, что говорить о пользе интерферонов можно на ранних стадиях заражения, так как их использование во время тяжёлого течения заболевания может дать обратный эффект и способствовать опасному для жизни сверхактивному иммунному ответу.
Для проверки своих предположений Фоксман и её коллеги заразили выращенные в лаборатории образцы ткани дыхательных путей человека коронавирусом SARS-CoV-2 и обнаружили, что в течение первых трёх дней количество коронавирусных частиц удваивалось в них примерно каждые шесть часов. При этом в образцах, подвергшихся воздействию риновируса, размножение вируса COVID-19 было полностью остановлено. Как отмечают исследователи, если бы противовирусная интерфероновая защита была заблокирована, SARS-CoV-2 смог бы вновь реплицироваться.
Результаты эксперимента также показали, что интерфероны способны замедлить распространение SARS-CoV-2 даже без риновируса, но только если инфекционная доза была низкой, сообщила Эллен Фоксман.
«Между вирусами существуют скрытые взаимодействия, которые нам не вполне понятны, и эти открытия — тот кусочек мозаики, который мы сейчас рассматриваем», — заключила Фоксман.
- Между вирусами существуют скрытые взаимодействия, полагают американские исследователи
- Gettyimages.ru
- © Viaframe
Данные учёных из Йеля подтверждаются и более ранними работами исследователей, сообщил в беседе с RT академик РАН, заведующий кафедрой клинической иммунологии и аллергологии Сеченовского университета Александр Караулов.
По его словам, использование препаратов на основе интерферона для предотвращения и лечения вирусных заболеваний было известно ещё советским учёным. Экспериментальная работа 1986 года американских учёных показала, что интерфероны имеют защитное действие и при обычной коронавирусной инфекции, отметил Караулов. Также он напомнил, что в настоящее время в России профилактика и лечение COVID-19 с помощью генно-инженерных интерферонов и вовсе прописаны в официальных рекомендациях Минздрава.
Также он напомнил, что в настоящее время в России профилактика и лечение COVID-19 с помощью генно-инженерных интерферонов и вовсе прописаны в официальных рекомендациях Минздрава.
«Напомню, на нашем рынке давно существуют лекарства, содержащие интерферон альфа-2b. Это разработка центра Гамалеи, сейчас знаменитого на весь мир благодаря вакцине «Спутник V». При этом, несмотря на все преимущества интерферона, достоверно известно, что лучшим средством противовирусной профилактики была и остаётся массовая вакцинация населения», — подытожил Караулов.
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ КОМБИНАЦИИ РИБАВИРИНА И ПЕГИЛИРОВАННОГО ИНТЕРФЕРОНА АЛЬФА-2А У ПАЦИЕНТОВ С ХРОНИЧЕСКИМ ГЕПАТИТОМ С: РЕЗУЛЬТАТЫ ДВУХ МУЛЬТИЦЕНТРОВЫХ, ПРОСПЕКТИВНЫХ, ОТКРЫТЫХ, НЕСРАВНИТЕЛЬНЫХ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ | Жданов
1. Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: new estimates of age-specific antibody to HCV seroprevalence // Hepatology. – 2013. – Vol. 57(4) – P. 1333-1342.
– 2013. – Vol. 57(4) – P. 1333-1342.
2. EASL Recommendations on Treatment of Hepatitis C 2015 // Journal of Hepatology. – 2015. – Vol. 63. – P. 199-236.
3. Богословская, Е.В. Оценка эффективности противовирусной терапии хронического гепатита С в максимально ранние сроки / Е.В. Богословская [и др.] // РЖГГК. – 2007. – № 2. – С. 35–39.
4. Бивол, С. Гепатит С в России: эпидемия бездействия. – Издание в рамках проекта «Доступность лечения гепатита С в России: оценка ситуации и выработка рекомендаций для дальнейших действий», финансируемого Фондами «Открытое общество» / С. Бивол, А. Саранг. – http://www. domjour.ru/sites/default/files/Gepatit-otchet-FAR-2013.pdf.
5. Официальная статистика ВИЧ, СПИДа в России (свежие данные). – Статистика. – https://spid-vich-zppp.ru/statistika/ofitsialnaya-statistika-vich-spid-rf-2016.html.
– Статистика. – https://spid-vich-zppp.ru/statistika/ofitsialnaya-statistika-vich-spid-rf-2016.html.
6. Мурыванова, Н.Н. Социальные проблемы ВИЧинфекции регионального уровня / Н.Н. Мурыванова // Фундаментальные и прикладные исследования в современном мире. Материалы IV Международной научно-практической конференции. – 2013. – С. 184–191.
7. Белозеров, Е.С. ВИЧ-инфекция : руководство для врачей / Е.С. Белозеров. – СПб.: ИнформМед., 2012. – 171 с.
8. Ющук, Н.Д. Комбинированная терапия хронического гепатита С пегилированным интерфероном α-2а и рибавирином у больных с ВИЧ-инфекцией и больных с моноинфекцией HCV / Н.Д. Ющук [и др.] // РЖГГК. – 2009. – № 1. – С. 35–42.
9. Ascione, M. de Luca, M. T. Tartaglione, F. Lampasi, G. G. di Costanzo, A. G. Lanza, F. P. Picciotto, G. Marino-Marsilia, L. Fontanella, G. Leandro. Комбинация пэгинтерферона альфа-2a и рибавирина более эффективна для лечения хронического вирусного гепатита C, чем комбинация пэгинтерферона альфа-2b и рибавирина // Гастроэнтерология. – 2014. – № 1 (51). – С. 69–77.
de Luca, M. T. Tartaglione, F. Lampasi, G. G. di Costanzo, A. G. Lanza, F. P. Picciotto, G. Marino-Marsilia, L. Fontanella, G. Leandro. Комбинация пэгинтерферона альфа-2a и рибавирина более эффективна для лечения хронического вирусного гепатита C, чем комбинация пэгинтерферона альфа-2b и рибавирина // Гастроэнтерология. – 2014. – № 1 (51). – С. 69–77.
10. Саркисянц, Н.К. Опыт прогнозирования побочных эффектов лечения хронического вирусного гепатита С пэгинтерфероном α-2а с рибавирином / Н.К. Саркисянц, Э.Г. Григорян // Клиническая медицина. – 2013. – № 5. – С. 46–49.
11. Sherman M, Yoshida EM, Deschenes M, Krajden M, Bain VG, Peltekian K, Anderson F, Kaita K, Simonyi S, Balshaw R, Lee SS. Peginterferon alfa-2a (40KD) plus ribavirin in chronic hepatitis C patients who failed previous interferon therapy // Gut. – 2006. – Vol. 55. – P. 1631-1638.
1631-1638.
12. Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C: an update // Hepatology. – 2009. – Vol. 49/ – P. 1335-1374.
13. Manns MP, McHutchison JG, Gordon SC et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial // Lancet. – 2001. – Vol.358. – P. 958-965.
14. Mc Hutchison JG, Gordon SC, Schiff ER et al. Interferon alpha-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group // N. Engl. J. Med. – 1998. – Vol. 339. – P. 1485-1492.
15. Sporea I., Danila M. , Sirli R. et al. Comparative study concerning the efficacy of Peg-IFN alpha-2a versus Peg-IFN alpha-2b on the early virological response (EVR) in patients with chronic viral C hepatitis // J. Gastrointest. Liver Dis. – 2006. – Vol.15. – P. 125-130.
, Sirli R. et al. Comparative study concerning the efficacy of Peg-IFN alpha-2a versus Peg-IFN alpha-2b on the early virological response (EVR) in patients with chronic viral C hepatitis // J. Gastrointest. Liver Dis. – 2006. – Vol.15. – P. 125-130.
16. Yenice N., Mehtap O., Gumrah M. et al. The efficacy of pegylated interferon alpha 2a or 2b plus ribavirin in chronic hepatitis C patients // Turk. J. Gastroenterol. – 2006. – Vol. 17. – P. 94-98.
17. Pockros PJ. An urgency to identify and treat chronic hepatitis C // Minerva Gastroenterol Dietol. – 2005. Vol. 51. – P. 235-246.
18. Ющук, Н.Д. Протокол диагностики и лечения больных вирусными гепатитами В и С / Н.Д. Ющук [и др.] // Российский журнал гастоэнтерологии, гепатологии, колопроктологии. – 2010. – №20 (6). – С. 4–60.
– С. 4–60.
19. Weksler B. B. Review article: the pathophysiology of thrombocytopenia in hepatitis C virus infection and chronic liver disease // Aliment. Pharmacol. Ther. – 2007. – Vol. 26 (1). – P. 13-19.
20. Huang Y., Li M.-H., Hou M., Xie Y. Peginterferon alfa-2a for the treatment of chronic hepatitis C in the era of direct-acting antivirals // Hepatobiliary Pancreat Dis Int. – 2017. – Vol. 16 (5). – P. 470-479.
Альфа-интерферон — LiverTox — NCBI Bookshelf
ОБЗОР
Введение
Альфа-интерферон — это цитокин, вырабатываемый врожденной иммунной системой в ответ на воздействие окружающей среды, включая вирусные инфекции. Альфа-интерферон в различных формах был разработан для лечения нескольких форм рака и вирусных инфекций, но его основное применение было в терапии хронического гепатита С. Терапия альфа-интерфероном может быть связана с кратковременным, от умеренного до умеренного повышения уровня аминотрансферазы в сыворотке крови и это было связано с индукцией аутоиммунных состояний, включая аутоиммунный гепатит, у восприимчивых людей.
Терапия альфа-интерфероном может быть связана с кратковременным, от умеренного до умеренного повышения уровня аминотрансферазы в сыворотке крови и это было связано с индукцией аутоиммунных состояний, включая аутоиммунный гепатит, у восприимчивых людей.
Общие сведения
Альфа-интерферон (в терминологии «терфер») — это встречающийся в природе цитокин, который вырабатывается клетками врожденной иммунной системы в ответ на вирусную инфекцию или другие стрессы окружающей среды. Альфа- и бета-интерферон считаются интерферонами типа I. которые обладают противовирусным, иммуномодулирующим, а также антипролиферативным действием. Пути индукции и действия альфа-интерферона довольно сложны, а противовирусные эффекты обусловлены индукцией множества внутриклеточных генов.В целом интерфероны типа I создают антивирусное состояние внутри клеток, которое снижает репликацию вируса и защищает от инфекции. В геноме человека имеется по крайней мере 20 копий гена альфа-интерферона, и было произведено несколько составов стандартного рекомбинантного интерферона (альфа-2а, альфа-2b и альфа-кон1 или «консенсусный» интерферон). Кроме того, молекула интерферона может быть пегилирована, что вызывает продление ее периода полужизни, что позволяет вводить ее один раз в неделю, а не ежедневно или через день.Поскольку интерферон является белком, его следует вводить парентерально (обычно подкожно). Рекомбинантные человеческие интерфероны были одобрены для использования при раке в 1980-х годах, при гепатите B в 1991 году и гепатите C в 1992 году. Пегинтерферон стал доступен в 2000 году и в значительной степени заменил стандартные препараты. Типичная доза пегинтерферона альфа-2a составляет 180 мкг один раз в неделю в течение 24 или 48 недель, а пегинтерферона альфа-2b — 1,5 мкг / кг один раз в неделю в течение 24-48 недель. При хроническом гепатите С пегинтерферон обычно назначают с рибавирином, а в последнее время — в виде тройной терапии с ингибитором протеазы, таким как боцепревир, телапревир, симипревир или софосбувир.В конечном итоге пероральные противовирусные схемы, вероятно, заменят терапию пегинтерфероном при хроническом гепатите С.
Кроме того, молекула интерферона может быть пегилирована, что вызывает продление ее периода полужизни, что позволяет вводить ее один раз в неделю, а не ежедневно или через день.Поскольку интерферон является белком, его следует вводить парентерально (обычно подкожно). Рекомбинантные человеческие интерфероны были одобрены для использования при раке в 1980-х годах, при гепатите B в 1991 году и гепатите C в 1992 году. Пегинтерферон стал доступен в 2000 году и в значительной степени заменил стандартные препараты. Типичная доза пегинтерферона альфа-2a составляет 180 мкг один раз в неделю в течение 24 или 48 недель, а пегинтерферона альфа-2b — 1,5 мкг / кг один раз в неделю в течение 24-48 недель. При хроническом гепатите С пегинтерферон обычно назначают с рибавирином, а в последнее время — в виде тройной терапии с ингибитором протеазы, таким как боцепревир, телапревир, симипревир или софосбувир.В конечном итоге пероральные противовирусные схемы, вероятно, заменят терапию пегинтерфероном при хроническом гепатите С. Стандартный интерферон альфа также одобрен для использования при волосисто-клеточном лейкозе, злокачественной меланоме, фолликулярной лимфоме и связанной со СПИДом саркоме Капоши. Для лечения остроконечных кондилом используются местные инъекции интерферона. Интерферон имеет множество побочных эффектов, которые часто ограничивают дозу и продолжительность терапии. Наиболее частые побочные эффекты включают усталость, мышечные боли, головные боли, депрессию, беспокойство, угнетение костного мозга и сыпь.
Стандартный интерферон альфа также одобрен для использования при волосисто-клеточном лейкозе, злокачественной меланоме, фолликулярной лимфоме и связанной со СПИДом саркоме Капоши. Для лечения остроконечных кондилом используются местные инъекции интерферона. Интерферон имеет множество побочных эффектов, которые часто ограничивают дозу и продолжительность терапии. Наиболее частые побочные эффекты включают усталость, мышечные боли, головные боли, депрессию, беспокойство, угнетение костного мозга и сыпь.
Гепатотоксичность
Терапия интерфероном или пегинтерфероном может быть связана с временным и бессимптомным легким или умеренным повышением уровня аминотрансферазы в сыворотке почти у половины пациентов. Поскольку в основном пегинтерферон используется при гепатите С или у онкологических пациентов, принимающих несколько других лекарств, повышение уровня АЛТ в сыворотке часто трудно отнести к терапии, а не к основному заболеванию. Однако важно отметить, что у 1-2% людей, получающих альфа-интерферон в течение 24-48 недель, развивается аутоиммунное состояние, которое может быть аутоиммунным гепатитом, характеризующимся развитием выраженной активности аминотрансфераз в сыворотке и желтухой. Этот побочный эффект обычно возникает в течение 1-2 месяцев после начала терапии, но может возникнуть позже или даже после завершения терапии (Случай 1). Типичный образец сывороточного повышения — гепатоцеллюлярный, и у большинства, но не у всех пациентов вырабатываются или уже имеются аутоантитела, такие как антинуклеарные антитела (ANA) или антитела к микросомам печени почек (анти-LKM) в сыворотке. Сообщалось о случаях первичного билиарного цирроза, саркоидоза и гранулем печени после терапии интерфероном. Наконец, терапия гепатита B интерфероном может вызвать острое обострение гепатита, которое часто связано с клиренсом ДНК HBV и HBeAg, и на самом деле может быть благоприятным прогностическим признаком, предполагающим устойчивый ответ (Случай 2).
Этот побочный эффект обычно возникает в течение 1-2 месяцев после начала терапии, но может возникнуть позже или даже после завершения терапии (Случай 1). Типичный образец сывороточного повышения — гепатоцеллюлярный, и у большинства, но не у всех пациентов вырабатываются или уже имеются аутоантитела, такие как антинуклеарные антитела (ANA) или антитела к микросомам печени почек (анти-LKM) в сыворотке. Сообщалось о случаях первичного билиарного цирроза, саркоидоза и гранулем печени после терапии интерфероном. Наконец, терапия гепатита B интерфероном может вызвать острое обострение гепатита, которое часто связано с клиренсом ДНК HBV и HBeAg, и на самом деле может быть благоприятным прогностическим признаком, предполагающим устойчивый ответ (Случай 2).
Оценка вероятности: A (хорошо известная причина клинически очевидного поражения печени).
Механизм повреждения
Интерферон оказывает разнообразное воздействие на несколько типов клеток. Аутоиммунный гепатитоподобный синдром, который связывают с терапией интерфероном, по-видимому, возникает у пациентов, предрасположенных к аутоиммунным заболеваниям, и, вероятно, связан с иммуномодулирующими эффектами альфа-интерферона в увеличении отображения антигенов HLA на клеточной поверхности и в влиянии на CD4 и CD8 +. Активность Т-клеток.Терапия альфа-интерфероном может вызвать обострение аутоиммунного заболевания, а некоторые случаи острого гепатитоподобного синдрома, развивающегося на терапии интерфероном, могут представлять собой обострение аутоиммунного гепатита, который сосуществовал или был ошибочно принят за хронический гепатит B или C.
Активность Т-клеток.Терапия альфа-интерфероном может вызвать обострение аутоиммунного заболевания, а некоторые случаи острого гепатитоподобного синдрома, развивающегося на терапии интерфероном, могут представлять собой обострение аутоиммунного гепатита, который сосуществовал или был ошибочно принят за хронический гепатит B или C.
Исход и лечение
Нарушения сывороточной аминотрансферазы, возникающие во время терапии интерфероном, обычно протекают бессимптомно, проходят самостоятельно и редко требуют изменения дозы. Напротив, аутоиммунный гепатитоподобный синдром, вызванный интерфероном, требует немедленного прекращения терапии.В большинстве случаев состояние улучшается или разрешается после прекращения терапии, но сообщалось о случаях самовоспроизводящихся аутоиммунных заболеваний печени (саркоидоз, аутоиммунный гепатит, первичный билиарный цирроз). Пациентам с аутоиммунным гепатитом, вызванным интерфероном, может потребоваться кортикостероидная или иммуносупрессивная терапия, которая, по-видимому, облегчает течение травмы и может потребоваться в долгосрочной перспективе. Сообщалось о нескольких случаях острой печеночной недостаточности и случаях хронического аутоиммунного гепатита, вызванного терапией интерфероном, но лечение не было связано с хроническим синдромом исчезающих желчных протоков.
Сообщалось о нескольких случаях острой печеночной недостаточности и случаях хронического аутоиммунного гепатита, вызванного терапией интерфероном, но лечение не было связано с хроническим синдромом исчезающих желчных протоков.
Родственные биологические агенты включают бета-интерферон, гамма-интерферон, интерлейкин 2.
Агенты, активные против гепатита С, включают альфа-интерферон, пегинтерферон, боцепревир, рибавирин, симепревир, софосбувир, телапревир.
Класс лекарств: противовирусные препараты, агенты гепатита C
ОТЧЕТЫ О ПРАКТИКЕ
Случай 1. Вызвание аутоиммунного гепатита курсом пегинтерферона и рибавирина при хроническом гепатите C.
[Пациент NIH № P40]
52 года У женщины с хроническим гепатитом С через 4 недели после начала терапии пегинтерфероном развилось внезапное обострение болезни и желтуха.Было известно, что у нее хронический гепатит С в течение 12 лет, когда было обнаружено повышение уровня аминотрансферазы в сыворотке и антител к гепатиту C в сыворотке. В основном она протекала бессимптомно и не имела других проблем со здоровьем. Источником гепатита С считалось переливание крови после кесарева сечения 25 лет назад. При биопсии печени и портальном фиброзе у нее был хронический гепатит легкой степени тяжести (фиброз 2+ по шкале от 0 до 6+). Уровни РНК HCV варьировались от 1 до 2 миллионов МЕ / мл, а генотип HCV — 1b.Ей был назначен пегинтерферон альфа-2а в дозе 180 мкг в неделю, а через 4 недели был добавлен рибавирин (1200 мг в день). После лечения уровень РНК HCV в сыворотке крови быстро упал (таблица). Однако уровни аминотрансферазы в сыворотке начали расти и к четвертой неделе превысили 1000 Ед / л. К пятой неделе у нее появилась желтуха, и прием пегинтерферона и рибавирина был прекращен. Сыворотка ANA была отрицательной, но SMA была слабоположительной (1:40) и анти-LKM присутствовали. IgM анти-HAV, HBsAg, анти-HBc и анти-HDV были отрицательными.Ультразвук не выявил обструкции желчевыводящих путей. Уровни иммуноглобина были повышены до терапии и еще больше повысились (IgG 2130 до 2910 мг / дл).
В основном она протекала бессимптомно и не имела других проблем со здоровьем. Источником гепатита С считалось переливание крови после кесарева сечения 25 лет назад. При биопсии печени и портальном фиброзе у нее был хронический гепатит легкой степени тяжести (фиброз 2+ по шкале от 0 до 6+). Уровни РНК HCV варьировались от 1 до 2 миллионов МЕ / мл, а генотип HCV — 1b.Ей был назначен пегинтерферон альфа-2а в дозе 180 мкг в неделю, а через 4 недели был добавлен рибавирин (1200 мг в день). После лечения уровень РНК HCV в сыворотке крови быстро упал (таблица). Однако уровни аминотрансферазы в сыворотке начали расти и к четвертой неделе превысили 1000 Ед / л. К пятой неделе у нее появилась желтуха, и прием пегинтерферона и рибавирина был прекращен. Сыворотка ANA была отрицательной, но SMA была слабоположительной (1:40) и анти-LKM присутствовали. IgM анти-HAV, HBsAg, анти-HBc и анти-HDV были отрицательными.Ультразвук не выявил обструкции желчевыводящих путей. Уровни иммуноглобина были повышены до терапии и еще больше повысились (IgG 2130 до 2910 мг / дл). Желтуха усилилась в течение недели, и был назначен преднизон (20 мг в день), после чего начали улучшаться уровни билирубина и аминотрансферазы. Как только уровни АЛТ вернулись к исходному уровню, преднизолон постепенно снижался, а затем прекращался. Однако уровни АЛТ и иммуноглобулина в сыворотке снова начали расти, и был повторно введен преднизон. После того, как уровни АЛТ в сыворотке крови снова упали, доза преднизона была снижена и был начат азатиоприн (первоначально 100 мг в день, а затем 50 мг в день), что в конечном итоге позволило отменить преднизолон.Уровни аминотрансферазы в сыворотке крови оставались нормальными при приеме только азатиоприна, но ANA становилась слабо положительной. Типирование HLA показало A33, B42, B53 и DRB 3.
Желтуха усилилась в течение недели, и был назначен преднизон (20 мг в день), после чего начали улучшаться уровни билирубина и аминотрансферазы. Как только уровни АЛТ вернулись к исходному уровню, преднизолон постепенно снижался, а затем прекращался. Однако уровни АЛТ и иммуноглобулина в сыворотке снова начали расти, и был повторно введен преднизон. После того, как уровни АЛТ в сыворотке крови снова упали, доза преднизона была снижена и был начат азатиоприн (первоначально 100 мг в день, а затем 50 мг в день), что в конечном итоге позволило отменить преднизолон.Уровни аминотрансферазы в сыворотке крови оставались нормальными при приеме только азатиоприна, но ANA становилась слабо положительной. Типирование HLA показало A33, B42, B53 и DRB 3.
Ключевые точки
Просмотр в собственном окне
| Лекарство: | Пегинтерферон альфа-2a (180 мкг / неделя) |
|---|---|
| T1_1_1_1_1″ rowspan=»1″ colspan=»1″> Образец: | Гепатоцеллюлярный (R = 20) |
| Степень тяжести: | 3+ (желтуха, требующая госпитализации и вмешательства) |
| Латентность: | 5 недель до начала желтухи |
| Выздоровление: | Неполное, хроническое аутоиммунное гепатит, требующий длительного лечения |
| Другие лекарства: | T1_1_1_5_1″ rowspan=»1″ colspan=»1″> Рибавирин |
Лабораторные значения
Просмотр в собственном окне
| Время после начала | Терапия | ALT (ЕД / л) | Alk P (Ед / л) | Билирубин (мг / дл) | РНК HCV (МЕ / мл) | Другое |
|---|---|---|---|---|---|---|
| — 8 недель | 9011 3204 | 91 | -0.9 | 1,420,000 | T2_1_1_1_7″ rowspan=»1″ colspan=»1″> IgG 2130 мг / дл, ANA neg | |
| — 4 недели | 185 | 83 | 0,7 | 2,890,000 | ||
| Пегинтерферон (180 мкг / неделя) | ||||||
| T2_1_1_1_1″ rowspan=»1″ colspan=»1″> 0 | 203 | 92 | 0,4 | 2 130 000 | ||
| 2 недели | Пегинтерферон | 329 | 102 | 0.4 | T2_1_1_1_6″ rowspan=»1″ colspan=»1″> 587,000 | |
| 4 недели | Пегинтерферон | 1093 | 133 | 0,9 | <100 | |
| 6 недель | Peg & Rbv | 1002 900 | T2_1_1_1_6″ rowspan=»1″ colspan=»1″> <10 | IgG 2910, ANA neg, LKM pos | ||
| 7 недель | Нет | 1206 | 147 | 15,8 | <10 | |
| T2_1_1_1_7″ colspan=»7″ rowspan=»1″> Преднизон начат (20 мг в день) | ||||||
| 8 недель | Пред 20 мг | 1110 | 136 | 5.3 | <10 | |
| 10 недель | Pred 20 мг | 784 | T2_1_1_1_4″ rowspan=»1″ colspan=»1″> 117 | 2,1 | 212,000 | |
| 5 мес | Pred 10 мг | 66 900 50 | 0,6 | |||
| 9 мес | T2_1_1_1_2″ rowspan=»1″ colspan=»1″> Pred 5 мг | 134 | 85 | 0,6 | 1,350,000 | |
| Преднизон остановлен | ||||||
| 18 мес | Нет | T2_1_1_1_4″ rowspan=»1″ colspan=»1″> 98 | 0.4 | 3,645,000 | ||
| 25 мес. | Нет | 348 | 121 | 0,8 | 2,656,800 | |
| T2_1_1_1_3 hd_h_Alpha_Peginterferon.T2_1_1_1_4 hd_h_Alpha_Peginterferon.T2_1_1_1_5 hd_h_Alpha_Peginterferon.T2_1_1_1_6 hd_h_Alpha_Peginterferon.T2_1_1_1_7″ colspan=»7″ rowspan=»1″> Преднизон (20 мг 29 в сутки) с повторным приемом азатиоприна | 54 | 100 | 0,8 | 7,452,000 | ||
| 40 мес. | Pred 5 и Az | T2_1_1_1_3″ rowspan=»1″ colspan=»1″> 30 | 62 | 0.4 | ||
| Прекращение приема преднизона и продолжение приема азатиоприна (100 мг в день) | ||||||
| 4 года | Az 100 | 26 | T2_1_1_1_4″ rowspan=»1″ colspan=»1″> 86 | 0,8 | 11,529,000 | |
| 5 | Az 100 | 35 | 118 | 0,5 | 20,682,000 | |
| 10 лет | T2_1_1_1_2″ rowspan=»1″ colspan=»1″> Az 50 | 38 | 47 | 0.4 | 28,300,000 | |
| Нормальные значения | <42 | <115 | <1,2 | T2_1_1_1_7″ rowspan=»1″ colspan=»1″> | ||
Peg, peg, peg, peg, peg, peg, peg, peg, peg, peg Rbv, рибавирин; Пред, преднизон; Аз, азатиоприн.
Случай 2. Острая вспышка гепатита В на фоне терапии альфа-интерфероном.
[NIH Case # T37]
47-летний мужчина с хроническим гепатитом B участвовал в клинических испытаниях терапии альфа-интерфероном в начале 1989 года.Было известно, что он имел HBsAg и HBeAg в сыворотке крови в течение предыдущих 8 лет и имел стойкое повышение уровня аминотрансферазы в сыворотке. У него были симптомы легкой усталости с периодическими периодами тошноты, но отрицал темную мочу, желтуху, зуд, потерю веса или вздутие живота. Физикальное обследование не выявило. Биопсия печени показала хронический гепатит с выраженной активностью (оценка гистологической активности = 11 из 18 возможных) и переходным фиброзом печени (оценка фиброза Исхака 4 из 6 возможных).Ему был назначен интерферон альфа-2b в дозе 10 миллионов единиц (МЕ) три раза в неделю. Когда он вернулся после 4 недель терапии, он пожаловался на усталость, тошноту и желтуху, а уровень билирубина в сыворотке был 10,4 мг / дл. Однако ДНК HBV больше не определялась (нижний предел обнаружения составлял 160 000 копий / мл). Дозу интерферона снижали до 5 МЕ трижды в неделю. Его симптомы быстро исчезли, и в последующем уровни билирубина и аминотрансферазы в сыворотке упали до нормального уровня. Он стал как HBeAg, так и HBsAg-отрицательным, но не выработал анти-HBs.В течение длительного периода наблюдения он оставался HBsAg-отрицательным, с нормальным уровнем сывороточных аминотрансфераз и отсутствием детектируемой ДНК HBV.
Когда он вернулся после 4 недель терапии, он пожаловался на усталость, тошноту и желтуху, а уровень билирубина в сыворотке был 10,4 мг / дл. Однако ДНК HBV больше не определялась (нижний предел обнаружения составлял 160 000 копий / мл). Дозу интерферона снижали до 5 МЕ трижды в неделю. Его симптомы быстро исчезли, и в последующем уровни билирубина и аминотрансферазы в сыворотке упали до нормального уровня. Он стал как HBeAg, так и HBsAg-отрицательным, но не выработал анти-HBs.В течение длительного периода наблюдения он оставался HBsAg-отрицательным, с нормальным уровнем сывороточных аминотрансфераз и отсутствием детектируемой ДНК HBV.
Ключевые точки
Вид в собственном окне
| Лекарство: | Интерферон альфа (10 МЕ трижды в неделю) |
|---|---|
| Образец: | T3_1_1_1_1″ rowspan=»1″ colspan=»1″> Гепатоцеллюлярный |
| Уровень серьезности: | 2+ ( желтуха и симптомы) |
| Латентность: | 4 недели |
| Восстановление: | 12 недель |
| Другие лекарства: | Нет |
Лабораторные значения
Просмотр в собственном окне
| Время после запуска | Время после остановки | АЛТ (Ед / л) | Alk P (Ед / л) | Билирубин (мг / дл) | ДНК HBV (копий / мл) | Другое | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| До | 197 | 110 | 0.8 | 234000 | HBsAg положительный | |||||||
| 0 | 334 | 105 | 0,9 | 5,254 000 | HBeAg положительный | |||||||
| Интерферон альфа-2b1 трижды в неделю 4 недели | 1037 | 148 | 5,9 | <160,000 | ||||||||
| 8 недель | 151 | 140 | 2.3 | <160,000 | HBeAg отрицательный | |||||||
| 12 недель | 93 | 119 | 1,7 | <160,000 | HBsAg отрицательный | |||||||
| 16 недель | 0 | 905 11025 440,7 | ||||||||||
| Прекращение приема интерферона альфа-2b | ||||||||||||
| 20 недель | 4 недели | 36 | 96 | 0,6 | ||||||||
| 24 недели | 8 недель 25 | 93 | 0.7 | |||||||||
| 1 год | 8 месяцев | 14 | 66 | 0,3 | Необнаруживаемый | |||||||
| 5 лет | 5 лет | 13 | 112 | Нет | HBsAg отрицательный | |||||||
| Нормальные значения | <42 | <115 | <1,2 | |||||||||
Интерферон Лекарство Альфа-2 Информация
Интерферон альфа-2b выпускается в виде порошка во флаконе для смешивания с жидкостью и в виде раствора для инъекций подкожно (непосредственно под кожу), внутримышечно (в мышцу), внутривенно (в вену) или внутри очага поражения (в поражение).Лучше всего вводить лекарство примерно в одно и то же время дня в дни инъекций, обычно ближе к вечеру или вечером.
Если у вас есть:
- HCV, вводите лекарство подкожно или внутримышечно три раза в неделю.
- HBV, вводите лекарство подкожно или внутримышечно три раза в неделю, обычно в течение 16 недель.
- волосатоклеточный лейкоз, вводите лекарство внутримышечно или подкожно 3 раза в неделю на срок до 6 месяцев.
- злокачественная меланома, введите лекарство внутривенно в течение 5 дней подряд в течение 4 недель, затем подкожно три раза в неделю в течение 48 недель.
- фолликулярная меланома, вводите лекарство подкожно три раза в неделю на срок до 18 месяцев.
- остроконечных кондилом, вводите лекарство внутри очага поражения три раза в неделю через день в течение 3 недель, затем лечение можно продолжать до 16 недель.
- Саркома Капоши, вводите лекарство подкожно или внутримышечно три раза в неделю в течение 16 недель.
Тщательно следуйте инструкциям на этикетке рецепта и попросите своего врача или фармацевта объяснить любую часть, которую вы не понимаете. Используйте инъекцию интерферона альфа-2b точно в соответствии с указаниями. Не используйте больше или меньше этого лекарства или используйте его чаще или в течение более длительного периода времени, чем предписано вашим доктором.
Ваш врач может уменьшить вашу дозу, если у вас возникнут серьезные побочные эффекты лекарства. Обязательно сообщите своему врачу, как вы себя чувствуете во время лечения, и спросите своего врача или фармацевта, если у вас есть вопросы о количестве лекарств, которое вы должны использовать.
Вы получите первую дозу интерферона альфа-2b в кабинете врача. После этого вы можете ввести интерферон альфа-2b самостоятельно или попросить друга или родственника сделать вам инъекцию. Прежде чем использовать интерферон альфа-2b в первый раз, вы или человек, который будет делать инъекции, должны прочитать информацию производителя для пациента, который идет с ним. Попросите вашего врача или фармацевта показать вам или человеку, который будет вводить лекарство, как вводить его. Если другой человек будет вводить вам лекарство, убедитесь, что он или она знает, как избежать случайных уколов иглой.
Если вы вводите это лекарство подкожно, вводите интерферон альфа-2b в любую область живота, предплечий или бедер, кроме области талии или вокруг пупка (пупка). Не вводите лекарство в кожу, которая раздражена, покрыта синяками, покраснела, инфицирована или покрыта рубцами.
Если вы вводите это лекарство внутримышечно, введите интерферон альфа-2b в предплечья, бедра или внешнюю область ягодиц. Не используйте одно и то же место два раза подряд.Не вводите лекарство в кожу, которая раздражена, покрыта синяками, покраснела, инфицирована или покрыта рубцами.
Если вы вводите это лекарство внутри очага поражения, введите его непосредственно в центр основания бородавки.
Никогда не используйте повторно шприцы, иглы или флаконы с интерфероном альфа-2b. Выбрасывайте использованные иглы и шприцы в контейнер, устойчивый к проколам, а использованные флаконы с лекарствами выбрасывайте в мусор. Поговорите со своим врачом или фармацевтом о том, как утилизировать устойчивый к проколам контейнер.
Перед применением интерферона альфа-2b посмотрите на раствор во флаконе. Лекарство должно быть прозрачным и не содержать плавающих частиц. Проверьте флакон, чтобы убедиться в отсутствии протечек, и проверьте срок годности. Не используйте раствор, если он просрочен, мутный, содержит частицы или находится в протекающем флаконе.
Следует смешивать только один флакон интерферона альфа-2b за раз. Лучше всего смешать лекарство непосредственно перед тем, как вы планируете ввести его. Однако вы можете заранее смешать лекарство, хранить его в холодильнике и использовать в течение 24 часов.Обязательно достаньте лекарство из холодильника и дайте ему остыть до комнатной температуры, прежде чем вводить его.
Ваш врач или фармацевт даст вам лист с информацией о пациенте от производителя (Руководство по лекарствам), когда вы начнете лечение интерфероном альфа-2b, и каждый раз, когда вы будете получать лекарства по рецепту. Внимательно прочтите информацию и спросите своего врача или фармацевта, если у вас есть какие-либо вопросы.
Интрон А, дозирование интерферона альфа-2b (интерферон альфа 2b), показания, взаимодействия, побочные эффекты и др.
ИНТЕРФЕРОН АЛЬФА — ВПРЫСК
(ин-тер-ФЭЭР-на АЛ-фу)
ОБЩЕЕ НАИМЕНОВАНИЕ БРЕНДА: Альферон N, Интрон А, Роферон-А
ПРЕДУПРЕЖДЕНИЕ: это лекарство редко может вызывать или ухудшать серьезные (редко смертельные) заболевания, включая психические расстройства / состояния настроения (например,ж., депрессия), проблемы с иммунной системой (аутоиммунные состояния, такие как волчанка или ревматоидный артрит), проблемы с кровообращением или инфекции. Если ваша история болезни включает какое-либо из этих состояний, немедленно сообщите об этом врачу. Также немедленно сообщите своему врачу, если возникнут какие-либо серьезные симптомы или побочные эффекты (см. Раздел «Побочные эффекты»). Это лекарство можно комбинировать с рибавирином для лечения хронического гепатита С. Рибавирин может причинить вред нерожденному ребенку или привести к смерти. Женщины должны избегать беременности, пока они или их партнеры-мужчины принимают рибавирин.Рибавирин может вызвать заболевание крови (гемолитическую анемию), которое может усугубить болезнь сердца. Если вы используете этот препарат с рибавирином для лечения хронического гепатита С, также внимательно прочтите информацию о препарате для рибавирина.
ИСПОЛЬЗОВАНИЕ: Этот препарат используется для лечения различных видов рака (например, лейкемии, меланомы, саркомы Капоши, связанной со СПИДом). Он также используется для лечения вирусных инфекций (например, хронического гепатита B, хронического гепатита C, остроконечных кондилом). Это лекарство аналогично белку, который вырабатывается вашим организмом естественным путем (интерферон).Считается, что в организме он действует, влияя на функцию / рост клеток и естественные защитные силы организма (иммунную систему) разными способами. Добавление большего количества интерферона может помочь вашему организму бороться с раком или вирусными инфекциями.
КАК ИСПОЛЬЗОВАТЬ: Прочтите руководство по лекарствам, которое можно получить у фармацевта, перед тем, как начать использовать это лекарство, и каждый раз, когда вы будете получать его повторно. Изучите все инструкции по приготовлению и применению, предоставленные производителем. Если у вас есть какие-либо вопросы, проконсультируйтесь с врачом или фармацевтом. Это лекарство вводится путем инъекции в мышцу или под кожу по указанию врача.Поворачивайте место инъекции каждый раз, когда вводите это лекарство, чтобы предотвратить болезненность. Его также можно вводить путем инъекции в вену или непосредственно в очаг поражения, обычно врачом. Если вы принимаете это лекарство самостоятельно дома, изучите все инструкции по приготовлению и применению у своего лечащего врача. Не трясите контейнер с лекарством (флакон или шприц). Это может снизить эффективность препарата. Перед использованием проверьте продукт визуально на наличие частиц или обесцвечивания.Если они присутствуют, не используйте жидкость. Узнайте, как безопасно хранить и выбрасывать медицинские принадлежности. Никогда не используйте повторно одноразовые шприцы или иглы. Многоразовую ручку можно использовать повторно. Лучше всего использовать вечером перед сном, чтобы уменьшить побочные эффекты. Пейте много жидкости во время использования этого лекарства, если иное не назначено вашим доктором. Дозировка зависит от вашего состояния здоровья и реакции на терапию. Не изменяйте дозу или частоту использования этого лекарства без одобрения врача.Регулярно используйте это лекарство, чтобы получить от него максимальную пользу. Чтобы помочь вам запомнить, принимайте его каждый вечер в одно и то же время, когда у вас запланированная доза. Различные марки интерферона альфа могут привести к разному количеству лекарства в крови. Это лекарство выпускается в разных формах (порошок во флаконе, раствор во флаконе и ручка для нескольких доз). Способ введения этого лекарства зависит от формы, которую вы используете. Тщательно следуйте указаниям врача. Не меняйте торговую марку без разрешения врача.
ПОБОЧНЫЕ ДЕЙСТВИЯ: Возможны реакции в месте инъекции (боль / отек / покраснение), головная боль, усталость, диарея, расстройство желудка, потеря аппетита, боли в спине, головокружение, сухость во рту, изменение вкуса, тошнота или рвота. Если какой-либо из этих эффектов сохраняется или усиливается, немедленно сообщите об этом своему врачу или фармацевту. Могут возникнуть гриппоподобные симптомы, такие как лихорадка, озноб и мышечные боли, особенно при первом применении этого лекарства. Эти симптомы обычно сохраняются примерно через 1 день после инъекции и улучшаются или исчезают через несколько недель непрерывного использования.Вы можете уменьшить эти побочные эффекты, вводя это лекарство перед сном и используя жаропонижающее / обезболивающее, такое как ацетаминофен, перед каждой дозой. Для получения дополнительной информации проконсультируйтесь с врачом или фармацевтом. Иногда во время лечения могут возникать проблемы с зубами и деснами. Сухость во рту может усугубить этот побочный эффект. Предотвратите сухость во рту, выпив много воды или используя заменитель слюны. Чистите зубы как минимум два раза в день и регулярно проходите стоматологические осмотры. Если во время лечения у вас возникла рвота, прополощите рот после этого, чтобы уменьшить вероятность проблем с зубами и деснами.Возможна временная потеря волос. Нормальный рост волос должен возобновиться после окончания лечения. Помните, что это лекарство было назначено, потому что ваш врач посчитал, что польза для вас больше, чем риск побочных эффектов. Многие люди, принимающие это лекарство, не имеют серьезных побочных эффектов. Немедленно сообщите своему врачу, если у вас есть какие-либо серьезные побочные эффекты, в том числе: ощущение слишком горячего или холодного (больше, чем у окружающих), быстрое / нерегулярное сердцебиение, повышенная жажда / мочеиспускание, менструальные изменения (отсутствие / задержка / нерегулярные менструации), онемение / покалывание рук / ног, отек (особенно лица / рук / ног), проблемы со сном, проблемы с ходьбой, изменения зрения (например, нечеткость зрения, частичная потеря зрения), легкое кровотечение / синяк, постоянная тошнота / рвота, признаки инфекции (напр.ж., лихорадка, постоянная боль в горле), боль в животе / животе, темная моча, черный / дегтеобразный стул, пожелтение глаз / кожи. Немедленно обратитесь за медицинской помощью при возникновении любого из этих очень серьезных побочных эффектов: боль в груди, судороги, слабость одна сторона тела, проблемы с речью. Этот препарат может вызвать у вас серьезные психические изменения / изменения настроения, которые могут ухудшиться во время лечения или после приема последней дозы. Немедленно сообщите своему врачу, если у вас есть такие симптомы, как замешательство, депрессия, мысли о самоубийстве или причинении вреда другим, необычная раздражительность или агрессивное поведение.В этом случае рекомендуется психиатрическая терапия и наблюдение во время и после лечения этим препаратом. Очень серьезные аллергические реакции на этот препарат возникают редко. Однако немедленно обратитесь за медицинской помощью, если вы заметили какие-либо симптомы серьезной аллергической реакции, в том числе: сыпь, зуд / отек (особенно лица / языка / горла), сильное головокружение, затрудненное дыхание. Это не полный список возможных побочные эффекты. Если вы заметили другие эффекты, не перечисленные выше, обратитесь к врачу или фармацевту.В США — обратитесь к врачу за медицинской консультацией по поводу побочных эффектов. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088 или на сайте www.fda.gov/medwatch. В Канаде — позвоните своему врачу для получения медицинской консультации о побочных эффектах. Вы можете сообщить о побочных эффектах в Министерство здравоохранения Канады по телефону 1-866-234-2345.
МЕРЫ ПРЕДОСТОРОЖНОСТИ: См. Также раздел «Предупреждение». Перед использованием интерферона альфа сообщите своему врачу или фармацевту, если у вас на него аллергия; или если у вас есть другие аллергии. Этот продукт может содержать неактивные ингредиенты (например, альбумин), которые могут вызывать аллергические реакции или другие проблемы.Поговорите со своим фармацевтом для получения более подробной информации. Перед использованием этого лекарства сообщите своему врачу или фармацевту о своей истории болезни, особенно о: нарушениях клеток крови (например, анемия, нейтропения, тромбоцитопения), сгустках крови, раке, диабете, проблемах с глазами, сердечных заболеваниях. (например, стенокардия, нерегулярное сердцебиение), высокое кровяное давление, ВИЧ-инфекция, заболевания иммунной системы (например, волчанка, псориаз, ревматоидный артрит), кишечное заболевание (например, колит), заболевание почек, заболевание печени (например, аутоиммунный гепатит, декомпенсированный) заболевание печени), болезни легких (например,g., хроническая обструктивная болезнь легких (ХОБЛ, астма, пневмония), психические расстройства / расстройства настроения (например, тревога, депрессия), высокий уровень триглицеридов в крови, панкреатит, судорожное расстройство, заболевание щитовидной железы, употребление / злоупотребление наркотиками / алкоголем. может вызвать у вас головокружение. Алкоголь или марихуана (каннабис) могут вызвать у вас головокружение. Не садитесь за руль, не используйте механизмы и не делайте ничего, что требует бдительности, пока вы не научитесь делать это безопасно. Ограничьте употребление алкогольных напитков. Поговорите со своим врачом, если вы употребляете марихуану (каннабис). Не делайте иммунизацию / вакцинацию без согласия вашего врача и избегайте контактов с людьми, которые недавно получили пероральную вакцину от полиомиелита или вакцину от гриппа, вдыхаемую через нос.Хорошо мойте руки, чтобы предотвратить распространение инфекций. Чтобы снизить риск порезов, ушибов или травм, будьте осторожны с острыми предметами, такими как бритвы и кусачки для ногтей, и избегайте таких занятий, как контактные виды спорта. Перед операцией сообщите об этом своему врачу. или стоматолога обо всех продуктах, которые вы используете (включая рецептурные препараты, безрецептурные препараты и растительные продукты). Дети могут быть более чувствительны к побочным эффектам этого препарата, особенно к психическим изменениям / изменениям настроения (например, тяжелой депрессии, мыслям / попыткам самоубийства). ).Интерферон и рибавирин также могут замедлять скорость роста ребенка. Нормальный набор веса и скорость роста обычно возвращаются после завершения лечения, но окончательный рост взрослого человека может быть ниже ожидаемого. Периодически контролируйте рост и вес вашего ребенка во время лечения. Рекомендуется соблюдать осторожность при применении этого препарата у пожилых людей, поскольку они могут быть более чувствительны к воздействию препарата, особенно к головокружению, психическим изменениям / изменениям настроения и воздействию на сердце. интерферон альфа следует использовать только тогда, когда это явно необходимо.Обсудите риски и преимущества с вашим врачом. Интерферон альфа, когда он используется в сочетании с рибавирином, не должен использоваться во время беременности ни беременной женщиной, ни ее партнером-мужчиной. Комбинация может нанести вред нерожденному ребенку. Необходимо использовать две надежные формы контроля рождаемости (например, презервативы, противозачаточные таблетки) всякий раз, когда хотя бы один сексуальный партнер принимает эти лекарства вместе, и в течение как минимум 6 месяцев после прекращения лечения. Если вы или ваш партнер забеременели или считаете, что вы или ваш партнер беременны, немедленно сообщите об этом своему врачу.Неизвестно, проникает ли этот препарат в грудное молоко. Перед кормлением грудью проконсультируйтесь с врачом.
ВЗАИМОДЕЙСТВИЕ С ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ: Взаимодействие с лекарствами может изменить то, как действуют ваши лекарства, или повысить риск серьезных побочных эффектов. Этот документ не содержит всех возможных лекарственных взаимодействий. Составьте список всех продуктов, которые вы используете (включая рецептурные / безрецептурные препараты и растительные продукты), и поделитесь им со своим врачом и фармацевтом. Не начинайте, не останавливайте и не изменяйте дозировку каких-либо лекарств без одобрения врача.Некоторые продукты, которые могут взаимодействовать с этим препаратом, включают: барбитураты (например, фенобарбитал), колхицин, препараты, которые могут повлиять на вашу иммунную систему (например, химиотерапия рака, альдеслейкин, циклоспорин), гидроксимочевина, телбивудин, теофиллины (например, аминофиллин, теофиллин).
ПЕРЕДОЗИРОВКА: Если у кого-то произошла передозировка и наблюдаются серьезные симптомы, такие как обморок или затрудненное дыхание, позвоните по телефону 911. В противном случае сразу же позвоните в токсикологический центр. Жители США могут позвонить в местный токсикологический центр по телефону 1-800-222-1222.Жители Канады могут позвонить в провинциальный токсикологический центр. Симптомы передозировки могут включать: боль в груди, постоянную тошноту / рвоту, боль в животе / животе, темную мочу.
ПРИМЕЧАНИЯ: Не передавайте этот препарат другим лицам. Лабораторные и / или медицинские тесты (например, анализ крови, тесты на щитовидную железу, функцию почек / печени, уровень триглицеридов, осмотр глаз) должны выполняться перед началом лечения, периодически для контроля вашего состояния. прогресс или проверить наличие побочных эффектов. В зависимости от вашей истории болезни могут потребоваться другие тесты (например, ЭКГ).Для получения более подробной информации проконсультируйтесь с врачом. Не меняйте марку интерферона, не посоветовавшись с врачом или фармацевтом. Другие интерфероны могут не оказывать такого же воздействия на ваше заболевание.
ПРОПУЩЕННАЯ ДОЗА: Важно получать каждую дозу этого лекарства в соответствии с графиком. Если вы пропустите прием, немедленно обратитесь к врачу или фармацевту за новым графиком приема. Не удваивайте дозу, чтобы наверстать упущенное.
ХРАНЕНИЕ: Хранить в холодильнике при температуре от 2 до 8 градусов C вдали от света и влаги.Не мерзни. Храните все лекарства в недоступном для детей и домашних животных месте. После смешивания этого лекарства проконсультируйтесь с инструкциями по продукту или у вашего фармацевта для получения дополнительных сведений о хранении. Многодозовую ручку можно использовать до 4 недель после первой инъекции. Не оставляйте это лекарство вне холодильника более 48 часов. После 4 недель использования выбросьте ручку, даже если она все еще содержит неиспользованный раствор. Не смывайте лекарства в унитаз и не выливайте их в канализацию, если это не указано в инструкции.Правильно утилизируйте этот продукт, когда срок его годности истек или он больше не нужен. Проконсультируйтесь с фармацевтом или в местной компании по утилизации отходов.
Последний раз информация обновлялась в августе 2021 г. Copyright (c) 2021 First Databank, Inc.
ВАЖНАЯ ИНФОРМАЦИЯ: КАК ИСПОЛЬЗОВАТЬ ДАННУЮ ИНФОРМАЦИЮ: Это сводка, в которой НЕ содержится всей возможной информации об этом продукте. Эта информация не гарантирует, что этот продукт безопасен, эффективен или подходит для вас. Эта информация не является индивидуальным медицинским советом и не заменяет совет вашего лечащего врача.Всегда спрашивайте у своего лечащего врача полную информацию об этом продукте и ваших конкретных медицинских потребностях.
Альфа-интерферон — обзор
Интерферон-α
ИФН-α используется для лечения ГЭК более 25 лет как в виде монотерапии, так и в комбинации с другими агентами. Ряд исследований показал, что этот тип терапии может успешно противодействовать HE и HES у пациентов, у которых лечение преднизоном и HU не помогло. Частота ответа на IFN-α варьируется в зависимости от основного заболевания и дозы, но может составлять приблизительно 50% при использовании в качестве монотерапии и 75% в сочетании с другими агентами.Обычно терапию начинают с дозы 1 миллион единиц три раза в неделю и титруют до 4 миллионов единиц три раза в неделю. У пациентов, ответивших на лечение, количество эозинофилов снижается, а также отмечается улучшение спленомегалии и гепатомегалии. Более того, риск сердечных и тромбоэмболических осложнений может быть снижен путем лечения IFN-α. Наконец, могут значительно улучшиться язвенные поражения слизистой оболочки и другие кожные проявления. Необработанная и пегилированная форма IFN-α могут быть одинаково эффективными.Однако, несмотря на эффективность, введение IFN-α проблематично из-за побочных эффектов. Эти побочные эффекты часто зависят от дозы и включают лихорадку, гриппоподобный синдром, усталость, импотенцию, депрессию, суицидальные мысли и психоз. Кроме того, терапия IFN-α может привести к обострениям аутоиммунных заболеваний, таких как аутоиммунный тиреоидит, псориаз, язвенный колит и др., А также к обострению депрессии или других психических заболеваний. Другие серьезные побочные эффекты, наблюдаемые при применении IFN-α, включают чрезмерное подавление показателей крови, ретинопатию, саркоидоз и левостороннюю сердечную недостаточность.Все эти (потенциальные) побочные эффекты следует принимать во внимание, особенно при длительном назначении IFN-α в относительно высоких дозах. С другой стороны, IFN-α не является мутагенным и считается лекарством, которое можно назначать даже во время беременности. Механизм действия IFN-α до конца не изучен. Рецепторы этого цитокина экспрессируются на мультипотентных гематопоэтических клетках-предшественниках, предшественниках, коммитированных эозинофилами, и зрелыми эозинофилами крови. Следовательно, в отличие от кортикостероидов, IFN-α работает у пациентов с HES с различной этиологией, включая HES L , но также и с HES N и даже с HES I .IFN-α подавляет активацию эозинофилов и высвобождение различных токсичных медиаторов из эозинофилов. Однако IFN-α может также оказывать противовоспалительное действие на другие типы клеток, которые могут способствовать повреждению тканей при HES.
Рекомбинантный альфа-интерферон — обзор
Рекомбинантный интерферон-α
Рекомбинантный интерферон-α впервые был изучен в качестве альтернативного лечения пациентов с PV; было отмечено снижение тромбоцитоза и эритроцитоза примерно у двух третей пациентов. 216 Введение рекомбинантного IFN-α значительно снизило количество тромбоцитов примерно у 85% пациентов с ET и оказало положительное влияние на размер селезенки примерно у одной трети реципиентов. 216
IFN-α подавляет пролиферацию плюрипотентных и коммитированных клонами гематопоэтических предшественников и ингибирует рост предшественников мегакариоцитов in vivo и in vitro. 217-220 IFN-α также снижает тромбопоэз и вызывает умеренное сокращение средней продолжительности жизни тромбоцитов. 221 IFN-α не проникает через плаценту 222 и, как известно, не обладает тератогенным действием; он безопасно используется у беременных женщин с ХМЛ и является препаратом выбора для лечения беременных пациенток с ЭТ. Использование IFN-α позволяет избежать теоретических опасений по поводу потенциальных рисков тератогенности гидроксимочевины и анагрелида. IFN-α не лейкемогенен и негонадотоксичен, но очень эффективно контролирует тромбоцитемию.
Рекомбинантный IFN-α обычно вводят в дозах 3 миллиона Ед подкожно три раза в неделю.Частота ответа при тромбоцитемии приближается к 90%, и после достижения начальной циторедукции доза интерферона обычно может быть уменьшена. Прекращение приема приводит к быстрому рецидиву тромбоцитемии, который обычно реагирует на возобновление терапии интерфероном. 216,223-226 У некоторых пациентов после терапии IFN-α были зарегистрированы стойкие ремиссии, что свидетельствует о том, что IFN-α оказывает антипролиферативное действие на неопластический клон. 223,227-229 Одно клиническое исследование продемонстрировало замедленную пролиферацию неопластического клона у пяти из семи пациентов, которым вводили IFN-α для лечения ЭТ. 229 IFN-α также противодействует действию тромбоцитарного фактора роста, продукта мегакариопоэза, который инициирует пролиферацию фибробластов. IFN-α может снизить врожденный риск прогрессирующего миелофиброза и лейкемогенеза в ET и других MPN за счет своего антипролиферативного и иммуномодулирующего действия. Ни в одном рандомизированном исследовании пока не сравнивали рекомбинантный IFN-α с гидроксимочевиной или анагрелидом в отношении безопасности, эффективности, выживаемости без лейкемии и выживаемости без тромбогеморрагических событий при лечении ЭТ.
Основными недостатками рекомбинантного IFN-α при лечении ЭТ являются связанные с ним побочные эффекты и высокая стоимость. 230 Почти все пациенты испытывают гриппоподобный синдром во время индукции с лихорадкой, ознобом, миалгиями, головной болью и артралгиями. Эти симптомы часто контролируются парацетамолом. Длительное лечение может привести к усталости, анорексии, потере веса, алопеции и аутоиммунным заболеваниям, включая аутоиммунный тиреоидит, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению и симметричную полиартропатию.У пациентов также могут развиться клинически значимые психоневрологические симптомы, включая изменение мышления, спутанность сознания и глубокую депрессию. 216,225,230 Лечащий врач должен знать о суицидальных мыслях у людей с личным и / или семейным анамнезом депрессии. Могут развиться нейтрализующие антитела к терапии рекомбинантным IFN-α, что приведет к увеличению количества тромбоцитов. В таких ситуациях была опробована терапия лейкоцитарным IFN-α с отличным ответом. 231
Обзор 273 случаев показал, что терапия IFN-α была прекращена у 25% пациентов.Наиболее частыми причинами отмены были побочные эффекты, связанные с интерфероном, у 55% и отказ пациентов — у 10%. 230 Многие побочные эффекты проходят со временем при продолжении приема препарата. Рекомбинантный IFN-α является очень привлекательным вариантом лечения ЭТ, поскольку он может (1) подавлять неопластический клон, (2) эффективно снижать количество тромбоцитов, (3) уменьшать и обращать вспять массивную спленомегалию и прогрессирование миелофиброза и (4) предотвращать потенциальная тератогенность анагрелида, гидроксимочевины и алкилирующих агентов, а также лейкемогенность гидроксимочевины и алкилирующих агентов.Тем не менее, IFN-α по-прежнему недостаточно используется для лечения этого заболевания, возможно, из-за его цены и спектра побочных эффектов. Он был зарезервирован в первую очередь для лечения пациенток с ЭТ, которые либо беременны, либо имеют массивную спленомегалию.
Пегилированный IFN-α (PEG-IFN-α) представляет собой химически модифицированный IFN-α, который получают путем ковалентного связывания полимеров этиленгликоля (PEG) с различной средней молекулярной массой, что дает PEG-IFN-α превосходные фармакокинетические и фармакодинамический профиль и дает лекарство, которое можно вводить еженедельно.По этой причине PEG-IFN-α оказался потенциально полезным терапевтическим агентом в клинических испытаниях с участием пациентов с bcr / abl -отрицательной тромбоцитемией, включая ET и PV. ПЕГ-ИФН-α, вероятно, более эффективен и лучше переносится, чем другие методы лечения, и может рассматриваться как нелейкемогенная альтернативная циторедуктивная терапия у более молодых пациентов с ЭТ. Два крупных исследования фазы 3, в которых профили активности и токсичности двух немного разных рекомбинантных молекул ПЭГ-ИФН-α сравнивались с профилями двух стандартных рекомбинантных молекул ИФН-α у пациентов с хронической фазой ХМЛ, показали явное превосходство ПЭГ-ИФН. -α по сравнению со стандартным IFN-α с точки зрения как эффективности, так и переносимости. 232 233 В исследовании фазы 2 с участием 36 пациентов из группы высокого риска с ЭТ, продолжительное лечение ПЭГ-ИФН-α2b было эффективным и безопасным для снижения количества тромбоцитов и имело токсичность, сравнимую с токсичностью обычного интерферона. 234 Частота полной ремиссии через 1 год составила 67%, и 23 из 36 пациентов с ЭТ (64%) продолжили длительную терапию ПЭГ-ИФН-α2b. 201 В исследовании фазы 2, проведенном Nordic Study Group for Myeloproliferative Disorders, PEG-IFN-α2b вводился в начальной дозе 0.Пациентам с PV ( n = 22) и ET ( n = 20) вводили 5 мкг / кг один раз в неделю. Пятнадцать пациентов ранее получали циторедуктивную терапию. Четыре пациента (10%) прекратили терапию вскоре после начала лечения из-за токсичности, и еще 9 были исключены из исследования через 6 месяцев из-за побочных эффектов или недостаточного ответа. Через 12 месяцев у 20 пациентов (48%) сохранялась полная ремиссия, но 22 пациента (52%) прекратили терапию, в основном из-за побочных эффектов, которые возникали чаще, чем в предыдущих исследованиях. 235 Итальянская кооперативная группа GIMEMA сообщила об аналогичном большом многоцентровом исследовании фазы 2, предназначенном для оценки безопасности и переносимости 2-летнего лечения ПЭГ-ИФН-α2b. 236 Было включено 90 пациентов с ЭТ высокого риска (30 мужчин, 60 женщин), из которых 60% ранее лечились циторедуктивными агентами. В течение первого года терапии ПЭГ-ИФН-α2b вводился в дозе 25 мкг еженедельно с увеличением до 100 мкг еженедельно до тех пор, пока количество тромбоцитов не станет менее 500 000 / мкл.Спустя 12 месяцев 79% пациентов все еще получали ПЭГ-ИФН-α2b (в средней дозе 50 ± 22 мкг в неделю), а 64 (71%) пациентов достигли целевого количества тромбоцитов. Через 24 месяца снижение количества тромбоцитов сохранилось у 75%, а распространенность спленомегалии снизилась с 22% до 6%. Исходно две трети случаев ET были классифицированы в соответствии с критериями костного мозга, предложенными ВОЗ (см. Таблицу 19-4), и показали следующее распределение: истинное ET, 23%; CIMF-0 (премиелофиброз) 17%; CIMF-1 (ранний миелофиброз) 40%; CIMF-2 или CIMF-3 (классический миелофиброз) 3%; и неклассифицированные миелопролиферативные расстройства — 17%. 237 Ни у одного пациента с истинной ЭТ не наблюдалось развития костного мозга при лечении PEG-IFN-α2b, тогда как у пациентов с CIMF-1, CIMF-2 или CIMF-3 наблюдалось усиление фиброза костного мозга. Что еще более важно, частота полной гематологической ремиссии в конце первого года была выше у пациентов с истинной ЭТ (93%), чем у пациентов с CIMF-0 (60%) и CIMF-1 или CIMF-2 (71%). . 237 В целом, эти данные предполагают, что естественная история эволюции миелофиброза очень редка среди пациентов с истинной ЭТ и что у этих пациентов наблюдается значительно более высокая частота ответа на терапию PEG-IFN-α2b, чем у пациентов с тромбоцитемией, связанной с префибротическим CIMF- 0 или ранний фиброзный CIMF-1 (ложный ЕТ).
Границы | Подтипы интерферона-α как дополнительный терапевтический подход к функциональному лечению вируса иммунодефицита человека
Введение
Инфекции, вызванные вирусом иммунодефицита человека (ВИЧ), характеризуются тяжелым иммунодефицитом и началом оппортунистических инфекций. В настоящее время в мире насчитывается более 36 миллионов человек, живущих с ВИЧ. Начало высокоактивной антиретровирусной терапии (ВААРТ) привело к лучшему вирусному контролю и долгосрочным результатам у ВИЧ-инфицированных пациентов.По мере того как доступ к терапии становится все более доступным во всем мире, ожидается, что количество новых инфекций и случаев передачи резко сократится, что вселяет надежду на то, что эпидемию ВИЧ можно контролировать и контролировать. Обнадеживающие исследования (1), показывающие эффективность нейтрализующих антител для контроля вирусного отскока, и разработка препаратов длительного действия, вероятно, окажут серьезное влияние на эпидемиологию заболевания. По мере того, как предпринимаются серьезные усилия по борьбе с эпидемией ВИЧ, основное внимание уделяется поиску лекарства для пациентов, которые уже инфицированы ВИЧ.
Вирус иммунодефицита человека — это ретровирус, который интегрируется в геном хозяина. Таким образом, ВИЧ-инфицированный человек инфицирован на всю жизнь. Первичной клеткой-мишенью для ВИЧ является Т-клетка CD4, причем ВИЧ устанавливает латентный период в этих клетках, и этот латентный резервуар продолжает сохраняться во время ВААРТ. За исключением случая Тимоти Брауна, который является единственным известным случаем полного излечения ВИЧ, полное искоренение резервуара ВИЧ оказалось сложной задачей не только из-за интеграции ВИЧ в геном хозяина, но и из-за большого размера. скрытого стойкого резервуара.В связи с этим в последнее время акцент сместился на разработку функциональных стратегий лечения, цель которых состоит в достижении полной ремиссии в отсутствие антиретровирусных препаратов.
Доказательства функционального излечения появились довольно случайно, когда ребенок, рожденный от ВИЧ-инфицированной матери, лечился непрерывно в течение более 2 лет в течение нескольких часов после рождения. Ребенок оставался свободным от ВИЧ в течение примерно 2 лет после отмены терапии, что повышает вероятность того, что ранняя ВААРТ может потенциально достичь полной ремиссии у ВИЧ-инфицированных субъектов.Однако волнение было недолгим, так как ВИЧ восстановился, что свидетельствует о том, что латентный резервуар не был ликвидирован с помощью ранней терапии и реактивирован в отсутствие долгосрочной ВААРТ. Ряд новых подходов, таких как «шокируй и убей» с использованием агентов, обращающих латентный период (LRA), хотя и несколько успешны в реактивации латентного ВИЧ (1), их влияние на вирусный резервуар было довольно ограниченным, что позволяет предположить, что LRA необходимо сочетать с другие подходы, такие как вакцинация против ВИЧ, которая может одновременно активировать иммунную систему для распознавания вирусных антигенов, экспрессируемых на поверхности латентно инфицированных клеток после реактивации LRA.В настоящее время проводится ряд исследований для изучения этой стратегии.
Другие стратегии были сосредоточены на активации внутриклеточных защитных механизмов с использованием интерферона α (IFN-α) в сочетании с LRA или другими иммунными медиаторами с некоторыми многообещающими данными, полученными на моделях нечеловеческих приматов. Здесь мы рассматриваем прогресс, достигнутый на сегодняшний день в понимании роли IFN-α в ВИЧ-инфекции, и исследуем потенциал использования IFN-α и его подтипа в качестве стратегии функционального излечения.
IFN типа I и ВИЧ-инфекция
С момента первого открытия в 1957 г. факторов, ингибирующих репликацию вирусов (2), роль врожденного IFN при вирусных инфекциях широко изучалась. Первичным источником IFN-α являются плазмоцитоидные DC (pDC), тогда как IFN-β продуцируется большинством типов клеток (3, 4). pDC играет важную роль в регуляции иммунной системы и являются самыми ранними клетками, попадающими в места проникновения вируса. Было показано, что в ответ на молекулярные структуры, связанные с вирусными патогенами, pDC продуцируют в ~ 1000 раз больше IFN-α / β, чем другие типы клеток (5).
Плазмацитоидные DC экспрессируют множество рецепторов распознавания патогенов (PRR), таких как Toll-подобный рецептор (TLR) 3, TLR7, TLR8 и TLR9, которые могут воспринимать вирусные нуклеиновые кислоты, приводящие к секреции IFN-α (6-8). Недавние исследования показали, что цитоплазматический ДНК-сенсор cGAS играет важную роль в секреции IFN-α во время как ВИЧ-инфекций, так и SIV-инфекций (9). Lahaye et al. (10) показали, что смысловая вирусная кДНК DC в цитоплазме, опосредованная cGAS и блокирующая cGAS или обратная транскрипция, ингибирует эти ответы (11).Аналогичным образом Herzner et al. (12) показали, что одноцепочечная ДНК ВИЧ-1 активирует cGAS, а обратные транскрипты ВИЧ-1 были преобладающей вирусной ДНК, обнаруживаемой в цитоплазме во время ранней инфекции. Джордж и др. (3) показали, что лечение ингибиторами обратной транскриптазы сразу после инфицирования полностью блокировало IFN-α в плазме у SIV-инфицированных макак-резус. Взятые вместе, эти исследования показывают, что многочисленные PRR врожденной чувствительности способствуют индукции IFN-α ответов во время ВИЧ-инфекции.
Хотя продукция IFN-α во время ВИЧ-инфекции была четко продемонстрирована, точная роль этих IFN во время инфекции менее ясна.Блокада IFN-αR антителом против IFN-αR была связана с более высокой репликацией ВИЧ, тогда как ВИЧ реплицировался на более низких уровнях в культурах с истощенным pDC, обработанных IFN-α (13). Было обнаружено, что IFN-α ограничивает репликацию ВИЧ-1, уменьшая образование продуктов поздней обратной транскриптазы в инфицированных клетках (14), а обработка вновь инфицированных CD4 T-клеток IFN-α в течение короткого периода времени была связана со значительной инактивацией ВИЧ. на ранних стадиях репликации (15). IFN-α замедляет прогрессирование ВИЧ-инфекции в рандомизированных плацебо-контролируемых исследованиях (16), а также Asmuth et al.(17) сообщили, что лечение пегилированным IFN-α2a имело статистически значимый анти-ВИЧ эффект. Другие показали, что обработка IFN-α ингибировала репликацию ВИЧ и SIV в линиях CD4 Т-клеток (18), моноцитах (19) и макрофагах (20). Сообщалось, что IFN-α влияет на поздние стадии репликации ВИЧ-1 в хронически инфицированных клетках, ингибируя сборку и высвобождение вируса и снижая инфекционность вирионов (21). Другие исследования показали, что индуцированные IFN-α гены, стимулированные IFN (ISG), эффективно подавляют репликацию ВИЧ (22–24).
Интерферон α индуцирует многочисленные ISG, которые способны ограничивать репликацию ВИЧ, а именно семейство цитидиндезаминаз, редактирующих мРНК аполипопротеина B (APOBEC3), TRIM5α, тетерин (BST-2), SAMHD1, MX2 и т. Д. (25– 27). Исследования показали высокий уровень экспрессии ISG в Т-лимфоцитах CD4 на очень ранней стадии инфицирования (28), и было обнаружено, что повышенные уровни APOBEC3G коррелируют с более низкими уровнями инфекции в макрофагах во время инфекции SIV (29). Другие сообщили, что уровень ISG значительно повышается во время инфекции SIV (30–33).В дополнение к индукции ISG, IFN-α, как было показано, запускает адаптивные иммунные ответы путем перекрестного представления вирусных антигенов Т-клеткам CD8 + (34–36). Интересно, что Boasso et al. продемонстрировали, что IFN-α-индуцированная индоламин-2,3-диоксигеназа (IDO) из pDC ингибирует пролиферацию Т-клеток CD4 + во время ВИЧ-инфекции (37), и было обнаружено, что блокада взаимодействий gp120 / CD4 ингибирует опосредованную ВИЧ индукцию IDO и IFN-α (38, 39).
В отличие от защитного действия IFN-α во время ВИЧ-инфекции, увеличение продукции IFN-α сопровождалось увеличением нагрузки ВИЧ (40).Mandl et al. (41) утверждали, что генерализованная иммунная активация и прогрессирующее истощение Т-лимфоцитов CD4, наблюдаемые при патогенной инфекции SIV, вероятно, были вызваны аберрантной активацией врожденной иммунной системы и повышенным продуцированием IFN-α в отличие от естественных хозяев, таких как сажистые мангабеи. Мартинсон и др. (42) сообщили, что стимуляция TLR и секреция IFN-α с помощью pDC способствуют активации иммунной системы во время ВИЧ-инфекции. Другие показали, что быстрое прогрессирование ВИЧ было связано с непрерывной выработкой IFN-α, вероятно, за счет усиленной дифференцировки и активации Т-клеток (43).Parrish et al (44) продемонстрировали, что передаваемые вирусы-основатели более эффективно реплицируются и распространяются в Т-клетках CD4 в присутствии IFN-α. Fraietta et al. (45) показали, что IFNα / β усиливает экспрессию Bak, проапоптотического белка, который коррелирует с повышенным апоптозом Т-клеток, низким количеством Т-лимфоцитов CD4 + и высокой вирусной нагрузкой у ВИЧ-инфицированных пациентов. Было обнаружено, что пациенты, у которых развилось заболевание, имели более низкие уровни pDC, но имели более высокие уровни IFN-α и MxA по сравнению со здоровыми людьми (46).В других исследованиях сообщается, что IFN-α способствует хронической иммунной активации, апоптозу и иммунной дисфункции во время ВИЧ-1-инфекции (47–51). Аналогичным образом было обнаружено, что IFN-α регулирует апоптоз CD4 + Т-клеток, индуцированный неинфекционным ВИЧ-1, путем усиления экспрессии TNF-связанного лиганда, индуцирующего апоптоз (TRAIL) (38). Cha et al. (52) сообщили, что IFN-α значительно усиливает пролиферацию, индуцированную активацией, но не гомеостатическую пролиферацию, предполагая, что IFN-α, вероятно, способствует потере CD4 T-клеток за счет ускорения обновления клеток и гибели клеток, вызванной активацией.С другой стороны, Dondi et al. обнаружили, что IFN-α проявляет противоположные свойства индуцирования пролиферации и проапоптоза (53). Хроническая передача сигналов IFN-α участвует в других стойких вирусных инфекциях, таких как LCMV (54, 55).
Подтипы IFN типа I и ВИЧ-инфекция
С момента его первоначального открытия были идентифицированы многочисленные изоформы IFN типа I. Эти изоформы, кодируемые генами одного экзона, включают IFN-α (который содержит 13 различных подтипов, а именно IFN-α1, α2, α4, α5, α6, α7, α8, α10, α13, α14, α16, α17 и α21), IFN-β, IFN-ε, IFN-κ и IFN-ω (56).Все подтипы IFN типа I передают сигнал через общий рецепторный комплекс, состоящий из субъединиц IFN-αR1 и IFN-αR2. У людей подтипы IFN-α имеют ~ 70–99% идентичности аминокислотных последовательностей друг с другом и ~ 35% идентичности с IFN-β (57).
Эволюционное преимущество наличия нескольких изоформ одного и того же гена, которые связываются с общим рецепторным комплексом, неясно. Однако есть свидетельства того, что разные подтипы демонстрируют различную аффинность связывания с общими рецепторами (58-60), что, в свою очередь, по-видимому, влияет на их эффективность и действенность (суммированные в Таблице 1).Подтипы, такие как IFNα-10, связываются с рецепторным комплексом IFN-αR1 / 2 со сродством, которое в 10–100 раз превышает сродство IFNα-1 (61). Интересно, что IFNα-10 оказался высокоэффективным против вируса леса Семлики и вируса везикулярного стоматита, тогда как IFN-α1 оказался наименее эффективным среди девяти различных протестированных подтипов (61). Cull et al. (62) исследовали экспрессию IFN-α1, α2, α4, α5, α6 и α9 и IFN-β при миокардите, вызванном цитомегаловирусом мышей, и обнаружили, что IFN-α6 снижает репликацию вируса и воспаление в отличие от IFN-α2 и α5. это увеличило репликацию.
Таблица 1 . Противовирусная активность подтипов IFN-α.
Sperber et al. Показали, что IFNα-2 индуцировал гены хемотаксиса и был наиболее эффективным против ВИЧ-1 (72), тогда как IFN-α8 индуцировал ISG, которые защищали от репликации HCV (65). Foster et al (64) показали, что IFN-α8 обладает очень высокой противовирусной активностью по сравнению с некоторыми другими подтипами. С другой стороны, Scagnolari et al. (69) сообщили, что IFN-α5, 6, 8 и 10 обладают высокой эффективностью против метапневмовируса человека, тогда как IFN-α2, 17 и 21 были наименее эффективными.Другие показали значительные различия в противовирусных и антипролиферативных эффектах in vitro различных подтипов (73–75). Хибберт и Фостер (76) исследовали влияние различных подтипов на В-клетки человека и показали, что IFN-α8 индуцирует пролиферацию в очень низких концентрациях по сравнению с другими подтипами, при этом IFN-α1 в значительной степени неактивен. Аналогичным образом, Hilkens et al. (77) исследовали передачу сигналов через киназу Janus / STAT и транскрипционные ответы на выбранные подтипы IFN-α в человеческих Т-клетках и дендритных клетках и сообщили о различиях в способности различных подтипов индуцировать ISG.
Многочисленные исследования изучали экспрессию подтипов IFN при инфицировании как ВИЧ, так и SIV. Зарицкий и др. (78) оценили экспрессию как общей мРНК IFNα, так и характер экспрессии мРНК подтипа IFN-α у макак во время острой инфекции SIV и обнаружили, что все 13 подтипов экспрессировались в селезенке, причем IFN-α4, 17 и 21 были наименьшими. в изобилии по сравнению с высокими уровнями IFN-α2, 8 и 13. Напротив, только подтипы IFN-α2, 6 и 13 были экспрессированы в головном мозге, тогда как подтипы IFN-α6 и 13 были активированы в легких, что свидетельствует о тканевой -специфические различия в экспрессии различных подтипов.Lehman et al. (46) сообщили, что уровень IFN-α2 и IFN-α6 значительно повышается у ВИЧ-инфицированных пациентов. С другой стороны, Ли и др. (79) показали, что IFN-α2 и 16 активируются во время хронической ВИЧ-инфекции. Джордж и др. (3) исследовали экспрессию подтипов IFN I и III типа в периферической крови, слизистой оболочке тощей кишки и лимфатических узлах (LN) инфицированных SIV макак-резус и сообщили, что все подтипы (IFN-α01 / 13, 02, 06, 08 , 14, 16, 23, 24, 25, 27, 28 и 29, IFN-β, IFN-ω и IFN-λ1) были значительно повышены в LN на 10 день после инфицирования по сравнению с ограниченной экспрессией в PBMC (IFN -α01 / 13 и IFN-λ1) и слизистой оболочки тонкой кишки (IFN-α1, 6, 8, 14 и 23, IFN-ω и IFN-λ).Харпер и др. (80) оценили экспрессию различных подтипов IFN-α и их эффективность в pDC, подвергнутых воздействию ВИЧ-1, с использованием культуральной модели lamina propria aggregate ex vivo и сообщили, что ВИЧ-инфекция индуцировала многочисленные подтипы IFN-α с IFN-α6, IFN. -α8 и IFN-α14 являются наиболее эффективными при ингибировании ВИЧ-инфекции. Более ранние исследования (72) показали, что IFN-α2 был эффективен в подавлении репликации ВИЧ-1, хотя более поздние исследования (70) показали, что IFN-α14 проявляет значительно более высокую противовирусную активность, чем IFN-α2, против ВИЧ-инфекции на гуманизированных моделях мышей.
Подтипы IFN-α и потенциал для функционального лечения
Учитывая способность IFN-α вызывать активацию иммунной системы во время ВИЧ-инфекции, существует потенциальное беспокойство относительно его использования в стратегиях функционального лечения, хотя есть неофициальные данные о том, что IFN-α может подавлять репликацию вируса во время антиретровирусной терапии.
Лечение ВИЧ-инфицированных субъектов с помощью ВААРТ пегилированным IFN-α2a было связано с подавлением нагрузки РНК ВИЧ (81). Аналогичным образом Sun et al.(82) продемонстрировали, что лечение пациентов с коинфекцией ВИЧ / ВГС IFN-α / рибавирином во время ВААРТ привело к умеренному, но значительному и устойчивому снижению клеточно-ассоциированной ДНК ВИЧ. Недавние сообщения об использовании IFN-α в сочетании с другими факторами кажутся многообещающими. Micci et al. (83) сообщили, что комбинация рекомбинантного IL-21 и пегилированного-IFN-α2a ограничивает остаточное воспаление и вирусную персистентность у SIV-инфицированных макак-резус и значительно замедляет вирусный отскок после отмены антиретровирусной терапии.Другие (84) показали, что предварительная обработка CD4 T-клеток IFN-α и IFN-β обращала латентность ВИЧ в T-клетках как in vitro, , так и ex vivo , и была связана с уменьшением количества латентно инфицированных клеток. . Аззони и др. (81) продемонстрировали, что монотерапия пегилированным IFN-α2 успешно подавляла репликацию ВИЧ-1 и уменьшала ассоциированную с клетками ДНК ВИЧ.
Недавние исследования Lavender et al. (70) показали, что IFN-α14 при доставке в той же клинической дозе, что и IFN-α2 гуманизированным мышам, значительно подавлял репликацию ВИЧ и провирусную нагрузку и снижал активацию иммунной системы, что сопровождалось индукцией высоких уровней APOBEC3G, MX2 и тезерина, которые имели было показано, что он мешает репликации ВИЧ (85–88).Abraham et al. (66) показали, что генная терапия плазмидами, кодирующими IFN-β и IFN-α14, значительно подавляла репликацию ВИЧ-1 у мышей в течение более длительных периодов времени по сравнению с другими широко используемыми подтипами, такими как IFN-α2. Интересно, что все обработанные мыши восстановились после прекращения лечения IFN-α14. Необходимы дополнительные исследования, чтобы определить, активировала ли защитная эффективность IFN-α14 специфические врожденные защиты во время антиретровирусной терапии, которые отличались от тех, которые были вызваны другими протестированными подтипами.Эти исследования, однако, повышают вероятность того, что подтипы IFN, такие как IFN-α14, могут быть мощным дополнением к существующим подходам, изучающим стратегии функционального лечения у ВИЧ-инфицированных субъектов.
Другие исследования показали, что определенные подтипы IFN более эффективны при активации NK-клеток, которые могут быть использованы для уничтожения латентно инфицированных клеток после реактивации. Гибберт и др. (89) продемонстрировали, что IFN-α11-активированные NK-клетки, которые обеспечивают цитолитическое уничтожение клеток, инфицированных ретровирусом Friend, по сравнению с другими подтипами, такими как IFN-α2 и IFN-α5.Hua et al. (90) недавно сообщили, что лечение пациентов с коинфекцией ВИЧ-1 / HCV на ВААРТ с помощью пегилированного IFN-α индуцировало активацию CD56 bright CD16 — и CD56 bright CD16 + NK-клеток, экспрессирующих NKG2D. NKp30, который значительно коррелировал со снижением уровня резервуара вируса ВИЧ-1 в Т-клетках CD4. Song et al. (67) исследовали влияние подтипов IFN-α на инфекцию HBV и обнаружили, что IFN-α4 и IFN-α5 коррелировали с размножением эффекторных NK-клеток как в печени, так и в селезенке, что было связано с лучшим контролем репликации HBV.Было обнаружено, что обработка ВИЧ-инфицированных гуманизированных мышей IFN-α14 увеличивает экспрессию цитотоксической молекулы TRAIL в NK-клетках, тогда как Stegmann et al. (91) показали, что индукция TRAIL на NK-клетках IFN-α была связана с лучшим контролем инфекции гепатита С. NK-клетки играют важную роль в борьбе с ВИЧ-инфекциями (92), и стратегии, которые могут повысить активность NK-клеток, могут быть полезны для уничтожения латентно инфицированных клеток.
Исследования, описанные выше, предполагают, что подмножество подтипов IFN может быть более эффективным в борьбе с инфекцией, чем другие, хотя в наших знаниях о сроках введения этих подтипов в контексте супрессивной ВААРТ существует значительный пробел, который потенциально может повлиять на их эффективность. .Sandler et al. (32) лечили инфицированных SIV макак-резус IFN-α2 во время острой фазы инфекции и сообщили, что IFN-α2 первоначально усиливал экспрессию противовирусных генов, тогда как непрерывное лечение сопровождалось десенсибилизацией и увеличением размера вирусного резервуара. Хотя эффект от начала терапии ИФН на ранней стадии инфекции кажется очевидным, неясно, будут ли субъекты, находящиеся на супрессивных схемах ВААРТ, не реагировать на лечение различными подтипами ИФН.
В двух интересных новых исследованиях (93, 94) с использованием модели гуманизированных мышей сообщается, что блокирование передачи сигналов IFN и снижение IFN-индуцированной активации путем обработки антителом к рецептору IFN может уменьшить размер резервуара ВИЧ и замедлить отскок вируса после прекращения лечения. ВААРТ. Эти исследования, по-видимому, контрастируют с тем, о чем сообщалось ранее с использованием моделей приматов, не относящихся к человеку, где было обнаружено, что блокада IFN-αR имеет противоположный эффект (32). Audige et al. сообщили, что лечение антителом против IFN-αR было связано с усилением репликации ВИЧ (13).С другой стороны, было показано, что блокада хронической передачи сигналов IFN снижает активацию иммунной системы и устраняет стойкую инфекцию LCMV у мышей (55). Необходимы дополнительные исследования, чтобы лучше прояснить и подтвердить эти результаты на ВИЧ-инфицированных.
Заключение
Срочно необходимы функциональные стратегии лечения, которые могут уничтожить резервуар вируса. В настоящее время изучается ряд подходов для достижения этой цели. Хотя терапия IFN-α была предпринята в этой области, появились новые данные, свидетельствующие о том, что определенные подтипы, такие как IFN-α8 и 14, могут проявлять более высокую эффективность против ВИЧ-инфекции, чем подтипы, такие как IFN-α2, которые использовались в прошлом. .Могут ли эти подтипы усиливать врожденную иммунную защиту во время супрессивной ВААРТ и будут ли эти врожденные защиты достаточными для уничтожения реактивированного латентного резервуара, еще предстоит выяснить. Исследования, в которых используется комбинация подходов, таких как конкретные подтипы IFN-α вместе с терапевтической иммунизацией для активации как врожденного, так и адаптивного иммунного ответа во время супрессивной ВААРТ, вероятно, будут более эффективными для достижения полной ремиссии ВИЧ.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Финансирование
Описанный проект был поддержан фондами NIAID (AI125260) и Университета военной службы для JJM. Мнения или утверждения, содержащиеся в данном документе, являются частными для авторов и не должны рассматриваться как официальные или отражающие точку зрения Министерства обороны, Университета силовых структур или любого другого агентства правительства США.
Список литературы
2. Айзекс А., Линденманн Дж. Вирусное вмешательство. I. Интерферон. Proc R Soc Lond B Biol Sci (1957) 147 (927): 258–67. DOI: 10.1098 / rspb.1957.0049
CrossRef Полный текст | Google Scholar
3. Джордж Дж., Ренн Л., Вертели Д., Рёдерер М., Рабин Р. Л., Маттапаллил Дж. Дж. Раннее лечение ингибиторами обратной транскриптазы значительно подавляет пик IFN-альфа в плазме in vivo во время острой инфекции вируса иммунодефицита обезьян. Cell Immunol (2016) 310: 156–64.DOI: 10.1016 / j.cellimm.2016.09.003
CrossRef Полный текст | Google Scholar
5. Сигал Ф.П., Кадоваки Н., Шоделл М., Фицджеральд-Бокарсли П.А., Шах К., Хо С. и др. Природа основных продуцирующих интерферон клеток 1 типа в крови человека. Наука (1999) 284 (5421): 1835–7. DOI: 10.1126 / science.284.5421.1835
CrossRef Полный текст | Google Scholar
7. Ито Т., Ван Ю.Х., Лю Ю.Дж. Плазмацитоидные предшественники дендритных клеток / клетки, продуцирующие интерферон I типа, обнаруживают вирусную инфекцию с помощью toll-подобных рецепторов (TLR) 7 и TLR9. Springer Semin Immunopathol (2005) 26 (3): 221–9. DOI: 10.1007 / s00281-004-0180-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Круг А., Ротенфуссер С., Хорнунг В., Ярсдорфер Б., Блэквелл С., Баллас З. К. и др. Идентификация олигонуклеотидных последовательностей CpG с высокой индукцией IFN-альфа / бета в плазматических дендритных клетках. Eur J Immunol (2001) 31 (7): 2154–63. DOI: 10.1002 / 1521-4141 (200107) 31: 7 <2154 :: AID-IMMU2154> 3.0.CO; 2-U
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9.Гао Д., Ву Дж., Ву Ю. Т., Ду Ф, Аро С., Ян Н. и др. Циклическая GMP-AMP-синтаза является сенсором врожденного иммунитета ВИЧ и других ретровирусов. Наука (2013) 341 (6148): 903–6. DOI: 10.1126 / science.1240933
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Лахайе X, Сато Т., Джентили М., Цербони С., Конрад С., Хурбейн И. и др. Капсиды ВИЧ-1 и ВИЧ-2 определяют иммунное обнаружение вирусной кДНК с помощью врожденного сенсора cGAS в дендритных клетках. Иммунитет (2013) 39 (6): 1132–42.DOI: 10.1016 / j.immuni.2013.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Мартин-Гайо Э., Бузон М.Дж., Оуян З., Хикман Т., Кронин Дж., Пименова Д. и др. Мощные клеточные иммунные ответы в дендритных клетках способствуют ВИЧ-1-специфическому Т-клеточному иммунитету у элитных контроллеров ВИЧ-1. PLoS Pathog (2015) 11 (6): e1004930. DOI: 10.1371 / journal.ppat.1004930
CrossRef Полный текст | Google Scholar
12. Герцнер А.М., Хагманн С.А., Голдек М., Вольтер С., Кублер К., Виттманн С. и др.Последовательно-специфическая активация ДНК-сенсора cGAS Y-образными структурами ДНК, обнаруженными в первичной кДНК ВИЧ-1. Nat Immunol (2015) 16 (10): 1025–33. DOI: 10.1038 / ni.3267
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Audige A, Urosevic M, Schlaepfer E, Walker R, Powell D, Hallenberger S и др. Состояние анти-ВИЧ, но не апоптоз, зависит от сигнатуры IFN в CD4 + Т-клетках. J Immunol (2006) 177 (9): 6227–37. DOI: 10.4049 / jimmunol.177.9.6227
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Бака-Реген Л., Хайнцингер Н., Стивенсон М., Гендельман Х. Антиретровирусная активность, индуцированная альфа-интерфероном: ограничение синтеза вирусных нуклеиновых кислот и продукции вирионов потомства в моноцитах, инфицированных вирусом иммунодефицита человека 1 типа. J Virol (1994) 68 (11): 7559–65.
Google Scholar
15. Chen K, Huang J, Zhang C, Huang S, Nunnari G, Wang FX и др. Альфа-интерферон сильно усиливает активность APOBEC3G против вируса иммунодефицита человека типа 1 в покоящихся первичных Т-лимфоцитах CD4. J Virol (2006) 80 (15): 7645–57. DOI: 10.1128 / JVI.00206-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Lane HC, Davey V, Kovacs JA, Feinberg J, Metcalf JA, Herpin B, et al. Интерферон-альфа у пациентов с бессимптомной инфекцией вируса иммунодефицита человека (ВИЧ). Рандомизированное плацебо-контролируемое исследование. Ann Intern Med (1990) 112 (11): 805–11. DOI: 10.7326 / 0003-4819-112-11-805
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17.Asmuth DM, Murphy RL, Rosenkranz SL, Lertora JJ, Kottilil S, Cramer Y, et al. Безопасность, переносимость и механизмы антиретровирусной активности пегилированного интерферона альфа-2a у участников, инфицированных ВИЧ-1: клиническое испытание фазы II. J Infect Dis (2010) 201 (11): 1686–96. DOI: 10.1086 / 652420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Агы М.Б., Акер Р.Л., Шерберт С.Х., Катце М.Г. Лечение интерфероном подавляет репликацию вируса в ВИЧ-1- и SIV-инфицированных линиях CD4 + Т-клеток с помощью различных механизмов: свидетельства снижения стабильности и аберрантного процессинга белков ВИЧ-1. Вирусология (1995) 214 (2): 379–86. DOI: 10.1006 / viro.1995.0047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Беднарик Д.П., Моска Д.Д., Радж Н.Б., Пита П.М. Ингибирование репликации вируса иммунодефицита человека (ВИЧ) трансактивированным ВИЧ альфа-2-интерфероном. Proc Natl Acad Sci U S. A (1989) 86 (13): 4958–62. DOI: 10.1073 / pnas.86.13.4958
CrossRef Полный текст | Google Scholar
20. Goujon C, Malim MH. Характеристика индуцированного альфа-интерфероном постентрийного блока ВИЧ-1-инфекции в первичных макрофагах человека и Т-клетках. J Virol (2010) 84 (18): 9254–66. DOI: 10.1128 / JVI.00854-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Дианзани Ф., Кастиллетти С., Джентиле М., Гелдерблом Х.Р., Фрезза Ф., Капобианки МР. Влияние IFN-альфа на поздние стадии цикла репликации ВИЧ-1. Biochimie (1998) 80 (8–9): 745–54. DOI: 10.1016 / S0300-9084 (99) 80028-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Хансен Б.Д., Нара П.Л., Махешвари Р.К., Сидху Г.С., Бернбаум Дж. Г., Хукзема Д. и др.Потеря инфекционности вирусом-потомком от Т-клеток, инфицированных вирусом иммунодефицита человека 1-го типа, обработанных альфа-интерфероном, связана с дефектной сборкой gp120 оболочки. J Virol (1992) 66 (12): 7543-8.
Google Scholar
23. Кинзл П., Отани Т., Бенц Р., Миновада Дж. Интерферон-альфа и -гамма по-разному снижают быструю гибель незрелых Т-клеток при контакте с клонами клеток-носителей ВИЧ-1 in vitro. Microbiol Immunol (1997) 41 (9): 709–16. DOI: 10.1111 / j.1348-0421.1997.tb01915.x
CrossRef Полный текст | Google Scholar
24. Ширази Й, Питха ПМ. Интерферон подавляет экспрессию гена CXCR4 (фузин) в мононуклеарных клетках периферической крови. J Hum Virol (1998) 1 (2): 69–76.
Google Scholar
25. Герни КБ, Колантонио А.Д., Блом Б., Спитс Н, Уиттенбогаарт СН. Продукция эндогенного IFN-альфа плазматическими дендритными клетками оказывает противовирусное действие на инфекцию ВИЧ-1 в тимусе. J Immunol (2004) 173 (12): 7269–76.DOI: 10.4049 / jimmunol.173.12.7269
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Сакума Р., Маэль А.А., Икеда Ю. Альфа-интерферон усиливает TRIM5-альфа-опосредованную противовирусную активность в клетках человека и макака-резуса. J Virol (2007) 81 (18): 10201–6. DOI: 10.1128 / JVI.00419-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Босингер С.Е., Ли К., Гордон С.Н., Клатт Н.Р., Дуан Л., Сюй Л. и др. Глобальный геномный анализ показывает быстрый контроль над устойчивой врожденной реакцией у сажистых мангабеев, инфицированных вирусом SIV. J Clin Invest (2009) 119 (12): 3556–72. DOI: 10.1172 / JCI40115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Мур А.С., Бикслер С.Л., Льюис М.Г., Вертели Д., Маттапаллил Дж. Дж. Слизистые и периферические мононуклеарные клетки Lin- HLA-DR + CD11c / 123- CD13 + CD14- предпочтительно инфицированы во время острой инфекции вируса обезьяньего иммунодефицита. J Virol (2012) 86 (2): 1069–78. DOI: 10.1128 / JVI.06372-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30.Абель К., Алегрия-Хартман MJ, Rothaeusler K, Marthas M, Miller CJ. Взаимосвязь между уровнями РНК вируса обезьяньего иммунодефицита и уровнями мРНК альфа / бета-интерферонов (IFN-альфа / бета) и IFN-альфа / бета-индуцируемого Mx в лимфоидных тканях макак-резус во время острой и хронической инфекции. J Virol (2002) 76 (16): 8433–45. DOI: 10.1128 / JVI.76.16.8433-8445.2002
CrossRef Полный текст | Google Scholar
31. Кадер М., Смит А.П., Гвидуччи С., Вандерлих Е.Р., Нормолл Д., Уоткинс С.К. и др.Блокирование опосредованной TLR7 и TLR9 продукции IFN-альфа плазматическими дендритными клетками не снижает иммунную активацию при ранней инфекции SIV. PLoS Pathog (2013) 9 (7): e1003530. DOI: 10.1371 / journal.ppat.1003530
CrossRef Полный текст | Google Scholar
32. Сандлер Н.Г., Босингер С.Е., Эстес Д.Д., Чжу Р.Т., Тарп Г.К., Бориц Э. и др. Реакция интерферона I типа у макак-резусов предотвращает инфекцию SIV и замедляет прогрессирование заболевания. Nature (2014) 511 (7511): 601–5.DOI: 10.1038 / природа13554
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Schaefer TM, Fuller CL, Basu S, Fallert BA, Poveda SL, Sanghavi SK, et al. Повышенная экспрессия индуцируемых интерфероном генов в тканях легких макак во время инфицирования вирусом иммунодефицита обезьян. Микробы заражают (2006) 8 (7): 1839–50. DOI: 10.1016 / j.micinf.2006.02.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ле Бон А., Этчарт Н., Россманн К., Эштон М., Хоу С., Геверт Д. и др.Перекрестное прайминг CD8 + Т-клеток, стимулированных вирус-индуцированным интерфероном I типа. Nat Immunol (2003) 4 (10): 1009-15. DOI: 10.1038 / ni978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. Виттер Ф., Баруки Ф., Гриффин Д., Надлер П., Вудс А., Вуд Д. и др. Биологический ответ (противовирусный) на рекомбинантный человеческий интерферон альфа 2а в зависимости от дозы и пути введения у здоровых добровольцев. Clin Pharmacol Ther (1987) 42 (5): 567–75. DOI: 10.1038 / clpt.1987.198
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Боассо А., Хербеваль Дж. П., Харди А. В., Андерсон С. А., Долан М. Дж., Фукс Д. и др. ВИЧ подавляет пролиферацию CD4 + Т-клеток, индуцируя индоламин-2,3-диоксигеназу в плазматических дендритных клетках. Кровь (2007) 109 (8): 3351–9. DOI: 10.1182 / кровь-2006-07-034785
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Herbeuval JP, Hardy AW, Boasso A, Anderson SA, Dolan MJ, Dy M, et al.Регулирование связанного с TNF лиганда, индуцирующего апоптоз, на первичных CD4 + Т-клетках с помощью ВИЧ-1: роль плазматических дендритных клеток, продуцирующих IFN I типа. Proc Natl Acad Sci U S. A (2005) 102 (39): 13974–9. DOI: 10.1073 / pnas.0505251102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Манчес О., Манн Д., Фаллахи А., Лифсон Дж., Шаперо Л., Плумас Дж. И др. ВИЧ-активированные плазмоцитоидные DC человека индуцируют Treg через индоламин-2,3-диоксигеназозависимый механизм. J Clin Invest (2008) 118 (10): 3431–9. DOI: 10.1172 / JCI34823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Стейси А.Р., Норрис П.Дж., Цинь Л., Хейгрин Е.А., Тейлор Э., Хейтман Дж. И др. Индукция поразительного системного каскада цитокинов до пика виремии при острой инфекции вируса иммунодефицита человека типа 1, в отличие от более умеренных и отсроченных ответов при острых вирусных инфекциях гепатита B и C. J Virol (2009) 83 (8): 3719–33. DOI: 10.1128 / JVI.01844-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Мандл Дж. Н., Барри А. П., Вандерфорд Т. Х., Козырь Н., Чаван Р., Клукинг С. и др. Дивергентная передача сигналов TLR7 и TLR9 и продукция интерферона типа I различают патогенные и непатогенные вирусные инфекции СПИДа. Nat Med (2008) 14 (10): 1077–87. DOI: 10,1038 / нм.1871
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Мартинсон Дж. А., Монтойя С. Дж., Усуга Х, Ронкильо Р., Ландей А. Л., Десаи С. Н..Хлорохин модулирует индуцированный ВИЧ-1 плазматический интерферон дендритных клеток: значение для активации Т-клеток. Антимикробные агенты Chemother (2010) 54 (2): 871–81. DOI: 10.1128 / AAC.01246-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Hyrcza MD, Kovacs C, Loutfy M, Halpenny R, Heisler L, Yang S, et al. Четкие профили транскрипции в ex vivo CD4 + и CD8 + Т-клетках устанавливаются на ранних стадиях инфицирования вирусом иммунодефицита человека 1 типа и характеризуются хроническим интерфероновым ответом, а также обширными транскрипционными изменениями в CD8 + Т-клетках. J Virol (2007) 81 (7): 3477–86. DOI: 10.1128 / JVI.01552-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Пэрриш Н.Ф., Гао Ф., Ли Х., Джорджи Э.Э., Барбиан Х.Дж., Пэрриш Э.Х. и др. Фенотипические свойства переданного основателя ВИЧ-1. Proc Natl Acad Sci U S. A (2013) 110 (17): 6626–33. DOI: 10.1073 / pnas.1304288110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Fraietta JA, Mueller YM, Yang G, Boesteanu AC, Gracias DT, Do DH, et al.Интерферон типа I активирует активность Bak и способствует потере Т-клеток во время инфицирования вирусом иммунодефицита человека (ВИЧ). PLoS Pathog (2013) 9 (10): e1003658. DOI: 10.1371 / journal.ppat.1003658
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Леманн К., Тауберт Д., Юнг Н., Фаткенхойер Г., ван Лунзен Дж., Хартманн П. и др. Предпочтительная повышающая регуляция экспрессии интерферона-альфа подтипа 2 у пациентов с ВИЧ-1. Ретровирусы AIDS Res Hum (2009) 25 (6): 577–81.DOI: 10.1089 / помощь.2008.0238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Herbeuval JP, Nilsson J, Boasso A, Hardy AW, Kruhlak MJ, Anderson SA и др. Дифференциальная экспрессия IFN-альфа и TRAIL / DR5 в лимфоидной ткани прогрессирующих и непрогрессорных пациентов, инфицированных ВИЧ-1. Proc Natl Acad Sci U S A (2006) 103 (18): 7000–5. DOI: 10.1073 / pnas.0600363103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Седагхат А.Р., Герман Дж., Теслович Т.М., Кофранческо Дж. Младший, Джи С.К., Талбот С.К. младший и др.Хроническая активация и истощение CD4 + Т-клеток при инфекции вируса иммунодефицита человека типа 1: опосредованное интерфероном нарушение динамики Т-клеток типа I. J Virol (2008) 82 (4): 1870–83. DOI: 10.1128 / JVI.02228-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Стилиану Э., Аукруст П., Мюллер Ф., Нордой I, Фроланд СС. Комплексное влияние интерферона-альфа на сеть цитокинов при ВИЧ-инфекции — возможный вклад в иммуносупрессию. Цитокин (2001) 14 (1): 56–62.DOI: 10.1006 / cyto.2000.0850
CrossRef Полный текст | Google Scholar
50. Стилиану Э., Иннестад А., Сиккеланд Л.И., Бьеркели В., Дамас Дж. К., Хауг Т. и др. Влияние интерферона-альфа на экспрессию генов хемокинов и членов суперсемейства факторов некроза опухолей у ВИЧ-инфицированных пациентов. Clin Exp Immunol (2002) 130 (2): 279–85. DOI: 10.1046 / j.1365-2249.2002.01980.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Загури Д., Лачгар А., Чамс В., Фолл Л.С., Бернард Дж., Загури Дж. Ф. и др.Участие интерферона альфа и Tat в иммуносупрессии неинфицированных Т-клеток и снижении хемокинов C-C при СПИДе. Proc Natl Acad Sci U S. A (1998) 95 (7): 3851–6. DOI: 10.1073 / pnas.95.7.3851
CrossRef Полный текст | Google Scholar
52. Cha L, de Jong E, French MA, Fernandez S. IFN-alpha оказывает противоположное действие на индуцированную активацией и индуцированную IL-7 пролиферацию Т-клеток, которая может нарушать гомеостатическое поддержание количества CD4 + Т-клеток при пролеченной ВИЧ-инфекции. . J Immunol (2014) 193 (5): 2178–86. DOI: 10.4049 / jimmunol.1302536
CrossRef Полный текст | Google Scholar
53. Dondi E, Roue G, Yuste VJ, Susin SA, Pellegrini S. Двойная роль IFN-альфа в балансе между пролиферацией и гибелью CD4 + T-лимфоцитов человека во время первичного ответа. J Immunol (2004) 173 (6): 3740-7. DOI: 10.4049 / jimmunol.173.6.3740
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Тейджаро Дж. Р., Нг К., Ли А. М., Салливан Б. М., Шихан К. С., Уэлч М. и др.Стойкая инфекция LCMV контролируется блокадой передачи сигналов интерферона I типа. Наука (2013) 340 (6129): 207–11. DOI: 10.1126 / science.1235214
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Wilson EB, Yamada DH, Elsaesser H, Herskovitz J, Deng J, Cheng G, et al. Блокада хронической передачи сигналов интерферона типа I для контроля стойкой инфекции LCMV. Наука (2013) 340 (6129): 202–7. DOI: 10.1126 / science.1235208
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56.Теофилопулос А.Н., Баккала Р., Бейтлер Б., Коно Д.Х. Интерфероны типа I (альфа / бета) для иммунитета и аутоиммунитета. Annu Rev Immunol (2005) 23: 307–36. DOI: 10.1146 / annurev.immunol.23.021704.115843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Genin P, Vaccaro A, Civas A. Роль дифференциальной экспрессии человеческого интерферона — генов в противовирусном иммунитете. Cytokine Growth Factor Rev (2009) 20 (4): 283–95. DOI: 10.1016 / j.cytogfr.2009.07.005
CrossRef Полный текст | Google Scholar
58. Ламкен П., Лата С., Гавутис М., Пилер Дж. Индуцированная лигандом сборка рецептора интерферона типа I на поддерживаемых липидных бислоях. J Mol Biol (2004) 341 (1): 303–18. DOI: 10.1016 / j.jmb.2004.05.059
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Piehler J, Roisman LC, Schreiber G. Новые структурные и функциональные аспекты взаимодействия интерферона I типа с рецептором, выявленные с помощью всестороннего мутационного анализа интерфейса связывания. J Biol Chem (2000) 275 (51): 40425–33. DOI: 10.1074 / jbc.M006854200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Roisman LC, Jaitin DA, Baker DP, Schreiber G. Мутационный анализ сайта связывания IFNAR1 на IFNalpha2 выявляет архитектуру слабого сайта связывания лиганд-рецептор. J Mol Biol (2005) 353 (2): 271–81. DOI: 10.1016 / j.jmb.2005.08.042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Ямаока Т., Кодзима С., Ичи С., Кашивадзаки Ю., Коиде Т., Сокава Ю.Биологические и связывающие активности подтипов IFN-альфа в клетках почечно-клеточной карциномы человека ACHN и клетках лимфомы Дауди Беркитта. J Interferon Cytokine Res (1999) 19 (12): 1343–9. DOI: 10.1089 / 10799
12803PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Калл В.С., Бартлетт Э.Дж., Джеймс СМ. Генная терапия интерфероном типа I защищает от миокардита, вызванного цитомегаловирусом. Иммунология (2002) 106 (3): 428–37. DOI: 10.1046 / j.1365-2567.2002.01423.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Йео В.С., Лоусон С.М., Бейльгарц М.В. Противовирусная активность отдельных подтипов мышиного IFN-альфа in vivo: внутримышечная инъекция конструкций экспрессии IFN снижает репликацию цитомегаловируса. J Immunol (1998) 160 (6): 2932–9.
Google Scholar
64. Фостер Г.Р., Родригес О., Гуз Ф., Шульте-Фрохлинде Э., Теста Д., Ляо М.Дж. и др. Различные относительные активности подтипов интерферона-альфа, происходящего из клеток человека: IFN-альфа 8 обладает очень высокой противовирусной активностью. J Interferon Cytokine Res (1996) 16 (12): 1027–33.
Google Scholar
65. Кояма Т., Сакамото Н., Танабэ Ю., Накагава М., Ицуи Ю., Такеда Ю. и др. Дивергентная активность подтипов интерферона-альфа против внутриклеточной репликации вируса гепатита С. Hepatol Res (2006) 34 (1): 41–9. DOI: 10.1016 / j.hepres.2005.10.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Авраам С., Чой Дж. Г., Ортега Н. М., Чжан Дж., Шанкар П., Свами Н. М..Генная терапия плазмидами, кодирующими IFN-бета или IFN-alpha14, придает долгосрочную устойчивость к ВИЧ-1 у гуманизированных мышей. Oncotarget (2016) 7 (48): 78412–20. DOI: 10.18632 / oncotarget.12512
CrossRef Полный текст | Google Scholar
67. Сонг Дж., Ли С., Чжоу Й., Лю Дж., Франсуа С., Лу М. и др. Различные противовирусные эффекты подтипов IFNalpha на мышиной модели инфекции HBV. Научный журнал (2017) 7 (1): 334. DOI: 10.1038 / s41598-017-00469-1
CrossRef Полный текст | Google Scholar
68.Moll HP, Maier T, Zommer A, Lavoie T., Brostjan C. Дифференциальная активность подтипов интерферона-альфа согласуется с различными генами-мишенями и типами клеток. Цитокин (2011) 53 (1): 52–9. DOI: 10.1016 / j.cyto.2010.09.006
CrossRef Полный текст | Google Scholar
69. Скагнолари С., Тромбетти С., Селваджи С., Карбон Т, Монтелеоне К., Спано Л. и др. Чувствительность метапневмовируса человека к интерферонам I типа in vitro. Viral Immunol (2011) 24 (2): 159–64.DOI: 10.1089 / vim.2010.0073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Лаванда К.Дж., Гибберт К., Петерсон К.Э., Ван Дис Э., Франсуа С., Вудс Т. и др. Подавление ВИЧ-1-инфекции, специфичное для подтипа интерферона альфа, in vivo. J Virol (2016) 90 (13): 6001–13. DOI: 10.1128 / JVI.00451-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Markusic M, Santak M, Kosutic-Gulija T, Jergovic M, Jug R, Forcic D. Индукция подтипов IFN-альфа и их противовирусная активность при инфицировании вирусом паротита. Viral Immunol (2014) 27 (10): 497–505. DOI: 10.1089 / vim.2014.0028
CrossRef Полный текст | Google Scholar
72. Sperber SJ, Gocke DJ, Haberzettl C, Kuk R, Schwartz B, Pestka S. Анти-ВИЧ-1 активность рекомбинантных и гибридных видов интерферона-альфа. J Interferon Res (1992) 12 (5): 363–8. DOI: 10.1089 / jir.1992.12.363
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Век П.К., Апперсон С., Мэй Л., Стеббинг Н. Сравнение противовирусной активности различных клонированных подтипов человеческого интерферона-альфа в культурах клеток млекопитающих. J Gen Virol (1981) 57 (Pt 1): 233–7. DOI: 10.1099 / 0022-1317-57-1-233
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75. Янаи Й, Сану О, Каяно Т., Ариясу Х., Ямамото К., Ямаути Х. и др. Анализ противовирусной активности препаратов природного IFN-альфа и их подтипных составов. J Interferon Cytokine Res (2001) 21 (10): 835–41. DOI: 10.1089 / 10799
53238088PubMed Аннотация | CrossRef Полный текст | Google Scholar
76.Хибберт Л., Фостер Г.Р. Интерфероны человека I типа сильно различаются по своему влиянию на пролиферацию первичных В-клеток. J Interferon Cytokine Res (1999) 19 (4): 309–18. DOI: 10.1089 / 10799
14009PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Hilkens CM, Schlaak JF, Kerr IM. Дифференциальные ответы на подтипы IFN-альфа в человеческих Т-клетках и дендритных клетках. J Immunol (2003) 171 (10): 5255–63. DOI: 10.4049 / jimmunol.171.10.5255
CrossRef Полный текст | Google Scholar
78.Зарицкий Л.А., Дери А., Леонг В.Й., Гама Л., Клементс Дж. Э. Тканеспецифический ответ подтипа интерферона альфа на инфекцию SIV в головном мозге, селезенке и легких. J Interferon Cytokine Res (2013) 33 (1): 24–33. DOI: 10.1089 / jir.2012.0018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Li Y, Sun B, Esser S, Jessen H, Streeck H, Widera M и др. Характер экспрессии отдельных подтипов IFNA при хронической ВИЧ-инфекции. J Interferon Cytokine Res (2017) 37 (12): 541–9.DOI: 10.1089 / jir.2017.0076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Харпер М.С., Го К., Гибберт К., Ли Э.Дж., Диллон С.М., Барретт Б.С. и др. Подтипы интерферона-альфа в модели ex vivo острой инфекции ВИЧ-1: экспрессия, эффективность и эффекторные механизмы. PLoS Pathog (2015) 11 (11): e1005254. DOI: 10.1371 / journal.ppat.1005254
CrossRef Полный текст | Google Scholar
81. Аззони Л., Фоулкс А.С., Папасаввас Э., Мексас А.М., Линн К.М., Маунзер К. и др.Montaner: Монотерапия пегилированным интерфероном альфа-2a приводит к подавлению репликации ВИЧ 1 типа и снижению клеточно-ассоциированной интеграции ДНК ВИЧ. J Infect Dis (2013) 207 (2): 213–22. DOI: 10.1093 / infdis / jis663
CrossRef Полный текст | Google Scholar
82. Сун Х., Базон М.Дж., Шоу А., Берг Р.К., Ю XG, Феррандо-Мартинес С. и др. Терапия гепатита С интерфероном-альфа и рибавирином снижает уровень ДНК ВИЧ-1, ассоциированной с CD4 Т-клетками, у пациентов с коинфекцией вируса ВИЧ-1 / гепатита С. J Infect Dis (2014) 209 (9): 1315–20. DOI: 10.1093 / infdis / jit628
CrossRef Полный текст | Google Scholar
83. Миччи Л., Харпер Дж., Паганини С., Кинг С., Райан Е., Виллинджер Ф. и др. Комбинированное лечение ИЛ-21 и ИФНα ограничивает остаточное воспаление и задерживает вирусный отскок у макак, инфицированных SIV (OA4-1). Форум IAS по лечению ВИЧ и рака. Июль 2017 года. Париж, Франция. J Virus Eradic (2017) 3 (Приложение 1): 1–5.
Google Scholar
84. Ван дер Слуис Р.М., Мота Т., Кумар Н.А., Эванс А.Н., Харман С., Р.Теннакун С.Г. и др.Плазмацитоидные DC контролируют латентный период ВИЧ в покоящихся Т-клетках с помощью IFNα типа I (P 32). Форум IAS по лечению ВИЧ и рака. Июль 2017 года. Париж, Франция. J Virus Eradic (2017) 3 (Приложение 1): 6–19.
Google Scholar
85. Кейн М., Ядав С.С., Битцегейо Дж., Кутлуай С.Б., Занг Т., Уилсон С.Дж. и др. MX2 — это индуцированный интерфероном ингибитор инфекции ВИЧ-1. Nature (2013) 502 (7472): 563–6. DOI: 10.1038 / nature12653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86.Мангеат Б., Турелли П., Карон Г., Фридли М., Перрин Л., Троно Д. Широкая антиретровирусная защита человеческим APOBEC3G посредством летального редактирования возникающих обратных транскриптов. Nature (2003) 424 (6944): 99–103. DOI: 10.1038 / nature01709
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87. Пиллаи С.К., Абдель-Мохсен М., Гуателли Дж., Скаско М., Монто А., Фудзимото К. и др. Роль факторов рестрикции ретровирусов в опосредованном интерфероном-альфа подавлении ВИЧ-1 in vivo. Proc Natl Acad Sci U S A (2012) 109 (8): 3035–40.DOI: 10.1073 / pnas.1111573109
CrossRef Полный текст | Google Scholar
88. Шихи А.М., Гаддис, Северная Каролина, Чой Д.Д., Малим М.Х. Выделение человеческого гена, который подавляет инфекцию ВИЧ-1 и подавляется вирусным белком Vif. Nature (2002) 418 (6898): 646–50. DOI: 10.1038 / nature00939
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Гибберт К., Джодике Дж. Дж., Мерик А., Триллинг М., Франсуа С., Дуппах Дж. И др. Подтип 11 интерферона-альфа активирует NK-клетки и позволяет контролировать ретровирусную инфекцию. PLoS Pathog (2012) 8 (8): e1002868. DOI: 10.1371 / journal.ppat.1002868
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Хуа С., Вигано С., Цзе С., Чжэнъю О, Харрингтон С., Негрон Дж. И др. Пегилированный IFN-альфа-индуцированная активация NK-клеток связана со снижением ДНК ВИЧ-1 у пациентов с коинфекцией ВИЧ-1 / HCV, принимающих АРТ. Clin Infect Dis (2017). DOI: 10.1093 / cid / cix1111
CrossRef Полный текст | Google Scholar
91. Stegmann KA, Bjorkstrom NK, Veber H, Ciesek S, Riese P, Wiegand J, et al.TRAIL, индуцированный интерфероном-альфа на естественных клетках-киллерах, связан с контролем инфекции вируса гепатита С. Гастроэнтерология (2010) 138 (5): 1885–97. DOI: 10.1053 / j.gastro.2010.01.051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Cheng L, Ma J, Li J, Li D, Li G, Li F и др. Блокирование передачи сигналов интерферона типа I увеличивает восстановление Т-клеток и уменьшает резервуары ВИЧ-1. J Clin Invest (2017) 127 (1): 269–79. DOI: 10.1172 / JCI
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94.Zhen A, Rezek V, Youn C, Lam B, Chang N, Rick J и др. Нацеленная активация, опосредованная интерфероном I типа, восстанавливает иммунную функцию при хронической ВИЧ-инфекции. J Clin Invest (2017) 127 (1): 260–8. DOI: 10.1172 / JCI89488
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Интерфероны α и β при раке: терапевтические возможности благодаря новым открытиям
Borden, E.C. et al. Интерфероны в возрасте 50 лет: прошлое, настоящее и будущее влияние на биомедицину. Nat.Rev. Drug Discov. 6 , 975–990 (2007). Этот обзор охватывает основные клеточные эффекты интерферонов в отношении ингибирования рака, вирусных инфекций и рассеянного склероза .
CAS PubMed Google ученый
Gresser, I., Bourali, C., Levy, J.P., Fontaine-Brouty-Boye, D. & Thomas, M.T. Повышение выживаемости мышей, инокулированных опухолевыми клетками и обработанных препаратами интерферона. Proc. Natl Acad. Sci. США 63 , 51–57 (1969).
CAS PubMed Google ученый
Борден, Э. С. Интерфероны: обоснование клинических испытаний при опухолевых заболеваниях. Ann. Междунар. Med. 91 , 472–479 (1979).
CAS PubMed Google ученый
Страндер, Х., Кантелл, К., Карлстром, Г. и Якобссон, П.A. Клинические и лабораторные исследования человека: системное введение сильнодействующего интерферона человеку. J. Natl Cancer Inst. 51 , 733–742 (1973).
CAS PubMed Google ученый
Gutterman, J. U. et al. Индуцированная лейкоцитарным интерфероном регрессия опухоли при метастатическом раке груди человека, множественной миеломе и злокачественной лимфоме. Ann. Междунар. Med. 93 , 399–406 (1980).
CAS PubMed Google ученый
Борден, Э. С. Прогресс в терапевтическом применении интерферонов, 1979–1983 гг. Рак 54 , 2770–2776 (1984).
CAS PubMed Google ученый
Кесада, Дж. Р., Рубен, Дж., Мэннинг, Дж. Т., Херш, Э. М. и Гуттерман, Дж. У. Альфа-интерферон для индукции ремиссии при волосисто-клеточном лейкозе. N. Engl. J. Med. 310 , 15–18 (1984).
CAS PubMed Google ученый
Rai, K. R. et al. Рекомбинантный альфа-2b-интерферон в терапии ранее нелеченого волосатоклеточного лейкоза: результаты долгосрочного наблюдения, проведенного Группой B по раку и лейкемии. Лейкемия 9 , 1116–1120 (1995).
CAS PubMed Google ученый
Kantarjian, H. M. et al. Хронический миелогенный лейкоз — прогресс в онкологическом центре им. М. Д. Андерсона за последние два десятилетия и будущие направления: первая лекция Эмиля Дж. Фрейриха. Clin. Cancer Res. 3 , 2723–2733 (1997).
CAS PubMed Google ученый
Итальянская совместная исследовательская группа по хроническому миелоидному лейкозу. Долгосрочное наблюдение за итальянским испытанием интерферона-альфа по сравнению с традиционной химиотерапией при хроническом миелоидном лейкозе. Кровь 92 , 1541–1548 (1998).
Google ученый
Кирквуд, Дж. М. и др. Адъювантная терапия интерфероном альфа-2b резецированной кожной меланомы высокого риска: исследование Восточной кооперативной онкологической группы EST 1684. J. Clin. Онкол. 14 , 7–17 (1996).
CAS PubMed Google ученый
Ives, N.J. et al.Адъювантный интерферон-альфа для лечения меланомы высокого риска: метаанализ индивидуальных данных пациента. Eur. J. Cancer 82 , 171–183 (2017). Эта статья представляет собой обновленную информацию о международных испытаниях, оценивающих IFNα2 в снижении риска рецидива после резекции первичной меланомы .
CAS PubMed Google ученый
Rudick, R.A. & Goelz, S.E. Бета-интерферон при рассеянном склерозе. Exp. Cell Res. 317 , 1301–1311 (2011).
CAS PubMed Google ученый
Лин, Ф. К. и Янг, Х. А. Интерфероны: успех в противовирусной иммунотерапии. Cytokine Growth Factor Rev. 25 , 369–376 (2014).
CAS PubMed PubMed Central Google ученый
Hoffmann, H.H., Schneider, W.М. и Райс, С. М. Интерфероны и вирусы: эволюционная гонка вооружений молекулярных взаимодействий. Trends Immunol. 36 , 124–138 (2015).
CAS PubMed PubMed Central Google ученый
Борден, Э. К. и Паркинсон, Д. Взгляд на клиническую эффективность и переносимость интерферона-альфа. Семин. Онкол. 25 , 3–8 (1998). Этот обзор дает представление о побочных эффектах лечения интерферонами .
CAS PubMed Google ученый
Вебер, Дж. С., Янг, Дж. К., Аткинс, М. Б. и Дисис, М. Л. Токсичность иммунотерапии для практикующего врача. J. Clin. Онкол. 33 , 2092–2099 (2015).
CAS PubMed PubMed Central Google ученый
Masci, P. et al. Модуляторные эффекты генов, фармакокинетика и клиническая переносимость интерферона-альфа1b: второго члена семейства интерферона-альфа. Clin. Pharmacol. Ther. 81 , 354–361 (2007).
CAS PubMed Google ученый
Курсунель М. А. и Эсендагли Г. Нерассказанная история IFN-гамма в биологии рака. Cytokine Growth Factor Rev. 31 , 73–81 (2016).
PubMed Google ученый
Ласфар, А., Гогас, Х., Злоза, А., Кауфман, Х.Л. и Кирквуд, Дж. М. Иммунотерапия рака IFN-лямбда: новый ребенок на пороге. Иммунотерапия 8 , 877–888 (2016).
CAS PubMed PubMed Central Google ученый
Чен, К., Сан, Л. и Чен, З. Дж. Регуляция и функция пути cGAS-STING при зондировании цитозольной ДНК. Nat. Иммунол. 17 , 1142–1149 (2016). Это всесторонний обзор молекулярных и клеточных аспектов оси cGAS – STING .
CAS PubMed Google ученый
Барбер, Г. Н. СТИНГ: инфекция, воспаление и рак. Nat. Rev. Immunol. 15 , 760–770 (2015). Это отличный обзор, который дополняет предыдущий, добавляя больше деталей о патофизиологии дерегуляции пути cGAS – STING .
CAS PubMed PubMed Central Google ученый
Woo, S. R. et al. Зависимость от СИНГ-зависимой цитозольной ДНК опосредует распознавание иммуногенными опухолями врожденным иммунитетом. Иммунитет 41 , 830–842 (2014).
CAS PubMed PubMed Central Google ученый
Ву, Дж. И Чен, З. Дж. Врожденное иммунное зондирование и передача сигналов цитозольных нуклеиновых кислот. Annu. Rev. Immunol. 32 , 461–488 (2014).
CAS PubMed Google ученый
Li, X. D. et al. Основные роли передачи сигналов cGAS-cGAMP в противовирусной защите и иммунных адъювантных эффектах. Наука 341 , 1390–1394 (2013).
CAS PubMed Google ученый
Sun, L., Wu, J., Du, F., Chen, X. & Chen, Z. J. Циклическая GMP-AMP-синтаза представляет собой цитозольный ДНК-сенсор, который активирует путь интерферона I типа. Наука 339 , 786–791 (2013).
CAS PubMed Google ученый
Wu, J. et al. Циклический GMP-AMP является вторичным эндогенным посредником в передаче сигналов врожденного иммунитета цитозольной ДНК. Наука 339 , 826–830 (2013).
CAS PubMed Google ученый
Икусима, Х., Негиси, Х. и Танигучи, Т. Факторы транскрипции семейства IRF на стыке врожденных и адаптивных иммунных ответов. Cold Spring Harb. Symp. Quant. Биол. 78 , 105–116 (2013).
PubMed Google ученый
Liu, S. et al. Фосфорилирование адаптерных белков врожденного иммунитета MAVS, STING и TRIF индуцирует активацию IRF3. Наука 347 , aaa2630 (2015).
PubMed Google ученый
Ablasser, A. et al. Внутренний иммунитет клетки распространяется на клетки-свидетели через межклеточный перенос цГАМФ. Природа 503 , 530–534 (2013).
CAS PubMed PubMed Central Google ученый
Gray, E. E. et al. Рецепторы, подобные AIM2, незаменимы для интерферонового ответа на внутриклеточную ДНК. Иммунитет 45 , 255–266 (2016).
CAS PubMed PubMed Central Google ученый
Almine, J. F. et al. IFI16 и cGAS взаимодействуют в активации STING во время зондирования ДНК в кератиноцитах человека. Nat. Commun. 8 , 14392 (2017).
CAS PubMed PubMed Central Google ученый
Jonsson, K. L. et al. IFI16 необходим для зондирования ДНК в макрофагах человека, способствуя выработке и функции цГАМФ. Nat. Commun. 8 , 14391 (2017).
CAS PubMed PubMed Central Google ученый
Зевини А., Оланье Д. и Хискотт Дж. Перекрестные помехи между цитоплазматическими путями зондирования RIG-I и STING. Trends Immunol. 38 , 194–205 (2017). В этом обзоре обсуждаются эффекты стимуляции синтеза интерферонов как РНК, так и ДНК .
CAS PubMed PubMed Central Google ученый
McArthur, K. et al. Макропоры BAK / BAX способствуют образованию митохондриальных грыж и оттоку мтДНК во время апоптоза. Наука 359 , eaao6447 (2018).
Google ученый
Йонеяма М., Ономото К., Джоги М., Акабоши Т. и Фуджита Т. Обнаружение вирусной РНК с помощью RIG-I-подобных рецепторов. Curr. Opin. Иммунол. 32 , 48–53 (2015).
CAS PubMed Google ученый
Wu, Y., Wu, X., Wu, L., Wang, X. & Liu, Z. Противораковые функции RIG-I-подобных рецепторов, RIG-I и MDA5, и их применения в терапии рака. Transl Res. 190 , 51–60 (2017).
CAS PubMed Google ученый
Xu, X. X. et al. RIG-I: многофункциональный белок за пределами рецептора распознавания образов. Protein Cell 9 , 246–253 (2017).
PubMed PubMed Central Google ученый
Widau, R.C. et al. RIG-I-подобный рецептор LGP2 защищает опухолевые клетки от ионизирующего излучения. Proc. Natl Acad. Sci. США 111 , E484 – E491 (2014).
CAS PubMed Google ученый
Klarquist, J. et al. Опосредованное STING определение ДНК способствует развитию противоопухолевых и аутоиммунных реакций на умирающие клетки. J. Immunol. 193 , 6124–6134 (2014).
CAS PubMed PubMed Central Google ученый
Corrales, L., McWhirter, S.M., Dubensky, Jr, T. W. и Gajewski, T. F. Путь STING хозяина на стыке рака и иммунитета. J. Clin. Инвестировать. 126 , 2404–2411 (2016). В этом обзоре анализируется критическая иммуномодулирующая роль STING .
PubMed PubMed Central Google ученый
Larkin, B. et al. Передний край: активация STING в Т-клетках вызывает ответы IFN I типа и гибель клеток. J. Immunol. 199 , 397–402 (2017).
CAS PubMed PubMed Central Google ученый
Wang, H. et al. cGAS необходим для противоопухолевого эффекта блокады иммунных контрольных точек. Proc. Natl Acad. Sci. США 114 , 1637–1642 (2017).
CAS PubMed Google ученый
Deng, L. et al. STING-зависимое цитозольное распознавание ДНК способствует индуцированному излучением интерферон-зависимому противоопухолевому иммунитету типа I в иммуногенных опухолях. Иммунитет 41 , 843–852 (2014).
CAS PubMed PubMed Central Google ученый
Fu, J. et al. Противораковые вакцины на основе агонистов СТИНГА могут вылечить уже сформировавшиеся опухоли, устойчивые к блокаде PD-1. Sci. Transl Med. 7 , 283ра252 (2015).
Google ученый
Corrales, L. et al. Прямая активация STING в микросреде опухоли приводит к сильной и системной регрессии опухоли и иммунитету. Cell Rep. 11 , 1018–1030 (2015).
CAS PubMed PubMed Central Google ученый
Fuertes, M. B. et al. Сигналы IFN-хозяина типа I необходимы для противоопухолевых ответов CD8 + Т-клеток через дендритные клетки CD8 {альфа} +. J. Exp. Med. 208 , 2005–2016 (2011).
CAS PubMed PubMed Central Google ученый
Ohkuri, T. et al. STING способствует формированию иммунитета против глиомы через запуск сигналов IFN типа I в микроокружении опухоли. Cancer Immunol. Res. 2 , 1199–1208 (2014).
CAS Google ученый
Спиотто, М., Фу, Ю. X. и Вейксельбаум, Р. Р. Взаимодействие лучевой терапии и иммунотерапии: механизмы и клинические последствия. Sci. Иммунол. 1 , eaag1266 (2016). Это обзор усиления радиотерапевтических эффектов интерферонами типа I .
PubMed PubMed Central Google ученый
Song, S. et al. Снижение экспрессии STING предсказывает плохой прогноз у пациентов с раком желудка. Sci. Отчет 7 , 39858 (2017).
CAS PubMed PubMed Central Google ученый
Kato, K. et al. Структурный и функциональный анализ ДНК-зондирования и активации иммунной системы человеческим cGAS. PLOS ONE 8 , e76983 (2013).
CAS PubMed PubMed Central Google ученый
Baird, J. R. et al. Лучевая терапия в сочетании с новыми олигонуклеотидами, нацеленными на STING, приводит к регрессии установленных опухолей. Cancer Res. 76 , 50–61 (2016).
CAS PubMed Google ученый
Luo, M. et al. Нановакцина, активирующая СТИНГ, для иммунотерапии рака. Nat. Nanotechnol. 12 , 648–654 (2017).
CAS PubMed PubMed Central Google ученый
Kimura, Y. et al. Новое химическое соединение SINCRO с двойной функцией в путях гибели интерферона STING-типа I и опухолевых клеток. Cancer Sci. 109 , 2687–2696 (2018).
CAS PubMed PubMed Central Google ученый
Leach, D. G. et al. STINGel: контролируемое высвобождение циклического динуклеотида для усиленной иммунотерапии рака. Биоматериалы 163 , 67–75 (2018).
CAS PubMed Google ученый
Burnette, B.C. et al. Эффективность лучевой терапии зависит от индукции интерферон-зависимого врожденного и адаптивного иммунитета. Cancer Res. 71 , 2488–2496 (2011).
CAS PubMed PubMed Central Google ученый
Vanpouille-Box, C. et al. Экзонуклеаза ДНК Trex1 регулирует иммуногенность опухоли, вызванную лучевой терапией. Nat. Commun. 8 , 15618 (2017).
PubMed PubMed Central Google ученый
Angioli, R. et al. Усиление радиационной цитотоксичности in vitro рекомбинантными интерферонами в клеточных линиях рака шейки матки. Рак 71 , 3717–3725 (1993).
CAS PubMed Google ученый
Werner, L.R. et al. Опосредованные транскрипцией эффекты излучения на экспрессию маркеров иммунной восприимчивости при меланоме. Радиатор. Онкол. 124 , 418–426 (2017).
CAS PubMed PubMed Central Google ученый
Schiavoni, G. et al. Циклофосфамид действует синергично с интерферонами I типа за счет системной реактивации дендритных клеток и индукции иммуногенного апоптоза опухоли. Cancer Res. 71 , 768–778 (2011).
CAS PubMed Google ученый
Hannesdottir, L. et al. Лапатиниб и доксорубицин усиливают Stat1-зависимый противоопухолевый иммунный ответ. Eur. J. Immunol. 43 , 2718–2729 (2013).
CAS PubMed Google ученый
Sistigu, A. et al. Независимый от раковых клеток вклад передачи сигналов интерферона I типа в эффективность химиотерапии. Nat. Med. 20 , 1301–1309 (2014).
CAS PubMed Google ученый
Li, T. et al. Противоопухолевая активность cGAMP посредством стимуляции cGAS-cGAMP-STING-IRF3 опосредованного врожденного иммунного ответа. Sci. Отчет 6 , 19049 (2016).
CAS PubMed PubMed Central Google ученый
Demaria, O. et al.Активация STING эндотелиальных клеток опухоли инициирует спонтанный и терапевтический противоопухолевый иммунитет. Proc. Natl Acad. Sci. США 112 , 15408–15413 (2015).
CAS PubMed Google ученый
Harding, S. M. et al. Митотическая прогрессия после повреждения ДНК делает возможным распознавание образов внутри микроядер. Природа 548 , 466–470 (2017).
CAS PubMed PubMed Central Google ученый
Benci, J. L. et al. Передача сигналов опухолевого интерферона регулирует программу мультигенной устойчивости к блокаде иммунных контрольных точек. Ячейка 167 , 1540–1554 (2016). В этом обзоре подробно описано влияние путей интерферона на активацию иммунных контрольных точек .
CAS PubMed PubMed Central Google ученый
Garcia-Diaz, A. et al. Пути передачи сигналов рецептора интерферона, регулирующие экспрессию PD-L1 и PD-L2. Cell Rep. 19 , 1189–1201 (2017).
CAS PubMed Google ученый
Ito, T. et al. Дифференциальная регуляция субпопуляций дендритных клеток крови человека с помощью IFN. J. Immunol. 166 , 2961–2969 (2001).
CAS PubMed Google ученый
Зитвогель, Л., Галлуцци, Л., Кепп, О., Смит, М. Дж. И Кремер, Г.Интерфероны I типа в противоопухолевом иммунитете. Nat. Rev. Immunol. 15 , 405–414 (2015).
CAS PubMed Google ученый
Alculumbre, S. et al. Плазмацитоидные пре-дендритные клетки (pDC): от молекулярных путей к функции и ассоциации с заболеванием. Семин. Cell Dev. Биол. https://doi.org/10.1016/j.semcdb.2018.02.014 (2018).
Артикул PubMed Google ученый
Банете, А., Сивер, К., Бакши, Д., Джи, К. и Баста, С. О снятии СТИНГА из иммунной активации. J. Leukoc. Биол. 103 , 1189–1195 (2018).
CAS Google ученый
Mattei, F., Schiavoni, G., Belardelli, F. & Tough, DF IL-15 экспрессируется дендритными клетками в ответ на IFN типа I, двухцепочечную РНК или липополисахарид и способствует развитию дендритных клеток. активация. Дж.Иммунол. 167 , 1179–1187 (2001).
CAS PubMed Google ученый
Parlato, S. et al. Экспрессия хемокинов CCR-7, MIP-3beta и Th-1 в IFN-индуцированных дендритных клетках, происходящих из моноцитов: важность для быстрого приобретения мощной миграционной и функциональной активности. Кровь 98 , 3022–3029 (2001).
CAS PubMed Google ученый
Simmons, D. P. et al. IFN типа I управляет характерным фенотипом созревания дендритных клеток, который позволяет продолжать синтез MHC класса II и процессинг антигена. J. Immunol. 188 , 3116–3126 (2012).
CAS PubMed PubMed Central Google ученый
Heise, R. et al. Передача сигналов интерферона альфа и ее значение для повышающего эффекта белков-переносчиков, связанных с процессингом антигена (TAP), у пациентов со злокачественной меланомой. PLOS ONE 11 , e0146325 (2016).
PubMed PubMed Central Google ученый
Diamond, M. S. et al. Интерферон I типа избирательно требуется дендритным клеткам для иммунного отторжения опухолей. J. Exp. Med. 208 , 1989–2003 (2011).
CAS PubMed PubMed Central Google ученый
Виллемен Ю.и другие. Конструирование дендритных клеток, полученных из моноцитов, для секреции интерферона-альфа, увеличивает их способность стимулировать адаптивные и врожденные эффекторные противоопухолевые иммунные функции. Cancer Immunol. Immunother. 64 , 831–842 (2015).
CAS PubMed Google ученый
Zarling, J. M. et al. Усиление цитотоксических ответов Т-клеток очищенным интерфероном фибробластов человека. J. Immunol. 121 , 2002–2004 (1978).
CAS PubMed Google ученый
Brinkmann, V., Geiger, T., Alkan, S. & Heusser, C.H. Интерферон альфа увеличивает частоту продуцирования интерферона гамма CD4 + Т-клеток человека. J. Exp. Med. 178 , 1655–1663 (1993).
CAS PubMed Google ученый
Колумам, Г. А., Томас, С., Томпсон, Л. Дж., Спрент, Дж.& Мурали-Кришна, К. Интерфероны типа 1 действуют непосредственно на Т-лимфоциты CD8, обеспечивая клональную экспансию и формирование памяти в ответ на вирусную инфекцию. J. Exp. Med. 202 , 637–650 (2005).
CAS PubMed PubMed Central Google ученый
Маршалл, Х. Д., Принс, А. Л., Берг, Л. Дж. И Уэлш, Р. М. IFN-альфа-бета и собственный MHC переводят CD8 Т-клетки в отдельный путь дифференцировки, характеризующийся быстрым приобретением эффекторных функций. J. Immunol. 185 , 1419–1428 (2010).
CAS PubMed PubMed Central Google ученый
Hervas-Stubbs, S. et al. Примирование Т-лимфоцитов CD8 в присутствии ИФН-альфа делает ЦТЛ более чувствительными к гомеостатическим цитокинам и отзывным антигенам: важные черты для адоптивной Т-клеточной терапии. J. Immunol. 189 , 3299–3310 (2012).
CAS PubMed Google ученый
Гернер, М. Ю., Хелтемес-Харрис, Л. М., Файф, Б. Т. и Мешер, М. Ф. Передовые технологии: ИЛ-12 и ИФН типа I дифференцированно программируют Т-клетки CD8 для уровней повторной экспрессии запрограммированной смерти 1 и борьбы с опухолью. J. Immunol. 191 , 1011–1015 (2013).
CAS PubMed PubMed Central Google ученый
Harlin, H. et al. Экспрессия хемокинов в метастазах меланомы, связанная с привлечением CD8 + Т-клеток. Cancer Res. 69 , 3077–3085 (2009).
CAS PubMed Google ученый
Gajewski, T. F. et al. Цели иммунотерапии рака основаны на понимании микросреды опухоли, воспаленной Т-клетками, и не воспаленной Т-клетками. Adv. Exp. Med. Биол . 1036 , 19–31 (2017). В данной статье анализируется иммуномодуляция в микроокружении опухоли .
CAS PubMed Google ученый
Гаевски, Т. Ф. Следующее препятствие в иммунотерапии рака: преодоление опухолевого микроокружения, не связанного с воспалением Т-лимфоцитов. Семин. Онкол. 42 , 663–671 (2015).
PubMed PubMed Central Google ученый
Корралес, Л., Матсон, В., Флуд, Б., Спрангер, С. и Гаевски, Т. Ф. Врожденная иммунная сигнализация и регуляция в иммунотерапии рака. Cell Res. 27 , 96–108 (2017).
CAS PubMed Google ученый
Le Bon, A. et al. Передний край: усиление ответа антител за счет прямой стимуляции В- и Т-клеток интерфероном типа I. J. Immunol. 176 , 2074–2078 (2006).
PubMed Google ученый
Izaguirre, A. et al. Сравнительный анализ экспрессии IRF и IFN-альфа в человеческих плазматических и дендритных клетках, происходящих из моноцитов. J. Leukoc. Биол. 74 , 1125–1138 (2003).
CAS PubMed Google ученый
Kim, S. et al. Самовсасывание определяет продукцию IFN I типа плазматическими дендритными клетками. Eur. J. Immunol. 44 , 807–818 (2014).
CAS PubMed PubMed Central Google ученый
Tel, J. et al.Плазмацитоидные дендритные клетки человека обладают антигенпрезентирующей и опухолевой способностью. Кровь 120 , 3936–3944 (2012).
CAS PubMed Google ученый
Свецки М. и Колонна М. Многогранная биология плазмоцитоидных дендритных клеток. Nat. Rev. Immunol. 15 , 471–485 (2015).
CAS PubMed PubMed Central Google ученый
Kalb, ML, Glaser, A., Stary, G., Koszik, F. & Stingl, G. TRAIL (+) плазматические дендритные клетки человека убивают опухолевые клетки in vitro: механизмы противоопухолевой реактивности, опосредованной имиквимодом и IFN-альфа . J. Immunol. 188 , 1583–1591 (2012).
CAS PubMed Google ученый
Wu, J. et al. TLR-активированные плазматические дендритные клетки подавляют рост клеток рака груди in vitro и in vivo. Oncotarget 8 , 11708–11718 (2017).
PubMed Google ученый
Butsch, R. et al. Внутриопухолевые плазмоцитоидные дендритные клетки связаны с увеличением выживаемости у пациентов с фолликулярной лимфомой. Leuk. Лимфома 52 , 1230–1238 (2011).
CAS PubMed Google ученый
Саулеп-Истон, Д.и другие. Цитокиновая потеря функции плазматических дендритных клеток при хроническом лимфоцитарном лейкозе. Лейкемия 28 , 2005–2015 (2014).
CAS PubMed PubMed Central Google ученый
Kranz, L. M. et al. Системная доставка РНК к дендритным клеткам использует противовирусную защиту для иммунотерапии рака. Природа 534 , 396–401 (2016).
PubMed Google ученый
Kreutz, M. et al. Опосредованная IFN типа I синергическая активация субпопуляций DC мыши и человека агонистами TLR. Eur. J. Immunol. 45 , 2798–2809 (2015).
CAS PubMed Google ученый
Ши, М., Чен, X., Йе, К., Яо, Ю. и Ли, Ю. Потенциал применения толл-подобных рецепторов в иммунотерапии рака: систематический обзор. Медицина 95 , e3951 (2016).
PubMed PubMed Central Google ученый
Mikulandra, M., Pavelic, J. & Glavan, T.M. Последние данные о применении агонистов toll-подобных рецепторов в терапии рака. Curr. Med. Chem. 24 , 2011–2032 (2017).
CAS PubMed Google ученый
млн лет назад, H. et al. Отсутствие Stat1 в донорских CD4 (+) Т-клетках способствует увеличению количества Treg и снижает реакцию «трансплантат против хозяина» у мышей. J. Clin. Инвестировать. 121 , 2554–2569 (2011).
CAS PubMed PubMed Central Google ученый
Sisirak, V. et al. Нарушение продукции IFN-альфа плазматическими дендритными клетками способствует увеличению регулирующих Т-клеток, которые могут способствовать прогрессированию рака груди. Cancer Res. 72 , 5188–5197 (2012).
CAS PubMed Google ученый
Piconese, S., Pacella, I., Timperi, E. & Barnaba, V. Дивергентные эффекты интерферонов типа I на регуляторные Т-клетки. Фактор роста цитокинов Ред. . 26 , 133–141 (2015).
CAS PubMed Google ученый
Pace, L. et al. Активация APC IFN-альфа снижает регуляторные Т-клетки и усиливает функции Th-клеток. J. Immunol. 184 , 5969–5979 (2010).
CAS PubMed Google ученый
Hashimoto, H. et al. Доставка гена IFN типа I подавляет регуляторные Т-клетки в опухолях. Cancer Gene Ther. 21 , 532–541 (2014).
CAS PubMed Google ученый
Anz, D. et al. Подавление внутриопухолевого CCL22 интерфероном типа i подавляет миграцию регуляторных Т-клеток и блокирует прогрессирование рака. Cancer Res. 75 , 4483–4493 (2015).
CAS PubMed Google ученый
Эдвардс, Б.С., Мерритт, Дж. А., Фулбригге, Р. К. и Борден, Е. С. Низкие дозы интерферона альфа приводят к более эффективной клинической активации естественных клеток-киллеров. J. Clin. Инвестировать. 75 , 1908–1913 (1985).
CAS PubMed PubMed Central Google ученый
Muller, L., Aigner, P. & Stoiber, D. Интерфероны типа I и регуляция естественных клеток-киллеров при раке. Фронт. Иммунол. 8 , 304 (2017).
PubMed PubMed Central Google ученый
Swann, J. B. et al. IFN типа I способствует гомеостазу, активации и противоопухолевой функции NK-клеток. J. Immunol. 178 , 7540–7549 (2007).
CAS PubMed Google ученый
Bidwell, B. N. et al. Замалчивание путей Irf7 в клетках рака груди способствует метастазированию в кости за счет ускользания иммунной системы. Nat. Med. 18 , 1224–1231 (2012).
CAS PubMed Google ученый
Zhao, Y. et al. Сверхэкспрессия фактора регуляции интерферона 7 (IRF7) снижает метастазирование клеток рака простаты в кости у мышей. Онкол. Res. 25 , 511–522 (2017).
PubMed Google ученый
Takashima, K. et al. STING в опухоли и клетках-хозяевах совместно работают на задержку роста опухоли, опосредованную NK-клетками. Biochem. Биофиз. Res. Commun. 478 , 1764–1771 (2016).
CAS PubMed Google ученый
Пилаева, Э., Ланг, С. и Яблонска, Дж. Существенная роль интерферонов типа I в дифференцировке и активации нейтрофилов, ассоциированных с опухолью. Фронт. Иммунол. 7 , 629 (2016).
PubMed PubMed Central Google ученый
Andzinski, L. et al. IFN типа I индуцируют противоопухолевую поляризацию нейтрофилов, ассоциированных с опухолью, у мышей и человека. Внутр. J. Cancer 138 , 1982–1993 (2016).
CAS PubMed Google ученый
Jablonska, J., Leschner, S., Westphal, K., Lienenklaus, S. & Weiss, S. Нейтрофилы, реагирующие на эндогенный IFN-бета, регулируют ангиогенез и рост опухоли на модели опухоли мышей. J. Clin.Инвестировать. 120 , 1151–1164 (2010).
CAS PubMed PubMed Central Google ученый
Wu, C. F. et al. Недостаток интерферона I типа вызывает опосредованное нейтрофилами образование дометастатической ниши в легких мыши. Внутр. J. Cancer 137 , 837–847 (2015).
CAS PubMed Google ученый
Zoglmeier, C.и другие. CpG блокирует иммуносупрессию миелоидными клетками-супрессорами у мышей с опухолью. Clin. Cancer Res. 17 , 1765–1775 (2011).
CAS PubMed Google ученый
Chiappinelli, K. B. et al. Ингибирование метилирования ДНК вызывает ответ интерферона при раке через дцРНК, включая эндогенные ретровирусы. Ячейка 162 , 974–986 (2015).
CAS PubMed PubMed Central Google ученый
Сайто Ю., Накаока Т. и Сайто Х. Новый молекулярный механизм, лежащий в основе противоопухолевого действия ингибиторов метилирования ДНК через противовирусный иммунный ответ. Adv. Protein Chem. Struct. Биол . 106 , 227–242 (2017).
CAS PubMed Google ученый
Леонова К.И. и др. p53 взаимодействует с метилированием ДНК и суицидным ответом интерферона для поддержания эпигенетического молчания повторов и некодирующих РНК. Proc. Natl Acad. Sci. США 110 , E89 – E98 (2013).
CAS PubMed Google ученый
Wrangle, J. et al. Изменения иммунного ответа немелкоклеточного рака легкого с азацитидином. Oncotarget 4 , 2067–2079 (2013).
PubMed PubMed Central Google ученый
Roulois, D. et al.Агенты, деметилирующие ДНК, нацелены на клетки колоректального рака, индуцируя вирусную мимикрию эндогенными транскриптами. Ячейка 162 , 961–973 (2015).
CAS PubMed PubMed Central Google ученый
Stone, M. L. et al. Эпигенетическая терапия активирует передачу сигналов интерферона I типа при раке яичников у мышей, снижая иммуносупрессию и опухолевую нагрузку. Proc. Natl Acad. Sci. США 114 , E10981 – E10990 (2017).
CAS PubMed Google ученый
Ся, Т., Конно, Х., Ан, Дж. И Барбер, Г. Н. Нарушение регуляции передачи сигналов STING при колоректальной карциноме ограничивает ответы на повреждение ДНК и коррелирует с онкогенезом. Cell Rep. 14 , 282–297 (2016).
CAS PubMed Google ученый
Wang, L. X. et al. Лечение низкими дозами децитабина индуцирует экспрессию CD80 в раковых клетках и стимулирует опухолеспецифический ответ цитотоксических Т-лимфоцитов. PLOS ONE 8 , e62924 (2013).
CAS PubMed PubMed Central Google ученый
Luo, N. et al. Ингибирование ДНК-метилтрансферазы активирует MHC-I для усиления реакции цитотоксических Т-лимфоцитов при раке груди. Nat. Commun. 9 , 248 (2018).
PubMed PubMed Central Google ученый
Чиаппинелли, К. Б., Захнов, К. А., Ахуджа, Н. и Бейлин, С. Б. Сочетание эпигенетической и иммунотерапии для борьбы с раком. Cancer Res. 76 , 1683–1689 (2016). В этой статье обсуждается возможность сочетания ингибирования метилирования генома и иммунотерапии для усиления эффектов интерферонов типа I .
CAS PubMed PubMed Central Google ученый
Старк, Г. Р., Cheon, H. & Wang, Y. Ответы на цитокины и интерфероны, которые зависят от JAK и STAT. Cold Spring Harb. Перспектива. Биол. 10 , а028555 (2018). В этом обзоре обсуждаются фундаментальные молекулярные эффекты интерферонов типа I на передачу сигналов, опосредованную JAK – STAT .
PubMed Google ученый
Старк, Г. Р. и Дарнелл, Дж. Э. мл. Путь JAK-STAT в двадцать лет. Иммунитет 36 , 503–514 (2012).
CAS PubMed PubMed Central Google ученый
Герцог П. Дж. И Уильямс Б. Р. Тонкая настройка интерфероновых ответов типа I. Фактор роста цитокинов Ред. . 24 , 217–225 (2013).
CAS PubMed Google ученый
Cheon, H., Borden, E.C. и Stark, G.R. Интерфероны и их стимулированные гены в микроокружении опухоли. Семин. Онкол. 41 , 156–173 (2014). Это обзор молекулярного и клеточного ответа, модулируемого интерферонами .
CAS PubMed PubMed Central Google ученый
Shin, D. S. et al. Первичная устойчивость к блокаде PD-1, опосредованная мутациями JAK1 / 2. Рак Discov. 7 , 188–201 (2016).
PubMed PubMed Central Google ученый
Зарецкий, Дж. М. и др. Мутации, связанные с приобретенной устойчивостью к блокаде PD-1 при меланоме. N. Engl. J. Med. 375 , 819–829 (2016).
CAS PubMed PubMed Central Google ученый
Battle, T. E., Lynch, R. A. & Frank, D. A. Сигнальный преобразователь и активатор активации транскрипции 1 в эндотелиальных клетках является негативным регулятором ангиогенеза. Cancer Res. 66 , 3649–3657 (2006).
CAS PubMed Google ученый
Fish, E. N. & Platanias, L.C. Передача сигналов рецептора интерферона при злокачественных новообразованиях: сеть клеточных путей, определяющих биологические результаты. Mol. Cancer Res. 12 , 1691–1703 (2014).
CAS PubMed PubMed Central Google ученый
Русинова И. и др. Интерфером v2.0: обновленная база данных аннотированных генов, регулируемых интерфероном. Nucleic Acids Res. 41 , D1040 – D1046 (2013).
CAS PubMed Google ученый
Дер, С. Д., Чжоу, А., Уильямс, Б. Р. и Сильверман, Р. Х. Идентификация генов, дифференциально регулируемых интерфероном альфа, бета или гамма, с использованием массивов олигонуклеотидов. Proc. Natl Acad. Sci. США 95 , 15623–15628 (1998). Это основополагающая статья, которая определяет спектр ISG .
CAS PubMed Google ученый
Шнайдер В. М., Шевиллотт М. Д. и Райс К. М. Стимулируемые интерфероном гены: сложная сеть защитных механизмов хозяина. Annu. Rev. Immunol. 32 , 513–545 (2014).
CAS PubMed PubMed Central Google ученый
Форстер С.С., Тейт М.Д. и Герцог П.Дж. МикроРНК как транскрипты, регулируемые интерфероном I типа, и модуляторы врожденного иммунного ответа. Фронт. Иммунол. 6 , 334 (2015).
PubMed PubMed Central Google ученый
Ортис, А. и Фукс, С. Ю. Антиметастатические функции интерферонов 1 типа: основа адъювантной терапии рака. Цитокин 89 , 4–11 (2017).
CAS PubMed Google ученый
Грессер И. и Беларделли Ф. Эндогенные интерфероны типа I как защита от опухолей. Фактор роста цитокинов Ред. . 13 , 111–118 (2002).
CAS PubMed Google ученый
Dunn, G.P. et al. Важнейшая функция интерферонов типа I при иммуноредактировании рака. Nat.Иммунол. 6 , 722–729 (2005).
CAS PubMed Google ученый
Picaud, S., Bardot, B., De Maeyer, E. & Seif, I. Повышенное развитие опухоли у мышей, лишенных функционального рецептора интерферона I типа. J. Interferon Cytokine Res. 22 , 457–462 (2002).
CAS PubMed Google ученый
Асьерто, М.L. et al. Сигнатура генов иммунной функции, связанных с безрецидивной выживаемостью у пациентов с раком груди. Breast Cancer Res. Относиться. 131 , 871–880 (2012).
CAS PubMed Google ученый
Linsley, P. S., Speake, C., Whalen, E. & Chaussabel, D. Потеря числа копий кластера генов интерферона в меланомах связана с уменьшением инфильтрата Т-клеток и плохим прогнозом пациента. PLOS ONE 9 , e109760 (2014).
PubMed PubMed Central Google ученый
Chang, L.C. et al. IFNAR1 является предиктором общей выживаемости при колоректальном раке, и экспрессия его мРНК коррелирует с IRF7, но не с TLR9. Медицина 93 , e349 (2014).
CAS PubMed PubMed Central Google ученый
Katlinski, K. V. et al. Инактивация рецептора интерферона способствует созданию иммунного привилегированного микроокружения опухоли. Cancer Cell 31 , 194–207 (2017). В этой статье обсуждается критическая роль IFNAR в опухоли .
CAS PubMed PubMed Central Google ученый
Chan, S. R. et al. У STAT1-дефицитных мышей спонтанно развиваются альфа-положительные по рецептору эстрогена карциномы молочной железы. Breast Cancer Res. 14 , R16 (2012).
CAS PubMed PubMed Central Google ученый
Гуджам, Ф. Дж., Макмиллан, Д. С. и Эдвардс, Дж. Взаимосвязь между общей и фосфорилированной экспрессией опухолевых клеток STAT1 и STAT3, компонентами микросреды опухоли и выживаемостью у пациентов с инвазивным протоковым раком молочной железы. Oncotarget 7 , 77607–77621 (2016).
PubMed PubMed Central Google ученый
Schneckenleithner, C. et al. Тормозит онкогенез молочной железы: потеря STAT1 предрасполагает к интраэпителиальным новообразованиям. Oncotarget 2 , 1043–1054 (2011).
PubMed PubMed Central Google ученый
Messina, N. L. et al. Модуляция противоопухолевых иммунных ответов за счет внутриопухолевой экспрессии Stat1. Immunol. Cell Biol. 91 , 556–567 (2013).
CAS PubMed Google ученый
Yue, C. et al. Ось хозяина STAT2 / интерферона типа I контролирует рост опухоли. Внутр. J. Cancer 136 , 117–126 (2015).
CAS PubMed Google ученый
Вестал Д. Дж. И Джейаратнам Дж. А. Гуанилат-связывающие белки: новые сведения о биохимических свойствах и функциях этого семейства большой интерферон-индуцированной гуанозинтрифосфатазы. J. Interferon Cytokine Res. 31 , 89–97 (2011).
CAS PubMed PubMed Central Google ученый
Чавла-Саркар, М. и др. Апоптоз и интерфероны: роль стимулированных интерфероном генов как медиаторов апоптоза. Апоптоз 8 , 237–249 (2003).
CAS PubMed Google ученый
Chawla-Sarkar, M., Leaman, D. W. & Borden, E. C. Предпочтительная индукция апоптоза интерфероном (IFN) -бета по сравнению с IFN-alpha2: корреляция с индукцией TRAIL / Apo2L в клеточных линиях меланомы. Clin.Cancer Res. 7 , 1821–1831 (2001).
CAS PubMed Google ученый
Chen, Q. et al. Apo2L / TRAIL и родственные Bcl-2 белки регулируют индуцированный интерфероном апоптоз I типа при множественной миеломе. Кровь 98 , 2183–2192 (2001).
CAS PubMed PubMed Central Google ученый
Cheriyath, V., Leaman, D. W. & Borden, E. C. Новые роли членов семейства FAM14 (G1P3 / ISG 6–16 и ISG12 / IFI27) в врожденном иммунитете и раке. J. Interferon Cytokine Res. 31 , 173–181 (2011).
CAS PubMed Google ученый
Райх, Н. К. Смертельная роль ISG54 / IFIT2. J. Interferon Cytokine Res. 33 , 199–205 (2013).
CAS PubMed PubMed Central Google ученый
Mao, H. et al. Ген 15, стимулированный интерфероном, вызывает гибель раковых клеток, подавляя сигнальный путь NF-kappaB. Oncotarget 7 , 70143–70151 (2016).
PubMed PubMed Central Google ученый
Gytz, H. et al. Апоптотические свойства индуцированного интерфероном 1-го типа белков ISG12 митохондриальной мембраны человека. Biol. Ячейка 109 , 94–112 (2017).
CAS PubMed Google ученый
Zhou, M. J. et al. ISG15 подавляет рост раковых клеток и способствует апоптозу. Внутр. J. Mol. Мед . 39 , 446–452 (2017).
CAS PubMed Google ученый
Cheriyath, V. et al. G1P3, белок выживания, индуцированный интерфероном и эстрогеном, способствует гиперплазии, устойчивости к тамоксифену и плохим исходам при раке груди. Онкоген 31 , 2222–2236 (2012).
CAS PubMed Google ученый
Порритт Р. А. и Герцог П. Дж. Динамический контроль передачи сигналов IFN типа I с помощью интегрированной сети отрицательных регуляторов. Trends Immunol. 36 , 150–160 (2015).
CAS PubMed Google ученый
Аримото, К. И., Miyauchi, S., Stoner, S.A., Fan, J. B. & Zhang, D. E. Отрицательная регуляция передачи сигналов IFN I типа. J. Leukoc. Биол. 103 , 1099–1116 (2018). В этом обзоре обсуждается баланс интерфероновых ответов в результате негативной молекулярной регуляции .
CAS Google ученый
Weichselbaum, R.R. et al. Сигнатура связанного с интерфероном гена устойчивости к повреждению ДНК является прогностическим маркером химиотерапии и лучевой терапии при раке груди. Proc. Natl Acad. Sci. США 105 , 18490–18495 (2008).
CAS PubMed Google ученый
Ходарев Н. Н., Ройзман Б. и Вейксельбаум Р. Р. Молекулярные пути: путь интерферона / stat1: роль в устойчивости опухоли к генотоксическому стрессу и агрессивному росту. Clin. Cancer Res. 18 , 3015–3021 (2012).
CAS PubMed Google ученый
Sung, P. S. et al. Роль нефосфорилированного ISGF3 в инфицировании вирусом гепатита С и чувствительности к интерферону. Proc. Natl Acad. Sci. США 112 , 10443–10448 (2015).
CAS PubMed Google ученый
Duarte, C. W. et al. Сигнатура экспрессии сигнальных генов IFN / STAT1 предсказывает плохой результат выживания в мультиформной глиобластоме в зависимости от подтипа. PLOS ONE 7 , e29653 (2012).
CAS PubMed PubMed Central Google ученый
Канг К., Робинсон Г. В. и Хеннигхаузен Л. Комплексный метаанализ геномных паттернов связывания сигнальных преобразователей и активаторов транскрипции (STAT) позволяет выявить клеточно-специфические цис-регуляторные модули. BMC Genomics 14 , 4 (2013).
CAS PubMed PubMed Central Google ученый
Ng, K. W., Marshall, E. A., Bell, J. C. & Lam, W. L. cGAS-STING и рак: дихотомические роли в иммунитете и развитии опухоли. Trends Immunol. 39 , 44–54 (2018).
CAS PubMed Google ученый
Ahn, J. et al. Канцерогенез, вызванный воспалением, опосредуется STING. Nat. Commun. 5 , 5166 (2014).
CAS PubMed PubMed Central Google ученый
Bakhoum, S. F. et al. Хромосомная нестабильность приводит к метастазированию через ответ цитозольной ДНК. Природа 553 , 467–472 (2018).
CAS PubMed PubMed Central Google ученый
Yildirim, C. et al. Интерферон-бета, решающий фактор в ангиогенезе и артериогенезе. J. Interferon Cytokine Res. 35 , 411–420 (2015).
CAS PubMed Google ученый
Сидки Ю. А. и Борден Е. С. Ингибирование ангиогенеза интерферонами: влияние на сосудистые ответы, индуцированные опухолью и лимфоцитами. Cancer Res. 47 , 5155–5161 (1987).
CAS PubMed Google ученый
Dvorak, H. F. & Gresser, I. Микрососудистое повреждение в патогенезе интерферон-индуцированного некроза подкожных опухолей у мышей. J. Natl Cancer Inst. 81 , 497–502 (1989).
CAS PubMed Google ученый
McCarty, MF, Bielenberg, D., Donawho, C., Bucana, CD & Fidler, IJ Доказательства причинной роли эндогенного интерферона-альфа / бета в регуляции ангиогенеза, онкогенности и метастазирования кожные новообразования. Clin. Exp. Метастаз 19 , 609–615 (2002).
CAS PubMed Google ученый
Spaapen, R.M. et al. Терапевтическая активность высоких доз внутриопухолевого IFN-бета требует прямого воздействия на сосудистую сеть опухоли. J. Immunol. 193 , 4254–4260 (2014).
CAS PubMed Google ученый
Huang, S., Bucana, C. D., Van Arsdall, M. & Fidler, I. J. Stat1 отрицательно регулирует ангиогенез, онкогенность и метастазирование опухолевых клеток. Онкоген 21 , 2504–2512 (2002).
CAS PubMed Google ученый
Гербер С.А. и Побер Дж. С. IFN-альфа индуцирует транскрипцию индуцируемого гипоксией фактора-1-альфа для ингибирования пролиферации эндотелиальных клеток человека. J. Immunol. 181 , 1052–1062 (2008).
CAS PubMed PubMed Central Google ученый
Taylor, K. L. et al. Идентификация стимулированных интерфероном-бета генов, ингибирующих ангиогенез in vitro. J. Interferon Cytokine Res. 28 , 733–740 (2008).
CAS PubMed Google ученый
Borden, E.C. et al. Регулирующие гены и клинические эффекты интерферона бета у пациентов с метастатической меланомой: исследование фазы II. J. Interferon Cytokine Res. 31 , 433–440 (2011).
CAS PubMed PubMed Central Google ученый
Cheng, X., Liu, Y., Chu, H. & Kao, H.Y. Белок промиелоцитарного лейкоза (PML) регулирует образование и миграцию эндотелиальной клеточной сети в ответ на фактор некроза опухоли альфа (TNFalpha) и интерферон альфа (IFNalpha). J. Biol. Chem. 287 , 23356–23367 (2012).
CAS PubMed PubMed Central Google ученый
Go, R. S. et al. Испытание фазы II ECOG с применением градуированных доз пегинтерферона альфа-2b у пациентов с метастатической меланомой со сверхэкспрессией основного фактора роста фибробластов (E2602). Clin. Cancer Res. 19 , 6597–6604 (2013).
CAS PubMed Google ученый
Takano, S., Ishikawa, E., Matsuda, M., Yamamoto, T. & Matsumura, A. Интерферон-бета ингибирует ангиогенез глиомы за счет подавления фактора роста эндотелия сосудов и усиления индуцируемого интерфероном белка 10 Внутр. J. Oncol. 45 , 1837–1846 (2014).
CAS PubMed PubMed Central Google ученый
Hsu, K. S. et al. Двойная регуляция Stat1 и Stat3 белком-супрессором опухолей PML способствует опосредованному интерфероном альфа ингибированию ангиогенеза. J. Biol. Chem. 292 , 10048–10060 (2017).
CAS PubMed PubMed Central Google ученый
Guenzi, E. et al. Спиральный домен GBP-1 опосредует ингибирование пролиферации эндотелиальных клеток воспалительными цитокинами. EMBO J 20 , 5568–5577 (2001).
CAS PubMed PubMed Central Google ученый
Raffaella, R. et al. Ген IFI16, индуцируемый интерфероном, ингибирует морфогенез трубочки и пролиферацию первичных, но не иммортализованных Е6 / Е7 ВПЧ16 эндотелиальных клеток человека. Exp. Cell Res. 293 , 331–345 (2004).
CAS PubMed Google ученый
von Marschall, Z. et al. Влияние интерферона альфа на транскрипцию гена фактора роста эндотелия сосудов и ангиогенез опухоли. J. Natl Cancer Inst. 95 , 437–448 (2003).
Google ученый
Hiroi, M., Mori, K., Sakaeda, Y., Shimada, J. & Ohmori, Y. STAT1 репрессирует индуцируемую гипоксией транскрипцию фактора-1. Biochem. Биофиз. Res. Commun. 387 , 806–810 (2009).
CAS PubMed Google ученый
Legros, L. et al. Интерферон снижает уровень VEGF у пациентов с хроническим миелолейкозом, принимающих иматиниб. Leuk. Res. 38 , 662–665 (2014).
CAS PubMed Google ученый
Dinney, C.P. et al. Ингибирование экспрессии основного фактора роста фибробластов, ангиогенеза и роста карциномы мочевого пузыря человека у мышей системным введением интерферона-альфа. Cancer Res. 58 , 808–814 (1998).
CAS PubMed Google ученый
Сингх Р. К., Гутман М., Лланса Н. и Фидлер И. Дж. Интерферон-бета предотвращает повышенную регуляцию экспрессии интерлейкина-8 в клетках меланомы человека. J. Interferon Cytokine Res. 16 , 577–584 (1996).
CAS PubMed Google ученый
Ezekowitz, R.A., Mulliken, J. B. & Folkman, J. Терапия интерфероном альфа-2a угрожающих жизни гемангиом младенчества. N. Engl. J. Med. 326 , 1456–1463 (1992).
CAS PubMed Google ученый
Краун, С. Е. СПИД-ассоциированная саркома Капоши: есть ли еще роль интерферона альфа? Фактор роста цитокинов Ред. . 18 , 395–402 (2007).
CAS PubMed PubMed Central Google ученый
Rini, B. I. et al. Рандомизированное исследование III фазы темсиролимуса и бевацизумаба в сравнении с интерфероном альфа и бевацизумабом при метастатической почечно-клеточной карциноме: исследование INTORACT. J. Clin. Онкол. 32 , 752–759 (2014).
CAS PubMed Google ученый
Пелхам, Дж. М., Грей, Дж. Д., Фланнери, Г. Р., Пимм, М. В. и Болдуин, Р. В. Конъюгация интерферона-альфа с моноклональным антителом 791T / 36 человека к остеогенной саркоме. Cancer Immunol. Immunother. 15 , 210–216 (1983).
CAS PubMed Google ученый
Хуанг, Т. Х., Чинталачаруву, К. Р. и Моррисон, С. Л. Нацеливание IFN-альфа на В-клеточную лимфому с помощью опухолеспецифического антитела вызывает сильную противоопухолевую активность. J. Immunol. 179 , 6881–6888 (2007).
CAS PubMed Google ученый
Росси, Э. А., Гольденберг, Д. М., Кардилло, Т. М., Штейн, Р. и Чанг, С. H. Тетрамерный интерферон-альфа, нацеленный на CD20, новый и мощный иммуноцитокин для терапии В-клеточных лимфом. Кровь 114 , 3864–3871 (2009).
CAS PubMed PubMed Central Google ученый
Dubrot, J. et al. Внутриопухолевая инъекция интерферона-альфа и системная доставка агонистических моноклональных антител к CD137 синергичны для иммунотерапии. Внутр. J. Cancer 128 , 105–118 (2011).
CAS PubMed Google ученый
Trinh, K. R. et al. Анти-CD20-интерферон-бета слитный белок терапии лимфом мышиных B-клеток. J. Immunother. 36 , 305–318 (2013).
CAS PubMed PubMed Central Google ученый
Yang, X. et al. Воздействие на микроокружение опухоли с помощью мостиков интерферона-бета врожденного и адаптивного иммунного ответа. Cancer Cell 25 , 37–48 (2014).
PubMed PubMed Central Google ученый
Pogue, S. L. et al. Нацеливание ослабленного интерферона-альфа на клетки миеломы с помощью антитела к CD38 вызывает сильную регрессию опухоли с пониженной активностью вне мишени. PLOS ONE 11 , e0162472 (2016).
PubMed PubMed Central Google ученый
Li, Z. et al. Анти-VEGFR2-интерферон-альфа2 регулирует микросреду опухоли и проявляет сильную противоопухолевую эффективность против колоректального рака. Онкоиммунология 6 , e12
(2017).
PubMed PubMed Central Google ученый
Сондел, П. М. и Гиллис, С. Д. Текущее и потенциальное использование иммуноцитокинов в качестве иммунотерапии рака. Антитела 1 , 149–171 (2012).
CAS PubMed PubMed Central Google ученый
Суан, К., Стюард, К. К., Тиммерман, Дж. М. и Моррисон, С. Л. Целенаправленная доставка интерферона-альфа посредством слияния с анти-CD20 приводит к сильной противоопухолевой активности против В-клеточной лимфомы. Кровь 115 , 2864–2871 (2010).
CAS PubMed PubMed Central Google ученый
Vega, G.G. et al. Преодоление лекарственной устойчивости ритуксимаба с помощью генно-инженерного слитого белка анти-CD20-hIFN-альфа: прямая цитотоксичность и синергизм с химиотерапией. Внутр. J. Oncol. 47 , 1735–1748 (2015).
CAS PubMed PubMed Central Google ученый
Greiner, J. W. et al. Доказательства повышения уровня карциноэмбрионального антигена и опухолевого гликопротеина-72 в сыворотке крови у пациентов, получавших интерфероны. Cancer Res. 51 , 4155–4163 (1991).
CAS PubMed Google ученый
Ozzello, L., Derosa, C., Habif, D., Cantell, K. & Pestka, S. Повышающая регуляция опухоль-ассоциированного антигена (tag-72) интерфероном-альфа и интерфероном -гамма у пациентов с рецидивами кожного рака молочной железы. Внутр. J. Oncol. 6 , 985–991 (1995).
CAS PubMed Google ученый
Sivaraman, S. et al. Влияние интерферона-альфа на экспрессию антигена CD20 при хроническом лимфоцитарном лейкозе В-клеток. Cytokines Cell. Мол. Ther. 6 , 81–87 (2000).
CAS PubMed Google ученый
Проуэлл, Т. М., Теорет, М. Р. и Паздур, Р. Бесшовная онкология — разработка лекарств. N. Engl. J. Med. 374 , 2001–2003 (2016).
PubMed Google ученый
Meyer, M. S. et al. Генетическая изменчивость RNASEL, связанная с риском и прогрессированием рака простаты. Канцерогенез 31 , 1597–1603 (2010).
CAS PubMed PubMed Central Google ученый
Слэттери М. Л., Лундгрин А., Бондюрант К. Л. и Вольф Р. К. Путь передачи сигналов интерферона: ассоциации с риском рака прямой и толстой кишки и последующей выживаемостью. Канцерогенез 32 , 1660–1667 (2011).
CAS PubMed PubMed Central Google ученый
Lenci, R.E. et al. Влияние генетических вариантов в генах интерферона I типа на выживаемость и лечение меланомы. PLOS ONE 7 , e50692 (2012).
CAS PubMed PubMed Central Google ученый
Lu, S. et al. Полиморфизм одиночных нуклеотидов в генах сигнального пути интерферона связан с предрасположенностью к колоректальному раку и выживаемостью. PLOS ONE 9 , e111061 (2014).
PubMed PubMed Central Google ученый
Galon, J. et al. К введению «Иммуноскора» в классификацию злокачественных опухолей. J. Pathol. 232 , 199–209 (2014).
CAS PubMed Google ученый
Зайнулабадин А., Яо П. и Заре Х.Недостаточная экспрессия определенных генов интерферона связана с плохим прогнозом меланомы. PLOS ONE 12 , e0170025 (2017).
PubMed PubMed Central Google ученый
Доэрти, М. Р. и др. Интерферон-бета подавляет свойства раковых стволовых клеток при тройном отрицательном раке груди. Proc. Natl Acad. Sci. США 114 , 13792–13797 (2017).
CAS PubMed Google ученый
Piccaluga, P. P. et al. Снижение экспрессии IFI16 коррелирует с неблагоприятным исходом при хроническом лимфолейкозе. APMIS 125 , 511–522 (2017).
CAS PubMed Google ученый
Callari, M. et al. Подтип-зависимая прогностическая значимость метагена индуцированного интерфероном пути при раке молочной железы без лимфоузлов. Mol. Онкол . 8 , 1278–1289 (2014).
CAS PubMed PubMed Central Google ученый
Godoy, P. et al. Интерферон-индуцируемый связывающий гуанилат белок (GBP2) связан с лучшим прогнозом при раке груди и указывает на эффективный Т-клеточный ответ. Рак молочной железы 21 , 491–499 (2014).
PubMed Google ученый
Parkes, E. E. et al. Активация STING-зависимой передачи сигналов врожденного иммунитета при повреждении ДНК, специфичном для S-фазы, при раке молочной железы. J. Natl Cancer Inst. 109 , djw199 (2017).
Google ученый
Датский, H. H. et al. Интерферон-индуцированный белок с тетратрикопептидными повторами 1 (IFIT1) в качестве прогностического маркера для местного контроля при раке молочной железы T1-2 N0, леченном с помощью консервативной хирургии груди и лучевой терапии (BCS + RT). Breast J. 19 , 231–239 (2013).
CAS PubMed PubMed Central Google ученый
Zhang, J. F. et al. Высокая экспрессия IFIT1 предсказывает улучшение клинического исхода, а IFIT1 вместе с MGMT более точно предсказывает прогноз при впервые диагностированной глиобластоме. Hum. Патол. 52 , 136–144 (2016).
CAS PubMed Google ученый
Cohen, S. et al. Фактор регуляции интерферона 1 является независимым предиктором устойчивости к платине и выживаемости при тяжелой серозной карциноме яичников. Gynecol. Онкол. 134 , 591–598 (2014).
CAS PubMed Google ученый
Ranoa, D. R. et al. Лечение рака активирует путь RIG-I-подобного рецептора через эндогенные некодирующие РНК. Oncotarget 7 , 26496–26515 (2016).
PubMed PubMed Central Google ученый
Legrier, M. E.и другие. Активация передачи сигналов IFN / STAT1 предсказывает ответ на химиотерапию при раке молочной железы, отрицательном по рецепторам эстрогена. Br. J. Cancer 114 , 177–187 (2016).
CAS PubMed Google ученый
Kim, Y.A. et al. Экспрессия MxA связана с лимфоцитами, инфильтрирующими опухоль, и является прогностическим фактором при тройном отрицательном раке молочной железы. Breast Cancer Res. Относиться. 156 , 597–606 (2016).
CAS PubMed Google ученый
Mushinski, J. F. et al. Ингибирование подвижности опухолевых клеток интерферон-индуцируемой GTPase MxA. J. Biol. Chem. 284 , 15206–15214 (2009).
CAS PubMed PubMed Central Google ученый
Brown, S. G. et al. Индуцируемый интерфероном противовирусный MxA обратно связан с раком простаты и регулирует клеточный цикл, инвазию и апоптоз, индуцированный доцетакселом. Простата 75 , 266–279 (2015).
CAS PubMed Google ученый
Марголис, С. Р., Уилсон, С. С. и Вэнс, Р. Е. Эволюционное происхождение передачи сигналов cGAS-STING. Trends Immunol. 38 , 733–743 (2017).
CAS PubMed Google ученый
Mackenzie, K. J. et al. Контроль микроядер cGAS связывает нестабильность генома с врожденным иммунитетом. Природа 548 , 461–465 (2017).
CAS PubMed PubMed Central Google ученый
Juergens, R.A. et al. Комбинированная эпигенетическая терапия эффективна у пациентов с рефрактерным распространенным немелкоклеточным раком легкого. Рак Дисков . 1 , 598–607 (2011).
CAS PubMed PubMed Central Google ученый
Reu, F. J. et al. Экспрессия RASSF1A, эпигенетически подавляемого опухолевого супрессора, преодолевает устойчивость к индукции апоптоза интерферонами. Cancer Res. 66 , 2785–2793 (2006).
CAS PubMed PubMed Central Google ученый
Reu, F. J. et al. Преодоление устойчивости к интерферон-индуцированному апоптозу клеток карциномы почек и меланомы путем деметилирования ДНК. J. Clin.Онкол. 24 , 3771–3779 (2006).
CAS PubMed Google ученый
Lucarini, V. et al. Комбинирование интерферонов типа I и 5-аза-2′-дезоксицитидина для улучшения противоопухолевого ответа против меланомы. J. Invest. Дерматол. 137 , 159–169 (2017).
CAS PubMed Google ученый
Lipnik, K. et al.Человеческий гуанилат-связывающий белок 1, индуцированный интерфероном гамма, подавляет рост опухоли молочной железы у мышей. Mol. Med. 16 , 177–187 (2010).
CAS PubMed PubMed Central Google ученый
Britzen-Laurent, N. et al. GBP-1 действует как опухолевый супрессор в клетках колоректального рака. Канцерогенез 34 , 153–162 (2013).
CAS PubMed Google ученый
Weinlander, K. et al. Связывающий гуанилат белок-1 ингибирует распространение и миграцию эндотелиальных клеток за счет индукции экспрессии интегрина альфа4. FASEB J. 22 , 4168–4178 (2008).
PubMed Google ученый
Guenzi, E. et al. ГТФаза гуанилатсвязывающего протеина-1 контролирует инвазивную и ангиогенную способность эндотелиальных клеток посредством ингибирования экспрессии ММР-1. EMBO J. 22 , 3772–3782 (2003).
CAS PubMed PubMed Central Google ученый
Bleiziffer, O. et al. Экспрессия гуанилатсвязывающего белка 1 в эмбриональных эндотелиальных клетках-предшественниках снижает плотность кровеносных сосудов и клеточный апоптоз в конструкции, созданной с помощью тканевой инженерии с осевой васкуляризацией. BMC Biotechnol. 12 , 94 (2012).
CAS PubMed PubMed Central Google ученый
Naschberger, E. et al. Ангиостатическая иммунная реакция при колоректальном раке: влияние на выживаемость и перспективы антиангиогенной терапии. Внутр. J. Cancer 123 , 2120–2129 (2008).
CAS PubMed Google ученый
Зоун К. и Смит М. Э. Очистка и характеристика интерферонов. Гориз. Biochem. Биофиз. 6 , 123–135 (1982).
CAS PubMed Google ученый
Пестка, С. Человеческие интерфероны — от очистки и последовательности белков до клонирования и экспрессии в бактериях: до, между и после. Arch. Biochem. Биофиз. 221 , 1–37 (1983).
CAS PubMed Google ученый
Gutterman, J. U. et al. Рекомбинантный лейкоцитарный интерферон А: фармакокинетика, переносимость однократной дозы и биологические эффекты у онкологических больных. Ann. Междунар. Med. 96 , 549–556 (1982).
CAS PubMed Google ученый
Foote, J. B. et al. Агонист STING, вводимый с модуляторами рецептора OX40 и PD-L1, повышает иммунитет и снижает рост опухоли у толеризованных мышей. Cancer Immunol. Res . 5 , 468–479 (2017).
CAS PubMed PubMed Central Google ученый
Weiss, J. M. et al. Агонист STING DMXAA запускает взаимодействие между Т-лимфоцитами и миелоидными клетками, что приводит к регрессии опухоли. Онкоиммунология 6 , e1346765 (2017).
PubMed PubMed Central Google ученый
Дэи Фаршчи Адли, А., Джаханбан-Эсфахлан, Р., Сейди, К., Самандари-Рад, С. и Заргами, Н. Обзор Вадимезана (DMXAA): агента, разрушающего сосуды. Chem.Биол. Drug Des. 91 , 996–1006 (2018).
CAS PubMed Google ученый
Адамус Т. и Кортилевски М. Возрождение иммунотерапии рака на основе CpG-олигонуклеотидов. Contemp. Онкол. 22 , 56–60 (2018).
Google ученый
Hou, J. et al. Печеночный RIG-I прогнозирует выживаемость и терапевтический ответ интерферона-альфа при гепатоцеллюлярной карциноме. Cancer Cell 25 , 49–63 (2014).
CAS PubMed Google ученый
Engel, C. et al. RIG-I сопротивляется индуцированной гипоксией иммуносупрессии и дедифференцировке. Cancer Immunol. Res. 5 , 455–467 (2017).
CAS PubMed Google ученый
Кроу, М. К. Интерферон I типа в патогенезе волчанки. J. Immunol. 192 , 5459–5468 (2014).
CAS PubMed PubMed Central Google ученый
Liu, Y. et al. Активированный СТИНГ при сосудисто-легочном синдроме. N. Engl. J. Med. 371 , 507–518 (2014).
CAS PubMed PubMed Central Google ученый
Yu, F. et al. IFITM1 способствует метастазированию колоректального рака человека через CAV-1. Cancer Lett. 368 , 135–143 (2015).
CAS PubMed Google ученый
Ogony, J., Choi, HJ, Lui, A., Cristofanilli, M. & Lewis-Wambi, J. Сверхэкспрессия трансмембранного белка 1 (IFITM1), индуцированная интерфероном, усиливает агрессивный фенотип воспалительного рака молочной железы SUM149 клетки в зависимости от преобразователя сигнала и активатора транскрипции 2 (STAT2). Резолюция о раке молочной железы . 18 , 25 (2016).
PubMed PubMed Central Google ученый
Yang, Y.G. et al. Индуцированная интерфероном трансмембранная ось передачи сигналов EGFR / SOX2, опосредованная белком 1, важна для прогрессирования немелкоклеточного рака легкого. Внутр. J. Cancer https://doi.org/10.1002/ijc.31926 (2018).
Артикул PubMed PubMed Central Google ученый
Chen, R.H. et al. ISG15 предсказывает плохой прогноз и способствует фенотипу раковых стволовых клеток при карциноме носоглотки. Oncotarget 7 , 16910–16922 (2016).
PubMed PubMed Central Google ученый
D’Cunha, J. et al. Иммунорегуляторные свойства ISG15, цитокина, индуцированного интерфероном. Proc. Natl Acad. Sci. США 93 , 211–215 (1996).
PubMed Google ученый
Хан, Х. Г., Мун, Х. В. и Чон, Ю. Дж. ISG15 при раке: помимо убиквитиноподобного белка. Cancer Lett. 438 , 52–62 (2018).
CAS PubMed Google ученый
Machiraju, D.

