Рак прямой кишки. Послеоперационная профилактика расстройств
Хирургическое лечение рака прямой кишки в начале разработки этой проблемы было связано с обеспечением безопасности оперативных вмешательств и борьбой с интраоперационными осложнениями, затем — с возрастанием радикальности операций и расширением зоны лимфодиссекции. Впервые радикальную операцию по поводу рака прямой кишки — брюшно-промежностную экстирпацию — выполнил W.Miles. Суть операции заключалась в футлярном удалении непосредственно самой прямой кишки. В отечественной хирургии приоритет в разработке и внедрении в клиническую практику передней (чрезбрюшинной) резекции прямой кишки принадлежит Б.А. Петрову, впервые выполнившему эту ССО в 1937 году.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
|
Новые возможности для увеличения доли ССО появились с внедрением в хирургическую практику циркулярных сшивающих аппаратов последних моделей в сочетании с зажимом для наложения кисетного шва и монофиламентных нитей на прямых гнущихся иглах.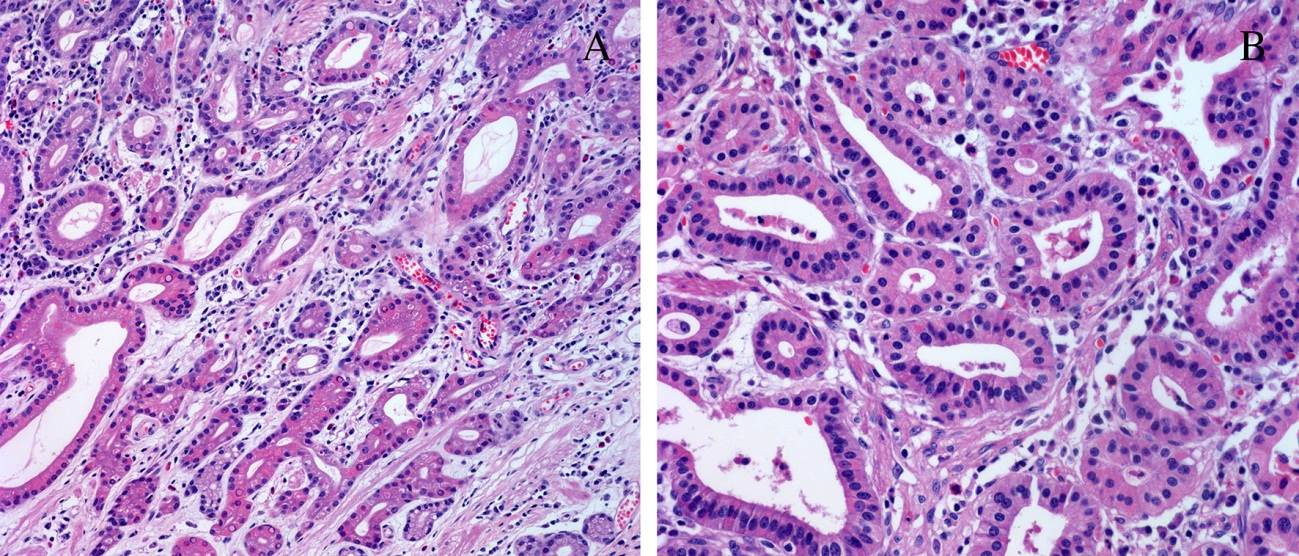 Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Все это упростило выполнение предельно низких от анокутанной линии резекций прямой кишки. К этому добавились специальные исследования об особенностях внутрикишечного распространения ракового поля в дистальном направлении от видимого края опухоли. Оказалось, что достаточно отступить на 1,5 — 2 см от нижней границы пальпируемой части раковой опухоли, чтобы линия резекции пришлась по здоровой, непораженной опухолевыми клетками кишке. Стали выполняться не только низкие, но и ультранизкие резекции прямой кишки. Появились сообщения из высококвалифицированных и специализированных лечебно-научных учреждений о транссфинктерных резекциях ПК.
Профилактика послеоперационных колоректальных расстройств
при раке прямой кишки
В последние годы с целью профилактики послеоперационных колоректальных расстройств широкое распространение получили операции формирования толстокишечного резервуара при резекциях прямой кишки. Исходные позиции этого предложения очевидны — создать вместо утраченных после резекции прямой кишки накопительной и эвакуаторной функций, подобие их, за счет резервуара из толстой кишки.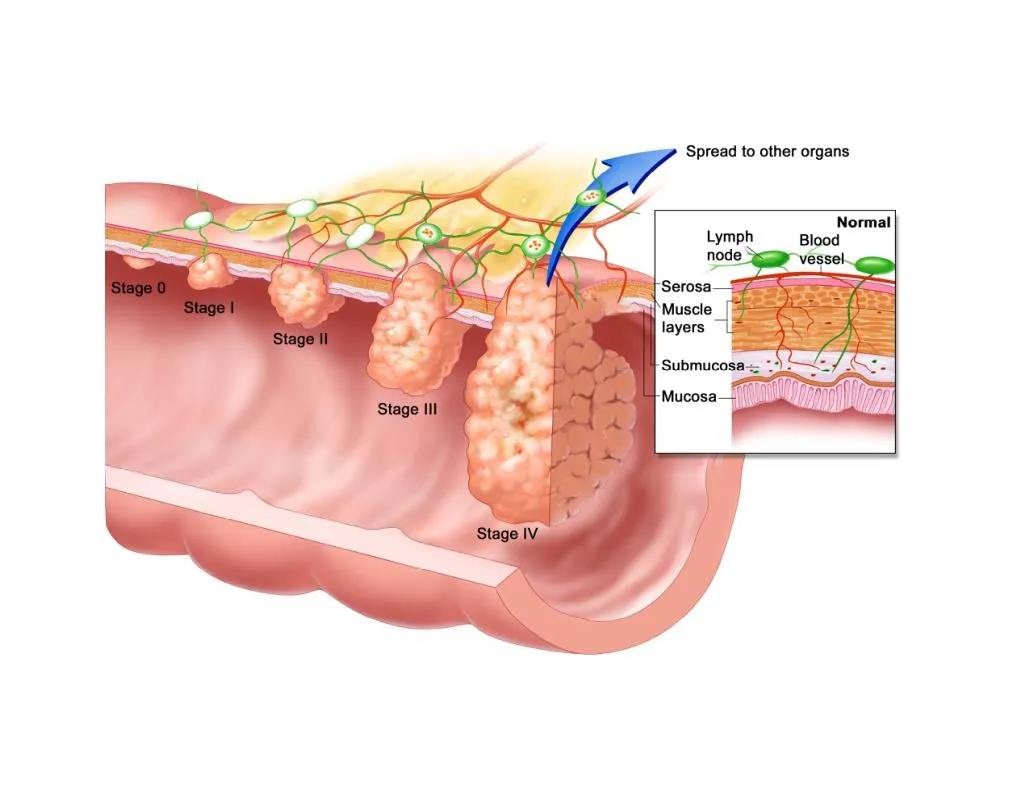 Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Работ в этом плане довольно много. Использовался при этом многолетний опыт формирования тонкокишечных резервуаров при тотальной проктоколэктомии. Со временем стало очевидным, что чисто механически замена утраченных функций прямой кишки так просто не решается и последовала оценка результатов операций с формированием толстокишечных резервуаров, сообщения об изменении методики операции и новые предложения. Термин «неоректум» стал применяться все реже и реже.
Первоначально резервуар стремились формировать достаточно объемным 7,5-10 см. По мере изучения функциональных результатов резекций ПК с созданием толстокишечных резервуаров становилось очевидным, что лучшие данные выявляются при резервуарах меньшего размера — 5 см. Так, Jin-Ichi Hida et all. (1996 г.) проводили рандомизированные исследования с формированием резервуаров 10 и 5 см (длина). Первая группа (10 см) — 20 чел., вторая группа (5 см) — тоже 20 чел. Оценивали результаты через 1 год. Эвакуаторная функция при резервуаре 5 см была значительно выше, чем при «неоректум» 10 см. Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Сфинктерная функция была одинаковой в обеих группах. Оценивая функцию по ряду параметров, авторы определенно высказываются за создание толстокишечного резервуара 5 см. Они пишут: «J-резервуар 5 см дает адекватную резервуарную функцию без компрометирующей эвакуации». Через 3 года авторы вернулись к этому вопросу и убежденно пришли к заключению, что наблюдающиеся затруднения с эвакуацией кишечного содержимого после операций определенно связаны с размером резервуара — чем он больше, тем чаше наблюдаются затруднения.
Необходимость формирования толстокишечного резервуара возникает при низких резекциях прямой кишки. Правда понятие «низкая резекция» определяется по-разному и значение здесь имеет каждый сантиметр. Обычно речь идет о раке среднеампулярного отдела прямой кишки с определением нижней границы резекции. Т.С.Одарюк с соавт. (2000 г.) пишут, что это в среднем 1,5 см от аноректальной линии. Необходимость в резервуаре авторы обуславливали развитием «Синдрома низкой передней резекции» после прямых наданальных анастомозов.
Jin-ichi Hida et all (1998 г.) приходят к заключению, что при резекции прямой кишки выше 4 см от зубчатой линии нужно выполнять прямой колоанальный анастомоз, а ниже 4 см — формировать J-резервуар.
Для оценки колоректальной функции у больных после резекций прямой кишки с формированием толстокишечного резервуара используется метод анкетирования (вопросник) и объективные исследования аноректальной функции в разные сроки после оперативного вмешательства.
Наряду с безусловно положительной оценкой резекции прямой кишки при раковом ее поражении с формированием толстокишечного резервуара, ряд авторов обращает внимание на недостатки такой операции. Справедливо замечают Г.И.Воробьев с соавт. (2000 г.), что «до настоящего времени сохраняется нестабильность и непредсказуемость функциональных результатов, особенно в отдаленные сроки после данного вмешательства (операции с резервуарами)». Так, у 15-20% больных не удается добиться нужной континенции.
В связи с выявленными негативными сторонами J-резервуаров в литературе стали обращать внимание на особенности формирования самого толстокишечного резервуара.
Интересный вариант ССО предложили В.В.Яновой с соавт. при низких резекциях ПК, когда опухоль располагается не выше 3 см от зубчатой линии анального канала. Эти авторы с 1989 г. делают в низведенной кишке две продольные насечки с последующим сшиванием их поперек, что создает S-образный изгиб и увеличивает объем кишки.
Поиск лучших вариантов формирования толстокишечных резервуаров и оценка колоанальной функции в таких случаях продолжается. Совершенствование колопластических операций в этом плане, вероятно, займет определяющее место.
Склонностью к лимфотропизму при раке прямой кишки
В связи с тем, что рак прямой кишки, согласно исследованиям, обладает склонностью к лимфотропизму, именно лимфаденэктомии в хирургическом лечении рака прямой кишки придается весьма важное значение. Лимфогенное метастазирование рака прямой кишки является одной из вероятных причин развития локорегионального рецидива после операции. Поэтому наряду с удалением первичной опухоли целью хирургического лечения является радикальное удаление зон регионарного метастазирования опухоли.
Еще W.Miles в 1908 г. были определены три основные пути лимфогенного метастазирования при раке прямой кишки — восходящий, нисходящий и латеральный, что послужило началом разработки принципов лимфодиссекции при неопластических образованиях ПК.
- Восходящее метастазирование охватывает параректальные, верхние ректальные и нижние брыжеечные лимфоузлы.
- Латеральное метастазирование затрагивает средние ректальные, запирательные, внутренние подвздошные и общие подвздошные узлы.
- Нисходящее метастазирование — паховые лимфоузлы.
Периневральная инвазия
При наличии инвазии опухоли в нервную ткань метастазы в лимфоузлах обнаруживается в 81%, а без такового — в 37%.
Первичный рак прямой кишки характеризуется тем, что опухоль остается длительное время локализованной и относительно медленно растет по сравнению с другими опухолями пищеварительного тракта. Локализованный и медленный рост характерен так же и для метастазов в лимфоузлы. Исходя из этой биологической особенности рака прямой кишки, было сделано предположение, что, увеличив объем лимфаденэктомии, можно достичь снижения количества рецидивов.
Впервые расширенная лимфаденэктомия была описана Kuru в 1942 г. Однако, результаты исследований не показали статистически значимой разницы в 5-летней выживаемости между группами больных, которым проводились стандартная и расширенная лимфаденэктомия. Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Вновь интерес к расширенной лимфаденэктомии появился в 80-е годы, когда Heald и соавт. предложили выполнение тотальной мезоректумэктомии, т.е. удаление совокупности тканей и органов, находящихся в пределах фасциальной оболочки прямой кишки, включающей в себя параректальную клетчатку, кровеносные и лимфатические сосуды. Используя данную методику, этим авторам удалось снизить частоту местных рецидивов до 5%, что, однако не удалось воспроизвести другим исследователям, но вновь возник интерес к расширенной лимфаденэктомии.
Takahashi T. и соавт. предложили различать несколько вариантов лимфаденэктомии: ограниченную, стандартную и расширенную. Однако такое деление не является общепризнанным.
- Ограниченной лимфаденэктомии соответствует тотальная мезоректумэктомия.
- Стандартная лимфаденэктомия — ограниченная + высокая перевязка нижней брыжеечной артерии у аорты и удаление лимфоузлов по ходу подвздошных сосудов.
- Расширенная лимфаденэктомия — стандартная + лимфодиссекция в запирательном пространстве.

По мнению японских хирургов, ограниченная лимфаденэктомия показана при ранних стадиях рака прямой кишки, стандартная — при распространенном раке верхних отделов ПК, расширенная — при распространенном раке нижних отделов ПК.
Данные о влиянии расширенной лимфаденэктомии на 5-летнюю выживаемость больных раком стадии В и С по Dukes весьма противоречивы. Необходимы дальнейшие многоцентровые исследования.
Недостатки лимфаденэктомии при раке прямой кишки
Основным недостатком лимфаденэктомии является нарушение мочевой и половой функций, которые встречаются в 30% и 80 — 100% наблюдений соответственно. Такие нарушения могут быть связаны с разными причинами, но, несомненно, они возникают при пересечении вегетативных нервов таза. Выясняя функциональные результаты ССО выполненных по поводу РПК, мы также обращали внимание на частоту мочеполовой дисфункции у этих больных. Это послужило поводом для проведения собственных исследований по выяснению особенностей строения и расположения вегетативных нервов таза.
Казалось бы очевидным, что для получения лучших функциональных результатов после низкой резекции ПК необходимо позаботиться о сохранении вегетативной иннервации органов таза, однако специальных исследований в этом плане очень мало. Вероятно, правы Yasutomi Masayuki et all. (1995 г.), которые пишут, что в предыдущие годы все внимание было сосредоточено на повышение радикальности операций. К этому нужно добавить, что не существует, а мы специально интересовались, специфических методов идентификации нервных структур (окраска, свечение и т.д.).
Проблему составляет сохранение иннервации при резекциях ПК и ряд хирургов призывают бережно относиться к нервным структурам таза. В этом отношении нужно отметить определенную настойчивость и последовательность исследований японских хирургов.
Сохранение вегетативных нервов малого таза при операциях у больных РПК реально при начальных формах ракового поражения при стадиях по Dukes А и В. Окончательно неясным и спорным является вопрос о возможности и целесообразности сохранения гипогастральных нервов при более распространенных формах опухолевого поражения ПК, не пренебрегая онкологическими интересами.
Оригинальные исследования T.Kono et all. (1998 г.), которые провели исследование на крысах по трансплантации тазовых нервов после их предварительного иссечения. Через 6 недель они уже регистрировали ритмичные сокращения мочевого пузыря у всех подопытных. Авторы делают смелый вывод, что трансплантация нервов таза успешно восстанавливает функцию мочевого пузыря и поэтому такую операцию можно рекомендовать в практику.
Yasutomi M. et all. при низких резекциях ПК у 185 больных ранними формами ракового поражения всегда стремились сохранить пучки вегетативных нервов. Дисфункция мочеиспускания после операции уменьшилась до 15% (раньше — 33%), половая потенция снизилась до 21% (раньше — 81%), 5-летняя выживаемость — 81%.
Sugihara Kenichi et all., сохраняя нервные пучки с обеих сторон при резекциях прямой кишки отметили способность к произвольному мочеиспусканию у 93,5%, а половую потенцию — у 70,4%. При ранних раках прямой кишки, замечают авторы, нервы должны сохраняться полностью, а при обнаружении метастазов опухоли в тазу — следует стремиться к сохранению нервов хотя бы с одной стороны. 5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
5-летняя выживаемость составила при стадиях по Dukes А — 96,4%, В — 84,0%, С — 67,3%. Ishikura S. et all. (1999 г.) оперировали 50 больных низким РПК, сохраняя нервные тазовые пучки. 3-летняя выживаемость составила в среднем — 88%. При I-II стадиях — 97%, при III стадии — 73%. Авторы подчеркивают, что сохранение нервных пучков не было причиной местного рецидива раковой опухоли. Matsumoto A. et all. (1995 г.) обращают внимание на то, что рассечение пучка гипогастрального нерва с одной стороны не нарушает функцию мочевого пузыря. Sugihara K. et all. (1996 г.) при операции 214 больных с низким РПК сберегали нервы таза. У 70,4% мужчин сохранилась половая функция. 5-летняя выживаемость после таких операций составила: при стадии А — 96,4%, В — 84%, С — 67,3%.
Интересна работа хирургов из Нидерланд. Хирурги этой страны обратили внимание на то обстоятельство, что после операций по поводу рака на прямой кишке, возникает значительное число мочеполовых нарушений, что, безусловно, сказывается на КЖ этих пациентов. В связи с этим они пригласили японских хирургов и с их помощью оперировали 47 больных с низким раком ПК, которым сохраняли нервы таза. Мочевых расстройств не развилось ни у кого из больных. 19 из 30 мужчин были сексуально активны. Половое бессилие связано по их наблюдениям с повреждением гипогастрального сплетения. Для сохранения эякуляции необходимо сохранение верхнего гипогастрального сплетения. Авторы заключают, что операции с сохранением нервов таза должны стать хирургическим стандартом при оперативном лечении начальных форм рака прямой кишки.
О возможности сохранения нервов таза при резекциях прямой кишки сообщают и отечественные авторы: Г.И.Воробьев с соавт., П.В.Царьков с соавт. А.И.Темников и Ю.П.Дугин.
Мы провели собственное исследование с целью изучить некоторые особенности и варианты расположения верхнего подчревного сплетения, подчревных нервов и их ветвей, с целью возможного сохранения их при операциях по поводу низкого рака ПК.
Материалом для исследования послужили 12 бальзамированных и 5 нефиксированных трупов людей, умерших от причин не связанных с патологией органов малого таза. Методика исследования заключалась в проведении общей и специальной антропометрии, препарирования, зарисовки, протоколирования, фотографирования, видеозаписи.
Верхнее подчревное сплетение формируется при слиянии вегетативных нервов расположенных впереди нижней части абдоминального отдела аорты и, как правило, по своей ширине соответствует поперечным размерам аорты в области ее бифуркации. В результате проведенных исследований было выявлено в основном два варианта строения верхнего подчревного сплетения — многоветвистая и маловетвистая формы. Многоветвистая форма представлена нервным сплетением в виде широкой «пластины», имеющей треугольную или трапецивидную форму с основанием обращенным вниз, образованной большим количеством нервных волокон, формирующих густую сеть ниже бифуркации аорты. При этом сплетение располагается кзади от позадипрямокишечной клетчатки и прямокишечных сосудов. Позади верхнего подчревного сплетения располагается пристеночный листок фасции таза и левая общая подвздошная вена. Нижний край сплетения определялся четко при выделении тупфером и располагался ниже мыса крестца (по средней сагиттальной линии) на 0,4 — 2,4 см. От нижнего края сплетения, являясь продолжением его, отходят правый и левый подчревные нервы. Они располагаются на заднебоковой поверхности таза и направляются вниз, вдоль и медиальнее мочеточников и внутренней подвздошной артерии. В местах перекреста мочеточника с маточной артерией или семенным протоком, эти нервы располагаются так, что артерия матки (семенной проток) находится спереди, а мочеточник сзади от нервов. В этой зоне нервы распадаются преимущественно на три группы нервных волокон, образуя нижнее подчревное билатеральное сплетение. Эти группы нервных волокон направляются соответственно: к мочевому пузырю, к матке (семенным пузырькам, простате), к прямой кишке. К стенке кишки волокна нервов подходят в составе боковой связки прямой кишки вместе со средней прямокишечной артерией и веной, располагаясь произвольно относительно друг друга.
Маловетвистая форма строения нервов характеризовалась наличием отдельных, немногочисленных, относительно толстых волокон с единичными анастомозами между ними. Волокна сплетения так же располагаются кзади от позадипрямокишечной клетчатки, верхних прямокишечных сосудов и не связаны с этими образованиями.
С учетом особенностей топографо-анатомического расположения автономных нервов таза, мы применили нерв-сберегающую технику оперирования при выполнении операций на прямой кишке по поводу рака ее различной локализации.
Показанием к операции у всех больных была аденокарцинома. Большинство новообразований соответствовало стадии Dukes B с высокой и умеренной степенью дифференцировки опухоли и локализацией ее в средне и нижнеампулярном отделах. Преобладающим типом операции была низкая передняя аппаратная резекция и брюшно-промежностная экстирпация прямой кишки. Обязательными этапами операции у всех больных были: высокая перевязка нижнебрыжеечной артерии и вены непосредственно у аорты, иссечение мезоректальной клетчатки, определение формы верхнего подчревного сплетения, выделение, взятие на «держалку» и мобилизация правого и левого подчревных нервов.
После предварительной перевязки нижних мезентериальных сосудов у аорты и пересечения сигмовидной кишки, мы считали необходимым выяснить особенности строения верхнего гипогастрального сплетения, а затем приступали к выделению правого и левого подчревных нервов, до этапа мобилизации прямой кишки. Ориентиром для определения верхнего гипогастрального сплетения является тазовый мыс, где нетрудно визуализировать его нижний край. Над поверхностью нерва тупфером сдвигали жировую ткань, брали его на “держалку” и преимущественно острым путем выделяли из параректальной клетчатки, передвигая “держалку” вниз к боковой связке прямой кишки. С помощью такого приема выделяли нерв с другой стороны. После этого подчревные нервы становились подвижными и смещаемыми в стороны на 5 — 6 см. Это обстоятельство является весьма важным, так как дает возможность производить иссечение мезоректальной клетчатки в необходимом объеме, без ущерба для онкологических принципов проведения операции. У большинства больных гипогастральные нервы никак не выделяются, а сливаются с окружающими тканями и представляются в виде тонкой и узкой “полоски”. Именно у таких пациентов подчревные нервы могут быть легко повреждены при мобилизации прямой кишки или иссечения мезоректальной клетчатки. Только у трех больных подчревные нервы были представлены хорошо контурирующимися, достаточно толстыми стволами и легко визуализировались.
При дальнейшей мобилизации прямой кишки, мы старались выделить и визуализировать боковые связки ее (которые пересекаем на зажимах), с тем чтобы в инструмент, вместе со средними прямокишечными сосудами, попали только те веточки нижнего билатерального сплетения, которые направляются к стенке прямой кишки. Ветви идущие к другим органам малого таза, сохраняли с удалением окружающей их клетчатки. В тех случаях, когда раковая опухоль распространялась на окружающие ткани и вовлекала гипогастральный нерв с одной стороны, мы принебрегали им, соблюдая онкологические принципы оперирования и старались сохранить целостность подчревного нерва с другой стороны. Так мы оперировали трех больных.
В тех же случаях, когда опухоль распространяется на окружающие ткани с вовлечением вегетативных нервов таза с обеих сторон, ее следует удалять единым блоком совместно с нервами.
Мочевую функцию оценивали путем расспроса пациентов о характере позывов, частоте мочеиспускания и объеме выделяемой мочи, после удаления мочевого катетера, который вводили на 2 — 4 суток. У 94% больных было свободное, произвольное мочеиспускание сразу после извлечения катетера Фоллея. Пациенты не отмечали разницы в характере позывов, частоте мочеиспускания и объеме мочи, по сравнению с дооперационным периодом. У всех сексуально-активных мужчин сохранилась половая функция.
- Мы представили современное состояние проблемы, связанной с функциональными результатами после операций на прямой кишке при раковом поражении ее.
- Мы не склонны давать категорические рекомендации относительно выбора одного единственного способа лечения, для уменьшения частоты функциональных расстройств после операций на прямой кишке.
- Знание литературы этой проблемы — залог для оперирующих хирургов правильно подойти к выбору нужной тактики в каждом конкретном случае. Однако несомненно, что соблюдение онкологических принципов оперирования нужно иметь в виду прежде всего. Далее — всегда следует стремиться к выполнению ССО, если даже для этого придется делать интерсфинктерные резекции ПК. Несомненно, оперирующим на ПК хирургам нужно освоить методику формирования толстокишечных резервуаров и колопластику.
- Бережное отношение к нервам таза — еще одна забота при операциях на прямой кишке. Это реально, о чем свидетельствуют, как литературные данные, так и наши целенаправленные исследования и результаты проводившихся оперативных вмешательств.
Лечение рака прямой кишки в Санкт-Петербурге
Лечение рака прямой кишки является актуальной проблемой современной онкологии. В некоторых случаях рак прямой кишки требует комбинированного лечения, то есть сочетания хирургического, лучевого и химиотерапевтического методов, выбор этапности и объема которого зависит от стадии заболевания.
Лучевая терапия в основном проводится на предоперационном этапе, в случаях значительного локорегионарного (местного) распространении опухоли, с целью уменьшения её размеров и повышения радикальности предстоящей операции. Лучевая терапия рака прямой кишки проводится при локализации опухоли в средне- и нижнеампулярном отделах прямой кишки. При локализации опухоли в верхнеампулярном и/или ректосигмоидном отделе прямой кишки лучевая терапия не проводится.
Химиотерапия может проводиться как на предоперационном этапе, с целью уменьшения размеров первичной опухоли, уменьшения размеров имеющихся метастазов, так и в послеоперационном периоде, в тех случаях, когда при исследовании материала, удаленного во время операции обнаруживаются лимфатические узлы с метастазами опухоли (регионарные метастазы). Другим основанием для назначения химиотерапии является наличие отдаленных метастазов.
Но в любом случае, операция является основным этапом лечения.
В нашем стационаре проводится комбинированное лечение злокачественных опухолей прямой кишки. Оно включает в себя:
1. Оперативное лечение:
- традиционные (открытые) оперативные вмешательства
- Лапароскопические операции
- Роботассистированные операции (при помощи робота Da Vinci).
2. Химиотерапевтическое лечение:
- Предоперационная (неоадъювантная) химиотерапия
- Послеоперационная (адъювантная) химиотерапия
Операция выбора
Принципиальными факторами, влияющими на выбор объема оперативного вмешательства, является соблюдение двух обязательных условий:
- обеспечение максимального радикализма операции, то есть удаление раковой опухоли вместе с зонами и путями регионарного метастазирования в едином фасциальном (эмбриональном) футляре
- и стремление хирурга обеспечить максимальную физиологичность выполняемой операции.
Кроме того, выбор характера и объема оперативного вмешательства (в первую очередь органосохраняющего) зависит от степени местного распространения опухолевого процесса и уровня локализации опухоли в прямой кишке.
В нашем стационаре используется следующая классификация локализации раковой опухоли:
Уровни локализации рака прямой кишки
|
|
С учетом перечисленных факторов все операции на прямой кишке можно разделить на две группы – с сохранением и без сохранения сфинктерного аппарата прямой кишки.
В последние годы, прежде всего благодаря развитию медицинского инструментария, появлению специальных сшивающих аппаратов количество органосохраняющих операций неуклонно растет.
Лечение рака ректосигмоидного, верхне- и среднеампулярного отделов
При раке ректосигмоидного, верхне- и среднеампулярного отделов прямой кишки операцией выбора является внутрибрюшная (передняя) резекция прямой кишки.
Смысл операции заключается в удалении (резекции) части прямой кишки с окружающей её жировой клетчаткой в единой фасциально-футлярной капсуле (мезоректумэктомия) ниже опухоли на 5-6 см.
| Хирургическое лечение рака прямой кишки |
| Резекция части прямой кишки |
| Хирургическое лечение рака |
| Удаление части прямой кишки |
Данный этап операции особенно важен, так как адекватность и полнота его выполнения является важнейшим фактором для профилактики местного рецидива (из околопрямокишечных лимфатических узлов). Адекватная и полная лимфодиссекция с учетом основного пути лимфооттока также является очень важным фактором профилактики локорегионарных рецидивов, ассоциированных с заболеванием регионарных лимфатических узлов. Она достигается за счет высокой перевязки нижней брыжеечной артерии у места её отхождения от брюшной аорты.
| Операция при раке прямой кишки |
| Циркулярный сшивающий аппарат |
Завершается операция формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов циркулярного шва. Тем самым восстанавливается непрерывность кишечной трубки.
Лечение рака нижнеампулярного отдела прямой кишки
На протяжении длительного периода времени операцией выбора с позиции соблюдения принципов онкологического радикализма при локализации опухоли в нижнеампулярном отделе прямой кишки была брюшно-промежностная экстирпация прямой кишки. Суть операции заключалась в удалении всей прямой кишки с окружающей её параректальной клетчаткой и вместе со сфинктерным аппаратом.
| Удаление прямой кишки при нижнеампулярной локализации | Формирование колостомы на передней брюшной стенке |
Операция завершается формированием противоестественного заднепроходного отверстия (колостомы) на передней брюшной стенке.
В настоящее время брюшно-промежностная экстирпация выполняется только при больших распространенных опухолях, которые располагаются глубоко в малом тазу и вовлекают мышцы анального сфинктера или в случае локализации опухоли на расстоянии 1-2 см от анального сфинктера.
В нашем стационаре используется более радикальная методика — «цилиндрическая» экстралеваторная брюшно-промежностная экстирпация прямой кишки в модификации Хольма. Суть операции сводится к выполнению промежностного этапа вмешательства в положении больного лежа на животе, что обеспечивает более радикальное удаление опухоли при локализации ее в нижнеампулярном отделе. Выполнение промежностного этапа в положении пациента лежа на животе дает существенные преимущества при визуализации структур таза, особенно у мужчин.
В случае расположения опухоли на расстоянии 3 см и выше от анального жома возможно выполнение сфинктеросохраняющей операции, так называемой ультранизкой передней резекции прямой кишки. Суть операции заключается в том, что также удаляется прямая кишка вместе с окружающей параректальной клетчаткой в едином фасциальном футляре, высоко у аорты перевязывается нижняя брыжеечная артерия, а сама линия резекции прямой кишки проходит непосредственно над сфинктерным аппаратом.
Завершается операция как и при оперировании ректосигмоидного, верхне- и среднеампулярного отделов — формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз также формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов, что позволяет восстановить непрерывность кишечной трубки.
Единственной особенностью этой операции является то, что её можно выполнить только лапароскопически или роботассистированно. Это связано с особенностями топографии прямой кишки, которая располагается в полости малого таза, в очень малом и узком по объему пространстве в окружении костей таза, крупных магистральных сосудов и нервных сплетений.
После операции
Раньше, при выполнении подобных операций традиционным способом, в послеоперационном периоде пациенты сталкивались с нарушением функции тазовых органов, в первую очередь у них были проблемы с мочеиспусканием. Сейчас, благодаря использованию малотравматичных эндовидеохирургических методов (лапароскопические и роботические операции на хирургическом комплексе Da Vinci) с их высокой четкостью и детализацией мельчайших структур можно выполнять бережные нервосохраняющие операции. Благодаря которым у больных не только не нарушается мочевыделительная функция, но и сохраняется способность получения полового удовлетворения (оргазма), что особенной важно для молодых пациентов.
| Роботоассистированное лечение рака прямой кишки |
| Робот Да Винчи. Положение ассистента. |
| Робото ассистированная операция |
| Положение оперирующего хирурга. |
По мнению большинства авторов, а также по результатам множества исследований установлено, что наиболее оптимальным местом использования роботоассистированных операций является так называемая хирургия малых пространств, к которым относится и малый таз.
В нашем стационаре выполняется весь спектр операций на прямой кишке как традиционным (открытым) методом, так и высокотехнологичными малотравматичными методами: лапароскопически и роботассистированно.
Наш стационар с его онкологическим отделением единственный в городе Санкт-Петербурге имеющий роботический комплекс DaVinci. Специалисты нашего отделения проходили стажировку в крупнейших клиниках и научных центрах США и Европы, накоплен серьезный собственный опыт выполнения такого рода операций.
Эти операции относятся к разряду высокотехнологичных, а потому дорогостоящих. Однако, благодаря наличию федеральных квот эти операции доступны всем нуждающимся в них.
Операции при раке прямой кишки
Особенности проведения операций при раке прямой кишки
Расположение в узком пространстве
Прямая кишка лежит глубоко в малом тазу и фиксирована со всех сторон – к нижним отделам позвоночника (крестцу и копчику), к органам моче-половой системы и к боковым стенкам таза. Удаление прямой кишки – технически очень сложная операция. Ее выполняют правильно лишь в специализированных отделениях и центрах.
Хирурги, которые выполняют такие операции редко, рискуют не до конца убрать опухоль, а также повредить органы и структуры рядом с прямой кишкой, что может привести к развитию серьезных послеоперационных осложнений, например, нарушению оттока мочи, отсутствию сексуальной функции, повреждению крупных сосудов и нервов.
Кроме того, во многих клиниках и онкодиспансерах до сих пор применяется старый способ выполнения операции «вслепую», когда хирург освобождает прямую кишку из окружающих тканей на ощупь. Из-за отсутствия четкой видимости во время операции и применения этого способа выделения прямой кишки, опухолевые клетки часто остаются в теле пациента, что приводит к быстрому развитию рецидива – повтора заболевания. Помимо этого грубое выделение рукой «вслепую» приводит к ранению нервов, лимфатических протоков, сосудов.
Как это решается в Клинике колопроктологии и малоинвазивной хирургии:
Мы выполняем такие операции каждый день, в нашей клинике накоплен значительный опыт различных видов операций при всех видах и стадиях рака прямой кишки прямая кишка освобождается из окружающих тканей всегда только под контролем зрения с тщательным сохранением всех окружающих нервов, сосудов и органов во время открытых операций применяются специальные ранорасширители немецкого производства для достижения хорошего обзора и выполнения всех этапов операции под контролем зрения. Все опухолевые клетки удаляются, ничего не остается.
Лапароскопические операции выполняются на видео-оборудовании HD-качества, в том числе с 3D-изображением, которое обеспечивает превосходную видимость даже в самых глубоких местах малого таза.
Необходимость тщательного сохранения нервов
Рядом с прямой кишкой проходят нервы, которые обеспечивают работу всех органов малого таза: у мужчин это мочевой пузырь, предстательная железа, семенные пузырьки, мочевыводящий канал. У женщин – влагалище, матка, шейка матки и мочевой пузырь. Прямая кишка располагается в очень узком пространстве малого таза, окруженная очень важными анатомическими структурами. Поэтому, во время удаления прямой кишки существует опасность повреждения окружающих ее сосудов и нервов, что может привести к значительному нарушению функции органов моче-половой системы после операции.
Как это решается в Клинике колопроктологии и малоинвазивной хирургии:
Нами разработаны и активно применяются методики нервосохраняющих операций при всех стадиях рака прямой кишки во время каждой операции для отделения нервов от прямой кишки используются специальные высокотехнологичные хирургические инструменты, использующие энергию ультразвука, которая не травмирует нервную ткань и сводит на ноль риск кровотечения
Сохранение/удаление анального канала
Чем ближе опухоль располагается к анальному каналу, тем выше вероятность что для полного удаления опухоли потребуется удалить также и анальный канал вместе с прямой кишкой. При этом формируется постоянная колостома – вывод кишки на живот, при этом стул поступает в специальный мешочек, который крепится к животу пациента. В начале 20 века все операции при раке прямой кишки выполняли только таким образом.
В 21 веке в связи с развитием хирургических технологий операции с полным удалением анального канала выполняются все реже: в специализированных клиниках – не более, чем у 20% пациентов. Однако, во многих клиниках продолжают выполнять операции с постоянными колостомами почти всем больным. Причиной этому могут быть недостаточная квалификация хирургов, нехватка специальных инструментов, нежелание осваивать современные технологии. И многие пациенты становятся инвалидами, хотя у них была возможность удалить опухоль прямой кишки и сохранить анальный канал.
Как это решается в Клинике колопроктологии и малоинвазивной хирургии:
Более 80% операций при раке прямой кишки в нашей клинике выполняются с сохранением анального канала – как открытые, так и лапароскопические операции. Для формирования анастомоза (место соединения кишок) применяются современные одноразовые сшивающие аппараты, которые позволяют минимизировать риск развития осложнений.
В нашей клинике разработана и применяется уникальная методика сохранения сфинктера даже при очень близком расположении опухоли к анальному каналу – интерсфинктерные резекции.
Как и при раке ободочной кишки, при раке прямой кишки хирургическое удаление пораженной части кишечника является единственным методом излечения. Для этого необходимо удалить сегмент прямой кишки с опухолью, который включает жировую ткань вокруг сосудов, питающих этот сегмент, и расположенные рядом лимфатические узлы. Кроме того, нужно удалять некоторые неизмененные ткани вокруг опухоли для того, чтобы снизить риск возврата рака (рецидива). Варианты хирургического лечения рака прямой кишки могут быть очень различными, от местного иссечения при небольших озлокачествленных полипах, до обширных резекций при распространенных опухолях. Операции, при которых сохраняется анальный сфинктер и не формируется постоянная колостома, называют «сфинктерсохраняющими». Примерами таких операций могут быть передняя резекция, низкая передняя резекция и трансанальное иссечение. Если сфинктеры сохранить невозможно, необходимо выполнить брюшно-промежностную экстирпацию, при которой удаляется анальный сфинктер и формируется постоянная колостома.
Варианты операций при раке прямой кишки
Передняя резекция
При этом виде операций через разрез живота в нижней части удаляются опухоли, которые располагаются в верхней части прямой кишки. Удаляется сегмент кишечника, состоящий из верхней части прямой кишки и нижней части сигмовидной кишки, и затем концы кишечника соединяются (формируется анастомоз).
Низкая передняя резекция
Выполняется при расположении опухолей в средней и нижней частях прямой кишки. Как и при передней резекции производят разрез передней брюшной стенки в нижней части живота. По сравнению с передней резекцией при низкой передней резекции удаляется большей тканей, включая почти всю прямую кишку, ее брыжейку (мезоректум) вплоть до мышц анального сфинктера. Тотальная мезоректумэктомия в настоящее время является стандартом лечения опухолей прямой кишки, которые располагаются в ее нижнем отделе. При этом методе хирургического лечения частота возврата заболевания (рецидив) минимален. После удаления части прямой кишки, конец ободочной кишки соединяется с оставшейся самой нижней частью прямой кишки или анальным каналом (коло-анальный анастомоз). Так как в данном случае не требуется формирования постоянной стомы, эта операция считается сфинктерсохраняющей. Тем не менее, может потребоваться формирование временной стомы (трансверзостомы или илестомы) для того, чтобы защитить место анастомоза во время его заживления.
Брюшно-промежностная экстирпация
Раньше эта операция была стандартом лечения раковых опухолей прямой кишки, располагающихся в ее нижнем отделе. Операция выполняется из двух разрезов – один через живот, и второй вокруг анального канала в промежности. При брюшно-промежностной экстирпации полностью удаляются прямая кишка, анальный канал и окружающие его мышцы анального сфинктера. Из-за того, что удаляются мышцы анального сфинктера, восстановить нормальный ход кишечника невозможно, поэтому для отведения кала формируется постоянная колостома.
В последнее время все чаще стали выполняться сфинктерсохраняющие операции, даже таких случаях, когда раньше единственным методом лечения считалась брюшно-промежностная экстирпация. При этом удается избежать формирования постоянной колостомы. Основная причина, почему это стало возможно, – использование современных степлерных аппаратов, которые значительно упростили выполнение операции. Кроме того, удаление небольших опухолей прямой кишки можно делать через анус (трансанальное иссечение). Поэтому в настоящее время брюшно-промежностная эктирпация выполняется только при больших распространенных опухолях, которые располагаются глубоко в малом тазу и вовлекают мышцы анального сфинктера. Каждый год частота выполнения брюшно-промежностных экстирпаций снижается. Сфинктер-сохраняющие операции могут во многих случаях заменить брюшно-промежностную экстирпацию, так как гарантируют такую же продолжительность жизни после операции и не требуют формирования колостомы.
Трансанальное иссечение
Выполняется при маленьких опухолях в нижних отделах прямой кишки. Также как и низкая передняя резекция, при выполнении трансанального иссечения опухоли не требуется формирование постоянной стомы и эта операция является сфинктер-сохраняющей. При этой операции хирург не удаляет всю прямую кишку, а только часть ее стенки, где находится опухоль. Операция производится специальными инструментами через анальный канал. Иссеченная часть стенки прямой кишки с опухолью удаляется и дефект в стенке ушивается несколькими швами. Так как при трансанальном иссечении удаляется только часть кишечной стенки, расположенные вблизи лимфатические узлы не удаляются. Если в них на момент операции содержатся микроскопические раковые клетки, они могут стать причиной возникновения рецидива опухоли (повтора заболевания). Поэтому этот вид операций можно выполнять только при маленьких опухолях с неагрессивным ростом.
Некоторые пациенты возражают против выполнения операции, боясь что потеряют способность контролировать стул и не смогут справиться с временной стомой. Тем не менее, следует помнить, что для рака прямой кишки кроме хирургической операции, другого метода излечения нет. Менее инвазивные процедуры, такие как деструкция опухолевой ткани с помощью электричества, лазера или местной лучевой терапии, играют лишь ограниченную роль в крайне редких случаях, однако в целом эти методы не могут считаться излечивающими.
Предоперационная лучевая терапия и излечивающая операция для лечения локализованной карциномы прямой кишки
Актуальность
Рак прямой кишки является одной из наиболее распространенных онкологических причин смерти в западном мире. Людей с диагностированным раком прямой кишки лечат преимущественно хирургически. Однако, сохраняется риск рецидива рака прямой кишки после хирургического лечения. Курс лучевой терапии перед операцией может снизить риск местного рецидива, так как лучевая терапия может разрушить небольшие остаточные опухоли и усилить эффекты операции.
Характеристика исследований
4 июня 2018 года мы провели поиск рандомизированных испытаний (экспериментальных исследований, в которых людей случайным образом распределяют по двум или более группам лечения) в медицинских базах данных, чтобы определить, есть ли у людей с раком прямой кишки польза от лучевой терапии перед операцией с точки зрения снижения риска смерти от любой причины, риска смерти от рака и риска рецидива рака в полости таза. Мы рассматривали лучевую терапию в высоких дозах с последующим хирургическим вмешательством любого типа для удаления рака прямой кишки.
Результаты
Мы нашли четыре испытания с участием 4 663 человек с операбельным раком прямой кишки. Наши результаты свидетельствуют о том, что проведение короткого курса лучевой терапии перед операцией, вероятно, снижает смертность. Однако, когда наш анализ ограничивался современным типом хирургического вмешательства (тотальная мезоректальная эксцизия), доказательств разницы между группой, получавшей лучевую терапию до операции, и группой, которой проводили только операцию, не было. При проведении короткого курса лучевой терапии различия между группами в смертности, связанной с раком, могли быть небольшими или вовсе отсутствовать.
Мы нашли доказательства среднего качества в пользу того, что в сравнении с хирургическим вмешательством предоперационная лучевая терапия может принести существенную пользу в плане снижения вероятности местного рецидива рака.
Предоперационная лучевая терапия мало или вовсе не влияла на радикальную резекцию или щадящие сфинктер операции.
Мы обнаружили более высокую частоту сепсиса, а также хирургических и половых осложнений у участников, получавших лучевую терапию, в сравнении с теми, кому проводили только операцию.
Качество доказательств
В целом дизайн исследований был хорошим. Мы посчитали качество доказательств средним для рецидивов рака и общей смертности, поскольку были серьезные опасения касательно применимости результатов к современному лечению рака прямой кишки.
Мы снизили оценку качества доказательств по остальным исходам из-за неточных результатов и/или различий между испытаниями по критериям определения рака прямой кишки, стадии рака у участников, предоперационной визуализации для оценки стадии, типам проводившихся операций, дозам и фракционированию излучения, времени между лучевой терапией и операцией, а также по применению адъювантной или послеоперационной терапии.
Операции при раке прямой кишки | 3861$
Заведующая онкологическим отделением в клинике Ихилов.
Онколог с 20-летним стажем.
Задать вопрос
Содержание
Как пройти дистанционное лечение рака в Израиле во время эпидемии коронавируса?
Хирургическая операция – это традиционный метод лечения рака прямой кишки. Тип операции по удалению злокачественной опухоли зависит от локализации и степени распространенности рака:- Если опухоль располагается намного выше анального отверстия, врач может назначить нижнюю переднюю резекцию (LAR). Эта операция позволяет сохранить нормальную функцию прямой кишки и опорожнять кишечник естественным способом.
- Если опухоль располагается ближе к анальному отверстию, ее можно удалить вместе со сфинктером в ходе процедуры под названием “брюшно-промежностная экстирпация прямой кишки”. В таком случае пациенту придется пользоваться калоприемником, присоединенным к колостоме – отверстию в брюшной стенке, через которое толстая кишка открывается наружу. Калоприемник – это съемный мешок для сбора кала.
Нижняя передняя резекция (LAR)
Нижняя передняя резекция – это традиционный способ хирургического лечения опухолей прямой кишки, расположенных высоко над анальным отверстием. Во время такой операции хирург производит разрез внизу живота и удаляет всю опухоль, а также прилегающую к ней нормальную ткань прямой кишки и ближайшие лимфатические узлы.
После удаления опухоли врач сшивает разрезанные края прямой кишки. Таким образом сохраняется естественное движение кала из толстого кишечника к анальному отверстию. Если опухоль располагается ниже, обрезанный фрагмент толстого кишечника присоединяют напрямую к анусу. Эта процедура называется формированием колоанального анастомоза.
При формировании колоанального анастомоза некоторые хирурги создают временную колостому, чтобы защитить хрупкое хирургическое соединение толстого кишечника с анальным сфинктером. По завершении периода послеоперационной реабилитации временную колостому убирают, и стул естественным образом проходит через толстый кишечник. Толстую кишку заново присоединяют к анальному сфинктеру.
- После операции
Эти опухолевые клетки называются микрометастазами; их нельзя обнаружить ни одним из известных способов диагностики. Наличие микроскопических очагов поражения приводит к рецидивам, возникающим после хирургического лечения без дополнительной терапии. Для очищения организма от микрометастазов применяются дистанционная лучевая терапия и химиотерапия. Облучение и противоопухолевые медикаменты улучшают результаты хирургического лечения рака в Израиле.
- Возможные осложнения
Пациенты, перенесшие нижнюю переднюю резекцию, нередко жалуются на боль внизу живота после операции. К менее распространенным осложнениям хирургического вмешательства относятся:
- кровотечения
- инфекции
- временные затруднения с опорожнением мочевого пузыря
- сексуальная дисфункция (у мужчин)
Летальный исход оперативного вмешательства фиксируется менее, чем в 5% случаев. Пациенту следует уточнить у хирурга, какие бывают осложнения и как часто они встречаются. Желательно обсудить эти вопросы с хирургом, работающим в больнице, где пациент планирует лечиться.
Брюшно-промежностная экстирпация прямой кишки (APR)
Брюшно-промежностная экстирпация прямой кишки – это традиционный способ лечения раковых опухолей, расположенных ближе к анальному отверстию. В ходе такой операции хирург производит разрез внизу живота и в промежности (коже вокруг анального отверстия). Удалению подлежит вся раковая опухоль целиком, а также окружающая ее здоровая ткань прямой кишки, анальный сфинктер и ближайшие лимфатические узлы.
После удаления злокачественного новообразования разрез в промежности зашивают. Обрезанную часть толстого кишечника присоединяют к отверстию в брюшной стенке. Это отверстие называется колостомой. Каловые массы движутся по толстому кишечнику к колостоме и собираются в специальный мешок, закрывающий отверстие. В отличие от нижней передней резекции, брюшно-промежностная экстирпация прямой кишки подразумевает формирование постоянной колостомы.
Многие пациенты хотели бы избежать формирования постоянной колостомы. Если раковая опухоль располагается вблизи от анального сфинктера, врачи обычно назначают брюшно-промежностную экстирпацию прямой кишки. В некоторых случаях проводят менее обширную операцию, чтобы не пришлось формировать колостому. Иногда пациенту назначают лучевую терапию, благодаря которой опухоль уменьшается в размере. После облучения можно провести операцию с сохранением функции кишечника.
Возможные осложнения при этой операции – такие же, как при нижней передней резекции.
Сфинктерсохраняющая операция
Анальный сфинктер – это кольцевая мышечная структура, контролирующая дефекацию. При повреждении сфинктера пациент теряет контроль функции кишечника. Сфинктерсохраняющая операция – это способ лечения раковой опухоли, расположенной вблизи анального отверстия, без удаления сфинктера.Стандартной хирургической процедурой, назначаемой в целях удаления опухоли, выросшей рядом с анальным отверстием, является брюшно-промежностная экстирпация прямой кишки (APR). В ходе такой процедуры опухоль удаляют вместе со сфинктером, а обрезанную часть толстой кишки присоединяют к отверстию в брюшной стенке – колостоме. Колостому закрывают мешком, в который собирается кал, выводимый кишечником.
Из-за неудобств, связанных с колостомой, врачи проводят сфинктерсохраняющие операции. Как правило, это менее обширное хирургическое вмешательство, за которым следует комбинация химиотерапии и лучевой терапии. Цель такой операции – удаление опухоли и небольшого фрагмента здоровой прямой кишки. Сфинктер при этом остается на месте. Процедуру проводят либо через задний проход (трансанальная резекция), либо через копчик.
Трансанальная резекция показана при маленьких опухолях, расположенных вблизи (на расстоянии до 5 см) анального сфинктера. Небольшие новообразования, расположенные выше в прямой кишке, удаляют методом резекции через копчик.
Местное иссечение
Ограниченное оперативное вмешательство назначается в случаях, когда нужно удалить раковую опухоль, сохранить сфинктер и предотвратить осложнения, характерные для более обширных операций (нижней передней резекции или брюшно-промежностной экстирпации прямой кишки). При местном иссечении хирург удаляет злокачественное новообразование и небольшой фрагмент здоровых тканей прямой кишки, однако анальный сфинктер остается на месте. Операцию проводят через анальное отверстие (трансанальная резекция) или через копчик.
В целях обеспечения эффективности ограниченного хирургического вмешательства удаляют не только опухоль, но и фрагмент здоровой ткани. Пациентам с более крупными, инвазивными или агрессивными новообразованиями предстоит традиционная хирургия. Чтобы повысить вероятность полного излечения в результате местного иссечения опухоли, вросшей в мышечную стенку прямой кишки, больному дополнительно назначают комбинацию химиотерапии и лучевой терапии.
- Возможные осложнения
Пациенты, перенесшие местное иссечение раковой опухоли, нередко жалуются на боль в области промежности или копчика. Такие послеоперационные осложнения, как кровотечения, инфекции и медленное заживление стенки прямой кишки, встречаются сравнительно редко. Летальный исход ограниченного хирургического вмешательства можно считать исключительным случаем.
Стратегии совершенствования лечения
Прогресс в лечении рака прямой кишки предопределяется:- совершенствованием хирургических техник
- развитием неоадъювантных и адъювантных методов терапии распространенного рака
- участием пациентов в клинических испытаниях
- Улучшенные сфинктерсохраняющие операции
Из-за неудобств, связанных с колостомой, врачи проводят сфинктерсохраняющие операции, позволяющие сохранить анус у пациентов с низко расположенными опухолями прямой кишки. В настоящее время разрабатываются новые методы отбора пациентов, которым показано ограниченное хирургическое вмешательство с последующей адъювантной химиотерапией и лучевой терапией.
Более агрессивное применение предоперационной (неоадъювантной) химиолучевой терапии может обеспечить сохранение функции сфинктера даже при более крупных новообразованиях, расположенных низко в прямой кишке.
Уточнить цену у специалиста
- Неоадъювантная терапия
Если опухоль прямой кишки невозможно удалить в ходе оперативного вмешательства, вероятность полного излечения значительно уменьшается. Предоперационную лучевую терапию и/или химиотерапию называют неоадъювантной терапией. Неоадъювантная терапия способствует уменьшению некоторых опухолей прямой кишки и тем самым облегчает полное удаление новообразований. В данный момент ученые устанавливают принципы назначения оптимальной неоадъювантной химиотерапии и лучевой терапии.
Стоимость диагностики и лечения рака прямой кишки в Израиле
Для удобства пациентов из-за рубежа приведем цены на некоторые виды диагностики и лечения рака прямой кишки, которые возможно пройти в онкоцентре Ихилов.
| процедура диагностики или лечения | Стоимость |
|---|---|
| Эндоскопическая резекция опухоли прямой кишки | $2165 |
| Консультация колоректального хирурга | $562 |
| Открытое хирургическое вмешательство при раке прямой кишки | $12985 |
| Трансректальное УЗИ | $338 |
Нами также гарантируется полное соблюдение врачебного этикета в плане неразглашения информации.
Диагностика и лечение рака прямой кишки в Институте онкологии ЕМС в Москве
Рассказывает Анвар Йулдашев — колопроктолог, хирург-онколог, к.м.н.
Рак прямой кишки – злокачественная опухоль, которая развивается чаще из клеток слизистой ткани, выстилающей прямую кишку, реже из клеток мышц, сосудов, переходного эпителия анального канала, анальных желез, перианальной кожи.
Прямая кишка является последним звеном пищеварительной системы и представляет собой конечный отдел толстой кишки, находящейся в малом тазу. В настоящее время на рак прямой кишки приходится около 4-5% всех онкологических заболеваний и около 70% всех онкологических заболеваний кишечника.
Наиболее часто опухоль прямой кишки выявляется в возрасте 50-60 лет, однако она может появиться и в возрасте 20-30 лет. В виду опасности заболевания необходимо своевременное лечение рака прямой кишки.
Факторы риска рака прямой кишки
-
Отсутствие физической активности
-
Нездоровое питание
-
Возраст старше 40 лет
-
Онкологически отягощенная наследственность
-
Молекулярно–генетические наследственные синдромы:
-
Генетические мутации
-
Воспалительные заболевания кишечника:
Язвенный колит
Первичный склерозирующий холангит
Воспалительные псевдополипы
Болезнь Крона
-
Абдоминальное излучение
-
Раса и пол (чаще у мужчин, у темнокожих)
-
Акромегалия
-
Трансплантация почек
-
Ожирение
-
Сахарный диабет и резистентность к инсулину.
-
Употребление в пищу красного мяса
-
Курение
-
Алкоголь
-
Холецистэктомия в анамнезе
Рак прямой кишки: клиническая картина
Рак на ранних стадиях не имеет ярко выраженных симптомов, однако с ростом опухоли у больного появляется ощущение тупой боли при прохождении каловых масс, выделение со стулом слизи и крови. Отметим, что симптомы опухоли прямой кишки могут быть очень похожи на проявление внутреннего геморроя.
На поздних стадиях наблюдается кишечная непроходимость, кровотечения, а также воспалительные осложнения: перитонит, флегмона, абсцесс. Опухоль может прорасти в мочевой пузырь, влагалище, крестец, вызывать сдавливание мочеточников и т.д.
Диагностика рака прямой кишки
К наиважнейшему и самому простому методу диагностики опухоли относится пальцевое исследование прямой кишки, однако зачастую больные игнорируют данный метод обследования при профилактических осмотрах.
Вторым методом обследования является ректороманоскопия или колоноскопия, которая позволяет сочетать осмотр прямой кишки с биопсией. Данное обследование крайне необходимо.
Третьим методом является эндоскопической обследование, которое позволяет выявить картину, сходную с раком толстой кишки.
К дополнительным методам обследования относятся ультразвуковое исследование и компьютерная томография, позитронно-эмиссионная томография – оценка распространенности опухоли по организму, лабораторная диагностика – оценка уровня онкомаркеров, оценка степени нарушения работы почек и печени.
Стадии рака прямой кишки
1 стадия – Опухоль инфильтрирует стенку кишки до подслизистой, или мышечный слой стенки кишки. Отсутствие метастатического поражения регионарных лимфоузлов, отсутствие отдаленных метастазов.
2 стадия разделяется на подстадии IIA и IIB.
Стадия IIA – Опухоль инфильтрирует субсерозу или ткань неперитонизированных участков ободочной и прямой кишки.
Стадия IIВ – Опухоль прорастает висцеральную брюшину или непосредственно распространяется на соседние органы и структуры.
Для второй стадии характерно отсутствие метастатического поражения регионарных лимфоузлов, отсутствие отдаленных метастазов.
3 стадия разделяется на три подстадии:
IIIA — Опухоль инфильтрирует стенку кишки до подслизистой, или мышечный слой стенки кишки. Метастатическое поражение трех и менее регионарных лимфоузлов.
IIIB — Опухоль инфильтрирует субсерозу или ткань неперитони-зированных участков ободочной и прямой кишки, или опухоль прорастает висцеральную брюшину или непосредственно распространяется на соседние органы и структуры. Метастатическое поражение трех и менее регионарных лимфоузлов.
IIIC – Любой из вышеперечисленных объем вовлечения первичной опухолью. Метастатическое поражение в четырех и более регионарных лимфоузлах.
Для третьей стадии характерно отсутствие отдаленных метастазов.
4 стадия – любой объем первичной опухоли и любое количество метастатически пораженных регионарных лимфатических узлов. Наличие отдаленных метастазов.
Лечение рака прямой кишки
В настоящее время выделяют 3 метода лечения:
Лечение рака прямой кишки: операция
Хирургическое лечение рака прямой кишки является основным методом терапии. В зависимости от размеров и расположения опухоли выполняют 4 основных операции: внутрибрюшная резекция или передняя резекция прямой кишки, низкая передняя резекция прямой кишки, экстирпация прямой кишки, операция Гартмана.
Если опухоль локализована в верхней трети прямой кишки, то выполняется передняя резекция прямой кишки (внутрибрюшным доступом).
Передняя резекция – это удаление пораженной кишки с последующим сшиванием ее концов. Сшивание происходит при помощи специальных аппаратов, а также вручную, в некоторых случаях без этого не обойтись. Отметим, что при внутрибрюшной резекции сфинктер сохраняется, удаляется только участок кишки с опухолью. Данная операция обладает наилучшими функциональными результатами, но ее не всегда удается провести из-за больших размеров опухоли или анатомических особенностей пациента.
Если опухоль расположена в среднем отделе прямой кишки, но выше 6 см. от края ануса, то выполняется низкая передняя резекция прямой кишки. Сшивание кишки происходит при помощи специальных сшивающих аппаратов. Операция существенно лучше брюшно-анальной резекции, поскольку сохраняет сфинктерный аппарат анального канала.
Раньше вместо низкой передней резекции выполнялась брюшно-анальная резекция прямой кишки – когда пораженную кишку удаляют, «верхний» конец кишки протягивают внутрь «нижнего», после чего ждут срастания и только потом отсекают избыток протянутой в задний проход кишки. Данная операция была наиболее распространенной, так как она позволяла удалить опухоль без ущерба онкологическому радикализму и частично сохраняла сфинктерный аппарат.
При раке прямой кишки, осложненном перифокальным воспалением, острой толстокишечной непроходимостью, выполняется операция Гартмана. При этом опухоль удаляют, после чего «верхний» конец кишки выводят в виде временной или постоянной колостомы (искусственный задний проход), а «нижний» – зашивают. Операция Гартмана выполняется в том случае, когда сшивать концы кишки слишком рискованно.
Если опухоль ниже 6 см. от края заднего прохода, наиболее обоснованной с онкологических позиций операцией является брюшно-промежностная экстирпация прямой кишки, которая может быть закончена выведением колостомы на живот или формированием колостомы на промежности, в месте ранее существовавшего ануса.
При брюшно-промежностной экстирпации прямая кишка удаляется полностью вместе с сфинктерным аппаратом и формируется колостома, которую после удалить невозможно. Данная операция применяется в том случае, когда опухоль расположена очень близко к заднему проходу и когда невозможно провести брюшно-анальную резекцию.
Лечение рака прямой кишки: лучевая терапия
Лучевое лечение рака прямой кишки часто применяется до или после хирургической операции, а также в сочетании с химиотерапией. Применение лучевой терапии позволяет уменьшить опухоль и облегчить ее удаление, а также избежать наложения колостомы и снизить риск возникновения новой опухоли.
Лечение рака прямой кишки: химиотерапия
Химиотерапия используется для лечения метастазов опухоли, а также для профилактики метастазов после операции. Доказано, что применение химиотерапии увеличивает продолжительность жизни больных с метастазами рака прямой кишки.
Эффективность лечения онкологических заболеваний, в первую очередь, зависит от оборудования и методик. Европейский медицинский центр располагает самым современным оборудованием, новейшими методами терапии, в штате – лучшие врачи России и Западной Европы, имеющие большой опыт работы и практику в ведущих европейских клиниках.
Химиотерапия рака кишечника
Рецидив опухоли в предстательной железе: выжить вопреки всему (пациенту 80 лет)
Существуют врачи, хорошие врачи и врачи от бога. В сети клиник Медскан работают именно такие специалисты, которые сражаются за жизнь пациента до последнего.
В этом интервью мы познакомим Вас с Сергеем Владимировичем Усычкиным — заведующим отделением лучевой терапии Медскан. Опыт работы доктора – более 12 лет. В течение нескольких лет он проходил стажировку и работал в испанской клинике лучевой терапии и радиохирургии Grupo IMO (Мадридский Институт Онкологии), а также длительное время работал под руководством профессора Цви Фукса, известного мирового эксперта по лучевой терапии рака предстательной железы (Memorial Sloan Kettering Cancer Center, Нью Йорк).
История пациента Сергея Владимировича заставляет верить в лучшее тогда, когда, казалось бы, не осталось надежды.
— Сергей Владимирович, расскажите нам об успешном лечении мужчины с рецидивом рака предстательной железы. Ваши коллеги называют этот случай чудом не иначе.
— Не скрою, я и сам был впечатлен результатом, которого мы добились с Александром. Мужчина обратился ко мне спустя 5 лет после брахитерапии, проведенной в одном из федеральных государственных центров. Лечение не остановило патологию, как результат — локальный рецидив рака. Врачи-урологи рекомендовали Александру пройти паллиативную гормональную терапию. По их прогнозам, радикальное хирургическое вмешательство вызвало бы осложнения, учитывая пожилой возраст пациента и его предыдущий опыт лучевого воздействия. При обследовании Александра я убедился, что опухолевый очаг в предстательной железе – единственное проявление заболевания в организме. В этой ситуации существует только две возможности лечения рецидива – либо радикальная операция, в которой уже отказали пациенту, либо повторная лучевая терапия. Теоретически второй метод также связан с высоким риском осложнений, так как нормальные ткани вокруг предстательной железы уже «выбрали» дозу облучения. Но все же, обсудив с пациентом все возможные последствия, мы остановились на варианте с повторной лучевой терапией. Этот выбор помог нам добиться успеха.
— Как проходили процедуры и сколько ушло времени на лечение?
— В 2016 году на линейном ускорителе Varian TrueBeam мы провели стереотаксическую лучевую терапию за 5 сеансов на рецидив опухоли в предстательной железе без каких-либо осложнений в процессе лечения. Современное оборудование, высокоточное планирование облучения и специальная техника защиты нормальных тканей позволили добиться основной цели лечения – подвести радикальную дозу на рецидив и «пощадить» нормальные ткани – прямую кишку, мочевой пузырь и уретру.
— Как себя чувствует пациент в настоящее время? Поддерживаете ли Вы связь?
— Разумеется, мы продолжаем общаться. Я никогда не бросаю своих пациентов после лечения. Они у меня все молодцы, регулярно сдают анализы на ПСА, заносят их в специальные дневники, заполняют опросники по побочным эффектам и качеству жизни. Александр – не исключение, он исправно проверяет свое состояние. Уже в течение первого года после лечения у него была отмечена выраженная положительная динамика в виде снижения ПСА с 4,3 нг/мл до 0,040 нг/мл. Пациент при этом не получал гормональную терапию. Никаких осложнений со стороны мочевого пузыря, уретры или прямой кишки не было отмечено. Сейчас, спустя более 4-х лет после повторной лучевой терапии, пациент следит за уровнем ПСА и этот показатель все эти годы остается низким (
«Мне повезло, что меня лечил профессионал Сергей Владимирович Усычкин. В 2016 г. он провел ювелирную операцию по лучевой терапии моей бедной простаты. Дело в том, что это был рецидив, т.е. дело рискованное. Тем не менее была проведена блестящая работа, результаты которой на лицо. Сейчас у меня хорошие показатели ПСА и такое чувство, что этот врач буквально вытащил меня из опасной ситуации. Большое ему спасибо!»
Меня очень растрогало это письмо.
— Что бы Вы пожелали людям, которые оказались в ситуации Александра?
Никогда не отчаивайтесь. Не тяните время, ищите того самого врача, который найдет выход из вашей ситуации. Скажу банальную фразу, но онкология сегодня – не приговор. На моих глазах в Медскане сотни пациентов побеждают страшную болезнь, потому что получают качественное лечение и ежедневный контроль со стороны докторов. Нам есть чем гордиться!
*Имя пациента изменено с целью сохранения анонимности и врачебной этики.
Показать полностью
Рецидив и пятилетняя выживаемость у пациентов с колоректальным раком после операции
Иран J Cancer Prev. 2015 Авг; 8 (4): e3439.
Сейед Реза Фатеми
1 Исследовательский центр гастроэнтерологии и заболеваний печени, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук им. Шахида Бехешти, Тегеран, Иран
Мохамад Амин Поурхосеингхоли
9000 Diverhoseingholi Исследовательский центр, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти, Тегеран, Иран Медицинские науки, Тегеран, ИранМохсен Вахеди
2 Департамент эпидемиологии и биостатистики, Школа общественного здравоохранения Тегеранского университета медицинских наук, Тегеран, Иран
Сара Паша
1 Гастроэнтерология и болезни печени Исследовательский центр, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти, Тегеран, Иран
Лейла Ализаде
1 Исследовательский центр гастроэнтерологии и заболеваний печени, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти Тегеран, Иран
Мохаммад Реза Зали
1 Исследовательский центр гастроэнтерологии и заболеваний печени, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти, Тегеран, Иран
1 Гастроэнтерология и исследования желудочно-кишечного тракта Центр, Исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти, Тегеран, Иран
2 Кафедра эпидемиологии и биостатистики, Школа общественного здравоохранения Тегеранского университета медицинских наук, Тегеран, Иран
* Автор, ответственный за переписку: Moh amad Amin Pourhoseingholi, Исследовательский центр гастроэнтерологии и заболеваний печени, Научно-исследовательский институт гастроэнтерологии и заболеваний печени, Университет медицинских наук Шахида Бехешти, Тегеран, Иран.Тел .: + 98-2122432515, электронная почта: moc.liamg@ghpnimaПоступила в редакцию 6 июля 2015 г .; Принято 11 июля 2015 г.
Авторские права © 2015, Иранский журнал профилактики рака. Это статья в открытом доступе, распространяемая в соответствии с условиями Международной лицензии Creative Commons Attribution-NonCommercial 4.0 (http://creativecommons.org/licenses/by- nc / 4.0 /), который позволяет копировать и распространять материал только в некоммерческих целях при условии правильного цитирования оригинальной работы. Эта статья цитировалась в других статьях PMC.Abstract
Справочная информация:
Колоректальный рак (CRC) является распространенным злокачественным новообразованием во всем мире, и его исход наиболее тесно связан со степенью заболевания на момент обращения. Ранняя диагностика бессимптомного рецидива увеличивает вероятность полной хирургической резекции.
Цели:
Целью данного исследования было оценить частоту рецидивов колоректального рака и выживаемость в течение 5 лет после операции.
Пациенты и методы:
В течение 9-летнего периода с 21 марта 2004 г. по 20 марта 2013 г. пациенты, у которых первичный колоректальный рак был удален в больнице Талегани, Тегеран, Иран, были отобраны в историческую когорту.Были собраны необходимые данные, такие как демографические, возраст, пол, семейная история CRC, место и размер опухоли, стадия опухоли, детали операции, гистологические результаты, метод лечения, гистопатологические и т. Д. Затем оценивали рецидив и выживаемость колоректального рака в течение 5 лет после операции и их факторы риска. Значение P менее 0,05 считалось значимым. Весь анализ был выполнен с использованием программного обеспечения SPSS.
Результаты:
В общей сложности 107 пациентов прошли резекцию по поводу колоректального рака в течение периода исследования, средний возраст составил 53 года.50 ± 12,68 лет (от 24 до 76 лет), выживаемость 73,8% (прямая кишка 70,0% и толстая кишка 75,9%) и среднее время выживаемости 142,17 ± 21,60 месяца. Частота рецидивов у пациентов с CRC в течение пяти лет после операции составила 5,7%. Регионарные лимфатические узлы, дистанционные метастазы и адъювантная терапия были важными факторами прогноза выживаемости после операции.
Выводы:
Частота рецидивов у иранских пациентов была низкой, что могло быть связано с повышением точности и квалификации хирургов или улучшенной адъювантной терапией.Значительная связь между выживаемостью и адъювантной терапией проясняет этот вывод. Ранняя диагностика и первичное выявление могут увеличить выживаемость.
Ключевые слова: Колоректальный рак, хирургическая резекция, выживаемость, рецидив
1. Общие сведения
Колоректальный рак (CRC) является распространенным раком во всем мире (1). Эта злокачественная опухоль является бременем для общественного здравоохранения в большинстве промышленно развитых стран и является наиболее частой причиной смерти от рака в мире (2).Уровень заболеваемости и смертности от этого рака в Иране увеличивается, и прогнозируется, что иранское население может столкнуться с увеличением его бремени в будущем (3-5).
Хирургическая резекция — единственный метод лечения локализованного рака толстой кишки. Это основной метод лечения CRC, и исход наиболее тесно связан со степенью заболевания на момент обращения. Расположение первичной опухоли также может иметь прогностическое значение. Для каждой стадии злокачественные опухоли, возникающие в области перитонеального отражения или ниже (ректосигмоид и прямая кишка), имеют худшую пятилетнюю выживаемость, чем опухоли, возникающие более проксимально (6).Кроме того, в прямой кишке дистальные раковые образования имеют худший прогноз, чем более проксимальные поражения.
За последние 50 лет наблюдается постепенный сдвиг в сторону правостороннего или проксимального рака толстой кишки (5). Показатели выживаемости CRC различаются во всем мире из-за качества лечения, включая хирургические методы, что является предиктором исходов для местных рецидивов и показателей излечения (7, 8). CRC, который метастазировал или распространился в регионарные лимфатические узлы, имеет худший прогноз и более высокий риск рецидива.Исследования показали, что от 15 до 30 процентов пациентов, у которых диагностирован колоректальный рак без лимфоузлов, рецидивируют в течение 2-5 лет (9, 10). Эта высокая частота рецидивов и более высокая частота колоректального рака у субъектов с высоким риском развития КРР подчеркивают возможность здравоохранения для наблюдения или мероприятий по снижению заболеваемости, связанной с КРР (11).
2. Цели
Целью этого исследования было оценить частоту рецидивов колоректального рака и выживаемость в течение 5 лет после поражения этим раком, с учетом влияния других клинических и демографических факторов.
3. Пациенты и методы
Это было историческое когортное исследование, в котором все пациенты с первичным колоректальным раком были удалены только одним квалифицированным персоналом колоректального хирурга или под его наблюдением и зарегистрированы в больнице Талегани, Тегеран, с 21 марта. , 2004 г. по 20 марта 2013 г. вошли в исследование.
Необходимые данные, такие как демографические данные, возраст, пол, семейный анамнез CRC, место и размер опухоли, стадия опухоли, детали операции, гистологические результаты, метод лечения и т. Д.были извлечены из медицинских карт. За всеми пациентами наблюдали прогноз, уровень смертности и рецидивы после операции (путем повторных периодических посещений, колоноскопии и телефонного контакта). Время выживания рассчитывали от даты регистрации операции до смерти или окончания исследования.
В соответствии с протоколом ведения CRC пациентам со стадиями II-III и некоторыми симптомами IV стадии была сделана колэктомия (хирургическое удаление опухоли, регионарных лимфатических узлов и близлежащих тканей), а затем была предложена химиотерапия на основе 5-фторурацила пациентам моложе 75 лет с раком толстой кишки III или IV стадии или осложненной стадией II.Послеоперационная химиолучевая терапия предлагалась только пациентам со стадией II или III ректосигмоидного рака, когда местный клиренс был под сомнением, а предоперационная химиолучевая терапия проводилась пациентам с фиксированными поражениями T4.
Тест хи-квадрат и анализ Каплана-Мейера были выполнены для определения факторов прогноза, связанных с выживаемостью и рецидивом. Значения P менее 0,05 считались статистически значимыми. Все анализы проводились с использованием программного обеспечения SPSS, версия 17.
4.Результаты
Всего 107 пациентов (51,2% мужчин), которым была выполнена резекция по поводу колоректального рака в течение периода исследования, приняли участие в этом исследовании. 23,4% пациентов имели положительный семейный анамнез CRC, а 53,8% — спорадический CRC. Средний возраст составил 53,50 ± 12,68 года (от 24 до 76 лет), а выживаемость составила 73,8% при средней продолжительности жизни 142,17 ± 21,60 месяца. Частота рецидивов после операции составила 5,7%, и все они были живы до конца исследования. Средняя продолжительность рецидива после операции составила 3.50 ± 1,23 года. Областью рецидивов были: пять пациентов (83,3%) рядом с местом анастомоза или предыдущей опухолью и один пациент точно в месте анастомоза. Демографические и клинико-патологические факторы, связанные со временем выживания после операции, были представлены в и. Согласно лог-ранговому тесту региональные лимфатические узлы, дистанционное метастазирование и адъювантная терапия были факторами прогноза выживаемости у пациентов с CRC после операции, соответственно. Пациенты с регионарной LN N1, уровнем метастазирования M0 и адъювантной терапией имели более высокую выживаемость.Кроме того, не было существенной связи между типом хирургического вмешательства и риском смерти у исследуемых пациентов ().
Таблица 1.
Демографические факторы и пятилетняя выживаемость после операции у пациентов с колоректальным раком
| Переменные | Кол-во (%) смерти | Время выживания / ст. Ошибка, Mo | Значение P | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Пол | 0,672 | ||||||||
| Мужской | 15 (27.3) | 84,20 / 7,79 | |||||||
| Внутренний | 13 (25,0) | 161,32 / 20,49 | |||||||
| Возраст, лет | 0,176 | ||||||||
| ≤ 50 | 10 (23,2) | 151,29 / 25,29 | |||||||
| > 50 | 18 (28,1) | 7,98 Семейная история | 0.555 | ||||||
| Отрицательный | 22 (26,8) | 149,42 / 17,51 | |||||||
| Положительный | 6 (24,0) | 84,55 / 8,47 | 0,474 | ||||||
| 18,6 — 24,9 | 18 (30,0) | 125,42 / 25,66 | |||||||
| 25 — 29,9 | 8 (2013,7) | Категория CRC | 0.646 | ||||||
| ≥ 30 | 2 (25,0) | 78,13 / 13,40 | |||||||
| Спорадическое | 12 (26,1) | 62,19 / 5,13 | 9011P | 148,14 / 23,97 | |||||
| FAP | 1 (33,3) | 29,00 / 0,00 |
Таблица 2.
Клинико-патологические факторы после пяти 9 лет после операции на кишечнике Тип операции и смертность, после операции Демографические и клинико-патологические факторы, связанные с риском рецидива, представлены в и. Согласно результатам, ни один из демографических и клинико-патологических факторов не был достоверно связан с рецидивом после операции. Демографические факторы и рецидив после операции у пациентов с колоректальным раком Это исследование показало, что у пациентов, перенесших резекцию по поводу колоректального рака, выживаемость высока, а частота рецидивов составляет всего 5,7%. Оценка послеоперационной выживаемости колоректального рака необходима из-за сравнения результатов, а затем повторной оценки причин различий (вид операции, опыт хирургов, проведение химиотерапии или химиолучевой терапии и ее режимы, качество послеоперационного ухода и наблюдения) . В этом исследовании не было корреляции между ИМТ и выживаемостью CRC, что отличается от многих аналогичных предыдущих исследований (12, 13). В этом исследовании не наблюдалось зависимости возраста и пола с выживаемостью пациентов с CRC, однако некоторые иранские исследования показали, что колоректальный рак возникает в более молодом возрасте (14). До конца исследования ни один из пациентов в группе рецидива не погиб. Эта статистика лучше, чем на других сайтах в Иране и других странах (15, 16), и аналогична некоторым азиатским исследованиям (17), что может быть связано с улучшением точности и опыта хирурга или лучшей адъювантной терапией или различиями стадий у пациентов. кто был прооперирован.Значительная связь между выживаемостью и адъювантной терапией также проясняет этот вывод. Однако необходимо оценить эффективность этих методов лечения на более низких стадиях. Количество исследованных лимфатических узлов и удаленное метастазирование статистически предсказывали выживаемость, что аналогично исследованию, которое показало, что риск смерти был выше у пациентов с отдаленными метастазами (18). Размер опухоли, степень опухоли и некоторые другие клинические факторы не были связаны с выживаемостью, что контрастирует с западными исследованиями (19). Заболеваемость CRC ниже в Иране по сравнению с западными странами; однако его бремя в последние годы увеличивается (20, 21). Кроме того, пятилетняя выживаемость при CRC ниже, чем в мире (22, 23). Похоже, что среди исследованных прогностических факторов наиболее важными являются те, которые относятся к ранней диагностике рака. Таким образом, первичное выявление возможно, поскольку доступны эффективные методы скрининга (24). Из-за ограниченных данных о выживаемости и рецидивах колоректального рака после операции и его факторах риска в различных районах Ирана, наше исследование было бы полезно для улучшения эпиднадзора (до и после операции), выживаемости и рецидивов CRC и, по крайней мере, для улучшения управление и контроль факторов риска.Оценка частоты и продолжительности рецидива колоректального рака (где определяется место, стадия на момент проявления и место рецидива) может помочь нам в улучшении планирования послеоперационного наблюдения, переоценке вида хирургического вмешательства, адъювантной и неоадъювантной химиотерапии и химиолучевой терапии. , чтобы увеличить выживаемость пациентов. Ограничением данного исследования является небольшой размер выборки пациентов, перенесших резекцию по поводу колоректального рака. Таким образом, при некотором сравнении выживаемости результаты не были значительными.Необходимо провести многоцентровое исследование, чтобы объединить набор данных пациента и повысить надежность результатов для будущих исследований в Иране. Авторы выражают признательность Научно-исследовательскому институту гастроэнтерологии и заболеваний печени за поддержку этого исследования. Вклад авторов: SRF и MAP разработали и разработали это исследование, интерпретировали результаты и составили рукопись. FA, MV и SP участвовали в написании и редактировании рукописи.LA и SP участвовали в сборе данных и одобрили окончательный вариант рукописи. MRZ курировала исследование и одобрила черновик рукописи. Все авторы прочитали и улучшили окончательную рукопись. Конфликт интересов: Конфликт интересов отсутствует. Раскрытие финансовой информации: Это исследование спонсировалось грантом Центра исследований гастроэнтерологии и заболеваний печени, Университет медицинских наук им. Шахида Бехешти, Тегеран, Иран. [Рекомендации] Национальная комплексная онкологическая сеть. Руководство NCCN по клинической практике в онкологии. Рак прямой кишки. Доступно на http://www.nccn.org/professionals/physician_gls/PDF/rectal.pdf. Версия 1.2021 — 22 декабря 20200 г .; Дата обращения: 5 января 2021 г. Американское онкологическое общество.Рак в цифрах и фактах, 2021 г. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/annual-cancer-facts-and-figures/2021/cancer-facts-and-figures- 2021.pdf. Дата обращения: 6 апреля 2021 г. Джованнуччи Э, Ву К. Рак толстой и прямой кишки. Schottenfeld D, Fraumeni J, ред. Рак. Эпидемиология и профилактика . 3-е изд. Издательство Оксфордского университета; 2006. Anagnostopoulos G, Sakorafas GH, Kostopoulos P, et al.Плоскоклеточный рак прямой кишки: описание случая и обзор литературы. Eur J Cancer Care (Engl) . 2005 14 марта (1): 70-4. [Медлайн]. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T. Предоперационная лучевая терапия в сочетании с полным мезоректальным иссечением при резектабельном раке прямой кишки. N Engl J Med . 2001 30 августа. 345 (9): 638-46. [Медлайн]. DʼSouza N, de Neree Tot Babberich MPM, d’Hoore A, et al.Определение прямой кишки: международный экспертный консенсус Delphi. Энн Сург . 2019 Декабрь 270 (6): 955-959. [Медлайн]. Хилд Р.Дж. «Священный план» ректальной хирургии. J R Soc Med . 1988 сентябрь 81 (9): 503-8. [Медлайн]. [Полный текст]. Leggett BA, Devereaux B, Biden K, Searle J, Young J, Jass J. Гиперпластический полипоз: связь с колоректальным раком. Am J Surg Pathol . 2001 25 февраля (2): 177-84.[Медлайн]. Wheeler JM, Bodmer WF, Mortensen NJ. Гены репарации несоответствия ДНК и колоректальный рак. Кишечник . 2000 июл. 47 (1): 148-53. [Медлайн]. [Полный текст]. Сигель Р.Л., Федева С.А., Андерсон В.Ф., Миллер К.Д., Ма Дж., Розенберг П.С. и др. Модели заболеваемости колоректальным раком в США, 1974–2013 гг. Национальный институт рака . 28 февраля 2017 г. 109: [Полный текст]. Siegel RL, Miller KD, Goding Sauer A, Fedewa SA, Butterly LF, Anderson JC и др.Статистика колоректального рака, 2020. CA Cancer J Clin . 2020 5 марта. [Medline]. [Полный текст]. Всемирная организация здравоохранения. Колоректальный рак. КТО. Доступно по адресу http://gco.iarc.fr/today/data/factsheets/cancers/10_8_9-Colorectum-fact-sheet.pdf. 2020; Дата обращения: 7 апреля 2021 г. Программа эпиднадзора, эпидемиологии и конечных результатов. Факты статистики рака: колоректальный рак. Национальный институт рака. Доступно по адресу http: //seer.cancer.gov / statfacts / html / colorect.html. Дата обращения: 5 января 2021 г. Yothers G, Sargent DJ, Wolmark N, et al. Результаты среди чернокожих пациентов со стадией II и III рака толстой кишки, получающих химиотерапию: анализ испытаний адъюванта ACCENT. Национальный институт рака . 2011, 19 октября. 103 (20): 1498-1506. [Медлайн]. [Полный текст]. Роббинс А.С., Сигель Р.Л., Джемал А. Расовые различия в показателях смертности от колоректального рака в зависимости от стадии с 1985 по 2008 год. Дж. Клин Онкол . 2012 1 февраля. 30 (4): 401-5. [Медлайн]. Ротвелл П.М., Фаукс Г.Р., Белч Дж.Ф., Огава Х., Варлоу С.П., Мид Т.В. Влияние ежедневного приема аспирина на долгосрочный риск смерти от рака: анализ данных отдельных пациентов из рандомизированных исследований. Ланцет . 7 декабря 2010 г .; Ранняя онлайн-публикация. [Полный текст]. Burn J, Gerdes AM, Macrae F и др. Долгосрочное влияние аспирина на риск рака у носителей наследственного колоректального рака: анализ рандомизированного контролируемого исследования CAPP2. Ланцет . 2011 17 декабря. 378 (9809): 2081-7. [Медлайн]. [Полный текст]. Rothwell PM, Price JF, Fowkes FG, Zanchetti A, Roncaglioni MC, Tognoni G, et al. Краткосрочные эффекты ежедневного приема аспирина на заболеваемость раком, смертность и несосудистую смертность: анализ динамики рисков и преимуществ в 51 рандомизированном контролируемом исследовании. Ланцет . 2012 28 апреля. 379 (9826): 1602-12. [Медлайн]. Stitzenberg KB, Sanoff HK, Penn DC, Meyers MO, Tepper JE.Практические шаблоны и долгосрочное выживание при ранней стадии рака прямой кишки. Дж. Клин Онкол . 13 декабря 2013 г. 31 (34): 4276-82. [Медлайн]. [Полный текст]. Eu KW, Seow-Choen F, Ho JM, Ho YH, Leong AF. Местный рецидив после резекции прямой кишки по поводу рака. J R Coll Surg Edinb . 1998 декабрь 43 (6): 393-6. [Медлайн]. [Полный текст]. Thong MS, Mols F, Lemmens VE, et al. Влияние предоперационной лучевой терапии на общее и конкретное заболевание состояние здоровья выживших после рака прямой кишки: популяционное исследование. Int J Radiat Oncol Biol Phys . 2011 г. 1. 81 (3): e49-58. [Медлайн]. Харрисон П. Провоспалительная диета увеличивает риск CRC у обоих полов. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/8. 23 января 2018 г .; Доступ: 30 января 2018 г. Табунг Ф.К., Лю Л., Ван В., Фунг Т.Т., Ву К., Смит-Уорнер С.А. и др. Ассоциация диетического воспалительного потенциала с риском колоректального рака у мужчин и женщин. JAMA Oncol . 18 января 2018 г. [Medline]. Джанфреди В., Нуччи Д., Сальватори Т., Даллагиакома Г., Фатигони С., Моретти М. и др. Рак прямой кишки: снижение риска на 20% благодаря потреблению пищевых волокон. Систематический обзор и метаанализ. Питательные вещества . 2019 12 июля. 11 (7): 916-32. [Медлайн]. [Полный текст]. Чао А., Тун М.Дж., Коннелл С.Дж. и др. Употребление мяса и риск колоректального рака. ЯМА . 2005 12 января 293 (2): 172-82.[Медлайн]. Baron JA, Beach M, Mandel JS, van Stolk RU, Haile RW, Sandler RS и др. Добавки кальция для профилактики колоректальных аденом. Исследовательская группа по профилактике полипов кальция. N Engl J Med . 1999, 14 января. 340 (2): 101-7. [Медлайн]. Феррари П., Дженаб М., Норат Т., Москаль А., Слимани Н., Олсен А. и др. Пожизненное и исходное потребление алкоголя и риск рака толстой и прямой кишки в Европейском проспективном исследовании рака и питания (EPIC). Инт Дж. Рак . 2007 г. 1. 121 (9): 2065-72. [Медлайн]. Kabat GC, Howson CP, Wynder EL. Потребление пива и рак прямой кишки. Int J Epidemiol . 1986, 15 декабря (4): 494-501. [Медлайн]. Tsoi KK, Pau CY, Wu WK, Chan FK, Griffiths S, Sung JJ. Курение сигарет и риск колоректального рака: метаанализ проспективных когортных исследований. Клин Гастроэнтерол Гепатол . 2009 июн. 7 (6): 682-688.e1-5. [Медлайн]. Фиппс А.И., Барон Дж., Ньюкомб, Пенсильвания. Предиагностический анамнез курения, употребления алкоголя и выживаемость при колоректальном раке: Семейный реестр рака толстой кишки в Сиэтле. Рак . 2011 г. 1. 117 (21): 4948-57. [Медлайн]. [Полный текст]. Johns LE, Houlston RS. Систематический обзор и метаанализ риска семейного колоректального рака. Ам Дж. Гастроэнтерол . 2001 Октябрь 96 (10): 2992-3003. [Медлайн]. Берт RW.Семейный риск и колоректальный рак. Гастроэнтерол Clin North Am . 1996 25 декабря (4): 793-803. [Медлайн]. [Рекомендации] Национальная комплексная онкологическая сеть. NCCN Clinical Practice Guidelines in Oncology: Genetic / Familial High Risk Assessment: Colorectal. NCCN. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf. Версия 2.2021 — 20 ноября 2020 г .; Дата обращения: 5 января 2021 г. Хендерсон Д.Домашний тест стула выявляет 79% колоректального рака. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/820194. Доступ: 10 февраля 2014 г. Ли Дж.К., Лайлс Э.Г., Бент С., Левин Т.Р., Корли Д.А. Точность иммунохимических тестов кала на колоректальный рак: систематический обзор и метаанализ. Энн Интерн Мед. . 2014 Февраль 4. 160 (3): 171. [Медлайн]. [Полный текст]. de Wijkerslooth TR, Stoop EM, Bossuyt PM, Meijer GA, van Ballegooijen M, van Roon AH, et al.Иммунохимический анализ кала на скрытую кровь одинаково чувствителен для проксимальных и дистальных продвинутых неоплазий. Ам Дж. Гастроэнтерол . 2012 31 июля. [Medline]. Nelson H, Petrelli N, Carlin A, Couture J, Fleshman J, Guillem J и др. Рекомендации 2000 г. по хирургии рака прямой и толстой кишки. Национальный институт рака . 2001, 18 апреля. 93 (8): 583-96. [Медлайн]. Schoen RE, Pinsky PF, Weissfeld JL, Yokochi LA, Church T, Laiyemo AO и др.Заболеваемость и смертность от рака прямой и прямой кишки при скрининговой гибкой сигмоидоскопии. N Engl J Med . 2012 г. 21 мая. [Medline]. [Рекомендации] Целевая группа превентивных служб США, Биббинс-Доминго К., Гроссман Д.К., Карри С.Дж., Дэвидсон К.В., Эплинг Дж. У. мл. И др. Скрининг колоректального рака: Рекомендация рабочей группы США по профилактическим услугам. ЯМА . 2016, 21 июня. 315 (23): 2564-75. [Медлайн]. [Полный текст]. Макнамара Д.Доказательства поддерживают скрининг молодых людей на колоректальный рак. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/887768. 30 октября 2017 г .; Доступ: 15 ноября 2017 г. Браунтс Л.Р., Леманн Р.К., Лесперанс К.Э., Браун Т.А., Стил С.Р. Повышение показателей скрининга на колоректальный рак среди населения с равным доступом. Am J Surg . 2009 Май. 197 (5): 609-12; обсуждение 612-3. [Медлайн]. Келлер Д.С., Берхо М., Перес Р.О., Векснер С.Д., Чанд М.Междисциплинарное лечение рака прямой кишки. Нат Рев Гастроэнтерол Гепатол . 2020 Июл.17 (7): 414-429. [Медлайн]. Бакстер Н.Н., Гарсия-Агилар Дж. Консервация органов при раке прямой кишки. Дж. Клин Онкол . 2007 10 марта. 25 (8): 1014-20. [Медлайн]. Hospers G, Bahadoer RR, Dijkstra EA, et al. Краткосрочная лучевая терапия с последующей химиотерапией перед ТМЭ при местнораспространенном раке прямой кишки: рандомизированное исследование RAPIDO. Дж. Клин Онкол . 2020. 38 (Suppl; abstr 4006): [Полный текст]. Cercek A, Roxburgh CSD, Strombom P, Smith JJ, Temple LKF, Nash GM и др. Принятие тотальной неоадъювантной терапии местнораспространенного рака прямой кишки. JAMA Oncol . 14 июня 2018 г. 4 (6): e180071. [Медлайн]. [Полный текст]. Rothenberger D, Garcia-Aquilar J. Рак прямой кишки, местное лечение. Современная терапия в хирургии толстой и прямой кишки . 2-е изд. Филадельфия, Пенсильвания: Мосби; 2005 г. Peng J, Chen W., Venook AP, et al. Отдаленный исход рака прямой кишки на ранней стадии после стандартной резекции и местного иссечения. Clin Colorectal Cancer . 2011 г. 1. 10 (1): 37-41. [Медлайн]. Брукс М. Местное иссечение рака прямой кишки увеличивается, но неэффективно. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/815376. 4 декабря 2013 г .; Дата обращения: 5 января 2021 г. Weiser MR, Landmann RG, Wong WD, Shia J, Guillem JG, Temple LK, et al.Хирургическое лечение рецидива рака прямой кишки после трансанального иссечения. Диск прямой кишки . 2005 июн. 48 (6): 1169-75. [Медлайн]. Кваан MR, Стюарт старший DB, Данн КБ. Толстая кишка, прямая кишка и анус. Бруникарди ФК, Андерсен Д.К., Биллиар Т.Р. и др., Ред. Принципы хирургии Шварца . 11-е изд. Нью-Йорк, Нью-Йорк: образование Макгроу-Хилл; 2019. Vol 2: 1259-1330. Li S, Chi P, Lin H, Lu X, Huang Y. Долгосрочные результаты лапароскопической хирургии по сравнению с открытой резекцией при раке средней и нижней прямой кишки: исследование NTCLES. Эндоскопическая хирургия . 2011 25 октября (10): 3175-82. [Медлайн]. Green BL, Marshall HC, Collinson F, Quirke P, Guillou P, Jayne DG и др. Долгосрочное наблюдение за результатами исследования CLASICC, проведенного Советом по медицинским исследованиям, по сравнению традиционной и лапароскопической резекции при колоректальном раке. Br J Surg . 2012 6 ноября [Medline]. Bonjer HJ, Deijen CL, Abis GA, Cuesta MA, van der Pas MH, de Lange-de Klerk ES, et al. Рандомизированное исследование лапароскопических и открытых операций при раке прямой кишки. N Engl J Med . 2015 Апрель 2. 372 (14): 1324-32. [Медлайн]. Augestad KM, Crawshaw B, Delany CP. Рак прямой кишки: оперативное лечение. Fazio VW, Church JM, Delaney CP, Kiran RP, ред. Современная терапия в хирургии толстой и прямой кишки . 3-е изд. Филадельфия, Пенсильвания: Эльзевьер; 2017. 146-151. Maurer CA, Renzulli P, Kull C, et al. Влияние введения тотального мезоректального иссечения на частоту местных рецидивов и выживаемость при раке прямой кишки: отдаленные результаты. Энн Сург Онкол . 2011 июл.18 (7): 1899-906. [Медлайн]. Fujita S, Akasu T, Mizusawa J, Saito N, Kinugasa Y, Kanemitu Y и др. Послеоперационная заболеваемость и смертность после мезоректального иссечения с и без латеральной лимфодиссекции для клинической стадии II или III стадии рака нижней прямой кишки (JCOG0212): результаты многоцентрового рандомизированного контролируемого исследования не меньшей эффективности. Ланцет Онкол . 2012 июн.13 (6): 616-21. [Медлайн]. Han YD, Kim WR, Park SW, Cho MS, Hur H, Min BS и др.Предикторы патологического полного ответа у пациентов с раком прямой кишки, подвергающихся тотальному иссечению мезоректальной кишки после предоперационной химиолучевой терапии. Медицина (Балтимор) . Ноябрь 2015. 94 (45): e1971. [Медлайн]. [Полный текст]. Якобс М., Вердея Дж. К., Гольдштейн Х.С. Минимально инвазивная резекция толстой кишки (лапароскопическая колэктомия). Хирургическая лапароскопическая эндоскопия . 1991 Сентябрь 1 (3): 144-50. [Медлайн]. Trastulli S, Cirocchi R, Listorti C, Cavaliere D, Avenia N, Gullà N и др.Лапароскопическая и открытая резекция рака прямой кишки: метаанализ рандомизированных клинических исследований. Колоректальный Дис . 2012, 14 июня (6): e277-96. [Медлайн]. van der Pas MH, Haglind E, Cuesta MA, Fürst A, Lacy AM, Hop WC, et al. Сравнение лапароскопических и открытых операций при раке прямой кишки (ЦВЕТ II): краткосрочные результаты рандомизированного исследования фазы 3. Ланцет Онкол . 2013 14 марта (3): 210-8. [Медлайн]. Fleshman J, Branda M, Sargent DJ и др.Влияние лапароскопической резекции по сравнению с открытой резекцией рака прямой кишки II или III стадии на патологические исходы: рандомизированное клиническое испытание ACOSOG Z6051. ЯМА . 2015 Октябрь 6. 314 (13): 1346-55. [Медлайн]. [Полный текст]. Bujko K, Rutkowski A, Chang GJ, Michalski W, Chmielik E, Kusnierz J. Основано ли правило 1 см для края дистальной резекции кишечника при раке прямой кишки на основании клинических данных? Систематический обзор. Индийский Дж. Сург Онкол . 2012 июн. 3 (2): 139-46.[Медлайн]. [Полный текст]. Quan D, Gallinger S, Nhan C, Auer RA, Biagi JJ, Fletcher GG, et al. Роль резекции печени при метастазах колоректального рака в эпоху мультимодального лечения: систематический обзор. Хирургия . 2012 Июнь 151 (6): 860-70. [Медлайн]. Dhir M, Lyden ER, Wang A, et al. Влияние границ на общую выживаемость после резекции печени по поводу колоректального метастаза: метаанализ. Энн Сург .2011 Август 254 (2): 234-42. [Медлайн]. Маргалит Д. Н., Мамон Х. Дж., Анчукевич М. и др. Переносимость комбинированной терапии рака прямой кишки у пожилых пациентов в возрасте 75 лет и старше. Int J Radiat Oncol Biol Phys . 2011 декабрь 1. 81 (5): e735-41. [Медлайн]. Ceelen WP, Van Nieuwenhove Y, Fierens K. Предоперационная химиолучевая терапия в сравнении с одной только радиацией при резектабельном раке прямой кишки II и III стадии. Кокрановская база данных Syst Rev .2009 21 января. CD006041. [Медлайн]. Якобсен А., Плоен Дж., Вуонг Т., Аппельт А., Линдебьерг Дж., Рафаэльсен С.Р. Зависимость эффекта от дозы в химиолучевой терапии для местнораспространенного рака прямой кишки: рандомизированное испытание, сравнивающее две дозы облучения. Int J Radiat Oncol Biol Phys . 2012 15 мая. [Medline]. Вонг Р.К., Тандан В., Де Силва С., Фигередо А. Предоперационная лучевая терапия и лечебная хирургия для лечения локализованной карциномы прямой кишки. Кокрановская база данных Syst Rev . 18 апреля 2007 г. CD002102. [Медлайн]. Кэссиди Р.Дж., Лю Й., Патель К., Чжун Дж., Стойер С.Е., Куби Д.А. и др. Можем ли мы отказаться от неоадъювантной химиолучевой терапии в пользу неоадъювантной мультиагентной химиотерапии для некоторых ректальных аденокарцином II / III стадии: анализ национальной базы данных по раку. Рак . Март 2017. 123 (5): 783-793. [Медлайн]. [Полный текст]. Ng K, Ogino S, Meyerhardt JA и др.Связь между использованием статинов и рецидивом рака толстой кишки и выживаемостью: результаты CALGB 89803. J Natl Cancer Inst . 2011 Октябрь 19, 103 (20): 1540-51. [Медлайн]. [Полный текст]. Kidwell KM, Yothers G, Ganz PA, Land SR, Ko CY, Cecchini RS и др. Долгосрочные нейротоксические эффекты оксалиплатина, добавленного к фторурацилу и лейковорину в качестве адъювантной терапии рака толстой кишки: результаты испытаний C-07 и LTS-01 Национального хирургического адъювантного проекта груди и кишечника. Рак . 2012 8 мая. [Medline]. Цао С., Бхаттачарья А., Дуррани Ф.А., Факих М. Иринотекан, оксалиплатин и ралтитрексед для лечения распространенного колоректального рака. Expert Opin Pharmacother . 2006 г., 7 (6): 687-703. [Медлайн]. Maughan TS, Adams RA, Smith CG, et al. Добавление цетуксимаба к комбинированной химиотерапии первой линии на основе оксалиплатина для лечения распространенного колоректального рака: результаты рандомизированного исследования MRC COIN фазы 3. Ланцет . 2011, 18 июня. 377 (9783): 2103-14. [Медлайн]. Douillard JY, Siena S, Cassidy J, Tabernero J, Burkes R, Barugel M и др. Рандомизированное испытание фазы III панитумумаба с инфузией фторурацила, лейковорина и оксалиплатина (FOLFOX4) по сравнению с одним только FOLFOX4 в качестве терапии первой линии у пациентов с ранее нелеченным метастатическим колоректальным раком: исследование PRIME. Дж. Клин Онкол . 2010, 1. 28 (31): 4697-705. [Медлайн]. Peeters M, Price TJ, Cervantes A, Sobrero AF, Ducreux M, Hotko Y.Рандомизированное исследование фазы III панитумумаба с фторурацилом, лейковорином и иринотеканом (FOLFIRI) по сравнению с одним только FOLFIRI в качестве лечения второй линии у пациентов с метастатическим колоректальным раком. Дж. Клин Онкол . 2010, 1. 28 (31): 4706-13. [Медлайн]. Simkens LH, Koopman M, Mol L, et al. Влияние индекса массы тела на исход у пациентов с запущенным колоректальным раком, получающих химиотерапию с таргетной терапией или без нее. евро J Cancer .2011 ноябрь 47 (17): 2560-7. [Медлайн]. Boisen MK, Johansen JS, Dehlendorff C, Larsen JS, Osterlind K, Hansen J и др. Первичная локализация опухоли и эффективность бевацизумаба у пациентов с метастатическим колоректальным раком. Энн Онкол . 17 июля 2013 г. [Medline]. Nelson R. Pembro Одобрено для использования 1-й линии при колоректальном раке MSI-H / dMMR. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/ Райан ЭДЖ, О’Салливан Д.П., Келли М.Э., Сайед А.З., Нири ПК, О’Коннелл П.Р. и др. Мета-анализ эффекта увеличения интервала после длительного курса химиолучевой терапии перед операцией при местнораспространенном раке прямой кишки. Br J Surg . 2019 июн 19, 10 (9): e0138720. [Медлайн]. Эберт М.П., Танцер М., Баллафф Б. и др. TFAP2E-DKK4 и химиорезистентность при колоректальном раке. N Engl J Med . 2012, 5 января, 366 (1): 44-53. [Медлайн]. Hendlisz A, Van den Eynde M, Peeters M, Maleux G, Lambert B, Vannoote J, et al. Испытание фазы III, сравнивающее длительную внутривенную инфузию только фторурацила или радиоэмболизацию микросфер из смолы иттрия-90 для лечения ограниченного печенью метастатического колоректального рака, резистентного к стандартной химиотерапии. Дж. Клин Онкол . 2010 10 августа. 28 (23): 3687-94. [Медлайн]. Wasan HS, et al; Исследователи испытаний FOXFIRE., Исследователи испытаний SIRFLOX., Исследователи исследования FOXFIRE-Global., Ван Хейзел Г., Шарма Р.А. Селективная внутренняя лучевая терапия первой линии плюс химиотерапия по сравнению с одной химиотерапией у пациентов с метастазами в печень от колоректального рака (FOXFIRE, SIRFLOX и FOXFIRE-Global): комбинированный анализ трех многоцентровых рандомизированных исследований фазы 3. Ланцет Онкол . 2017 Сентябрь 18 (9): 1159-1171. [Медлайн]. [Полный текст]. Santiago I, Barata M, Figueiredo N, Parés O, Henriques V, Galzerano A, et al.Признак расщепленного рубца как показатель устойчивого полного ответа на неоадъювантную терапию при раке прямой кишки. евро Радиол . 26 июля 2019 г. [Medline]. Song M, Wu K, Meyerhardt JA, Ogino S, Wang M, Fuchs CS и др. Потребление клетчатки и выживаемость после диагностики колоректального рака. JAMA Oncol . 2 ноября 2017 г. [Medline]. [Полный текст]. Давенпорт Л. Высокое потребление клетчатки связано с улучшением выживаемости при раке толстой кишки. Медицинские новости Medscape.Доступно на https://www.medscape.com/viewarticle/888006. 3 ноября 2017 г .; Дата обращения: 8 ноября 2017 г. [Рекомендации] Кахи С.Дж., Боланд С.Р., Доминиц Д.А., Джардиелло Ф.М., Джонсон Д.А., Кальтенбах Т. и др. Наблюдение за колоноскопией после резекции колоректального рака: Рекомендации Рабочей группы многих обществ США по колоректальному раку. Гастроэнтерология . 2016 Mar.150 (3): 758-768.e11. [Медлайн]. [Полный текст]. [Рекомендации] Левин Б., Либерман Д.А., МакФарланд Б. и др.Скрининг и наблюдение для раннего обнаружения колоректального рака и аденоматозных полипов, 2008 г .: совместное руководство Американского онкологического общества, Целевой группы США по колоректальному раку и Американского колледжа радиологии. CA Cancer J Clin . 2008 май-июнь. 58 (3): 130-60. [Медлайн]. [Рекомендации] Рекомендации Американского онкологического общества по скринингу колоректального рака. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/cancer/colon-rectal-cancer/detection-diagnosis-staging/acs-recommendations.html. 17 ноября 2020 г .; Дата обращения: 6 апреля 2021 г. Уилт Т.Дж., Харрис Р.П., Касим А., Целевая группа по уходу за особо важными лицами Американского колледжа врачей. Скрининг на рак: рекомендации Американского колледжа врачей по оказанию высококачественной помощи. Энн Интерн Мед. . 2015 19 мая. 162 (10): 718-25. [Медлайн]. Shaukat A, Kahi CJ, Burke CA, Rabeneck L, Sauer BG, Rex DK. Клинические рекомендации ACG: скрининг колоректального рака, 2021 г. Am J Gastroenterol .1 марта 2021 г. 116 (3): 458-479. [Медлайн]. [Полный текст]. [Рекомендации] Национальная комплексная онкологическая сеть. NCCN Clinical Practice Guidelines in Oncology: Colorectal Cancer Screening. NCCN. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/colorectal_screening.pdf. Версия 1.2021 — 25 марта 2021 г .; Дата обращения: 6 апреля 2021 г. [Рекомендации] Рубенштейн Дж. Х., Эннс Р., Хайдельбо Дж., Баркун А., Комитет по клиническим руководствам. Руководство Института Американской гастроэнтерологической ассоциации по диагностике и лечению синдрома Линча. Гастроэнтерология . 2015 сентябрь 149 (3): 777-82; викторина e16-7. [Медлайн]. [Полный текст]. [Рекомендации] Бальманья Дж., Балагер Ф., Сервантес А., Арнольд Д., Рабочая группа по рекомендациям ESMO. Семейный риск колоректального рака: Руководство по клинической практике ESMO. Энн Онкол . 2013 24 октября Дополнение 6: vi73-80. [Медлайн]. [Полный текст]. [Рекомендации] Стоффель Э.М., Мангу П.Б., Грубер С.Б., Гамильтон С.Р., Калади М.Ф., Лау М.В. и др. Синдромы наследственного колоректального рака: Американское общество клинической онкологии. Подтверждение рекомендаций по клинической практике семейного риска — колоректального рака: Руководства по клинической практике Европейского общества медицинской онкологии. Дж. Клин Онкол . 2015 10 января. 33 (2): 209-17. [Медлайн]. [Полный текст]. [Рекомендации] Syngal S, Brand RE, Church JM, Giardiello FM, Hampel HL, Burt RW и др. Клинические рекомендации ACG: Генетическое тестирование и лечение наследственных синдромов рака желудочно-кишечного тракта. Ам Дж. Гастроэнтерол . 2015 февраль 110 (2): 223-62; викторина 263. [Medline]. [Полный текст]. Umar A, Boland CR, Terdiman JP, et al. Пересмотренные рекомендации Bethesda по наследственному неполипозному колоректальному раку (синдром Линча) и микросателлитной нестабильности. Национальный институт рака . 2004 18 февраля. 96 (4): 261-8. [Медлайн]. [Руководство] Гупта С., Либерман Д., Андерсон Дж. К., Берк Калифорния, Доминиц Дж. А., Кальтенбах Т. и др. Рекомендации по наблюдению после колоноскопии и полипэктомии: обновленный консенсус Целевой группы США по колоректальному раку. Гастроэнтерология . 2020 Март 158 (4): 1131-1153.e5. [Медлайн]. [Рекомендации] Раттер, М.Д., Ист Дж., Рис К.Дж., Криппс Н., Дочерти Дж., Долвани С. и др.Британское общество гастроэнтерологов / Ассоциация колопроктологов Великобритании и Ирландии / Управление общественного здравоохранения Англии после полипэктомии и постколоректальной резекции рака. Кишечник . 2020 Февраль 69 (2): 201-223. [Медлайн]. [Полный текст]. [Рекомендации] Черч Дж., Симманг К., Целевая группа по стандартам, Американское общество хирургов толстой и прямой кишки, Совместная группа Америк по наследственному колоректальному раку и Комитет по стандартам Американского общества хирургов толстой и прямой кишки.Параметры практики лечения пациентов с доминантно наследственным колоректальным раком (семейный аденоматозный полипоз и наследственный неполипозный колоректальный рак). Диск прямой кишки . 2003 августа 46 (8): 1001-12. [Медлайн]. [Рекомендации] Монсон Дж. Р., Вейзер М. Р., Буйе В. Д., Чанг Дж. Дж., Рафферти Дж. Ф., Буйе В. Д. и др. Параметры практики лечения рака прямой кишки (пересмотренная). Диск прямой кишки . 2013 май. 56 (5): 535-50. [Медлайн]. [Рекомендации] Глинн-Джонс Р., Вирвиц Л., Тирет Е., Браун Г., Рёдель С., Сервантес А. и др.Рак прямой кишки: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2018 г., 1. 29 (Приложение_4): iv263. [Медлайн]. [Полный текст]. [Рекомендации] Meyerhardt JA, Mangu PB, Flynn PJ, Korde L, Loprinzi CL, Minsky BD, et al. Последующее наблюдение, протокол наблюдения и меры вторичной профилактики для переживших колоректальный рак: одобрение руководства по клинической практике Американского общества клинической онкологии. Дж. Клин Онкол .2013 декабрь 10. 31 (35): 4465-70. [Медлайн]. [Рекомендации] Лабианка Р., Нордлингер Б., Беретта Г.Д., Москони С., Мандала М., Сервантес А. и др. Ранний рак толстой кишки: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2013 24 октября Дополнение 6: vi64-72. [Медлайн]. [Рекомендации] Стил С.Р., Чанг Г.Дж., Хендрен С., Вейзер М., Ирани Дж., Буйе В.Д. и др. Практическое руководство по наблюдению за пациентами после лечения рака прямой и толстой кишки. Диск прямой кишки . 2015 Август 58 (8): 713-25. [Медлайн]. [Полный текст]. [Рекомендации] Аллегра С.Дж., Рамбл Р.Б., Гамильтон С.Р., Мангу П.Б., Роуч Н., Хантел А. и др. Расширенное тестирование мутации генов RAS при метастатической колоректальной карциноме для прогнозирования ответа на терапию моноклональными антителами рецептора против эпидермального фактора роста: Обновление предварительного клинического заключения Американского общества клинической онкологии, 2015 г. J Clin Oncol . 2016 10 января. 34 (2): 179-85. [Медлайн].[Полный текст]. [Рекомендации] Ван Катсем Э., Сервантес А., Адам Р. и др. Консенсусное руководство ESMO по ведению пациентов с метастатическим колоректальным раком. Энн Онкол . 2016 27 августа (8): 1386-422. [Медлайн]. [Полный текст]. Вопросы, которые следует задать перед операцией при раке прямой кишки 7 вопросов, которые следует задать перед операцией при раке прямой кишки В Memorial Sloan Kettering хирургия является наиболее распространенным методом лечения многих стадий рака прямой кишки.Если вам или близкому вам человеку был поставлен диагноз рака прямой кишки, мы хотим помочь вам понять возможные варианты хирургического вмешательства, чтобы у вас был наилучший результат. Эта информация может помочь вам подготовиться к решениям, которые вы и ваши врачи примете вместе. Как и в случае со многими видами рака, раннее выявление имеет решающее значение. Сама по себе операция часто может быть единственным необходимым лечением небольших опухолей, которые не распространились через стенку прямой кишки. Иногда опухоль можно удалить через задний проход, не удаляя всю прямую кишку.Другим людям потребуется удалить большую часть прямой кишки или всю ее. Рак, распространившийся через стенку прямой кишки или близлежащие лимфатические узлы, обычно требует химиотерапии и лучевой терапии в дополнение к хирургическому вмешательству. Хирургия рака прямой кишки имеет некоторые проблемы. Например, таз состоит из множества узких частей, что затрудняет оперирование этой области. Эта область также содержит нервы, которые контролируют вашу способность пользоваться ванной, а также нервы, влияющие на ваше сексуальное здоровье.Ваш хирург MSK примет все меры предосторожности, чтобы защитить эти нервы. Некоторые виды рака прямой кишки могут вернуться после операции. Поскольку оперировать в области малого таза сложнее, химиотерапию и лучевую терапию можно использовать для уменьшения опухолей прямой кишки перед операцией, особенно больших опухолей. Такой подход называется неоадъювантной терапией. Если вы являетесь кандидатом на эту терапию, ваша медицинская бригада будет работать с вами, чтобы определить, какая комбинация подходит вам. В центре MSK неоадъювантная терапия является стандартной рекомендацией при запущенном раке прямой кишки, который не распространился, или при опухоли около заднего прохода. Если у вас запущенный рак, который распространился на лимфатические узлы, комбинация химиотерапии и лучевой терапии перед операцией может убить микроскопические разрастания раковых клеток, прежде чем они станут больше. Это может снизить риск рецидива рака. Неоадъювантная терапия с последующим хирургическим вмешательством и химиотерапией дает людям с раком прямой кишки, не распространившим общий показатель излечения более чем на 70 процентов.Рак прямой кишки возвращается менее чем у 10 процентов людей, прошедших такую последовательность лечения. Вот несколько вопросов, которые вы можете задать своему хирургу. MSK постоянно разрабатывают новые, более эффективные методы, чтобы защитить возможность нормально пользоваться туалетом у людей, перенесших операцию по поводу рака прямой кишки. Например, в прошлом многим людям требовалась постоянная колостома. Это хирургическая процедура, при которой удаляется прямая кишка и выводится один конец толстой кишки через брюшную стенку.Людям с постоянной колостомой устанавливают мешочную систему для стомы. Это обычно называется мешком для колостомы. Мешок собирает отходы из кишечника. Люди с постоянной колостомой используют мешок для сбора мусора до конца своей жизни. В центре MSK подавляющее большинство людей с раком прямой кишки теперь могут избежать постоянной колостомы благодаря прогрессу в хирургических методах. Некоторым людям действительно нужна временная стома. После короткого периода заживления хирург может восстановить кишечник, чтобы можно было вернуться к обычным привычкам в ванной. Наши колоректальные хирурги используют передовые хирургические процедуры, в том числе: В малоинвазивной хирургии врачи могут использовать меньшие разрезы (разрезы), чем при традиционной хирургии. Эти методы могут помочь минимизировать повреждение близлежащих органов и тканей. Люди, перенесшие малоинвазивную операцию, имеют более низкий риск заражения и меньшую кровопотерю.Часто они быстрее восстанавливаются. В MSK мы используем следующие малоинвазивные методы: Исследования показывают, что хирурги в центрах, где проводится большое количество процедур, дают наилучшие результаты для своих пациентов. Хирурги MSK — одни из самых опытных в мире по удалению рака прямой кишки. MSK признан во всем мире лидером в области лечения рака прямой кишки. Каждый год мы лечим более 1200 человек с раком прямой и толстой кишки, восстанавливая здоровье людей после всех видов рака прямой кишки, включая самые редкие.Мы разработаем лечение специально для вас. Многие из самых передовых методов, разработанных недавно, были впервые изучены и использованы командой MSK по лечению колоректального рака. Люди, о которых мы заботимся, имеют доступ к клиническим испытаниям с новыми вариантами лечения, которые могут быть недоступны в других больницах. Мы считаем, что вам следует выбрать MSK, потому что мы предлагаем: Наши специалисты обеспечат комплексное последующее наблюдение, чтобы помочь вам жить хорошо после лечения рака прямой кишки.В наш сервис входит: Выживаемость при раке прямой кишки была связана в основном с клинической и патологической стадией. Рецидив является наиболее сложной проблемой при хирургическом лечении рака прямой кишки. Это исследование направлено на установление модели рецидивов аденокарциномы прямой кишки, подвергшейся хирургическому лечению в период с марта 2003 г. по июль 2016 г. После применения критериев исключения было проанализировано 122 пациента.Глобальный рецидив был обнаружен у 22% из них, а у 13,1% был местный рецидив. Выживаемость без заболевания составила в среднем 23,9 месяца, а средний период наблюдения — 34,13 месяца, варьируя от 6 до 115 месяцев. Рецидив в литературе обычно составляет от 3 до 35% за 5 лет, а 5-летняя выживаемость составляет всего 5%. Примерно в 50% случаев рецидив бывает локальным, ограниченным тазом. Эти данные соответствуют литературным данным по большинству изученных аспектов, хотя обнаружение высокой частоты местных рецидивов остается проблемой при поиске лучших результатов хирургического вмешательства. A sobrevida de pacientes com câncer retal tem sido relacionada, sobretudo, aos estadiamentos clínico e patológico. De longe a recorrência é o проблема mais desafiador, no que Concerne ao tratamento cirúrgico do câncer retal. Esse estudo pretende created um padrão de recorrência para pacientes com adenocarcinoma retal submetidos a tratamento cirúrgico entre março de 2003 e julho de 2016. Após a aplicação dos critérios de exclusão, foram analisados 122 pacientes.Recorrência global foi constatada em 22% dos pacientes, enquanto que 13,1% tiveram recorrência localizada. Média para sobrevida livre de doença foi de 23,9 meses, e o acompanhamento médio foi de 34,13 meses, com variação entre 6-115 meses. Na literatura, em geral a recorrência se situa entre 3-35% após 5 anos, com um percentual de sobrevida após 5 anos de apenas 5%. Em cerca de 50% dos casos a recorrência é localizada, ficando confinada à pelve. Os presentes dados acompanharam os achados da literatura na maioria dos aspectos avaliados, embora o achado de elevado процентная запись локализада permaneça ainda ум аспекто desafiador na busca de desfechos cirúrgicos maisisfatórios. Рецидив Рак прямой кишки Хирургия Recorrência Câncer retal Cirurgia Рекомендуемые статьи Опубликовано Elsevier Editora Ltda. Если у вас рак толстой кишки, ваша лечащая бригада будет включать медицинских онкологов, хирургов и онкологов-радиологов.Эти специалисты будут работать вместе, чтобы разработать лучший план лечения для вашего состояния. Лечение рака толстой кишки будет зависеть от того, насколько рано рак обнаружен. Иногда ваш врач может удалить полипы во время колоноскопии, и дальнейшее лечение не требуется. В других случаях вам может потребоваться операция и / или химиотерапия. Определение стадии (степени) заболевания — важный шаг в разработке наилучшей и наиболее эффективной схемы лечения.Этап поможет определить, когда и как используются различные методы лечения. По данным Американского общества клинической онкологии, примерно у 39 процентов пациентов с раком толстой кишки имеется локализованное заболевание. Наиболее распространенным методом лечения рака толстой кишки на ранней стадии является хирургическое вмешательство. Некоторые пациенты с ранней стадией заболевания также могут получать химиотерапию после операции. Для пациентов с локализованным раком толстой кишки пятилетняя выживаемость составляет 90 процентов. Когда рак толстой кишки метастазирует (распространяется), он обычно появляется в печени.Он также может распространяться на легкие, мозг, брюшину (слизистую оболочку брюшной полости) и / или отдаленные лимфатические узлы. Для пациентов с этим типом болезни на поздней стадии пятилетняя выживаемость составляет 14 процентов. (Пациенты, у которых рак толстой кишки распространился на окружающие ткани или органы и / или региональные лимфатические узлы, имеют пятилетнюю выживаемость около 71 процента.) Если рак толстой кишки распространился на близлежащие лимфатические узлы, но не на другие части тела , может использоваться операция с последующей химиотерапией.Когда болезнь распространилась на отдаленные участки, химиотерапия может использоваться в качестве основного лечения, особенно если хирургическое вмешательство вряд ли приведет к излечению рака. Если болезнь распространилась в виде небольшого количества отдаленных опухолей, можно использовать хирургическое вмешательство, чтобы помочь вылечить болезнь или продлить жизнь пациента. Другие варианты лечения поздних стадий рака желудочно-кишечного тракта могут включать циторедуктивную операцию (удаление опухоли) и гипертермическую внутрибрюшинную химиотерапию (HIPEC). Эти процедуры оказались эффективным вариантом лечения некоторых злокачественных новообразований на поверхности брюшины и других видов рака желудочно-кишечного тракта. В настоящее время разрабатываются инновационные методы лечения, чтобы дать пациентам с запущенной стадией заболевания больше возможностей. Некоторые пациенты могут участвовать в клинических испытаниях, чтобы попробовать эти новые методы лечения. Ваш конкретный курс лечения будет зависеть от точного местоположения рака и того, как рано он был обнаружен. Лечение рака толстой кишки включает: Часто полипы безопасно удаляются во время колоноскопии. Некоторые очень большие полипы могут быть удалены без хирургического вмешательства специально обученными гастроэнтерологами, известными как терапевты-эндоскописты.Если полипы были большими, ваш врач мог пометить место полипэктомии (удаления полипа) специальными чернилами во время колоноскопии. Маркировка области может помочь при последующих колоноскопических исследованиях. В целом пациенты с небольшими полипами не имеют повышенного риска развития рака толстой кишки и должны регулярно проходить скрининг. Пациентам с более крупными полипами или более чем тремя полипами контрольные колоноскопии следует проводить чаще. Проконсультируйтесь с врачом по поводу рекомендованного графика обследований.. Лучшим методом лечения рака толстой кишки является хирургическая резекция, которая включает удаление рака хирургическим путем. Операция проводится для полного удаления рака и восстановления кишечника, если это возможно, чтобы ваша послеоперационная функция кишечника была нормальной или почти нормальной. Ваша конкретная стратегия резекции толстой кишки будет зависеть от многих факторов, включая следующие: Местоположение опухоли Наличие других видов рака или полипов Стадия рака Риск развития рака толстой кишки в будущем Ваши предпочтения Во время резекции хирург удаляет ту часть толстой кишки, которая содержит опухоль, а также небольшую часть окружающих нормальная ткань.Хирург также может удалить лимфатические узлы и проверить их на рак. Если рак полностью удален во время операции и подтверждена ранняя стадия заболевания, дальнейшее лечение не требуется. Если раковые клетки обнаруживаются в окружающих тканях или лимфатических узлах, ваш врач может порекомендовать адъювантную (что означает «в дополнение к») химиотерапию. После операции по поводу рака толстой кишки бдительный мониторинг является важной частью последующего наблюдения. Существует риск рецидива, особенно если рак поражает лимфатические узлы.После операции ваш врач будет посещать вас в следующее время: С интервалом от трех до шести месяцев в течение трех лет После этого каждые шесть-12 месяцев в течение пяти лет Колоноскопии проводятся тоже важно. Через год после операции по поводу рака толстой кишки вам сделают колоноскопию. Затем каждые один-три года после первой контрольной колоноскопии вам будет проводиться колоноскопия, чтобы проверить наличие новых полипов или рака. Регулярное обследование, медицинский осмотр и анализы крови важны для вашего послеоперационного обследования и являются наилучшими способами отслеживания рецидивов заболевания. Химиотерапевтические препараты проходят через кровоток, чтобы разрушить опухолевые клетки, которые могли оторваться от исходной опухоли и снова начать расти в других частях тела. Их можно вводить перорально или внутривенно. Химиотерапия может применяться на различных стадиях лечения рака толстой кишки. Иногда перед операцией проводят химиотерапию, чтобы уменьшить опухоль и уменьшить объем операции. Это называется неоадъювантной терапией. При более запущенных формах рака вам может потребоваться курс химиотерапии после операции.Этот тип химиотерапии обычно проводится в амбулаторных условиях. Химиолучевая терапия (химиотерапия в сочетании с лучевой терапией) также может применяться после операции. Для некоторых пациентов химиотерапия может сделать облучение более эффективным при лечении рака толстой кишки. (Лучевая терапия обычно не используется для лечения рака толстой кишки.) [[Colon_cancer_pages]] Несмотря на радикальное хирургическое вмешательство, у 33% пациентов с раком прямой кишки разовьется локорегиональный рецидив.Ведение таких пациентов особенно сложно. Хирургия — это основа лечения пациентов с мобильным рецидивом. Однако у большинства пациентов развиваются рецидивы с поражением тазовой стенки. Сообщалось, что у этих пациентов комбинированная терапия, включая радикальное хирургическое вмешательство и интраоперационную лучевую терапию, обеспечила 5-летнюю выживаемость до 31% и частоту местного контроля 50–71%. Наиболее важным фактором для получения длительного местного контроля и выживаемости является резекция R0. Расширенная операция, такая как абдоминально-крестцовая резекция, не пользуется популярностью из-за 5-летней выживаемости 16–31% и значительной послеоперационной заболеваемости.Повторный рецидив после операции возникает локально и в легких и остается серьезной проблемой. При хирургическом лечении местного рецидива решающее значение имеют факторы, связанные с хирургом. Следует разработать систему стадирования с использованием степени фиксации и других прогностических факторов, чтобы в каждом случае применялись соответствующие методы лечения. У 4–33% пациентов, перенесших радикальное хирургическое вмешательство по поводу рака прямой кишки, развивается локорегиональный рецидив. Без лечения эти пациенты с местно-рецидивирующим раком прямой кишки (LRRC) имеют медианную выживаемость ~ 8 месяцев.Если лечение не проводится, они страдают от серьезных симптомов, особенно от боли, и качество их жизни (КЖ) становится крайне низким (1–4). Почти половина LRRC расположена в тазу без отдаленных метастазов. Лучшее лечение LRRC в этих условиях — полная резекция рецидивирующей опухоли. Есть несколько различных вариантов лечения LRRC. Эти варианты зависят от характера LRRC, который может проявляться как мобильный рецидив или огромная масса, занимающая таз. При нефиксированных рецидивных опухолях полная резекция может быть достигнута с помощью ограниченного хирургического вмешательства, такого как абдоминально-перинеальная резекция, и результаты относительно благоприятны. Когда LRRC растет в узком тазу, он может легко проникнуть в стенку таза, проявляясь в виде фиксированной рецидивирующей опухоли (FRT). Если FRT затрагивает только передние структуры, полное расширение таза достигает адекватных границ. Однако у большинства пациентов с LRRC имеется дорсальное и / или дорсолатеральное поражение таза.Эти пациенты представляют собой особую проблему. Может потребоваться обширное хирургическое вмешательство, такое как абдоминально-крестцовая резекция. Однако несоответствующее хирургическое вмешательство у этих пациентов может вызвать распространение ятрогенного рака, что приведет к ухудшению качества жизни. У пациентов с LRRC, которые не подходят для хирургического вмешательства, химиорадация является основным доступным терапевтическим методом. Эффект лучевой терапии зависит от размера опухоли и полученной общей дозы облучения.Доза 45 Гр обеспечивает хорошее облегчение боли у 50–80% пациентов (5) с низким риском токсичности для тонкой кишки. Однако при этой дозе нельзя ожидать противоопухолевого эффекта, который может привести к полному ответу или увеличению выживаемости. Другой подход — введение дозы 50 Гр в то же поле излучения, которое используется для лечения первичного рака прямой кишки. Затем поле излучения уменьшается, чтобы охватить только место рецидива опухоли, и к этому месту доставляется общая доза 60–70 Гр.Однако только внешняя лучевая лучевая терапия (ДЛТ) не показала значительного улучшения выживаемости. По этой причине обычно используется комбинация лучевой терапии и химиотерапии. Обоснование комбинированной терапии включает (i) усиление цитотоксичности с помощью противоопухолевого агента и облучения, (ii) использование химиотерапии, которая обеспечивает лечение отдаленных метастазов в дополнение к локальному контролю опухоли, обеспечиваемому лучевой терапией, и (iii) потенциальная возможность для снижения дозировки агентов и, следовательно, их токсичности путем сочетания различных методов лечения без снижения общей эффективности (6,7). ДЛТ, применяемая отдельно или в сочетании с химиотерапией, обеспечивает временное улучшение симптомов у большинства пациентов. Среднее время выживания составляет 14 месяцев, а время местного контроля — 5 месяцев. Пятилетняя выживаемость у этих пациентов обычно составляет <5% (8). Предоперационная химиолучевая терапия используется при первичном раке прямой кишки для снижения стадии опухоли и улучшения резектабельности. Тот же подход использовался и для LRRC. Rodel et al. (9) проводили химиолучевую терапию перед операцией 35 пациентам с LLRC с использованием 5-FU (1000 мг / м 2 / день).Они сообщили, что добились резекций без края в 17 случаях (61%). Ожидается, что другие химиотерапевтические агенты, такие как СРТ-11 и оксалиплатин, будут играть важную роль в ведении этих пациентов в будущем (10). Отчеты некоторых западных центров показывают, что улучшенный местный контроль и выживаемость могут быть достигнуты у отдельных пациентов с помощью предоперационной химиолучевой терапии, радикальной хирургии и интраоперационной лучевой терапии (ИОЛТ) (11–22).Этот подход признает, что удовлетворительный противоопухолевый эффект не может быть достигнут только с помощью химиолучевой терапии. Добавление ИОЛТ означает, что максимально возможная доза облучения может быть доставлена рецидивной опухоли. Это может позволить провести менее обширную операцию. Одним из преимуществ ИОЛТ является то, что он дает в три раза больший биологический эффект, чем фракционированный EBRT. Кроме того, ИОЛТ имеет то преимущество, что излучение точно доставляется в ложе опухоли, смещая соседние нормальные структуры из поля облучения.Использование ИОЛТ позволяет снизить дозу ДЛТ и, таким образом, снижает токсичность этого метода. Исследователи клиники Мэйо сообщили о 3-летней выживаемости 39% и 5-летней выживаемости 20% у 123 пациентов с LRRC, которые лечились с помощью ИОЛТ и хирургического вмешательства (14). Mannaerts et al. (16,18) в Нидерландах использовали предоперационную дозу лучевой терапии 50,4 Гр (30 Гр для пациентов, получавших ратиотерапию) перед операцией, во время которой они выполняли ИОЛТ. Доза ИОЛТ определялась R-статусом резекции.Пациенты, перенесшие резекцию R0 (микроскопически отрицательные края), получали дозу 10 Гр, резекции R1 (микроскопически положительные поля) — дозу 15 Гр и случаи R2 (макроскопически положительные поля) — дозу 17,5 Гр. Общая 3-летняя выживаемость составила 58%. Однако пациенты, перенесшие резекцию R2, показали худший прогноз в этой серии. Wiig et al. (19) сообщили о 5-летней выживаемости 60% у пациентов, получавших дооперационное облучение и имевших резекцию R0.Это поднимает вопрос о том, действительно ли IORT требуется в случаях с предыдущей резекцией R0, особенно потому, что не все случаи R0 в этой серии получали IORT. Можно утверждать, что истинная резекция R0 не оставляет раковых клеток, которые необходимо уничтожить с помощью ИОЛТ. Однако в клинической практике, поскольку не всегда легко отличить фиброз от рецидивирующего рака, у некоторых пациентов, перенесших резекцию R0, может быть остаточное заболевание, и ИОЛТ может помочь (20,21). Abuchaibe et al. (12) и Bussieres et al.(15) сообщили о пациентах с резекцией R2, которым проводилась ИОЛТ, но не выполнялась послеоперационная ДЛТ. Эта стратегия привела к плохому результату и предполагает, что дополнительный EBRT важен для достижения местного контроля. Облучения пациентов, которые ранее получали лучевую терапию, обычно избегают из-за опасения серьезной поздней лучевой токсичности. Mohiuddin et al. (2,23) сообщили о 103 случаях, которые получили повторное облучение и показали приемлемую позднюю токсичность (17% с хронической тяжелой диареей, 15% с непроходимостью тонкой кишки и 4% с фистулой). Несмотря на использование мультимодальной терапии, 5-летняя выживаемость пациентов с LRRC остается 22–31%, а частота местного контроля — 50–71% (Таблица 1). Нельзя ожидать, что ИОЛТ компенсирует резекцию R2 (13), и сама по себе связана с потенциальными осложнениями. Наиболее частыми побочными эффектами являются стеноз мочеточника и периферическая невропатия. В серии из 123 случаев, проведенных в клинике Mayo (14), частичный стеноз мочеточника как осложнение возник у 6% пациентов, при этом 10% потребовали установки мочеточникового стента.Периферическая нейропатия наблюдалась у 16–34% пациентов. Результат после комбинированной терапии Результат после комбинированной терапии Брахитерапия использует гамма-лучи или бета-лучи, излучаемые герметичным закрытым радиоактивным источником для проведения интерстициального облучения.В последнее время из-за опасений по поводу воздействия радиации на хирурга и изоляции пациентов все чаще используются системы удаленной постнагрузки с высокой мощностью дозы (24,25). Goes et al. (24) сообщили об использовании трубок для последующей нагрузки, вводимых во время операции после операции по уменьшению опухоли, для проведения брахитерапии у 30 ранее облученных пациентов. У этих пациентов с LRRC местный контроль был достигнут в 18 случаях (64%) со средним периодом наблюдения 36 месяцев. Преимущество брахитерапии заключается в том, что она сводит к минимуму количество излучения, которому подвергаются окружающие ткани, и, следовательно, это полезный метод для ранее облученных пациентов.Однако точное размещение зондов для постнагрузки может быть затруднено, поскольку рецидивирующее поражение окружено рубцовой тканью и находится глубоко внутри таза. Альтернативные методы точного размещения трубок включают чрескожное введение под контролем КТ, но это связано с риском повреждения тонкой кишки и образования свищей, если трубка повреждает часть тонкой кишки, лежащую внутри таза. Следовательно, брахитерапия еще не стала стандартной терапией для LRRC. Очевидно, что для достижения долгосрочного местного контроля и повышения выживаемости у пациентов с LRRC необходимо выполнить резекцию R0.Это особая проблема, когда пациенты имеют FRT с дорсальным и / или дорсолатеральным поражением. В 1981 году Ванебо представил технику абдоминально-крестцовой резекции, которую переняли другие хирурги (26–39). Расширенная хирургия FRT не стала популярной из-за того, что 5-летняя выживаемость составляет 16–31% (Таблица 2). Bozzetti et al. (34) указали на ограничения хирургического лечения, а Wiggers et al. (33) показали критическое отношение к расширенной хирургии. В 1999 году Ванебо и др.(36) проанализировали результаты расширенной операции у 53 пациентов. Операционная летальность составила 8%, средняя кровопотеря — более 8000 мл, а средняя продолжительность операции — ~ 20 часов. Все пациенты ранее были облучены. Общая 5-летняя выживаемость составила 31%, а 5-летняя выживаемость без признаков заболевания — 23%. Высокая ампутация крестца была выполнена в 32 случаях (60%) по поводу рецидивов таза, распространяющихся до мыса крестца или седалищной вырезки. Во всех случаях были сохранены внутренние подвздошные сосуды и выполнена лимфодиссекция в тазу.Метастазирование в боковые лимфоузлы наблюдалось только в одном случае (1,8%), что является удивительно низкой частотой. Остается неясным, произошло ли это из-за воздействия радиации или из-за метода, использованного для поиска метастазов. Вряд ли можно утверждать, что расширенная операция приемлема как с точки зрения хирургической инвазивности, так и с точки зрения онкологических исходов, и, следовательно, эта терапия позиционируется как сложное и сложное лечение. Результат после комбинированной резекции Результат после комбинированной резекции В 2004 году мы сообщили об исходе лечения тотального экзентерации таза с помощью дистальной сакрэктомии (TPES) у 57 пациентов с FRT (39).Операционная летальность составила 3,5%, медиана кровопотери и время операции — 2500 мл и 682 мин соответственно. Эти результаты отличаются от результатов, сообщенных Wanebo et al. (36). Мы проанализировали факторы, которые могут быть причиной этой разницы. Наши пациенты с первичным раком прямой кишки подвергаются полному мезоректальному иссечению или более обширной операции, тогда как в США обычно выполнялись менее обширные операции. Все пациенты Ванебо прошли предоперационную лучевую терапию, в результате которой развился фиброз таза.Однако у наших пациентов послеоперационное рубцевание после обширной первичной резекции приводит к более техническим трудностям при удалении рецидива заболевания. Кроме того, половине наших пациентов была проведена предоперационная лучевая терапия. Мы пришли к выводу, что в целом разница в результатах не связана с объемом первоначальной операции, которую перенес пациент, или с тем, была ли лучевая терапия проведена до операции. Основное различие между двумя сериями — это степень резекции крестца. В отличие от Wanebo, мы ограничили уровень крестцовой ампутации нижним краем второго крестцового позвонка или ниже, чтобы сохранить вторые крестцовые нервы.Высокая крестцовая ампутация связана с более тяжелыми осложнениями, включая затруднения с подвижностью и значительное ухудшение качества жизни. После менее обширной крестцовой ампутации пациенты достигли приемлемого качества жизни, за исключением жизни с двойной стомой и временной болью из-за резекции крестцовых нервов (39,40). Для наших пациентов выживаемость составила 61% через 3 года и 46% через 5 лет. Несмотря на эти улучшенные результаты по сравнению с серией Ванебо, местный рецидив и метастазы в легкие встречаются у более чем 90% пациентов. Меры по предотвращению дальнейших местных рецидивов и метастазов остаются проблемой при ведении таких пациентов. Мы пришли к выводу, что хирургическое лечение, включая резекцию тазовой стенки и ИОЛТ, является оптимальным методом для улучшения показателей местного контроля у пациентов с LRRC. Новые противоопухолевые агенты, такие как CPT-11, UFT, капецитабин и оксалиплатин, показали эффективность при лечении рака прямой кишки и будут играть все более важную роль у пациентов с метастатическим заболеванием. Факторы, предсказывающие успех операции по поводу LRRC, остаются спорными.Некоторые параметры, такие как тип первичной операции, размер опухоли, наличие тяжелых симптомов и уровень СЕА в сыворотке до повторной резекции, были оценены как потенциальные прогностические индикаторы (41). Willet и Wanebo обнаружили улучшенную резектабельность у пациентов с начальной низкой передней резекцией по сравнению с первоначальной APR (11,31). Напротив, мы не обнаружили разницы ни в резектабельности, ни в выживаемости у пациентов, у которых развилась FRT (39). Среди других факторов, отрицательная резекция CEA и R0 были связаны с лучшим прогнозом.Shoup et al. (42) сообщили, что сосудистая инвазия и резекция R1 / R2 являются факторами плохого прогноза. В обоих отчетах подчеркивается, что наиболее важным прогностическим фактором является то, была ли выполнена резекция R0. Уже было показано, что при хирургическом лечении первичного рака прямой кишки решающее значение имеют факторы, связанные с хирургом, а также биологические факторы. Состояние хирургической границы и осложнения определяются исключительно техническими навыками хирурга (43). Сложные операции, такие как TPES или абдоминально-крестцовая резекция, должны проводиться только в специализированных центрах, которые обладают особым опытом в таких сложных операциях. Не существует установленного метода определения стадии для пациентов с LRRC. Судзуки и др. (44,45) оценили степень фиксации опухоли к окружающим структурам в соответствии с хирургическими и патологическими данными и предложили свой собственный метод стадирования. Valentini et al. (17) также сообщили об аналогичной системе стадирования, основанной на компьютерной томографии. Они отметили, что степень фиксации является независимым прогностическим фактором. Wanebo et al. (36) предложили новую систему стадий для стадий TR1-2 – TR-5, которые определяются степенью инвазии. Очень важно разработать систему стадирования для этих сложных пациентов, чтобы обеспечить проведение соответствующей терапии. Ведение пациентов с LRRC представляет собой серьезную проблему. Потенциально существует большое количество доступных терапевтических вариантов. Хирургическое вмешательство остается оптимальным лечением местного рецидива, если оно может быть достигнуто с приемлемым качеством жизни. Роль химиотерапии и лучевой терапии еще предстоит выяснить.ИОЛТ может улучшить местный контроль заболевания у пациентов, у которых может быть достигнута резекция R0 или R1. Гундерсон Л.Л., Сосин Х. Зона поражения, обнаруженная при повторной операции после «лечебной операции» по поводу аденокарциномы прямой кишки. Рак 1974 34 1278 McDermott FT, Hughes ES, Pihl E, Johnson WR, Price AB. Местный рецидив после потенциально излечивающей резекции рака прямой кишки у 1008 пациентов. Br J Surg 1985 72 34 McCall JL, Cox MR, Wattchow DA. Анализ частоты местных рецидивов рака прямой кишки только после операции. Int J Colorectal Dis 1995 10 126 Pilipshen SJ, Heilweil M, Quan SH, Sternberg SS, Enker WE. Особенности рецидивов тазовых органов после окончательной резекции рака прямой кишки. Рак 1984 53 1354 Пачини П., Чионини Л., Пиртоли, Пиртоли Л., Чиатто С., Туччи Е. и др. Симптоматические рецидивы рака прямой и сигмовидной кишки. Влияние лучевой терапии на качество жизни. Dis Colon Rectum 1986 29 865 О’Коннелл MJ, Детский DS, Moertel CG, Holbrook MA, Schutt AJ, Rubin J, et al. Проспективная контролируемая оценка комбинированной лучевой терапии органов малого таза и экстракции метанолом остатков БЦЖ (MER) при локально неоперабельном или рецидивирующем раке прямой кишки. Int J Radiat Oncol Biol Phys 1982 8 1115 О’Коннелл MJ, Мартенсон JA, Wieand HS, Macdonald JS, Haller DG, Gunderson LL, et al. Улучшение адъювантной терапии рака прямой кишки путем сочетания длительной инфузии 5-ФУ с лучевой терапией после радикальной хирургии. N Engl J Med 1994 331 502 Wong CS, Cumming BJ, Brierly JD, Catton CN, McLean M, Catton P и др.Результаты лечения местно-рецидивирующей карциномы прямой кишки и факторы прогноза. Int J Radiat Oncol Bio Phys 1998 40 427 Родель С., Грабенбауэр Г.Г., Мацель К., Шик С., Фиткау Р., Пападопулос Т. и др. Обширное хирургическое вмешательство после предоперационной химиолучевой терапии в высоких дозах при местнораспространенном рецидивирующем раке прямой кишки. Dis Colon Rectum 2000 43 312 Рич Т.А., Кириченко А.В.График приема камптотецина и время приема с облучением. Онкология 2001 15 37 Willett CG, Shellito PC, Tepper JE, Eliseo R, Convery K, деревянный туалет. Интраоперационная лучевая терапия электронным пучком при рецидивирующей местно-распространенной карциноме прямой или прямой кишки. Рак 1991 67 1504 Abuchaibe O, Calvo FA, Azinovic I, Aristu J, Pardo F, Alvarez-Cienfuegos J.Интраоперационная лучевая терапия при местнораспространенном рецидивирующем колоректальном раке. Int J Radiat Oncol Biol Phys 1993 26 859 Уоллес Х.Дж., Виллет К.Г., Шеллито П.С., Коэн Дж.Дж., Гувер Х.С. Интраоперационная лучевая терапия при местнораспространенном раке прямой или прямой кишки. J Surg Oncol 1995 60 122 Гандерсон Л.Л., Нельсон Х., Мартенсон Дж. А., Ча С., Хэддок М., Девайн Р., Фик Дж. М. и др.Интраоперационное электронное и внешнее лучевое облучение с 5-фторурацилом или без него и максимальная хирургическая резекция ранее необлученного, местно-рецидивирующего колоректального рака. Dis Colon Rectum 1996 39 1379 Bussieres E, Gilly FN, Rouanet P, Mahe MA, Roussel A, Delannes M, et al. Рецидивы рака прямой кишки: результаты мультимодального подхода с интраоперационной лучевой терапией. Французская группа интраоперационной лучевой терапии. Int J Radiat Oncol Biol Phys 1996 34 49 Mannaerts GHH, Martijn H, Crommelin MA, Stultiens GNM, Dries W., Repelaer van Driel и др. Интраоперационная электронно-лучевая терапия при местно-рецидивирующем раке прямой кишки. Int J Radiat Oncol Biol Phys 1999 45 297 Валентини В., Морганти А., Де Франко А., Коко С., Ратто С., Доглитто Г.Б. и др. Химиолучевая терапия с интраоперационной лучевой терапией или без нее у пациентов с местно рецидивирующей карциномой прямой кишки. 1999 86 2612 Mannaerts GHH, Rutten HJT, Martijn H, Groen GJ, Hanssens PEJ, Wiggers T. Абдоминально-крестцовая резекция при первичном нерезектабельном и местно-рецидивирующем раке прямой кишки. Dis Colon Rectum 2001 44 806 Wiig JN, Poulsen JP, Larsen S, Braendengen M, Waehre H, Giercksky KE. Тотальная экзентерация таза с предоперационным облучением при распространенном первичном и рецидивирующем раке прямой кишки. евро J Surg 2002 168 42 Hahnloser D, Haddock MG, Nelson H. Интраоперационная лучевая терапия в мультимодальном подходе к колоректальному раку. Surg Oncol Clin N Am 2003 12 993 Hahnloser D, Nelson H, Gunderson LL, Hassan I, Haddock MG, O’Connell MJ, et al. Лечебный потенциал комплексной терапии местно-рецидивирующего рака прямой кишки. Ann Surg 2003 237 502 Mohuiddin M, Lingareddy V, Rakinic J, Marks G. Повторное облучение рака прямой кишки и хирургическая резекция после сверхвысоких доз. Int J Radiat Oncol Biol Phys 1993 27 1159 Mohuiddin M, Marks G, Marks J. Долгосрочные результаты повторного облучения пациентов с рецидивирующей карциномой прямой кишки. 2002 95 1144 Goes RN, Беарт RW, Саймонс А.Дж., Гундерсон Л.Л., Градо Дж., Стритер О.Использование брахтерапии в лечении местно-рецидивирующего рака прямой кишки. Dis Colon Rectum 1997 40 1177 Кюне Дж., Клейсли Т., Бирнацки П., Гирвигиан М., Стритер О., Корман М.Л. и др. Использование брахитерапии с высокой мощностью дозы в лечении местно-рецидивирующего рака прямой кишки 2003 46 895 Wanebo HJ, Марков, RC. Абдоминально-крестцовая резекция местно-рецидивирующего рака прямой кишки. Ann Surg 1981 194 458 Такаги Х., Моримото Т., Хара С., Сузуки Р., Хорио С. Семь случаев экзентерации таза в сочетании с резекцией крестца по поводу местного рака прямой кишки. J Surg Oncol 1986 32 184 Hafner GH, Herrera L, Petrelli NT. Характер рецидива колоректальной аденокарциномы после экзентерации таза. Arch Surg 1991 126 1510 Maetani S, Nishikawa T, Iijima Y, Tobe T, Kotoura Y.Шиката Дж. И др. Обширная резекция единым блоком регионально рецидивирующей карциномы прямой кишки. Рак 1992 69 2876 Temple WJ, Ketcham AS. Резекция крестца для лечения опухолей малого таза. Am J Surg 1992 163 370 Wanebo HJ, Koness J, Vezeridis MP, Cohen SI, Wrobleski D. Резекция таза рецидивирующего рака прямой кишки. Ann Surg 1994 220 586 Magrini S, Nelson H, Gunderson LL. Крестцово-тазовая резекция и интраоперационное электронное облучение в лечении рецидивирующего рака прямой кишки. Dis Colon Rectum 1996 39 1 Wiggers T, de Vries MR, Veeze-Kuypers B. Хирургия местного рецидива рака прямой кишки. Dis Colon Rectum 1996 39 323 Боццетти Ф., Бертарио Л., Россетти С., Дженнари Л., Андреола С., Баратти Д. и др.Хирургическое лечение местно-рецидивирующей карциномы прямой кишки. Dis Colon Rectum 1997 40 1421 Маэтани С., Онодера Х., Нисикава Т., Моримото Х., Ида К. и др. Значение местного рецидива рака прямой кишки как местного или диссеминированного заболевания. Brit J Surg 1998 85 521 Ванебо Х.Дж., Антонюк П., Конесс Дж., Леви А., Везеридис М., Коэн С.И. и др. Тазовая резекция рецидивирующего рака прямой кишки. Dis Colon Rectum 1999 42 1438 Temple WJ, Saettler EB. Местно рецидивирующий рак прямой кишки: роль комплексной резекции обширных опухолей таза со стратегиями минимизации риска рецидива. J Surg Oncol 2000 73 47 Ямада К., Исидзава Т., Нива К., Чуман И., Акиба С. и др. Характер инвазии в области малого таза является прогностическим при лечении местно-рецидивирующего рака прямой кишки. Brit J Surg 2001 88 988 Мория Й, Акасу Т., Фудзита С., Ямамото С. Полная экзентерация таза с дистальной сакрэктомией при фиксированном рецидивирующем раке прямой кишки в тазу. Dis Colon Rectum 2004 47 2047 Гурен MG, Wiig JN, Dueland S, Tveit KM, Fossa SD. Качество жизни пациентов с отводом мочи после операции по поводу местнораспространенного рака прямой кишки. евро J Surg Oncol 2001 27 645 Lopez-Kostner F, Fazio VW, Vignali A, Rybicki LA, Lavery C. Местно рецидивирующий рак прямой кишки. Предсказатели и успех спасательной операции. Dis Colon Rectum 2001 44 173 Shoup M, Guillem JG, Alektiar KM, Liau K, Paty PB, Cohen AM и др. Предикторы выживаемости при рецидивирующем раке прямой кишки после резекции и интраоперационной лучевой терапии. Dis Colon Rectum 2000 45 585 Портер Г.А., Соскольне ЦЛ, Якимец В.В., Ньюман СК. Факторы, связанные с хирургом, и исход при раке прямой кишки. Ann Surg 1998 227 157 Suzuki K, Gunderson LL, Devine RM, Weaver AL, Dozois RR, Ilstrup D, et al. Интраоперационное облучение после паллиативных операций по поводу местно-рецидивирующего рака прямой кишки. Рак 1995 75 939 Suzuki K, Dozois RR, Devine RM, Nelson H, Weaver AL, Gunderson LL и др.Лечебная повторная операция при местно-рецидивирующем раке прямой кишки. Dis Colon Rectum 1996 39 730 © 2006 Фонд содействия исследованиям рака Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине.Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке. Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке. PDQ — это служба NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы.Это не политические заявления NCI или NIH. В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака прямой кишки. Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения. Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком.Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения. Информация в этом обзоре пациентов была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых. Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое.Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком. Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании.Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение. Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237). PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.Тем не менее, пользователю будет разрешено написать предложение, например: «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]». Лучший способ процитировать это резюме PDQ: Редакционная коллегия PDQ® Adult Treatment. PDQ Лечение рака прямой кишки. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/colorectal/patient/rectal-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>.[PMID: 26389378] Изображения в этом резюме используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений. Информация, содержащаяся в этом резюме, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховом покрытии можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами». Переменные No.(%) смертей Время выживания / Станд. Ошибка, Mo Значение P Гистология 0,306 Аденокарцинома 26 (25,2) 144,84 / 22,02 Остальные 212/5013 2 (5013) 2 (5013) 9011 Место первичной опухоли 0,289 Рт.толстая кишка 8 (34,8) 129,43 / 30,09 Толстая кишка 20 (24,7) 88,14 / 6,41 Региональный LN 0,023 N0 9 (16,7) 95,29 / 7,58 N1 12 (40,0) 2480131 9013 9011 125,19 901 6 (40.0) 59,54 / 12,50 Дистанционные метастазы <0,001 Mx 2 (11,7) 75,03 / 5,90 M0 18 (25,3) 143 8 (66,73) 36,77 / 10,77 Степень опухоли 0.215 Дифференциал скважины 10 (18,2) 178,21 / 19,56 Умеренный перепад 10 (38,5) 78,49 / 9,92 30131 ) 60,01 / 17,24 Лучевая терапия 0,782 Нет 19 (27,19) 157,19 / 17,10 Да 7 (21.9) 83,74 / 7,91 Неоадъювант 0,436 Нет 24 (28,6) 138,31 / 21,79 Да 2 (12,5) /10 Адъювантная терапия 0,018 Нет 11 (36,7) 58.32 / 8,47 Да 15 (21,4) 157,64 / 24,45 Таблица 3.
Пациенты при колоректальном раке Тип операции Количество (%) смерти Значение P Частичная колэктомия 14 (23,0) 0,643 Тотальная колэктомия 3 (37.5) 0,643 Прочая техника 6 (22,2) 0,643 Таблица 4.
Переменные No.(%) от повторения Значение P Пол 0,357 Мужской 4 (7,4) Женский 2 (3,8) Возраст, лет 0,532 ≤ 50 2 (4,7) > 50 4 (6,3) Семейная история 0.434 Отрицательный 4 (4,9) Положительный 2 (8,0) ИМТ, кг / м 2 0,274 18,6 — 24,9 2 (3,4) 25 — 29,9 4 (10,3) Категория CRC 0.870 Спорадический 3 (6,7) HNPCC 3 (5,3) FAP 0 (0,03 9134 0 (0,0) 9134 0 (0,0) Клинико-патологические факторы и рецидив после операции у пациентов с колоректальным раком Переменные Количество (%) рецидива Значение P Гистология 0.617 Аденокарцинома 6 (5,9) Другая гистология 0 (0,0) Место первичной опухоли 0,621 Рт. толстая кишка 1 (4,5) Толстая кишка левая 5 (6,2) Размер опухоли, см 0,917 <1 0 (0.0) 1-5 4 (5,5) > 5 1 (4,2) Глубина опухоли 0,846 T1 0 (0,0) T2 1 (4,0) T3 0 (0,0) Региональный LN 0.616 N0 3 (5,6) N1 1 (3,4) N2 0 (0,0) Отдаленные метастазы 0,717 Mx 1 (5,9) M0 3 (4,3) M1 0 Степень опухоли 0.326 Дифференциал скважины 5 (9,1) Умеренный дифференциал 0 (0,0) Плохой дифференциал 0 (0,0) 0 (0,0) Лучевая терапия 0,509 Нет 3 (4,3) Да 2 (6.3) Неоадъювантная терапия 0,183 Нет 3 (3,6) Да 2 (12,5) Адъювантная терапия 0,520 Нет 1 (3,3) Да 4 (5,8) Вид операции 0.281 Частичная колэктомия 2 (3,7) Тотальная колэктомия 0 (0,0) Другие методы 3 (11,5) 3 (11,5) Обсуждение Благодарности
Сноски
Список литературы
1.Джемал А., Симард Е.П., Дорелл С., Нун А.М., Марковиц Л.Е., Колер Б. и др. Ежегодный отчет для нации о статусе рака, 1975–2009 годы, в котором представлены данные о бремени и тенденциях в области рака, ассоциированного с вирусом папилломы человека (ВПЧ), и об уровнях охвата вакцинацией против ВПЧ. J Natl Cancer Inst. 2013; 105 (3): 175–201. DOI: 10.1093 / jnci / djs491. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 2. Паркин Д.М., Ферлей Дж., Курадо М.П., Брей Ф., Эдвардс Б., Шин Х.Р. и др. 50 лет заболеваемости раком: CI5 I-IX. Int J Cancer.2010. 127 (12): 2918–27. DOI: 10.1002 / ijc.25517. [PubMed] [CrossRef] [Google Scholar] 3. Azadeh S, Moghimi-Dehkordi B, Fatem SR, Pourhoseingholi MA, Ghiasi S, Zali MR. Колоректальный рак в Иране: эпидемиологическое исследование. Азиатский Pac J Cancer Prev. 2008. 9 (1): 123–6. [PubMed] [Google Scholar] 4. Поурхосеингхоли М.А., Вахеди М., Могими-Дехкорди Б., Поурхосингхоли А., Гафарнеджад Ф., Мазерат Е. и др. Бремя госпитализации для больных раком желудочно-кишечного тракта — результаты перекрестного исследования в Тегеране.Азиатский Pac J Cancer Prev. 2009. 10 (1): 107–10. [PubMed] [Google Scholar] 5. Поурхосеингхоли М.А., Фагихзаде С., Гаджизаде Э., Гатта Г., Зали М.Р., Абади А.Р. Анализ тенденций смертности от рака желудка и колоректального рака в Иране, 1995-2003 гг. Иран J Рак Пред. 2011; 4 (1): 38–43. [Google Scholar] 6. Halvorsen TB, Johannesen E. Плоидность ДНК, место опухоли и прогноз при колоректальном раке. Исследование проточной цитометрии залитой парафином ткани. Сканд Дж Гастроэнтерол. 1990. 25 (2): 141–8. [PubMed] [Google Scholar] 7. Рабенек Л., Давила Дж. А., Эль-Сераг HB.Есть ли настоящий «сдвиг» в заболеваемость колоректальным раком в правую кишку? Am J Gastroenterol. 2003. 98 (6): 1400–9. DOI: 10.1111 / j.1572-0241.2003.07453.x. [PubMed] [CrossRef] [Google Scholar] 8. Huang L, Li TJ, Zhang JW, Liu S, Fu BS, Liu W. Неоадъювантная химиотерапия с последующим хирургическим вмешательством в сравнении с только хирургическим вмешательством при колоректальном раке: метаанализ рандомизированных контролируемых исследований. Медицина (Балтимор). 2014; 93 (28): e3439. DOI: 10.1097 / MD.0000000000000231. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9.Краруп П.М., Нордхольм-Карстенсен А., Йоргенсен Л.Н., Харлинг Х. Несостоятельность анастомоза увеличивает отдаленный рецидив и долгосрочную смертность после лечебной резекции рака толстой кишки: общенациональное когортное исследование. Ann Surg. 2014. 259 (5): 930–8. DOI: 10.1097 / SLA.0b013e3182a6f2fc. [PubMed] [CrossRef] [Google Scholar] 10. Вонг CKH, Law WL, Wan YF, Poon JTC, Lam CLK. Связанное со здоровьем качество жизни и риск рецидива колоректального рака и смерть от всех причин среди поздних стадий колоректального рака через 1 год после постановки диагноза.Рак BMC. 2014; 14 (1): 337. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Стоян М., Стейт Н., Русу Э., Стойка В., Гаврил Р.С., Герасим А. и др. Злокачественность и летальность колоректальных полипов. Преподобный Мед Чир Соц Мед Нат Яссы. 2014. 118 (2): 399–406. [PubMed] [Google Scholar] 12. Мерфи Т.К., Калле Е.Е., Родригес К., Кан Х.С., Тун М.Дж. Индекс массы тела и смертность от рака толстой кишки в большом проспективном исследовании. Am J Epidemiol. 2000. 152 (9): 847–54. [PubMed] [Google Scholar] 13. Терри П., Джованнуччи Е., Бергквист Л., Холмберг Л., Волк А.Вес тела и риск колоректального рака в группе шведских женщин: соотношение зависит от возраста и локализации рака. Br J Рак. 2001. 85 (3): 346–349. DOI: 10.1054 / bjoc.2001.1894. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. Арьяи М., Рошандель Г., Семнани С., Асади-Лари М., Аараби М., Вакили М.А. и др. Предикторы выживаемости при колоректальном раке в Голестане, Иран: популяционное исследование. Эпидемиол. Здоровье. 2013; 35. DOI: 10.4178 / epih / e2013004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15.Эдж С.Б., Берд Д.Р., Комптон СС. AJCC (Американский объединенный комитет по раку) Руководство по стадированию рака. 7-е изд. Нью-Йорк: Спрингер; 2010. [Google Scholar] 16. Саней Б., Махмудие М., Колахдузан М., Мехраби Кушки А., Ферасат Ф. Время выживания и частота рецидивов у пациентов с раком прямой кишки. J Isfahan Med Sch. 2013; 31: 1194–207. [Google Scholar] 18. Аль-Ахвал М.С., Шафик Й.Х., Аль-Ахвал Х.М. Первые национальные данные о выживаемости при колоректальном раке среди саудовцев в период с 1994 по 2004 год: что дальше? BMC Public Health. 2013; 13: 73.DOI: 10.1186 / 1471-2458-13-73. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Агуэро Ф., Мурта-Насименто С., Галлен М., Андреу-Гарсия М., Пера М., Эрнандес С. и др. Выживаемость при колоректальном раке: результаты больничного регистра рака. Rev Esp Enferm Dig. 2012. 104 (11): 572–7. [PubMed] [Google Scholar] 21. Поурхосингхоли М.А., Фазели З., Аштари С., Баванд-Пур Ф.С. Тенденции смертности от рака желудочно-кишечного тракта среди населения Ирана. Gastroenterol Hepatol Bed Bench. 2013; 6 (Приложение 1): S52–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22.Моради А., Хайямзаде М., Гуйя М., Мирзаи Х.Р., Салманян Р., Рахша А. и др. Выживаемость колоректального рака в Иране. Азиатский Pac J Cancer Prev. 2009. 10 (4): 583–6. [PubMed] [Google Scholar] 23. Эсна-Ашари Ф., Сохраби М.Р., Абади А.Р., Мехрабиан А.А., Мофид Б., Болули М. и др. Распространенность колоректального рака по данным выживаемости в Иране-2007. Иран J Рак Пред. 2009; 2: 15–8. [Google Scholar] 24. Могими-Дехкорди Б., Сафай А. Обзор выживаемости и прогноза рака прямой кишки в Азии. Мир J Gastrointest Oncol.2012; 4 (4): 71–5. DOI: 10.4251 / wjgo.v4.i4.71. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Насколько распространены рецидивы рака прямой кишки и каков прогноз?
Хирургия рака прямой кишки | Мемориальный онкологический центр им. Слоуна Кеттеринга
Вернуться наверх
Вернуться наверх
Вернуться наверх
Вернуться наверх Рецидив рака прямой кишки после хирургического лечения.Анализ 122 пациентов в центре высокоспециализированной медицинской помощи
https://doi.org/10.1016/j.jcol.2017.09.420 Получить права и содержание Резюме
Resumo
Ключевые слова
Palavras-chave
Рекомендуемые статьи
Ссылки на статьи
Лечение рака толстой кишки | Johns Hopkins Medicine
Стратегии лечения рака толстой кишки по стадиям
Ранняя стадия заболевания
Поздняя стадия заболевания
Варианты лечения
Эндоскопическое лечение
Хирургия
Факторы, влияющие на хирургическую технику
Наблюдение после операции
Химиотерапия
Стратегия лечения местно-рецидивирующего рака прямой кишки | Японский журнал клинической онкологии
Аннотация
ВВЕДЕНИЕ
ОБЫЧНОЕ ЛЕЧЕНИЕ
МУЛЬТИМОДАЛЬНОЕ ЛЕЧЕНИЕ
Автор
. Год
. Количество дел
. Резекция (%)
. Хирургический
. 5-YSR (%)
. Повторный местный рецидив (%)
. Willet et al. (11) 1991 30 27 38 Magrini et al. (32) 1996 16 100 Расширенный 48 (2 года) 36 Bussieres et al. (15) 1996 73 57 Смешанный 31 29 Valentini et al.(17) 1999 47 45 Limited 22 31 Wiig et al. (19) 2000 107 41 Limited 30 50 Mannaerts et al. (18) 2001 33 64 Смешанный 60 (3-летние) 27 Hahnloser et al. (21) 2003 304 100 Limited 25
Таблица 1. Автор
. Год
. Количество дел
. Резекция (%)
. Хирургический
. 5-YSR (%)
. Повторный местный рецидив (%)
. Willet et al. (11) 1991 30 27 38 Magrini et al.(32) 1996 16 100 Расширенный 48 (2 года) 36 Bussieres et al. (15) 1996 73 57 Смешанный 31 29 Valentini et al. (17) 1999 47 45 Limited 22 31 Wiig et al. (19) 2000 107 41 Limited 30 50 Mannaerts et al.(18) 2001 33 64 Смешанный 60 (3-летние) 27 Hahnloser et al. (21) 2003 304 100 Limited 25 Автор
. Год
. Количество дел
. Резекция (%)
. Хирургический
. 5-YSR (%)
. Повторный местный рецидив (%)
. Willet et al. (11) 1991 30 27 38 Magrini et al. (32) 1996 16 100 Расширенный 48 (2 года) 36 Bussieres et al.(15) 1996 73 57 Смешанный 31 29 Valentini et al. (17) 1999 47 45 Limited 22 31 Wiig et al. (19) 2000 107 41 Limited 30 50 Mannaerts et al. (18) 2001 33 64 Смешанный 60 (3-летние) 27 Hahnloser et al.(21) 2003 304 100 Limited 25 Автор
. Год
. Количество дел
. Резекция (%)
. Хирургический
. 5-YSR (%)
. Повторный местный рецидив (%)
. Willet et al. (11) 1991 30 27 38 Magrini et al. (32) 1996 16 100 Расширенный 48 (2 года) 36 Bussieres et al. (15) 1996 73 57 Смешанный 31 29 Valentini et al.(17) 1999 47 45 Limited 22 31 Wiig et al. (19) 2000 107 41 Limited 30 50 Mannaerts et al. (18) 2001 33 64 Смешанный 60 (3-летние) 27 Hahnloser et al. (21) 2003 304 100 Limited 25 КОМБИНИРОВАННЫЙ ОТДЕЛ
Автор
. Год
. Количество дел
. TPE
. PW
. РТ
. 5-YSR (%)
. Повторный местный рецидив (%)
. Hafner et al. (28) 1991 21 11 1 20 38 Maetani et al.(35) 1998 59 39 43 26 25 61 Wanebo et al. (36) 1999 53 27 53 31 49 Ямада и др. (38) 2001 60 30 23 16 Мория (39) 2004 57 57 369 25
Таблица 2. Автор
. Год
. Количество дел
. TPE
. PW
. РТ
. 5-YSR (%)
. Повторный местный рецидив (%)
. Hafner et al. (28) 1991 21 11 1 20 38 Maetani et al.(35) 1998 59 39 43 26 25 61 Wanebo et al. (36) 1999 53 27 53 31 49 Ямада и др. (38) 2001 60 30 23 16 Мория (39) 2004 57 57 369 25 Автор
. Год
. Количество дел
. TPE
. PW
. РТ
. 5-YSR (%)
. Повторный местный рецидив (%)
. Hafner et al.(28) 1991 21 11 1 20 38 Maetani et al. (35) 1998 59 39 43 26 25 61 Wanebo et al. (36) 1999 53 27 53 31 49 Ямада и др. (38) 2001 60 30 23 16 Мория (39) 2004 57 57 369 25 Автор
. Год
. Количество дел
. TPE
. PW
. РТ
. 5-YSR (%)
. Повторный местный рецидив (%)
. Hafner et al. (28) 1991 21 11 1 20 38 Maetani et al.(35) 1998 59 39 43 26 25 61 Wanebo et al. (36) 1999 53 27 53 31 49 Ямада и др. (38) 2001 60 30 23 16 Мория (39) 2004 57 57 369 25 ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
СТАНДАРТНАЯ СИСТЕМА
ЗАКЛЮЧЕНИЕ
Список литературы
1. Лечение рака прямой кишки (PDQ®) — версия для пациента
О PDQ
Цель этого обзора
Рецензенты и обновления
Информация о клиническом испытании
Разрешение на использование данного обзора
Заявление об отказе от ответственности


