Профилактика и лечение кишечной недостаточности (статья) > MedElement
Одной из проблем в лечении пациентов после хирургического вмешательства на органах брюшной полости является профилактика и восстановление нарушений моторно-эвакуаторной функции желудка и кишечника. Своевременная эвакуация продуктов метаболизма, токсических веществ, остатков непереваренной пищи и др. способствует сохранению постоянства внутренней среды, предотвращает развитие эндотоксикоза и септических осложнений. К сожалению, задержка отхождения газов и стула на несколько суток являются признанной «нормой» течения послеоперационного периода.
Причинами развития кишечной недостаточности в раннем послеоперационном периоде могут быть:
— высокая травматичность хирургического вмешательства;
— продолжительная ишемия и гипоксия стенок желудка и кишечника;
— развитие тормозящего кишечник рефлекса, реализующегося через вегетативную нервную систему, в условиях длительно сохраняющейся после операции мощной рефлексогенной зоны;
— негативное влияние на моторику некоторых медикаментов (наркотических аналгетиков), медиаторов, гормонов, как местного так и общего действия, электролитов (гипокалиемия), эндотоксинов и др. биологически активных веществ.
Не имеет никаких оснований и является глубоким заблуждением мнение многих хирургов и реаниматологов, что ранняя стимуляция кишечника противопоказана у пациентов после операций на желудке и кишечнике. Нарушения микроциркуляции и атония кишечника и является причиной кишечной недостаточности на фоне энтерита. Помимо развития стрессовых язв и транслокации это приводит и к несостоятельности анастомозов – ишемизированный, отечный и «валяющийся» — раздутый кишечник не способен к заживлению! Достаточно глупо связывать перистальтику с несостоятельностью анастамоза – амплитуда перистальтических волн редко превышает 0,5см, но в сознании некоторых врачей эта амплитуда такова, что разрывает анастомоз, т.е. составляет не менее 10-20см. Необходимо знать патофизиологические механизмы и реально представлять, что при отсутствии перистальтики – пассажа содержимого, начинается застой – заполнение кишечника гниющей и газообразующей жидкостью, которая раздувает кишечник и «рвет» анастомозы.
Современные способы профилактики и лечения послеоперационной кишечной недостаточности:
1. Блокада рефлексогенных зон, ноцицептивной импульсации. Методом выбора является эпидуральная аналгезия (блокада). Продленная эпидуральная блокада наиболее полно выключает поступление патологической импульсации с зоны выполненной операции, выключает негативное влияние симпатической иннервации и не влияет на парасимпатический отдел вегетативной нервной системы.
2. Применение ненаркотических аналгетиков в сочетании с спазмолитиками (Но-шпы (дротаверина гидрохлорид) или папаверина) направлено на ликвидацию высокого тонического состояния гладких мышц кишечной трубки. Доказано, что введение в течение 2 суток после операции 2% раствора Но-шпы по 2,0 мл каждые 6 часов ведет к снятию спазма толстой кишки, быстрому восстановлению перистальтики, что может быть альтернативой эпидуральному блоку.
4. Парентеральное введение медикаментов антихолинэстеразного (прозерин, неостигмин) или холиномиметического действия (ацеклидин, убретид, калимин) в небольших дозах в первые 2 суток с целью восстановления моторики тонкого кишечника. Введение больших доз холиномиметиков приведет к усилению перистальтики только тонкой кишки и повышению тонуса/спазма толстой, к истощению энергетических запасов ЖКТ и прогрессированию пареза кишечника.
5. Мероприятия по терапии и профилактике гипоксии: нормализация функции внешнего дыхания, устранение ишемии, анемии — вплоть до продленной ИВЛ, баротерапии.
6. Коррекция водно-электролитного обмена (калий плазмы поддерживать на верхней границе нормы). Учитывая задержку воды и накопление ее в зоне хирургического вмешательства суточный объем инфузионной терапии в первые 48 часов назначают из расчета не более 40 мл/кг массы пациента.
 Необходим четкий контроль водного баланса с учетом всех потерь – его необходимо поддерживать на нулевом уровне.
Необходим четкий контроль водного баланса с учетом всех потерь – его необходимо поддерживать на нулевом уровне.7. Коррекция гипопротеинемии альбумином. Рутинное применение синтетических коллоидов противопоказано, т.к. они способны накапливаться в интерстиции и поддерживать отек кишечника.
8. Постоянное дренирование верхних и нижних отделов ЖКТ.
9. Раннее энтеральное или зондовое питание. При нахождении зонда в желудке или тонкой кишке можно начинать введение изотонических растворов через 6-8-12 часов после плановых операций (восстановление всасывающей функции тонкой кишки обычно совпадает с появлением перистальтических шумов).
ФАРМАТЕКА » Современное состояние вопроса профилактики и лечения послеоперационного пареза кишечника в акушерской практике
Актуальность
Рост оперативной активности в мировой и отечественной хирургии закономерно привел к увеличению числа послеоперационных осложнений во многом за счет расширения показаний к операциям, внедрения концепций «ускоренной реабилитации» при использовании малоинвазивных технологий, а также более детального скринингового обследования населения на предмет наличия патологии, требующей радикальной оперативной коррекции [1].
Важно отметить, что увеличение числа операций характерно не только для абдоминальной хирургии и онкологии, но и для акушерско-гинекологической службы, где доля оперативного родоразрешения в последние годы имеет тенденцию к значительному росту за счет беременных с акушерской или экстрагенитальной патологией. Частота выполнения кесарева сечения на территории РФ составляет 30–31,2% (в США – 32,8%) и имеет неуклонный прогрессивный рост за последние десятилетия, что отражается в приросте оперативного родоразрешения на 1% в год [2–4].
Интенсификация оперативной активности в акушерско-гинекологической сфере сопровождается увеличением доли гнойно-воспалительных осложнений, таких как эндометрит, несостоятельность швов на матке, послеоперационный парез, перитонит. При этом динамическая кишечная непроходимость признается одной из ведущих причин пролонгации стационарного этапа лечения в 3–4 раза по сравнению с неосложненным послеоперационным течением [5].
Терминология, риски, причины
Под термином «послеоперационный парез кишечника» (динамическая кишечная непроходимость, послеоперационная мальдигестия, послеоперационная дисфункция кишечника, моторно-эвакуаторные нарушения перистальтики в послеоперационном периоде и т.д.) следует понимать как угнетение пропульсивной способности пищеварительного тракта с нарушением аборальной эвакуации кишечного содержимого. С формальной точки зрения подразумевается невозможность полноценного энтерального питания с ограничением или полным исключением абсорбции нутриентов в сроки до 72–96 часов с момента окончания операции, что характеризуется вариабельным симптомокомплексом от явлений тошноты и рвоты до стойкой динамической кишечной непроходимости, выраженной нутритивной (энтеральной) или полиорганной недостаточности. Имеется мнение, будто моторно-эвакуаторные послеоперационные нарушения пищеварительного тракта являются закономерным следствие интраоперационной хирургической агрессии, что в своих крайних негативных проявлениях существенно увеличивает как летальность, так и затраты на лечение.
Среди факторов риска послеоперационного пареза кишечника следует отметить такие общие факторы, как исходно (до операции) низкий уровень альбумина, рутинное использование опиоидов и опиоидных анальгетиков, наличие в анамнезе операций на органах брюшной полости и малого таза, длительность и характер (экстренный) хирургического вмешательства, объем интраоперационной кровопотери и необходимость гемотрансфузии, а также расширенный объем вмешательства с лимфодиссекцией, мультивисцеральными резекциями и т. д. [1, 6].
д. [1, 6].
Существует концепция оперативной травмы брюшины, богатой рецепторами, что и инициирует микроциркуляторную недостаточность, ишемию кишечной стенки, повышение тонуса симпатической нервной системы с выбросом катехоламинов и поддержанием микроциркуляторных расстройств [1, 7], что позволяет в какой- то мере рассматривать развивающиеся моторно-эвакуаторные осложнения как протективную реакцию в первые несколько суток после «агрессивного» хирургического вмешательства [8]. Схематические варианты патофизиологических поломок представлены на рисунке.
На сегодняшний день можно выделить две основные причины неудовлетворенности результатами разрешения послеоперационных парезов. Первая кроется в широкой доминации традиционного стандартного подхода к выбору лечебных мероприятий без учета патогенетических нюансов [9]. Таким образом, схемы являются общими, рутинными, без учета индивидуальных нюансов пациента, его коморбидного фона, органной патологии и ранее выполненных вмешательств. Вторая более важная причина является следствием старта лечения послеоперационных парезов по факту их развития, в то время как мероприятия по профилактике моторно-эвакуаторных нарушений должны проводиться в раннем послеоперационном периоде до появления клинических признаков дисмоторики или дисфункции кишечника [10, 11].
В реалиях современной России послеоперационные моторно-эвакуаторные осложнения в акушерской практике регистрируются с частотой до 6% от общего числа оперированных пациенток. Среди всех форм динамического послеоперационного илеуса тяжелые формы дисмоторики, зачастую требующие привлечения специалистов хирургического профиля и даже оперативной коррекции, по данным Е.Ю. Упрямовой и соавт. [2], встречаются в 2,5% от всех вмешательств акушерско-гинекологического профиля.
Безусловно можно сколько угодно предлагать новые алгоритмы и схемы терапии пареза кишечника, однако на первом месте видится профилактика последнего, в т.ч. после родоразрешения путем кесарева сечения.
Предоперационный менеджмент и способы профилактики после операции
Однозначного мнения касательно предоперационной подготовки кишечника в настоящее время не существует. По мнению ряда хирургов, подобная рутинная практика видится дискутабельной, а эффективность ее весьма низкая [12]. По мнению P. Bucher et al. [13], при механической подготовке кишечника имеется риск развития несостоятельности анастомозов, что является крайне актуальным для абдоминальной хирургии, а также возрастает процент воспалительных осложнений, что может наблюдаться и в акушерско-гинекологической практике [14].
Одним из направлений предоперационной профилактики динамических моторно-эвакуаторных нарушений у оперированных пациенток является использование пробиотиков, что убедительно доказано в работах S. Bengmark et al. [15]. Справедливости ради стоит признать, что подобная практика не получила должного распространения, что существенным образом ограничивает лечебные протоколы с внедрением предоперационной пробиотикотерапии, особенно при экстренном характере родоразрешения [14].
Вопрос рутинного голодания с вечера накануне операции в последние годы как прямое нарушение принципов «ускоренной реабилитации» претерпел существенные изменения. Доказано, что применение высокоуглеводных энтеральных смесей за несколько часов до вмешательства сокращает время восстановления моторной функции кишечника [16]. Рассчитана экономическая преференция, а также достоверное сокращение длительности госпитализации ввиду снижения риска послеоперационной мальдигестии [14].
В свете протекции послеоперационных моторно-эвакуаторных нарушений, в т.ч. после родоразрешения путем кесарева сечения, важное место следует отводить четкому соблюдению протоколов периоперационного менеджмента. В последние годы доказана эффективность эпидурального обезболивания, что по сравнению с опиоидными анальгетиками в раннем послеоперационном периоде позволяет минимизировать риски моторных нарушений. При этом, по данным мета-анализов, при эпидуральной анестезии отмечается снижение сроков восстановления моторики кишечника до 24 часов против 37 при использовании опиоидных анальгетиков [1, 14].
По мнению зарубежных экспертов, малоинвазивный характер оперативного пособия также способствует сокращению сроков «физиологического» пареза [17], однако применение эндовидеохирургии в родоразрешении невозможно по определению, а значит, и все положительные моменты лапароскопии не экстраполируются на акушерскую практику.
Большинство зарубежных хирургов отрицательно относятся к интубации тонкой кишки, указывая на ее травматичность, частые послеоперационные осложнения, плохую переносимость больными длительного пребывания зонда в носоглотке [18]. Также имеется весьма неутешительная статистика о практически 20% неудач при выполнении интестинального шинирования ввиду технических сложностей, анатомических особенностей и т.д. [19]. При этом вариант подобных манипуляций из надлонного доступа практически невыполним технически или требует расширения доступа, что не выполняется рутинно ввиду отсутствия признаков пареза на момент операции, а лишь по факту развития моторных нарушений в ранние сроки послеоперационного периода.
Даже для абдоминальной хирургии рутинная назогастральная декомпрессия видится весьма дискутабельной, а уж применение ее с целью профилактики динамической кишечной непроходимости после оперативного родоразрешения видится крайне сомнительным и нарушающим life quality рожениц. Согласно целой серии рандомизированных исследований, данный вариант декомпрессии не только не эффективен, но и способствует пролонгации восстановления пропульсивности кишечника после оперативных вмешательств [14]. С другой стороны, преимущество выбора декомпрессии с помощью назогастрального зонда обосновывается законами физики. Раздутая и аперистальтирующая кишка представляет собой полость с газами и жидкостью, что позволяет создать разность давления сообщающихся сосудов и таким образом раздренировать всю цепь пищеварительной трубки [19].
Таким образом, рутинный желудочный зонд в состоянии выполнить практически тотальную декомпрессию тонкой кишки, снизить внутрипросветную гипертензию и создать плацдарм для восстановления перистальтики, однако ее применение ограничивается резким снижением качества жизни оперированных и не может считаться обязательной манипуляцией при кесаревом сечении.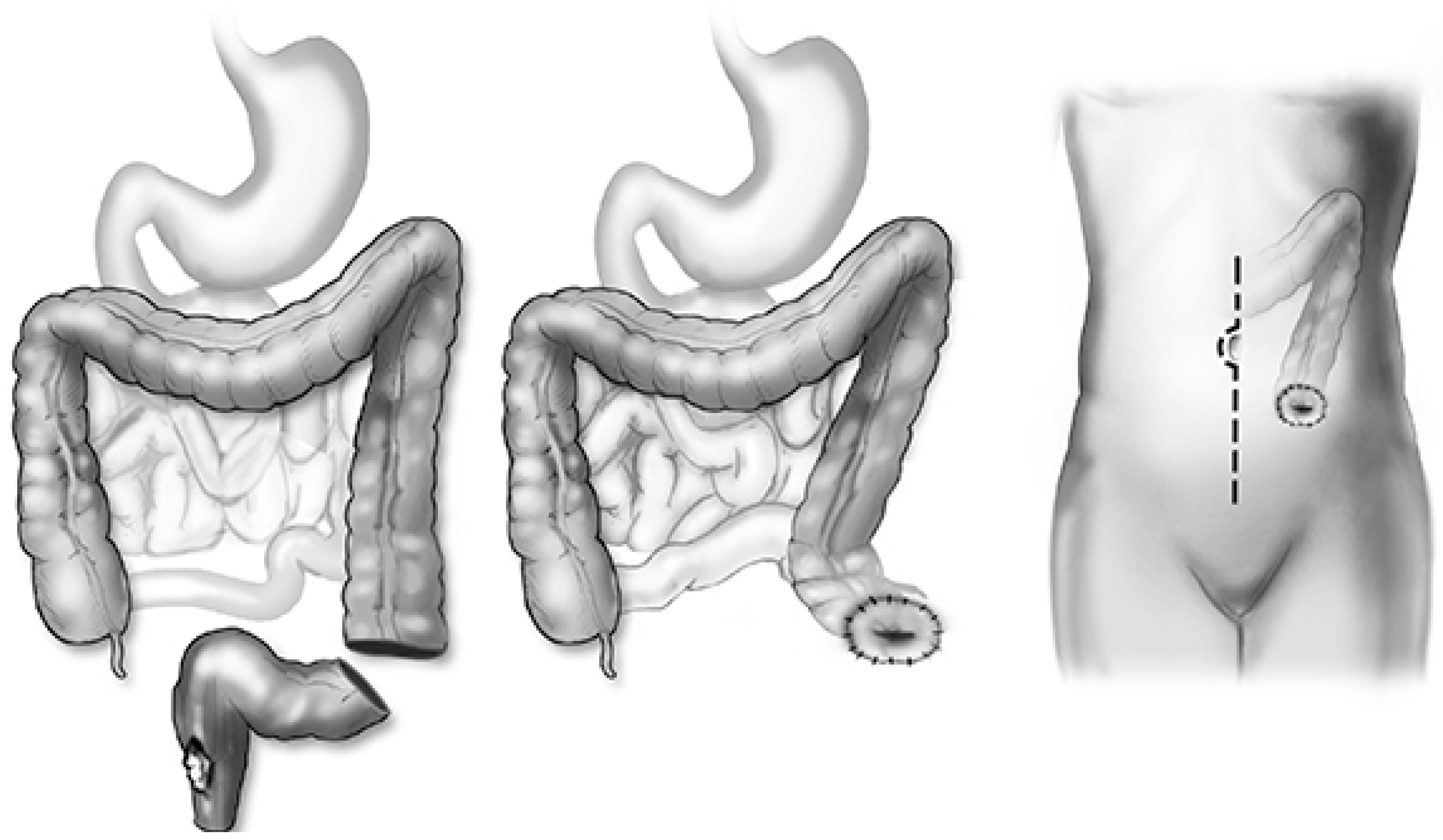 Однако в случае развития послеоперационных паретических осложнений назогастральная декомпрессия после абдоминального родоразрешения оправданна при экспозиции шинирования до восстановления моторики в течение не менее суток [2].
Однако в случае развития послеоперационных паретических осложнений назогастральная декомпрессия после абдоминального родоразрешения оправданна при экспозиции шинирования до восстановления моторики в течение не менее суток [2].
Отдельного внимания заслуживает теория «ложного кормления», заключающаяся в употреблении жевательной резинки в раннем послеоперационном периоде. Данная простая и незатейливая методика доказала свою состоятельность при оценке моторики кишечника в послеоперационном периоде у больных с парезом пищеварительного тракта [14, 20]. Вышеприведенный тезис обосновывается целой серией рандомизированных исследований с применением жевательной резинки для восстановления перистальтики кишечника после кесарева сечения, где отмечались сокращение пареза, более раннее отхождение газов и экономическая преференция подобного подхода [21, 22].
Лечение пареза в раннем послеоперационном периоде
К сожалению, профилактика моторно-эвакуаторных нарушений проводится далеко не всем пациенткам, а основной акцент делается на лечении уже наступивших динамических дисфункций кишечника в раннем послеоперационном периоде. Также следует указать на то, что на сегодняшний день общепризнанной и на 100% эффективной схемы лечения послеоперационного динамического илеуса не существует.
Рутинная практика большинства хирургических клиник подразумевает лишь декомпрессию проксимальных отделов пищеварительной трубки и проведение массивной инфузионной терапии для коррекции волемических и электролитных нарушений [23]. Крайне спорным представляется массивная водная нагрузка, приводящая к висцеральныму отеку, согласно закону Ф. Старлинга, что замыкает очередной «порочный» круг, усугубляет тяжесть илеуса и утяжеляет состояние пациента [1, 24].
Большинство исследователей сходятся во мнении о целесообразности рестриктивного режима инфузионной терапии, при этом объем вводимой жидкости не должен превышать 1–1,25 мл/кг/ч [25, 26]. Рекомендовано введение кристаллоидов с обязательным замещением эквивалентным объемом ретроградных потерь по назогастральному зонду или с рвотой, а также коррекция гипоальбуминемии как фактора риска дисмоторики, приводящего к нарастанию отека и растяжению кишечной стенки [25].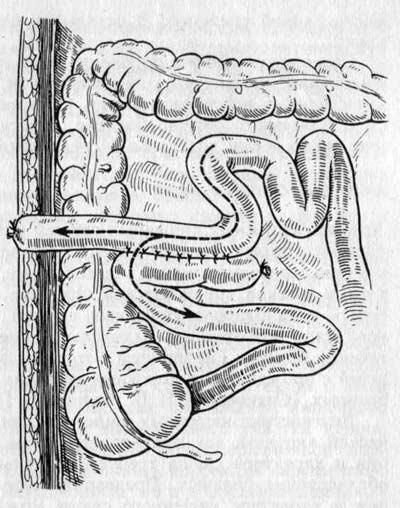
Доказана роль электролитного дисбаланса в поддержании дисмоторики, что проиллюстрировано результатами ретроспективных обзоров как одного из факторов риска послеоперационного пареза [27]. По данным ряда работ прослежена прямая корреляционная связь между уровнем послеоперационной гипокалиемии, гипокальциемии и тяжестью динамической кишечной непроходимости, а также связь между гипонатриемией и парезом кишечной стенки [2, 27]. На основании данных литературы рекомендованы регулярный контроль и коррекция вышеприведенных маркеров, при этом коррекция дефицита калия проводится до достижения его концентрации в плазме не менее 4,0 ммоль/л под контролем показателей кислотно-основного состояния крови в динамике [2].
Развитие фармацевтической индустрии привело к активному изучению рынка препаратов, напрямую или косвенно влияющих на моторно-эвакуаторную функцию пищеварительного тракта, что увеличило количество наименований фарм-агентов для коррекции пареза.
Имеются убедительные доказательства влияния клеток APUD-системы (продуцентов серотонина – субстанции Р и мотилина) на возникновение послеоперационного пареза кишечника, т.к. последние участвуют в работе мигрирующего миоэлектрического комплекса кишки, а также определяют перфузию кишечной стенки [1].
Именно подобные теоретические предпосылки указывают на целесообразность и обоснованность применения препаратов серотонинергической группы с целью профилактики и лечения послеоперационного пареза. Согласно данному механизму регуляции, под воздействием серотонина происходит высвобождение ацетилхолина из постганглионарных нервных окончаний в ауэрбаховском межмышечном нервном сплетении и таким образом восстанавливается пропульсивная активность кишечника [28, 29]. Вводимый извне серотонин обладает более высоким сродством к серотониновым рецепторам, благодаря чему он легко вытесняет лиганды и восстанавливает нормальную перистальтику [30].
Имеются работы об эффективности препаратов серотонина в снижении доли тошноты и рвоты после ряда хирургических абдоминальных операций [31], а также при применении комплексной коррекции в качестве одного из компонентов лечебной тактики [32]. В последние годы терапия препаратами серотонинового ряда в аспектах коррекции пареза все чаще освещается в отечественной литературе [8, 30]. Так, подобная схема терапии успешно апробирована в ходе проспективного исследования у 28 родильниц [8]. Авторы убедительно указали на снижение доли послеоперационных моторных нарушений кишечника, а также тяжести течения раннего послеоперационного периода: через 3 часа боль в животе сохранялась лишь в 22% случаев, а тошнота в 3,7%. У абсолютного большинства пациенток исчезли такие симптомы, как вздутие живота, отхождение газов прослежено через 6 часов после введения серотонина-адипината [8].
В последние годы терапия препаратами серотонинового ряда в аспектах коррекции пареза все чаще освещается в отечественной литературе [8, 30]. Так, подобная схема терапии успешно апробирована в ходе проспективного исследования у 28 родильниц [8]. Авторы убедительно указали на снижение доли послеоперационных моторных нарушений кишечника, а также тяжести течения раннего послеоперационного периода: через 3 часа боль в животе сохранялась лишь в 22% случаев, а тошнота в 3,7%. У абсолютного большинства пациенток исчезли такие симптомы, как вздутие живота, отхождение газов прослежено через 6 часов после введения серотонина-адипината [8].
К сожалению, клинических рекомендаций о целесообразности подобной терапии при послеоперационных парезах после кесарева сечения с высоким уровнем доказательности в доступной литературе в настоящее время не отмечено, что не позволяет рекомендовать повсеместно подобные схемы терапии.
Важным звеном в коррекции динамической кишечной непроходимости являются ингибиторы холинэстеразы (неостигмина метилсульфат). При анализе серий рандоминизированных исследований и малых выборок (case reports) получены убедительные доказательства обоснованности применения неостигмина как безопасного и эффективного агента в коррекции илеуса. Однако терапия подобными препаратами не лишена недостатков, т.к. требует мониторинга побочных эффектов, проявляющихся в виде брадикардии, холинергического криза с параличом дыхательной мускулатуры и т.д. [28, 33, 34].
В работах В. Caliskan et al. [33] при применении неостигмина бромида отмечалось достоверное сокращение времени восстановления перистальтики и сроков отхождения газов по сравнению с группой плацебо: 11,6±11,2 часа против 22,6±12,8 и 21,8±15,6 часа против 36,6±19,1 (p≤0,05). Преимущество неостигмина отмечено и в работе B. Kram et al. [35], при этом время получения первого стула после подкожного введения препарата составило 29,19 часа от начала лечения. Сами исследователи позитивно оценивают действие препарата на восстановление пропульстивности кишечника, однако в трех наблюдениях ввиду резвившегося холинергического криза терапия неостигмином была прекращена, что позволило сформировать относительные противопоказания к применению ингибиторов холинэстеразы у пациентов с аномалиями проводящей системы сердца, AV (атрио-вентрикулярными)-блокадами 2-й и 3-й степеней, бронхиальной астмой, стенокардией, а также после резекции кишечника с первичным анастомозом ввиду риска развития несостоятельности [35].
Важно отметить, что помимо клинических противопоказаний ввиду риска тех или иных побочных эффектов препарата важное ограничение его внедрения для профилактики и лечения послеоперационных послеродовых осложнений вносит категория «С» действия на плод по FDA (Food and Drug Administration).
Долгие годы изучаются варианты профилактики и возможной коррекции послеоперационной динамической кишечной непроходимости с помощью метоклопрамида. Далеко не всегда отмечается преимущество его использования по сравнению с группой плацебо по параметрам отхождения газов, нормализации перистальтических шумов, первого эпизода дефекации [24], но в ряде работ дается положительная оценка применения метоклопрамида в комплексных схемах коррекции илеуса после кесарева сечения [36].
Работы последних лет активно освещают комплексное применение регулятора моторики пищеварительного тракта тримебутина, являющегося полным агонистом всех типов периферических опиоидных (энкефалиновых) рецепторов [37]. К сожалению, этот препарат не только не разрешен в I триместре беременности ввиду тератогенного действия, но и не рекомендован в период лактации вследствие отсутствия достоверных клинических данных, подтверждающих его безопасность.
Одной из перспективных и безопасных с точки зрения применения в период лактации видится методика электрофизиологического транскутанного воздействия на пропульсивную активность кишечника [28, 32]. В ряде экспериментальных работ указывается на наличие собственного ритма у каждого отдела пищеварительной трубки, что при совпадении частотных спектров с экзогенной электростимуляцией проявляется эффектом резонанса и, следовательно, усилением электрической и моторной активности какого-то конкретного или всех отделов желудочно-кишечного тракта [38].
В настоящее время подобную резонансную стимуляцию используют спорадически в основном больным в критических состояниях с выраженными нарушениями моторно-эвакуаторной функции кишечника при полной несостоятельности иных методов и средств [39], хотя имеются и единичные описания применения методики для лечения пареза после оперативного родоразрешения [32].
Имеются указания на применение альтернативных методов лечения послеоперационной динамической кишечной непроходимости (например, прием слабительных препаратов), что имеет на сегодняшний день низкий уровень доказательности [24]. Существуют убедительные данные рандомизированного исследования о сокращении сроков отхождения газов и получения первого стула в группе применения масла ромашки после кесарева сечения [40], однако данный вопрос требует более детального изучения и обсуждения.
Заключение
На основании анализа современных вариантов профилактики, стимуляции (фармакологической, электрофизиологической) и иных вариантов терапии динамической кишечной непроходимости после родоразрешения путем кесарева сечения следует указать на крайнюю актуальность и злободневность вышеуказанной проблемы. К сожалению, в доступной нами литературе не отмечено единых взглядов на патогенез и, соответственно, на лечебную тактику и меры профилактики подобных моторно-эвакуаторных нарушений.
На основании вышеизложенного становится очевидной необходимость систематизации многообразия фармакологических агентов, методов неинвазивного воздействия, а также пересмотра рутинных традиционных «приемов» профилактики и лечения послеоперационных парезов в акушерско-гинекологической практике. Подобный системный характер позволит продуктивно подойти к созданию практико-ориентированных алгоритмов, схем и клинических рекомендаций для улучшения результатов лечения пациенток после оперативного родоразрешения.
1. Евсеев М.А., Фомин В.С., Никитин В.Е. Патогенетические аспекты развития синдрома энтеральной недостаточности в послеоперационном периоде. Анналы хирургии. 2018;23(1):5–13. 2. Щукина Н.А., Буянова С.Н. Гнойно-септические осложнения после гинекологических операций. Медицинский алфавит. 2017;1(3):20–5. 3. Упрямова Е.Ю., Новикова С.В., Цивцивадзе Е.Б.Послеоперационный парез кишечника в акушерско-гинекологической практике. Акушерство и гинекология. 2018;11:159–64. 4. Hamilton B.E., Martin J.A., Ventura S.J. Births: preliminary data for 2012. Natl Vital Stat Rep. 2013;62(3):1–20. 5. Blumenfeld Y.J., El-Sayed Y.Y., Lyell D.J., Nelson L.M.,Butwick A.J. Risk factors for prolonged postpartum length of stay following cesarean delivery. Am J Perinatol. 2015;32(9):825–32. 6. Bragg D., El-Sharkawy A.M., Psaltis E., Maxwell-Armstrong C.A., Lobo D.N. Postoperative ileus. Recent developments in pathophysiology and management. Clin Nutr. 2015;34 (3):367–76. 7. Schwarz N.T., Beer-Stolz D., Simmons R.L., et al. Pathogenesis of paralytic ileus: intestinal manipulation opens a transient pathway between the intestinal lumen and the leukocytic infiltrate of the jejunal muscularis. Ann Surg. 2002;235:1:31–40. 8. Кадырбердиева Ф.З., Каримова Г.Н., Игнатьева А.А., Шмаков Р.Г. К вопросу об этиопатогенезе послеоперационного пареза кишечника. Применение серотонина адипината в акушерской практике. Медицинский оппонент. 2018;1(4):44–50. 9. Chen S.C., Lee C.C., Yen Z.S., et al. Specific oral medications decrease the need for surgery in adhesive partial small-bowel obstruction. Surg. 2006;139(3):312–6. 10. Каминский В.В., Дубов А.М., Ткаченко Р.А. Методы профилактики парезов кишечника в оперативной гинекологии. Таврический медико-биологический вестник. 2011;14(3 часть 2):264–66. 11. Luckey A., Livingston E., Taché Y. Mechanisms and treatment of postoperative ileus. Arch. Surg. 2003;138:206–14. 12. Zmora O., Mahajna A., Bar-Zakai B., et al. Colon and rectal surgery without mechanical bowel preparation: a randomized prospective trial. Ann Surg. 2003;237:363–67. 13. Bucher P., Mermillod B., Morel P., Soravia C.Does mechanical bowel preparation have a role in preventing postoperative complications in elective colorectal surgery? Swiss Med Wkly. 2004;134:69–74. 14. Story S.K., Chamberlain R.S. A Comprehensive Review of Evidence-Based Strategies to Prevent and Treat Postoperative Ileus Dig. 15. Bengmark S., Gil A. Bioecological and nutritional control of disease: prebiotics, probiotics, and synbiotics. Nutr Hosp. 2006;21:72–84 16. Fearon K.C., Luff R. The nutritional management of surgical patients: enhanced recovery after surgery. Proc Nutr Soc. 2003;62:807–11 17. Person B., Wexner S.D. The management of postoperative ileus. Curr Probl Surg. 2006;43(1):6–65. 18. Al Sarakbi W., Bentley P.G. Whole gut intubation splinting – last refuge for the surgically desperate? Ann R Coll Surg Engl. 2010;92(6):529–30. 19. Мендель Н.А., Волостников Е.В., Плотников Ю.В.и др. Эффективна ли интубация кишечника при острой кишечной непроходимости? Старые догмы и эволюция взглядов. Вестник хирургии им. И.И. Грекова. 2013;172(4):100–4. 20. Shang H., Yang Y., Tong X., et al. Gum chewing slightly enhances early recovery from postoperative ileus after cesarean section: results of a prospective, randomized, controlled trial. Am J Perinatol. 2010;27(5):387–91. 21. Mohsenzadeh Ledari F., Barat S., Nasiri Amiri F., et al. Effect of gum chewing after cesarean-delivery on return of bowel function. Bosn J Basic Med Sci. 2012;14:19–24. 22. Pereira Gomes Morais E., Riera R., Porfírio G.J.M., et al. Chewing gumfor enhancing early recovery of bowel function after caesarean section. Cochrane Database Syst Rev. 2016;10:CD011562. 23. Cheatham M.L., Chapman W.C., Key S.P., Sawyers J.L. A meta-analysis of selective versus routine nasogastric decompression after elective laparotomy. Ann Surg 1995;221:469–78. 24. Holte K., Kehlet H. Postoperative ileus: progress towards effective management. Drugs. 2002;62:2603–15. 25. Kim Y.S., Choi S.D., Bae D.H. Risk factors for complications in patients undergoing myomectomy at the time of cesarean section. J Obstet Gynecol Res. 2010;36(3):550–54. 26. Hsu Y.Y., Hung H.Y., Chang S.C., Chang Y.J. Early oral intake and gastrointestinal function after cesarean delivery: a systematic review and meta-analysis. 27. Vather R., Bissett I.P. Risk factors for the development of prolonged post-operative ileus following elective colorectal surgery. Int J Colorectal Dis. 2013;28(10):1385–91. 28. Соловьев И.А., Колунов А.В. Послеоперационный парез кишечника – проблема абдоминальной хирургии. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2013;8(2):112–18. 29. Mawe G.M., Hoffman J.M. Serotonin signalling in the gut-functions, dysfunction and therapeutic targets. Nat Rev Gastroenterol Hepatol. 2013;10(8):473–86. 30. Шур В.Ю., Самотруева М.А., Мажитова М.В.и др. Серотонин: биологические свойства и перспективы клинического применения. Фундаментальные исследования. 2014;7(3):621–29. 31. Okafor D., Kaye A.D., Kaye R.J., Urman R.D. The role of neurokinin-1 (substance P) antagonists in the prevention of postoperative nausea and vomiting. J Anaesth Clin Pharmacol. 2017;33(4):441–45. 32. Халидов О.Х., Фомин В.С., Гудков А.Н. и др. Случай успешного разрешения динамической кишечной непроходимости методом транскутанной резонансной электростимуляции после экстренного кесарева сечения. Эндоскопическая хирургия. 2018;24(3):51–5. 33. Caliskan E., Turkoz A., Sener M., et al. A prospective randomized double-blind study to determine the effect of thoracic epidural neostigmine on postoperative ileus after abdominal aortic surgery. Anesth Analg. 2008;106(3):959–64. 34. Vogel J.D., Feingold D.L., Stewart D.B., et al. Clinical Practice Guidelines for Colon Volvulus and Acute Colonic Pseudo-Obstruction. Dis Colon Rectum. 2016;59(7):589–600. 35. Kram B., Greenland M., Grant M., et al. Efficacy and Safety of Subcutaneous Neostigmine for Ileus, Acute Colonic Pseudo-obstruction, or Refractory Constipation. Ann Pharmacother. 2018:1;1060028018754302. 36. Agah J., Baghani R., Rakhshani M.H., Rad A. Metoclopramide role in preventing ileus after cesarean, a clinical trial. Eur J Clin Pharmacol. 37. Булгаков С.А., Белоусова Е.Л. Лекарственные средства – лиганды опиатных рецепторов и их применение в гастроэнтерологии. Фарматека. 2011;2:26–31. 38. Яковенко В.Н., Фомин В.С., Бобринская И.Г. Основные направления развития электрогастроэнтерографии и восстановления координации сокращений пищеварительного тракта у больных хирургического профиля. Хирургическая практика. 2017;3:5–11. 39. Бобринская И.Г, Мороз В.В, Яковенко В.Н. и др. Селективная полиграфия и резонансная стимуляция ЖКТ в раннем послеоперационном периоде при перитоните. Общая реаниматология. 2016;12(2):90–9. 40. Khadem E., Shirazi M., Janani L., el. Effect of Topical Chamomile Oil on Postoperative Bowel Activity after Cesarean Section: A Randomized Controlled Trial. J Res Pharm Pract. 2018;7(3):128–35.
 Surg. 2009;26:265–27.
Surg. 2009;26:265–27. Obstet Gynecol. 2013;121(6):1327–34.
Obstet Gynecol. 2013;121(6):1327–34. 2015;71(6):657–62.
2015;71(6):657–62.
Автор для связи: В.С. Фомин, к.м.н., доцент кафедры хирургических болезней и клинической ангиологии, Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва, Россия; e-mail: [email protected], ORCID: https://orcid.org/0000-0002-1594-4704; Адрес: 127473, Россия, Москва, ул. Делегатская, 20, стр. 1
Влияние инфузии на развитие послеоперационной кишечной недостаточности | Петрова
1. Хрупкин В.И., Ханевич М.Д., Шестопалов А.Е., Шпак Е.Г., Староконь П.М. Энтеральная терапия синдрома кишечной недостаточности у больных перитонитом. Вестн. хирургии им. И.И.Грекова. 2003; 162 (6): 16-19. PMID: 14997807
2. Бобринская И.Г., Мороз В.В., Яковенко В.Н., Кудряков О.Н., Спиридонова Е.А., Солдатова В.Ю. Cелективная полиграфия и резонансная стимуляция желудочнокишечного тракта в раннем послеоперационном периоде при перитоните. Общая реаниматология. 2016; 12 (2): 90-99. DOI: 10.15360/1813-9779-2016-2-90-99
3. Алексеева Е.В., Попова Т.С., Сальников П.С., Баранов Г.А., Пасечник И.Н. Анализ изменений электрической активности желудочно-кишечного тракта у больных в критических состояниях. Общая реани- матология. 2013; 9 (5): 45-55. DOI: 10.15360/1813-9779-2013-5-45
4. Коньков Д.Г., Степанюк Л.И. Особенности профилактики послеоперационного пареза кишечника в гинекологической практике. Новости медицины и фармации. 2013; 17(471)
5. Савельев В.С., Магомедов М.С., Ревякин В.И., Кириенко П.А., Миронов А.В., Петухов В.А. Влияние операции холецистэктомии на моторику органов желудочно-кишечного тракта. Эндоскопическая хирургия. 2007; 13 (3): 32-38.
6. Герасимов Л.В., Мороз В.В. Водно-электролитный и кислотно-основной баланс у больных в критических состояниях. Общая реанима- тология. 2008; 4 (4): 79-85. DOI: 10.15360/1813-9779-2008-4-79
7. Ермолов А.С., Попова Т.С., Пахомова Г.В., Утешев Н.С. Синдром кишечной недостаточности в неотложной абдоминальной хирургии. М.: МедЭкспертПресс; 2005: 460.
8. Сабиров Д.М., Батиров У.Б., Саидов A.C. Внутрибрюшная гипертензия -реальная клиническая проблема. Вестн. интенс. терапии. 2006; 1: 21- 23.
9. Becker B.F., Chappell D., Bruegger D., Annecke T., Jacob M. Therapeutic strategies targeting the endothelial glycocalyx: acute deficits, but great potential. Cardiovasc. Res. 2010; 87 (2): 300-310. DOI: 10.1093/cvr/cvq137. PMID: 20462866
10. Соловьев И.А., Колунов А.В. Послеоперационный парез кишечника: проблема абдоминальной хирургии. Хирургия. Журн. им. Н.И. Пирогова. 2013; 11: 46-52. PMID: 24300611
11. Стручков Ю.В., Сотников Д.Н., Курилов В.П. Коррекция энтеральной недостаточности при острой кишечной непроходимости. Медицинские науки. 2010; 5: 29-34.
12. Behm B., Stollman N. Postoperative ileus: etiologies and interventions. Clin. Gastroenterol. Hepatol. 2003; 1 (2): 71-80. DOI: 10.1053/cgh.2003.50012. PMID: 15017498
13. Пасечник И.Н., Смешной И.А., Губайдуллин Р.Р., Сальников П.С. Оптимизация инфузионной терапии при обширных абдоминальных операциях. Хирургия. Журн. им. Н.И. Пирогова. 2015; 2: 25-29. PMID: 26031816
14. Johnson M.D., Walsh R.M. Current therapies to shorten postoperative ileus. Cleve. Clin. J. Med. 2009; 76 (11): 641-648. DOI: 10.3949/ccjm.76a.09051. PMID: 19884293
15. Федоров A.B., Чадаев А.П., Сажин A.B., Стегний К.В., Карлов Д.И. Релапароскопия в лечении послеоперационных осложнений. Хирургия. Журн. им. Н.И.Пирогова. 2005; 8: 80 — 85. PMID: 16091686
16. Талалин Л.А., Шаймарданов Р.Ш. Внутрикишечная электростимуляция при распространенном перитоните. Тюменский мед. журнал. 2005; 5: 78.
17. Симоненков А.П., Федоров В.Д., Клюжев В.М., Ардашев В.Н. Применение серотонина адипината для восстановления нарушенной функции гладкой мускулатуры у хирургических и терапевтических больных. Вестн. интенс. терапии. 2005; 1: 53-57.
18. Лямин А.Ю., Никифоров Ю.В., Мороз В.В. Мониторинг внутрибрюшного давления у больных острым панкреатитом. Общая реаниматология. 2006; 2 (5-6): 123-128. DOI: 10.15360/1813-9779-2006-6-123-128
19. Какаулина Л.Н., Верзакова И.В., Мехдиев Д.И. Ультразвуковая диагностика разлитого перитонита. В кн.: Ультразвуковая диагностика острых заболеваний органов брюшной полости. Уфа; 1999: 91.
20. Хубутия М.Ш., Попова Т.С., Салтанов А.И. (ред.). Парентеральное и энтеральное питание. Национальное руководство. М.: ГЭОТАР- Медиа; 2014: 800.
ФАКТОРЫ РИСКА ПОСЛЕОПЕРАЦИОННОГО ПАРЕЗА ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ | Хомяков
1. Гальперин Ю. М. Парезы, параличи и функциональная непроходимость кишечника. М. : Медицина, 1975. 217 с.
2. Грибков Ю. И., Урбанович А. С. Ранняя диагностика и лечение послеоперационного пареза желудочно-кишечного тракта // Хирургия. 1992. № 2. С. 120-123.
3. Лукашевич И. В., Ачкасов С. И., Сушков О. И., Савушкин А. В. Результаты внедрения оптимизированного протокола периоперационного ведения пациентов, перенесших резекцию ободочной кишки // Колопроктология. 2015. № 3. С. 52-59[Lukashevich I. V., Achkasov S. I., Sushkov O. I., Sa vush kin A. V. Rezul’taty vnedreniya optimizirovannogo protokola perio peratsionnogo vedeniya patsientov, perenesshikh rezektsiyu obo dochnoi kishki // Koloproktologiya. 2015. № 3. P. 52-59].
4. Хомяков Е. А., Пономаренко А. А., Рыбаков Е. Г. Неостигмин в лечении и профилактике послеоперационного пареза желудочно-кишечного тракта // Колопроктология. 2016. № 3. С. 91-102.
5. Artinyan A., Nunoo-Mensah J. W., Balasubramaniam S., Gauderman J., Essani R., Gonzalez-Ruiz C. et al. Prolonged postoperative ileus-definition, risk factors, and predictors after surgery // World J. Surg. 2008. № 32. P. 1495-1500.
6. Behm B., Stollman N. Postoperative ileus : etiologies and interventions // Clin. Gastroenterol. Hepatol. 2003. Vol. 2, № 1. P. 71-80.
7. Chapuis P. H., Bokey L., Keshava A. et al. Risk factors for prolonged ileus after resection of colorectal cancer : an observational study of 2400 consecutive patients // Ann. Surg. 2013. № 257. P. 909.
8. Delaney C., Kehlet H., Senagore A. J. et al. Clinical consensus update in general surgery //. 2006. Roswell : pharmatecture, LLC. http://www.clinicalwebcasts.com/pdfs/GenSurg_WEB. pdf.
9. Forbes A. Crohn’s disease : rehabilitation after resection // Dig Dis. 2014. № 32. P. 395-398.
10. Holte K., Kehlet H. Postoperative ileus : a preventable event // Brit. J. Surg. 2000. № 87. P. 1480-1493.
11. Iyer S., Saunders W. B., Stemkowski S. Economic burden of postoperative ileus associated with colectomy in the United States // J. Manag. Care Pharm. 2009. № 15. P. 485-494.
12. Kehlet H. Fast-track colorectal surgery // Lancet. 2008. № 371. P. 791-793.
13. Kronberg U., Kiran R. P., Soliman M. S. et al. A characterization of factors determining postoperative ileus after laparoscopic colectomy enables the generation of a novel predictive score // Ann. Surg. 2011. № 253. P. 78.
14. Livingston E. H. Stomach and duodenum // Chapter in : Norton J. A., Bollinger R. R., Chang A. E. et al. Surgery: basic science and clinical evidence. New York : Springer-Verlag, 2001. P. 489-516.
15. Livingston E. H., Passaro E. P. Postoperative ileus // Dig. Dis. Sci. 1990. № 35 (1). P. 121-132.
16. Millan M., Biondo S., Fraccalvieri D. et al. Risk factors for prolonged postoperative ileus after colorectal cancer surgery // World J. Surg. 2012. № 36. P. 179-185.
17. Moghadamyeghaneh Z., Hwang G. S., Hanna M. H. et al. Risk factors for prolonged ileus following colon surgery // Surg. Endosc. 2016. № 30 (2). P. 603-609.
18. Schwartz’s Principles of Surgery, 8th ed, Brunicardi F. C. (Ed). New York : McGraw Hill, 2005. 2069 p.
19. Svatek R. S., Fisher M. B., Williams M. B. et al. Age and body mass index are independent risk factors for the development of postoperative paralytic ileus after radical cystectomy // Urology. 2010. № 76. P. 1419.
20. Townsend C. M., Beauchamp R. D., Evers B. M., Mattox K. L. Textbook of Surgery. The biological basis of modern surgical practice, 17th ed. Philadelphia : Elsevier Saunders, 2004. 2353 p.
Послеоперационные нарушения функции пищеварительного тракта
Рассматриваются патогенетические и клинические аспекты состояния пищеварительной системы в раннем послеоперационном периоде.
Одной из причин и принципиально важной составной частью дисметаболических изменений у пациентов после хирургических вмешательств является нарушение функций пищеварительного тракта, известное как синдром энтеральной недостаточности (син. — синдром кишечной недостаточности, послеоперационная мальдигестия). Большинство авторов под послеоперационной дисфункцией пищеварительного тракта (при любом ее терминологическом обозначении) понимает невозможность энтерального питания с ограничением или полным исключением абсорбции адекватного количества питательных веществ, возникающую в период 72 часов с момента окончания операции и охватывающую большое число нежелательных явлений от тошноты и рвоты до стойкого пареза, выраженной нутритивной и, в коечном счете, полиорганной недостаточности. При этом принято считать, что послеоперационное нарушение функции пищеварительного тракта, как таковое, является стандартной реакцией на хирургическое вмешательство и в крайних негативных своих проявлениях существенно увеличивает летальность и стоимость лечения.
Нарушение перистальтики в ближайшем послеоперационном периоде является стандартной ситуацией для абдоминальной хирургии и возникает не менее чем у 90% больных. Несмотря на это ряд авторов сообщает о том, что на фоне мультимодального подхода к ведению больных в послеоперационном периоде собственно илеус (динамическая кишечная непроходимость) возникает не более чем у 5% пациентов. Дисфункция пищеварительного тракта является более широким понятием, чем послеоперационный парез, и включает в себя широкий диапазон изменений, зависящих степени хирургической агрессии. Относительно небольшое число иследований включает пациентов с нарушениями функции пищеварительной трубки после экстраабдоминальных оперативных вмешательств. Тем не менее в ряде рандомизированных исследований было продемонстрировано, что экстраабдоминальные оперативные вмешательства сопровождались нарушениями функции пищеварительного тракта, что проявлялось невозможностью полного энтерального питания на протяжении 7 суток у 42 – 51% пациентов. При этом именно нарушение функции пищеварительного тракта являлось основным статистически значимым фактором развития послеоперационных осложнений, пролонгирования и значительного увеличения стоимости госпитализации. Было установлено, что стоимость лечения пациентов с послеоперационными осложнениями, связанными с дисфункцией пищеварительного тракта (14% от исследуемой группы), составила примерно 50% от всей стоимости лечения всех пациентов исследуемой группы.
Патогенез послеоперационной дисфункции пищеварительного тракта представляет собой целый комплекс различных факторов. Синдром энтеральной недостаточности объединяет в себе несколько взаимосвязанных и протекающих последовательно или параллельно патологических процессов в пищеварительном тракте, а именно: нарушение моторики пищеварительной трубки, нарушение внутрипросветного и пристеночного пищеварения, нарушение абсорбции питательных веществ, возникновение феномена бактериальной транслокации. Указанные патологические процессы являются закономерным следствием изменений нейрогуморальной регуляции, системной дисциркуляции и воспаления, развивающихся в ходе ответной реакции на операционную травму. Заметим однако, что дискуссия о патогенезе послеоперационной дисфункции пищеварительного тракта продолжается и в настоящее время, что подтверждается в первую очередь отсутствием четкой доказательной базы в отношении тех или иных лечебных мероприятий.
Традиционно в качестве ведущей составляющей синдрома энтеральной недостаточности у оперированных пациентов рассматривается нарушение моторно-эвакуаторной функции пищеварительного тракта. Исследования, посвященные изучению механизмов возникновения послеоперационного пареза пищеварительной трубки имеют длительную историю. Впервые угнетающее влияние спинальных рефлексов на деятельность кишечника в эксперименте установил еще в 1872 году F. Goltz. В 1899 году в своем классическом труде «The movements and innervation of the small intestine» W. Bayliss и E. Starling показали, что абляция nn. splanchnici может повышать моторную активность кишечника, угнетенную после лапаротомии. Авторы установили данную связь, используя так называемый энтерограф, позволивший им исследовать моторику интактной и поврежденной тонкой кишки в эксперименте. В последующие десятилетия ряд работ подтвердил влияние симпатической нервной системы на возникновение послеоперационного пареза пищеварительной трубки.
С точки зрения современной физиологии нормальная перистальтика является результатом комплекса взаимодействий нервных сплетений пищеварительной трубки, центральной нервной системы, гормональных влияний, локальных факторов, влияющих на гладкомышечную активность. Известно, что перистальтика желудка и тонкой кишки зависит от фазы пищеварения. По сравнению с периодом голодания перистальтика после приема пищи представляет собой набор низкочастотных, с вариабельной амплитудой, несгруппированных сокращений, чьи число, интенсивность и продолжительность зависят от физического состояния и химического состава пищи. Тем не менее и в межпищеварительный период (время голода) так называемый мигрирующий моторный комплекс, впервые описанный J. Szurszewski в 1969году, определяет возникновение периодических сокращений кишечной трубки и тем самым обеспечивает продвижение содержимого просвета кишечника длительное время после приема пищи. У человека подобные сокращения возникают примерно один раз каждые 1 – 2 часа. Мигрирующий моторный комплекс в межпищеварительный период включает в себя четыре фазы. Первая фаза заключается в изменении мембранного потенциала гладкомышечных клеток без мышечного сокращения. Появление перемежающихся мышечных сокращений знаменует переход ко второй фазе. В течение третьей фазы отмечаются максимальные по своей частоте сокращения, следующие за медленными волнами перистальтики (примерно 3 сокращения в минуту для желудка, 11 сокращений в минуту для двенадцатиперстной кишки). Четвертая фаза характеризуется снижением частоты перистальтических волн и возникновением относительного покоя кишечной трубки. Прием пищи нарушает функционирование мигрирующего моторного комплекса с возникновением нерегулярных, различных по частоте и силе сокращений гладкой мускулатуры.
Как известно мышечная оболочка желудка и тонкой кишки представлена тесно ассоциированным клеточным массивом, предполагающим возможность реализации электрофизиологических отправлений. Различают три разновидности электропотенциала мышечной оболочки: потенциал покоя, медленноволновой потенциал и пиковый потенциал, вызывающий гладкомышечные сокращения. При этом пиковый потенциал может возникнуть только при фоновом наличии медленноволнового потенциала, обусловленного активностью кишечного пейсмекера. Мнение об основополагающем и определяющем влиянии гастроинтестинальных гормонов на моторную активность пищеварительной трубки в последние годы подверглось серьезному пересмотру. В настоящее время принято считать, что моторная активность желудка и тонкой кишки определяется комплексом взаимодействий локальных электрофизиологических процессов, нисходящих нервных влияний и действия гастроинтестинальных гормонов.
Толстая кишка, чья основная роль заключается в абсорбции воды и формировании кала, по своей структуре и функционированию от других отделов кишечника. Измерение электрической активности толстой кишки показало наличие нерегулярных импульсов с различной амплитудой. Гладкая мускулатура толстой кишки не содержит достаточного числа специфических межклеточных контактов и поэтому не функционирует как единое целое. В толстой кишке также различают три вида электрической активности: собственно мембранный потенциал, дискретную электрическую активность, представляющую собой периодически возникающие пиковые потенциалы, накладывающиеся на осцилляции мембранного потенциала, и продолжительную электрическую активность, не относящуюся к осцилляциям мембранного потенциала, но определяющую возникновение мышечных сокращений и пассаж пищевых масс.
Хирургические манипуляции на пищеварительной трубке сопровождаются нарушением нормальной базальной электрической активности гладкомышечных клеток желудка и тонкой кишки. В частности в желудке отмечается нерегулярность возникновения пиковой активности и медленноволновой активности. Единственным стимулом перистальтических сокращений кишечника в послеоперационном периоде у пациентов, не получающих энтерально пищевые субстанции, остается мигрирующий моторный комплекс. Поэтому голодание в послеоперационном периоде уже само по себе закономерно влечет наличие минимальной перистальтической активности кишечника.
Установлено, что многие фармакологические агенты, например средства для наркоза, могут оказывать весьма вариабельное воздействие на активность мигрирующего моторного комплекса. Так галотан ингибирует активность мигрирующего моторного комплекса, в то время как энфлюран, напротив — возбуждает. Рассечение париетальной брюшины также уменьшает активность мигрирующего моторного комплекса, а длительное угнетение его активности наблюдается при любых механических воздействиях на кишечник в ходе операции. Вследствие операционной травмы также нарушаются и все три вида электрической активности толстой кишки. При этом восстановление продолжительной электрической активности, определяющей возникновение мышечных сокращений, занимает значительный период времени (около 72 часов после операции) и знаменуется началом отхождения газов и появлением стула. Несмотря на то, что очевидной причиной послеоперационного пареза является сниженная электрическая активность пищеварительной трубки, восстановление электрической активности гладкомышечных клеток не всегда совпадает с разрешением пареза.
Моторика пищеварительной трубки во многом определяется балансом стимулирующих влияний парасимпатического отдела и тормозящих влияний симпатического отдела вегетативной нервной системы. Влияние симпатической нервной системы, являясь эфферентной составляющей многих патологических рефлексов, является определяющим в ингибировании моторной активности кишечника. Механизм симпатического ингибирования заключается в препятствовании освобождению ацетилхолина в синапсах и проведению стимулирующего моторную активность нервного импульса волокнами парасимпатического мезентериального сплетения. Подтверждением этого является возможность нивелирования послеоперационного пареза кишечника и угнетения моторики желудка медикаментозной симпатэктомией с помощью 6-гидроксидопамина. Подтверждением роли симпатической нервной системы в развитии послеоперационного пареза может служить и экспериментально выявленный факт быстрого выхода из кишечного депо катехоламинов в ответ на операционную травму. Тем не менее клинические наблюдения показывают, что блокады симпатических нервных сплетений не всегда успешны в разрешении послеоперационного пареза. Очевидно в этой связи, что в развитии послеоперационного угнетения моторной активности пищеварительной трубки, помимо адренергических и холинергических влияний, играют роль и другие патогенетические механизмы. К настоящему времени доказано влияние на возникновения послеоперационного пареза активации калликреин-кининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ; снижения биологической активности клеток APUD-системы (продуцентов серотонина — субстанции Р и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и определяющих локальную гемоперфузию кишечной стенки; дисрегуляторного поступления секретина, холецистокинина и энтероглюкагона. Так, в качестве факторов, влияющих на развитие послеоперационного пареза, рассматривалось большое число нейротрансмиттеров, локальных регуляторных полипептидов и гормонов, однако не один из них не был признан определяющим. Тем не менее механизмы влияния тех или иных факторов достаточно хорошо изучены и подтверждены экспериментально. Вазоактивный интестинальный пептид (VIP) потенцирует влияние холинэргических нейронов в желудке, что проявляется снижением активности мышечного слоя антрального отдела и пилоруса. Субстанция Р, являющаяся нейротрансмиттером и участвующая в эфферентной ноцицептивной передаче, напротив, оказывает стимулирующее влияние на перистальтику в послеоперационном периоде. Серотонин также усиливает двигательную активность гладкой мускулатуры, благодаря усилению секреции субстанции Р в окончаниях сенсорных нейронов и путем воздействия на ионотропные и метаботропные рецепторы.
В настоящее время известно, что серотонин играет важную роль в регуляции функций желудочно-кишечного тракта. Наибольший запас серотонина в организме находится в желудочно-кишечном тракте, составляя более чем 95 % от серотонина во всем организме. Основная часть серотонина содержится в энтерохроматофинных клетках кишечного эпителия, в пределах которого серотонин синтезируется из L-триптофана и хранится в секреторных гранулах. Серотонин действует как медиатор межнейрональных связей в мышечной оболочке тонкой кишки. Серотонин, выделяемый из энтерохроматофинных клеток, в ответ на химическую или механическую стимуляцию, воздействует на желудочно-кишечную моторику и кишечный транспорт электролитов. Перистальтика различных отделов кишечника координируется нейронами тонкокишечной нервной системы, которые после активации серотониновых механизмов продуцируют другие медиаторы. Помимо этого серотонин, находящийся в энтерохроматофинных клетках, регулирует рост соседних эпителиоцитов и может замедлять кишечное поглощение сахара и L-альфа-аминоизокапроновой кислоты (И.А. Соловьев, 2013).
В 2003 году А.П. Симоненков и соавт. представили патогенетическую концепцию серотониновой недостаточности как ключевого фактора развития синдрома энтеральной недостаточности, в том числе и в послеоперационном периоде. Согласно данной концепции, дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. На основании экспериментальных и клинических исследований установлено, что при патологических состояниях в организме увеличивается количество лигандов серотониновых рецепторов. Антагонисты серотонина при взаимодействии с серотониновыми рецепторами вызывают паралич гладкой мускулатуры. Агонисты напротив вызывают спазм гладкой мускулатуры. Согласно данной концепции дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Всё это ведёт к растяжению кишечных петель и повышению внутриполостного давления, приводя к повреждению, как всей пищеварительной системы, так и других функциональных систем гомеостаза.
Оксид азота (NO) в настояще время рассматривается как наиболее значимый нехолинергический и неадренергический ингибитор мышечной активности пищеварительной трубки. Считается, что свое ингибирующее действие NO оказывает внутри кишечных нейронов вследствие активизации NO-синтетазы. В экспериментах показано, что антагонист вазоактивного интестинального пептида, субстанция Р, и ингибиторы NO-синтетазы, достоверно усиливают кишечную перистальтику. Кальцитонин ген-связанный пептид присутствует в афферентных нейронах пищеварительного тракта, а также в интерстициальных рецепторах. Показана роль кальцитонин ген-связанного пептида в замедлении перистальтики и, в частности, в задержке эвакуации из желудка. Предполагается, что высвобождение кальцитонин ген-связанного пептида стимулируется операционной травмой и реализуется в замедлении перистальтики, что подтверждается влиянием антагонистов рецепторов данного медиатора или специфических моноклональных тел к нему на активизацию моторной активности пищеварительной трубки.
Эндогенные опиоиды, в большом количестве высвобождаемые в ответ на операционную травму, также рассматриваются как фактор возникновения послеоперационного пареза. Их тормозящий эффект на моторную активность желудка и кишечника реализуется посредством активации мю-опиоидных рецепторов. Так энкефалин вызывает угнетение желудочной и кишечной перистальтики и считается одним из факторов возникновения послеоперационного пареза.
Как обсуждалось выше кортикотропин-релизинг фактор (КРФ) является одним из ключевых медиаторов любой стрессовой реакции организма. Установлено, что КРФ и КРФ-связанный пептид индуцируют задержку эвакуации из желудка и ингибируют кишечную перистальтику, создавая картину, аналогичную послеоперационному парезу. При этом замедление перистальтики не зависит от приема питательных субстанций как энтерально, так и парентерально. В эксперименте было показано, что введение антагонистов КРФ-рецепторов перед оперативным вмешательством исключает возникновение пареза даже в случае механического воздействия на кишечник как минимум в течение 3 часов после операции. Отмечено повышение плазменного уровня КРФ в ответ на операционную травму, однако место синтеза данного медиатора до настоящего времени не установлено. Известно лишь, что данный пептид имеется в мозговом слое надпочечников, а активность чревных нервов и гормональная стимуляция катехоламинами является триггером к его высвобождению в кровоток. Отмечено также, что вазопрессин, выделяемый в ответ на физический стресс, может способствовать высвобождению КРФ.
В 2001 году N. Schwarz в эксперименте установил факт увеличения экспрессии циклооксигеназы 2 типа (ЦОГ-2) в тканевых макрофагах и нейронах кишечной стенки после механических манипуляций на кишечной трубке, что сопровождается увеличением концентрации простагландинов в перитонеальной жидкости и в плазме. При этом повышение концентрации простагландинов коррелирует со степенью снижения моторной активности кишечника, а ингибиторы ЦОГ-2 восстанавливают моторику кишечной трубки.
Как указывалось выше целый ряд средств анестезиологического пособия оказывают выраженное влияние на послеоперационные изменения моторики пищеварительного тракта. Известно, что средства для наркоза оказывают наибольшее ингибирующее влияние на моторику толстой кишки, что связано с особенностями ее автономной иннервации, а именно — с отсутствием плотных интрацеллюлярных контактов в гладкомышечном слое. Задержка эвакуации из желудка наиболее часто наблюдается при длительном воздействии препаратов, используемых при проведении нароза, таких как атропин, галотан, энфлюран.
Эпидуральная анестезия способна блокировать афферентные и эфферентные рефлексы, ингибирующие перистальтику, увеличивать спланхнический кровоток и оказывать противовоспалительное действие. Помимо этого еще одним положительным фактором проведения эпидуральной анестезии является способность к блокаде афферентных стимулов, служащих триггерами для развития эндокринной и метаболической реакции на стресс, что опосредованно снижает интенсивность послеоперационного катаболизма. Многочисленными исследованиями показано, что эпидуральная анестезия бупивокаином (за исключением нижне-грудного и поясничного уровней) достоверно снижает выраженность послеоперационного пареза пищеварительного тракта по сравнению с системным или эпидуральным введением опиоидов. Сами по себе опиоиды оказывают выраженный ингибирующий эффект на моторную активность желудка, вызывая при этом гипертонус его антрального отдела и проксимальной части двенадцатиперстной кишки. Влияние опиоидов на тонкую кишку более сложно. Морфин имеет двухфазное действие: 1) инициальная стимуляция моторики кишечника при активации третьей фазы мигрирующего моторного комплекса, 2) возникновение атонии мышечного слоя кишечной трубки. Морфин повышает тонус и амплитуду непропульсивных сокращений и снижает выраженность пропульсивных волн в толстой кишке, что в целом сопровождается снижением ее моторной активности. Вместе с тем использование антагониста опиоидных рецепторов налоксона оказывается неэффективным в лечении послеоперационного пареза. С другой стороны новые антагонисты опиоидных рецепторов, не оказывающие центрального действия (метилналтрексон) в клинических исследованиях зарекомендовали себя как средства, способствующие разрешению пареза на фоне системной анальгезии морфином. Новые агонисты опиоидных рецепторов k (ADL-8-2698), обладая анальгетическими свойствами опиоидов, при этом не оказывают влияния на перистальтику кишечника и даже способствуют раннему разрешению послеоперационного пареза.
Нарушение моторики пищеварительной трубки, а именно – возникновение ее пареза, определяет нарушение пассажа химуса, возникновение внутрипросветного дисбаланса его жидкой и газовой фаз, влекущего за собой, помимо нарушения всасывания, изменение микробной флоры кишки и проницаемости кишечной стенки.
Согласно патогенетической концепции, изложенной И.П. Колесник (2007), непосредственно после возникновения пареза пищеварительной трубки, несмотря на глубокое угнетение ее моторной функции, вследствие сохранности гемоциркуляции в кишечной стенке скопления газов и жидкости в просвете кишки не происходит. При этом процессы всасывания, моррфологическая структура эпителиоцитов слизистой оболочки тонкой кишки и микроциркуляции в кишечной стенке не нарушены. При сохранении пареза нарушение абсорбции начинается с угнетения всасывания сначала газов, а затем воды, электролитов и мономеров основных питательных веществ. Происходит растяжение кишечных петель и скопление в просвете кишки больших объемов газа и жидкости. Морфологические исследования выявляют выраженные изменения со стороны эпителия ворсинок и сосудов микроциркуляции, что проявляется нарушением оттока из ворсин по венам и лимфатическим сосудам, что при сохранности артериального притока ведет к увеличению фильтрационной секреции в просвет кишечной трубки и нарушению всасывания. Данный процесс принято обозначать термином «внутрипросветная секвестрация жидкости». В дальнейшем прогрессирование нарушения моторной и эвакуаторной функции приводит к нарушению всасывания газов и дальнейшему повышению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что в свою очередь обуславливает дальнейшее растяжение кишечных петель и нарушение артериальной перфузии кишечной стенки.
Возникновение ишемии пищеварительной трубки в послеоперационном периоде является закономерным следствием системной дисциркуляции и по мнению целого ряда авторов играет решающую роль в развитии синдрома энтеральной недостаточности. К основным причинам ишемизации стенки кишечника (вообще и в послеоперационном периоде — в частности) относят системное токсическое влияние медиаторов воспаления (цитокины, активированные нейтрофилы, свободные кислородные радикалы), нарушение микроциркуляции и периферического шунтирования крови (нарушение реологии, чрезмерный выброс цитокинов и вазоактивных веществ, активация эластиназы), системные нарушения кровоснабжения кишечника (централизация кровообращения, артериальная гипотония, снижение сердечного выброса), анатомические особенности кровоснабжения слизистой кишечника («феномен шпилькообразной петли и сепарации плазмы»), открытие артериоло-венулярных шунтов и выключение из кровообращения части микрососудистой сети, перивазальные изменения в виде отека тканей, лейкоцитарной инфильтрации и микрогеморрагий.
Очевидно, что перфузия кишечной стенки ухудшается по мере повышения внутриполостного кишечного давления. А.А. Курыгин и совт. (2007) указывают на то, что критическое давление в просвете кишки составляет 30 мм рт. ст. При повышении давления до 40-60 мм рт. ст. почти вся кровь минует интрамуральную капиллярную сеть и шунтируется в венозное русло. При этом нарушения регионарного кровообращения и микроциркуляции ведут к недостаточной доставке кислорода и энергетических субстратов к тканям стенки кишки, в результате чего развиваются вторичная тканевая гипоксия и глубокие нарушения метаболических процессов. Ишемия приводит к анаэробному метаболизму, ацидозу, исчерпанию энергетических запасов клетки и необратимым её изменениям. Снижается активность дыхательных ферментов клетки, уменьшается образование макроэргов. Активизируются распад тканевых липидов, катаболизм белков, дезаминирование и переаминирование аминокислот. Нарушение процесса окислительного фосфорилирования, который происходит в митохондриях, может приводить к переходу клетки на анаэробный метаболизм даже в присутствии кислорода. На сегодняшний день общепризнанной является точка зрения, согласно которой максимальное повреждающее действие на ткани оказывает не столько ишемия, сколько феномен реперфузии. В условиях восстановленного кровотока в присутствии кислорода фермент ксантиноксидаза преобразует гипоксантин в ураты и кислородные радикалы (О2‾, ОН+), запускающие процесс перекисного окисления тканей. Причем, это явление происходит не только при абсолютной, но и на фоне относительной гипероксии. Происходят активация перекисного окисления липидов, приводищее, в первую очередь, к повреждению клеточных мембран, состоящих из фосфолипидов. Перекисное окисление белков вызывает инактивацию ферментов; углеводов — деполимеризацию полисахаридов, составляющих основу межклеточного вещества. Кроме того, при реперфузии повреждающим механизмом является перемещение ионов кальция внутрь клетки. При этом разрушаются рибосомы с последующим нарушением синтеза белка и АТФ, развивается вазоспазм, активируется метаболизм арахидоновой кислоты, что приводит в результате к усилению расстройств микроциркуляции и нарушению проницаемости мембран. По А.П. Зильберу (1995) возросшая в условиях ишемии осмолярность тканей (на 40—50 мосм) после восстановления кровотока способствует привлечению воды в чрезмерно большом количестве, что неизбежно приводит к развитию отека тканей.
Морфологическими проявлениями нарушения гемоперфузии кишечной стенки является разрушение микроворсинок щеточной каймы, гликокаликса и самой цитоплазматической мембраны с выходом в просвет кишки цитоплазматических органелл и включений, а также к расширение межклеточных контактов и разрыхлению самой плазмоллемы. При длительной гипоксии кишечной стенки выявляются некроз и слущивание энтероцитов в просвет кишки, в глубокие дистрофические изменения структуры миоцитов и клеток серозной оболочки. При этом возникает утрата эпителиальной целостности слизистой оболочки с формированием эрозий и язв.
Следствием гипоксии кишечной стенки и дистрофических изменений в ее мышечном слое является нарушение проводимости в интрамуральных нервных сплетениях и резкое снижение сократительной способности гладкомышечных клеток. Данная ситуация в еще большей степени усугубляет парез пищеварительной трубки и тем самым усиливает нарушение ее гемоперфузии, замыкая circulus vitiosus.
Нарушение пассажа кишечного содержимого практически сразу же влечет за собой нарушение микробного пейзажа кишечника. При этом имеет место восходящая миграция толстокишечной микрофлоры и избыточная (от 10 4 до 10 12 КОЕ/мл) бактериальное обсеменение тонкой кишки, обозначаемая в литературе как синдром избыточной бактериальной колонизации. Гиперпролиферация условно-патогенных бактерий сопровождается усилением бродильных процессов и повышением газообразования, что определяет дальнейшее повышение внутрипросветного давления с растяжением кишечной стенки. Происходит избыточное образование высокотоксичных веществ: индола, скатола, кадаверина. Дополнительное повреждающее действие на кишечную стенку оказывают и образующиеся в процессе микробного метаболизма аммиак и сероводород. Вследствие гипоксии и нарушения кровообращения подавляется биосинтез муцина и эпителий слизистой повреждается ферментами. Прогрессирующие деструктивные процессы слизистой оболочки, а именно — разрушение слоя слизи и гликокаликса, щеточной каймы и самих энтероцитов, деструкция базальной мембраны и собственной пластинки слизистой, приводят к утрате кишечной трубкой барьерной функции и возникновению феномена бактериальной транслокации. Лимфоидная ткань пищеварительной трубки в норме предотвращает внедрение инфекционных агентов во внутреннюю среду организма. В экспериментах установлено, что при стимуляции моторики усиливается синтез IL-4 и IL-10 собственной оболочкой тонкого кишечника, что увеличивает продукцию IgA на поверхности слизистой и ингибирует внутриклеточную молекулу адгезии — 1 (ICAM-1) сосудистого эндотелия и последующие нейтрофил-ассоциированное воспаление и повреждение. При возникновении пареза кишечной трубки утрачивается антагонистическая активность эпителия по отношению к патогенным микроорганизмам. Усиленное их размножение и активное функционирование нарушают транспорт электролитов и усиливают секрецию в просвет кишки. Происходит адгезия микробов к кишечному эпителию с последующим внедрением в энтероциты, под базальную мембрану и собственную пластинку. При этом экзо- и эндотоксины микробных клеток, сами бактерии и токсичные продукты их метаболизма проникают в лимфатическое русло и кровоток, определяя резкое усугубление системной воспалительной реакции. Нарушение барьерной функции кишечника принято рассматривать как принципиально важное звено в патогенезе синдрома системного воспалительного ответа и полиорганной недостаточности, индуцированных воспалительными цитокинами. В настоящее время именно бактериальной транслокации придаётся ведущая роль в насыщении организма эндотоксином (с включением липополисахаридного комплекса), являющимся основным индуктором развития синдрома системного воспалительного ответа, абдоминального сепсиса и полиорганной недостаточности. Считается, что с интенсивностью бактериальной транслокации связаны характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции.
В результате сочетанного действия вышеуказанных факторов энтеральной недостаточности развиваются имеющие принципиальное значение в нарушении системного метаболизма нарушение полостного и пристеночного пищеварения и нарушение всасывания питательных веществ. Динамическое исследование амилолитической активности слизистой оболочки всех отделов тонкой кишки в ранние сроки после операций большого объема позволило выявить функциональные нарушения процессов полостного, пристеночного и внутриклеточного пищеварения и структурные изменения в стенке органа, обусловленные тяжелыми послеоперационными расстройствами микроциркуляции. При этом первоначально отмечается повышение ферментативной активности слизистой, что многие авторы склонны расценивать как компенсаторно-приспособительный механизм, обеспечивающий усиление переваривания поступающих в пищеварительный тракт нутриентов и всасывания мономеров в критических состояниях. А. М. Уголевым и соавт. (1995) в эксперименте было доказано, что имеет место отрицательная корреляция между повышением активности полостной фракции фермента и одновременным снижением активности фракций фермента щеточной каймы слизистой оболочки тонкой кишки, и наоборот. У больных после резекции желудка увеличивается содержание энтерокиназы и щелочной фосфатазы в кишечном содержимом, а после гастрэктомии активность этих ферментов в тощей кишке в 6-8 раз превышает показатели у здоровых людей. Данные компенсаторные возможности ферментовыделительной функции тонкой кишки зависят от состояния питания организма. У истощенных субъектов с исходными нарушениями деятельности пищеварительной системы значительного увеличения активности ферментов не наступает. Согласно данным, полученным Л.О. Барской и соавт. (2013), уже через 6 часов после операции большого объема выявляется значительное повышение активности полостной фракции амилазы во всех отделах тонкой кишки на фоне явного снижения активности десорбируемых фракций щеточной каймы дистальных отделов органа. По мнению исследователей это следует расценивать как компенсаторно-приспособительную реакцию слизистой оболочки тонкой кишки в ответ на чрезмерное поступление панкреатического сока в полость двенадцатиперстной кишки, тем более что на данном сроке послеоперационного периода структурных изменений в стенке тонкой кишки выявлено не было. Однако к 12 часам послеоперационного периода в двенадцатиперстной кишке на фоне повышенной активности полостной амилазы выявляется значтельное повышение внутриклеточной фракции фермента, что свидетельствует о нарушении прочности связей фермента с мембраной энтероцитов и поступлении его в полость кишки, суммируя эффект нарастания активности поджелудочной фракции амилазы. Кроме этого, нарушаются процессы адсорбции в щеточной кайме, обусловленные ее гипоксическим, ишемическим и реперфузионным повреждением. Однако уже спустя сутки после операции на фоне высокой активности полостной амилазы возрастает активность всех фракций фермента тонкой и подвздошной кишок, а морфологические проявления нарушений микроциркуляции носят неравномерный характер и приходятся на зоны максимального скопления сосудов. Они выражаются деструктивными изменениями слизистой оболочки в местах максимальной плотности микрососудов и нарастанием отека периваскулярных образований собственной пластинки и подслизистого слоя тонкой кишки. Все эти структурные изменения отражаются и на функциональном состоянии щеточной каймы: вследствие резкого уменьшения площади пищеварения снижается адсорбционная способность и угнетаются процессы пристеночного гидролиза полисахаридов. В последующие сутки послеоперационного периода на фоне достаточно высокой активности панкреатической фракции амилазы прогрессирует повышение активности всех фракций щеточной каймы тонкой кишки, что свидетельствует о снижении адсорбционной способности и угнетении процессов пристеночного пищеварения. Данные функциональные изменения имеют структурную основу: в эти сроки наблюдаются деструктивные изменения всех отделов тонкой кишки, а именно поверхностные эрозии слизистой оболочки с отсутствием в них ворсин. К 7-м суткам отчетливо выражены процессы репаративной регенерации кишечных ворсин. Однако данный эпителий морфологически незрел, а значит, и неспособен выполнять свою специфическую пищеварительную функцию в условиях послеоперационного периода. А.А. Курыгин и совт. (2003) считают, что, благодаря компенсаторным процессам, максимальный уровень снижения амилолитической активности в первые дни после операций на проксимальном отделе пищеварительной трубки не превышает 50 %. В течение 10 сут после операции полного восстановления функций энтероцитов проксимального отдела тощей кишки не происходит, однако уровень амилолитической активности позволяет проводить энтеральное зондовое питание не только моно- и олигосахаридами, но и полисахаридами.
В раннем послеоперационном периоде происходят выраженные изменения условий функционирования гидролитического механизма тонкой кишки во всех его основных звеньях — синтез кишечных ферментов, транслокация, встраивание в апикальную мембрану энтероцитов, а также адсорбция ферментов (преимущественно панкреатических) из полости кишечной трубки. Недостаточное образование ферментов, расщепляющих белки, транспортных переносчиков конечных продуктов пищеварения через кишечную стенку приводит к дефициту аминокислот и белковому голоданию организма. Дефекты процесса гидролиза, расстройство всасывания и утилизации углеводов обусловливают дефицит моно- и дисахаридов. Нарушение процессов расщепления и всасывания липидов усиливает стеаторею. Патология слизистой оболочки наряду с дисбактериозом кишечника, пониженной секрецией панкреатической липазы и нарушением эмульгирования жиров желчными кислотами ведут к недостаточному всасыванию жиров. Расстройство всасывания жира возникает и при избыточном поступлении солей кальция и магния. На дефицит водо- и жирорастворимых витаминов, железа, микроэлементов, связанный с изменением всасывания этих веществ обращают внимание многие исследователи.
Большинство современных исследователей, рассматривая проблему послеоперационной мальдигестии, акцентируют внимание на высокой чувствительности самой тонкой кишки к белково-энергетической недостаточности питания, связанной с ежедневными специфическими потерями питательных веществ из-за необходимости перманентного обновления кишечного эпителия (период полного обновления составляет в среднем 2-3 дня). Известно, что тонкая кишка получает питание не только из системы кровообращения, но и непосредственно из собственного просвета не менее чем на 50%, а толстая — не менее чем на 70%. Энтероциты страдают без поступления важнейших веществ, содержащихся обычно в химусе, при сбалансированной диете, включающей основные нутриенты, а также витамины, витаминоподобные вещества, микроэлементы и антиоксиданты. При отсутствии поступления и расщепления пищевых субстанций в прсвете кишечной трубки формируется еще один порочный круг. Патологический процесс в тонкой кишке при недостаточном поступлении нутриентов в энтероциты характеризуется истончением слизистой оболочки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением верхних отделов тонкой кишки бактериями, что приводит к еще более выраженным трофическим нарушениям в самой слизистой. Клинические наблюдения свидетельствуют о том, что при длительном парентеральном питании возникает выраженная атрофия секреторных желез слизистой, появляется прогрессирующая ферментная недостаточность, нарушается экскреция желчи. При этом помимо слизистой оболочки страдает ассоциированная с кишечником лимфоидная ткань, нарушается биоценоз и усиливается бактериальная транслокация.
Параллельно в патогенез синдрома энтеральной недостаточности включается угнетение резорбции жидкости из просвета кишки, полностью прекращающаяся при повышении внутрикишечного давления примерно до уровня диастолического давления крови. В просвет кишки поступают значительные объемы жидкости. Помимо транссудации, большую роль играет усиленная, так называемая «паралитическая», секреция кишечных желез. В гастродуоденальной зоне она возрастает до 120 мл/час (норма 30-35 мл/час), в тонкой кишке – до 65 мл/час (норма 1,5 мл/час). Вместе с жидкостью в просвет кишки поступает значительное количество электролитов и белка, прежде всего калия и альбуминов из-за относительно небольшого размера их молекул. Принято считать, что снижение абсорбционной способности кишечной трубки связано с цитоплазматической перегрузкой кальцием и истощение запасов АТФ в эпителиоцитах, со сниженной активностью ферментов щеточной каймы, с уменьшением всасывательной поверхности эпителия, а также с гипоальбуминемией. Введение в просвет кишки легкоусваиваемых питательных веществ (олиго- и мономеров) сохраняет запасы АТФ в энтероцитах, защищает от повреждения слизистую и улучшает ее абсорбирующую способность. С другой стороны вследствие повреждения структуры слизистой оболочки тонкой кишки изменяется ее пассивная проницаемость, благодаря чему крупные макромолекулы могут проникать в субэпителиальные ткани, повышается вероятность функционального повреждения межклеточных связей.
Во многом нарушение пищеварения при синдроме энтеральной недостаточности связаны с избыточной бактериальной колонизацией тонкой кишки. При этом бактериальная флора действует как конкурент макроорганизма в метаболизации пищевых субстратов и секрета кишки, нарушая таким образом процессы полостного пищеварения и переваривания пищевых веществ. Кроме того, имеются данные о поражении микробами щеточной каймы и гликокаликса энтероцитов, в результате чего нарушаются процессы мембранного пищеварения и всасывания. Посредством гидролитических ферментов кишечных бактерий происходит замена собственного пищеварения симбионтным и интенсивное образование биологически активных среднемолекулярных пептидов. В свою очередь низкомолекулярные фракции этих соединений, поступая через нарушенный кишечный барьер в кровь и лимфу, оказывают системный провоспалительный эффект и локальное воздействие, провоцируя вазодилатацию и повышение проницаемости капиллярной стенки. Таким образом избыточная бактериальная колонизация значительно усугубляет и без того имеющиеся нарушения полостного пищеварения, переваривания в слоях слизи, мембранного пищеварения и всасывания, которые в свою очередь способствуют прогрессированию гиперпролиферации бактериальной флоры. Следует отметить, что помимо нарушения пищеварительной функции избыточная бактериальная колонизация имеет отношение и к нарушению процесса абсорбции питательных веществ. Нарушение всасывания белков при гиперколонизации возникает вследствие собственно утилизации пищевых белков бактериями, вызванных микробной инвазией функциональных расстройств слизистой оболочки со значительным уменьшением всасывания аминокислот, а также вследствие потери белков при усиленной транссудации. Мальабсорбция углеводов при этом также относится к многофакторным процессам, включающим внутриполостной бактериальный катаболизм и нарушение всасывания. Доказано, что некоторые виды бактерий, особенно В. fragilis, С. perfringens и S.faecalis, содержат протеазы, способные удалять мальтазу из щеточной каймы, а некоторые виды бактероидов образуют протеазы, разрушающие дисахаридазы щеточной каймы энтероцитов человека. Наиболее частым проявлением избыточной бактериальной колонизации тонкой кишки является мальабсорбция жиров, которая клинически проявляется стеатореей, когда с фекалиями выделяется больше жиров, чем поступает с пищей. При наличии способных к деконъюгации бактерий концентрация связанных желчных солей снижается, что собственно и приводит к недостаточному образованию мицелл, мальабсорбции жиров и стеаторее. Нарушение метаболизма жирных кислот в свою очередь определяет нарушение всасывания жирорастворимых витаминов A, D, Е, К.
Очевидно, что в наибольшей степени выраженные нарушения пищеварения отмечаются у пациентов после операций на структурах пищеварительного тракта. Из курса нормальной физиологии нам известно, что кишечное переваривание и всасывание белков, углеводов, жиров и других нутриентов начинается в двенадцатиперстной кишке и почти заканчивается в пределах первых 120–150 см тощей кишки. Тонкая кишка получает дополнительно 6–8 л жидкости ежедневно, 80% которой всасывается в дистальной части подвздошной кишки. Подвздошная кишка является единственным местом всасывания витамина В12 и солей желчных кислот. Только от 1,5 до 2 л жидкости входит в толстую кишку, где все, за исключением 150 мл, реабсорбируется. Данные факты объясняют возникновение умеренной диареи после обширной резекции тощей кишки. И напротив, полная резекция подвздошной кишки приводит к большим расстройствам всасывания, и диарея зависит не от повышенного объема жидкости, входящей в толстую кишку, а и от солей желчных кислот и невсосавшихся жирных кислот, достигающих толстой кишки и вызывающих диарею и стеаторею со значительной потерей жирорастворимых витаминов. Сохранение толстой кишки способствует ферментации растворимых пищевых волокон до короткоцепочечных жирных кислот, таким образом повышая всасывание энергетических субстратов на 5%.
После обширной резекции тонкой кишки возникает значительный дефицит всасывающей поверхности, снижается стимуляция функций поджелудочной железы секретином и холецистокинином, синтез которых в оставшейся после резекции кишке снижается. При резекции дистальных отделов подвздошной кишки с удалением или выключением илеоцекальной области бактериальная флора из толстой кишки легко проникает в тонкую, в результате чего может развиться синдром избыточной бактериальной колонизации тонкой кишки со свойственным ему синдромом мальабсорбции и мальдигестии. Развитию энтеральной недостаточности после резекции тонкой кишки способствует ускорение транзита химуса по укороченной кишке, как было сказано выше, наиболее выраженное после резекции подвздошной кишки.
По данным А.А. Курыгина и соавт. (2003) абсолютной зависимости между тяжестью синдрома мальабсорбции и объемом резекции тонкой кишки нет, если удаляется менее половины ее длины. Состояние пищеварения после операции зависит от многих факторов. Основными из них являются: протяженность и локализация резекции, сохранение илеоцекального отдела кишечника, вариант межкишечного анастомоза (тонко-тонкокишечный или тонко-толстокишечный), морфологическое и функциональное состояния слизистой оболочки тонкой кишки до операции, состояние желудка, печени и поджелудочной железы. Резекция 40 % тонкой кишки хорошо переносится больными при условии сохранения двенадцатиперстной кишки, дистальной половины подвздошной и илеоцекального сфинктера. Резекция дистальных отделов подвздошной кишки с илеоцекальной областью может вызвать выраженную диарею и мальабсорбцию, если удалено даже менее 25 % тонкой кишки. Резекция более 50 % тонкой кишки приводит к выраженной энтеральной недостаточности, а 70 % и более — к катастрофическим последствиям.
Безусловно, на функционирование пищеварительного тракта влияют резекция его анатомических образований и те или иные варианты реконструкции пищеварительной трубки. Так M. Chang et al. (2013), анализируя изменения функционирования пищеварительного тракта после гастропанкреатодуоденальной резеции, отметил, что дуоденэктомия не только разрушает согласованную работу мигрирующего моторного комплекса желудка и кишечника, но и нарушает взаимосвязь пищеварительной моторики и панкреатической секреции, циклические колебания уровня гастроинтестинальных гормонов в плазме крови в межпищеварительном периоде. С другой стороны А.А. Курыгин и соавт. (2003) на основании анализа функциональных результатов операций на гастродуоденальной зоне пришли к выводу о том, что действительно как в ранние, так и в отдаленные сроки после резекции желудка всегда имеются те или иные функциональные расстройства тонкой кишки. Эти изменения у разных больных могут касаться различных функций (в первую очередь тех, нарушения которых уже имелись до операции), могут быть выражены в различной степени (нередко на субклиническом уровне), но в большинстве случаев не вызывают значительных диспепсических расстройств благодаря компенсаторным механизмам органов пищеварительной системы.
Таким образом послеоперационные нарушения функции пищеварительного тракта, являясь закономерным следствием нейро-гуморальных составляющих системного ответа на операционную травму, с одной стороны определяют возникновение дефицита экзогенных питательных субстанций, что в свою очередь, усугубляет процессы катаболизма с расходованием эндогенных источников энергии и пластического материала, а с другой стороны — возникновением бактериальной транслокации, продукцией цитокинов и эйкозаноидов способствуют прогрессированию системной воспалительной реакции.
Статья добавлена 27 января 2016 г.
DoctorSPB.ru — информационно-справочный портал о медицинеDoctorSPB.ru — информационно-справочный портал о медицине, здоровье и красоте. Методы лечения ВИЧ,СПИД и гепатита,обзор фармакологических препаратов.Диагностика венерических заболеваний. На сайте размещены учебные медицинские фильмы,медицинские книги и методические пособия, рефераты и историй болезней для студентов и практикующих врачей. Задачей медицинской генетики является выявление и профилактика наследственных болезней. Генетика человека изучает явления наследственности и изменчивости в популяциях людей, особенности наследования нормальных и патологических признаков, зависимость заболевания от генетической предрасположенности и факторов среды.Читать полностью… Для диагностики острого инфаркта миокарда довольно широко использовалось определение в крови концентрации миоглобина. Специфичным лабораторным тестом острого инфаркта миокарда является определение МВ-фракции КФК. Любые кардиохирургические вмешательства, включая коронароангиографию, катетеризацию полостей сердца и электроимпульсную терапию, как правило, сопровождаются кратковременным подъемом активности МВ-фракции КФК. Читать полностью… Болезни печени сопровождаются рядом лабораторных синдромов. При анализе результатов биохимического исследования у больных с заболеваниями печени целесообразно выделять четыре лабораторных синдрома, каждый из которых в известной степени соответствует определенным морфологическим и функциональным изменениям в органе: цитолитический синдром, мезенхимально-воспалительный синдром, холестатический синдром (синдом холестаза), синдром малой печеночно-клеточной недостаточности. Обычно в каждом конкретном случае заболевания имеет место сочетание нескольких биохимических синдромов. Читать полностью… В настоящее время продолжается интенсивный поиск новых препаратов, обладающих анксиолитическим действием и вместе с тем более безопасных и эффективных, чем существующие лекарственные средства. Транквилизаторы – это особая группа психотропных средств, которые уменьшают или устраняют страх, тревогу, беспокойство, раздражительность, эмоциональную напряженность, выраженность эмоциональной насыщенности переживаний, то есть оказывают антиневротическое действие. Читать полностью… Боль в животе практически во всех случаях достаточно серьезное явление, к которому нельзя относиться безразлично. При заболеваниях желудка боли беспокоят в верхней половине живота. Боль обуславливается повышением секреторной и моторной функции. К болевым синдромам относится «гиперсекреторный невроз», описанный Райхманом. для него характерна повторная рвота с большим количеством кислого содержимого в сочетании с резкой болью. Чаще приступы возникают натощак и ночью, могут сопровождаться развитием гипохлоремической тетании, напоминают картину гипергатросуккореи, характерную для пилородуоденальной локализации язвенной болезни. Читать полностью… Внутривенное введение сверхвысоких, ударных доз глюкокортикостероидных гормонов, или пульс-терапия, получило наибольшее распространение в медицине критических состояний – септический шок, астматический статус, острый инфаркт миокарда с развитием синдрома Дресслера, отек Квинке, отек мозга, синдром Лайела, рассеянный склероз и др. Стандартным считается применение пульс-терапии для профилактики и купирования криза отторжения трансплантата. Именно успешное применение пульс-терапии у больных с кризом отторжения, в основе которого лежит целый ряд иммунных нарушений, послужило основой для использования пульс-терапии у больных с аутоиммунными ревматическими заболеваниями. Читать полностью… Основным элементом дегенерации межпозвонкового диска является уменьшение количества протеингликанов. Происходит фрагментация аггреканов, потеря глюкозаминогликанов, что приводит к падению осмотического давления и, как следствие, дегидратации диска. Однако даже в дегенерированных дисках клетки сохраняют способность к продуцированию нормальных аггреканов. Одной из основных причин дегенерации межпозвонкового диска является нарушение адекватного питания его клеточных элементов. In vitro было показано, что клетки межпозвонкового диска достаточно чувствительны к дефициту кислорода, глюкозы и изменению pH. Читать полностью… Дисбиозы – это микроэкологические нарушения, которые выражаются в нарушениях состава и функций нормальной микрофлоры. Состояние здоровья человека во многом определяется его микрофлорой. Именно поэтому современные стоматологи уделяют такое внимание проблеме дисбиоза и дисбактериоза полости рта. В полости рта и глотке человека встречается более 300 видов микробов. Читать полностью… Это лечение больных сифилисом с установленным и подтвержденным диагнозом. Арсенал применяемых противосифилитических препаратов включает: (1) антибиотики, которые в свою очередь подразделяются на антибиотики выбора и антибиотики резерва, а также (2) препараты висмута и йода, которые применяют значительно реже. Поскольку лечение сифилиса проводится почти исключительно антибиотиками, то до начала терапии необходимо собрать аллергологический анамнез в отношении их переносимости, а перед первыми инъекциями назначить антигистаминные средства. Читать полностью… Снижение массы тела не является самостоятельным диагнозом – этот симптом лишь свидетельствует о происходящем в организме патологическом процессе. Вместе с массой тела человек теряет и компенсаторные возможности, становясь уязвимым к любым неблагоприятным воздействиям окружающей среды. Поэтому любой случай похудения заслуживает адекватного внимания и лечения. Читать полностью… Pin-Up onlayn kazino ən populyar oyun portalı halına gəldi və https://dreamhomeworks.co/ veb saytında fəxrlə yer aldı ki, resurs rəhbərliyi oyunçular üçün rahat şəraitlər yaratdı. Читать полностью… |
Парез кишечника и функциональная кишечная непроходимость
В литературе нет единого термина для обозначения состояния, возникающего в результате нарушения моторной деятельности кишечника в послеоперационном периоде. Это состояние называют «послеоперационным метеоризмом», «динамической кишечной непроходимостью», «функциональным стазом кишечника», «послеоперационной функциональной кишечной непроходимостью». Однако в настоящее время все чаще используется термин послеоперационный парез кишечника, который указывает на то, что ведущим является нарушение двигательной функции кишечника, появившееся в послеоперационном периоде.
Парез кишечника является актуальной проблемой ургентной и плановой хирургии. Это связано с высокой частотой этого осложнения после хирургических операций на органах живота и забрюшинного пространства – от 6,7 до 50% и трудностями его лечения (Нечай А.И. и соавт., 1981; Аскерханов Р.П. и соавт., 1986; Kern Е., 1980; Bennett-Guerrero Е. et al., 1999; Holte К. et al., 2000; Gan T.J. et al., 2002).
У больных пожилого и преклонного возраста парез кишечника значительно влияет на летальность в послеоперационном периоде, которая остается высокой и колеблется от 13% до 55% (В.К. Гостищев и соавт., 2002; М.Д. Дибиров и соавт., 2012; A. Luckey et al.,2003).
По сводным данным из различных источников частота релапаротомий, предпринятых по поводу развившегося пареза кишечника в послеоперационном периоде, составляет 4-7% (Гальперин Ю.М., 1975; Луцевич Э.В., 2000; Ярема И.В., 2002; Ермолов A.C. и соавт., 2005; Петухов В.А., 2008; Brolin R., 1984; Kaprai W., 1986).
Угнетение моторики кишечной стенки в виде пареза запускает ряд патологических изменений, прогрессирование которых ведет к развитию паралича, клинически проявляющегося в развитии динамической кишечной непроходимости (паралитического послеоперационного илеуса). Раннее восстановление моторики кишечника в послеоперационном периоде является важной мерой профилактики развития ряда осложнений – синдрома энтеральной (кишечной) недостаточности, синдрома абдоминальной гипертензии, острой спаечной кишечной непроходимости и спаечной болезни (Гальперин Ю.М., 1975; Нечай А.И. и соавт., 1981; Boeckxstaens G.E. et al., Chieveley-Williams S., 1999; Kreiss C. et al., 2004).
Вовремя не устраненный послеоперационный парез кишечника усугубляет тяжелое течение раннего послеоперационного периода из-за возникновения нарушений гомеостаза вследствие скрытых потерь жидкости, электролитов, белков, что обусловливает развитие гиповолемического шока и выраженной интоксикации.
Восстановление перистальтики кишечника позволяет:
- Раньше начать энтеральное питание
- Уменьшить объем внутривенной инфузии
- Снизить риск транслокации кишечной флоры
- Уменьшить вероятность послеоперационной пневмонии
- Уменьшить потери белка, воды и электролитов
- Снизить риск развития спаечного процесса
Наиболее частые причины пареза кишечника
- До- и послеоперационный перитонит;
- Факторы травматического воздействия на кишечник;
- Интра- и ретроперитонеальные гематомы;
- Острая артериальная или венозная недостаточность мезентериальных сосудов;
- Абсолютный и относительный дефицит ОЦК;
- Электролитные сдвиги в организме;
- Интра- или послеоперационный инфаркт миокарда.
Этиопатогенез послеоперационного пареза кишечника
Патогенез послеоперационного пареза кишечника весьма сложен и в его основе лежит множество причин. Парез кишечника может быть обусловлен острыми или хроническими заболеваниями органов брюшной полости, забрюшинного пространства, травмой и гематомами забрюшинных отделов клетчатки, брыжейки тонкой или ободочной кишки, заболеваниями и повреждениями центральных и периферических нервных образований, но чаще всего он развивается после операций на органах брюшной полости (Петров В.И., 1964; Гальперин Ю.М., 1975). В основе развития послеоперационного пареза кишечника многими авторами прослеживается патологическое тормозящее действие симпатической импульсации, возникающее вследствие раздражения интерорецепторов кишечника и брюшины из-за операционной травмы, воспаления и других факторов, приводящих к активации гормонального и медиаторного звеньев симпатико-адреналовой системы и рефлекторному угнетению двигательной активности кишечной мускулатуры (Гальперин Ю.М., 1975; Нечай А.И. и соавт., 1981; Boeckxstaens G., Chieveley — Williams S., 1999; Kreiss C. et al., 2004).
Приблизительно 100 лет назад, в экспериментах на животных было продемонстрировано отрицательное воздействие манипуляций с тканями желудочно-кишечного тракта на его моторику. Многие авторы объясняют это тем, что при оперативных вмешательствах травмируется богатая рецепторами брюшина. Индуцированная хирургическим стрессом избыточная симпатическая стимуляция кишечника угнетает его пропульсивную активность. Таким образом, как ноцицептивные афференты, так и симпатические эфференты играют ключевую роль в механизмах пареза желудочно-кишечного тракта. Повышенный тонус симпатического отдела вегетативной нервной системы приводит к выбросу в кровь большого количества катехоламинов, вследствие чего развиваются сосудистый спазм в стенке органов желудочно-кишечного тракта. Следует отметить, что продолжительность и выраженность его в кишечнике сильнее, чем, например, в таких жизненно важных органах, как сердце и головной мозг, что связано с обилием aльфа-адренорецепторов. Вследствие вазоконстрикции в кишечнике возможно появление эффекта централизации кровообращения, который приводит к изменению реологических свойств крови и повышенному тромбообразованию.
Патогенез пареза кишечника
Нередко причиной угнетения перистальтики оказываются первичные нарушения микроциркуляции в кишечной стенке, обусловленные расстройствами гемодинамики. Циркуляторная гипоксия, являющаяся главным звеном этих изменений, нарушает деятельность интрамурального нервного аппарата, в результате чего утрачивается способность передачи импульсов. Глубокие метаболические и внутриклеточные электролитные нарушения делают гладкомышечные клетки не способными к восприятию импульсов на сокращение. Дальнейшим этапом патогенеза становится эндогенная интоксикация, которая замыкает порочный круг, усиливая тканевую гипоксию (Калинин А.В., 2001, Kreiss C., 2004).
Другие исследователи считают, что одним из факторов развития послеоперационного пареза являются тяжелые водно-электролитные нарушения в дооперационном периоде, особенно калиевая недостаточность (Костюченко А.Л., 2000; Mythen N., 2005).
Среди разнообразных механизмов, лежащих в основе развития послеоперационного пареза кишечника, важное место занимает местный воспалительный ответ и адгезия на миоцитах активированных клеток иммунной системы (Kalff et al., 1998). Группа исследователей в экспериментах на животных показала, что хирургическое воздействие на кишечник активирует множество тканевых макрофагов. За счет активации ядерных факторов транскрипции происходит массивный выброс воспалительных агентов и провоспалительных цитокинов: TNF-?, IL-6 и IL-1?. Кроме того, простагландины и оксид азота (NO) играют важную роль в угнетении сократительной способности гладкомышечных клеток (Andrew L., Livingston E., Yvette T., 2003) При развитии воспалительных изменений в брюшной полости обнаружены существенные изменения динамики выброса высокоактивных биогенных аминов, таких как гистамин и серотонин. Повышение уровня серотонина параллельно с возрастанием его выделения говорит о форсированном его вымывании из энтерохромаффинных клеток кишечника. В свою очередь усиленная потеря этого кишечного медиатора клинически вполне согласуется с развитием прогрессирующего пареза кишечника (Лукич В.Л., Кузнецов Н.А., Полякова Л.В., 1993). Так же в генезе двигательных нарушений тонкой кишки при воспалении, имеет место расстройства микроциркуляции с изменением проницаемости эндотелиоцитов и развитием интерстициального отека, разобщения миоцитов, что влечет за собой нарушение проведения потенциалов по кишечной стенке, поражение нервных сплетений, развитие ишемии и гипоксии (Савицкий Г. Г., 1983; Ерюхин И. А. и др., 1985, 1999).
Лекарственные препараты, традиционно применяемые для послеоперационного обезболивания, оказывают различное действие на моторику желудочно-кишечного тракта в зависимости от их фармакологических свойств и пути введения. Например, опиоиды, вводимые системно, подавляют продольную перистальтику тонкого и толстого кишечника и повышают тонус сфинктеров (Andrew L., Livingston E., Yvette T., 2003)
Отрицательные эффекты опиоидов на желудочно-кишечный тракт (Pappagallo M., 2001)Фармакологические | Клинические |
Торможение моторики желудка | Усиление дуодено-гастрального рефлюкса |
Торможение моторики тонкой кишки | Замедление всасывания медикаментов и питательных веществ |
Торможение моторики толстой кишки | Вздутие живота, неполная эвакуация содержимого |
Повышение тонуса привратника, илеоцекального клапана | Абдоминальный болевой синдром, кишечная колика |
Повышение тонуса анального сфинктера | Снижение способности опорожнения дистальных отделов толстой кишки |
Сокращение сфинктера Одди | Дискомфорт в эпигастрии, печеночная колика |
Уменьшение секреции желез желудочно-кишечного тракта. Увеличивается абсорбция воды из просвета кишки. | Запоры |
Клинические последствия и профилактика послеоперационного пареза кишечника
Главное место в генезе развивающегося пареза кишечника принадлежит прогрессирующему угнетению моторной функции вплоть до полного паралича кишечника. Парез, являясь первичным звеном в цепи последовательно развивающихся патологических процессов, приводит к кишечному стазу, вследствие чего в просвете кишки скапливается большое количество газов и жидкости. Утрата кишечником эвакуаторной функции немедленно влечет за собой восходящую миграцию микрофлоры толстой кишки с избыточной бактериальной колонизацией всей тонкой кишки, усилением бродильных процессов и газообразования, дальнейшим повышением внутрипросветного давления и растяжением кишечной стенки. Перерастяжение кишечной трубки газами, нарушение микроциркуляции и непосредственное воздействие токсичных веществ на слизистую оболочку кишки приводят к нарушениям ее барьерной функции. Происходит массивное поступление микробов и токсичных веществ в лимфатическое и кровяное русло. Транслокация бактерий приводит к появлению и прогрессированию синдрома системного воспалительного ответа, полиорганной недостаточности, сепсису (Белов В.А., Шестопалов А.И., 1985; Шалимов А.А. с соавт., 1986; Гостищев В.К., 2007).
Таким образом, формируется цепь глубоких системных расстройств, начало которым положено нарушением моторной функции желудочно-кишечного тракта. К этому времени проявляются и начинают быстро прогрессировать острые нарушения секреторной и резорбтивной функций кишечника. В результате возникающих изменений развивается состояние, которое может быть обозначено как синдром энтеральной недостаточности (Ермолов А.С. с соавт., 2005; Попова Т.С., 2008; Усенко Л.В., Мальцева Л.А., 2008).
При дальнейшем прогрессировании патологического процесса парез кишечника достигает последней стадии двигательных нарушений – паралича, а в клиническом смысле эти изменения можно трактовать как паралитическую кишечную непроходимость (Гальперин Ю.М., 1975; Ерюхин И.А., Петров В.П., Ханевич М.Д., 1999). Совокупность синдромов энтеральной недостаточности, нарушений водно-электролитного и белкового обменов, эндотоксикоза определяют клиническую картину, тяжесть состояния, прогноз и лечебную тактику при паралитической кишечной непроходимости.
Парез кишечника является наиболее частым и тяжелым осложнением перитонита. По мнению большинства исследователей в патогенезе перитонита одним из ключевых факторов прогрессирования заболевания является синдром энтеральной недостаточности. Он рассматривается в качестве патологического симптомокомплекса, возникающего при острой хирургической патологии и травмах органов брюшной полости и сопровождающегося нарушением всех функций пищеварительного тракта, когда кишечник становится основным источником интоксикации и развития полиорганной недостаточности [Курыгин А.А. Моторная функция тонкой кишки в норме и при некоторых патологических состояниях / А.А. Курыгин, Багаев В.А., Курыгин Ал.А. и др.- СПб.: Наука, 1994. 202 с. // Гаин Ю.М. Энтеральная недостаточность при перитоните: теоретические и практические аспекты, диагностика и лечение / Ю.М. Гаин, С.И. Леонович, С.А. Алексеев. – Молодечно, 2001.- 265 с. // Deitch E.A. Bacterial translocation: the influence of dietary variables / E.A. Deitch // Gut.- 1994.- Vol. 35, Suppl.1.- P. S23-S27].
При развитии воспаления в брюшной полости одним из патогенетических механизмов, определяющих изменение моторной функции желудочно-кишечного тракта, является нарушение взаимоотношения между симпатической и парасимпатической нервными системами. Гипертонус симпатической нервной системы распространяется не только на гладкие мышцы кишечной стенки, но и на снабжающие их сосуды, что приводит, с одной стороны, к угнетению моторики кишечника, с другой (в результате нарастающего артериального спазма) к резкому снижению регионарного кровотока [Гаин Ю.М. Энтеральная недостаточность при перитоните: теоретические и практические аспекты, диагностика и лечение / Ю.М. Гаин, С.И. Леонович, С.А. Алексеев. – Молодечно, 2001.- 265 с. // Weiner N. Drugs that inhibit adrenergic nerves and block adrenergic receptors / N. Weiner // The Pharmacological Basis of Therapeutics. — 6-th Ed. -1980.-P. 176-210].
В начале развития парез кишечника может быть обусловлен дисфункцией со стороны эндокринных механизмов регуляции:
- выбросом катехоламинов;
- активацией каллекриин-кининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ;
- снижением биологической активности клеток APUD-системы (серотонина [субстанции Р] и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и периферической гемоциркуляции [Биряльцев В.Н. Электрогастроэнтерография в хирургической гастроэнтерологии / В.Н. Биряльцев, А.В. Бердников, В.А.Филиппов, Н.А. Велиев. — Казань.: Изд-во Казан. гос. тех. ун-та., 2003.- 156 с. // Adrian T.E. Human distribution and release of a putative new gut hormone, peptide YY/ T.E. Adrian, G.L. Ferri, A.J. Bacarese-Hamilton // Gastroenterology.-1985.-Vol. 89, N 5.-P. 1070-1077. // Espat N.J. Vasoactive intestinal peptide and substance P receptor antagonists improve postoperative ileus / N.J. Espat, G. Cheng, M.C. Kelley // J. Surg. Res. -1995.- Vol. 58, N 6.- P. 719-723];
- дисрегуляторным поступлением секретина, холецистокинина и энтероглюкагона [Петров В.П. Кишечная непроходимость / В.П. Петров, И.А. Ерюхин. – М.: Медицина, 1999.- 285 с.].
Многочисленные экспериментальные и клинические исследования доказали, что одним из патогенетических механизмов возникновения и поддержания послеоперационного пареза кишечника является нарушение обмена эндогенного серотонина, который, в норме участвует в автономной координационной регуляции мотороно-эвакуаторной функции желудочно-кишечного тракта. Серотонин, связываясь с серотониновыми рецепторами гладкомышечных и интерстициальных клеток способствует генерации мигрирующего миоэлектрического комплекса (Гроховский Л.П., 1970; Дедерер Ю.М., 1971; Куликова Л.А. и соавт., 1972; Гальперин Ю.М., 1975; Федоров В.Д., 1998; Симоненков А.П., 2002; Weisbrodt N. 1983, Hong—Nian L., Susumu O., Yuji N., Kenta S., Satoshi I., Mohsin Md S., Kazunori G., Yuji I., Shinsuke N., 2011). Доказано, что различные лекарственные препараты и активные метаболиты снижают чувствительность клеток кишечной стенки к серотонину за счет конкурентного ингибирования серотониновых рецепторов, приводя к относительной серотониновой недостаточности и еще больше усиливая парез кишечника.
Дисфункция гладкой мускулатуры (ГМ) организма, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики и микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. Подавление сократительной функции и автоматизма гладкомышечных клеток кишечной трубки приводит к угнетению моторно-эвакуаторной функции желудочно-кишечного тракта. Для восстановления нарушенной функции ГМ требуется экзогенное введение дополнительных доз серотонина, чтобы «очистить» серотониновые рецепторы от лигандов и тем самым нормализовать биохимические процессы в миоцитах. Другими словами, воздействие лигандов серотониновых рецепторов обусловливает относительную недостаточность серотонина, который в обычных условиях жизнедеятельности организма и при нормальном кровообращении в тканях в большинстве случаев может компенсироваться за счет дополнительной продукции этого вещества энтерохромаффинными клетками желудочно-кишечного тракта и переноса его тромбоцитами к тканям [23, 26]. Однако при нарушении микроциркуляции, а тем более в условиях указанного эксперимента на изолированном сегменте кишки такая компенсация недостатка серотонина не происходит и необходимо экзогенное его введение для нормализации функции ГМ.
Исходя из понимания генеза дисфункции ГМ, для профилактики и лечения функциональной кишечной непроходимости и сосудистой недостаточности (нарушение локальной и региональной микроциркуляции с гипотонией и без нее) в клинической практике стали применять внутривенное введение серотонина адипината с первых часов послеоперационного периода. Восстановление функции ГМ и нормализация моторно-эвакуаторной функции кишечника под действием серотонина адипината происходили непосредственно во время введения препарата, которое сопровождалось усилением перистальтики, отхождением газов и каловых масс. Клинические и аускультативные признаки восстановления моторно-эвакуаторной функции кишечника подтверждаются также рентгенологическими, ультразвуковыми, электромиографическими и другими методами [1, 3, 7-8, 19-27, 29-31].
Парентеральное введение раствора серотонина адипината (препарат Динатон) способно восстанавливать нарушенную моторику желудочно-кишечного тракта вне зависимости от вызвавших ее причин (Симоненков А.П., Федоров В.Д., Клюжев В.М., Ардашев В.Н., 2005).
Механизмы и лечение послеоперационного подвздошного кишечника | Гастроэнтерология | JAMA Surgery
Цель Рассмотреть патогенез и лечение послеоперационной кишечной непроходимости.
Источники данных Данные, собранные для этого обзора, были получены в результате поиска англоязычной литературы в базе данных MEDLINE. Точные термины индексации были «послеоперационная кишечная непроходимость», «лечение», «этиология» и «патофизиология».»Были также использованы предыдущие обзорные статьи и соответствующие ссылки из этих статей.
Выбор исследования Были включены все соответствующие исследования. Исключались только статьи, в которых были представлены клинические случаи или мимоходом упоминалась послеоперационная кишечная непроходимость.
Синтез данных Патогенез послеоперационной кишечной непроходимости сложен, в его развитии одновременно или в разное время участвуют несколько факторов.Эти факторы включают тормозящие эффекты симпатического входа; высвобождение гормонов, нейротрансмиттеров и других медиаторов; воспалительная реакция; и действие анестетиков и анальгетиков. Многочисленные методы лечения использовались для облегчения послеоперационной кишечной непроходимости, но без особого успеха.
Выводы Этиология послеоперационной кишечной непроходимости лучше всего может быть описана как многофакторная. Подход к комбинированному лечению должен включать ограничение введения агентов, которые, как известно, способствуют возникновению послеоперационной кишечной непроходимости (наркотики), использование грудной эпидуральной анестезии с местными анестетиками, когда это возможно, и выборочное применение назогастральной декомпрессии.
ИЛЕУС ОПРЕДЕЛЯЕТСЯ в иллюстрированном медицинском словаре Дорланда просто как «непроходимость кишечника». 1 Однако определение послеоперационной кишечной непроходимости, являющейся темой данного обзора, несколько менее однозначно. В 1990 г. Ливингстон и Пассаро 2 определили кишечная непроходимость как «функциональное ингибирование пропульсивной активности кишечника независимо от патогенетических механизмов». Далее они определили послеоперационную кишечную непроходимость как «неосложненную кишечную непроходимость, возникающую после операции, спонтанно разрешающуюся в течение 2–3 дней.»Наконец, термин паралитическая послеоперационная кишечная непроходимость был определен как форма кишечной непроходимости, продолжающаяся более 3 дней после операции. 2 Такое различие было необходимо, потому что разные механизмы, вероятно, ответственны за 2 типа послеоперационной кишечной непроходимости. Это может быть Правильнее называть послеоперационную кишечную непроходимость первичной кишечной непроходимостью, поскольку она, скорее всего, является неизбежной реакцией на хирургическую травму. При послеоперационной кишечной непроходимости угнетение перистальтики тонкой кишки носит временный характер, и желудок восстанавливается в течение 24-48 часов, тогда как функция толстой кишки занимает 48 до 72 часов, чтобы вернуться. 2 Определение конца послеоперационной непроходимости является несколько спорным. В исследованиях в литературе использовались разные конечные точки, и у каждого из них есть свои слабые стороны. Звуки кишечника иногда используются в качестве конечной точки, но они требуют частой аускультации, их присутствие не обязательно указывает на двигательную активность, и они могут быть результатом деятельности тонкой кишки, а не функции толстой кишки. 3 Газы тоже не идеальная конечная точка. Для этого нужен находящийся в сознании пациент, которому удобно сообщать исследователю о его возникновении.Кроме того, есть некоторые вопросы относительно корреляции между отхождением газов и испражнениями. 4 Опорожнение кишечника, по-видимому, является наиболее надежной конечной точкой, хотя они также могут быть неспецифическими, представляя дистальную эвакуацию кишечника в отличие от общей функции желудочно-кишечного тракта. В конце концов, врач должен оценить пациента в целом, чтобы определить разрешение послеоперационной кишечной непроходимости.
Снижение перистальтики кишечника после операции описано с конца 1800-х годов.Было опубликовано множество исследований послеоперационной кишечной непроходимости, но патогенез остается загадкой (Таблица 1). С момента введения назогастральной декомпрессии не произошло большого прогресса в эффективных схемах лечения. Илеус представляет собой серьезную медицинскую проблему и является наиболее частой причиной задержки выписки из больницы после абдоминальной хирургии. Экономические последствия кишечной непроходимости в США оцениваются в 750–1 млрд долларов. 5 Дискомфорт пациента более важен, чем расходы на медицинское обслуживание.Симптомы послеоперационной кишечной непроходимости варьируются от спазмов и болей в животе до тошноты и рвоты.
Наличие тормозных спинномозговых рефлексов, действующих на кишечник, было впервые продемонстрировано в 1872 году Гольцем. 6 В 1899 году Bayliss и Starling 7 определили, что удаление чревных нервов улучшит перистальтику кишечника после лапаротомии. Они обнаружили это с помощью устройства, названного энтерографом , , которое позволило им изучить интактную деятельность тонкого кишечника у неанестезированной собаки. 7 За последние несколько десятилетий было опубликовано множество отчетов, подтверждающих роль симпатических путей в послеоперационной кишечной непроходимости. За прошедшие годы были разработаны экспериментальные модели послеоперационной кишечной непроходимости для оценки пропульсивно-моторной функции кишечника. Некоторые из этих моделей включают опорожнение желудка, время прохождения по тонкому и толстому кишечнику и выделение гранул стула, а также регистрацию изменений моторики кишечника. 8 -14 Экспериментальная модель с использованием тензометрических датчиков на бодрствующих крысах описана 15 как метод измерения моторики желудочно-кишечного тракта.Было выдвинуто множество новых теорий, объясняющих патогенез послеоперационной кишечной непроходимости.
Нормальная физиология перистальтики желудочно-кишечного тракта
Нормальная перистальтика кишечника является результатом сложных взаимодействий между кишечной нервной системой, центральной нервной системой, гормонами и местными факторами, влияющими на деятельность гладких мышц.Подвижность желудка и тонкого кишечника зависит от того, находится ли человек в состоянии голодания или после еды. По сравнению с голоданием режим кормления состоит из непрерывных разнесенных по амплитуде сокращений, количество, интенсивность и продолжительность которых зависят от принятой пищи (количества, физического и химического состава). Однако между приемами пищи мигрирующий двигательный комплекс (ММС) определяет сократительную способность кишечника. Считается, что MMC, впервые описанная Szurszewski, 16 , выполняет функцию «экономки», продвигая внутрипросветное содержимое дистально во время голодания. 17 У человека эти сокращения происходят примерно каждые 1-2 часа.
Четыре фазы задействованы в MMC в голодном состоянии. Первая фаза включает колебания потенциалов гладкомышечных мембран без фактических мышечных сокращений. Возникновение прерывистых мышечных сокращений знаменует переход ко второй фазе. Во время фазы III сокращения увеличиваются до максимальной частоты сокращений, допускаемой медленной волной (примерно 3 сокращения в минуту в желудке и 11 сокращений в минуту в двенадцатиперстной кишке).Фаза IV отмечена прекращением сокращений, и кишечник становится неподвижным. 18 Кормление сопровождается прерыванием MMC и появлением другого паттерна, состоящего из устойчивой нерегулярной фазовой сократительной активности.
Мускулатура желудка состоит из тесно связанных клеток, что позволяет им выполнять электрофизиологические функции. Существует 3 различных электрических потенциала: потенциал покоя; медленноволновый или кардиостимуляторный потенциал; и пиковый потенциал 19 , который вызывает схватки.Однако эти потенциалы могут возникать только на медленной частоте и, таким образом, определяются кардиостимулятором. Недавно был проведен обзор многочисленных желудочно-кишечных гормонов, влияющих на моторику желудочно-кишечного тракта, 20 , и подробное обсуждение этой темы выходит за рамки этого обзора. Таким образом, перистальтика желудка определяется сложными взаимодействиями между электрофизиологическими характеристиками, нервными сигналами и желудочно-кишечными гормонами.
Ободочная кишка, основная цель которой — поглощать воду и хранить фекалии, отличается по структуре и функциям от остальной части кишечника.Измеренная электрическая активность в толстой кишке выявляет нерегулярные колебания с различной амплитудой. Гладкая мышца толстой кишки не содержит щелевых соединений и поэтому не действует как единое целое. У людей можно выделить 3 электрические активности моторики толстой кишки: электрическая контролирующая активность представляет собой колебания потенциала гладкомышечной мембраны, дискретная электрическая ответная активность состоит из спайк-волновых потенциалов, наложенных на колебания, а непрерывная электрическая ответная активность не связана с колебаниями, а участвует в сокращениях, которые охватывают содержимое просвета дистально. 21
Изменение моторики желудочно-кишечного тракта при послеоперационном подвздошном кишечнике
В желудке и тонком кишечнике нормальная базальная электрическая активность нарушается после хирургических вмешательств. В частности, в желудке наблюдается нерегулярный спайк желудка и медленноволновая активность.Кроме того, после операции, если пациенты не кормятся, считается, что активность MMC является «единственным стимулом к сокращению кишечника». 2 Таким образом, считается, что пациенты, которым запрещено принимать что-либо через рот после операции, имеют минимально пропульсивную перистальтику кишечника. Различные анестетики могут влиять на активность MMC. Например, эфир и галотан ингибируют, тогда как энфлуран возбуждает. 22 , 23 Надрез брюшины также ингибирует активность ММС, и длительное ингибирование наблюдается после манипуляции с кишечником. 2
Электрическая активность толстой кишки также нарушается в результате хирургических вмешательств. После операции на обезьянах и людях происходит нарушение трех электрических активностей, описанных в предыдущем разделе. 24 , 25 Непрерывная электрическая ответная активность возвращается к норме в последнюю очередь (примерно через 72 часа после операции) и связана с появлением газов. Хотя электрическая активность желудочно-кишечного тракта нарушается у пациентов с паралитической послеоперационной кишечной непроходимостью, восстановление нормальной электрической активности не всегда совпадает с разрешением кишечной непроходимости.
Роль вегетативной нервной системы
В регуляции перистальтики кишечника существует баланс между возбуждающим и тормозящим действием. Парасимпатическая стимуляция увеличивает моторику желудочно-кишечного тракта, тогда как симпатическая стимуляция тормозит. Симпатическая стимуляция служит преобладающим тормозящим импульсом для кишечника и обеспечивает эфферентную конечность многочисленных рефлекторных путей.Подтверждающие доказательства этой концепции основаны на экспериментах на животных 26 , которые продемонстрировали преобладание симпатического торможения после разделения парасимпатического (блуждающего) и симпатического (внутренностного) нервного импульса. Предыдущие исследования продемонстрировали симпатический выход как фактор в патогенезе послеоперационной кишечной непроходимости. Механизм симпатического торможения включает предотвращение высвобождения ацетилхолина из возбуждающих волокон, расположенных в мышечно-кишечном сплетении. Послеоперационная кишечная непроходимость и задержка опорожнения желудка удаляются с помощью химической симпатэктомии с 6-гидроксидофамином. 27 , 28 Кроме того, после лапаротомии запасы катехоламинов в кишечнике истощаются быстрее, чем без лапаротомии. 29
Однако симпатическая блокада не всегда помогает обратить вспять подавление моторики желудочно-кишечного тракта, вызванное абдоминальными хирургическими вмешательствами. 30 Таким образом, другие механизмы, такие как неадренергические нехолинергические нервы, как полагают, играют роль в подавлении перистальтики кишечника после операции.
Роль нейротрансмиттеров, местных факторов и гормонов
Было высказано предположение, что различные нейротрансмиттеры, местные факторы и гормоны способствуют возникновению послеоперационной непроходимости кишечной непроходимости, хотя однозначно доказано, что их ответственность не существует.Вазоактивный кишечный пептид вызывает усиление подавляющего воздействия на холинергические нейроны желудка, вызывая снижение антральной и пилорической активности. 31 Вещество P, которое является нейротрансмиттером, участвующим в боли, также предположительно играет роль в послеоперационной кишечной непроходимости. 32
Оксид азота (NO) считается преобладающим ингибирующим неадренергическим нехолинергическим нейромедиатором желудочно-кишечного тракта. Считается, что он действует через свою конститутивную форму NO-синтетазы в кишечных нейронах. 33 Исследователи 30 , 34 изучили роль NO в модели послеоперационной кишечной непроходимости у крыс. Крысам назначили разрез кожи, только лапаротомию или лапаротомию, потрошение и манипуляции со слепой кишкой и тонкой кишкой. Резерпин, ингибитор адренергической нейротрансмиссии, и N ω-нитро-L-аргинин, ингибитор NO-синтазы, применялись отдельно и в комбинации. При применении одного только резерпин значительно увеличивал желудочно-кишечный транзит у крыс, перенесших кожный разрез, полностью устранял ингибирование, вызванное одной только лапаротомией, но только частично обращало вспять ингибирование транзита, вызванное лапаротомией, потрошением и манипуляциями.Напротив, введение ω-нитро-L-аргинина N не имело эффекта на желудочно-кишечный транзит, измененный только разрезом кожи или лапаротомией, и частично обращало негативные эффекты на моторику, вызванные лапаротомией, потрохами и манипуляциями. При введении в комбинации эти препараты не показали дополнительных эффектов по сравнению с терапией только резерпином в группах с разрезом кожи и только лапаротомией; однако введение этих лекарств привело к полному устранению ингибирования моторики желудочно-кишечного тракта, вызванного лапаротомией, потрошениями и манипуляциями.Эти результаты подтверждают участие высвобождения NO в послеоперационной кишечной непроходимости. Роль NO в патогенезе послеоперационной кишечной непроходимости у человека остается неясной. Экспериментальные данные 13 , 35 показали, что антагонисты вазоактивного кишечного пептида, вещества P и ингибиторы синтеза NO улучшают послеоперационную перистальтику кишечника.
Пептид, связанный с геном кальцитонина (CGRP), присутствует в висцеральных афферентных нейронах желудочно-кишечного тракта и действует на периферические рецепторы, задерживая опорожнение желудка и моторику желудочно-кишечного тракта у крыс. 14 , 36 Вполне возможно, что хирургические вмешательства на брюшной полости стимулируют высвобождение CGRP из этих нейронов, вызывая угнетение перистальтики кишечника. Было показано, что введение антагонистов рецептора CGRP или моноклональных антител к CGRP, 36 , частично предотвращает послеоперационную кишечную непроходимость желудка у крыс.
Эндогенные опиоиды выделяются после операции и были предложены как причина послеоперационной кишечной непроходимости. 37 , 38 Их влияние на опорожнение желудка и сокращение гладких мышц кишечника опосредуется µ-опиоидным рецептором.Энкефалин является мощным агонистом дельта-опиоидных рецепторов, который, как сообщалось, подавляет перистальтику желудка и повышает тонус привратника в экспериментах на животных. 39 , 40
Кортикотропин-высвобождающий фактор (CRF) играет важную роль в организации стрессовой реакции. 41 , 42 Предыдущее исследование Taché et al. 43 показало, что периферическое введение CRF и связанных с CRF пептидов вызывает задержку опорожнения желудка и ингибирование моторики желудка, подобное тому, которое наблюдается при послеоперационной кишечной непроходимости кишечника. .Периферический CRF снижает опорожнение желудка от непищевой или питательной пищи у крыс, мышей и собак при внутривенном введении. Подобные эффекты наблюдаются у крыс и мышей, если CRF или родственные CRF пептиды вводятся внутрибрюшинно или подкожно. 10 , 44 -50 Кроме того, периферическая инъекция неселективного антагониста рецептора CRF перед лапаротомией и пальпация слепой кишки полностью облегчают послеоперационную кишечную непроходимость желудка, оцениваемую в течение первых 3 часов после операции у крыс. 47 , 51 У людей хирургический стресс был связан с повышением циркулирующих уровней CRF. 52 -54 Источник CRF неясен. Пептид присутствует в мозговом веществе надпочечников, а внутренние нервы и гормональная стимуляция могут вызвать его высвобождение. 55 , 56 В частности, аргинин вазопрессин, который высвобождается в ответ на хирургический стресс, может запускать высвобождение CRF. Исследования продолжаются, чтобы выяснить механизмы, с помощью которых CRF ингибирует опорожнение желудка.
В 1998 г. Kalff et al. 57 предположили, что обычные хирургические процедуры, выполняемые на кишечнике, вызывают активацию сети макрофагов в наружной мышечной оболочке и вызывают рекрутирование лейкоцитов. Он также предположил, что эта воспалительная реакция ответственна за период послеоперационной нарушения моторики. 57 В этом исследовании крысы подвергались разной степени «щадящих» хирургических манипуляций, от лапаротомии по средней линии до «бегства» кишечника.Крысы, которые не подвергались лапаротомии или анестезии, служили контролем соответствующего возраста. Результаты подтвердили их гипотезу в том, что прогрессирующее увеличение инфильтрации нейтрофилов наблюдалось с увеличением степени манипуляции с кишечником. Авторы пришли к выводу, что их данные подтверждают мнение о том, что воспалительное событие, вызванное абдоминальными хирургическими вмешательствами, связано с послеоперационной кишечной непроходимостью. Однако они также признали, что экстраабдоминальная хирургически вызванная послеоперационная кишечная непроходимость вызвана другим механизмом.
Schwarz et al. 58 обнаружили индукцию матричной РНК и белка циклооксигеназы 2 (COX-2) в резидентных макрофагах и субпопуляции кишечных нейронов после лапаротомии и манипуляций с кишечником у крыс. Повышение экспрессии ЦОГ-2 привело к повышению уровня простагландинов в брюшной полости и кровообращении. В результате in vitro наблюдалось снижение сократимости круговых мышц тощей кишки. Этот эффект можно было обратить вспять с помощью ингибиторов ЦОГ-2.Клиницисты должны с осторожностью применять эту модель к людям. Хотя у крыс тонкий кишечник считается хорошей моделью послеоперационной кишечной непроходимости, это не относится к людям. Было бы целесообразно изучить влияние ингибирования ЦОГ-2 на послеоперационную моторику желудка и толстой кишки.
Все виды анестезии влияют на перистальтику кишечника. 59 Анестетики оказывают самое сильное воздействие на ту область кишечника, которая больше всего зависит от нейронной интеграции.В частности, толстая кишка лишена межклеточных щелевых контактов, что делает толстую кишку более восприимчивой к ингибирующему действию анестетиков. 2
После анестезии наблюдается задержка опорожнения желудка. Атропин, галотан и энфлуран уменьшают опорожнение желудка. Последствиями задержки опорожнения желудка являются возможная аспирация, повышенный риск послеоперационной тошноты и рвоты, а также задержка всасывания лекарств. 60 -62
Теоретически эпидуральная анестезия с местными анестетиками может блокировать афферентные и эфферентные тормозные рефлексы, увеличивать внутренний кровоток и оказывать противовоспалительное действие. 63 , 64 Эпидуральные анестетики обладают дополнительным преимуществом, блокируя афферентные стимулы, которые запускают эндокринный метаболический стресс-ответ на операцию и, таким образом, подавляют катаболическую активность гормонов, высвобождаемых во время этого процесса. 65 В большинстве исследований 66 -76 грудная эпидуральная анестезия с бупивакаина гидрохлоридом значительно уменьшала кишечную непроходимость по сравнению с системной опиоидной терапией у пациентов, перенесших абдоминальные хирургические вмешательства. В одном из статистически незначимых исследований, 64 , использовалась эпидуральная анестезия продолжительностью 24 часа, а не продолжительностью от 48 до 72 часов, как в других исследованиях.По крайней мере, 4 исследования 67 , 72 , 74 , 75 сравнивали эпидуральный бупивакаин с эпидуральным опиоидом, и 3 из этих исследований продемонстрировали значительное сокращение продолжительности послеоперационной кишечной непроходимости в группе эпидурального бупивакаина по сравнению с эпидуральная группа опиоидов. Из нескольких проспективных исследований 72 , 74 , 76 , сравнивающих эффекты эпидурального бупивакаина и комбинированного эпидурального бупивакаина и морфина на восстановление послеоперационной кишечной непроходимости, один эпидуральный бупивакаин, по-видимому, лучше, не оказывая значительного отрицательного воздействия на обезболивание.Расположение эпидуральной анестезии важно; эпидуральное введение в нижнегрудной и поясничный отделы не было показано 64 , 72 , 73,77 , 78 для положительного воздействия на послеоперационную кишечную непроходимость.
Послеоперационная наркотическая анальгезия
Опиоиды подавляют перистальтику желудка, а также повышают тонус антрального отдела и первой части двенадцатиперстной кишки у здоровых людей. 79 Действие опиатов на тонкий кишечник несколько сложнее. Сульфат морфина обладает двухфазными свойствами у человека: (1) начальное воздействие на моторику стимулирует через активацию фазы III MMC, и (2) за этой стимуляцией следует атония, которая отвечает за замедление желудочно-кишечного транзита. 79 , 80 Морфин увеличивает тонус и амплитуду непропульсивных сокращений и уменьшает пропульсивные волны в толстой кишке. Дополнительный эффект этих действий заключается в снижении перистальтики толстой кишки. 79
Однако лечение антагонистом морфиновых рецепторов налоксона гидрохлоридом оказалось неэффективным при лечении послеоперационной кишечной непроходимости. 2 Разрабатываются новые антагонисты µ-опиоидных рецепторов, которые могут иметь потенциал для облегчения побочных эффектов, связанных с опиатами. Метилналтрексон бромид, четвертичное производное налтрексона, является одним из таких препаратов. Он плохо растворяется в жирах и поэтому не проникает через гематоэнцефалический барьер, но может подавлять негативное воздействие опиоидов на кишечник.В результате он не противодействует центральным анальгетическим эффектам морфина и не вызывает отмены опиоидов. 81 Другой исследуемый препарат — антагонист µ-опиоидных рецепторов ADL-8-2698. Введение 6 мг этого препарата сократило среднее время до отхождения первых газов, среднее время до первого испражнения и продолжительность пребывания в больнице в исследовании 82 79 пациентов, из которых 15 подверглись частичной колэктомии и 63 перенесла полную абдоминальную гистерэктомию.Другие экспериментальные исследования 37 показывают, что опиоидные агонисты, воздействующие на κ-рецептор, могут быть полезными, выступая в качестве анальгетика и уменьшая послеоперационную кишечную непроходимость. Остаются вопросы о роли этих агентов у пациентов, не леченных опиоидами от послеоперационной боли, и о том, наблюдаются ли положительные эффекты этих агентов у пациентов, перенесших другие хирургические процедуры.
На протяжении многих лет назогастральный зонд был основой лечения; однако недавние исследования поставили под сомнение его рутинное использование.Эти рандомизированные клинические исследования 83 , 84 пришли к выводу, что назогастральная декомпрессия не сокращает время до первого опорожнения кишечника и не сокращает время до адекватного перорального приема. Кроме того, в этих исследованиях 83 , 84 сообщается, что неправильное использование может способствовать послеоперационным осложнениям, таким как лихорадка, пневмония и ателектаз. Хотя эти исследования не рекомендуют рутинное использование назогастральной интубации, клиницист мог выбрать случаи, в которых пациенту приносит пользу облегчение симптомов.
Учитывая предыдущие описания аномальной электрической активности желудочно-кишечного тракта, были предприняты попытки использовать электрическую стимуляцию в качестве корректирующей меры. Была предпринята попытка применить электрическую стимуляцию непосредственно к стенке кишечника у собак, но эта процедура не увенчалась успехом. 85 Другие исследования показывают, что использование стимуляции желудочно-кишечного тракта у людей в значительной степени неэффективно. 2
Раннее послеоперационное кормление
Раннее послеоперационное энтеральное питание путем перорального или назоэнтерального введения было предложено как способ уменьшения продолжительности послеоперационной кишечной непроходимости.Логика раннего энтерального кормления заключается в том, что прием пищи может (1) стимулировать рефлекс, который вызывает скоординированную двигательную активность, и (2) вызывать секрецию желудочно-кишечных гормонов, вызывая общий положительный эффект на перистальтику кишечника. 86 Роль раннего послеоперационного энтерального питания остается неясной, поскольку одни исследования подтверждают, а другие опровергают его пользу в сокращении послеоперационной кишечной непроходимости. 87 -91
Лапароскопические процедуры предлагают теоретическое преимущество уменьшения травм тканей по сравнению с открытыми процедурами.Уменьшение травмирования тканей может привести к более быстрому восстановлению послеоперационной функции кишечника. Недавно Leung et al. 92 обнаружили более низкие уровни цитокинов (интерлейкин 1β и интерлейкин 6) и С-реактивного белка у пациентов, перенесших лапароскопическую резекцию толстой кишки, по сравнению с теми, у кого были открытые процедуры. Исследования на животных и клинические испытания 93 -96 обнаружили статистически значимое уменьшение продолжительности послеоперационной кишечной непроходимости после лапароскопических по сравнению с открытыми процедурами резекции толстой кишки.Точный механизм, ответственный за это улучшение послеоперационной перистальтики кишечника, остается неясным. Текущие исследования могут дать ответ на этот вопрос и дать представление об этиологии паралитической кишечной непроходимости после открытых процедур.
Нестероидная противовоспалительная лекарственная терапия может улучшить послеоперационную непроходимость кишечника, позволяя врачу снизить количество вводимых опиоидов на 20–30%. 97 Дополнительное улучшение перистальтики кишечника может быть получено за счет противовоспалительных свойств нестероидных противовоспалительных препаратов. 98 В большинстве экспериментальных и клинических исследований 99 -102 назначение нестероидных противовоспалительных препаратов привело к уменьшению тошноты и рвоты и улучшению желудочно-кишечного транзита.
Многие врачи используют слабительные для лечения паралитической послеоперационной кишечной непроходимости. Насколько нам известно, рандомизированных испытаний, оценивающих роль этих агентов в паралитической послеоперационной кишечной непроходимости, не проводилось. При поиске в базе данных MEDLINE ключевых слов «слабительные» и «послеоперационная кишечная непроходимость» было найдено только 1 нерандомизированное неслепое испытание.В это испытание вошли 20 пациентов, перенесших радикальную гистерэктомию и получавших послеоперационное лечение 30 мл магнезиального молока внутрь два раза в день и бисколиевые свечи каждый день. 103 Среднее время выхода газов и дефекации составило 3 дня. Авторы наблюдали сокращение продолжительности пребывания в больнице на 50% по сравнению с группой пациентов из ранее описанного проспективного исследования 103 пациентов, перенесших радикальную гистерэктомию (4 против 8 дней). За этим исследованием должно последовать рандомизированное проспективное двойное слепое контролируемое исследование для определения пользы слабительных средств, если таковая имеется.
Известно, что простагландины влияют на перистальтику кишечника. Механизм действия простагландина E 2 и простагландина F 2 , хотя и не совсем ясен, по-видимому, заключается в стимуляции высвобождения ацетилхолина из нейронов миэнтериального сплетения. 104 У людей пероральный простагландин E 2 , как сообщается, увеличивает транзит через тонкий и толстый кишечник. 2 Необходимы дальнейшие исследования, чтобы определить, есть ли клиническая польза от простагландинов.
Считается, что симпатическая тормозящая способность играет роль в патогенезе послеоперационной кишечной непроходимости. 27 , 28 Таким образом, на основе имеющихся экспериментальных данных были проведены исследования на людях, пытающиеся вызвать адренергическое ингибирование и холинергическую активацию. Эти исследования 105 не продемонстрировали разрешения послеоперационной кишечной непроходимости. Исследования 106 , 107 с использованием хлорида эдрофония и хлорида бетанехола сообщили об улучшении послеоперационной кишечной непроходимости у людей, но побочные эффекты этих агентов ограничивают их использование.
Ацетилхолин высвобождается из кишечной нервной системы и вызывает усиление сократимости стенок кишечника. 108 Ацетилхолин расщепляется в синаптической щели под действием ацетилхолинэстеразы. Неостигмин является обратимым ингибитором ацетилхолинэстеразы и, как таковой, исследовался в качестве потенциального средства лечения послеоперационной кишечной непроходимости. Kreis et al. 109 недавно обнаружили, что терапия неостигмином значительно увеличивает моторику толстой кишки в раннем послеоперационном периоде у пациентов, перенесших колоректальную операцию.Эти результаты обнадеживают, но «ранний послеоперационный период», скорее всего, связан с физиологической кишечной непроходимостью, и необходимо провести эксперименты по определению влияния неостигмина на паралитическую кишечную непроходимость.
Метоклопрамида гидрохлорид — прокинетический агент, который действует как холинергический агонист и антагонист дофамина. Он инициирует активность фазы III MMC через свое антагонистическое действие на дофамин. По крайней мере, 6 контролируемых клинических испытаний 105 -111 изучали влияние терапии метоклопрамидом на пациентов, перенесших абдоминальные хирургические процедуры.Хотя конечные точки, использованные в исследованиях, различались, ни одна из них не дала значительного преимущества в лечении послеоперационной кишечной непроходимости. 110 -116
Эритромицин — это 13-углеродный антибиотик, принадлежащий к семейству макролидов. Побочные эффекты со стороны желудочно-кишечного тракта, вызываемые этим антибиотиком, включают спазмы в животе, тошноту, рвоту и диарею. Эритромицин является агонистом рецептора мотилина, который связывается с рецепторами гладкомышечных мембран желудочно-кишечного тракта, вытесняя эндогенный лиганд мотилин.В ходе проспективных рандомизированных клинических исследований терапия эритромицином не позволила устранить послеоперационную кишечную непроходимость у пациентов, перенесших абдоминальные операции. 117 , 118
Цизаприд является агонистом серотонина, который способствует высвобождению ацетилхолина из внутреннего сплетения. По крайней мере, 9 рандомизированных клинических исследований 119 -127 были проведены на пациентах, получавших цизаприд по поводу послеоперационной кишечной непроходимости после различных хирургических процедур.Однако сравнение этих исследований затруднительно, поскольку использовались разные конечные точки, пациенты подвергались различным хирургическим процедурам, а дозы, продолжительность и способы введения были разными. В 4 исследованиях 119 -122 наблюдалось статистически значимое уменьшение послеоперационной кишечной непроходимости. Хотя эти результаты обнадеживают, многие исследования 123 , 126 , 127 не сообщили об отсутствии статистически значимых эффектов. Вопросы относительно эффективности цизаприда останутся, поскольку он был удален с рынка из-за вредных побочных эффектов.
Церулетид — синтетический пептид, который может усиливать перистальтику желудочно-кишечного тракта, действуя как антагонист холецистокинина. 1 Небольшое уменьшение кишечной непроходимости было отмечено в 2 клинических плацебо-контролируемых исследованиях. 128 , 129 Терапия церулетидом имеет побочные эффекты в виде тошноты и рвоты, что может ограничивать ее клиническую эффективность. Прежде чем можно будет рекомендовать клиническое использование, необходимы дальнейшие исследования.
Октреотид — аналог соматостатина, который, как известно, подавляет секрецию многих желудочно-кишечных гормонов.Каллен и др., , 130, показали, что терапия октреотидом сокращает продолжительность кишечной непроходимости в тонкой и толстой кишке собак. Однако необходимы клинические исследования, чтобы доказать его эффективность на людях.
Жевание жевательной резинки может быть простым, но эффективным средством лечения послеоперационной кишечной непроходимости. Asao et al. 131 провели рандомизированное проспективное контролируемое исследование жевания резинки как метода стимуляции перистальтики кишечника после лапароскопической колэктомии по поводу колоректального рака.Пациенты жевали резинку 3 раза в день с 1 дня после операции до приема внутрь. Первые газы выделялись в среднем на 1,1 дня раньше в группе жевательной резинки, чем в контрольной (2,1 день против 3,2). Первая дефекация также была значительно раньше у пациентов, которые жевали резину (послеоперационный день 3,1), чем в контрольной группе (послеоперационный день 5,8). Однако продолжительность пребывания в больнице существенно не различалась между двумя группами (13,5 против 14,5 дней) и в целом была несколько дольше, чем указано в литературе.Авторы предполагают, что помощь в восстановлении послеоперационной кишечной непроходимости, достигаемая при жевании резинки, может быть связана с эффектами имитационного кормления. Мнимое кормление вызывает вагусную холинергическую стимуляцию желудочно-кишечного тракта и вызывает высвобождение гастрина, полипептида поджелудочной железы и нейротензина, которые влияют на моторику желудочно-кишечного тракта. 132 , 133 Необходимы дальнейшие проспективные рандомизированные контролируемые исследования влияния жевания резинки на послеоперационную перистальтику кишечника.
Lobo et al. 134 хотели определить влияние водно-солевого баланса на восстановление желудочно-кишечного транзита у пациентов, перенесших резекцию толстой кишки по поводу рака толстой кишки. Их дизайн исследования случайным образом распределял пациентов для получения стандартного послеоперационного режима жидкости (3 л воды и 154 ммоль натрия в день) или ограниченного протокола приема жидкости (≤2 л воды и 77 ммоль натрия в день). Первичные конечные точки исследования включали твердофазное и жидкофазное опорожнение желудка, измеренное сцинтиграфией изотопных радионуклидов на четвертый послеоперационный день, при этом первый газ и дефекация служили вторичными конечными точками.Результаты продемонстрировали значительно более длительное опорожнение желудка твердой и жидкой средой для стандартной группы по сравнению с группой с ограничением жидкости (твердое вещество: 175 против 72 минут; жидкость: 110 против 73 минут). У пациентов, получавших ограниченное количество жидкости, первые газы отошли на 1 день раньше, у них была первая дефекация на 2,5 дня раньше и средняя продолжительность пребывания в больнице была на 3 дня короче, чем у пациентов, получавших стандартные объемы жидкости ( P = 0,001 для всех) . Авторы пришли к выводу, что положительный солевой и водный баланс, достаточно значительный, чтобы добавить 3 кг массы тела после резекции толстой кишки, задерживает желудочно-кишечный транзит и продлевает пребывание в больнице.
Многомодельный подход к послеоперационной подвздошной кишке
Из всех доступных методов лечения (Таблица 2) какое лучше? Лучшее лечение, доступное в настоящее время, — это мультимодальный режим. Basse et al. 135 исследовали мультимодальную схему реабилитации для лечения послеоперационной кишечной непроходимости, состоящую из непрерывной эпидуральной анальгезии, раннего перорального питания и мобилизации, а также цизаприда и слабительного лечения с магнезией.Используя этот режим, авторы наблюдали нормализацию времени прохождения через желудочно-кишечный тракт в течение 48 часов после резекции толстой кишки по сравнению с подобранной контрольной группой. Время желудочно-кишечного транзита оценивали сцинтиграфическим методом пентетата индия In 111. Относительный вклад каждой модальности неизвестен. Этот конкретный подход далеко не идеален, учитывая, что цизаприд больше не доступен. Также не было показано, что передвижение улучшает послеоперационную перистальтику кишечника, хотя это полезно для пациентов по другим причинам. 136
Другое исследование 137 в поддержку мультимодального подхода было проведено на пациентах, перенесших сегментарную колэктомию. Авторы использовали режим, который включал грудную эпидуральную анестезию в течение 48 часов, отсутствие назогастрального зонда, 1 л жидкости перорально в день операции, мобилизацию в течение 8 часов после операции, использование молока магнезии и изменение разреза. (изогнутые или поперечные) для минимизации боли и легочной дисфункции. Девяносто пять из 100 обследованных пациентов исполнились через 48-72 часа.
Паралитическая послеоперационная кишечная непроходимость продолжает оставаться серьезной клинической проблемой. Этиологию этого процесса лучше всего охарактеризовать как многофакторную. Эти факторы действуют одновременно или в разное время в течение развития послеоперационной кишечной непроходимости. Механизмы, участвующие в паралитической послеоперационной непроходимости кишечной непроходимости, включают тормозящую симпатическую активность; высвобождение гормонов, нейротрансмиттеров и других медиаторов; воспалительная реакция; и эффекты анальгетиков.Экспериментальные исследования продолжают выяснять роль и механизмы действия всех этих факторов. В клинических условиях для облегчения послеоперационной кишечной непроходимости использовались многочисленные методы, но без особого успеха. В это время лучше всего порекомендовать подход, который уменьшит факторы, способствующие паралитической послеоперационной кишечной непроходимости. Этот подход будет включать ограничение приема наркотиков и использование альтернативных анальгетиков, таких как нестероидные противовоспалительные препараты, а также, по возможности, эпидуральную анестезию грудной клетки с местными анестетиками.Выборочное использование назогастральной декомпрессии и коррекция электролитного дисбаланса также важны при мультимодальном подходе к лечению паралитической послеоперационной кишечной непроходимости. Текущие исследования могут иметь положительное влияние в таких областях, как селективный антагонист опиоидов, лапароскопическая хирургия и манипулирование местными факторами, нейротрансмиттерами и гормонами стресса. Клиницисты с нетерпением ждут того дня, когда паралитическая послеоперационная кишечная непроходимость уйдет в прошлое.
Автор, отвечающий за переписку, и оттиски: Эндрю Лаки, доктор медицины, Медицинская школа Дэвида Геффена при Калифорнийском университете в Лос-Анджелесе, CURE: Исследовательский центр болезней пищеварения, VA Greater LA Healthcare System, 11301 Wilshire Blvd, Building 115, Room 217, Los Анхелес, Калифорния (электронная почта: LuckeyA @ хирургия.uscf.edu).
1.Недоступно, иллюстрированный медицинский словарь Дорланда, 28-е изд. Филадельфия, Пенсильвания, WB Saunders Co, 1994; 819
4, Вальдхаузен Дж. Х. Шаффри MESkenderis BS IIJones RSSchirmer BD. Миоэлектрическая проницаемость желудочно-кишечного тракта и клинические картины восстановления после лапаротомии. Ann Surg. 1990; 211777-784Google ScholarCrossref 5. Мосс GRegal MELichtig LK Уменьшение послеоперационной боли, наркотиков и продолжительности госпитализации. Хирургия. 1986; -210 Google Scholar6.Neely JCatchpole B Ileus: восстановление моторики пищеварительного тракта фармакологическими средствами. Br J Surg. 1971; 5821-28Google ScholarCrossref 7.Bayliss WMStarling Э. Х. Движения и иннервация тонкой кишки. J. Physiol (Лондон). 1899; 2499–143Google Scholar8.Dubois AHenry Д.Копин I Катехоламины плазмы и послеоперационное опорожнение желудка и продвижение тонкого кишечника у крыс. Гастроэнтерология. 1975; 68466-469 Google Scholar9, Сарграда AFargeas MJBueno L Участие альфа-1 и альфа-2 адренорецепторов в постлапаротомных кишечных двигательных нарушениях у крыс. Gut. 1987; 28955-959Google ScholarCrossref 10.Barquist EZinner MRivier JTaché Y Задержка опорожнения желудка у крыс, вызванная абдоминальной хирургией: роль CRF и сенсорных нейронов. Am J Physiol. 1992; 262G616- G620Google Scholar 11.Zittel TTReddy NSPlourde VRaybould HE Роль спинальных афферентов и пептида, связанного с геном кальцитонина, в послеоперационной кишечной непроходимости желудка у анестезированных крыс. Ann Surg. 1994; 21979-87Google ScholarCrossref 12. Ривьер JMPascaud XChevalier Эле Галлу BJunien JL Федотозин устраняет непроходимость кишечной непроходимости, вызванную хирургическим вмешательством или перитонитом: действие на периферические κ-опиоидные рецепторы. Гастроэнтерология. 1993; 104724-731Google Scholar 13.Эспат NJCheng GKelley MCVogel СБСнинский CAHocking Вазоактивный кишечный пептид МП и антагонисты рецепторов вещества Р улучшают состояние послеоперационной кишечной непроходимости. J Surg Res. 1995; 58719-723Google ScholarCrossref 14.Zittel TTLloyd KCKTothenhofer IWong HWalsh JHRaybould Пептид, связанный с геном кальцитонина, и спинальные афференты частично опосредуют послеоперационную кишечную непроходимость кишечника у крыс. Хирургия. 1998; 123518-527Google ScholarCrossref 15.Huge AKreis MEJehle EC и другие. Модель для исследования послеоперационной кишечной непроходимости с тензометрическими датчиками у бодрствующих крыс. J Surg Res. 1998; 74112-118Google ScholarCrossref 16.Szurszewski JH Мигрирующий электрический комплекс тонкой кишки собаки. Am J Physiol. 1969; 2171757-1763Google Scholar17.Code CFSchlegel J Межпищеварительная домработница желудочно-кишечного тракта: моторный коррелят межпищеварительного миоэлектрического комплекса собаки.Даниэль EEed. Труды четвертого международного симпозиума по подвижности желудочно-кишечного тракта Ванкувер, Британская Колумбия Mitchell Press, 1973; Google Scholar18, Сарна СК Циклическая двигательная активность; мигрирующий двигательный комплекс: 1985. Гастроэнтерология. 1985; 89894- 913Google Scholar19.Hocking MPVogel С.Б. Физиология желудочной секреции и моторики при нормальных и постгастрэктомических (постваготомических) состояниях. Подкакивание MPVogel SBeds. Постгастрэктомические синдромы Вудворда. 2-е изд. Филадельфия, Пенсильвания, WB Saunders Co, 1991; 29-46, Google Scholar20.Fujimiya Минуи Пептидергическая регуляция моторики желудочно-кишечного тракта у грызунов. Пептиды. 2000; 211565–1582Google ScholarCrossref 21.Sarna С.К.Бардакджян BEводопад WELind JF Электроуправляемая деятельность человека (ECA). Гастроэнтерология. 1980; 781526-1536Google Scholar22.Bueno LFerre JPRuckebusch Y Влияние анестезии и хирургических процедур на миоэлектрическую активность кишечника у крыс. Am J Dig Dis. 1978; 23690-695Google ScholarCrossref 23. Маршалл FNPittenger CBLong JP Влияние галотана на моторику желудочно-кишечного тракта. Анестезиология. 1961; 22363-366Google ScholarCrossref 24.Condon RECowles VESchulte WJFrantzides CTMahoney JLSarna С.К. Разрешение послеоперационной кишечной непроходимости у человека. Ann Surg. 1986; 203574-581Google ScholarCrossref 25. Woods Дж. Х. Эриксон LWКондон RESchulte WJSillin LF Послеоперационная кишечная непроходимость: проблема толстой кишки? Хирургия. 1978; 84527-533 Google Scholar, 26. Кенвентер J Блуждающий контроль моторики двенадцатиперстной и подвздошной кишки и кровотока. Acta Physiol Scand. 1965; 631-68Google ScholarCrossref 27.Nilsson FJung B Опорожнение желудка и малый толчок после лапаротомии. Acta Chir Scand. 1973; 139724-730Google Scholar28.Dubois AWeise В.К.Копин И. Я. Послеоперационная кишечная непроходимость крысы: физиология, этиология и лечение. Ann Surg. 1973; 178781-786Google ScholarCrossref 29.Дюбуа А.Копин И.Дж.Петтигрю KDJacobowitz М.Д. Химические и гистохимические исследования послеоперационной симпатической активности пищеварительного тракта крысы. Гастроэнтерология. 1974; 66403-407Google Scholar 30. Де Винтер BYBoeckxstaens GEDe Man JGMoreels TGHerman А.Г.Пелькманс П.А. Влияние адренергической и нитрергической блокады на экспериментальную кишечную непроходимость крыс. Br J Pharmacol. 1997; 120464-468Google ScholarCrossref 31.Делоф SCroix Д.Траму G Роль вазоактивного кишечного полипептида в ингибировании антральной и пилорической электрической активности у кроликов. J Auton Nerv Syst. 1988; 22167-173Google ScholarCrossref 32.Holzer PLippe Ингибирование желудочно-кишечного транзита из-за хирургической травмы или раздражения брюшины снижается у крыс, получавших капсаицин. Гастроэнтерология. 1986;Джонсон LR Физиология желудочно-кишечного тракта . Нью-Йорк, Нью-Йорк Рэйвен Пресс, 1994;
87. Стюарт BTWoods RJCollopy BTFink RJMackay JRKeck JO Раннее кормление после плановой открытой колоректальной резекции: проспективное рандомизированное исследование. Aust N Z J Surg. 1998; 68125-128Google ScholarCrossref 88.Di Fronzo Л.А. Цимерман Джо’Коннелл Факторы ТХ, влияющие на раннее послеоперационное кормление после плановой открытой резекции толстой кишки. Arch Surg. 1999; 134941-945Google ScholarCrossref 89.Macmillan SLMKammerer-Doak Дрогеры RGParker К.М. Раннее кормление и частота желудочно-кишечных симптомов после обширных гинекологических операций. Акушер Гинекол. 2000; 96604-608Google ScholarCrossref 90.Heslin MJLatkany LLeung D и другие. Проспективное рандомизированное исследование раннего энтерального питания после удаления злокачественного новообразования верхних отделов желудочно-кишечного тракта. Ann Surg. 1997; 226567–577Google ScholarCrossref 91. Water Дж. М. Киркпатрик С.М.Норрис С.Б.Шамджи FMWells GA Немедленное послеоперационное кормление приводит к нарушению дыхательной механики и снижению подвижности. Ann Surg. 1997; 226369–377Google ScholarCrossref 92.Leung KLLai PBHo RL и другие. Системный цитокиновый ответ после лапароскопической резекции ректосигмоидной карциномы: проспективное рандомизированное исследование. Ann Surg. 2000; 231506-511Google ScholarCrossref 93.Lacy AMGarcia-Valdecasas JCPique JM и другие. Краткосрочный анализ результатов рандомизированного исследования, сравнивающего лапароскопическую и открытую колэктомию при раке толстой кишки. Эндоскопическая хирургия. 1995; -1105Google Scholar94.Bohm BMilsom JWFazio VW Послеоперационная перистальтика кишечника после традиционных и лапароскопических операций на кишечнике. Arch Surg. 1995; 130415-419Google ScholarCrossref 95.Senagore AJLuchtefeld МАКЕЙГАН Дж. М. Мазье WP Открытая колэктомия и лапароскопическая колэктомия: есть ли различия? Am Surg. 1993; 59549-553Google Scholar96.Schwenk WBohm BHaase OJunghans TMuller JM Лапароскопическая резекция прямой кишки по сравнению с традиционной: проспективное рандомизированное исследование послеоперационной кишечной непроходимости и раннего кормления. Langenbecks Arch Surg. 1998; 38349-55Google ScholarCrossref 97.Merry BPower W Периоперационные НПВП: к большей безопасности. Pain Rev.9 1995; 2268-291Google Scholar98.Yee МКЭванс WDFacey PEHayward MWRosen M Опорожнение желудка и прохождение тонкой кишки у мужчин-добровольцев после внутримышечной инъекции. кеторолак и морфин. Br J Anaesth. 1991; 67426- 431Google ScholarCrossref 99.Kelley MCHocking MPMarchand С.Д.Снинский CA Ketorolac предотвращает послеоперационную кишечную непроходимость у крыс. Am J Surg. 1993; 165107-111Google ScholarCrossref 100.De Winter BYBoeckxstaens GEDe Man JGMoreels TGHerman А.Г.Пелькманс П.А. Дифференциальное действие индометацина и кеторолака на послеоперационную кишечную непроходимость крыс. Eur J Pharmacol. 1998; 34471-76Google ScholarCrossref 101.Cheng GCassissi CDrexler П.Ф.Фогель СБСнинский CAHocking MP Salsalate, морфин и послеоперационная кишечная непроходимость. Am J Surg. 1996; 17185-88Google ScholarCrossref 102.Ferraz AACowles VECondon RE и другие. Неопиоидные анальгетики сокращают продолжительность послеоперационной кишечной непроходимости. Am Surg. 1995; 611079-1083Google Scholar103.Fanning Ю-Брекке S Проспективное исследование агрессивной послеоперационной стимуляции кишечника после радикальной гистерэктомии. Gynecol Oncol. 1999; 73412-414Google ScholarCrossref 104.Ruwart MJKlepper MSRush BD Механизм стимуляции желудочно-кишечного тракта у крыс послеоперационной кишечной непроходимости 16, 16-диметил-PGE 2 . Adv Prostaglandin Thromboxane Res. 1980; 81603-1607Google Scholar 105.Heimbach DMCrout JR Лечение паралитической кишечной непроходимости препаратами, блокирующими адренергические нейроны. Хирургия. 1971; 69582-587Google Scholar106.Furness JBCosta М. Адинамическая кишечная непроходимость, ее патогенез и лечение. Med Biol. 1974; 5282-89Google Scholar 108.Burks ТФ Нейротрансмиссия и нейротрансмиттеры. Джонсон LRAlpers Д.М. Кристенсен JJacobson ЭДУолш JHeds. Физиология желудочно-кишечного тракта Том 13-е изд. Нью-Йорк, NY Raven Press, 1994; Google Scholar109.Kreis MEKasparek MZittel TTBecker HDJehle EC Neostigmine увеличивает послеоперационную моторику толстой кишки у пациентов, перенесших колоректальную операцию. Хирургия. 2001; 130449-456Google ScholarCrossref 110.Jepsen SKlaerke ANielsen PHSimonsen O Отрицательный эффект метоклопрамида при послеоперационной адинамической непроходимости кишечника: проспективное рандомизированное двойное слепое исследование. Br J Surg. 1986; 73290-291Google ScholarCrossref 111.Cheape JDWexner SDJames К.Ягельман Д.Г. Уменьшает ли метоклопрамид длину кишечной непроходимости после колоректальной хирургии? проспективное рандомизированное исследование. Dis Colon Rectum. 1991; 34437-441Google ScholarCrossref 112.Tollesson POCassuto JFaxen ARimback GMattsson ERosen S Отсутствие эффекта метоклопрамида на перистальтику толстой кишки после холецистэктомии. Eur J Surg. 1991; 157355-358Google Scholar113.Breivik HLind B Противорвотные и пропульсивные перистальтические свойства метоклопрамида. Br J Anaesth. 1971; 43400-403Google ScholarCrossref 114 Дэвидсон EDHersh TBrinner RABarnett SMBoyle LP Влияние метоклопрамида на послеоперационную кишечную непроходимость: рандомизированное двойное слепое исследование. Ann Surg. 1979; 19027-30 Google ScholarCrossref 115. Кивало IMiettinen K Влияние метоклопрамида на послеоперационную тошноту и функцию кишечника. Энн Чир Гинекол Фенн. 1970; 59155-158. Google Scholar, 116. Сета. MLKale-Pradham PB Эффективность метоклопрамида при послеоперационной кишечной непроходимости после исследовательской лапаротомии. Фармакотерапия. 2001; 101181-1186Google ScholarCrossref 117.Smith AJНиссан Алануэтт НМ и другие. Прокинетический эффект эритромицина после колоректального хирургического вмешательства: рандомизированное, плацебо-контролируемое, двойное слепое исследование. Dis Colon Rectum. 2000; 43333-337Google ScholarCrossref 118.Bonacini MQuiason Рейнольдс MGaddis MPemberton BSmith O Влияние эритромицина на послеоперационную кишечную непроходимость. Am J Gastroenterol. 1993; 88208-211Google Scholar119.Tollesson POCassuto JRimback GFaxen А.Бергман Л.Маттссон E Лечение послеоперационной паралитической кишечной непроходимости цизапридом. Сканд Дж Гастроэнтерол. 1991; 26477-482Google ScholarCrossref 120.Brown TAMcDonald JWilliard W Проспективное рандомизированное двойное слепое плацебо-контролируемое исследование цизаприда после колоректальной хирургии. Am J Surg. 1999; 177399-401Google ScholarCrossref 121.Boghaert BHaesaert GMourisse PVerlinden M Плацебо-контролируемое исследование цизаприда при послеоперационной кишечной непроходимости. Acta Anaesthesiol Belg. 1987; 38195-1999Google Scholar122.Verlinden Мичильс GBoghaert Аде Костер MDehertog P Лечение послеоперационной атонии желудочно-кишечного тракта. Br J Surg. 1987; 74614-617Google ScholarCrossref 123. von Ritter CHunter Шиндер Цизаприд RA не уменьшает послеоперационную непроходимость кишечника. S Afr J Surg. 1987; 2519-21Google Scholar124.Lander Бредкарь RNicholls грамм и другие. Цизаприд уменьшает послеоперационную непроходимость кишечника новорожденных: рандомизированное плацебо-контролируемое исследование. Arch Dis Child Fetal Neonatal Ed. 1997; 77F119- F122Google ScholarCrossref 125.Barone JAJessen LMColaizzi JLBierman RH Cisapride: желудочно-кишечный прокинетический препарат. Ann Pharmacother. 1994; 28488-500 Google Scholar126.Hallerback HBergman BBong ЧАС и другие.Цизаприд в лечении послеоперационной кишечной непроходимости. Aliment Pharmacol Ther. 1991; 5503-511Google ScholarCrossref 127.Roberts JPBenson MJRodgers JDeeks JJWingate DLWilliams Н.С. Влияние цизаприда на перистальтику дистального отдела толстой кишки в раннем послеоперационном периоде после анастомоза левой кишки. Dis Colon Rectum. 1995; 38139-145Google ScholarCrossref 128.Sadek SACranford CEriksen C и другие.Фармакологические манипуляции с адинамической кишечной непроходимостью: контролируемое рандомизированное двойное слепое исследование церулетида на двигательную активность кишечника после плановой абдоминальной хирургии. Aliment Pharmacol Ther. 1988; 247-54Google ScholarCrossref 129.Madsen П.В.Люккегор-Нильсен MNielsen OV Ceruletide уменьшает послеоперационный паралич кишечника: двойное слепое плацебо-контролируемое исследование. Dis Colon Rectum. 1983; 26159-160Google ScholarCrossref 130. Каллен JJEagon JCKelly КА Пептидные гормоны желудочно-кишечного тракта при послеоперационной кишечной непроходимости: действие октреотида. Dig Dis Sci. 1994; 3-1184Google ScholarCrossref 131.Asao TKuwano HNakamura JMoringa NHirayama IIde M Жевание резинки ускоряет восстановление послеоперационной кишечной непроходимости после лапароскопической колэктомии. J Am Coll Surg. 2002; 19530-32Google ScholarCrossref 132.Soffer EEAdrian Т. е. Влияние состава пищи и ложного кормления на моторику двенадцатиперстной кишки у человека. Dig Dis Sci. 1992; 371009-1014Google ScholarCrossref 133.Качинский MDahmen GReinshagen M и другие. Головная стимуляция секреторной и моторной реакции желудочно-кишечного тракта у людей. Гастроэнтерология. 1992; 103383-391Google Scholar134.Lobo DNBostock KANeal К.Р.Перкинс ACRowlands BJAllison SP Влияние солевого и водного баланса на функцию желудочно-кишечного тракта после плановой резекции толстой кишки. Ланцет. 2002; 35-1818Google ScholarCrossref 135.Basse LMadsen JLKehlet H Нормальный желудочно-кишечный транзит после резекции толстой кишки с использованием эпидуральной анальгезии, принудительного перорального питания и слабительного. Br J Surg. 2001; 881498-1500Google ScholarCrossref 136.Waldenhausen JHSchirmer BD Влияние передвижения на восстановление послеоперационной кишечной непроходимости. Ann Surg. 1990; 212671–677Google ScholarCrossref 137.Basse LJacobsen DBillesbolle п и другие. Клинический способ ускорения восстановления после резекции толстой кишки. Ann Surg. 2000; 23251-57Google ScholarCrossref
Послеоперационный подвздошный кишечник: история вопроса, патофизиология, этиология
Чапман С.Дж., EuroSurg Collaborative.Ileus Management International (IMAGINE): протокол многоцентрового обсервационного исследования кишечной непроходимости после колоректальной хирургии. Колоректальный Дис . 2018 20 января (1): O17-O25. [Медлайн].
Ливингстон Э. Х., Пассаро Э. П. Мл. Послеоперационная кишечная непроходимость. Dig Dis Sci . 1990, январь, 35 (1): 121-32. [Медлайн].
Шибата Ю., Тойода С., Нимура Ю., Мияти М. Модели восстановления перистальтики кишечника на ранней стадии после абдоминальной хирургии: клиническое и манометрическое исследование. Мир J Surg . 1997, 21 октября (8): 806-9; обсуждение 809-10. [Медлайн].
Holte K, Kehlet H. Послеоперационная кишечная непроходимость: событие, которое можно предотвратить. Br J Surg . 2000 ноябрь 87 (11): 1480-93. [Медлайн].
Васкес В., Эрнандес А. В., Гарсия-Сабридо Ю. Л. Полезно ли жевание резинки при кишечной непроходимости после плановой колоректальной хирургии? Систематический обзор и метаанализ рандомизированных клинических исследований. J Гастроинтест Сург . 2009 апр.13 (4): 649-56. [Медлайн].
Barletta JF, Senagore AJ. Снижение бремени послеоперационной кишечной непроходимости: оценка и реализация научно обоснованной стратегии. Мир J Surg . 2014 августа 38 (8): 1966-77. [Медлайн].
Iyer S, Saunders WB, Stemkowski S. Экономическое бремя послеоперационной кишечной непроходимости, связанной с колэктомией в США. Дж. Манаг Кэр Фарм . 2009 июль-авг. 15 (6): 485-94. [Медлайн].
Резник Дж., Гринвальд Д.А., Брандт Л.Дж.Задержка опорожнения желудка и послеоперационная кишечная непроходимость после абдоминальных операций на животе: часть I. Am J Gastroenterol . 1997 Май. 92 (5): 751-62. [Медлайн].
Резник Дж., Гринвальд Д.А., Брандт Л.Дж. Задержка опорожнения желудка и послеоперационная кишечная непроходимость после абдоминальных операций на животе: часть II. Ам Дж. Гастроэнтерол . 1997 июн. 92 (6): 934-40. [Медлайн].
Kalff JC, Schraut WH, Simmons RL, Bauer AJ. Хирургическое вмешательство в кишечнике вызывает воспалительную реакцию мускулов кишечника, приводящую к послеоперационной непроходимости кишечника. Энн Сург . 1998 Ноябрь 228 (5): 652-63. [Медлайн]. [Полный текст].
Boeckxstaens GE, de Jonge WJ. Нейроиммунные механизмы при послеоперационной кишечной непроходимости. Кишечник . 2009 Сентябрь 58 (9): 1300-11. [Медлайн].
Espat NJ, Cheng G, Kelley MC, Vogel SB, Sninsky CA, Hocking MP. Вазоактивный кишечный пептид и антагонисты рецепторов вещества P улучшают состояние послеоперационной кишечной непроходимости. J Surg Res . 1995 июн. 58 (6): 719-23. [Медлайн].
Kalff JC, Schraut WH, Billiar TR, Simmons RL, Bauer AJ.Роль индуцибельной синтазы оксида азота в послеоперационной дисфункции гладких мышц кишечника у грызунов. Гастроэнтерология . 2000 Февраль 118 (2): 316-27. [Медлайн].
Pohl JM, Gutweiler S, Thiebes S, et al. Irf4-зависимые дендритные клетки CD103 + CD11b + и микробиом кишечника регулируют активацию моноцитов и макрофагов и перистальтику кишечника при послеоперационной кишечной непроходимости. Кишечник . 2017 Декабрь 66 (12): 2110-20. [Медлайн].
Фарро Г., Стакенборг М., Гомес-Пинилья П.Дж. и др.CCR2-зависимые макрофаги, происходящие из моноцитов, устраняют воспаление и восстанавливают моторику кишечника при послеоперационной непроходимости кишечника. Кишечник . 2017 Декабрь 66 (12): 2098-109. [Медлайн].
Cameron JL, изд. Современная хирургическая терапия. 7-е изд. Чикаго: Мосби; 2001.
Толлессон П.О., Кассуто Дж., Римбэк Г. Паттерны движущей силы в толстой кишке человека после операций на брюшной полости. Eur J Surg . 1992 апр. 158 (4): 233-6. [Медлайн].
Senagore AJ.Патогенез и клинико-экономические последствия послеоперационной кишечной непроходимости. Am J Health Syst Pharm . 2007 октября 15. 64 (20 Дополнение 13): S3-7. [Медлайн].
Куруба Р., Фаярд Н., Снайдер Д. Эпидуральная анальгезия и лапароскопическая техника не снижают частоту длительной кишечной непроходимости при плановых резекциях толстой кишки. Am J Surg . 2012 ноябрь 204 (5): 613-8. [Медлайн].
Wolff BG, Viscusi ER, Delaney CP, Du W, Techner L. Модели восстановления желудочно-кишечного тракта после резекции кишечника и тотальной абдоминальной гистерэктомии: объединенные результаты плацебо-групп в североамериканских клинических испытаниях III фазы альвимопана. J Am Coll Surg . 2007 июл.205 (1): 43-51. [Медлайн].
Китахата Р., Накадзима С., Судзуки Т., Плитман Э, Мимура М., Учида Х. Рецидив кишечной непроходимости у пациентов с психическими расстройствами: обзор двухлетней карты. Генеральная психиатрическая больница . 2016 янв-фев. 38: 31-6. [Медлайн].
Gokce AM, Ozel L, Ibisoglu S, et al. Редкая причина кишечной непроходимости у пациентов с трансплантатом почки с перитонеальным диализом в анамнезе: инкапсулированный склероз брюшины. Exp Clin Трансплантация . 2015 13 декабря (6): 588-92. [Медлайн].
Loftus CG, Harewood GC, Baron TH. Оценка предикторов ответа на неостигмин при острой псевдообструкции толстой кишки. Ам Дж. Гастроэнтерол . 2002 декабрь 97 (12): 3118-22. [Медлайн].
Wu Z, Boersema GS, Dereci A, Menon AG, Jeekel J, Lange JF. Клиническая конечная точка, раннее выявление и дифференциальная диагностика послеоперационной кишечной непроходимости: систематический обзор литературы. Eur Surg Res . 2015. 54 (3-4): 127-38. [Медлайн].
Кронберг У., Киран Р.П., Солиман М.С. и др. Характеристика факторов, определяющих послеоперационную кишечную непроходимость после лапароскопической колэктомии, позволяет получить новую прогностическую оценку. Энн Сург . 2011 Январь 253 (1): 78-81. [Медлайн].
Гоц М., Браун Г., Якобс Р. и др., Fur die Mitglieder der DGVS-Kommission im Anhang. [Позиция Немецкого общества гастроэнтерологов, пищеварительных и метаболических заболеваний (DGVS) по эндоскопической декомпрессии при остром подвздошном кишечнике]. Z Гастроэнтерол . 2017 Декабрь 55 (12): 1499-1508. [Медлайн].
Liang X, Li W, Zhao B, Zhang L, Cheng Y. Сравнительный анализ MDCT и MRI в диагностике хронической перфорации желчных камней и кишечной непроходимости. Eur J Radiol . 2015 Октябрь 84 (10): 1835-42. [Медлайн].
Шварц С.И., изд. Принципы хирургии. 7-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 1999.
Брунс Б.Р., Козар РА. Питание послеоперационного больного на вазопрессорной опоре: кормление и прессорная опора. Нутр Клин Практик . 2016 31 февраля (1): 14-7. [Медлайн].
Кали Р.Л., Мид П.Г., Суонсон М.С., Фриман С. Влияние морфина и длины разреза на функцию кишечника после колэктомии. Диск прямой кишки . 2000 Февраль 43 (2): 163-8. [Медлайн].
Ферраз А.А., Коулз В.Е., Кондон Р.Е. и др. Неопиоидные анальгетики сокращают продолжительность послеоперационной кишечной непроходимости. Am Surg . 1995 г., декабрь 61 (12): 1079-83. [Медлайн].
Ян П.Ф., Морган М.Дж.Лапароскопия по сравнению с открытой отменой процедуры Хартмана: ретроспективный обзор. ANZ J Surg . 2014 декабрь 84 (12): 965-9. [Медлайн].
Purkayastha S, Tilney HS, Darzi AW, Tekkis PP. Метаанализ рандомизированных исследований по оценке жевательной резинки для улучшения послеоперационного восстановления после колэктомии. Arch Surg . 2008, август, 143 (8): 788-93. [Медлайн].
Shang H, Yang Y, Tong X, Zhang L, Fang A, Hong L. Жевание резинки слегка улучшает раннее восстановление послеоперационной кишечной непроходимости после кесарева сечения: результаты проспективного рандомизированного контролируемого исследования. Am J Perinatol . 2010 май. 27 (5): 387-91. [Медлайн].
Waldhausen JH, Schirmer BD. Влияние ходьбы на восстановление послеоперационной кишечной непроходимости. Энн Сург . 1990 Декабрь 212 (6): 671-7. [Медлайн]. [Полный текст].
Zingg U, Miskovic D, Hamel CT, Erni L, Oertli D, Metzger U. Влияние торакальной эпидуральной анальгезии на послеоперационное обезболивание и непроходимость кишечной непроходимости после лапароскопической колоректальной резекции: польза от эпидуральной анальгезии. Эндоскопическая хирургия . 2009 23 февраля (2): 276-82. [Медлайн].
Лю С.С., Карпентер Р.Л., Макки Д.К. и др. Влияние периоперационной анальгетической техники на скорость восстановления после операции на толстой кишке. Анестезиология . 1995 Октябрь 83 (4): 757-65. [Медлайн].
Mann C, Pouzeratte Y, Boccara G, et al. Сравнение внутривенной или эпидуральной анальгезии, контролируемой пациентом, у пожилых людей после обширных операций на брюшной полости. Анестезиология .2000 Февраль 92 (2): 433-41. [Медлайн].
Marret E, Rolin M, Beaussier M, Bonnet F. Мета-анализ внутривенного лидокаина и послеоперационного восстановления после абдоминальной хирургии. Br J Surg . 2008 ноябрь 95 (11): 1331-8. [Медлайн].
Харви К.П., Адаир Дж. Д., Ишо М., Робинсон Р. Может ли внутривенный лидокаин уменьшить послеоперационную кишечную непроходимость и сократить пребывание в больнице при плановой операции на кишечнике? Пилотное исследование и обзор литературы. Am J Surg .2009 августа 198 (2): 231-6. [Медлайн].
Becker G, Blum HE. Новые антагонисты опиоидов при дисфункции кишечника и послеоперационной кишечной непроходимости. Ланцет . 2009 г., 4 апреля 373 (9670): 1198-206. [Медлайн].
Марон DJ, Фрай RD. Новые методы лечения послеоперационной кишечной непроходимости желудочно-кишечного тракта. Am J Ther . 2008 янв-фев. 15 (1): 59-65. [Медлайн].
Yuan CS, Foss JF, Osinski J, Toledano A, Roizen MF, Moss J.Безопасность и эффективность перорального метилналтрексона в предотвращении морфин-индуцированной задержки времени орально-слепого транзита. Clin Pharmacol Ther . 1997 апр. 61 (4): 467-75. [Медлайн].
Candy B, Jones L, Goodman ML, Drake R, Tookman A. Слабительные или метилналтрексон для лечения запоров у пациентов, оказывающих паллиативную помощь. Кокрановская база данных Syst Rev . 2011 19 января. CD003448. [Медлайн].
Yu CS, Chun HK, Stambler N, et al.Безопасность и эффективность метилналтрексона в сокращении продолжительности послеоперационной кишечной непроходимости после сегментарной колэктомии: результаты двух рандомизированных плацебо-контролируемых исследований фазы 3. Диск прямой кишки . 2011 Май. 54 (5): 570-8. [Медлайн].
Эрншоу С.Р., Кауф Т.Л., МакДейд С. и др. Экономическое влияние алвимопана с учетом различных определений послеоперационной кишечной непроходимости. J Am Coll Surg . 2015 Ноябрь 221 (5): 941-50. [Медлайн].
Тагучи А., Шарма Н., Салим Р.М. и др.Селективное послеоперационное угнетение опиоидных рецепторов желудочно-кишечного тракта. N Engl J Med . 2001, 27 сентября. 345 (13): 935-40. [Медлайн].
Тан Е.К., Корниш Дж., Дарзи А.В., Теккис П.П. Метаанализ: Альвимопан в сравнении с плацебо в лечении послеоперационной кишечной непроходимости. Aliment Pharmacol Ther . 2007, 1. 25 (1): 47-57. [Медлайн].
Тан Е.К., Корниш Дж., Дарзи А.В., Теккис П.П. Мета-анализ: Альвимопан в сравнении с плацебо в лечении послеоперационной кишечной непроходимости. Aliment Pharmacol Ther . 2007, 1. 25 (1): 47-57. [Медлайн].
Zingg U, Miskovic D, Pasternak I, Meyer P, Hamel CT, Metzger U. Влияние бисакодила на послеоперационную перистальтику кишечника при плановой колоректальной хирургии: проспективное рандомизированное исследование. Int J Colorectal Dis . 2008 г., 23 (12): 1175-83. [Медлайн].
Wiriyakosol S, Kongdan Y, Euanorasetr C, Wacharachaisurapol N, Lertsithichai P. Рандомизированное контролируемое испытание бисакодиловых суппозиториев по сравнению с плацебо при послеоперационной кишечной непроходимости после плановой колэктомии при раке толстой кишки. Азиатский J Surg . 2007 июля 30 (3): 167-72. [Медлайн].
Траут У., Брюггер Л., Кунц Р. и др. Системное прокинетическое фармакологическое лечение послеоперационной адинамической кишечной непроходимости после абдоминальной хирургии у взрослых. Кокрановская база данных Syst Rev . 2008 23 января. CD004930. [Медлайн].
Wattchow DA, De Fontgalland D, Bampton PA, Leach PL, McLaughlin K, Costa M. Клиническое испытание: влияние ингибиторов циклооксигеназы на восстановление желудочно-кишечного тракта после обширной операции — рандомизированное двойное слепое контролируемое испытание целекоксиба или диклофенака по сравнению сплацебо. Aliment Pharmacol Ther . 2009 15 ноября. 30 (10): 987-98. [Медлайн].
Yeh YC, Klinger EV, Reddy P. Фармакологические варианты профилактики послеоперационной кишечной непроходимости. Энн Фармакотер . 2009 Сентябрь 43 (9): 1474-85. [Медлайн].
Abd-El-Maeboud KH, Ibrahim MI, Shalaby DA, Fikry MF. Жевание резинки стимулирует скорейшее восстановление перистальтики кишечника после кесарева сечения. БЖОГ . 2009 сентябрь 116 (10): 1334-9. [Медлайн].
Бем Б., Столлман Н.Послеоперационная кишечная непроходимость: этиология и вмешательства. Клин Гастроэнтерол Гепатол . 2003 Март 1 (2): 71-80. [Медлайн].
Картер С. Хирургическая бригада и лечение исходов: акцент на послеоперационной кишечной непроходимости. J Perianesth Nurs . 2006 г., 21 апреля (2A Suppl): S2-6. [Медлайн].
Delaney CP, Senagore AJ, Viscusi ER, et al. Послеоперационное восстановление верхних и нижних отделов желудочно-кишечного тракта и желудочно-кишечные заболевания у пациентов, перенесших резекцию кишечника: объединенный анализ данных плацебо из 3 рандомизированных контролируемых исследований. Am J Surg . 2006 Март 191 (3): 315-9. [Медлайн].
Houwen RH, van der Doef HP, Sermet I, et al. Определение DIOS и запора при муковисцидозе с помощью многоцентрового исследования заболеваемости, характеристик и лечения DIOS. J Педиатр Gastroenterol Nutr . 2010 января 50 (1): 38-42. [Медлайн].
Джонс М.П., Вессингер С. Периодичность тонкого кишечника. Curr Opin Гастроэнтерол . 2006 22 марта (2): 111-6. [Медлайн].
Mattei P, Rombeau JL. Обзор патофизиологии и лечения послеоперационной кишечной непроходимости. Мир J Surg . 2006 30 августа (8): 1382-91. [Медлайн].
Мур Б.А., Альберс К.М., Дэвис Б.М., Грандис-младший, Тогель С., Бауэр А.Дж.. Измененная экспрессия воспалительного гена лежит в основе повышенной восприимчивости к послеоперационной непроходимости кишечной непроходимости у мышей с возрастом. Am J Physiol Gastrointest Liver Physiol . 2007 июн 292 (6): G1650-9. [Медлайн].
Ng WQ, Neill J. Доказательства раннего перорального кормления пациентов после плановой открытой колоректальной хирургии: обзор литературы. Дж Клин Нурс . 2006 июн.15 (6): 696-709. [Медлайн].
Лицо Б, Векснер SD. Лечение послеоперационной кишечной непроходимости. Curr Probl Surg . 2006, январь, 43 (1): 6-65. [Медлайн].
Saclarides TJ. Текущие варианты — хорошие или плохие — для упреждающего лечения послеоперационной кишечной непроходимости: взгляд хирурга. J Perianesth Nurs . 2006 21 апреля (2A доп.): S7-15. [Медлайн].
Saunders MD. Острая псевдообструкция толстой кишки. Gastrointest Endosc Clin N Am . 2007 г., 17 (2): 341-60, vi-vii. [Медлайн].
Schuster R, Grewal N, Greaney GC, Waxman K. Жевание резинки уменьшает кишечную непроходимость после плановой открытой колэктомии сигмовидной кишки. Arch Surg . 2006 февраль 141 (2): 174-6. [Медлайн].
Суми Т., Кацумата К., Цучида А., Сонода И., Симадзу М., Аоки Т.Оценка последовательной оценки органной недостаточности у пациентов с удушающей кишечной непроходимостью. Langenbecks Arch Surg . 2010 Январь 395 (1): 27-31. [Медлайн].
Sutton DH, Harrell SP, Wo JM. Диагностика и ведение взрослых пациентов с хронической псевдообструкцией кишечника. Нутр Клин Практик . 2006 21 февраля (1): 16-22. [Медлайн].
Сангер Дж. Дж., Фернесс Дж. Б. Рецепторы грелина и мотилина как мишени для лекарств при желудочно-кишечных расстройствах. Нат Рев Гастроэнтерол Гепатол . 2016 13 января (1): 38-48. [Медлайн].
Mosinska P, Zielinska M, Fichna J. Экспрессия и физиология опиоидных рецепторов в желудочно-кишечном тракте. Curr Opin Endocrinol Диабет Ожирение . 2016 23 февраля (1): 3-10. [Медлайн].
Johnson MD, Walsh RM. Современные методы лечения для сокращения послеоперационной кишечной непроходимости. Клив Клин Дж. Мед. . 2009 ноябрь 76 (11): 641-8. [Медлайн].
Park JS, Kim J, Jang WS и др.Лечение послеоперационной кишечной непроходимости после роботизированной лапароскопической простатэктомии. Медицина (Балтимор) . 2018 ноябрь 97 (44): e13036. [Медлайн].
Альхашеми М., Фиоре Дж. Ф. младший, Сафа Н. и др. Частота и предикторы длительной послеоперационной кишечной непроходимости после колоректальной хирургии в контексте усиленного пути восстановления. Эндоскопическая хирургия . 17 октября 2018 г. [Medline].
Медицинская помощь, хирургическая помощь, диета
Чапман С.Дж., EuroSurg Collaborative.Ileus Management International (IMAGINE): протокол многоцентрового обсервационного исследования кишечной непроходимости после колоректальной хирургии. Колоректальный Дис . 2018 20 января (1): O17-O25. [Медлайн].
Ливингстон Э. Х., Пассаро Э. П. Мл. Послеоперационная кишечная непроходимость. Dig Dis Sci . 1990, январь, 35 (1): 121-32. [Медлайн].
Шибата Ю., Тойода С., Нимура Ю., Мияти М. Модели восстановления перистальтики кишечника на ранней стадии после абдоминальной хирургии: клиническое и манометрическое исследование. Мир J Surg . 1997, 21 октября (8): 806-9; обсуждение 809-10. [Медлайн].
Holte K, Kehlet H. Послеоперационная кишечная непроходимость: событие, которое можно предотвратить. Br J Surg . 2000 ноябрь 87 (11): 1480-93. [Медлайн].
Васкес В., Эрнандес А. В., Гарсия-Сабридо Ю. Л. Полезно ли жевание резинки при кишечной непроходимости после плановой колоректальной хирургии? Систематический обзор и метаанализ рандомизированных клинических исследований. J Гастроинтест Сург . 2009 апр.13 (4): 649-56. [Медлайн].
Barletta JF, Senagore AJ. Снижение бремени послеоперационной кишечной непроходимости: оценка и реализация научно обоснованной стратегии. Мир J Surg . 2014 августа 38 (8): 1966-77. [Медлайн].
Iyer S, Saunders WB, Stemkowski S. Экономическое бремя послеоперационной кишечной непроходимости, связанной с колэктомией в США. Дж. Манаг Кэр Фарм . 2009 июль-авг. 15 (6): 485-94. [Медлайн].
Резник Дж., Гринвальд Д.А., Брандт Л.Дж.Задержка опорожнения желудка и послеоперационная кишечная непроходимость после абдоминальных операций на животе: часть I. Am J Gastroenterol . 1997 Май. 92 (5): 751-62. [Медлайн].
Резник Дж., Гринвальд Д.А., Брандт Л.Дж. Задержка опорожнения желудка и послеоперационная кишечная непроходимость после абдоминальных операций на животе: часть II. Ам Дж. Гастроэнтерол . 1997 июн. 92 (6): 934-40. [Медлайн].
Kalff JC, Schraut WH, Simmons RL, Bauer AJ. Хирургическое вмешательство в кишечнике вызывает воспалительную реакцию мускулов кишечника, приводящую к послеоперационной непроходимости кишечника. Энн Сург . 1998 Ноябрь 228 (5): 652-63. [Медлайн]. [Полный текст].
Boeckxstaens GE, de Jonge WJ. Нейроиммунные механизмы при послеоперационной кишечной непроходимости. Кишечник . 2009 Сентябрь 58 (9): 1300-11. [Медлайн].
Espat NJ, Cheng G, Kelley MC, Vogel SB, Sninsky CA, Hocking MP. Вазоактивный кишечный пептид и антагонисты рецепторов вещества P улучшают состояние послеоперационной кишечной непроходимости. J Surg Res . 1995 июн. 58 (6): 719-23. [Медлайн].
Kalff JC, Schraut WH, Billiar TR, Simmons RL, Bauer AJ.Роль индуцибельной синтазы оксида азота в послеоперационной дисфункции гладких мышц кишечника у грызунов. Гастроэнтерология . 2000 Февраль 118 (2): 316-27. [Медлайн].
Pohl JM, Gutweiler S, Thiebes S, et al. Irf4-зависимые дендритные клетки CD103 + CD11b + и микробиом кишечника регулируют активацию моноцитов и макрофагов и перистальтику кишечника при послеоперационной кишечной непроходимости. Кишечник . 2017 Декабрь 66 (12): 2110-20. [Медлайн].
Фарро Г., Стакенборг М., Гомес-Пинилья П.Дж. и др.CCR2-зависимые макрофаги, происходящие из моноцитов, устраняют воспаление и восстанавливают моторику кишечника при послеоперационной непроходимости кишечника. Кишечник . 2017 Декабрь 66 (12): 2098-109. [Медлайн].
Cameron JL, изд. Современная хирургическая терапия. 7-е изд. Чикаго: Мосби; 2001.
Толлессон П.О., Кассуто Дж., Римбэк Г. Паттерны движущей силы в толстой кишке человека после операций на брюшной полости. Eur J Surg . 1992 апр. 158 (4): 233-6. [Медлайн].
Senagore AJ.Патогенез и клинико-экономические последствия послеоперационной кишечной непроходимости. Am J Health Syst Pharm . 2007 октября 15. 64 (20 Дополнение 13): S3-7. [Медлайн].
Куруба Р., Фаярд Н., Снайдер Д. Эпидуральная анальгезия и лапароскопическая техника не снижают частоту длительной кишечной непроходимости при плановых резекциях толстой кишки. Am J Surg . 2012 ноябрь 204 (5): 613-8. [Медлайн].
Wolff BG, Viscusi ER, Delaney CP, Du W, Techner L. Модели восстановления желудочно-кишечного тракта после резекции кишечника и тотальной абдоминальной гистерэктомии: объединенные результаты плацебо-групп в североамериканских клинических испытаниях III фазы альвимопана. J Am Coll Surg . 2007 июл.205 (1): 43-51. [Медлайн].
Китахата Р., Накадзима С., Судзуки Т., Плитман Э, Мимура М., Учида Х. Рецидив кишечной непроходимости у пациентов с психическими расстройствами: обзор двухлетней карты. Генеральная психиатрическая больница . 2016 янв-фев. 38: 31-6. [Медлайн].
Gokce AM, Ozel L, Ibisoglu S, et al. Редкая причина кишечной непроходимости у пациентов с трансплантатом почки с перитонеальным диализом в анамнезе: инкапсулированный склероз брюшины. Exp Clin Трансплантация . 2015 13 декабря (6): 588-92. [Медлайн].
Loftus CG, Harewood GC, Baron TH. Оценка предикторов ответа на неостигмин при острой псевдообструкции толстой кишки. Ам Дж. Гастроэнтерол . 2002 декабрь 97 (12): 3118-22. [Медлайн].
Wu Z, Boersema GS, Dereci A, Menon AG, Jeekel J, Lange JF. Клиническая конечная точка, раннее выявление и дифференциальная диагностика послеоперационной кишечной непроходимости: систематический обзор литературы. Eur Surg Res . 2015. 54 (3-4): 127-38. [Медлайн].
Кронберг У., Киран Р.П., Солиман М.С. и др. Характеристика факторов, определяющих послеоперационную кишечную непроходимость после лапароскопической колэктомии, позволяет получить новую прогностическую оценку. Энн Сург . 2011 Январь 253 (1): 78-81. [Медлайн].
Гоц М., Браун Г., Якобс Р. и др., Fur die Mitglieder der DGVS-Kommission im Anhang. [Позиция Немецкого общества гастроэнтерологов, пищеварительных и метаболических заболеваний (DGVS) по эндоскопической декомпрессии при остром подвздошном кишечнике]. Z Гастроэнтерол . 2017 Декабрь 55 (12): 1499-1508. [Медлайн].
Liang X, Li W, Zhao B, Zhang L, Cheng Y. Сравнительный анализ MDCT и MRI в диагностике хронической перфорации желчных камней и кишечной непроходимости. Eur J Radiol . 2015 Октябрь 84 (10): 1835-42. [Медлайн].
Шварц С.И., изд. Принципы хирургии. 7-е изд. Нью-Йорк, штат Нью-Йорк: Макгроу-Хилл; 1999.
Брунс Б.Р., Козар РА. Питание послеоперационного больного на вазопрессорной опоре: кормление и прессорная опора. Нутр Клин Практик . 2016 31 февраля (1): 14-7. [Медлайн].
Кали Р.Л., Мид П.Г., Суонсон М.С., Фриман С. Влияние морфина и длины разреза на функцию кишечника после колэктомии. Диск прямой кишки . 2000 Февраль 43 (2): 163-8. [Медлайн].
Ферраз А.А., Коулз В.Е., Кондон Р.Е. и др. Неопиоидные анальгетики сокращают продолжительность послеоперационной кишечной непроходимости. Am Surg . 1995 г., декабрь 61 (12): 1079-83. [Медлайн].
Ян П.Ф., Морган М.Дж.Лапароскопия по сравнению с открытой отменой процедуры Хартмана: ретроспективный обзор. ANZ J Surg . 2014 декабрь 84 (12): 965-9. [Медлайн].
Purkayastha S, Tilney HS, Darzi AW, Tekkis PP. Метаанализ рандомизированных исследований по оценке жевательной резинки для улучшения послеоперационного восстановления после колэктомии. Arch Surg . 2008, август, 143 (8): 788-93. [Медлайн].
Shang H, Yang Y, Tong X, Zhang L, Fang A, Hong L. Жевание резинки слегка улучшает раннее восстановление послеоперационной кишечной непроходимости после кесарева сечения: результаты проспективного рандомизированного контролируемого исследования. Am J Perinatol . 2010 май. 27 (5): 387-91. [Медлайн].
Waldhausen JH, Schirmer BD. Влияние ходьбы на восстановление послеоперационной кишечной непроходимости. Энн Сург . 1990 Декабрь 212 (6): 671-7. [Медлайн]. [Полный текст].
Zingg U, Miskovic D, Hamel CT, Erni L, Oertli D, Metzger U. Влияние торакальной эпидуральной анальгезии на послеоперационное обезболивание и непроходимость кишечной непроходимости после лапароскопической колоректальной резекции: польза от эпидуральной анальгезии. Эндоскопическая хирургия . 2009 23 февраля (2): 276-82. [Медлайн].
Лю С.С., Карпентер Р.Л., Макки Д.К. и др. Влияние периоперационной анальгетической техники на скорость восстановления после операции на толстой кишке. Анестезиология . 1995 Октябрь 83 (4): 757-65. [Медлайн].
Mann C, Pouzeratte Y, Boccara G, et al. Сравнение внутривенной или эпидуральной анальгезии, контролируемой пациентом, у пожилых людей после обширных операций на брюшной полости. Анестезиология .2000 Февраль 92 (2): 433-41. [Медлайн].
Marret E, Rolin M, Beaussier M, Bonnet F. Мета-анализ внутривенного лидокаина и послеоперационного восстановления после абдоминальной хирургии. Br J Surg . 2008 ноябрь 95 (11): 1331-8. [Медлайн].
Харви К.П., Адаир Дж. Д., Ишо М., Робинсон Р. Может ли внутривенный лидокаин уменьшить послеоперационную кишечную непроходимость и сократить пребывание в больнице при плановой операции на кишечнике? Пилотное исследование и обзор литературы. Am J Surg .2009 августа 198 (2): 231-6. [Медлайн].
Becker G, Blum HE. Новые антагонисты опиоидов при дисфункции кишечника и послеоперационной кишечной непроходимости. Ланцет . 2009 г., 4 апреля 373 (9670): 1198-206. [Медлайн].
Марон DJ, Фрай RD. Новые методы лечения послеоперационной кишечной непроходимости желудочно-кишечного тракта. Am J Ther . 2008 янв-фев. 15 (1): 59-65. [Медлайн].
Yuan CS, Foss JF, Osinski J, Toledano A, Roizen MF, Moss J.Безопасность и эффективность перорального метилналтрексона в предотвращении морфин-индуцированной задержки времени орально-слепого транзита. Clin Pharmacol Ther . 1997 апр. 61 (4): 467-75. [Медлайн].
Candy B, Jones L, Goodman ML, Drake R, Tookman A. Слабительные или метилналтрексон для лечения запоров у пациентов, оказывающих паллиативную помощь. Кокрановская база данных Syst Rev . 2011 19 января. CD003448. [Медлайн].
Yu CS, Chun HK, Stambler N, et al.Безопасность и эффективность метилналтрексона в сокращении продолжительности послеоперационной кишечной непроходимости после сегментарной колэктомии: результаты двух рандомизированных плацебо-контролируемых исследований фазы 3. Диск прямой кишки . 2011 Май. 54 (5): 570-8. [Медлайн].
Эрншоу С.Р., Кауф Т.Л., МакДейд С. и др. Экономическое влияние алвимопана с учетом различных определений послеоперационной кишечной непроходимости. J Am Coll Surg . 2015 Ноябрь 221 (5): 941-50. [Медлайн].
Тагучи А., Шарма Н., Салим Р.М. и др.Селективное послеоперационное угнетение опиоидных рецепторов желудочно-кишечного тракта. N Engl J Med . 2001, 27 сентября. 345 (13): 935-40. [Медлайн].
Тан Е.К., Корниш Дж., Дарзи А.В., Теккис П.П. Мета-анализ: Альвимопан в сравнении с плацебо в лечении послеоперационной кишечной непроходимости. Aliment Pharmacol Ther . 2007, 1. 25 (1): 47-57. [Медлайн].
Тан Е.К., Корниш Дж., Дарзи А.В., Теккис П.П. Мета-анализ: Альвимопан в сравнении с плацебо в лечении послеоперационной кишечной непроходимости. Aliment Pharmacol Ther . 2007, 1. 25 (1): 47-57. [Медлайн].
Zingg U, Miskovic D, Pasternak I, Meyer P, Hamel CT, Metzger U. Влияние бисакодила на послеоперационную перистальтику кишечника при плановой колоректальной хирургии: проспективное рандомизированное исследование. Int J Colorectal Dis . 2008 г., 23 (12): 1175-83. [Медлайн].
Wiriyakosol S, Kongdan Y, Euanorasetr C, Wacharachaisurapol N, Lertsithichai P. Рандомизированное контролируемое испытание бисакодиловых суппозиториев по сравнению с плацебо при послеоперационной кишечной непроходимости после плановой колэктомии при раке толстой кишки. Азиатский J Surg . 2007 июля 30 (3): 167-72. [Медлайн].
Траут У., Брюггер Л., Кунц Р. и др. Системное прокинетическое фармакологическое лечение послеоперационной адинамической кишечной непроходимости после абдоминальной хирургии у взрослых. Кокрановская база данных Syst Rev . 2008 23 января. CD004930. [Медлайн].
Wattchow DA, De Fontgalland D, Bampton PA, Leach PL, McLaughlin K, Costa M. Клиническое испытание: влияние ингибиторов циклооксигеназы на восстановление желудочно-кишечного тракта после обширной операции — рандомизированное двойное слепое контролируемое испытание целекоксиба или диклофенака по сравнению сплацебо. Aliment Pharmacol Ther . 2009 15 ноября. 30 (10): 987-98. [Медлайн].
Yeh YC, Klinger EV, Reddy P. Фармакологические варианты профилактики послеоперационной кишечной непроходимости. Энн Фармакотер . 2009 Сентябрь 43 (9): 1474-85. [Медлайн].
Abd-El-Maeboud KH, Ibrahim MI, Shalaby DA, Fikry MF. Жевание резинки стимулирует скорейшее восстановление перистальтики кишечника после кесарева сечения. БЖОГ . 2009 сентябрь 116 (10): 1334-9. [Медлайн].
Бем Б., Столлман Н.Послеоперационная кишечная непроходимость: этиология и вмешательства. Клин Гастроэнтерол Гепатол . 2003 Март 1 (2): 71-80. [Медлайн].
Картер С. Хирургическая бригада и лечение исходов: акцент на послеоперационной кишечной непроходимости. J Perianesth Nurs . 2006 г., 21 апреля (2A Suppl): S2-6. [Медлайн].
Delaney CP, Senagore AJ, Viscusi ER, et al. Послеоперационное восстановление верхних и нижних отделов желудочно-кишечного тракта и желудочно-кишечные заболевания у пациентов, перенесших резекцию кишечника: объединенный анализ данных плацебо из 3 рандомизированных контролируемых исследований. Am J Surg . 2006 Март 191 (3): 315-9. [Медлайн].
Houwen RH, van der Doef HP, Sermet I, et al. Определение DIOS и запора при муковисцидозе с помощью многоцентрового исследования заболеваемости, характеристик и лечения DIOS. J Педиатр Gastroenterol Nutr . 2010 января 50 (1): 38-42. [Медлайн].
Джонс М.П., Вессингер С. Периодичность тонкого кишечника. Curr Opin Гастроэнтерол . 2006 22 марта (2): 111-6. [Медлайн].
Mattei P, Rombeau JL. Обзор патофизиологии и лечения послеоперационной кишечной непроходимости. Мир J Surg . 2006 30 августа (8): 1382-91. [Медлайн].
Мур Б.А., Альберс К.М., Дэвис Б.М., Грандис-младший, Тогель С., Бауэр А.Дж.. Измененная экспрессия воспалительного гена лежит в основе повышенной восприимчивости к послеоперационной непроходимости кишечной непроходимости у мышей с возрастом. Am J Physiol Gastrointest Liver Physiol . 2007 июн 292 (6): G1650-9. [Медлайн].
Ng WQ, Neill J. Доказательства раннего перорального кормления пациентов после плановой открытой колоректальной хирургии: обзор литературы. Дж Клин Нурс . 2006 июн.15 (6): 696-709. [Медлайн].
Лицо Б, Векснер SD. Лечение послеоперационной кишечной непроходимости. Curr Probl Surg . 2006, январь, 43 (1): 6-65. [Медлайн].
Saclarides TJ. Текущие варианты — хорошие или плохие — для упреждающего лечения послеоперационной кишечной непроходимости: взгляд хирурга. J Perianesth Nurs . 2006 21 апреля (2A доп.): S7-15. [Медлайн].
Saunders MD. Острая псевдообструкция толстой кишки. Gastrointest Endosc Clin N Am . 2007 г., 17 (2): 341-60, vi-vii. [Медлайн].
Schuster R, Grewal N, Greaney GC, Waxman K. Жевание резинки уменьшает кишечную непроходимость после плановой открытой колэктомии сигмовидной кишки. Arch Surg . 2006 февраль 141 (2): 174-6. [Медлайн].
Суми Т., Кацумата К., Цучида А., Сонода И., Симадзу М., Аоки Т.Оценка последовательной оценки органной недостаточности у пациентов с удушающей кишечной непроходимостью. Langenbecks Arch Surg . 2010 Январь 395 (1): 27-31. [Медлайн].
Sutton DH, Harrell SP, Wo JM. Диагностика и ведение взрослых пациентов с хронической псевдообструкцией кишечника. Нутр Клин Практик . 2006 21 февраля (1): 16-22. [Медлайн].
Сангер Дж. Дж., Фернесс Дж. Б. Рецепторы грелина и мотилина как мишени для лекарств при желудочно-кишечных расстройствах. Нат Рев Гастроэнтерол Гепатол . 2016 13 января (1): 38-48. [Медлайн].
Mosinska P, Zielinska M, Fichna J. Экспрессия и физиология опиоидных рецепторов в желудочно-кишечном тракте. Curr Opin Endocrinol Диабет Ожирение . 2016 23 февраля (1): 3-10. [Медлайн].
Johnson MD, Walsh RM. Современные методы лечения для сокращения послеоперационной кишечной непроходимости. Клив Клин Дж. Мед. . 2009 ноябрь 76 (11): 641-8. [Медлайн].
Park JS, Kim J, Jang WS и др.Лечение послеоперационной кишечной непроходимости после роботизированной лапароскопической простатэктомии. Медицина (Балтимор) . 2018 ноябрь 97 (44): e13036. [Медлайн].
Альхашеми М., Фиоре Дж. Ф. младший, Сафа Н. и др. Частота и предикторы длительной послеоперационной кишечной непроходимости после колоректальной хирургии в контексте усиленного пути восстановления. Эндоскопическая хирургия . 17 октября 2018 г. [Medline].
Симптомы, причины, лечение и выздоровление
Илеус — это временное и часто болезненное отсутствие движения в кишечнике.
Непроходимость кишечника возникает, когда кишечник не продвигает пищу нормальным образом. Часто возникает после операций на брюшной полости.
Это тяжелое состояние, потому что, если его не лечить, кишечная непроходимость может перекрыть кровоснабжение кишечника и вызвать гибель тканей. Это может привести к разрыву кишечника или опасной для жизни инфекции брюшной полости.
Прочтите, чтобы узнать больше о распознавании и лечении кишечной непроходимости.
Обычно мышцы кишечника сокращаются и расслабляются, вызывая волнообразное движение, называемое перистальтикой.Это движение помогает пище проходить через кишечник.
Когда возникает кишечная непроходимость, она останавливает перистальтику и препятствует прохождению частиц пищи, газов и жидкостей через пищеварительный тракт.
Если люди продолжают есть твердую пищу, это может привести к накоплению частиц пищи, что может вызвать полную или частичную непроходимость кишечника.
Непроходимость кишечника чаще всего возникает после операций на органах брюшной полости или таза. По некоторым оценкам, кишечная непроходимость или другая непроходимость кишечника является второй наиболее частой причиной повторной госпитализации в течение первого месяца после операции.
Это может быть связано с тем, что:
- нормальная перистальтика медленно восстанавливается после операции
- лекарства, прописанные после операции, влияют на движение кишечника
- послеоперационное рубцевание может вызвать закупорку
Некоторые лекарства, которые влияют на мышцы и нервы в пищеварительный тракт включает:
- опиоидные обезболивающие
- антихолинергические средства, которые используются для лечения многих состояний, включая заболевания мочевого пузыря, ХОБЛ и болезнь Паркинсона
- блокаторы кальциевых каналов, которые часто используются для лечения сердечных заболеваний
Другие причины кишечной непроходимости включают инфекции и нарушения мышц и нервов, такие как болезнь Паркинсона.
У детей инвагинация или «телескопирование» часто вызывает кишечную непроходимость. Инвагинация — это когда часть кишечника скользит внутрь себя, как при закрытии телескопа.
Некоторые факторы, которые могут увеличить риск кишечной непроходимости, включают:
Симптомы кишечной непроходимости включают:
- спазмы и боль в желудке
- вздутие живота
- тошнота
- рвота
- запор или выделение небольшого количества жидкости
- потеря аппетита
- чувство сытости
- невозможность отвода газов
кишечная непроходимость и кишечная непроходимость имеют сходство, но кишечная непроходимость возникает из-за мышечных или нервных проблем, которые останавливают перистальтику, в то время как непроходимость — это физическая закупорка пищеварительного тракта .
Однако тип кишечной непроходимости, известной как паралитическая кишечная непроходимость, может вызвать физический блок из-за скопления пищи в кишечнике.
Другие причины непроходимости включают:
- области фиброзной ткани, которые образуются после операции (спайки кишечника)
- рак толстой кишки
- дивертикулит, воспаленные мешочки в пищеварительном тракте
- грыжа
- пораженный кал
- заболевания кишечника (ВЗК)
Чтобы диагностировать кишечную непроходимость, врач сначала спросит о симптомах и соберет полную историю болезни.Они спросят о:
- текущих или прошлых заболеваниях
- использовании лекарств
- хирургическом анамнезе
Затем врач проведет медицинский осмотр, чтобы проверить, нет ли отека или боли в животе. Они могут использовать стетоскоп, чтобы прислушиваться к звукам кишечника. Отсутствие или чрезмерный шум в кишечнике указывает на кишечную непроходимость, хотя для подтверждения диагноза обычно требуются визуализирующие исследования.
Визуализирующие тесты
Визуализирующие тесты помогают определить местонахождение кишечной непроходимости путем выявления аномалий в кишечнике, таких как скопление газов или увеличение кишечника.Иногда может быть физическая закупорка. Используемые тесты включают:
- Рентген . Рентген брюшной полости может показать некоторые препятствия, но они не всегда выявляют кишечную непроходимость или другие кишечные проблемы.
- Компьютерная томография (КТ) . Компьютерная томография дает больше деталей, чем стандартные рентгеновские снимки. Эти сканирования с большей вероятностью выявят непроходимость кишечника, поскольку они показывают кишечник под разными углами. Иногда человек проглатывает специальный краситель, который создает более четкое изображение.
- Ультразвук . Врачи часто диагностируют у детей подозрение на кишечную непроходимость с помощью ультразвукового исследования. Ультразвуковое сканирование обычно показывает спиральную область в кишечнике при наличии инвагинации.
- Воздух или бариевая клизма . Это включает введение воздуха или жидкого бария в толстую кишку через прямую кишку с последующим рентгеновским снимком брюшной полости. Эта процедура может устранить кишечную непроходимость, вызванную инвагинацией, у некоторых детей.
Варианты лечения кишечной непроходимости включают ожидание разрешения кишечной непроходимости, изменение диеты или корректировку приема лекарств.Иногда требуется операция. Лечение будет зависеть от тяжести кишечной непроходимости и ее первопричины.
Возможные методы лечения кишечной непроходимости включают:
Больничное лечение
Хирургическая кишечная непроходимость часто заживает в течение нескольких дней после операции, а паралитическая кишечная непроходимость обычно проходит после того, как человек изменит свое лечение. Однако людям может потребоваться пребывание в больнице до полного разрешения проблемы.
Лечение в больнице может включать:
- внутривенное введение жидкостей для предотвращения обезвоживания
- назогастральная декомпрессия, при которой используется трубка для отсасывания материалов, которые в противном случае может вызвать рвота
- обезболивание
Диетические изменения
как болезнь Крона, так и дивертикулит могут вызвать частичную кишечную непроходимость.Некоторый материал кишечника может проходить через кишечник, но не весь.
Врач может порекомендовать людям с этой проблемой соблюдать диету с низким содержанием клетчатки, чтобы облегчить дефекацию. Это подразумевает сокращение употребления цельнозерновых продуктов, сырых овощей и орехов.
Смена лекарств
Паралитическая кишечная непроходимость, вызванная приемом лекарств, часто можно лечить, принимая другое лекарство, такое как метоклопрамид (Реглан), для стимуляции движения кишечника.
Другой вариант — прекратить прием лекарства, вызывающего кишечную непроходимость.Однако делайте это только под наблюдением врача. Не всегда рекомендуется внезапно прекращать прием антидепрессантов и некоторых других лекарств.
Хирургия
Если лекарства или диетические изменения не устраняют кишечную непроходимость или если закупорка серьезная, то человеку может потребоваться операция.
Хирургические процедуры включают устранение закупорки, восстановление или удаление поврежденной части кишечника.
Пожилые люди или люди с раком толстой кишки могут не подходить для проведения обширной операции.Вместо этого они могут быть оснащены стентом (трубкой), чтобы кишечник оставался открытым и позволял материалам кишечника проходить через него более легко.
В некоторых случаях человеку может потребоваться удаление всего кишечника. В этом случае хирург выполнит стому. Они образуют отверстие в брюшной полости, называемое стомой, через которое стул переходит из кишечника в мешочек.
Хотя стома требует ухода, человек может жить здоровой жизнью без кишечника.
Недиагностированная и нелеченная кишечная непроходимость может вызвать серьезные и потенциально опасные для жизни осложнения, такие как:
Некроз
Некроз — это отмирание тканей.Некроз возникает, когда кровь не может достичь кишечника. Кишечная ткань отмирает и ослабевает. Слабая стенка кишечника склонна к разрыву, что приводит к утечке содержимого кишечника.
Инфекция
Содержимое кишечника полно бактерий. Когда они попадают в брюшную полость, они вызывают серьезную инфекцию, называемую перитонитом. Бактериальный перитонит может привести к сепсису — широко распространенной инфекции, которая может привести к летальному исходу.
После операции функция кишечника обычно приходит в норму в течение 5 дней.Если он сохраняется дольше этого времени, это считается паралитической кишечной непроходимостью.
Восстановление кишечной непроходимости зависит от правильного лечения основной причины.
Илеус — относительно распространенное заболевание, которое легко поддается лечению. Это особенно часто встречается у тех, кто недавно перенес операцию на брюшной полости или тазу.
Осведомленность о симптомах является ключом к улучшению прогноза и снижению риска осложнений. Очень важно немедленно обратиться за медицинской помощью, как только появятся симптомы.
Послеоперационная подвздошная кишка — TeachMeSurgery
Введение
Послеоперационная кишечная непроходимость описывает замедление или остановку перистальтики кишечника после операции. Он классифицируется как функциональная непроходимость кишечника и очень часто встречается, особенно после абдоминальной хирургии или ортопедической хирургии таза.
Помните, однако, что хотя у большинства пациентов это невиновно, это может быть признаком другой внутрибрюшной патологии *, в частности скопления или несостоятельности анастомоза (поскольку гной или фекалии раздражают кишечник и часто приводят к его прекращению) .
Доказано, что послеоперационная кишечная непроходимость продлевает пребывание в больнице и увеличивает больничные расходы ; действительно, общие годовые расходы в США, вторичные по отношению к послеоперационной кишечной непроходимости, составляют от 750 до 1 миллиарда долларов .
* Важно понимать, что у любого пациента с картиной непроходимости кишечника, у которого после резекции кишечника не наблюдается ожидаемого прогрессирования, наблюдается несостоятельность анастомоза, пока не будет доказано обратное
Факторы риска
- Факторы пациента
- Повышенный возраст
- Нарушение электролита (напр.грамм. Na + , K + и Ca 2+ )
- Неврологические расстройства (например, деменция или болезнь Паркинсона)
- Использование антихолинергических препаратов
- Хирургические факторы
- Употребление опиоидных препаратов
- Тазовая хирургия
- Интенсивная интраоперационная обработка кишечника
- Загрязнение брюшины (свободным гноем или фекалиями)
- Резекция кишечника
Клинические особенности
Послеоперационная кишечная непроходимость — это просто задержка восстановления нормальной функции кишечника.В результате симптомы послеоперационной непроходимости кишечника могут быть такими же, как и при механической непроходимости.
Таким образом, общие характеристики представления следующие:
- Отсутствие отхождения газов или фекалий
- Ощущение вздутия живота и вздутие живота
- Тошнота и рвота (или высокий выход NG)
При осмотре: вздутие живота и отсутствие кишечных звуков (тогда как при механической непроходимости присутствуют классические «звонкие» кишечные звуки)
Расследования
У пациентов с подозрением на послеоперационную кишечную непроходимость цель исследования — исключить более серьезные патологии и определить основную причину.
Первичный рутинный анализ крови следует взять, включая FBC и CRP (для проверки маркеров воспаления), а также U & Es (поскольку в адинамическом кишечнике может происходить сдвиг жидкости, ведущий к AKI). Электролиты , включая Ca2 +, PO₄³⁻ и Mg2 +, также должны быть проверены и исправлены соответственно
A КТ брюшная полость и таз (часто с пероральным контрастированием) подтвердит диагноз (рис. 1) и, что важно, также исключит любые внутрибрюшные скопления или протечки анастомоза.
Рис. 1. КТ (коронарный вид), показывающая кишечную непроходимость [/ caption]Менеджмент
До тех пор, пока исключена серьезная патология (например, несостоятельность анастомоза), лечение послеоперационной кишечной непроходимости является консервативным .
Любая установленная послеоперационная кишечная непроходимость первоначально должна лечиться с помощью:
- Нет для приема внутрь (NBM), обеспечивая адекватное поддержание внутривенных жидкостей
- Запустить график строгого баланса жидкости для контроля ввода-вывода
- Суточная кровь , включая электролиты
- Исправьте любые нарушения электролитного баланса и следите за острым повреждением почек
- Поощрять мобилизацию как допустимо
- Снижение опиатной анальгезии и любых других лекарств, снижающих подвижность кишечника
Важно предупредить пациентов, что после того, как он осядет, у них может быть очень водянистый стул при первых 2–3 испражнениях.
Рис. 2. Назогастральный зонд следует вводить как часть лечения послеоперационной кишечной непроходимости [/ caption]Меры профилактики
Чтобы снизить риск развития послеоперационной кишечной непроходимости, профилактические меры включают:
- Минимизация интраоперационных манипуляций с кишечником
- Избегать перегрузки жидкостью (вызывает отек кишечника)
- Свести к минимуму употребление опиатов
- Поощрять раннюю мобилизацию
[start-Clinical]
Ключевые точки
- Послеоперационная кишечная непроходимость описывает замедление или остановку перистальтики кишечника после операции
- И пациенты, и хирургические факторы повышают риск его развития
- Основой лечения является трубка NBM +/- NG, внутривенное введение жидкостей, мобилизация, устранение электролитных аномалий и предотвращение приема лекарств, снижающих подвижность кишечника
- КТ может потребоваться, особенно в длительных случаях, из-за исключения более серьезных внутрибрюшных патологий как первопричины
[окончание клинической картины]
Послеоперационная подвздошная кишка — обзор
Лечение осложнений хирургии колоректального рака
Послеоперационная кишечная непроходимость — одно из наиболее часто встречающихся осложнений после резекции толстой кишки.Фактически, некоторая степень непроходимости кишечной непроходимости в большинстве случаев является нормальной физиологической реакцией, но есть различия в ее клинической значимости. 385 Большинство пойдет мягким курсом самоограничения. Нет никаких доказательств того, что регулярное использование назогастрального зонда (НГТ) предотвращает длительную кишечную непроходимость. Фактически, как обсуждалось ранее, ранняя подпитка и предотвращение NGT являются ключевыми компонентами большинства ускоренных процедур и ERP. Другими способствующими факторами являются отказ от опиатной анальгезии и перегрузки жидкостью. 386 Использование таких мультимодальных подходов связано с сокращением времени отхождения газов и более коротким пребыванием в больнице. 387 Однако в условиях длительной кишечной непроходимости, когда у пациента наблюдается постоянная рвота и он все еще не может переносить пероральную диету, через несколько дней после операции уместны более агрессивные меры. Важно, в первую очередь, исключить первопричину, например послеоперационный сбор или механическую обструкцию.Обычно это лучше всего делать с помощью компьютерной томографии с пероральным и внутривенным контрастированием. 386 Таким пациентам обычно требуется период голодания и установка NGT. Дилемма в этих случаях заключается в том, когда начинать полное парентеральное питание. Эксперты пришли к единому мнению, что при отсутствии предоперационного дефицита питания перед началом полного парентерального питания целесообразно подождать не менее 5 дней. 387,388 Полное парентеральное питание сопряжено с осложнениями и, в частности, существует риск сепсиса из-за наличия центрального венозного катетера для облегчения кормления.
Расхождение анастомоза связано со значительной заболеваемостью, а зарегистрированный уровень смертности колеблется от 6% до 18%. 389 390 Хотя субклинические утечки, вероятно, более распространены, клинически значимые утечки происходят примерно в 4–5% случаев. 391 Средний срок постановки диагноза — 7 дней после операции. Несостоятельность анастомоза связана с плохой функцией в долгосрочной перспективе, а также с увеличением риска постоянной стомы. 392 Пациенты с несостоятельностью анастомоза могут проявлять себя по-разному: от тяжелого сепсиса с генерализованным перитонитом до простой непроходимой кишечной непроходимости или возникновения аритмии, такой как фибрилляция предсердий.Важно иметь низкий индекс подозрительности для ранней диагностики утечки, позволяющей оперативно управлять ею. Хотя некоторым пациентам потребуется повторное обследование, удаление анастомоза и формирование разрушающейся стомы, у многих из них можно лечить консервативно. Те, у кого утечка «сдерживается», как клинически, так и радиологически, часто могут лечиться с помощью внутривенных антибиотиков или чрескожного дренажа под радиологическим контролем, если есть доказательства скопления.
Инфекции ран — частая послеоперационная проблема после резекции толстой кишки.Факторы риска раневой инфекции могут зависеть от пациента или от операционной техники и объема операции. Факторы, влияющие на пациента, включают ожирение, курение, сахарный диабет 393 394 и подавление иммунитета. Плохая хирургическая техника и фекальное загрязнение также увеличивают риск. 395 В настоящее время уровень инфицирования ран варьируется от 5% до 10%. При плановой настройке уровень заражения должен быть менее 5%. Это снижение по сравнению с исторически более высокими показателями связано с периоперационным введением антибиотиков.Многие центры в настоящее время обычно вводят разовую дозу антибиотика широкого спектра действия во время индукции анестезии. Нет никакой пользы от рутинного введения дополнительных послеоперационных доз. 396
Инфекции раны обычно проявляются примерно на пятый послеоперационный день с отеком и эритемой раны с системными признаками сепсиса или без них. Если есть признаки целлюлита, следует ввести антибиотики внутривенно. В некоторых случаях может потребоваться снятие нескольких швов или скоб с кожи, чтобы обеспечить дренаж скопления подкожной жидкости.Затем с этим типом раны обычно можно справиться с помощью ежедневного тампонирования и позволить заживать вторичным натяжением. Если имеется более обширное поверхностное расхождение раны с большим объемом экссудата, может быть целесообразно использовать вакуумную повязку с отрицательным давлением, чтобы обеспечить более эффективное управление выделениями из раны и ускорить заживление. 397 Если есть опасения, что оболочка подстилающей мышцы не полностью цела, следует избегать использования вакуумного устройства из-за потенциального риска образования кожно-кишечного свища.Судя по доступным гетерогенным исследованиям, риск составляет от 6% до 25%. 398 Расхождение раны встречается редко, но риск значительно увеличивается для тех, кто подвергается экстренной операции по поводу рака толстой кишки. 399
Критически важным для улучшения результатов пациента при КРР является подготовка, опыт и объем операции хирурга. Один из таких отчетов включал ретроспективный анализ 15 427 госпитализаций в северном Иллинойсе, которым в период с 1994 по 1997 год была проведена сегментарная резекция толстой кишки, выполненная в 76 нефедеральных больницах с 514 оперированными хирургами.Авторы определили стационарную летальность, осложнения хирургического вмешательства и продолжительность пребывания в стационаре. Они обнаружили, что сертификация Американского совета по хирургии и многолетний опыт связаны со снижением смертности. Добавленная колоректальная сертификация и место обучения не повлияли существенно на результаты. 400 В отличие от этого, COST, которое было рандомизированным контролируемым исследованием по изучению лапароскопических и открытых операций при раке толстой кишки, не продемонстрировало каких-либо различий в осложнениях или отдаленных результатах в зависимости от объема хирургического вмешательства. 401 Но, глядя на исходы в отношении рака прямой кишки, Боровски и его коллеги продемонстрировали улучшение выживаемости при раке у тех, кто перенес операцию в центрах с большим объемом операций. 402
Выявлен механизм паралича кишечника после операции — ScienceDaily
В дни после абдоминальной операции содержимое кишечника у пациентов выходит медленнее или не выходит вовсе. Новое исследование, проведенное в KU Leuven (Левенский университет), Бельгия, теперь показало, что это явление, известное как послеоперационная кишечная непроходимость или паралич кишечника, не вызывается клетками, которые ранее считались основными действующими лицами.На самом деле, как раз наоборот: клетки даже помогают восстановить функцию кишечника. Полученные результаты очень важны для дальнейших исследований послеоперационного лечения пациентов.
После операции на брюшной полости пациенты должны оставаться в больнице в течение нескольких дней, поскольку эта процедура вызывает послеоперационную кишечную непроходимость или паралич кишечника. В результате пациенты не могут переносить еду или опорожнять кишечник. Это приводит к личному дискомфорту и продлевает пребывание в больнице, что, в свою очередь, увеличивает экономические затраты.
Ученые давно ищут способы предотвратить паралич кишечника или ускорить восстановление функции кишечника. Всегда считалось, что в параличе кишечника больше всего виноваты моноциты, особый тип лейкоцитов. Профессор Джанлука Маттеоли и профессор Гай Бёксстенс из отделения TARGID в KU Leuven теперь показали, что верно обратное.
«Абдоминальная хирургия всегда приводит к легкому воспалению кишечной мышцы. Это воспаление в основном состоит из моноцитов», — говорит профессор Маттеоли.«Мы провели исследование на мышах, которые были генетически модифицированы, чтобы моноциты не могли покинуть кровоток и попасть в кишечную мышцу. Мы ожидали, что это позволит нам предотвратить паралич кишечника. Однако, к нашему удивлению, у мышей все же развился паралич кишечника.

