Фетоплацентарная недостаточность.
Всем известно, что ребёнок в утробе живёт за счёт плаценты. Это уникальный орган, формирующийся в организме беременной женщины и обеспечивает плода газообменом (доставляет кислород из крови мамы через маточно-плацентарную-плодовую систему и выводит углекислый газ маме же обратно в кровь), производит доставку питательных веществ, необходимых для его жизнедеятельности, роста и развития, осуществляет синтез гормонов, необходимых для поддержания беременности — прогестерон, ХГЧ, эстрогены и пр., защищает плода от воздействия вредных веществ, так или иначе попавших в организм будущей мамы. Однако, эта функция ограничена и пропускает многие лекарственные препараты, алкоголь и никотин. Иными словами, малыш не может существовать в утробе без плаценты. Естественно, что любые отклонения в работе этого органа ведут к серьёзным нарушениям в развитии плода. В этом случае говорят о фетоплацентарной недостаточности, когда нарушается кровообращение и рушится связь мать — плацента — плод.
Фетоплацентарная недостаточность (ФПН) — одно из наиболее часто встречающихся осложнений беременности. У 50-77% беременных женщин она становится основной причиной невынашивания, у 32% — возникает вследствие гестоза, в 25-45% случаев развивается при наличии экстрагенитальной патологии, после перенесенной вирусной или бактериальной инфекции проявляется более чем в 60% наблюдений.
Фетоплацентарная недостаточность, или плацентарная недостаточность (ПН), характеризуется морфологическими (строение), а также функциональными нарушениями в плаценте, прогрессирование которых может привести к гипоксии, задержке развития и даже к антенатальной гибели плода.
По времени и механизму возникновения различают два вида ПН:
- Первичная (до 16 недель), связана с нарушением процессов плацентации и имплантации;
- Вторичная (после 16 недель), развивается под влиянием внешних факторов, воздействующих на плод и/или мать, в уже сформированной плаценте.
По клиническому течению ПН выделяют:
- Острая – чаще всего возникает на фоне отслойки низко или нормально расположенной плаценты.
 Острая ПН происходит преимущественно в родах, однако не исключается ее возникновение на любом сроке гестации;
Острая ПН происходит преимущественно в родах, однако не исключается ее возникновение на любом сроке гестации; - Хроническая – возникает в различные сроки беременности. В свою очередь ее подразделяют на:
Компенсированную форму ПН – при которой нарушаются метаболические процессы в плаценте, но кровообращение в системе «мать-плацента-плод» не нарушено. За счет компенсаторных возможностей материнского организма, плод к этим изменениям приспосабливается и не испытывает дискомфорта;
Субкомпенсированную форму ПН – в случае если причины возникновения ПН не были устранены, компенсаторные механизмы организма испытывают нагрузку и постепенно начинают истощаться, достигая следующей стадии;
Декомпенсированную форму ПН – прогрессирование патологического процесса приводит к возникновению гемодинамических нарушений в системе «мать-плацента-плод» на уровне плодово-плацентарного и/или маточно-плацентарного кровообращения.
При использовании метода допплерометрии определяют 3 степени декомпенсированной формы ФПН:
- I степень
- ФПН Iа степени – нарушение гемодинамики происходит только в маточно-плацентарном кровотоке;
- ФПН Iб степени – нарушение возникает только плодово–плацентарном кровотоке;
- II степень – происходит нарушение кровотока на двух уровнях, но они не достигают критических значений;
- III степень – уровень нарушений в плодово–плацентарном кровотоке критический, жизнь плода под угрозой.

- Причины
Фетоплацентарная недостаточность ФПН встречается у будущих мам довольно часто, и неудивительно: причин, вызывающих её можно назвать весьма много.
- Патологии гипоталамуса и надпочечников, болезни щитовидной железы, диабет, астма, болезни почек, пороки сердца, артериальная гипертония — всё это может быть привести к развитию ФПН у будущих мам.
- Анемия говорит о дефиците железа в материнско-плодовом кровотоке, и ФПН может развиться как следствие. Проблемы со свёртываемостью крови могут спровоцировать появление тромбов в сосудах плаценты и нарушить плодово-плацентарный кровоток.
- Инфекции, обостряющиеся во время беременности, легко могут спровоцировать ФПН, поскольку вирусы и бактерии способны нанести повреждения плаценте. На ранних сроках беременности очевидным последствием может быть выкидыш, а начиная со второго триместра последствия будут зависеть от причины, вызвавшей ФПН и от особенностей её течения.
- Патологии матки могут вызвать ФПН, например, миометрия или эндометриоз.

- Преэкламсия, беременность более чем одним малышом, предлежание плаценты, тазовое предлежание плода, резус-конфликт — всё это так же с лёгкостью может вызвать появление ФПН.
Если большинство факторов, способных спровоцировать появление ФПН не зависит от самой будущей мамы, то следует знать о том меньшинстве, на которое повлиять возможно. Аборты в прошлом, курение, наркотики или алкоголь — всё это также относится к факторам риска, и развитие ФПН — лишь один из возможных поворотов событий.
Симптомы
Симптомы фетоплацентарной недостаточности начинают проявляться лишь при декомпенсированной форме ПН. Однако поначалу беременная может предъявлять лишь жалобы, характерные для экстрагенитальных и акушерских заболеваний, на фоне которых развивается ФПН, например, головная боль при гипертензии или отеки при преэкламсии. Но параллельно с этим, она может отметить, что число шевелений плода уменьшилось.
В случае если при ПН происходит внутриутробная задержка развития плода, то отмечается некоторое несоответствие высоты стояния дна матки к срокам гестации (косвенный признак), которое может быть выявлено при очередном посещении врача женской консультации.
Появление кровянистых выделений из влагалища на разных сроках беременности – опасный симптом. Он говорит о том, что произошла преждевременная отслойка плаценты, которая может привести к острой ФПН и гипоксии плода. В этом случае лучше немедленно обратиться за медицинской помощью!
Диагностика
Особое внимание необходимо уделять женщинам, входящим в группу риска по развитию ФПН. Таким беременным требуется в регулярное клиническое наблюдение. При каждом акушерском осмотре врач должен обращать внимание на прибавку в весе, измерять высоту стояния дна матки (ВДМ) и окружность живота. Несоответствие разности численного значения срока беременности и ВДМ, уменьшение числа шевелений, изменение частоты и глухость тонов сердцебиения плода является сигналом для проведения дополнительных исследований.
Определить ФПН можно при помощи 3-х основных методов:
- Ультразвуковое исследование. Этот метод позволяет оценить состояние плаценты (толщину, расположение, степень зрелости и т.д.) и плода (размеры, наличие пороков развития, соответствие темпов роста сроку гестации), а так же измерить количество околоплодных вод;
- Допплерометрия. С помощью данного метода диагностики исследуется кровоток в различных сосудах матери и плода, что позволяет точнее установить степень и уровень нарушений в системе мать-плацента-плод, а также позволяет подобрать рациональную терапию;
- Кардиотокография. Исследование, позволяющее оценить сердечную деятельность плода и косвенно судить о его состоянии.
Своевременная диагностика ФПН помогает вовремя распознать и отреагировать адекватным лечением на отклонения в развитии плода и течении беременности.
Лечение
При компенсированной форме ФПН допускается амбулаторное лечение при условии постоянного наблюдения (увеличивается число посещений в женскую консультацию). В остальных случаях необходима госпитализация. К сожалению, все существующие способы лечения не позволяют полностью восстановить нормальные функции и строение плаценты. Они лишь способствуют стабилизации процесса и предотвращают дальнейшее его прогрессирование.
В остальных случаях необходима госпитализация. К сожалению, все существующие способы лечения не позволяют полностью восстановить нормальные функции и строение плаценты. Они лишь способствуют стабилизации процесса и предотвращают дальнейшее его прогрессирование.
Поскольку основной причиной развития данной патологии является нарушение кровообращения в сосудах, то все действия должны быть направлены на их устранения.
Все лечебные мероприятия проводятся исключительно в стационаре, под строгим наблюдением врачей и постоянным контролем допплерометрии, УЗИ и КТГ, в течение не менее 2-х недель.
Риски и последствия
Фетоплацентарная недостаточность при беременности часто приводит к следующим осложнениям:
- Прерыванию беременности;
- Гипоксии плода;
- Задержке развития и роста плода;
- Возникает риск антенатальной (внутриутробной) гибели плода.
ВАЖНО!!! Наличие ФПН при беременности еще не означает, что ребенок родится с ЗРП или раньше срока. При небольшой степени гемодинамических нарушений в системе мать-плацента-плод, раннем выявлении и адекватном лечении – прогноз для беременности и плода благоприятный. Безусловно, при выраженных нарушениях гемодинамики, положительный исход заболевания подвергается сомнению.
При небольшой степени гемодинамических нарушений в системе мать-плацента-плод, раннем выявлении и адекватном лечении – прогноз для беременности и плода благоприятный. Безусловно, при выраженных нарушениях гемодинамики, положительный исход заболевания подвергается сомнению.
Профилактика фетоплацентарной недостаточности
Сегодня можно отметить хорошую тенденцию в отношении такого понятия, как «Планирование беременности». Всё больше пар относятся осознанно к этому, понимая важность и осознавая собственную ответственность друг перед другом и перед будущим малышом.
Только планируя свою беременность, только пройдя необходимые обследования и сдав соответствующие анализы, можно будет с уверенностью сказать: «Мы сделали всё, чтобы наш ребёнок появился на свет здоровым»! Ведь зная заранее, относятся ли родители к той или иной группе риска, можно предсказать ход развития беременности, вовремя её скорректировать, вылечить скрытые инфекции, словом, сделать всё, чтобы диагнозов подобно ФПН попросту не возникало. Всегда профилактика лучше и безопаснее лечения!
Всегда профилактика лучше и безопаснее лечения!
Конечно, незапланированная беременность до сих пор всё же является очень и очень частым событием, и в этом случае, чем раньше будущая мама отправится к врачу, тем лучше будет ей и ещё не рождённому крохе. Надо проходить все обследования в назначенный срок, сдавать анализы, показываться врачу-гинекологу так часто, как он сочтёт нужным. В идеале, ещё на этапе планирования беременности, или хотя бы с того дня, как тест показал вторую полоску, надо отказаться от алкоголя, сигарет и прочих вредных привычек. Они и так отравляют человеческий организм, и могут нанести такой необратимый вред малышу, что об этом даже страшно задуматься. Хороший здоровый сон будущей мамы должен составлять не менее 8-ми часов в сутки, ежедневных пеших прогулок на свежем воздухе должно быть как можно больше. Никаких нервов, стрессов, ругани — всё это в ваших руках, главное, поставить себе цель и чётко следовать ей.
На этапе планирования беременности профилактика фетоплацентарной недостаточности заключается в исключении неблагоприятных факторов риска:
- Ведение здорового образа жизни: полный отказ от вредных привычек;
- Полноценный сон;
- Рациональное и правильное питание;
- Прием витаминов;
- Исключение тяжелого физического труда, стрессов;
- Лечение хронических заболеваний и инфекций передаваемых половым путем
С наступлением беременности следует правильно организовывать режим для пациентки с полноценным отдыхом, включающим сон не менее 8-10 ч, в том числе и дневной в течение 2 ч, а также пребывание на свежем воздухе 3-4 ч.
Важное значение для здоровья матери и правильного развития плода имеет рациональное сбалансированное питание, с адекватным содержанием белков, жиров, углеводов, витаминов и микроэлементов. Потребление жидкости (при отсутствии отеков) для профилактики гиповолемии должно составлять 1-1,5 л.
Важно следить за увеличением массы тела во время беременности. К ее окончанию прибавка массы тела должна составлять в среднем 10- 12 кг.
Профилактические мероприятия с применением медикаментозных препаратов у беременных группы риска целесообразно проводить в 14-16 нед и в 28-34 нед.
Длительность каждого из таких курсов должна составлять 4-6 нед.
Проведение профилактической медикаментозной терапии с началом II триместра обусловлено тем, что в эти сроки беременности происходит наиболее интенсивный рост плода и плаценты, требующий адекватного кровоснабжения и оптимального энергетического обеспечения.
У беременных группы риска уже с этого срока начинает формироваться хроническая плацентарная недостаточность и особенно остро проявляются признаки дезадаптации к развивающейся беременности.
Медикаментозная профилактика усиливает компенсаторно-приспособительные реакции матери и плода, предупреждает дисциркуляторные нарушения МПК и ФПК и морфологические нарушения в плаценте.
Список литературы:
- Акушерство: учебник для медицинских вузов/ Э.К. Айламазян.
- Акушерство: Учебное пособие для студентов учреждений обеспеивающих получение высшего медицинского образования/ Г.И. Герасимович
- Фетоплацентарная недостаточность. – Учебно-методическое пособие. / С.Н.Занько.
Димитриева Татьяна Михайловна
врач-акушер-гинеколог 2-ой квалификационной
категории женской консультации
поликлиники №4
Плацентарная недостаточность — что это и как лечить
- Виды и причины плацентарной недостаточности
- Диагностика плацентарной недостаточности
- Лечение плацентарной недостаточности
Большинство женщин знают, что плацента связывает маму и малыша во время беременности и при помощи нее к малышу поступают питательные вещества и кислород.
Бывают ли такие ситуации, когда плацента перестает правильно и полноценно выполнять свою функцию? Можно ли как то предотвратить это?
Какую функцию выполняет плацента
Итак, плацента – это важный орган, который образуется только во время беременности. Образуется плацента из хориона — зародышевых оболочек плода. В самом начале беременности ворсины хориона – выросты оболочки — равномерно покрывают всю поверхность плодного яйца, начиная со второго месяца беременности с одной стороны плодного яйца ворсины начинают удлиняться, увеличиваться в размерах и формируют плаценту.
Внутри ворсин течет кровь малыша, а снаружи они омываются кровью матери. Между кровотоком мамы и малыша расположен всего один слой клеток, который и играет роль барьера между организмом матери и ребенка. Благодаря этой мембране кровь матери и плода не смешивается.
Однако в последние годы стало известно, что клетки крови плода все-таки проникают через плацентарный барьер в кровоток матери и благодаря этому стало возможным проведение генетических анализов и определение хромосомных аномалий, резуса фактора и пола плода по крови беременной женщины (неинвазивный пренатальный тест).
В плаценте происходит постоянный обмен веществ между мамой и ребенком. Из материнской крови к плоду поступает кислород и питательные вещества, от плода обратно к матери углекислый газ и продукты обмена, подлежащие выведению из организма.
Плацентарный барьер выполняет иммунологическую функцию, поскольку пропускает некоторые защитные антитела – клетки крови, обеспечивающие борьбу с инфекционными агентами, кроме того он является непроницаемым для некоторых вредных веществ, вирусов и бактерий. К сожалению, плацентарный барьер легко преодолевают наркотические вещества, алкоголь, никотин, компоненты многих лекарств и некоторые вирусы.
Важной функцией плаценты является выработка гормонов и биологически активных веществ. В первую очередь это гормоны, важные для успешного вынашивания беременности, например хорионический гонадотропин, плацентарный лактоген, эстрогены и др.
К сожалению, не всегда все складывается вполне благополучно. В силу самых различных причин на разных сроках беременности могут происходить отклонения в развитии и функционировании плаценты. Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Изменения эти никогда не проходят бесследно для мамы и малыша, а зачастую имеют грозные последствия.
Если плацента перестает выполнять свои функции в полной мере, развивается так называемая плацентарная недостаточность. По сути, она заключается в ухудшении кровообращения в системе мать-плацента-плод.
Виды и причины плацентарной недостаточности
Врачи различают острую и хроническую плацентарную недостаточность:
Острая плацентарная недостаточность
Это состояние, требующее экстренного вмешательства врачей. Она характеризуется стремительным ухудшением плацентарного кровотока. Острая плацентарная недостаточность возникает в основном в результате отслойки плаценты или гибели отдельных участков ткани плаценты например при образовании тромбов в сосудах. Причиной отслойки может послужить травма живота, антифосфолипидный синдром.
Фосфолипиды – это сложные жиры, которые входят в состав оболочек всех клеток организма. В ряде случаев иммунная система организма вырабатывает большое количество антител к некоторым собственным фосфолипидам и белкам, связывающим эти липиды. Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Они называются антифосфолипидные антитела и при взаимодействии с клетками организма вызывают повреждение клеток и активацию свертывающей системы крови, что приводит к тромбообразованию.
Антифосфолипидный синдром является самой частой причиной тромботических осложнений при беременности, в том числе причиной отслойки плаценты и острой плацентаной недостаточности.
Вызвать отслойку плаценты может также тяжелое течение гестоза – грозного осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Острая плацентарная недостаточность развивается при отслойке более 2/3 поверхности плаценты.
В случае развития острой плацентарной недостаточности необходимо максимально быстро провести операцию кесарева сечения для сохранения жизни малыша и мамы.
Хроническая плацентарная недостаточность
Значительно чаще у беременных женщин встречается хроническая плацентарная недостаточность. В этом случае происходит нарушение формирования и созревания плаценты, уменьшается маточно-плацентарный и плодово-плацентарный кровотоки, ограничивается газообмен и обмен веществ в плаценте, снижается синтез плацентарных гормонов. Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Все эти изменения определяют недостаточное поступление кислорода и питательных веществ малышу, вызывают задержку роста и развития плода.
Причинами плацентарной недостаточности чаще всего являются перенесенные аборты, особенно хирургический аборт при первой беременности, курение, при этом количество и крепость выкуриваемых сигарет значения не имеют, поскольку на формировании неполноценных сосудов плаценты негативное действие оказывает табачный дым, а не никотин.
В группу риска по развитию плацентарной недостаточности входят также женщины с хроническими заболеваниями, такими как артериальная гипертензия, железодефицитная анемия, пиелонефрит, сахарный диабет, заболевания щитовидной железы.
В последние годы наблюдается значительный рост плацентарной недостаточности, вызванной бактериями, вирусами, грибами. Причиной этого может быть как острая инфекция, перенесенная будущей мамой во время беременности, так и активация хронического инфекционного процесса в организме беременной женщины.
Немаловажное значение в формировании хронической плацентарной недостаточности играет патология матки: эндометриоз, пороки развития матки (седловидная, двурогая). Фактором риска врачи считают также миому матки. Безусловно, целый ряд лекарственных средств оказывает неблагоприятное влияние на формирование плаценты и развитие плода. В настоящее время определен список препаратов, не разрешенных к применению во время беременности.
Также большое значение в развитии плацентарной недостаточности имеет тромбофилия – повышенная склонность организма к образованию сгустков крови — тромбов в сосудах.
В некоторых случаях плацентарная недостаточность может быть обусловлена наличием хромосомных нарушений у плода, в частности при синдромах Дауна (наличие дополнительной 21 хромосомы у плода) или синдроме Эдвардса (дополнительная 18 хромосома у плода) уже в ранние сроки беременности диагностируется нарушение функции плаценты.
Следует отметить, что среди осложнений беременности, наиболее часто приводящих к развитию хронической плацентарной недостаточности, существенным фактором является преэклампсия (или поздний гестоз) – это осложнения второй половины беременности, проявляющееся отеками, повышением давления и появлением белка в моче.
Независимо от факторов, способствующих развитию плацентарной недостаточности, в основе ее лежат нарушения кровообращения в маточно-плацентарном комплексе, приводящие к нарушению всех функций плаценты. Следовательно, симптомы хронической плацентарной недостаточности будут обусловлены недостатком поступления кислорода и питательных веществ к плоду.
Это прежде всего, задержка внутриутробного развития плода – отставание размеров плода и замедление темпов его роста. Часто имеют место изменение двигательной активности плода. Сначала может быть некоторое усиление движений, а затем уменьшение. Нарушение защитной функции плаценты приводит к внутриутробному инфицированию плода под действием проникающих через плаценту патогенных (болезнетворных) микроорганизмов. Плод, развитие которого происходит в условиях плацентарной недостаточности, в значительно большей степени подвержен риску травматизации в родах, у них отмечается нарушение адаптации к внеутробной жизни, повышенная заболеваемость в первый год жизни.
По времени возникновения врачи разделяют плацентарную недостаточность на раннюю и позднюю.
Ранняя (или первичная) плацентарная недостаточность
Развивается до 16 недель беременности. Она возникает уже на этапе формирования плаценты и связана с заболеваниями беременной женщины, имеющимися до беременности, к примеру с патологией матки, хронической артериальной гипертензией, эндокринологическими заболеваниями. При этом происходит формированием неполноценных сосудов в плаценте.
Поздняя (или вторичная) плацентарная недостаточность
Возникает после 16 недель беременности и чаще всего связана с заболеваниями, возникшими уже во время беременности. Чаще всего это железодефицитная анемия (то есть снижение концентрации гемоглобина и железа в крови), гестационный сахарный диабет (то есть нарушение усвоения организмом глюкозы, возникшее на фоне беременности), перенесенные вирусные и бактериальные инфекции.
Важным является подразделение плацентарной недостаточности на компенсированную и декомпенсированные формы.
Компенсированная плацентарная недостаточность
Развивается, к примеру, при угрозе прерывания беременности и нетяжелых формах позднего гестоза, в случае, если эти осложнения успешно поддаются медикаментозной коррекции.
Декомпенсированная плацентарная недостаточность
Вызывает развитие задержки развития плода, хронической внутриутробной гипоксии, вплоть до гибели плода.
Диагностика плацентарной недостаточности
Лечить уже развившуюся плацентарную недостаточность практически невозможно, поэтому врачи активно стремятся выявлять беременных женщин, угрожаемых в отношении формирования нарушений функции плаценты. Если плацентарная недостаточность выявляется в 3 триместре беременности, эффективного лечения, к сожалению, не существует. Поэтому очень активно в настоящее время применяются все способы выявления в ранние сроки беременности тех женщин, в формировании плаценты которых произошли нарушения.
В первую очередь, при постановке на учет по беременности выявляют максимально значимые факторы риска – курение, перенесенные аборты, отягощенную наследственность (низкий вес при рождении, склонность к тромбозам), наличие хронических заболеваний сердца, сосудов, сахарного диабета.
Профилактические мероприятия против развития плацентарной недостаточности особенно актуальны и необходимы до 16-17 недель беременности, когда происходит формирование структур плаценты.
Значимую помощь в оценке риска развития плацентарной недостаточности оказывает пренатальный скрининг, который проводится в 11-14 недель беременности. Он проводится для выявления синдромов Дауна, Эдвардса и др. хромосомных болезней у плода. В настоящее время самым актуальным является проведение комплексного ранний скрининг беременной на прогнозирование риска развития плацентарной недостаточности, преэклампсии и внутриутробной задержки развития плода. Поскольку данный вид диагностики относится к самым современным и передовым, к сожалению, он пока не включен в перечень услуг, предоставляемых в женской консультации в рамках ОМС, но доступен всем желающим в центрах пренатальной диагностики.
Определение белков, вырабатываемых плацентой
В первую очередь проводят определение белка РАРР-А, он является также маркером хромосомных аномалий плода. Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Снижение концентрации РАРР-А в крови в 11-14 недель беременности встречается у беременных женщин, имеющих высокий риск плацентарной недостаточности и задержки развития плода.
Второй гормон плаценты, который помогает в оценке рисков плацентарной недостаточности – PIGF (плацентарный фактор роста). Его концентрация в крови снижается задолго до первых проявлений плацентарной недостаточности. Его определение применяют не настолько широко, как PAPP-A, но тем не менее многие лаборатории уже включили данный белок в пренатальный скрининг 1 триместра. Крайне важное значение при проведении скрининга 1 триместра имеет измерение кровотоков в сосудах матки. Однозначно доказано, что сужение сосудов матки, определяемое при исследовании, свидетельствует о неполноценности формирования плаценты, которое будет ухудшаться с увеличением срока беременности и приведет к снижению питания малыша и снабжения его кислородов, то есть к развитию плацентарной недостаточности и задержки развития плода. При нормальных размерах маточных сосудов в 11-14 недель беременности риск тяжелой плацентарной недостаточности ничтожно мал.
Следующее обязательное скрининговое ультразвуковое исследование проводится в 20-21 неделю беременности. При этом обязательно проводят измерения плода, чтобы оценить, нет ли отставания в росте. Ведь при кислородном голодании замедляются темпы роста плода и размеры его начинают отставать от нормы для каждого срока беременности. Кроме того врач обязательно оценивает состояние и зрелость плаценты. Во время УЗИ проводится также допплерометрия сосудов матки для выявления ранних изменений, предшествующих клиническим проявлениям плацентарной недостаточности.
У пациенток, относящихся к группе высокого риска кроме УЗИ и допплерометрии проводят также суточное мониторирование колебаний артериального давления, определение количества белка в анализе мочи, собранном за сутки, оценивают показатели системы свертывания крови.
Третье УЗИ проводится всем будущим мамам в 30–34 недели беременности. Врач измеряет окружность головы и живота крохи, длину костей его ручек и ножек, и вычисляет предполагаемый вес плода. Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Эти измерения позволяют доктору убедиться в том, что малыш развивается нормально. Также имеет значение строение плаценты, наличие в ней признаков старения, вследствие чего она обычно перестает полноценно снабжать малыша кровью, а, значит, ему перестает хватать кислорода и питательных веществ и развитие ребенка нарушается. Во время УЗИ оценивается количество и вид околоплодных вод, которые также могут изменяться при внутриутробном страдании плода.
Допплерометрия
Допплерометрия сосудов плаценты и пуповины (метод исследования скоростей кровотоков в этих сосудах) так же позволяет оценить самочувствие малыша. Доктор исследует кровоток в артериях матки, пуповины, сердца и мозга ребенка. Это исследование позволяет определить, хорошо ли работает плацента, нет ли признаков нехватки кислорода у малыша, или развития гестоза у мамы. При снижении скорости кровотока в каком-либо сосуде можно говорить о нарушениях питания плода различной степени тяжести.
Вовремя проведенное обследование позволяет выявить начальные стадии дефицита кровоснабжения. В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
В таких случаях лечение сможет предотвратить грозные осложнения, такие как гипоксия и внутриутробная задержка развития малыша. Допперометрию проводят в 20–21 неделю и в 30-32 недели беременности, при наличии изменений, контроль осуществляют минимум каждые две недели.
Кардиотокография
Это важный метод оценки состояния плода. Проводится КТГ при сроке беременности 33 недели и более, поскольку только на этом этапе внутриутробного развития малыша устанавливается полноценная регуляция деятельности сердечно-сосудистой системы плода центрами спинного и головного мозга. Запись сердцебиений плода проводят в течение 20–40 минут, а при необходимости исследование может быть продлено до 1,5 часов.
Аппарат регистрирует и записывает частоту сердцебиений малыша. Врач акушер-гинеколог оценивает кривую записи сердцебиений, эпизоды урежения и резкого учащения частоты сердечных сокращений плода и на основании этих данных делает заключение о том, насколько комфортно малыш чувствует себя в животе у мамы. К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
К примеру, при снижении концентрации кислорода в крови плода, уменьшается и его поступление к клеткам нервной системы, что в свою очередь отражается на частоте сердечных сокращений. При нормальном течении беременности КТГ проводят после 33 недели 1 раз в 10–14 дней, иногда чаще. В некоторых клиниках в настоящее время предлагается услуга постоянного КТГ-мониторирования, что приобретает актуальность при наличии признаков плацентарной недостаточности. Беременной женщине выдается мониторчик, который регистрирует изменения сердечной деятельности малыша и эти данные по интернету передаются лечащему врачу.
Лечение плацентарной недостаточности
Специфических способов лечения плацентарной недостаточности в настоящее время не существует, поскольку нет лекарственных препаратов, которые избирательно улучшают маточно-плацентарный кровоток. Именно поэтому все меры борьбы с плацентарной недостаточностью направлены на профилактику. Если пациентка относится к группе высокого риска по развитию плацентарной недостаточности, с раннего срока беременности ей назначают лекарственные препараты, эффективность которых хорошо доказана и которые предупреждают раннее развитие выраженных нарушений функции плаценты.
Если во время проведения дополнительных методов оценки состояния плода выявляются начальные нарушения поступления кислорода к малышу, проводится медикаментозное лечение, направленное на увеличение притока крови и кислорода через плаценту и обязательные контрольные обследования на фоне проводимой терапии. Если изменения серьезные и малыш испытывает выраженный дефицит кислорода и питательных веществ, состояние его страдает, то в таких случаях проводится экстренное родоразрешение.
Плацентарная недостаточность: диагностика, возможные осложнения и лечение
Плацента — уникальный орган, формирующийся у женщины во время беременности. Плацента устанавливает связь между плодом и матерью. Через нее осуществляется передача будущему ребенку питательных веществ, а также дыхательная, выделительная, защитная и гормональная функции плода.
Если плацента перестает выполнять данные функции в полной мере, начинает развиваться фетоплацентарная недостаточность. По сути, недостаточность — это нарушение кровообращения в системе мать-плацента-плод.
Если подобные нарушения незначительны, то они не окажут негативного влияния на плод, но при особенно выраженной ФПН может развиться гипоксия плода (кислородная недостаточность), что впоследствии может привести к его гибели.
По своему течению существуют 2 формы ФПН: хроническая и острая
При острой ФПН может быть обнаружена преждевременная отслойка нормально расположенной плаценты, вызванная резким нарушением маточно-плацентарного кровотока, что в ряде случаев может привести к гибели плода.
При хронической ФПН (наиболее распространенной) происходит постепенное нарушение кровообращения в плаценте.
Медики выделяют компенсированную и декомпенсированную формы хронической плацентарной недостаточности.
Несмотря на не слишком выраженное ухудшение кровоснабжения при компенсированной ФПН, плод не страдает и приспосабливается к этим изменениям, благодаря компенсаторным возможностям материнского организма.
При декомпенсированной ФПН изменения имеют более стойкий характер, что приводит к недостаточному снабжению кислородом плода, к нарушению его сердечной деятельности и задержке развития.
К факторам, способным вызвать появление ФПН во время беременности, относятся:
Симптомы заболевания
При компенсированной хронической ФПН симптомы заболевания практически отсутствуют, и беременная чувствует себя вполне нормально. О наличии у нее плацентарной недостаточности женщина может узнать, как правило, во время прохождения ультразвукового исследования.
При хронической и острой декомпенсированной ФПН симптомы более выражены. Сначала отмечаются активные движения плода, после активность резко уменьшается.
Помните о том, что, начиная с 28 недели, будущая мама в норме должна ощущать движения плода не менее десяти раз в сутки. Если плод не столь активен — это является поводом для того, чтобы немедленно наведаться к своему акушеру-гинекологу.
Кроме того, если имеется задержка развития плода, при декомпенсированной ФПН отмечается некоторое уменьшение размеров живота. Правда, самостоятельно выявить данные изменения очень сложно, поэтому обычно уменьшение выявляется гинекологом во время планового приема.
Правда, самостоятельно выявить данные изменения очень сложно, поэтому обычно уменьшение выявляется гинекологом во время планового приема.
И напоследок: наиболее опасный признак развития острой ФПН — это кровянистые выделения из влагалища. Это свидетельствует о том, что произошла преждевременная отслойка нормально расположенной плаценты, и подобная ситуация требует незамедлительного обращения к акушеру-гинекологу.
Диагностика ФПН
Для диагностики ФПН в акушерской практике применяют 3 основных метода: ультразвуковое исследование (УЗИ), кардиотокографию (КТГ) и допплерометрию. При любом незначительном подозрении на плацентарную недостаточность следует провести все эти обследования в обязательном порядке!
При УЗИ будет оцениваться двигательная активность плода, состояние плаценты (ее зрелость и толщина), количество околоплодных вод и размеры плода.
Фетоплацентарная недостаточность (Фпн) — признаки, причины, симптомы, лечение и профилактика
Диагностика
После сбора анамнестических сведений и физикального осмотра пациентки ей назначаются лабораторные тестирования, оценивающие состояние матери и ребенка в динамике. В этих целях выполняются исследования уровня плацентарного лактогена, эстриола, хорионического гонадотропина, кортизола.
В этих целях выполняются исследования уровня плацентарного лактогена, эстриола, хорионического гонадотропина, кортизола.
Установление параметров гемостаза и обмена веществ в организме роженицы учитывают с помощью анализа показателей аспартатаминотрансферазы, аланинаминотрансферазы, щелочной фосфатазы.
Оценку ПЛ-развития проводят, измеряя окружность живота и массу тела беременной, используя кардиотокографию, ультразвуковое исследование (УЗИ) и ПЛ-биометрию. УЗИ-диагностика также необходима для определения дыхательных ПЛ-движений и двигательной ПЛ-активности.
Определение статуса плацентарного кровообращения выполняют с помощью дуплексного сканирования и допплерографии, способных выявить любые гемодинамические расстройства маточно-плацентарного комплекса.
Лечение
Формирование тактики ведения лиц с ФПН-изменениями осуществляется с учетом результатов консультаций акушер-гинеколога, хирурга, гематолога, УЗИ-диагноста.
Лечебные мероприятия при данном недуге предполагают проведение этиотропной терапии по индивидуальным показаниям больной. Они должны быть направлены на ликвидацию ведущих факторов ФПН-возникновения и максимальное пролонгирование гестации.
Они должны быть направлены на ликвидацию ведущих факторов ФПН-возникновения и максимальное пролонгирование гестации.
Этиотропная медикаментозная коррекция осуществляется средствами защиты ПЦ-мембраны, повышающими клеточный уровень аденозинтрифосфорной кислоты, нормализующими маточно-плацентарную гемодинамику, противоанемическими препаратами.
Выбор способа родоразрешения зависит от эффективности ФПН-терапии и благоприятного прогноза относительно естественных родов. Для оказания экстренной помощи показано проведение кесарева сечения.
Профилактика
В основе ФПН-профилактики – раннее обнаружение и клиническое прогнозирование плацентарной дисфункции у пациенток с физиологическим и осложненным течением гестации. При выявлении таких случаев требуется рациональное ведение беременности с постоянным мониторингом состояния женщины и ПЛ-развития с помощью лабораторных и инструментальных методик.
Литература и источники
 П. Патология системы мать-плацента-плод: Руководство для врачей. — Москва: «Медицина». 1999 г.
П. Патология системы мать-плацента-плод: Руководство для врачей. — Москва: «Медицина». 1999 г.Видео по теме:
Отделение акушерской гипербарической оксигенации | КОГБУЗ «Кировский областной клинический перинатальный центр»
Гипербарическая оксигенобаротерапия (ГБО) – это один из эффективных безмедикаментозных методов лечения кислородом под повышенным давлением в барокамерах. В основе терапевтического эффекта ГБО лежит значительное увеличение кислородной емкости жидких сред организма (кровь, лимфа, тканевая жидкость и т. д.), которые при этом становятся достаточно мощными переносчиками кислорода к клеткам всех органов, и ликвидируется общая и местная гипоксия, вызванная тем или иным патологическим процессом. Повышенное давление вдыхаемого кислорода на каждую атмосферу, влечет за собой дополнительное растворение в 100 мл крови около 2,3 мл кислорода.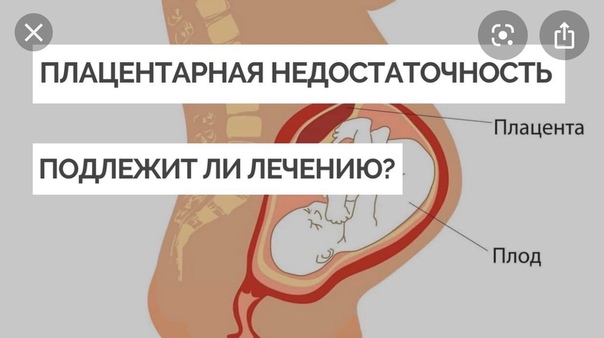
Применяется метод ГБО в медицинской практике в течение 55 – 60 лет. Лидирующее положение в области оксигенобаротерапии бесспорно принадлежит России. Это тесно связано с достижениями в области построения барокамер, а так же с успехами водолазной и космической физиологии и медицины. Ускоренное развитие службы ГБО в США, Германии, Японии, Италии и других странах связано с расцветом водолазного и подводного туризма, авиа воздушных видов спорта, когда скачкообразно возросла частота профессиональных заболеваний, поддающихся лечению только лишь в условиях гипербарического кислорода. Метод ГБО незаменим при спасении экипажей затонувших кораблей, подводных лодок, оказание помощи пострадавшим при пожарах, при отравлениях цианидами, седативными препаратами, с синдромом длительного сдавления (краш-синдром) после ДТП, при разборе завалов и т.д. ГБО является единственно действенным методом лечения декомпрессионной болезни, баротравмы легких, артериальной газовой эмболии и отравлении угарным газом. Активно используется данный метод при лечении газовой гангрены и других анаэробных инфекциях, инфицированных ран.
Активно используется данный метод при лечении газовой гангрены и других анаэробных инфекциях, инфицированных ран.
Повышенное содержание кислорода позволяет нормализовать микроциркуляцию, стимулирует иммунологическую неспецифическую резистентность организма и регенеративные процессы. Таким образом, область применения ГБО в медицине чрезвычайно велика. Широкое распространение в медицине данный метод получил в связи с тем, что гипоксия – одна из центральных проблем современной патологии. В клинических условиях гипоксия возникает вторично, однако, развившись, она в свою очередь усугубляет течение основного заболевания, что ведет к утяжелению уже имеющейся кислородной недостаточности. Поэтому ГБО используется как основной или как дополнительный метод лечения многих заболеваний.
История создания отделения ГБО
Кировский областной клинически перинатальный центр является самым крупным родовспомогательным учреждением Кировской области. На его базе в августе 1991 году было создано отделение ГБО (гипербарической оксигенации). Организовал и в течение 9 лет заведовал отделением врач акушер-гинеколог высшей квалификационной категории Семеновский Николай Владимирович, ныне являющийся главным врачом Перинатального центра. В настоящее время заведует отделением врач высшей квалификационной категории Гулина Татьяна Леонидовна. Отделение укомплектовано квалифицированным средним медицинским персоналом, всем медицинским сестрам присвоены высшие квалификационные категории. С момента организации отделения ГБО работает на должности старшей медсестры Чугаева Ефросинья Федоровна. Медсестры барооператоры Семенова Вера Васильевна и Куликова Любовь Александровна в совершенстве владеют методикой проведения сеансов на одноместных лечебных барокамерах. Безотказную работу бароаппаратов обеспечивают инженеры Колосов Олег Николаевич и Пестов Валерий Сергеевич.
Организовал и в течение 9 лет заведовал отделением врач акушер-гинеколог высшей квалификационной категории Семеновский Николай Владимирович, ныне являющийся главным врачом Перинатального центра. В настоящее время заведует отделением врач высшей квалификационной категории Гулина Татьяна Леонидовна. Отделение укомплектовано квалифицированным средним медицинским персоналом, всем медицинским сестрам присвоены высшие квалификационные категории. С момента организации отделения ГБО работает на должности старшей медсестры Чугаева Ефросинья Федоровна. Медсестры барооператоры Семенова Вера Васильевна и Куликова Любовь Александровна в совершенстве владеют методикой проведения сеансов на одноместных лечебных барокамерах. Безотказную работу бароаппаратов обеспечивают инженеры Колосов Олег Николаевич и Пестов Валерий Сергеевич.
В течение 20 лет проведено более 50 тысяч сеансов, пролечено свыше 9 тысяч пациентов.
Заведующая отделением Гулина Татьяна Леонидовна, врач, высшая квалификационная категория, врачебный стаж с 1989 г. , стаж работы в отделении с 2000 г.
, стаж работы в отделении с 2000 г.
Старшая медсестра Куликова Любовь Александровна, высшая квалификационная категория, медицинский стаж с 1993 г., стаж работы в отделении с 2010 г.
Сотрудники отделения ГБО
Основные преимущества ГБО
по сравнению с кислородной терапией без повышенного давления.
- компенсирует практически любую форму гипоксии, прежде всего обусловленную потерей или инактивацией значительной части циркулирующего гемоглобина;
- удлиняет расстояние эффективного проникновения кислорода в тканях;
- создает определенный резерв кислорода в организме.
Спектр показаний к использованию метода ГБО в акушерстве и гинекологии
- нарушение маточноплацентарного кровотока (НМПК)
- фетоплацентарная недостаточность (ФПН)
- хроническая и острая внутриутробная гипоксия плода
- внутриутробная задержка развития плода (ВЗРП)
- анемия беременных
- угроза прерывания беременности
- гепатоз беременных
- резус – и АВО-конфликтная беременность
- гестозы различной степени тяжести
- соматические заболевания беременных
- послеродовые гнойно-воспалительные заболевания
- послеродовые анемии
- бесплодие
- нарушение менструального цикла и т.
 д.
д.
Сеансы ГБО проводятся ежедневно в одноместных барокамерах. Режимы подбираются индивидуально в зависимости от срока гестации и исходного состояния беременной. Средний курс лечения состоит из 6-8 сеансов. Курс ГБО проводится в комплексе с медикаментозными средствами, в ряде случаях сочетается с психотерапией.
ГБО в низкодозовых режимах не оказывает отрицательного действия на плод и является эффективным методом в комплексном лечении ФПН, гипоксии, гипотрофии плода и пролонгировании беременности. После проведенного курса ГБО нормализуется фетоплацентарный кровоток, усиливается детоксикационное действие при тяжелом гестозе раннего периода (1-я половина беременности). Отсутствие в некоторых случаях четкого положительного влияния ГБО на степень гипоксии и гипотрофии плода объясняется поздним началом курса оксигенобаротерапии, когда возникшие изменения на фоне обострения экстрогенитальной патологии и акушерских осложнений были достаточно стабильны, а плацента менее чувствительна к повышенной концентрации кислорода.
При применении ГБО в комплексной терапии осложненной беременности на фоне гепатоза ликвидируется гиперферментемия и рост ферментов не возобновляется до родов, благодаря проведению последующих поддерживающих курсов.
Большинство беременных, получивших курс лечения ГБО, отмечают улучшения общего состояния, сна и аппетита, появление чувства свежести и бодрости, улучшение двигательной активности плода. ГБО обеспечивает нормальные безопасные роды у рожениц с сопутствующей соматической патологией или осложненным течением беременности
Противопоказания к назначению ГБО.
- наличие в анамнезе эпилепсии
- наличие недренированных полостей (каверны, абсцессы) в легких
- тяжелые формы гипертонической болезни
- нарушение проходимости слуховых (евстахиевых) труб и каналов, соединяющих придаточные пазухи носа с внешней средой
- ОРВИ
- клаустрофобия
- угроза прерывания беременности с кровотечением
При наличии абсолютных жизненных показаний большинство противопоказаний может быть устранено.
Применение ГБО в комплексной терапии патологии беременности и послеродового периода имеет много преимуществ, как немедикаментозный и неинвазивный метод. Использование мягких режимов применения ГБО позволяет избегать осложнений, что подтверждается опытом многих тысяч лечебных сеансов, проведенных в акушерских клиниках. Однако, необходимо помнить, что гипербарическая оксигенация может оказать положительный эффект только при сохранении резервных возможностей и физиологических резервов организма, для правильной оценки которых необходимо сотрудничество врача отделения ГБО и акушера.
По Постановлению Правительства РФ от 28 декабря 2020 г. № 2299 “О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2021 год и на плановый период 2022 и 2023 годов”
Лечение методом гипербарической оксигенации (ГБО) не входит в перечень видов оказываемой бесплатно медицинской помощи за исключением:
— пациентам по жизненным показаниям из отделений реанимации и интенсивной терапии;
— пациентам после объемных кровопотерь;
— юным беременным;
— несовершеннолетним;
— пациентам при отравлении окисью углерода, метгемоглобинобразователями
— пациентам с клостридиальной инфекцией
— пациентам при газовой эмболии
В остальных случаях пациенты получают медицинскую помощь методом ГБО на платной основе.
Плата осуществляется непосредственно потребителем медицинской услуги или учреждением, направившим пациента на лечение, согласно договору заключенного между медицинскими учреждениями.
Оплата производится через кассу медицинского учреждения.
При назначении (получении) лечебных сеансов ГБО № 6 сумма оплаты составит 820 Х 6 =4920 рубля.
Лечение методом ГБО могут получить все пациентки находящиеся на стационарном лечении в перинатальном центре, а также беременные по направлению из других женских консультаций и родильных домов в амбулаторных условиях.
(PDF) отчет тиоцетамФПН
L-аргинин,мкм/г 8,2±0,3 7,0±0,2 7,8±0,5 7,0±0,8
Метионин,мкм/г 4,3±0,2 3,2±0,07 4,0±0,03*# 3,0±0,3
Цистеин,мкм/г 2,7±0,05 1,4±0,05 2,2±0,07*# 1,4±0,08
Общие восстановленные
SH-группы,мкм/г
177,8±5,4 93,5±3,1 157,0±7,7*# 100,3±8,3
Активность
Глутатионредуктазы(ГР),
Мкм/мг/мин
24,7±1,17 11,6±0,34 20,7±0,75*# 15,8±1,33
АФГ, у. е/ г 17,7±1,00 32,7±1,55 23,3±1,00* 29,2±1,78
е/ г 17,7±1,00 32,7±1,55 23,3±1,00* 29,2±1,78
КФГ, у.е. / г 34,7±1,12 58,1±1,76 43,8±1,21* 50,8±2,33
В матке животных с ФПН на 17 сутки беременности регистрировалось
угнетение процессов синтеза оксида азота, о чем свидетельствовало
уменьшение активности NO-синтазы на фоне выраженного дефицита
субстрата синтеза- L-аргинина. Параллельно регистрировалось и нарушение
транспорта оксида азота – снижение уровня тиосодержащих аминокислот и
суммарного количества восстановленных тиольных соединений. Дефицит
тиолов наблюдался на фоне резкого снижения активности
глутатионрелуктазы – фермента , регулирующего тио-дисульфидное
равновесие.Общеизвестно, что NO является нестабильным,
короткоживущим радикалом и для его стабилизации и последующей
транспортировки предусмотренны такие механизмы, как образование с
тиосодержащими низкомолекулярными соединениями
(глутатион,цистеин,метионин) устойчивых тионитрозольных
комплексов[5,10,16,38]. В условиях дефицита тиольных соединений
В условиях дефицита тиольных соединений
(оксидативный стресс, нитрозирующий стресс ,ишемия, интоксикации,
гипоксия , инфекция и т.д.) нарушается транспорт NO, т.к. он подвергается
атаке таких АФК , как супероксидрадикал и гидроксилрадикал с
превращением в цитотоксический продукт – пероксинитрита [16,38]. При
моделировании ФПН наблюдается усиление продукции «паразитарной»
формы NO – пероксинитрита о чем свидетельствовало повышение в матке
маркерного продукта – нитротирозина. Развитие оксидативногос тресса в
Виды и риски осложненной беременности
Ведение беременности опытным акушером-гинекологом позволяет предотвратить или уменьшить риски появления осложнений, которые могут стать причиной серьезных проблем с репродуктивной системой у женщины и вызвать самопроизвольный аборт. Рассказываем о частых видах осложнений и связанным с этим рисках.
В I триместре
В первом триместре (до 12 недель) врачи чаще всего сталкиваются с тремя угрожающими здоровью плода и матери состояниями: ранним токсикозом (50–60%), угрозой прерывания (20%), заболеваниями гриппом и ОРВИ. В группу угрозы прерывания беременности входит замирание плода, внематочная беременность, самопроизвольный аборт и другие. Кроме риска потери малыша, осложнения могут также вызвать авитаминоз, обострения хронических экстрагенитальных заболеваний, инфицирование плода, риск развития в будущем гипоксии плода, рождение малыша с пороками развития.
В группу угрозы прерывания беременности входит замирание плода, внематочная беременность, самопроизвольный аборт и другие. Кроме риска потери малыша, осложнения могут также вызвать авитаминоз, обострения хронических экстрагенитальных заболеваний, инфицирование плода, риск развития в будущем гипоксии плода, рождение малыша с пороками развития.
Во II триместре
С 12 по 26 неделю возможна анемия (в 21–80% случаев в зависимости от региона проживания и сбалансированности питания), прерывание беременности (5–10%), предлежание плаценты (10%) и другие осложнения. Перечисленные осложнения могут стать причиной фетоплацентарной недостаточности, задержки развития или хронической гипоксии плода, самопроизвольного прерывания беременности, повышенного риска гестозов, осложнений в процессе родов (в том числе из-за неправильного положения ребенка) или сразу после них.
В III триместре
На поздних сроках беременности одним из самых опасных состояний является гестоз («поздний токсикоз»), он угрожает жизни и здоровью как малыша, так и матери. При осложнениях возможно развитие патологий почек и сердца, отеки легких, отслойка плаценты, гипотрофия плода, кома у матери или гибель плода. Важно вовремя диагностировать это состояние и исключить развитие осложнений. Среди других опасных состояний третьего триместра: фетоплацентарная недостаточность, отслойка плаценты и т. п.
При осложнениях возможно развитие патологий почек и сердца, отеки легких, отслойка плаценты, гипотрофия плода, кома у матери или гибель плода. Важно вовремя диагностировать это состояние и исключить развитие осложнений. Среди других опасных состояний третьего триместра: фетоплацентарная недостаточность, отслойка плаценты и т. п.
Осложнения на ранних и поздних сроках беременности — чрезвычайно опасные состояния для матери и ребенка. Именно поэтому важно регулярно посещать своего акушера-гинеколога и контролировать состояние, чтобы успеть предпринять все меры для рождения здорового малыша и исключения рисков патологий у мамы.
Болезнь ферропортина: патогенез, диагностика и лечение
Реферат
Ферропортиновая болезнь (ФБ) — аутосомно-доминантное наследственное заболевание, связанное с загрузкой железа, связанное с гетерозиготными мутациями гена ферропортина-1 ( FPN ). Он представляет собой одну из самых распространенных причин генетической гиперферритинемии, независимо от этнической принадлежности. FPN1 переносит железо из кишечника, макрофагов и плаценты в кровоток. При FD мутации FPN1 с потерей функции ограничивают, но не нарушают экспорт железа в энтероцитах, но они серьезно влияют на перенос железа в макрофагах.Это приводит к прогрессивному и предпочтительному захвату железа в тканевых макрофагах, снижению выделения железа в сывороточный трансферрин (то есть к несоответствующему низкому насыщению трансферрина) и тенденции к анемии при менархе или после интенсивного кровопускания. Отличительным признаком ФД является заметное накопление железа в клетках Купфера печени. Во всем мире зарегистрированы многочисленные мутации, связанные с FD, некоторые из которых встречаются в разных популяциях, а о некоторых чаще сообщается (например, Val192del, A77D и G80S). Полиморфизмы FPN1 также представляют собой варианты генов, наиболее часто ответственные за гиперферритинемию у африканцев.Дифференциальный диагноз включает в основном наследственный гемохроматоз, синдром, обычно вызываемый HFE или TfR2 , HJV , HAMP и, в редких случаях, FPN1 .
FPN1 переносит железо из кишечника, макрофагов и плаценты в кровоток. При FD мутации FPN1 с потерей функции ограничивают, но не нарушают экспорт железа в энтероцитах, но они серьезно влияют на перенос железа в макрофагах.Это приводит к прогрессивному и предпочтительному захвату железа в тканевых макрофагах, снижению выделения железа в сывороточный трансферрин (то есть к несоответствующему низкому насыщению трансферрина) и тенденции к анемии при менархе или после интенсивного кровопускания. Отличительным признаком ФД является заметное накопление железа в клетках Купфера печени. Во всем мире зарегистрированы многочисленные мутации, связанные с FD, некоторые из которых встречаются в разных популяциях, а о некоторых чаще сообщается (например, Val192del, A77D и G80S). Полиморфизмы FPN1 также представляют собой варианты генов, наиболее часто ответственные за гиперферритинемию у африканцев.Дифференциальный диагноз включает в основном наследственный гемохроматоз, синдром, обычно вызываемый HFE или TfR2 , HJV , HAMP и, в редких случаях, FPN1 . Здесь, в отличие от FD, гиперферритинемия ассоциируется с высоким насыщением трансферрина, железосохраняющими макрофагами и прогрессирующей нагрузкой железа в паренхиматозных клетках. Магнитно-резонансная томография (МРТ) брюшной полости, ключевой неинвазивный диагностический инструмент для диагностики FD, показывает характерную триаду SSL нагрузки железом (селезенка, позвоночник и печень).Рекомендуется неагрессивный режим флеботомии с тщательным мониторингом насыщения трансферрина и гемоглобина из-за риска анемии. Семейный скрининг является обязательным, поскольку у братьев и сестер и потомства есть 50% -ный шанс быть носителем патогенной мутации.
Здесь, в отличие от FD, гиперферритинемия ассоциируется с высоким насыщением трансферрина, железосохраняющими макрофагами и прогрессирующей нагрузкой железа в паренхиматозных клетках. Магнитно-резонансная томография (МРТ) брюшной полости, ключевой неинвазивный диагностический инструмент для диагностики FD, показывает характерную триаду SSL нагрузки железом (селезенка, позвоночник и печень).Рекомендуется неагрессивный режим флеботомии с тщательным мониторингом насыщения трансферрина и гемоглобина из-за риска анемии. Семейный скрининг является обязательным, поскольку у братьев и сестер и потомства есть 50% -ный шанс быть носителем патогенной мутации.
Введение
Название болезни ферропортина (FD) относится к клинической сущности, которая отличается от всех других известных форм наследственной перегрузки железом, включая гемохроматоз (HC) [синоним наследственного гемохроматоза (HH)], т.е.е. синдром, вызванный мутациями гена гемохроматоза HFE или не HFE . 1 У человека ряд генетических нарушений связан с системной перегрузкой железом (), в то время как другие вызваны неправильным распределением железа и связаны с региональным накоплением железа в субклеточных компартментах (например, митохондриях при атаксии Фридрейха) или определенных типах клеток. и органы (например, базальные ганглии при нейроферритинопатии) (). Строго говоря, не все последние расстройства можно квалифицировать как истинные состояния перегрузки железом, поскольку общее содержание железа в организме не может быть увеличено.ФД, которая сегодня является одной из самых распространенных форм наследственного расстройства, вызванного перегрузкой железом, помимо HFE-гемохроматоза, характеризуется уникальной патогенетической базой и клиническими проявлениями и, в отличие от HC, регистрируется во всем мире, независимо от этнической принадлежности.
1 У человека ряд генетических нарушений связан с системной перегрузкой железом (), в то время как другие вызваны неправильным распределением железа и связаны с региональным накоплением железа в субклеточных компартментах (например, митохондриях при атаксии Фридрейха) или определенных типах клеток. и органы (например, базальные ганглии при нейроферритинопатии) (). Строго говоря, не все последние расстройства можно квалифицировать как истинные состояния перегрузки железом, поскольку общее содержание железа в организме не может быть увеличено.ФД, которая сегодня является одной из самых распространенных форм наследственного расстройства, вызванного перегрузкой железом, помимо HFE-гемохроматоза, характеризуется уникальной патогенетической базой и клиническими проявлениями и, в отличие от HC, регистрируется во всем мире, независимо от этнической принадлежности.
Таблица 1.
Наследственные заболевания человека, связанные с перегрузкой железом и неправильным его распределением.
Болезнь ферропортина (фенотип MIM-номер 606069, ген / локус; MIM-номер 604653; https://www.omim.org/entry/606069?search=ferroportin%20disease&highlight=ferroportin%20disease) возникает из-за патогенных (обычно бессмысленных) мутации гена ферропортина1 ( FPN1 ; SLC40A1 ), который кодирует единственный до сих пор идентифицированный экспортер железа у млекопитающих; 2 — 4 мутации отсутствия функции ухудшают способность FPN1 экспортировать железо, особенно в клетках с высоким оборотом железа, таких как тканевые макрофаги.В отличие от мутаций, вызывающих FD, другие редкие мутации FPN1 (такие как N144H, C326Y, C326S и C326F), 5 — 8 не нарушают экспрессию белка на клеточной мембране или его способность экспортировать железо, но делают FPN1 устойчивы к ингибирующему эффекту гепсидина, физиологического ингибитора FPN1 (см. ниже в разделе «Патогенез»). Это вызывает неконтролируемую активность FPN1 по экспорту железа; возникающее в результате клиническое заболевание отличается от FD и неотличимо от других форм наследственной HC (и).
Таблица 2.
Основные признаки болезни Ферропортина и других наследственных нарушений, связанных с перегрузкой железом, у человека.
Определение и классификация
База данных OMIM классифицирует две формы наследственной перегрузки железом из-за мутаций FPN1 в той же таксономической категории, как «гемохроматоз 4 типа» (https://www.omim.org/entry/606069?search= ферропортин% 20 заболевание и выделение = ферропортин% 20 заболевание). Сходная терминология была затем принята Orphanet с включением двух подкатегорий: гемохроматоз типа 4A (относится к классическому FD из-за мутации FPN1 с отсутствием функции) и гемохроматоз типа 4B (относится к FD из-за мутаций FPN1 с усилением функции. ) (http: // www.orpha.net/consor/cgibin/OC_Exp.php?Lng=EN&Expert=139491). Эти классификации были включены в недавние публикации с некоторыми вариантами. 9 , 10 Наименования и классификация болезней (таксономия) может варьироваться в зависимости от различных критериев, таких как патогенные гены, механизмы, клинические проявления и т. Д. В идеале таксономия (и названия) болезней также должна помогать клиницистам распознавать, диагностировать и лечить болезни. В этом контексте таксономия, принятая OMIM и Orphanet, охватывающая два патогенетически и клинически разных расстройства, вызванных мутациями в одном и том же гене под термином «гемохроматоз», может не достичь этих целей.За последние десятилетия термин гемохроматоз непоследовательно использовался в литературе и в клинической практике для неточного обозначения: i) любой формы перегрузки организма железом; ii) перегрузка тканями железом, вызывающая повреждение органов и заболевание; iii) генетически обусловленная перегрузка железом; и, недавно, iv) перегрузка железом, связанная с HFE. 11 Недавние открытия в этой области показали, что, независимо от лежащего в основе генетического дефекта, ряд наследственных нарушений нагрузки железом (т.е. вызванные мутациями потери функции HFE, TfR2, HJV, HAMP и мутациями увеличения функции FPN1) принадлежат к одному и тому же синдромному объекту, поскольку они разделяют патогенетическую основу (отсутствие функции-активности гепсидина), биохимическая экспрессия (высокое насыщение трансферрина и высокий уровень ферритина в сыворотке), особенности патологии печени (накопление железа в паренхимных клетках с железосохраненными клетками Купфера до поздней стадии), повреждение и заболевание отдельных органов-мишеней (печень, сердце, эндокринные железы, суставы) и терапевтический подход с оптимальным ответом на флеботомию.
Д. В идеале таксономия (и названия) болезней также должна помогать клиницистам распознавать, диагностировать и лечить болезни. В этом контексте таксономия, принятая OMIM и Orphanet, охватывающая два патогенетически и клинически разных расстройства, вызванных мутациями в одном и том же гене под термином «гемохроматоз», может не достичь этих целей.За последние десятилетия термин гемохроматоз непоследовательно использовался в литературе и в клинической практике для неточного обозначения: i) любой формы перегрузки организма железом; ii) перегрузка тканями железом, вызывающая повреждение органов и заболевание; iii) генетически обусловленная перегрузка железом; и, недавно, iv) перегрузка железом, связанная с HFE. 11 Недавние открытия в этой области показали, что, независимо от лежащего в основе генетического дефекта, ряд наследственных нарушений нагрузки железом (т.е. вызванные мутациями потери функции HFE, TfR2, HJV, HAMP и мутациями увеличения функции FPN1) принадлежат к одному и тому же синдромному объекту, поскольку они разделяют патогенетическую основу (отсутствие функции-активности гепсидина), биохимическая экспрессия (высокое насыщение трансферрина и высокий уровень ферритина в сыворотке), особенности патологии печени (накопление железа в паренхимных клетках с железосохраненными клетками Купфера до поздней стадии), повреждение и заболевание отдельных органов-мишеней (печень, сердце, эндокринные железы, суставы) и терапевтический подход с оптимальным ответом на флеботомию. 11 Как описано в следующих разделах, каждая отдельная функция, описанная выше, отличается в классическом FD. 1 Таким образом, использование термина «гемохроматоз» для классической FD или термина «болезнь ферропортина» для FPN1-ассоциированного HC вводит в заблуждение, особенно для клиницистов, поскольку клинические подозрения, диагностическая стратегия и лечение сильно различаются. Основываясь на этих соображениях и на нашем нынешнем понимании патогенеза и клинических проявлений этих расстройств, предлагается, чтобы расстройство, вызванное мутациями отсутствия функции FPN1, было названо «болезнью ферропортина», как первоначально было описано, 1 , , и нарушение, вызванное мутациями FPN1, связанными с усилением функции, называется «гемохроматоз, ассоциированный с FPN-1» ().Вместо этого, по аналогии с другими классификациями, связанными с белками (например, ферритинопатии; гемоглобинопатии), оба нарушения, вызванные мутациями отсутствия и увеличения функции FPN1, вполне могут быть включены в более широкую таксономическую категорию под названием «ферропортинопатии».
11 Как описано в следующих разделах, каждая отдельная функция, описанная выше, отличается в классическом FD. 1 Таким образом, использование термина «гемохроматоз» для классической FD или термина «болезнь ферропортина» для FPN1-ассоциированного HC вводит в заблуждение, особенно для клиницистов, поскольку клинические подозрения, диагностическая стратегия и лечение сильно различаются. Основываясь на этих соображениях и на нашем нынешнем понимании патогенеза и клинических проявлений этих расстройств, предлагается, чтобы расстройство, вызванное мутациями отсутствия функции FPN1, было названо «болезнью ферропортина», как первоначально было описано, 1 , , и нарушение, вызванное мутациями FPN1, связанными с усилением функции, называется «гемохроматоз, ассоциированный с FPN-1» ().Вместо этого, по аналогии с другими классификациями, связанными с белками (например, ферритинопатии; гемоглобинопатии), оба нарушения, вызванные мутациями отсутствия и увеличения функции FPN1, вполне могут быть включены в более широкую таксономическую категорию под названием «ферропортинопатии».
Исторические аспекты
В 1996 году был идентифицирован ген гемохроматоза HFE, чья гомозиготная мутация C282Y является причиной большинства случаев HH у кавказцев. 12 Вскоре стало очевидно, что не все наследственные нарушения, связанные с перегрузкой железом, можно объяснить мутациями HFE , особенно в Южной Европе, где процветал активный поиск других генов, связанных с генетической перегрузкой железом.С 2000 по 2004 год все известные гены, отличные от HFE , ассоциированные на данный момент с HC, а именно рецептор трансферрина 2 ( TfR2 ), 13 FPN1 , 5 гепсидин ( HAMP ), 14 и гемоювелин ( HJV ) 15 .
Несколькими годами ранее, в 1999 году, в большой семье с наследственной перегрузкой железом из Италии был зарегистрирован отчетливый и несколько необычный фенотип.Селективная загрузка макрофагов печени железом, гиперферритинемия, сосуществующая с насыщением трансферрина в норме и низким, и склонность к анемии после интенсивной флеботомии были отличительными признаками заболевания. 16 В 2001 году сообщалось, что все пораженные члены семьи были гетерозиготными по c. 230 C → Замена, приводящая к замене аланина 77 на аспартат в FPN1. 17 Это предприятие впоследствии было переименовано в FD. 1
16 В 2001 году сообщалось, что все пораженные члены семьи были гетерозиготными по c. 230 C → Замена, приводящая к замене аланина 77 на аспартат в FPN1. 17 Это предприятие впоследствии было переименовано в FD. 1
С другой стороны, HC, связанный с FPN1, из-за мутации FPN1 с усилением функции (стр.N144H), о котором впервые сообщили Njajou и др. . in 2001. 5 Тем не менее, стоит упомянуть, что первое клиническое описание «аутосомно-доминантной» формы классической HC уже было сообщено Eason et al . в меланезийском родстве в 1990 году. 18 В этой же популяции Arden et al . 19 позже связали фенотип HC с мутацией FPN1, вызванной усилением функции NI44T.
Биология и физиология ферропортина и FD
FPN1, продукт гена FPN1 ( SLC40A1 ), переносит железо из внешней среды (т. е.е. материнская кровь или просвет кишечника), а также из внутренних мест хранения железа и рециркулирует его в кровоток. Фактически, он высоко экспрессируется в макрофагах печени и селезенки, просвете энтероцитов и синцитиотрофобластов плаценты. 2 — 4
е.е. материнская кровь или просвет кишечника), а также из внутренних мест хранения железа и рециркулирует его в кровоток. Фактически, он высоко экспрессируется в макрофагах печени и селезенки, просвете энтероцитов и синцитиотрофобластов плаценты. 2 — 4
FPN1 регулируется на разных уровнях рядом факторов, в том числе транскрипционно гемом, 20 трансляционно железо-регуляторными белками (IRP), 21 и посттрансляционно главным образом гепсидином, гормоном железа.Гепсидин вырабатывается печенью в ответ на железо, воспаление и различные факторы стресса. 22 — 25 Гепсидин связывается с внеклеточной петлей FPN1 и запускает его убиквитинилирование на остатках лизина, расположенных во внутриклеточном домене, что приводит к интернализации и деградации в лизосомах. 26 — 28 Этот механизм позволяет точно регулировать отток железа из энтероцитов и макрофагов в кровоток, когда требуется больше железа во время активного эритропоэза (в этом случае синтез гепсидина подавляется эритроидными сигналами) или железо в крови должно контролироваться из-за пролиферации / роста патогенов или начинающейся перегрузки железом (здесь синтез гепсидина индуцируется медиаторами воспаления или железа, соответственно) (обзор Drakesmith, Nemeth и Ganz 29 ).
Топология FPN1 и организация мембраны уже давно рассматриваются с противоречивыми результатами, касающимися локализации N- и C-терминальных конечностей и количества трансмембранных сегментов. 30 — 39 Недавно была предсказана открытая внутрь конформация переносчика, 34 , 37 с кластером остатков, лежащих в центральном ядре белка, важного для движения железа и согласуется с сайтом связывания железа 37 и остатками, участвующими в связывании гепсидина, полностью доступными в модели, открытой наружу. 37 Форма, открытая внутрь, может представлять состояние покоя белка, а состояние открытого наружу — как конформацию, достижимую только в присутствии внутриклеточного железа, то есть когда FPN1 перемещается между двумя конформациями (). Избирательное связывание гепсидина с обращенной наружу конформацией должно, следовательно, гарантировать, что деградация FPN1 может происходить только тогда, когда внутриклеточное железо в изобилии 37 и активно прокачивается через канал 38 (). Недавно кристаллические структуры бактериального гомолога FPN1, BbFPN, были разрешены как во внешнем, так и во внутреннем состояниях, и была разработана модель гомологии с FPN1 человека. 39 Согласно Au, FPN1 имеет 12 TM-спиралей, как было предсказано ранее, 32 и разделен на две половины, одна из которых формирует долю N, а другая — долю C, соединенную длинной цитозольной петлей. с центральной полостью между долями, открытой с внеклеточной стороны и недоступной с внутриклеточной стороны ().FPN1 претерпевает внутридоменную конформационную перестройку во время транспортного цикла. Когда гепсидин проникает в центральную полость между долями N и C и взаимодействует с сайтом связывания гепсидина, расположенным в доле C, он вызывает два эффекта: а) увеличивает доступность внутриклеточных петель, которые содержат сайты убиквитинирования, для убиквитина. лигазы; и б) он останавливает конформационный переход FPN1 из обращенного наружу состояния в обращенное внутрь состояние, ингибируя доступ железа из цитоплазмы к сайту связывания субстрата внутри внутриклеточных ворот ().
Недавно кристаллические структуры бактериального гомолога FPN1, BbFPN, были разрешены как во внешнем, так и во внутреннем состояниях, и была разработана модель гомологии с FPN1 человека. 39 Согласно Au, FPN1 имеет 12 TM-спиралей, как было предсказано ранее, 32 и разделен на две половины, одна из которых формирует долю N, а другая — долю C, соединенную длинной цитозольной петлей. с центральной полостью между долями, открытой с внеклеточной стороны и недоступной с внутриклеточной стороны ().FPN1 претерпевает внутридоменную конформационную перестройку во время транспортного цикла. Когда гепсидин проникает в центральную полость между долями N и C и взаимодействует с сайтом связывания гепсидина, расположенным в доле C, он вызывает два эффекта: а) увеличивает доступность внутриклеточных петель, которые содержат сайты убиквитинирования, для убиквитина. лигазы; и б) он останавливает конформационный переход FPN1 из обращенного наружу состояния в обращенное внутрь состояние, ингибируя доступ железа из цитоплазмы к сайту связывания субстрата внутри внутриклеточных ворот (). 39
39
Биология ферропортина и постулируемая патобиология болезни ферропортина (FD). (A) Структурно-функциональная взаимосвязь активности ферропортина с экспортом железа. 39 (B) Предполагаемые механизмы связывания гепсидина с FPN и его деградации. 39 (C) Постулируемая основа для FD. (Верхняя панель) В клетках, подвергающихся относительно низкому притоку железа, таких как энтероциты, продукт аллеля FPN дикого типа способен достигать плазматической мембраны и экспортировать железо.Для ясности, мутировавший FPN1 не был изображен на поверхности клетки: на основе предыдущей работы in vitro было высказано предположение, что некоторые мутантные FPN1 все еще могут достигать клеточной поверхности и сохранять некоторую способность к транспорту железа, но это все еще спорно. (Нижняя панель) В клетках с высоким оборотом железа, таких как макрофаги, повышенные запросы на экспорт железа предъявляют высокие требования к трафику FPN, что приводит к « пробке » в компартментах эндоцитоза / плазмамембраны и деградации и неадекватно низкому нацеливанию продуктов аллелей дикого типа к клеточной мембране. 54 (D) Предполагаемый эффект мутаций FPN, которые влияют на формирование внутриклеточных ворот и доступ к сайту связывания железа. 39
54 (D) Предполагаемый эффект мутаций FPN, которые влияют на формирование внутриклеточных ворот и доступ к сайту связывания железа. 39
Молекулярный патогенез
Общая патофизиологическая основа FD четко определена и основана на нарушенном экспорте железа из места хранения / рециркуляции железа (особенно макрофагов) в кровоток. показывает основной дефект транспорта железа в FD в отличие от FPN1-ассоциированных HC.В последних случаях, как обсуждалось выше, мутации, которые влияют на сайт связывания гепсидина и / или убиквитинирование FPN1, приводят к снижению «чувствительности» FPN к гепсидину, что приводит к фенотипу HC, связанному с FPN1. Это было хорошо проиллюстрировано информативной мышиной моделью, соответствующей мутации сайта связывания гепсидина. 40
Основа аномального переноса железа в кровоток при болезни Ферропортина в отличие от наследственного гемохроматоза, связанного с ФПН.
Несмотря на эти достижения, молекулярный патогенез FD долгое время оставался неуловимым. В ряде исследований in vitro , в основном с использованием сверхэкспрессированного экзогенного FPN1 дикого типа и мутанта FPN1 в различных клеточных линиях, изучались биология и функция FPN1, а также влияние различных мутантов FPN1 на трафик белков и способность к переносу железа. хотя и с противоречивыми результатами, в зависимости от используемой клеточной линии или методологии. 30 — 32 , 34 , 35 , 38 , 41 — 47
В этом контексте активно обсуждается вопрос о том, объясняет ли гапло-недостаточность FPN1 FD или заболевание возникает в результате доминантно-негативного воздействия.Утверждалось, что если гапло-недостаточность была объяснением FD, то бессмысленные мутации также должны приводить к расстройству; однако до сих пор подавляющее большинство зарегистрированных мутаций в FD являются миссенс-мутациями. 48 Кроме того, целенаправленная делеция гена в гене мышиного Fpn1 имеет небольшой эффект у гетерозиготных животных, 49 , тогда как мышь flatiron (ffe) с миссенс-мутацией в Fpn1, которая влияет на ее локализацию и активность экспорта железа. при сверхэкспрессии in vitro имеют фенотип, сходный с фенотипом пациентов-людей. 50 В исследованиях с использованием экзогенного меченого белка in vitro , Fpn1 образует мультимеры, а мутантный Fpn1 предотвращает локализацию Fpn1 дикого типа на клеточной мембране. 33 , 42 , 50 Мультимерный белок за счет доминантно-негативного эффекта лучше объяснил бы аутосомно-доминантный признак FD. Однако другие исследования из разных групп предоставили экспериментальные доказательства в поддержку противоположного вывода и показали, что Fpn1 является мономером в культивируемых клетках 35 , 51 , 52 и in vivo . 53 Совсем недавно Sabelli et al. ., 54 , используя впервые культивированные макрофаги от пациентов с БФ, обнаружили, что эндогенный FPN1 обнаруживает локализацию, аналогичную локализации в донорских макрофагах, за исключением большего накопления. в лизосомах, что указывает на более высокую скорость деградации мутантного FPN1. Неожиданно и вопреки предыдущим исследованиям с использованием сверхэкспрессируемого мутантного белка в клеточных линиях, FPN1 в макрофагах FD циркулирует в раннем эндоцитарном компартменте, не мультимеризуется, он достигает плазматической мембраны, является компетентным в отношении транспорта железа (хотя и в меньшей степени, чем нормальные макрофаги), быстро интернализируется и разрушается при воздействии гепсидина.Однако, когда макрофаги FD подвергаются воздействию больших количеств гемового железа, в отличие от макрофагов-доноров, FPN1 больше не может достигать клеточной поверхности, что приводит к заметной задержке внутриклеточного железа. На основе этих наблюдений была предложена модель FD, в которой мономеры FPN1, несмотря на то, что половина белков мутированы, все еще могут достигать клеточной поверхности и экспортировать железо в клетки, которые подвергаются воздействию in vivo относительно низкого уровня. поток железа, например энтероцитов (). 54 Напротив, в клетках, подвергающихся высокому обмену железа in vivo , таких как тканевые макрофаги, достаточное количество FPN1 не может достигать плазматической мембраны, возможно, из-за «пробки» в процессе деградации и / или эндоцитоза. велосипедные дорожки.Эта модель согласуется с клиническим проявлением FD, характеризующимся ранним накоплением железа в клетках Купфера печени и нормальным насыщением трансферрина, что указывает на то, что активность мутантного FPN1 не ограничивает перенос железа в кишечнике; последний становится критически низким у молодых женщин во время менархе или после агрессивной флеботомии, когда высокие потребности в железе для эритропоэза, вероятно, вызывают повышенный трафик / цикличность FPN1 в тканевых макрофагах. 1 , 16 , 17 (см. Ниже в разделе «Клинические проявления, диагностика и лечение»).В этом исследовании не рассматривался вопрос о том, достигает ли мутантный FPN1 или только FPN1 дикого типа плазматической мембраны и является ли мутантный FPN1 транспортным. Предыдущие исследования не дали окончательных результатов. Во всех исследованиях было обнаружено, что экзогенно экспрессируемые мутанты p.A77D и p.Val162del FPN1 не способны переносить железо, но в некоторых случаях способны достигать клеточной мембраны, 34 , 35 , 38 , 41 , 43 и не в других. 30 , 31 Стр.Мутант G80S FPN1 был локализован на поверхности клетки в двух опубликованных исследованиях, 43 , 55 , и обнаружил, что транспорт железа компетентен в одном 55 и некомпетентен в другом. 43
Согласно Taniguchi et al. ., 39 сайты мутаций, связанные с FD, в основном картируются на междолевом интерфейсе, в основном на внутриклеточной стороне, и образуют внутриклеточные ворота.Эти мутации д., Следовательно, дестабилизируют междольные взаимодействия, тем самым влияя на стабильное формирование внутриклеточных ворот и снижая активность транспорта железа FPN1 (). Возможно, что разные мутанты по-разному влияют на способность FPN1 к транспорту железа; в то время как это может быть лучше преодолено нормальным аллельным продуктом в клетках с низким оборотом железа, таких как энтероциты или гепатоциты, это может быть еще больше затруднено в таких клетках, как макрофаги, где дополнительная «пробка» в компартменте эндоцитоз-плазмамембраны усугубит основной дефект. (см. выше).
Генетика и эпидемиология
Список опубликованных мутаций, связанных с FD и FPN1-зависимым HC, представлен в. 5 — 8 , 17 , 43 , 56 — 102 К настоящему времени были идентифицированы многочисленные мутации гена FPN1 у пробандов с классическим фенотипом FD франко-канадского, Меланезийское, тайское, японское и европейское наследие.
Таблица 3.
Болезненные мутации гена FPN1.
Несколько общих мутаций FPN1 были зарегистрированы в независимых родословных в разных странах (например, Val192del; 56 , 60 , 72 — 79 , 92 A77D, 17 , 59 , 60 G80S. 43 , 55 , 56 , 61 — 63 Сейчас считается, что наиболее часто встречающиеся мутации FPN1, такие как p.Val162del, являются выявляются чаще, чем другие мутации SLC40A1, потому что они встречались несколько раз в изолированных популяциях, а не возникали один раз и распространялись на разные популяции, на что указывает идентификация de novo p.Вариант Val162del в единичном случае ФД. 79
Варианты FPN1 широко распространены в африканских популяциях. Первым распространенным вариантом FPN1, зарегистрированным у африканцев и чернокожих американцев, был общий полиморфизм Q248H (p.Gln248His). 82 , 83 , 100 — 102 Интересно, что глобальный анализ вариантов в гене SLC40A1 (который включает мутации, связанные как с FD, так и с FPN1-ассоциированным HH) выявил частоту аллелей 0.0364%, что дает прогнозируемую частоту носительства патогенного генотипа 1 из 1373, цифру, которая приближается к частоте HFE-HC. 103 Это было в значительной степени связано с относительно высокими частотами аллелей для двух вариантов SLC40A1 (p.Asp270Val 84 , 85 и p.Arg371Trp 56 ) в африканских популяциях; прогнозируемая частота носителей патогенного генотипа SLC40A1 этих двух вариантов составляет 1: 197 среди африканского населения. 103 Q248H, 101 , 102 стр.Asp270Val, p.Arg371Trp и другие полиморфные варианты FPN1 84 также могут предрасполагать к перегрузке железом; но не было предоставлено четких доказательств этого (например, отсутствие функциональных исследований), хотя остается возможность, что из-за небольшого размера выборки эти наблюдения могут быть отнесены к случайности или что выявленные полиморфизмы могут быть связаны неравновесием с другим заболеванием. -вызывающие локусы. Тем не менее, вместе взятые, собранные данные делают FPN1 геном, наиболее часто связанным с наследственной гиперферритинемией у африканцев.
Клинические проявления и диагностика
Как уже говорилось, FD вызывается мутациями потери функции в FPN1. Эти мутации нарушают экспорт железа, особенно из ретикулоэндотелиальных макрофагов. В результате происходит накопление железа в макрофагах селезенки, печени и костей (что отражается высокими уровнями SF) (). При гистологии печени паренхиматозные клетки этих органов в значительной степени сохранены (), но также заметны дискретные отложения железа в гепатоцитах из-за дефектной активности FPN1 в гепатоцитах даже на ранних стадиях. 16 Клинические проявления неоднородны, но в целом выраженность более мягкая, чем у классического HC, и связанное с ним заболевание печени обычно не такое тяжелое (и). 1 , 16 , 17 , 56 То же, что и при классических формах HFE HC, а также в факторах хозяина FD (менструации, кровопотеря и т. Д.), Совместное наследование мутаций другого железа -гены или варианты генов, связанных с антиоксидантной защитой и фиброзом органов, и связанные с ними патологические состояния (метаболический синдром, вирусный гепатит и т. д.)) могут влиять на фенотип. Гипохромная анемия не редкость у молодых менструирующих женщин.
Различные стадии и исходы «удержания железа» при болезни Ферропортина по сравнению с «накоплением железа» при FPN1-ассоциированном гемохроматозе (HC). Изображения гистологии печени воспроизведены с разрешения Sabelli et al . 54
Из-за слабой клинической выразительности, описанной в литературе, были высказаны сомнения относительно пенетрантности генетического дефекта и обоснования для терапии по удалению железа.Однако в опубликованных отчетах имеется ограниченная и обычно не детальная клиническая информация; это, а также отсутствие проспективных исследований по-прежнему мешают нашему пониманию реального клинического воздействия заболевания. В единственном опубликованном отчете за 6 членами родословной, в которой впервые был описан FD, 16 наблюдали в течение 11–24 лет. 104 Пробанд в возрасте 83 лет, перенесший скрытую инфекцию HBV с 56 лет, после прекращения 20-летней программы флеботомии заболел раком печени без цирроза; У 2 братьев и сестер, которые также прервали лечение, отмечалось прогрессирование фиброза.Эти клинические данные, хотя и представляют интерес, не позволяют сделать определенные выводы о патогенетической связи между накоплением железа при ФД и повреждением и заболеванием печени.
Отличительной чертой классического ФД является накопление железа в ячейках Купфера (). Клетки Купфера жизненно важны для производства фиброгенных медиаторов, иммунологического надзора за опухолью и удаления трансформированных гепатоцитов. 105 Избирательная и массивная перегрузка железом может нарушить эти активности и способствовать фиброгенезу и канцерогенезу.Более того, как обсуждалось выше, накопление железа в гепатоцитах также имеет место при FD, хотя и в гораздо меньшей степени, чем в HFE- и non-HFE HC, и установленная прооксидантная повреждающая активность железа в паренхимных клетках также может способствовать прогрессированию заболевания. .
В отличие от HFE-HC, тип наследования FD аутосомно-доминантный. Следовательно, любой из родителей является носителем патогенной мутации FPN1 и имеет необъяснимую гиперферритинемию. Кроме того, у пробанда 50% -ный риск заболеть больным ребенком.Заболевание следует заподозрить у любого человека с необъяснимой гиперферритинемией и низко-нормальным насыщением трансферрина (TS) или сидерозом непаренхимальных клеток при биопсии печени или накоплении железа в печени и селезенке при МРТ ().
Таблица 4.
Подозрение и диагностика болезни Ферропортина.
Гиперферритинемия при ФБ возникает в очень раннем возрасте, и необъяснимая гиперферритинемия с нормальным ТС у ребенка должна побудить МРТ оценить накопление железа в печени, селезенке и костном мозге 106 (см. Ниже).
показывает предложенный алгоритм диагностики FD. Если гиперферритинемия ассоциируется с высоким TS (что подтверждено по крайней мере двумя последовательными определениями), но при отсутствии анемии, типичная картина HFE- и не HFE-HC (включая FPN1-ассоциированный HC из-за мутаций FPN1, вызванных усилением функции) исключается априори . Если гиперферритинемия ассоциируется с высоким TS и анемией, типичной картиной наследственной гемоглобинопатии и дефектами эритроцитов или атрансферринемией, FD снова исключается ().
Алгоритм диагностики болезни Ферропортина и наследственной гиперферритинемии. ACD / AI: анемия хронического заболевания / анемия воспаления. * Болезнь Гоше может проявляться как с сидерозом, так и без него, в зависимости от стадии заболевания. ** Расширенный ACD / AI может также проявляться сидерозом на МРТ (обычно селезенки и костного мозга).
Напротив, у субъектов с повышенным уровнем сывороточного ферритина и низким или нормальным TS обследование должно быть сосредоточено на общих причинах вторичной гиперферритинемии и других редких причинах наследственной гиперферритинемии для подтверждения диагноза FD ().Во-первых, следует рассмотреть общие причины гиперферритинемии, такие как нарушение обмена веществ, воспаление, рак и т. Д. Если они не обнаружены или гиперферритинемия сохраняется после лечения, следующий шаг зависит от наличия анемии. При отсутствии явной анемии, если содержание железа в печени и селезенке повышается на МРТ или биопсия печени показывает значительную нагрузку железом в клетках Купфера, следует рассмотреть возможность заболевания ФД и провести генетическое тестирование для подтверждения диагноза ().Другой частой причиной наследственной гиперферритинемии с нормальной TS, связанной с накоплением железа и анемией, является болезнь Гоше, обычно связанная с гепатоспленомегалией, цитопенией, аномальной коагуляцией, заболеванием костей и невропатическими проявлениями. 107
При отсутствии накопления железа в организме, но при наличии повышенных уровней SF и нормального TS, аутосомно-доминантная гиперферритинемия с катарактой (из-за мутаций чувствительного к железу элемента в 5′-нетранслируемой области L мРНК ферритина 108 ) или без катаракты, следует учитывать 109 .Если присутствует явная анемия, но TS нормальный / низкий, следует заподозрить ацерулоплазминемию, редкое аутосомно-рецессивное заболевание из-за мутаций потери функции церулоплазмина (CP), приводящее к перегрузке железом в печени и поджелудочной железе и прогрессирующей нейродегенерации, диабету. и дегенерация сетчатки. 110
МРТ головного мозга с типичным накоплением железа в базальных ганглиях и таламусе может помочь подтвердить диагноз. Как упоминалось выше, другим редким генетическим заболеванием, проявляющимся гиперферритинемией и анемией, является атрансферринемия / гипотрансферринемия 111 , которое, однако, характеризуется повышенным насыщением трансферрина из-за чрезвычайно низкого уровня трансферрина в сыворотке.
Дифференциальная диагностика в основном включает классические (HFE) и неклассические (TfR2, HAMP, HJV и FPN1) формы HH, все из которых характеризуются ранним и прогрессивным увеличением TS с последующим повышением сывороточного ферритина по мере увеличения накопления железа в паренхиматозных клетках печень, поджелудочная железа, сердце и другие органы (). Как уже говорилось, в отличие от HH, у FD клиническая выраженность мягче.
МРТ брюшной полости — полезный неинвазивный инструмент для классификации и диагностики заболевания, поскольку он может дифференцировать пациентов с ФД, характеризующимися задержкой железа в триаде SSL (селезенка, позвоночник, печень) (), от всех других форм ГГ, включая FPN1-HC, связанный с перегрузкой железа в печени, но с нормальным содержанием железа в селезенке и костном мозге (). 112
Картина абдоминальной магнитно-резонансной томографии (МРТ) болезни Ферропортина (ФД). МРТ. Т2 * -взвешенные последовательности градиентного эха использовали для обнаружения накопления железа. (A) Нормальный предмет. (B) FD. (C) FD после завершения программы флеботомии (обратите внимание, что избыток железа все еще обнаруживается в печени и позвоночнике, несмотря на нормальные уровни ферритина и насыщения трансферрина в сыворотке). (D) Ферропортин-ассоциированный наследственный гемохроматоз: накопление железа затрагивает только печень и сохраняет селезенку и позвоночник (стрелки).
Лечение
Венесекция является краеугольным камнем терапии также при БФ, но она может не переноситься одинаково у всех пациентов, и низкий TS с анемией может быть быстро установлен, несмотря на то, что SF все еще повышается. 1 Перегрузка макрофагами железом очень устойчива к отмене железа при этом заболевании, даже у пациентов, которые, по-видимому, хорошо лечились (). Следовательно, в отличие от HH, во время терапии следует тщательно контролировать не только сывороточный ферритин, но особенно TS. Кроме того, терапия не должна быть направлена на достижение обычных целей HH для истощения запасов железа (TS ниже 20%, SF 50 нг / л или легкая анемия), а должна быть более консервативной.Нет исследований по оптимальному графику флеботомии при FD. С практической точки зрения, сеанс флеботомии ежемесячно / раз в два месяца в течение 1-2 лет, в зависимости от основной мутации, позволяет достичь приемлемого состояния истощения запасов железа, в то время как поддерживающая терапия (обычно сеанс флеботомии каждые 4-6 месяцев) должен продолжаться на всю жизнь. Разумной целью для терапии является уровень SF 100–200 нг / мл. В некоторых случаях такие значения Ft могут по-прежнему отражать некоторую загрузку железом тканевых макрофагов (), но связанный с этим клинический риск незначителен.В идеале оптимальной целью является самый низкий приемлемый уровень ферритина для TS и уровни гемоглобина не ниже нижнего предела нормы. (Спорные) диетические ограничения, которые иногда рекомендуются пациентам с ГГ (избегание витамина С или продуктов, богатых железом или обогащенных), не применяются к ФД из-за другой патогенной основы по сравнению с ГГ: нормальное / достаточное всасывание железа энтероцитами и нормальное / незначительное увеличенное накопление железа в паренхиматозных клетках в FD по сравнению с увеличило абсорбцию железа и заметное накопление железа в паренхимных клетках в HH.
Хелатирование железа может быть вариантом в отдельных случаях. 79
Братья и сестры пациентов с ФД, как и их потомки, должны пройти скрининг, поскольку у них 50% вероятность быть восприимчивыми.
Болезнь ферропортина: патогенез, диагностика и лечение
Резюме
Болезнь ферропортина (ФБ) — аутосомно-доминантное наследственное заболевание, связанное с загрузкой железа, связанное с гетерозиготными мутациями гена ферропортина-1 ( FPN ).Он представляет собой одну из самых распространенных причин генетической гиперферритинемии, независимо от этнической принадлежности. FPN1 переносит железо из кишечника, макрофагов и плаценты в кровоток. При FD мутации FPN1 с потерей функции ограничивают, но не нарушают экспорт железа в энтероцитах, но они серьезно влияют на перенос железа в макрофагах. Это приводит к прогрессивному и предпочтительному захвату железа в тканевых макрофагах, снижению выделения железа в сывороточный трансферрин (то есть к несоответствующему низкому насыщению трансферрина) и тенденции к анемии при менархе или после интенсивного кровопускания.Отличительным признаком ФД является заметное накопление железа в клетках Купфера печени. Во всем мире зарегистрированы многочисленные мутации, связанные с FD, некоторые из которых встречаются в разных популяциях, а о некоторых чаще сообщается (например, Val192del, A77D и G80S). Полиморфизмы FPN1 также представляют собой варианты генов, наиболее часто ответственные за гиперферритинемию у африканцев. Дифференциальный диагноз включает в основном наследственный гемохроматоз, синдром, обычно вызываемый HFE или TfR2 , HJV , HAMP и, в редких случаях, FPN1 .Здесь, в отличие от FD, гиперферритинемия ассоциируется с высоким насыщением трансферрина, железосохраняющими макрофагами и прогрессирующей нагрузкой железа в паренхиматозных клетках. Магнитно-резонансная томография (МРТ) брюшной полости, ключевой неинвазивный диагностический инструмент для диагностики FD, показывает характерную триаду SSL нагрузки железом (селезенка, позвоночник и печень). Рекомендуется неагрессивный режим флеботомии с тщательным мониторингом насыщения трансферрина и гемоглобина из-за риска анемии. Семейный скрининг является обязательным, поскольку у братьев и сестер и потомства есть 50% -ный шанс быть носителем патогенной мутации.
Введение
Название ферропортиновая болезнь (FD) относится к клинической картине, которая отличается от всех других известных форм наследственной перегрузки железом, включая гемохроматоз (HC) [синоним наследственного гемохроматоза (HH)], т.е. HFE или не мутации гена гемохроматоза HFE . 1 У людей ряд генетических нарушений связан с системной перегрузкой железом (), в то время как другие вызваны неправильным распределением железа и связаны с региональным накоплением железа в субклеточных компартментах (например,грамм. митохондрии при атаксии Фридрейха) или определенные типы клеток и органы (например, базальные ганглии при нейроферритинопатии) (). Строго говоря, не все последние расстройства можно квалифицировать как истинные состояния перегрузки железом, поскольку общее содержание железа в организме не может быть увеличено. ФД, которая сегодня является одной из самых распространенных форм наследственного расстройства, вызванного перегрузкой железом, помимо HFE-гемохроматоза, характеризуется уникальной патогенетической базой и клиническими проявлениями и, в отличие от HC, регистрируется во всем мире, независимо от этнической принадлежности.
Таблица 1.
Наследственные заболевания человека, связанные с перегрузкой железом и неправильным его распределением.
Болезнь ферропортина (фенотип MIM-номер 606069, ген / локус; MIM-номер 604653; https://www.omim.org/entry/606069?search=ferroportin%20disease&highlight=ferroportin%20disease) возникает из-за патогенных (обычно бессмысленных) мутации гена ферропортина1 ( FPN1 ; SLC40A1 ), который кодирует единственный до сих пор идентифицированный экспортер железа у млекопитающих; 2 — 4 мутации отсутствия функции ухудшают способность FPN1 экспортировать железо, особенно в клетках с высоким оборотом железа, таких как тканевые макрофаги.В отличие от мутаций, вызывающих FD, другие редкие мутации FPN1 (такие как N144H, C326Y, C326S и C326F), 5 — 8 не нарушают экспрессию белка на клеточной мембране или его способность экспортировать железо, но делают FPN1 устойчивы к ингибирующему эффекту гепсидина, физиологического ингибитора FPN1 (см. ниже в разделе «Патогенез»). Это вызывает неконтролируемую активность FPN1 по экспорту железа; возникающее в результате клиническое заболевание отличается от FD и неотличимо от других форм наследственной HC (и).
Таблица 2.
Основные признаки болезни Ферропортина и других наследственных нарушений, связанных с перегрузкой железом, у человека.
Определение и классификация
База данных OMIM классифицирует две формы наследственной перегрузки железом из-за мутаций FPN1 в той же таксономической категории, как «гемохроматоз 4 типа» (https://www.omim.org/entry/606069?search= ферропортин% 20 заболевание и выделение = ферропортин% 20 заболевание). Сходная терминология была затем принята Orphanet с включением двух подкатегорий: гемохроматоз типа 4A (относится к классическому FD из-за мутации FPN1 с отсутствием функции) и гемохроматоз типа 4B (относится к FD из-за мутаций FPN1 с усилением функции. ) (http: // www.orpha.net/consor/cgibin/OC_Exp.php?Lng=EN&Expert=139491). Эти классификации были включены в недавние публикации с некоторыми вариантами. 9 , 10 Наименования и классификация болезней (таксономия) может варьироваться в зависимости от различных критериев, таких как патогенные гены, механизмы, клинические проявления и т. Д. В идеале таксономия (и названия) болезней также должна помогать клиницистам распознавать, диагностировать и лечить болезни. В этом контексте таксономия, принятая OMIM и Orphanet, охватывающая два патогенетически и клинически разных расстройства, вызванных мутациями в одном и том же гене под термином «гемохроматоз», может не достичь этих целей.За последние десятилетия термин гемохроматоз непоследовательно использовался в литературе и в клинической практике для неточного обозначения: i) любой формы перегрузки организма железом; ii) перегрузка тканями железом, вызывающая повреждение органов и заболевание; iii) генетически обусловленная перегрузка железом; и, недавно, iv) перегрузка железом, связанная с HFE. 11 Недавние открытия в этой области показали, что, независимо от лежащего в основе генетического дефекта, ряд наследственных нарушений нагрузки железом (т.е. вызванные мутациями потери функции HFE, TfR2, HJV, HAMP и мутациями увеличения функции FPN1) принадлежат к одному и тому же синдромному объекту, поскольку они разделяют патогенетическую основу (отсутствие функции-активности гепсидина), биохимическая экспрессия (высокое насыщение трансферрина и высокий уровень ферритина в сыворотке), особенности патологии печени (накопление железа в паренхимных клетках с железосохраненными клетками Купфера до поздней стадии), повреждение и заболевание отдельных органов-мишеней (печень, сердце, эндокринные железы, суставы) и терапевтический подход с оптимальным ответом на флеботомию. 11 Как описано в следующих разделах, каждая отдельная функция, описанная выше, отличается в классическом FD. 1 Таким образом, использование термина «гемохроматоз» для классической FD или термина «болезнь ферропортина» для FPN1-ассоциированного HC вводит в заблуждение, особенно для клиницистов, поскольку клинические подозрения, диагностическая стратегия и лечение сильно различаются. Основываясь на этих соображениях и на нашем нынешнем понимании патогенеза и клинических проявлений этих расстройств, предлагается, чтобы расстройство, вызванное мутациями отсутствия функции FPN1, было названо «болезнью ферропортина», как первоначально было описано, 1 , , и нарушение, вызванное мутациями FPN1, связанными с усилением функции, называется «гемохроматоз, ассоциированный с FPN-1» ().Вместо этого, по аналогии с другими классификациями, связанными с белками (например, ферритинопатии; гемоглобинопатии), оба нарушения, вызванные мутациями отсутствия и увеличения функции FPN1, вполне могут быть включены в более широкую таксономическую категорию под названием «ферропортинопатии».
Исторические аспекты
В 1996 году был идентифицирован ген гемохроматоза HFE, чья гомозиготная мутация C282Y является причиной большинства случаев HH у кавказцев. 12 Вскоре стало очевидно, что не все наследственные нарушения, связанные с перегрузкой железом, можно объяснить мутациями HFE , особенно в Южной Европе, где процветал активный поиск других генов, связанных с генетической перегрузкой железом.С 2000 по 2004 год все известные гены, отличные от HFE , ассоциированные на данный момент с HC, а именно рецептор трансферрина 2 ( TfR2 ), 13 FPN1 , 5 гепсидин ( HAMP ), 14 и гемоювелин ( HJV ) 15 .
Несколькими годами ранее, в 1999 году, в большой семье с наследственной перегрузкой железом из Италии был зарегистрирован отчетливый и несколько необычный фенотип.Селективная загрузка макрофагов печени железом, гиперферритинемия, сосуществующая с насыщением трансферрина в норме и низким, и склонность к анемии после интенсивной флеботомии были отличительными признаками заболевания. 16 В 2001 году сообщалось, что все пораженные члены семьи были гетерозиготными по c. 230 C → Замена, приводящая к замене аланина 77 на аспартат в FPN1. 17 Это предприятие впоследствии было переименовано в FD. 1
С другой стороны, HC, связанный с FPN1, из-за мутации FPN1 с усилением функции (стр.N144H), о котором впервые сообщили Njajou и др. . in 2001. 5 Тем не менее, стоит упомянуть, что первое клиническое описание «аутосомно-доминантной» формы классической HC уже было сообщено Eason et al . в меланезийском родстве в 1990 году. 18 В этой же популяции Arden et al . 19 позже связали фенотип HC с мутацией FPN1, вызванной усилением функции NI44T.
Биология и физиология ферропортина и FD
FPN1, продукт гена FPN1 ( SLC40A1 ), переносит железо из внешней среды (т.е.е. материнская кровь или просвет кишечника), а также из внутренних мест хранения железа и рециркулирует его в кровоток. Фактически, он высоко экспрессируется в макрофагах печени и селезенки, просвете энтероцитов и синцитиотрофобластов плаценты. 2 — 4
FPN1 регулируется на разных уровнях рядом факторов, в том числе транскрипционно гемом, 20 трансляционно железо-регуляторными белками (IRP), 21 и посттрансляционно главным образом гепсидином, гормоном железа.Гепсидин вырабатывается печенью в ответ на железо, воспаление и различные факторы стресса. 22 — 25 Гепсидин связывается с внеклеточной петлей FPN1 и запускает его убиквитинилирование на остатках лизина, расположенных во внутриклеточном домене, что приводит к интернализации и деградации в лизосомах. 26 — 28 Этот механизм позволяет точно регулировать отток железа из энтероцитов и макрофагов в кровоток, когда требуется больше железа во время активного эритропоэза (в этом случае синтез гепсидина подавляется эритроидными сигналами) или железо в крови должно контролироваться из-за пролиферации / роста патогенов или начинающейся перегрузки железом (здесь синтез гепсидина индуцируется медиаторами воспаления или железа, соответственно) (обзор Drakesmith, Nemeth и Ganz 29 ).
Топология FPN1 и организация мембраны уже давно рассматриваются с противоречивыми результатами, касающимися локализации N- и C-терминальных конечностей и количества трансмембранных сегментов. 30 — 39 Недавно была предсказана открытая внутрь конформация переносчика, 34 , 37 с кластером остатков, лежащих в центральном ядре белка, важного для движения железа и согласуется с сайтом связывания железа 37 и остатками, участвующими в связывании гепсидина, полностью доступными в модели, открытой наружу. 37 Форма, открытая внутрь, может представлять состояние покоя белка, а состояние открытого наружу — как конформацию, достижимую только в присутствии внутриклеточного железа, то есть когда FPN1 перемещается между двумя конформациями (). Избирательное связывание гепсидина с обращенной наружу конформацией должно, следовательно, гарантировать, что деградация FPN1 может происходить только тогда, когда внутриклеточное железо в изобилии 37 и активно прокачивается через канал 38 ().Недавно кристаллические структуры бактериального гомолога FPN1, BbFPN, были разрешены как во внешнем, так и во внутреннем состояниях, и была разработана модель гомологии с FPN1 человека. 39 Согласно Au, FPN1 имеет 12 TM-спиралей, как было предсказано ранее, 32 и разделен на две половины, одна из которых формирует долю N, а другая — долю C, соединенную длинной цитозольной петлей. с центральной полостью между долями, открытой с внеклеточной стороны и недоступной с внутриклеточной стороны ().FPN1 претерпевает внутридоменную конформационную перестройку во время транспортного цикла. Когда гепсидин проникает в центральную полость между долями N и C и взаимодействует с сайтом связывания гепсидина, расположенным в доле C, он вызывает два эффекта: а) увеличивает доступность внутриклеточных петель, которые содержат сайты убиквитинирования, для убиквитина. лигазы; и б) он останавливает конформационный переход FPN1 из обращенного наружу состояния в обращенное внутрь состояние, ингибируя доступ железа из цитоплазмы к сайту связывания субстрата внутри внутриклеточных ворот (). 39
Биология ферропортина и постулируемая патобиология болезни ферропортина (FD). (A) Структурно-функциональная взаимосвязь активности ферропортина с экспортом железа. 39 (B) Предполагаемые механизмы связывания гепсидина с FPN и его деградации. 39 (C) Постулируемая основа для FD. (Верхняя панель) В клетках, подвергающихся относительно низкому притоку железа, таких как энтероциты, продукт аллеля FPN дикого типа способен достигать плазматической мембраны и экспортировать железо.Для ясности, мутировавший FPN1 не был изображен на поверхности клетки: на основе предыдущей работы in vitro было высказано предположение, что некоторые мутантные FPN1 все еще могут достигать клеточной поверхности и сохранять некоторую способность к транспорту железа, но это все еще спорно. (Нижняя панель) В клетках с высоким оборотом железа, таких как макрофаги, повышенные запросы на экспорт железа предъявляют высокие требования к трафику FPN, что приводит к « пробке » в компартментах эндоцитоза / плазмамембраны и деградации и неадекватно низкому нацеливанию продуктов аллелей дикого типа к клеточной мембране. 54 (D) Предполагаемый эффект мутаций FPN, которые влияют на формирование внутриклеточных ворот и доступ к сайту связывания железа. 39
Молекулярный патогенез
Общая патофизиологическая основа FD четко определена и основана на нарушенном экспорте железа из места хранения / рециркуляции железа (особенно макрофагов) в кровоток. показывает основной дефект транспорта железа в FD в отличие от FPN1-ассоциированных HC.В последних случаях, как обсуждалось выше, мутации, которые влияют на сайт связывания гепсидина и / или убиквитинирование FPN1, приводят к снижению «чувствительности» FPN к гепсидину, что приводит к фенотипу HC, связанному с FPN1. Это было хорошо проиллюстрировано информативной мышиной моделью, соответствующей мутации сайта связывания гепсидина. 40
Основа аномального переноса железа в кровоток при болезни Ферропортина в отличие от наследственного гемохроматоза, связанного с ФПН.
Несмотря на эти достижения, молекулярный патогенез FD долгое время оставался неуловимым. В ряде исследований in vitro , в основном с использованием сверхэкспрессированного экзогенного FPN1 дикого типа и мутанта FPN1 в различных клеточных линиях, изучались биология и функция FPN1, а также влияние различных мутантов FPN1 на трафик белков и способность к переносу железа. хотя и с противоречивыми результатами, в зависимости от используемой клеточной линии или методологии. 30 — 32 , 34 , 35 , 38 , 41 — 47
В этом контексте активно обсуждается вопрос о том, объясняет ли гапло-недостаточность FPN1 FD или заболевание возникает в результате доминантно-негативного воздействия.Утверждалось, что если гапло-недостаточность была объяснением FD, то бессмысленные мутации также должны приводить к расстройству; однако до сих пор подавляющее большинство зарегистрированных мутаций в FD являются миссенс-мутациями. 48 Кроме того, целенаправленная делеция гена в гене мышиного Fpn1 имеет небольшой эффект у гетерозиготных животных, 49 , тогда как мышь flatiron (ffe) с миссенс-мутацией в Fpn1, которая влияет на ее локализацию и активность экспорта железа. при сверхэкспрессии in vitro имеют фенотип, сходный с фенотипом пациентов-людей. 50 В исследованиях с использованием экзогенного меченого белка in vitro , Fpn1 образует мультимеры, а мутантный Fpn1 предотвращает локализацию Fpn1 дикого типа на клеточной мембране. 33 , 42 , 50 Мультимерный белок за счет доминантно-негативного эффекта лучше объяснил бы аутосомно-доминантный признак FD. Однако другие исследования из разных групп предоставили экспериментальные доказательства в поддержку противоположного вывода и показали, что Fpn1 является мономером в культивируемых клетках 35 , 51 , 52 и in vivo . 53 Совсем недавно Sabelli et al. ., 54 , используя впервые культивированные макрофаги от пациентов с БФ, обнаружили, что эндогенный FPN1 обнаруживает локализацию, аналогичную локализации в донорских макрофагах, за исключением большего накопления. в лизосомах, что указывает на более высокую скорость деградации мутантного FPN1. Неожиданно и вопреки предыдущим исследованиям с использованием сверхэкспрессируемого мутантного белка в клеточных линиях, FPN1 в макрофагах FD циркулирует в раннем эндоцитарном компартменте, не мультимеризуется, он достигает плазматической мембраны, является компетентным в отношении транспорта железа (хотя и в меньшей степени, чем нормальные макрофаги), быстро интернализируется и разрушается при воздействии гепсидина.Однако, когда макрофаги FD подвергаются воздействию больших количеств гемового железа, в отличие от макрофагов-доноров, FPN1 больше не может достигать клеточной поверхности, что приводит к заметной задержке внутриклеточного железа. На основе этих наблюдений была предложена модель FD, в которой мономеры FPN1, несмотря на то, что половина белков мутированы, все еще могут достигать клеточной поверхности и экспортировать железо в клетки, которые подвергаются воздействию in vivo относительно низкого уровня. поток железа, например энтероцитов (). 54 Напротив, в клетках, подвергающихся высокому обмену железа in vivo , таких как тканевые макрофаги, достаточное количество FPN1 не может достигать плазматической мембраны, возможно, из-за «пробки» в процессе деградации и / или эндоцитоза. велосипедные дорожки.Эта модель согласуется с клиническим проявлением FD, характеризующимся ранним накоплением железа в клетках Купфера печени и нормальным насыщением трансферрина, что указывает на то, что активность мутантного FPN1 не ограничивает перенос железа в кишечнике; последний становится критически низким у молодых женщин во время менархе или после агрессивной флеботомии, когда высокие потребности в железе для эритропоэза, вероятно, вызывают повышенный трафик / цикличность FPN1 в тканевых макрофагах. 1 , 16 , 17 (см. Ниже в разделе «Клинические проявления, диагностика и лечение»).В этом исследовании не рассматривался вопрос о том, достигает ли мутантный FPN1 или только FPN1 дикого типа плазматической мембраны и является ли мутантный FPN1 транспортным. Предыдущие исследования не дали окончательных результатов. Во всех исследованиях было обнаружено, что экзогенно экспрессируемые мутанты p.A77D и p.Val162del FPN1 не способны переносить железо, но в некоторых случаях способны достигать клеточной мембраны, 34 , 35 , 38 , 41 , 43 и не в других. 30 , 31 Стр.Мутант G80S FPN1 был локализован на поверхности клетки в двух опубликованных исследованиях, 43 , 55 , и обнаружил, что транспорт железа компетентен в одном 55 и некомпетентен в другом. 43
Согласно Taniguchi et al. ., 39 сайты мутаций, связанные с FD, в основном картируются на междолевом интерфейсе, в основном на внутриклеточной стороне, и образуют внутриклеточные ворота.Эти мутации д., Следовательно, дестабилизируют междольные взаимодействия, тем самым влияя на стабильное формирование внутриклеточных ворот и снижая активность транспорта железа FPN1 (). Возможно, что разные мутанты по-разному влияют на способность FPN1 к транспорту железа; в то время как это может быть лучше преодолено нормальным аллельным продуктом в клетках с низким оборотом железа, таких как энтероциты или гепатоциты, это может быть еще больше затруднено в таких клетках, как макрофаги, где дополнительная «пробка» в компартменте эндоцитоз-плазмамембраны усугубит основной дефект. (см. выше).
Генетика и эпидемиология
Список опубликованных мутаций, связанных с FD и FPN1-зависимым HC, представлен в. 5 — 8 , 17 , 43 , 56 — 102 К настоящему времени были идентифицированы многочисленные мутации гена FPN1 у пробандов с классическим фенотипом FD франко-канадского, Меланезийское, тайское, японское и европейское наследие.
Таблица 3.
Болезненные мутации гена FPN1.
Несколько общих мутаций FPN1 были зарегистрированы в независимых родословных в разных странах (например, Val192del; 56 , 60 , 72 — 79 , 92 A77D, 17 , 59 , 60 G80S. 43 , 55 , 56 , 61 — 63 Сейчас считается, что наиболее часто встречающиеся мутации FPN1, такие как p.Val162del, являются выявляются чаще, чем другие мутации SLC40A1, потому что они встречались несколько раз в изолированных популяциях, а не возникали один раз и распространялись на разные популяции, на что указывает идентификация de novo p.Вариант Val162del в единичном случае ФД. 79
Варианты FPN1 широко распространены в африканских популяциях. Первым распространенным вариантом FPN1, зарегистрированным у африканцев и чернокожих американцев, был общий полиморфизм Q248H (p.Gln248His). 82 , 83 , 100 — 102 Интересно, что глобальный анализ вариантов в гене SLC40A1 (который включает мутации, связанные как с FD, так и с FPN1-ассоциированным HH) выявил частоту аллелей 0.0364%, что дает прогнозируемую частоту носительства патогенного генотипа 1 из 1373, цифру, которая приближается к частоте HFE-HC. 103 Это было в значительной степени связано с относительно высокими частотами аллелей для двух вариантов SLC40A1 (p.Asp270Val 84 , 85 и p.Arg371Trp 56 ) в африканских популяциях; прогнозируемая частота носителей патогенного генотипа SLC40A1 этих двух вариантов составляет 1: 197 среди африканского населения. 103 Q248H, 101 , 102 стр.Asp270Val, p.Arg371Trp и другие полиморфные варианты FPN1 84 также могут предрасполагать к перегрузке железом; но не было предоставлено четких доказательств этого (например, отсутствие функциональных исследований), хотя остается возможность, что из-за небольшого размера выборки эти наблюдения могут быть отнесены к случайности или что выявленные полиморфизмы могут быть связаны неравновесием с другим заболеванием. -вызывающие локусы. Тем не менее, вместе взятые, собранные данные делают FPN1 геном, наиболее часто связанным с наследственной гиперферритинемией у африканцев.
Клинические проявления и диагностика
Как уже говорилось, FD вызывается мутациями потери функции в FPN1. Эти мутации нарушают экспорт железа, особенно из ретикулоэндотелиальных макрофагов. В результате происходит накопление железа в макрофагах селезенки, печени и костей (что отражается высокими уровнями SF) (). При гистологии печени паренхиматозные клетки этих органов в значительной степени сохранены (), но также заметны дискретные отложения железа в гепатоцитах из-за дефектной активности FPN1 в гепатоцитах даже на ранних стадиях. 16 Клинические проявления неоднородны, но в целом выраженность более мягкая, чем у классического HC, и связанное с ним заболевание печени обычно не такое тяжелое (и). 1 , 16 , 17 , 56 То же, что и при классических формах HFE HC, а также в факторах хозяина FD (менструации, кровопотеря и т. Д.), Совместное наследование мутаций другого железа -гены или варианты генов, связанных с антиоксидантной защитой и фиброзом органов, и связанные с ними патологические состояния (метаболический синдром, вирусный гепатит и т. д.)) могут влиять на фенотип. Гипохромная анемия не редкость у молодых менструирующих женщин.
Различные стадии и исходы «удержания железа» при болезни Ферропортина по сравнению с «накоплением железа» при FPN1-ассоциированном гемохроматозе (HC). Изображения гистологии печени воспроизведены с разрешения Sabelli et al . 54
Из-за слабой клинической выразительности, описанной в литературе, были высказаны сомнения относительно пенетрантности генетического дефекта и обоснования для терапии по удалению железа.Однако в опубликованных отчетах имеется ограниченная и обычно не детальная клиническая информация; это, а также отсутствие проспективных исследований по-прежнему мешают нашему пониманию реального клинического воздействия заболевания. В единственном опубликованном отчете за 6 членами родословной, в которой впервые был описан FD, 16 наблюдали в течение 11–24 лет. 104 Пробанд в возрасте 83 лет, перенесший скрытую инфекцию HBV с 56 лет, после прекращения 20-летней программы флеботомии заболел раком печени без цирроза; У 2 братьев и сестер, которые также прервали лечение, отмечалось прогрессирование фиброза.Эти клинические данные, хотя и представляют интерес, не позволяют сделать определенные выводы о патогенетической связи между накоплением железа при ФД и повреждением и заболеванием печени.
Отличительной чертой классического ФД является накопление железа в ячейках Купфера (). Клетки Купфера жизненно важны для производства фиброгенных медиаторов, иммунологического надзора за опухолью и удаления трансформированных гепатоцитов. 105 Избирательная и массивная перегрузка железом может нарушить эти активности и способствовать фиброгенезу и канцерогенезу.Более того, как обсуждалось выше, накопление железа в гепатоцитах также имеет место при FD, хотя и в гораздо меньшей степени, чем в HFE- и non-HFE HC, и установленная прооксидантная повреждающая активность железа в паренхимных клетках также может способствовать прогрессированию заболевания. .
В отличие от HFE-HC, тип наследования FD аутосомно-доминантный. Следовательно, любой из родителей является носителем патогенной мутации FPN1 и имеет необъяснимую гиперферритинемию. Кроме того, у пробанда 50% -ный риск заболеть больным ребенком.Заболевание следует заподозрить у любого человека с необъяснимой гиперферритинемией и низко-нормальным насыщением трансферрина (TS) или сидерозом непаренхимальных клеток при биопсии печени или накоплении железа в печени и селезенке при МРТ ().
Таблица 4.
Подозрение и диагностика болезни Ферропортина.
Гиперферритинемия при ФБ возникает в очень раннем возрасте, и необъяснимая гиперферритинемия с нормальным ТС у ребенка должна побудить МРТ оценить накопление железа в печени, селезенке и костном мозге 106 (см. Ниже).
показывает предложенный алгоритм диагностики FD. Если гиперферритинемия ассоциируется с высоким TS (что подтверждено по крайней мере двумя последовательными определениями), но при отсутствии анемии, типичная картина HFE- и не HFE-HC (включая FPN1-ассоциированный HC из-за мутаций FPN1, вызванных усилением функции) исключается априори . Если гиперферритинемия ассоциируется с высоким TS и анемией, типичной картиной наследственной гемоглобинопатии и дефектами эритроцитов или атрансферринемией, FD снова исключается ().
Алгоритм диагностики болезни Ферропортина и наследственной гиперферритинемии. ACD / AI: анемия хронического заболевания / анемия воспаления. * Болезнь Гоше может проявляться как с сидерозом, так и без него, в зависимости от стадии заболевания. ** Расширенный ACD / AI может также проявляться сидерозом на МРТ (обычно селезенки и костного мозга).
Напротив, у субъектов с повышенным уровнем сывороточного ферритина и низким или нормальным TS обследование должно быть сосредоточено на общих причинах вторичной гиперферритинемии и других редких причинах наследственной гиперферритинемии для подтверждения диагноза FD ().Во-первых, следует рассмотреть общие причины гиперферритинемии, такие как нарушение обмена веществ, воспаление, рак и т. Д. Если они не обнаружены или гиперферритинемия сохраняется после лечения, следующий шаг зависит от наличия анемии. При отсутствии явной анемии, если содержание железа в печени и селезенке повышается на МРТ или биопсия печени показывает значительную нагрузку железом в клетках Купфера, следует рассмотреть возможность заболевания ФД и провести генетическое тестирование для подтверждения диагноза ().Другой частой причиной наследственной гиперферритинемии с нормальной TS, связанной с накоплением железа и анемией, является болезнь Гоше, обычно связанная с гепатоспленомегалией, цитопенией, аномальной коагуляцией, заболеванием костей и невропатическими проявлениями. 107
При отсутствии накопления железа в организме, но при наличии повышенных уровней SF и нормального TS, аутосомно-доминантная гиперферритинемия с катарактой (из-за мутаций чувствительного к железу элемента в 5′-нетранслируемой области L мРНК ферритина 108 ) или без катаракты, следует учитывать 109 .Если присутствует явная анемия, но TS нормальный / низкий, следует заподозрить ацерулоплазминемию, редкое аутосомно-рецессивное заболевание из-за мутаций потери функции церулоплазмина (CP), приводящее к перегрузке железом в печени и поджелудочной железе и прогрессирующей нейродегенерации, диабету. и дегенерация сетчатки. 110
МРТ головного мозга с типичным накоплением железа в базальных ганглиях и таламусе может помочь подтвердить диагноз. Как упоминалось выше, другим редким генетическим заболеванием, проявляющимся гиперферритинемией и анемией, является атрансферринемия / гипотрансферринемия 111 , которое, однако, характеризуется повышенным насыщением трансферрина из-за чрезвычайно низкого уровня трансферрина в сыворотке.
Дифференциальная диагностика в основном включает классические (HFE) и неклассические (TfR2, HAMP, HJV и FPN1) формы HH, все из которых характеризуются ранним и прогрессивным увеличением TS с последующим повышением сывороточного ферритина по мере увеличения накопления железа в паренхиматозных клетках печень, поджелудочная железа, сердце и другие органы (). Как уже говорилось, в отличие от HH, у FD клиническая выраженность мягче.
МРТ брюшной полости — полезный неинвазивный инструмент для классификации и диагностики заболевания, поскольку он может дифференцировать пациентов с ФД, характеризующимися задержкой железа в триаде SSL (селезенка, позвоночник, печень) (), от всех других форм ГГ, включая FPN1-HC, связанный с перегрузкой железа в печени, но с нормальным содержанием железа в селезенке и костном мозге (). 112
Картина абдоминальной магнитно-резонансной томографии (МРТ) болезни Ферропортина (ФД). МРТ. Т2 * -взвешенные последовательности градиентного эха использовали для обнаружения накопления железа. (A) Нормальный предмет. (B) FD. (C) FD после завершения программы флеботомии (обратите внимание, что избыток железа все еще обнаруживается в печени и позвоночнике, несмотря на нормальные уровни ферритина и насыщения трансферрина в сыворотке). (D) Ферропортин-ассоциированный наследственный гемохроматоз: накопление железа затрагивает только печень и сохраняет селезенку и позвоночник (стрелки).
Лечение
Венесекция является краеугольным камнем терапии также при БФ, но она может не переноситься одинаково у всех пациентов, и низкий TS с анемией может быть быстро установлен, несмотря на то, что SF все еще повышается. 1 Перегрузка макрофагами железом очень устойчива к отмене железа при этом заболевании, даже у пациентов, которые, по-видимому, хорошо лечились (). Следовательно, в отличие от HH, во время терапии следует тщательно контролировать не только сывороточный ферритин, но особенно TS. Кроме того, терапия не должна быть направлена на достижение обычных целей HH для истощения запасов железа (TS ниже 20%, SF 50 нг / л или легкая анемия), а должна быть более консервативной.Нет исследований по оптимальному графику флеботомии при FD. С практической точки зрения, сеанс флеботомии ежемесячно / раз в два месяца в течение 1-2 лет, в зависимости от основной мутации, позволяет достичь приемлемого состояния истощения запасов железа, в то время как поддерживающая терапия (обычно сеанс флеботомии каждые 4-6 месяцев) должен продолжаться на всю жизнь. Разумной целью для терапии является уровень SF 100–200 нг / мл. В некоторых случаях такие значения Ft могут по-прежнему отражать некоторую загрузку железом тканевых макрофагов (), но связанный с этим клинический риск незначителен.В идеале оптимальной целью является самый низкий приемлемый уровень ферритина для TS и уровни гемоглобина не ниже нижнего предела нормы. (Спорные) диетические ограничения, которые иногда рекомендуются пациентам с ГГ (избегание витамина С или продуктов, богатых железом или обогащенных), не применяются к ФД из-за другой патогенной основы по сравнению с ГГ: нормальное / достаточное всасывание железа энтероцитами и нормальное / незначительное увеличенное накопление железа в паренхиматозных клетках в FD по сравнению с увеличило абсорбцию железа и заметное накопление железа в паренхимных клетках в HH.
Хелатирование железа может быть вариантом в отдельных случаях. 79
Братья и сестры пациентов с ФД, как и их потомки, должны пройти скрининг, поскольку у них 50% вероятность быть восприимчивыми.
Болезнь ферропортина: патогенез, диагностика и лечение
Резюме
Болезнь ферропортина (ФБ) — аутосомно-доминантное наследственное заболевание, связанное с загрузкой железа, связанное с гетерозиготными мутациями гена ферропортина-1 ( FPN ).Он представляет собой одну из самых распространенных причин генетической гиперферритинемии, независимо от этнической принадлежности. FPN1 переносит железо из кишечника, макрофагов и плаценты в кровоток. При FD мутации FPN1 с потерей функции ограничивают, но не нарушают экспорт железа в энтероцитах, но они серьезно влияют на перенос железа в макрофагах. Это приводит к прогрессивному и предпочтительному захвату железа в тканевых макрофагах, снижению выделения железа в сывороточный трансферрин (то есть к несоответствующему низкому насыщению трансферрина) и тенденции к анемии при менархе или после интенсивного кровопускания.Отличительным признаком ФД является заметное накопление железа в клетках Купфера печени. Во всем мире зарегистрированы многочисленные мутации, связанные с FD, некоторые из которых встречаются в разных популяциях, а о некоторых чаще сообщается (например, Val192del, A77D и G80S). Полиморфизмы FPN1 также представляют собой варианты генов, наиболее часто ответственные за гиперферритинемию у африканцев. Дифференциальный диагноз включает в основном наследственный гемохроматоз, синдром, обычно вызываемый HFE или TfR2 , HJV , HAMP и, в редких случаях, FPN1 .Здесь, в отличие от FD, гиперферритинемия ассоциируется с высоким насыщением трансферрина, железосохраняющими макрофагами и прогрессирующей нагрузкой железа в паренхиматозных клетках. Магнитно-резонансная томография (МРТ) брюшной полости, ключевой неинвазивный диагностический инструмент для диагностики FD, показывает характерную триаду SSL нагрузки железом (селезенка, позвоночник и печень). Рекомендуется неагрессивный режим флеботомии с тщательным мониторингом насыщения трансферрина и гемоглобина из-за риска анемии. Семейный скрининг является обязательным, поскольку у братьев и сестер и потомства есть 50% -ный шанс быть носителем патогенной мутации.
Введение
Название ферропортиновая болезнь (FD) относится к клинической картине, которая отличается от всех других известных форм наследственной перегрузки железом, включая гемохроматоз (HC) [синоним наследственного гемохроматоза (HH)], т.е. HFE или не мутации гена гемохроматоза HFE . 1 У людей ряд генетических нарушений связан с системной перегрузкой железом (), в то время как другие вызваны неправильным распределением железа и связаны с региональным накоплением железа в субклеточных компартментах (например,грамм. митохондрии при атаксии Фридрейха) или определенные типы клеток и органы (например, базальные ганглии при нейроферритинопатии) (). Строго говоря, не все последние расстройства можно квалифицировать как истинные состояния перегрузки железом, поскольку общее содержание железа в организме не может быть увеличено. ФД, которая сегодня является одной из самых распространенных форм наследственного расстройства, вызванного перегрузкой железом, помимо HFE-гемохроматоза, характеризуется уникальной патогенетической базой и клиническими проявлениями и, в отличие от HC, регистрируется во всем мире, независимо от этнической принадлежности.
Таблица 1.
Наследственные заболевания человека, связанные с перегрузкой железом и неправильным его распределением.
Болезнь ферропортина (фенотип MIM-номер 606069, ген / локус; MIM-номер 604653; https://www.omim.org/entry/606069?search=ferroportin%20disease&highlight=ferroportin%20disease) возникает из-за патогенных (обычно бессмысленных) мутации гена ферропортина1 ( FPN1 ; SLC40A1 ), который кодирует единственный до сих пор идентифицированный экспортер железа у млекопитающих; 2 — 4 мутации отсутствия функции ухудшают способность FPN1 экспортировать железо, особенно в клетках с высоким оборотом железа, таких как тканевые макрофаги.В отличие от мутаций, вызывающих FD, другие редкие мутации FPN1 (такие как N144H, C326Y, C326S и C326F), 5 — 8 не нарушают экспрессию белка на клеточной мембране или его способность экспортировать железо, но делают FPN1 устойчивы к ингибирующему эффекту гепсидина, физиологического ингибитора FPN1 (см. ниже в разделе «Патогенез»). Это вызывает неконтролируемую активность FPN1 по экспорту железа; возникающее в результате клиническое заболевание отличается от FD и неотличимо от других форм наследственной HC (и).
Таблица 2.
Основные признаки болезни Ферропортина и других наследственных нарушений, связанных с перегрузкой железом, у человека.
Определение и классификация
База данных OMIM классифицирует две формы наследственной перегрузки железом из-за мутаций FPN1 в той же таксономической категории, как «гемохроматоз 4 типа» (https://www.omim.org/entry/606069?search= ферропортин% 20 заболевание и выделение = ферропортин% 20 заболевание). Сходная терминология была затем принята Orphanet с включением двух подкатегорий: гемохроматоз типа 4A (относится к классическому FD из-за мутации FPN1 с отсутствием функции) и гемохроматоз типа 4B (относится к FD из-за мутаций FPN1 с усилением функции. ) (http: // www.orpha.net/consor/cgibin/OC_Exp.php?Lng=EN&Expert=139491). Эти классификации были включены в недавние публикации с некоторыми вариантами. 9 , 10 Наименования и классификация болезней (таксономия) может варьироваться в зависимости от различных критериев, таких как патогенные гены, механизмы, клинические проявления и т. Д. В идеале таксономия (и названия) болезней также должна помогать клиницистам распознавать, диагностировать и лечить болезни. В этом контексте таксономия, принятая OMIM и Orphanet, охватывающая два патогенетически и клинически разных расстройства, вызванных мутациями в одном и том же гене под термином «гемохроматоз», может не достичь этих целей.За последние десятилетия термин гемохроматоз непоследовательно использовался в литературе и в клинической практике для неточного обозначения: i) любой формы перегрузки организма железом; ii) перегрузка тканями железом, вызывающая повреждение органов и заболевание; iii) генетически обусловленная перегрузка железом; и, недавно, iv) перегрузка железом, связанная с HFE. 11 Недавние открытия в этой области показали, что, независимо от лежащего в основе генетического дефекта, ряд наследственных нарушений нагрузки железом (т.е. вызванные мутациями потери функции HFE, TfR2, HJV, HAMP и мутациями увеличения функции FPN1) принадлежат к одному и тому же синдромному объекту, поскольку они разделяют патогенетическую основу (отсутствие функции-активности гепсидина), биохимическая экспрессия (высокое насыщение трансферрина и высокий уровень ферритина в сыворотке), особенности патологии печени (накопление железа в паренхимных клетках с железосохраненными клетками Купфера до поздней стадии), повреждение и заболевание отдельных органов-мишеней (печень, сердце, эндокринные железы, суставы) и терапевтический подход с оптимальным ответом на флеботомию. 11 Как описано в следующих разделах, каждая отдельная функция, описанная выше, отличается в классическом FD. 1 Таким образом, использование термина «гемохроматоз» для классической FD или термина «болезнь ферропортина» для FPN1-ассоциированного HC вводит в заблуждение, особенно для клиницистов, поскольку клинические подозрения, диагностическая стратегия и лечение сильно различаются. Основываясь на этих соображениях и на нашем нынешнем понимании патогенеза и клинических проявлений этих расстройств, предлагается, чтобы расстройство, вызванное мутациями отсутствия функции FPN1, было названо «болезнью ферропортина», как первоначально было описано, 1 , , и нарушение, вызванное мутациями FPN1, связанными с усилением функции, называется «гемохроматоз, ассоциированный с FPN-1» ().Вместо этого, по аналогии с другими классификациями, связанными с белками (например, ферритинопатии; гемоглобинопатии), оба нарушения, вызванные мутациями отсутствия и увеличения функции FPN1, вполне могут быть включены в более широкую таксономическую категорию под названием «ферропортинопатии».
Исторические аспекты
В 1996 году был идентифицирован ген гемохроматоза HFE, чья гомозиготная мутация C282Y является причиной большинства случаев HH у кавказцев. 12 Вскоре стало очевидно, что не все наследственные нарушения, связанные с перегрузкой железом, можно объяснить мутациями HFE , особенно в Южной Европе, где процветал активный поиск других генов, связанных с генетической перегрузкой железом.С 2000 по 2004 год все известные гены, отличные от HFE , ассоциированные на данный момент с HC, а именно рецептор трансферрина 2 ( TfR2 ), 13 FPN1 , 5 гепсидин ( HAMP ), 14 и гемоювелин ( HJV ) 15 .
Несколькими годами ранее, в 1999 году, в большой семье с наследственной перегрузкой железом из Италии был зарегистрирован отчетливый и несколько необычный фенотип.Селективная загрузка макрофагов печени железом, гиперферритинемия, сосуществующая с насыщением трансферрина в норме и низким, и склонность к анемии после интенсивной флеботомии были отличительными признаками заболевания. 16 В 2001 году сообщалось, что все пораженные члены семьи были гетерозиготными по c. 230 C → Замена, приводящая к замене аланина 77 на аспартат в FPN1. 17 Это предприятие впоследствии было переименовано в FD. 1
С другой стороны, HC, связанный с FPN1, из-за мутации FPN1 с усилением функции (стр.N144H), о котором впервые сообщили Njajou и др. . in 2001. 5 Тем не менее, стоит упомянуть, что первое клиническое описание «аутосомно-доминантной» формы классической HC уже было сообщено Eason et al . в меланезийском родстве в 1990 году. 18 В этой же популяции Arden et al . 19 позже связали фенотип HC с мутацией FPN1, вызванной усилением функции NI44T.
Биология и физиология ферропортина и FD
FPN1, продукт гена FPN1 ( SLC40A1 ), переносит железо из внешней среды (т.е.е. материнская кровь или просвет кишечника), а также из внутренних мест хранения железа и рециркулирует его в кровоток. Фактически, он высоко экспрессируется в макрофагах печени и селезенки, просвете энтероцитов и синцитиотрофобластов плаценты. 2 — 4
FPN1 регулируется на разных уровнях рядом факторов, в том числе транскрипционно гемом, 20 трансляционно железо-регуляторными белками (IRP), 21 и посттрансляционно главным образом гепсидином, гормоном железа.Гепсидин вырабатывается печенью в ответ на железо, воспаление и различные факторы стресса. 22 — 25 Гепсидин связывается с внеклеточной петлей FPN1 и запускает его убиквитинилирование на остатках лизина, расположенных во внутриклеточном домене, что приводит к интернализации и деградации в лизосомах. 26 — 28 Этот механизм позволяет точно регулировать отток железа из энтероцитов и макрофагов в кровоток, когда требуется больше железа во время активного эритропоэза (в этом случае синтез гепсидина подавляется эритроидными сигналами) или железо в крови должно контролироваться из-за пролиферации / роста патогенов или начинающейся перегрузки железом (здесь синтез гепсидина индуцируется медиаторами воспаления или железа, соответственно) (обзор Drakesmith, Nemeth и Ganz 29 ).
Топология FPN1 и организация мембраны уже давно рассматриваются с противоречивыми результатами, касающимися локализации N- и C-терминальных конечностей и количества трансмембранных сегментов. 30 — 39 Недавно была предсказана открытая внутрь конформация переносчика, 34 , 37 с кластером остатков, лежащих в центральном ядре белка, важного для движения железа и согласуется с сайтом связывания железа 37 и остатками, участвующими в связывании гепсидина, полностью доступными в модели, открытой наружу. 37 Форма, открытая внутрь, может представлять состояние покоя белка, а состояние открытого наружу — как конформацию, достижимую только в присутствии внутриклеточного железа, то есть когда FPN1 перемещается между двумя конформациями (). Избирательное связывание гепсидина с обращенной наружу конформацией должно, следовательно, гарантировать, что деградация FPN1 может происходить только тогда, когда внутриклеточное железо в изобилии 37 и активно прокачивается через канал 38 ().Недавно кристаллические структуры бактериального гомолога FPN1, BbFPN, были разрешены как во внешнем, так и во внутреннем состояниях, и была разработана модель гомологии с FPN1 человека. 39 Согласно Au, FPN1 имеет 12 TM-спиралей, как было предсказано ранее, 32 и разделен на две половины, одна из которых формирует долю N, а другая — долю C, соединенную длинной цитозольной петлей. с центральной полостью между долями, открытой с внеклеточной стороны и недоступной с внутриклеточной стороны ().FPN1 претерпевает внутридоменную конформационную перестройку во время транспортного цикла. Когда гепсидин проникает в центральную полость между долями N и C и взаимодействует с сайтом связывания гепсидина, расположенным в доле C, он вызывает два эффекта: а) увеличивает доступность внутриклеточных петель, которые содержат сайты убиквитинирования, для убиквитина. лигазы; и б) он останавливает конформационный переход FPN1 из обращенного наружу состояния в обращенное внутрь состояние, ингибируя доступ железа из цитоплазмы к сайту связывания субстрата внутри внутриклеточных ворот (). 39
Биология ферропортина и постулируемая патобиология болезни ферропортина (FD). (A) Структурно-функциональная взаимосвязь активности ферропортина с экспортом железа. 39 (B) Предполагаемые механизмы связывания гепсидина с FPN и его деградации. 39 (C) Постулируемая основа для FD. (Верхняя панель) В клетках, подвергающихся относительно низкому притоку железа, таких как энтероциты, продукт аллеля FPN дикого типа способен достигать плазматической мембраны и экспортировать железо.Для ясности, мутировавший FPN1 не был изображен на поверхности клетки: на основе предыдущей работы in vitro было высказано предположение, что некоторые мутантные FPN1 все еще могут достигать клеточной поверхности и сохранять некоторую способность к транспорту железа, но это все еще спорно. (Нижняя панель) В клетках с высоким оборотом железа, таких как макрофаги, повышенные запросы на экспорт железа предъявляют высокие требования к трафику FPN, что приводит к « пробке » в компартментах эндоцитоза / плазмамембраны и деградации и неадекватно низкому нацеливанию продуктов аллелей дикого типа к клеточной мембране. 54 (D) Предполагаемый эффект мутаций FPN, которые влияют на формирование внутриклеточных ворот и доступ к сайту связывания железа. 39
Молекулярный патогенез
Общая патофизиологическая основа FD четко определена и основана на нарушенном экспорте железа из места хранения / рециркуляции железа (особенно макрофагов) в кровоток. показывает основной дефект транспорта железа в FD в отличие от FPN1-ассоциированных HC.В последних случаях, как обсуждалось выше, мутации, которые влияют на сайт связывания гепсидина и / или убиквитинирование FPN1, приводят к снижению «чувствительности» FPN к гепсидину, что приводит к фенотипу HC, связанному с FPN1. Это было хорошо проиллюстрировано информативной мышиной моделью, соответствующей мутации сайта связывания гепсидина. 40
Основа аномального переноса железа в кровоток при болезни Ферропортина в отличие от наследственного гемохроматоза, связанного с ФПН.
Несмотря на эти достижения, молекулярный патогенез FD долгое время оставался неуловимым. В ряде исследований in vitro , в основном с использованием сверхэкспрессированного экзогенного FPN1 дикого типа и мутанта FPN1 в различных клеточных линиях, изучались биология и функция FPN1, а также влияние различных мутантов FPN1 на трафик белков и способность к переносу железа. хотя и с противоречивыми результатами, в зависимости от используемой клеточной линии или методологии. 30 — 32 , 34 , 35 , 38 , 41 — 47
В этом контексте активно обсуждается вопрос о том, объясняет ли гапло-недостаточность FPN1 FD или заболевание возникает в результате доминантно-негативного воздействия.Утверждалось, что если гапло-недостаточность была объяснением FD, то бессмысленные мутации также должны приводить к расстройству; однако до сих пор подавляющее большинство зарегистрированных мутаций в FD являются миссенс-мутациями. 48 Кроме того, целенаправленная делеция гена в гене мышиного Fpn1 имеет небольшой эффект у гетерозиготных животных, 49 , тогда как мышь flatiron (ffe) с миссенс-мутацией в Fpn1, которая влияет на ее локализацию и активность экспорта железа. при сверхэкспрессии in vitro имеют фенотип, сходный с фенотипом пациентов-людей. 50 В исследованиях с использованием экзогенного меченого белка in vitro , Fpn1 образует мультимеры, а мутантный Fpn1 предотвращает локализацию Fpn1 дикого типа на клеточной мембране. 33 , 42 , 50 Мультимерный белок за счет доминантно-негативного эффекта лучше объяснил бы аутосомно-доминантный признак FD. Однако другие исследования из разных групп предоставили экспериментальные доказательства в поддержку противоположного вывода и показали, что Fpn1 является мономером в культивируемых клетках 35 , 51 , 52 и in vivo . 53 Совсем недавно Sabelli et al. ., 54 , используя впервые культивированные макрофаги от пациентов с БФ, обнаружили, что эндогенный FPN1 обнаруживает локализацию, аналогичную локализации в донорских макрофагах, за исключением большего накопления. в лизосомах, что указывает на более высокую скорость деградации мутантного FPN1. Неожиданно и вопреки предыдущим исследованиям с использованием сверхэкспрессируемого мутантного белка в клеточных линиях, FPN1 в макрофагах FD циркулирует в раннем эндоцитарном компартменте, не мультимеризуется, он достигает плазматической мембраны, является компетентным в отношении транспорта железа (хотя и в меньшей степени, чем нормальные макрофаги), быстро интернализируется и разрушается при воздействии гепсидина.Однако, когда макрофаги FD подвергаются воздействию больших количеств гемового железа, в отличие от макрофагов-доноров, FPN1 больше не может достигать клеточной поверхности, что приводит к заметной задержке внутриклеточного железа. На основе этих наблюдений была предложена модель FD, в которой мономеры FPN1, несмотря на то, что половина белков мутированы, все еще могут достигать клеточной поверхности и экспортировать железо в клетки, которые подвергаются воздействию in vivo относительно низкого уровня. поток железа, например энтероцитов (). 54 Напротив, в клетках, подвергающихся высокому обмену железа in vivo , таких как тканевые макрофаги, достаточное количество FPN1 не может достигать плазматической мембраны, возможно, из-за «пробки» в процессе деградации и / или эндоцитоза. велосипедные дорожки.Эта модель согласуется с клиническим проявлением FD, характеризующимся ранним накоплением железа в клетках Купфера печени и нормальным насыщением трансферрина, что указывает на то, что активность мутантного FPN1 не ограничивает перенос железа в кишечнике; последний становится критически низким у молодых женщин во время менархе или после агрессивной флеботомии, когда высокие потребности в железе для эритропоэза, вероятно, вызывают повышенный трафик / цикличность FPN1 в тканевых макрофагах. 1 , 16 , 17 (см. Ниже в разделе «Клинические проявления, диагностика и лечение»).В этом исследовании не рассматривался вопрос о том, достигает ли мутантный FPN1 или только FPN1 дикого типа плазматической мембраны и является ли мутантный FPN1 транспортным. Предыдущие исследования не дали окончательных результатов. Во всех исследованиях было обнаружено, что экзогенно экспрессируемые мутанты p.A77D и p.Val162del FPN1 не способны переносить железо, но в некоторых случаях способны достигать клеточной мембраны, 34 , 35 , 38 , 41 , 43 и не в других. 30 , 31 Стр.Мутант G80S FPN1 был локализован на поверхности клетки в двух опубликованных исследованиях, 43 , 55 , и обнаружил, что транспорт железа компетентен в одном 55 и некомпетентен в другом. 43
Согласно Taniguchi et al. ., 39 сайты мутаций, связанные с FD, в основном картируются на междолевом интерфейсе, в основном на внутриклеточной стороне, и образуют внутриклеточные ворота.Эти мутации д., Следовательно, дестабилизируют междольные взаимодействия, тем самым влияя на стабильное формирование внутриклеточных ворот и снижая активность транспорта железа FPN1 (). Возможно, что разные мутанты по-разному влияют на способность FPN1 к транспорту железа; в то время как это может быть лучше преодолено нормальным аллельным продуктом в клетках с низким оборотом железа, таких как энтероциты или гепатоциты, это может быть еще больше затруднено в таких клетках, как макрофаги, где дополнительная «пробка» в компартменте эндоцитоз-плазмамембраны усугубит основной дефект. (см. выше).
Генетика и эпидемиология
Список опубликованных мутаций, связанных с FD и FPN1-зависимым HC, представлен в. 5 — 8 , 17 , 43 , 56 — 102 К настоящему времени были идентифицированы многочисленные мутации гена FPN1 у пробандов с классическим фенотипом FD франко-канадского, Меланезийское, тайское, японское и европейское наследие.
Таблица 3.
Болезненные мутации гена FPN1.
Несколько общих мутаций FPN1 были зарегистрированы в независимых родословных в разных странах (например, Val192del; 56 , 60 , 72 — 79 , 92 A77D, 17 , 59 , 60 G80S. 43 , 55 , 56 , 61 — 63 Сейчас считается, что наиболее часто встречающиеся мутации FPN1, такие как p.Val162del, являются выявляются чаще, чем другие мутации SLC40A1, потому что они встречались несколько раз в изолированных популяциях, а не возникали один раз и распространялись на разные популяции, на что указывает идентификация de novo p.Вариант Val162del в единичном случае ФД. 79
Варианты FPN1 широко распространены в африканских популяциях. Первым распространенным вариантом FPN1, зарегистрированным у африканцев и чернокожих американцев, был общий полиморфизм Q248H (p.Gln248His). 82 , 83 , 100 — 102 Интересно, что глобальный анализ вариантов в гене SLC40A1 (который включает мутации, связанные как с FD, так и с FPN1-ассоциированным HH) выявил частоту аллелей 0.0364%, что дает прогнозируемую частоту носительства патогенного генотипа 1 из 1373, цифру, которая приближается к частоте HFE-HC. 103 Это было в значительной степени связано с относительно высокими частотами аллелей для двух вариантов SLC40A1 (p.Asp270Val 84 , 85 и p.Arg371Trp 56 ) в африканских популяциях; прогнозируемая частота носителей патогенного генотипа SLC40A1 этих двух вариантов составляет 1: 197 среди африканского населения. 103 Q248H, 101 , 102 стр.Asp270Val, p.Arg371Trp и другие полиморфные варианты FPN1 84 также могут предрасполагать к перегрузке железом; но не было предоставлено четких доказательств этого (например, отсутствие функциональных исследований), хотя остается возможность, что из-за небольшого размера выборки эти наблюдения могут быть отнесены к случайности или что выявленные полиморфизмы могут быть связаны неравновесием с другим заболеванием. -вызывающие локусы. Тем не менее, вместе взятые, собранные данные делают FPN1 геном, наиболее часто связанным с наследственной гиперферритинемией у африканцев.
Клинические проявления и диагностика
Как уже говорилось, FD вызывается мутациями потери функции в FPN1. Эти мутации нарушают экспорт железа, особенно из ретикулоэндотелиальных макрофагов. В результате происходит накопление железа в макрофагах селезенки, печени и костей (что отражается высокими уровнями SF) (). При гистологии печени паренхиматозные клетки этих органов в значительной степени сохранены (), но также заметны дискретные отложения железа в гепатоцитах из-за дефектной активности FPN1 в гепатоцитах даже на ранних стадиях. 16 Клинические проявления неоднородны, но в целом выраженность более мягкая, чем у классического HC, и связанное с ним заболевание печени обычно не такое тяжелое (и). 1 , 16 , 17 , 56 То же, что и при классических формах HFE HC, а также в факторах хозяина FD (менструации, кровопотеря и т. Д.), Совместное наследование мутаций другого железа -гены или варианты генов, связанных с антиоксидантной защитой и фиброзом органов, и связанные с ними патологические состояния (метаболический синдром, вирусный гепатит и т. д.)) могут влиять на фенотип. Гипохромная анемия не редкость у молодых менструирующих женщин.
Различные стадии и исходы «удержания железа» при болезни Ферропортина по сравнению с «накоплением железа» при FPN1-ассоциированном гемохроматозе (HC). Изображения гистологии печени воспроизведены с разрешения Sabelli et al . 54
Из-за слабой клинической выразительности, описанной в литературе, были высказаны сомнения относительно пенетрантности генетического дефекта и обоснования для терапии по удалению железа.Однако в опубликованных отчетах имеется ограниченная и обычно не детальная клиническая информация; это, а также отсутствие проспективных исследований по-прежнему мешают нашему пониманию реального клинического воздействия заболевания. В единственном опубликованном отчете за 6 членами родословной, в которой впервые был описан FD, 16 наблюдали в течение 11–24 лет. 104 Пробанд в возрасте 83 лет, перенесший скрытую инфекцию HBV с 56 лет, после прекращения 20-летней программы флеботомии заболел раком печени без цирроза; У 2 братьев и сестер, которые также прервали лечение, отмечалось прогрессирование фиброза.Эти клинические данные, хотя и представляют интерес, не позволяют сделать определенные выводы о патогенетической связи между накоплением железа при ФД и повреждением и заболеванием печени.
Отличительной чертой классического ФД является накопление железа в ячейках Купфера (). Клетки Купфера жизненно важны для производства фиброгенных медиаторов, иммунологического надзора за опухолью и удаления трансформированных гепатоцитов. 105 Избирательная и массивная перегрузка железом может нарушить эти активности и способствовать фиброгенезу и канцерогенезу.Более того, как обсуждалось выше, накопление железа в гепатоцитах также имеет место при FD, хотя и в гораздо меньшей степени, чем в HFE- и non-HFE HC, и установленная прооксидантная повреждающая активность железа в паренхимных клетках также может способствовать прогрессированию заболевания. .
В отличие от HFE-HC, тип наследования FD аутосомно-доминантный. Следовательно, любой из родителей является носителем патогенной мутации FPN1 и имеет необъяснимую гиперферритинемию. Кроме того, у пробанда 50% -ный риск заболеть больным ребенком.Заболевание следует заподозрить у любого человека с необъяснимой гиперферритинемией и низко-нормальным насыщением трансферрина (TS) или сидерозом непаренхимальных клеток при биопсии печени или накоплении железа в печени и селезенке при МРТ ().
Таблица 4.
Подозрение и диагностика болезни Ферропортина.
Гиперферритинемия при ФБ возникает в очень раннем возрасте, и необъяснимая гиперферритинемия с нормальным ТС у ребенка должна побудить МРТ оценить накопление железа в печени, селезенке и костном мозге 106 (см. Ниже).
показывает предложенный алгоритм диагностики FD. Если гиперферритинемия ассоциируется с высоким TS (что подтверждено по крайней мере двумя последовательными определениями), но при отсутствии анемии, типичная картина HFE- и не HFE-HC (включая FPN1-ассоциированный HC из-за мутаций FPN1, вызванных усилением функции) исключается априори . Если гиперферритинемия ассоциируется с высоким TS и анемией, типичной картиной наследственной гемоглобинопатии и дефектами эритроцитов или атрансферринемией, FD снова исключается ().
Алгоритм диагностики болезни Ферропортина и наследственной гиперферритинемии. ACD / AI: анемия хронического заболевания / анемия воспаления. * Болезнь Гоше может проявляться как с сидерозом, так и без него, в зависимости от стадии заболевания. ** Расширенный ACD / AI может также проявляться сидерозом на МРТ (обычно селезенки и костного мозга).
Напротив, у субъектов с повышенным уровнем сывороточного ферритина и низким или нормальным TS обследование должно быть сосредоточено на общих причинах вторичной гиперферритинемии и других редких причинах наследственной гиперферритинемии для подтверждения диагноза FD ().Во-первых, следует рассмотреть общие причины гиперферритинемии, такие как нарушение обмена веществ, воспаление, рак и т. Д. Если они не обнаружены или гиперферритинемия сохраняется после лечения, следующий шаг зависит от наличия анемии. При отсутствии явной анемии, если содержание железа в печени и селезенке повышается на МРТ или биопсия печени показывает значительную нагрузку железом в клетках Купфера, следует рассмотреть возможность заболевания ФД и провести генетическое тестирование для подтверждения диагноза ().Другой частой причиной наследственной гиперферритинемии с нормальной TS, связанной с накоплением железа и анемией, является болезнь Гоше, обычно связанная с гепатоспленомегалией, цитопенией, аномальной коагуляцией, заболеванием костей и невропатическими проявлениями. 107
При отсутствии накопления железа в организме, но при наличии повышенных уровней SF и нормального TS, аутосомно-доминантная гиперферритинемия с катарактой (из-за мутаций чувствительного к железу элемента в 5′-нетранслируемой области L мРНК ферритина 108 ) или без катаракты, следует учитывать 109 .Если присутствует явная анемия, но TS нормальный / низкий, следует заподозрить ацерулоплазминемию, редкое аутосомно-рецессивное заболевание из-за мутаций потери функции церулоплазмина (CP), приводящее к перегрузке железом в печени и поджелудочной железе и прогрессирующей нейродегенерации, диабету. и дегенерация сетчатки. 110
МРТ головного мозга с типичным накоплением железа в базальных ганглиях и таламусе может помочь подтвердить диагноз. Как упоминалось выше, другим редким генетическим заболеванием, проявляющимся гиперферритинемией и анемией, является атрансферринемия / гипотрансферринемия 111 , которое, однако, характеризуется повышенным насыщением трансферрина из-за чрезвычайно низкого уровня трансферрина в сыворотке.
Дифференциальная диагностика в основном включает классические (HFE) и неклассические (TfR2, HAMP, HJV и FPN1) формы HH, все из которых характеризуются ранним и прогрессивным увеличением TS с последующим повышением сывороточного ферритина по мере увеличения накопления железа в паренхиматозных клетках печень, поджелудочная железа, сердце и другие органы (). Как уже говорилось, в отличие от HH, у FD клиническая выраженность мягче.
МРТ брюшной полости — полезный неинвазивный инструмент для классификации и диагностики заболевания, поскольку он может дифференцировать пациентов с ФД, характеризующимися задержкой железа в триаде SSL (селезенка, позвоночник, печень) (), от всех других форм ГГ, включая FPN1-HC, связанный с перегрузкой железа в печени, но с нормальным содержанием железа в селезенке и костном мозге (). 112
Картина абдоминальной магнитно-резонансной томографии (МРТ) болезни Ферропортина (ФД). МРТ. Т2 * -взвешенные последовательности градиентного эха использовали для обнаружения накопления железа. (A) Нормальный предмет. (B) FD. (C) FD после завершения программы флеботомии (обратите внимание, что избыток железа все еще обнаруживается в печени и позвоночнике, несмотря на нормальные уровни ферритина и насыщения трансферрина в сыворотке). (D) Ферропортин-ассоциированный наследственный гемохроматоз: накопление железа затрагивает только печень и сохраняет селезенку и позвоночник (стрелки).
Лечение
Венесекция является краеугольным камнем терапии также при БФ, но она может не переноситься одинаково у всех пациентов, и низкий TS с анемией может быть быстро установлен, несмотря на то, что SF все еще повышается. 1 Перегрузка макрофагами железом очень устойчива к отмене железа при этом заболевании, даже у пациентов, которые, по-видимому, хорошо лечились (). Следовательно, в отличие от HH, во время терапии следует тщательно контролировать не только сывороточный ферритин, но особенно TS. Кроме того, терапия не должна быть направлена на достижение обычных целей HH для истощения запасов железа (TS ниже 20%, SF 50 нг / л или легкая анемия), а должна быть более консервативной.Нет исследований по оптимальному графику флеботомии при FD. С практической точки зрения, сеанс флеботомии ежемесячно / раз в два месяца в течение 1-2 лет, в зависимости от основной мутации, позволяет достичь приемлемого состояния истощения запасов железа, в то время как поддерживающая терапия (обычно сеанс флеботомии каждые 4-6 месяцев) должен продолжаться на всю жизнь. Разумной целью для терапии является уровень SF 100–200 нг / мл. В некоторых случаях такие значения Ft могут по-прежнему отражать некоторую загрузку железом тканевых макрофагов (), но связанный с этим клинический риск незначителен.В идеале оптимальной целью является самый низкий приемлемый уровень ферритина для TS и уровни гемоглобина не ниже нижнего предела нормы. (Спорные) диетические ограничения, которые иногда рекомендуются пациентам с ГГ (избегание витамина С или продуктов, богатых железом или обогащенных), не применяются к ФД из-за другой патогенной основы по сравнению с ГГ: нормальное / достаточное всасывание железа энтероцитами и нормальное / незначительное увеличенное накопление железа в паренхиматозных клетках в FD по сравнению с увеличило абсорбцию железа и заметное накопление железа в паренхимных клетках в HH.
Хелатирование железа может быть вариантом в отдельных случаях. 79
Братья и сестры пациентов с ФД, как и их потомки, должны пройти скрининг, поскольку у них 50% вероятность быть восприимчивыми.
Болезнь ферропортина: патогенез, диагностика и лечение
Резюме
Болезнь ферропортина (ФБ) — аутосомно-доминантное наследственное заболевание, связанное с загрузкой железа, связанное с гетерозиготными мутациями гена ферропортина-1 ( FPN ).Он представляет собой одну из самых распространенных причин генетической гиперферритинемии, независимо от этнической принадлежности. FPN1 переносит железо из кишечника, макрофагов и плаценты в кровоток. При FD мутации FPN1 с потерей функции ограничивают, но не нарушают экспорт железа в энтероцитах, но они серьезно влияют на перенос железа в макрофагах. Это приводит к прогрессивному и предпочтительному захвату железа в тканевых макрофагах, снижению выделения железа в сывороточный трансферрин (то есть к несоответствующему низкому насыщению трансферрина) и тенденции к анемии при менархе или после интенсивного кровопускания.Отличительным признаком ФД является заметное накопление железа в клетках Купфера печени. Во всем мире зарегистрированы многочисленные мутации, связанные с FD, некоторые из которых встречаются в разных популяциях, а о некоторых чаще сообщается (например, Val192del, A77D и G80S). Полиморфизмы FPN1 также представляют собой варианты генов, наиболее часто ответственные за гиперферритинемию у африканцев. Дифференциальный диагноз включает в основном наследственный гемохроматоз, синдром, обычно вызываемый HFE или TfR2 , HJV , HAMP и, в редких случаях, FPN1 .Здесь, в отличие от FD, гиперферритинемия ассоциируется с высоким насыщением трансферрина, железосохраняющими макрофагами и прогрессирующей нагрузкой железа в паренхиматозных клетках. Магнитно-резонансная томография (МРТ) брюшной полости, ключевой неинвазивный диагностический инструмент для диагностики FD, показывает характерную триаду SSL нагрузки железом (селезенка, позвоночник и печень). Рекомендуется неагрессивный режим флеботомии с тщательным мониторингом насыщения трансферрина и гемоглобина из-за риска анемии. Семейный скрининг является обязательным, поскольку у братьев и сестер и потомства есть 50% -ный шанс быть носителем патогенной мутации.
Введение
Название ферропортиновая болезнь (FD) относится к клинической картине, которая отличается от всех других известных форм наследственной перегрузки железом, включая гемохроматоз (HC) [синоним наследственного гемохроматоза (HH)], т.е. HFE или не мутации гена гемохроматоза HFE . 1 У людей ряд генетических нарушений связан с системной перегрузкой железом (), в то время как другие вызваны неправильным распределением железа и связаны с региональным накоплением железа в субклеточных компартментах (например,грамм. митохондрии при атаксии Фридрейха) или определенные типы клеток и органы (например, базальные ганглии при нейроферритинопатии) (). Строго говоря, не все последние расстройства можно квалифицировать как истинные состояния перегрузки железом, поскольку общее содержание железа в организме не может быть увеличено. ФД, которая сегодня является одной из самых распространенных форм наследственного расстройства, вызванного перегрузкой железом, помимо HFE-гемохроматоза, характеризуется уникальной патогенетической базой и клиническими проявлениями и, в отличие от HC, регистрируется во всем мире, независимо от этнической принадлежности.
Таблица 1.
Наследственные заболевания человека, связанные с перегрузкой железом и неправильным его распределением.
Болезнь ферропортина (фенотип MIM-номер 606069, ген / локус; MIM-номер 604653; https://www.omim.org/entry/606069?search=ferroportin%20disease&highlight=ferroportin%20disease) возникает из-за патогенных (обычно бессмысленных) мутации гена ферропортина1 ( FPN1 ; SLC40A1 ), который кодирует единственный до сих пор идентифицированный экспортер железа у млекопитающих; 2 — 4 мутации отсутствия функции ухудшают способность FPN1 экспортировать железо, особенно в клетках с высоким оборотом железа, таких как тканевые макрофаги.В отличие от мутаций, вызывающих FD, другие редкие мутации FPN1 (такие как N144H, C326Y, C326S и C326F), 5 — 8 не нарушают экспрессию белка на клеточной мембране или его способность экспортировать железо, но делают FPN1 устойчивы к ингибирующему эффекту гепсидина, физиологического ингибитора FPN1 (см. ниже в разделе «Патогенез»). Это вызывает неконтролируемую активность FPN1 по экспорту железа; возникающее в результате клиническое заболевание отличается от FD и неотличимо от других форм наследственной HC (и).
Таблица 2.
Основные признаки болезни Ферропортина и других наследственных нарушений, связанных с перегрузкой железом, у человека.
Определение и классификация
База данных OMIM классифицирует две формы наследственной перегрузки железом из-за мутаций FPN1 в той же таксономической категории, как «гемохроматоз 4 типа» (https://www.omim.org/entry/606069?search= ферропортин% 20 заболевание и выделение = ферропортин% 20 заболевание). Сходная терминология была затем принята Orphanet с включением двух подкатегорий: гемохроматоз типа 4A (относится к классическому FD из-за мутации FPN1 с отсутствием функции) и гемохроматоз типа 4B (относится к FD из-за мутаций FPN1 с усилением функции. ) (http: // www.orpha.net/consor/cgibin/OC_Exp.php?Lng=EN&Expert=139491). Эти классификации были включены в недавние публикации с некоторыми вариантами. 9 , 10 Наименования и классификация болезней (таксономия) может варьироваться в зависимости от различных критериев, таких как патогенные гены, механизмы, клинические проявления и т. Д. В идеале таксономия (и названия) болезней также должна помогать клиницистам распознавать, диагностировать и лечить болезни. В этом контексте таксономия, принятая OMIM и Orphanet, охватывающая два патогенетически и клинически разных расстройства, вызванных мутациями в одном и том же гене под термином «гемохроматоз», может не достичь этих целей.За последние десятилетия термин гемохроматоз непоследовательно использовался в литературе и в клинической практике для неточного обозначения: i) любой формы перегрузки организма железом; ii) перегрузка тканями железом, вызывающая повреждение органов и заболевание; iii) генетически обусловленная перегрузка железом; и, недавно, iv) перегрузка железом, связанная с HFE. 11 Недавние открытия в этой области показали, что, независимо от лежащего в основе генетического дефекта, ряд наследственных нарушений нагрузки железом (т.е. вызванные мутациями потери функции HFE, TfR2, HJV, HAMP и мутациями увеличения функции FPN1) принадлежат к одному и тому же синдромному объекту, поскольку они разделяют патогенетическую основу (отсутствие функции-активности гепсидина), биохимическая экспрессия (высокое насыщение трансферрина и высокий уровень ферритина в сыворотке), особенности патологии печени (накопление железа в паренхимных клетках с железосохраненными клетками Купфера до поздней стадии), повреждение и заболевание отдельных органов-мишеней (печень, сердце, эндокринные железы, суставы) и терапевтический подход с оптимальным ответом на флеботомию. 11 Как описано в следующих разделах, каждая отдельная функция, описанная выше, отличается в классическом FD. 1 Таким образом, использование термина «гемохроматоз» для классической FD или термина «болезнь ферропортина» для FPN1-ассоциированного HC вводит в заблуждение, особенно для клиницистов, поскольку клинические подозрения, диагностическая стратегия и лечение сильно различаются. Основываясь на этих соображениях и на нашем нынешнем понимании патогенеза и клинических проявлений этих расстройств, предлагается, чтобы расстройство, вызванное мутациями отсутствия функции FPN1, было названо «болезнью ферропортина», как первоначально было описано, 1 , , и нарушение, вызванное мутациями FPN1, связанными с усилением функции, называется «гемохроматоз, ассоциированный с FPN-1» ().Вместо этого, по аналогии с другими классификациями, связанными с белками (например, ферритинопатии; гемоглобинопатии), оба нарушения, вызванные мутациями отсутствия и увеличения функции FPN1, вполне могут быть включены в более широкую таксономическую категорию под названием «ферропортинопатии».
Исторические аспекты
В 1996 году был идентифицирован ген гемохроматоза HFE, чья гомозиготная мутация C282Y является причиной большинства случаев HH у кавказцев. 12 Вскоре стало очевидно, что не все наследственные нарушения, связанные с перегрузкой железом, можно объяснить мутациями HFE , особенно в Южной Европе, где процветал активный поиск других генов, связанных с генетической перегрузкой железом.С 2000 по 2004 год все известные гены, отличные от HFE , ассоциированные на данный момент с HC, а именно рецептор трансферрина 2 ( TfR2 ), 13 FPN1 , 5 гепсидин ( HAMP ), 14 и гемоювелин ( HJV ) 15 .
Несколькими годами ранее, в 1999 году, в большой семье с наследственной перегрузкой железом из Италии был зарегистрирован отчетливый и несколько необычный фенотип.Селективная загрузка макрофагов печени железом, гиперферритинемия, сосуществующая с насыщением трансферрина в норме и низким, и склонность к анемии после интенсивной флеботомии были отличительными признаками заболевания. 16 В 2001 году сообщалось, что все пораженные члены семьи были гетерозиготными по c. 230 C → Замена, приводящая к замене аланина 77 на аспартат в FPN1. 17 Это предприятие впоследствии было переименовано в FD. 1
С другой стороны, HC, связанный с FPN1, из-за мутации FPN1 с усилением функции (стр.N144H), о котором впервые сообщили Njajou и др. . in 2001. 5 Тем не менее, стоит упомянуть, что первое клиническое описание «аутосомно-доминантной» формы классической HC уже было сообщено Eason et al . в меланезийском родстве в 1990 году. 18 В этой же популяции Arden et al . 19 позже связали фенотип HC с мутацией FPN1, вызванной усилением функции NI44T.
Биология и физиология ферропортина и FD
FPN1, продукт гена FPN1 ( SLC40A1 ), переносит железо из внешней среды (т.е.е. материнская кровь или просвет кишечника), а также из внутренних мест хранения железа и рециркулирует его в кровоток. Фактически, он высоко экспрессируется в макрофагах печени и селезенки, просвете энтероцитов и синцитиотрофобластов плаценты. 2 — 4
FPN1 регулируется на разных уровнях рядом факторов, в том числе транскрипционно гемом, 20 трансляционно железо-регуляторными белками (IRP), 21 и посттрансляционно главным образом гепсидином, гормоном железа.Гепсидин вырабатывается печенью в ответ на железо, воспаление и различные факторы стресса. 22 — 25 Гепсидин связывается с внеклеточной петлей FPN1 и запускает его убиквитинилирование на остатках лизина, расположенных во внутриклеточном домене, что приводит к интернализации и деградации в лизосомах. 26 — 28 Этот механизм позволяет точно регулировать отток железа из энтероцитов и макрофагов в кровоток, когда требуется больше железа во время активного эритропоэза (в этом случае синтез гепсидина подавляется эритроидными сигналами) или железо в крови должно контролироваться из-за пролиферации / роста патогенов или начинающейся перегрузки железом (здесь синтез гепсидина индуцируется медиаторами воспаления или железа, соответственно) (обзор Drakesmith, Nemeth и Ganz 29 ).
Топология FPN1 и организация мембраны уже давно рассматриваются с противоречивыми результатами, касающимися локализации N- и C-терминальных конечностей и количества трансмембранных сегментов. 30 — 39 Недавно была предсказана открытая внутрь конформация переносчика, 34 , 37 с кластером остатков, лежащих в центральном ядре белка, важного для движения железа и согласуется с сайтом связывания железа 37 и остатками, участвующими в связывании гепсидина, полностью доступными в модели, открытой наружу. 37 Форма, открытая внутрь, может представлять состояние покоя белка, а состояние открытого наружу — как конформацию, достижимую только в присутствии внутриклеточного железа, то есть когда FPN1 перемещается между двумя конформациями (). Избирательное связывание гепсидина с обращенной наружу конформацией должно, следовательно, гарантировать, что деградация FPN1 может происходить только тогда, когда внутриклеточное железо в изобилии 37 и активно прокачивается через канал 38 ().Недавно кристаллические структуры бактериального гомолога FPN1, BbFPN, были разрешены как во внешнем, так и во внутреннем состояниях, и была разработана модель гомологии с FPN1 человека. 39 Согласно Au, FPN1 имеет 12 TM-спиралей, как было предсказано ранее, 32 и разделен на две половины, одна из которых формирует долю N, а другая — долю C, соединенную длинной цитозольной петлей. с центральной полостью между долями, открытой с внеклеточной стороны и недоступной с внутриклеточной стороны ().FPN1 претерпевает внутридоменную конформационную перестройку во время транспортного цикла. Когда гепсидин проникает в центральную полость между долями N и C и взаимодействует с сайтом связывания гепсидина, расположенным в доле C, он вызывает два эффекта: а) увеличивает доступность внутриклеточных петель, которые содержат сайты убиквитинирования, для убиквитина. лигазы; и б) он останавливает конформационный переход FPN1 из обращенного наружу состояния в обращенное внутрь состояние, ингибируя доступ железа из цитоплазмы к сайту связывания субстрата внутри внутриклеточных ворот (). 39
Биология ферропортина и постулируемая патобиология болезни ферропортина (FD). (A) Структурно-функциональная взаимосвязь активности ферропортина с экспортом железа. 39 (B) Предполагаемые механизмы связывания гепсидина с FPN и его деградации. 39 (C) Постулируемая основа для FD. (Верхняя панель) В клетках, подвергающихся относительно низкому притоку железа, таких как энтероциты, продукт аллеля FPN дикого типа способен достигать плазматической мембраны и экспортировать железо.Для ясности, мутировавший FPN1 не был изображен на поверхности клетки: на основе предыдущей работы in vitro было высказано предположение, что некоторые мутантные FPN1 все еще могут достигать клеточной поверхности и сохранять некоторую способность к транспорту железа, но это все еще спорно. (Нижняя панель) В клетках с высоким оборотом железа, таких как макрофаги, повышенные запросы на экспорт железа предъявляют высокие требования к трафику FPN, что приводит к « пробке » в компартментах эндоцитоза / плазмамембраны и деградации и неадекватно низкому нацеливанию продуктов аллелей дикого типа к клеточной мембране. 54 (D) Предполагаемый эффект мутаций FPN, которые влияют на формирование внутриклеточных ворот и доступ к сайту связывания железа. 39
Молекулярный патогенез
Общая патофизиологическая основа FD четко определена и основана на нарушенном экспорте железа из места хранения / рециркуляции железа (особенно макрофагов) в кровоток. показывает основной дефект транспорта железа в FD в отличие от FPN1-ассоциированных HC.В последних случаях, как обсуждалось выше, мутации, которые влияют на сайт связывания гепсидина и / или убиквитинирование FPN1, приводят к снижению «чувствительности» FPN к гепсидину, что приводит к фенотипу HC, связанному с FPN1. Это было хорошо проиллюстрировано информативной мышиной моделью, соответствующей мутации сайта связывания гепсидина. 40
Основа аномального переноса железа в кровоток при болезни Ферропортина в отличие от наследственного гемохроматоза, связанного с ФПН.
Несмотря на эти достижения, молекулярный патогенез FD долгое время оставался неуловимым. В ряде исследований in vitro , в основном с использованием сверхэкспрессированного экзогенного FPN1 дикого типа и мутанта FPN1 в различных клеточных линиях, изучались биология и функция FPN1, а также влияние различных мутантов FPN1 на трафик белков и способность к переносу железа. хотя и с противоречивыми результатами, в зависимости от используемой клеточной линии или методологии. 30 — 32 , 34 , 35 , 38 , 41 — 47
В этом контексте активно обсуждается вопрос о том, объясняет ли гапло-недостаточность FPN1 FD или заболевание возникает в результате доминантно-негативного воздействия.Утверждалось, что если гапло-недостаточность была объяснением FD, то бессмысленные мутации также должны приводить к расстройству; однако до сих пор подавляющее большинство зарегистрированных мутаций в FD являются миссенс-мутациями. 48 Кроме того, целенаправленная делеция гена в гене мышиного Fpn1 имеет небольшой эффект у гетерозиготных животных, 49 , тогда как мышь flatiron (ffe) с миссенс-мутацией в Fpn1, которая влияет на ее локализацию и активность экспорта железа. при сверхэкспрессии in vitro имеют фенотип, сходный с фенотипом пациентов-людей. 50 В исследованиях с использованием экзогенного меченого белка in vitro , Fpn1 образует мультимеры, а мутантный Fpn1 предотвращает локализацию Fpn1 дикого типа на клеточной мембране. 33 , 42 , 50 Мультимерный белок за счет доминантно-негативного эффекта лучше объяснил бы аутосомно-доминантный признак FD. Однако другие исследования из разных групп предоставили экспериментальные доказательства в поддержку противоположного вывода и показали, что Fpn1 является мономером в культивируемых клетках 35 , 51 , 52 и in vivo . 53 Совсем недавно Sabelli et al. ., 54 , используя впервые культивированные макрофаги от пациентов с БФ, обнаружили, что эндогенный FPN1 обнаруживает локализацию, аналогичную локализации в донорских макрофагах, за исключением большего накопления. в лизосомах, что указывает на более высокую скорость деградации мутантного FPN1. Неожиданно и вопреки предыдущим исследованиям с использованием сверхэкспрессируемого мутантного белка в клеточных линиях, FPN1 в макрофагах FD циркулирует в раннем эндоцитарном компартменте, не мультимеризуется, он достигает плазматической мембраны, является компетентным в отношении транспорта железа (хотя и в меньшей степени, чем нормальные макрофаги), быстро интернализируется и разрушается при воздействии гепсидина.Однако, когда макрофаги FD подвергаются воздействию больших количеств гемового железа, в отличие от макрофагов-доноров, FPN1 больше не может достигать клеточной поверхности, что приводит к заметной задержке внутриклеточного железа. На основе этих наблюдений была предложена модель FD, в которой мономеры FPN1, несмотря на то, что половина белков мутированы, все еще могут достигать клеточной поверхности и экспортировать железо в клетки, которые подвергаются воздействию in vivo относительно низкого уровня. поток железа, например энтероцитов (). 54 Напротив, в клетках, подвергающихся высокому обмену железа in vivo , таких как тканевые макрофаги, достаточное количество FPN1 не может достигать плазматической мембраны, возможно, из-за «пробки» в процессе деградации и / или эндоцитоза. велосипедные дорожки.Эта модель согласуется с клиническим проявлением FD, характеризующимся ранним накоплением железа в клетках Купфера печени и нормальным насыщением трансферрина, что указывает на то, что активность мутантного FPN1 не ограничивает перенос железа в кишечнике; последний становится критически низким у молодых женщин во время менархе или после агрессивной флеботомии, когда высокие потребности в железе для эритропоэза, вероятно, вызывают повышенный трафик / цикличность FPN1 в тканевых макрофагах. 1 , 16 , 17 (см. Ниже в разделе «Клинические проявления, диагностика и лечение»).В этом исследовании не рассматривался вопрос о том, достигает ли мутантный FPN1 или только FPN1 дикого типа плазматической мембраны и является ли мутантный FPN1 транспортным. Предыдущие исследования не дали окончательных результатов. Во всех исследованиях было обнаружено, что экзогенно экспрессируемые мутанты p.A77D и p.Val162del FPN1 не способны переносить железо, но в некоторых случаях способны достигать клеточной мембраны, 34 , 35 , 38 , 41 , 43 и не в других. 30 , 31 Стр.Мутант G80S FPN1 был локализован на поверхности клетки в двух опубликованных исследованиях, 43 , 55 , и обнаружил, что транспорт железа компетентен в одном 55 и некомпетентен в другом. 43
Согласно Taniguchi et al. ., 39 сайты мутаций, связанные с FD, в основном картируются на междолевом интерфейсе, в основном на внутриклеточной стороне, и образуют внутриклеточные ворота.Эти мутации д., Следовательно, дестабилизируют междольные взаимодействия, тем самым влияя на стабильное формирование внутриклеточных ворот и снижая активность транспорта железа FPN1 (). Возможно, что разные мутанты по-разному влияют на способность FPN1 к транспорту железа; в то время как это может быть лучше преодолено нормальным аллельным продуктом в клетках с низким оборотом железа, таких как энтероциты или гепатоциты, это может быть еще больше затруднено в таких клетках, как макрофаги, где дополнительная «пробка» в компартменте эндоцитоз-плазмамембраны усугубит основной дефект. (см. выше).
Генетика и эпидемиология
Список опубликованных мутаций, связанных с FD и FPN1-зависимым HC, представлен в. 5 — 8 , 17 , 43 , 56 — 102 К настоящему времени были идентифицированы многочисленные мутации гена FPN1 у пробандов с классическим фенотипом FD франко-канадского, Меланезийское, тайское, японское и европейское наследие.
Таблица 3.
Болезненные мутации гена FPN1.
Несколько общих мутаций FPN1 были зарегистрированы в независимых родословных в разных странах (например, Val192del; 56 , 60 , 72 — 79 , 92 A77D, 17 , 59 , 60 G80S. 43 , 55 , 56 , 61 — 63 Сейчас считается, что наиболее часто встречающиеся мутации FPN1, такие как p.Val162del, являются выявляются чаще, чем другие мутации SLC40A1, потому что они встречались несколько раз в изолированных популяциях, а не возникали один раз и распространялись на разные популяции, на что указывает идентификация de novo p.Вариант Val162del в единичном случае ФД. 79
Варианты FPN1 широко распространены в африканских популяциях. Первым распространенным вариантом FPN1, зарегистрированным у африканцев и чернокожих американцев, был общий полиморфизм Q248H (p.Gln248His). 82 , 83 , 100 — 102 Интересно, что глобальный анализ вариантов в гене SLC40A1 (который включает мутации, связанные как с FD, так и с FPN1-ассоциированным HH) выявил частоту аллелей 0.0364%, что дает прогнозируемую частоту носительства патогенного генотипа 1 из 1373, цифру, которая приближается к частоте HFE-HC. 103 Это было в значительной степени связано с относительно высокими частотами аллелей для двух вариантов SLC40A1 (p.Asp270Val 84 , 85 и p.Arg371Trp 56 ) в африканских популяциях; прогнозируемая частота носителей патогенного генотипа SLC40A1 этих двух вариантов составляет 1: 197 среди африканского населения. 103 Q248H, 101 , 102 стр.Asp270Val, p.Arg371Trp и другие полиморфные варианты FPN1 84 также могут предрасполагать к перегрузке железом; но не было предоставлено четких доказательств этого (например, отсутствие функциональных исследований), хотя остается возможность, что из-за небольшого размера выборки эти наблюдения могут быть отнесены к случайности или что выявленные полиморфизмы могут быть связаны неравновесием с другим заболеванием. -вызывающие локусы. Тем не менее, вместе взятые, собранные данные делают FPN1 геном, наиболее часто связанным с наследственной гиперферритинемией у африканцев.
Клинические проявления и диагностика
Как уже говорилось, FD вызывается мутациями потери функции в FPN1. Эти мутации нарушают экспорт железа, особенно из ретикулоэндотелиальных макрофагов. В результате происходит накопление железа в макрофагах селезенки, печени и костей (что отражается высокими уровнями SF) (). При гистологии печени паренхиматозные клетки этих органов в значительной степени сохранены (), но также заметны дискретные отложения железа в гепатоцитах из-за дефектной активности FPN1 в гепатоцитах даже на ранних стадиях. 16 Клинические проявления неоднородны, но в целом выраженность более мягкая, чем у классического HC, и связанное с ним заболевание печени обычно не такое тяжелое (и). 1 , 16 , 17 , 56 То же, что и при классических формах HFE HC, а также в факторах хозяина FD (менструации, кровопотеря и т. Д.), Совместное наследование мутаций другого железа -гены или варианты генов, связанных с антиоксидантной защитой и фиброзом органов, и связанные с ними патологические состояния (метаболический синдром, вирусный гепатит и т. д.)) могут влиять на фенотип. Гипохромная анемия не редкость у молодых менструирующих женщин.
Различные стадии и исходы «удержания железа» при болезни Ферропортина по сравнению с «накоплением железа» при FPN1-ассоциированном гемохроматозе (HC). Изображения гистологии печени воспроизведены с разрешения Sabelli et al . 54
Из-за слабой клинической выразительности, описанной в литературе, были высказаны сомнения относительно пенетрантности генетического дефекта и обоснования для терапии по удалению железа.Однако в опубликованных отчетах имеется ограниченная и обычно не детальная клиническая информация; это, а также отсутствие проспективных исследований по-прежнему мешают нашему пониманию реального клинического воздействия заболевания. В единственном опубликованном отчете за 6 членами родословной, в которой впервые был описан FD, 16 наблюдали в течение 11–24 лет. 104 Пробанд в возрасте 83 лет, перенесший скрытую инфекцию HBV с 56 лет, после прекращения 20-летней программы флеботомии заболел раком печени без цирроза; У 2 братьев и сестер, которые также прервали лечение, отмечалось прогрессирование фиброза.Эти клинические данные, хотя и представляют интерес, не позволяют сделать определенные выводы о патогенетической связи между накоплением железа при ФД и повреждением и заболеванием печени.
Отличительной чертой классического ФД является накопление железа в ячейках Купфера (). Клетки Купфера жизненно важны для производства фиброгенных медиаторов, иммунологического надзора за опухолью и удаления трансформированных гепатоцитов. 105 Избирательная и массивная перегрузка железом может нарушить эти активности и способствовать фиброгенезу и канцерогенезу.Более того, как обсуждалось выше, накопление железа в гепатоцитах также имеет место при FD, хотя и в гораздо меньшей степени, чем в HFE- и non-HFE HC, и установленная прооксидантная повреждающая активность железа в паренхимных клетках также может способствовать прогрессированию заболевания. .
В отличие от HFE-HC, тип наследования FD аутосомно-доминантный. Следовательно, любой из родителей является носителем патогенной мутации FPN1 и имеет необъяснимую гиперферритинемию. Кроме того, у пробанда 50% -ный риск заболеть больным ребенком.Заболевание следует заподозрить у любого человека с необъяснимой гиперферритинемией и низко-нормальным насыщением трансферрина (TS) или сидерозом непаренхимальных клеток при биопсии печени или накоплении железа в печени и селезенке при МРТ ().
Таблица 4.
Подозрение и диагностика болезни Ферропортина.
Гиперферритинемия при ФБ возникает в очень раннем возрасте, и необъяснимая гиперферритинемия с нормальным ТС у ребенка должна побудить МРТ оценить накопление железа в печени, селезенке и костном мозге 106 (см. Ниже).
показывает предложенный алгоритм диагностики FD. Если гиперферритинемия ассоциируется с высоким TS (что подтверждено по крайней мере двумя последовательными определениями), но при отсутствии анемии, типичная картина HFE- и не HFE-HC (включая FPN1-ассоциированный HC из-за мутаций FPN1, вызванных усилением функции) исключается априори . Если гиперферритинемия ассоциируется с высоким TS и анемией, типичной картиной наследственной гемоглобинопатии и дефектами эритроцитов или атрансферринемией, FD снова исключается ().
Алгоритм диагностики болезни Ферропортина и наследственной гиперферритинемии. ACD / AI: анемия хронического заболевания / анемия воспаления. * Болезнь Гоше может проявляться как с сидерозом, так и без него, в зависимости от стадии заболевания. ** Расширенный ACD / AI может также проявляться сидерозом на МРТ (обычно селезенки и костного мозга).
Напротив, у субъектов с повышенным уровнем сывороточного ферритина и низким или нормальным TS обследование должно быть сосредоточено на общих причинах вторичной гиперферритинемии и других редких причинах наследственной гиперферритинемии для подтверждения диагноза FD ().Во-первых, следует рассмотреть общие причины гиперферритинемии, такие как нарушение обмена веществ, воспаление, рак и т. Д. Если они не обнаружены или гиперферритинемия сохраняется после лечения, следующий шаг зависит от наличия анемии. При отсутствии явной анемии, если содержание железа в печени и селезенке повышается на МРТ или биопсия печени показывает значительную нагрузку железом в клетках Купфера, следует рассмотреть возможность заболевания ФД и провести генетическое тестирование для подтверждения диагноза ().Другой частой причиной наследственной гиперферритинемии с нормальной TS, связанной с накоплением железа и анемией, является болезнь Гоше, обычно связанная с гепатоспленомегалией, цитопенией, аномальной коагуляцией, заболеванием костей и невропатическими проявлениями. 107
При отсутствии накопления железа в организме, но при наличии повышенных уровней SF и нормального TS, аутосомно-доминантная гиперферритинемия с катарактой (из-за мутаций чувствительного к железу элемента в 5′-нетранслируемой области L мРНК ферритина 108 ) или без катаракты, следует учитывать 109 .Если присутствует явная анемия, но TS нормальный / низкий, следует заподозрить ацерулоплазминемию, редкое аутосомно-рецессивное заболевание из-за мутаций потери функции церулоплазмина (CP), приводящее к перегрузке железом в печени и поджелудочной железе и прогрессирующей нейродегенерации, диабету. и дегенерация сетчатки. 110
МРТ головного мозга с типичным накоплением железа в базальных ганглиях и таламусе может помочь подтвердить диагноз. Как упоминалось выше, другим редким генетическим заболеванием, проявляющимся гиперферритинемией и анемией, является атрансферринемия / гипотрансферринемия 111 , которое, однако, характеризуется повышенным насыщением трансферрина из-за чрезвычайно низкого уровня трансферрина в сыворотке.
Дифференциальная диагностика в основном включает классические (HFE) и неклассические (TfR2, HAMP, HJV и FPN1) формы HH, все из которых характеризуются ранним и прогрессивным увеличением TS с последующим повышением сывороточного ферритина по мере увеличения накопления железа в паренхиматозных клетках печень, поджелудочная железа, сердце и другие органы (). Как уже говорилось, в отличие от HH, у FD клиническая выраженность мягче.
МРТ брюшной полости — полезный неинвазивный инструмент для классификации и диагностики заболевания, поскольку он может дифференцировать пациентов с ФД, характеризующимися задержкой железа в триаде SSL (селезенка, позвоночник, печень) (), от всех других форм ГГ, включая FPN1-HC, связанный с перегрузкой железа в печени, но с нормальным содержанием железа в селезенке и костном мозге (). 112
Картина абдоминальной магнитно-резонансной томографии (МРТ) болезни Ферропортина (ФД). МРТ. Т2 * -взвешенные последовательности градиентного эха использовали для обнаружения накопления железа. (A) Нормальный предмет. (B) FD. (C) FD после завершения программы флеботомии (обратите внимание, что избыток железа все еще обнаруживается в печени и позвоночнике, несмотря на нормальные уровни ферритина и насыщения трансферрина в сыворотке). (D) Ферропортин-ассоциированный наследственный гемохроматоз: накопление железа затрагивает только печень и сохраняет селезенку и позвоночник (стрелки).
Лечение
Венесекция является краеугольным камнем терапии также при БФ, но она может не переноситься одинаково у всех пациентов, и низкий TS с анемией может быть быстро установлен, несмотря на то, что SF все еще повышается. 1 Перегрузка макрофагами железом очень устойчива к отмене железа при этом заболевании, даже у пациентов, которые, по-видимому, хорошо лечились (). Следовательно, в отличие от HH, во время терапии следует тщательно контролировать не только сывороточный ферритин, но особенно TS. Кроме того, терапия не должна быть направлена на достижение обычных целей HH для истощения запасов железа (TS ниже 20%, SF 50 нг / л или легкая анемия), а должна быть более консервативной.Нет исследований по оптимальному графику флеботомии при FD. С практической точки зрения, сеанс флеботомии ежемесячно / раз в два месяца в течение 1-2 лет, в зависимости от основной мутации, позволяет достичь приемлемого состояния истощения запасов железа, в то время как поддерживающая терапия (обычно сеанс флеботомии каждые 4-6 месяцев) должен продолжаться на всю жизнь. Разумной целью для терапии является уровень SF 100–200 нг / мл. В некоторых случаях такие значения Ft могут по-прежнему отражать некоторую загрузку железом тканевых макрофагов (), но связанный с этим клинический риск незначителен.В идеале оптимальной целью является самый низкий приемлемый уровень ферритина для TS и уровни гемоглобина не ниже нижнего предела нормы. (Спорные) диетические ограничения, которые иногда рекомендуются пациентам с ГГ (избегание витамина С или продуктов, богатых железом или обогащенных), не применяются к ФД из-за другой патогенной основы по сравнению с ГГ: нормальное / достаточное всасывание железа энтероцитами и нормальное / незначительное увеличенное накопление железа в паренхиматозных клетках в FD по сравнению с увеличило абсорбцию железа и заметное накопление железа в паренхимных клетках в HH.
Хелатирование железа может быть вариантом в отдельных случаях. 79
Братья и сестры пациентов с ФД, как и их потомки, должны пройти скрининг, поскольку у них 50% вероятность быть восприимчивыми.
Ферроптоз индуцируется после лечения клеток рака груди сирамезином и лапатинибом
Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE et al . Ферроптоз: железозависимая форма неапоптотической гибели клеток. Ячейка 2012; 149 : 1060–1072.
CAS Статья Google ученый
Ягода Н., фон Рехенберг М., Заганджор Э., Бауэр А. Дж., Янг В. С., Фридман Д. Д. и др. . RAS-RAF-MEK-зависимая окислительная гибель клеток с участием потенциал-зависимых анионных каналов. Nature 2007; 447 : 864–868.
Артикул Google ученый
Christofferson DE, Yuan J.Некроптоз как альтернативная форма запрограммированной гибели клеток. Curr Opin Cell Biol 2010; 22 : 263–268.
CAS Статья Google ученый
Jacobson MD, Raff MC. Запрограммированная гибель клеток и защита от Bcl-2 при очень низком содержании кислорода. Nature 1995; 374 : 814–816.
CAS Статья Google ученый
Боя П., Кремер Г.Проницаемость лизосомальной мембраны при гибели клеток. Онкоген 2008; 27 : 6434–6451.
CAS Статья Google ученый
Заголовок C. Сирамезин H Lundbeck. Curr Opin Investig Drugs 2001; 2 : 266–270.
CAS PubMed Google ученый
Остенфельд М.С., Ференбахер Н., Хойер-Хансен М., Томсен С., Фаркас Т., Яаттела М.Эффективная гибель опухолевых клеток лигандом сигма-2 рецептора сирамезином включает лизосомную утечку и окислительный стресс. Cancer Res 2005; 65 : 8975–8983.
CAS Статья Google ученый
Rusnak DW, Lackey K, Affleck K, Wood ER, Alligood KJ, Rhodes N и др. . Эффекты нового рецептора обратимого эпидермального фактора роста / ингибитора тирозинкиназы ErbB-2, GW2016, на рост человеческих нормальных и опухолевых клеточных линий in vitro и in vivo . Mol Cancer Ther 2001; 1 : 85–94.
CAS PubMed Google ученый
Wood ER, Truesdale AT, McDonald OB, Yuan D, Hassell A, Dickerson SH et al . Уникальная структура рецептора эпидермального фактора роста, связанного с GW572016 (лапатиниб): взаимосвязь между конформацией белка, скоростью выхода ингибитора и активностью рецептора в опухолевых клетках. Cancer Res 2004; 64 : 6652–6659.
CAS Статья Google ученый
Xia J, Deng H, Feng Y, Zhang H, Pan Q, Dai H и др. . Новый локус аутосомно-доминантной несиндромальной потери слуха, идентифицированный в 5q31.1-32 в китайской родословной. J Hum Genet 2002; 47 : 635–640.
CAS Статья Google ученый
Веттерског Д., Шиу К.К., Чонг И., Мейджер Т., Маккей А., Ламброс М. и др. .Идентификация новых детерминант устойчивости к лапатинибу при раке, усиленном ERBB2. Онкоген 2014; 33 : 966–976.
CAS Статья Google ученый
Park SH, Ito K, Olcott W, Katsyv I, Halstead-Nussloch G, Irie HY. Ингибирование PTK6 способствует апоптозу лапатиниб-устойчивых клеток рака молочной железы Her2 (+) за счет индукции Bim. Breast Cancer Res 2015; 17 : 86.
Артикул Google ученый
Nahta R, Yuan LX, Du Y, Esteva FJ.Лапатиниб индуцирует апоптоз в клетках рака молочной железы, устойчивых к трастузумабу: влияние на передачу сигналов инсулиноподобного фактора роста I. Mol Cancer Ther 2007; 6 : 667–674.
CAS Статья Google ученый
Танидзаки Дж., Окамото И., Фумита С., Окамото В., Нисио К., Накагава К. Роль индукции BIM и подавления сурвивина в индуцированном лапатинибом апоптозе в клетках рака молочной железы с амплификацией HER2. Онкоген 2011; 30 : 4097–4106.
CAS Статья Google ученый
Dixon SJ, Stockwell BR. Роль железа и активных форм кислорода в гибели клеток. Nat Chem Biol 2014; 10 : 9–17.
CAS Статья Google ученый
Горлач А., Димова Е.Ю., Петри А., Мартинес-Руис А., Эрнансанц-Агустин П., Роло А.П. и др. .Активные формы кислорода, питание, гипоксия и болезни: проблемы решены? Редокс Биол 2015; 6 : 372–385.
Артикул Google ученый
Heid ME, Keyel PA, Kamga C, Shiva S, Watkins SC, Salter RD. Активные формы кислорода в митохондриях вызывают NLRP3-зависимое повреждение лизосом и активацию инфламмасом. J Immunol 2013; 191 : 5230–5238.
CAS Статья Google ученый
Шахбази-Гахруэй Д., Абдолахи М.Суперпарамагнитный оксид железа-C595: потенциальные контрастные вещества для МРТ для обнаружения рака яичников. J Med Phys 2013; 38 : 198–204.
Артикул Google ученый
Gkouvatsos K, Papanikolaou G, Pantopoulos K. Регуляция транспорта железа и роль трансферрина. Biochim Biophys Acta 2012; 1820 : 188–202.
CAS Статья Google ученый
Ward DM, Kaplan J.Ферропортин-опосредованный транспорт железа: экспрессия и регуляция. Biochim Biophys Acta 2012; 1823 : 1426–1433.
CAS Статья Google ученый
Dixon SJ, Patel DN, Welsch M, Skouta R, Lee ED, Hayano M и др. . Фармакологическое подавление обмена цистин-глутамат вызывает стресс эндоплазматического ретикулума и ферроптоз. Элиф 2014; 3 : e02523.
Артикул Google ученый
Цзян Л., Кон Н., Ли Т., Ван С.Дж., Су Т., Хибшош Х. и др. .Ферроптоз как р53-опосредованная активность при подавлении опухоли. Природа 2015; 520 : 57–62.
CAS Статья Google ученый
Ян В.С., Шри Рамаратнам Р., Велш М.Э., Шимада К., Скута Р., Вишванатан В.С. и др. . Регулирование гибели ферроптотических раковых клеток с помощью GPX4. Ячейка 2014; 156 : 317–331.
CAS Статья Google ученый
Теббутт Н., Педерсен М.В., Джонс Т.Г.Ориентация на семью ERBB при раке: терапия для пар. Nat Rev Cancer 2013; 13 : 663–673.
CAS Статья Google ученый
Ларбурэ С., Габорит Н., Шардес Т., Коэльо М., Кампинья Е., Баскуль-Моллеви С. и др. . При карциноме поджелудочной железы двойное нацеливание на EGFR / HER2 с цетуксимабом / трастузумабом более эффективно, чем лечение только трастузумабом / эрлотинибом или лапатинибом: это связано с понижающей регуляцией рецепторов и разрушением димеров. Неоплазия 2012; 14 : 121–130.
CAS Статья Google ученый
Johansson AC, Appelqvist H, Nilsson C, Kagedal K, Roberg K, Ollinger K. Регуляция апоптоз-ассоциированной проницаемости лизосомальной мембраны. Апоптоз 2010; 15 : 527–540.
CAS Статья Google ученый
Ghosh M, Carlsson F, Laskar A, Yuan XM, Li W.Проницаемость лизосомальной мембраны вызывает окислительный стресс и индукцию ферритина в макрофагах. FEBS Lett 2011; 585 : 623–629.
CAS Статья Google ученый
Остенфельд М.С., Хойер-Хансен М., Бастхольм Л., Ференбахер Н., Ольсен О.Д., Грот-Педерсен Л. и др. . Противораковое средство сирамезин является лизосомотропным детергентом, который вызывает накопление цитопротекторных аутофагосом. Аутофагия 2008; 4 : 487–499.
CAS Статья Google ученый
Zambrano J, Yeh ES. Аутофагия и апоптотические перекрестные помехи: механизм терапевтической устойчивости при HER2-положительном раке молочной железы. Рак молочной железы (Окл) 2016; 10 : 13–23.
CAS Google ученый
Maycotte P, Thorburn A. Ориентация на аутофагию при раке груди. World J Clin Oncol 2014; 5 : 224–240.
Артикул Google ученый
Friedmann Angeli JP, Schneider M, Proneth B, Tyurina YY, Tyurin VA, Hammond VJ et al . Инактивация регулятора ферроптоза Gpx4 вызывает острую почечную недостаточность у мышей. Nat Cell Biol 2014; 16 : 1180–1191.
CAS Статья Google ученый
Ву Д., Чен Л. Ферроптоз: новая форма гибели клеток будет многообещающей мишенью для лечения болезней. Acta Biochim Biophys Sin (Шанхай) 2015; 47 : 857–859.
CAS Статья Google ученый
Matsushita M, Freigang S, Schneider C, Conrad M, Bornkamm GW, Kopf M. Перекисное окисление липидов Т-клеток вызывает ферроптоз и предотвращает иммунитет к инфекции. J Exp Med 2015; 212 : 555–568.
CAS Статья Google ученый
Chen L, Hambright WS, Na R, Ran Q.Удаление ингибитора ферроптоза глутатионпероксидазы 4 в нейронах приводит к быстрой дегенерации и параличу двигательных нейронов. J Biol Chem 2015; 290 : 28097–28106.
CAS Статья Google ученый
Линкерманн А., Скута Р., Химмеркус Н., Мулай С.Р., Девиц С., Де Зен Ф. и др. . Синхронизированная гибель клеток почечных канальцев включает ферроптоз. Proc Natl Acad Sci U S A 2014; 111 : 16836–16841.
CAS Статья Google ученый
Sun X, Ou Z, Chen R, Niu X, Chen, Kang R и др. . Активация пути p62-Keap1-NRF2 защищает от ферроптоза в клетках гепатоцеллюлярной карциномы. Гепатология 2015; 63 : 173–184.
Артикул Google ученый
Лоринц Т., Йемниц К., Кардон Т., Мандл Дж., Шарка А.Ферроптоз участвует в гибели клеток, вызванной ацетаминофеном. Pathol Oncol Res 2015; 21 : 1115–1121.
CAS Статья Google ученый
Zhang Z, Zhang F, An P, Guo X, Shen Y, Tao Y и др. . Дефицит ферропортина1 в макрофагах мыши нарушает гомеостаз железа и воспалительные реакции. Кровь 2011; 118 : 1912–1922.
CAS Статья Google ученый
Miller LD, Coffman LG, Chou JW, Black MA, Bergh J, D’Agostino R Jr. и др. . Сигнатура гена, регулирующего железо, предсказывает исход рака груди. Cancer Res 2011; 71 : 6728–6737.
CAS Статья Google ученый
Chitambar CR, Wereley JP. Зависимый и независимый от рецептора трансферрина транспорт железа в галлий-резистентных лимфоидных лейкозных клетках человека. Кровь 1998; 91 : 4686–4693.
CAS PubMed Google ученый
Яманиши Х, Ияма С., Ямагути Й, Канакура Й, Иватани Я.Общая железосвязывающая способность рассчитывается из сывороточной концентрации трансферрина или сывороточной концентрации железа и ненасыщенной железосвязывающей способности. Clin Chem 2003; 49 : 175–178.
CAS Статья Google ученый
Гао М., Мониан П., Куадри Н., Рамасами Р., Цзян Х. Глутаминолиз и трансферрин регулируют ферроптоз. Mol Cell 2015; 59 : 298–308.
CAS Статья Google ученый
Ян В.С., Стоквелл BR.Синтетический летальный скрининг выявляет соединения, активирующие железозависимую неапоптотическую гибель клеток в онкогенных раковых клетках, несущих РАС. Chem Biol 2008; 15 : 234–245.
CAS Статья Google ученый
Ишимото Т., Нагано О, Яэ Т., Тамада М., Мотохара Т., Осима Х. и др. . Вариант CD44 регулирует окислительно-восстановительный статус раковых клеток путем стабилизации субъединицы xCT системы xc (-) и тем самым способствует росту опухоли. Cancer Cell 2011; 19 : 387–400.
CAS Статья Google ученый
Lewerenz J, Hewett SJ, Huang Y, Lambros M, Gout PW, Kalivas PW и др. . Система цистин / глутаматный антипортер x (c) (-) в здоровье и болезни: от молекулярных механизмов до новых терапевтических возможностей. Antioxid Redox Signal 2013; 18 : 522–555.
CAS Статья Google ученый
Habib E, Linher-Melville K, Lin HX, Singh G.Экспрессия xCT и активность системы x регулируются NRF2 в клетках рака груди человека в ответ на окислительный стресс. Редокс Биол 2015; 5 : 33–42.
CAS Статья Google ученый
Chiste RC, Freitas M, Mercadante AZ, Fernandes E. Каротиноиды ингибируют перекисное окисление липидов и окисление гемоглобина, но не вызывают истощение глутатиона, вызванное ROS в эритроцитах человека. Life Sci 2014; 99 : 52–60.
CAS Статья Google ученый
Скута Р., Диксон С.Дж., Ван Дж., Данн Д.Е., Орман М., Шимада К. и др. . Ферростатины ингибируют окислительное повреждение липидов и гибель клеток в различных моделях заболеваний. J Am Chem Soc 2014; 136 : 4551–4556.
CAS Статья Google ученый
Петерсен Н.Х., Олсен О.Д., Грот-Педерсен Л., Эллегаард А.М., Билгин М., Редмер С. и др. .Связанные с трансформацией изменения метаболизма сфинголипидов повышают чувствительность клеток к гибели лизосомных клеток, вызванной ингибиторами кислой сфингомиелиназы. Cancer Cell 2013; 24 : 379–393.
CAS Статья Google ученый
Zhang D, Pal A, Bornmann WG, Yamasaki F, Esteva FJ, Hortobagyi GN et al . Активность лапатиниба не зависит от уровня экспрессии EGFR в клетках рака молочной железы, сверхэкспрессирующих HER2. Mol Cancer Ther 2008; 7 : 1846–1850.
CAS Статья Google ученый
Lachaier E, Louandre C, Godin C, Saidak Z, Baert M, Diouf M et al . Сорафениб вызывает ферроптоз в линиях раковых клеток человека, происходящих из различных солидных опухолей. Anticancer Res 2014; 34 : 6417–6422.
CAS PubMed Google ученый
Azad MB, Chen Y, Henson ES, Cizeau J, McMillan-Ward E, Israels SJ и др. .Гипоксия вызывает гибель аутофагических клеток в компетентных к апоптозу клетках посредством механизма, включающего BNIP3. Аутофагия 2008; 4 : 195–204.
CAS Статья Google ученый
ТЦ Чоу, Талалай П. Количественный анализ зависимости доза-эффект: комбинированные эффекты нескольких лекарств или ингибиторов ферментов. Adv Enzyme Regul 1984; 22 : 27–55.
CAS Статья Google ученый
Нокдаун ферропортина ускоряет индуцированный эрастином ферроптоз в клетках нейробластомы
Eur Rev Med Pharmacol Sci 2018; 22 (12): 3826-3836DOI: 10.26355 / eurrev_201806_15267
Н. Гэн, Б.-Дж. Ши, С.-Л. Ли, З.-Й. Чжун, Ю.-К. Ли, В.-Л. Сюа, Х. Чжоу, Ж.-Х. Цай
Отделение детской хирургии, Вторая больница, Медицинский университет Хэбэй, Хэбэй, Шицзячжуан, Китай. [email protected]
ЦЕЛЬ: Ферроптоз — это недавно обнаруженная железозависимая форма неапоптотической регулируемой гибели клеток (RCD), которая активируется при терапии несколькими противоопухолевыми средствами, но потенциальный механизм остается неясным.Эрастин, проявляя селективность в отношении раковых клеток с мутацией RAS, индуцирует ферроптоз за счет увеличения уровней железа и липидно-активных форм кислорода (АФК) в клетке. Ферропортин (Fpn), единственный белок, экспортирующий железо, участвует в регуляции внутриклеточной концентрации железа. В этом исследовании мы исследовали роль Fpn в ферроптозе, вызванном эрастином в клетках SH-SY5Y.
МАТЕРИАЛЫ И МЕТОДЫ: Жизнеспособность клеток определяли с помощью набора для анализа нерадиоактивной пролиферации клеток CellTiter 96® AQueous.Активность каспазы-3 измеряли с помощью набора для ELISA. qRT-PCR была проведена для проверки экспрессии мРНК Fpn. Был проведен вестерн-блоттинг для проверки уровня экспрессии маркерных белков. Для исследования уровней MDA, ROS и железа в клетках, соответственно, использовали специальные коммерческие наборы.
РЕЗУЛЬТАТЫ: Ферроптоз оценивали по уровню внутриклеточных липидных АФК и концентрации железа. Гепсидин может предотвратить ферроптоз, вызванный эрастином, за счет разрушения Fpn. Было обнаружено, что эрастин (5 мкг / мл) индуцирует ферроптоз в клетках нейробластомы через 6 часов, чему способствует нокдаун Fpn.Экспрессия гена и белка Fpn снижалась в клетках SH-SY5Y, обработанных эрастином. После обработки эрастином трансфекция миРНК Fpn в клетках SH-SY5Y была способна ускорять фенотипические изменения, связанные с ферроптозом. Fpn действует как негативный регулятор ферроптоза, снижая внутриклеточную концентрацию железа. Нокдаун Fpn усиливал противоопухолевую активность эрастина.
ВЫВОДЫ: Эти результаты предполагают, что нокдаун Fpn ускоряет индуцированный эрастином ферроптоз за счет увеличения накопления железозависимых липидных АФК, выделяя Fpn как потенциальный терапевтический сайт-мишень для нейробластомы.Таким образом, ингибиторы Fpn могут открыть новые возможности для химиосенсибилизации нейробластомы.
Бесплатная загрузка PDFцитировать эту статью
Н. Гэн, Б.-Дж. Ши, С.-Л. Ли, З.-Й. Чжун, Ю.-К. Ли, В.-Л. Сюа, Х. Чжоу, Ж.-Х. Cai
Нокдаун ферропортина ускоряет вызванный эрастином ферроптоз в клетках нейробластомы
Eur Rev Med Pharmacol Sci
Год: 2018
Vol.22 — N. 12
Страницы: 3826-3836
DOI: 10.26355 / eurrev_201806_15267
Биология | Бесплатный полнотекстовый | Нейротоксический эффект фипронила у самцов крыс Wistar: улучшающий эффект L-аргинина и L-карнитина
2. Материалы и методы
2.1. Животные
В этом случае 36 взрослых крыс-самцов линии Wistar были куплены в Доме лабораторных животных факультета ветеринарной медицины Университета Суэцкого канала, Египет. Вес крыс колебался от 210 до 230 г.Перед началом исследования крыс оставляли на 1 неделю в качестве стандартной программы для адаптации к окружающей среде. По три крысы в клетке содержались в помещении с покрытым опилками полом и контролируемой температурой (25 ± 2 ° C). Крысам разрешался неограниченный доступ к стандартной диете и воде. Процедуры этого эксперимента были выполнены в соответствии с утверждением (№ 2021012) и руководящими принципами комитета по научным исследованиям и биологической этике для животных, используемых в лабораторных экспериментах на факультете ветеринарной медицины Университета Суэцкого канала, Египет.
2.2. Фипронил, L-аргинин и L-карнитин
Фипронил (Coash SC 20%), препарат от Star Chem. Company (Велфорд, Южная Каролина, США) и производится Zhejiang Yongnong Chem. Co. (Шаосин, Китай). L-аргинин был получен от NOW Foods Company (Блумингдейл, Иллинойс, США). L-карнитин был приобретен у Mepaco Co. (Каир, Египет).
2.3. План эксперимента
Крысы были случайным образом разделены на шесть групп, в каждой группе было по шесть крыс.
Группа I. Контрольные крысы получали только дистиллированную воду.
- Группа II (L-аргинин, LA). Крысам вводили зонд в дозе 500 мг / кг LA (25% мас. / Об. В дистиллированной воде) [13].
- Группа III (L-карнитин, LC), крысам вводили через зонд 100 мг / кг LC [14].
- Группа IV (фипронил, FPN). Крыс лечили 4,85 мг / кг FPN (1/20 FPN LD50). Дозировка была выбрана в соответствии с имеющимися публикациями относительно пероральной LD50 фипронила для крыс [15].
Группа V (FPN + LA), крысам вводили через зонд 500 мг / кг LA (25% мас. / Об. В дистиллированной воде) и 4.85 мг / кг FPN (1/20 FPN LD50) с интервалом в один час.
Группа VI (FPN + LC), крысам вводили зонд LC 100 мг / кг и 4,85 мг / кг FPN (1/20 FPN LD50) с интервалом в один час.
Дозы вводились через желудочный зонд ежедневно в течение 6 недель подряд.
2.4. Масса тела и мозга
Масса тела проверялась в начале и в конце исследования. В конце экспериментального периода животных умерщвляли и взвешивали мозг.
2.5. Лабиринт Барнса (BM)
Поведенческий тест и подготовка комнаты проводились, как описано Барнсом [16]. Были выполнены три основные процедуры. Привыкание: животных приучали к человеческому прикосновению перед поведенческими экспериментами, перемещая каждое животное из бокса, и частые манипуляции и прикосновения применялись в течение 5 минут, затем животных снова возвращали в бокс. Крыс приучали к пространственной памяти BM и парадигме обучения за день до начала фазы приобретения, чтобы уменьшить тревогу, которая может изменить поведение крысы.Привыкание проводили, давая крысам возможность свободно исследовать лабиринт в течение 1 минуты, после чего осторожно направляли крыс к выходному отверстию в течение примерно 2 минут. Окружающие визуальные подсказки были размещены в виде трех картонных фишек (круг, треугольник и звезда). Эти сигналы оставались неизменными во время фаз привыкания, приобретения и исследования. Фаза сбора (для оценки пространственного обучения или усвоения): каждое испытание по приобретению начиналось с помещения крысы в середину платформы, которая была покрыта темным цилиндрическим стартовым ящиком, который затем поднимался через 15 с, что позволяло крысе свободно исследовать платформу и найдите целевое отверстие.Это повторяли для всех крыс в течение 4 дней подряд обучения. Платформа лабиринта очищалась 70% этиловым спиртом для удаления запахов. Пробное испытание (для оценки кратковременного сохранения пространственной памяти): на 5-й день спасательный ящик был удален, и все реплики остались на том же месте. Крыс проверяли на запоминание того, что было ранее изучено. Приобретение на этапе обучения обычно оценивалось по задержке времени для каждой крысы, чтобы достичь целевой норы.2.6.Кровь и сбор образцов
Образцы крови были взяты из ретроорбитального венозного сплетения под действием легкой ингаляционной анестезии тетрагидрофураном в простые пробирки в 7:00 утра. Сыворотки отделяли и хранили при -80 ° C до определения уровня кортикостерона и других биохимических маркеров. Мозг взвешивали и делили медиально на две равные половины. Одну половину погружали в 10% формалин для гистопатологии, а другую половину подвергали дальнейшей гомогенизации.
2.7. Гомогенат головного мозга
Одну половину промывали холодным фосфатным буферным солевым раствором (PBS) для устранения загрязнения крови, затем сушили фильтровальной бумагой.Рассекали кору головного мозга и гиппокамп. Гомогенизацию коры головного мозга и гиппокампа проводили отдельно в холодном фосфатном буфере (PH = 7,4), затем центрифугировали при 4000 об / мин на холодной центрифуге. Супернатанты хранили при -80 ° C до получения малонового диальдегида (MDA), общей антиоксидантной способности (TAC), анализа дофамина. Другая половина мозга была погружена в 10% нейтральный забуференный формалин.
2,8. Общая антиоксидантная способность (TAC) и малоновый диальдегид (MDA)
Содержание MDA в коре головного мозга и гомогенате гиппокампа в качестве индикатора перекисного окисления липидов и TAC определяли с использованием коммерческого набора для ELISA (кат., MBS268427, MyBioSource Co., Сан-Диего, Калифорния, США) и (№ по каталогу, MBS733414, MyBioSource Co., Сан-Диего, Калифорния, США), соответственно. Все этапы выполнялись согласно протоколу производителя.
2.9. Уровни дофамина и кортикостерона
Гомогенат коры головного мозга дофамина (CSB-E08660r, Cusabio Co., Ухань, Китай) и сывороточного кортикостерона (CSB-E07014r, Cusabio Co., Ухань, Китай) определяли с использованием специальных наборов для ELISA. Процедуры выполнялись в соответствии с инструкциями производителя.
2.10. Гистопатология
Фиксированные в формалине половинки тканей мозга сушили в градуированных спиртах и удаляли ксилолом, после чего погружали в парафин. Гистологические срезы нарезали на 4–5 мкм и окрашивали гематоксилином и эозином (H&E) согласно Culling et al. [17].2.11. Иммуногистохимия (IHC)
Залитый в парафин мозг разрезали на 5 мкм срезы на положительно заряженных предметных стеклах для серотониновых (S-2A) рецепторов, ионизированного кальций-связывающего адаптера (Iba-1) и иммуногистохимического метода двойного кортина (DCX).Следующие первичные антитела; (# sc-32538, Santa Cruz Biotechnology, Dallas, TX, USA) в концентрации 1: 100, (# sc-32725, Santa Cruz Biotechnology, Dallas, TX, USA) в концентрации 200 мкг / мл и (# sc-271390 , Santa Cruz Biotechnology, Dallas, TX, USA) в концентрации 1: 400 соответственно. Протокол для IHC был выполнен, как описано Schacht и Kern [18] для рецепторов S-2A, Farrag et al. [19] для Iba-1 и Sirerol-Piquer et al. [20] для DCX. Количественный анализ процентного содержания иммунореактивных частей (IRP%) проводили с использованием программного обеспечения Image J.Семь случайных микроскопических полей на слайде подвергали анализу после вычитания светового фона.2.12. Статистический анализ
Результаты были оценены на предмет нормальности, и было обнаружено, что наборы данных соответствуют нормальному распределению. Данные были представлены как среднее значение ± стандартная ошибка. Для проведения анализа использовали программное обеспечение SPSS 20 (SPSS Inc., Чикаго, Иллинойс, США). Различия между группами анализировали с помощью одностороннего дисперсионного анализа (ANOVA) с последующим апостериорным критерием множественного диапазона Дункана.p <0,05 указывает на достоверные различия между группами.
4. Обсуждение
Широкое использование пестицидов в сельском хозяйстве, бытовых и домашних условиях представляет серьезную угрозу не только для целевых видов, но также для окружающей среды и каждого живого организма, подвергающегося их воздействию [21]. Группа фенилпиразолов является одним из наиболее широко используемых инсектицидов во всем мире из-за его высокой токсичности для беспозвоночных, простоты применения и системного характера, что обеспечивает их эффективное распространение на всей обрабатываемой территории [22].Воздействие пестицидов на нецелевые организмы считается краеугольным камнем программ борьбы с вредителями [23]. Воздействие пестицидов, прямо или косвенно, может вызывать широкий спектр токсических эффектов на нецелевые организмы, включая гепатотоксичность, нефротоксичность, нейротоксичность, гематотоксичность и т. Д. [24,25]. Это исследование было разработано для оценки биохимических и когнитивных последствий, вызванных субхроническим воздействием одного из наиболее широко используемых пестицидов, FPN, и возможных смягчающих эффектов LA или LC.Биохимические, функциональные и динамические взаимодействия между гиппокампом и префронтальной корой имеют решающее значение для познания, пространственной навигации и мнемонической обработки [26]. Обучение и память — это фундаментальные когнитивные процессы, включающие приобретение, хранение и извлечение знаний или информации. Они выполняют важные функции, позволяя организму изменять свое поведение в ответ на переменные изменения окружающей среды [27]. Предполагается, что длительный стресс из-за частого воздействия пестицидов связан с физиологическими, когнитивными и поведенческими изменениями, включая пространственную память и нарушения обучения [13].Лабиринт Барнса — ценный метод оценки нарушений пространственного обучения и памяти у грызунов [28]. Данные этого исследования показали, что ФПН резко влияет на когнитивные функции и память крыс. По сравнению с контрольной группой крысы, получавшие FPN, демонстрировали заметные нарушения пространственного восприятия и сохранения памяти. Они прошли более длинный путь и потребовалось больше времени для обнаружения аварийного отверстия, что совпало с заметно повышенным числом ошибок как на фазах сбора данных, так и на фазах зондирования. Увеличенная задержка вместе с большим количеством ошибок может указывать на повышенное беспокойство крысы.Подобно нашим результатам, Taibi et al. [29], Годиньо и др. [6] и Terçariol et al. [30], которые сообщили о нарушении когнитивных способностей у крыс, подвергшихся воздействию ФПН, при исследовании с использованием нескольких типов пространственных лабиринтов, таких как BM, лабиринт с восемью лучевыми рукавами и приподнятый крестообразный лабиринт. Продемонстрированные ретроградные нейрофизиологические нарушения в текущем эксперименте соответствовали вакуолизации нейроцитов, и в такой группе существовала дегенерация. Многие исследования связывали клеточные и структурные изменения в коре и гиппокампе с ухудшением пространственных когнитивных функций [31,32,33,34].Более того, когнитивные и поведенческие дефициты, а также дегенерация гиппокампа, наблюдаемые в группе FPN, могут быть связаны с повреждением, вызванным FPN-индуцированным окислительным стрессом (OS) на структуру и функцию мозга. Наши результаты показали, что лечение крыс ФПН изменило окислительно-восстановительный баланс мозга. Об этом свидетельствуют значительно повышенные уровни MDA при подавлении TAC в гомогенате головного мозга. Эти данные свидетельствуют об увеличении количества активных форм кислорода (АФК) в головном мозге и развитии ОС из-за липофильной природы ФПН и ее метаболитов, что делает их более легкими для прохождения через гематоэнцефалический барьер [35].ОС может серьезно влиять на функции ЦНС за счет индукции митохондриальной дисфункции, нарушения синапсов, вмешательства в нейрональную передачу и подавления нейрогенеза [36,37], что приводит к нарушению памяти и способности к обучению. В соответствии с нашими результатами, многие исследования показали, что лечение FPN индуцирует образование ROS [38,39,40]. Редокс-баланс имеет решающее значение для поддержания клеточного гомеостаза [41]. Дисбаланс между прооксидантами и антиоксидантами в пользу первых приводит к развитию ОС [42].Биохимическая целостность мозга имеет решающее значение для физиологических функций ЦНС. Ежедневное введение LA или LC одновременно с FPN восстановило память и когнитивные способности, а также уменьшило дегенерацию гиппокампа и коры. Считалось, что как LA [43], так и LC [44] обладают антиоксидантным и антилипидным эффектом перекисного окисления в ткани мозга, что проявляется в текущем исследовании через снижение уровня MDA и повышение TAC у крыс, получавших FPN и получавших LA и LC. Более того, LA может повысить эффективность утилизации O 2 [45] и производства оксида азота (NO).Последний является важным нейротрансмиттером, который играет второстепенную роль в поддержании нормальных функций ЦНС и усиливает церебральный кровоток, нейронные коммуникации, передачу внутриклеточных сигналов и память [10,46]. Наблюдаемые улучшающие эффекты LC против FPN-индуцированного OS могут быть связаны с его хелатирующими свойствами железа и действием, запрещающим перекисное окисление липидов [47,48,49], где железо, как известно, необходимо для клеточной генерации мощного окислителя, гидроксильных радикалов, через реакцию Фентона [50].Кроме того, LC увеличивает базальную антиоксидантную способность за счет увеличения отношения восстановленного глутатиона к окисленному глутатиону (GSH / GSSG) [51] и активации антиоксидантных ферментов, включая супероксиддисмутазу, каталазу, глутатионредуктазу и глутатионпероксидазу [52,53] . L-картин может уменьшать перекисное окисление липидов за счет транспортировки жирных кислот к митохондриям для производства энергии, тем самым уменьшая количество жирных кислот, доступных для перекисного окисления [54]. В соответствии с нашими результатами, во многих исследованиях сообщалось об улучшении обучения и ускорении поиска задач лабиринта после лечения LA [55] и LC [56,57].Текущее исследование показало, что воздействие ФПН значительно повышает уровень кортикостерона в сыворотке. Это открытие отражает стресс, которым подвергаются животные из-за длительного воздействия пестицида. В то время как кортикостерон, главный гормон стресса, вырабатывается корой надпочечников у крыс [58] в результате физического или эмоционального стресса. Его секреция контролируется кортикотропин-рилизинг-гормоном и адренокортикотропным гормоном в оси гипоталамус-гипофиз-надпочечники (HPA) [59]. Нарушенная отрицательная обратная связь оси HPA связана с перепроизводством ROS [60], что приводит к когнитивным нарушениям, потере памяти и поведенческим дефицитам [61].Антиоксидантное влияние как LA, так и LC эффективно улучшало продукцию кортикостерона, стимулированную HPA. Субхроническое воздействие FPN вызывало заметную воспалительную реакцию. Это проявлялось в заметном повышении IRP% Iba-1 активированных клеток микроглии. Этот вывод согласуется с выводом, полученным Park et al. [62]. Повышение уровня Iba-1, наиболее используемого маркера активации микроглии, у крыс, которым вводили FPN, может указывать на чрезмерно активированные клетки микроглии и нейротоксический эффект.Воспаление и ОС тесно связаны друг с другом [63]. Таким образом, повышенная ОС, запускаемая ФПН, включается в провоспалительные состояния мозга и активацию микроглии. Эти данные имеют большое значение, поскольку нейродегенерация и снижение когнитивных функций тесно связаны с активацией микроглии и повышенным ОС [64]. Текущие данные хорошо коррелируют с гистопатологическими изменениями, развивающимися в коре и гиппокампе крыс, подвергшихся воздействию пестицида. Другое объяснение состоит в том, что введение FPN может ингибировать рецепторы ГАМК, которые были инкриминированы в ухудшении когнитивных функций [65], где ГАМК играет решающую роль в различных патофизиологических процессах, включая; интеграция информации, обработка информации, нейронные колебания, связанные с когнитивными функциями, и модуляция нейронных цепей и активности коры и гиппокампа [66].Более того, передача сигналов ГАМК использует взаимное влияние на нейровоспалительные процессы [67]. Данные текущего исследования показали, что подавление опосредованного микроглией воспалительного ответа является одним из возможных механизмов, лежащих в основе нейропротекторного потенциала LA и LC. Совместное лечение либо с LA, либо с LC заметно уменьшало активацию гиппокампа и кортикальных микроглии, вызванную FPN, таким образом, предполагая легкую воспалительную реакцию. Противовоспалительное свойство, которым обладают LA и LC, может улучшить целостность нервной системы и способствовать восстановлению клеток после воздействия травмы.Это объясняет потенцирование когнитивных функций в этих группах. Пониженный воспалительный ответ, проявляющийся в снижении% IRP Iba-1, наблюдался у крыс, обработанных LA и LC. может быть связано с улучшением TAC в этих группах, что привело к снижению продукции O 2 — и ONOO. Было документально подтверждено, что как LA, так и LC регулируют иммунную функцию и воспалительный ответ [68,69]. Они играют фундаментальную роль в ограничении ОС и деструктивной воспалительной реакции [69,70], следовательно, смягчают нервное повреждение.Более того, как LA, так и LC могут модулировать зависимые пути для уменьшения нейровоспаления. Можно предположить, что L-аргинин активирует ГАМК-зависимые мембранные токи посредством NO-независимого механизма, поэтому он может усиливать синаптическую передачу и пластичность ГАМК [71], а также устранять нейровоспаление, вызванное ФПН. Кроме того, LC может метаболизироваться в цикле трикарбоновых кислот и включаться в углеродный скелет глутамата, глутамина и ГАМК [72]. Следовательно, он может улучшить синаптическую передачу, опосредованную ГАМК, а также уменьшить нейровоспаление, вызванное ФПН.Эти характеристики могут помочь выяснить полезную роль LA и LC в подавлении провоспалительного ответа, запускаемого FPN. Механизм, участвующий в противовоспалительных свойствах LA и LC, может быть обусловлен антиоксидантным эффектом [52,73,74], который был четко продемонстрирован в настоящем исследовании. Нарушение регуляции нейрогенеза у взрослых является общим признаком различных неврологических заболеваний, включая эпилепсию [75]. ], когнитивная дисфункция [76], депрессия, расстройства настроения [77], болезнь Паркинсона [78] и болезнь Альцгеймера [79].Растущее количество литературы подчеркивает неблагоприятное воздействие пестицидов на пре- и постнатальный нейрогенез [80,81,82]. Тяжесть может влиять на пролиферацию нервных клеток-предшественников, изменять судьбу развития новорожденных нейронов или даже снижать фундаментальные когнитивные процессы [83,84]. При исследовании коры головного мозга и гиппокампа результаты показали, что повторное ежедневное введение FPN в течение 6 недель связано с заметным повышением IRP% DCX в исследуемых областях по сравнению с контрольной группой.DCX — важный белок микротрубочек. Он временно экспрессируется во время нейрогенеза взрослых млекопитающих незрелыми новообразованными нейронами, в то время как подавляется до созревания нейронов [85], поэтому считается маркером незрелой нейрональной пролиферации. Наряду с влиянием на ось HPA во время стресса [86], как OS, так и нейровоспаление индуцировали выработку большого количества NO, который был обвинен в демиелинизации и препятствовании регенерации нервов [87]. Более того, подчеркивалось, что ОС и воспаление могут ингибировать рост клеток и даже вызывать апоптоз [88,89] за счет индукции различных чувствительных к АФК апоптотических путей и факторов транскрипции, таких как каспазы и митоген-активируемые протеинкиназы (MAPK) [90]. .Была выдвинута гипотеза, что FPN может вызывать повышенную регуляцию апоптотических белков P53, каспазы-3 и Bax, тогда как понижающую регуляцию антиапоптотических белков Bcl-2 [91]. Следовательно, отмеченное в результате увеличение генерации нейронов можно интерпретировать как компенсаторную реакцию организма на потерю нейронов после ежедневного воздействия ФПН. Они согласуются с вакуолизированными и дегенерированными нейроцитами, отображаемыми в коре и гиппокампе этой группы. Кроме того, Zhang et al. [92] заявили, что чрезмерная активация микроглии может изменять нейрогенез и вызывать депрессивное подобное поведение [92].Кроме того, стресс считается одним из важных механизмов, влияющих на нейрогенез у взрослых. Он запускает выработку глюкокортикоидов за счет стимуляции оси HPA [93]. Высвободившиеся глюкокортикоиды оказывают серьезное влияние на нейрогенез взрослых через нарушение пролиферации, дифференцировки и выживания нервных клеток [94]. Несмотря на благотворную роль нейронов гиппокампа, рожденных взрослыми, в когнитивных процессах, но нейроны, генерируемые взрослыми, все еще находящиеся в незрелой фазе, выясняют что они еще не могли быть синаптически включены в ранее существовавшие нейронные цепи мозга.Наши результаты заявили о пагубном влиянии ФПН на нейрогенез у взрослых и могут помочь в выяснении когнитивных и поведенческих нарушений, наблюдаемых в этой группе. В соответствии с нашими результатами, Sidiropoulou et al. и Ласситер и др. [95,96] показали, что FPN является мощным нарушителем нервного развития и дифференцировки в клеточных линиях млекопитающих.Текущее исследование показало заметное снижение IRP% DCX в головном мозге крыс, подвергшихся воздействию LA или LC, совпадающего с пестицидом. Это убедительно подтверждает возможность того, что оба метода лечения, благодаря своим антиоксидантным и противовоспалительным свойствам, улучшают целостность и жизнеспособность нейронов, что, как можно предположить, связано с уменьшением невральной потери и апоптоза.Другая согласованная перспектива может заключаться в том, что LA и LC усиливают регенерацию нейронов и способствуют выживанию, а также созреванию новообразованных нейронов. Это отражается в заметном улучшении структуры нейроцитов в обследованных срезах мозга и их большом сходстве с контрольной группой. В этом отношении LA и LC могут быть использованы для улучшения регенерации, выживания и созревания нейронов.
Наши результаты показали, что крысы, получавшие FPN, демонстрировали значительное снижение концентрации гомогената дофамина в головном мозге в сочетании с заметным снижением IRP% рецепторов S-2A.Оба являются решающими катехоламинергическими нейротрансмиттерами, играющими жизненно важную роль в доминировании над многочисленными функциями организма. Они регулируют положение тела, эмоции, поведение, познание и двигательные функции [97,98] и очень подвержены воздействию токсических веществ из окружающей среды [99,100]. Результаты настоящего исследования согласуются с результатами Bharatiya et al. и Anadón et al. [7,101,102]. Наблюдаемые когнитивные нарушения после длительного воздействия ФПН считались прямым следствием опасного воздействия пестицидов на нейромедиатор дофамина и рецепторы S-2A, что привело к нарушению связи между мозгом.Вредное воздействие FPN на дофаминергические и серотонинергические системы нейротрансмиссии может быть вызвано нейротоксическим воздействием FPN на антиоксидантную систему мозга и клетки микроглии. Окислительный стресс и нейровоспаление усиливают друг друга и устраняют защитный механизм мозга, что вызывает дегенеративные изменения в нейронах [103,104,105]. Обостренное воспаление, вызванное ФПН, может приводить к кумулятивной потере нигростриатных дофаминергических нейронов [62] и рецепторов S-2A [106].Кроме того, подавленный нейрогенез у взрослых и созревание нейронов снижают вероятность замещения нейронов, которые усугубляют состояние [107] и способствуют истощению дофаминергической и серотонинергической нейротрансмиссии. Эти влияния явно свидетельствуют о нейротоксическом эффекте пестицида FPN на организмы, не являющиеся мишенями. С другой стороны, совместное введение LA или LC с FPN заметно повышает концентрацию дофамина и восстанавливает рецепторы S-2A. Обнаруженное чудесное улучшение нейрохимии мозга согласуется с потенцированными когнитивными способностями, показанными в задачах BM, выполняемых этими группами.Более того, по сравнению с контрольной группой животные, которым вводили LA и LC, демонстрировали более высокую иммунореактивность кортикальных рецепторов S-2A, что может подчеркивать их положительное влияние на нейроны головного мозга. Эти результаты совпадают с результатами Штрассера и др., Волца и Шенка, Лоррена и Халла и Лечина и др. [108,109,110,111] для LA и Lechin et al., Juliet et al. и Hamza et al. [112,113,114] для LC. Аргинин, входящий в семейство глутаматов [115], может метаболизироваться до глутамата, основного возбуждающего нейромедиатора в ЦНС [116].Кроме того, путь LA-NO участвует в консолидации нейротрансмиссии. NO-индуцированный синтез цГМФ увеличивает синаптическую пластичность и эффективность нейротрансмиссии. Это приводит к усилению когнитивного поведения и ДП [117,118]. L-карнитин и его изомер, ацетил-L-карнитин (ALC), используются в качестве церебральной биоэнергетики для улучшения функции митохондрий и повышения активности нервных клеток [119]. Действительно, этот эффект был подтвержден несколькими исследованиями [112, 120].В этом контексте проявленное улучшение в дофаминергической и серотонинергической системах может быть связано с нейропотенцирующими эффектами, проявляемыми как LA, так и LC, что является результатом нескольких интегрирующих дисциплин.Они включают в себя восстановление гемостаза оксидантов / антиоксидантов в головном мозге, минимизацию общего стресса, снятие нейровоспаления, поддержание целостности нервной системы, консолидацию клеточного энергетического метаболизма, усиление эффективного нейрогенеза и модуляцию нейрохимии мозга.


 Острая ПН происходит преимущественно в родах, однако не исключается ее возникновение на любом сроке гестации;
Острая ПН происходит преимущественно в родах, однако не исключается ее возникновение на любом сроке гестации;

 д.
д.