Протей (proteus) — причина заболеваний человека
ПРОТЕЙ (PROTEUS) — ПРИЧИНА ЗАБОЛЕВАНИЙ ЧЕЛОВЕКА
Протей (лат. proteus) — род грамотрицательных, споронеобразующих, факультативно анаэробных бактерий. Представитель нормальной, условно-патогенной микрофлоры кишечника человека.
Протей в систематике бактерий
Род протей (proteus) входит в семейство энтеробактерии (enterobacteriaceae), порядок энтеробактерии (enterobacteriales), класс гамма-протеобактерии (γ proteobacteria), тип протеобактерии (proteobacteria), царство бактерии.
Род протей включает следующие виды: proteus hauseri, proteus mirabilis, proteus myxofaciens, proteus penneri, proteus vulgaris.
Ранее относящиеся к роду протей бактерии вида proteus morganii перенесены в род morganella morganii семейства
энтеробактерий, а proteus rettgeri реклассифицированы в providencia stuartii и providencia rettgeri.
Протей. Общие сведения
Протеи имеют вид мелких, 0,3 на 3 мкм, нитевидных палочек. Они отличаются очень активной подвижностью. Протеи обладают токсическими (вырабатывают эндотоксин) и гемолитическими свойствами.
Протеи считаются санитарно-показательными бактериями. Количество обнаруживаемых proteus mirabilis рассматривают как показатель фекального загрязнения, а proteus vulgaris — как показатель загрязнения объекта органическими веществами.
Протей — причина заболеваний человека
Три вида из рода протей — proteus mirabilis, proteus vulgaris и proteus penneri являются патогенными для человека, причем 75–90 % инфекций вызывает proteus mirabilis.
Наиболее часто острые кишечные инфекции, вызываемые протеем, встречаются у детей раннего возраста: ослабленных или с
пониженным иммунитетом. Причиной протейной инфекции также может быть бесконтрольный прием антибиотиков. Заболевание обычно протекает в виде гастроэнтерита, гастрита и колиэнтерита. Очень часто
острые кишечные протейные инфекции сопровождается повышением температуры, рвотой, нарушением аппетита, кратковременными судорогами, наблюдается также изменение характера стула и его
учащение.
Заболевание обычно протекает в виде гастроэнтерита, гастрита и колиэнтерита. Очень часто
острые кишечные протейные инфекции сопровождается повышением температуры, рвотой, нарушением аппетита, кратковременными судорогами, наблюдается также изменение характера стула и его
учащение.
Бактерии рода протей, наряду с другими микроорганизмами, могут вызывать заболевания мочевыводящих путей и почек человека, в частности, острый и хронический простатит, цистит, пиелонефрит, в том числе большинство ксантогранулематозных пиелонефритов. Proteus mirabilis является причиной раневых инфекций. Proteus vulgaris присутствует в кишечнике здорового человека и многих животных, он обнаруживается в навозе, почве и загрязненных водах.
Протей в результатах анализа кала на дисбактериоз
При микробиологическом анализе кала протей рассматривается в комплексе с другими условно-патогенными бактериями, относящимися к
семейству
энтеробактерий и входящими в состав нормальной микрофлоры кишечника человека (кроме протея это клебсиелла, энтеробактер, гафния, серратия, морганелла,
провиденция, цитробактер и др.
Протей обнаруживается в кале у 2,0±0,5 % здоровых людей, причем среднее содержание в 1 г кала от 1600 до 4000 КОЕ протея (М.Д.Ардатская, О.Н.Минушкин).
Протей в анализе мочи
Бактериурия — наличие бактерий в моче может являться признаком воспаления в мочевыводящих путях, мочевом пузыре, почках. При отсутствии
каких-либо симптомов, истинная бактериурия (инфекция мочевых путей) диагностируется при наличии не менее 105 микробных тел протеев (или других энтеробактерий) в 1 мл свежевыпущенной мочи, иначе
предполагается, что загрязнение мочи происходит при ее заборе. Если бактериурия не сопровождается какими-либо симптомами, тогда она называется бессимптомной бактериурией. Бессимптомная
бактериурия не всегда требует немедленного лечения.
При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. В частности, при наличии соответствующей клинической симптоматики (лихорадка, озноб, тошнота, рвота, боли в поясничной области, дизурия) и выделении не менее 10 лейкоцитов в 1 мкл мочи, критерием для диагностики острого пиелонефрита является наличие не менее 104 протеев (или других патогенных энтеробактерий) в 1 мл свежевыпущенной мочи.
Активность антибиотиков в отношении протея
Антибиотики, активные в отношении протея: рифаксимин, нифуроксазид. Антибактериальные средства, активные в отношении
proteus mirabilis: амоскициллин (за исключением индолположительных штаммов протея (proteus vulgaris) которые, наоборот, к амоксициллину устойчивы). Менее активен нифурател (только в отношении
proteus mirabilis и proteus vulgaris). Большинство штаммов proteus mirabilis, в отличие от proteus vulgaris, чувствительны не только к ампициллину, но и к цефалоспоринам.
Proteus vulgaris — Proteus vulgaris
Proteus vulgaris
P. vulgaris был одним из трех видов, идентифицированных Хаузером из гнилого мяса (1885 г.).
За последние два десятилетия род Proteus , в частности P. vulgaris , претерпел ряд серьезных таксономических изменений. В 1982 г. P. vulgaris был разделен на три биогруппы на основе продукции индола .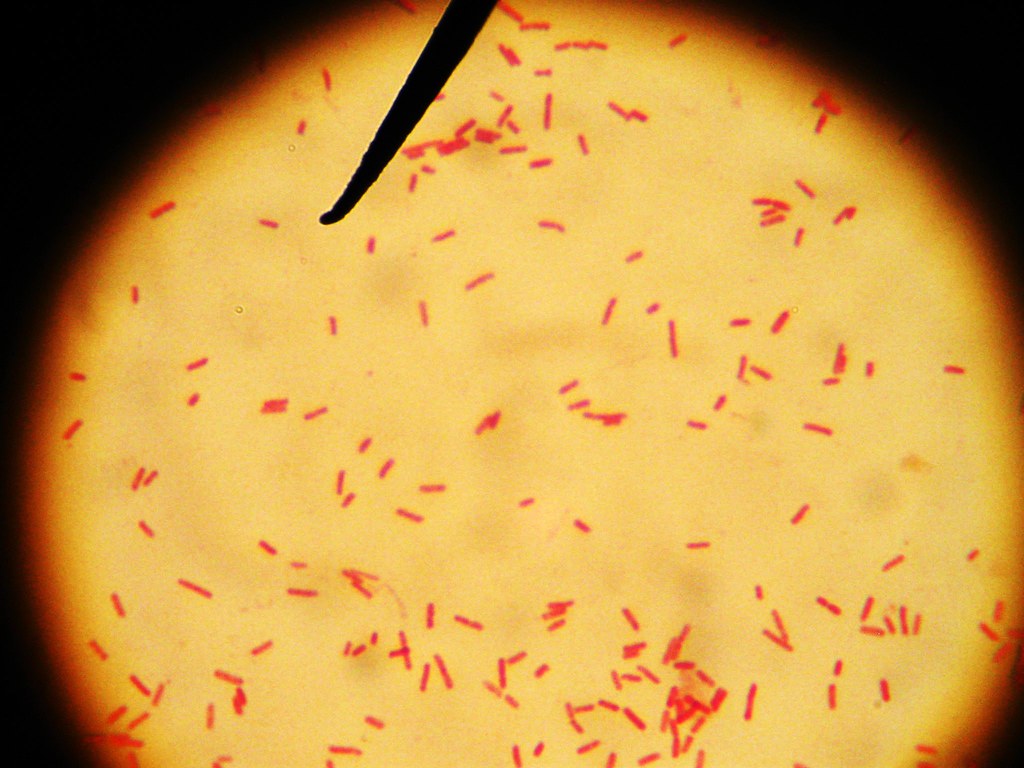 Биогруппа 1 была индол-отрицательной и представляла новый вид, P. penneri , в то время как биогруппы 2 и 3 остались вместе как P. vulgaris .
Биогруппа 1 была индол-отрицательной и представляла новый вид, P. penneri , в то время как биогруппы 2 и 3 остались вместе как P. vulgaris .
Идентификация лаборатории
Согласно лабораторным тестам ферментации, P. vulgaris ферментирует глюкозу и амигдалин, но не ферментирует маннит или лактозу. P. vulgaris также дает положительный результат теста на метиловый красный (смешанное кислотное брожение) и также является чрезвычайно подвижным организмом.
Когда P. vulgaris тестируется с использованием системы идентификации API 20E, он дает положительные результаты по снижению содержания серы, продукции уреазы, продукции триптофандезаминазы, продукции индола, иногда положительной активности желатиназы и ферментации сахарозы, а также отрицательные результаты по остальным тестам на тестовая полоска.
Он упоминается в Индексе аналитического профиля с использованием девятизначного кода: 047602157.
Оптимальные условия роста этого организма — факультативная анаэробная среда со средней температурой около 40 ° C.
Система Becton / Dickinson BBL Enterotube II для идентификации членов отряда Enterobacterales, инокулированных P. vulgaris, может дать следующие результаты:
- Положительный результат ферментации глюкозы (с выделением газа)
- Отрицательный по лизину и орнитину
- Положительно для производства сероводорода и индола
- Отрицательно для лактозы , арабинозы , адонита , сорбита и дульцита.
- Положительный результат теста на фенилаланин и теста на мочевину Харнстоффа
P. vulgaris может дать положительный или отрицательный результат на цитрат. Все они объединяются для получения идентификатора биокода 31406 (идентификаторы биокода 31402, 31404, 31407, все приводящие к P. vulgaris с бессимптомным результатом) для использования в Руководстве по интерпретации / компьютерной системе кодирования и идентификации.
Протейные инфекции
Причина и эпидемиология
- Нозокомиальные инфекции
- P. mirabilis вызывает 9% инфекций Proteus .
- P. vulgaris и P. penneri легко изолировать от людей в учреждениях длительного ухода и больницах, а также от пациентов с основными заболеваниями или ослабленной иммунной системой.
- Пациенты с рецидивирующими инфекциями, со структурными аномалиями мочевыводящих путей, пациенты, у которых были уретральные инструменты, и те, чьи инфекции были приобретены в больнице, имеют повышенную частоту инфекций, вызванных Proteus и другими организмами (например, Klebsiella , Enterobacter , Pseudomonas , энтерококки и стафилококки).

- P. vulgaris обладает высокой устойчивостью к антибиотикам из-за присутствующих в бактериях плазмид, что делает лечение инфекций чрезвычайно трудным. Это связано с тем, что плазмиды имеют различные маркеры устойчивости к лекарствам.
Клиническое выражение
Виды Enterobacterales (членом которых является Proteus ) и Pseudomonas являются микроорганизмами, наиболее часто ответственными за грамотрицательную бактериемию и сепсис.
Наличие синдрома сепсиса, связанного с инфекцией мочевыводящих путей (ИМП), должно повысить вероятность обструкции мочевыводящих путей. Это особенно верно в отношении пациентов, которые проживают в учреждениях длительного ухода, у которых установлены постоянные уретральные катетеры в течение длительного времени или у которых в анамнезе есть анатомические аномалии уретры.
- Непроходимость ИМП
Производство уреазы приводит к осаждению органических и неорганических соединений, что приводит к образованию струвитных камней. Камни струвита состоят из комбинации фосфата магния-аммония (струвита) и карбоната-апатита кальция. Образование струвитных камней может поддерживаться только при увеличении выработки аммиака и повышении pH мочи для снижения растворимости фосфата. Оба эти требования могут возникать только тогда, когда моча инфицирована организмом, продуцирующим уреазу, таким как Proteus . Уреаза метаболизирует мочевину до аммиака и углекислого газа: мочевина 2 NH 3 + CO 2 . Буферная пара аммиак / аммоний имеет pK 9,0, что дает комбинацию сильно щелочной и богатой аммиаком мочи.
Камни струвита состоят из комбинации фосфата магния-аммония (струвита) и карбоната-апатита кальция. Образование струвитных камней может поддерживаться только при увеличении выработки аммиака и повышении pH мочи для снижения растворимости фосфата. Оба эти требования могут возникать только тогда, когда моча инфицирована организмом, продуцирующим уреазу, таким как Proteus . Уреаза метаболизирует мочевину до аммиака и углекислого газа: мочевина 2 NH 3 + CO 2 . Буферная пара аммиак / аммоний имеет pK 9,0, что дает комбинацию сильно щелочной и богатой аммиаком мочи.
Симптомы, связанные со струвитными камнями, встречаются редко. Чаще женщины обращаются с ИМП, болью в боку или гематурией, и обнаруживается, что у них постоянно щелочной pH мочи (> 7,0).
Лечение
Антибиотики, к которым, как известно, чувствительны P. vulgaris :
Смотрите также
Рекомендации
«Proteus Vulgaris».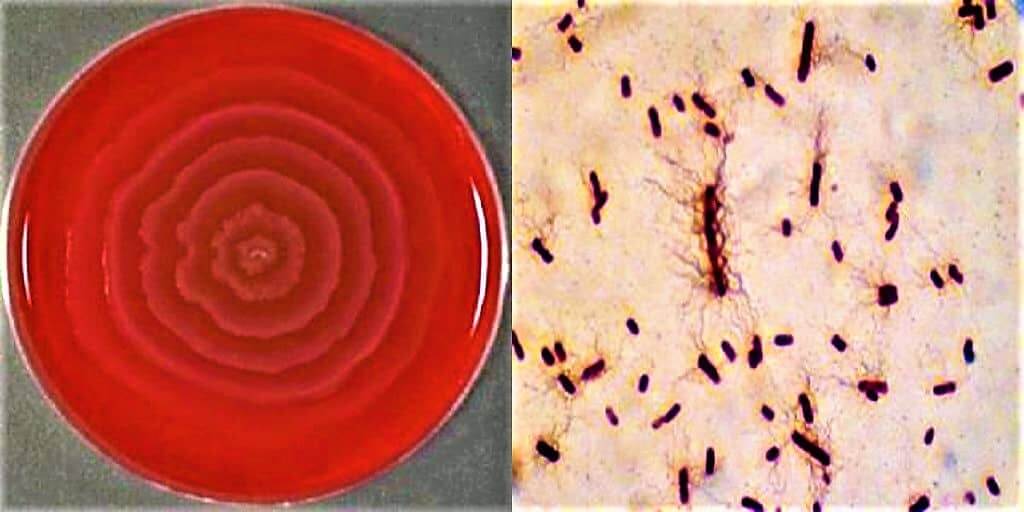 Thistle, Thistle.co, www.thistle.co.za/pdf_files/education/microbiology/microbiology_legends/Cycle_41/Cycle%2041%20Organism%203%20-%20Proteus%20Vulgaris.pdf.
Thistle, Thistle.co, www.thistle.co.za/pdf_files/education/microbiology/microbiology_legends/Cycle_41/Cycle%2041%20Organism%203%20-%20Proteus%20Vulgaris.pdf.
внешние ссылки
Бактериофаг колипротейный инструкция по применению: показания, противопоказания, побочное действие – описание Bacteriophagum coliprotei р-р д/приема внутрь, местн. и наружн. прим. 100 мл: фл. 1 шт. (36443)
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости.
Рекомендуемые дозировки препарата
| Возраст пациента | Доза на 1 прием (мл) | |
| внутрь | в клизме | |
| 0-6 мес | 5 | 5-10 |
| 6-12 мес | 10 | 10-20 |
| от 1 года до 3 лет | 15 | 20-30 |
| от 3 до 8 лет | 15-20 | 30-40 |
| от 8 лет и старше | 20-30 | 40-50 |
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и приемом препарата внутрь в течение 7-20 дней (по клиническим показаниям).
В случае если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9 % раствором натрия хлорида.
В зависимости от очага инфекции бактериофаг применяют:
1. В виде орошения, примочек и тампонирования в объеме до 200 мл в зависимости от размеров пораженного участка. При абсцессе после удаления гнойного содержимого с помощью пункции препарат вводят в количестве меньшем, чем объем удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
2. При введении в полости (плевральную, суставную и другие ограниченные полости) до 100 мл, после чего оставляют капиллярный дренаж, через который бактериофаг вводят в течение нескольких дней.
3. При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
4. При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно, при кольпите — по 10 мл орошением или тампонированием 2 раза в день. Тампоны закладывают на 2 часа.
5. При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введение смоченных турунд (оставляя их на 1 час).
6. При энтеральных инфекциях, дисбактериозе кишечника препарат принимают внутрь 3 раза в день за 1 ч до приема пищи. Возможно сочетание двукратного приема внутрь с однократным ректальным введением разовой возрастной дозы бактериофага в виде клизмы после опорожнения кишечника.
Применение бактериофага у детей (до 6 месяцев).
При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки в дозе 5-10 мл. При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в виде высоких клизм) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалита, пиодермии, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или пораженный участок кожи).
Протейная инфекция — Удмуртский ветеринарно-диагностический центр
За прошедшие две недели сотрудниками бактериологического отдела было выявлено
4 случая протейной инфекции:
-1 случай в мясе вынужденного убоя от крупного рогатого скота;
-2 случая в материале от птицы;
-1 случай в корме растительного происхождения.
Инфекции, вызванные протеем, в настоящее время приобретают все большее распространение в силу совершенствования методов выявляемости.
Так кто же такой протей и чем он опасен.
Протейная инфекция — энтеробактериальная болезнь молодняка животных, в том числе птиц, характеризующаяся нарушением пищеварения.
Возбудитель. Болезнь вызывают кишечные бактерии из семейства Enterobacteriaceae. Род Proteus характеризуют полиморфность палочек грамнегативность, отсутствие образования спор и капсул, подвижность за счет перитрихиальных жгутиков.
Выделяют несколько видов протея: Proteus mirabilis, Proteus vulgaris, Proteus myxofaciens, Proteus hauseri, Proteus penneri.
В этиопатогенезе кишечных расстройств у молодняка участвуют в основном P. vulgaris и P. mirabilis. Эти виды протея — наиболее часто выделяемые и патогенные для животных, в том числе птиц. Из лабораторных животных к парентеральному введению протея чувствительны белые мыши, кролики, морские свинки. Являясь слабовирулентными, протейные палочки становятся причиной болезни ослабленного молодняка, наиболее подверженного стрессам, находящегося в иммунодепрессивном состоянии. Кроме того, протейные инфекции часто развиваются вторично при дисбактериозах неспецифического характера (диспепсия, гастроэнтериты) и при вирусной инфекции. Пассажируясь через ослабленных животных, возбудитель накапливает вирулентность и выделяется в больших количествах с фекальными массами больных животных. Это служит причиной заражения молодняка остального поголовья, что приводит, несомненно, к нежелательным финансовым растратам. Палочки протея выделяют из ран, среднего уха при отитах, смывов с глазного яблока при керато-конъюнктивальных поражениях, дерматитных и язвенных поражений межпальцевых пространств, ногтевого ложа, носового хода животных практически всех видов, в том числе птиц, а также человека..
Являясь слабовирулентными, протейные палочки становятся причиной болезни ослабленного молодняка, наиболее подверженного стрессам, находящегося в иммунодепрессивном состоянии. Кроме того, протейные инфекции часто развиваются вторично при дисбактериозах неспецифического характера (диспепсия, гастроэнтериты) и при вирусной инфекции. Пассажируясь через ослабленных животных, возбудитель накапливает вирулентность и выделяется в больших количествах с фекальными массами больных животных. Это служит причиной заражения молодняка остального поголовья, что приводит, несомненно, к нежелательным финансовым растратам. Палочки протея выделяют из ран, среднего уха при отитах, смывов с глазного яблока при керато-конъюнктивальных поражениях, дерматитных и язвенных поражений межпальцевых пространств, ногтевого ложа, носового хода животных практически всех видов, в том числе птиц, а также человека..
Восприимчивые животные. Преимущественно телята первых трех недель жизни, поросята до 2-месячного возраста. . Протей может быть причиной пищевых токсикоинфекций человека.
. Протей может быть причиной пищевых токсикоинфекций человека.
Основой постановки диагноза являются бактериологические исследования с обязательной постановкой биопробы.
Дифференциальный диагноз. Протейную инфекцию дифференцируют от сходно протекающих заболеваний молодняка: эшерихиоза, сальмонеллеза, клебсиеллеза, псевдомоноза, стрептококкоза, диспепсии, рота-, корона-, парво-, аденовирусных инфекций, вирусной диареи, дизентерии свиней. Дифференциальная лабораторная диагностика протейной инфекции не вызывает затруднений — протей легко отличим по культуральным свойствам.
Чем опасны бактерии рода Proteus в продуктах питания
Микробиологические исследования на обнаружение бактерий рода Proteus в пищевых продуктах, а также присутствие данных микроорганизмов на объектах окружающей среды в сфере пищевого производства и оборота пищевых продуктов, проводят в отделе исследований и анализа сектор ветеринарно- санитарных исследований ФГБУ «Центральная научно-производственная радиологическая лаборатория».
Протей – Proteus vulgaris (ползучий) микроорганизм из группы условно-патогенных, относящийся к семейству энтеробактерий (Еnterobacteriaceae), порядку Enterobacteriales, классу гамма-протеобактерии, типу протеобактерии (Proteobacteria). Они являются своеобразным «индикатором гнилостной порчи» пищевого продукта.
В соответствии с техрегламентом Таможенного союза «О безопасности пищевой продукции», доброкачественные продукты — колбасные изделия, студни, жареная птица, кулинарные изделия из рубленого мяса не должны содержать бактерий рода Proteus. Поэтому важно уделять большое внимание производственному контролю на предприятиях по роду деятельности, связанные с пищевыми продуктами.
Кроме микробиологического исследования сырья и готовой пищевой продукции необходимо исследовать смывы с объектов окружающей среды (со спецодежды и рук работников, с оборудования, инвентаря, посуды, столовых приборов).
Работник-бактерионоситель может инфицировать любой продукт или блюдо. Протейные палочки длительно сохраняются и размножаются в пищевых продуктах. Чаще всего токсикоинфекции, вызываемые протеями, связаны с употреблением белковых продуктов: мясных продуктов и изделий, мясных салатов, рыбы и рыбных изделий, паштетов и др. Изменения органолептичсских свойств пищи не происходит.
Чаще всего токсикоинфекции, вызываемые протеями, связаны с употреблением белковых продуктов: мясных продуктов и изделий, мясных салатов, рыбы и рыбных изделий, паштетов и др. Изменения органолептичсских свойств пищи не происходит.
Источником инфицирования блюд очень часто являются загрязненные остатками пищи посуда, инвентарь и оборудование. Обсеменение может происходить при использовании одних и тех же разделочных досок, ножей, мясорубок для сырых и вареных продуктов.
Так как протейная палочка погибает при тепловой обработке, обнаружение ее в готовой продукции говорит о нарушениях режима тепловой обработки или плохой санитарной обработке инвентаря, посуды и оборудования, а также несоблюдении условий хранения и и сроков реализации.
Более подробно читайте на сайте www.fgu-radiovetlab.ru
На правах рекламы.
Proteus (бактерії) — Вікіпедія
Матеріал з Вікіпедії — вільної енциклопедії.
У Вікіпедії є статті про інші значення цього терміна: Протей.Проте́й (Proteus) — рід бактерій, що відносяться до родини Enterobacteriaceae.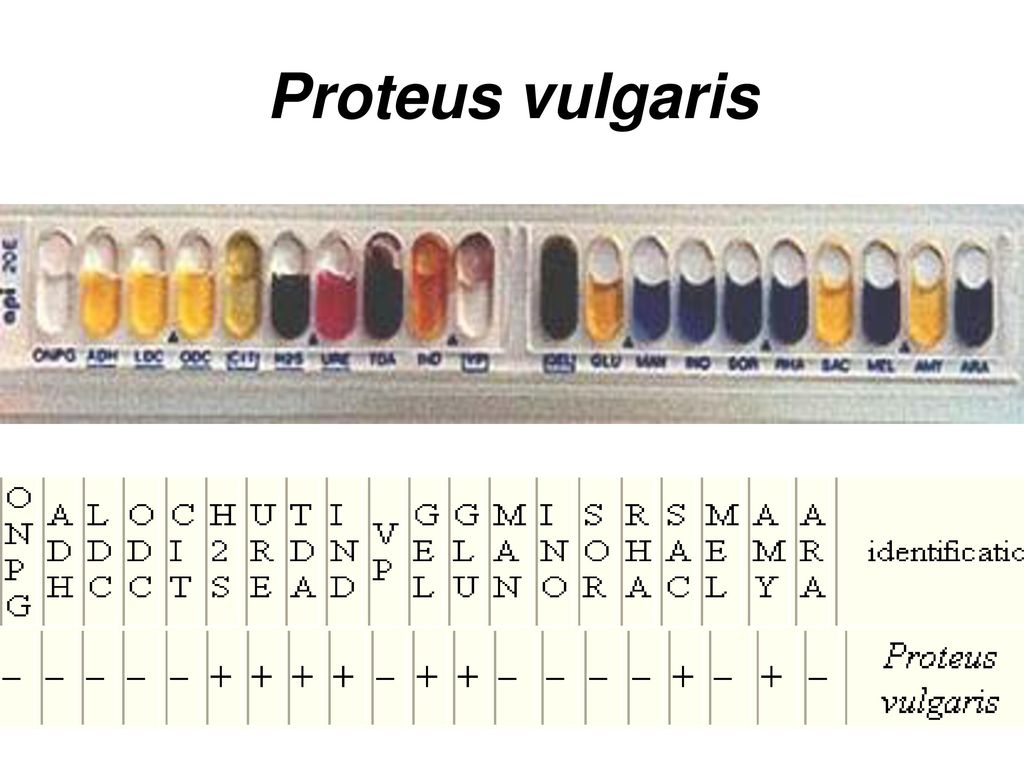 Представник нормальної, умовно-патогенної мікрофлори кишечника людини.
Представник нормальної, умовно-патогенної мікрофлори кишечника людини.
Всі представники роду Proteus — грам-негативні палички із закругленими кінцями, розміром 0,4 — 0,6 мкм у товщину і 1 — 3 мкм у довжину. Спор і капсул не утворюють, є перитрихами. Схильні до поліморфізму, спостерігаються коковидні і ниткоподібні форми. Іноді зустрічаються і нерухомі варіанти, позбавлені джгутиків (О-форма). Факультативні анаероби, хемоорганотрофи.
Протей добре росте на звичайних поживних середовищах. На щільних середовищах утворює два види колоній: великі, прозорі, з рівними краями (О-форма) і колонії, що утворюють на поверхні середовища суцільний хвилеподібний наліт — так званий феномен роїння (Н-форма).
Для бактерій з роду Proteus оптимальна температура росту 25 — 37 °C; гинуть при 60 °C протягом 1 години, при 80 °C — за 5 хвилин. Бактерії стійкі до низьких температур, переносять триразове поперемінне заморожування і відтавання. 1%-ний розчин фенолу викликає загибель протея через 30 хвилин.
Ферментативні властивості[ред. | ред. код]
Представники роду Proteus ферментують глюкозу з утворенням кислоти і невеликої кількості газу, не ферментують лактозу і маніт, стійкі до ціаніду, утворюють уреазу і фенілаланіндезаміназу. Залежно від здатності продукувати індол, протеї поділяються на індол-негативні та індол-позитивні.
Протей відноситься до числа умовно-патогенних бактерій і може бути причиною токсикоінфекцій, диспепсій і різних гнійних захворювань.
Як санітарно-показові мікроорганізми бактерії роду Proteus разом з Є. coli, ентерококом, Cl. perfringens і бактеріофагом застосовують для санітарно-гігієнічної оцінки ґрунту, води відкритих водойм. Кількість виявлених Proteus mirabilis розглядають як показник фекального забруднення, а Proteus vulgaris — як показник забруднення об’єкта органічними речовинами.
Назва бактерій — це ім’я сина грецького бога Посейдона, Протея, відомого своєю здатністю змінювати обличчя. Ця назва була дана протею не випадково — в залежності від середовища, віку колонії, присутності різних хімічних сполук ці бактерії здатні змінювати свій зовнішній вигляд.
Ця назва була дана протею не випадково — в залежності від середовища, віку колонії, присутності різних хімічних сполук ці бактерії здатні змінювати свій зовнішній вигляд.
- Климнюк С. І., Ситник І. О., Творко М. С., Широбоков В. П. Практична мікробіологія: Посібник.—Тернопіль: Укрмедкнига, 2004. ISBN 966-673-059-6
- Коротяев А. И. Медицинская микробиология. иммунология и вирусология: учебник / А. И. Коротяев, С. А. Бабичев. — 5-е изд., СПб. : СпецЛит, 2012. ISBN 978-5-299-00425-0
Анализ чувствительности бактерий семейства Enterobacteriaceae к антибиотикам
Цитировать:
Джамбетова П.М., Бисултанова З.И., Джамбетова Л.М. Анализ чувствительности бактерий семейства Enterobacteriaceae к антибиотикам // Universum: химия и биология : электрон. научн. журн. 2018. № 7 (49). URL: https://7universum.com/ru/nature/archive/item/6118 (дата обращения: 07.02. 2021).
2021).
Прочитать статью:
АННОТАЦИЯ
Изучены 200 образцов биоматериала больных кишечными инфекция г.Грозного. В 99 пробах были обнаружены представители семейства Enterobacteriaceae: выявлены виды E.coli и Klebsiellaрneumonia, Р. mirabilis, Р. vulgaris, относящиеся к трем родам: Escherichia, Klebsiella и Рroteus, устойчивые к ряду наиболее часто используемых в терапии антибиотиков.
ABSTRACT
200 samples of biomaterial of patients with intestinal infection of Grozny were studied. In 99 samples, representatives of the Enterobacteriaceae family were found: E. coli and Klebsiella pneumonia, P. mirabilis, P. vulgaris, belonging to three genera: Escherichia, Klebsiella and Proteus, were found to be resistant to a number of antibiotics most frequently used in therapy.
Ключевые слова: антбиотики, кишечные инфекции, устойчивость, семейство Enterobacteriaceae.
Keywords: antibiotic, intestinal infections, resistance, family Enterobacteriaceae.
К проблеме человечества остаться без защиты от болезнетворных бактерий, привлекла внимание Всемирная организация здравоохранения (ВОЗ) в опубликованном в сентябре 2017 года в Женеве докладе (www.who.int/ru, 2017). ВОЗ опубликовала список 12 видов бактерий, “приоритетных патогенов”, в котором бактерии разделены на три группы по уровню потребности в создании новых антибиотиков: крайне приоритетные, высокоприоритетные и среднеприоритетные. Бактерии семейства Enterobacteriacea внесены в 1-ую категорию приоритетности: критически высокий уровень патогенности (www.who.int/ru, 2017). Бактериальные патогены, вызывающие инфекции человека, претерпевают эволюционные изменения в условиях антропогенной трансформации внешней среды, путей передачи инфекции и восприимчивости к ним человеческой популяции [Alekshun, Levy, 2007; Biswas, Raoult, Rolain, 2008; Courvalin, 2006; Nikaido, 2009; Ramirez et al. , 2010; Singh et al., 2012].
, 2010; Singh et al., 2012].
На сегоднящний день, при выборе антимикробных препаратов полагаться на данные литературы нельзя, нужно знать спектр микрофлоры и ее резистентность в своем регионе, так как эти параметры чрезвычайно изменчивы в зависимости от популяции [Шевченко, 2015]. В связи с чем, целью данной работы является изучение чувствительности бактерий семейства энтеробактерий к антибиотикам в Чеченской Республике.
Материалы и методы. Всего было исследовано 200 образцов биоматериала, из них в 99 образцах были обнаружены штаммы семейства Enterobacteriaceae. Определение антибиотикоустойчивости микроорганизмов проводили в соответствии с общепринятыми методиками.
Исследована резистентность к 13 антимикробным препаратам (АМП), принадлежащим к семи фармакологическим группам: пенициллины, карбапенемы, монобактамы, цефалоспорины, аминогликозиды, фторхинолоны, тетрациклины, сульфаниламиды [Определение чувствительности микро, 2004].
Для части культур анализ проводили на комбинированных панелях для грамотрицательных, грамположительных микроорганизмов и стрептококков с применением полуавтоматической системы идентификации микроорганизмов и определения антибиотикочувствительности Microscan AutoScan-4 S («Siemens», США). Работа проводилась в бактериологической лаборатории ЦКП ФГБОУ ВО «Чеченский государственный университет»
Работа проводилась в бактериологической лаборатории ЦКП ФГБОУ ВО «Чеченский государственный университет»
Результаты исследования. В 200 образцах биоматериала было идентифицировано 160 микроорганизмов из различных семейств. В 99 пробах были обнаружены представители семейства Enterobacteriaceae: выявлены виды E.coli и Klebsiellaрneumonia, Р. mirabilis, Р. vulgaris, относящиеся к трем родам: Escherichia, Klebsiella и Рroteus.
В таблице 1 представлены данные о спектре и общем количестве выявленных штаммов семейства Enterobacteriaceae, обнаруженных в исследованном биоматериале, их видовая принадлежность.
Таблица 1.
Состав и частота встречаемости штаммов семейства Enterobacteriaceae
|
Штаммы |
Число штаммов |
% |
|
Echerichia. |
56 |
56,5 |
|
Klebsiellaрneumonia |
25 |
25,3 |
|
Рroteus mirabilis, |
10 |
10,1 |
|
Рroteus vulgaris |
8 |
8,1 |
|
всего |
99 |
100 |
Как мы видим, в этиологии заболеваний, обусловленных действием энтеробактерий, ведущее место занимают штаммы E. coli,K. рneumonia (табл.1). Наши данные согласуются с результатами других исследователей, проведенных в различных лечебно-профилактических учреждений которые показывают преобладание грамотрицательных микроорганизмов, среди которых наиболее распространены Escherichia coli (хотя и с меньшей частотой по сравнению с полученными результатами) и ряд других микроорганизмов (Киреев, Матвеенкова, 2014).
coli,K. рneumonia (табл.1). Наши данные согласуются с результатами других исследователей, проведенных в различных лечебно-профилактических учреждений которые показывают преобладание грамотрицательных микроорганизмов, среди которых наиболее распространены Escherichia coli (хотя и с меньшей частотой по сравнению с полученными результатами) и ряд других микроорганизмов (Киреев, Матвеенкова, 2014).
Выявленные микроорганизмы были чувствительны к 16 наиболее часто используемым в клинической практике антибиотикам (табл. 2).
Таблица 2.
Количество штаммов бактерий, устойчивых к антибиотикам
|
№ |
Антибиотики |
E.coli |
K. |
Р.mirabilis |
Р.vulgaris |
|
|
ципрофлоксацин |
37 |
15 |
10 |
2 |
||
|
амикацин |
21 |
6 |
— |
— |
||
|
ампициллин/сульбактам |
34 |
16 |
5 |
2 |
||
|
цефоперазон |
38 |
13 |
2 |
1 |
||
|
ампициллин |
29 |
12 |
10 |
8 |
||
|
цефазолин |
22 |
12 |
7 |
4 |
||
|
цефепим |
23 |
15 |
7 |
8 |
||
|
цефотаксим |
10 |
13 |
2 |
6 |
||
|
амоксициллин/клавуланат |
13 |
6 |
5 |
4 |
||
|
цефуроксим |
26 |
15 |
4 |
1 |
||
|
гентамицин |
22 |
6 |
7 |
7 |
||
|
тетрациклин |
18 |
5 |
— |
|||
|
цефтазидим |
21 |
9 |
5 |
6 |
||
|
моксифлоксацин |
20 |
2 |
1 |
— |
||
|
меропенем |
3 |
— |
— |
— |
||
|
левофлоксацин |
12 |
2 |
1 |
1 |
||
|
Примечание: «-» — чувствительность к препарату не определялась |
||||||
Высокую степень устойчивости к большинству использованных в работе антибиотиков показали представители рода Рroteus, чаще всего их резистентность определялась в отношении ципрофлоксацина и ампицилина.
Наиболее антибиотикоустойчивыми оказались штаммы E.coli. Проанализировав данные по чувствительности микроорганизмов из числа используемых для определения резистентности антимикробных препаратов, было получено, что 66% штаммов E.coli обладали устойчивостью к ципрофлоксацину, ампициллин/сульбактаму, цефоперазону. K. рneumoniae устойчива также к ципрофлоксацину, ампициллин/ сульбактаму, цефепиму (табл. 2).
При определении комплексной чувствительности к антибиотикам 63,0% штаммов E.coli оказались устойчивыми к комплексу из трех антибиотиков: ципрофлоксацин, ампициллин/сульбактам, цефоперазон; 54,2% K.рneumoniae показали устойчивость к комплексу из пяти антибиотиков: ципрофлоксацин, ампициллин/сульбактам, цефтазидим, цефепим и 27,4% Р. mirabilis устойчивы к ципрофлоксацину, ампициллину (табл. 3).
Таблица 3.
Множественная устойчивость к антибиотикам ведущих представителей семейства Enterobacteriaceae
|
Антибиотики |
Штамм |
Количество штаммов |
% от общего числа штаммов |
|
ципрофлоксацин, ампициллин/сульбактам, цефоперазон |
E. |
36 |
63,0 |
|
ципрофлоксацин, ампициллин/сульбактам, цефтазидим, цефепим |
K.рneumoniae |
13 |
54,2 |
|
ципрофлоксацин, ампициллин |
Р. mirabilis |
3 |
27,4 |
С учетом полученных результатов (табл. 2,3) можно сделать вывод о практически полной утрате вышеперечисленных антимикробных препаратов способности подавлять рост патогенных бактерий семейства Enterobacteriaceae.
Таким образом, своевременное выявление изменений в распространении бактериальной резистентности к антибиотикам, имеет важное практическое и теоретическое значение, так как позволяет корректировать рекомендации по антибактериальной терапии нозокомиальных инфекций, разрабатывать экспрессные молекулярные методы детекции антибактериальной резистентности, дает важную информацию для создания новых препаратов, преодолевающих резистентность.
Список литературы:
1. Киреев С.С., Матвеенкова Л.В. Интенсивная терапия внутрибольничной инфекции в отделении реанимации и интенсивной терапии // Вестник новых медицинских технологий – 2014 – Т . 21, № 4 – С.23-26. DOI: 10.12737/7277
2. Определение чувствительности микроорганизмов к антибактериальным препаратам: Методические указа-ния. //М.: ФЦ Госсанэпиднадзора Минздрава России, 2004. — 91 с.
3. Шевченко С.Ю. Частота встречаемости госпитальных уропатогенов и динамика их чувствительности / Е.В. Кульчавеня, А.Г. Чередниченко, А.И. Неймарк, С.Ю. Шевченко //Урология. 2015. – № (2). – С.13-16.
4. Alekshun M., Levy S., Molecular Mechanisms of Antibactial //Multidrug Resistance. Cell., 2007. — №128. – Р.1037 – 1050.
5. Biswas S., Raoult D., Rolain J.-M. A bioinformatic aррroach to understanding antibiotic resistance in intracellular bacteria through whole genome analysis. //Int. J. Antimicrob. Agents, 2008. — №32. – Р. 207-220.
6. Bush K , Jacoby GA, Medeiros AA. A functional classification scheme for beta-lactamases and its correlation with molecular structure. //Antimicrob Agents Chemother., 1995 . — №39(6). – Р. 1211-33.
A functional classification scheme for beta-lactamases and its correlation with molecular structure. //Antimicrob Agents Chemother., 1995 . — №39(6). – Р. 1211-33.
7. Courvalin Р. Vancomycin resistance in gram-рositive cocci. //Clin Infect Dis., 2006. — № 42 (Suррl 1). – Р. 25-34.
8. Nikaido H. Multidrug resistance in bacteria. //Annu Rev Biochem., 2009. -№78. – Р.119-146.
9. Ramirez M., Tolmasky M. Aminoglycoside modifying enzymes. //Drug Res. Uрdat., 2010. — №13. – Р.151 – 171.
10. Singh M., Dominy B. The evolution of cefotaximase activity in the TEM β-lactamase. J. Mol. Biol.,2012. — № 415. – Р.205 – 220.
11. www.httр://tass.ru/obschestvo/4575496
12. www.who.int/ru
Инфекций Proteus: история вопроса, патофизиология, эпидемиология
Автор
Ширин А. Мазумдер, доктор медицины, FIDSA Доцент медицины, директор программы стипендий по инфекционным заболеваниям, Отделение инфекционных заболеваний, Департамент внутренней медицины, Медицинский научный центр Университета Теннесси Медицинский колледж, Врачи-методисты Университета Теннесси
Ширин А. Мазумдер, доктор медицины, FIDSA является членом следующих медицинских обществ: Американской академии медицины ВИЧ, Американского колледжа врачей, Американской медицинской ассоциации, Ассоциации медицины ВИЧ, Общества инфекционных болезней Америки, Медицинского общества Мемфиса, Общества эпидемиологии здравоохранения Америки. , Tennessee Medical Association
Мазумдер, доктор медицины, FIDSA является членом следующих медицинских обществ: Американской академии медицины ВИЧ, Американского колледжа врачей, Американской медицинской ассоциации, Ассоциации медицины ВИЧ, Общества инфекционных болезней Америки, Медицинского общества Мемфиса, Общества эпидемиологии здравоохранения Америки. , Tennessee Medical Association
Раскрытие информации: не раскрывать.
Специальная редакционная коллегия
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Получил зарплату от Medscape за работу. для: Medscape.
Аарон Глатт, доктор медицины Председатель медицинского отдела, начальник отдела инфекционных заболеваний, эпидемиолог больницы, Больница сообществ Южного Нассау
Аарон Глатт, доктор медицины, является членом следующих медицинских обществ: Американская ассоциация руководителей врачей, Американский колледж врачей-терапевтов, Американский колледж врачей, Американский колледж врачей-Американское общество внутренней медицины, Американская медицинская ассоциация, Американское общество микробиологии, Американское торакальное общество, Американская ассоциация венерических заболеваний, Американское общество инфекционных заболеваний, Международное общество по СПИДу, Общество Эпидемиология здравоохранения Америки
Раскрытие информации: нечего раскрывать.
Главный редактор
Майкл Стюарт Бронз, доктор медицины Дэвид Росс Бойд Профессор и председатель медицинского факультета, кафедра внутренних болезней, кафедра медицины, Научный центр здравоохранения Университета Оклахомы; Магистр Американского колледжа врачей; Научный сотрудник Американского общества инфекционных болезней; Член Королевского колледжа врачей, Лондон
Майкл Стюарт Бронз, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американская медицинская ассоциация, Ассоциация профессоров медицины, Общество инфекционных болезней Америки, Государственная медицинская ассоциация штата Оклахома, Южное общество клинических исследований
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Гас Гонсалес, доктор медицины Медицинский онколог, Медицинский центр Кокса Брэнсон и CoxHealth Springfield
Гас Гонсалес, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей — Американское общество внутренней медицины
Раскрытие информации: раскрывать нечего.
Благодарности
Ретт Л. Джексон, доктор медицины Адъюнкт-профессор и заместитель председателя по вопросам образования медицинского факультета, директор программы резидентуры по внутренним болезням Медицинского колледжа Университета Оклахомы; Помощник начальника медицинской службы больницы по делам ветеранов Оклахома-Сити
Ретт Л. Джексон, доктор медицины, является членом следующих медицинских обществ: Американского колледжа врачей-Американского общества внутренней медицины и Американской медицинской ассоциации
Раскрытие: Ничего не раскрывать.
Келли Страбл, научный сотрудник DO , факультет инфекционных болезней, Медицинский колледж Университета Оклахомы
Kelley Struble, DO является членом следующих медицинских обществ: Американского колледжа врачей и Общества инфекционистов Америки
webmd.com»> Раскрытие: Ничего не раскрывать.Классификация, идентификация и клиническое значение Proteus, Providencia и Morganella
Текущая классификация Род Providencia состоит из пяти видов: P.alcalifaciens , P. heimbachae , P. rettgeri , P. rustigianii и P. stuartii .
В 1904 году Реттгер изолировал ранее неописанный организм от цыплят во время эпидемии, напоминающей птичью холеру, но он не подвергал этот изолят подробному исследованию до 14 лет спустя, когда он был дополнительно охарактеризован и назван Bacterium rettgerei Hadley et al. . (Таблица 2) (41).
В 1920 году Орнштейн описал организм, который назвал Bacillus inconstans (75).Этот штамм был выделен из кишечника человека и позже будет определен как первое описание штамма рода Providencia . За прошедшие годы во многих литературных источниках, включая Шоу и Кларк (88), работа Орнштейна была опубликована в 1921 году. Однако первоначальная публикация, а также издание 1921 года издания Index Medicus (36) показали что эта работа была фактически опубликована в 1920 году.
Однако первоначальная публикация, а также издание 1921 года издания Index Medicus (36) показали что эта работа была фактически опубликована в 1920 году.
В 1941 году Рустигиан и Стюарт изучили штамм, обозначенный 33111, и узнали, что он легко атакует мочевину (83).В следующем году Коуп и Киландер опубликовали исследование группы из 83 «атипичных» организмов, которые были биохимически похожи на « Shigella paradysenteriae » Flexner, но были антигенно отличны от хорошо известных типов Shigella (17). В 1943 году Стюарт и др. В сотрудничестве с Копом осознали, что обе их лаборатории изучали один и тот же организм, чьи штаммы тогда насчитывали 48, и что эти организмы явно принадлежали к роду Proteus (98).Эти штаммы были положительными как в отношении мочевины, так и индола, как и штаммы Shigella rettgeri , изученные Сент-Джон-Брукс 20 лет назад (97). В 1942 г. Нетер уже предлагал исключить « S. rettgeri » из рода Shigella (70), и теперь это предложение имело достаточное обоснование. Рустигиан и Стюарт рекомендовали переопределить эти штаммы как Proteus rettgeri , хотя, в отличие от других Proteeae , они были положительными по ферментации d-маннита (84).
Рустигиан и Стюарт рекомендовали переопределить эти штаммы как Proteus rettgeri , хотя, в отличие от других Proteeae , они были положительными по ферментации d-маннита (84).
Изменения претерпела и классификация аналогичной группы организмов, именуемой «анаэрогенный параколон 29911» (98). В 1943 году Стюарт первоначально изучил 23 из этих штаммов, которые не были Proteeae , потому что не было гомологичных реакций с антисывороткой Proteus . В следующем году Гомес описал « Eberthella alcalifaciens » (38), который позже стал типовым видом Providencia . В 1951 году Кауфманн обозначил анаэрогенные штаммы параколон 29911 Стюарта (1943) как группу Провиденс, поскольку Стюарт работал в Университете Брауна в Провиденсе, Р.И. (53). Кауфманн показал, что единственное достоверное различие между этими штаммами Providence и штаммами из рода Proteus заключается в неспособности штаммов Providence разлагать мочевину. Еще 35 штаммов группы Providence, выделенных из образцов мочи, были описаны Бруком в 1951 г.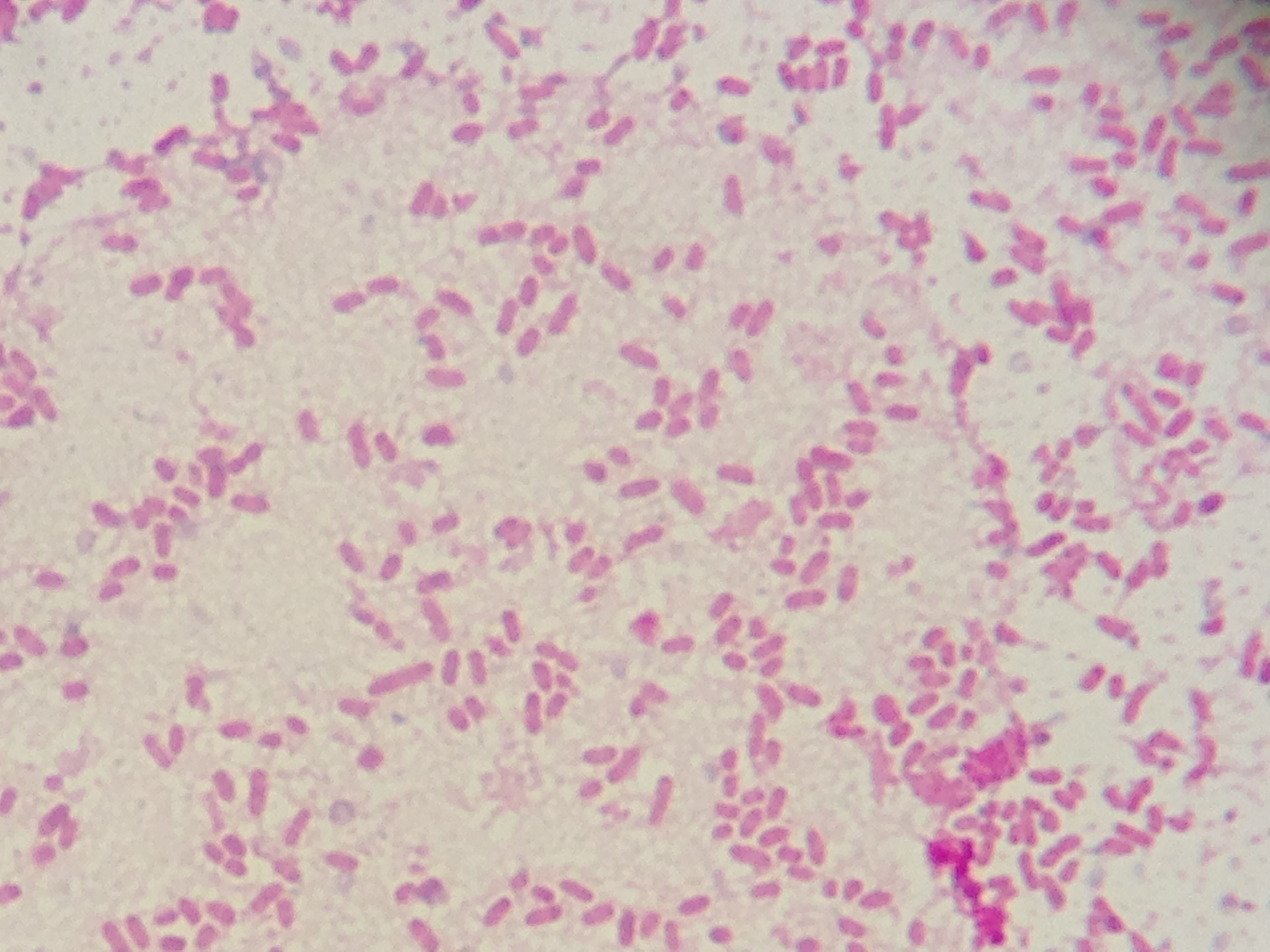 (11). К 1952 году Кауфманн и Эдвардс отнесли к этой группе род Providencia с видом providenciae (56).
(11). К 1952 году Кауфманн и Эдвардс отнесли к этой группе род Providencia с видом providenciae (56).
В период с 1952 по 1962 год этот род характеризовался значительной таксономической нестабильностью.В другом предложении в 1953 году Кауфман создал отдельный род для Proteus rettgeri , который получил название « Rettgerella » (54). Он изменил это мнение в 1954 г. (55).
В 1954 г. Сингер и Бар-Чай предложили (92), а Буттио и др. предложили (13) отнести группу Провиденс Стюарт к роду Proteus как Proteus stuartii , потому что их физиологические характеристики запаха, а также их биохимические характеристики были так похожи на таковые у Proteus rettgeri .Сингер также установил, что превращение фенилаланина в фенилпировиноградную кислоту было ценным дифференциальным тестом для отделения группы Proteus -Providence, положительных в этом тесте, от других членов группы Enterobacteriaceae , все из которых считались таковыми.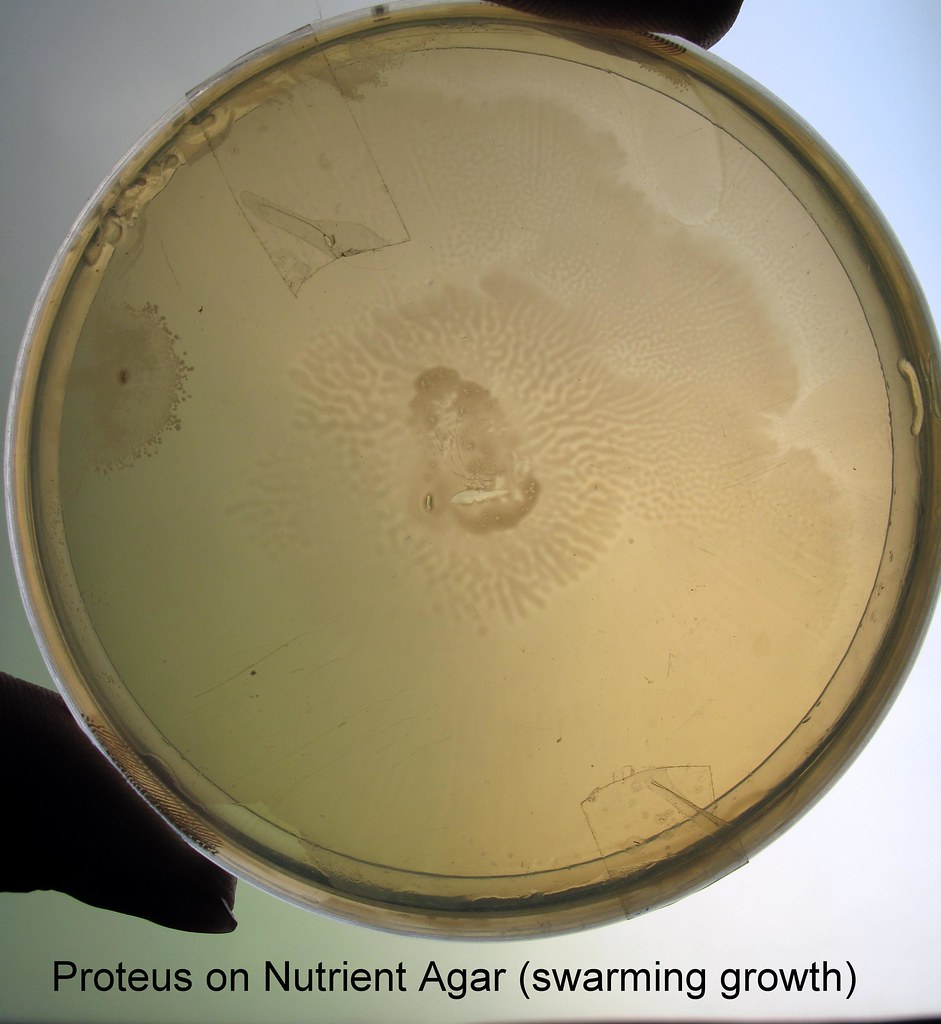 время быть отрицательным в этом тесте.
время быть отрицательным в этом тесте.
Ewing et al., Также в 1954 году, дополнительно разделили группу Провиденс на две биохимические группы, обозначенные 1 и 2, на основе образования газа из глюкозы, а также моделей ферментации адонита и инозита (28).Они также сообщили, что штаммы Providence оказались промежуточной группой между Proteus morganii и Proteus rettgeri , но отличались от видов Proteus на основании их неспособности использовать мочевину.
В 1955 году Шоу и Кларк, используя дополнительные биохимические тесты, смогли укрепить родство культур группы Провиденс с культурами рода Proteus . Они писали, что первое описанное описание культуры Providence оказалось описанием « Bacillus inconstans » Орнштейна 1920, так что типовым видом изолятов Providence на самом деле должен быть Proteus inconstans (88).В том же журнале в том же месяце Проом привел веский аргумент против включения группы Providence и штаммов P. rettgeri в род Proteus , поскольку некоторые из их биохимических характеристик отличались от таковых у других представителей этого рода. Его альтернативой было создание нового рода, включающего группу Providence и изолятов Proteus rettgeri (79).
rettgeri в род Proteus , поскольку некоторые из их биохимических характеристик отличались от таковых у других представителей этого рода. Его альтернативой было создание нового рода, включающего группу Providence и изолятов Proteus rettgeri (79).
В статьях 1958 и 1962 годов, которые можно было бы считать знаковыми, Юинг рассмотрел таксономию Proteeae (25, 26).Он согласился с тем, что группа Providence не может быть включена в род Proteus , и заявил, что правильным родовым термином для группы Providencia должно быть Providencia , а правильным названием вида — Providencia inconstans . Однако он также утверждал, что не было достаточных доказательств для исключения Proteus rettgeri из рода Proteus или создания этого нового рода, содержащего только группу Providence и Proteus rettgeri .Он также предположил, что существующий род Morganella , впервые предложенный в 1943 г. (35), может включать виды morganii , rettgeri и inconstans . Судя по всему, это предложение так и не было принято Судебной комиссией.
Судя по всему, это предложение так и не было принято Судебной комиссией.
В отчете 1962 года Юинг счел специфический эпитет « Providernciae » недействительным, поскольку этот вид не был ни определен, ни охарактеризован (26). Однако была доступна оригинальная культура Eberthella alcalifaciens de Salles Gomes 1944, которая была определена, охарактеризована и достоверно опубликована (38).Фенотипически было показано, что E. alcalifaciens очень похож на описание штаммов Providencia . Юинг был удовлетворен тем, что фенотипические характеристики были достаточно похожи, чтобы рекомендовать типовой вид для Providencia Providencia alcalifaciens . В результате продолжающейся работы Providencia, подгруппы A и B Юинга теперь могут быть еще более четко разделены. Подгруппа A стала P. alcalifaciens , а подгруппа B стала P.stuartii (26). Десять лет спустя, в 1972 году, Ewing et al. выделили четыре биогруппы из P.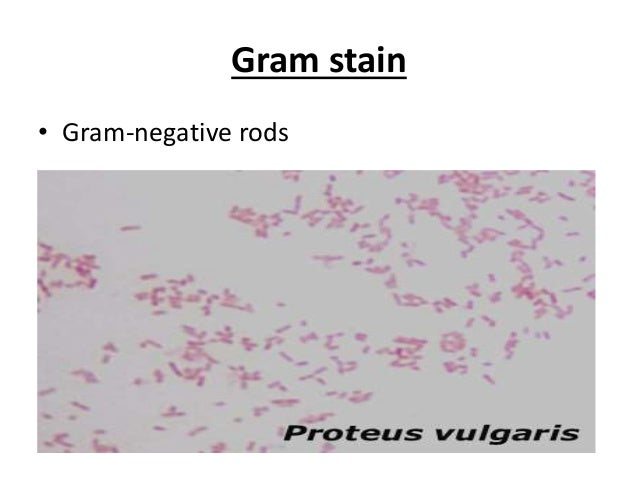 alcalifaciens и две биогруппы из P. stuartii на основе образования газа из глюкозы и производства кислоты из адонита и инозита (27).
alcalifaciens и две биогруппы из P. stuartii на основе образования газа из глюкозы и производства кислоты из адонита и инозита (27).
Способность Proteus rettgeri продуцировать кислоту из салицина, l-рамнозы, d-маннита, адонита, d-арабита и эритрита легла в основу, использованную Penner et al. в 1975 г. разделить эти штаммы на пять биогрупп (77).Два года спустя Farmer et al. (30) предложили реклассифицировать P. rettgeri биогруппы 5 как Providencia stuartii с положительной мочевиной.
В исследовании 1978 года Brenner et al. переклассифицировали несколько организмов на основе гибридизации ДНК-ДНК (9). Proteus rettgeri стал Providencia rettgeri , и было подтверждено отнесение Proteus rettgeri биогруппы 5 к роду Providencia как P. stuartii .
Гибридизация ДНК в 1983 г. дала P.alcalifaciens биогруппа 3 была названа Providencia rustigianii в честь Роберта Рустигиана, который провел ранние исследования группы Proteus (48). Этот отчет также подтвердил, что P. alcalifaciens биогруппы 4 совпадают с P. stuartii . Четыре вида Providencia теперь можно разделить по их способности гидролизовать мочевину и производить кислоту из — -инозита, адонита, d-арабита, трегалозы и d-галактозы. Позже в том же году Мюллер, работавший независимо в Германии, опубликовал отчет с описанием Providencia Friedericiana , который был выделен из фекальных образцов пяти разновидностей пингвинов (67).Три года спустя исследования ДНК-гибридизации докажут, что P. fredericiana и P. rustigianii идентичны, а названию P. rustigianii будет отдан приоритет над P. Friedericiana , поскольку оно было опубликовано и проверено первым ( 47). По совпадению, в 1986 году Мюллер и др. описали еще один новый вид, Providencia heimbachae , также выделенный из фекалий пингвинов (69). Это конкретное название было выбрано в честь Фридерике Хаймбах, которая выделила 12 исходных штаммов.
Этот отчет также подтвердил, что P. alcalifaciens биогруппы 4 совпадают с P. stuartii . Четыре вида Providencia теперь можно разделить по их способности гидролизовать мочевину и производить кислоту из — -инозита, адонита, d-арабита, трегалозы и d-галактозы. Позже в том же году Мюллер, работавший независимо в Германии, опубликовал отчет с описанием Providencia Friedericiana , который был выделен из фекальных образцов пяти разновидностей пингвинов (67).Три года спустя исследования ДНК-гибридизации докажут, что P. fredericiana и P. rustigianii идентичны, а названию P. rustigianii будет отдан приоритет над P. Friedericiana , поскольку оно было опубликовано и проверено первым ( 47). По совпадению, в 1986 году Мюллер и др. описали еще один новый вид, Providencia heimbachae , также выделенный из фекалий пингвинов (69). Это конкретное название было выбрано в честь Фридерике Хаймбах, которая выделила 12 исходных штаммов.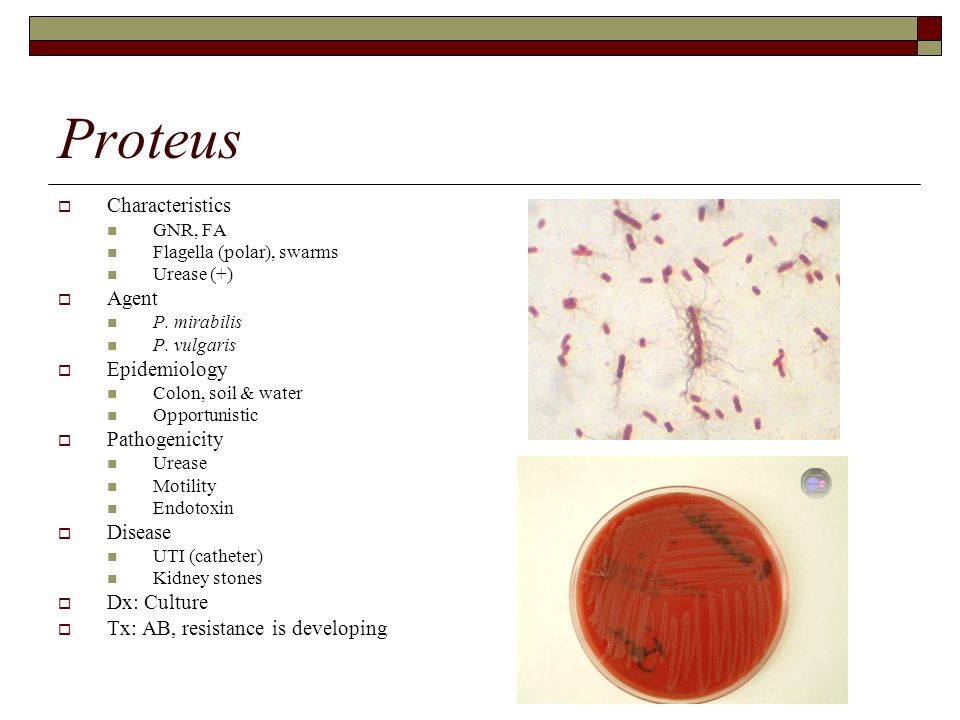
В 1987 году Owen et al. подтвердили содержание G + C в типовых штаммах Providencia и сообщили, что этот род имеет узкий и однородный диапазон от 39 до 43 мол.% (76). В таблице 5 перечислены соответствующие типовые штаммы для родов Providencia .
Клиническая значимость Человеческие изоляты вида Providencia были выделены из образцов мочи, горла, промежности, подмышек, стула, крови и ран. P. heimbachae и P. rustigianii также были выделены от пингвинов (48, 69).
Когда Гомес впервые описал Eberthella (сейчас Providencia ) alcalifaciens в 1944 году, штамм, с которым он работал, был изолирован от 11-месячного ребенка с дизентерией (38). Хейнс и Хоуки обнаружили более высокую заболеваемость P. alcalifaciens у пациентов с диареей, чем у здоровых пациентов, и предположили, что этот организм может быть причиной диареи, особенно у детей (44). Альберт и др. показали, что P. alcalifaciens способен проникать в монослои HEp-2 у кроликов, но его отношение к заболеванию человека неясно (1).
P. stuartii уже давно признан возбудителем для пациентов домов престарелых с хроническими постоянными мочевыми катетерами. В общей сложности от 21 до 61% образцов мочевыводящих путей в этой популяции содержат P. mirabilis или P. stuartii , и эти микроорганизмы могут даже привести к фатальной бактериемии (105).
Были редкие случаи, когда P. rettgeri вызывали нозокомиальные инфекции. Трауб и др. сообщили о вспышке инфекций мочевыводящих путей, вызванных высокорезистентным ферментирующим лактозу штаммом P.rettgeri (102). Хотя благодаря этой необычной биохимической характеристике организм можно было легко отследить, общего источника вспышки обнаружено не было. В аналогичном отчете у 10 пациентов были инфекции мочевыводящих путей, вызванные высокорезистентным штаммом P. rettgeri , и считалось, что одна смерть была вызвана этими инфекциями (22). Распространение инфекции, вероятно, произошло при контакте с персоналом больницы; вспышка прекратилась после использования одноразовых перчаток и применения процедур изоляции контактов. О других подобных проблемах сообщалось в литературе (61).
О других подобных проблемах сообщалось в литературе (61).
Чувствительность к противомикробным препаратам P. rettgeri и P. stuartii обычно устойчивы к гентамицину и тобрамицину, но чувствительны к амикацину. Изоляты мочи чувствительны к пероральным цефалоспоринам расширенного спектра действия, включая цефаклор, цефуроксим, цефетамет, цефподоксим, ципрофлоксацин и амоксициллин-клавулановую кислоту (18). Providencia spp. также чувствительны к тиенамицину, цефтазидиму, цефотаксиму, цефтизоксиму и моксалактаму.Альтернативные варианты противомикробной терапии включают цефтриаксон, мезлоциллин, имипенем и триметоприм-сульфаметоксазол (94).
В непрерывном мониторинговом исследовании использования имипенема и ципрофлоксацина с неприхотливыми клиническими изолятами Fass et al. сообщили, что восприимчивость P. stuartii к ципрофлоксацину снизилась со 100 до 46% за 6-летний период пребывания в их учреждении, что свидетельствует о возможности возникновения резистентности в этой группе и необходимости проведения рутинных тестов на чувствительность (31). Практически все штаммы Morganella spp., Proteus vulgaris , Proteus penneri и Providencia способны продуцировать индуцибельные β-лактамазы, которые будут гидролизовать пенициллины и цефалоспорины первичного и расширенного спектра действия (99). По этим причинам необходимо контролировать чувствительность изолятов Providencia и проводить специализированное тестирование.
Практически все штаммы Morganella spp., Proteus vulgaris , Proteus penneri и Providencia способны продуцировать индуцибельные β-лактамазы, которые будут гидролизовать пенициллины и цефалоспорины первичного и расширенного спектра действия (99). По этим причинам необходимо контролировать чувствительность изолятов Providencia и проводить специализированное тестирование.
Больничная вспышка полирезистентного P. rettgeri произошла в 1976 году и охватила 127 пациентов в течение 22 месяцев в Теннесси (52).Эти штаммы были устойчивы при дисковой диффузии к 15 противомикробным препаратам и к 3 противомикробным препаратам при микроразбавлении в бульоне. Воздействие нескольких противомикробных препаратов в сочетании с одновременным введением гентамицина, промыванием мочевого пузыря полимиксином и неомицином или постоянными устройствами мочевыводящих путей предрасполагает пациентов к инфекциям с устойчивыми штаммами.
Паспорта безопасности патогенов: инфекционные вещества — Proteus spp.
ПАСПОРТ БЕЗОПАСНОСТИ ДЛЯ ПАТОГЕНОВ — ИНФЕКЦИОННЫЕ ВЕЩЕСТВА
РАЗДЕЛ I — ИНФЕКЦИОННЫЙ АГЕНТ
НАЗВАНИЕ : Proteus spp.(патогены человека включают P. mirabilis , P. vulgaris , P. penneri и P. hauseri )
СИНОНИМ ИЛИ ПЕРЕКРЕСТНАЯ ССЫЛКА : Иногда их называют членами трибы Proteeae. Footnote 1 . Бывшие виды рода Proteus теперь являются гомотипными синонимами с другими видами: P. inconstans с Providencia alcalifaciens , P. morganii с Morganella morganii и P.rettgeri с Providencia rettgeri Сноска 2 .
ХАРАКТЕРИСТИКИ : Proteus spp. состоят из грамотрицательных, подвижных аэробных палочковидных бацилл, принадлежащих к семейству Enterobacteriaceae Footnote 3, Footnote 4 . Члены семейства Enterobacteriaceae обычно имеют ширину от 0,3 до 1,0 мм и длину от 0,6 до 6,0 мм.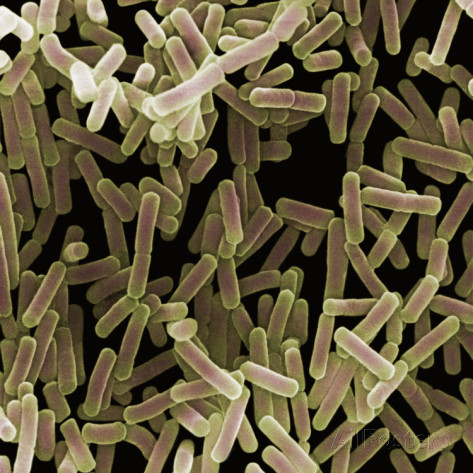 Footnote 3 . Они положительны по уреазе и образуют роевые клетки, которые обеспечивают подвижность роя на твердой среде.Они являются частью нормальной флоры желудочно-кишечного тракта человека.
Footnote 3 . Они положительны по уреазе и образуют роевые клетки, которые обеспечивают подвижность роя на твердой среде.Они являются частью нормальной флоры желудочно-кишечного тракта человека.
РАЗДЕЛ II — ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
ПАТОГЕННОСТЬ / ТОКСИЧНОСТЬ : Proteus spp. обычно связаны с осложненными инфекциями мочевыводящих путей ( UTI s) Footnote 1, Footnote 3-Footnote 5 . Обычно они поражают верхние мочевыводящие пути (распространенное место инфекции), вызывая такие инфекции, как мочекаменная болезнь (образование камней в почках или мочевом пузыре) Footnote 3, Footnote 4 , цистит Footnote 4 и острый пиелонефрит.Редкие случаи бактериемии, связанные с UTI s, с Proteus spp. также сообщалось Footnote 1 . Другие инфекции включают сепсис и раневые инфекции. После прикрепления и колонизации в мочевыводящих путях Proteus spp. высвобождает уреазу, которая катализирует превращение мочевины в аммиак и CO 2 Footnote 3, Footnote 5 . Это вызывает снижение pH мочи и может в конечном итоге привести к образованию камней в почках или мочевом пузыре. P. mirabilis вызывает наибольшее количество инфекций среди всех Proteus spp.
высвобождает уреазу, которая катализирует превращение мочевины в аммиак и CO 2 Footnote 3, Footnote 5 . Это вызывает снижение pH мочи и может в конечном итоге привести к образованию камней в почках или мочевом пузыре. P. mirabilis вызывает наибольшее количество инфекций среди всех Proteus spp.
ЭПИДЕМИОЛОГИЯ: Proteus spp. инфекции происходят во всем мире, и Proteus spp. являются частью кишечной флоры человека Сноска 1 , Сноска 3 — Сноска 5 . Они также широко распространены в окружающей среде, включая животных, почву и загрязненную воду. Они являются важными возбудителями внебольничных и нозокомиальных ИМП; в Европе и Северной Америке от 4 до 6% инфекций Proteus являются внебольничными, а от 3 до 6% — внутрибольничными. Footnote 3 .Proteus spp. обычно считаются патогенными для молодых людей и условно-патогенными микроорганизмами для пожилых людей Footnote 4 .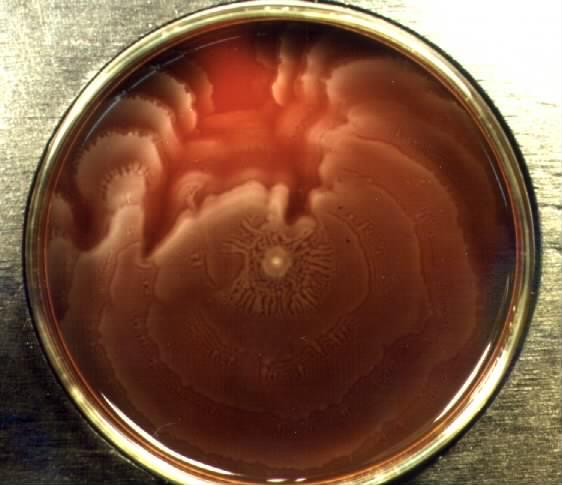 Уровень инфицирования наиболее высок среди пожилых людей, особенно у тех, у кого постоянные катетеры (длительная катетеризация) или при частой терапии антибиотиками. Footnote 1 , Footnote 4 , Footnote 5 . Другие целевые группы включают мужчин и женщин в препубертатном возрасте, при этом более высокий уровень инфицирования зарегистрирован среди необрезанных мужчин Footnote 4 .Люди с длительной катетеризацией или структурными аномалиями мочевыводящих путей более восприимчивы к инфекции Proteus spp. Сноска 1 , Сноска 4 , Сноска 5 . Нозокомиальные вспышки, вызванные устойчивостью к антибиотикам Proteus spp. было сообщено Footnote 4 .
Уровень инфицирования наиболее высок среди пожилых людей, особенно у тех, у кого постоянные катетеры (длительная катетеризация) или при частой терапии антибиотиками. Footnote 1 , Footnote 4 , Footnote 5 . Другие целевые группы включают мужчин и женщин в препубертатном возрасте, при этом более высокий уровень инфицирования зарегистрирован среди необрезанных мужчин Footnote 4 .Люди с длительной катетеризацией или структурными аномалиями мочевыводящих путей более восприимчивы к инфекции Proteus spp. Сноска 1 , Сноска 4 , Сноска 5 . Нозокомиальные вспышки, вызванные устойчивостью к антибиотикам Proteus spp. было сообщено Footnote 4 .
ДИАПАЗОН ХОЗЯЙСТВ : Люди Сноска 3 .
ИНФЕКЦИОННАЯ ДОЗА : Неизвестно.
РЕЖИМ ПЕРЕДАЧИ : Proteus spp.являются частью кишечной флоры человека Сноска 1, Сноска 3-Сноска 5 и могут вызвать инфекцию при выходе из этого места. Они также могут передаваться через зараженные катетеры (в частности, мочевые катетеры) Footnote 1, Footnote 4, Footnote 5 или случайной парентеральной инокуляцией. Однако конкретный способ передачи не установлен.
Они также могут передаваться через зараженные катетеры (в частности, мочевые катетеры) Footnote 1, Footnote 4, Footnote 5 или случайной парентеральной инокуляцией. Однако конкретный способ передачи не установлен.
ПЕРИОД ИНКУБАЦИИ : Неизвестно.
КОММУНИКАЦИЯ : Proteus spp.не передаются от человека к человеку.
РАЗДЕЛ III — РАСПРОСТРАНЕНИЕ
РЕЗЕРВУАР : люди сноска 1, сноска 3, сноска 4 , животные, птицы сноска 3 и рыбы. Proteus spp. широко распространены в окружающей среде, включая почву, воду и канализацию Footnote 1, Footnote 4 .
ЗООНОЗ : Нет.
ВЕКТОРОВ : Нет.
РАЗДЕЛ IV — УСТОЙЧИВОСТЬ И ЖЕСТКОСТЬ
ЛЕКАРСТВЕННАЯ УСТОЙЧИВОСТЬ : Proteus spp.обычно чувствительны к цефалоспоринам широкого спектра действия, аминогликозидам и имипенему.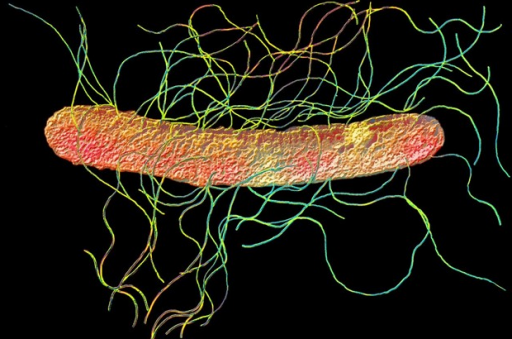 Footnote 3 . P. mirabilis также чувствителен к триметоприм-сульфаметоксазолу, ампициллину, амоксициллину и пиперациллину. P. vulgaris и P. penneri также чувствительны к цефокситину, цефепиму и азтреонаму. P. mirabilis устойчив к нитрофурантоину. Устойчивость к ципрофлоксацину может развиться при неограниченном применении. P. vulgaris и P.penneri устойчивы к пиперациллину, амоксициллину, ампициллину, цефоперазону, цефуроксиму и цефазолину. P. penneri более устойчив к пенициллину, чем P. vulgaris . Устойчивость к β-лактамазам среди Proteus spp. появляется Сноска 4 . Устойчивость к карбапенемам, включая пан-устойчивые изоляты, описана в сноске 6, , Индия .
Footnote 3 . P. mirabilis также чувствителен к триметоприм-сульфаметоксазолу, ампициллину, амоксициллину и пиперациллину. P. vulgaris и P. penneri также чувствительны к цефокситину, цефепиму и азтреонаму. P. mirabilis устойчив к нитрофурантоину. Устойчивость к ципрофлоксацину может развиться при неограниченном применении. P. vulgaris и P.penneri устойчивы к пиперациллину, амоксициллину, ампициллину, цефоперазону, цефуроксиму и цефазолину. P. penneri более устойчив к пенициллину, чем P. vulgaris . Устойчивость к β-лактамазам среди Proteus spp. появляется Сноска 4 . Устойчивость к карбапенемам, включая пан-устойчивые изоляты, описана в сноске 6, , Индия .
УСТОЙЧИВОСТЬ К ДЕЗИНФЕКЦИОННЫМ СРЕДСТВАМ : Грамотрицательные бактерии обычно чувствительны к ряду дезинфицирующих средств, включая фенольные соединения, гипохлориты (1% гипохлорит натрия), спирты (70% этанол), формальдегид (18. 5 г / л; 5% формалина в воде), глутаральдегид и йод (0,075 г / л) Footnote 7 .
5 г / л; 5% формалина в воде), глутаральдегид и йод (0,075 г / л) Footnote 7 .
ФИЗИЧЕСКАЯ НЕАКТИВАЦИЯ : Бактерии обычно чувствительны к влажному теплу (121 ° C в течение не менее 15 минут) и сухому теплу (от 160 до 170 ° C в течение не менее 1 часа) Footnote 8 .
ВЫЖИВАНИЕ ВНЕ ХОЗЯЙСТВА : Proteus spp. выжить на неодушевленных поверхностях всего несколько дней; и только 1-2 дня в случае P. vulgaris Footnote 9 . Они также хорошо выживают в окружающей среде, в почве, воде и сточных водах. Footnote 3 .
РАЗДЕЛ V — ПЕРВАЯ ПОМОЩЬ / МЕДИЦИНСКАЯ
НАБЛЮДЕНИЕ : Следите за симптомами. Proteus spp. могут быть диагностированы путем выделения и дифференциации с хромогенными средами (т.е. с помощью культивированных организмов из образцов мочи и крови) Footnote 3 .
ПЕРВАЯ ПОМОЩЬ / ЛЕЧЕНИЕ : При необходимости назначить соответствующую антибактериальную терапию Footnote 3, Footnote 4 . Помимо этого, лечение в основном направлено на устранение симптомов.
Помимо этого, лечение в основном направлено на устранение симптомов.
ИММУНИЗАЦИЯ : Нет.
PROPHYLAXIS : Нет.
РАЗДЕЛ VI — ЛАБОРАТОРНАЯ ОПАСНОСТЬ
ИНФЕКЦИИ, ПРИОБРЕТЕННЫЕ В ЛАБОРАТОРИИ : На сегодняшний день сообщений о случаях лабораторной инфекции не поступало.
ИСТОЧНИКИ / ОБРАЗЦЫ : Образцы из мочевых путей, ран и образцы крови Footnote 3 . Выявленные конкретные источники включают:
P. mirabilis : Мочевыводящие пути, кровь и спинномозговая жидкость.
P. penneri : Мочевыводящие пути, кровь, рана, кал, глаз.
P. vulgaris : Мочевыводящие и дыхательные пути, рана и стул.
ОСНОВНЫЕ ОПАСНОСТИ : Использование зараженных катетеров (особенно мочевых катетеров) в медицинских процедурах Footnote 1, Footnote 4, Footnote 5 , а также случайная парентеральная инокуляция и / или проглатывание зараженного материала.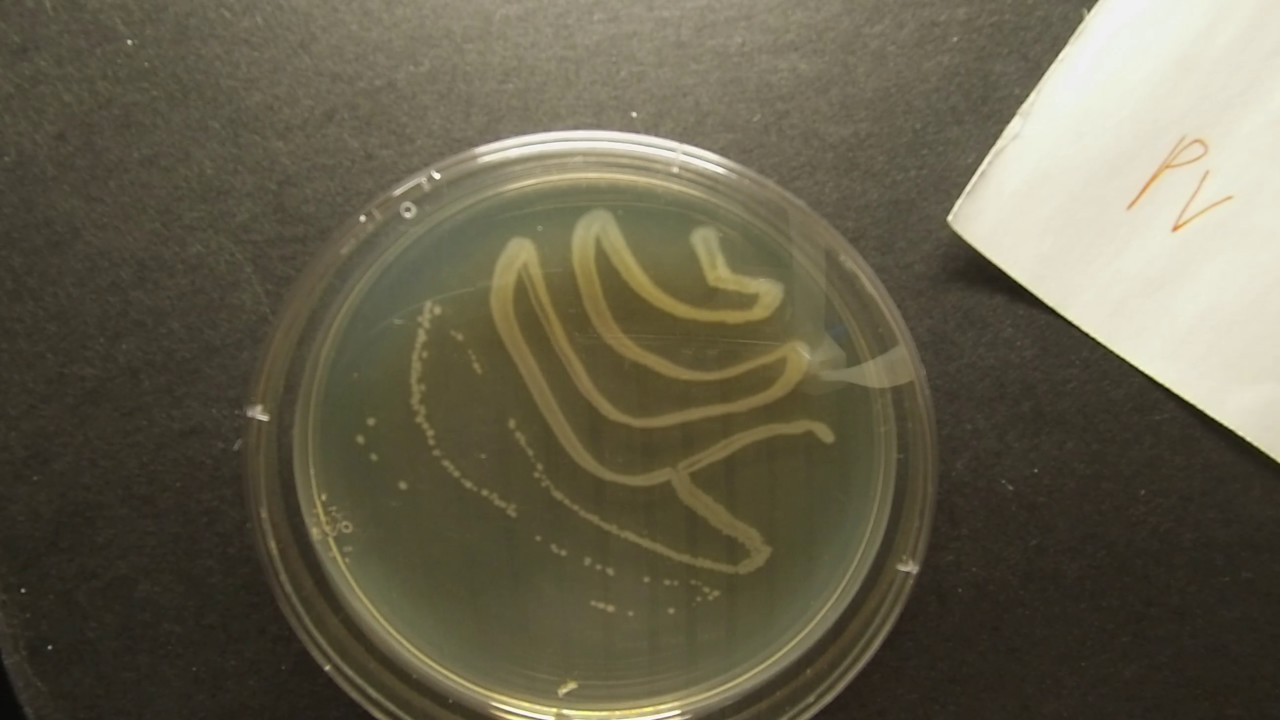
ОСОБЫЕ ОПАСНОСТИ : Нет.
РАЗДЕЛ VII — КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
КЛАССИФИКАЦИЯ ГРУПП РИСКА : Группа риска 2 Сноска 10 .Группа риска, связанная с « Proteus spp.» отражает род в целом, но не обязательно отражает классификацию групп риска каждого вида в пределах рода.
ТРЕБОВАНИЯ К СОДЕРЖАНИЮ : Помещения, оборудование и эксплуатационные методы уровня 2 для работы с инфекционными или потенциально инфекционными материалами, животными или культурами Сноска 11 . Эти требования по содержанию применяются ко всему роду в целом и могут не применяться к каждому виду в пределах рода.
ЗАЩИТНАЯ ОДЕЖДА : Лабораторный халат. Перчатки при неизбежном прямом контакте кожи с инфицированными материалами или животными. При наличии известного или потенциального риска разбрызгивания следует использовать средства защиты глаз. Footnote 10 .
ДРУГИЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ : Все процедуры, которые могут привести к образованию аэрозолей, или связаны с высокими концентрациями или большими объемами, должны проводиться в боксе биологической безопасности ( BSC ). Использование игл, шприцев и других острых предметов должно быть строго ограничено. Footnote 10 .Дополнительные меры предосторожности следует учитывать при работе с животными или крупномасштабной деятельности.
РАЗДЕЛ VIII — ОБРАЩЕНИЕ И ХРАНЕНИЕ
РАЗЛИВЫ : Дать возможность аэрозолям осесть. Надев защитную одежду, осторожно накройте место разлива впитывающим бумажным полотенцем и нанесите соответствующее дезинфицирующее средство, начиная с периметра и двигаясь к центру. Перед очисткой дайте достаточно времени для контакта. Footnote 11 .
УТИЛИЗАЦИЯ : Обеззараживайте все отходы, которые содержат или вступили в контакт с инфекционным организмом, перед их утилизацией в автоклаве, химической дезинфекции, гамма-облучением или сжиганием.
ХРАНЕНИЕ : Инфекционный агент должен храниться в герметичных контейнерах, имеющих соответствующую маркировку Сноска 11 .
РАЗДЕЛ IX — НОРМАТИВНАЯ И ДРУГАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ: Импорт, транспортировка и использование патогенных микроорганизмов в Канаде регулируется многими регулирующими органами, включая Агентство общественного здравоохранения Канады, Министерство здравоохранения Канады, Канадское агентство по инспекции пищевых продуктов, Министерство окружающей среды Канады и Министерство транспорта Канады.Пользователи несут ответственность за соблюдение всех соответствующих законов, постановлений, руководств и стандартов.
ОБНОВЛЕНО : сентябрь 2011
ПОДГОТОВЛЕНО : Управление по регулированию патогенов, Агентство общественного здравоохранения Канады.
Хотя информация, мнения и рекомендации, содержащиеся в этом Паспорте безопасности патогенов, собраны из источников, которые считаются надежными, мы не несем ответственности за точность, достаточность или надежность, а также за любые потери или травмы, возникшие в результате использования информации. Часто обнаруживаются новые опасности, и эта информация может быть не полностью актуальной.
Часто обнаруживаются новые опасности, и эта информация может быть не полностью актуальной.
Авторские права ©
Агентство общественного здравоохранения Канады, 2011 г.
Канада
| Proteus vulgaris Род Proteus является классифицируется в кишечных бактериях , вместе с Escherichia coli , Salmonella , Shigella , Enterobacter и Serratia .Все эти бактерии мелкие, грамотрицательные палочки, их факультативно . анаэробы : они сбраживают сахар в анаэробных условиях, но может использовать широкий спектр органических молекул в аэробных условиях. Некоторые кишечные
основные патогены человека, но Proteus видов
в основном обитатели почвы, особенно распространены в
разлагающееся органическое вещество. | |
| Proteus имеет две интересные и примечательные особенности, показанные на изображениях над. Во-первых, клетки очень подвижны и часто рой по поверхности пластин с агаром ( Рисунок A ). Рой приводит к появлению очень тонкой пленки бактерий на поверхность агара, но периоды роения чередуются с периодами, когда клетки останавливаются и проходят цикл рост и деление, так что колония имеет отчетливую зональность, хорошо заметная на рис.A. Другая примечательная особенность обоих Proteus и Providentia — способность разлагать мочевину.
в аммиак, путем производства фермента уреазы . | |
| Диагностика методы в микробиологии Простые биохимические тесты, подобные приведенному выше
всегда были важным подспорьем в идентификации
бактерии, потому что разные группы бактерий и
виды обладают характерной метаболической активностью. А
ряд сложных инструментов теперь доступен для
клинический диагноз. Некоторые основаны на моноклональных
антитела и другие на простых, быстрых биохимических
методы. Система API 20E показанный ниже стал популярным для быстрой идентификации представителей Enterobacteriaceae и других Грамотрицательные бактерии. Пластиковые полоски состоят из 20 небольшие лунки, содержащие компоненты обезвоженной среды (вверху ряд). Тестируемая бактерия суспендирована в стерильном физиологический раствор и добавлен в каждую лунку, затем полоска инкубируют в течение 16-24 часов, и цветовые реакции отмечены как положительные или отрицательные.Результаты теста могут быть введены в компьютерную программу для идентификации бактерия. Инокулированные четыре полоски с четырьмя различными бактериями показаны на рисунке. В В каждом случае спектр результатов был разным. | |
Верхний ряд, Proteus vulgaris ; второй
ряд неопознанных кишечных бактерий; третий ряд, Клебсиелла
pneumoniae ; нижний ряд: Vibrio alginolyticus . | |
| Некоторые тесты этих полосок описаны ниже. Слева:
Справа:
GO К ПОЛНОМУ СПИСКУ ПРОФИЛЕЙ? |
Proteus vulgaris — статья энциклопедии
Proteus vulgaris — палочковидная грамотрицательная хемогетеротрофная бактерия. Размер отдельных ячеек варьируется от 0,4 ~ 0,6 мкм до 1,2 ~ 2,5 мкм. P. vulgaris обладает перитрихозными жгутиками, что делает его активно подвижным. Населяет почву, загрязненную воду, сырое мясо, желудочно-кишечный тракт животных и пыль. У людей виды Proteus наиболее часто вызывают инфекции мочевыводящих путей, но могут также вызывать тяжелые абсцессы; P. mirabilis вызывает 90 процентов случаев и встречается в сообществе, но P. vulgaris связан с нозокомиальной инфекцией [1] [2]
Размер отдельных ячеек варьируется от 0,4 ~ 0,6 мкм до 1,2 ~ 2,5 мкм. P. vulgaris обладает перитрихозными жгутиками, что делает его активно подвижным. Населяет почву, загрязненную воду, сырое мясо, желудочно-кишечный тракт животных и пыль. У людей виды Proteus наиболее часто вызывают инфекции мочевыводящих путей, но могут также вызывать тяжелые абсцессы; P. mirabilis вызывает 90 процентов случаев и встречается в сообществе, но P. vulgaris связан с нозокомиальной инфекцией [1] [2]
Изоляция организма
Используя базовую микробиологическую технику, образцы, предположительно содержащие Proteus , сначала инкубируют на питательном агаре с образованием колоний.Для проверки грамотрицательных и оксидазонегативных характеристик Enterobacteriaceae выполняются окрашивания по Граму и оксидазные тесты. Организмы Candidae грамм и оксидаза отрицательны. Затем представляющие интерес колонии инокулируют на селективную культуральную среду, агар MacConkey. [3] Соли желчных кислот в среде, являющиеся нормальной частью кишечной флоры, подавляют организмы, которые обычно не являются частью домашней среды Proteus . Агар МакКонки содержит лактозу, которую Proteus не ферментирует, что позволяет дифференцировать организмы с различной ферментацией. Proteus , анаэроб, можно дополнительно дифференцировать, инкубируя культуру в анаэробных условиях.
[3] Соли желчных кислот в среде, являющиеся нормальной частью кишечной флоры, подавляют организмы, которые обычно не являются частью домашней среды Proteus . Агар МакКонки содержит лактозу, которую Proteus не ферментирует, что позволяет дифференцировать организмы с различной ферментацией. Proteus , анаэроб, можно дополнительно дифференцировать, инкубируя культуру в анаэробных условиях.
Структура генома
Rts1 представляет собой большую конъюгативную плазмиду, выделенную из Proteus vulgaris . [4] Нуклеотидное секвенирование Rts1 было завершено в Школе медицины Университета Синсю, Япония. В геноме 217 182 пары оснований и 300 открытых рамок считывания. Продукты 141 из них показали значительное сходство последовательностей с известными белками, и среди них 99 были гомологичны белкам, функции которых известны или предсказаны.Интересным открытием было присутствие tus -подобных генов, которые могли участвовать в терминации репликации. [5]
[5]
Строение и метаболизм клеток
Proteus виды имеют внецитоплазматическую внешнюю мембрану. Наружная мембрана содержит липидный бислой, липопротеины, полисахариды и липополисахариды. Споры или капсулы не образуются.
P. vulgaris получает энергию и электроны от органических молекул.Он сбраживает глюкозу, сахарозу, галактозу, глицерин и иногда мальтозу с образованием газа, но не лактозу; он разжижает желатин, казеин и сыворотку крови, свертывая молоко с образованием кислоты. Он не ограничен каким-либо конкретным температурным диапазоном, но хороший рост происходит при 20 ° и 30 °, а рост плохой при 37 °.
P. vulgaris имеет две интересные особенности. Клетки очень подвижны и роятся по поверхности пластинок агара, образуя очень тонкую пленку бактерий.Когда клетки останавливаются и проходят цикл роста и деления, периоды роения чередуются с периодами, и колония имеет отчетливую зональность. Другой особенностью является то, что P. vulgaris может продуцировать уреазу и разлагать мочевину до аммиака. Подщелачивая мочу, P. vulgaris делает окружающую среду более подходящей для его выживания.
vulgaris может продуцировать уреазу и разлагать мочевину до аммиака. Подщелачивая мочу, P. vulgaris делает окружающую среду более подходящей для его выживания.
Экология
P. vulgaris , как утверждается, присутствует во всех сточных водах, постоянном источнике загрязнения, который является благоприятной средой для роста.
Если инфекция P. mirabilis чаще бывает внебольничной, то инфекция P. vulgaris более склонна вызывать нозокомиальные инфекции. Чтобы предотвратить передачу внутрибольничных патогенов в больницах, оценивали устойчивость внутрибольничных патогенов на поверхностях. Чем дольше нозокомиальный патоген остается на поверхности, тем дольше он может быть источником передачи и, следовательно, выше вероятность контакта с восприимчивым пациентом или персоналом больницы. Результат показал, что P.vulgaris выживает 1-2 дня.
Чтобы снизить риск передачи внутрибольничных патогенов с неодушевленных поверхностей чувствительным пациентам, рекомендуется дезинфекция поверхностей в определенных зонах ухода за пациентами.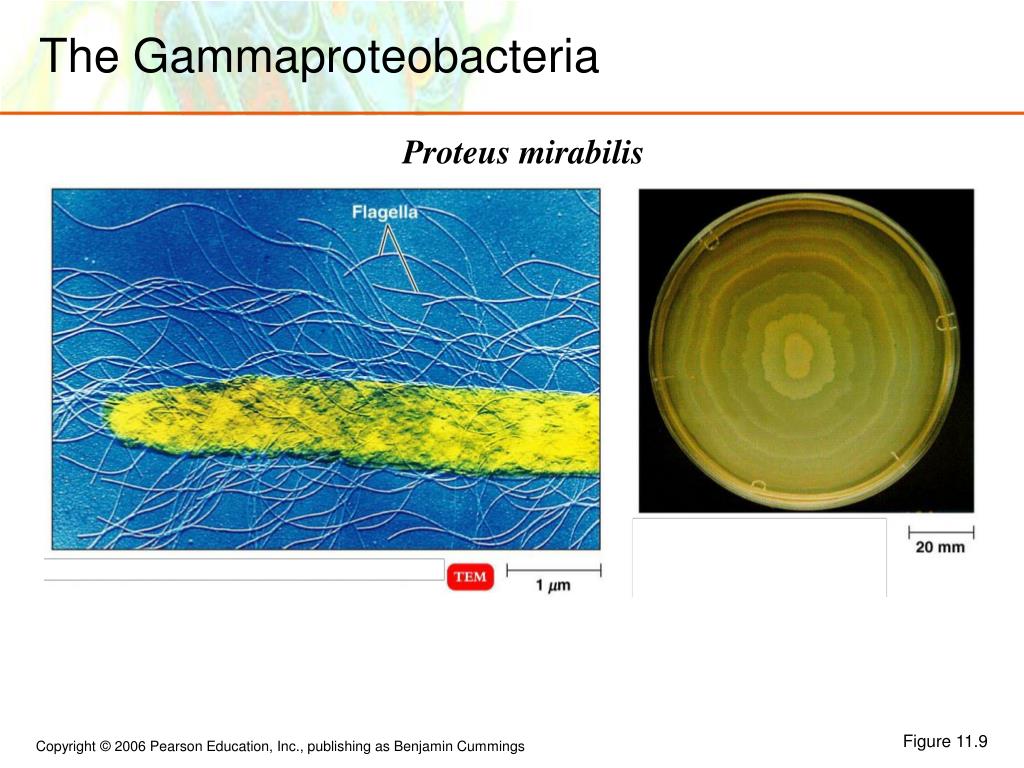 [6]
[6]
Патология
Множественные палочковидные бактерии между лейкоцитами пациента с инфекцией мочевыводящих путей. Кредит: Стивен Фруитсмаак P. vulgaris и P. mirabilis — два распространенных вида Proteus , ассоциированные с инфекцией человека.Одним из выявленных факторов вирулентности является то, что они содержат фимбрии. [7] Определенные химические вещества на кончике пилей позволяют организму прикрепиться к выбранному месту. Из-за наличия жгутиков перитрихии Proteus очень подвижен. Наиболее распространенными инфекциями, вызываемыми этим видом, являются инфекции мочевыводящих путей и раневые инфекции. P. mirabilis является основным возбудителем ИМП. Proteus богат уреазой. Уреаза расщепляет мочевину на диоксид углерода (CO 2 ) и аммиак (NH 3 ).Аммиак делает мочу очень щелочной (pH> 7) и может вызвать образование почечных камней. Некоторые из симптомов инфекции Proteus включают боль в боку, гематурию и стойкую щелочную мочу.
У животных одни штаммы Proteus могут быть вредными, а другие — нет. Proteus , выделенный из рвоты пациентов с мясным ядом, вызывал диарею и смерть при скармливании мышам. Когда мышам скармливали другой культивированный Proteus , не было ни болезней, ни иммунитета.Когда P. vulgaris был введен в брюшную полость морской свинки, это вызвало быструю смерть. Однако, когда такое же количество было введено в подкожный слой, возник обширный некроз. Внутривенное введение кошек вызвало сильную рвоту, кровавую диарею и смерть.
Антибактериальная терапия
Протеи обладают высокой устойчивостью к антибиотикам, поэтому инфекции бывает трудно вылечить. Их плазмиды ответственны за распространение генов устойчивости к антибиотикам в микробной популяции.Многие виды Proteus имеют различные маркеры множественной лекарственной устойчивости, которые кодируются на переносимых плазмидах. Резистентные плазмиды можно переносить с частотой от 2х10 -4 до 4х10 -2 на донорские клетки. Следовательно, маркеры устойчивых к антибиотикам плазмид могут быть легко перенесены путем конъюгации. Однако большинство плазмидных маркеров не переносятся, что отражает характеристику устойчивости к антибиотикам.
Следовательно, маркеры устойчивых к антибиотикам плазмид могут быть легко перенесены путем конъюгации. Однако большинство плазмидных маркеров не переносятся, что отражает характеристику устойчивости к антибиотикам.
Proteus vulgaris наименее устойчив к ципрофлоксацину и цефотаксиму, но когда он вводится в эти препараты, следует использовать более высокие дозы, чем «нормальные». [8]
Действие лизоцима на индуцированные пенициллином филаменты P. vulgaris
Низкие дозы пенициллина вызывают превращение грамотрицательных бактерий в филаменты, но сам пенициллин не вредит оболочкам клеток и клеточной стенке. Лизоцим белка куриного яйца, который не влияет на нормальные клетки P. vulgaris P 18, модифицирует оболочку нитей. [9]
Низкая доза пенициллина остановила клеточную септацию у P. vulgaris P 18 и вызвала его трансформацию в филаменты без изменения структуры клеточной оболочки.В филаментах, индуцированных пенициллином, лизоцим проникает через клеточную оболочку и растворяет самый внутренний слой клеточной стенки. Действие пенициллина вызвало снятие барьера для этого фермента. В результате пятислойная стена превращается в трехслойную структуру. Эта трехслойная структура содержала внешнюю мембрану, а нить трансформировалась в сферопласты.
Действие пенициллина вызвало снятие барьера для этого фермента. В результате пятислойная стена превращается в трехслойную структуру. Эта трехслойная структура содержала внешнюю мембрану, а нить трансформировалась в сферопласты.
Список литературы
- ↑ Struble K et al. (2009), «Proteus Infections: Overview», eMedicine
- ↑ O’Hara CM et al. (2000) Классификация, идентификация и клиническое значение Proteus, Providencia и Morganella Clin Microbiol Rev 13: 534-46
- ↑ Протоколы чашек с агаром МакКонки , Американское общество микробиологии
- ↑ Murata T et al. (2010) Нуклеотидная последовательность плазмиды Rts1: значение для эволюции больших плазмидных геномов J Bacteriol 183: 3194–202
- ↑ Полная последовательность Rts1 плазмиды Proteus vulgaris UR-75
- ↑ Kramer A et al. (2006), «Как долго нозокомиальные патогены сохраняются на неодушевленных поверхностях? Систематический обзор», BMC Infect Dis 6 : 130.
 , DOI: 10.1186 / 1471-2334-6-130.
, DOI: 10.1186 / 1471-2334-6-130. - ↑ Розальский А и др. () Потенциальные факторы вирулентности Proteus bacilli Microbiol Mol Biol Rev 61: 65-89
- ↑ Yah SC и др. (2007) Широко распространенные гены устойчивости к плазмидам среди видов Proteus в диабетических ранах пациентов в университетской больнице Ахмаду Белло (ABUTH) Zaria Afr J Biotechnol 6: 1757-62
- ↑ Fleck J et al. Действие лизоцима на пенициллин-индуцированные волокна Proteus vulgaris J Bacteriol 120: 929–33
Чувствительность Proteus mirabilis к противомикробным препаратам: продолжительное общенациональное исследование Тайваньской программы надзора за устойчивостью к противомикробным препаратам (TSAR) | BMC Infectious Diseases
Mobley HL, Belas R: Роение и патогенность Proteus mirabilis в мочевыводящих путях. Trends Microbiol. 1995, 3: 280-284.10.1016 / S0966-842X (00) 88945-3.
Trends Microbiol. 1995, 3: 280-284.10.1016 / S0966-842X (00) 88945-3.
CAS Статья PubMed Google ученый
Розальский А., Сидорчик З., Котелко К.: Потенциальные факторы вирулентности бацилл Proteus . Microbiol Mol Biol Rev.1997, 61: 65-89.
CAS PubMed PubMed Central Google ученый
Уоррен Дж. У., Тенни Дж. Х., Хупес Дж. М., Манси Х. Л., Энтони В. К.: проспективное микробиологическое исследование бактериурии у пациентов с хроническими постоянными уретральными катетерами.J Infect Dis. 1982, 146: 719-723. 10.1093 / infdis / 146.6.719.
CAS Статья PubMed Google ученый
Кунин С.М.: Закупорка мочевых катетеров: роль микроорганизмов и составляющих мочи в образовании налетов. J Clin Epidemiol. 1989, 42: 835-842. 10.1016 / 0895-4356 (89) -6.
CAS Статья PubMed Google ученый
Chanal C, Bonnet R, De Champs C, Sirot D, Labia R, Sirot J: Распространенность β-лактамаз среди 1072 клинических штаммов Proteus mirabilis : двухлетнее исследование во французской больнице. Антимикробные агенты Chemother. 2000, 44: 1930-1935. 10.1128 / AAC.44.7.1930-1935.2000.
CAS Статья PubMed PubMed Central Google ученый
Буш К., Якоби Г.А.: Обновленная функциональная классификация β-лактамаз. Антимикробные агенты Chemother. 2010, 54: 969-976. 10.1128 / AAC.01009-09.
2010, 54: 969-976. 10.1128 / AAC.01009-09.
CAS Статья PubMed Google ученый
Д’Андреа М.М., Литерацка Е., Зиога А., Джани Т., Бараняк А., Фиетт Дж., Садоуи Е., Тассиос П.Т., Россолини Г.М., Гнядковски М., Мириагоу В.: Эволюция и распространение лекарственной устойчивости с множественной лекарственной устойчивостью . Клон Proteus mirabilis с хромосомными цефалоспориназами AmpC-типа в Европе. Антимикробные агенты Chemother. 2011, 55: 2735-2742. 10.1128 / AAC.01736-10.
Артикул PubMed PubMed Central Google ученый
Накано Р., Накано А., Абэ М., Иноуэ М., Окамото Р. Региональная вспышка продуцирующей β-лактамазы CTX-M-2 Proteus mirabilis в Японии. J Med Microbiol. 2012, 61: 1727-1735. 10.1099 / jmm.0.049726-0.
J Med Microbiol. 2012, 61: 1727-1735. 10.1099 / jmm.0.049726-0.
Артикул PubMed Google ученый
Endimiani A, Luzzaro F, Brigante G, Perilli M, Lombardi G, Amicosante G, Rossolini GM, Toniolo A: Proteus mirabilis Инфекции кровотока: факторы риска и результаты лечения, связанные с выражением расширенного спектра β-лактамазы.Антимикробные агенты Chemother. 2005, 49: 2598-2605. 10.1128 / AAC.49.7.2598-2605.2005.
CAS Статья PubMed PubMed Central Google ученый
Bush K: тревожная опосредованная β-лактамазой резистентность у множественной лекарственной устойчивости Enterobacteriaceae . Curr Opin Microbiol. 2010, 13: 558-564. 10.1016 / j.mib.2010. 09.006.
09.006.
CAS Статья PubMed Google ученый
Nordmann P, Naas T, Poirel L: Глобальное распространение карбапенемаз-продуцирующих Enterobacteriaceae . Emerg Infect Dis. 2011, 17: 1791-1798. 10.3201 / eid1710.110655.
CAS Статья PubMed PubMed Central Google ученый
Хорнер С.С., Эбберли Н., Дентон М., Уилкокс М.Х .: Наблюдение за чувствительностью к антибиотикам Enterobacteriaceae , выделенных из образцов мочи, собранных у местных пациентов в большом мегаполисе, 2010–2012 гг.Epidemiol Infect. 2014, 142: 399-403. 10.1017 / S0950268813000988.
CAS Статья PubMed Google ученый
Miro E, Aguero J, Larrosa MN, Fernandez A, Conejo MC, Bou G, Gonzalez-Lopez JJ, Lara N, Martinez-Martinez L, Oliver A, Aracil B, Oteo J, Pascual A, Rodriguez -Bano J, Zamorano L, Navarro F: Распространенность и молекулярная эпидемиология приобретенных β-лактамаз и карбапенемаз AmpC в изолятах Enterobacteriaceae из 35 больниц в Испании.Eur J Clin Microbiol Infect Dis. 2013, 32: 253-259. 10.1007 / s10096-012-1737-0.
CAS Статья PubMed Google ученый
Sheng WH, Badal RE, Hsueh PR: Распределение β-лактамаз расширенного спектра, β-лактамаз AmpC и карбапенемаз среди изолятов Enterobacteriaceae , вызывающих интраабдоминальные инфекции в Азиатско-Тихоокеанском регионе: результаты Исследование по мониторингу тенденций устойчивости к противомикробным препаратам (SMART).Антимикробные агенты Chemother. 2013, 57: 2981-2988. 10.1128 / AAC.00971-12.
2013, 57: 2981-2988. 10.1128 / AAC.00971-12.
CAS Статья PubMed PubMed Central Google ученый
Bouchillon SK, Badal RE, Hoban DJ, Hawser SP: Чувствительность к противомикробным препаратам изолятов грамотрицательных бактерий мочевыводящих путей в стационарных условиях в США: результаты программы исследования по мониторингу тенденций устойчивости к противомикробным препаратам (SMART): 2009 г. –2011. Clin Ther. 2013, 35: 872-877.10.1016 / j.clinthera.2013.03.022.
CAS Статья PubMed Google ученый
Hawser SP, Badal RE, Bouchillon SK, Hoban DJ, Hackel MA, Biedenbach DJ, Goff DA: Чувствительность грамотрицательных аэробных бацилл от внутрибрюшных патогенов к антимикробным агентам, собранным в США в 2011 году. J Infect. 2014, 68: 71-76. 10.1016 / j.jinf.2013.09.001.
J Infect. 2014, 68: 71-76. 10.1016 / j.jinf.2013.09.001.
Артикул PubMed Google ученый
Karlowsky JA, Adam HJ, Baxter MR, Lagace-Wiens PR, Walkty AJ, Hoban DJ, Zhanel GG: In vitro активность цефтаролин-авибактама против грамотрицательных и грамположительных патогенов, выделенных от пациентов в канадских больницах с 2010 г. до 2012 г .: результаты эпиднадзора CANWARD. Антимикробные агенты Chemother. 2013, 57: 5600-5611. 10.1128 / AAC.01485-13.
CAS Статья PubMed PubMed Central Google ученый
Sader HS, Farrell DJ, Flamm RK, Jones RN: Антимикробная чувствительность грамотрицательных организмов, выделенных от пациентов, госпитализированных в отделения интенсивной терапии в больницах США и Европы (2009–2011). Диагностика Microbiol Infect Dis. 2014, 78: 443-448. 10.1016 / j.diagmicrobio.2013.11.025.
Диагностика Microbiol Infect Dis. 2014, 78: 443-448. 10.1016 / j.diagmicrobio.2013.11.025.
CAS Статья PubMed Google ученый
Институт клинических и лабораторных стандартов: Стандарты эффективности тестирования на чувствительность к противомикробным препаратам.Двадцать четвертое информационное приложение. M100-S24. Институт клинических и лабораторных стандартов. 2014, Уэйн, Пенсильвания: CLSI, документ M100-S24
Google ученый
Villar HE, Danel F, Livermore DM: проницаемость для карбапенемов мутантов Proteus mirabilis , отобранных по устойчивости к имипенему или другим β-лактамам. J Antimicrob Chemother. 1997, 40: 365-370. 10.1093 / jac / 40.3.365.
CAS Статья PubMed Google ученый
Jean SS, Hsueh PR, Lee WS, Yu KW, Liao CH, Chang FY, Ko WC, Wu JJ, Chen YH, Chen YS, Liu JW, Lu MC, Liu CY, Lam C, Chen RJ: восприимчивость к карбапенемам и отсутствие — соответствие чувствительности к различным карбапенемам среди клинически важных грамотрицательных бактерий, выделенных из отделений интенсивной терапии на Тайване: результаты надзора за многоцентровой устойчивостью к противомикробным препаратам в Тайване (SMART) в 2009 году. Int J Antimicrob Agents. 2013, 41: 457-462. 10.1016 / j.ijantimicag.2013.02.001.
CAS Статья PubMed Google ученый
Lau SM, Peng MY, Chang FY: Показатели устойчивости к часто используемым противомикробным препаратам среди возбудителей как бактериемических, так и небактериемических внебольничных инфекций мочевыводящих путей. J Microbiol Immunol Infect. 2004, 37: 185-191.
CAS PubMed Google ученый
Kuo SC, Chang SC, Wang HY, Lai JF, Chen PC, Shiau YR, Huang I.W, Lauderdale TL: Появление комплекса Acinetobacter baumannii с широкой лекарственной устойчивостью за 10 лет: общенациональные данные из Тайваня Программа надзора за устойчивостью к противомикробным препаратам (TSAR).BMC Infect Dis. 2012, 12: 200-10.1186 / 1471-2334-12-200.
Артикул PubMed PubMed Central Google ученый
Институт клинических и лабораторных стандартов: Методы разведения тестов на чувствительность к противомикробным препаратам для бактерий, которые растут в аэробных условиях; Утвержденное стандартное девятое издание. Документы CLSI M07-A09. Институт клинических и лабораторных стандартов. 2012, Уэйн, Пенсильвания, США: CLSI
2012, Уэйн, Пенсильвания, США: CLSI
Google ученый
Институт клинических и лабораторных стандартов: Стандарты эффективности испытаний на чувствительность к противомикробным препаратам. Девятнадцатое информационное приложение. M100-S19. Институт клинических и лабораторных стандартов (CLSI). 2009, Уэйн, Пенсильвания: CLSI, документ M100-S19
Google ученый
Monstein HJ, Ostholm-Balkhed A, Nilsson MV, Nilsson M, Dornbusch K, Nilsson LE: анализ мультиплексной ПЦР-амплификации для обнаружения bla SHV , bla ТЭМ и бла генов CTX-M в Enterobacteriaceae .АПМИС. 2007, 115: 1400-1408. 10.1111 / j.1600-0463.2007.00722.x.
CAS Статья PubMed Google ученый
Perez-Perez FJ, Hanson ND: Обнаружение плазмид-опосредованных генов β-лактамазы AmpC в клинических изолятах с помощью мультиплексной ПЦР. J Clin Microbiol. 2002, 40: 2153-2162. 10.1128 / JCM.40.6.2153-2162.2002.
CAS Статья PubMed PubMed Central Google ученый
О’Брайен Т.Ф., Стеллинг Дж.: Комплексное многоуровневое наблюдение за мировыми микробами-инфекциями и их устойчивостью к противомикробным препаратам. Clin Microbiol Rev.2011, 24: 281-295. 10.1128 / CMR.00021-10.
Артикул PubMed PubMed Central Google ученый
Castanheira M, Farrell SE, Krause KM, Jones RN, Sader HS: Современное разнообразие β-лактамаз среди Enterobacteriaceae в девяти США. Области переписи и активность цефтазидим-авибактама проверены в отношении изолятов, продуцирующих наиболее распространенные группы β-лактамаз. Антимикробные агенты Chemother. 2014, 58: 833-838. 10.1128 / AAC.01896-13.
Области переписи и активность цефтазидим-авибактама проверены в отношении изолятов, продуцирующих наиболее распространенные группы β-лактамаз. Антимикробные агенты Chemother. 2014, 58: 833-838. 10.1128 / AAC.01896-13.
Артикул PubMed PubMed Central Google ученый
Su CH, Wang JT, Hsiung CA, Chien LJ, Chi CL, Yu HT, Chang FY, Chang SC: рост резистентности к карбапенемам. Acinetobacter baumannii инфекция в больницах неотложной помощи на Тайване: связь с больницей использование противомикробных препаратов.PLoS One. 2012, 7: e37788-10.1371 / journal.pone.0037788.
CAS Статья PubMed PubMed Central Google ученый
Европейский комитет по тестированию чувствительности к противомикробным препаратам: Распределение МПК. 2012 г., http://www.eucast.org/mic_distributions/ [дата обращения 01.04.14]
2012 г., http://www.eucast.org/mic_distributions/ [дата обращения 01.04.14]
Google ученый
Центры по контролю и профилактике заболеваний: руководство CDC по контролю за инструментарием CRE-2012 CRE.Доступно по адресу http://www.cdc.gov/hai/pdfs/cre/CRE-guidance-508.pdf,
Дадли М.Н., Амброуз П.Г., Бхавнани С.М., Крейг В.А., Ферраро М.Дж., Джонс Р.Н.: Предпосылки и обоснование пересмотренных критериев интерпретации института клинических и лабораторных стандартов (контрольных точек) для Enterobacteriaceae и Pseudomonas aeruginosa : I. Цефалоспорины и азтреонам. Clin Infect Dis. 2013, 56: 1301-1309. 10.1093 / cid / cit017.
Артикул PubMed Google ученый
Hawser SP, Badal RE, Bouchillon SK, Hoban DJ, Hsueh PR: Сравнение клинических контрольных точек по цефалоспорину CLSI 2009, CLSI 2010 и EUCAST в недавно проведенных клинических изолятах Escherichia coli , Klebsiella pneumoniae и Klebsiella pneumoniae и Klebsiella olebsiella глобальное эпиднадзорное исследование. Int J Antimicrob Agents. 2010, 36: 293-294. 10.1016 / j.ijantimicag.2010.05.012.
CAS Статья PubMed Google ученый
Tan TY, Ng LS, He J, Chen DM: улучшенное обнаружение β-лактамаз AmpC в Escherichia coli , Klebsiella pneumoniae и Proteus mirabilis с использованием новых контрольных точек чувствительности для цефалоспоринов третьего поколения. Диагностика Microbiol Infect Dis. 2011, 70: 423-424. 10.1016 / j.diagmicrobio.2011.03.008.
CAS Статья PubMed Google ученый
Россолини Г.М., Д’Андреа М.М., Мугнайоли С. Распространение β-лактамаз расширенного спектра CTX-M-типа.Clin Microbiol Infect. 2008, 14 (Приложение 1): 33-41.
CAS Статья PubMed Google ученый
Границы | Биопленка Proteus mirabilis: разработка и терапевтические стратегии
Введение
Род Proteus включает палочковидные грамотрицательные бактерии, принадлежащие к семейству Enterobacteriaceae (Penner, 2005). Они широко распространены в окружающей среде, главным образом в воде, почве и желудочно-кишечном тракте людей и животных (Drzewiecka, 2016).Из микробиоты кишечника человека видов Proteus составляют <0,05% у здоровых людей (Яцуненко и др., 2012). Среди всех видов Proteus , Proteus mirabilis является наиболее частой причиной инфекций человека (Jacobsen and Shirtliff, 2011). Это условно-патогенный микроорганизм, вызывающий у человека различные заболевания дыхательных путей, желудочно-кишечного тракта, глаз, ушей и кожи, в том числе (O’hara et al., 2000).
Это условно-патогенный микроорганизм, вызывающий у человека различные заболевания дыхательных путей, желудочно-кишечного тракта, глаз, ушей и кожи, в том числе (O’hara et al., 2000).
P. mirabilis также является частой причиной осложненных инфекций мочевыводящих путей (ИМП) у пациентов с анатомическими или функциональными проблемами (Jamil et al., 2020). Это особенно проблематично у пациентов, подвергающихся длительной постоянной катетеризации мочи, у которых могут развиться катетер-ассоциированные инфекции мочевыводящих путей (CAUTI). Такие инфекции осложняются уникальной способностью P. mirabilis образовывать кристаллические биопленки, что в конечном итоге приводит к образованию инкрустированных и заблокированных катетеров (Jones et al., 2007). Пациенты могут страдать от задержки мочи и рефлюкса, которые сопровождаются болезненным растяжением мочевого пузыря и пиелонефритом.В этом случае могут быть неминуемы летальные осложнения, такие как сепсис и эндотоксический шок (Chen et al. , 2012). Более того, это может вызвать травму уретры и слизистой оболочки мочевого пузыря при удалении катетера (Vaidyanathan et al., 2010). Для замены заблокированных катетеров также могут потребоваться дополнительные посещения медсестер и направления к специалистам. Кроме того, кристаллические биопленки связаны с устойчивостью P. mirabilis в мочевыводящих путях за счет защиты от антибиотиков и иммунного ответа хозяина (Jacobsen et al., 2008).
, 2012). Более того, это может вызвать травму уретры и слизистой оболочки мочевого пузыря при удалении катетера (Vaidyanathan et al., 2010). Для замены заблокированных катетеров также могут потребоваться дополнительные посещения медсестер и направления к специалистам. Кроме того, кристаллические биопленки связаны с устойчивостью P. mirabilis в мочевыводящих путях за счет защиты от антибиотиков и иммунного ответа хозяина (Jacobsen et al., 2008).
Колонизация кишечника с помощью P. mirabilis является резервуаром для периодической колонизации периуретральной области. Во время введения мочевые катетеры заражаются микроорганизмами, которые впоследствии передаются в мочевой пузырь (Mathur et al., 2005). Адгезия к поверхности катетера или эпителию мочевого пузыря вызывает продукцию экзополисахаридов и образование биопленок (Nicolle, 2014).
Биопленки — это хорошо организованные структуры одно- или многовидовых микробных сообществ, в которых микробные клетки необратимо прикреплены к субстрату и друг к другу.Внутри биопленок клетки встроены в самостоятельно продуцируемую матрицу внеклеточных полимерных веществ, включая полисахариды, белки, липиды и внеклеточную ДНК (Flemming and Wingender, 2010). Формирование биопленок — это многоступенчатый процесс, который начинается с обратимой бактериальной адгезии к биотическим или абиотическим поверхностям, за которой следует необратимое прикрепление, образование микроколоний и, наконец, развитие зрелой биопленки. Затем с поверхности зрелой биопленки начинают выделяться свободные бактерии, которые распространяются в других благоприятных условиях окружающей среды (O’toole et al., 2000).
Формирование биопленки используется некоторыми видами микробов для выживания в суровых условиях окружающей среды и повышения устойчивости к антибиотикам, а также иммунной системы хозяина. Было обнаружено, что устойчивость к противомикробным препаратам микроорганизмов, связанных с биопленкой, в 10–1000 раз выше, чем у их планктонных аналогов (Hoiby et al., 2010). Причины такого резкого увеличения устойчивости могут быть связаны с матрицей биопленки, которая препятствует проникновению антимикробных агентов через слои биопленки, и физиологическими характеристиками микробных клеток внутри биопленок, особенно с персистирующими клетками (Tseng et al., 2013).
Образование биопленок
Среди огромного арсенала факторов вирулентности, используемых P. mirabilis , чтобы вызвать катетер-ассоциированные инфекции мочевыводящих путей (CAUTI), некоторые факторы вирулентности были связаны с их способностью образовывать биопленки, например, подвижность роя, фимбрии, продукция уреазы, капсула полисахаридные и отводящие насосы. Роль различных факторов вирулентности в формировании биопленки из P. mirabilis проиллюстрирована на Рисунке 1.
Рисунок 1 .Роль различных факторов вирулентности в формировании кристаллических биопленок под действием P. mirabilis на поверхности катетера.
P. mirabilis особенно хорошо известен своей отличительной способностью к роению. Рост организма на твердых поверхностях вызывает дифференциацию коротких стержневидных «пловцов» в сильно удлиненные и гипер-жгутиковые «роевые клетки», которые способны выстраиваться в многоклеточные рафты. Эти рафты клеток могут быстро координированно мигрировать по твердым поверхностям (Stickler and Hughes, 1999; Harshey, 2003). Таким образом, роящаяся подвижность может способствовать миграции P.mirabilis из периуретральной области вдоль поверхности катетера в мочевой пузырь, инициируя CAUTI (Jones et al., 2005). Утрата способности к роению из-за мутаций была связана с неспособностью P. mirabilis мигрировать по поверхности катетера (Jones et al., 2004). Более того, роевые клетки часто демонстрируют более высокую экспрессию факторов вирулентности, что еще больше усиливает их способность прикрепляться к поверхности катетера и эпителию мочевого пузыря (Allison et al., 1992; Fraser et al., 2002). Однако некоторые исследования показали, что роение должно подавляться для того, чтобы P. mirabilis оставался прикрепленным к поверхности катетера и инициировал образование биопленки (Liaw et al., 2003; Jones et al., 2005).
Начальной стадией образования биопленок на поверхности катетера является прикрепление фимбрий (адгезинов) к белковой оболочке, полученной из жидкостей организма, на поверхности катетера (Donlan, 2002) или непосредственно к материалу катетера (Downer et al., 2003) . По крайней мере 17 фимбриальных оперонов были идентифицированы в геноме P.mirabilis путем секвенирования всего генома. Это в основном самый высокий показатель среди всех секвенированных бактериальных геномов (Pearson et al., 2008; Scavone et al., 2016) и четко отражается в его наибольшей способности прикрепляться к поверхности катетера среди грамотрицательных бактерий (Roberts et al., 1990 ). Наиболее изученными фимбриями являются маннозоустойчивые / протейоподобные (MR / P) фимбрии, маннозоустойчивые / клебсиеллоподобные (MR / K) гемагглютинины (Old and Adegbola, 1982), фимбрии P. mirabilis (PMF) (Бахрани и др., 1993), адгезины уроэпителиальных клеток (UCA) / неагглютинирующие фимбрии (NAF) (Wray et al., 1986) и фимбрии при температуре окружающей среды (ATF) (Massad et al., 1996).
Экспрессия гемагглютининов MR / K была связана с прикреплением P. mirabilis к поверхностям катетера, чтобы инициировать образование биопленок во время CAUTI (Jacobsen et al., 2008). Однако до сих пор неизвестно, опосредован ли паттерн гемагглютинации MR / K определенным типом фимбрий или более чем одним типом фимбрий.Точная природа гена (ов), связанного с паттерном гемагглютинации MR / K, также еще не установлена (Schaffer and Pearson, 2015). Как MR / P фимбрии, так и PMF, как было обнаружено, играют важную роль в избирательном прикреплении P. mirabilis к эпителию мочевого пузыря (Sareneva et al., 1990; Rozalski et al., 1997). В исследовании Jansen et al. (2004), было обнаружено, что фимбрии MR / P не являются ни необходимыми, ни достаточными для инициации образования биопленок. В том же исследовании сделан вывод, что их конститутивная экспрессия усиливает образование биопленок.О решающей роли MR / P в формировании биопленок у P. mirabilis свидетельствуют более мелкие биопленки, образованные мутантами MR / P по сравнению со штаммами дикого типа (Scavone et al., 2016). Напротив, в том же исследовании сообщается об усиленном образовании биопленок у изогенных мутантов, неспособных экспрессировать PMF. Было обнаружено, что UCA, также называемые неагглютинирующими фимбриями (NAF) (Tolson et al., 1995), структурно гомологичны кишечным колонизационным фимбриям E. coli (Cook et al., 1995).Таким образом, было высказано предположение, что они способствуют колонизации кишечника P. mirabilis , таким образом формируя резервуар организмов, которые потенциально могут вызывать CAUTI (Coker et al., 2000). Совсем недавно Wurpel et al. (2016) идентифицировали новые UCA-подобные фимбрии (UCL) у уропатогенной E. coli (UPEC). Авторы продемонстрировали свою способность способствовать образованию биопленок на абиотических поверхностях и их участие в прикреплении UPEC к уроэпителиальным клеткам. Между тем, способность к образованию биопленок оказалась ниже у мутанта UCA P.mirabilis , выращенные в искусственной моче, по сравнению со штаммами дикого типа (Scavone et al., 2016). Несмотря на их первоначальное сообщение о том, что ATF не играет роли в ИМП P. mirabilis (Zunino et al., 2000), Scavone et al. (2016) позже продемонстрировали их роль в адгезии и образовании биопленок на абиотических поверхностях. Это, скорее, может быть связано с их возможной ролью в выживании P. mirabilis в окружающей среде, о чем свидетельствует их оптимальная температура экспрессии (23 ° C) (Rocha et al., 2007).
Характерной чертой P. mirabilis является его уникальная способность образовывать необычные кристаллические биопленки, которые обычно приводят к инкрустации и закупорке катетеров, что усложняет ОСТОРОЖНО. Два фактора вирулентности, которые, как известно, играют важную роль в формировании кристаллических биопленок из P. mirabilis , — это фермент уреаза и капсульные полисахариды (CPS) (Jacobsen and Shirtliff, 2011). Практически все клинические штаммы P. mirabilis продуцируют исключительно мощный фермент уреазу.Фермент катализирует гидролиз мочевины в моче до аммиака, повышая местный pH мочи (Розальский и др., 1997). Обычно это сочетается с местным перенасыщением и осаждением минералов, обычно присутствующих в моче, с образованием кристаллов струвита (фосфат аммония, магния) и кристаллы гидроксиапатита (фосфат кальция) (Bichler et al., 2002). Такие кристаллы включаются в развивающуюся биопленку — процесс, называемый уреолитической биоминерализацией (Jacobsen and Shirtliff, 2011). Помимо своей основной роли в формировании кристаллической биопленки, сильно щелочной аммиак, продуцируемый ферментом уреаза, является непосредственно токсичным для клеток млекопитающих и может вызывать повреждение тканей (Burne and Chen, 2000).
Было обнаружено, что помимо уреолитической активности P. mirabilis их ХПС ускоряют рост минеральных кристаллов (Jacobsen and Shirtliff, 2011). Благодаря кислой природе бактериальных CPS, они обладают большим сродством к связыванию катионов металлов в моче посредством электростатического взаимодействия. Тем не менее, бактериальные виды, такие как E. coli , с высоким сродством к Mg 2+ , как было обнаружено, ингибируют образование кристаллов струвита при нейтральном pH. Возможно, это связано с сильным хелатированием ионов Mg 2+ , которые больше не доступны для роста кристаллов.Напротив, CPS P. mirabilis имеют более низкое сродство к ионам Mg 2+ . Таким образом, ионы слабо связаны с организмом. Следовательно, они становятся концентрированными, но легко высвобождаются для образования кристаллов струвита (Dumanski et al., 1994).
Системы оттока, как недавно было обнаружено, играют важную роль в кристаллических биопленках P. mirabilis , образование которых снижается за счет нарушения гена bcr (Holling et al., 2014). Этот ген кодирует оттокный насос MFS, известный как белок устойчивости к бицикломицину.В E. coli этот оттокный насос участвует в устойчивости к сульфонамиду и бицикломицину (Bentley et al., 1993) в дополнение к экспорту коротких пептидов (Hayashi et al., 2010). Являясь компонентом полимерной матрицы, продуцируемой биопленками (Flemming and Wingender, 2010), отток пептидов может способствовать формированию биопленок (Alav et al., 2018). Пептиды также могут быть частью системы восприятия кворума (QS) P. mirabilis , следовательно, их отток может влиять на передачу сигналов во время образования биопленки (Alav et al., 2018).
Несмотря на существование некоторых фенотипов, требующих межклеточной координации, таких как роение, образование моновидовых и многовидовых биопленок, полностью определенная система QS, включающая продуцент аутоиндукторного сигнала и соответствующий ему рецептор, еще не идентифицирована у P. mirabilis (Schaffer and Pearson , 2015). Следовательно, необходимы дальнейшие исследования, чтобы заполнить этот пробел в знаниях. В отличие от Serratia marcescenes , где подвижность роения регулируется гомологом системы LuxI / LuxR QS на основе ацилированного гомосеринлактон (AHL) (Sakuraoka et al., 2019), гомологи этой системы не были идентифицированы в геноме P. mirabilis (Armbruster, Mobley, 2012). Однако было обнаружено, что воздействие на P. mirabilis N-бутаноил гомосеринлактон (BHL) значительно влияет на формирование биопленок у P. mirabilis O18 (Stankowska et al., 2012). Другой системой QS, широко распространенной у грамотрицательных и грамположительных бактерий, является система LuxS / LuxP или LsR. Было обнаружено, что P. mirabilis обладает геном LuxS , который продуцирует LuxS-зависимую молекулу QS (AI2) во время роения.Однако нулевая мутация этого гена не влияла на подвижность роя или вирулентность (Schneider et al., 2002). С другой стороны, ни LuxP , ни Lsr гомологи не были идентифицированы в геноме P. mirabilis (Pearson et al., 2008). Отсутствие гомологов для известных сайтов связывания AI2 может указывать на возможность использования этой системы в передаче сигналов между видами (Pereira et al., 2013). Было обнаружено, что гомолог LuxQ, гибридной сенсорной киназы, в системе LuxS / LuxP QS в Vibrio harveyi , кодируется геном RsbA в P.mirabilis . Было обнаружено, что этот ген играет роль в роении и чувствителен к плотности бактерий (Belas et al., 1998).
Терапевтические стратегии
Противомикробные средства
Как и у других биопленкообразующих бактерий, образование биопленок у P. mirabilis сопровождается большей устойчивостью к антимикробным препаратам. Это было продемонстрировано некоторыми исследованиями (Aiassa et al., 2006). Таким образом, было предпринято множество попыток усилить действие антимикробных средств против P.mirabilis биопленки. Одна попытка состояла в том, чтобы ввести противомикробный агент в режиме циклического дозирования, в котором курс лечения прерывается на время выдержки, которое позволяет персистирующим клеткам терять толерантность к противомикробному агенту (Lewis, 2001, 2005). Это было предложено для устранения биопленок и их персистирующих клеток. Однако для успешного удаления биопленок с использованием этого режима время выдержки должно строго коррелировать со временем, необходимым для восстановления клетками-персистерами их антимикробной чувствительности (Lewis, 2001).Это осложняется отсутствием полного понимания точных механизмов, с помощью которых достигается толерантность (Azeredo and Sutherland, 2008). С другой стороны, было обнаружено, что два последовательных применения противомикробных препаратов к биопленке P. mirabilis уменьшают количество клеток-персистеров только на один log (Abokhalil et al., 2020). В том же исследовании комбинация ципрофлоксацина с нитратом серебра полностью уничтожила клетки-персистеры в планктонных популяциях P. mirabilis . Это может быть связано с производством активных форм кислорода и повышенной проницаемостью бактериальных клеток как в активном, так и в неактивном состоянии под действием нитрата серебра (Morones-Ramirez et al., 2013).
Были также проведены исследования для проверки влияния минимальной ингибирующей концентрации (МИК) и уровней субмикк антибиотиков на подавление прилипания микробных клеток к пластиковым поверхностям и, следовательно, на подавление образования биопленок. Их влияние на предварительно сформированные биопленки также широко изучалось. Исследование Wasfi et al. (2012) проверили влияние уровней суб-МПК четырех антибиотиков на микробную адгезию и образование биопленок сильными биопленкообразующими клиническими штаммами P.mirabilis . Проверенные антибиотики включали: ципрофлоксацин, цефтриаксон, нитрофурантоин и гентамицин. Из них наиболее активен ципрофлоксацин. Снижение образования биопленок до 93% было достигнуто при использовании концентрации ципрофлоксацина, соответствующей 1 / 2MIC. При тестировании воздействия более низких концентраций на те же штаммы ингибирующее действие ципрофлоксацина на образование биопленок было резко снижено.
С другой стороны, Kwiecinska-Pirog et al. (2013a) проверили влияние субмиккологических уровней ципрофлоксацина и цефтазидима на предварительно сформированные биопленки.Антибиотики использовали в концентрациях, соответствующих уровням 1 / 8-1 / 4-, 1/2-МИК и на уровне МИК для каждого. Действие тестируемых антибиотиков на биопленки оценивали с помощью колориметрического анализа, основанного на клеточной физиологии биопленок с использованием хлорида 2,3,5-трифенил-тетразолия (ТТС). Обработка предварительно сформированной биопленки ципрофлоксацином при значении МИК показала значительное снижение жизнеспособности микробов. Напротив, было обнаружено, что более низкие концентрации (1/8 МИК) ципрофлоксацина увеличивают интенсивность окраски ТТС, отражая повышенную жизнеспособность по сравнению с контролем.Однако правомерность использования TTC для оценки биопленок P. mirabilis сомнительна. Только несколько исследований использовали этот метод для P. mirabilis (Kwiecinska-Pirog et al., 2013b, 2014), и ни одно из опубликованных исследований не оптимизировало этот метод для этого организма. Напротив, этот метод был оптимизирован для анализа биопленок Pseudomonas aeruginosa (Sabaeifard et al., 2014) и Campylobacter jejuni (Brown et al., 2013) путем корректировки времени инкубации биопленок с TTC до 5 и 24 часов. соответственно.Здесь следует отметить, что Квечинска-Пирог и его коллеги использовали всего 2 часа инкубации.
Сильный ингибирующий эффект ципрофлоксацина в концентрациях ниже МИК на биопленок P. mirabilis по сравнению с другими классами антимикробных агентов можно объяснить ингибированием уреазы (Abdullah et al., 2016) и уменьшением образования жгутиков (Horii et al. , 2003). Дополнительное преимущество использования ципрофлоксацина при лечении инфекций, связанных с P.mirabilis сообщили Irwin et al. (2013). Они обнаружили, что как бактериостатическое, так и бактерицидное действие ципрофлоксацина на клетки, образующие биопленку P. mirabilis , усиливались за счет увеличения pH с 5 до 9. Это отражалось в 10-кратном снижении минимальной концентрации уничтожения биопленки (MBEC). Повышенная активность при высоких уровнях pH делает ципрофлоксацин хорошим кандидатом для использования при лечении CAUTI P. mirabilis , в которых фермент уреаза играет главную роль.Irwin et al. (2013) обосновали свои выводы приобретением отрицательного суммарного заряда молекулами ципрофлоксацина при высоком pH, что позволяет им легко диффундировать через матрицу биопленки. Однако при более низком pH молекулы антибиотика приобретают положительный суммарный заряд и сильно притягиваются к отрицательно заряженной экзополимерной матрице биопленки. Это препятствует проникновению антибиотика через матрицу биопленки. В отличие от ранее упомянутых результатов, другое исследование искусственной мочи показало, что проникновение ципрофлоксацина в P.mirabilis снижалась при высоком pH за счет биоминерализации. Это было очевидно среди штаммов, продуцирующих уреазу, по сравнению с штаммами, не продуцирующими уреазу, при окрашивании LIVE / DEAD (Li et al., 2016).
Было использовано несколько стратегий для контроля образования биопленок в катетерах с использованием противомикробных агентов, среди которых адсорбция противомикробных агентов на поверхности катетера и использование модифицированного материала покрытия, таким образом подавляя адгезию бактерий. Только катетеры, покрытые серебром и антибиотиками, прошли клинические испытания (Singha et al., 2016). Было обнаружено, что наполнение баллонов катетера водой, содержащей растворимые противомикробные препараты, обеспечивает адгезию противомикробного агента к поверхности катетера, предотвращая последующую адгезию микроорганизмов (Stickler et al., 2003; Williams and Stickler, 2008). Примером этой стратегии является использование смеси миндальной / молочной кислоты в силиконовых катетерах, что дало спорные результаты (Robertson and Norton, 1990; Stickler and Hewett, 1991). Вторая стратегия заключается в использовании модифицированного покрытия катетера с антимикробным эффектом для предотвращения P.mirabilis колонизация. Серебряные покрытия и силиконовые катетеры, покрытые нитрофуразоном, показали значительную профилактику катетер-ассоциированной бактериурии во время краткосрочной катетеризации госпитализированных пациентов (Stensballe et al., 2007; Schumm and Lam, 2008; Johnson et al., 2012). Однако кристаллические биопленки все же могут образовываться на катетерах Фолея, покрытых гидрогелем / серебром, особенно когда антимикробное покрытие не может диффундировать из материала катетера в просвет катетера (Morgan et al., 2009). С другой стороны, было обнаружено, что включение ципрофлоксацина в биоразлагаемый полиуретан на водной основе усиливает ингибирующее действие ципрофлоксацина на образование биопленок у P. mirabilis в среде искусственной мочи in vitro (Xu et al., 2019).
Фитохимические продукты
Исторически растения считались богатым источником широкого спектра биоактивных соединений, известных как фитохимические вещества (Ahmed and Urooj, 2009). Среди их разнообразных применений фитохимические вещества особенно вызвали большой интерес из-за их антибиотикопленочной активности.Эта активность объяснялась их способностью подавлять факторы вирулентности, в том числе: прилипание микробов к поверхностям, определение кворума, активность уреазы и выработку экзополисахаридного матрикса (таблица 1). В нескольких исследованиях сообщалось о развитии устойчивости к антивирулентным соединениям (Beceiro et al., 2013).
Таблица 1 . Обзор фитохимических веществ, оцениваемых для контроля биопленок Proteus mirabilis .
Было обнаружено, что подавление прилипания к поверхностям является первым шагом в образовании биопленок, что снижает общую способность микроорганизмов образовывать биопленки.Многочисленные исследования показали корреляцию между потреблением клюквы ( Vaccinum macrocarpon ) и профилактикой ИМП (Nowack and Schmitt, 2008; Tempera et al., 2010). Основополагающий механизм еще окончательно не установлен. Тем не менее, было высказано предположение, что клюква препятствует адгезии бактерий к уроэпителиальным клеткам, что приводит к неспособности бактериальных клеток колонизировать мочевыводящие пути (Nicolosi et al., 2014). Такой эффект был коррелирован с двумя компонентами клюквы, включая фруктозу, которая блокирует фимбрии 1 типа (чувствительные к маннозе), и проантоцианидины (PAC), которые ингибируют устойчивые к маннозе P-фимбрии (Ermel et al., 2012). В исследовании O’may et al. (2016), обработка клюквой P. mirabilis снижает адгезию к клеточной линии HT1376 на 75%. Подвижность и активность уреазы также снизились в ответ на такое же лечение. С другой стороны, обработка клюквы в упомянутом исследовании усиливала образование биопленок P. mirabilis на пластиковых поверхностях. Такой эффект был связан с временным снижением подвижности бактерий. Это также было клинически очевидным по более высокому уровню P.mirabilis- вызывал инкрустацию катетера в моче у людей, которые употребляли клюквенный сок, чем у тех, кто потреблял эквивалентное количество воды (Morris et al., 1997; Morris and Stickler, 2001).
Еще одним фитохимическим соединением, которое продемонстрировало ингибирующее действие на биопленок P. mirabilis , является экстракт Ibicella lutea , местного растения из Южной Америки. Антибиотикопленочная активность Ibicella lutea была связана с его способностью ингибировать роящуюся дифференцировку P.mirabilis (Соса, Зунино, 2009). Как упоминалось ранее, подвижность роения используется организмом для перемещения по твердым поверхностям, пока не достигнет места колонизации. За этим следует ингибирование движения жгутиков и образование биопленок (Guttenplan and Kearns, 2013).
Щелочной pH мочи, обусловленный активностью фермента уреазы, играет важную роль в развитии кристаллических биопленок у P. mirabilis . Соответственно, ингибирование продукции уреазы и последующее повышение pH может быть важной целью предотвращения образования биопленок.Фитохимическое соединение, которое нацелено на производство уреазы у P. mirabilis , представляет собой аллицин, экстрагированный из чеснока. На уровнях ниже МПК он может снизить образование биоминерализованной биопленки до 35%, как сообщили Ranjbar-Omid et al. (2015). Авторы также сообщили о полном уничтожении укоренившихся биопленок при более высоких концентрациях аллицина. Уникальной особенностью аллицина, среди некоторых других соединений, является его способность проникать через мембрану бактериальной клетки и внутриклеточно ингибировать фермент уреазу (Miron et al., 2000). Однако клиническому применению аллицина препятствует его нестабильность в биологических жидкостях (Rosen et al., 2001). Ингибирование продукции уреазы и образования биопленок у P. mirabilis также было очевидным для N-ацетилцистеина (NAC) и дипропилдисульфида, двух компонентов лукового масла (Abdel-Baky et al., 2017). Помимо своей ингибирующей уреазу активности, NAC разрушает дисульфидные связи во внеклеточном полимерном матриксе, тем самым нарушая архитектуру биопленки (Kregiel et al., 2019).
Несмотря на отсутствие четкой информации о четко определенной системе QS в P. mirabilis , в нескольких исследованиях сообщалось об антикворумном эффекте некоторых фитохимических соединений. Такие результаты были основаны на их способности подавлять выработку виолаацеина Chromobacterium violaceum (ATCC 12472), не влияя на рост микробов. Насколько нам известно, ни в одном из опубликованных исследований не изучалась продукция АГЛ у P. mirabilis путем тестирования эффекта P.mirabilis на мутанте биосенсора Chromobacterium violaceum CV026.
В исследовании Salini et al. (2015), Hyptis suaveolens , ароматное многолетнее растение, произрастающее в тропической Америке, было оценено на предмет потенциальной терапевтической ценности. Растительный экстракт проявлял сильную антикворум-чувствительную активность при использовании биосенсора QS Chromobacterium violaceum (ATCC 12472) и мог уменьшать массу биопленки Proteus sp. в зависимости от дозы.При концентрации 200 мкг / мл экстракт Hyptis suaveolens может эффективно вытеснять биопленку P. mirabilis и P. vulgaris на 42% и 59% соответственно, не влияя на рост микробов.
В исследовании, проведенном Packiavathy et al. (2014) было обнаружено, что уровни суб-МПК куркумина, мощного ингибитора QS, снижают выработку полисахаридов и подвижность роя, следовательно, уменьшают образование биопленок. Соединение также может ингибировать образование микроколоний и разрушать предварительно сформированные P.mirabilis биопленки.
Было обнаружено, что фитохимическое соединение, пирроло [1,2-a] пиразин-1,4-дион, гексагидро-3- (2-метилпропил), экстрагированное из эндофитного актиномицета. Nocardiosis sp., Ингибирует прикрепление микробов и образование биопленок. . Исследовательская группа доказала ингибирующее действие этого соединения на QS с помощью биосенсора QS Chromobacterium violaceum (ATCC 12472) (Rajivgandhi et al., 2018).
Capparis spinose — это специя, которая, как сообщается, обладает рядом потенциально полезных лечебных свойств, включая антиоксидантную, противогрибковую, противовоспалительную, антидиабетическую и противодействующую ожирению.Иссак с соавторами продемонстрировали антикворумную активность экстракта C. spinose . Под действием экстракта с помощью конфокальной лазерной сканирующей микроскопии (CLSM) было выявлено четкое изменение архитектуры биопленки P. mirabilis . Это было связано с ингибированием образования биопленок и продукции экзополисахаридов до 70 и 67% соответственно. Одним из биоактивных метаболитов в спинозе C. , которому приписывают негативное влияние на образование биопленок, является ванильная кислота (Issac Abraham et al., 2011). О антикворумной активности ванилиновой кислоты сообщали и другие исследования (Choo et al., 2006; Sethupathy et al., 2017).
Латекс Euphorbia trigona использовался для лечения инфекционных и воспалительных заболеваний в Индии как часть их фармакопеи. Об ингибировании роя подвижности и факторов вирулентности, таких как активность уреаз у P. mirabilis в присутствии латекса E. trigona , сообщили Nashikkar et al. (2011).Такие эффекты приписывались некоторым компонентам экстракта, обладающим антикворум-чувствительной активностью.
Линалоол — это монотерпеновый спирт, содержащийся в эфирных маслах многих цветочно-ароматических и пряных растений (Peana et al., 2002). Ингибирующее действие линалоола на факторов вирулентности P. mirabilis было предметом недавнего исследования Durgadevi et al. (2019). Линалоол в концентрации 0,4 мг / мл достигал до 75% ингибирования образования кристаллической биопленки. Анализ транскриптома показал подавление активности генов flhD, flhB, speA, rsbA, ureR, hpmB и hpmA .В свою очередь, упомянутые гены влияют на свойства вирулентности P. mirabilis , такие как подвижность, образование биопленок, уреазная активность и продукция гемолизина.
Апитерапия
Одной из естественных альтернатив антибиотикам для борьбы с биопленками является апитерапия, практика, при которой продукты пчеловодства, такие как мед, пыльца и прополис, используются для профилактики или лечения заболеваний (Malone and Tsai, 2016).
Мед — это природное соединение, антибиотикопленочная активность которого была предметом многих исследований.Ингибирующее действие нескольких видов меда различного ботанического происхождения на биопленок P. mirabilis было оценено Майтаном и его сотрудниками. Все образцы меда были способны значительно ингибировать прилипание клеток P. mirabilis к пластиковым поверхностям при значении суб-МПК 10% (мас. / Об.). Более того, частичное отделение предварительно сформированных биопленок достигалось при концентрации 50% (мас. / Об.) Каждой. Среди протестированных видов меда наиболее сильные антибиотикопленочные свойства показал мед манука, полученный из нектара дерева манука.Он может полностью уничтожить все встроенные в биопленку клетки P. mirabilis . Считается, что метилглиоксаль, основной антибактериальный компонент меда манука, легко диффундирует через установленную матрицу биопленки P. mirabilis и убивает бактериальные клетки (Majtan et al., 2014).
Еще одно доказательство эффективности меда манука в разрушении предварительно сформированных биопленок P. mirabilis было представлено Аббасом (2014), который также сообщил о таком же эффекте для меда из египетского клевера.Мед манука также был признан другим исследованием за его иммуностимулирующий эффект и ускорение заживления ран (Gannabathula et al., 2012).
Другой продукт пчеловодства, который, как известно, является одним из самых богатых источников активных соединений, таких как флавоноиды и фенольные соединения, — это этанольный экстракт прополиса (EEP) (Freires et al., 2016). Kwiecinska-Pirog и его коллеги оценили влияние EEP на формирование биопленок P. mirabilis , а также его влияние на предварительно сформированные биопленки (Kwiecinska-Pirog et al., 2019). Уменьшение образования биопленок наблюдалось в диапазоне согласованности 2,5–100 мг / мл, в то время как более высокие концентрации (25–100 мг / мл) могут успешно уменьшить образование предварительно сформированных биопленок. Между тем, образование биопленки у P. mirabilis усиливалось обработкой низкой концентрацией (1,5 мг / мл) EEP. Это может быть связано с подавлением подвижности бактерий при более низкой концентрации экстракта, что усиливает прилипание клеток к поверхностям (De Marco et al., 2017).
Препараты перепрофилирования
Переназначение лекарственных средств или изменение их положения — это использование утвержденных препаратов для лечения заболеваний, отличных от тех, для которых они были первоначально показаны.Это позволяет сэкономить время и средства за счет пропуска некоторых этапов клинических испытаний, необходимых для утверждения новых лекарств (Pushpakom et al., 2019).
Амброксол — муколитическое и отхаркивающее средство, обычно применяемое у пациентов с астмой и хроническим бронхитом. Сообщалось, что он препятствует образованию биопленки в результате его способности ингибировать адгезию, QS и производство матрикса биопленки (Lu et al., 2010). В исследовании Аббаса (2013) амброксол ингибировал образование биопленок и устранял предварительно сформированные биопленки дозозависимым образом.Ингибирование биопленки и уничтожение предварительно сформированной биопленки P. mirabilis достигли 80 и 76% соответственно.
Другие перепрофилированные препараты с потенциальной антибиотикопленочной активностью включают флуоксетин и тиоридазин, которые показаны для лечения депрессии и психоза соответственно. Было обнаружено, что оба препарата значительно снижают скорость образования кристаллической биопленки P. mirabilis на модели катетера и увеличивают время, необходимое для закупорки катетера. Значительное снижение плавания и роения на P.mirabilis также была очевидна после лечения флуоксетином и тиоридазином (Nzakizwanayo et al., 2017). Используя методы молекулярного докинга, было предсказано, что оба препарата сильно взаимодействуют с связанной с биопленкой системой оттока Bcr / CflA . Эта система оттока ранее была связана с образованием и подвижностью биопленок у P. mirabilis (Holling et al., 2014).
Фаготерапия
Фаготерапия (ФТ) возникает как один из новых альтернативных методов борьбы с бактериями с использованием естественного хищника (бактериофага), который специфически убивает бактерии (Miedzybrodzki et al., 2012). За последние два десятилетия наблюдается рост интереса к терапевтическому использованию фагов. Это было вызвано высокой распространенностью бактерий с множественной лекарственной устойчивостью и недостаточным открытием новых антибиотиков (Skurnik et al., 2007).
Фаги могут быть более предпочтительными по сравнению с антибиотиками при лечении бактериальных инфекций по нескольким причинам: (а) Узкий спектр действия, что позволяет избирательно воздействовать на патогенные бактерии, не затрагивая нормальную флору. Однако специфичность штаммов может ограничивать их терапевтическое применение и предполагает использование коктейлей из бактериофагов (Alves et al., 2016; Язди и др., 2018). Коктейли также используются, чтобы избежать появления устойчивых к фагам штаммов за счет изменения рецепторов бактериальных мембран. (B) Способность фага к размножению в месте инфекции (Hanlon, 2007; Gorski et al., 2009; Kutter et al. 2010; Harper et al., 2014), (c) Сохранение активности против бактерий с множественной лекарственной устойчивостью, поскольку он использует уникальный механизм действия (Sillankorva et al., 2011), (d) низкая стоимость (Stafford, 2011), (e) Обнаружение новых бактериофагов намного проще и требует меньше времени, чем открытие антибиотиков.
Бактериофаги повсеместно встречаются в окружающей среде. Их также много в пищеварительном тракте людей и животных (Viertel et al., 2014). Было предпринято несколько исследований по выделению бактериофагов с потенциалом борьбы с биопленками P. mirabilis . В таких исследованиях использовались методы обогащения, в которых клинические штаммы P. mirabilis использовались для выделения бактериофагов из проб сточных вод (Lehman and Donlan, 2015; Nzakizwanayo et al., 2015; Melo et al., 2016) и человеческих фекалий (Морозова и др., 2016). Как показал трансмиссионный электронный микроскоп (ТЕМ), бактериофаги с активностью против биопленок P. mirabilis принадлежали к отряду Caudovirales , который включает хвостатые бактериофаги. Среди них некоторые принадлежали к семейству Siphoviridae (фаги с длинным гибким несокращающимся хвостом) (Maszewska et al., 2018; Yazdi et al., 2018), а другие принадлежали семейству Podoviridae (фаги с короткими короткими концами). хвост) (Kaca et al., 2011; Alves et al., 2016; Melo et al., 2016) и Myoviridae (фаги с сократительным хвостом) (Kaca et al., 2011; Melo et al., 2016; Maszewska et al., 2018; Alves et al., 2019). Все они были литического типа, которые реплицируются внутри клеток-хозяев, в конечном итоге вызывая их разрыв с высвобождением потомства вирусов (Skurnik et al., 2007; Gill and Hyman, 2010).
Были предложены различные механизмы антибиотикопленочной активности фагов. Фаги могут перемещаться по водным каналам, чтобы достигнуть бактериальных клеток, залитых биопленкой (Chan and Abedon, 2014).Они локально реплицируются в клетках, которых они достигли, чтобы увеличиваться в количестве и распространяться на соседние клетки, уменьшая общее количество клеток, образующих биопленку. Кроме того, фаги могут экспрессировать или индуцировать экспрессию деполимеризующих ферментов, которые разрушают экзополисахарид и способствуют распространению фагов внутри биопленок (Latka et al., 2017). Бактериофаги также могут инфицировать реактивированные клетки-персистеры, предотвращая рецидив инфекций из-за этой реактивации (Harper et al., 2014).
Однако несколько исследований показали, что фаги могут более эффективно предотвращать образование P.mirabilis , чем разрушает предварительно сформированную (Carson et al., 2010; Lehman, Donlan, 2015). Это было связано с плохой проницаемостью фагов в более старые слои биопленок (Chhibber et al., 2013). Эффективный лизис бактериофага в биопленках был недостаточным из-за низкой концентрации активно пролиферирующих клеток. Это связано с низкой метаболической активностью во внутренних частях биопленок (Sillankorva et al., 2004; Cerca et al., 2007). Соответственно, при введении на ранней стадии бактериальной колонизации было продемонстрировано, что бактериофаги предотвращают закупорку катетеров Фолея P.mirabilis в течение более 8 дней (Nzakizwanayo et al., 2015; Aniejurengho, 2016). С другой стороны, установленные или поздние стадии инфекций, связанных с биопленками, более устойчивы к уничтожению бактериофагами (Aniejurengho, 2016).
Что касается использования бактериофагов для обработки кристаллических биопленок P. mirabilis , было обнаружено, что несколько факторов в мочевыводящих путях влияют на адсорбцию фага клетками-хозяевами. К таким факторам относятся химическая среда и pH (Jonczyk et al., 2011). Катионы кофакторов, такие как CaCl 2 и MgCl 2 , в моче, как было обнаружено, увеличивают инфекционность фагов в результате более высокой концентрации фагов на поверхности бактериальных клеток и изменения рецепторов. В результате доступ фагов к рецепторам или транслокация фаговых нуклеиновых кислот ускоряется (Jamal et al., 2015; Yazdi et al., 2018). С другой стороны, кристаллы, образующиеся в моче во время образования биопленки, ингибируют адсорбцию фагов на их клетки-мишени.
Противоречивые результаты о влиянии pH на активность бактериофагов были получены в предыдущих исследованиях. Некоторые из них продемонстрировали инактивацию фагов при экстремальных значениях pH (pH 2 и 11) и снижение титра фагов при pH 8 примерно на 30%. Соответственно, авторы предположили, что эффективность фагов может снижаться из-за щелочных условий в моче во время инфицирования P. mirabilis . Тогда для уничтожения биопленок могут потребоваться более высокие in vivo доз фагов (Maszewska et al., 2018; Язди и др., 2018). С другой стороны, бактериофаги, выделенные Yazdi et al. (2018) показали высокую стабильность в широком диапазоне pH (3–11). Открытие, которое было сочтено полезным для обработки биопленки P. mirabilis с колебаниями pH. Хотя внешняя часть биопленки имеет щелочную природу, в матрице биопленки наблюдается низкий pH из-за накопления кислых метаболитов. Таким образом, стабильность фагов в широком диапазоне pH позволяет сохранять активность во время транслокации через различные части биопленки, что делает фаги хорошими кандидатами для лечения ИМП, вызванных P.mirabilis биопленки.
Донлан (2009) предложил две стратегии на основе фагов для борьбы с образованием бактериальной биопленки на поверхности катетера. Первая стратегия основана на предотвращении бактериальной адгезии и образования биопленок путем покрытия поверхности катетера фагами. Во втором случае для уничтожения биопленок использовались литические бактериофаги, а также фаговые деполимеразы.
До сих пор в нескольких исследованиях на моделях катетера in vitro , покрытых фагом, было достигнуто снижение образования биопленок до 90% (Carson et al., 2010; Нзакизванайо и др., 2015; Melo et al., 2016; Томпсон, 2018). Потенциальный недостаток этой стратегии — неизвестная и неконтролируемая ориентация фагов. Однако было обнаружено, что эта стратегия исключает раннюю колонизацию биопленкой и отсрочивает закупорку катетера (Nzakizwanayo et al., 2015). Противоречивые результаты были получены в другом исследовании, проведенном Томпсоном (2018), которое показало большую адгезию бактериальных клеток к участкам катетера, предварительно обработанным фагом, — эффект, который зависит от штамма (Aniejurengho, 2016).Возможным объяснением его открытия является образование кондиционирующей пленки из лизированных бактериальных клеток, которая маскирует действие фагов и обеспечивает липкую поверхность для адгезии (Fernandez et al., 2017).
Более успешным подходом к использованию бактериофагов для борьбы с биопленками является использование комбинаций фаг-антибиотик (Yazdi et al., 2018). Неудача этого подхода к обработке биопленок маловероятна, поскольку бактериальные клетки, проявляющие устойчивость к одному агенту, будут восприимчивы к другому (Chhibber et al., 2013). Более того, проходя через слои биопленки, бактериофаги будут способствовать диффузии антибиотика через слои биопленки (Verma et al., 2009; Harper, 2013; Harper et al., 2014).
Наночастицы
Наноразмерные материалы (1–1000 нм) широко используются в настоящее время из-за их высокой способности нацеливаться на ткани (Savolainen et al., 2010). Уменьшение размера до наномасштаба может изменить свойства материалов с точки зрения их химических, механических, электрических, структурных, морфологических и оптических свойств (Buzea et al., 2007).
Катионные дендримерные пептиды представляют собой новый класс молекул с антимикробным потенциалом. Предполагается, что положительный заряд на поверхности таких пептидов взаимодействует с отрицательно заряженными молекулами на поверхности бактериальных клеток, такими как фосфатные группы грамотрицательных липополисахаридов (Jenssen et al., 2006; Weidenmaier and Peschel, 2008). Кроме того, их сверхразветвленная природа предлагает химически активные группы, к которым могут быть присоединены другие молекулы, придающие терапевтические свойства (Shi et al., 2007). В качестве антибио-пленочных агентов дендримеры обладают рядом многообещающих характеристик. Благодаря небольшому размеру частиц они могут легко проникать в матрицу EPS, проявляя некоторую бактериостатическую активность. Также было обнаружено, что дендримеры ингибируют образование матрикса EPS путем индукции мутаций нуклеиновых кислот (Limoli et al., 2014). Они также способны подавлять синтез белка (Mardirossian et al., 2014). Другой возможный механизм, посредством которого могут действовать катионные дендримерные пептиды, — это их действие, подобное детергенту.Они взаимодействуют с анионными компонентами бактериальных мембран и матрикса биопленок, что приводит к потере мембранного потенциала. Aniejurengho (2016) продемонстрировал способность дендронов сокращать предварительно сформированные биопленки из P. mirabilis до 83,5%. Таким образом, они представляют собой клинически полезную альтернативу антибиотикам для уничтожения преформированных биопленок, которая достижима только при недостижимых концентрациях in vivo (Hengzhuang et al., 2011; Belfield et al., 2015; Wu et al., 2015).
Селен (Se) представляет собой металлоид, содержащий микроэлементы. Он является структурной частью нескольких ферментов, таких как глутатионпероксидазы, йодтиронин дейодиназы и тиоредоксинредуктаза, которые участвуют в антиоксидантной защите, детоксикации и метаболизме, соответственно (Messarah et al., 2012; Zhai et al., 2017). Влияние биологически синтезированных (биогенных) наночастиц селена (SeNP) на биопленок P. mirabilis было изучено Shakibaie et al. (2015). Интересно, что он подавлял образование биопленок до 53.4%. Согласно данным in vitro и in vivo , биогенные SeNP обладают меньшей токсичностью, чем селенит или селенат (Shakibaie et al., 2010). В результате биогенные SeNP или противомикробные препараты, нанесенные на поверхность SeNP, могут быть хорошими кандидатами для использования в качестве новых антибио-пленочных агентов.
Было обнаружено, что низкие концентрации НЧ ZnO: MgO влияют на развитие биопленки P. mirabilis в отношении количества бактерий и внеклеточного матрикса. Это было связано с предотвращением колонизации бактериями поверхностей и образования зрелых биопленок.Также было обнаружено, что НЧ ZnO: MgO влияют на выработку внеклеточного матрикса, важного компонента биопленки, защищающей бактерии от стресса окружающей среды (Iribarnegaray et al., 2019). Уменьшение количества бактерий в биопленках также можно объяснить антибактериальной активностью НЧ. Наночастицы ZnO (НЧ ZnO) показали высокую антибактериальную активность против P. mirabilis (Gunalan et al., 2012). Основными механизмами, с помощью которых НЧ ZnO могут проявлять свою антибактериальную активность, является изменение целостности клеточной мембраны (Brayner et al., 2006; Irzh et al., 2010) и генерации активных форм кислорода (Sawai, 2003; Jones et al., 2008). Синергетическая активность также может быть достигнута с НЧ MgO (Pradeev Raj et al., 2018), которые также показали высокую антибактериальную активность против грамотрицательных и грамположительных бактерий (Hayat et al., 2018).
Заключение
Proteus mirabilis является одной из основных причин ОСТОРОЖНОСТЕЙ. Такие инфекции осложняются уникальной способностью P. mirabilis образовывать кристаллические биопленки.По сравнению с их планктонными аналогами, клетки, внедренные в биопленку, значительно устойчивы к противомикробной терапии и иммунному ответу хозяина. Формирование биопленок — это многоступенчатый процесс, который начинается с обратимой адгезии бактериальных клеток к биотическим или абиотическим поверхностям, за которой следует необратимое прикрепление, образование микроколоний и, наконец, развитие зрелой биопленки. Некоторые факторы вирулентности были связаны со способностью P. mirabilis образовывать кристаллические биопленки.К таким факторам относятся подвижность роя, фимбрии, продукция уреазы, полисахарид в капсулах и оттокные насосы. Ингибирующее действие различных противомикробных препаратов на биопленок P. mirabilis было оценено во многих исследованиях. Было обнаружено широкое согласие в отношении эффективности ципрофлоксацина в ингибировании образования биопленок и уничтожении предварительно сформированных биопленок. Дополнительным преимуществом было проявление активности при высоких уровнях pH. Циклическое введение противомикробных препаратов также показало многообещающие результаты в борьбе с биопленками.Однако эффективность этого подхода была тесно связана с лучшим пониманием клеток-персистеров и механизмов, лежащих в основе их устойчивости к антимикробным препаратам. Некоторая информация о характеристиках клеток-персистеров в планктонных культурах P. mirabilis была предоставлена недавними исследованиями. Однако необходимы дополнительные исследования, чтобы заполнить пробел в знаниях об их свойствах в биопленках, а также о влиянии комбинаций противомикробных препаратов на их жизнеспособность. Другие исследования были связаны с эффектом антибиотикопленки различных фитохимических веществ, извлеченных из трав, используемых в народной медицине.Многие фитохимические вещества показали многообещающие антивирулентные эффекты, включая влияние на подвижность, уреазную активность, выработку полисахарида и приверженность. Это увеличивает потребность в проведении дополнительных исследований влияния комбинаций фитохимических и противомикробных препаратов. Такие комбинации могут снизить селективное давление на микроорганизмы при использовании одних только противомикробных препаратов, что приводит к развитию устойчивости к противомикробным препаратам. Апитерапия — одна из естественных альтернатив, чья антибиотическая активность была продемонстрирована некоторыми исследованиями.Ингибирование образования биопленок и уничтожение предварительно сформированных биопленок P. mirabilis было доказано для различных типов меда, а также этанольного экстракта прополиса. Некоторые исследования также рекомендовали перепрофилирование некоторых одобренных FDA препаратов для борьбы с биопленками P. mirabilis . Среди этих препаратов — амброксол, флуоксетин и тиоридазин. Помимо их многообещающего применения для лечения бактериальных инфекций, вызывала озабоченность роль бактериофагов в борьбе с биопленками.Были успешно выделены различные типы бактериофагов, проявляющих ингибирующее действие на биопленок P. mirabilis . Однако была отмечена их более высокая способность эффективно предотвращать образование биопленки P. mirabilis , чем разрушать предварительно сформированную. Для лечения и / или профилактики CAUTI, опосредованных P. mirabilis , бактериофаги продемонстрировали несколько преимуществ. Наиболее важными являются их способность выдерживать высокие уровни pH и повышенная активность в присутствии катионов мочи.Также была очевидна эффективность комбинаций фаго-противомикробных препаратов. Наконец, среди новых областей исследования в борьбе с биопленками P. mirabilis являются наночастицы. Для этого оценивали активность различных соединений наноразмерного размера. Среди которых катионные дендримерные пептиды, биогенные НЧ селена и НЧ ZNO: MgO показали многообещающие результаты.
Все терапевтические стратегии, упомянутые в этом обзоре, следует рассматривать для борьбы с биопленками P. mirabilis .Каждый использует уникальные механизмы действия, что позволяет использовать комбинированные стратегии для достижения лучших результатов. Тем не менее, необходимы дополнительные исследования для изучения некоторых из этих продуктов на предмет их действия in vivo на и обеспечения переносимости и отсутствия токсичности.
Авторские взносы
RW, SH, MA и LF приняли участие в составлении, редактировании и подготовке рукописи. Рукопись была доработана и подготовлена для подачи RW и SH. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Аббас, Х. (2014). Сравнительная антибактериальная и антибиотикопленочная активность меда манука и меда египетского клевера. Asian J. Appl. Sci. 2, 110–115.
Google Scholar
Аббас, Х.А. (2013). Амброксол блокирует роение и плавание, а также ингибирует образование биопленок с помощью Proteus mirabilis , изолированного от инфекции диабетической стопы. Asian J. Pharacy Technol. 3, 109–116.
Google Scholar
Абдель-Баки, Р. М., Али, М. А., Абуо-Рахма, Г., и Абдельазиз, Н. (2017). Ингибирование продукции фермента уреазы и некоторых других факторов вирулентности в Proteus mirabilis с помощью N-ацетилцистеина и дипропилдисульфида. Adv. Exp. Med. Биол. 973, 99–113. DOI: 10.1007 / 5584_2016_197
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Абдулла, М.А., Эль-Баки, Р. М. А., Хассан, Х. А., Абдельхафез, Э.-С. М. Н., Абуо-Рахма, Г. Э.-Д. А. (2016). Фторхинолоны как ингибиторы уреазы: анти- Proteus mirabilis активность и исследования молекулярного докинга. Am. J. Microbiol. Res. 4, 81–84. DOI: 10.12691 / ajmr-4-3-3
CrossRef Полный текст | Google Scholar
Абохалил Р. Н., Эльхатиб В. Ф., Абулвафа М. М. и Хассуна Н. А. (2020). Персистеры Klebsiella pneumoniae и Proteus mirabilis : общее явление и разные профили поведения. Curr. Microbiol. 77, 1233–1244. DOI: 10.1007 / s00284-020-01926-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахмед Ф. и Урудж А. (2009). Глюкозоснижающая, гепатопротекторная и гиполипидемическая активность стволовой коры Ficus racemosa у крыс с индуцированным стрептозотоцином диабетом. J. Young Pharm. 1, 160–164. DOI: 10.4103 / 0975-1483.55749
CrossRef Полный текст | Google Scholar
Айасса В., Барнс А. и Албеса И.(2006). Действие ципрофлоксацина на планктонные бактерии и биопленку Proteus mirabilis . Биопленки 3, 11–17. DOI: 10.1017 / S14707002086
CrossRef Полный текст | Google Scholar
Эллисон К., Лай Х. С. и Хьюз К. (1992). Координировать экспрессию генов вирулентности во время дифференцировки роя клеток и миграции популяции Proteus mirabilis . Мол. Microbiol. 6, 1583–1591. DOI: 10.1111 / j.1365-2958.1992.tb00883.х
PubMed Аннотация | CrossRef Полный текст
Алвес, Д. Р., Нзакизванайо, Дж., Деди, К., Олимпиу, К., Ханин, А., Кот, В., и др. (2019). Геномная и экогеномная характеристика бактериофагов Proteus mirabilis . Фронт. Microbiol. 10: 1783. DOI: 10.3389 / fmicb.2019.01783
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алвес, Д. Р., Перес-Эстебан, П., Кот, В., Бин, Дж. Э., Арно, Т., Хансен, Л. Х. и др. (2016).Новый коктейль бактериофагов уменьшает и диспергирует биопленки Pseudomonas aeruginosa в статических и проточных условиях. Microb. Biotechnol. 9, 61–74. DOI: 10.1111 / 1751-7915.12316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Aniejurengho, О. У. В. (2016). Синтетические бактериофаги на основе дендронов для лечения инфекций Porteus mirabilis. Докторская диссертация, Брайтонский университет.
Google Scholar
Армбрустер, К.Э. и Мобли Х. Л. (2012). Слияние мифологии и морфологии: многогранный образ жизни Proteus mirabilis . Nat. Rev. Microbiol. 10, 743–754. DOI: 10.1038 / nrmicro2890
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бахрани, Ф. К., Кук, С., Халл, Р. А., Массад, Г., и Мобли, Х. Л. (1993). Proteus mirabilis fimbriae: N-концевая аминокислотная последовательность основной фимбриальной субъединицы и нуклеотидные последовательности генов двух штаммов. Заражение. Иммун. 61, 884–891. DOI: 10.1128 / IAI.61.3.884-891.1993
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бесейро А., Томас М. и Боу Г. (2013). Устойчивость к противомикробным препаратам и вирулентность: успешная или вредная ассоциация в бактериальном мире? Clin. Microbiol. Ред. 26, 185–230. DOI: 10.1128 / CMR.00059-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Белас Р., Шнайдер Р. и Мельх М.(1998). Характеристика преждевременных роящихся мутантов Proteus mirabilis : идентификация rsbA, кодирующего регулятор поведения роения. J. Bacteriol. 180, 6126–6139. DOI: 10.1128 / JB.180.23.6126-6139.1998
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Белфилд, К., Бейстон, Р., Бирчелл, Дж. П., и Дэниел, М. (2015). Достигают ли концентрации антибиотиков, принимаемых перорально, в среднем ухе, достаточной для уничтожения планктонных и биопленочных бактерий? Обзор. Внутр. J. Pediatr. Оториноларингол. 79, 296–300. DOI: 10.1016 / j.ijporl.2015.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бентли, Дж., Хаятт, Л. С., Эйнли, К., Пэриш, Дж. Х., Герберт, Р. Б. и Уайт, Г. Р. (1993). Клонирование и анализ последовательности гена Escherichia coli , придающего устойчивость к бицикломицину. Ген 127, 117–120. DOI: 10.1016 / 0378-1119 (93) -D
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бихлер, К.Х., Эйппер, Э., Набер, К., Браун, В., Циммерманн, Р., и Ламе, С. (2002). Камни мочевой инфекции. Внутр. J. Antimicrob. Агенты 19, 488–498. DOI: 10.1016 / S0924-8579 (02) 00088-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брайнер, Р., Феррари-Илиу, Р., Бривуа, Н., Джедиат, С., Бенедетти, М. Ф., и Фьевет, Ф. (2006). Исследования токсикологического воздействия на бактерии Escherichia coli в коллоидной среде ультратонких наночастиц ZnO. Nano Lett. 6, 866–870. DOI: 10.1021 / nl052326h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун, Х. Л., Ван Влит, А. Х., Беттс, Р. П., и Рейтер, М. (2013). Восстановление тетразолия позволяет оценить образование биопленок Campylobacter jejuni в модели пищевого матрикса. J. Appl. Microbiol. 115, 1212–1221. DOI: 10.1111 / jam.12316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карсон, Л., Горман, С. П., и Гилмор, Б.Ф. (2010). Использование литических бактериофагов для предотвращения и уничтожения биопленок Proteus mirabilis и Escherichia coli. FEMS Immunol. Med. Microbiol. 59, 447–455. DOI: 10.1111 / j.1574-695X.2010.00696.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cerca, N., Oliveira, R., and Azeredo, J. (2007). Восприимчивость планктонных клеток и биопленок Staphylococcus epidermidis к литическому действию стафилококкового бактериофага К. Lett. Appl. Microbiol. 45, 313–317. DOI: 10.1111 / j.1472-765X.2007.02190.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, C.Y., Chen, Y.H., Lu, P.L., Lin, W.R., Chen, T.C. и Lin, C.Y. (2012). Proteus mirabilis Инфекция мочевыводящих путей и бактериемия: факторы риска, клинические проявления и исходы. J. Microbiol. Иммунол. Заразить. 45, 228–236. DOI: 10.1016 / j.jmii.2011.11.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чиббер, С., Наг, Д., и Бансал, С. (2013). Ингибирование образования биопленок Klebsiella pneumoniae B5055 с использованием молекулы, антагонистической железу, и бактериофага. BMC Microbiol. 13: 174. DOI: 10.1186 / 1471-2180-13-174
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу Дж. Х., Рукаяди Ю. и Хван Дж. К. (2006). Подавление определения кворума бактерий экстрактом ванили. Lett. Appl. Microbiol. 42, 637–641. DOI: 10.1111 / j.1472-765X.2006.01928.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кокер К., Пур К. А., Ли Х. и Мобли Х. Л. (2000). Патогенез инфекции мочевыводящих путей Proteus mirabilis . Microbes Infect. 2, 1497–1505. DOI: 10.1016 / S1286-4579 (00) 01304-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кук, С. В., Моди, Н., Валле, Дж., И Халл, Р. (1995). Молекулярное клонирование Proteus mirabilis генов адгезии уроэпителиальных клеток (uca). Заражение. Иммун. 63, 2082–2086. DOI: 10.1128 / IAI.63.5.2082-2086.1995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Марко, С., Пиччони, М., Паджиотти, Р., и Пьетрелла, Д. (2017). Антибиотикопленка и антиоксидантная активность смол прополиса и почек тополя по сравнению с Pseudomonas aeruginosa . Evid. На базе Комплем. Альтерн. Med. 2017: 5163575. DOI: 10.1155 / 2017/5163575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даунер, А., Моррис, Н., Фист, У. Дж., И Стиклер, Д. (2003). Свойства поверхности полимера и их влияние на адгезию Proteus mirabilis . Proc. Inst. Мех. Англ. H 217, 279–289. DOI: 10.1243 / 095441103322060730
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Думански, А.Дж., Хеделин, Х., Эдин-Лильегрен, А., Бошемин, Д., и Маклин, Р. Дж. (1994). Уникальная способность капсулы Proteus mirabilis усиливать рост минералов в инфекционных мочевых камнях. Заражение. Иммун. 62, 2998–3003. DOI: 10.1128 / IAI.62.7.2998-3003.1994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дургадеви, Р., Вира Рави, А., Алекспанди, Р., Кришнан Света, Т., Абирами, Г., Вишну, С. и др. (2019). Нацеленный на вирулентность ингибирующий эффект линалоола против эксклюзивного уропатогена Proteus mirabilis . Биообрастание 35, 508–525. DOI: 10.1080 / 084.2019.1619704
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрмель, Г., Джорджо, С., Инисан, К., и Безнар, М. (2012). Подавление адгезии уропатогенных бактерий Escherichia coli к уроэпителиальным клеткам экстрактами из клюквы. J. Med. Еда. 15, 126–134. DOI: 10.1089 / jmf.2010.0312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фернандес, Л., Гонсалес, С., Кампело, А. Б., Мартинес, Б., Родригес, А., и Гарсия, П. (2017). Низкий уровень хищничества литического фага phiIPLA-RODI способствует образованию биопленок и вызывает строгий ответ у Staphylococcus aureus. Sci Rep 7: 40965. DOI: 10.1038 / srep40965
PubMed Аннотация | CrossRef Полный текст
Фрейзер, Г. М., Кларе, Л., Фернесс, Р., Гупта, С., и Хьюз, К. (2002). Связанная с роем экспрессия оперона гемолизина Proteus mirabilis hpmBA. Microbiology (Рединг, Англия) 148, 2191–2201. DOI: 10.1099 / 00221287-148-7-2191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрейрес, И.А., Кейруш, В., Фурлетти, В.Ф., Икегаки, М., Де Аленкар, С. М., Дуарте, М. С. Т. и др. (2016). Химический состав и противогрибковый потенциал бразильского прополиса против Candida spp. J Mycol. Med. 26, 122–132. DOI: 10.1016 / j.mycmed.2016.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ганнабатула, С., Скиннер, М. А., Розендейл, Д., Гринвуд, Дж. М., Мутукумира, А. Н., Стейнхорн, Г. и др. (2012). Белки арабиногалактана способствуют иммуностимулирующим свойствам новозеландского меда. Immunopharmacol. Иммунотоксикол. 34, 598–607. DOI: 10.3109 / 083.2011.641974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Горски А., Мендзыбродски Р., Борисовски Дж., Вебер-Домбровска Б., Лобокка М., Фортуна В. и др. (2009). Бактериофаговая терапия для лечения инфекций. Curr. Мнение. Расследование. Наркотики. 10, 766–774.
Google Scholar
Гуналан, С., Сиварадж, Р., Раджендран, В. (2012). Грин синтезировал наночастицы ZnO против бактериальных и грибковых патогенов. Progr. Nat. Sci. Mater. Int. 22, 693–700. DOI: 10.1016 / j.pnsc.2012.11.015
CrossRef Полный текст | Google Scholar
Хэнлон, Г. В. (2007). Бактериофаги: оценка их роли в лечении бактериальных инфекций. Внутр. J. Antimicrob. Агенты 30, 118–128. DOI: 10.1016 / j.ijantimicag.2007.04.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харпер, Д.Г. (2013). Благоприятные эффекты лечения бактериофагами .Заявка на патент США 8475787.
Google Scholar
Харпер, Д. Р., Паррахо, Х. М. Р. Т., Уокер, Дж., Шарп, Р., Хьюз, Г., Вертен, М. и др. (2014). Бактериофаги и биопленки. Антибиотики 3, 270–284. DOI: 10.3390 / antibiotics3030270
CrossRef Полный текст | Google Scholar
Хаяси, М., Табата, К., Ягасаки, М., и Йонетани, Ю. (2010). Влияние генов переносчиков множественного лекарственного оттока на устойчивость к дипептидам и гиперпродукцию у Escherichia coli. FEMS Microbiol. Lett. 304, 12–19. DOI: 10.1111 / j.1574-6968.2009.01879.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hayat, S., Muzammil, S., Rasool, M.H., Nisar, Z., Hussain, S.Z., Sabri, A.N., et al. (2018). In vitro. Антибиотикопленка и антиадгезионные эффекты наночастиц оксида магния против устойчивых к антибиотикам бактерий. Microbiol. Иммунол. 62, 211–220. DOI: 10.1111 / 1348-0421.12580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hengzhuang, W., Ву, Х., Чофу, О., Сонг, З., и Хойби, Н. (2011). Фармакокинетика / фармакодинамика колистина и имипенема на мукоидных и немукоидных биопленках Pseudomonas aeruginosa . Антимикробный. Агенты Chemother. 55, 4469–4474. DOI: 10.1128 / AAC.00126-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хойби, Н., Бьярнсхольт, Т., Гивсков, М., Молин, С., и Чофу, О. (2010). Устойчивость бактериальных биопленок к антибиотикам. Внутр. J. Antimicrob. Агенты 35, 322–332.DOI: 10.1016 / j.ijantimicag.2009.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холлинг Н., Леднор Д., Цанг С., Бисселл А., Кэмпбелл Л., Нзакизванайо Дж. И др. (2014). Выяснение генетической основы образования кристаллической биопленки у Proteus mirabilis . Заражение. Иммун. 82, 1616–1626. DOI: 10.1128 / IAI.01652-13
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хории, Т., Морита, М., Мурамацу, Х., Муранака, Ю., Канно, Т., и Маэкава, М. (2003). Влияние мупироцина в субингибирующих концентрациях на образование жгутиков у Pseudomonas aeruginosa и Proteus mirabilis . J. Antimicrob. Chemother. 51, 1175–1179. DOI: 10.1093 / jac / dkg226
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ирибарнегарай, В., Наварро, Н., Робино, Л., Зунино, П., Моралес, Дж., И Скавоне, П. (2019). Наночастицы оксида цинка, легированные магнием, изменяют формирование биопленки у Proteus mirabilis . Наномедицина (Лондон) 14, 1551–1564. DOI: 10.2217 / nnm-2018-0420
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ирвин, Н. Дж., Маккой, К. П., и Карсон, Л. (2013). Влияние pH на восприимчивость in vitro планктонных и биопленочных растений Proteus mirabilis к хинолоновым антимикробным препаратам. J. Appl. Microbiol. 115, 382–389. DOI: 10.1111 / jam.12241
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ирж, А., Гениш, И., Кляйн, Л., Соловьев, Л. А., Геданкен, А. (2010). Синтез наночастиц ZnO и Zn в микроволновой плазме и их нанесение на предметные стекла. Langmuir 26, 5976–5984. DOI: 10.1021 / la9s
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иссак Абрахам, С. В., Палани, А., Рамасвами, Б. Р., Шунмугиа, К. П., и Арумугам, В. Р. (2011). Antiquorum sensing и потенциал антибиотикопленки Capparis spinosa . Arch. Med.Res. 42, 658–668. DOI: 10.1016 / j.arcmed.2011.12.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобсен, С. М., Стиклер, Д. Дж., Мобли, Х. Л., и Шертлифф, М. Э. (2008). Осложненные катетер-ассоциированные инфекции мочевыводящих путей, вызванные Escherichia coli и Proteus mirabilis . Clin. Microbiol. Ред. 21, 26–59. DOI: 10.1128 / CMR.00019-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джамал, М., Хуссейн, Т., Дас, К. Р., и Андлиб, С. (2015). Характеристика фага Z Siphoviridae и изучение его эффективности против планктонных клеток и биопленок с множественной лекарственной устойчивостью Klebsiella pneumoniae . J. Med. Microbiol. 64, 454–462. DOI: 10.1099 / jmm.0.000040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янсен А. М., Локатель В., Джонсон Д. Э. и Мобли Х. Л. (2004). Устойчивые к маннозе Proteus-подобные фимбрии продуцируются большинством штаммов Proteus mirabilis , инфицирующих мочевыводящие пути, определяют локализацию бактерий in vivo и способствуют образованию биопленок. Заражение. Иммун. 72, 7294–7305. DOI: 10.1128 / IAI.72.12.7294-7305.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йенссен, Х., Хэмилл, П. и Хэнкок, Р. Э. У. (2006). Пептидные противомикробные агенты. J Clin. Microbiol. Ред. 19, 491–511. DOI: 10.1128 / CMR.00056-05
CrossRef Полный текст | Google Scholar
Джонсон, Дж. Р., Джонстон, Б., и Кусковски, М. А. (2012). In vitro Сравнение катетеров Фолея с покрытием из нитрофуразона и сплава серебра для контактно-зависимого и диффузного ингибирования микроорганизмов, связанных с инфекцией мочевыводящих путей. Антимикробный. Агенты Chemother. 56, 4969–4972. DOI: 10.1128 / AAC.00733-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Йончик, Э., Клак, М., Мендзыбродски, Р., и Гурски, А. (2011). Влияние внешних факторов на бактериофаги — обзор. Folia Microbiol. 56, 191–200. DOI: 10.1007 / s12223-011-0039-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Б.В., Янг, Р., Махентиралингам, Э., и Стиклер, Д.Дж. (2004). Ультраструктура плотов роевых клеток Proteus mirabilis и роль роения в катетер-ассоциированной инфекции мочевыводящих путей. Заражение. Иммун. 72, 3941–3950. DOI: 10.1128 / IAI.72.7.3941-3950.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Г. Л., Рассел, А. Д., Калискан, З., и Стиклер, Д. Дж. (2005). Стратегия контроля закупорки катетера кристаллической биопленкой Proteus mirabilis с использованием антибактериального агента триклозана. Eur. Урол. 48, 838–845. DOI: 10.1016 / j.eururo.2005.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, Н., Рэй, Б., Ранджит, К.Т., и Манна, А.С. (2008). Антибактериальная активность суспензий наночастиц ZnO в отношении широкого спектра микроорганизмов. FEMS Microbiol. Lett. 279, 71–76. DOI: 10.1111 / j.1574-6968.2007.01012.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонс, С. М., Йерли, Дж., Ху, Ю., Кери, Х., и Мартинуцци, Р. (2007). Структура биопленок Proteus mirabilis , выращенных в искусственной моче и стандартных лабораторных средах. FEMS Microbiol. Lett. 268, 16–21. DOI: 10.1111 / j.1574-6968.2006.00587.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каца В., Гленска Дж., Лехович Л., Грабовски С., Браунер А. и Квинковски М. (2011). Серотипирование клинических штаммов Proteus mirabilis на основе липополисахаридных O-полисахаридов и основных олигосахаридных структур. Biochem. Биохимия 76, 851–861. DOI: 10.1134 / S0006297
0169PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крегель, Д., Ригала, А., Колесинская, Б., Новацка, М., Херц, А. С., и Ковалевска, А. (2019). Антимикробные и антибиотикопленочные силоксановые полимеры с привитыми N-ацетил-L-цистеином, которые могут быть использованы в водных системах. Внутр. J. Mol Sci. 20: 2011. DOI: 10.3390 / ijms20082011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куттер, Э., Де Вос, Д., Гвасалия, Г., Алавидзе, З., Гогохия, Л., Куль, С. и др. (2010). Фаговая терапия в клинической практике: лечение инфекций человека. Curr. Pharm. Biotechnol. 11, 69–86. DOI: 10.2174 / 13807
401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kwiecinska-Pirog, J., Bogiel, T., and Gospodarek, E. (2013a). Влияние цефтазидима и ципрофлоксацина на образование биопленок в стержнях Proteus mirabilis . J. Antibiot. (Токио) 66, 593–597.DOI: 10.1038 / ja.2013.59
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kwiecinska-Pirog, J., Bogiel, T., Skowron, K., Wieckowska, E., and Gospodarek, E. (2014). Proteus mirabilis Биопленка — качественная и количественная оценка на основе колориметрических методов. Braz. J. Microbiol. 45, 1423–1431. DOI: 10.1590 / S1517-83822014000400037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kwiecinska-Pirog, J., Skowron, K., Sniegowska, A., Przekwas, J., Balcerek, M., Zaluski, D., et al. (2019). Влияние этанольного экстракта прополиса на биопленку, образующуюся штаммами Proteus mirabilis , выделенными при хронических инфекциях ран. Nat. Prod. Res. 33, 3293–3297. DOI: 10.1080 / 14786419.2018.1470513
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kwiecinska-Pirog, J., Skowron, K., Zniszczol, K., and Gospodarek, E. (2013b). Оценка восприимчивости Proteus mirabilis к цефтазидиму и ципрофлоксацину и влияние этих антибиотиков в субингибирующих концентрациях на биопленки Proteus mirabilis . Biomed. Res. Инт . 2013: 930876. DOI: 10.1155 / 2013/930876
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Латка А., Мацеевска Б., Майковска-Скробек Г., Бриерс Ю. и Друлис-Кава З. (2017). Кодируемые бактериофагом ферменты, связанные с вирионом, для преодоления углеводных барьеров во время процесса инфекции. Заявл. Microbiol. Biotechnol. 101, 3103–3119. DOI: 10.1007 / s00253-017-8224-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леман, С.М., Донлан Р. М. (2015). Бактериофаг-опосредованный контроль двухвидовой биопленки, образованной микроорганизмами, вызывающими катетер-ассоциированные инфекции мочевыводящих путей в модели мочевого катетера in vitro . Антимикробный. Агенты Chemother. 59, 1127–1137. DOI: 10.1128 / AAC.03786-14
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, X., Лу, Н., Брэди, Х., и Пакман, А. (2016). Уреолитическая биоминерализация снижает чувствительность биопленок Proteus mirabilis к ципрофлоксацину. Антимикробный. Агенты Chemother. 60, AAC.00203–00216. DOI: 10.1128 / AAC.00203-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лиав, С. Дж., Лай, Х. К., Хо, С. В., Лух, К. Т., и Ван, В. Б. (2003). Роль RsmA в регуляции подвижности роя и экспрессии фактора вирулентности у Proteus mirabilis . J. Med. Microbiol. 52, 19–28. DOI: 10.1099 / jmm.0.05024-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лимоли, Д.Х., Рокель, А. Б., Хост, К. М., Джа, А., Копп, Б. Т., Холлис, Т. и др. (2014). Катионные антимикробные пептиды способствуют микробному мутагенезу и патоадаптации при хронических инфекциях. PLoS Pathog. 10: e1004083. DOI: 10.1371 / journal.ppat.1004083
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лу, К., Ю, Дж., Янг, X., Ван, Дж., Ван, Л., Лин, Ю. и др. (2010). Амброксол препятствует распознаванию кворума Pseudomonas aeruginosa . Внутр.J. Antimicrob. Агенты 36, 211–215. DOI: 10.1016 / j.ijantimicag.2010.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Майтан, Дж., Бохова, Дж., Хорняцкова, М., Клаудины, Дж., И Майтан, В. (2014). Антибиопленочные эффекты меда против раневых патогенов Proteus mirabilis и Enterobacter cloacae. Phytother. Res. 28, 69–75. DOI: 10.1002 / ptr.4957
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мэлоун, М., и Цай, Г. (2016). Заживление ран с помощью апитерапии: обзор эффектов меда. J. Apither. 1:29. DOI: 10.5455 / ja.20160620031837
CrossRef Полный текст | Google Scholar
Mardirossian, M., Grzela, R., Giglione, C., Meinnel, T., Gennaro, R., Mergaert, P., et al. (2014). Антимикробный пептид хозяина Bac71-35 связывается с бактериальными рибосомными белками и подавляет синтез белка. Chem. Биол. 21, 1639–1647. DOI: 10.1016 / j.chembiol.2014.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Массад, Г., Фулкерсон, Дж. Ф. младший, Уотсон, Д. К., и Мобли, Х. Л. (1996). Proteus mirabilis фимбрии при температуре окружающей среды: клонирование и нуклеотидная последовательность заднего кластера генов. Infect Immun. 64, 4390–4395. DOI: 10.1128 / IAI.64.10.4390-4395.1996
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Maszewska, A., Zygmunt, M., Grzejdziak, I., and Rozalski, A. (2018). Использование поливалентных бактериофагов для борьбы с биопленкой Proteus mirabilis , вызывающей катетер-ассоциированные инфекции мочевыводящих путей. J. Appl. Microbiol. 125, 1253–1265. DOI: 10.1111 / jam.14026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Матур, С., Саббуба, Н.А., Саллер, М.Т., Стиклер, Д.Дж., и Фенели, Р.С. (2005). Генотипирование мочи и кала изолятов Proteus mirabilis от лиц с длительными мочевыми катетерами. Eur. J. Clin. Microbiol. Заразить. Дис. 24, 643–644. DOI: 10.1007 / s10096-005-0003-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мело, Л.Д., Вейга, П., Черка, Н., Кропински, А. М., Алмейда, К., Азередо, Дж. И др. (2016). Разработка фагового коктейля для борьбы с инфекциями мочевыводящих путей, вызванными катетером Proteus mirabilis . Фронт. Microbiol. 7: 1024. DOI: 10.3389 / fmicb.2016.01024
CrossRef Полный текст | Google Scholar
Messarah, M., Klibet, F., Boumendjel, A., Abdennour, C., Bouzerna, N., Boulakoud, M.S., et al. (2012). Гепатопротекторная роль и антиоксидантная способность селена при повреждении печени у крыс, вызванном мышьяком. Exp. Toxicol. Патол. 64, 167–174. DOI: 10.1016 / j.etp.2010.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Miedzybrodzki, R., Borysowski, J., Weber-Dabrowska, B., Fortuna, W., Letkiewicz, S., Szufnarowski, K., et al. (2012). «Глава 3 — Клинические аспекты фаговой терапии», в Advances in Virus Research , ред. М. Лобокка и В. Шибальский (Кембридж, Массачусетс: Academic Press), 73–121. DOI: 10.1016 / B978-0-12-394438-2.00003-7
CrossRef Полный текст | Google Scholar
Мирон Т., Рабинков, А., Мирельман, Д., Вильчек, М., и Вайнер, Л. (2000). Механизм действия аллицина: его проницаемость через фосфолипидные мембраны может способствовать его биологической активности. Biochim. Биофия. Acta 1463, 20–30. DOI: 10.1016 / S0005-2736 (99) 00174-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морган, С. Д., Ригби, Д., Стиклер, Д. Дж. (2009). Исследование структуры кристаллических бактериальных биопленок, которые могут инкрустировать и блокировать серебряные катетеры Фолея. Урол. Res. 37, 89–93. DOI: 10.1007 / s00240-009-0176-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моронес-Рамирес, Дж. Р., Винклер, Дж. А., Спина, К. С., и Коллинз, Дж. Дж. (2013). Серебро усиливает действие антибиотиков против грамотрицательных бактерий. Sci. Пер. Med. 5: 190ra181. DOI: 10.1126 / scitranslmed.3006276
PubMed Аннотация | CrossRef Полный текст
Морозова В., Козлова Ю., Щедко Е., Курильщиков А., Бабкин И., Тупикин А. и др. (2016). Литический бактериофаг PM16, специфичный для Proteus mirabilis : новый представитель рода Phikmvvirus. Arch. Virol. 161, 2457–2472. DOI: 10.1007 / s00705-016-2944-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моррис, Н.С., Стиклер, Д.Дж., и Уинтерс, К. (1997). Какие постоянные уретральные катетеры устойчивы к инкрустации биопленок Proteus mirabilis ? Br. J. Urol. 80, 58–63.DOI: 10.1046 / j.1464-410X.1997.00185.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моррис, Н. С., Стиклер, Д. Дж. (2001). Производит ли употребление клюквенного сока мочу, препятствующую развитию кристаллических биопленок, блокирующих катетер Proteus mirabilis ? BJU Int. 88, 192–197. DOI: 10.1046 / j.1464-410x.2001.02248.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нашиккар, Н., Бегде, Д., Бундейл, С., Писе, М., Рудра, Дж., И Упадхьяй, А. (2011). Подавление подвижности роя, образования биопленок и экспрессии фактора вирулентности уропатогенов экстрактами латекса Euphorbia trigona. Внутр. J. Pharm. Sci. Res. 2, 558–566. DOI: 10.13040 / IJPSR.0975-8232
CrossRef Полный текст | Google Scholar
Николози Д., Темпера Г., Дженовезе К. и Фурнери П. М. (2014). Антиадгезионная активность проантоцианидинов А2-типа (основного компонента клюквы) в отношении уропатогенных бактерий E.coli и P. mirabilis . Антибиотики (Базель) 3, 143–154. DOI: 10.3390 / antibiotics3020143
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новак Р. и Шмитт В. (2008). Клюквенный сок для профилактики инфекций мочевыводящих путей — выводы из клинического опыта и исследований. Фитомедицина 15, 653–667. DOI: 10.1016 / j.phymed.2008.07.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нзакизванайо, Дж., Hanin, A., Alves, D. R., Mccutcheon, B., Dedi, C., Salvage, J., et al. (2015). Бактериофаг может предотвратить образование инкрустации и закупорку мочевых катетеров Proteus mirabilis . Антимикробный. Агенты Chemother. 60, 1530–1536. DOI: 10.1128 / AAC.02685-15
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nzakizwanayo, J., Scavone, P., Jamshidi, S., Hawthorne, J. A., Pelling, H., Dedi, C., et al. (2017). Флуоксетин и тиоридазин подавляют отток и ослабляют образование кристаллической биопленки с помощью Proteus mirabilis . Sci. Отчет 7: 12222. DOI: 10.1038 / s41598-017-12445-w
PubMed Аннотация | CrossRef Полный текст
О’Хара, К. М., Бреннер, Ф. У., и Миллер, Дж. М. (2000). Классификация, идентификация и клиническое значение Proteus, Providencia и Morganella. Clin. Microbiol. Ред. 13, 534–546. DOI: 10.1128 / CMR.13.4.534
PubMed Аннотация | CrossRef Полный текст | Google Scholar
О’мей, К., Амзаллаг, О., Бечир, К., и Туфенкджи, Н.(2016). Производные клюквы усиливают образование биопленок и временно нарушают роющую подвижность уропатогена Proteus mirabilis HI4320. Банка. J. Microbiol. 62, 464–474. DOI: 10.1139 / cjm-2015-0715
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пакьявати, И.А., Прия, С., Пандиан, С.К., и Рави, А.В. (2014). Подавление образования биопленок уропатогенов куркумином — антикворум-чувствительным агентом из Curcuma longa. Food Chem. 148, 453–460. DOI: 10.1016 / j.foodchem.2012.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пеана, А. Т., Д’Акуила, П. С., Панин, Ф., Серра, Г., Пиппия, П., и Моретти, М. Д. (2002). Противовоспалительная активность линалоола и линалилацетата, составляющих эфирные масла. Фитомедицина 9, 721–726. DOI: 10.1078 / 094471102321621322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пирсон, М. М., Себайхия, М., Черчер, К., Куэл, М.А., Сешасайи, А.С., Ласкомб, Н.М. и др. (2008). Полная последовательность генома уропатогенного белка Proteus mirabilis , мастера как приверженности, так и подвижности. J. Bacteriol. 190, 4027–4037. DOI: 10.1128 / JB.01981-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пеннер, Дж. Л. (2005). «Род XXIX. Proteus »в« Руководстве по систематической бактериологии »Бергей № . Proteobacteria: Part B, Gammaproteobacteria, 2-е изд., ред. Д. Дж. Бреннер, Н. Р. Криг, Дж. Т. Стейли и Г. М. Гэррити (Филадельфия, Пенсильвания: Lippincott Williams & Wilkins), 745–753.
Прадеев Радж, К., Садаянди, К., Кеннеди, А., Сагадеван, С., Чоудхури, З. З., Йохан, М. Р. Б. и др. (2018). Влияние легирования Mg на наночастицы ZnO для улучшенной фотокаталитической оценки и антибактериального анализа. Nanoscale Res. Lett. 13: 229. DOI: 10.1186 / s11671-018-2643-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пушпаком, С., Иорио, Ф., Эйерс, П. А., Эскотт, К. Дж., Хоппер, С., Уэллс, А. и др. (2019). Перепрофилирование лекарств: прогресс, проблемы и рекомендации. Nat. Rev. Drug. Discov. 18, 41–58. DOI: 10.1038 / nrd.2018.168
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Радживганди, Г., Виджаян, Р., Марутупанди, М., Васихаран, Б., и Манохаран, Н. (2018). Антибиотикопленочный эффект Nocardiopsis sp. GRG 1 (KT235640) соединение против биопленок, образующих грамотрицательные бактерии на ИМП. Microb. Патог. 118, 190–198. DOI: 10.1016 / j.micpath.2018.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ранджбар-Омид, М., Арзанлу, М., Амани, М., Шокри Аль-Хашем, С.К., Амир Мозафари, Н., и Пири Догахех, Х. (2015). Аллицин из чеснока ингибирует образование биопленок и активность уреазы Proteus mirabilis in vitro . FEMS Microbiol. Lett. 362: fnv049. DOI: 10.1093 / femsle / fnv049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Робертсон, М.Х. и Нортон М.С. (1990). Эффект 1% миндальной кислоты в качестве жидкости для промывания мочевого пузыря у пациентов с внутренними катетерами. Br. J. Clin. Практик. 44, 142–144.
PubMed Аннотация | Google Scholar
Розен, Р. Т., Хисеродт, Р. Д., Фукуда, Э. К., Руис, Р. Дж., Чжоу, З., Лех, Дж. И др. (2001). Определение аллицина, S-аллилцистеина и летучих метаболитов чеснока в выдыхаемом воздухе, плазме или имитируемой желудочной жидкости. J. Nutr. 131, 968S-971S. DOI: 10.1093 / jn / 131.3.968S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сабайфард П., Абди-Али А., Суди М. Р. и Динарванд Р. (2014). Оптимизация анализа соли тетразолия для биопленки Pseudomonas aeruginosa с использованием метода микротитровального планшета. J. Microbiol. Методы 105, 134–140. DOI: 10.1016 / j.mimet.2014.07.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сакураока, Р., Судзуки, Т., и Морохоши, Т.(2019). Распределение и генетическое разнообразие генов, участвующих в восприятии кворума и биосинтезе продигиозина в полных последовательностях генома Serratia marcescens. Genome Biol. Evol. 11, 931–936. DOI: 10.1093 / GBE / evz046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Салини, Р., Синдхулакшми, М., Пунготай, Т., и Пандиан, С.К. (2015). Ингибирование развития биопленок, опосредованного восприятием кворума, и вирулентности уропатогенов с помощью Hyptis suaveolens. Антони Ван Левенгук 107, 1095–1106. DOI: 10.1007 / s10482-015-0402-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саренева Т., Холтхофер Х., Корхонен Т.К. (1990). Аффинность связывания с тканью фимбрий Proteus mirabilis в мочевыводящих путях человека. Заражение. Иммун. 58, 3330–3336. DOI: 10.1128 / IAI.58.10.3330-3336.1990
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саволайнен, К., Pylkkänen, L., Norppa, H., Falck, G., Lindberg, H., Tuomi, T., et al. (2010). Нанотехнологии, инженерные наноматериалы и охрана труда и техника безопасности — обзор. Safety Sci. 48, 957–963. DOI: 10.1016 / j.ssci.2010.03.006
CrossRef Полный текст | Google Scholar
Савай Дж. (2003). Количественная оценка антибактериальной активности порошков оксидов металлов (ZnO, MgO и CaO) с помощью кондуктометрического анализа. J. Microbiol. Методы 54, 177–182. DOI: 10.1016 / S0167-7012 (03) 00037-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скавоне, П., Ирибарнегарай, В., Каэтано, А.Л., Шлапп, Г., Хартель, С., и Зунино, П. (2016). Фимбрии играют различимую роль в формировании биопленок Proteus mirabilis . Pathog. Дис. 74: ftw033. DOI: 10.1093 / femspd / ftw033
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаффер, Дж. Н., Пирсон, М. (2015). Proteus mirabilis и инфекции мочевыводящих путей. Microbiol. Спектр. 3, 1–66. DOI: 10.1128 / microbiolspec.UTI-0017-2013
PubMed Аннотация | CrossRef Полный текст
Шнайдер Р., Локатель К., Джонсон Д. и Белас Р. (2002). Обнаружение и мутация аутоиндуктора, кодируемого luxS, у Proteus mirabilis . Microbiology (Рединг, Англия) 148, 773–782. DOI: 10.1099 / 00221287-148-3-773
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шумм К. и Лам Т.Б. (2008). Типы уретральных катетеров для лечения краткосрочных проблем с мочеиспусканием у госпитализированных взрослых: краткая версия Кокрановского обзора. Neurourol. Уродын. 27, 738–746. DOI: 10.1002 / nau.20645
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сетупати, С., Ананти, С., Селварадж, А., Шанмуганатан, Б., Виньешвари, Л., Баламуруган, К. и др. (2017). Ванильная кислота из Actinidia deliciosa препятствует вирулентности Serratia marcescens, воздействуя на S-слой, флагеллин и белки биосинтеза жирных кислот. Sci. Отчет 7: 16328. DOI: 10.1038 / s41598-017-16507-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шакибайе М., Форутанфар Х., Голкари Ю., Мохаммади-Хорсанд Т. и Шакибайе М.Р. (2015). Антибиотикопленочная активность биогенных наночастиц селена и диоксида селена против клинических изолятов Staphylococcus aureus, Pseudomonas aeruginosa и Proteus mirabilis . J. Trace Elem. Med. Биол. 29, 235–241.DOI: 10.1016 / j.jtemb.2014.07.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шакибайе, М., Хоррамизаде, М. Р., Фарамарзи, М. А., Сабзевари, О., и Шахверди, А. Р. (2010). Биосинтез и восстановление наночастиц селена и влияние на экспрессию матричной металлопротеиназы-2. Biotechnol. Appl. Biochem. 56, 7–15. DOI: 10.1042 / BA20100042
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, X., Ван, С., Сан, Х. и Бейкер, Дж. Р. (2007). Улучшенная биосовместимость наночастиц золота с функционализированными дендримером. Soft Matter 3, 71–74. DOI: 10.1039 / B612972B
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Силланкорва С., Нойбауэр П. и Азаредо Дж. (2011). Использование бактериофагов для контроля биопленок. Саарбрюккен: Академическое издательство LAP Lambert.
Google Scholar
Силланкорва, С., Оливейра, Р., Виейра, М.Дж., Сазерленд, И., и Азередо, Дж. (2004). Инфекция Pseudomonas fluorescens бактериофагом PhiS1: влияние температуры, фазы роста хозяина и среды. FEMS Microbiol. Lett. 241, 13–20. DOI: 10.1016 / j.femsle.2004.06.058
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сингха П., Локлин Дж. И Ханда Х. (2016). Обзор последних достижений в области противомикробных покрытий для мочевых катетеров. Acta Biomater. 50, 20–40.DOI: 10.1016 / j.actbio.2016.11.070
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соса В., Зунино П. (2009). Влияние Ibicella lutea на рост, вирулентность и образование биопленок уропатогенных растений Proteus mirabilis . J. Infect. Dev. Ctries 3, 762–770. DOI: 10.3855 / jidc.232
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Станковска, Д., Червонка, Г., Розальска, С., Грошицка, М., Дзядек, Дж., И Каца, В.(2012). Влияние сигнальных молекул, воспринимающих кворум, на образование биопленок у Proteus mirabilis O18. Folia Microbiol. (Прага) 57, 53–60. DOI: 10.1007 / s12223-011-0091-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Stensballe, J., Tvede, M., Looms, D., Lippert, F. K., Dahl, B., Tonnesen, E., et al. (2007). Риск заражения мочевыми катетерами, пропитанными нитрофуразоном, у пациентов с травмами: рандомизированное исследование. Ann. Междунар. Med. 147, 285–293. DOI: 10.7326 / 0003-4819-147-5-200709040-00002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стиклер Д. и Хьюетт П. (1991). Активность антисептиков против биопленок смешанных видов бактерий, растущих на силиконовых поверхностях. Eur. J. Clin. Microbiol. Заразить. Дис. 10, 157–162. DOI: 10.1007 / BF01964448
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Темпера, Г., Корселло, С., Дженовезе, К., Карузо, Ф. Э., и Николози, Д. (2010). Ингибирующее действие экстракта клюквы на липкость бактерий в моче женщин: исследование ex-vivo . Внутр. J. Immunopathol. Pharmacol. 23, 611–618. DOI: 10.1177 / 039463201002300223
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томпсон, Р.В. (2018). Выделение и характеристика бактериофагов Proteus Mirabilis и их влияние на колонизацию и закупорку мочевого катетера S .Доктор философии, Университет Западной Англии.
Google Scholar
Толсон, Д. Л., Барригар, Д. Л., Маклин, Р. Дж., И Альтман, Э. (1995). Экспрессия неагглютинирующей фимбрии с помощью Proteus mirabilis . Заражение. Иммун. 63, 1127–1129. DOI: 10.1128 / IAI.63.3.1127-1129.1995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ценг, Б.С., Чжан, В., Харрисон, Дж. Дж., Квач, Т. П., Сонг, Дж. Л., Пентерман, Дж. И др.(2013). Внеклеточный матрикс защищает биопленки Pseudomonas aeruginosa , ограничивая проникновение тобрамицина. Environ. Microbiol. 15, 2865–2878. DOI: 10.1111 / 1462-2920.12155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вайдьянатан С., Сони Б. М., Хьюз П. Л., Сингх Г. и Оо Т. (2010). Тяжелая вентральная эрозия полового члена, вызванная постоянным уретральным катетером и надуванием баллона Фолея в уретре — необходимо составить список «никогда не возникающих при травме спинного мозга», чтобы предотвратить эти осложнения у пациентов с параличом нижних конечностей и тетраплегией. Adv. Урол. , 2010: 461539. DOI: 10.1155 / 2010/461539
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Верма В., Харджай К. и Чиббер С. (2009). Характеристика Т7-подобного литического бактериофага Klebsiella pneumoniae B5055: потенциального терапевтического агента. Curr. Microbiol. 59, 274–281. DOI: 10.1007 / s00284-009-9430-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фиртель, Т. М., Риттер, К., и Хорц, Х. П. (2014). Вирусы против бактерий — новые подходы к фаговой терапии как инструменту против патогенов с множественной лекарственной устойчивостью. J. Antimicrob. Chemother. 69, 2326–2336. DOI: 10.1093 / jac / dku173
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Васфи Р., Абд эль-Рахман О. А., Мансур Л. Э., Ханора А. С., Хашем А. М. и Ашур М. С. (2012). Антимикробная активность против биопленки, образованной изолятами Proteus mirabilis от инфекций ран и мочевыводящих путей. Indian J. Med. Microbiol. 30, 76–80. DOI: 10.4103 / 0255-0857.93044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weidenmaier, C., and Peschel, A. (2008). Тейхоевые кислоты и родственные гликополимеры клеточной стенки в грамположительной физиологии и взаимодействиях с хозяином. Nat. Rev. Microbiol. 6, 276–287. DOI: 10.1038 / nrmicro1861
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уильямс, Г. Дж., И Стиклер, Д. Дж.(2008). Влияние триклозана на образование кристаллических биопленок смешанными сообществами патогенов мочевыводящих путей на мочевых катетерах. J. Med. Microbiol. 57, 1135–1140. DOI: 10.1099 / jmm.0.2008 / 002295-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рэй, С. К., Халл, С. И., Кук, Р. Г., Барриш, Дж., И Халл, Р. А. (1986). Идентификация и характеристика адгезина уроэпителиальных клеток из уропатогенного изолята Proteus mirabilis . Заражение. Иммун. 54, 43–49. DOI: 10.1128 / IAI.54.1.43-49.1986
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, H., Moser, C., Wang, H.-Z., Høiby, N., and Song, Z.-J. (2015). Стратегии борьбы с бактериальными инфекциями биопленок. Внутр. J. Oral Sci. 7, 1–7. DOI: 10.1038 / ijos.2014.65
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вурпель, Д. Дж., Тоцика, М., Оллсопп, Л. П., Уэбб, Р. И., Мориэль, Д. Г., и Шембри, М.А. (2016). Сравнительная протеомика уропатогенной Escherichia coli во время роста в моче человека позволяет идентифицировать UCA-подобные (UCL) фимбрии как фактор адгезии, участвующий в образовании биопленок и связывании с уроэпителиальными клетками. J. Proteomics 131, 177–189. DOI: 10.1016 / j.jprot.2015.11.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Ю., Ван, Дж., Хао, З., Ван, С., и Лян, К. (2019). Биоразлагаемые полиуретановые полимеры на водной основе с ципрофлоксацином предотвращают образование бактериальной биопленки in vitro . Exp. Терапия. Med. 17, 1831–1836. DOI: 10.3892 / etm.2018.7113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яцуненко Т., Рей Ф. Э., Манари М. Дж., Трехан И., Домингес-Белло М. Г., Контрерас М. и др. (2012). Микробиом кишечника человека в зависимости от возраста и географии. Природа 486, 222–227. DOI: 10.1038 / nature11053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Язди М., Бузари М. и Гэми Э.А. (2018). Выделение и характеристика литического бактериофага (vB_PmiS-TH) и его применение в комбинации с ампициллином против планктонных и биопленочных форм Proteus mirabilis , выделенных из инфекции мочевыводящих путей. J. Mol. Microbiol. Biotechnol. 28, 37–46. DOI: 10.1159 / 000487137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжай, X., Чжан, К., Чжао, Г., Столл, С., Рен, Ф., и Ленг, X. (2017). Антиоксидантные свойства наночастиц селена, стабилизированных хитозаном. J. Nanobiotechnol. 15: 4. DOI: 10.1186 / s12951-016-0243-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zunino, P., Geymonat, L., Allen, A.G., Legnani-Fajardo, C.



 coli
coli рneumoniae
рneumoniae coli
coli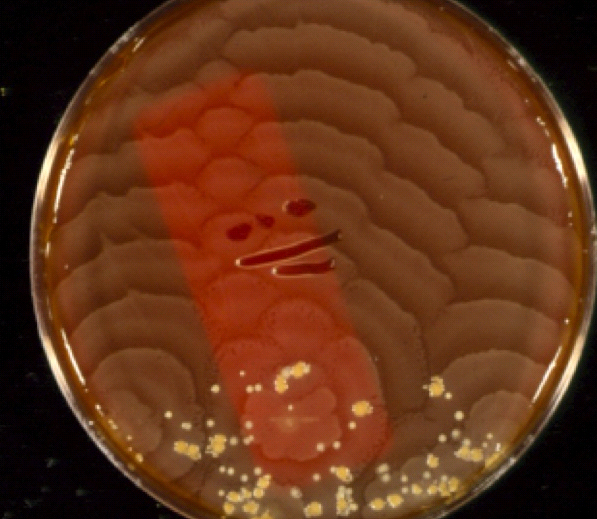
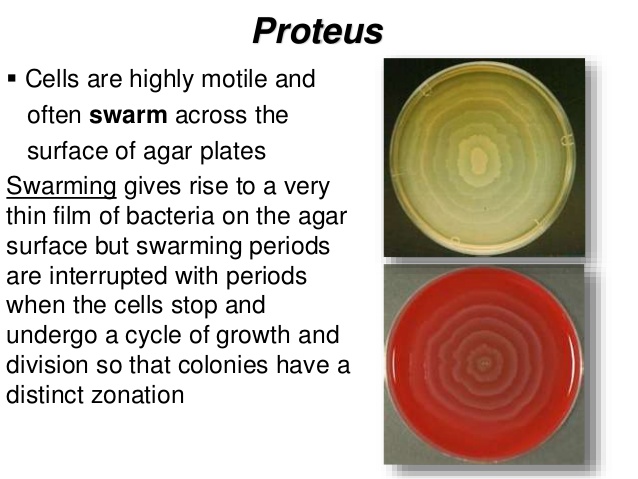 Proteus и
родственный род Providencia довольно часто может
вызывают инфекции мочевыводящих путей.
Proteus и
родственный род Providencia довольно часто может
вызывают инфекции мочевыводящих путей. Это отличает их от других кишечных средств и
используется в простом диагностическом тесте ( Рисунок B ).
Бактерии, выделенные из образцов мочи, инокулируют на
питательный агар, содержащий мочевину и индикаторный фенол
красный. После инкубации в течение ночи аммиак, производимый Proteus или Providentia повышает pH и изменяет
цвет среды от желтого до красного.
Это отличает их от других кишечных средств и
используется в простом диагностическом тесте ( Рисунок B ).
Бактерии, выделенные из образцов мочи, инокулируют на
питательный агар, содержащий мочевину и индикаторный фенол
красный. После инкубации в течение ночи аммиак, производимый Proteus или Providentia повышает pH и изменяет
цвет среды от желтого до красного.
 , DOI: 10.1186 / 1471-2334-6-130.
, DOI: 10.1186 / 1471-2334-6-130.