Последствия удаления матки. Выпадение и опущение влагалища: причины, симптомы, лечение, операция.
Выпадение влагалища – это состояние, характеризующееся смещением одной или нескольких стенок влагалища относительно своего естественного положения. Формально выпадение стенок влагалища свойственно любому опущению, вместе с тем этот термин чаще применяется при описании пролапса, развивающегося после удаления матки. В тоже время часто используется термин неполное выпадение стенок влагалища, который характеризует начальные степени выпадения матки и влагалища.
Симптомы
Симптомы выпадения влагалища в зависимости от задействованного органа можно разделить на следующие группы:
- Связанные с опущением мочевого пузыря (выпадение передней стенки влагалища): затрудненное мочеиспускание, мочеиспускание малыми порциями, необходимость вправлять выпадение для полного опорожнения мочевого пузыря, чувство неполного опорожнения мочевого пузыря, учащенное мочеиспускание, потерю мочи при напряжении и на фоне резких позывов в туалет
- Связанные с опущением прямой кишки (выпадение задней стенки влагалища): затрудненная дефекация, чувство неполного опорожнения прямой кишки, дефекация порциями, необходимость вправлять опущение или опорожнять пальцем кишку для полного ее опустошения
Кроме того для выпадения любой из стенок влагалища характерно чувство инородного тела во влагалище, выделения из влагалища, сухость опустившейся наружу слизистой влагалища, травматизация выпадающих стенок влагалища с возможным формированием язв, дискомфорт при половом контакте, а также тянущие боли внизу живота
Задайте вопрос анонимно врачу, через форму обратной связи, мы постараемся Вам помочь.
|
Задать вопрос |
Причины
Природа выпадения стенок влагалища многофакторный и длительный процесс. Основной причиной заболевания являются роды, во время которых повреждается поддерживающий аппарат тазового дна. Этот фактор становится критически важным в случае затяжных родов, крупного плода, родоразрешения с использованием акушерских щипцов или вакуум экстрактора.
Конечно, это только пусковой механизм, так как чаще всего имеется предрасполагающий фактор – наследственная слабость соединительной ткани. Другой механизм развития заболевания заключается в хронически высоком внутрибрюшном давлении, которое значительно увеличивает нагрузку на связочный аппарат тазового дна.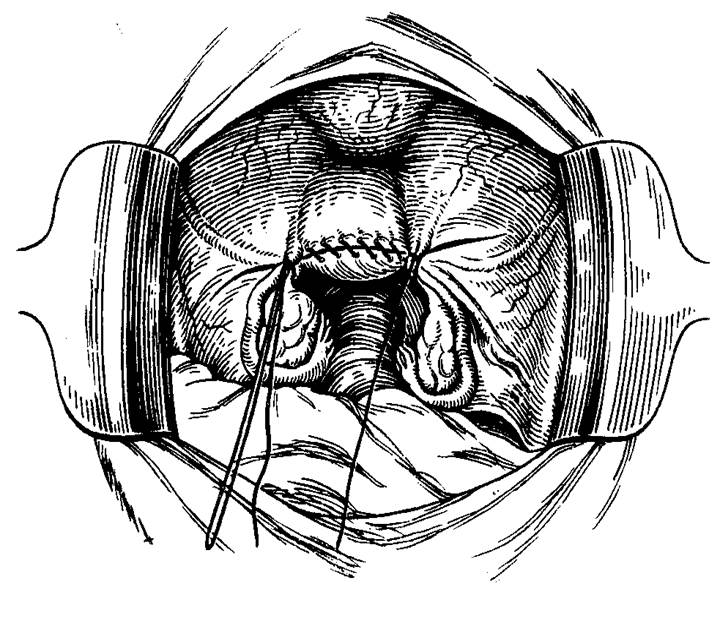
Еще одной причиной, которая приводит к выпадению стенок влагалища, является операции по удалению матки. Дело в том, что чаще всего эти вмешательства выполняются в качестве метода лечения опущения матки и стенок влагалища. К сожалению, в этой ситуации это нередко приводит к еще большему повреждению поддерживающего аппарата тазового дна и рецидиву заболевания, доходящему до 50%. Формируется так называемое выпадение культи влагалища или постгистерэктомический пролапс, при котором стенки влагалища частично и полностью выворачиваются наружу.
| Большая часть пациенток получает помощь бесплатно (без скрытых доплат за «сеточки» и пр.) в рамках обязательного медицинского страхования (по полису ОМС). |
Заявка на лечение по ОМС |
Диагностика
Диагностика выпадения стенок влагалища состоит в выполнении стандартного гинекологического осмотра, на котором определяется задействованный в патологическом процессе отдел влагалища и степень опущения. Всего выделяют 4 степени выпадения стенок влагалища:
Всего выделяют 4 степени выпадения стенок влагалища:
- 1 степень – Характеризует состояние, когда стенки влагалища сместились со своего естественного положения, но еще не доходят до входа во влагалище на 2см и более
- 2 степень – При этой стадии выпадения стенки влагалища находятся на уровне входа во влагалище.
- 3 степень – В этом случае отмечается выпадение стенок влагалища за пределы половой щели, но не более чем на 2/3 своей длины
- 4 степень – Полное выпадение стенок влагалища
При первых двух степенях пациентка может не чувствовать выпадения и оно часто протекает бессимптомно и требует лишь наблюдения. 3-4 степень опущения это запущенная стадия заболевания, при котором необходимо лечение.
Лечение
Лечение выпадения стенок влагалища выполняется только в случае значительного снижения качества жизни больных и нарушения функции внутренних органов. Принципиально все виды помощи можно разделить на консервативные и оперативные.
Принципиально все виды помощи можно разделить на консервативные и оперативные.
К первому типу относятся тренировки мышц тазового дна и пессарии. Упражнения при выпадении стенок влагалища малоэффективны, так как чаще всего имеется повреждение связочного аппарата тазового дна, который тренировками не восстановить. Это особенно актуально при постгистерэктомическом пролапсе. Пессарии представляют собой устройства, которые как распорка не дают выпасть опустившимся стенкам влагалища наружу. Данный метод можно рассматривать, как временную меру, когда по каким-либо причинам оперативное лечение провести невозможно. Более того использование пессариев сопровождается дискомфортом во влагалища, ведет к хроническому воспалению и выделениям, что требует регулярного посещения гинеколога.
Единственно действенным методом лечения является хирургический. Вместе с тем и наиболее сложным, так как выполнение операций после удаления матки сопряжено с высоким риском осложнений и рецидивов. Вмешательства при выпадении стенок влагалища могут проводиться как через брюшную полость, так и через влагалище. Первый вариант кроме дорогостоящего оборудования и стоимости лечения сопряжен с большой длительностью операции, требующей хорошего состояния здоровья пациентки. Так же ему свойственны специфические осложнения: риск повреждения органов брюшной полости и мочеточников и послеоперационные проблемы с дефекацией. Более популярным является трансвагинальный тип реконструкции, который имеет меньшую длительность операций, а значит легче переносится больными.
Вместе с тем и наиболее сложным, так как выполнение операций после удаления матки сопряжено с высоким риском осложнений и рецидивов. Вмешательства при выпадении стенок влагалища могут проводиться как через брюшную полость, так и через влагалище. Первый вариант кроме дорогостоящего оборудования и стоимости лечения сопряжен с большой длительностью операции, требующей хорошего состояния здоровья пациентки. Так же ему свойственны специфические осложнения: риск повреждения органов брюшной полости и мочеточников и послеоперационные проблемы с дефекацией. Более популярным является трансвагинальный тип реконструкции, который имеет меньшую длительность операций, а значит легче переносится больными.
Практически полностью исключается повреждение органов брюшной полости. Более того он позволяет одномоментно выполнить реконструкцию обеих стенок влагалища и промежности. При этом риск развития осложнения связанных с использованием синтетических протезов, как у абдоминальных операций, так и у трансвагинальных одинаковый и напрямую зависит от опыта хирурга. Наибольшую популярность сейчас приобретают гибридные операции, которые совмещают в себе преимущества использования синтетических материалов и собственных тканей пациентки.
Наибольшую популярность сейчас приобретают гибридные операции, которые совмещают в себе преимущества использования синтетических материалов и собственных тканей пациентки.
Удаление (экстирпация) матки — цена, лапароскопическое удаление матки в Москве, Клинический Госпиталь на Яузе
Записаться на процедуруСколько длится операция
Лапароскопия с целью удаления матки проводится всегда только под эндотрахеальным наркозом. Продолжительность операции как правило от 1,5 до 2,5 часов (зависит от интраоперационной ситуации, размеров матки и т.п.).
После проведения лапароскопии в отделении гинекологии нашей клиники вы будете находиться в стационаре 1–2 суток, а затем в течение 2–3 недель необходимо быть под наблюдением акушера-гинеколога. В течение месяца рекомендуется ограничить тяжелые физические нагрузки и половую жизнь.
Преимущества лапароскопического и влагалищного удаления матки
- Благодаря отсутствию травматизации кожи, мышц, бережному лапароскопическому отделению матки от связок, фиксирующих её в малом тазу, снижается количество послеоперационных осложнений — кровотечений, гематом.

- Короткий период восстановления и быстрое возвращение к полноценной жизни.
- Отсутствие швов, рубцов на передней брюшной стенке.
- Значительное сокращение срока нетрудоспособности пациента. При классической полостной операции он составляет не менее 30 дней, при лапароскопической — до 14 дней.
- Максимально снижен риск формирования послеоперационных спаек.
- Скорое восстановление работы кишечника, мочевого пузыря.
- Сведение к минимуму риска послеоперационных осложнений.
Преимущества лапароскопии в Клиническом госпитале на Яузе
- Инновационное оборудование операционных: устойчивые к инфекциям бесшовные монолитные конструкции, 5 уровней стерильности благодаря сложной системе вентиляции.
- Использование хирургической техники признанных мировых производителей медицинского оборудования — «Karl Storz», «Covidien», «Erbe» и др.».
- Операция проводится очень бережно и нацелена на получение максимально возможной эффективности вмешательства.
 Поэтому пациентки быстро восстанавливаются и возвращаются к полноценной жизни.
Поэтому пациентки быстро восстанавливаются и возвращаются к полноценной жизни.
Статья проверена врачом акушером-гинекологом, проф. Камоевой С.В., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
Почему мы
- Врачи. Большой опыт в выполнении эндоскопических и комбинированных операций, высокая квалификация специалистов.
- Безопасность. Лапароскопические операции — это минимальные риски кровотечений, спаечной болезни и других осложнений во время и после операции.
- Быстрое восстановление. Срок возвращения к нормальной жизни и работе снижен в 2 раза по сравнению с полостными операциями.
- Комплексность.

- Только положительные отзывы пациенток. Сотни женщин, которым была проведена лапароскопия в нашей гинекологии, сохранили свое женское здоровье и вернулись к полноценной жизни.
При наличии показаний к удалению матки, лучше всего сделать эту операцию наиболее щадящим способом — с помощью комбинированной (лапароскопической + вагинальной) методики, которая с успехом применяется специалистами Клинического госпиталя на Яузе!
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
восстановление после операции, половая жизнь и последствия для женщины
Оглавление
Операция по удалению матки (гистерэктомия, экстирпация матки) является одной из самых распространенных в оперативной гинекологии. Она производится в том случае, когда все другие возможные способы показали свою неэффективность, и зачастую, речь идет о спасении жизни женщины. В некоторых случаях во время этой операции кроме матки удаляют также маточные трубы и яичники (овариэктомия).
Удаление матки – наверное, одно из самых трудных испытаний в жизни женщины любого возраста. Какими бы не были показания к данной операции, редкая женщина безучастно относится к радикальному хирургическому вмешательству. Чаще всего пациентки страшатся физического дискомфорта и болевых ощущений, переживают разнообразные страхи, чувство растерянности и неполноценности, многие ощущают эмоциональную подавленность в силу отсутствия информации. Так что же представляет собой операция по удалению матки, какие существуют показания для ее проведения, и как жить полноценной жизнью после перенесенной операции?
Когда удаляют матку?
Показаниями к проведению гистерэктомии являются следующие заболевания:
- Злокачественная опухоль (рак) тела или шейки матки
- Эндометриоз или аденомиоз (в случае длительного сильного кровотечения)
- Доброкачественная опухоль матки (фибромиома) в перименопаузе или менопаузе
- Выпадение или выраженное опущение матки
- Постоянные тазовые боли, вызванные патологией матки
- Иногда операция по удалению матки проводится сразу после тяжелых родов.
 Ситуация довольно редкая, но имеет место быть
Ситуация довольно редкая, но имеет место быть
Операция по удалению матки
Зачастую выбор способа проведения операции зависит опыта хирурга. Также, всегда принимают во внимание причины, по которым операция назначается. И, конечно же, многое зависит и от общего состояния здоровья женщины. Вот почему на стадии выбора «своего» доктора следует быть особенно внимательными и задавать как можно больше вопросов. Со специалистом необходимо обсудить все детали и в частности – вид операции.
Операция по удалению матки может быть абдоминальной (то есть через разрез на передней брюшной стенке), влагалищной (все швы остаются внутри влагалища и совсем не заметны) или лапароскопической (через небольшие разрезы на коже живота). Вид процедуры зависит от формы заболевания, стадии его развития и общего состояния здоровья пациентки. Все они выполняются под общим наркозом. Конечно же, малоинвазивные операции выглядят более привлекательно, но следует помнить, что в некоторых случаях лапароскопическая операция невозможна.
Минимально инвазивные методы удаления матки имеют множество преимуществ по сравнению с традиционной открытой гистерэктомией. Восстановление после такой операции проходит быстрее, пациенткам нужно меньше времени оставаться в стационаре; кроме того, после операции пациентки меньше испытывают болевой синдром. Риск инфекций при минимально инвазивных процедурах существенно ниже, чем при традиционных открытых операциях.
Последствия удаления матки
В результате удаления матки женщина забывает о прорывных кровотечениях, болях в животе, смещении внутренних органов из-за фибромы, тяжелом течении предменструального синдрома.
После удаления матки у женщин возникает целый ряд вопросов, которые они не всегда готовы обсуждать с хирургом. Они касаются и здоровья, и внешнего вида, и сексуальных отношений и качества жизни после операции в целом.
Основные последствия удаления матки вполне очевидны. Устраняется причина заболевания.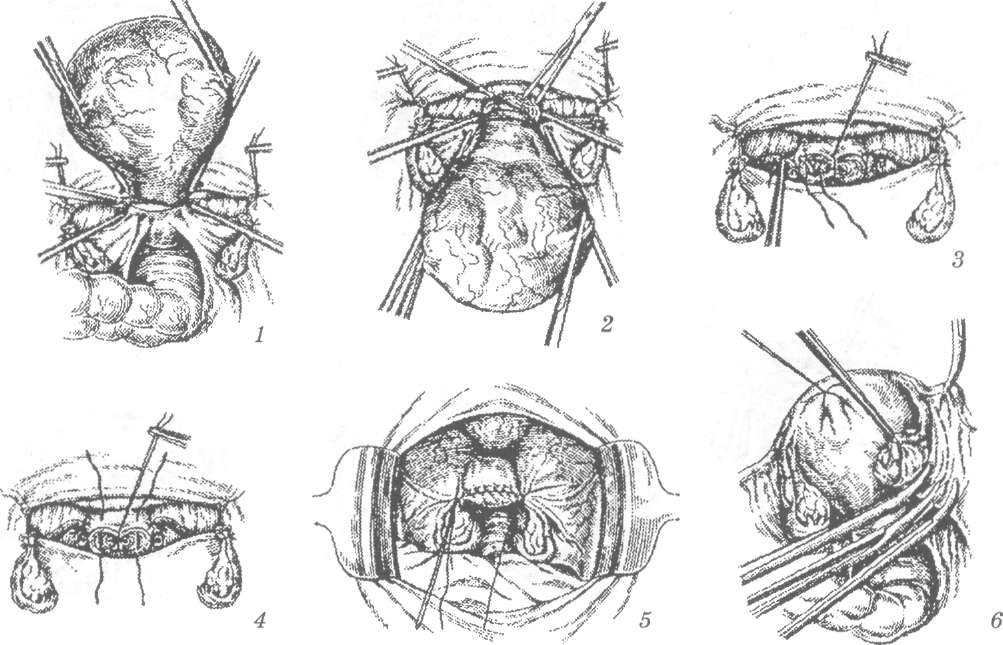 Но помимо этого, конечно, женщина не сможет рожать и у нее незначительно изменится положение органов малого таза. Если операция прошла вовремя и без осложнений, то восстановление у женщин происходит быстро, без видимых потерь для внешности и общего повседневного самочувствия. Но, дорогие женщины, крайне важно относиться к себе очень внимательно! Если вдруг возникает боль внизу живота или кровотечение после удаления матки – это повод экстренно обратиться к врачу. И сколько бы времени не прошло, надо понимать, что это риск.
Но помимо этого, конечно, женщина не сможет рожать и у нее незначительно изменится положение органов малого таза. Если операция прошла вовремя и без осложнений, то восстановление у женщин происходит быстро, без видимых потерь для внешности и общего повседневного самочувствия. Но, дорогие женщины, крайне важно относиться к себе очень внимательно! Если вдруг возникает боль внизу живота или кровотечение после удаления матки – это повод экстренно обратиться к врачу. И сколько бы времени не прошло, надо понимать, что это риск.
После операции по удалению матки, велика вероятность проявления следующих симптомов:
- Боли после удаления матки (могут быть связаны с плохим заживлением рубца или образованием спаек после операции)
- Выделения после удаления матки (могут быть вызваны тем, что работа яичников не затронута и на шейку матки влияют половые гормоны)
- Кровотечения после удаления матки (иногда продолжаются до четырех недель, их усиление – опасный признак)
Осложнения после удаления матки
Осложнения после удаления матки, которые требует незамедлительного визита к врачу:
- Сильные кровотечения
- Нагноения швов
- Воспалительные процессы в паховых лимфатических узлах
- Повышение температуры тела
- Сильные и резкие боли (которые нельзя снять лекарственными препаратами)
- Нарушение акта мочеиспускания
- Покраснение и боли в области голени (вероятный признак образования тромбов)
Осложнения после удаления матки, чаще всего вызваны физиологическими последствиями операции, так как наблюдается нарушение положения мочевого пузыря и кишечника. Ослабевают мышцы тазового дна и бывают уже не в состоянии поддерживать влагалище. Поэтому, реабилитация после операции обязательно включает в себя упражнения по системе Кегеля.
Ослабевают мышцы тазового дна и бывают уже не в состоянии поддерживать влагалище. Поэтому, реабилитация после операции обязательно включает в себя упражнения по системе Кегеля.
И хотя, удаление матки – это достаточно распространенная и безопасная операция, которая обычно не вызывает серьезных проблем у подавляющего большинства женщин, прошедших ее, тем не менее, иногда удаление матки может иметь следующие осложнения:
- Недержание мочи
- Выпадение влагалища
- Образование свища (аномальный канал, соединяющий влагалище и мочевой пузырь)
- Хронические боли
Следует помнить, что все прогнозы может сделать специалист только после консультации и обследования пациентки. К сожалению, многие женщины, послушав рассказы про ужасы операции или послеоперационного периода (или проведя настоящее расследование в Интернете), испугавшись, затягивают с принятием решения и откладывают необходимое лечение. Но здесь всегда следует помнить о том, что игнорирование проблемы – не решает проблему. И чем скорее бывает выполнена операция, тем меньше осложнений она может повлечь за собой.
И чем скорее бывает выполнена операция, тем меньше осложнений она может повлечь за собой.
Удаление матки – жизнь после операции
Многие женщины полагают, что после удаления матки их половая жизнь завершается. Это далеко не так, если сама женщина понимает необходимость операции и справляется с депрессией.
Зачастую, многие женщины после операции по удалению матки могут испытывать симптомы климакса. Так как удаление матки влечет за собой нарушение кровоснабжения в яичниках, то это влияет на их функцию: даже в случае сохранения яичников, климакс у женщин, перенесших удаление матки, наступает на несколько лет раньше, чем это случилось бы без операции. Если проводилась тотальная гистерэктомия (удаление матки и яичников), то впоследствии развивается хирургический климакс. Это состояние может сопровождаться всеми симптомами, которые проявляются в период менопаузы -эмоциональными расстройствами (депрессиями, тревожностью), приливами, перебоями в работе сердечно-сосудистой системы, остеопорозом. Для профилактики хирургического климакса и смягчения его негативных симптомов, связанных с дефицитом гормонов, всем женщинам после удаления матки необходимо применять заместительную гормонотерапию препаратами, содержащими эстрогены или комбинацию эстрогенов с гестагенами. Прием гормональных препаратов обычно начинают через 1-2 месяца после операции, но только после консультации с лечащим врачом.
Для профилактики хирургического климакса и смягчения его негативных симптомов, связанных с дефицитом гормонов, всем женщинам после удаления матки необходимо применять заместительную гормонотерапию препаратами, содержащими эстрогены или комбинацию эстрогенов с гестагенами. Прием гормональных препаратов обычно начинают через 1-2 месяца после операции, но только после консультации с лечащим врачом.
К группе риска по развитию атеросклероза сосудов и остеопороза также попадают женщины с удаленной маткой. Для профилактики развития указанных проблем необходимо начинать прием соответствующих препаратов буквально через несколько месяцев после операции. Во избежание быстрого набора веса, следует соблюдать диету с ограниченной калорийностью (уменьшенным содержанием жиров и легкоусвояемых углеводов), а также показаны регулярные физические нагрузки (зарядка, бассейн).
Половая жизнь после удаления матки
Только при полной гистерэктомии (с удалением яичников и маточных труб) у женщин могут возникнуть проблемы в сексуальной жизни после операции – чаще всего это выражается в сухости влагалища и снижении полового влечения (либидо).
Несмотря на распространенное мнение, половая жизнь женщины после гистерэктомии не заканчивается! Когда организм полностью восстановится, женщина может жить полноценной сексуальной жизнью. Если в ходе операции была удалена часть влагалища, то женщина может испытывать болезненные ощущения во время занятия сексом.
Однако, большую проблему представляют психологические последствия удаления матки. У некоторых женщин, перенесших операцию, на фоне депрессивных расстройств наблюдается значительное снижение полового влечения и они полностью утрачивают интерес к сексу. Часть женщин, напротив, отмечает усиление полового влечения и улучшение качества сексуальной жизни (отсутствие боли и зачастую уменьшение объема живота – при удалении крупной миомы, идут на пользу). Применять контрацептивы после гистерэктомии не нужно, поскольку в результате проведения операции женщина не может забеременеть.
Профилактика удаления матки
Профилактикой удаления матки могут быть общие рекомендации для всех женщин:
- Здоровый образ жизни
- Систематическое наблюдение у опытного гинеколога
- Своевременное лечение гинекологических заболеваний
- Отсутствие самолечения
- Гигиена интимной сферы
- Контроль веса
- Регулярное прохождение скринингов (в том числе и онкологических)
И еще, многие специалисты сталкиваются с ситуациями, когда женщины в поисках хорошего специалиста, на самом деле ищут доктора, который скажет им то, что они хотят услышать. Что ситуация не критическая и можно лечить заболевание не прибегая к хирургическому вмешательству. Будьте очень внимательны! Не делайте выводов на основе эмоций. Конечно же, операций всем и всегда хочется избежать, но даже в самых эмоционально-сложных ситуациях следует помнить, что жизнь – это абсолютный приоритет!
Что ситуация не критическая и можно лечить заболевание не прибегая к хирургическому вмешательству. Будьте очень внимательны! Не делайте выводов на основе эмоций. Конечно же, операций всем и всегда хочется избежать, но даже в самых эмоционально-сложных ситуациях следует помнить, что жизнь – это абсолютный приоритет!
Что представляет собой культя шейки матки, выпадение и рак
Культя шейки матки – это остаток полового органа после проведённой операции. Качество жизни женщины после вмешательства может быть различным – некоторым пациенткам не мешает утрата репродуктивной функции, другие считают это существенной проблемой. Но культя шейки матки грозит и другими осложнениями, о которых нужно помнить женщине и врачу прежде чем принять решение об операции.
Операции по удалению матки: виды и показания
Удаление матки – очень рискованный шаг для женщины, поскольку такое вмешательство полностью исключает деторождение в будущем. Именно поэтому для проведения операции должны быть строгие показания, которые можно разделить на абсолютные и относительные.
Абсолютные показания к операции – злокачественная опухоль женских половых органов, выпадение матки, непрекращающееся послеродовое кровотечение (это экстренное показание). Абсолютные показания подразумевают, что вылечить заболевание другим способом, кроме оперативного вмешательства, невозможно. Такие операции проводятся женщинам (иногда и девочкам-подросткам) независимо от возраста и количества рождённых детей, поскольку это единственный способ спасти здоровье и жизнь пациентки.
Относительные показания – крупная или множественная миома, которая быстро прогрессирует, эндометриоз, аденометриоз, воспалительные заболевания женских половых органов, частые и сильные менструальные кровотечения. Речь об удалении во всех этих случаях идёт только тогда, когда консервативные методы лечения оказываются неэффективными. В некоторых случаях удаление матки при перечисленных состояниях проводят женщинам в постменопаузе или уже имеющим двоих детей (по желанию пациентки), даже если состояние женщины не настолько критичное.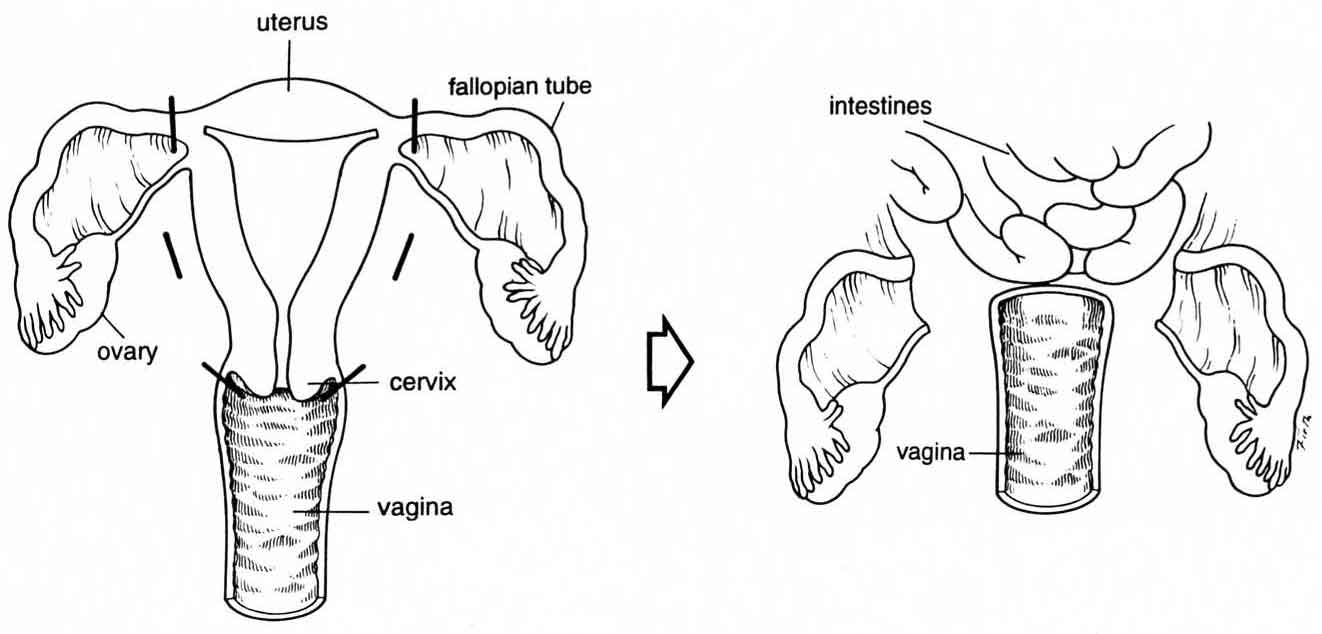
Существует несколько основных видов удаления матки. Выбор конкретного вида остаётся за врачом. Два основных вида – ампутация (шейка метки остаётся на месте) и экстирпация (матка удаляется вместе с шейкой и частично влагалищем). Оба этих вида операции могут затрагивать придатки (маточные трубы и яичники), а могут оставлять их сохранными.
Поскольку при экстирпации шейка матки удаляется полностью, в дальнейшем речь пойдёт только об ампутации матки. По объёму данное вмешательство может быть двух видов – субтотальная и тотальная ампутация. Первый вид – наиболее щадящий, при этом сохраняется влагалище, шейка матки вплоть до внутреннего зева, маточные трубы (ушиваются) и яичники. Во втором случае матка удаляется полностью с придатками, но влагалище и шейка матки остаются на месте.
По способу проведения ампутация матки может быть гистероскопической, лапароскопической и лапаротомической. Гистероскопическая – наиболее щадящий вариант, выполняется под местной или субдуральной анестезией.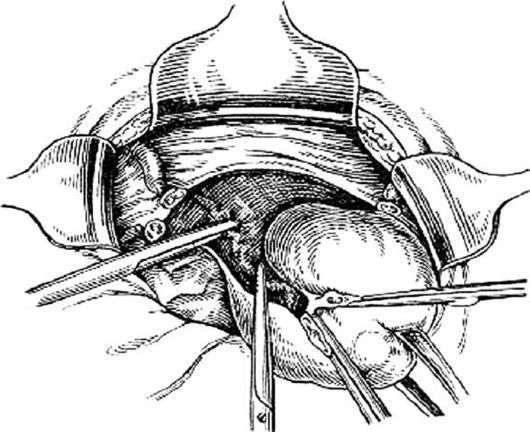 Инструменты вводятся через влагалище, шрамов на коже не остаётся. Лапароскопия – удаление операции через небольшой прокол на коже, если есть необходимость выполнить большой объём. Чревосечение применяют в тяжёлых случаях, например, при послеродовом кровотечении.
Инструменты вводятся через влагалище, шрамов на коже не остаётся. Лапароскопия – удаление операции через небольшой прокол на коже, если есть необходимость выполнить большой объём. Чревосечение применяют в тяжёлых случаях, например, при послеродовом кровотечении.
Кроме показаний существуют и противопоказания к удалению матки. К ним относятся тяжёлое состояние женщины, вызванное декомпенсацией хронической патологии – в этом случае операцию проводят после стабилизации состояния пациентки. Острые инфекционные заболевания также являются противопоказанием для вмешательства – их нужно вылечить до операции. И третье абсолютное противопоказание – рак любого органа, в том числе матки, 4 стадии.
Что представляет собой культя шейки матки
Культя – это остаток органа, оставшийся после его удаления. В случае с шейкой матки это фрагмент от внутреннего зева (ушивается во время операции) до наружного зева (влагалищная часть). Влагалище при этом остаётся полностью сохранным. Культя шейки матки является следствием перенесённой операции – ампутации матки (с придатками или без них).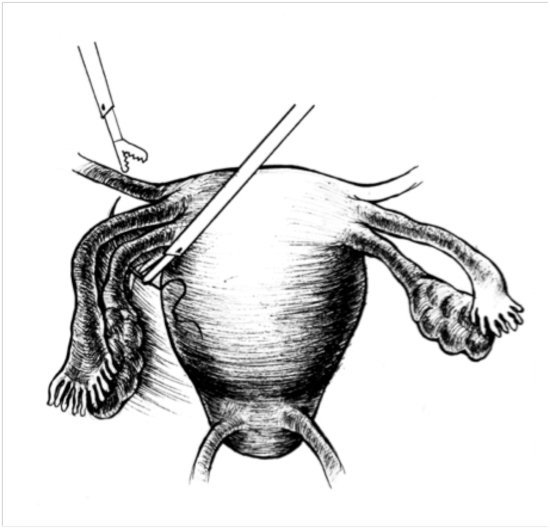
Отсутствие матки и наличие культи никоим образом не сказывается на внешнем облике (особенно если операция была проведена гистероскопическим методом) или на качестве жизни женщины. Пациентки, перенесшие ампутацию матки, продолжают жить полноценной сексуальной жизнью, испытывая не менее яркие ощущения. Тем не менее, после удаления матки полностью теряется репродуктивная способность, поэтому у молодых женщин, не имеющих детей, врачи крайне неохотно назначают данную операцию, если нет жизненных показаний.
Существует распространённое мнение, что последствия ампутации матки значительно сказываются на женском организме – например, что женщина значительно быстрее стареет, или у неё повышается вероятность других гинекологических заболеваний. Здесь следует уточнить, что происходящие изменения зависят от объёма проведения операции.
Если у женщины удалена только матка, а яичники и маточные трубы остались, то её гормональный фон после операции остаётся нормальным, она выглядит здоровой и чувствует себя хорошо. Поэтому данный вид вмешательства предпочтителен у молодых дам.
Поэтому данный вид вмешательства предпочтителен у молодых дам.
Если же была проведена тотальная ампутация матки с придатками, то в отсутствие женских половых гормонов менопауза действительно наступает раньше. Если женщина находится в постклимактерическом периоде, то эти изменения не оказывают на неё влияния, но если до операции она имела стабильный менструальный цикл, то симптомы преждевременного климакса устраняют с помощью гормональной терапии.
Что касается вероятности развития гинекологических заболеваний, в частности, рака груди, то в этом случае связь есть не с самой операцией, а с причинами, вызвавшими заболевание. В частности, вероятность рака груди выше у женщин, у которых диагностирована миома (при неэффективности консервативной терапии это заболевание – показание к ампутации матки).
Самое заметное изменение образа жизни женщины после операции – исчезновение менструаций. Многие пациентки считают эту особенность скорее положительной, особенно если во время заболевания страдали обильными и болезненными месячными. Тем не менее, если вмешательство проведено неправильно или в недостаточном объёме, и фактор, вызывающий заболевание, оказался не полностью удалён, возможны осложнения позднего послеоперационного периода – выпадение и рак культи шейки матки.
Тем не менее, если вмешательство проведено неправильно или в недостаточном объёме, и фактор, вызывающий заболевание, оказался не полностью удалён, возможны осложнения позднего послеоперационного периода – выпадение и рак культи шейки матки.
Послеоперационный период и его осложнения
Адаптация к культе шейки матки начинается сразу же после проведения манипуляции. Реабилитацию разделяют на раннюю (в стационаре) и позднюю. Ранняя реабилитация может длится от суток до 12 дней, в зависимости от того, какой тип операции проводился у данной пациентки (абдоминальная, лапароскопическая, гистероскопическая). Поздняя реабилитация включает в себя длительный период после выписки из больницы.
На раннем этапе пациентке необходимо наблюдение врача, чтобы предотвратить кровотечения, осложнения со стороны внутренних органов. Поэтому женщине нужно быть внимательной к своему состоянию, вовремя сообщать врачу о том, что у неё болит живот или она испытывает любые другие неприятные ощущения.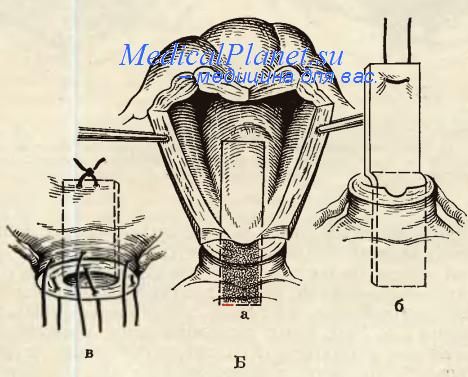
В раннем послеоперационном периоде возможны кровотечения, воспалительные процессы в области швов, захватывающие как шейку матки и влагалище, так и соседние органы брюшной полости. Если при определении объёма операции была допущена диагностическая ошибка, и женщина имела рак шейки матки на начальной стадии, симптомы опухоли могут проявиться в ранний послеоперационный период.
Поздний реабилитационный период – это довольно длительные мероприятия, позволяющие женщине вернуться к полноценной жизни. Вот почему этому периоду нужно уделить не меньше внимания, чем лечению в стационаре. Рекомендуется носить бандаж, поддерживающий мышцы живота. Женщине придётся ограничить физический труд, особенно поднятие тяжестей, купание в открытых водоёмах и половую жизнь на 2 месяца после выписки из больницы.
Если швы были наложены неправильно, то они будут способствовать образованию кисты. Чаще всего подобное заболевание является следствием многих факторов, среди которых может оказаться и нарушение технологии проведения оперативного вмешательства. Фото кисты можно найти в интернете, как правило, это состояние протекает бессимптомно и с минимальным риском для здоровья.
Фото кисты можно найти в интернете, как правило, это состояние протекает бессимптомно и с минимальным риском для здоровья.
В норме на месте шва формируется рубцовая, а затем фиброзная ткань, которая изолирует влагалище и шейку матки, предотвращает сообщение половых органов с брюшной полостью, не допускает распространения инфекций, а также случайного попадания сперматозоидов и связанного с ними риска развития внематочной беременности.
Выпадение культи шейки матки
Это довольно редкое состояние. Чаще всего его причина в том, что до операции имелось выпадение матки или предпосылки к нему, которые не были полностью устранены. Причины подобного состояния – травматичные роды в анамнезе, заболевания соединительной ткани, неправильно проведённая ампутация матки.
Выпадение культи шейки развивается довольно медленно, и редко имеет тенденцию к самостоятельному вправлению. Пациентки отмечают чувство инородного тела, боли в животе, которые усиливаются при кашле, чихании, поднятии тяжестей.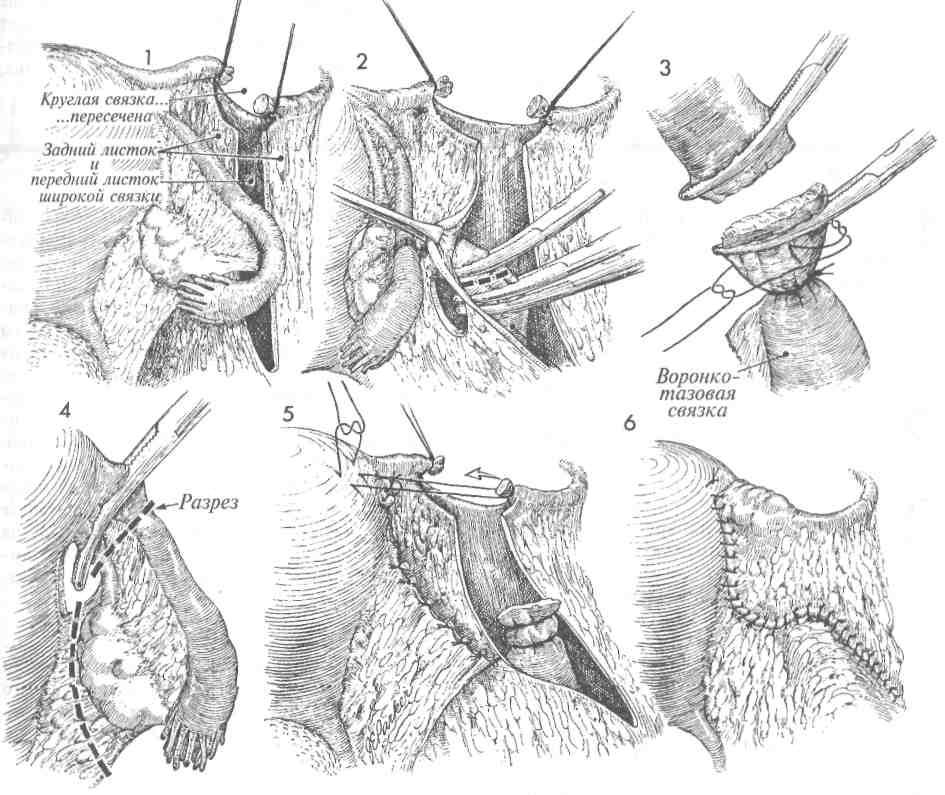 Также нарушаются мочеиспускание и дефекация.
Также нарушаются мочеиспускание и дефекация.
Лечение данного состояния – фиксация шейки матки с помощью специальных материалов. В этом случае чаще всего проводится чревосечение, чтобы обеспечить наибольший простор для действий хирурга. Шейка матки может искусственно прикрепляться к крестцово-маточным или другим связкам, поддерживающим матку.
Рак культи шейки матки
Рак шейки матки – частая онкологическая патология в гинекологической практике. После проведения ампутации матки вероятность развития злокачественного процесса в шейке сохраняется. Более того, встречаются ситуации, когда на момент принятия решения о вмешательстве по поводу миомы или эндометриоза женщина уже имеет раковую опухоль на ранней стадии, но врачи принимают симптомы рака за симптомы болезни матки и оставляют их без внимания. Это приводит к тому, что вместо экстирпации производится более щадящее вмешательство, а рак остаётся и прогрессирует.
Симптомы заболевания – это выделения из влагалища, на ранних стадиях – коричневатые, затем приобретающие кровянистый характер, с неприятным запахом, их обильность может быть различной.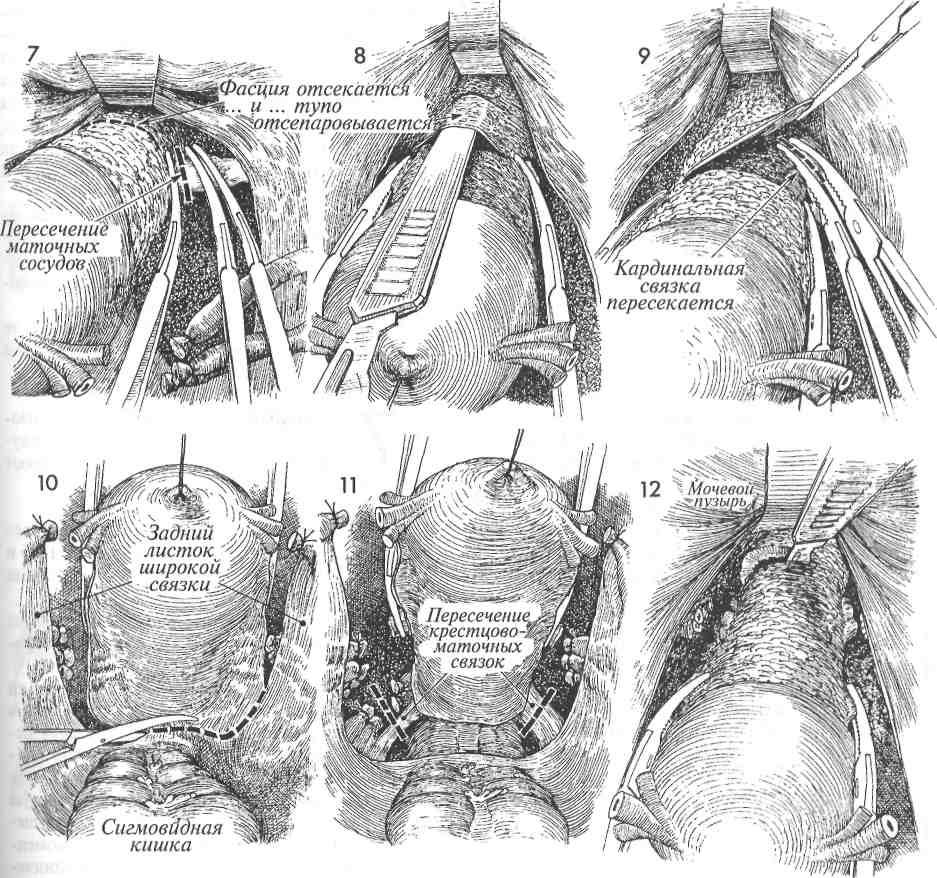 Появление выделений должно особенно насторожить женщину, перенесшую удаление матки, ведь в норме после этого все выделения прекращаются или становятся незначительными.
Появление выделений должно особенно насторожить женщину, перенесшую удаление матки, ведь в норме после этого все выделения прекращаются или становятся незначительными.
Позже появляются боли в животе, нарушения мочеиспускания и дефекации, общетоксический синдром. Особенность рака шейки матки и её культи в развитии метастазов в тазовые лимфоузлы. Это приводит к отёчности нижних конечностей и наружных половых органов, чуть позже возникают отёки пальцев и кистей рук, набухание вен на шее – это симптомы поздних стадий с обширными метастазами.
Лечение рака культи после удаления матки производится несколькими способами. Предпочтительным считается лучевая терапия с созданием максимальной дозы в области поражения. Химиотерапию назначают довольно редко, поскольку она не всегда эффективна. При неэффективности лучевой терапии прибегают к оперативному вмешательству – удалению культи шейки матки.
Опасные симптомы, или когда нужно обратиться к врачу?
Оба указанных выше состояния значительно угрожают здоровью и жизни пациентки, поэтому важно вовремя распознать опасные симптомы, чтобы принятые лечебные меры оказались эффективными.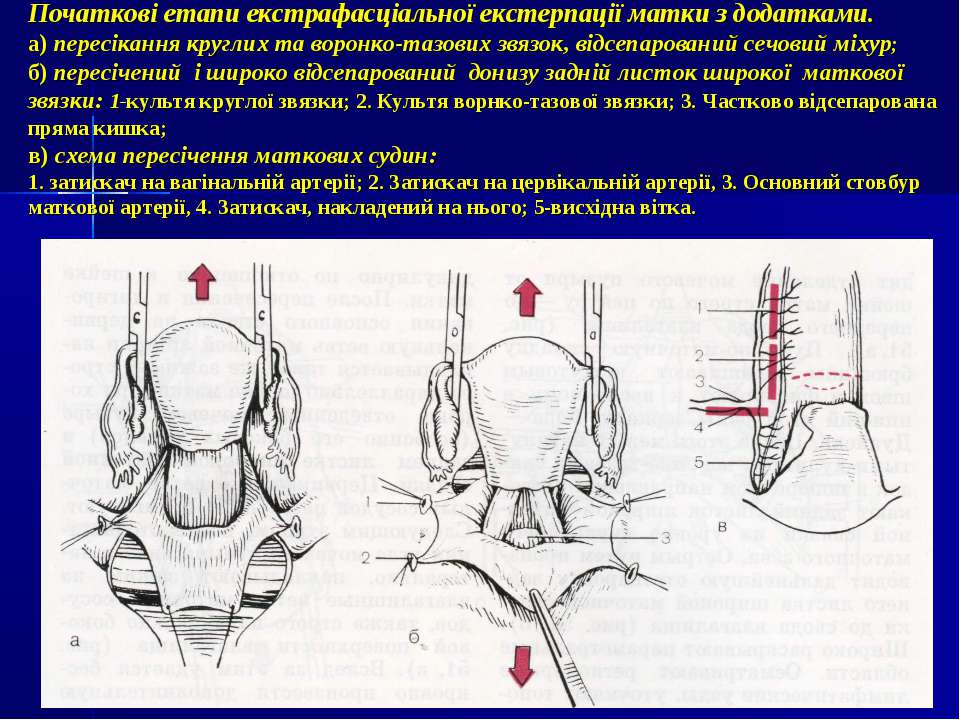 Следует немедленно обратиться к врачу, если:
Следует немедленно обратиться к врачу, если:
- Появились боли внизу живота;
- Появились какие- либо выделения из половых путей, тем более, если влагалище кровит;
- Нарушилось мочеиспускание и дефекация.
Эти симптомы возникают и при выпадении, и при раке культи шейки матки, отличить эти заболевания в домашних условиях, не будучи специалистом невозможно. Для постановки диагноза необходимо пройти ряд процедур, начиная с осмотра в гинекологическом кресле. Следует помнить, что одно из заболеваний не исключает другое, оба диагноза могут сопутствовать друг другу.
Отзывы из различных источников
Кристина, 34 года, Омск
Вторые роды у меня прошли тяжело – случилось кровотечение, доктор говорит, что еле откачали, хотя сама я вообще плохо помню те сутки. Из-за кровотечения мне пришлось удалить матку, но шейку оставили, чтобы было меньше побочных эффектов. Прошло три месяца, разрывы благополучно зажили, малыш здоровый. С мужем всё тоже хорошо, хотя поначалу я чувствовала себя странно. В общем, не сказала бы, что жизнь взяла и улучшилась, но хуже не стала.
С мужем всё тоже хорошо, хотя поначалу я чувствовала себя странно. В общем, не сказала бы, что жизнь взяла и улучшилась, но хуже не стала.
Анастасия, 48 лет, Кемерово
14 лет назад у меня диагностировали эндометриоз яичников. Два года лечения, разные препараты, результат довольно слабый. Я хотела третьего ребёнка, но гинеколог сказал, что с моей болезнью забеременеть я не смогу. А вылечиться я не могла, становилось только хуже. Совместно с доктором приняли непростое решение об удалении матки с придатками. После операции пришлось пить гормоны, но в общем и целом я чувствовала себя неплохо. Наблюдаюсь у гинеколога, в ближайшее время мне предстоит прекратить пить гормоны, чтобы наступил климакс.
Дарья, 46 лет, Новосибирск
Три года как мне удалили матку. Перед операцией я читала отзывы, и в них говорилось, что ничего страшного в операции нет, будут жить обычной жизнью. Но не тут-то было, уже через полгода начались какие-то неприятные ощущения в животе, как будто матка заново начала отрастать. Потом появились выделения, было очень неприятно, живот болел. И только месяц назад я пришла на приём к гинекологу, она поставила диагноз «выпадение культи шейки матки». Теперь нужна ещё одна операция, чтобы восстановить это всё.
Потом появились выделения, было очень неприятно, живот болел. И только месяц назад я пришла на приём к гинекологу, она поставила диагноз «выпадение культи шейки матки». Теперь нужна ещё одна операция, чтобы восстановить это всё.
Заключение
Если врач решается удалять матку у пациентки – это серьёзный шаг, который должен быть мотивирован соображениями сохранения жизни и здоровья женщины. Оставшаяся культя шейки матки никак не влияет на социальную и половую жизнь, не оставляет следов на внешности, но навсегда лишает женщину возможности стать матерью. Осложнений после операции обычно не возникает, но прооперированным женщинам необходимо регулярно посещать гинеколога, чтобы надёжнее обезопасить себя.
Видео: экстирпация культи шейки матки
Данная статья размещена исключительно в образовательных целях и не является научным материалом или профессиональным медицинским советом. Всегда доверяйте в первую очередь своему лечащему врачу! У всех методов лечения и препаратов приведенных в статье могут быть противопоказания. Необходима консультация специалиста
Необходима консультация специалиста
Оптимизация методики гистерэктомии и экстирпации культи шейки матки лапароскопическим доступом Текст научной статьи по специальности «Клиническая медицина»
© м. м. Высоцкий, оптимизация методики гистерэктомии
Е. О. сазонова, И экстИрпАцИИ культи шЕйкИ МАткИ
Ю. Ю. домокеева лАпАрОскОпИчЕскИМ доступом
Московский государственный медико-
стоматологический университет УДК: 618.14-089.87
■ Авторами проведен анализ характера и частоты осложнений гистерэктомии и экстирпации культи шейки матки лапароскопическим доступом с целью оптимизации техники проведения оперативных вмешательств и повышения их безопасности. Стандартизация основных этапов проведения лапароскопических операций позволяет снизить частоту осложнений и повысить эффективность хирургического лечения.
■ Ключевые слова: гистерэктомия; экстирпация культи шейки матки; осложнения.
Несмотря на то, что с момента выполнения первой лапароскопической гистерэктомии (ЛГ) прошло более 20 лет, с сожалением можно констатировать, что в настоящее время подавляющее большинство операций выполняется традиционными доступами и оперативными приемами. Одной из причин ограниченного применения лапароскопического доступа является высокий риск осложнений на этапах освоения методики гистерэктомии [4]. Различная информированность врачей и уровень технического обеспечения привели к тому, что единой хирургической школы в нашей стране не сложилось. Повсеместное распространение и отсутствие единых тактических подходов к проведению основных этапов ЛГ создают предпосылки для увеличения числа неблагоприятных последствий проведенного лечения.
Вне зависимости от хирургического доступа при удалении матки прежде всего стоит вопрос об объеме операции: проведении надвлагалищной ампутации или экстирпации матки. Вопрос об удалении или сохранении шейки матки обсуждается, прежде всего, с онкологических позиций. Стремление к необоснованному сохранению шейки матки при гистерэктомии нередко приводит к тому, что при оперативном вмешательстве не удаляется патологически измененная шейка матки. В последующем при этом имеется риск развития фоновых предраковых и раковых заболеваний культи шейки матки, требующих в дальнейшем хирургического лечения [5]. Экстирпация культи щейки матки с использованием лапароскопического доступа наряду с гистерэктомией, безусловно, относится к категории операций повышенной сложности. Нарушенные топографоанатомические взаимоотношения органов малого таза после перенесенной надвлагалищной ампутации матки обусловливают высокий потенциальный риск развития ин-тра- и послеоперационных осложнений [3].
Вопрос об удалении или сохранении шейки матки обсуждается, прежде всего, с онкологических позиций. Стремление к необоснованному сохранению шейки матки при гистерэктомии нередко приводит к тому, что при оперативном вмешательстве не удаляется патологически измененная шейка матки. В последующем при этом имеется риск развития фоновых предраковых и раковых заболеваний культи шейки матки, требующих в дальнейшем хирургического лечения [5]. Экстирпация культи щейки матки с использованием лапароскопического доступа наряду с гистерэктомией, безусловно, относится к категории операций повышенной сложности. Нарушенные топографоанатомические взаимоотношения органов малого таза после перенесенной надвлагалищной ампутации матки обусловливают высокий потенциальный риск развития ин-тра- и послеоперационных осложнений [3].
Целью настоящего исследования явилась оптимизация техники лапароскопической гистерэктомии и экстирпации культи шейки матки на основании анализа частоты и характера осложнений оперативных вмешательств.
Материалы и методы исследования
Ретроспективно изучены истории болезни 502 пациенток, перенесших гистерэктомию и 50 больных, подвергавшихся экстирпации культи шейки матки лапароскопическим доступом.
Превалирующим показанием к гистерэктомии являлись опухоли яичников в сочетании с аденомиозом, рецидивирующей гиперплазией эндометрия, миомой матки или CIN II и III. Возраст пациенток варьировал от 39 до 75 лет, 398 (79,6 %) пациенток находилось в постменопаузе. Ранее подвергались различным гинекологическим и хирургическим оперативным вмешательствам на органах брюшной полости 185 (37 %) больных. У 90 (18 %) пациенток имелось ожирение 2-3-й степени. Варикозным расширением вен нижних конечностей страдало 23 (4,3 %) больных.
ЯПТПАЛЪ АКУШЕРСТВА » ЖЕНСКИ)» БОЛЪЗНЕИ
ТОМ LXI ВЫПУСК 3/2012
ISSN 1684-0461
ЛГ выполнялась под эндотрахеальным наркозом с помощью комплекта оборудования фирмы «Karl Storz» (Германия) по интрафасциальной методике. Методика интрафасциальной тотальной лапароскопической гистерэктомии позволила сократить время операции в среднем до 50,5 ± 7,2 мин. при размерах матки до 10 недель и типичном течении операции. К настоящему времени минимальное время оперативного вмешательства при выполнении тотальной лапароскопической гистерэктомии у пациенток в постменопаузе с доброкачественными опухолями яичников составило 31 мин., что, вероятнее всего, связано со скудным кровоснабжением органов малого таза в этой возрастной группе.
Методика интрафасциальной тотальной лапароскопической гистерэктомии позволила сократить время операции в среднем до 50,5 ± 7,2 мин. при размерах матки до 10 недель и типичном течении операции. К настоящему времени минимальное время оперативного вмешательства при выполнении тотальной лапароскопической гистерэктомии у пациенток в постменопаузе с доброкачественными опухолями яичников составило 31 мин., что, вероятнее всего, связано со скудным кровоснабжением органов малого таза в этой возрастной группе.
Массивный спаечный процесс отмечен у 280 (56 %) пациенток. Различные степени наружного эндометриоза интраоперационно выявлены у 157 (38,3 %) пациенток. У всех больных с эндометрио-зом во время операции проводилось иссечение очагов эндометриоза и эндометриоидных инфильтратов. Коагуляции подвергали лишь единичные очаги на тазовой брюшине при условии отсутствия рубцевания подлежащих тканей. Сакрокольпопексией дополняли гистерэктомию у 16 пациенток. У одной пациентки гистерэктомия была дополнена уретеро-лизом тазового отдела мочеточника в связи с данными о его сужении в нижней трети, в параметрии.
У одной пациентки гистерэктомия была дополнена уретеро-лизом тазового отдела мочеточника в связи с данными о его сужении в нижней трети, в параметрии.
Средний возраст пациенток, перенесших экстирпацию культи шейки матки лапароскопическим доступом, варьировал от 43 до 67 лет, составив в среднем 47 ± 3,2 года. Предшествующие субтотальные гистерэктомии проводились по поводу миомы матки у 32 (63,8 %), миомы матки в сочетании с аденомио-зом у 16 (32,0 %), послеродового гипотонического кровотечения у 2 (4,2 %) пациенток. У 23 (46,6 %) больных в анамнезе имелась так называемая «эрозия» шейки матки, по поводу чего в разные периоды жизни выполнена диатермокоагуляция. Отмечена редкая посещаемость пациентками гинеколога из-за «псевдоуспокоенности» после якобы радикального оперативного лечения. Так, не обращались к врачу более 7 лет 24 (46 %) женщин. У всех пациенток обнаружили патологию шейки матки, представленной лейкоплакией с атипией шейки матки, цервикальной интраэпителиальной неоплазией шейки матки 1-3-й степени, эндометриозом культи шейки матки, рецидивирующими полипами шейки матки.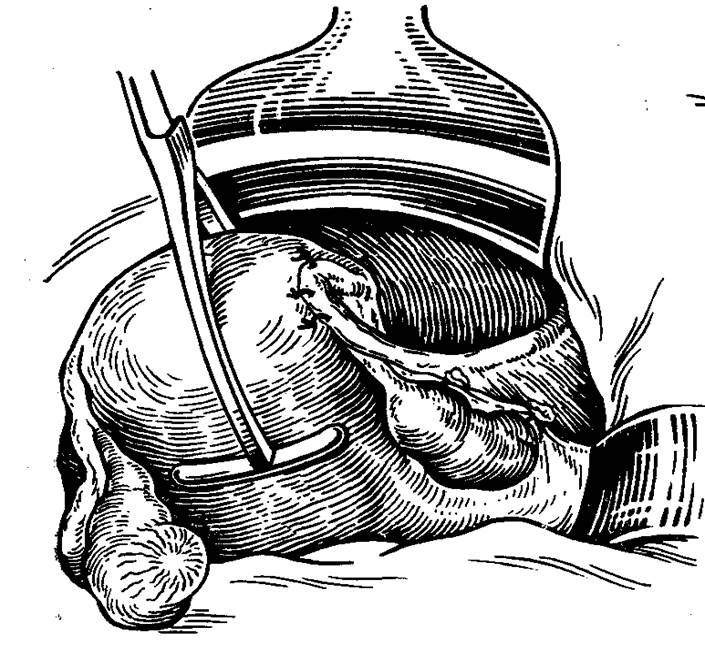 У одной пациентки через 2 месяца после операции субтотальной гистерэктомии, во время третьего выскабливания по поводу рецидивирующих кровотечений и полипа шейки матки возникли сомнения в целостности шейки и состоятельности швов, что потребовало экстренного оперативного вмешательства.
У одной пациентки через 2 месяца после операции субтотальной гистерэктомии, во время третьего выскабливания по поводу рецидивирующих кровотечений и полипа шейки матки возникли сомнения в целостности шейки и состоятельности швов, что потребовало экстренного оперативного вмешательства.
Экстирпацию культи шейки матки начинали с попытки идентифицировать культю круглой связки матки, что позволяло после ее пересечения создать
«окно» в параметрии и безопасно скелетировать во-ронкотазовую связку. В дальнейшем методика экстирпации соответствует модифицированной методике лапароскопической гистерэктомии. Влагалище отсекали от шейки матки циркулярным разрезом с применением маточного манипулятора фирмы «Апекс» (Россия). Купол влагалища формировали, сшивая переднюю и заднюю стенки фасциального футляра с краями влагалища отдельными швами. Для укрепления и высокой фиксации культи влагалища подшивали пузырно-лобковую фасцию к крестцово-маточным связкам.
Длительность операций составила в среднем 73 минуты (от 55 до 142).
результаты исследования и их обсуждение
Интраоперационные осложнения во время гистерэктомии отмечены у 8 пациенток. Из них в 4 наблюдениях имели место ранения мочевого пузыря, в 1 — повреждение мочеточника, в 3 — кровотечения из маточных сосудов. Все кровотечения наблюдались на начальном этапе освоения лапароскопического доступа при использовании монополярной коагуляции маточных сосудов. В дальнейшем мы отказались от использования монополярной коагуляции в пользу биполярной методики гемостаза. Повреждения мочевого пузыря отмечались на этапе проведения диссекции у больных, перенесших от 1 до 3 кесаревых сечений. Мочеточник был пересечен латеральнее перекреста с маточной артерией при попытке перевязки ее основного ствола. Конверсия произведена у 2 пациенток. У одной пациентки с ранением мочевого пузыря и 3 кесаревыми сечениями в анамнезе, учитывая невозможность выделить заднюю стенку мочевого пузыря, выполнено иссечение передней стенки матки вместе с задней стенкой мочевого пузыря в виде мышечной пластинки. С помощью этого мышечного лоскута сформирован лоскут и закрыт дефект пузыря. Кроме того, конверсия выполнена после интраоперационной диагностики повреждения мочеточника с целью проведения неоуретероцистоанастомоза. Все остальные осложнения корригированы во время лапароскопии. В целом, частота осложнений оказалась невысокой и составила 1,59 %.
С помощью этого мышечного лоскута сформирован лоскут и закрыт дефект пузыря. Кроме того, конверсия выполнена после интраоперационной диагностики повреждения мочеточника с целью проведения неоуретероцистоанастомоза. Все остальные осложнения корригированы во время лапароскопии. В целом, частота осложнений оказалась невысокой и составила 1,59 %.
Развитие серьезных осложнений, таких как кровотечение, повреждение мочевого пузыря, мочеточников и кишечника в ходе лапароскопических операций, в основном, связано с дефектами хирургической техники. В известной мере причиной интра- и послеоперационных осложнений являются нарушенные топографо-анатомические отношения органов малого таза у больных с наружным эндометриозом, спаечным процессом, миомой матки с шеечной локализацией миоматозных узлов [4]. В настоящем исследовании все кровотечения из маточных сосудов
■ атттьАШШРСТВА •• ЖЕНСКИЕ Б0.ТОНЕЙ ТОМ LXI ВЫПУСК 3/2012 ISSN 1684-0461
и ранение мочеточника наблюдались на начальном этапе освоения лапароскопического доступа при использовании экстрафасциальной методики для выполнения гистерэктомии. Основным приемом, обеспечивающим безопасное оперирование, является использование интрафасциальной методики, которая подразумевает вскрытие лоннопузырной фасции после пересечения восходящих ветвей маточных сосудов и проведение всех дальнейших манипуляций в пределах фасциального листка, что обеспечивает необходимую защиту от соседних, в том числе интимно спаянных органов и позволяет адекватно восстановить тазовую анатомию в последующем [1]. При выполнении радикальных оперативных вмешательств на матке ранения мочеточника чаще всего происходят на уровне перекреста с маточными сосудами. Чрезвычайно важным аспектом в профилактике повреждения мочеточника во время лапароскопической гистерэктомии является определение уровня коагуляции маточной артерии [2]. Как правило, деление маточной артерии на восходящую и нисходящую ветви происходит ниже уровня перекреста с мочеточником, т. е. мочеточник перекрещивал общий ствол маточной артерии. Поэтому безопасная коагуляция сосудистого пучка матки возможна только в области восходящей ветви маточной артерии.
Основным приемом, обеспечивающим безопасное оперирование, является использование интрафасциальной методики, которая подразумевает вскрытие лоннопузырной фасции после пересечения восходящих ветвей маточных сосудов и проведение всех дальнейших манипуляций в пределах фасциального листка, что обеспечивает необходимую защиту от соседних, в том числе интимно спаянных органов и позволяет адекватно восстановить тазовую анатомию в последующем [1]. При выполнении радикальных оперативных вмешательств на матке ранения мочеточника чаще всего происходят на уровне перекреста с маточными сосудами. Чрезвычайно важным аспектом в профилактике повреждения мочеточника во время лапароскопической гистерэктомии является определение уровня коагуляции маточной артерии [2]. Как правило, деление маточной артерии на восходящую и нисходящую ветви происходит ниже уровня перекреста с мочеточником, т. е. мочеточник перекрещивал общий ствол маточной артерии. Поэтому безопасная коагуляция сосудистого пучка матки возможна только в области восходящей ветви маточной артерии.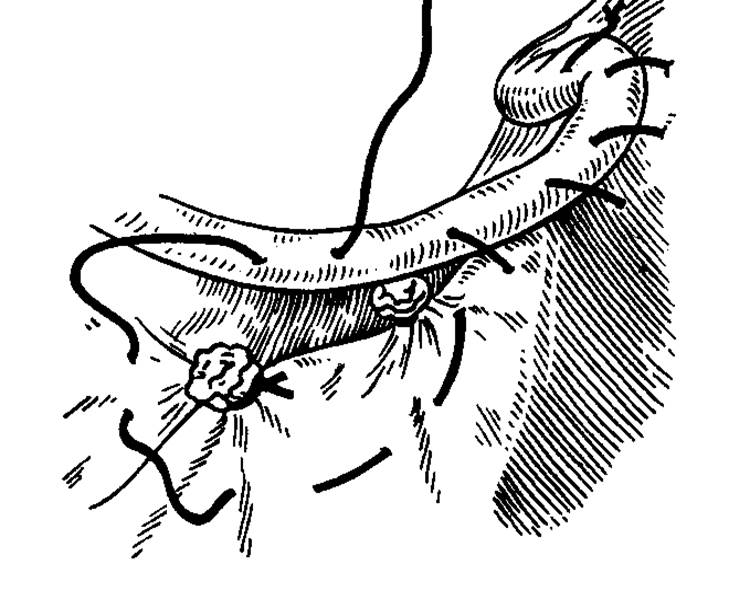 С целью гемостаза предпочтительнее использовать биполярную коагуляцию. Отметим также, что мы не обеспечиваем гемостаз стенок влагалища коагуляцией, сразу приступая к ушиванию стенок. Отсутствие кровотечений в послеоперационном периоде у наших пациенток позволяет предполагать, что, видимо, надежная фиксация сосудов в шве без выраженной зоны коагуляционного некроза с риском отторжения струпа является профилактикой поздних кровотечений из культи влагалища. Следовательно, точная идентификация анатомических структур, отказ от массивной коагуляции, использование современных маточных манипуляторов (типа Клермон компании «Карл Шторц», Апекс фирмы «Апекс») обеспечивают минимальный риск осложнений лапароскопической гистерэктомии.
С целью гемостаза предпочтительнее использовать биполярную коагуляцию. Отметим также, что мы не обеспечиваем гемостаз стенок влагалища коагуляцией, сразу приступая к ушиванию стенок. Отсутствие кровотечений в послеоперационном периоде у наших пациенток позволяет предполагать, что, видимо, надежная фиксация сосудов в шве без выраженной зоны коагуляционного некроза с риском отторжения струпа является профилактикой поздних кровотечений из культи влагалища. Следовательно, точная идентификация анатомических структур, отказ от массивной коагуляции, использование современных маточных манипуляторов (типа Клермон компании «Карл Шторц», Апекс фирмы «Апекс») обеспечивают минимальный риск осложнений лапароскопической гистерэктомии.
Осложнения лапароскопической экстирпации культи шейки матки в настоящем исследовании имели место у 3 пациенток с массивным спаечным процессом брюшной полости и малого таза. Во всех наблюдениях констатированы повреждения кишечника. Интраоперационно было диагностировано и ушито ранение стенки кишечника у одной пациентки. Как известно, осложнения лапароскопии в гинекологии зачастую носят специфический характер и существенно отличаются от осложнений, возникающих при лапаратомном и влагалищном доступах. Лапаросокпическая техника предусматривает более широкое использование электрохирургического воздействия с целью гемостаза и рассечения тканей, что
Интраоперационно было диагностировано и ушито ранение стенки кишечника у одной пациентки. Как известно, осложнения лапароскопии в гинекологии зачастую носят специфический характер и существенно отличаются от осложнений, возникающих при лапаратомном и влагалищном доступах. Лапаросокпическая техника предусматривает более широкое использование электрохирургического воздействия с целью гемостаза и рассечения тканей, что
создает предпосылки для возникновения термических повреждений органов малого таза [6]. У одной пациентки в послеоперационном периоде вследствие термического повреждения сигмовидной кишки развился кишечно-влагалищный свищ. У другой больной, перенесшей экстирпацию культи шейки как 5-ю по счету операцию (субтотальная гистерэктомия лапаротомным доступом, 2 операции по поводу опухолей яичников), вследствие нераспознанного интраоперационно ранения стенки сигмовидной кишки во время выделения последней из спаечного конгломерата, на 7-е сутки развился перитонит. Таким образом, частота осложнений экстирпации культи шейки матки лапароскопическим доступом составила 6 %. Следует отметить, что повреждений мочевого пузыря и мочеточников не было отмечено ни в одном наблюдении.
Таким образом, частота осложнений экстирпации культи шейки матки лапароскопическим доступом составила 6 %. Следует отметить, что повреждений мочевого пузыря и мочеточников не было отмечено ни в одном наблюдении.
Профилактика интраоперационных осложнений лапароскопической экстирпации культи шейки матки представляет собой сложную проблему. Вообще стандартизация методики повторных операций любым доступом может быть непосильной задачей. Однако, некоторые попытки систематизации можно сделать, базируясь на методике лапароскопической гистерэктомии. Следует отметить, что начинать операцию с мобилизации мочевого пузыря, как это иногда рекомендуется в классических руководствах и, возможно, уместно в случае открытой операции, нецелесообразно из-за интимного его сращения с культей шейки матки. Наиболее безопасно пересечь круглую связку в аваскулярном участке и создать в параметрии «окно». Этот прием позволяет точнее разобраться в анатомических взаимоотношениях между мочевым пузырем, культей шейки и ворон-котазовой связкой. Важно выделить, скелетировать и пересечь воронкотазовую связку, обеспечив гемостаз. Идентификация мочеточника крайне желательна на этом этапе операции, хотя выделение его считаем необязательным. При наличии опухоли яичника конгломерат с опухолью отводится от стенки таза в центр и острым путем отделяется от кишечника, так как прямая кишка при тракциях смещается кзади, облегчая идентификацию границ тканей. Кровотечения на этом этапе практически не бывает, так как крупные сосуды пересечены. Дальнейшая методика зависит от длины культи шейки. Если она позволяет ввести маточный манипулятор, применяющийся для лапароскопической гистерэктомии, то можно, после пересечения крестцово-маточных связок, выделить и пересечь восходящие ветви маточных сосудов, контрастируя свод влагалища с помощью пластикового полукольца маточного манипулятора. Если же культя короткая, то выделение и точная идентификация сосудов на этом этапе проблематична. Необходимо идентифицировать пузырно-лобковую фасцию и, действуя интрафасциально, низвести мочевой пу-
Важно выделить, скелетировать и пересечь воронкотазовую связку, обеспечив гемостаз. Идентификация мочеточника крайне желательна на этом этапе операции, хотя выделение его считаем необязательным. При наличии опухоли яичника конгломерат с опухолью отводится от стенки таза в центр и острым путем отделяется от кишечника, так как прямая кишка при тракциях смещается кзади, облегчая идентификацию границ тканей. Кровотечения на этом этапе практически не бывает, так как крупные сосуды пересечены. Дальнейшая методика зависит от длины культи шейки. Если она позволяет ввести маточный манипулятор, применяющийся для лапароскопической гистерэктомии, то можно, после пересечения крестцово-маточных связок, выделить и пересечь восходящие ветви маточных сосудов, контрастируя свод влагалища с помощью пластикового полукольца маточного манипулятора. Если же культя короткая, то выделение и точная идентификация сосудов на этом этапе проблематична. Необходимо идентифицировать пузырно-лобковую фасцию и, действуя интрафасциально, низвести мочевой пу-
ЖУРПАЛЪ АКУШЕРСТВА — ЖЕНСКИ!» БОЛЪЗНЕЙ Т0М 1X1 ВЫПУСК 3/2012 155М 1684-0461 ■
зырь, коагулируя сосуды по мере их появления в поле зрения лапароскопа. Подобные приемы позволяют избежать осложнений, связанных с анатомическими взаимоотношениями между мочеточником, маточными сосудами и мочевым пузырем. Однако полностью исключить риск осложнений, связанных с отделением стенки кишки при любой методике в этой ситуации невозможно.
Подобные приемы позволяют избежать осложнений, связанных с анатомическими взаимоотношениями между мочеточником, маточными сосудами и мочевым пузырем. Однако полностью исключить риск осложнений, связанных с отделением стенки кишки при любой методике в этой ситуации невозможно.
Таким образом, стандартизация методики выполнения сложных и радикальных операций лапароскопическим доступом позволяет снизить частоту осложнений и повысить эффективность хирургического лечения.
литература
1. Высоцкий М. М. Молекулярно-биологические факторы в патогенезе опухолей яичников и их роль в выборе объема операции: автореф. дис… д-ра мед. наук. — М., 2006. — 48 с.
2. МанухинИ. Б., ВысоцкийМ. М. Лапароскопическая гистерэктомия при опухолях яичников: обработка маточных сосудов // Эндоскопическая хирургия — 2004. — № 6. — С. 44-47.
— № 6. — С. 44-47.
3. Осложнения при выполнении сложных эндохирурги-ческих вмешательств: состояние проблемы / Галлямо-ва С. В. [и др.] // Эндоскопическая хирургия. — 2008. — № 1. — С. 25-29.
4. Сазонова Е. О. Безопасность лапароскопических операций на органах малого таза у женщин: автореф. дис… д-ра мед. наук. — М., 2008. — 48 с.
5. Donnez J., Squifflet J. Laparoscopic hysterectomy: Should we remove cervix? // Controversies in obstetrics gynecology and infertility. Proceedings of the congress. — Athens, 2005. — P.350-356.
6. Laparoscopic complication evaluation throughout 18 years follow up / Gonzalez L. [et al.] // Gynecological surgery. — 2008. — Vol. 5, suppl. — P. 44
Статья представлена В. Ф. Беженарем, ФГБУ «НИИАГ им. Д. О. Отта» СЗО РАМН, Санкт-Петербург
Д. О. Отта» СЗО РАМН, Санкт-Петербург
OPTIMIZATION TECHNIQUES OF HYSTERECTOMY AND HYSTERECTOMY CERVICAL STUMP BY LAPAROSCOPIC ACCESS
Visotsky M. M., Sazonova E. O., Domokeeva U. U.
■ Summary: The authors analyze the nature and frequency of complications of hysterectomy and extirpation of the cervical stump by laparoscopic access in order to optimize techniques for surgery and improve their security. Standardization of the basic steps of laparoscopic surgery reduces the incidence of complications and improve the effectiveness of surgical treatment.
■ Key words: hysterectomy; extirpation of the cervical stump; complications.
■ Адреса авторов для переписки-
Высоцкий Максим Маркович — д. м. н., профессор. Московский государственный медико-стоматологический университет. Кафедра эндоскопической хирургии ФПДО. 127473, Москва, ул. Делегатская, 20/1. Сазонова Елена Олеговна — д. м. н., профессор. Московский государственный медико-стоматологический университет. Кафедра эндоскопической хирургии ФПДО. 127473, Москва, ул. Делегатская, 20/1. E-mail: [email protected].
м. н., профессор. Московский государственный медико-стоматологический университет. Кафедра эндоскопической хирургии ФПДО. 127473, Москва, ул. Делегатская, 20/1. Сазонова Елена Олеговна — д. м. н., профессор. Московский государственный медико-стоматологический университет. Кафедра эндоскопической хирургии ФПДО. 127473, Москва, ул. Делегатская, 20/1. E-mail: [email protected].
Домокеева Юлия Юрьевна — аспирант кафедры эндоскопической хирургии. Московский государственный медико-стоматологический университет, Кафедра эндоскопической хирургии ФПДО. 127473, Москва, ул. Делегатская, 20/1.
Visotsky Maxim M. — professor. Department of Endoscopic Surgery. Moscow State University of Medicine and Dentistry. 127473, Moscow, street Delegate 20/1.
Sazonova Elena O. — professor. Department of Endoscopic Surgery. Moscow State University of Medicine and Dentistry. 127473, Moscow, street Delegate 20/1. E-mail: [email protected].
127473, Moscow, street Delegate 20/1. E-mail: [email protected].
Domokeeva Uliya U. — aspirant.
Moscow State University of Medicine and Dentistry.
Department of Endoscopic Surgery. 127473, Moscow, street Delegate 20/1.
■ ¡РРПАЛЪ АКУШЕРСТВА — ЖЕНСКИХ»! Б0.ШНЕЙ
ТОМ LXI ВЫПУСК 3/2012
ISSN 1684-0461
Культит, осложнённый бактериальным циститом — сеть ветеринарных клиник «Свой Доктор»
На прием в ветеринарную клинику в ноябре 2017 года поступила собака по кличке Нора, беспородная, в возрасте 13 лет. У владельцев живет с двух месячного возраста, кормление промышленным кормом премиального класса, содержание домашнее с регулярным выгулом, вакцинация ежегодная, обработки от экто- и эндопаразитов регулярные. Не щенилась. Со слов владельцев 2 года назад в сторонней клиники проводилась овариогистерэктомия по причине пиометры. Ни каких лекарственных средств на данный момент не получает, хронических заболеваний не имеет.
Не щенилась. Со слов владельцев 2 года назад в сторонней клиники проводилась овариогистерэктомия по причине пиометры. Ни каких лекарственных средств на данный момент не получает, хронических заболеваний не имеет.
На посещение ветеринарного врача, владельцев с подвигли следующие симптомы: в течение трех дней у Норы наблюдаются частые мочеиспускания малыми порциями в не предназначенных местах, иногда с примесью крови, активность и аппетит снижены.
По результатам осмотра: температура тела 39,00С, вес 13,5кг, видимые слизистые оболочки розового цвета, упитанность средняя, шерстный покров тусклый взъерошенный, дегидратация легкая, брюшная стенка напряжена. По согласованию с владельцами собаки, были взяты общеклинический и биохимический анализы крови, общеклинический анализ мочи, проведено ультразвуковое исследование брюшной полости. По результату УЗИ выявили признаки цистита, так же в области мочевого пузыря визуализируется объемное (6,0х5,3 см) образование с неоднородным содержимым, без четких границ, расширение посвета культи матки с признаками спаечного процесса с мочевым пузырем и толстым отделом кишечника. 9, ферменты АЛТ, АСТ, ЩФ — завышены в несколько раз). Животному была назначена симптоматическая терапия (внутривенная инфузия, антибиотик, спазмолитики), взят анализ мочи методом цистоцентеза на бактериологический посев и оперативное лечение – гистерэктомия (хирургическое лечение культита тела матки). В ходе операции был подтвержден спаечный процесс измененного участка матки с мочевым пузырем и прямой кишкой. Произведено удаление культи с последующим гистологическим исследованием. Операция прошла без осложнений, животное было помещено в стационар для выхода из наркоза и стабилизации состояния. На симптоматическую терапию (внутривенные инфузии, антибиотикотерапия, обезболивающие препараты) Нора реагировала положительно. Признаки цистита прекратились уже на 2-3 день после операции. Нора выздоровела и была выписана.
9, ферменты АЛТ, АСТ, ЩФ — завышены в несколько раз). Животному была назначена симптоматическая терапия (внутривенная инфузия, антибиотик, спазмолитики), взят анализ мочи методом цистоцентеза на бактериологический посев и оперативное лечение – гистерэктомия (хирургическое лечение культита тела матки). В ходе операции был подтвержден спаечный процесс измененного участка матки с мочевым пузырем и прямой кишкой. Произведено удаление культи с последующим гистологическим исследованием. Операция прошла без осложнений, животное было помещено в стационар для выхода из наркоза и стабилизации состояния. На симптоматическую терапию (внутривенные инфузии, антибиотикотерапия, обезболивающие препараты) Нора реагировала положительно. Признаки цистита прекратились уже на 2-3 день после операции. Нора выздоровела и была выписана.
Манчестерская операция — цена в Частной врачебной практике
Описание
Если вы столкнулись с проблемой опущения или выпадения матки, не стоит отчаиваться! Опытные специалисты помогут вам вернуться к полноценной жизни в предельно сжатые сроки.
Суть манчестерской операции
Пролапс гениталий (предполагающий опущение или выпадение матки) в гинекологии представляет собой патологическое состояние, которое чаще всего диагностируется у женщин среднего возраста. Его развитию способствует преимущественно сложное течение естественных родов. В соответствии с данными статистики в настоящее время такая патология выявляется и у пациенток моложе 30 лет.
Современные реалии таковы, что при прохождении планового осмотра после родов у 50 % женщин выявляется выпячивание стенок влагалища. В последующем у этих пациенток может быть диагностировано выпадение матки. При отсутствии своевременной медицинской помощи справиться с подобной проблемой поможет исключительно оперативная гинекология.
Важно! Манчестерская операция – один из действенных способов устранения такой проблемы, как опущение или частичное выпадение матки. Оперативное вмешательство должно проводиться хирургом, который отлично владеет методами эстетической и классической хирургии.
Манчестерская операция – хирургическое вмешательство, представляющее собой сочетание пластики задней и передней стенок влагалища и:
- ампутация шейки матки;
- укрепления культи шейки кардинальными связками.
Медицинская манипуляция предупреждает дальнейшее опущение органов малого таза, способствует сохранению менструальной функции. Она особенно эффективна в том случае, когда опущение стенок влагалища сопровождается выраженным цистоцеле(опущением мочевого пузыря) и неполным выпадением матки.
Основные преимущества операции перечислены ниже:
- отсутствие послеоперационных рубцов и шрамов от швов в области промежности;
- сравнительно короткий период реабилитации;
- возможность одновременного выполнения операции по удалении миомы матки.
После проведения хирургического вмешательства не возникает резких болей. Благодаря использованию современных эндоскопических осложнений вероятность возникновения осложнений после операции минимальна.
Оперативное вмешательство осуществляется влагалищным доступом. До медицинской манипуляции выполняются:
- расширение канала шейки;
- диагностическое выскабливание слизистой оболочки матки.
Стандартная пошаговая последовательность действий такова:
1. Шейка захватывается пулевыми щипцами и низводится к входу во влагалище.
2. Делается циркулярный разрез стенки влагалища спереди.
3. Продольным разрезом рассекается передняя стенка влагалища (начиная с 1,5 см ниже наружного отверстия мочеиспускательного канала и вплоть до циркулярного разреза).
4. После удаления треугольного лоскута выполняется отсепаровка мочевого пузыря от шейки матки. При этом подсекаются соответствующие соединительнотканные волокна (расположенные между такими органами, как мочевой пузырь и шейка матки).
5. Затем мочевой пузырь смещается подъёмником в сторону лобкового симфиза.
6. На следующем этапе делается клиновидная ампутация шейки. Нижнюю часть кардинальных связок прикрепляют к передней стенке шейки матки.
7. Ушивают влагалищно-пузырную фасцию.
8. На заключительном этапе зашивается разрез стенки влагалища и формируется культя шейки, проводится кольпоперинеопластика.
Показания и противопоказания
Основное показание к выполнение манчестерской операции в гинекологии – выпадение или опущение матки у женщин. Такое состояние является следствием снижение упругости тазового дна пациентки.
Абсолютных противопоказаний к проведению манчестерской операции не существует. Относительные противопоказания для пластики передней и задней стенок влагалища и ампутации матки – инфекционно-воспалительные заболевания половых органов, проблемы со свёртываемостью крови.
Подготовка к операции
Перед тем как назначается операция, женщине нужно пройти следующие лабораторно-инструментальные исследования:- Клинический анализ крови
- Биохимический анализ крови: общий белок, билирубин общий, глюкоза крови, мочевина, креатинин, АСТ, АЛТ
- Электролиты в сыворотке (калий, натрий хлор)
- ВИЧ, гепатиты В, С, сифилис
- Группа крови и резус-фактор
- Коагулограмма: Протромбин (по Квику), МНО, Фибриноген
- Общий анализ мочи
- Микроскопическое исследование мазка
- ЭКГ с описанием
- Осмотр терапевта
- Флюорография
В современных медицинских центрах установлено современное оборудование. Поэтому все лабораторно-инструментальные исследования выполняются в течение одного дня.
Поэтому все лабораторно-инструментальные исследования выполняются в течение одного дня.
Послеоперационный период
Операция представляет собой малотравматичную медицинскую манипуляцию. При условии соблюдения всех предписаний врача продолжительность периода реабилитации минимальна.
Более подробную информацию о послеоперационных ограничениях предоставит врач. После оперативного вмешательства стоит соблюдать перечисленные ниже рекомендации:
- отказ от поднятия тяжестей;
- соблюдение полового покоя на протяжении 6 недель после оперативного вмешательства.
Чтобы операцию можно было считать успешной, женщине стоит следить и за своим питанием. Для более активного заживления швов в области промежности стоит исключить из рациона продукты, провоцирующие возникновение запоров и повышенного газообразования.
В настоящее время проводятся и другие операции, способствующие укреплению фиксирующего аппарата матки. Гинеколог посоветует вам оптимальный способ устранения несостоятельности мышц, расположенных в области тазового дна, после беременности.
Цены услуг специалистов в области гинекологии довольно демократичны. В случае необходимости проводится предварительное УЗИ репродуктивных органов и мочевого пузыря.
Клинико-сонографические характеристики, последующее наблюдение и рецидив
Резюме
Предпосылки
Опухоль гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) является редкой опухолью и рассматривается как подклассификация опухолей гладких мышц матки между доброкачественными и злокачественными . В этом исследовании мы оценили характеристики случаев с диагнозом STUMP за 10-летний период.
Методы
Мы ретроспективно оценили медицинские карты пациентов с гистопатологическим диагнозом STUMP в Стамбульской учебно-исследовательской больнице, третичном центре.Мы проанализировали предоперационные демографические, клинические особенности и послеоперационное наблюдение. Были повторно проанализированы предоперационные сонографические данные.
Результаты
Средний возраст составил 42 года. Одна пациентка находилась в постменопаузе, а пять пациенток — в пременопаузе. У всех была жалоба на менометроррагию. Мы повторно оценили предоперационные ультразвуковые изображения пациентов и определили 83,3% как четко определенные границы, 66,7% гиперэхогенные, 100% гетерогенные, 66,7% не кистозные, 50% кальцинозные и 66.7% акустическое затенение. Патологические признаки показали среднее количество митозов 8, легкую атипию 66,7% и некроз 33,3%. У 24-летней незамужней пациентки, перенесшей миомэктомию, мы обнаружили рецидив опухоли в сонографических и МРТ исследованиях через 11 месяцев и подтвердили диагноз с помощью биопсии Tru-cut. Не было никакой связи между результатами сонографии и атипией, некрозом и митозом. Рецидив не был связан с митозом, степенью атипии и некроза. Мы не обнаружили связи между диаметром опухоли и митозом, атипией, некрозом и рецидивом.
Выводы
Пень классифицируется как промежуточная форма гистопатологически, поэтому однозначно назвать ее доброкачественной или злокачественной невозможно.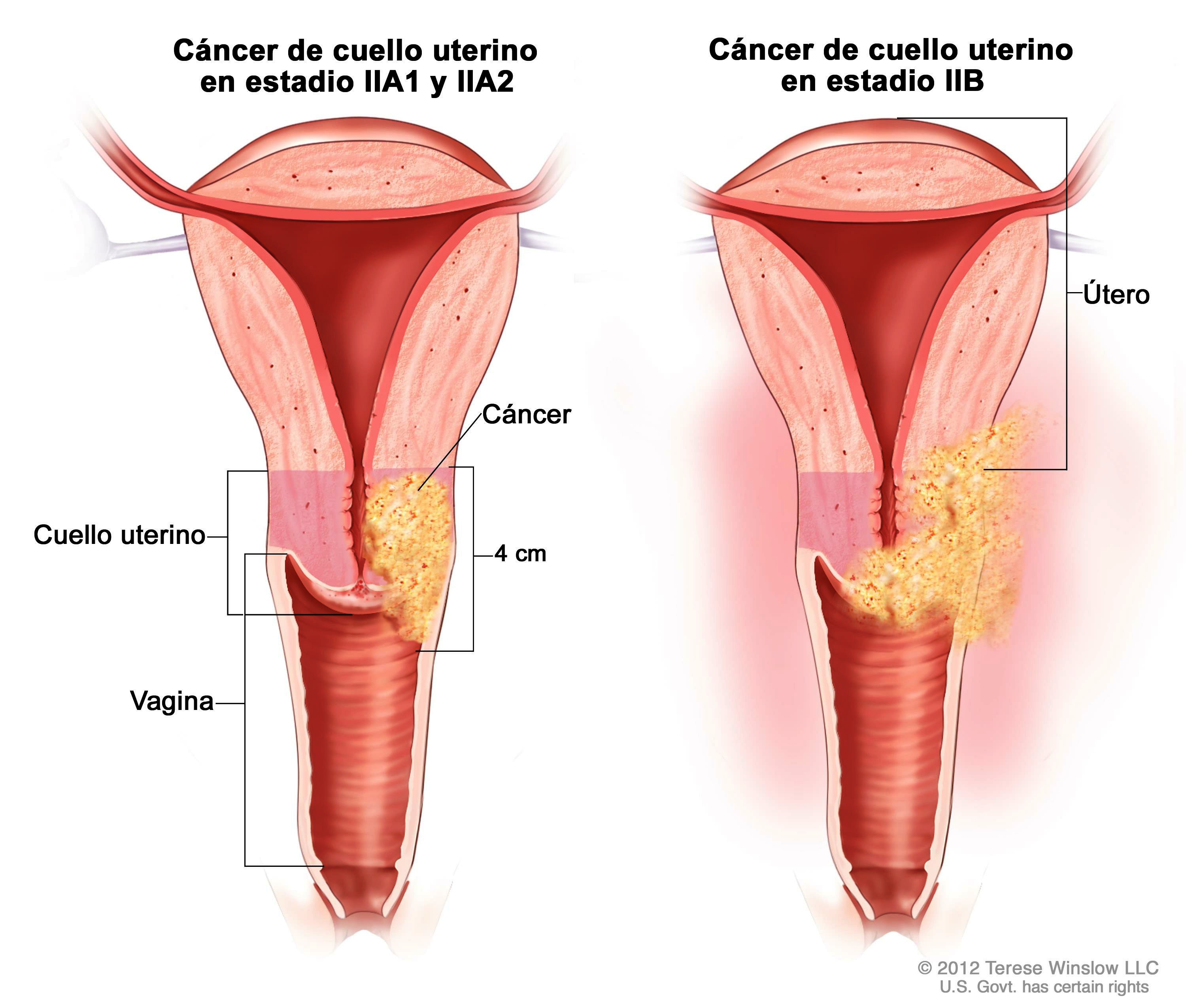 Сингулярность, солидность, гиперэхогенность, неоднородность, а также особенности акустического затенения и границ могут помочь нам в предоперационной сонографической диагностике. Через много лет после операции можно увидеть рецидив / метастазы, и таких пациентов следует наблюдать в течение длительного времени.
Сингулярность, солидность, гиперэхогенность, неоднородность, а также особенности акустического затенения и границ могут помочь нам в предоперационной сонографической диагностике. Через много лет после операции можно увидеть рецидив / метастазы, и таких пациентов следует наблюдать в течение длительного времени.
Ключевые слова: Опухоль гладких мышц матки, STUMP, сонография
Введение
Опухоль гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) является редкой опухолью.
Опухоли гладких мышц матки классифицируются как доброкачественная лейомиома и злокачественная лейомиосаркома по наличию некроза опухолевых клеток, цитологической атипии и митотической активности. STUMP рассматривается в классификации Всемирной организации здравоохранения (ВОЗ) как опухоль гладких мышц между доброкачественными и злокачественными [1].
STUMP наблюдается в основном у людей в возрасте от 40 до 40 лет, оперированных с предоперационным диагнозом лейомиомы. Факторы риска и прогноз до конца не изучены, но при долгосрочном наблюдении существует вероятность рецидива или метастазирования.
Факторы риска и прогноз до конца не изучены, но при долгосрочном наблюдении существует вероятность рецидива или метастазирования.
В этом исследовании мы оценили прогноз, сонографические и клинико-патологические особенности случаев с гистопатологическим диагнозом STUMP.
Материалы и методы
Мы ретроспективно оценили медицинские карты пациентов с гистопатологическим диагнозом STUMP в период с 2005 по 2015 год в Стамбульской учебно-исследовательской больнице, специализированном центре. Мы проанализировали предоперационные демографические, клинические и гистопатологические особенности, а также послеоперационное наблюдение. Были повторно проанализированы предоперационные сонографические данные.
SPSS 15.0 для Windows использовался для статистического анализа. Описательная статистика была определена как число и процент для категориальных переменных и среднее значение, стандартное отклонение, минимум и максимум для числовой переменной. Сравнение двух независимых групп проводилось с помощью U-критерия Манна-Уитни. Соотношение в двух группах для категориальных переменных было проанализировано с помощью точного критерия Фишера. Числовые переменные были проанализированы с помощью корреляционного анализа Спирмена из-за невыполнения условия параметрического теста.Уровень статистической значимости принят P <0,05.
Соотношение в двух группах для категориальных переменных было проанализировано с помощью точного критерия Фишера. Числовые переменные были проанализированы с помощью корреляционного анализа Спирмена из-за невыполнения условия параметрического теста.Уровень статистической значимости принят P <0,05.
Результаты
Особенности случая и их статистический анализ шести пациентов с диагнозом STUMP представлены в и. Средний возраст составлял 42 года. Одна пациентка находилась в постменопаузе, а пять пациенток — в пременопаузе. У всех была жалоба на менометроррагию. Среднее число беременностей составило 5,5, а среднее число родов — 3,5. Мы повторно оценили предоперационные сонографические изображения опухоли и определили 83,3% как четко очерченную капсулу опухоли, 66.7% гиперэхогенный, 100% гетерогенный, 66,7% не кистозный, 50% кальциноз и 66,7% акустическое затенение. Мы выполнили тотальную абдоминальную гистерэктомию (TAH) и двустороннюю сальпингоофорэктомию (BSO) у 66,7% и миомэктомию у 33,3% пациентов. При гистопатологии средний диаметр опухоли составлял 9,4 см, локализация была интрамуральной у 83,3%, среднее количество митозов было 8 (в 10 полях высокого увеличения (HPF)), легкая атипия у 66,7% и некроз у 33,3%. Среднее время наблюдения составило 63,4 месяца. В послеоперационном периоде мы не смогли связаться с одним пациентом.У 24-летней нерожавшей женщины, перенесшей миомэктомию, мы обнаружили рецидив опухоли в ультразвуковых и МРТ исследованиях после 11-месячного наблюдения и подтвердили диагноз с помощью биопсии Tru-cut.
При гистопатологии средний диаметр опухоли составлял 9,4 см, локализация была интрамуральной у 83,3%, среднее количество митозов было 8 (в 10 полях высокого увеличения (HPF)), легкая атипия у 66,7% и некроз у 33,3%. Среднее время наблюдения составило 63,4 месяца. В послеоперационном периоде мы не смогли связаться с одним пациентом.У 24-летней нерожавшей женщины, перенесшей миомэктомию, мы обнаружили рецидив опухоли в ультразвуковых и МРТ исследованиях после 11-месячного наблюдения и подтвердили диагноз с помощью биопсии Tru-cut.
Таблица 1
Функции на основе случая
| Случай 1 | Случай 2 | Случай 3 | Случай 4 | Случай 5 | Случай 6 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Возраст | 48 | 44 | 40 | 43 | 52 | 24 | |||||||
| Gravida | 12 | 8 | 2 | 4 | 7 | 0 | |||||||
| Четность | 5 | 6 | 2 | 4 | 4 | 0 | |||||||
| Менопаузальное состояние | Пост | До | До | До | До | До | |||||||
| Жалоба | MM | MM | MM | MM | MM | MM и тазовая боль | |||||||
| Сонографические данные | |||||||||||||
| Количество опухолей / миомы | 5 | 1 | 1 | 1 | 1 | 2 | |||||||
| Поля опухоли | Плохо определено | Хорошо- определенная | четко определенная | четко определенная | четко определенная | четко определенная | |||||||
| эхогенная | смешанная | смешанная | гиперэхогенная | гиперэхогенная | гиперэхогенная | гиперэхогенная | гиперэхогенная | гиперэхогенная | |||||
| Гетерогенный | Гетерогенный | Гетерогенный | Гетерогенный | Гетерогенный | Гетерогенный | ||||||||
| Кистозная форма | + | + | — | — | — | — | |||||||
| + | + | — 90 072 | — | + | |||||||||
| Акустическое затенение | + | — | — | + | + | + | |||||||
| Свободная жидкость | — | — | — | — | — | — | |||||||
| Патология | |||||||||||||
| Процедура | TAH + BSO | TAH + BSO | Миомэктомия | TAH + BSO | TAH + BSO | Миомэктомия | |||||||
| Диаметр опухоли (см) | 3.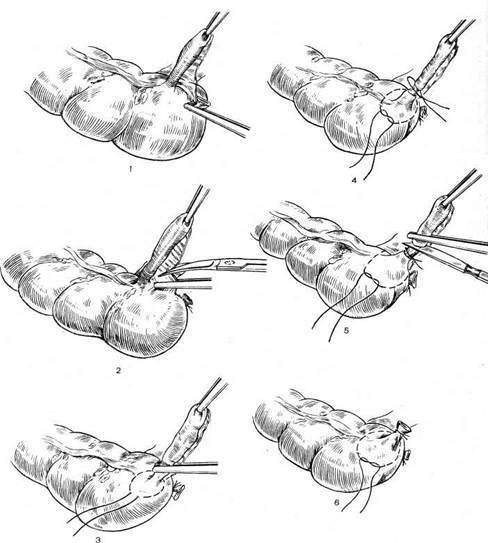 5 5 | 8 | 7 | 20 | 10 | 8 | |||||||
| Локализация | Внутримуральная | Подслизистая | Внутримуральная | Внутримуральная | Внутримышечная | Внутрираматическая | |||||||
| Число митозов (n / 10 HPF) | 4 | 17 | 8 | 5 | 8 | 6 | |||||||
| Атипия | Легкая | Умеренная | Умеренная | Умеренная | Легкая | Умеренная | |||||||
| Некроз | + | + | — | — | — | — | |||||||
Последующее наблюдение (мес. ) ) | 120 | 119 | NR | 38 | 29 | 11 | |||||||
| Повторение | — | — | NR | — | — | + |
Возраст, среднее ± стандартное отклонение (мин. — макс.) — макс.) | 41,8 ± 9,7 (24 — 52) |
| Беременность, среднее ± стандартное отклонение (мин. — макс.) | 5,5 ± 4,4 (0 — 12) |
| Четность, среднее ± стандартное отклонение ( мин. — макс.) | 3,5 ± 2,2 (0-6) |
| Менапауза, n (%) | |
| Постменапауза | 1 (16,7) |
| Предменапауза | 5 (83,3 ) |
| Жалоба, n (%) | |
| Менометроррагия | 6 (100) |
| Сонография | |
Количество опухолей / миомы, среднее ± стандартное отклонение (мин. — макс.) — макс.) | 1,8 ± 1,6 (1 — 5) |
| Поля опухоли, n (%) | |
| Плохо определено | 1 (16,7) |
| Четко определено | 5 (83,3) |
| Эхогенность опухоли, n (%) | |
| Гиперэхогенная | 4 (66,7) |
| Смешанная | 2 (33,3) |
| Гетерогенность опухоли, n (%) ) | |
| Гетерогенный | 6 (100) |
| Кистозный вид, n (%) | |
| + | 2 (33.3) |
| — | 4 (66,7) |
| Расчет n (%) | |
| + | 3 (50,0) |
| — | 3 (50,0) |
| Акустическое затенение, n (%) | |
| + | 4 (66,7) |
| — | 2 (33,3) |
| Свободная жидкость, n (%) | 0 |
| Патология | |
| Процедура, n (%) | |
| Миомэктомия | 2 (33.3) |
| TAH + BSO | 4 (66,7) |
| Диаметр опухоли (см), среднее ± стандартное отклонение (мин. — макс.) | 9,4 ± 5,6 (3,5 — 20) |
| Локализация , n (%) | |
| Внутримышечно | 5 (83,3) |
| Подслизистая | 1 (16,7) |
| Число митозов (n / 10 HPF), среднее ± стандартное отклонение (мин. — макс. .) | 8,0 ± 4,7 (4-17) |
| Атипия, n (%) | |
| Легкая | 2 (33.3) |
| Умеренная | 4 (66,7) |
| Некроз, n (%) | |
| + | 2 (33,3) |
| — | 4 (66,7) |
| Конечная ситуация n (%) | |
| Рецидив | 1 (20) |
| Без заболевания | 4 (80) |
| NR | 1 |
| Последующее наблюдение (мес. ), среднее ± стандартное отклонение (мин.- макс.) | 63,4 ± 52,1 (11 — 120) |
Не было статистически значимого соответствия между результатами сонографии и количеством атипий, некрозов и митозов (P> 0,05). Рецидив не был связан с митозом, степенью атипии и некроза. Мы не обнаружили связи между диаметром опухоли и митозом, атипией, некрозом и рецидивом. В случае развивающегося рецидива было две опухоли с наибольшим диаметром 8 см, умеренной атипией, 6 митозами и отсутствием некроза.Другой случай миомэктомии был похож: одна опухоль с наибольшим диаметром 7 см, умеренная атипия, 8 митозов и отсутствие некроза.
Обсуждение
ПЕНЬ, которая считается подтипом опухолей гладкой мускулатуры матки, является редкой опухолью, поэтому ее частота неизвестна. Также нет единого мнения по гистопатологическому описанию.
Клинические признаки и симптомы аналогичны лейомиоме и лейомиосаркоме [2-4]. Это тазовая боль, аномальное маточное кровотечение, масса в тазу и ощущение давления в тазу или их сочетание.Средний возраст — 45 лет [2-4]. Большинство пациенток находятся в пременопаузе [4]. В наших случаях средний возраст составлял 42 года. 83,3% пациентов были пременопаузальными. У всех была мено метроррагия.
Предоперационная диагностика STUMP или дифференциация от лейомиомы-лейомиосаркомы с помощью методов визуализации — непростая задача. Бонно и др. Опубликовали первое исследование по этому поводу в 2013 году [5]. В этом исследовании они сравнили результаты сонографии и МРТ 85 лейомиомы и 23 случаев злокачественной мезенхимальной опухоли (MMT) и STUMP и сообщили, что наличие единственной опухоли, отсутствие акустической тени и наличие свободной жидкости связаны с MMT / STUMP.Мы также ретроспективно оценили наши ультразвуковые изображения в соответствии с их критериями: в четырех случаях была единственная опухоль, в двух случаях не было акустического затенения, и ни в одном из случаев не было свободной жидкости. Наши сонографические данные показали 83,3% четко выраженных, 66,7% гиперэхогенных, 100% гетерогенных, 66,7% некистозных, 50% кальциноза и 66,7% акустических теней.
Опухоли гладких мышц матки исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основании цитологической атипии, скорости митоза и наличия или отсутствия некроза опухолевых клеток (CTCN) [6].Стэнфордские критерии гистологического диагноза лейомиосаркомы, о которых сообщают Белл и др., Включают по крайней мере два из следующих критериев: диффузная атипия от умеренной до тяжелой, митотическое число не менее 10 митотических фигур на 10 HPF и критерии некроза опухолевых клеток; отсутствие некроза и атипии, ≤ 4 митозов, указывающих на доброкачественную лейомиому. В литературе нет единого мнения о диагностических критериях STUMP. Согласно классификации ВОЗ, ЗПМ матки, не диагностированную однозначно как доброкачественную или злокачественную, следует определять как ПНТ.Опухоли STUMP были разделены Bell et al [6] на три группы: 1) атипичная лейомиома с низким риском рецидива — диффузная атипия от умеренной до тяжелой, <10 митозов / 10 HPF и без CTCN; 2) атипичная лейомиома, но с ограниченным опытом - тяжелая атипия, <20 митозов / 10 HPF, без CTCN; и 3) гладкомышечная опухоль с низким злокачественным потенциалом имеет CTCN, митоз менее 10/10 HPF, отсутствует до легкой ядерной атипии. Guntupalli et al [2] поставили диагноз STUMP по одному из следующих критериев: некроз опухоли (+), отсутствие атипии, митоз ≤ 10/10 HPF; диффузная атипия (+), некроз опухоли отсутствует, митоз ≤ 10/10 HPF; нет некроза опухоли, нет атипии, митоз ≥ 20/10 HPF; клеточность или гиперцеллюлярность с митозом ≥ 4/10 HPF; неровные края или сосудистая инвазия на периферической стороне опухоли.
Д’Анджело и Прат [7] описали следующие критерии STUMP: некроз опухоли при типичных лейомиоа; некроз и ≥ 10 митозов / 10 HPF или выраженная диффузная атипия; заметная диффузная или очаговая атипия и пограничный митоз; и некроз с трудом классифицируется. Как правило, диагноз STUMP ставится после миомэктомии или гистерэктомии в соответствии с тремя гистологическими критериями Стэнфордского университета. Если опухоль не соответствует критериям лейомиосаркомы и имеет комбинацию критериев Стэнфорда, диагноз STUMP является точным.
Сообщенная частота рецидивов STUMP составляет 7-27% [8, 9]. Некроз опухоли, степень атипии и митоза коррелируют со злокачественным поведением, но связь с рецидивом не ясна. Потому что рецидивы наблюдаются при единичных или переменных комбинациях и степенях таковых [2-4, 8-12]. Следовательно, не так просто предвидеть биологическое поведение, метастатический потенциал или прогноз STUMP. Рецидивирующая опухоль представляет собой пень или лейомиосаркому и может возникать в матке, тазу, забрюшинном пространстве, легких, печени и костях [2, 3, 9–12].У пациентов с STUMP рост опухоли медленнее, и рецидив часто откладывается в среднем на 51 месяц после первоначального диагноза. Кроме того, клиническое течение часто откладывается, средняя выживаемость составляет 61,5 месяца [8]. Пятилетняя выживаемость 92–100% [4, 12]. В нашем исследовании средняя продолжительность наблюдения составила 63 месяца, а частота рецидивов — 20%. Пять пациентов были живы, четверо из них не болели. В нашем случае рецидива количество митозов было 6, с умеренной атипией и без некроза.В этом случае рецидив был диагностирован через 11 месяцев как ПЕНЬ.
Частота рецидивов после гистерэктомии и миомэктомии аналогична [2]. Частота рецидивов миомэктомии составляет 6,6% [8]. При постмиомэктомии диагностика STUMP может быть выполнена вторую миомэктомию или гистерэктомию в зависимости от состояния пациента. Прежде чем выбирать процедуру, следует тщательно рассмотреть возраст пациента, фертильность, патологические свойства опухоли, количество рецидивов, размер и расположение опухоли. Показатель успешной беременности после миомэктомии составляет 52% [8].Пациенты, желающие забеременеть, должны быть проинформированы о потенциальной заболеваемости и смертности от опухоли. Варианты лечения рецидива в дополнение к хирургическому вмешательству включают адъювантную химиотерапию, лучевую терапию и прогестиновые аналоги ГнРГ [2-4, 8-11]. В нашем случае рецидива был холост, 24 года, было несколько узелков, самый большой из которых составлял 12 см, и после подробного инструктажа мы рекомендовали хирургическое вмешательство и адъювантную терапию.
Пациенты должны проходить базовую оценку и регулярное наблюдение каждые 6 месяцев в течение первых 5 лет, а затем ежегодное наблюдение в течение следующих 5 лет [8].Последующие визиты должны включать в себя сбор анамнеза, общее и тазовое обследование, а также визуализационные исследования ежегодно, включая рентгенографию грудной клетки, УЗИ органов малого таза, МРТ и / или ПЭТ-КТ для выявления рецидивов.
Заключение
STUMP — редкая гетерогенная опухоль. Все пациенты были прооперированы с доброкачественным предоперационным гинекологическим диагнозом, и окончательный диагноз был поставлен гистопатологически. Нелегко предугадать биологический образец поведения и прогноз ПНЯ. Гистопатологически он классифицируется как промежуточная форма, поэтому однозначно назвать его доброкачественным или злокачественным невозможно.У нас мало литературной информации по STUMP. Окончательный гистопатологический диагноз обычно ставится в соответствии с критериями Стэнфордского университета. Перед операцией ультразвуковое различение лейомиомы или лейомиосаркомы однозначно невозможно. Хотя количество наших случаев ограничено, единичность, надежность, гиперэхогенность, гетерогенность и особенности акустического затенения и границ могут помочь нам в предоперационной сонографической диагностике. STUMP клинически доброкачественный, но через много лет после операции можно увидеть рецидивы / метастазы, и таких пациентов следует наблюдать в течение длительного времени.
Гладкомышечные опухоли матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы
Int J Clin Exp Pathol. 2014; 7 (11): 8136–8142.
Опубликовано в Интернете 15 октября 2014 г.
Андреа Далл’Аста
1 Департамент хирургических наук Пармского университета, Италия
Сальваторе Гиццо
2 Департамент здоровья женщин и детей Университета Падуи , Падуя, Италия
Андреа Мусаро
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Марко Новента
2 Кафедра здоровья женщин и детей Университета Падуи, Падуя, Италия
Констанца Мильявакка
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Джулио Соцци
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Кафедра Микела Моника
7 Хирургических наук — Пармский университет, Парма, ИталияДаниэле Маутоне
1 Кафедра хирургических наук ces-University of Parma, Парма, Италия
Роберто Берретта
1 Кафедра хирургических наук Пармского университета, Италия
1 Кафедра хирургических наук Пармского университета, Парма, Италия
2 Кафедра здоровья женщин и детей Падуанского университета, Падуя, Италия
3 Кафедра акушерства и гинекологии, Веронский университет, Верона, Италия
Адрес для корреспонденции: Dr.Сальваторе Гиццо, Dipartimento della Salute della Donna e del Bambino, U.O.C. di Clinica Ginecologica e Ostetrica, Via Giustiniani 3, Padova 35128, Италия. Тел .: +39 333 5727248; +39049 8213400; Факс: +39049 8211785; E-mail: ti.orebil@avodap_aigolocenigПоступила в редакцию 9 сентября 2014 г .; Принято 31 октября 2014 г.
Эта статья цитируется в других статьях в PMC.Abstract
Термин гладкая мышца матки с неопределенным злокачественным потенциалом (STUMP) означает группу гладкомышечных опухолей матки (SMT), которые нельзя однозначно диагностировать как доброкачественные или злокачественные.Диагностика, хирургическое лечение и последующее наблюдение этого новообразования остаются спорными, особенно у женщин в пременопаузе с желанием фертильности, из-за неагрессивного поведения и большей выживаемости по сравнению с лейомиосаркомами. Однако рецидивы оцениваются от 8,7% до 11% и могут включать отсроченные рецидивы. Мы сообщили о пяти случаях опухолей матки, леченных хирургической процедурой, с диагнозом STUMP при окончательной патологии. Четырем пациентам была выполнена полная абдоминальная гистерэктомия с сальпингоофорэктомией или без нее.Одной пациентке после постановки диагноза STUMP было выполнено удаление массы матки с последующей тотальной абдоминальной гистерэктомией плюс двусторонняя сальпингоофорэктомия. На сегодняшний день все пациенты в нашем исследовании не имели рецидивов (период наблюдения составил от 6 до 81 месяца). Основываясь на нашем опыте и учитывая отсутствие консенсуса в отношении злокачественного потенциала, диагностических критериев, золотого стандарта лечения и последующего наблюдения, мы считаем, что в случае STUMP необходимо тщательное междисциплинарное лечение.Мы предлагаем, чтобы гинеколог, специализированный патолог (с высоким уровнем экспертизы в гинекологической патологии) и онколог работали как одна команда в консультировании и лечении этого новообразования от обнаружения до завершения наблюдения. Кроме того, мы рекомендуем иммуногистохимию для исследования сверхэкспрессии p16 и p53, чтобы определить группу пациентов с повышенным риском рецидива, которым могут быть полезны более агрессивные хирургические онкологические стратегии.
Ключевые слова: Неопределенный злокачественный потенциал, новообразование гладких мышц матки, хирургическое лечение, последующее наблюдение, операция по сохранению фертильности
Введение
Гладкомышечные опухоли матки (SMT) исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основе цитологическая атипия, скорость митоза и наличие или отсутствие некроза опухолевых клеток [1].Стэнфордские критерии гистологического диагноза злокачественной SMT (лейомиосаркомы), описанные Bell et al. включают, по крайней мере, два из следующих критериев: диффузная атипия от умеренной до тяжелой, количество митозов не менее 10 митотических фигур (MF) / 10 полей высокой мощности (HPF) и некроз опухолевых клеток [2].
Клеточность, которая является субъективным диагнозом, границы опухоли и их отношения с окружающим миометрием представляют собой дополнительные, но менее взвешенные морфологические критерии в диагнозе «гладкая мышца матки с неопределенным злокачественным потенциалом» (STUMP) [2].
Термин пень впервые был использован в литературе Кемпсоном в 1973 году [3], и текущая классификация Всемирной организации здравоохранения указывает, что СМТ матки, не диагностированная однозначно как доброкачественная или злокачественная, должна определяться как пень [4].
Отсутствие единых диагностических критериев и диагностическая неопределенность STUMP на протяжении многих лет приводили к гипердиагностике этой неоплазии [5]. На самом деле, как сообщает Ip et al., Диагноз STUMP уместен, когда опухоль демонстрирует любую необычную комбинацию трех вышеупомянутых признаков, но не удовлетворяет Стэнфордским критериям лейомиосаркомы [6].
В литературе мы находим множество терминов, определяющих опухоли гладкомышечных клеток матки. Диагностические термины, полученные из Стэнфордского исследования Белла и др., Включают следующие подтипы: «атипичная лейомиома с ограниченным опытом» (AL-LE), «атипичная лейомиома, низкий риск рецидива» (AL-LRR), «опухоль гладкой мускулатуры. низкий злокачественный потенциал »(SMT-LMP) и« митотически активная лейомиома, ограниченный опыт »(MAL-LE) [2]. Гистологический диагноз STUMP впоследствии развился в течение последних 38 лет [7], и в настоящее время основные диагностические признаки основаны на критериях, обозначенных Kempson et al., Которые идентифицировали 3 варианта опухолей гладкомышечных клеток: [3,8].
Наличие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, атипия от отсутствия до легкой степени. Bell et al. признали, что внешне доброкачественная SMT, содержащая только некроз опухолевых клеток, иногда может быть клинически злокачественной, и, таким образом, такие опухоли в настоящее время соответственно считаются STUMP [2,7]; Отсутствие коагуляционного некроза, митотическое число на 10 HPF больше 10, очаговая атипия от средней до тяжелой. В схеме Кемпсона это обозначается как STUMP, если митотическая активность выше 15; Отсутствие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, очаговая атипия от средней до тяжелой.Это называется AL-LRR в схеме Кемпсона (AL-LRR) [8].
Митотически активная лейомиома, которая определяется как опухоль с высоким митотическим индексом (> 5 и <19 митозов на поле высокого увеличения), теперь считается доброкачественным вариантом лейомиомы и отличается от STUMP из-за отсутствия рецидивов и метастазов вне таза [9].
Использование термина «атипичная лейомиома» не является общепринятым среди патологов, и естественная история таких опухолей остается спорной.В настоящее время «лейомиомы с причудливыми ядрами» (LBN), «причудливые лейомиомы» или «симпластические лейомиомы» признаны клинически доброкачественными опухолями [6].
Сообщаемая частота рецидивов STUMP колеблется от 8,7% до 11%, но в литературе имеются недостаточные данные. Вероятно, что SMT, определяемые как STUMP, могут быть вариантами лейомиомы с необычными патологическими особенностями. С другой стороны, некоторые опухоли, рассматриваемые как пень, на самом деле могут быть недостаточно диагностированными лейомиосаркомами. Фактически, различные свидетельства показали, что рецидивирующие пеньки могут представлять собой форму «пограничной» опухоли или лейомиосаркомы низкой степени злокачественности [5].
Важность правильного дифференциального диагноза между STUMP и лейомиосаркомой связана с часто агрессивным клиническим течением лейомиосаркомы высокой степени с ранним рецидивом и метастазами; В отличие от STUMPs показали более низкий рост опухоли, и возможное рецидивирование часто откладывается через несколько лет после первоначального события [1,2,5,10-12].
Ранее мы опубликовали серию случаев трех пациентов с диагнозом STUMP при окончательной патологии. Целью данной статьи является обновление нашего опыта в отношении клинического ведения, хирургического лечения и последующего наблюдения за этой редкой и малоизвестной неоплазией матки.Мы сообщаем о пяти новых случаях.
Представление клинических случаев
Мы зарегистрировали еще 5 пациентов с окончательным диагнозом STUMP, помимо тех, которые ранее были описаны Берреттой и др. [1], которые обратились в Клиническое отделение гинекологии и акушерства Департамента хирургических наук Пармского университета в г. период с 2007 по 2013 год. Все пациенты были должным образом проинформированы о процедуре и дали согласие на использование своих данных для этого исследования путем письменного согласия с уважением их конфиденциальности (Закон Италии 675/96).
Во всех случаях диагностика ПНТ была проведена патологоанатомом с большим опытом работы в гинекологической онкологии.
Первый случай произошел у 44-летней женщины (PARA 0) с хронической тазовой болью, гиперменореей и вторичной анемией из-за хронического аномального маточного кровотечения (AUB) в анамнезе. В мае 2007 г. перенесена лапаротомическая гистерэктомия с сохранением придатков. Макроскопическое обследование, проведенное опытным гинекологом-патологом, показало большую миому с максимальным диаметром 12 см, которая при окончательной патологии выявила наличие очаговой атипии от умеренной до тяжелой с ядерным полиморфизмом высокой степени и поэтому была классифицирована как STUMP (AL-LRR).Пациент прошел тщательное клинико-инструментальное наблюдение в соответствии с описанным в нашей предыдущей статье [1]. Адъювантная химиотерапия и / или лучевая терапия не проводились, и пациент оставался здоровым через 81 месяц.
Второй случай произошел у 51-летней пациентки (PARA 2), перенесшей в анамнезе два кесарева сечения. Предоперационная визуализация выявила 12-сантиметровую тазовую массу с подозрением на придаточное происхождение. Онкомаркеры сыворотки крови до операции были отрицательными. В августе 2007 г. больной выполнена лапаротомическая гистерэктомия и двусторонняя сальпингоофорэктомия.Заключительное гистологическое исследование показало ядерную атипию от умеренной до тяжелой и очаговые некротические области, совместимые с STUMP. Адъювантная терапия не проводилась, и у пациента не было рецидивов через 78 месяцев после первоначального диагноза.
Третий случай произошел у 49-летней пациентки (PARA 1) без соответствующей предыдущей истории болезни, поступившей в наше отделение по поводу хронической AUB, вторичной по отношению к миоме матки. В марте 2011 года перенесена лапаротомическая гистерэктомия с двусторонней сальпингоофорэктомией.STUMP был диагностирован на миоме размером 2,5 см, который выявил области очаговой атипии от умеренной до тяжелой без некроза и повышенного митотического индекса. Окончательный диагноз был совместим с AL-LRR. Никакой адъювантной терапии не проводилось, и после периода наблюдения в течение 33 месяцев пациент остается здоровым.
Четвертый случай произошел с пациентом 45 лет (PARA 0), который периодически выполнял трансвагинальное ультразвуковое исследование в связи с наличием большой бессимптомной миомы диаметром 14 см.После 24-месячного периода наблюдения, в мае 2012 года, пациент выбрал лапаротомную миомэктомию. Окончательный патологический отчет выявил очаговую атипию от умеренной до тяжелой без увеличения митотического индекса или коагуляционного некроза, что соответствует окончательному диагнозу AL-LRR. Послеоперационная стадия с помощью компьютерной томографии (КТ) не показала метастазов. Никакой адъювантной терапии не потребовалось, и после периода наблюдения в течение 19 месяцев у пациента в настоящее время нет болезни.
Последний случай представлен 48-летней пациенткой (PARA 2) без соответствующего медицинского или хирургического анамнеза, за исключением диагноза множественной миомы матки, осложненной хронической АМБ.В августе 2013 г. пациенту проведена лапароскопическая миомэктомия с последующим диагнозом ПТИ по окончательной патологии. Послеоперационная стадия, выполненная с помощью компьютерной томографии (КТ) всего тела, не выявила метастазов. Поэтому мы сделали выбор в пользу повторного хирургического вмешательства и в октябре 2013 года выполнили лапароскопическую вагинальную гистерэктомию и двустороннюю овариэктомию. Макроскопическое исследование показало наличие внутрисосудистых пальцевидных выступов с увеличенными интрамуральными и субсерозными кровеносными сосудами.Окончательный отчет о патологии выявил легкую атипию, отсутствие повышенного митотического индекса или коагуляционного некроза и паттерн, соответствующий эпителиоидному внутрисосудистому лейомиоматозу. Адъювантная терапия не проводилась. Первое контрольное обследование было выполнено через 3 месяца после гистерэктомии и не выявило рецидива. Наш опыт обобщен в.
Таблица 1
Клинические особенности пациентов, включенных в нашу серию случаев
| Месяц и год | Возраст | Гистология | Лечение | Адъювантная терапия | Последующее наблюдение до 28 февраля -го , 2014 | Рецидив | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ноябрь 2003 г. * | 44 | Центральный некроз, очаговая легкая дисплазия | Лапаротомная тотальная гистерэктомия | № | 123 месяца 2006 г., без болезней | № | * | 35 | Высокий митотический индекс, необычные ядра | Лапаротомная миомэктомия | Нет | 97 месяцев, без болезней | Нет |
| 1995 * | 47 | От умеренной до тяжелой степени | Лапаротомная тотальная гистерэктомия | Нет | клинически стабильная | Метастазы в легких 9 лет после гистерэктомии | |||||||
| май 2007 г. | 44 | Очаговая атипия средней и тяжелой степени | Лапаротомная тотальная гистерэктомия | № | 81 месяц, без заболевания | № | |||||||
| август 2007 г. 51 | Ядерная атипия от средней до тяжелой и очаговые некротические области | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 78 месяцев, без заболевания | № | ||||||||
| март 2011 г. | 49 | Очаговая от средней до -тяжелая атипия без некроза | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 35 месяцев, без заболевания | № | |||||||
| май 2012 г. | 45 | Очаговая атипия средней и тяжелой степени | Лапаротомия № | 22 месяца, без болезней | № | ||||||||
| август 2013 г. | 48 | STUMP | Лапароскопическая миомэктомия с последующей лапароскопической гистерэктомией с двусторонней аднексэктомией | № | 6 месяцев, без заболевания | № |
Обсуждение
группы STUMP как с гистологической, так и с клинической точки зрения.Из-за редкости этих опухолей существующая литература по этой теме остается скудной, и поэтому консенсус относительно диагноза, злокачественного потенциала, лечения выбора и последующего наблюдения еще не достигнут [1,2,9,10,13].
Клиническая картина пней напоминает лейомиомы матки. Типичные клинические признаки включают патологическое вагинальное кровотечение, симптомы анемии, быстрорастущую массу таза, симптомы давления и тазовую боль [6]. Факторы риска и биологические события, которые приводят к STUMP, остаются плохо изученными, и поэтому последующее клиническое поведение трудно предсказать [9].Средний возраст на момент обращения схож у пациентов с диагнозом лейомиосаркома, а также у пациентов с доброкачественными лейомиомами. Интересным наблюдением является то, что пациенты, пораженные STUMP, осложненным последующим рецидивом заболевания, были моложе, чем пациенты с последующим наблюдением без осложнений [6,7].
Обычно патологический анализ, выполняемый на образце матки в случае диагноза STUMP, не демонстрирует сопутствующей патологии, кроме наличия лейомиомы, как сообщили Ip et al.[5].
Клинически кажется обязательным классифицировать СМТ матки как опухоли с рецидивом и / или метастатическим потенциалом или без него (или редко) [6]. Тремя основными критериями оценки биологического потенциала опухолей матки являются цитологическая атипия, митотический индекс и коагуляционный некроз опухолевых клеток (CTCN). Среди них фактором, наиболее тесно связанным со злокачественным поведением, по-видимому, является CTCN, который характеризуется резким переходом между жизнеспособными клетками и некротическими областями.Прогностическое значение CTCN таково, что его следует дифференцировать от других типов безобидных морфологических изменений (а именно, гиалинизирующего некроза), некроза, связанного с поверхностным изъязвлением подслизистых лейомиом и кровоизлиянием в лейомиомы [2].
Стандартные протоколы ведения пациентов с подозрением на STUMP еще не утверждены. В случае диагноза STUMP в образцах миомэктомии, учитывая доказанную возможность рецидива, гистерэктомия представляет собой золотой стандарт для тех женщин, которые завершили деторождение.Сообщалось об успешных беременностях после операции по сохранению фертильности, однако этих пациенток следует надлежащим образом информировать о риске рецидива, и обязательна строгая программа последующего наблюдения с использованием клинических методов и методов визуализации [11]. Четыре из пяти случаев, о которых сообщалось в нашем исследовании, подверглись хирургическому лечению путем тотальной гистерэктомии в качестве первого доступа или в качестве полной хирургической стадии (второй осмотр). В двух случаях мы провели промывание брюшины, которое в обоих случаях было отрицательным.
Как сообщает Ip et al.Пни характеризуются возможностью повторного появления с задержкой. Однако у них самая высокая средняя выживаемость после рецидива, в отличие от агрессивной злокачественной неоплазии матки [6,14-17]. Рецидивирующие STUMP являются биологически низкосортными LMS; Однако, используя современные методы анализа, этот диагноз нельзя поставить до тех пор, пока не разовьется рецидив [7].
Похоже, что нет единого мнения относительно гистологических признаков, способных предсказать вероятность и клинических характеристик рецидива, таких как анатомическая локализация (таз, брюшная полость, печень, легкие, лимфатические узлы, плечевая кость, забрюшинное пространство и матка — если гистерэктомия была выполнена). ранее не выполнялись), сроках (от 15 месяцев до 9 лет) и гистологическом типе (STUMP или лейомиосаркома) [2,6,9,11,12,18].Более того, ни демографические характеристики (возраст, этническая принадлежность, употребление табака), ни обычные онкологические сывороточные маркеры (CA125 и He4) не позволяют прогнозировать рецидив заболевания [9,19,20].
ПНИ могут повторяться либо как ПНИ [21,22], либо как лейомиосаркомы [2,5,21]. В случае рецидива лечением выбора является хирургическое удаление с последующей адъювантной терапией, такой как облучение таза, химиотерапия (доксорубицин и цисплатин), медроксипрогестерон и аналог гонадотропин-рилизинг-гормона [2,5,21-24].В то время как эффективность адъювантной терапии общепризнана, клиническое течение без осложнений было отмечено даже в отсутствие такого лечения [7].
Дело, представленное Шапиро и др. [11] также подчеркивает неопределенный прогноз, который несет в себе диагноз STUMP, даже в случае гистологического отсутствия CTCN. Клиническое ведение и последующее наблюдение этого заболевания остаются предметом дискуссий [10].
Пациенты в нашем исследовании были европеоидной расы; возраст колебался от 44 до 51 года.Адъювантная терапия не проводилась ни у одного пациента из нашей серии случаев, и в течение периода наблюдения не наблюдалось рецидивов. В нашей ранее опубликованной серии случаев мы сообщили [1] 3 случая, из которых только в одном случае развился рецидив с признаками диффузных метастазов в легкие через 9 лет после первоначального диагноза: в настоящее время клинические особенности трех пациентов не изменились.
Ip et al. [5] сообщили о серии случаев из 16 пациентов с диагнозом STUMP. Адъювантная терапия не проводилась ни одному из пациентов исследуемой группы.Рецидив заболевания наблюдался только в 2 случаях, оба из которых имели иммуногистологический диагноз AL-LE и положительное окрашивание на p16 и p53. Авторы предполагают потенциальную роль иммуногистохимии p16 и p53 в идентификации более агрессивной формы STUMP. Аткинс и др. [10] сообщили о трех случаях (из 8 пациентов) метастатического заболевания после постановки диагноза STUMP: у первого пациента развились метастазы в брюшину и лимфатические узлы, и он был последовательно пролечен прогестероном после удаления опухоли и оставался здоровым в течение трех. годы; у других пациентов развились метастазы в печень, которые лечили хирургическим путем.Согласно Ip et al, иммуногистохимический анализ показал сильное положительное окрашивание на p16 с диффузным и фокальным распределением соответственно в 2 и 1 из наблюдаемых рецидивов.
В настоящее время прогестерон, аналог ГнРГ или химиотерапевтические агенты были предложены в качестве адъювантной терапии, но пока ни один из них не доказал свою эффективность в предотвращении рецидивов заболевания [5,6,9]. Если эффективность прогестерона подтверждена, внутриматочная спираль, высвобождающая прогестерон (LNS-IUS), может быть подходящим вариантом в случае операции по сохранению фертильности [25].Кроме того, отсутствует консенсус относительно внедрения протоколов последующего наблюдения [6,7]. Ip et al. Предлагают интенсивную программу последующего наблюдения с оценкой, проводимой каждые 6 месяцев в течение первых 5 лет, с последующим ежегодным наблюдением в течение следующих 5 лет [6,7]. В нашем Институте у пациентов, перенесших гистерэктомию, мы обычно проводим клиническую оценку каждые шесть месяцев с последующим ежегодным компьютерным томографическим сканированием (КТ) всего тела, тогда как у пациентов, которым была проведена операция по сохранению матки, мы проводим клиническую и сонографическую оценку каждый раз. 6 месяцев и ежегодная магнитно-резонансная томография (МРТ) малого таза в сочетании с рентгеном грудной клетки.
Выводы
Классификация новообразований гладкомышечных клеток матки с неизвестным злокачественным потенциалом остается спорной. Некоторые авторы предполагают, что, возможно, даже определенные типы «доброкачественных лейомиом» из-за агрессивного клинического поведения, которое их характеризует, должны быть включены в настоящую классификацию [26].
Пациентов с ПНТ необходимо проконсультировать относительно потенциального риска рецидива лейомиосаркомы. Многопрофильное лечение, осуществляемое командой, состоящей из гинеколога, профильного патолога (имеющего опыт работы в гинекологической патологии) и онколога, является обязательным для раннего выявления этого заболевания и определения лечения по выбору и программы последующего наблюдения.Несмотря на то, что STUMP демонстрируют низкую степень злокачественности, длительную выживаемость и отсрочку рецидива, пациенты с STUMP требуют более тщательного наблюдения, чем ежегодное обследование, из-за немалого риска метастазов даже через много лет после первоначального диагноза. Исходя из этого, мы считаем, что пациенты, пораженные STUMP, должны проходить долгосрочное наблюдение с использованием методов клинической оценки и визуализации [5].
Наконец, в соответствии с Atkins et al. и Ip et al., возможность тестирования с помощью иммуногистохимического анализа избыточной экспрессии p16 и p53 в гистологических образцах может быть полезной в будущем для выявления группы пациентов с повышенным риском рецидива, которым может быть полезно «индивидуализированное» хирургическое вмешательство. -онкологические стратегии.
Раскрытие информации о конфликте интересов
Нет.
Ссылки
1. Берретта Р., Ролла М., Меризио С., Джордано Дж., Нарделли, Великобритания. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: отчет о трех случаях. Int J Gynecol Cancer. 2008. 18: 1121–6. [PubMed] [Google Scholar] 2. Белл SW, Кемпсон RL, Хендриксон MR. Проблемные новообразования гладких мышц матки. Клинико-патологическое исследование 213 случаев. Am J Surg Pathol. 1994; 18: 535–58. [PubMed] [Google Scholar] 3. Кемпсон Р.Л.Саркомы и родственные новообразования. В: Норрис HJ, Hertig AT, Abell MR, редакторы. Матка. Балтимор: Уильямс и Уилкинс; 1973. [Google Scholar] 4. Тавассоли Ф.А., Девили П. Классификация опухолей Всемирной организации здравоохранения: опухоли груди и женских половых органов. Лион: Международное агентство исследований рака Press; 2003. С. 236–239. [Google Scholar] 5. ИП П.П., Чунг А.Н., Клемент ПБ. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев.Am J Surg Pathol. 2009; 33: 992–1005. [PubMed] [Google Scholar] 6. Ип П.П., Це К.Ю., Там К.Ф. Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Anat Pathol. 2010. 17: 91–112. [PubMed] [Google Scholar] 7. ИП ПП, Чунг АН. Патология лейомиосарком матки и опухолей гладких мышц с неопределенным злокачественным потенциалом. Лучшая практика Res Clin Obstet Gynaecol.2011; 25: 691–704. [PubMed] [Google Scholar] 8. Розай Дж. Розай и хирургическая патология Акермана. 2-й набор томов; 10-е издание: Глава 19. Elsevier; Дата выпуска 20 июня 2011 г. [Google Scholar] 9. Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Опухоль гладких мышц матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol. 2009. 113: 324–6. [PubMed] [Google Scholar] 10. Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 в улучшении гистологической классификации опухолей гладких мышц матки.Am J Surg Pathol. 2008. 32: 98–102. [PubMed] [Google Scholar] 11. Шапиро А., Ференци А., Тюркотт Р., Брухим I, Готлиб У. Гладкомышечная опухоль матки с неопределенным потенциальным злокачественным новообразованием, метастазирующая в плечевую кость как лейомиосаркома высокой степени. Gynecol Oncol. 2004; 94: 818–20. [PubMed] [Google Scholar] 12. Amant F, Moerman P, Vergote I. Отчет о необычном проблемном новообразовании гладких мышц матки, подчеркивающий прогностическую важность коагуляционного некроза опухолевых клеток. Int J Gynecol Cancer. 2005; 15: 1210–2.[PubMed] [Google Scholar] 13. D’Angelo E, Prat J. Саркомы матки: обзор. Gynecol Oncol. 2010; 116: 131–9. [PubMed] [Google Scholar] 14. Берретта Р., Патрелли Т.С., Файоли Р., Маутоне Д., Гиццо С., Меццоджорно А., Джордано Г., Модена А.Б. Дедифференцированный рак эндометрия: атипичный случай, диагностированный на основании метастазов в мозжечок и надпочечники: описание случая и обзор литературы. Int J Clin Exp Pathol. 2013; 6: 1652–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Gizzo S, Ancona E, Patrelli TS, Saccardi C, Anis O, Donato D, Nardelli GB.Сохранение фертильности у молодых женщин с раком шейки матки: онкологическая дилемма или новая концепция операции по сохранению фертильности? Рак Инвест. 2013; 31: 189. [PubMed] [Google Scholar] 16. Patrelli TS, Gizzo S, Di Gangi S, Guidi G, Rondinelli M, Nardelli GB. Мюллерова аденосаркома шейки матки с гетерологичным саркоматозным разрастанием: четвертый случай и обзор литературы. BMC Рак. 2011; 11: 236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Патрелли Т.С., Силини Е.М., Гиццо С., Берретта Р., Франки Л., Тай Э., Луканович А., Нарделли Г.Б., Модена А.Б.Экстрагенитальная мюллерова аденосаркома с мешочной локализацией Дугласа. BMC Рак. 2011; 11: 171. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ng JS, Han A, Chew SH, Low J. Клинико-патологическое исследование опухолей гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) Ann Acad Med Singapore. 2010; 39: 625–8. [PubMed] [Google Scholar] 19. Gizzo S, Ancona E, Saccardi C, D’Antona D, Nardelli GB, Plebani M. Может ли нарушение клубочковой фильтрации почек представлять собой «ахиллесовую пяту» маркера сыворотки HE4? Возможное дальнейшее следствие.Clin Chem Lab Med. 2014; 52: e45–6. [PubMed] [Google Scholar] 20. Патрелли Т.С., Берретта Р., Гиццо С., Пеццуто А., Франки Л., Луканович А., Нарделли Г.Б., Модена А.Б. Значения CA 125 в сыворотке у пациентов с хирургическим лечением эндометриоза и его взаимосвязь с анатомическими участками эндометриоза и частотой наступления беременности. Fertil Steril. 2011; 95: 393–6. [PubMed] [Google Scholar] 21. Климент ПБ. Патология опухолей гладких мышц матки и смешанных стромально-гладкомышечных опухолей эндометрия: выборочный обзор с акцентом на последние достижения.Int J Gynecol Pathol. 2000; 19: 39–55. [PubMed] [Google Scholar] 22. Гао Х.Г., ЛиВолси В.А., Чжан П.Дж. Использование красителей трихрома и ретикулина для характеристики некрозов при опухолях гладкой мускулатуры матки. Мод Pathol. 2007; 20: 198А. [Google Scholar] 23. Миттал К., Попиолек Д., Демопулос Р.И. Миксоидная лейомиосаркома матки внутри лейомиомы. Hum Pathol. 2000; 31: 398–400. [PubMed] [Google Scholar] 24. Клемент ПБ, Янг Р.Х. Атлас гинекологической хирургической патологии. 2-е издание. Филадельфия: У. Б. Сондерс; 2007. Мезенхимальные и смешанные эпителиально-мезенхимальные опухоли тела и шейки матки; стр.194–235. [Google Scholar] 25. Gizzo S, Di Gangi S, Bertocco A, Noventa M, Fagherazzi S, Ancona E, Saccardi C, Patrelli TS, D’Antona D, Nardelli GB. Внутриматочная система левоноргестрела в адъювантной терапии тамоксифеном: баланс риска для груди и пользы для эндометрия — систематический обзор литературы. Reprod Sci. 2014; 21: 423–31. [PubMed] [Google Scholar] 26. Канчиани Г. Н., Бурбос Н., Дункан Т. Дж., Лонсдейл Р., Ньето Дж. Дж. Позднее проявление метастатического новообразования гладких мышц матки с низким злокачественным потенциалом.J Gynecol Oncol. 2012; 23: 69–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]Гладкомышечные опухоли матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы
Int J Clin Exp Pathol. 2014; 7 (11): 8136–8142.
Опубликовано в Интернете 15 октября 2014 г.
Андреа Далл’Аста
1 Департамент хирургических наук Пармского университета, Италия
Сальваторе Гиццо
2 Департамент здоровья женщин и детей Университета Падуи , Падуя, Италия
Андреа Мусаро
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Марко Новента
2 Кафедра здоровья женщин и детей Университета Падуи, Падуя, Италия
Констанца Мильявакка
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Джулио Соцци
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Кафедра Микела Моника
7 Хирургических наук — Пармский университет, Парма, ИталияДаниэле Маутоне
1 Кафедра хирургических наук ces-University of Parma, Парма, Италия
Роберто Берретта
1 Кафедра хирургических наук Пармского университета, Италия
1 Кафедра хирургических наук Пармского университета, Парма, Италия
2 Кафедра здоровья женщин и детей Падуанского университета, Падуя, Италия
3 Кафедра акушерства и гинекологии, Веронский университет, Верона, Италия
Адрес для корреспонденции: Dr.Сальваторе Гиццо, Dipartimento della Salute della Donna e del Bambino, U.O.C. di Clinica Ginecologica e Ostetrica, Via Giustiniani 3, Padova 35128, Италия. Тел .: +39 333 5727248; +39049 8213400; Факс: +39049 8211785; E-mail: ti.orebil@avodap_aigolocenigПоступила в редакцию 9 сентября 2014 г .; Принято 31 октября 2014 г.
Эта статья цитируется в других статьях в PMC.Abstract
Термин гладкая мышца матки с неопределенным злокачественным потенциалом (STUMP) означает группу гладкомышечных опухолей матки (SMT), которые нельзя однозначно диагностировать как доброкачественные или злокачественные.Диагностика, хирургическое лечение и последующее наблюдение этого новообразования остаются спорными, особенно у женщин в пременопаузе с желанием фертильности, из-за неагрессивного поведения и большей выживаемости по сравнению с лейомиосаркомами. Однако рецидивы оцениваются от 8,7% до 11% и могут включать отсроченные рецидивы. Мы сообщили о пяти случаях опухолей матки, леченных хирургической процедурой, с диагнозом STUMP при окончательной патологии. Четырем пациентам была выполнена полная абдоминальная гистерэктомия с сальпингоофорэктомией или без нее.Одной пациентке после постановки диагноза STUMP было выполнено удаление массы матки с последующей тотальной абдоминальной гистерэктомией плюс двусторонняя сальпингоофорэктомия. На сегодняшний день все пациенты в нашем исследовании не имели рецидивов (период наблюдения составил от 6 до 81 месяца). Основываясь на нашем опыте и учитывая отсутствие консенсуса в отношении злокачественного потенциала, диагностических критериев, золотого стандарта лечения и последующего наблюдения, мы считаем, что в случае STUMP необходимо тщательное междисциплинарное лечение.Мы предлагаем, чтобы гинеколог, специализированный патолог (с высоким уровнем экспертизы в гинекологической патологии) и онколог работали как одна команда в консультировании и лечении этого новообразования от обнаружения до завершения наблюдения. Кроме того, мы рекомендуем иммуногистохимию для исследования сверхэкспрессии p16 и p53, чтобы определить группу пациентов с повышенным риском рецидива, которым могут быть полезны более агрессивные хирургические онкологические стратегии.
Ключевые слова: Неопределенный злокачественный потенциал, новообразование гладких мышц матки, хирургическое лечение, последующее наблюдение, операция по сохранению фертильности
Введение
Гладкомышечные опухоли матки (SMT) исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основе цитологическая атипия, скорость митоза и наличие или отсутствие некроза опухолевых клеток [1].Стэнфордские критерии гистологического диагноза злокачественной SMT (лейомиосаркомы), описанные Bell et al. включают, по крайней мере, два из следующих критериев: диффузная атипия от умеренной до тяжелой, количество митозов не менее 10 митотических фигур (MF) / 10 полей высокой мощности (HPF) и некроз опухолевых клеток [2].
Клеточность, которая является субъективным диагнозом, границы опухоли и их отношения с окружающим миометрием представляют собой дополнительные, но менее взвешенные морфологические критерии в диагнозе «гладкая мышца матки с неопределенным злокачественным потенциалом» (STUMP) [2].
Термин пень впервые был использован в литературе Кемпсоном в 1973 году [3], и текущая классификация Всемирной организации здравоохранения указывает, что СМТ матки, не диагностированная однозначно как доброкачественная или злокачественная, должна определяться как пень [4].
Отсутствие единых диагностических критериев и диагностическая неопределенность STUMP на протяжении многих лет приводили к гипердиагностике этой неоплазии [5]. На самом деле, как сообщает Ip et al., Диагноз STUMP уместен, когда опухоль демонстрирует любую необычную комбинацию трех вышеупомянутых признаков, но не удовлетворяет Стэнфордским критериям лейомиосаркомы [6].
В литературе мы находим множество терминов, определяющих опухоли гладкомышечных клеток матки. Диагностические термины, полученные из Стэнфордского исследования Белла и др., Включают следующие подтипы: «атипичная лейомиома с ограниченным опытом» (AL-LE), «атипичная лейомиома, низкий риск рецидива» (AL-LRR), «опухоль гладкой мускулатуры. низкий злокачественный потенциал »(SMT-LMP) и« митотически активная лейомиома, ограниченный опыт »(MAL-LE) [2]. Гистологический диагноз STUMP впоследствии развился в течение последних 38 лет [7], и в настоящее время основные диагностические признаки основаны на критериях, обозначенных Kempson et al., Которые идентифицировали 3 варианта опухолей гладкомышечных клеток: [3,8].
Наличие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, атипия от отсутствия до легкой степени. Bell et al. признали, что внешне доброкачественная SMT, содержащая только некроз опухолевых клеток, иногда может быть клинически злокачественной, и, таким образом, такие опухоли в настоящее время соответственно считаются STUMP [2,7]; Отсутствие коагуляционного некроза, митотическое число на 10 HPF больше 10, очаговая атипия от средней до тяжелой. В схеме Кемпсона это обозначается как STUMP, если митотическая активность выше 15; Отсутствие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, очаговая атипия от средней до тяжелой.Это называется AL-LRR в схеме Кемпсона (AL-LRR) [8].
Митотически активная лейомиома, которая определяется как опухоль с высоким митотическим индексом (> 5 и <19 митозов на поле высокого увеличения), теперь считается доброкачественным вариантом лейомиомы и отличается от STUMP из-за отсутствия рецидивов и метастазов вне таза [9].
Использование термина «атипичная лейомиома» не является общепринятым среди патологов, и естественная история таких опухолей остается спорной.В настоящее время «лейомиомы с причудливыми ядрами» (LBN), «причудливые лейомиомы» или «симпластические лейомиомы» признаны клинически доброкачественными опухолями [6].
Сообщаемая частота рецидивов STUMP колеблется от 8,7% до 11%, но в литературе имеются недостаточные данные. Вероятно, что SMT, определяемые как STUMP, могут быть вариантами лейомиомы с необычными патологическими особенностями. С другой стороны, некоторые опухоли, рассматриваемые как пень, на самом деле могут быть недостаточно диагностированными лейомиосаркомами. Фактически, различные свидетельства показали, что рецидивирующие пеньки могут представлять собой форму «пограничной» опухоли или лейомиосаркомы низкой степени злокачественности [5].
Важность правильного дифференциального диагноза между STUMP и лейомиосаркомой связана с часто агрессивным клиническим течением лейомиосаркомы высокой степени с ранним рецидивом и метастазами; В отличие от STUMPs показали более низкий рост опухоли, и возможное рецидивирование часто откладывается через несколько лет после первоначального события [1,2,5,10-12].
Ранее мы опубликовали серию случаев трех пациентов с диагнозом STUMP при окончательной патологии. Целью данной статьи является обновление нашего опыта в отношении клинического ведения, хирургического лечения и последующего наблюдения за этой редкой и малоизвестной неоплазией матки.Мы сообщаем о пяти новых случаях.
Представление клинических случаев
Мы зарегистрировали еще 5 пациентов с окончательным диагнозом STUMP, помимо тех, которые ранее были описаны Берреттой и др. [1], которые обратились в Клиническое отделение гинекологии и акушерства Департамента хирургических наук Пармского университета в г. период с 2007 по 2013 год. Все пациенты были должным образом проинформированы о процедуре и дали согласие на использование своих данных для этого исследования путем письменного согласия с уважением их конфиденциальности (Закон Италии 675/96).
Во всех случаях диагностика ПНТ была проведена патологоанатомом с большим опытом работы в гинекологической онкологии.
Первый случай произошел у 44-летней женщины (PARA 0) с хронической тазовой болью, гиперменореей и вторичной анемией из-за хронического аномального маточного кровотечения (AUB) в анамнезе. В мае 2007 г. перенесена лапаротомическая гистерэктомия с сохранением придатков. Макроскопическое обследование, проведенное опытным гинекологом-патологом, показало большую миому с максимальным диаметром 12 см, которая при окончательной патологии выявила наличие очаговой атипии от умеренной до тяжелой с ядерным полиморфизмом высокой степени и поэтому была классифицирована как STUMP (AL-LRR).Пациент прошел тщательное клинико-инструментальное наблюдение в соответствии с описанным в нашей предыдущей статье [1]. Адъювантная химиотерапия и / или лучевая терапия не проводились, и пациент оставался здоровым через 81 месяц.
Второй случай произошел у 51-летней пациентки (PARA 2), перенесшей в анамнезе два кесарева сечения. Предоперационная визуализация выявила 12-сантиметровую тазовую массу с подозрением на придаточное происхождение. Онкомаркеры сыворотки крови до операции были отрицательными. В августе 2007 г. больной выполнена лапаротомическая гистерэктомия и двусторонняя сальпингоофорэктомия.Заключительное гистологическое исследование показало ядерную атипию от умеренной до тяжелой и очаговые некротические области, совместимые с STUMP. Адъювантная терапия не проводилась, и у пациента не было рецидивов через 78 месяцев после первоначального диагноза.
Третий случай произошел у 49-летней пациентки (PARA 1) без соответствующей предыдущей истории болезни, поступившей в наше отделение по поводу хронической AUB, вторичной по отношению к миоме матки. В марте 2011 года перенесена лапаротомическая гистерэктомия с двусторонней сальпингоофорэктомией.STUMP был диагностирован на миоме размером 2,5 см, который выявил области очаговой атипии от умеренной до тяжелой без некроза и повышенного митотического индекса. Окончательный диагноз был совместим с AL-LRR. Никакой адъювантной терапии не проводилось, и после периода наблюдения в течение 33 месяцев пациент остается здоровым.
Четвертый случай произошел с пациентом 45 лет (PARA 0), который периодически выполнял трансвагинальное ультразвуковое исследование в связи с наличием большой бессимптомной миомы диаметром 14 см.После 24-месячного периода наблюдения, в мае 2012 года, пациент выбрал лапаротомную миомэктомию. Окончательный патологический отчет выявил очаговую атипию от умеренной до тяжелой без увеличения митотического индекса или коагуляционного некроза, что соответствует окончательному диагнозу AL-LRR. Послеоперационная стадия с помощью компьютерной томографии (КТ) не показала метастазов. Никакой адъювантной терапии не потребовалось, и после периода наблюдения в течение 19 месяцев у пациента в настоящее время нет болезни.
Последний случай представлен 48-летней пациенткой (PARA 2) без соответствующего медицинского или хирургического анамнеза, за исключением диагноза множественной миомы матки, осложненной хронической АМБ.В августе 2013 г. пациенту проведена лапароскопическая миомэктомия с последующим диагнозом ПТИ по окончательной патологии. Послеоперационная стадия, выполненная с помощью компьютерной томографии (КТ) всего тела, не выявила метастазов. Поэтому мы сделали выбор в пользу повторного хирургического вмешательства и в октябре 2013 года выполнили лапароскопическую вагинальную гистерэктомию и двустороннюю овариэктомию. Макроскопическое исследование показало наличие внутрисосудистых пальцевидных выступов с увеличенными интрамуральными и субсерозными кровеносными сосудами.Окончательный отчет о патологии выявил легкую атипию, отсутствие повышенного митотического индекса или коагуляционного некроза и паттерн, соответствующий эпителиоидному внутрисосудистому лейомиоматозу. Адъювантная терапия не проводилась. Первое контрольное обследование было выполнено через 3 месяца после гистерэктомии и не выявило рецидива. Наш опыт обобщен в.
Таблица 1
Клинические особенности пациентов, включенных в нашу серию случаев
| Месяц и год | Возраст | Гистология | Лечение | Адъювантная терапия | Последующее наблюдение до 28 февраля -го , 2014 | Рецидив | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ноябрь 2003 г. * | 44 | Центральный некроз, очаговая легкая дисплазия | Лапаротомная тотальная гистерэктомия | № | 123 месяца 2006 г., без болезней | № | * | 35 | Высокий митотический индекс, необычные ядра | Лапаротомная миомэктомия | Нет | 97 месяцев, без болезней | Нет |
| 1995 * | 47 | От умеренной до тяжелой степени | Лапаротомная тотальная гистерэктомия | Нет | клинически стабильная | Метастазы в легких 9 лет после гистерэктомии | |||||||
| май 2007 г. | 44 | Очаговая атипия средней и тяжелой степени | Лапаротомная тотальная гистерэктомия | № | 81 месяц, без заболевания | № | |||||||
| август 2007 г. 51 | Ядерная атипия от средней до тяжелой и очаговые некротические области | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 78 месяцев, без заболевания | № | ||||||||
| март 2011 г. | 49 | Очаговая от средней до -тяжелая атипия без некроза | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 35 месяцев, без заболевания | № | |||||||
| май 2012 г. | 45 | Очаговая атипия средней и тяжелой степени | Лапаротомия № | 22 месяца, без болезней | № | ||||||||
| август 2013 г. | 48 | STUMP | Лапароскопическая миомэктомия с последующей лапароскопической гистерэктомией с двусторонней аднексэктомией | № | 6 месяцев, без заболевания | № |
Обсуждение
группы STUMP как с гистологической, так и с клинической точки зрения.Из-за редкости этих опухолей существующая литература по этой теме остается скудной, и поэтому консенсус относительно диагноза, злокачественного потенциала, лечения выбора и последующего наблюдения еще не достигнут [1,2,9,10,13].
Клиническая картина пней напоминает лейомиомы матки. Типичные клинические признаки включают патологическое вагинальное кровотечение, симптомы анемии, быстрорастущую массу таза, симптомы давления и тазовую боль [6]. Факторы риска и биологические события, которые приводят к STUMP, остаются плохо изученными, и поэтому последующее клиническое поведение трудно предсказать [9].Средний возраст на момент обращения схож у пациентов с диагнозом лейомиосаркома, а также у пациентов с доброкачественными лейомиомами. Интересным наблюдением является то, что пациенты, пораженные STUMP, осложненным последующим рецидивом заболевания, были моложе, чем пациенты с последующим наблюдением без осложнений [6,7].
Обычно патологический анализ, выполняемый на образце матки в случае диагноза STUMP, не демонстрирует сопутствующей патологии, кроме наличия лейомиомы, как сообщили Ip et al.[5].
Клинически кажется обязательным классифицировать СМТ матки как опухоли с рецидивом и / или метастатическим потенциалом или без него (или редко) [6]. Тремя основными критериями оценки биологического потенциала опухолей матки являются цитологическая атипия, митотический индекс и коагуляционный некроз опухолевых клеток (CTCN). Среди них фактором, наиболее тесно связанным со злокачественным поведением, по-видимому, является CTCN, который характеризуется резким переходом между жизнеспособными клетками и некротическими областями.Прогностическое значение CTCN таково, что его следует дифференцировать от других типов безобидных морфологических изменений (а именно, гиалинизирующего некроза), некроза, связанного с поверхностным изъязвлением подслизистых лейомиом и кровоизлиянием в лейомиомы [2].
Стандартные протоколы ведения пациентов с подозрением на STUMP еще не утверждены. В случае диагноза STUMP в образцах миомэктомии, учитывая доказанную возможность рецидива, гистерэктомия представляет собой золотой стандарт для тех женщин, которые завершили деторождение.Сообщалось об успешных беременностях после операции по сохранению фертильности, однако этих пациенток следует надлежащим образом информировать о риске рецидива, и обязательна строгая программа последующего наблюдения с использованием клинических методов и методов визуализации [11]. Четыре из пяти случаев, о которых сообщалось в нашем исследовании, подверглись хирургическому лечению путем тотальной гистерэктомии в качестве первого доступа или в качестве полной хирургической стадии (второй осмотр). В двух случаях мы провели промывание брюшины, которое в обоих случаях было отрицательным.
Как сообщает Ip et al.Пни характеризуются возможностью повторного появления с задержкой. Однако у них самая высокая средняя выживаемость после рецидива, в отличие от агрессивной злокачественной неоплазии матки [6,14-17]. Рецидивирующие STUMP являются биологически низкосортными LMS; Однако, используя современные методы анализа, этот диагноз нельзя поставить до тех пор, пока не разовьется рецидив [7].
Похоже, что нет единого мнения относительно гистологических признаков, способных предсказать вероятность и клинических характеристик рецидива, таких как анатомическая локализация (таз, брюшная полость, печень, легкие, лимфатические узлы, плечевая кость, забрюшинное пространство и матка — если гистерэктомия была выполнена). ранее не выполнялись), сроках (от 15 месяцев до 9 лет) и гистологическом типе (STUMP или лейомиосаркома) [2,6,9,11,12,18].Более того, ни демографические характеристики (возраст, этническая принадлежность, употребление табака), ни обычные онкологические сывороточные маркеры (CA125 и He4) не позволяют прогнозировать рецидив заболевания [9,19,20].
ПНИ могут повторяться либо как ПНИ [21,22], либо как лейомиосаркомы [2,5,21]. В случае рецидива лечением выбора является хирургическое удаление с последующей адъювантной терапией, такой как облучение таза, химиотерапия (доксорубицин и цисплатин), медроксипрогестерон и аналог гонадотропин-рилизинг-гормона [2,5,21-24].В то время как эффективность адъювантной терапии общепризнана, клиническое течение без осложнений было отмечено даже в отсутствие такого лечения [7].
Дело, представленное Шапиро и др. [11] также подчеркивает неопределенный прогноз, который несет в себе диагноз STUMP, даже в случае гистологического отсутствия CTCN. Клиническое ведение и последующее наблюдение этого заболевания остаются предметом дискуссий [10].
Пациенты в нашем исследовании были европеоидной расы; возраст колебался от 44 до 51 года.Адъювантная терапия не проводилась ни у одного пациента из нашей серии случаев, и в течение периода наблюдения не наблюдалось рецидивов. В нашей ранее опубликованной серии случаев мы сообщили [1] 3 случая, из которых только в одном случае развился рецидив с признаками диффузных метастазов в легкие через 9 лет после первоначального диагноза: в настоящее время клинические особенности трех пациентов не изменились.
Ip et al. [5] сообщили о серии случаев из 16 пациентов с диагнозом STUMP. Адъювантная терапия не проводилась ни одному из пациентов исследуемой группы.Рецидив заболевания наблюдался только в 2 случаях, оба из которых имели иммуногистологический диагноз AL-LE и положительное окрашивание на p16 и p53. Авторы предполагают потенциальную роль иммуногистохимии p16 и p53 в идентификации более агрессивной формы STUMP. Аткинс и др. [10] сообщили о трех случаях (из 8 пациентов) метастатического заболевания после постановки диагноза STUMP: у первого пациента развились метастазы в брюшину и лимфатические узлы, и он был последовательно пролечен прогестероном после удаления опухоли и оставался здоровым в течение трех. годы; у других пациентов развились метастазы в печень, которые лечили хирургическим путем.Согласно Ip et al, иммуногистохимический анализ показал сильное положительное окрашивание на p16 с диффузным и фокальным распределением соответственно в 2 и 1 из наблюдаемых рецидивов.
В настоящее время прогестерон, аналог ГнРГ или химиотерапевтические агенты были предложены в качестве адъювантной терапии, но пока ни один из них не доказал свою эффективность в предотвращении рецидивов заболевания [5,6,9]. Если эффективность прогестерона подтверждена, внутриматочная спираль, высвобождающая прогестерон (LNS-IUS), может быть подходящим вариантом в случае операции по сохранению фертильности [25].Кроме того, отсутствует консенсус относительно внедрения протоколов последующего наблюдения [6,7]. Ip et al. Предлагают интенсивную программу последующего наблюдения с оценкой, проводимой каждые 6 месяцев в течение первых 5 лет, с последующим ежегодным наблюдением в течение следующих 5 лет [6,7]. В нашем Институте у пациентов, перенесших гистерэктомию, мы обычно проводим клиническую оценку каждые шесть месяцев с последующим ежегодным компьютерным томографическим сканированием (КТ) всего тела, тогда как у пациентов, которым была проведена операция по сохранению матки, мы проводим клиническую и сонографическую оценку каждый раз. 6 месяцев и ежегодная магнитно-резонансная томография (МРТ) малого таза в сочетании с рентгеном грудной клетки.
Выводы
Классификация новообразований гладкомышечных клеток матки с неизвестным злокачественным потенциалом остается спорной. Некоторые авторы предполагают, что, возможно, даже определенные типы «доброкачественных лейомиом» из-за агрессивного клинического поведения, которое их характеризует, должны быть включены в настоящую классификацию [26].
Пациентов с ПНТ необходимо проконсультировать относительно потенциального риска рецидива лейомиосаркомы. Многопрофильное лечение, осуществляемое командой, состоящей из гинеколога, профильного патолога (имеющего опыт работы в гинекологической патологии) и онколога, является обязательным для раннего выявления этого заболевания и определения лечения по выбору и программы последующего наблюдения.Несмотря на то, что STUMP демонстрируют низкую степень злокачественности, длительную выживаемость и отсрочку рецидива, пациенты с STUMP требуют более тщательного наблюдения, чем ежегодное обследование, из-за немалого риска метастазов даже через много лет после первоначального диагноза. Исходя из этого, мы считаем, что пациенты, пораженные STUMP, должны проходить долгосрочное наблюдение с использованием методов клинической оценки и визуализации [5].
Наконец, в соответствии с Atkins et al. и Ip et al., возможность тестирования с помощью иммуногистохимического анализа избыточной экспрессии p16 и p53 в гистологических образцах может быть полезной в будущем для выявления группы пациентов с повышенным риском рецидива, которым может быть полезно «индивидуализированное» хирургическое вмешательство. -онкологические стратегии.
Раскрытие информации о конфликте интересов
Нет.
Ссылки
1. Берретта Р., Ролла М., Меризио С., Джордано Дж., Нарделли, Великобритания. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: отчет о трех случаях. Int J Gynecol Cancer. 2008. 18: 1121–6. [PubMed] [Google Scholar] 2. Белл SW, Кемпсон RL, Хендриксон MR. Проблемные новообразования гладких мышц матки. Клинико-патологическое исследование 213 случаев. Am J Surg Pathol. 1994; 18: 535–58. [PubMed] [Google Scholar] 3. Кемпсон Р.Л.Саркомы и родственные новообразования. В: Норрис HJ, Hertig AT, Abell MR, редакторы. Матка. Балтимор: Уильямс и Уилкинс; 1973. [Google Scholar] 4. Тавассоли Ф.А., Девили П. Классификация опухолей Всемирной организации здравоохранения: опухоли груди и женских половых органов. Лион: Международное агентство исследований рака Press; 2003. С. 236–239. [Google Scholar] 5. ИП П.П., Чунг А.Н., Клемент ПБ. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев.Am J Surg Pathol. 2009; 33: 992–1005. [PubMed] [Google Scholar] 6. Ип П.П., Це К.Ю., Там К.Ф. Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Anat Pathol. 2010. 17: 91–112. [PubMed] [Google Scholar] 7. ИП ПП, Чунг АН. Патология лейомиосарком матки и опухолей гладких мышц с неопределенным злокачественным потенциалом. Лучшая практика Res Clin Obstet Gynaecol.2011; 25: 691–704. [PubMed] [Google Scholar] 8. Розай Дж. Розай и хирургическая патология Акермана. 2-й набор томов; 10-е издание: Глава 19. Elsevier; Дата выпуска 20 июня 2011 г. [Google Scholar] 9. Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Опухоль гладких мышц матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol. 2009. 113: 324–6. [PubMed] [Google Scholar] 10. Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 в улучшении гистологической классификации опухолей гладких мышц матки.Am J Surg Pathol. 2008. 32: 98–102. [PubMed] [Google Scholar] 11. Шапиро А., Ференци А., Тюркотт Р., Брухим I, Готлиб У. Гладкомышечная опухоль матки с неопределенным потенциальным злокачественным новообразованием, метастазирующая в плечевую кость как лейомиосаркома высокой степени. Gynecol Oncol. 2004; 94: 818–20. [PubMed] [Google Scholar] 12. Amant F, Moerman P, Vergote I. Отчет о необычном проблемном новообразовании гладких мышц матки, подчеркивающий прогностическую важность коагуляционного некроза опухолевых клеток. Int J Gynecol Cancer. 2005; 15: 1210–2.[PubMed] [Google Scholar] 13. D’Angelo E, Prat J. Саркомы матки: обзор. Gynecol Oncol. 2010; 116: 131–9. [PubMed] [Google Scholar] 14. Берретта Р., Патрелли Т.С., Файоли Р., Маутоне Д., Гиццо С., Меццоджорно А., Джордано Г., Модена А.Б. Дедифференцированный рак эндометрия: атипичный случай, диагностированный на основании метастазов в мозжечок и надпочечники: описание случая и обзор литературы. Int J Clin Exp Pathol. 2013; 6: 1652–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Gizzo S, Ancona E, Patrelli TS, Saccardi C, Anis O, Donato D, Nardelli GB.Сохранение фертильности у молодых женщин с раком шейки матки: онкологическая дилемма или новая концепция операции по сохранению фертильности? Рак Инвест. 2013; 31: 189. [PubMed] [Google Scholar] 16. Patrelli TS, Gizzo S, Di Gangi S, Guidi G, Rondinelli M, Nardelli GB. Мюллерова аденосаркома шейки матки с гетерологичным саркоматозным разрастанием: четвертый случай и обзор литературы. BMC Рак. 2011; 11: 236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Патрелли Т.С., Силини Е.М., Гиццо С., Берретта Р., Франки Л., Тай Э., Луканович А., Нарделли Г.Б., Модена А.Б.Экстрагенитальная мюллерова аденосаркома с мешочной локализацией Дугласа. BMC Рак. 2011; 11: 171. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ng JS, Han A, Chew SH, Low J. Клинико-патологическое исследование опухолей гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) Ann Acad Med Singapore. 2010; 39: 625–8. [PubMed] [Google Scholar] 19. Gizzo S, Ancona E, Saccardi C, D’Antona D, Nardelli GB, Plebani M. Может ли нарушение клубочковой фильтрации почек представлять собой «ахиллесовую пяту» маркера сыворотки HE4? Возможное дальнейшее следствие.Clin Chem Lab Med. 2014; 52: e45–6. [PubMed] [Google Scholar] 20. Патрелли Т.С., Берретта Р., Гиццо С., Пеццуто А., Франки Л., Луканович А., Нарделли Г.Б., Модена А.Б. Значения CA 125 в сыворотке у пациентов с хирургическим лечением эндометриоза и его взаимосвязь с анатомическими участками эндометриоза и частотой наступления беременности. Fertil Steril. 2011; 95: 393–6. [PubMed] [Google Scholar] 21. Климент ПБ. Патология опухолей гладких мышц матки и смешанных стромально-гладкомышечных опухолей эндометрия: выборочный обзор с акцентом на последние достижения.Int J Gynecol Pathol. 2000; 19: 39–55. [PubMed] [Google Scholar] 22. Гао Х.Г., ЛиВолси В.А., Чжан П.Дж. Использование красителей трихрома и ретикулина для характеристики некрозов при опухолях гладкой мускулатуры матки. Мод Pathol. 2007; 20: 198А. [Google Scholar] 23. Миттал К., Попиолек Д., Демопулос Р.И. Миксоидная лейомиосаркома матки внутри лейомиомы. Hum Pathol. 2000; 31: 398–400. [PubMed] [Google Scholar] 24. Клемент ПБ, Янг Р.Х. Атлас гинекологической хирургической патологии. 2-е издание. Филадельфия: У. Б. Сондерс; 2007. Мезенхимальные и смешанные эпителиально-мезенхимальные опухоли тела и шейки матки; стр.194–235. [Google Scholar] 25. Gizzo S, Di Gangi S, Bertocco A, Noventa M, Fagherazzi S, Ancona E, Saccardi C, Patrelli TS, D’Antona D, Nardelli GB. Внутриматочная система левоноргестрела в адъювантной терапии тамоксифеном: баланс риска для груди и пользы для эндометрия — систематический обзор литературы. Reprod Sci. 2014; 21: 423–31. [PubMed] [Google Scholar] 26. Канчиани Г. Н., Бурбос Н., Дункан Т. Дж., Лонсдейл Р., Ньето Дж. Дж. Позднее проявление метастатического новообразования гладких мышц матки с низким злокачественным потенциалом.J Gynecol Oncol. 2012; 23: 69–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]Гладкомышечные опухоли матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы
Int J Clin Exp Pathol. 2014; 7 (11): 8136–8142.
Опубликовано в Интернете 15 октября 2014 г.
Андреа Далл’Аста
1 Департамент хирургических наук Пармского университета, Италия
Сальваторе Гиццо
2 Департамент здоровья женщин и детей Университета Падуи , Падуя, Италия
Андреа Мусаро
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Марко Новента
2 Кафедра здоровья женщин и детей Университета Падуи, Падуя, Италия
Констанца Мильявакка
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Джулио Соцци
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Кафедра Микела Моника
7 Хирургических наук — Пармский университет, Парма, ИталияДаниэле Маутоне
1 Кафедра хирургических наук ces-University of Parma, Парма, Италия
Роберто Берретта
1 Кафедра хирургических наук Пармского университета, Италия
1 Кафедра хирургических наук Пармского университета, Парма, Италия
2 Кафедра здоровья женщин и детей Падуанского университета, Падуя, Италия
3 Кафедра акушерства и гинекологии, Веронский университет, Верона, Италия
Адрес для корреспонденции: Dr.Сальваторе Гиццо, Dipartimento della Salute della Donna e del Bambino, U.O.C. di Clinica Ginecologica e Ostetrica, Via Giustiniani 3, Padova 35128, Италия. Тел .: +39 333 5727248; +39049 8213400; Факс: +39049 8211785; E-mail: ti.orebil@avodap_aigolocenigПоступила в редакцию 9 сентября 2014 г .; Принято 31 октября 2014 г.
Эта статья цитируется в других статьях в PMC.Abstract
Термин гладкая мышца матки с неопределенным злокачественным потенциалом (STUMP) означает группу гладкомышечных опухолей матки (SMT), которые нельзя однозначно диагностировать как доброкачественные или злокачественные.Диагностика, хирургическое лечение и последующее наблюдение этого новообразования остаются спорными, особенно у женщин в пременопаузе с желанием фертильности, из-за неагрессивного поведения и большей выживаемости по сравнению с лейомиосаркомами. Однако рецидивы оцениваются от 8,7% до 11% и могут включать отсроченные рецидивы. Мы сообщили о пяти случаях опухолей матки, леченных хирургической процедурой, с диагнозом STUMP при окончательной патологии. Четырем пациентам была выполнена полная абдоминальная гистерэктомия с сальпингоофорэктомией или без нее.Одной пациентке после постановки диагноза STUMP было выполнено удаление массы матки с последующей тотальной абдоминальной гистерэктомией плюс двусторонняя сальпингоофорэктомия. На сегодняшний день все пациенты в нашем исследовании не имели рецидивов (период наблюдения составил от 6 до 81 месяца). Основываясь на нашем опыте и учитывая отсутствие консенсуса в отношении злокачественного потенциала, диагностических критериев, золотого стандарта лечения и последующего наблюдения, мы считаем, что в случае STUMP необходимо тщательное междисциплинарное лечение.Мы предлагаем, чтобы гинеколог, специализированный патолог (с высоким уровнем экспертизы в гинекологической патологии) и онколог работали как одна команда в консультировании и лечении этого новообразования от обнаружения до завершения наблюдения. Кроме того, мы рекомендуем иммуногистохимию для исследования сверхэкспрессии p16 и p53, чтобы определить группу пациентов с повышенным риском рецидива, которым могут быть полезны более агрессивные хирургические онкологические стратегии.
Ключевые слова: Неопределенный злокачественный потенциал, новообразование гладких мышц матки, хирургическое лечение, последующее наблюдение, операция по сохранению фертильности
Введение
Гладкомышечные опухоли матки (SMT) исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основе цитологическая атипия, скорость митоза и наличие или отсутствие некроза опухолевых клеток [1].Стэнфордские критерии гистологического диагноза злокачественной SMT (лейомиосаркомы), описанные Bell et al. включают, по крайней мере, два из следующих критериев: диффузная атипия от умеренной до тяжелой, количество митозов не менее 10 митотических фигур (MF) / 10 полей высокой мощности (HPF) и некроз опухолевых клеток [2].
Клеточность, которая является субъективным диагнозом, границы опухоли и их отношения с окружающим миометрием представляют собой дополнительные, но менее взвешенные морфологические критерии в диагнозе «гладкая мышца матки с неопределенным злокачественным потенциалом» (STUMP) [2].
Термин пень впервые был использован в литературе Кемпсоном в 1973 году [3], и текущая классификация Всемирной организации здравоохранения указывает, что СМТ матки, не диагностированная однозначно как доброкачественная или злокачественная, должна определяться как пень [4].
Отсутствие единых диагностических критериев и диагностическая неопределенность STUMP на протяжении многих лет приводили к гипердиагностике этой неоплазии [5]. На самом деле, как сообщает Ip et al., Диагноз STUMP уместен, когда опухоль демонстрирует любую необычную комбинацию трех вышеупомянутых признаков, но не удовлетворяет Стэнфордским критериям лейомиосаркомы [6].
В литературе мы находим множество терминов, определяющих опухоли гладкомышечных клеток матки. Диагностические термины, полученные из Стэнфордского исследования Белла и др., Включают следующие подтипы: «атипичная лейомиома с ограниченным опытом» (AL-LE), «атипичная лейомиома, низкий риск рецидива» (AL-LRR), «опухоль гладкой мускулатуры. низкий злокачественный потенциал »(SMT-LMP) и« митотически активная лейомиома, ограниченный опыт »(MAL-LE) [2]. Гистологический диагноз STUMP впоследствии развился в течение последних 38 лет [7], и в настоящее время основные диагностические признаки основаны на критериях, обозначенных Kempson et al., Которые идентифицировали 3 варианта опухолей гладкомышечных клеток: [3,8].
Наличие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, атипия от отсутствия до легкой степени. Bell et al. признали, что внешне доброкачественная SMT, содержащая только некроз опухолевых клеток, иногда может быть клинически злокачественной, и, таким образом, такие опухоли в настоящее время соответственно считаются STUMP [2,7]; Отсутствие коагуляционного некроза, митотическое число на 10 HPF больше 10, очаговая атипия от средней до тяжелой. В схеме Кемпсона это обозначается как STUMP, если митотическая активность выше 15; Отсутствие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, очаговая атипия от средней до тяжелой.Это называется AL-LRR в схеме Кемпсона (AL-LRR) [8].
Митотически активная лейомиома, которая определяется как опухоль с высоким митотическим индексом (> 5 и <19 митозов на поле высокого увеличения), теперь считается доброкачественным вариантом лейомиомы и отличается от STUMP из-за отсутствия рецидивов и метастазов вне таза [9].
Использование термина «атипичная лейомиома» не является общепринятым среди патологов, и естественная история таких опухолей остается спорной.В настоящее время «лейомиомы с причудливыми ядрами» (LBN), «причудливые лейомиомы» или «симпластические лейомиомы» признаны клинически доброкачественными опухолями [6].
Сообщаемая частота рецидивов STUMP колеблется от 8,7% до 11%, но в литературе имеются недостаточные данные. Вероятно, что SMT, определяемые как STUMP, могут быть вариантами лейомиомы с необычными патологическими особенностями. С другой стороны, некоторые опухоли, рассматриваемые как пень, на самом деле могут быть недостаточно диагностированными лейомиосаркомами. Фактически, различные свидетельства показали, что рецидивирующие пеньки могут представлять собой форму «пограничной» опухоли или лейомиосаркомы низкой степени злокачественности [5].
Важность правильного дифференциального диагноза между STUMP и лейомиосаркомой связана с часто агрессивным клиническим течением лейомиосаркомы высокой степени с ранним рецидивом и метастазами; В отличие от STUMPs показали более низкий рост опухоли, и возможное рецидивирование часто откладывается через несколько лет после первоначального события [1,2,5,10-12].
Ранее мы опубликовали серию случаев трех пациентов с диагнозом STUMP при окончательной патологии. Целью данной статьи является обновление нашего опыта в отношении клинического ведения, хирургического лечения и последующего наблюдения за этой редкой и малоизвестной неоплазией матки.Мы сообщаем о пяти новых случаях.
Представление клинических случаев
Мы зарегистрировали еще 5 пациентов с окончательным диагнозом STUMP, помимо тех, которые ранее были описаны Берреттой и др. [1], которые обратились в Клиническое отделение гинекологии и акушерства Департамента хирургических наук Пармского университета в г. период с 2007 по 2013 год. Все пациенты были должным образом проинформированы о процедуре и дали согласие на использование своих данных для этого исследования путем письменного согласия с уважением их конфиденциальности (Закон Италии 675/96).
Во всех случаях диагностика ПНТ была проведена патологоанатомом с большим опытом работы в гинекологической онкологии.
Первый случай произошел у 44-летней женщины (PARA 0) с хронической тазовой болью, гиперменореей и вторичной анемией из-за хронического аномального маточного кровотечения (AUB) в анамнезе. В мае 2007 г. перенесена лапаротомическая гистерэктомия с сохранением придатков. Макроскопическое обследование, проведенное опытным гинекологом-патологом, показало большую миому с максимальным диаметром 12 см, которая при окончательной патологии выявила наличие очаговой атипии от умеренной до тяжелой с ядерным полиморфизмом высокой степени и поэтому была классифицирована как STUMP (AL-LRR).Пациент прошел тщательное клинико-инструментальное наблюдение в соответствии с описанным в нашей предыдущей статье [1]. Адъювантная химиотерапия и / или лучевая терапия не проводились, и пациент оставался здоровым через 81 месяц.
Второй случай произошел у 51-летней пациентки (PARA 2), перенесшей в анамнезе два кесарева сечения. Предоперационная визуализация выявила 12-сантиметровую тазовую массу с подозрением на придаточное происхождение. Онкомаркеры сыворотки крови до операции были отрицательными. В августе 2007 г. больной выполнена лапаротомическая гистерэктомия и двусторонняя сальпингоофорэктомия.Заключительное гистологическое исследование показало ядерную атипию от умеренной до тяжелой и очаговые некротические области, совместимые с STUMP. Адъювантная терапия не проводилась, и у пациента не было рецидивов через 78 месяцев после первоначального диагноза.
Третий случай произошел у 49-летней пациентки (PARA 1) без соответствующей предыдущей истории болезни, поступившей в наше отделение по поводу хронической AUB, вторичной по отношению к миоме матки. В марте 2011 года перенесена лапаротомическая гистерэктомия с двусторонней сальпингоофорэктомией.STUMP был диагностирован на миоме размером 2,5 см, который выявил области очаговой атипии от умеренной до тяжелой без некроза и повышенного митотического индекса. Окончательный диагноз был совместим с AL-LRR. Никакой адъювантной терапии не проводилось, и после периода наблюдения в течение 33 месяцев пациент остается здоровым.
Четвертый случай произошел с пациентом 45 лет (PARA 0), который периодически выполнял трансвагинальное ультразвуковое исследование в связи с наличием большой бессимптомной миомы диаметром 14 см.После 24-месячного периода наблюдения, в мае 2012 года, пациент выбрал лапаротомную миомэктомию. Окончательный патологический отчет выявил очаговую атипию от умеренной до тяжелой без увеличения митотического индекса или коагуляционного некроза, что соответствует окончательному диагнозу AL-LRR. Послеоперационная стадия с помощью компьютерной томографии (КТ) не показала метастазов. Никакой адъювантной терапии не потребовалось, и после периода наблюдения в течение 19 месяцев у пациента в настоящее время нет болезни.
Последний случай представлен 48-летней пациенткой (PARA 2) без соответствующего медицинского или хирургического анамнеза, за исключением диагноза множественной миомы матки, осложненной хронической АМБ.В августе 2013 г. пациенту проведена лапароскопическая миомэктомия с последующим диагнозом ПТИ по окончательной патологии. Послеоперационная стадия, выполненная с помощью компьютерной томографии (КТ) всего тела, не выявила метастазов. Поэтому мы сделали выбор в пользу повторного хирургического вмешательства и в октябре 2013 года выполнили лапароскопическую вагинальную гистерэктомию и двустороннюю овариэктомию. Макроскопическое исследование показало наличие внутрисосудистых пальцевидных выступов с увеличенными интрамуральными и субсерозными кровеносными сосудами.Окончательный отчет о патологии выявил легкую атипию, отсутствие повышенного митотического индекса или коагуляционного некроза и паттерн, соответствующий эпителиоидному внутрисосудистому лейомиоматозу. Адъювантная терапия не проводилась. Первое контрольное обследование было выполнено через 3 месяца после гистерэктомии и не выявило рецидива. Наш опыт обобщен в.
Таблица 1
Клинические особенности пациентов, включенных в нашу серию случаев
| Месяц и год | Возраст | Гистология | Лечение | Адъювантная терапия | Последующее наблюдение до 28 февраля -го , 2014 | Рецидив | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ноябрь 2003 г. * | 44 | Центральный некроз, очаговая легкая дисплазия | Лапаротомная тотальная гистерэктомия | № | 123 месяца 2006 г., без болезней | № | * | 35 | Высокий митотический индекс, необычные ядра | Лапаротомная миомэктомия | Нет | 97 месяцев, без болезней | Нет |
| 1995 * | 47 | От умеренной до тяжелой степени | Лапаротомная тотальная гистерэктомия | Нет | клинически стабильная | Метастазы в легких 9 лет после гистерэктомии | |||||||
| май 2007 г. | 44 | Очаговая атипия средней и тяжелой степени | Лапаротомная тотальная гистерэктомия | № | 81 месяц, без заболевания | № | |||||||
| август 2007 г. 51 | Ядерная атипия от средней до тяжелой и очаговые некротические области | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 78 месяцев, без заболевания | № | ||||||||
| март 2011 г. | 49 | Очаговая от средней до -тяжелая атипия без некроза | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 35 месяцев, без заболевания | № | |||||||
| май 2012 г. | 45 | Очаговая атипия средней и тяжелой степени | Лапаротомия № | 22 месяца, без болезней | № | ||||||||
| август 2013 г. | 48 | STUMP | Лапароскопическая миомэктомия с последующей лапароскопической гистерэктомией с двусторонней аднексэктомией | № | 6 месяцев, без заболевания | № |
Обсуждение
группы STUMP как с гистологической, так и с клинической точки зрения.Из-за редкости этих опухолей существующая литература по этой теме остается скудной, и поэтому консенсус относительно диагноза, злокачественного потенциала, лечения выбора и последующего наблюдения еще не достигнут [1,2,9,10,13].
Клиническая картина пней напоминает лейомиомы матки. Типичные клинические признаки включают патологическое вагинальное кровотечение, симптомы анемии, быстрорастущую массу таза, симптомы давления и тазовую боль [6]. Факторы риска и биологические события, которые приводят к STUMP, остаются плохо изученными, и поэтому последующее клиническое поведение трудно предсказать [9].Средний возраст на момент обращения схож у пациентов с диагнозом лейомиосаркома, а также у пациентов с доброкачественными лейомиомами. Интересным наблюдением является то, что пациенты, пораженные STUMP, осложненным последующим рецидивом заболевания, были моложе, чем пациенты с последующим наблюдением без осложнений [6,7].
Обычно патологический анализ, выполняемый на образце матки в случае диагноза STUMP, не демонстрирует сопутствующей патологии, кроме наличия лейомиомы, как сообщили Ip et al.[5].
Клинически кажется обязательным классифицировать СМТ матки как опухоли с рецидивом и / или метастатическим потенциалом или без него (или редко) [6]. Тремя основными критериями оценки биологического потенциала опухолей матки являются цитологическая атипия, митотический индекс и коагуляционный некроз опухолевых клеток (CTCN). Среди них фактором, наиболее тесно связанным со злокачественным поведением, по-видимому, является CTCN, который характеризуется резким переходом между жизнеспособными клетками и некротическими областями.Прогностическое значение CTCN таково, что его следует дифференцировать от других типов безобидных морфологических изменений (а именно, гиалинизирующего некроза), некроза, связанного с поверхностным изъязвлением подслизистых лейомиом и кровоизлиянием в лейомиомы [2].
Стандартные протоколы ведения пациентов с подозрением на STUMP еще не утверждены. В случае диагноза STUMP в образцах миомэктомии, учитывая доказанную возможность рецидива, гистерэктомия представляет собой золотой стандарт для тех женщин, которые завершили деторождение.Сообщалось об успешных беременностях после операции по сохранению фертильности, однако этих пациенток следует надлежащим образом информировать о риске рецидива, и обязательна строгая программа последующего наблюдения с использованием клинических методов и методов визуализации [11]. Четыре из пяти случаев, о которых сообщалось в нашем исследовании, подверглись хирургическому лечению путем тотальной гистерэктомии в качестве первого доступа или в качестве полной хирургической стадии (второй осмотр). В двух случаях мы провели промывание брюшины, которое в обоих случаях было отрицательным.
Как сообщает Ip et al.Пни характеризуются возможностью повторного появления с задержкой. Однако у них самая высокая средняя выживаемость после рецидива, в отличие от агрессивной злокачественной неоплазии матки [6,14-17]. Рецидивирующие STUMP являются биологически низкосортными LMS; Однако, используя современные методы анализа, этот диагноз нельзя поставить до тех пор, пока не разовьется рецидив [7].
Похоже, что нет единого мнения относительно гистологических признаков, способных предсказать вероятность и клинических характеристик рецидива, таких как анатомическая локализация (таз, брюшная полость, печень, легкие, лимфатические узлы, плечевая кость, забрюшинное пространство и матка — если гистерэктомия была выполнена). ранее не выполнялись), сроках (от 15 месяцев до 9 лет) и гистологическом типе (STUMP или лейомиосаркома) [2,6,9,11,12,18].Более того, ни демографические характеристики (возраст, этническая принадлежность, употребление табака), ни обычные онкологические сывороточные маркеры (CA125 и He4) не позволяют прогнозировать рецидив заболевания [9,19,20].
ПНИ могут повторяться либо как ПНИ [21,22], либо как лейомиосаркомы [2,5,21]. В случае рецидива лечением выбора является хирургическое удаление с последующей адъювантной терапией, такой как облучение таза, химиотерапия (доксорубицин и цисплатин), медроксипрогестерон и аналог гонадотропин-рилизинг-гормона [2,5,21-24].В то время как эффективность адъювантной терапии общепризнана, клиническое течение без осложнений было отмечено даже в отсутствие такого лечения [7].
Дело, представленное Шапиро и др. [11] также подчеркивает неопределенный прогноз, который несет в себе диагноз STUMP, даже в случае гистологического отсутствия CTCN. Клиническое ведение и последующее наблюдение этого заболевания остаются предметом дискуссий [10].
Пациенты в нашем исследовании были европеоидной расы; возраст колебался от 44 до 51 года.Адъювантная терапия не проводилась ни у одного пациента из нашей серии случаев, и в течение периода наблюдения не наблюдалось рецидивов. В нашей ранее опубликованной серии случаев мы сообщили [1] 3 случая, из которых только в одном случае развился рецидив с признаками диффузных метастазов в легкие через 9 лет после первоначального диагноза: в настоящее время клинические особенности трех пациентов не изменились.
Ip et al. [5] сообщили о серии случаев из 16 пациентов с диагнозом STUMP. Адъювантная терапия не проводилась ни одному из пациентов исследуемой группы.Рецидив заболевания наблюдался только в 2 случаях, оба из которых имели иммуногистологический диагноз AL-LE и положительное окрашивание на p16 и p53. Авторы предполагают потенциальную роль иммуногистохимии p16 и p53 в идентификации более агрессивной формы STUMP. Аткинс и др. [10] сообщили о трех случаях (из 8 пациентов) метастатического заболевания после постановки диагноза STUMP: у первого пациента развились метастазы в брюшину и лимфатические узлы, и он был последовательно пролечен прогестероном после удаления опухоли и оставался здоровым в течение трех. годы; у других пациентов развились метастазы в печень, которые лечили хирургическим путем.Согласно Ip et al, иммуногистохимический анализ показал сильное положительное окрашивание на p16 с диффузным и фокальным распределением соответственно в 2 и 1 из наблюдаемых рецидивов.
В настоящее время прогестерон, аналог ГнРГ или химиотерапевтические агенты были предложены в качестве адъювантной терапии, но пока ни один из них не доказал свою эффективность в предотвращении рецидивов заболевания [5,6,9]. Если эффективность прогестерона подтверждена, внутриматочная спираль, высвобождающая прогестерон (LNS-IUS), может быть подходящим вариантом в случае операции по сохранению фертильности [25].Кроме того, отсутствует консенсус относительно внедрения протоколов последующего наблюдения [6,7]. Ip et al. Предлагают интенсивную программу последующего наблюдения с оценкой, проводимой каждые 6 месяцев в течение первых 5 лет, с последующим ежегодным наблюдением в течение следующих 5 лет [6,7]. В нашем Институте у пациентов, перенесших гистерэктомию, мы обычно проводим клиническую оценку каждые шесть месяцев с последующим ежегодным компьютерным томографическим сканированием (КТ) всего тела, тогда как у пациентов, которым была проведена операция по сохранению матки, мы проводим клиническую и сонографическую оценку каждый раз. 6 месяцев и ежегодная магнитно-резонансная томография (МРТ) малого таза в сочетании с рентгеном грудной клетки.
Выводы
Классификация новообразований гладкомышечных клеток матки с неизвестным злокачественным потенциалом остается спорной. Некоторые авторы предполагают, что, возможно, даже определенные типы «доброкачественных лейомиом» из-за агрессивного клинического поведения, которое их характеризует, должны быть включены в настоящую классификацию [26].
Пациентов с ПНТ необходимо проконсультировать относительно потенциального риска рецидива лейомиосаркомы. Многопрофильное лечение, осуществляемое командой, состоящей из гинеколога, профильного патолога (имеющего опыт работы в гинекологической патологии) и онколога, является обязательным для раннего выявления этого заболевания и определения лечения по выбору и программы последующего наблюдения.Несмотря на то, что STUMP демонстрируют низкую степень злокачественности, длительную выживаемость и отсрочку рецидива, пациенты с STUMP требуют более тщательного наблюдения, чем ежегодное обследование, из-за немалого риска метастазов даже через много лет после первоначального диагноза. Исходя из этого, мы считаем, что пациенты, пораженные STUMP, должны проходить долгосрочное наблюдение с использованием методов клинической оценки и визуализации [5].
Наконец, в соответствии с Atkins et al. и Ip et al., возможность тестирования с помощью иммуногистохимического анализа избыточной экспрессии p16 и p53 в гистологических образцах может быть полезной в будущем для выявления группы пациентов с повышенным риском рецидива, которым может быть полезно «индивидуализированное» хирургическое вмешательство. -онкологические стратегии.
Раскрытие информации о конфликте интересов
Нет.
Ссылки
1. Берретта Р., Ролла М., Меризио С., Джордано Дж., Нарделли, Великобритания. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: отчет о трех случаях. Int J Gynecol Cancer. 2008. 18: 1121–6. [PubMed] [Google Scholar] 2. Белл SW, Кемпсон RL, Хендриксон MR. Проблемные новообразования гладких мышц матки. Клинико-патологическое исследование 213 случаев. Am J Surg Pathol. 1994; 18: 535–58. [PubMed] [Google Scholar] 3. Кемпсон Р.Л.Саркомы и родственные новообразования. В: Норрис HJ, Hertig AT, Abell MR, редакторы. Матка. Балтимор: Уильямс и Уилкинс; 1973. [Google Scholar] 4. Тавассоли Ф.А., Девили П. Классификация опухолей Всемирной организации здравоохранения: опухоли груди и женских половых органов. Лион: Международное агентство исследований рака Press; 2003. С. 236–239. [Google Scholar] 5. ИП П.П., Чунг А.Н., Клемент ПБ. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев.Am J Surg Pathol. 2009; 33: 992–1005. [PubMed] [Google Scholar] 6. Ип П.П., Це К.Ю., Там К.Ф. Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Anat Pathol. 2010. 17: 91–112. [PubMed] [Google Scholar] 7. ИП ПП, Чунг АН. Патология лейомиосарком матки и опухолей гладких мышц с неопределенным злокачественным потенциалом. Лучшая практика Res Clin Obstet Gynaecol.2011; 25: 691–704. [PubMed] [Google Scholar] 8. Розай Дж. Розай и хирургическая патология Акермана. 2-й набор томов; 10-е издание: Глава 19. Elsevier; Дата выпуска 20 июня 2011 г. [Google Scholar] 9. Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Опухоль гладких мышц матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol. 2009. 113: 324–6. [PubMed] [Google Scholar] 10. Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 в улучшении гистологической классификации опухолей гладких мышц матки.Am J Surg Pathol. 2008. 32: 98–102. [PubMed] [Google Scholar] 11. Шапиро А., Ференци А., Тюркотт Р., Брухим I, Готлиб У. Гладкомышечная опухоль матки с неопределенным потенциальным злокачественным новообразованием, метастазирующая в плечевую кость как лейомиосаркома высокой степени. Gynecol Oncol. 2004; 94: 818–20. [PubMed] [Google Scholar] 12. Amant F, Moerman P, Vergote I. Отчет о необычном проблемном новообразовании гладких мышц матки, подчеркивающий прогностическую важность коагуляционного некроза опухолевых клеток. Int J Gynecol Cancer. 2005; 15: 1210–2.[PubMed] [Google Scholar] 13. D’Angelo E, Prat J. Саркомы матки: обзор. Gynecol Oncol. 2010; 116: 131–9. [PubMed] [Google Scholar] 14. Берретта Р., Патрелли Т.С., Файоли Р., Маутоне Д., Гиццо С., Меццоджорно А., Джордано Г., Модена А.Б. Дедифференцированный рак эндометрия: атипичный случай, диагностированный на основании метастазов в мозжечок и надпочечники: описание случая и обзор литературы. Int J Clin Exp Pathol. 2013; 6: 1652–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Gizzo S, Ancona E, Patrelli TS, Saccardi C, Anis O, Donato D, Nardelli GB.Сохранение фертильности у молодых женщин с раком шейки матки: онкологическая дилемма или новая концепция операции по сохранению фертильности? Рак Инвест. 2013; 31: 189. [PubMed] [Google Scholar] 16. Patrelli TS, Gizzo S, Di Gangi S, Guidi G, Rondinelli M, Nardelli GB. Мюллерова аденосаркома шейки матки с гетерологичным саркоматозным разрастанием: четвертый случай и обзор литературы. BMC Рак. 2011; 11: 236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Патрелли Т.С., Силини Е.М., Гиццо С., Берретта Р., Франки Л., Тай Э., Луканович А., Нарделли Г.Б., Модена А.Б.Экстрагенитальная мюллерова аденосаркома с мешочной локализацией Дугласа. BMC Рак. 2011; 11: 171. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ng JS, Han A, Chew SH, Low J. Клинико-патологическое исследование опухолей гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) Ann Acad Med Singapore. 2010; 39: 625–8. [PubMed] [Google Scholar] 19. Gizzo S, Ancona E, Saccardi C, D’Antona D, Nardelli GB, Plebani M. Может ли нарушение клубочковой фильтрации почек представлять собой «ахиллесовую пяту» маркера сыворотки HE4? Возможное дальнейшее следствие.Clin Chem Lab Med. 2014; 52: e45–6. [PubMed] [Google Scholar] 20. Патрелли Т.С., Берретта Р., Гиццо С., Пеццуто А., Франки Л., Луканович А., Нарделли Г.Б., Модена А.Б. Значения CA 125 в сыворотке у пациентов с хирургическим лечением эндометриоза и его взаимосвязь с анатомическими участками эндометриоза и частотой наступления беременности. Fertil Steril. 2011; 95: 393–6. [PubMed] [Google Scholar] 21. Климент ПБ. Патология опухолей гладких мышц матки и смешанных стромально-гладкомышечных опухолей эндометрия: выборочный обзор с акцентом на последние достижения.Int J Gynecol Pathol. 2000; 19: 39–55. [PubMed] [Google Scholar] 22. Гао Х.Г., ЛиВолси В.А., Чжан П.Дж. Использование красителей трихрома и ретикулина для характеристики некрозов при опухолях гладкой мускулатуры матки. Мод Pathol. 2007; 20: 198А. [Google Scholar] 23. Миттал К., Попиолек Д., Демопулос Р.И. Миксоидная лейомиосаркома матки внутри лейомиомы. Hum Pathol. 2000; 31: 398–400. [PubMed] [Google Scholar] 24. Клемент ПБ, Янг Р.Х. Атлас гинекологической хирургической патологии. 2-е издание. Филадельфия: У. Б. Сондерс; 2007. Мезенхимальные и смешанные эпителиально-мезенхимальные опухоли тела и шейки матки; стр.194–235. [Google Scholar] 25. Gizzo S, Di Gangi S, Bertocco A, Noventa M, Fagherazzi S, Ancona E, Saccardi C, Patrelli TS, D’Antona D, Nardelli GB. Внутриматочная система левоноргестрела в адъювантной терапии тамоксифеном: баланс риска для груди и пользы для эндометрия — систематический обзор литературы. Reprod Sci. 2014; 21: 423–31. [PubMed] [Google Scholar] 26. Канчиани Г. Н., Бурбос Н., Дункан Т. Дж., Лонсдейл Р., Ньето Дж. Дж. Позднее проявление метастатического новообразования гладких мышц матки с низким злокачественным потенциалом.J Gynecol Oncol. 2012; 23: 69–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]Гладкомышечные опухоли матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы
Int J Clin Exp Pathol. 2014; 7 (11): 8136–8142.
Опубликовано в Интернете 15 октября 2014 г.
Андреа Далл’Аста
1 Департамент хирургических наук Пармского университета, Италия
Сальваторе Гиццо
2 Департамент здоровья женщин и детей Университета Падуи , Падуя, Италия
Андреа Мусаро
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Марко Новента
2 Кафедра здоровья женщин и детей Университета Падуи, Падуя, Италия
Констанца Мильявакка
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Джулио Соцци
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Кафедра Микела Моника
7 Хирургических наук — Пармский университет, Парма, ИталияДаниэле Маутоне
1 Кафедра хирургических наук ces-University of Parma, Парма, Италия
Роберто Берретта
1 Кафедра хирургических наук Пармского университета, Италия
1 Кафедра хирургических наук Пармского университета, Парма, Италия
2 Кафедра здоровья женщин и детей Падуанского университета, Падуя, Италия
3 Кафедра акушерства и гинекологии, Веронский университет, Верона, Италия
Адрес для корреспонденции: Dr.Сальваторе Гиццо, Dipartimento della Salute della Donna e del Bambino, U.O.C. di Clinica Ginecologica e Ostetrica, Via Giustiniani 3, Padova 35128, Италия. Тел .: +39 333 5727248; +39049 8213400; Факс: +39049 8211785; E-mail: ti.orebil@avodap_aigolocenigПоступила в редакцию 9 сентября 2014 г .; Принято 31 октября 2014 г.
Эта статья цитируется в других статьях в PMC.Abstract
Термин гладкая мышца матки с неопределенным злокачественным потенциалом (STUMP) означает группу гладкомышечных опухолей матки (SMT), которые нельзя однозначно диагностировать как доброкачественные или злокачественные.Диагностика, хирургическое лечение и последующее наблюдение этого новообразования остаются спорными, особенно у женщин в пременопаузе с желанием фертильности, из-за неагрессивного поведения и большей выживаемости по сравнению с лейомиосаркомами. Однако рецидивы оцениваются от 8,7% до 11% и могут включать отсроченные рецидивы. Мы сообщили о пяти случаях опухолей матки, леченных хирургической процедурой, с диагнозом STUMP при окончательной патологии. Четырем пациентам была выполнена полная абдоминальная гистерэктомия с сальпингоофорэктомией или без нее.Одной пациентке после постановки диагноза STUMP было выполнено удаление массы матки с последующей тотальной абдоминальной гистерэктомией плюс двусторонняя сальпингоофорэктомия. На сегодняшний день все пациенты в нашем исследовании не имели рецидивов (период наблюдения составил от 6 до 81 месяца). Основываясь на нашем опыте и учитывая отсутствие консенсуса в отношении злокачественного потенциала, диагностических критериев, золотого стандарта лечения и последующего наблюдения, мы считаем, что в случае STUMP необходимо тщательное междисциплинарное лечение.Мы предлагаем, чтобы гинеколог, специализированный патолог (с высоким уровнем экспертизы в гинекологической патологии) и онколог работали как одна команда в консультировании и лечении этого новообразования от обнаружения до завершения наблюдения. Кроме того, мы рекомендуем иммуногистохимию для исследования сверхэкспрессии p16 и p53, чтобы определить группу пациентов с повышенным риском рецидива, которым могут быть полезны более агрессивные хирургические онкологические стратегии.
Ключевые слова: Неопределенный злокачественный потенциал, новообразование гладких мышц матки, хирургическое лечение, последующее наблюдение, операция по сохранению фертильности
Введение
Гладкомышечные опухоли матки (SMT) исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основе цитологическая атипия, скорость митоза и наличие или отсутствие некроза опухолевых клеток [1].Стэнфордские критерии гистологического диагноза злокачественной SMT (лейомиосаркомы), описанные Bell et al. включают, по крайней мере, два из следующих критериев: диффузная атипия от умеренной до тяжелой, количество митозов не менее 10 митотических фигур (MF) / 10 полей высокой мощности (HPF) и некроз опухолевых клеток [2].
Клеточность, которая является субъективным диагнозом, границы опухоли и их отношения с окружающим миометрием представляют собой дополнительные, но менее взвешенные морфологические критерии в диагнозе «гладкая мышца матки с неопределенным злокачественным потенциалом» (STUMP) [2].
Термин пень впервые был использован в литературе Кемпсоном в 1973 году [3], и текущая классификация Всемирной организации здравоохранения указывает, что СМТ матки, не диагностированная однозначно как доброкачественная или злокачественная, должна определяться как пень [4].
Отсутствие единых диагностических критериев и диагностическая неопределенность STUMP на протяжении многих лет приводили к гипердиагностике этой неоплазии [5]. На самом деле, как сообщает Ip et al., Диагноз STUMP уместен, когда опухоль демонстрирует любую необычную комбинацию трех вышеупомянутых признаков, но не удовлетворяет Стэнфордским критериям лейомиосаркомы [6].
В литературе мы находим множество терминов, определяющих опухоли гладкомышечных клеток матки. Диагностические термины, полученные из Стэнфордского исследования Белла и др., Включают следующие подтипы: «атипичная лейомиома с ограниченным опытом» (AL-LE), «атипичная лейомиома, низкий риск рецидива» (AL-LRR), «опухоль гладкой мускулатуры. низкий злокачественный потенциал »(SMT-LMP) и« митотически активная лейомиома, ограниченный опыт »(MAL-LE) [2]. Гистологический диагноз STUMP впоследствии развился в течение последних 38 лет [7], и в настоящее время основные диагностические признаки основаны на критериях, обозначенных Kempson et al., Которые идентифицировали 3 варианта опухолей гладкомышечных клеток: [3,8].
Наличие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, атипия от отсутствия до легкой степени. Bell et al. признали, что внешне доброкачественная SMT, содержащая только некроз опухолевых клеток, иногда может быть клинически злокачественной, и, таким образом, такие опухоли в настоящее время соответственно считаются STUMP [2,7]; Отсутствие коагуляционного некроза, митотическое число на 10 HPF больше 10, очаговая атипия от средней до тяжелой. В схеме Кемпсона это обозначается как STUMP, если митотическая активность выше 15; Отсутствие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, очаговая атипия от средней до тяжелой.Это называется AL-LRR в схеме Кемпсона (AL-LRR) [8].
Митотически активная лейомиома, которая определяется как опухоль с высоким митотическим индексом (> 5 и <19 митозов на поле высокого увеличения), теперь считается доброкачественным вариантом лейомиомы и отличается от STUMP из-за отсутствия рецидивов и метастазов вне таза [9].
Использование термина «атипичная лейомиома» не является общепринятым среди патологов, и естественная история таких опухолей остается спорной.В настоящее время «лейомиомы с причудливыми ядрами» (LBN), «причудливые лейомиомы» или «симпластические лейомиомы» признаны клинически доброкачественными опухолями [6].
Сообщаемая частота рецидивов STUMP колеблется от 8,7% до 11%, но в литературе имеются недостаточные данные. Вероятно, что SMT, определяемые как STUMP, могут быть вариантами лейомиомы с необычными патологическими особенностями. С другой стороны, некоторые опухоли, рассматриваемые как пень, на самом деле могут быть недостаточно диагностированными лейомиосаркомами. Фактически, различные свидетельства показали, что рецидивирующие пеньки могут представлять собой форму «пограничной» опухоли или лейомиосаркомы низкой степени злокачественности [5].
Важность правильного дифференциального диагноза между STUMP и лейомиосаркомой связана с часто агрессивным клиническим течением лейомиосаркомы высокой степени с ранним рецидивом и метастазами; В отличие от STUMPs показали более низкий рост опухоли, и возможное рецидивирование часто откладывается через несколько лет после первоначального события [1,2,5,10-12].
Ранее мы опубликовали серию случаев трех пациентов с диагнозом STUMP при окончательной патологии. Целью данной статьи является обновление нашего опыта в отношении клинического ведения, хирургического лечения и последующего наблюдения за этой редкой и малоизвестной неоплазией матки.Мы сообщаем о пяти новых случаях.
Представление клинических случаев
Мы зарегистрировали еще 5 пациентов с окончательным диагнозом STUMP, помимо тех, которые ранее были описаны Берреттой и др. [1], которые обратились в Клиническое отделение гинекологии и акушерства Департамента хирургических наук Пармского университета в г. период с 2007 по 2013 год. Все пациенты были должным образом проинформированы о процедуре и дали согласие на использование своих данных для этого исследования путем письменного согласия с уважением их конфиденциальности (Закон Италии 675/96).
Во всех случаях диагностика ПНТ была проведена патологоанатомом с большим опытом работы в гинекологической онкологии.
Первый случай произошел у 44-летней женщины (PARA 0) с хронической тазовой болью, гиперменореей и вторичной анемией из-за хронического аномального маточного кровотечения (AUB) в анамнезе. В мае 2007 г. перенесена лапаротомическая гистерэктомия с сохранением придатков. Макроскопическое обследование, проведенное опытным гинекологом-патологом, показало большую миому с максимальным диаметром 12 см, которая при окончательной патологии выявила наличие очаговой атипии от умеренной до тяжелой с ядерным полиморфизмом высокой степени и поэтому была классифицирована как STUMP (AL-LRR).Пациент прошел тщательное клинико-инструментальное наблюдение в соответствии с описанным в нашей предыдущей статье [1]. Адъювантная химиотерапия и / или лучевая терапия не проводились, и пациент оставался здоровым через 81 месяц.
Второй случай произошел у 51-летней пациентки (PARA 2), перенесшей в анамнезе два кесарева сечения. Предоперационная визуализация выявила 12-сантиметровую тазовую массу с подозрением на придаточное происхождение. Онкомаркеры сыворотки крови до операции были отрицательными. В августе 2007 г. больной выполнена лапаротомическая гистерэктомия и двусторонняя сальпингоофорэктомия.Заключительное гистологическое исследование показало ядерную атипию от умеренной до тяжелой и очаговые некротические области, совместимые с STUMP. Адъювантная терапия не проводилась, и у пациента не было рецидивов через 78 месяцев после первоначального диагноза.
Третий случай произошел у 49-летней пациентки (PARA 1) без соответствующей предыдущей истории болезни, поступившей в наше отделение по поводу хронической AUB, вторичной по отношению к миоме матки. В марте 2011 года перенесена лапаротомическая гистерэктомия с двусторонней сальпингоофорэктомией.STUMP был диагностирован на миоме размером 2,5 см, который выявил области очаговой атипии от умеренной до тяжелой без некроза и повышенного митотического индекса. Окончательный диагноз был совместим с AL-LRR. Никакой адъювантной терапии не проводилось, и после периода наблюдения в течение 33 месяцев пациент остается здоровым.
Четвертый случай произошел с пациентом 45 лет (PARA 0), который периодически выполнял трансвагинальное ультразвуковое исследование в связи с наличием большой бессимптомной миомы диаметром 14 см.После 24-месячного периода наблюдения, в мае 2012 года, пациент выбрал лапаротомную миомэктомию. Окончательный патологический отчет выявил очаговую атипию от умеренной до тяжелой без увеличения митотического индекса или коагуляционного некроза, что соответствует окончательному диагнозу AL-LRR. Послеоперационная стадия с помощью компьютерной томографии (КТ) не показала метастазов. Никакой адъювантной терапии не потребовалось, и после периода наблюдения в течение 19 месяцев у пациента в настоящее время нет болезни.
Последний случай представлен 48-летней пациенткой (PARA 2) без соответствующего медицинского или хирургического анамнеза, за исключением диагноза множественной миомы матки, осложненной хронической АМБ.В августе 2013 г. пациенту проведена лапароскопическая миомэктомия с последующим диагнозом ПТИ по окончательной патологии. Послеоперационная стадия, выполненная с помощью компьютерной томографии (КТ) всего тела, не выявила метастазов. Поэтому мы сделали выбор в пользу повторного хирургического вмешательства и в октябре 2013 года выполнили лапароскопическую вагинальную гистерэктомию и двустороннюю овариэктомию. Макроскопическое исследование показало наличие внутрисосудистых пальцевидных выступов с увеличенными интрамуральными и субсерозными кровеносными сосудами.Окончательный отчет о патологии выявил легкую атипию, отсутствие повышенного митотического индекса или коагуляционного некроза и паттерн, соответствующий эпителиоидному внутрисосудистому лейомиоматозу. Адъювантная терапия не проводилась. Первое контрольное обследование было выполнено через 3 месяца после гистерэктомии и не выявило рецидива. Наш опыт обобщен в.
Таблица 1
Клинические особенности пациентов, включенных в нашу серию случаев
| Месяц и год | Возраст | Гистология | Лечение | Адъювантная терапия | Последующее наблюдение до 28 февраля -го , 2014 | Рецидив | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ноябрь 2003 г. * | 44 | Центральный некроз, очаговая легкая дисплазия | Лапаротомная тотальная гистерэктомия | № | 123 месяца 2006 г., без болезней | № | * | 35 | Высокий митотический индекс, необычные ядра | Лапаротомная миомэктомия | Нет | 97 месяцев, без болезней | Нет |
| 1995 * | 47 | От умеренной до тяжелой степени | Лапаротомная тотальная гистерэктомия | Нет | клинически стабильная | Метастазы в легких 9 лет после гистерэктомии | |||||||
| май 2007 г. | 44 | Очаговая атипия средней и тяжелой степени | Лапаротомная тотальная гистерэктомия | № | 81 месяц, без заболевания | № | |||||||
| август 2007 г. 51 | Ядерная атипия от средней до тяжелой и очаговые некротические области | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 78 месяцев, без заболевания | № | ||||||||
| март 2011 г. | 49 | Очаговая от средней до -тяжелая атипия без некроза | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 35 месяцев, без заболевания | № | |||||||
| май 2012 г. | 45 | Очаговая атипия средней и тяжелой степени | Лапаротомия № | 22 месяца, без болезней | № | ||||||||
| август 2013 г. | 48 | STUMP | Лапароскопическая миомэктомия с последующей лапароскопической гистерэктомией с двусторонней аднексэктомией | № | 6 месяцев, без заболевания | № |
Обсуждение
группы STUMP как с гистологической, так и с клинической точки зрения.Из-за редкости этих опухолей существующая литература по этой теме остается скудной, и поэтому консенсус относительно диагноза, злокачественного потенциала, лечения выбора и последующего наблюдения еще не достигнут [1,2,9,10,13].
Клиническая картина пней напоминает лейомиомы матки. Типичные клинические признаки включают патологическое вагинальное кровотечение, симптомы анемии, быстрорастущую массу таза, симптомы давления и тазовую боль [6]. Факторы риска и биологические события, которые приводят к STUMP, остаются плохо изученными, и поэтому последующее клиническое поведение трудно предсказать [9].Средний возраст на момент обращения схож у пациентов с диагнозом лейомиосаркома, а также у пациентов с доброкачественными лейомиомами. Интересным наблюдением является то, что пациенты, пораженные STUMP, осложненным последующим рецидивом заболевания, были моложе, чем пациенты с последующим наблюдением без осложнений [6,7].
Обычно патологический анализ, выполняемый на образце матки в случае диагноза STUMP, не демонстрирует сопутствующей патологии, кроме наличия лейомиомы, как сообщили Ip et al.[5].
Клинически кажется обязательным классифицировать СМТ матки как опухоли с рецидивом и / или метастатическим потенциалом или без него (или редко) [6]. Тремя основными критериями оценки биологического потенциала опухолей матки являются цитологическая атипия, митотический индекс и коагуляционный некроз опухолевых клеток (CTCN). Среди них фактором, наиболее тесно связанным со злокачественным поведением, по-видимому, является CTCN, который характеризуется резким переходом между жизнеспособными клетками и некротическими областями.Прогностическое значение CTCN таково, что его следует дифференцировать от других типов безобидных морфологических изменений (а именно, гиалинизирующего некроза), некроза, связанного с поверхностным изъязвлением подслизистых лейомиом и кровоизлиянием в лейомиомы [2].
Стандартные протоколы ведения пациентов с подозрением на STUMP еще не утверждены. В случае диагноза STUMP в образцах миомэктомии, учитывая доказанную возможность рецидива, гистерэктомия представляет собой золотой стандарт для тех женщин, которые завершили деторождение.Сообщалось об успешных беременностях после операции по сохранению фертильности, однако этих пациенток следует надлежащим образом информировать о риске рецидива, и обязательна строгая программа последующего наблюдения с использованием клинических методов и методов визуализации [11]. Четыре из пяти случаев, о которых сообщалось в нашем исследовании, подверглись хирургическому лечению путем тотальной гистерэктомии в качестве первого доступа или в качестве полной хирургической стадии (второй осмотр). В двух случаях мы провели промывание брюшины, которое в обоих случаях было отрицательным.
Как сообщает Ip et al.Пни характеризуются возможностью повторного появления с задержкой. Однако у них самая высокая средняя выживаемость после рецидива, в отличие от агрессивной злокачественной неоплазии матки [6,14-17]. Рецидивирующие STUMP являются биологически низкосортными LMS; Однако, используя современные методы анализа, этот диагноз нельзя поставить до тех пор, пока не разовьется рецидив [7].
Похоже, что нет единого мнения относительно гистологических признаков, способных предсказать вероятность и клинических характеристик рецидива, таких как анатомическая локализация (таз, брюшная полость, печень, легкие, лимфатические узлы, плечевая кость, забрюшинное пространство и матка — если гистерэктомия была выполнена). ранее не выполнялись), сроках (от 15 месяцев до 9 лет) и гистологическом типе (STUMP или лейомиосаркома) [2,6,9,11,12,18].Более того, ни демографические характеристики (возраст, этническая принадлежность, употребление табака), ни обычные онкологические сывороточные маркеры (CA125 и He4) не позволяют прогнозировать рецидив заболевания [9,19,20].
ПНИ могут повторяться либо как ПНИ [21,22], либо как лейомиосаркомы [2,5,21]. В случае рецидива лечением выбора является хирургическое удаление с последующей адъювантной терапией, такой как облучение таза, химиотерапия (доксорубицин и цисплатин), медроксипрогестерон и аналог гонадотропин-рилизинг-гормона [2,5,21-24].В то время как эффективность адъювантной терапии общепризнана, клиническое течение без осложнений было отмечено даже в отсутствие такого лечения [7].
Дело, представленное Шапиро и др. [11] также подчеркивает неопределенный прогноз, который несет в себе диагноз STUMP, даже в случае гистологического отсутствия CTCN. Клиническое ведение и последующее наблюдение этого заболевания остаются предметом дискуссий [10].
Пациенты в нашем исследовании были европеоидной расы; возраст колебался от 44 до 51 года.Адъювантная терапия не проводилась ни у одного пациента из нашей серии случаев, и в течение периода наблюдения не наблюдалось рецидивов. В нашей ранее опубликованной серии случаев мы сообщили [1] 3 случая, из которых только в одном случае развился рецидив с признаками диффузных метастазов в легкие через 9 лет после первоначального диагноза: в настоящее время клинические особенности трех пациентов не изменились.
Ip et al. [5] сообщили о серии случаев из 16 пациентов с диагнозом STUMP. Адъювантная терапия не проводилась ни одному из пациентов исследуемой группы.Рецидив заболевания наблюдался только в 2 случаях, оба из которых имели иммуногистологический диагноз AL-LE и положительное окрашивание на p16 и p53. Авторы предполагают потенциальную роль иммуногистохимии p16 и p53 в идентификации более агрессивной формы STUMP. Аткинс и др. [10] сообщили о трех случаях (из 8 пациентов) метастатического заболевания после постановки диагноза STUMP: у первого пациента развились метастазы в брюшину и лимфатические узлы, и он был последовательно пролечен прогестероном после удаления опухоли и оставался здоровым в течение трех. годы; у других пациентов развились метастазы в печень, которые лечили хирургическим путем.Согласно Ip et al, иммуногистохимический анализ показал сильное положительное окрашивание на p16 с диффузным и фокальным распределением соответственно в 2 и 1 из наблюдаемых рецидивов.
В настоящее время прогестерон, аналог ГнРГ или химиотерапевтические агенты были предложены в качестве адъювантной терапии, но пока ни один из них не доказал свою эффективность в предотвращении рецидивов заболевания [5,6,9]. Если эффективность прогестерона подтверждена, внутриматочная спираль, высвобождающая прогестерон (LNS-IUS), может быть подходящим вариантом в случае операции по сохранению фертильности [25].Кроме того, отсутствует консенсус относительно внедрения протоколов последующего наблюдения [6,7]. Ip et al. Предлагают интенсивную программу последующего наблюдения с оценкой, проводимой каждые 6 месяцев в течение первых 5 лет, с последующим ежегодным наблюдением в течение следующих 5 лет [6,7]. В нашем Институте у пациентов, перенесших гистерэктомию, мы обычно проводим клиническую оценку каждые шесть месяцев с последующим ежегодным компьютерным томографическим сканированием (КТ) всего тела, тогда как у пациентов, которым была проведена операция по сохранению матки, мы проводим клиническую и сонографическую оценку каждый раз. 6 месяцев и ежегодная магнитно-резонансная томография (МРТ) малого таза в сочетании с рентгеном грудной клетки.
Выводы
Классификация новообразований гладкомышечных клеток матки с неизвестным злокачественным потенциалом остается спорной. Некоторые авторы предполагают, что, возможно, даже определенные типы «доброкачественных лейомиом» из-за агрессивного клинического поведения, которое их характеризует, должны быть включены в настоящую классификацию [26].
Пациентов с ПНТ необходимо проконсультировать относительно потенциального риска рецидива лейомиосаркомы. Многопрофильное лечение, осуществляемое командой, состоящей из гинеколога, профильного патолога (имеющего опыт работы в гинекологической патологии) и онколога, является обязательным для раннего выявления этого заболевания и определения лечения по выбору и программы последующего наблюдения.Несмотря на то, что STUMP демонстрируют низкую степень злокачественности, длительную выживаемость и отсрочку рецидива, пациенты с STUMP требуют более тщательного наблюдения, чем ежегодное обследование, из-за немалого риска метастазов даже через много лет после первоначального диагноза. Исходя из этого, мы считаем, что пациенты, пораженные STUMP, должны проходить долгосрочное наблюдение с использованием методов клинической оценки и визуализации [5].
Наконец, в соответствии с Atkins et al. и Ip et al., возможность тестирования с помощью иммуногистохимического анализа избыточной экспрессии p16 и p53 в гистологических образцах может быть полезной в будущем для выявления группы пациентов с повышенным риском рецидива, которым может быть полезно «индивидуализированное» хирургическое вмешательство. -онкологические стратегии.
Раскрытие информации о конфликте интересов
Нет.
Ссылки
1. Берретта Р., Ролла М., Меризио С., Джордано Дж., Нарделли, Великобритания. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: отчет о трех случаях. Int J Gynecol Cancer. 2008. 18: 1121–6. [PubMed] [Google Scholar] 2. Белл SW, Кемпсон RL, Хендриксон MR. Проблемные новообразования гладких мышц матки. Клинико-патологическое исследование 213 случаев. Am J Surg Pathol. 1994; 18: 535–58. [PubMed] [Google Scholar] 3. Кемпсон Р.Л.Саркомы и родственные новообразования. В: Норрис HJ, Hertig AT, Abell MR, редакторы. Матка. Балтимор: Уильямс и Уилкинс; 1973. [Google Scholar] 4. Тавассоли Ф.А., Девили П. Классификация опухолей Всемирной организации здравоохранения: опухоли груди и женских половых органов. Лион: Международное агентство исследований рака Press; 2003. С. 236–239. [Google Scholar] 5. ИП П.П., Чунг А.Н., Клемент ПБ. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев.Am J Surg Pathol. 2009; 33: 992–1005. [PubMed] [Google Scholar] 6. Ип П.П., Це К.Ю., Там К.Ф. Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Anat Pathol. 2010. 17: 91–112. [PubMed] [Google Scholar] 7. ИП ПП, Чунг АН. Патология лейомиосарком матки и опухолей гладких мышц с неопределенным злокачественным потенциалом. Лучшая практика Res Clin Obstet Gynaecol.2011; 25: 691–704. [PubMed] [Google Scholar] 8. Розай Дж. Розай и хирургическая патология Акермана. 2-й набор томов; 10-е издание: Глава 19. Elsevier; Дата выпуска 20 июня 2011 г. [Google Scholar] 9. Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Опухоль гладких мышц матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol. 2009. 113: 324–6. [PubMed] [Google Scholar] 10. Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 в улучшении гистологической классификации опухолей гладких мышц матки.Am J Surg Pathol. 2008. 32: 98–102. [PubMed] [Google Scholar] 11. Шапиро А., Ференци А., Тюркотт Р., Брухим I, Готлиб У. Гладкомышечная опухоль матки с неопределенным потенциальным злокачественным новообразованием, метастазирующая в плечевую кость как лейомиосаркома высокой степени. Gynecol Oncol. 2004; 94: 818–20. [PubMed] [Google Scholar] 12. Amant F, Moerman P, Vergote I. Отчет о необычном проблемном новообразовании гладких мышц матки, подчеркивающий прогностическую важность коагуляционного некроза опухолевых клеток. Int J Gynecol Cancer. 2005; 15: 1210–2.[PubMed] [Google Scholar] 13. D’Angelo E, Prat J. Саркомы матки: обзор. Gynecol Oncol. 2010; 116: 131–9. [PubMed] [Google Scholar] 14. Берретта Р., Патрелли Т.С., Файоли Р., Маутоне Д., Гиццо С., Меццоджорно А., Джордано Г., Модена А.Б. Дедифференцированный рак эндометрия: атипичный случай, диагностированный на основании метастазов в мозжечок и надпочечники: описание случая и обзор литературы. Int J Clin Exp Pathol. 2013; 6: 1652–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Gizzo S, Ancona E, Patrelli TS, Saccardi C, Anis O, Donato D, Nardelli GB.Сохранение фертильности у молодых женщин с раком шейки матки: онкологическая дилемма или новая концепция операции по сохранению фертильности? Рак Инвест. 2013; 31: 189. [PubMed] [Google Scholar] 16. Patrelli TS, Gizzo S, Di Gangi S, Guidi G, Rondinelli M, Nardelli GB. Мюллерова аденосаркома шейки матки с гетерологичным саркоматозным разрастанием: четвертый случай и обзор литературы. BMC Рак. 2011; 11: 236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Патрелли Т.С., Силини Е.М., Гиццо С., Берретта Р., Франки Л., Тай Э., Луканович А., Нарделли Г.Б., Модена А.Б.Экстрагенитальная мюллерова аденосаркома с мешочной локализацией Дугласа. BMC Рак. 2011; 11: 171. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ng JS, Han A, Chew SH, Low J. Клинико-патологическое исследование опухолей гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) Ann Acad Med Singapore. 2010; 39: 625–8. [PubMed] [Google Scholar] 19. Gizzo S, Ancona E, Saccardi C, D’Antona D, Nardelli GB, Plebani M. Может ли нарушение клубочковой фильтрации почек представлять собой «ахиллесовую пяту» маркера сыворотки HE4? Возможное дальнейшее следствие.Clin Chem Lab Med. 2014; 52: e45–6. [PubMed] [Google Scholar] 20. Патрелли Т.С., Берретта Р., Гиццо С., Пеццуто А., Франки Л., Луканович А., Нарделли Г.Б., Модена А.Б. Значения CA 125 в сыворотке у пациентов с хирургическим лечением эндометриоза и его взаимосвязь с анатомическими участками эндометриоза и частотой наступления беременности. Fertil Steril. 2011; 95: 393–6. [PubMed] [Google Scholar] 21. Климент ПБ. Патология опухолей гладких мышц матки и смешанных стромально-гладкомышечных опухолей эндометрия: выборочный обзор с акцентом на последние достижения.Int J Gynecol Pathol. 2000; 19: 39–55. [PubMed] [Google Scholar] 22. Гао Х.Г., ЛиВолси В.А., Чжан П.Дж. Использование красителей трихрома и ретикулина для характеристики некрозов при опухолях гладкой мускулатуры матки. Мод Pathol. 2007; 20: 198А. [Google Scholar] 23. Миттал К., Попиолек Д., Демопулос Р.И. Миксоидная лейомиосаркома матки внутри лейомиомы. Hum Pathol. 2000; 31: 398–400. [PubMed] [Google Scholar] 24. Клемент ПБ, Янг Р.Х. Атлас гинекологической хирургической патологии. 2-е издание. Филадельфия: У. Б. Сондерс; 2007. Мезенхимальные и смешанные эпителиально-мезенхимальные опухоли тела и шейки матки; стр.194–235. [Google Scholar] 25. Gizzo S, Di Gangi S, Bertocco A, Noventa M, Fagherazzi S, Ancona E, Saccardi C, Patrelli TS, D’Antona D, Nardelli GB. Внутриматочная система левоноргестрела в адъювантной терапии тамоксифеном: баланс риска для груди и пользы для эндометрия — систематический обзор литературы. Reprod Sci. 2014; 21: 423–31. [PubMed] [Google Scholar] 26. Канчиани Г. Н., Бурбос Н., Дункан Т. Дж., Лонсдейл Р., Ньето Дж. Дж. Позднее проявление метастатического новообразования гладких мышц матки с низким злокачественным потенциалом.J Gynecol Oncol. 2012; 23: 69–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]Гладкомышечные опухоли матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы
Int J Clin Exp Pathol. 2014; 7 (11): 8136–8142.
Опубликовано в Интернете 15 октября 2014 г.
Андреа Далл’Аста
1 Департамент хирургических наук Пармского университета, Италия
Сальваторе Гиццо
2 Департамент здоровья женщин и детей Университета Падуи , Падуя, Италия
Андреа Мусаро
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Марко Новента
2 Кафедра здоровья женщин и детей Университета Падуи, Падуя, Италия
Констанца Мильявакка
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Джулио Соцци
1 Кафедра хирургических наук Пармского университета, Парма, Италия
Кафедра Микела Моника
7 Хирургических наук — Пармский университет, Парма, ИталияДаниэле Маутоне
1 Кафедра хирургических наук ces-University of Parma, Парма, Италия
Роберто Берретта
1 Кафедра хирургических наук Пармского университета, Италия
1 Кафедра хирургических наук Пармского университета, Парма, Италия
2 Кафедра здоровья женщин и детей Падуанского университета, Падуя, Италия
3 Кафедра акушерства и гинекологии, Веронский университет, Верона, Италия
Адрес для корреспонденции: Dr.Сальваторе Гиццо, Dipartimento della Salute della Donna e del Bambino, U.O.C. di Clinica Ginecologica e Ostetrica, Via Giustiniani 3, Padova 35128, Италия. Тел .: +39 333 5727248; +39049 8213400; Факс: +39049 8211785; E-mail: ti.orebil@avodap_aigolocenigПоступила в редакцию 9 сентября 2014 г .; Принято 31 октября 2014 г.
Эта статья цитируется в других статьях в PMC.Abstract
Термин гладкая мышца матки с неопределенным злокачественным потенциалом (STUMP) означает группу гладкомышечных опухолей матки (SMT), которые нельзя однозначно диагностировать как доброкачественные или злокачественные.Диагностика, хирургическое лечение и последующее наблюдение этого новообразования остаются спорными, особенно у женщин в пременопаузе с желанием фертильности, из-за неагрессивного поведения и большей выживаемости по сравнению с лейомиосаркомами. Однако рецидивы оцениваются от 8,7% до 11% и могут включать отсроченные рецидивы. Мы сообщили о пяти случаях опухолей матки, леченных хирургической процедурой, с диагнозом STUMP при окончательной патологии. Четырем пациентам была выполнена полная абдоминальная гистерэктомия с сальпингоофорэктомией или без нее.Одной пациентке после постановки диагноза STUMP было выполнено удаление массы матки с последующей тотальной абдоминальной гистерэктомией плюс двусторонняя сальпингоофорэктомия. На сегодняшний день все пациенты в нашем исследовании не имели рецидивов (период наблюдения составил от 6 до 81 месяца). Основываясь на нашем опыте и учитывая отсутствие консенсуса в отношении злокачественного потенциала, диагностических критериев, золотого стандарта лечения и последующего наблюдения, мы считаем, что в случае STUMP необходимо тщательное междисциплинарное лечение.Мы предлагаем, чтобы гинеколог, специализированный патолог (с высоким уровнем экспертизы в гинекологической патологии) и онколог работали как одна команда в консультировании и лечении этого новообразования от обнаружения до завершения наблюдения. Кроме того, мы рекомендуем иммуногистохимию для исследования сверхэкспрессии p16 и p53, чтобы определить группу пациентов с повышенным риском рецидива, которым могут быть полезны более агрессивные хирургические онкологические стратегии.
Ключевые слова: Неопределенный злокачественный потенциал, новообразование гладких мышц матки, хирургическое лечение, последующее наблюдение, операция по сохранению фертильности
Введение
Гладкомышечные опухоли матки (SMT) исторически отличались от доброкачественных лейомиом и злокачественных лейомиосарком на основе цитологическая атипия, скорость митоза и наличие или отсутствие некроза опухолевых клеток [1].Стэнфордские критерии гистологического диагноза злокачественной SMT (лейомиосаркомы), описанные Bell et al. включают, по крайней мере, два из следующих критериев: диффузная атипия от умеренной до тяжелой, количество митозов не менее 10 митотических фигур (MF) / 10 полей высокой мощности (HPF) и некроз опухолевых клеток [2].
Клеточность, которая является субъективным диагнозом, границы опухоли и их отношения с окружающим миометрием представляют собой дополнительные, но менее взвешенные морфологические критерии в диагнозе «гладкая мышца матки с неопределенным злокачественным потенциалом» (STUMP) [2].
Термин пень впервые был использован в литературе Кемпсоном в 1973 году [3], и текущая классификация Всемирной организации здравоохранения указывает, что СМТ матки, не диагностированная однозначно как доброкачественная или злокачественная, должна определяться как пень [4].
Отсутствие единых диагностических критериев и диагностическая неопределенность STUMP на протяжении многих лет приводили к гипердиагностике этой неоплазии [5]. На самом деле, как сообщает Ip et al., Диагноз STUMP уместен, когда опухоль демонстрирует любую необычную комбинацию трех вышеупомянутых признаков, но не удовлетворяет Стэнфордским критериям лейомиосаркомы [6].
В литературе мы находим множество терминов, определяющих опухоли гладкомышечных клеток матки. Диагностические термины, полученные из Стэнфордского исследования Белла и др., Включают следующие подтипы: «атипичная лейомиома с ограниченным опытом» (AL-LE), «атипичная лейомиома, низкий риск рецидива» (AL-LRR), «опухоль гладкой мускулатуры. низкий злокачественный потенциал »(SMT-LMP) и« митотически активная лейомиома, ограниченный опыт »(MAL-LE) [2]. Гистологический диагноз STUMP впоследствии развился в течение последних 38 лет [7], и в настоящее время основные диагностические признаки основаны на критериях, обозначенных Kempson et al., Которые идентифицировали 3 варианта опухолей гладкомышечных клеток: [3,8].
Наличие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, атипия от отсутствия до легкой степени. Bell et al. признали, что внешне доброкачественная SMT, содержащая только некроз опухолевых клеток, иногда может быть клинически злокачественной, и, таким образом, такие опухоли в настоящее время соответственно считаются STUMP [2,7]; Отсутствие коагуляционного некроза, митотическое число на 10 HPF больше 10, очаговая атипия от средней до тяжелой. В схеме Кемпсона это обозначается как STUMP, если митотическая активность выше 15; Отсутствие коагуляционного некроза, количество митозов на 10 HPF равно или меньше 10, очаговая атипия от средней до тяжелой.Это называется AL-LRR в схеме Кемпсона (AL-LRR) [8].
Митотически активная лейомиома, которая определяется как опухоль с высоким митотическим индексом (> 5 и <19 митозов на поле высокого увеличения), теперь считается доброкачественным вариантом лейомиомы и отличается от STUMP из-за отсутствия рецидивов и метастазов вне таза [9].
Использование термина «атипичная лейомиома» не является общепринятым среди патологов, и естественная история таких опухолей остается спорной.В настоящее время «лейомиомы с причудливыми ядрами» (LBN), «причудливые лейомиомы» или «симпластические лейомиомы» признаны клинически доброкачественными опухолями [6].
Сообщаемая частота рецидивов STUMP колеблется от 8,7% до 11%, но в литературе имеются недостаточные данные. Вероятно, что SMT, определяемые как STUMP, могут быть вариантами лейомиомы с необычными патологическими особенностями. С другой стороны, некоторые опухоли, рассматриваемые как пень, на самом деле могут быть недостаточно диагностированными лейомиосаркомами. Фактически, различные свидетельства показали, что рецидивирующие пеньки могут представлять собой форму «пограничной» опухоли или лейомиосаркомы низкой степени злокачественности [5].
Важность правильного дифференциального диагноза между STUMP и лейомиосаркомой связана с часто агрессивным клиническим течением лейомиосаркомы высокой степени с ранним рецидивом и метастазами; В отличие от STUMPs показали более низкий рост опухоли, и возможное рецидивирование часто откладывается через несколько лет после первоначального события [1,2,5,10-12].
Ранее мы опубликовали серию случаев трех пациентов с диагнозом STUMP при окончательной патологии. Целью данной статьи является обновление нашего опыта в отношении клинического ведения, хирургического лечения и последующего наблюдения за этой редкой и малоизвестной неоплазией матки.Мы сообщаем о пяти новых случаях.
Представление клинических случаев
Мы зарегистрировали еще 5 пациентов с окончательным диагнозом STUMP, помимо тех, которые ранее были описаны Берреттой и др. [1], которые обратились в Клиническое отделение гинекологии и акушерства Департамента хирургических наук Пармского университета в г. период с 2007 по 2013 год. Все пациенты были должным образом проинформированы о процедуре и дали согласие на использование своих данных для этого исследования путем письменного согласия с уважением их конфиденциальности (Закон Италии 675/96).
Во всех случаях диагностика ПНТ была проведена патологоанатомом с большим опытом работы в гинекологической онкологии.
Первый случай произошел у 44-летней женщины (PARA 0) с хронической тазовой болью, гиперменореей и вторичной анемией из-за хронического аномального маточного кровотечения (AUB) в анамнезе. В мае 2007 г. перенесена лапаротомическая гистерэктомия с сохранением придатков. Макроскопическое обследование, проведенное опытным гинекологом-патологом, показало большую миому с максимальным диаметром 12 см, которая при окончательной патологии выявила наличие очаговой атипии от умеренной до тяжелой с ядерным полиморфизмом высокой степени и поэтому была классифицирована как STUMP (AL-LRR).Пациент прошел тщательное клинико-инструментальное наблюдение в соответствии с описанным в нашей предыдущей статье [1]. Адъювантная химиотерапия и / или лучевая терапия не проводились, и пациент оставался здоровым через 81 месяц.
Второй случай произошел у 51-летней пациентки (PARA 2), перенесшей в анамнезе два кесарева сечения. Предоперационная визуализация выявила 12-сантиметровую тазовую массу с подозрением на придаточное происхождение. Онкомаркеры сыворотки крови до операции были отрицательными. В августе 2007 г. больной выполнена лапаротомическая гистерэктомия и двусторонняя сальпингоофорэктомия.Заключительное гистологическое исследование показало ядерную атипию от умеренной до тяжелой и очаговые некротические области, совместимые с STUMP. Адъювантная терапия не проводилась, и у пациента не было рецидивов через 78 месяцев после первоначального диагноза.
Третий случай произошел у 49-летней пациентки (PARA 1) без соответствующей предыдущей истории болезни, поступившей в наше отделение по поводу хронической AUB, вторичной по отношению к миоме матки. В марте 2011 года перенесена лапаротомическая гистерэктомия с двусторонней сальпингоофорэктомией.STUMP был диагностирован на миоме размером 2,5 см, который выявил области очаговой атипии от умеренной до тяжелой без некроза и повышенного митотического индекса. Окончательный диагноз был совместим с AL-LRR. Никакой адъювантной терапии не проводилось, и после периода наблюдения в течение 33 месяцев пациент остается здоровым.
Четвертый случай произошел с пациентом 45 лет (PARA 0), который периодически выполнял трансвагинальное ультразвуковое исследование в связи с наличием большой бессимптомной миомы диаметром 14 см.После 24-месячного периода наблюдения, в мае 2012 года, пациент выбрал лапаротомную миомэктомию. Окончательный патологический отчет выявил очаговую атипию от умеренной до тяжелой без увеличения митотического индекса или коагуляционного некроза, что соответствует окончательному диагнозу AL-LRR. Послеоперационная стадия с помощью компьютерной томографии (КТ) не показала метастазов. Никакой адъювантной терапии не потребовалось, и после периода наблюдения в течение 19 месяцев у пациента в настоящее время нет болезни.
Последний случай представлен 48-летней пациенткой (PARA 2) без соответствующего медицинского или хирургического анамнеза, за исключением диагноза множественной миомы матки, осложненной хронической АМБ.В августе 2013 г. пациенту проведена лапароскопическая миомэктомия с последующим диагнозом ПТИ по окончательной патологии. Послеоперационная стадия, выполненная с помощью компьютерной томографии (КТ) всего тела, не выявила метастазов. Поэтому мы сделали выбор в пользу повторного хирургического вмешательства и в октябре 2013 года выполнили лапароскопическую вагинальную гистерэктомию и двустороннюю овариэктомию. Макроскопическое исследование показало наличие внутрисосудистых пальцевидных выступов с увеличенными интрамуральными и субсерозными кровеносными сосудами.Окончательный отчет о патологии выявил легкую атипию, отсутствие повышенного митотического индекса или коагуляционного некроза и паттерн, соответствующий эпителиоидному внутрисосудистому лейомиоматозу. Адъювантная терапия не проводилась. Первое контрольное обследование было выполнено через 3 месяца после гистерэктомии и не выявило рецидива. Наш опыт обобщен в.
Таблица 1
Клинические особенности пациентов, включенных в нашу серию случаев
| Месяц и год | Возраст | Гистология | Лечение | Адъювантная терапия | Последующее наблюдение до 28 февраля -го , 2014 | Рецидив | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ноябрь 2003 г. * | 44 | Центральный некроз, очаговая легкая дисплазия | Лапаротомная тотальная гистерэктомия | № | 123 месяца 2006 г., без болезней | № | * | 35 | Высокий митотический индекс, необычные ядра | Лапаротомная миомэктомия | Нет | 97 месяцев, без болезней | Нет |
| 1995 * | 47 | От умеренной до тяжелой степени | Лапаротомная тотальная гистерэктомия | Нет | клинически стабильная | Метастазы в легких 9 лет после гистерэктомии | |||||||
| май 2007 г. | 44 | Очаговая атипия средней и тяжелой степени | Лапаротомная тотальная гистерэктомия | № | 81 месяц, без заболевания | № | |||||||
| август 2007 г. 51 | Ядерная атипия от средней до тяжелой и очаговые некротические области | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 78 месяцев, без заболевания | № | ||||||||
| март 2011 г. | 49 | Очаговая от средней до -тяжелая атипия без некроза | Лапаротомная тотальная гистерэктомия с двусторонней аднексэктомией | № | 35 месяцев, без заболевания | № | |||||||
| май 2012 г. | 45 | Очаговая атипия средней и тяжелой степени | Лапаротомия № | 22 месяца, без болезней | № | ||||||||
| август 2013 г. | 48 | STUMP | Лапароскопическая миомэктомия с последующей лапароскопической гистерэктомией с двусторонней аднексэктомией | № | 6 месяцев, без заболевания | № |
Обсуждение
группы STUMP как с гистологической, так и с клинической точки зрения.Из-за редкости этих опухолей существующая литература по этой теме остается скудной, и поэтому консенсус относительно диагноза, злокачественного потенциала, лечения выбора и последующего наблюдения еще не достигнут [1,2,9,10,13].
Клиническая картина пней напоминает лейомиомы матки. Типичные клинические признаки включают патологическое вагинальное кровотечение, симптомы анемии, быстрорастущую массу таза, симптомы давления и тазовую боль [6]. Факторы риска и биологические события, которые приводят к STUMP, остаются плохо изученными, и поэтому последующее клиническое поведение трудно предсказать [9].Средний возраст на момент обращения схож у пациентов с диагнозом лейомиосаркома, а также у пациентов с доброкачественными лейомиомами. Интересным наблюдением является то, что пациенты, пораженные STUMP, осложненным последующим рецидивом заболевания, были моложе, чем пациенты с последующим наблюдением без осложнений [6,7].
Обычно патологический анализ, выполняемый на образце матки в случае диагноза STUMP, не демонстрирует сопутствующей патологии, кроме наличия лейомиомы, как сообщили Ip et al.[5].
Клинически кажется обязательным классифицировать СМТ матки как опухоли с рецидивом и / или метастатическим потенциалом или без него (или редко) [6]. Тремя основными критериями оценки биологического потенциала опухолей матки являются цитологическая атипия, митотический индекс и коагуляционный некроз опухолевых клеток (CTCN). Среди них фактором, наиболее тесно связанным со злокачественным поведением, по-видимому, является CTCN, который характеризуется резким переходом между жизнеспособными клетками и некротическими областями.Прогностическое значение CTCN таково, что его следует дифференцировать от других типов безобидных морфологических изменений (а именно, гиалинизирующего некроза), некроза, связанного с поверхностным изъязвлением подслизистых лейомиом и кровоизлиянием в лейомиомы [2].
Стандартные протоколы ведения пациентов с подозрением на STUMP еще не утверждены. В случае диагноза STUMP в образцах миомэктомии, учитывая доказанную возможность рецидива, гистерэктомия представляет собой золотой стандарт для тех женщин, которые завершили деторождение.Сообщалось об успешных беременностях после операции по сохранению фертильности, однако этих пациенток следует надлежащим образом информировать о риске рецидива, и обязательна строгая программа последующего наблюдения с использованием клинических методов и методов визуализации [11]. Четыре из пяти случаев, о которых сообщалось в нашем исследовании, подверглись хирургическому лечению путем тотальной гистерэктомии в качестве первого доступа или в качестве полной хирургической стадии (второй осмотр). В двух случаях мы провели промывание брюшины, которое в обоих случаях было отрицательным.
Как сообщает Ip et al.Пни характеризуются возможностью повторного появления с задержкой. Однако у них самая высокая средняя выживаемость после рецидива, в отличие от агрессивной злокачественной неоплазии матки [6,14-17]. Рецидивирующие STUMP являются биологически низкосортными LMS; Однако, используя современные методы анализа, этот диагноз нельзя поставить до тех пор, пока не разовьется рецидив [7].
Похоже, что нет единого мнения относительно гистологических признаков, способных предсказать вероятность и клинических характеристик рецидива, таких как анатомическая локализация (таз, брюшная полость, печень, легкие, лимфатические узлы, плечевая кость, забрюшинное пространство и матка — если гистерэктомия была выполнена). ранее не выполнялись), сроках (от 15 месяцев до 9 лет) и гистологическом типе (STUMP или лейомиосаркома) [2,6,9,11,12,18].Более того, ни демографические характеристики (возраст, этническая принадлежность, употребление табака), ни обычные онкологические сывороточные маркеры (CA125 и He4) не позволяют прогнозировать рецидив заболевания [9,19,20].
ПНИ могут повторяться либо как ПНИ [21,22], либо как лейомиосаркомы [2,5,21]. В случае рецидива лечением выбора является хирургическое удаление с последующей адъювантной терапией, такой как облучение таза, химиотерапия (доксорубицин и цисплатин), медроксипрогестерон и аналог гонадотропин-рилизинг-гормона [2,5,21-24].В то время как эффективность адъювантной терапии общепризнана, клиническое течение без осложнений было отмечено даже в отсутствие такого лечения [7].
Дело, представленное Шапиро и др. [11] также подчеркивает неопределенный прогноз, который несет в себе диагноз STUMP, даже в случае гистологического отсутствия CTCN. Клиническое ведение и последующее наблюдение этого заболевания остаются предметом дискуссий [10].
Пациенты в нашем исследовании были европеоидной расы; возраст колебался от 44 до 51 года.Адъювантная терапия не проводилась ни у одного пациента из нашей серии случаев, и в течение периода наблюдения не наблюдалось рецидивов. В нашей ранее опубликованной серии случаев мы сообщили [1] 3 случая, из которых только в одном случае развился рецидив с признаками диффузных метастазов в легкие через 9 лет после первоначального диагноза: в настоящее время клинические особенности трех пациентов не изменились.
Ip et al. [5] сообщили о серии случаев из 16 пациентов с диагнозом STUMP. Адъювантная терапия не проводилась ни одному из пациентов исследуемой группы.Рецидив заболевания наблюдался только в 2 случаях, оба из которых имели иммуногистологический диагноз AL-LE и положительное окрашивание на p16 и p53. Авторы предполагают потенциальную роль иммуногистохимии p16 и p53 в идентификации более агрессивной формы STUMP. Аткинс и др. [10] сообщили о трех случаях (из 8 пациентов) метастатического заболевания после постановки диагноза STUMP: у первого пациента развились метастазы в брюшину и лимфатические узлы, и он был последовательно пролечен прогестероном после удаления опухоли и оставался здоровым в течение трех. годы; у других пациентов развились метастазы в печень, которые лечили хирургическим путем.Согласно Ip et al, иммуногистохимический анализ показал сильное положительное окрашивание на p16 с диффузным и фокальным распределением соответственно в 2 и 1 из наблюдаемых рецидивов.
В настоящее время прогестерон, аналог ГнРГ или химиотерапевтические агенты были предложены в качестве адъювантной терапии, но пока ни один из них не доказал свою эффективность в предотвращении рецидивов заболевания [5,6,9]. Если эффективность прогестерона подтверждена, внутриматочная спираль, высвобождающая прогестерон (LNS-IUS), может быть подходящим вариантом в случае операции по сохранению фертильности [25].Кроме того, отсутствует консенсус относительно внедрения протоколов последующего наблюдения [6,7]. Ip et al. Предлагают интенсивную программу последующего наблюдения с оценкой, проводимой каждые 6 месяцев в течение первых 5 лет, с последующим ежегодным наблюдением в течение следующих 5 лет [6,7]. В нашем Институте у пациентов, перенесших гистерэктомию, мы обычно проводим клиническую оценку каждые шесть месяцев с последующим ежегодным компьютерным томографическим сканированием (КТ) всего тела, тогда как у пациентов, которым была проведена операция по сохранению матки, мы проводим клиническую и сонографическую оценку каждый раз. 6 месяцев и ежегодная магнитно-резонансная томография (МРТ) малого таза в сочетании с рентгеном грудной клетки.
Выводы
Классификация новообразований гладкомышечных клеток матки с неизвестным злокачественным потенциалом остается спорной. Некоторые авторы предполагают, что, возможно, даже определенные типы «доброкачественных лейомиом» из-за агрессивного клинического поведения, которое их характеризует, должны быть включены в настоящую классификацию [26].
Пациентов с ПНТ необходимо проконсультировать относительно потенциального риска рецидива лейомиосаркомы. Многопрофильное лечение, осуществляемое командой, состоящей из гинеколога, профильного патолога (имеющего опыт работы в гинекологической патологии) и онколога, является обязательным для раннего выявления этого заболевания и определения лечения по выбору и программы последующего наблюдения.Несмотря на то, что STUMP демонстрируют низкую степень злокачественности, длительную выживаемость и отсрочку рецидива, пациенты с STUMP требуют более тщательного наблюдения, чем ежегодное обследование, из-за немалого риска метастазов даже через много лет после первоначального диагноза. Исходя из этого, мы считаем, что пациенты, пораженные STUMP, должны проходить долгосрочное наблюдение с использованием методов клинической оценки и визуализации [5].
Наконец, в соответствии с Atkins et al. и Ip et al., возможность тестирования с помощью иммуногистохимического анализа избыточной экспрессии p16 и p53 в гистологических образцах может быть полезной в будущем для выявления группы пациентов с повышенным риском рецидива, которым может быть полезно «индивидуализированное» хирургическое вмешательство. -онкологические стратегии.
Раскрытие информации о конфликте интересов
Нет.
Ссылки
1. Берретта Р., Ролла М., Меризио С., Джордано Дж., Нарделли, Великобритания. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: отчет о трех случаях. Int J Gynecol Cancer. 2008. 18: 1121–6. [PubMed] [Google Scholar] 2. Белл SW, Кемпсон RL, Хендриксон MR. Проблемные новообразования гладких мышц матки. Клинико-патологическое исследование 213 случаев. Am J Surg Pathol. 1994; 18: 535–58. [PubMed] [Google Scholar] 3. Кемпсон Р.Л.Саркомы и родственные новообразования. В: Норрис HJ, Hertig AT, Abell MR, редакторы. Матка. Балтимор: Уильямс и Уилкинс; 1973. [Google Scholar] 4. Тавассоли Ф.А., Девили П. Классификация опухолей Всемирной организации здравоохранения: опухоли груди и женских половых органов. Лион: Международное агентство исследований рака Press; 2003. С. 236–239. [Google Scholar] 5. ИП П.П., Чунг А.Н., Клемент ПБ. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев.Am J Surg Pathol. 2009; 33: 992–1005. [PubMed] [Google Scholar] 6. Ип П.П., Це К.Ю., Там К.Ф. Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Anat Pathol. 2010. 17: 91–112. [PubMed] [Google Scholar] 7. ИП ПП, Чунг АН. Патология лейомиосарком матки и опухолей гладких мышц с неопределенным злокачественным потенциалом. Лучшая практика Res Clin Obstet Gynaecol.2011; 25: 691–704. [PubMed] [Google Scholar] 8. Розай Дж. Розай и хирургическая патология Акермана. 2-й набор томов; 10-е издание: Глава 19. Elsevier; Дата выпуска 20 июня 2011 г. [Google Scholar] 9. Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Опухоль гладких мышц матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol. 2009. 113: 324–6. [PubMed] [Google Scholar] 10. Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 в улучшении гистологической классификации опухолей гладких мышц матки.Am J Surg Pathol. 2008. 32: 98–102. [PubMed] [Google Scholar] 11. Шапиро А., Ференци А., Тюркотт Р., Брухим I, Готлиб У. Гладкомышечная опухоль матки с неопределенным потенциальным злокачественным новообразованием, метастазирующая в плечевую кость как лейомиосаркома высокой степени. Gynecol Oncol. 2004; 94: 818–20. [PubMed] [Google Scholar] 12. Amant F, Moerman P, Vergote I. Отчет о необычном проблемном новообразовании гладких мышц матки, подчеркивающий прогностическую важность коагуляционного некроза опухолевых клеток. Int J Gynecol Cancer. 2005; 15: 1210–2.[PubMed] [Google Scholar] 13. D’Angelo E, Prat J. Саркомы матки: обзор. Gynecol Oncol. 2010; 116: 131–9. [PubMed] [Google Scholar] 14. Берретта Р., Патрелли Т.С., Файоли Р., Маутоне Д., Гиццо С., Меццоджорно А., Джордано Г., Модена А.Б. Дедифференцированный рак эндометрия: атипичный случай, диагностированный на основании метастазов в мозжечок и надпочечники: описание случая и обзор литературы. Int J Clin Exp Pathol. 2013; 6: 1652–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Gizzo S, Ancona E, Patrelli TS, Saccardi C, Anis O, Donato D, Nardelli GB.Сохранение фертильности у молодых женщин с раком шейки матки: онкологическая дилемма или новая концепция операции по сохранению фертильности? Рак Инвест. 2013; 31: 189. [PubMed] [Google Scholar] 16. Patrelli TS, Gizzo S, Di Gangi S, Guidi G, Rondinelli M, Nardelli GB. Мюллерова аденосаркома шейки матки с гетерологичным саркоматозным разрастанием: четвертый случай и обзор литературы. BMC Рак. 2011; 11: 236. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Патрелли Т.С., Силини Е.М., Гиццо С., Берретта Р., Франки Л., Тай Э., Луканович А., Нарделли Г.Б., Модена А.Б.Экстрагенитальная мюллерова аденосаркома с мешочной локализацией Дугласа. BMC Рак. 2011; 11: 171. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Ng JS, Han A, Chew SH, Low J. Клинико-патологическое исследование опухолей гладких мышц матки с неопределенным злокачественным потенциалом (STUMP) Ann Acad Med Singapore. 2010; 39: 625–8. [PubMed] [Google Scholar] 19. Gizzo S, Ancona E, Saccardi C, D’Antona D, Nardelli GB, Plebani M. Может ли нарушение клубочковой фильтрации почек представлять собой «ахиллесовую пяту» маркера сыворотки HE4? Возможное дальнейшее следствие.Clin Chem Lab Med. 2014; 52: e45–6. [PubMed] [Google Scholar] 20. Патрелли Т.С., Берретта Р., Гиццо С., Пеццуто А., Франки Л., Луканович А., Нарделли Г.Б., Модена А.Б. Значения CA 125 в сыворотке у пациентов с хирургическим лечением эндометриоза и его взаимосвязь с анатомическими участками эндометриоза и частотой наступления беременности. Fertil Steril. 2011; 95: 393–6. [PubMed] [Google Scholar] 21. Климент ПБ. Патология опухолей гладких мышц матки и смешанных стромально-гладкомышечных опухолей эндометрия: выборочный обзор с акцентом на последние достижения.Int J Gynecol Pathol. 2000; 19: 39–55. [PubMed] [Google Scholar] 22. Гао Х.Г., ЛиВолси В.А., Чжан П.Дж. Использование красителей трихрома и ретикулина для характеристики некрозов при опухолях гладкой мускулатуры матки. Мод Pathol. 2007; 20: 198А. [Google Scholar] 23. Миттал К., Попиолек Д., Демопулос Р.И. Миксоидная лейомиосаркома матки внутри лейомиомы. Hum Pathol. 2000; 31: 398–400. [PubMed] [Google Scholar] 24. Клемент ПБ, Янг Р.Х. Атлас гинекологической хирургической патологии. 2-е издание. Филадельфия: У. Б. Сондерс; 2007. Мезенхимальные и смешанные эпителиально-мезенхимальные опухоли тела и шейки матки; стр.194–235. [Google Scholar] 25. Gizzo S, Di Gangi S, Bertocco A, Noventa M, Fagherazzi S, Ancona E, Saccardi C, Patrelli TS, D’Antona D, Nardelli GB. Внутриматочная система левоноргестрела в адъювантной терапии тамоксифеном: баланс риска для груди и пользы для эндометрия — систематический обзор литературы. Reprod Sci. 2014; 21: 423–31. [PubMed] [Google Scholar] 26. Канчиани Г. Н., Бурбос Н., Дункан Т. Дж., Лонсдейл Р., Ньето Дж. Дж. Позднее проявление метастатического новообразования гладких мышц матки с низким злокачественным потенциалом.J Gynecol Oncol. 2012; 23: 69–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]STUMP, неожиданная находка в большой миоме матки у 20-летнего ребенка w
Отделение акушерства и гинекологии, Госпиталь Лайелла МакЭвина, Аделаида, SA, Австралия
Abstract: Мы сообщаем о случае 20-летней нерожавшей женщины с меноррагией, связанной с гладкомышечной опухолью с неопределенным злокачественным потенциалом (STUMP), которая реагировала на гозерелин. В этом деле подробно рассмотрено расследование и ведение молодой женщины, которая желает постоянного сохранения фертильности.ПЕНЬ — это редкая опухоль матки, имеющая ограниченное количество литературы по лечению и последующему развитию злокачественного новообразования, особенно в случае пациентки, желающей сохранить фертильность.
Ключевые слова: гладкомышечная опухоль с неопределенным злокачественным потенциалом, STUMP, злокачественный потенциал, сохранение фертильности, миома матки
Введение
Гладкомышечная опухоль с неопределенным злокачественным потенциалом (STUMP) включает широкую группу новообразований матки, которые не соответствуют современным гистологическим критериям для диагностики доброкачественной или злокачественной опухоли.Считается, что STUMP может представлять собой «переходную» опухоль между лейомиомой и лейомиосаркомой или, возможно, недиагностированной лейомиосаркомой низкой степени злокачественности. 1 Среди женщин, перенесших гистерэктомию или миомэктомию в связи с предполагаемым диагнозом лейомиомы, 0,01% получают диагноз STUMP. 2 Из-за редкости этого заболевания и непоследовательности диагностических критериев истинную распространенность ПНЯ определить трудно. 8 Кроме того, имеются ограниченные данные о злокачественном потенциале ПНЯ, и это вызывает серьезные разногласия в отношении лечения, особенно когда субъект желает продолжения фертильности, как в вышеупомянутом случае.
История болезни
Врач общей практики направил 20-летнюю нерожавшую женщину из Камбоджи в больницу Лайелла МакЭвина в Аделаиде, Южная Австралия, для оценки обильного менструального кровотечения на фоне большой миомы матки.
В анамнезе у нее были обильные менструальные периоды продолжительностью 8–10 дней со сгустками в течение предыдущих 3–4 лет. Она достигла менархе в 14 лет, и раньше у нее были регулярные месячные и нормальный объем. Она никогда не была сексуально активной.
Она также недавно заметила вздутие живота с симптомами дискомфорта внизу живота, вздутие живота и учащенное мочеиспускание. Она думала, что вздутие живота быстро увеличилось за предыдущие 5–6 месяцев. Не было связанной истории потери аппетита или потери веса.
В течение последнего года она принимала комбинированные оральные противозачаточные таблетки, прописанные ее терапевтом для симптоматического лечения обильных менструаций. В остальном у нее не было серьезной истории болезни в прошлом.
Обследование выявило стройную молодую женщину с индексом массы тела 21. Ее жизненные показатели были в норме. Ее живот был мягким и безболезненным, а от таза исходило твердое, неравномерное образование, которое выступало на 4 см выше пупка. У массы были нечеткие границы и ограниченная мобильность. Клинических признаков асцита не было. Тазовое обследование не проводилось, так как пациентка не вел активную половую жизнь.
Ее исходные исследования выявили гемоглобин 93 г / л (референсный диапазон 115–155 г / л), нормальные тромбоциты, низкий уровень ферритина в сыворотке 10 мкг / л (референтный диапазон 30–250 мкг / л), нормальная лактатдегидрогеназа 163 Ед / л, нормальная функция печени и почек и нормальный посев мочи в середине потока.Трансабдоминальное ультразвуковое исследование показало наличие большой субсерозной миомы на дне матки размером 20 × 18 см. Невозможно было визуализировать оба яичника, поскольку миома занимала таз, но свободной жидкости внутрибрюшинно не было.
Был поставлен предварительный диагноз обильного менструального кровотечения и железодефицитной анемии, вторичных по отношению к большой лейомиоме. Магнитно-резонансная томография (МРТ) брюшной полости и таза была проведена из-за быстрого роста в анамнезе.
МРТ с использованием T1 / T2 аксиально-коронарной визуализации и постконтрастной визуализации T1 подтвердила наличие большой миомы дна матки с участками некроза, что указывает на интрамуральную лейомиому с кистозной дегенерацией. Был ассоциированный от легкой до умеренной степени правосторонний гидронефроз, вторичный по отношению к давлению со стороны миомы. Яичники выглядели нормально, лимфаденопатии или асцита не было. Внешний вид не указывал на злокачественное новообразование, перитонеальных или отдаленных метастазов не наблюдалось.
Результаты были обсуждены с пациентом, и после соответствующего консультирования пациент был начат 3.Подкожный имплантат гозерелина (агонист гонадотропин-рилизинг-гормона [GnRH]) по 6 мг каждые 4 недели в течение 6 месяцев. Этот препарат в конечном итоге приводит к подавлению гонадотропинов гипофиза, что приводит к гипогонадальному состоянию у пациента. гозерелин используется в качестве краткосрочной предоперационной терапии для облегчения хирургического лечения миомы за счет уменьшения объема опухоли и облегчения лечения анемии за счет ограничения кровопотери.
Она хорошо перенесла имплант без каких-либо серьезных побочных эффектов.Ей также сделали внутривенное вливание железа.
После шести доз гозерелина размер миомы значительно уменьшился и теперь составляет 2 см ниже пупка. Учитывая тот факт, что предполагаемая миома обычно реагировала уменьшением объема на гормональное лечение, это было интерпретировано как обнадеживающее для доброкачественного диагноза. Впоследствии пациент получил согласие на миомэктомию. Это было выполнено через разрез Pfannenstiel, выявив увеличенную матку с единственной субсерозной фибромой в передней стенке.И яичники, и трубы в норме. В тазу не было свободной жидкости и видимых признаков злокачественного новообразования. На уровне перешейка матки был наложен жгут, чтобы временно уменьшить приток крови к матке за счет сжатия восходящих ветвей маточной артерии, после чего была выполнена миомэктомия. Дефект ушили в два слоя швами Полиглактин 910. Гемостаз удовлетворительный, расчетная кровопотеря — 100 мл. Послеоперационное восстановление протекало без осложнений, пациент был выписан на 3-й день.
Послеоперационная гистология образца была отмечена как STUMP. Опухоль имела низкий митотический индекс с пятью митотическими фигурами на 10 мощных полей (HPF) и отсутствие коагуляционного некроза опухоли; однако сообщалось о диффузной значительной цитологической атипии.
Ее случай был передан в гинекологическую онкологическую бригаду Королевской больницы Аделаиды, и после обзора мультидисциплинарной группы вместе с обзором научной литературы было решено, что ее лечение должно включать ежегодные клинические обзоры и УЗИ органов малого таза, и ей следует сделать простую гистерэктомию, когда она пополняет ее семью.Пациентка была уверена в низком потенциале злокачественных новообразований и низком риске рецидива. Письменное информированное согласие было предоставлено пациентом для публикации деталей случая.
Обсуждение
STUMP часто проявляется симптомами доброкачественной лейомиомы. Как и в этом случае, эти симптомы включают комбинацию аномального маточного кровотечения, образования в тазу или симптомов, вызванных вторичным сдавлением и анемией. 3 Возраст начала заболевания аналогичен возрасту лейомиомы или лейомиосаркомы, и мало что известно о конкретных факторах риска, которые предрасполагают к постановке диагноза STUMP.В литературе предполагается, что средний возраст, в котором ставится диагноз ПНТ, составляет 43 года; однако из-за редкости этого диагноза демографические данные ограничены. 4 Это делает предоперационный диагноз практически невозможным, и, следовательно, STUMP часто неожиданно обнаруживается после гистерэктомии или миомэктомии. До операции очень сложно отличить доброкачественную лейомиому от злокачественной саркомы. МРТ использовалась для различения доброкачественных и злокачественных опухолей матки с использованием повышенной интенсивности сигнала; однако существует мало доказательств, позволяющих отличить STUMP от лейомиомы. 5 Этот метод следует использовать в случаях с высоким подозрением на саркому, как это было в случае, когда в анамнезе предполагалось быстрое увеличение размера миомы у молодой азиатской женщины. Однако следует отметить, что почти все быстрорастущие миомы являются гистологически доброкачественными, и МРТ не может достоверно исключить злокачественную патологию. 6 Однако это наиболее чувствительный метод визуализации, доступный для предоперационной диагностики лейомиосаркомы. Было высказано предположение, что ~ 54% лейомиосарком матки не были идентифицированы до операции. 7
Текущие критерии гистопатологической классификации опухолей гладких мышц основаны на Стэнфордских критериях, и они диагностируются путем оценки обильного митоза (≥10 на 10 HPF), клеточной атипии и наличия областей коагуляционного некроза опухолевых клеток. 3,8 STUMP имеет комбинацию вышеперечисленных функций, не выполняя диагностику лейомиосаркомы. 3 Учитывая гетерогенность гистологических характеристик опухолей, классифицированных в этой группе, можно предположить, что существуют значительные различия в естественном течении и исходах в этой группе.Таким образом, в нескольких исследованиях эти опухоли были дополнительно подразделены на подклассы, чтобы лучше предсказать прогноз. В этом случае у нашей пациентки были гистологические особенности, соответствующие диагнозу STUMP, поскольку у нее был низкий митотический индекс и отсутствие коагуляционного некроза, но значительная диффузная клеточная атипия. Одно из таких исследований дополнительно классифицировало эти опухоли на «атипичную лейомиому с ограниченным опытом», «опухоли гладких мышц с низким злокачественным потенциалом», «атипичную лейомиому — низкий риск рецидива» и «митотически активную лейомиому — ограниченный опыт». 9 В этом обсервационном исследовании рецидив произошел в 2 из 16 случаев, причем оба относились к «группе атипичной лейомиомы с ограниченным опытом» с гистологическими признаками «мультифокальной атипии от умеренной до тяжелой, без некроза опухолевых клеток и количеством митотических клеток. четыре и пять митотических фигур / 10 HPF соответственно », 9 , как в случае с нашим пациентом. Было высказано предположение, что более высокая частота рецидивов может быть связана с диффузной иммунореактивностью для p16 и P53. 9,10 Однако это следует использовать с осторожностью, поскольку количество исследований было небольшим и требует дальнейшей оценки, прежде чем можно будет сделать окончательные результаты.
В целом, эти опухоли часто медленно растут и метастазируют позже по сравнению с лейомиосаркомами. 3 Тем не менее, было показано, что STUMP рецидивирует, метастазирует и трансформируется в лейомиосаркому. 11 Следует отметить, что было высказано предположение, что у более молодых пациентов вероятность рецидива заболевания выше, чем у их старших коллег. 1 В одном исследовании сообщалось, что среднее время рецидива составляло 51 месяц, при этом рецидив регистрировался от 15 месяцев до 9 лет. 12 Частота рецидивов STUMP составляет от 7,3% до 26% в зависимости от подтипа, 3,4,9,13 с общей частотой рецидивов 11%. 3 Однако истинную частоту рецидивов трудно определить из-за различных диагностических критериев, представленных в исследованиях, ограниченного размера выборки и различных сроков наблюдения, указанных в этих исследованиях. Следует отметить, что было высказано предположение, что опухоли, связанные с рецидивом, часто имеют диффузную иммунореактивность p16 и p53. 3
Из-за нехватки доступной литературы консенсус относительно ведения не был достигнут, и от клиницистов требуется моделировать дальнейшее ведение и последующее наблюдение на основе ограниченных, в основном данных наблюдений.Было высказано предположение, что методом выбора является гистерэктомия. Стандартное последующее наблюдение после гистерэктомии составляло шесть месяцев в течение 5 лет с последующим ежегодным наблюдением в течение следующих 5 лет с обзором симптомов при каждом посещении и ежегодной визуализацией с помощью МРТ для доказательства рецидива или метастазов.
Пациентам, которые выбирают сохранение фертильности, требуется более частый мониторинг. 3 и его необходимо сопоставить с риском рецидива. Рекомендуется обследовать этих пациентов на предмет рецидива до зачатия. 12 Это особенно важно для этой пациентки, учитывая ее гистологические особенности, поскольку она, вероятно, имеет повышенный риск рецидива заболевания по сравнению с другими формами STUMP. Хотя рецидив заболевания часто имеет хороший прогноз, ранее сообщалось о смерти. 12 Адъювантная терапия прогестероном, аналогом GnRH или химиотерапия была предложена для пациентов, страдающих рецидивом STUMP. 1,3 Однако имеется мало данных об использовании этих агентов для предотвращения рецидивов заболевания или для лечения первичного заболевания.Нашему пациенту первоначально назначили гозерелин (агонист ГнРГ), который уменьшил размер опухоли STUMP. Следует рассмотреть вопрос о дальнейших исследованиях, чтобы изучить роль этого агента в лечении этого новообразования.
Успешная беременность ранее была документально подтверждена после предварительного диагноза STUMP. 12 Это произошло у пациента с p16- и 53-отрицательной гистопатологией и самопроизвольным зачатием через 6 месяцев после миомэктомии. В этом случае пациентка перенесла гистерэктомию через 1 год после родов, и в настоящее время у нее нет рецидива через 4 года после операции.Это особенно важно в данном случае, поскольку наша пациентка — 20-летняя нерожавшая женщина, и окончательное лечение с помощью гистерэктомии может иметь значительные психологические и психосоциальные последствия без явного улучшения прогноза. Тем не менее, это необходимо сбалансировать с учетом риска рецидива, и рекомендуется строгое наблюдение с учетом послеродовой гистерэктомии. Наш пациент прошел обширное послеоперационное консультирование и с помощью многопрофильной команды гинекологов-онкологов выбрал сохранение фертильности и выжидательную тактику.
Вся информация, относящаяся к вышеупомянутому случаю, была собрана с помощью поисковой системы PubMed посредством поиска по ключевым словам и использования медицинских предметных заголовков. Журнальные статьи исключались, если публикация не была представлена на английском языке.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Список литературы
1. | Далл’Аста А., Гиззо С., Мусаро А. и др.Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): патология, наблюдение и рецидивы. Int J Clin Exp Pathol . 2014. 7 (11): 8136–8142. | |
2. | Picerno TM, Wasson MN, Gonzalez Rios AR, et al. Морцелляция и частота скрытых злокачественных новообразований матки: обзор двойного учреждения. Int J Гинекольный рак . 2016; 26 (1): 149–155. | |
3. | IP PP, Tse KY, Tam KF.Опухоли гладкой мускулатуры матки, отличные от обычных лейомиом и лейомиосарком: обзор выбранных вариантов с акцентом на недавние достижения и необычную морфологию, которая может вызывать опасения по поводу злокачественности. Adv Анат Патол . 2010. 17 (2): 91–112. | |
4. | Guntupalli SR, Ramirez PT, Anderson ML, Milam MR, Bodurka DC, Malpica A. Гладкомышечная опухоль матки с неопределенным злокачественным потенциалом: ретроспективный анализ. Gynecol Oncol .2009. 113 (3): 324–326. | |
5. | Schwartz LB, Zawin M, Carcangiu ML, Lange R, McCarthy S. Различают ли тазовая магнитно-резонансная томография между гистологическими подтипами лейомиомы матки? Fertil Steril . 1998. 70 (3): 580–587. | |
6. | Benson C, Miah AB. Саркома матки — современные перспективы. Int J Женское здоровье . 2017; 9: 597–606. | |
7. | Skorstad M, Kent A, Lieng M. Предоперационная оценка у женщин с лейомиосаркомой матки. Общенациональное когортное исследование. Acta Obstet Gynecol Scand . 2016; 95 (11): 1228–1234. | |
8. | Стюарт EA, Quade BJ, Laughlin-Tommaso SK [домашняя страница в Интернете]. Варианты леймиомы (миомы) матки. 2017. Доступно по адресу: http://www.uptodate.com. Доступ 13 августа 2017 г. | |
9. | IP PP, Cheung AN, Clement PB. Опухоли гладкой мускулатуры матки с неопределенным злокачественным потенциалом (STUMP): клинико-патологический анализ 16 случаев. Am J Surg Pathol . 2009. 33 (7): 992–1005. | |
10. | Аткинс К.А., Арронте Н., Дарус С.Дж., Райс Л.В. Использование p16 для улучшения гистологической классификации опухолей гладких мышц матки. Am J Surg Pathol .2008. 32 (1): 98–102. | |
11. | Maccio A, Chiappe G, Kotsonis P, et al. Абдоминальный лейомиосаркоматоз после операции с внешней морцеллой по поводу скрытых гладкомышечных опухолей с неопределенным злокачественным потенциалом: отчет о клиническом случае. |


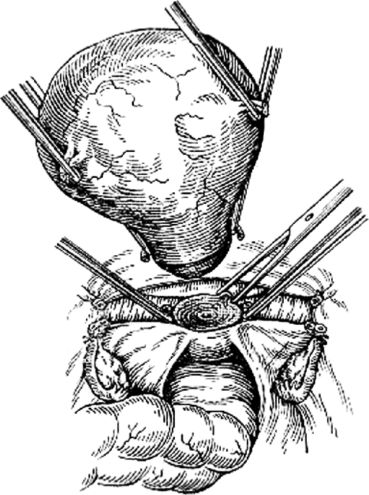
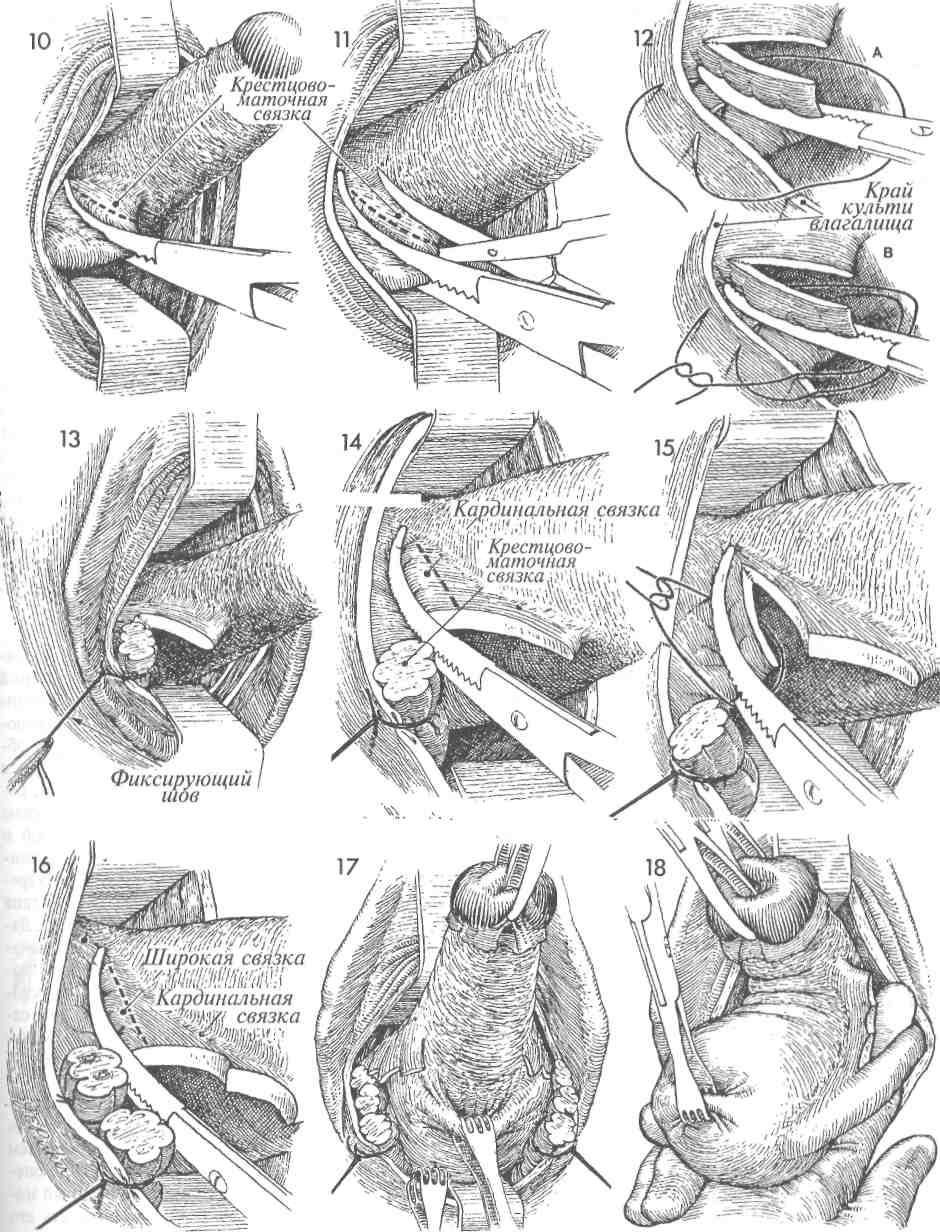 Поэтому пациентки быстро восстанавливаются и возвращаются к полноценной жизни.
Поэтому пациентки быстро восстанавливаются и возвращаются к полноценной жизни.
 Ситуация довольно редкая, но имеет место быть
Ситуация довольно редкая, но имеет место быть