Все о кишечной палочке | Domestos
Причины передачи кишечной палочки, причины и каналы ее распространения, а также методы профилактики.
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Мы поможем вам разобраться с такими вопросами, как «кишечная палочка: причины», «как передается кишечная палочка?» и расскажем, каким образом Domestos может помочь убить вредоносные бактерии, живущие в вашем туалете, и предотвратить распространение заболевания. Давайте рассмотрим подробнее, что представляет собой эта бактерия.
Кишечная палочка: симптомы
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Перед тем, как ответить на вопросы «откуда берется кишечная палочка?» и «как передается кишечная палочка?», нужно упомянуть симптомы, появляющиеся при заражении, такие как рвота, спазмы желудка и температура.
Кишечная палочка: причины
Одним из первых шагов по профилактике кишечной палочки в вашем доме должен стать ответ на вопрос «как передается кишечная палочка?» Для этого существует несколько основных причин:
Зараженная еда:
Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
Зараженная вода:
Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.
Все описанные выше причины и являются ответом на вопрос «откуда возникает кишечная палочка?» А теперь перейдем к самому важному – профилактике кишечной палочки в вашем доме.
Кишечная палочка передается?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка: профилактика с помощью личной гигиены
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
После обращения с животными
После любого контакта с зараженным человеком
Перед и после приготовления еды
После замены подгузников, грязной одежды или постельного белья
После использования туалета
После уборки
Кишечная палочка: профилактика дома
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
Следуйте этим простым советам, чтобы защитить свой дом:
Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.![]()
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат — чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
Кишечная палочка
Микроорганизмы в пищевых продуктах присутствуют всегда. Патогенные микроорганизмы могут быть уничтожены благодаря обработке продуктов. Они могут стремительно размножаться из-за неправильной транспортировки, хранения, приготовления, или подачи. Увеличение количества этих микроорганизмов может привести не только к порче пищи, но и вызвать серьёзное отравление. Распространённый представитель пищевых патогенных бактерий — кишечная палочка. Кишечная палочка является частью микрофлоры кишечника человека и животных.
Распространённый представитель пищевых патогенных бактерий — кишечная палочка. Кишечная палочка является частью микрофлоры кишечника человека и животных.
Некоторые виды кишечных палочек — патогенные для человека, то есть способны вызвать заболевание.
Бактерии группы кишечной палочки — универсальный показатель качества пищевых продуктов. Наличие кишечной палочки — показатель фекального загрязнения, особенно воды.
К сожалению, по внешнему виду, запаху или вкусу мы не сможем сказать, загрязнена ли пища кишечной палочкой (E. coli).
Кишечной палочкой могут быть обсеменены многие продукты, включая говядину, зелень, готовые к употреблению салаты, фрукты, сырое молоко и сырое тесто, нарезки колбас, сыров , особенно в условиях рынка, где не всегда обрабатывается аппарат для нарезки, мясорубки для приготовления фарша. Кишечная палочка активно размножается во время гниения продуктов.
Механизм передачи возбудителя фокально-оральный. Заражение происходит через пищу, воду, грязные руки.
Эта бактерия способна вырабатывать токсины (25 типов) и в зависимости от типа токсина, вырабатываемого кишечной палочкой, она обладают определенным действием.
Например, энтеротоксигенные E.coli имеют высокомолекулярный термолабильный токсин, который действует аналогично холерному, вызывая холероподобную диарею (гастроэнтериты у детей младшего возраста, диарею путешественников и др.).
Энтероинвазивные кишечные палочки вызывают профузную диарею с примесью крови и большим количеством лейкоцитов (аналогично дизентерие).
Энтеропатогенные E.coli вызыают водянистую диарею и выраженное обезвоживание.
Энтерогеморрагические кишечные палочки вызывают диарею с примесью крови.
Симптомы
Симптомы пищевого отравления отравления кишечной палочкой: боль в животе, тошнота, рвота, диарея более 20 раз в сутки, возможно с кровью. Температура тела обычно повышается незначительно или остаётся в норме.
Кишечная палочка является наиболее распространенным патогеном, вызывающим менингит у новорождённых детей. Он имеет высокие показатели заболеваемости и смертности во всем мире.
Он имеет высокие показатели заболеваемости и смертности во всем мире.
В группе риска
-Взрослые в возрасте 65 лет и старше
-Дети младше 5 лет
-Люди с ослабленной иммунной системой, в том числе беременные
-Люди, которые путешествуют в определенные страны
Профилактика
Чтобы защитить себя от инфекций, вызванных кишечной палочкой, а также от других болезней пищевого происхождения, соблюдайте основные правила безопасности:
-Мойте руки, посуду и кухонные поверхности горячей мыльной водой до и после приготовления или приема пищи.
— Используйте отдельные разделочные доски для сырых продуктов и готовых
-Тщательно мойте фрукты и овощи, испотльзуйте щетку для овощей.
-Держите сырые продукты, особенно мясо и птицу, отдельно от готовых к употреблению продуктов.
— Охлаждайте или замораживайте скоропортящиеся продукты как можно быстрее.
— Избегайте непастеризованных соков, молочных продуктов.
— Не ешьте сырое тесто.
— Пейте бутилированную воду.
-Тщательно прожаривайте мясо.
Кишечную палочку перевели на питание метанолом
Frederic Y.-H. Chen et al. / Cell, 2020
Тайваньские ученые вывели штамм кишечной палочки (Escherichia coli), способный использовать метанол в качестве единственного источника пищи, сообщается в Cell. Скорость размножения таких бактерий значимо не отличалась от скорости размножения видов, которые изначально были метилотрофами: количество питающихся метанолом кишечных палочек удваивалось каждые 8,5 часа.
Чтобы поддерживать различные биохимические процессы в организме и обновлять структуры в его составе, всему живому необходимо питаться — получать энергию, углерод и электроны. В зависимости от того, какими источниками пищи пользуется вид, его относят к разным категориям «-трофов» («питающихся» по-древнегречески). К примеру, среди бактерий существуют метилотрофы — те, кто получает углерод и электроны из производных метана CH4, но не из него самого. Однако их не очень много.
Меж тем метанол (CH3OH) — соединение, способное служить хорошим источником электронов для микроорганизмов. Кроме того, его легко получить из парниковых газов — CO2
и метана. Если бы получилось создать легко разводимых бактерий, которые могут перерабатывать метанол, удалось бы снизить выбросы этих газов в атмосферу.
Попытки вывести метилотрофов уже предпринимали с кишечной палочкой (Escherichia coli) — самым популярным модельным объектом-прокариотом. Для этого разные коллективы микробиологов определяли, какие ферменты позволят бактериям перерабатывать CH3OH и какими генами эти ферменты кодируются. Также выявляли, какие методики культивирования лучше использовать, чтобы максимально эффективно выращивать нужные бактерии. Однако штаммов кишечной палочки, которые были бы способны использовать метанол в качестве единственного источника питания, пока не создали.
Теперь сотрудники Института биологической химии Академии Синика (Тайвань) под руководством Джеймса Ляо (James C. Liao) сумели добиться того, чтобы E. coli выживала и с приемлемой скоростью размножалась на одном лишь метаноле. Для этого они постепенно, не за одно поколение, заменяли бактериям гены ферментов, участвующих в пентозофосфатном цикле, на такие, которые позволяют перерабатывать метанол (новые гены «брали» из метилотрофов).
Первые модифицированные бактерии могли расти на среде, содержащей метанол и сахар ксилозу. Они пока не могли питаться одним лишь метанолом, но и не были в состоянии жить только на одной ксилозе. Это создало эволюционное давление, в ходе которого в популяции закреплялись гены, позволяющие перерабатывать метанол. Затем E. coli заменяли и другие участки ДНК, за счет чего находили оптимальный уровень экспрессии генов, нужных для метаболизма CH3OH. Дело в том, что при его переработке образуется токсичный формальдегид, который нужно успевать нейтрализовать. Состав питательной среды тоже меняли так, что в конечном счете в ней остался только метанол.
Изменения генов и состава питательной среды при создании кишечных палочек-метилотрофов
Frederic Y. -H. Chen et al. / Cell, 2020
-H. Chen et al. / Cell, 2020
 Число клеток у него при питании метанолом могло удваиваться за 8,5 часа, что сопоставимо с возможностями «природных» представителей этой группы — Methylobacterium extorquens (от 4 до 6 часов в зависимости от штамма) и грибов Pichia pastoris (8,2 часа).
Число клеток у него при питании метанолом могло удваиваться за 8,5 часа, что сопоставимо с возможностями «природных» представителей этой группы — Methylobacterium extorquens (от 4 до 6 часов в зависимости от штамма) и грибов Pichia pastoris (8,2 часа).Схема исследования
Frederic Y.-H. Chen et al. / Cell, 2020
Исследование тайваньских ученых показало, что хотя сменить источник электронов и углерода у бактерий и сложно, но возможно. В дальнейшем можно будет создать штаммы E. coli, которые производят из метанола конкретные нужные человеку вещества. Если удастся внедрить бактерии гены метанмонооксигеназ, превращающих метан в метанол, и они будут работать, тогда «синтетические» метилотрофы смогут питаться метаном и появится новый способ утилизации этого парникового газа. Существующих метанотрофов сложно использовать для этой цели, так как им для жизни обычно нужна среда, далекая от лабораторной, — почва, лед или тела других организмов.
Существующих метанотрофов сложно использовать для этой цели, так как им для жизни обычно нужна среда, далекая от лабораторной, — почва, лед или тела других организмов.Светлана Ястребова
Физики порвали кишечную палочку
Adrián del Valle et al.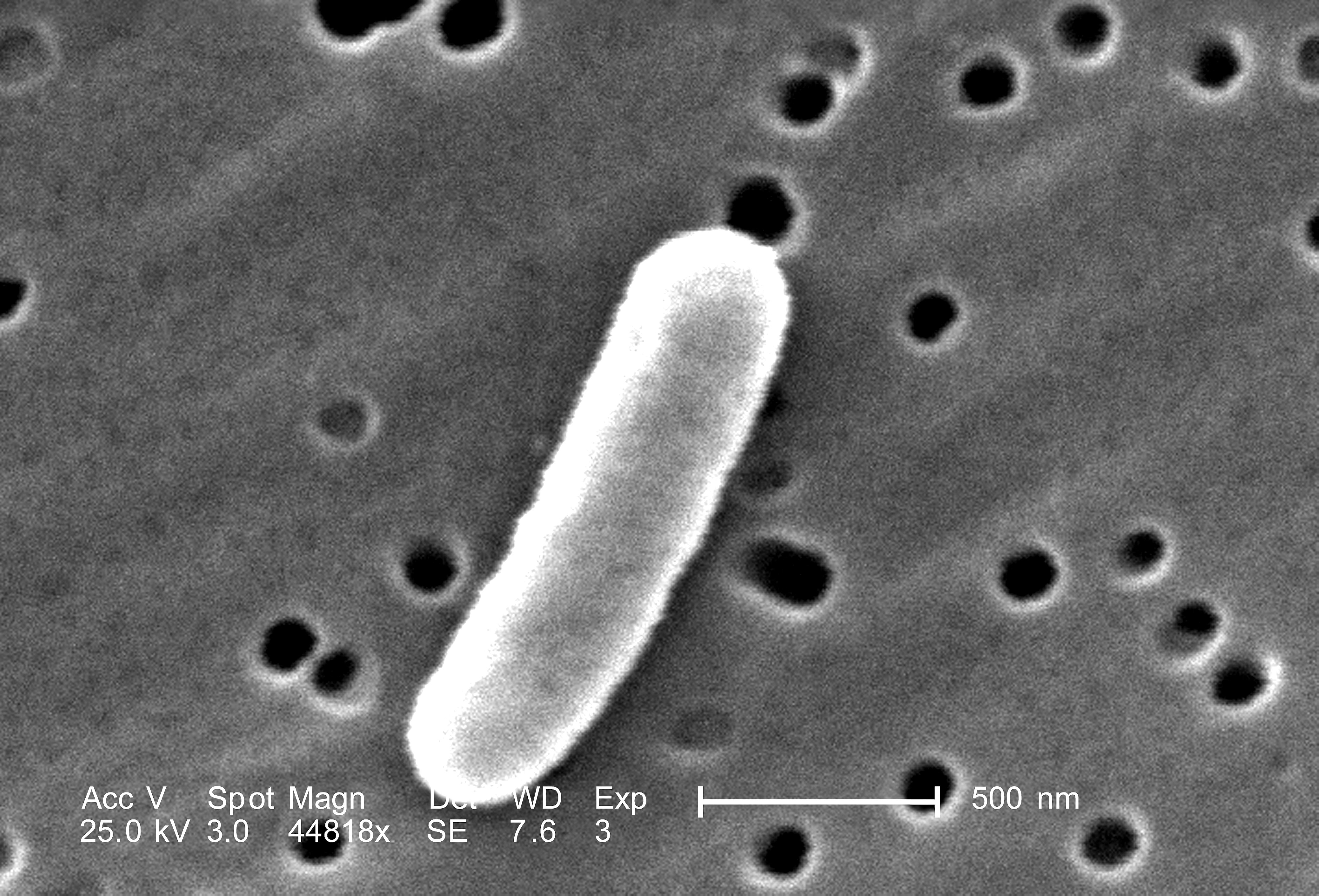
Испанским физикам удалось прорвать клеточную стенку кишечной палочки с помощью иглы атомно-силового микроскопа. Для разрыва понадобилась сила более 20 наноньютонов, что превышает предыдущие оценки. Кроме того, оказалось, что для прекращения клеточного деления палочки достаточно и слабых надавливаний. В статье, опубликованной в журнале ACS Applied Materials & Interfaces, для достижения такого механо-бактерицидного эффекта ученые предлагают использовать вытянутые коллоидные наночастицы в растворе.
В последние годы бактерии со все большей скоростью приспосабливаются к традиционным химическим антибиотикам, после чего последние перестают работать (подробно о проблемах современных антибиотиков и мультирезистентных бактерий мы уже писали в материале «Конец прекрасной эпохи»).
Механизм такого разрушения клеточной стенки до конца не изучен, хотя ученые уже наблюдали за ним через атомный силовой микроскоп и пытались моделировать. Так, физики уже прокалывали иглой атомно-силового микроскопа клеточную стенку грамотрицательной бактерии Salmonella typhimurium — для разрыва потребовалась сила в один-два наноньютона. Однако ученые заметили, что клетка все еще была жива после нескольких проколов благодаря перестройке фосфолипидов в клеточной мембране. Также иглой атомно-силового микроскопа моделировали взаимодействие бактерии и одностеночной углеродной нанотрубки. Для высушенных клеток Escherichia coli и Bacillus subtilis сила для разрыва клеточной стенки превысила десять наноньютонов, чего не может обеспечить один контакт нанотрубки с бактерией, но его, например, возможно достичь в процессе фильтрации через нанотрубочную мембрану.
Чтобы установить необходимую силу для прокалывания кишечной палочки, испанские физики из Автономного Университета Мадрида под руководством Кристины Флорс (Cristina Flors), надавливали на обездвиженные клетки иглой атомно-силового микроскопа. За жизнеспособностью клетки наблюдали с помощью флуоресценции йодида пропидиума, который после связывания с молекулами ДНК и РНК увеличивает свою светимость.
Зависимость прикладываемой силы от погружения — синими стрелками обозначено событие прорыва клеточной мембраны
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
Ученые надавливали на клеточную стенку с разной силой и в месте разрыва наблюдали резкое изменение механических свойств (после клеточной стенки игла не встречала достаточного сопротивления от цитоплазмы клетки). Разрыв произошел при силе в 20 наноньютон на глубине в 373 нанометра, что приблизительно равно половине диаметра кишечной палочки.
Разрыв произошел при силе в 20 наноньютон на глубине в 373 нанометра, что приблизительно равно половине диаметра кишечной палочки.Изменение флуоресценции со временем при прикладываемой силе в 35 наноньютон, во вставке — картирование до (сверху) и после (снизу) проникновения иглы
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
Изменение флуоресценции со временем при прикладываемой силе в 50 наноньютон, во вставке — картирование до (сверху) и после (снизу) проникновения иглы
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
В отличие от экспериментов с вирусами, у кишечной палочки ученые обнаружили задержку в пару секунд между проколом клеточной стенки и увеличением флуоресценции йодида пропидиума. Чтобы проверить, не мешает ли сама игла проникновению в клетку, физики оставили иглу в кишечной палочке на пять-десять секунд — проникновение вещества началось только после вытаскивания иглы. Такое поведение может быть связано не только с блокировкой отверстия иглой, но и с более сложной диффузией йодида пропидиума по поврежденной бактерии.
Чтобы проверить, не мешает ли сама игла проникновению в клетку, физики оставили иглу в кишечной палочке на пять-десять секунд — проникновение вещества началось только после вытаскивания иглы. Такое поведение может быть связано не только с блокировкой отверстия иглой, но и с более сложной диффузией йодида пропидиума по поврежденной бактерии.
Задержка увеличения флуоресценции при блокировании пути проникновения иглой
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
Далее ученые проследили за физиологическим состоянием клетки во время надавливания с разной силой по периоду колебаний белковой системы Min, которая определяет положение клеточной стенки при делении, что напрямую связано с ее общим состоянием. До надавливания период колебаний составил 63 секунды, при слабом надавливании с силой в пять наноньютонов период незначительно повысился, а при силе в 45 наноньютонов колебания прекратились полностью. Примечательно, что при последовательных надавливаниях с силой в два наноньютона колебания белковой системы также прекращаются, хотя разрушения клеточной оболочки не происходит.
Примечательно, что при последовательных надавливаниях с силой в два наноньютона колебания белковой системы также прекращаются, хотя разрушения клеточной оболочки не происходит.
Сверху — колебания флуоресценкии белковой системы Min. Прерывистая красная линия — приложение небольшой силы в пять наноньютон, прямая красная линия — приложение большой силы, после которой колебания затухли. Ниже кимограммы проколотого образца (P) и контроля (C)
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
Система Min нарушается и при последовательном слабом воздействии иголкой без разрыва клетки
Adrián del Valle et al./ ACS Applied Materials & Interfaces, 2020
Авторы заключили, что для разрушения клеточной оболочки кишечной палочки необязательно ее протыкать: можно просто на нее много раз надавить — и бактерия все равно перестанет функционировать. Именно поэтому для подобного механо-бактерицидного эффекта подойдут, например, и коллоидные продолговатые наночастицы, которые могут перемещаться по всему объему раствора и многократно надавливать на стенки бактерий.
Именно поэтому для подобного механо-бактерицидного эффекта подойдут, например, и коллоидные продолговатые наночастицы, которые могут перемещаться по всему объему раствора и многократно надавливать на стенки бактерий.Сфера традиционных химических антибиотиков тоже развивается: месяц назад американские ученые представили новый препарат, не вызывающий резистентность. Бактерии не смогли выработать устойчивость из-за двойного механизма воздействия вещества SCH-79797 — он влияет сразу на клеточную мембрану и метаболизм фолатов.
Артем Моськин
Посев на энтеропатогенную кишечную палочку О157:Н7 (E.coli О157:Н7) и определение чувствительности к антимикробным препаратам
Метод определения бактериологический
Исследуемый материал Кал
Доступен выезд на дом
Диагностика этиологии геморрагического колита и гемолитического уремического синдрома.
Escherichia coli (или просто E.coli) — грамотрицательные палочковидные бактерии. Названы в честь открывшего их в 1885 г. T. Escherich. Обычный обитатель кишечника. В организме человека E.coli выполняет полезную роль, подавляя рост вредных бактерий и синтезируя некоторые витамины. Но эти бактерии могут вызывать у человека острые кишечные заболевания эшерихиозы с фекально-оральным механизмом заражения.
E. Coli O157:H7 вырабатывает шига-токсин. Инкубационный период длится от 3 до 6 дней. В наибольшей степени восприимчивы к заболеванию дети раннего возраста, пожилые и ослабленные люди.
У детей эшерихиоз протекает в виде различной тяжести энтеритов, энтероколитов в сочетании с синдромом общей интоксикации и острой почечной недостаточностью. При средних и тяжёлых формах сопровождается повышением температуры, поносом, сепсисом.
У взрослых заболевание, вызванное эшерихией, напоминает по течению и клиническим симптомам острую дизентерию. Нередко развивается тромбоцитопеническая пурпура.
Выделяемые возбудители: E. Coli O157:H7.
Обращаем внимание на необходимость предварительного приобретения стерильной пробирки с питательной средой, используемой при взятии биоматериала, в любом медицинском офисе ИНВИТРО.
Литература
- Богомолов Г.И. Дифференциальная диагностика инфекционных болезней М. 2000. 231 стр.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
- Wallach J. Interpretation of diagnostic tests/Lippincott Williams & Wilkins/2000/ 1026 ps.
Роскачество обнаружило кишечную палочку в обезжиренном твороге
https://ria.ru/20210408/tvorog-1727303603.html
Роскачество обнаружило кишечную палочку в обезжиренном твороге
Роскачество нашло кишечную палочку в обезжиренном твороге некоторых производителей
Роскачество обнаружило кишечную палочку в обезжиренном твороге
Исследование обезжиренного творога почти двух десятков известных торговых марок показало наличие кишечной палочки в трети исследованных образцов, говорится в… РИА Новости, 08.04.2021
2021-04-08T08:26
2021-04-08T08:26
2021-04-08T12:45
россия
роскачество
здоровье — общество
общество
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn24.img.ria.ru/images/07e5/04/08/1727345078_0:184:3313:2048_1920x0_80_0_0_ea47cfa99420599f6b7af971fd431c8f.jpg
МОСКВА, 8 апр — РИА Новости. Исследование обезжиренного творога почти двух десятков известных торговых марок показало наличие кишечной палочки в трети исследованных образцов, говорится в сообщении Роскачества.В экспертизу вошла продукция 18 федеральных и региональных российских производителей, а также две торговые марки из Белоруссии, которые были закуплены в пяти крупных федеральных сетях и двух интернет-магазинах. Творог проверили по 113 показателям, включая содержание растительных жиров, наличие антибиотиков и полезных молочнокислых бактерий, а также выяснили, действительно ли его можно назвать обезжиренным.Так, в обезжиренном твороге семи торговых марок были обнаружены бактерии кишечной палочки, в твороге 14 марок значительное превышены нормы количества дрожжей, у некоторых — в 150 раз. «Причин этих нарушений может быть несколько: низкое качество поступающего на производство сырья, нарушение санитарного состояния производства, несоблюдение условий транспортировки, хранения или реализации. Одна из основных причин порчи — хранение творога на прилавке без соблюдения температурного режима», — говорится в сообщении.Также эксперты обнаружили признаки фальсификации — растительные жиры в продукции одного производителя, а три образца других содержали недостаточное количество молочнокислых бактерий. Также было установлено, что у 18 марок жирность творога не превышала одного процента, однако у продукции двух она оказалась выше.
https://rsport.ria.ru/20210407/banan-1727092002.html
https://ria.ru/20210205/pitanie-1596127725.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/07e5/04/08/1727345078_582:0:3313:2048_1920x0_80_0_0_b2d8bf7356fffda478641ef9a9b9e35e.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
россия, роскачество, здоровье — общество, общество
МОСКВА, 8 апр — РИА Новости. Исследование обезжиренного творога почти двух десятков известных торговых марок показало наличие кишечной палочки в трети исследованных образцов, говорится в сообщении Роскачества.«Роскачество завершило исследование обезжиренного творога, с жирностью от нуля до 1,8%. Экспертиза показала, что треть исследованной продукции с нарушениями по безопасности: найдены бактерии кишечной палочки и зафиксированы превышения норм по дрожжам в твороге. Кроме того, обнаружен товар с признаками фальсификации: производитель заменил животный жир растительным», — говорится в сообщении.
В экспертизу вошла продукция 18 федеральных и региональных российских производителей, а также две торговые марки из Белоруссии, которые были закуплены в пяти крупных федеральных сетях и двух интернет-магазинах. Творог проверили по 113 показателям, включая содержание растительных жиров, наличие антибиотиков и полезных молочнокислых бактерий, а также выяснили, действительно ли его можно назвать обезжиренным.
7 апреля, 05:00ЗОЖЧто произойдет с организмом, если съедать один банан каждый деньТак, в обезжиренном твороге семи торговых марок были обнаружены бактерии кишечной палочки, в твороге 14 марок значительное превышены нормы количества дрожжей, у некоторых — в 150 раз. «Причин этих нарушений может быть несколько: низкое качество поступающего на производство сырья, нарушение санитарного состояния производства, несоблюдение условий транспортировки, хранения или реализации. Одна из основных причин порчи — хранение творога на прилавке без соблюдения температурного режима», — говорится в сообщении.
Также эксперты обнаружили признаки фальсификации — растительные жиры в продукции одного производителя, а три образца других содержали недостаточное количество молочнокислых бактерий. Также было установлено, что у 18 марок жирность творога не превышала одного процента, однако у продукции двух она оказалась выше.
5 февраля, 10:41
В популярных марках детского питания нашли мышьяк, свинец и ртутьВ геноме кишечной палочки освободили место под новую информацию. Это дает возможность «заставить» ее гены кодировать новые, несвойственные ей биополимеры — Наука
Переписывание генома — важный шаг на пути к созданию искусственной клетки. Ученые по всему миру раз за разом пытаются его усовершенствовать: то выкинут лишние гены, создав так называемый минимальный геном, то, наоборот, добавят новые буквы-нуклеотиды, расширив генетический алфавит.
Параллельно продолжаются попытки оптимизировать сам генетический код, то есть записать в ДНК информацию более экономичным способом. Механизм, который используют для кодирования информации живые организмы, избыточен: на каждую аминокислоту в ДНК приходится от 1 до 6 «слов» (кодонов, последовательностей из трех нуклеотидов), которые могут ее обозначать. Как правило, кодоны для одной аминокислоты похожи и отличаются в основном последними нуклеотидами. Это нужно для страховки информации от мутаций: если один нуклеотид случайно поменяется на другой, это никак не скажется на последовательности итогового белка именно благодаря избыточности кодонов.
Но если мы беремся синтезировать ДНК с нуля и работать с искусственным геномом, то нам мутации не страшны. Поэтому можно попробовать освободить место в генетическом коде, сделав так, чтобы каждой аминокислоте соответствовало меньшее количество кодонов. В ходе предыдущего подобного эксперимента команда американского молекулярного биолога Джорджа Черча попыталась высвободить целых семь кодонов. Ученые заявили, что им удалось заменить целых 62 с лишним тысячи кодонов, однако они подтвердили это далеко не во всех случаях.
Группа исследователей из США, Великобритании и Таиланда поставила перед собой менее масштабную задачу, но подошла к ней более педантично. Они выбрали три кодона, которые собираются «исключить» из ДНК. Затем они проверили, какие из этих кодонов входят в состав нескольких генов одновременно. Иногда последовательность ДНК можно прочесть как в одну сторону, так и в другую, и не всегда границы «слов»-кодонов при этом совпадают. В таких случаях ученые создавали две копии ДНК — для чтения «туда» и «обратно» — и изменяли их независимо.
В итоге исследователи вывели новую последовательность ДНК кишечной палочки и целиком синтезировали ее заново. Чтобы не нарушить жизнеспособность бактерии, ее внедряли по кусочкам. Всю искусственную молекулу ДНК разбили на восемь частей (от А до Н) и c помощью молекулярных ножниц CRISPR-Cas9 встроили в отдельные искусственные хромосомы. Затем их по отдельности внедрили в клетки кишечной палочки, а дальше эти клетки заставили обмениваться последовательностями ДНК. Причем делали это по очереди: сначала клетки с А-фрагментом «скрестили» с клетками с В-фрагментом. Потом проверили, что в некоторых клетках фрагменты успешно соединились. Затем клетки с АВ-участком подсадили к клеткам с С-участком, и так далее.
На финише клетки кишечной палочки несли полноценную синтетическую ДНК. Они были вполне жизнеспособны, практически не отличались от обычных ни формой, ни скоростью роста, ни белковым составом. Более того, если выключить в них ген, ответственный за транспортную РНК, которая должна узнавать «уничтоженные» кодоны, то в жизни клетки ничего не меняется. Это значит, что ученым удалось полностью убрать из генетического кода кишечной палочки несколько «слов», не повлияв на ее жизнеспособность. Следующим шагом должно стать «обучение» бактерии сборке белков с неканоническими аминокислотами.
Полина Лосева
Высокое число копий и высокостабильная челночная плазмида Escherichia coli — Bacillus subtilis на основе pWB980 | Фабрики микробных клеток
Донг Х., Чжан Д. Текущее развитие стратегий генной инженерии видов Bacillus . Факт о микробной клетке. 2014; 13: 63.
PubMed PubMed Central Статья CAS Google Scholar
Zhang K, Su L, Duan X, Liu L, Wu J. Продукция внеклеточного белка на высоком уровне в Bacillus subtilis с использованием оптимизированной системы экспрессии с двумя промоторами.Факт о микробной клетке. 2017; 16:32.
PubMed PubMed Central Статья CAS Google Scholar
Ji S, Li W, Rasheed Baloch A, Wang M, Li H, Cao B, Zhang H. Эффективный биосинтез мутанта цекропина A-мелиттина в Bacillus subtilis WB700. Научные отчеты. 2017; 7: 40587.
CAS PubMed PubMed Central Статья Google Scholar
Li W, Zhou X, Lu P. Узкие места в экспрессии и секреции гетерологичных белков в Bacillus subtilis . Res Microbiol. 2004. 155: 605–10.
CAS PubMed PubMed Central Статья Google Scholar
Маркус С., Аджай С., Уорд ОП. Развитие использования видов Bacillus в промышленном производстве. Может J Microbiol. 2004; 50: 1.
Артикул Google Scholar
Hallberg ZF, Su Y, Kitto RZ, Ming CH. Разработка и применение рибопереключателей in vivo. Анну Рев Биохим. 2017; 86: 515–39.
CAS PubMed Статья PubMed Central Google Scholar
Вилленбахер Дж., Мор Т., Хенкель М., Гебхард С., Машер Т., Силдатк С., Хаусманн Р. Замена нативного промотора srfA конститутивным P veg в двух штаммах B. subtilis и оценка эффекта по производству сурфактина.J Biotechnol. 2016; 224: 14–7.
CAS PubMed Статья PubMed Central Google Scholar
Maeda T, Sanchez-Torres V, Wood TK. Продукция водорода рекомбинантными штаммами Escherichia coli . Microb Biotechnol. 2012; 5: 214–25.
CAS PubMed PubMed Central Статья Google Scholar
Лу З, Ян С., Юань Х, Ши И, Оуян Л., Цзян С., Йи Л., Чжан Г.Многомерная регуляция с помощью CRISPR для точной настройки экспрессии генов в Bacillus subtilis . Nucleic Acids Res. 2019; 47: e40.
PubMed PubMed Central Статья CAS Google Scholar
Iannelli F, Santagati M, Santoro F, Oggioni MR, Stefani S, Pozzi G. Нуклеотидная последовательность конъюгативного профага Φ1207.3 (ранее Tn1207.3), несущего гены mef (A) / msr (D) на устойчивость к макролидам у Streptococcus pyogenes .Front Microbiol. 2014; 5: 687.
PubMed PubMed Central Статья Google Scholar
Сюй Х, Сяо Т., Чен Ч., Ли В, Лю С. Детерминанты последовательности улучшенного дизайна sgRNA CRISPR. Genome Res. 2015; 25: 1147–57.
CAS PubMed PubMed Central Статья Google Scholar
Gros MF, Te Riele H, Ehrlich SD. Репликация по катящемуся кругу одноцепочечной ДНК плазмиды pC194.EMBO J. 1987; 6: 3863–9.
CAS PubMed PubMed Central Статья Google Scholar
Pluta R, Espinosa M. Антисмысловой и все же чувствительный: контроль числа копий реплицирующихся плазмид по катящемуся кругу с помощью малых РНК. ПРОВОДОВ РНК. 2018; 9: e1500.
PubMed Статья CAS Google Scholar
Лю М., Квонг С.М., Дженсен С., Брзоска А., Ферт Н.Биология стафилококковой конъюгированной плазмиды множественной резистентности pSK41. Плазмида. 2013; 70: 42–51.
CAS PubMed Статья Google Scholar
Yihan L, Fuping L, Guanqun C, Snyder CL, Jing S, Yu L, Jianling W., Jing X. Высокий уровень экспрессии, очистки и характеристики рекомбинантной среднетемпературной альфа-амилазы из Bacillus subtilis . Biotech Lett. 2010; 32: 119–24.
Артикул CAS Google Scholar
Nguyen HD, Nguyen QA, Ferreira RC, Ferreira LC, Tran LT, Schumann W. Конструирование векторов экспрессии на основе плазмид для Bacillus subtilis , демонстрирующих полную структурную стабильность. Плазмида. 2005; 54: 241–8.
CAS PubMed Статья Google Scholar
Phan TT, Nguyen HD, Schumann W. Новые векторы экспрессии на основе плазмид для внутри- и внеклеточного производства рекомбинантных белков в Bacillus subtilis .Protein Expr Purif. 2006; 46: 189–95.
CAS PubMed Статья Google Scholar
Wu SC, Wong SL. Разработка улучшенных векторов на основе pUB110 для исследований экспрессии и секреции в Bacillus subtilis . J Biotechnol. 1999. 72: 185–95.
CAS PubMed Статья Google Scholar
Рейнхард Б., Суй-Лам В., Дитер Дж. Производство PHA-деполимеразы A (PhaZ5) из Paucimonas lemoignei в Bacillus subtilis .FEMS Microbiol Lett. 2002; 209: 237–41.
Артикул Google Scholar
Линь Б., Ли З., Чжан Х., Ву Дж., Луо М. Клонирование и экспрессия гена синтетазы γ-полиглутаминовой кислоты pgs BCA в Bacillus subtilis WB600. Biomed Res Int. 2016; 2016: 1–7.
Google Scholar
Sun TY, Shao JX, Gao YY, Chen LM, Gao ZQ, Lin WP, Fu-Ping LU. Установление высокоэффективной трансформации и экспрессии гена, кодирующего щелочную протеазу PB92, в Bacillus subtilis DB104.Цзянсу Дж. Сельское хозяйство. 2009; 25: 534–7.
CAS Google Scholar
Крамер М.Г., Эспиноза М., Мисра Т.К., Хан С.А. Характеристика одноцепочечного ориджина, ssoU, необходимого для репликации плазмид типа «катящийся круг» в широком диапазоне хозяев. Mol Microbiol. 2010; 33: 466–75.
Артикул Google Scholar
Gryczan TJ, Dubnau D. Конструирование и свойства химерных плазмид в Bacillus subtilis .Proc Natl Acad Sci USA. 1978; 75: 1428–32.
CAS PubMed Статья Google Scholar
Zhou Z, Liu Y, Chang Z, Wang H, Leier A, Marquez-Lago TT, Ma Y, Li J, Song J. Конструирование на основе структуры пектатлиазы с улучшенной удельной активностью для удаления слизи из рами. . Appl Microbiol Biotechnol. 2016; 101: 1–11.
Google Scholar
van der Laan JC, Gerritse G, Mulleners LJ, van der Hoek RA, Quax WJ.Клонирование, характеристика и множественная хромосомная интеграция гена щелочной протеазы Bacillus. Appl Environ Microbiol. 1991; 57: 901–9.
PubMed PubMed Central Статья Google Scholar
Xu J, Ren F, Huang CH, Zheng Y, Zhen J, Sun H, Ko TP, He M, Chen CC, Chan HC, et al. Функциональные и структурные исследования пуллуланазы из Anoxybacillus sp. ЛМ18-11. Белки. 2014; 82: 1685–93.
CAS PubMed Статья Google Scholar
Zhou M, Wu J, Wang T, Gao L, Yin H, Lü X. Очистка и характеристика новой щелочной устойчивой пектатлиазы, продуцируемой Bacillus subtilis PB1. Мир J Microbiol Biotechnol. 2017; 33: 190.
CAS PubMed Статья Google Scholar
Tjalsma H, Koetje EJ, Kiewiet R, Kuipers OP, Kolkman M, Laan J, Daskin R, Ferrari E, Bron S. Разработка систем определения кворума для улучшенного производства щелочной протеазы с помощью Bacillus subtilis .J Appl Microbiol. 2004; 96: 569–78.
CAS PubMed Статья Google Scholar
Feto NA. Bacillus spp. и их биотехнологическая роль в «зеленой» промышленности. Чам: Спрингер; 2016.
Книга. Google Scholar
Liu L, Liu Y, Shin HD, Chen RR, Wang NS, Li J, Du G, Chen J. Разработка Bacillus spp. как клеточная фабрика по производству микробных ферментов и промышленно важных биохимических веществ в контексте системной и синтетической биологии.Appl Microbiol Biotechnol. 2013; 97: 6113–27.
CAS PubMed Статья PubMed Central Google Scholar
Bron S, Luxen E, Swart P. Нестабильность рекомбинантных плазмид pUB110 в Bacillus subtilis : кодируемая плазмид функция стабильности и эффекты вставок ДНК. Плазмида. 1988; 19: 231–41.
CAS PubMed Статья PubMed Central Google Scholar
Maciag IE, Viret JF, Alonso JC. Свойства репликации и несовместимости плазмиды pUB110 в Bacillus subtilis . Mol Gen Genet. 1988. 212: 232–40.
CAS PubMed Статья PubMed Central Google Scholar
Танака Т., Суэока Н. Сайт-специфичное связывание in vitro плазмиды pUB110 с мембранной фракцией Bacillus subtilis . J Bacteriol. 1983; 154: 1184–94.
CAS PubMed PubMed Central Статья Google Scholar
Вирет Дж. Ф., Алонсо Ю. Последовательность ДНК вне минимального репликона pUB110 необходима для нормальной репликации в Bacillus subtilis . Nucleic Acids Res. 1988. 16: 4389–406.
CAS PubMed PubMed Central Статья Google Scholar
Thomas CD, Jennings LJ. RepD / D *: аддукт белок-ДНК, возникающий во время репликации плазмиды. Biochem Soc Trans. 1995; 23: 442С.
CAS PubMed Статья PubMed Central Google Scholar
Алонсо Дж. К., Вирет Дж. Ф., Портной Р. Х. Поддержание плазмиды у мутантов Bacillus subtilis с дефицитом рекомбинации. Mol Genet Genomics. 1987. 208: 349–52.
CAS Статья Google Scholar
Нуарот-Грос М.Ф., Эрлих С.Д. Изменение каталитической реакции, осуществляемой белком репликации ДНК. Наука. 1996. 274: 777–80.
CAS PubMed Статья PubMed Central Google Scholar
Alonso JC, Stiege CA, Tailor RH, Viret JF. Функциональный анализ мутантов ДНК (Ts) Bacillus subtilis : репликация плазмиды pUB110 в качестве модельной системы. Mol Gen Genet. 1988; 214: 482–9.
CAS PubMed Статья Google Scholar
Брон С., Люксен Э. Сегрегационная нестабильность производных pUB110 рекомбинантных плазмид в Bacillus subtilis . Плазмида. 1985; 14: 235–44.
CAS PubMed Статья Google Scholar
Вассенаар TM, Кабал А. Мобильный элемент dso-gene-sso в плазмидах катящегося круга стафилококков отражает эволюционную историю его гена устойчивости. Lett Appl Microbiol. 2017; 65: 192–8.
CAS PubMed Статья Google Scholar
Costa A, Hood IV, Berger JM. Механизмы инициации репликации клеточной ДНК. Анну Рев Биохим. 2013; 82: 25–54.
CAS PubMed PubMed Central Статья Google Scholar
Блейхерт Ф, Ботчан MR. Механизмы инициации репликации клеточной ДНК. Наука. 2017; 355: eaah6317.
PubMed Статья CAS Google Scholar
Li SF, Xu JY, Bao YJ, Zheng HC, Song H. Конструирование пуллуланазы на основе анализа структуры и последовательности из Anoxybacillus sp. LM18-11 для повышения термостабильности. J Biotechnol. 2015; 210: 8–14.
CAS PubMed Статья Google Scholar
Zeng Y, Zheng H, Shen Y, Xu J, Tan M, Liu F, Song H. Идентификация и анализ связывающих остатков в CBM68 пуллуланазы PulA из Anoxybacillus sp. ЛМ18-11. J Biosci Bioeng. 2019; 127: 8–15.
CAS PubMed Статья Google Scholar
Цзэн Ю., Сюй Дж., Фу Х, Тан М., Лю Ф., Чжэн Х., Сонг Х. Влияние различных модулей связывания углеводов на ферментативные свойства пуллуланазы. Int J Biol Macromol.2019; 137: 973–81.
CAS PubMed Статья Google Scholar
Phan TTP, Tran LT, Schumann W, Nguyen HD. Разработка векторов экспрессии на основе Pgrac100, обеспечивающих высокие уровни продукции белка в Bacillus subtilis и относительно низкую базальную экспрессию в Escherichia coli . Факт о микробной клетке. 2015; 14:72.
PubMed PubMed Central Статья CAS Google Scholar
Zyprian E, Matzura H. Характеристика сигналов, способствующих экспрессии гена на плазмиде pUB110 Staphylococcus aureus, и разработка системы грамположительных векторов экспрессии. ДНК. 1986; 5: 219–25.
CAS PubMed Статья Google Scholar
Nguyen HD, Phan TT, Schumann W. Экспрессионные векторы для быстрой очистки рекомбинантных белков в Bacillus subtilis . Curr Microbiol. 2007; 55: 89–93.
CAS PubMed Статья Google Scholar
Guo S, Tang JJ, Wei DZ, Wei W. Создание челночного вектора для секреторной экспрессии белка в Bacillus subtilis и применение функциональной гетерологичной экспрессии маннаназы. J Microbiol Biotechnol. 2014; 24: 431–9.
CAS PubMed Статья PubMed Central Google Scholar
Гуань С., Цуй В., Ченг Дж., Лю Р., Лю З., Чжоу Л., Чжоу З. Конструирование высокоактивной секреторной системы экспрессии с помощью сконструированного двойного промотора и высокоэффективного сигнального пептида в Bacillus subtilis . New Biotechnol. 2016; 33: 372–9.
CAS Статья Google Scholar
Миядзаки К. Клонирование MEGAWHOP: метод создания библиотек случайного мутагенеза с помощью мегапримерной ПЦР целых плазмид. Методы Энзимол.2011; 498: 399–406.
CAS PubMed Статья Google Scholar
Грин М.Р., Сэмбрук Дж. Молекулярное клонирование: лабораторное руководство (четвертое издание): набор из трех томов. Лабораторный пресс Колд-Спринг-Харбор 2012, 1: часть 1.
Turgeon N, Laflamme C, Ho J, Duchaine C. Оценка количества копий плазмиды в спорах B. cereus во время прорастания, роста бактерий и споруляции с использованием ПЦР в реальном времени.Плазмида. 2008; 60: 118–24.
CAS PubMed Статья Google Scholar
Friehs K. Число копий плазмиды и стабильность плазмиды. Adv Biochem Eng Biotechnol. 2004; 86: 47.
CAS PubMed Google Scholar
Майдак Б.Л., Ларсен Н., Маккаги М.Дж., Овербек Р., Олсен Г.Дж., Фогель К., Бланди Дж., Везе С.Р. Проект базы данных рибосом. Nucleic Acids Res.1994; 22: 3485–7.
CAS PubMed PubMed Central Статья Google Scholar
Providenti MA, O’Brien JM, Ewing RJ, Paterson ES, Smith ML. Число копий плазмид и других генетических элементов можно определить с помощью количественной ПЦР в реальном времени на основе SYBR-Green. J Microbiol Methods. 2006. 65: 476–87.
CAS PubMed Статья Google Scholar
Ван Х, Ли Х, Ма И, Сонг Дж. Оптимизация процесса внеклеточной продукции высокого уровня щелочной пектатлиазы в рекомбинантной Escherichia coli BL21 (DE3). Биохим Энг Дж. 2015; 93: 38–46.
CAS Статья Google Scholar
He XS, Shyu YT, Nathoo S, Wong SL, Doi RH. Конструирование и использование мутанта Bacillus subtilis , дефицитного по множественным генам протеаз для экспрессии эукариотических генов.Ann N Y Acad Sci. 2010; 646: 69–77.
Артикул Google Scholar
Влияние берберина на Escherichia coli, Bacillus subtilis и их смеси, определенное с помощью изотермической микрокалориметрии
Arias M, Garcia-Falcon MS, Garcia-Rio L, Mejuto JC, Rial-Otero R, Simal-Gandara J ( 2007) Константы связывания окситетрациклина с двухвалентными катионами кормов для животных. J Food Eng 78: 69–73
Статья CAS Google Scholar
Батовская Д., Парушев С., Славова А., Банкова В., Цветкова И., Нинова М., Найденский Н. (2007) Изучение действия заместителей ряда синтетических халконов против дрожжей Candida albicans .Eur J Med Chem 42: 87–92
Статья CAS Google Scholar
Belongia EA, MacDonald KL, Parham GL, White KE, Korlath MN, Lobato SM (1991) Вспышка Escherichia coli O157: колит H7, связанный с потреблением предварительно приготовленных мясных котлет. J Infect Dis 164: 338–343
Статья CAS Google Scholar
Braissant O, Wirz D, Göpfert B, Daniels AU (2010) Использование изотермической микрокалориметрии для мониторинга микробной активности.FEMS Microbiol Lett 303: 1–8
Статья CAS Google Scholar
Chardin B, Dolla A, Chaspoul F, Fardeau ML, Gallice P, Bruschi M (2002) Биовосстановление хромата: термодинамический анализ воздействия Cr (VI) на сульфатредуцирующие бактерии. Appl Microbiol Biotechnol 60: 352–360
Статья CAS Google Scholar
Coates A, Hu YM, Bax R, Page C (2002) Будущие задачи, стоящие перед разработкой новых противомикробных соединений.Nat Rev Drug Discov 1: 895–910
Статья CAS Google Scholar
Haydon DJ, Stokes NR, Ure R, Galbraith G, Bennett JM, Brown DR, Baker PJ, Barynin VV, Rice DW, Sedelnikova SE, Heal JR, Sheridan JM, Aiwale ST, Chauhan PK, Srivastava A, Taneja A, Collins I, Errington J, Czaplewski LG (2008) Ингибитор FtsZ с сильной и селективной антистафилококковой активностью. Наука 321: 1673–1675
Статья CAS Google Scholar
Kong WJ, Wang JB, Jin C, Zhao YL, Dai CM, Xiao XH, Li ZL (2009) Эффект эмодина на рост Candida albicans исследовали с помощью микрокалориметрии в сочетании с хемометрическим анализом.Appl Microbiol Biotechnol 83: 1183–1190
Статья CAS Google Scholar
Kong WJ, Jin C, Xiao XH, Zhao YL, Li ZL, Zhang P, Liu W, Li XF (2010) Сравнительное исследование эффектов двух производных желчных кислот на Staphylococcus aureus с помощью нескольких аналитических методов. J Hazard Mater 179: 742–747
Статья CAS Google Scholar
Kong WJ, Wang JB, Xing XY, Jin C, Xiao XH, Zhao YL, Zhang P, Zang QC, Li ZL (2011) Скрининг новых антибактериальных агентов на основе активности соединений в метаболизме Escherichia coli : микрокалориметрическое исследование.J Hazard Mater 185: 346–352
Статья CAS Google Scholar
Kong WJ, Wang JB, Xiao XH, Chen SL, Yang MH (2012) Оценка антибактериального эффекта и режима Coptidis rhizoma с помощью микрокалориметрии в сочетании с хемометрическими методами. Аналитик 137: 216–222
Статья CAS Google Scholar
Ленг П., Го XL, Ян Й, Лу HX (2007) Первичное исследование противогрибковой активности и отмены резистентности к флуконазолу плагиохина E.Chin Pharm J 42: 349–352
CAS Google Scholar
Li X, Zhang ZJ, Wang CG, Zhang T, He K, Deng FH (2011) Синтез, кристаллическая структура и действие на Escherichia coli с помощью микрокалориметрии комплексов меди с 1,10-фенантролином и аминокислотой. J Inorg Biochem 105: 23–30
Статья CAS Google Scholar
Müller EE, Ehlers MM, Grabow WOK (2001) Появление E.coli O157: H7 в источниках воды в Южной Африке, предназначенных для прямого и косвенного потребления человеком. Water Res 35: 3085–3088
Статья Google Scholar
Сантос М.В., Зарицки Н., Калифано А. (2010) Стратегия управления для обеспечения условий безопасности при термической обработке мясных продуктов с использованием численных алгоритмов. Food Control 21: 191–197
Статья Google Scholar
Sendzik J, Lode H, Stahlmann R (2009) Артропатия, индуцированная хинолоном: обновление с акцентом на новые механистические и клинические данные.Int J Antimicrob Agents 33: 194–200
Статья CAS Google Scholar
Sommer MOA, Dantas G, Church GM (2009) Функциональная характеристика резервуара устойчивости к антибиотикам в микрофлоре человека. Science 325: 1128–1131
Статья CAS Google Scholar
Wadsö I (1995) Микрокалориметрические методы для характеристики живых клеточных систем.Будут ли какие-то важные практические приложения? Thermochim Acta 47: 337–350
Статья Google Scholar
Wadsö I (2001) Изотермическая микрокалориметрия: современные проблемы и перспективы. J Therm Anal Calorim 64: 75–84
Статья Google Scholar
ВОЗ (2008) Новые лабораторные диагностические инструменты для борьбы с туберкулезом. p 20, WHO Press
Xie CL, Tang HK, Song ZH, Qu SS (1988) Микрокалориметрическое исследование роста бактерий.Thermochim Acta 123: 33–41
Статья Google Scholar
Yang Y, Ye XL, Li XG, Zhen LS (2007) Антимикробный эффект четырех алкалоидов из Coptidis rhizoma . Med Mater Med Res 18: 3013–3014
CAS Google Scholar
Zhang T, Li X, Min XM, Fang TT, Zhang ZJ, Yang L, Liu P (2012) Острая токсичность хлорбензолов в Tetrahymena: оценка с помощью микрокалориметрии и механизма.Environ Toxicol Pharmacol 33: 377–385
Статья CAS Google Scholar
Zhao YL, Yan D, Wang JB, Zhang P, Xiao XH (2010) Противогрибковое действие берберина на Candida albicans по данным микрокалориметрии с анализом соответствия. J Therm Anal Calorim 102: 49–55
Статья CAS Google Scholar
Zhuang RS, Chen HL, Yao J, Li Z, Burnet JE, Choi MMF (2011) Влияние бета-циперметрина на микробное сообщество почвы, связанное с его биодоступностью: комбинированное исследование с помощью изотермической микрокалориметрии и методов ферментного анализа.J Hazard Mater 189: 323–328
Статья CAS Google Scholar
Zlitni S, Brown ED (2009) Не так здорово, как мы думали. Nature 458: 39–40
Статья CAS Google Scholar
УФ-индуцированных поперечных сшивок в 16S рРНК Escherichia coli, Bacillus subtilis и Thermus aquaticus и их значение для структуры рибосом и фотохимии | Исследование нуклеиновых кислот
Аннотация
Шестнадцать сшивок дальнего действия индуцируются в Escherichia coli 16S рРНК под действием дальнего УФ-излучения.Паттерны сшивания у двух других организмов, Bacillus subtilis и Thermus aquaticus , были исследованы, чтобы определить, происходят ли количество и расположение сшивок в E.coli из-за необычно фотореактивных нуклеотидов в определенных местах последовательности рРНК. Тринадцать поперечных сшивок с большим радиусом действия в B.subtilis и 15 сшивок с большим радиусом действия в T.aquaticus были обнаружены гель-электрофорезом, и 10 сшивок в каждом организме были полностью идентифицированы с помощью анализа обратной транскрипции.Из 10 идентифицированных перекрестных связей в B.subtilis восемь точно соответствуют перекрестным связям E.coli , а две перекрестные связи образуются рядом с сайтами перекрестных связей в E.coli . Из 10 идентифицированных перекрестных связей в T.aquaticus , пять точно соответствуют перекрестным связям E.coli , три образуются рядом с сайтами перекрестного сшивания E.coli , одна перекрестная связь соответствует индуцированной УФ-лазерным облучением перекрестной связи в E .coli и последний не встречается в E.coli . Общее сходство положений поперечных связей в трех организмах предполагает, что поперечные связи возникают в результате третичных взаимодействий, которые являются высококонсервативными, но с различиями в деталях в некоторых регионах.
Поступило 24.05.2000 г .; Изменено и принято 31 июля 2000 г.
ВВЕДЕНИЕ
Внутримолекулярные сшивки в 16S рРНК предоставляют полезную информацию о близости конкретных нуклеотидов в третичной структуре рРНК. Эта информация особенно важна для перекрестных ссылок, расположенных в регионах, функционально важных для перевода. Escherichia coli 16S рРНК была исследована ранее для определения местоположения УФ-индуцированных поперечных сшивок (1–5). Возникновение сшивки должно зависеть от комбинации факторов, включая природную фотореактивность соединяемых нуклеотидов, правильное расстояние и геометрическое расположение нуклеотидов и молекулярную динамику в месте сшивки. Таким образом, появление определенного количества УФ-сшивок в рРНК E.coli 16S может не воспроизводиться в других организмах из-за различий в последовательности или структурных различиях.
Сравнительный анализ последовательностей продемонстрировал универсальную консервацию центральной вторичной структуры в рРНК (6). Внутри центральной части вторичной структуры 16S рРНК сохраняется расположение и длина спаренных областей оснований, даже несмотря на наличие компенсирующих изменений в последовательности (7). Кроме того, существует универсальная консервация некоторых интервалов последовательностей в 16S рРНК. Это означает, что элементы, содержащие эти последовательности, сохраняются как требование для правильной функции при трансляции (8).Что еще не было продемонстрировано, так это степень идентичности третичных структур 16S рРНК у разных организмов. Пример, относящийся к связи между последовательностью РНК и структурой, можно найти в РНК РНКазы P. Анализ перекрестного связывания РНК РНКазы P E.coli и Bacillus subtilis показал, что даже при двух несходных последовательностях и вторичных структурах третичные структуры контактируют и сшиваются между этими контактами (9), а также существенные особенности функции РНК консервативны.Внутри бактериального царства последовательность и вторичная структура 16S рРНК варьируются в гораздо меньшей степени, чем РНКазы Р РНК, но рибосома по-прежнему функционирует в широком диапазоне окружающей среды.
Шестнадцать УФ-индуцированных внутримолекулярных перекрестных связей РНК × РНК были идентифицированы в 16S рРНК E.coli в пределах 30S субъединицы и 70S рибосомы (4,5). Это исследование повторяет тот анализ с использованием рибосом из B.subtilis и Thermus aquaticus , и сравнивается распределение поперечных связей между этими организмами. Bacillus subtilis является грамположительным организмом, представляющим род Bacillus , и имеет 78% идентичность последовательности 16S рРНК с E.coli . Восстановление 30S-субъединиц может быть выполнено с помощью малых субъединиц Bacillus stearathermophilus и E.coli 16S рРНК, что указывает на совместимость рибосомных белков и РНК (10,11). Thermus thermophilus рибосомные субъединицы были тщательно изучены с помощью электронной микроскопии (12) и совсем недавно кристаллические структуры пустых T.thermophilus 30S субъединицы были расшифрованы с разрешением 5,5 (13) и 6,7 Å (14), а комплекс 70S рибосома · тРНК · мРНК с разрешением 7,8 Å (15). Последовательность рРНК T.aquaticus 16S на 71% идентична последовательности E.coli и очень похожа на последовательность T.thermophilus , являясь примером термофильного организма, рибосомы которого функционируют при повышенных температурах.
Используемый здесь метод определения сшивок, индуцированных УФ-излучением, включает этап разделения и выделения сшитых молекул с помощью гель-электрофореза.Сшитые нуклеотиды должны находиться на расстоянии не менее 50 нуклеотидов друг от друга в первичной последовательности, чтобы их можно было разделить этим методом, поэтому все поперечные сшивки имеют большой диапазон. Сшивки классифицируются как вторичные или третичные в зависимости от того, происходят ли они между нуклеотидами, которые, как уже было известно, близки друг к другу в силу вторичной структуры. Однако УФ-индуцированные поперечные сшивки обычно не возникают между нуклеотидами в спаренных по основанию областях (4), предположительно из-за отсутствия благоприятного стэкинга между основаниями из противоположных цепей или эффективного гашения активированного состояния, поэтому поперечные связи вторичной структуры все еще являются показателем необычная геометрия в этом регионе.Сшивки третичной структуры соединяют нуклеотиды, удаленные во вторичной структуре, подтверждая глобальную 3-мерную укладку рРНК. Если паттерны сшивания очень отличаются между организмами, это может быть связано с различиями в третичной структуре, эффектами контекста первичной последовательности или с обоими, и необходимо будет изучить последовательности, участвующие в сайтах, или провести дополнительные мутационные эксперименты, чтобы определить причины различий. узоры. Различия во вторичной структуре не должны способствовать различиям в сшивании, поскольку настоящая вторичная структура была строго подтверждена сравнительным анализом последовательностей (8).С другой стороны, если структуры сшивки очень похожи, это будет свидетельством сохранения третичной структуры. Кроме того, анализ сшивок в организмах, отличных от E.coli , должен дать больше доказательств участия пуриновых и пиримидиновых нуклеотидов в фотохимических процессах. Данные этих экспериментов показывают, что хотя ряд вторичных и третичных поперечных связей сохраняется в трех исследованных организмах, несколько поперечных связей различаются по положению, возможно, из-за локальных структурных вариаций неизвестной значимости.Кроме того, большое количество пуринов участвует в сшивании, что позволяет предположить, что пурины в среде большой свернутой РНК являются более фотореактивными, чем предполагалось в предыдущих экспериментах.
МАТЕРИАЛЫ И МЕТОДЫ
Получение рибосом и процедуры УФ-сшивания
Замороженные клетки E.coli [MRE 600 (1/2 log) клетки] были получены из центра ферментации клеточных культур Университета Алабамы, Бирмингем, Алабама. Bacillus subtilis (штамм Marburg, ATCC 6051) и T.aquaticus (штамм RF 4738, ATCC 25104) 70S рибосомы и рибосомные субъединицы получали согласно Makhno et al . (16). Клетки Bacillus subtilis выращивали в среде LB до OD 1 при 600 нм. Thermus aquaticus клетки выращивали в среде Castenholz TYE (культуральная среда ATCC 461) до OD 1 при 600 нм. Субъединицы рибосом очищали и, наконец, растворяли в активационном буфере (20 мМ Трис-HCl, pH 7.5, 20 мМ MgCl 2 , 200 мМ NH 4 Cl, 4 мМ β-меркаптоэтанол) во всех случаях. Чтобы минимизировать деградацию рРНК, рибосомы T.aquaticus 70S промывали солью, но не диссоциировали и повторно ассоциировали. Рибосомы Escherichia coli и B.subtilis 70S получали путем повторного связывания эквимолярных количеств 30S и 50S субъединиц и не содержали мРНК или тРНК. Облучение рибосом и очистку РНК проводили, как описано ранее (4). Гели агарозы (1%) использовали для выделения 16S рРНК до мечения 5′-конца [γ- 32 P] АТФ полинуклеотидкиназой Т4 или 3′-мечения путем лигирования с [5′- 32 P] pCp.
Сшитую 16S рРНК разделяли гель-электрофорезом на гелях, сделанных из 3,6% акриламида: бис-акриламида (70: 1), 8,3 М мочевины и буфера BTBE [30 мМ бис (2-гидроксиэтил) иминотрис (гидроксиметил) метана, 30 мМ. мМ борная кислота, 2,5 мМ ЭДТА, pH 6,8], как описано ранее (4). Для анализа сайтов сшивания положение полос, содержащих несшитую и сшитую 16S рРНК, определяли с помощью фосфорного визуализатора, полосы вырезали и элюировали ультрацентрифугированием через подушки, содержащие 2 M CsCl, 0.2 M EDTA, pH 7,4, в течение 12 ч при 40000 об / мин. (17). Осадки РНК повторно растворяли в 250 мкл H 2 O, экстрагировали фенолом и повторно осаждали перед дальнейшим анализом.
Определение идентичности и частоты сшитых сайтов
Сайты сшивания в разделенных 16S рРНК были обнаружены анализом удлинения праймеров с использованием праймеров ДНК, комплементарных участкам соответствующих последовательностей 16S рРНК (4). Для B.subtilis и T.aquaticus 11 праймеров, соответствующих тем же участкам, что и проанализированы в E.coli .
Первичные последовательности и вторичные структуры
Первичные последовательности для E.coli , B.subtilis и T.aquaticus и вторичные структуры для E.coli и B.subtilis были взяты из проекта Ribosomal Database Project II (RDP) (http: //www.cme.msu.edu/rdp/) (18). Схема последовательности и вторичной структуры для T.aquaticus была изменена по сравнению со схемой вторичной структуры для T.thermophilus , также взято из RDP.
РЕЗУЛЬТАТЫ
Bacillus subtilis 16S рРНК была выбрана в этом эксперименте из-за степени сходства последовательности с E.coli 16S рРНК и сходства в окружающей среде, в которой функционируют рибосомы этих двух организмов. Bacillus subtilis представляет собой грамположительный организм с 16S рРНК длиной 1550 нуклеотидов по сравнению с 1542 нуклеотидами у E.coli . Он имеет содержание G + C (55%), что аналогично содержанию E.coli (54%), и эти два организма имеют идентичность последовательности 16S рРНК на 78%. В качестве альтернативы была выбрана 16S рРНК T.aquaticus , поскольку она является экстремальным термофилом, чья рибосомная структура стабильна in vivo при температурах, которые полностью противоречат функции рибосомы E.coli . Thermus aquaticus 16S рРНК имеет более высокое содержание G + C (63%), как и ожидалось для функциональности при более высоких температурах, на 71% последовательность идентична E.coli и короче (1470 нуклеотидов), чем у E .coli . Идентичность последовательности 16S рРНК между B.subtilis и T.aquaticus составляет 72%.
УФ-облучение проводили на 30S субъединицах и 70S рибосомах для индукции перекрестных связей в 16S рРНК. Сшитые молекулы 16S рРНК, содержащие петли размером от ~ 50 до 600 н., Можно разделить с помощью гель-электрофореза. Молекулы с более крупными петлями не отделяются друг от друга этим методом, а молекулы с более мелкими петлями не отделяются от линейной РНК. Присутствие УФ-индуцированных сшивок в 16S рРНК продемонстрировано гель-электрофорезом для трех организмов (рис.1). Сходство в структурах сшитых полос можно легко увидеть при сравнении рРНК E.coli и B.subtilis 16S, но структура полос отличается у T.aquaticus . Шестнадцать полос в паттерне E.coli были охарактеризованы ранее. Тринадцать и 15 полос видны в образцах для B.subtilis и T.aquaticus соответственно.
РНКвыделяли из полос полиакриламидного геля, как показано на фиг. 1, и проводили эксперименты по обратной транскрипции для идентификации перекрестно сшитых нуклеотидов в каждой из полос.Праймеры ДНК для сайтов по всей последовательности рРНК каждого организма использовали для перекрывающихся считываний РНК. Сшитый нуклеотид ингибирует вставку комплементарного нуклеотида и вызывает прерывание удлинения комплементарной цепи ДНК. Часто наблюдается одиночная остановка обратной транскрипции на конкретном нуклеотиде, и это поведение было определено ранее, чтобы указать на перекрестную связь на 5′-соседнем нуклеотиде для UV- (19,20), псоралена- (21) и s 4 U- индуцированные (22) сшивки.В других случаях дублетная остановка присутствует, потому что структура сшивки позволяет спаривать комплементарный нуклеотид на сшитом нуклеотиде. В этом случае 5′-нуклеотид дублета является сшитым нуклеотидом (21). Один пример обратной транскрипции сшивок в интервале nt 1075–1215 (нумерация E.coli ) показан на рисунке 2 для T.aquaticus и E.coli . Сравнение паттерна обратной транскрипции от РНК в определенной полосе с паттерном от РНК в других полосах (содержащих другие поперечные связи) или РНК в облученной, но несшитой полосе (фракция 1 во всех трех образцах) позволяет идентифицировать специфические остановки обратной транскрипции, связанные с сшивка этой конкретной полосы.Остановка обратной транскрипции из-за других типов УФ-индуцированных изменений и посттранскрипционно модифицированные нуклеотиды будут видны во всех образцах, поэтому их нельзя будет принять за сайты сшивания на больших расстояниях. Дополнительные критерии для определения перекрестной сшивки заключаются в том, что сайт перекрестного сшивания виден с разными праймерами, чтобы исключить артефакты прайминга обратной транскрипции, и что подвижность видов РНК должна соответствовать размеру петли, предсказанному участвующими нуклеотидами.
Обратная транскрипция, выполненная с РНК из всех видимых сшитых полос, показанных на рисунке 1, привела к полной идентификации 10 сшивок каждая в B.subtilis и T.aquaticus . В остальных полосах в B.subtilis и T.aquaticus только одна сторона перекрестной сшивки (орфанные стопы) могла быть определена по удлинению праймера, возможно, из-за маскирования сшитых нуклеотидных стоп естественными стопами в паттерне обратной транскрипции. маскирование из-за наличия посттранскрипционных модификаций РНК или неспособности обратной транскриптазы AMV блокировать некоторые типы перекрестных связей.
Большинство сшивок в B.subtilis и T.aquaticus включают одни и те же нуклеотиды или почти одинаковые нуклеотиды по сравнению с E.coli при выравнивании с последовательностью E.coli 16S рРНК и вторичной структурой (Таблица 1). Для всех этих сайтов выравнивание является однозначным, и для описания всех положений будет использована нумерация E.coli . Восемь из 10 поперечных сшивок, идентифицированных в B.subtilis , включают сшитые пары нуклеотидов, которые находятся в точно таких же положениях, как и в E.coli . В первом исключении при сшивании C586 × C756 в B.subtilis 5′- и 3′-концы сшивки сдвигают 5 и 3 н., Соответственно, по сравнению с эквивалентной перекрестной сшивкой E.coli (Фиг. . 3). Это перемещает расположение поперечной сшивки на небольшое расстояние в стержне с парными основаниями от соответствующей поперечной сшивки в E.coli . Во втором исключении в B.subtilis , перекрестном сшивке C54 × C352, нижестоящий участвующий нуклеотид находится на 352, а не на 353, как видно в E.coli .
Пять из 10 пар сшитых нуклеотидов, идентифицированных в T.aquaticus , точно соответствуют парам сшитых нуклеотидов в E.coli . Три других сшивки T.aquaticus расположены в тех же положениях, что и сшивки в E.coli , но имеют один или оба сайта сшивания, расположенные до нескольких нуклеотидов, соседних с нуклеотидом, идентифицированным в E.coli . 3′-конец поперечной сшивки C54 × C352 составляет 1 нт в 5′-направлении (размещение его в том же месте, что и в B.subtilis ). Оба конца поперечной сшивки G581 × A759 в T.aquaticus смещены на 1 нт в 5′-направлении по сравнению с соответствующей поперечной сшивкой E.coli . Как 5′-, так и 3′-концы сшивки T.aquaticus A1092 × C1183 составляют 1 н. 5 ‘по сравнению с эквивалентной сшивкой E.coli (фиг. 2). Две поперечные сшивки, наблюдаемые в домене III (рис.2) в T.aquaticus 16S рРНК, C1054 × U1196 (поперечная связь 17) и U1065 × A1188 (поперечная связь 18), не имеют соответствующих поперечных связей, идентифицированных в E.coli в этом эксперименте.
В экспериментах по облучению B.subtilis и T.aquaticus было обнаружено несколько орфанных стоп. Это сильные остановки удлинения праймера, которые возникают в определенных фракциях РНК, для которых невозможно найти партнера. РНК из двух фракций, одна в верхней половине геля, содержащая U723 (нумерация E.coli ), и одна в нижней половине, содержащая C1400 (нумерация E.coli ), наблюдалась в экспериментах B.subtilis .Три «орфанных» остановки были обнаружены в поперечных сшивках от разделенных 16S рРНК T.aquaticus . Это были C1400, G724 и C795 (нумерация E.coli ), соответственно, и они показаны на рисунке 1.
Чтобы определить, изменит ли повышенная температура характер сшивания 16S рРНК T.aquaticus , проводят эксперимент по сшиванию. повторяли на 30S субъединицах T.aquaticus, и 70S рибосомах при 70 ° C (рис. 4). Из-за фрагментации РНК этот эксперимент по сшиванию нельзя было провести при температурах> 70 ° C и нельзя было провести с повторно связанными субъединицами (12,23).Частота перекрестного сшивания и расположение нуклеотидных участников, определенные анализом обратной транскрипции (результаты не показаны), не изменились для большинства перекрестных сшивок, за исключением двух полос, наблюдаемых в образце рибосомы 70S, облученном при 70 ° C. Они отмечены стрелками на фиг. 4. Анализ удлинения праймера (результаты не показаны) показывает, что эти полосы содержали остановки на C1397 и C1400 (нумерация E.coli ). Невозможно идентифицировать остановки удлинения второго праймера в РНК для этих фракций, которые указывали бы сайты перекрестного связывания партнеров.Кроме того, рибосомы 70S, используемые в анализе, могут содержать остаточную тРНК или мРНК, и они могут участвовать в перекрестных связях с рРНК в этой области (24; J.W. Noah и P.Wollenzien, неопубликованное наблюдение). Однако сшивки с участием T.aquaticus C1397 и C1400 не происходили при более низкой температуре в одном и том же препарате рибосом, и это указывает на различия в структуре декодирующей области T.aquaticus 16S рРНК, которые зависят от температуры.
ОБСУЖДЕНИЕ
Картина индуцированного ультрафиолетом сшивания в E.coli 16S рРНК указывает на то, что существует ограниченное количество положений в свернутой РНК, расположение которых позволяет сшивать между нуклеотидами, удаленными от первичной последовательности. Этот результат повторяется для B.subtilis и T.aquaticus , потому что в 16S рРНК этих организмов обнаружено 13 и 15 перекрестных связей, соответственно. Восемь из 10 полностью идентифицированных поперечных сшивок в B.subtilis идентичны тем, которые наблюдаются в E.coli , а оставшиеся два аналогичны.Пять из 10 полностью идентифицированных сшивок в T.aquaticus идентичны, а еще три аналогичны тем, которые наблюдаются в E.coli . Кроме того, из 18 полностью идентифицированных сшивок в этих организмах 11 являются общими (идентичными или подобными) по крайней мере в двух организмах. Из них семь представляют собой поперечные связи вторичной структуры, а четыре — поперечные связи третичной структуры. Это дает более низкую оценку сходства схем сшивки, поскольку три перекрестных сшивки E.coli либо были получены в условиях, отличных от описанных здесь, либо были определены методами, дополняющими анализ обратной транскрипции.Кроме того, пять других поперечных сшивок в B.subtilis и T.aquaticus определены не полностью, но частичная информация для них снова предполагает сходство между двумя организмами. Таким образом, сходство в их расположении указывает на третичную структуру, которая в целом является высококонсервативной.
Результаты указывают на полезность УФ-индуцированного сшивания для этих типов анализов. Несмотря на значительные различия в последовательностях РНК, легко выявляются многие сходства в третичной структуре РНК.Это предполагает, что третичные взаимодействия специфически уравновешивают определенные пары нуклеотидов для относительно эффективного УФ-индуцированного образования ковалентной связи. Важно отметить, что эти взаимодействия кажутся специфическими, ограниченными по количеству, а эффективность сшивания достаточно хороша, чтобы позволить их использовать для мониторинга конформационных изменений.
В то же время, когда видны сходства, есть также некоторые различия в точном расположении нескольких поперечных связей, которые указывают на то, что определенные области демонстрируют вариации в деталях третичной структуры.В B.subtilis и T.aquaticus C54 × C352 (сшивка 1) отличается от сшивки, обнаруженной в той же области E.coli , на 1 нуклеотид. Во втором исключении сшивки B.subtilis C586 × C756 и T.aquaticus G581 × A759 (сшивка 5) соответствуют сшивкам E.coli C582 × G760, но каждая из версий встречается в немного разных расположение в базовых парных областях 20a и 20b (см. рис. 5). Район РНК 20a / 20b находится в платформенном районе в 30S-субъединице (13; M.А.Долан, П. Бабин и П. Волленциен, неопубликованные наблюдения). Платформенная область в 30S субъединице в E.coli претерпевает структурные изменения во время ассоциации субъединиц (25) и связывания IF-3 (24,26–28). Эти результаты УФ-сшивания показывают, что в этой области у трех организмов может присутствовать несколько иное третичное расположение, даже в пустых нерабочих рибосомах. В последнем примере разности поперечных сшивок, T.aquaticus сшивает A1092 × C1183, оба нуклеотида занимают 5 ‘в последовательности по сравнению с E.coli версия той же сшивки.
Две перекрестные связи, обнаруженные в области декодирования E.coli , C967 × C1400 и C1402 × C1501, также были идентифицированы в B.subtilis . Однако эти сшивки не были однозначно идентифицированы в T.aquaticus . Остановка удлинения праймера наблюдается на нуклеотиде, который соответствует E.coli C1400 в образцах T.aquaticus , выделенных из области препаративного геля, который должен содержать поперечные связи между нуклеотидами, удаленными от первичной последовательности.Однако остановка, которая соответствовала бы положению E.coli C967, не видна. Это может быть связано с интенсивной естественной остановкой в области 967 у T.aquaticus в анализе удлинения праймера, который маскирует соседние нуклеотиды (данные не показаны), что затрудняет идентификацию перекрестных связей. Сшивка, эквивалентная E.coli C1402 × C1501, не встречается в T.aquaticus при 4 ° C. Однако перекрестные сшивки с участием декодирующей области были обнаружены у T.aquaticus при 70 ° C (рис.4), поэтому отсутствие может быть связано с динамикой конструкции. Альтернативно, декодирующая область в 16S рРНК сильно посттранскрипционно модифицирована, и это может влиять на фотохимию.
С точки зрения фотохимии, сшивание, по-видимому, менее чувствительно к идентичности оснований, чем можно было бы предсказать из экспериментов с ДНК. Теоретические и экспериментальные работы показали, что неподеленные электроны в возбужденных состояниях S1 или T1 локализованы вокруг двойной связи C (5) = C (6) в пиримидинах (29–31), что частично объясняет фотореактивность пиримидинов.Пуриновые сшивки также были охарактеризованы, хотя и в гораздо меньшей степени. Квантовые выходы фотореактивности пурина в коротких олигомерах ДНК почти в 10 раз ниже, чем у пиримидинов (32), а пуриновые поперечные сшивки обычно находятся в меньшинстве, как можно было бы статистически ожидать в смешанной системе пурин / пиримидин (33).
Есть три примера, которые иллюстрируют, что пурины, а также пиримидины являются эффективными участниками УФ-индуцированного перекрестного связывания в 16S рРНК. Первая — это сшивка C54 × A353 в E.coli , который включает сшивку C × A. Однако поперечная сшивка (с использованием нумерации E.coli ) в B.subtilis и T.aquaticus представляет собой C54 × C352 и включает поперечную сшивку C × C (см. Таблицу 1). Таким образом, в E.coli индуцированная ультрафиолетом сшивка включает пуриновый остаток, даже если соседним нуклеотидом является C352, а С352 участвует в сшивании в B.subtilis и T.aquaticus. Второй пример — сшивка, обнаруженная в области 582 × 760.Здесь можно найти три различных варианта сшивки (все нумерация E.coli ): C582 × G760 ( E.coli ), C586 × C756 ( B.subtilis ) и G581 × A759 ( T.aquaticus ). Таким образом, наблюдаются три различных варианта сшивки между взаимодействующими цепями в этой области, даже если последовательности в трех организмах почти идентичны, и картина не зависит от участия пиримидинового нуклеотида в сшивке. Наконец, идентичные сшивки в A1093 × G1182 обнаружены в E.coli и B.subtilis , но поперечная сшивка в T.aquaticus вместо этого представляет собой A1092 × C1183 (нумерация E.coli ).
Сумма поперечных сшивок 16S рРНК в этих организмах составляет 24 пиримидин × пиримидин, семь пиримидин × пурин и пять пурин × пурин. Эти числа указывают на сильное предпочтение сшивок пиримидин × пиримидин, но существует достаточно примеров пуринсодержащих сшивок, чтобы предположить, что влияющие факторы ориентации задействованных нуклеотидов, степени динамической энергии, связанной с этими нуклеотидами, и окружающей электронной среды являются важный (34).Это указывает на то, что в контексте структуры рибосомы пуриновые остатки могут быть организованы во взаимодействиях, которые изменяют их электронные характеристики, повышают эффективность межнуклеотидных реакций или снижают скорость потери энергии возбуждения за счет передачи энергии. В ряде случаев в других РНК и рибонуклеопротеинах пурины были обнаружены как участники сшивки УФ. К ним относятся специфические продукты G × U с высоким выходом в РНК вироида веретенов клубня картофеля и 5S рРНК HeLa (35), минорный продукт G × U после облучения пре-тРНК и РНКазы P (36), специфический и высокий выход A × Продукт в рибозиме Tetrahymena группы I (37), специфические продукты G × U и A × U с высоким выходом в рибозиме шпильки и димеризованный рибозим шпильки (38), специфический продукт G × C в мяРНК U6 (39) и специфический продукт G × A в отожженной мяРНК U2 / мяРНК U6 (40).Таким образом, существуют другие примеры РНК, в которых специфически продуцируются пуринсодержащие фотопродукты.
БЛАГОДАРНОСТИ
Мы благодарим доктора Джеймса Брауна (Университет штата Северная Каролина) за предоставленный штамм B.subtilis , использованный в этих экспериментах, а также за его советы и комментарии. Эта работа была поддержана грантом GM43237 Национальных институтов здравоохранения и стипендией GAANN для J.W.N.
Рисунок 1. Разделение и идентификация поперечных сшивок в 16S рРНК E.coli , B.subtilis и T.aquaticus с помощью гель-электрофореза. Сшитая 16S рРНК из каждого организма помечена над соответствующим набором сшивок. Эксперименты, проведенные с 30S-субъединицами или 70S-рибосомами, указаны над каждой полосой. Идентификаторы перекрестных связей помечены слева от каждого набора дорожек в соответствии с нумерацией вторичной структуры E.coli . Соответствующий B.subtilis и T.aquaticus нумерация перечислены в таблице 1. Помечены полосы, содержащие орфанные остановки в анализе удлинения праймера обратной транскрипции, указывающие на нуклеотиды без идентифицированного партнера по перекрестной связи. Пронумерованные подразделения справа от каждого набора дорожек соответствуют участкам гелей для препаративного электрофореза, проанализированных с помощью обратной транскрипции, как показано на пронумерованных дорожках на фиг. 2 и 3. Области гелей, обозначенные перекрестной штриховкой, не использовались для выделения РНК.
Рисунок 1. Разделение и идентификация перекрестных связей в 16S рРНК E.coli , B.subtilis и T.aquaticus с помощью гель-электрофореза. Сшитая 16S рРНК из каждого организма помечена над соответствующим набором сшивок. Эксперименты, проведенные с 30S-субъединицами или 70S-рибосомами, указаны над каждой полосой. Идентификаторы перекрестных связей помечены слева от каждого набора дорожек в соответствии с нумерацией вторичной структуры E.coli .Соответствующие нумерации B.subtilis и T.aquaticus перечислены в таблице 1. Полосы, содержащие орфанные остановки в анализе удлинения праймера обратной транскрипции, указывающие на нуклеотиды без идентифицированного партнера поперечной сшивки, помечены. Пронумерованные подразделения справа от каждого набора дорожек соответствуют участкам гелей для препаративного электрофореза, проанализированных с помощью обратной транскрипции, как показано на пронумерованных дорожках на фиг. 2 и 3. Области гелей, обозначенные перекрестной штриховкой, не использовались для выделения РНК.
Рисунок 2. Анализ обратной транскрипции структуры поперечных сшивок в 30S рибосомных субъединицах T.aquaticus и E.coli . Анализ удлинения праймера, соответствующего нуклеотидам 1060–1196 из 16S рРНК T.aquaticus , показан в ( A ). Анализ удлинения праймера, соответствующий E.coli, нуклеотидов 1075–1215, показан в ( B ). Сшитые нуклеотиды указаны справа от каждой панели и пронумерованы в соответствии с E.coli вторичная структура. Как в (A), так и в (B) удлинение праймера останавливается на 1 нт перед меченым сшитым нуклеотидом. Образцы обратной транскрипции в левой части каждой панели были приготовлены с использованием тотальной необлученной 16S рРНК с ddTTP, ddCTP, ddGTP или ddATP или без дидезоксинуклеотида (полоса 0 в B). Дорожки с номерами 1–10 справа от (A) и 1–13 справа от (B) были приготовлены с использованием облученной 16S рРНК из 30S рибосом, выделенных из препаративных образцов сшитой 16S рРНК T.aquaticus или E.coli , как показано на рисунке 1.
Рисунок 2. Анализ обратной транскрипции структуры сшивок в 30S рибосомных субъединицах T.aquaticus и E.coli . Анализ удлинения праймера, соответствующего нуклеотидам 1060–1196 из 16S рРНК T.aquaticus , показан в ( A ). Анализ удлинения праймера, соответствующий E.coli, нуклеотидов 1075–1215, показан в ( B ). Сшитые нуклеотиды указаны справа от каждой панели и пронумерованы в соответствии с E.coli вторичная структура. Как в (A), так и в (B) удлинение праймера останавливается на 1 нт перед меченым сшитым нуклеотидом. Образцы обратной транскрипции в левой части каждой панели были приготовлены с использованием тотальной необлученной 16S рРНК с ddTTP, ddCTP, ddGTP или ddATP или без дидезоксинуклеотида (полоса 0 в B). Дорожки с номерами 1–10 справа от (A) и 1–13 справа от (B) были приготовлены с использованием облученной 16S рРНК из 30S рибосом, выделенных из препаративных образцов сшитой 16S рРНК T.aquaticus или E.coli , как показано на Рисунке 1.
Рисунок 3. Анализ обратной транскрипции перекрестной сшивки 5 в 30S рибосомных субъединицах B.subtilis и E.coli . Анализ удлинения праймера, соответствующего нуклеотидам 564-616 из 16S рРНК B.subtilis , показан в ( A ). Анализ удлинения праймера, соответствующий нуклеотидам 740–787, показан в ( B ). Как в (А), так и в (В) дорожка 5 показывает остановку удлинения праймера на 1 нт перед сшитым нуклеотидом.Сшитые нуклеотиды указаны справа от каждой панели. Анализ удлинения праймера E.coli 16S рРНК nt 554–612 показан в ( C ). Анализ удлинения праймера нуклеотидов 740-780 показан в ( D ). В (C) и (D) дорожка 11 содержит ограничитель удлинения праймера, соответствующий каждому концу поперечной сшивки. Нумерация соответствует вторичной структуре E.coli . Образцы обратной транскрипции слева от каждой панели были приготовлены с общей необлученной 16S рРНК с ddTTP, ddCTP, ddGTP или ddATP или без дидезоксинуклеотида (дорожка 0).Дорожки с номерами 1–12 в правой части (A) и (B) и 1–12 справа от (C) и (D) были получены с облученной 16S рРНК из 30S рибосом, выделенных из препаративных образцов сшитой 16S рРНК из . B.subtilis или E.coli , как показано на рисунке 1.
Рисунок 3. Анализ обратной транскрипции сшивки 5 в 30S рибосомных субъединицах B.subtilis и E.coli . Анализ удлинения праймера, соответствующий нуклеотидам 564–616 из B.subtilis 16S рРНК представлена в ( A ). Анализ удлинения праймера, соответствующий нуклеотидам 740–787, показан в ( B ). Как в (А), так и в (В) дорожка 5 показывает остановку удлинения праймера на 1 нт перед сшитым нуклеотидом. Сшитые нуклеотиды указаны справа от каждой панели. Анализ удлинения праймера E.coli 16S рРНК nt 554–612 показан в ( C ). Анализ удлинения праймера нуклеотидов 740-780 показан в ( D ). В (C) и (D) дорожка 11 содержит ограничитель удлинения праймера, соответствующий каждому концу поперечной сшивки.Нумерация соответствует вторичной структуре E.coli . Образцы обратной транскрипции слева от каждой панели были приготовлены с общей необлученной 16S рРНК с ddTTP, ddCTP, ddGTP или ddATP или без дидезоксинуклеотида (дорожка 0). Дорожки с номерами 1–12 в правой части (A) и (B) и 1–12 справа от (C) и (D) были получены с облученной 16S рРНК из 30S рибосом, выделенных из препаративных образцов сшитой 16S рРНК из . B.subtilis или E.coli , как показано на рисунке 1.
Рис. 4. Сравнение поперечных сшивок, наблюдаемых в T.aquaticus 16S рРНК из 30S и 70S рибосом при 4 и 70 ° C. Дорожки 1–4 показывают сшивки, идентифицированные в каждом образце, в соответствии с условиями сшивания. Дорожка 1 показывает поперечные связи, наблюдаемые в 30S субъединицах при 4 ° C; дорожка 2 показывает поперечные сшивки, наблюдаемые в рибосомах 70S при 4 ° C; дорожка 3 показывает 30S субъединицы при 70 ° C; дорожка 4 показывает рибосомы 70S, сшитые при 70 ° C. Сшивки указаны слева от панели.Две стрелки в правом нижнем углу панели указывают на две орфанные остановки обратной транскрипции, идентифицированные в этой области геля только в образце рибосомы 70S, сшитом при 70 ° C.
Рис. 4. Сравнение поперечных сшивок, наблюдаемых в T.aquaticus 16S рРНК от 30S и 70S рибосом при 4 и 70 ° C. Дорожки 1–4 показывают сшивки, идентифицированные в каждом образце, в соответствии с условиями сшивания. Дорожка 1 показывает поперечные связи, наблюдаемые в 30S субъединицах при 4 ° C; дорожка 2 показывает поперечные сшивки, наблюдаемые в рибосомах 70S при 4 ° C; дорожка 3 показывает 30S субъединицы при 70 ° C; дорожка 4 показывает рибосомы 70S, сшитые при 70 ° C.Сшивки указаны слева от панели. Две стрелки в правом нижнем углу панели указывают на две орфанные остановки обратной транскрипции, идентифицированные в этой области геля только в образце рибосомы 70S, сшитом при 70 ° C.
Рисунок 5. Сшивки, картированные на вторичной структуре 16S рРНК в E.coli , B.subtilis и T.aquaticus . ( A , C и E ) Полная вторичная структура соответствующих 16S рРНК.( B ) Детальный вид нуклеотидов 750–764 и 577–589 в E.coli , который представляет собой область, содержащую сшивку 5 (C582 × G760). Соответствующие области в B.subtilis и T.aquaticus , показанные в ( D ) и ( F ), указывают на изменение положения сшивки 5. Основные парные области 20a и 20b показаны на панелях ( B), (D) и (F). Нуклеотидные поперечные связи нуклеотидов обозначены большими стрелками, пронумерованными 1–18. Пронумерованные сшивки соответствуют приведенным в таблице 1.
Рис. 5. Сшивки, картированные на вторичной структуре 16S рРНК в E.coli , B.subtilis и T.aquaticus . ( A , C и E ) Полная вторичная структура соответствующих 16S рРНК. ( B ) Детальный вид нуклеотидов 750–764 и 577–589 в E.coli , который представляет собой область, содержащую сшивку 5 (C582 × G760). Соответствующие области в B.subtilis и T.aquaticus , показанные в ( D ) и ( F ), указывают на изменение положения сшивки 5. Базовые парные области 20a и 20b показаны на панелях (B), (D) и (F). Нуклеотидные поперечные связи нуклеотидов обозначены большими стрелками, пронумерованными 1–18. Пронумерованные сшивки соответствуют приведенным в таблице 1.
Таблица 1.Идентификация перекрестных связей, обнаруженных в 16S рРНК в E.coli , B.subtilis и T.aquaticus рибосомы
| Поперечная сшивка | Escherichia coli a | Bacillus subtilis a | Thermus aquaticus 912 912 912 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 911 C352 (55 × 358) | C54 × C352 (55 × 348) | |||||||||
| 2 | U244 × G894 | C244 × G894 (240–872) | |||||||||||
| 3 | 912|||||||||||||
| 4 | U562 × U884 | U562 × U884 (568 × 892) | U562 × U884 (546 × 862) | ||||||||||
| 5 | C58214 × G 763) | G581 × A759 (565 × 743) | |||||||||||
| 6 | G894 × A1468 | ||||||||||||
| 7 | C934 × U1345 | U | |||||||||||
| 8 | C967 × C1400 | C967 × C1400 (975 × 1407) | |||||||||||
| 9 | U991 × U1212 | U991 × U1212 (99914 × 1112 U1212 (99914 × 1219) 99914 × 121912 ) | |||||||||||
| 10 | U1052 × C1200 | U1052 × U1200 (1060 × 1206) | U1052 × U1200 (1035 × 1181) | ||||||||||
| 11 | A1093 × G1182 11014 | A1092 × C1183 (1075 × 1165) | |||||||||||
| 12 | U1126 × C1281 | U1126 × C1281 (1134 × 1288) | U1126 × U1281 (1109 × 1263) | 4 | C1501 | C1402 × C1501 (1409 × 1510) | |||||||
| 14 | C1400 × C1501 | ||||||||||||
| 15 | C139712 912 912 | G15179121 4 | |||||||||||
| 17 | C1054 × A1196 b | C1054 × U1196 (1037 × 1178) | |||||||||||
| 18 | U106514 | 9128 | 9128 c | G724 ×? (708 ×?) | |||||||||
| 20 c | C795 ×? (779 ×?) | ||||||||||||
| 21 c | C1397 ×? (1378 ×?) d | ||||||||||||
| 22 c | C1400 ×? (1407 ×?) | C1400 ×? (1381 ×?) d | |||||||||||
| 23 c | U723 ×? (729 ×?) |
| Поперечная сшивка | Escherichia coli a | Bacillus subtilis a 14 912 912 912 912 914 aqua | a 14 912 914 | 912 914 914 914 | 912 914 | 907 C54 × A353 | C54 × C352 (55 × 358) | C54 × C352 (55 × 348) |
| 2 | U244 × G894 | C244 × G894 (24012–833 | A441 × G494 | |||||
| 4 | U562 × U884 | U562 × U884 (568 × 892) | U562 × U883 (546 × 862) | U562 × U8833 (546 × 862) | 912 912 912C586 × C756 (592 × 763) | G581 × A759 (565 × 743) | ||
| 6 | G894 × A1468 | |||||||
| 7 | U1345 ( | U1345 | U1345 U913) × 1352) 9121 4||||||
| 8 | C967 × C1400 | C967 × C1400 (975 × 1407) | ||||||
| 9 | U991 × U1212 | U99114 × 121912 ( | U121912) | 969 × 1194) | ||||
| 10 | U1052 × C1200 | U1052 × U1200 (1060 × 1206) | U1052 × U1200 (1035 × 1181) | |||||
| 11 | A1093 × G1182 A1093 1101 × 1189) | A1092 × C1183 (1075 × 1165) | ||||||
| 12 | U1126 × C1281 | U1126 × C1281 (1134 × 1288) | U1126 × U1281 (1101214 | C1402 × C1501 | C1402 × C1501 (1409 × 1510) | |||
| 14 | C1400 × C1501 | |||||||
| 15 | ||||||||
| U793 × G1517 | 91 214 | |||||||
| 17 | C1054 × A1196 b | C1054 × U1196 (1037 × 1178) | ||||||
| 18 | U 19 c | G724 ×? (708 ×?) | ||||||
| 20 c | C795 ×? (779 ×?) | |||||||
| 21 c | C1397 ×? (1378 ×?) d | |||||||
| 22 c | C1400 ×? (1407 ×?) | C1400 ×? (1381 ×?) d | ||||||
| 23 c | U723 ×? (729 ×?) |
Идентификация перекрестных сшивок, обнаруженных в 16S рРНК в рибосомах E.coli , B.subtilis и T.aquaticus
| Crosslink | Escherichia coli 960711 a a | Thermus aquaticus a | |||||||||||||||
| 1 | C54 × A353 | C54 × C352 (55 × 358) | C54 × C352 (55 × 348) | 2 G894 | C244 × G894 (240–872) | ||||||||||||
| 3 | A441 × G494 | ||||||||||||||||
| 4 | U562 × 12 U884 U562814 962814 962814 × U884 (546 × 862) | ||||||||||||||||
| 5 | C582 × G760 | C586 × C756 (592 × 763) | G581 × A759 (565 × 743) | ||||||||||||||
| 6 | 14 | ||||||||||||||||
| 7 | C934 × U1345 | U934 × U1345 (944 × 1352) | |||||||||||||||
| 8 | C967 × C1400 | C | 9 | U991 × U1212 | U991 × U1212 (999 × 1219) | U991 × U1212 (969 × 1194) | |||||||||||
| 10 | U1052 × C1200 | U1052 × U1200 (1060 × U1200) 912 U1200 (1035 × 1181) | |||||||||||||||
| 11 | A1093 × G1182 | A1093 × G1182 (1101 × 1189) | A1092 × C1183 (1075 × 1165) | ||||||||||||||
| 12 | 6U1 C1281 (1134 × 1288) | U1126 × U1281 (1109 × 1263) | |||||||||||||||
| 13 | C1402 × C1501 | C1402 × C1501 (1409 × 1510) | |||||||||||||||
| 15 | C1397 × U14 95 | ||||||||||||||||
| 16 | U793 × G1517 | ||||||||||||||||
| 17 | C1054 × A1196 b | U1213 | U1065 × A1188 (1048 × 1170) | ||||||||||||||
| 19 c | G724 ×? (708 ×?) | ||||||||||||||||
| 20 c | C795 ×? (779 ×?) | ||||||||||||||||
| 21 c | C1397 ×? (1378 ×?) d | ||||||||||||||||
| 22 c | C1400 ×? (1407 ×?) | C1400 ×? (1381 ×?) d | |||||||||||||||
| 23 c | U723 ×? (729 ×?) |
| Поперечная сшивка | Escherichia coli a | Bacillus subtilis a 14 912 912 912 912 914 aqua | a 14 912 914 | 912 914 914 914 | 912 914 | 907 C54 × A353 | C54 × C352 (55 × 358) | C54 × C352 (55 × 348) |
| 2 | U244 × G894 | C244 × G894 (24012–833 | A441 × G494 | |||||
| 4 | U562 × U884 | U562 × U884 (568 × 892) | U562 × U883 (546 × 862) | U562 × U8833 (546 × 862) | 912 912 912C586 × C756 (592 × 763) | G581 × A759 (565 × 743) | ||
| 6 | G894 × A1468 | |||||||
| 7 | U1345 ( | U1345 | U1345 U913) × 1352) 9121 4||||||
| 8 | C967 × C1400 | C967 × C1400 (975 × 1407) | ||||||
| 9 | U991 × U1212 | U99114 × 121912 ( | U121912) | 969 × 1194) | ||||
| 10 | U1052 × C1200 | U1052 × U1200 (1060 × 1206) | U1052 × U1200 (1035 × 1181) | |||||
| 11 | A1093 × G1182 A1093 1101 × 1189) | A1092 × C1183 (1075 × 1165) | ||||||
| 12 | U1126 × C1281 | U1126 × C1281 (1134 × 1288) | U1126 × U1281 (1101214 | C1402 × C1501 | C1402 × C1501 (1409 × 1510) | |||
| 14 | C1400 × C1501 | |||||||
| 15 | ||||||||
| U793 × G1517 | 91 214 | |||||||
| 17 | C1054 × A1196 b | C1054 × U1196 (1037 × 1178) | ||||||
| 18 | U 19 c | G724 ×? (708 ×?) | ||||||
| 20 c | C795 ×? (779 ×?) | |||||||
| 21 c | C1397 ×? (1378 ×?) d | |||||||
| 22 c | C1400 ×? (1407 ×?) | C1400 ×? (1381 ×?) d | ||||||
| 23 c | U723 ×? (729 ×?) |
Список литературы
1 Атмаджа, Дж.и Brimacombe, R. (
1985
)Nucleic Acids Res.
,13
,6919
–6937.2 Атмаджа, Дж., Штиге, В., Зобава, М., Греур, Б., Оссвальд, М. и Brimacombe, R. (
1986
)Nucleic Acids Res.
,14
,659
–673.3 Доринг, Т., Грейер, Б. и Brimacombe, R. (
1992
)Nucleic Acids Res.
,20
,1593
–1597.4 Wilms, C., Ной, Дж. У., Чжун, Д. и Wollenzien, P. (
1997
)РНК
,3
,602
–612.5 Ной, Дж. и Wollenzien, P. (
1998
)Биохимия
,37
,15442
–15448.6 Гутелл Р., Ларсен Н. и Woese, C. (
1994
)Microbiol. Ред.
,58
,10
–26.7 Ноллер, Х.Ф. (
1993
) В Гестеланд, Р.Ф. и Аткинс, Дж.F. (eds), The RNA World , Cold Spring Harbor Monograph Series no. 24. Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк.8 Gutell, R.R. (
1993
) В Nierhaus, K.H., Franceschi, F. и Субраманиан А. (ред.), Аппарат перевода . Plenum Press, New York, NY, pp.477
–488.9 Chen, J.L., Nolan, J.M., Harris, M.E. и Пейс, Н. (
1998
)EMBO J.
,17
,1515
–1525.10 Номура, М. и Held, W.A. (
1974
) В Номура, М., Тиссьер, А. и Lengyel, P. (ред.), Рибосомы . Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк, стр.193
–223.11 Номура, М. (
1987
)Колд-Спринг-Харбор Symp. Quant. Биол.
,52
,653
–663.12 Харауз, Г., Летвенюк, Л. и Фланниган, Д. (
1992
)Biochim.Биофиз. Acta
,1129
,207
–214.13 Клемонс, У.М.Дж., Мэй, Дж.Л.С., Уимберли, Б.Т., Маккатчеон, Дж. П., Кейпел, М.С. и Рамакришнан, В. (
1999
)Nature
,400
,833
–840.14 Tocilj, A., Schlunzen, F., Janell, D., Gluhmann, M., Hansen, H.A.S., Harms, J., Bashan, A., Bartels, H., Agmon, I., Franceschi, F. и Йонат, А. (
1999
)Proc. Natl Acad. Sci. США
,96
,14252
–14257.15 Кейт Дж.Х., Юсупов М.М., Юсупова Г.З., Эрнест Т.Н. и Ноллер, Х.Ф. (
1999
)Science
,285
,2095
–2104.16 Махно В.И., Пешин Н.Н., Семенков Ю.П. и Кириллов С.В. (
1988
)Мол. Биол.
,22
,528
–537.17 Wilms, C. и Wollenzien, P. (
1994
)Анал. Biochem.
,221
,204
–205.18 Майдак, Б.Л., Коул, младший, Паркер, Коннектикут, младший, Гаррити, GM, Ларсен, Н., Ли, Б., Лилберн, Т.Г., МакКоги, М.Дж., Олсен, Г.Дж., Овербек, Р., Праманик, С. ., Шмидт, Т.М., Тидье, Дж. М. и Woese, C.R. (
1999
)Nucleic Acids Res.
,27
,171
–173.19 Денман, Р., Негре, Д., Каннингем, П.Р., медсестра, К., Колган, Дж., Вайцманн, К. и Офенганд Дж. (
1989
)Биохимия
,28
,1012
–1019.20 Каннингем, П.Р., медсестра, К., Бакин, А., Вайцманн, К.Дж., Пфлумм, М. и Офенганд Дж. (
1992
)Биохимия
,31
,12012
–12022.21 Эриксон, Г. и Wollenzien, P. (
1988
)Анал. Biochem.
,174
,215
–223.22 Лемегр-Дебрёй Ю., Эксперт-Безансон А. и Фавр, А. (
1991
)Nucleic Acids Res.
,19
,3653
–3660.23 Хайтович Р., Манкин А.С., Грин Р., Ланкастер Л. и Ноллер, Х.Ф. (
1999
)Proc. Natl Acad. Sci. США
,96
,85
–90.24 Шапкина Т.Г., Долан М.А., Бабин П. и Wollenzien, P. (
2000
)J. Mol. Биол.
,299
,617
–630.25 Мерриман, К., Моазед, Д., Мак-Уиртер, Дж. и Ноллер, Х. (
1999
)J. Mol. Биол.
,285
,97
–105.26 Мураликришна, п. и Wickstrom, E. (
1989
)Биохимия
,28
,7505
–7510.27 Моазед, Д., Самаха, Р., Гуалерзи, К. и Ноллер, Х. (
1995
)J. Mol. Биол.
,248
,207
–210.28 Маккатчеон, Дж. П., Агравал, Р., Филипс, С., Грассуччи, Р., Герхман, С., Клемонс, В., младший, Рамакришнан, В. и Фрэнк Дж. (
1999
)Proc. Natl Acad.Sci. США
,96
,3401
–4306.29 Шульман Р.Г. и Ран, Р.О. (
1966
)J. Chem. Phys.
,45
,2940
.30 Снайдер, Л.С., Шульман, Р.Г. и Нойман, Д. (
1970
)J. Chem. Phys.
,53
,256
.31 Пуллман, Б. (
1968
)Photochem. Photobiol.
,7
,525
.32 Смит, К.C. (
1967
) В Силини, Г. (ред.), Radiation Research . North-Holland Publishing, Амстердам, Нидерланды.33 Патрик, M.H. и Ран, Р.О. (
1976
) In Wang, S.Y. (ред.), Фотохимия и фотобиология нуклеиновых кислот . Academic Press, Нью-Йорк, Нью-Йорк.34 Гилберт, А. и Бэгготт, Дж. (
1991
) Основы молекулярной фотохимии . Blackwell Scientific, Кембридж, Массачусетс.35 Бранч, А. Д., Бенефельд, Б. Дж. и Робертсон, Х. (
1985
)Proc. Natl Acad. Sci. США
,82
,6590
–6594.36 Guerrier-Takada, C., Lumelsky, N. и Альтман, С. (
1989
)Science
,246
,1578
–1584.37 Даунс, W.D. и Чех, Т. (
1990
)Биохимия
29
,5605
–5613.38 Мясник, С.Э. и Берк Дж. (
1994
)Биохимия
33
,992
–999.39 Вс, Ж.-С., Валадхан, С. и Мэнли, Дж. (
1998
)РНК
,4
,489
–497.40 Валадхан, с. и Мэнли, Дж. (
2000
)РНК
,6
,206
–219.| слева колика артерия [математика] | الشِّرْيانُ القولونِيُّ الأيسَر |
| средний колика артерия [медицинский] | الشِّرْيانُ القولونِيُّ الأَوسَط |
| справа колика артерия [Компьютер] | الشِّرْيانُ القولونِيُّ الأيمَن |
| верхний дополнительный правый колика артерия [медицинский] | الشِّرْيانُ القولونِيُّ الأَيمَنُ العُلْوِيُّ الإِضافِيّ |
| верхняя левая колика артерия [общая] | الشريان المبطن الأيسر العلوي |
| колики угол [медицинский] | الزَّاوِيَةُ القَولونِيَّة |
| желчная колика (= печеночная колика ) [медицинский] | مَغْصٌ مَرارِيّ (= مَغْصٌ كَبِدِيّ) |
| колибацилемия [Медицинский] | وُجُوْدُ القَوْلُونِيَّاتِ فِي الدَّم |
| колибациллурия ; coliuria [Медицинский] | بِيلَةُ العُصَيَّاتِ القولونِيَّة |
| colibacilus [Аптека] | العُصَيَّةُ القولونِيَّة |
| Девоншир колики (= свинцовые колики ) [Медицинский] | مَغْصُ ديفونشاير (= مَغْصٌ رَصاصِيّ) |
| желчный камень колика (= желчная колика ) [медицинский] | مَغْصُ الحَصاةِ الصَّفْراوِيَّة (= مَغْصٌ مَرارِيّ) |
| почечная колика (= почечная колика ) [Сельское хозяйство] | مَغْصٌ كُلْوِيّ |
| Пуату колики (= свинец колики ) [Сельское хозяйство] | مَغْصُ بواتو (= مَغْصٌ رَصاصِيّ) |
| сатурнин колики (= свинец колики ) [медицинский] | مَغْصٌ رَصاصِيّ |
| КОЛИБАЦИЛЛЕЗ [Медицинский] | مج بالعصيات القولونية |
| кишечник колибактериоз из телят [Общие] | التهاب القولون المعوي للعجول |
| брюшной колики [общие] | مغص بطني |
| аппендикуляр колика [медицинский] | مَغْصٌ زائِدِيّ |
| аппендикулярный колика [медицинский] | مَغْصٌ زائِدِيّ |
Разнообразие по размеру и щелочности термостабильных α-амилаза-пуллуланаз (АапТ), продуцируемых рекомбинантными Escherichia coli, Bacillus subtilis и Bacillus sp.
Abstract
Щелочная Bacillus sp. XAL601 производит термостабильную и алкалифильную α-амилазу-пуллуланазу с высокой молекулярной массой (AapT; MB 220 кДа). Ген aapT , который был клонирован и экспрессирован в Escherichia coli , был субклонирован в Bacillus subtilis ANA-1. Фермент, экспрессируемый рекомбинантным B. subtilis ANA-1, был обнаружен в виде двух усеченных форм (AapT-1, 85 кДа; AapT-2, 135 кДа) на геле, окрашивающем активность амилазы, в то время как рекомбинантный E.coli экспрессирует единственную амилазу с молекулярной массой 220 кДа (AapT), что соответствует молекулярной массе, рассчитанной из открытой рамки считывания aapT . Оптимальная температура для активности AapT-1 (85 кДа) и AapT-2 (135 кДа) составляла 70 ° C, что совпадает с температурой полноразмерного AapT (220 кДа) из E. coli . Напротив, оптимальные значения pH для активности AapT-1 и AapT-2 были pH 7,0 и pH 8,0, соответственно, тогда как pH AapT (220 кДа) составлял 9.0. Эти наблюдения показали, что оптимальный pH для активности AapT был изменен с щелочной на нейтральную область, когда фермент экспрессировался в усеченной форме с более низкой молекулярной массой. Кроме того, выравнивание аминокислотной последовательности позволило предположить, что AapT был усечен в его C-концевой области. Следовательно, некаталитический C-концевой участок может быть ответственным за высокий оптимальный pH активности фермента. Кроме того, окрашивание активности и дальнейший анализ AapT из исходного штамма Bacillus sp.XAL601 показал гликозилирование фермента.
Ключевые слова
α-амилаза-пуллуланаза
алкалифильный фермент
усеченная форма
Рекомендуемые статьи Цитирующие статьи (0)
Полный текстАвторские права © 1996 Издано Elsevier BV
929ibac00 Coliting Medical Определение | Медицинский словарь Merriam-Webster co · li · ba · cil · lo · sis | \ -ˌBas-ə-ˈlō-səs \ множественные колибактериозы \ — sēz \: инфекция или заболевание, вызванное бациллами толстой кишки (особенно E.coli)
исследований диареи кишечной палочки у телят в штате Хартум, Судан
Аннотация:
Молочные фермы, расположенные в разных населенных пунктах штата Хартум, были исследовали на наличие диареи телят.Исследование было продлено на два лет и охватывала разные сезоны (зима, осень и лето) 2010, 2011 и 2012 годов. По результатам анкетного опроса 500 хозяйств, две первые недели телятного возраста — самые опасные и рискованные. снижается до 79,0%, 73,6% и 10,0% на третьей, четвертой, пятой неделях соответственно. Потери телят из-за диареи телят и усыновления различные испытания лечения диареи телят. Большинство владельцев предпочли Диаклин (77.6%), тетрациклин (69,2%) и сульфаниламиды (58,0%) и меньшинство обратили внимание на инфузионную терапию (15,0%), ципрофлоксацин (35,8%) и Колипра (31,8%). Девять целых четыре десятых процента владельцев не обращались с понос теленка и только уменьшение частоты сосания молока телят. Случаи диареи телят были зарегистрированы в 300 из 500 ферм Хартума. Состояние с заболеваемостью 60%. Осенью заболеваемость была выше. сезоны и зимние сезоны, чем летние сезоны.Среди 300 телят с поносом, которые послужили источниками образцов, смертность была выше в первую и вторую недели (29,8% и 20,0%). соответственно), чем на третьей неделе (19,1%). Всего было отобрано 300 проб фекалий из разных мест Штат Хартум и в общей сложности было получено 342 бактериальных изолята. В соответствии культуральным характеристикам, морфологии бактерий и биохимическим реакциям По результатам идентифицированные бактерии: Escherichia coli (76.0%), эшерихии fergusoni (2,3%), Escherichia vulneris (0,6%), Klebsiella pneumonia sub spp. Ozaenae (6,4%), Proteus mirabilis (8,8%) и Enterococcus faecalis (5,8%). Девяносто E. coli, 8 Escherichia fergusoni и 2 Escherichia vulneris изоляты были подтверждены с помощью полосок API 20E. Различная идентификация XI процентное содержание от 89,8% до 99,8% было получено полосами API 20E. Двадцать изолятов E. coli имели высокий процент вероятности в диапазоне от 96%. до 99% при использовании системы VITEK2.Это первый отчет в Судане об использовании Автоматическая идентификационная система VITEK2 для идентификации изолятов E. coli. Сто десять изолятов E. coli, выбранных случайным образом и проверенных на владение специфическими фимбриальными антигенами. Фимбриальные адгезины были обнаружены в тестируемых изоляты с разным процентным содержанием. K99 (F5) (17,3%), K88 (F4) (15,5%) и 987p (F6) был обнаружен (как новая находка) с процентом 1,8%. Пятьдесят изолятов E. coli были отобраны случайным образом и исследованы на предмет их производство STa с помощью теста на мышах-сосунках.Сорок пять изолятов (90,0%) были положительными. Эти 50 изолятов E. coli, использованные в тесте SMT, были подвергнуты LT Тест способности продуцировать энтеротоксины с помощью набора RPLA. Десять изолятов (20%) дала положительные результаты. Это первое сообщение в Судане об обнаружении LT у E. coli, выделенную из диареи телят молочного скота с помощью наборов RPLA. В этом исследовании 150 изолятов из 260 E. coli, выделенных при диарее. образцы были подвергнуты тестам на чувствительность с использованием 10 противомикробных препаратов, используемых для лечение диареи телят в Судане.Девяносто шесть целых семь десятых процента изоляты были чувствительны к гентамицину, 90,7% к ампициллину, 84,0% к Ципрофлоксацин, 80,0% к сульфаметоксазол-триметоприму, 76,0% к Цефалотин, 74,6% к канамицину, 74,0% к хлорамфениколу, 70,0% к Тетрациклин, 15,3% к эритромицину и 0,0% к прокаину пенициллину
.
