Рак печени | анализы крови на онкомаркеры со скидкой 50% от стоимости в Lab4U
Информация об анализе
Развитие злокачественной опухоли печени связано с наличием фоновой патологии печени (вирусные гепатиты, цирроз печени любой этиологии, неалкогольный стеатогепатит, аутоиммунный, токсический гепатит, наследственные заболевания). Чаще, чем первичный рак печени встречаются метастазы опухолей других органов.
Комплексное исследование показано при имеющихся хроническом гепатите, циррозе и других заболеваниях печени. Если врач не назначил чаще, то ежегодно и при ухудшении состояния.
Исследование может использоваться при опухолях любой локализации в комплексной оценке состояния печени.
Интерпретацию результатов, выбор обследований и лечения определяет лечащий врач.
Материал для исследования — Сыворотка крови
Состав и результаты
Срок исполнения
Анализ будет готов в течение 1 дня, исключая воскресенье и день забора. Срок может быть увеличен на 1 день в случае необходимости. Вы получите результаты на эл. почту сразу по готовности.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)Подготовка к анализу
ЗаранееОбсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
НаканунеЗа 24 часа до взятия крови:
- Ограничьте жирную и жареную пищу, не принимайте алкоголь.
- Исключите тяжёлые физические нагрузки.
От 8 до 14 часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
Перед забором крови
- 60 минут не курить,
- 15-30 минут находиться в спокойном состоянии.
Новообразования печени
Печеночноклеточный рак (гепатоцеллюлярная карцинома) — самая распространенная первичная злокачественная опухоль печению. Более часто встречаются метастазы в печень из первичных опухолей других органов. Это связано с сильным кровоснабжением органа. Метастазируют в печень практически все опухоли, чаще других колоректальный рак.
Как правило, рак печени развивается бессимптомно, и выявляется случайно. У некоторых возникает болевой синдром в правом подреберье, потеря аппетита, потеря веса.При развитии заболевания возможно появление желтушности кожных покровов и склер.
У некоторых возникает болевой синдром в правом подреберье, потеря аппетита, потеря веса.При развитии заболевания возможно появление желтушности кожных покровов и склер.
Менее 10% случаев рака развивается в здоровой печени. Развитие заболевания связано с наличием фоновой патологии печени (вирусные гепатиты, цирроз печени любой этиологии, неалкогольный стеатогепатит, аутоиммунный, токсический гепатит, наследственные заболевания). Выраженность нарушений функций печени влияет на возможности лечения опухоли.
Альфа-фетопротеин (АФП) – опухолево-специфический маркер для печеночноклеточного рака, но его уровень может повышаться при гепатитах, других болезнях печени и иных опухолях. В случаях обследования на ранних стадиях АФП повышается лишь у 10-20% больных. В этих случаях его оценивают вместе с уровнем ферритина.
Комплексное исследование, включает в себя определение концентрации АФП (альфа-фетопротеина), РЭА (раково-эмбрионального антигена) и ферритина в сыворотке крови. Исследование используется для диагностики первичного рака печени, метастазов в печень. Онкомаркерами являются высокомолекулярные соединения, исследуемые в крови, в моче или на поверхности клеток, идентификация и определение их уровня используется для диагностики пациентов и планирования лечения. Онкомаркеры выделяются из клеток опухоли, либо нормальными клетками в присутствии опухоли. Однако не следует слишком переоценивать их диагностическое значение, так как повышенные показатели онкомаркеров могут встречаются у пациентов с изменениями, не связанными со злокачественными новообразованиями. С другой стороны, несмотря на наличие злокачественной опухоли, уровень онкомаркера может быть в пределах референсных значений. Это бывает часто при начальных стадиях развития опухоли.
Исследование используется для диагностики первичного рака печени, метастазов в печень. Онкомаркерами являются высокомолекулярные соединения, исследуемые в крови, в моче или на поверхности клеток, идентификация и определение их уровня используется для диагностики пациентов и планирования лечения. Онкомаркеры выделяются из клеток опухоли, либо нормальными клетками в присутствии опухоли. Однако не следует слишком переоценивать их диагностическое значение, так как повышенные показатели онкомаркеров могут встречаются у пациентов с изменениями, не связанными со злокачественными новообразованиями. С другой стороны, несмотря на наличие злокачественной опухоли, уровень онкомаркера может быть в пределах референсных значений. Это бывает часто при начальных стадиях развития опухоли.
В клинической практике определение уровня онкомаркеров проводится как дополнительный метод диагностики онкологических заболеваний в сочетании с другими методами исследований. Исследование онкомаркеров проводиться также с целью раннего обнаружения опухоли и метастазов (скрининговые обследования групп риска) и прогноза течения заболевания.
Общая схема назначения исследования онкомаркеров в клинической практике:
- Перед началом лечения рекомендуется провести исследования необходимых онкомаркеров и в дальнейшем проводить исследования тех онкомаркеров, концентрация которых была повышена.
- После курса лечения или операции исследование онкомаркеров рекомендуется провести через 10-21 дней (в соответствии с периодом полураспада онкомаркера) с целью установления исходного уровня для дальнейшего мониторинга.
- Для оценки эффективности проведенного лечения исследование онкомаркеров проводится через месяц, далее исследование концентрации онкомаркеров рекомендуется проводить с интервалом в 3-4 месяца в течение 2-х лет, затем с интервалом в 6 месяцев в течение 3-5 лет.

- Исследование концентрации онкомаркеров рекомендуется проводить перед любым изменением лечения.
- Определение онкомаркеров проводится при подозрении на рецидив или метастазирование опухоли.
- Повторное определение уровня онкомаркера рекомендуется провести через 3-4 недели, после первого выявления повышенной концентрации.
Ученые открыли новый биомаркер для диагностики рака печени
Онкомаркерами называют вещества, по которым врачи могут определить наличие у человека онкологического заболевания. В качестве онкомаркеров могут использовать любые вещества, концентрация которых значимо отличается у больного и здорового человека. В роли онкомаркеров могут выступать некодирующие РНК – молекулы РНК, не кодирующие белки, но играющие важную роль в процессах регуляции жизнедеятельности клеток. Некодирующие РНК разделяют на универсальные, присутствующие во всех клетках организма, и тканеспецифичные, обнаруживаемые только в определённых органах и тканях.
Группа ученых из Сколтеха нашла в печени ранее неописанную некодирующую РНК, которую можно использовать в качестве биомаркера. Новую молекулу назвали HELIS (HEalthy LIver Specific), потому что в отличие от классических онкомаркеров, свидетельствующим о наличии заболевания, она служит маркером здоровой печени, ее можно даже назвать анти-онкомаркером.
По словам первого автора исследования научного сотрудника Центра наук о жизни Сколтеха Ольги Бурениной эта особенность может трактоваться как преимущество: «Многие классические онкомаркеры далеко не всегда проявляют себя при раке, или их количество может возрастать из-за других болезней, в случае печени из-за цирроза или гепатита. Маркеры “здоровой печени” могут быть более информативны, ведь если в раковых клетках что-то «сломалось”, например, нарушено производство HELIS, то это уже так просто не починится».
В сотрудничестве с НИИ канцерогенеза ФГБНУ «Российский научный онкологический центр имени Н. Н. Блохина» Минздрава РФ и Российским научным центром хирургии им. акад. Б.В. Петровского, предоставившими ученым постоперационные образцы 6 видов опухолей печени, удалось показать, что во всех опухолевых образцах уровень HELIS снижался по сравнению с нормой, причем в некоторых типах рака вплоть до полного исчезновения. Далее ученые посмотрели на поведение уже известных некодирующих РНК в этих образцах и отобрали еще 3 потенциальные онкомаркера. В итоге получилась панель из четырех биомаркеров, по-разному изменяющихся в разных типах рака, в том числе способных отличить доброкачественную и злокачественную опухоль.
Н. Блохина» Минздрава РФ и Российским научным центром хирургии им. акад. Б.В. Петровского, предоставившими ученым постоперационные образцы 6 видов опухолей печени, удалось показать, что во всех опухолевых образцах уровень HELIS снижался по сравнению с нормой, причем в некоторых типах рака вплоть до полного исчезновения. Далее ученые посмотрели на поведение уже известных некодирующих РНК в этих образцах и отобрали еще 3 потенциальные онкомаркера. В итоге получилась панель из четырех биомаркеров, по-разному изменяющихся в разных типах рака, в том числе способных отличить доброкачественную и злокачественную опухоль.
«На данный момент нет ни одного хорошего диагностического маркера для рака печени, диагноз ставят в основном по УЗИ или КТ и вырезают всю опухоль вне зависимости оттого, какую именно подозревают. Биопсию чаще всего не берут. Поэтому реальный диагноз ставится по результатам гистологии, которую ждут 10–14 дней», – рассказывает Ольга Буренина.

Новая панель может использоваться для быстрой первичной диагностики постоперационных препаратов опухолей печени, а также для дополнительного анализа сомнительных клинических случаев.
Лабораторная диагностика рака желудка
Комплексное исследование — определение онкомаркеров, — используемое в диагностике рака желудка; определяемый онкомаркер CA 19, ассоциированный с раковыми патологиями, и специфический антиген СА 72-4, продуцируемый в большом количестве злокачественными опухолями железистой ткани, такими как карцинома желудка, для большей диагностической ценности исследуются совместно с еще одним онкомаркером — РЭА — раково-эмбриональным антигеном. Исследование информативно в том случае, когда имеется подозрение на рак органа, в целях мониторинга состояния больного после радикальной операции, для того чтобы убедиться, что во время удаления части желудка опухоль удалена полностью; чтобы спрогнозировать вероятность рецидива заболевания; в целях мониторинга эффективности проводимой противоопухолевой терапии.
Состав исследования:
- CA 19-9
- CA 72-4
- Раковый эмбриональный антиген (РЭА)
Синонимы русские
Углеводный антиген 19-9, раковый антиген СА 19-9, карциноэмбриональный антиген, раково-эмбриональный антиген.
Синонимы английские
Ca 19-9, Cancer Antigen 19-9, Carbohydrate Antigen 19-9, Gastrointestinal Cancer Antigen, Carcino Embryonic Antigen, Carcinoembryonic Antigen, CEA, CA 72-4.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.

- Не курить в течение 24 часов до исследования.
Общая информация об исследовании
Рак желудка — подробнее о заболевании: https://helix.ru/kb/item/735.
Раковый антиген СА 19-9 – это высокомолекулярный гликопротеин, который в норме вырабатывается клетками эпителия желудочно-кишечного тракта. Его уровень повышается практически у всех пациентов с опухолями желудочно-кишечного тракта, особенно поджелудочной железы. Продуцируясь опухолевыми клетками, СА 19-9 поступает в кровоток, что делает его эффективным маркером опухоли, позволяющим следить за течением заболевания.
Уровень онкомаркера CA 19-9 повышен у 70 % пациентов с раком поджелудочной железы.
Может увеличиваться его концентрация и при опухолях других локализаций (колоректальном раке, раке печени, желудка, желчного пузыря или желчных путей, яичников), заболеваниях печени (гепатите, циррозе), желчнокаменной болезни, панкреатите, муковисцидозе.
При этом сам по себе тест на СА 19-9 не используется для первичной диагностики рака, так как не обладает достаточной чувствительностью и специфичностью. В данном исследовании для большей достоверности и точности диагностики он определяется совместно с еще одним онкомаркером — РЭА.
В данном исследовании для большей достоверности и точности диагностики он определяется совместно с еще одним онкомаркером — РЭА.
В случаях когда повторный тест показывает меньшие значения, чем в первый раз, можно говорить о затухании воспалительного процесса, о высокой эффективности лечения. Если же после удаления опухоли онкомаркер держится на стабильно одинаковых, высоких результатах, речь идет о метастазировании.
Раковый антиген СА 72-4 – это высокомолекулярный муциноподобный гликопротеин, который вырабатывается во многих тканях плода и в норме практически не обнаруживается у взрослого человека. Производство СА 72-4 увеличивается практически у всех пациентов со злокачественными опухолями железистого генеза, особенно при раке желудка, муцинозном раке яичников.
СА 72-4 продуцируется опухолевыми клетками и поступает в кровоток, что делает его эффективным маркером опухоли.
Раковый эмбриональный антиген (РЭА) – это вещество белковой природы, которое используется в лабораторной практике в качестве тканевого маркера онкологических заболеваний. Определение уровня РЭА используется для диагностики ряда злокачественных опухолей, в первую очередь рака толстой и прямой кишки. Если в норме содержание РЭА очень низкое, то при онкологическом процессе оно резко возрастает и может достигать очень больших значений. В связи с этим его относят к тканевым маркерам онкологических заболеваний, или онкомаркерам. Анализ на РЭА применяется для ранней диагностики, наблюдения за течением заболевания и контроля за результатами его лечения при некоторых опухолях, в первую очередь если это рак толстого кишечника и прямой кишки, но также РЭА может повышаться при раке желудка, поджелудочной, молочной железы, легких, яичников.
Определение уровня РЭА используется для диагностики ряда злокачественных опухолей, в первую очередь рака толстой и прямой кишки. Если в норме содержание РЭА очень низкое, то при онкологическом процессе оно резко возрастает и может достигать очень больших значений. В связи с этим его относят к тканевым маркерам онкологических заболеваний, или онкомаркерам. Анализ на РЭА применяется для ранней диагностики, наблюдения за течением заболевания и контроля за результатами его лечения при некоторых опухолях, в первую очередь если это рак толстого кишечника и прямой кишки, но также РЭА может повышаться при раке желудка, поджелудочной, молочной железы, легких, яичников.
Для чего используется исследование?
- Для контроля за эффективностью лечения рака поджелудочной железы и выявления рецидивов заболевания.
- Для получения информации о распространенности опухолевого процесса, наличии отдаленных метастазов при раке поджелудочной железы.
- Для дифференциальной диагностики рака поджелудочной железы с другими заболеваниями, такими как панкреатит.

Когда назначается исследование?
- При симптомах рака поджелудочной железы: боли в животе, тошноте, потере веса, желтухе.
- Для мониторинга карциномы поджелудочной железы.
- Периодически для контроля за эффективностью лечения и выявления рецидивов у пациентов с раком поджелудочной железы с изначально повышенным уровнем CA 19-9.
- При подозрении на рак печени, желчного пузыря или желчных путей, желудка, толстого кишечника (в комплексе с другими онкомаркерами).
Что означают результаты?
Изолированное использование исследования в целях скрининга и диагностики онкологических заболеваний недопустимо. Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. Диагностика любого заболевания строится на основании разностороннего обследования с использованием различных, не только лабораторных методов и осуществляется исключительно врачом.
CA 19-9
Референсные значения: 0 — 34 Ед/мл.
Отсутствие или низкий уровень ракового антигена СА 19-9 в крови характерен для здоровых людей.
Чрезмерное содержание онкомаркера СА 19-9 в крови чаще всего свидетельствует о раке поджелудочной железы. Как правило, чем выше у пациента уровень СА 19-9, тем более у него поздняя стадия заболевания. Очень высокая концентрация СА 19-9 наблюдается в случае метастазирования рака поджелудочной железы.
Кроме того, высокий показатель CA 19-9 может указывать на различные заболевания: колоректальный рак, рак печени, желудка, желчного пузыря или желчных путей, яичников, заболевания печени (гепатит, цирроз), желчнокаменную болезнь, панкреатит, муковисцидоз.
При этом нормальная концентрация CA 19-9 не исключает наличия рака поджелудочной железы. Так бывает на начальной стадии опухолевого процесса, когда уровень CA 19-9 еще не повысился.
Периодические измерения СА 19-9 могут быть полезны во время и после лечения рака поджелудочной железы. По нарастанию или снижению его уровня можно оценивать эффективность проводимого лечения или выявлять рецидивы опухоли.
Отсутствие или пониженное содержание раковых антигенов СА 19-9 в крови означает:
- норму,
- успешность проводимого лечения,
- раннюю стадию рака поджелудочной железы, когда уровень онкомаркеров не успел повыситься.
Повышенное содержание раковых антигенов СА 19-9 в крови означает:
- рак поджелудочной железы,
- опухоль других локализаций (колоректальный рак, рак печени, желудка, желчного пузыря или желчных путей, яичников),
- заболевания печени (гепатит, цирроз),
- желчнокаменную болезнь,
- панкреатит,
- муковисцидоз.
CA 72-4
Референсные значения: 0 — 6,9 Ед/мл.
Отсутствие или низкий уровень ракового антигена СА 72-4 в крови характерен для здоровых людей.
По нарастанию или снижению концентрации СА 72-4 со временем можно оценить эффективность проводимого лечения или выявить рецидивы опухоли.
Причины повышения CA 72-4
- Рак желудка (обычно чем выше уровень СА 72-4, тем более поздняя стадия рака желудка).

- Муцинозный рак яичников.
- Метастазирование рака желудка.
- Опухоли других локализаций (колоректальный рак, рак легких).
- Заболевания печени (гепатит, цирроз).
- Доброкачественные заболевания яичников (киста).
- Воспалительные заболевания желудочно-кишечного тракта (язвенная болезнь желудка).
РЭА
Референсные значения
- Для некурящих: 0 — 3,8 нг/мл;
- для курящих: 0 — 5,5 нг/мл.
Нормальное количество РЭА в сыворотке крови указывает на низкий риск онкологического заболевания. Кроме того, такой результат возможен, если данный тест нечувствителен к тому или иному типу опухоли.
Причины повышения уровня РЭА
- Злокачественные новообразования:
- толстого кишечника,
- прямой кишки,
- желудка,
- легких,
- молочной железы,
- рака поджелудочной железы.

- Метастазы злокачественных опухолей в печень, костную ткань.
- Рецидив онкологического процесса.
- Цирроз печени и хронические гепатиты.
- Полипы толстого кишечника и прямой кишки.
- Язвенный колит.
- Панкреатит.
- Туберкулез.
- Пневмония, бронхит, эмфизема легких.
- Муковисцидоз.
- Почечная недостаточность.
- Болезнь Крона.
- Аутоиммунные заболевания.
- Курение.
Небольшое повышение уровня РЭА может быть связано с доброкачественными заболеваниями внутренних органов в их острой стадии, однако не исключает начальной стадии онкологического заболевания.
Значительное повышение концентрации РЭА (кратное) возникает при злокачественных опухолях. При метастазах обычно наблюдается повышение в десятки раз.
Причины снижения уровня РЭА
- Хирургическое удаление злокачественной опухоли.
- Успешная терапия онкологического заболевания.

- Ремиссия доброкачественной опухоли.
Онкомаркеры. Важный сигнал или деньги на ветер?
ПСА, СА125, СА242, СА15-5 и многие другие анализы известные как онкомаркеры. Насколько они точны и когда их стоит сдавать? Помогут ли они в раннем выявлении опухолей?
Что такое онкомаркеры?
Представим теоретическую ситуацию — врач дал направление на онкомаркеры, сейчас даже не будем выяснять, на какие именно: • Какие чувства испытывает пациент, получив такое направление и ожидая результата? • Какие эмоции вызовет цифра на бланке, если она окажется вне границ нормы? • Ужас, страх, отчаяние. А нужны ли они нам?
Давайте разберемся насколько точны онкомаркеры и когда нужно определять их уровень. Мы будем использовать данные только очень серьезных источников: статистические данные Всемирной Организации здравоохранения и международные рекомендации разработанные Национальной Академией Клинической Биохимии (NACB, США) и Европейской Группой по Изучению Опухолевых Маркеров (EGTM), конечно с адаптацией к Российской действительности.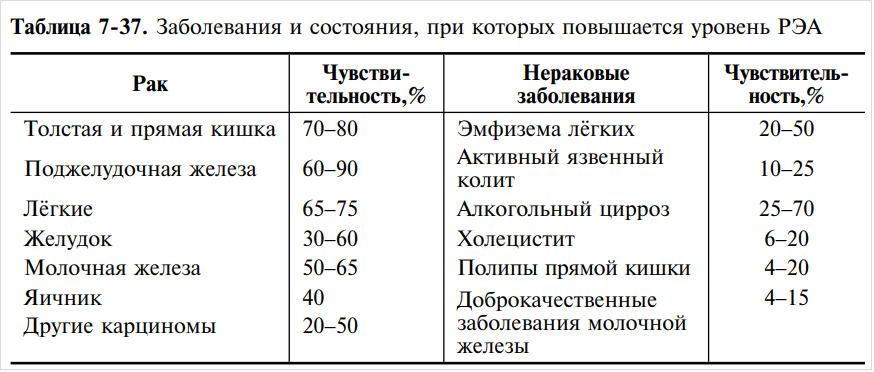
Давайте разберемся с самого начала:
Онкомаркерами называют те или иные вещества, которые определяют в биологических жидкостях организма (чаще всего речь идет о сыворотке крови), так же онкомаркеры могут выявлять в экстрактах или парафиновых блоках тканей. Идеальный маркер должен обладать двумя характеристиками: • чувствительность — это процент положительных результатов у людей с опухолью • специфичность — это процент здоровых людей, у которых тест дает отрицательный результат
Идеальными были бы 100% чувствительность и 100% специфичность. При этом онкомаркер должен быть характерным для какого-то конкретного вида опухолей.
К сожалению, подобных маркеров еще не обнаружено, поэтому всегда сохраняется право на ошибку, как в сторону ложного диагноза, так и в сторону ложного спокойствия.
Важность диагностики опухолей
По данным Всемирной Организации Здравоохранения (ВОЗ) ежегодно 6 миллионов человек в мире умирает от злокачественных опухолей. И ежегодно выявляется более 10 миллионов новых случаев онкологических заболеваний.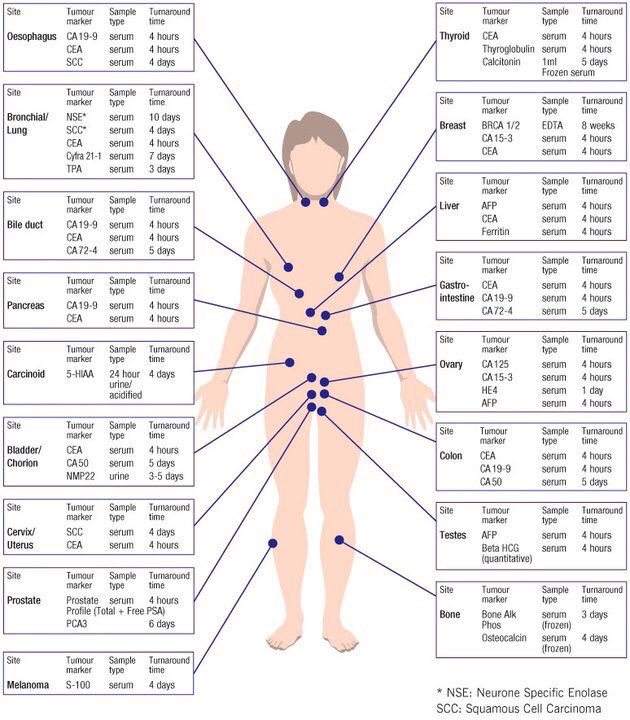 По прогнозам ВОЗ в ближайшие 20 лет ситуация будет только ухудшаться — смертность возрастет до 10 миллионов в год, в заболеваемость до 15 миллионов в год.
По прогнозам ВОЗ в ближайшие 20 лет ситуация будет только ухудшаться — смертность возрастет до 10 миллионов в год, в заболеваемость до 15 миллионов в год.
При этом до 40% случаев рака можно было избежать, сократив осознанные контакты с канцерогенами и 30% смертей можно предотвратить, выявляя опухоли на ранних этапах.
Какие онкомаркеры нам известны
Перечень известных онкомаркеров стремится к бесконечности. Большая часть из них очень специфичны и не известны врачам общей практики. Чаще всего врачей, которые не специализируются на ведении больных с онкопатологией, интересуют следующие:
- ПСА (простат-специфический антиген) — антиген характерный для ткани предстательной железы, его уровень в крови повышается как при злокачественных, так и при доброкачественных заболеваниях простаты. Кроме того уровень ПСА может быть повышен после травм, пальпации, механического раздражения железы или эякуляции накануне сдачи анализа.
- СА125 антиген, присутствующий в нормальной ткани эндометрия.
 Он проникает в кровоток только в случае повреждения природных барьеров. Его уровни в крови могут удваиваться во время менструации и при эндометриозе. Значительное повышение уровня СА125 происходит при раке яичников (в 80% случаев) и других органов женской половой системы, опухолях молочной и поджелудочной желез, прямой кишки, желудка легких и печени. Из доброкачественных заболеваний к повышению уровня этого маркера приводят воспалительные заболевания органов женской половой системы, гепатиты, циррозы и аутоиммунные заболевания.
Он проникает в кровоток только в случае повреждения природных барьеров. Его уровни в крови могут удваиваться во время менструации и при эндометриозе. Значительное повышение уровня СА125 происходит при раке яичников (в 80% случаев) и других органов женской половой системы, опухолях молочной и поджелудочной желез, прямой кишки, желудка легких и печени. Из доброкачественных заболеваний к повышению уровня этого маркера приводят воспалительные заболевания органов женской половой системы, гепатиты, циррозы и аутоиммунные заболевания. - СА15-3 антиген, наиболее характерный для опухолевых клеток из молочной железы, его уровень может увеличиваться и при злокачественных опухолях других локализаций (желудка, печени, поджелудочной железы и органов женской репродуктивной системы). Кроме того его уровень повышается при доброкачественных заболеваниях молочных желез и аутоиммунных процессах
- СА19-9 антиген, который вырабатывается клетками карциномы поджелудочной железы, реже опухолей желудка (второй по значимости маркёр этих опухолей), печени и молочной железы.
 Из доброкачественных заболеваний к повышению его уровня приводят гепатиты и цирроз, холецистит и муковисцидоз.
Из доброкачественных заболеваний к повышению его уровня приводят гепатиты и цирроз, холецистит и муковисцидоз. - СА242 это маркёр злокачественных опухолей желудочно-кишечного тракта, в основном повышается при опухолях поджелудочной железы, кишечника и желудка, но может быть повышен и при доброкачественных заболеваниях этих органов.
- СЕА (он же РЕА- раково-эмбриональный антиген) обнаруживается в некоторых тканях взрослых в очень малых количествах. При опухолевых процессах концентрация РЭА в крови значительно повышается. Рост концентрации этого маркера происходит при колоректальном раке, раке лёгкого, молочной или поджелудочной желез, метастазах злокачественных опухолей в печень, костную ткань, опухолях простаты и яичников. При этом повышение происходит и при доброкачественных заболеваниях кишечника, печени и легких, особенно у заядлых курильщиков.
А теперь, давайте узнаем, в каких случаях стоит проводить подобный анализ.
Самые распространенные опухоли.

Достаточно часто люди боятся рака в целом. Но провериться на все болезни нельзя, поэтому посмотрим статистику ВОЗ и узнаем, какие опухоли уносят больше всего жизней у жителей России.
Мужчины:
- Раки трахеи, бронхов и легких- 27,8%
- Опухоли желудка — 12,55
- Раки толстой и прямой кишки — 11,8 %
- Рак предстательной железы — 7,7%
- Опухоли слизистых рта и ротоглотки 5,0%
- 35,3% приходится на смерти от всех остальных видов опухолей
Женщины:
- Опухоли молочных желез — 17,8%
- Опухоли прямой и толстой кишки — 16,5%
- Опухоли желудка — 10,9%
- Раки трахеи, бронхов и легких — 6,8%
- Опухоли поджелудочной железы 5,9%
- 42,2% приходится на смерти от всех остальных видов опухолей
А теперь рассмотрим возможности использования онкомаркеров для выявления и лечения людей с этими опухолями.
Раки трахеи, бронхов и легких
Маркерами которые могут быть использованы для определения прогнозов при раке легкого считаются НСЕ, РЕА и CYFRA21. 1. НСЕ (нейрон-специфическая энолаза)-характерна только для одного вида этого рака-для мелкоклеточного. Для остальных видов рака легкого используются РЕА и CYFRA21.1. Ни один из этих маркеров не может быть использован для диагностики, так как специфичность их очень низка (другими словами выявляется достаточно много ложноположительных результатов при низкой чувствительности метода. Однако эти маркеры необходимы для оценки результатов лечения- при сравнении уровней их до начала терапии и в процессе лечения. Так же они могут применяться после хирургического лечения для выявления рецидива.
1. НСЕ (нейрон-специфическая энолаза)-характерна только для одного вида этого рака-для мелкоклеточного. Для остальных видов рака легкого используются РЕА и CYFRA21.1. Ни один из этих маркеров не может быть использован для диагностики, так как специфичность их очень низка (другими словами выявляется достаточно много ложноположительных результатов при низкой чувствительности метода. Однако эти маркеры необходимы для оценки результатов лечения- при сравнении уровней их до начала терапии и в процессе лечения. Так же они могут применяться после хирургического лечения для выявления рецидива.
Опухоли молочных желез
Опухоли молочной железы являются самой частой причиной смерти женщин от онкологических заболеваний. Особенностью этих опухолей являются хорошие результаты лечения на ранних стадиях, поэтому очень важно своевременное выявление. При раке молочной железы наибольшее значение имеют РЭА и СА15.3 . Доказано, что у женщинам, перенесших радикальное лечение, повышение СА15.3 практически всегда говорит о рецидиве болезни. Динамика уровней этого маркера в процессе лечения отражает эффективность выбранного метода терапии. Однако учитывая низкую специфичность СА15.3 не рекомендуется использовать его для скрининга рака молочной железы
Динамика уровней этого маркера в процессе лечения отражает эффективность выбранного метода терапии. Однако учитывая низкую специфичность СА15.3 не рекомендуется использовать его для скрининга рака молочной железы
Опухоли прямой и толстой кишки
Если колоректальный рак выявлен на ранней стадии, то 5-илетняя выживаемость после лечения достигает 90%, это очень хороший показатель в онкологии. Самым частым маркером этого вида опухолей является РЭА. Однако и здесь в рекомендациях экспертов мы видим картину схожую с предыдущими. Динамика РЭА может использоваться для выявления прогрессирования после проведенного лечения, особенно важен этот маркер для выявления прогрессирования после удаления метастазов из печени. Но его определение не используется для скрининга колоректального рака.
Опухоли предстательной железы
В России определение ПСА используется для скрининга рака предстательной железы при ежегодных диспансерных обследованиях мужчин старше 50 лет. В США и странах Европы так же рекомендовано определение этого маркера всем мужчинам старше 50 лет, а при отягощенной наследственности от 40-45 лет. Однако, полагаясь на результаты теста, необходимо учитывать несколько интересных фактов о данном маркере:
Однако, полагаясь на результаты теста, необходимо учитывать несколько интересных фактов о данном маркере:
- ПСА информативен только в сочетании с пальцевым ректальным исследованием
- При сдаче крови на анализ необходима соответствующая подготовка
- При оценке результата необходимо использовать возрастные нормы
- Мужчинам старше 75 лет подобный скрининг не назначается, так как лечение неклинических форм рака предстательной железы только ухудшает прогноз для жизни
- Данные исследований, опубликованные в 2011 году подтвердили, что раннее выявление рака предстательной железы благодаря скринингу в долгосрочной перспективе никак не повлияло на специфическую продолжительность жизни.
Поэтому даже такой специфичный и привычный маркер как ПСА сдает свои позиции в ранней диагностике.
Опухоли женской репродуктивной системы
Опухоли женской репродуктивной системы являются причиной примерно 10% смертей от злокачественных опухолей. Они не вошли в наш первоначальный список, так как в статистике ВОЗ они разделены по опухолям отдельных органов (опухоли эндометрия, шейки матки, яичников и т.д).
Среди них, рак яичников уносит больше всего женских жизней. Для дифференциальной диагностики между доброкачественными и злокачественными процессами при выявлении патологических образований в малом тазу можно использовать СА125. Этот маркер используется для дальнейшего наблюдения за пролеченными пациентками, а его уровни в динамике для оценки эффективности терапии. Анализ СА125 не рекомендуется экспертами для скрининга у женщин без каких-либо жалоб. Однако это исследование следует проводить каждые 6 месяцев совместно с УЗИ органов малого таза у женщин с высокой наследственной предрасположенностью — при наличии мутаций в генах BRCA1 и BRCA2.
Когда онкомаркеры действительно необходимы
Определение большей части онкомаркеров имеет значение и должно быть использовано при наличии клинических проявления опухоли и ее инструментальном подтверждении для дифференциальной диагностики или мониторинга эффективности терапии.
В качестве скрининга анализ на онкомаркеры не стоит использовать. Однако это не говорит о том, что маркер не способствует раннему выявлению опухолей, а лишь о том, что подобное обследование не улучшает прогноз средней группы людей. При этом никто не сможет сказать, как оно повлияет на жизнь конкретного человека.
Крайне важно, чтобы любое обследование назначал врач, который владеет достаточными знаниями и может трактовать результат анализа во благо пациента. Это поможет не только сохранить здоровье, а также избежать стрессовых ситуаций и лишних материальных трат.
Раннее выявление опухолей способно спасти миллионы жизней. Где место онкомаркеров в этом процессе?
Комоза Валентин Александрович
врач онколог-хирург ГАУЗ БООД
Анализы на онкомаркеры: легкие, молочная железа, кишечник, желудок, печень
По статистике ВООЗ, рак занимает второе место среди причин смертности в мире. Та же организация озвучила цифру в почти 10 млн. смертей с диагнозом «рак» среди всего населения Земли в 2018-м году. Выделяют более 100 типов этого заболевания.
Что же это за заболевание, которое может коснуться любого органа и системы организма без исключения? Итак, начнем, пожалуй, с определения. Рак – общее название для группы заболеваний, особенностью которых является быстрый рост аномальных клеток. Разрастание первичных очагов опухоли приводит к сдавливанию соседних органов, а в процессе распространения раковых клеток в организме образуются вторичные очаги – метастазы опухоли.
Большая часть злокачественных опухолей поддается лечению, но на успех влияет дифференциация клетки, локализация опухоли и ее стадия. Поэтому важно проходить своевременную диагностику.
Причины возникновения
Как свидетельствуют результаты исследований разных видов рака, большинство факторов, влияющих на его возникновение, являются внешними. Например, воздействие окружающей среды, излучения, различные канцерогены. Также нельзя исключать генетическую предрасположенность.
Среди основных причин заболевания выделяют употребление табачных продуктов, спиртного, отсутствие здорового питания и регулярной физической нагрузки.
Есть ряд инфекционных заболеваний (ВИЧ, Вирус папилломы человека, гепатиты В и С), на основе которых может развиться рак. С возрастом из-за необратимых процессов в организме риск заболеть увеличиваются.
Основные типы рака
Рак легких
Рак легких является самым распространенным онкологическим заболеванием в мире. Ежегодно в мире фиксируется около 1 млн. новых диагнозов «рак легких» с уровнем смертности в 60%. Чаще всего от него страдают мужчины-курильщики с длительной историей никотиновой зависимости в возрасте после 50-ти, но по последним данным из года в год растет и доля женщин в этой статистике.
Из-за канцерогенов, содержащихся в табачном дыме, в организм попадает масса вредных веществ, которые имеют свойство накапливаться, и провоцировать опухоль. К слову, страдает не только сам потребитель табачных изделий, как известно, а и пассивный курильщик, который также подвергается риску формирования злокачественного новообразования.
Помимо курения, среди причин стоит отметить неблагоприятную экологию, воздействие тяжелых металлов, лишний вес, генетическую предрасположенность, хронические легочные заболевания.
При таком заболевании, как рак легких, симптомы первых стадий могут быть приняты за простуду: сухой кашель, небольшое повышение температуры, быстрая утомляемость, похудение. Симптомы рака легких прогрессируют при развитии заболевания – кашель усиливается, в мокроте выявляется кровь, появляется охриплость голоса, затруднение при глотании, боль в области грудной клетки, одышка. Признаки рака легких нередко игнорируются на первых стадиях, из-за чего диагностика происходит слишком поздно.
Рак молочной железы
Рак молочной железы уверенно лидирует по распространённости у женщин и занимает второе место среди общего числа онкологических заболеваний у населения планеты.
По статистике в Украине каждый год фиксируется 16,5 тыс. новых случаев рака молочной железы. Жертвами этого заболевания в основном являются женщины, но 1 % случаев составляет рак грудной железы у мужчин, в связи с наличием железистой ткани вне зависимости от пола.
Рак молочной железы является одной из самых изученных форм рака, поэтому идентифицированы факторы, влияющие на развитие опухоли. Доказано, что в 10% случаев причиной возникновения является наследственность. Также в зоне риска находятся женщины, не рожавшие до 35 лет, с мастопатией, лишним весом, диабетом, проживающие в экологически неблагоприятных регионах, подвластные вредным привычкам.
На начальных стадиях у людей с таким заболеванием, как рак молочной железы, симптомы могут отсутствовать, но при профилактическом осмотре у врача или регулярном самообследовании заболевание можно выявить своевременно. При прощупывании можно почувствовать уплотнение в груди, которое может быть первым сигналом.
Также симптомы рака молочной железы выражены изменениями формы груди, болезненными ощущениями при поднятии рук в области подмышек, выделениями из сосков при нажатии, пятнами и сыпью на груди, болезненностью молочных желез в преддверии начала цикла.
Для диагностики врач может назначить: Онкомаркер BRCA1 и BRCA2 — выявление мутаций генов, Онкомаркер СА 15-3, Цитологическое исследование выделений из грудной железы, Гистологическое исследование биоптата молочной железы, Иммуногистохимия рецепторов к эстрогенам, Иммуногистохимия рецепторов к прогестерону, ИГХ рецепторов к эстрогенам молочной железы с парафинблоков других лабораторий, ИГХ рецепторов к эстрогенам и прогестерону молочной железы, НER2, Иммуногистохимия рецепторов к эстрогенам и прогестерону молочной железы, ИГХ рецепторов к прогестерону молочной железы с парафинблоков др. лабор.
Рак кишечника
Колоректальный рак, объединяющий в себя понятия рак прямой кишки, рак толстой кишки, поражает нижнюю часть кишечника.
Ежегодно по всему миру фиксируется около 600 тыс. новых диагнозов «рак толстой кишки», что ставит эту болезнь на 4-е место по распространенности у женщин и на 5-е – у мужчин среди всех онкологических заболеваний. Рак прямой кишки выявляют у 9 тыс. украинцев каждый год.
Среди причин, способствующих образованию колоректального рака можно выделить генетические факторы, полипоз, неправильное питание, злоупотребление алкогольных напитков и табачной продукции, воспаления кишечника.
Когда возникает рак кишечника, симптомы выявляются только на 2-3 стадии, из-за чего уменьшаются шансы на эффективное лечение. Рак толстой, как и рак прямой кишки, симптомы проявляет через болезненные ощущения в желудке, кишечные колики, проблемы с пищеварением, изменения характера стула (цвет, структура), наличие крови в кале, общую слабость, анемию. Симптомы рака кишечника у женщин дополняются развитием ректовагинального свища, изменениями в цикле, кровью в моче.
Рак предстательной железы
Рак предстательной железы (рак простаты) является одним из самых распространенных онкологических заболеваний у мужчин. Каждый год ставится 400 тыс. новых диагнозов по всему миру. Наиболее подвержены раку простаты мужчины в возрасте после 65 лет.
Среди факторов риска возникновения рака предстательной железы можно отметить старение, вредные привычки, генетическую предрасположенность, вирусные инфекции.
Симптомы рака простаты на первых этапах развития похожи на проявления инфекции мочеполовой системы: частые позывы в туалет по малой нужде, слабая струя, чувство остатка жидкости в мочевом пузыре после мочеиспускания. На более поздних стадиях рак предстательной железы может сопровождаться недержанием, болевыми ощущениями в костях таза, кровь в семенной жидкости и моче.
Рак желудка
Рак желудка развивается из клеток слизистой оболочки этого органа и возникает в любом его отделе. Это злокачественное новообразование входит в пятерку самых распространенных онкологических заболеваний в мире. Каждый год от него умирает приблизительно 800 тыс. человек.
Раку желудка больше подвержены мужчины, особенно в возрасте 50+.
В зону риска в первую очередь попадают люди, имеющие ряд заболеваний желудочно-кишечного тракта, зачастую предшествующих образованию опухоли желудка, таких как: язва, полипы, гастрит, анемия из-за дефицита В16, инфицированность Helicobacter pylori. Помимо этого, имеют свое негативное воздействие неправильное питание, потребление спиртных напитков и курение, неблагоприятная экология.
Признаки рака желудка можно не сразу связать с онкологией. У тех, кто столкнулся с такой проблемой как рак желудка, симптомы заболевания на первых этапах развития могут быть выражены незначительно – потеря аппетита, проблемы с пищеварением, тошнота, быстрая утомляемость. При дальнейшем росте опухоли симптомы рака желудка могут усугубляться: кровотечения, прогрессирующая потеря веса, непрекращающиеся болевые ощущения.
Рак печени
Рак печени чаще всего возникает у представителей мужского пола в возрасте 50-60 лет. Точной причины появления этого заболевания на данный момент не установлено, но среди провоцирующих факторов можно назвать гепатиты типа В и С, цирроз, употребление канцерогенов.
По клеточному составу выделяют гепатоцеллюлярный рак печени – опухоль из печеночных клеток, холангиому – опухоль из желчных путей, гепатохолангиому – смешанный тип.
Рак печени симптомы проявляет по мере развития. Поводами для проверки могут быть болевые ощущения в области подреберья, вздутие живота, тошнота, потеря аппетита и похудение, потеря сил, появление желтизны кожи и глаз, повышенная температура тела, зуд. Ну и, конечно, обследование проходят люди с диагностированным циррозом и вирусными гепатитами. В случае превышения показателей лабораторных исследований врач может назначить дополнительное обследование УЗИ, томографию.
Рак шейки матки
По распространенности среди женщин репродуктивного возраста рак шейки матки занимает второе место. В 90% случаев причиной возникновения этого заболевания является вирус папилломы человека (ВПЧ). При игнорировании этой проблемы в течение продолжительного времени в женском организме происходят изменения, которые в дальнейшем могут спровоцировать формирование злокачественного новообразования.
Также повысить риск развития рака шейки матки могут такие факторы, как генетическая предрасположенность к онкологии, травматизация шейки при родах или абортах, частая смена половых партнеров, употребление табачных изделий, отсутствие систематических проверок организма и другие.
Рак шейки матки стадии 1 и 2 может протекать бессимптомно или с малозначительными изменениями, такими как быстрая утомляемость, потеря веса, температура. В дальнейшем при развитии болезни, симптомы рака шейки матки усиливаются и состояние может сопровождаться вагинальными кровотечениями, изменениями в цикле, болями в малом тазу, во время полового акта.
Рак шейки матки, симптомы которого, как уже отмечено ранее, проявляются постепенно – имеет предшествующее предраковое состояние, которое можно выявить на приеме у гинеколога. По статистике, примерно шести тысячам украинских женщин каждый год ставят диагноз «рак шейки матки», и, к сожалению, около 25% из них обращаются к врачу уже на этапе запущенной формы заболевания.
Для диагностики врач может назначить: Программа 129 «Защити себя от рака шейки матки», Программа 159 «Мониторинг здоровья шейки матки», Пап-тест методом жидкостной цитологии (технология SurePath BD), ВПЧ, Комплексное генотипировання ДНК 28 типов, полуколичеств.формат, REAL TIME ПЦР, Пап-тест традиционный (цитологическое исследование шейки матки), Гистологическое исследование тела матки, Гистологичесоке иследование материала из церв. канала шейки матки и полости матки, Гистологическое исследование биоптата шейки матки, Гистологическое исследование материала конусоподобной резекции шейки матки, Гистологическое исследование материала из полости матки, Гистологическое исследование тела и шейки матки (без придат.или с прид.), Цитологическое исследование аспирата из цервик-ного канала, полости матки.
Рак горла (гортани)
Понятие «рак горла» зачастую используют, имея в виду злокачественные новообразования в области гортани и глотки. Распространенность его не так велика, как у некоторых других видов рака (на него приходится всего 3% от общего числа онкологических заболеваний), но от этого заболевание не становится менее опасным. Жертвами преимущественно являются представители мужского пола среднего возраста, большая часть из которых злоупотребляют табачными изделиями.
Помимо курения, возникновению рака гортани также способствует употребление спиртных напитков, ВПЧ, инфекции ротовой полости, неблагоприятные факторы окружающей среды, экологии, генетическая предрасположенность. Часто признаки рака горла появляются на фоне затяжного ларингита.
Рак горла, симптомы которого поначалу схожи с проявлениями обычных простудных заболеваний, сложно диагностировать самостоятельно на ранних стадиях. Например, первыми признаками могут быть першение в горле, систематический сухой кашель. При последующем развитии такого заболевания как рак гортани, симптомы проявляются через осиплость голоса, бессонницу, боль при глотании.
Симптомы рака горла отличаются в зависимости от стадии развития и локализации.
Рак щитовидной железы
Рак щитовидной железы составляет 1% в структуре онкологических заболеваний. Подвержены этому злокачественному новообразованию в основном женщины, мужчины же страдают от него реже примерно в 2-3 раза.
Рак щитовидной железы может проявиться в любом возрасте, но по статистике пик приходится на 40-65 лет.
Причину, вызвавшую рак щитовидной железы, не всегда удается установить, но можно выделить факторы, способствующие развитию опухоли. Как и во многих случаях рака других органов и систем, свое негативное воздействие оказывают табакокурение и употребление спиртных напитков, генетическая предрасположенность, старение, стресс, ионизирующее излучение. Также в зоне риска находятся люди с доброкачественными новообразованиями щитовидной железы.
На ранних стадиях рака щитовидной железы симптомы могут полностью отсутствовать. При дальнейшем развитии заболевание можно идентифицировать по появлению дополнительных образований в области щитовидной железы, увеличению лимфоузлов на шее. По мере роста опухоли добавляется чувство комка в горле, трудности в процессе глотания, болевые ощущения в области шеи, кашель, изменение голоса, одышка.
Рак яичников
Рак яичников лидирует в качестве причины смертности среди женщин в перечне гинекологических онко-заболеваний – занимает 20% от общего числа. В зоне риска находятся женщины с:
- ранним началом половой жизни и поздней менопаузой
- полным отсутствие половой жизни или поздним ее началом
- мутацией генов BRCA
- отсутствием беременностей и родов в репродуктивный период
- нарушением обменных процессов
Также, как и в случае с раком шейки матки, только в большей степени, основная проблема заключается в поздней диагностике заболевания – большая часть больных обращается к врачу уже на этапе третьей или четвертой стадии.
Нередко это заболевание называют «тихим убийцей», поскольку симптомы рака яичников на ранних стадиях могут никак не заявлять о себе. При дальнейшем развитии болезни ее могут сопровождать изменения менструального цикла, болевые ощущения внизу живота, затруднение работы органов ЖКТ, отечность ног.
Рак яичников, симптомы которого настолько разнообразны, выявить непросто, но при регулярных проверках у гинеколога возможна диагностика на ранних стадиях, что немало влияет на шансы успешного лечения.
Рак костей
Рак костей – общее название для злокачественных новообразований в костной ткани. Среди злокачественных образований, относящихся к первичному раку костей, выделяют: остеогенную хордому, хондросаркому и саркому Юинга. Жертвами рака костей в большинстве своем являются дети мужского пола в ранний период полового созревания и активного развития костной системы, но юным возрастом этот тип рака не ограничивается.
Многие ученые настаивают на том, что основной причиной возникновения рака костей является наследственность, обусловленная различного типа генными мутациями. К последним можно отнести болезнь Педжета, некоторые скелетные аномалии. Среди факторов, способствующих возникновению костных опухолей, следует отметить ионизирующее излучение.
У больных такой формой онкологии как рак костей, симптомы проявляются через болевые ощущения, отечность, воспаления на месте поражения, хрупкость костей.
Рак крови
Понятие «рак крови» объединяет в себе группу заболеваний органов кроветворной системы, которые сопровождаются мутациями клеток костного мозга. В медицине чаще используют термины «лейкоз» и «лейкемия».
Точные причины, являющиеся катализатором возникновения болезни, пока научно не выявлены. Но есть предположения, что могут оказать свое влияние на процесс зарождения лейкоза: инфекционно-вирусные поражения, генетическая предрасположенность, канцерогены, ионизирующее излучение.
По типу развития болезни выделяют хронический лейкоз – на основе созревающих и зрелых клеток, и острый лейкоз – на основе незрелых клеток. Эти две формы имеют разные проявления. Например, острая форма имеет агрессивный характер поражения, а хроническая – длительный этап формирования.
После того как у человека появился рак крови, симптомы и первые проявления дают о себе знать через полтора-три месяца. Опасность заключается в том, что первые признаки легко спутать с простудными заболеваниями. Симптомы рака крови сопровождаются болезненными ощущениями в костях, суставах, головными болями, воспалением лимфоузлов, быстрой утомляемостью, похудением, затрудненным дыханием, повышением температуры тела.
Рак поджелудочной железы
Рак поджелудочной железы чаще всего появляется у пожилых людей после 70-ти, но также встречается и у молодых. Опасность заключается в высоком уровне смертности от этого злокачественного новообразования.
Причину, вызвавшую рак поджелудочной железы не всегда удается установить, но среди провоцирующих факторов можно выделить: употребление табачных изделий и спиртных напитков, цирроз печени, язва желудка, сахарный диабет, лишний вес, мутация генов. В зоне риска люди с аденомой или кистой поджелудочной железы, панкреатитом.
Люди с таким заболеванием, как рак поджелудочной железы, симптомы могут иметь следующие: желтуха, изменение цвета мочи и кала, болевые ощущения вверху живота и в спине, похудение, быстрая потеря сил.
Рак мозга
Рак мозга – общее название для различных злокачественных новообразований, располагающихся внутри черепа или в центральном спинномозговом канале. Причины, из-за которых возникает рак головного мозга, не всегда возможно установить, но среди способствующих факторов выделяют ионизирующие и электромагнитные излучения, генетическую предрасположенность к онкологии.
По клеточному составу выделяют несколько типов рака мозга. Наиболее часто встречаются нейроэпителиальные опухоли, такие как глиома, на которые приходится около 60% от всех внутричерепных опухолей. Они формируются в мозговой ткани и могут разрастаться до размера яблока. Реже – в 25% случаев — возникают опухоли из тканей мозговых оболочек – менингиомы.
В зависимости от стадии и места, где расположена опухоль мозга, симптомы могут проявляться по-разному. Зачастую болезнь сопровождается головными болями, тошнотой, приступами эпилепсии, нарушениями памяти.
Рак кожи
Рак кожи поражает зачастую представителей нордического типа – светловолосых, светлокожих – у которых нет естественной защиты от солнца в южных странах. Ученые заметили, что данному типу опухоли больше подвержены люди, проводящие много времени на открытом воздухе.
Среди основных причин возникновения рака кожи можно по праву считать длительное и насыщенное воздействие ультрафиолетовых лучей. Свою долю ответственности имеют канцерогены, попадающие в организм или на кожу, рубцы, радиоактивные излучения, употребление табачных изделий, наследственность.
На первых этапах такого заболевания, как рак кожи, симптомы можно заметить по некоторым признакам, если быть внимательными к своему телу. Например, первичным проявлением может быть появление новообразований кожи. Вокруг новообразования формируются беспричинные трещинки, раны на коже, воспаления, появляется зуд. Может измениться размер и форма родинок.
Выводы
Рак – очень опасное заболевание, которое из-за неспецифических симптомов можно перепутать с другими болезнями, из-за чего не обратиться к специалисту на первых стадиях развития. Для того, чтобы предотвратить печальный исход, во многих случаях достаточно профилактики.
- Отказ от вредных привычек – табакокурения и употребления спиртного.
- Переход на здоровое и сбалансированное питание.
- Регулярные физические нагрузки.
- Уменьшение воздействия ультрафиолетового излучения.
- Вакцинация против инфекций, вызываемых ВПЧ и вирусом гепатита В.
- Регулярные плановые осмотры у врача и самоосмотры в случаях, когда это возможно.
Другие новости
03.12.2021
02.12.2021
01.12.2021
Онкомаркеры щитовидной железы — CMD
Термин «Опухолевые маркеры», или онкомаркеры (ОМ), объединяет широкий спектр различных высокомолекулярных веществ, продуцируемых опухолевыми клетками. Сюда могут входить фетальные белки, гормоны, ферменты, антигенные детерминанты, определяемые с помощью моноклональных антител, фрагменты молекул иммуноглобулинов и т.д. ОМ формируются внутри или на поверхности опухолевых клеток, или же под действием опухоли происходит их индукция в других клетках. Так или иначе ОМ попадают в кровеносное русло и могут быть количественно определены в периферической крови или в другой биологической жидкости (моча, спинномозговая жидкость, плевральная жидкость, содержимое кист, асцит и т.д.).
В настоящее время известно более 200 ОМ, но лишь некоторые из них представляют интерес для клинической практики. Единой классификации ОМ нет. С клинической точки зрения их удобно подразделять в соответствии с локализацией и гистологическим строением опухоли. В таблице 14 приведены сведения об использовании в практике наиболее значимых ОМ.
ОМ находят широкое применение в клинике. В сочетании с другими методами исследования они оказывают реальную помощь в диагностике злокачественного новообразования, оценке прогноза течения заболевания и радикальности операции, раннем выявлении рецидивов, контроле эффективности терапии, а также в получении дополнительной информации.
Диагностика онкологических заболеваний. В идеале ОМ должны продуцироваться только клетками злокачественной опухоли, и поэтому не должны присутствовать у здоровых людей и у лиц с доброкачественными патологиями. В действительности не найдено ни одного маркера, специфичного только для опухоли.
Диагностическая значимость ОМ определяется тремя характеристиками: диагностической чувствительностью, диагностической специфичностью и дискриминационным уровнем или дискриминационной концентрацией (ДУ, ДК) (Рис. 7).
ДУ – допустимая верхняя граница концентрации ОМ у здоровых людей и у пациентов с доброкачественными заболеваниями. Все значения маркера, которые превышают ДУ, считаются положительными или патологически повышенными.
Диагностическая специфичность ОМ – частота истинно отрицательных результатов теста в группе здоровых индивидуумов и/или лиц с доброкачественными патологиями, выраженная в процентах. В идеальном варианте она должна составлять 100% (рис.7, а), однако в действительности (рис. 7, б) всегда имеет место выявление ОМ у некоторой доли лиц, не имеющих онкопатологии, т.е. регистрация ложноположительных результатов. Чем ниже процент таких результатов, тем выше специфичность.
Диагностическая чувствительность ОМ – частота истинно положительных результатов теста в группе онкологических больных, выраженная в процентах. Чем выше чувствительность, тем реже отмечают ложноотрицательные результаты.
| Локализация опухоли | Гистологическое строение опухоли | Опухолевые маркеры |
|---|---|---|
| Печень | Гепатоцеллюлярная карцинома, гепатобластома | АФП |
| Холангиоцеллюлярная карцинома | СА19.9 | |
| Ободочная и прямая кишка | Аденокарцинома | РЭА, СА19.9 |
| Анальный канал | Плоскоклеточная карцинома | SСС, CYFRA21.1 |
| Желудок | Аденокарцинома | РЭА, СА19.9, СА72.4, пепсиногены I и II |
| Поджелудочная железа | Аденокарцинома | СА19.9, СА242 |
| Пищевод | Плоскоклеточная карцинома | SСС, РЭА , CYFRA21.1 |
| Молочная железа | Аденокарцинома | СА15.3, РЭА |
| Яичник | Эпителиальные опухоли | СА125, СА199, НЕ4 |
| Герминогенные опухоли | АФП+ХГЧ | |
| Гранулезоклеточные опухоли | Ингибины | |
| Матка | Аденокарцинома | СА125, РЭА, НЕ4 |
| Хориокарцинома | ХГЧ | |
| Шейка матки | Плоскоклеточная карцинома | SСС , CYFRA21.1 |
| Яичко | Несеминома | АФП+ХГЧ |
| Семинома | ЛДГ, ХГЧ, НСЕ | |
| Щитовидная железа | Медуллярная карцинома | |
| Фолликулярная, папиллярная карцинома | Тиреоглобулин, ТТГ, РЭА | |
| Легкое | Аденокарцинома | РЭА |
| Плоскоклеточная карцинома | CYFRA21.1, SСС | |
| Мелкоклеточный рак | НСЕ, Pro-GRP | |
| Предстательная железа | Аденокарцинома | ПСАобщ., ПСАсвоб./ПСАобщ. |
| Кожа | Меланома | S100 |
| Мочевой пузырь и мочевыводящие пути | Плоскоклеточная карцинома; Переходно-клеточная карцинома | UBC, CYFRA21.1, TPS, TPА |
Чувствительность и специфичность – не постоянные значения. Их можно изменять в соответствии с поставленными задачами. Например, если необходимо увеличить выявляемость соответствующей патологии в данной группе людей, следует повысить чувствительность маркера. Для этого нужно снизить ДУ (сместить ДУ влево на рис. б). При этом чувствительность повысится, но за счет снижения специфичности. Наоборот, если нужно повысить специфичность, (снизить долю ложноположительных значений ОМ в контрольной группе), следует увеличить ДУ (сместить ДУ вправо на рис. б). При этом специфичность повысится, но в ущерб чувствительности, за счет увеличения числа “пропущенных” онкологических больных. Следовательно, чувствительность и специфичность ОМ взаимосвязаны между собой таким образом, что улучшение одной из этих характеристик сопровождается ухудшением другой. На практике всегда стараются найти разумный компромисс и устанавливают ДУ для ОМ таким, чтобы специфичность составляла 95–98%. При этом чувствительность может колебаться в широких пределах – от 15% до более 90% для разных ОМ или для одного и того же ОМ, используемого в диагностике разных опухолей.
Использование ОМ в диагностических целях весьма ограничено. Большинство циркулирующих ОМ по причине недостаточной чувствительности и специфичности непригодно для выявления онкопатологии в бессимптомной популяции. И хотя чувствительность многих маркеров превышает 80%, это значение относится в большинстве случаев к поздним стадиям заболевания. При ранних стадиях, когда лечение может быть эффективным, чувствительность большинства ОМ не достигает 50%. Однако в группах с повышенным риском того или иного злокачественного новообразования, а также у пациентов с соответствующей симптоматикой (т.е. в случаях, когда частота данного заболевания значительно превосходит общепопуляционную) использование ОМ дает возможность раннего выявления ряда опухолей.
При использовании ОМ в диагностических целях следует принимать во внимание, что:
- ОМ никогда не используются для постановки диагноза самостоятельно, но лишь как дополнение к другим диагностическим процедурам и обязательно с учетом клинических данных;
- диагностическое значение могут иметь только ОМ, обладающие чувствительностью не ниже 50%.
Оценка прогноза заболевания. При выявлении злокачественного новообразования прогнозирование течения болезни является важной клинической задачей. Использование различных прогностических факторов и расчет прогноза приносят реальную пользу в лечении рака. Они представляют большой интерес не только для вычисления выживаемости, но служат для подразделения пациентов на группы риска, в соответствии с которыми назначается дополнительная к оперативному лечению терапия (химио-, гормональная или лучевая), призванная разрушить не обнаруженные при операции опухолевые образования, которые могут привести к появлению метастазов. Для пациентов с хорошим и плохим прогнозом течения заболевания используют дифференцированные схемы лечения, которые отрабатываются в рандомизированных исследованиях. Это может позитивно отражаться на качестве жизни пациента, толерантности к терапии, эффективности лечения и рациональной экономии. Уровни большинства ОМ до лечения коррелируют с основными факторами прогноза – размером опухоли, поражением лимфатических узлов, наличием или отсутствием метастазов, гистологическим типом и степенью дифференцировки опухоли и т.п. Для многих ОМ показано их значение в качестве независимых прогностических факторов.
Оценка радикальности операции. После радикального удаления опухоли концентрация ОМ в крови должна снижаться в соответствии с его периодом полужизни. T1/2 – время, необходимое для снижения концентрации ОМ вдвое после радикального удаления опухоли. T1/2 значительно варьирует у разных ОМ – от нескольких часов для β -ХГЧ до нескольких суток для РЭА. Эти данные могут быть важны при оценке эффективности лечения. Если скорость снижения маркера значительно ниже теоретической, то с большой долей вероятности можно предполагать наличие скрытых метастазов.
Мониторинг в период ремиссии. По окончании лечения пациент должен находиться под наблюдением онколога с обязательным регулярным определением ОМ. При отрицательных значениях ОМ рецидива не наблюдается. Повышение ОМ с высокой степенью вероятности свидетельствует о рецидиве, клинические симптомы которого могут быть замечены лишь 3-6 месяцев спустя. Поэтому в некоторых случаях, например, при герминогенных опухолях, повышение уровня ОМ является достаточным основанием для начала химиотерапии, что позволяет улучшить отдаленные результаты.
Оценка эффективности лечения. Многочисленные литературные данные свидетельствуют о том, что регрессия опухоли сопровождается снижением уровня соответствующего маркера в сыворотке крови до нормальных значений. Отсутствие изменений или нарастание значений ОМ дает основание думать о резистентности опухоли к проводимой терапии и является основанием для пересмотра ее тактики.
При интерпретации результатов следует учитывать множество факторов, способных влиять на уровень ОМ: наследственные, расовые, пол, возраст, физиологическое состояние, циркадные ритмы и суточные изменения, вредные привычки, проводимые диагностические исследования (неинвазивные и инвазивные), течение послеоперационного периода, доброкачественные патологии, лекарства.
Для определения ОМ используются различные иммунохимические методы – РИА, ИФА, ИХЛА, ЭХЛА и др. При трактовке результатов важно учитывать, каким методом определялся ОМ, а при необходимости динамического определения ОМ в течение длительного времени анализы рекомендуется проводить в одной и той же лаборатории. Это важно потому, что иммунологические методы, основанные на использовании моноклональных антител, определяют отдельные эпитопы, количество которых на одной молекуле может широко варьировать у разных людей. Экспрессия эпитопов может значительно изменяться в зависимости от физических условий и структурных особенностей молекулы. Многие современные методы распознают отщепленные от молекулы эпитопы, в результате чего можно получить трудно сравнимые как с клинической, так и с аналитической точек зрения результаты. При рутинном определении ОМ в разных лабораториях отличающиеся результаты могут быть функцией используемого метода. Например, при определении ХГЧ могут быть использованы анти-бета, анти-альфа и анти-бета/альфа антитела. В любом случае необходимо учитывать метод и факторы, которые могут вызывать ложноположительные результаты.
Содержание большинства ОМ определяют в крови, некоторые – в моче. Для определения условий взятия и хранения биопроб следует руководствоваться инструкцией к используемому набору реагентов.
Одной кровью: ученые научились диагностировать рак легких без рентгена | Статьи
Ученые научились диагностировать рак легких с помощью анализа крови. В качестве маркеров заболевания использованы шесть белков. Определить их наличие в организме можно с помощью электрохимического чипа, разработанного сибирскими учеными. Новая методика уже проверена на группе добровольцев. Исследователи надеются, что в дальнейшем смогут не просто распознавать болезнь, но и оценивать ее стадию.
Фатальные прятки
По статистике ВОЗ, в 2018 году каждый пятый онкобольной в России умер от рака легких. Рано диагностировать его крайне трудно — симптомы можно перепутать с другими заболеваниями, например хроническим бронхитом или затяжной простудой. К тому же в легких мало нервных окончаний, и явные болевые ощущения начинают появляться только на последних стадиях болезни.
Флюорография, которую применяют при массовых профилактических обследованиях, не позволяет обнаружить опухоль в ранней фазе, поэтому ученые активно ищут альтернативные методы диагностики болезни. Одним из них является оценка содержания в крови продуктов распада опухоли — определенных белков-биомаркеров, или, как их еще называют, онкомаркеров. Однако до настоящего времени не было найдено ни одного маркера онкологического заболевания, позволяющего поставить абсолютно точный диагноз. Причина — варьирование концентрации этих биомаркеров у больного раком, которая может оказаться такой же, как и у здорового человека.
Поэтому коллектив исследователей из Красноярского научного центра СО РАН, Красноярского государственного медицинского университета и Томского государственного университета предложил определять наличие не одного, а шести белков-онкомаркеров с помощью специально созданного чипа. По словам ученых, работа с группой белков, а не с отдельными онкомаркерами значительно снижает вероятность ошибки при постановке диагноза.
Биологические мишени
— Чтобы определить наличие того или иного белка в крови пациента, мы решили использовать аптамеры — короткие одноцепочечные фрагменты ДНК, — рассказал научный сотрудник лаборатории биомолекулярных и медицинских технологий Красноярского государственного медицинского университета Юрий Глазырин. — Благодаря своей уникальной структуре аптамеры могут связываться с любыми биологическими мишенями, в данном случае с шестью белками-биомаркерами. Сами аптамеры были искусственно синтезированы на основе образцов, ранее полученных в нашей лаборатории.
Эти аптамеры было решено использовать в устройстве для анализа содержания в крови нужных белков. Прибор представляет собой электрохимический чип размером с фалангу пальца взрослого человека. На нем располагаются шесть электродов, на каждом из которых закреплен один из шести аптамеров. С электродов ученые снимали вольт-амперную характеристику, составляя график зависимости величины возникающего тока от подаваемого электрического потенциала.
— Чтобы зарегистрировать отклик системы на присутствие белков-онкомаркеров, мы смотрели разницу между величинами пика на графиках вольт-амперной характеристики до и после контакта электрода с плазмой крови, — рассказывает старший научный сотрудник лаборатории новых материалов и перспективных технологий Сибирского физико-технического института Томского государственного университета Анастасия Шабалина. — Если закрепленный на электроде аптамер связывается с белком, сигнал тока от этого электрода меняется. Мы наносили на чип кровь здоровых людей, снимали вольт-амперную характеристику для каждого аптамера, затем делали то же самое с кровью больных раком легких. Полученные для обеих категорий сигналы усредняли, а затем сравнивали друг с другом.
Оказалось, что вольт-амперная характеристика для всех шести аптамеров отличалась у больных и здоровых людей. У первых пик на графике был заметно выше. Поэтому ученые сделали вывод, что данный чип можно использовать для диагностики.
Анализ опухоли
Для эффективного лечения рака важно не только диагностировать болезнь на ранней стадии, но и определить злокачественность опухоли. Обычно для этого используют биопсию. Но в случае с раком легких операция по забору фрагмента ткани довольно сложна и болезненна. Иногда приходится выпиливать часть ребра. Поэтому авторы работы предлагают использовать созданный чип также и для оценки злокачественности опухоли. Показателем того или иного параметра болезни может служить концентрация белков-онкомаркеров.
Диагностика с помощью чипов на данный момент — очень популярное направление, считает директор клиники онкологии, реконструктивно-пластической хирургии и радиологии университета им. И.М. Сеченова Игорь Решетов. Эксперт отмечает удобство проведения такого анализа для пациента. Однако, по его мнению, устройство может быть полезно только для поиска людей, входящих в группу риска заболевания раком легких. При подозрении на болезнь пациента необходимо направить на дополнительное обследование.
В дальнейшие планы коллектива сибирских ученых входит создание точной системы определения степени заболевания на основе концентрации шести белков-онкомаркеров. Как считают авторы работы, внедрение системы анализа крови с помощью созданного электрохимического чипа позволит одновременно и определять наличие болезни, и делать заключения о том, как опухоль прогрессирует.
ЧИТАЙТЕ ТАКЖЕ
опухолевых маркеров гепатоцеллюлярной карциномы: простые и значимые предикторы исхода у пациентов с ГЦК — FullText — Liver Cancer 2015, Vol. 4, № 2
Аннотация
Справочная информация: Эффективность онкомаркеров в оценке исходов у пациентов с гепатоцеллюлярной карциномой (ГЦК) еще предстоит выяснить. Резюме: Полезность онкомаркеров ГЦК, альфа-фетопротеина (AFP), Lens culinaris агглютинин-реактивной фракции альфа-фетопротеина (AFP-L3) и дез-гамма-карбоксипротромбина (DCP) была определена. рассмотрено.Повышение уровня этих онкомаркеров на момент постановки диагноза ГЦК коррелирует с прогрессированием заболевания, что оценивается как визуализирующими исследованиями, так и патологическими исследованиями. Комбинация этих трех онкомаркеров дает хорошие прогностические возможности для выживаемости пациентов после постановки диагноза. Кроме того, комбинация во время диагностики ГЦК этих трех онкомаркеров (в качестве меры прогрессирования опухоли) и уровней сывороточного альбумина и билирубина (в качестве индикаторов остаточной функции печени) может использоваться для определения стадии ГЦК и дальнейшего прогнозирования прогноза у пациентов с HCC. Ключевое сообщение: Прогноз для пациентов с ГЦК может быть хорошо определен только на основе сывороточных маркеров. Определение стадии ГЦК с помощью сывороточных маркеров является объективным; при наличии хранимых образцов сыворотки стадии ГЦК можно стандартизировать для разных стран и периодов времени.
© 2015 S. Karger AG, Базель
Введение
Измерение уровней опухолевых биомаркеров гепатоцеллюлярной карциномы (ГЦК) является важным инструментом для лечения заболеваний.Альфа-фетопротеин (AFP), Lens culinaris агглютинин A-реактивная фракция альфа-фетопротеина (AFP-L3) и дез-гамма-карбоксипротромбин (DCP) были установлены как HCC-специфические маркеры опухолей [1,2, 3,4,5,6,7,8,9,10,11,12,13,14]. Хотя уровни опухолевых маркеров не включены в диагностические критерии ГЦК или в рекомендации по скринингу в руководящих принципах Американской ассоциации по изучению заболеваний печени или Европейской ассоциации по изучению печени [15,16], они представляют собой ценную информацию. вспомогательная информация для диагностики ГЦК.Более того, недавнее исследование показало, что комбинация этих трех онкомаркеров полезна для диагностики ГЦК; эта комбинация имела очень высокую чувствительность и специфичность для диагностики ГЦК без использования визуализационных исследований [17].
Уровни AFP, AFP-L3 и DCP обычно повышаются по мере прогрессирования ГЦК, то есть с увеличением размера и количества очагов ГЦК и прогрессированием до инвазии воротной вены [18,19,20,21,22]. Кроме того, в некоторых исследованиях сообщается, что повышение уровня онкомаркеров указывает на высокую степень злокачественности ГЦК независимо от морфологического прогрессирования [22,23].Следовательно, повышение уровня этих онкомаркеров предвещает неблагоприятный прогноз после первоначального диагноза.
В этом обзоре мы оценили три опухолевых маркера ГЦК, а именно AFP, AFP-L3 и DCP, как индикаторы прогрессирования опухоли и предикторы исхода болезни у пациента. Кроме того, мы рассматриваем попытки предсказать прогноз исключительно на основе сывороточных маркеров.
Ограничения в оценке прогрессирования ГЦК с помощью визуализационных исследований и функции печени по классификации Чайлд-Пью
Прогрессирование ГЦК обычно оценивается морфологически, исходя из размера и количества опухолей и наличия инвазии воротной вены [24,25, 26].Такие оценки в основном основаны на исследованиях изображений до лечения; однако оценка прогрессирования опухоли с помощью визуализационных исследований имеет несколько недостатков. Например, выявляемость опухолей печени с помощью ультразвукового исследования (УЗИ), рутинного, основного инструмента визуализации для наблюдения за ГЦК, зависит от навыков специалиста по сонографии. Кроме того, выявляемость опухолей печени сильно зависит от разрешающей способности метода визуализации и качества оборудования, используемого для УЗИ, компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ).Последние достижения в области оборудования для визуализации, например, используемого в УЗИ, КТ с несколькими рядами детекторов [27,28] и МРТ, улучшили обнаружение узелков в печени, включая небольшие опухоли ГЦК на ранних стадиях. Более того, разработка контрастных веществ еще больше повысила способность обнаруживать и характеризовать узелки в печени, включая ГЦК [29,30,31,32,33,34,35,36]. Таким образом, количество обнаруженных HCC будет увеличиваться с развитием технологий визуализации, что будет иметь эффект отодвинутого на второй план HCC. Кроме того, достижения в области методов визуализации также улучшают визуализационную оценку патологических характеристик ГЦК, включая сосудистую инвазию и макроскопический тип [37,38,39].Это также может привести к задержке прогрессирования ГЦК.
Расхождения между результатами визуализации и патологическими результатами часто обнаруживаются у пациентов, перенесших резекцию печени. Согласно ежегодному исследованию ГЦК, проведенному Японской группой по изучению рака печени, распространенность ГЦК с портальной инвазией составила 13,1% по данным визуализационных исследований и 26,0% по данным патологического анализа [40]. Используя визуализационные исследования, часто бывает трудно обнаружить микрососудистую инвазию в ГЦК или мельчайшие сателлитные узелки; однако эти образования часто обнаруживаются при патологическом анализе после резекции, что указывает на расхождения в стадиях прогрессирования ГЦК.
Функцию печени у пациентов с ГЦК обычно оценивают по шкале Чайлд-Пью [41]. Эта оценка основана на уровнях сывороточного альбумина и билирубина пациента, протромбиновом времени, а также наличии и контролируемости асцита и печеночной энцефалопатии. Однако наличие и контролируемость асцита и печеночной энцефалопатии часто являются субъективными. Наличие асцита варьируется от симптоматического асцита и асцита, обнаруженного врачами при физикальном обследовании, до легкого асцита, обнаруживаемого только при УЗИ.Кроме того, контролируемость асцита зависит от дозы и типа используемых лекарств. Более того, тяжесть печеночной энцефалопатии может варьироваться от комы до субклинической энцефалопатии.
Связь между уровнями опухолевых маркеров и прогрессированием ГЦК
В нескольких исследованиях сообщалось о связи между повышенными опухолевыми маркерами, особенно AFP-L3 и DCP, и прогрессированием ГЦК [19,20,42]. Повышенный уровень AFP-L3 был связан с микросателлитными поражениями и гиперваскуляризацией опухоли HCC [18,19].Напротив, повышенный уровень DCP был связан с более высокой распространенностью инвазии воротной вены [20]. Наше предыдущее исследование характеристик ГЦК в зависимости от повышения различных онкомаркеров дало аналогичные результаты [43]. Среди 685 пациентов, у которых AFP, AFP-L3 и DCP были измерены при постановке диагноза, мы обнаружили повышение одного из трех опухолевых маркеров у 220 пациентов, тогда как у 159 пациентов не было повышенных онкомаркеров (рис. 1). При сравнении этих пациентов (таблица 1), пациенты с повышенным уровнем AFP-L3 имели большее количество опухолей, а пациенты с повышенным уровнем только DCP имели более высокую распространенность тромбоза воротной вены.Напротив, не наблюдалось различий в прогрессировании ГЦК между пациентами с повышенным уровнем АФП и пациентами без повышенных онкомаркеров. Когда повышение этих трех опухолевых маркеров рассматривалось вместе (таблица 2), наблюдалось увеличение размера самой большой опухоли, количества опухолей и распространенности тромбоза воротной вены по мере увеличения количества повышенных опухолевых маркеров. Следовательно, существует корреляция между количеством повышенных онкомаркеров и стадией опухоли TNM (как определено Японским исследованием рака печени [26], таблица 3).Таким образом, повышение этих онкомаркеров связано с морфологическим прогрессированием ГЦК, что оценивается с помощью визуализационных исследований.
Таблица 1
Морфологическая прогрессия опухоли на основе результатов визуализации у пациентов без повышения опухолевых маркеров и пациентов с повышенным уровнем только одного онкомаркера (n = 379) [43]
Таблица 2
Морфологическое прогрессирование опухоли на основе изображений результаты по количеству повышенных онкомаркеров (n = 685) [43]
Таблица 3
Связь между стадией опухоли TNM a и количеством повышенных опухолевых маркеров (n = 685) [43]
Рис.1
Характер повышения опухолевых маркеров у 685 пациентов с гепатоцеллюлярной карциномой [43]. Точки отсечения опухолевых маркеров составляли 20 нг / дл AFP, 10% AFP-L3 и 40 мАЕ / мл DCP.
Повышение уровня онкомаркеров также связано с патологическими характеристиками ГЦК [44]. Таблица 4 демонстрирует связь между количеством повышенных онкомаркеров и размером и количеством очагов ГЦК, дифференцировкой, типом роста [40] и инвазией воротной вены на основе патологического исследования резецированных образцов ГЦК у 173 пациентов, перенесших гепатэктомию.Помимо увеличения размера опухоли, наблюдалось увеличение распространенности умеренно или плохо дифференцированной ГЦК, ГЦК с инфильтративным ростом и микроскопической инвазии воротной вены по мере увеличения количества повышенных опухолевых маркеров, что указывает на прогрессирующую природу ГЦК. Таким образом, эти опухолевые маркеры отражают прогрессирование ГЦК с точки зрения патологических особенностей, а также результатов визуализационных исследований.
Таблица 4
Морфологическая прогрессия опухоли на основе патологического обследования в соответствии с количеством повышенных онкомаркеров (n = 173) [44]
Прогнозирование выживаемости пациентов с ГЦК на основе опухолевых маркеров
На рисунке 2 показаны показатели выживаемости после Диагностика ГЦК в соответствии с повышением уровня каждого онкомаркера.Выживаемость пациентов с повышенным уровнем опухолевых маркеров была значительно ниже, чем у пациентов без повышенных онкомаркеров (p <0,0001). Более низкая выживаемость у пациентов с повышенным уровнем AFP-L3 или DCP на момент постановки диагноза может быть результатом прогрессирующего характера ГЦК у этих пациентов. Действительно, в предыдущих исследованиях сообщалось, что повышение уровня AFP-L3 связано с более высокой частотой рецидивов [45] и более низкой выживаемостью [45,46]. Кроме того, повышение уровня DCP было связано с более высокой частотой рецидивов и более низкой выживаемостью [47,48].
Рис. 2
Выживаемость пациентов по наличию повышения онкомаркера. p <0,0001 для всех сравнений.
Несмотря на слабую связь между прогрессированием ГЦК и повышением уровня АФП, выживаемость у пациентов с повышенным уровнем АФП ниже. Предыдущие исследования показали более высокую частоту ГЦК у пациентов с повышенным уровнем АФП [49,50]. Следовательно, повышение уровня АФП может отражать потенциальный риск развития ГЦК в фоновой печени в большей степени, чем прогрессирование ГЦК.
Повышение комбинаций этих трех онкомаркеров дополнительно определяет выживаемость пациентов с ГЦК (рис. 3). Согласно нашему предыдущему анализу, количество повышенных онкомаркеров связано с выживаемостью пациента после постановки диагноза независимо от остаточной функции печени (то есть класса Чайлд-Пью) и используемых методов лечения [43].
Рис. 3
Выживаемость пациентов по количеству повышенных онкомаркеров [43]. 0 против 1, p = 0,0181; 1 против 2, p = 0.0141; 2 по сравнению с 3, p <0,0001.
Определение стадии пациентов с ГЦК только на основе маркеров сыворотки
Поскольку функция печени, помимо распространения опухоли, является важным фактором, влияющим на прогноз пациентов с ГЦК, существует несколько систем прогнозирования стадий ГЦК, которые включают параметры, указывающие как на прогрессирование опухоли, так и на наличие остатка функции печени были предложены [51,52,53,54,55,56]. Лишь несколько систем стадирования включают опухолевые маркеры в качестве факторов [51,53]; однако, как показано в этом обзоре, опухолевые маркеры связаны с выживаемостью у пациентов с ГЦК.
Как описано выше, классификация Чайлд-Пью не является полностью объективной для оценки функции печени. В предыдущем исследовании Tateishi et al. предложили новую систему стадирования ГЦК, в которой только значения сывороточного альбумина и билирубина используются в качестве индикаторов остаточной функции печени [56]; этот подход позволяет объективно и стандартизировать оценку остаточной функции печени. В более позднем исследовании также сообщалось, что комбинация билирубина и альбумина в сыворотке крови демонстрирует лучшую дискриминационную способность, чем класс Чайлд-Пью, в отношении прогноза у пациентов с ГЦК [57].Поэтому возникает вопрос, в какой степени сочетание сывороточных значений AFP, AFP-L3 и DCP (в качестве индикаторов прогрессирования опухоли) и билирубина и альбумина (в качестве индикаторов остаточной функции печени) составляет объективную прогностическую систему стадирования для пациентов с ГЦК. ?
Была разработана система стадирования ГЦК, основанная исключительно на сывороточных маркерах, без визуализации, патологических или клинических оценок, и оценена ее способность определять выживаемость пациентов [58]. Среди факторов, отражающих остаточную функцию печени, уровни сывороточного альбумина выше 3.5 г / дл, 2,8–3,5 г / дл или менее 2,8 г / дл оценивались как 0, 1 или 2 соответственно. Уровни общего билирубина в сыворотке ниже 1,0 мг / дл, 1,0–2,0 мг / дл или выше 2,0 мг / дл оценивались как 0, 1 или 2 соответственно. Затем функция печени была классифицирована по сумме этих двух баллов как A (0 или 1), B (2 или 3) или C (4). В качестве фактора прогрессирования опухоли мы просто использовали количество повышенных онкомаркеров. Оценка стадии ГЦК, основанная на этих лабораторных данных, была рассчитана как сумма фактора прогрессии опухоли и фактора функции печени, как показано в таблице 5.Мы назвали это оценкой BALAD, основанной на первой букве каждого из пяти сывороточных маркеров (билирубин, альбумин, Lens culinaris, агглютинин А-реактивная фракция AFP, AFP и DCP). Оценка BALAD хорошо определяет выживаемость пациентов после постановки диагноза и сравнима с системами стадирования, основанными на исследованиях визуализации и классе Чайлд-Пью [58]. Кроме того, недавнее исследование показало, что этот показатель может предсказывать прогноз пациентов с ГЦК в разных странах, несмотря на различия в этиологии ГЦК [59].
Таблица 5
Расчет балла BALAD
Преимущества и недостатки оценки пациентов с ГЦК только на основе сывороточных маркеров
Преимущество этой системы стадирования, основанной исключительно на сывороточных маркерах, заключается в ее объективности. Результаты являются числовыми и не зависят от качества технологии визуализации, навыков оператора или субъективной оценки. Поскольку это определение стадии может быть основано на одном образце сыворотки и использует один стандарт, стадия ГЦК может быть стандартизирована для разных стран и периодов времени (если хранящиеся образцы сыворотки доступны).Напротив, система стадирования, основанная только на сывороточных маркерах, неприменима для диагностики, планирования лечения или самого лечения из-за отсутствия визуальной информации; Для этих целей обязательны визуализирующие исследования. Эта система стадирования не предназначена для использования в качестве системы распределения лечения: она предназначена исключительно для определения стадии ГЦК для прогнозирования результатов лечения пациентов. Кроме того, эта система определения стадии на основе маркеров сыворотки не применима для пациентов, которым вводят лекарства, которые могут влиять на уровни маркеров сыворотки, или при наличии нарушений, которые могут влиять на уровни этих маркеров сыворотки.
Перспектива
Хотя биомаркеры не получили широкого признания в качестве важных клинических инструментов, они вносят ценную информацию для ведения пациентов с ГЦК в отношении наблюдения, диагностики, оценки эффективности лечения и прогнозирования результатов. Их полезность не зависит от страны или этиологии ГЦК. Помимо рассмотренных здесь онкомаркеров ГЦК (AFP, AFP-L3 и DCP), были изучены многие сывороточные биомаркеры, включая глипикан-3, инсулиноподобный фактор роста, остеопонтин, протеин Гольджи-73 и антиген плоскоклеточной карциномы. исследованы как кандидаты на опухолевые маркеры ГЦК [60,61,62,63,64,65,66].Эти новые потенциальные опухолевые маркеры HCC, по отдельности или в комбинации с другими маркерами, будут в дальнейшем способствовать лечению пациентов с HCC. Кроме того, несколько сывороточных маркеров или индексов фиброза печени были описаны как факторы риска развития ГЦК или прогностические факторы при ГЦК [67,68,69]. Эти маркеры фиброза печени могут дополнительно улучшить прогноз исхода у пациентов с ГЦК.
Список литературы
- Цукума Х., Хияма Т., Танака С., Накао М., Ябуучи Т., Китамура Т., Наканиши К., Фудзимото И., Иноуэ А., Ямазаки Н., Кавасима Т.: Факторы риска гепатоцеллюлярной карциномы среди пациентов с хроническим заболеванием печени.N Engl J Med 1993; 328: 1797-1801.
- Ока Х, Тамори А., Куроки Т., Кобаяси К., Ямамото С.: Проспективное исследование альфа-фетопротеина у пациентов с циррозом печени, отслеживаемых на предмет развития гепатоцеллюлярной карциномы. Гепатология 1994; 19: 61-66.
- Di Bisceglie AM, Sterling RK, Chung RT, Everhart JE, Dienstag JL, Bonkovsky HL, Wright EC, Everson GT, Lindsay KL, Lok AS, Lee WM, Morgan TR, Ghany MG, Gretch DR, Пробная группа HALT-C: сыворотка Уровни альфа-фетопротеина у пациентов с запущенным гепатитом C: результаты исследования HALT-C.J Hepatol 2005; 43: 434-441.
- Taketa K, Sekiya C, Namiki M, Akamatsu K, Ohta Y, Endo Y, Kosaka K: Лектин-реактивные профили альфа-фетопротеина, характеризующие гепатоцеллюлярную карциному и связанные с ней состояния. Гастроэнтерология 1990; 99: 508-518.
- Taketa K, Endo Y, Sekiya C, Tanikawa K, Koji T, Taga H, Satomura S, Matsuura S, Kawai T., Hirai H: совместное исследование по оценке лектин-реактивных α-фетопротеинов при раннем обнаружении гепатоцеллюлярной карциномы.Cancer Res 1993; 53: 5419-5423.
- Симидзу К., Таниичи Т., Сатомура С., Мацуура С., Тага Х, Такета К.: Создание наборов для определения микрогетерогенности альфа-фетопротеина с использованием электрофореза сродства к лектину. Clin Chim Acta 1993; 214: 3-12.
- Oka H, Saito A, Ito K, Kumada T., Satomura S, Kasugai H, Osaki Y, Seki T, Kudo M, Tanaka M, Совместная группа по изучению гепатоонкологии Японии: Многоцентровый проспективный анализ недавно диагностированной гепатоцеллюлярной карциномы в отношении Процент Lens culinaris агглютинин-реактивного альфа-фетопротеина.J Gastroenterol Hepatol 2001; 16: 1378-1383.
- Либман Х.А., Фьюри BC, Тонг М.Дж., Бланшар Р.А., Ло К.Дж., Ли С.Д., Колман М.С., Фьюри Б.: дез-гамма-карбокси (аномальный) протромбин как сывороточный маркер первичной гепатоцеллюлярной карциномы. N Engl J Med 1984; 310: 1427-1431.
- Окуда Х., Обата Х., Наканиши Т., Фурукава Р., Хашимото Е. Производство аномального протромбина (дез-гамма-карбоксипротромбин) гепатоцеллюлярной карциномой.Клинико-экспериментальное исследование. J. Hepatol 1987; 4: 357-363.
- Mita Y, Aoyagi Y, Yanagi M, Suda T., Suzuki Y, Asakura H: Полезность определения дез-гамма-карбоксипротромбина с помощью чувствительного иммуноферментного анализа в ранней диагностике пациентов с гепатоцеллюлярной карциномой.Рак 1998; 82: 1643-1648.
- Окуда Х., Наканиши Т., Такацу К., Сайто А., Хаяши Н., Ватанабе К., Магарио Н., Йоку Т., Нараки Т.: Измерение уровней дез-гамма-карбоксипротромбина в сыворотке крови у пациентов с гепатоцеллюлярной карциномой с помощью обновленного набора для иммуноферментного анализа с повышенная чувствительность.Рак 1999; 85: 812-818.
- Номура Ф., Исидзима М., Кува К., Танака Н., Накай Т., Охниши К.: Уровни дез-гамма-карбоксипротромбина в сыворотке, определяемые с помощью нового поколения чувствительных иммуноанализов у пациентов с гепатоцеллюлярной карциномой небольшого размера. Am J Gastroenterol 1999; 94: 650-654.
- Окуда Х., Наканиси Т., Такацу К., Сайто А., Хаяши Н., Такасаки К., Такенами К., Ямамото М., Накано М.: Уровни дез-гамма-карбоксипротромбина в сыворотке измерены с помощью обновленного набора для иммуноферментного анализа с повышенной чувствительностью в отношении клинико-патологии. особенности солитарной гепатоцеллюлярной карциномы.Рак 2000; 88: 544-549.
- Fujiyama S, Tanaka M, Maeda S, Ashihara H, Hirata R, Tomita K: опухолевые маркеры в ранней диагностике, последующем наблюдении и лечении пациентов с гепатоцеллюлярной карциномой. Онкология 2002; 62 (Дополнение 1): 57-63.
- Bruix J, Sherman M, Американская ассоциация по изучению заболеваний печени: управление гепатоцеллюлярной карциномой: обновленная информация.Гепатология 2011; 53: 1020-1022.
- Европейская ассоциация по изучению печени, Европейская организация по исследованию и лечению рака: Рекомендации EASL-EORTC по клинической практике: лечение гепатоцеллюлярной карциномы. Журнал Hepatol 2012; 56: 908-943.
- Johnson PJ, Pirrie SJ, Cox TF, Berhane S, Teng M, Palmer D, Morse J, Hull D, Patman G, Kagebayashi C, Hussain S, Graham J, Reeves H, Satomura S: выявление гепатоцеллюлярной карциномы с использованием проспективного разработана и утверждена модель на основе серологических биомаркеров.Биомаркеры эпидемиологии рака Prev.2014; 23: 144-153.
- Kumada T, Nakano S, Takeda I, Kiriyama S, Sone Y, Hayashi K, Katoh H, Endoh T, Sassa T, Satomura S: Клиническая применимость Lens culinaris агглютинин-реактивного альфа-фетопротеина при малой гепатоцеллюлярной карциноме: специальный справочник к визуальной диагностике.J Hepatol 1999;30:125-130.
- Tada T, Kumada T, Toyoda H, Kiriyama S, Sone Y, Tanikawa M, Hisanaga Y, Kitabatake S, Kuzuya T, Nonogaki K, Shimizu J, Yamaguchi A, Isogai M, Kaneoka Y, Washizu J, Satomura S: Relationship between Lens culinaris agglutinin-reactive α-fetoprotein and pathologic features of hepatocellular carcinoma.Liver Int 2005; 25: 848-853.
- Koike Y, Shiratori Y, Sato S, Obi S, Teratani T, Imamura M, Yoshida H, Shiina S, Omata M: дез-гамма-карбоксипротромбин как полезный предрасполагающий фактор для развития инвазии воротной вены у пациентов с гепатоцеллюлярной карциномой : проспективный анализ 227 пациентов.Рак 2001; 91: 561-569.
- Toyoda H, Kumada T, Osaki Y, Oka H, Kudo M: Роль онкомаркеров в оценке прогрессирования опухоли и прогнозировании результатов у пациентов с гепатоцеллюлярной карциномой. Hepatol Res 2007; 37 (Приложение 2): S166-S171.
- Ямамото К., Имамура Х., Мацуяма Й., Хасегава К., Бек Й., Сугавара Й., Макуучи М., Кокудо Н.: Значение альфа-фетопротеина и дез-гамма-карбоксипротромбина у пациентов с гепатоцеллюлярной карциномой, перенесших гепатэктомию.Энн Сург Онкол 2009; 16: 2795-2804.
- Яманака Дж., Яманака Н., Накашо К., Танака Т., Андо Т., Ясуи К., Курода Н., Таката М., Маэда С., Мацусита К., Уэмацу К., Окамото Е. Клинико-патологический анализ гепатоцеллюлярной карциномы стадии II-III, показывающий ранний массивный рецидив после резекция печени.J Gastroenterol Hepatol 2000; 15: 1192-1198.
- Международный союз борьбы с раком (UICC): Печень. В: Sobin LH, Wittekind CH, eds. Классификация злокачественных опухолей TNM. 6-е изд. Нью-Йорк, штат Нью-Йорк: Wiley, 2002: 81-83.
- Вотти Дж. Н., Лауэрс Г. Ю., Эснаола Н. Ф., До К. А., Белгити Дж., Мирза Н., Керли С. А., Эллис Л. М., Регимбо Дж. М., Рашид А., Клири К. Р., Нагорни Д. М.: Упрощенная стадия гепатоцеллюлярной карциномы.Дж. Клин Онкол 2002; 20: 1527-1536.
- Японская группа по изучению рака печени: Общие правила клинического и патологического исследования первичного рака печени (англ. Ред.) Kaneraha & Co. Ltd.: Токио, 2003 г.
- Кавата С., Мураками Т., Ким Т., Хори М., Федерле М.П., Кумано С., Сугихара Е., Макино С., Накамура Х., Кудо М.: Мультидетекторная КТ: диагностическое влияние толщины среза на обнаружение гиперваскулярной гепатоцеллюлярной карциномы.AJR Am J Roentgenol 2002; 179: 61-66.
- Итикава Т., Эртурк С.М., Араки Т.: Многофазная многорядная КТ печени с контрастным усилением: теория повышения контрастности и практический протокол сканирования с комбинацией фиксированной продолжительности инъекции и дозировки контрастного вещества, адаптированной к массе тела пациента.Eur J Radiol 2006; 58: 165-176.
- Нумата К., Фукуда Х., Мива Х., Исии Т., Мория С., Кондо М., Нодзаки А., Моримото М., Окада М., Такебаяши С., Маеда С., Нодзава А., Накано М., Танака К.: результаты ультразвукового исследования с контрастированием с использованием перфлубутана на основе контрастного вещества у пациентов с ранней гепатоцеллюлярной карциномой.Eur J Radiol 2014; 83: 95-102.
- Quaia E, De Paoli L, Angileri R, Pizzolato R, Cabibbo B, Cova MA: Доказательства диагностической модели улучшения в узлах гепатоцеллюлярной карциномы ≤2 см в соответствии с пересмотренными критериями AASLD / EASL. Визуализация брюшной полости 2013; 38: 1245-1253.
- Ди Мартино М., Де Филиппис Дж., Де Сантис А., Гейгер Д., Дель Монте М., Ломбардо К. В., Росси М., Коррадини С. Г., Меннини Дж., Каталано С. Гепатоцеллюлярная карцинома у пациентов с циррозом: проспективное сравнение УЗИ, КТ и МРТ.Eur Radiol 2013; 23: 887-896.
- Hamm B, Staks T, Mühler A, Bollow M, Taupitz M, Frenzel T, Wolf KJ, Weinmann HJ, Lange L: Клиническая оценка фазы I Gd-EOB-DTPA в качестве контрастного агента гепатобилиарной МРТ: безопасность, фармакокинетика и МРТ изображения. Радиология 1995; 195: 785-792.
- Vogl TJ, Kümmel S, Hammerstingl R, Schellenbeck M, Schumacher G, Balzer T, Schwarz W., Müller PK, Bechstein WO, Mack MG, Söllner O, Felix R: Опухоли печени: сравнение МРТ с Gd-EOB-DTPA и Gd-DTPA.Радиология 1996; 200: 59-67.
- Kim SH, Kim SH, Lee J, Kim MJ, Jeon YH, Park Y, Choi D, Lee WJ, Lim HK: МРТ с усилением гадоксетической кислоты по сравнению с трехфазным МДКТ для предоперационного выявления гепатоцеллюлярной карциномы. AJR Am J Roentgenol 2009; 192: 1675-1681.
- Ван Бирс Б.Э., пастор К.М., Хуссейн Х.К .: Примовист, Эовист: чего ожидать? Журнал Hepatol 2012; 57: 421-429.
- Reimer P, Rummeny EJ, Shamsi K, Balzer T, Daldrup HE, Tombach B, Hesse T., Berns T, Peters PE: Фаза II клинической оценки Gd-EOB-DTPA: доза, аспекты безопасности и последовательность импульсов. Радиология 1996; 199: 177-183.
- Ширабе К., Кадзияма К., Абэ Т., Сакамото С., Фукуя Т., Акадзава К., Морита К., Маэхара Ю.: Предикторы микроскопической инвазии воротной вены гепатоцеллюлярной карциномой: измерение соотношения площадей дефекта портальной перфузии.J Gastroenterol Hepatol 2009; 24: 1431-1436.
- Тада Т, Кумада Т, Тойода Х, Ито Т, Сон И, Канеока Й, Маеда А, Окуда С., Отобе К., Такахаши К.: Ультразвук с контрастным усилением и перфлубутаном для диагностики макроскопического типа небольших узловых гепатоцеллюлярных карцином.Eur Radiol 2014; 24: 2157-2166.
- Тада Т, Кумада Т, Тойода Х, Ито Т, Сон И, Окуда С., Огава С, Игура Т, Имаи Y: Диагностическая точность для макроскопической классификации узловой гепатоцеллюлярной карциномы: сравнение магнитно-резонансной томографии с усилением этоксибензилдиэтилентриамина гадолиния и пентауксусной кислоты и компьютерная томография с применением ангиографии.Журнал Гастроэнтерол 2015; 50: 85-94.
- Ikai I, Kudo M, Arii S, Omata M, Kojiro M, Sakamoto M, Takayasu K, Hayashi N, Makuuchi M, Matsuyama Y, Monden M: Отчет о 18-м последующем исследовании первичного рака печени в Японии. Hepatol Res 2010; 40: 1043-1059.
- Пью Р.Н., Мюррей-Лайон И.М., Доусон Дж. Л., Пьетрони М.С., Уильямс Р.: Перерезка пищевода при кровотечении из варикозно расширенных вен пищевода.Br J Surg 1973; 60: 646-649.
- Кайбори М., Ишизаки М., Мацуи К., Квон А.Х .: Предикторы микрососудистой инвазии перед гепатэктомией по поводу гепатоцеллюлярной карциномы. Журнал J Surg Oncol 2010; 102: 462-468.
- Тойода Х., Кумада Т., Кирияма С., Сон Й, Таникава М., Хисанага Й, Ямагути А., Исогай М., Канеока Й, Васизу Дж.: Прогностическое значение одновременного измерения трех онкомаркеров у пациентов с гепатоцеллюлярной карциномой.Clin Gastroenterol Hepatol 2006; 4: 111-117.
- Тойода Х, Кумада Т, Тада Т, Нииноми Т, Ито Т, Канеока Й, Маеда А: прогностическое значение комбинации онкомаркеров до и после лечения для гепатоцеллюлярной карциномы, леченной с помощью гепатэктомии. Журнал Hepatol 2012; 57: 1251-1257.
- Хаяси К., Кумада Т., Накано С., Такеда I, Сугияма К., Кирияма С., Соне Y, Мията А., Симидзу Х, Сатомура С. Полезность измерения Lens culinaris агглютинин-реактивной фракции альфа-фетопротеина в качестве маркера прогноз и рецидив малой гепатоцеллюлярной карциномы.Am J Gastroenterol 1999; 94: 3028-3033.
- Ямасита Ф., Танака М., Сатомура С., Таникава К.: Прогностическое значение Линзы culinaris агглютинин А-реактивный альфа-фетопротеин в небольших гепатоцеллюлярных карциномах. Гастроэнтерология 1996; 111: 996-1001.
- Toyoda H, Kumada T, Kaneoka Y, Osaki Y, Kimura T, Arimoto A, Oka H, Yamazaki O, Manabe T, Urano F, Chung H, Kudo M, Matsunaga T: прогностическое значение уровней онкомаркеров перед лечением для гепатоцеллюлярной карциномы на выживаемость после излечивающего лечения пациентов с ГЦК.J. Hepatol 2008; 49: 223-232.
- Kobayashi M, Ikeda K, Kawamura Y, Yatsuji H, Hosaka T, Sezaki H, Akuta N, Suzuki F, Suzuki Y, Saitoh S, Arase Y, Kumada H: высокий уровень дез-гамма-карбоксипротромбина в сыворотке предсказывает плохой прогноз после радиочастоты. абляция гепатоцеллюлярной карциномы.Рак 2009; 115: 571-580.
- Tateyama M, Yatsuhashi H, Taura N, Motoyoshi Y, Nagaoka S, Yanagi K, Abiru S, Yano K, Komori A, Migita K, Nakamura M, Nagahama H, Sasaki Y, Miyakawa Y, Ishibashi H: альфа-фетопротеин выше нормы уровни как фактор риска развития гепатоцеллюлярной карциномы у пациентов, инфицированных вирусом гепатита С.Журнал Гастроэнтерол 2011; 46: 92-100.
- Кумада Т., Тойода Х., Кирияма С., Таникава М., Хисанага Ю., Канамори А., Тада Т., Танака Дж., Йошизава Х .: Прогностическое значение онкомаркеров для гепатоканцерогенеза у пациентов с вирусом гепатита С. Журнал Гастроэнтерол 2011; 46: 536-544.
- Исследователи Итальянской программы рака печени (CLIP): новая прогностическая система для гепатоцеллюлярной карциномы: ретроспективное исследование 435 пациентов: исследователи Итальянской программы рака печени (CLIP).Гепатология 1998; 28: 751-755.
- Llovet JM, Brú C, Bruix J: Прогноз гепатоцеллюлярной карциномы: классификация стадии BCLC. Semin Liver Dis 1999; 19: 329-338.
- Chevret S, Trinchet JC, Mathieu D, Rached AA, Beaugrand M, Chastang C: новая прогностическая классификация для прогнозирования выживаемости у пациентов с гепатоцеллюлярной карциномой.Groupe d’Etude et de Traitement du Carcinome Hépatocellulaire. J. Hepatol 1999; 31: 133-141.
- Леунг Т.В., Тан А.М., Зи Б., Лау В.Й., Лай ПБ, Леунг К.Л., Лау Дж.Т., Ю. С.К., Джонсон П.Дж.: Построение Прогностического индекса китайского университета для гепатоцеллюлярной карциномы и сравнение с системой стадирования TNM, системой стадирования Okuda, и система стадирования итальянской программы рака печени: исследование на 926 пациентах.Рак 2002; 94: 1760-1769.
- Kudo M, Chung H, Haji S, Osaki Y, Oka H, Seki T, Kasugai H, Sasaki Y, Matsunaga T: Валидация новой системы прогнозирования стадий гепатоцеллюлярной карциномы: оценка JIS по сравнению с оценкой CLIP. Гепатология 2004; 40: 1396-1405.
- Татейши Р., Йошида Х., Шиина С., Имамура Х., Хасегава К., Тератани Т., Оби С., Сато С., Коике Й., Фудзисима Т., Макуучи М., Омата М.: Предложение новой прогностической модели гепатоцеллюлярной карциномы: анализ 403 пациенты.Кишечник 2005; 54: 419-425.
- Джонсон П.Дж., Берхан С., Кагебаяши С., Сатомура С., Тенг М., Ривз Х.Л., О’Бейрн Дж., Фокс Р., Сковронска А., Палмер Д., Йео В., Мо Ф, Лай П., Инаррайраги М., Чан С.Л., Сангро Б., Миксад Р., Тада Т, Кумада Т., Тойода Х: Оценка функции печени у пациентов с гепатоцеллюлярной карциномой: новый подход, основанный на доказательствах — уровень «ALBI».J Clin Oncol (в печати).
- Toyoda H, Kumada T, Osaki Y, Oka H, Urano F, Kudo M, Matsunaga T: Определение стадии гепатоцеллюлярной карциномы с помощью новой системы баллов (оценка BALAD) на основе маркеров сыворотки. Clin Gastroenterol Hepatol 2006; 4: 1528-1536.
- Fox R, Berhane S, Teng M, Cox T, Tada T, Toyoda H, Kumada T., Kagebayashi C, Satomura S, Johnson PJ: Прогноз на основе биомаркеров при гепатоцеллюлярной карциноме: проверка и расширение модели BALAD.Br J Cancer 2014;110:2090-2098.
- Hippo Y, Watanabe K, Watanabe A, Midorikawa Y, Yamamoto S, Ihara S, Tokita S, Iwanari H, Ito Y, Nakano K, Nezu J, Tsunoda H, Yoshino T, Ohizumi I, Tsuchiya M, Ohnishi S, Makuuchi M, Hamakubo T, Kodama T, Aburatani H: Identification of soluble Nh3-terminal fragment of glypican-3 as a serological marker for early-stage hepatocellular carcinoma.Cancer Res 2004;64:2418-2423.
- Capurro M, Wanless IR, Sherman M, Deboer G, Shi W, Miyoshi E, Filmus J: Glypican-3: a novel serum and histochemical marker for hepatocellular carcinoma. Gastroenterology 2003;125:89-97.
- Nakatsura T, Yoshitake Y, Senju S, Monji M, Komori H, Motomura Y, Hosaka S, Beppu T, Ishiko T, Kamohara H, Ashihara H, Katagiri T, Furukawa Y, Fujiyama S, Ogawa M, Nakamura Y, Nishimura Y: Glypican-3, over-expressed specifically in human hepatocellular carcinoma, is a novel tumor marker.Biochem Biophys Res Commun 2003; 306: 16-25.
- Tsai JF, Jeng JE, Chuang LY, You HL, Wang LY, Hsieh MY, Chen SC, Chuang WL, Lin ZY, Yu ML, Dai CY: сывороточный инсулиноподобный фактор роста-II как серологический маркер малой гепатоцеллюлярной карциномы. Сканд Дж. Гастроэнтерол 2005; 40: 68-75.
- Kim J, Ki SS, Lee SD, Han CJ, Kim YC, Park SH, Cho SY, Hong YJ, Park HY, Lee M, Jung HH, Lee KH, Jeong SH: Повышенные уровни остеопонтина в плазме у пациентов с гепатоцеллюлярной карциномой. Am J Gastroenterol 2006; 101: 2051-2059.
- Marrero JA, Romano PR, Николаева O, Steel L, Mehta A, Fimmel CJ, Comunale MA, D’Amelio A, Lok AS, Block TM: GP73, резидентный гликопротеин Гольджи, является новым маркером сыворотки для гепатоцеллюлярной карциномы.J. Hepatol 2005; 43: 1007-1012.
- Giannelli G, Marinosci F, Trerotoli P, Volpe A, Quaranta M, Dentico P, Antonaci S: антиген SCCA в сочетании с альфа-фетопротеином в качестве серологических маркеров HCC. Int J Cancer 2005; 117: 506-509.
- Ямасаки К., Татеяма М., Абиру С., Комори А., Нагаока С., Саеки А., Хашимото С., Сасаки Р., Бекки С., Кугияма Ю., Миядзо Ю., Куно А., Коренага М., Тогаячи А., Очо М., Мизоками М., Наримацу Х. , Yatsuhashi H: Повышенные уровни сыворотки Wisteria floribunda агглютинин-позитивного человеческого Mac-2 связывающего белка предсказывают развитие гепатоцеллюлярной карциномы у пациентов с гепатитом С.Гепатология 2014; 60: 1563-1570.
- Тамаки Н., Куросаки М., Мацуда С., Мураока М., Ясуи Ю., Сузуки С., Хосокава Т., Уэда К., Цучия К., Наканиси Х., Итакура Дж., Такахаши Ю., Асахина Ю., Изуми Н.: неинвазивное прогнозирование развития гепатоцеллюлярной карциномы. с использованием маркера фиброза сыворотки у пациентов с хроническим гепатитом С.Журнал Гастроэнтерол 2014; 49: 1495-1503.
- Тойода Х, Кумада Т, Тада Т, Канеока Й, Маеда А: лабораторный маркер, индекс FIB-4, в качестве предиктора долгосрочных результатов у пациентов с гепатоцеллюлярной карциномой после лечебной резекции печени. Хирургия (в печати).
Автор Контакты
Хиденори Тойода, доктор медицинских наук
Отделение гастроэнтерологии, муниципальная больница Огаки
4-86 Minaminokawa, Ogaki, Gifu 503-8502 (Япония)
Тел.+81584 81 3341, электронная почта [email protected]
Подробности статьи / публикации
Предварительный просмотр первой страницы
Опубликовано онлайн: 8 апреля 2015 г.
Дата выпуска: апрель 2015 г.
Количество страниц для печати: 11
Количество рисунков: 3
Количество столов: 5
ISSN: 2235-1795 (печатный)
eISSN: 1664-5553 (онлайн)
Для дополнительной информации: https: // www.karger.com/LIC
Авторские права / Дозировка препарата / Заявление об ограничении ответственности
Авторские права: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме или любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование, или с помощью какой-либо системы хранения и поиска информации, без письменного разрешения издателя. .
Дозировка лекарства: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор и дозировка лекарства, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации.Тем не менее, ввиду продолжающихся исследований, изменений в правительственных постановлениях и постоянного потока информации, касающейся лекарственной терапии и реакций на них, читателю рекомендуется проверять листок-вкладыш для каждого препарата на предмет любых изменений показаний и дозировки, а также дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендованным средством является новое и / или редко применяемое лекарство.
Отказ от ответственности: утверждения, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и соавторам, а не издателям и редакторам.Появление в публикации рекламы и / или ссылок на продукты не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор (-ы) не несут ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в контенте или рекламе.
Тесты на рак печени
Некоторые виды рака печени могут быть обнаружены путем тестирования людей из группы высокого риска, у которых нет симптомов (скрининг), но большинство случаев рака печени обнаруживаются, потому что они вызывают симптомы.Если у вас есть возможные признаки или симптомы рака печени, обратитесь к врачу, который осмотрит вас и может назначить некоторые анализы.
История болезни и медицинский осмотр
Ваш врач спросит о вашей истории болезни, чтобы узнать больше о ваших симптомах и возможных факторах риска. Ваш врач также осмотрит вас на предмет признаков рака печени и других проблем со здоровьем, вероятно, уделив особое внимание вашему животу и проверив вашу кожу и белки глаз на предмет желтухи (желтоватого цвета).
Если симптомы и / или результаты медицинского осмотра позволяют предположить, что у вас рак печени, вероятно, будут проведены дополнительные анализы. Сюда могут входить визуализирующие тесты, лабораторные тесты и / или биопсия ткани печени.
Визуальные тесты
Визуализирующие тесты используют рентгеновские лучи, магнитные поля или звуковые волны для создания изображений внутренней части вашего тела. Визуализирующие исследования могут проводиться по ряду причин как до, так и после диагностики рака печени, в том числе:
- Чтобы помочь найти подозрительные участки, которые могут быть раковыми
- Чтобы помочь врачу направить иглу для биопсии в подозрительную область для взятия пробы
- Чтобы узнать, насколько далеко мог распространиться рак
- В помощь при определенных методах лечения печени
- Чтобы помочь определить, работает ли лечение
- Для поиска возможных признаков рецидива рака после лечения
УЗИ
Ультразвук часто является первым методом исследования печени.Он использует звуковые волны для создания изображения на экране компьютера. Этот тест может показать опухоли, растущие в печени, которые затем при необходимости могут быть проверены на рак.
Компьютерная томография (КТ)
Компьютерная томография — это рентгеновский снимок, позволяющий получить подробные изображения вашего тела. КТ брюшной полости может помочь обнаружить многие типы опухолей печени. Он может предоставить конкретную информацию о размере, форме и расположении любых опухолей в печени или других частях брюшной полости, а также о близлежащих кровеносных сосудах.Компьютерная томография также может использоваться для точного ввода иглы для биопсии в предполагаемую опухоль (так называемая игольная биопсия под контролем КТ ). Если у вас обнаружен рак печени, также может быть сделана компьютерная томография грудной клетки, чтобы определить возможное распространение рака на легкие.
Магнитно-резонансная томография (МРТ)
Как и компьютерная томография, МРТ позволяет получить подробные изображения мягких тканей тела. Но при МРТ вместо рентгеновских лучей используются радиоволны и сильные магниты. МРТ может быть очень полезным при поиске опухолей печени.Иногда они могут отличить доброкачественную опухоль от злокачественной. Их также можно использовать для осмотра кровеносных сосудов в печени и вокруг нее, чтобы увидеть любые закупорки, и могут помочь определить, распространился ли рак печени на другие части тела.
Ангиография
Ангиограмма — это рентгеновский анализ кровеносных сосудов. Контрастная среда или краситель вводится в артерию, чтобы очертить кровеносные сосуды во время получения рентгеновских снимков.
Ангиография может использоваться для выявления артерий, снабжающих кровью рак печени, что может помочь врачам решить, можно ли удалить рак, и помочь спланировать операцию.Его также можно использовать для руководства некоторыми видами нехирургического лечения, такими как эмболизация (см. Эмболизирующая терапия рака печени).
Ангиография может быть неудобной, поскольку для введения красителя необходимо ввести небольшой катетер (гибкую полую трубку) в артерию, ведущую к печени. Обычно катетер вводят в артерию в паху и вводят в печеночную артерию. Вы должны оставаться неподвижными, пока катетер на месте. Перед введением катетера часто используется местный анестетик.Затем быстро вводится краситель, чтобы очертить все сосуды, пока делается рентген.
Ангиографию также можно выполнить с помощью КТ-сканера (КТ-ангиография) или МРТ (МР-ангиография). Эти методы часто используются вместо рентгеновской ангиографии, поскольку они могут дать информацию о кровеносных сосудах в печени без необходимости установки катетера в паху. Вам по-прежнему понадобится капельница на руке, чтобы во время теста в кровь можно было ввести контрастный краситель.
Сканирование костей
Сканирование костей может помочь найти рак, который распространился (метастазировал) в кости. Врачи обычно не назначают этот тест людям с раком печени, если у вас нет таких симптомов, как боль в костях, или если есть вероятность, что вы можете претендовать на трансплантацию печени для лечения рака.
Другие тесты и процедуры
Другие типы тестов могут быть выполнены, если ваш врач считает, что у вас может быть рак печени, но результаты визуализации не являются точными.
Биопсия
Биопсия — это взятие образца ткани для определения рака. Иногда единственный способ убедиться в наличии рака печени — это взять биопсию и посмотреть ее в лаборатории патологии. Но в некоторых случаях врачи могут быть уверены в том, что у человека рак печени, на основании результатов визуализирующих исследований, таких как КТ и МРТ. В этих случаях биопсия может не потребоваться.
Врачи часто обеспокоены тем, что, воткнув иглу в опухоль или потревожив ее иным образом, не удаляя ее полностью, раковые клетки могут распространиться по пути иглы.Это серьезная проблема, если хирургическое вмешательство или трансплантация печени могут быть вариантом лечения рака, поскольку любое распространение рака может лишить человека права на трансплантацию. Вот почему некоторые эксперты рекомендуют пациентам, которые могут быть кандидатами на трансплантацию, делать биопсию только в центре, где будет сделана трансплантация.
Если требуется биопсия, ее можно сделать несколькими способами.
Игольная биопсия: Полая игла вводится через кожу в брюшной полости в печень.Перед введением иглы кожа сначала обезболивается местной анестезией. Этот тип биопсии обычно выполняется с помощью УЗИ или компьютерной томографии для направления иглы.
Лапароскопическая биопсия: Образцы биопсии также можно брать во время лапароскопии. Это позволяет врачу увидеть поверхность печени и взять образцы аномальных участков.
Хирургическая биопсия: Послеоперационная биопсия (удаление части опухоли) или эксцизионная биопсия (удаление всей опухоли и некоторых окружающих нормальных тканей печени) могут быть выполнены хирургическим путем.
Для получения дополнительной информации о биопсиях и способах их тестирования см. Тестирование биопсийных и цитологических образцов на рак.
Лабораторные испытания
Ваш врач может назначить лабораторные анализы по ряду причин:
- Для диагностики рака печени
- Чтобы помочь определить, что могло вызвать рак печени
- Чтобы узнать, насколько хорошо работает ваша печень, что может повлиять на то, какое лечение вы можете пройти
- Чтобы получить представление о вашем общем состоянии здоровья и о том, насколько хорошо работают ваши другие органы, что также может повлиять на то, какое лечение вы можете проходить
- Посмотреть, насколько хорошо работает лечение
- Искать признаки того, что рак вернулся после лечения
Анализ крови на альфа-фетопротеин (АФП)
AFP — это белок, который может быть обнаружен в высоких концентрациях у взрослых с заболеваниями печени, раком печени, беременных или другими видами рака.
Если уровень АФП очень высок у человека с опухолью печени, это может быть признаком рака печени. Но рак печени — не единственная причина высокого уровня АФП. Многие пациенты с ранним раком печени имеют нормальный уровень AFP, поэтому высокий уровень AFP не очень помогает в определении того, может ли опухоль в печени быть раком.
Однако этот тест иногда полезен для людей, у которых уже диагностирован рак печени. Уровень AFP может помочь в выборе вариантов лечения. Во время лечения тест можно использовать, чтобы получить представление о том, насколько хорошо он работает, поскольку уровень АФП должен снизиться, если лечение будет эффективным.Тест также можно использовать после лечения, чтобы искать возможные признаки того, что рак вернулся (рецидив).
Другие анализы крови
Анализы на вирусный гепатит: Ваш врач может назначить анализы крови для проверки на гепатиты B и C.
Функциональные тесты печени (LFT): Поскольку рак печени часто развивается в печени, уже поврежденной гепатитом и / или циррозом, врачам необходимо знать состояние вашей печени до начала лечения.Если часть вашей печени, не пораженная раком, не работает должным образом, возможно, вам не удастся сделать операцию, чтобы попытаться вылечить рак, поскольку операция может потребовать удаления большой части вашей печени. Другие варианты лечения, такие как определенная таргетная терапия или химиотерапия, также могут быть не лучшим выбором, если ваша печень не работает должным образом.
Тесты на свертываемость крови: Печень также вырабатывает белки, которые помогают свертываться крови при кровотечении. Поврежденная печень может не вырабатывать достаточно этих факторов свертывания, что может увеличить риск кровотечения.Ваш врач может назначить анализы крови, чтобы измерить этот риск.
Функциональные тесты почек: Тесты на уровень азота мочевины (АМК) и креатинина в крови часто проводятся, чтобы оценить, насколько хорошо работают ваши почки.
Полный анализ крови (CBC): Этот тест измеряет уровни красных кровяных телец (которые переносят кислород по всему телу), лейкоцитов (которые борются с инфекциями) и тромбоцитов (которые способствуют свертыванию крови). Это дает представление о том, насколько хорошо функционирует костный мозг (где образуются новые клетки крови).
Анализы химического состава крови и другие анализы: Анализы химического состава крови проверяют уровни ряда веществ в крови, некоторые из которых могут быть поражены раком печени. Например, рак печени может повысить уровень кальция в крови, а уровень глюкозы в крови может упасть. Рак печени также может иногда повышать уровень холестерина, поэтому это тоже можно проверить.
Для получения дополнительной информации о тестах см. «Экзамены и тесты на рак».
тестов на рак печени | Hepatitis C Trust
Анализы крови
Гепатоцеллюлярная карцинома (ГЦК или рак печени) не может быть диагностирована с помощью обычных анализов крови.Существует только один конкретный анализ крови, который можно использовать для диагностики ГЦК. Этот тест специально измеряет уровни белка альфа-фетопротеина в сыворотке (AFP).
К сожалению, только около половины всех опухолей дает повышенное значение AFP. Таким образом, нормальный тест на АФП не исключает наличия ГЦК. Это еще больше осложняется тем фактом, что AFP также продуцируется пролиферирующими клетками печени, поэтому у кого-то с циррозом и регенерацией печени, вероятно, уже был повышен уровень AFP.Как следствие, врачи, вероятно, захотят проверить, стабильны ли уровни AFP. Повышение уровня АФП с большей вероятностью указывает на ГЦК.
Даже при отсутствии обнаруживаемых признаков ГЦК у людей с циррозом печени и аномальным уровнем AFP все еще существует высокий риск его развития. У любого человека с циррозом и повышенным уровнем АФП, особенно с постоянно растущим уровнем АФП, скорее всего, либо разовьется ГЦК, либо уже будет нераспознанный ГЦК.
Визуализирующие исследования
Не существует единого метода визуализации, который бы правильно идентифицировал все ГЦК.У каждой современной техники есть свои сильные и слабые стороны.
УЗИ
Ультразвук обычно является первым скрининговым тестом, проводимым при подозрении на ГЦК. Точность ультразвукового исследования во многом зависит от техника или радиолога, выполняющего сканирование. Некоторые опытные операторы могут обнаружить поражения (участки аномальной ткани) размером до 0,5 см. Другие могут идентифицировать только гораздо более крупные поражения. У ультразвука есть преимущества, заключающиеся в отсутствии ионизирующего излучения и внутривенного введения контрастного вещества (введение химического вещества в организм для улучшения контрастности изображения).Стоимость УЗИ также ниже, чем у других видов сканирования.
Сканирование для компьютерной томографии (КТ)
При выполнении с усиливающим контрастным веществом сканирование КТ может быть столь же чувствительным, как и ультразвук. Это связано с тем, что агент улучшает визуализацию артериальной и венозной систем. КТ гораздо меньше зависит от оператора, чем УЗИ. У них также есть то преимущество, что они могут предоставить изображения большего количества областей тела. КТ значительно дороже, чем УЗИ, и подвергает людей воздействию ионизирующего излучения.
Печеночная ангиография
При этой процедуре катетер вводится в печеночную артерию, и в печень вводится внутривенное контрастное вещество. Это может быть полезно для оценки сложных поражений, но оно также связано с риском ионизирующего излучения, пункцией артерии и введением контрастного вещества. Печеночная ангиография обычно проводится людям, которые относятся к группе высокого риска, но у которых не было выявлено никаких признаков ГЦК с помощью других визуализационных исследований.Во время ангиографии, если опухоль обнаружена, может быть принято решение заблокировать артерию, питающую опухоль, и до введения в нее противоопухолевых препаратов (химиоэмболизация).
Магнитно-резонансная томография (МРТ)
МРТ становится все более популярным для диагностики опухолей печени. Как и компьютерная томография, он может исследовать большие области груди и живота за один сеанс. Но поскольку ионизирующее излучение не используется, визуализацию можно повторять много раз с небольшим риском.Технология эволюционировала до такой степени, что новые МРТ могут реконструировать изображения желчных протоков, желчного пузыря, а также артерий и вен печени. Использование внутривенных контрастных веществ значительно увеличивает чувствительность процедуры, но также увеличивает затраты. МРТ в настоящее время стоит дорого, а доступность аппаратов МРТ ограничена.
Биопсия печени
Единственный четкий способ отличить злокачественное новообразование от доброкачественного — изучить его, взяв образец ткани и изучив его под микроскопом.Этот процесс называется биопсией. Биопсия может проводиться одновременно с УЗИ или компьютерной томографией.
Лапароскопия
В этой процедуре хирург помещает инструмент, называемый лапароскопом (тонкая гибкая трубка с камерой и светом на кончике), в тело через небольшой разрез в брюшной полости. Лапароскоп позволяет хирургу непосредственно смотреть на печень, чтобы определить признаки ГЦК.
биомаркеров гепатоцеллюлярной карциномы
Гепатоцеллюлярная карцинома (ГЦК) — одна из наиболее распространенных злокачественных опухолей с низкой выживаемостью.Ведение пациентов с риском развития ГЦК остается сложной задачей. Более глубокое понимание биологии рака и технический прогресс позволили идентифицировать множество патологических, генетических и молекулярных событий, которые управляют гепатоканцерогенезом, что привело к открытию множества потенциальных биомаркеров этого заболевания. В настоящее время они активно изучаются, чтобы установить их ценность для ранней диагностики, оптимизации терапии, уменьшения появления новых опухолей и предотвращения рецидивов после хирургической резекции или трансплантации печени.Эти маркеры не только помогают в прогнозировании прогноза или рецидива, но также могут помочь в выборе подходящего метода лечения и могут представлять новые потенциальные цели для терапевтических вмешательств. В этой статье был представлен обзор наиболее важных имеющихся данных из опубликованных статей, в которых описаны различные тканевые и сывороточные биомаркеры, участвующие в гепатоцеллюлярной карциноме.
1. Введение
В качестве молекулярных индикаторов биологического статуса биомаркеры, обнаруживаемые в крови, моче или тканях, могут быть полезны для клинического лечения различных болезненных состояний.Пороговые концентрации можно использовать для определения наличия различных заболеваний. Колебания концентрации могут определять терапию при прогрессировании заболевания. Были идентифицированы многочисленные биомаркеры различных болезненных состояний. Исследования продолжаются, чтобы полностью понять и оценить клиническое значение использования биомаркеров. Время и деньги можно сэкономить, отказавшись от эмпирических или широких подходов к лечению заболеваний конкретных органов или систем, и в идеале биомаркеры могут служить инструментом измерения для выявления наличия и прогрессирования заболевания и для руководства более целенаправленной терапией.Многие болезненные состояния, особенно различные типы рака, можно лучше понять с помощью опухолевых биомаркеров. Гепатоцеллюлярная карцинома (ГЦК) является одним из таких видов рака, для которого могут быть полезны диагностические, терапевтические и прогностические возможности опухолевых биомаркеров.
ГЦК — пятая по распространенности злокачественная опухоль и третья по значимости причина смерти от рака. Ежегодно во всем мире регистрируется около 626 000 новых случаев ГЦК и около 600 000 случаев смерти от ГЦК, частота которых равна уровню смертности [1, 2].Хотя молекулярные механизмы развития ГЦК остаются в значительной степени неясными, было идентифицировано множество патологических, генетических и молекулярных событий, которые управляют гепатоцеллюлярным канцерогенезом.
Текущий золотой стандарт и наиболее часто используемые биомаркеры для пациентов с риском ГЦК, альфа-фетопротеин (AFP) вместе с ультразвуком каждые 6–12 месяцев, далек от совершенства. Уровни АФП в сыворотке более 400 нг / мл считаются диагностическими; однако такие высокие значения наблюдаются только у небольшого процента пациентов с ГЦК.Ультразвуковое наблюдение, даже проводимое каждые три месяца, не может улучшить выявление небольших ГЦК из-за ограничений в процедурах отзыва [3, 4].
С прогрессом в понимании биологии опухолей, наряду с развитием клеточных и молекулярных методов, роль биомаркеров, связанных с ранним обнаружением, инвазивностью, метастазированием и рецидивом, привлекла большой исследовательский интерес, что привело к открытию и использованию нескольких новых маркеры этого заболевания.В этой статье мы попытаемся дать обзор имеющихся данных по этой быстрорастущей области исследований.
2. Биомаркеры рака печени
2.1. Онкофетальные и гликопротеиновые антигены
2.1.1. Альфа-фетопротеин (AFP)
Первым серологическим тестом для выявления и последующего клинического наблюдения пациентов с гепатоцеллюлярной карциномой был альфа-фетопротеин (AFP), который был стандартным биомаркером опухоли для HCC в течение многих лет. Это гликопротеин, который вырабатывается печенью и желточным мешком плода во время беременности.Уровни АФП в сыворотке часто повышены при ГЦК, но это не всегда так. Уровень АФП может сначала повышаться на ранних стадиях ГЦК, а затем снижаться или даже нормализоваться, прежде чем снова повыситься по мере прогрессирования заболевания [5]. Кроме того, повышение уровня АФП также было обнаружено при наличии острого и хронического вирусного гепатита, а также у пациентов с циррозом, вызванным гепатитом С. Учитывая многочисленные показания, которые присутствуют при повышенных уровнях АФП, необходимо оценить значимость концентраций в сыворотке. .В целом, постоянно повышенные уровни АФП в сыворотке, превышающие 500 нг / мл, указывают на ГЦК. Более низкие сывороточные концентрации, которые носят временный характер, чаще встречаются при доброкачественных заболеваниях печени [6]. Если пациенту известны факторы риска ГЦК, такие как наличие цирроза, повышение уровня АФП коррелирует с развитием ГЦК [6]. К сожалению, сывороточные концентрации АФП плохо коррелируют с прогностическими значениями ГЦК, такими как размер опухоли, стадия или прогрессирование заболевания, а также может существовать этническая изменчивость.Более того, в некоторых случаях ГЦК повышение уровня АФП вообще не проявляется [7]. Общий AFP можно разделить на три различных гликоформы, AFP-L1, AFP-L2 и AFP-L3, в зависимости от их способности связываться с лектином Lens culinaris aglutinin (LCA). Было показано, что высокий процент AFP-L3 связан с плохой дифференцировкой и биологически злокачественными характеристиками, ухудшением функции печени и большей массой опухоли [8].
2.1.2. Глипикан-3
Глипикан-3 (GPC3), мембранно-заякоренный протеогликан сульфата гепарина, взаимодействует с факторами роста и модулирует их активность.Он связывается с клеточной мембраной через якоря гликозилфосфатидилинозитола. Уровень мРНК GPC3 был значительно повышен в опухолевых тканях HCC по сравнению с паранеопластической тканью печени, тканями печени здоровых взрослых и тканями печени пациентов с доброкачественной гепатопатией. Экспрессия GPC3 (как на уровне мРНК, так и на уровне белка) в сыворотке пациентов с ГЦК была значительно выше, чем в сыворотке здоровых взрослых или пациентов с доброкачественными заболеваниями. Он может быть обнаружен у 40–53% пациентов с HCC и 33% пациентов с HCC, серонегативных как по AFP, так и по дез-гамма-карбоксипротромбину (DCP) [9, 10].Было показано, что растворимый GPC3 (sGPC3), NH 2 -концевая часть GPC3, превосходит AFP в чувствительности обнаружения хорошо или умеренно дифференцированной HCC, а одновременное определение обоих маркеров улучшает общую чувствительность с 50%. до 72%. Недавно было проведено исследование, в котором сравнивали выживаемость между GPC3-положительными и GPC3-отрицательными пациентами с ГЦК. Положительность GPC3 коррелировала с плохим прогнозом и идентифицировалась как независимый прогностический фактор для общей выживаемости при многомерном анализе [11].
2.2. Ферменты и изоферменты
2.2.1. Дез-гамма-карбокси (аномальный) протромбин (DCP)
DCP продуцируется злокачественными гепатоцитами и, по-видимому, является результатом приобретенного посттрансляционного дефекта в витамин К-зависимой карбоксилазной системе. Продукция DCP не зависит от дефицита витамина K, хотя фармакологические дозы витамина K могут временно подавлять продукцию DCP в некоторых опухолях. Уровни DCP, превышающие 0,1 AU / мл (100 нг / мл) по данным ELISA, с большой вероятностью указывают на ГЦК или рецидив опухоли.Нормализация уровней DCP хорошо коррелирует с успешной резекцией опухоли и, по-видимому, является отличным маркером активности опухоли. Считается, что комбинация анализов AFP и DCP повысит чувствительность тестирования. Корреляция между размером опухоли и уровнями DCP еще четко не определена. Похоже, что существует корреляция между уровнями DCP и большими опухолями; однако этого не происходит с небольшими опухолями (<3 см) [15]. Поперечное исследование случай-контроль с участием 207 пациентов показало, что DCP более чувствителен и специфичен, чем AFP, для дифференциации HCC от незлокачественного заболевания печени.В этом исследовании изучались 4 группы: нормальные здоровые испытуемые; пациенты с нецирротическим хроническим гепатитом, пациенты с компенсированным циррозом печени и пациенты с гистологически подтвержденным ГЦК. Уровни как DCP, так и AFP увеличивались среди групп по мере увеличения тяжести заболевания (от нормального до HCC), но значения DCP имели меньшее совпадение между группами, чем AFP. Результаты исследования показали, что значение DCP 125 мАЕ / мл обеспечивает наилучшую чувствительность и специфичность для дифференциации пациентов с ГЦК от пациентов с циррозом и хроническим гепатитом [16].Чувствительность и специфичность общего AFP, гликоформ AFP, DCP и комбинаций обоих маркеров суммированы в таблице 1.
| ||||||||||||||||||||||||||||||
2.2.2. Гамма-глутамилтрансфераза
Сывороточная гамма-глутамилтрансфераза (GGT) у здоровых взрослых в основном секретируется клетками Купфера печени и эндотелиальными клетками желчных протоков, и ее активность увеличивается в тканях с ГЦК.Общий GGT можно разделить на 13 изоферментов с помощью электрофореза в полимерно-акриламидном градиентном геле, и некоторые из них могут быть обнаружены только в сыворотке пациентов с HCC. Сообщается, что чувствительность к GGTII составляет 74,0% при обнаружении большого HCC и 43,8% при обнаружении небольшого HCC. Чувствительность можно значительно улучшить при одновременном определении GGTII, DCP и AFP [17].
2.2.3. Альфа-1-фукозидаза в сыворотке крови
Альфа-1-фукозидаза (AFU) представляет собой лизосомальный фермент, обнаруженный во всех клетках млекопитающих, с функцией гидролиза фукозных гликозидных связей гликопротеина и гликолипидов.Его активность увеличивается в сыворотке крови пациентов с ГЦК (нмоль / мл / ч) по сравнению с таковой в сыворотке здоровых взрослых (нмоль / мл / ч), пациентов с циррозом печени (нмоль / мл / ч) и пациентов с хроническим гепатитом. (Нмоль / мл / ч). Сообщалось, что чувствительность и специфичность AFU при пороговом значении 870 нмоль / мл / ч составляли 81,7% и 70,7% соответственно [18]. Измерение AFU полезно в сочетании с AFP в ранней диагностике HCC и может служить ценным дополнением к AFP. Было указано, что ГЦК разовьется в течение нескольких лет у 82% пациентов с циррозом печени, если их сывороточная активность AFU превышает 700 нмоль / мл / ч.Сообщалось, что активность AFU повышена у 85% пациентов, по крайней мере, за 6 месяцев до выявления HCC с помощью ультразвукового исследования [19].
2.2.4. Карбонилредуктаза человека 2
Этот фермент, экспрессируемый в печени и почках человека, важен для детоксикации реактивных альфа-дикарбонильных соединений и активных форм кислорода, возникающих в результате окислительного стресса при ГЦК. Показано, что уровни карбонилредуктазы 2 человека обратно коррелируют с патологической степенью ГЦК [20].
2.2.5. Фосфопротеин Гольджи 2
Фосфопротеин Гольджи 2 (GOLPh3), белок, связанный с аппаратом Гольджи, имеет более высокую чувствительность, чем АФП, при обнаружении ГЦК [21]. Недавнее исследование показало, что белок GOLPh3 высоко экспрессируется в тканях пациентов с ГЦК (71%) и карциномой желчных протоков (85%). Уровни белка GOLPh3 определялись и количественно определялись в сыворотке с помощью ELISA. У пациентов с гепатитом C серийные измерения ELISA в ходе заболевания, по-видимому, являются многообещающим дополнительным маркером сыворотки для наблюдения за ГЦК [22].
2.3. Факторы роста и их рецепторы
2.3.1. Трансформирующий фактор роста-бета (TGF-Beta)
Принадлежащий к суперсемейству полипептидных сигнальных молекул, участвующих в регуляции роста, дифференцировки, ангиогенеза, инвазии и иммунной функции клеток, TGF-бета является преобладающей формой семейства факторов роста у людей. Его мРНК и белок сверхэкспрессируются при ГЦК по сравнению с окружающими тканями печени, особенно в небольших и хорошо дифференцированных ГЦК [23]. Однако не было показано никакой связи между экспрессией TGF-бета и выживаемостью после гепатэктомии [24].Было обнаружено, что сывороточный уровень TGF-бета повышен у пациентов с ГЦК по сравнению со здоровыми взрослыми или пациентами с доброкачественными заболеваниями печени [25–27].
2.3.2. Опухоль-специфический фактор роста (TSGF)
Злокачественные опухоли выделяют опухолеспецифический фактор роста (TSGF) в периферическую кровь во время периода роста. Уровни TSGF в сыворотке могут отражать наличие опухоли. TSGF может использоваться в качестве диагностического маркера при обнаружении ГЦК, и его чувствительность может достигать 82% при пороговом значении 62 Ед / мл и может иметь более высокую точность при одновременном определении других онкомаркеров.Одновременное определение TSGF (при пороговом значении 65 Ед / мл), AFP (при пороговом значении 25 нг / мл) и сывороточного ферритина (при пороговом значении 240 нг / мл) могут достигать чувствительности и специфичности 98,4% и 99% соответственно [26].
2.3.3. Семейство рецепторов эпидермального фактора роста
Семейство рецепторов эпидермального фактора роста (EGFR) состоит из четырех тесно связанных рецепторов трансмембранных тирозинкиназ: EGFR (erbB-1), c-erb-2 (Her-2 / neu), c-erb- 3 (HER-3) и c-erb-4 (HER-4).Они связываются с лигандами семейства EGF, включая EGF, TGF-альфа и гепарин-связывающий EGF. Высокие уровни экспрессии EGFR были связаны с ранним рецидивом и снижением выживаемости без признаков заболевания после резекции гепатоцеллюлярной карциномы [27].
2.3.4. Фактор роста гепатоцитов / фактор рассеяния
Фактор роста гепатоцитов / фактор рассеяния (HGF / SF) — это цитокин с широким спектром эффектов, связанных с эмбриональным развитием и регенерацией печени. Это связано с молекулярными механизмами гепатоканцерогенеза через паракринную систему с участием его клеточного рецептора c-met.Высокая экспрессия c-met была показана при ГЦК инвазивного типа и была связана с метастазированием и снижением общей выживаемости [28, 29].
2.3.5. Основной фактор роста фибробластов
Это растворимый гепарин-связывающий полипептид с сильным митогенным действием на эндотелиальные клетки. Было показано, что повышенные уровни выше среднего> 10,8 пг / мл предсказывают снижение безрецидивной выживаемости [30]. Недавние предварительные данные о таргетной терапии леналидомидом, который ингибирует фактор роста фибробластов (FGF), показали многообещающую и у некоторых пациентов значительную активность у пациентов с ГЦК [31].
2.4. Молекулярные маркеры
2.4.1. Циркулирующие нуклеиновые кислоты: мРНК
Анализ циркулирующих нуклеиновых кислот в плазме предлагает еще один способ неинвазивного мониторинга различных физиологических и патологических состояний [30, 31]. Сообщалось о многочисленных применениях, основанных на обнаружении циркулирующих бесклеточных нуклеиновых кислот в плазме человека для лечения злокачественных новообразований. Фундаментальный принцип, лежащий в основе этих приложений, связан с обнаружением в плазме внеклеточных молекул нуклеиновых кислот, полученных из больных органов.Анализ бесклеточной РНК плазмы открывает возможность для разработки маркеров, связанных с патологией [32–34].
мРНК альфа-фетопротеина (мРНК AFP)
Matsumura et al. впервые сообщил, что одиночные клетки HCC могут быть обнаружены в кровотоке с помощью полимеразной цепной реакции с обратной транскрипцией (RT-PCR), нацеленной на мРНК AFP [35]. Это привело к дальнейшим сообщениям о значении мРНК AFP в качестве предиктора рецидива HCC. Довольно противоречивые результаты были приписаны дисперсии в крови как опухолевых клеток, так и нормальных клеток печени и неправильной транскрипции мРНК, кодирующей AFP, периферическими мононуклеарными клетками.Сообщалось, что безрецидивный интервал у пациентов с ГЦК с послеоперационной положительной сывороткой на мРНК АФП был значительно короче, чем у пациентов с ГЦК с послеоперационным негативом (53% против 88% через 1 год, 37% против 60% через 2 года) [ 34] и (52,6% против 81,8% через 1 год, 15,6% против 54,5% через 2 года и 0% против 29,2% через 3 года) [36]. Метаанализ показал, что экспрессия мРНК AFP через неделю после операции коррелировала с рецидивом ГЦК [37].
мРНК гамма-глутамилтрансферазы (мРНК GGT)
Подобно AFP, мРНК GGT может быть обнаружена в сыворотке и тканях печени здоровых взрослых, пациентов с заболеваниями печени, доброкачественными опухолями печени, HCC и вторичными опухолями печени [38].Были идентифицированы два типа мРНК GGT, тип A и тип B. Тип B является преобладающим в раковой ткани, что позволяет предположить, что изменения в экспрессии мРНК печеночного GGT могут быть связаны с развитием HCC [39]. Пациенты с HCC, несущей мРНК GGT типа B как при раке, так и в доброкачественной ткани, имели худший исход, более ранний рецидив и большую смертность, связанную с рецидивом. Присутствие мРНК GGT типа B в злокачественной ткани статистически коррелировало с высоким уровнем АФП в сыворотке крови, дочерними узелками, более высокой частотой рецидивов после резекции, чем те, у которых он отсутствует (63.6% против 14,3%) и более низкая выживаемость после рецидива. Присутствие мРНК GGT типа B в доброкачественной ткани печени значительно коррелировало с инфекцией гепатита С, высоким уровнем АФП в сыворотке, отсутствием инфильтрации капсулы, проницаемостью сосудов, дочерними узелками, рецидивом после резекции и выживаемостью после рецидива [40].
мРНК инсулиноподобного фактора роста II (IGF-II)
Аномальная экспрессия мРНК IGF-II может быть полезным опухолевым маркером для диагностики, дифференциации, внепеченочных метастазов и мониторинга послеоперационных рецидивов ГЦК.Определение сывороточного инсулиноподобного фактора роста-II (IGF-II) (при пороговом значении 4,1 мг / г, преальбумин) имеет чувствительность 63%, специфичность 90% и точность 70% в диагностика малого ГЦК [41]. Он может быть дополнительным онкомаркером к AFP для диагностики небольшого HCC. Одновременное определение IGF-II и AFP (при пороговом значении 50 нг / мл) может повысить чувствительность до 80% и точность до 88% [42].
мРНК альбумина
Альбумин — это самый распространенный в организме белок, синтезируемый печенью.мРНК альбумина обнаруживается в плазме человека и может быть диагностически чувствительным маркером патологий печени. Было обнаружено, что внеклеточные анализы (циркулирующая ДНК / РНК) лучше, чем клеточные анализы (циркулирующие опухолевые клетки) в обнаружении пренеопластических поражений и микрометастазов, поскольку уровни в плазме циркулирующих нуклеиновых кислот, полученных из рака, выше, чем уровни циркулирующих раковые клетки и менее подвержены ошибкам отбора проб. Cheung и его коллеги изучили предоперационные образцы плазмы, полученные от 72 пациентов с ГЦК, перенесших трансплантацию печени, и обнаружили, что пациенты с уровнем мРНК альбумина плазмы (> 14.6) при многомерном анализе частота рецидивов была значительно выше. Высокий уровень мРНК альбумина в плазме предсказал частоту рецидивов через 2 года с чувствительностью и специфичностью 73% и 70% соответственно [43].
МикроРНК (miRNAs)
MicroRNAs (miRNAs) представляют собой семейство эндогенных малых (21–23 нуклеотидов) некодирующих, но функциональных РНК, которые были обнаружены у червей, мух и млекопитающих, включая человека [44]. Подсчитано, что в геноме человека имеется около 1000 генов miRNA, из которых уже идентифицировано около 500 генов miRNA [45].Подобно мРНК, миРНК, ассоциированные с ГЦК, могут использоваться в качестве диагностических и прогностических биомаркеров ГЦК с потенциалом для еще большей точности. MiRNA могут точно предсказать, будет ли рак печени распространяться и будет ли выживаемость пациентов с раком печени короче или дольше. МикроРНК регулируют экспрессию генов, связываясь со специфическими информационными РНК и предотвращая их трансляцию в белок. Поскольку каждый тип miRNA способен подавлять активность сотен генов одновременно, они могут контролировать целые программы транскрипции, которые определяют фундаментальные клеточные свойства и поведение.Соответственно, профилирование miRNA стало чрезвычайно ценным методом фенотипирования и подклассификации опухолей [44]. По сравнению с обычным профилированием экспрессии генов (при котором исследуются матричные РНК, кодирующие белок), анализ miRNA имеет несколько преимуществ. Из-за стабильности miRNA могут использоваться образцы, фиксированные формалином (а не замороженные ткани). Более того, опрос сотен miRNAs (и часто значительно меньшего числа) дает столько информации, сколько можно почерпнуть из изучения тысяч информационных РНК.
Многие независимые группы провели всесторонний анализ miRNAs при HCC, и было идентифицировано множество информации о маркерах miRNA. Многие из этих сигнатур miRNA коррелируют с важными биологическими параметрами, такими как метастазирование [46–48], дифференцировка [49–51], инфекция HBV или HCV [52, 53], рецидив опухоли [54] и выживаемость пациентов [55, 56]. ]. Некоторые miRNA участвуют в канцерогенезе HCC, способствуя развитию раковых стволовых клеток и контролируя пролиферацию и апоптоз клеток; другие связаны с прогрессированием HCC, контролируя миграцию и инвазию клеток.Эти миРНК, ассоциированные с ГЦК, не только позволяют по-новому взглянуть на молекулярные основы ГЦК, но также служат в качестве новых инструментов для диагностики и прогноза ГЦК. Однако в настоящее время несколько сигнатур miRNA потенциально могут быть использованы в этой области. Некоторые miRNA прошли валидацию в независимой когорте, что открыло путь для клинически полезных платформ для оценки риска и исходов ГЦК. Эта многообещающая область исследований требует дальнейшего подтверждения в проспективных исследованиях [57].
2,5. Патологические биомаркеры
Наконец, появились сообщения о патологических биомаркерах ГЦК для диагностики и прогноза.Некоторые из этих диагностических биомаркеров сосредоточены на иммунохимических образцах окрашивания, чтобы отличить диспластические узелки высокой степени злокачественности и хорошо дифференцированный ГЦК. Сообщается, что лучшим типом иммуноокрашивания для этого тяжелого состояния является комбинация белка теплового шока 70 (HSP70), глипикана-3 (GPC3) и глутаминсинтетазы (GS). Для прогностического использования был изучен ряд гистологических и иммуно-гистохимических маркеров, таких как маркеры пролиферации клеток (Ki67), апоптоза или выживаемости клеток (сурвивин), молекулы клеточной адгезии (E-кадгерин), неоангиогенеза (VEGF) и др. небольшие исследования, показывающие многообещающие; однако большинство этих маркеров не прошли валидацию в крупных исследованиях [57].Различные биомаркеры ГЦК и их клиническое применение сведены в таблицу 2.
| ||||||||||||||||||||||||||||||||||||
3.Обсуждение
Гепатоканцерогенез — сложный многоступенчатый процесс, обычно происходящий после многих лет хронического воздействия нескольких митогенных и мутагенных сред, вызывающих случайные генетические изменения. Последние данные свидетельствуют о том, что внутренние биологические характеристики опухоли с точки зрения пролиферации и инвазивности, вероятно, связаны с различным составом и активностью микросреды, что приводит к очень разным клиническим исходам. ГЦК довольно уникален своей способностью синтезировать различные белки, связанные с опухолями, что делает его более подходящим для исследований, связанных с биомаркерами, чем другие опухоли.Из-за большого количества биомаркеров, описываемых при этом заболевании, выбор биомаркеров, которые были бы наиболее полезны в клинической практике, был более чем сложной задачей. В этом довольно кратком обзоре мы постарались сосредоточиться на наиболее широко используемых и признанных биомаркерах.
Несмотря на свои ограничения, сывороточный АФП по-прежнему остается наиболее широко используемым онкомаркером в клинической практике. Недавние исследования отдают предпочтение циркулирующей субфракции AFP, специфичной для гепатомы, AFP-L3 и DCP по сравнению с одним только AFP в дифференциации HCC от доброкачественной гепатопатии и обнаружении небольшого HCC.Кроме того, было показано, что некоторые другие опухолевые маркеры, такие как GPC3, GGT II, AFU, дополняют AFP и DCP при обнаружении HCC. Некоторые из них даже могут быть обнаружены у пациентов с ГЦК, серонегативных как по AFP, так и по DCP, что указывает на то, что одновременное определение этих маркеров может повысить точность.
Однако наиболее захватывающей и многообещающей областью исследований этого заболевания было определение новой группы молекул, называемых миРНК. Было обнаружено, что miRNA аномально экспрессируются при HCC, и некоторые из них функционально вовлечены в канцерогенез и прогрессирование HCC.Кроме того, определенные микроРНК связаны с ГЦК или связаны с подтипами ГЦК, что предполагает потенциальное использование микроРНК в стратификации диагноза и прогноза пациентов с ГЦК. Некоторые из этих миРНК, ассоциированных с ГЦК, были проверены в независимых когортах. Это дает возможность разработки клинически полезных платформ для диагностики ГЦК, оценки риска и стратификации риска пациента с конечной целью персонализированной терапии.
4. Заключение
Исследования молекулярной биологии гепатоканцерогенеза выявили многочисленные биомаркеры, которые могут предоставить дополнительную информацию о метастазах биологического поведения и рецидивах ГЦК по сравнению с традиционными гистопатологическими признаками.Было показано, что большое количество биомаркеров имеет потенциальное прогностическое значение. Однако большинство из них были изучены ретроспективно. Усилия должны быть направлены на проспективные клинические испытания для оценки прогностической значимости этих маркеров. Эти молекулы не только помогают в прогнозировании прогноза для пациентов с ГЦК, но также могут помочь в выборе подходящего метода лечения и представляют собой новые цели для терапевтических вмешательств.
Оценка диагностической эффективности PIVKA-II и других опухолевых маркеров при ГЦК — Просмотр полного текста
Краткое описание:
Заболеваемость гепатоцеллюлярной карциномой (ГЦК) растет во всем мире.Однако в большинстве случаев ГЦК на момент установления диагноза находилась на поздней стадии. Ранняя диагностика улучшает прогноз. Исследование предназначено для оценки диагностической эффективности белка, вызванного отсутствием витамина К или антагониста-II (PIVKA-II). Это международное многоцентровое исследование, к которому присоединились несколько больниц в Китае, Сингапуре, Таиланде и Вьетнаме. В когорту последовательно набирали участников, включая здоровых людей, пациентов с ГЦК, метастатическим раком печени, вирусом гепатита B (HBV) и циррозом печени.Все образцы сыворотки собираются перед любым лечением и будут протестированы в одном центре, чтобы уменьшить систематическую ошибку. Образцы сыворотки были протестированы на PIVKA-II, альфа-фетопротеин и биохимические показатели, включая аланинаминотрансферазу (ALT), аспартатаминотрансферазу (AST), гамма-глутамилтрансферазу (GGT), альфа-1-фукозидазу (AFU) и т. Д.
| Гепатоцеллюлярная карцинома | Диагностический тест: ПИВКА-II |
Гепатоцеллюлярная карцинома (ГЦК) является третьей по значимости причиной смерти от рака во всем мире.Ранняя диагностика улучшает прогноз. Белок, индуцируемый антагонистом-II витамина K (PIVKA-II), также известный как дез-γ-карбоксипротромбин (DCP) или акарбоксипротромбин, представляет собой аномальную форму протромбина, вызванную отсутствием витамина K или антагонистом-II. Исследование предназначено для оценки диагностической эффективности белка, вызванного отсутствием витамина К или антагониста-II (PIVKA-II). PIVKA-II как эффективный онкомаркер гепатоцеллюлярной карциномы (ГЦК) широко используется в западных странах, где большинство случаев связано с вирусом гепатита С (ВГС).Однако большинство ГЦК в Китае связаны с ВГВ. Несмотря на широкое применение PIVKA-II в некоторых больницах Китая, диагностическая эффективность, включая чувствительность, специфичность, положительную прогностическую ценность и отрицательную прогностическую ценность, по-прежнему требует дополнительных клинических данных для оценки. Список целей исследования: 1. Определение диагностического порогового значения 2. Оценка диагностической эффективности PIVKA-II 3. Оценка комбинации PIVKA-II и других онкомаркеров для HCC. Это международное многоцентровое исследование, к которому присоединились несколько больниц в Китае, Сингапуре, Таиланде и Вьетнаме.В когорту последовательно набирали участников, включая здоровых людей, пациентов с ГЦК, метастатическим раком печени, ВГВ и циррозом печени. Все образцы сыворотки собираются перед любым лечением и будут протестированы в одном центре, чтобы уменьшить систематическую ошибку. Образцы сыворотки крови были протестированы на PIVKA-II, альфа-фетопротеин (AFP), альфа-фетопротеин L3 и биохимические показатели, включая ALT, AST, GGT, AFU и т. Д. Диагноз ГЦК был основан на гистопатологическом исследовании. На момент анализа все диагнозы ГЦК были подтверждены.Для сравнения непрерывных переменных использовался t-критерий Стьюдента (или критерий Манна-Уитни), а для категориальных переменных — критерий хи-квадрат (или точный критерий Фишера). Кривая характеристики оператора приемника (ROC) использовалась для оценки рабочих характеристик измерений PIVKA-II, AFP, AFP-L3.
Рак печени (гепатоцеллюлярная карцинома) | Johns Hopkins Medicine
Гепатоцеллюлярная карцинома (ГЦК) или рак печени возникает, когда опухоль растет в печени. Он является причиной более 12 000 смертей в год в Соединенных Штатах, что делает его одним из самых серьезных видов рака у взрослых.
Симптомы рака печени
Рак печени часто выявляется во время скрининга на основное заболевание. Пациенты часто жалуются на симптомы, связанные с заболеванием печени, и при обследовании обнаруживается рак.
Если вы испытываете какие-либо из этих симптомов более двух недель, запишитесь на прием к гастроэнтерологу:
Дискомфорт или вздутие живота (увеличение)
Похудание
Желтуха (пожелтение кожи и белков глаз)
Желудочно-кишечное кровотечение (кровотечение)
Тошнота или рвота
Постоянный зуд
лихорадка
Варианты минимально инвазивной хирургии рака печени | Вопросы и ответы с доктором.Цзинь Хэ
Хирург-онколог Джона Хопкинса Джин Он обсуждает, когда операция является подходящим лечением рака печени, предлагаемые минимально инвазивные хирургические варианты, он является идеальным кандидатом для минимально инвазивной хирургии печени и важность лечения в рамках комплексной программы лечения рака.
Диагностика рака печени
Диагностика рака печени начинается со всестороннего медицинского осмотра, во время которого вы описываете свои симптомы и историю болезни.Другие диагностические процедуры включают:
Исследование альфа-фетопротеинов
Альфа-фетопротеин (AFP) — это белок, вырабатываемый печенью плода. Уровень АФП в крови падает почти до нуля к годовалому возрасту.
AFP является онкомаркером, потому что он продуцируется опухолями печени. Высокий уровень АФП может указывать на рак печени. В целом, постоянно повышающийся уровень АФП свидетельствует о раке печени. Если вы страдаете циррозом печени высокого риска (у вас гепатит C, гепатит B или гемохроматоз), ваш врач может захотеть проверять ваш уровень AFP каждые три-четыре месяца.
Ваш врач может также проверить наличие других онкомаркеров. Некоторые маркеры, особенно при использовании в комбинации, обладают повышенной чувствительностью и специфичностью для диагностики ГЦК.
Визуальные тесты
Визуализирующие тесты могут выявить опухоли в печени. Использование различных технологий визуализации позволит создать детальное изображение аномальной области:
Ультразвук использует звуковые волны для создания детального изображения вашей печени.
Компьютерная томография (КТ) — это мощный рентгеновский снимок.
Магнитно-резонансная томография (МРТ) использует магнитные волны.
Ангиография используется, чтобы увидеть внутреннюю часть кровеносных сосудов и органов.
Биопсия печени
Биопсия печени позволяет установить окончательный диагноз, но в этом нет необходимости. Если ваш уровень АФП значительно повышен и ваш врач видит опухоль на снимке, то диагноз может быть поставлен без биопсии.
Если результаты других процедур неясны, ваш врач может назначить биопсию.Во время биопсии ткань печени удаляется и отправляется в лабораторию патологии, чтобы определить, является ли ткань злокачественной.
Ваша медицинская бригада также захочет определить стадию опухоли, которая определяет степень тяжести рака. Поскольку рак печени часто связан с запущенным циррозом, ваш врач определит, насколько далеко цирроз, прежде чем рекомендовать план лечения.
Диагностика и мониторинг рака груди
Leer esta página en español
Ваш врач может назначить анализы крови на рак / онкомаркеры для выявления активности рака в организме.Белки и циркулирующие опухолевые клетки — это два типа маркеров, которые можно измерить. Раковая опухоль часто производит определенный белок в крови, который служит маркером рака. Циркулирующие опухолевые клетки — это клетки, которые отделяются от рака и попадают в кровоток. Белковые маркеры и циркулирующие опухолевые клетки можно измерить с помощью простых анализов крови.
Тесты на маркеры крови могут быть выполнены перед лечением, чтобы помочь диагностировать рак груди и определить, переместился ли он в другие части тела; во время лечения, чтобы оценить, реагирует ли рак; и после лечения, чтобы увидеть, вернулся ли рак (рецидив).
Примеры маркеров, на которые ваш врач может проверить:
- CA 15.3: используется для обнаружения рака груди и яичников
- TRU-QUANT и CA 27.29: могут означать наличие рака груди
- CA125: может сигнализировать о раке яичников, рецидиве рака яичников и рецидиве рака груди
- CEA (карциноэмбриональный антиген): маркер наличия рака толстой кишки, легких и печени.Этот маркер можно использовать, чтобы определить, распространился ли рак груди на другие части тела.
- Циркулирующие опухолевые клетки: клеток, которые отделяются от рака и перемещаются в кровоток. Большое количество циркулирующих опухолевых клеток может указывать на рост рака. Тест CellSearch был одобрен Управлением по контролю за продуктами и лекарствами США для мониторинга циркулирующих опухолевых клеток у женщин с диагнозом метастатический рак груди.
Некоторые врачи используют результаты маркерных тестов как ранние индикаторы прогрессирования рака груди (ухудшение состояния рака) или рецидива.Они могут использовать эту информацию, чтобы принимать решения о том, когда менять терапию — если текущее лечение не работает — или начинать лечение в случае рецидива. Если у вас повышенный маркер, ваш врач может периодически проверять этот маркер, чтобы оценить вашу реакцию на химиотерапию или другие методы лечения.
Хотя тесты на маркеры в крови рака груди многообещающие, они не являются окончательными. Когда тест на маркер крови на рак груди оказывается отрицательным, это не обязательно означает, что вы свободны от рака груди.И не всегда положительный результат означает рост рака. Эти тесты могут помочь в диагностике, но использование онкологических маркеров для обнаружения метастатического рака груди еще не помогло улучшить выживаемость.
При принятии решения о том, следует ли вам пройти тестирование на маркеры крови рака груди, есть несколько вещей, которые вы можете рассмотреть:
- стоимость: тесты могут быть дорогими
- беспокойство: не только из-за повышенного маркера в крови, но и из всех тестов, которые могут вам понадобиться, чтобы выяснить, что вызывает повышение маркера
Поговорите со своим врачом о возможных преимуществах и рисках тестирования маркеров крови в вашей уникальной ситуации.
Эта статья была полезной? Да / Нет Эта статья была полезной?
Последнее изменение 4 ноября 2021 г.


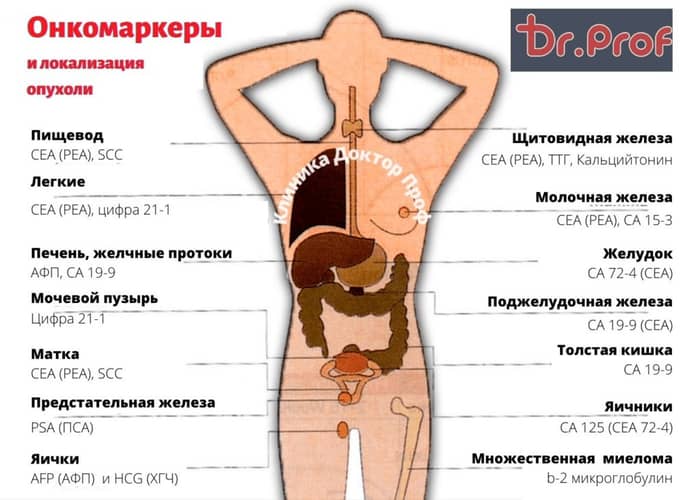




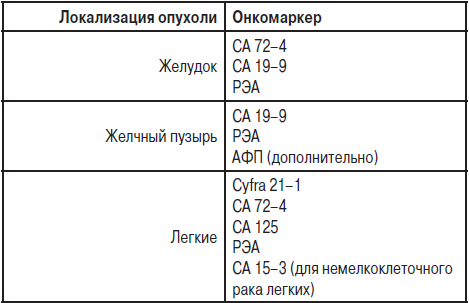

 Он проникает в кровоток только в случае повреждения природных барьеров. Его уровни в крови могут удваиваться во время менструации и при эндометриозе. Значительное повышение уровня СА125 происходит при раке яичников (в 80% случаев) и других органов женской половой системы, опухолях молочной и поджелудочной желез, прямой кишки, желудка легких и печени. Из доброкачественных заболеваний к повышению уровня этого маркера приводят воспалительные заболевания органов женской половой системы, гепатиты, циррозы и аутоиммунные заболевания.
Он проникает в кровоток только в случае повреждения природных барьеров. Его уровни в крови могут удваиваться во время менструации и при эндометриозе. Значительное повышение уровня СА125 происходит при раке яичников (в 80% случаев) и других органов женской половой системы, опухолях молочной и поджелудочной желез, прямой кишки, желудка легких и печени. Из доброкачественных заболеваний к повышению уровня этого маркера приводят воспалительные заболевания органов женской половой системы, гепатиты, циррозы и аутоиммунные заболевания. Из доброкачественных заболеваний к повышению его уровня приводят гепатиты и цирроз, холецистит и муковисцидоз.
Из доброкачественных заболеваний к повышению его уровня приводят гепатиты и цирроз, холецистит и муковисцидоз.