Лабораторные исследования — ГУЗ «Консультативно-диагностическая поликлиника № 2»
Клиническая лабораторная диагностика или, проще говоря, проведение лабораторных исследований – это важный раздел медицины, который является одним из основных направлений деятельности нашего учреждения.
Для чего назначают лабораторные исследования?Во-первых, для постановки диагноза заболевания. Хорошо известно ,что до 70% диагностической информации врачи получают по результатам лабораторных исследований.
Во-вторых, для оценки степени тяжести и динамики развития протекающего заболевания.
В-третьих, для оценки эффективности проводимого лечения.
В-четвёртых, при профилактическом обследовании можно обнаружить факторы риска и прогнозировать вероятность развития тех или иных патологических процессов в организме человека в будущем.
Чем обеспечивается качество результатов исследования в нашем лабораторном отделении?Более 95% исследований проводятся на полностью автоматическом оборудовании. Автоматизация процесса минимизирует возможные ошибки и неточности при выполнении анализа, связанные с «человеческим фактором».
Автоматизация процесса минимизирует возможные ошибки и неточности при выполнении анализа, связанные с «человеческим фактором».
Работа оборудования ежедневно контролируется проведением внутрилабораторного контроля качества исследований с использованием качественных аттестованных контрольных материалов.Наша лаборатория постоянный участник ФСВОК (федеральной системы внешней оценки качества).
В лаборатории трудятся сертифицированные специалисты среднего и высшего медицинского звена. Многие сотрудники имеют многолетний опыт работы и высшие квалификационные категории. 6 врачей являются кандидатами медицинских наук.
По каким направлениям лабораторной медицины можно пройти обследование в лабораторном отделении нашей поликлиники?КоагулограммаКоагулограмма (другое название − гемостазиограмма) – исследование показателей крови, позволяющей судить о работе свертывающей и противосвертывающей системы организма.
Свёртывающая система предотвращает кровопотерю при ранениях и иных повреждениях сосуда, а противосвертывающая контролирует ее работу и препятствует образованию тромбов.
Чаще коагулограмму крови проводят больным, имеющим патологию сердечно-сосудистой системы при назначении антикоагулянтов и оценке риска образования тромбов, перед плановой операцией, в обязательном порядке беременным женщинам.
Для первичной оценки состояния свертывания крови достаточно исследование четырех показателей:Протромбиновое время, которое можно выразить как ПТИ (протромбиновый индекс) или протромбин по Квику, или МНО (Международное нормализованное отношение), фибриноген по Клаусу, АЧТВ (активированное частичное тромбопластиновое время), ТВ (тромбиновое время). Комплексная оценка этих показателей дает врачу возможность оценить риск развития кровотечений (что особенно важно при проведении операций) или тромбообразования, своевременно назначить лекарства и оценить эффект проводимой терапии.
В ряде случаев (например, при тромбозе, выкидыше, отслойке плаценты и т.д.) необходимо провести более детальное исследование, которое включает оценку других показателей, таких как Д-димер и Антитромбин III.
Антитромбин III – это физиологический антикоагулянт, основной компонент противосвертывающей системы. Снижение антитромбина III приводит к увеличению риска развития тромбоза и, как следствие, инфаркта, инсульта.
Д-димер – образуется при разрушении белка тромба фибрина.Диагностически значимым его повышение может является при тромбозе глубоких вен, тромбоэмболии легочной артерии, синдроме ДВС ( диссеминированное внутрисосудистое свёртывание ).Также Д-димер может повышаться при осложненной беременности (с преэклампсией, эклампсией, диабетом и заболеванием почек).
ИммунохимияВесь перечень анализов из раздела «Иммунохимия» проводится на оборудовании, работа которого основана на иммунохемилюминесцентном (ИХЛ) методе. В сравнении с другими иммунохимическими методами диагностики, например ИФА, ИХЛ-метод отличается лучшими аналитическими характеристиками: чувствительностью и специфичностью, что в свою очередь обеспечивает высокую надежность и гарантирует точные результаты.
В данном разделе диагностики выполняется широкий спектр анализов, включающий 45 лабораторных тестов. Среди них: определение антител к возбудителям инфекционных заболеваний, анализ уровня гормонов щитовидной железы и гормонов репродуктивного профиля, оценка концентрации онкомаркеров в крови, а также специфические тесты, проводимые с целью мониторинга беременных.
Помимо вышеперечисленного, лаборатория выполняет современный анализ по определению промозгового натрийуретического пептида, являющегося важным лабораторным маркером сердечной недостаточности.
ГематологияОбщий анализ крови (ОАК) – это совокупность лабораторных исследований, которая назначается практически при любом заболевании человека.
Отличительные особенности проведения ОАК в нашей лаборатории:
-тромбоциты в каждом анализе,
-автоматический подсчёт ретикулоцитов.,
-уникальный для Волгоградской области алгоритм проведения ОАК:
Все поступившие пробы для ОАК проходят скрининг на автоматических анализаторах Advia 2120.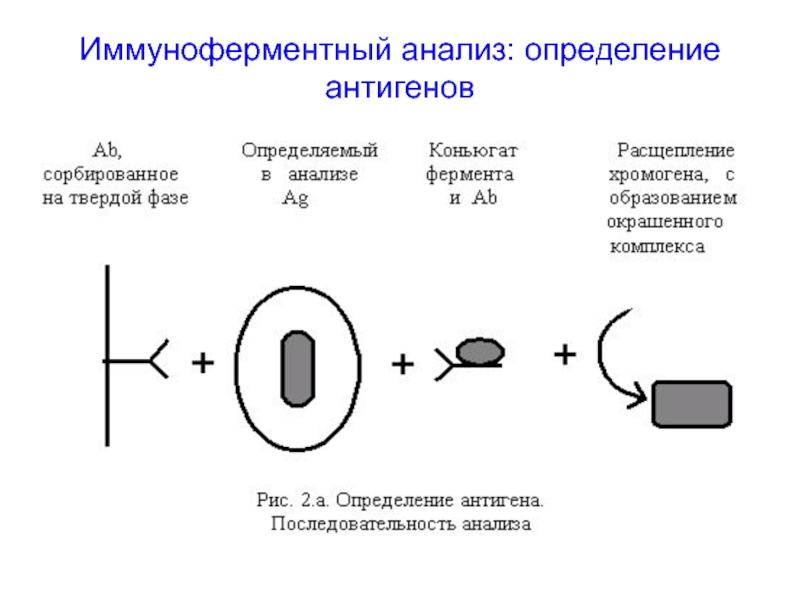 Врач проводит первичный просмотр, отбор проб с помощью регламентированных критериев для назначения микроскопии мазка при получении патологических значений на автоматическом гематологическом анализаторе Advia2120. Мазки для микроскопии приготавливаются с помощью автоматического окрасчикаSP-10. Преимущества автоматизации окраски заключаются в ускорении процесса, стандартизации, высоком качестве получаемых препаратов.
Врач проводит первичный просмотр, отбор проб с помощью регламентированных критериев для назначения микроскопии мазка при получении патологических значений на автоматическом гематологическом анализаторе Advia2120. Мазки для микроскопии приготавливаются с помощью автоматического окрасчикаSP-10. Преимущества автоматизации окраски заключаются в ускорении процесса, стандартизации, высоком качестве получаемых препаратов.
Микроскопия мазков крови осуществляется с помощью уникальных приборов для автоматической визуализации – Цифровая система для морфологического анализа клеток HemaVisionUltimate.Также возможно проведение и ручной световой микроскопии.
БиохимияМеню тестов биохимических автоматических анализаторов составляет 41наименование.С помощью биохимических исследований возможно оценить белковый обмен, функцию печени, поджелудочной железы, почек,, возможна диагностика аутоиммунных заболеваний, определение иммунного статуса.
Отдельно хочется отметить, что для диагностики сахарного диабета мы предлагаем определять гликированный гемоглобин – этот показатель считается более стандартизированным, чем уровень глюкозы натощак.
При изучении липидного обмена мы определяем расширенный спектр показателей, включающий общий холестерин, триглицериды ,липопротеиды высокой плотности, липопротеиды низкой плотности, липопротеин (а),аполипопротеин А, аполипопротеин B.
Для диагностики анемий мы предлагаем определять не только сывороточное железо но и современные маркеры – ферритин и трансферрин.
Оценка состояния клеточного звена иммунитета проводится с использованием проточного цитофлуориметраBeckmanCoulterCytomicsFC500 .
Количественная оценка клеточного звена проводится по относительному и абсолютному содержанию Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-цитотоксических лимфоцитов (CD8+), Т-активированных лимфоцитов (CD3+/HLA-Dr+), В-лимфоцитов (CD19+/CD22+), естественных киллеров (CD16+/CD56+).
Такжепроводится диагностика гемобластозов(лейкозов)с помощью панели ранних, бластных и линейных маркеров диференцировки клеток методом проточной цитометрии. Устанавливается принадлежность к Т-, В-клеточной, миелоидной линии. Материалом исследования, как правило, является пунктат костного мозга.
Иммунный статусКомплекс исследований, включающий:
(ОАК) общий анализ крови,(СОЭ) скорость оседания эритроцитов, субпопуляции лимфоцитов, (ЦИК) циркулирующие иммунные комплексы, фагоцитоз, С3и С4 компоненты комплемента, общие иммуноглобулины классов А, М, G, E, позволяет давать развёрнутую характеристику иммунного статуса человека.
Диагностика аллергииВ лабораторной диагностике аллергических состояний мы используем серологические тесты, выявляющие суммарный уровень IgE (общий IgE) и содержание аллерген-специфических IgE. В лаборатории проводится определение специфических IgE к пищевым аллергенам – 76 наименований, пыльцевым аллергенам (сорные травы – 8, луговые травы – 8, древесные аллергены -14), грибковым аллергенам -8 наименований плесневых грибов, эпидермальным(аллергены домашних животных и птиц)– 12, инсектным(аллергенам насекомых) – 8, клещам домашней пыли – 8, лекарственным – 26 наименований.
По сравнению с кожными пробами (invivo), которые остаются в числе общепринятых методов диагностики аллергий, серологические тесты (invitro) более удобны для пациента, не несут риска осложнений, не требуют отмены антигистаминных препаратов. Согласнорекомендациям Европейской академии аллергологии и клинической иммунологии, серологическое тестирование может быть использовано в любом возрастном периоде, включая детей младшего возраста. Однако IgE в крови присутствуют в низких концентрациях, достаточно быстро выводятся из крови, и их повышенный уровень обычно наблюдается при текущей экспозиции к аллергену. В тканях же ,в частности, в коже, связанные с тучными клетками IgE сохраняются в течение срока жизни клеток — от нескольких дней до нескольких месяцев. С этим могут быть связаны некоторые случаи расхождения результатов серологических тестов и кожных проб при тестировании реактивности к идентичным аллергенам.
Достаточно распространенной патологией верхних дыхательных путей является ринит (насморк) — неспецифическое воспалительное заболевание слизистой оболочки носа.
В нашей лаборатории проводитсяцитологическое исследование назального секрета с подсчетом состава клеточных элементов (риноцитограмма), позволяющее проводить дифференциальную диагностику различных форм ринитов, в частности вазомоторного и аллергического, которая сложна в силу идентичности симптомов, особенно на первых этапах этих заболеваний;оценить выраженность и динамику воспаления слизистой оболочки;оценить качество лечения.
Специфическая диагностика инфекционной патологииЛабораторная диагностика инфекционных заболеваний основана на выявлении либо возбудителя(антигена или его нуклеиновой кислоты), либо антител, специфичных к данному возбудителю.
Количество антител, выраженное в титре или в коэффициенте позитивности помогает диагностировать заболевание, оценивать остроту процесса и эффективность лечения. Об остроте заболевания можно судить по наличию специфических антител класса IgМ, либо по нарастанию титра IgG.Особенно актуально определение антител, когда представляется трудным взятие клинического материала на выявление возбудителя.
В нашей лаборатории для обнаружения возбудителя(антигена) и антител, специфичных к данному возбудителю используются иммунохимические методы (иммунохемилюминесцентный и иммуноферментный).Также для обнаружения возбудителя (нуклеиновой кислоты) используется высокочувствительный ПЦР – анализ.
В заключение нашего краткого обзора хотелось бы сказать следующее:
Общее развитие лабораторной медицины происходит очень быстро!
Наша лаборатория будет расширять спектр предоставляемых услуг!
В 2017 году планируется открытие единого микробиологического центра Волгоградской области!
Следите за новостями!
ИФА диагностика инфекций в Медицинском Комплексе
ИФА диагностика инфекций — распространённый метод иммуноферментного анализа, основан на выявлении в человеческом организме антител и антигенов возбудителя заболеваний. Антигены — вещества, попадающие в организм и включающие ответную реакцию защиты со стороны иммунной системы, усиленно вырабатывающей антитела.
Антигены — вещества, попадающие в организм и включающие ответную реакцию защиты со стороны иммунной системы, усиленно вырабатывающей антитела.
ИФА диагностика исследует реакцию антигенов на внесённые антитела, с высокой точностью помогает определить конкретный микроорганизм, ответственный за появление антигена даже при слабой жизнеспособности вируса. У всех возбудителей собственный набор антигенов, выявляющихся диагностикой, позволяя лечащему врачу определить подозрительные микроорганизмы.
ИФА диагностика инфекций применяется
- Для выявления гормонального статуса человека.
- При подборе антител для инфекционных болезней любого характера.
- При опухолевых заболеваниях и обследованиях на онкомаркеры.
- Для выявления антигенов венерологических и прочих инфекционных заболеваний.
- Для обнаружения аутоиммунных болезней.
Главный недостаток ИФА: результат исследований на присутствие антител не всегда может быть точным при одноразовой проверке.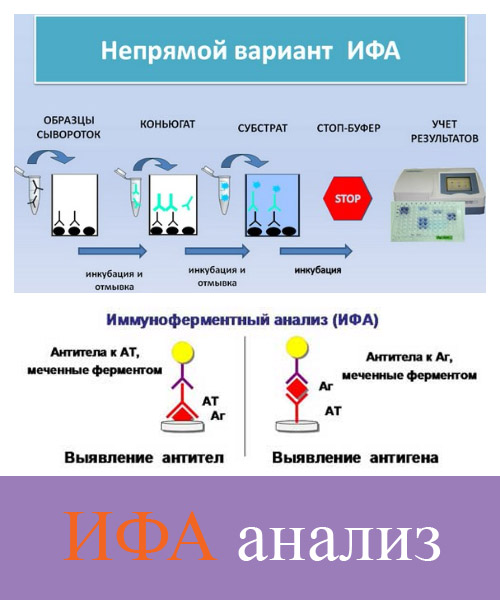 Для уточнения диагноза необходим повторный анализ через полмесяца после первого. ИФА для большей части инфекционных болезней назначается через три недели после начала течения инфекции. Второй недостаток: выявляются антитела, но не сам возбудитель.
Для уточнения диагноза необходим повторный анализ через полмесяца после первого. ИФА для большей части инфекционных болезней назначается через три недели после начала течения инфекции. Второй недостаток: выявляются антитела, но не сам возбудитель.
ИФА диагностика инфекций: преимущества
- Краткий срок проведения исследования, 1-3 дня.
- Высокая чувствительность метода (более 90%).
- Диагностика широкого спектра различных инфекций:
• передаваемых половых путём: хламидиоз, сифилис, микоплазмоз, уреаплазмоз
• вирусных: ВИЧ, гепатиты, цитомегаловирус, герпес, краснуха, корь
• паразитозы: описторхоз, трихинеллез, лямблиоз, токсокароз, эхинококкоз
• клещевого энцефалита
• токсоплазмоза
• боррелиоза
• и прочих. - Лучший способ для выявления антигена возбудителя или для однократного определения уровня антител.
- Возможность определить характер заболевания, отследить динамику процесса, сравнивая количество антител в различные промежутки времени.

- ИФА диагностика поможет в случаях невозможности применения микроскопии или культивирования
- Даёт оценку эффективности ответа иммунной системы организма на внедрение возбудителя.
- Результаты исследований выдаются в качественном и количественном виде.
- Позволяет точно определить стадию заболевания.
- Доступность во многих учреждениях медицины.
Материалами для анализа служат: сыворотка крови, сдаваемая пациентом натощак, спинномозговая жидкость, мазки, содержимое стекловидного тела, слизь из цервикального канала и уретры.
Пройдя ИФА диагностику инфекций в нашей поликлинике, все пациенты будут вовремя оповещены об угрожающих инфекционных заболеваниях и получат лучшие средства для их устранения.
Интермедикал | ИФА паразиты
Анализ крови на паразитов – это информативный метод диагностики паразитов, который повышает эффективность исследования на любые виды паразитов. На сегодняшний день известно более 20 методов исследования на паразитов, большая часть из которых позволяет выявить наличие взрослых особей в организме. Наиболее эффективными методами исследования является сдача крови на паразитов.
На сегодняшний день известно более 20 методов исследования на паразитов, большая часть из которых позволяет выявить наличие взрослых особей в организме. Наиболее эффективными методами исследования является сдача крови на паразитов.
Такой метод диагностики позволяет не только выявить глистов, но и простейших паразитов, что повышает информативность исследования. Для выявления глистов у детей применяется микроскопический метод исследования.
Какой метод исследования пройти, зависит от общих показаний и симптомов и, как правило, определяется врачом.
Паразиты – это большая группа простейших существ, которые обитают в организме хозяина и не способны на самостоятельное существование. К этой группе относится более 700 видов разных существ, которые атакуют человека ежедневно. Некоторые паразиты, такие как глисты, обитают преимущественно в кишечнике человека, но есть такие паразиты, которые могут жить в лимфатических сосудах (простейшие), на коже (клещи, клопы), гельминты, поражающие внутренние органы и ткани. Все эти паразиты разрушают организм изнутри и влияют на его работу.
Все эти паразиты разрушают организм изнутри и влияют на его работу.
Трудности в постановке диагноза обусловлены тем, что не все гельминты имеют характерное клиническое появление.
В некоторых случаях паразитная инвазия скрывается за симптомами других заболеваний, что усложняет диагностику и своевременное лечение. Для каждого типа паразитных микроорганизмов есть конкретный вид диагностики, но когда определить точно, что именно является причиной плохого самочувствия невозможно, применяются универсальные методики.
Иммуноферментный анализ на паразитов (сокращенно ИФА) — лабораторный иммунологический тест, который использует антитела и их способность менять цвет, может диагностировать широкий круг инфекционных заболеваний, вызванных паразитами, выяснить присутствие онкологических маркеров различного происхождения, определять наличие гормонов, пептидов и белков при диагностике репродуктивной способности человека. Сейчас большой популярностью пользуется анализ крови на лямблии. Такие диагностические исследования также используются в качестве аналитического инструмента в области биомедицинских исследований для выявления количественной оценки специфичных антигенов в лабораторном образце.
Такие диагностические исследования также используются в качестве аналитического инструмента в области биомедицинских исследований для выявления количественной оценки специфичных антигенов в лабораторном образце.
Иммуноферментный анализ и его использование
Метод ИФА не стоит путать со способом дуоденального зондирования и анализом кала, которые проводятся при помощи микроскопических мероприятий и ставят перед собой цель обнаружить глистные инвазии, микроскопических паразитов или их остатки, яйца и личинки в отобранном или сданном образце фекалии.
Анализ кала может диагностировать наличие гельминтов, паразитирующих не только в кишечнике, но и в печени, желчевыводящих путях, поджелудочной железе и двенадцатиперстной кишке. В данном случае правдивость теста прежде всего зависит от внимательности и квалификации сотрудников лаборатории, возможностей лабораторного оборудования.
Если вредитель не выполнил кладку яиц в период проведения теста и присутствует у человека в минимальном количестве, его наличие сложно определить, даже при особой внимательности лаборанта.
В последние годы в арсенале лаборантов появился новый, более современный метод иммунологического исследования. Он позволяет по крови больного обнаружить присутствие антигенов и антител к паразитам разных типов. Точность тестов зависит от:
- типа паразита;
- его активности к размножению;
- концентрации в организме.
На чем основан иммуноферментный анализ?
Иммуноферментный анализ использует основы фундаментальной иммунологии и концепцию связывания антигена с его специфическими антителами. Он состоит из 2-х различных составляющих:
- иммунного ответа;
- ферментативной реакции.
Иммунный рефлекс может связывать биологические молекулы, части клетки и микроорганизмы, которые необходимо обнаружить в ходе проведения теста, а ферментативная реакция позволяет визуально оценить и измерить показатели этой реакции.
Другими словами, иммунная реакция является частью сложной методики, которая прямым образом может обнаружить искомый микроб в отобранном образце. А ферментативная реакция — частью, позволяющей перевести полученный результат в форму, которую можно оценить глазом и измерить при помощи доступной биохимической методики.
Что такое иммунная реакция, и как выяснить узнаваемость антигена?
Иммунная реакция — процесс связывания антигена с антителом. В результате реакции образуется иммунный комплекс. Антигены — сложные структуры, которые живут на поверхности клетки и несут в себе сведения о клетке. Антигены у людей индивидуальны, они схожи у различных людей, но всегда отличаются и не имеют копий.
Узнаваемость антигена основана на свойстве клетки распознавать свои и чужеродные клетки ИС. Когда иммунная клетка соединяется с опасной, образуется чужеродная клетка. На поверхности чужеродной клетки образуется антиген, не совпадающий с тем, который присутствовал в памяти здоровой клетки. Когда клетка обнаруживает чужой антиген, она запускает процесс уничтожения подозрительного объекта. Точность иммунологического распознания составляет в среднем 99,97%.
Антитело: какое это вещество, его виды
Антитело — динамичная молекула, которая располагается на теле иммунной клетки. Антитело может соединяться с антигенами опасной клетки и передавать сведения в тело клетки для распознавания своей и чужой клетки. При обнаружении своей клетки антитело убивает связь с антигеном и высвобождает клетку.
В природе выявлено пять классов антител, именуемых также белковыми структурами или иммуноглобулинами. Все типы антител имеют способность связываться с различными антигенами в различных частях организма. Антитела именуются знаками латинского алфавита — A, M, G, D и E и в анализах тестов обозначаются следующими буквенными символами: IgA, IgM, IgG, IgD и IgE.
Как проводится тест ИФА на паразиты?
Иммуноферментный анализ крови на паразитов проводится путем сдачи венозной крови из локтевой вены в сухую стерильную пробирку. Для получения достоверной информации тестов из вены отбирается от 3 до 5 мл образца. У новорожденных младенцев анализ крови на глисты и лямблии рекомендуется проводить из сохранившейся плаценты или пуповинной вены и отбирать пуповинную кровь.
Перед сдачей крови пациентам рекомендуется воздержание от принятия еды на срок 8 часов, исключить из употребления алкоголь, газированные напитки, прием лекарственных и антибактериальных препаратов.
Расшифровка и описание результатов ИФА
При иммуноферментном анализе крови на гельминты, лямблии, глисты и другие паразиты расшифровка результатов устанавливает наличие в организме различных видов антител (иммуноглобулинов) и антигенов — паразитов и продуктов их жизнедеятельности.
Расшифровка при иммуноферментном анализе крови может быть представлена в табличном виде и внутри себя содержать следующие стандартизованные значения классов антител:
- Ig M (-), Ig G (-), IgA (-) — отрицательный результат иммунитета к инфекции;
- IgM (-), IgG (+), IgA (-) — присутствие поствакционного (постинфекционного) иммунитета;
- IgM (+), IgG (-/+), IgA (-/+) — диагностирование острой инфекции;
- IgM (+), IgG (+), IgA (+) — диагностирование обострения хронической инфекции;
- IgM (-), IgG (+/-), IgA (+/-) — присутствие хронической инфекции;
- IgM (-) — полное выздоровление.
В иммуноферментном анализе крови в расшифровке знак (+) обозначает положительный результат, а знак (-) — отрицательное значение.
Кроме уточнения классов антител иммуноферментный анализ крови в расшифровке может иметь количественные, цифровые целые или дробные показатели антител. Обширное объяснение значений больному может по требованию предоставить только лечащий врач.
Многократное проведение тестов и исследование наличия и концентрации антител различных классов в некоторых случаях позволяет врачу выяснить стадии инфекционного процесса: начальную, активную, хроническую или запущенную.
Анализ крови или анализ кала: что лучше?
Положительный тест в этом случае ложным не бывает, а вот ложно-отрицательный встречается достаточно часто, так как цисты могут быть не замечены в ходе микроскопического теста.
Помимо анализа кала, можно выявлять анализ крови на паразитов, считающийся более чувствительным. Такой анализ крови позволяет вести поиск не самих паразитов в отобранном материале, а обнаружить присутствие антител и антигенов, которые появились в результате паразитирующей деятельности паразитов.
Положительный результат теста свидетельствует о присутствии паразитов в организме или же сообщать о только что перенесенном инфицировании.
Какой из анализов лучше: иммуноферментный или дуоденальный? На данный вопрос однозначного ответа нет. Лучшим считается тот анализ, который дает положительный результат, а именно обнаруживает присутствие инфекции в организме.
Лабораторное оборудование для иммуноферментного анализа импортного и российского производства
Главная→ Каталог→ Аналитическое оборудование→ ИФА иммуноферментный анализ
Все категории (2)Оборудование иммуноферментного анализа (ИФА) для лабораторий
Иммуноферментный анализ (ИФА, англ. ELISA — enzyme-linked immunosorbent assay) или лабораторное исследование ИФА — это иммунологический метод качественного либо количественного определения низкомолекулярных соединений, а также макромолекул и микроорганизмов. Лабораторная диагностика методом ИФА основана на специфической реакции антиген-антитело. Теоретические основы иммуноферментного анализа опираются на иммунохимию и химическую энзимологию и на физико-химические закономерности реакции антиген-антитело. Существует огромное количество вариантов этого метода. Исходя из этого, оборудование для ИФА отличается большим разнообразием. По одним только вариантам регистрации ферментативной активности существует несколько видов методов: фотометрические, флуорометрические, био- и хемолюминесцентные, электрохимические и микрокалориметрические, которые нуждаются в соответствующем оборудовании ИФА диагностики.
ИФА — наиболее активно развивающиеся направление химической энзимологии. Оборудование иммуноферментного анализа — это устройства и аппараты для иммунологической диагностики антигенов и антител. Приборы ИФА включают в себя планшетные шейкеры и планшетные фотометры, термошейкеры и мультиплексные иммуноанализаторы, а также вошеры, или промыватели планшетов. В нашей компании вы можете подобрать и купить качественное ИФА-оборудование для лабораторий. Мы гарантируем, что используя наши приборы, вы сможете вывести лабораторные исследования методом ИФА на новый уровень. Они смогут повысить точность и в то же время значительно ускорить процесс работы.
Anti-HCV, антитела, ИФА
Anti-HCV – специфические иммуноглобулины классов IgM и IgG к белкам вируса гепатита С, свидетельствующие о возможной инфицированности или ранее перенесенной инфекции.
Синонимы русские
Суммарные антитела к вирусу гепатита С.
Синонимы английские
Antibodies to Hepatitis C Virus, IgM, IgG; HCVAb, Total.
Метод исследования
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Вирус гепатита С (ВГС) – РНКсодержащий вирус из семейства Flaviviridae, который поражает клетки печени и вызывает гепатит. Он способен размножаться в клетках крови (нейтрофилах, моноцитах и макрофагах, В-лимфоцитах) и ассоциирован с развитием криоглобулинемии, болезни Шегрена и В-клеточных лимфопролиферативных заболеваний. Среди всех возбудителей вирусных гепатитов у ВГС наибольшее количество вариаций, а благодаря высокой мутационной активности он способен избегать защитных механизмов иммунной системы человека. Существует 6 генотипов и множество субтипов вируса, которые имеют разные значения для прогноза заболевания и эффективности противовирусной терапии.
Основной путь передачи инфекции – через кровь (при переливании элементов крови и плазмы, пересадке донорских органов, через нестерильные шприцы, иглы, инструменты для татуирования, пирсинга). Вероятна передача вируса при половом контакте и от матери ребенку во время родов, но это происходит реже.
Острый вирусный гепатит, как правило, протекает бессимптомно и остается невыявленным в большинстве случаев. Только у 15 % инфицированных заболевание протекает остро, с тошнотой, ломотой в теле, отсутствием аппетита и потерей веса, редко оно сопровождается желтухой. У 60-85 % зараженных развивается хроническая инфекция, что в 15 раз превышает частоту хронизации при гепатите В. Для хронического вирусного гепатита С характерна «волнообразность» с повышением печеночных ферментов и слабовыраженными симптомами. У 20-30 % больных заболевание приводит к циррозу печени, увеличивая риск развития печеночной недостаточности и гепатоцеллюлярной карциномы.
Специфические иммуноглобулины вырабатываются к ядру вируса (нуклеокапсидному белку core), оболочке вируса (нуклеопротеинам Е1-Е2) и фрагментам генома вируса гепатита С (неструктурным белкам NS). У большинства больных ВГС первые антитела появляются через 1-3 месяца после инфицирования, но иногда могут отсутствовать в крови больше года. В 5 % случаев антитела к вирусу так никогда и не обнаруживаются. При этом о ВГC будет свидетельствовать выявление суммарных антител к антигенам вируса гепатита С.
В острый период болезни образуются антитела классов IgM и IgG к нуклеокапсидному белку core. В период латентного течения инфекции и при ее реактивации в крови присутствуют антитела класса IgG к неструктурным белкам NS и нуклеокапсидному белку core.
После перенесенной инфекции специфические иммуноглобулины циркулируют в крови 8-10 лет с постепенным снижением концентрации или сохраняются пожизненно в очень низких титрах. Они не защищают от вирусной инфекции и не снижают риска повторного заражения и развития заболевания.
Для чего используется исследование?
- Для диагностики вирусного гепатита С.
- Для дифференциальной диагностики гепатитов.
- Для выявления ранее перенесенного вирусного гепатита С.
Когда назначается исследование?
- При симптомах вирусного гепатита и повышении уровня печеночных трансаминаз.
- Если известно о перенесенном гепатите неуточненной этиологии.
- При обследовании людей из группы риска по заражению вирусным гепатитом С.
- При скрининговых обследованиях.
Что означают результаты?
Референсные значения
Результат: отрицательный.
Отношение S/CO (signal/cutoff): 0 — 1.
Причины anti-HCV положительного результата:
- острый или хронический вирусный гепатит С;
- ранее перенесенный вирусный гепатит С.
Причины anti-НСV отрицательного результата:
- отсутствие вируса гепатита С в организме;
- ранний период после инфицирования;
- отсутствие антител при вирусном гепатите С (серонегативный вариант, около 5 % случаев).
Что может влиять на результат?
- Ревматоидный фактор в крови способствует ложноположительному результату.
ELISA
Скачать.pdfСодержание
— Введение
— Растворы
— Сорбция антител на поверхность подложки
— Блокировка
— Инкубация с антигеном
— Инкубация с антителами, конъюгированными с пероксидазой хрена
— Проведение ферментативной реакции
— Остановка ферментативной реакции
Введение
Иммуноферментный анализ «сэндвич» типа («сэндвич»-ИФА) — лабораторный иммунологический метод выявления антигенов. Общая схема проведения метода заключается в следующем. На твердой фазе адсорбированы антитела к исследуемому антигену. После инкубации исследуемого материала и образования комплекса «антитело — антиген» проводится удаление несвязавшихся компонентов, добавляется конъюгат, т.е. антитела к искомому антигену, меченые ферментом. По завершении инкубации, с последующим удалением непрореагировавшего коньюгата промывкой, образуется комплекс, в котором антиген как бы заключен между двумя слоями антител. Наличие меченных ферментом антител определяется при помощи соответствующего субстрата.
Растворы
Буфер для иммобилизации
20 мМ Na2CO3
Проверить pH и довести до pH 9,6
Буфер для блокировки
150 мМ NaCl
10 мМ Na2HPO4
1 мг/мл альбумина быка (BSA)
Проверить pH и довести до pH 7,5
Буфер для промывки (PBST)
150 мМ NaCl
10 мМ Na2HPO4
0,2% Tween-20
Проверить pH и довести до pH 7,5
Буфер для промывки (PBST)
150 мМ NaCl
10 мМ Na2HPO4
0,2% Tween-20
Проверить pH и довести до pH 7,5
Буфер для разведения (PBS)
150 мМ NaCl
10 мМ Na2HPO4
Проверить pH и довести до pH 7,5
Сорбция антител на поверхность подложки
В лунки 96-ти луночного планшета для проведения иммуноанализа добавьте 100 мкл буферного раствора для иммобилизации, содержащего антитела. Мы рекомендуем использовать конечную концентрацию антител для иммобилизации в диапазоне 5-10 мкг/мл. Проведите инкубацию в течение 2 часов при комнатной температуре и постоянном перемешивании на горизонтальном шейкере для планшетов, либо в течение ночи при +4℃. Для удаления несвязавшихся антител, промойте 1 раз планшет буферным раствором для промывки (PBST)
Блокировка
Для блокировки мест неспецифичного связывания в лунки планшета внесите по 200 мкл буферного раствора для блокировки. Проведите инкубацию в течение 30-40 минут при комнатной температуре и постоянном перемешивании. Проведите отмывку раствором PBST 3 раза.
Инкубация с антигеном
В лунки планшета внесите по 50-100 мкл исследуемого раствора, либо стандартных разведений антигена. И исследуемый раствор, и стандартные разведения антигена необходимо вносить попарно, используя по две лунки на каждое разведение белка. Проведите инкубацию при комнатной температуре в течение 60 минут при постоянном перемешивании. Для удаления несвязавшегося антигена, проведите отмывку планшета раствором PBST 3 раза.
Инкубация с антителами, конъюгированными с пероксидазой хрена
В лунки планшета внесите по 100 мкл раствора специфичных антител, конъюгированных с ферментной меткой. Оптимальная концентрация большинства конъюгированных антител производства ООО фирмы «Имтек» составляет 0,1 мкг/мл. Проведите инкубацию при комнатной температуре в течение 60 минут при постоянном перемешивании. Для удаления несвязавшихся конъюгированных антител, проведите отмывку планшета раствором PBST 5-6 раза.
Проведение ферментативной реакции
В лунки планшета вносят по 100 мкл раствора субстрата (ТМБ) и инкубируют в течение 5-10 минут при комнатной температуре и постоянном перемешивании, в защищенном от света месте до появления в лунках синего окрашивания разной интенсивности
Остановка ферментативной реакции
Остановка реакции проводится добавлением в каждую лунку планшета по 50 мкл 0,5М серной кислоты. Окраска стабильна в течение 30 мин
Измерение оптической плотности
Оптическая плотность раствора окрашенного продукта измеряется при длине волны 450 нм с использованием планшетного спектрофотометра
Анализы на скрытые инфекции методами ПЦР и ИФА
Иммуноферментный анализ (ИФА)
Иммуноферментный анализ (ИФА) — это метод лабораторной диагностики, заключающийся в выявлении специфических (индивидуальных для каждого микроорганизма, вируса) антител.
Антитела (иммуноглобулины, Ig) — специфические белки-защитники, вырабатываемые лейкоцитами (белыми кровяными тельцами) в ответ на появление в организме чужеродного генетического материала (вирусов, бактерий, простейших).
Иными словами, результат иммуноферментного анализа (ИФА) показывает не факт наличия инфекционного агента (инфекции) в организме, а состояние иммунитета к этому инфекционному агенту.
Таким образом, на основании результатов исследования крови методом ИФА можно лишь опосредованно (косвенно) судить о наличии /отсутствии инфекционного агента (вирусов, бактерий, простейших) по ответной реакции на него иммунной (защитной) системы организма.
В зависимости от срока давности существования в организме человека вирусов, бактерий, простейших вырабатываются антитела классов А, M, G (IgА, IgM, IgG).
Антитела классов А, M, G свидетельствуют о свежем, недавнем или давно существующем заражении соответственно.
По комбинации количественных показателей антител данных классов можно судить об обострении или снижении активности хронического инфекционного процесса, или повторном заражении.
Данная информация представляет в гинекологии и дерматовенерологии известную ценность, позволяя ответить на вопрос «кто кого заразил?» и подобрать лечение в зависимости от длительности инфекционного процесса.
Исследование крови методом ИФА в гинекологии широко используют для диагностики микоплазмоза, уреаплазмоза, трихомоноза, гарднереллеза, гонореи, TORCH-инфекций (токсоплазмы, краснухи, цитомегаловирусной инфекции и герпеса).
В случае низкой иммуногенности инфекционного агента (инфекции) либо недостаточной активности иммунной системы выработка антител (иммуноглобулинов классов А, M, G) может отсутствовать или быть диагностически незначимой при фактическом (реальном) наличии инфекционного агента (инфекции) в организме по данным полимеразной цепной реакции (ПЦР).
Слабой иммуногенностью (способностью существовать незаметно для иммунной системы) обладают микоплазмы, уреаплазмы, трихомонада.
Результаты иммуноферментного анализа (ИФА) в ряде случаев могут быть ложноположительными, т.е. при фактическом отсутствии инфекционного агента (инфекции) в организме иммуноферментный анализ (ИФА) определяет наличие антител к нему.
Высокая частота ложноположительных реакций часто отмечается при диагностике методом ИФА трихомоноза (трихомониаза).
Низкой иммуногенностью инфекционного агента (бактерий, вирусов, простейших) и индивидуальными особенностями иммунитета человека объясняется кажущееся противоречие результатов ИФА и ПЦР, при котором исследование методом ИФА не находит инфекцию, а метод ПЦР свидетельствует о наличии инфекции в организме.
Таким образом, диагностика инфекционных заболеваний, включая инфекции, передаваемые половым путем (анализ на скрытые инфекции), требует комплексной (совокупной) оценки результатов нескольких диагностических методов.
Иммуноферментный анализ (ИФА) позволяет выявить специфические белки, возникающие в организме человека при наличии онкологического процесса — так называемые онкомаркеры.
Полимеразная цепная реакция (ПЦР)
ПЦР (полимеразная цепная реакция, ПЦР-анализ) — это метод лабораторной диагностики различных вирусов, бактерий, простейших на основании выявления их генетического материала (РНК и ДНК) в исследуемом биологическом материале: в крови, слюне, эякуляте (сперме), моче, выделениях из половых путей, мазках, соскобах и т.д.
В основе метода ПЦР лежит многократное удвоение типоспецифического (т.е. характерного для конкретного микроорганизма) участка РНК или ДНК, вследствие чего нарабатывается достаточное для точной идентификации данного микроорганизма количество РНК или ДНК.
Метод ПЦР является молекулярно-генетическим методом исследования.
В настоящее время полимеразная цепная реакция (ПЦР) является самым точным и чувствительным методом диагностики скрытых инфекций (инфекций, передаваемых половым путем) и иных инфекционных заболеваний после культурального исследования (посева на среду).
Таким образом, результаты исследования методом ПЦР свидетельствуют о наличии/отсутствии непосредственно инфекционного агента (вирусов, бактерий, простейших) в исследуемом органе (образце клеток, ткани).
Основным преимуществом метода ПЦР является высокая чувствительность и специфичность, т.е. способность определить возбудителя заболевания при наличии в пробе всего нескольких молекул его ДНК или РНК. Поэтому возможным становится обнаружение возбудителей заболеваний (в том числе скрытых инфекций) даже в тех случаях, когда другими методами их выявление не возможно.
Специфичность ПЦР (т.е. способность безошибочно определить данный вирус, бактерию) близка к 100%, что значительно превышает возможности микроскопии, иммуноферментного анализа (ИФА).
По этой причине исследование методом ПЦР нашло широкое применение в практике врачей Курортной клиники женского здоровья при экспертном выявлении скрытых инфекций: хламидиоза, микоплазмоза, уреаплазмоза, трихомоноза, бактериального вагиноза, вирусов папилломы человека и других вялотекущих либо скрыто существующих инфекций.
Следует учитывать, что результат ПЦР-исследования распространяется лишь на орган (ткань), клеточный материал которого с помощью мазка-соскоба забирается на исследование.
Это вносит известные ограничения, не позволяющие в ряде случаев судить о распространенности процесса. Например, выявление хламидий в канале шейки матки не позволяет утверждать присутствие хламидий в маточных трубах, ткани яичников, суставах, легких и иных органах и тканях.
Таким образом, метод ПЦР (ПЦР-анализ) отличается высокой информативностью и достоверностью относительно инфицирования (заражения) конкретного органа (участка ткани), а метод ИФА косвенно показывает распространенность процесса и возможную вовлеченность в инфекционный процесс органов и тканей, недоступных для прямой диагностики.
Методы ИФА и ПЦР взаимо дополняют друг друга. В рутинной (повседневной) практике Курортной клиники женского здоровья мы применяем все методы исследования для быстрой, достоверной диагностики.
Забор крови и мазков с целью проведения исследований методами ИФА и ПЦР в Курортной клинике женского здоровья осуществляют профессионально подготовленные акушерки, прошедшие специализацию по лабораторной диагностике. Забор крови и мазков выполняется безболезненно и в комфортных условиях.
Особенности диагностики инфекций, передаваемых половым путем (скрытых инфекций), и условия подготовки к исследованиям подробно изложены на нашем сайте в соответствующих статьях.
Мы в полном Вашем распоряжении при возникновении любых сомнений или пожеланий.
Мы работаем без выходных и праздничных дней:
понедельник — пятница с 8.00 до 20.00,
суббота, воскресенье, праздничные дни с 8.00 до 17.00.
Прием по предварительной записи по многоканальному телефону 8 (800) 500-52-74 (звонок по России бесплатный), или +7 (928) 022-05-32, или [email protected].
Вопросы и ответы
Вопрос: Анализ ИФА, что это в гинекологии?
Ответ: Иммуноферментный анализ (ИФА) — это метод лабораторной диагностики, заключающийся в выявлении специфических (индивидуальных для каждого микроорганизма, вируса) антител.
На основании результатов исследования крови методом ИФА можно лишь опосредованно (косвенно) судить о наличии /отсутствии инфекционного агента (вирусов, бактерий, простейших) по ответной реакции на него иммунной (защитной) системы организма.
Вопрос: Хламидиоз в крови как выявить?
Ответ: Хламидиоз в крови можно выявить методом иммуноферментного анализа (ИФА). Иммуноферментный анализ позволяет определить в крови антитела классов A, M, G к хламидии. Чувствительность выявления хламидий методом ИФА (точность метода) составляет 50-60%.
Иными словами, иммуноферментный анализ (ИФА) позволяет определить в крови наличие антител (иммуноглобулинов (Ig) классов А,М,G) к хламидии. Специфические иммуноглобулины классов A, M, G вырабатываются организмом в ответ на свежее (Ig A), недавнее (Ig M) появление хламидий и длительное (Ig G) носительство хламидий.
Вопрос: Анализ ПЦР положительный после лечения. Как такое может быть?
Ответ: Положительный ПЦР после лечения свидетельствует о наличии ДНК возбудителя инфекции: вируса или бактерии. При этом, если ПЦР-мазок был взят ранее, чем через 30 дней после последнего приема антибиотиков, положительный анализ ПЦР может свидетельствовать о выявлении мертвых бактерий или вирусов.
Положительный анализ ПЦР после 30 дней с момента окончания лечения свидетельствует о сохранении инфекции и устойчивости инфекции к лечению, то есть о необходимости продолжить лечение.
Вопрос: ПЦР анализ, что это такое?
Ответ: ПЦР (полимеразная цепная реакция, ПЦР-анализ) — это метод лабораторной диагностики различных вирусов, бактерий, простейших на основании выявления их генетического материала (РНК и ДНК) в исследуемом биологическом материале: в крови, слюне, эякуляте (сперме), моче, выделениях из половых путей, мазках, соскобах и т.д.
Результаты исследования методом ПЦР свидетельствуют о наличии/отсутствии непосредственно инфекционного агента (вирусов, бактерий, простейших) в исследуемом органе (образце клеток, ткани).
Иммунофлуоресцентный тест — обзор
2.3 Тельца Кахаля и ядерные спеклы: биогенез, созревание и хранение snRNP
Иммунофлуоресцентные анализы раскрыли каждый из пяти сплайсинговых snRNP пре-мРНК в ядерных фокусах (Carmo-Fonseca et al., 1991), особенно в свернутых кольцами телах или телах Кахала (Carmo-Fonseca, Pepperkok, Carvalho, & Lamond, 1992), которые помечены маркером coilin (рис. 5, стрелки). Локализация мяРНК в спиральных тельцах зависит от транскрипции (Carmo-Fonseca et al., 1992). Помимо расположения свернутого тела, пятнистый паттерн распределения был приписан snRNAs U1 и U2 (Huang & Spector, 1992). Сходным образом, не-snRNP вспомогательный фактор сплайсинга SC35 был идентифицирован по пятнистой картине окрашивания в субядерных структурах, ранее описанных как межхроматиновые гранулы (Spector, 1993). Пятнистый узор межхроматиновых гранул обычно назвал их пятнами, что видно на фиг. 5 и помечено маркером SC35. Индуцированная разборка этих гранул, как было показано, изменяет координацию между транскрипцией и сплайсингом пре-мРНК (Sacco-Bubulya & Spector, 2002).Предыдущие и дополнительные исследования показали, что сплайсинг пре-мРНК происходит в сайтах транскрипции, определенных как фибриллы перихроматина (Bachellerie, Puvion, & Zalta, 1975), но не в крапинках (Zhang, Taneja, Singer, & Green, 1994). Эти выводы были основаны на быстром мечении тритием (Bachellerie et al., 1975), характеристике фибрилл перихроматина, указывающей на присутствие возникающих РНК (обзор Spector, 1993).
Рис. 5. Ядерные тельца, важные для сплайсинга пре-мРНК, о чем свидетельствует окрашивание на ламин B (ядерная пластинка), коилин (тельца Кахаля, стрелки) и белок SR SC35 (крапинки).Клетки HEK293 культивировали в минимальной необходимой среде Дульбекко (DMEM) с добавлением 10% фетальной бычьей сыворотки, 1 мМ пирувата натрия, 2 мМ глутамина, пенициллина и стрептомицина, менее 5% диоксида углерода и 37 ° C. Клетки фиксировали в метаноле при -20 ° C в течение 5 минут, проницаемость в 0,3% Triton X-100 в течение 20 минут, затем 20 минут в 0,1 М глицине и блокирование в 5% нормальной сыворотке осла в течение 1 часа. Первичные (мышиные моноклональные антитела против SC35, Abcam, Кембридж, Массачусетс, США; мышиные моноклональные антитела против коилина, Abcam; и козьи поликлональные антитела против ламина B, Santa Cruz Biotechnologies, Санта-Крус, Калифорния, США) и Alexa 488- или инкубации вторичных антител, конъюгированных с Alexa 594, проводились в течение 1 часа каждая.Все промывки были в PBS, а разведения антител были в 5% нормальной ослиной сыворотке и 0,1% Triton X-100. После окончательной промывки предметные стекла помещали в среду, содержащую DAPI (Invitrogen, Carlsbad, CA), и герметизировали после помещения на предметное стекло. Изображения получали в конфокальном микроскопе LSM 880 (Carl Zeiss, Германия).
SnRNP изначально собираются в цитоплазме. Каждая мяРНК перемещается в цитоплазму, где она взаимодействует с белком SMN (Fischer, Liu, & Dreyfuss, 1997), который экспрессируется геном SMN1 , гомозиготным у пациентов со спинальной мышечной атрофией (SMA, OMIM # 253300; обзор Wood, Talbot, & Bowerman, 2017).SMN играет центральную роль в биогенезе snRNP. После своего синтеза в цитоплазме белок SMN собирает комплекс, содержащий гептамерное кольцо белков Sm, расположенное вокруг каждой мяРНК (Friesen & Dreyfuss, 2000), на котором другие белки будут связываться с образованием мяРНП, которое будет транспортироваться в ядро (Renvoise и др., 2006). Похоже, что мяРНП сначала направляются в тельца Кахаля, где мяРНК модифицируются с помощью псевдоуридинилирования и метилирования. Все еще в тельцах Кахала snRNPs завершают созревание (Nesic, Tanackovic, & Kramer, 2004) и затем направляются в пятнышки (Sleeman & Lamond, 1999) под контролем фосфорилирования (Misteli & Spector, 1996).Тельца Кахаля дополнительно показаны как место сборки и рециклинга частиц tri-snRNP (Stanek et al., 2008). Следовательно, тельца Кахаля представляют собой центр созревания и распределения snRNPs в ядре клетки, тогда как спеклы эквивалентны хранению snRNP для дальнейшего распределения в фибриллах перихроматина при инициации транскрипции. Хотя SMN экспрессируется повсеместно и необходим для сборки snRNP, пока не ясно, почему его потеря специфически влияет на двигательные нейроны (обзор Wood et al., 2017). Хотя он может играть разные функциональные роли, особенно в аксонах нейронов, интересно отметить, что его потеря функции значительно увеличивает удержание интронов в зрелой мРНК (Jangi et al., 2017), что согласуется с его значимостью в биогенезе мяРНП.
Непрямой иммунофлуоресцентный анализ (IFA) — LabCE.com, Лаборатория непрерывного образования
IFA — один из двух наиболее часто используемых тестов для ANA. Обычно клетки HEp-2 используются в качестве субстрата для обнаружения антител в сыворотке крови человека.Клетки HEp-2 в настоящее время являются одними из наиболее распространенных субстратов для обнаружения ANA с помощью IFA. Предметные стекла микроскопа покрыты клетками HEp-2, и сыворотка инкубируется с клетками. Если антитела присутствуют, они будут связываться с антигенами на клетках, а в случае ANA антитела обычно связываются с ядром. Связывание визуализируют путем добавления флуоресцентно меченного антитела против человека, которое связывается с антителами. Обычно флуоресцеинизотиоцианат (FITC) используется в качестве флуоресцентного маркера вторичного антитела.Связанный комплекс будет флуоресцировать на определенной длине волны света, которую можно увидеть под микроскопом. В зависимости от антитела, присутствующего в сыворотке крови человека, и локализации антигена в клетке, на клетках HEp-2 будут видны различные паттерны флуоресценции.
В положительных образцах ядра клеток будут демонстрировать яркую яблочно-зеленую флуоресценцию с рисунком окрашивания, характерным для конкретного распределения ядерного антигена в клетках. Если образец отрицательный на АНА, в ядре не будет четко различимой картины ядерной флуоресценции.Цитоплазма может демонстрировать слабое окрашивание, в то время как нехромосомная область митотических клеток демонстрирует более яркое окрашивание.
Уровни антител анализируются путем разбавления образца сыворотки и отражаются в виде титра. Это самое высокое разведение сыворотки, при котором аутоантитела еще обнаруживаются. В зависимости от лаборатории и конкретного используемого метода титр ANA обычно считается отрицательным, если он меньше или равен 1:40. Титр, равный или меньший 1:80, часто считается пограничным, а титр более 1:80 считается положительным.Более высокие титры более клинически значимы, тогда как низкие положительные результаты (≤1: 160) могут быть обнаружены почти у 20% здоровых людей (особенно у пожилых). Хотя положительные титры 1: 160 или выше сильно связаны с аутоиммунными нарушениями, они также обнаруживаются у 5% здоровых людей.
Важно подчеркнуть, что скрининг на аутоантитела полезен при диагностике аутоиммунных расстройств, а мониторинг уровней помогает предсказать прогрессирование заболевания. Однако положительный тест на ANA редко бывает полезным, если отсутствуют другие клинические или лабораторные данные, подтверждающие диагноз.
Паттерны клеточной флуоресценции
Помимо титра ANA, положительные результаты IFA будут включать описание конкретного типа наблюдаемого флуоресцентного паттерна. Различные паттерны были связаны с различными аутоиммунными заболеваниями, хотя могут иметь место некоторые совпадения. Вот некоторые из наиболее распространенных моделей:- Гомогенная (диффузная) картина: Обычно ассоциируется с СКВ, смешанным заболеванием соединительной ткани и волчанкой, вызванной лекарствами.
- Пятнистый узор: Связан с СКВ, синдромом Шегрена, склеродермией, полимиозитом, РА и смешанным заболеванием соединительной ткани.
- Тип ядра: Связан со склеродермией и полимиозитом.
- Центромерный (периферический) образец: Связан со склеродермией и CREST (кальциноз, синдром Рейно, нарушение моторики пищевода, склеродактилия, телеангиэктазия).
Типичные результаты, сообщаемые с использованием метода IFA, должны включать титр разведения ANA и описание картины флуоресценции, например «Положительный результат при разведении 1: 320 с гомогенной картиной».«При оценке результатов теста врач должен учитывать следующее:
- Результаты теста на ANA могут быть положительными у людей без каких-либо известных аутоиммунных заболеваний, поэтому их необходимо тщательно оценивать с учетом индивидуальных признаков и симптомов.
- Тест ANA может стать положительным до того, как разовьются признаки и симптомы аутоиммунного заболевания; поэтому может потребоваться время, чтобы интерпретировать значение положительного теста ANA у человека, у которого нет симптомов.
- Некоторые лекарства могут стимулировать выработку ANA, включая прокаинамид, гидралазин и фенитоин. ANA, которые стимулируются лекарствами, называются ANA, индуцированными лекарствами.
- В конечном итоге результат ANA должен интерпретироваться в конкретном контексте симптомов отдельного пациента, основных медицинских состояний и других результатов тестов. Это может быть или не быть значительным, даже если положительным, для данного человека.
Антинуклеарные антитела и тест IFA
Антитела в изобилии вырабатываются иммунной системой человека.За их производство отвечают лейкоциты, в том числе лимфоциты (Т-клетки и В-клетки) и антигенпрезентирующие клетки. Их задача — обеспечить скоординированный ответ на чужеродные вещества (антигены), а также уничтожить вредные патогены, такие как бактерии и вирусы. Человеческое тело содержит огромное количество и разнообразие нормальных и основных человеческих белков, называемых аутоантигенами. В некоторых ситуациях иммунная система организма делает ошибку и распознает обычно встречающиеся аутоантигены как «чужеродные», связываясь с ними, чтобы разрушить и удалить их из организма.Специфическая подгруппа антител, которые атакуют нормальные белки, обнаруженные в ядре клетки, называются, что неудивительно, антинуклеарными антителами , или сокращенно «АНА». Эти введенные в заблуждение антитела направляют свою атаку против нуклеиновых кислот клетки и иногда связанных с ними белков, которые находятся в ядре клетки или рядом с ним. Повышенные уровни ANA были связаны с различными ревматическими заболеваниями, включая системную красную волчанку (СКВ), ревматоидный артрит, синдром Шегрена, склеродермию, полимиозит, дерматомиозит и различные другие системные аутоиммунные заболевания.
В 1957 году ANA были впервые продемонстрированы с помощью непрямой иммунофлуоресценции (IF) Holborow et al (1). На протяжении многих лет был разработан непрямой иммунофлуоресцентный анализ (IFA), который использовался для обнаружения и идентификации ANA. IFA — это лабораторный тест, при котором специфические антитела в сыворотке или других жидкостях организма связываются с флуоресцентным соединением, которое дает зеленое свечение при воздействии ультрафиолетового света, обычно под микроскопом. Метод обнаружения IFA получил все большее признание среди врачей, которые используют эту информацию в качестве вспомогательного средства в диагностике и лечении заболеваний, связанных с ANA.С 2009 года Американский колледж ревматологии рекомендует использовать IFA для обнаружения ANA, и он до сих пор считается «золотым стандартом». MBL International предлагает тест-систему ANA (Anti-Nuclear Antibody), непрямой флуоресцентный анализ антител с использованием клеток культуры ткани HEp-2 в качестве субстрата для качественного и / или полуколичественного определения антинуклеарных антител в сыворотке крови человека, чтобы помочь в диагностике некоторые аутоиммунные заболевания. Более 30 лет мы поставляем полную линейку аутоиммунных продуктов IFA, предназначенных для полуколичественного определения аутоантител против различных типов субклеточных компонентов, включая нуклеиновые кислоты, ядерные белки и цитоплазматические белки в сыворотке крови человека.
- Холбороу EJ, Weir DM, Johnson GD. Сывороточный фактор красной волчанки со сродством к ядрам ткани. Br Med J1957; 2: 732–40.
Границы | Оценка ELISA, иммунофлуоресценции и анализа бокового потока для серологических анализов SARS-CoV-2
Введение
Новая пандемия коронавируса возникла в декабре 2019 года в Ухане, Китай. За 7 месяцев более девяти миллионов человек были инфицированы тяжелым острым респираторным синдромом — коронавирусом 2 (SARS-CoV-2), названным так из-за высокой гомологии последовательности с SARS-CoV (Li X.и др., 2020). Это коронавирусное заболевание 2019 г. (или CoVID-19) имеет доброкачественное течение у большинства субъектов, но может вызывать пневмонию, острый респираторный дистресс-синдром (ОРДС) и смерть примерно у 5–10% пациентов (Zhang et al., 2020; Zhou и др., 2020). В настоящее время золотым стандартом диагностики CoVID-19 является ОТ-ПЦР SARS-CoV-2, несмотря на новые молекулярные методы, основанные на технологиях LAMP (Park et al., 2020) или CRISPR-Cas9 (Joung et al., 2020). Антигенные тесты вирусных белков дешевле и быстрее, чем молекулярная диагностика, но их чувствительность низкая (Scohy et al., 2020). Определение серологического статуса может отслеживать предыдущий контакт с SARS-CoV-2 и является инструментом для ретроспективной диагностики или серологических и эпидемиологических исследований. В этой работе мы сравнили внутреннюю систему и четыре коммерческих решения, основанные на трех методах, чтобы определить конкретные преимущества и недостатки каждого из пяти анализов.
Материалы и оборудование
Внутренний иммунофлуоресцентный анализ
Мы разработали собственный непрямой иммунофлуоресцентный анализ (IFA) для обнаружения антител против SARS-CoV-2 (Edouard et al., 2020). Вкратце, клетки Vero E6, инфицированные штаммом SARS-CoV-2 IHU-MI2 (полная последовательность генома этого штамма, доступная в Европейской лаборатории молекулярной биологии, номер доступа проекта EMBL PRJEB38023), собирали между 24 и 48 часами после инокуляции, промывали и инактивировали 5% параформальдегидом. В каждую лунку предметного стекла микроскопа вносили 50 нл этого раствора (в качестве антигена), неинфицированные клетки (в качестве отрицательного контроля) и клинический изолят Staphylococcus aureus (в качестве положительного контроля для отложений сыворотки) (Gouriet et al., 2008). Затем образцы сыворотки инкубировали 30 минут при 56 ° C для инактивации комплемента, разбавляли от 1:25 до 1: 1600 для определения IgM и от 1:50 до 1: 3200 для определения IgG и наносили на предметные стекла. После 30-минутной инкубации при 37 ° C и трех промывок PBS добавляли конъюгаты анти-IgG и анти-IgM (bioRad France, Марн-ла-Кокетт, Франция) с последующей 30-минутной инкубацией при 37 ° C. (Таблица 1). Блокирующих ступеней не было. После промывания предметные стекла наблюдали под флуоресцентным микроскопом (AxioSkop 40, Zeiss, Марли-ле-Руа, Франция) двумя независимыми операторами.В случае несоответствия скважину считывает третий оператор. Для каждой сыворотки о наличии или отсутствии антител против SARS-CoV-2 сообщалось только в том случае, если техническая валидация соответствующего пятна была успешно пройдена (отсутствие флуоресценции в неинфицированных клетках (отрицательный контроль) и видимая флуоресценция в S. aureus spot (положительный контроль). ИФА давал количественные результаты путем последовательного титрования.
Таблица 1. Сравнение методов.
ELISA
Мы оценили два коммерческих набора для ИФА: EUROIMMUN ® ELISA SARS-CoV-2 IgG (Euroimmun France ® , Бюсси-Сен-Мартен, Франция, далее именуемый «Евроиммун») и NovaLisa ® SARS-CoV-2 IgG. и IgM (NovaTec ® , Dietzenbach, Германия, далее именуемая «NovaLisa»). Вкратце, оба метода были прямым ELISA с использованием конъюгата, меченного пероксидазой хрена (HRP), и тетраметилбензидина (TMB) в качестве выявляющего агента (таблица 1). Анализы проводились в соответствии с инструкциями производителя, включая повторное тестирование.Для каждого образца рассчитывали соотношение между средней оптической плотностью (OD) и пороговым значением. Для Euroimmun антитела считались необнаруживаемыми (отрицательный результат), если соотношение было ниже 0,8, неубедительным между 0,8 и 1,1 и положительным результатом выше 1,1. Для NovaLisa отношения были выражены в NTU (NovaTec Unit), а пороговые значения составляли 9 NTU, 9–11 NTU и выше 11 NTU соответственно для отрицательной, неубедительной и положительной интерпретации. Для каждого набора ELISA были оценены и успешно пройдены отрицательный и положительный контроли.
Анализ бокового потока
Мы оценили две системы анализа латерального потока (LFA): T-Tek ® SARS-CoV-2 IgG / IgM Antibody Test Kit (T-Tek ® , Вильфранш-сюр-Сон, Франция, далее именуемый «T- Tek ») и Sure Bio-tech ® SARS-CoV-2 IgM / IgG Antibody Rapid Test (Нью-Йорк, штат Нью-Йорк, США, далее именуемый« Sure Bio-tech »). Вкратце, эти кассеты представляют собой иммунохроматографические анализы с использованием метода захвата для качественного определения антител IgM и IgG к SARS-CoV-2 (таблица 1).Прямое наблюдение проводилось двумя независимыми операторами, и сообщалось о качественном результате (положительном или отрицательном). Никаких расхождений между операторами при чтении LFA не поступало.
Пациенты и методы
Пациенты и образцы
взрослых пациентов ( n = 40) с подтвержденной ОТ-ПЦР инфекцией SARS-CoV-2 (Amrane et al., 2020), посещающих больничный институт Méditerranée Infection University (Assistance Publique — Hôpitaux de Marseille, Франция), оценивались на предмет Антитела SARS-CoV-2 в рамках планового медицинского наблюдения.Сыворотки собирали и немедленно замораживали при -80 ° C. Демографические характеристики, факторы риска, тяжесть заболевания (National Institutes Health, 2020), лабораторные данные и данные об исходах были извлечены из электронных медицинских карт, ретроспективно проанализированы и представлены в таблице 2. Мы также отобрали 10 сывороток, которые были собраны в 2019 году у пациентов. без какой-либо коронавирусной инфекции.
Таблица 2. Демографические и лабораторные данные исследуемой когорты.
Анализ данных
Результаты иммунофлуоресцентного анализа, ELISA и LFA выражались как положительные или отрицательные.Неубедительные результаты ELISA были признаны отрицательными для статистического анализа. Поиск значимых связей между переменными производился с использованием критерия хи-квадрат (или точного критерия Фишера для предотвращения переоценки статистической значимости для небольших наборов данных) и определения степени согласия и Каппа Коэна. Порог значимости был установлен на уровне p <0,05.
Мы изучили серологический ответ в зависимости от времени забора сыворотки, относящегося к заявленной дате появления симптома COVID-19.Расчетная чувствительность тестов была рассчитана на основе предположения, что специфические IgM и IgG должны определяться через 10 дней после начала заболевания. Действительно, предыдущие исследования кинетики антител продемонстрировали, что обнаружение антител SARS-CoV-2 до 10 дней было редкостью (Guo et al., 2020; Okba et al., 2020).
Результаты
Демографические данные
Средний возраст пациентов составлял 39,9 года (5–95 процентиль: 23,6–63,8). Большинство из них составляли мужчины (57,5%) и имели легкие или умеренные клинические проявления, 10% пациентов нуждались в госпитализации, у двух пациентов (пациенты № 37 и № 38) был диагностирован синдром острого респираторного дистресс-синдрома (ОРДС, 5%), без летального исхода. .Шестнадцать пациентов (40%) имели один фактор риска тяжелого заболевания (гипертония, ожирение или сахарный диабет), и только один имел два таких основных состояния. Средняя вирусная нагрузка при постановке диагноза составила 25,9 Ct (т.е. 480 950 копий генома / мл), диапазон 20,0–34,9 (941–25 миллионов копий генома / мл). У двух пациентов с ОРДС образцы были собраны через 60 дней после начала заболевания. У двух других пациентов, нуждающихся в госпитализации, образцы были собраны через 8 (пациент № 9) и 15 (пациент № 23) дней после начала болезни.Индивидуальные результаты анализов IgG и IgM показаны на фигурах 1A, 2A соответственно.
Рисунок 1. Результаты серологического анализа на IgG. (A) Результаты отдельных пациентов с CoVID-19. Каждая строка представляет пациента, каждый столбец — серологический тест, черный блок — положительный результат, серый блок — неубедительный результат (для методов ELISA) и белый блок — отрицательный результат (B) Общее согласие, значение Каппа Коэна и Хи-квадрат (или точный критерий Фишера курсивом) p -значение между двумя тестами (C) График корреляции между двумя методами ELISA.
Рисунок 2. Результаты серологического анализа на IgM. (A) Результаты отдельных пациентов с CoVID-19. Каждая строка представляет пациента, каждый столбец — серологический тест, черный блок — положительный результат, серый блок — неубедительный результат (для методов ELISA) и белый блок — отрицательный результат (B) Общее согласие, значение Каппа Коэна и Хи-квадрат (или точный критерий Фишера курсивом) p — значение между двумя тестами.
Обнаружение SARS-CoV-2 IgG
ОпределениеAnti-SARS-CoV-2 IgG было включено в пять анализов (рис. 1).Контрольные сыворотки были отрицательными против SARS-CoV-2 IgG во всех анализах (данные не показаны). У пациентов сравнение Intermethod для определения IgG было 50% или выше (Рисунок 1B). Внутренние IFA и EuroImmun имели умеренное согласие со всеми другими системами (не менее 60% согласия и 0,26 Каппа Коэна), за исключением друг друга (Каппа Коэна 0,05 и хи-квадрат p — значение 0,72). T-Tek и NovaLisa также имели умеренное согласие со всеми системами (по крайней мере 62,5% согласия и 0,29 Каппа Коэна), за исключением друг друга (Каппа Коэна 0.13, тест Фишера p — значение 0,476). Конечно, Bio-tech продемонстрировала справедливое согласие со всеми системами (согласие 60–75%; Каппа Коэна 0,26–0,48; критерий Хи-квадрат или Фишера — все значимо). График корреляции между двумя системами ELISA (рис. 1C) выявил значительную корреляцию между результатами EuroImmun и NovaLisa IgG (коэффициент корреляции = 0,35; p -значение теста Пирсона = 0,025), несмотря на то, что большинство положительных результатов с EuroImmun были слабый (между 1.1 и 4), что может объяснить скромный коэффициент корреляции. Наилучшие оценки чувствительности (рис. 1A и таблица 3) были получены с Sure Bio-tech и EuroImmun (соответственно 71,0 и 61,3%), тогда как чувствительность других методов была менее 50%. Что касается двух пациентов с ОРДС, IgG были обнаружены всеми системами. Для двух других госпитализированных пациентов был только неубедительный результат для пациентов № 9 и № 23 с EuroImmun и положительный результат для № 23 с IFA.
Таблица 3. Расчетная чувствительность по результатам IgG и IgM.
Обнаружение SARS-CoV-2 IgM
Определение IgM к SARS-CoV-2 было доступно с помощью четырех оцененных анализов (рис. 2). Контрольные сыворотки были отрицательными по IgM к SARS-CoV-2 во всех анализах (данные не показаны). Наилучшее интерметодическое соответствие было между двумя растворами LFA Sure Bio-tech и T-Tek (65% 0,353 теста Коэна Каппа и Фишера p — значение 0,005), в противном случае совпадение варьировалось от 30 до 72,5%, −0,349–0 .106 Каппы Коэна. Несмотря на значительный критерий хи-квадрат между T-Tek и IFA ( p = 0,017), согласие было низким (отрицательный результат по Коэновской каппе и 30% согласия). Расчетная чувствительность (рисунок 2A и таблица 3) составляла 64,5% для T-Tek, но только 19,4–35,5% для IFA, NovaLisa и Sure Bio-tech. У двух пациентов с ОРДС IgM к SARS-CoV-2 были обнаружены только с T-Tek. Для двух других госпитализированных пациентов у №9 был положительный результат только с T-Tek, тогда как у №23 был положительный результат с IFA и NovaLisa.
Обсуждение
В этом исследовании рассматривались аналитические характеристики пяти серологических тестов на SARS-CoV-2 с помощью панели внутренних и коммерческих, качественных и количественных, ручных и автоматизированных методов и решений. Один собственный метод IFA, два коммерческих набора для ELISA и два коммерческих набора LFA были применены к образцам сыворотки от 40 пациентов, инфицированных SARS-CoV-2 с подтвержденной ОТ-ПЦР, и 10 контрольных образцов, отрицательных по коронавирусу, собранных до вспышки SARS-CoV-2. .
Согласие между всеми тестами было от умеренного до умеренного.Сравнение методов выявило расхождения в результатах, обусловленные выбором метода анализа и антигена, которые являются основными проблемами серологии SARS-CoV-2. ИФА является наиболее трудоемким методом и требует наличия лаборатории с уровнем биобезопасности 3 для культивирования и обработки инфицированных клеток, но при этом используются экстракты целых вирусных антигенов, что позволяет обнаруживать антитела практически против любого вирусного белка. Однако анализы, основанные на рекомбинантных белках, более точны и могут быть легче стандартизированы из-за более высокой воспроизводимости и аналогичной иммунореактивности, тогда как «естественные» белки демонстрируют большую вариабельность.Методы ELISA надежны и могут быть легко автоматизированы в виде непрерывной системы, выдающей десятки результатов за пару часов, но существует неубедительная («серая») зона с неопределенными результатами. В других исследованиях сравнивали тесты ELISA на CoVID-19 с хорошей чувствительностью и отличным общим соглашением между методами (Elslande et al., 2020; Nicol et al., 2020; Theel et al., 2020). Несмотря на необходимость количественной оценки положительных результатов, LFA — это быстрый и простой в использовании метод, не требующий специальной подготовки перед его внедрением (Li Z.и др., 2020). Различные результаты также можно объяснить вариацией антигенов, используемых в анализах (таблица 1). Метод NovaLisa нацелен только на рекомбинантный белок нуклеокапсида (N), несмотря на ключевую роль белка spike (S) во входе вируса, который отображается на всей поверхности вируса (Hoffmann et al., 2020). Более того, аминокислотная последовательность N-белка, и особенно N-концевой домен, высококонсервативна во всех бета-коронавирусах и может вызывать ложноположительные результаты и / или не обнаруживать истинную раннюю сенсибилизацию.Другие методы нацелены на белок S по отдельности или в комбинации, поскольку он может быть одним из наиболее иммуногенных белков SARS-CoV-2 (Lan et al., 2020; Ni et al., 2020). Были разработаны и многообещающие в этом контексте системы, такие как хемилюминесцентные иммуноанализы или технологии массивов суспензий на основе микросфер (Hou et al., 2020; Kohmer et al., 2020).
Низкая оценочная чувствительность определения IgG и IgM была поразительной. Насколько нам известно, сывороточный IgM может быстро снижаться, что потенциально объясняет очевидную низкую чувствительность анализа.Предыдущие исследования показали немного лучшие результаты чувствительности: 66,7–98% для IgG и 60–95% для IgM (Beavis et al., 2020; Guo et al., 2020; Hou et al., 2020; Kohmer et al., 2020; Li Z. et al., 2020; Ma et al., 2020; Nagappa and Marimuthu, 2020; Qu et al., 2020; Трауготт и др., 2020; Tuaillon et al., 2020; Van Elslande et al., 2020 ; Zhao et al., 2020). Трудно точно определить клиническую эффективность без метода золотого стандарта, поэтому мы рассчитали «оценочную» чувствительность: мы предположили, что антитела присутствовали, по крайней мере, через 10 дней после появления симптомов.Очень раннее образование антител необычно при респираторных вирусных инфекциях (Allie and Randall, 2017). Среднее время для первого обнаружения IgG составило 14 дней (IQR 10–18) после появления симптомов (Guo et al., 2020). В контексте CoVID-19 обнаружение периферических антител через несколько дней после появления симптомов или молекулярной диагностики можно объяснить более длительным инкубационным периодом, поздним диагнозом для бессимптомных пациентов или ложноположительным результатом. В противном случае для выработки определяемых уровней антител может потребоваться больше времени, как это наблюдалось во время предыдущих вспышек коронавируса (Tang et al., 2004; Ko et al., 2017), особенно у пациентов с ослабленным иммунитетом.
Было высказано предположение, что антителозависимые механизмы играют основную роль во время иммунных ответов против SARS-CoV-2 и могут зависеть от развития вирус-специфического CD4 + и CD8 + Т-клеточного иммунитета (St John and Rathore, 2020; Vabret et al., 2020). Однако антитела, вырабатываемые после заражения SARS-CoV-2, непоследовательно несут нейтрализующую активность (Seydoux et al., 2020). Взятые вместе, текущие данные показывают, что серологические тесты SARS-CoV-2 могут быть полезны в качестве косвенных биомаркеров предыдущего контакта с SARS-CoV-2, но не индивидуальной защиты от повторного заражения.В этом исследовании мы показали, что чувствительность пяти серологических растворов была сравнимой, хотя согласие между методами не было оптимальным. Каждая лаборатория должна провести тщательную аналитическую характеристику и оценку качества после того, как будет выбран метод для рутинного исследования у пациентов.
Заключение
Сравнение пяти коммерческих и собственных анализов на антитела IgG и IgM к SARS-CoV-2 обнаружило ограниченную чувствительность и общую согласованность. Был ли этот результат связан с покрытыми антигенами, аналитическими процессами или кинетикой и величиной антител против SARS-CoV-2 у пациентов, требует дальнейших исследований.Место и показания для оценки серологического статуса с помощью доступных в настоящее время инструментов в пандемии CoVID-19 нуждаются в переоценке.
Заявление о доступности данныхОригинальные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Этическая экспертиза и одобрение не требовалось для исследования участников-людей в соответствии с местным законодательством и требованиями учреждения.Письменное информированное согласие на участие не требовалось для этого исследования в соответствии с национальным законодательством и институциональными требованиями.
Авторские взносы
MM, AB, MD и JV внесли свой вклад в концепцию и дизайн исследования. MM и AB проводили эксперименты. SE, FF и FD выполнили статистический анализ. J-LM написал первый черновик рукописи. Все авторы внесли свой вклад в доработку рукописи, прочитали и одобрили представленную версию.
Конфликт интересов
Два набора ELISA и анализ бокового потока были любезно предоставлены поставщиками для оценки.
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Благодарим Лоуренса Томаса за техническую помощь. Philippe Bignotti за любезное предоставление бесплатного набора NovaLisa ® SARS-CoV-2 IgG и IgM (NovaTec ® , Дитценбах, Германия).Arthur Qin за любезно предоставленные бесплатные наборы для экспресс-теста на антитела Sure Bio-tech ® SARS-CoV-2 IgM / IgG (Sure Bio-tech ® , Нью-Йорк, Нью-Йорк, США). Паскаля Тридона за любезное предоставление бесплатных наборов T-Tek ® SARS-CoV-2 IgG / IgM Antibody Test Kit (T-Tek ® , Вильфранш-сюр-Сон, Франция).
Список литературы
Amrane, S., Tissot-Dupont, H., Doudier, B., Eldin, C., Hocquart, M., Mailhe, M., et al. (2020). Быстрая вирусная диагностика и амбулаторное ведение случаев подозрения на COVID-19 при поступлении в инфекционную больницу в марселе, франция, — 31 января — 1 марта 2020 г .: снимок респираторного вируса. Travel Med. Заразить. Дис. 36: 101632. DOI: 10.1016 / j.tmaid.2020.101632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бивис, К. Г., Матушек, С. М., Абеледа, А. П. Ф., Бетел, К., Хант, К., Гиллен, С., и др. (2020). Оценка анализа ELISA EUROIMMUN Anti-SARS-CoV-2 для выявления антител IgA и IgG. J. Clin. Virol. 129: 104468. DOI: 10.1016 / j.jcv.2020.104468
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдуард, С., Colson, P., Melenotte, C., Pinto, F. D., Thomas, L., Scola, B. L., et al. (2020). Оценка серологического статуса пациентов с COVID-19 с помощью непрямого иммунофлуоресцентного анализа, Франция. Eur. J. Clin. Microbiol. Заразить. Дис. 11, 1–11. DOI: 10.1101 / 2020.05.05.20092064
CrossRef Полный текст | Google Scholar
Elslande, J. V., Decru, B., Jonckheere, S., Wijngaerden, E. V., Houben, E., Vandecandelaere, P., et al. (2020). Антительный ответ против спайкового белка и нуклеопротеина SARS-CoV-2 оценивали с помощью четырех автоматических иммуноанализов и трех ELISA. Clin. Microbiol. Заразить. 26, 1557.e1–1557.e7. DOI: 10.1016 / j.cmi.2020.07.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gouriet, F., Samson, L., Delaage, M., Mainardi, J.-L., Meconi, S., Drancourt, M., et al. (2008). Мультиплексный микрочип целого бактериального антигена, новый формат для автоматизации серодиагностики: парадигма культурально-отрицательного эндокардита. Clin. Microbiol. Заразить. 14, 1112–1118. DOI: 10.1111 / j.1469-0691.2008.02094.х
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Го, Л., Рен, Л., Ян, С., Сяо, М., Чанг, Д., Ян, Ф. и др. (2020). Профилирование раннего гуморального ответа для диагностики нового коронавирусного заболевания (COVID-19). Clin. Заразить. Дис. 71, 778–785. DOI: 10.1093 / cid / ciaa310
CrossRef Полный текст | Google Scholar
Hoffmann, M., Kleine-Weber, H., Schroeder, S., Krüger, N., Herrler, T., Erichsen, S., et al. (2020). Вход в клетки SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Ячейка 181, 271–280. DOI: 10.1016 / j.cell.2020.02.052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hou, H., Wang, T., Zhang, B., Luo, Y., Mao, L., Wang, F., et al. (2020). Обнаружение антител IgM и IgG у пациентов с коронавирусной болезнью 2019. Клин. Пер. Иммунол. 9: e1136. DOI: 10.1002 / cti2.1136
CrossRef Полный текст | Google Scholar
Joung, J., Ladha, A., Saito, M., Kim, N.-G., Woolley, A.E., Segel, M., и другие. (2020). Обнаружение SARS-CoV-2 с помощью теста SHERLOCK One-Pot. N. Engl. J. Med. 383, 1492–1494. DOI: 10.1056 / NEJMc2026172
CrossRef Полный текст | Google Scholar
Ko, J.-H., Müller, M.A., Seok, H., Park, G.E., Lee, J.Y., Cho, S.Y., et al. (2017). Серологические ответы 42 пациентов, инфицированных MERS-коронавирусом, в зависимости от тяжести заболевания. Диагностика. Microbiol. Заразить. Дис. 89, 106–111. DOI: 10.1016 / j.diagmicrobio.2017.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кохмер, Н., Westhaus, S., Rühl, C., Ciesek, S., и Rabenau, H.F. (2020). Краткая клиническая оценка шести высокопроизводительных анализов антител IgG к SARS-CoV-2. J. Clin. Virol. 129: 104480. DOI: 10.1016 / j.jcv.2020.104480
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lan, J., Ge, J., Yu, J., Shan, S., Zhou, H., Fan, S., et al. (2020). Структура спайкового домена, связывающего рецептор SARS-CoV-2, связанного с рецептором ACE2. Природа 581, 215–220. DOI: 10.1038 / s41586-020-2180-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Х., Гэн, М., Пэн, Ю., Мэн, Л., и Лу, С. (2020). Молекулярный иммунный патогенез и диагностика COVID-19. J. Pharm. Анальный. 10, 102–108. DOI: 10.1016 / j.jpha.2020.03.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Li, Z., Yi, Y., Luo, X., Xiong, N., Liu, Y., Li, S., et al. (2020). Разработка и клиническое применение экспресс-теста комбинированных антител IgM-IgG для диагностики инфекции SARS-CoV-2. J. Med. Virol. 2020: 25727. DOI: 10.1002 / jmv.25727
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, Х., Цзэн, В., Хэ, Х., Чжао, Д., Цзян, Д., Чжоу, П. и др. (2020). Сывороточные ответы IgA, IgM и IgG при COVID-19. Cell Mol. Иммунол. 17, 773–775. DOI: 10.1038 / s41423-020-0474-z
CrossRef Полный текст | Google Scholar
Ni, L., Ye, F., Cheng, M.-L., Feng, Y., Deng, Y.-Q., Zhao, H., et al. (2020). Выявление гуморального и клеточного иммунитета, специфичного для SARS-CoV-2, у выздоравливающих людей с COVID-19. Иммунитет 52, 971–977. DOI: 10.1016 / j.immuni.2020.04.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nicol, T., Lefeuvre, C., Serri, O., Pivert, A., Joubaud, F., Dubée, V., et al. (2020). Оценка серологических тестов SARS-CoV-2 для диагностики COVID-19 посредством оценки трех иммуноанализов: двух автоматических иммуноанализов (Euroimmun и Abbott) и одного быстрого иммуноанализа с боковым потоком (NG Biotech). J. Clin. Virol. 129: 104511.DOI: 10.1016 / j.jcv.2020.104511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Окба, Н. М. А., Мюллер, М. А., Ли, В., Ван, К., Геуртсван, Кессель, К. Х., Корман, В. М. и др. (2020). Тяжелый острый респираторный синдром, специфичный для коронавируса 2, у пациентов с коронавирусной болезнью. Emerg. Заразить. Дис. 26, 1478–1488. DOI: 10.3201 / eid2607.200841
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парк, Г.-С., Ку, К., Бэк, С.-Х., Ким, С.-Дж., Ким, С.И., Ким, Б.-Т., и др. (2020). Разработка методов изотермической амплификации, опосредованных обратной транскрипцией, для лечения тяжелого острого респираторного синдрома, вызванного коронавирусом 2 (SARS-CoV-2). J. Mol. Диаг. JMD 22, 729–735. DOI: 10.1016 / j.jmoldx.2020.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цюй, Дж., Ву, К., Ли, X., Чжан, Г., Цзян, З., Ли, X. и др. (2020). Профиль иммуноглобулинов G и антител IgM к коронавирусу 2 тяжелого острого респираторного синдрома (SARS-CoV-2). Clin. Заразить. Дис. 2020: 489. DOI: 10.1093 / cid / ciaa489
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скохи, А., Анантараджа, А., Бодеус, М., Кабамба-Мукади, Б., Веррокен, А., и Родригес-Вильялобос, Х. (2020). Низкая эффективность экспресс-теста на обнаружение антигена в качестве основного теста для диагностики COVID-19. J. Clin. Virol. 129: 104455. DOI: 10.1016 / j.jcv.2020.104455
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сейду, Э., Homad, L.J., MacCamy, A.J., Parks, K.R., Hurlburt, N.K., Jennewein, M.F., et al. (2020). Анализ индивидуума, инфицированного SARS-CoV-2, показывает развитие мощных нейтрализующих антител к отдельным эпитопам с ограниченной соматической мутацией. Иммунитет 53, 98–105. DOI: 10.1016 / j.immuni.2020.06.001
CrossRef Полный текст | Google Scholar
Тан П., Луи М., Ричардсон С. Э., Смейя М., Симор А. Э., Джеймисон Ф. и др. (2004). Интерпретация диагностических лабораторных тестов при тяжелом остром респираторном синдроме: опыт Торонто. CMAJ Can. Med. Доц. J. 170, 47–54.
Google Scholar
Тел Э. С., Харринг Дж., Хилгарт Х. и Грейнджер Д. (2020). рабочие характеристики четырех высокопроизводительных иммуноанализов для выявления антител IgG против SARS-CoV-2. J. Clin. Microbiol. 58:20. DOI: 10.1128 / JCM.01243-20
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Трауготт, М., Аберле, С. В., Аберле, Дж. Х., Гриблер, Х., Кароли, М., Павелка, Э., и другие. (2020). Проведение анализов на антитела к SARS-CoV-2 на разных стадиях инфекции: сравнение коммерческого ИФА и экспресс-тестов. J. Infect. Дис. 222, 362–366. DOI: 10.1093 / infdis / jiaa305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tuaillon, E., Bolloré, K., Pisoni, A., Debiesse, S., Renault, C., Marie, S., et al. (2020). Обнаружение антител SARS-CoV-2 с использованием коммерческих тестов и моделей сероконверсии у госпитализированных пациентов. J. Infect. 81, e39 – e45. DOI: 10.1016 / j.jinf.2020.05.077
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вабрет Н., Бриттон Г. Дж., Грубер К., Хегде С., Ким Дж., Куксин М. и др. (2020). Иммунология COVID-19: современное состояние науки. Иммунитет 52, 910–941. DOI: 10.1016 / j.immuni.2020.05.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Эльсланд, Дж., Хубен, Э., Депипер, М., Бракенир, А., Desmet, S., André, E., et al. (2020). Диагностические характеристики семи быстрых тестов на антитела IgG / IgM и ELISA на иммунные IgA / IgG у пациентов с COVID-19. Clin. Microbiol. Заразить. 26, 1082–1087. DOI: 10.1016 / j.cmi.2020.05.023
CrossRef Полный текст | Google Scholar
Zhang, J.-J., Dong, X., Cao, Y.-Y., Yuan, Y.-D., Yang, Y.-B., Yan, Y.-Q., et al. (2020). Клинические характеристики 140 пациентов, инфицированных SARS-CoV-2, в Ухане, Китай. Аллергия 75, 1730–1741.DOI: 10.1111 / all.14238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhao, J., Yuan, Q., Wang, H., Liu, W., Liao, X., Su, Y., et al. (2020). Ответы антител на SARS-CoV-2 у пациентов с новым коронавирусным заболеванием 2019 г. Clin. Заразить. Дис. 2020: 344. DOI: 10.1093 / cid / ciaa344
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhou, F., Yu, T., Du, R., Fan, G., Liu, Y., Liu, Z., et al. (2020). Клиническое течение и факторы риска смертности взрослых пациентов с COVID-19 в Ухане, Китай: ретроспективное когортное исследование. Ланцет 395, 1054–1062. DOI: 10.1016 / S0140-6736 (20) 30566-3
CrossRef Полный текст | Google Scholar
164947: Антинуклеарные антитела (ANA) от IFA
Непрямой иммунофлуоресцентный тест включает три элемента, которые следует учитывать в результате:
1. Положительная или отрицательная флуоресценция. Отрицательный результат теста является убедительным свидетельством против диагноза СКВ, но не окончательным.
2. Титр (разведение), до которого флуоресценция остается положительной (отражает концентрацию или авидность антитела).Многие люди, особенно пожилые, могут иметь низкий титр АНА без серьезного заболевания, подтвержденного после обследования.
3. Характер ядерной флуоресценции (отражающий специфичность для различных заболеваний). Гомогенный и / или ядерный обод (периферический) паттерн коррелирует с антителами к нативной ДНК и дезоксинуклеопротеинам и имеет корреляцию с СКВ, активностью СКВ и волчаночным нефритом. Гомогенная (диффузная) картина свидетельствует о СКВ или других заболеваниях соединительной ткани. Пятнистый рисунок коррелирует с антителами к ядерным антигенам, экстрагируемым физиологическим раствором; он обнаруживается при многих болезненных состояниях, включая СКВ и склеродермию.Когда присутствуют антитела к ДНК и дезоксирибонуклеопротеину (ободок и гомогенный рисунок), это может помешать обнаружению пятнистого рисунка. Ядрышковый узор наблюдается в сыворотках крови пациентов с прогрессирующим системным склерозом и синдромом Шегрена. Паттерн центромеры наблюдается при синдроме CREST.
Идентификация паттерна ANA | Найдено в | Последующие тесты | 9045 hom6Анти-дцДНК | |||
|---|---|---|---|---|---|---|
Анти-оцДНК | ||||||
Антикардиолипин | ||||||
Антихроматин | ||||||
Антихроматин | ||||||
RF | ||||||
| 9044 SS- | ||||||
Иммунный ком plex | ||||||
крапчатый | SLE | Anti-dsDNA | ||||
Anti-Sm | 904 | Анти-SS-A / SS-B | ||||
Антигистон | ||||||
Вирусная или индуцированная волчанка | ||||||
| 946D | ||||||
RA | RF | |||||
Ядрышковые | PSS / Склеродермия | 45 | Anti-RNP | Anti-SS-A / SS-B | ||
Sjögren ‘ s синдром | Anti-SS-A / SS-B | |||||
Подкожный SLE | Иммунный комплекс | |||||
SLE 05 9463 904 | Анти-ssDNA | |||||
Centromere | Склеродермия | SS-A / SS-B | ||||
CRS | Scl-70 | |||||
Anti-RNP |
Пять процентов явно «нормальной популяции» демонстрируют сывороточный ANA.Низкие титры реактивности АНА могут наблюдаться у пациентов с ревматоидным артритом (от 40% до 60% пациентов), склеродермией (от 60% до 90%), дискоидной волчанкой, некротическим васкулитом, синдромом Шегрена (80%), хроническим активным гепатитом, легочным интерстициальный фиброз, пневмокониоз, туберкулез, злокачественные новообразования, возраст старше 60 лет (18%), а также при СКВ, особенно если заболевание протекает в неактивном состоянии или лечится. Титры ≥1: 160 обычно указывают на наличие активной СКВ, хотя иногда другие аутоиммунные заболевания могут вызывать такие высокие титры.В настоящее время известны группы пациентов с «ANA-отрицательной волчанкой». У таких пациентов часто есть антитела к антигену SS-A / Ro (обычно при использовании субстрата из замороженных срезов) и подострой кожной волчанке. Десять процентов пациентов с СКВ демонстрируют ложноположительные биологические тесты на сифилис; это может быть даже начальное проявление. Некоторые другие тесты, используемые для дифференциации аутоиммунных состояний, включают антитела к двухцепочечной ДНК, ревматоидный фактор, антитела к экстрагируемым ядерным антигенам, общий гемолитический комплемент (C3, C4 и т. Д.).Хотя тесты ANA иногда назначают для спинномозговой или синовиальной жидкости, текущие анализы не стандартизированы для этих жидкостей, и такие анализы не добавляют к диагностическому процессу.
Устранение недостатков тестирования ANA с помощью IFA
Создать PDFCharna Albert
, март 2020 г. — Стандартизация непрямого иммунофлюоресцентного тестирования на антинуклеарные антитела является критически важной задачей для лабораторного сообщества, и сейчас это более актуально, поскольку новые критерии классификации делают положительный анализ ANA ключевым фактором в диагностике волчанки, — сказал Марк Х.Венер, доктор медицины, на заседании ежегодного собрания Американской ассоциации клинической химии в прошлом году.
Иммунофлуоресцентный анализ (IFA) с использованием культивированной линии клеток HEp-2 является традиционным предпочтительным методом скрининга ANA, рекомендованным Американским колледжем ревматологии, сказал д-р Венер, профессор кафедры лабораторной медицины и адъюнкт-профессор кафедры медицины. , Медицинский факультет Вашингтонского университета. Фактически, ACR считает его эталонным методом скрининга, как и Всемирная организация здравоохранения и Европейская инициатива по стандартизации аутоиммунных заболеваний.Согласно международным рекомендациям по оценке аутоантител (Agmon-Levin N, et al. Ann Rheum Dis. 2014; 73 [1]: 17–23), «если клиническое подозрение сильное, а альтернативный метод отрицательный, он обязательно для выполнения ИФА », — сказал д-р Венер, который также является содиректором клиники склеродермии UW Medical Center и директором иммунологии и клинических лабораторий в UW Medical Center.
Тем не менее, ревматологи выразили обеспокоенность по поводу противоречивых результатов тестирования ANA, проведенного IFA.Некоторые из того, что слышат в ревматологическом сообществе: «Вы делаете это неправильно»; «Мы не можем доверять вашим результатам»; «Ваши ANA не всегда положительны при волчанке» (хотя ожидается).
«Какова реакция лабораторного сообщества?» — спросил доктор Венер. «Является ли IFA по-прежнему золотым стандартом? Это все еще полезно или устарело? Можно ли его улучшить или переработать? Как нам интегрировать ANA IFA с другими тестами? »
«Я думаю, многие скажут, что ANA от IFA не является золотым стандартом, — сказал он, — и у нас есть альтернативные методы ANA.«Они включают антиген-специфические твердофазные технологии, такие как ELISA, системы мультиплексных шариков и твердофазные флуоресцентные иммуноанализы. Но следует ли использовать твердофазные анализы для скрининга ANA вместо иммунофлуоресценции, остается открытым и спорным вопросом.
«Существует неоднозначный ответ на этот вопрос, — сказал доктор Венер. Тест ANA IFA можно улучшить. «На самом деле, если бы у меня был выбор, мы бы назвали это Американской ассоциацией клинической алхимии, потому что я попытаюсь убедить вас, что мы можем пройти этот несовершенный тест ANA IFA и сделать его более совершенным, если не 24 -каратное золото.”
ACR созвал комитет (членом которого был доктор Венер) более десяти лет назад, чтобы обсудить растущее использование не-IFA методов для скрининга ANA. Его члены написали документ с изложением позиции, который подтвердил, что IFA является золотым стандартом в тестировании ANA в то время, и рекомендовал лабораториям указывать в отчетах об испытаниях ANA методы, используемые для скрининга (Meroni PL, et al. Ann Rheum Dis .2010; 69 [8]: 1420–1422).
ACR традиционно возражает против использования не-IFA методов для скрининга ANA.Венер сказал, потому что иммуноферментные и мультиплексные анализы не так чувствительны. Клетки HEp-2 содержат больше антигенов, чем твердофазные анализы. Иммунофлуоресценция имеет 95-процентную чувствительность для обнаружения волчанки; для сравнения, мультиплексный экран при заболеваниях соединительной ткани чувствителен на 69 процентов, сказал он, цитируя статью 2018 года, опубликованную в Autoimmunity Reviews (Bizzaro N, et al. 2018; 17 [6]: 541–547). Для склеродермии чувствительность составляет 97 процентов по ИФА и 81 процент по экрану CTD. «Это беспокойство или жалоба ревматологов, если хотите», — сказал доктор.Венер сказал: «Если мы заменим скрининг чем-то помимо иммунофлуоресценции, это станет проблемой».
Волчанка сложно диагностировать, потому что, хотя заболевание встречается относительно редко, его симптомы являются общими. «Но есть признак. Постоянным признаком волчанки является положительный результат ANA, а чувствительные тесты на волчанку и некоторые другие заболевания соединительной ткани зависят от положительного результата ANA ».
Но проверка ANA, проводимая IFA, далека от совершенства. Одним из решений, по словам доктора Венера, является скрининг как с помощью IFA, так и с помощью мультиплексного тестирования.
Доктор Венер
«Есть дополнительные расходы, но если есть достаточно высокая вероятность предварительного тестирования, я думаю, что комбинация будет полезной», — сказал он. Если ИФА и мультиплексное тестирование дают подтверждающие результаты, которые совпадают, это обеспечивает сильную положительную прогностическую ценность. Кроме того, информация от мультиплексного тестирования может сделать результаты IFA более интерпретируемыми, и наоборот. Например, по его словам, низко-положительные антитела против анти-U1-рибонуклеопротеина в результате мультиплексирования являются довольно распространенным результатом, который, вероятно, будет иметь клиническое значение только в том случае, если тестирование с помощью IFA обнаружит совместимый ANA с ядерным грубым пятнистым рисунком (образец, связанный с MCTD). .С другой стороны, низкий титр U1-RNP с отрицательным ANA, вероятно, не является диагностически значимым и может вводить в заблуждение.
«Опытные врачи могут понять это явление, и лаборатория может помочь с этой интерпретацией», — добавил он.
Для тех, кто работает в клинической лаборатории, существует еще один вид синергии: тесты могут использоваться «как мера качества» друг для друга. «Поскольку специфические антитела, такие как U1-RNP или центромера, должны иметь связанные паттерны IFA, если они противоречат друг другу, это настораживает лабораторию», — сказал он.
Несоответствие между различными методами тестирования можно использовать «для проверки и, возможно, сброса пороговых значений IFA и результатов конкретных антител», — сказал он, потому что тесты на антитела «действительно должны совпадать». В долгосрочной перспективе, по его словам, лабораторный результат мультиплексирования может частично зависеть от результатов IFA — другими словами, от того, является ли ANA положительным или отрицательным, а также от модели.
Интегрированный подход к тестированию может предоставить директорам лабораторий возможность расширить неопределенную область мультиплексных результатов, что часто является проблемой для интерпретации, сказал он.«Это также может быть предупреждением о пересмотре порогового значения положительного результата для IFA ANA, используемого в отдельной лаборатории». Результаты должны быть взаимодополняющими, то есть, если с течением времени наблюдается слишком много несоответствий, это сигнал к пересмотру того, что делается.
Например, неоднократно положительный рибонуклеопротеин с низким титром и отрицательный ИФА HEp-2 предполагает, что лаборатория может расширить неопределенный диапазон RNP, сказал он. «Мы не хотим быть слишком бесцеремонными», говоря, что отдельные лаборатории меняют результаты.Но «расширение неопределенной зоны для аналита или переоценка пороговых значений IFA» — это то, что лаборатории имеют право делать в пределах своей популяции.
«Многие из наших результатов испытаний попадают в этот неопределенный диапазон, и согласование результатов IFA с результатом мультиплексирования позволяет нам тщательно изменять этот результат, исходя из клинических данных, который мы считаем целесообразным», — добавил он.
По словам доктора Венера, проблема, с которой должно столкнуться лабораторное сообщество, заключается в отсутствии стандартизации тестирования ANA между различными тестами и разными лабораториями.Исследование, проведенное в 2018 году, показало, что отрицательность ANA может варьироваться в зависимости от поставщика и комплекта (Pisetsky DS, et al. Ann Rheum Dis. 2018; 77 [6]: 911–913). Исследователи протестировали сыворотку 103 пациентов с установленной волчанкой с использованием трех разных наборов IFA и обнаружили, что «частота отрицательного ответа на ANA варьировала от 5 до 23 из 103 образцов», — пишут авторы. Тестирование также проводилось с использованием ELISA и мультиплексных анализов на основе шариков; 12 и 14 образцов были отрицательными соответственно. Авторы говорят, что результаты ставят под сомнение, следует ли использовать положительность ANA для определения права на участие в клинических испытаниях.
Расхождения в результатах ANA между лабораториями также могут иметь далеко идущие клинические последствия. Доктор Венер сослался на исследование 2016 года, в котором измерялось соответствие между парными результатами ANA, полученными в двух коммерческих лабораториях. Авторы провели анализ чувствительности, чтобы определить степень согласия с использованием различных критериев. Согласно наиболее консервативному определению согласия — отрицательные результаты тестирования в обеих лабораториях или положительные титры в двухкратном диапазоне друг от друга — совпадение наблюдалось в 18 процентах парных лабораторных результатов.Сорок два процента тестирования соответствовали наиболее мягким критериям, которые определяли титры ANA менее 1: 160 как отрицательные и допускали меньшую или равную четырехкратной разнице в титрах, чтобы быть приемлемым соглашением (Abeles AM, et al. Clin Rheumatol .2016; 35 [7]: 1713–1718).
Авторы пишут: «Это открытие ставит под сомнение надежность тестирования ANA в том виде, в каком оно проводится в настоящее время, и предполагает, что результаты могут частично зависеть от лабораторного центра, в который направляются пациенты.”
«Это проблема лабораторного сообщества», — сказал доктор Венер. «Легко увидеть что-то очень яркое или явно черное и негативное, но где же конечная точка? Где провести грань между положительным и отрицательным? » Фактически, это проблема для флуоресцентной микроскопии в целом.
Есть проблема внутри лабораторий и между лабораториями, «но есть также проблема между наборами и между реагентами», — сказал доктор Венер, цитируя исследование 2012 года, опубликованное в Американском журнале клинической патологии (Copple SS, et al.2012; 137 [5]: 825–830). Авторы сравнили результаты пяти анализов ANA IFA с использованием образцов сыворотки от пациентов с различными заболеваниями соединительной ткани и от 100 здоровых пациентов контрольной группы. В целом, согласие между пятью анализами составило 78 процентов (анализы считались согласующимися, когда они демонстрировали одинаковый титр и удвоение разведения).
«Это было тщательно проведенное исследование в рамках одной лаборатории с использованием единого критерия отсечения, при этом разные технологи смотрели на слайды», — сказал д-р.- сказал Венер. «Среди пациентов с волчанкой один и тот же образец, в зависимости от того, какой набор использовался, можно назвать положительным при 1:80 или положительным при 1: 2560. Один и тот же образец можно назвать отрицательным на АНА или положительным при титре до 1: 320 ».
| | Прямой | Косвенный |
| Время | Протоколы для прямой IF обычно короче, поскольку они требуют только одного шага маркировки. | Тот факт, что вы должны использовать конъюгированное вторичное антитело для обнаружения первичного антитела, требует дополнительных шагов. |
| Стоимость | Конъюгированные первичные антитела обычно дороже, чем их неконъюгированные аналоги. | Вторичные антитела относительно недороги по сравнению с первичными антителами. Дополнительная экономия может быть достигнута за счет использования одного и того же конъюгированного вторичного антитела для обнаружения различных первичных антител. |
| Сложность | Меньшее количество шагов в протоколе упрощает прямые методы. | Дополнительная сложность непрямых методов может быть результатом выбора подходящего вторичного антитела. Это особенно актуально в мультиплексных экспериментах, где необходимо несколько вторичных антител, каждое из которых нацелено на разные виды и конъюгировано с разными красителями. |
| Гибкость | Коммерчески доступные предварительно конъюгированные первичные антитела ограничивают вашу гибкость. | Возможность использования различных конъюгированных вторичных антител добавляет большую гибкость. |
| Чувствительность | Сигнал, полученный прямыми методами, может показаться слабым по сравнению с непрямыми методами, поскольку усиления сигнала, обеспечиваемого использованием вторичных антител, не происходит. | Несколько вторичных антител будут связываться с первичным антителом, что приведет к усилению сигнала. |
| Перекрестная реактивность видов | Перекрестная реактивность видов минимизирована прямыми методами, поскольку флуорофор уже конъюгирован с первичным антителом. | Вторичные антитела могут перекрестно реагировать с видами, отличными от мишени. Использование предварительно адсорбированных вторичных антител может предотвратить перекрестную реактивность. |
| Фон | Неспецифическое связывание снижается за счет использования конъюгированных первичных антител. | Образцы с эндогенными иммуноглобулинами могут показывать высокий фон при использовании непрямых методов. |


