Аортальные пороки. Часть 1 Аортальный стеноз
Стадии аортального стеноза 0 ст – компенсация: площадь аортального отверстия 0,75-1 см2, систолическая гипертензия, минутный объем – N, мелодия аортального стеноза, субъективных симптомов нет. Гемодинамика сохранена
1 ст – скрытая недостаточность кровообращения: площадь 0,75 и <см2, резкая систолическая гипертензия, градиент АД, минутный объем – N (в покое), фиксированный сердечный выброс, формируется гипертрофия левого желудочка, сохраняется мелодия АС, появление симптомов при физической нагрузке
2 ст – хроническая недостаточность кровообращения: площадь 0,75-0,5 см2 Дистрофия и фиброз миокарда левого желудочка, фиксированный сердечный выброс, повышение давления в малом круге, ишемия сердца и мозга. Клиника (головокружение, одышка, сердечная астма)
3 ст– тотальная недостаточность кровообращения: необратимые дистрофия и фиброз левого желудочка, повышение давления в малом и большом круге, дистрофия органов, тотальная хроническая сердечная недостаточность. На этой стадии операцию делать поздно
На этой стадии операцию делать поздно
Дифференциальная диагностика систолических шумов
Систолический шум при аортальной стенозе грубый, проводится над сосудами шеи. При аускультации возможно услышать шум при эмфиземе легких – он лучше слышен лежа на правом боку, на выдохе. Систолический шум при врожденных пороках (дефект межжелудочковой перегородки) сопровождается гипертрофией правого желудочка и гипертрофией правого предсердия, происходит увеличения правых отделов сердца. Систолический шум можно выслушать при коарктации аорты – симптомом является снижение систолического давления на ногах и подкожная пульсация межреберных артерий.
Показания к оперативному лечению
• Появление частых ангинозных болей, сердечной астмы и обмороков
• ЭКГ-признаки ГЛЖ и ишемические изменения ST
• ЭХОКГ-признаки АС (критический АС, выраженная ГЛЖ, митрализация порока, рост конечного диастолического давления)
Критическим аортальный стенозом считается амплитуда открытия створок менее 1 см и градиент давления на уровне аортального клапана более 50.
Консервативная терапия
Включает в себя лечение сердечной недостаточности, лечение сопутствующей патологии с целью замедления прогрессирования аортального стеноза.
Необходимо избегать энергичной спортивной и физической нагрузки при выраженном аортальном стенозе. Если у пациента легкая форма аортального стеноза, то ему рекомендовано проводить ЭХОКГ каждые 2 года. Бессимптомным пациентам с выраженным аортальным стенозом ЭХОКГ рекомендовано проводить ЭХОКГ каждые 6-12 месяцев.
При компенсации – лечение симптоматическое, при АГ и стенокардии – бета-адреноблокаторы. При декомпенсации – лечение хронической сердечной недостаточности: диуретики, ингибиторы АПФ, сердечные гликозиды.
Противопоказаны периферические вазодилататоры (в том числе и при стенокардии)
У пациентов с выраженным аортальным стенозом при формировании гипертрофии левого желудочка могут появляться желудочковые нарушения ритма. Это требует лечения. Наиболее подходящим препаратом является амиодарон.
Наиболее подходящим препаратом является амиодарон.
Осложнения аортального стеноза
• Полная блокада левой ножки пучка Гиса, АВ-блокада
• Острый инфаркт миокарда
• Левожелудочковая недостаточность
• Синкопальные состояния
• Внезапная смерть
Показания для протезирования аортального клапана при аортальном стенозе
- Симптомный выраженный аортальный стеноз
- Умеренный или выраженный аортальный стеноз на момент проведения аортокоронарного шунтирования
- Бессимптомный аортальный стеноз с дисфункцией левого желудочка.
- Бессимптомный выраженный аортальный стеноз в случае:
• требования более высокого уровня физической нагрузки
• планируемого переезда в места, отдаленные от медицинской помощи
• операции выбора для пациентов с выраженной обструкцией с учетом их пожеланий
Прогноз
• Продолжительность жизни после появления недостаточности кровообращения – 2-3 года
• 15-20% — внезапная смерть
• Своевременная операция – при выраженном стенозе
• Оперативное лечение при незначительном АС – ухудшает прогноз!
Если стеноз незначительный, не требующий срочного оперативного вмешательства, требующий только наблюдения, оперативное лечение проводить не следует. Операция проводится при появлении клинических признаков аортального стеноза.
Операция проводится при появлении клинических признаков аортального стеноза.
Факторы риска при оперативной лечении
• Ишемическая болезнь сердца, формирование фибрилляций предсердий, артериальная гипертензия
• Женский пол
• Возраст более 70 лет
• Формирование сердечной недостаточности, фракция выброса <45%
• Одновременная пластика митрального клапана
• Хроническая почечная недостаточность
• Экстренная операция
При обсуждении оперативного лечения при аортальной стенозе эти факторы нужно учитывать.
Аортальные пороки. Часть 2 Аортальная недостаточность
Видна гипертрофия левого желудочка. При митрализации порока можно увидеть гипертрофию левого предсердия и потом в стадию декомпенсации комбинированную гипертрофию за счет того, что присоединятся гипертрофия правого желудочка.Рентген
На рентгене можно видеть аортальную конфигурацию сердца: выбухание дуги левого желудочка, выбухание восходящей аорты, тень сердца увеличена вправо и усилен легочный рисунок.
ЭХОКГ
Структура аортального клапана – деформация, кальциноз, нарушение движения створок. Описание регургитации на аортальном клапане и описание камер сердца (дилатация и гипертрофия левого желудочка).
Диагностические критерии
• Клапанные (прямые) критерии аортальной недостаточности: диастолический шум, ослабление 2 тона, аортальная регургитация, отсутствие смыкания створок АК
• Левожелудочковые (косвенные) критерии: гипертрофия левого желудочка, дилатация
• Периферические критерии: низкое диастолическое давление, рост систолического давления, боли в сердце за счет перерастяжения коронарных сосудов, шум Траубе.
Степени аортальной недостаточности по Мухарлямову
• 1ст – незначительная выраженность. Небольшой диастолический шум в точке Боткина, незначительная гипертрофия левого желудочка
• 2 ст – умеренная. Диастолический шум интенсивнее, проводится на верхушку, ослабление 2 тона, увеличение конечного систолического размера (до 5,5 см) и конечного диастолического размера (до 7 см)
• 3 ст. – резкая выраженность. Диастолический шум над всеми точками, отсутствие 2 тона, значительное увеличение конечного систолического и диастолического размера.
– резкая выраженность. Диастолический шум над всеми точками, отсутствие 2 тона, значительное увеличение конечного систолического и диастолического размера.
Лечение
Консервативное лечение сводится к лечению хронической сердечной недостаточности. Хирургическое лечение – обсуждается имплантация клапана при клинических проявлениях и выраженном увеличении левого желудочка.
Комбинированный порок аортального клапана
Комбинированный порок – это сочетание и стеноза и недостаточности аортального клапана. По рентгену можно увидеть аортальную конфигурацию сердца. Кроме этого наблюдается гипертрофия левого желудочка, грубый систолический шум (признак аортального стеноза) и мягкий диастолический шум (признак аортальной недостаточности). Рост пульсового давления и объемная перегрузка (признак аортальной недостаточности). Если формируется систолическая перегрузка и гипертрофия левого желудочка концентрическая, а пульсовое давление в норме – это преобладание аортального стеноза.
Решение принимается по данным ЭХОКГ или же по ангиографии. Необходимо выявить, какой порок преобладает: стеноз или недостаточность. Выбор в пользу комиссуротомии или в пользу протезирования клапана.
В последнее время считается, что единственным эффективным и радикальным методом лечения таких пациентов является протезирование аортального клапана.
Дифференциальный диагноз пороков сердца по данным физикального обследования
Приобретенный порок сердца
Определение
Пороки сердца приобретенные — поражения сердечного клапана (клапанов), створки которого оказываются неспособными к полному раскрытию (стеноз) клапанного отверстия или к смыканию (недостаточность клапана) или к тому и другому (комбинированный порок).
Этиология и патогенез
Этиология стеноза и комбинированного порока ревматическая, недостаточности клапанов — обычно ревматическая, редко септическая, атеросклеротическая, травматическая, сифилитическая.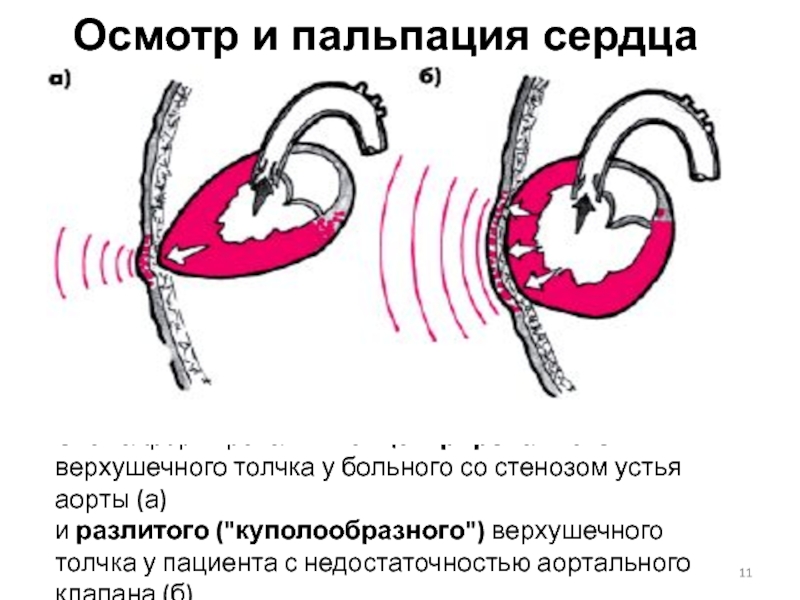 Стеноз образуется вследствие рубцового сращения или рубцовой ригидности створок клапана, подклапанных структур; недостаточность клапана — вследствие их разрушения, повреждения или рубцовой деформации. Пораженные клапаны образуют препятствие прохождению крови — анатомическое при стенозе, динамическое при недостаточности. Последнее заключается в том, что часть крови хотя и проходит через отверстие, но в следующую фазу сердечного цикла возвращается обратно. К эффективному объему добавляется «паразитический», совершающий маятникообразное движение по обе стороны пораженного клапана. Значительная клапанная недостаточность осложняется относительным стенозом (за счет увеличения объема крови). Препятствие прохождению крови ведет к перегрузке, гипертрофии и расширению вышележащих камер сердца. Затруднение работы сердца вследствие неправильного функционирования клапана и дистрофии гипертрофированного миокарда приводит к развитию сердечной недостаточности.
Стеноз образуется вследствие рубцового сращения или рубцовой ригидности створок клапана, подклапанных структур; недостаточность клапана — вследствие их разрушения, повреждения или рубцовой деформации. Пораженные клапаны образуют препятствие прохождению крови — анатомическое при стенозе, динамическое при недостаточности. Последнее заключается в том, что часть крови хотя и проходит через отверстие, но в следующую фазу сердечного цикла возвращается обратно. К эффективному объему добавляется «паразитический», совершающий маятникообразное движение по обе стороны пораженного клапана. Значительная клапанная недостаточность осложняется относительным стенозом (за счет увеличения объема крови). Препятствие прохождению крови ведет к перегрузке, гипертрофии и расширению вышележащих камер сердца. Затруднение работы сердца вследствие неправильного функционирования клапана и дистрофии гипертрофированного миокарда приводит к развитию сердечной недостаточности.
Клиническая картина
Митральный порок — поражение митрального клапана, сопровождающееся затруднением прохождения крови из малого круга в большой на уровне левого атриовентрикулярного отверстия. Проявляется сердечной недостаточностью. При повышении давления в малом круге появляются жалобы на одышку (более выраженную при стенозе), сердцебиение, кашель, при нарастании правожелудочковой недостаточности — на задержку жидкости и боль в правом подреберье. При осмотре в выраженных случаях заметен характерный цианотичный румянец щек и губ. Нередко бывает экстрасистолия.
Проявляется сердечной недостаточностью. При повышении давления в малом круге появляются жалобы на одышку (более выраженную при стенозе), сердцебиение, кашель, при нарастании правожелудочковой недостаточности — на задержку жидкости и боль в правом подреберье. При осмотре в выраженных случаях заметен характерный цианотичный румянец щек и губ. Нередко бывает экстрасистолия.
Митральный стеноз. При незначительном сужении левого атриовентрикулярного отверстия (площадь отверстия более 1,5 см2) одышка появляется только при значительных нагрузках. При умеренном стенозе (площадь атриовентрикулярного отверстия от 1 до 1,5 см2) одышка появляется при менее значительных нагрузках. Прогрессирующая сердечная недостаточность может развиться и при умеренном стенозе, но не так быстро и неотвратимо, как при резком. Для резкого стеноза (площадь атриовентрикулярного отверстия 1 см2 и менее) характерна одышка при незначительных и минимальных нагрузках, приступы удушья, ортопноэ. Резкий митральный стеноз предопределяет развитие прогрессирующей сердечной недостаточности.
Недостаточность митрального клапана. При незначительной недостаточности жалоб нет. При умеренной недостаточности могут появиться жалобы на сердцебиение, повышенную утомляемость, умеренную одышку, задержку жидкости. Эпизодически отмечается пастозность голеней. При значительной недостаточности митрального клапана симптомы сердечной недостаточности могут быть выраженными вплоть до признаков отечнодистрофической стадии, но могут оставаться и едва уловимыми.
Аортальный порок. Симптомы и течение определяются формой порока (аортальный стеноз или недостаточность аортального клапана) и тяжестью гемодинамических расстройств. Аортальный стеноз может быть ревматическим (атеросклеротическим) или врожденным. Недостаточность выброса крови в аорту может приводить к недостаточности мозгового и коронарного кровообращения (в первую очередь при нагрузке и переходе в вертикальное положение), что проявляется как субъективными, так и объективными признаками. Симптомы зависят от степени стеноза и гемодинамических расстройств. Стадия порока определяется наличием хотя бы одного из нижеперечисленных «достаточных» признаков более тяжелой стадии.
Стадия порока определяется наличием хотя бы одного из нижеперечисленных «достаточных» признаков более тяжелой стадии.
Стадия I: только акустические признаки порока.
Стадия II: субъективных расстройств еще нет. Наличие шума.
Стадия III: могут появиться субъективные расстройства — головокружение, потемнение в глазах, стенокардия при физических нагрузках.
Стадия IV: выраженные расстройства мозгового или коронарного кровообращения при незначительных нагрузках. Митрализация порока с появлением хотя бы одного из следующих признаков застойной левожелудочковой недостаточности: выраженная одышка при умеренных физических нагрузках, эпизоды сердечной астмы. У некоторых больных — мерцательная аритмия. Летальный исход обычно наступает в этой стадии, нередко — в предыдущей.
Стадия V (терминальная) успевает развиться только у некоторых больных. Ее признаками являются кардиомегалия, правожелудочковая недостаточность, частые (неоднократные в течение недели) приступы сердечной астмы, тяжелая стенокардия.
Недостаточность аортального клапана. Этиология обычно ревматическая. Редко — подострый септический эндокардит, атеросклероз аорты и др. Характерным признаком является специфический дующий диастолический шум.
Стадия I: только диастолический шум. В следующих стадиях обнаруживаются перечисляемые ниже признаки более тяжелой степени нарушения гемодинамики.
Стадия II: субъективных расстройств нет.
Стадия III: субъективные расстройства отсутствуют или выражены умеренно (сердцебиение, умеренная стенокардия, головокружение, ощущение пульсации в голове, в других областях).
Стадия IV: выраженная стенокардия, левожелудочковая недостаточность с одышкой при умеренных нагрузках. Возможны мерцательная аритмия и другие нарушения сердечного ритма.
Стадия V: тяжелая стенокардия. Выраженная застойная левожелудочковая недостаточность с частыми (повторными в течение месяца) приступами сердечной астмы. У многих больных — одышка при незначительных нагрузках.
Диагностика
Электрокардиография. Эхокардиографическое исследование позволяет обнаружить стеноз и оценить его степень; в режиме секторального сканирования степень митрального стеноза (площадь левого атриовентрикулярного отверстия) определяется с большой точностью. При допплеркардиографическом исследовании обнаруживается обратный ток крови (недостаточность клапана). Рентгенологически обнаруживаются увеличение границ сердца и застойные изменения в легких. Ангиографическое исследование помогает определить размеры полости левого желудочка, толщину его стенок, место ссужения, степень деформации и подвижность створок клапана.
Лечение
Лечение собственно порока может быть только хирургическим. Для уточнения показаний к такому лечению необходима своевременная консультация специалиста — кардиохирурга. Консервативная терапия сводится к предупреждению и лечению рецидива основного процесса и осложнений, к лечению и предупреждению сердечной недостаточности, также нарушений сердечного ритма.
Лечение сердечной недостаточности требует применения диуретинов и сердечных гликозидов. Применяются также вазодилататоры. Антиангинальные препараты и вазодилататоры применяют при необходимости.
Большое значение имеют своевременная и адекватная профессиональная ориентация .к трудоустройство больного.
Прогноз
Прогноз и трудоспособность определяется степенью сердечной недостаточности.
Стеноз аортального клапана
Дата публикации: .
Содержание:
Стеноз аортального клапана является наиболее часто встречающейся клапанной патологией сердца и третьей наиболее распространенной сердечной патологией после артериальной гипертензии и ИБС. В популяции старше 65 лет аортальный стеноз встречается у 2-7% людей. Учитывая увеличивающуюся продолжительность жизни и возрастание числа пожилых людей, встречаемость данной патологии будет только увеличивается, что имеет большую социальную значимость.
Анатомия аортального клапана
Аортальный клапан отделяет терминальный отдел выводного отдела левого желудочка (ЛЖ) от аорты. В норме аортальный клапан имеет 3 полулунные створки. Пространство между свободным краем створки и местами крепления створки к аорте называется синусом Вальсальвы. Так как коронарные артерии отходят только от двух из трех створок, синусы и соответствующие им створки называются: левая коронарная, правая коронарная и некоронарная створка (синус). Створки отделены одна от другой с помощью комиссур. Створки аортального клапана соприкасаются по центру аорты образуя линию коаптации.
Из-за полулунной формы створок аортальный клапан не имеет истинного фиброзного кольца в традиционном понимании. Места крепления створок к стенке корня аорты имеют полулунную форму.
Аортальный клапан открывается и закрывается в ответ на разницу давления между левым желудочком и аортой во время разных фаз сердечного цикла. Давление, создаваемое во время сокращения левого желудочка, приводит к открытию клапана, с последующим закрытием клапана в ответ на возросшее давление в аорте. Анатомо-физиологические свойства клапана позволяют ему открываться с минимальным трансклапанным градиентом и полностью закрываться с минимальным обратным кровотоком (регургитацией).
Этиология и патогенез стеноза аортального клапана
Аортальный стеноз может быть вызван:
- Дегенерацией клапана – кальцификацией анатомически нормального трехстворчатого аортального клапана в старческом возрасте.
- Прогрессивной кальцификацией врожденного двухстворчатого аортального клапана.
- Ревматическим поражением, которое вызывает стеноз и недостаточность аортального клапана, а также чаще всего сопровождается поражением митрального клапана.
Дегенерация клапана – это активный процесс, который схож с атеросклерозом, вызываемый воспалением, гемодинамической травмой и отложением липидов с макрофагальной инфильтрацией. Атеросклеротическое поражение артерий присутствует у примерно 50% пациентов с кальцинированный аортальным стенозом. Кальцинированный стеноз врожденного двухстворчатого аортального клапана встречается преимущественно в возрасте 30-60 лет, в то время как дегенеративный кальцинированный стеноз трехстворчатого аортального клапана чаще выявляется в возрасте 70-80 лет.
Аортальный стеноз является наиболее распространенной клапанной патологией, встречающейся в развитых странах у взрослых.1 Выполнение скрининговой эхокардиографии (ЭхоКГ) показывает, что у 2% популяции старше 65 лет присутствует изолированный кальцинированный стеноз аортального клапана, а у 29% возрастной склероз аортального клапана без стеноза.2 Аортальный стеноз чаще встречается у мужчин и эта частота увеличивается с возрастом.3 В возрасте 65-75 лет, 75-85 лет и старше 85 лет частота встречаемости аортального стеноза составляет 1,3%, 2,4% и 4% от популяции.4
Дегенеративный аортальный стеноз
Возрастная дегенерация аортального клапана является наиболее частой причиной формирования аортального стеноза, которая наиболее часто возникает у 70-ти и 80-ти летних. Первично возникает кальциноз основания створок (места сгибания створок), что делает створки неподвижными. В дальнейшем процесс распространяется на фиброзное кольцо аортального клапана и даже на стенку аорты. После этого, неподвижные створки начинают испытывать повышенную гемодинамическую нагрузку и травму. Этот процесс продолжается в течении многих лет, вызывая в них пролиферативные и воспалительные изменения. Эти изменения заключаются в накоплении жиров, повышении активности ангиотензинпреврашающего фермента (АПФ), инфильтрации макрофагами и Т лимфоцитами, что схоже патогенезу атеросклероза. 5
Факторами риска развития кальцинированного стеноза аортального клапана являются факторы, которые аналогичны факторам риска развития атеросклероза:4
- Повышенный уровень липопротеидов низкой плотности.
- Сахарный диабет.
- Курение.
- Артериальная гипертензия.
Следовательно, ИБС часто встречается у пациентов с кальцинированным стенозом аортального клапана. Возрастные склеротические изменения аортального клапана сопровождаются повышением риска внезапной сердечной смерти и инфаркта миокарда.
Другими причинами, которые могут вызывать кальцинированный стеноз аортального клапана являются:
- Болезнь Педжета.
- Терминальная стадия почечной недостаточности.
- Охроноз.
- Поражение сердца после лучевой терапии.
Кальциноз 2х створчатого клапана
Кальцинированный стеноз 2х створчатого аортального клапана является наиболее часто встречающейся формой врожденного аортального порока. Частота встречаемости 2х створчатого аортального клапана составляет 2% от популяции. Постепенная кальцинации 2х створчатого аортального клапана приводит к формированию значимого стеноза аортального клапана в возрасте 40-50 лет. Это процесс идет быстрее при моностворчатом аортальном клапане чем при двухстворчатом, а также у мужчин это происходит раньше, чем у женщин.6,7 Патологическая анатомия моно- и двухстворчатого аортального клапана приводит к турбулентному потоку, что повреждает створки и приводит к фиброзу, ригидности, кальцинозу створок и как следствие – к сужению отверстия аортального клапана. 8 Исследования выявили влияние нескольких генов на формировании двухстворчатого аортального клапана. Была установлена связь между генной мутацией, строением клапана и последующим его кальцинозом с формированием аортального стеноза.9-10 Структурные аномалии микрофибрилл в аортальном клапане и в стенке аорты приводят к нарушению их структурной целостности, что вызывает дилатацию аорты, формированию аневризмы и диссекции.11
Ревматический аортальный стеноз
В западных странах ревматизм реже всего является причиной формирования аортального стеноза, в то время как в РФ существуют эндемичные регионы по ревматизму. Ревматический аортальный стеноз редко бывает изолированным и часто сопровождается стенозом митрального клапана.
Патогенез стеноза аортального клапана
Аортальный клапан имеет площадь отверстия 3-4 см2 и пропускает кровь практически без сопротивления (имеет минимальный трансклапанный градиент). Приобретенный стеноз аортального клапана характеризуется постепенной кальцинацией створок и прогрессивным уменьшением площади отверстия. При формировании аортального стеноза, необходимый объем кровотока поддерживается за счет гипертрофии ЛЖ с одновременным повышением градиента на аортальном клапане. Гипертрофия ЛЖ это компенсаторный механизм, который направлен на уменьшение нагрузки на стенку ЛЖ и поддержание должного объема кровотока при увеличенной постнагрузке, которая возникает за счет стеноза аортального клапана. На этой стадии наполнение ЛЖ кровью в диастолу и укорочение по длинной оси в систолу уже снижено. Когда стеноз аортального клапана ограничивает увеличение кровотока в ответ на физическую нагрузку, могут возникать такие симптомы как одышка, гипотония, боли в области сердца и даже эпизоды потери сознания. Далее происходит гибель кардиомиоцитов и замещение их соединительной тканью (фиброз), таким образом, гипертрофия приводит к дисфункции ЛЖ и появлению симптомов сердечной недостаточности.
Пациенты со стенозом аортального клапана остаются бессимптомными в течении нескольких лет, а момент появления симптомов является переломным – с этого момента погибает 50% пациентов в течении 3х лет. У пациентов, не предъявляющих жалобы и выраженным аортальным стенозом частота внезапной сердечной смерти составляет 1,5% в год. Дифференциальная диагностика бессимптомных пациентов и пациентов, предъявляющих незначительные жалобы часто является затруднительной, однако это имеет большое значение так как появление симптомов является прямым показанием к хирургическому вмешательству. Предвестниками появления симптомов у бессимптомных пациентов являются: старческий возраст, темпы возрастания градиента на аортальном клапане, атеросклеротическое поражение периферических артерий, увеличение градиента на аортальном клапане при физической нагрузке, выраженная гипертрофия миокарда ЛЖ и появление симптомов при физической нагрузке. Появление симптомов является не единственным показанием к хирургическому вмешательству. Снижение ФВ ЛЖ ≤50% является также показанием к протезированию аортального клапана.
Клинические симптомы
Основными симптомами стеноза аортального клапана являются:
- Грудная жаба или стенокардия (ощущение или чувство дискомфорта, или боли за грудиной).
- Синкопальные состояния или обморок (кратковременные эпизоды потери сознания).
- Сердечная недостаточность (одышка, отеки нижних конечностей).
В то время как механизмы, вызывающие стенокардию и сердечную недостаточность ясны, механизмы, вызывающие синкопальные состояния недостаточно изучены. Общепринятая теория возникновения этого симптома считает, что увеличения сердечного выброса, которое происходит при физической нагрузке, не возникает из-за суженного отверстия аортального клапана, далее происходит снижение периферического сосудистого сопротивления в ответ на физическую нагрузку, падение артериального давления и как следствие гипоперфузия головного мозга.14 Синкопальные состояния также могут вызываться дисфункцией работы барорецепторов и как следствие неадекватным вазопрессорным ответом на увеличенное систолическое давление в ЛЖ во время физической нагрузки. Кроме того, помимо перечисленных выше, основных симптомов стеноза аортального клапана, пациенты предъявляют незначительные жалобы на усталость, снижение переносимости физической нагрузки и одышку при ней.
Другими проявлениями выраженного аортального стеноза являются фибрилляция предсердий (ФП) и легочная гипертензия (ЛГ). Инфекционный эндокардит при стенозе аортального клапана может возникать у молодых пациентов, в то время как у пожилых, с тяжелым кальцинированным стенозом аортального клапана он встречается редко.
У пациентов с выраженным стенозом аортального клапана присутствует долгий период бессимптомного прогрессирования, во время которого риск смерти относительно низкий.16 Риск внезапной сердечной смерти составляет 1% в год в бессимптомном периоде. После манифестации симптомов, без хирургического лечения, риск внезапной сердечной смерти составляет 25% в год.17 Если проявление симптомов начинается со стенокардии, то 5-ти летняя выживаемость составляет 50%. При синкопальных состояниях, как первый симптом, 50% погибают уже в течении 3-х лет, а симптомы сердечной недостаточности, возникающие как первый признак, говорят о 100% смертности в течении 2-х лет.16
Диагностика
Аускультация
Как правило стеноз аортального клапана выявляется при аускультации – это систолический шум, который выслушивается над 2-ым межреберьем справа от грудины и проводится на сосуды шеи.
ЭКГ
У большинства пациентов с выраженным стенозом аортального клапана наблюдаются изменения комплекса QRS и интервала ST, что отражает гипертрофию ЛЖ. При высоком градиенте на аортальном клапане на ЭКГ могут присутствовать признаки перегрузки ЛЖ.
Рентгенография
При компенсированном стенозе аортального клапана на рентгеногрфии грудной клетки можно увидеть концентрическую гипертрофию ЛЖ без кардиомегалии, постстенотическое расширение восходящей аорты и кальциноз створок аортального клапана. При декомпенсации проявляется кардиомегалия и усиление легочного рисунка.
Необходимо отметить, что рентгенологическая картина может быть в пределах нормы у пациентов с компенсированным аортальным стенозом.
Эхокардиография
Эхокардиография (ЭхоКГ) является методом выбора в диагностике стеноза аортального клапана и определения его выраженности. ЭхоКГ используется для определения выраженности стеноза аортального клапана и его этиологии, сопутствующей патологии других клапанов, определения размеров камер сердца и их функции.
Развитие диастолической дисфункции у пациентов со стенозом аортального клапана может приводить к появлению симптомов и увеличению летальности после протезирования аортального клапана.18,19
При выявлении стеноза аортального клапана, ЭхоКГ должна выполнятся при изменении симптомов или их появлении при их изначальном отсутствии, или с определенной периодичностью – раз в 3-5 лет при невыраженном аортальном стенозе, раз в 1-2 года при умеренном стенозе и раз в 6-12 месяцев при выраженном стенозе. Цель этого исследования – оценка прогрессирования стеноза, появления дисфункции ЛЖ, оценка гипертрофии ЛЖ и недостаточности митрального клапана.
Классификация выраженности стеноза аортального клапана
20|
Показатель |
Невыраженный |
Умеренный |
Выраженный |
|
Площадь аортального клапана (см2) |
>1,5 |
1,0-1,5 |
<1,0 |
|
Средний трансклапанный градиент ( мм рт. ст.) |
<25 |
25-40 |
>40 |
|
Пиковая скорость кровотока (м/сек) |
<3,0 |
3,0-4,0 |
>4,0 |
Нагрузочные пробы
У пациентов со стенозом аортального клапана и симптоматикой нагрузочные пробы должны избегаться. Считается, что выраженный стеноз аортального клапана является относительным противопоказанием к выполнению нагрузочных проб, однако последние исследования показали безопасность проведения ЭхоКГ с нагрузкой у бессимптомных пациентов. Это исследование может выявлять пациентов, которые находятся в группе риска манифестации симптомов и/или которым показано протезирование аортального клапана. У бессимптомных пациентов с выраженным стенозом аортального клапана, которые начинают предъявлять жалобы во время нагрузки, выше риск внезапной сердечной смерти или необходимости протезирования аортального клапана.21,22,23 Таким образом, пациенты с выраженным стенозом аортального клапана и дебютом симптомов во время нагрузочной пробы следует считать предъявляющими жалобами. Добутаминовая стресс ЭхоКГ может проводиться у пациентов с умеренным аортальным стенозом и сниженной ФВ ЛЖ для определения резерва сократимости и выраженности стеноза.24,25
Показания к операции
Определение показаний к оперативному вмешательству при стенозе аортального клапана, а также выбор его метода (открытая операция или TAVR) в настоящее время основывается на клинических рекомендациях, которые представляют собой четкий алгоритм по принятию решения, который основывается на данных доказательной медицины.
Показания к вмешательству при стенозе аортального клапана и рекомендации по выбору типа вмешательства.
|
Аортальный стеноз с клиническими проявлениями |
Класс1 |
Уровень2 |
|
Показано вмешательство у пациентов предъявляющих жалобы с выраженным, высокоградиентным аортальным стенозом (средний градиент ≥40 мм рт. ст. или пиковая скорость ≥4,0 м/с. |
I |
B |
|
Показано вмешательство у пациентов предъявляющих жалобы с выраженным низкопоточным, низкоградиентным (<40 мм рт. ст.) аортальным стенозом со сниженной ФВ и доказанным резервом потока (сократимости) за исключением псевдовыраженного аортального стеноза. |
I |
C |
|
Вмешательство должно рассматриваться у пациентов предъявляющих жалобы с низкопоточным, низкоградиентным (<40 мм рт. ст.) аортальным стенозом с нормальной ФВ после точного подтверждения выраженности аортального стеноза. |
IIa |
C |
|
Вмешательство должно рассматриваться у пациентов, предъявляющих жалобы с низкопоточным, низкоградиентным аортальным стенозом со сниженной ФВ и отсутствием резервом потока (сократимости), особенно при подтверждении выраженности аортального стеноза по степени кальцификации аортального клапан на КТ. |
IIa |
C |
|
Вмешательство не должно выполняться пациентам с тяжелой сопутствующей патологией если его выполнение с малой вероятностью улучшит качество жизни или увеличит выживаемость. |
III |
C |
|
Выбор типа вмешательства при аортальном стенозе с клиническими проявлениями |
Класс1 |
Уровень2 |
|
Вмешательства на аортальном клапане должны выполняться только в клиниках где есть отделения кардиологии (интервенционной) и кардиохирургии при их тесном взаимодействии, включая мультидисциплинарные консилиумы. |
I |
C |
|
Выбор типа вмешательства должен основываться на тщательной индивидуальной оценки применимости метода и взвешивания преимуществ и недостатков в конкретном случае. Так же должен учитываться опыт и результаты выбранного метода в конкретной клинике. |
I |
C |
|
ПАК рекомендуется выполнять пациентам с низким риском хирургического вмешательства (STS или EuroSCORE II <4% или logistic EuroSCORE I <10% и отсутствие других факторов, не учтенных в данных калькуляторах риска таких как «фарфоровая» аорта и последствия лучевой терапии). |
I |
B |
|
TAVI рекомендуется выполнять пациентам, которые не подходят для ПАК решением мультидисциплинарного консилиума. |
I |
B |
|
У пациентов с повышенным риском хирургического вмешательства (STS или EuroSCORE II ≥4% или logistic EuroSCORE I ≥10% или присутствие других факторов, не учтенных в данных калькуляторах риска таких как «фарфоровая» аорта и последствия лучевой терапии), решение о выборе ПАК или TAVI должно приниматься мультидисциплинарным консилиумом исходя из индивидуальных особенностей пациента, отдавая предпочтение TAVI у пожилых пациентов с возможностью трансфеморального доступа. |
I |
B |
|
Баллонная аортальная вальвулопластика может быть рассмотрена как «мост» к ПАК или TAVI у гемодинамически нестабильных пациентов или у пациентов с выраженным аортальным стенозом и клиническими проявлениями при необходимости выполнения большой операции по поводу экстракардиальной патологии. |
IIb |
C |
|
Баллонная аортальная вальвулопластика может быть рассмотрена как диагностическое средство у пациентов с выраженным стенозом аортального клапана или другими потенциальными причинами симптомов (заболевания легких) и у пациентов с выраженной дисфункцией миокарда, почечной недостаточностью или другой патологией органов, которая может иметь обратимый характер, при выполнении в клинике имеющей возможность при необходимости выполнить TAVI. |
IIb |
C |
|
Бессимптомные пациенты с выраженным аортальным стенозом (относится только к пациентам подходящим для ПАК) |
Класс1 |
Уровень2 |
|
ПАК показано бессимптомным пациентам с выраженным аортальным стенозом и систолической дисфункцией ЛЖ (ФВ ЛЖ <50%), которая не вызвана другой причиной. |
I |
C |
|
ПАК показано бессимптомным пациентам с выраженным аортальным стенозом и положительной нагрузочной пробой, которая вызывает симптомы, четко связанные с аортальным стенозом. |
I |
C |
|
ПАК должно быть рассмотрено у бессимптомных пациентов с выраженным аортальным и положительной нагрузочной пробой, при которой происходит падение АД ниже исходного уровня. |
IIa |
C |
|
ПАК должно быть рассмотрено у бессимптомных пациентов с нормальной ФВ ЛЖ и отсутствием одного из вышеперечисленных проявлений нагрузочной пробы если риск хирургического вмешательства низкий и присутствует одно из нижеперечисленного: · Критический аортальный стеноз с пиковой скоростью трансклапанного кровотока >5,5 м/с. · Выраженный кальциноз клапана и увеличение пиковой скорости трансклапанного кровотока ≥0,3 м/с/год. · Заметно повышенный уровень BNP (более трехкратное увеличения возрастной/половой нормы) при повторных исследованиях, без других причин, объясняющих его увеличение. · Высокая легочная гипертензия (систолическое давление в легочной артерии в покое >60 мм рт. ст., что подтверждено инвазивным измерением), без других причин, объясняющих его увеличение. |
IIa |
C |
|
Одномоментное вмешательство на аортальном клапане при выполнении других операций на сердце/аорте. |
Класс1 |
Уровень1 |
|
ПАК показано пациентам с выраженным аортальным стенозом при выполнении АКШ или при вмешательстве на восходящей аорте или другом клапане. |
I |
C |
|
ПАК должно быть рассмотрено у пациентов с умеренным аортальным стенозом при выполнении АКШ или при вмешательстве на восходящей аорте или другом клапане, после решения мультидисциплинарного консилиума. |
IIa |
C |
ПАК – протезирование аортального клапана (открытое), TAVI – transcatheter aortic valve implantation (транскатетерная имплантация аортального клапана, STS – Society of Thoracic Surgeons (Сообщество торакальных хирургов США), BNP — мозговой натрийуретический пептид.
1Класс рекомендаций.
2Уровень доказательности.
Показания к вмешательству при аортальном стенозе с клиническими проявлениями
Всем пациентам с выраженным аортальным стенозом и клиническими проявлениями настоятельно рекомендуется незамедлительно начать лечение в связи с неутешительным прогнозом при отсутствии лечения. Единственным исключением являются пациенты с тяжелой сопутствующей патологией и ожидаемой продолжительностью жизни менее 1 года, а также пациенты у которых сопутствующая патология или общее состояние вследствие преклонного возраста не дадут улучшения качества и выживаемости после коррекции порока.
Если средний трансклапанный градиент остается >40 мм рт. ст. то по факту, никакое снижение ФВ ЛЖ не является противопоказанием к коррекции порока, будь то ПАК или TAVI.
Лечение же пациентов с низкоградиентыми стенозами аортального клапана представляет собой более сложную задачу.
Выбор метода коррекции аортального стеноза у пациентов с клиническими проявлениями
При выборе метода коррекции порока следует учитывать кардиальную и эстракардиальную патологию пациента, индивидуальный риск хирургического вмешательства, который оценивается мультидисциплинарным консилиумом по мимо расчета по специальным шкалам, а также применимость TAVI в конкретном случае и опыт клиники.
В настоящее время, имеется крайне ограниченное количество данных по применению TAVI у пациентов моложе 75 лет и с низким риском открытого оперативного вмешательства, у которых ПАК является общепринятым методом коррекции стеноза аортального клапана. Так же необходимо отметить, что более молодые пациенты отличаются по анатомии аортального клапана (больше 2х створчатых аортальных клапанов), что влияет на результаты TAVI (2х створчатые аортальные клапаны в целом исключались из исследований по применению TAVI), кроме того по-прежнему имеется недостаточно данных о долговечности TAVI в отдаленном периоде.
Доступные данные рандомизированных исследований и крупных регистров по применению TAVI у престарелых пациентов с повышенным риском хирургического вмешательства показали ее преимущество в выживаемости над лекарственной терапией у пациентов с крайне высоким риском, не худшие или лучшие результаты по сравнению с ПАК у пациентов с высоким риском и не худшие результаты по сравнению с ПАК или даже лучшие при возможности применения трансфеморального доступа у пациентов со средним риском хирургического вмешательства.26,27,28 Средний возраст пациентов в двух крупных исследований, включавших пациентов со средним риском хирургического вмешательства, составил 82 и 80 лет, а средний STS score 5,8% и 4,5%, кроме того большинство пациентов были признаны немощными (дряхлыми).29,30 Поэтому результаты достоверны при сравнении только сопоставимых групп. Совокупное количество сосудистых осложнений, имплантаций элекстрокардиостимулятора (ЭКС) и возникновения парапротеной регургитации было значительно больше при TAVI чем при ПАК, в то время как частота возникновения осложнений варьировалась в зависимости от типа протеза (TAVI).31 С другой стороны, тяжелые кровотечения, острая почечная недостаточность и возникновение фибрилляции предсердий наблюдаются чаще при ПАК, в то время как количество мозговых осложнений при ПАК и TAVI не отличалось. Благоприятные результаты TAVI были получены в масштабных национальных регистрах, которые суммируют результаты рандомизированных исследований. Эти данные поддерживают преимущества TAVI над ПАК у пожилых пациентов с повышенным риском хирургического вмешательства. Тем не менее, окончательное решение о применении ПАК или TAVI (включая выбор доступа) должно приниматься на мультидисциплинарном консилиуме после тщательной индивидуальной оценки. Баллонная вальвулопластика аортального клапана может быть рассмотрена как «мост» к ПАК или TAVI, или как диагностическая процедура.
Бессимптомный аортальный стеноз
Тактика лечения бессимптомного аортального стеноза остается до конца неопределенной. Результаты исследований, проведенных к настоящему времени, не дают убедительных данных за заблаговременное ПАК даже у пациентов с критическим аортальным стенозом.32,33 Принятие решения об операции у бессимптомных пациентов требует тщательного взвешивания пользы и рисков. Это относится только к пациентам, которым планируется ПАК, т.к. TAVI не рекомендуется бессимптомным пациентам. Заблаговременное выборочное хирургическое лечение показано бессимптомным пациентам со сниженной функцией ЛЖ, при отсутствии других причин для ее возникновения, у которых появляются жалобы при нагрузочных пробах.34,35
Прогностические факторы возникновения жалоб и неблагоприятного прогноза, у бессимптомных пациентов, включают в себя клинические аспекты (преклонный возраст, наличие факторов риска развития атеросклероза), эхокардиографические параметры (кальциноз клапана, пиковая скорость трансклапанного кровотока, ФВ ЛЖ, степень изменения гемодинамики, увеличение среднего трансклапанного градиента >20 мм рт. ст. во время нагрузочной пробы, чрезмерная гипертрофия ЛЖ, патологическая кинетика сокращения ЛЖ и легочная гипертензия) и биомаркеры (повышенный уровень BNP, однако точный уровень повышенных значений до сих пор не определен).36, 37, 38, 39 Когда рассматривается вариант превентивной операции у пациентов с нормальной переносимостью физических нагрузок, из-за наличия перечисленных выше прогностических факторов, риск хирургического вмешательства должен быть низкий. У пациентов с отсутствием прогностических факторов, наблюдательная тактика представляется безопасной и превентивное хирургическое вмешательство маловероятно принесет пользу.
Краткое содержание рекомендаций по аортальному стенозу: выбор сроков вмешательства.
|
Рекомендации |
Класс (сила) рекомендаций |
Уровень (качество) доказательств |
|
ПАК или TAVI рекомендуется пациентам с клиническими проявлениями (в анамнезе или при нагрузочной пробе) и выраженным высокоградиентным аортальным стенозом. |
I |
B |
|
ПАК или TAVI рекомендуется бессимптомным пациентам с выраженным аортальным стеноз и ФВ ЛЖ <50%. |
I |
B |
|
ПАК или TAVI показано пациентам с выраженным аортальным стенозом идущих на другую кардиохирургическую операцию. |
I |
B |
|
ПАК или TAVI рационально у бессимптомных пациентов с критическим аортальным стенозом (пиковая скорость трансклапанного кровотока ≥5,0 м/с) и низким риском хирургического вмешательства. |
IIa |
B |
|
ПАК или TAVI рационально у бессимптомных пациентов с выраженным аортальным стенозом и сниженной переносимостью физических нагрузок или падением АД во время нагрузочной пробы. |
IIa |
B |
|
ПАК или TAVI рационально у пациентов с клиническими проявлениями и низкопоточным/низкоградиентным выраженным аортальным стенозом со сниженной ФВ ЛЖ и пиковой скоростью трансклапанного кровотока ≥4,0 м/с (или средний трансклапанный градиент ≥40 мм рт. ст.) при выполнении стресс ЭхоКГ с низкими дозами добутамина и площадью аортального клапана ≤1,0 см2 при любой дозировке добутамина. |
IIa |
B |
|
ПАК или TAVI рационально у пациентов с клиническими проявлениями с низкопоточным/низкоградиентным выраженным аортальным стенозом, нормальным уровнем АД и ФВ ЛЖ ≥50% если клинические, гемодинамические и анатомические данные подтверждают сужение клапана и которые наиболее вероятно вызывают клинические проявления. |
IIa |
C |
|
ПАК или TAVI рационально у пациентов с умеренным аортальным стенозом (пиковая скорость трансклапанного кровотока 3,0-3,9 м/с) идущих на другую кардиохирургическую операцию. |
IIa |
C |
|
ПАК или TAVI может быть рассмотрено у бессимптомных пациентов с выраженным аортальным стенозом и быстрым прогрессированием стеноза и низкой степенью хирургического риска. |
IIb |
C |
Рекомендации по выбору типа вмешательства.
|
Класс (сила) рекомендаций |
Уровень (качество) доказательств |
Рекомендации |
|
I |
C |
Пациенты, рассматриваемые на TAVI или ПАК с высоким хирургическим риском, должны обсуждаться на мультидисциплинарном консилиуме, состоящем из специалистов по лучевой диагностике, интервенционной кардиологии, кардиоанестезиологии и кардиохирургии, которые имеют опыт в лечении клапанной патологии сердца для принятия решения об оптимальном лечении. |
|
I |
B-NR |
ПАК рекомендуется пациентам с выраженным аортальным стенозом и клиническими проявлениями, бессимптомным пациентам с выраженным аортальным стенозом, которым показано ПАК при низком или умеренном риске хирургического вмешательства. Обновления 2017: Уровень (качество) доказательств изменено с A на B-NR. |
|
I |
A |
Выбор между ПАК или TAVI у пациентов с выраженным аортальным стенозом и клиническими проявлениями при высоком риске хирургического вмешательства рекомендуется производить, основываясь на индивидуальных рисках вмешательства, показаниях и предпочтениях. Обновления 2017: Класс (сила) рекомендаций изменен с IIa на I, уровень (качество) доказательств изменен с B на A. Оценка в отдаленном периоде и рандомизированные исследования показали, что TAVI и ПАК равнозначны у пациентов с выраженным аортальным стенозом и клинической симптоматикой при крайне высоком риске хирургического вмешательства. |
|
I |
A |
TAVI рекомендуется пациентам с выраженным аортальным стенозом и клинической симптоматикой и крайне высоким риском ПАК, у которых ожидаемая продолжительность жизни после TAVI больше 12 мес. Обновления 2017: Уровень (качество) доказательств изменено с B на A. Оценка в отдаленном периоде в рандомизированных исследованиях и дополнительные исследования показали преимущество TAVI у пациентов с крайне высоким риском ПАК. |
|
IIa |
B-R |
TAVI является рациональной альтернативой ПАК у пациентов с выраженным хирургическим риском, клинической симптоматикой при умеренном риске хирургического вмешательства в зависимости от индивидуальных рисков вмешательства, показаний и предпочтений. Обновления 2017: Новые рандомизированные исследования показали отсутствие преимуществ TAVI над ПАК у пациентов с выраженным аортальным стенозом и клиническими проявлениями при умеренном хирургическом риске. |
|
IIb |
C |
Чрескожная баллонная аортальная вальвулопластика может быть рассмотрена как «мост» к ПАК или TAVI у пациентов с выраженным аортальным стенозом и клиническими проявлениями. |
|
III |
B |
TAVI не рекомендуется пациентам, у которых сопутствующая патология сведет на нет предполагаемую пользу от коррекции аортального стеноза. |
ПАК – протезирование аортального клапана (открытое), TAVI – transcatheter aortic valve implantation (транскатетерная имплантация аортального клапана.
Выбор типа протеза
Протезы аортального клапана в целом делятся на два вида – механические и биологические. Основными направлениями при разработке новых протезов было улучшение их гемодинамических характеристик, увеличение долговечности и снижение количества осложнений. Несмотря на это, не существует идеального искусственного клапана сердца и все протезы клапанов имеют недостатки.
Механические клапаны сердца
Наиболее часто имплантируемый вид механического протеза – это двухстворчатый протез. Основным преимуществом механических протезов является их долговечность. Однако их основным недостатком является необходимость в пожизненной антикоагулянтной терапии, что обуславливает необходимость частого контроля МНО (международное нормализованное отношение), трудности во взаимодействии с другими препаратами и поддержании адекватного уровня антикоагуляции, а также высокая частота кровотечений. Частота кровотечений, вызванных антикоагулянтной терапии, составляет 1-2% в год. Риски осложнений от антикоагулянтной терапии выше у возрастных пациентов и у пациентов с сопутствующей патологией такой как застойная сердечная недостаточность, артериальная гипертензия, сахарный диабет, ОНМК (острое нарушение мозгового кровообращения) или ТИА (транзиторная ишемическая атака). Так же к недостаткам механических протезов относят звук от закрытия створок, который может быть хорошо слышен. Однако только 6% пациентов с механическими протезами предъявляют жалобы на шум от их работы.
Биологические клапаны сердца
Каркасный ксеноперикардиальный биопреотез является наиболее часто имплантируемым биопротезом в позицию аортального клапана. Створки такого протеза изготавливаются из бычьего или свиного перикарда и поэтому подвергнуты риску структурной дегенерации. Возраст пациента в момент имплантации протеза является наиболее критичным фактором риска, чем моложе пациент, тем выше риск дегенерации протеза. Ожидаемая продолжительность жизни является основным фактором, который принимается во внимание при выборе типа протеза, однако надо учитывать, что ожидаемая продолжительность жизни у пациентов с протезом клапана сердца ниже чем в целом по популяции.
Обычно у пациентов старше 65 лет ожидаемая продолжительность жизни меньше, чем срок начала дегенерации биопротеза и его имплантации позволяет избежать антикоагулянтной терапии. У пациентов в возрастном интервале 60-65 лет, которым предстоит протезирование аортального клапана, имплантация двухстворчатого механического протеза представляется оптимальным решением. Несмотря на это, увеличивается использование биологических протезов у 60-ти летних пациентов и даже у более молодых из-за лучшего качества жизни, которое достигается отсутствием приема варфарина и акустическим комфортом, что обеспечивается применением биопротезов. Долговечность биопротезов обеспечивающая низкую частоту структурной дегенерации, усовершенствованные хирургические методики и послеоперационное лечение снизили риски повторных вмешательств после биопротезирования аортального клапана. Применение TAVI в рамках концепции «valve-in-valve» также может снизить рекомендуемый возраст выполнения биопротезирования. Пациенты с биопротезами также нуждаются в антикоагулянтах, при развитии у них фибрилляции предсердий. Однако, при фибрилляции предсердий можно поддерживать гипокоагуляцию другими доступными группами препаратов не требующих постоянный лабораторный контроль, а уровень гипокаогуляции возможен на более низком уровне, чем требуют механические клапаны сердца, что снижает частоту кровотечений.
Если необходимо протезирование клапана сердца женщине детородного возраста, выбор типа протеза представляется сложным. Имплантация механического протеза предполагает применение варфарина, фенпрокумона или аценкумарола, что увеличивает риск потери или врожденных пороков развития плода, а также повышает риски тромбоза протеза или родовых кровотечений.
Кроме качеств протеза, которые рассматриваются при выборе типа, необходимо учитывать особенности пациента. Так если у пациента отсутствует приверженность назначенному медикаментозному лечению, нет возможности контроля уровня гипокоагуляции или пациент отказывается принимать антикоагулянты, то применение биопротеза может быть предпочтительным, а механического нецелесообразным. С другой стороны, если пациент против возможной повторной операции из-за дегенерации биопротеза, механический протез является более подходящим.
Клинические рекомендации Американской ассоциации сердца и Американского колледжа кардиологов по лечению пациентов с клапанной патологией сердца 2014 года.
2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease
- Предполагается применение механического протеза при протезировании аортального клапана у пациентов моложе 60 лет при отсутствии противопоказаний к антикоагулянтной терапии.
- Предполагается применение биопротеза у пациентов старше 70 лет или при ожидаемой продолжительности жизни пациента меньше чем предполагаемая долговечность протеза.
- Предполагается применение механического или биологического протеза у пациентов в возрасте 60-70 лет.
- Рекомендуется применение биопротеза у пациентов любого возраста при наличии противопоказаний к антикоагулянтной терапии, при отсутствии возможности должного ее контроля или при нежелательности ее.
- Протезирование аортального клапана легочным аутографтом (операция Росса) может быть рассмотрено у молодых пациентов (при выполнении опытным хирургом) при наличии противопоказаний к антикоагулянтной терапии или ее нежелательности (возможность беременности).
Техника операции
Общие аспекты
Традиционным доступом считается срединная стернотомия так как она обеспечивает наибольшую визуализацию и удобство, что важно при выполнении протезирования аортального клапана. Так же применяется минестернотомия. Этот доступ позволяют минимизировать хирургическую травму, получить отличный косметический результат и сократить период нахождения пациента в стационаре и период восстановления.
В настоящее время протезирование аортального клапана выполняется в условиях искусственного кровообращения и остановленного сердца. Искусственное кровообращение используется при условиях гипотермии, умеренной гипотермии или нормотермии. Кардиоплегия используется кристаллоидная или кровяная.
Доступ к аортальному клапану при его протезировании осуществляется через аорту.
Осложнения
Тромбоэмболические осложнения
Тромбоэмболические события являются основной причиной нелетальных и летальных осложнений после операции протезирования аортального клапана. Частота тромбоэмболий составляет 0,6-2,3% в год. Частота тромбоэмболических осложнений одинаковая при протезировании аортального клапана механическими и биологическими протезами, однако следует учитывать, что пациенты с механическими протезами находятся на постоянной антикоагулянтной терапии.
У пациентов, которые постоянно принимают антикоагулянты, после протезирования аортального клапана, частота кровотечений составляет 1-2% в год.
Тромбоз протеза
Тромбоз механического протеза аортального клапана может возникать вследствие неадекватной антикоагулянтной терапии, что приводит к формированию функционального стеноза или регуритации. Тромбоз протеза может развиваться как постепенно, так и остро.
При развитии тромбоза протеза у гемдинамически стабильных пациентов возможно внутривенное назначение антикоагулянтов, как первый этап лечения. При нестабильности гемодинамики, часто требуется реоперация, которая заключается в репротезировании аортального клапана.
У двухстворчатых механических протезов тромбоз чаще всего происходит в области шарнирных сочленений створок и корпуса. У дисковых протезов наиболее частой локализацией является малое отверстие протеза.
Частота тромбоза механического протеза аортального клапана составляет 0,3% в год, а свобода от реоперации составляет более 97% в 20ти летнем периоде.40-42 Тромбоз биопротезов в аортальной позиции имеет место быть, но встречается крайне редко.43
Образование паннуса
Формирование паннуса – это разрастание фиброзной ткани, которое сужает просвет протеза и тем самым нарушает его функцию. Частота такого осложнения крайне низкая и в основном у механических протезов, причем у дисковых моделей.
Несоответствие протез-пациент
Несоответствие протез-пациент происходит, когда отверстие протеза слишком мало для обеспечения нормального кровотока. Это осложнение, у большинства пациентов, может не влиять на выживаемость, однако ухудшает прогноз у пациентов с нарушенной функцией левого желудочка. Тяжелое несоответствие протез-пациент приводит к увеличению госпитальной летальности.
Исследования, изучающие применение как механических, так и биологических протезов показали, что умеренное и тяжелое несоответствие протез-пациент встречается у 38% пациентов.44 При применении только биологических протезов, исследования выявили умеренную и тяжелую степень этого осложнения в 15 и 6% случаев соответственно.45
Необходимо отметить, что современные модели как механических, так и биологических протезов позволяют избежать это осложнение. Существуют специальные модификации протезов, предназначенные для пациентов с высоким риском возникновения несоответствия протез-пациент.
Структурная дегенерация
Нарушение функции механических протезов в чистом виде встречается крайне редко. Так исследование оценивавшее функцию механических протезов, после операции протезирования аортального клапана, и включавшее в себя 21742 пациент/лет с полнотой охвата 94% показало отсутствие структурной дегенерации механических протезов.46
У биопротезов структурная дегенерация встречается намного чаще и является основной причиной реоперации после протезирования аортального клапана биопротезом. Так исследования, изучавшие результаты протезирования аортального клапана биопротезами, показали, что свобода от реоперации составляет в течении 5 лет – 95%, 10 лет – 90% и 15 лет – 70%.47,48,49 Однако следует отметить, что большинство исследований выявили стремительное увеличение частоты встречаемости структурной дегенерации биопротезов в сроки более 15 лет после протезирования аортального клапана.50 У пациентов, которым было меньше 60 лет в момент биопротезирования аортального клапана, свобода от реоперации составляет в течении 10 лет – 87,4%, 15 лет – 62,2% и 20 лет – 52,2%.51 При использовании биопротезов у пациентов моложе 50 лет, свобода от реоперации по поводу структурной дегенерации биопротеза составляет только 31,9% через 18 лет после операции.
Протезный эндокардит
Риск возникновения протезного эндокардита после протезирования аортального клапана составляет 0,5% в год. Чаще всего протезный эндокардит развивается в первый месяц после операции (ранний протезный эндокардит) и вызывается Staphylococcus epidermidis. Поздний протезный эндокардит вызывается тем же спектром микроорганизмов, что и эндокардит нативного клапана. Как правило, синтетическая манжета протеза вовлечена в инфекционный процесс и формирует абсцесс фиброзного кольца аортального клапана, что может приводить к парапротезной регургитации (парапротезная фистула).
Парапротезная фистула (регургитация)
Парапротезная фистула — это осложнение чаще всего связанное с техникой операции, но иногда с протезным эндокардитом. Суть этого осложнения в появлении кровотока вне клетки протеза, между его манжетой и фиброзным кольцом аортального клапана. При тщательной декальцинации фиброзного кольца аортального клапана и частом наложении протезных швов, частоту этого осложнения можно минимизировать.
Большинство парапротезых фистул, которые выявляются вовремя (при выполнении интраоперационной чреспищеводной ЭхоКГ) или сразу после операции, являются гемодинамически незначительными и не увеличиваются в отдаленном периоде. Парапротезные фистулы, выявленные в отдаленном периоде, которых не было после операции, чаще всего связаны с перенесенным эндокардитом.
Если парапротезная фистула вызывает симптомы сердечной недостаточности (из-за парапротезной регургитации или повышенного градиента на протезе), то она требует вмешательства – реоперации или закрытие эндоваскулярно.
Гемолиз (гемолитическая анемия)
Обычно гемолиз носит незначительный характер и чаще встречается после протезирования аортального клапана механическим протезом. Гемолиз в основном вызван парапротезной фистулой при которой возникает резкое ускорение и затем замедление парапротезного потока крови и/или высоким пиковым градиентом на протезе. Гемолиз также может быть вызван образованием паннуса или структурной дегенерацией биопротеза, которые могут приводить к нарушению его нормальной функции.
Незначительный гемолиз может лечиться консервативно путем назначения препаратов железа, фолиевой кислоты при постоянном контроле уровня гемоглобина, гаптоглобина и ЛДГ (лактатдегидрогеназы).
Тяжелые формы гемолиза после протезирования аортального клапана вызывают значительную анемию, могут приводить к почечной недостаточности и требовать реоперации.
Непосредственные результаты
Госпитальная летальность при протезировании аортального клапана, по поводу его стеноза, составляет 1-3% у пациентов моложе 70 лет и 4-8% у пациентов старше 70 лет. Факторами риска повышения летальности являются:
- Возраст.
- Атеросклероз периферических сосудов.
- Перенесенное ОНМК или ТИА.
- Легочная гипертензия.
- Нарушение функции левого желудочка.
- Сопутствующая ИБС.
- Перенесенная операция АКШ или протезирование клапана.
Обычно после успешного протезирования аортального клапана улучшается качество жизни и увеличивается ожидаемая продолжительность жизни.
Отдаленные результаты
Выживаемость в отдаленном периоде после протезирования аортального клапана биопротезом составляет 77%, 54% и 32% в сроки 5, 10 и 15 лет соответственно. При сравнении механических и биологических протезов в отдаленном периоде первые показали незначительное преимущество, так летальность в 15 летнем периоде составила 66 и 79% в группе механических и биологических протезов соответственно.50
Литература
- Carabello BA, Paulus WJ: Aortic stenosis. The Lancet 2009; 373:956-966.
- Otto CM, Lind BK, Kitzman DW, Gersh BJ, Siscovick DS: Association of aortic-valve sclerosis with cardiovascular mortality and morbidity in the elderly. N Engl J Med 1999; 341:142-147.
- Nkomo VT, Gardin JM, Skelton TN, et al: Burden of valvular heart diseases: a population-based study. Lancet Lond Engl 2006; 368:1005-1011.
- Stewart BF, Siscovick D, Lind BK, et al: Clinical factors associated with calcific aortic valve disease fn1. J Am Coll Cardiol 1997; 29:630-634.
- Ghaisas NK, Foley JB, O’Briain DS, et al: Adhesion molecules in nonrheumatic aortic valve disease: endothelial expression, serum levels and effects of valve replacement. J Am Coll Cardiol 2000; 36:2257-2262.
- Subramanian R, Olson LJ, Edwards WD: Surgical pathology of pure aortic stenosis: a study of 374 cases. Mayo Clin Proc 1984; 59:683-690.
- Kouchoukos NT, Blackstone EH, Doty DB, Hanley FL, Karp RB: Kirklin/Barratt-Boyes Cardiac Surgery: Morphology, Diagnostic Criteria, Natural History, Techniques, Results, and Indications. Churchill Livingstone, 2003.
- Fedak PWM, Verma S, David TE, et al: Clinical and pathophysiological implications of a bicuspid aortic valve. Circulation 2002; 106:900-904.
- Tadros TM, Klein MD, Shapira OM: Ascending aortic dilatation associated with bicuspid aortic valve pathophysiology, molecular biology, and clinical implications. Circulation 2009; 119:880-890.
- Siu SC, Silversides CK: Bicuspid aortic valve disease. J Am Coll Cardiol 2010; 55:2789-2800.
- Fedak PWM, de Sa MP, Verma S, et al: Vascular matrix remodeling in patients with bicuspid aortic valve malformations: implications for aortic dilatation. J Thorac Cardiovasc Surg 2003; 126:797-806.
- Passik CS, Ackermann DM, Pluth JR, Edwards WD: Temporal changes in the causes of aortic stenosis: a surgical pathologic study of 646 cases. РMayo Clin Proc 1987; 62:119-123.
- Bonow RO, Carabello B, C. de Leon A, et al: Guidelines for the Management of Patients With Valvular Heart Disease Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of Patients With Valvular Heart Disease). Circulation 1998; 98:1949-1984.
- Schwartz LS, Goldfischer J, Sprague GJ, Schwartz SP: Syncope and sudden death in aortic stenosis. Am J Cardiol 1969; 23:647-658.
- Otto CM, Burwash IG, Legget ME, et al: Prospective study of asymptomatic valvular aortic stenosis. Clinical, echocardiographic, and exercise predictors of outcome. Circulation 1997; 95:2262-2270.
- Ross J, Braunwald E: Aortic stenosis. Circulation 1968; 38:61-67.
- Carabello BA, Paulus WJ: Aortic stenosis. The Lancet 2009; 373:956-966.
- Mihaljevic T, Nowicki ER, Rajeswaran J, et al: Survival after valve replacement for aortic stenosis: implications for decision making. J Thorac Cardiovasc Surg 2008; 135:1270-1278; discussion 1278-1279.
- Gjertsson P, Caidahl K, Farasati M, Odén A, Bech-Hanssen O: Preoperative moderate to severe diastolic dysfunction: a novel Doppler echocardiographic long-term prognostic factor in patients with severe aortic stenosis. J Thorac Cardiovasc Surg 2005; 129:890-896.
- Bonow RO, Carabello BA, Chatterjee K, de Leon AC Jr, Faxon DP, et al: 2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to revise the 1998 guidelines for the management of patients with valvular heart disease). Endorsed by the Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008; 52(13):e1-142.
- Nishimura RA, Otto CM, Bonowet RO, et al: 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: a Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 63:e57-e185.
- Amato MC, Moffa PJ, Werner KE, Ramires JA: Treatment decision in asymptomatic aortic valve stenosis: role of exercise testing. Heart Br Card Soc 2001; 86:381-386.
- Das P, Rimington H, Chambers J: Exercise testing to stratify risk in aortic stenosis. Eur Heart J 2005; 26:1309-1313.
- deFilippi CR, Willett DL, Brickner ME, et al: Usefulness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol 1995; 75:191-194.
- Monin J-L, Quéré JP, Monchi M, et al: Low-gradient aortic stenosis: operative risk stratification and predictors for long-term outcome: a multicenter study using dobutamine stress hemodynamics. Circulation 2003; 108, 319-324.
- Leon MB, Smith CR, Mack M, Miller DC, Moses JW, Svensson LG, Tuzcu EM, Webb JG, Fontana GP, Makkar RR, Brown DL, Block PC, Guyton RA, Pichard AD, Bavaria JE, Herrmann HC, Douglas PS, Petersen JL, Akin JJ, Anderson WN, Wang D, Pocock S, PARTNER Trial Investigators. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med 2010;363:1597–1607.
- Deeb GM, Reardon MJ, Chetcuti S, Patel HJ, Grossman PM, Yakubov SJ, Kleiman NS, Coselli JS, Gleason TG, Lee JS, Hermiller JB Jr, Heiser J, Merhi W, Zorn GL 3rd, Tadros P, Robinson N, Petrossian G, Hughes GC, Harrison JK, Maini B, Mumtaz M, Conte J, Resar J, Aharonian V, Pfeffer T, Oh JK, Qiao H, Adams DH, Popma JJ, CoreValve US Clinical Investigators. 3-year outcomes in high-risk patients who underwent surgical or transcatheter aortic valve replacement. J Am Coll Cardiol 2016;67:2565–2574.
- Thyregod HG, Steinbruchel DA, Ihlemann N, Nissen H, Kjeldsen BJ, Petursson P, Chang Y, Franzen OW, Engstrom T, Clemmensen P, Hansen PB, Andersen LW, Olsen PS, Sondergaard L. Transcatheter versus surgical aortic valve replacement in patients with severe aortic valve stenosis: 1-year results from the all-comers NOTION randomized clinical trial. J Am Coll Cardiol 2015;65:2184–2194.
- Leon MB, Smith CR, Mack MJ, Makkar RR, Svensson LG, Kodali SK, Thourani VH, Tuzcu EM, Miller DC, Herrmann HC, Doshi D, Cohen DJ, Pichard AD, Kapadia S, Dewey T, Babaliaros V, Szeto WY, Williams MR, Kereiakes D, Zajarias A, Greason KL, Whisenant BK, Hodson RW, Moses JW, Trento A, Brown DL, Fearon WF, Pibarot P, Hahn RT, Jaber WA, Anderson WN, Alu MC, Webb JG, PARTNER 2 Investigators. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med 2016;374:1609–1620.
- Reardon MJ, Van Mieghem NM, Popma JJ, Kleiman NS, Sondergaard L, Mumtaz M, Adams DH, Deeb GM, Maini B, Gada H, Chetcuti S, Gleason T, Heiser J, Lange R, Merhi W, Oh JK, Olsen PS, Piazza N, Williams M, Windecker S, Yakubov SJ, Grube E, Makkar R, Lee JS, Conte J, Vang E, Nguyen H, Chang Y, Mugglin AS, Serruys PW, Kappetein AP, SURTAVI Investigators. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med 2017;376:1321–1331.
- Siontis GC, Praz F, Pilgrim T, Mavridis D, Verma S, Salanti G, Sondergaard L, Juni P, Windecker S. Transcatheter aortic valve implantation vs. surgical aortic valve replacement for treatment of severe aortic stenosis: a meta-analysis of randomized trials. Eur Heart J 2016;37:3503–3512.
- Rosenhek R, Binder T, Porenta G, Lang I, Christ G, Schemper M, Maurer G, Baumgartner H. Predictors of outcome in severe, asymptomatic aortic stenosis. N Engl J Med 2000;343:611–617.
- Genereux P, Stone GW, O’Gara PT, Marquis-Gravel G, Redfors B, Giustino G, Pibarot P, Bax JJ, Bonow RO, Leon MB. Natural history, diagnostic approaches, and therapeutic strategies for patients with asymptomatic severe aortic stenosis. J Am Coll Cardiol 2016;67:2263–2288.
- Rafique AM, Biner S, Ray I, Forrester JS, Tolstrup K, Siegel RJ. Meta-analysis of prognostic value of stress testing in patients with asymptomatic severe aortic stenosis. Am J Cardiol 2009;104:972–977.
- Das P, Rimington H, Chambers J. Exercise testing to stratify risk in aortic stenosis. Eur Heart J 2005;26:1309–1313.
- Rosenhek R, Zilberszac R, Schemper M, Czerny M, Mundigler G, Graf S, Bergler-Klein J, Grimm M, Gabriel H, Maurer G. Natural history of very severe aortic stenosis. Circulation 2010;121:151–156.
- Cioffi G, Faggiano P, Vizzardi E, Tarantini L, Cramariuc D, Gerdts E, de Simone G. Prognostic effect of inappropriately high left ventricular mass in asymptomatic severe aortic stenosis. Heart 2011;97:301–307.
- Dahl JS, Videbaek L, Poulsen MK, Rudbaek TR, Pellikka PA, Moller JE. Global strain in severe aortic valve stenosis: relation to clinical outcome after aortic valve replacement. Circ Cardiovasc Imaging 2012;5:613–620.
- Zlotnick DM, Ouellette ML, Malenka DJ, DeSimone JP, Leavitt BJ, Helm RE, Olmstead EM, Costa SP, DiScipio AW, Likosky DS, Schmoker JD, Quinn RD, Sisto D, Klemperer JD, Sardella GL, Baribeau YR, Frumiento C, Brown JR, O’Rourke DJ, Northern New England Cardiovascular Disease Study Group. Effect of preoperative pulmonary hypertension on outcomes in patients with severe aortic stenosis following surgical aortic valve replacement. Am J Cardiol 2013;112:1635–1640.
- Oxenham H, Bloomfield P, Wheatley DJ, et al: Twenty-year comparison of a Bjork-Shiley mechanical heart valve with porcine bioprostheses. Heart 2003; 89:697.
- Khan SS, Trento A, DeRobertis M, et al: Twenty-year comparison of tissue and mechanical valve replacement. J Thorac Cardiovasc Surg 2001; 122:257.
- Emery RW, Krogh CC, Arom DV, et al: The St. Jude Medical cardiac valve prosthesis: a 25-year experience with single valve replacement. Ann Thorac Surg 2005; 79:776.
- Wu YX, Burchart EG, Borer JS, Yoganathon A, Grunicemeier GL: Clinical evaluation of new heart valve prosthesis: update of objective performance Criteria. Ann Thorac Surg 2014; 98:1865-1874.
- Pibarot P, Dumesnil JG: Hemodynamic and clinical impact of prosthesis-patient mismatch in the aortic valve position and its prevention. J Am Coll Cardiol 2000; 36:1131.
- Yadlapati A, Diep J, Barnes MJ, et al: Comprehensive hemodynamic comparison and frequency of patient prosthesis mismatch between the St. Jude Medical Trifecta and Epic bioprosthetic aortic valves. J Am Soc Echocardiogr 2014; 27:581-589.
- Emery RW, Arom KV, Krogh CC, Joyce LD: Long-term results with the St. Jude Medical aortic valve: a 25-year experience. J Am Coll Cardiol 2004; 435:429A.
- Wendt D, Thielmann M, Plicht B, et al: The new St Jude Trifecta versus Carpentier-Edwards Perimount Magna and Magna Ease aortic bioprosthesis: is there a hemodynamic superiority? J Thorac Cardiovasc Surg 2014; 147:1553.
- Johnston DR, Soltesz EG, Vakil N, et al: Long-term durability of bioprosthetic aortic valves: implications from 12,569 implants. Ann Thorac Surg 2015 [Epub ahead of print]. Forcillo J, Pellerin M, Perrault LP, et al: Carpentier-Edwards pericardial valve in the aortic position: 25-years experience. Ann Thorac Surg 2013; 96:486-493.
- Valfre C, Ius P, Minniti G, et al: The fate of Hancock II porcine valve recipients 25 years after implant. Eur J Cardiothorac Surg 2010; 38:141-146.
- Hammermeister K, Sethi GK, Henderson WG, et al: Outcomes 15 years after valve replacement with a mechanical versus a bioprosthetic valve: final report of the Veterans Affairs randomized trial. J Am Coll Cardiol 2000; 36:1152.
9 Аортальные пороки сердца — СтудИзба
Лекция. Аортальные пороки сердца
Рассматриваемые вопросы:
1. Этиология.
2. Клинико-анатомические формы и патогенез нарушений гемодинамики.
3. Недостаточность клапана.
4. Стеноз.
5. Сочетание недостаточности со стенозом.
6. Классификация и номенклатура приобретенных пороков.
7. Методы диагностики.
Рекомендуемые файлы
8. Патогенез, клиника, диагностика и лечение отдельных пороков сердца.
9. Стеноз устья аорты.
10. Недостаточность клапана аорты.
11. Аортальный стеноз и недостаточность.
Аортальная недостаточность. Состояние, при котором в диастолу кровь из аорты оттекает в левый желудочек вследствие несостоятельности аортального клапана.
Этиология. Чаще возникает в результате воспалительного процесса в створках клапана при острой ревматической лихорадке, инфекционном эндокардите, сифилисе, значительно реже – при других заболеваниях.
Гемодинамика. Во время диастолы кровь поступает в левый желудочек не только из левого предсердия, но и из аорты за счет обратного кровотока. Это приводит к переполнению и растяжению левого желудочка в период диастолы. Объем крови, возвращающейся в левый желудочек, может превышать половину всего сердечного выброса. Во время систолы левому желудочку приходится сокращаться с большей силой для того, чтобы выбросить в аорту увеличенный ударный объем крови. Повышенная работа левого желудочка приводит к его гипертрофии, а увеличение систолического объема крови в аорте вызывает ее дилатацию. Характерно резкое колебание давления крови в аорте во время систолы и диастолы. Длительное время порок компенсируется гипертрофированным левым желудочком, при ослаблении его сократительной способности развиваются застойные явления в малом круге, что может проявляться приступом сердечной астмы. Расширение левого желудочка при ослаблении его миокарда приводит к относительной недостаточности митрального клапана, что еще больше увеличивает венозный застой в малом круге и создает дополнительную нагрузку на правый желудочек. Это называется митрализацией аортальной недостаточности, которая может стать причиной венозного застоя в большом круге.
Клиническая картина. Несмотря на выраженные нарушения внутрисердечной гемодинамики, многие больные с аортальной недостаточностью в течение многих лет могут не предъявлять каких-либо жалоб, выполнять тяжелую физическую работу. Однако при выраженной аортальной недостаточности появляются боли в области сердца по типу стенокардических, одышка, иногда развиваются головокружения.
Диагностика. При аортальной недостаточности наблюдается много характерных симптомов при исследовании периферических сосудов: снижение диастолического артериального давления, повышение пульсового давления, пульс Корригена, усиленная артериальная пульсация, симптом Мюссе, пульс Квинке, увеличение разницы между давлением в плечевой и бедренной артериях, двойной тон Траубе, шум Дюрозье и другие.
При пальпации: верхушечный толчок – в шестом или седьмом межреберье, разлитой, усиленный. При перкуссии: смещение границ сердечной тупости влево, аортальная конфигурация сердца.
При аускультации: диастолический шум во втором межреберье справа или в точке Боткина-Эрба, систолический шум на аорте, ослабление I тона на верхушке и II тона на аорте, пресистолический шум Флинта.
На электрокардиограмме: гипертрофия левого желудочка, увеличение левого предсердия, отклонение электрической оси сердца влево.
При рентгеновском исследовании выявляют увеличение левого желудочка, причем в типичных случаях сердце приобретает так называемую аортальную конфигурацию. Нередко расширен восходящий отдел аорты, а иногда и вся дуга.
При эхокардиографии: конечный диастолический размер левого желудочка увеличен. Определяется гиперкинезия задней стенки левого желудочка и межжелудочковой перегородки. Регистрируется высокочастотное дрожание передней створки митрального клапана, межжелудочковой перегородки, а иногда и задней створки во время диастолы. Митральный клапан закрывается преждевременно, а в период его открытия амплитуда движения створок уменьшена. На допплере регистрируется аортальная регургитация.
Прогноз и течение. Продолжительность жизни больных обычно более 5 лет с момента установления диагноза. Прогноз ухудшается с присоединением коронарной недостаточности и хронической сердечной недостаточности. Лекарственная терапия в этих случаях обычно малоэффективна. Продолжительность жизни больных после появления хронической сердечной недостаточности – около 2 лет.
Своевременное хирургическое лечение значительно улучшает прогноз.
Медикаментозное лечение направлено в стадии компенсации на уменьшение интенсивности и объема выброса крови из левого желудочка. В стадии декомпенсации: на контроль давления в большом круге кровообращения; уменьшение преднагрузки; нормализацию ритма сердца, профилактику инфекционного эндокардита.
Аортальный стеноз. Состояние, при котором существует препятствие току крови из левого желудочка. Возникает при сращении створок аортального клапана либо вследствие рубцового сужения аортального отверстия. Может быть клапанным, подклапанным и надклапанным.
Этиология. Причинами являются хроническая ревматическая болезнь сердца, атеросклеротическое поражение и первично-дегенеративные изменения клапанов с последующим их обызвествлением.
Гемодинамика. При аортальном стенозе затрудняется ток крови из левого желудочка в аорту, вследствие чего значительно увеличивается градиент систолического давления между полостью левого желудочка и аортой. Вследствие такой нагрузки давлением повышается функция левого желудочка и возникает его гипертрофия, которая зависит от степени сужения аортального отверстия. Особенно тяжелые нарушения возникают при уменьшении площади отверстия до 0,5 см2. Конечное диастолическое давление может оставаться нормальным или слегка повышаться вследствие нарушения расслабления левого желудочка, что связывают с его выраженной гипертрофией. Благодаря большим компенсаторным возможностям гипертрофированного левого желудочка, сердечный выброс долго остается нормальным, хотя при нагрузке он увеличивается меньше, чем у здоровых лиц. При появлении симптомов декомпенсации наблюдаются более выраженное повышение конечного диастолического давления и дилатация левого желудочка.
Клиническая картина. Аортальный стеноз может долго не вызывать каких-либо субъективных ощущений. При выраженном аортальном стенозе возникают боли по типу стенокардических, одышка, обмороки.
Диагностика. При пальпации верхушечный толчок смещен влево, реже вниз, разлитой, резистентный. Во втором межреберье справа от грудины нередко ощущается систолическое «кошачье мурлыканье». При выраженном стенозе пульс становится малым, мягким, с медленным подъемом. Есть склонность к снижению пульсового и систолического давления. При перкуссии: смещение левой границы влево, аортальная конфигурация сердца. При аускультации: ослабление I тона на верхушке и II тона над аортой, грубый систолический шум на аорте, который проводится на сонные артерии.
Электрокардиограмма долго может оставаться неизменной. Позднее выявляются отклонение электрической оси сердца влево и другие признаки гипертрофии левого желудочка.
Люди также интересуются этой лекцией: Сосницкая культура.
При рентгеновском исследовании определяется увеличение левого желудочка, позже может быть увеличено и левое предсердие. Характерны постстенотическое расширение восходящей части аорты, иногда кальцификация клапанов аорты.
При эхокардиографии находят утолщение створок аортального клапана с множественным эхо-сигналом с них, уменьшение систолического расхождения створок клапанного отверстия в период систолы. Обнаруживается также гипертрофия межжелудочковой перегородки и задней стенки левого желудочка, конечный диастолический диаметр левого желудочка долго остается нормальным, ускорение турбулентного трансаортального систолического потока.
Течение и прогноз. Аортальный стеноз долго остается компенсированным пороком. При появлении симптомов летальность и риск осложнений увеличиваются: средняя продолжительность жизни при появлении стенокардии составляет 5 лет, при появлении обмороков – 3 года и при появлении сердечной систолической недостаточности – 2 года.
Медикаментозное лечение в стадии компенсации направлено на контроль давления в большом круге кровообращения и уменьшение градиента давления между левым желудочком и аортой. В стадии декомпенсации: на контроль давления в большом круге кровообращения и уменьшение постнагрузки; улучшение коронарного кровообращения; восстановление синусового ритма; устранение симптомов хронической сердечной недостаточности, профилактику инфекционного эндокардита.
При необходимости проводят хирургическую коррекцию порока.
Таким образом, лечение аортальных пороков требует знаний гемодинамики, клиники и инструментальных методов обследования.
Гемодинамика парадоксального тяжелого стеноза аорты: выводы из анализа петли давления и объема
Ким В.К., Хамм К.В. (2018) Транскатетерная имплантация аортального клапана в Германии. Clin Res Cardiol 107 (Приложение 2): 81–87
Артикул PubMed Google ученый
Doenst T, Kirov H, Moschovas A et al (2018) Обзор кардиохирургии, 2017 г. Clin Res Cardiol 107 (12): 1087–1102. https://doi.org/10.1007/s00392-018-1280-9 (PMID: 29777372)
Артикул PubMed Google ученый
Nishimura RA, Otto CM, Bonow RO, Американский колледж кардиологов / Целевая группа Американской кардиологической ассоциации по практическим рекомендациям и др. (2014) Руководство AHA / ACC по ведению пациентов с пороком клапанов сердца: краткое содержание: отчет американского Колледж кардиологии / Целевая группа Американской кардиологической ассоциации по практическим рекомендациям. J Am Coll Cardiol 63: 2438–2488
Артикул Google ученый
Отто CM, Прендергаст B (2014) Стеноз аортального клапана — от пациентов из группы риска до тяжелой обструкции клапана.N Engl J Med 371: 744–756
Статья CAS PubMed Google ученый
Clavel MA, Magne J, Pibarot P (2016) Низкоградиентный стеноз аорты. Eur Heart J 37: 2645–2657
Статья PubMed PubMed Central Google ученый
Jander N, Minners J, Holme I et al (2011) Исход пациентов с низкоградиентным «тяжелым» стенозом аорты и сохраненной фракцией выброса.Тираж 123: 887–895 (Исправление в: Circulation. 2011; 124: e336)
Артикул PubMed Google ученый
Chhabra L (2016) Несоответствие гемодинамических данных при низкоградиентном тяжелом стенозе аорты. J Am Coll Cardiol 67: 2446–2447
Артикул PubMed Google ученый
Clavel MA, Dumesnil JG, Capoulade R, Mathieu P, Sénéchal M, Pibarot P (2012) Исход пациентов со стенозом аорты, небольшой площадью клапана и низким потоком, низким градиентом, несмотря на сохраненный выброс левого желудочка дробная часть.J Am Coll Cardiol 60: 1259–1267
Артикул PubMed Google ученый
Даян В., Виньоло Дж., Магне Дж., Клавель М.А., Мохти Д., Пибарот П. (2015) Результат и влияние замены аортального клапана у пациентов с сохраненной ФВ ЛЖ и низкоградиентным стенозом аорты. J Am Coll Cardiol 66: 2594–2603
Статья PubMed Google ученый
Chin CWL, Ding ZP, Lam CSP, Ling LH (2016) Парадоксальный низкоградиентный стеноз аорты: HFpEF стеноза аорты.J Am Coll Cardiol 67: 2447–2448
Артикул PubMed Google ученый
Борлоуг Б.А., Касс Д.А. (2009) Оценка инвазивной гемодинамики при сердечной недостаточности. Клиника сердечной недостаточности 5: 217–228
Статья PubMed PubMed Central Google ученый
Баумгартнер Х., Хунг Дж., Бермеджо Дж. И др. (2017) Рекомендации по эхокардиографической оценке стеноза аортального клапана: целенаправленное обновление от Европейской ассоциации сердечно-сосудистой визуализации и Американского общества эхокардиографии.J Am Soc Echocardiogr 30: 372–392
Статья PubMed Google ученый
Ланг Р.М., Бадано Л.П., Мор-Ави В. и др. (2015) Рекомендации по количественной оценке камеры сердца с помощью эхокардиографии у взрослых: обновленные данные Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации. J Am Soc Echocardiogr 28: 1–39.e14
Статья Google ученый
Lancellotti P, Tribouilloy C, Hagendorff A, Комитет по научным документам Европейской ассоциации сердечно-сосудистой визуализации и др. (2013) Рекомендации по эхокардиографической оценке собственной клапанной регургитации: резюме Европейской ассоциации сердечно-сосудистой визуализации. Eur Heart J Cardiovasc Imaging 14: 611–644
Статья Google ученый
Briand M, Dumesnil JG, Kadem L et al (2005) Снижение системной артериальной эластичности значительно влияет на постнагрузку левого желудочка и его функцию при стенозе аорты: значение для диагностики и лечения.J Am Coll Cardiol 46: 291–298
Статья PubMed Google ученый
Baan J, Jong TT, Kerkhof PL et al (1981) Непрерывный ударный объем и сердечный выброс на основе внутрижелудочковых размеров, полученных с помощью импедансного катетера. Cardiovasc Res 15: 328–334
Статья CAS PubMed Google ученый
Baan J, van der Velde ET, de Bruin HG et al (1984) Непрерывное измерение объема левого желудочка у животных и людей с помощью проводящего катетера.Тираж 70: 812–823
Статья CAS PubMed Google ученый
ten Brinke EA, Klautz RJ, Verwey HF et al (2010) Оценка отношения конечного систолического давления и объема левого желудочка к объему конечного систолического давления в левом желудочке у пациентов с сердечной недостаточностью. Acta Physiol (Oxf) 198: 37–46
Статья CAS Google ученый
Burkhoff D, Mirsky I., Suga H (2005) Оценка систолических и диастолических свойств желудочков с помощью анализа давления-объема: руководство для клинических, трансляционных и фундаментальных исследователей.Am J Physiol Heart Circ Physiol 289: H501 – H512
Статья CAS PubMed Google ученый
Tribouilloy C, Lévy F, Rusinaru D et al (2009) Результат после замены аортального клапана по поводу стеноза аорты с низким потоком / низким градиентом без сократительного резерва при добутаминовой стресс-эхокардиографии. J Am Coll Cardiol 53: 1865–1873
Артикул PubMed Google ученый
Schymik G, Tzamalis P, Herzberger V et al (2017) Транскатетерная имплантация аортального клапана у пациентов со сниженной фракцией выброса левого желудочка: опыт одного центра у 2000 пациентов (TAVIK Registry). Clin Res Cardiol 106: 1018–1025
Артикул PubMed Google ученый
Hachicha Z, Dumesnil JG, Bogaty P, Pibarot P (2007) Парадоксальный низкий кровоток, тяжелый стеноз аорты с низким градиентом, несмотря на сохраненную фракцию выброса, связан с более высокой постнагрузкой и снижением выживаемости.Тираж 115: 2856–2864
Статья PubMed Google ученый
Zheng Q, Djohan AH, Lim E et al (2017) Влияние замены аортального клапана на тяжелый стеноз аорты и сохраненную систолическую функцию: систематический обзор и сетевой метаанализ. Sci Rep 7: 5092
Статья CAS PubMed PubMed Central Google ученый
Adda J, Mielot C, Giorgi R et al (2012) Тяжелый стеноз аорты с низким потоком и низким градиентом, несмотря на нормальную фракцию выброса, связан с тяжелой дисфункцией левого желудочка, по оценке спекл-трекинговой эхокардиографии: многоцентровый учиться.Circ Cardiovasc Imaging 5: 27–35
Статья PubMed Google ученый
Herrmann S, Störk S, Niemann M. et al (2011) Низкоградиентный стеноз аортального клапана, миокардиальный фиброз и его влияние на функцию и исход. J Am Coll Cardiol 58: 402–412
Статья PubMed Google ученый
Kawaguchi M, Hay I, Fetics B, Kass DA (2003) Комбинированное систолическое систолическое и артериальное напряжение желудочков у пациентов с сердечной недостаточностью и сохраненной фракцией выброса: последствия для ограничения систолического и диастолического резерва.Тираж 107: 714–720
Статья PubMed Google ученый
Borlaug BA, Paulus WJ (2011) Сердечная недостаточность с сохраненной фракцией выброса: патофизиология, диагностика и лечение. Eur Heart J 32: 670–679
Статья PubMed Google ученый
Gotzmann M (2018) Блокада ренин-ангиотензиновой системы после TAVI: есть ли связь между регрессом гипертрофии левого желудочка и прогнозом? Сердце 104: 628–629
Статья PubMed Google ученый
Гемодинамика и механобиология воспаления и кальцификации аортального клапана
Сердечные клапаны функционируют механически сложная среда, открытие и закрытие близко к миллиард раз в течение средней человеческой жизни, испытывает чресклапанное давление и пульсирует и колебательные касательные напряжения, а также изгиб и осевое напряжение.Хотя изначально считалось, что клапаны пассивные кусочки ткани, недавние свидетельства к интимному взаимодействию между гемодинамическими окружающая среда и биологический ответ клапана. Несколько десятилетий исследований были посвящены понимание этих разнообразных механических стимулов и как они могут вызвать патологию клапана. Мы тут проанализировать усилия, предпринятые для понимания клапанного ответ на его механическую среду и ключ выводы, полученные из in vitro и ex vivo исследований целых тканей в механобиология ремоделирования аортального клапана, воспаление и кальциноз.
1. Введение
Сердечные клапаны — это динамичные сложные структуры, которые тесно взаимодействуют с окружающей гемодинамической средой. Аортальный клапан, расположенный между левым желудочком и аортой, и легочный клапан, расположенный между правым желудочком и легочной артерией, обозначаются как полулунные клапаны и предотвращают обратный ток крови из соответствующих путей оттока в желудочки. Атриовентрикулярные клапаны, обеспечивающие ток крови от предсердий к желудочкам, состоят из митрального клапана, расположенного между левым предсердием и левым желудочком, и трехстворчатого клапана, расположенного между правым предсердием и правым желудочком.Хотя эти четыре клапана имеют разную анатомию и разные характеристики открытия / закрытия, они обеспечивают однонаправленный поток крови, максимизируя скорость потока и сводя к минимуму сопротивление потоку. Хотя первоначально считалось, что клапаны пассивно перемещаются из-за кровотока, теперь признано, что механизмы, обеспечивающие правильную структуру и функцию сердечных клапанов, по существу контролируются взаимодействием между клапаном, его клетками и окружающими гемодинамическими или механическими элементами. среда.Понимание влияния механической среды на биологию сердечного клапана, то есть его механобиологию, поэтому имеет решающее значение для лучшего понимания нормальной функции клапана и прогрессирования заболевания. В этой статье представлен подробный обзор гемодинамики и механобиологии сердечного клапана в связи с патологией клапана с акцентом на аортальном клапане. Работа разделена на два основных раздела. Первый раздел суммирует гемодинамические силы, испытываемые нормальными и больными полулунными клапанами, и завершается подробным описанием гемодинамических сил, испытываемых аортальным клапаном.Во втором разделе рассматриваются результаты недавних исследований in vitro, и ex vivo, , посвященных влиянию этих гемодинамических сил на биологию и заболевание аортального клапана. Таким образом, в этой статье дается всестороннее описание гемодинамики и механобиологии клапана как в нормальных, так и при патологических состояниях, уделяя особое внимание аортальному клапану.
2. Полулунная гемодинамика клапана сердца на уровне органа
Изучение механобиологии клапана будет неполным без предварительного анализа механической и гемодинамической среды клапана.Таким образом, цель этого раздела двоякая: (I) качественно и количественно обрисовать, насколько это возможно, сложную механическую среду клапана (Рисунок 1) и (II) дать общее представление об изменениях в механике, которые происходят из-за к клапанной болезни. Таблица 1 объединяет соответствующие механические тесты с точки зрения практических параметров, которые могут быть смоделированы экспериментально.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(a) Систолические механические силы
(б) механические силы
(a) Систолические механические силы
(b) Диастолические механические силы
2.1. Нормальная гемодинамика клапана
Аортальный клапан открывается во время систолы, когда желудочек сокращается, и затем закрывается во время диастолы, когда желудочек расслабляется (рис. 1). У здоровых людей кровь течет через аортальный клапан с ускорением до максимального значения 1,35 ± 0,35 м / с [1]. Клапан закрывается ближе к концу фазы замедления систолы с очень небольшим обратным потоком через клапан. Неблагоприятный осевой перепад давления вызывает замедление потока с низкой инерцией в развивающемся пограничном слое вдоль стенки аорты, а затем изменение направления в обратном направлении, что приводит к возникновению вихрей в синусах за створками аортального клапана [2].Это действие отталкивает брюшко створок от стенки аорты к закрытому положению. Когда эта сила сочетается с вихрями, которые толкают кончики створок в закрытое положение, достигается очень эффективное и быстрое закрытие. Исследования in vitro показали, что одной лишь разницы осевого давления достаточно для закрытия клапана [2]. Таким образом, без завихрений в пазухах клапан все равно закрывается, но его закрытие не так эффективно.
Профиль скорости на уровне кольца аортального клапана относительно плоский.Однако имеется небольшой перекос в сторону перегородки (менее 10% от центральной линии), вызванный ориентацией аортального клапана относительно длинной оси левого желудочка [9]. Характер потока сразу после аортального клапана (в выводном тракте) представляет особый интерес из-за их сложности и связи с заболеванием артерий. Сильно искаженные профили скорости и соответствующие спиральные структуры потока наблюдались в дуге аорты человека с помощью магнитно-резонансного картирования фазовой скорости [9]. Эксперименты по количественной оценке потока in vitro (с помощью лазерной доплеровской анемометрии) показали, что эти модели потока зависят от геометрии клапана и, таким образом, могут использоваться для оценки функции и пригодности сердечного клапана [10].
2.2. Гемодинамика пораженных клапанов
Патология аортального клапана, долгое время считавшаяся следствием пассивного дегенеративного заболевания клапана, вызванного увеличением продолжительности жизни в сочетании с ревматическим и инфекционным эндокардитом [11], теперь признана результатом активных болезненных процессов, таких как воспаление и модуляция клеточного фенотипа. [12–15].Текущие хирургические вмешательства включают ремонт или замену клапана в зависимости от диагноза. Огромный прогресс был достигнут за последнее столетие в разработке и усовершенствовании протезных клапанов, но на сегодняшний день не существует идеального заменяющего клапана. Поскольку знание гемодинамики может быть неоценимым при лечении таких патологий, были проведены исследования по характеристике жидкой среды вблизи пораженных полулунных клапанов.
Стеноз аортального клапана — это состояние, характеризующееся неполным открытием клапана.Частичное открытие клапана создает препятствие, ограничивающее прямой кровоток из левого желудочка в аорту. Йоганатан [6] провел несколько измерений потока на биопротезных клапанах, имитирующих различные степени стеноза аорты in vitro . В физиологических условиях (частота сердечных сокращений 70 ударов в минуту, систолическая продолжительность 300 мс и среднее аортальное давление 90–100 мм рт. Ст.) Визуализация потока показала, что жидкость выходит из стенотического клапана в виде асимметричной струи с изогнутым углом.По мере увеличения степени стеноза диаметр струи у основания аорты уменьшается, а поле потока становится более беспорядочным и беспорядочным (рис. 2). Кроме того, измерения потока показали, что по сравнению с равномерно распределенным полем потока, полученным на пике систолы в нормальном аортальном клапане (максимальная осевая скорость 1,20 м / с), стенозирующий клапан характеризуется полем потока струйного типа (максимальная осевая скорость 7 м / с) с зонами отрыва, расположенными вокруг струи и высокотурбулентными сдвиговыми слоями (максимальная среднеквадратичная осевая скорость 2.0 м / с) (Рисунок 2). Повышенные уровни турбулентности, измеренные ниже стенозированных клапанов, достаточно высоки, чтобы вызвать повреждение элементов крови (эритроцитов и тромбоцитов) и эндотелиальных клеток, выстилающих стенку восходящей аорты.
3. Механические силы, действующие на аортальный клапан
3.1. Давление
In vivo давление на створку изменяется от систолы до диастолы, изменяя напряжение и, следовательно, длину створки.В нормальных физиологических условиях закрытый клапан поддерживает чресклапанное давление 80–120 мм рт. Ст., Действующее перпендикулярно области створки (нормальное напряжение). Эта сила поддерживается слоем фиброзной пластинки створки и передается от волокон коллагена к клеткам в тканях, которые выровнены с волокнами коллагена. Давление, действующее на створки, обычно оценивается с точки зрения напряжений, предполагая, что ткань однородна [3]. В действительности створка неоднородна, анизотропна, нелинейна и вязкоупруга со сложной геометрией.
In vivo исследования с использованием метода маркерной рентгеноскопии с рентгеноконтрастными маркерами, размещенными на створках аортального клапана собак, были проведены еще в 1980 году. геометрия. Напряжения мембраны в окружном направлении створки составили 0,167 кПа во время систолы и 2,4 кПа во время диастолы [3]. В другом исследовании для анализа напряжений использовалась формулировка конечных элементов.На основании давления 114,7 мм рт. Ст. И толщины створки аортального клапана человека 0,6 мм максимальное основное напряжение было установлено, что оно составило 2,19 кПа, что сопоставимо с исследованием in vivo [16].
3.2. Напряжение сдвига жидкости
Напряжение сдвига жидкости аортального клапана является важным фактором синтетической активности клапанных клеток, а также влияет на клеточную адгезию макрофагов и другие факторы в кровотоке. Напряжение сдвига испытывает поверхность створок желудочков, когда кровь течет мимо створок во время систолы, и на поверхности аорты, когда кровь скапливается в пазухах во время диастолы.Оценка этих стрессов помогает понять влияние стрессов на клеточную функцию листка и выяснить клеточные реакции [17]. Из-за его очевидного значения для атеросклероза, эффекты напряжения сдвига на сосудистые эндотелиальные клетки были тщательно изучены. Одним из самых ранних признанных эффектов напряжения сдвига является удлинение и перестройка эндотелиальных клеток. Культивируемые эндотелиальные клетки, подверженные постоянному ламинарному сдвиговому напряжению, удлиняются в направлении потока, в то время как клапанные эндотелиальные клетки выстраиваются перпендикулярно потоку [18, 19].Актиновые стрессовые волокна в цитоскелете также подвергаются перестройке с течением и увеличиваются в количестве с увеличением напряжения сдвига [20]. Деградация и разрушение тканей из-за кальцификации створок было связано с областями высоких напряжений сдвига и изгиба в створках во время открытия и закрытия клапана [21]. Недавно Yap et al. количественно определяли напряжение сдвига жидкости на аортальной и желудочковой сторонах створки аортального клапана и сообщали о различиях в максимальных величинах и качественных профилях сдвиговых напряжений с обеих сторон [4, 5].
3.3. Напряжение изгиба
Изменение кривизны створки во время сердечного цикла вызывает напряжения изгиба, сдвига или коробления [3]. Коллагеновые хорды в структуре створки могут свободно изгибаться в окружном направлении без значительного сопротивления со стороны эластичных волокон, выровненных в радиальном направлении. Напряжение изгиба является как растягивающим, так и сжимающим, при этом створка на выпуклой стороне испытывает растягивающее напряжение, в то время как вогнутая сторона испытывает сжимающее напряжение.Во время изгиба брюшко створки подвергается изменению кривизны из-за нагрузки и разгрузки клапана, в то время как зона прикрепления действует как шарнир, облегчающий движение створки. Напряжение изгиба увеличивается с увеличением жесткости створки, что приводит к раннему отказу некоторых биопротезных клапанов. Thubrikar использовал технику рентгеноконтрастных маркеров для расчета деформаций изгиба in vivo в аортальных клапанах собак. Деформации изгиба, рассчитанные по модулю упругости, толщине и радиусу створки, составили 2% во время систолы и 2%.2% при диастоле в окружном направлении [3]. In vitro эксперименты с использованием литых погружением полиуретановых трехстворчатых клапанов были выполнены для определения значений деформации изгиба и напряжения на свободном крае створки в физиологических пульсирующих условиях. Изгиб был наибольшим во время фазы открытия, соответствующей максимальной деформации и напряжению 14,5% и 1,22 МПа, соответственно. Во время фазы закрытия максимальная деформация и напряжение составили 8,3% и 0,71 МПа соответственно [7].Вероятно, что это большое различие между результатами in vitro и in vivo связано с разной толщиной створок собачьего клапана и полимерных трехстворчатых клапанов, и необходимы дальнейшие исследования, чтобы точно охарактеризовать деформации изгиба, испытываемые клапаном в vivo .
3.4. Осевое растяжение
Растяжение важно для бугорка, поскольку оно позволяет бугорку расширяться и формировать коаптивное уплотнение с двумя другими бугорками во время диастолы [22–24].Это необходимо для поддержания адекватной зоны коаптации [22]. Растяжение листка может быть потеряно относительно быстро по причинам, которые еще не выяснены [3]. Первые и самые быстрые изменения начинаются в позднем подростковом возрасте. Растяжение в этот период сокращается вдвое с 80% до 40% за период от 15 до 25 лет. Это соответствует линеаризованному снижению скорости растяжения примерно на 4% в год. В возрасте от 25 до 40 лет растяжение остается примерно постоянным и составляет около 40%.После 40 лет растяжение продолжает уменьшаться с более медленной линеаризованной скоростью примерно 1% в год до 58 лет [25]. Таким образом, клапан от 15-летнего донора растягивается примерно в четыре раза больше, чем клапан от 58-летнего донора. Ткани становятся менее растяжимыми с возрастом, потому что фибриллогенез коллагена увеличивает диаметр некоторых составляющих фибрилл дискретными шагами. Таким образом, большее количество толстых коллагеновых фибрилл потребует большей силы, чтобы произвести такое же удлинение, что приведет к уменьшению растяжения.
Исследования in vivo , проведенные Thubrikar, измеряли изменение длины створки в окружном и радиальном направлениях во время сердечного цикла в аортальных клапанах собак. Он заметил, что створка как в окружном, так и в радиальном направлениях длиннее во время диастолы, чем во время систолы. Створки удлиняются на 11% в окружном направлении и на 31% в радиальном от систолы к диастоле [3]. Это связано с тем, что коллаген в окружном направлении обеспечивает большую прочность на разрыв, чем в радиальном направлении, который в основном состоит из эластичных структур.Эти результаты in vivo хорошо согласуются с результатами in vitro , недавно опубликованными Yap et al. [8] демонстрирует окружную деформацию ~ 11% в окружном направлении и ~ 28% в радиальном направлении. Кроме того, Christie и Barratt-Boyes [25] измерили двухосные свойства свежих и фиксированных глутаральдегидом створок легочного и аортального клапана во время разгибания. Для легочных створок радиальное растяжение было больше, чем для створок аорты, и окружное растяжение было аналогичным.Таким образом, отношение радиального к окружному растяжению составляло 6,0 ± 1,1 для створок аорты и 9,0 ± 1,8 для створок легкого. После фиксации в 0,2% глутаровом альдегиде соотношения в створках аорты были такими же, за исключением значительного уменьшения растяжения в обоих направлениях.
4. Механобиология ремоделирования, воспаления и кальцификации аортального клапана
Теперь очевидно, что собственные сердечные клапаны — в частности, аортальный и митральный клапаны — функционируют в значительной и сложной окружающей гемодинамической среде, на которую клапанная структура постоянно реагирует.Механическая среда меняется в пространстве и во времени в течение сердечного цикла. Тесная корреляция между механическими нагрузками и биологией сердечного клапана давно подтверждена клиническими наблюдениями и исследованиями на животных [26–30]. Однако клеточные и молекулярные события, вовлеченные в эти процессы, все еще остаются неясными. Более того, биологический ответ и механотрансдуктивные сигнальные пути, по-видимому, отличаются от широко изученных аналогов сосудистых клеток [19, 31].
Согласно различным ранним исследованиям, структурные компоненты аортального клапана подвергаются постоянному обновлению в ответ на механическую нагрузку [26], а участки синтеза белка и гликозаминогликанов в створках коррелируют с областями функционального стресса [27]. Изменения механической нагрузки, в свою очередь, изменяют биосинтетическое поведение клапанных клеток. Например, синтез коллагена в створках митрального клапана был усилен в результате изменения распределения напряжения из-за инфаркта левого желудочка [32].Другие исследования показывают, что аномальная гемодинамика створок клапана вызывает воспаление тканей, которое может привести к кальцификации, стенозу и окончательной недостаточности клапана [33–37]. Общей чертой вальвулопатии, по-видимому, является экспрессия фенотипа активированных миофибробластов в интерстиции клапана [38], который отсутствует в покоящейся створке, но присутствует в большом количестве во время инициации и прогрессирования заболевания [39, 40]. Выражение определенных фенотипов клапанных эндотелиальных и интерстициальных клеток, по-видимому, зависит не только от комбинации внутренней генетически запрограммированной биологии, но также и от местных гемодинамических факторов окружающей среды, одним из семейств которых являются стрессы, вызванные кровотоком и структурной деформацией из-за створки. деформация.Поэтому есть надежда, что детальное понимание клапанной механобиологии и регуляции болезни позволит разработать лучшие варианты лечения клапанной болезни.
Традиционные лабораторные исследования можно разделить на ex vivo или in vitro . Исследования in vitro подходят к биологической проблеме на клеточном уровне и имеют огромную полезность для выяснения механизмов передачи сигналов. Тем не менее, в клапане, где существует несколько типов клеток, паракринная передача сигналов между эндотелиальными и интерстициальными клетками является ключевой, и in vitro исследования одноклеточных ограничены в их способности объяснить.Лишь недавно были достигнуты успехи в разработке 2D и 3D моделей кокультуры in vitro для клапана [41]. Кроме того, критические взаимодействия клетки с внеклеточным матриксом не могут быть полностью смоделированы in vitro . Ex vivo Исследования целых тканей могут восполнить этот критический пробел.
Биореакторы — это стандартные средства приложения механических сил к клеткам или тканям. Коммерчески доступные устройства включают в себя устройства Flexercell для растяжения, сжатия или потока, которые в основном используются для клеток в культуре.Несколько исследовательских групп также разработали индивидуальные биореакторы для культивирования участков ткани клапана или всего клапанного аппарата. К ним относятся устройства, которые подвергают ткани растяжению, напряжениям сдвига [42], напряжениям изгиба [43] и давлению [44, 45]. В последнее время стали более распространенными биореакторы, подвергающие ткань клапана комбинированным механическим силам [43, 46], и «настольные имитаторы сердца» [47–49], которые подвергают весь эксплант клапана гемодинамическим силам. В следующих разделах обсуждаются ключевые результаты лабораторных исследований in vitro и ex vivo , посвященных патологическим изменениям, которые испытывает аортальный клапан при воздействии различных гемодинамических стимулов, организованных различными механическими силами.
4.1. Влияние статического и пульсирующего давления
Влияние давления на культивируемые клетки широко изучалось на эндотелиальных клетках сосудов, гладкомышечных клетках, хондроцитах хряща и других типах клеток [50–54]. Затронутые свойства включают пролиферацию клеток, апоптоз, синтетическую активность и экспрессию генов, что позволяет предположить, что влияние давления на клеточную функцию является сложным. Кроме того, было доказано наличие двух различных механорегуляторных механизмов статического и пульсирующего давления, как указано в работе Суховой и соавт.[54]. Эффекты изменений статического и пульсирующего циклического давления были исследованы на всей ткани клапана с использованием биореакторов с камерой под давлением. По большей части, либо сжатый воздух, либо поршень использовался для контролируемого изменения давления внутри камеры под давлением. Xing et al. исследовали влияние статического и циклического давления на створки аортального клапана, уделяя особое внимание величине давления и частоте пульса [44]. Широкий диапазон давлений (80–120, 120–160 и 150–190 мм рт. Ст.) И частот импульсов (0.5, 1.167 и 2 Гц). Повышенное статическое давление вызывало увеличение синтеза коллагена, которое было более значительным при повышенном давлении, в то время как не наблюдалось значительной разницы в синтезе ДНК или sGAG. Заметное снижение α -SMA, стандартного маркера активации интерстициальных клеток клапана, наблюдалось в ходе этих экспериментов, хотя не наблюдалось значительной разницы между группами давления и контроля. Был сделан вывод, что повышенное давление вызывает пропорциональное увеличение синтеза коллагена створками аортального клапана свиньи и оказывает понижающее влияние на активацию клапанных клеток.Культивирование под пульсирующим давлением показало, что увеличение величины давления (с частотой, фиксированной на 1,167 Гц) приводило к значительному увеличению синтеза как коллагена, так и сульфатированного гликозаминогликана (sGAG), в то время как синтез ДНК оставался неизменным. Ответы на частоту пульса (со средней величиной, установленной на уровне 100 мм рт. Ст.) Были более сложными. Синтез коллагена и синтез сГАГ увеличивались при 0,5 Гц, но не изменялись при 1,167 и 2 Гц. Напротив, синтез ДНК увеличивался при 2 Гц, но не при 0.5 и 1,167 Гц. В условиях экстремального гипертонического давления (170 мм рт. Ст., 2 Гц) синтез коллагена и синтез сГАГ были увеличены, но в меньшей степени, чем при 170 мм рт. Ст. И 1,167 Гц. Как и в случае исследований статического давления, в ходе экспериментов наблюдалось заметное снижение α -SMA. В последующем исследовании Warnock et al. [55] сообщили о значительном увеличении экспрессии VCAM-1 при повышенном давлении, что свидетельствует о раннем воспалительном ответе.
Эти результаты предполагают, что циклическое давление влияет на биосинтетическую активность створок аортального клапана в зависимости от величины и частоты.Синтез коллагена и синтез сГАГ были положительно коррелированы и более чувствительны к величине давления, чем к частоте пульса. Синтез ДНК больше реагировал на частоту пульса, чем на величину давления. Однако при объединении величина давления и частота импульсов оказывали ослабляющее влияние друг на друга. Интересно, что активированный сократительный фенотип интерстициальной клетки клапана, измеренный по экспрессии α -SMA, не экспрессировался при культивировании под изолированным давлением.Взятые вместе, наблюдаемое увеличение провоспалительной экспрессии предполагает важную роль трансклапанного давления в опосредовании клапанного заболевания и активации клапанных клеток.
4.2. Влияние напряжения сдвига в жидкости
Ранние исследования в основном были сосредоточены на влиянии постоянного напряжения сдвига на биологию аортального клапана [56]. Эти исследования в основном проводились в биореакторах с параллельными пластинчатыми камерами и показали, что постоянное напряжение сдвига изменяет биосинтетическую активность створок аортального клапана и не может сохранить экспрессию α -SMA в клетках [56].Хотя клеточные механизмы, запускающие этот специфический ответ на напряжение сдвига, не были хорошо изучены, было высказано предположение, что клапанный эндотелий играет важную роль. Butcher et al. [19] сообщили, что эндотелиальные клетки клапана выровнены параллельно стабильному ламинарному потоку в отличие от эндотелиальных клеток сосудов, подчеркивая разницу между этими двумя типами клеток. Было также постулировано, что эндотелиальные клетки аортального клапана, совместно культивируемые с гладкомышечными клетками, могут влиять на свойства гладкомышечных клеток посредством высвобождения паракринных факторов [41]. Ex vivo эксперименты из лаборатории Йоганатана продемонстрировали, что клапанные реакции на сдвиг в отсутствие эндотелия заметно отличались от ответов интактных створок (рис. 3). Синтез коллагена в неповрежденных листочках усиливался под действием напряжения сдвига, но не изменялся в листочках, лишенных эндотелия, при том же напряжении сдвига; На содержание sGAG не влияло напряжение сдвига в неповрежденных створках, но оно регулировалось напряжением сдвига в обнаженных створках. Эти результаты показывают, что интерстициальные клетки аортального клапана реагируют на напряжение сдвига в отсутствие эндотелиальных клеток аортальных клапанов, но присутствие эндотелиальных клеток аортальных клапанов опосредует эти ответы.
Известно, что матриксные металлопротеиназы и катепсины играют важную роль в ремоделировании различных типов тканей и часто экспрессируются на ранних стадиях прогрессирования заболевания аортальных клапанов [57, 58]. Это было элегантно продемонстрировано с помощью молекулярной визуализации Aikawa et al. [59]. Было показано, что активность катепсина L снижается в ответ на устойчивое ламинарное напряжение сдвига [60]. Поскольку функция катепсина L заключается в деградации коллагена, наблюдаемое более высокое содержание коллагена в условиях напряжения сдвига, вероятно, связано, по крайней мере частично, с увеличением общего содержания коллагена из-за подавления процесса деградации.Результирующий пул коллагена в ткани клапана представляет собой динамический баланс между новым синтезом и деградацией коллагеназами, такими как катепсины, которые регулируются механическими факторами, такими как напряжение сдвига. Кроме того, ингибирующие эффекты напряжения сдвига на активность катепсина L, по-видимому, не зависят от присутствия интактного эндотелия, как предполагалось в исследовании ex vivo [60]. Снижение активности катепсина L в листочках, лишенных эндотелия, почти аналогично тому, которое наблюдается в интактных листочках, подвергшихся воздействию сдвигового напряжения жидкости.Это означает, что регуляция активности катепсина напряжением сдвига может быть достигнута посредством пути, который не требует участия эндотелия.
Напряжение сдвига также является важной гемодинамической силой, которая напрямую регулирует воспаление, кальцификацию и оссификацию, которые являются общими чертами заболеваний аортального клапана [52, 53, 61]. Хотя события, приводящие к этим болезненным состояниям, имеют некоторое сходство с минерализацией костей [34, 54], их молекулярные механизмы остаются в значительной степени недостаточно изученными [62].Заболевания аортального клапана преимущественно возникают на аортальной стороне створок клапана, где они подвергаются сложным и нестабильным гемодинамическим условиям [58, 63]. Причины этой побочной реакции, потенциально связанной с местной средой напряжения сдвига, до конца не изучены. Хотя было проведено множество исследований для характеристики реакции сосудистых эндотелиальных клеток на напряжение сдвига [64, 65], исследований клапанных эндотелиальных клеток немного. Было показано, что воздействие на клапанный эндотелий постоянного однонаправленного напряжения сдвига приводит к выравниванию эндотелиальных клеток перпендикулярно потоку, тогда как эндотелиальные клетки сосудов выравниваются параллельно потоку [19].Кроме того, профили транскрипции обоих типов клеток сравнивались в условиях статического напряжения и напряжения сдвига, и было обнаружено, что до 10% генов, рассмотренных в этом исследовании, значительно различаются [66], что свидетельствует о явных фенотипических различиях между этими двумя клетками. типы в ответ на напряжение сдвига. Несмотря на эти различия, было показано, что патологические воспалительные реакции двух типов клеток включают сходные медиаторы, такие как молекула адгезии сосудистых клеток-1 (VCAM-1) и молекула внутриклеточной адгезии-1 (ICAM-1) [67].В контексте клапанного ответа эти медиаторы экспрессируются преимущественно на аортальной стороне створки. Помимо этой побочной специфичности, кальцификация и воспаление аортального клапана связаны с экспрессией трансформирующего фактора роста-бета1 (TGF- β 1) [68]. TGF- β 1 представляет собой полипептидный член суперсемейства TGF- β , который состоит из TGF- β s, ингибинов, костных морфогенных белков (BMP), факторов дифференцировки роста, антимюллерова гормона, активинов и миостатина. [69].Было показано, что TGF- β 1 запускает кальцификацию в интерстициальных клетках аортального клапана овцы за счет увеличения активности щелочной фосфатазы [70]. Хотя клеточные и клинические исследования предполагают потенциальную роль TGF- β 1 в инициации и прогрессировании кальцификации в интерстициальных клетках аортального клапана, исследования на тканевом уровне отсутствуют. Кроме того, хотя было показано, что воздействие на эндотелиальные клетки сосудов осциллирующего напряжения сдвига вызывает воспалительные реакции посредством BMP-зависимых механизмов [71, 72], неясно, играет ли BMP роль в воспалительных ответах в створке аортального клапана в реакция на измененную механическую среду.
Sucosky et al. изучили влияние пульсирующих и колебательных сдвиговых напряжений на образцы створок аортального клапана в модифицированном конусно-пластинчатом биореакторе [42, 73]. Основная цель этого исследования состояла в том, чтобы понять влияние измененной гемодинамики на клеточный ответ аортального клапана. Воздействие на поверхность аорты пульсирующего напряжения сдвига (т.е. нефизиологической или измененной гемодинамической силы) увеличивало экспрессию воспалительных маркеров (рис. 4). Напротив, ни пульсирующее, ни колебательное напряжение сдвига не влияло на экспрессию воспалительных маркеров на поверхности желудочков.Зависимая от напряжения сдвига экспрессия VCAM-1, ICAM-1 и BMP-4, но не TGF- β 1, была значительно снижена ингибитором BMP noggin, тогда как ингибитор TGF- β 1 SB431542 блокировал Экспрессия BMP-4 (рис. 5) на поверхности аорты, подверженной импульсному напряжению сдвига. Таким образом, эти результаты демонстрируют, что измененная гемодинамика стимулирует экспрессию молекул адгезии эндотелия AV створки TGF- β 1- и BMP-4-зависимым образом, обеспечивая некоторые потенциальные направления для будущей лекарственной терапии заболеваний AV.
Как продолжение этой работы, еще одно исследование ex vivo изучало отдельные эффекты изменений величины напряжения сдвига на активацию клапанного эндотелия [74]. Фиброза листочков свиньи подвергалась воздействию субфизиологических, физиологических и супрафизиологических величин собственного колебательного напряжения сдвига в одном и том же устройстве с конусом и пластиной. В условиях умеренного и тяжелого надфизиологического напряжения сдвига экспрессия VCAM-1 и ICAM-1 наблюдалась на эндотелиальной выстилке фиброзы, в то время как положительное окрашивание BMP-4 и TGF- β 1 было обнаружено как в эндотелиальном, так и в субэндотелиальном слоях. (Рисунок 6 (а)).Напротив, воздействие на фиброзу физиологического и субфизиологического напряжения сдвига не вызывало какого-либо положительного окрашивания. Эти результаты демонстрируют зависимость величины напряжения сдвига от патологического состояния створки в ответ на гемодинамические изменения. Кроме того, были исследованы синергические эффекты BMP-4 и TGF- β 1 на активацию клапанного эндотелия, вызванную напряжением сдвига, путем подавления этих цитокинов с помощью культуральной среды, дополненной антагонистом BMP noggin и TGF-. β 1 ингибитор SB-431542.При сверхфизиологическом напряжении сдвига комбинированная обработка noggin + SB-431542 значительно снижала экспрессию цитокинов и молекул клеточной адгезии по сравнению с уровнями, измеренными в тканях, подвергшихся воздействию аналогичных условий в стандартной среде, и возвращала их к уровням, измеренным в свежих контролях ( Рисунок 6 (б)). Эти результаты демонстрируют, что (1) воздействие на фиброзу надфизиологического напряжения сдвига стимулирует экспрессию цитокинов и молекул клеточной адгезии в течение 48 часов, (2) BMP-4 и TGF- β 1 взаимодействуют, синергетически регулируя активацию эндотелия в ответ. на повышенное напряжение сдвига, и (3) TGF- β 1 играет доминирующую роль в патологической реакции АВ створок, вызванной стрессом сдвига.
4.3. Эффекты циклического растяжения
Как упоминалось ранее, циклическое растяжение является одной из сил, испытываемых аортальным клапаном во время сердечного цикла, которая позволяет створкам клапана расширяться и формировать коаптивное уплотнение во время диастолы [22, 23]. Клапан в нормальных физиологических условиях во время диастолы растягивается примерно на 10% [3, 75]. Используя проточную петлю in vitro и нативный аортальный клапан свиньи, Yap et al. продемонстрировали, что на каждые 40 мм рт. ст. повышение давления приводит к увеличению циклического растяжения на 5% [8].Эффекты циклического растяжения на аортальном клапане были исследованы на клапанных клетках, а также на клапанной ткани в целом. Большинство исследований in vitro было проведено с использованием устройства Flexercell и в основном в качестве одноклеточных моделей, изучающих эндотелиальные или интерстициальные клетки [76–78]. In vitro моделей сокультивирования для циклического растяжения отсутствовали, в то время как биореакторы, изготовленные на заказ, использовались для изучения всего клапана. Одним из таких устройств является биореактор растяжения при растяжении, который использовался для культивирования целых образцов клапана при определенной форме волны растяжения [79–81].
Batten et al. сообщили, что циклическое растяжение усиливает синтез коллагена в интерстициальных клетках клапана, а также в мезенхимальных стволовых клетках [78], что также недавно было продемонстрировано Balachandran et al. на створках клапана целиком с использованием вышеупомянутого биореактора растяжения [79]. Это исследование показало, что содержание коллагена увеличивалось с увеличением растяжения, в то время как содержание sGAG снижалось. Также было показано, что циклическое растяжение усиливает сократительный фенотип интерстициальных клеток, что контрастирует с результатами исследований давления.Кроме того, исследования растяжения показывают, что α -актин гладких мышц преимущественно экспрессируется на желудочковой стороне растянутой створки аортального клапана [79]. Merryman et al. сообщили, что интерстициальные клетки клапана реагируют на локальные тканевые стрессы изменением клеточной жесткости посредством биосинтеза коллагена [82]. Действительно, было высказано предположение, что жесткость клапана может быть важным регулятором кальцификации [83]. Hopkins et al. также сообщили, что присутствие цитокинов, таких как TGF- β 1, в среде циклического растяжения может потенциально привести к измененной архитектуре матрикса и нарушению функции клапана, что подчеркивает важность циклического растяжения в регуляции структуры клапана, функции и прогрессирования заболевания [81 ].
Стеноз аорты и регургитация, которые являются клиническими проявлениями болезни аортального клапана, у нескольких пациентов коррелировали со сверхэкспрессией протеолитических ферментов, таких как матриксные металлопротеиназы (ММП), их тканевые ингибиторы (ТИМП) и катепсины [84]. Во время нормального гомеостаза в аортальном клапане существует баланс между биосинтезом внеклеточного матрикса и деградацией, поддерживаемый этими ферментами [85]. Нарушение этого хрупкого равновесия может привести к патологическому ремоделированию тканевого матрикса и нарушению функции клапана [84].Некоторые из этих катепсинов, ММП и ТИМП, также участвуют в ключевых клеточных процессах, таких как апоптоз, пролиферация и дифференцировка клеток, и продемонстрировали свою роль в путях поражения клапанов [86]. Катепсины K, L и S, которые являются мощными эластолитическими протеазами, были связаны с прогрессированием атеросклеротических бляшек [53] и миксоматозными сердечными клапанами [87].
Сукоски и др. [80] изучали влияние трех уровней циклического растяжения (10% -физиологическое, 15% -патологическое, 20% -гиперпатологическое) на ремоделирование внеклеточного матрикса аортального клапана в аортальных клапанах свиней с акцентом на вышеупомянутые MMP, TIMP и катепсины. .Иммуногистохимическое окрашивание показало, что экспрессия катепсина S и K повышалась на 15% циклическим растяжением, тогда как экспрессия катепсина L снижалась по сравнению с контролем. Желатиновая зимография и обратная зимография выявили модуляцию активности ММП и ТИМП в зависимости от времени и величины. Активность ТИМП была значительно снижена на всех уровнях циклического растяжения по сравнению со свежими контролями. Активность коллагеназы была значительно увеличена по сравнению со свежими контролями после 15% и 20% растяжения.Эти результаты предполагают, что активность некоторых протеолитических ферментов (катепсин S, K, MMP-2,9) может быть механочувствительной и играть важную роль в прогрессировании вальвулопатии при изменении механической нагрузки.
Более детально исследуя механизмы, лежащие в основе заболевания клапана, вызванного растяжением, мы стремились понять влияние растяжения на кальцификацию клапанной ткани [88]. Используя остеогенную среду для стимуляции быстрого воспаления клапана и кальцификации на столе, Balachandran et al.наблюдали, что минерализация ткани происходила в зависимости от величины растяжения, которая ингибировалась антагонистом костного морфогенного белка noggin, зависимым от концентрации noggin образом. Таким образом, эти результаты подчеркивают, что, как и при сдвиговом напряжении жидкости, воспаление клапана и кальцификация модулируются цитокинами, такими как TGF- β 1 и BMP-4, и что сигнальные пути, индуцированные этими молекулами, могут быть очень чувствительными к механочувствительности. Smith et al. [77] сообщили о противовоспалительном действии циклической деформации на интерстициальные клетки аортального клапана.Очевидная разница с результатами, полученными Balachandran et al. считается, что это связано с отсутствием эндотелиальных клеток в предыдущем исследовании, что подчеркивает важность перекрестного взаимодействия между эндотелиальными и интерстициальными клетками. Кроме того, Ferdous et al. [89] продемонстрировали, что механизмы, вызываемые растяжением интерстициальных клеток клапана, отличаются от механизмов гладкомышечных клеток сосудов. Поэтому необходимы дальнейшие исследования в этой области, чтобы идентифицировать уникальные молекулы-кандидаты-мишени для генной и молекулярной терапии, чтобы предотвратить или замедлить воспалительное заболевание клапана.
4.4. Сложные режимы нагрузки
Из-за сложного взаимодействия между различными механическими силами, испытываемыми клапаном, возникла столь необходимая тенденция к разработке новых биореакторов, которые могут моделировать комбинированные механические силы на ткани клапана. Engelmayr et al. разработали биореактор «гибкий-растягивающий-поток» для изучения комбинированного воздействия изгиба, растяжения и напряжения сдвига на образцы тканей [43]. Thayer et al. разработали биореактор с растягивающим давлением и сообщили о несинергетической регуляции фенотипа клеток аортального клапана двумя механическими силами (т.е., противоположные эффекты растяжения по сравнению с давлением), предполагая важность комбинированной гаммы механической стимуляции для поддержания фенотипа клапана [46]. Действительно, Xing et al. продемонстрировали необходимость всех механических сил in vivo для нормального гомеостатического поддержания клапана [90]. Недавно Barzilla et al. разработали новый биореактор разбрызгивания [49] для митрального клапана, который также продемонстрировал важность механической стимуляции для нормальной функции сердечного клапана.Та же группа также продемонстрировала полезность этих моделей культуры целых органов при изучении серотонинергических клапанных заболеваний [48]. В целом, кажется, что реакция клапана на комбинированную механическую стимуляцию — это не просто сумма эффектов каждой из отдельных сил, а более сложная реакция.
5. Резюме и направление на будущее
Очевидно, что эта область добилась огромного прогресса в понимании механоответа клапанных клеток и того, как это связано с заболеванием.Исследования в области механобиологии сердечных клапанов были сравнительно недавними, и мы только сейчас начинаем получать более глубокое понимание сложного взаимодействия между клапанными клетками, внеклеточным матриксом и окружающей механической средой. Ранняя работа была сосредоточена на понимании механической среды и разработке биореакторов для проведения лабораторных исследований. В будущей работе необходимо уделять больше внимания деталям в конструкции точных биореакторов, которые моделируют комбинированные механические силы окружающей среды естественных тканей.Совместное культивирование (интерстициальные и эндотелиальные клетки) in vitro Модели также нуждаются в дальнейшем изучении [91], поскольку исследования ex vivo сами по себе не могут обеспечить уровень детализации в механорегуляции сигнальных путей. Кроме того, роль внеклеточного матрикса [83] и потенциальной нейрональной регуляции [12, 92] функции клапана стала важной во взаимодействии между структурой клапана, механикой и функцией, и ее нельзя упускать из виду. С целью разработки фармакологической и генной терапии воспаления и кальцификации клапана также существует острая потребность в устройствах, которые могут выполнять высокопроизводительное тестирование клапанных клеток или тканей и их механобиологических реакций.Moraes et al. продемонстрировали такое устройство при исследовании механорегуляции передачи сигналов wnt / β -catenin в клетках клапана [93]. Кроме того, новые доказательства региональных / фокальных вариаций в механике клапана [94] имеют потенциальное значение для понимания региональных вариаций клеточного ответа на эти разнообразные механические стимулы. Наконец, в настоящее время у нас нет возможности обратить вспять последствия кальцификации клапана после постановки диагноза. Замена сердечного клапана часто является единственным вариантом для этих пациентов, и было бы чрезвычайно ценно иметь возможность применить результаты механобиологии к разработке методов лечения, которые могут стимулировать клетки к резорбции или деградации кальцифицированных поражений.
По мере того, как мы углубляемся в наше понимание механобиологии клапана, стало ясно, что для ее изучения требуется междисциплинарный, иерархический подход (рис. 7). Ключевыми являются подходы, основанные на пересечении биологии, механики, биоинформатики и микро / наноинженерии. Интимные перекрестные помехи между различными шкалами длины позволят полностью понять механическую реакцию клапана. С таким пониманием можно работать над достижением конечной цели разработки методов лечения и функциональной замены пораженных клапанов.
Стеноз аорты
Обзор стеноза аорты
Стеноз аорты является наиболее частой причиной обструкции оттока ЛЖ (менее частые причины включают HOCM, подклапанный стеноз или, реже, надклапанный стеноз).
Этиология
AS можно разделить на врожденный (двустворчатый), ревматический или дегенеративный (кальцинозный). Если он сочетается с ревматической лихорадкой, почти всегда связан с митральной патологией. У этих пациентов частота внезапной смерти выше по сравнению с населением в целом.Большинство из них не проявляют симптомов (площадь клапана <0,9 см2) до 30 лет после начала.
Размеры клапана
Нормальная площадь клапана 2,5–3,5 см2 (2–4 см2 по Барашу). «Гемодинамически значимый стеноз» возникает при площади <1,2 см2. , но эти пациенты не обязательно имеют симптомы. «Симптоматический стеноз» обычно возникает при падении площади ниже 0,8–0,9 см2. Симптомы включают стенокардию (сердце), одышку при физической нагрузке (легкие) и ортостатический или физический обморок (мозг).Безоперационная выживаемость составляет 2-5 лет после появления симптомов. Варианты лечения на этом этапе включают медикаментозную терапию (дигоксин, ограничение натрия, диуретики), вальвулопластику (идеально подходит для молодых пациентов, эффективность обычно временна у пожилых пациентов) или хирургическое восстановление / замена.
«Критический стеноз аорты» возникает, когда площадь клапана <0,7 см2, при этом трансклапанный градиент будет составлять 50 мм рт. Ст. В покое (т.е. при нормальном сердечном выбросе) - при 0,7 см2 / 50 мм рт. их сердечный выброс.
Влияние на анатомию сердца
Левый желудочек становится концентрически утолщенным из-за увеличения постнагрузки, что имеет двойной эффект увеличения потребности миокарда и снижения податливости желудочков (таким образом, синусовый ритм и толчок предсердий являются КРИТИЧНЫМИ , обеспечивая 30-40% LVEDV). Повышенное систолическое давление еще больше увеличивает потребность. В начале заболевания LVEDP будет увеличиваться (что приводит к легочным симптомам), хотя LVEDV (преднагрузка) не увеличивается до поздних стадий заболевания.Сократимость миокарда со временем ухудшается, что еще больше ухудшает функцию левого желудочка.
Стеноз аорты во внесердечной хирургии
Мониторинг
Артериальный катетер сокращает время обнаружения гемодинамических нарушений и является обязательным в тяжелых случаях АС. Результаты ЭКГ часто не видны из-за ГЛЖ, что затрудняет обнаружение инфаркта миокарда. Катетеры легочной артерии используются часто, однако имейте в виду, что давление клина составляет , а не , что является хорошим показателем наполнения желудочков, поскольку податливость желудочков значительно снижается.Следует избегать использования вазодилататоров, если не установлен катетер PA. TEE также может быть полезным дополнением. Всегда имейте под рукой дефибриллятор. , потому что внешние компрессии практически бесполезны при значительном стенозе.
Гемодинамика
О пациентах с СА лучше всего думать на основании их гемодинамических нарушений — у них повышенная потребность миокарда в кислороде, снижение наполнения левого желудочка и, со временем, снижение сократимости. Что касается перфузии миокарда, диастолический объем должен поддерживаться . Нормальный синус имеет решающее значение для заполнения ЛЖ, при этом HR 60-90 является оптимальным ( эти пациенты часто ведут себя HR-зависимыми, поэтому брадикардия может быть разрушительной ).
Необходимо поддерживать постнагрузку (и, следовательно, перфузионное давление), ИЗБЕГАТЬ гипотонии . Может использоваться летучая или внутривенная общая анестезия, хотя летучие анестетики могут снижать автоматизм пазух, приводя к узловому ритму, а также вызывать угнетение миокарда, поэтому предпочтительнее анестетики на основе опиатов.Индукцию можно безопасно осуществить с помощью опиатов / бензодиазепинов, этомидата или бензодиазепинов / кетамина. Если используется летучий агент, его следует тщательно титровать, чтобы избежать угнетения миокарда, расширения сосудов или потери NSR.
Тахикардия и гипертония, которые плохо переносятся, следует лечить путем увеличения глубины анестезии. Если используется адреноблокатор, предпочтительнее эсмолол. Гипотонию обычно следует лечить небольшими дозами (25–50 мкг) фенилэфрина .Амиодарон эффективен как при наджелудочковых, так и при желудочковых аритмиях, хотя при наличии гемодинамической нестабильности показана немедленная кардиоверсия. Частая желудочковая эктопия (которая часто отражает ишемию) плохо переносится гемодинамически и требует лечения лидокаином внутривенно.
Центральная нейроаксиальная анальгезия может использоваться (с особой осторожностью) в легких случаях, но в противном случае ее следует избегать, поскольку она может привести к чрезмерному снижению УВО и, как следствие, ДАД / перфузии миокарда.Если используется, эпидуральная анальгезия предпочтительнее спинномозговой анальгезии.
Стеноз аорты в кардиохирургии
После ремонта / байпас
Поддерживайте систолическое давление <~ 100 мм рт. Ст., Чтобы защитить шовный нить аорты. e. Помните, что, хотя клапан был заменен, LV все еще дисфункциональный (например, снижение податливости), и этим пациентам может потребоваться относительно высокий LVEDP (т.е. они могут зависеть от предварительной нагрузки).
Эхокардиографическая оценка стеноза аорты
Для количественной оценки AS ASE рекомендует измерять скорость струи , средний градиент давления и площадь клапана (с использованием уравнения непрерывности).Если требуется дополнительная информация, можно оценить «безразмерный индекс» (VTI_LVOT / VTI_valve, серьезный, если <0,25) и площадь клапана с помощью 2D планиметрии .
Рекомендации ASE по количественному определению AS 1. Скорость струи (> 4 м / с — серьезная) 2. Градиент среднего давления (> 40 мм рт.
Полные рекомендации и комментарии см. В Руководстве ASE.
Стеноз аорты: диагностика и лечение
1.Линдроос М, Купари М, Heikkilä J, Тилвис Р. Распространенность аномалий аортального клапана у пожилых людей: эхокардиографическое исследование случайной выборки населения. Джам Колл Кардиол . 1993; 21 (5): 1220–1225 ….
2. Отто CM, Knuusisto J, Райхенбах Д.Д., Платье AM, О’Брайен К.Д. Характеристика раннего поражения «дегенеративного» клапанного стеноза аорты. Гистологические и иммуногистохимические исследования. Тираж .1994; 90 (2): 844–853.
3. Левин М.Б., Отто CM. Двустворчатый аортальный клапан: неблагоприятные исходы от младенчества до старости. Тираж . 2005. 111 (7): 832–834.
4. Тобин-младший, Рахимтула Ш. Бланделл ЧП, Swan HJ. Процент потери работы при инсульте левого желудочка. Простая гемодинамическая концепция для оценки степени тяжести клапанного стеноза аорты. Тираж . 1967. 35 (5): 868–879.
5.Пантели Г, Мортон М, Rahimtoola SH. Влияние успешной неосложненной замены клапана на гипертрофию, объем и производительность желудочков при стенозе аорты и недостаточности аорты. J Thorac Cardiovasc Surg . 1978. 75 (3): 383–391.
6. Гроссман В, Джонс Д, McLaurin LP. Напряжение стенки и паттерны гипертрофии левого желудочка человека. Дж. Клин Инвест . 1975. 56 (1): 56–64.
7. Гесс О.М., Риттер М, Шнайдер Дж., Гримм Дж. Турина М, Krayenbuehl HP.Диастолическая жесткость и структура миокарда при заболевании аортального клапана до и после замены клапана. Тираж . 1984. 69 (5): 855–865.
8. Гесс О.М., Виллари Б, Krayenbuehl HP. Диастолическая дисфункция при стенозе аорты. Тираж . 1993. 87 (5 доп.): 73–76.
9. Stott DK, Марполь Д.Г., Бристоу JD, Kloster FE, Griswold HE. Роль транспорта левого предсердия в аортальном и митральном стенозе. Тираж . 1970. 41 (6): 1031–1041.
10. Росс мл. Несоответствие постнагрузки и резерв преднагрузки: концептуальная основа для анализа функции желудочков. Программа Cardiovasc Dis . 1976; 18 (4): 255–264.
11. Johnson LL, Sciacca RR, Эллис К, Вайс МБ, Cannon PJ. Снижение кровотока в миокарде левого желудочка на единицу массы при стенозе аорты. Тираж . 1978. 57 (3): 582–590.
12. Маркус М.Л., Доти БД, Хирацка Л.Ф., Райт CB, Eastham CL. Снижение коронарного резерва: механизм стенокардии у пациентов со стенозом аорты и нормальными коронарными артериями. N Engl J Med . 1982. 307 (22): 1362–1366.
13. Бач Р.Дж., Ван И, Йоргенсен CR. Гемодинамические эффекты упражнений при изолированном клапанном стенозе аорты. Тираж . 1971. 44 (6): 1003–1013.
14.Греч Е.Д., Рамсдейл DR. Обморок при физической нагрузке при стенозе аорты: данные в поддержку несоответствующей реакции барорецепторов левого желудочка. Сердце Дж. . 1991; 121 (2 ч. 1): 603–606.
15. Шварц Л.С., Гольдфишер Дж. Sprague GJ, Schwartz SP. Обморок и внезапная смерть при стенозе аорты. Ам Дж. Кардиол . 1969. 23 (5): 647–658.
16. Кульбертус HE. Желудочковые аритмии, обмороки и внезапная смерть при стенозе аорты. Eur Heart J . 1988; 9 (приложение E): 51–52.
17. Мунт Б, Леггет МЕНЯ, Крафт CD, Мияке-Халл CY, Фудзиока М, Отто CM. Физикальное обследование при стенозе клапанного аорты: корреляция с тяжестью стеноза и прогноз клинического исхода. Сердце Дж. . 1999. 137 (2): 298–306.
18. Etchells E, Гленнс V, Shadowitz S, Белл C, Сиу С. Правило клинического прогноза у постели больного для выявления умеренного или тяжелого стеноза аорты. J Gen Intern Med . 1998. 13 (10): 699–704.
19. Боноу РО, Карабелло Б.А., Кану С, и другие. Рекомендации ACC / AHA 2006 по ведению пациентов с пороками клапанов сердца: отчет Целевой группы Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям [опубликованные исправления опубликованы в Circulation. 2007; 115 (15): e409]. Тираж . 2006; 114 (5): e84 – e231.
20. Отто CM, Перлман А.С.Допплерэхокардиография у взрослых с симптоматическим стенозом аорты. Диагностическая полезность и рентабельность. Arch Intern Med . 1988. 148 (12): 2553–2560.
21. Амблер Г, Омар Р.З., Ройстон П., Родственник Р, Кио БЭ, Тейлор К.М. Общая простая модель стратификации риска для операций на сердечном клапане. Тираж . 2005. 112 (2): 224–231.
22. Эдвардс FH, Петерсон Э.Д., Кумбс LP, и другие.Прогнозирование операционной смертности после операции по замене клапана. Джам Колл Кардиол . 2001. 37 (3): 885–892.
23. Общество торакальных хирургов. Управляющее резюме. Отчет СТС Весна 2005. http://www.sts.org/documents/pdf/Spring2005STS-ExecutiveSummary.pdf. По состоянию на ноябрь 2005 г.
24. Pellikka PA, Сарано МЭ, Нисимура Р.А., и другие. Исход у 622 взрослых с бессимптомным гемодинамически значимым стенозом аорты в течение длительного периода наблюдения. Тираж . 2005. 111 (24): 3290–3295.
25. Шварц Ф, Бауманн П., Манти Дж. и другие. Влияние замены аортального клапана на выживаемость. Тираж . 1982; 66 (5): 1105–1110.
26. Horstkotte D, Луген Ф. Естественное течение стеноза аортального клапана. Eur Heart J . 1988; 9 (приложение E): 57–64.
27. Линдблом Д., Линдблом U, Qvist J, Лундстрем Х.Долгосрочная относительная выживаемость после замены сердечного клапана. Джам Колл Кардиол . 1990. 15 (3): 566–573.
28. Отто CM. Стеноз клапанного аорты: тяжесть заболевания и сроки вмешательства. Джам Колл Кардиол . 2006. 47 (11): 2141–2151.
29. Vaquette B, Корбино H, Лоран М, и другие. Замена клапана у пациентов с критическим стенозом аорты и сниженной функцией левого желудочка: предикторы операционного риска, восстановления функции левого желудочка и отдаленные результаты. Сердце . 2005. 91 (10): 1324–1329.
30. Розенек Р, Связующее Т, Порента G, и другие. Предикторы исхода тяжелого бессимптомного стеноза аорты. N Engl J Med . 2000. 343 (9): 611–617.
31. Пелликка П.А., Нисимура Р.А., Бейли К.Р., Таджикский AJ. Естественное течение взрослых с бессимптомным гемодинамически значимым стенозом аорты. Джам Колл Кардиол . 1990. 15 (5): 1012–1017.
32. Amato MC, Моффа П.Дж., Вернер К.Э., Рамирес JA. Решение о лечении при бессимптомном стенозе аортального клапана: роль тестов с физической нагрузкой. Сердце . 2001. 86 (4): 381–386.
33. Дас П, Римингтон H, Чемберс Дж. Тесты с физической нагрузкой для определения риска стеноза аорты. Eur Heart J . 2005. 26 (13): 1309–1313.
34. Альборино Д, Хоффманн JL, ПК Fournet, Блох А. Значение нагрузочных тестов для оценки показаний к хирургическому вмешательству у бессимптомных пациентов с клапанным стенозом аорты. J Сердце клапана Dis . 2002. 11 (2): 204–209.
35. Антонини-Кантерин Ф, Хуан Г, Cervesato E, и другие. Симптоматический стеноз аорты: играет ли системная гипертензия дополнительную роль? Гипертония . 2003. 41 (6): 1268–1272.
36. O’Brien KD, Чжао XQ, Шавелле ДМ, и другие. Гемодинамические эффекты ингибитора ангиотензинпревращающего фермента рамиприла у пациентов с легким и умеренным стенозом аорты и сохраненной функцией левого желудочка. Дж. Исследование Мед. . 2004. 52 (3): 185–191.
37. Хименес-Кандил Дж., Бермеджо Дж., Йотти Р., и другие. Эффекты ингибиторов ангиотензинпревращающего фермента у пациентов с гипертонией и стенозом аортального клапана: исследование отмены лекарств. Сердце . 2005. 91 (10): 1311–1318.
38. Чоккалингам А, Венкатесан С, Субраманиам Т, и другие. Безопасность и эффективность ингибиторов ангиотензинпревращающего фермента при симптоматическом тяжелом стенозе аорты: пилотное исследование симптоматической обструкции сердца эналаприла при стенозе аорты (SCOPE-AS). Сердце Дж. . 2004; 147 (4): E19.
39. Zipes DP, Libby P, Bonow RO, Braunwald E, eds. Болезнь сердца Браунвальда: Учебник сердечно-сосудистой медицины. 7-е изд. Филадельфия, Пенсильвания: Эльзевир; 2005: 1582–1592.
40. Целевая группа превентивных служб США. Справочник по клинико-профилактическим службам. 3-е изд. 2000–2002 гг. http://www.ahrq.gov/clinic/prevnew.htm. По состоянию на 29 мая 2008 г.
41. Bonow RO, Чейтлин MD, Кроуфорд MH, Дуглас PS. Целевая группа 3: пороки сердца. Джам Колл Кардиол . 2005. 45 (8): 1334–1340.
42. Розенек Р, Райдер F, Лохо Н, и другие. Статины, но не ингибиторы ангиотензинпревращающего фермента, замедляют прогрессирование стеноза аорты. Тираж . 2004. 110 (10): 1291–1295.
43. Беллами М.Ф., Пелликка П.А., Кларич К.В., Таджикский А.Дж., Энрикес-Сарано М. Связь уровней холестерина, лечения ингибитором гидроксиметилглутарилкофермента-А-редуктазы и прогрессирования стеноза аорты в сообществе. Джам Колл Кардиол . 2002. 40 (10): 1723–1730.
44. Коуэлл С.Дж., Ньюби ДЕ, Прескотт Р.Дж., и другие., для исследователей шотландского исследования стеноза аорты и снижения уровня липидов, «Воздействие на регресс» (SALTIRE). Рандомизированное исследование интенсивной гиполипидемической терапии кальцифицирующего стеноза аорты. N Engl J Med . 2005. 352 (23): 2389–2397.
45. Фриман Р.В., Отто CM. Спектр кальцифицированного поражения аортального клапана: патогенез, прогрессирование заболевания и стратегии лечения. Тираж . 2005. 111 (24): 3316–3326.
46. Уилсон В., Тауберт К.А., Гевиц М, и другие. Профилактика инфекционного эндокардита: рекомендации Американской кардиологической ассоциации: рекомендации Комитета по ревматической лихорадке, эндокардиту и болезни Кавасаки, Совета по сердечно-сосудистым заболеваниям у молодежи и Совета по клинической кардиологии, Совета по сердечно-сосудистой хирургии и анестезии Американской кардиологической ассоциации , и Междисциплинарная рабочая группа по исследованию качества медицинской помощи и результатов [опубликованное исправление появляется в Circulation.2007; 116 (15): e376–377]. Тираж . 2007. 116 (15): 1736–1754.
Стеноз аортального клапана — Knowledge @ AMBOSS
Последнее обновление: 30 апреля 2021 г.
Резюме
Стеноз аортального клапана (AS) — это порок клапанов сердца, характеризующийся сужением аортального клапана. В результате затрудняется отток крови из левого желудочка в аорту. Это приводит к хронической и прогрессирующей избыточной нагрузке на левый желудочек и, возможно, к левожелудочковой недостаточности.Пациент может длительное время оставаться бессимптомным; по этой причине АС часто обнаруживается поздно, когда он впервые становится симптоматическим (одышка при физической нагрузке, стенокардия или обморок). При аускультации выявляется резкий шум крещендо-декрещендо в систоле, который иррадирует в сонные артерии, а пульсации замедляются с уменьшением ударов сонной артерии вверх. Эхокардиография — неинвазивный золотой стандарт диагностики. Пациенты с легким бессимптомным стенозом аорты лечатся консервативно с мониторингом и медикаментозным лечением связанных состояний (например,г, артериальная гипертензия). Пациентам с симптомами или пациентам с тяжелым стенозом аортального клапана требуется немедленная замена аортального клапана (ЗАК) в качестве окончательного лечения. Варианты замены клапана включают хирургическую AVR или транскатетерную AVR (TAVR) для пациентов с высоким операционным риском. Пациенты с тяжелым АС имеют высокий риск развития острых осложнений, таких как сердечная недостаточность и кардиогенный шок, которые сложно контролировать и часто требуют вмешательства в интенсивную терапию и ускоренного хирургического вмешательства или TAVR.
Эпидемиология
Эпидемиологические данные относятся к США, если не указано иное.
Этиология
Наиболее частые этиологии клапанного стеноза аорты включают:
- Склероз аортального клапана: кальциноз и фиброз створок аортального клапана [2]
- Двустворчатый аортальный клапан (BAV): слияние двух из трех створок аортального клапана в утробе матери [2]
- Ревматическая лихорадка [3]
- Редкая причина АС в странах с высоким уровнем доходов из-за постоянного использования антибиотиков для лечения стрептококкового фарингита
- По-прежнему остается важной причиной АС в странах с низким уровнем дохода, где антибиотики могут быть менее доступны.
- Стеноз вызывается спаечным слиянием. [3]
Патофизиология
Ссылки: [5] [6]
Клинические особенности
Стеноз аорты может оставаться бессимптомным в течение многих лет; , особенно при стенозе легкой или средней степени тяжести. Симптомы обычно начинают развиваться, когда болезнь переходит в тяжелую форму АС, и могут проявляться в состоянии покоя или при физической нагрузке.
Чтобы вспомнить три основных симптома стеноза аортального клапана, подумайте: САД (обморок, стенокардия, одышка).
Каталожные номера: [5] [7]
Классификация
Система стадирования Американской кардиологической ассоциации (AHA) / Американского колледжа кардиологии (ACC)
[8]- Используется для мониторинга прогрессирования заболевания и определения необходимости вмешательства
- На основе эхокардиографических критериев анатомии клапана и гемодинамики
| Стадия AHA / ACC при стенозе аортального клапана [8] | ||||||||
|---|---|---|---|---|---|---|---|---|
| Стадия | Определение | Зона аортального клапана (AVA) | Трансаортальный градиент скорости | 909 909 909 908 909 909 909 Средний градиент аортального давления 909Стеноз аортального клапана стадии А | С риском АС | 3–4 см 2 | ||
| Стеноз аортального клапана стадии B | Progressive AS | Легкая: 1.5–2,9 см 2 | 2,0–2,9 м / с | 10–19 мм рт. | ||||
| Стеноз аортального клапана стадии C1 | Бессимптомный тяжелый АС (нормальный LVEF) | ≤ 1,0 см 2 | ≥ 4,0 м / с | ≥ 40 мм рт. Ст. | ||||
| Стеноз аортального клапана C2 | s Бессимптомный тяжелый AS (LVEF)||||||||
| Стеноз аортального клапана стадии D | Симптоматический тяжелый AS | |||||||
Диагностика
Первичная оценка
Эхокардиография
[8]- Показания: Оценка структуры, функции и степени стеноза аортального клапана, левого желудочка и других сердечных клапанов (см. Клапанные пороки сердца)
- TTE: рекомендуемый первичный тест и неинвазивный золотой стандарт, используемый для подтверждения диагноза и определения степени тяжести AS [8]
- TEE: метод второй линии для подтверждения результатов TTE или оперативного планирования [9]
- Подтверждающие данные
Прочее
Дополнительная оценка
[8]Стресс-тест с низкими дозами добутамина
- Показания: стадия D АС с ФВЛЖ для определения истинной анатомической тяжести стеноза.
- Типовые выводы
Тестирование с физической нагрузкой
Тестирование с физической нагрузкой противопоказано пациентам с тяжелым симптоматическим АС (стадия D).
Катетеризация сердца
Расширенная визуализация
[8] [14] [15]Рассмотрите следующие варианты неинвазивной визуализации при периоперационной оценке пациентов с тяжелым АС вместе с консультацией специалиста. [8] [14]
- КТ сердца
- Используется у некоторых пациентов для исключения сопутствующей ИБС, если вероятность предварительного тестирования низкая
- Может количественно определить кальцификацию клапана
- Полезно для конкретных измерений, необходимых до TAVR
- МРТ сердца
- Предоставляет точную информацию об анатомии и гемодинамике
- Может быть полезно при оценке степени тяжести СА, но не всегда доступно
Дифференциальный диагноз
Лечение
Общие принципы
[8]- Стеноз аортального клапана — это прогрессирующее состояние, и для окончательного лечения требуется замена клапана.
- Срочность ремонта / замены клапана зависит от стадии.
- Симптоматический и / или тяжелый АС: обычно показано протезирование аортального клапана
- Бессимптомный или АС легкой-средней степени тяжести: ведение сопутствующих соматических заболеваний и мониторинговая эхокардиография; некоторым может быть полезна ранняя замена клапана [16]
- Лечение острых осложнений требует индивидуального и специализированного ухода.
Ведение врача
Ведение сопутствующих соматических заболеваний
[8]Все пациенты должны пройти обследование и пройти лечение по поводу других факторов сердечного риска.
Ведение острых осложнений
[3] [8] [16] [24]Рекомендуется незамедлительная консультация специалиста по интенсивной терапии и быстрое направление к хирургу. Пациенты должны получить AVR как можно скорее.
Уменьшение постнагрузки (например, с помощью вазодилататоров или диуретиков) при тяжелом АС может снизить сердечный выброс настолько, чтобы нарушить системную и миокардиальную перфузию. Рекомендуется тщательное титрование под руководством специалиста.
Тяжелый АС нарушает коронарную перфузию (из-за высокого давления в ЛЖ и низкого давления в корне аорты).Избегайте гипотонии, так как она может вызвать ишемию сердца.
Мониторинг и профилактика антибиотиков
[8]- Эхокардиография
- Регулярное последующее обследование показано бессимптомным пациентам с:
- Визуализация по запросу показана пациентам с:
- Любыми изменениями признаков или симптомов
- Состояниями с высокими гемодинамическими / метаболическими требованиями
- Профилактические антибиотики
Замена и восстановление аортального клапана (AVR)
Показания
- Симптоматические пациенты с тяжелым высокоградиентным АС (стадия АС D)
- Бессимптомные пациенты с тяжелым AS и:
- AVR также могут быть полезны для некоторых пациентов с умеренным (стадия B AS) до тяжелого (стадия D AS) с определенными характеристиками.
Наличие симптомов физической нагрузки (одышка при физической нагрузке, стенокардия, обморок) является показанием к хирургическому вмешательству.
Процедура
Все пациенты, которым предполагается провести ТАВР или хирургическую ЗАК с высоким риском, должны лечиться членами бригады клапанов сердца. [8]
- Хирургический AVR
- Рекомендован для пациентов с: [8]
- Транскатетерная AVR (TAVR)
- Рекомендуется для пациентов с высоким или недопустимым хирургическим риском и прогнозируемой выживаемостью> 12 месяцев [8] [14]
- Разумная альтернатива для пациентов со средним хирургическим риском [8]
- Неотложная ТАВР может быть рассмотрена у определенных групп пациентов. [28] [29] [30]
- Чрескожная баллонная вальвулопластика
- Показана детям, подросткам и молодым людям без атриовентрикулярной кальцификации [8]
- Может рассматриваться как промежуточное вмешательство у пациентов высокого риска со стадией АС D, но общая польза сомнительна. [8] [31]
Осложнения при замене аортального клапана
[32] [33] [34]Антитромботическая терапия после протезирования аортального клапана
NOAC следует избегать у пациентов с механическими клапанами.
Прогноз
- Бессимптомные пациенты: Показатель смертности в данном году. [20]
- Пациенты с симптомами: Смертность в первые 2 года составляет> 50% при отсутствии лечения. [35]
Ссылки
- Джеймсон Дж. Л., Фаучи А. С., Каспер Д. Л., Хаузер С. Л., Лонго Д. Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона, Двадцатое издание (Том 1 и Том 2) . McGraw-Hill Образование / Медицина ; 2018 г.
- Карабелло Б.А., Паулюс В.Дж.Стеноз аорты. Ланцет . 2009; 373 (9667): стр.956-966. DOI: 10.1016 / s0140-6736 (09) 60211-7. | Открыть в режиме чтения QxMD
- Siu SC, Silversides CK. Заболевание двустворчатого аортального клапана. Джам Колл Кардиол . 2010; 55 (25): с.2789-2800. DOI: 10.1016 / j.jacc.2009.12.068. | Открыть в режиме чтения QxMD
- Osnabrugge RLJ, Mylotte D, Head SJ, et al. Стеноз аорты у пожилых людей: распространенность заболевания и количество кандидатов на транскатетерное протезирование аортального клапана: метаанализ и исследование моделирования. Джам Колл Кардиол . 2013; 62 (11): с.1002-1012. DOI: 10.1016 / j.jacc.2013.05.015. | Открыть в режиме чтения QxMD
- Нисимура Р.А., Отто С.М., Боноу Р.О. и др. Руководство AHA / ACC от 2014 года по ведению пациентов с пороком клапанов сердца: отчет Американского колледжа кардиологов / Американской кардиологической ассоциации по практическим рекомендациям. Джам Колл Кардиол . 2014; 63 (22): p.e57-185. DOI: 10.1016 / j.jacc.2014.02.536. | Открыть в режиме чтения QxMD
- Каспер Д.Л., Фаучи А.С., Хаузер С.Л., Лонго Д.Л., Ламесон Дж.Л., Лоскальцо Дж. Принципы внутренней медицины Харрисона . McGraw-Hill Education ; 2015 г.
- Отто CM. Клинические проявления и диагностика стеноза аорты у взрослых. В: Сообщение TW, под ред. Дата обновления . Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/clinical-manifestations-and-diagnosis-of-aortic-stenosis-in-adults .Последнее обновление: 24 октября 2016 г. Дата обращения: 4 октября 2017 г.
- Crawford MH. Текущая диагностика и лечение: кардиология . Lange ; 2013
- Naqvi TZ. Эхокардиография при транскатетерной имплантации аортального (основного) клапана: Часть 2-Чреспищеводная эхокардиография. Эхокардиография . 2018; 35 год (7): с.1020-1041. DOI: 10.1111 / echo.14034. | Открыть в режиме чтения QxMD
- Сольберг О.Г., Уеланд Т., Вергеланд Р. и др.Высокочувствительный тропонин Т и N-терминальный натрийуретический пептид мозга предсказывают исход симптоматического стеноза аорты. Скандинавский сердечно-сосудистый журнал . 2012; 46 (5): с.278-285. DOI: 10.3109 / 14017431.2012.687836. | Открыть в режиме чтения QxMD
- Рёсё Х, Андреассен Дж, Эдвардсен Т., Омланд Т. Прогностическая полезность циркулирующего высокочувствительного тропонина Т при стенозе аорты и связь с эхокардиографическими индексами сердечной функции и анатомии. Американский журнал кардиологии . 2011; 108 (1): с.88-91. DOI: 10.1016 / j.amjcard.2011.02.346. | Открыть в режиме чтения QxMD
- Купари М., Эрикссон С., Турто Х, Ломми Дж., Петтерсон К. Утечка сердечного тропонина I при стенозе аортального клапана. Журнал внутренней медицины . 2005; 258 (3): с.231-237. DOI: 10.1111 / j.1365-2796.2005.01529.x. | Открыть в режиме чтения QxMD
- Нисимура Р.А., Карабелло Б.А.Гемодинамика в лаборатории катетеризации сердца 21 века. Тираж . 2012; 125 (17): с.2138-2150. DOI: 10.1161 / cycleaha.111.060319. | Открыть в режиме чтения QxMD
- Нисимура Р.А., Отто С.М., Боноу Р.О. и др. Обновление рекомендаций AHA / ACC от 2014 г. по ведению пациентов с клапанной болезнью сердца, сфокусированное на 2017 г. Тираж . 2017; 135 (25). DOI: 10.1161 / cir.0000000000000503. | Открыть в режиме чтения QxMD
- Клавель М.А., Малуф Дж., Мессика-Зейтун Д., Араоз П.А., Микелена Х.И., Энрикес-Сарано М. Расчет площади аортального клапана при стенозе аорты с помощью компьютерной томографии и допплер-эхокардиографии. JACC: Кардиоваскулярная визуализация . 2015; 8 (3): с.248-257. DOI: 10.1016 / j.jcmg.2015.01.009. | Открыть в режиме чтения QxMD
- Маркиз-Гравел Г, Редфорс Б, Леон МБ, Женере П.Медикаментозное лечение стеноза аорты. Тираж . 2016; 134 (22): с.1766-1784. DOI: 10.1161 / cycleaha.116.023997. | Открыть в режиме чтения QxMD
- Кан Т.С., Парк С. Антигипертензивное лечение тяжелого стеноза аорты. Журнал сердечно-сосудистой визуализации . 2018; 26 год (2): с.45. DOI: 10.4250 / jcvi.2018.26.e9. | Открыть в режиме чтения QxMD
- Хименес-Кандил Дж. Эффекты ингибиторов ангиотензинпревращающего фермента у пациентов с гипертонией и стенозом аортального клапана: исследование отмены лекарств. Сердце . 2005; 91 (10): с.1311-1318. DOI: 10.1136 / hrt.2004.047233. | Открыть в режиме чтения QxMD
- Рутледж Х., Тауненд Дж. Ингибирование АПФ при стенозе аорты: опасное лекарство или золотая возможность ?. Журнал гипертонии человека . 2001; 15 (10): с.659-667. DOI: 10.1038 / sj.jhh.1001260. | Открыть в режиме чтения QxMD
- Пелликка П.А., Сарано М.Э., Нисимура Р.А. и др. Исход 622 взрослых с бессимптомным гемодинамически значимым стенозом аорты во время длительного наблюдения. Тираж . 2005; 111 (24): с.3290-3295. DOI: 10.1161 / cycleaha.104.495903. | Открыть в режиме чтения QxMD
- Юн С.-Х, Шмидт Т., Блейзиффер С. и др. Транскатетерная замена аортального клапана при чистой регургитации нативного аортального клапана. Журнал Американского кардиологического колледжа . 2017; 70 (22): с.2752-2763. DOI: 10.1016 / j.jacc.2017.10.006. | Открыть в режиме чтения QxMD
- Franzone A, Pilgrim T, Stortecky S, Windecker S.Развитие показаний к транскатетерному вмешательству на аортальном клапане. Текущие кардиологические отчеты . 2017; 19 (11). DOI: 10.1007 / s11886-017-0921-3. | Открыть в режиме чтения QxMD
- Банович М., Атитан Л., Макканн Г.П. Стеноз аорты и сахарный диабет: грозное сочетание. Исследования диабета и сосудистых заболеваний . 2019; 16 (4): с.310-323. DOI: 10.1177 / 1479164118820657. | Открыть в режиме чтения QxMD
- Чен Р.С., Бивенс М.Дж., Гроссман С.А.Диагностика и лечение клапанной болезни сердца в неотложной медицине. Emerg Med Clin North Am . 2011; 29 (4): с.801-810. DOI: 10.1016 / j.emc.2011.08.001. | Открыть в режиме чтения QxMD
- Хот УН, Новаро Г.М., Попович З.Б. и др. Нитропруссид у тяжелобольных пациентов с дисфункцией левого желудочка и стенозом аорты. Медицинский журнал Новой Англии . 2003; 348 (18): с.1756-1763. DOI: 10,1056 / nejmoa022021.| Открыть в режиме чтения QxMD
- Аксой О., Юсефзай Р., Сингх Д. и др. Кардиогенный шок на фоне тяжелого стеноза аорты: роль поддержки внутриаортального баллонного насоса. Сердце . 2010; 97 (10): с.838-843. DOI: 10.1136 / hrt.2010.206367. | Открыть в режиме чтения QxMD
- Гербер М.А., Балтимор Р.С., Итон CB и др. Профилактика ревматической лихорадки, диагностика и лечение острого стрептококкового фарингита. Тираж .2009; 119 (11): с.1541-1551. DOI: 10.1161 / cycleaha.109.191959. | Открыть в режиме чтения QxMD
- Хуанг Х., Ковач С., Райсман М. и др. TCT-100 Emergency TAVR при кардиогенном шоке — функция правых отделов сердца и ранняя механическая поддержка кровообращения улучшают результаты. Журнал Американского кардиологического колледжа . 2018; 72 (13): стр.B43-B44. DOI: 10.1016 / j.jacc.2018.08.1198. | Открыть в режиме чтения QxMD
- Маша Л., Вемулапалли С., Манандхар П. и др.Демографические, процедурные характеристики и клинические результаты, когда кардиогенный шок предшествует TAVR в США. Журнал Американского колледжа кардиологов: сердечно-сосудистые вмешательства . 2020; 13 (11): с.1314-1325. DOI: 10.1016 / j.jcin.2020.02.033. | Открыть в режиме чтения QxMD
- Кольте Д., Кхера С., Вемулапалли С. и др. Результаты после неотложной / неотложной транскатетерной замены аортального клапана. Журнал Американского колледжа кардиологов: сердечно-сосудистые вмешательства .2018; 11 (12): с.1175-1185. DOI: 10.1016 / j.jcin.2018.03.002. | Открыть в режиме чтения QxMD
- Либерман Е.Б., Башор Т.М., Хермиллер Дж.Б. и др. Баллонная вальвулопластика аорты у взрослых: несостоятельность процедуры для улучшения долгосрочной выживаемости. Журнал Американского кардиологического колледжа . 1995; 26 год (6): с.1522-1528. DOI: 10.1016 / 0735-1097 (95) 00363-0. | Открыть в режиме чтения QxMD
- Колкаила А.А., Дукки Р., Пеллетье М.П., Волгман А.С., Канеко Т., Набхан А.Ф.Транскатетерная имплантация аортального клапана в сравнении с хирургической заменой аортального клапана при тяжелом стенозе аорты у людей с низким хирургическим риском. Кокрановская база данных систематических обзоров . 2019 г. . DOI: 10.1002 / 14651858.cd013319.pub2. | Открыть в режиме чтения QxMD
- Виртанен МПО, Эскола М., Ялава М.П. и др. Сравнение результатов после транскатетерной замены аортального клапана и хирургической замены аортального клапана у пациентов со стенозом аорты с низким операционным риском. Журнал Американской медицинской ассоциации . 2019; 2 (6): p.e195742. DOI: 10.1001 / jamanetworkopen.2019.5742. | Открыть в режиме чтения QxMD
- Кодали С.К., Уильямс М.Р., Смит С.Р. и др. Двухлетние результаты после транскатетерной или хирургической замены аортального клапана. Медицинский журнал Новой Англии . 2012; 366 (18): с.1686-1695. DOI: 10,1056 / nejmoa1200384. | Открыть в режиме чтения QxMD
- Отто CM, Прендергаст Б.Стеноз аортального клапана — от пациентов с риском до тяжелой обструкции клапана. Медицинский журнал Новой Англии . 2014; 371 (8): с.744-756. DOI: 10,1056 / nejmra1313875. | Открыть в режиме чтения QxMD
- Сайкришнан Н., Кумар Г., Савая Ф.Дж., Леракис С., Йоганатан А.П. Точная оценка стеноза аорты: обзор методов диагностики и гемодинамики. Тираж . 2014; 129 (2): с.244-253. DOI: 10.1161 / CIRCULATIONAHA.113.002310. | Открыть в режиме чтения QxMD
- Стеноз аорты: патофизиология, диагностика и лечение нехирургических пациентов. https://www.ncbi.nlm.nih.gov/pubmed/23547127 . Обновлено: 13 февраля 2017 г. Доступ: 21 марта 2018 г.
- Ren X. Стеноз аорты. Стеноз аорты . Нью-Йорк, штат Нью-Йорк: WebMD. http://emedicine.medscape.com/article/150638 . Обновлено: 11 декабря 2016 г. Проверено: 26 февраля 2017 г.
- Stritzke J, Linsel-nitschke P, Markus MR, et al. Связь между дегенеративным заболеванием аортального клапана и долгосрочным воздействием факторов риска сердечно-сосудистых заболеваний: результаты продольного популяционного исследования KORA / MONICA. Eur Heart J . 2009; 30 (16): с.2044-2053. DOI: 10,1093 / eurheartj / ehp287. | Открыть в режиме чтения QxMD
- Мохти Д., Пислару С. Пороки клапанов сердца у пожилых людей. В: Сообщение TW, под ред. Дата обновления .Уолтем, Массачусетс: UpToDate. https://www.uptodate.com/contents/valvular-heart-disease-in-elderly-adults . Последнее обновление: 22 декабря 2016 г. Дата обращения: 28 ноября 2017 г.
- Ван Дипен С., Кац Дж. Н., Альберт Н. М. и др. Современное лечение кардиогенного шока: научное заявление Американской кардиологической ассоциации. Тираж . 2017; 136 (16). DOI: 10.1161 / cir.0000000000000525. | Открыть в режиме чтения QxMD
- Grimard BH, Safford RE, Burns EL.Стеноз аорты: диагностика и лечение .. Американский семейный врач . 2016; 93 (5): с.371-8.
- Bayer MF. Острый отек легких из-за стрессовой кардиомиопатии у пациента со стенозом аорты: история болезни. Журнал дел . 2009; 2 (1). DOI: 10.1186 / 1757-1626-2-9128. | Открыть в режиме чтения QxMD
- Ян А.Т., Кох М., Чан К.К. и др. Связь между сердечно-сосудистыми факторами риска и стенозом аорты. Журнал Американского кардиологического колледжа . 2017; 69 (12): с.1523-1532. DOI: 10.1016 / j.jacc.2017.01.025. | Открыть в режиме чтения QxMD
- Natorska J, Wypasek E, Grudzień G, et al. Ускоряет ли диабет прогрессирование стеноза аорты за счет усиления воспалительной реакции в аортальных клапанах ?. Воспаление . 2011; 35 год (3): с.834-840. DOI: 10.1007 / s10753-011-9384-7. | Открыть в режиме чтения QxMD
- Тестуз А., Нгуен В., Матье Т. и др.Влияние метаболического синдрома и диабета на прогрессирование кальцифицированного стеноза аортального клапана. Международный кардиологический журнал . 2017; 244 : с.248-253. DOI: 10.1016 / j.ijcard.2017.06.104. | Открыть в режиме чтения QxMD
Сопутствующая обструкция LVOT и стеноз аорты
Аннотация
Авторы описывают пациента с гипертрофической кардиомиопатией с сопутствующей обструкцией выходного тракта левого желудочка и стенозом аорты.Была проведена подробная гемодинамическая оценка серийных поражений. Абляция спиртовой перегородки привела к значительному уменьшению градиентов в выводном тракте левого желудочка.
Раскрытие информации: Авторы не заявляют о конфликте интересов.
Поступила:
Опубликовано онлайн:
Образец цитирования: Обзор интервенционной кардиологии, 2021 г .; 16: e11.
Для корреспонденции: Хоуман Халили, Атлантический университет Флориды, Тенет Флорида, Бока-Ратон, Флорида 33431, США. Эл. Почта: [email protected]
Открытый доступ:Это произведение находится в открытом доступе по лицензии CC-BY-NC 4.0, которая позволяет пользователям копировать, распространять и создавать производные работы в некоммерческих целях при условии правильного цитирования оригинала.
Сопутствующий стеноз аорты (AS) и обструкция выходного тракта левого желудочка (LVOT) все чаще встречаются в клинической практике с учетом старения населения. Гемодинамическое взаимодействие между этими двумя заболеваниями может быть сложной задачей для диагностики, распознавания и лечения.
Исследование этих пациентов может потребовать инвазивной гемодинамической оценки, чтобы определить не только вклад каждого из них в общую физиологию обструкции, но также их влияние друг на друга.Тем не менее, выявление обструктивных поражений в серии все еще может быть затруднено, как, например, интерпретация фракционного резерва кровотока при серийных коронарных стенозах.1 Обструкция LVOT может быть замаскирована из-за повышенной постнагрузки при тяжелом AS, в то время как тяжелая обструкция LVOT может уменьшить ударный объем, приводя к низкому градиент, слабый поток AS. Наиболее точным процессом является оценка остаточного градиента после лечения наиболее обструктивного поражения, определяемого методом отката.
Отчет о болезни
82-летний мужчина с артериальной гипертензией и АС был направлен в нашу структурную кардиологическую клинику для оценки транскатетерного протезирования аортального клапана.У него были симптомы сердечной недостаточности класса III Нью-Йоркской кардиологической ассоциации, и он чувствовал головокружение. Его кардиологическое обследование отличалось боковым смещением апикального импульса и резким систолическим шумом с поздним пиком 3/6 без значительных изменений, заметных при стоянии или во время маневра Вальсальвы.
Отчет трансторакальной эхокардиограммы (TTE) амбулаторного больного показал тяжелый AS со средним градиентом (MG) 47 мм рт.ст. и площадью аортального клапана (AVA) 0,8 см2 по непрерывности. Мультидетекторная компьютерная томография сердца (МДКТ) выявила необструктивную болезнь коронарных артерий; наблюдалась асимметричная гипертрофия перегородки и систолическое переднее движение (SAM) митральной створки, что вызывало опасения по поводу сопутствующей обструкции LVOT.
Повторная TTE, выполненная в нашем учреждении, выявила гипертрофию базальной перегородки, связанную с SAM, и ускорение кровотока в LVOT (дополнительное видео 1). Импульсно-волновой допплер на уровне LVOT выявил спектральную огибающую в форме кинжала с поздним пиком и наложением спектров, совместимым с обструкцией LVOT (, рис. 1, ). Максимальный мгновенный градиент (PG) составлял 56 мм рт. Ст. В состоянии покоя (, фиг. 2, ). Аортальный клапан кальцинирован с уменьшенной экскурсией. Исходная частота сердечных сокращений 50–55 ударов в минуту и сопутствующий стеноз аорты ограничивали дополнительные возможности медикаментозной терапии.Учитывая преклонный возраст пациента и сопутствующие заболевания, было принято многопрофильное решение о проведении детальной гемодинамической оценки обструкции LVOT и стеноза аорты с возможной аблацией алкогольной перегородки (ASA).
Базовое одновременное отслеживание давления в восходящей аорте (AAo) и левом желудочке (LV) было получено с использованием катетера типа «косичка» и многоцелевого катетера (MP) с концевым отверстием, соответственно. Отслеживание давления AAo показало спайк-куполообразную картину после преждевременного сокращения желудочков (PVC), связанного с динамической обструкцией LVOT, с комбинированным размахом (PP) LVOT / AS, равным 75 мм рт. Ст. В покое.Пульсовое давление AAo снизилось после провокации ЖЭ (признак Брокенбро – Браунвальда – Морроу) с увеличением комбинированного градиента до 140 мм рт. Катетер MP был осторожно выведен ниже аортального клапана, чтобы изолировать градиент на клапане, и одновременное давление было повторно получено. Градиент ААо-субаортального ПП составил 24 мм рт.
Учитывая данные о тяжелой динамической обструкции LVOT при отсутствии значительной регургитации митрального клапана, затем было проведено исследование ASA.В качестве начальной мишени был выбран самый базальный перфоратор перегородки, ветвь промежуточной артерии. ASA выполнялась обычным образом (дополнительное видео 2) 2
Непрерывно-волновой допплер в выводном тракте левого желудочка
Одновременное давление в восходящей аорте и левом желудочке
Получены повторные инвазивные записи давления AAo / LV.Отслеживание давления AAo теперь показало отложенный паттерн восходящего движения в покое и после ЖЭ — в соответствии со стенозом аорты — и уменьшенный комбинированный градиент LVOT / AS PP в покое на 30 мм рт.ст. (, рис. 5, ). Пульсовое давление AAo оставалось неизменным после провокации ЖЭ с небольшим увеличением градиента PP до 50 мм рт. Ст., Что соответствовало фиксированному стенозу AS.
Сразу после ASA, LVOT PG по допплерографии измерял 9 мм рт. Пациент оставался гемодинамически стабильным при тщательном наблюдении в отделении интенсивной терапии в течение 48 часов.По данным телеметрии аномалий проводимости не отмечено.
Он был выписан домой, и через 6 недель после процедуры ПГ ВЛЖ составила 9 мм рт. Ст. С помощью допплера. MG аортального клапана измерял 27 мм рт. Ст. И AVA 1,2 см2 по уравнению неразрывности. Учитывая полное исчезновение его симптомов, его АС было выбрано настороженное ожидание.
Обсуждение
Серийные поражения, такие как те, которые обнаруживаются при гипертрофической обструктивной кардиомиопатии (HOCM) и AS, опровергают предположения моделирования, сделанные с помощью модифицированного уравнения Бернулли на эхокардиографии, потому что проксимальный стеноз приводит к значительному приближению к дистальному стенозу.Вязкость и трение также могут иметь большее значение при тандемных поражениях, которые модифицированное уравнение Бернулли не учитывает.3
Перед оценкой сопутствующих структурных заболеваний необходимо тщательное междисциплинарное предоперационное планирование с мультимодальной визуализацией. Хотя MDCT сердца можно использовать для оценки диаметра LVOT и морфологических проявлений SAM, он дает меньше информации о гемодинамике и характеристиках тканей, чем МРТ сердца.4 Следовательно, важны инвазивные измерения гемодинамики.
Пациенты с AS демонстрируют отслеживание parvus et tardus — уменьшенное по амплитуде и с задержкой — из-за ограничивающего открытия клапана и, как следствие, фиксированной обструкции. С другой стороны, обструкция LVOT является динамической и возникает в поздней систоле, когда аортальное давление быстро повышается во время открытия аортального клапана, создавая, таким образом, спайко-куполообразную картину. Обычно после ЖЭ наступает компенсаторная пауза, которая вызывает увеличение времени диастолического наполнения и впоследствии увеличивает диастолический объем.Следуя механизмам Франка-Старлинга, ударный объем увеличивается с увеличением конечного диастолического объема, что приводит к большему растяжению сердечной мышцы и сократимости миокарда, вызывая повышение артериального пульсового давления.5 Феномен Брокенбро-Браунвальда-Морроу возникает при обструкции LVOT как парадоксальное снижение артериального пульсового давления после ЖЭ. Однако при сосуществовании обоих болезненных процессов снижение пульсового давления может быть затуплено.6
Одновременное давление в восходящей аорте и левом желудочке после аблации спиртовой перегородки
В представленном случае общие гемодинамические данные соответствовали значительному вкладу LVOT в общую обструкцию: форма шипов-куполов; падение пульсового давления в аорте после ПВК; и более высокий градиент транс-LVOT по сравнению с градиентом транс-AS.В качестве альтернативы можно использовать фармакологические агенты, такие как фенилэфрин, чтобы вызвать увеличение постнагрузки, уменьшая обструкцию оттока.7
Сначала может быть устранена обструкция LVOT, не только для точного определения тяжести AS, но и для снижения риска гемодинамических нарушений после замены аортального клапана. При сопутствующей тяжелой обструкции AS и LVOT замена аортального клапана снимает высокую постнагрузку, которая может ухудшить степень обструкции LVOT из-за увеличения сопротивления кровотока и силы Бернулли.
ASA появился в середине 1990-х годов и с тех пор был разработан как безопасная альтернатива хирургической миэктомии для лечения пожилых пациентов со значительными сопутствующими заболеваниями и благоприятной анатомией коронарных артерий, симптомы которых не поддаются оптимальной медикаментозной терапии.
Расслоение левой передней нисходящей артерии, спазм коронарной артерии, инфаркт передней стенки и перфорация сердца являются возможными осложнениями (2%), в то время как атриовентрикулярная блокада является наиболее распространенным.9,10 АСК может вызвать временное или постоянное нарушение проводящей системы: первое Атриовентрикулярная блокада степени может развиться у 53% пациентов, блокада правой ножки пучка Гиса — у 46% и полная блокада сердца, требующая постоянной имплантации кардиостимулятора, — у 10.5% .11,12
Более низкая частота инъекций алкоголя коррелировала с более низкой частотой полной блокады сердца.12 Кроме того, общая частота осложнений коррелировала со снижением дозы алкоголя (в среднем с 2,9 мл до 0,8 мл) 13. возможность развития аритмогенного рубца, но не было продемонстрировано, что это оказывает пагубное влияние на долгосрочную выживаемость14.
Одновременное давление восходящей аорты и субаортального отдела
После процедуры резкое снижение градиента, вероятно, представляет собой оглушение и патофизиологически отличается от более отсроченного явления, которое является результатом рубцевания и истончения базальной перегородки.Немедленное уменьшение градиента оттока может сопровождаться повторением градиента через 1-3 дня после ASA. Поэтому рекомендуется повторить TTE с оценкой градиентов LVOT и AS через 1-2 месяца, после чего можно будет принять решение о лечении AS15.
Заключение
Представленный случай иллюстрирует сложное гемодинамическое взаимодействие между обструкцией LVOT и сопутствующим AS и выявлением этих поражений путем тщательной инвазивной оценки. ASA может быть безопасно и успешно выполнено у пациентов с сосуществующей обструкцией LVOT и тяжелым AS.
Инвазивные гемодинамические характеристики тяжелого стеноза аорты с низким градиентом, несмотря на сохраненную фракцию выброса
% PDF-1.7 % 1 0 объект > поток application / pdfdoi: 10.1016 / j.jacc.2013.02.009

