Лабораторная диагностика инфекций | Медицинский центр «Вера»
На сегодняшний день наличие огромного количества новейших тестов для диагностики патологических состояний требует от клиницистов знаний не только основ клинической биохимии, но и новых алгоритмов лабораторной диагностики.
В представленных работах мы попытались помочь клиницистам подобрать правильный подход в лабораторной диагностике ряда патологических состояний, не по протоколам, а основываясь на рекомендациях Всемирной организации здравоохранения, новейших достижениях науки и клинической практике, собственных научно практических исследований.
Представленные в наших работах комбинации различных тестов дадут возможность врачам охарактеризовать патологические процессы в организме, выйти на правильные диагностические критерии и проследить ход лечения.
При Вашем интересе к работам, мы можем продолжить публикации.
Лабораторная диагностика инфекций
В процессе диагностики инфекций выделяют следующие биохимические методы:
- культуральный метод;
- иммунохимические (иммуноферментный метод анализа (ИФА), иммухемилюминесцентный, иммунофлуоресцентный и т.
 д.) — определение антител к конкретному возбудителю, иммунный ответ.
д.) — определение антител к конкретному возбудителю, иммунный ответ.
Идеальный вариант для диагностики – комбинация указанных методов. Однако клиницисты часто пытаются выделить один основной метод, пренебрегая другими. Особенно в их рядах разногласия вызывают значимость методов ПЦР – диагностики и ИФА. Показательным является диагностика коронавирусной инфекции, где основным методом был признан ПЦР, дающий определенный процент ложноположительных и ложноотрицательных результатов, а вспомогательными иммунохимические методы.
В этой связи хотелось бы обратиться к коллегам клиницистам, в лабораторной диагностике каждый из биохимических методов несет диагностическую информацию, дополняет друг друга и именно сочетание этих методов даст возможность выйти на правильный лабораторный диагноз. В нашей работе мы охарактеризуем иммунохимические методы (ИФА), как массовый метод, позволяющий с высокой точностью проводить мониторинг инфекций.
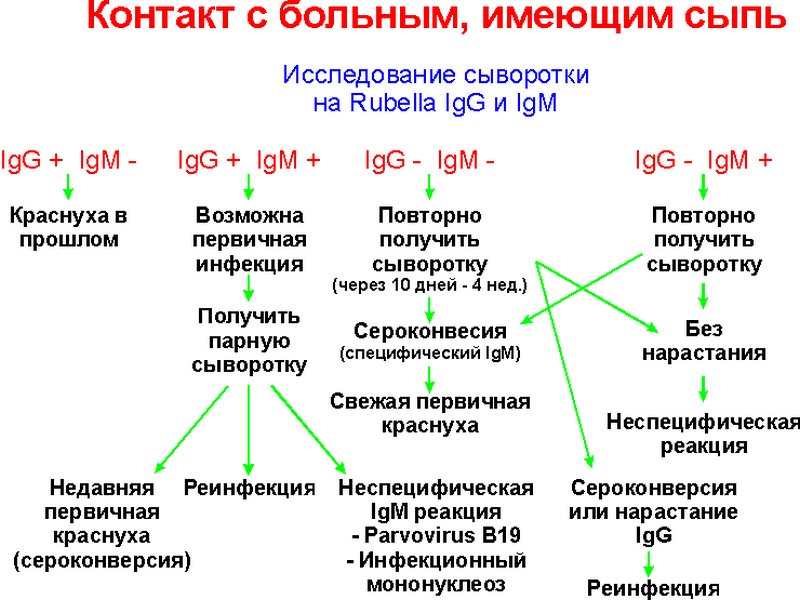
Еще раз напомним, IgM антитела определяют в начале заболевания (3-7 дней) они достигают пика от одной до четырех недель, затем снижаются до диагностически незначительных уровней в течение нескольких месяцев даже без проведенного лечения. IgG антитела можно определить через 15-23 дней от начала заболевания.
IgG антитела можно определить через 15-23 дней от начала заболевания.
Интересен следующий факт, что достоверными результатами в диагностике инфекций могут являться повышение уровня IgG при взятии парных сывороток больного (3-7 день и через 10-14 дней). При вирусных инфекциях четырехкратное и более повышение титра антител во второй сыворотке имеет диагностические значения для текущей инфекции или реинфекции. IgG могут находиться на низком уровне в течение многих лет.
IgA антитела повышаются в сыворотке через 10-14 дней от начала заболевания и их уровень обычно снижается к 2-4 месяцу в результате успешного лечения.
В лабораторной диагностике уровень антител IgM, G, A определяются для диагностики текущей перенесенной и хронической инфекции, что в клинике трактуется, как острая, перенесенная, хроническая (обострение хронической) инфекции. Исследуя уровень антител можно диагностировать заболевание, выбрать адекватную терапию и оценить результаты лечения.
Это возможно только при исследовании комбинации IgM, G, A, а не их по отдельности, что является достаточно частой ошибкой клиницистов. Для этих целей у каждого клинициста должна быть следующая таблица под названием — интерпретация результатов, основанных на определении комбинации IgM, G, A антител.
Для этих целей у каждого клинициста должна быть следующая таблица под названием — интерпретация результатов, основанных на определении комбинации IgM, G, A антител.
|
Уровни АТ |
Интерпретация результатов |
||
|
IgG |
IgM |
IgA |
|
|
— |
— |
— |
Инфекция не выявлена |
|
— или+ |
+ |
|
Текущая инфекция |
|
-или+ |
— |
+ |
Текущая или хроническая инфекция |
|
+ |
— |
— |
Перенесенная инфекция или хроническая инфекция |
(-) – отрицательный результат, (+) – положительный результат.
Для проведения диагностики и контроля за лечением возможно использование тест систем, которые позволяют получать результаты в полуколичественном или количественном варианте. Если результат сомнительный необходимо повторить тест через 10-14 дней.
В заключении мы еще раз хотели бы отметить, что для правильного лабораторного диагноза имеет значение выбор не одного метода исследования, а комбинации различных методов, которая позволит с высокой достоверностью дать характеристику патологическому процессу.
Автор статьи: д.м.н., профессор Слюсарь Н. Н.
что показывает, расшифровка результатов, нормы
Иммуноферментный анализ (ИФА) — метод лабораторной диагностики, позволяющий обнаруживать специфические антитела и антигены при самых разных патологиях.
Где можно сдать анализ?
ИФА — один из самых распространенных и точных методов для выявления инфекций, передающихся половым путем, в частности ВИЧ, ВПЧ, гепатита В.
Узнать больше…
Для того чтобы результаты анализов были максимально достоверными, необходимо правильно подготовиться к их сдаче.

Как подготовиться?
Современная диагностика в медицине немыслима без высокочувствительных лабораторных анализов. Прежде для установления причин тех или иных симптомов врачи были вынуждены ориентироваться на косвенные признаки болезни, а также проводить многоступенчатые микроскопические исследования в попытке обнаружить возбудителя инфекции. Сегодня достаточно одного-единственного теста — такого как иммуноферментный анализ — чтобы подтвердить или опровергнуть первоначальный диагноз.
Основные понятия и принцип метода иммуноферментного анализа
Иммуноферментный анализ (ИФА) — это метод лабораторной диагностики, основанный на реакции «антиген-антитело», который позволяет выявить вещества белковой природы (в том числе ферменты, вирусы, фрагменты бактерий и другие компоненты биологических жидкостей).
Чтобы понять, как устроен иммуноферментный анализ, попробуем разобраться в сути реакции «антиген-антитело». Антиген — это чужеродная для организма молекула, как правило, белкового происхождения, которая может попасть в тело человека вместе с инфекционным агентом. Частицы чужой крови (если она не совпадает с нашей по группе) также являются антигенами. В организме антигены способны вызывать иммунную реакцию, направленную на защиту целостности внутренней среды от чужеродных веществ. Поэтому наше тело синтезирует особые вещества — антитела (иммуноглобулины), способные по принципу «ключ к замку» соединяться с антигенами, связывая их в иммунный комплекс (этот процесс как раз называется реакцией «антиген-антитело»). Такие иммунные комплексы легче распознаются и уничтожаются клетками иммунитета.
Частицы чужой крови (если она не совпадает с нашей по группе) также являются антигенами. В организме антигены способны вызывать иммунную реакцию, направленную на защиту целостности внутренней среды от чужеродных веществ. Поэтому наше тело синтезирует особые вещества — антитела (иммуноглобулины), способные по принципу «ключ к замку» соединяться с антигенами, связывая их в иммунный комплекс (этот процесс как раз называется реакцией «антиген-антитело»). Такие иммунные комплексы легче распознаются и уничтожаются клетками иммунитета.
Существует несколько разновидностей антител, каждая из которых вступает в действие на определенном этапе иммунного ответа. Так, первыми в ответ на проникновение антигена в организм синтезируются иммуноглобулины класса М (IgM). Содержание этих антител наиболее высоко в первые дни инфекционного процесса.
Следом за ними иммунная система выбрасывает в кровь иммуноглобулины класса G (IgG), которые помогают уничтожать антигены до полной победы над инфекцией, а также продолжают циркулировать по сосудам в дальнейшем, обеспечивая иммунитет к повторному заражению. На этом явлении основана вакцинация: благодаря прививкам, содержащим ослабленные антигены микробов и вирусов, в нашей крови появляется большое количество IgG, которые при контакте с реальной угрозой быстро подавляют инфекцию — до того, как она нанесет вред здоровью.
На этом явлении основана вакцинация: благодаря прививкам, содержащим ослабленные антигены микробов и вирусов, в нашей крови появляется большое количество IgG, которые при контакте с реальной угрозой быстро подавляют инфекцию — до того, как она нанесет вред здоровью.
Также существуют иммуноглобулины класса А (они в большом количестве содержатся в слизистых оболочках, защищая «подступы» к организму), Е (борются с паразитарными инфекциями) и другие. В лабораторной диагностике объектами интереса чаще всего являются IgM, IgG и IgA: по их концентрации можно оценить, на какой стадии находится инфекционный процесс, а также узнать, болел ли когда-либо человек тем или иным недугом (например, краснухой или ветряной оспой).
Как узнать, какие именно антигены или антитела присутствуют в организме человека? Когда врач предполагает, что причиной заболевания является определенная инфекция, или желает измерить концентрацию определенного гормона, он назначает пациенту иммуноферментный анализ.
Реакцию «антиген-антитело» можно воспроизвести в лабораторных условиях: использовать уже готовые антитела или антигены, чтобы определить, есть ли в исследуемом образце соответствующее им соединение.
Для начала необходимо получить образец биологической жидкости — обычно, это сыворотка крови. Лаборатория использует пластиковые планшеты с лунками, в которых уже содержатся очищенные антигены предполагаемого возбудителя (или — антитела, в случае если задачей является поиск антигена). Образцы вносятся в лунки, где происходит — или не происходит — образование иммунных комплексов. Если «встреча» состоялась, особое красящее вещество вступает в ферментную реакцию с объединенной молекулой, что позволяет с помощью инструментальной оценки оптической плотности сделать выводе о результатах анализа.
ИФА бывает качественным и количественным. В первом случае подразумевается однозначный ответ: искомое вещество или найдено, или не найдено в образце. В случае с количественным анализом более сложная цепь реакций дает возможность оценить концентрацию антител в крови человека, что в сравнении с результатами предыдущих тестов даст ответ на вопрос о том, как развивается инфекционный процесс.
Это интересно
Предшественником иммуноферментного анализа был радиоиммунный анализ, в котором для идентификации успешной реакции использовались меченые антитела и антигены. Поскольку проведение такой диагностики представляло потенциальную угрозу для здоровья сотрудников лаборатории, ученые озаботились поиском безопасной альтернативы по «окраске» образцов. Так в 1971 году был изобретен ИФА.
Преимущества метода
Бесспорные преимущества ИФА — высокая чувствительность и специфичность метода. Чувствительность — это возможность распознать искомое вещество, даже если его концентрация в образце невысока. Специфичность же подразумевает безошибочность диагностики: если результат положительный, значит, найдены именно те антитело или антиген, которые предполагались, а не какие-то другие.
ИФА во многом заменил «золотой стандарт» микробиологии — бактериологический метод диагностики, в ходе которого для идентификации возбудителя требовалось выделить его из организма, а затем в течение нескольких дней выращивать культуру на питательной среде в пробирке. Все то время, пока производился анализ, врачи были вынуждены лечить пациента «вслепую», догадываясь о происхождении микроорганизма по симптомам болезни. Определение IgM с помощью ИФА позволяет поставить точный диагноз уже в первые дни болезни.
Все то время, пока производился анализ, врачи были вынуждены лечить пациента «вслепую», догадываясь о происхождении микроорганизма по симптомам болезни. Определение IgM с помощью ИФА позволяет поставить точный диагноз уже в первые дни болезни.
Высокая степень технологичности проведения иммуноферментного анализа минимизирует влияние человеческого фактора, что снижает вероятность ошибки. Большинство используемых в современных лабораториях тест-систем и реактивов для ИФА выпускаются в промышленных условиях, что гарантирует точный результат.
Недостатки метода
К сожалению, для проведения ИФА нужно знать, что именно искать: методика анализа подразумевает, что врач заранее имеет предположение о природе заболевания. Поэтому нет смысла назначать такой тест в надежде случайно «угадать» диагноз.
В случае диагностики инфекционных заболеваний иммуноферментный анализ не может найти возбудителя и определить его специфичные свойства: он лишь указывает на наличие антител в крови у больного, косвенно свидетельствующих о присутствии чужеродного микроорганизма в теле человека.
ИФА — крайне точный, но не дешевый метод, поэтому обращаться к нему нужно с умом, а интерпретацией результатов должен заниматься квалифицированный врач.
Показания к назначению и выявляемые заболевания
Невозможно охватить полный список показаний к проведению ИФА. Вот наиболее распространенные цели анализа:
- Диагностика острых и хронических инфекционных заболеваний:
- IgM и IgG к вирусным гепатитам А, B, C, E, а также антигенов гепатитов В и С;
- IgG к ВИЧ;
- Ig M и IgG к цитомегаловирусной инфекции;
- Ig M и IgG к вирусу Эпштейна-Барр;
- Ig M и IgG к герпетическим инфекциям;
- Ig M и IgG к токсоплазмозу;
- Ig M и IgG к кори, краснухе, сальмонеллезу, дизентерии, клещевому энцефалиту и другим заболеваниям;
- IgG к паразитарным заболеваниям;
- Ig M и IgG к инфекциям, передающимся половым путем;
- IgG к хеликобактерной инфекции.

Анализируемый биоматериал и особенности его забора
Основной биоматериал для проведения ИФА — это сыворотка крови: в лаборатории у пациента берут образец крови из вены, из которого в дальнейшем удаляют форменные элементы, затрудняющие проведение анализа. В некоторых других случаях для анализа используется спинномозговая жидкость, околоплодные воды, мазки слизистых оболочек и т.д.
Для того чтобы избежать искажений в результатах, рекомендуется сдавать кровь натощак, а за две недели до исследования (если целью является диагностика хронических, скрыто протекающих инфекционных заболеваний) необходимо отказаться от приема антибиотиков и противовирусных препаратов.
Сроки готовности результатов ИФА
При наличии необходимых реактивов и хорошей организации работы лаборатории результат анализа вы получите в течение 1–2 суток после забора крови. В некоторых случаях, при необходимости получения экстренного ответа, этот срок может быть сокращен до 2–3 часов.
В некоторых случаях, при необходимости получения экстренного ответа, этот срок может быть сокращен до 2–3 часов.
Расшифровка иммуноферментного анализа
Результатом качественного ИФА будет однозначный вердикт: искомое вещество либо найдено, либо не найдено в образце. Если же речь о количественном анализе, то концентрация может выражаться числовым значением или определенным количеством знаков «+» (от одного до нескольких).
Анализируемые показатели- IgM — наличие этого класса иммуноглобулинов говорит об остром инфекционном процессе в организме. Отсутствие IgM может говорить как об отсутствии конкретного возбудителя в организме, так и о переходе инфекции в хроническую стадию.
- IgA при отрицательном результате теста на IgM чаще всего свидетельствует о хронической или скрыто протекающей инфекции.
- IgM и IgA (совместное присутствие) — два положительных результата говорят о разгаре острой фазы заболевания.

- IgG говорит либо о хронизации заболевания, либо о выздоровлении и выработке иммунитета к инфекционному агенту.
В зависимости от содержания анализа в бланке могут быть представлены данные в виде таблицы с перечислением всех антител или антигенов с пометками об отрицательной или положительной реакции, либо будет указано количественное значение результата (отрицательный, слабоположительный, положительный или резко положительный). Последний вариант определяет, сколько антител содержится в анализируемом образце.
Еще один количественный показатель — индекс авидности антител, выраженный в процентах. Он указывает, сколько времени прошло от начала инфекционного процесса (чем выше индекс — тем больше).
Сегодня выпускаются тысячи видов тест-систем ИФА, позволяющих обнаруживать специфические антитела и антигены при самых разных патологиях. Поэтому этот анализ используется практически во всех медицинских отраслях. Диагноз, поставленный с помощью ИФА, — это гарантия назначения адекватной терапии и эффективного лечения заболевания.
Диагноз, поставленный с помощью ИФА, — это гарантия назначения адекватной терапии и эффективного лечения заболевания.
Метод ИФА диагностики Ижевск, где сдать кровь на ИФА, как подготовиться к исследованию
Иммуноферментный анализ (ИФА)
До появления высокочувствительных методов диагностики, для постановки точного диагноза, биоматериал долго изучали под микроскопом.
К ним относится метод ИФА или иммуноферментный анализ. Он основывается на реакции «антиген-антитело», с помощью которой можно определить уровень гормонов, иммуноглобулинов и других веществ в крови.
Что определяет ИФА
ИФА-диагностика позволяет устанавливать наличие антигенов возбудителей инфекции и антител, которые вырабатывает иммунная система, чтобы бороться с ними. В основном определяют классы антител IgA, IgM, IgG.
Анализ назначают, чтобы выявить заболевание на ранних стадиях, определить скрытые патологии или проконтролировать реакцию иммунитета после проведения вакцинации. Чаще всего проводится при подозрении на:
Чаще всего проводится при подозрении на:
- ВИЧ;
- сифилис и хламидиоз;
- герпес, краснуху, токсоплазмоз;
- оспу, корь, гепатит;
- пневмонию и менингит;
- паразитов.
Преимущества ИФА
По сравнению с другими методами иммуноферментный анализ обладает следующими достоинствами:
- Высокая чувствительность. Это означает, что распознавать антиген можно при минимальной концентрации в крови;
- Ранняя диагностика. Заболевание можно определять на начальной стадии и своевременно принимать меры для успешного выздоровления;
- Технологичность. Практически полная автоматизация проведения анализа исключает влияние человеческого фактора и гарантирует точность результатов.

Как подготовиться к анализу
Иммуноферментный анализ предполагает забор крови из вены в утренние часы на голодный желудок. Чтобы подготовиться:
- за 24 часа исключите из рациона жирные блюда и спиртное;
- не курите перед исследованием;
- не ешьте минимум за 8 часов до исследования.
Где сделать
Нужны быстрые и точные результаты? Тогда сдайте кровь на ИФА в многопрофильной клинике «Юнимед» в Ижевске. Чтобы проконсультироваться и задать вопросы звоните по одному из телефонов, указанных в разделе «Контакты». Администратор сориентирует по ценам ИФА и подберёт оптимальное время для посещения.
Анализ крови методом ИФА, диагностика инфекций в Ижевске
Как вас зовут * :
Специалист * : Базина Лилия Викторовна (Медицинская сестра)
Гущина Ирина Александровна (Медицинская сестра)
Баймурзина Надежда Валерьевна (Медицинская сестра)
Кудрина Светлана Викторовна (Медицинская сестра)
Куликова Ирина Юрьевна (Медицинская сестра)
Мухаметзянова Рита Раульевна (Врач-стоматолог-терапевт.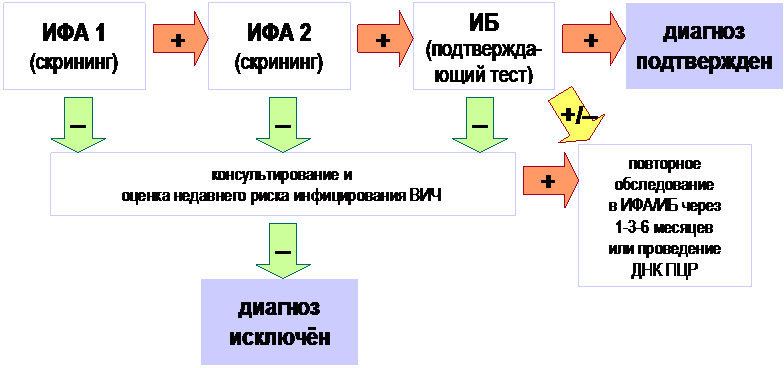
 Специалист ультразвуковой диагностики.)
Вахрушева Аделина Альбертовна ()
Владыкина Ксения Владимировна ()
Сивенцева Рамзалия Хайдаровна ()
Иванова Виктория Игоревна ()
Иванова Наталья Игоревна ()
Ленточкина Елена Валерьевна ()
Морданова Альмира Ринатовна ()
Черепанова Дария Анатольевна ()
Шаимова Виктория Александровна ()
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Ложкина Екатерина Петровна (Врач-гинеколог.
Специалист ультразвуковой диагностики.)
Вахрушева Аделина Альбертовна ()
Владыкина Ксения Владимировна ()
Сивенцева Рамзалия Хайдаровна ()
Иванова Виктория Игоревна ()
Иванова Наталья Игоревна ()
Ленточкина Елена Валерьевна ()
Морданова Альмира Ринатовна ()
Черепанова Дария Анатольевна ()
Шаимова Виктория Александровна ()
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Ложкина Екатерина Петровна (Врач-гинеколог. Специалист ультразвуковой диагностики. )
Дубинина Ольга Владимировна (Гинеколог-эндокринолог. Специалист УЗД.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Лукиных Татьяна Олеговна (Врач-гинеколог. Специалист ультразвуковой диагностики. )
Аржевитина Мария Александровна (Врач-гинеколог. Специалист ультразвуковой диагностики. )
Богданова Мария Александровна (Врач-гинеколог. Специалист ультразвуковой диагностики)
Дубинина Ольга Владимировна (Гинеколог-эндокринолог.
Специалист ультразвуковой диагностики. )
Дубинина Ольга Владимировна (Гинеколог-эндокринолог. Специалист УЗД.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Лукиных Татьяна Олеговна (Врач-гинеколог. Специалист ультразвуковой диагностики. )
Аржевитина Мария Александровна (Врач-гинеколог. Специалист ультразвуковой диагностики. )
Богданова Мария Александровна (Врач-гинеколог. Специалист ультразвуковой диагностики)
Дубинина Ольга Владимировна (Гинеколог-эндокринолог. Специалист УЗД.)
Шмыкова Елена Михайловна (Врач-дерматовенеролог.)
Усманова Татьяна Ивановна ( Врач-дерматовенеролог)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог. Высшая квалификационная категория. )
Михайлова Ираида Геннадьевна (Врач-педиатр)
Ежов Сергей Борисович (Врач-невролог.)
Филатова Светлана Владимировна (Врач — невролог. )
Вахрушева Елена Витальевна (Врач-невролог.)
Бегишев Георгий Николаевич (Врач-невролог. Заслуженный работник здравоохранения. Первая квалификационная категория.)
Мерзляков Вадим Сергеевич (Врач-невролог)
Никонова Нина Александровна (Врач-невролог)
Степанов Дмитрий Петрович (Врач-невролог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Адамова Лина Юрьевна (Врач-педиатр, специалист ультразвуковой диагностики)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог.
Специалист УЗД.)
Шмыкова Елена Михайловна (Врач-дерматовенеролог.)
Усманова Татьяна Ивановна ( Врач-дерматовенеролог)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог. Высшая квалификационная категория. )
Михайлова Ираида Геннадьевна (Врач-педиатр)
Ежов Сергей Борисович (Врач-невролог.)
Филатова Светлана Владимировна (Врач — невролог. )
Вахрушева Елена Витальевна (Врач-невролог.)
Бегишев Георгий Николаевич (Врач-невролог. Заслуженный работник здравоохранения. Первая квалификационная категория.)
Мерзляков Вадим Сергеевич (Врач-невролог)
Никонова Нина Александровна (Врач-невролог)
Степанов Дмитрий Петрович (Врач-невролог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Адамова Лина Юрьевна (Врач-педиатр, специалист ультразвуковой диагностики)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог. Высшая квалификационная категория. )
Петухова Валентина Алексеевна (Врач-кардиолог. Ревматолог. Врач высшей квалификационной категории. Заслуженный врач Российской Федерации. )
Гасанов Акпер Магарлам оглы (Врач-хирург.)
Серебрянников Денис Петрович (Врач-хирург)
Курочкина Наталья Викторовна (Врач аллерголог-иммунолог.)
Зернов Владимир Германович (Врач-эндоскопист.)
Третьяков Евгений Васильевич (Врач-эндоскопист. Кандидат медицинских наук.)
Елмашев Юрий Владимирович (Врач-эндоскопист)
Курочкина Наталья Викторовна (Врач аллерголог-иммунолог.
Высшая квалификационная категория. )
Петухова Валентина Алексеевна (Врач-кардиолог. Ревматолог. Врач высшей квалификационной категории. Заслуженный врач Российской Федерации. )
Гасанов Акпер Магарлам оглы (Врач-хирург.)
Серебрянников Денис Петрович (Врач-хирург)
Курочкина Наталья Викторовна (Врач аллерголог-иммунолог.)
Зернов Владимир Германович (Врач-эндоскопист.)
Третьяков Евгений Васильевич (Врач-эндоскопист. Кандидат медицинских наук.)
Елмашев Юрий Владимирович (Врач-эндоскопист)
Курочкина Наталья Викторовна (Врач аллерголог-иммунолог. )
Филатова Светлана Владимировна (Врач — невролог. )
Зеленин Константин Андреевич (Кардиолог. Специалист УЗД.)
Бусарева Марина Евгеньевна (Врач — терапевт. Кардиолог.)
Петухова Валентина Алексеевна (Врач-кардиолог. Ревматолог. Врач высшей квалификационной категории. Заслуженный врач Российской Федерации. )
Габушева Наталья Станиславовна (Врач кардиолог-аритмолог. Высшая квалификационная категория)
Петров Александр Генрихович (Врач-кардиолог. Специалист УЗД. Кандидат медицинских наук.)
Михайлова Светлана Семеновна (Врач-кардиолог)
Исхакова Альфия Сабитовна (Врач-кардиолог.
)
Филатова Светлана Владимировна (Врач — невролог. )
Зеленин Константин Андреевич (Кардиолог. Специалист УЗД.)
Бусарева Марина Евгеньевна (Врач — терапевт. Кардиолог.)
Петухова Валентина Алексеевна (Врач-кардиолог. Ревматолог. Врач высшей квалификационной категории. Заслуженный врач Российской Федерации. )
Габушева Наталья Станиславовна (Врач кардиолог-аритмолог. Высшая квалификационная категория)
Петров Александр Генрихович (Врач-кардиолог. Специалист УЗД. Кандидат медицинских наук.)
Михайлова Светлана Семеновна (Врач-кардиолог)
Исхакова Альфия Сабитовна (Врач-кардиолог. Кандидат медицинских наук)
Радаева Оксана Викторовна (Врач-кардиолог. Гастроэнтеролог. Специалист ультразвуковой диагностики.)
Данилова Мария Леонидовна (Врач-нефролог. Кандидат медицинских наук.)
Гареева Альфия Рашидовна (Врач-нефролог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Аблаеев Рифкат Равилевич (Врач УЗД.
Кандидат медицинских наук)
Радаева Оксана Викторовна (Врач-кардиолог. Гастроэнтеролог. Специалист ультразвуковой диагностики.)
Данилова Мария Леонидовна (Врач-нефролог. Кандидат медицинских наук.)
Гареева Альфия Рашидовна (Врач-нефролог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Аблаеев Рифкат Равилевич (Врач УЗД. )
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Козленкова Ирина Николаевна (Врач ультразвуковой диагностики. Высшая квалификационная категория.)
Сухолита Леонид Григорьевич (Специалист УЗД.)
Веретенникова Татьяна Викторовна (Специалист УЗД. Гастроэнтеролог. Высшая квалификационная категория.)
Щус Николай Иванович (Врач УЗД.)
Шмакова Марина Линаровна (Врач УЗД. Высшая квалификационная категория.)
Кедров Юрий Николаевич (Врач УЗД.)
Майлова Анна Валерьевна (Специалист УЗД.
)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Козленкова Ирина Николаевна (Врач ультразвуковой диагностики. Высшая квалификационная категория.)
Сухолита Леонид Григорьевич (Специалист УЗД.)
Веретенникова Татьяна Викторовна (Специалист УЗД. Гастроэнтеролог. Высшая квалификационная категория.)
Щус Николай Иванович (Врач УЗД.)
Шмакова Марина Линаровна (Врач УЗД. Высшая квалификационная категория.)
Кедров Юрий Николаевич (Врач УЗД.)
Майлова Анна Валерьевна (Специалист УЗД. Эндокринолог.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Никифорова Елена Александровна (Врач-гинеколог. Специалист УЗД. Высшая квалификационная категория.)
Передвигина Анастасия Владимировна (Врач УЗД. Гинеколог. Кандидат медицинских наук.)
Суховерхова Наталья Валерьевна (Врач УЗД.)
Могунова Екатерина Александровна (Специалист УЗД. Сердечно-сосудистый хирург. )
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Смердова Ирина Михайловна (Специалист УЗД.)
Перевощиков Александр Евгеньевич (Специалист УЗД.
Эндокринолог.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Никифорова Елена Александровна (Врач-гинеколог. Специалист УЗД. Высшая квалификационная категория.)
Передвигина Анастасия Владимировна (Врач УЗД. Гинеколог. Кандидат медицинских наук.)
Суховерхова Наталья Валерьевна (Врач УЗД.)
Могунова Екатерина Александровна (Специалист УЗД. Сердечно-сосудистый хирург. )
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Смердова Ирина Михайловна (Специалист УЗД.)
Перевощиков Александр Евгеньевич (Специалист УЗД. )
Дубинина Ольга Владимировна (Гинеколог-эндокринолог. Специалист УЗД.)
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Скорнякова Ольга Геннадьевна (Врач-гинеколог. Специалист УЗД.)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Акулов Геннадий Михайлович (Врач-гинеколог. Специалист УЗД.)
Зеленина Валентина Николаевна (Врач-гинеколог. Специалист УЗД.)
Крекнин Юрий Владимирович (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. Высшая квалификационная категория.
)
Дубинина Ольга Владимировна (Гинеколог-эндокринолог. Специалист УЗД.)
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Скорнякова Ольга Геннадьевна (Врач-гинеколог. Специалист УЗД.)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Акулов Геннадий Михайлович (Врач-гинеколог. Специалист УЗД.)
Зеленина Валентина Николаевна (Врач-гинеколог. Специалист УЗД.)
Крекнин Юрий Владимирович (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. Высшая квалификационная категория..jpg) )
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Петров Александр Генрихович (Врач-кардиолог. Специалист УЗД. Кандидат медицинских наук.)
Зеленин Константин Андреевич (Кардиолог. Специалист УЗД.)
Калинкина Кристина Андреевна (Врач ультразвуковой диагностики. Терапевт. )
Земан Надежда Яковлевна (Врач-гинеколог, специалист ультразвуковой диагностики)
Лисаковская Екатерина Валентиновна (Врач-гинеколог, гинеколог-эндокринолог, гинеколог-онколог, специалист УЗД. Врач первой категории)
Трынкова Мария Станиславовна (Врач-гинеколог, гинеколог-эндокринолог. Специалист ультразвуковой диагностики.
)
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Петров Александр Генрихович (Врач-кардиолог. Специалист УЗД. Кандидат медицинских наук.)
Зеленин Константин Андреевич (Кардиолог. Специалист УЗД.)
Калинкина Кристина Андреевна (Врач ультразвуковой диагностики. Терапевт. )
Земан Надежда Яковлевна (Врач-гинеколог, специалист ультразвуковой диагностики)
Лисаковская Екатерина Валентиновна (Врач-гинеколог, гинеколог-эндокринолог, гинеколог-онколог, специалист УЗД. Врач первой категории)
Трынкова Мария Станиславовна (Врач-гинеколог, гинеколог-эндокринолог. Специалист ультразвуковой диагностики. )
Ивакина Елена Витальевна (Врач-эндокринолог.)
Михайлова Светлана Семеновна (Врач-эндокринолог. Терапевт)
Майлова Анна Валерьевна (Специалист УЗД. Эндокринолог.)
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Овсянникова Ирина Николаевна (Врач-эндокринолог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Веретенникова Татьяна Викторовна (Специалист УЗД. Гастроэнтеролог. Высшая квалификационная категория.)
Чухланцева Наталья Демьяновна (Врач гастроэнтеролог.)
Федоров Руслан Владиславович (Врач-отоларинголог)
Дагаков Владимир Васильевич (Врач-онколог.
)
Ивакина Елена Витальевна (Врач-эндокринолог.)
Михайлова Светлана Семеновна (Врач-эндокринолог. Терапевт)
Майлова Анна Валерьевна (Специалист УЗД. Эндокринолог.)
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Овсянникова Ирина Николаевна (Врач-эндокринолог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Веретенникова Татьяна Викторовна (Специалист УЗД. Гастроэнтеролог. Высшая квалификационная категория.)
Чухланцева Наталья Демьяновна (Врач гастроэнтеролог.)
Федоров Руслан Владиславович (Врач-отоларинголог)
Дагаков Владимир Васильевич (Врач-онколог. Высшая квалификационная категория.)
Могунова Екатерина Александровна (Врач — маммолог. Специалист УЗД.)
Клековкина Елена Анисимовна (Врач-гинеколог. Маммолог. Высшая квалификационная категория.)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Шайдуллин Азат Ахатович (Врач-онколог, онколог-маммолог)
Могунова Екатерина Александровна (Врач — онколог. Специалист УЗД.)
Дагаков Владимир Васильевич (Врач-онколог. Высшая квалификационная категория.)
Попова Милана Олеговна (Профпатолог)
Дудорова Ирина Николаевна (Врач-профпатолог)
Федоров Руслан Владиславович (Врач-отоларинголог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Третьяков Евгений Васильевич (Врач-эндоскопист.
Высшая квалификационная категория.)
Могунова Екатерина Александровна (Врач — маммолог. Специалист УЗД.)
Клековкина Елена Анисимовна (Врач-гинеколог. Маммолог. Высшая квалификационная категория.)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Шайдуллин Азат Ахатович (Врач-онколог, онколог-маммолог)
Могунова Екатерина Александровна (Врач — онколог. Специалист УЗД.)
Дагаков Владимир Васильевич (Врач-онколог. Высшая квалификационная категория.)
Попова Милана Олеговна (Профпатолог)
Дудорова Ирина Николаевна (Врач-профпатолог)
Федоров Руслан Владиславович (Врач-отоларинголог)
Михайлова Ираида Геннадьевна (Врач-педиатр)
Третьяков Евгений Васильевич (Врач-эндоскопист.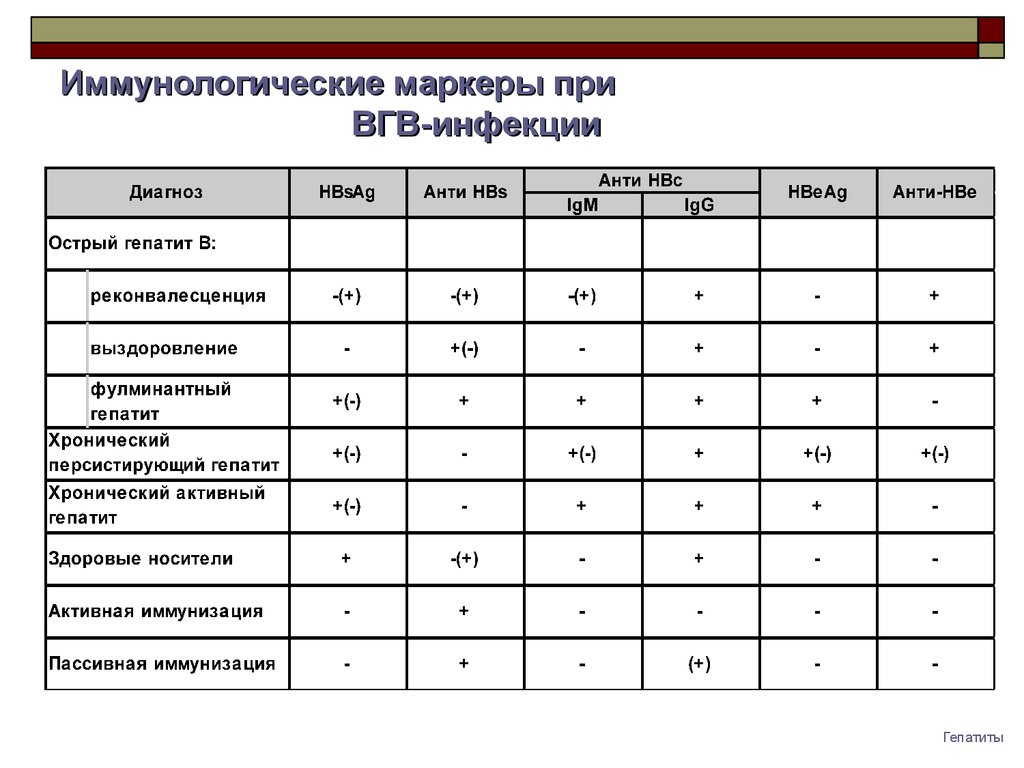 Кандидат медицинских наук.)
Зернов Владимир Германович (Врач-эндоскопист.)
Крекнин Юрий Владимирович (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. Высшая квалификационная категория.)
Назаров Сергей Борисович (Врач-ангиохирург. Флеболог. Сердечно-сосудистый хирург. Высшая квалификационная категория. Кандидат медицинских наук.)
Могунова Екатерина Александровна (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. )
Чухланцева Наталья Демьяновна (Врач гастроэнтеролог.)
Балобанов Владимир Юрьевич (Врач — гастроэнтеролог. Кандидат медицинских наук.)
Веретенникова Татьяна Викторовна (Специалист УЗД.
Кандидат медицинских наук.)
Зернов Владимир Германович (Врач-эндоскопист.)
Крекнин Юрий Владимирович (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. Высшая квалификационная категория.)
Назаров Сергей Борисович (Врач-ангиохирург. Флеболог. Сердечно-сосудистый хирург. Высшая квалификационная категория. Кандидат медицинских наук.)
Могунова Екатерина Александровна (Врач-флеболог. Сердечно-сосудистый хирург. Специалист УЗД. )
Чухланцева Наталья Демьяновна (Врач гастроэнтеролог.)
Балобанов Владимир Юрьевич (Врач — гастроэнтеролог. Кандидат медицинских наук.)
Веретенникова Татьяна Викторовна (Специалист УЗД. Гастроэнтеролог. Высшая квалификационная категория.)
Радаева Оксана Викторовна (Врач-кардиолог. Гастроэнтеролог. Специалист ультразвуковой диагностики.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог. Высшая квалификационная категория. )
Федоров Руслан Владиславович (Врач-отоларинголог)
Стрелкова Диана Михайловна (Врач-оториноларинголог)
Сунцов Андрей Евгеньевич (Врач психиатр-нарколог.)
Мухаметзянова Рита Раульевна (Врач-стоматолог-терапевт.)
Осипов Андрей Владимирович (Врач-уролог.
Гастроэнтеролог. Высшая квалификационная категория.)
Радаева Оксана Викторовна (Врач-кардиолог. Гастроэнтеролог. Специалист ультразвуковой диагностики.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Снигирева Наталья Николаевна (Врач ревматолог-кардиолог. Высшая квалификационная категория. )
Федоров Руслан Владиславович (Врач-отоларинголог)
Стрелкова Диана Михайловна (Врач-оториноларинголог)
Сунцов Андрей Евгеньевич (Врач психиатр-нарколог.)
Мухаметзянова Рита Раульевна (Врач-стоматолог-терапевт.)
Осипов Андрей Владимирович (Врач-уролог. )
Комов Руслан Вячеславович (Врач уролог. Специалист УЗД.)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Ленцов Иван Петрович (Врач-уролог)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Скорнякова Ольга Геннадьевна (Врач-гинеколог. Специалист УЗД.)
Клековкина Елена Анисимовна (Врач-гинеколог. Маммолог. Высшая квалификационная категория.)
Зеленина Валентина Николаевна (Врач-гинеколог. Специалист УЗД.)
Дубинина Ольга Владимировна (Гинеколог-эндокринолог.
)
Комов Руслан Вячеславович (Врач уролог. Специалист УЗД.)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Ленцов Иван Петрович (Врач-уролог)
Жуковская Инна Геннадьевна (Врач-гинеколог-эндокринолог. Специалист УЗД. Доктор медицинских наук. Высшая квалификационная категория.)
Скорнякова Ольга Геннадьевна (Врач-гинеколог. Специалист УЗД.)
Клековкина Елена Анисимовна (Врач-гинеколог. Маммолог. Высшая квалификационная категория.)
Зеленина Валентина Николаевна (Врач-гинеколог. Специалист УЗД.)
Дубинина Ольга Владимировна (Гинеколог-эндокринолог.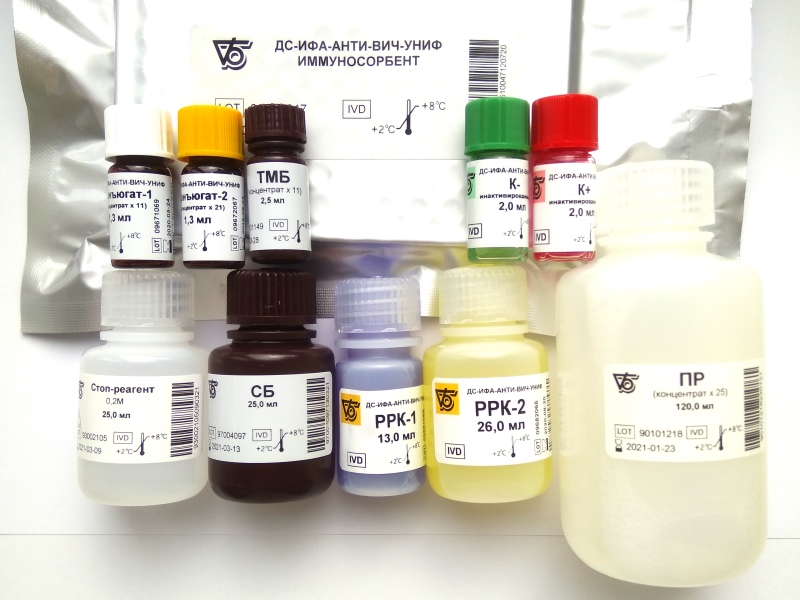 Специалист УЗД.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Акулов Геннадий Михайлович (Врач-гинеколог. Специалист УЗД.)
Никифорова Елена Александровна (Врач-гинеколог. Специалист УЗД. Высшая квалификационная категория.)
Шмыкова Елена Михайловна (Врач-дерматовенеролог.)
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Гусманова Эльгиза Хадисовна ()
Петрунина Дарья Сергеевна (Врач-офтальмолог.)
Сташкова Лариса Ивановна (Врач-офтальмолог)
Чубуков Максим Александрович (Врач-офтальмолог)
Зеленин Борис Павлович (Врач-терапевт.)
Бусарева Марина Евгеньевна (Врач — терапевт. Кардиолог.)
Михайлова Светлана Семеновна (Врач-эндокринолог. Терапевт)
Метелева Юлия Игоревна ( Врач — терапевт.)
Ларченкова Ольга Владимировна (Врач-терапевт.)
Татаркина Екатерина Дмитриевна (Врач-терапевт.)
Калинкина Кристина Андреевна (Врач ультразвуковой диагностики. Терапевт. )
Хузина Ильнара Аликова (Врач-терапевт)
Кудрявцева Анна Леонидовна (Врач-терапевт)
Тройникова Юлия Анатольевна (Врач ФД. Высшая квалификационная категория.)
Кузнецова Ирина Анатольевна (Врач ФД. Кандидат медицинских наук.)
Никитина Асия Флеровна (Врач УЗД. Врач первой квалификационной категории.)
Сапегина Ольга Дмитриевна (Врач функциональной диагностики)
Габушева Наталья Станиславовна (Врач кардиолог-аритмолог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Аблаеев Рифкат Равилевич (Врач УЗД.)
Сухолита Леонид Григорьевич (Специалист УЗД.)
Специалист УЗД.)
Латыпова Гульнара Флюровна (Гинеколог-эндокринолог. Специалист УЗД.)
Лебедева Надежда Васильевна (Гинеколог-эндокринолог. Специалист УЗД.)
Дьяконова Ирина Николаевна (Врач-гинеколог-эндокринолог. Специалист УЗД.)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Акулов Геннадий Михайлович (Врач-гинеколог. Специалист УЗД.)
Никифорова Елена Александровна (Врач-гинеколог. Специалист УЗД. Высшая квалификационная категория.)
Шмыкова Елена Михайловна (Врач-дерматовенеролог.)
Давыдов Пётр Алексеевич (Врач-эндокринолог. Специалист УЗД.)
Гусманова Эльгиза Хадисовна ()
Петрунина Дарья Сергеевна (Врач-офтальмолог.)
Сташкова Лариса Ивановна (Врач-офтальмолог)
Чубуков Максим Александрович (Врач-офтальмолог)
Зеленин Борис Павлович (Врач-терапевт.)
Бусарева Марина Евгеньевна (Врач — терапевт. Кардиолог.)
Михайлова Светлана Семеновна (Врач-эндокринолог. Терапевт)
Метелева Юлия Игоревна ( Врач — терапевт.)
Ларченкова Ольга Владимировна (Врач-терапевт.)
Татаркина Екатерина Дмитриевна (Врач-терапевт.)
Калинкина Кристина Андреевна (Врач ультразвуковой диагностики. Терапевт. )
Хузина Ильнара Аликова (Врач-терапевт)
Кудрявцева Анна Леонидовна (Врач-терапевт)
Тройникова Юлия Анатольевна (Врач ФД. Высшая квалификационная категория.)
Кузнецова Ирина Анатольевна (Врач ФД. Кандидат медицинских наук.)
Никитина Асия Флеровна (Врач УЗД. Врач первой квалификационной категории.)
Сапегина Ольга Дмитриевна (Врач функциональной диагностики)
Габушева Наталья Станиславовна (Врач кардиолог-аритмолог. Высшая квалификационная категория)
Пичугина Елена Борисовна (Врач-гинеколог-эндокринолог. Высшая квалификационная категория)
Гулько Александр Геннадьевич (Специалист УЗД. Уролог. Репродуктолог. Высшая квалификационная категория.)
Аблаеев Рифкат Равилевич (Врач УЗД.)
Сухолита Леонид Григорьевич (Специалист УЗД.)Контактный телефон * :
- Любая клиника
- Ижевск, ул. Весенняя 6
- Ижевск, ул. Зои Космодемьянской, 15
- Ижевск, ул. Петрова 33 Б
- Ижевск, ул. 30 лет Победы, 43
- Ижевск, ул. Кунгурцева, 6
- Ижевск, ул. Ленина, 146
- Ижевск, ул. Красноармейская, 86а
- Сарапул, ул. Дубровская, 61
- Воткинск, ул. 1 Мая, 74
- Можга, ул. Наговицына, 162
- Глазов, ул. Комсомольская,16
- Якшур-Бодья, ул. Пушиной, д.109
- Малая Пурга, площадь Победы, 2
- Ува, ул. Пушкина, 36
- с. Малая Пурга, площадь Победы, 2
- Игра, мкр. Нефтяников, дом 1
- Камбарка, ул. Советская, 23
- Яр, Школьная, 10
Записаться на прием
Мы сами перезвоним вам в течение 1 рабочего часа, ответим на вопросы или запишем на приём.
ИФА | Медика
Для оценки способности организма сопротивляться инфекционным болезням или для определения фазы патологии применяют анализ крови. Метод ИФА занимает важное место среди лабораторных исследований, он помогает всесторонне изучить деятельность защитной функции крови, определить иммунодефицит при инфекционных заболевания, недугах крови, гормональных, аутоиммунных процессах.
Что такое иммуноферментный анализ крови
Этот метод относится к лабораторным исследованиям, определяет наличие защитных факторов крови белковой природы (антител) к определенным болезнетворным агентам (антигенам). Иммуноферментный анализ крови определяет иммуноглобулины, которые могут обнаруживаться в виде иммунокомплексов. Появляются они при возникновении сложных нейрогуморальных реакций иммунной защиты человека, которые становятся ответом на внедрение чужеродных антигенов. Против каждого вида болезнетворного агента производятся в организме специфические антитела. Далее происходит связывание патологического микроорганизма или антигена, образуется комплексное соединение «антиген-антитело». Затем оно нейтрализуется, происходит ферментативный лизис, реакция фагоцитоза, и заканчивается процесс выводом из организма. Наличие конкретных комплексов, определяющееся ИФА, говорит о виде возбудителя, вредного вещества у больного.
Классы иммуноглобулинов
Учеными обнаружено и изучено 5 видов иммуноглобулинов: IgE, IgD, IgG, IgM, IgА. Существуют и другие классы, но они находятся еще на стадии исследования, и не до конца выяснена их роль. В практической медицине важное значение имеют А, М, G. Информативность, точность определения базируется на временных промежутках, за которые они появляются, достигают максимума и исчезают.
- Иммуноглобулины IgA (А) – выполняют защитную функцию слизистых мочевыделительной системы, желудочно-кишечного тракта, дыхательных путей. Выявить их при остром начале патологии нельзя, они образуется только через 2 недели после первых признаков болезни, в некоторых ситуациях еще позже. Сосредоточен глобулин А в слизистых тканях (около 80% от общего количества). Оставшаяся часть находится в крови, чтобы обезвреживать и уничтожать микроорганизмы. К 8 неделе после стихания острой фазы патологии количество этих иммуноглобулинов уменьшается до полного исчезновения.
- Первым и главным маркером острого периода развития болезни становятся глобулины IgM (M). Анализ их показывает на 5 сутки после начала появления первых признаков патологии. Выявляет ИФА эти иммуноглобулины первые 6 недель, затем они быстро исчезают.
- Класс иммуноглобулинов IgG (G) показывает остаточный иммунный ответ в крови на патологический процесс. Анализ покажет фактор спустя месяц после начала болезни. Потом они могут еще долгие месяцы, года и даже всю жизнь определяться в анализе. Они защищают человека от рецидива недуга, иногда обеспечивают невозможность вторичного развития патологии. При определении роста иммуноглобулина G подозревают повторное заражение патологией. Для подтверждения проводят несколько проб ИФА с промежутком в 2 недели.
- В паразитологии и аллергологии используется иммуноглобулин IgE (E).
- Иммуноглобулин IgD (D) находится на В-лимфоцитах, небольшая концентрация встречается и у здоровых людей. Достигает максимальных значений после 10 лет жизни человека. При анализе ИФА отмечается рост иммуноглобулина D у пациентов с системными патологиями соединительной ткани, во время беременности, при бронхиальной астме, недугах, которые спровоцированы иммунодефицитным состоянием.
Показания к исследованию крови методом ИФА
При помощи этого анализа можно оценивать эффективность лечения, проводить комплексное исследование перед трансплантологическими операциями, определять состояние иммунодефицита и антитела к более 600 видов аллергенов. Исследование крови методом ИФА использует в качестве дополнительного способа обнаружения онкологических клеток. Назначают анализ при необходимости обнаружения антител к микробам, которые провоцируют венерические патологии:
- трихомониаз;
- сифилис;
- токсоплазмоз;
- микоплазмоз;
- уреаплазмоз.
При глистных инвазиях в анализе ИФА будет отмечен рост количества иммуноглобулинов. Проводится исследования для подтверждения наличия у больного:
- вируса Эпштейна-Барра;
- герпетических инфекций;
- цитомегаловируса;
- группы вирусных гепатитов.
В паразитологии
Анализ ИФА используется в диагностике паразитарных патологий, показателем становится специфический иммуноглобулин IgE. Отмечается его рост в крови при заражении организма пациента паразитами. Иммуноглобулин Е становится маркером атопической реакции при аллергических процессах. Содержание в крови – незначительное. Локализуется, как правило, на слизистых оболочках, макрофагах, базофилах.
Основная функция белкового комплекса – защита слизистых оболочек организма. Также он участвует в иммунных реакциях, которые направлены на уничтожение паразитов. Отвечают за активизацию IgE макрофаги и эозинофилы. При сопоставлении с данными анализа этот факт помогает установить диагноз. Анализ ИФА используют для обнаружения:
- хронической, острой формы описторхоза;
- круглых гельминтов: остриц, аскарид;
- лямблий;
- трихинеллеза;
- амебиаза;
- форм лейшманиоза;
- содержания токсоплазм.
Подготовка:
Сдавать анализ необходимо натощак, перед ИФА не рекомендуется принимать медицинские препараты, которые могут повлиять на результат. Следует отказаться от алкоголя, курения, употребления наркотических веществ перед сдачей биоматериала.Варианты результатов теста:
- При отрицательных показателях иммуноглобулинов IgG, IgM, IgA, врачи говорят об отсутствии патологии или начальной стадии. Такой же результат (отрицательный) будет после полного выздоровления по прошествии длительного периода.
- Если IgG проявляется положительно, а IgM и IgA не обнаружены, это указывает на образование иммунитета после прививки или инфекционной болезни.
- При высоких титрах IgM и отрицательных IgA, IgG ставят диагноз острого инфекционного заболевания.
- При положительном показателе IgG, IgM, IgA врачи говорят об острой фазе рецидива уже имеющегося хронического недуга.
- При хронической инфекции, которая находится на стадии стихания (ремиссии), анализ ИФА показывает отрицательные титры IgM, а IgA и IgG будут положительными.
Преимущества и недостатки ИФА анализа
Основным отрицательным моментом этого исследования является вероятность получения ложноположительных или ложноотрицательных результатов. Причиной недостоверности становится прием медикаментов, технические недочеты лаборатории. Фальсифицировать анализ может процесс нарушения метаболизма в организме. Главными достоинствами анализа ИФА являются:
- точность, диагностическая специфичность;
- невысокая себестоимость анализа;
- скорость получения результатов;
- возможность динамического контроля стадии патологии, эффективности лечения;
- простота исследования;
- возможность выполнять массовые обследования очагов инфекции;
- безболезненность, безопасность для больного;
- применение при обработке информационных технологий.
ИФА и ПЦР: просто о сложных лабораторных методах диагностики инфекций
В лабораторной диагностике существует множество методов выявления необходимого элемента в биоматериале. Для диагностики инфекционных заболеваний чаще всего используют два принципиально разных метода: ИФА и ПЦР. Мы предлагаем Вам ознакомиться с данными методами, чтоб понять плюсы и минусы каждого из них.
ИФА (иммуноферментный анализ) – это определение в крови пациента антител к инфекционным агентам. Антитела (иммуноглобулины, Ig) представляют собой белки, которые вырабатывает наша иммунная система в ответ на инфекцию. Для каждого возбудителя заболевания продуцируются сугубо индивидуальные антитела. Антитела «помечают» микробов, и по наличию таких «меток» на поверхности микробных клеток организм узнает цель для уничтожения. Антитела к одному возбудителю могут отличаться между собой по срокам появления:
IgM – в острый период
IgG – если процесс хронический, или в качестве постоянного иммунитета (в зависимости от вида возбудителя)
IgA – при обострении хронического процесса
Метод ИФА ищет «следы» реакции на вторжение инфекции, а не саму инфекцию!
Из-за низкой цены и использования в качестве биоматериала крови, метод применяется в качестве скрининга. Например, при подозрении на паразитозы пациенты сдают кровь на определение антител к аскаридам, лямблиям и т.д. Если результат пришел положительным, то не стоит сразу приступать к лечению паразитов – необходимо сопоставить клиническую картину, результаты ИФА и, возможно, результаты других методов обследования. Стоит помнить, что после пройденного курса лечения антитела могут оставаться в нашем организме очень долго, даже после того, как инфекция покинула наше тело, т.е. остается, так называемый, «серологический шрам».
Приведем пример: в ночном небе тысячи звезд. Многие из этих звезд уже давно погибли, но до нас до сих пор, веками, идет их свет. По сути, мы видим только след звезды. Свет есть, а звезды уже давно нет. Но если света нет, это не говорит о том, что звезды там не было.
То же самое и с антителами. Их наличие не гарантирует присутствия в организме искомого инфекционного агента. Отсутствие антител не говорит о том, что инфекции нет.
Если результат анализа методом ИФА положительный, то это значит, что нужно искать инфекцию более специфическими и дорогостоящими методами — ПЦР, бактериологические посевы. Возможен ложноположительный результат в случае, если несколько микробов обладают схожей антигенной структурой, тогда к разным микробам будут вырабатываться «похожие» антитела.
ПЦР – один из самых наукоемких методов. Он обнаруживает ДНК микроорганизма. Генетический материал индивидуален для любого микроба, а это значит, что метод обладает самой высокой специфичностью и не может «обознаться». Принцип ПЦР заключается в том, что в пробирке происходит многократное удвоение искомого генетического кода. В случае присутствия даже незначительного количества этого кода, произойдет увеличение его количества, и анализатор сможет «уловить» его наличие. Таким образом, ПЦР – «золотой стандарт» выявления инфекционных агентов. Однако, у этого метода есть и свои минусы. Во-первых, в отличие от ИФА, ПЦР может сказать о наличии возбудителя только в месте взятия биоматериала, которое ограничено мазком (например, с уретры или из носа). Во-вторых, за счет своей высокой чувствительности, ПЦР может обнаружить даже мертвые частицы микробов, что наблюдается сразу после лечения. В таком случае, результат будет ложноположительный.
Резюмируя вышесказанное, приведем таблицу сравнения этих двух методов друг с другом:
Характеристика метода | ПЦР | ИФА |
| Биоматериал | Мазок / кровь | Кровь |
Цена | Выше | Ниже |
Чувствительность | Выше | Ниже |
Специфичность | Выше | Ниже |
Срок выполнения | Дольше | Короче |
«Человеческий фактор» | Отсутствует | Отсутствует |
Подготовка к сдаче анализа | Требуется | Не требуется |
Локализация возбудителя в организме | Только в месте взятия биоматериала | Роли не играет |
Возможность определения стадии инфекционного процесса | Нет | Да |
Отмена антибиотикотерапии при выполнении анализа | Да | Нет |
Выявление возбудителя на ранней стадии | Да | Нет |
Внимание! Данные «классические» методы диагностики в КДЛ «ОЛИМП» модифицированы: ПЦР выполняется в Real-time режиме, вместо ИФА используют ЭХЛ, что повышает качество исследований и сводит к минимуму вероятность ложных результатов.
Иммуноферментная диагностика (ИФА) заболеваний в медицинском центре «ШЕКИ»
Иммуноферментный анализ – ИФА, представляет собой метод лабораторной диагностики, позволяющий выявить ответ организма на вирус или инфекцию. Данная методика является непрямым методом диагностики, позволяет выявить наличие антител к вирусу или инфекции в организме, но не позволяет выявить самого возбудителя. Его рекомендуется проводить в комплексе с ПЦР диагностикой. Тем не менее, важность ИФА нельзя принижать, так как во многих случаях, когда важно определить стадию заболевания, мониторинг проведенного курса лечения, ответ организма на лечение, определения оптимальной схемы терапии, может помочь именно иммуноферментное исследование.
Особенности метода ИФА
Метод лабораторных исследований ИФА позволяет выявить антитела (иммуноглобулины), которые вырабатывает организм человека к той или иной инфекции. Важно отметить, что на разных стадиях заболевания, организм вырабатывает определенные иммуноглобулины. Так, на острой стадии заболевания (с момента заражения проходит от недели до трех), в крови будут преобладать IgM антитела. Также они могут появиться в организме при обострении хронического вида заболевания. При более длительном периоде заболевания в крови будут обнаружены еще и IgA. А через месяц и более, в организме вырабатываются IgG. Их количественный показатель значительно снижается после проведения лечения, главным образом тех инфекций, которые не дают стойкого иммунитета. Метод исследований ИФА может при некоторых ситуациях, давать ложноположительные или ложноотрицательные результаты. Поэтому, его рекомендуют сочетать с ПЦР анализами. ПЦР исследования дают точный ответ с достоверностью в 100% на предмет наличия вируса в организме, но не дает ответа, на какой именно стадии заболевание. Сочетание этих двух методик для постановки правильного диагноза – оптимальное решение для формирования грамотной схемы терапии.
Что можно выявить ИФА?
Иммуноферментная диагностика проводится для выявления различных инфекций:
- Гепатитов, вирусной нагрузки
- Хламидии
- Микоплазмы
- Паразитарные инфекции
- Вирус Эпштейн-Барра
- Герпес
- Цитомегаловирус
- Микоплазмоз
- Уреаплазмоз и др.
Назначить какие виды исследований необходимо провести решает только врач.
Достоинства ИФА
Данная методика имеет ряд неоспоримых достоинств:
- Позволяет выявить широкий спектр инфекций
- Быстрое получение результата
- Высокая точность
- Раннее выявление заболевания
- Мониторинг лечения
- Для проведения анализа необходимо минимум исследуемого материала
- Высокая чувствительность метода позволяет проводить диагностику с точностью до 90%
- Автоматизация всех процессов проведения лабораторного исследования, исключает вероятность ошибки в тестировании
- Доступная стоимость проведения диагностики
Кому показаны иммуноферментные анализы?
Диагностика иммуноферментным методом показана всем пациентам, которые долгое время не могут выявить причину своей болезни или плохого самочувствия. Рекомендуется сдавать ИФА и после перенесенной инфекции попрошествии определенного времени по завершении терапии, чтобы удостовериться в ее эффективности. Также, важно проведение ИФА всем женщинам, которые планируют беременность, и хотят обезопасить себя от возможных рисков заболеть во время беременности инфекционным заболеванием. Целесообразность проведения того или иного исследования, решает врач.
Какова роль ИФА в диагностике амебиаза?
Притт Б.С., Кларк К.Г. Амебиаз. Mayo Clin Proc . 2008 окт. 83 (10): 1154-9; викторина 1159-60. [Медлайн].
Греку Ф., Булгариу Т., Бланару О, Драгомир С., Лунка С., Стратан I и др. Инвазивный амебиаз. Chirurgia (Bucur) . 2006 сентябрь-октябрь. 101 (5): 539-42. [Медлайн].
Haque R, Huston CD, Hughes M, Houpt E, Петри WA младший Amebiasis. N Engl J Med .2003 г., 17 апреля. 348 (16): 1565-73. [Медлайн].
Стэнли С.Л. Младший Амебиаз. Ланцет . 2003 22 марта. 361 (9362): 1025-34. [Медлайн].
Ширли Д.Т., Фарр Л., Ватанабе К., Муна С. Обзор глобального бремени, новых диагностических средств и современных методов лечения амебиаза. Открытый форум Infect Dis . 2018 5 (7) июля: ofy161. [Медлайн].
Равдин Дж. И., Стэнли П., Мерфи К. Ф., Петри В. А. Младший. Характеристика углеводных рецепторов клеточной поверхности для лектина, связанного с адгезией Entamoeba histolytica. Заражение иммунной . 1989 июл.57 (7): 2179-86. [Медлайн]. [Полный текст].
Хименес С., Серритос Р., Рохас Л., Долабелла С., Моран П., Шибаяма М. и др. Амебиаз человека: нарушение парадигмы ?. Int J Environ Res Public Health . 2010 марта 7 (3): 1105-20. [Медлайн]. [Полный текст].
Хак Р., Мондал Д., Дуггал П., Кабир М., Рой С., Фарр Б. М. и др. Инфекция Entamoeba histolytica у детей и защита от последующего амебиаза. Заражение иммунной . 2006 февраль 74 (2): 904-9. [Медлайн]. [Полный текст].
Seydel KB, Stanley SL Jr. Entamoeba histolytica индуцирует гибель клеток-хозяев в амебном абсцессе печени посредством не-Fas-зависимого, не зависимого от фактора некроза опухоли альфа-пути апоптоза. Заражение иммунной . 1998 июн. 66 (6): 2980-3. [Медлайн]. [Полный текст].
Que X, Рид SL. Цистеиновые протеиназы и патогенез амебиаза. Clin Microbiol Ред. .2000 Апрель, 13 (2): 196-206. [Медлайн]. [Полный текст].
Kelsall BL, Ravdin JI. Расщепление человеческого IgA под действием Entamoeba histolytica. J Заразить Dis . 1993 ноябрь 168 (5): 1319-22. [Медлайн].
Reed SL, Keene WE, McKerrow JH, Gigli I. Расщепление C3 нейтральной цистеиновой протеиназой Entamoeba histolytica. Дж Иммунол . 1 июля 1989 г. 143 (1): 189-95. [Медлайн].
Abhyankar MM, Shrimal S, Gilchrist CA, Bhattacharya A, Petri WA Jr.Индуцируемая сывороткой трансмембранная киназа EhTMKB1-9 Entamoeba histolytica участвует в кишечном амебиазе. Int J Parasitol Drugs Drug Resist . 2012 Декабрь 2: 243-248. [Медлайн]. [Полный текст].
Seydel KB, Li E, Swanson PE, Stanley SL Jr. Клетки кишечного эпителия человека продуцируют провоспалительные цитокины в ответ на инфекцию в модели амебиаза с ксенотрансплантатом мыши и человека SCID. Заражение иммунной . 1997 Май. 65 (5): 1631-9. [Медлайн].[Полный текст].
Стенсон В.Ф., Чжан З., Рил Т., Стэнли С.Л. мл. Амебная инфекция в толстой кишке человека индуцирует циклооксигеназу-2. Заражение иммунной . 2001 Май. 69 (5): 3382-8. [Медлайн]. [Полный текст].
Braga LL, Ninomiya H, McCoy JJ, Eacker S, Wiedmer T., Pham C и др. Ингибирование комплекса атаки мембраны комплемента за счет галактозоспецифической адгезии Entamoeba histolytica. Дж. Клин Инвест . 1992 Сентябрь 90 (3): 1131-7.[Медлайн]. [Полный текст].
Фотедар Р., Старк Д., Биби Н., Марриотт Д., Эллис Дж., Харкнесс Дж. Лабораторные методы диагностики видов Entamoeba. Clin Microbiol Ред. . 2007 июл.20 (3): 511-32, содержание. [Медлайн]. [Полный текст].
Симокава С., Кабир М., Таниучи М., Мондал Д., Кобаяси С., Али И.К. и др. Entamoeba moshkovskii вызывает диарею у младенцев и вызывает диарею и колит у мышей. J Заразить Dis .2012 Сентябрь 1. 206 (5): 744-51. [Медлайн].
Verkerke HP, Петри В.А. младший, Мари К.С. Динамическая взаимозависимость амебиаза, врожденного иммунитета и недостаточного питания. Семин Иммунопатол . 2012 ноябрь 34 (6): 771-85. [Медлайн]. [Полный текст].
Сваминатан А., Торрези Дж., Шлагенхаф П., Терски К., Уайлдер-Смит А., Коннор Б. А. и др. Глобальное исследование патогенов и факторов риска хозяина, связанных с инфекционными желудочно-кишечными заболеваниями, у вернувшихся международных путешественников. J Заразить . 2009 Июль 59 (1): 19-27. [Медлайн].
Гюнтер Дж., Шафир С., Бристоу Б., Сорвилло Ф. Краткий отчет: Смертность, связанная с амебиазом, среди жителей США, 1990-2007 гг. Ам Дж. Троп Мед Хиг . 2011 декабрь 85 (6): 1038-40. [Медлайн].
Гюнтер Дж., Шафир С., Бристоу Б., Сорвилло Ф. Краткий отчет: Смертность, связанная с амебиазом, среди жителей США, 1990-2007 гг. Ам Дж. Троп Мед Хиг . 2011 декабрь 85 (6): 1038-40.[Медлайн]. [Полный текст].
Валенсуэла О., Моран П., Гомес А., Кордова К., Корралес Н., Кардоза Дж. И др. Эпидемиология амебного абсцесса печени в Мексике: случай Соноры. Энн Троп Мед Паразитол . 2007 сентябрь 101 (6): 533-8. [Медлайн].
van Hal SJ, Stark DJ, Fotedar R, Marriott D, Ellis JT, Harkness JL. Амебиаз: текущее состояние в Австралии. Med J Aust . 2007 16 апреля. 186 (8): 412-6. [Медлайн].
Хименес К., Моран П., Рохас Л., Валадес А., Гомес А.Переоценка эпидемиологии амебиаза: современное состояние. Заразить Genet Evol . 2009 Декабрь 9 (6): 1023-32. [Медлайн].
Stauffer W, Abd-Alla M, Ravdin JI. Распространенность и заболеваемость инфекцией Entamoeba histolytica в Южной Африке и Египте. Arch Med Res . 2006 Февраль 37 (2): 266-9. [Медлайн].
Стэнли С.Л. Младший Амебиаз. Ланцет . 2003 22 марта. 361 (9362): 1025-34. [Медлайн].
Тенгку С.А., Норхаяти М.Общественное здоровье и клиническое значение амебиаза в Малайзии: обзор. Троп Биомед . 2011 28 августа (2): 194-222. [Медлайн].
Caballero-Salcedo A, Viveros-Rogel M, Salvatierra B, Tapia-Conyer R, Sepulveda-Amor J, Gutierrez G, et al. Сероэпидемиология амебиаза в Мексике. Ам Дж. Троп Мед Хиг . 1994 апр. 50 (4): 412-9. [Медлайн].
Blessmann J, Van Linh P, Nu PA, Thi HD, Muller-Myhsok B, Buss H, et al. Эпидемиология амебиаза в регионе высокой заболеваемости амебным абсцессом печени в центральном Вьетнаме. Ам Дж. Троп Мед Хиг . 2002 май. 66 (5): 578-83. [Медлайн].
Bowley DM, Loveland J, Omar T, Pitcher GJ. Инфекция вируса иммунодефицита человека и амебиаз. Pediatr Infect Dis J . 2006 25 декабря (12): 1192-3. [Медлайн].
Brindicci G, Picciarelli C, Fumarola L, Carbonara S, Stano F, Ciracì E, et al. Амебные абсцессы печени у ВИЧ-инфицированного пациента. Уход за больными СПИДом ЗППП . 2006 Сентябрь 20 (9): 606-11.[Медлайн].
Chen Y, Zhang Y, Yang B, Qi T, Lu H, Cheng X и др. Распространенность инфекции Entamoeba histolytica у ВИЧ-инфицированных в Китае. Ам Дж. Троп Мед Хиг . 2007 ноябрь 77 (5): 825-8. [Медлайн]. [Полный текст].
Hsu MS, Hsieh SM, Chen MY, Hung CC, Chang SC. Связь между амебным абсцессом печени и инфекцией вируса иммунодефицита человека у тайваньских субъектов. BMC Infect Dis . 2008 16 апреля 8:48.[Медлайн]. [Полный текст].
Karp CL, Auwaerter PG. Коинфекция с ВИЧ и тропическими инфекционными заболеваниями. I. Протозойные патогены. Clin Infect Dis . 2007 г. 1. 45 (9): 1208-13. [Медлайн].
Park WB, Choe PG, Jo JH, Kim SH, Bang JH, Kim HB и др. Амебный абсцесс печени у ВИЧ-инфицированных, Республика Корея. Emerg Infect Dis . 2007 марта 13 (3): 516-7. [Медлайн]. [Полный текст].
Инфекция вирусом иммунодефицита человека-1 не является фактором риска амебиаза. Ам Дж. Троп Мед Хиг . 2006 ноябрь 75 (5): 1023. [Медлайн].
Hung CC, Ji DD, Sun HY, Lee YT, Hsu SY, Chang SY и др. Повышенный риск заражения Entamoeba histolytica и инвазивного амебиаза у ВИЧ-инфицированных мужчин, практикующих секс с мужчинами, на Тайване. PLoS Negl Trop Dis . 2008 27 февраля, 2 (2): e175. [Медлайн]. [Полный текст].
Muzaffar J, Madan K, Sharma MP, Kar P. Рандомизированное, простое слепое, плацебо-контролируемое многоцентровое исследование для сравнения эффективности и безопасности метронидазола и сатранидазола у пациентов с амебным абсцессом печени. Dig Dis Sci . 2006 декабрь 51 (12): 2270-3. [Медлайн].
Hung CC, Wu PY, Chang SY, Ji DD, Sun HY, Liu WC и др. Амебиаз среди лиц, обратившихся за добровольным консультированием и тестированием на инфекцию вируса иммунодефицита человека: исследование случай-контроль. Ам Дж. Троп Мед Хиг . 2011 Январь 84 (1): 65-9. [Медлайн]. [Полный текст].
Acuna-Soto R, Maguire JH, Wirth DF. Гендерное распределение при бессимптомном и инвазивном амебиазе. Ам Дж. Гастроэнтерол .2000 Май. 95 (5): 1277-83. [Медлайн].
Нагата Н., Симбо Т., Акияма Дж., Накашима Р., Нишимура С., Яда Т. Факторы риска кишечного инвазивного амебиаза в Японии, 2003-2009 гг. Emerg Infect Dis . 2012 май. 18 (5): 717-24. [Медлайн].
Аристизабаль Х., Асеведо Дж., Ботеро М. Фульминантный амебный колит. Мир J Surg . 1991 март-апрель. 15 (2): 216-21. [Медлайн].
Андраде Дж. Э., Медерос Р., Риверо Х., Сендзишев М. А., Соаита М., Робинсон М. Дж. И др.Амебиаз проявляется в виде острого аппендицита. Южный Мед J . 2007 ноябрь 100 (11): 1140-2. [Медлайн].
Рао С., Солаймани-Мохаммади С., Петри В.А. младший, Паркер СК. Печеночный амебиаз: напоминание об осложнениях. Curr Opin Pediatr . 2009 21 февраля (1): 145-9. [Медлайн]. [Полный текст].
Госвами А., Дадхич С., Бхаргава Н. Поражение толстой кишки в амебном абсцессе печени: имеет ли значение место расположения ?. Энн Гастроэнтерол . 2014 г.27 (2): 156-161. [Медлайн]. [Полный текст].
Хардин Р.Э., Ферзли Г.С., Зенилман М.Э., Гаданги П.К., Боун В.Б. Инвазивный амебиаз и образование амебомы в виде ректального образования: необычный случай злокачественного маскарада в западном медицинском центре. Мир Дж. Гастроэнтерол . 2007 14 ноября. 13 (42): 5659-61. [Медлайн].
Лоулерг П., Мир О. Эмпиема плевры вторичная после амебного абсцесса печени. Int J Заразить Dis . 2009 Май. 13 (3): e135-6.[Медлайн].
Дхаван В.К., Малик СК. Острая пневмония правой нижней доли. Сундук . 1975 марта 67 (3): 346-7. [Медлайн]. [Полный текст].
Отан Э., Акбулут С., Каяалп С. Амебный острый аппендицит: систематический обзор 174 случаев. Мир J Surg . 2013 Сентябрь 37 (9): 2061-73. [Медлайн].
Содхи К.С., Оджили В., Сакуджа В., Ханделвал Н. Тромбоз печени и нижней полой вены: сосудистое осложнение амебного абсцесса печени. J Emerg Med . 2008 Февраль 34 (2): 155-7. [Медлайн].
Абд-Алла, доктор медицины, Джексон Т.Ф., Гатирам В., Эль-Хавей А.М., Равдин Д.И. Дифференциация патогенных инфекций Entamoeba histolytica от непатогенных инфекций путем обнаружения антигена адгезионного белка, ингибирующего галактозу, в сыворотке крови и кале. Дж. Клин Микробиол . 1993 31 ноября (11): 2845-50. [Медлайн]. [Полный текст].
Хак Р., Моллах Н.Ю., Али И.К., Алам К., Юбэнкс А., Лайерли Д. и др.Диагностика амебного абсцесса печени и кишечной инфекции с помощью тестов TechLab Entamoeba histolytica II и тестов на антитела. Дж. Клин Микробиол . 2000 Сентябрь 38 (9): 3235-9. [Медлайн]. [Полный текст].
Хельми М.М., Рашед Л.А., Абдель-Фаттах Х.С. Обнаружение и дифференциация изолятов Entamoeba histolytica и Entamoeba dispar в клинических образцах с помощью ПЦР. J Egypt Soc Parasitol . 2007 Апрель 37 (1): 257-74. [Медлайн].
Singh A, Houpt E, Петри, Вашингтон.Быстрая диагностика кишечных паразитарных простейших с особым вниманием к Entamoeba histolytica. Междисциплинарная перспектива заражения Dis . 2009. 2009: 547090. [Медлайн]. [Полный текст].
Танюксель М., Петри В.А. мл. Лабораторная диагностика амебиаза. Clin Microbiol Ред. . 2003 16 октября (4): 713-29. [Медлайн]. [Полный текст].
Саидин С., Осман Н., Нордин Р. Последние сведения о лабораторной диагностике амебиаза. евро J Clin Microbiol Infect Dis .2019 января 38 (1): 15-38. [Медлайн].
Shamsuzzaman SM, Haque R, Hasin SK, Hashiguchi Y. Оценка непрямого флуоресцентного теста на антитела и иммуноферментного анализа для диагностики печеночного амебиаза в Бангладеш. Дж Паразитол . 2000 июн. 86 (3): 611-5. [Медлайн].
Ахмад Н., Хан М., Хок М.И., Хак Р., Мондол Д. Обнаружение ДНК Entamoeba histolytica из аспирата абсцесса печени с использованием полимеразной цепной реакции (ПЦР): диагностический инструмент для амебного абсцесса печени. Bangladesh Med Res Counc Bull . 2007 апр. 33 (1): 13-20. [Медлайн].
Фотедар Р., Старк Д., Биби Н., Марриотт Д., Эллис Дж., Харкнесс Дж. ПЦР-определение Entamoeba histolytica, Entamoeba dispar и Entamoeba moshkovskii в образцах стула из Сиднея, Австралия. Дж. Клин Микробиол . 2007 марта 45 (3): 1035-7. [Медлайн]. [Полный текст].
Khairnar K, Parija SC. Новый анализ вложенной мультиплексной полимеразной цепной реакции (ПЦР) для дифференциального обнаружения Entamoeba histolytica, E.moshkovskii и E. dispar ДНК в образцах стула. BMC Microbiol . 2007 24 мая. 7:47. [Медлайн]. [Полный текст].
Старк Д., ван Хал С., Фотедар Р., Мясник А., Марриотт Д., Эллис Дж. И др. Сравнение наборов для обнаружения антигенов стула с ПЦР для диагностики амебиаза. Дж. Клин Микробиол . 2008 май. 46 (5): 1678-81. [Медлайн]. [Полный текст].
Сингх П., Мирда Б.Р., Ахуджа В., Сингх С. Анализ изотермической амплификации, опосредованной петлей (LAMP), для быстрого обнаружения Entamoeba histolytica в амебном абсцессе печени. Мир J Microbiol Biotechnol . 2013 29 января (1): 27-32. [Медлайн].
Мисра С.П., Мисра В., Двиведи М. Илеоцекальные образования у пациентов с амебным абсцессом печени: этиология и лечение. Мир Дж. Гастроэнтерол . 2006 28 марта, 12 (12): 1933-6. [Медлайн].
Нагата Н., Симбо Т., Акияма Дж., Накашима Р., Ниикура Р., Нисимура С. и др. Прогностическая ценность эндоскопических данных в диагностике активного кишечного амебиаза. Эндоскопия . 2012 Апрель 44 (4): 425-8. [Медлайн].
Гонзалес М.Л., Данс Л.Ф., Мартинес Э.Г. Антиамебные препараты для лечения амебного колита. Кокрановская база данных Syst Rev . 2009 15 апреля. CD006085. [Медлайн].
Петри В.А. младший, Сингх У. Диагностика и лечение амебиаза. Clin Infect Dis . 1999 29 ноября (5): 1117-25. [Медлайн].
Salles JM, Salles MJ, Moraes LA, Silva MC. Инвазивный амебиаз: обновленная информация о диагностике и лечении. Expert Rev Anti Infect Ther . 2007 Октябрь 5 (5): 893-901. [Медлайн].
Кимура М., Накамура Т., Нава Ю. Опыт применения метронидазола внутривенно для лечения амебиаза средней и тяжелой степени в Японии. Ам Дж. Троп Мед Хиг . 2007 августа 77 (2): 381-5. [Медлайн].
Moon TD, Оберхельман, РА. Противопаразитарная терапия у детей. Педиатрическая клиника North Am . 2005 июн. 52 (3): 917-48, viii. [Медлайн].
Gonzales MLM, Dans LF, Sio-Aguilar J.Антиамебные препараты для лечения амебного колита. Кокрановская база данных Syst Rev . 2019 9 января. 1: CD006085. [Медлайн].
Bammigatti C, Ramasubramanian NS, Kadhiravan T, Das AK. Чрескожная пункционная аспирация при неосложненном амебном абсцессе печени: рандомизированное исследование. Троп Докт . 2013 Январь 43 (1): 19-22. [Медлайн].
Cordel H, Prendki V, Madec Y, Houze S, Paris L, Bourée P и др. Импортированный из Франции амебный абсцесс печени. PLoS Negl Trop Dis . 2013. 7 (8): e2333. [Медлайн].
МакГрегор А., Браун М., Туэй К., Райт С.Г. Фульминантный амебный колит после применения лоперамида. Дж Трэвел Мед . 2007 янв-фев. 14 (1): 61-2. [Медлайн].
Athié-Gutiérrez C, Rodea-Rosas H, Guízar-Bermúdez C, Alcántara A, Montalvo-Javé EE. Эволюция хирургического лечения перфорации толстой кишки, связанной с амебиазом. Дж Гастроинтест Сург . 2010 14 января (1): 82-7.[Медлайн].
Jha AK, Das G, Maitra S, Sengupta TK, Sen S. Лечение большого амебного абсцесса печени — сравнительное исследование пункционной аспирации и катетерного дренажа. Дж. Индийская медицинская ассоциация . 2012 января 110 (1): 13-5. [Медлайн].
Ширли Д.А., Мунах С. Фульминантный амебный колит после терапии кортикостероидами: систематический обзор. PLoS Negl Trop Dis . 2016 10 июля (7): e0004879. [Медлайн].
Чаудри О.А., Петри В.А. мл.Перспективы вакцинации от амебиаза. Вакцины Expert Rev . 2005 г., 4 (5): 657-68. [Медлайн].
Snow MJ, Stanley SL Jr. Последние достижения в вакцинах от амебиаза. Arch Med Res . 2006 Февраль 37 (2): 280-7. [Медлайн].
Стэнли С.Л. мл. Вакцины от амебиаза: барьеры и возможности. Паразитология . 2006. 133 Приложение: S81-6. [Медлайн].
Quach J, Сен-Пьер Дж., Чади К.Будущее разработки вакцины против Entamoeba histolytica. Hum Vaccin Immunother . 2014 6 февраля. 10 (6): [Medline].
Кикучи Т., Кога М., Симидзу С., Миура Т., Маруяма Х., Кимура М. Эффективность и безопасность паромомицина для лечения амебиаза в Японии. Паразитол Инт . 2013 декабрь 62 (6): 497-501. [Медлайн].
Какова роль непрямого иммунофлуоресцентного анализа на антитела (IFA) в диагностике бабезиоза?
Автор
Rachel E Strength, MD Врач-резидент, Отделение внутренней медицины и педиатрии, Медицинский научный центр Университета Теннесси, Медицинский колледж
Раскрытие: Ничего не разглашать.
Соавтор (ы)
Ширин А. Мазумдер, доктор медицины, FIDSA Адъюнкт-профессор медицины, директор программы стипендий по инфекционным заболеваниям, Отделение инфекционных болезней, Департамент внутренней медицины, Медицинский научный центр Университета Теннесси, Медицинский колледж, Врачи-методисты Университета Теннесси
Ширин А. Мазумдер, доктор медицины, FIDSA является членом следующих медицинских обществ: Американская академия медицины ВИЧ, Американский колледж врачей, Американская медицинская ассоциация, Ассоциация медицины ВИЧ, Американское общество инфекционных болезней, Медицинское общество Мемфиса, Общество эпидемиологии здравоохранения Америки. , Tennessee Medical Association
Раскрытие информации: Ничего не нужно раскрывать.
Главный редактор
Майкл Стюарт Бронз, доктор медицины Дэвид Росс Бойд Профессор и председатель медицинского факультета, кафедра внутренней медицины, кафедра медицины, Научный центр здравоохранения Университета Оклахомы; Магистр Американского колледжа врачей; Научный сотрудник Американского общества инфекционных болезней; Член Королевского колледжа врачей, Лондон
Майкл Стюарт Бронз, доктор медицинских наук, является членом следующих медицинских обществ: Alpha Omega Alpha, Американский колледж врачей, Американская медицинская ассоциация, Ассоциация профессоров медицины, Общество инфекционных болезней Америки, Государственная медицинская ассоциация Оклахомы, Южное общество клинических исследований
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Burke A Cunha, MD Профессор медицины Медицинской школы государственного университета Нью-Йорка в Стоуни-Брук; Заведующий отделением инфекционных заболеваний больницы Уинтропского университета
Берк А. Кунья, доктор медицины, является членом следующих медицинских обществ: Американского колледжа грудных врачей, Американского колледжа врачей, Американского общества инфекционных болезней
Раскрытие информации: раскрывать нечего.
Благодарности
Эдвард Бессман, MD Председатель отделения неотложной медицины, Медицинский центр Джона Хопкинса Бэйвью; Доцент кафедры неотложной медицины, Университет Джона Хопкинса
Эдвард Бессман, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Ицхак Брук, MD, MSc Профессор кафедры педиатрии Медицинской школы Джорджтаунского университета
Ицхак Брук, доктор медицинских наук, магистр наук является членом следующих медицинских обществ: Американской ассоциации развития науки, Американского колледжа врачей-Американского общества внутренней медицины, Американской федерации клинических исследований, Американской медицинской ассоциации, Американского общества микробиологии, Общество инфекционных заболеваний вооруженных сил, Ассоциация военных хирургов США, Американское общество инфекционных заболеваний, Международное принимающее общество с ослабленным иммунитетом, Международное общество инфекционных заболеваний, Медицинское общество округа Колумбия, Нью-Йоркская академия наук, Общество детских инфекционных болезней, Общество по развитию ушей, носа и горла у детей, Общество экспериментальной биологии и медицины, Общество педиатрических исследований, Южная медицинская ассоциация и Общество хирургических инфекций
Раскрытие: Ничего не нужно раскрывать.
Винод К. Дхаван, доктор медицины, FACP, FRCP (C) Профессор, кафедра клинической медицины, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена; Начальник отдела инфекционных болезней Национального реабилитационного центра Ранчо Лос Амигос, Дауни, Калифорния.
Винод К. Дхаван, доктор медицины, FACP, FRCP (C) является членом следующих медицинских обществ: Американского колледжа врачей, Американского общества микробиологии, Американского общества тропической медицины и гигиены, Общества инфекционных болезней Америки и Королевского колледжа Врачи и хирурги Канады
Раскрытие информации: Pfizer Inc Honoraria Выступление и обучение
Аллан Д. Фридман, доктор медицины, магистр здравоохранения Председатель, отделение общей педиатрии, кафедра педиатрии, профессор педиатрии, Университет Содружества Вирджинии, Система здравоохранения VCUH
Аллан Д. Фридман, доктор медицинских наук, магистр здравоохранения является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие: Ничего не нужно раскрывать.
Тарлан Хедаяти, MD Доцент кафедры неотложной медицины, Медицинский колледж Раш, Больница Джона Х. Строгера округа Кук
Тарлан Хедаяти, доктор медицины, является членом следующих медицинских обществ: Американской академии неотложной медицины, Американского колледжа врачей неотложной помощи и Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Рик Кулкарни, MD Лечащий врач, Отделение неотложной медицины, Кембриджский альянс здравоохранения, Отделение неотложной медицины, Гарвардская медицинская школа
Рик Кулкарни, доктор медицины, является членом следующих медицинских обществ: Alpha Omega Alpha, Американская академия неотложной медицины, Американский колледж врачей неотложной помощи, Американская медицинская ассоциация, Американская ассоциация медицинской информатики, Phi Beta Kappa и Общество академической неотложной медицины
Раскрытие информации: WebMD Salary Employment
Кэмерон Нима Нурани, MD Врач-резидент, Отделение неотложной медицины, Больница Джона Х. Строгера округа Кук
Кэмерон Нима Нурани, доктор медицины, является членом следующих медицинских обществ: Ассоциация резидентов скорой медицинской помощи
Раскрытие: Ничего не нужно раскрывать.
Ом Пракаш Шарма, MD, FRCP, FCCP, DTM & H Профессор, кафедра медицины, отделение легочной медицины и реанимации, Медицинская школа Кек Университета Южной Калифорнии
Ом Пракаш Шарма, доктор медицины, FRCP, FCCP, DTM & H является членом следующих медицинских обществ: Американской академии аллергии, астмы и иммунологии, Американского колледжа грудных врачей, Американского колледжа врачей, Американской федерации медицинских исследований, Американского общества Ослера, Американское торакальное общество, Нью-Йоркская медицинская академия и Королевское медицинское общество
Раскрытие: Ничего не нужно раскрывать.
Сат Шарма, доктор медицины, FRCPC Профессор и руководитель отделения легочной медицины, факультет внутренней медицины, Университет Манитобы; Заведующий отделением респираторной медицины, больница общего профиля Святого Бонифация
Сат Шарма, доктор медицины, FRCPC является членом следующих медицинских обществ: Американской академии медицины сна, Американского колледжа грудных врачей, Американского колледжа врачей-Американского общества внутренней медицины, Американского торакального общества, Канадской медицинской ассоциации, Королевского колледжа Врачи и хирурги Канады, Королевское медицинское общество, Общество реаниматологии и Всемирная медицинская ассоциация
Раскрытие: Ничего не нужно раскрывать.
Барри Дж. Шеридан, DO Начальник отдела неотложной медицинской помощи, Армейский медицинский центр Брук
Barry J Sheridan, DO является членом следующих медицинских обществ: American Academy of Emergency Medicine
Раскрытие: Ничего не нужно раскрывать.
Russell W. Steele, MD Руководитель отделения детских инфекционных болезней Детского оздоровительного центра Ochsner; Клинический профессор кафедры педиатрии медицинского факультета Тулейнского университета
Рассел Стил, доктор медицинских наук, является членом следующих медицинских обществ: Американской академии педиатрии, Американской ассоциации иммунологов, Американского педиатрического общества, Американского общества микробиологов, Американского общества инфекционистов, Медицинского общества штата Луизиана, Общества педиатрических инфекционных болезней, Общество педиатрических исследований и Южная медицинская ассоциация
Раскрытие: Ничего не нужно раскрывать.
Франсиско Талавера, фармацевт, доктор философии Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Medscape Reference Salary Employment
Мартин Вайсе, директор программы MD , доцент кафедры педиатрии, Университет Западной Вирджинии
Мартин Вайсе, доктор медицины, является членом следующих медицинских обществ: Амбулаторной педиатрической ассоциации, Американской академии педиатрии и Общества педиатрических инфекционных болезней
Раскрытие: Ничего не нужно раскрывать.
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие: Ничего не нужно раскрывать.
Тест иммунофлуоресценции— обзор
2.3 Тельца Кахаля и ядерные спеклы: биогенез, созревание и хранение snRNP
Иммунофлуоресцентные анализы раскрыли каждый из пяти snRNP, сплайсирующих пре-мРНК, в ядерных фокусах (Carmo-Fonseca et al., 1991), особенно в свернутых кольцами тельцах или тельцах Кахала (Carmo-Fonseca, Pepperkok, Carvalho, & Lamond, 1992), которые помечены маркером coilin (Fig. 5, стрелки). Локализация snRNA в спиральных тельцах зависит от транскрипции (Carmo-Fonseca et al., 1992). Помимо расположения свернутого тела, пятнистый паттерн распределения был приписан snRNAs U1 и U2 (Huang & Spector, 1992). Сходным образом, не-snRNP вспомогательный фактор сплайсинга SC35 был идентифицирован по пятнистой картине окрашивания в субядерных структурах, ранее описанных как межхроматиновые гранулы (Spector, 1993).Пятнистый узор межхроматиновых гранул обычно назвал их пятнами, что видно на фиг. 5 и помечено маркером SC35. Индуцированная разборка этих гранул, как было показано, изменяет координацию между транскрипцией и сплайсингом пре-мРНК (Sacco-Bubulya & Spector, 2002). Предыдущие и дополнительные исследования показали, что сплайсинг пре-мРНК происходит в сайтах транскрипции, определенных как фибриллы перихроматина (Bachellerie, Puvion, & Zalta, 1975), но не в крапинках (Zhang, Taneja, Singer, & Green, 1994).Эти выводы были основаны на быстром мечении тритием (Bachellerie et al., 1975), характеристике фибрилл перихроматина, указывающей на присутствие возникающих РНК (обзор Spector, 1993).
Рис. 5. Ядерные тельца, важные для сплайсинга пре-мРНК, о чем свидетельствует окрашивание на ламин B (ядерная пластинка), коилин (тельца Кахаля, стрелки) и SR-белок SC35 (крапинки). Клетки HEK293 культивировали в минимальной необходимой среде Дульбекко (DMEM) с добавлением 10% фетальной бычьей сыворотки, 1 мМ пирувата натрия, 2 мМ глутамина, пенициллина и стрептомицина, менее 5% диоксида углерода и 37 ° C.Клетки фиксировали в метаноле при -20 ° C в течение 5 минут, проницаемость в 0,3% Triton X-100 в течение 20 минут, затем 20 минут в 0,1 М глицине и блокирование в 5% нормальной сыворотке осла в течение 1 часа. Первичные (мышиные моноклональные антитела против SC35, Abcam, Кембридж, Массачусетс, США; мышиные моноклональные антитела против коилина, Abcam; и козьи поликлональные антитела против ламина B, Santa Cruz Biotechnologies, Санта-Крус, Калифорния, США) и Alexa 488- или инкубации вторичных антител, конъюгированных с Alexa 594, проводились в течение 1 часа каждая. Все промывания были в PBS, а разведения антител были в 5% нормальной ослиной сыворотке и 0.1% Тритон Х-100. После окончательной промывки предметные стекла помещали в среду, содержащую DAPI (Invitrogen, Carlsbad, CA), и герметизировали после помещения на предметное стекло. Изображения получали в конфокальном микроскопе LSM 880 (Carl Zeiss, Германия).
SnRNP изначально собираются в цитоплазме. Каждая мяРНК перемещается в цитоплазму, где она взаимодействует с белком SMN (Fischer, Liu, & Dreyfuss, 1997), который экспрессируется геном SMN1 , гомозиготным у пациентов со спинальной мышечной атрофией (SMA, OMIM # 253300; обзор Wood, Talbot, & Bowerman, 2017).SMN играет центральную роль в биогенезе snRNP. После синтеза в цитоплазме белок SMN собирает комплекс, содержащий гептамерное кольцо белков Sm, расположенное вокруг каждой мяРНК (Friesen & Dreyfuss, 2000), на котором другие белки будут связываться с образованием мяРНП, которое будет транспортироваться в ядро (Renvoise и др., 2006). Похоже, что мяРНП сначала направляются в тельца Кахаля, где мяРНК модифицируются с помощью псевдоуридинилирования и метилирования. Все еще в тельцах Кахаля snRNPs завершают созревание (Nesic, Tanackovic, & Kramer, 2004) и затем направляются в пятнышки (Sleeman & Lamond, 1999) под контролем фосфорилирования (Misteli & Spector, 1996).Тельца Кахаля дополнительно показаны как место сборки и рециклинга частиц tri-snRNP (Stanek et al., 2008). Следовательно, тельца Кахаля представляют собой центр созревания и распределения snRNPs в ядре клетки, тогда как спеклы эквивалентны хранению snRNP для дальнейшего распределения в фибриллах перихроматина при инициации транскрипции. Хотя SMN экспрессируется повсеместно и необходим для сборки snRNP, пока не ясно, почему его потеря специфически влияет на двигательные нейроны (обзор Wood et al., 2017). Хотя он может играть разные функциональные роли, особенно в аксонах нейронов, интересно отметить, что его потеря функции значительно увеличивает удержание интронов в зрелой мРНК (Jangi et al., 2017), что согласуется с его значимостью в биогенезе мяРНП.
Метод непрямых флуоресцентных антител — обзор
Инфекция матери
Серология является основным методом диагностики. Наиболее часто используемые тесты включают ELISA, непрямой тест флуоресцентных антител и иммуноферментный анализ агглютинации. 8 Во время иммунного ответа инфицированного человека IgM появляется раньше и снижается быстрее, чем IgG. Однако уровни IgM могут сохраняться в течение многих лет у облученного человека, что затрудняет диагностику. Несмотря на то, что чувствительность и специфичность вышеупомянутых тестов колеблются между 93,3% и 100% и 77,5% и 100%, соответственно, 9 неприемлемых ложноположительных результатов теста все же имеют место. Этот ошибочный результат теста может привести к прерыванию нормальной беременности у некоторых пациенток с предполагаемым токсоплазмозом на ранних сроках беременности.Таким образом, рекомендуется проводить дальнейшую оценку положительной серологии IgM в предпочтительной референс-лаборатории, Toxoplasma Serology Laboratory, Palo Alto Medical Foundation (PAMF-TSL; http://www.pamf.org/serology; 415-326-8120). 10 В этой лаборатории можно провести серологический профиль Toxoplasma , который включает «золотой стандарт» тест с красителем Сабина – Фельдмана, ИФА IgM, ИФА IgA, ИФА IgE и тест дифференциальной агглютинации, чтобы лучше выявить острую по сравнению с предыдущей инфекцией Toxoplasma .
Врожденная инфекция плода
Предпочтительным тестом для диагностики врожденного токсоплазмоза является высокочувствительный (> 98%) и специфический (> 98%) ПЦР-анализ околоплодных вод. 11 Это необходимо сделать примерно через 4 недели после постановки диагноза острой материнской инфекции, чтобы предотвратить возможность получения ложноотрицательных результатов. 12 Однако следует избегать тестирования на сроке менее 18 недель беременности из-за более низкой чувствительности и большего риска повреждения плода. 13 Ежемесячное УЗИ плода также рекомендуется беременным женщинам с подозрением или диагностированным острым токсоплазмозом. 4
Врожденная неонатальная инфекция
При подозрении на инфекцию у новорожденного необходимо взять образцы периферической крови матери и новорожденного на предмет наличия антител IgM и IgA. 5 Следует исключить и другие врожденные вирусные инфекции, особенно герпес, ЦМВ и краснуху.Необходимо провести исследования спинномозговой жидкости новорожденных (включая ПЦР на ДНК T. gondii ), визуализацию головы и непрямое глазное обследование на хориоретинит.
30290 — Babesia duncani WA1 IgG IFA | Клиническая
Клиническая службаТест Babesia duncani WA1 IgG используется для выявления антител, вызванных инфекцией клещевых простейших Babesia duncani в случаях неопределенности диагностики или подозрения на хроническую инфекцию.Анализ проводится методом непрямых флуоресцентных антител (IFA). Значения титра выше контрольных интервалов считаются свидетельством текущей инфекции или перенесенной инфекции (например, в течение последнего года).
О Babesia
Бабезиоз вызывается простейшими паразитами, которые поражают эритроциты и передаются в основном через укусы инфицированных клещей. Babesia microti ( B. microti ) — основной вид, вызывающий заболевания у людей, а B.duncani WA1 — важная вторичная причина бабезиоза в США. Бабезиоз — это заболевание, похожее на малярию, при котором эритроциты заражаются и повреждаются паразитом. Многие люди не проявляют никаких признаков болезни. У некоторых развиваются неспецифические симптомы гриппа. Бабезиоз может быть опасным для жизни, особенно для пожилых или молодых людей, у которых нет селезенки, ослаблена иммунная система или есть другие серьезные заболевания (например, заболевание печени или почек). В последнее время вызывает беспокойство учащение случаев бабезиоза, связанного с переливанием крови. Бабезия — наиболее распространенный паразит, связанный с переливанием крови, однако скрининговый анализ доноров крови отсутствует. Когда клинические признаки бабезиоза совпадают либо с возможным контактом с клещами, либо с переливанием крови от донора, проживающего в эндемичном регионе, серологическое тестирование с помощью IFA обычно используется для подтверждения диагноза бабезиоза.
Первый изолят B. duncani был обнаружен в штате Вашингтон, отсюда и название «WA1». До недавнего времени не было известно, что B.duncani заражает людей из многих регионов США и мира, хотя самые высокие показатели серологической распространенности по-прежнему наблюдаются на северо-западе Тихого океана. Инфекция, вызванная B. duncani , не может быть диагностирована ни по мазку крови пациента, ни по культуре крови, а также не может быть обнаружена с помощью Babesia microti IgG IFA. Сыворотки пациентов, инфицированных клещевыми патогенами B. microti , Rickettsia rickettsii и Borrelia burgdorferi , были протестированы и оказались отрицательными с помощью анализа Babesia duncani WA1 IgG IFA.
ПроцедураЧеловеческое антитело IgG к Babesia duncani ( B. duncani ) WA1-антигены обнаруживают с помощью анализа непрямых флуоресцентных антител (IFA). Вкратце, предметное стекло, покрытое фиксированными инфицированными B. duncani эритроцитами, инкубируют с разбавленным образцом сыворотки человека. Если присутствуют специфические антитела B. duncani , они остаются связанными, затем метятся конъюгатом антител, меченных флуоресцеином, а затем обнаруживаются с помощью флуоресцентной микроскопии.Этот тест был разработан, и его рабочие характеристики были определены Viracor Eurofins. Этот тест не был одобрен или одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Результаты следует использовать вместе с клиническими данными, и они не должны служить единственным основанием для постановки диагноза или решения о лечении.
Специфичностьсывороток пациентов, инфицированных клещевыми патогенами — Babesia microti, Rickettsia rickettsii и Borrelia burgdorferi — были протестированы и оказались отрицательными с помощью B.анализ duncani WA1 IgG IFA.
Вирус лейкемии кошек | Колледж ветеринарной медицины Корнельского университета
Вирус лейкемии кошек (FeLV) — одно из наиболее распространенных инфекционных заболеваний кошек, которым страдают от 2 до 3% всех кошек в Соединенных Штатах. Уровень инфицирования значительно выше (до 30%) у кошек, которые больны или иным образом относятся к группе высокого риска (см. Ниже). К счастью, распространенность FeLV у кошек значительно снизилась за последние 25 лет с момента разработки эффективной вакцины и точных процедур тестирования.
Кошки, постоянно инфицированные FeLV, служат источником инфекции для других кошек. Вирус выделяется со слюной, выделениями из носа, мочой, фекалиями и молоком инфицированных кошек. Передача вируса от кошки к кошке может происходить через укушенную рану, при взаимном уходе и (редко) при совместном использовании туалетных принадлежностей и кормушек. Передача также может происходить от инфицированной матери-кошки ее котятам либо до их рождения, либо во время кормления грудью. FeLV не выживает долго вне тела кошки — вероятно, менее нескольких часов в нормальных домашних условиях.
Кошки, подверженные наибольшему риску заражения FeLV, — это те, которые могут контактировать с инфицированными кошками либо в результате длительного тесного контакта, либо через укушенные раны. К таким кошкам относятся кошки, живущие с инфицированными кошками или кошками с неизвестным инфекционным статусом, кошки, оставленные на открытом воздухе без присмотра, где они могут быть укушены инфицированной кошкой, и котята, рожденные от инфицированных матерей.
Котята гораздо более восприимчивы к инфекции FeLV, чем взрослые кошки, и поэтому подвергаются наибольшему риску заражения при контакте с ними.Однако даже здоровые взрослые кошки могут заразиться при достаточном воздействии.
Клинические признаки
FeLV во многих отношениях отрицательно влияет на организм кошки. Это наиболее частая причина рака у кошек, может вызывать различные заболевания крови и может привести к состоянию иммунодефицита, который препятствует способности кошки защищаться от других инфекций. Из-за этого обычные бактерии, вирусы, простейшие и грибки, которые обычно не поражают здоровых кошек, могут вызывать тяжелые заболевания у кошек, инфицированных FeLV.Эти вторичные инфекции являются причиной многих заболеваний, связанных с FeLV.
На ранних стадиях заражения кошки обычно не проявляют никаких признаков болезни. Однако со временем (недели, месяцы или даже годы) здоровье инфицированной кошки может прогрессивно ухудшаться, или он / она могут испытывать повторяющиеся циклы болезни и относительного здоровья. Знаки могут включать:
Диагностика
Для диагностики FeLV обычно используются два типа анализов крови, оба из которых обнаруживают белковый компонент вируса, называемый FeLV P27.Один из этих тестов, называемый иммуноферментным анализом (ELISA), обычно сначала выполняется как инструмент скрининга, и его можно запустить в кабинете ветеринара. Тесты типа ELISA обнаруживают наличие свободных частиц FeLV, которые обычно обнаруживаются в кровотоке как на ранних, так и на поздних стадиях инфекции.
Непрямой иммунофлуоресцентный анализ на антитела (IFA) обычно отправляется в диагностическую лабораторию после положительного теста ELISA, чтобы подтвердить инфекцию FeLV и определить, достигла ли кошка более поздних стадий инфекции.Тесты IFA обнаруживают присутствие вирусных частиц в лейкоцитах, что обычно является признаком более поздней инфекции. Большинство кошек, у которых есть положительный результат теста на ИФА, остаются инфицированными на всю жизнь. В некоторых случаях может быть рекомендовано выделение всего вируса или обнаружение ДНК вируса с помощью теста, называемого полимеразной цепной реакцией (ПЦР), чтобы определить, инфицировал ли FeLV костный мозг. Всегда консультируйтесь с ветеринаром, чтобы определить, какие тесты подходят вашей кошке.
Лечение и профилактика
Хотя есть некоторые методы лечения, которые, как было показано, снижают количество FeLV в кровотоке пораженных кошек, эти методы лечения могут иметь серьезные побочные эффекты и могут быть эффективными не во всех случаях.К сожалению, в настоящее время нет окончательного лекарства от FeLV. Ветеринары, лечащие и поддерживающие FeLV-положительных кошек с признаками заболевания, обычно лечат конкретные проблемы (например, назначают антибиотики от бактериальных инфекций или проводят переливание крови при тяжелой анемии).
Единственный надежный способ защитить кошек от FeLV — это предотвратить их контакт с кошками, инфицированными FeLV. Рекомендуется держать кошек в помещении, вдали от потенциально инфицированных кошек. Если разрешен доступ на улицу, обеспечьте наблюдение или поместите кошек в безопасное вольер, чтобы предотвратить блуждание и драки.Все кошки должны быть проверены на вирус FeLV, прежде чем попадать в дом, а здоровые кошки должны содержаться отдельно от инфицированных кошек. Миски с едой и водой и туалетные лотки не должны использоваться совместно инфицированными FeLV и неинфицированными кошками. К сожалению, у многих кошек, инфицированных FeLV, диагноз ставится только после того, как они переживут других кошек. В таких случаях все остальные кошки в доме должны быть проверены на вирус FeLV. В идеале инфицированных и неинфицированных кошек следует разделить, чтобы исключить возможность передачи FeLV.
Доступна относительно эффективная вакцина против FeLV, хотя она не защитит 100% вакцинированных кошек и не считается базовой вакциной. Владельцы, планирующие вакцинацию неинфицированных кошек против FeLV, должны учитывать риск заражения кошек FeLV-инфицированными кошками и обсудить преимущества и недостатки вакцинации с ветеринаром. Поскольку не все вакцинированные кошки будут защищены вакцинацией, предотвращение заражения остается важным даже для вакцинированных домашних животных.Вакцины против FeLV не приводят к ложноположительным результатам ELISA, IFA или любых других доступных тестов на FeLV.
Прогноз
Хотя диагноз FeLV может быть эмоционально разрушительным, важно понимать, что кошки с FeLV могут жить нормальной жизнью в течение продолжительных периодов времени. Среднее время выживания кошек после диагностики FeLV составляет 2,5 года. После того, как кошке был поставлен диагноз FeLV, тщательный мониторинг веса, аппетита, уровня активности, привычек устранения, внешнего вида рта и глаз и поведения является важной частью борьбы с этим заболеванием.Любые признаки аномалии в любой из этих областей должны требовать немедленной консультации с ветеринаром.
Обновлено в мае 2016 г.
Является ли ПЦР в реальном времени предпочтительнее прямой иммунофлуоресценции при диагностике пневмонии, вызванной Pneumocystis jirovecii, у ВИЧ-инфицированных пациентов? | Примечания к исследованию BMC
Методы
В это ретроспективное исследование было включено 66 образцов бронхоальвеолярного лаважа от 62 пациентов с ВИЧ, полученных в период с 1998 по 2009 годы.Из-за отсутствия достаточного количества материала пришлось исключить 3 образца БАЛ от 3 пациентов. В наше исследование были включены 63 БАЛ от оставшихся 59 пациентов.
БАЛ проводился в больнице Бернского университета в соответствии со стандартизованным протоколом: 150 мл стерильного физиологического раствора закапывали в бронхиальные стволы и выделяли в трех фракциях. Для диагностики Pneumocystis образцы 10 мл нативной жидкости БАЛ центрифугировали и использовали для диагностики ИФА.Оставшийся материал замораживали при -80 ° C.
MONOFLUO ™ P. jirovecii Тестовый набор IFA был использован в качестве золотого стандарта для рутинной диагностики P. jirovecii. Набор для тестирования состоит из коммерчески доступных мышиных моноклональных антител, меченных флуоресцеинизотиоцинатом, который взаимодействует со всеми формами стадий Pneumocystis . Держатели образцов сканировались двумя независимыми исследователями с увеличением 400 × в световом микроскопе (Zeiss Axiophot).
Полуколичественная микроскопия была выполнена для каждого образца (количество асков или трофических форм в поле зрения: — = отсутствует, + = <1 (мало), ++ = 1–10 (много), +++ => 10 (в изобилии). Чувствительность этого IFA близка к 100%, а специфичность составляет около 95,8% по данным производителя [7].
Для процедур ПЦР нуклеиновые кислоты экстрагировали из 25 мкл осадка BAL с использованием автоматизированного NucliSense ® easy MAG ™ platform (bioMérieux, Швейцария). Использовалась ПЦР в реальном времени, нацеленная на ген главного поверхностного гликопротеина (MSG), на основе работы Linssen, 2006 [8].Реакция ПЦР в реальном времени содержала 5 мкл очищенной ДНК, 0,6 мкл каждого праймера PCPFor и PCPRev, 0,15 мкМ PCPProbe, 1xTaqMan Universal Master Mix (ABI), 1x Exo IPC Mix (ABI) и 1x Exo IPC DNA (ABI). Каждый образец ДНК анализировали в дупликации в соответствии с протоколом амплификации, выполненным на системе определения последовательности ABI PRISM 7000 (ABI).
Каждый цикл состоит из 2 минут при 50 ° C (переваривание продуктов предыдущей амплификации), 10 минут при 95 ° C (инактивация ферментов и активация полимеразы), затем 42 цикла по 15 секунд при 95 ° C и 60 секунд при 60 ° C.В качестве положительных контролей использовали различные концентрации плазмиды, содержащие вставку основного гена поверхностного гликопротеина (MSG) P. jirovecii и линеаризовали 2×10 5 , 2×10 4 , 2×10 3 , 10 3 , 2×10 2 , и 10 2 копий на реакцию для построения стандартной кривой. В каждый прогон были включены три отрицательных контроля. (1) вода, (2) блок 10x Exo IPC (Applied Biosystems (ABI) Foster City, CA, USA; NAC = без контроля амплификации) и отрицательный контроль экстракции.Для обнаружения ингибиторов в образцах в каждую реакцию ПЦР в реальном времени включали ДНК EXO IPC (ABI). Количественное определение ДНК Pneumocystis было проиллюстрировано пороговым значением цикла (Ct) и числом копий / мл. Поскольку ген MSG состоит из 50–100 копий, все наши результаты ПЦР основаны на среднем количестве с 50 копиями на геном. Образец считался положительным, если дубликаты были положительными. Повторный тест образца проводился, если только один результат был положительным.Если этот повторный тест снова был положительным, образец считался положительным на P. jirovecii . Отрицательный образец интерпретировался как подтвержденный отрицательный, когда результаты EXO IPC DNA (ABI) исключали ингибитор в образце.
Для определения предела обнаружения IFA с помощью ПЦР мы отобрали сильно IFA-положительного пациента с более чем десятью асковыми / трофическими формами на поле зрения (+++) при полуколичественной микроскопии и выполнили серию десятикратных разведений (log10 ). Предел обнаружения составил 190 копий / мл или 35 циклов.Чтобы сравнить диагностические характеристики двух тестов (IFA и ПЦР в реальном времени), был проведен анализ кривой рабочих характеристик приемника (ROC).
Данные выполненного ретроспективного анализа медицинских карт пациента были проанализированы с помощью Stata ™ 10 для Windows, StataCorp., США: двумерный анализ (критерий хи-квадрат Пирсона или тренд-хи-квадрат), отношения шансов, 95% доверительные интервалы и Был проведен многомерный анализ.
Анамнез всех 62 пациентов был проанализирован ретроспективно с акцентом на возраст, пол, клинические симптомы (лихорадка, кашель, одышка), визуализационные исследования, фон ВИЧ (количество CD4, вирусная нагрузка, КАРТ), лабораторный анализ (ЛДГ), PCP. -Профилактика перед БАЛ, PCP-терапия после БАЛ и исход.Ретроспективный анализ данных был одобрен кантональной комиссией по этике Берна.
Результаты
Все 30 IFA-положительных образцов БАЛ также дали положительный результат с помощью ПЦР. Патогенетическая нагрузка колебалась от 698 копий / мл до 2440000 копий / мл. Среди 36 IFA-отрицательных зондов BAL 35 были отрицательными по результатам ПЦР. Грибковая нагрузка (количество асков или трофических форм на поле зрения) хорошо коррелировала с результатами ПЦР. Только один IFA-отрицательный образец BAL дал положительный результат ПЦР. Он содержал самую низкую нагрузку Pneumocystis (297 копий / мл) из всех положительных тестов БАЛ (рис.1).
Рис. 1Сравнение IFA (количество асков или трофических форм на поле зрения) и ПЦР (копий / мл) всех протестированных образцов БАЛ. Один образец с несовпадающим результатом с отрицательным IFA и положительным ПЦР с низким числом копий (297 копий / мл) показал в красном кружке
. Рассматривая результаты ПЦР как двоичный результат (положительный / отрицательный), чувствительность составила 100%, специфичность 97,2%. Площадь под кривой ROC составила 0,99.
Данные проанализированного анамнеза представлены в таблице 1.Не было обнаружено значительных различий по возрасту и полу в группах IFA-отрицательных и положительных, и клинические симптомы были сходными.
Таблица 1 Подробные характеристики 62 ВИЧ-положительных пациентовПациенты с положительным ИФА имели схожую вирусную нагрузку при последнем измерении перед БАЛ, но меньшее количество CD4 и реже получали комбинированную антиретровирусную терапию (АРТ). У пациентов с положительным ИФА уровень ЛДГ был выше. Они с меньшей вероятностью проходили профилактику анти-PCP и с большей вероятностью начали лечение PCP, как показано в таблице 1.
Единственный пациент с несовпадающим результатом (ИФА- / ПЦР +) был обследован более подробно. История болезни этого пациента показала, что у пациента было хроническое обструктивное заболевание легких (ХОБЛ), и он проходил антиретровирусную терапию с текущим уровнем CD4 150 клеток / мкл и РНК ВИЧ в плазме 22 копий / мл. У него были типичные клинические признаки PCP с лихорадкой и одышкой в течение нескольких дней и аномальным насыщением O2. Компьютерная томография показала заметные помутнения матового стекла во всех полях легких. В БАЛ не было обнаружено других причин пневмонита, и он отреагировал на 3-недельный курс триметоприма / сульфаметоксазола.На основании этого пациент был признан больным ПЦП.
Был проведен дополнительный анализ затрат, времени и личных расходов. Стоимость одного иммунофлуоресцентного теста составляет 23,80 швейцарских франков, а стоимость одной ПЦР в реальном времени — 63 швейцарских франка (соотношение ПЦР / IFA = 2,6). Результаты теста IFA доступны в течение 2 часов, ПЦР, включая выделение ДНК, занимает 4,5 часа (соотношение ПЦР / IFA = 2,25). Хотя ИФА можно легко выполнить в небольших лабораториях с помощью флуоресцентного микроскопа, интерпретация теста ИФА может быть затруднена из-за артефактов, которые можно легко спутать с трофическими формами или асками.Следовательно, для получения правильных результатов необходим квалифицированный персонал. Для ПЦР-тестов, включая экстракцию ДНК, необходимы большие лаборатории с точным оборудованием (машина для экстракции ДНК, термоциклер и т. Д.), Но обычно они проводятся в дневное время только в рабочие дни, что ограничивает реальную доступность. Интерпретация результатов теста может быть произведена без специальной подготовки.
Обсуждение
Предыдущие публикации сообщают о несоответствии между отрицательной иммунофлуоресценцией и положительными результатами ПЦР у пациентов с ослабленным иммунитетом, не инфицированных ВИЧ, с лучшей чувствительностью и специфичностью в анализе ПЦР по сравнению с обычными микроскопическими исследованиями [9, 10].
Мы не смогли найти такого расхождения у ВИЧ-инфицированных пациентов в настоящем исследовании. Мы обнаружили очень хорошую корреляцию в 97,2% из всех 66 протестированных образцов БАЛ у 62 пациентов с ВИЧ. Только один образец дал противоречивый результат: IFA был отрицательным, а ПЦР выявила положительный сигнал, соответствующий самой низкой нагрузке Pneumocystis (298 копий / мл) из всех протестированных БАЛ. Клинические и радиологические данные пациентов и реакция на лечение ПП были хорошо совместимы с ПП, и на основании этого мы не считали этот противоречивый результат ложноположительным.Известно, что у этого пациента также была ХОБЛ как еще одно заболевание легких. Можно предположить, что у этого пациента на вирусологически успешной КАРТ, но CD4 ниже 200 клеток / мкл, более низкая грибковая нагрузка была связана с PCP, частично также объясняется ХОБЛ, которая была связана с более высоким риском колонизации Pneumocystis и более высоким риском PCP. у больных СПИДом [11, 12]. Это могло объяснить наш противоречивый результат.
Поскольку мы не обнаружили ложноположительных результатов ПЦР, было невозможно установить пороговое значение для нашего количественного анализа ПЦР.Другими словами, и в случае несоответствия с пациентами, не имеющими иммунитета против ВИЧ, положительный результат ПЦР в совместимой клинике всегда должен рассматриваться как диагностический для PCP и приводить к соответствующей терапии.
Однако необходимо учитывать, что колонизация Pneumocystis может происходить и у ВИЧ-инфицированных пациентов, как показали многочисленные исследования [13, 14].
Обзор медицинских карт выявил более низкое количество CD4 +, более низкий уровень АРТ и профилактики PCP и более высокие уровни ЛДГ в группе IFA-положительных по сравнению с IFA-отрицательными образцами.Таким образом, эти пациенты имеют более убедительные доказательства наличия инфекции, вызываемой Pneumocystis jirovecii.
Это исследование показывает, что как ИФА, так и ПЦР обладают высокой чувствительностью для обнаружения Pneumocystis у больных СПИДом с PCP. Некоторые исследования обнаружили более низкую чувствительность IFA у ВИЧ-отрицательных лиц с PCP. Эти данные можно объяснить более высокой грибковой нагрузкой у ВИЧ-инфицированных пациентов с PCP по сравнению с пациентами с PCP с другими иммунодефицитами [15, 16].Из-за сопоставимой диагностической точности ПЦР и ИФА в нашем исследовании мы также изучили их рентабельность и смогли показать, что в наших условиях ПЦР в реальном времени в три раза дороже, а производительность занимает в два раза больше времени, чем анализ ИФА. . Преимущество IFA заключается в удобстве этого метода, который может быть легко выполнен в небольших лабораториях, если доступен флуоресцентный микроскоп с подходящим фильтром. Оборудование, необходимое для проведения ПЦР, дорогое (машина для экстракции ДНК, термоциклер и т. Д.).) и логистические проблемы обычно ограничивали его использование в дневное время в рабочие дни. С другой стороны, выполнение ИФА требует специальной подготовки, а ПЦР — нет.
Выводы
Таким образом, наши результаты показывают, что ПЦР и ИФА являются точными диагностическими инструментами у ВИЧ-инфицированных пациентов.


 д.) — определение антител к конкретному возбудителю, иммунный ответ.
д.) — определение антител к конкретному возбудителю, иммунный ответ. 