Дыхательный тест для выявления Хеликобактер пилори.
На сегодняшний день существует несколько методик, чтобы выявить хеликобактер пилори: анализ на антитела к хеликобактер пилори, анализ кала способом пцр, уреазный дхательный тест, биопсия, цитология. Самыми эффективными являются ифа (иммуноферментный анализ) на хеликобактер и анализ кала (пцр).
Диагностика хеликобактер пилори проводится двумя методами:
- инвазивный (эндоскопия с биопсией)
- неинвазивный (лабораторные методы).
Надежным методом определения хеликобактер является инвазивный. Анализ на бактерию проводят всем, кто жалуется на боли и дискомфорт в желудке.
Выявление pylori igg антител является обычным делом для исследования эпидемиологии инфекции.
Ифа
Иммуноферментный анализ на антитела IgG позволяет узнать концентрацию антител в крови относительно хеликобактер в организме человека. Количество антител определяется с помощью различных химических реакций. IgG – показатель, который подтверждает присутствие в организме бактерии. Высокий уровень igg к helicobacter pylori может сохраняться до и после устранения микроорганизма.
Высокий уровень igg к helicobacter pylori может сохраняться до и после устранения микроорганизма.
Дыхательный тест – определение и его виды
Дыхательный тест на выявление хеликобактер пилори – это диагностика инфекции, которая позволяет выявить активность хеликобатер пилори, оценить уровень заражения. Гастроэнтерологи, терапевты, педиатры часто применяют его в своей практике. Дыхательный тест на хеликобактер пилори применяется для первичной диагностики бактерии. Еще используют для контроля лечебного процесса заболевания и проверки действенности терапевтического лечения.
Метод является абсолютно безопасным, самым эффективным и востребованным в медицине на сегодняшний день. Анализ показывает продукты жизнедеятельности бактерии в воздухе, который вдыхает пациент.
Есть два основных вида метода. Они отличаются по реагирующему компоненту:
- углеродный
- аммонийный.
Более точный результат дает углеродный дыхательный анализ.
Преимущества и недостатки метода
Этот респираторный метод имеет свои преимущества:
- Результат готов за короткий промежуток времени (20-25 минут).

- Достоверность результата 90-95%.
- Тест не наносит вреда организму человека.
Так как у метода одни достоинства он не имеет противопоказаний. Но результат будет точным только в том случае, если к тесту правильно подготовиться.
Подготовка к дыхательному тесту
Чтобы тест дал самые точные результаты, рекомендуется специальная подготовка к дыхательному тесту:
- за месяц до прохождения теста нельзя принимать антибиотики;
- за три дня до обследования не употреблять бобовые и спиртные напитки;
- за 6 часов до сдачи анализа ничего не есть;
- за 14 дней до обследования исключить прием препаратов, которые подавляют течение; физиологических и ферментативных процессов в организме;
- за несколько часов нельзя жевать жвачку, курить;
- последний прием пищи не позднее 22 часов, это должен быть легкий ужин;
- за час до обследования можно выпить не более 10 мл воды;
- чтобы результат анализа был точным, пациент не должен двигаться;
- перед обследованием хорошо почистить зубы и ротовую полость.

Очень важно подготовиться к тесту правильно, иначе точного результата не будет. Если пациент не смог выполнить все правила, он должен сообщить об этом врачу и ему будет назначено другое время.
Как проводится тест
Процедуру проводят в условиях стационара под наблюдением специалиста. Если обследование проводят с помощью трубки, манипуляция длится не более 15 минут. Если используется электронный прибор, время процедуры составляет 10 минут.
Проводится процедура просто:
- пациент принимает удобное положение
- в рот кладется пластиковая трубка, а дыхание должно быть в обычном режиме
- желательно не касаться трубки языком и небом, чтобы туда не попала слюна
- если скапливается слюна, ее разрешается сплюнуть или сглотнуть, вытащив трубку, берется проба воздуха
- первый этап манипуляции продолжается 6 минут
- пациенту дают выпить раствор карбамида
- трубку помещают опять в рот
- второй этап также длится 6 минут, проводится исследование воздуха
- после этого выдается результат.

Расшифровка результатов анализа и показатели нормы
Нормой является, когда разница между показателями первого и второго этапа обследования равна нулю. Если в организме имеется хеликобактер, показатель будет выше нуля.
При показателе:
- следовое значение — 1, 5 -3,5, микроорганизма находится в неактивной фазе и от него можно быстро избавиться;
- 3,5 — 5.5 – низкий уровень;
- малый — до 7 промилле;
- от 7 до 15, бактерия в активной фазе, размножается, процесс лечения затрудняется;
- выше 15 – высокий уровень обсеменения.
При любом положительном результате, терапию нужно начинать сразу, это позволит избежать осложнений и болевых ощущений. Но схема лечения хеликобактер должна быть составлена врачом.
Противопоказания к проведению
Метод не имеет противопоказаний, так как не включает в себя никаких вмешательств и нагрузок. Его можно применять для всех, без ограничений.
Анализы крови
При жалобах пациента на боли в желудке, любой дискомфорт, при функциональных расстройствах пищеварения, при гастритах и язвенной болезни сдается анализ крови на хеликобактер пилори. Антитела к helicobacter pylori в крови являются показателем заражения человека бактерией хеликобактериоза.
Антитела к helicobacter pylori в крови являются показателем заражения человека бактерией хеликобактериоза.
Сдавать кровь на бактерию хеликобактер рекомендуется при:
- слабом иммунитете
- наследственная предрасположенность к онкологическим заболеваниям желудка
- в качестве профилактической диагностики
- с целью оценки полученного лечения от инфекции.
Как подготовиться к анализу?
Перед анализом необходимо за 8 часов до проведения теста не принимать пищу, кофе, чай, спиртные напитки, не курить. Этот анализ на хеликобактер пилори определяет количество иммуноглобулинов. Когда в организм человека попадает определенный токсин, вирус, микроб, иммуноглобулины взаимодействуют с ними и нейтрализуют эти вредные вещества. Анализ показывает взаимодействие возбудителя болезни и иммуноглобулинов, что дает возможность установить, есть ли хеликобактер пилори в желудке или двенадцатиперстной кишке.
Преимущества и недостатки
Преимущества данного теста:
- диагностическая процедура не дорогая;
- высокая точность результата;
- анализ доступен для всех.

Тест на хеликобактери пилори имеет свои недостатки:
- имеются факторы, которые влияют на результат анализа;
- некоторые пациенты испытывают страх при заборе крови;
- тщательный результат получают через 4-6 дней.
Расшифровка анализа
Расшифровка результата анализа крови на хеликобактер пилори можно сделать и без медицинских навыков. Антитела разделяют на категории A, G, M. Напротив каждой категории на бланке имеется результат. Если все показатели анализов крови на хеликобактер пилори не превышают норму, значит бактерии в организме нет:
- иммуноглабулин LgG отсутствует или значительно ниже нормы: бактерии отсутствуют в организме;
- LgG обнаружен: хеликобактриоз есть или был перенесен раньше;
- иммуноглабулин LgM не обнаружен или ниже нормы: условная норма хеликобактер пилори;
- LgM класса обнаружен: начальная стадия заболевания;
- иммуноглабулин LgA не обнаружен в крови: это может свидетельствовать о ранней стадии болезни, недавно проведенной терапии антибиотиками или больной на этапе выздоровления.

Противопоказания
Анализ крови на хеликобактер не проводят:
- при судорогах
- при повышенной возбудимости больного
- если в месте инъекции имеется поражение кожи.
Анализ крови на антитела при флебите вен также не назначают.
Анализ кала
ПЦР – что это такое? Это чувствительный способ определения инфекции. Он распознает ДНК или РНК возбудителя. Для ПЦР материалом для исследования является кал.
Анализ кала на антиген хеликобактер является самым удобным исследованием для пожилых людей, детей и тяжелобольных. В этом случае не требуется присутствия пациента в лаборатории и процедура не связана с травмированием организма. Кстати, о хеликобактер пилори у детей мы расскажем отдельно.
Но обнаружить бактерию в кале не просто. В кишечнике микроорганизм повергается воздействию неблагоприятных условий для него (желчные кислоты, недостаток кислорода). Поэтому активные организмы приспосабливаются к новым условиям, меняют свою форму и их число резко снижается.
Применяется специальный метод полимеразной цепной реакции (пцр), который позволяет определить фрагмент ДНК микроорганизма. Точность результата – 95-96%.
Что нельзя перед сдачей кала
Важно знать, как правильно сдать анализ на хеликобактер. Перед сдачей кала, за 3-4 дня не рекомендуется принимать много пищевых волокон, красящих продуктов, неорганических солей, лекарств, которые усиливают перистальтику кишечника.
Не годится для исследования на хеликобактер кал после клизмы или слабительного.
Анализ кала на хеликобактер пилори проводят до начала лечения. Если до этого пациент принимал антибактериальную терапию по поводу лечения какого-либо заболевания, лучше назначить другой метод обследования.
Расшифровка анализа
Результат анализа на helicobacter pylori бывает положительный и отрицательный. Положительный результат свидетельствует о наличии или перенесенной инфекции. Отрицательные данные — об отсутствии болезни или неправильном проведении исследования.
Цитологический анализ
Цитология есть один из самых точных методов обнаружения хеликобактер пилори в слизистый желудок. При этом методе анализ на хеликобактер пилори практически не дает ложных положительных результатов.
Для исследования берется при фиброгастродуаденоскопии (фгдс) биопсийный материал, мазок – отпечаток слизистой. Результат бывает положительный или отрицательный. По степени обсеменения:
- слабая – при увеличении в 360 раз в поле зрения обнаруживается до 20 бактерий;
- умеренная – 20-40;
- высокая – более 40 бактерий.
Гастроскопия
При помощи фгс (желудочного зонда) при фгдс зрительно проникают в ЖКТ, выбирают самые подозрительные участки для забора слизи из желудка. Затем ее помещают на специальную среду, где определяют уреазную активность микроорганизма. Если индикатор из желтого цвета окрасится в малиновый, это означает, что в материале есть бактерии.
Полезные статьи на сайте лаборатории Литех
ДИАГНОСТИКА Helicobacter pylori-ИНФЕКЦИИ
С момента открытия Н. pylori прошло чуть более 20-ти лет. За этот период времени было разработано большое количество методов диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Развитие и усовершенствование этих методов помогло в получении ценной информации об эпидемиологии хеликобактериоза, сыграло большую роль в понимании патогенеза этой инфекции. Это, в свою очередь, позволило разработать наиболее эффективные схемы противохеликобактерной терапии и мероприятия, направленные на профилактику хеликобактериоза.
pylori прошло чуть более 20-ти лет. За этот период времени было разработано большое количество методов диагностики, позволяющих выявлять и идентифицировать этот микроорганизм. Развитие и усовершенствование этих методов помогло в получении ценной информации об эпидемиологии хеликобактериоза, сыграло большую роль в понимании патогенеза этой инфекции. Это, в свою очередь, позволило разработать наиболее эффективные схемы противохеликобактерной терапии и мероприятия, направленные на профилактику хеликобактериоза.
Тем не менее, ни один из существующих методов диагностики Н.pylori- инфекции не универсален. Пределы возможностей этих методов могут быть ограничены не только их чувствительностью, но, зачастую зависят от возраста пациента, его индивидуальных особенностей, стадии заболевания, а также индивидуальных особенностей течения инфекции.

Методы лабораторной диагностики Helicobacter pylori — инфекции
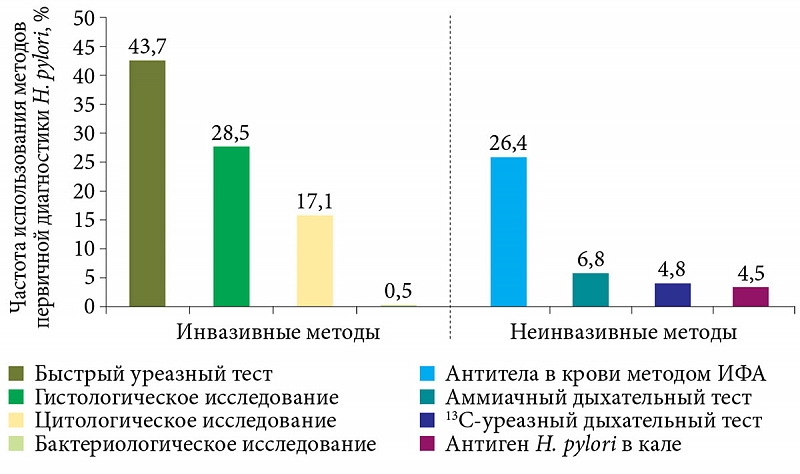
Инвазивные методы
Неинвазивные методы
• Бактериологический метод
• Бактериологический метод
• Гистологический метод
• Молекулярно-биологический метод (ПЦР)
• Фазово-контрасная микроскопия • Серологический метод
• Молекулярно-биологический метод (ПЦР)
• Уреазный дыхательный тест*
________________________________________
* проводится только в офисе на Новослободской
Все инвазивные методы диагностики Н.pylori-инфекции предусматривают проведение эндоскопического исследования с последующим взятием биопсийного материала. Неинвазивные методы включают в себя различного рода иммунологические исследования, позволяющие определять наличие антител в сыворотке крови или бактериального антигена в фекалиях, ПЦР исследование на Helicobacter Pylori с определением ДНК Н.pylori в фекалиях и уреазный дыхательный тест на Helicobacter pylori с С13 или С14 меченным атомом углерода.
Принципиальное значение для практики имеет проведение диагностики Н.pylori-инфекции до лечения — первичная диагностика, и после проведения противохеликобактерной терапии — контроль эффективности выбранной схемы лечения. Принципы выбора диагностических манипуляций при Н.pylori-инфекции изложены в «Рекомендациях по диагностике и лечению Н.pylori-инфекции у взрослых при язвенной болезни желудка и двенадцатиперстной кишки» (1997, Российская группа по изучению Нelicobacter pylori).
1. Бактериологический метод: посев биоптата слизистой оболочки желудка или двенадцатиперстной кишки на дифференциально-диагностическую среду с целью выделения чистой культуры Н.pylori;
2. Гистологический метод – «золотой стандарт» диагностики Н.
 pylori- инфекции: окраска бактерии в гистологических препаратах слизистой оболочки желудка или двенадцатиперстной кишки по Гимзе, толуидиновым синим, Вартину-Старии, Генте;
pylori- инфекции: окраска бактерии в гистологических препаратах слизистой оболочки желудка или двенадцатиперстной кишки по Гимзе, толуидиновым синим, Вартину-Старии, Генте;3. Дыхательный тест на Helicobacter pylori: определение в выдыхаемом больным воздухе изотопов 13С или 14С ; они выделяются в результате расщепления в желудке больного меченной мочевины под действием уреазы Н.pylori;
4. Уреазный тест: определение уреазной активности в биоптате слизистой оболочки желудка или двенадцатиперстной кишки путем помещения его в жидкую гелеобразную среду, содержащую субстрат, буфер и индикатор.
При соблюдении всех правил выполнения методик и надлежащей стерилизации эндоскопической аппаратуры первичный диагноз Н.pylori- инфекции является достаточным для начала противохеликобактерной терапии при обнаружении бактерии одним из описанных методов.
Диагностика эрадикации Н.pylori (оценка адекватности проведенной противохеликобактериальной терапии) направлена на выявление вегетативных и кокковых форм Н.
 pylori. В «Рекомендациях» даны строгие правила по проведению этого этапа диагностики:/p>
pylori. В «Рекомендациях» даны строгие правила по проведению этого этапа диагностики:/p>1. Сроки ее проведения – не ранее, чем через 4-6 недель после окончания курса противохеликобактерной терапии, либо окончания лечения любыми антибиотиками или антисекреторными средствами сопутствующих заболеваний.
Скрининг методы, позволяющие снизить стоимость диагностики Н.pylori-инфекции
Для проведения скрининга чаще всего используются методы антител классов А и G в сыворотке, плазме или капиллярной крови обследуемых лиц. Наиболее изученными являются следующие серологические методы:
1.
 Серологический метод;
Серологический метод;2. Экспресс-тесты на основе иммунопреципитации или иммуноцитохимии с использованием в качестве пробы капиллярной крови больных и цветовым усилением продуктов реакции.
Экспресс-тесты могут быть использованы для удешевления процесса первичной диагностики Н.pylori-инфекции, так как положительный результат теста в ясной клинической ситуации позволяет исключить дорогостоящее эндоскопическое исследование, а также использование методов непосредственной диагностики. Нельзя использовать экспресс-тесты для определения эрадикации после лечения.
Диагностика хеликобактер пилори | Клинический госпиталь на Яузе, Москва
О возбудителе
Согласно статистическим данным, около 60% населения земного шара инфицированы Helicobacter pylori: этот возбудитель был выявлен у 99,9% людей с язвенной болезнью желудка и двенадцатиперстной кишки, а также у 80% пациентов, страдающих от хронического гастрита.
Хеликобактер пилори — это микроорганизм, характерными особенностями которого считаются кислотоустойчивость и способность разрушать слизистую оболочку желудка и/или двенадцатиперстной кишки.
Диагностические мероприятия
В Клиническом госпитале на Яузе диагностика возбудителя проводится с помощью следующих методик:
- Морфологическое исследование биоптата слизистой оболочки и пристеночной слизи, которые также получают в ходе ЭФГДС. Это самый точный метод диагностики H.pylori.
- Молекулярно-генетическое исследование: полимеразная цепная реакция (ПЦР), материалом для которой служит биоптат слизистой оболочки пораженного органа.
- 13С уреазный дыхательный тест на хеликобактер — самый простой метод контроля эрадикации (уничтожения) Helicobacter pylori.
Показания для диагностики Helicobacter pylori
- язвенная болезнь желудка и двенадцатиперстной кишки;
- гастроэзофагальный рефлюкс;
- хронический гастрит;
- эрозивный гастрит;
- язвенноподобные диспепсические расстройства;
- появление голодных болей у пациентов с язвенной болезнью в анамнезе;
- контроль терапии язвенной болезни.

Почему мы?
Обратившись в Клинический госпиталь на Яузе, вы гарантированно получите:
- Индивидуальный подход: наши специалисты порекомендуют наиболее информативный и комфортный метод диагностики для каждого пациента.
- Достоверный результат: подтверждение наличия Helicobacter pylori исследованием биоптата, взятого при ФГДС, исключает возможность ошибочного толкования полученных данных.
- Комплексное обследование: с результатами тестов вы можете обратиться к гастроэнтерологу нашего госпиталя и получить исчерпывающую консультацию по поводу терапии выявленной патологии.
- Эффективное лечение: в нашей клинике применяются передовые методы эрадикации, избавления от хеликобактер пилори, которые базируются на принципах доказательной медицины.
Диагностика Helicobacter pylori и выбор эрадикационной терапии: результаты анкетирования врачей в различных регионах Российской Федерации | Дехнич
1. International Agency for Research on Cancer. Helicobacter pylori eradication as a strategy for preventing gastric cancer. IARC Working Group Reports. Vol 8, WHO Press, World Health Organization. Geneva, Switzerland; 2014.
2. Malfertheiner P., Megraud F., O’Morain C. et al. Management of Helicobacter pylori infectionMaastricht V/Florence consensus report. Gut 2017; 66(1):6-30.
3. Qu X.H., Huang X.L., Xiong P. et al. Does Helicobacter pylori infection play a role in iron deficiency anemia? A meta-analysis. World J Gastroenterol 2010; 16:886-96.
4. Franceschi F., Tortora A., Gasbarrini G., Gasbarrini A. Helicobacter pylori and extragastric diseases. Helicobacter 2014; 19(Supl 1):52-8.
5. Kuwana M. Helicobacter pylori-associated immune thrombocytopenia: clinical features and pathogenic mechanisms. World J Gastroenterol 2014; 20(3):714-23.
6. Correa P., Fontham E.T., Bravo J.C. et al. Chemoprevention of gastric dysplasia: randomized trial of antioxidant supplements and anti-Helicobacter pylori therapy. J Nat Cancer Inst 2000; 92:1881-8.
7. Chen L.T., Lin J.T., Tai J.J. et al. Long-term results of anti-Helicobacter pylori therapy in early-stage gastric high-grade transformed MALT lymphoma. J Nat Cancer Inst 2005; 97:1345-53.
8. Chan F.K., Chung S.C., Suen B.Y. et al. Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or aproxen. N Engl J Med 2001; 344:967-73.
9. Lai K.C., Lam S.K., Chu K.M. et al. Lansoprazole for the prevention of recurrences of ulcer complications from long-term low-dose aspirin use. N Engl J Med 2002; 346:2033-8.
10. Chan F., Ching J., Suen B. et al. H. pylori eradication on the long-term incidence of recurrent ulcer bleeding in high-risk aspirin users: a 10-year prospective cohort study. Gastroenterology 2011; 140:173-4.
11. Leung W.K., Lin S.R., Ching J.Y. et al. Factors predicting progression of gastric intestinal metaplasia: results of a randomised trial on Helicobacter pylori eradication. Gut 2004; 53:1244-9.
12. Wang J., Xu L., Shi R. et al. Gastric atrophy and intestinal metaplasia before and after Helicobacter pylori eradication: a meta-analysis. Digestion 2011; 83:253-60.
13. Здравоохранение в России. 2015. Стат.сб./Росстат. М.; 2015. 174 с.
14. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А. и Комитет экспертов. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых. Рос журн гастроэнтерол гепатол колопроктол 2012; 22(1):87-9.
15. Ивашкин В.Т., Маев И.В., Лапина Т.Л., Шептулин А.А. и др. Лечение инфекции Helicobacter pylori: Мейнстрим и новации. Рос журн гастроэнтерол гепатол колопроктол 2017; 27(4):4-21.
16. Ивашкин В.Т., Страчунский Л.С., Лапина Т.Л., Дехнич Н.Н. и др. Реальная практика ведения пациентов с язвенной болезнью желудка и 12-перстной кишки в России: результаты многоцентрового фармакоэпидемиологического исследования. Рос журн гастроэнтерол гепатол колопроктол 2005; 6:16-21.
17. Бордин Д.С., Янова О.Б., Абдулхаков Р.А. и др. Европейский регистр Helicobacter pylori (протокол Hp-EuReg): первые результаты Российских центров. Доказательная гастроэнтерология 2016; 5(1):9-15.
18. Jones N.L., Koletzko S., Goodman K. et al. Guidelines for the management of Helicobacter pylori in children and adolescents. JPGN 2017; 64(6):991-1003.
19. Kunin C.M., Tupasi T., Craig W.A. Use of antibiotics. A brief exposition on the problem and some tentative solutions. Ann Intern Med 1973; 79:555-60. Megraud F., Bessede E., Lehours F. Diagnosis of Helicobacter pylori infection. Helicobacter 2014; 19(1):610.
Статьи: Методы диагностики инфекции Хеликобактер пилори (Helicobacter pylori) в клинический практике
Лазебник Л.Б., Васильев Ю.В., Щербаков П.Л., Хомерики С.Г.,
Машарова А.А., Бордин Д.С., Касьяненко В.И., Дубцова Е.А.
Helicobacter pylori: распространенность, диагностика, лечение.
Экспериментальная и клиническая гастроэнтерология.
2010;(2):3-7 [Lazebnik LB, Vasiliev YuV, Shcherbakov PL,
Khomeriki SG, Masharova AA, Bordin DS, Kasyanenko VI,
Dubtsova EA. Helicobacter pylori: prevalence, diagnostics, treat-
ment. Eksperimental’naya i Klinicheskaya Gastroenterologiya.
2010;(2):3-7 (In Russ.)].
2. Герман С.В., Зыкова И.Е., Модестова А.В., Ермаков Н.В. Распро-
страненность инфекции H. pylori среди населения Москвы. Рос-
сийский журнал гастроэнтерологии, гепатологии, колопроктоло-
гии. 2010;(2):25-30 [German SV, Zykova IE, Modestova AV, Er-
makov NV. The prevalence of H. pylori among the population of
Moscow. Rossiyskiy Zhurnal Gastroenterologii, Gepatologii, Kolo-
proktologii. 2010;(2):25-30 (In Russ.)].
3. Барышникова Н.В., Ткаченко Е.И., Успенский Ю.П. Современные
аспекты состояния проблемы Helicobacter pylori-ассоциированных
заболеваний. В кн.: Лазебник Л.Б., Щербаков П.Л., редакторы. Га-
строэнтерология. Болезни взрослых. М.: МК; 2011. С. 103 [Barysh-
nikova NV, Tkachenko EI, Uspensky YuP. Modern aspects of the state of
the problem of Helicobacter pylori-associated diseases. In: Lazebnik LB,
Shcherbakov PL, editors. Gastroenterologiya. Bolezni vzroslykh [Gas-
troenterology. Adult disaeses]. Moscow: MK; 2011. P. 103 (In Russ.)].
4. Цуканов В.В., Хоменко О.В., Ржавичева О.С., Буторин Н.Н., Шты-
гашева О.В., Маады А.С., Бичурина Т.Б., Амельчугова О.С. Распро-
страненность Helicobacter pylori и ГЭРБ у монголоидов и европеои-
дов восточной Сибири. Российский журнал гастроэнтерологии
гепатологии, колопроктологии. 2009;19(3):38-41 [Tsukanov VV,
Khomenko OV, Savicheva OC, Butorin NN, Shtygasheva OV,
Maadi AS, Bichurina TB, Amelchugov OS. The Prevalence of Heli-
cobacter pylori and GERD in Mongoloids and Caucasians of Eastern
Siberia Rossiyskiy Zhurnal Gastroenterologii, Gepatologii, Koloprok-
tologii. 2009;19(3):38-41 (In Russ.)].
5. Решетников О.В., Курилович С.А., Кротов С.А., Кротова В.А. Хе-
ликобактерная инфекция в сибирских популяциях. Бюллетень Си-
бирского отделения Российской академии медицинских наук.
2010;(2):88-93 [Reshetnikov OV, Kurilovich SA, Krotov SA,
Krotova VA. Helicobacter pylori infection in Siberian populations.
Byulleten’ Sibirskogo Otdeleniya Rossiyskoy Akademii Meditsinskikh
Nauk. 2010;(2):88-93 (In Russ.)].
6. Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyin-
goh D, Malfertheiner P, Graham DY, Wong VWS, Wu JCY,
Chan FKL, Sung JJY, Kaplan GG, Ng SC. Global Prevalence of Heli-
cobacter pylori Infection: Systematic Review and Meta-Analysis. Gas-
troenterology. 2017;153:420-9. doi: 10.1053/j.gastro.2017.04.022
7. Nagy P, Johansson S, Molloy-Bland M. Systematic review of time
trends in the prevalence of Helicobacter pylori infection in China and
the USA. Gut Pathog. 2016;8:8. doi: 10.1186/s13099-016-0091-7
8. Graham DY. History of Helicobacter pylori, duodenal ulcer, gastric ul-
cer and gastric cancer. World J Gastroenterol. 2014;20:5191-204.
doi: 10.3748/wjg.v20.i18.5191
9. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S,
Haruma K, Asaka M, Uemura N, Malfertheiner P. Kyoto global con-
sensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-
67. doi: 10.1136/gutjnl-2015-309252
10. Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Heli-
cobacter pylori infection – the Maastricht V/Florence Consensus Re-
port. Gut. 2017;66(1):6-30. doi: 10.1136/gutjnl-2016-312288
11. Marshall BJ, Warren JR. Unidentified curved bacilli in the stomach of
patients with gastritis and peptic ulceration. Lancet.
1984;1(8390):1311-5.
12. International Agency for Research on Cancer Helicobacter pylori
Working Group. Helicobacter pylori Eradication as a Strategy for Pre-
venting Gastric Cancer. (IARC Working Group Reports, No. 8). Lyon,
France: International Agency for Research on Cancer, 2014. Доступно
по ссылке [Available under the link]: http://www.iarc.fr/en/publica-
tions/pdfs- online/wrk/wrk8/index.php
13. Лазебник Л.Б., Ткаченко Е.И., Абдулганиева Д.И., Абдулхаков Р.А.,
Абдулхаков С.Р., Авалуева Е.Б., Ардатская М.Д., Ахмедов В.А.,
Бордин Д.С., Бурков С.Г., Бутов М.А. и др. VI национальные реко-
мендации по диагностике и лечению кислотозависимых и ассо-
циированных с Helicobacter pylori заболеваний (VI Московские со-
глашения). Экспериментальная и клиническая гастроэнтерология.
2017;2(138):3-21 [Lazebnik LB, Tkachenko EI, Abdulganiev DI, Ab-
dulhakov RA, Abdulhakov SR, Valueva EB, Ardatskaya MD, Akhme-
dov VA, Bordin DS, Burkov SG, Butov MA, et al. VI national recom-
mendations for the diagnosis and treatment of acid-dependent diseases
and diseases associated with Helicobacter pylori (VI Moscow agree-
ments). Eksperimental’naya i Klinicheskaya Gastroenterologiya.
2017;2(138):3-21 (In Russ.)].
14. Atkinson NS, Braden B. Helicobacter Pylori Infection: Diagnostic
Strategies in Primary Diagnosis and After Therapy. Dig Dis Sci.
2016;61(1):19-24. doi: 10.1007/s10620-015-3877-4
15. Wang YK, Kuo FC, Liu CJ, Wu MC, Shih HY, Wang SS, Wu JY,
Kuo CH, Huang YK, Wu DC. Diagnosis of Helicobacter pylori infec-
tion: Current options and developments. World J Gastroenterol.
2015;21(40):11221-35. doi: 10.3748/wjg.v21.i40.11221
16. Бунова С.С., Рыбкина Л.Б., Бакалов И.А., Копин Е.Ж.,
Шамшев Ю.В. Методы диагностики инфекции Helicobacter pylori:
современное состояние вопроса. Молодой ученый. 2012;(12):540-3
[Bunova SS, Rybkin LB, Bakalov IA, Kopin, EZh, Shamshev YuV.
Methods of diagnosis of Helicobacter pylori infection: current status of
the issue. Molodoy Uchenyy. 2012;(12):540-3 (In Russ.)].
17. Корниенко Е.А. Инфекция Helicobacter pylori у детей и подростков
России – диагностика, лечение, контроль эффективности лечения.
Гастроэнтерологический силлабус. 2016;(3):83-93 [Kornienko EA.
Helicobacter pylori Infection in children and adolescents of Russia –
diagnosis, treatment, control of treatment effectiveness. Gastroentero-
logicheskiy Sillabus. 2016;(3):83-93 (In Russ.)].
18. Lopes AI, Vale FF, Oleastro M. Helicobacter pylori infection – recent
developments in diagnosis. World J Gastroenterol. 2014 Jul
28;20(28):9299-313. doi: 10.3748/wjg.v20.i28.9299
19. Lee JY, Kim N. Diagnosis of Helicobacter pylori by invasive test: his-
tology. Ann Transl Med. 2015;3(1):10. doi: 10.3978/j.issn.2305-
5839.2014.11.03
20. Rugge M, Fassan M, Pizzi M, Pennelli G, Nitti D, Farinati F. Operative
Link for Gastritis Assessment gastritis staging incorporates intestinal
metaplasia subtyping. Hum Pathol. 2011;42:1539-44.
doi: 10.1016/j.humpath.2010.12.017
21. Lee YC, Tseng PH, Liou JM, Chen MJ, Chen CC, Tu CH, Chiang TH,
Chiu HM, Lai CF, Ho JC, et al. Performance of a one-step fecal sam-
ple-based test for diagnosis of Helicobacter pylori infection in primary
care and mass screening settings. J Formos Med Assoc. 2014;113:899-
907. doi: 10.1016/j.jfma.2012.05.014
22. Craanen ME, Blok P, Dekker W, et al. Subtypes of intestinal metaplasia
and Helicobacter pylori. Gut. 1992;33:597-600.
23. Braden B. Diagnosis of Helicobacter pylori infection. BMJ.
2012;344:e828. doi: 10.1136/bmj.e828
24. Vaira D, Vakil N, Gatta L, Ricci C, Perna F, Saracino I, Fiorini G,
Holton J. Accuracy of a new ultrafast rapid urease test to diagnose Heli-
cobacter pylori infection in 1000 consecutive dyspeptic patients. Aliment
Pharmacol Ther. 2010;31:331-8. doi: 10.1111/j.1365-2036.2009.04196.x
25. Uotani T, Graham DY. Diagnosis of Helicobacter pylori using the rapid
urease test. Ann Transl Med. 2015;3(1):9. doi: 10.3978/j.issn.2305-
5839.2014.12.04
26. Dolak W, Bilgilier C, Stadlmann A, Leiner J, Püspök A, Plieschneg-
ger W, Siebert F, Wewalka F, Schöfl R, Huber-Schönauer U, Datz C,
Biowski-Frotz S, Högenauer C, Schrutka-Kölbl C, Makristathis A,
Schöniger-Hekele M, Steininger C; Austrian Helicobacter Pylori Study
Group. A multicenter prospective study on the diagnostic performance
of a new liquid rapid urease test for the diagnosis of Helicobacter pylori
infection. Gut Pathog. 2017;9:78. doi: 10.1186/s13099-017-0226-5
27. Seo JH, Park JS, Yeom JS, et al. Correlation between positive rate
and number of biopsy samples on urease test in childhood Helicobac-
ter pylori infection. J Korean Med Sci. 2014;29:106-9.
doi: 10.3346/jkms.2014.29.1.106
28. Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, Wang JY,
Yang YC, Lin YC, Wang WM, et al. Dual specimens increase the diag-
nostic accuracy and reduce the reaction duration of rapid urease test.
World J Gastroenterol. 2010;16:2926-30.
29. Malfertheiner P. Diagnostic methods for H.pylori infection: choices,
opportunities and pitfalls. United Eur Gastroenterol J. 2015;3:429-31.
doi: 10.1177/2050640615600968
30. Eisdorfer I, Shalev V, Goren S, Chodick G, Muhsen K. Sex differences
in urea breath test results for the diagnosis of Helicobacter pylori in-
fection: a large cross-sectional study. Biol Sex Differ. 2018;9:1.
doi: 10.1186/s13293-017-0161-7
31. Ferwana M, Abdulmajeed I, Alhajiahmed A, Madani W, Firwana B,
Hasan R, Altayar O, Limburg PJ, Murad MH, Knawy B. Accuracy of
urea breath test in Helicobacter pylori infection: meta-analysis. World
J Gastroenterol. 2015;21:1305-14. doi: 10.3748/wjg.v21.i4.1305
32. Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN,
Greiner W. Efficacy and cost-effectiveness of the 13 C-urea breath test as
the primary diagnostic investigation for the detection of Helicobacter
pylori infection compared to invasive and non-invasive diagnostic tests.
GMS Health Technol Assess. 2009;5:Doc14. doi: 10.3205/hta000076
33. Маев И.В., Сайфутдинов Р.Г., Самсонов А.А., Гречушников В.Б. Ре-
зультаты открытого мультицентрового исследования эффективно-
сти дыхательных тестов в диагностике H. pylori. Дневник казанской
медицинской школы. 2013;(5):21-3 [Maev IV, Sayfutdinov RG, Sam-
sonov AA, Grechushnikov VB. Results of an open multicentre study of
the effectiveness of respiratory tests in the diagnosis of H. pylori.
Dnevnik Kazanskoy Meditsinskoy Shkoly. 2013;(5):21-3 (In Russ.)].
34. Агеева Е.А., Харитонова Т.И., Гуляко Л.Ф., Зайнулина З.У. и соавт.
Диагностические возможности уреазного дыхательного (Хелик)
теста в оценке эрадикации Helicobacter pylori – инфекции. Дальне-
восточный медицинский журнал. 2010;(4):12-5 [Ageeva EA,
Kharitonova TI, Gulyako LF, Zainulina ZU, et al. Diagnostic capabili-
ties of the urease respiratory (Helik) test in assessing the eradication of
Helicobacter pylori – infection. Dal’nevostochnyy Meditsinskiy Zhur-
nal. 2010;(4):12-5 (In Russ.)].
35. Shimoyama T. Stool antigen tests for the management of Helicobacter
pylori infection. World J Gastroenterol. 2013;19(45):8188-91.
doi: 10.3748/wjg.v19.i45.8188
36. El-Shabrawi M, El-Aziz NA, El-Adly TZ, Hassanin F, Eskander A,
Abou-Zekri M, Mansour H, Meshaal S. Stool antigen detection versus
13 C-urea breath test for non-invasive diagnosis of pediatric Helicobac-
ter pylori infection in a limited resource setting. Arch Med Sci.
2018;14(1):69-73. doi: 10.5114/aoms.2016.61031
37. Zhou X, Su J, Xu G, Zhang G. Accuracy of stool antigen test for the diagno-
sis of Helicobacter pylori infection in children: a meta-analysis. Clin Res
Hepatol Gastroenterol.2014;38:629-38. doi: 10.1016/j.clinre.2014.02.001
38. Кудрявцева Л.В., Щербаков П.Л., Иваников И.О., Говорун В.М.
Helicobacter pylori – инфекция: современные аспекты диагности-
ки и терапии (пособие для врачей). М., 2004 [Kudryavtseva LV,
Shcherbakov PL, Ivanikov IO, Govorun VM. Helicobacter pylori – in-
fektsiya: sovremennye aspekty diagnostiki i terapii (posobie dlya
vrachey) [Helicobacter pylori infection: modern aspects of diagnosis
and therapy (manual for doctors)]. Moscow, 2004 (In Russ.)].
39. Malfertheiner P, Megraud F, O’Morain C, et al; European Helicobacter
Study Group. Management of Helicobacter pylori infection – the
Maastricht IV/Florence Consensus Report. Gut. 2012;61(5):646-64.
doi: 10.1136/gutjnl-2012-302084
40. Bessède E, Arantes V, Mégraud F, Coelho LG. Diagnosis of Helicobacter
pylori infection. Helicobacter. 2017;22(Suppl 1). doi: 10.1111/hel.12404
41. Lazebnik LB, Masharova AA, Bordin DS, Khomeriki SG. Influence of
bismuth on gastritis healing and effectiveness of Helicobacter pylori
eradication. Helicobacter. 2010;15:343.
42. Лазебник Л.Б., Бордин Д.С.; исследовательская группа программы
«ПАРАД». Ведение пациентов с Helicobacter pylori-ассоциирован-
ными заболеваниями в условиях реальной клинической практики.
Промежуточные результаты наблюдательной программы. Экспе-
риментальная и клиническая гастроэнтерология. 2013;(5):93-101
[Lazebnik LB, Bordin DS; Research Group «Parad». Management of
patients with Helicobacter pylori-related illness in the ordinary clinical
practice. Intermediate results of monitoring program. Eksperimental’-
naya i Klinicheskaya Gastroenterologiya. 2013;(5):93-101 (In Russ.)].
43. Бордин Д.С., Янова О.Б., Абдулхаков Р.А., Цуканов В.В.,
Ливзан М.А. и др. Европейский регистр Helicobacter pylori (прото-
кол Hp-EuReg): первые результаты Российских центров. Терапев-
тический архив. 2016;88(2):33-8 [Bordin DS, Yanova OB, Ab-
dulkhakov RA, Tsukanov VV, Livzan MA, et al. European Helicobacter
pylori register (Hp-EuReg protocol): first results of Russian centers. Ter.
Arkh. 2016;88(2):33-8 (In Russ.)]. doi: 10.17116/terarkh301688233-38
44. Бордин Д.С., Эмбутниекс Ю.В., Вологжанина Л.Г., Ильчиши-
на Т.А., Войнован И.Н., Сарсенбаева А.С. и др. Европейский ре-
гистр Helicobacter pylori (Hp-EuReg): анализ данных 2360 боль-
ных, получавших терапию первой линии в России. Терапевти-
ческий архив. 2018;(2):35-42 [Bordin DS, Embutnieks YuV,
Vologzhanina LG, Ilchishina TA, Voinovan IN, Sarsenbaeva AS,
et al. European Helicobacter pylori register (Hp-EuReg): data analy-
sis of 2360 patients who received first line therapy in Russia. Ter.
Arkh. 2018;(2):35-42 (In Russ.)].
Тест на Хеликобактер пилори — все виды по выгодным ценам в Клинике ЭКСПЕРТ.
В нашей клинике можно сделать все виды тестов на Хеликобактер пилори (Helicobacter pylori). У каждого из них есть свои плюсы и минусы. Если сомневаетесь, какой подходит лучше всего, проконсультируйтесь с врачом.
ЗаписатьсяДлительность
15-45 минут
Как обнаружить Helicobacter pylori – современные методы диагностики
Существуют различные варианты диагностики, которые помогают обнаружить Helicobacter pylori. К ним относится:
13С-уреазный дыхательный тест
- Достоверность. 13С-уреазный аэротест обладает очень высоким уровнем чувствительности (до 95%) и специфичности (95-100%), его рекомендуют как российские, так и европейские гастроэнтерологи. Только этот тест, помимо наличия бактерии, определяет также ее количество. Этот тест идеально подходит для того, чтобы количественно оценить уровень инфицированности пациента до и после антихеликобактерной терапии и сделать выводы об эффективности лечения.
- Скорость. Тест проводится в течение 40-45 минут, его результаты пациент получает в течение 1-2 дней. Результатом 13С-уреазного теста является заключение с графиком, в котором сопоставляются данные пациента с нормальными и предельными значениями, определяется наличие и количество бактерии Helicobacter Pylori (от отсутствия или незначительного количества до выраженного или высокого уровня инфицированности).
- Методика и условия проведения. Тест абсолютно безопасен и не доставляет неприятных ощущений пациенту. 13С-дыхательный тест необходимо проводить в утреннее время натощак или в дневное время после 4-6 часов после приема пищи.
- Подготовка. Условия для получения точного результата: проведение теста спустя 6 недель после применения антибиотиков и препаратов висмута; за 2-3 дня до теста необходимо исключить прием спиртных напитков; не позднее, чем за две недели до проведения теста необходимо прекратить прием ингибиторов протонной помпы (омепразол, рабепразол, лансопразол, эзомепразол, пантопразол) или блокаторов гистаминовых рецепторов второго типа (ранитидин, фамотидин, низатидин, роксатидин), согласовав это с лечащим врачом.
- Противопоказания. Абсолютных противопоказаний нет. Проконсультируйтесь с лечащим врачом о проведении теста, при наличии в анамнезе операций на желудке.
Для анализа выдыхаемый пациентом воздух собирается 2 или 4 раза: первый раз — как контрольный образец, и три раза каждые 10 минут после того, как пациент принимает препарат, содержащий 75 мг 13С-меченой мочевины. Высокоточный инфракрасный анализатор определяет состав воздуха и, соответственно, количество и активность бактерии.
Дыхательный Хелик-тест
- Достоверность. Хелик-тест обеспечивает выявление бактерии. Данный аэротест на хеликобактер может назначаться для первичной диагностики.
- Скорость. Проведение теста занимает 15-30 минут. Заключение выдается пациенту на руки сразу после теста.
- Методика проведения. Дыхательный тест на Хеликобактер Пилори (Хелик-тест) — быстрый, легкий и безболезненный способ диагностики бактерии Helicobacter Pylori. Тест относится к неинвазивным методам, т.е. не требует проведения эндоскопического исследования или забора крови, и не доставляет каких-либо неприятных ощущений. Он безопасен для пациентов разного возраста и для проведения во время беременности.
Для проведения теста требуется предварительная подготовка. Аэротест сдают натощак, перед проведением запрещается курить, жевать жвачку. Тест проводится спустя 2-4 недели после окончания терапии антибиотиками.
Анализ выдыхаемого воздуха проводится два раза: натощак и после того, как пациент выпьет специальный раствор карбамида. Таким образом оценивается уреазная активность бактерии Helicobacter Pylori, которая свидетельствует о наличии бактерии.
Тест на Хеликобактер при ФГДС
- Достоверность. Взятие биоптата для анализа непосредственно из среды желудка считается наиболее достоверным методом диагностики хеликобактериоза..
- Скорость. Процедура ФГДС длится 2-5 минут, и заключение по результатам и наличию хеликобактерной инфекции выдается на руки сразу после исследования. В целом исследование и беседа с врачом эндоскопистом занимает 30-40 минут.
- Методика проведения. В тех случаях, когда гастроэнтеролог назначает пациенту ФГДС, особенно в случае с гастритом и язвенной болезнью, то сделанный одновременно анализ на хеликобактер внесет существенный вклад в диагностику. В этом случае пациент получит два заключения из одного исследования. Во время ФГДС (эндоскопическое исследование – фиброгастроэуоденоскопия) врач эндоскопист собственными глазами видит состояние слизистой желудка и 12-перстной кишки, выявляет пораженные участки и берет из них образцы для исследования (биоптат).
Эта процедура проводится строго натощак. Подробнее о подготовке и методике проведения ФГДС.
Анализ крови на антитела к Helicobacter pylori
- Достоверность. Наличие антител в крови указывает на то, что иммунная система когда-то столкнулась с бактерией, распознала ее и отреагировала. Это значит, что анализ не выявляет непосредственно хеликобактер, а только косвенно указывает на его присутствие в прошлом или настоящем. Антитела к бактерии проявляются через 3-4 недели после заражения, а также около 1 месяца сохраняются в крови после лечения. Иногда антитела сохраняются в крови пожизненно независимо от присутствия хеликобактера. Поэтому результат анализа не всегда достоверен: он может быть как ложноположительным, так и ложноотрицательным, и для уточнения результатов может понадобиться еще ряд анализов.
- Скорость. Анализ выполняется 2-3 дня.
- Методика проведения. Производится забор крови из вены. Кровь сдается натощак, перед сдачей нельзя принимать пищу в течение 8 часов.
Как выбрать подходящий метод?
В качестве базовой диагностики на Helicobacter pylori подойдет дыхательный хелик-тест. Он поможет с высокой долей достоверности определить, заражен ли пациент в принципе бактерией хеликобактера.
Для более тщательного обследования рекомендуется остановить выбор на 13С-уреазном дыхательном тесте. Этот тест определит не только наличие, но и количество бактерии Helicobacter pylori. Это важно, когда проводится лечение хеликобактериоза и требуется оценить его динамику. Однако цена на уреазный дыхательный тест на хеликобактер пилори выше.
Самым надежным и достоверным методом считается тест на Helicobacter pylori при проведении ФГДС. В то же время это инвазивный метод, и потому достаточно неприятный. Однако в тех случаях, когда врач назначает ФГДС для диагностики язвы, гастрита, эрозии и других заболеваний желудка и двенадцатиперстной кишки, одновременно проводится и диагностика хеликобактериоза как одного из факторов развития заболевания.
Также в диагностической практике существует метод анализа крови на Helicobacter pylori. Врачи Клиники ЭКСПЕРТ не рекомендуют сдавать кровь для первичной диагностики Хеликобактер Пилори, т.к. из всех методов это наименее информативный. Его имеет смысл сдавать только по показаниям специалиста.
Почему в Клинике ЭКСПЕРТ?
- Наличие всех необходимых современных тест-систем для диагностики хеликобактериоза, которыми оснащено далеко не каждое медицинское учреждение в городе.
- Специалисты, имеющие большой опыт работы в области диагностики и лечения хеликобактериоза.
- Возможность проконсультироваться с врачом гастроэнтерологом сразу после обследования.
Стоимость тестов на Хеликобактер пилори
| Исследование биоптата на H.Pylori | 1 100 ₽ |
| Исследование на H.Pylori с помощью 13С дыхательного теста (4 пробы) | 2 510 ₽ |
| Исследование на H.Pylori с помощью тест-системы ХЕЛИК ® | 1 010 ₽ |
| Helicobacter pylori (Хеликобактер пилори), IgA (количественно) ИФА | 690 ₽ |
| Helicobacter pylori (Хеликобактер пилори), кал методом ПЦР | 560 ₽ |
| Helicobacter pylori (Хеликобактер пилори), IgG (количественно) ИФА | 590 ₽ |
| Helicobacter pylori (Хеликобактер пилори), антиген | 830 ₽ |
| Helicobacter pylori (Хеликобактер пилори), IgG (методом Вестерн-блот) | 3 240 ₽ |
| Helicobacter pylori (Хеликобактер пилори), IgА (методом Вестерн-блот) | 3 240 ₽ |
| Бактериологическое исследование на Helicobacter p с подбором АБ | 2 840 ₽ |
Зачем диагностировать и лечить хеликобактериоз?
Хеликобактер пилори способствует развитию:
- рака желудка
- атрофии слизистой
- язвенной болезни
- неязвенной диспепсии
- гастрита.
* % случаев развития заболеваний, связанных с бактерией Helicobacter Pylori.
Механизм негативного воздействия Helicobacter Pylori
Helicobacter Pylori — это грамотрицательная бактерия, которая инфицирует желудок и двенадцатиперстную кишку. Бактерия выделяет токсичные ферменты, которые повреждают клетки желудка и двенадцатиперстной кишки.
Это вызывает изъязвление слизистой оболочки. Helicobacter Pylori задерживает заживление язв, незащищенная стенка желудка начинает подвергаться действию желудочного сока, а это способствует переходу заболевания в хроническую форму. Бактерия затрудняет трофику и микроциркуляцию тканей, что в свою очередь тоже мешает нормальному заживлению любых повреждений. В этом случае может помочь терапия, которая направлена на эрадикацию бактерий (полное их уничтожение) и нормализацию механизмов регенерации.
Кому нужно сдать анализ на хеликобактер?
Обследование необходимо, если вы заметили у себя один из перечисленных ниже симптомов:
- дискомфорт и боли преимущественно в верхних отделах живота
- жалобы на запах изо рта
- рецидивирующий кариес
- изжога
- отрыжка
- нарушения стула
- тошнота и даже рвота
Дополнительный повод для диагностики хеликобактер пилори – это перенесенные заболевания желудочно-кишечного тракта (хронического гастрита, гастродуоденита, язвенной болезни желудка и 12-перстной кишки, перенесенной операции по поводу рака желудка), а также наследственная предрасположенность (наличие бактерии или заболеваний ЖКТ у членов семьи).
Хеликобактериоз является серьезной проблемой, но иногда человек даже не догадывается о присутствии бактерии в организме. Именно поэтому гастроэнтерологи Клиники ЭКСПЕРТ рекомендуют проходить обследование на Helicobacter Pylori даже с целью профилактики.
Кто может быть инфицирован хеликобактер?
До 80% населения России инфицировано бактерией Helicobacter pylori.
Ситуация осложняется тем, что распространение инфекции может происходить очень легко. Бактерия передается во время поцелуя, при использовании одной посуды, средств личной гигиены (зубная щетка), при очищении детской соски с помощью «облизывания» инфицированной матерью и пр. Если заражен один член семьи, то с большой долей вероятности можно говорить о том, что и другие члены семьи через какое-то время будут инфицированы.
Рекомендации и профилактика
После диагностики и лечения очень важно не допустить повторного заражения. При выявлении Хеликобактер пилори у одного из членов семьи, рекомендуется провести диагностику и всем остальным, а при необходимости — пройти лечение, чтобы избежать распространения инфекции.
Меры профилактики:
- тщательное соблюдение личной гигиены и использование только индивидуальных гигиенических средств
- важно избегать использования общей немытой посуды
- во время приема пищи не пробуйте еду чужой ложкой и не откусывайте от общего куска, а лучше положите, отрежьте, отлейте свою порцию
- не давайте маленьким детям кушать с чужой ложки, следите за чистотой детской посуды, пустышек, бутылочек
- не целуйтесь с незнакомыми людьми, помните о том, что именно так инфекция очень легко попадает в организм
- пересмотрите образ жизни, не употребляйте алкоголь, не курите, старайтесь не находиться рядом с другим курящим человеком.
После проведения анализа на helicobacter pylori рекомендована консультация врача гастроэнтеролога, который определит:
- необходимость углубленного обследования
- необходимость скринингового обследования членов семьи
- необходимость и схему эрадикационной терапии Helicobacter Pylori
- необходимость и дату контрольного обследования после лечения.
Обратитесь к врачу гастроэнтерологу при появлении характерной симптоматики или в случае наличия заболеваний желудочно-кишечного тракта. Не занимайтесь самолечением!
Хеликобактерная инфекция — симптомы и диагностика в Москве клиника «Диамед»
Хеликобактерная инфекция (Helicobacter pylori) — спиралевидная грамотрицательная бактерия, которая инфицирует различные области желудка и двенадцатиперстной кишки. Многие случаи язв желудка и двенадцатиперстной кишки, гастритов, дуоденитов, и, возможно, некоторые случаи лимфом желудка и рака желудка связаны с инфицированием Helicobacter pylori.
Хеликобактерная инфекция: симптомы заражения
Если вас беспокоят:
- периодические болезненные ощущения в желудке;
- дискомфорт «под ложечкой»;
- изжога;
- тошнота;
- чувство переполненности желудка;
- обложенность языка;
- неприятный привкус во рту;
- отрыжка;
- повышенная кровоточивость десен;
- есть повод подумать о хеликобактерной агрессии против вашего организма.
Как можно определить наличие Helicobacter pylori?
Высокая точность диагностики достигается сочетанием различных методов. Существует несколько способов для определения присутствия Helicobacter pylori:
- Анализ крови. В ответ на инфицирование в организме образуются антитела, которые могут быть обнаружены с помощью анализа крови. Они свидетельствуют об инфекции, но анализ может быть ложноотрицательным при недавнем инфицировании и ложноположительным после успешного излечения;
- ФГДС. Во время осмотра желудка – эндоскопии – захватывается крошечный кусочек слизистой желудка (биоптат) и передают в лабораторию на анализ. Путем биопсии определяется наличие бактерии в желудке.
- Дыхательный тест. Оперативный тест, который проводят путем исследования химической реакции. Сначала пациент выдыхает в одну пробирку, затем выпивает специальный раствор (абсолютно безвредный и не имеющий резких вкусовых качеств) и выдыхает в другую пробирку. После этого в образцы добавляется диагностический раствор и анализируется реакция. Время проведения теста составляет около 30 минут. На сегодняшний день это самый актуальный способ выявления наличия бактерии.
Инфекция Helicobacter pylori (H. pylori) — Диагностика и лечение
Диагностика
Чтобы определить, есть ли у вас инфекция H. pylori , используются несколько тестов и процедур. Тестирование важно для обнаружения H. pylori , но также для проверки после лечения, чтобы убедиться, что он устранен.
Испытания стула. Самый распространенный тест стула для выявления H.pylori — это тест на антиген стула, который ищет чужеродные белки (антигены), связанные с инфекцией H. pylori в стуле. Антибиотики, препараты, подавляющие кислотность, известные как ингибиторы протонной помпы (ИПП) и субсалицилат висмута (пепто-бисмол), могут повлиять на точность этих тестов. Если у вас ранее был диагностирован и лечился от H. pylori , ваш врач обычно подождет не менее четырех недель после завершения лечения антибиотиками, чтобы проверить ваш стул.Если вы принимаете PPI , ваш врач попросит вас прекратить прием лекарств PPI за одну или две недели до теста. Этот тест доступен для взрослых и детей старше 3.
Лабораторный тест, называемый тестом полимеразной цепной реакции стула (ПЦР), может обнаружить инфекцию H. pylori в стуле и мутации, которые могут быть устойчивыми к антибиотикам, используемым для ее лечения. Этот тест более дорогой и может быть недоступен во всех медицинских центрах.Этот тест доступен для взрослых и детей.
Дыхательный тест. Во время проверки дыхания вы проглатываете таблетку, жидкость или пудинг, содержащие меченые молекулы углерода. Если у вас инфекция H. pylori , углерод выделяется при расщеплении раствора в желудке.
Ваше тело поглощает углерод и выводит его на выдохе. Вы выдыхаете в мешок, и ваш врач с помощью специального устройства обнаруживает молекулы углерода.
Как и в тестах на стул, PPI , субсалицилат висмута (пепто-бисмол) и антибиотики могут повлиять на точность этого теста. Если вы принимаете PPI , ваш врач попросит вас прекратить прием лекарств PPI за одну или две недели до теста. Если у вас ранее был диагностирован и лечился от H. pylori , ваш врач обычно подождет не менее четырех недель после завершения лечения антибиотиками, чтобы выполнить тест дыхания.Этот тест доступен для взрослых и детей.
Объем проверки. Перед этим тестом, известным как верхняя эндоскопия, вы получите успокоительное. Во время обследования врач вводит длинную гибкую трубку, снабженную крошечной камерой (эндоскопом), через горло и пищевод в желудок и двенадцатиперстную кишку. Этот инструмент позволяет вашему врачу просматривать любые нарушения в верхних отделах пищеварительного тракта и брать образцы тканей (биопсия). Эти образцы проанализированы на H.pylori инфекция.
Этот тест проводится для изучения симптомов, которые могут быть вызваны другими состояниями, такими как язва желудка или гастрит, которые могут быть вызваны H. pylori . Тест может быть повторен после лечения в зависимости от того, что было обнаружено при первой эндоскопии, или если симптомы сохраняются после лечения H. pylori . На этом втором обследовании можно выполнить биопсию, чтобы убедиться в удалении H. pylori . Если вам ранее был поставлен диагноз H.pylori , ваш врач обычно подождет не менее четырех недель после завершения лечения антибиотиками, чтобы выполнить тест дыхания. Если вы принимаете PPI , ваш врач попросит вас прекратить прием лекарств PPI за одну или две недели до теста.
Этот тест не всегда рекомендуется исключительно для диагностики инфекции H. pylori , потому что он более инвазивен, чем анализ дыхания или стула. Но его можно использовать для подробного тестирования врачей, чтобы точно определить, какой антибиотик назначить для лечения H.pylori , особенно если антибиотики неэффективны или исключают другие нарушения пищеварения.
Лечение
Инфекции H. pylori обычно лечат как минимум двумя разными антибиотиками одновременно, чтобы предотвратить развитие устойчивости бактерий к одному определенному антибиотику. Ваш врач также пропишет или порекомендует препараты, подавляющие кислотность, чтобы помочь заживлению слизистой оболочки желудка.
К лекарствам, подавляющим кислотность, относятся:
- Ингибиторы протонной помпы (ИПП). Эти препараты препятствуют выработке кислоты в желудке. Некоторыми примерами ИПП являются омепразол (Прилосек), эзомепразол (Нексиум), лансопразол (Превацид) и пантопразол (Протоникс).
- Блокаторы гистамина (H-2). Эти лекарства блокируют вещество, называемое гистамином, которое вызывает выработку кислоты. Одним из примеров является циметидин (Tagamet HB).
- Субсалицилат висмута. Этот препарат, более известный под торговой маркой «Пепто-Бисмол», действует, покрывая язву и защищая ее от желудочной кислоты.
Ваш врач может порекомендовать вам пройти тестирование на H. pylori как минимум через четыре недели после лечения. Если тесты показывают, что лечение было безуспешным, вы можете пройти еще один курс лечения с другой комбинацией антибиотиков.
Подготовка к приему
Обратитесь к своему лечащему врачу, если у вас есть признаки или симптомы, указывающие на осложнение H.pylori инфекция. Ваш врач может проверить и вылечить вас от инфекции H. pylori или направить вас к специалисту, который лечит заболевания пищеварительной системы (гастроэнтерологу).
Поскольку встречи могут быть короткими и часто есть что обсудить, хорошо подготовиться к встрече. Вот некоторая информация, которая поможет вам подготовиться к приему и чего ожидать от врача.
Что вы можете сделать
Во время записи на прием обязательно спросите, есть ли что-нибудь, что вам нужно сделать заранее, например, ограничить свой рацион.Перед встречей вы можете составить список, который отвечает на следующие вопросы:
- Когда у вас появились симптомы?
- Что-нибудь делает их лучше или хуже?
- Испытывали ли когда-нибудь подобные проблемы у ваших родителей, братьев и сестер?
- Какие лекарства или добавки вы принимаете регулярно?
Ваше время с врачом ограничено. Если вы подготовите список вопросов, это поможет вам максимально эффективно проводить время вместе.В отношении инфекции H. pylori вам следует задать врачу следующие основные вопросы:
- Как инфекция H. pylori вызвала те осложнения, которые у меня возникают?
- Может ли H. pylori вызвать другие осложнения?
- Какие тесты мне нужны?
- Требуют ли эти тесты специальной подготовки?
- Какие методы лечения доступны?
- Как я узнаю, сработало ли лечение?
Во время разговора задавайте дополнительные вопросы, которые возникают у вас на приеме.
Чего ожидать от врача
Ваш врач, скорее всего, задаст вам ряд вопросов. Если вы будете готовы ответить на них, у вас будет больше времени, чтобы обсудить другие вопросы, которые вы хотите затронуть. Ваш врач может спросить:
- Ваши симптомы были постоянными или случайными?
- Насколько серьезны ваши симптомы?
- Принимаете ли вы какие-либо безрецептурные болеутоляющие, такие как аспирин, ибупрофен (Адвил, Мотрин IB и др.) Или напроксен натрия (Алив)?
18 мая 2021 г.
Показать ссылки- Пептические язвы (язвы желудка).Национальный институт диабета, болезней органов пищеварения и почек. https://www.niddk.nih.gov/health-information/digestive-diseases/peptic-ulcers-stomach-ulcers/all-content. По состоянию на 9 января 2017 г.
- Papadakis MA, et al., Eds. Желудочно-кишечные расстройства. В: Текущая медицинская диагностика и лечение, 2017. 56-е изд. Нью-Йорк, штат Нью-Йорк: компании McGraw-Hill; 2017. http://www.accessmedicine.com. По состоянию на 9 января 2017 г.
- Инфекция Helicobacter pylori. Руководство Merck Professional Version.https://www.merckmanuals.com/professional/gastrointestinal-disorders/gastritis-and-peptic-ulcer-disease/helicobacter-pylori-infection. По состоянию на 6 мая 2021 г.
- Helicobacter pylori и рак. Национальный институт рака. https://www.cancer.gov/about-cancer/causes-prevention/risk/infectious-agents/h-pylori-fact-sheet. По состоянию на 9 января 2017 г.
- Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Американский колледж гастроэнтерологии.http://gi.org/guideline/management-of-helicobacter-pylori-infection/. По состоянию на 9 января 2017 г.
- Crowe SE. Бактериология и эпидемиология инфекции Helicobacter pylori. http://www.uptodate.com/home. По состоянию на 9 января 2017 г.
- Crowe SE. Показания и диагностические тесты при инфекции Helicobacter pylori. http://www.uptodate.com/home. По состоянию на 6 мая 2021 г.
- AskMayoExpert. Helicobacter pylori (взрослый). Клиника Майо; 2020.
Helicobacter pylori (H.pylori) инфекция
Диагностика инфекции Helicobacter pylori: текущие возможности и разработки
World J Gastroenterol. 2015 окт 28; 21 (40): 11221–11235.
Яо-Куанг Ван, Отделение внутренней медицины, Городская больница Сяо-Канг Гаосюн, Гаосюн 812, Тайвань
Яо-Куанг Ван, Чунг-Юнг Лю, Мэн-Чие Ву, Сян-Яо Ши, Софи С.В. Ван, Дженг -Yih Wu, Chao-Hung Kuo, Deng-Chyang Wu, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, Гаосюн 807, Тайвань
Fu-Chen Kuo, школа медицины, медицинский колледж, E-Da Больница, Университет И-Шоу, Гаосюн 824, Тайвань
Мэн-Чи Ву, Сян-Яо Ши, Дэн-Чьянг Ву, Отделение внутренней медицины, Городская больница Та-Тунг Гаосюна, Гаосюн 801, Тайвань
Софи С.В. Ван, Чао-Хун Куо, Дэн-Чьянг Ву, Рак для исследования стволовых клеток, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Софи С.В. Ван, Дэн-Чьянг Ву, Центр исследований инфекционных заболеваний и рака, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Яо-Кан Хуанг, отдел гастрономии энтерология, отделение внутренней медицины, больница Тен Чан, Чун-Ли, Таоюань 320, Тайвань
Вклад авторов: Ван ЮК написал эту рукопись; Kuo FC, Liu CJ, Wu MC, Shih HY, Wang SSW, Wu JY и Kuo CH разработали исследования; Хуан Ю.К. и Ву Д.К. полировали бумагу; Хуан Ю.К. и Ву Д.К. в равной степени внесли свой вклад в эту рукопись.Для корреспонденции: Deng-Chyang Wu, MD, PhD, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, 100 Tz-You 1st road, Kaohsiung 807, Taiwan. moc.oohay@uwhced
Телефон: + 886-7-3121101-7451 Факс: + 886-7-3135612
Поступила в редакцию 29 апреля 2015 г .; Пересмотрено 6 августа 2015 г .; Принято, 2015 г. 28 сентября.
Авторские права © Автор (ы) 2015 г. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Реферат
Точная диагностика инфекции Helicobacter pylori (H. pylori) — важнейшая составляющая эффективного лечения многих гастродуоденальных заболеваний. Для обнаружения H. pylori доступно несколько инвазивных и неинвазивных диагностических тестов, и каждый тест имеет свою полезность и ограничения в различных клинических ситуациях. Хотя ни один из них не может считаться единственным золотым стандартом в клинической практике, было разработано несколько методов, позволяющих получить более надежные результаты.Инвазивные тесты выполняются с помощью образцов эндоскопической биопсии, и эти тесты включают гистологию, посев, экспресс-тест на уреазу, а также молекулярные методы. Развитие эндоскопического оборудования также способствует диагностике H. pylori в режиме реального времени во время эндоскопии. Дыхательный тест на мочевину и тест на антиген стула являются наиболее широко используемыми неинвазивными тестами, в то время как серология полезна в скрининговых и эпидемиологических исследованиях. Молекулярные методы использовались в различных образцах, кроме слизистой оболочки желудка.Помимо выявления инфекции H. pylori , несколько тестов используются для оценки факторов вирулентности и чувствительности к антибиотикам H. pylori , а также для скрининга предраковых поражений и рака желудка. Целью этой статьи является обзор текущих возможностей и новых разработок диагностических тестов и их применения в различных клинических условиях или для конкретных целей.
Ключевые слова: Helicobacter pylori , Диагностика, Инвазивный, Неинвазивный, Пероральный образец, Кровотечение, Гастрэктомия, Искоренение
Основной наконечник: В настоящее время доступны несколько тестов для диагностики Helicobacter pylori (H. pylori ).pylori ) инфекция. В этом обзоре мы сосредоточимся на полезности и ограничениях современных диагностических методов, а также на последних разработках этих тестов, которые способствуют повышению диагностической точности. Кроме того, мы также подчеркиваем обнаружение H. pylori в образцах из полости рта и у пациентов с различными клиническими обстоятельствами, включая кровотечение, постгастрэктомию и постэрадикационную терапию.
ВВЕДЕНИЕ
Helicobacter pylori ( H.pylori ) является грамотрицательным микроаэробным патогеном человека, а инфекция H. pylori тесно связана со многими гастродуоденальными заболеваниями, включая хронический активный гастрит, язвенную болезнь, атрофический гастрит, лимфому лимфоидной ткани слизистой оболочки (MALT) и некардиальный рак желудка. . Инфекция H. pylori поражает более половины взрослого населения во всем мире, но распространенность инфекции H. pylori широко варьируется в зависимости от географического региона, возраста, расы и социально-экономического статуса.Обычно распространенность инфекции H. pylori увеличивается с возрастом в большинстве стран, однако в последние десятилетия при анализе временных тенденций в нескольких крупных популяциях наблюдалось снижение распространенности инфекции H. pylori [1]. Более 80% язвенной болезни вызывается инфекцией H. pylori , а предполагаемый риск развития язвенной болезни в течение жизни у пациентов, инфицированных H. pylori , составляет примерно 15% [2]. Рак желудка является третьей по значимости причиной смерти от рака во всем мире, а случаев H.pylori является причиной 74,7% всех случаев некардиального рака желудка [3,4]. Рак желудка и язвенная болезнь вместе вызывают более миллиона смертей в год в мире, и инфекция H. pylori всегда является важной проблемой для здоровья [5]. Для выявления инфекции H. pylori разработаны различные диагностические методы, и диагностические тесты с высокой чувствительностью и специфичностью, превышающей 90%, необходимы для точной диагностики инфекции H. pylori в клинической практике.Хотя сейчас доступно множество диагностических тестов, каждый метод имеет свои преимущества, недостатки и ограничения. Выбор того или иного метода может зависеть от наличия и доступности диагностических тестов, уровня лабораторий, клинического состояния пациентов и отношения вероятности положительных и отрицательных тестов при различных клинических обстоятельствах. Диагностические тесты обычно делятся на инвазивные (эндоскопические) и неинвазивные методы. Инвазивные диагностические тесты включают эндоскопическое изображение, гистологию, экспресс-тест на уреазу, культивирование и молекулярные методы.Неинвазивные диагностические тесты включали дыхательный тест на мочевину, тест на антиген стула, серологические и молекулярные исследования. В данной статье мы кратко рассмотрим текущие варианты и разработки диагностических тестов и связанных с ними приложений в клинической практике, а также выбор диагностических тестов для различных клинических состояний (таблица).
Таблица 1
Варианты диагностики инфекции Helicobacter pylori при различных клинических обстоятельствах и особые применения диагностических тестов
| Гастродуоденальное кровотечение | Постэктомия | Постэктомия | Особые области применения | |||||||||
| Экспресс-тест на уреазу | √ | |||||||||||
| Гистология | √ | |||||||||||
| Культура | Антибиотическая цепьАнтибиотическая цепь реакция | √ | √ | √Чувствительность к антибиотикам 287 | √ | |||||||
| Серология 1 | √ | √ | √ | √ Факторы вирулентности |
.pylori
-ассоциированные заболевания, такие как язвенная болезнь, атрофический гастрит, MALT-лимфома и рак желудка. Эндоскопия также является инструментом, обычно используемым для получения образцов, обычно слизистой оболочки желудка из биопсии, для дальнейших исследований других инвазивных тестов, включая экспресс-тест на уреазу, гистологию, посев и молекулярные методы. Антрум является предпочтительным местом биопсии для выявления инфекции H. pylori в большинстве случаев, но для избежания ложноотрицательных результатов пациентам с антральной атрофией или кишечной метаплазией предлагается биопсия тела по большей кривой [6,7].Неравномерное распределение H. pylori в желудке в различных клинических условиях неизбежно приводит к ошибкам отбора проб при исследованиях на основе биопсии, и было сделано несколько попыток диагностики инфекции H. pylori в режиме реального времени во время эндоскопического исследования.Большинство признаков слизистой оболочки желудка, таких как покраснение, отек слизистой оболочки или узелковое изменение, при обычной эндоскопии недостаточно специфичны для диагностики инфекции H. pylori и не имеют большого значения для точного диагноза [8].Хотя тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может повысить точность диагностики, но это может занять много времени и не дать лучших результатов, чем другие инвазивные тесты [9]. В дополнение к традиционной эндоскопии, хромоэндоскопия с феноловым красным также была оценена для диагностики инфекции H. pylori на основе специфической уреазной активности H. pylori . Однако этот метод не является надежным тестом из-за его низкой чувствительности (73% -81%) и низкой специфичности (76% -81%) [10,11].Эндоскопия с увеличением обеспечивает прямое наблюдение микроструктуры поверхности слизистой оболочки желудка, а эндоскопические изображения слизистой оболочки с высоким разрешением тесно связаны с гистопатологическими изменениями, включая инфекцию H. pylori . Чувствительность и специфичность для прогнозирования телесного гастрита с положительным результатом на H. pylori с помощью увеличительной эндоскопии с окрашиванием индигокармином составили 97,6% и 100% соответственно. Однако чувствительность и специфичность снизились до 88.4% и 75,0% соответственно у H. pylori -положительного антрального гастрита [12]. Конфокальная лазерная эндомикроскопия (CLE) — это еще один увеличительный эндоскопический метод, который обеспечивает подповерхностный анализ и in vivo, гистологическое исследование слизистой оболочки желудка во время эндоскопии. Три характеристики, включая белые пятна, нейтрофилы и микроабсцессы, основанные на данных CLE, были использованы для диагностики H. pylori , а точность, чувствительность и специфичность составили 92,8%, 89,2% и 95,7% соответственно [13].Увеличивающая узкополосная визуализация и I-сканирование также использовались для обнаружения инфекции H. pylori , но были представлены различные результаты [14–16]. Различные классификации характеристик изображений от увеличительной эндоскопии обеспечивают различную диагностическую точность, а точность эндоскопического теста также зависит от оператора, что означает, что его использование требует процесса обучения со стороны опытного супервизора и наличия оборудования от местного отделения эндоскопии [17-20]. Более того, тщательное обследование с использованием увеличения с использованием метода улучшения изображения или без него также требует много времени и может причинить больший дискомфорт пациенту, чем другие тесты на основе биопсии.Эти факторы обычно ограничивают клиническое использование увеличительной эндоскопии для выявления инфекции H. pylori в повседневной практике.
Гистология
Гистология обычно считается золотым стандартом при прямом обнаружении инфекции H. pylori , а также первым методом, используемым для обнаружения H. pylori . Однако на диагностическую точность гистологии влияет несколько факторов, таких как место, размер и количество биопсий, методы окрашивания, ингибитор протонной помпы (ИПП), антибиотики и опыт исследующего патолога.Использование ИПП может привести к противоречивым результатам гистологического исследования, поэтому рекомендуется отменить ИПП за 2 недели до проведения гистологического исследования [21]. Дополнительные образцы биопсии, собранные в соответствующем месте для анализа, могут уменьшить количество ошибок выборки и ложноотрицательных результатов в гистологическом тесте, а также в других тестах, основанных на биопсии. В клинической практике обычно рекомендуются биопсии как антрального отдела, так и тела, и получение как минимум двух биоптатов из антрального отдела и тела является наиболее разумной стратегией, гарантирующей максимальный диагностический результат [22,23].Как упоминалось выше, биопсия тела важна для диагностики H. pylori . на фоне атрофического гастрита [7].
Окрашивание является важной частью гистологического исследования, и несколько красок, таких как обычное окрашивание HE, окраска по Гимзе, Вартина-Старри, Hp серебром, толуидиновым синим, акридиновым оранжевым, Макмалленом, Гента, Дитерле и иммуногистохимическим окрашиванием, были использованы для обнаружения H pylori . Хотя иммуногистохимическое окрашивание является наиболее чувствительным и специфическим красителем, окрашивания HE обычно достаточно для диагностики H.pylori в повседневной клинической практике. Дополнительное окрашивание обычно рекомендуется для образцов биопсии, которые выявляют умеренный или тяжелый хронический гастрит, но не H. pylori , идентифицированные при окрашивании HE. Кроме того, иммуногистохимическое окрашивание должно быть первым выбором, если решено использовать вспомогательное окрашивание для обнаружения H. pylori [24,25]. Если иммуногистохимические окрашивания недоступны, окрашивание по Гимзе является предпочтительным методом в клинической практике, поскольку оно простое, высокочувствительное и менее затратное [26].
Пептидная флуоресцентная нуклеиновая кислота in situ Гибридизация (PNA-FISH), которую можно использовать на гистологических препаратах, является высокочувствительным (чувствительность 97%) и специфическим (специфичность 100%) методом диагностики H. pylori. инфекция. PNA-FISH может идентифицировать кокковидную форму H. pylori , которую обычно невозможно обнаружить при рутинном гистологическом исследовании, поскольку этот метод позволяет избежать индивидуальной предвзятости от морфологической идентификации. Кроме того, PNA-FISH — это быстрый, точный и экономичный метод обнаружения H.pylori устойчивость к кларитромицину в образцах биопсии желудка [27–29]. FISH также может сыграть потенциальную роль в обнаружении H. pylori в пробах окружающей среды, и дальнейшие исследования передачи и резервуаров H. pylori в окружающей среде могут быть проведены с использованием FISH [30,31]. Несмотря на преимущества обнаружения H. pylori и устойчивости к кларитромицину одновременно, недостатки PNA-FISH, такие как трудоемкая подготовка, требующая флуоресцентного микроскопа и специальных знаний для чтения слайдов, могут ограничивать широкое использование этого метода. .
БЫСТРЫЕ ИСПЫТАНИЯ МОЧЕИ
Для повседневной клинической практики экспресс-тест на уреазу (RUT) является наиболее полезным инвазивным тестом для диагностики инфекции H. pylori , поскольку он недорогой, быстрый, простой в выполнении, высокоспецифичный и широко доступный . Основываясь на активности фермента уреазы H. pylori , присутствие H. pylori в образце биопсии превращает реагент теста мочевины в аммиак, что приводит к увеличению pH и изменению цвета на мониторе pH.В настоящее время доступны несколько коммерческих тестов на уреазу, включая тесты на геле (CLOtest, HpFast), бумажные тесты (PyloriTek, ProntoDry) и тесты на жидкой основе (UFT300, EndoscHp), а различные коммерческие тестовые тестеры имеют разное время реакции для получения результатов. CLOtest обычно занимает 24 часа, чтобы получить точный результат, тогда как PyloriTek занимает 1 час, а UFT 300 — 5 минут, чтобы обеспечить более быстрые результаты. Считывание тестов на уреазу раньше рекомендованного времени может привести к ложноотрицательным результатам [32]. Помимо дизайна коммерческих наборов, плотность бактерий, присутствующих в образце биопсии, также влияет на время реакции и диагностическую точность RUT, в то время как для получения положительного результата RUT обычно требуется минимум 10000 организмов.Другие факторы, влияющие на диагностическую точность тестов на уреазу, включают антагонисты рецепторов H 2 , ИПП, соединения висмута, антибиотики, ахлоргидрию и наличие крови, все из которых увеличивают вероятность ложноотрицательных результатов. Кроме того, контаминация биоптатов формалином также снижает чувствительность RUT [21,33-35].
Обычно коммерческие экспресс-тесты на уреазу имеют специфичность выше 95% -100% и чувствительность выше 85% -95%. Увеличение количества биопсий антрального отдела желудка может повысить чувствительность RUT, и образцы двойной биопсии из тела желудка и антрального отдела предпочтительнее, чем образцы биопсии только антрального отдела желудка, поскольку дополнительная биопсия тела увеличивает диагностическую точность и позволяет избежать систематической ошибки выборки из-за неравномерного распределения H.pylori в желудке. Более того, объединение образцов антрального отдела и тела перед RUT, а не отдельных образцов, также увеличило чувствительность RUT и ускорило время реакции [32,36-39]. Перед RUT рекомендуется избегать приема лекарств, влияющих на активность уреазы, а плотность бактерий — для уменьшения ложноотрицательных результатов, например, 2 недели для ИПП и 4 недели для антибиотиков. Кровотечение значительно снижает чувствительность и специфичность RUT и делает RUT более ненадежным тестом, чем другие тесты в этом клиническом состоянии [40].В исследовании, посвященном оценке влияния различного количества и места биопсии на результаты RUT у пациентов с кровотечением из язвенной болезни, было показано, что четыре биопсии из антрального отдела или одна биопсия из тела увеличивают чувствительность RUT по сравнению с только одной биопсией из антрального отдела. В этом исследовании чувствительность одной биопсии антрального отдела составила 64%, тогда как чувствительность четырех биопсий антрального отдела и одной биопсии тела составила 74% и 73% соответственно [41]. Если для пациента с желудочно-кишечным кровотечением по-прежнему выбирается RUT, для повышения точности диагностики предлагалось выполнить биопсию как антрального отдела, так и тела.
Культура
Культивирование H. pylori из образца биопсии желудка — высокоспецифичный, но менее чувствительный метод. В целом, культивирование имеет почти 100% специфичность, но чувствительность культуры значительно варьируется, от 85% до 95%. Из-за деликатной и требовательной природы H. pylori для культивирования in vitro требуется определенная транспортная среда, среда для выращивания и среда для инкубации. Образцы биопсии можно хранить в транспортной среде, такой как Portagerm pylori или транспортная среда Стюарта, до 24 часов при 4 ° C.Для культивирования можно использовать несколько типов агара, поскольку H. pylori выделены. Обычно используемые среды включают агар Pylori, агар Скирроу, кровяной агар Columbia, агар Brucella, инфузию сердца мозга или соевый агар с триптиказой, дополненный кровью овцы или лошади. Чашки с агаром обычно инкубируют в микроаэробной среде (80-90% N 2 , 5-10% CO 2 , 5-10% O 2 ) при температуре от 35 до 37 ° C в течение не менее 5-7 дней, потому что H. pylori считается микроаэрофилом.Однако недавнее исследование показало, что росту H. pylori способствует уровень кислорода в атмосфере с присутствием 10% CO 2 , в результате чего появилась новая концепция, согласно которой H. pylori может быть капногильным аэробом [42]. Диагностика H. pylori из культуральной среды основана на морфологических характеристиках, а также положительных реакциях на уреазу, каталазу и оксидазу, что означает, что микробиологические лаборатории должны быть оборудованы и обучены для выделения этой бактерии.
Такие условия, как низкое качество образцов, отложенная транспортировка, воздействие аэробной среды или неопытного микробиолога, оказывают неблагоприятное влияние на производительность посева и снижают диагностическую точность [43].Недавнее исследование, проведенное в 26 больницах для анализа влияния времени транспортировки, а также температуры на скорость культивирования, показало, что положительная скорость культивирования снизилась до 26,3% в 48-часовой транспортной группе по сравнению с 32,8% в 24-часовой транспортной группе ( P <0,001 ). Это исследование также показало, что средняя температура повысилась с 4,7 ° C до 29,1 ° C во время транспортировки, что привело к снижению уровня положительных культур с 36,7% до 24,1% [44]. Недавнее развитие транспортной среды - это новая транспортная среда, транспортная среда GESA.Транспортная среда GESA представляет собой полутвердую среду, в которой образцы биопсии желудка могут храниться при 4 ° C в течение до 10 дней и обеспечивать поддающуюся количественной оценке степень восстановления H. pylori (90,7%) [45]. Для культивирования H. pylori в биопсии желудка был также разработан новый двухфазный тест, который сочетал селективный обогащающий бульон и биохимический тест с использованием агара с мочевиной в одном сосуде. В этом небольшом исследовании двухфазный тест был проведен на 55 образцах биопсии и показал 100% положительный прогностический клапан после 48 часов инкубации.Более того, этот метод имел более низкую частоту ложноположительных результатов и требовал более низкой бактериальной нагрузки, примерно 10 5 КОЕ / мл, по сравнению с CLOtest. В то же время этот тест можно было использовать в аэробных условиях и позволять культивирование, а также тестирование чувствительности к антибиотикам [46].
Факторы-хозяева, такие как высокая активность гастрита, низкая бактериальная нагрузка, кровотечение, употребление алкоголя и употребление H 2 — антагонистов рецепторов, ИПП, антибиотиков, оказывают отрицательное влияние на положительный результат посева.Эти препараты, за исключением антибиотиков, которых следует избегать по крайней мере за 4 недели, также рекомендуется избегать за 2 недели до посева. Чтобы избежать систематической ошибки при выборке из-за неоднородного распределения H. pylori в желудке, было рекомендовано как минимум 2 образца биопсии из антрального отдела и 2 образца биопсии из тела [47,48].
Хотя посев — трудоемкий, дорогой и трудоемкий тест для диагностики H. pylori , тест на чувствительность к антибиотикам H. pylori , полученный с помощью посева, является особым преимуществом в клинической практике.В соответствии с рекомендациями консенсусного отчета Маастрихт IV, культура H. pylori и определение чувствительности к антибиотикам следует проводить, если первичная резистентность к кларитромицину превышает 20% в данном географическом районе или после неэффективности лечения препаратами второй линии [21]. Кроме того, культивирование также позволяет изолировать H. pylori для дальнейшего анализа фенотипических и генотипических характеристик, чтобы лучше понять патогены и, следовательно, предложить оценку терапии.С ростом распространенности устойчивости к антибиотикам культивирование по-прежнему остается надежным методом лечения неэффективности лечения H. pylori , а также изучения устойчивости к антибиотикам в популяционных исследованиях до того, как другие молекулярные тесты станут более доступными.
Полимеразная цепная реакция
С момента применения полимеразной цепной реакции (ПЦР) для обнаружения инфекции H. pylori , ПЦР широко использовалась для диагностики H. pylori из образцов биопсии желудка, слюны, стула, желудочного сока. сок и разные экземпляры.ПЦР обеспечивает превосходную чувствительность и специфичность, превышающую 95%, по сравнению с другими традиционными тестами и дает более точные результаты обнаружения H. pylori у пациентов с кровотечением. Несколько генов-мишеней, включая UreA , glmM , UreC , 16S рРНК , 23S рРНК , HSP60 и VacA , были использованы для обнаружения H. различные консервативные гены-мишени могут повысить специфичность, что, в свою очередь, позволяет избежать ложноположительных результатов, особенно для образцов, отличных от образцов биопсии желудка.Другие преимущества ПЦР, в том числе меньшее количество бактерий, требуемых в образце, более быстрые результаты и отсутствие необходимости в специальных материалах для обработки или транспортировке, позволяют врачам принимать более быстрое и точное решение о лечении пациента. Кроме того, ПЦР также позволяет одновременно обнаруживать специфические мутации, приводящие к устойчивости к антибиотикам, такие как устойчивость к макролидам и фторхинолонам, и факторы вирулентности, такие как CagA и VacA [49-51].
По сравнению с методом разведения в агаре (Etest), который обычно считается золотым стандартом теста на чувствительность к антибиотикам, ПЦР в реальном времени (RT-PCR) имеет несколько преимуществ.Во-первых, использование фиксированной формальдегидом залитой парафином ткани желудка в ПЦР-тесте более удобно, быстро и чувствительно, чем использование свежего биоптата в Etest, более того, в этих условиях RT-PCR также показала не худшие результаты тестирования чувствительности к антибиотикам, чем Etest. Кроме того, ПЦР более надежна для выявления гетерорезистентного статуса, который часто приводит к ложноотрицательному результату в Etest, следовательно, ПЦР может предоставить более точную информацию для клиницистов перед началом лечения антибиотиками [52].В недавнем исследовании, в котором использовалась ОТ-ПЦР в фиксированных формалином и залитых парафином образцах для выявления инфекции H. pylori и ассоциированного статуса устойчивости к кларитромицину, изучалась эффективность четырехкомпонентной терапии на основе генотипической резистентности в качестве лечения первой линии для 385 пациентов с функциональная диспепсия. В этом исследовании у 136 пациентов (35,3%) была диагностирована инфекция H. pylori , а чувствительность ОТ-ПЦР и гистологического исследования составила 95,6% и 69,9% соответственно.Четырехкратная терапия цитратом калия висмута, рабепразолом, амоксициллином и кларитромицином использовалась для генотипически чувствительных пациентов, в отличие от генотипически резистентных пациентов лечили цитратом висмута калия, рабепразолом, амоксициллином и фуразолидоном. Авторы обнаружили, что уровень эрадикации составил 100% для пациентов с чувствительным к кларитромицину H. pylori и 94% для пациентов с устойчивым к кларитромицину H. pylori соответственно для анализа по протоколу [53].Во-вторых, ОТ-ПЦР также является удобным методом эпидемиологического исследования региональной степени устойчивости к антибиотикам в качестве руководства для эмпирического лечения первой линии. Кроме того, ОТ-ПЦР может обнаруживать точечные мутации, которые вызывают устойчивость к антибиотикам, а также обнаруживать изменение точечной мутации или появление новой мутации, что дает дополнительную информацию для эпидемиологических и молекулярных исследований взаимосвязи генотип-фенотип. Из-за возможного изменения мутаций, которые вызывают устойчивость к антибиотикам со временем, определение более 5 точечных мутаций при использовании методов на основе ПЦР важно для достижения хорошей точности при обнаружении устойчивости к антибиотикам [54-56].
Были описаны генетические мутации, вызывающие устойчивость к кларитромицину (23S рРНК), хинолонам ( gyrA ген), тетрациклину (16S рРНК), рифабутину ( rpoB ген) и амоксициллину ( pbp-1a в предыдущем гене). исследования и несколько коммерческих наборов, таких как набор MutaREAL H. pylori , анализ ПЦР в реальном времени ClariRes и система обнаружения АПФ Seeplex ClaR- H. pylori [57]. Однако точный механизм устойчивости к метронидазолу менее ясен, и гены восприимчивости, такие как rdxA и frxA, участвовали в предыдущих исследованиях с спорными результатами.Недавнее исследование с использованием секвенирования нового поколения Illumina для поиска мутаций-кандидатов на устойчивость к метронидазолу. Это исследование подтвердило, что мутации в гене rdxA играют основную роль в устойчивости к метронидазолу у H. pylori , а мутации в гене frxA могут усиливать устойчивость к метронидазолу только при наличии мутаций rdxA. Кроме того, новое открытие мутаций в гене rpsU может сыграть роль в устойчивости к метронидазолу для объяснения устойчивых к метронидазолу штаммов без мутаций в генах rdxA и frxA [58].Анализ GenoType HelicoDR — это молекулярный тест, сочетающий ПЦР и гибридизацию, позволяющий провести молекулярную дефекацию H. pylori , а также устойчивость к кларитромицину и фторхинолонам в течение 6 часов. В предыдущих исследованиях анализ GenoType HelicoDR с использованием штаммов бактерий или образцов биопсии желудка был высокоточным для устойчивости к кларитромицину с чувствительностью 94–100% и специфичностью 86–99% соответственно; Анализ GenoType HelicoDR также точен для устойчивости к фторхинолонам с чувствительностью 83% -87% и 95% -98.Специфичность 5% соответственно по сравнению с методом на основе культуры [59,60]. Однако недавнее исследование по оценке клинической применимости GenoType HelicoDR в Корее показало, что чувствительность и специфичность в отношении устойчивости к кларитромицину составляли только 55,0% и 80,0% соответственно. GenoType HelicoDR также не был точным для устойчивости к фторхинолонам, показывая чувствительность и специфичность 74,4% и 70,0% соответственно. Клиническая применимость GenoType HelicoDR для определения устойчивости к антибиотикам может иметь некоторые ограничения, которые требуют дальнейшего изучения [61].ОТ-ПЦР обычно используется для количественного определения ДНК H. pylori в образцах биопсии, но выполнение ОТ-ПЦР может быть проблемой для клинических лабораторий из-за дорогостоящих термоциклеров. Мультиплексная ПЦР на основе двойного примирования олигонуклеотидов (DPO) была разработана для обнаружения инфекции H. pylori и устойчивости к кларитромицину, и этот тест можно проводить в любом стандартном термоциклере, который стоит меньше, чем RT-PCR. Благодаря особой конструкции праймера DPO для амплификации рДНК H. pylori 23S и обнаружения наиболее распространенных мутаций, A2142G и A2143G, придающих устойчивость к кларитромицину, DPO-PCR оказалась быстрой и точной для H.pylori диагностика и определение чувствительности к кларитромицину с помощью биоптатов желудка [62,63]. Кроме того, недавнее исследование с использованием образцов тканей, обработанных RUT для оценки диагностической точности DPO-PCR, показало, что DPO-PCR имеет более высокую чувствительность, чем RUT и гистология, а DPO-PCR может обнаружить инфекцию H. pylori в RUT- отрицательные образцы, что означает, что этот тест может уменьшить ложноотрицательный результат и уменьшить необходимость повторного эндоскопического обследования.Степень согласованности DPO-PCR между образцами биопсии желудка и образцами, обработанными RUT, составила 94,4% [64].
Обнаружение факторов вирулентности с помощью ПЦР помогает оценить генетические вариации факторов вирулентности H. pylori и дает больше информации для понимания клинических различий между пациентами, инфицированными разными штаммами H. pylori . Несколько исследований показали, что наличие факторов вирулентности, таких как ген CagA и VacA , связано с более тяжелым воспалением желудка и более высокой распространенностью язвенной болезни и рака желудка [65–67].Ген А промотора язвы двенадцатиперстной кишки (DupA) также предполагалось связать с образованием язв, индуцированным H. pylori , но в предыдущих исследованиях сообщалось о противоречивых результатах, которые предположительно были вызваны несовпадением праймеров. Недавно разработанная ОТ-ПЦР со специальным праймером, разработанным на основе выравнивания всех 221 последовательностей гена DupA, была введена недавно для повышения скорости обнаружения гена DupA. Этот метод повысил уровень обнаружения до 64,2%, независимо от того, имели ли обычно используемые ПЦР уровень обнаружения между 29.От 9% до 37,8%. Авторы указали, что дизайн ПЦР оказал большое влияние на обнаружение фактора вирулентности, и обнаружение специфического аллеля DupA не то же самое, что обнаружение фактического гена DupA [68].
ПЦР также помогает обнаружить H. pylori в пробах окружающей среды для эпидемиологических исследований. Высокая распространенность H. pylori , обнаруженная в образцах питьевой воды с помощью ПЦР, предоставила дополнительную информацию о передаче H. pylori через питьевую воду [69].Более высокий уровень обнаружения заражения H. pylori в немытых овощах свидетельствует о том, что точное мытье овощей снижает загрязнение H. pylori [70]. ПЦР также использовалась для определения генотипирования H. pylori в овощах, и высокая степень сходства в образце генотипирования H. pylori среди образцов овощей и образцов человека позволила предположить, что овощи могут быть источниками бактерий [71].
За исключением более быстрых и высокоточных результатов ПЦР для обнаружения H.pylori и штаммы, устойчивые к антибиотикам, опасения по поводу стоимости, доступного местного оборудования и опыта в области молекулярных методов неизбежно влияют на возможность проведения ПЦР в местных лабораториях.
НЕИНВАЗИВНЫЕ ИСПЫТАНИЯ
Было сделано несколько попыток избежать использования эндоскопических методов диагностики по нескольким причинам. Прежде всего, эндоскопия — это инвазивная процедура, которая вызывает дискомфорт и не подходит для пациентов с тяжелыми сопутствующими заболеваниями или противопоказаниями. Кроме того, стоимость эндоскопии и дополнительные расходы на эндоскопию, такие как одноразовые щипцы и анестезия, могут быть высокими.И последнее, но не менее важное: систематическая ошибка выборки почти неизбежно встречается в методах, основанных на биопсии, из-за неравномерного распределения H. pylori в желудке.
Дыхательный тест на мочевину
Дыхательный тест на мочевину (UBT) используется уже почти 30 лет и до сих пор остается самым популярным и точным неинвазивным тестом для диагностики инфекции H. pylori . За счет уреазной активности H. pylori , 13 C- или 14 C-меченная мочевина, проглоченная пациентом, гидролизуется до меченого CO 2 в желудке, затем меченый CO 2 абсорбируется в желудке. кровь и выдыхаемый при дыхании, в котором можно измерить помеченный CO 2 .Хотя несколько факторов, включая пациента, бактерии и сам тест, влияют на результаты UBT, UBT — это высокоточный и воспроизводимый тест с чувствительностью и специфичностью около 95% при стандартных процедурах. Недавно опубликованный метаанализ для оценки диагностической точности UBT у взрослых пациентов с диспепсическими симптомами показал, что совокупная чувствительность составила 96% (95% ДИ: 0,95-0,97), а совокупная специфичность составила 93% (95% ДИ: 0,91-0,94). [72]. UBT также полезен для эпидемиологических исследований и для оценки эффективности эрадикационной терапии [21,73].Пациенту следует прекратить прием ИПП за 2 недели и антибиотик за 4 недели до обследования, чтобы избежать ложноотрицательных результатов [74]. Кровотечение также влияет на диагностическую точность UBT, и отсроченное UBT после восстановления после кровотечения обязательно для уменьшения ложноотрицательного результата [75]. Иногда, хотя и редко, присутствие в желудке других патогенов, продуцирующих уреазу, также вызывает ложноположительные результаты.
UBT — подходящий метод со многими преимуществами, такими как простой, неинвазивный и безопасный, для обнаружения H.pylori у педиатрических пациентов, хотя точность UBT у педиатрических пациентов не так хороша, как у взрослых пациентов, особенно для детей младше 6 лет, с чувствительностью и специфичностью от 75% до 100% [76].
13 C-UBT предпочтительнее 14 C-UBT, чтобы избежать воздействия радиации, хотя 14 C-UBT безопасен для детей и беременных женщин, потому что излучение от 14 C-UBT ниже чем радиация, полученная из окружающей среды.Однако из-за отсутствия дорогостоящего оборудования и возможности платить высокую стоимость в размере 13 C-UBT, 14 C-UBT более популярны в развивающихся странах. Диагностическая точность между 13 C-UBT и 14 C-UBT не отличается, и оба теста можно считать золотым стандартом среди различных неинвазивных тестов для диагностики инфекции H. pylori [77]. Существует два протокола, некапсулированный и инкапсулированный, которые используются для перорального введения 14 С-мочевины пациентам для H.pylori диагноз. Первоначально инкапсулированный 14 C-UBT был разработан, чтобы избежать проблемы гидролиза 14 C-мочевины под действием продуцирующей уреазу флоры полости рта, и этот метод устранил проблему ложноположительных результатов в пробах из раннего дыхания [78] . Тем не менее, быстрый транзит капсулы, содержащей 14 C-мочевину, из желудочного тракта или ее неполное рассасывание в желудке во время фазы сбора выдыхаемого воздуха приводит к инкапсулированию 14 C-UBT, возможно, не лучшим вариантом, чем протокол без капсул [79 ].В недавнем исследовании использовалась методика динамического сцинтискана для мониторинга судьбы капсулы в желудке и сравнивалась чувствительность между протоколами без инкапсулирования и инкапсулирования у 100 пациентов с диспепсией. Это исследование показало, что неинкапсулированный протокол имел более высокую чувствительность, чем инкапсулированный протокол, а чувствительность инкапсулированного и неинкапсулированного 14 C-UBT составляла 90,5% и 98,6% через 10 минут и 91,8% и 97,2% через 15 минут соответственно. Неполное разрешение или отсутствие разрешения капсулы 14 C-мочевины в желудке во время фазы сбора выдыхаемого воздуха, отмеченное динамическими изображениями сцинтискана, послужило объяснением более низкой чувствительности инкапсулированного 14 C-UBT по сравнению с неинкапсулированным 14 C-UBT [80].
Точное значение отсечения для значения дельта по сравнению с исходным уровнем (DOB) для различения между H. pylori -положительными и H. pylori -отрицательными результатами является другой спорной проблемой. Отсечной клапан для UBT был первоначально определен как 5,0, что было наиболее широко рекомендовано, тогда как более низкие значения, 3,0 или 3,5, также были предложены для повышения его точности без ущерба для чувствительности и специфичности этого теста. «Серая зона», в которой результаты UBT неубедительны, упоминалась в предыдущих исследованиях, и пограничное значение DOB, например, очень близкое к выбранной точке отсечения, следует интерпретировать с осторожностью [81].Недавно был представлен новый метод UBT с использованием интегрированной системы выходной спектроскопии с оптическим резонатором, обеспечивающей оптимальную диагностическую точку отсечки. Этот предварительный тест определил диагностическую точку отсечения как совокупный процент восстановленной дозы 13 C (c-PDR) = 1,47% через 60 минут и продемонстрировал 100% чувствительность и 100% специфичность с точностью 100% по сравнению с инвазивной эндоскопией. тесты. Однако в этом исследовании используется небольшое количество образцов, и для подтверждения этих результатов необходимы дальнейшие более масштабные исследования [82].
STOOL ANTIGEN TEST
Тест на антиген кала (SAT) — другой неинвазивный метод с хорошей чувствительностью и специфичностью, 94% и 97% соответственно в глобальном метаанализе, при диагностике инфекции H. pylori [83]. Этот метод определяет присутствие H. pylori антигена в образцах стула. Существует два типа SAT, используемых для обнаружения H. pylori, методы, основанные на иммуноферментном анализе (EIA) и иммунохроматографическом анализе (ICA), с использованием либо поликлональных антител, либо моноклональных антител.В настоящее время доступно множество SAT для диагностики инфекции H. pylori , и различная диагностическая точность показана в разных исследованиях с разными SAT и разным дизайном исследований. В целом тесты на основе моноклональных антител более точны, чем тесты на основе поликлональных антител [83], а тесты на основе EIA обеспечивают более надежные результаты, чем тесты на основе ICA [84,85]. В недавнем исследовании EIA на антиген Tesmate pylori (TPAg) с использованием моноклональных антител для проверки нативной каталазы H. pylori было выявлено 92.4% чувствительность и 100% специфичность у взрослых по сравнению с ОТ-ПЦР, а точность этого теста составила 94,9% [86]. Тест Premier Platinum HpSA Plus, другой моноклональный тест на основе EIA, также показал надежные диагностические результаты с чувствительностью 92,2%, специфичностью 94,4% и точностью 93,4% для диагностики инфекции H. pylori по сравнению с другими 4 тестами SAT, включая 1 моноклональный На основе EIA (тест на антиген H. pylori ), на основе 2 моноклональных ICA (тест ImmunoCard STAT! HpSA и H.pylori фекального антигена) и 1 теста на основе поликлонального ICA (одноэтапный тест на антиген H. pylori ), точность которых была ниже 90% [84]. Однако тесты на основе ICA просты в выполнении и не требуют специального оборудования, что делает его подходящим для тестирования в офисе и в развивающихся странах. Новый тест SAT на основе моноклональных ICA, Atlas H. pylori Antigen Test, также был недавно представлен и обеспечивает лучшие результаты, чем предыдущие SAT на основе моноклональных ICA, с 91.Чувствительность 7%, специфичность 100% и точность 96,6% [87].
Помимо UBT, SAT на основе моноклонального EIA также является надежным тестом, рекомендованным руководящими принципами для оценки эффективности эрадикационной терапии H. pylori , и время для тестирования после окончания лечения должно составлять не менее 4 недель [21 , 88]. В предыдущем метаанализе совокупная чувствительность и специфичность моноклонального SAT для подтверждения эрадикации после терапии составляли 93% и 96% соответственно [83]. В недавних исследованиях было подтверждено, что SAT на основе моноклональных EIA является полезным и точным инструментом для определения результатов H.pylori с чувствительностью 91,6–100% и специфичностью 93,6–98,4% [89, 90]. Кроме того, моноклональные тесты SAT на основе ICA, RAPID Hp StAR и ImmunoCard STAT! HpSA также дает многообещающие результаты с чувствительностью 90,0–100% и специфичностью 93,6–94,9%.
В дополнение к оценке эрадикационной терапии, моноклональный САТ является удобным, неинвазивным и полезным тестом для диагностики инфекции H. pylori у педиатрических пациентов [91]. Исследование с применением SAT у детей в возрасте от 6 до 30 месяцев показало надежные результаты SAT для диагностики H.pylori у детей раннего возраста [92]. Недавний метаанализ, включающий 45 исследований и 5931 пациента, для оценки эффективности SATS у детей показал, что совокупная чувствительность и специфичность составили 92,1% и 94,1% соответственно. В анализе подгрупп чувствительность и специфичность моноклонального SAT, поликлонального SAT и одноэтапного быстрого моноклонального SAT составила 96,2% и 94,7%, 88,0% и 93,0% и 88,1% и 94,2% соответственно. Моноклональная SAT — надежный тест для диагностики инфекции H. pylori у детей [93].Более того, SAT — полезный инструмент для программ эпидемиологического исследования и скрининга [94,95]. По стоимости и оснащению SAT больше подходит для массовых опросов, чем UBT. По сравнению с серологическими тестами, которые обычно используются для скрининга, SAT дает более надежные результаты в диагностике инфекции H. pylori . Однако предыдущее исследование показало, что SAT был менее точным, чем серологический тест у пациентов с тяжелым атрофическим гастритом, и влияние этого результата требует дальнейшей оценки для оценки роли SAT в скрининге H.pylori -ассоциированные заболевания, такие как рак желудка [96]. В то время как другое исследование с использованием нового SAT на основе поликлонального EIA (EZ-STEP H. pylori ) обнаружило наличие атрофического гастрита и / или кишечной метаплазии, которые существенно не повлияли на результаты SAT [97].
На точность SAT влияет несколько факторов, таких как антибиотик, ИПП, N-ацетилцистеин, дефекация и кровотечение из верхних отделов желудочно-кишечного тракта. Сохранность образца, такая как температура и время транспортировки перед испытанием, а также отсечной клапан также влияют на диагностическую точность SAT [98-100].
ИСПЫТАНИЯ НА ОСНОВЕ АНТИТЕЛ
Для диагностики H. pylori широко доступны многочисленные серологические тесты, основанные на обнаружении антител IgG к H. pylori, и тест EIA является наиболее распространенным и точным методом среди них. Серологические тесты также часто используются при скрининге для эпидемиологических исследований из-за их недорогой, быстрой и приемлемости для пациентов. Кроме того, серологический тест полезен для оценки инфекции H. pylori у детей.Недавнее исследование с использованием E-Plate, коммерческого набора сывороточных антител, для сравнения эффективности серологического теста с SAT у 73 детей показало, что чувствительность, специфичность и отношение правдоподобия для серологического теста составили 91,2%, 97,4% и 35,6%. , соответственно. Эти результаты были получены при использовании запорного клапана, рекомендованного для взрослых, у детей [101]. Поскольку точность серологических тестов зависит от антигена, используемого в коммерческом наборе, и степени распространенности конкретных штаммов H. pylori , используемых в качестве источника антигена.Надлежащие антигены, используя либо местные штаммы в качестве источника антигена, либо объединяющие антигены из штаммов разных групп, а также надежное пороговое значение серологического теста должны быть проверены на местном уровне перед исследованием популяции [102,103]. Некоторые иммуногенные белки, такие как CagA, VacA, UreA, Omp и GroEL, были использованы в качестве кандидатов для обнаружения инфекции. Белок H. pylori FliD, важный элемент в сборке функциональных жгутиков, также признан новым маркером для серологической диагностики H.pylori с чувствительностью и специфичностью 99% и 97% соответственно [104]. Недавно для серологической диагностики инфекции H. pylori был введен новый метод иммуноанализа «РекомЛайн H. pylori » с использованием шести высокоиммуногенных факторов вирулентности (CagA, VacA, GroEL, gGT, HcpC и UreA). В отличие от EIA и иммуноблоттинга, RecomLine позволяет идентифицировать специфический ответ антител против различных антигенов H. pylori и увеличивает дискриминирующую способность.По сравнению с гистологией, рекомЛайн показала чувствительность и специфичность 97,6% и 96,2% соответственно. РекомЛайн также является полезным инструментом для идентификации специфических факторов вирулентности H. pylori [105,106].
Другое преимущество серологического теста заключается в том, что на точность серологических тестов не влияют язвенное кровотечение, атрофия желудка, а также использование ИПП или антибиотиков, которые вызывают ложноотрицательные результаты в других инвазивных или неинвазивных тестах. Однако серологический тест не является надежным тестом для оценки эрадикационной терапии, поскольку уровни антител могут сохраняться в крови в течение длительных периодов времени даже после успешной эрадикации [21].Поскольку серологические тесты не различают активную инфекцию и прошлое воздействие H. pylori , перед эрадикационной терапией требуется дополнительное подтверждение другими тестами.
Как и SAT, серологические тесты на основе EIA имеют лучшую точность, чем тесты на основе ICA. Недавнее исследование, сравнивающее 29 коммерческих серологических тестов (17 на основе EIA и 12 на основе ICA), показало, что точность 9 из 17 тестов на основе EIA была выше 90%, тогда как только один из 12 тестов на основе ICA имел точность> 90 %.Гетерогенные характеристики также наблюдались между различными серологическими тестами, выявление чувствительности варьировалось от 57,8% до 100%, а специфичность варьировалась от 58,7% до 96,8% в тестах на основе EIA; Чувствительность варьировала от 55,6% до 97,8%, а специфичность — от 60,3% до 96,8% в тестах на основе ICA. Серологические тесты следует выбирать правильно в соответствии с их конкретными рабочими параметрами для достижения различных целей, таких как скрининг, первоначальный диагноз или подтверждение другого теста [107].
Серологический тест также играет важную роль в изучении факторов патогенеза и вирулентности, поскольку некоторые антигенные белки могут быть обнаружены иммунологическими методами и имеют дополнительную диагностическую ценность.Было предпринято несколько попыток найти потенциальные биомаркеры для идентификации пациента, инфицированного штаммом H. pylori высокого риска, с помощью серологических тестов. Уровни пепсиногена (PG) I, PG II и соотношения PG I / II в сочетании с антителом H. pylori широко используются для прогнозирования атрофического гастрита и риска рака желудка [108,109]. Соотношение PG I / II также может быть полезно для наблюдения за раком желудка у пациентов после эрадикационной терапии [110]. Однако получены противоречивые результаты по клиническому применению этих серологических препаратов.Недавнее исследование, оценивающее точность GastroPanel, который измеряет гастрин-17, антитела H. pylori , PG I и PG II, для выявления атрофического гастрита, показало только 50% чувствительность и 80% специфичность, что было хуже, чем в предыдущих исследованиях [111 ]. Пепсиногеновый тест также оказался недостаточно точным для диагностики рака желудка с чувствительностью 71,0% и специфичностью 69,2% [112]. Некоторые факторы вирулентности также были оценены для прогнозирования заболеваний, ассоциированных с H. pylori .Присутствие сывороточных антител CagA, VacA и GroEL у пациентов с инфекцией H. pylori связано с предраковыми поражениями желудка, а также с раком желудка, и эти сывороточные маркеры могут служить потенциальными предикторами для пациентов, инфицированных штаммами высокого риска, которые могут быть связано с развитием рака желудка [106,113]. Хотя связь между факторами вирулентности и клиническими проявлениями была обнаружена в ходе предыдущих эпидемиологических исследований, серологические тесты все еще недостаточно надежны для диагностики рака желудка.В недавнем метаанализе совокупная чувствительность и специфичность антител CagA, используемых для диагностики рака желудка, составила 71% и 40% соответственно, а диагностическое отношение шансов составило 2,11 [114].
Обнаружение H. pylori IgG в моче также оценивалось у детей в предыдущих исследованиях, однако были представлены различные результаты [115,116]. Кроме того, диагностическая точность теста на основе ИФА для выявления IgG в слюне H. pylori также была недостаточной в качестве надежного теста [117,118].Определение антител в моче или слюне менее точное, чем другие тесты, и его не рекомендуется использовать при ведении пациентов [119].
ДИАГНОСТИКА
H. PYLORI В ДРУГИХ ОБРАЗЦАХИспользование ПЦР для обнаружения H. pylori в кале является надежным и быстрым методом, особенно привлекательным для детей в качестве неинвазивного теста. ПЦР стула также дает преимущества в идентификации конкретных генотипов и устойчивости микроорганизмов к антибиотикам [120,121].Полость рта считается внегастральным резервуаром H. pylori , хотя значение H. pylori в полости рта как источника повторного инфицирования или пути передачи все еще неясно. Слюна и зубной налет были образцами, обычно используемыми для обнаружения H. pylori в полости рта, а ПЦР была наиболее распространенным и надежным тестом, используемым в недавних исследованиях. RUT и посев также были выполнены для выявления орального H. pylori в ранних исследованиях.Распространенность обнаружения H. pylori в полости рта сильно варьировала, от 0% до 100%, и обычно обнаруживалась более низкая распространенность в слюне по сравнению с зубным налетом [122]. Широкие различия в распространенности H. pylori в полости рта могут быть связаны с разными методологиями, разными популяциями и разными праймерами, использованными в исследованиях. Недавние исследования были сосредоточены на модификации праймера для повышения диагностической точности или оценке нового метода преодоления ограничений ПЦР.Недавно была разработана новая система ПЦР с использованием наборов праймеров, специфичных для H. pylori на основе высококонсервативных последовательностей полных геномов 48 штаммов H. pylori , для повышения диагностической точности ПЦР в полости рта [123] . Петлевая изотермическая амплификация (LAMP), новый метод высокоспецифичной и чувствительной амплификации ДНК, сравнивалась с ПЦР по скорости обнаружения H. pylori в образцах зубного налета в небольшом исследовании, в котором приняли участие 45 участников.Это исследование показало, что LAMP имеет более высокий уровень обнаружения, чем ПЦР, и уровень обнаружения H. pylori в образцах зубного налета с помощью LAMP и ПЦР составляет 66,67% и 44% соответственно [124].
ДИАГНОСТИКА
H. PYLORI ПРИ ОСОБЫХ КЛИНИЧЕСКИХ ОБСТОЯТЕЛЬСТВАХКак упоминалось ранее, кровотечение из верхних отделов желудочно-кишечного тракта (UGIB) снижает диагностическую точность многих тестов, включая инвазивные и неинвазивные, для выявления инфекции H. pylori . В предыдущем метаанализе RUT, гистология и культура показали низкую чувствительность и высокую специфичность у пациентов с UGIB.UBT по-прежнему оставался надежным тестом, тогда как SAT стал менее точным в этих клинических условиях. Хотя UGIB не повлиял на серологический анализ, его нельзя рекомендовать в качестве первого диагностического теста на инфекцию H. pylori [40]. При сравнении CLO, культуры и гистологии, гистология была меньше подвержена влиянию язвенного кровотечения и могла быть надежным тестом даже в присутствии крови [125]. ПЦР имела значительно более высокую чувствительность, чем RUT, гистология и культура, с чувствительностью 91%, 66%, 43% и 37% соответственно и показала аналогичную чувствительность по сравнению с серологией и UBT, 94% и 94% соответственно.ПЦР была аналогична UBT по диагностической точности для выявления инфекции H. pylori в кровоточащих пептических язвах. Однако специфичность ПЦР (100%) превосходила только серологию (65%) и не отличалась от других тестов (RUT: 95%, гистология: 95%, культура: 100%, UBT: 85%) [126]. Исследование также показало, что ОТ-ПЦР может выявить инфекцию H. pylori с использованием фиксированных формалином образцов биопсии, залитых парафином, гистология которых показала отрицательные результаты у пациентов с кровотечением из язвенной болезни [127].Ликвидация H. pylori важна для лечения язвенного кровотечения, связанного с H. pylori , с целью предотвращения дальнейшего кровотечения, а успешная эрадикационная терапия даже более эффективна, чем длительная поддерживающая антисекреторная терапия с ИПП для уменьшения повторного кровотечения. Тестирование на основе биопсии H. pylori обычно рекомендуется во время эндоскопического исследования UGIB, даже если кровотечение снижает чувствительность тестов на основе биопсии. По результатам мета-регрессионного исследования, отложенный тест, через 4 недели после эпизода UGIB, имел более высокий уровень обнаружения H.pylori у пациентов с УГИБ. Поскольку точное определение этиологии кровоточащих язв имеет решающее значение при лечении язвенных кровотечений, в руководствах также рекомендовано подтверждение отрицательного результата с помощью последующего неинвазивного теста [22,128,129]. Низкая прогностическая ценность отрицательного результата была также обнаружена, когда UBT проводился сразу после экстренной эндоскопии, и тест задержки также был обязательным для всех отрицательных результатов раннего UBT [75]. Несмотря на важность тестирования H. pylori у пациентов с UGIB, доля пациентов, получивших прямое лечение H.pylori было прекращено, около 12% -60% отметили по результатам предыдущих исследований. Опасения по поводу снижения чувствительности, связанной с кровотечением или применением ИПП, и повышенным риском побочных эффектов, связанных с биопсией желудка или увеличением времени процедуры для выполнения биопсии желудка, могут повлиять на решения клиницистов о тестировании H. pylori [130].
Диагностика H. pylori у пациентов с частичной гастрэктомией — еще одна проблема, которой уделялось меньше внимания, поскольку эти пациенты составляли очень небольшую часть населения в целом.В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной гастрэктомией, гистология показала лучшие результаты, за ней следовала RUT, тогда как UBT имела низкую диагностическую точность. Эти исследования показали высокую степень гетерогенности, а совокупная чувствительность и специфичность гистологии, RUT и UBT составили 93% и 85%; 79% и 94%; 77% и 89% соответственно. RUT был предложен в качестве первоначального выбора теста для этих пациентов, и были рекомендованы образцы биопсии из дна желудка или верхней части остаточного желудка.Гистологическое исследование было рекомендовано этим пациентам после отрицательного результата РУТ [131]. SAT может быть другим надежным тестом для обнаружения H. pylori у пациентов с дистальной гастрэктомией. Небольшое исследование с использованием теста HpSA для оценки диагностической точности SAT у 59 пациентов с дистальной резекцией желудка по поводу рака желудка показало, что чувствительность, специфичность и точность теста HpSA составляли 100%, 90,5% и 96,6% соответственно [132]. Возможная причина неадекватного выполнения УБТ при диагностике H.pylori у пациентов с дистальной резекцией желудка может быть недостаточно времени для того, чтобы мочевина оставалась в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori . BreathID, быстрый непрерывный UBT в реальном времени, казалось, преодолел этот недостаток и показал лучшую точность, чем RUT, 87% и 72% соответственно. Однако в этом исследовании также была обнаружена более низкая чувствительность и специфичность RUT, 82% и 71% соответственно, по сравнению с предыдущими исследованиями, и биопсия, взятая из тела желудка немного дистальнее глазного дна, в этом исследовании может повлиять на диагностические характеристики RUT [133 ].Недавнее исследование также продемонстрировало противоречивые результаты между UBT и биопсийными тестами у пациентов с частичной гастэктомией после эрадикационной терапии H. pylori . Авторы предположили, что дополнительные тесты на основе эндоскопической биопсии помогут избежать ненужного лечения, поскольку у этих пациентов после эрадикационной терапии были обнаружены высокий уровень ложноположительных результатов и низкая прогностическая ценность UBT, 19,1% и 44,7% соответственно [134].
Точное определение статуса H. pylori у пациентов после эрадикационной терапии имеет важное значение, и UBT, а также SAT рекомендуются руководящими принципами для оценки эффективности эрадикационной терапии.Эти тесты обычно рекомендуется проводить более чем через 4 недели после окончания терапии [21,88]. Однако высокий уровень ложноположительных результатов в 52,9% был обнаружен при использовании 13 C-UBT с текущим пороговым значением (2,5 ‰), особенно у пациентов с более чем двукратной предыдущей эрадикационной терапией и у пациентов с умеренной и тяжелой кишечной метаплазией желудка [ 135]. Недавнее исследование с использованием вложенной ПЦР для обнаружения H. pylori в образцах биопсии желудка после эрадикационной терапии показало, что вложенная ПЦР более чувствительна, чем RUT, гистология и культура.Кроме того, метод, основанный на ПЦР, позволяет отличить реинфекцию или рецидив после эрадикационной терапии [136].
ЗАКЛЮЧЕНИЕ
Развитие современных методов диагностики позволяет более точно диагностировать инфекцию H. pylori , что, в свою очередь, улучшает лечение заболеваний, связанных с H. pylori- . Хотя теста золотого стандарта может не существовать, выбор теста для выявления инфекции H. pylori зависит от распространенности и штамма H.pylori о эндемичных регионах, доступности, преимуществах и недостатках каждого метода, а также о различных клинических обстоятельствах каждого пациента. Объединение результатов двух или более тестов может быть разумной стратегией в повседневной клинической практике для достижения наиболее надежного результата. Мы полагаем, что будут продолжаться попытки улучшить диагностическую ценность инфекции H. pylori для различных клинических целей, конкретных популяций и генотипических характеристик, чтобы иметь более надежные и осуществимые методы диагностики H.pylori в будущем.
Сноски
При поддержке (частично) грантов Медицинского университета Гаосюн «Грант для лучших университетов», гранты № KMU-TP104G00, № KMU-TP104G03 и № KMU-TP104E25; и Общая больница Тен Чан, совместный исследовательский проект Чун-Ли и КМУ, № ST102004; и больница Гаосюнского медицинского университета, № KMUh200-0R01.
Заявление о конфликте интересов: у авторов нет конфликта интересов, о котором следует сообщать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана штатным редактором и полностью рецензирована внешними рецензентами.Он распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях. См .: http://creativecommons.org/licenses/by-nc/4.0/
Рецензирование началось: 12 мая 2015 г.
Первое решение: 13 июля 2015 г.
Статья в печати: 30 сентября 2015 г.
P- Рецензент: Tosetti C S- Редактор: Ma YJ L- Редактор: A E- Редактор: Zhang DN
Ссылки
1.Пелетейро Б., Бастос А., Ферро А., Лунет Н. Распространенность инфекции Helicobacter pylori во всем мире: систематический обзор исследований с национальным охватом. Dig Dis Sci. 2014; 59: 1698–1709. [PubMed] [Google Scholar] 2. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 3. Фок КМ. Обзорная статья: эпидемиология и профилактика рака желудка.Алимент Pharmacol Ther. 2014; 40: 250–260. [PubMed] [Google Scholar] 4. де Мартель С., Ферли Дж., Франчески С., Винья Дж., Брей Ф., Форман Д., Пламмер М. Глобальное бремя рака, связанное с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол. 2012; 13: 607–615. [PubMed] [Google Scholar] 5. Axon A. Helicobacter pylori и общественное здравоохранение. Helicobacter. 2014; 19 Приложение 1: 68–73. [PubMed] [Google Scholar] 6. Ли Дж.Х., Пак Й.С., Чхве К.С., Ким до Х., Чой К.Д., Сон Х.Д., Ли Г.Х., Чан С.Дж., Чон Х.Й., Ким Дж.Х. Оптимальное место биопсии для обнаружения Helicobacter pylori во время эндоскопической мукозэктомии у пациентов с обширной атрофией желудка.Helicobacter. 2012; 17: 405–410. [PubMed] [Google Scholar] 7. Лан Х.С., Чен Т.С., Ли А.Ф., Чанг Ф.Й., Лин Х.С. Дополнительная биопсия тела позволяет выявить инфекцию Helicobacter pylori на фоне гастрита с атрофией. BMC Gastroenterol. 2012; 12: 182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Като Т., Яги Н., Камада Т., Шимбо Т., Ватанабе Х., Ида К. Диагностика инфекции Helicobacter pylori в слизистой оболочке желудка по эндоскопическим признакам: многоцентровое проспективное исследование. Dig Endosc. 2013; 25: 508–518.[PubMed] [Google Scholar] 9. Чо Дж.Х., Чанг Ю.В., Чан Дж.Й., Шим Дж.Дж., Ли СК, Донг С.Х., Ким ХДЖ, Ким Б. Тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может предсказать статус инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 279–284. [PubMed] [Google Scholar] 10. Чо Ю.С., Чае Х.С., Чан С.Н., Ким Дж.С., Сон Х.С., Ким Х.К., Ким Б.В., Хан С.В., Чой К.Й., Ли Х.К. и др. Сравнение дыхательного теста с 13C-мочевиной и эндоскопического теста pH слизистой оболочки феноловым красным при количественной оценке нагрузки инфекции Helicobacter pylori.Korean J Intern Med. 2008. 23: 134–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Hernández-Garcés HR, Castellanos-González VV, González-Fabián L, Infante-Velázquez M, Peña K, Andrain-Sierra Y. Хромоэндоскопия с красным фенолом в диагностике инфекции Helicobacter pylori. Rev Esp Enferm Dig. 2012; 104: 4–9. [PubMed] [Google Scholar] 12. Гонен С., Симсек И., Сариоглу С., Акпинар Х. Сравнение увеличительной эндоскопии с высоким разрешением и стандартной видеоэндоскопии для диагностики гастрита Helicobacter pylori в рутинной клинической практике: проспективное исследование.Helicobacter. 2009; 14: 12–21. [PubMed] [Google Scholar] 13. Цзи Р, Ли YQ, Гу ХМ, Ю Т, Цзо XL, Чжоу СиДжей. Конфокальная лазерная эндомикроскопия для диагностики инфекции Helicobacter pylori: проспективное исследование. J Gastroenterol Hepatol. 2010. 25: 700–705. [PubMed] [Google Scholar] 14. Яги К., Сака А., Нодзава Ю., Накамура А. Прогнозирование статуса Helicobacter pylori с помощью обычной эндоскопии, узкополосной визуализации с увеличением эндоскопии в желудке после эндоскопической резекции рака желудка. Helicobacter. 2014; 19: 111–115.[PubMed] [Google Scholar] 15. Ци QQ, Zuo XL, Li CQ, Ji R, Li Z, Zhou CJ, Li YQ. Эндоскопия с увеличением высокого разрешения с i-scan в диагностике инфекции Helicobacter pylori: пилотное исследование. J Dig Dis. 2013; 14: 579–586. [PubMed] [Google Scholar] 16. Лю Х, Ву Дж, Линь XC, Вэй Н, Лин В, Чанг Х, Ду ХМ. Оценка диагнозов поражений антрального отдела желудка с помощью увеличительной эндоскопии с узкополосной визуализацией у населения Китая. Dig Dis Sci. 2014; 59: 1513–1519. [PubMed] [Google Scholar] 17. Яги К., Накамура А., Секин А.Сравнение результатов эндоскопии с увеличением и результатов гистологического, посевного и уреазного теста слизистой оболочки тела желудка. Эндоскопия. 2002; 34: 376–381. [PubMed] [Google Scholar] 18. Накагава С., Като М., Симидзу Ю., Накагава М., Ямамото Дж., Луис П.А., Кодаира Дж., Каварасаки М., Такеда Х., Сугияма Т. и др. Связь между гистопатологическим гастритом и микроваскуляризацией слизистой оболочки: наблюдения с увеличительной эндоскопией. Gastrointest Endosc. 2003. 58: 71–75. [PubMed] [Google Scholar] 19. Кавамура М., Секин Х., Абэ С., Сибуя Д., Като К., Масуда Т.Клиническое значение белых отверстий желудочных крипт, наблюдаемых при увеличительной эндоскопии. Мир Дж. Гастроэнтерол. 2013; 19: 9392–9398. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ватанабе К., Нагата Н., Симбо Т., Накашима Р., Фурухата Е., Сакураи Т., Акадзава Н., Ёкои С., Кобаякава М., Акияма Дж. И др. Точность эндоскопической диагностики инфекции Helicobacter pylori в соответствии с уровнем эндоскопического опыта и эффектом тренировки. BMC Gastroenterol. 2013; 13: 128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др. Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 22. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007. 102: 1808–1825. [PubMed] [Google Scholar] 23. Lash JG, Genta RM. Соблюдение рекомендаций Сиднейской системы увеличивает вероятность выявления гастрита, вызванного Helicobacter, и кишечной метаплазии в 400738 наборах биопсий желудка.Алимент Pharmacol Ther. 2013; 38: 424–431. [PubMed] [Google Scholar] 24. Хартман DJ, Оуэнс SR. Требуются ли обычные вспомогательные окрашивания для диагностики инфекции Helicobacter в образцах биопсии желудка? Обзор институционального обеспечения качества. Am J Clin Pathol. 2012; 137: 255–260. [PubMed] [Google Scholar] 25. Баттс К.П., Кетовер С., Какар С., Красинскас А.М., Митчелл К.А., Уилкокс Р., Вестерхофф М., Ранг J, Гибсон Дж., Маттиа А.Р. и др. Надлежащее использование специальных красителей для идентификации Helicobacter pylori: рекомендации Rodger C.Общество патологии желудочно-кишечного тракта Хаггитта. Am J Surg Pathol. 2013; 37: e12 – e22. [PubMed] [Google Scholar] 26. Ротими О., Кэрнс А., Грей С., Моайеди П., Диксон М. Ф. Гистологическая идентификация Helicobacter pylori: сравнение методов окрашивания. J Clin Pathol. 2000. 53: 756–759. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз О., Демирай Э. Клиническая роль и важность метода флуоресцентной гибридизации in situ в диагностике инфекции H. pylori и определении устойчивости к кларитромицину при эрадикационной терапии H. pylori.Мир Дж. Гастроэнтерол. 2007. 13: 671–675. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Таджбахш С., Самарбаф-Заде А.Р., Мусавиан М. Сравнение флуоресцентной гибридизации in situ и гистологического метода диагностики Helicobacter pylori в образцах биопсии желудка. Med Sci Monit. 2008; 14: BR183 – BR187. [PubMed] [Google Scholar] 29. Cerqueira L, Fernandes RM, Ferreira RM, Oleastro M, Carneiro F, Brandão C, Pimentel-Nunes P, Dinis-Ribeiro M, Figueiredo C, Keevil CW и др. Валидация метода флуоресцентной гибридизации in situ с использованием зондов пептидных нуклеиновых кислот для выявления устойчивости к кларитромицину Helicobacter pylori в образцах биопсии желудка.J Clin Microbiol. 2013; 51: 1887–1893. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Тиродимос И., Бобос М., Казакос Э., Хайдич А.Б., Дардавессис Т., Костопулос И., Арванитиду М. Молекулярное обнаружение Helicobacter pylori в большой средиземноморской реке с помощью прямого подсчета жизнеспособности с помощью флуоресцентной гибридизации in situ (DVC-FISH) J Water Health. 2014; 12: 868–873. [PubMed] [Google Scholar] 31. Сантьяго П., Морено Ю., Феррус Массачусетс. Идентификация жизнеспособных Helicobacter pylori в источниках питьевой воды культурными и молекулярными методами.Helicobacter. 2015; 20: 252–259. [PubMed] [Google Scholar] 32. Вайра Д., Вакил Н., Гатта Л., Риччи С., Перна Ф., Сарацино И., Фиорини Г., Холтон Дж. Точность нового сверхбыстрого экспресс-теста на уреазу для диагностики инфекции Helicobacter pylori у 1000 последовательных пациентов с диспепсией. Алимент Pharmacol Ther. 2010. 31: 331–338. [PubMed] [Google Scholar] 33. Lerang F, Moum B, Mowinckel P, Haug JB, Ragnhildstveit E, Berge T, Bjørneklett A. Точность семи различных тестов для диагностики инфекции Helicobacter pylori и влияние антагонистов h3-рецепторов на результаты тестов.Сканд Дж Гастроэнтерол. 1998. 33: 364–369. [PubMed] [Google Scholar] 34. Озаслан Э., Косеоглу Т., Пурнак Т., Йылдыз А. Забытая причина ложноотрицательного экспресс-теста на уреазу: загрязнение образца формалином. Гепатогастроэнтерология. 2010; 57: 2 с. предыдущее оглавление. [PubMed] [Google Scholar] 35. Сиавоши Ф., Сани П., Халили-Самани С., Хоссейни Ф., Малакутихах Ф., Мамиванд М., Шахреза С., Шарифи А. Х. Оценка методов выявления H. pylori при потреблении ИПП с использованием посева, экспресс-теста на уреазу и исследования мазка.Ann Transl Med. 2015; 3: 11. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Цэн ЦА, Ван ВМ, Ву округ Колумбия. Сравнение клинической осуществимости трех экспресс-тестов на уреазу в диагностике инфекции Helicobacter pylori. Dig Dis Sci. 2005. 50: 449–452. [PubMed] [Google Scholar] 37. Сиддик И., Аль-Мехайзим К., Алатеи Н., Мемон А., Хасан Ф. Диагностика Helicobacter pylori: повышение чувствительности CLOtest за счет увеличения количества биопсий антрального отдела желудка. J Clin Gastroenterol. 2008. 42: 356–360. [PubMed] [Google Scholar] 38.Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, Wang JY, Yang YC, Lin YC, Wang WM и др. Двойные образцы повышают диагностическую точность и сокращают время реакции экспресс-теста на уреазу. Мир Дж. Гастроэнтерол. 2010; 16: 2926–2930. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, Shim SG, Kim HJ, Jung WT, Lee OJ. Объединенный экспресс-тест на уреазу превосходит отдельный тест в обнаружении Helicobacter pylori в антральном отделе желудка и в образцах тела.Clin Endosc. 2012; 45: 392–396. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Gisbert JP, Abraira V. Точность диагностических тестов Helicobacter pylori у пациентов с кровоточащей язвенной болезнью: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 848–863. [PubMed] [Google Scholar] 41. Ли TH, Лин CC, Chung CS, Lin CK, Liang CC, Tsai KC. Увеличение количества биопсий и забор образцов из тела желудка улучшает чувствительность экспресс-теста на уреазу у пациентов с кровотечением из язвенной болезни. Dig Dis Sci.2015; 60: 454–457. [PubMed] [Google Scholar] 42. Парк С.А., Ко А, Ли Н.Г. Стимуляция роста возбудителя желудочного заболевания человека Helicobacter pylori за счет атмосферного уровня кислорода при высоком давлении углекислого газа. BMC Microbiol. 2011; 11: 96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Ндип Р.Н., Маккей В.Г., Фартинг М.Дж., Уивер Л.Т. Культивирование Helicobacter pylori из клинических образцов: обзор микробиологических методов. J Pediatr Gastroenterol Nutr. 2003. 36: 616–622. [PubMed] [Google Scholar] 44. Гонг Ю.Н., Ли Ю.М., Янг Н.М., Ли ХЗ, Го Ф., Линь Л., Ван Цюй, Чжан Дж.К., Цзи Цзы, Мао Дж. Б. и др.Централизованная изоляция Helicobacter pylori из множества центров и условий транспортировки. Мир Дж. Гастроэнтерол. 2015; 21: 944–952. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Челлини Л., Ди Кампли Э, Ди Бартоломео С., Бесса Л. Дж., Баффони М., Ди Джулио М. Новая транспортная среда для культивирования Helicobacter pylori. J Clin Microbiol. 2014; 52: 4325–4329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Wisessombat S, Meethai C, Hamgo S. Новый двухфазный тест для обнаружения Helicobacter pylori в биопсиях желудка.J Microbiol Methods. 2014; 96: 19–24. [PubMed] [Google Scholar] 47. Leszczyńska K, Namiot A, Namiot Z, Leszczyńska JK, Jakoniuk P, Chilewicz M, Namiot DB, Kemona A, Milewski R, Bucki R. Факторы пациента, влияющие на культуру Helicobacter pylori, выделенную из образцов слизистой оболочки желудка. Adv Med Sci. 2010; 55: 161–166. [PubMed] [Google Scholar] 48. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Momtaz H, Souod N, Dabiri H, Sarshar M. Изучение статуса генотипа Helicobacter pylori в слюне, зубных бляшках, образцах стула и биопсии желудка. Мир Дж. Гастроэнтерол. 2012; 18: 2105–2111. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Lehours P, Mégraud F. Молекулярная диагностика Helicobacter pylori. Эксперт Rev Mol Diagn. 2011; 11: 351–355. [PubMed] [Google Scholar] 52. Monno R, Giorgio F, Carmine P, Soleo L, Cinquepalmi V, Ierardi E. Устойчивость к кларитромицину Helicobacter pylori, обнаруженная с помощью Etest и TaqMan полимеразной цепной реакции в реальном времени: сравнительное исследование. APMIS. 2012; 120: 712–717. [PubMed] [Google Scholar] 53. Лю Цюй, Ци Д, Кан Дж, Цзинь И, Лю В., Гао В., Хоу П, Лу Дж.Эффективность обнаружения инфекции Helicobacter pylori на основе ПЦР в реальном времени и четырехкратной терапии на основе генотипической резистентности в качестве лечения первой линии функциональной диспепсии, вызванной инфекцией Helicobacter pylori. Eur J Gastroenterol Hepatol. 2015; 27: 221–225. [PubMed] [Google Scholar] 54. Онцира Нгойи Э.Н., Атипо Ибара Б.И., Мойен Р., Ахуи Апенди П.К., Ибара Дж. Р., Обенги О., Осиби Ибара Р. Б., Нгуимби Е., Ниама РФ, Уамба Дж. Молекулярное определение Helicobacter pylori и его устойчивости к противомикробным препаратам в Браззавиле, Конго.Helicobacter. 2015; 20: 316–320. [PubMed] [Google Scholar] 55. Де Франческо V, Зулло А., Джорджио Ф., Сарачино I, Заккаро С., Хассан С., Иерарди Э., Ди Лео А., Фиорини Дж., Кастелли В. и др. Изменение точечных мутаций в рРНК Helicobacter pylori, связанных с устойчивостью к кларитромицину в Италии. J Med Microbiol. 2014; 63: 453–457. [PubMed] [Google Scholar] 56. Ивамото А., Танахаши Т., Окада Р., Ёсида Ю., Кикучи К., Кейда Ю., Мураками Ю., Ян Л., Ямамото К., Нишиуми С. и др. Полногеномное секвенирование Helicobacter pylori, устойчивого к кларитромицину, характеризует неидентифицированные варианты генов эффлюксной помпы с множественной лекарственной устойчивостью.Gut Pathog. 2014; 6: 27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Смит С.М., О’Морайн С., Макнамара Д. Тестирование чувствительности к противомикробным препаратам для Helicobacter pylori во времена повышения устойчивости к антибиотикам. Мир Дж. Гастроэнтерол. 2014; 20: 9912–9921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Бинь Т.Т., Сузуки Р., Транг Т.Т., Квон Д.Х., Ямаока Ю. Поиск новых мутаций-кандидатов на устойчивость к метронидазолу у Helicobacter pylori с использованием секвенирования следующего поколения. Антимикробные агенты Chemother.2015; 59: 2343–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F. Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Miendje Deyi VY, Burette A, Bentatou Z, Maaroufi Y, Bontems P, Lepage P, Reynders M. Практическое использование GenoType® HelicoDR, молекулярного теста для обнаружения Helicobacter pylori и тестирования чувствительности.Диагностика Microbiol Infect Dis. 2011; 70: 557–560. [PubMed] [Google Scholar] 61. Ли Дж. У., Ким Н., Нам Р., Пак Дж. Х., Чой Й. Дж., Ким Дж. М., Ким Дж. С., Юнг ХК. Тест GenoType HelicoDR для определения устойчивости Helicobacter pylori к противомикробным препаратам в Корее. Сканд Дж Гастроэнтерол. 2014; 49: 1058–1067. [PubMed] [Google Scholar] 62. Woo HY, Park DI, Park H, Kim MK, Kim DH, Kim IS, Kim YJ. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом для обнаружения Helicobacter pylori и определения устойчивости к кларитромицину с помощью биоптатов желудка.Helicobacter. 2009. 14: 22–28. [PubMed] [Google Scholar] 63. Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Chung WC, Jung SH, Oh JH, Kim TH, Cheung DY, Kim BW, Kim SS, Kim JI, Sin EY. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом с использованием образцов ткани в экспресс-тесте на уреазу при обнаружении инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2014; 20: 6547–6553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Алмейда Н., Донато М. М., Ромаозиньо Дж. М., Люксо С., Кардозу О, Сиприано М. А., Мариньо С., Фернандес А., София С. Корреляция генотипов Helicobacter pylori с гистопатологией желудка в центральном регионе южно-европейской страны. Dig Dis Sci. 2015; 60: 74–85. [PubMed] [Google Scholar] 66. Сиддик I, Аль-Кабанди А., Аль-Али Дж., Алазми В., Мемон А., Мустафа А.С., Джунаид Т.А. Связь между генотипами Helicobacter pylori и тяжестью хронического гастрита, язвенной болезни и уровнями интерлейкина-8 в слизистой оболочке желудка: данные исследования, проведенного на Ближнем Востоке.Gut Pathog. 2014; 6: 41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Феррейра Р.М., Мачадо Дж. К., Фигейредо С. Клиническая значимость генотипов VacA и cagA Helicobacter pylori при карциноме желудка. Лучшие Практики Рес Клин Гастроэнтерол. 2014; 28: 1003–1015. [PubMed] [Google Scholar] 68. Абади А.Т., Лоффельд Р.Дж., Констанция А.С., Вагенаар Дж.А., Кустерс Дж.Г. На обнаружение гена dupA Helicobacter pylori сильно влияет дизайн ПЦР. J Microbiol Methods. 2014; 106: 55–56. [PubMed] [Google Scholar] 69. Амирхошанг А., Рамин А., Эхсан А., Мансур Р., Шахрам Б.Высокая частота ДНК Helicobacter pylori в питьевой воде в Керманшахе, Иран, в июне-ноябре 2012 года. J Water Health. 2014; 12: 504–512. [PubMed] [Google Scholar] 70. Атапур С., Сафарпур Дехкорди Ф., Рахими Э. Обнаружение Helicobacter pylori в различных типах овощей и салатов. Jundishapur J Microbiol. 2014; 7: e10013. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Yahaghi E, Khamesipour F, Mashayekhi F, Safarpoor Dehkordi F, Sakhaei MH, Masoudimanesh M, Khameneie MK. Helicobacter pylori в овощах и салатах: генотипирование и свойства устойчивости к противомикробным препаратам.Biomed Res Int. 2014; 2014: 757941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Фервана М., Абдулмаджид И., Альхаджахмед А., Мадани В., Фирвана Б., Хасан Р., Алтаяр О, Лимбург П.Дж., Мурад М.Х., Кнави Б. Точность дыхательного теста на мочевину при инфекции Helicobacter pylori: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21: 1305–1314. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Gong Y, Wei W, Yuan Y. Связь между риском аномальной функции желудка и инфекцией Helicobacter pylori, оцененная с помощью ELISA и дыхательного теста с 14C-мочевиной.Диагностика Microbiol Infect Dis. 2014; 80: 316–320. [PubMed] [Google Scholar] 74. Макколл К.Э. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med. 2010; 362: 1597–1604. [PubMed] [Google Scholar] 75. Велайос Б., Фернандес-Салазар Л., Понс-Ренедо Ф., Муньос М.Ф., Альмарас А., Аллер Р., Руис Л., Дель Ольмо Л., Гисберт Дж. П., Гонсалес-Эрнандес Дж. М.. Точность дыхательной пробы мочевины, выполняемой сразу после экстренной эндоскопии при кровотечении из язвенной болезни. Dig Dis Sci. 2012; 57: 1880–1886. [PubMed] [Google Scholar] 76. Гварнер Дж., Калач Н., Элитсур Ю., Колецко С.Диагностические тесты Helicobacter pylori у детей: обзор литературы с 1999 по 2009 год. Eur J Pediatr. 2010; 169: 15–25. [PubMed] [Google Scholar] 77. Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN, Greiner W. Эффективность и рентабельность дыхательного теста с мочевиной 13C в качестве основного диагностического исследования для выявления инфекции Helicobacter pylori по сравнению с инвазивной и неинвазивной -инвазивные диагностические тесты. GMS Health Technol Assess. 2009; 5: Doc14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78.Гамлет А.К., Эрландссон К.И., Ольбе Л., Свеннерхольм А.М., Бакман В.Е., Петтерссон А.Б. Простой, быстрый и высоконадежный дыхательный тест с мочевиной 14C на основе капсул для диагностики инфекции Helicobacter pylori. Сканд Дж Гастроэнтерол. 1995; 30: 1058–1063. [PubMed] [Google Scholar] 79. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Превосходство некапсулированного дыхательного теста с 14С-мочевиной над методом на основе капсул для выявления инфекции Helicobacter pylori — предварительный отчет.Троп Гастроэнтерол. 2012; 33: 123–128. [PubMed] [Google Scholar] 80. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Сравнение инкапсулированного и неинкапсулированного (14) дыхательного теста с C-мочевиной для выявления инфекции Helicobacter pylori: сцинтиграфическое исследование. Helicobacter. 2014; 19: 116–123. [PubMed] [Google Scholar] 81. Gisbert JP, Pajares JM. Обзорная статья: Дыхательный тест на 13C-мочевину в диагностике инфекции Helicobacter pylori — критический обзор. Алимент Pharmacol Ther.2004. 20: 1001–1017. [PubMed] [Google Scholar] 82. Som S, Maity A, Banik GD, Ghosh C, Chaudhuri S, Daschakraborty SB, Ghosh S, Pradhan M. Кинетика экскреции дыхательного теста с мочевиной 13C: влияние выработки эндогенного CO2 и восстановления дозы на диагностическую точность инфекции Helicobacter pylori. Anal Bioanal Chem. 2014; 406: 5405–5412. [PubMed] [Google Scholar] 83. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ.Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 84. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori. Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 85. Кесли Р., Гоктюрк Х.С., Эрбайрак М., Карабаглы П., Терзи Ю. Сравнение диагностических значений трех различных тестов на антигены стула для неинвазивной диагностики инфекции Helicobacter pylori. J Investig Med.2010. 58: 982–986. [PubMed] [Google Scholar] 86. Okuda M, Osaki T, Kikuchi S, Ueda J, Lin Y, Yonezawa H, Maekawa K, Hojo F, Kamiya S, Fukuda Y. Оценка теста на антиген стула с использованием mAb для нативной каталазы для диагностики инфекции Helicobacter pylori у детей и взрослые. J Med Microbiol. 2014; 63: 1621–1625. [PubMed] [Google Scholar] 87. Осман Х.А., Хасан Х., Суппиан Р., Бахар Н., Хусин Н.С., Рахим А.А., Хассан С., Анди Д.З., Зилфалил Б.А. Оценка теста на антиген стула Atlas Helicobacter pylori для диагностики инфекции у взрослых пациентов.Азиатский Pac J Cancer Prev. 2014; 15: 5245–5247. [PubMed] [Google Scholar] 88. Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 89. Дегучи Р., Мацусима М., Сузуки Т., Майн Т., Фукуда Р., Нишина М., Одзава Х., Такаги А. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori после эрадикационной терапии.J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 90. Кальвет X, Ларио С., Рамирес-Лазаро М.Дж., Монтсеррат А., Кесада М., Ривз Л., Мастерс Х., Суарес-Ламас Д., Галлах М., Микель М. и др. Точность моноклональных тестов стула для определения излечения от инфекции Helicobacter pylori после лечения. Helicobacter. 2010; 15: 201–205. [PubMed] [Google Scholar] 91. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 92. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE. Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Чжоу X, Су Дж., Сюй Дж., Чжан Г. Точность теста на антиген стула для диагностики инфекции Helicobacter pylori у детей: метаанализ.Клин Рес Гепатол Гастроэнтерол. 2014; 38: 629–638. [PubMed] [Google Scholar] 94. Ли YC, Tseng PH, Liou JM, Chen MJ, Chen CC, Tu CH, Chiang TH, Chiu HM, Lai CF, Ho JC, et al. Проведение одноэтапного теста на основе образца фекалий для диагностики инфекции Helicobacter pylori в учреждениях первичной медико-санитарной помощи и массовых обследований. J Formos Med Assoc. 2014; 113: 899–907. [PubMed] [Google Scholar] 95. Okuda M, Osaki T, Lin Y, Yonezawa H, Maekawa K, Kamiya S, Fukuda Y, Kikuchi S. Низкая распространенность и частота инфекции Helicobacter pylori у детей: популяционное исследование в Японии.Helicobacter. 2015; 20: 133–138. [PubMed] [Google Scholar] 96. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 97. Choi J, Kim CH, Kim D, Chung SJ, Song JH, Kang JM, Yang JI, Park MJ, Kim YS, Yim JY и др. Проспективная оценка нового теста на антиген стула для обнаружения Helicobacter pylori в сравнении с гистологией, экспресс-тестом на уреазу, (13) дыхательным тестом на C-мочевину и серологией.J Gastroenterol Hepatol. 2011; 26: 1053–1059. [PubMed] [Google Scholar] 98. Demirtürk L, Yazgan Y, Tarçin O, Ozel M, Diler M, Oncül O, Yildirim S. Влияет ли N-ацетилцистеин на чувствительность и специфичность теста на антиген стула Helicobacter pylori? Helicobacter. 2003. 8: 120–123. [PubMed] [Google Scholar] 99. Inelmen EM, Gasparini G, Sergi G, Enzi G. Оценка Helicobacter pylori с помощью анализа стула на антиген у ослабленных пожилых пациентов. Сканд Дж Гастроэнтерол. 2005; 40: 794–799. [PubMed] [Google Scholar] 101.Ueda J, Okuda M, Nishiyama T., Lin Y, Fukuda Y, Kikuchi S. Диагностическая точность набора для тестирования сывороточных антител E-plate при обнаружении инфекции Helicobacter pylori среди японских детей. J Epidemiol. 2014; 24: 47–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Марчилдон П.А., Сугияма Т., Фукуда Ю., Пикок Дж. С., Асака М., Симояма Т., Грэм Д. Я. Оценка влияния вариации штамм-специфического антигена на точность серологической диагностики инфекции Helicobacter pylori. J Clin Microbiol. 2003. 41: 1480–1485.[Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Hoang TT, Wheeldon TU, Bengtsson C, Phung DC, Sörberg M, Granström M. Иммуноферментный анализ на Helicobacter pylori нуждается в корректировке для исследуемой популяции. J Clin Microbiol. 2004. 42: 627–630. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Khalifeh Gholi M, Kalali B, Formichella L, Göttner G, Shamsipour F, Zarnani AH, Hosseini M, Busch DH, Shirazi MH, Gerhard M. Helicobacter pylori FliD является высокочувствительным и специфическим маркером для серологической диагностики H.pylori. Int J Med Microbiol. 2013; 303: 618–623. [PubMed] [Google Scholar] 105. Формичелла Л., Ромберг Л., Больц С., Вьет М., Гепперт М., Гёттнер Г., Нёльтинг К., Вальтер Д., Шепп В., Шнайдер А. и др. Иммуноферментный анализ новой линии, основанный на рекомбинантных факторах вирулентности, позволяет проводить высокоспецифичную и чувствительную серологическую диагностику инфекции Helicobacter pylori. Clin Vaccine Immunol. 2013; 20: 1703–1710. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Пан KF, Formichella L, Zhang L, Zhang Y, Ma JL, Li ZX, Liu C, Wang YM, Goettner G, Ulm K, et al.Ответы антител против Helicobacter pylori и эволюция предраковых поражений желудка в китайской популяции. Int J Cancer. 2014; 134: 2118–2125. [PubMed] [Google Scholar] 107. Бурукоа С., Дельшер Дж. С., Курийон-Малле А., де Корвин Дж. Д., Мегро Ф., Зербиб Ф., Раймонд Дж., Фошер Дж. Л.. Сравнительная оценка 29 коммерческих серологических наборов Helicobacter pylori. Helicobacter. 2013; 18: 169–179. [PubMed] [Google Scholar] 108. Абнет СС, Чжэн В., Йе В., Камангар Ф., Джи Б.Т., Перссон С., Ян Джи, Ли Х.Л., Ротман Н., Шу ХО и др.Пепсиногены плазмы, антитела против Helicobacter pylori и риск рака желудка в когорте Шанхайского исследования здоровья женщин. Br J Рак. 2011; 104: 1511–1516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Ёсида Т., Като Дж., Иноуэ И., Ёсимура Н., Дегучи Х., Мукубаяси К., Ока М., Ватанабэ М., Эномото С., Нива Т. и др. Развитие рака на основе хронического активного гастрита и вызванной им атрофии желудка, что оценивается по уровням пепсиногена в сыворотке крови и титру антител к Helicobacter pylori. Int J Cancer.2014; 134: 1445–1457. [PubMed] [Google Scholar] 110. Ханэда М., Като М., Исигаки С., Судзуки М., Такахаши М., Накагава М., Оно С., Мори И., Мабе К., Накагава С. и др. Идентификация группы высокого риска рака желудка с использованием сывороточного пепсиногена после успешной ликвидации Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 78–83. [PubMed] [Google Scholar] 111. McNicholl AG, Forné M, Barrio J, De la Coba C, González B, Rivera R, Esteve M, Fernandez-Bañares F, Madrigal B, Gras-Miralles B и др. Точность GastroPanel в диагностике атрофического гастрита.Eur J Gastroenterol Hepatol. 2014; 26: 941–948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Шиката К., Ниномия Т., Йонемото К., Икеда Ф., Хата Дж., Дой Й, Фукухара М., Мацумото Т., Иида М., Китазоно Т. и др. Оптимальное пороговое значение уровня пепсиногена в сыворотке для прогнозирования заболеваемости раком желудка: исследование Хисаяма. Сканд Дж Гастроэнтерол. 2012; 47: 669–675. [PubMed] [Google Scholar] 113. Карами Н., Талебхан Й., Сабери С., Эсмаили М., Огалайе А., Абдирад А., Мостафави Е., Хоссейни М.Э., Мохагеги М.А., Мохаммади М.Серореактивность к антигенам Helicobacter pylori как индикатор риска рака желудка. Азиатский Pac J Cancer Prev. 2013; 14: 1813–1817. [PubMed] [Google Scholar] 114. Zhao Z, Li Y, Liu S, Fu W. Сывороточные антитела Helicobacter pylori CagA нельзя использовать в качестве онкомаркера для диагностики рака желудка в странах Восточной Азии. Tumor Biol. 2014; 35: 12217–12224. [PubMed] [Google Scholar] 115. Мухсен К., Атхамна А., Атхамна М., Спунгин-Бялик А., Коэн Д. Оценка иммуноферментного анализа мочи для выявления инфекции Helicobacter pylori среди здоровых детей израильских арабов от 3 до 5 лет.J Pediatr Gastroenterol Nutr. 2006; 43: 398–401. [PubMed] [Google Scholar] 116. Окуда М., Камия С., Книга М., Кикучи С., Осаки Т., Хиватани Т., Маекава К., Фукуда Ю. Диагностическая точность наборов на основе мочи для обнаружения антител к Helicobacter pylori у детей. Pediatr Int. 2013; 55: 337–341. [PubMed] [Google Scholar] 117. Луцца Ф., Именео М., Мараско А., Кротта С., Иерарди Е., Усай П., Вирджилио С., Нардоне Г., Марчи С., Санна Г. и др. Оценка коммерческого серологического набора для определения иммуноглобулина G в слюне к Helicobacter pylori: многоцентровое исследование.Eur J Gastroenterol Hepatol. 2000; 12: 1117–1120. [PubMed] [Google Scholar] 118. Ян Б.Л., Йе Ц., Квонг В.Г., Ли С.Д. Новый одноэтапный тест на антиген слюны Helicobacter pylori. J Chin Med Assoc. 2015; 78: 96–100. [PubMed] [Google Scholar] 119. Брейден Б. Диагностика инфекции Helicobacter pylori. BMJ. 2012; 344: e828. [PubMed] [Google Scholar] 120. Сичински Л.А., Корреа П., Браво Л.Е., Пик Р.М., Уилсон К.Т., Ло Дж. Т., Йепез М.С., Голд Б.Д., Томпсон Д.Т., Обложка Т.Л. и др. Неинвазивное генотипирование Helicobacter pylori cagA, vacA и hopQ у бессимптомных детей.Helicobacter. 2012; 17: 96–106. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Xiong LJ, Tong Y, Wang Z, Mao M. Выявление устойчивой к кларитромицину Helicobacter pylori с помощью ПЦР стула у детей: всесторонний обзор литературы. Helicobacter. 2013; 18: 89–101. [PubMed] [Google Scholar] 122. Ананд П.С., Камат К.П., Анил С. Роль зубного налета, слюны и заболеваний пародонта в инфекции Helicobacter pylori. Мир Дж. Гастроэнтерол. 2014; 20: 5639–5653. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123.Огая Ю., Номура Р., Ватанабе Ю., Накано К. Обнаружение ДНК Helicobacter pylori в образцах воспаленной пульпы зуба от японских детей и подростков. J Med Microbiol. 2015; 64: 117–123. [PubMed] [Google Scholar] 124. Amiri N, Abiri R, Eyvazi M, Zolfaghari MR, Alvandi A. Частота Helicobacter pylori в зубном налете, возможно, недооценена. Arch Oral Biol. 2015; 60: 782–788. [PubMed] [Google Scholar] 125. Чой Й.Дж., Ким Н., Лим Дж., Чо Си, Шин СМ, Ли Х.С., Ли Ш., Пак Й.С., Хван Дж. Х., Ким Дж. У. и др.Точность диагностических тестов на Helicobacter pylori у больных с кровотечением из язвенной болезни. Helicobacter. 2012; 17: 77–85. [PubMed] [Google Scholar] 126. Ло С.К., Лай К.Х., Пэн Нью-Джерси, Ло Г.Х., Ценг Х.Х., Лин С.К., Ши С.Б., Ву С.М., Чен Ю.С., Хуанг В.К. и др. Полимеразная цепная реакция: чувствительный метод выявления инфекции Helicobacter pylori при кровоточащих пептических язвах. Мир Дж. Гастроэнтерол. 2005; 11: 3909–3914. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Рамирес-Лазаро М.Дж., Ларио С., Казалотс А., Санфелиу Э, Бойкс Л., Гарсиа-Иглесиас П., Санчес-Дельгадо Д., Монтсеррат А., Белла-Куэто М. Р., Галлах М. и др.ПЦР в реальном времени улучшает обнаружение Helicobacter pylori у пациентов с кровотечением из язвенной болезни. PLoS One. 2011; 6: e20009. [Бесплатная статья PMC] [PubMed] [Google Scholar] 128. Баркун А.Н., Барду М., Койперс Э.Дж., Сунг Дж., Хант Р.Х., Мартель М., Синклер П. Рекомендации международного консенсуса по ведению пациентов с кровотечением из неварикозно-верхних отделов желудочно-кишечного тракта. Ann Intern Med. 2010. 152: 101–113. [PubMed] [Google Scholar] 129. Санчес-Дельгадо Дж., Джене Э, Суарес Д., Гарсия-Иглесиас П., Брюлле Э, Галлах М., Феу Ф, Гисберт Дж. П., Кальвет X.Была ли недооценена распространенность H. pylori при кровоточащей язвенной болезни? Мета-регресс. Am J Gastroenterol. 2011; 106: 398–405. [PubMed] [Google Scholar] 130. Kim JJ, Lee JS, Olafsson S, Laine L. Низкая приверженность к тестированию на Helicobacter pylori у госпитализированных пациентов с кровоточащей язвенной болезнью. Helicobacter. 2014; 19: 98–104. [PubMed] [Google Scholar] 131. Тянь XY, Чжу Х, Чжао Дж, Ше Кью, Чжан Джи. Диагностическая эффективность дыхательного теста на мочевину, экспресс-теста на мочевину и гистологии инфекции Helicobacter pylori у пациентов с частичной гастрэктомией: метаанализ.J Clin Gastroenterol. 2012; 46: 285–292. [PubMed] [Google Scholar] 132. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале — надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка. J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 133. Варди Дж., Шалев Т., Шевах О., Боаз М., Авни Ю., Ширин Х. Быстрый дыхательный тест на 13C-мочевину в непрерывном режиме в реальном времени для обнаружения Helicobacter pylori у пациентов после частичной гастрэктомии.J Clin Gastroenterol. 2012; 46: 293–296. [PubMed] [Google Scholar] 134. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Yoon H, Shin CM, Park YS, Lee DH. Диагностическая валидность дыхательного теста (13) c-мочевины у пациентов, подвергшихся гастрэктомии: ретроспективное когортное исследование одного третичного центра. J Cancer Prev. 2014; 19: 309–317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 135. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Hwang JJ, Lee HJ, Lee A, Jeong YS, Oh S и др. Диагностическая ценность теста на выдыхание C-мочевины без лимонной кислоты в высоких дозах (13) после эрадикации Helicobacter pylori в Корее.Helicobacter. 2015; 20: 159–168. [PubMed] [Google Scholar] 136. Patel SK, Mishra GN, Pratap CB, Jain AK, Nath G. Helicobacter pylori не искореняется после тройной терапии: исследование на основе вложенной ПЦР. Biomed Res Int. 2014; 2014: 483136. [Бесплатная статья PMC] [PubMed] [Google Scholar]Диагностика инфекции Helicobacter pylori: текущие возможности и разработки
World J Gastroenterol. 2015 окт 28; 21 (40): 11221–11235.
Яо-Куанг Ван, Отделение внутренней медицины, Городская больница Сяо-Канг Гаосюн, Гаосюн 812, Тайвань
Яо-Куанг Ван, Чунг-Юнг Лю, Мэн-Чие Ву, Сян-Яо Ши, Софи С.В. Ван, Дженг -Yih Wu, Chao-Hung Kuo, Deng-Chyang Wu, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, Гаосюн 807, Тайвань
Fu-Chen Kuo, школа медицины, медицинский колледж, E-Da Больница, Университет И-Шоу, Гаосюн 824, Тайвань
Мэн-Чи Ву, Сян-Яо Ши, Дэн-Чьянг Ву, Отделение внутренней медицины, Городская больница Та-Тунг Гаосюна, Гаосюн 801, Тайвань
Софи С.В. Ван, Чао-Хун Куо, Дэн-Чьянг Ву, Рак для исследования стволовых клеток, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Софи С.В. Ван, Дэн-Чьянг Ву, Центр исследований инфекционных заболеваний и рака, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Яо-Кан Хуанг, отдел гастрономии энтерология, отделение внутренней медицины, больница Тен Чан, Чун-Ли, Таоюань 320, Тайвань
Вклад авторов: Ван ЮК написал эту рукопись; Kuo FC, Liu CJ, Wu MC, Shih HY, Wang SSW, Wu JY и Kuo CH разработали исследования; Хуан Ю.К. и Ву Д.К. полировали бумагу; Хуан Ю.К. и Ву Д.К. в равной степени внесли свой вклад в эту рукопись.Для корреспонденции: Deng-Chyang Wu, MD, PhD, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, 100 Tz-You 1st road, Kaohsiung 807, Taiwan. moc.oohay@uwhced
Телефон: + 886-7-3121101-7451 Факс: + 886-7-3135612
Поступила в редакцию 29 апреля 2015 г .; Пересмотрено 6 августа 2015 г .; Принято, 2015 г. 28 сентября.
Авторские права © Автор (ы) 2015 г. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Реферат
Точная диагностика инфекции Helicobacter pylori (H. pylori) — важнейшая составляющая эффективного лечения многих гастродуоденальных заболеваний. Для обнаружения H. pylori доступно несколько инвазивных и неинвазивных диагностических тестов, и каждый тест имеет свою полезность и ограничения в различных клинических ситуациях. Хотя ни один из них не может считаться единственным золотым стандартом в клинической практике, было разработано несколько методов, позволяющих получить более надежные результаты.Инвазивные тесты выполняются с помощью образцов эндоскопической биопсии, и эти тесты включают гистологию, посев, экспресс-тест на уреазу, а также молекулярные методы. Развитие эндоскопического оборудования также способствует диагностике H. pylori в режиме реального времени во время эндоскопии. Дыхательный тест на мочевину и тест на антиген стула являются наиболее широко используемыми неинвазивными тестами, в то время как серология полезна в скрининговых и эпидемиологических исследованиях. Молекулярные методы использовались в различных образцах, кроме слизистой оболочки желудка.Помимо выявления инфекции H. pylori , несколько тестов используются для оценки факторов вирулентности и чувствительности к антибиотикам H. pylori , а также для скрининга предраковых поражений и рака желудка. Целью этой статьи является обзор текущих возможностей и новых разработок диагностических тестов и их применения в различных клинических условиях или для конкретных целей.
Ключевые слова: Helicobacter pylori , Диагностика, Инвазивный, Неинвазивный, Пероральный образец, Кровотечение, Гастрэктомия, Искоренение
Основной наконечник: В настоящее время доступны несколько тестов для диагностики Helicobacter pylori (H. pylori ).pylori ) инфекция. В этом обзоре мы сосредоточимся на полезности и ограничениях современных диагностических методов, а также на последних разработках этих тестов, которые способствуют повышению диагностической точности. Кроме того, мы также подчеркиваем обнаружение H. pylori в образцах из полости рта и у пациентов с различными клиническими обстоятельствами, включая кровотечение, постгастрэктомию и постэрадикационную терапию.
ВВЕДЕНИЕ
Helicobacter pylori ( H.pylori ) является грамотрицательным микроаэробным патогеном человека, а инфекция H. pylori тесно связана со многими гастродуоденальными заболеваниями, включая хронический активный гастрит, язвенную болезнь, атрофический гастрит, лимфому лимфоидной ткани слизистой оболочки (MALT) и некардиальный рак желудка. . Инфекция H. pylori поражает более половины взрослого населения во всем мире, но распространенность инфекции H. pylori широко варьируется в зависимости от географического региона, возраста, расы и социально-экономического статуса.Обычно распространенность инфекции H. pylori увеличивается с возрастом в большинстве стран, однако в последние десятилетия при анализе временных тенденций в нескольких крупных популяциях наблюдалось снижение распространенности инфекции H. pylori [1]. Более 80% язвенной болезни вызывается инфекцией H. pylori , а предполагаемый риск развития язвенной болезни в течение жизни у пациентов, инфицированных H. pylori , составляет примерно 15% [2]. Рак желудка является третьей по значимости причиной смерти от рака во всем мире, а случаев H.pylori является причиной 74,7% всех случаев некардиального рака желудка [3,4]. Рак желудка и язвенная болезнь вместе вызывают более миллиона смертей в год в мире, и инфекция H. pylori всегда является важной проблемой для здоровья [5]. Для выявления инфекции H. pylori разработаны различные диагностические методы, и диагностические тесты с высокой чувствительностью и специфичностью, превышающей 90%, необходимы для точной диагностики инфекции H. pylori в клинической практике.Хотя сейчас доступно множество диагностических тестов, каждый метод имеет свои преимущества, недостатки и ограничения. Выбор того или иного метода может зависеть от наличия и доступности диагностических тестов, уровня лабораторий, клинического состояния пациентов и отношения вероятности положительных и отрицательных тестов при различных клинических обстоятельствах. Диагностические тесты обычно делятся на инвазивные (эндоскопические) и неинвазивные методы. Инвазивные диагностические тесты включают эндоскопическое изображение, гистологию, экспресс-тест на уреазу, культивирование и молекулярные методы.Неинвазивные диагностические тесты включали дыхательный тест на мочевину, тест на антиген стула, серологические и молекулярные исследования. В данной статье мы кратко рассмотрим текущие варианты и разработки диагностических тестов и связанных с ними приложений в клинической практике, а также выбор диагностических тестов для различных клинических состояний (таблица).
Таблица 1
Варианты диагностики инфекции Helicobacter pylori при различных клинических обстоятельствах и особые применения диагностических тестов
| Гастродуоденальное кровотечение | Постэктомия | Постэктомия | Особые области применения | |||||||||
| Экспресс-тест на уреазу | √ | |||||||||||
| Гистология | √ | |||||||||||
| Культура | Антибиотическая цепьАнтибиотическая цепь реакция | √ | √ | √Чувствительность к антибиотикам 287 | √ | |||||||
| Серология 1 | √ | √ | √ | √ Факторы вирулентности |
.pylori
-ассоциированные заболевания, такие как язвенная болезнь, атрофический гастрит, MALT-лимфома и рак желудка. Эндоскопия также является инструментом, обычно используемым для получения образцов, обычно слизистой оболочки желудка из биопсии, для дальнейших исследований других инвазивных тестов, включая экспресс-тест на уреазу, гистологию, посев и молекулярные методы. Антрум является предпочтительным местом биопсии для выявления инфекции H. pylori в большинстве случаев, но для избежания ложноотрицательных результатов пациентам с антральной атрофией или кишечной метаплазией предлагается биопсия тела по большей кривой [6,7].Неравномерное распределение H. pylori в желудке в различных клинических условиях неизбежно приводит к ошибкам отбора проб при исследованиях на основе биопсии, и было сделано несколько попыток диагностики инфекции H. pylori в режиме реального времени во время эндоскопического исследования.Большинство признаков слизистой оболочки желудка, таких как покраснение, отек слизистой оболочки или узелковое изменение, при обычной эндоскопии недостаточно специфичны для диагностики инфекции H. pylori и не имеют большого значения для точного диагноза [8].Хотя тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может повысить точность диагностики, но это может занять много времени и не дать лучших результатов, чем другие инвазивные тесты [9]. В дополнение к традиционной эндоскопии, хромоэндоскопия с феноловым красным также была оценена для диагностики инфекции H. pylori на основе специфической уреазной активности H. pylori . Однако этот метод не является надежным тестом из-за его низкой чувствительности (73% -81%) и низкой специфичности (76% -81%) [10,11].Эндоскопия с увеличением обеспечивает прямое наблюдение микроструктуры поверхности слизистой оболочки желудка, а эндоскопические изображения слизистой оболочки с высоким разрешением тесно связаны с гистопатологическими изменениями, включая инфекцию H. pylori . Чувствительность и специфичность для прогнозирования телесного гастрита с положительным результатом на H. pylori с помощью увеличительной эндоскопии с окрашиванием индигокармином составили 97,6% и 100% соответственно. Однако чувствительность и специфичность снизились до 88.4% и 75,0% соответственно у H. pylori -положительного антрального гастрита [12]. Конфокальная лазерная эндомикроскопия (CLE) — это еще один увеличительный эндоскопический метод, который обеспечивает подповерхностный анализ и in vivo, гистологическое исследование слизистой оболочки желудка во время эндоскопии. Три характеристики, включая белые пятна, нейтрофилы и микроабсцессы, основанные на данных CLE, были использованы для диагностики H. pylori , а точность, чувствительность и специфичность составили 92,8%, 89,2% и 95,7% соответственно [13].Увеличивающая узкополосная визуализация и I-сканирование также использовались для обнаружения инфекции H. pylori , но были представлены различные результаты [14–16]. Различные классификации характеристик изображений от увеличительной эндоскопии обеспечивают различную диагностическую точность, а точность эндоскопического теста также зависит от оператора, что означает, что его использование требует процесса обучения со стороны опытного супервизора и наличия оборудования от местного отделения эндоскопии [17-20]. Более того, тщательное обследование с использованием увеличения с использованием метода улучшения изображения или без него также требует много времени и может причинить больший дискомфорт пациенту, чем другие тесты на основе биопсии.Эти факторы обычно ограничивают клиническое использование увеличительной эндоскопии для выявления инфекции H. pylori в повседневной практике.
Гистология
Гистология обычно считается золотым стандартом при прямом обнаружении инфекции H. pylori , а также первым методом, используемым для обнаружения H. pylori . Однако на диагностическую точность гистологии влияет несколько факторов, таких как место, размер и количество биопсий, методы окрашивания, ингибитор протонной помпы (ИПП), антибиотики и опыт исследующего патолога.Использование ИПП может привести к противоречивым результатам гистологического исследования, поэтому рекомендуется отменить ИПП за 2 недели до проведения гистологического исследования [21]. Дополнительные образцы биопсии, собранные в соответствующем месте для анализа, могут уменьшить количество ошибок выборки и ложноотрицательных результатов в гистологическом тесте, а также в других тестах, основанных на биопсии. В клинической практике обычно рекомендуются биопсии как антрального отдела, так и тела, и получение как минимум двух биоптатов из антрального отдела и тела является наиболее разумной стратегией, гарантирующей максимальный диагностический результат [22,23].Как упоминалось выше, биопсия тела важна для диагностики H. pylori . на фоне атрофического гастрита [7].
Окрашивание является важной частью гистологического исследования, и несколько красок, таких как обычное окрашивание HE, окраска по Гимзе, Вартина-Старри, Hp серебром, толуидиновым синим, акридиновым оранжевым, Макмалленом, Гента, Дитерле и иммуногистохимическим окрашиванием, были использованы для обнаружения H pylori . Хотя иммуногистохимическое окрашивание является наиболее чувствительным и специфическим красителем, окрашивания HE обычно достаточно для диагностики H.pylori в повседневной клинической практике. Дополнительное окрашивание обычно рекомендуется для образцов биопсии, которые выявляют умеренный или тяжелый хронический гастрит, но не H. pylori , идентифицированные при окрашивании HE. Кроме того, иммуногистохимическое окрашивание должно быть первым выбором, если решено использовать вспомогательное окрашивание для обнаружения H. pylori [24,25]. Если иммуногистохимические окрашивания недоступны, окрашивание по Гимзе является предпочтительным методом в клинической практике, поскольку оно простое, высокочувствительное и менее затратное [26].
Пептидная флуоресцентная нуклеиновая кислота in situ Гибридизация (PNA-FISH), которую можно использовать на гистологических препаратах, является высокочувствительным (чувствительность 97%) и специфическим (специфичность 100%) методом диагностики H. pylori. инфекция. PNA-FISH может идентифицировать кокковидную форму H. pylori , которую обычно невозможно обнаружить при рутинном гистологическом исследовании, поскольку этот метод позволяет избежать индивидуальной предвзятости от морфологической идентификации. Кроме того, PNA-FISH — это быстрый, точный и экономичный метод обнаружения H.pylori устойчивость к кларитромицину в образцах биопсии желудка [27–29]. FISH также может сыграть потенциальную роль в обнаружении H. pylori в пробах окружающей среды, и дальнейшие исследования передачи и резервуаров H. pylori в окружающей среде могут быть проведены с использованием FISH [30,31]. Несмотря на преимущества обнаружения H. pylori и устойчивости к кларитромицину одновременно, недостатки PNA-FISH, такие как трудоемкая подготовка, требующая флуоресцентного микроскопа и специальных знаний для чтения слайдов, могут ограничивать широкое использование этого метода. .
БЫСТРЫЕ ИСПЫТАНИЯ МОЧЕИ
Для повседневной клинической практики экспресс-тест на уреазу (RUT) является наиболее полезным инвазивным тестом для диагностики инфекции H. pylori , поскольку он недорогой, быстрый, простой в выполнении, высокоспецифичный и широко доступный . Основываясь на активности фермента уреазы H. pylori , присутствие H. pylori в образце биопсии превращает реагент теста мочевины в аммиак, что приводит к увеличению pH и изменению цвета на мониторе pH.В настоящее время доступны несколько коммерческих тестов на уреазу, включая тесты на геле (CLOtest, HpFast), бумажные тесты (PyloriTek, ProntoDry) и тесты на жидкой основе (UFT300, EndoscHp), а различные коммерческие тестовые тестеры имеют разное время реакции для получения результатов. CLOtest обычно занимает 24 часа, чтобы получить точный результат, тогда как PyloriTek занимает 1 час, а UFT 300 — 5 минут, чтобы обеспечить более быстрые результаты. Считывание тестов на уреазу раньше рекомендованного времени может привести к ложноотрицательным результатам [32]. Помимо дизайна коммерческих наборов, плотность бактерий, присутствующих в образце биопсии, также влияет на время реакции и диагностическую точность RUT, в то время как для получения положительного результата RUT обычно требуется минимум 10000 организмов.Другие факторы, влияющие на диагностическую точность тестов на уреазу, включают антагонисты рецепторов H 2 , ИПП, соединения висмута, антибиотики, ахлоргидрию и наличие крови, все из которых увеличивают вероятность ложноотрицательных результатов. Кроме того, контаминация биоптатов формалином также снижает чувствительность RUT [21,33-35].
Обычно коммерческие экспресс-тесты на уреазу имеют специфичность выше 95% -100% и чувствительность выше 85% -95%. Увеличение количества биопсий антрального отдела желудка может повысить чувствительность RUT, и образцы двойной биопсии из тела желудка и антрального отдела предпочтительнее, чем образцы биопсии только антрального отдела желудка, поскольку дополнительная биопсия тела увеличивает диагностическую точность и позволяет избежать систематической ошибки выборки из-за неравномерного распределения H.pylori в желудке. Более того, объединение образцов антрального отдела и тела перед RUT, а не отдельных образцов, также увеличило чувствительность RUT и ускорило время реакции [32,36-39]. Перед RUT рекомендуется избегать приема лекарств, влияющих на активность уреазы, а плотность бактерий — для уменьшения ложноотрицательных результатов, например, 2 недели для ИПП и 4 недели для антибиотиков. Кровотечение значительно снижает чувствительность и специфичность RUT и делает RUT более ненадежным тестом, чем другие тесты в этом клиническом состоянии [40].В исследовании, посвященном оценке влияния различного количества и места биопсии на результаты RUT у пациентов с кровотечением из язвенной болезни, было показано, что четыре биопсии из антрального отдела или одна биопсия из тела увеличивают чувствительность RUT по сравнению с только одной биопсией из антрального отдела. В этом исследовании чувствительность одной биопсии антрального отдела составила 64%, тогда как чувствительность четырех биопсий антрального отдела и одной биопсии тела составила 74% и 73% соответственно [41]. Если для пациента с желудочно-кишечным кровотечением по-прежнему выбирается RUT, для повышения точности диагностики предлагалось выполнить биопсию как антрального отдела, так и тела.
Культура
Культивирование H. pylori из образца биопсии желудка — высокоспецифичный, но менее чувствительный метод. В целом, культивирование имеет почти 100% специфичность, но чувствительность культуры значительно варьируется, от 85% до 95%. Из-за деликатной и требовательной природы H. pylori для культивирования in vitro требуется определенная транспортная среда, среда для выращивания и среда для инкубации. Образцы биопсии можно хранить в транспортной среде, такой как Portagerm pylori или транспортная среда Стюарта, до 24 часов при 4 ° C.Для культивирования можно использовать несколько типов агара, поскольку H. pylori выделены. Обычно используемые среды включают агар Pylori, агар Скирроу, кровяной агар Columbia, агар Brucella, инфузию сердца мозга или соевый агар с триптиказой, дополненный кровью овцы или лошади. Чашки с агаром обычно инкубируют в микроаэробной среде (80-90% N 2 , 5-10% CO 2 , 5-10% O 2 ) при температуре от 35 до 37 ° C в течение не менее 5-7 дней, потому что H. pylori считается микроаэрофилом.Однако недавнее исследование показало, что росту H. pylori способствует уровень кислорода в атмосфере с присутствием 10% CO 2 , в результате чего появилась новая концепция, согласно которой H. pylori может быть капногильным аэробом [42]. Диагностика H. pylori из культуральной среды основана на морфологических характеристиках, а также положительных реакциях на уреазу, каталазу и оксидазу, что означает, что микробиологические лаборатории должны быть оборудованы и обучены для выделения этой бактерии.
Такие условия, как низкое качество образцов, отложенная транспортировка, воздействие аэробной среды или неопытного микробиолога, оказывают неблагоприятное влияние на производительность посева и снижают диагностическую точность [43].Недавнее исследование, проведенное в 26 больницах для анализа влияния времени транспортировки, а также температуры на скорость культивирования, показало, что положительная скорость культивирования снизилась до 26,3% в 48-часовой транспортной группе по сравнению с 32,8% в 24-часовой транспортной группе ( P <0,001 ). Это исследование также показало, что средняя температура повысилась с 4,7 ° C до 29,1 ° C во время транспортировки, что привело к снижению уровня положительных культур с 36,7% до 24,1% [44]. Недавнее развитие транспортной среды - это новая транспортная среда, транспортная среда GESA.Транспортная среда GESA представляет собой полутвердую среду, в которой образцы биопсии желудка могут храниться при 4 ° C в течение до 10 дней и обеспечивать поддающуюся количественной оценке степень восстановления H. pylori (90,7%) [45]. Для культивирования H. pylori в биопсии желудка был также разработан новый двухфазный тест, который сочетал селективный обогащающий бульон и биохимический тест с использованием агара с мочевиной в одном сосуде. В этом небольшом исследовании двухфазный тест был проведен на 55 образцах биопсии и показал 100% положительный прогностический клапан после 48 часов инкубации.Более того, этот метод имел более низкую частоту ложноположительных результатов и требовал более низкой бактериальной нагрузки, примерно 10 5 КОЕ / мл, по сравнению с CLOtest. В то же время этот тест можно было использовать в аэробных условиях и позволять культивирование, а также тестирование чувствительности к антибиотикам [46].
Факторы-хозяева, такие как высокая активность гастрита, низкая бактериальная нагрузка, кровотечение, употребление алкоголя и употребление H 2 — антагонистов рецепторов, ИПП, антибиотиков, оказывают отрицательное влияние на положительный результат посева.Эти препараты, за исключением антибиотиков, которых следует избегать по крайней мере за 4 недели, также рекомендуется избегать за 2 недели до посева. Чтобы избежать систематической ошибки при выборке из-за неоднородного распределения H. pylori в желудке, было рекомендовано как минимум 2 образца биопсии из антрального отдела и 2 образца биопсии из тела [47,48].
Хотя посев — трудоемкий, дорогой и трудоемкий тест для диагностики H. pylori , тест на чувствительность к антибиотикам H. pylori , полученный с помощью посева, является особым преимуществом в клинической практике.В соответствии с рекомендациями консенсусного отчета Маастрихт IV, культура H. pylori и определение чувствительности к антибиотикам следует проводить, если первичная резистентность к кларитромицину превышает 20% в данном географическом районе или после неэффективности лечения препаратами второй линии [21]. Кроме того, культивирование также позволяет изолировать H. pylori для дальнейшего анализа фенотипических и генотипических характеристик, чтобы лучше понять патогены и, следовательно, предложить оценку терапии.С ростом распространенности устойчивости к антибиотикам культивирование по-прежнему остается надежным методом лечения неэффективности лечения H. pylori , а также изучения устойчивости к антибиотикам в популяционных исследованиях до того, как другие молекулярные тесты станут более доступными.
Полимеразная цепная реакция
С момента применения полимеразной цепной реакции (ПЦР) для обнаружения инфекции H. pylori , ПЦР широко использовалась для диагностики H. pylori из образцов биопсии желудка, слюны, стула, желудочного сока. сок и разные экземпляры.ПЦР обеспечивает превосходную чувствительность и специфичность, превышающую 95%, по сравнению с другими традиционными тестами и дает более точные результаты обнаружения H. pylori у пациентов с кровотечением. Несколько генов-мишеней, включая UreA , glmM , UreC , 16S рРНК , 23S рРНК , HSP60 и VacA , были использованы для обнаружения H. различные консервативные гены-мишени могут повысить специфичность, что, в свою очередь, позволяет избежать ложноположительных результатов, особенно для образцов, отличных от образцов биопсии желудка.Другие преимущества ПЦР, в том числе меньшее количество бактерий, требуемых в образце, более быстрые результаты и отсутствие необходимости в специальных материалах для обработки или транспортировке, позволяют врачам принимать более быстрое и точное решение о лечении пациента. Кроме того, ПЦР также позволяет одновременно обнаруживать специфические мутации, приводящие к устойчивости к антибиотикам, такие как устойчивость к макролидам и фторхинолонам, и факторы вирулентности, такие как CagA и VacA [49-51].
По сравнению с методом разведения в агаре (Etest), который обычно считается золотым стандартом теста на чувствительность к антибиотикам, ПЦР в реальном времени (RT-PCR) имеет несколько преимуществ.Во-первых, использование фиксированной формальдегидом залитой парафином ткани желудка в ПЦР-тесте более удобно, быстро и чувствительно, чем использование свежего биоптата в Etest, более того, в этих условиях RT-PCR также показала не худшие результаты тестирования чувствительности к антибиотикам, чем Etest. Кроме того, ПЦР более надежна для выявления гетерорезистентного статуса, который часто приводит к ложноотрицательному результату в Etest, следовательно, ПЦР может предоставить более точную информацию для клиницистов перед началом лечения антибиотиками [52].В недавнем исследовании, в котором использовалась ОТ-ПЦР в фиксированных формалином и залитых парафином образцах для выявления инфекции H. pylori и ассоциированного статуса устойчивости к кларитромицину, изучалась эффективность четырехкомпонентной терапии на основе генотипической резистентности в качестве лечения первой линии для 385 пациентов с функциональная диспепсия. В этом исследовании у 136 пациентов (35,3%) была диагностирована инфекция H. pylori , а чувствительность ОТ-ПЦР и гистологического исследования составила 95,6% и 69,9% соответственно.Четырехкратная терапия цитратом калия висмута, рабепразолом, амоксициллином и кларитромицином использовалась для генотипически чувствительных пациентов, в отличие от генотипически резистентных пациентов лечили цитратом висмута калия, рабепразолом, амоксициллином и фуразолидоном. Авторы обнаружили, что уровень эрадикации составил 100% для пациентов с чувствительным к кларитромицину H. pylori и 94% для пациентов с устойчивым к кларитромицину H. pylori соответственно для анализа по протоколу [53].Во-вторых, ОТ-ПЦР также является удобным методом эпидемиологического исследования региональной степени устойчивости к антибиотикам в качестве руководства для эмпирического лечения первой линии. Кроме того, ОТ-ПЦР может обнаруживать точечные мутации, которые вызывают устойчивость к антибиотикам, а также обнаруживать изменение точечной мутации или появление новой мутации, что дает дополнительную информацию для эпидемиологических и молекулярных исследований взаимосвязи генотип-фенотип. Из-за возможного изменения мутаций, которые вызывают устойчивость к антибиотикам со временем, определение более 5 точечных мутаций при использовании методов на основе ПЦР важно для достижения хорошей точности при обнаружении устойчивости к антибиотикам [54-56].
Были описаны генетические мутации, вызывающие устойчивость к кларитромицину (23S рРНК), хинолонам ( gyrA ген), тетрациклину (16S рРНК), рифабутину ( rpoB ген) и амоксициллину ( pbp-1a в предыдущем гене). исследования и несколько коммерческих наборов, таких как набор MutaREAL H. pylori , анализ ПЦР в реальном времени ClariRes и система обнаружения АПФ Seeplex ClaR- H. pylori [57]. Однако точный механизм устойчивости к метронидазолу менее ясен, и гены восприимчивости, такие как rdxA и frxA, участвовали в предыдущих исследованиях с спорными результатами.Недавнее исследование с использованием секвенирования нового поколения Illumina для поиска мутаций-кандидатов на устойчивость к метронидазолу. Это исследование подтвердило, что мутации в гене rdxA играют основную роль в устойчивости к метронидазолу у H. pylori , а мутации в гене frxA могут усиливать устойчивость к метронидазолу только при наличии мутаций rdxA. Кроме того, новое открытие мутаций в гене rpsU может сыграть роль в устойчивости к метронидазолу для объяснения устойчивых к метронидазолу штаммов без мутаций в генах rdxA и frxA [58].Анализ GenoType HelicoDR — это молекулярный тест, сочетающий ПЦР и гибридизацию, позволяющий провести молекулярную дефекацию H. pylori , а также устойчивость к кларитромицину и фторхинолонам в течение 6 часов. В предыдущих исследованиях анализ GenoType HelicoDR с использованием штаммов бактерий или образцов биопсии желудка был высокоточным для устойчивости к кларитромицину с чувствительностью 94–100% и специфичностью 86–99% соответственно; Анализ GenoType HelicoDR также точен для устойчивости к фторхинолонам с чувствительностью 83% -87% и 95% -98.Специфичность 5% соответственно по сравнению с методом на основе культуры [59,60]. Однако недавнее исследование по оценке клинической применимости GenoType HelicoDR в Корее показало, что чувствительность и специфичность в отношении устойчивости к кларитромицину составляли только 55,0% и 80,0% соответственно. GenoType HelicoDR также не был точным для устойчивости к фторхинолонам, показывая чувствительность и специфичность 74,4% и 70,0% соответственно. Клиническая применимость GenoType HelicoDR для определения устойчивости к антибиотикам может иметь некоторые ограничения, которые требуют дальнейшего изучения [61].ОТ-ПЦР обычно используется для количественного определения ДНК H. pylori в образцах биопсии, но выполнение ОТ-ПЦР может быть проблемой для клинических лабораторий из-за дорогостоящих термоциклеров. Мультиплексная ПЦР на основе двойного примирования олигонуклеотидов (DPO) была разработана для обнаружения инфекции H. pylori и устойчивости к кларитромицину, и этот тест можно проводить в любом стандартном термоциклере, который стоит меньше, чем RT-PCR. Благодаря особой конструкции праймера DPO для амплификации рДНК H. pylori 23S и обнаружения наиболее распространенных мутаций, A2142G и A2143G, придающих устойчивость к кларитромицину, DPO-PCR оказалась быстрой и точной для H.pylori диагностика и определение чувствительности к кларитромицину с помощью биоптатов желудка [62,63]. Кроме того, недавнее исследование с использованием образцов тканей, обработанных RUT для оценки диагностической точности DPO-PCR, показало, что DPO-PCR имеет более высокую чувствительность, чем RUT и гистология, а DPO-PCR может обнаружить инфекцию H. pylori в RUT- отрицательные образцы, что означает, что этот тест может уменьшить ложноотрицательный результат и уменьшить необходимость повторного эндоскопического обследования.Степень согласованности DPO-PCR между образцами биопсии желудка и образцами, обработанными RUT, составила 94,4% [64].
Обнаружение факторов вирулентности с помощью ПЦР помогает оценить генетические вариации факторов вирулентности H. pylori и дает больше информации для понимания клинических различий между пациентами, инфицированными разными штаммами H. pylori . Несколько исследований показали, что наличие факторов вирулентности, таких как ген CagA и VacA , связано с более тяжелым воспалением желудка и более высокой распространенностью язвенной болезни и рака желудка [65–67].Ген А промотора язвы двенадцатиперстной кишки (DupA) также предполагалось связать с образованием язв, индуцированным H. pylori , но в предыдущих исследованиях сообщалось о противоречивых результатах, которые предположительно были вызваны несовпадением праймеров. Недавно разработанная ОТ-ПЦР со специальным праймером, разработанным на основе выравнивания всех 221 последовательностей гена DupA, была введена недавно для повышения скорости обнаружения гена DupA. Этот метод повысил уровень обнаружения до 64,2%, независимо от того, имели ли обычно используемые ПЦР уровень обнаружения между 29.От 9% до 37,8%. Авторы указали, что дизайн ПЦР оказал большое влияние на обнаружение фактора вирулентности, и обнаружение специфического аллеля DupA не то же самое, что обнаружение фактического гена DupA [68].
ПЦР также помогает обнаружить H. pylori в пробах окружающей среды для эпидемиологических исследований. Высокая распространенность H. pylori , обнаруженная в образцах питьевой воды с помощью ПЦР, предоставила дополнительную информацию о передаче H. pylori через питьевую воду [69].Более высокий уровень обнаружения заражения H. pylori в немытых овощах свидетельствует о том, что точное мытье овощей снижает загрязнение H. pylori [70]. ПЦР также использовалась для определения генотипирования H. pylori в овощах, и высокая степень сходства в образце генотипирования H. pylori среди образцов овощей и образцов человека позволила предположить, что овощи могут быть источниками бактерий [71].
За исключением более быстрых и высокоточных результатов ПЦР для обнаружения H.pylori и штаммы, устойчивые к антибиотикам, опасения по поводу стоимости, доступного местного оборудования и опыта в области молекулярных методов неизбежно влияют на возможность проведения ПЦР в местных лабораториях.
НЕИНВАЗИВНЫЕ ИСПЫТАНИЯ
Было сделано несколько попыток избежать использования эндоскопических методов диагностики по нескольким причинам. Прежде всего, эндоскопия — это инвазивная процедура, которая вызывает дискомфорт и не подходит для пациентов с тяжелыми сопутствующими заболеваниями или противопоказаниями. Кроме того, стоимость эндоскопии и дополнительные расходы на эндоскопию, такие как одноразовые щипцы и анестезия, могут быть высокими.И последнее, но не менее важное: систематическая ошибка выборки почти неизбежно встречается в методах, основанных на биопсии, из-за неравномерного распределения H. pylori в желудке.
Дыхательный тест на мочевину
Дыхательный тест на мочевину (UBT) используется уже почти 30 лет и до сих пор остается самым популярным и точным неинвазивным тестом для диагностики инфекции H. pylori . За счет уреазной активности H. pylori , 13 C- или 14 C-меченная мочевина, проглоченная пациентом, гидролизуется до меченого CO 2 в желудке, затем меченый CO 2 абсорбируется в желудке. кровь и выдыхаемый при дыхании, в котором можно измерить помеченный CO 2 .Хотя несколько факторов, включая пациента, бактерии и сам тест, влияют на результаты UBT, UBT — это высокоточный и воспроизводимый тест с чувствительностью и специфичностью около 95% при стандартных процедурах. Недавно опубликованный метаанализ для оценки диагностической точности UBT у взрослых пациентов с диспепсическими симптомами показал, что совокупная чувствительность составила 96% (95% ДИ: 0,95-0,97), а совокупная специфичность составила 93% (95% ДИ: 0,91-0,94). [72]. UBT также полезен для эпидемиологических исследований и для оценки эффективности эрадикационной терапии [21,73].Пациенту следует прекратить прием ИПП за 2 недели и антибиотик за 4 недели до обследования, чтобы избежать ложноотрицательных результатов [74]. Кровотечение также влияет на диагностическую точность UBT, и отсроченное UBT после восстановления после кровотечения обязательно для уменьшения ложноотрицательного результата [75]. Иногда, хотя и редко, присутствие в желудке других патогенов, продуцирующих уреазу, также вызывает ложноположительные результаты.
UBT — подходящий метод со многими преимуществами, такими как простой, неинвазивный и безопасный, для обнаружения H.pylori у педиатрических пациентов, хотя точность UBT у педиатрических пациентов не так хороша, как у взрослых пациентов, особенно для детей младше 6 лет, с чувствительностью и специфичностью от 75% до 100% [76].
13 C-UBT предпочтительнее 14 C-UBT, чтобы избежать воздействия радиации, хотя 14 C-UBT безопасен для детей и беременных женщин, потому что излучение от 14 C-UBT ниже чем радиация, полученная из окружающей среды.Однако из-за отсутствия дорогостоящего оборудования и возможности платить высокую стоимость в размере 13 C-UBT, 14 C-UBT более популярны в развивающихся странах. Диагностическая точность между 13 C-UBT и 14 C-UBT не отличается, и оба теста можно считать золотым стандартом среди различных неинвазивных тестов для диагностики инфекции H. pylori [77]. Существует два протокола, некапсулированный и инкапсулированный, которые используются для перорального введения 14 С-мочевины пациентам для H.pylori диагноз. Первоначально инкапсулированный 14 C-UBT был разработан, чтобы избежать проблемы гидролиза 14 C-мочевины под действием продуцирующей уреазу флоры полости рта, и этот метод устранил проблему ложноположительных результатов в пробах из раннего дыхания [78] . Тем не менее, быстрый транзит капсулы, содержащей 14 C-мочевину, из желудочного тракта или ее неполное рассасывание в желудке во время фазы сбора выдыхаемого воздуха приводит к инкапсулированию 14 C-UBT, возможно, не лучшим вариантом, чем протокол без капсул [79 ].В недавнем исследовании использовалась методика динамического сцинтискана для мониторинга судьбы капсулы в желудке и сравнивалась чувствительность между протоколами без инкапсулирования и инкапсулирования у 100 пациентов с диспепсией. Это исследование показало, что неинкапсулированный протокол имел более высокую чувствительность, чем инкапсулированный протокол, а чувствительность инкапсулированного и неинкапсулированного 14 C-UBT составляла 90,5% и 98,6% через 10 минут и 91,8% и 97,2% через 15 минут соответственно. Неполное разрешение или отсутствие разрешения капсулы 14 C-мочевины в желудке во время фазы сбора выдыхаемого воздуха, отмеченное динамическими изображениями сцинтискана, послужило объяснением более низкой чувствительности инкапсулированного 14 C-UBT по сравнению с неинкапсулированным 14 C-UBT [80].
Точное значение отсечения для значения дельта по сравнению с исходным уровнем (DOB) для различения между H. pylori -положительными и H. pylori -отрицательными результатами является другой спорной проблемой. Отсечной клапан для UBT был первоначально определен как 5,0, что было наиболее широко рекомендовано, тогда как более низкие значения, 3,0 или 3,5, также были предложены для повышения его точности без ущерба для чувствительности и специфичности этого теста. «Серая зона», в которой результаты UBT неубедительны, упоминалась в предыдущих исследованиях, и пограничное значение DOB, например, очень близкое к выбранной точке отсечения, следует интерпретировать с осторожностью [81].Недавно был представлен новый метод UBT с использованием интегрированной системы выходной спектроскопии с оптическим резонатором, обеспечивающей оптимальную диагностическую точку отсечки. Этот предварительный тест определил диагностическую точку отсечения как совокупный процент восстановленной дозы 13 C (c-PDR) = 1,47% через 60 минут и продемонстрировал 100% чувствительность и 100% специфичность с точностью 100% по сравнению с инвазивной эндоскопией. тесты. Однако в этом исследовании используется небольшое количество образцов, и для подтверждения этих результатов необходимы дальнейшие более масштабные исследования [82].
STOOL ANTIGEN TEST
Тест на антиген кала (SAT) — другой неинвазивный метод с хорошей чувствительностью и специфичностью, 94% и 97% соответственно в глобальном метаанализе, при диагностике инфекции H. pylori [83]. Этот метод определяет присутствие H. pylori антигена в образцах стула. Существует два типа SAT, используемых для обнаружения H. pylori, методы, основанные на иммуноферментном анализе (EIA) и иммунохроматографическом анализе (ICA), с использованием либо поликлональных антител, либо моноклональных антител.В настоящее время доступно множество SAT для диагностики инфекции H. pylori , и различная диагностическая точность показана в разных исследованиях с разными SAT и разным дизайном исследований. В целом тесты на основе моноклональных антител более точны, чем тесты на основе поликлональных антител [83], а тесты на основе EIA обеспечивают более надежные результаты, чем тесты на основе ICA [84,85]. В недавнем исследовании EIA на антиген Tesmate pylori (TPAg) с использованием моноклональных антител для проверки нативной каталазы H. pylori было выявлено 92.4% чувствительность и 100% специфичность у взрослых по сравнению с ОТ-ПЦР, а точность этого теста составила 94,9% [86]. Тест Premier Platinum HpSA Plus, другой моноклональный тест на основе EIA, также показал надежные диагностические результаты с чувствительностью 92,2%, специфичностью 94,4% и точностью 93,4% для диагностики инфекции H. pylori по сравнению с другими 4 тестами SAT, включая 1 моноклональный На основе EIA (тест на антиген H. pylori ), на основе 2 моноклональных ICA (тест ImmunoCard STAT! HpSA и H.pylori фекального антигена) и 1 теста на основе поликлонального ICA (одноэтапный тест на антиген H. pylori ), точность которых была ниже 90% [84]. Однако тесты на основе ICA просты в выполнении и не требуют специального оборудования, что делает его подходящим для тестирования в офисе и в развивающихся странах. Новый тест SAT на основе моноклональных ICA, Atlas H. pylori Antigen Test, также был недавно представлен и обеспечивает лучшие результаты, чем предыдущие SAT на основе моноклональных ICA, с 91.Чувствительность 7%, специфичность 100% и точность 96,6% [87].
Помимо UBT, SAT на основе моноклонального EIA также является надежным тестом, рекомендованным руководящими принципами для оценки эффективности эрадикационной терапии H. pylori , и время для тестирования после окончания лечения должно составлять не менее 4 недель [21 , 88]. В предыдущем метаанализе совокупная чувствительность и специфичность моноклонального SAT для подтверждения эрадикации после терапии составляли 93% и 96% соответственно [83]. В недавних исследованиях было подтверждено, что SAT на основе моноклональных EIA является полезным и точным инструментом для определения результатов H.pylori с чувствительностью 91,6–100% и специфичностью 93,6–98,4% [89, 90]. Кроме того, моноклональные тесты SAT на основе ICA, RAPID Hp StAR и ImmunoCard STAT! HpSA также дает многообещающие результаты с чувствительностью 90,0–100% и специфичностью 93,6–94,9%.
В дополнение к оценке эрадикационной терапии, моноклональный САТ является удобным, неинвазивным и полезным тестом для диагностики инфекции H. pylori у педиатрических пациентов [91]. Исследование с применением SAT у детей в возрасте от 6 до 30 месяцев показало надежные результаты SAT для диагностики H.pylori у детей раннего возраста [92]. Недавний метаанализ, включающий 45 исследований и 5931 пациента, для оценки эффективности SATS у детей показал, что совокупная чувствительность и специфичность составили 92,1% и 94,1% соответственно. В анализе подгрупп чувствительность и специфичность моноклонального SAT, поликлонального SAT и одноэтапного быстрого моноклонального SAT составила 96,2% и 94,7%, 88,0% и 93,0% и 88,1% и 94,2% соответственно. Моноклональная SAT — надежный тест для диагностики инфекции H. pylori у детей [93].Более того, SAT — полезный инструмент для программ эпидемиологического исследования и скрининга [94,95]. По стоимости и оснащению SAT больше подходит для массовых опросов, чем UBT. По сравнению с серологическими тестами, которые обычно используются для скрининга, SAT дает более надежные результаты в диагностике инфекции H. pylori . Однако предыдущее исследование показало, что SAT был менее точным, чем серологический тест у пациентов с тяжелым атрофическим гастритом, и влияние этого результата требует дальнейшей оценки для оценки роли SAT в скрининге H.pylori -ассоциированные заболевания, такие как рак желудка [96]. В то время как другое исследование с использованием нового SAT на основе поликлонального EIA (EZ-STEP H. pylori ) обнаружило наличие атрофического гастрита и / или кишечной метаплазии, которые существенно не повлияли на результаты SAT [97].
На точность SAT влияет несколько факторов, таких как антибиотик, ИПП, N-ацетилцистеин, дефекация и кровотечение из верхних отделов желудочно-кишечного тракта. Сохранность образца, такая как температура и время транспортировки перед испытанием, а также отсечной клапан также влияют на диагностическую точность SAT [98-100].
ИСПЫТАНИЯ НА ОСНОВЕ АНТИТЕЛ
Для диагностики H. pylori широко доступны многочисленные серологические тесты, основанные на обнаружении антител IgG к H. pylori, и тест EIA является наиболее распространенным и точным методом среди них. Серологические тесты также часто используются при скрининге для эпидемиологических исследований из-за их недорогой, быстрой и приемлемости для пациентов. Кроме того, серологический тест полезен для оценки инфекции H. pylori у детей.Недавнее исследование с использованием E-Plate, коммерческого набора сывороточных антител, для сравнения эффективности серологического теста с SAT у 73 детей показало, что чувствительность, специфичность и отношение правдоподобия для серологического теста составили 91,2%, 97,4% и 35,6%. , соответственно. Эти результаты были получены при использовании запорного клапана, рекомендованного для взрослых, у детей [101]. Поскольку точность серологических тестов зависит от антигена, используемого в коммерческом наборе, и степени распространенности конкретных штаммов H. pylori , используемых в качестве источника антигена.Надлежащие антигены, используя либо местные штаммы в качестве источника антигена, либо объединяющие антигены из штаммов разных групп, а также надежное пороговое значение серологического теста должны быть проверены на местном уровне перед исследованием популяции [102,103]. Некоторые иммуногенные белки, такие как CagA, VacA, UreA, Omp и GroEL, были использованы в качестве кандидатов для обнаружения инфекции. Белок H. pylori FliD, важный элемент в сборке функциональных жгутиков, также признан новым маркером для серологической диагностики H.pylori с чувствительностью и специфичностью 99% и 97% соответственно [104]. Недавно для серологической диагностики инфекции H. pylori был введен новый метод иммуноанализа «РекомЛайн H. pylori » с использованием шести высокоиммуногенных факторов вирулентности (CagA, VacA, GroEL, gGT, HcpC и UreA). В отличие от EIA и иммуноблоттинга, RecomLine позволяет идентифицировать специфический ответ антител против различных антигенов H. pylori и увеличивает дискриминирующую способность.По сравнению с гистологией, рекомЛайн показала чувствительность и специфичность 97,6% и 96,2% соответственно. РекомЛайн также является полезным инструментом для идентификации специфических факторов вирулентности H. pylori [105,106].
Другое преимущество серологического теста заключается в том, что на точность серологических тестов не влияют язвенное кровотечение, атрофия желудка, а также использование ИПП или антибиотиков, которые вызывают ложноотрицательные результаты в других инвазивных или неинвазивных тестах. Однако серологический тест не является надежным тестом для оценки эрадикационной терапии, поскольку уровни антител могут сохраняться в крови в течение длительных периодов времени даже после успешной эрадикации [21].Поскольку серологические тесты не различают активную инфекцию и прошлое воздействие H. pylori , перед эрадикационной терапией требуется дополнительное подтверждение другими тестами.
Как и SAT, серологические тесты на основе EIA имеют лучшую точность, чем тесты на основе ICA. Недавнее исследование, сравнивающее 29 коммерческих серологических тестов (17 на основе EIA и 12 на основе ICA), показало, что точность 9 из 17 тестов на основе EIA была выше 90%, тогда как только один из 12 тестов на основе ICA имел точность> 90 %.Гетерогенные характеристики также наблюдались между различными серологическими тестами, выявление чувствительности варьировалось от 57,8% до 100%, а специфичность варьировалась от 58,7% до 96,8% в тестах на основе EIA; Чувствительность варьировала от 55,6% до 97,8%, а специфичность — от 60,3% до 96,8% в тестах на основе ICA. Серологические тесты следует выбирать правильно в соответствии с их конкретными рабочими параметрами для достижения различных целей, таких как скрининг, первоначальный диагноз или подтверждение другого теста [107].
Серологический тест также играет важную роль в изучении факторов патогенеза и вирулентности, поскольку некоторые антигенные белки могут быть обнаружены иммунологическими методами и имеют дополнительную диагностическую ценность.Было предпринято несколько попыток найти потенциальные биомаркеры для идентификации пациента, инфицированного штаммом H. pylori высокого риска, с помощью серологических тестов. Уровни пепсиногена (PG) I, PG II и соотношения PG I / II в сочетании с антителом H. pylori широко используются для прогнозирования атрофического гастрита и риска рака желудка [108,109]. Соотношение PG I / II также может быть полезно для наблюдения за раком желудка у пациентов после эрадикационной терапии [110]. Однако получены противоречивые результаты по клиническому применению этих серологических препаратов.Недавнее исследование, оценивающее точность GastroPanel, который измеряет гастрин-17, антитела H. pylori , PG I и PG II, для выявления атрофического гастрита, показало только 50% чувствительность и 80% специфичность, что было хуже, чем в предыдущих исследованиях [111 ]. Пепсиногеновый тест также оказался недостаточно точным для диагностики рака желудка с чувствительностью 71,0% и специфичностью 69,2% [112]. Некоторые факторы вирулентности также были оценены для прогнозирования заболеваний, ассоциированных с H. pylori .Присутствие сывороточных антител CagA, VacA и GroEL у пациентов с инфекцией H. pylori связано с предраковыми поражениями желудка, а также с раком желудка, и эти сывороточные маркеры могут служить потенциальными предикторами для пациентов, инфицированных штаммами высокого риска, которые могут быть связано с развитием рака желудка [106,113]. Хотя связь между факторами вирулентности и клиническими проявлениями была обнаружена в ходе предыдущих эпидемиологических исследований, серологические тесты все еще недостаточно надежны для диагностики рака желудка.В недавнем метаанализе совокупная чувствительность и специфичность антител CagA, используемых для диагностики рака желудка, составила 71% и 40% соответственно, а диагностическое отношение шансов составило 2,11 [114].
Обнаружение H. pylori IgG в моче также оценивалось у детей в предыдущих исследованиях, однако были представлены различные результаты [115,116]. Кроме того, диагностическая точность теста на основе ИФА для выявления IgG в слюне H. pylori также была недостаточной в качестве надежного теста [117,118].Определение антител в моче или слюне менее точное, чем другие тесты, и его не рекомендуется использовать при ведении пациентов [119].
ДИАГНОСТИКА
H. PYLORI В ДРУГИХ ОБРАЗЦАХИспользование ПЦР для обнаружения H. pylori в кале является надежным и быстрым методом, особенно привлекательным для детей в качестве неинвазивного теста. ПЦР стула также дает преимущества в идентификации конкретных генотипов и устойчивости микроорганизмов к антибиотикам [120,121].Полость рта считается внегастральным резервуаром H. pylori , хотя значение H. pylori в полости рта как источника повторного инфицирования или пути передачи все еще неясно. Слюна и зубной налет были образцами, обычно используемыми для обнаружения H. pylori в полости рта, а ПЦР была наиболее распространенным и надежным тестом, используемым в недавних исследованиях. RUT и посев также были выполнены для выявления орального H. pylori в ранних исследованиях.Распространенность обнаружения H. pylori в полости рта сильно варьировала, от 0% до 100%, и обычно обнаруживалась более низкая распространенность в слюне по сравнению с зубным налетом [122]. Широкие различия в распространенности H. pylori в полости рта могут быть связаны с разными методологиями, разными популяциями и разными праймерами, использованными в исследованиях. Недавние исследования были сосредоточены на модификации праймера для повышения диагностической точности или оценке нового метода преодоления ограничений ПЦР.Недавно была разработана новая система ПЦР с использованием наборов праймеров, специфичных для H. pylori на основе высококонсервативных последовательностей полных геномов 48 штаммов H. pylori , для повышения диагностической точности ПЦР в полости рта [123] . Петлевая изотермическая амплификация (LAMP), новый метод высокоспецифичной и чувствительной амплификации ДНК, сравнивалась с ПЦР по скорости обнаружения H. pylori в образцах зубного налета в небольшом исследовании, в котором приняли участие 45 участников.Это исследование показало, что LAMP имеет более высокий уровень обнаружения, чем ПЦР, и уровень обнаружения H. pylori в образцах зубного налета с помощью LAMP и ПЦР составляет 66,67% и 44% соответственно [124].
ДИАГНОСТИКА
H. PYLORI ПРИ ОСОБЫХ КЛИНИЧЕСКИХ ОБСТОЯТЕЛЬСТВАХКак упоминалось ранее, кровотечение из верхних отделов желудочно-кишечного тракта (UGIB) снижает диагностическую точность многих тестов, включая инвазивные и неинвазивные, для выявления инфекции H. pylori . В предыдущем метаанализе RUT, гистология и культура показали низкую чувствительность и высокую специфичность у пациентов с UGIB.UBT по-прежнему оставался надежным тестом, тогда как SAT стал менее точным в этих клинических условиях. Хотя UGIB не повлиял на серологический анализ, его нельзя рекомендовать в качестве первого диагностического теста на инфекцию H. pylori [40]. При сравнении CLO, культуры и гистологии, гистология была меньше подвержена влиянию язвенного кровотечения и могла быть надежным тестом даже в присутствии крови [125]. ПЦР имела значительно более высокую чувствительность, чем RUT, гистология и культура, с чувствительностью 91%, 66%, 43% и 37% соответственно и показала аналогичную чувствительность по сравнению с серологией и UBT, 94% и 94% соответственно.ПЦР была аналогична UBT по диагностической точности для выявления инфекции H. pylori в кровоточащих пептических язвах. Однако специфичность ПЦР (100%) превосходила только серологию (65%) и не отличалась от других тестов (RUT: 95%, гистология: 95%, культура: 100%, UBT: 85%) [126]. Исследование также показало, что ОТ-ПЦР может выявить инфекцию H. pylori с использованием фиксированных формалином образцов биопсии, залитых парафином, гистология которых показала отрицательные результаты у пациентов с кровотечением из язвенной болезни [127].Ликвидация H. pylori важна для лечения язвенного кровотечения, связанного с H. pylori , с целью предотвращения дальнейшего кровотечения, а успешная эрадикационная терапия даже более эффективна, чем длительная поддерживающая антисекреторная терапия с ИПП для уменьшения повторного кровотечения. Тестирование на основе биопсии H. pylori обычно рекомендуется во время эндоскопического исследования UGIB, даже если кровотечение снижает чувствительность тестов на основе биопсии. По результатам мета-регрессионного исследования, отложенный тест, через 4 недели после эпизода UGIB, имел более высокий уровень обнаружения H.pylori у пациентов с УГИБ. Поскольку точное определение этиологии кровоточащих язв имеет решающее значение при лечении язвенных кровотечений, в руководствах также рекомендовано подтверждение отрицательного результата с помощью последующего неинвазивного теста [22,128,129]. Низкая прогностическая ценность отрицательного результата была также обнаружена, когда UBT проводился сразу после экстренной эндоскопии, и тест задержки также был обязательным для всех отрицательных результатов раннего UBT [75]. Несмотря на важность тестирования H. pylori у пациентов с UGIB, доля пациентов, получивших прямое лечение H.pylori было прекращено, около 12% -60% отметили по результатам предыдущих исследований. Опасения по поводу снижения чувствительности, связанной с кровотечением или применением ИПП, и повышенным риском побочных эффектов, связанных с биопсией желудка или увеличением времени процедуры для выполнения биопсии желудка, могут повлиять на решения клиницистов о тестировании H. pylori [130].
Диагностика H. pylori у пациентов с частичной гастрэктомией — еще одна проблема, которой уделялось меньше внимания, поскольку эти пациенты составляли очень небольшую часть населения в целом.В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной гастрэктомией, гистология показала лучшие результаты, за ней следовала RUT, тогда как UBT имела низкую диагностическую точность. Эти исследования показали высокую степень гетерогенности, а совокупная чувствительность и специфичность гистологии, RUT и UBT составили 93% и 85%; 79% и 94%; 77% и 89% соответственно. RUT был предложен в качестве первоначального выбора теста для этих пациентов, и были рекомендованы образцы биопсии из дна желудка или верхней части остаточного желудка.Гистологическое исследование было рекомендовано этим пациентам после отрицательного результата РУТ [131]. SAT может быть другим надежным тестом для обнаружения H. pylori у пациентов с дистальной гастрэктомией. Небольшое исследование с использованием теста HpSA для оценки диагностической точности SAT у 59 пациентов с дистальной резекцией желудка по поводу рака желудка показало, что чувствительность, специфичность и точность теста HpSA составляли 100%, 90,5% и 96,6% соответственно [132]. Возможная причина неадекватного выполнения УБТ при диагностике H.pylori у пациентов с дистальной резекцией желудка может быть недостаточно времени для того, чтобы мочевина оставалась в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori . BreathID, быстрый непрерывный UBT в реальном времени, казалось, преодолел этот недостаток и показал лучшую точность, чем RUT, 87% и 72% соответственно. Однако в этом исследовании также была обнаружена более низкая чувствительность и специфичность RUT, 82% и 71% соответственно, по сравнению с предыдущими исследованиями, и биопсия, взятая из тела желудка немного дистальнее глазного дна, в этом исследовании может повлиять на диагностические характеристики RUT [133 ].Недавнее исследование также продемонстрировало противоречивые результаты между UBT и биопсийными тестами у пациентов с частичной гастэктомией после эрадикационной терапии H. pylori . Авторы предположили, что дополнительные тесты на основе эндоскопической биопсии помогут избежать ненужного лечения, поскольку у этих пациентов после эрадикационной терапии были обнаружены высокий уровень ложноположительных результатов и низкая прогностическая ценность UBT, 19,1% и 44,7% соответственно [134].
Точное определение статуса H. pylori у пациентов после эрадикационной терапии имеет важное значение, и UBT, а также SAT рекомендуются руководящими принципами для оценки эффективности эрадикационной терапии.Эти тесты обычно рекомендуется проводить более чем через 4 недели после окончания терапии [21,88]. Однако высокий уровень ложноположительных результатов в 52,9% был обнаружен при использовании 13 C-UBT с текущим пороговым значением (2,5 ‰), особенно у пациентов с более чем двукратной предыдущей эрадикационной терапией и у пациентов с умеренной и тяжелой кишечной метаплазией желудка [ 135]. Недавнее исследование с использованием вложенной ПЦР для обнаружения H. pylori в образцах биопсии желудка после эрадикационной терапии показало, что вложенная ПЦР более чувствительна, чем RUT, гистология и культура.Кроме того, метод, основанный на ПЦР, позволяет отличить реинфекцию или рецидив после эрадикационной терапии [136].
ЗАКЛЮЧЕНИЕ
Развитие современных методов диагностики позволяет более точно диагностировать инфекцию H. pylori , что, в свою очередь, улучшает лечение заболеваний, связанных с H. pylori- . Хотя теста золотого стандарта может не существовать, выбор теста для выявления инфекции H. pylori зависит от распространенности и штамма H.pylori о эндемичных регионах, доступности, преимуществах и недостатках каждого метода, а также о различных клинических обстоятельствах каждого пациента. Объединение результатов двух или более тестов может быть разумной стратегией в повседневной клинической практике для достижения наиболее надежного результата. Мы полагаем, что будут продолжаться попытки улучшить диагностическую ценность инфекции H. pylori для различных клинических целей, конкретных популяций и генотипических характеристик, чтобы иметь более надежные и осуществимые методы диагностики H.pylori в будущем.
Сноски
При поддержке (частично) грантов Медицинского университета Гаосюн «Грант для лучших университетов», гранты № KMU-TP104G00, № KMU-TP104G03 и № KMU-TP104E25; и Общая больница Тен Чан, совместный исследовательский проект Чун-Ли и КМУ, № ST102004; и больница Гаосюнского медицинского университета, № KMUh200-0R01.
Заявление о конфликте интересов: у авторов нет конфликта интересов, о котором следует сообщать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана штатным редактором и полностью рецензирована внешними рецензентами.Он распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях. См .: http://creativecommons.org/licenses/by-nc/4.0/
Рецензирование началось: 12 мая 2015 г.
Первое решение: 13 июля 2015 г.
Статья в печати: 30 сентября 2015 г.
P- Рецензент: Tosetti C S- Редактор: Ma YJ L- Редактор: A E- Редактор: Zhang DN
Ссылки
1.Пелетейро Б., Бастос А., Ферро А., Лунет Н. Распространенность инфекции Helicobacter pylori во всем мире: систематический обзор исследований с национальным охватом. Dig Dis Sci. 2014; 59: 1698–1709. [PubMed] [Google Scholar] 2. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 3. Фок КМ. Обзорная статья: эпидемиология и профилактика рака желудка.Алимент Pharmacol Ther. 2014; 40: 250–260. [PubMed] [Google Scholar] 4. де Мартель С., Ферли Дж., Франчески С., Винья Дж., Брей Ф., Форман Д., Пламмер М. Глобальное бремя рака, связанное с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол. 2012; 13: 607–615. [PubMed] [Google Scholar] 5. Axon A. Helicobacter pylori и общественное здравоохранение. Helicobacter. 2014; 19 Приложение 1: 68–73. [PubMed] [Google Scholar] 6. Ли Дж.Х., Пак Й.С., Чхве К.С., Ким до Х., Чой К.Д., Сон Х.Д., Ли Г.Х., Чан С.Дж., Чон Х.Й., Ким Дж.Х. Оптимальное место биопсии для обнаружения Helicobacter pylori во время эндоскопической мукозэктомии у пациентов с обширной атрофией желудка.Helicobacter. 2012; 17: 405–410. [PubMed] [Google Scholar] 7. Лан Х.С., Чен Т.С., Ли А.Ф., Чанг Ф.Й., Лин Х.С. Дополнительная биопсия тела позволяет выявить инфекцию Helicobacter pylori на фоне гастрита с атрофией. BMC Gastroenterol. 2012; 12: 182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Като Т., Яги Н., Камада Т., Шимбо Т., Ватанабе Х., Ида К. Диагностика инфекции Helicobacter pylori в слизистой оболочке желудка по эндоскопическим признакам: многоцентровое проспективное исследование. Dig Endosc. 2013; 25: 508–518.[PubMed] [Google Scholar] 9. Чо Дж.Х., Чанг Ю.В., Чан Дж.Й., Шим Дж.Дж., Ли СК, Донг С.Х., Ким ХДЖ, Ким Б. Тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может предсказать статус инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 279–284. [PubMed] [Google Scholar] 10. Чо Ю.С., Чае Х.С., Чан С.Н., Ким Дж.С., Сон Х.С., Ким Х.К., Ким Б.В., Хан С.В., Чой К.Й., Ли Х.К. и др. Сравнение дыхательного теста с 13C-мочевиной и эндоскопического теста pH слизистой оболочки феноловым красным при количественной оценке нагрузки инфекции Helicobacter pylori.Korean J Intern Med. 2008. 23: 134–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Hernández-Garcés HR, Castellanos-González VV, González-Fabián L, Infante-Velázquez M, Peña K, Andrain-Sierra Y. Хромоэндоскопия с красным фенолом в диагностике инфекции Helicobacter pylori. Rev Esp Enferm Dig. 2012; 104: 4–9. [PubMed] [Google Scholar] 12. Гонен С., Симсек И., Сариоглу С., Акпинар Х. Сравнение увеличительной эндоскопии с высоким разрешением и стандартной видеоэндоскопии для диагностики гастрита Helicobacter pylori в рутинной клинической практике: проспективное исследование.Helicobacter. 2009; 14: 12–21. [PubMed] [Google Scholar] 13. Цзи Р, Ли YQ, Гу ХМ, Ю Т, Цзо XL, Чжоу СиДжей. Конфокальная лазерная эндомикроскопия для диагностики инфекции Helicobacter pylori: проспективное исследование. J Gastroenterol Hepatol. 2010. 25: 700–705. [PubMed] [Google Scholar] 14. Яги К., Сака А., Нодзава Ю., Накамура А. Прогнозирование статуса Helicobacter pylori с помощью обычной эндоскопии, узкополосной визуализации с увеличением эндоскопии в желудке после эндоскопической резекции рака желудка. Helicobacter. 2014; 19: 111–115.[PubMed] [Google Scholar] 15. Ци QQ, Zuo XL, Li CQ, Ji R, Li Z, Zhou CJ, Li YQ. Эндоскопия с увеличением высокого разрешения с i-scan в диагностике инфекции Helicobacter pylori: пилотное исследование. J Dig Dis. 2013; 14: 579–586. [PubMed] [Google Scholar] 16. Лю Х, Ву Дж, Линь XC, Вэй Н, Лин В, Чанг Х, Ду ХМ. Оценка диагнозов поражений антрального отдела желудка с помощью увеличительной эндоскопии с узкополосной визуализацией у населения Китая. Dig Dis Sci. 2014; 59: 1513–1519. [PubMed] [Google Scholar] 17. Яги К., Накамура А., Секин А.Сравнение результатов эндоскопии с увеличением и результатов гистологического, посевного и уреазного теста слизистой оболочки тела желудка. Эндоскопия. 2002; 34: 376–381. [PubMed] [Google Scholar] 18. Накагава С., Като М., Симидзу Ю., Накагава М., Ямамото Дж., Луис П.А., Кодаира Дж., Каварасаки М., Такеда Х., Сугияма Т. и др. Связь между гистопатологическим гастритом и микроваскуляризацией слизистой оболочки: наблюдения с увеличительной эндоскопией. Gastrointest Endosc. 2003. 58: 71–75. [PubMed] [Google Scholar] 19. Кавамура М., Секин Х., Абэ С., Сибуя Д., Като К., Масуда Т.Клиническое значение белых отверстий желудочных крипт, наблюдаемых при увеличительной эндоскопии. Мир Дж. Гастроэнтерол. 2013; 19: 9392–9398. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ватанабе К., Нагата Н., Симбо Т., Накашима Р., Фурухата Е., Сакураи Т., Акадзава Н., Ёкои С., Кобаякава М., Акияма Дж. И др. Точность эндоскопической диагностики инфекции Helicobacter pylori в соответствии с уровнем эндоскопического опыта и эффектом тренировки. BMC Gastroenterol. 2013; 13: 128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др. Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 22. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007. 102: 1808–1825. [PubMed] [Google Scholar] 23. Lash JG, Genta RM. Соблюдение рекомендаций Сиднейской системы увеличивает вероятность выявления гастрита, вызванного Helicobacter, и кишечной метаплазии в 400738 наборах биопсий желудка.Алимент Pharmacol Ther. 2013; 38: 424–431. [PubMed] [Google Scholar] 24. Хартман DJ, Оуэнс SR. Требуются ли обычные вспомогательные окрашивания для диагностики инфекции Helicobacter в образцах биопсии желудка? Обзор институционального обеспечения качества. Am J Clin Pathol. 2012; 137: 255–260. [PubMed] [Google Scholar] 25. Баттс К.П., Кетовер С., Какар С., Красинскас А.М., Митчелл К.А., Уилкокс Р., Вестерхофф М., Ранг J, Гибсон Дж., Маттиа А.Р. и др. Надлежащее использование специальных красителей для идентификации Helicobacter pylori: рекомендации Rodger C.Общество патологии желудочно-кишечного тракта Хаггитта. Am J Surg Pathol. 2013; 37: e12 – e22. [PubMed] [Google Scholar] 26. Ротими О., Кэрнс А., Грей С., Моайеди П., Диксон М. Ф. Гистологическая идентификация Helicobacter pylori: сравнение методов окрашивания. J Clin Pathol. 2000. 53: 756–759. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз О., Демирай Э. Клиническая роль и важность метода флуоресцентной гибридизации in situ в диагностике инфекции H. pylori и определении устойчивости к кларитромицину при эрадикационной терапии H. pylori.Мир Дж. Гастроэнтерол. 2007. 13: 671–675. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Таджбахш С., Самарбаф-Заде А.Р., Мусавиан М. Сравнение флуоресцентной гибридизации in situ и гистологического метода диагностики Helicobacter pylori в образцах биопсии желудка. Med Sci Monit. 2008; 14: BR183 – BR187. [PubMed] [Google Scholar] 29. Cerqueira L, Fernandes RM, Ferreira RM, Oleastro M, Carneiro F, Brandão C, Pimentel-Nunes P, Dinis-Ribeiro M, Figueiredo C, Keevil CW и др. Валидация метода флуоресцентной гибридизации in situ с использованием зондов пептидных нуклеиновых кислот для выявления устойчивости к кларитромицину Helicobacter pylori в образцах биопсии желудка.J Clin Microbiol. 2013; 51: 1887–1893. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Тиродимос И., Бобос М., Казакос Э., Хайдич А.Б., Дардавессис Т., Костопулос И., Арванитиду М. Молекулярное обнаружение Helicobacter pylori в большой средиземноморской реке с помощью прямого подсчета жизнеспособности с помощью флуоресцентной гибридизации in situ (DVC-FISH) J Water Health. 2014; 12: 868–873. [PubMed] [Google Scholar] 31. Сантьяго П., Морено Ю., Феррус Массачусетс. Идентификация жизнеспособных Helicobacter pylori в источниках питьевой воды культурными и молекулярными методами.Helicobacter. 2015; 20: 252–259. [PubMed] [Google Scholar] 32. Вайра Д., Вакил Н., Гатта Л., Риччи С., Перна Ф., Сарацино И., Фиорини Г., Холтон Дж. Точность нового сверхбыстрого экспресс-теста на уреазу для диагностики инфекции Helicobacter pylori у 1000 последовательных пациентов с диспепсией. Алимент Pharmacol Ther. 2010. 31: 331–338. [PubMed] [Google Scholar] 33. Lerang F, Moum B, Mowinckel P, Haug JB, Ragnhildstveit E, Berge T, Bjørneklett A. Точность семи различных тестов для диагностики инфекции Helicobacter pylori и влияние антагонистов h3-рецепторов на результаты тестов.Сканд Дж Гастроэнтерол. 1998. 33: 364–369. [PubMed] [Google Scholar] 34. Озаслан Э., Косеоглу Т., Пурнак Т., Йылдыз А. Забытая причина ложноотрицательного экспресс-теста на уреазу: загрязнение образца формалином. Гепатогастроэнтерология. 2010; 57: 2 с. предыдущее оглавление. [PubMed] [Google Scholar] 35. Сиавоши Ф., Сани П., Халили-Самани С., Хоссейни Ф., Малакутихах Ф., Мамиванд М., Шахреза С., Шарифи А. Х. Оценка методов выявления H. pylori при потреблении ИПП с использованием посева, экспресс-теста на уреазу и исследования мазка.Ann Transl Med. 2015; 3: 11. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Цэн ЦА, Ван ВМ, Ву округ Колумбия. Сравнение клинической осуществимости трех экспресс-тестов на уреазу в диагностике инфекции Helicobacter pylori. Dig Dis Sci. 2005. 50: 449–452. [PubMed] [Google Scholar] 37. Сиддик И., Аль-Мехайзим К., Алатеи Н., Мемон А., Хасан Ф. Диагностика Helicobacter pylori: повышение чувствительности CLOtest за счет увеличения количества биопсий антрального отдела желудка. J Clin Gastroenterol. 2008. 42: 356–360. [PubMed] [Google Scholar] 38.Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, Wang JY, Yang YC, Lin YC, Wang WM и др. Двойные образцы повышают диагностическую точность и сокращают время реакции экспресс-теста на уреазу. Мир Дж. Гастроэнтерол. 2010; 16: 2926–2930. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, Shim SG, Kim HJ, Jung WT, Lee OJ. Объединенный экспресс-тест на уреазу превосходит отдельный тест в обнаружении Helicobacter pylori в антральном отделе желудка и в образцах тела.Clin Endosc. 2012; 45: 392–396. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Gisbert JP, Abraira V. Точность диагностических тестов Helicobacter pylori у пациентов с кровоточащей язвенной болезнью: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 848–863. [PubMed] [Google Scholar] 41. Ли TH, Лин CC, Chung CS, Lin CK, Liang CC, Tsai KC. Увеличение количества биопсий и забор образцов из тела желудка улучшает чувствительность экспресс-теста на уреазу у пациентов с кровотечением из язвенной болезни. Dig Dis Sci.2015; 60: 454–457. [PubMed] [Google Scholar] 42. Парк С.А., Ко А, Ли Н.Г. Стимуляция роста возбудителя желудочного заболевания человека Helicobacter pylori за счет атмосферного уровня кислорода при высоком давлении углекислого газа. BMC Microbiol. 2011; 11: 96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Ндип Р.Н., Маккей В.Г., Фартинг М.Дж., Уивер Л.Т. Культивирование Helicobacter pylori из клинических образцов: обзор микробиологических методов. J Pediatr Gastroenterol Nutr. 2003. 36: 616–622. [PubMed] [Google Scholar] 44. Гонг Ю.Н., Ли Ю.М., Янг Н.М., Ли ХЗ, Го Ф., Линь Л., Ван Цюй, Чжан Дж.К., Цзи Цзы, Мао Дж. Б. и др.Централизованная изоляция Helicobacter pylori из множества центров и условий транспортировки. Мир Дж. Гастроэнтерол. 2015; 21: 944–952. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Челлини Л., Ди Кампли Э, Ди Бартоломео С., Бесса Л. Дж., Баффони М., Ди Джулио М. Новая транспортная среда для культивирования Helicobacter pylori. J Clin Microbiol. 2014; 52: 4325–4329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Wisessombat S, Meethai C, Hamgo S. Новый двухфазный тест для обнаружения Helicobacter pylori в биопсиях желудка.J Microbiol Methods. 2014; 96: 19–24. [PubMed] [Google Scholar] 47. Leszczyńska K, Namiot A, Namiot Z, Leszczyńska JK, Jakoniuk P, Chilewicz M, Namiot DB, Kemona A, Milewski R, Bucki R. Факторы пациента, влияющие на культуру Helicobacter pylori, выделенную из образцов слизистой оболочки желудка. Adv Med Sci. 2010; 55: 161–166. [PubMed] [Google Scholar] 48. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Momtaz H, Souod N, Dabiri H, Sarshar M. Изучение статуса генотипа Helicobacter pylori в слюне, зубных бляшках, образцах стула и биопсии желудка. Мир Дж. Гастроэнтерол. 2012; 18: 2105–2111. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Lehours P, Mégraud F. Молекулярная диагностика Helicobacter pylori. Эксперт Rev Mol Diagn. 2011; 11: 351–355. [PubMed] [Google Scholar] 52. Monno R, Giorgio F, Carmine P, Soleo L, Cinquepalmi V, Ierardi E. Устойчивость к кларитромицину Helicobacter pylori, обнаруженная с помощью Etest и TaqMan полимеразной цепной реакции в реальном времени: сравнительное исследование. APMIS. 2012; 120: 712–717. [PubMed] [Google Scholar] 53. Лю Цюй, Ци Д, Кан Дж, Цзинь И, Лю В., Гао В., Хоу П, Лу Дж.Эффективность обнаружения инфекции Helicobacter pylori на основе ПЦР в реальном времени и четырехкратной терапии на основе генотипической резистентности в качестве лечения первой линии функциональной диспепсии, вызванной инфекцией Helicobacter pylori. Eur J Gastroenterol Hepatol. 2015; 27: 221–225. [PubMed] [Google Scholar] 54. Онцира Нгойи Э.Н., Атипо Ибара Б.И., Мойен Р., Ахуи Апенди П.К., Ибара Дж. Р., Обенги О., Осиби Ибара Р. Б., Нгуимби Е., Ниама РФ, Уамба Дж. Молекулярное определение Helicobacter pylori и его устойчивости к противомикробным препаратам в Браззавиле, Конго.Helicobacter. 2015; 20: 316–320. [PubMed] [Google Scholar] 55. Де Франческо V, Зулло А., Джорджио Ф., Сарачино I, Заккаро С., Хассан С., Иерарди Э., Ди Лео А., Фиорини Дж., Кастелли В. и др. Изменение точечных мутаций в рРНК Helicobacter pylori, связанных с устойчивостью к кларитромицину в Италии. J Med Microbiol. 2014; 63: 453–457. [PubMed] [Google Scholar] 56. Ивамото А., Танахаши Т., Окада Р., Ёсида Ю., Кикучи К., Кейда Ю., Мураками Ю., Ян Л., Ямамото К., Нишиуми С. и др. Полногеномное секвенирование Helicobacter pylori, устойчивого к кларитромицину, характеризует неидентифицированные варианты генов эффлюксной помпы с множественной лекарственной устойчивостью.Gut Pathog. 2014; 6: 27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Смит С.М., О’Морайн С., Макнамара Д. Тестирование чувствительности к противомикробным препаратам для Helicobacter pylori во времена повышения устойчивости к антибиотикам. Мир Дж. Гастроэнтерол. 2014; 20: 9912–9921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Бинь Т.Т., Сузуки Р., Транг Т.Т., Квон Д.Х., Ямаока Ю. Поиск новых мутаций-кандидатов на устойчивость к метронидазолу у Helicobacter pylori с использованием секвенирования следующего поколения. Антимикробные агенты Chemother.2015; 59: 2343–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F. Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Miendje Deyi VY, Burette A, Bentatou Z, Maaroufi Y, Bontems P, Lepage P, Reynders M. Практическое использование GenoType® HelicoDR, молекулярного теста для обнаружения Helicobacter pylori и тестирования чувствительности.Диагностика Microbiol Infect Dis. 2011; 70: 557–560. [PubMed] [Google Scholar] 61. Ли Дж. У., Ким Н., Нам Р., Пак Дж. Х., Чой Й. Дж., Ким Дж. М., Ким Дж. С., Юнг ХК. Тест GenoType HelicoDR для определения устойчивости Helicobacter pylori к противомикробным препаратам в Корее. Сканд Дж Гастроэнтерол. 2014; 49: 1058–1067. [PubMed] [Google Scholar] 62. Woo HY, Park DI, Park H, Kim MK, Kim DH, Kim IS, Kim YJ. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом для обнаружения Helicobacter pylori и определения устойчивости к кларитромицину с помощью биоптатов желудка.Helicobacter. 2009. 14: 22–28. [PubMed] [Google Scholar] 63. Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Chung WC, Jung SH, Oh JH, Kim TH, Cheung DY, Kim BW, Kim SS, Kim JI, Sin EY. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом с использованием образцов ткани в экспресс-тесте на уреазу при обнаружении инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2014; 20: 6547–6553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Алмейда Н., Донато М. М., Ромаозиньо Дж. М., Люксо С., Кардозу О, Сиприано М. А., Мариньо С., Фернандес А., София С. Корреляция генотипов Helicobacter pylori с гистопатологией желудка в центральном регионе южно-европейской страны. Dig Dis Sci. 2015; 60: 74–85. [PubMed] [Google Scholar] 66. Сиддик I, Аль-Кабанди А., Аль-Али Дж., Алазми В., Мемон А., Мустафа А.С., Джунаид Т.А. Связь между генотипами Helicobacter pylori и тяжестью хронического гастрита, язвенной болезни и уровнями интерлейкина-8 в слизистой оболочке желудка: данные исследования, проведенного на Ближнем Востоке.Gut Pathog. 2014; 6: 41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Феррейра Р.М., Мачадо Дж. К., Фигейредо С. Клиническая значимость генотипов VacA и cagA Helicobacter pylori при карциноме желудка. Лучшие Практики Рес Клин Гастроэнтерол. 2014; 28: 1003–1015. [PubMed] [Google Scholar] 68. Абади А.Т., Лоффельд Р.Дж., Констанция А.С., Вагенаар Дж.А., Кустерс Дж.Г. На обнаружение гена dupA Helicobacter pylori сильно влияет дизайн ПЦР. J Microbiol Methods. 2014; 106: 55–56. [PubMed] [Google Scholar] 69. Амирхошанг А., Рамин А., Эхсан А., Мансур Р., Шахрам Б.Высокая частота ДНК Helicobacter pylori в питьевой воде в Керманшахе, Иран, в июне-ноябре 2012 года. J Water Health. 2014; 12: 504–512. [PubMed] [Google Scholar] 70. Атапур С., Сафарпур Дехкорди Ф., Рахими Э. Обнаружение Helicobacter pylori в различных типах овощей и салатов. Jundishapur J Microbiol. 2014; 7: e10013. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Yahaghi E, Khamesipour F, Mashayekhi F, Safarpoor Dehkordi F, Sakhaei MH, Masoudimanesh M, Khameneie MK. Helicobacter pylori в овощах и салатах: генотипирование и свойства устойчивости к противомикробным препаратам.Biomed Res Int. 2014; 2014: 757941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Фервана М., Абдулмаджид И., Альхаджахмед А., Мадани В., Фирвана Б., Хасан Р., Алтаяр О, Лимбург П.Дж., Мурад М.Х., Кнави Б. Точность дыхательного теста на мочевину при инфекции Helicobacter pylori: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21: 1305–1314. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Gong Y, Wei W, Yuan Y. Связь между риском аномальной функции желудка и инфекцией Helicobacter pylori, оцененная с помощью ELISA и дыхательного теста с 14C-мочевиной.Диагностика Microbiol Infect Dis. 2014; 80: 316–320. [PubMed] [Google Scholar] 74. Макколл К.Э. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med. 2010; 362: 1597–1604. [PubMed] [Google Scholar] 75. Велайос Б., Фернандес-Салазар Л., Понс-Ренедо Ф., Муньос М.Ф., Альмарас А., Аллер Р., Руис Л., Дель Ольмо Л., Гисберт Дж. П., Гонсалес-Эрнандес Дж. М.. Точность дыхательной пробы мочевины, выполняемой сразу после экстренной эндоскопии при кровотечении из язвенной болезни. Dig Dis Sci. 2012; 57: 1880–1886. [PubMed] [Google Scholar] 76. Гварнер Дж., Калач Н., Элитсур Ю., Колецко С.Диагностические тесты Helicobacter pylori у детей: обзор литературы с 1999 по 2009 год. Eur J Pediatr. 2010; 169: 15–25. [PubMed] [Google Scholar] 77. Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN, Greiner W. Эффективность и рентабельность дыхательного теста с мочевиной 13C в качестве основного диагностического исследования для выявления инфекции Helicobacter pylori по сравнению с инвазивной и неинвазивной -инвазивные диагностические тесты. GMS Health Technol Assess. 2009; 5: Doc14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78.Гамлет А.К., Эрландссон К.И., Ольбе Л., Свеннерхольм А.М., Бакман В.Е., Петтерссон А.Б. Простой, быстрый и высоконадежный дыхательный тест с мочевиной 14C на основе капсул для диагностики инфекции Helicobacter pylori. Сканд Дж Гастроэнтерол. 1995; 30: 1058–1063. [PubMed] [Google Scholar] 79. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Превосходство некапсулированного дыхательного теста с 14С-мочевиной над методом на основе капсул для выявления инфекции Helicobacter pylori — предварительный отчет.Троп Гастроэнтерол. 2012; 33: 123–128. [PubMed] [Google Scholar] 80. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Сравнение инкапсулированного и неинкапсулированного (14) дыхательного теста с C-мочевиной для выявления инфекции Helicobacter pylori: сцинтиграфическое исследование. Helicobacter. 2014; 19: 116–123. [PubMed] [Google Scholar] 81. Gisbert JP, Pajares JM. Обзорная статья: Дыхательный тест на 13C-мочевину в диагностике инфекции Helicobacter pylori — критический обзор. Алимент Pharmacol Ther.2004. 20: 1001–1017. [PubMed] [Google Scholar] 82. Som S, Maity A, Banik GD, Ghosh C, Chaudhuri S, Daschakraborty SB, Ghosh S, Pradhan M. Кинетика экскреции дыхательного теста с мочевиной 13C: влияние выработки эндогенного CO2 и восстановления дозы на диагностическую точность инфекции Helicobacter pylori. Anal Bioanal Chem. 2014; 406: 5405–5412. [PubMed] [Google Scholar] 83. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ.Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 84. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori. Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 85. Кесли Р., Гоктюрк Х.С., Эрбайрак М., Карабаглы П., Терзи Ю. Сравнение диагностических значений трех различных тестов на антигены стула для неинвазивной диагностики инфекции Helicobacter pylori. J Investig Med.2010. 58: 982–986. [PubMed] [Google Scholar] 86. Okuda M, Osaki T, Kikuchi S, Ueda J, Lin Y, Yonezawa H, Maekawa K, Hojo F, Kamiya S, Fukuda Y. Оценка теста на антиген стула с использованием mAb для нативной каталазы для диагностики инфекции Helicobacter pylori у детей и взрослые. J Med Microbiol. 2014; 63: 1621–1625. [PubMed] [Google Scholar] 87. Осман Х.А., Хасан Х., Суппиан Р., Бахар Н., Хусин Н.С., Рахим А.А., Хассан С., Анди Д.З., Зилфалил Б.А. Оценка теста на антиген стула Atlas Helicobacter pylori для диагностики инфекции у взрослых пациентов.Азиатский Pac J Cancer Prev. 2014; 15: 5245–5247. [PubMed] [Google Scholar] 88. Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 89. Дегучи Р., Мацусима М., Сузуки Т., Майн Т., Фукуда Р., Нишина М., Одзава Х., Такаги А. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori после эрадикационной терапии.J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 90. Кальвет X, Ларио С., Рамирес-Лазаро М.Дж., Монтсеррат А., Кесада М., Ривз Л., Мастерс Х., Суарес-Ламас Д., Галлах М., Микель М. и др. Точность моноклональных тестов стула для определения излечения от инфекции Helicobacter pylori после лечения. Helicobacter. 2010; 15: 201–205. [PubMed] [Google Scholar] 91. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 92. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE. Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Чжоу X, Су Дж., Сюй Дж., Чжан Г. Точность теста на антиген стула для диагностики инфекции Helicobacter pylori у детей: метаанализ.Клин Рес Гепатол Гастроэнтерол. 2014; 38: 629–638. [PubMed] [Google Scholar] 94. Ли YC, Tseng PH, Liou JM, Chen MJ, Chen CC, Tu CH, Chiang TH, Chiu HM, Lai CF, Ho JC, et al. Проведение одноэтапного теста на основе образца фекалий для диагностики инфекции Helicobacter pylori в учреждениях первичной медико-санитарной помощи и массовых обследований. J Formos Med Assoc. 2014; 113: 899–907. [PubMed] [Google Scholar] 95. Okuda M, Osaki T, Lin Y, Yonezawa H, Maekawa K, Kamiya S, Fukuda Y, Kikuchi S. Низкая распространенность и частота инфекции Helicobacter pylori у детей: популяционное исследование в Японии.Helicobacter. 2015; 20: 133–138. [PubMed] [Google Scholar] 96. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 97. Choi J, Kim CH, Kim D, Chung SJ, Song JH, Kang JM, Yang JI, Park MJ, Kim YS, Yim JY и др. Проспективная оценка нового теста на антиген стула для обнаружения Helicobacter pylori в сравнении с гистологией, экспресс-тестом на уреазу, (13) дыхательным тестом на C-мочевину и серологией.J Gastroenterol Hepatol. 2011; 26: 1053–1059. [PubMed] [Google Scholar] 98. Demirtürk L, Yazgan Y, Tarçin O, Ozel M, Diler M, Oncül O, Yildirim S. Влияет ли N-ацетилцистеин на чувствительность и специфичность теста на антиген стула Helicobacter pylori? Helicobacter. 2003. 8: 120–123. [PubMed] [Google Scholar] 99. Inelmen EM, Gasparini G, Sergi G, Enzi G. Оценка Helicobacter pylori с помощью анализа стула на антиген у ослабленных пожилых пациентов. Сканд Дж Гастроэнтерол. 2005; 40: 794–799. [PubMed] [Google Scholar] 101.Ueda J, Okuda M, Nishiyama T., Lin Y, Fukuda Y, Kikuchi S. Диагностическая точность набора для тестирования сывороточных антител E-plate при обнаружении инфекции Helicobacter pylori среди японских детей. J Epidemiol. 2014; 24: 47–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Марчилдон П.А., Сугияма Т., Фукуда Ю., Пикок Дж. С., Асака М., Симояма Т., Грэм Д. Я. Оценка влияния вариации штамм-специфического антигена на точность серологической диагностики инфекции Helicobacter pylori. J Clin Microbiol. 2003. 41: 1480–1485.[Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Hoang TT, Wheeldon TU, Bengtsson C, Phung DC, Sörberg M, Granström M. Иммуноферментный анализ на Helicobacter pylori нуждается в корректировке для исследуемой популяции. J Clin Microbiol. 2004. 42: 627–630. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Khalifeh Gholi M, Kalali B, Formichella L, Göttner G, Shamsipour F, Zarnani AH, Hosseini M, Busch DH, Shirazi MH, Gerhard M. Helicobacter pylori FliD является высокочувствительным и специфическим маркером для серологической диагностики H.pylori. Int J Med Microbiol. 2013; 303: 618–623. [PubMed] [Google Scholar] 105. Формичелла Л., Ромберг Л., Больц С., Вьет М., Гепперт М., Гёттнер Г., Нёльтинг К., Вальтер Д., Шепп В., Шнайдер А. и др. Иммуноферментный анализ новой линии, основанный на рекомбинантных факторах вирулентности, позволяет проводить высокоспецифичную и чувствительную серологическую диагностику инфекции Helicobacter pylori. Clin Vaccine Immunol. 2013; 20: 1703–1710. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Пан KF, Formichella L, Zhang L, Zhang Y, Ma JL, Li ZX, Liu C, Wang YM, Goettner G, Ulm K, et al.Ответы антител против Helicobacter pylori и эволюция предраковых поражений желудка в китайской популяции. Int J Cancer. 2014; 134: 2118–2125. [PubMed] [Google Scholar] 107. Бурукоа С., Дельшер Дж. С., Курийон-Малле А., де Корвин Дж. Д., Мегро Ф., Зербиб Ф., Раймонд Дж., Фошер Дж. Л.. Сравнительная оценка 29 коммерческих серологических наборов Helicobacter pylori. Helicobacter. 2013; 18: 169–179. [PubMed] [Google Scholar] 108. Абнет СС, Чжэн В., Йе В., Камангар Ф., Джи Б.Т., Перссон С., Ян Джи, Ли Х.Л., Ротман Н., Шу ХО и др.Пепсиногены плазмы, антитела против Helicobacter pylori и риск рака желудка в когорте Шанхайского исследования здоровья женщин. Br J Рак. 2011; 104: 1511–1516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Ёсида Т., Като Дж., Иноуэ И., Ёсимура Н., Дегучи Х., Мукубаяси К., Ока М., Ватанабэ М., Эномото С., Нива Т. и др. Развитие рака на основе хронического активного гастрита и вызванной им атрофии желудка, что оценивается по уровням пепсиногена в сыворотке крови и титру антител к Helicobacter pylori. Int J Cancer.2014; 134: 1445–1457. [PubMed] [Google Scholar] 110. Ханэда М., Като М., Исигаки С., Судзуки М., Такахаши М., Накагава М., Оно С., Мори И., Мабе К., Накагава С. и др. Идентификация группы высокого риска рака желудка с использованием сывороточного пепсиногена после успешной ликвидации Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 78–83. [PubMed] [Google Scholar] 111. McNicholl AG, Forné M, Barrio J, De la Coba C, González B, Rivera R, Esteve M, Fernandez-Bañares F, Madrigal B, Gras-Miralles B и др. Точность GastroPanel в диагностике атрофического гастрита.Eur J Gastroenterol Hepatol. 2014; 26: 941–948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Шиката К., Ниномия Т., Йонемото К., Икеда Ф., Хата Дж., Дой Й, Фукухара М., Мацумото Т., Иида М., Китазоно Т. и др. Оптимальное пороговое значение уровня пепсиногена в сыворотке для прогнозирования заболеваемости раком желудка: исследование Хисаяма. Сканд Дж Гастроэнтерол. 2012; 47: 669–675. [PubMed] [Google Scholar] 113. Карами Н., Талебхан Й., Сабери С., Эсмаили М., Огалайе А., Абдирад А., Мостафави Е., Хоссейни М.Э., Мохагеги М.А., Мохаммади М.Серореактивность к антигенам Helicobacter pylori как индикатор риска рака желудка. Азиатский Pac J Cancer Prev. 2013; 14: 1813–1817. [PubMed] [Google Scholar] 114. Zhao Z, Li Y, Liu S, Fu W. Сывороточные антитела Helicobacter pylori CagA нельзя использовать в качестве онкомаркера для диагностики рака желудка в странах Восточной Азии. Tumor Biol. 2014; 35: 12217–12224. [PubMed] [Google Scholar] 115. Мухсен К., Атхамна А., Атхамна М., Спунгин-Бялик А., Коэн Д. Оценка иммуноферментного анализа мочи для выявления инфекции Helicobacter pylori среди здоровых детей израильских арабов от 3 до 5 лет.J Pediatr Gastroenterol Nutr. 2006; 43: 398–401. [PubMed] [Google Scholar] 116. Окуда М., Камия С., Книга М., Кикучи С., Осаки Т., Хиватани Т., Маекава К., Фукуда Ю. Диагностическая точность наборов на основе мочи для обнаружения антител к Helicobacter pylori у детей. Pediatr Int. 2013; 55: 337–341. [PubMed] [Google Scholar] 117. Луцца Ф., Именео М., Мараско А., Кротта С., Иерарди Е., Усай П., Вирджилио С., Нардоне Г., Марчи С., Санна Г. и др. Оценка коммерческого серологического набора для определения иммуноглобулина G в слюне к Helicobacter pylori: многоцентровое исследование.Eur J Gastroenterol Hepatol. 2000; 12: 1117–1120. [PubMed] [Google Scholar] 118. Ян Б.Л., Йе Ц., Квонг В.Г., Ли С.Д. Новый одноэтапный тест на антиген слюны Helicobacter pylori. J Chin Med Assoc. 2015; 78: 96–100. [PubMed] [Google Scholar] 119. Брейден Б. Диагностика инфекции Helicobacter pylori. BMJ. 2012; 344: e828. [PubMed] [Google Scholar] 120. Сичински Л.А., Корреа П., Браво Л.Е., Пик Р.М., Уилсон К.Т., Ло Дж. Т., Йепез М.С., Голд Б.Д., Томпсон Д.Т., Обложка Т.Л. и др. Неинвазивное генотипирование Helicobacter pylori cagA, vacA и hopQ у бессимптомных детей.Helicobacter. 2012; 17: 96–106. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Xiong LJ, Tong Y, Wang Z, Mao M. Выявление устойчивой к кларитромицину Helicobacter pylori с помощью ПЦР стула у детей: всесторонний обзор литературы. Helicobacter. 2013; 18: 89–101. [PubMed] [Google Scholar] 122. Ананд П.С., Камат К.П., Анил С. Роль зубного налета, слюны и заболеваний пародонта в инфекции Helicobacter pylori. Мир Дж. Гастроэнтерол. 2014; 20: 5639–5653. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123.Огая Ю., Номура Р., Ватанабе Ю., Накано К. Обнаружение ДНК Helicobacter pylori в образцах воспаленной пульпы зуба от японских детей и подростков. J Med Microbiol. 2015; 64: 117–123. [PubMed] [Google Scholar] 124. Amiri N, Abiri R, Eyvazi M, Zolfaghari MR, Alvandi A. Частота Helicobacter pylori в зубном налете, возможно, недооценена. Arch Oral Biol. 2015; 60: 782–788. [PubMed] [Google Scholar] 125. Чой Й.Дж., Ким Н., Лим Дж., Чо Си, Шин СМ, Ли Х.С., Ли Ш., Пак Й.С., Хван Дж. Х., Ким Дж. У. и др.Точность диагностических тестов на Helicobacter pylori у больных с кровотечением из язвенной болезни. Helicobacter. 2012; 17: 77–85. [PubMed] [Google Scholar] 126. Ло С.К., Лай К.Х., Пэн Нью-Джерси, Ло Г.Х., Ценг Х.Х., Лин С.К., Ши С.Б., Ву С.М., Чен Ю.С., Хуанг В.К. и др. Полимеразная цепная реакция: чувствительный метод выявления инфекции Helicobacter pylori при кровоточащих пептических язвах. Мир Дж. Гастроэнтерол. 2005; 11: 3909–3914. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Рамирес-Лазаро М.Дж., Ларио С., Казалотс А., Санфелиу Э, Бойкс Л., Гарсиа-Иглесиас П., Санчес-Дельгадо Д., Монтсеррат А., Белла-Куэто М. Р., Галлах М. и др.ПЦР в реальном времени улучшает обнаружение Helicobacter pylori у пациентов с кровотечением из язвенной болезни. PLoS One. 2011; 6: e20009. [Бесплатная статья PMC] [PubMed] [Google Scholar] 128. Баркун А.Н., Барду М., Койперс Э.Дж., Сунг Дж., Хант Р.Х., Мартель М., Синклер П. Рекомендации международного консенсуса по ведению пациентов с кровотечением из неварикозно-верхних отделов желудочно-кишечного тракта. Ann Intern Med. 2010. 152: 101–113. [PubMed] [Google Scholar] 129. Санчес-Дельгадо Дж., Джене Э, Суарес Д., Гарсия-Иглесиас П., Брюлле Э, Галлах М., Феу Ф, Гисберт Дж. П., Кальвет X.Была ли недооценена распространенность H. pylori при кровоточащей язвенной болезни? Мета-регресс. Am J Gastroenterol. 2011; 106: 398–405. [PubMed] [Google Scholar] 130. Kim JJ, Lee JS, Olafsson S, Laine L. Низкая приверженность к тестированию на Helicobacter pylori у госпитализированных пациентов с кровоточащей язвенной болезнью. Helicobacter. 2014; 19: 98–104. [PubMed] [Google Scholar] 131. Тянь XY, Чжу Х, Чжао Дж, Ше Кью, Чжан Джи. Диагностическая эффективность дыхательного теста на мочевину, экспресс-теста на мочевину и гистологии инфекции Helicobacter pylori у пациентов с частичной гастрэктомией: метаанализ.J Clin Gastroenterol. 2012; 46: 285–292. [PubMed] [Google Scholar] 132. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале — надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка. J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 133. Варди Дж., Шалев Т., Шевах О., Боаз М., Авни Ю., Ширин Х. Быстрый дыхательный тест на 13C-мочевину в непрерывном режиме в реальном времени для обнаружения Helicobacter pylori у пациентов после частичной гастрэктомии.J Clin Gastroenterol. 2012; 46: 293–296. [PubMed] [Google Scholar] 134. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Yoon H, Shin CM, Park YS, Lee DH. Диагностическая валидность дыхательного теста (13) c-мочевины у пациентов, подвергшихся гастрэктомии: ретроспективное когортное исследование одного третичного центра. J Cancer Prev. 2014; 19: 309–317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 135. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Hwang JJ, Lee HJ, Lee A, Jeong YS, Oh S и др. Диагностическая ценность теста на выдыхание C-мочевины без лимонной кислоты в высоких дозах (13) после эрадикации Helicobacter pylori в Корее.Helicobacter. 2015; 20: 159–168. [PubMed] [Google Scholar] 136. Patel SK, Mishra GN, Pratap CB, Jain AK, Nath G. Helicobacter pylori не искореняется после тройной терапии: исследование на основе вложенной ПЦР. Biomed Res Int. 2014; 2014: 483136. [Бесплатная статья PMC] [PubMed] [Google Scholar]Диагностика инфекции Helicobacter pylori: текущие возможности и разработки
World J Gastroenterol. 2015 окт 28; 21 (40): 11221–11235.
Яо-Куанг Ван, Отделение внутренней медицины, Городская больница Сяо-Канг Гаосюн, Гаосюн 812, Тайвань
Яо-Куанг Ван, Чунг-Юнг Лю, Мэн-Чие Ву, Сян-Яо Ши, Софи С.В. Ван, Дженг -Yih Wu, Chao-Hung Kuo, Deng-Chyang Wu, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, Гаосюн 807, Тайвань
Fu-Chen Kuo, школа медицины, медицинский колледж, E-Da Больница, Университет И-Шоу, Гаосюн 824, Тайвань
Мэн-Чи Ву, Сян-Яо Ши, Дэн-Чьянг Ву, Отделение внутренней медицины, Городская больница Та-Тунг Гаосюна, Гаосюн 801, Тайвань
Софи С.В. Ван, Чао-Хун Куо, Дэн-Чьянг Ву, Рак для исследования стволовых клеток, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Софи С.В. Ван, Дэн-Чьянг Ву, Центр исследований инфекционных заболеваний и рака, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Яо-Кан Хуанг, отдел гастрономии энтерология, отделение внутренней медицины, больница Тен Чан, Чун-Ли, Таоюань 320, Тайвань
Вклад авторов: Ван ЮК написал эту рукопись; Kuo FC, Liu CJ, Wu MC, Shih HY, Wang SSW, Wu JY и Kuo CH разработали исследования; Хуан Ю.К. и Ву Д.К. полировали бумагу; Хуан Ю.К. и Ву Д.К. в равной степени внесли свой вклад в эту рукопись.Для корреспонденции: Deng-Chyang Wu, MD, PhD, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, 100 Tz-You 1st road, Kaohsiung 807, Taiwan. moc.oohay@uwhced
Телефон: + 886-7-3121101-7451 Факс: + 886-7-3135612
Поступила в редакцию 29 апреля 2015 г .; Пересмотрено 6 августа 2015 г .; Принято, 2015 г. 28 сентября.
Авторские права © Автор (ы) 2015 г. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Реферат
Точная диагностика инфекции Helicobacter pylori (H. pylori) — важнейшая составляющая эффективного лечения многих гастродуоденальных заболеваний. Для обнаружения H. pylori доступно несколько инвазивных и неинвазивных диагностических тестов, и каждый тест имеет свою полезность и ограничения в различных клинических ситуациях. Хотя ни один из них не может считаться единственным золотым стандартом в клинической практике, было разработано несколько методов, позволяющих получить более надежные результаты.Инвазивные тесты выполняются с помощью образцов эндоскопической биопсии, и эти тесты включают гистологию, посев, экспресс-тест на уреазу, а также молекулярные методы. Развитие эндоскопического оборудования также способствует диагностике H. pylori в режиме реального времени во время эндоскопии. Дыхательный тест на мочевину и тест на антиген стула являются наиболее широко используемыми неинвазивными тестами, в то время как серология полезна в скрининговых и эпидемиологических исследованиях. Молекулярные методы использовались в различных образцах, кроме слизистой оболочки желудка.Помимо выявления инфекции H. pylori , несколько тестов используются для оценки факторов вирулентности и чувствительности к антибиотикам H. pylori , а также для скрининга предраковых поражений и рака желудка. Целью этой статьи является обзор текущих возможностей и новых разработок диагностических тестов и их применения в различных клинических условиях или для конкретных целей.
Ключевые слова: Helicobacter pylori , Диагностика, Инвазивный, Неинвазивный, Пероральный образец, Кровотечение, Гастрэктомия, Искоренение
Основной наконечник: В настоящее время доступны несколько тестов для диагностики Helicobacter pylori (H. pylori ).pylori ) инфекция. В этом обзоре мы сосредоточимся на полезности и ограничениях современных диагностических методов, а также на последних разработках этих тестов, которые способствуют повышению диагностической точности. Кроме того, мы также подчеркиваем обнаружение H. pylori в образцах из полости рта и у пациентов с различными клиническими обстоятельствами, включая кровотечение, постгастрэктомию и постэрадикационную терапию.
ВВЕДЕНИЕ
Helicobacter pylori ( H.pylori ) является грамотрицательным микроаэробным патогеном человека, а инфекция H. pylori тесно связана со многими гастродуоденальными заболеваниями, включая хронический активный гастрит, язвенную болезнь, атрофический гастрит, лимфому лимфоидной ткани слизистой оболочки (MALT) и некардиальный рак желудка. . Инфекция H. pylori поражает более половины взрослого населения во всем мире, но распространенность инфекции H. pylori широко варьируется в зависимости от географического региона, возраста, расы и социально-экономического статуса.Обычно распространенность инфекции H. pylori увеличивается с возрастом в большинстве стран, однако в последние десятилетия при анализе временных тенденций в нескольких крупных популяциях наблюдалось снижение распространенности инфекции H. pylori [1]. Более 80% язвенной болезни вызывается инфекцией H. pylori , а предполагаемый риск развития язвенной болезни в течение жизни у пациентов, инфицированных H. pylori , составляет примерно 15% [2]. Рак желудка является третьей по значимости причиной смерти от рака во всем мире, а случаев H.pylori является причиной 74,7% всех случаев некардиального рака желудка [3,4]. Рак желудка и язвенная болезнь вместе вызывают более миллиона смертей в год в мире, и инфекция H. pylori всегда является важной проблемой для здоровья [5]. Для выявления инфекции H. pylori разработаны различные диагностические методы, и диагностические тесты с высокой чувствительностью и специфичностью, превышающей 90%, необходимы для точной диагностики инфекции H. pylori в клинической практике.Хотя сейчас доступно множество диагностических тестов, каждый метод имеет свои преимущества, недостатки и ограничения. Выбор того или иного метода может зависеть от наличия и доступности диагностических тестов, уровня лабораторий, клинического состояния пациентов и отношения вероятности положительных и отрицательных тестов при различных клинических обстоятельствах. Диагностические тесты обычно делятся на инвазивные (эндоскопические) и неинвазивные методы. Инвазивные диагностические тесты включают эндоскопическое изображение, гистологию, экспресс-тест на уреазу, культивирование и молекулярные методы.Неинвазивные диагностические тесты включали дыхательный тест на мочевину, тест на антиген стула, серологические и молекулярные исследования. В данной статье мы кратко рассмотрим текущие варианты и разработки диагностических тестов и связанных с ними приложений в клинической практике, а также выбор диагностических тестов для различных клинических состояний (таблица).
Таблица 1
Варианты диагностики инфекции Helicobacter pylori при различных клинических обстоятельствах и особые применения диагностических тестов
| Гастродуоденальное кровотечение | Постэктомия | Постэктомия | Особые области применения | |||||||||
| Экспресс-тест на уреазу | √ | |||||||||||
| Гистология | √ | |||||||||||
| Культура | Антибиотическая цепьАнтибиотическая цепь реакция | √ | √ | √Чувствительность к антибиотикам 287 | √ | |||||||
| Серология 1 | √ | √ | √ | √ Факторы вирулентности |
.pylori
-ассоциированные заболевания, такие как язвенная болезнь, атрофический гастрит, MALT-лимфома и рак желудка. Эндоскопия также является инструментом, обычно используемым для получения образцов, обычно слизистой оболочки желудка из биопсии, для дальнейших исследований других инвазивных тестов, включая экспресс-тест на уреазу, гистологию, посев и молекулярные методы. Антрум является предпочтительным местом биопсии для выявления инфекции H. pylori в большинстве случаев, но для избежания ложноотрицательных результатов пациентам с антральной атрофией или кишечной метаплазией предлагается биопсия тела по большей кривой [6,7].Неравномерное распределение H. pylori в желудке в различных клинических условиях неизбежно приводит к ошибкам отбора проб при исследованиях на основе биопсии, и было сделано несколько попыток диагностики инфекции H. pylori в режиме реального времени во время эндоскопического исследования.Большинство признаков слизистой оболочки желудка, таких как покраснение, отек слизистой оболочки или узелковое изменение, при обычной эндоскопии недостаточно специфичны для диагностики инфекции H. pylori и не имеют большого значения для точного диагноза [8].Хотя тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может повысить точность диагностики, но это может занять много времени и не дать лучших результатов, чем другие инвазивные тесты [9]. В дополнение к традиционной эндоскопии, хромоэндоскопия с феноловым красным также была оценена для диагностики инфекции H. pylori на основе специфической уреазной активности H. pylori . Однако этот метод не является надежным тестом из-за его низкой чувствительности (73% -81%) и низкой специфичности (76% -81%) [10,11].Эндоскопия с увеличением обеспечивает прямое наблюдение микроструктуры поверхности слизистой оболочки желудка, а эндоскопические изображения слизистой оболочки с высоким разрешением тесно связаны с гистопатологическими изменениями, включая инфекцию H. pylori . Чувствительность и специфичность для прогнозирования телесного гастрита с положительным результатом на H. pylori с помощью увеличительной эндоскопии с окрашиванием индигокармином составили 97,6% и 100% соответственно. Однако чувствительность и специфичность снизились до 88.4% и 75,0% соответственно у H. pylori -положительного антрального гастрита [12]. Конфокальная лазерная эндомикроскопия (CLE) — это еще один увеличительный эндоскопический метод, который обеспечивает подповерхностный анализ и in vivo, гистологическое исследование слизистой оболочки желудка во время эндоскопии. Три характеристики, включая белые пятна, нейтрофилы и микроабсцессы, основанные на данных CLE, были использованы для диагностики H. pylori , а точность, чувствительность и специфичность составили 92,8%, 89,2% и 95,7% соответственно [13].Увеличивающая узкополосная визуализация и I-сканирование также использовались для обнаружения инфекции H. pylori , но были представлены различные результаты [14–16]. Различные классификации характеристик изображений от увеличительной эндоскопии обеспечивают различную диагностическую точность, а точность эндоскопического теста также зависит от оператора, что означает, что его использование требует процесса обучения со стороны опытного супервизора и наличия оборудования от местного отделения эндоскопии [17-20]. Более того, тщательное обследование с использованием увеличения с использованием метода улучшения изображения или без него также требует много времени и может причинить больший дискомфорт пациенту, чем другие тесты на основе биопсии.Эти факторы обычно ограничивают клиническое использование увеличительной эндоскопии для выявления инфекции H. pylori в повседневной практике.
Гистология
Гистология обычно считается золотым стандартом при прямом обнаружении инфекции H. pylori , а также первым методом, используемым для обнаружения H. pylori . Однако на диагностическую точность гистологии влияет несколько факторов, таких как место, размер и количество биопсий, методы окрашивания, ингибитор протонной помпы (ИПП), антибиотики и опыт исследующего патолога.Использование ИПП может привести к противоречивым результатам гистологического исследования, поэтому рекомендуется отменить ИПП за 2 недели до проведения гистологического исследования [21]. Дополнительные образцы биопсии, собранные в соответствующем месте для анализа, могут уменьшить количество ошибок выборки и ложноотрицательных результатов в гистологическом тесте, а также в других тестах, основанных на биопсии. В клинической практике обычно рекомендуются биопсии как антрального отдела, так и тела, и получение как минимум двух биоптатов из антрального отдела и тела является наиболее разумной стратегией, гарантирующей максимальный диагностический результат [22,23].Как упоминалось выше, биопсия тела важна для диагностики H. pylori . на фоне атрофического гастрита [7].
Окрашивание является важной частью гистологического исследования, и несколько красок, таких как обычное окрашивание HE, окраска по Гимзе, Вартина-Старри, Hp серебром, толуидиновым синим, акридиновым оранжевым, Макмалленом, Гента, Дитерле и иммуногистохимическим окрашиванием, были использованы для обнаружения H pylori . Хотя иммуногистохимическое окрашивание является наиболее чувствительным и специфическим красителем, окрашивания HE обычно достаточно для диагностики H.pylori в повседневной клинической практике. Дополнительное окрашивание обычно рекомендуется для образцов биопсии, которые выявляют умеренный или тяжелый хронический гастрит, но не H. pylori , идентифицированные при окрашивании HE. Кроме того, иммуногистохимическое окрашивание должно быть первым выбором, если решено использовать вспомогательное окрашивание для обнаружения H. pylori [24,25]. Если иммуногистохимические окрашивания недоступны, окрашивание по Гимзе является предпочтительным методом в клинической практике, поскольку оно простое, высокочувствительное и менее затратное [26].
Пептидная флуоресцентная нуклеиновая кислота in situ Гибридизация (PNA-FISH), которую можно использовать на гистологических препаратах, является высокочувствительным (чувствительность 97%) и специфическим (специфичность 100%) методом диагностики H. pylori. инфекция. PNA-FISH может идентифицировать кокковидную форму H. pylori , которую обычно невозможно обнаружить при рутинном гистологическом исследовании, поскольку этот метод позволяет избежать индивидуальной предвзятости от морфологической идентификации. Кроме того, PNA-FISH — это быстрый, точный и экономичный метод обнаружения H.pylori устойчивость к кларитромицину в образцах биопсии желудка [27–29]. FISH также может сыграть потенциальную роль в обнаружении H. pylori в пробах окружающей среды, и дальнейшие исследования передачи и резервуаров H. pylori в окружающей среде могут быть проведены с использованием FISH [30,31]. Несмотря на преимущества обнаружения H. pylori и устойчивости к кларитромицину одновременно, недостатки PNA-FISH, такие как трудоемкая подготовка, требующая флуоресцентного микроскопа и специальных знаний для чтения слайдов, могут ограничивать широкое использование этого метода. .
БЫСТРЫЕ ИСПЫТАНИЯ МОЧЕИ
Для повседневной клинической практики экспресс-тест на уреазу (RUT) является наиболее полезным инвазивным тестом для диагностики инфекции H. pylori , поскольку он недорогой, быстрый, простой в выполнении, высокоспецифичный и широко доступный . Основываясь на активности фермента уреазы H. pylori , присутствие H. pylori в образце биопсии превращает реагент теста мочевины в аммиак, что приводит к увеличению pH и изменению цвета на мониторе pH.В настоящее время доступны несколько коммерческих тестов на уреазу, включая тесты на геле (CLOtest, HpFast), бумажные тесты (PyloriTek, ProntoDry) и тесты на жидкой основе (UFT300, EndoscHp), а различные коммерческие тестовые тестеры имеют разное время реакции для получения результатов. CLOtest обычно занимает 24 часа, чтобы получить точный результат, тогда как PyloriTek занимает 1 час, а UFT 300 — 5 минут, чтобы обеспечить более быстрые результаты. Считывание тестов на уреазу раньше рекомендованного времени может привести к ложноотрицательным результатам [32]. Помимо дизайна коммерческих наборов, плотность бактерий, присутствующих в образце биопсии, также влияет на время реакции и диагностическую точность RUT, в то время как для получения положительного результата RUT обычно требуется минимум 10000 организмов.Другие факторы, влияющие на диагностическую точность тестов на уреазу, включают антагонисты рецепторов H 2 , ИПП, соединения висмута, антибиотики, ахлоргидрию и наличие крови, все из которых увеличивают вероятность ложноотрицательных результатов. Кроме того, контаминация биоптатов формалином также снижает чувствительность RUT [21,33-35].
Обычно коммерческие экспресс-тесты на уреазу имеют специфичность выше 95% -100% и чувствительность выше 85% -95%. Увеличение количества биопсий антрального отдела желудка может повысить чувствительность RUT, и образцы двойной биопсии из тела желудка и антрального отдела предпочтительнее, чем образцы биопсии только антрального отдела желудка, поскольку дополнительная биопсия тела увеличивает диагностическую точность и позволяет избежать систематической ошибки выборки из-за неравномерного распределения H.pylori в желудке. Более того, объединение образцов антрального отдела и тела перед RUT, а не отдельных образцов, также увеличило чувствительность RUT и ускорило время реакции [32,36-39]. Перед RUT рекомендуется избегать приема лекарств, влияющих на активность уреазы, а плотность бактерий — для уменьшения ложноотрицательных результатов, например, 2 недели для ИПП и 4 недели для антибиотиков. Кровотечение значительно снижает чувствительность и специфичность RUT и делает RUT более ненадежным тестом, чем другие тесты в этом клиническом состоянии [40].В исследовании, посвященном оценке влияния различного количества и места биопсии на результаты RUT у пациентов с кровотечением из язвенной болезни, было показано, что четыре биопсии из антрального отдела или одна биопсия из тела увеличивают чувствительность RUT по сравнению с только одной биопсией из антрального отдела. В этом исследовании чувствительность одной биопсии антрального отдела составила 64%, тогда как чувствительность четырех биопсий антрального отдела и одной биопсии тела составила 74% и 73% соответственно [41]. Если для пациента с желудочно-кишечным кровотечением по-прежнему выбирается RUT, для повышения точности диагностики предлагалось выполнить биопсию как антрального отдела, так и тела.
Культура
Культивирование H. pylori из образца биопсии желудка — высокоспецифичный, но менее чувствительный метод. В целом, культивирование имеет почти 100% специфичность, но чувствительность культуры значительно варьируется, от 85% до 95%. Из-за деликатной и требовательной природы H. pylori для культивирования in vitro требуется определенная транспортная среда, среда для выращивания и среда для инкубации. Образцы биопсии можно хранить в транспортной среде, такой как Portagerm pylori или транспортная среда Стюарта, до 24 часов при 4 ° C.Для культивирования можно использовать несколько типов агара, поскольку H. pylori выделены. Обычно используемые среды включают агар Pylori, агар Скирроу, кровяной агар Columbia, агар Brucella, инфузию сердца мозга или соевый агар с триптиказой, дополненный кровью овцы или лошади. Чашки с агаром обычно инкубируют в микроаэробной среде (80-90% N 2 , 5-10% CO 2 , 5-10% O 2 ) при температуре от 35 до 37 ° C в течение не менее 5-7 дней, потому что H. pylori считается микроаэрофилом.Однако недавнее исследование показало, что росту H. pylori способствует уровень кислорода в атмосфере с присутствием 10% CO 2 , в результате чего появилась новая концепция, согласно которой H. pylori может быть капногильным аэробом [42]. Диагностика H. pylori из культуральной среды основана на морфологических характеристиках, а также положительных реакциях на уреазу, каталазу и оксидазу, что означает, что микробиологические лаборатории должны быть оборудованы и обучены для выделения этой бактерии.
Такие условия, как низкое качество образцов, отложенная транспортировка, воздействие аэробной среды или неопытного микробиолога, оказывают неблагоприятное влияние на производительность посева и снижают диагностическую точность [43].Недавнее исследование, проведенное в 26 больницах для анализа влияния времени транспортировки, а также температуры на скорость культивирования, показало, что положительная скорость культивирования снизилась до 26,3% в 48-часовой транспортной группе по сравнению с 32,8% в 24-часовой транспортной группе ( P <0,001 ). Это исследование также показало, что средняя температура повысилась с 4,7 ° C до 29,1 ° C во время транспортировки, что привело к снижению уровня положительных культур с 36,7% до 24,1% [44]. Недавнее развитие транспортной среды - это новая транспортная среда, транспортная среда GESA.Транспортная среда GESA представляет собой полутвердую среду, в которой образцы биопсии желудка могут храниться при 4 ° C в течение до 10 дней и обеспечивать поддающуюся количественной оценке степень восстановления H. pylori (90,7%) [45]. Для культивирования H. pylori в биопсии желудка был также разработан новый двухфазный тест, который сочетал селективный обогащающий бульон и биохимический тест с использованием агара с мочевиной в одном сосуде. В этом небольшом исследовании двухфазный тест был проведен на 55 образцах биопсии и показал 100% положительный прогностический клапан после 48 часов инкубации.Более того, этот метод имел более низкую частоту ложноположительных результатов и требовал более низкой бактериальной нагрузки, примерно 10 5 КОЕ / мл, по сравнению с CLOtest. В то же время этот тест можно было использовать в аэробных условиях и позволять культивирование, а также тестирование чувствительности к антибиотикам [46].
Факторы-хозяева, такие как высокая активность гастрита, низкая бактериальная нагрузка, кровотечение, употребление алкоголя и употребление H 2 — антагонистов рецепторов, ИПП, антибиотиков, оказывают отрицательное влияние на положительный результат посева.Эти препараты, за исключением антибиотиков, которых следует избегать по крайней мере за 4 недели, также рекомендуется избегать за 2 недели до посева. Чтобы избежать систематической ошибки при выборке из-за неоднородного распределения H. pylori в желудке, было рекомендовано как минимум 2 образца биопсии из антрального отдела и 2 образца биопсии из тела [47,48].
Хотя посев — трудоемкий, дорогой и трудоемкий тест для диагностики H. pylori , тест на чувствительность к антибиотикам H. pylori , полученный с помощью посева, является особым преимуществом в клинической практике.В соответствии с рекомендациями консенсусного отчета Маастрихт IV, культура H. pylori и определение чувствительности к антибиотикам следует проводить, если первичная резистентность к кларитромицину превышает 20% в данном географическом районе или после неэффективности лечения препаратами второй линии [21]. Кроме того, культивирование также позволяет изолировать H. pylori для дальнейшего анализа фенотипических и генотипических характеристик, чтобы лучше понять патогены и, следовательно, предложить оценку терапии.С ростом распространенности устойчивости к антибиотикам культивирование по-прежнему остается надежным методом лечения неэффективности лечения H. pylori , а также изучения устойчивости к антибиотикам в популяционных исследованиях до того, как другие молекулярные тесты станут более доступными.
Полимеразная цепная реакция
С момента применения полимеразной цепной реакции (ПЦР) для обнаружения инфекции H. pylori , ПЦР широко использовалась для диагностики H. pylori из образцов биопсии желудка, слюны, стула, желудочного сока. сок и разные экземпляры.ПЦР обеспечивает превосходную чувствительность и специфичность, превышающую 95%, по сравнению с другими традиционными тестами и дает более точные результаты обнаружения H. pylori у пациентов с кровотечением. Несколько генов-мишеней, включая UreA , glmM , UreC , 16S рРНК , 23S рРНК , HSP60 и VacA , были использованы для обнаружения H. различные консервативные гены-мишени могут повысить специфичность, что, в свою очередь, позволяет избежать ложноположительных результатов, особенно для образцов, отличных от образцов биопсии желудка.Другие преимущества ПЦР, в том числе меньшее количество бактерий, требуемых в образце, более быстрые результаты и отсутствие необходимости в специальных материалах для обработки или транспортировке, позволяют врачам принимать более быстрое и точное решение о лечении пациента. Кроме того, ПЦР также позволяет одновременно обнаруживать специфические мутации, приводящие к устойчивости к антибиотикам, такие как устойчивость к макролидам и фторхинолонам, и факторы вирулентности, такие как CagA и VacA [49-51].
По сравнению с методом разведения в агаре (Etest), который обычно считается золотым стандартом теста на чувствительность к антибиотикам, ПЦР в реальном времени (RT-PCR) имеет несколько преимуществ.Во-первых, использование фиксированной формальдегидом залитой парафином ткани желудка в ПЦР-тесте более удобно, быстро и чувствительно, чем использование свежего биоптата в Etest, более того, в этих условиях RT-PCR также показала не худшие результаты тестирования чувствительности к антибиотикам, чем Etest. Кроме того, ПЦР более надежна для выявления гетерорезистентного статуса, который часто приводит к ложноотрицательному результату в Etest, следовательно, ПЦР может предоставить более точную информацию для клиницистов перед началом лечения антибиотиками [52].В недавнем исследовании, в котором использовалась ОТ-ПЦР в фиксированных формалином и залитых парафином образцах для выявления инфекции H. pylori и ассоциированного статуса устойчивости к кларитромицину, изучалась эффективность четырехкомпонентной терапии на основе генотипической резистентности в качестве лечения первой линии для 385 пациентов с функциональная диспепсия. В этом исследовании у 136 пациентов (35,3%) была диагностирована инфекция H. pylori , а чувствительность ОТ-ПЦР и гистологического исследования составила 95,6% и 69,9% соответственно.Четырехкратная терапия цитратом калия висмута, рабепразолом, амоксициллином и кларитромицином использовалась для генотипически чувствительных пациентов, в отличие от генотипически резистентных пациентов лечили цитратом висмута калия, рабепразолом, амоксициллином и фуразолидоном. Авторы обнаружили, что уровень эрадикации составил 100% для пациентов с чувствительным к кларитромицину H. pylori и 94% для пациентов с устойчивым к кларитромицину H. pylori соответственно для анализа по протоколу [53].Во-вторых, ОТ-ПЦР также является удобным методом эпидемиологического исследования региональной степени устойчивости к антибиотикам в качестве руководства для эмпирического лечения первой линии. Кроме того, ОТ-ПЦР может обнаруживать точечные мутации, которые вызывают устойчивость к антибиотикам, а также обнаруживать изменение точечной мутации или появление новой мутации, что дает дополнительную информацию для эпидемиологических и молекулярных исследований взаимосвязи генотип-фенотип. Из-за возможного изменения мутаций, которые вызывают устойчивость к антибиотикам со временем, определение более 5 точечных мутаций при использовании методов на основе ПЦР важно для достижения хорошей точности при обнаружении устойчивости к антибиотикам [54-56].
Были описаны генетические мутации, вызывающие устойчивость к кларитромицину (23S рРНК), хинолонам ( gyrA ген), тетрациклину (16S рРНК), рифабутину ( rpoB ген) и амоксициллину ( pbp-1a в предыдущем гене). исследования и несколько коммерческих наборов, таких как набор MutaREAL H. pylori , анализ ПЦР в реальном времени ClariRes и система обнаружения АПФ Seeplex ClaR- H. pylori [57]. Однако точный механизм устойчивости к метронидазолу менее ясен, и гены восприимчивости, такие как rdxA и frxA, участвовали в предыдущих исследованиях с спорными результатами.Недавнее исследование с использованием секвенирования нового поколения Illumina для поиска мутаций-кандидатов на устойчивость к метронидазолу. Это исследование подтвердило, что мутации в гене rdxA играют основную роль в устойчивости к метронидазолу у H. pylori , а мутации в гене frxA могут усиливать устойчивость к метронидазолу только при наличии мутаций rdxA. Кроме того, новое открытие мутаций в гене rpsU может сыграть роль в устойчивости к метронидазолу для объяснения устойчивых к метронидазолу штаммов без мутаций в генах rdxA и frxA [58].Анализ GenoType HelicoDR — это молекулярный тест, сочетающий ПЦР и гибридизацию, позволяющий провести молекулярную дефекацию H. pylori , а также устойчивость к кларитромицину и фторхинолонам в течение 6 часов. В предыдущих исследованиях анализ GenoType HelicoDR с использованием штаммов бактерий или образцов биопсии желудка был высокоточным для устойчивости к кларитромицину с чувствительностью 94–100% и специфичностью 86–99% соответственно; Анализ GenoType HelicoDR также точен для устойчивости к фторхинолонам с чувствительностью 83% -87% и 95% -98.Специфичность 5% соответственно по сравнению с методом на основе культуры [59,60]. Однако недавнее исследование по оценке клинической применимости GenoType HelicoDR в Корее показало, что чувствительность и специфичность в отношении устойчивости к кларитромицину составляли только 55,0% и 80,0% соответственно. GenoType HelicoDR также не был точным для устойчивости к фторхинолонам, показывая чувствительность и специфичность 74,4% и 70,0% соответственно. Клиническая применимость GenoType HelicoDR для определения устойчивости к антибиотикам может иметь некоторые ограничения, которые требуют дальнейшего изучения [61].ОТ-ПЦР обычно используется для количественного определения ДНК H. pylori в образцах биопсии, но выполнение ОТ-ПЦР может быть проблемой для клинических лабораторий из-за дорогостоящих термоциклеров. Мультиплексная ПЦР на основе двойного примирования олигонуклеотидов (DPO) была разработана для обнаружения инфекции H. pylori и устойчивости к кларитромицину, и этот тест можно проводить в любом стандартном термоциклере, который стоит меньше, чем RT-PCR. Благодаря особой конструкции праймера DPO для амплификации рДНК H. pylori 23S и обнаружения наиболее распространенных мутаций, A2142G и A2143G, придающих устойчивость к кларитромицину, DPO-PCR оказалась быстрой и точной для H.pylori диагностика и определение чувствительности к кларитромицину с помощью биоптатов желудка [62,63]. Кроме того, недавнее исследование с использованием образцов тканей, обработанных RUT для оценки диагностической точности DPO-PCR, показало, что DPO-PCR имеет более высокую чувствительность, чем RUT и гистология, а DPO-PCR может обнаружить инфекцию H. pylori в RUT- отрицательные образцы, что означает, что этот тест может уменьшить ложноотрицательный результат и уменьшить необходимость повторного эндоскопического обследования.Степень согласованности DPO-PCR между образцами биопсии желудка и образцами, обработанными RUT, составила 94,4% [64].
Обнаружение факторов вирулентности с помощью ПЦР помогает оценить генетические вариации факторов вирулентности H. pylori и дает больше информации для понимания клинических различий между пациентами, инфицированными разными штаммами H. pylori . Несколько исследований показали, что наличие факторов вирулентности, таких как ген CagA и VacA , связано с более тяжелым воспалением желудка и более высокой распространенностью язвенной болезни и рака желудка [65–67].Ген А промотора язвы двенадцатиперстной кишки (DupA) также предполагалось связать с образованием язв, индуцированным H. pylori , но в предыдущих исследованиях сообщалось о противоречивых результатах, которые предположительно были вызваны несовпадением праймеров. Недавно разработанная ОТ-ПЦР со специальным праймером, разработанным на основе выравнивания всех 221 последовательностей гена DupA, была введена недавно для повышения скорости обнаружения гена DupA. Этот метод повысил уровень обнаружения до 64,2%, независимо от того, имели ли обычно используемые ПЦР уровень обнаружения между 29.От 9% до 37,8%. Авторы указали, что дизайн ПЦР оказал большое влияние на обнаружение фактора вирулентности, и обнаружение специфического аллеля DupA не то же самое, что обнаружение фактического гена DupA [68].
ПЦР также помогает обнаружить H. pylori в пробах окружающей среды для эпидемиологических исследований. Высокая распространенность H. pylori , обнаруженная в образцах питьевой воды с помощью ПЦР, предоставила дополнительную информацию о передаче H. pylori через питьевую воду [69].Более высокий уровень обнаружения заражения H. pylori в немытых овощах свидетельствует о том, что точное мытье овощей снижает загрязнение H. pylori [70]. ПЦР также использовалась для определения генотипирования H. pylori в овощах, и высокая степень сходства в образце генотипирования H. pylori среди образцов овощей и образцов человека позволила предположить, что овощи могут быть источниками бактерий [71].
За исключением более быстрых и высокоточных результатов ПЦР для обнаружения H.pylori и штаммы, устойчивые к антибиотикам, опасения по поводу стоимости, доступного местного оборудования и опыта в области молекулярных методов неизбежно влияют на возможность проведения ПЦР в местных лабораториях.
НЕИНВАЗИВНЫЕ ИСПЫТАНИЯ
Было сделано несколько попыток избежать использования эндоскопических методов диагностики по нескольким причинам. Прежде всего, эндоскопия — это инвазивная процедура, которая вызывает дискомфорт и не подходит для пациентов с тяжелыми сопутствующими заболеваниями или противопоказаниями. Кроме того, стоимость эндоскопии и дополнительные расходы на эндоскопию, такие как одноразовые щипцы и анестезия, могут быть высокими.И последнее, но не менее важное: систематическая ошибка выборки почти неизбежно встречается в методах, основанных на биопсии, из-за неравномерного распределения H. pylori в желудке.
Дыхательный тест на мочевину
Дыхательный тест на мочевину (UBT) используется уже почти 30 лет и до сих пор остается самым популярным и точным неинвазивным тестом для диагностики инфекции H. pylori . За счет уреазной активности H. pylori , 13 C- или 14 C-меченная мочевина, проглоченная пациентом, гидролизуется до меченого CO 2 в желудке, затем меченый CO 2 абсорбируется в желудке. кровь и выдыхаемый при дыхании, в котором можно измерить помеченный CO 2 .Хотя несколько факторов, включая пациента, бактерии и сам тест, влияют на результаты UBT, UBT — это высокоточный и воспроизводимый тест с чувствительностью и специфичностью около 95% при стандартных процедурах. Недавно опубликованный метаанализ для оценки диагностической точности UBT у взрослых пациентов с диспепсическими симптомами показал, что совокупная чувствительность составила 96% (95% ДИ: 0,95-0,97), а совокупная специфичность составила 93% (95% ДИ: 0,91-0,94). [72]. UBT также полезен для эпидемиологических исследований и для оценки эффективности эрадикационной терапии [21,73].Пациенту следует прекратить прием ИПП за 2 недели и антибиотик за 4 недели до обследования, чтобы избежать ложноотрицательных результатов [74]. Кровотечение также влияет на диагностическую точность UBT, и отсроченное UBT после восстановления после кровотечения обязательно для уменьшения ложноотрицательного результата [75]. Иногда, хотя и редко, присутствие в желудке других патогенов, продуцирующих уреазу, также вызывает ложноположительные результаты.
UBT — подходящий метод со многими преимуществами, такими как простой, неинвазивный и безопасный, для обнаружения H.pylori у педиатрических пациентов, хотя точность UBT у педиатрических пациентов не так хороша, как у взрослых пациентов, особенно для детей младше 6 лет, с чувствительностью и специфичностью от 75% до 100% [76].
13 C-UBT предпочтительнее 14 C-UBT, чтобы избежать воздействия радиации, хотя 14 C-UBT безопасен для детей и беременных женщин, потому что излучение от 14 C-UBT ниже чем радиация, полученная из окружающей среды.Однако из-за отсутствия дорогостоящего оборудования и возможности платить высокую стоимость в размере 13 C-UBT, 14 C-UBT более популярны в развивающихся странах. Диагностическая точность между 13 C-UBT и 14 C-UBT не отличается, и оба теста можно считать золотым стандартом среди различных неинвазивных тестов для диагностики инфекции H. pylori [77]. Существует два протокола, некапсулированный и инкапсулированный, которые используются для перорального введения 14 С-мочевины пациентам для H.pylori диагноз. Первоначально инкапсулированный 14 C-UBT был разработан, чтобы избежать проблемы гидролиза 14 C-мочевины под действием продуцирующей уреазу флоры полости рта, и этот метод устранил проблему ложноположительных результатов в пробах из раннего дыхания [78] . Тем не менее, быстрый транзит капсулы, содержащей 14 C-мочевину, из желудочного тракта или ее неполное рассасывание в желудке во время фазы сбора выдыхаемого воздуха приводит к инкапсулированию 14 C-UBT, возможно, не лучшим вариантом, чем протокол без капсул [79 ].В недавнем исследовании использовалась методика динамического сцинтискана для мониторинга судьбы капсулы в желудке и сравнивалась чувствительность между протоколами без инкапсулирования и инкапсулирования у 100 пациентов с диспепсией. Это исследование показало, что неинкапсулированный протокол имел более высокую чувствительность, чем инкапсулированный протокол, а чувствительность инкапсулированного и неинкапсулированного 14 C-UBT составляла 90,5% и 98,6% через 10 минут и 91,8% и 97,2% через 15 минут соответственно. Неполное разрешение или отсутствие разрешения капсулы 14 C-мочевины в желудке во время фазы сбора выдыхаемого воздуха, отмеченное динамическими изображениями сцинтискана, послужило объяснением более низкой чувствительности инкапсулированного 14 C-UBT по сравнению с неинкапсулированным 14 C-UBT [80].
Точное значение отсечения для значения дельта по сравнению с исходным уровнем (DOB) для различения между H. pylori -положительными и H. pylori -отрицательными результатами является другой спорной проблемой. Отсечной клапан для UBT был первоначально определен как 5,0, что было наиболее широко рекомендовано, тогда как более низкие значения, 3,0 или 3,5, также были предложены для повышения его точности без ущерба для чувствительности и специфичности этого теста. «Серая зона», в которой результаты UBT неубедительны, упоминалась в предыдущих исследованиях, и пограничное значение DOB, например, очень близкое к выбранной точке отсечения, следует интерпретировать с осторожностью [81].Недавно был представлен новый метод UBT с использованием интегрированной системы выходной спектроскопии с оптическим резонатором, обеспечивающей оптимальную диагностическую точку отсечки. Этот предварительный тест определил диагностическую точку отсечения как совокупный процент восстановленной дозы 13 C (c-PDR) = 1,47% через 60 минут и продемонстрировал 100% чувствительность и 100% специфичность с точностью 100% по сравнению с инвазивной эндоскопией. тесты. Однако в этом исследовании используется небольшое количество образцов, и для подтверждения этих результатов необходимы дальнейшие более масштабные исследования [82].
STOOL ANTIGEN TEST
Тест на антиген кала (SAT) — другой неинвазивный метод с хорошей чувствительностью и специфичностью, 94% и 97% соответственно в глобальном метаанализе, при диагностике инфекции H. pylori [83]. Этот метод определяет присутствие H. pylori антигена в образцах стула. Существует два типа SAT, используемых для обнаружения H. pylori, методы, основанные на иммуноферментном анализе (EIA) и иммунохроматографическом анализе (ICA), с использованием либо поликлональных антител, либо моноклональных антител.В настоящее время доступно множество SAT для диагностики инфекции H. pylori , и различная диагностическая точность показана в разных исследованиях с разными SAT и разным дизайном исследований. В целом тесты на основе моноклональных антител более точны, чем тесты на основе поликлональных антител [83], а тесты на основе EIA обеспечивают более надежные результаты, чем тесты на основе ICA [84,85]. В недавнем исследовании EIA на антиген Tesmate pylori (TPAg) с использованием моноклональных антител для проверки нативной каталазы H. pylori было выявлено 92.4% чувствительность и 100% специфичность у взрослых по сравнению с ОТ-ПЦР, а точность этого теста составила 94,9% [86]. Тест Premier Platinum HpSA Plus, другой моноклональный тест на основе EIA, также показал надежные диагностические результаты с чувствительностью 92,2%, специфичностью 94,4% и точностью 93,4% для диагностики инфекции H. pylori по сравнению с другими 4 тестами SAT, включая 1 моноклональный На основе EIA (тест на антиген H. pylori ), на основе 2 моноклональных ICA (тест ImmunoCard STAT! HpSA и H.pylori фекального антигена) и 1 теста на основе поликлонального ICA (одноэтапный тест на антиген H. pylori ), точность которых была ниже 90% [84]. Однако тесты на основе ICA просты в выполнении и не требуют специального оборудования, что делает его подходящим для тестирования в офисе и в развивающихся странах. Новый тест SAT на основе моноклональных ICA, Atlas H. pylori Antigen Test, также был недавно представлен и обеспечивает лучшие результаты, чем предыдущие SAT на основе моноклональных ICA, с 91.Чувствительность 7%, специфичность 100% и точность 96,6% [87].
Помимо UBT, SAT на основе моноклонального EIA также является надежным тестом, рекомендованным руководящими принципами для оценки эффективности эрадикационной терапии H. pylori , и время для тестирования после окончания лечения должно составлять не менее 4 недель [21 , 88]. В предыдущем метаанализе совокупная чувствительность и специфичность моноклонального SAT для подтверждения эрадикации после терапии составляли 93% и 96% соответственно [83]. В недавних исследованиях было подтверждено, что SAT на основе моноклональных EIA является полезным и точным инструментом для определения результатов H.pylori с чувствительностью 91,6–100% и специфичностью 93,6–98,4% [89, 90]. Кроме того, моноклональные тесты SAT на основе ICA, RAPID Hp StAR и ImmunoCard STAT! HpSA также дает многообещающие результаты с чувствительностью 90,0–100% и специфичностью 93,6–94,9%.
В дополнение к оценке эрадикационной терапии, моноклональный САТ является удобным, неинвазивным и полезным тестом для диагностики инфекции H. pylori у педиатрических пациентов [91]. Исследование с применением SAT у детей в возрасте от 6 до 30 месяцев показало надежные результаты SAT для диагностики H.pylori у детей раннего возраста [92]. Недавний метаанализ, включающий 45 исследований и 5931 пациента, для оценки эффективности SATS у детей показал, что совокупная чувствительность и специфичность составили 92,1% и 94,1% соответственно. В анализе подгрупп чувствительность и специфичность моноклонального SAT, поликлонального SAT и одноэтапного быстрого моноклонального SAT составила 96,2% и 94,7%, 88,0% и 93,0% и 88,1% и 94,2% соответственно. Моноклональная SAT — надежный тест для диагностики инфекции H. pylori у детей [93].Более того, SAT — полезный инструмент для программ эпидемиологического исследования и скрининга [94,95]. По стоимости и оснащению SAT больше подходит для массовых опросов, чем UBT. По сравнению с серологическими тестами, которые обычно используются для скрининга, SAT дает более надежные результаты в диагностике инфекции H. pylori . Однако предыдущее исследование показало, что SAT был менее точным, чем серологический тест у пациентов с тяжелым атрофическим гастритом, и влияние этого результата требует дальнейшей оценки для оценки роли SAT в скрининге H.pylori -ассоциированные заболевания, такие как рак желудка [96]. В то время как другое исследование с использованием нового SAT на основе поликлонального EIA (EZ-STEP H. pylori ) обнаружило наличие атрофического гастрита и / или кишечной метаплазии, которые существенно не повлияли на результаты SAT [97].
На точность SAT влияет несколько факторов, таких как антибиотик, ИПП, N-ацетилцистеин, дефекация и кровотечение из верхних отделов желудочно-кишечного тракта. Сохранность образца, такая как температура и время транспортировки перед испытанием, а также отсечной клапан также влияют на диагностическую точность SAT [98-100].
ИСПЫТАНИЯ НА ОСНОВЕ АНТИТЕЛ
Для диагностики H. pylori широко доступны многочисленные серологические тесты, основанные на обнаружении антител IgG к H. pylori, и тест EIA является наиболее распространенным и точным методом среди них. Серологические тесты также часто используются при скрининге для эпидемиологических исследований из-за их недорогой, быстрой и приемлемости для пациентов. Кроме того, серологический тест полезен для оценки инфекции H. pylori у детей.Недавнее исследование с использованием E-Plate, коммерческого набора сывороточных антител, для сравнения эффективности серологического теста с SAT у 73 детей показало, что чувствительность, специфичность и отношение правдоподобия для серологического теста составили 91,2%, 97,4% и 35,6%. , соответственно. Эти результаты были получены при использовании запорного клапана, рекомендованного для взрослых, у детей [101]. Поскольку точность серологических тестов зависит от антигена, используемого в коммерческом наборе, и степени распространенности конкретных штаммов H. pylori , используемых в качестве источника антигена.Надлежащие антигены, используя либо местные штаммы в качестве источника антигена, либо объединяющие антигены из штаммов разных групп, а также надежное пороговое значение серологического теста должны быть проверены на местном уровне перед исследованием популяции [102,103]. Некоторые иммуногенные белки, такие как CagA, VacA, UreA, Omp и GroEL, были использованы в качестве кандидатов для обнаружения инфекции. Белок H. pylori FliD, важный элемент в сборке функциональных жгутиков, также признан новым маркером для серологической диагностики H.pylori с чувствительностью и специфичностью 99% и 97% соответственно [104]. Недавно для серологической диагностики инфекции H. pylori был введен новый метод иммуноанализа «РекомЛайн H. pylori » с использованием шести высокоиммуногенных факторов вирулентности (CagA, VacA, GroEL, gGT, HcpC и UreA). В отличие от EIA и иммуноблоттинга, RecomLine позволяет идентифицировать специфический ответ антител против различных антигенов H. pylori и увеличивает дискриминирующую способность.По сравнению с гистологией, рекомЛайн показала чувствительность и специфичность 97,6% и 96,2% соответственно. РекомЛайн также является полезным инструментом для идентификации специфических факторов вирулентности H. pylori [105,106].
Другое преимущество серологического теста заключается в том, что на точность серологических тестов не влияют язвенное кровотечение, атрофия желудка, а также использование ИПП или антибиотиков, которые вызывают ложноотрицательные результаты в других инвазивных или неинвазивных тестах. Однако серологический тест не является надежным тестом для оценки эрадикационной терапии, поскольку уровни антител могут сохраняться в крови в течение длительных периодов времени даже после успешной эрадикации [21].Поскольку серологические тесты не различают активную инфекцию и прошлое воздействие H. pylori , перед эрадикационной терапией требуется дополнительное подтверждение другими тестами.
Как и SAT, серологические тесты на основе EIA имеют лучшую точность, чем тесты на основе ICA. Недавнее исследование, сравнивающее 29 коммерческих серологических тестов (17 на основе EIA и 12 на основе ICA), показало, что точность 9 из 17 тестов на основе EIA была выше 90%, тогда как только один из 12 тестов на основе ICA имел точность> 90 %.Гетерогенные характеристики также наблюдались между различными серологическими тестами, выявление чувствительности варьировалось от 57,8% до 100%, а специфичность варьировалась от 58,7% до 96,8% в тестах на основе EIA; Чувствительность варьировала от 55,6% до 97,8%, а специфичность — от 60,3% до 96,8% в тестах на основе ICA. Серологические тесты следует выбирать правильно в соответствии с их конкретными рабочими параметрами для достижения различных целей, таких как скрининг, первоначальный диагноз или подтверждение другого теста [107].
Серологический тест также играет важную роль в изучении факторов патогенеза и вирулентности, поскольку некоторые антигенные белки могут быть обнаружены иммунологическими методами и имеют дополнительную диагностическую ценность.Было предпринято несколько попыток найти потенциальные биомаркеры для идентификации пациента, инфицированного штаммом H. pylori высокого риска, с помощью серологических тестов. Уровни пепсиногена (PG) I, PG II и соотношения PG I / II в сочетании с антителом H. pylori широко используются для прогнозирования атрофического гастрита и риска рака желудка [108,109]. Соотношение PG I / II также может быть полезно для наблюдения за раком желудка у пациентов после эрадикационной терапии [110]. Однако получены противоречивые результаты по клиническому применению этих серологических препаратов.Недавнее исследование, оценивающее точность GastroPanel, который измеряет гастрин-17, антитела H. pylori , PG I и PG II, для выявления атрофического гастрита, показало только 50% чувствительность и 80% специфичность, что было хуже, чем в предыдущих исследованиях [111 ]. Пепсиногеновый тест также оказался недостаточно точным для диагностики рака желудка с чувствительностью 71,0% и специфичностью 69,2% [112]. Некоторые факторы вирулентности также были оценены для прогнозирования заболеваний, ассоциированных с H. pylori .Присутствие сывороточных антител CagA, VacA и GroEL у пациентов с инфекцией H. pylori связано с предраковыми поражениями желудка, а также с раком желудка, и эти сывороточные маркеры могут служить потенциальными предикторами для пациентов, инфицированных штаммами высокого риска, которые могут быть связано с развитием рака желудка [106,113]. Хотя связь между факторами вирулентности и клиническими проявлениями была обнаружена в ходе предыдущих эпидемиологических исследований, серологические тесты все еще недостаточно надежны для диагностики рака желудка.В недавнем метаанализе совокупная чувствительность и специфичность антител CagA, используемых для диагностики рака желудка, составила 71% и 40% соответственно, а диагностическое отношение шансов составило 2,11 [114].
Обнаружение H. pylori IgG в моче также оценивалось у детей в предыдущих исследованиях, однако были представлены различные результаты [115,116]. Кроме того, диагностическая точность теста на основе ИФА для выявления IgG в слюне H. pylori также была недостаточной в качестве надежного теста [117,118].Определение антител в моче или слюне менее точное, чем другие тесты, и его не рекомендуется использовать при ведении пациентов [119].
ДИАГНОСТИКА
H. PYLORI В ДРУГИХ ОБРАЗЦАХИспользование ПЦР для обнаружения H. pylori в кале является надежным и быстрым методом, особенно привлекательным для детей в качестве неинвазивного теста. ПЦР стула также дает преимущества в идентификации конкретных генотипов и устойчивости микроорганизмов к антибиотикам [120,121].Полость рта считается внегастральным резервуаром H. pylori , хотя значение H. pylori в полости рта как источника повторного инфицирования или пути передачи все еще неясно. Слюна и зубной налет были образцами, обычно используемыми для обнаружения H. pylori в полости рта, а ПЦР была наиболее распространенным и надежным тестом, используемым в недавних исследованиях. RUT и посев также были выполнены для выявления орального H. pylori в ранних исследованиях.Распространенность обнаружения H. pylori в полости рта сильно варьировала, от 0% до 100%, и обычно обнаруживалась более низкая распространенность в слюне по сравнению с зубным налетом [122]. Широкие различия в распространенности H. pylori в полости рта могут быть связаны с разными методологиями, разными популяциями и разными праймерами, использованными в исследованиях. Недавние исследования были сосредоточены на модификации праймера для повышения диагностической точности или оценке нового метода преодоления ограничений ПЦР.Недавно была разработана новая система ПЦР с использованием наборов праймеров, специфичных для H. pylori на основе высококонсервативных последовательностей полных геномов 48 штаммов H. pylori , для повышения диагностической точности ПЦР в полости рта [123] . Петлевая изотермическая амплификация (LAMP), новый метод высокоспецифичной и чувствительной амплификации ДНК, сравнивалась с ПЦР по скорости обнаружения H. pylori в образцах зубного налета в небольшом исследовании, в котором приняли участие 45 участников.Это исследование показало, что LAMP имеет более высокий уровень обнаружения, чем ПЦР, и уровень обнаружения H. pylori в образцах зубного налета с помощью LAMP и ПЦР составляет 66,67% и 44% соответственно [124].
ДИАГНОСТИКА
H. PYLORI ПРИ ОСОБЫХ КЛИНИЧЕСКИХ ОБСТОЯТЕЛЬСТВАХКак упоминалось ранее, кровотечение из верхних отделов желудочно-кишечного тракта (UGIB) снижает диагностическую точность многих тестов, включая инвазивные и неинвазивные, для выявления инфекции H. pylori . В предыдущем метаанализе RUT, гистология и культура показали низкую чувствительность и высокую специфичность у пациентов с UGIB.UBT по-прежнему оставался надежным тестом, тогда как SAT стал менее точным в этих клинических условиях. Хотя UGIB не повлиял на серологический анализ, его нельзя рекомендовать в качестве первого диагностического теста на инфекцию H. pylori [40]. При сравнении CLO, культуры и гистологии, гистология была меньше подвержена влиянию язвенного кровотечения и могла быть надежным тестом даже в присутствии крови [125]. ПЦР имела значительно более высокую чувствительность, чем RUT, гистология и культура, с чувствительностью 91%, 66%, 43% и 37% соответственно и показала аналогичную чувствительность по сравнению с серологией и UBT, 94% и 94% соответственно.ПЦР была аналогична UBT по диагностической точности для выявления инфекции H. pylori в кровоточащих пептических язвах. Однако специфичность ПЦР (100%) превосходила только серологию (65%) и не отличалась от других тестов (RUT: 95%, гистология: 95%, культура: 100%, UBT: 85%) [126]. Исследование также показало, что ОТ-ПЦР может выявить инфекцию H. pylori с использованием фиксированных формалином образцов биопсии, залитых парафином, гистология которых показала отрицательные результаты у пациентов с кровотечением из язвенной болезни [127].Ликвидация H. pylori важна для лечения язвенного кровотечения, связанного с H. pylori , с целью предотвращения дальнейшего кровотечения, а успешная эрадикационная терапия даже более эффективна, чем длительная поддерживающая антисекреторная терапия с ИПП для уменьшения повторного кровотечения. Тестирование на основе биопсии H. pylori обычно рекомендуется во время эндоскопического исследования UGIB, даже если кровотечение снижает чувствительность тестов на основе биопсии. По результатам мета-регрессионного исследования, отложенный тест, через 4 недели после эпизода UGIB, имел более высокий уровень обнаружения H.pylori у пациентов с УГИБ. Поскольку точное определение этиологии кровоточащих язв имеет решающее значение при лечении язвенных кровотечений, в руководствах также рекомендовано подтверждение отрицательного результата с помощью последующего неинвазивного теста [22,128,129]. Низкая прогностическая ценность отрицательного результата была также обнаружена, когда UBT проводился сразу после экстренной эндоскопии, и тест задержки также был обязательным для всех отрицательных результатов раннего UBT [75]. Несмотря на важность тестирования H. pylori у пациентов с UGIB, доля пациентов, получивших прямое лечение H.pylori было прекращено, около 12% -60% отметили по результатам предыдущих исследований. Опасения по поводу снижения чувствительности, связанной с кровотечением или применением ИПП, и повышенным риском побочных эффектов, связанных с биопсией желудка или увеличением времени процедуры для выполнения биопсии желудка, могут повлиять на решения клиницистов о тестировании H. pylori [130].
Диагностика H. pylori у пациентов с частичной гастрэктомией — еще одна проблема, которой уделялось меньше внимания, поскольку эти пациенты составляли очень небольшую часть населения в целом.В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной гастрэктомией, гистология показала лучшие результаты, за ней следовала RUT, тогда как UBT имела низкую диагностическую точность. Эти исследования показали высокую степень гетерогенности, а совокупная чувствительность и специфичность гистологии, RUT и UBT составили 93% и 85%; 79% и 94%; 77% и 89% соответственно. RUT был предложен в качестве первоначального выбора теста для этих пациентов, и были рекомендованы образцы биопсии из дна желудка или верхней части остаточного желудка.Гистологическое исследование было рекомендовано этим пациентам после отрицательного результата РУТ [131]. SAT может быть другим надежным тестом для обнаружения H. pylori у пациентов с дистальной гастрэктомией. Небольшое исследование с использованием теста HpSA для оценки диагностической точности SAT у 59 пациентов с дистальной резекцией желудка по поводу рака желудка показало, что чувствительность, специфичность и точность теста HpSA составляли 100%, 90,5% и 96,6% соответственно [132]. Возможная причина неадекватного выполнения УБТ при диагностике H.pylori у пациентов с дистальной резекцией желудка может быть недостаточно времени для того, чтобы мочевина оставалась в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori . BreathID, быстрый непрерывный UBT в реальном времени, казалось, преодолел этот недостаток и показал лучшую точность, чем RUT, 87% и 72% соответственно. Однако в этом исследовании также была обнаружена более низкая чувствительность и специфичность RUT, 82% и 71% соответственно, по сравнению с предыдущими исследованиями, и биопсия, взятая из тела желудка немного дистальнее глазного дна, в этом исследовании может повлиять на диагностические характеристики RUT [133 ].Недавнее исследование также продемонстрировало противоречивые результаты между UBT и биопсийными тестами у пациентов с частичной гастэктомией после эрадикационной терапии H. pylori . Авторы предположили, что дополнительные тесты на основе эндоскопической биопсии помогут избежать ненужного лечения, поскольку у этих пациентов после эрадикационной терапии были обнаружены высокий уровень ложноположительных результатов и низкая прогностическая ценность UBT, 19,1% и 44,7% соответственно [134].
Точное определение статуса H. pylori у пациентов после эрадикационной терапии имеет важное значение, и UBT, а также SAT рекомендуются руководящими принципами для оценки эффективности эрадикационной терапии.Эти тесты обычно рекомендуется проводить более чем через 4 недели после окончания терапии [21,88]. Однако высокий уровень ложноположительных результатов в 52,9% был обнаружен при использовании 13 C-UBT с текущим пороговым значением (2,5 ‰), особенно у пациентов с более чем двукратной предыдущей эрадикационной терапией и у пациентов с умеренной и тяжелой кишечной метаплазией желудка [ 135]. Недавнее исследование с использованием вложенной ПЦР для обнаружения H. pylori в образцах биопсии желудка после эрадикационной терапии показало, что вложенная ПЦР более чувствительна, чем RUT, гистология и культура.Кроме того, метод, основанный на ПЦР, позволяет отличить реинфекцию или рецидив после эрадикационной терапии [136].
ЗАКЛЮЧЕНИЕ
Развитие современных методов диагностики позволяет более точно диагностировать инфекцию H. pylori , что, в свою очередь, улучшает лечение заболеваний, связанных с H. pylori- . Хотя теста золотого стандарта может не существовать, выбор теста для выявления инфекции H. pylori зависит от распространенности и штамма H.pylori о эндемичных регионах, доступности, преимуществах и недостатках каждого метода, а также о различных клинических обстоятельствах каждого пациента. Объединение результатов двух или более тестов может быть разумной стратегией в повседневной клинической практике для достижения наиболее надежного результата. Мы полагаем, что будут продолжаться попытки улучшить диагностическую ценность инфекции H. pylori для различных клинических целей, конкретных популяций и генотипических характеристик, чтобы иметь более надежные и осуществимые методы диагностики H.pylori в будущем.
Сноски
При поддержке (частично) грантов Медицинского университета Гаосюн «Грант для лучших университетов», гранты № KMU-TP104G00, № KMU-TP104G03 и № KMU-TP104E25; и Общая больница Тен Чан, совместный исследовательский проект Чун-Ли и КМУ, № ST102004; и больница Гаосюнского медицинского университета, № KMUh200-0R01.
Заявление о конфликте интересов: у авторов нет конфликта интересов, о котором следует сообщать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана штатным редактором и полностью рецензирована внешними рецензентами.Он распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях. См .: http://creativecommons.org/licenses/by-nc/4.0/
Рецензирование началось: 12 мая 2015 г.
Первое решение: 13 июля 2015 г.
Статья в печати: 30 сентября 2015 г.
P- Рецензент: Tosetti C S- Редактор: Ma YJ L- Редактор: A E- Редактор: Zhang DN
Ссылки
1.Пелетейро Б., Бастос А., Ферро А., Лунет Н. Распространенность инфекции Helicobacter pylori во всем мире: систематический обзор исследований с национальным охватом. Dig Dis Sci. 2014; 59: 1698–1709. [PubMed] [Google Scholar] 2. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 3. Фок КМ. Обзорная статья: эпидемиология и профилактика рака желудка.Алимент Pharmacol Ther. 2014; 40: 250–260. [PubMed] [Google Scholar] 4. де Мартель С., Ферли Дж., Франчески С., Винья Дж., Брей Ф., Форман Д., Пламмер М. Глобальное бремя рака, связанное с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол. 2012; 13: 607–615. [PubMed] [Google Scholar] 5. Axon A. Helicobacter pylori и общественное здравоохранение. Helicobacter. 2014; 19 Приложение 1: 68–73. [PubMed] [Google Scholar] 6. Ли Дж.Х., Пак Й.С., Чхве К.С., Ким до Х., Чой К.Д., Сон Х.Д., Ли Г.Х., Чан С.Дж., Чон Х.Й., Ким Дж.Х. Оптимальное место биопсии для обнаружения Helicobacter pylori во время эндоскопической мукозэктомии у пациентов с обширной атрофией желудка.Helicobacter. 2012; 17: 405–410. [PubMed] [Google Scholar] 7. Лан Х.С., Чен Т.С., Ли А.Ф., Чанг Ф.Й., Лин Х.С. Дополнительная биопсия тела позволяет выявить инфекцию Helicobacter pylori на фоне гастрита с атрофией. BMC Gastroenterol. 2012; 12: 182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Като Т., Яги Н., Камада Т., Шимбо Т., Ватанабе Х., Ида К. Диагностика инфекции Helicobacter pylori в слизистой оболочке желудка по эндоскопическим признакам: многоцентровое проспективное исследование. Dig Endosc. 2013; 25: 508–518.[PubMed] [Google Scholar] 9. Чо Дж.Х., Чанг Ю.В., Чан Дж.Й., Шим Дж.Дж., Ли СК, Донг С.Х., Ким ХДЖ, Ким Б. Тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может предсказать статус инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 279–284. [PubMed] [Google Scholar] 10. Чо Ю.С., Чае Х.С., Чан С.Н., Ким Дж.С., Сон Х.С., Ким Х.К., Ким Б.В., Хан С.В., Чой К.Й., Ли Х.К. и др. Сравнение дыхательного теста с 13C-мочевиной и эндоскопического теста pH слизистой оболочки феноловым красным при количественной оценке нагрузки инфекции Helicobacter pylori.Korean J Intern Med. 2008. 23: 134–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Hernández-Garcés HR, Castellanos-González VV, González-Fabián L, Infante-Velázquez M, Peña K, Andrain-Sierra Y. Хромоэндоскопия с красным фенолом в диагностике инфекции Helicobacter pylori. Rev Esp Enferm Dig. 2012; 104: 4–9. [PubMed] [Google Scholar] 12. Гонен С., Симсек И., Сариоглу С., Акпинар Х. Сравнение увеличительной эндоскопии с высоким разрешением и стандартной видеоэндоскопии для диагностики гастрита Helicobacter pylori в рутинной клинической практике: проспективное исследование.Helicobacter. 2009; 14: 12–21. [PubMed] [Google Scholar] 13. Цзи Р, Ли YQ, Гу ХМ, Ю Т, Цзо XL, Чжоу СиДжей. Конфокальная лазерная эндомикроскопия для диагностики инфекции Helicobacter pylori: проспективное исследование. J Gastroenterol Hepatol. 2010. 25: 700–705. [PubMed] [Google Scholar] 14. Яги К., Сака А., Нодзава Ю., Накамура А. Прогнозирование статуса Helicobacter pylori с помощью обычной эндоскопии, узкополосной визуализации с увеличением эндоскопии в желудке после эндоскопической резекции рака желудка. Helicobacter. 2014; 19: 111–115.[PubMed] [Google Scholar] 15. Ци QQ, Zuo XL, Li CQ, Ji R, Li Z, Zhou CJ, Li YQ. Эндоскопия с увеличением высокого разрешения с i-scan в диагностике инфекции Helicobacter pylori: пилотное исследование. J Dig Dis. 2013; 14: 579–586. [PubMed] [Google Scholar] 16. Лю Х, Ву Дж, Линь XC, Вэй Н, Лин В, Чанг Х, Ду ХМ. Оценка диагнозов поражений антрального отдела желудка с помощью увеличительной эндоскопии с узкополосной визуализацией у населения Китая. Dig Dis Sci. 2014; 59: 1513–1519. [PubMed] [Google Scholar] 17. Яги К., Накамура А., Секин А.Сравнение результатов эндоскопии с увеличением и результатов гистологического, посевного и уреазного теста слизистой оболочки тела желудка. Эндоскопия. 2002; 34: 376–381. [PubMed] [Google Scholar] 18. Накагава С., Като М., Симидзу Ю., Накагава М., Ямамото Дж., Луис П.А., Кодаира Дж., Каварасаки М., Такеда Х., Сугияма Т. и др. Связь между гистопатологическим гастритом и микроваскуляризацией слизистой оболочки: наблюдения с увеличительной эндоскопией. Gastrointest Endosc. 2003. 58: 71–75. [PubMed] [Google Scholar] 19. Кавамура М., Секин Х., Абэ С., Сибуя Д., Като К., Масуда Т.Клиническое значение белых отверстий желудочных крипт, наблюдаемых при увеличительной эндоскопии. Мир Дж. Гастроэнтерол. 2013; 19: 9392–9398. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ватанабе К., Нагата Н., Симбо Т., Накашима Р., Фурухата Е., Сакураи Т., Акадзава Н., Ёкои С., Кобаякава М., Акияма Дж. И др. Точность эндоскопической диагностики инфекции Helicobacter pylori в соответствии с уровнем эндоскопического опыта и эффектом тренировки. BMC Gastroenterol. 2013; 13: 128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др. Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 22. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007. 102: 1808–1825. [PubMed] [Google Scholar] 23. Lash JG, Genta RM. Соблюдение рекомендаций Сиднейской системы увеличивает вероятность выявления гастрита, вызванного Helicobacter, и кишечной метаплазии в 400738 наборах биопсий желудка.Алимент Pharmacol Ther. 2013; 38: 424–431. [PubMed] [Google Scholar] 24. Хартман DJ, Оуэнс SR. Требуются ли обычные вспомогательные окрашивания для диагностики инфекции Helicobacter в образцах биопсии желудка? Обзор институционального обеспечения качества. Am J Clin Pathol. 2012; 137: 255–260. [PubMed] [Google Scholar] 25. Баттс К.П., Кетовер С., Какар С., Красинскас А.М., Митчелл К.А., Уилкокс Р., Вестерхофф М., Ранг J, Гибсон Дж., Маттиа А.Р. и др. Надлежащее использование специальных красителей для идентификации Helicobacter pylori: рекомендации Rodger C.Общество патологии желудочно-кишечного тракта Хаггитта. Am J Surg Pathol. 2013; 37: e12 – e22. [PubMed] [Google Scholar] 26. Ротими О., Кэрнс А., Грей С., Моайеди П., Диксон М. Ф. Гистологическая идентификация Helicobacter pylori: сравнение методов окрашивания. J Clin Pathol. 2000. 53: 756–759. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз О., Демирай Э. Клиническая роль и важность метода флуоресцентной гибридизации in situ в диагностике инфекции H. pylori и определении устойчивости к кларитромицину при эрадикационной терапии H. pylori.Мир Дж. Гастроэнтерол. 2007. 13: 671–675. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Таджбахш С., Самарбаф-Заде А.Р., Мусавиан М. Сравнение флуоресцентной гибридизации in situ и гистологического метода диагностики Helicobacter pylori в образцах биопсии желудка. Med Sci Monit. 2008; 14: BR183 – BR187. [PubMed] [Google Scholar] 29. Cerqueira L, Fernandes RM, Ferreira RM, Oleastro M, Carneiro F, Brandão C, Pimentel-Nunes P, Dinis-Ribeiro M, Figueiredo C, Keevil CW и др. Валидация метода флуоресцентной гибридизации in situ с использованием зондов пептидных нуклеиновых кислот для выявления устойчивости к кларитромицину Helicobacter pylori в образцах биопсии желудка.J Clin Microbiol. 2013; 51: 1887–1893. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Тиродимос И., Бобос М., Казакос Э., Хайдич А.Б., Дардавессис Т., Костопулос И., Арванитиду М. Молекулярное обнаружение Helicobacter pylori в большой средиземноморской реке с помощью прямого подсчета жизнеспособности с помощью флуоресцентной гибридизации in situ (DVC-FISH) J Water Health. 2014; 12: 868–873. [PubMed] [Google Scholar] 31. Сантьяго П., Морено Ю., Феррус Массачусетс. Идентификация жизнеспособных Helicobacter pylori в источниках питьевой воды культурными и молекулярными методами.Helicobacter. 2015; 20: 252–259. [PubMed] [Google Scholar] 32. Вайра Д., Вакил Н., Гатта Л., Риччи С., Перна Ф., Сарацино И., Фиорини Г., Холтон Дж. Точность нового сверхбыстрого экспресс-теста на уреазу для диагностики инфекции Helicobacter pylori у 1000 последовательных пациентов с диспепсией. Алимент Pharmacol Ther. 2010. 31: 331–338. [PubMed] [Google Scholar] 33. Lerang F, Moum B, Mowinckel P, Haug JB, Ragnhildstveit E, Berge T, Bjørneklett A. Точность семи различных тестов для диагностики инфекции Helicobacter pylori и влияние антагонистов h3-рецепторов на результаты тестов.Сканд Дж Гастроэнтерол. 1998. 33: 364–369. [PubMed] [Google Scholar] 34. Озаслан Э., Косеоглу Т., Пурнак Т., Йылдыз А. Забытая причина ложноотрицательного экспресс-теста на уреазу: загрязнение образца формалином. Гепатогастроэнтерология. 2010; 57: 2 с. предыдущее оглавление. [PubMed] [Google Scholar] 35. Сиавоши Ф., Сани П., Халили-Самани С., Хоссейни Ф., Малакутихах Ф., Мамиванд М., Шахреза С., Шарифи А. Х. Оценка методов выявления H. pylori при потреблении ИПП с использованием посева, экспресс-теста на уреазу и исследования мазка.Ann Transl Med. 2015; 3: 11. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Цэн ЦА, Ван ВМ, Ву округ Колумбия. Сравнение клинической осуществимости трех экспресс-тестов на уреазу в диагностике инфекции Helicobacter pylori. Dig Dis Sci. 2005. 50: 449–452. [PubMed] [Google Scholar] 37. Сиддик И., Аль-Мехайзим К., Алатеи Н., Мемон А., Хасан Ф. Диагностика Helicobacter pylori: повышение чувствительности CLOtest за счет увеличения количества биопсий антрального отдела желудка. J Clin Gastroenterol. 2008. 42: 356–360. [PubMed] [Google Scholar] 38.Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, Wang JY, Yang YC, Lin YC, Wang WM и др. Двойные образцы повышают диагностическую точность и сокращают время реакции экспресс-теста на уреазу. Мир Дж. Гастроэнтерол. 2010; 16: 2926–2930. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, Shim SG, Kim HJ, Jung WT, Lee OJ. Объединенный экспресс-тест на уреазу превосходит отдельный тест в обнаружении Helicobacter pylori в антральном отделе желудка и в образцах тела.Clin Endosc. 2012; 45: 392–396. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Gisbert JP, Abraira V. Точность диагностических тестов Helicobacter pylori у пациентов с кровоточащей язвенной болезнью: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 848–863. [PubMed] [Google Scholar] 41. Ли TH, Лин CC, Chung CS, Lin CK, Liang CC, Tsai KC. Увеличение количества биопсий и забор образцов из тела желудка улучшает чувствительность экспресс-теста на уреазу у пациентов с кровотечением из язвенной болезни. Dig Dis Sci.2015; 60: 454–457. [PubMed] [Google Scholar] 42. Парк С.А., Ко А, Ли Н.Г. Стимуляция роста возбудителя желудочного заболевания человека Helicobacter pylori за счет атмосферного уровня кислорода при высоком давлении углекислого газа. BMC Microbiol. 2011; 11: 96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Ндип Р.Н., Маккей В.Г., Фартинг М.Дж., Уивер Л.Т. Культивирование Helicobacter pylori из клинических образцов: обзор микробиологических методов. J Pediatr Gastroenterol Nutr. 2003. 36: 616–622. [PubMed] [Google Scholar] 44. Гонг Ю.Н., Ли Ю.М., Янг Н.М., Ли ХЗ, Го Ф., Линь Л., Ван Цюй, Чжан Дж.К., Цзи Цзы, Мао Дж. Б. и др.Централизованная изоляция Helicobacter pylori из множества центров и условий транспортировки. Мир Дж. Гастроэнтерол. 2015; 21: 944–952. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Челлини Л., Ди Кампли Э, Ди Бартоломео С., Бесса Л. Дж., Баффони М., Ди Джулио М. Новая транспортная среда для культивирования Helicobacter pylori. J Clin Microbiol. 2014; 52: 4325–4329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Wisessombat S, Meethai C, Hamgo S. Новый двухфазный тест для обнаружения Helicobacter pylori в биопсиях желудка.J Microbiol Methods. 2014; 96: 19–24. [PubMed] [Google Scholar] 47. Leszczyńska K, Namiot A, Namiot Z, Leszczyńska JK, Jakoniuk P, Chilewicz M, Namiot DB, Kemona A, Milewski R, Bucki R. Факторы пациента, влияющие на культуру Helicobacter pylori, выделенную из образцов слизистой оболочки желудка. Adv Med Sci. 2010; 55: 161–166. [PubMed] [Google Scholar] 48. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Momtaz H, Souod N, Dabiri H, Sarshar M. Изучение статуса генотипа Helicobacter pylori в слюне, зубных бляшках, образцах стула и биопсии желудка. Мир Дж. Гастроэнтерол. 2012; 18: 2105–2111. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Lehours P, Mégraud F. Молекулярная диагностика Helicobacter pylori. Эксперт Rev Mol Diagn. 2011; 11: 351–355. [PubMed] [Google Scholar] 52. Monno R, Giorgio F, Carmine P, Soleo L, Cinquepalmi V, Ierardi E. Устойчивость к кларитромицину Helicobacter pylori, обнаруженная с помощью Etest и TaqMan полимеразной цепной реакции в реальном времени: сравнительное исследование. APMIS. 2012; 120: 712–717. [PubMed] [Google Scholar] 53. Лю Цюй, Ци Д, Кан Дж, Цзинь И, Лю В., Гао В., Хоу П, Лу Дж.Эффективность обнаружения инфекции Helicobacter pylori на основе ПЦР в реальном времени и четырехкратной терапии на основе генотипической резистентности в качестве лечения первой линии функциональной диспепсии, вызванной инфекцией Helicobacter pylori. Eur J Gastroenterol Hepatol. 2015; 27: 221–225. [PubMed] [Google Scholar] 54. Онцира Нгойи Э.Н., Атипо Ибара Б.И., Мойен Р., Ахуи Апенди П.К., Ибара Дж. Р., Обенги О., Осиби Ибара Р. Б., Нгуимби Е., Ниама РФ, Уамба Дж. Молекулярное определение Helicobacter pylori и его устойчивости к противомикробным препаратам в Браззавиле, Конго.Helicobacter. 2015; 20: 316–320. [PubMed] [Google Scholar] 55. Де Франческо V, Зулло А., Джорджио Ф., Сарачино I, Заккаро С., Хассан С., Иерарди Э., Ди Лео А., Фиорини Дж., Кастелли В. и др. Изменение точечных мутаций в рРНК Helicobacter pylori, связанных с устойчивостью к кларитромицину в Италии. J Med Microbiol. 2014; 63: 453–457. [PubMed] [Google Scholar] 56. Ивамото А., Танахаши Т., Окада Р., Ёсида Ю., Кикучи К., Кейда Ю., Мураками Ю., Ян Л., Ямамото К., Нишиуми С. и др. Полногеномное секвенирование Helicobacter pylori, устойчивого к кларитромицину, характеризует неидентифицированные варианты генов эффлюксной помпы с множественной лекарственной устойчивостью.Gut Pathog. 2014; 6: 27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Смит С.М., О’Морайн С., Макнамара Д. Тестирование чувствительности к противомикробным препаратам для Helicobacter pylori во времена повышения устойчивости к антибиотикам. Мир Дж. Гастроэнтерол. 2014; 20: 9912–9921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Бинь Т.Т., Сузуки Р., Транг Т.Т., Квон Д.Х., Ямаока Ю. Поиск новых мутаций-кандидатов на устойчивость к метронидазолу у Helicobacter pylori с использованием секвенирования следующего поколения. Антимикробные агенты Chemother.2015; 59: 2343–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F. Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Miendje Deyi VY, Burette A, Bentatou Z, Maaroufi Y, Bontems P, Lepage P, Reynders M. Практическое использование GenoType® HelicoDR, молекулярного теста для обнаружения Helicobacter pylori и тестирования чувствительности.Диагностика Microbiol Infect Dis. 2011; 70: 557–560. [PubMed] [Google Scholar] 61. Ли Дж. У., Ким Н., Нам Р., Пак Дж. Х., Чой Й. Дж., Ким Дж. М., Ким Дж. С., Юнг ХК. Тест GenoType HelicoDR для определения устойчивости Helicobacter pylori к противомикробным препаратам в Корее. Сканд Дж Гастроэнтерол. 2014; 49: 1058–1067. [PubMed] [Google Scholar] 62. Woo HY, Park DI, Park H, Kim MK, Kim DH, Kim IS, Kim YJ. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом для обнаружения Helicobacter pylori и определения устойчивости к кларитромицину с помощью биоптатов желудка.Helicobacter. 2009. 14: 22–28. [PubMed] [Google Scholar] 63. Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Chung WC, Jung SH, Oh JH, Kim TH, Cheung DY, Kim BW, Kim SS, Kim JI, Sin EY. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом с использованием образцов ткани в экспресс-тесте на уреазу при обнаружении инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2014; 20: 6547–6553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Алмейда Н., Донато М. М., Ромаозиньо Дж. М., Люксо С., Кардозу О, Сиприано М. А., Мариньо С., Фернандес А., София С. Корреляция генотипов Helicobacter pylori с гистопатологией желудка в центральном регионе южно-европейской страны. Dig Dis Sci. 2015; 60: 74–85. [PubMed] [Google Scholar] 66. Сиддик I, Аль-Кабанди А., Аль-Али Дж., Алазми В., Мемон А., Мустафа А.С., Джунаид Т.А. Связь между генотипами Helicobacter pylori и тяжестью хронического гастрита, язвенной болезни и уровнями интерлейкина-8 в слизистой оболочке желудка: данные исследования, проведенного на Ближнем Востоке.Gut Pathog. 2014; 6: 41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Феррейра Р.М., Мачадо Дж. К., Фигейредо С. Клиническая значимость генотипов VacA и cagA Helicobacter pylori при карциноме желудка. Лучшие Практики Рес Клин Гастроэнтерол. 2014; 28: 1003–1015. [PubMed] [Google Scholar] 68. Абади А.Т., Лоффельд Р.Дж., Констанция А.С., Вагенаар Дж.А., Кустерс Дж.Г. На обнаружение гена dupA Helicobacter pylori сильно влияет дизайн ПЦР. J Microbiol Methods. 2014; 106: 55–56. [PubMed] [Google Scholar] 69. Амирхошанг А., Рамин А., Эхсан А., Мансур Р., Шахрам Б.Высокая частота ДНК Helicobacter pylori в питьевой воде в Керманшахе, Иран, в июне-ноябре 2012 года. J Water Health. 2014; 12: 504–512. [PubMed] [Google Scholar] 70. Атапур С., Сафарпур Дехкорди Ф., Рахими Э. Обнаружение Helicobacter pylori в различных типах овощей и салатов. Jundishapur J Microbiol. 2014; 7: e10013. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Yahaghi E, Khamesipour F, Mashayekhi F, Safarpoor Dehkordi F, Sakhaei MH, Masoudimanesh M, Khameneie MK. Helicobacter pylori в овощах и салатах: генотипирование и свойства устойчивости к противомикробным препаратам.Biomed Res Int. 2014; 2014: 757941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Фервана М., Абдулмаджид И., Альхаджахмед А., Мадани В., Фирвана Б., Хасан Р., Алтаяр О, Лимбург П.Дж., Мурад М.Х., Кнави Б. Точность дыхательного теста на мочевину при инфекции Helicobacter pylori: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21: 1305–1314. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Gong Y, Wei W, Yuan Y. Связь между риском аномальной функции желудка и инфекцией Helicobacter pylori, оцененная с помощью ELISA и дыхательного теста с 14C-мочевиной.Диагностика Microbiol Infect Dis. 2014; 80: 316–320. [PubMed] [Google Scholar] 74. Макколл К.Э. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med. 2010; 362: 1597–1604. [PubMed] [Google Scholar] 75. Велайос Б., Фернандес-Салазар Л., Понс-Ренедо Ф., Муньос М.Ф., Альмарас А., Аллер Р., Руис Л., Дель Ольмо Л., Гисберт Дж. П., Гонсалес-Эрнандес Дж. М.. Точность дыхательной пробы мочевины, выполняемой сразу после экстренной эндоскопии при кровотечении из язвенной болезни. Dig Dis Sci. 2012; 57: 1880–1886. [PubMed] [Google Scholar] 76. Гварнер Дж., Калач Н., Элитсур Ю., Колецко С.Диагностические тесты Helicobacter pylori у детей: обзор литературы с 1999 по 2009 год. Eur J Pediatr. 2010; 169: 15–25. [PubMed] [Google Scholar] 77. Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN, Greiner W. Эффективность и рентабельность дыхательного теста с мочевиной 13C в качестве основного диагностического исследования для выявления инфекции Helicobacter pylori по сравнению с инвазивной и неинвазивной -инвазивные диагностические тесты. GMS Health Technol Assess. 2009; 5: Doc14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78.Гамлет А.К., Эрландссон К.И., Ольбе Л., Свеннерхольм А.М., Бакман В.Е., Петтерссон А.Б. Простой, быстрый и высоконадежный дыхательный тест с мочевиной 14C на основе капсул для диагностики инфекции Helicobacter pylori. Сканд Дж Гастроэнтерол. 1995; 30: 1058–1063. [PubMed] [Google Scholar] 79. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Превосходство некапсулированного дыхательного теста с 14С-мочевиной над методом на основе капсул для выявления инфекции Helicobacter pylori — предварительный отчет.Троп Гастроэнтерол. 2012; 33: 123–128. [PubMed] [Google Scholar] 80. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Сравнение инкапсулированного и неинкапсулированного (14) дыхательного теста с C-мочевиной для выявления инфекции Helicobacter pylori: сцинтиграфическое исследование. Helicobacter. 2014; 19: 116–123. [PubMed] [Google Scholar] 81. Gisbert JP, Pajares JM. Обзорная статья: Дыхательный тест на 13C-мочевину в диагностике инфекции Helicobacter pylori — критический обзор. Алимент Pharmacol Ther.2004. 20: 1001–1017. [PubMed] [Google Scholar] 82. Som S, Maity A, Banik GD, Ghosh C, Chaudhuri S, Daschakraborty SB, Ghosh S, Pradhan M. Кинетика экскреции дыхательного теста с мочевиной 13C: влияние выработки эндогенного CO2 и восстановления дозы на диагностическую точность инфекции Helicobacter pylori. Anal Bioanal Chem. 2014; 406: 5405–5412. [PubMed] [Google Scholar] 83. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ.Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 84. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori. Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 85. Кесли Р., Гоктюрк Х.С., Эрбайрак М., Карабаглы П., Терзи Ю. Сравнение диагностических значений трех различных тестов на антигены стула для неинвазивной диагностики инфекции Helicobacter pylori. J Investig Med.2010. 58: 982–986. [PubMed] [Google Scholar] 86. Okuda M, Osaki T, Kikuchi S, Ueda J, Lin Y, Yonezawa H, Maekawa K, Hojo F, Kamiya S, Fukuda Y. Оценка теста на антиген стула с использованием mAb для нативной каталазы для диагностики инфекции Helicobacter pylori у детей и взрослые. J Med Microbiol. 2014; 63: 1621–1625. [PubMed] [Google Scholar] 87. Осман Х.А., Хасан Х., Суппиан Р., Бахар Н., Хусин Н.С., Рахим А.А., Хассан С., Анди Д.З., Зилфалил Б.А. Оценка теста на антиген стула Atlas Helicobacter pylori для диагностики инфекции у взрослых пациентов.Азиатский Pac J Cancer Prev. 2014; 15: 5245–5247. [PubMed] [Google Scholar] 88. Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 89. Дегучи Р., Мацусима М., Сузуки Т., Майн Т., Фукуда Р., Нишина М., Одзава Х., Такаги А. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori после эрадикационной терапии.J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 90. Кальвет X, Ларио С., Рамирес-Лазаро М.Дж., Монтсеррат А., Кесада М., Ривз Л., Мастерс Х., Суарес-Ламас Д., Галлах М., Микель М. и др. Точность моноклональных тестов стула для определения излечения от инфекции Helicobacter pylori после лечения. Helicobacter. 2010; 15: 201–205. [PubMed] [Google Scholar] 91. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 92. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE. Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Чжоу X, Су Дж., Сюй Дж., Чжан Г. Точность теста на антиген стула для диагностики инфекции Helicobacter pylori у детей: метаанализ.Клин Рес Гепатол Гастроэнтерол. 2014; 38: 629–638. [PubMed] [Google Scholar] 94. Ли YC, Tseng PH, Liou JM, Chen MJ, Chen CC, Tu CH, Chiang TH, Chiu HM, Lai CF, Ho JC, et al. Проведение одноэтапного теста на основе образца фекалий для диагностики инфекции Helicobacter pylori в учреждениях первичной медико-санитарной помощи и массовых обследований. J Formos Med Assoc. 2014; 113: 899–907. [PubMed] [Google Scholar] 95. Okuda M, Osaki T, Lin Y, Yonezawa H, Maekawa K, Kamiya S, Fukuda Y, Kikuchi S. Низкая распространенность и частота инфекции Helicobacter pylori у детей: популяционное исследование в Японии.Helicobacter. 2015; 20: 133–138. [PubMed] [Google Scholar] 96. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 97. Choi J, Kim CH, Kim D, Chung SJ, Song JH, Kang JM, Yang JI, Park MJ, Kim YS, Yim JY и др. Проспективная оценка нового теста на антиген стула для обнаружения Helicobacter pylori в сравнении с гистологией, экспресс-тестом на уреазу, (13) дыхательным тестом на C-мочевину и серологией.J Gastroenterol Hepatol. 2011; 26: 1053–1059. [PubMed] [Google Scholar] 98. Demirtürk L, Yazgan Y, Tarçin O, Ozel M, Diler M, Oncül O, Yildirim S. Влияет ли N-ацетилцистеин на чувствительность и специфичность теста на антиген стула Helicobacter pylori? Helicobacter. 2003. 8: 120–123. [PubMed] [Google Scholar] 99. Inelmen EM, Gasparini G, Sergi G, Enzi G. Оценка Helicobacter pylori с помощью анализа стула на антиген у ослабленных пожилых пациентов. Сканд Дж Гастроэнтерол. 2005; 40: 794–799. [PubMed] [Google Scholar] 101.Ueda J, Okuda M, Nishiyama T., Lin Y, Fukuda Y, Kikuchi S. Диагностическая точность набора для тестирования сывороточных антител E-plate при обнаружении инфекции Helicobacter pylori среди японских детей. J Epidemiol. 2014; 24: 47–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Марчилдон П.А., Сугияма Т., Фукуда Ю., Пикок Дж. С., Асака М., Симояма Т., Грэм Д. Я. Оценка влияния вариации штамм-специфического антигена на точность серологической диагностики инфекции Helicobacter pylori. J Clin Microbiol. 2003. 41: 1480–1485.[Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Hoang TT, Wheeldon TU, Bengtsson C, Phung DC, Sörberg M, Granström M. Иммуноферментный анализ на Helicobacter pylori нуждается в корректировке для исследуемой популяции. J Clin Microbiol. 2004. 42: 627–630. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Khalifeh Gholi M, Kalali B, Formichella L, Göttner G, Shamsipour F, Zarnani AH, Hosseini M, Busch DH, Shirazi MH, Gerhard M. Helicobacter pylori FliD является высокочувствительным и специфическим маркером для серологической диагностики H.pylori. Int J Med Microbiol. 2013; 303: 618–623. [PubMed] [Google Scholar] 105. Формичелла Л., Ромберг Л., Больц С., Вьет М., Гепперт М., Гёттнер Г., Нёльтинг К., Вальтер Д., Шепп В., Шнайдер А. и др. Иммуноферментный анализ новой линии, основанный на рекомбинантных факторах вирулентности, позволяет проводить высокоспецифичную и чувствительную серологическую диагностику инфекции Helicobacter pylori. Clin Vaccine Immunol. 2013; 20: 1703–1710. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Пан KF, Formichella L, Zhang L, Zhang Y, Ma JL, Li ZX, Liu C, Wang YM, Goettner G, Ulm K, et al.Ответы антител против Helicobacter pylori и эволюция предраковых поражений желудка в китайской популяции. Int J Cancer. 2014; 134: 2118–2125. [PubMed] [Google Scholar] 107. Бурукоа С., Дельшер Дж. С., Курийон-Малле А., де Корвин Дж. Д., Мегро Ф., Зербиб Ф., Раймонд Дж., Фошер Дж. Л.. Сравнительная оценка 29 коммерческих серологических наборов Helicobacter pylori. Helicobacter. 2013; 18: 169–179. [PubMed] [Google Scholar] 108. Абнет СС, Чжэн В., Йе В., Камангар Ф., Джи Б.Т., Перссон С., Ян Джи, Ли Х.Л., Ротман Н., Шу ХО и др.Пепсиногены плазмы, антитела против Helicobacter pylori и риск рака желудка в когорте Шанхайского исследования здоровья женщин. Br J Рак. 2011; 104: 1511–1516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Ёсида Т., Като Дж., Иноуэ И., Ёсимура Н., Дегучи Х., Мукубаяси К., Ока М., Ватанабэ М., Эномото С., Нива Т. и др. Развитие рака на основе хронического активного гастрита и вызванной им атрофии желудка, что оценивается по уровням пепсиногена в сыворотке крови и титру антител к Helicobacter pylori. Int J Cancer.2014; 134: 1445–1457. [PubMed] [Google Scholar] 110. Ханэда М., Като М., Исигаки С., Судзуки М., Такахаши М., Накагава М., Оно С., Мори И., Мабе К., Накагава С. и др. Идентификация группы высокого риска рака желудка с использованием сывороточного пепсиногена после успешной ликвидации Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 78–83. [PubMed] [Google Scholar] 111. McNicholl AG, Forné M, Barrio J, De la Coba C, González B, Rivera R, Esteve M, Fernandez-Bañares F, Madrigal B, Gras-Miralles B и др. Точность GastroPanel в диагностике атрофического гастрита.Eur J Gastroenterol Hepatol. 2014; 26: 941–948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Шиката К., Ниномия Т., Йонемото К., Икеда Ф., Хата Дж., Дой Й, Фукухара М., Мацумото Т., Иида М., Китазоно Т. и др. Оптимальное пороговое значение уровня пепсиногена в сыворотке для прогнозирования заболеваемости раком желудка: исследование Хисаяма. Сканд Дж Гастроэнтерол. 2012; 47: 669–675. [PubMed] [Google Scholar] 113. Карами Н., Талебхан Й., Сабери С., Эсмаили М., Огалайе А., Абдирад А., Мостафави Е., Хоссейни М.Э., Мохагеги М.А., Мохаммади М.Серореактивность к антигенам Helicobacter pylori как индикатор риска рака желудка. Азиатский Pac J Cancer Prev. 2013; 14: 1813–1817. [PubMed] [Google Scholar] 114. Zhao Z, Li Y, Liu S, Fu W. Сывороточные антитела Helicobacter pylori CagA нельзя использовать в качестве онкомаркера для диагностики рака желудка в странах Восточной Азии. Tumor Biol. 2014; 35: 12217–12224. [PubMed] [Google Scholar] 115. Мухсен К., Атхамна А., Атхамна М., Спунгин-Бялик А., Коэн Д. Оценка иммуноферментного анализа мочи для выявления инфекции Helicobacter pylori среди здоровых детей израильских арабов от 3 до 5 лет.J Pediatr Gastroenterol Nutr. 2006; 43: 398–401. [PubMed] [Google Scholar] 116. Окуда М., Камия С., Книга М., Кикучи С., Осаки Т., Хиватани Т., Маекава К., Фукуда Ю. Диагностическая точность наборов на основе мочи для обнаружения антител к Helicobacter pylori у детей. Pediatr Int. 2013; 55: 337–341. [PubMed] [Google Scholar] 117. Луцца Ф., Именео М., Мараско А., Кротта С., Иерарди Е., Усай П., Вирджилио С., Нардоне Г., Марчи С., Санна Г. и др. Оценка коммерческого серологического набора для определения иммуноглобулина G в слюне к Helicobacter pylori: многоцентровое исследование.Eur J Gastroenterol Hepatol. 2000; 12: 1117–1120. [PubMed] [Google Scholar] 118. Ян Б.Л., Йе Ц., Квонг В.Г., Ли С.Д. Новый одноэтапный тест на антиген слюны Helicobacter pylori. J Chin Med Assoc. 2015; 78: 96–100. [PubMed] [Google Scholar] 119. Брейден Б. Диагностика инфекции Helicobacter pylori. BMJ. 2012; 344: e828. [PubMed] [Google Scholar] 120. Сичински Л.А., Корреа П., Браво Л.Е., Пик Р.М., Уилсон К.Т., Ло Дж. Т., Йепез М.С., Голд Б.Д., Томпсон Д.Т., Обложка Т.Л. и др. Неинвазивное генотипирование Helicobacter pylori cagA, vacA и hopQ у бессимптомных детей.Helicobacter. 2012; 17: 96–106. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Xiong LJ, Tong Y, Wang Z, Mao M. Выявление устойчивой к кларитромицину Helicobacter pylori с помощью ПЦР стула у детей: всесторонний обзор литературы. Helicobacter. 2013; 18: 89–101. [PubMed] [Google Scholar] 122. Ананд П.С., Камат К.П., Анил С. Роль зубного налета, слюны и заболеваний пародонта в инфекции Helicobacter pylori. Мир Дж. Гастроэнтерол. 2014; 20: 5639–5653. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123.Огая Ю., Номура Р., Ватанабе Ю., Накано К. Обнаружение ДНК Helicobacter pylori в образцах воспаленной пульпы зуба от японских детей и подростков. J Med Microbiol. 2015; 64: 117–123. [PubMed] [Google Scholar] 124. Amiri N, Abiri R, Eyvazi M, Zolfaghari MR, Alvandi A. Частота Helicobacter pylori в зубном налете, возможно, недооценена. Arch Oral Biol. 2015; 60: 782–788. [PubMed] [Google Scholar] 125. Чой Й.Дж., Ким Н., Лим Дж., Чо Си, Шин СМ, Ли Х.С., Ли Ш., Пак Й.С., Хван Дж. Х., Ким Дж. У. и др.Точность диагностических тестов на Helicobacter pylori у больных с кровотечением из язвенной болезни. Helicobacter. 2012; 17: 77–85. [PubMed] [Google Scholar] 126. Ло С.К., Лай К.Х., Пэн Нью-Джерси, Ло Г.Х., Ценг Х.Х., Лин С.К., Ши С.Б., Ву С.М., Чен Ю.С., Хуанг В.К. и др. Полимеразная цепная реакция: чувствительный метод выявления инфекции Helicobacter pylori при кровоточащих пептических язвах. Мир Дж. Гастроэнтерол. 2005; 11: 3909–3914. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Рамирес-Лазаро М.Дж., Ларио С., Казалотс А., Санфелиу Э, Бойкс Л., Гарсиа-Иглесиас П., Санчес-Дельгадо Д., Монтсеррат А., Белла-Куэто М. Р., Галлах М. и др.ПЦР в реальном времени улучшает обнаружение Helicobacter pylori у пациентов с кровотечением из язвенной болезни. PLoS One. 2011; 6: e20009. [Бесплатная статья PMC] [PubMed] [Google Scholar] 128. Баркун А.Н., Барду М., Койперс Э.Дж., Сунг Дж., Хант Р.Х., Мартель М., Синклер П. Рекомендации международного консенсуса по ведению пациентов с кровотечением из неварикозно-верхних отделов желудочно-кишечного тракта. Ann Intern Med. 2010. 152: 101–113. [PubMed] [Google Scholar] 129. Санчес-Дельгадо Дж., Джене Э, Суарес Д., Гарсия-Иглесиас П., Брюлле Э, Галлах М., Феу Ф, Гисберт Дж. П., Кальвет X.Была ли недооценена распространенность H. pylori при кровоточащей язвенной болезни? Мета-регресс. Am J Gastroenterol. 2011; 106: 398–405. [PubMed] [Google Scholar] 130. Kim JJ, Lee JS, Olafsson S, Laine L. Низкая приверженность к тестированию на Helicobacter pylori у госпитализированных пациентов с кровоточащей язвенной болезнью. Helicobacter. 2014; 19: 98–104. [PubMed] [Google Scholar] 131. Тянь XY, Чжу Х, Чжао Дж, Ше Кью, Чжан Джи. Диагностическая эффективность дыхательного теста на мочевину, экспресс-теста на мочевину и гистологии инфекции Helicobacter pylori у пациентов с частичной гастрэктомией: метаанализ.J Clin Gastroenterol. 2012; 46: 285–292. [PubMed] [Google Scholar] 132. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале — надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка. J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 133. Варди Дж., Шалев Т., Шевах О., Боаз М., Авни Ю., Ширин Х. Быстрый дыхательный тест на 13C-мочевину в непрерывном режиме в реальном времени для обнаружения Helicobacter pylori у пациентов после частичной гастрэктомии.J Clin Gastroenterol. 2012; 46: 293–296. [PubMed] [Google Scholar] 134. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Yoon H, Shin CM, Park YS, Lee DH. Диагностическая валидность дыхательного теста (13) c-мочевины у пациентов, подвергшихся гастрэктомии: ретроспективное когортное исследование одного третичного центра. J Cancer Prev. 2014; 19: 309–317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 135. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Hwang JJ, Lee HJ, Lee A, Jeong YS, Oh S и др. Диагностическая ценность теста на выдыхание C-мочевины без лимонной кислоты в высоких дозах (13) после эрадикации Helicobacter pylori в Корее.Helicobacter. 2015; 20: 159–168. [PubMed] [Google Scholar] 136. Patel SK, Mishra GN, Pratap CB, Jain AK, Nath G. Helicobacter pylori не искореняется после тройной терапии: исследование на основе вложенной ПЦР. Biomed Res Int. 2014; 2014: 483136. [Бесплатная статья PMC] [PubMed] [Google Scholar]Диагностика инфекции Helicobacter pylori: текущие возможности и разработки
World J Gastroenterol. 2015 окт 28; 21 (40): 11221–11235.
Яо-Куанг Ван, Отделение внутренней медицины, Городская больница Сяо-Канг Гаосюн, Гаосюн 812, Тайвань
Яо-Куанг Ван, Чунг-Юнг Лю, Мэн-Чие Ву, Сян-Яо Ши, Софи С.В. Ван, Дженг -Yih Wu, Chao-Hung Kuo, Deng-Chyang Wu, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, Гаосюн 807, Тайвань
Fu-Chen Kuo, школа медицины, медицинский колледж, E-Da Больница, Университет И-Шоу, Гаосюн 824, Тайвань
Мэн-Чи Ву, Сян-Яо Ши, Дэн-Чьянг Ву, Отделение внутренней медицины, Городская больница Та-Тунг Гаосюна, Гаосюн 801, Тайвань
Софи С.В. Ван, Чао-Хун Куо, Дэн-Чьянг Ву, Рак для исследования стволовых клеток, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Софи С.В. Ван, Дэн-Чьянг Ву, Центр исследований инфекционных заболеваний и рака, Медицинский университет Гаосюн, Гаосюн 807, Тайвань
Яо-Кан Хуанг, отдел гастрономии энтерология, отделение внутренней медицины, больница Тен Чан, Чун-Ли, Таоюань 320, Тайвань
Вклад авторов: Ван ЮК написал эту рукопись; Kuo FC, Liu CJ, Wu MC, Shih HY, Wang SSW, Wu JY и Kuo CH разработали исследования; Хуан Ю.К. и Ву Д.К. полировали бумагу; Хуан Ю.К. и Ву Д.К. в равной степени внесли свой вклад в эту рукопись.Для корреспонденции: Deng-Chyang Wu, MD, PhD, отделение гастроэнтерологии, отделение внутренней медицины, больница медицинского университета Гаосюн, 100 Tz-You 1st road, Kaohsiung 807, Taiwan. moc.oohay@uwhced
Телефон: + 886-7-3121101-7451 Факс: + 886-7-3135612
Поступила в редакцию 29 апреля 2015 г .; Пересмотрено 6 августа 2015 г .; Принято, 2015 г. 28 сентября.
Авторские права © Автор (ы) 2015 г. Опубликовано Baishideng Publishing Group Inc. Все права защищены. Эта статья цитируется в других статьях PMC.Реферат
Точная диагностика инфекции Helicobacter pylori (H. pylori) — важнейшая составляющая эффективного лечения многих гастродуоденальных заболеваний. Для обнаружения H. pylori доступно несколько инвазивных и неинвазивных диагностических тестов, и каждый тест имеет свою полезность и ограничения в различных клинических ситуациях. Хотя ни один из них не может считаться единственным золотым стандартом в клинической практике, было разработано несколько методов, позволяющих получить более надежные результаты.Инвазивные тесты выполняются с помощью образцов эндоскопической биопсии, и эти тесты включают гистологию, посев, экспресс-тест на уреазу, а также молекулярные методы. Развитие эндоскопического оборудования также способствует диагностике H. pylori в режиме реального времени во время эндоскопии. Дыхательный тест на мочевину и тест на антиген стула являются наиболее широко используемыми неинвазивными тестами, в то время как серология полезна в скрининговых и эпидемиологических исследованиях. Молекулярные методы использовались в различных образцах, кроме слизистой оболочки желудка.Помимо выявления инфекции H. pylori , несколько тестов используются для оценки факторов вирулентности и чувствительности к антибиотикам H. pylori , а также для скрининга предраковых поражений и рака желудка. Целью этой статьи является обзор текущих возможностей и новых разработок диагностических тестов и их применения в различных клинических условиях или для конкретных целей.
Ключевые слова: Helicobacter pylori , Диагностика, Инвазивный, Неинвазивный, Пероральный образец, Кровотечение, Гастрэктомия, Искоренение
Основной наконечник: В настоящее время доступны несколько тестов для диагностики Helicobacter pylori (H. pylori ).pylori ) инфекция. В этом обзоре мы сосредоточимся на полезности и ограничениях современных диагностических методов, а также на последних разработках этих тестов, которые способствуют повышению диагностической точности. Кроме того, мы также подчеркиваем обнаружение H. pylori в образцах из полости рта и у пациентов с различными клиническими обстоятельствами, включая кровотечение, постгастрэктомию и постэрадикационную терапию.
ВВЕДЕНИЕ
Helicobacter pylori ( H.pylori ) является грамотрицательным микроаэробным патогеном человека, а инфекция H. pylori тесно связана со многими гастродуоденальными заболеваниями, включая хронический активный гастрит, язвенную болезнь, атрофический гастрит, лимфому лимфоидной ткани слизистой оболочки (MALT) и некардиальный рак желудка. . Инфекция H. pylori поражает более половины взрослого населения во всем мире, но распространенность инфекции H. pylori широко варьируется в зависимости от географического региона, возраста, расы и социально-экономического статуса.Обычно распространенность инфекции H. pylori увеличивается с возрастом в большинстве стран, однако в последние десятилетия при анализе временных тенденций в нескольких крупных популяциях наблюдалось снижение распространенности инфекции H. pylori [1]. Более 80% язвенной болезни вызывается инфекцией H. pylori , а предполагаемый риск развития язвенной болезни в течение жизни у пациентов, инфицированных H. pylori , составляет примерно 15% [2]. Рак желудка является третьей по значимости причиной смерти от рака во всем мире, а случаев H.pylori является причиной 74,7% всех случаев некардиального рака желудка [3,4]. Рак желудка и язвенная болезнь вместе вызывают более миллиона смертей в год в мире, и инфекция H. pylori всегда является важной проблемой для здоровья [5]. Для выявления инфекции H. pylori разработаны различные диагностические методы, и диагностические тесты с высокой чувствительностью и специфичностью, превышающей 90%, необходимы для точной диагностики инфекции H. pylori в клинической практике.Хотя сейчас доступно множество диагностических тестов, каждый метод имеет свои преимущества, недостатки и ограничения. Выбор того или иного метода может зависеть от наличия и доступности диагностических тестов, уровня лабораторий, клинического состояния пациентов и отношения вероятности положительных и отрицательных тестов при различных клинических обстоятельствах. Диагностические тесты обычно делятся на инвазивные (эндоскопические) и неинвазивные методы. Инвазивные диагностические тесты включают эндоскопическое изображение, гистологию, экспресс-тест на уреазу, культивирование и молекулярные методы.Неинвазивные диагностические тесты включали дыхательный тест на мочевину, тест на антиген стула, серологические и молекулярные исследования. В данной статье мы кратко рассмотрим текущие варианты и разработки диагностических тестов и связанных с ними приложений в клинической практике, а также выбор диагностических тестов для различных клинических состояний (таблица).
Таблица 1
Варианты диагностики инфекции Helicobacter pylori при различных клинических обстоятельствах и особые применения диагностических тестов
| Гастродуоденальное кровотечение | Постэктомия | Постэктомия | Особые области применения | |||||||||
| Экспресс-тест на уреазу | √ | |||||||||||
| Гистология | √ | |||||||||||
| Культура | Антибиотическая цепьАнтибиотическая цепь реакция | √ | √ | √Чувствительность к антибиотикам 287 | √ | |||||||
| Серология 1 | √ | √ | √ | √ Факторы вирулентности |
.pylori
-ассоциированные заболевания, такие как язвенная болезнь, атрофический гастрит, MALT-лимфома и рак желудка. Эндоскопия также является инструментом, обычно используемым для получения образцов, обычно слизистой оболочки желудка из биопсии, для дальнейших исследований других инвазивных тестов, включая экспресс-тест на уреазу, гистологию, посев и молекулярные методы. Антрум является предпочтительным местом биопсии для выявления инфекции H. pylori в большинстве случаев, но для избежания ложноотрицательных результатов пациентам с антральной атрофией или кишечной метаплазией предлагается биопсия тела по большей кривой [6,7].Неравномерное распределение H. pylori в желудке в различных клинических условиях неизбежно приводит к ошибкам отбора проб при исследованиях на основе биопсии, и было сделано несколько попыток диагностики инфекции H. pylori в режиме реального времени во время эндоскопического исследования.Большинство признаков слизистой оболочки желудка, таких как покраснение, отек слизистой оболочки или узелковое изменение, при обычной эндоскопии недостаточно специфичны для диагностики инфекции H. pylori и не имеют большого значения для точного диагноза [8].Хотя тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может повысить точность диагностики, но это может занять много времени и не дать лучших результатов, чем другие инвазивные тесты [9]. В дополнение к традиционной эндоскопии, хромоэндоскопия с феноловым красным также была оценена для диагностики инфекции H. pylori на основе специфической уреазной активности H. pylori . Однако этот метод не является надежным тестом из-за его низкой чувствительности (73% -81%) и низкой специфичности (76% -81%) [10,11].Эндоскопия с увеличением обеспечивает прямое наблюдение микроструктуры поверхности слизистой оболочки желудка, а эндоскопические изображения слизистой оболочки с высоким разрешением тесно связаны с гистопатологическими изменениями, включая инфекцию H. pylori . Чувствительность и специфичность для прогнозирования телесного гастрита с положительным результатом на H. pylori с помощью увеличительной эндоскопии с окрашиванием индигокармином составили 97,6% и 100% соответственно. Однако чувствительность и специфичность снизились до 88.4% и 75,0% соответственно у H. pylori -положительного антрального гастрита [12]. Конфокальная лазерная эндомикроскопия (CLE) — это еще один увеличительный эндоскопический метод, который обеспечивает подповерхностный анализ и in vivo, гистологическое исследование слизистой оболочки желудка во время эндоскопии. Три характеристики, включая белые пятна, нейтрофилы и микроабсцессы, основанные на данных CLE, были использованы для диагностики H. pylori , а точность, чувствительность и специфичность составили 92,8%, 89,2% и 95,7% соответственно [13].Увеличивающая узкополосная визуализация и I-сканирование также использовались для обнаружения инфекции H. pylori , но были представлены различные результаты [14–16]. Различные классификации характеристик изображений от увеличительной эндоскопии обеспечивают различную диагностическую точность, а точность эндоскопического теста также зависит от оператора, что означает, что его использование требует процесса обучения со стороны опытного супервизора и наличия оборудования от местного отделения эндоскопии [17-20]. Более того, тщательное обследование с использованием увеличения с использованием метода улучшения изображения или без него также требует много времени и может причинить больший дискомфорт пациенту, чем другие тесты на основе биопсии.Эти факторы обычно ограничивают клиническое использование увеличительной эндоскопии для выявления инфекции H. pylori в повседневной практике.
Гистология
Гистология обычно считается золотым стандартом при прямом обнаружении инфекции H. pylori , а также первым методом, используемым для обнаружения H. pylori . Однако на диагностическую точность гистологии влияет несколько факторов, таких как место, размер и количество биопсий, методы окрашивания, ингибитор протонной помпы (ИПП), антибиотики и опыт исследующего патолога.Использование ИПП может привести к противоречивым результатам гистологического исследования, поэтому рекомендуется отменить ИПП за 2 недели до проведения гистологического исследования [21]. Дополнительные образцы биопсии, собранные в соответствующем месте для анализа, могут уменьшить количество ошибок выборки и ложноотрицательных результатов в гистологическом тесте, а также в других тестах, основанных на биопсии. В клинической практике обычно рекомендуются биопсии как антрального отдела, так и тела, и получение как минимум двух биоптатов из антрального отдела и тела является наиболее разумной стратегией, гарантирующей максимальный диагностический результат [22,23].Как упоминалось выше, биопсия тела важна для диагностики H. pylori . на фоне атрофического гастрита [7].
Окрашивание является важной частью гистологического исследования, и несколько красок, таких как обычное окрашивание HE, окраска по Гимзе, Вартина-Старри, Hp серебром, толуидиновым синим, акридиновым оранжевым, Макмалленом, Гента, Дитерле и иммуногистохимическим окрашиванием, были использованы для обнаружения H pylori . Хотя иммуногистохимическое окрашивание является наиболее чувствительным и специфическим красителем, окрашивания HE обычно достаточно для диагностики H.pylori в повседневной клинической практике. Дополнительное окрашивание обычно рекомендуется для образцов биопсии, которые выявляют умеренный или тяжелый хронический гастрит, но не H. pylori , идентифицированные при окрашивании HE. Кроме того, иммуногистохимическое окрашивание должно быть первым выбором, если решено использовать вспомогательное окрашивание для обнаружения H. pylori [24,25]. Если иммуногистохимические окрашивания недоступны, окрашивание по Гимзе является предпочтительным методом в клинической практике, поскольку оно простое, высокочувствительное и менее затратное [26].
Пептидная флуоресцентная нуклеиновая кислота in situ Гибридизация (PNA-FISH), которую можно использовать на гистологических препаратах, является высокочувствительным (чувствительность 97%) и специфическим (специфичность 100%) методом диагностики H. pylori. инфекция. PNA-FISH может идентифицировать кокковидную форму H. pylori , которую обычно невозможно обнаружить при рутинном гистологическом исследовании, поскольку этот метод позволяет избежать индивидуальной предвзятости от морфологической идентификации. Кроме того, PNA-FISH — это быстрый, точный и экономичный метод обнаружения H.pylori устойчивость к кларитромицину в образцах биопсии желудка [27–29]. FISH также может сыграть потенциальную роль в обнаружении H. pylori в пробах окружающей среды, и дальнейшие исследования передачи и резервуаров H. pylori в окружающей среде могут быть проведены с использованием FISH [30,31]. Несмотря на преимущества обнаружения H. pylori и устойчивости к кларитромицину одновременно, недостатки PNA-FISH, такие как трудоемкая подготовка, требующая флуоресцентного микроскопа и специальных знаний для чтения слайдов, могут ограничивать широкое использование этого метода. .
БЫСТРЫЕ ИСПЫТАНИЯ МОЧЕИ
Для повседневной клинической практики экспресс-тест на уреазу (RUT) является наиболее полезным инвазивным тестом для диагностики инфекции H. pylori , поскольку он недорогой, быстрый, простой в выполнении, высокоспецифичный и широко доступный . Основываясь на активности фермента уреазы H. pylori , присутствие H. pylori в образце биопсии превращает реагент теста мочевины в аммиак, что приводит к увеличению pH и изменению цвета на мониторе pH.В настоящее время доступны несколько коммерческих тестов на уреазу, включая тесты на геле (CLOtest, HpFast), бумажные тесты (PyloriTek, ProntoDry) и тесты на жидкой основе (UFT300, EndoscHp), а различные коммерческие тестовые тестеры имеют разное время реакции для получения результатов. CLOtest обычно занимает 24 часа, чтобы получить точный результат, тогда как PyloriTek занимает 1 час, а UFT 300 — 5 минут, чтобы обеспечить более быстрые результаты. Считывание тестов на уреазу раньше рекомендованного времени может привести к ложноотрицательным результатам [32]. Помимо дизайна коммерческих наборов, плотность бактерий, присутствующих в образце биопсии, также влияет на время реакции и диагностическую точность RUT, в то время как для получения положительного результата RUT обычно требуется минимум 10000 организмов.Другие факторы, влияющие на диагностическую точность тестов на уреазу, включают антагонисты рецепторов H 2 , ИПП, соединения висмута, антибиотики, ахлоргидрию и наличие крови, все из которых увеличивают вероятность ложноотрицательных результатов. Кроме того, контаминация биоптатов формалином также снижает чувствительность RUT [21,33-35].
Обычно коммерческие экспресс-тесты на уреазу имеют специфичность выше 95% -100% и чувствительность выше 85% -95%. Увеличение количества биопсий антрального отдела желудка может повысить чувствительность RUT, и образцы двойной биопсии из тела желудка и антрального отдела предпочтительнее, чем образцы биопсии только антрального отдела желудка, поскольку дополнительная биопсия тела увеличивает диагностическую точность и позволяет избежать систематической ошибки выборки из-за неравномерного распределения H.pylori в желудке. Более того, объединение образцов антрального отдела и тела перед RUT, а не отдельных образцов, также увеличило чувствительность RUT и ускорило время реакции [32,36-39]. Перед RUT рекомендуется избегать приема лекарств, влияющих на активность уреазы, а плотность бактерий — для уменьшения ложноотрицательных результатов, например, 2 недели для ИПП и 4 недели для антибиотиков. Кровотечение значительно снижает чувствительность и специфичность RUT и делает RUT более ненадежным тестом, чем другие тесты в этом клиническом состоянии [40].В исследовании, посвященном оценке влияния различного количества и места биопсии на результаты RUT у пациентов с кровотечением из язвенной болезни, было показано, что четыре биопсии из антрального отдела или одна биопсия из тела увеличивают чувствительность RUT по сравнению с только одной биопсией из антрального отдела. В этом исследовании чувствительность одной биопсии антрального отдела составила 64%, тогда как чувствительность четырех биопсий антрального отдела и одной биопсии тела составила 74% и 73% соответственно [41]. Если для пациента с желудочно-кишечным кровотечением по-прежнему выбирается RUT, для повышения точности диагностики предлагалось выполнить биопсию как антрального отдела, так и тела.
Культура
Культивирование H. pylori из образца биопсии желудка — высокоспецифичный, но менее чувствительный метод. В целом, культивирование имеет почти 100% специфичность, но чувствительность культуры значительно варьируется, от 85% до 95%. Из-за деликатной и требовательной природы H. pylori для культивирования in vitro требуется определенная транспортная среда, среда для выращивания и среда для инкубации. Образцы биопсии можно хранить в транспортной среде, такой как Portagerm pylori или транспортная среда Стюарта, до 24 часов при 4 ° C.Для культивирования можно использовать несколько типов агара, поскольку H. pylori выделены. Обычно используемые среды включают агар Pylori, агар Скирроу, кровяной агар Columbia, агар Brucella, инфузию сердца мозга или соевый агар с триптиказой, дополненный кровью овцы или лошади. Чашки с агаром обычно инкубируют в микроаэробной среде (80-90% N 2 , 5-10% CO 2 , 5-10% O 2 ) при температуре от 35 до 37 ° C в течение не менее 5-7 дней, потому что H. pylori считается микроаэрофилом.Однако недавнее исследование показало, что росту H. pylori способствует уровень кислорода в атмосфере с присутствием 10% CO 2 , в результате чего появилась новая концепция, согласно которой H. pylori может быть капногильным аэробом [42]. Диагностика H. pylori из культуральной среды основана на морфологических характеристиках, а также положительных реакциях на уреазу, каталазу и оксидазу, что означает, что микробиологические лаборатории должны быть оборудованы и обучены для выделения этой бактерии.
Такие условия, как низкое качество образцов, отложенная транспортировка, воздействие аэробной среды или неопытного микробиолога, оказывают неблагоприятное влияние на производительность посева и снижают диагностическую точность [43].Недавнее исследование, проведенное в 26 больницах для анализа влияния времени транспортировки, а также температуры на скорость культивирования, показало, что положительная скорость культивирования снизилась до 26,3% в 48-часовой транспортной группе по сравнению с 32,8% в 24-часовой транспортной группе ( P <0,001 ). Это исследование также показало, что средняя температура повысилась с 4,7 ° C до 29,1 ° C во время транспортировки, что привело к снижению уровня положительных культур с 36,7% до 24,1% [44]. Недавнее развитие транспортной среды - это новая транспортная среда, транспортная среда GESA.Транспортная среда GESA представляет собой полутвердую среду, в которой образцы биопсии желудка могут храниться при 4 ° C в течение до 10 дней и обеспечивать поддающуюся количественной оценке степень восстановления H. pylori (90,7%) [45]. Для культивирования H. pylori в биопсии желудка был также разработан новый двухфазный тест, который сочетал селективный обогащающий бульон и биохимический тест с использованием агара с мочевиной в одном сосуде. В этом небольшом исследовании двухфазный тест был проведен на 55 образцах биопсии и показал 100% положительный прогностический клапан после 48 часов инкубации.Более того, этот метод имел более низкую частоту ложноположительных результатов и требовал более низкой бактериальной нагрузки, примерно 10 5 КОЕ / мл, по сравнению с CLOtest. В то же время этот тест можно было использовать в аэробных условиях и позволять культивирование, а также тестирование чувствительности к антибиотикам [46].
Факторы-хозяева, такие как высокая активность гастрита, низкая бактериальная нагрузка, кровотечение, употребление алкоголя и употребление H 2 — антагонистов рецепторов, ИПП, антибиотиков, оказывают отрицательное влияние на положительный результат посева.Эти препараты, за исключением антибиотиков, которых следует избегать по крайней мере за 4 недели, также рекомендуется избегать за 2 недели до посева. Чтобы избежать систематической ошибки при выборке из-за неоднородного распределения H. pylori в желудке, было рекомендовано как минимум 2 образца биопсии из антрального отдела и 2 образца биопсии из тела [47,48].
Хотя посев — трудоемкий, дорогой и трудоемкий тест для диагностики H. pylori , тест на чувствительность к антибиотикам H. pylori , полученный с помощью посева, является особым преимуществом в клинической практике.В соответствии с рекомендациями консенсусного отчета Маастрихт IV, культура H. pylori и определение чувствительности к антибиотикам следует проводить, если первичная резистентность к кларитромицину превышает 20% в данном географическом районе или после неэффективности лечения препаратами второй линии [21]. Кроме того, культивирование также позволяет изолировать H. pylori для дальнейшего анализа фенотипических и генотипических характеристик, чтобы лучше понять патогены и, следовательно, предложить оценку терапии.С ростом распространенности устойчивости к антибиотикам культивирование по-прежнему остается надежным методом лечения неэффективности лечения H. pylori , а также изучения устойчивости к антибиотикам в популяционных исследованиях до того, как другие молекулярные тесты станут более доступными.
Полимеразная цепная реакция
С момента применения полимеразной цепной реакции (ПЦР) для обнаружения инфекции H. pylori , ПЦР широко использовалась для диагностики H. pylori из образцов биопсии желудка, слюны, стула, желудочного сока. сок и разные экземпляры.ПЦР обеспечивает превосходную чувствительность и специфичность, превышающую 95%, по сравнению с другими традиционными тестами и дает более точные результаты обнаружения H. pylori у пациентов с кровотечением. Несколько генов-мишеней, включая UreA , glmM , UreC , 16S рРНК , 23S рРНК , HSP60 и VacA , были использованы для обнаружения H. различные консервативные гены-мишени могут повысить специфичность, что, в свою очередь, позволяет избежать ложноположительных результатов, особенно для образцов, отличных от образцов биопсии желудка.Другие преимущества ПЦР, в том числе меньшее количество бактерий, требуемых в образце, более быстрые результаты и отсутствие необходимости в специальных материалах для обработки или транспортировке, позволяют врачам принимать более быстрое и точное решение о лечении пациента. Кроме того, ПЦР также позволяет одновременно обнаруживать специфические мутации, приводящие к устойчивости к антибиотикам, такие как устойчивость к макролидам и фторхинолонам, и факторы вирулентности, такие как CagA и VacA [49-51].
По сравнению с методом разведения в агаре (Etest), который обычно считается золотым стандартом теста на чувствительность к антибиотикам, ПЦР в реальном времени (RT-PCR) имеет несколько преимуществ.Во-первых, использование фиксированной формальдегидом залитой парафином ткани желудка в ПЦР-тесте более удобно, быстро и чувствительно, чем использование свежего биоптата в Etest, более того, в этих условиях RT-PCR также показала не худшие результаты тестирования чувствительности к антибиотикам, чем Etest. Кроме того, ПЦР более надежна для выявления гетерорезистентного статуса, который часто приводит к ложноотрицательному результату в Etest, следовательно, ПЦР может предоставить более точную информацию для клиницистов перед началом лечения антибиотиками [52].В недавнем исследовании, в котором использовалась ОТ-ПЦР в фиксированных формалином и залитых парафином образцах для выявления инфекции H. pylori и ассоциированного статуса устойчивости к кларитромицину, изучалась эффективность четырехкомпонентной терапии на основе генотипической резистентности в качестве лечения первой линии для 385 пациентов с функциональная диспепсия. В этом исследовании у 136 пациентов (35,3%) была диагностирована инфекция H. pylori , а чувствительность ОТ-ПЦР и гистологического исследования составила 95,6% и 69,9% соответственно.Четырехкратная терапия цитратом калия висмута, рабепразолом, амоксициллином и кларитромицином использовалась для генотипически чувствительных пациентов, в отличие от генотипически резистентных пациентов лечили цитратом висмута калия, рабепразолом, амоксициллином и фуразолидоном. Авторы обнаружили, что уровень эрадикации составил 100% для пациентов с чувствительным к кларитромицину H. pylori и 94% для пациентов с устойчивым к кларитромицину H. pylori соответственно для анализа по протоколу [53].Во-вторых, ОТ-ПЦР также является удобным методом эпидемиологического исследования региональной степени устойчивости к антибиотикам в качестве руководства для эмпирического лечения первой линии. Кроме того, ОТ-ПЦР может обнаруживать точечные мутации, которые вызывают устойчивость к антибиотикам, а также обнаруживать изменение точечной мутации или появление новой мутации, что дает дополнительную информацию для эпидемиологических и молекулярных исследований взаимосвязи генотип-фенотип. Из-за возможного изменения мутаций, которые вызывают устойчивость к антибиотикам со временем, определение более 5 точечных мутаций при использовании методов на основе ПЦР важно для достижения хорошей точности при обнаружении устойчивости к антибиотикам [54-56].
Были описаны генетические мутации, вызывающие устойчивость к кларитромицину (23S рРНК), хинолонам ( gyrA ген), тетрациклину (16S рРНК), рифабутину ( rpoB ген) и амоксициллину ( pbp-1a в предыдущем гене). исследования и несколько коммерческих наборов, таких как набор MutaREAL H. pylori , анализ ПЦР в реальном времени ClariRes и система обнаружения АПФ Seeplex ClaR- H. pylori [57]. Однако точный механизм устойчивости к метронидазолу менее ясен, и гены восприимчивости, такие как rdxA и frxA, участвовали в предыдущих исследованиях с спорными результатами.Недавнее исследование с использованием секвенирования нового поколения Illumina для поиска мутаций-кандидатов на устойчивость к метронидазолу. Это исследование подтвердило, что мутации в гене rdxA играют основную роль в устойчивости к метронидазолу у H. pylori , а мутации в гене frxA могут усиливать устойчивость к метронидазолу только при наличии мутаций rdxA. Кроме того, новое открытие мутаций в гене rpsU может сыграть роль в устойчивости к метронидазолу для объяснения устойчивых к метронидазолу штаммов без мутаций в генах rdxA и frxA [58].Анализ GenoType HelicoDR — это молекулярный тест, сочетающий ПЦР и гибридизацию, позволяющий провести молекулярную дефекацию H. pylori , а также устойчивость к кларитромицину и фторхинолонам в течение 6 часов. В предыдущих исследованиях анализ GenoType HelicoDR с использованием штаммов бактерий или образцов биопсии желудка был высокоточным для устойчивости к кларитромицину с чувствительностью 94–100% и специфичностью 86–99% соответственно; Анализ GenoType HelicoDR также точен для устойчивости к фторхинолонам с чувствительностью 83% -87% и 95% -98.Специфичность 5% соответственно по сравнению с методом на основе культуры [59,60]. Однако недавнее исследование по оценке клинической применимости GenoType HelicoDR в Корее показало, что чувствительность и специфичность в отношении устойчивости к кларитромицину составляли только 55,0% и 80,0% соответственно. GenoType HelicoDR также не был точным для устойчивости к фторхинолонам, показывая чувствительность и специфичность 74,4% и 70,0% соответственно. Клиническая применимость GenoType HelicoDR для определения устойчивости к антибиотикам может иметь некоторые ограничения, которые требуют дальнейшего изучения [61].ОТ-ПЦР обычно используется для количественного определения ДНК H. pylori в образцах биопсии, но выполнение ОТ-ПЦР может быть проблемой для клинических лабораторий из-за дорогостоящих термоциклеров. Мультиплексная ПЦР на основе двойного примирования олигонуклеотидов (DPO) была разработана для обнаружения инфекции H. pylori и устойчивости к кларитромицину, и этот тест можно проводить в любом стандартном термоциклере, который стоит меньше, чем RT-PCR. Благодаря особой конструкции праймера DPO для амплификации рДНК H. pylori 23S и обнаружения наиболее распространенных мутаций, A2142G и A2143G, придающих устойчивость к кларитромицину, DPO-PCR оказалась быстрой и точной для H.pylori диагностика и определение чувствительности к кларитромицину с помощью биоптатов желудка [62,63]. Кроме того, недавнее исследование с использованием образцов тканей, обработанных RUT для оценки диагностической точности DPO-PCR, показало, что DPO-PCR имеет более высокую чувствительность, чем RUT и гистология, а DPO-PCR может обнаружить инфекцию H. pylori в RUT- отрицательные образцы, что означает, что этот тест может уменьшить ложноотрицательный результат и уменьшить необходимость повторного эндоскопического обследования.Степень согласованности DPO-PCR между образцами биопсии желудка и образцами, обработанными RUT, составила 94,4% [64].
Обнаружение факторов вирулентности с помощью ПЦР помогает оценить генетические вариации факторов вирулентности H. pylori и дает больше информации для понимания клинических различий между пациентами, инфицированными разными штаммами H. pylori . Несколько исследований показали, что наличие факторов вирулентности, таких как ген CagA и VacA , связано с более тяжелым воспалением желудка и более высокой распространенностью язвенной болезни и рака желудка [65–67].Ген А промотора язвы двенадцатиперстной кишки (DupA) также предполагалось связать с образованием язв, индуцированным H. pylori , но в предыдущих исследованиях сообщалось о противоречивых результатах, которые предположительно были вызваны несовпадением праймеров. Недавно разработанная ОТ-ПЦР со специальным праймером, разработанным на основе выравнивания всех 221 последовательностей гена DupA, была введена недавно для повышения скорости обнаружения гена DupA. Этот метод повысил уровень обнаружения до 64,2%, независимо от того, имели ли обычно используемые ПЦР уровень обнаружения между 29.От 9% до 37,8%. Авторы указали, что дизайн ПЦР оказал большое влияние на обнаружение фактора вирулентности, и обнаружение специфического аллеля DupA не то же самое, что обнаружение фактического гена DupA [68].
ПЦР также помогает обнаружить H. pylori в пробах окружающей среды для эпидемиологических исследований. Высокая распространенность H. pylori , обнаруженная в образцах питьевой воды с помощью ПЦР, предоставила дополнительную информацию о передаче H. pylori через питьевую воду [69].Более высокий уровень обнаружения заражения H. pylori в немытых овощах свидетельствует о том, что точное мытье овощей снижает загрязнение H. pylori [70]. ПЦР также использовалась для определения генотипирования H. pylori в овощах, и высокая степень сходства в образце генотипирования H. pylori среди образцов овощей и образцов человека позволила предположить, что овощи могут быть источниками бактерий [71].
За исключением более быстрых и высокоточных результатов ПЦР для обнаружения H.pylori и штаммы, устойчивые к антибиотикам, опасения по поводу стоимости, доступного местного оборудования и опыта в области молекулярных методов неизбежно влияют на возможность проведения ПЦР в местных лабораториях.
НЕИНВАЗИВНЫЕ ИСПЫТАНИЯ
Было сделано несколько попыток избежать использования эндоскопических методов диагностики по нескольким причинам. Прежде всего, эндоскопия — это инвазивная процедура, которая вызывает дискомфорт и не подходит для пациентов с тяжелыми сопутствующими заболеваниями или противопоказаниями. Кроме того, стоимость эндоскопии и дополнительные расходы на эндоскопию, такие как одноразовые щипцы и анестезия, могут быть высокими.И последнее, но не менее важное: систематическая ошибка выборки почти неизбежно встречается в методах, основанных на биопсии, из-за неравномерного распределения H. pylori в желудке.
Дыхательный тест на мочевину
Дыхательный тест на мочевину (UBT) используется уже почти 30 лет и до сих пор остается самым популярным и точным неинвазивным тестом для диагностики инфекции H. pylori . За счет уреазной активности H. pylori , 13 C- или 14 C-меченная мочевина, проглоченная пациентом, гидролизуется до меченого CO 2 в желудке, затем меченый CO 2 абсорбируется в желудке. кровь и выдыхаемый при дыхании, в котором можно измерить помеченный CO 2 .Хотя несколько факторов, включая пациента, бактерии и сам тест, влияют на результаты UBT, UBT — это высокоточный и воспроизводимый тест с чувствительностью и специфичностью около 95% при стандартных процедурах. Недавно опубликованный метаанализ для оценки диагностической точности UBT у взрослых пациентов с диспепсическими симптомами показал, что совокупная чувствительность составила 96% (95% ДИ: 0,95-0,97), а совокупная специфичность составила 93% (95% ДИ: 0,91-0,94). [72]. UBT также полезен для эпидемиологических исследований и для оценки эффективности эрадикационной терапии [21,73].Пациенту следует прекратить прием ИПП за 2 недели и антибиотик за 4 недели до обследования, чтобы избежать ложноотрицательных результатов [74]. Кровотечение также влияет на диагностическую точность UBT, и отсроченное UBT после восстановления после кровотечения обязательно для уменьшения ложноотрицательного результата [75]. Иногда, хотя и редко, присутствие в желудке других патогенов, продуцирующих уреазу, также вызывает ложноположительные результаты.
UBT — подходящий метод со многими преимуществами, такими как простой, неинвазивный и безопасный, для обнаружения H.pylori у педиатрических пациентов, хотя точность UBT у педиатрических пациентов не так хороша, как у взрослых пациентов, особенно для детей младше 6 лет, с чувствительностью и специфичностью от 75% до 100% [76].
13 C-UBT предпочтительнее 14 C-UBT, чтобы избежать воздействия радиации, хотя 14 C-UBT безопасен для детей и беременных женщин, потому что излучение от 14 C-UBT ниже чем радиация, полученная из окружающей среды.Однако из-за отсутствия дорогостоящего оборудования и возможности платить высокую стоимость в размере 13 C-UBT, 14 C-UBT более популярны в развивающихся странах. Диагностическая точность между 13 C-UBT и 14 C-UBT не отличается, и оба теста можно считать золотым стандартом среди различных неинвазивных тестов для диагностики инфекции H. pylori [77]. Существует два протокола, некапсулированный и инкапсулированный, которые используются для перорального введения 14 С-мочевины пациентам для H.pylori диагноз. Первоначально инкапсулированный 14 C-UBT был разработан, чтобы избежать проблемы гидролиза 14 C-мочевины под действием продуцирующей уреазу флоры полости рта, и этот метод устранил проблему ложноположительных результатов в пробах из раннего дыхания [78] . Тем не менее, быстрый транзит капсулы, содержащей 14 C-мочевину, из желудочного тракта или ее неполное рассасывание в желудке во время фазы сбора выдыхаемого воздуха приводит к инкапсулированию 14 C-UBT, возможно, не лучшим вариантом, чем протокол без капсул [79 ].В недавнем исследовании использовалась методика динамического сцинтискана для мониторинга судьбы капсулы в желудке и сравнивалась чувствительность между протоколами без инкапсулирования и инкапсулирования у 100 пациентов с диспепсией. Это исследование показало, что неинкапсулированный протокол имел более высокую чувствительность, чем инкапсулированный протокол, а чувствительность инкапсулированного и неинкапсулированного 14 C-UBT составляла 90,5% и 98,6% через 10 минут и 91,8% и 97,2% через 15 минут соответственно. Неполное разрешение или отсутствие разрешения капсулы 14 C-мочевины в желудке во время фазы сбора выдыхаемого воздуха, отмеченное динамическими изображениями сцинтискана, послужило объяснением более низкой чувствительности инкапсулированного 14 C-UBT по сравнению с неинкапсулированным 14 C-UBT [80].
Точное значение отсечения для значения дельта по сравнению с исходным уровнем (DOB) для различения между H. pylori -положительными и H. pylori -отрицательными результатами является другой спорной проблемой. Отсечной клапан для UBT был первоначально определен как 5,0, что было наиболее широко рекомендовано, тогда как более низкие значения, 3,0 или 3,5, также были предложены для повышения его точности без ущерба для чувствительности и специфичности этого теста. «Серая зона», в которой результаты UBT неубедительны, упоминалась в предыдущих исследованиях, и пограничное значение DOB, например, очень близкое к выбранной точке отсечения, следует интерпретировать с осторожностью [81].Недавно был представлен новый метод UBT с использованием интегрированной системы выходной спектроскопии с оптическим резонатором, обеспечивающей оптимальную диагностическую точку отсечки. Этот предварительный тест определил диагностическую точку отсечения как совокупный процент восстановленной дозы 13 C (c-PDR) = 1,47% через 60 минут и продемонстрировал 100% чувствительность и 100% специфичность с точностью 100% по сравнению с инвазивной эндоскопией. тесты. Однако в этом исследовании используется небольшое количество образцов, и для подтверждения этих результатов необходимы дальнейшие более масштабные исследования [82].
STOOL ANTIGEN TEST
Тест на антиген кала (SAT) — другой неинвазивный метод с хорошей чувствительностью и специфичностью, 94% и 97% соответственно в глобальном метаанализе, при диагностике инфекции H. pylori [83]. Этот метод определяет присутствие H. pylori антигена в образцах стула. Существует два типа SAT, используемых для обнаружения H. pylori, методы, основанные на иммуноферментном анализе (EIA) и иммунохроматографическом анализе (ICA), с использованием либо поликлональных антител, либо моноклональных антител.В настоящее время доступно множество SAT для диагностики инфекции H. pylori , и различная диагностическая точность показана в разных исследованиях с разными SAT и разным дизайном исследований. В целом тесты на основе моноклональных антител более точны, чем тесты на основе поликлональных антител [83], а тесты на основе EIA обеспечивают более надежные результаты, чем тесты на основе ICA [84,85]. В недавнем исследовании EIA на антиген Tesmate pylori (TPAg) с использованием моноклональных антител для проверки нативной каталазы H. pylori было выявлено 92.4% чувствительность и 100% специфичность у взрослых по сравнению с ОТ-ПЦР, а точность этого теста составила 94,9% [86]. Тест Premier Platinum HpSA Plus, другой моноклональный тест на основе EIA, также показал надежные диагностические результаты с чувствительностью 92,2%, специфичностью 94,4% и точностью 93,4% для диагностики инфекции H. pylori по сравнению с другими 4 тестами SAT, включая 1 моноклональный На основе EIA (тест на антиген H. pylori ), на основе 2 моноклональных ICA (тест ImmunoCard STAT! HpSA и H.pylori фекального антигена) и 1 теста на основе поликлонального ICA (одноэтапный тест на антиген H. pylori ), точность которых была ниже 90% [84]. Однако тесты на основе ICA просты в выполнении и не требуют специального оборудования, что делает его подходящим для тестирования в офисе и в развивающихся странах. Новый тест SAT на основе моноклональных ICA, Atlas H. pylori Antigen Test, также был недавно представлен и обеспечивает лучшие результаты, чем предыдущие SAT на основе моноклональных ICA, с 91.Чувствительность 7%, специфичность 100% и точность 96,6% [87].
Помимо UBT, SAT на основе моноклонального EIA также является надежным тестом, рекомендованным руководящими принципами для оценки эффективности эрадикационной терапии H. pylori , и время для тестирования после окончания лечения должно составлять не менее 4 недель [21 , 88]. В предыдущем метаанализе совокупная чувствительность и специфичность моноклонального SAT для подтверждения эрадикации после терапии составляли 93% и 96% соответственно [83]. В недавних исследованиях было подтверждено, что SAT на основе моноклональных EIA является полезным и точным инструментом для определения результатов H.pylori с чувствительностью 91,6–100% и специфичностью 93,6–98,4% [89, 90]. Кроме того, моноклональные тесты SAT на основе ICA, RAPID Hp StAR и ImmunoCard STAT! HpSA также дает многообещающие результаты с чувствительностью 90,0–100% и специфичностью 93,6–94,9%.
В дополнение к оценке эрадикационной терапии, моноклональный САТ является удобным, неинвазивным и полезным тестом для диагностики инфекции H. pylori у педиатрических пациентов [91]. Исследование с применением SAT у детей в возрасте от 6 до 30 месяцев показало надежные результаты SAT для диагностики H.pylori у детей раннего возраста [92]. Недавний метаанализ, включающий 45 исследований и 5931 пациента, для оценки эффективности SATS у детей показал, что совокупная чувствительность и специфичность составили 92,1% и 94,1% соответственно. В анализе подгрупп чувствительность и специфичность моноклонального SAT, поликлонального SAT и одноэтапного быстрого моноклонального SAT составила 96,2% и 94,7%, 88,0% и 93,0% и 88,1% и 94,2% соответственно. Моноклональная SAT — надежный тест для диагностики инфекции H. pylori у детей [93].Более того, SAT — полезный инструмент для программ эпидемиологического исследования и скрининга [94,95]. По стоимости и оснащению SAT больше подходит для массовых опросов, чем UBT. По сравнению с серологическими тестами, которые обычно используются для скрининга, SAT дает более надежные результаты в диагностике инфекции H. pylori . Однако предыдущее исследование показало, что SAT был менее точным, чем серологический тест у пациентов с тяжелым атрофическим гастритом, и влияние этого результата требует дальнейшей оценки для оценки роли SAT в скрининге H.pylori -ассоциированные заболевания, такие как рак желудка [96]. В то время как другое исследование с использованием нового SAT на основе поликлонального EIA (EZ-STEP H. pylori ) обнаружило наличие атрофического гастрита и / или кишечной метаплазии, которые существенно не повлияли на результаты SAT [97].
На точность SAT влияет несколько факторов, таких как антибиотик, ИПП, N-ацетилцистеин, дефекация и кровотечение из верхних отделов желудочно-кишечного тракта. Сохранность образца, такая как температура и время транспортировки перед испытанием, а также отсечной клапан также влияют на диагностическую точность SAT [98-100].
ИСПЫТАНИЯ НА ОСНОВЕ АНТИТЕЛ
Для диагностики H. pylori широко доступны многочисленные серологические тесты, основанные на обнаружении антител IgG к H. pylori, и тест EIA является наиболее распространенным и точным методом среди них. Серологические тесты также часто используются при скрининге для эпидемиологических исследований из-за их недорогой, быстрой и приемлемости для пациентов. Кроме того, серологический тест полезен для оценки инфекции H. pylori у детей.Недавнее исследование с использованием E-Plate, коммерческого набора сывороточных антител, для сравнения эффективности серологического теста с SAT у 73 детей показало, что чувствительность, специфичность и отношение правдоподобия для серологического теста составили 91,2%, 97,4% и 35,6%. , соответственно. Эти результаты были получены при использовании запорного клапана, рекомендованного для взрослых, у детей [101]. Поскольку точность серологических тестов зависит от антигена, используемого в коммерческом наборе, и степени распространенности конкретных штаммов H. pylori , используемых в качестве источника антигена.Надлежащие антигены, используя либо местные штаммы в качестве источника антигена, либо объединяющие антигены из штаммов разных групп, а также надежное пороговое значение серологического теста должны быть проверены на местном уровне перед исследованием популяции [102,103]. Некоторые иммуногенные белки, такие как CagA, VacA, UreA, Omp и GroEL, были использованы в качестве кандидатов для обнаружения инфекции. Белок H. pylori FliD, важный элемент в сборке функциональных жгутиков, также признан новым маркером для серологической диагностики H.pylori с чувствительностью и специфичностью 99% и 97% соответственно [104]. Недавно для серологической диагностики инфекции H. pylori был введен новый метод иммуноанализа «РекомЛайн H. pylori » с использованием шести высокоиммуногенных факторов вирулентности (CagA, VacA, GroEL, gGT, HcpC и UreA). В отличие от EIA и иммуноблоттинга, RecomLine позволяет идентифицировать специфический ответ антител против различных антигенов H. pylori и увеличивает дискриминирующую способность.По сравнению с гистологией, рекомЛайн показала чувствительность и специфичность 97,6% и 96,2% соответственно. РекомЛайн также является полезным инструментом для идентификации специфических факторов вирулентности H. pylori [105,106].
Другое преимущество серологического теста заключается в том, что на точность серологических тестов не влияют язвенное кровотечение, атрофия желудка, а также использование ИПП или антибиотиков, которые вызывают ложноотрицательные результаты в других инвазивных или неинвазивных тестах. Однако серологический тест не является надежным тестом для оценки эрадикационной терапии, поскольку уровни антител могут сохраняться в крови в течение длительных периодов времени даже после успешной эрадикации [21].Поскольку серологические тесты не различают активную инфекцию и прошлое воздействие H. pylori , перед эрадикационной терапией требуется дополнительное подтверждение другими тестами.
Как и SAT, серологические тесты на основе EIA имеют лучшую точность, чем тесты на основе ICA. Недавнее исследование, сравнивающее 29 коммерческих серологических тестов (17 на основе EIA и 12 на основе ICA), показало, что точность 9 из 17 тестов на основе EIA была выше 90%, тогда как только один из 12 тестов на основе ICA имел точность> 90 %.Гетерогенные характеристики также наблюдались между различными серологическими тестами, выявление чувствительности варьировалось от 57,8% до 100%, а специфичность варьировалась от 58,7% до 96,8% в тестах на основе EIA; Чувствительность варьировала от 55,6% до 97,8%, а специфичность — от 60,3% до 96,8% в тестах на основе ICA. Серологические тесты следует выбирать правильно в соответствии с их конкретными рабочими параметрами для достижения различных целей, таких как скрининг, первоначальный диагноз или подтверждение другого теста [107].
Серологический тест также играет важную роль в изучении факторов патогенеза и вирулентности, поскольку некоторые антигенные белки могут быть обнаружены иммунологическими методами и имеют дополнительную диагностическую ценность.Было предпринято несколько попыток найти потенциальные биомаркеры для идентификации пациента, инфицированного штаммом H. pylori высокого риска, с помощью серологических тестов. Уровни пепсиногена (PG) I, PG II и соотношения PG I / II в сочетании с антителом H. pylori широко используются для прогнозирования атрофического гастрита и риска рака желудка [108,109]. Соотношение PG I / II также может быть полезно для наблюдения за раком желудка у пациентов после эрадикационной терапии [110]. Однако получены противоречивые результаты по клиническому применению этих серологических препаратов.Недавнее исследование, оценивающее точность GastroPanel, который измеряет гастрин-17, антитела H. pylori , PG I и PG II, для выявления атрофического гастрита, показало только 50% чувствительность и 80% специфичность, что было хуже, чем в предыдущих исследованиях [111 ]. Пепсиногеновый тест также оказался недостаточно точным для диагностики рака желудка с чувствительностью 71,0% и специфичностью 69,2% [112]. Некоторые факторы вирулентности также были оценены для прогнозирования заболеваний, ассоциированных с H. pylori .Присутствие сывороточных антител CagA, VacA и GroEL у пациентов с инфекцией H. pylori связано с предраковыми поражениями желудка, а также с раком желудка, и эти сывороточные маркеры могут служить потенциальными предикторами для пациентов, инфицированных штаммами высокого риска, которые могут быть связано с развитием рака желудка [106,113]. Хотя связь между факторами вирулентности и клиническими проявлениями была обнаружена в ходе предыдущих эпидемиологических исследований, серологические тесты все еще недостаточно надежны для диагностики рака желудка.В недавнем метаанализе совокупная чувствительность и специфичность антител CagA, используемых для диагностики рака желудка, составила 71% и 40% соответственно, а диагностическое отношение шансов составило 2,11 [114].
Обнаружение H. pylori IgG в моче также оценивалось у детей в предыдущих исследованиях, однако были представлены различные результаты [115,116]. Кроме того, диагностическая точность теста на основе ИФА для выявления IgG в слюне H. pylori также была недостаточной в качестве надежного теста [117,118].Определение антител в моче или слюне менее точное, чем другие тесты, и его не рекомендуется использовать при ведении пациентов [119].
ДИАГНОСТИКА
H. PYLORI В ДРУГИХ ОБРАЗЦАХИспользование ПЦР для обнаружения H. pylori в кале является надежным и быстрым методом, особенно привлекательным для детей в качестве неинвазивного теста. ПЦР стула также дает преимущества в идентификации конкретных генотипов и устойчивости микроорганизмов к антибиотикам [120,121].Полость рта считается внегастральным резервуаром H. pylori , хотя значение H. pylori в полости рта как источника повторного инфицирования или пути передачи все еще неясно. Слюна и зубной налет были образцами, обычно используемыми для обнаружения H. pylori в полости рта, а ПЦР была наиболее распространенным и надежным тестом, используемым в недавних исследованиях. RUT и посев также были выполнены для выявления орального H. pylori в ранних исследованиях.Распространенность обнаружения H. pylori в полости рта сильно варьировала, от 0% до 100%, и обычно обнаруживалась более низкая распространенность в слюне по сравнению с зубным налетом [122]. Широкие различия в распространенности H. pylori в полости рта могут быть связаны с разными методологиями, разными популяциями и разными праймерами, использованными в исследованиях. Недавние исследования были сосредоточены на модификации праймера для повышения диагностической точности или оценке нового метода преодоления ограничений ПЦР.Недавно была разработана новая система ПЦР с использованием наборов праймеров, специфичных для H. pylori на основе высококонсервативных последовательностей полных геномов 48 штаммов H. pylori , для повышения диагностической точности ПЦР в полости рта [123] . Петлевая изотермическая амплификация (LAMP), новый метод высокоспецифичной и чувствительной амплификации ДНК, сравнивалась с ПЦР по скорости обнаружения H. pylori в образцах зубного налета в небольшом исследовании, в котором приняли участие 45 участников.Это исследование показало, что LAMP имеет более высокий уровень обнаружения, чем ПЦР, и уровень обнаружения H. pylori в образцах зубного налета с помощью LAMP и ПЦР составляет 66,67% и 44% соответственно [124].
ДИАГНОСТИКА
H. PYLORI ПРИ ОСОБЫХ КЛИНИЧЕСКИХ ОБСТОЯТЕЛЬСТВАХКак упоминалось ранее, кровотечение из верхних отделов желудочно-кишечного тракта (UGIB) снижает диагностическую точность многих тестов, включая инвазивные и неинвазивные, для выявления инфекции H. pylori . В предыдущем метаанализе RUT, гистология и культура показали низкую чувствительность и высокую специфичность у пациентов с UGIB.UBT по-прежнему оставался надежным тестом, тогда как SAT стал менее точным в этих клинических условиях. Хотя UGIB не повлиял на серологический анализ, его нельзя рекомендовать в качестве первого диагностического теста на инфекцию H. pylori [40]. При сравнении CLO, культуры и гистологии, гистология была меньше подвержена влиянию язвенного кровотечения и могла быть надежным тестом даже в присутствии крови [125]. ПЦР имела значительно более высокую чувствительность, чем RUT, гистология и культура, с чувствительностью 91%, 66%, 43% и 37% соответственно и показала аналогичную чувствительность по сравнению с серологией и UBT, 94% и 94% соответственно.ПЦР была аналогична UBT по диагностической точности для выявления инфекции H. pylori в кровоточащих пептических язвах. Однако специфичность ПЦР (100%) превосходила только серологию (65%) и не отличалась от других тестов (RUT: 95%, гистология: 95%, культура: 100%, UBT: 85%) [126]. Исследование также показало, что ОТ-ПЦР может выявить инфекцию H. pylori с использованием фиксированных формалином образцов биопсии, залитых парафином, гистология которых показала отрицательные результаты у пациентов с кровотечением из язвенной болезни [127].Ликвидация H. pylori важна для лечения язвенного кровотечения, связанного с H. pylori , с целью предотвращения дальнейшего кровотечения, а успешная эрадикационная терапия даже более эффективна, чем длительная поддерживающая антисекреторная терапия с ИПП для уменьшения повторного кровотечения. Тестирование на основе биопсии H. pylori обычно рекомендуется во время эндоскопического исследования UGIB, даже если кровотечение снижает чувствительность тестов на основе биопсии. По результатам мета-регрессионного исследования, отложенный тест, через 4 недели после эпизода UGIB, имел более высокий уровень обнаружения H.pylori у пациентов с УГИБ. Поскольку точное определение этиологии кровоточащих язв имеет решающее значение при лечении язвенных кровотечений, в руководствах также рекомендовано подтверждение отрицательного результата с помощью последующего неинвазивного теста [22,128,129]. Низкая прогностическая ценность отрицательного результата была также обнаружена, когда UBT проводился сразу после экстренной эндоскопии, и тест задержки также был обязательным для всех отрицательных результатов раннего UBT [75]. Несмотря на важность тестирования H. pylori у пациентов с UGIB, доля пациентов, получивших прямое лечение H.pylori было прекращено, около 12% -60% отметили по результатам предыдущих исследований. Опасения по поводу снижения чувствительности, связанной с кровотечением или применением ИПП, и повышенным риском побочных эффектов, связанных с биопсией желудка или увеличением времени процедуры для выполнения биопсии желудка, могут повлиять на решения клиницистов о тестировании H. pylori [130].
Диагностика H. pylori у пациентов с частичной гастрэктомией — еще одна проблема, которой уделялось меньше внимания, поскольку эти пациенты составляли очень небольшую часть населения в целом.В метаанализе, сравнивающем три часто используемых теста у пациентов с частичной гастрэктомией, гистология показала лучшие результаты, за ней следовала RUT, тогда как UBT имела низкую диагностическую точность. Эти исследования показали высокую степень гетерогенности, а совокупная чувствительность и специфичность гистологии, RUT и UBT составили 93% и 85%; 79% и 94%; 77% и 89% соответственно. RUT был предложен в качестве первоначального выбора теста для этих пациентов, и были рекомендованы образцы биопсии из дна желудка или верхней части остаточного желудка.Гистологическое исследование было рекомендовано этим пациентам после отрицательного результата РУТ [131]. SAT может быть другим надежным тестом для обнаружения H. pylori у пациентов с дистальной гастрэктомией. Небольшое исследование с использованием теста HpSA для оценки диагностической точности SAT у 59 пациентов с дистальной резекцией желудка по поводу рака желудка показало, что чувствительность, специфичность и точность теста HpSA составляли 100%, 90,5% и 96,6% соответственно [132]. Возможная причина неадекватного выполнения УБТ при диагностике H.pylori у пациентов с дистальной резекцией желудка может быть недостаточно времени для того, чтобы мочевина оставалась в культе желудка для взаимодействия с уреазой, продуцируемой H. pylori . BreathID, быстрый непрерывный UBT в реальном времени, казалось, преодолел этот недостаток и показал лучшую точность, чем RUT, 87% и 72% соответственно. Однако в этом исследовании также была обнаружена более низкая чувствительность и специфичность RUT, 82% и 71% соответственно, по сравнению с предыдущими исследованиями, и биопсия, взятая из тела желудка немного дистальнее глазного дна, в этом исследовании может повлиять на диагностические характеристики RUT [133 ].Недавнее исследование также продемонстрировало противоречивые результаты между UBT и биопсийными тестами у пациентов с частичной гастэктомией после эрадикационной терапии H. pylori . Авторы предположили, что дополнительные тесты на основе эндоскопической биопсии помогут избежать ненужного лечения, поскольку у этих пациентов после эрадикационной терапии были обнаружены высокий уровень ложноположительных результатов и низкая прогностическая ценность UBT, 19,1% и 44,7% соответственно [134].
Точное определение статуса H. pylori у пациентов после эрадикационной терапии имеет важное значение, и UBT, а также SAT рекомендуются руководящими принципами для оценки эффективности эрадикационной терапии.Эти тесты обычно рекомендуется проводить более чем через 4 недели после окончания терапии [21,88]. Однако высокий уровень ложноположительных результатов в 52,9% был обнаружен при использовании 13 C-UBT с текущим пороговым значением (2,5 ‰), особенно у пациентов с более чем двукратной предыдущей эрадикационной терапией и у пациентов с умеренной и тяжелой кишечной метаплазией желудка [ 135]. Недавнее исследование с использованием вложенной ПЦР для обнаружения H. pylori в образцах биопсии желудка после эрадикационной терапии показало, что вложенная ПЦР более чувствительна, чем RUT, гистология и культура.Кроме того, метод, основанный на ПЦР, позволяет отличить реинфекцию или рецидив после эрадикационной терапии [136].
ЗАКЛЮЧЕНИЕ
Развитие современных методов диагностики позволяет более точно диагностировать инфекцию H. pylori , что, в свою очередь, улучшает лечение заболеваний, связанных с H. pylori- . Хотя теста золотого стандарта может не существовать, выбор теста для выявления инфекции H. pylori зависит от распространенности и штамма H.pylori о эндемичных регионах, доступности, преимуществах и недостатках каждого метода, а также о различных клинических обстоятельствах каждого пациента. Объединение результатов двух или более тестов может быть разумной стратегией в повседневной клинической практике для достижения наиболее надежного результата. Мы полагаем, что будут продолжаться попытки улучшить диагностическую ценность инфекции H. pylori для различных клинических целей, конкретных популяций и генотипических характеристик, чтобы иметь более надежные и осуществимые методы диагностики H.pylori в будущем.
Сноски
При поддержке (частично) грантов Медицинского университета Гаосюн «Грант для лучших университетов», гранты № KMU-TP104G00, № KMU-TP104G03 и № KMU-TP104E25; и Общая больница Тен Чан, совместный исследовательский проект Чун-Ли и КМУ, № ST102004; и больница Гаосюнского медицинского университета, № KMUh200-0R01.
Заявление о конфликте интересов: у авторов нет конфликта интересов, о котором следует сообщать.
Открытый доступ: эта статья является статьей открытого доступа, которая была выбрана штатным редактором и полностью рецензирована внешними рецензентами.Он распространяется в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая позволяет другим распространять, ремикшировать, адаптировать, использовать эту работу в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно цитируется и используется в некоммерческих целях. См .: http://creativecommons.org/licenses/by-nc/4.0/
Рецензирование началось: 12 мая 2015 г.
Первое решение: 13 июля 2015 г.
Статья в печати: 30 сентября 2015 г.
P- Рецензент: Tosetti C S- Редактор: Ma YJ L- Редактор: A E- Редактор: Zhang DN
Ссылки
1.Пелетейро Б., Бастос А., Ферро А., Лунет Н. Распространенность инфекции Helicobacter pylori во всем мире: систематический обзор исследований с национальным охватом. Dig Dis Sci. 2014; 59: 1698–1709. [PubMed] [Google Scholar] 2. Kuipers EJ. Helicobacter pylori, риск и лечение сопутствующих заболеваний: гастрита, язвенной болезни, атрофического гастрита и рака желудка. Алимент Pharmacol Ther. 1997; 11 Дополнение 1: 71–88. [PubMed] [Google Scholar] 3. Фок КМ. Обзорная статья: эпидемиология и профилактика рака желудка.Алимент Pharmacol Ther. 2014; 40: 250–260. [PubMed] [Google Scholar] 4. де Мартель С., Ферли Дж., Франчески С., Винья Дж., Брей Ф., Форман Д., Пламмер М. Глобальное бремя рака, связанное с инфекциями, в 2008 г .: обзор и синтетический анализ. Ланцет Онкол. 2012; 13: 607–615. [PubMed] [Google Scholar] 5. Axon A. Helicobacter pylori и общественное здравоохранение. Helicobacter. 2014; 19 Приложение 1: 68–73. [PubMed] [Google Scholar] 6. Ли Дж.Х., Пак Й.С., Чхве К.С., Ким до Х., Чой К.Д., Сон Х.Д., Ли Г.Х., Чан С.Дж., Чон Х.Й., Ким Дж.Х. Оптимальное место биопсии для обнаружения Helicobacter pylori во время эндоскопической мукозэктомии у пациентов с обширной атрофией желудка.Helicobacter. 2012; 17: 405–410. [PubMed] [Google Scholar] 7. Лан Х.С., Чен Т.С., Ли А.Ф., Чанг Ф.Й., Лин Х.С. Дополнительная биопсия тела позволяет выявить инфекцию Helicobacter pylori на фоне гастрита с атрофией. BMC Gastroenterol. 2012; 12: 182. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Като Т., Яги Н., Камада Т., Шимбо Т., Ватанабе Х., Ида К. Диагностика инфекции Helicobacter pylori в слизистой оболочке желудка по эндоскопическим признакам: многоцентровое проспективное исследование. Dig Endosc. 2013; 25: 508–518.[PubMed] [Google Scholar] 9. Чо Дж.Х., Чанг Ю.В., Чан Дж.Й., Шим Дж.Дж., Ли СК, Донг С.Х., Ким ХДЖ, Ким Б. Тщательное наблюдение за картиной слизистой оболочки желудка с помощью стандартной эндоскопии может предсказать статус инфекции Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 279–284. [PubMed] [Google Scholar] 10. Чо Ю.С., Чае Х.С., Чан С.Н., Ким Дж.С., Сон Х.С., Ким Х.К., Ким Б.В., Хан С.В., Чой К.Й., Ли Х.К. и др. Сравнение дыхательного теста с 13C-мочевиной и эндоскопического теста pH слизистой оболочки феноловым красным при количественной оценке нагрузки инфекции Helicobacter pylori.Korean J Intern Med. 2008. 23: 134–139. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Hernández-Garcés HR, Castellanos-González VV, González-Fabián L, Infante-Velázquez M, Peña K, Andrain-Sierra Y. Хромоэндоскопия с красным фенолом в диагностике инфекции Helicobacter pylori. Rev Esp Enferm Dig. 2012; 104: 4–9. [PubMed] [Google Scholar] 12. Гонен С., Симсек И., Сариоглу С., Акпинар Х. Сравнение увеличительной эндоскопии с высоким разрешением и стандартной видеоэндоскопии для диагностики гастрита Helicobacter pylori в рутинной клинической практике: проспективное исследование.Helicobacter. 2009; 14: 12–21. [PubMed] [Google Scholar] 13. Цзи Р, Ли YQ, Гу ХМ, Ю Т, Цзо XL, Чжоу СиДжей. Конфокальная лазерная эндомикроскопия для диагностики инфекции Helicobacter pylori: проспективное исследование. J Gastroenterol Hepatol. 2010. 25: 700–705. [PubMed] [Google Scholar] 14. Яги К., Сака А., Нодзава Ю., Накамура А. Прогнозирование статуса Helicobacter pylori с помощью обычной эндоскопии, узкополосной визуализации с увеличением эндоскопии в желудке после эндоскопической резекции рака желудка. Helicobacter. 2014; 19: 111–115.[PubMed] [Google Scholar] 15. Ци QQ, Zuo XL, Li CQ, Ji R, Li Z, Zhou CJ, Li YQ. Эндоскопия с увеличением высокого разрешения с i-scan в диагностике инфекции Helicobacter pylori: пилотное исследование. J Dig Dis. 2013; 14: 579–586. [PubMed] [Google Scholar] 16. Лю Х, Ву Дж, Линь XC, Вэй Н, Лин В, Чанг Х, Ду ХМ. Оценка диагнозов поражений антрального отдела желудка с помощью увеличительной эндоскопии с узкополосной визуализацией у населения Китая. Dig Dis Sci. 2014; 59: 1513–1519. [PubMed] [Google Scholar] 17. Яги К., Накамура А., Секин А.Сравнение результатов эндоскопии с увеличением и результатов гистологического, посевного и уреазного теста слизистой оболочки тела желудка. Эндоскопия. 2002; 34: 376–381. [PubMed] [Google Scholar] 18. Накагава С., Като М., Симидзу Ю., Накагава М., Ямамото Дж., Луис П.А., Кодаира Дж., Каварасаки М., Такеда Х., Сугияма Т. и др. Связь между гистопатологическим гастритом и микроваскуляризацией слизистой оболочки: наблюдения с увеличительной эндоскопией. Gastrointest Endosc. 2003. 58: 71–75. [PubMed] [Google Scholar] 19. Кавамура М., Секин Х., Абэ С., Сибуя Д., Като К., Масуда Т.Клиническое значение белых отверстий желудочных крипт, наблюдаемых при увеличительной эндоскопии. Мир Дж. Гастроэнтерол. 2013; 19: 9392–9398. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Ватанабе К., Нагата Н., Симбо Т., Накашима Р., Фурухата Е., Сакураи Т., Акадзава Н., Ёкои С., Кобаякава М., Акияма Дж. И др. Точность эндоскопической диагностики инфекции Helicobacter pylori в соответствии с уровнем эндоскопического опыта и эффектом тренировки. BMC Gastroenterol. 2013; 13: 128. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21.Мальфертхайнер П., Мегроуд Ф., О’Морайн К.А., Атертон Дж., Аксон А.Т., Баццоли Ф., Дженсини Г.Ф., Гисберт Дж. П., Грэм Д. Ю., Роккас Т. и др. Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник. 2012. 61: 646–664. [PubMed] [Google Scholar] 22. Чей В.Д., Вонг BC. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Am J Gastroenterol. 2007. 102: 1808–1825. [PubMed] [Google Scholar] 23. Lash JG, Genta RM. Соблюдение рекомендаций Сиднейской системы увеличивает вероятность выявления гастрита, вызванного Helicobacter, и кишечной метаплазии в 400738 наборах биопсий желудка.Алимент Pharmacol Ther. 2013; 38: 424–431. [PubMed] [Google Scholar] 24. Хартман DJ, Оуэнс SR. Требуются ли обычные вспомогательные окрашивания для диагностики инфекции Helicobacter в образцах биопсии желудка? Обзор институционального обеспечения качества. Am J Clin Pathol. 2012; 137: 255–260. [PubMed] [Google Scholar] 25. Баттс К.П., Кетовер С., Какар С., Красинскас А.М., Митчелл К.А., Уилкокс Р., Вестерхофф М., Ранг J, Гибсон Дж., Маттиа А.Р. и др. Надлежащее использование специальных красителей для идентификации Helicobacter pylori: рекомендации Rodger C.Общество патологии желудочно-кишечного тракта Хаггитта. Am J Surg Pathol. 2013; 37: e12 – e22. [PubMed] [Google Scholar] 26. Ротими О., Кэрнс А., Грей С., Моайеди П., Диксон М. Ф. Гистологическая идентификация Helicobacter pylori: сравнение методов окрашивания. J Clin Pathol. 2000. 53: 756–759. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз О., Демирай Э. Клиническая роль и важность метода флуоресцентной гибридизации in situ в диагностике инфекции H. pylori и определении устойчивости к кларитромицину при эрадикационной терапии H. pylori.Мир Дж. Гастроэнтерол. 2007. 13: 671–675. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Таджбахш С., Самарбаф-Заде А.Р., Мусавиан М. Сравнение флуоресцентной гибридизации in situ и гистологического метода диагностики Helicobacter pylori в образцах биопсии желудка. Med Sci Monit. 2008; 14: BR183 – BR187. [PubMed] [Google Scholar] 29. Cerqueira L, Fernandes RM, Ferreira RM, Oleastro M, Carneiro F, Brandão C, Pimentel-Nunes P, Dinis-Ribeiro M, Figueiredo C, Keevil CW и др. Валидация метода флуоресцентной гибридизации in situ с использованием зондов пептидных нуклеиновых кислот для выявления устойчивости к кларитромицину Helicobacter pylori в образцах биопсии желудка.J Clin Microbiol. 2013; 51: 1887–1893. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Тиродимос И., Бобос М., Казакос Э., Хайдич А.Б., Дардавессис Т., Костопулос И., Арванитиду М. Молекулярное обнаружение Helicobacter pylori в большой средиземноморской реке с помощью прямого подсчета жизнеспособности с помощью флуоресцентной гибридизации in situ (DVC-FISH) J Water Health. 2014; 12: 868–873. [PubMed] [Google Scholar] 31. Сантьяго П., Морено Ю., Феррус Массачусетс. Идентификация жизнеспособных Helicobacter pylori в источниках питьевой воды культурными и молекулярными методами.Helicobacter. 2015; 20: 252–259. [PubMed] [Google Scholar] 32. Вайра Д., Вакил Н., Гатта Л., Риччи С., Перна Ф., Сарацино И., Фиорини Г., Холтон Дж. Точность нового сверхбыстрого экспресс-теста на уреазу для диагностики инфекции Helicobacter pylori у 1000 последовательных пациентов с диспепсией. Алимент Pharmacol Ther. 2010. 31: 331–338. [PubMed] [Google Scholar] 33. Lerang F, Moum B, Mowinckel P, Haug JB, Ragnhildstveit E, Berge T, Bjørneklett A. Точность семи различных тестов для диагностики инфекции Helicobacter pylori и влияние антагонистов h3-рецепторов на результаты тестов.Сканд Дж Гастроэнтерол. 1998. 33: 364–369. [PubMed] [Google Scholar] 34. Озаслан Э., Косеоглу Т., Пурнак Т., Йылдыз А. Забытая причина ложноотрицательного экспресс-теста на уреазу: загрязнение образца формалином. Гепатогастроэнтерология. 2010; 57: 2 с. предыдущее оглавление. [PubMed] [Google Scholar] 35. Сиавоши Ф., Сани П., Халили-Самани С., Хоссейни Ф., Малакутихах Ф., Мамиванд М., Шахреза С., Шарифи А. Х. Оценка методов выявления H. pylori при потреблении ИПП с использованием посева, экспресс-теста на уреазу и исследования мазка.Ann Transl Med. 2015; 3: 11. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Цэн ЦА, Ван ВМ, Ву округ Колумбия. Сравнение клинической осуществимости трех экспресс-тестов на уреазу в диагностике инфекции Helicobacter pylori. Dig Dis Sci. 2005. 50: 449–452. [PubMed] [Google Scholar] 37. Сиддик И., Аль-Мехайзим К., Алатеи Н., Мемон А., Хасан Ф. Диагностика Helicobacter pylori: повышение чувствительности CLOtest за счет увеличения количества биопсий антрального отдела желудка. J Clin Gastroenterol. 2008. 42: 356–360. [PubMed] [Google Scholar] 38.Hsu WH, Wang SS, Kuo CH, Chen CY, Chang CW, Hu HM, Wang JY, Yang YC, Lin YC, Wang WM и др. Двойные образцы повышают диагностическую точность и сокращают время реакции экспресс-теста на уреазу. Мир Дж. Гастроэнтерол. 2010; 16: 2926–2930. [Бесплатная статья PMC] [PubMed] [Google Scholar] 39. Moon SW, Kim TH, Kim HS, Ju JH, Ahn YJ, Jang HJ, Shim SG, Kim HJ, Jung WT, Lee OJ. Объединенный экспресс-тест на уреазу превосходит отдельный тест в обнаружении Helicobacter pylori в антральном отделе желудка и в образцах тела.Clin Endosc. 2012; 45: 392–396. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Gisbert JP, Abraira V. Точность диагностических тестов Helicobacter pylori у пациентов с кровоточащей язвенной болезнью: систематический обзор и метаанализ. Am J Gastroenterol. 2006; 101: 848–863. [PubMed] [Google Scholar] 41. Ли TH, Лин CC, Chung CS, Lin CK, Liang CC, Tsai KC. Увеличение количества биопсий и забор образцов из тела желудка улучшает чувствительность экспресс-теста на уреазу у пациентов с кровотечением из язвенной болезни. Dig Dis Sci.2015; 60: 454–457. [PubMed] [Google Scholar] 42. Парк С.А., Ко А, Ли Н.Г. Стимуляция роста возбудителя желудочного заболевания человека Helicobacter pylori за счет атмосферного уровня кислорода при высоком давлении углекислого газа. BMC Microbiol. 2011; 11: 96. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Ндип Р.Н., Маккей В.Г., Фартинг М.Дж., Уивер Л.Т. Культивирование Helicobacter pylori из клинических образцов: обзор микробиологических методов. J Pediatr Gastroenterol Nutr. 2003. 36: 616–622. [PubMed] [Google Scholar] 44. Гонг Ю.Н., Ли Ю.М., Янг Н.М., Ли ХЗ, Го Ф., Линь Л., Ван Цюй, Чжан Дж.К., Цзи Цзы, Мао Дж. Б. и др.Централизованная изоляция Helicobacter pylori из множества центров и условий транспортировки. Мир Дж. Гастроэнтерол. 2015; 21: 944–952. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Челлини Л., Ди Кампли Э, Ди Бартоломео С., Бесса Л. Дж., Баффони М., Ди Джулио М. Новая транспортная среда для культивирования Helicobacter pylori. J Clin Microbiol. 2014; 52: 4325–4329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Wisessombat S, Meethai C, Hamgo S. Новый двухфазный тест для обнаружения Helicobacter pylori в биопсиях желудка.J Microbiol Methods. 2014; 96: 19–24. [PubMed] [Google Scholar] 47. Leszczyńska K, Namiot A, Namiot Z, Leszczyńska JK, Jakoniuk P, Chilewicz M, Namiot DB, Kemona A, Milewski R, Bucki R. Факторы пациента, влияющие на культуру Helicobacter pylori, выделенную из образцов слизистой оболочки желудка. Adv Med Sci. 2010; 55: 161–166. [PubMed] [Google Scholar] 48. Mégraud F, Lehours P. Обнаружение Helicobacter pylori и тестирование на чувствительность к противомикробным препаратам. Clin Microbiol Rev.2007; 20: 280–322. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49.Momtaz H, Souod N, Dabiri H, Sarshar M. Изучение статуса генотипа Helicobacter pylori в слюне, зубных бляшках, образцах стула и биопсии желудка. Мир Дж. Гастроэнтерол. 2012; 18: 2105–2111. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Саез Дж., Бельда С., Сантибаньес М., Родригес Дж. К., Сола-Вера Дж., Галиана А., Руис-Гарсия М., Бротонс А., Лопес-Жирона Е., Жирона Е. и др. ПЦР в реальном времени для диагностики инфекции Helicobacter pylori у пациентов с кровотечением из верхних отделов желудочно-кишечного тракта: сравнение с другими классическими методами диагностики.J Clin Microbiol. 2012; 50: 3233–3237. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Lehours P, Mégraud F. Молекулярная диагностика Helicobacter pylori. Эксперт Rev Mol Diagn. 2011; 11: 351–355. [PubMed] [Google Scholar] 52. Monno R, Giorgio F, Carmine P, Soleo L, Cinquepalmi V, Ierardi E. Устойчивость к кларитромицину Helicobacter pylori, обнаруженная с помощью Etest и TaqMan полимеразной цепной реакции в реальном времени: сравнительное исследование. APMIS. 2012; 120: 712–717. [PubMed] [Google Scholar] 53. Лю Цюй, Ци Д, Кан Дж, Цзинь И, Лю В., Гао В., Хоу П, Лу Дж.Эффективность обнаружения инфекции Helicobacter pylori на основе ПЦР в реальном времени и четырехкратной терапии на основе генотипической резистентности в качестве лечения первой линии функциональной диспепсии, вызванной инфекцией Helicobacter pylori. Eur J Gastroenterol Hepatol. 2015; 27: 221–225. [PubMed] [Google Scholar] 54. Онцира Нгойи Э.Н., Атипо Ибара Б.И., Мойен Р., Ахуи Апенди П.К., Ибара Дж. Р., Обенги О., Осиби Ибара Р. Б., Нгуимби Е., Ниама РФ, Уамба Дж. Молекулярное определение Helicobacter pylori и его устойчивости к противомикробным препаратам в Браззавиле, Конго.Helicobacter. 2015; 20: 316–320. [PubMed] [Google Scholar] 55. Де Франческо V, Зулло А., Джорджио Ф., Сарачино I, Заккаро С., Хассан С., Иерарди Э., Ди Лео А., Фиорини Дж., Кастелли В. и др. Изменение точечных мутаций в рРНК Helicobacter pylori, связанных с устойчивостью к кларитромицину в Италии. J Med Microbiol. 2014; 63: 453–457. [PubMed] [Google Scholar] 56. Ивамото А., Танахаши Т., Окада Р., Ёсида Ю., Кикучи К., Кейда Ю., Мураками Ю., Ян Л., Ямамото К., Нишиуми С. и др. Полногеномное секвенирование Helicobacter pylori, устойчивого к кларитромицину, характеризует неидентифицированные варианты генов эффлюксной помпы с множественной лекарственной устойчивостью.Gut Pathog. 2014; 6: 27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Смит С.М., О’Морайн С., Макнамара Д. Тестирование чувствительности к противомикробным препаратам для Helicobacter pylori во времена повышения устойчивости к антибиотикам. Мир Дж. Гастроэнтерол. 2014; 20: 9912–9921. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Бинь Т.Т., Сузуки Р., Транг Т.Т., Квон Д.Х., Ямаока Ю. Поиск новых мутаций-кандидатов на устойчивость к метронидазолу у Helicobacter pylori с использованием секвенирования следующего поколения. Антимикробные агенты Chemother.2015; 59: 2343–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Cambau E, Allerheiligen V, Coulon C, Corbel C, Lascols C, Deforges L, Soussy CJ, Delchier JC, Megraud F. Оценка нового теста, генотип HelicoDR, для молекулярного определения устойчивости к антибиотикам у Helicobacter pylori. J Clin Microbiol. 2009. 47: 3600–3607. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Miendje Deyi VY, Burette A, Bentatou Z, Maaroufi Y, Bontems P, Lepage P, Reynders M. Практическое использование GenoType® HelicoDR, молекулярного теста для обнаружения Helicobacter pylori и тестирования чувствительности.Диагностика Microbiol Infect Dis. 2011; 70: 557–560. [PubMed] [Google Scholar] 61. Ли Дж. У., Ким Н., Нам Р., Пак Дж. Х., Чой Й. Дж., Ким Дж. М., Ким Дж. С., Юнг ХК. Тест GenoType HelicoDR для определения устойчивости Helicobacter pylori к противомикробным препаратам в Корее. Сканд Дж Гастроэнтерол. 2014; 49: 1058–1067. [PubMed] [Google Scholar] 62. Woo HY, Park DI, Park H, Kim MK, Kim DH, Kim IS, Kim YJ. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом для обнаружения Helicobacter pylori и определения устойчивости к кларитромицину с помощью биоптатов желудка.Helicobacter. 2009. 14: 22–28. [PubMed] [Google Scholar] 63. Lehours P, Siffré E, Mégraud F. Мультиплексная ПЦР DPO в качестве альтернативы тестированию на культуру и чувствительность для выявления Helicobacter pylori и его устойчивости к кларитромицину. BMC Gastroenterol. 2011; 11: 112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Chung WC, Jung SH, Oh JH, Kim TH, Cheung DY, Kim BW, Kim SS, Kim JI, Sin EY. Мультиплексная ПЦР на основе олигонуклеотидов с двойным праймингом с использованием образцов ткани в экспресс-тесте на уреазу при обнаружении инфекции Helicobacter pylori.Мир Дж. Гастроэнтерол. 2014; 20: 6547–6553. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Алмейда Н., Донато М. М., Ромаозиньо Дж. М., Люксо С., Кардозу О, Сиприано М. А., Мариньо С., Фернандес А., София С. Корреляция генотипов Helicobacter pylori с гистопатологией желудка в центральном регионе южно-европейской страны. Dig Dis Sci. 2015; 60: 74–85. [PubMed] [Google Scholar] 66. Сиддик I, Аль-Кабанди А., Аль-Али Дж., Алазми В., Мемон А., Мустафа А.С., Джунаид Т.А. Связь между генотипами Helicobacter pylori и тяжестью хронического гастрита, язвенной болезни и уровнями интерлейкина-8 в слизистой оболочке желудка: данные исследования, проведенного на Ближнем Востоке.Gut Pathog. 2014; 6: 41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Феррейра Р.М., Мачадо Дж. К., Фигейредо С. Клиническая значимость генотипов VacA и cagA Helicobacter pylori при карциноме желудка. Лучшие Практики Рес Клин Гастроэнтерол. 2014; 28: 1003–1015. [PubMed] [Google Scholar] 68. Абади А.Т., Лоффельд Р.Дж., Констанция А.С., Вагенаар Дж.А., Кустерс Дж.Г. На обнаружение гена dupA Helicobacter pylori сильно влияет дизайн ПЦР. J Microbiol Methods. 2014; 106: 55–56. [PubMed] [Google Scholar] 69. Амирхошанг А., Рамин А., Эхсан А., Мансур Р., Шахрам Б.Высокая частота ДНК Helicobacter pylori в питьевой воде в Керманшахе, Иран, в июне-ноябре 2012 года. J Water Health. 2014; 12: 504–512. [PubMed] [Google Scholar] 70. Атапур С., Сафарпур Дехкорди Ф., Рахими Э. Обнаружение Helicobacter pylori в различных типах овощей и салатов. Jundishapur J Microbiol. 2014; 7: e10013. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Yahaghi E, Khamesipour F, Mashayekhi F, Safarpoor Dehkordi F, Sakhaei MH, Masoudimanesh M, Khameneie MK. Helicobacter pylori в овощах и салатах: генотипирование и свойства устойчивости к противомикробным препаратам.Biomed Res Int. 2014; 2014: 757941. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Фервана М., Абдулмаджид И., Альхаджахмед А., Мадани В., Фирвана Б., Хасан Р., Алтаяр О, Лимбург П.Дж., Мурад М.Х., Кнави Б. Точность дыхательного теста на мочевину при инфекции Helicobacter pylori: метаанализ. Мир Дж. Гастроэнтерол. 2015; 21: 1305–1314. [Бесплатная статья PMC] [PubMed] [Google Scholar] 73. Gong Y, Wei W, Yuan Y. Связь между риском аномальной функции желудка и инфекцией Helicobacter pylori, оцененная с помощью ELISA и дыхательного теста с 14C-мочевиной.Диагностика Microbiol Infect Dis. 2014; 80: 316–320. [PubMed] [Google Scholar] 74. Макколл К.Э. Клиническая практика. Инфекция Helicobacter pylori. N Engl J Med. 2010; 362: 1597–1604. [PubMed] [Google Scholar] 75. Велайос Б., Фернандес-Салазар Л., Понс-Ренедо Ф., Муньос М.Ф., Альмарас А., Аллер Р., Руис Л., Дель Ольмо Л., Гисберт Дж. П., Гонсалес-Эрнандес Дж. М.. Точность дыхательной пробы мочевины, выполняемой сразу после экстренной эндоскопии при кровотечении из язвенной болезни. Dig Dis Sci. 2012; 57: 1880–1886. [PubMed] [Google Scholar] 76. Гварнер Дж., Калач Н., Элитсур Ю., Колецко С.Диагностические тесты Helicobacter pylori у детей: обзор литературы с 1999 по 2009 год. Eur J Pediatr. 2010; 169: 15–25. [PubMed] [Google Scholar] 77. Nocon M, Kuhlmann A, Leodolter A, Roll S, Vauth C, Willich SN, Greiner W. Эффективность и рентабельность дыхательного теста с мочевиной 13C в качестве основного диагностического исследования для выявления инфекции Helicobacter pylori по сравнению с инвазивной и неинвазивной -инвазивные диагностические тесты. GMS Health Technol Assess. 2009; 5: Doc14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78.Гамлет А.К., Эрландссон К.И., Ольбе Л., Свеннерхольм А.М., Бакман В.Е., Петтерссон А.Б. Простой, быстрый и высоконадежный дыхательный тест с мочевиной 14C на основе капсул для диагностики инфекции Helicobacter pylori. Сканд Дж Гастроэнтерол. 1995; 30: 1058–1063. [PubMed] [Google Scholar] 79. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Превосходство некапсулированного дыхательного теста с 14С-мочевиной над методом на основе капсул для выявления инфекции Helicobacter pylori — предварительный отчет.Троп Гастроэнтерол. 2012; 33: 123–128. [PubMed] [Google Scholar] 80. Патхак К.М., Каур Б., Бхасин Д.К., Миттал Б.Р., Шарма С., Кхандуджа К.Л., Аггарвал Л., Рана СС. Сравнение инкапсулированного и неинкапсулированного (14) дыхательного теста с C-мочевиной для выявления инфекции Helicobacter pylori: сцинтиграфическое исследование. Helicobacter. 2014; 19: 116–123. [PubMed] [Google Scholar] 81. Gisbert JP, Pajares JM. Обзорная статья: Дыхательный тест на 13C-мочевину в диагностике инфекции Helicobacter pylori — критический обзор. Алимент Pharmacol Ther.2004. 20: 1001–1017. [PubMed] [Google Scholar] 82. Som S, Maity A, Banik GD, Ghosh C, Chaudhuri S, Daschakraborty SB, Ghosh S, Pradhan M. Кинетика экскреции дыхательного теста с мочевиной 13C: влияние выработки эндогенного CO2 и восстановления дозы на диагностическую точность инфекции Helicobacter pylori. Anal Bioanal Chem. 2014; 406: 5405–5412. [PubMed] [Google Scholar] 83. Gisbert JP, de la Morena F, Abraira V. Точность теста на моноклональный антиген стула для диагностики инфекции H. pylori: систематический обзор и метаанализ.Am J Gastroenterol. 2006; 101: 1921–1930. [PubMed] [Google Scholar] 84. Коркмаз Х., Кесли Р., Карабаглы П., Терзи Ю. Сравнение диагностической точности пяти различных тестов на антигены стула для диагностики инфекции Helicobacter pylori. Helicobacter. 2013; 18: 384–391. [PubMed] [Google Scholar] 85. Кесли Р., Гоктюрк Х.С., Эрбайрак М., Карабаглы П., Терзи Ю. Сравнение диагностических значений трех различных тестов на антигены стула для неинвазивной диагностики инфекции Helicobacter pylori. J Investig Med.2010. 58: 982–986. [PubMed] [Google Scholar] 86. Okuda M, Osaki T, Kikuchi S, Ueda J, Lin Y, Yonezawa H, Maekawa K, Hojo F, Kamiya S, Fukuda Y. Оценка теста на антиген стула с использованием mAb для нативной каталазы для диагностики инфекции Helicobacter pylori у детей и взрослые. J Med Microbiol. 2014; 63: 1621–1625. [PubMed] [Google Scholar] 87. Осман Х.А., Хасан Х., Суппиан Р., Бахар Н., Хусин Н.С., Рахим А.А., Хассан С., Анди Д.З., Зилфалил Б.А. Оценка теста на антиген стула Atlas Helicobacter pylori для диагностики инфекции у взрослых пациентов.Азиатский Pac J Cancer Prev. 2014; 15: 5245–5247. [PubMed] [Google Scholar] 88. Асака М., Като М., Такахаши С., Фукуда Й., Сугияма Т., Ота Х, Уэмура Н., Мураками К., Сато К., Сугано К. Руководство по лечению инфекции Helicobacter pylori в Японии: пересмотренное издание 2009 г. Helicobacter. 2010; 15: 1–20. [PubMed] [Google Scholar] 89. Дегучи Р., Мацусима М., Сузуки Т., Майн Т., Фукуда Р., Нишина М., Одзава Х., Такаги А. Сравнение моноклонального и поликлонального иммуноферментного анализа стула на основе антител при диагностике инфекции Helicobacter pylori после эрадикационной терапии.J Gastroenterol. 2009. 44: 713–716. [PubMed] [Google Scholar] 90. Кальвет X, Ларио С., Рамирес-Лазаро М.Дж., Монтсеррат А., Кесада М., Ривз Л., Мастерс Х., Суарес-Ламас Д., Галлах М., Микель М. и др. Точность моноклональных тестов стула для определения излечения от инфекции Helicobacter pylori после лечения. Helicobacter. 2010; 15: 201–205. [PubMed] [Google Scholar] 91. Леал Ю.А., Седильо-Ривера Р., Симон Дж. А., Веласкес Дж. Р., Флорес Л.Л., Торрес Дж. Полезность тестов на основе образцов стула для диагностики инфекции Helicobacter pylori у детей.J Pediatr Gastroenterol Nutr. 2011; 52: 718–728. [PubMed] [Google Scholar] 92. Queiroz DM, Saito M, Rocha GA, Rocha AM, Melo FF, Checkley W, Braga LL, Silva IS, Gilman RH, Crabtree JE. Инфекция Helicobacter pylori у младенцев и детей ясельного возраста в Южной Америке: соответствие между дыхательным тестом на [13C] мочевину и моноклональным тестом на антиген стула H. pylori. J Clin Microbiol. 2013; 51: 3735–3740. [Бесплатная статья PMC] [PubMed] [Google Scholar] 93. Чжоу X, Су Дж., Сюй Дж., Чжан Г. Точность теста на антиген стула для диагностики инфекции Helicobacter pylori у детей: метаанализ.Клин Рес Гепатол Гастроэнтерол. 2014; 38: 629–638. [PubMed] [Google Scholar] 94. Ли YC, Tseng PH, Liou JM, Chen MJ, Chen CC, Tu CH, Chiang TH, Chiu HM, Lai CF, Ho JC, et al. Проведение одноэтапного теста на основе образца фекалий для диагностики инфекции Helicobacter pylori в учреждениях первичной медико-санитарной помощи и массовых обследований. J Formos Med Assoc. 2014; 113: 899–907. [PubMed] [Google Scholar] 95. Okuda M, Osaki T, Lin Y, Yonezawa H, Maekawa K, Kamiya S, Fukuda Y, Kikuchi S. Низкая распространенность и частота инфекции Helicobacter pylori у детей: популяционное исследование в Японии.Helicobacter. 2015; 20: 133–138. [PubMed] [Google Scholar] 96. Симояма Т., Ояма Т., Мацудзака М., Данджо К., Накадзи С., Фукуда С. Сравнение теста на антиген стула и серологии для диагностики инфекции Helicobacter pylori в массовом опросе. Helicobacter. 2009; 14: 87–90. [PubMed] [Google Scholar] 97. Choi J, Kim CH, Kim D, Chung SJ, Song JH, Kang JM, Yang JI, Park MJ, Kim YS, Yim JY и др. Проспективная оценка нового теста на антиген стула для обнаружения Helicobacter pylori в сравнении с гистологией, экспресс-тестом на уреазу, (13) дыхательным тестом на C-мочевину и серологией.J Gastroenterol Hepatol. 2011; 26: 1053–1059. [PubMed] [Google Scholar] 98. Demirtürk L, Yazgan Y, Tarçin O, Ozel M, Diler M, Oncül O, Yildirim S. Влияет ли N-ацетилцистеин на чувствительность и специфичность теста на антиген стула Helicobacter pylori? Helicobacter. 2003. 8: 120–123. [PubMed] [Google Scholar] 99. Inelmen EM, Gasparini G, Sergi G, Enzi G. Оценка Helicobacter pylori с помощью анализа стула на антиген у ослабленных пожилых пациентов. Сканд Дж Гастроэнтерол. 2005; 40: 794–799. [PubMed] [Google Scholar] 101.Ueda J, Okuda M, Nishiyama T., Lin Y, Fukuda Y, Kikuchi S. Диагностическая точность набора для тестирования сывороточных антител E-plate при обнаружении инфекции Helicobacter pylori среди японских детей. J Epidemiol. 2014; 24: 47–51. [Бесплатная статья PMC] [PubMed] [Google Scholar] 102. Марчилдон П.А., Сугияма Т., Фукуда Ю., Пикок Дж. С., Асака М., Симояма Т., Грэм Д. Я. Оценка влияния вариации штамм-специфического антигена на точность серологической диагностики инфекции Helicobacter pylori. J Clin Microbiol. 2003. 41: 1480–1485.[Бесплатная статья PMC] [PubMed] [Google Scholar] 103. Hoang TT, Wheeldon TU, Bengtsson C, Phung DC, Sörberg M, Granström M. Иммуноферментный анализ на Helicobacter pylori нуждается в корректировке для исследуемой популяции. J Clin Microbiol. 2004. 42: 627–630. [Бесплатная статья PMC] [PubMed] [Google Scholar] 104. Khalifeh Gholi M, Kalali B, Formichella L, Göttner G, Shamsipour F, Zarnani AH, Hosseini M, Busch DH, Shirazi MH, Gerhard M. Helicobacter pylori FliD является высокочувствительным и специфическим маркером для серологической диагностики H.pylori. Int J Med Microbiol. 2013; 303: 618–623. [PubMed] [Google Scholar] 105. Формичелла Л., Ромберг Л., Больц С., Вьет М., Гепперт М., Гёттнер Г., Нёльтинг К., Вальтер Д., Шепп В., Шнайдер А. и др. Иммуноферментный анализ новой линии, основанный на рекомбинантных факторах вирулентности, позволяет проводить высокоспецифичную и чувствительную серологическую диагностику инфекции Helicobacter pylori. Clin Vaccine Immunol. 2013; 20: 1703–1710. [Бесплатная статья PMC] [PubMed] [Google Scholar] 106. Пан KF, Formichella L, Zhang L, Zhang Y, Ma JL, Li ZX, Liu C, Wang YM, Goettner G, Ulm K, et al.Ответы антител против Helicobacter pylori и эволюция предраковых поражений желудка в китайской популяции. Int J Cancer. 2014; 134: 2118–2125. [PubMed] [Google Scholar] 107. Бурукоа С., Дельшер Дж. С., Курийон-Малле А., де Корвин Дж. Д., Мегро Ф., Зербиб Ф., Раймонд Дж., Фошер Дж. Л.. Сравнительная оценка 29 коммерческих серологических наборов Helicobacter pylori. Helicobacter. 2013; 18: 169–179. [PubMed] [Google Scholar] 108. Абнет СС, Чжэн В., Йе В., Камангар Ф., Джи Б.Т., Перссон С., Ян Джи, Ли Х.Л., Ротман Н., Шу ХО и др.Пепсиногены плазмы, антитела против Helicobacter pylori и риск рака желудка в когорте Шанхайского исследования здоровья женщин. Br J Рак. 2011; 104: 1511–1516. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Ёсида Т., Като Дж., Иноуэ И., Ёсимура Н., Дегучи Х., Мукубаяси К., Ока М., Ватанабэ М., Эномото С., Нива Т. и др. Развитие рака на основе хронического активного гастрита и вызванной им атрофии желудка, что оценивается по уровням пепсиногена в сыворотке крови и титру антител к Helicobacter pylori. Int J Cancer.2014; 134: 1445–1457. [PubMed] [Google Scholar] 110. Ханэда М., Като М., Исигаки С., Судзуки М., Такахаши М., Накагава М., Оно С., Мори И., Мабе К., Накагава С. и др. Идентификация группы высокого риска рака желудка с использованием сывороточного пепсиногена после успешной ликвидации Helicobacter pylori. J Gastroenterol Hepatol. 2013; 28: 78–83. [PubMed] [Google Scholar] 111. McNicholl AG, Forné M, Barrio J, De la Coba C, González B, Rivera R, Esteve M, Fernandez-Bañares F, Madrigal B, Gras-Miralles B и др. Точность GastroPanel в диагностике атрофического гастрита.Eur J Gastroenterol Hepatol. 2014; 26: 941–948. [Бесплатная статья PMC] [PubMed] [Google Scholar] 112. Шиката К., Ниномия Т., Йонемото К., Икеда Ф., Хата Дж., Дой Й, Фукухара М., Мацумото Т., Иида М., Китазоно Т. и др. Оптимальное пороговое значение уровня пепсиногена в сыворотке для прогнозирования заболеваемости раком желудка: исследование Хисаяма. Сканд Дж Гастроэнтерол. 2012; 47: 669–675. [PubMed] [Google Scholar] 113. Карами Н., Талебхан Й., Сабери С., Эсмаили М., Огалайе А., Абдирад А., Мостафави Е., Хоссейни М.Э., Мохагеги М.А., Мохаммади М.Серореактивность к антигенам Helicobacter pylori как индикатор риска рака желудка. Азиатский Pac J Cancer Prev. 2013; 14: 1813–1817. [PubMed] [Google Scholar] 114. Zhao Z, Li Y, Liu S, Fu W. Сывороточные антитела Helicobacter pylori CagA нельзя использовать в качестве онкомаркера для диагностики рака желудка в странах Восточной Азии. Tumor Biol. 2014; 35: 12217–12224. [PubMed] [Google Scholar] 115. Мухсен К., Атхамна А., Атхамна М., Спунгин-Бялик А., Коэн Д. Оценка иммуноферментного анализа мочи для выявления инфекции Helicobacter pylori среди здоровых детей израильских арабов от 3 до 5 лет.J Pediatr Gastroenterol Nutr. 2006; 43: 398–401. [PubMed] [Google Scholar] 116. Окуда М., Камия С., Книга М., Кикучи С., Осаки Т., Хиватани Т., Маекава К., Фукуда Ю. Диагностическая точность наборов на основе мочи для обнаружения антител к Helicobacter pylori у детей. Pediatr Int. 2013; 55: 337–341. [PubMed] [Google Scholar] 117. Луцца Ф., Именео М., Мараско А., Кротта С., Иерарди Е., Усай П., Вирджилио С., Нардоне Г., Марчи С., Санна Г. и др. Оценка коммерческого серологического набора для определения иммуноглобулина G в слюне к Helicobacter pylori: многоцентровое исследование.Eur J Gastroenterol Hepatol. 2000; 12: 1117–1120. [PubMed] [Google Scholar] 118. Ян Б.Л., Йе Ц., Квонг В.Г., Ли С.Д. Новый одноэтапный тест на антиген слюны Helicobacter pylori. J Chin Med Assoc. 2015; 78: 96–100. [PubMed] [Google Scholar] 119. Брейден Б. Диагностика инфекции Helicobacter pylori. BMJ. 2012; 344: e828. [PubMed] [Google Scholar] 120. Сичински Л.А., Корреа П., Браво Л.Е., Пик Р.М., Уилсон К.Т., Ло Дж. Т., Йепез М.С., Голд Б.Д., Томпсон Д.Т., Обложка Т.Л. и др. Неинвазивное генотипирование Helicobacter pylori cagA, vacA и hopQ у бессимптомных детей.Helicobacter. 2012; 17: 96–106. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Xiong LJ, Tong Y, Wang Z, Mao M. Выявление устойчивой к кларитромицину Helicobacter pylori с помощью ПЦР стула у детей: всесторонний обзор литературы. Helicobacter. 2013; 18: 89–101. [PubMed] [Google Scholar] 122. Ананд П.С., Камат К.П., Анил С. Роль зубного налета, слюны и заболеваний пародонта в инфекции Helicobacter pylori. Мир Дж. Гастроэнтерол. 2014; 20: 5639–5653. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123.Огая Ю., Номура Р., Ватанабе Ю., Накано К. Обнаружение ДНК Helicobacter pylori в образцах воспаленной пульпы зуба от японских детей и подростков. J Med Microbiol. 2015; 64: 117–123. [PubMed] [Google Scholar] 124. Amiri N, Abiri R, Eyvazi M, Zolfaghari MR, Alvandi A. Частота Helicobacter pylori в зубном налете, возможно, недооценена. Arch Oral Biol. 2015; 60: 782–788. [PubMed] [Google Scholar] 125. Чой Й.Дж., Ким Н., Лим Дж., Чо Си, Шин СМ, Ли Х.С., Ли Ш., Пак Й.С., Хван Дж. Х., Ким Дж. У. и др.Точность диагностических тестов на Helicobacter pylori у больных с кровотечением из язвенной болезни. Helicobacter. 2012; 17: 77–85. [PubMed] [Google Scholar] 126. Ло С.К., Лай К.Х., Пэн Нью-Джерси, Ло Г.Х., Ценг Х.Х., Лин С.К., Ши С.Б., Ву С.М., Чен Ю.С., Хуанг В.К. и др. Полимеразная цепная реакция: чувствительный метод выявления инфекции Helicobacter pylori при кровоточащих пептических язвах. Мир Дж. Гастроэнтерол. 2005; 11: 3909–3914. [Бесплатная статья PMC] [PubMed] [Google Scholar] 127. Рамирес-Лазаро М.Дж., Ларио С., Казалотс А., Санфелиу Э, Бойкс Л., Гарсиа-Иглесиас П., Санчес-Дельгадо Д., Монтсеррат А., Белла-Куэто М. Р., Галлах М. и др.ПЦР в реальном времени улучшает обнаружение Helicobacter pylori у пациентов с кровотечением из язвенной болезни. PLoS One. 2011; 6: e20009. [Бесплатная статья PMC] [PubMed] [Google Scholar] 128. Баркун А.Н., Барду М., Койперс Э.Дж., Сунг Дж., Хант Р.Х., Мартель М., Синклер П. Рекомендации международного консенсуса по ведению пациентов с кровотечением из неварикозно-верхних отделов желудочно-кишечного тракта. Ann Intern Med. 2010. 152: 101–113. [PubMed] [Google Scholar] 129. Санчес-Дельгадо Дж., Джене Э, Суарес Д., Гарсия-Иглесиас П., Брюлле Э, Галлах М., Феу Ф, Гисберт Дж. П., Кальвет X.Была ли недооценена распространенность H. pylori при кровоточащей язвенной болезни? Мета-регресс. Am J Gastroenterol. 2011; 106: 398–405. [PubMed] [Google Scholar] 130. Kim JJ, Lee JS, Olafsson S, Laine L. Низкая приверженность к тестированию на Helicobacter pylori у госпитализированных пациентов с кровоточащей язвенной болезнью. Helicobacter. 2014; 19: 98–104. [PubMed] [Google Scholar] 131. Тянь XY, Чжу Х, Чжао Дж, Ше Кью, Чжан Джи. Диагностическая эффективность дыхательного теста на мочевину, экспресс-теста на мочевину и гистологии инфекции Helicobacter pylori у пациентов с частичной гастрэктомией: метаанализ.J Clin Gastroenterol. 2012; 46: 285–292. [PubMed] [Google Scholar] 132. Ян Дж., Ямагути Т., Одака Т., Сузуки Т., Охьяма Н., Хара Т., Судо К., Накамура К., Денда Т., Такигучи Н. и др. Тест на антиген в кале — надежный метод обнаружения Helicobacter pylori в желудочном остатке после дистальной резекции желудка по поводу рака желудка. J Clin Gastroenterol. 2010; 44: 73–74. [PubMed] [Google Scholar] 133. Варди Дж., Шалев Т., Шевах О., Боаз М., Авни Ю., Ширин Х. Быстрый дыхательный тест на 13C-мочевину в непрерывном режиме в реальном времени для обнаружения Helicobacter pylori у пациентов после частичной гастрэктомии.J Clin Gastroenterol. 2012; 46: 293–296. [PubMed] [Google Scholar] 134. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Yoon H, Shin CM, Park YS, Lee DH. Диагностическая валидность дыхательного теста (13) c-мочевины у пациентов, подвергшихся гастрэктомии: ретроспективное когортное исследование одного третичного центра. J Cancer Prev. 2014; 19: 309–317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 135. Kwon YH, Kim N, Lee JY, Choi YJ, Yoon K, Hwang JJ, Lee HJ, Lee A, Jeong YS, Oh S и др. Диагностическая ценность теста на выдыхание C-мочевины без лимонной кислоты в высоких дозах (13) после эрадикации Helicobacter pylori в Корее.Helicobacter. 2015; 20: 159–168. [PubMed] [Google Scholar] 136. Patel SK, Mishra GN, Pratap CB, Jain AK, Nath G. Helicobacter pylori не искореняется после тройной терапии: исследование на основе вложенной ПЦР. Biomed Res Int. 2014; 2014: 483136. [Бесплатная статья PMC] [PubMed] [Google Scholar]Диагностика инфекции Helicobacter pylori
- Барбара Брейден, профессор, гастроэнтеролог-консультант
- 1 Отделение трансляционной гастроэнтерологии, больница Джона Рэдклиффа, больницы Оксфордского университета, Оксфордский университет OX3 9DU, UK
- Для корреспонденции: B Braden Barbara.braden {at} ouh.nhs.uk
В статье исследуется, как проверить инфекцию Helicobacter pylori и когда проверить, сработало ли лечение
Очки обучения
Дыхательный тест на мочевину С 13 или Тест на антиген в стуле может использоваться для неинвазивного скрининга на Helicobacter pylori в «стратегии тестирования и лечения» у более молодых пациентов с диспепсией без тревожных симптомов
Поскольку ингибиторы протонной помпы, антибиотики и острое кровотечение могут вызывать ложные отрицательные результаты (за исключением серологического тестирования), прекратить прием ингибиторов протонной помпы по крайней мере за две недели, а антибиотиков за четыре недели до тестирования; если имеется желудочно-кишечное кровотечение и анализы отрицательны, рассмотрите возможность серологического тестирования или подождите от четырех до восьми недель после события кровотечения и выполните неинвазивный тест (дыхательный тест или тест на антиген в стуле), затем
The 13 C мочевиной дыхание тест и тест на антиген стула надежны и точны для проверки эффективности лечения.
32-летняя медсестра испытывает периодический дискомфорт в верхней части живота более пяти месяцев, особенно во время голодания.Она отрицает потерю веса, периодическую рвоту, дисфагию, лихорадку или изменение привычек кишечника. Признаков желудочно-кишечного кровотечения нет. Она не принимает никаких лекарств, в том числе безрецептурных нестероидных противовоспалительных средств. Она не курит и выпивает около 4 единиц алкоголя в неделю. Обследование брюшной полости показывает легкую болезненность в эпигастрии.
Какое будет следующее расследование?
Диспепсия у пациентов моложе 55 лет без тревожных симптомов не требует эндоскопического исследования.1 Эмпирическое лечение ингибитором протонной помпы или стратегия «тест и лечение» для инфекции Helicobacter pylori являются рекомендуемыми стратегиями ведения в этих условиях и в равной степени экономически эффективны по отношению к контролю симптомов2. Инфекция H pylori обычно приобретается во время в детстве, и распространенность высокая (70-90%) в Азии, Африке, Южной Америке и Восточной Европе и низкая в Западной Европе и Северной Америке (30%). 3 Тестирование на…
Helicobacter pylori (H.pylori) Тестирование
Источники, использованные в текущем обзоре
Сантакроче, Л. и Бутани, М. (9 августа 2018 г., обновлено). Инфекция Helicobacter Pylori. Medscape Gastroenterology. Доступно на сайте https://emedicine.medscape.com/article/176938-overview. Доступ 9.08.18.
Лай, С. (обновлено 1 августа 2017 г.). Тесты на H. pylori. Медицинская энциклопедия MedlinePlus. Доступно на сайте https://medlineplus.gov/ency/article/007501.htm. Доступ 9.08.18.
Кутюрье, М. и Джарбо, Э. (август 2018 г., обновлено). Helicobacter pylori. ARUP Consult. Доступно на сайте https://arupconsult.com/content/helicobacter-pylori. Доступ 9.08.18.
Zingman, B. et. al. (12 октября 2017 г., обновлено). Инфекция Helicobacter pylori. Медицинская энциклопедия MedlinePlus. Доступно на сайте https://medlineplus.gov/ency/article/007715.htm. Доступ 9.08.18.
(© 1995– 2018). Дыхательный тест на Helicobacter pylori. Клиника Мэйо Медицинские лаборатории Мэйо.Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81590. Доступ 9.08.18.
(© 1995– 2018). Антиген Helicobacter pylori, Кал. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно на сайте https://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81806. Доступ 9.08.18.
Sultan, M. et. al. (12 февраля 2018 г., обновлено). Детская инфекция Helicobacter Pylori. Медицинская педиатрия: общая медицина.Доступно на сайте https://emedicine.medscape.com/article/2-overview. Доступ 9.08.18.
(5 апреля 2017 г.) Арманд В. Х. пилори, настоящий желудочный «жук»: кого врачи должны проверять и лечить? Гарвардское здоровье. Доступно на сайте https://www.health.harvard.edu/blog/h-pylori-a-true-stomach-bug-who-should-doctors-test-and-treat-2017040511328. По состоянию на сентябрь 2018 г.
(© 1995–2018). Алгоритм диагностики Helicobacter pylori. Клиника Мэйо Медицинские лаборатории Мэйо. Доступно в Интернете по адресу https: // www.mayocliniclabs.com/it-mmfiles/Helicobacter_pylori_Diagnostic_Algorithm.pdf. По состоянию на сентябрь 2018 г.
© 2018 ARUP Laboratories. Дыхательный тест на Helicobacter pylori. Доступно на сайте https://www.aruplab.com/testing/0020646. По состоянию на сентябрь 2018 г.
Источники, использованные в предыдущих обзорах
Медицинский информационный центр клиники Кливленда. Дыхательный тест на H. pylori (онлайн-информация). Доступно в Интернете по адресу http://www.clevelandclinic.org/health/. По состоянию на февраль 2008 г.
Пагана К., Пагана Т. Мосби Руководство по диагностическим и лабораторным исследованиям. 3-е издание, Сент-Луис: Мосби Эльзевьер; 2006.
Forbes BA, Sahm DF, Weissfeld AS. Диагностическая микробиология Бейли и Скотта, 12-е издание: Мосби Эльзевьер, Сент-Луис, Миссури; 2007.
Чисхолм С.А., Оуэн Р.Дж. Применение анализов на основе полимеразной цепной реакции для быстрой идентификации и скрининга устойчивости к антибиотикам Helicobacter pylori в биоптатах желудка. Diagnosis Microbiol Infect Dis. 11 января 2008 г.
Siddique I, et. al. Диагностика Helicobacter pylori : Повышение чувствительности теста CLO путем увеличения количества биопсий антрального отдела желудка. J Clin Gastroenterol. , апрель 2008 г .; 42 (4): 356-360.
Клиническая химия: принципы, процедуры, взаимосвязи. Епископ М., Дубен-Энгелькирк Дж., Фоди Е., ред. 4-е изд. Филадельфия: Липпинкотт Уильямс и Уилкинс; 2000.
Клиническая химия: теория, анализ и корреляции.Каплан Л., Пеше А., ред. 2-е изд. Сент-Луис: Компания К. В. Мосби; 1989.
Национальный информационный центр по заболеваниям пищеварительной системы. H. pylori и язвенная болезнь. Доступно в Интернете по адресу http://digestive.niddk.nih.gov/ddiseases/pubs/hpylori/. По состоянию на июнь 2011 г.
Майкл Селград, Арне Кандульски и Питер Малфертхайнер. Helicobacter pylori : Диагностика и лечение: Диагностика Helicobacter pylor i. Curr Opin Gastroenterol .2009; 25 (6): 549-556. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/711405_2. По состоянию на июнь 2011 г.
Бауманн А. и Кац П. (обновлено 27 января 2014 г.). Тест на антиген Helicobacter Pylori. Медицинские препараты и болезни [Информация в Интернете]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2117821-overview. По состоянию на октябрь 2014 г.
Сантакроче, Л. и Бутани, М. (обновлено 11 сентября 2014 г.). Инфекция Helicobacter Pylori. Медицинские препараты и болезни [Информация в Интернете].Доступно в Интернете по адресу http://emedicine.medscape.com/article/176938-overview. По состоянию на октябрь 2014 г.
Longstreth, G. (Обновлено 22 августа 2013 г.). Тесты на H. pylori. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/007501.htm. По состоянию на октябрь 2014 г.
ДиМарино, М. (редакция, май 2014 г.). Инфекция Helicobacter pylori. Руководство Merck Professional Edition [Электронная информация]. Доступно в Интернете по адресу http: // www.merckmanuals.com. По состоянию на октябрь 2014 г.
(© 1995–2014). Антитела к Helicobacter pylori, IgA, сыворотка. Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/35755. По состоянию на октябрь 2014 г.
(ноябрь 2013 г.). Инфекция Helicobacter pylori: стратегии использования тестов для диагностики. Коммюнике клиники Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http: //www.mayomedicallaboratories.ком / статьи / коммюнике / 2013/11-hpylori-заражение /. По состоянию на октябрь 2014 г.
Келли, Дж. (30 сентября 2014 г.). ВОЗ призывает провести скрининг на H. pylori для предотвращения рака желудка. Новости Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/832581. По состоянию на октябрь 2014 г.
Baron, E. et. al. (10 июля 2013 г.). Руководство по использованию микробиологической лаборатории для диагностики инфекционных заболеваний: Рекомендации Американского общества инфекционных болезней (IDSA) и Американского общества микробиологов (ASM), 2013 г.[Он-лайн информация]. Доступно в Интернете по адресу http://www.idsociety.org. По состоянию на октябрь 2014 г.
Пагана, К. Д., Пагана, Т. Дж., И Пагана, Т. Н. (© 2015). Справочник по диагностическим и лабораторным испытаниям Мосби, 12-е издание: Mosby, Inc., Сент-Луис, Миссури. Стр. 494-496.
.