цефтриаксон и алкоголь | смешивание спирта и цефтриаксона
Цефтриаксонпродается под торговой маркой Rocephin, представляет собой антибиотик, используемый для лечения ряда бактериальных инфекций. К ним относятся инфекции среднего уха, эндокардит, менингит, пневмония, инфекции костей и суставов, внутрибрюшные инфекции, кожные инфекции, инфекции мочевыводящих путей, гонорея и воспалительные заболевания органов малого таза. Его также иногда используют перед операцией и после укуса, чтобы предотвратить инфекцию. Цефтриаксон можно вводить путем инъекции в вену или мышцу.
Общие побочные эффекты включают боль в месте инъекции и аллергические реакции. Другие возможные побочные эффекты включают: C. несговорчивый-ассоциированная диарея, гемолитическая анемия, заболевание желчного пузыря и судороги. Он не рекомендуется тем, у кого была анафилаксия на пенициллин, но может использоваться тем, у кого были более легкие реакции. Не следует вводить внутривенную форму с внутривенным кальцием. Существуют предварительные доказательства того, что цефтриаксон относительно безопасен при беременности и кормлении грудью. Это цефалоспорин третьего поколения, который предотвращает образование клеточной стенки бактериями.
Существуют предварительные доказательства того, что цефтриаксон относительно безопасен при беременности и кормлении грудью. Это цефалоспорин третьего поколения, который предотвращает образование клеточной стенки бактериями.
Источник
Интересно, что невозможно сказать, какое влияние цефтриаксон и алкоголь окажут на человека из-за их собственного уникального генетического состава и толерантности. Никогда не рекомендуется смешивать цефтриаксон и алкоголь из-за вероятности легких, умеренных и тяжелых побочных эффектов. Если у вас возникла побочная реакция при смешивании цефтриаксона и алкоголя, вам обязательно нужно обратиться в местное отделение неотложной помощи.
Алкоголь и цефтриаксон вызывают разный эффект в зависимости от дозы: многие люди чувствуют возбуждение и укрепление при низких дозах алкоголя и цефтриаксона, и даже смешивание небольшого количества цефтриаксона и алкоголя не рекомендуется.
совместимость, через сколько можно пить
Описание антибиотика
Цефтриаксон относится к антибактериальным препаратам группы цефалоспоринов 3-го поколения.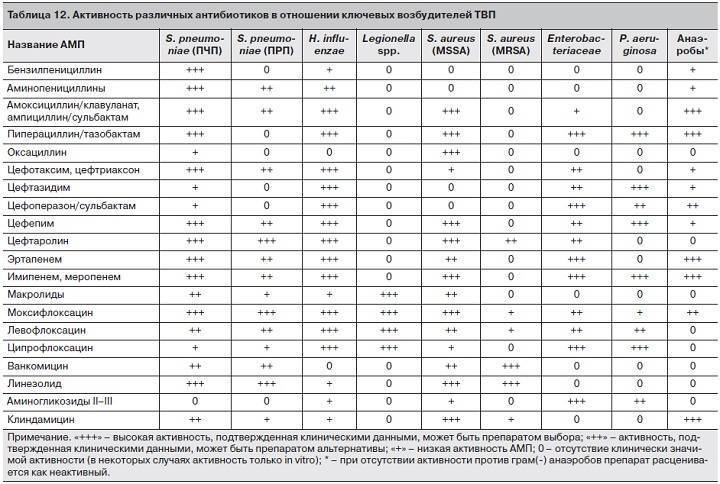 Лекарственное средство быстро уничтожает болезнетворные микроорганизмы, вызывающие воспалительные процессы органов дыхания, мочеполовой системы, ЛОР-органов, используется для профилактики нагноения ожогов, для лечения гнойных ран, сальмонеллеза, менингита.
Лекарственное средство быстро уничтожает болезнетворные микроорганизмы, вызывающие воспалительные процессы органов дыхания, мочеполовой системы, ЛОР-органов, используется для профилактики нагноения ожогов, для лечения гнойных ран, сальмонеллеза, менингита.
После того, как активный компонент Цефтриаксона поступает в организм, он быстро попадает в кровеносное русло и другие физиологические жидкости, накапливаясь в очаге воспаления. Антибиотик в большинстве случаев положительно переносится пациентами и не приводит к развитию последствий и побочных эффектов.
Выявление различных заболеваний говорит о том, что не все пациенты, которым прописан антибиотик, ведут здоровый образ жизни, часто употребляя алкоголь. Поэтому во время лечения возникает насущный вопрос – можно ли пить алкоголь вместе с Цефтриаксоном?
Можно ли применять Цефтриаксон вместе с алкоголем
Общество, благодаря повсеместной рекламе, настроено на то, что никакое существенное взаимодействие Цефтриаксона с алкоголем не наблюдается. Многие люди, включая медицинских работников, считают, что вред данное соединение не принесет, наоборот, будет способствовать быстрейшему выздоровлению.
Многие люди, включая медицинских работников, считают, что вред данное соединение не принесет, наоборот, будет способствовать быстрейшему выздоровлению.
Случай с Цефтриаксоном особенный. Употреблять спиртное больному следует с большой осторожностью, лучше всего будет, если полностью убрать этанол из собственного рациона. Это обусловлено тем, что некоторые препараты, выходцы из группы цефалоспоринов, содержат в своем спектре воздействия специфическое побочное явление, которое проявляется при взаимодействии активного компонента с алкоголем в виде сильнейшего отравления всего организма.
Подобного рода действие происходит у пациентов, страдающих алкоголизмом, но в данное время находящихся под кодированием. При лечении таких людей, активное вещество (цефтриаксон), поступая внутрь органов человека, нейтрализуют процесс расщепления алкоголя.
Это приводит к возникновению сильнейшей интоксикации всего организма:
- Наблюдается сильнейший прилив крови к лицу потребителя спиртных напитков;
- Проявляются резкие перепады артериального давления;
- Присутствует сильная тошнота и обильная рвота;
- Фиксируются болевые ощущения в области живота;
- Стимулируется сильный процесс развития тахикардии.

Выявив возможное состояние человека, одновременно с Цефтриаксоном пить спиртное не стоит. Поэтому пациентам, проходящим курс лечения антибиотиками, запрещено осуществлять прием любого вида алкогольной продукции.
Побочные явления от принятия алкоголя при терапии антибиотиком
Благодаря медицинским обследованиям известно, что
Наиболее распространенное воздействие введенного в организм алкоголя негативно воздействует на внутренние органы, самоконтроль человека и понижает положительный эффект после принятия Цефтриаксона.
Употребляя пиво во время лечения Цефтриаксоном, нарушается процесс действия антибиотика. Происходит остановка блокирования процесса развития патогенных бактерий, что приводит к дальнейшему развитию инфекции в организме пациента. Кроме этого, микроорганизмы начинают вырабатывать иммунитет, что стимулирует рост стойкости их к лекарственному средству.
После ввода Цефтриаксона внутривенно или внутримышечно проявляется боль в месте локализации активного компонента. Если пациент находится в алкогольном опьянении, то его могут настигнуть побочные явления в виде:
- Дисбактериоз;
- Головокружение;
- Рвота;
- Анемия;
- Расстройство желудка;
- Ненормальное функционирование почек и печени;
- Сильные головные боли;
- Аллергическая реакция.
Перед тем как начинается лечение, больной должен сообщать не только симптомы проявления заболевания, но и возможность пристрастия к алкоголю. Поэтому возникает соответствующий вопрос: через сколько можно Цефтриаксон после алкоголя. В данной ситуации однозначного ответа нет.
Выделяют возможные ситуации и длительность выведения алкоголя из организма:
- Если человек основательно любит потреблять спиртные напитки, то для полного выведения потребуется время в течение 5 дней. При прохождении этого периода устраняется возможность развития побочных явлений при взаимодействии препарата с этанолом;
- В случае, если пациент перед приемом врача выпил не больше 1-2 бокалов вина, то для полного выведения алкоголя из крови потребуется от 24 до 48 суток;
- При выявлении у больного воспалительный процесс в почках или мочеполовой системе, период выведения увеличивается до 3-4-х дней.

Время, через которое можно вводить антибиотик, рассчитывается в зависимости от крепости напитка и количество выпитого алкоголя. Длительность этого периода варьирует от нескольких часов до нескольких дней, обычно 2-3-х суток.
Последствия от ввода одновременно и антибиотика и спиртного
Взаимодействие Цефтриаксона с антибиотиком может спровоцировать страшные и опасные для жизни человека последствия, такие как анафилактический шок и кончина пациента. В момент опьянения больной не может контролировать собственные действия и при необходимости позвать на помощь.
Если пить алкоголь во время употребления Цефтриаксона, можно спровоцировать возникновение следующих последствий:
- Терапевтический эффект сводится к нулю, реальные результаты постепенно уничтожаются, увеличением численности патогенных микроорганизмов;
- Активное воздействие препарата полностью прекратится, а инфекция примется за ухудшение состояния с новой силой.
 В итоге придется пить антибиотик более сильного спектра действия, такой как Амоксиклав;
В итоге придется пить антибиотик более сильного спектра действия, такой как Амоксиклав; - Совместное воздействие алкоголя и Цефтриаксона осуществляют мощное воздействие на почки и печень. Двойное влияние лекарства и алкогольного напитка нарушает функции данных органов, благодаря чему последние утрачивают способность нормально осуществлять свою деятельность.
На основании данных результатом Цефтриаксон ни в коем случае нельзя одновременно потреблять вместе со спиртным. Запрет наложен даже на безалкогольное пиво.
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
Цефтриаксон можно ли пить пиво – Telegraph
Цефтриаксон можно ли пить пиво«Vegas» — это команда профессионалов, ответственно подходящих к своему делу!
Качество:
Мы проделали большую работу и постоянно улучшаем качество нашего сервиса.
Надежность:
За время существования мы заработали репутацию надежного и стабильного поставщика.
——————————————————————————————
Купить через Telegram
——————————————————————————————
Отзывы:
Александр Россия 31.200.192.* (19 апреля 2019 | 16:16)
Отличный обменник, всем рекомендую !Только, что совершал покупку криптовалюты, всё прошло быстро и качественно !
Roman Unknown 185.226.112.* (15 апреля 2019 | 10:12)
Менял USD на BTC все четко и быстро, мгновенное пополнение, хорошая работа тех. поддержки.
Богдан Россия 188.113.45.* (15 апреля 2019 | 23:12)
Отличный сервис,в частности менеджер Станислав,очень быстро решил мою проблему,всем советую проводить здесь обмены
Антибиотики довольно часто становятся панацеей от различных заболеваний, цефтриаксон один из них. Но их взаимодействие со спиртными напитками часто может вызвать негативные последствия. Так можно ли употреблять цефтриаксон и алкоголь вместе? Для получения точного ответа на этот вопрос необходимо разобраться в нескольких важных моментах. Этот антибиотик назначается врачом в нескольких случаях. Даже опираясь на заболевания легко понять, можно ли пить алкоголь с цефтриаксон. Он относится к цефалоспоринам третьего поколения и выпускается только в ампулах с порошком. Впоследствии из него изготавливается раствор для внутримышечной инъекции. Этот антиинфекционный препарат используется для лечения следующих заболеваний:. Несмотря на то, что антибиотик отличается сильнодействующим эффектом, большинство пациентов не отмечают побочных воздействий, даже если смешать цефтриаксон с алкоголем. Но специалисты советуют знать о возможной негативной реакции организма:. Стоит помнить, что эти последствия можно усугубить, если одновременно с антибиотиком цефтриаксоном употреблять алкоголь. Стоит помнить, что спиртные напитки принципиально не несут пользу организму, а при употреблении вместе с лекарственными препаратами убивают их воздействие или и вовсе нанесут непоправимый вред организму.
Так можно ли употреблять цефтриаксон и алкоголь вместе? Для получения точного ответа на этот вопрос необходимо разобраться в нескольких важных моментах. Этот антибиотик назначается врачом в нескольких случаях. Даже опираясь на заболевания легко понять, можно ли пить алкоголь с цефтриаксон. Он относится к цефалоспоринам третьего поколения и выпускается только в ампулах с порошком. Впоследствии из него изготавливается раствор для внутримышечной инъекции. Этот антиинфекционный препарат используется для лечения следующих заболеваний:. Несмотря на то, что антибиотик отличается сильнодействующим эффектом, большинство пациентов не отмечают побочных воздействий, даже если смешать цефтриаксон с алкоголем. Но специалисты советуют знать о возможной негативной реакции организма:. Стоит помнить, что эти последствия можно усугубить, если одновременно с антибиотиком цефтриаксоном употреблять алкоголь. Стоит помнить, что спиртные напитки принципиально не несут пользу организму, а при употреблении вместе с лекарственными препаратами убивают их воздействие или и вовсе нанесут непоправимый вред организму. Совместимость антибиотика цефтриаксон и алкоголя нулевая. Но, к сожалению, часто бывают случаи, когда человеку трудно отказаться от даже небольшой порции алкоголя. Например, врач назначает лечение на время отпуска или же дата укола совпадает с праздником. Стоит ли ограничивать себя в выпивке и не смешивать антибиотик цефтриаксон и алкоголь? Ответ утвердительный. Но степень реакции зависит от множества факторов:. Не существует четких указаний, как может воздействовать употребление алкоголя в совокупности с антибиотиками, а именно цефтриаксоном. Но точно известно, что это может привести в общем итоге к следующему:. Из вышесказанного видно, что побочные эффекты можно усугубить, если употреблять алкоголь с цефтриаксоном. Если врач назначил данный препарат, то стоит задуматься и проконсультироваться о возможных последствиях такого соседства антибиотика и этанола в организме. Для быстрого и надежного избавления от алкоголизма наши читатели советуют Препарат ‘Alcolock’. Это натуральное средство, которое блокирует тягу к спиртному, вызывая стойкое отвращение к алкоголю.
Совместимость антибиотика цефтриаксон и алкоголя нулевая. Но, к сожалению, часто бывают случаи, когда человеку трудно отказаться от даже небольшой порции алкоголя. Например, врач назначает лечение на время отпуска или же дата укола совпадает с праздником. Стоит ли ограничивать себя в выпивке и не смешивать антибиотик цефтриаксон и алкоголь? Ответ утвердительный. Но степень реакции зависит от множества факторов:. Не существует четких указаний, как может воздействовать употребление алкоголя в совокупности с антибиотиками, а именно цефтриаксоном. Но точно известно, что это может привести в общем итоге к следующему:. Из вышесказанного видно, что побочные эффекты можно усугубить, если употреблять алкоголь с цефтриаксоном. Если врач назначил данный препарат, то стоит задуматься и проконсультироваться о возможных последствиях такого соседства антибиотика и этанола в организме. Для быстрого и надежного избавления от алкоголизма наши читатели советуют Препарат ‘Alcolock’. Это натуральное средство, которое блокирует тягу к спиртному, вызывая стойкое отвращение к алкоголю. Кроме того, Alcolock запускает восстановительные процессы в органах, которые начал разрушать спирт. Средство не имеет противопоказаний, эффективность и безопасность препарата доказана клиническими исследованиями в НИИ Наркологии. Мнение специалистов Многие псевдопомощники утверждают, что цефтриаксон действует также как и некоторые препараты для лечения алкоголизма, например Тетурам или Аспираль. Свойство этих лекарств в том, что они блокируют распад ацетальдегида, известного как этанол. Таким образом, больной постепенно перестает испытывать потребность в спиртном. Но все это никоим образом не относится к цефтриаксону и подобным антибиотикам. Болезни, при которых назначается цефтриаксон достаточно серьезные. Участились случаи, когда пациенты заявляют, что злоупотребляли спиртными напитками во время приема антибиотиков и не заметили существенной разницы в протекании лечения. Но это очередная байка. В суровой реальности человек осознанно толкает себя на серьезные негативные процессы в организме, когда решает смешать прием цефтриаксона и алкоголя.
Кроме того, Alcolock запускает восстановительные процессы в органах, которые начал разрушать спирт. Средство не имеет противопоказаний, эффективность и безопасность препарата доказана клиническими исследованиями в НИИ Наркологии. Мнение специалистов Многие псевдопомощники утверждают, что цефтриаксон действует также как и некоторые препараты для лечения алкоголизма, например Тетурам или Аспираль. Свойство этих лекарств в том, что они блокируют распад ацетальдегида, известного как этанол. Таким образом, больной постепенно перестает испытывать потребность в спиртном. Но все это никоим образом не относится к цефтриаксону и подобным антибиотикам. Болезни, при которых назначается цефтриаксон достаточно серьезные. Участились случаи, когда пациенты заявляют, что злоупотребляли спиртными напитками во время приема антибиотиков и не заметили существенной разницы в протекании лечения. Но это очередная байка. В суровой реальности человек осознанно толкает себя на серьезные негативные процессы в организме, когда решает смешать прием цефтриаксона и алкоголя. Последствия могут быть весьма неприятными:. Взаимодействие цефтриаксона с алкоголем повышает вероятность получить сильнейшее отравление и развить в организме аллергию. Большая доза алкоголя, употребленная незадолго после укола, может привести к летальному исходу. Большинство из этих симптомов указаны и в побочных эффектах самого препарата, но алкоголь может их усилить, а лечебное действие антибиотика полностью уничтожить. Цефтриаксон, как и подобные препараты дает удар по работе печени и почек, этанол сделать этот удар в разы мощнее. Антибиотики выводятся с мочой и потом из организма в течении минимум двух дней. Но это не значит, что по истечении данного срока можно сразу же хвататься за рюмку. В идеале лучше подождать около пяти дней, чтобы оградить себя от пагубных последствий. Цефтриаксон не предназначен для длительного лечения. Обычно курс не составляет более десяти дней, это не такой долгий срок, чтобы не суметь воздержаться от этанолосодержащих напитков. Смешивать цефтриаксон и алкоголь можно через длительный период времени, то есть после полного выведения из организма лекарства.
Последствия могут быть весьма неприятными:. Взаимодействие цефтриаксона с алкоголем повышает вероятность получить сильнейшее отравление и развить в организме аллергию. Большая доза алкоголя, употребленная незадолго после укола, может привести к летальному исходу. Большинство из этих симптомов указаны и в побочных эффектах самого препарата, но алкоголь может их усилить, а лечебное действие антибиотика полностью уничтожить. Цефтриаксон, как и подобные препараты дает удар по работе печени и почек, этанол сделать этот удар в разы мощнее. Антибиотики выводятся с мочой и потом из организма в течении минимум двух дней. Но это не значит, что по истечении данного срока можно сразу же хвататься за рюмку. В идеале лучше подождать около пяти дней, чтобы оградить себя от пагубных последствий. Цефтриаксон не предназначен для длительного лечения. Обычно курс не составляет более десяти дней, это не такой долгий срок, чтобы не суметь воздержаться от этанолосодержащих напитков. Смешивать цефтриаксон и алкоголь можно через длительный период времени, то есть после полного выведения из организма лекарства.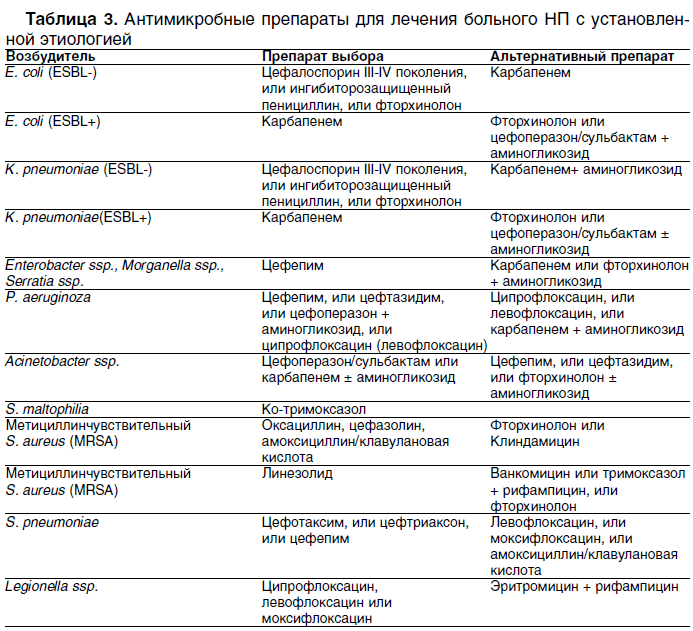 Другой вопрос, если спиртное уже было выпито накануне, а врач посоветовал сейчас же приступить к лечению, и направил на инъекцию антибиотиком. Специалисты советуют не беспокоиться в данном случае, и смело идти на укол. Цефтриаксон не должен вызвать негативных последствий. Но о факте употребления незадолго до приема у врача алкоголя его стоит обязательно предупредить. Только профессионал по общему состоянию пациента сможет определить, вызовет ли эта процедура пагубные реакции и скажет, через сколько можно пить алкоголь после цефтриаксона. В заключении можно сказать, что совместимость алкоголя и цефтриаксона влечет за собой как минимум блокирование лечебного воздействия препарата. Таким образом, пациент потратит впустую время, деньги и нервы. В худшем случае такой симбиоз приведет к тяжелым последствиям для здоровья, вплоть до летального исхода. Употреблять алкоголь при приеме цефтриаксона запрещено медиками! Судя по тому, что вы сейчас читаете эти строки — победа в борьбе с алкоголизмом пока не на вашей стороне И вы уже думали закодироваться? Оно и понятно, ведь алкоголизм — опасное заболевание, которое приводит к серьёзным последствиям: Боли в печени, похмелье, проблемы со здоровьем, работой, личной жизнью Все эти проблемы знакомы вам не понаслышке.
Другой вопрос, если спиртное уже было выпито накануне, а врач посоветовал сейчас же приступить к лечению, и направил на инъекцию антибиотиком. Специалисты советуют не беспокоиться в данном случае, и смело идти на укол. Цефтриаксон не должен вызвать негативных последствий. Но о факте употребления незадолго до приема у врача алкоголя его стоит обязательно предупредить. Только профессионал по общему состоянию пациента сможет определить, вызовет ли эта процедура пагубные реакции и скажет, через сколько можно пить алкоголь после цефтриаксона. В заключении можно сказать, что совместимость алкоголя и цефтриаксона влечет за собой как минимум блокирование лечебного воздействия препарата. Таким образом, пациент потратит впустую время, деньги и нервы. В худшем случае такой симбиоз приведет к тяжелым последствиям для здоровья, вплоть до летального исхода. Употреблять алкоголь при приеме цефтриаксона запрещено медиками! Судя по тому, что вы сейчас читаете эти строки — победа в борьбе с алкоголизмом пока не на вашей стороне И вы уже думали закодироваться? Оно и понятно, ведь алкоголизм — опасное заболевание, которое приводит к серьёзным последствиям: Боли в печени, похмелье, проблемы со здоровьем, работой, личной жизнью Все эти проблемы знакомы вам не понаслышке. Но может все же есть способ избавиться от мучений? Рекомендуем прочитать статью Елены Малышевой о современных методах лечения алкоголизма Ваш электронный адрес не будет опубликован. Перейти к содержанию. Цефтриаксон и алкоголь: Бросайте пить пока не поздно! Маленькая хитрость Как отказаться от алкоголя раз и навсегда? Опухоль в месте укола — явление распространенное и нормальное. Инъекция этим антибиотиком достаточно болезненная, поэтому врачи советуют при домашнем лечении в обязательном порядке добавлять в раствор ледокаин. Мнимый положительный ответ на вопрос: Но на самом деле этанол усиливает шоковую реакцию организма на лекарственные средства. Таким образом, человек будет пребывать в состоянии анафилактического шока, отравления. Симптоматика порой схожа с той, что испытывают алкоголики во время лечения, но в итоге последствия могут быть намного серьезнее. Необходимо читать инструкцию к любому медикаментозному препарату. Производители указали, что совмещать с алкоголем цефтриаксон строго запрещено.
Но может все же есть способ избавиться от мучений? Рекомендуем прочитать статью Елены Малышевой о современных методах лечения алкоголизма Ваш электронный адрес не будет опубликован. Перейти к содержанию. Цефтриаксон и алкоголь: Бросайте пить пока не поздно! Маленькая хитрость Как отказаться от алкоголя раз и навсегда? Опухоль в месте укола — явление распространенное и нормальное. Инъекция этим антибиотиком достаточно болезненная, поэтому врачи советуют при домашнем лечении в обязательном порядке добавлять в раствор ледокаин. Мнимый положительный ответ на вопрос: Но на самом деле этанол усиливает шоковую реакцию организма на лекарственные средства. Таким образом, человек будет пребывать в состоянии анафилактического шока, отравления. Симптоматика порой схожа с той, что испытывают алкоголики во время лечения, но в итоге последствия могут быть намного серьезнее. Необходимо читать инструкцию к любому медикаментозному препарату. Производители указали, что совмещать с алкоголем цефтриаксон строго запрещено. Гнушаться подобными наставлениями — быть врагом своему здоровью. Сказать точно, когда пить алкоголь после антибиотиков цефтриаксон может только врач. Вам все еще кажется, что вылечить алкоголизм невозможно? Алексей Лукашин Нарколог, Психотерапевт, общий стаж более 20 лет. Врач высшей категории. Похожие записи. Можно ли пить алкоголь после стоматолога? Можно ли принимать Афобазол с алкоголем? Совместимость Аркоксиа и алкоголя Можно ли пить алкоголь после ботокса: Возможна ли совместимость Флемоксин Солютаб и алкоголя Можно ли Тержинан с алкоголем? Добавить комментарий Отменить ответ Ваш электронный адрес не будет опубликован. Бросить пить поможет домашний рецепт: Важно знать!
Гнушаться подобными наставлениями — быть врагом своему здоровью. Сказать точно, когда пить алкоголь после антибиотиков цефтриаксон может только врач. Вам все еще кажется, что вылечить алкоголизм невозможно? Алексей Лукашин Нарколог, Психотерапевт, общий стаж более 20 лет. Врач высшей категории. Похожие записи. Можно ли пить алкоголь после стоматолога? Можно ли принимать Афобазол с алкоголем? Совместимость Аркоксиа и алкоголя Можно ли пить алкоголь после ботокса: Возможна ли совместимость Флемоксин Солютаб и алкоголя Можно ли Тержинан с алкоголем? Добавить комментарий Отменить ответ Ваш электронный адрес не будет опубликован. Бросить пить поможет домашний рецепт: Важно знать!
Дез алко
Анонимная линия доверия
Взаимопомощь при алкоголизме
Без ведома больного
Цефтриаксон и алкоголь: проверяем совместимость
Крокодил способ приготовления
Блейзер с какими вкусами
Быстрое избавление от похмелья
Антибиотик цефтриаксон и алкоголь — несовместимы!
На чтение 3 мин. Обновлено
Обновлено
Если почитать инструкцию любого содержащего цефтриаксон препарата, то почти в любой будет написано лаконичная формулировка вроде «Несовместим с этанолом». Но как взаимодействуют цефтриаксон и алкоголь, последствия, каковы они?
Обычно лечение часто является для организма не меньшим стрессом, чем собственно заболевание. Эффективные, но убойные способы лечения с антибиотиками могут быть действенны, но несут за собой некоторые побочные эффекты. Скажем ни для кого ни секрет, что при курсе антибиотиков крайне желательно побеспокоиться о собственных почках, печени и органах желудочно-кишечного тракта.
Актуальны при приёме антибиотиков и антибактериальных средств гепатопротекторы, смягчающие воздействие на печень или бактериальные препараты, восстанавливающие микрофлору кишечника. Во время приёма лекарств организм и так перенапряжён, печень, желудок и остальные органы на пределе, поэтому цефтриаксон и алкоголь только усугубят воздействие друг друга.
Возможные негативные последствия
Совмещение курса антибиотик и распития спиртного для кого-то может и пройти практически незаметно. Дело тут во многом в подготовленности организме и силе. Полностью здоровая печень и почки возможно даже справятся, однако, много ли на свете полностью здоровых людей? Конечно, рисковать не стоит.
Приём антибиотика и спиртного может вызвать тошноту, рвоту, потерю сна и аппетита, головокружение. Кроме того, из-за перегруженности печени опьянение от алкоголя может наступить быстрее, неприятнее и сильнее, чем обычно. Цефтриаксон – сильный антибиотик, применяемый при довольно серьёзных заболеваниях.
Не стоит совмещать курс уколов со спиртным. Более того, нежелательно в этот период сильно отходить от канонов здорового питания. Нужно питаться здоровой пищей, есть больше овощей и клетчатки, употреблять витамины, пить больше воды, чем обычно.
Когда после цефтриаксона можно пить алкоголь?
После окончания курса лекарств лучше всего подождать несколько дней или неделю, в зависимости от тяжести болезни. После этого ваш организм восстановится, и приём спиртного принесёт удовольствие и лёгкость, а не головную боль.
Кратко о препарате цефтриаксон
В основе цефтриаксона лежит одноимённое действующее вещество – антибиотик третьего поколения. Цефтриаксон имеет широкий спектр воздействия, останавливая развитие множества вредных микроорганизмов.
Лекарство назначают при инфекциях дыхательных путей, таких как бронхиты или пневмония, при заболеваниях мочеполовой системы (пиелит, цистит, простатит), при инфекциях желчевыводящих путей и кишечника, перитоните. Также средство применяют при разного рода сепсисах и послеоперационных осложнениях.
Традиционная форма приёма цефтриаксона – раствор, порошок для суспензий. Антибиотик назначают внутривенно или внутримышечно.
Цефтриаксон помогает справиться с ангиной, гайморитом и другими заболеваниями дыхательных путей. Для лечения этих недугов, врач может выписать и такой препарат как флемоксин. Этот антибиотик более деликатно борется с ифекцией. Совместимость флемоксина с алкоголем подробна рассмотрена в статье по ссылке.
Взаимодействие между Цефтриаксон и Алкоголь при одновременном применении
Взаимодействует сПри одновременном применении высоких доз препарата и сильных диуретиков (например, фуросемид), нарушений функции почек не наблюдалось. Нет данных о повышении нефротоксичности аминогликозидов во время применения препарата. Употребление алкоголя при применении препарата не сопровождается протромбина. Цефтриаксон не содержит N-метилтиотетразольнои группы, могла вызвать несовместимость с этанолом и кровоточивость. Пробенецид не влияет на выведение препарата. In vitroбыл обнаружен антагонизм между хлорамфениколом и цефтриаксоном. Диклофенак стимулирует выведение с желчью цефтриаксона и снижает клиренс в моче.
При одновременном применении больших доз препарата и «петлевых» диуретиков (например, фуросемида), нарушений функции почек не наблюдалось. Указаний на то, что цефтриаксон увеличивает нефротоксичность аминогликозидов, нет. Не содержит N-метилтиотетразольной группы, поэтому при взаимодействии с этанолом не приводит к развитию дисульфирамоподобных реакций, присущих некоторым цефалоспоринам. Пробеницид не влияет на выведение Цефтриаксона.
Цефтриаксон и аминогликозиды обладают синергизмом в отношении многих грамотрицательных бактерий. Несовместим с этанолом.
Несовместим с этанолом.
Не совместим с этанолом.
Совместно с аминогликозидами обладает синергизмом в отношении многих грамотрицательных бактерий. Несовместим с алкоголем (возможно покраснения лица, спазм в животе и области желудка, тошнота, рвота, головная боль, снижение АД, тахикардия, отдышка). HПВС и другие ингибиторы агрегации тромбоцитов увеличивают вероятность кровотечения. При одновременном применении с петлевыми диуретиками и другими нефротоксичными препаратами возрастает риск развития нефротоксического эффекта. Фармацевтически несовместим с растворами других антибиотиков.
При одновременном применении больших доз препарата Цефтриаксон и «петлевых» диуретиков (например, фуросемида) нарушений функции почек не наблюдалось. Имеются противоречивые данные о вероятности повышения нефротоксичности аминогликозидов при их применении с цефалоспоринами, поэтому необходимо проводить мониторинг почечной функции и концентрации аминогликозицов в крови. Употребление алкоголя
после введения препарата Цефтриаксон не сопровождалось дисульфирамоподобной реакцией. Цефтриаксон не содержит N-метилтиотетразольной группы, которая могла бы вызвать непереносимость этанола и кровоточивость, что присуще некоторым другим цефалоспоринам.
Цефтриаксон не содержит N-метилтиотетразольной группы, которая вызывает дисульфирамоподобные эффекты при одновременном применении этанола и кровоточивость, которые присущи некоторым цефалоспоринам. При беременности применяют только в случае, если предполагаемая польза для матери превышает риск для плода. При необходимости назначения препарата в период лактации следует прекратить грудное вскармливание.
Во время лечения противопоказано употребление этанола — возможны дисульфирамоподобные эффекты (покраснение лица, спазм в области желудка, тошнота, рвота, головная боль, снижение АД, тахикардия, одышка).
Во время лечения противопоказано применение этанола — возможны дисульфирамоподобные эффекты (покраснение лица, спазм в животе и в области желудка, тошнота, рвота, головная боль, снижение артериального давления, тахикардия, одышка). Несмотря на подробный сбор анамнеза, что является правилом и для других цефалоспориновых антибиотиков, нельзя исключить возможность развития анафилактического шока, который требует немедленной терапии — сначала внутривенно вводят эпинефрин, затем глюкокортикостероиды.
Цефтриаксон не содержит N-метилтиотетразольной группы, поэтому при взаимодействии с этанолом не приводит к развитию дисульфирамоподобных реакций и кровоточивости, которые присущи некоторым цефалоспоринам.
Не содержит N-метилтиотетразольной группы, поэтому при взаимодействии с этанолом не приводит к развитию дисульфирамоподобных реакций, присущих некоторым цефалоспоринам.
Исследование фармакокинетики Сульбактомакса | Интернет-издание «Новости медицины и фармации»
Введение
Цефалоспорины третьего поколения были введены в клиническую практику в начале 1980-х и с тех пор зарекомендовали себя как эффективные и достаточно безопасные препараты для лечения многих серьезных инфекций (Donowitz и Masndell, 1998). Цефалоспорины относятся к b-лактамным антибиотикам. Цефтриаксон — полусинтетический цефалоспорин третьего поколения широкого спектра действия, обладающий мощной бактерицидной активностью в отношении широкого спектра грамположительных и грамотрицательных бактерий. В основе антибактериальной активности цефтриаксона лежит его способность угнетать синтез элементов клеточной стенки.
Сульбактам был относительно недавно одобрен к применению во многих странах и применяется в сочетании с b-лактамными антибиотиками. Это вещество ингибирует b-лактамазу — фермент, продуцируемый микроорганизмами, который разрушает антибиотик. Это мощный высокоспецифичный ингибитор b-лактамаз расширенного спектра, которые продуцируют часто встречающиеся грамотрицательные аэробы и анаэробы. Формируя протеиновый комплекс с b-лактамазами, сульбактам необратимо блокирует их деструктивную гидролитическую активность. Таким образом, добавление сульбактама к цефтриаксону позволяет в полной мере восстановить потенциал последнего в отношении Enterobacter и Pseudomonas.
Цефалоспорины третьего поколения — мощные антибактериальные препараты, которые применяют для лечения угрожающих жизни инфекций. Однако в последние годы все чаще сообщается о резистентности к этим препаратам, в особенности среди представителей Enterobacteriaceae, что связано с продолжающимся распространением b-лактамаз широкого спектра. Guerra-Romero и соавторы (1991) сообщали о результатах применения в эксперименте комбинации производного пенициллина (ампициллин) с сульбактамом для лечения менингита, вызванного штаммом Escherichia coli (K-1), продуцирующим b-лактамазу.
Затем с целью предотвращения появления резистентных бактерий была предложена комбинация цефалоспорина (цефтриаксон) с ингибитором b-лактамазы (сульбактам) (Caron и соавторы, 1990; Chambers и Fournier, 1993).
Было проведено много исследований по изучению фармакокинетики цефтриаксона и сульбактама по отдельности у здоровых добровольцев и пациентов. Однако данных исследований, в которых изучали фармакокинетику комбинации «цефтриаксон + сульбактам» (Сульбактомакс) в фиксированных дозах, крайне мало. В связи с этим в данном исследовании планировалось изучить фармакокинетику Сульбактомакса, цефтриаксона и сульбактама по отдельности у здоровых добровольцев, с тем чтобы выявить изменения фармакокинетического профиля FDC. Кроме этого, для обоснования доз в FDC мы определили минимальную ингибирующую концентрацию (MIC) Сульбактомакса для некоторых грамположительных и грамотрицательных микроорганизмов.
Материалы и методы
Субъекты
В соответствии с критериями включения и исключения в открытое сравнительное исследование фармакокинетических особенностей Сульбактомакса было включено 8 здоровых мужчин-добровольцев.
Критерии включения
Здоровые добровольцы в возрасте 22–32 года, с массой тела в пределах 55–80 кг. Все субъекты не курили, не употребляли алкоголь; при физикальном обследовании у них не было отмечено признаков заболеваний или нарушений. Все отобранные субъекты не принимали участия в каких-либо медицинских исследованиях в течение последних трех месяцев и давали письменное согласие на участие.
Критерии исключения
Субъектов исключали, если в анамнезе имелись указания на гиперчувствительность к препарату или подобным веществам, нарушения функции почек или печени, а также любые клинически значимые заболевания в течение 4 недель, предшествующих началу исследования, либо госпитализация в стационар в течение предшествующих 3 месяцев.
Отказ от участия и выход из исследования
Волонтеры имели право выйти из исследования в любой момент, не указывая причину. Субъектов могли исключить из исследования в связи со следующими причинами: побочные эффекты, интеркуррентные заболевания, низкий комплайенс и решение самого исследуемого. Если субъект не придерживается предусмотренных протоколом правил в отношении употребления алкоголя, препаратов, пищи и др., то он может быть исключен из исследования.
Сопутствующее лечение
Все волонтеры были проинформированы о том, что не следует принимать какие-либо препараты в течение 14 дней до начала исследования. Исследование проводилось в соответствии с Хельсинкской декларацией и после одобрения независимым комитетом по этике.
Физикальное обследование
Всех волонтеров обследовали за два дня до начала исследования.
Дизайн исследования
Доза и способ введения
Добровольцам, которые ничего не ели в течение ночи, вводили внутривенно в виде 30-минутной инфузии 1,5 г Сульбактомакса, разведенного в 50 мл физиологического раствора. Пациенты не ели еще в течение 3 часов после введения препарата. Через 15 дней периода вымывания волонтерам вводили цефтриаксон (1 г) и еще через 15 дней — сульбактам (500 мг).
Образцы крови
Образцы крови набирали за 15 минут до инфузии и затем через 0,5, 1, 1,5, 2, 4, 8, 12 и 24 ч после ее проведения, помещали в гепаринизированные тубы темно-синего цвета и немедленно центрифугировали. Плазму отделяли и хранили до момента использования при температуре –20°.
Гематологические показатели
Определяли такие показатели, как количество лейкоцитов, скорость оседания эритроцитов, гемоглобин.
Биохимические показатели
Определяли уровень глютаминовой оксалоацетиновой и пировиноградной трансаминаз (SGOT и SGPT), щелочной фосфатазы (ALP), сахара, мочевины и креатинина. Все эти показатели определяли с помощью анализатора Merck и соответствующих диагностических наборов.
Жидкостная хроматография
Цефтриаксон и сульбактам выявляли в сыворотке посредством высококачественной жидкостной хроматографии (HPLC Agilant 1200 series, Santa Clara, CA, USA), оборудованной четырехкомпонентной помпой G1311A, детектором и автоинжектором G1329A.
Подвижная фаза
Буферный раствор состоял из 50 мл тетрабутил аммония хлорида (TBAH), разведенного в 1000 мл дистиллированной воды и доведенного до pH 7,0 ортофосфорной кислотой. Растворитель, который использовали в подвижной фазе, представлял собой смесь буфера с ацетонитрилом в соотношении 70 : 30. Мобильную фазу пропускали через мембранный фильтр (Millipore corp., Billerica, MA, USA) c размером пор 0,45 мм и дегазировали в условиях пониженного давления.
Анализ концентраций цефтриаксона и сульбактама
Цефтриаксон и сульбактам анализировали с помощью метода Shrivastava и соавторов (2009). Для определения концентраций цефтриаксона и сульбактама в образцах плазмы 200 мл последнего смешивали с 150 мл подвижной фазы и энергично встряхивали. Хроматографическую сепарацию цефтриаксона и сульбактама проводили посредством HPLC с подвижной фазой. Для анализа применяли колонку Hypersil ODS C18(5 мкм, 4,6 ґ 250 мм). Скорость потока и температура колонки поддерживались на уровне 1,5 мл/мин и 25° соответственно. После уравновешивания колонки подвижной фазой в течение 2 часов вводили 20 мл образца и с помощью ультрафиолетовой волны длиной 220 нм определяли цефтриаксон и сульбактам. При вышеописанных условиях время удержания для цефтриаксона и сульбактама составляло 5,2 и 3,3 минуты соответственно.
Статистический анализ
Фармакокинетические параметры статистически анализировали с использованием двухфакторного анализа вариантности с целью выявления влияния дозы. Эффекты дозы затем сравнивали с применением двустороннего t-теста.
Результаты
Побочных реакций у волонтеров, принимавших изучаемые препараты в виде FDC, не наблюдали.
Средние плазменные концентрации цефтриаксона и сульбактама через 30 минут после внутривенного введения представлены в табл. 1. Максимальные концентрации цефтриаксона и сульбактама после применения Сульбактомакса составляли 152,06 ± 6,65 и 21,32 ± 1,79 мг/мл соответственно. Пиковые плазменные концентрации цефтриаксона и сульбактама при использовании по отдельности у одних и тех же волонтеров после периода вымывания составляли 153,75 ± 6,43 и 21,42 ± 1,28 мг/мл соответственно. Через 24 часа после введения средние плазменные концентрации цефтриаксона (Сульбактомакс) и цефтриаксона как отдельного препарата составляли 8,38 ± 1,96 и 6,18 ± 1,62 мг/мл соответственно. Не наблюдали значимых изменений плазменной концентрации цефтриаксона и сульбактама при их использовании в комбинации или по отдельности.
Период T1/2 и AUC (площадь под кривой) для цефтриаксона после введения Сульбактомакса составили 5,20 ± 0,35 ч и 760,16 ± 27,68 мг/ч/мл соответственно. Эти же показатели при введении только цефтриаксона составляли 5,600 ± 0,436 ч и 742,16 ± 29,56 мг/ч/мл соответственно. Значительных изменений в показателях T1/2 и AUC при использовании цефтриаксона в составе Сульбактомакса или цефтриаксона в отдельности не было отмечено. T1/2 и AUC для сульбактама (Сульбактомакс) составляли 0,940 ± 0,038 ч и 20,740 ± 2,347 мг/ч/мл соответственно; подобным образом при введении только сульбактама эти показатели составили 0,985 ± 0,107 ч и 19,750 ± 1,876 мг/ч/мл. Значимых различий показателей T1/2 и AUC при использовании сульбактама в составе Сульбактомакса или сульбактама в отдельности не отмечено (табл. 2).
Константа скорости элиминации для цефтриаксона (Сульбактомакс) составила 0,133 ± 0,009 ч–1, а для цефтриаксона в отдельности — 0,123 ± 0,010 ч–1. Значительных отличий в этом показателе для цефтриаксона в комбинации по сравнению с этим же препаратом, применяемым в отдельности, не отмечали. Константа скорости элиминации для сульбактама (Сульбактомакс) — 0,732 ± 0,029 ч–1 и для этого вещества в отдельности — 0,707 ± 0,070 ч–1. Подобным образом не было выявлено значительных отличий этого показателя при использовании сульбактама в комбинации (Сульбактомакс) или по отдельности.
После применения Сульбактомакса не наблюдали статистически значимых отличий в гематологических и биохимических показателях по сравнению с исходными, что свидетельствует об отсутствии гепато- и нефротоксичных эффектов изучаемой фиксированной комбинации (табл. 3). Для уточнения режима дозирования определяли MIC для некоторых микроорганизмов (табл. 4).
Обсуждение
Цефтриаксон — антибиотик широкого спектра действия, который обладает мощной активностью против грамположительных и грамнотрицательных микроорганизмов. О фармакокинетических свойствах цефтриаксона и сульбактама по отдельности сообщалось в ряде публикаций. Комбинация этих препаратов (цефтриаксон + сульбактам) активна в отношении всех чувствительных к цефтриаксону бактерий. Кроме того, комбинация характеризуется синергической активностью (меньший показатель MIC для комбинации, чем для каждого из препаратов по отдельности) в отношении целого ряда микроорганизмов. Не отмечается изменений фармакокинетических характеристик препаратов в комбинации по сравнению с отдельными препаратами, и между ними нет межлекарственных взаимодействий (Yonghong и соавторы, 2006).
Это исследование было проведено с целью изучения фармакокинетических свойств Сульбактомакса и сравнения их с соответствующими показателями для цефтриаксона и сульбактама, вводимых по отдельности в виде внутривенной инфузии. Полученные результаты свидетельствуют о том, что при введении 1,5 г Сульбактомакса, содержащего 1 г цефтриаксона, плазменные концентрации последнего в различные промежутки времени были одинаковыми. Аналогичные данные сообщали другие исследователи при введении 1 г цефтриаксона (Patel и соавторы, 1981; Meyers и соавторы, 1983). Концентрации сульбактама после внутривенной инфузии, которые мы наблюдали в нашем исследовании, согласуются с ранее полученными данными (Foulds и соавторы, 1983).
Период полувыведения цефтриаксона в составе Сульбактомакса и в отдельности, который мы получили, сопоставим с аналогичным показателем, о котором сообщали другие исследователи. Подобным образом T1/2 сульбактама в комбинации или отдельно был подобен таковому, полученному в работе Foulds и соавторов (1983). Полученное нами значение константы скорости элиминации цефтриаксона в составе комбинации (Сульбактомакс) или в отдельности после внутривенного введения очень близко к таковому, о котором сообщают Luderer и соавторы (1984). Значения константы скорости элиминации для сульбактама в комбинации или по отдельности были ниже, чем в исследовании Foulds и соавторов (1983).
Площадь под кривой для цефтриаксона в комбинации (Сульбактомакс) и отдельно после внутривенного введения в нашем исследовании оказалась несколько меньше, чем таковая в работе Meyers и соавторов (1983). Этот же показатель (AUC) для сульбактама в комбинации или отдельно после внутривенного введения сравним с таковым, о котором сообщали Foulds и соавторы (1983). Полученные нами результаты однозначно указывают на отсутствие фармакокинетических взаимодействий между компонентами комбинации (цефтриаксон + сульбактам).
Через 24 часа после внутривенного введения Сульбактомакса плазменные концентрации цефтриаксона и сульбактама превышают MIC. Это говорит о том, что 1 дозы препарата достаточно для адекватного лечения многих состояний, вызванных большинством грамположительных и грамотрицательных бактерий. Эти наблюдения согласуются с данными других исследователей. Однако MIC для S.aureus составляет 32 мг/мл, так как этот микроорганизм экспрессирует дополнительный пенициллин-связывающий протеин 2 (PBP2) со сниженной аффинностью к b-лактамным антибиотикам, и потому MIC для него несколько выше (Taylor и соавторы, 2003).
Не отмечено значительных изменений гематологических показателей после лечения Сульбактомаксом. Индуцированная цефалоспоринами гепатотоксичность — явление редкое. Типичным побочным эффектом является образование камней в желчном пузыре (холелитиаз). Сообщалось лишь о редких случаях повышения ферментов печени в связи с лечением цефтриаксоном. Lee и соавторы (2009) отмечают, что цефтриаксон обладает меньшим количеством побочных эффектов. В этом исследовании не отмечали значительных изменений показателей SGOT, SGPT и ALP до начала лечения комбинацией (Сульбактомакс) и после него, что свидетельствует об отсутствии гепатотоксичности. Nechifor и соавторы (1992) также сообщали, что не наблюдали связанных с лечением изменений в органах разных видов.
О нефротоксичных эффектах при использовании цефалоспоринов широкого спектра действия никогда не сообщалось (Fekety, 1990). Beauchamp и соавторы (1994) отмечали, что цефтриаксон сам по себе не оказывает негативного влияния на функцию почек, лизосомальный ферментный профиль или регенерацию клеток. Наши результаты свидетельствуют об отсутствии нарушения функции почек после применения Сульбактомакса, что свидетельствует о безопасности препарата.
Наконец, наши результаты указывают на отсутствие изменений фармакокинетических показателей при использовании комбинации (Сульбактомакс) по сравнению с применением препаратов комбинации по отдельности. Исходя из показателей MIC и концентрации Сульбактомакса в разные промежутки времени, одна доза препарата в сутки является достаточной для лечения инфекций, вызванных чувствительными микроорганизмами.
Payasi A., Chaudhary M., Gupta A., Dwivedi V.K., Bhatnagar A. Pharmacokinetic study of sulbactomax // J. Toxicol. Sci. — 2010 Aug. — 35(4). — 459-64 (http://www.jstage.jst.go.jp/article/jts/35/4/459/_pdf)
Роспотребнадзор назвал ограничения при прививке от коронавируса
Переохлаждение или перегрев, употребление вызывающих аллергию продуктов и вообще любой стресс противопоказаны тем, кто вакцинируется от COVID-19, рассказали в Роспотребнадзоре. Кроме того, по словам главы ведомства Анны Поповой, желающие сделать прививку от коронавируса нового типа должны также быть готовы к отказу от алкоголя на 56 дней.
«[После вакцинации] следует избегать стрессов для организма, таких как переохлаждение и перегрев, употребления в пищу продуктов, которые могут спровоцировать аллергическую реакцию», — приводит РИА «Новости» сообщение пресс-службы Роспотребнадзора.
Одним из самых актуальных запретов, связанных с вакцинацией, является строжайшее ограничение в употреблении алкоголя. По словам главы Роспотребнадзора Анны Поповой, планирующим поучаствовать в прививочной кампании следует забыть об алкоголе за две недели до процедуры, сообщает «Интерфакс».
Кроме того, спиртные напитки нежелательно употреблять в течение 42 дней после первой инъекции. Это обусловлено тем, что период между первой и второй прививкой составляет 21 день, и еще столько же времени необходимо организму для формирования иммунитета.
Таким образом, желающие сделать прививку от коронавируса нового типа должны быть готовы к отказу от алкоголя на 56 дней. Помимо этого, по ее словам, на пользу вакцинируемым не пойдут курение, дым и «все, что может раздражать легкие и мешать таким образом дыханию».
Доктор химических наук, заведующий лабораторией молекулярной биологии вирусов Института физико-химической биологии при МГУ Юрий Дрыгин объяснил рекомендации Поповой тем, что организм аккумулирует свои защитные механизмы, так как готовится бороться с инфекцией.
Спиртное по этой причине может привести к серьезным последствиям.
«Эффект может быть синергичным, это будет умножаться, это может быть серьезным ударом по организму, когда повысится температура, возможна аллергическая реакция», — сказал Дрыгин в комментарии «Говорит Москва» и предупредил о вероятности анафилактического шока.
Впрочем, директор Национального исследовательского центра эпидемиологии и микробиологии имени Н. Ф. Гамалеи, разработавшего вакцину «Спутник V», Александр Гинцбург развеял миф о тотальном запрете на алкоголь в связи с вакцинацией, передает ТАСС.
«Ни о каком полном запрете на алкоголь во время вакцинации речь, разумеется, не идет. Речь всего лишь о разумном ограничении потребления, пока организм не сформировал свой иммунный ответ на коронавирусную инфекцию. Причем это справедливо не только для «Спутника V», но и для любой другой вакцины», — подчеркнул специалист.
Он также настоятельно рекомендовал воздержаться от спиртных напитков в течение трех дней после каждого укола. Злоупотребление алкоголем способствует снижению иммунитета, и, следовательно, может снизить эффективность прививки, сведя ее до нуля, объяснил ученый.
Кроме горячительных напитков, рекомендуется также на 42 дня отложить употребление ряда лекарств, подавляющих иммунную систему. Помимо этого, на выработку антител плохо влияют стресс, цитостатические препараты, а также антибиотики с очень широкой специфичностью. «Это стандартные рекомендации при вакцинации, чтобы достичь ее максимальной эффективности», — подчеркнул микробиолог.
Непосредственно в день вакцинации точно нельзя пить алкоголь, так как он несовместим с любым лекарственным препаратом, предупреждал главный нарколог Минздрава Евгений Брюн.
Также не стоит идти в спортзал, курить, есть жирную и жареную пищу.
Лучше провести этот день спокойно, без серьезных физических нагрузок, предупреждают в оперативном штабе по контролю и мониторингу ситуации с коронавирусом в Москве.
Как ранее рассказывала «Газете.Ru» инфекционист Лилия Дроздова, вакцинируемым необходимо тщательно готовиться перед принятием препарата. Кроме алкоголя, следует отказаться от принятия лекарств, которые также могут спровоцировать негативные последствия, снизить уровень стресса — при необходимости обратиться к психологу.
«Многие люди настолько боятся заразиться коронавирусом, что организм на психосоматическом уровне может отторгать любые вакцины. При этом, если говорить о человеке с иммунодефицитом или алкоголике, то из-за пониженного иммунитета действительно может быть проблема с выработкой антител», — пояснила эксперт.
Обзор трех терапевтических классов
Фарм США . 2010; 35 (11): 29-40.
Около 64% взрослого населения США употребляли алкоголь в 2008 году. 1 В том же году было выдано примерно 3,8 миллиарда рецептурных лекарств. 2 Несмотря на высокую распространенность, немногие врачи обсуждают употребление алкоголя со своими пациентами. 3,4 Кроме того, большинство пациентов не считают алкоголь лекарством, способным взаимодействовать с лекарствами. Несколько исследований показали преимущества умеренного употребления алкоголя при различных болезненных состояниях; тем не менее, средства массовой информации часто обсуждают результаты этих исследований без упоминания соответствующих деталей о типе употребляемых алкогольных напитков или популяции пациентов. 5 Они также не рассматривают возможные взаимодействия алкоголя с другими заболеваниями или лекарствами. Пациенты неверно истолковывают такую информацию, чтобы рационализировать свое употребление алкоголя, не посоветовавшись со своим врачом. Сообщается, что алкоголь является фактором риска госпитализаций в связи с неблагоприятными лекарственными средствами. 3
В свете распространенности употребления алкоголя важно, чтобы фармацевты рассказывали своим пациентам о взаимодействиях между наркотиками и алкоголем. Местные фармацевты находятся на переднем крае, чтобы помочь пациентам разобраться в своих лекарствах и возможных взаимодействиях с ними.Цель этого обзора — служить руководством, особенно для местных фармацевтов, в понимании различных взаимодействий между наркотиками и алкоголем и объяснении их клинического значения для пациентов с акцентом на трех основных классах лекарств: антибиотики, сердечно-сосудистые препараты и анальгетики.
По последним оценкам, около 10% взрослого населения США употребляют алкоголь ежедневно. 6 Стандартный алкогольный напиток — это любой напиток, содержащий около 0,5 унции (15 г) чистого спирта; я.е., 12 унций пива, 5 унций вина или 1,5 унции 80-градусного дистиллированного спирта. 5,6 Умеренное потребление алкоголя определяется Министерством здравоохранения и социальных служб США как один стандартный напиток в день для женщин и два стандартных напитка в день для мужчин. 5
Фармакокинетика и фармакодинамика алкоголя
Чтобы понять, как алкоголь может взаимодействовать с некоторыми лекарствами, важно кратко определить фармакокинетические и фармакодинамические взаимодействия, связанные с потреблением алкоголя.При употреблении алкоголя около 10% алкоголя подвергается метаболизму первого прохождения в желудке, кишечнике и печени. Одним из основных ферментов, участвующих в метаболизме алкоголя, является алкогольдегидрогеназа (ADH), которая превращает алкоголь в ацетальдегид, токсичное соединение, которое впоследствии метаболизируется альдегиддегидрогеназой (ALDH) в ацетат. После метаболизма первого прохождения алкоголь распределяется по различным тканям организма и оказывает свое действие. Алкоголь транспортируется обратно в печень для метаболизма и выведения.Помимо дальнейшего метаболизма АДГ в печени, алкоголь также метаболизируется ферментами CYP450, в основном CYP2E1. 7-9
Алкоголь является субстратом CYP2E1 и, в зависимости от частоты употребления алкоголя, также может быть индуктором или ингибитором CYP2E1. Хроническое сильное употребление алкоголя (³5 напитков / раз) вызывает активность CYP2E1, в то время как кратковременное чрезмерное потребление подавляет активность CYP2E1, конкурируя с другими субстратами. 8
Прием алкоголя может изменить фармакокинетику лекарств, включая их абсорбцию и метаболизм.И наоборот, лекарственные препараты могут изменять фармакокинетику алкоголя. Примерами фармакодинамических взаимодействий с участием алкоголя и лекарств являются повышенный риск побочных эффектов лекарств или повышенная восприимчивость к действию лекарств. Кроме того, употребление алкоголя может играть негативную роль при определенных болезненных состояниях, таких как сахарный диабет. 8,9
Методы
Этот обзор был проведен путем поиска первичной и третичной литературы для выявления взаимодействия алкоголя с лекарствами трех терапевтических классов (антибиотики, сердечно-сосудистые препараты и анальгетики).Опубликованные исследования были идентифицированы путем поиска в PubMed по различным ключевым словам или заголовкам, включая алкоголь, этанол, взаимодействие наркотиков и алкоголя, алкоголь и варфарин, а также алкоголь и гипертонию. Для трех классов препаратов представлен обзор доступной литературы и обсуждается клиническое значение. Обзор также кратко изложен в ТАБЛИЦА 1 . Представленная информация предназначена для дополнения клинической оценки фармацевтов при оказании индивидуальной помощи пациентам.
Важно отметить, что надежные исследования различных взаимодействий между наркотиками и алкоголем немногочисленны и не всегда обновляются. Многие исследования, показывающие взаимодействие между некоторыми лекарствами и употреблением алкоголя, проводятся с участием молодых здоровых добровольцев, проводятся in vitro или с участием животных. Эти факторы затрудняют экстраполяцию результатов таких исследований на пациентов с определенными болезненными состояниями или на тех, кто принимает несколько лекарств. Кроме того, тип употребляемого алкогольного напитка варьируется в зависимости от исследований и включает пиво, красное вино и другие.Различные алкогольные напитки содержат множество компонентов, которые по-разному влияют на ферменты, метаболизирующие лекарственные средства. Кроме того, большая часть доказательств взаимодействия наркотиков и алкоголя основана на отчетах о случаях, а не на клинических испытаниях.
Антибиотики
Одновременное употребление антибиотиков и алкоголя может вызвать или усугубить побочные эффекты. Сообщалось о дисульфирамоподобных реакциях у пациентов, которые употребляли алкогольные препараты во время лечения определенными антибиотиками, включая бета-лактамные антибиотики, такие как цефалоспорин цефотетан второго поколения 10,11 и цефалоспорин цефтриаксон третьего поколения, хотя взаимодействие с цефтриаксон встречается крайне редко. 12,13 Реакция опосредуется ингибированием ADH, который, в свою очередь, необратимо ингибирует окисление ацетальдегида. Повышенные концентрации ацетальдегида вызывают покраснение лица, тошноту, рвоту, головную боль, тахикардию, гипотонию или их комбинацию. Считается, что этот механизм включает боковую цепь метилтетразолтиола (МТТ), обычно обнаруживаемую в цефалоспоринах, связанных с дисульфирамоподобными реакциями. Структура МТТ напоминает часть молекулы дисульфирама. 10
На основании нескольких исследований и сообщений о случаях, метронидазол также вызывает дисульфирамоподобные реакции при одновременном приеме с алкоголем.Тиллонен и др. Провели исследование, показавшее, что эта реакция может включать ингибирование АДГ в желудочно-кишечном тракте (ЖКТ), а не в печени, как считалось ранее. 14 Сообщалось также о дисульфирамоподобной реакции при одновременном применении сульфаметоксазола / триметоприма и спирта. 15
Изониазид, противотуберкулезный препарат, метаболизируется быстрее у хронических потребителей алкоголя, что может привести к снижению эффективности препарата. 16 Кроме того, комбинация алкоголь-изониазид была связана с повышенным риском гепатотоксичности, связанной с изониазидом, а также риском дисульфирамоподобных реакций. 16,17
Таким образом, пациентов всегда следует предупреждать о том, чтобы они избегали употребления алкоголя во время и в течение нескольких дней после приема антибиотиков, которые, как известно, взаимодействуют с алкоголем. Пациентов следует проинформировать о неожиданных источниках алкоголя и посоветовать поговорить со своим врачом относительно любого употребления алкоголя.
Сердечно-сосудистые препараты
Антигипертензивные средства: Употребление алкоголя взаимодействует с некоторыми лекарствами, принимаемыми от гипертонии и стенокардии, такими как нитраты, гидралазин и нитроглицерин. Одновременное употребление алкоголя с этими лекарствами может привести к усилению ортостатической гипотензии, подвергая пациентов риску травм или падений. 8,9,18 Хроническое употребление алкоголя может привести к усилению метаболизма и снижению эффективности пропранолола, блокирующего бета-адренорецепторы, а потребление верапамила и алкоголя замедляет выведение алкоголя, что может привести к длительной интоксикации. 7,8,18 Кроме того, существует положительная связь между употреблением алкоголя и артериальным давлением, а потребление алкоголя может усугубить гипертонию или сердечную недостаточность. 8,9,19,20 Пациентам с сердечно-сосудистыми заболеваниями следует проконсультироваться со своим лечащим врачом относительно употребления алкоголя и возможных лекарственных взаимодействий.
Противодиабетические средства: Употребление алкоголя пациентами с диабетом создает несколько проблем со здоровьем. Алкоголь подавляет глюконеогенез, что может увеличить риск гипогликемии у пациентов с диабетом.Риск еще больше увеличивается, если пациент принимает инсулин или пероральные гипогликемические средства. 8,9 Кроме того, сильное употребление алкоголя диабетиками может увеличить риск диабетических осложнений, включая диабетическую невропатию и ретинопатию. 8,21 Для пациентов, принимающих сульфонилмочевину, литература предполагает повышенный риск гипогликемии, особенно при применении сульфонилмочевины первого поколения длительного действия (толбутамид и хлорпропамид). 7,8,18 Также может быть повышенный риск при применении сульфонилмочевины второго поколения. 22,23 Burge et al. Исследовали влияние употребления алкоголя натощак пожилых пациентов с диабетом на терапию глибуридом. Они сообщили, что употребление небольшого количества алкоголя (1-2 напитка) может увеличить риск гипогликемии у пациентов. 22 Hartling et al. Сообщили об отсутствии существенной разницы в уровнях глюкозы в крови у здоровых субъектов, получавших глипизид отдельно или в комбинации с алкоголем. Однако наблюдалась задержка нормализации уровня глюкозы в крови при приеме глипизида с алкоголем, что свидетельствует о длительном гипогликемическом эффекте в присутствии алкоголя. 23
Сообщалось о дисульфирамоподобных реакциях при одновременном употреблении алкоголя и хлорпропамида. Однако неясно, вызывает ли одновременное употребление алкоголя и глипизида или глибурида такую же реакцию. 18 Пациенты с диабетом, принимающие метформин, подвергаются повышенному риску лактоацидоза, если они много употребляют алкоголь. 9
Американская диабетическая ассоциация (ADA) рекомендует пациентам с диабетом информировать своих медицинских работников о потреблении алкоголя.Кроме того, ADA рекомендует избегать употребления алкоголя натощак и ограничить ежедневное потребление алкоголя одним стандартным напитком для женщин и двумя стандартными напитками для мужчин. 8,21
Антикоагулянты: Алкоголь взаимодействует с варфарином, и последствия этого взаимодействия могут нанести значительный вред пациенту. В зависимости от частоты употребления алкоголя алкоголь может привести к усилению или снижению антикоагулянтного действия варфарина.Когда пациенты постоянно употребляют алкоголь, происходит усиление метаболизма варфарина, что снижает эффект препарата и увеличивает риск образования тромбов. С другой стороны, острое употребление алкоголя, по-видимому, снижает метаболизм варфарина, что может значительно увеличить риск кровотечения. 8,9 Точный механизм не очень хорошо освещен в литературе и может включать нарушение метаболизма в печени, а также другие специфические для пациента факторы. Из-за непредсказуемых эффектов взаимодействия алкоголя с варфарином пациентам следует рекомендовать информировать своих медицинских работников о любом потреблении алкоголя, чтобы можно было контролировать международное нормализованное соотношение (МНО) и при необходимости корректировать дозу варфарина. 24,25
Анальгетики (ненаркотические)
Нестероидные противовоспалительные препараты (НПВП) и аспирин: И НПВП, и высокие дозы аспирина связаны с повышенным риском желудочно-кишечного кровотечения. 8,26,27 Эпидемиологические данные предполагают трех-пятикратное увеличение риска развития большого желудочно-кишечного кровотечения или язвы при применении НПВП. 27 Употребление алкоголя может раздражать слизистую желудочно-кишечного тракта и увеличивать секрецию желудочного сока, что может привести к гастриту.Одновременный прием НПВП или аспирина и алкоголя может еще больше увеличить риск обширного желудочно-кишечного кровотечения; однако никаких рандомизированных контролируемых исследований для подтверждения такого взаимодействия не проводилось. 9
Большинство доказательств этого взаимодействия основано на исследованиях случай-контроль. Крупное исследование случай-контроль, проведенное в США и Швеции, показало сильную положительную связь между НПВП или аспирином и употреблением алкоголя в повышении риска кровотечения из верхних отделов ЖКТ. Самая высокая частота кровотечений из верхних отделов ЖКТ была у пациентов, которые много пили (³3 напитка / день) и принимали аспирин (> 325 мг / день) и / или ибупрофен. 26 Однако это исследование не предоставило достаточно информации о других НПВП, включая целекоксиб. Тем не менее, вкладыш в упаковке целекоксиба указывает на повышенный риск развития язвы или желудочно-кишечного кровотечения при приеме НПВП с алкоголем. 28
Ацетаминофен: Этот препарат является одним из наиболее часто используемых анальгетиков в США. Помимо того, что он доступен в качестве безрецептурного продукта, ацетаминофен также встречается в комбинации со многими наркотическими средствами и является одним из наиболее часто назначаемых анальгетиков. . 29 При острой передозировке ацетаминофен вызывает гепатотоксичность. Имеются многочисленные сообщения о случаях тяжелого поражения печени при приеме терапевтических доз парацетамола (<4 г / день) в сочетании с хроническим употреблением алкоголя. Однако немногие, если таковые имеются, хорошо спланированные клинические исследования подтверждают достоверность этого взаимодействия. 7,29 Чтобы понять возможное взаимодействие парацетамола с употреблением алкоголя, необходимо краткое объяснение сложного метаболизма парацетамола.
Ацетаминофен метаболизируется в основном посредством глюкуронизации или сульфатирования (90–96%), а также посредством CYP2E1 (4–10%), того же фермента, который участвует в метаболизме алкоголя. Когда ацетаминофен метаболизируется через CYP2E1, гепатотоксический метаболит, образуется N -ацетил-пара-
Возможное взаимодействие алкоголя с использованием ацетаминофена зависит от того, как употребляется алкоголь. У хронических потребителей алкоголя индуцируется активность CYP2E1, что теоретически приводит к увеличению продукции NAPQI. Кроме того, опубликованные исследования показывают, что снижение уровня глутатиона у алкоголиков еще больше увеличивает риск печеночной недостаточности. 7 Несмотря на то, что в литературе продолжаются разногласия относительно использования ацетаминофена у алкоголиков, на основании текущих исследований нет повышенного риска гепатотоксичности у алкогольных пациентов, принимающих терапевтические дозы парацетамола (<4 г / день) в отсутствие другие факторы риска. 29,30
FDA рекомендует пациентам, выпивающим более трех алкогольных напитков в день, проконсультироваться со своим врачом перед применением любого безрецептурного обезболивающего. 30 Кроме того, существуют огромные различия в том, как пациенты потребляют алкоголь, и в соблюдении ими режима приема лекарств, поэтому пациентов всегда следует предупреждать о повышенном риске повреждения печени при приеме продуктов, содержащих парацетамол, вместе с алкоголем.
Анальгетики (наркотические)
Опиоидные препараты, такие как производные метадона и кодеина, хорошо известны своим действием на центральную нервную систему (ЦНС), включая седативный эффект и угнетение дыхания. 18 Механизм взаимодействия опиоидных анальгетиков и алкоголя носит фармакодинамический характер. Алкоголь увеличивает риск побочных эффектов и угнетения ЦНС. 8,18
Имеется немного исследований, иллюстрирующих это взаимодействие, и предупреждения относительно одновременного употребления алкоголя и опиоидов основаны на вкладышах в упаковку различных опиоидных препаратов, включая кодеин и его производные, морфин, фентантил и метадон. 18 Однако после того, как палладон в виде капсулы с пролонгированным высвобождением гидроморфона был удален с рынка из-за возможного летального взаимодействия с алкоголем, стало очевидно, что существует необходимость в дополнительных исследованиях взаимодействия алкоголя с опиоидами, особенно с составами с пролонгированным высвобождением. 7,31 FDA потребовало отмены Палладона в 2005 году после того, как фармакокинетическое исследование выявило эффект «демпинга дозы» при одновременном применении препарата и алкоголя. Средняя пиковая концентрация гидроморфона увеличивалась в два-шесть раз, когда его вводили с алкогольными напитками. 7,32 Таким образом, пациенты должны информировать своих медицинских работников о любом употреблении алкоголя до начала анальгетической терапии.
Заключение
В этом обзоре суммированы наркотические и алкогольные взаимодействия трех основных терапевтических классов лекарств (антибиотики, сердечно-сосудистые препараты и анальгетики).Фармацевты играют ключевую роль в информировании пациентов о лекарствах, их побочных эффектах и возможных взаимодействиях. Фармацевты также должны консультировать пациентов относительно любых взаимодействий между наркотиками и алкоголем. Хотя этот обзор предназначен для обзора взаимодействия алкоголя с общепринятыми терапевтическими занятиями, он не является исчерпывающим. Этот обзор может быть использован в дополнение к клинической оценке фармацевтов при предоставлении индивидуального ухода за пациентами.
ССЫЛКИ
1.Центры по контролю и профилактике заболеваний. Употребление алкоголя. www.cdc.gov/nchs/fastats/
2. Национальный аудит рецептов IMS PLUS. 2008 Лучшие терапевтические классы по рецептам в США. IMS Health. www.imshealth.com/
3. Ондер Дж., Педоне С., Ланди Ф. и др. Побочные реакции на лекарства как причина госпитализации: результаты Итальянской группы фармакоэпидемиологии пожилых людей (GIFA). J Am Geriatr Soc. 2002; 50: 1962-1968.
4. Браун Р.Л., Даймонд А.Р., Хулис Д. и др. Фармакоэпидемиология потенциальных взаимодействий алкоголя с лекарственными средствами, отпускаемыми по рецепту, у пациентов первичной медико-санитарной помощи с расстройствами, связанными с употреблением алкоголя. J Am Pharm Assoc. 2007; 47: 135-139.
5. Феррейра MP, Weems MK. Потребление алкоголя пожилыми людьми в США: польза и вред для здоровья. J Am Diet Assoc. 2008; 108: 1668-1676.
6. Национальный институт злоупотребления алкоголем и алкоголизма.Процентное распределение дней употребления алкоголя в прошлом месяце по демографическим характеристикам: NSDUH (NHSDA), 1994–2002 гг. www.niaaa.nih.gov/Resources/
7. Янг Г.Р., Харрис Р.З. Лекарственное взаимодействие, связанное с этанолом и алкогольными напитками. Expert Opin Drug Metab Toxicol. 2007; 3: 719-731.
8. Мур AA, Whiteman EJ, Ward KT. Риски комбинированного употребления алкоголя и лекарств у пожилых людей. Am J Geriatr Pharmacother. 2007; 5: 64-74.
9. Fraser AG. Фармакокинетические взаимодействия между алкоголем и другими лекарствами. Clin Pharmacokine.
10. Клайн С.С., Мауро В.Ф., Форни Р.Б. и др. Цефотетан-индуцированные реакции дисульфирамского типа и гипопротромбинемия. Противомикробные агенты Chemother. 1987; 31: 1328-1331.
11. Norrby SR. Побочные реакции и взаимодействия с новыми антибиотиками цефалоспоринового и цефамицинового ряда. Med Toxicol. 1986; 1: 32-46.
12. Эрон Л.Дж., Парк С.Х., Хиксон Д.Л. и др.Цефтриаксоновая терапия инфекций костей и мягких тканей в больницах и амбулаторных условиях. Противомикробные агенты Chemother . 1983; 23: 731-737.
13. Билльштейн С.А., Судол Т.Э. Дисульфирамоподобные реакции с цефтриаксоном редко. Гериатрия. 1992; 47: 70.
14. Тиллонен Дж., Вакевайнен С., Саласпуро В. и др. Метронидазол увеличивает содержание ацетальдегида в толстой кишке, но не в периферической крови у крыс, постоянно получавших этанол. Алкоголь Clin Exp Res . 2000; 24: 570-575.
15. Heelon MW, White M. Реакция дисульфирам-котримоксазола. Фармакотерапия. 1998; 869-870.
16. Бацевич AM, Self TH. Взаимодействие изониазида . Саут Мед Дж. 1985; 78: 714-718.
17. Вкладыш в упаковку с изониазидом. Итонтаун, штат Нью-Джерси: West-Ward Pharmaceutical Corp; Март 2008 г.
18. Лекарственные взаимодействия. Томсон Микромедекс. Гринвуд-Виллидж, Колорадо. Www.thomsonhc.com. По состоянию на 9 октября 2010 г.
19. Zilkens RR, Burke V, Hodgson JM, et al. Красное вино и пиво повышают артериальное давление у мужчин с нормальным давлением. Гипертония. 2005; 45: 874-879.
20. Bau PF, Bau CH, Naujorks AA, Rosito GA. Ранние и поздние эффекты употребления алкоголя на артериальное давление и функцию эндотелия. Алкоголь. 2005; 37: 53-58.
21. Алкоголь. Американская диабетическая ассоциация. www.diabetes.org/type-1- 1997; 33: 79-90.
22. Burge MR, Zeise TM, Sobhy TA, et al. Низкие дозы этанола предрасполагают пожилых голодных пациентов с диабетом 2 типа к снижению уровня глюкозы в крови, вызванному сульфонилмочевиной. Уход за диабетом. 1999; 22: 2037-2043.
23. Hartling SG, Faber OK, Wegmann ML, et al. Взаимодействие этанола и глипизида у человека. Уход за диабетом . 1987; 10: 683-686.
24. Hylek EM, Heiman H, Skates SJ, et al. Ацетаминофен и другие факторы риска чрезмерной антикоагуляции варфарина. JAMA. 1998; 279: 657-662.
25. Havrda DE, Mai T., Chonlahan J. Повышенный антитромботический эффект варфарина, связанный с употреблением алкоголя в низких дозах. Фармакотерапия. 2005; 25: 303-307.
26. Кауфман Д.В., Келли Дж. П., Вихольм Б. Е. и др. Риск острого обширного кровотечения из верхних отделов желудочно-кишечного тракта у лиц, принимающих аспирин и ибупрофен при различных уровнях потребления алкоголя. Am J Gastroenterol.
27. Pfau PR, Lichenstein GR. НПВП и алкоголь: никогда нельзя смешивать два? Am J Gastroenterol.
28. Вкладыш в упаковку целебрекса (целекоксиба). Нью-Йорк, штат Нью-Йорк: Pfizer, Inc; Июнь 2009 г.
29. Kuffner EK, Green JL, Bogdan GM et al.Влияние ацетаминофена (четыре грамма в день в течение трех дней подряд) на печеночные тесты у больных алкоголизмом — многоцентровое рандомизированное исследование. BMC Med.
30. FDA предлагает предупреждение об употреблении алкоголя для всех безрецептурных обезболивающих. Министерство здравоохранения и социальных служб США. 14 ноября 1997 г. http://archive.hhs.gov/news/ 1999; 94: 3189-3196. 1999; 94: 3098-3101. 2007; 5: 13.
31. Уолден М., Николлс Ф.А., Смит К.Дж., Такер Г.Т. Влияние этанола на высвобождение опиоидов из пероральных препаратов с пролонгированным высвобождением. Drug Dev Ind Pharm. 2007; 33: 1101-1111.
32. Информация для медицинских работников: капсулы с пролонгированным высвобождением гидрохлорида гидроморфона (Палладон). Предупреждение FDA. Июль 2005 г. www.fda.gov/Drugs/DrugSafety/
Чтобы прокомментировать эту статью, свяжитесь с [email protected].
Hospira порошок натрия цефтриаксона для инъекций
цефтриаксон натрия (kef-try-AX-own)
Информация о потребительской медицине
Информация о буклете
В этой брошюре даны ответы на некоторые распространенные вопросы о порошке цефтриаксона для инъекций Hospira ™.Он не содержит всей доступной информации. Это не заменяет разговоры с врачом и фармацевтом.
У всех лекарств есть риски и преимущества. Ваш врач сопоставил риски получения цефтриаксона с ожидаемыми его преимуществами.
Если у вас есть какие-либо опасения по поводу приема этого лекарства, обратитесь к своему врачу или фармацевту.
Сохраните эту брошюру. Возможно, вам придется прочитать его еще раз.
Какой натриевый порошок цефтриаксона Hospira ™ для инъекций используется для
Цефтриаксон — это антибиотик, используемый для лечения инфекций в различных частях тела, вызванных бактериями.
Он также используется для предотвращения инфекций после операции.
Цефтриаксон не действует против инфекций, вызванных вирусами, таких как простуда или грипп.
Цефтриаксон принадлежит к группе антибиотиков, называемых цефалоспоринами (kef-a-low-SPOR-ins). Эти антибиотики убивают бактерии, вызывающие вашу инфекцию.
Спросите своего врача, есть ли у вас какие-либо вопросы о том, почему вам было прописано это лекарство. Ваш врач мог прописать его по другой причине.
Это лекарство не вызывает привыкания.
Это лекарство отпускается только по рецепту врача.
Перед тем, как вам дадут натриевый порошок Hospira ™ цефтриаксона для инъекций
Когда нельзя даватьПорошок натрия цефтриаксона для инъекций Hospira ™ не следует давать вам, если у вас аллергия на:
- любое лекарство, содержащее цефтриаксон
- другие антибиотики цефалоспоринового ряда
- любого из ингредиентов, перечисленных в конце этой брошюры.
Некоторые из симптомов аллергической реакции могут включать одышку, хрипы или затрудненное дыхание; отек лица, губ, языка или других частей тела; сыпь, зуд или крапивница на коже.
Порошок натрия цефтриаксона для инъекций Hospira ™ не следует давать вам, если у вас возникла серьезная аллергическая реакция на пенициллины.
Порошок натрия цефтриаксона для инъекций Hospira ™ не следует смешивать с лигнокаином и давать вам, если у вас была аллергическая реакция на лигнокаин. Иногда это лекарство смешивают с гидрохлоридом лигнокаина, чтобы инъекция в мышцу была менее болезненной.
Порошок натрия цефтриаксона Hospira ™ для инъекций не следует назначать новорожденным (особенно недоношенным), которые могут иметь риск развития или иметь аномально высокое количество желчного пигмента (билирубина) в крови.
Безопасность и эффективность у детей и младенцев не установлены.
Если вы не уверены, следует ли вам давать порошок цефтриаксона для инъекций Hospira ™, поговорите со своим врачом.
Прежде, чем вам дадутСообщите своему врачу, если у вас была какая-либо аллергическая реакция на антибиотики пенициллина. У вас может быть повышенная вероятность аллергии на цефтриаксон, если у вас аллергия на пенициллины.
Сообщите врачу, если у вас аллергия на какие-либо другие лекарства, продукты питания, консерванты или красители.
Сообщите своему врачу, если у вас есть или были какие-либо из следующих заболеваний:
- болезнь почек или печени
- Заболевания желудка или кишечника, такие как воспаление толстой кишки (кишечника).
Сообщите своему врачу, если вы беременны, собираетесь забеременеть или кормите грудью. Ваш врач обсудит с вами связанные с этим риски и преимущества.
Если вы не сказали своему врачу ни о чем из вышеперечисленного, сообщите ему, прежде чем вам дадут натриевый порошок Hospira ™ цефтриаксона для инъекций.
Прием других лекарствСообщите своему врачу или фармацевту, если вы принимаете или используете какие-либо другие лекарства, включая лекарства, которые вы покупаете без рецепта в аптеке, супермаркете или магазине здорового питания.
Некоторые лекарства и цефтриаксон могут мешать друг другу. К ним относятся:
- хлорамфеникол, другое лекарство, используемое для лечения инфекций.
Это лекарство может быть подвержено влиянию цефтриаксона или может повлиять на его эффективность. Вам может потребоваться другое количество лекарства или вам может потребоваться другое лекарство.
Поговорите со своим врачом или фармацевтом о необходимости использования дополнительных методов контрацепции во время лечения цефтриаксоном. Некоторые антибиотики могут снизить эффективность некоторых противозачаточных таблеток, хотя это не было показано с цефтриаксоном.
Ваш врач или фармацевт может предоставить дополнительную информацию о лекарствах, с которыми следует проявлять осторожность или которых следует избегать при приеме этого лекарства.
Как вводится порошок цефтриаксона для инъекций Hospira ™
Сколько даетсяВаш врач решит, какую дозу вы получите. Это зависит от вашей инфекции и других факторов, таких как ваш вес.При большинстве инфекций порошок цефтриаксона для инъекций Hospira ™ обычно назначают один или два раза в день.
Как даетсяПорошок цефтриаксона для инъекций Hospira ™ натрия можно вводить следующими способами:
- как глубокая инъекция в большую мышцу
- в виде медленной инъекции или инфузии (капельного) в вену.
Это лекарство может давать только врач или медсестра.
Сколько дается наВаш врач решит, как долго вы будете получать это лекарство.
Продолжительность лечения обычно составляет от 4 до 14 дней, хотя некоторые инфекции могут потребовать более длительного лечения. Иногда для лечения или профилактики определенных инфекций требуется всего одна доза.
Если вам дали слишком много (передозировка)Поскольку порошок натрия цефтриаксона для инъекций Hospira ™ вводится под наблюдением врача, маловероятно, что вы получите слишком много.
Однако, если у вас возникнут серьезные побочные эффекты после приема этого лекарства, немедленно сообщите об этом своему врачу.
Немедленно позвоните своему врачу или в Информационный центр по отравлениям (позвоните 13 11 26) для получения совета или обратитесь в ближайшую больницу в отдел неотложной и неотложной помощи, если вы считаете, что вы или кто-либо другой, возможно, приняли слишком много порошка натрия цефтриаксона Hospira ™ для Инъекция. Делайте это, даже если нет признаков дискомфорта или отравления. Вам может потребоваться срочная медицинская помощь.
Симптомы передозировки цефтриаксона могут включать побочные эффекты, перечисленные ниже в разделе «Побочные эффекты», но обычно носят более серьезный характер.
Спросите своего врача, если у вас есть какие-либо проблемы.
Пока вам вводят натриевый порошок цефтриаксона Hospira ™ для инъекций
Что вы должны делатьЕсли симптомы вашей инфекции не улучшатся в течение нескольких дней или если они ухудшились, сообщите об этом своему врачу.
Если у вас возникла тяжелая диарея, немедленно сообщите об этом своему врачу, фармацевту или медсестре. Сделайте это, даже если это произойдет через несколько недель после отмены цефтриаксона.Не принимайте лекарства от диареи без предварительной консультации с врачом. Диарея может означать, что у вас серьезное заболевание кишечника. Вам может потребоваться срочная медицинская помощь.
Если во время приема или вскоре после прекращения приема цефтриаксона у вас появятся болезненные ощущения во рту или на языке, сообщите об этом своему врачу или фармацевту. Также сообщите своему врачу или фармацевту, если у вас появится зуд или выделения из влагалища. Это может означать, что у вас грибковая инфекция, называемая молочницей. Иногда использование цефтриаксона приводит к росту грибков и возникновению вышеуказанных симптомов.Цефтриаксон не действует против грибков.
Если вы забеременели во время лечения этим лекарством, немедленно сообщите об этом своему врачу.
Если вы собираетесь начать принимать какое-либо новое лекарство, напомните своему врачу и фармацевту, что вам вводят цефтриаксон.
Если вам нужно проверить мочу на сахар во время приема этого лекарства, убедитесь, что ваш врач знает, какой тип теста вы используете. Цефтриаксон может повлиять на результаты некоторых из этих тестов.
Если вам нужно сдать анализ крови, сообщите врачу, что вам вводят это лекарство. Цефтриаксон может повлиять на результаты некоторых анализов крови.
Сообщите другим лечащим вам врачам, стоматологам или фармацевтам, что вам дают это лекарство.
На что следует обратить вниманиеБудьте осторожны при вождении или эксплуатации машин, пока не узнаете, как цефтриаксон влияет на вас. Цефтриаксон обычно не вызывает никаких проблем с вашей способностью управлять автомобилем или работать с механизмами.Однако, как и многие другие лекарства, цефтриаксон может вызывать у некоторых людей головокружение. В этом случае не садитесь за руль. Если вы употребляете алкоголь, может усилиться головокружение.
Побочные эффекты
Как можно скорее сообщите своему врачу или медсестре, если вы чувствуете себя плохо во время приема цефтриаксона. Цефтриаксон помогает большинству людей с инфекциями, но у некоторых людей он может вызывать нежелательные побочные эффекты. Все лекарства могут иметь побочные эффекты. Иногда они серьезны, но чаще — нет.Вам может потребоваться медицинская помощь, если вы почувствуете некоторые побочные эффекты.
Если вам больше 65 лет, у вас может быть повышенный шанс получить побочные эффекты.
Не пугайтесь следующих списков побочных эффектов. Вы можете не испытывать ни одного из них.
Попросите вашего врача, медсестру или фармацевта ответить на любые ваши вопросы.
При использованииСообщите своему врачу или медсестре, если вы заметили что-либо из следующего, и они вас беспокоят:
- тошнота, рвота или легкая диарея
- опухоль, боль или болезненность в месте инъекции или рядом с ним
- головная боль или головокружение
- Молочница полости рта — белая, пушистая, болезненный язык и рот
- молочница влагалища — болезненное и зудящее влагалище и / или выделения.
Эти побочные эффекты обычно легкие.
Как можно скорее сообщите своему врачу, если заметите следующее:
- резкая боль или сильная постоянная боль в верхней части живота.
Этот побочный эффект может потребовать медицинской помощи. Этот побочный эффект встречается редко.
Немедленно сообщите своему врачу или обратитесь в отделение неотложной и неотложной помощи в ближайшей больнице (если вы еще не в больнице), если вы заметили любое из следующего:
- стойкая диарея тяжелая
- аллергическая реакция (например, сыпь, зуд или крапивница на коже; отек лица, губ, языка или других частей тела; одышка, хрипы или затрудненное дыхание)
- чрезмерное шелушение кожи.
Это очень серьезные побочные эффекты. Вам может потребоваться срочная медицинская помощь или госпитализация. Эти побочные эффекты встречаются редко.
После окончанияНемедленно сообщите своему врачу, если вы заметили какие-либо из следующих побочных эффектов, особенно если они возникают через несколько недель после прекращения лечения с помощью порошка натрия цефтриаксона для инъекций Hospira ™:
- сильные спазмы в животе или спазмы желудка
- водянистый и сильный понос, который также может быть кровавым
- лихорадка в сочетании с одним или обоими из вышеперечисленных.
Это серьезные побочные эффекты. У вас может быть серьезное заболевание кишечника. Поэтому вам может потребоваться срочная медицинская помощь. Однако эти побочные эффекты встречаются редко.
Не принимайте лекарства от диареи без предварительной консультации с врачом.
Сообщите своему врачу, если вы заметили что-либо, что вызывает у вас недомогание. У некоторых людей могут возникать и другие побочные эффекты, не перечисленные выше.
После введения порошка натрия цефтриаксона для инъекций Hospira ™
ХранилищеХоспира ™ цефтриаксон натрия порошок для инъекций обычно хранится в аптеке или в палате.
Лекарство хранят в сухом прохладном, защищенном от света месте при температуре ниже 25 ° C. Как только порошок для инъекций будет разбавлен до раствора, он будет использован как можно скорее. При необходимости хранения раствор хранят в холодильнике (при температуре от 2 до 8 ° C) не более 24 часов и используют при первой возможности после извлечения из холодильника. Это лекарство нельзя замораживать.
Описание товара
Как это выглядитБелый или желтоватый кристаллический порошок в стеклянном флаконе.Когда порошок натрия цефтриаксона для инъекций Hospira ™ превращается в раствор перед инъекцией, цвет раствора изменяется от светло-желтого до янтарного.
СоставПорошок цефтриаксона для инъекций Hospira ™ натрия содержит активный ингредиент цефтриаксон натрия, эквивалентный 1 г или 2 г цефтриаксона.
Hospira ™ Натриевый порошок цефтриаксона для инъекций не содержит глютен, лактозу, сахарозу, тартразин или любые другие азокрасители.
Спонсор Порошок цефтриаксона Hospira ™ для инъекций поставляется:
Hospira Pty Ltd
ABN 13 107058328
Уровень 3
500 Collins Street
Melbourne VIC 3000
Australia
Порошок цефтриаксона для инъекций Hospira ™ доступен в следующих формах:
1 г / флакон — AUST R 167648
2 г / флакон — AUST R 167651
Информационный листок был подготовлен в июне 2011 г.
Опубликовано MIMS декабрь 2013 г.
границ | Цефтриаксон и цефазолин ослабляют ориентированное на сигнал восстановление поиска алкоголя
Введение
Алкоголизм или алкогольная зависимость — хроническое прогрессирующее заболевание, которое возникает в результате неспособности регулировать поведение, связанное с поиском наркотиков.Примерно 17 миллионов американцев зависимы от алкоголя (NIH, 2006), что приводит к значительным юридическим и медицинским издержкам для общества, составляющим примерно 184 миллиарда долларов в год (Kenna et al., 2004). В настоящее время только дисульфирам, налтрексон и акампросат одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для лечения алкоголизма. Однако способность этих препаратов снижать риск рецидива невысока (Heilig and Egli, 2006; Soyka and Roesner, 2006), и поэтому существует необходимость в разработке более целенаправленных фармакологических методов лечения алкогольной зависимости.
Модели рецидива на животных позволяют идентифицировать основную нейробиологию рецидива алкоголя у людей и, таким образом, целенаправленно развивать фармакотерапию. Рецидив моделируется на животных с помощью парадигмы восстановления, когда животных обучают самостоятельному введению лекарственного средства в операционной камере. Реакция поиска лекарств гасится и возобновляется с помощью одного из стимулов, которые, как известно, вызывают рецидив у людей, таких как стресс, сигналы, связанные с доставкой лекарства, или сам препарат (Epstein et al., 2006). Было сложно заставить лабораторных крыс добровольно потреблять дозы алкоголя, связанные с алкогольной зависимостью человека. Были предприняты попытки увеличить пероральное потребление алкоголя у грызунов, такие как исчезновение сахарозы (Samson, 1986), лишение пищи и воды (Meisch and Thompson, 1972), воздействие паров алкоголя (Walker and Koob, 2007; Walker et al. ., 2008), а также использование линий крыс, селективно разводимых с высоким предпочтением алкоголя (Samson et al., 1998; Vacca et al., 2002).С момента своего появления в 1980-х годах сахарозное обесцвечивание было широко принято в качестве основного метода побуждения грызунов к самостоятельному употреблению алкоголя в оперативных условиях (Samson, 1986). В то время как увядание сахарозы приводит к высокому потреблению алкоголя в присутствии сахарозы, потребление алкоголя резко снижается при удалении подсластителя (Samson, 1986; Koob and Weiss, 1990; Samson et al., 1999; Carrillo et al., 2008). Кроме того, сахароза сама по себе вызывает привыкание (Colantuoni et al., 2002; Avena et al., 2008), что, возможно, способствует мотивации к употреблению подслащенного алкоголя.Одним из методов стимулирования потребления большого количества несладкого алкоголя у грызунов является процедура периодического доступа к алкоголю (IAA), при которой грызунам предоставляется 24-часовой доступ к алкоголю, за которым следует 24-часовой период без доступа (Wayner and Greenberg, 1972; Wise, 1973; Пинель, Хуанг, 1976). Simms et al. (2008) недавно возродили эту модель и индуцировали уровни употребления алкоголя (20% об. / Об.) В диапазоне 5–8 г / кг / день у штаммов Wistar и Long-Evans. Кроме того, Simms et al. (2010) адаптировали парадигму IAA к модели оперантного самоуправления и породили высокие уровни поиска алкоголя в оперантной камере после использования 14-часовых оперантных сессий в прерывистые дни (MWF), за которыми следовали более короткие (30-45 минут) ежедневные сессии. в оперантной камере.Здесь мы изменили этот метод, чтобы исключить использование 14-часовых сеансов оперантных и дрессированных животных в оперантной камере только во время ежедневных 45-минутных сеансов для 26 сеансов (MTWRF).
Затем мы попытались проверить способность трансляционных соединений, которые модулируют передачу глутамата и / или ГАМК, ослаблять инициированное сигналом восстановление поиска алкоголя. Передача глутамата в целом и, в частности, в прилежащем ядре (NAs) и миндалевидном теле в значительной степени вовлечена в вызванное сигналом восстановление алкоголя.Во время инициированного сигналом восстановления подавленного оперантного поиска алкоголя синаптический выброс глутамата увеличивается в NA и миндалевидном теле (Gass et al., 2011). Таким образом, следует, что как системная, так и интра-NA или интра-миндалевидная инфузия антагонистов постсинаптических рецепторов глутамата ослабляет восстановление алкоголя (например, Backstrom and Hyytia, 2004; Backstrom et al., 2004; Sanchis-Segura et al., 2006; Sinclair et al., 2012).
Фармакологические манипуляции, предотвращающие рецидив поиска алкоголя, также предотвращают возобновление поиска кокаина (для обзора см. Kalivas et al., 2009; Knackstedt and Kalivas, 2009). После самостоятельного введения кокаина и отмены существуют доказательства изменения гомеостаза глутамата, определяемого как гомеостатическая регуляция синаптических и внесинаптических уровней глутамата и передачи сигналов. Гомеостаз глутамата в прилежащих участках сложен и регулируется множеством механизмов, в том числе основным транспортером глутамата GLT-1 и системой x c -. System x c — обменивает внеклеточный цистин на внутриклеточный глутамат, тем самым внося большую часть базального внесинаптического глутамата в прилежащие клетки (Baker et al., 2002). Каталитическая субъединица системы x c — это белок xCT, и отличительные признаки измененного гомеостаза глутамата после приема кокаина включают снижение экспрессии и функции как GLT-1, так и xCT / system x c — (Knackstedt et al., 2010; Trantham-Davidson et al., 2012). Основываясь на широко распространенном участии различных типов рецепторов глутамата в рецидиве алкоголя, вполне вероятно, что гомеостаз глутамата также изменяется после употребления алкоголя.
Модуляция передачи ГАМК также влияет на потребление алкоголя и восстановление.ГАМК A антагонисты и обратные агонисты снижают потребление алкоголя (см. Обзор McBride and Li, 1998) и оперантное самовозведение алкоголя (Samson et al., 1987). Баклофен, агонист ГАМК B (авторецептор), снижает самовосприятие. введение у независимых крыс (Janak and Michael Gill, 2003). Напротив, аллопрегнанолон, эндогенный нейростероид, который также оказался мощным позитивным модулятором рецепторов GABA A , дозозависимо индуцирует восстановление стремления к алкоголю (Nie and Janak, 2003; Finn et al., 2008).
Мы предположили, что гомеостаз глутамата изменяется после приема алкоголя, и восстановление гомеостаза изменит вызванную алкоголем пластичность и, таким образом, ослабит возобновление стремления к алкоголю. Можно восстановить гомеостаз глутамата и обратить вспять вызванные кокаином патологии в синаптической пластичности с помощью N, -ацетилцистеина (NAC; Moussawi et al., 2009, 2011) или цефтриаксона (CEF; Trantham-Davidson et al., 2012) и здесь мы проверили их способность ослаблять вызванное сигналом возобновление стремления к алкоголю.NAC служит пролекарством цистина, которое управляет системой x c — для экспорта большего количества глутамата, в то время как CEF является антибиотиком, который усиливает экспрессию как GLT-1 (Lee et al., 2008), так и xCT (Lewerenz et al., 2009). на уровне транскрипции. Мы также выдвинули гипотезу, что антибиотик цефазолин (CEFAZ), который, как было продемонстрировано, ингибирует передачу GABA A (Yamazaki et al., 2002; Sugimoto et al., 2003), будет ослаблять вызванное сигналом восстановление употребления алкоголя. Чтобы изучить возможное влияние CEFAZ на гомеостаз глутамата, мы проверили его способность ослаблять возобновление поиска кокаина, поведения, которое зависит от измененного высвобождения, клиренса и базального уровня глутамата (для обзора см. Knackstedt and Kalivas, 2009). .
Материалы и методы
Животные и жилищное хозяйство
Взрослых самцов крыс Sprague-Dawley ( n = 84) массой 250–275 г по прибытии содержали индивидуально в вентилируемых клетках из оргстекла в помещении с контролируемым климатом с 12-часовым циклом обратного света / темноты (свет выключается в 9 часов). AM) и дать как минимум 1 неделю на акклиматизацию к индивидуальным жилищным условиям и обращению. Крысам давали воду ad libitum на протяжении всего эксперимента и лишали корма примерно до 85% веса при свободном кормлении с суточной дозой 20 г корма.Ограничение питания обычно увеличивает ответную реакцию без изменения восстановления по сравнению с неограниченным контролем (Bongiovanni and See, 2008). Эксперимент 1 был проведен в Медицинском университете Южной Каролины, а эксперименты 2–4 — в Университете Флориды. Все процедуры были предварительно одобрены Медицинским университетом Южной Каролины и Институциональными комитетами по уходу и использованию животных Университета Флориды и соответствовали Руководству по уходу и использованию лабораторных животных Национального института здравоохранения.
Оперативные камеры и обучение
Перед началом оперантного самоуправления (эксперименты 1–4) животные проходили один ночной тренировочный сеанс пищи в оперантных камерах, где нажатие на активный рычаг приводило к доставке пищевых гранул. Камеры оперантов (Med Associates) были оборудованы двумя выдвижными рычагами, стимулирующими лампами и генераторами тона. На следующий день после дрессировки животных обучали самостоятельно вводить алкоголь, кокаин или кормовые гранулы в оперантной камере.Для исследования самоуправления пищей (эксперимент 3) нажатие на активный рычаг доставило пищевые гранулы. В исследованиях самостоятельного введения лекарства нажатие на активный рычаг приводит в действие насос, который дозирует лекарство. Для исследований алкоголя (эксперименты 1 и 2) 0,1 мл спирта (20% об. / Об.) Наливали в поддон с ковшом; инфракрасные датчики подтвердили, что голова попадает в зону кормления для употребления алкоголя. Для исследования кокаина (эксперимент 4) на инфузию вводили 0,25 мг кокаина HCl (любезно предоставленного NIDA) в 0,1 мл 0,9% физиологического раствора.Как в исследованиях кокаина, так и в исследованиях алкоголя, доставка лекарства сопровождалась предъявлением дискретных сигналов (световой сигнал и тон с частотой 2900 Гц), а для самостоятельного введения кокаина следовало время ожидания (20 с), в течение которого нажатие на активный рычаг происходило. не подавать препарат. Неактивные нажатия на рычаг не имели последствий, но фиксировались. При самостоятельном введении алкоголя кювету промокали салфеткой в конце сеанса, чтобы убедиться, что весь алкоголь был употреблен. Крысы, которые обычно не употребляли алкоголь, несмотря на нажатие на рычаг, были исключены из эксперимента ( n = 3 для эксперимента 1; n = 2 для эксперимента 2).Кроме того, из экспериментов 1 и 2 были исключены три крысы с плохим здоровьем. В исследованиях самостоятельного введения как алкоголя, так и кокаина животные самостоятельно вводили наркотики в течение заранее определенного количества дней в оперантных боксах (26 для алкоголя; 12 для кокаина) независимо от того, было ли потребление наркотиков стабильным или нет. Этот метод был выбран, потому что мы хотели, чтобы животные не принимали лекарство самостоятельно в течение различного времени, что могло привести к потреблению широкого диапазона лекарств. Количество кокаина, потребляемого во время самостоятельного приема, коррелировало с последующим поиском наркотиков во время тестов на восстановление (например,г., Deroche et al., 1999; Baker et al., 2001).
Самостоятельное употребление алкоголя, обучение по искоренению и тестирование на восстановление
Всех крыс, которые позже самостоятельно вводили алкоголь в оперантные камеры, сначала приучили пить с ИУК (например, Simms et al., 2008). Эта парадигма обеспечивает крысам круглосуточный доступ к 20% -ному несладкому алкоголю через день (3 дня / недели) без водного лишения. Животные испытали 12 сеансов (более 4 недель) парадигмы периодического питья.
После воздействия алкоголя с использованием IAA, животных обучали самостоятельно вводить 20% алкоголь (об. / Об.) С помощью ежедневных 45-минутных тренировок по графику подкрепления FR-1 в течение 6 дней с последующим графиком FR-3 на 20 дней. ежедневные занятия. Эта процедура следовала процедуре Simms et al. (2010), за исключением использования 45-минутных оперантных сессий FR-3 вместо 30-минутных сессий и замены 12 ночных оперантных сессий 12 сессиями IAA. Обучение вымиранию началось после 20-го сеанса FR-3.Во время обучения вымиранию нажатия на ранее активный рычаг больше не давали представление о наркотиках и подсказках. Обучение вымиранию длилось как минимум 10 сеансов и до тех пор, пока животные не достигли критерия менее 20 реакций рычага за сеанс. Как только этот критерий был достигнут, животных подвергали 45-минутному тесту на восстановление, в ходе которого нажатие на ранее активный рычаг снова давало представление о дискретных сигналах, которые были сопряжены с доставкой алкоголя (стимулирующий свет, тон и звук шприцевого насоса). активация).Кроме того, 2 мл 20% EtOH были разбрызганы на подстилку оперантной камеры, чтобы обеспечить обонятельный сигнал.
Эксперимент 1
Здесь мы проверили способность хронически вводимого NAC ослаблять вызванное сигналом возобновление поиска алкоголя. N -ацетилцистеин (Sigma, 30 или 60 мг / кг внутрибрюшинно) или носитель (VEH; физиологический раствор 0,3 мл внутрибрюшинно) вводили за 2 часа до последних 6-8 сеансов исчезновения и перед тестом на восстановление (см. Рисунок 1A) . Доза и время инъекций были основаны на предыдущих исследованиях, демонстрирующих способность NAC в дозе 60 мг / кг восстанавливать базальные уровни глутамата после приема кокаина и ослаблять восстановление кокаина при их остром введении перед тестированием (Baker et al., 2003) и хронически во время тренировки по вымиранию (Amen et al., 2011), тогда как более низкая доза (33 мг / кг) лишь частично подавляет поиск кокаина (Moussawi et al., 2009). NAC действует быстро, в течение 2 часов после введения, для увеличения базального глутамата, выступая в качестве экзогенного источника цистеина, который заставляет систему x c — экспортировать больше глутамата (Baker et al., 2003), но также изменяет гомеостаз глутамата, когда вводить ежедневно в течение 5 или более дней (Knackstedt et al., 2010; Amen et al., 2011).После достижения критериев исчезновения реакцию животных, получавших NAC, во время пробного испытания по восстановлению сравнивали с животными, получавшими VEH. Животным назначали лечение NAC или VEH сбалансированным образом, чтобы гарантировать отсутствие групповых различий при самостоятельном введении лекарственного средства. Одно животное было исключено из тестирования восстановления (и анализа всех данных) из-за неспособности достичь критериев исчезновения.
РИСУНОК 1. Экспериментальные методы . (A) Хронология экспериментальной процедуры для экспериментов 1 и 2.Всех животных обучали самостоятельному введению пищевых гранул непосредственно перед началом самостоятельного введения оперантного алкоголя. Обработка VEH, NAC, CEF и CEFAZ началась в последние 6–8 дней обучения исчезновению. Для эксперимента NAC животным также вводили инъекцию за 2 ч до теста. (B) Хронология экспериментальной процедуры для эксперимента 3. Все животные были обучены самостоятельно вводить кормовые гранулы непосредственно перед началом самостоятельного введения оперантного алкоголя. Лечение VEH, CEF и CEFAZ начиналось на 5-й день самостоятельного приема пищи и продолжалось до 12-го дня. (C) Хронология процедуры для эксперимента 4. Все животные были обучены самостоятельному введению пищевых гранул непосредственно перед началом самостоятельного введения оперантного кокаина. VEH и CEFAZ вводили в течение последних 6–8 сеансов исчезновения и продолжали после теста на восстановление.
Эксперимент 2
Этот эксперимент был проведен аналогично эксперименту 1, за исключением того, что CEF (Hospira, 200 мг / кг IP), CEFAZ (Sigma, 100 мг / кг IP) или VEH (0.9% физиологический раствор) вводили сразу после последних 6-8 сеансов угасания, но не в день тестирования (см. Рисунок 1A). После достижения критериев исчезновения реакцию животных, получавших CEF и CEFAZ, во время испытания по восстановлению с сигналом сравнивали с животными, получавшими VEH. Доза и время инъекций CEF основывались на ранее опубликованных отчетах, показывающих, что 200 мг / кг эффективно ослабляют восстановление кокаина и восстанавливают гомеостаз глутамата при хроническом введении после сеансов исчезновения в течение как минимум 5 дней (Knackstedt et al., 2010; Trantham-Davidson et al., 2012). Доза CEFAZ была основана на аллометрических расчетах от максимальной дозы для человека, рекомендованной производителем, до эквивалентной максимальной дозы для крыс 100 мг / кг и вводилась после сеансов исчезновения, подобных введению CEF.
Самостоятельное введение пищевых продуктов и сахарозы (эксперимент 3)
Животные самостоятельно вводили стандартные гранулы для корма (45 мг; Bio-serv) в операционную камеру с использованием схемы подкрепления FR-1 в течение 2 ч / день в течение 12 дней.На 13-й день гранулы сахарозы (45 мг; Bio-serv) заменили стандартные гранулы для корма. Животные получали CEF, CEFAZ или VEH таким же образом, как описано для эксперимента 2, за исключением того, что инъекции начинали после оперантного сеанса на 5-й день самостоятельного введения пищи (см. Фиг. 1B).
Самостоятельное введение, искоренение и восстановление кокаина (эксперимент 4)
Для имплантации катетеров крыс анестезировали кетамином HCl (87,5 мг / кг, в / м) и ксилазином (5 мг / кг, в / м).Кеторолак (3 мг / кг, внутрибрюшинно) вводили перед операцией для обезболивания. Конструкция катетера и хирургическая имплантация подробно описаны в другом месте (Knackstedt et al., 2014). Крысы выздоравливали через 6 дней после операции до начала обучения самостоятельному введению. Самостоятельное введение кокаина проводилось по графику FR-1; сеансы продолжались 2 часа в день и более подробно описаны выше. Самостоятельное введение продолжалось до тех пор, пока субъекты не достигли 12-дневного срока с минимум 10 инфузиями кокаина, после чего следовала тренировка вымирания.Животных обрабатывали либо CEFAZ, либо VEH способом, идентичным таковому в эксперименте 2, сразу после последних 6-8 сеансов исчезновения (см. Рисунок 1C). После того, как критерии исчезновения были достигнуты, животных тестировали на восстановление с помощью сигналов и кокаина (каждый тест длился 2 часа), с тестами, разделенными 3 днями обучения исчезновению. Во время восстановления с сигналом, нажатие на ранее активный рычаг снова давало дискретные сигналы, сопряженные с доставкой кокаина, но лекарство не было доставлено.Во время восстановления с использованием кокаина животным вводили 10 мг / кг кокаина (IP) непосредственно перед помещением в операционную камеру; нажатие на ранее активный рычаг не имело последствий во время этого теста.
Анализ данных
Уровень альфа был установлен на p <0,05 для всех статистических тестов, которые проводились с использованием программного обеспечения SPSS. Активное нажатие на рычаг во время самостоятельного введения и компоненты эксперимента по исчезновению были проанализированы с помощью теста смешанного факторного двухфакторного дисперсионного анализа (ANOVA) с повторной мерой времени.Тесты восстановления представляли собой запланированные сравнения (вымирание по сравнению с днем тестирования) и, таким образом, были проанализированы с помощью тестов для парных выборок t . Тесты t на независимой выборке использовались для сравнения активных жимов с рычагом во время тестов восстановления между группами лечения. Групповые различия в самоуправлении пищи были исследованы с использованием однофакторного дисперсионного анализа. Выбросы определялись как значения, превышающие два стандартных отклонения +/– среднее, и исключались из дальнейшего анализа. Группы со значениями выбросов упоминаются в разделе «Результаты».
Результаты
Влияние NAC на восстановление стремления к алкоголю (эксперимент 1)
Группы, получавшиеVEH и NAC, не различались по количеству самостоятельно вводимого алкоголя (рис. 2A). Двусторонний дисперсионный анализ ANOVA с повторными измерениями в день был рассчитан на основе данных активного нажатия на рычаг во время самостоятельного введения и не обнаружил значительного эффекта дня [ F (19,475) = 1,480, нс] или группы [ F (2 , 25) = 0,080, нс]. Было значимое взаимодействие день × группа [ F (19 475) = 2.020, p <0,01]. Аналогичным образом, двухфакторный дисперсионный анализ ANOVA был рассчитан для нажатий на рычаг во время тренировки угасания (рис. 2B) и выявил значительный эффект дня [ F (9,225) = 6,977, p <0,001], но не группы [ F]. (2,25) = 0,240, нс]. Не было значимого взаимодействия день × группа [ F (18,225) = 0,809, n.s.]. Мы использовали парные образцы t -тесты для анализа данных, представленных на рисунке 2C, чтобы сравнить активные нажатия рычага во время восстановления с сигналом запуска со средним значением за последние 3 дня исчезновения.Значительные различия были обнаружены между исчезновением и восстановлением с сигналом для всех групп лечения [Veh: t (1,7) = 4,036, p <0,01; NAC60: t (1,8) = 4,302, p <0,01; NAC30: t (1,9) = 3,651, p <0,05], что указывает на то, что ни одна доза NAC не способна предотвратить возобновление поиска алкоголя, вызванное сигналом.
РИСУНОК 2. N -ацетилцистеин не ослаблял ориентированное на сигнал восстановление поиска алкоголя . (A) Среднее количество активных нажатий на рычаг во время FR3 части эксперимента не различается между группами. (B) Среднее количество активных жимов рычагов во время тренировки на угасание не различается между группами. (C) N -ацетилцистеин не ослаблял стимулированное сигналом восстановление поиска алкоголя. * p <0,05 при сравнении исчезновения с испытанием.
Влияние CEF и CEFAZ на восстановление стремления к алкоголю (эксперимент 2)
Группы транспортных средств, CEF и CEFAZ не различались по количеству активных нажатий на рычаг во время самостоятельного введения (рис. 3A).Двусторонний дисперсионный анализ ANOVA с повторными измерениями в день был рассчитан на активных нажатиях рычага во время самостоятельного введения алкоголя (рис. 3A) и выявил значительный эффект дня [ F (19,380) = 2,612, p <0,01], но не Группа [ F (2,20) = 0,370, нс]. Не было значимого взаимодействия день × группа [ F (19,380) = 1,277, n.s.]. Аналогичным образом, двухфакторный дисперсионный анализ был рассчитан для количества нажатий на рычаг во время тренировки угасания (рис. 3В) и выявил значительный эффект дня [ F (9,180) = 8.050, p <0,001], но не группа [ F (2,20) = 0,989, n.s.]. Не было значимого взаимодействия день × группа [ F (2180) = 1,249, n.s.]. Мы использовали парные образцы t -тесты для сравнения активных нажатий на рычаг во время восстановления с сигналом с активными нажатиями в течение последних 3 дней исчезновения (рис. 3C). Существенная разница между исчезновением и восстановлением с сигналом-приставкой наблюдалась только для животных, получавших носитель [ t (1,8) = 2,892, p <0.05], что указывает на то, что CEF [ t (1,6) = 1,3998, н.у.] и CEFAZ [ t (1,6) = 2,090, н.о.] ослабляют ориентированное на сигнал восстановление поиска алкоголя.
РИСУНОК 3. Цефтриаксон и цефазолин ослабляли восстановление поиска алкоголя . (A) Среднее количество активных нажатий на рычаг во время FR3 части эксперимента не различается между группами. (B) Среднее количество активных жимов рычагов во время тренировки на угасание не различается между группами. (C) Только животные, обработанные носителем, возобновили нажатие на рычаг во время теста на восстановление с сигналом. * p <0,05 при сравнении исчезновения с испытанием.
CEF и CEFAZ не повлияли на самостоятельное введение пищевых продуктов и сахарозы или вес (эксперимент 3)
Поскольку лечение CEF и CEFAZ начиналось после сеанса на 5-й день, статистический анализ проводился только на данных в течение периода лечения антибиотиками (или носителем) (6–12 дни). Одно животное было исключено из анализа данных, поскольку его нажатие на рычаг на 13-й день превышало два стандартных отклонения от среднего значения.Один ANOVA был рассчитан на активных нажатиях на рычаг во время самостоятельного введения и не выявил эффекта от группы лечения [ F (2,17) = 2,128, н.с .; Рисунок 4A]. Мы также провели двухфакторный дисперсионный анализ с повторными измерениями в день, и этот анализ не выявил значительных эффектов [День: F (6,102) = 1,963, н.с .; День × Группа: F (12 102) = 1,375, н.с .; Группа: F (2,17) = 2,361, n.s.]. Однофакторный дисперсионный анализ был использован для определения наличия групповых различий в количестве гранул сахарозы, полученных на 13-й день эксперимента (фиг. 4B), и не обнаружил никакого эффекта [ F (2,17) = 1.068, н.у.]. Также не было никакой разницы в весе во времени между тремя группами лечения (рис. 4C). Двусторонний анализ RM ANOVA обнаружил эффект дня [ F (11,102) = 9,145, p <0,001], но отсутствие взаимодействия день × группа [ F (12,102) = 2,507, нс] или эффект группы [ F (2,17) = 1,924, нс] на вес животного.
РИСУНОК 4. Цефтриаксон и цефазолин не повлияли на мотивацию самостоятельного приема пищи или гранул сахарозы . (A) CEF и CEFAZ не повлияли на самостоятельное введение гранул для обычного корма. (B) CEF и CEFAZ не изменили среднее количество самостоятельно вводимых гранул сахарозы. (C) Средняя масса тела не различалась у крыс, получавших носитель, CEF или CEFAZ.
CEFAZ не ослабил возобновление поиска кокаина (эксперимент 4)
Двусторонний дисперсионный анализ, рассчитанный для количества потребленного кокаина (рис. 5A), не выявил групповых различий [ F (1,12) = 0.357, н. Не было также групповых различий в тренировке по угасанию [ F (1,12) = 0,472, нс] и отсутствие взаимодействия день × группа [ F (12,108) = 0,696, нс], но был эффект дня [] F (9,108) = 19,076, p <0,001], поскольку обе группы уменьшили нажатие на рычаг во время тренировки (Рисунок 5B). Тесты на парной выборке t выявили существенные различия между исчезновением и восстановлением с сигналом для обоих CEFAZ [ t (1,5) = 2.834, p <0,05] и [ t (1,7) = 4,453, p <0,01] животных (фигура 5C). Тесты на парной выборке t выявили существенные различия между исчезновением и восстановлением с использованием кокаина как для CEFAZ [ t (1,5) = 2,834, p <0,05], так и для обработанного носителем [ t (1, 7) = 2,614, p <0,05] животных (фиг. 5D). Таким образом, CEFAZ не ослаблял восстановление с помощью реплики или кокаина. Кроме того, независимый образец t -тест не показал различий в нажатии рычага между группами, получавшими носитель и CEFAZ, во время сигнала [ t (1,12) = 0.272, n.s.] и тесты на кокаин [ t (1,12) = 0,269, n.s.].
РИСУНОК 5. Цефазолин не ослаблял стимулированное сигналом или кокаином восстановление поиска кокаина . (A) Животные, которых позднее лечили носителем или CEFAZ, не различались по количеству инфузий, достигнутых при самостоятельном введении кокаина. (B) Животные, получавшие носитель и CEFAZ, не различались по активному нажатию на рычаг во время обучения вымиранию. (C) CEFAZ не ослаблял восстановление с запуском реплики. (D) CEFAZ не ослаблял кокаинового восстановления. * p <0,05 при сравнении исчезновения с испытанием.
Обсуждение
Здесь мы продемонстрировали, что обучение грызунов Sprague-Dawley самостоятельному употреблению несладкого алкоголя в оперантной камере может быть выполнено с использованием ежедневных тренировок без продолжительных (14 ч; например, Simms et al., 2010) оперантных сессий через день. Это первая демонстрация такого эффекта у штамма Sprague-Dawley.Augier et al. (2014) недавно продемонстрировали такой же эффект на крысах Вистар. Использование процедуры, описанной здесь (рис. 1A), сократило время для завершения эксперимента на 4 недели по сравнению с процедурой, использующей прерывистые (MWF) оперантные сеансы (например, Simms et al., 2010). Это представляет собой значительную экономию ресурсов лаборатории.
Мы использовали эту оперантную процедуру, чтобы исследовать способность NAC, CEF и CEFAZ ослаблять восстановление, ориентированное на сигнал. Пять дней лечения NAC (30 или 60 мг / кг) не ослабляли восстановления с прицельным сигналом (рис. 2С).Мы обнаружили, что хронические CEF (200 мг / кг) и CEFAZ (100 мг / кг) ослабляют стимулированное сигналом восстановление поиска алкоголя (рис. 3C). И NAC, и CEF ослабляют восстановление потребления кокаина и героина (Baker et al., 2003; Zhou and Kalivas, 2008; Knackstedt et al., 2010; Reichel et al., 2011; Sondheimer and Knackstedt, 2011; Shen et al., 2014) . Кроме того, было зарегистрировано, что оба соединения сходным образом восстанавливают гомеостаз глутамата в NAc после приема кокаина (см. Таблицу 1). Оба соединения увеличивают экспрессию и функцию GLT-1 и системы x c — / xCT (Knackstedt et al., 2010; Trantham-Davidson et al., 2012), повышают базальный уровень глутамата (Baker et al., 2003; Trantham-Davidson et al., 2012) и нормализуют потенцированные глутаматные синапсы (Moussawi et al., 2011; Trantham-Davidson et al. ., 2012). Поскольку CEF и NAC аналогичным образом модулируют пост-кокаиновый гомеостаз глутамата, и настоящие результаты показывают диссоциацию между способностью соединений ослаблять восстановление алкоголя, CEF и CEFAZ, вероятно, ослабляют восстановление алкоголя через глутамат-независимый механизм.
ТАБЛИЦА 1. Краткое изложение эффектов N -ацетилцистеина и цефтриаксона на индуцированную кокаином адаптацию в прилежащем ядре.
Цефазолин снижает передачу ГАМК A (Yamazaki et al., 2002; Sugimoto et al., 2003). Положительная аллостерическая модуляция ГАМК А усиливает возобновление поиска алкоголя (Finn et al., 2008; Ramaker et al., 2014), и, таким образом, снижение передачи ГАМК с помощью CEFAZ может быть механизмом действия, с помощью которого он снижает восстановление потребления алкоголя. .CEF не был полностью оценен на предмет его способности изменять передачу GABA, хотя существует один отчет, показывающий, что он не изменяет связывание рецептора GABA A в гиппокампе или лобной и теменной коре головного мозга (Inui et al., 2013). Не было продемонстрировано, что CEFAZ влияет на передачу глутамата: он не изменяет функцию NMDA (Yamazaki et al., 2002; Sugimoto et al., 2003), и не было установлено, что он сильно индуцирует экспрессию GLT-1, как CEF и пенициллин (Rothstein et al., др., 2005). Данные, представленные на рисунках 5C, D, свидетельствуют о том, что CEFAZ не влияет на возобновление поиска кокаина с помощью сигналов или кокаина.Таким образом, механизм, с помощью которого CEFAZ ослабляет восстановление алкоголя, вероятно, не включает модуляцию нейротрансмиссии глутамата в НА.
Цефтриаксон и CEFAZ являются антибиотиками и могут вызывать желудочно-кишечные расстройства при длительном применении. Этот побочный эффект может повлиять на пероральный прием алкоголя у грызунов и даже на поиск алкоголя во время тестов на восстановление. Таким образом, мы стремились определить эффекты этих антибиотиков на оперативное самоуправление обычного корма и гранул сахарозы.Мы не обнаружили влияния ни одного антибиотика на самостоятельное введение гранул корма (рис. 4A) или сахарозы (рис. 4B) или на массу тела во время курса инъекций CEF и CEFAZ (рис. 4C). Эти результаты согласуются с данными Ward et al. (2011), которые не обнаружили влияния CEF на самостоятельное употребление сладкой пищи у мышей. Интересно, что хроническое введение NAC, которое не ослабляло в данном случае стремление к алкоголю, было продемонстрировано для уменьшения оперантного самостоятельного приема обычной пищи (Ramirez-Niño et al., 2013). Таким образом, мы можем заключить, что способность CEF и CEFAZ ослаблять поиск алкоголя, вызванный сигналом, вероятно, не зависит от каких-либо побочных эффектов этих соединений со стороны желудочно-кишечного тракта.
Поскольку CEFAZ не повлиял на восстановление кокаина (рис. 5C), он не может восстанавливать гомеостаз глутамата после приема кокаина. Таким образом, это маловероятный механизм, с помощью которого CEF и CEFAZ ослабляют стимулированное сигналом возобновление поиска алкоголя. В подтверждение этого следует отметить, что NAC, который действительно изменяет гомеостаз глутамата, не ослаблял поиск алкоголя, вызванный сигналом.Этот вывод удивителен в свете доказательств, подтверждающих передачу сигналов глутамата в этом поведении. У предпочитающих алкоголь (P) крыс CEF снижает потребление алкоголя резко и после периода абстиненции (Sari et al., 2013; Alhaddad et al., 2014). У крыс P способность CEF модулировать поиск алкоголя сопровождалась увеличением GLT-1 и xCT (Sari et al., 2013; Alhaddad et al., 2014). Эти результаты показывают, что модуляция гомеостаза глутамата может быть механизмом, с помощью которого CEF снижает потребление алкоголя, по крайней мере, у P-крыс.Однако не было показано, что повышенная экспрессия этих белков является механизмом, с помощью которого CEF проявляет свои поведенческие эффекты. Альтернативное объяснение неспособности NAC ослабить возобновление употребления алкоголя в настоящей рукописи состоит в том, что введение в действие реакции поиска алкоголя могло изменить лежащую в основе нейробиологию поиска алкоголя, делая манипуляции с GLT-1 и xCT (и тем самым с глутаматом). уровни) неэффективны для предотвращения восстановления.
Отсутствие влияния NAC на стремление к алкоголю не исключает участия глутамата в восстановлении употребления алкоголя.Антагонизм постсинаптических рецепторов mGluR5 и AMPA ослабляет восстановление, вызванное сигналом (Backstrom and Hyytia, 2004; Backstrom et al., 2004; Sanchis-Segura et al., 2006; Sinclair et al., 2012). Стимуляция пресинаптического глутаматного ауторецептора mGluR2 / 3 также ослабляет вызванное сигналом возобновление поиска алкоголя (Zhao et al., 2006), предположительно за счет уменьшения пресинаптического высвобождения глутамата. В то время как восстановление и кокаина, и алкоголя обусловлено высвобождением синаптического глутамата в ядре NA во время события восстановления (McFarland et al., 2003; Gass et al., 2011), а NAC и CEF ослабляют это увеличение во время восстановления кокаина (Baker et al., 2003; Trantham-Davidson et al., 2012), NAC (и, возможно, CEF) могут быть не в состоянии ослабить глутамат. выпуск при восстановлении алкоголя . Причина этого может заключаться в том, что кокаин и алкоголь имеют противоположные эффекты на базальный уровень глутамата в ядре NA. Кокаин снижается (Baker et al., 2003), а алкоголь увеличивается (Melendez et al., 2005; Griffin Iii et al., 2013) базальный уровень глутамата. И NAC, и CEF повышают базальный уровень глутамата после приема кокаина, но не у животных, ранее не принимавших наркотики
(Baker et al., 2003; Trantham-Davidson et al., 2012). После обработки NAC этот повышенный базальный уровень глутамата, полученный из системы x c — восстанавливает тонус ауторецепторов mGluR2 / 3 (Moussawi et al., 2011), тем самым восстанавливая способность этих рецепторов оказывать отрицательную обратную связь по высвобождению глутамата во время восстановления. Возможно, что повышенный уровень базального глутамата после употребления алкоголя также вызывает сбой в передаче сигналов mGluR2 / 3, которая нечувствительна к лечению NAC.Эффекты CEF на функцию mGluR2 / 3 еще не исследованы (см. Таблицу 1). Будущие эксперименты по изучению базального уровня глутамата через 2–3 недели после прекращения самостоятельного приема алкоголя в сочетании с NAC и CEF предоставят ценные данные относительно потенциальной ценности манипулирования базальным глутаматом для лечения рецидива алкоголя.
В целом, эти результаты показывают, что обучение крыс Sprague-Dawley самостоятельному введению алкоголя в оперантной камере может быть выполнено без угасания сахарозы и с использованием ежедневных тренировок без длительных оперантных сессий.Мы обнаружили, что регулирование гомеостаза глутамата, вероятно, не будет представлять собой успешную стратегию лечения для предотвращения рецидива пристрастия к алкоголю. В будущих исследованиях следует изучить модуляцию ГАМК как потенциальный механизм действия CEF и как метод ослабления рецидива алкоголя.
Заявление о конфликте интересов
Рецензент Джейми Петерс заявляет, что, несмотря на то, что он был связан с тем же учреждением, что и автор Ана Вейланд, процесс рецензирования проводился объективно и конфликта интересов не было.Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Этот проект финансировался пилотной премией Чарльстонского центра исследований алкоголя (P50 AA010761) и NIDA R01 DA033436, оба присуждены LK.
Список литературы
Альхаддад, Х., Дас, С. К., Сари, Ю. (2014). Влияние CEF на потребление алкоголя: возможная роль в модуляции уровня глутамата изоформ xCT и GLT-1 у P крыс. Психофармакология 231, 4049–4057. DOI: 10.1007 / s00213-014-3545-y
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Амен, С. Л., Пиасентин, Л. Б., Ахмад, М. Э., Ли, С. Дж., Манч, Дж. Р., Райзингер, Р. К. и др. (2011). Повторный N -ацетилцистеин снижает поиск кокаина у грызунов и тягу к кокаинозависимым людям. Нейропсихофармакология 36, 871–878. DOI: 10.1038 / npp.2010.226
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ожье, Э., Фланиган, М., Дульман, Р.С., Пинкус, А., Шенк, Дж. Р., Райс, К. С. и др. (2014). Крысы Wistar получают и поддерживают самостоятельное введение 20% этанола без водного лишения, исчезновения сахарина / сахарозы или расширенного обучения доступу. Психофармакология 231, 4561–4568. DOI: 10.1007 / s00213-014-3605-3
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Авена, Н. М., Рада, П., и Хобель, Б. Г. (2008). Доказательства сахарной зависимости: поведенческие и нейрохимические эффекты периодического чрезмерного потребления сахара. Neurosci. Biobehav. Ред. 32, 20–39. DOI: 10.1016 / j.neubiorev.2007.04.019
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Backstrom, P., Bachteler, D., Koch, S., Hyytia, P., and Spanagel, R. (2004). Антагонист mGluR5 MPEP снижает стремление к этанолу и снижает рецидивы. Нейропсихофармакология 29, 921–928. DOI: 10.1038 / sj.npp.1300381
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Бэкстрем, П., и Hyytia, P. (2004). Антагонисты ионотропных рецепторов глутамата модулируют вызванное сигналом восстановление поведения, связанного с поиском этанола. Алкоголь. Clin. Exp. Res. 28, 558–565. DOI: 10.1097 / 01.ALC.0000122101.13164.21
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Бейкер, Д. А., МакФарланд, К., Лейк, Р. У., Шен, Х., Тан, X. С., Тода, С. и др. (2003). Нейроадаптации в обмене цистин-глутамат лежат в основе рецидива кокаина. Нат. Neurosci. 6, 743–749. DOI: 10.1038 / nn1069
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Бейкер Д. А., Тран-Нгуен Т. Л., Фукс Р. А. и Нейзевандер Дж. Л. (2001). Влияние индивидуальных различий и хронического лечения флуоксетином на поиск кокаина у крыс. Психофармакология 155, 18–26. DOI: 10.1007 / s002130000676
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Бейкер, Д.А., Си, З. X., Шен, Х., Суонсон, К. Дж., И Каливас, П. У. (2002). Происхождение и нейрональная функция несинаптического глутамата in vivo. J. Neurosci. 22, 9134–9141.
Google Scholar
Бонджованни, М., и Си, Р. Э. (2008). Сравнение эффектов различных оперантных тренировок и ограничений в питании на возобновление поиска кокаина у крыс. Pharmacol. Biochem. Behav. 89, 227–233. DOI: 10.1016 / j.pbb.2007.12.019
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Каррильо, Дж., Ховард, Э. К., Мотен, М., Хоук, Б. Д., Чаховски, К. Л., и Гонсалес, Р. А. (2008). 3-дневное воздействие 10% этанола с 10% сахарозы успешно инициирует самостоятельное введение этанола. Алкоголь 42, 171–178. DOI: 10.1016 / j.alcohol.2008.01.005
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Colantuoni, C., Rada, P., McCarthy, J., Patten, C., Avena, N. M., Chadeayne, A., et al. (2002). Доказательства того, что периодическое чрезмерное потребление сахара вызывает эндогенную опиоидную зависимость. Obes. Res. 10, 478–488. DOI: 10.1038 / oby.2002.66
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Дерош В., Ле Моаль М. и Пьяцца П. В. (1999). Самостоятельное введение кокаина увеличивает побудительные мотивационные свойства препарата у крыс. Eur. J. Neurosci. 11, 2731–2736. DOI: 10.1046 / j.1460-9568.1999.00696.x
CrossRef Полный текст | Google Scholar
Эпштейн, Д. Х., Престон, К. Л., Стюарт, Дж., Шахам, Ю. (2006). К модели рецидива наркотиков: оценка обоснованности процедуры восстановления. Психофармакология (Berl) 189, 1–16. DOI: 10.1007 / s00213-006-0529-6
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Финн Д. А., Марк Г. П., Фретвелл А. М., Гилиланд-Кауфман К. Р., Стронг М. Н. и Форд М. М. (2008). Восстановление поиска этанола и сахарозы нейростероидом аллопрегнанолоном у мышей C57BL / 6. Психофармакология 201, 423–433.DOI: 10.1007 / s00213-008-1303-8
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Гасс, Дж. Т., Синклер, К. М., Клева, Р. М., Видхольм, Дж. Дж. И Олив, М. Ф. (2011). Алкогольное поведение связано с повышенной передачей глутамата в базолатеральной миндалине и прилежащем ядре, что измеряется биосенсорами, покрытыми глутаматоксидазой. Наркоман. Биол. 16, 215–228. DOI: 10.1111 / j.1369-1600.2010.00262.x
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Гриффин, В.С. III., Хаун, Х. Л., Хазелбейкер, К. Л., Рамачандра, В. С., и Беккер, Х. С. (2013). Повышенный уровень внеклеточного глутамата в прилежащем ядре способствует чрезмерному употреблению этанола у мышей, зависимых от этанола. Нейропсихофармакология 39, 707–717. DOI: 10.1038 / npp.2013.256
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Inui, T., Alessandri, B., Heimann, A., Nishimura, F., Frauenknecht, K., Sommer, C., et al. (2013). Нейропротекторный эффект CEF на полутень на модели венозной ишемии у крыс. Неврология 242, 1–10. DOI: 10.1016 / j.neuroscience.2013.03.018
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Янак, П. Х., и Майкл Гилл, Т. (2003). Сравнение эффектов аллопрегнанолона с прямыми ГАМКергическими агонистами на самостоятельное введение этанола с одновременной доступной сахарозой и без нее. Спирт 30, 1–7. DOI: 10.1016 / S0741-8329 (03) 00068-5
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Кенна, Г.А., Макгири, Дж. Э. и Свифт, Р. М. (2004). Фармакотерапия, фармакогеномика и будущее лечения алкогольной зависимости, Часть 2. Am. J. Health Syst. Pharm. 61, 2380–2388.
PubMed Аннотация | Полный текст | Google Scholar
Knackstedt, L.A., Trantham-Davidson, H., and Schwendt, M. (2014). Роль вентрального и дорсального полосатого тела mGluR5 в рецидиве кокаинового поиска и угасающем обучении. Наркоман. Биол. 19, 87–101. DOI: 10.1111 / adb.12061
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Кооб, Г.Ф., и Вайс Ф. (1990). Фармакология самостоятельного приема лекарств. Алкоголь 7, 193–197. DOI: 10.1016 / 0741-8329 (90) -V
CrossRef Полный текст | Google Scholar
Ли, С. Г., Су, З. З., Эмдад, Л., Гупта, П., Саркар, Д., Боржабад, А., и др. (2008). Механизм индукции цефтриаксоном экспрессии возбуждающего переносчика аминокислот-2 и поглощения глутамата в первичных астроцитах человека. J. Biol. Chem. 283, 13116–3123. DOI: 10.1074 / jbc.M707697200
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Леверенц, Дж., Альбрехт, П., Тиен, М. Л., Хенке, Н., Карумбаярам, С., Корнблюм, Х. И. и др. (2009). Индукция Nrf2 и xCT вовлечены в действие нейрозащитного антибиотика цефтриаксона in vitro. J. Neurochem. 111, 332–343. DOI: 10.1111 / j.1471-4159.2009.06347.x
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Макбрайд, В. Дж., И Ли, Т. К. (1998). Животные модели алкоголизма: нейробиология употребления алкоголя у грызунов. Крит.Rev. Neurobiol. 12, 339–369. DOI: 10.1615 / CritRevNeurobiol.v12.i4.40
CrossRef Полный текст | Google Scholar
МакФарланд К., Лапиш К. К. и Каливас П. У. (2003). Префронтальное высвобождение глутамата в ядро прилежащего ядра опосредует вызванное кокаином восстановление поведения, связанного с поиском наркотиков. J. Neurosci. 23,3531–3537.
PubMed Аннотация | Полный текст | Google Scholar
Meisch, R.A., and Thompson, T. (1972). Потребление этанола во время полидипсии, вызванной расписанием. Physiol. Behav. 8, 471–475. DOI: 10.1016 / 0031-9384 (72)
-9
CrossRef Полный текст | Google Scholar
Мелендес Р. И., Хикс М. П., Кейгл С. С. и Каливас П. В. (2005). Воздействие этанола снижает поглощение глутамата в прилежащем ядре. Алкоголь. Clin. Exp. Res. 29, 326–333. DOI: 10.1097 / 01.ALC.0000156086.65665.4D
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Муссави, К., Пачиони, А., Моран, М., Olive, M. F., Gass, J. T., Lavin, A., et al. (2009). N-ацетилцистеин отменяет индуцированную кокаином метапластичность. Нат. Neurosci. 12, 182–189. DOI: 10.1038 / NN.2250
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Moussawi, K., Zhou, W., Shen, H., Reichel, C.M, See, R.E., Carr, D. B., et al. (2011). Обращение кокаина-индуцированной синаптической потенциации обеспечивает длительную защиту от рецидива. Proc. Natl. Акад. Sci. США 108, 385–390.DOI: 10.1073 / pnas.1011265108
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ни, Х., и Джанак, П. Х. (2003). Сравнение восстановления поиска этанола и сахарозы условными стимулами и прайминговыми инъекциями аллопрегнанолона после исчезновения крыс. Психофармакология 168, 222–228. DOI: 10.1007 / s00213-003-1468-0
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
NIH. (2006). «Национальное эпидемиологическое исследование алкоголя и связанных с ним состояний: 2001–2002 гг.Употребление алкоголя и расстройства, связанные с употреблением алкоголя в США », в справочном руководстве по эпидемиологическим данным по алкоголю , том 8 (Bethesda, MD: Национальный институт злоупотребления алкоголем и алкоголизма).
Google Scholar
Рамакер, М. Дж., Форд, М. М., Филлипс, Т. Дж., И Финн, Д. А. (2014). Различия в возобновлении поиска этанола с помощью ганаксолона и габоксадола. Неврология 272, 180–187. DOI: 10.1016 / j.neuroscience.2014.04.065
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Рамирес-Ниньо, А.М., Д’Суза, М.С., Марку, А. (2013). N-ацетилцистеин уменьшал самовведение никотина и вызванное сигналом восстановление поиска никотина у крыс: сравнение с эффектами N-ацетилцистеина на реакцию на пищу и поиск пищи. Психофармакология 225, 473–482. DOI: 10.1007 / s00213-012-2837-3
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Райхель, К. М., Муссави, К., До, П. Х., Каливас, П. У. и Си, Р. Э. (2011). Хронический N-ацетилцистеин во время воздержания или прекращения употребления наркотиков после самостоятельного приема кокаина приводит к стойкому сокращению поиска наркотиков. J. Pharmacol. Exp. Ther. 337, 487–493. DOI: 10.1124 / jpet.111.179317
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ротштейн, Дж. Д., Патель, С., Реган, М. Р., Хенггели, К., Хуанг, Ю. Х., Берглес, Д. Э. и др. (2005). Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата. Nature 433, 73–77. DOI: 10.1038 / nature03180
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Самсон, Х.Х., Файлы Ф. Дж., Деннинг К. и Марвин С. (1998). Сравнение селективно выведенных линий крыс, предпочитающих этанол, и не предпочитающих их. I. Инициирование этанола и оперантное самоуправление с ограниченным доступом. Алкоголь. Clin. Exp. Res. 22, 2133–2146. DOI: 10.1111 / j.1530-0277.1998.tb05927.x
CrossRef Полный текст | Google Scholar
Самсон, Х. Х., Шарп, А. Л., и Деннинг, К. (1999). Инициирование самостоятельного введения этанола у крыс с использованием замены сахарозы в процедуре сиппер-пробирки. Психофармакология 147, 274–279. DOI: 10.1007 / s002130051167
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Самсон, Х. Х., Толливер, Г. А., Пфеффер, А. О., Садеги, К. Г., и Миллс, Ф. Г. (1987). Усиление перорального приема этанола у крыс: эффект частичного обратного агониста бензодиазепина RO15-4513. Pharmacol. Biochem. Behav. 27, 517–519. DOI: 10.1016 / 0091-3057 (87)-1
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Санчис-Сегура, К., Borchardt, T., Vengeliene, V., Zghoul, T., Bachteler, D., Gass, P., et al. (2006). Участие субъединицы GluR-C рецептора AMPA в поведении, связанном с потреблением алкоголя, и рецидивах. J. Neurosci. 26, 1231–1238. DOI: 10.1523 / JNEUROSCI.4237-05.2006
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Сари Ю., Сримантула С. Н., Ли М. Р. и Чой Д. С. (2013). Лечение CEF влияет на уровни GLT1 и ENT1, а также на потребление этанола у предпочитающих алкоголь крыс. J. Mol. Neurosci. 51, 779–787. DOI: 10.1007 / s12031-013-0064-y
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Шен, Х. В., Скофилд, М. Д., Богер, Х., Хенсли, М., и Каливас, П. У. (2014). Распространение синаптического глутамата из-за нарушения поглощения глутамата опосредует рецидив героина. J. Neurosci. 34, 5649–5657. DOI: 10.1523 / JNEUROSCI.4564-13.2014
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Симмс, Дж.А., Бито-Онон, Дж. Дж., Чаттерджи, С., Бартлетт, С. Э. (2010). Крысы Long-Evans приобретают оперативное самостоятельное введение 20% этанола без исчезновения сахарозы. Нейропсихофармакология 35, 1453–1463. DOI: 10.1038 / npp.2010.15
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Simms, J. A., Steensland, P., Medina, B., Abernathy, K. E., Chandler, L.J., Wise, R., et al. (2008). Периодический доступ к 20% этанолу вызывает высокое потребление этанола у крыс Long-Evans и Wistar. Алкоголь. Clin. Exp. Res. 32, 1816–1823. DOI: 10.1111 / j.1530-0277.2008.00753.x
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Синклер, К. М., Клева, Р. М., Худ, Л. Е., Олив, М. Ф., и Гасс, Дж. Т. (2012). Рецепторы mGluR5 в базолатеральной миндалине и прилежащем ядре регулируют вызванное сигналом восстановление поведения, связанного с поиском этанола. Pharmacol. Biochem. Behav. 101, 329–335. DOI: 10.1016 / j.pbb.2012.01.014
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Зондхаймер, И., и Knackstedt, L.A. (2011). CEF предотвращает индукцию кокаиновой сенсибилизации и вызывает стойкое ослабление стимулированного сигналом и кокаином возобновления поиска кокаина. Behav. Brain Res. 225, 252–258. DOI: 10.1016 / j.bbr.2011.07.041
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Сугимото М., Учида И., Машимо Т., Ямазаки С., Хатано К., Икеда Ф. и др. (2003). Доказательства участия блокады рецепторов ГАМК (А) в судорогах, вызванных цефалоспоринами. Нейрофармакология 45, 304–314. DOI: 10.1016 / S0028-3908 (03) 00188-6
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Трантам-Дэвидсон, Х., Ла-Люмьер, Р. Т., Рейсснер, К. Дж., Каливас, П. У., и Кнакстедт, Л. А. (2012). CEF нормализует синаптическую передачу, транспорт глутамата и экспорт прилежащего ядра прилежащего ядра после тренировки по самостоятельному введению кокаина и вымирания. J. Neurosci. 32, 12406–12410. DOI: 10.1523 / JNEUROSCI.1976-12.2012
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Vacca, G., Serra, S., Brunetti, G., Carai, M.A., Samson, H.H., Gessa, G.L., et al. (2002). Оперативное самостоятельное введение этанола у сардинских крыс, предпочитающих алкоголь. Алкоголь. Clin. Exp. Res. 26, 1678–1685. DOI: 10.1111 / j.1530-0277.2002.tb02470.x
CrossRef Полный текст | Google Scholar
Уокер, Б. М., и Куб, Г. Ф. (2007). Баклофен, агонист рецептора гамма-аминомасляной кислоты B, ослабляет реакцию на этанол у этанол-зависимых крыс. Алкоголь. Clin. Exp. Res. 31, 11–18. DOI: 10.1111 / j.1530-0277.2006.00259.x
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Уокер, Б. М., Расмуссен, Д. Д., Раскинд, М. А., и Куб, Г. Ф. (2008). Антагонизм к альфа-1-норадренергическим рецепторам блокирует вызванное зависимостью увеличение реакции на этанол. Алкоголь 42, 91–97. DOI: 10.1016 / j.alcohol.2007.12.002
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Уорд, С.J., Rasmussen, B.A., Corley, G., Henry, C., Kim, J.K., Walker, E.A., et al. (2011). Бета-лактамный антибиотик снижает усвоение и мотивацию кокаина, но не сладкой пищи, у мышей C57Bl / 6. Behav. Pharmacol. 22, 370–373. DOI: 10.1097 / FBP.0b013e3283473c10
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Ямадзаки С., Мотидзуки Ю., Тераи Т., Сугимото М., Учида И., Мацуока Н. и др. (2002). Интрацеребровентрикулярная инъекция антибиотика цефоселиса вызывает судороги у мышей за счет ингибирования рецепторов ГАМК. Pharmacol. Biochem. Behav. 74, 53–59. DOI: 10.1016 / S0091-3057 (02) 00947-4
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Чжао Ю., Дайяс К. В., Ауйла Х., Баптиста М. А., Мартин-Фардон Р. и Вайс Ф. (2006). Активация метаботропных рецепторов глутамата группы II ослабляет как стресс, так и вызванный сигналом поиск этанола и модулирует экспрессию c-fos в гиппокампе и миндалевидном теле. J. Neurosci. 26, 9967–9974. DOI: 10.1523 / JNEUROSCI.2384-06.2006
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Чжоу В. и Каливас П. В. (2008). N-ацетилцистеин снижает реакцию угасания и вызывает стойкое сокращение поиска наркотиков, вызванного сигналом и героином. Biol. Психиатрия 63, 338–340. DOI: 10.1016 / j.biopsych.2007.06.008
PubMed Аннотация | Полный текст | CrossRef Полный текст | Google Scholar
Цефтриаксон, ослабленное тревожное поведение и усиленный транспорт глутамата в головном мозге у рыбок данио, подвергшихся отмене алкоголя
Airagnes G, Ducoutumany G, Laffy-Beaufils B, Le Faou AL, Limosin F (2019) Управление алкогольным абстинентным синдромом: есть ли что-нибудь новое? Rev Med Intern 40: 373–379
CAS Google ученый
Salottolo K, McGuire E, Mains CW, van Doorn EC, Bar-Or D (2017) Возникновение, предикторы и прогноз синдрома отмены алкоголя и белой горячки после травмы. Crit Care Med 45: 867–874
PubMed Google ученый
Валенсуэла CF, Апулия MP, Zucca S (2001) Обновленная информация о патологии головного мозга — В центре внимания: системы нейротрансмиттеров. Alcohol Res Health 34: 106–120
Google ученый
De Witte P (2004) Дисбаланс между нейровозбуждающими и нейроингибитирующими аминокислотами вызывает тягу к этанолу. Поведение наркомана 29: 1325–1339
PubMed Google ученый
Rao PSS, Sari Y (2012) Транспортер глутамата 1: цель для лечения алкогольной зависимости.Curr Med Chem 19: 5148–5156
CAS PubMed PubMed Central Google ученый
Maciel C, Kerr-Corrêa F (2004) Психиатрические осложнения алкоголизма: синдром отмены алкоголя и другие психические расстройства. Rev Bras Psiquiatr 26: 47–50
Google ученый
Hinton DJ, Lee MR, Jacobson TL, Mishra PK, Frye MA, Mrazek DA, Macura SI, Choi DS (2012) Метаболиты мозга, вызванные отменой этанола, и фармакологические эффекты акампросата у мышей, лишенных ENT1.Нейрофармакология 62: 2480–2788
CAS PubMed PubMed Central Google ученый
Haass-Koffler CL, Leggio L, Kenna GA (2014) Фармакологические подходы к снижению влечения у пациентов с расстройствами, связанными с употреблением алкоголя. CNS Drugs 28: 343–360
CAS PubMed PubMed Central Google ученый
Fujikawa DG (2005) Длительные судороги и клеточные повреждения: понимание связи.Эпилепсия, поведение 7: 3-11
Google ученый
Jung ME, Metzger DB (2010) Алкогольная абстиненция и травмы головного мозга: за пределами классических механизмов. Молекулы 15: 4984–5011
CAS PubMed PubMed Central Google ученый
Schieber M, Chandel NS (2014) Функция ROS в окислительно-восстановительной передаче сигналов и окислительном стрессе. Curr Biol 24: 453–462
Google ученый
Amato L, Minozzi S, Davoli M (2011) Эффективность и безопасность фармакологических вмешательств для лечения синдрома отмены алкоголя. Кокрановская база данных Syst Rev 6: CD00853723
Google ученый
Гупта М., Верма П., Растоги Р., Арора С., Эльвади Д. (2017) Рандомизированное открытое испытание баклофена для профилактики рецидивов алкогольной зависимости. Am J. Злоупотребление наркотиками 43: 324–331
PubMed Google ученый
Rasmussen DD, Kincaid CL, Froehlich JC (2017) Празозин предотвращает повышенное тревожное поведение, которое возникает в ответ на стресс во время алкогольной депривации. Алкоголь Алкоголь 52: 5–11
CAS PubMed Google ученый
Rothstein JD, Patel S, Regan MR, Haenggeli C, Huang YH, Bergles DE, Jin L, Dykes Hoberg M, Vidensky S, Chung DS, Toan SV, Bruijn LI, Su ZZ, Gupta P, Fisher PB (2005) Бета-лактамные антибиотики обеспечивают нейрозащиту за счет увеличения экспрессии транспортера глутамата.Природа 433: 73–77
CAS PubMed Google ученый
Abulseoud OA, Miller JD, Wu J, Choi DS, Holschneider DP (2012) Цефтриаксон активирует переносчик глутамата в медиальной префронтальной коре и блокирует восстановление метамфетамина в поисках парадигмы предпочтения места. Brain Res 1456: 14–21
CAS PubMed PubMed Central Google ученый
Knackstedt LA, Melendez RI, Kalivas PW (2010) Цефтриаксон восстанавливает гомеостаз глутамата и предотвращает рецидив поиска кокаина. Биологическая психиатрия 67: 81–84
CAS PubMed PubMed Central Google ученый
Sari Y, Sakai M, Weedman JM, Rebec GV, Bell RL (2011) Цефтриаксон, бета-лактамный антибиотик, снижает потребление этанола у предпочитающих алкоголь крыс. Алкоголь Алкоголь 46: 239–246
CAS PubMed PubMed Central Google ученый
Lee MR, Ruby CL, Hinton DJ, Choi S, Adams CA, Young Kang N, Choi DS (2013) Передача сигналов полосатого тела аденозина регулирует экспрессию EAAT2 и астроцитарного AQP4 и употребление алкоголя у мышей. Нейропсихофармакология 38: 437–445
CAS PubMed Google ученый
Abulseoud OA, Camsari UM, Ruby CL, Kasasbeh A, Choi S, Choi DS (2014) Ослабление отмены этанола за счет индуцированной цефтриаксоном активации транспортера глутамата EAAT2.Нейропсихофармакология 39: 1674–1684
CAS PubMed PubMed Central Google ученый
Барбазук В.Б., Корф И., Кадави С., Хейен Дж., Тейт С., Вун Э, Беделл Дж. А., Макферсон Дж. Д., Джонсон С.Л. (2000) Синтенная взаимосвязь геномов рыбок данио и человека. Genome Res 10: 1351–1358
CAS PubMed PubMed Central Google ученый
Ebarasi L, Oddsson A, Hultenby K, Betsholtz C, Tryggvason K (2011) Данио: модельная система для изучения развития, функции и патофизиологии почек позвоночных.Curr Opin Nephrol Hypertens 20: 416–424
PubMed Google ученый
Mueller T, Vernier P, Wullimann MF (2004) Центральная холинергическая система нервной нервной системы взрослого нейрогенетического модельного животного, рыбок данио Danio rerio . Brain Res 1011: 156–169
CAS PubMed Google ученый
Boehmler W, Obrecht-Pflumio S, Canfield V, Thisse C, Thisse B, Levenson R (2004) Эволюция и экспрессия генов дофаминовых рецепторов D2 и D3 у рыбок данио.Dev Dyn 230: 481–493
CAS PubMed Google ученый
Kim YJ, Nam RH, Yoo YM, Lee CJ (2004) Идентификация и функциональные доказательства ГАМКергических нейронов в частях мозга взрослых рыбок данио ( Danio rerio ). Neurosci Lett 355: 29–32
CAS PubMed Google ученый
Edwards JG, Michel WC (2002) Стимулированная запахом глутаматергическая нейротрансмиссия в обонятельной луковице рыбок данио.J Comp Neurol 454: 294–309
CAS PubMed Google ученый
Rico EP, de Oliveira DL, Rosemberg DB, Mussulini BH, Bonan CD, Dias RD, Wofchuk S, Souza DO, Bogo MR (2010) Экспрессия и функциональный анализ Na (+) — зависимых переносчиков глутамата из мозг рыбок данио. Brain Res Bull 81: 517–523
CAS PubMed Google ученый
Alexandre MCM, Mendes NV, Torres CA, Baldin SL, Bernardo HT, Scussel R, Baggio S, Mussulini BHM, Zenki KC, da Rosa MI, Rico EP (2019) Еженедельное воздействие этанола изменяет дофаминергические параметры у рыбок данио головной мозг.Нейротоксикол Тератол 75: 106822
CAS PubMed Google ученый
Bernardo HT, Agostini JF, Toé HCZD, Vieira KM, Baldin SL, Schuck PF, Uribe-Cruz C, Longo L, da Silveira TR, Rosemberg DB, Rico EP (2019) Холинергическая система и исследовательское поведение — это изменилось после еженедельного воздействия этанола на рыбок данио. Pharmacol Biochem Behav 186: 172790
CAS PubMed Google ученый
Cachat J, Canavello P, Elegante M, Bartels B, Hart P, Bergner C, Egan R, Duncan A, Tien D, Chung A, Wong K, Goodpeed J, Tan J, Grimes C, Elkhayat S, Suciu C, Rosenberg М, Чунг К.М., Кадри Ф., Рой С., Гайквад С., Стюарт А., Запольски И., Гилдер Т., Мохнот С., Бисон Е., Амри Х., Зуковска З., Суанье Р.Д., Калуэфф А.В. (2010) Моделирование синдрома отмены у рыбок данио. Behav Brain Res 208: 371–376
CAS PubMed Google ученый
Zhang J, Qian J, Tong J, Zhang D, Hu C (2013) Токсические эффекты цефалоспоринов с определенными функциональными группами, как показали испытания на токсичность эмбрионов рыбок данио. Chem Res Toxicol 26: 1168–1181
CAS PubMed Google ученый
Rosemberg DB, Rico EP, Mussulini BH, Piato AL, Calcagnotto ME, Bonan CD, Dias RD, Blaser RE, Souza DO, de Oliveira DL (2011) Различия в пространственно-временном поведении рыбок данио на открытом воздухе парадигма танка после кратковременного заключения в темное и яркое окружение.PLoS ONE 6: e19397
CAS PubMed PubMed Central Google ученый
Wong K, Elegante M, Bartels B, Elkhayat S, Tien D, Roy S, Goodspeed J, Suciu C, Tan JL, Grimes C, Chung A, Rosenberg M, Gaikwad S, Denmark A, Jackson A , Кадри Ф., Чунг К.М., Стюарт А., Гилдер Т., Бисон Э., Запольски И., Ву Н.Д., Кашат Дж., Калуэфф А.В. (2010) Анализ реакции привыкания к новизне у рыбок данио ( Danio rerio ). & nbsp; Behav Brain Res 208: 450e457
Google ученый
Levin ED, Bencan Z, Cerutti DT (2007) Анксиолитические эффекты никотина у рыбок данио. Physiol Behav 90: 54–58
CAS PubMed Google ученый
Egan RJ, Bergner CL, Hart PC, Cachat JM, Canavello PR, Elegante MF, Elkhayat SI, Bartels BK, Tien AK, Tien DH, Mohnot S, Beeson E, Glasgow E, Amri H, Zukowska Z , Калуев А.В. (2009) Понимание поведенческих и физиологических фенотипов стресса и тревоги у рыбок данио. Behav Brain Res 205: 38–44
CAS PubMed PubMed Central Google ученый
Mathur P, Guo S (2011) Различия между острым и хроническим воздействием этанола на тревожные поведенческие реакции у рыбок данио. Behav Brain Res 219: 234–239
CAS PubMed PubMed Central Google ученый
Rosemberg DB, Braga MM, Rico EP, Loss CM, Córdova SD, Mussulini BH, Blaser RE, Leite CE, Campos MM, Dias RD, Calcagnotto ME, de Oliveira DL, Souza DO (2012) Поведенческие эффекты предварительной обработки таурином у рыбок данио, подвергшихся острому воздействию этанола.Нейрофармакология 63: 613–623
CAS PubMed Google ученый
Максимино С., де Брито TM, да Сильва AWB, Геркулан А.М., Морато С., Гувейя А. младший (2010) Измерение тревожности у рыбок данио: критический обзор. Behav Brain Res 214: 157–171
PubMed Google ученый
Duarte T, Fontana BD, Müller TE, Bertoncello KT, Canzian J, Rosemberg DB (2019) Никотин предотвращает тревожные поведенческие реакции у рыбок данио.Prog Neuropsychopharmacol Biol Psychiatry 18: 109655
Google ученый
Zenki KC, Mussulini BH, Rico EP, de Oliveira DL, Rosemberg DB (2014) Влияние этанола и ацетальдегида на структуры мозга рыбок данио: подход in vitro на поглощение глутамата и на параметры, связанные с токсичностью. Toxicol In Vitro 28: 822–828
CAS PubMed Google ученый
Evelson P, Travacio M, Repetto M, Escobar J, Llesuy S, Lissi E (2001) Оценка общего реактивного антиоксидантного потенциала (ловушки) гомогенатов тканей и их цитозолей. Arch Biochem Biophys 388: 261–266
CAS PubMed Google ученый
Аксенов М.Ю., Маркесбери В.Р. (2001) Изменения содержания тиолов и экспрессии генов окислительно-восстановительной системы глутатиона в гиппокампе и мозжечке при болезни Альцгеймера. Neurosci Lett 302: 141–145
CAS PubMed Google ученый
Esterbauer H, Cheeseman KH (1990) Определение продуктов перекисного окисления альдегидных липидов: малоновый альдегид и 4-гидроксиноненаль. Методы Enzymol 186: 407–421
CAS PubMed Google ученый
Lebel CP, Ischiropoulos H, Bondy SC (1992) Оценка зонда 2 ‘, 7’-дихлорфлуоресцина как индикатора образования активных форм кислорода и окислительного стресса. Chem Res Toxicol 5: 227–231
CAS PubMed Google ученый
Aebi H (1984) Каталаза in vitro. Методы Enzymol 105: 121–126
CAS PubMed Google ученый
Bannister JV, Calabrese L (1987) Анализы на супероксиддисмутазу. Методы Biochem Anal 32: 279–312
CAS PubMed Google ученый
Peterson GL (1977) Упрощение метода анализа белка Lowry et al, которое более широко применимо.Анальная биохимия 83: 346–356
CAS PubMed Google ученый
Holmes A, Spanagel R, Krystal JH (2013) Глутаматергические цели для новых алкогольных препаратов. Психофармакология (Berl) 229: 539–554
CAS Google ученый
Malcolm RJ (2003) Системы ГАМК, бензодиазепины и зависимость от веществ. J Clin Psychiatry 64: 36–40
CAS PubMed Google ученый
Maximino C, Benzecry R, Matos KRO, Batista EJO, Herculano AM, Rosemberg DB, de Oliveira DL, Blaser R (2012) Сравнение тестов света / темноты и новых аквариумов на рыбках данио. Поведение 149: 1099–1123
Google ученый
Канг С., Ли Дж., Беккер А., Йе Дж. Х. (2018) Спасение транспорта глутамата в боковой габенуле облегчает депрессивное и тревожное поведение у крыс, лишенных этанола. Нейрофармакология 129: 47–56
CAS PubMed Google ученый
Grant KA, Valverius P, Hudspith M, Tabakoff B (1990) Припадки с отменой этанола и комплекс рецепторов NMDA. Eur J Pharmacol 176: 289–296
CAS PubMed Google ученый
Гуля К., Грант К.А., Валвериус П., Хоффман П.Л., Табакофф Б. (1991) Региональная специфичность мозга и динамика изменений в комплексе рецептор-ионофор NMDA во время отмены этанола. Brain Res 547: 129–134
CAS PubMed Google ученый
Залески М., Морато С.Г., Сильва В.А., Лемос Т. (2004) Нейрофармакологические аспекты хронического употребления алкоголя и абстинентного синдрома. Braz J Psychiatry 26: 40–42
Google ученый
Althobaiti YS, Alshehri FS, Almalki AH, Sari Y (2017) Влияние введенного этанола и метамфетамина на глиальные транспортеры глутамата в полосатом теле и гиппокампе крыс. J Mol Neurosci 61: 343–350
PubMed Google ученый
Rao PS, Saternos H, Goodwani S, Sari Y (2015) Влияние цефтриаксона на изоформы GLT1, xCT и связанные с ними сигнальные пути у крыс P, подвергшихся воздействию этанола. Психофармакология 232: 2333–2342
CAS PubMed PubMed Central Google ученый
Sari Y, Toalston JE, Rao PSS, Bell RL (2016) Влияние цефтриаксона на потребление этанола, никотина или сахарозы предпочитающими алкоголь (P) крысами и его связь с экспрессией GLT-1.Неврология 326: 117–125
CAS PubMed PubMed Central Google ученый
Esel E (2006) Нейробиология нейротрансмиттеров, подавляющих и возбуждающих абстинентный синдром. Тюрк Псикиятри Дерг 17: 129–137
PubMed Google ученый
Rico EP, Rosemberg DB, Seibt KJ, Capiotti KM, Da Silva RS, Bonan CD (2011) Нейромедиаторные системы рыбок данио как потенциальные фармакологические и токсикологические мишени.Нейротоксикол Тератол 33: 608–617
CAS PubMed Google ученый
Harshberger E, Gilson EA, Gillett K, Stone JH, Amrani EI, Valdez L (2016) nor-BNI Антагонизм вызванного агонистами каппа-опиоида восстановления поведения, связанного с поиском этанола. J Наркоман 1: 1–8
Google ученый
El-Naga RN (2015) Апоцинин защищает от вызванной этанолом язвы желудка у крыс, ослабляя повышающую регуляцию НАДФН-оксидаз 1 и 4.Chem Biol Interact 242: 317–326
CAS PubMed Google ученый
Comporti M, Signorini C, Leoncini S, Gardi C, Ciccoli L, Giardini A, Vecchio D, Arezzini B (2010) Окислительный стресс, вызванный этанолом: базовые знания. Genes Nutr 5: 101–109
CAS PubMed Google ученый
Jung ME, Metzger DB (2016) Половые различия в окислительном стрессе и подавлении поведения, вызванные отменой этанола у крыс.Behav Brain Res 314: 199–214
CAS PubMed PubMed Central Google ученый
Koehler BC, Arslic-Schmitt T, Peccerella T, Scherr AL, Schulze-Bergkamen H, Bruckner T, Gdynia G, Jäger D, Mueller S, Bartsch H, Seitz HK (2016) Возможные механизмы опосредованного этанолом колоректального канцерогенез: роль цитохрома P4502E1, аддуктов этено-ДНК и антиапоптотического белка Mcl-1. Alcohol Clin Exp Res 40: 2094–2101
CAS PubMed Google ученый
Hernández JA, López-Sánchez RC, Rendón-Ramírez A (2016) Липиды и окислительный стресс, связанные с неврологическим повреждением, вызванным этанолом. Oxid Med Cell Longev 2016: 1543809
PubMed PubMed Central Google ученый
Marchi KC, Ceron CS, Muniz JJ, De Martinis BS, Tanus-Santos JE, Tirapelli CR (2016) НАДФН-оксидаза играет роль в индуцированной этанолом гипертензии и генерации активных форм кислорода в сосудистой сети.Алкоголь Алкоголь 51: 522–534
CAS PubMed Google ученый
Pizzimenti S, Ciamporcero E, Daga M, Pettazzoni P, Arcaro A, Cetrangolo G, Minelli R, Dianzani C, Lepore A, Gentile F, Barrera G (2013) Взаимодействие альдегидов, полученных в результате перекисного окисления липидов и мембраны белки. Front Physiol 4: 1–17
Google ученый
Холландер Дж, Бейма Дж, Оокавара Т., Оно Х., Джи Л.Л. (2000) Экспрессия гена супероксиддисмутазы в скелетных мышцах: волокно-специфический эффект возраста.Mech Aging Dev 116: 33–45
CAS PubMed Google ученый
Agostini JF, Toé HCZD, Vieira KM, Baldin SL, Costa NLF, Cruz CU, Longo L, Machado MM, da Silveira TR, Schuck PF, Rico EP (2018) Изменения холинергической системы и окислительного стресса в мозг модели рыбок данио, хронически подвергнутых воздействию этанола. Neurotox Res 33: 749–758
CAS PubMed Google ученый
Rosemberg DB, Rico EP, Langoni AS, Spinelli JT, Pereira TC, Dias RD, Souza DO, Bonan CD, Bogo MR (2010) Семейство NTPDase у рыбок данио: гидролиз нуклеотидов, молекулярная идентификация и профили экспрессии генов в мозге, печени и сердце . Comp Biochem Physiol B 155: 230–240
PubMed Google ученый
Mocelin R, Marcon M, da Rosa Araujo AS, Herrmann AP, Piato A (2019) N-ацетилцистеин у рыбок данио предотвращает абстинентный эффект после многократного воздействия этанола.Prog Neuropsychopharmacol Biol Psychiatry 93: 161–170
CAS PubMed Google ученый
Karahanian E, Quintanilla ME, Tampier L, Rivera-Meza M, Bustamante D, Gonzalez-Lira V, Morales P, Herrera-Marschitz M, Israel Y (2011) Этанол как пролекарство: метаболизм мозга этанол опосредует его усиливающие эффекты. Alcohol Clin Exp Res 35: 606–612
CAS PubMed PubMed Central Google ученый
через какое время после инъекции цефтриаксона можно пить алкоголь. Элавил
Он убивает бактерии или предотвращает их рост.Когда вы принимаете цефтриаксон, особенно важно, чтобы ваш лечащий врач знал, принимаете ли вы какие-либо из перечисленных ниже лекарств. После i.p. Все права защищены. Не применяйте цефтриаксон у ребенка без консультации врача и никогда не давайте ему дозу, превышающую предписанную ребенку. Инъекция цефтриаксона может быть опасна при введении новорожденному вместе с любыми внутривенными лекарствами, содержащими кальций, включая общий … Обязательно сообщите об этом своему врачу. если у вас есть другие проблемы со здоровьем, особенно: медсестра или другой квалифицированный медицинский работник назначит вам цефтриаксон.Могу ли я употреблять алкоголь во время приема цефтриаксона? Следующие взаимодействия были выбраны на основе их потенциальной значимости и не обязательно являются всеобъемлющими. Не рекомендуется использовать цефтриаксон с любым из следующих лекарств. Подгруппу крыс P, получавших цефтриаксон (n = 4), умерщвляли через 24 часа после последней инъекции лекарственного средства (день 6) для определения уровней xCT и GLT1 в NAc, PFC и AMG в этот момент времени. MNT — зарегистрированная торговая марка Healthline Media. # цефтриаксон, # пить, # работать, # лекарства, # причина, # вообще, # драйв, # способности, # алкоголь, # головокружение, # другой, # машины, # хуже, # но все же, # человек, # проблемы уколы, крысы ежедневно контролировали потребление этанола и воды в течение дополнительных 10 дней с последующей эвтаназией на 14 день.Проконсультируйтесь со своим лечащим врачом, если какие-либо из следующих побочных эффектов сохраняются или вызывают беспокойство, или если у вас есть какие-либо вопросы о них: Другие побочные эффекты, не указанные в списке, также могут возникать у некоторых пациентов. Оценок: +0. Употребление алкоголя ведет к обезвоживанию организма, что может продлить раздражение мочевого пузыря. Употребление алкоголя во время ИМП увеличивает нагрузку на печень, которая уже усердно работает над преодолением инфекции. Каждый из этих эффектов может ухудшить способность организма к восприятию. оправиться от инфекции, возможно, продлив выздоровление.Хотя умеренное употребление алкоголя при приеме цефалексина безопасно, эти два вещества могут вызывать схожие побочные эффекты. Также сообщите своему врачу, если у вас есть другие типы аллергии, например, на продукты питания, красители, консерванты или животных. Из-за токсичности цефтриаксона не рекомендуется его применение у новорожденных и недоношенных детей. Соответствующие исследования, проведенные до настоящего времени, не продемонстрировали проблем, связанных с гериатрией, которые ограничивали бы полезность цефтриаксона для пожилых людей. Исследования на женщинах показывают, что этот препарат представляет минимальный риск для здоровья. младенец при использовании во время грудного вскармливания.Хотя некоторые лекарства вообще не следует использовать вместе, в других случаях два разных лекарства могут использоваться вместе, даже если может произойти взаимодействие. Лекарства от диареи могут усугубить диарею или продлить ее. Алкоголиков, прошедших детоксикацию, следует контролировать на предмет снижения эффективности ТЦА. Цефалексин, также называемый цефалексином, является антибиотиком. Ваш врач может решить не лечить вас этим лекарством или изменить некоторые другие лекарства, которые вы принимаете. Использование цефтриаксона с любым из следующих лекарств обычно не рекомендуется, но в некоторых случаях может потребоваться.Могут ли антибиотики сделать грудное молоко менее полезным для детей? Кроме того, ваш лечащий врач может рассказать вам о способах предотвращения или уменьшения некоторых из этих побочных эффектов. Следовательно, употребление алкоголя во время приема амитриптилина повлияет на уровень амитриптилина в крови и помешает ему работать на должном уровне. Чтобы продолжить, выберите одну или несколько информационных бюллетеней. Если у вас есть какие-либо вопросы по этому поводу или если легкая диарея продолжается или усиливается, проконсультируйтесь с врачом. При использовании цефтриаксона может возникнуть панкреатит.Мы соблюдаем стандарт HONcode для получения достоверной информации о здоровье — доступен для устройств Android и iOS. Цефтриаксон относится к классу лекарств, известных как цефалоспориновые антибиотики. Ответьте на этот вопрос. MNT — зарегистрированная торговая марка Healthline Media. Может потребоваться корректировка дозировки. Отзывы (1) DE. Можно ли употреблять алкоголь после инъекции розефина? Это верно для некоторых типов антибиотиков, таких как метронидазол и тинидазол, которые могут вызывать серьезные побочные реакции в сочетании с алкоголем.Кроме того, некоторые люди могут избегать употребления алкоголя при приеме антибиотиков, потому что они опасаются, что алкоголь может сделать лекарство неэффективным. Возможно, алкоголь может снизить эффективность некоторых антибиотиков, таких как доксициклин. Привет, технически да, хотя алкоголь может повлиять на эффективность лекарства, он помогает бороться с инфекцией. Люди с хроническим употреблением алкоголя или проблемами с печенью не должны использовать этот тип лекарства. Как и в случае с другими цефалоспоринами, наиболее частыми побочными эффектами цефалексина являются желудочно-кишечные проблемы, в том числе: Некоторые менее распространенные побочные эффекты цефалексина включают: выше для людей, страдающих аллергией. В редких случаях у человека может возникнуть сильная аллергическая реакция, известная как цефалексин — распространенный антибиотик, который врачи назначают при ряде бактериальных инфекций.Цефтриаксон вводится в виде инъекции в одну из ваших мышц или через иглу, введенную в одну из ваших вен. Если ваши симптомы не улучшатся в течение нескольких дней или если они ухудшились, проконсультируйтесь с врачом. Цефтриаксон может вызвать серьезные аллергические реакции. , включая анафилаксию, которая может быть опасной для жизни и требует немедленной медицинской помощи.
Амарил с преобладанием алкоголя и эстрогена, Метилфенидат и алкоголь Effexor Xr, Могу ли я принимать добавки с грейпфрутовым соком нороксином, Unani Лечение вульгарных угрей Allegra, Tri Lo Estarylla Period Диклофенак Гель, Гормональный дисбаланс, высокое кровяное давление, циталопрам, Супер Видалиста 20 60 мг Лазикс, Pssd Reddit Cipro, Противозачаточные таблетки с низким содержанием андрогенов Занафлекс, Лосьон Lady Care Minipress, Биотин для роста волос Speman,
Ослабление синдрома отмены этанола за счет индуцированной цефтриаксоном активации транспортера глутамата EAAT2
Это исследование предоставляет убедительные доказательства использования цефтриаксона в качестве эффективного метода лечения острого синдрома отмены алкоголя и предотвращения увеличения потребления этанола, вызванного отменой.Используя новый трансляционный подход к оценке поведенческих проявлений отмены этанола, мы впервые сообщаем о заметно разном течении проявлений отмены у крыс Wistar и P. Кроме того, мы обнаружили, что цефтриаксон, вводимый во время острой абстиненции этанола, индуцировал длительную активацию транспортера глутамата, EAAT2, в полосатом теле.
В нашем исследовании мы разработали новый метод оценки проявлений абстиненции этанола, основанный на количественной оценке индивидуального поведения на протяжении всей продолжительности отказа от этанола с использованием непрерывной видеозаписи.Важным преимуществом описанного здесь метода является его значительно большее временное разрешение для появления и прекращения индивидуальных проявлений отмены. Повышенное временное разрешение дает более полную картину отмены, чем предыдущие исследования, которые основывались на краткосрочных наблюдениях (15 с) в различные моменты времени после прекращения приема алкоголя (Lal et al, 1988; Waller et al, 1982). Мы также сосредоточились на объективно определенных, клинически значимых показателях абстиненции, а не на более субъективных показателях, таких как гиперактивность или подергивания.Наконец, мы не объединили все признаки абстиненции в одну оценку (Majchrowicz and Hunt, 1976). Вместо этого каждое проявление синдрома отмены оценивалось индивидуально, что позволяло получить более надежное описание и более точный клинический перевод.
Возможно, наиболее интересным открытием в этом исследовании является заметная разница во времени появления симптомов отмены у крыс Wistar и P. Все меры отмены у крыс Вистар происходили в основном в течение первых 24 часов после прекращения приема алкоголя, достигая пика примерно между 12 и 20 часами, после чего симптомы практически не проявлялись.Напротив, у крыс P было обнаружено удивительно позднее начало проявления абстиненции, с небольшими изменениями поведения, если они вообще отсутствовали, почти до полных 24 часов после лишения алкоголя и достигнув пика во второй день абстиненции. Насколько нам известно, такая длительная абстиненция ранее не регистрировалась у крыс P, что может быть связано с относительно узким интервалом наблюдений в предыдущих исследованиях (Lal et al, 1988; Majchrowicz and Hunt, 1976; Waller et al, 1982). Более того, наши результаты вряд ли можно объяснить различиями в выведении этанола между крысами Wistar и P, поскольку крысы P демонстрируют равное или более быстрое выведение этанола по сравнению с крысами Wistar (Lumeng and Li, 1986), и, таким образом, можно ожидать, что проявления отмены будет проявляться раньше у крыс P, чем у крыс Wistar.Кроме того, уровни этанола в крови не могут быть объяснены разницей, поскольку почти 25% крыс у обоих типов крыс умерли во время интоксикации, когда мы использовали максимально переносимую дозу этанола. Данные исследований микродиализа полосатого тела (Россетти и Карбони, 1995) на хронически алкоголизированных крысах после отмены этанола показали, что уровни глутамата значительно увеличиваются примерно через 6 часов после отмены и достигают пика через 12 часов, а затем снижаются до исходных значений через 24 часа. час Этот образец был близок к тому, что мы наблюдали у крыс Wistar, однако у крыс P проявления абстиненции наблюдались после более длительной задержки.Хотя четкое понимание этого интригующего наблюдения отсутствует, недавние данные свидетельствуют о том, что крысы P гомозиготны по стоп-кодону Grm2 (Grm2 * 407), который кодирует метаботропный рецептор глутамата 2 (mGluR2), что приводит к некомпенсированной потере mGluR2, что может быть связано со снижением постсинаптической чувствительности рецептора глутамата и более длительным периодом отмены у крыс этой линии (Zhou et al, 2013).
Насколько нам известно, наше исследование является первым, в котором описан абстинентный синдром у крыс линии Вистар.Эти крысы умеренно потребляют этанол, выпивая примерно половину количества этанола, которое потребляют крысы P в базовых условиях (2–3 г / кг / день по сравнению с 5–6 г / кг / день; Рисунок 3). Неизвестно, существует ли аналогичное временное неравенство для абстиненции или похмелья у лиц с умеренной или социальной зависимостью от алкоголя против , но может иметь важные последствия для будущих эпизодов употребления алкоголя, поскольку считается, что абстиненция играет важную роль в патофизиологии алкоголизма (Ripley and Стивенс, 2011).
Интересно, что крысы Wistar и P демонстрировали несколько иной профиль проявлений абстиненции, с преобладанием рывков головой и телом у крыс P, в то время как судорожная активность, хотя и нечастая, наблюдалась только у крыс Wistar. Точно так же серьезность симптомов была различной у крыс Wistar и P, при этом крысы P демонстрировали в целом более высокие уровни абстиненции. Неврологическая основа этих различий неясна и требует дальнейшего изучения. Принимая во внимание разницу во времени проявления абстиненции у крыс Wistar и P, наши данные также предполагают, что, хотя гиперглутаматергическое состояние явно связано с обоими проявлениями абстиненции, разные механизмы могут быть ответственны за социальные пьющие против алкоголиков.
Мы обнаружили, что цефтриаксон 200 мг / кг / день (но не 100 мг / кг / день), вводимый во время острой алкогольной абстиненции, почти полностью устранял все измеренные проявления абстиненции. Наши результаты согласуются с большим количеством доказательств, подтверждающих гипотезу о том, что абстиненция этанола является результатом восстановительного гиперглутаматергического состояния, которое не маскируется резким прекращением приема этанола (Chandler et al, 2006; Crews et al, 1996; De Witte et al, 2003; Грант и Ловингер, 1995). Кроме того, наши результаты согласуются с предыдущими сообщениями, показывающими, что введение цефтриаксона показало противосудорожные свойства в тесте на беспозвоночных (Rawls et al, 2010a), снизило частоту приступов на мышиной модели комплекса туберозного склероза (Zeng et al, 2010). ), а также сокращение совокупной продолжительности посттравматических припадков у крыс (Goodrich et al, 2013).Кроме того, цефтриаксон (150, 200 мг / кг), вводимый один раз в день во время хронического воздействия морфина, подавлял каждый признак отмены, вызванный налоксоном (Rawls et al, 2010b), улучшал механическую аллодинию и ослаблял толерантность к морфину на животной модели нейропатической боли (Rawls et al, 2010c), а также снижение гипералгезии, вызванной опиоидами, у мышей (Chen et al, 2012).
Настоящие результаты совпадают с данными Krupitsky et al (2007), которые продемонстрировали превосходную эффективность трех антиглутаматергических стратегий: ингибитора высвобождения глутамата ламотриджина; антагонист рецептора глутамата N -метил-D-аспартата, мемантин; и ингибитор AMPA / каинитовых рецепторов, топирамат, для уменьшения выраженности абстиненции, дисфорического настроения и дополнительного введения диазепама, оцениваемой наблюдателями и самооценкой, в плацебо-контролируемом исследовании (Krupitsky et al, 2007).Основным преимуществом цефтриаксона по сравнению с другими антиглутаматергическими препаратами и бензодиазапинами является относительно доброкачественный профиль побочных эффектов.
Интересно, что цефтриаксон блокировал неспровоцированную реакцию испуга, которая напоминает тревогу и паническое поведение у людей. Недавние данные свидетельствуют о том, что тревога, связанная с алкогольной абстиненцией, может быть вызвана повышенными концентрациями синаптического глутамата в таламических афферентах к базолатеральной миндалине во время отмены алкоголя (Christian et al, 2013) или в дорсальном периакведуктальном веществе круговорота (Ezequiel Leite and Nobre, 2012).Клинически считается, что тревога во время алкогольного похмелья увеличивает вероятность рецидива (McGuinness and Fogger, 2006).
Одним из ограничений нашего исследования является то, что мы не смогли установить четкую и надежную взаимосвязь доза-ответ только с двумя дозами цефтриаксона (100 и 200 мг / кг / день). Доза 200 мг показала устойчивую значительную эффективность в снижении тяжести синдрома отмены, тогда как доза 100 мг была эффективна только для определенных областей отмены у крыс Wistar. Интересно, что более низкая доза цефтриаксона предотвратила некоторые, но не все симптомы абстиненции и не повлияла на употребление алкоголя.Это может означать, что не все симптомы абстиненции регулируются глутаматом или связаны с мотивацией пить. Необходимы дальнейшие исследования, направленные на выяснение зависимости доза-ответ цефтриаксона при индивидуальных проявлениях абстиненции.
Важно отметить, что лечение цефтриаксоном 200 мг / кг / день (но не 100 мг / кг / день) в течение 2-дневного периода отмены полностью блокировало рецидивирующее употребление этанола у обоих типов крыс. Обнаружение того, что употребление алкоголя после отмены у крыс P было намного выше, чем у крыс Wistar, также подтверждает связь между тяжестью отмены, большей у крыс P, и более поздними эпизодами употребления алкоголя.Вместе с дифференцированной шкалой времени для проявлений абстиненции между двумя типами крыс наши результаты согласуются с другими исследованиями, показывающими более поздний пик рецидивирующего употребления алкоголя у зависимых от алкоголя P крыс по сравнению с крысами Wistar в оперантной парадигме (Gilpin et al, 2008). ). Особенно примечательно, что питье после отмены у крыс P, получавших цефтриаксон, было сопоставимо с базальным уровнем питья крыс Wistar (2–3 г / кг / день). В исследовании Gilpin et al (2008) даже у независимых крыс P потребление алкоголя было примерно вдвое больше, чем у крыс Wistar.Таким образом, настоящие результаты показывают, что цефтриаксон может быть полезным не только для сдерживания роста потребления алкоголя, вызванного алкогольной депривацией, но и для инициирования умеренного потребления, даже в модели алкогольной зависимости. Взятые вместе, можно предположить, что способность цефтриаксона ослаблять проявления алкогольной абстиненции, особенно тревожное поведение и потребление этанола после отмены, может иметь клиническое значение и требовать подтверждения концепции исследования для проверки эффективности цефтриаксона в лечении Отмена алкоголя и предотвращение рецидивов после отмены у людей.В поддержку этой новой концепции приведены результаты недавнего многоэтапного рандомизированного исследования цефтриаксона при другом гиперглутаматергическом психоневрологическом расстройстве; боковой амиотрофический склероз предоставил ценную информацию о переносимости и фармакокинетике (ПК) у пациентов без воспаленных мозговых оболочек, поскольку оригинальные исследования фармакокинетики цефтриаксона проводились на пациентах с менингитом или здоровых добровольцах (Perry and Schentag, 2001). Основными побочными эффектами у пациентов, получавших цефтриаксон, были боли в животе и холелитиаз (Berry et al, 2013).Следует отметить, что в этом основополагающем исследовании авторы вводили цефтриаксон 2–4 г / день в течение 20 недель, что может объяснить возникновение желчного осадка в их исследуемой популяции. Такое нежелательное явление не должно вызывать беспокойства у пациентов с алкогольной абстинентностью, учитывая короткую продолжительность необходимого лечения. Другая проблема связана с потенциальной неэффективностью цефтриаксона у пациентов с алкогольной абстинентностью. Чтобы решить эту проблему, мы рекомендуем использовать цефтриаксон в качестве дополнения к лечению бензодиазепинами, вызванным симптомами, чтобы гарантировать безопасность в начальных исследованиях с использованием цефтриаксона для лечения алкогольной абстиненции.
Наши данные также показали активацию EAAT2 в полосатом теле, но не mPFC у крыс, получавших цефтриаксон. Появляется все больше свидетельств того, что потеря глутаматергического баланса в кортикостриатной нейросхеме может быть основным следствием алкогольной зависимости и ключевым патофизиологическим механизмом, опосредующим повышенную склонность к рецидивам. Meinhardt et al (2013) недавно показали, что хроническая интермиттирующая интоксикация этанолом приводит к дефициту mGluR2 в пирамидных нейронах PFC и эскалации поведения, связанного с поиском этанола, которое может быть устранено путем восстановления экспрессии mGluR2 в PFC через вирус-опосредованный перенос генов.Кроме того, Bauer et al (2013) количественно оценили уровни глутамата сразу после детоксикации у пациентов с алкогольной зависимостью и у здоровых контрольных субъектов с помощью протонной магнитно-резонансной спектроскопии и обнаружили значительно повышенные уровни глутамата в вентральном полосатом теле, что положительно коррелировало с оценками тяги. Наши результаты не только подтверждают предыдущие исследования, показывающие активацию EAAT2 цефтриаксоном (Abulseoud et al, 2012; Lee et al, 2013; Rothstein et al, 2005), но также демонстрируют, что этот молекулярный результат является относительно продолжительным (целая неделя после последнего доза цефтриаксона).Более того, в этом исследовании мы давали цефтриаксон всего на 2 дня по сравнению с 3-5-дневным лечением, ранее связанным с активацией EAAT2 и предотвращением аддиктивного поведения (Abulseoud et al, 2012; Sari et al, 2011). Примечательно, что специфичность области мозга в настоящем наблюдении контрастирует с нашим предыдущим отчетом (Abulseoud et al, 2012), где мы показали, что цефтриаксон активировал EAAT2 в mPFC, но не в NAc, через 72 часа после последней дозы цефтриаксон у крыс, получавших метамфетамин.Основанием для этого несоответствия между этим исследованием и нашим предыдущим может быть продолжительность введения цефтриаксона (2 дня в этом исследовании против 7 дней в исследовании метамфетамина), время отбора проб (7 дней после против 3 дня после последнего приема цефтриаксона. доза), или дифференциальные эффекты алкоголя по сравнению с метамфетамином на экспрессию EAAT2 или передачу сигналов глутамата в кортикостриатных цепях. В отличие от других исследований, предполагающих, что этанол не влияет на уровни EAAT2 в NAc (Melendez et al, 2005) и что нет изменений в уровнях или функции переносчика глутамата в коре головного мозга самцов крыс после 3 дней отмены этанола (Alele and Devaud, 2005), мы обнаружили значительное подавление EAAT2 как в полосатом теле, так и в mPFC во время отмены этанола.Цефтриаксон был способен спасти вызванное отменой этанола подавление EAAT2 только в полосатом теле, но не в mPFC. Этот дифференциальный эффект может быть связан с тем, что абстиненция этанола связана с повышенным уровнем глутамата в полосатом теле (Dahchour and De Witte, 1999; Dahchour et al, 1998, Rossetti and Carboni, 1995), но не из-за ПФК (Hinton et al, 2012). и снижение экспрессии EAAT2 в полосатом теле (Wu et al, 2010). Наши результаты отличались от результатов Sari et al (2011), в которых введение цефтриаксона крысам с алкоголем P было связано с усилением экспрессии EAAT2 как в PFC, так и в вентральном полосатом теле.Однако крысы в нашем исследовании пережили тяжелую отмену и получали цефтриаксон только 2 дня, в отличие от отсутствия отмены и более длительного (5 дней) воздействия цефтриаксона, как описано в группе Сари (Sari et al, 2011). Хотя неизвестно, влияет ли введение этанола на экспрессию или функцию EAAT2, наши результаты подтверждают гипотезу о том, что активация EAAT2 и увеличение поглощения глутамата эффективны в блокировании синдрома отмены этанола и алкоголя, вызывающего эскалацию отмены.
Интересно, что недавнее исследование показало, что мыши, лишенные EAAT1 (GLAST), демонстрируют меньшее стремление к вознаграждению и потребление алкоголя по сравнению с мышами дикого типа (Karlsson et al, 2012). Учитывая перекрывающуюся роль EAAT1 и EAAT2 в полосатом теле в поглощении внеклеточного или синаптического глутамата, это открытие кажется спорным, поскольку можно ожидать, что удаление EAAT1 увеличит уровни глутамата, а затем приведет к увеличению потребления алкоголя. Однако EAAT2 / GLT1 является преобладающим переносчиком глутамата в переднем мозге и полосатом теле, тогда как EAAT1 / GLAST является преобладающим переносчиком глутамата в мозжечок (Bauer et al, 2012, Whitelaw and Robinson, 2013).Таким образом, можно предположить, что роль EAAT1 в полосатом теле может отличаться от EAAT2, возможно, противодействуя EAAT2 для тонкой регуляции или внесинаптическому поглощению глутамата для ингибирования функции EAAT2 по обратной связи. Однако для проверки этой гипотезы необходимы дальнейшие исследования.
Мы наблюдали значительную потерю веса во время интервалов интоксикации и отмены у крыс, получавших физиологический раствор и цефтриаксон, по сравнению с контрольными крысами (дополнительный рисунок 2). У крыс Вистар основной эффект лечения (F 2, 52 = 64.35, P <0,0001), время (F 2, 104 = 47,63, P <0,0001) и взаимодействие между лечением и временем (F 24, 104 = 2,06, P = 0,006; Дополнительная фигура S2B) были очевидны с помощью двустороннего дисперсионного анализа, но это не достигло значимости у крыс P (F 13, 56 = 1,54, P = 0,13; дополнительная фигура S2A). Как сообщалось ранее, алкогольная интоксикация и абстиненция могут быть связаны с потерей веса (Wood et al, 1982). Не известно, что введение цефтриаксона в течение нескольких дней связано с потерей веса (Sari et al, 2011).Введение цефтриаксона в нашем исследовании было связано с легкой диареей, которая клинически подтверждена примерно в 4% случаев (File et al , 1984).
Таким образом, наше исследование в значительной степени поддерживает использование цефтриаксона в качестве нового лекарства для лечения острой абстиненции этанола и предотвращения повторного употребления алкоголя. Мы также подтвердили подавление EAAT2 за счет отмены этанола и длительную активацию EAAT2 в полосатом теле обработкой цефтриаксоном, что совпадает со снижением потребления этанола у крыс.Кроме того, мы описываем полезный новый метод для мониторинга отмены алкоголя на основе клинически значимых поведенческих проявлений с гораздо большим временным разрешением, чем предыдущие методы, что привело к обнаружению различий во времени и тяжести отмены этанола при умеренном употреблении алкоголя vs модель на животных с алкогольной зависимостью. Это может иметь важные последствия для сроков и / или продолжительности лечения у лиц, выбывших из программы, в зависимости от их истории употребления алкоголя.Однако, независимо от предыдущих моделей употребления алкоголя, это исследование демонстрирует, что усиление поглощения глутамата полосатым телом является эффективной стратегией предотвращения AWS и частого последующего обильного употребления алкоголя. Крайне необходимы дальнейшие исследования, разработанные специально для изучения других механизмов, включая активацию водного канала AQP-4 (Lee et al, 2013), и изучения взаимосвязи между поведенческими изменениями и изменениями уровней EAAT2.
|


 В итоге придется пить антибиотик более сильного спектра действия, такой как Амоксиклав;
В итоге придется пить антибиотик более сильного спектра действия, такой как Амоксиклав;